Tartalomjegyzék FOCUS MEDICINAE. Bevezetés...2 /Introduction/ Felelős szerkesztő: Dr. Szolnoky Miklós Főszerkesztő: Dr.
|
|
|
- Attila Bodnár
- 7 évvel ezelőtt
- Látták:
Átírás
1 FOCUS MEDICINAE Felelős szerkesztő: Dr. Szolnoky Miklós Főszerkesztő: Dr. Karabélyos Csaba Szerkesztőbizottság: Dr. Bencsik Krisztina Prof. Czirják László Prof. Horváth Örs Péter Dr. Kalmár Ágnes Dr. Mátrai Zoltán Dr. Nemes László Dr. Paál Mária Dr. Pál Katalin Prof. Zeher Margit Szerkesztőbizottság tanácsadó testülete: Prof. Fekete György Prof. Kiss Attila Prof. Kiss István Prof. Komoly Sámuel Prof. Lipták József Prof. Mándi Yvette Prof. Maródi László Prof. Medgyesi György Dr. Mészner Zsófia Dr. M. Tóth Antal Dr. Nagy Kálmán Prof. Pálóczi Katalin Prof. Perner Ferenc Prof. Pénzes István Prof. Péter Ferenc Prof. Romics Imre Prof. Rozgonyi Ferenc Prof. Sas Géza Prof. Schuler Dezső Dr. Siklós Pál Dr. Szita János Prof. Tekeres Miklós Prof. Tímár László Dr. Trestyánszky Zoltán Prof. Tulassay Tivadar Alapító: Biotest Hungaria Kft. Kiadja és a nyomdai munkáért felelős: Dursusz Bt Budapest, Szepesi u. 24. Felelős vezető: Gyulay Mihály Szerkesztőség és levelezési cím: 2045 Törökbálint, Torbágy u. 15/A ISSN: Megjelenik: évente négyszer Előfizetési díj: évre 2017,- Ft + 5% áfa Tartalomjegyzék Focus Medicinae Bevezetés...2 /Introduction/ Prof. Zeher Margit Újabb adatok a lupus patogenezisében...3 /Newer data in the pathogenesis of lupus/ Dr. Tarr Tünde A Sjögren-szindróma súlyos klinikai formái...7 /Severe clinical forms of Sjögren syndrome/ Dr. Szántó Antónia Autoimmun overlap szindróma...11 /Autoimmune overlap syndrome/ Prof. Bodolay Edit A D-vitamin immunmoduláns hatásai...15 /Immunomodulatory effects of Vitamine-D/ Dr. Zöld Éva Autoimmun bőrbetegségek...20 /Autoimmune skin diseases/ Prof. Bata-Csörgő Zsuzsanna Az allergiás szembetegségek és farmakoterápiájuk...23 /Allergic eye-diseases and their pharmacotherapy/ Dr. Kemény-Beke Ádám
2 FOCUS MEDICINAE Interdiszciplináris tudományos folyóirat Focus Medicinae Tisztelt Olvasó! Az autoimmun betegségek száma napjainkban már meghaladja a százat, és további növekedésük is várható. Egyes formáikat évtizedek óta ismerjük, de kialakulásuk pontos folyamata máig sem tisztázott annak ellenére, hogy nagyon intenzív és széleskörű kutatások folynak. A patogenezis egy-egy fontos lépésének megismerése elvezethet a hatékony kezelési eljárások kifejlesztéséhez. A lupus patogenezisében leírt újabb adatokat mutatja be Dr. Tarr Tünde közleménye, melyben saját kutatási eredményeinket is érinti. A második közleményben a Sjögren-szindróma súlyos klinikai formáiról írt Dr. Szántó Antónia. A közleményt figyelemfelkeltőnek szántuk. Azon kollégák, akik a klinikai immunológiát még régi tankönyvekből tanulták, nem kaphattak pontos információt a betegség természetéről. Ma már tudjuk, hogy a vezető sicca-s panaszok mellett kialakuló egyes szervi érintettségek súlyos klinikai képpel járhatnak, és kezelésük is nagy kihívás az orvos számára. A szisztémás autoimmun kórképek jellegzetessége, hogy nagy a társulási hajlandóságuk, így nem ritka, hogy egy betegnek két-három autoimmun betegsége is lehet. Mivel kialakulásuk egy folyamat, ezért különböző szervi manifesztációk együttesét látjuk. Az autoimmun overlap szindrómát mutatja be Dr. Bodolay Edit cikke, mely minden gyakorló orvos számára hasznos információkat tartalmaz. A vitaminok immunrendszerre kifejtett hatását sok éve intenzíven kutatják. Az utóbbi években nagyon sok adat gyűlt össze a D-vitamin immunmodulans hatásáról. Dr. Zöld Éva közleményében részletesen ismerteti azokat az elméleti bizonyítékokat, melyekkel sok tekintetben értelmezhető a velünk született és a szerzett immunitásra kifejtett hatás. Bár kevés betegségben történtek még átfogó vizsgálatok, de szaporodnak azok az adatok, melyek szerint az autoimmun betegség lefolyását enyhíti az aktív D3 vitamin kezelés a tünetek akut fellángolásának csökkentése által. Autoimmun betegségekben nem ritkák a bőrtünetek, ugyanakkor önálló autoimmun bőrbetegségeket is ismerünk. Dr. Bata Zsuzsa közleménye közérthető módon mutatja be ezen kórképeket, elősegítve felismerésüket, illetve a tudásunk felfrissítése céljából. Allergiás betegségek gyakran jelentkeznek szemészeti tünetekkel. Dr. Kemény-Beke Ádám cikkében részletesen bemutatja az allergia és az allergiás szembetegségek kialakulásának mechanizmusát, klinikai tüneteit és a kezelési lehetőségeket. A közlemény részletes áttekintő jellege miatt a gyakorlatban nagyon jól használható ismereteket nyújt. Úgy gondolom, hogy a cikksorozatban sok új, érdekes, a napi gyakorlat számára is felhasználható ismeret van, mindemellett a továbbképzést is jól szolgálják. Tisztelettel ajánlom a Focus Medicinae jelen számát minden kedves kolléga figyelmébe. Prof. Dr. Zeher Margit ÚTMUTATÓ SZERZŐINKNEK: A folyóiratban eredeti áttekintő jellegű közleményeket, valamint folyóiratreferátumokat jelentetünk meg. A kézirattal kapcsolatos formai követelmények (eredeti és áttekintő /review/ jellegű közlemények) a következők: A kézirat sorrendje: magyar nyelvű cím, szerzővel, intézettel együtt magyar nyelvű absztrakt magyar kulcsszavak angol nyelvű absztrakt angol kulcsszavak szöveg (csak magyarul) irodalomjegyzék (max. 30) táblázat(ok) ábrá(k), ábrajegyzék Cím: a szerzők a munkahelyük megjelölésével szerepeljenek a közlemény címét követően. Absztrakt: maximálisan 1 oldal terjedelmű legyen, az absztraktok esetén bekezdéseket ne használjunk, folyamatosan történjen a gépelés. Kulcsszavak: 5-6 jellemző kulcsszót emeljünk ki a szöveg elé, mindkét nyelven. Szöveg: (az itt felsorolt követelmények természetesen az absztraktra is vonatkoznak) 1 oldal: sor 1 sor: 70 leütés Betűtípus: Arial, normál 12-es méretű, (a szöveg, amennyiben lehetséges Windows XP vagy újabb változatban készüljön). Maximális oldalszám: 10 (esetenként ettől eltérés lehet a szerkesz tőbizottság döntése alapján), kívánt oldalszám: 6-8 oldal (A/4). Helyesírás: ahol lehet, magyar kifejezéseket és magyaros írásmódot használjunk. Irodalomjegyzék: a hivatkozások száma ne haladja meg a 30-at, a szövegben az adott bekezdés végén levő, dőlt, zárójelbe tett szám jelezze a citált publikációt, az irodalomjegyzék első szerző szerinti ABC-rendben készüljön. Formai kérések: 1. Szerzők megjelölése dőlt betűvel (elől családnév, utána keresztnév első betűje ponttal zárva). 3-nál több szerző esetén az első három szerző után et al.: álljon. 2. A cikk teljes címe 3. A folyóirat hivatalos rövidítése (pl. N.Engl.J.Med.), kötetszáma és oldalszáma, majd legvégül az évszám (pl. 73(1), , 1986) Táblázat(ok): a táblázatok Windows XP vagy újabb verzióval készüljenek, és legyenek címmel ellátva. Ábrá(k): színes ábrákat és fotókat nem áll módunkban leközölni, az esetleges színes ábrák fekete-fehér kópiában jelennek meg. Folyóiratreferátumok: Ezek esetében csak a referáló nevét és a forrást kell feltüntetni, (felül magyarra fordított cím, alatta a forrás pontos adatai, alul a referáló neve). A folyóirat-referátum a két gépelt oldal ter jedelmet ne haladja meg, az előbbiekben valamint az eredeti közleményeknél említett követelmények megtartása mellett. Kérjük a szerzőket, hogy a cikkeket -en adják le szer kesztőségünknek, és amennyiben mód van rá, kinyomtatott formában is juttassák el azt a Biotest Hungaria Kft. irodájába. Cím: 2045 Törökbálint, Torbágy u. 15/A biotest@biotest.hu vagy karabelyos.csaba@biotest.hu 2
3 Újabb adatok a lupus patogenezisében Újabb adatok a lupus patogenezisében Dr. Tarr Tünde DEOEC, Belgyógyászati Intézet, Klinikai Immunológiai Tanszék, Debrecen Összefoglalás: A szisztémás lupus erythematosus (SLE) sok szervet érintő autoimmun kórkép, melyre elsősorban nukleáris antigének elleni patogén autoantitestek megjelenése jellemző. Lupusban a saját antigénekkel szembeni tolerancia elvesztését genetikai-, epigenetikai faktorok, környezeti tényezők befolyásolják. A patogenezisben mind az innate, mind az adaptív immunrendszer nagyon fontos szerepet tölt be. Az innate immunrendszer sejtes elemei közül kiemelkedő a neutrofil granulocyták és plazmacytoid dendriticus sejtek (pdc) szerepe. A pdc-k által termelt interferon-α-nak központi szerepe van a gyulladásos válasz felerősítésében, kialakításában. Az adaptív immunrendszer részéről az autoreaktív T- és B-sejtek is szintén kiemelkedő jelentőséggel bírnak. A B-lymphocytákból differenciálódó plazma sejtek által termelt autoantitestek különböző mechanizmussal okozhatnak sejt, szövet és szervkárosodást. A szerző jelen munkában három területet érint, az innate és adaptív immunrendszer újabban felismert, az SLE patogenezisében résztvevő fontosabb elemeit, valamint az autoantitestek által okozott szövetkárosodás lehetséges mechanizmusait. Kulcsszavak: SLE, autotolerancia, autoantitestek, innate-, adaptív immunrendszer, szerv károsodás Bevezetés A szisztémás lupus erythematosus (SLE) a szisztémás autoimmun kórképek képviselője, mely a bőr, a belső szervek, a mozgás szervrendszer, valamint az idegrendszer érintettségével, döntően gyulladásos elváltozásával jár. Jellemzően számos autoantitest mutatható ki a betegek szérumában, melyek különböző mechanizmussal járulhatnak hozzá a betegég klinikai tüneteinek kialakulásához. Az antitestek megjelenése évekkel megelőzhetik a manifeszt betegséget. Az SLEre jellemző a saját sejt struktúrák elleni autotolerancia elvesztése. A betegség genetikailag fogékony egyénekben, környezeti trigger faktorok, mint például vírus, bakteriális infekciók, gyógyszerek, napfény hatására iniciálódik. A betegség patogenezisében mind az innate, mind az adaptív immunrendszer, ezeknek mind a humoralis, mind a sejtes elemei egyaránt részt vesznek. A patogenezisben szerepet játszó fontos elemek az 1. ábrán vannak összefoglalva (1). Genetikai, epigenetikai tényezők Egyre bővül azon felismert génhibák, génváltozatok száma, melyek megléte SLE-vel összefüggésbe hozható. Állatmodellek tették lehetővé először a genetikai háttér vizsgálatát, izolált gének szerepének tisztázását, immunológiai eltérések tanulmányozását, környezeti Summary: Systemic lupus erythematosus (SLE) is a systemic autoimmun disease with multi-organ inflammation. SLE is characterized by global loss of self-tolerance with activation of autoreactive T and B cells leading to production of pathogenic autoantibodies and tissue injury. The loss of tolerance with subsequent immune dysregulation is a consequence of genetic, epigenetic factors and environmental triggers. Aberrant innate and adaptive immun responses play a significant role in the pathogenesis of SLE, contributing both to tissue injury via release of inflammatory cytokines as well as to aberrant activation of autoreactive B and T cells, with the latter leading to pathogenic autoantibody production and resultant end-organ damage. This review will focus on three major areas, dysregulation of innate and adaptive immun responses in the pathogenesis of SLE, and the role of autoantibodies in triggering of organ injury. Keywords: SLE, autotolerance, autoantibodies, innate-, adaptive immune response, organ damage tényezők szerepének elemzését, a tünetek megjelenése előtti és utáni történések elkülönítését. A human genom feltérképezésével megismertük azokat a gén polimorfizmusokat, melyek hajlamosítanak az SLE kialakulásra. Ma már több, mint 50 olyan gén ismert, melyeket SLE fogékonysági génként tartunk számon. A legerősebb genetikai asszociáció a HLA vagy más néven MHC génekkel mutatható ki. Az MHC II-es és III-as osztályba tartozó gének közül a HLA-DR2 és HLA-DR3 erős fogékonyságot jelent SLE-re. A HLA gének a különböző rasszokban eltérőek lehetnek, ezen túl egyes MHC gének meghatározhatják az autoantitest profilt, ezáltal a betegség klinikai tüneteit, súlyosságát is (4). A genetikai faktorok másik nagy csoportját a nem-hla gének adják. Mind az adaptív, mind az innate immunrendszer működésének számos pontján sikerült olyan gén polimorfizmust azonosítani, melyek szintén SLE fogékonysági génként ismertek. Ezen gének polimorfizmusa következtében defektív lehet az apoptosis, a sejttörmelékek eltakarítását végző clearance mechanizmusok, de számos polimorfizmust leírtak a B- és T-sejtek, vagy antigén prezentáló sejtek működése kapcsán is (8). A genetikai tényezők önmagukban nem elégségesek ahhoz, hogy autoimmun kórkép, SLE kialakuljon. Még a teljesen azonos genetikai tulajdonsággal bíró homozigóta ikrekben sem 100% a betegség konkordanciája. Emiatt irányultak a kutatások az epigenetikai tényezők 3
4 Újabb adatok a lupus patogenezisében Genetikai, epigenetikai tényezők Fokozott apoptosis B- és T-sejt szignál abnormalitás Dysregulált apoptosis, károsodott sejttörmelék clearance NETosis Autotolerancia elvesztése Másodlagos necroticus sejtek/neoepitópok Monocyta és dendriticus sejt abnormalitás Antitest képzés és felszaporodás Autoantitestek és szervkárosodás 1. ábra: Az SLE patogenezisében részt vevő tényezők felé. Több mechanizmus is ismert, melyeket összefüggésbe hozzák SLE-vel. Ezek közül kiemelhető a DNS hypometilációja. SLE-ben, mind a T- és B-lymphocyták hypometilációját leírták. A T-sejtek közül a CD4+ T-sejtekben számos metiláció szenzitív gén túlműködése kimutatható, a hypometiláltság foka a betegség aktivitásával korrelál (19). A másik nagyon fontos epigenetikai tényező, amit saját munkacsoportunk is vizsgált a mikro RNS-ek. Ezek olyan nem kódoló RNS szakaszok, melyek fontos szerepet játszanak a gén expresszió szabályozásában, ezen keresztül a sejtek proliferációjában és differenciálódásában. Számos mirns ismert, melyek részt vesznek a gyulladásos citokinek képződésének szabályozásában vagy T-, B-sejt útvonalat, esetleg Toll like receptor függő lépéseket regulálnak. SLE-ben például a mir-146a csökkent működése mutatható ki. A mir146a egy olyan mikro RNS melynek csökkent működése fokozza az I. típusú interferon indukálta gének expresszióját, és fokozódik az interferon- képzése, mely, mint pleiotrop citokin számos immunkompetens sejt aktivációjához vezet (6,20). Innate immunrendszer szerepe Fokozott antigén kínálat, apoptosis, NETosis A sejten belüli folyamatok közül az autoimmunitás szempontjából kulcsfontosságú a programozott sejthalál szabályozása. SLE-ben az apoptosis többféle zavarát igazolták. Egyrészt rágcsáló modellben adott genetikai háttérrel rendelkező ún. spontán lupusos egerekben kimutatták a Fas receptor és a Fas ligand mutációit, melyek defektív apoptosissal járnak. Ennek következtében az autoreaktív T-sejtek tovább élnek, és a mutációk szoros összefüggésben állnak az autoimmun jelenségekkel. A fokozott apoptosis következménye a sejttörmelék megjelenése a keringésben, melynek legfontosabb összetevője a hiszton fehérjékből és DNS-ből álló nucleosoma, ez ismereteink szerint autoantigén forrásként szolgálhat. SLE-ben nagy mennyiségben mutattak ki a keringésben nucleosomát, illetve megjelennek nucleosoma specifikus T-sejtek és nucleosoma elleni autoantitestek, amelyek szoros korrelációt mutatnak az SLE-vel, illetve annak aktivitásával, valamint igazolt a szerepe a lupus nephritis patogenezisében (17). Ma már tudjuk, hogy az autoantigének nem csupán a programozott sejthalálból származhatnak, hanem neutrofil granulocyták egy speciális sejthalál formájából a NETosis kapcsán is keletkezhetnek. Ma úgy tartják, hogy ez adja a fokozott autoantigén kínálat túlnyomó részét. Az aktivált, saját antigéneket tartalmazó neutrofilek a NETosis során a sejtekben található NET-eket (neutrofil extracellular traps) bocsátanak ki, melyek myeloperoxidázt, hisztont, kromatint, elasztázt, mátrix metaloproteinázt, calthecidint, LL37-et tartalmaznak. A NET-ekből kiszabaduló sejttörmeléket a DNAase I degradálja, melynek a csökkent aktivitása SLE-ben jól ismert. A 4
5 jelentős mennyiségű extracellularis DNS a plazmacitoid dendriticus sejtek interferon- képződését, B-sejt aktivációt és autoantitest termelést eredményez (3,14,21). Plazmacytoid dendriticus sejtek és interferon-α Az SLE patogenezisének egyik legfontosabb citokinje az interferon-, melyet legnagyobb mennyiségben a plazmacitoid dendriticus sejtek (pdc) termelnek. A pdc-eket az apoptosis vagy NETosis során keletkező DNS-antimikrobiális peptid-antitest komplexe aktivál endocytosissal vagy a Toll like receptor 7-es vagy 9-esen keresztül, mely nagy mennyiségű interferon- képződéséhez és szekréciójához vezet. Az interferon hatására mintegy 400 gén aktivitása fokozódik, létre hozva az úgynevezett interferon szignatúrát. Az interferon indukálta gének, a szérumban mérhető interferon- szintje és a betegség aktivitása között lineáris összefüggés van. Az interferon- egy pleiotrop citokin, mely számos immunkompetens sejtre hatással van. Az interferon hatására fokozódik a monocyták differenciálódása, a dendriticus sejteken fokozódik az MHC és a kostimulációs molekulák expressziója, T-sejt aktiváló kapacitásuk is fokozódik. Hasonlóan nő a B- és T-sejtek aktivációja és differenciálódása, a B-sejtekben fokozódik az immunglobulin osztályváltás és plazmasejtekké történő differenciálódás. Nő a természetes ölő sejtek (NK) aktivitása, valamint különböző kemoatraktánsok képződése is (10,13,18). Adaptív immunrendszer szerepe B- és T-lymphocyták Az adaptív immunrendszer részéről a lupus patogenezisének központi szereplői a B-lymphocyták és a belőlük differenciálódó plazmasejtek. A B-sejtek intrinsic szignál abnormalitással bírnak, mely hozzájárul az autotolerancia elvesztéséhez. B-sejtek szerepe nem csak az autoantitest képzésre korlátozódik. A B-sejtek szabályozzák a T-lymphocytákat és a dendriticus sejteket, továbbá citokineket termelnek. A patogenezis szempontjából fontosnak tűnik a B-sejt tolerancia elvesztése. Igazolódott, hogy a B-sejt tolerancia megszűnésének többféle módja lehet SLE-ben. Ezek a deléció, a klonális ignorancia elmaradása, kisebb mértékű receptor felhígulás, megváltozott receptor feldolgozás ( editing ), a spontán megjelenő, illetve fokozott CD4+ T-helper sejt, valamint a csökkent CD4+/CD25+ regulatoricus T-sejt aktivitás. A B-sejt tolerancia elvesztését idézheti elő T-sejt independens poliklonális aktiváció is, amelyet a természetes immunitás, közelebbről a TLR-ok közvetítenek. A B-sejtekből differenciálódó plazmasejtek közül a magas affinitású IgG típusú antitest termelő hosszú életű plazmasejteknek van kiemelt szerepe, melyek hosszú ideig kimutathatók a keringésben. Ezen túl tudjuk, hogy a regulatív feladatokat ellátó B sejtek száma és funkciója is csökkent SLE-ben (9,12). Hasonlóan a B-sejtekhez a T-sejtek is intrinsic szignál abnormalitással rendelkeznek. A számos T-lympho cyta alcsoport közül szinte valamennyi részt vehet a lupus patogenezisében. A CD4+ T helper sejtek szerepe, mint tudjuk a B-sejt aktivációhoz elengedhetetlen. A cytotoxicus CD8+ T-sejteknek és T-helper 17-es sejteknek elsősorban a lupus nephritis patogenezisében van szerepe, ezen túl jól ismert, hogy a természetes, regulatív T-sejtek száma és funkciója is csökkent lupusban (2,5,15). A T-helper sejtek közül ki kell emelni az úgynevezett follicularis T-helper sejteket. Ezek a sejtek a másodlagos nyirokszervek centrum germinatívumában segítik a B-sejtek érését. CD4+ T-helper sejtekből differenciálódnak interleukin 12 hatására, ICOS-t és CXCR5-öt expresszálnak, interleukin 21-et termelnek. A segítségükkel megy végbe a centrum germinatívumban a B-sejtek érése és differenciálódása memória B-sejtekké és hosszú életű plazmasejtekké. Irodalmi adatok és saját megfigyeléseink szerint is SLE-s betegekben nő a periférián keringő follicularis T-helper-szerű sejtek száma, ezzel párhuzamosan emelkedik mind a rövid, mind a hosszú életű plazmasejtek aránya. A follicularis T-helper sejtek és a betegség aktivitása között lineáris összefüggés van (11,22). Szerv és szövetkárosodás lehetséges mechanizmusai SLE-ben a fokozott autoantigén kínálat autoantitestek megjelenéséhez vezet. A leggyakrabban előforduló antitesteket az 1. táblázat tartalmazza. Az autoantitestek Az autoantitest elnevezése anti-natív DNS anti-denaturált DNS anti-hiszton anti-kromatin anti-nucleosoma a-sm a-u1rnp a-ss-a a-ss-b a-scl70 a-ku PNCA anti-riboszomális P protein RF antifoszfolipid-antitest Újabb adatok a lupus patogenezisében Target antigén dupla szálú DNS egyszálú DNS H1, H2A, H2B, H3, H4 hisztonfehérjék dsdns, hiszton- és nem hisztonfehérjék dsdns és H2A/H2B, H3, H4 fehérjék U1 SnRNP B/ B, D, E, F, G proteinjei az U1 snrnp komplexből az U1, A és C 60 és 52 kd tömegű fehérje, Y1-Y5 RNS-sel 48 kd tömegű protein srns-sel topoizomeráz I 86 és 66 kd-os fehérjék 36 kd-os fehérje P0, P1, P2 foszfoproteinek IgG anionos foszfolipidek és protein kofaktor (pl. kardiolipin, anti- 2- glikoprotein I) ANCA neutrofil citoplazma vörösvérsejt elleni AT vörösvértest-felszíni antigének thrombocyta elleni vérlemezke-felszíni antigén antitest fehérvérsejt elleni neutrofil sejtfelszíni molekulák antitest endothel elleni AT endothel sejt 1. táblázat: Keringő antitestek és targetjeik SLE-ben 5
6 előfordulása betegenként változó lehet, meghatározva a klinikai tüneteket. Az autoantitestek különféle mechanizmussal okozhatnak szervkárosodást. SLE-ben az autoantigén-antitest kapcsolat révén immunkomplexek keletkezhetnek. Létrejöhetnek in loco, vagy a keringésben cirkulálhatnak. A legtöbb szervben, például vesében, bőrben, ízületben az immunkomplexek komplementet aktiválnak, lokális gyulladásos választ okozva. Ismert az autoantitestek direkt sejtkárosító hatása is, például a vér agy gát sérülése esetén a központi idegrendszerbe bejutó autoantitestek direkt neuronalis károsodást okozhatnak. Ugyanakkor SLE-ben fontosak az antifoszfolipid antitestek, melyek a véralvadási rendszer befolyásolása révén fokozott thrombosis készséget okoznak, vagy a hagyományos rizikó faktorokkal közösen részt vesznek az atherosclerosis kialakításában is (7,16). Összefoglalva elmondható, hogy az SLE patomechanizmusa egyre jobban ismert. A genetikai és epigenetikai faktorok feltérképezése folyamatosan bővül. A patogenezisben az innate és adaptív immunrendszernek is fontos szerepe van. Az innate immunrendszer cellularis elemei közül ki kell emelni a neutrofil granulocytákat, melyek a NETosis során fő autoantigén forrásként funkcionálnak. Ezek aktiválni képesek a plasmocytoid dendriticus sejteket, melyek nagy mennyiségű interferon- -t szecernálnak. Az interferon aktiválja az autoreaktív T-helper sejteket, mely B-sejt aktivációhoz, autoantitest képzéshez, majd sejt, szövet és szervkárosodáshoz vezethet. A patomechanizmus egyre jobb megismerése lehetővé teszi SLE-ben is a célzott terápiák fejlesztését. Irodalomjegyzék 1. Adinolfi A., Valentini E., Calabresi E. et al.: One year in review 2016: systemic lupus erythematosus. Clin. Exp. Rheumatol., 34(4), , Alunno A., Bartoloni E., Bistoni O. et al.: Balance between regulatory T and Th17 cells in systemic lupus erythematosus: the old and the new. Clin. Rev. Immunol., doi: /2012/ Aringer M., Günther C., Lee-Kirsch M.: Innate immune processes in lupus erythematosus. Clin. Immunol., 147(3), , Armstrong D., Zidovetzki R., Alercon-Riquelme M. et al.: GWAS identifies novel SLE susceptibility genes and explains the association of the HLA region. Genes Immun., 15(6), , Borchers A., Leibushor N., Naguwa S. et al.: Lupus nephritis: A critical rewiew. Autommm. Rev., 12, , Chen J., Papp G., Póliska S. et al.: MicroRNA expression profiles identify disease-specific alterations in Újabb adatok a lupus patogenezisében systemic lupus erythematosus and primary Sjögren s syndrome. PLoS One. 24, 12(3), e , Choi J., Kim S., Craft J.: The pathogenesis of systemic lupus erythematosus-an update. Curr. Opion. Immunol., 24, , Dai C., Deng Y., Quinlan A. et al.: Genetics of systemic lupus erythematosus: immune response and end organ resistance to damage. Curr. Opin. Immunol., 0, 87-96, Dörner T., Giesecker C., Lipsky P.: Mechnisms of B cell autoimmunity in SLE. Arthr. Res. Ther., 13(5), 243, Elkon K., Wiedeman A.: Type I INF system in the development and manifestation of SLE. Curr. Opin. Rheumatol., 24 (5), , Huijuan M., Suigui W., Changqing X.: New insights into the immunopathogenesis of systemic lupus erythematosus: the role of follicular helper cells. Chin. Med. J., 127(19), , Kil L., Hendriks R.: Abberant B cell selection and activation in systemic lupus erythematosus. Intern. Rev. Immunol., 32 (4), , Kim J., Park S., Kim H.: A plasmacytoid dentritic cellstype I interferon axis is a critically implicated in the pathogenesis of systemic lupus erythematosus. Int. J. Mol. Sci.,16(6), , Knight J., Kaplan M.: Lupus neutrophils: NET gain in understanding lupus pathogenesis. Curr.Opin. Rheumatol., 24(5): , Lech M., Anders H.: The pathogenesis of lupus nephritis. J. Am. Soc. Nephrol., 24(9), , Liu Z., Davidson A.: Taming lupus-a new understanding of pathogenesis is leading to clinical advances. Nat. Med., 6, 18(6), , Mahajan A., Herrmann M., Muñoz L.: Clearance Deficiency and Cell Death Pathways: A Model for the Pathogenesis of SLE. Front. Immunol., 8, 7, 35, Mauri C., Menon M.: The many faces of type I interferon in systemic lupus erythematosus. J. Clin. Invest., 125(7), , Miceli-Richard C.: Epigenetics and lupus. Joint Bone Spine, 82(2), 90-93, Qu B., Shen N.: mirnas in the Pathogenesis of Systemic Lupus Erythematosus. Int. J. Mol. Sci., 28, 16(5), , Smith C., Kaplan M.: The role of neutrophils in the pathogenesis of systemic lupus erythematosus. Curr. Opin. Rheumatol., 27(5), , Szabó K., Papp G., Szántó A. et al.: A comprehensive investigation on the distribution of circulating follicular T helper cells and B cell subsets in primary Sjögren s syndrome and systemic lupus erythematosus. Clin. Exp. Immunol., 183(1), 76-89,
7 A Sjögren-szindróma súlyos klinikai formái A Sjögren-szindróma súlyos klinikai formái Dr. Szántó Antónia DEOEC, Belgyógyászati Intézet, Klinikai Immunológia Tanszék, Debrecen Összefoglalás: A Sjögren-szindrómás betegek mintegy harmadánál a glandularis tüneteken kívül extraglandularis tünetek is jelentkeznek, melyek között súlyos klinikai formák is előfordulnak. Ezek közül a közlemény a tüdőérintettséget, a cryoglobulinaemiát és a limfómaképződést tekinti át. A tüdőérintettség diagnózisában ma már nem feltétlenül kell szövettani mintavételre törekedni, hiszen a modern képalkotó eljárások lehetőséget adnak ezek mellőzésére. Kivételt képez a limfóma gyanúja, amikor elengedhetetlen a pontos hisztopatológiai diagnózis. A cryoglobulinaemia felismerése a legnagyobb limfómakockázatú csoportba sorolja a Sjögren-szindrómás beteget. Kimutatása számos buktatót rejt magában, emiatt alapos klinikai gyanú esetén a negatív eredményt nem szabad elfogadni, többszöri ismétléssel kell törekedni az álnegatív eredmény elkerülésére. A kezelésben immunszuppresszív és immunmoduláns kezelés kombinálására van szükség. A malignus limfómák kezelése hematológiai feladat, de különböző klinikai tünetek illetve biomarkerek segítségével azonosítani lehet azokat a betegeket, akiknél nagy a kockázata a limfóma kialakulásának, így az immunológiai gondozás lehetőséget ad arra, hogy a limfóma irányú progressziót időben felismerjük. Kulcsszavak: Sjögren-szindróma, extraglandularis tünet, interstitialis tüdőbetegség, cryoglobulinaemia, limfóma Bevezetés A Sjögren-szindrómás betegek többségének tünetei a glandularis tünetekre (szem-, szájszárazság és egyéb exokrin mirigyek funkciójának csökkenése) korlátozódnak. Ezek a betegek nem igényelnek szisztémás immunszuppresszív kezelést, kórlefolyásuk enyhe, és bár életminőségüket hátrányosan befolyásolhatja a Sjögren-szindróma jelenléte, életkilátásaik nem különböznek kortársaikétól. A betegek mintegy harmadában azonban extraglandularis tünetek jelentkeznek, melyek között kifejezetten súlyos, életveszélyes vagy akár halálos kimenetelűek is előfordulnak. A Sjögren-szindróma súlyos klinikai formáinak meghatározása szubjektív; talán a közelmúltban megjelent betegségaktivitási index (ESSDAI EULAR Sjögren s syndrome disease activity index) szolgálhat támpontként a súlyosnak számító szervi érintettségeknek, illetve egy-egy adott szervi manifesztáció különböző súlyossági fokainak objektív megítélésében (17). Jelen közlemény keretei a legnagyobb gyakorlati jelentőséggel bíró szövődmények ismertetésére adnak lehetőséget. Tüdőérintettség Sjögren-szindrómában A légzőszervi manifesztációk prevalenciája a különböző irodalmi adatok alapján jelentős ingadozást Summary: During the disease course of Sjögren s syndrome, one third of patients develop extraglandular symptoms leading to severe organic manifestations. Among these, the paper summarizes pulmonary involvement, cryoglobuli nemia and progression to lymphoma. Regarding pulmonary involvement, exact histopathological diagnosis is no more necessary, except for the suspicion of lymphoma. In many other cases, modern imaging techniques allow the avoidance of biopsy sampling. Presence of cryoglobulinemia means the highest risk for malignant lymphoma. Detection of cryoglobulinemia has numerous pitfalls regarding sampling, transport and analysis. Therefore, if clinical suspicion is high, repeated analyses are required in order to rule out false negative results. Management of cryoglobulinemia requires combination of immunosuppressive and immunomodulant treatment. Although the management of malignant lymphoma remains a hematological task, it is possible to identify patients with high risk for lymphoma. Using clinical symptoms and biomarkers for the detection of high lymphoma risk, even immunologic follow-up is able to recognize lymphoma development. Keywords: Sjögren s-syndrome, extraglandular symptoms, interstitial lung disease, cryoglobulinemia, lymphoma mutat (9-75%), ez részben a betegpopulációk különbözőségéből, részben a tüdőérintettség definíciójának eltéréseiből adódik. Ha a tüdőérintettséget úgy definiáljuk, hogy légúti klinkai tünetek mellett vagy a légzésfunkciós tesztek, vagy a képalkotó eljárások mutatnak valamilyen eltérést, akkor a gyakoriság 9-22% közöttire módosul (10). A tüdőérintettség kialakulásának fő rizikótényezői a férfi nem, dohányzás, késői betegségkezdet és a hosszú betegségfennállási idő. A klinikai tünetek a kínzó, száraz köhögés, légszomj, ritkábban mellkasi fájdalom és láz lehetnek (5). Vizsgálati lehetőségek A légzésfunkciós tesztek a tüdők (restriktív tünetegyüttes) vagy a légutak (obstruktív tünetegyüttes) funkciókárosodását jelzik. A leggyakoribb eltérés a csökkent szénmonoxid-diffúziós kapacitás (DLCO), bár egyesek szerint ez nem elég szenzitív a szubklinikus eltérések észlelésére. (3) Képalkotó eljárások közül alapvizsgálatnak számít a mellkas röntgen, melynek során gyakoriak, de nem specifikusak az eltérések, melyek nem is feltétlenül mutatnak összefüggést a légzésfunkciós tesztekkel vagy a tünetekkel. Szenzitívebb a HRCT (nagy felbontású computer tomográfia), mely már a tüdőérintettség 7
8 formájára is enged következtetni a mintázat alapján (1. táblázat). Ezek a mintázatok olyan jól korrelálnak a hisztopatológiai eltérésekkel, hogy interstitialis pneumonia esetén rutinszerűen már nem is javasolnak tüdőbiopsziát (9,10,11). Mintázat Interstitialis pneumonia Lymphoproliferativ mintázat Cryptogen organizáló pneumonia Bronchiolitis CT jellegzetességek intralobularis interstitium megvastagodás, tejüveghomály, lépesméz-rajzolat, bronchiectasia, cysták tejüveghomály, a peribronchovascularis interstitium és interlobularis septum megvastagodása tejüveghomály, consolidatio centrilobularis abnormalitások (elágazó homályok, kis csomók) 1. táblázat: Összefüggés a CT mintázat és a tüdőérintettség típusa között (11) Bronchoalveolaris lavage során általában lymphocytosis észlelhető. A legpontosabb diagnózishoz természetesen kórszövettani vizsgálattal juthatunk, de a képalkotó eljárások korszerűsödésével egyes esetekben ez akár el is kerülhető (9,10). A tüdőérintettség típusai I. A légutak betegségei A betegek viszonylag gyakran számolnak be bronchialis hyperreaktivitásról, azaz légúti irritatív anyagok beszippantása utáni száraz ingerköhögésről. Ennek kezelésére inhalatív szteroidkészítmények kipróbálása ajánlott, változó hatékonysággal. A bronchiolitis a leggyakoribb légúti manifesztáció Sjögren-szindrómában; előfordulhat önállóan, de társulhat interstitialis tüdőbetegséggel is. Általában enyhe kórlefolyású, de súlyos formák is előfordulhatnak. A kezelésben szteroidon kívül rituximab vagy makrolid antibiotikum jön szóba. Idősebb betegeknél, illetve hiatus hernia jelenléte esetén gyakoribb a bronchiectasia, melyre a simaizom elleni antitest pozitivitás és az anti-ss-a ritkább előfordulása jellemző, és gyakran szolgál visszatérő légúti fertőzések alapjául (2,5,7,18). A Sjögren-szindróma súlyos klinikai formái a kétoldali basalis reticularis rajzolatfokozódás trakciós bronchiectasiával, peri-bronchovascularis terjedéssel. Kimenetele változó lehet: reverzíbilis; stabil - reziduális betegséggel; progresszív; irreverzíbilis a stabilizálódás lehetőségével, illetve irreverzíbilis és terápiarefrakter. A kezelés 0,5-1 mg/ttkg szteroid adását jelenti cyclophosphamiddal vagy azathioprinnal. A rituximab használatával kapcsolatban is vannak kedvező tapasztalatok, de az ezekről beszámoló klinikai vizsgálatok nem különítették el a különböző ILD altípusokat (5,6). 2. Szokványos interstitialis pneumonia (UIP) CT képére a kétoldali intralobularis reticularis rajzolatfokozódás, trakciós bronchiectasia és kis cysticus képletek jellemzőek, illetve a lépesméz rajzolatot is ebben a formában látjuk leggyakrabban. Irreverzibilitás és terápiarefrakteritás jellemzi, prognózisa rosszabb, mint a NSIP-é. 3. Lymphocytás interstitialis pneumonia (LIP) A LIP (1. ábra) feltehetőleg folytonosságot képvisel a follicularis bronchiolitisszel. CT mintázatának jellegzetességei ennek megfelelően a megvastagodott bronchovascularis kötegek, csomók, tejüveg-homályok és az interlobularis septum megvastagodása. A klonalitás felmérésére ennek az altípusnak a gyanújánál mindig szükséges biopszia, ennek a benignus limfoproliferatív folyamatnak a limfómától való elkülönítésére. A LIP általában reverzíbilis, de a progresszió kockázatát is magában hordozza. Kortikoszteroidok alkalmazásával a betegek állapota stabilizálódik vagy akár javulhat. Egyéb immunszuppresszív szerek (azathioprin, cyclophosphamid) változó hatékonyságúak (5,19). II. Interstitialis tüdőbetegség (ILD) Az ILD annyira jellegzetes Sjögren-szindrómára, hogy ILD diagnózisa esetén Sjögren-szindróma irányában kell kivizsgálni a beteget, a Sjögren-szindrómás betegeket pedig rendszeresen szűrni kell ILD-re (klinikai gyanú esetén mellkas CT végzésével) (5). Az ILD-nek négy fő típusát különítjük el: 1. Nem-specifikus interstitialis pneumonia (NSIP) A NSIP a leggyakoribb ILD altípus Sjögren-szindrómásoknál. Sajátos CT képe segít elkülöníteni a szokványos interstitialis pneumoniától (UIP): jellegzetességei 1. ábra: Limfocitás interstitialis pneumonia, HE, 10x (saját anyag) 4. Organizáló pneumonitis CT képe foltos homályokat mutat subpleuralis vagy peribronchovascularis elhelyezkedéssel, gyakran kétoldali megjelenéssel, tejüveghomályokkal vagy centrilobularis csomókkal. Szövettani vizsgálat során gyakran NSIP és organizáló pneumonia átfedését látjuk. Bár a betegek kezdetben jól reagálnak szteroidra, gyakori a relapszus és az NSIP kialakulása. Ilyenkor azathioprin, cyclophosphamid vagy rituximab jön szóba (9,13). 8
9 III. Tüdő limfóma A primer tüdőlimfómára radiológiailag egyszeres vagy többszörös nodulusok, tejüveghomály, mediastinalis lymphadenopathia és pleuralis folyadék jelenléte figyelmeztet. Elengedhetetlen a szövettani diagnózis, kezelése pedig hematológus feladata (5). Sjögren-szindróma és cryoglobulinemia A cryoglobulinok olyan immunglobulinok, melyek testhőmérsékletnél alacsonyabb hőmérsékleten kicsapódnak, majd újramelegítéskor ismét feloldódnak. Három fő típusuk különíthető el összetételük alapján (2. táblázat). A cryoglobulinemia az esetek egy részében tünetmentes, de a szimptómás eseteknek van egy jellegzetes triásza: purpura, arthralgia, gyengeség (16). A cryoglobulinaemia jelenléte a legnagyobb limfóma-rizikójú csoportba sorolja a Sjögren-szindrómás beteget, ezenkívül rövid túléléssel és extraglandularis tünetek kialakulásával asszociált. A cryoglobulinok az I-es típusban hyperviscositással, a II-III. típusban immunkomplex-vasculitises mechanizmussal okoznak szövetkárosodást. Ez utóbbi jellemző a Sjögren-szindrómára is. A vasculitis bőrtüneteként tapintható purpurák észlelhetők leginkább az alsó végtagokon, ritkábban a kezeken és a törzsön is. A tüneteket fizikai megterhelés, illetve epilálás is provokálhatja. A betegek harmadában veseérintettséggel (glomerulonephritis), 17-60%-ban perifériás neuropathiával (polyneuropathia, ritkábban mono neuritis multiplex) találkozhatunk. Ritkábban gast rointestinalis- (akár bélperforációt is okozhat), tüdő- (effort dyspnoe, alveolaris vérzés, tüdőfibrosis), központi idegrendszeri (stroke) érintettséget, de myocardialis vasculitist is okozhat (1,8,14). A cryoglobulinok kimutatása számos nehézségbe ütközhet: a diagnózis a megfelelő mintavételen és szállításon áll vagy bukik. A preanalitikai hiba miatti álnegatív eredmény elkerüléséhez elengedhetetlen, hogy a vérvétel 37 C-ra előmelegített csőbe történjen, ezután pedig a szállítás, alvadás, centrifugálás egyaránt 37 C-on menjen végbe. Ezt követően 3-7 napon át +4 C-on kell tartani a szérumot. Ha krioprecipitátum képződik, meg kell vizsgálni, hogy feloldódik-e 37 C-ra visszamelegítve. Ha nem, akkor a vizsgálat eredményét negatívnak kell tekinteni. Ha az eredmény pozitív, akkor következhet a kriokrit analízis (16). A Sjögren-szindróma súlyos klinikai formái A cryoglobulinaemia kezelése Súlyos esetekben pulzusszteroiddal ajánlott kezdeni a kezelést, később fokozatosan a legkisebb effektív dózisig csökkentve. Ennek eléréséhez cyclophosphamiddal (0,75 g/m 2 ), azathioprinnal (2 mg/ttkg), mycophenolát mofetillel (2.000 mg) érdemes kombinálni a terápiát. Életveszélyes szövődmények esetén plazmaferezis ajánlott, melyet cyclophosphamiddal javasolt szinkronizálni a rebound-hatás kivédésére. Hepatitis-C társulása esetén antivirális kezelés is szükséges. Terápiarefrakter esetekben rituximab jön szóba (16). Limfóma kialakulása Sjögren-szindrómában A betegség legsúlyosabb szövődménye a limfoproliferatív kórképek kialakulása, ez Sjögren-szindrómában a leggyakoribb betegségspecifikus halálok. Leggyakrabban non-hodgkin limfómák fordulnak elő, a standardizált incidencia arány 18,8%. A limfómagenezis során lépésről lépésre modellezhető, amint a krónikus antigénstimuláció krónikus gyulladást eredményez, a B-sejt aktiváló faktor (BAFF) és I-es típusú interferonok fokozott termelése poliklonális B-sejt aktivációhoz vezet, mely szöveti szinten a kisnyálmirigyek benignus lymphoepithelialis léziójának kialakulását jelenti. Az immunglobulin nehézláncok egyre kevésbé változatos felhasználása a B-sejt proliferáció során oligo- majd monoklonális folyamathoz vezet. A B-sejtek a proliferáció során szomatikus mutáción, rekombináción és izotípusváltáson mennek keresztül. Amennyiben ezek során onkogének transzlokációja vagy tumorszuppresszor gének deléciója következik be, az utat nyit a malignus limfóma indolens vagy akár agresszív típusainak kialakulásához. (4,20) Leggyakrabban (mintegy 65%-ban) indolens, marginális zóna típusú limfómák kialakulásával kell számolnunk, ezek extranodalis formája Sjögren-szindrómában a mucosa-asszociált nyirokszövetet (MALT) érinti, döntő többségében a nyálmirigyekre lokalizálódik, csontvelő-infiltráció nem jellemző és B-tünetek sem gyakoriak. A nodalis típusban lymphadenopathia, csontvelőérintettség is előfordul. A második leggyakoribb típus (18%) az agresszív, magas malignitású limfómák csoportja, ez leginkább diffúz nagy B-sejtes altípust jelent. Egyes elméletek szerint ezek az ún. high-grade limfómák az előbb említett indolens limfómák transzformációjából származnak. A rituximab elterjedésével ennek az ag- Típus Összetétel Klinikai tünetek Társuló kórképek I. Monoklonális IgG,A,M Raynaud-jelenség, acrocyanosis, gangrena, livedo reticularis II. III. Poliklonális IgG, monoklonális IgM-RF aktivitással Poliklonális IgG, poliklonális IgM-RF aktivitással cutan vasculitis, purpura, fekély, nephropathia, neuropathia változatos Myeloma multiplex, Waldenström-makroglobulinaemia, MGUS Sjögren-szindróma, Krónikus HCV/HBV, HIV, limfoproliferatív betegség, egyéb autoimmun betegségek Krónikus fertőzések, autoimmun betegségek (lupus, RA, IBD) 2. táblázat: A cryoglobulinaemia típusai (16) Rövidítések: MGUS: monoclonal gammopathy of unknown significance, RF: rheumatoid faktor, HCV: hepatitis C vírus, HBV: hepatitis B vírus, HIV: humán immundeficiencia vírus, RA: rheumatoid arthritis, IBD: gyulladásos bélbetegség (inflammatory bowel disease) 9
10 resszív típusnak a prognózisa jelentősen megváltozott: a korábbi 37%-os kétéves túlélés a rituximab használata óta 100%-ra emelkedett (15). Természetesen a limfómák kezelése speciális hematológiai feladat, de az immunológiai gondozás feladata annak a nagy limfóma-rizikójú betegcsoportnak az azonosítása, akiknél fokozott figyelmet kell szentelni ennek a hematológiai malignitásnak az időben történő felismerésére. Számos olyan tényezőt azonosítottak, amelyek a limfómaképződés prediktorai lehetnek a Sjögren-szindróma kórlefolyása során: - tapintható purpura - alacsony C4 komplement szint - cryoglobulinaemia - splenomegalia - lymphadenopathia - tartós parotisduzzanat - neutropenia (marginális zóna típusnál) - lymphopenia (nem-marginális zóna típusnál) - magas szérum β2-mikroglobulin szint - korábbi rheumatoid faktor pozitivitás eltűnése - CD27 expresszió megjelenése. (1,4,15) Említést érdemel, hogy a tartós nyálmirigyduzzanat csak akkor számít rizikótényezőnek, ha négy biomarker (leukopenia, alacsony C4 komplement szint, cryoglobulinaemia, anti-la/ss-b pozitivitás) közül legalább kettő jelen van az adott beteg esetén (12). Összefoglalás A Sjögren-szindróma nem banális betegség, hiszen a fentiekből is látható, hogy a kórlefolyás során súlyos, életveszélyes klinikai formák is kialakulhatnak. A beteggondozás egyik legfontosabb feladata, hogy ezeket a szövődményeket időben felismerjük és kezelésüket a legkörültekintőbben tudjuk végezni, irányítani. Irodalomjegyzék 1. Baimpa E., Dahabreh I.J., Voulgarelis M. et al.: Hematologic manifestations and predictors of lymphoma development in primary Sjö gren syndrome: clinical and pathophysiologic aspects. Medicine (Baltimore), 88, , Borie R., Schneider S., Debray M-P. et al.: Severe chronic bronchiolitis as the presenting feature of primary Sjögren s syndrome. Respir. Med., 105, , Davidson B.K., Kelly C.A., Griffiths A.D.: Ten year follow-up of pulmonary function in patients with primary Sjögren s syndrome. Ann. Rheum. Dis., 59, , Dong L., Chen Y., Masaki Y. et al.: Possible mechanisms of lymphoma development in Sjögren s syndrome. Curr. Immunol. Rev., 9, 13-22, Flament T., Bigot A., Chaigne B. et al.: Pulmonary manifestations of Sjögren s syndrome. Eur. Respir. Rev., 25, , 2016 A Sjögren-szindróma súlyos klinikai formái 6. Gottenberg J-E., Cinquetti G., Larroche C. et al.: Efficacy of rituximab in systemic manifestations of primary Sjogren s syndrome: results in 78 patients of the Autoimmune and Rituximab registry. Ann. Rheum. Dis., 72, , Gudbjörnsson B., Hedenström H., Stålenheim G. et al.: Bronchial hyperresponsiveness to methacholine in patients with primary Sjögren s syndrome. Ann. Rheum. Dis., 50, 36-40, Horváth I.F., Szántó A., Papp G. et al.: Clinical course, prognosis and cause of death in primary Sjögren s syndrome. J. Immunol. Res., 2014, , Ito I., Nagai S., Kitaichi M. et al.: Pulmonary manifestations of primary Sjögren s syndrome: a clinical, radiologic and pathologic study. Am. J. Respir. Crit. Care Med., 171, , Kreider M., Highland K.: Pulmonary involvement in Sjögren s syndrome. Semin. Respir. Crit. Care Med., 35, , Matsuyama N., Ashizawa K., Okimoto T. et al.: Pulmonary lesions associated with Sjögren s syndrome: radiographic and CT findings. Br. J. Radiol., 76(912), , Quartuccio L., Isola M., Baldini C. et al.: Biomarkers of lymphoma in Sjögren s syndrome and evaluation of the lymphoma risk in prelymphomatous conditions: results of a multicenter study. J. Autoimmun., 51, 75-80, Ramos-Casals M., Brito-Zerón P., Sisó-Almirall A. et al.: Topical and systemic medications for the treatment of primary Sjögren s syndrome. Nat. Rev. Rheumatol., 8, , Ramos-Casals M., Stone J.H., Cid M.C. et al.: The cryoglobulinemias. Lancet, 379, , Routsias J.G., Goules J.D., Charalampakis G. et al.: Malignant lymphoma in primary Sjögren s syndrome: An update on the pathogenesis and treatment. Semin. Arthr. Rheum., 43, , Sargur R., White P., Egner W.: Cryoglobulin evaluation: best practice? Ann. Clin. Biochem., 47, 8-16, Seror R., Ravaud P., Bowman S.J. et al.: EULAR Sjögren s syndrome disease activity index: development of a consensus systemic disease activity index for primary Sjögren s syndrome. Ann. Rheum. Dis., 69, , Soto-Cardenas M-J., Perez-De-Lis M., Bove A. et al.: Bron chiectasis in primary Sjögren s syndrome: pre valence and clinical significance. Clin. Exp. Rheumatol., 28, , Swigris J.J., Berry G.J., Raffin T.A. et al.: Lymphoid interstitial pneumonia: a narrative review. Chest, 122, , Zintzaras E., Voulgarelis M., Moutsopoulos H.M.: The risk of lymphoma development in autoimmune diseases: a meta-analysis. Arch. Intern. Med., 165(20), ,
11 Autoimmun overlap szindróma Autoimmun overlap szindróma Prof. Bodolay Edit DEOEC, Belgyógyászati Intézet, Klinikai Immunológiai Tanszék, Debrecen Összefoglalás: A poliszisztémás autoimmun kórképek sajátossága, hogy társulhatnak egymással. Az Overlap Szindróma két vagy több szisztémás vagy szerv specifikus autoimmun betegség egy betegben észlelt együttes megjelenését jelenti. Az Overlap Szindróma nem ritka, a szisztémás autoimmun betegségek mintegy 20-30%-ában olyan szervi eltéréseket vagy autoantitesteket lehet kimutatni, amelyek egy másik poliszisztémás vagy szerv specifikus autoimmun kórképre jellemzőek. Klinikailag rendkívül fontos felismerni az Overlap Szindrómát, mert a több kórképre jellemző patogén autoantitestek jelenléte megváltoztathatja a tiszta autoimmun betegség tünettanát, a kórlefolyást, a prognózist, és a kezelési lehetőségeket is a kórképnek megfelelően kell megválasztani. Kulcsszavak: overlap szindróma, szisztémás autoimmun betegségek, autoantitestek, tünetek, prognózis Bevezetés A szisztémás autoimmun kórképek diagnosztikus vagy klasszifikációs kritériumai pontosan körülhatároltak. Adott klinikai tünettan, autoantitestek vagy rutin laboratóriumi paraméterek alapján véleményezhető a Szisztémás Lupus Erythematosus (SLE), a Rheumatoid Arthritis (RA), a Szisztémás Sclerosis (SSc), a Polymyositis-Dermatomyositis (PM/DM), a Sjögren szindróma (Sj), a Kevert Kötőszöveti Betegség (MCTD), az Antiphospho lipid szindróma (APS) és a Szisztémás Vasculitisek (1,11,17,20,22,24). Az elmúlt két évtizedben az immunológiai centrumokban gondozott betegek követése során észlelték, hogy mind gyakoribb azoknak a betegeknek a száma, akik több autoimmun betegségre jellemző sajátosságot hordoznak. A szisztémás autoimmun (AI) kórképben szenvedő betegek 25-30%-ban észleltek több szisztémás vagy szerv specifikus AI kórkép egyidejű jelenlétét. Ezt a kórállapotot nevezik Overlap Szindrómának. Az Overlap Szindróma (OS) két vagy több autoimmun betegség egy betegben történő egyidejű jelenlétét jelenti (6,8). Az OS csoportosítása: 1. Két vagy több definitív szisztémás AI betegség diagnosztikus kritériumai egyaránt megtalálhatók egy betegben. 2. Egy szisztémás AI kórkép mellett más szisztémás vagy szervspecifikus autoimmun betegségre sajátos tünetek vagy autoantitestek észlelhetők, amelyek nem szükségesek, hogy kimerítsék a második betegség diagnosztikus feltételeit. Az OS ismerete fontos, mert a tünettan, kórlefolyás, prognózis, kezelés többnyire eltér az ún. tiszta, csak egy AI kórkép sajátosságait hordozó betegektől. Egy Summary: The characteristics of autoimmune diseases is that they may associate with each other. Overlap Syndromes have been defined as entities satisfying classification criteria of at least two autoimmune diseases occurring at the same or at different times in the same patient. Overlap Syndrome (OS) is not rare, 20-30% of systemic autoimmune diseases contains clinical symptoms and autoantibodies, which are characteristics for other autoimmune diseases. Every combination between these disorders has been reported. To detect of OS is very important because the combination of autoantibodies can modify the symptoms of pure autoimmune disorders, disease course, prognosis, and the therapy may be different. Key words: overlap syndrome, systemic autoimmune disorders, autoantibodies, symptoms, prognosis 2015-ben megjelent tanulmányban 1321 SLE-s, RA-s, Sjögren szindrómás és APS beteg közül 68%-nak volt egy típusú autoimmun betegsége, míg 32%-ban két vagy több AI kórkép egyidejű megjelenését észlelték (9). Az OS jelenléte befolyásolta a tünettant is. A tiszta SLE-s betegek életkora 5 évvel fiatalabb volt, mint az SLE overlap-ben. Az SLE-RA társulás a kéz és/vagy a láb ujjainak deformálódásával, erozív arthritis megjelenésével járt együtt. APS-ben az SLE társulás volt a leggyakoribb. Az APS-overlap betegeknek nagyobb dózisban kellett kortikoszteroid (KS) kezelést alkalmazni immunszuppresszív szerrel kiegészítve, mint a tiszta APS-ben. Az OS időbeli megjelenése változó. Az első szisztémás AI betegséget hónapok vagy több év múlva követheti a második AI betegség. Nehezíti a diagnózis pontosítását, amikor két vagy több kórkép tünetei, immunológiai eltérései egy időben észlelhetők. Ez esetben a prospektív vizsgálat, a követés dönti el, milyen típusú betegség(ek) állnak fenn. Általánosságban elmondható, hogy a második AI betegség megjelenése határozza meg a betegséggel összefüggő károsodást. Az Overlap Szindróma patomechanizmusa Genetikus tényezők szerepe Egy adott szisztémás autoimmun betegségre jellemző MHC komplex génjei mellett ismertek olyan gének is, amelyek poliautoimmunitásra, autoimmun betegségek együttes megjelenésére hajlamosítanak (5,15). A STAT4 (signal transducers and activators of transcription-4) gén haplotípusok növelik az RA és az SLE kialakulásának valószínűségét. A STAT4 transzkripciós faktor, ami több citokin (az interleukin 12 (IL-12), 11
12 IL-23, IL-27) intracellularis szignál aktivációját fokozza. Ezek a szignál utak alapvetően befolyásolják az effektor sejteket RA-ban és SLE-ben is, elősegítve a Th1 és a Th17 sejtek differenciálódását és proliferációját. A PTPN22 (protein tyrosine phosphatase, non-receptor type 22) gének variánsai RA-val, Type 1 diabetes mellitussal és a Crohn betegséggel függnek össze. A CTLA 4 (cytotoxicus T-lymphocyta-asszociált) gének a lymphocyta túlélés és apoptosis szabályozásában szerepet játszó sejtfelszíni receptorokat kódoló gének, mutációjuk RA-val és más autoimmun betegségekkel függ össze. A genetikai ismeretek bővülése további pontosabb magyarázatot ad az overlap szindrómák kialakulására. Az AI betegségre hajlamosító MHC és nem MHC típusú gének eltérő fenotípus sajátosságokat mutatnak. A fenotípus sajátosságokat a geográfiai, etnikai különbségek, és ma még nem teljességgel ismert környezeti hatások módosítják. Melyek a klinikai gyakorlatban leggyakoribb Overlap Szindrómák? 1. Polymyositis/Dermatomyositis és OS 1/1 Anti-szintetáz szindróma: Az anti-szintetáz szindróma (ASS) a myositis, SSc, és az interstitialis légzőszervi betegség (ILB) klinikai tüneteit hordozó overlap (10). A szintetázok enzimek, melyeknek az intracytoplasmaticus fehérje szintézisben van jelentőségük. Eddig 8 különböző szintetáz ellen termelődő antitest ismert. Mindegyik autoantitest sajátos klinikai fenotípus formájában jelenik meg. Az anti-szintetázok myositis specifikus antitestek, melyek a PM/DM betegek szérumában 30-40%-ban kimutathatóak. A klinikai gyakorlatban leggyakoribb az anti-jo1 antitestek jelenléte, ami a PM betegek 31%-ában, a DM betegek 4,5%-ában megtalálhatók. Az anti-jo1 antitest jelenlétében myopathia, ILB, non erozív arthritis, láz, mechanikus kéz, az ujjak lateralis és palmaris részére lokalizálódó hyperkeratosis alakulhat ki. Az anti-jo1 antitest mellett megjelenő anti-ro/ssa pozitivitás rendkívül rossz kórlefolyású, az ILB progresszív, kedvezőtlen kórjóslatú pulmonalis fibrosissal jár. ASS-RA overlap: Az ASS betegek 17%-ában anti-citrullinált peptid antitest (ACPA) pozitivitással és RA megjelenésével lehet számolni. Az ACPA pozitív ASS betegek 91%-ában ízületi duzzanat, erózió alakulhat ki a metacarpophalangealis (MCP) ízületekben, a csuklóban és a proximalis interphalangealis (PIP) ízületben (12). Az anti-szintetáz szindróma terápiája: Az ASS prognózisát a pulmonalis eltérések mértéke, súlyossága határozza meg. ASS-ben az alveolitis akut szakában kortikoszteroid (KS) kezelést kell alkalmazni. Terápia rezisztens esetekben immunszuppresszív szerek, cyclophosphamid (CYC), azathioprin (AZA), mycophenolát mofetil, cyclosporin, tacrolimus adására is szükség lehet. A progresszív interstitialis pulmonalis gyulladás esetén Rituximab kezelés bizonyult a leghatékonyabbnak (23). Autoimmun overlap szindróma 2. Szisztémás sclerosis (SSc) overlap szindrómák A SSc mellett többnyire myositis jelentkezik, de társulhat Sjögren szindrómával, RA-val, SLE-vel (2,3). Myositis az SSc diagnosztizálása után akár tíz év múlva is jelentkezhet. A TNF- gátló biológiai terápiát sokkal óvatosabban kell adni az SSc-hez társuló overlap szindrómákban, mint más autoimmun kórképekben, mert súlyosbíthatják az alveolitist SSc-ben. A leghatásosabb biológiai szer a Rituximab, ami csökkenti a keringő és a dermalis B-sejtek számát, bár kevésbé hat a bőrtünetekre. 2/1 Scleromyositis: A scleromyositis a leggyakoribb overlap, ahol az SSc és a PM/DM tünetei észlelhetők, és a sclerodermás bőrtünetek mellett myositis és arthritis egyidejűleg jelentkeznek (14). Scleromyositisben az izomérintettség enyhe, mérsékelt a kreatin kináz (CK) emelkedés és elektromyographiával (EMG) is csak enyhe myogen eltérések észlelhetők. A sclerodermatosus bőrelváltozások a limitált cutan SSc (lcssc) jellemzőit hordozzák. Scleromyositisben az anti-pm/scl antitest mellett a mortalitási arány 21%, míg az anti-scl70 antitest jelenléte súlyosbította a kórlefolyást, és a mortalitás 75%-ra növekedhet. Kezelés: Az anti-pm/scl scleromyositis jól reagál KS adására. A diffúz cutan SSc-vel járó formákban az alveolitisek kezelésében a KS kezelés mellett bolus CYC, intravénás immunglobulin adása szükséges. Súlyos Raynaud jelenség és a digitalis fekélyben prosztaglandin készítmények, ET-1R antagonisták, foszfodieszteráz gátló szerek kombinációjára van szükség. A TNF- gátló szerek adása ronthatja az interstitialis légzőszervi betegséget. Terápia refrakter alveolitisben a Rituximab az egyedüli hatásos és biztonságos készítmény. 2/2 SSc/SLE overlap: Az SSc/SLE overlap ritka, többnyire egyedi közlések vannak. Az SSc-s betegek 26,6%-a társul SLE-vel. Az SSc/SLE overlap-ben magas az anti-dns és az anti-scl70 autoantitestek előfordulása. Az anti-scl70 antitest pozitív SSc/SLE-s betegekben a scleroderma bőrtünetei állnak előtérben. Eseti közlések vannak SSc/ SLE overlap betegekben polyserositis, pancreatitis, avascularis csont necrosis, arthritis megjelenéséről. Bőr rash, tüdő érintettség, pulmonalis artériás hypertensio (PAH), valamint glomerulonephritis miatt az SSc/SLE társulása kedvezőtlen, akár végzetes lehet. Kezelés: Az SSc/SLE overlap-ben glomerulonephritisszel vagy PAH-al társuló esetekben KS kezelés, immunszuppresszív szerek, MTX, AZA, CYC adása szükséges. A scleroderma renalis krízis megelőzésére angiotenzin konvertáz gátlókat kell alkalmazni. PAHban a terápiát vasodilatator szerekkel, prostaglandinnal, foszfodiészteráz gátló Sildenafil, Tadalafil és ET-1R antagonista Bosentannal kell kiegészíteni. Esettanulmányok bizonyítják a Rituximab és a mycophenolat mofetil hatásosságát SSc/SLE overlap-ben. 12
13 2/3 SSc-RA overlap: SSc/RA a második leggyakoribb overlap. A betegek szérumában az ACPA és rheumatoid faktor (RF) igen magas szérumkoncentrációban található. Az SSc-RA overlap-ben gyakori a thrombocytopenia. A hazai populációban 477 SSc-s betegből 22 (4,6%) esetben találtak SSc/RA overlap-et (18). A 22 betegből 19 esetben elsőként az SSc-t diagnosztizálták, és 1-16 év múlva jelentek meg az RA klinikai és szerológiai sajátosságai. A második betegség volt az RA, ami nem súlyosbította a már meglevő SSc tüneteit. Az SSc/RA overlap egyaránt hordozta az SSc-re jellemző HLA-DR3 és a HLA-DR11 allélt, valamint az RA-ra jellemző HLA-DR1 és a HLA-DR4 allélt, ami az SSc/RA overlap genetikai hátterét igazolta. SSc-vel összefüggő HLA-DR gének, HLA-DR3, valamint az anti-topoizomeráz antitest 16,7-szeresre növelte a pulmonalis fibrosis kialakulásának veszélyét SSc-ben. Prognózis-kezelés: A bőr fibrosis és a tüdő érintettség miatt az SSc-RA overlap kórlefolyása nem kedvező. KS, MTX, HCQ, a TNF- gátlók csökkentették az arthritis súlyosságát, valamint a bőr vastagságot is. SSc/RA overlap-ben az immunszuppresszív szerek és a biológiai terápia alkalmazásakor rendkívül fontos figyelni az infekció elleni védelemre a tüdőfibrosis és a tuberculosis veszélye miatt. A terápiás lehetőségek közül a Rituximab és a szolubilis IL-6 receptor gátló (Tocilizumab) ígéretes terápiának bizonyulnak SSc/RA overlap-ben. 3. RHUPUS (Rheumatoid arthritis SLE overlap) Rhupus szindróma diagnosztizálható, amikor az anti-dns vagy anti-sm pozitív SLE-s betegekben erozív arthritis vagy reumás csomó jelenik meg (7,13,19). A tiszta SLE-s betegek 17%-ában is jelentkezhet enyhe synovitis, míg a rhupusos betegek csaknem mindegyikében súlyos ízületi gyulladás alakul ki, ACPA pozitivitással. Az ACPA rendkívül specifikus RA-ra, azonban más gyulladásos reumatológiai kórképekben is kimutatható, így psoriasisos arthritisben, juvenilis idiopathiás arthritisben és SLE-ben is. SLE-s betegekben az ACPA jelenléte 28,5-szörös veszélyt jelent arra, hogy erozív arthritis fog kialakulni. Rhupusos betegekben az SLE extraarticularis tünetei kevésbé súlyosak. A serositisek, a glomerulonephritis, a bőrtünetek és a neurológiai eltérések gyakorisága hasonló, mint a tiszta SLE-s betegekben. Kezelés: A rhupus terápiája hasonló az RA-hoz. A KS kezelést MTX, leflunomid és hydroxychloroquine (HCQ) adásával kell kiegészíteni. Mycophenolat mofetil és cyclosporin A adására is szükség lehet, ami hatásosan csökkenti az ízületi gyulladást és fájdalmat. A TNF- gátlók aktiválhatják az SLE szervi tüneteit. Azoknál a betegeknál, akik nem reagálnak a konvencionális kezelésre, Rituximab és Abatacept adását érdemes alkalmazni már a betegség korai szakában. 4. Sjögren szindróma és Overlap Az RA-s betegek 30-90%-a szenved a siccás panaszok miatt. Az ajakbiopszia szövettana gyulladásos infiltrációt mutat, ami Sj-ben és RA-ban is hasonló. A reggeli ízületi merevség, erozív arthritis, reumás csomók jelenléte Sj/RA overlap jelenlétét veti fel. A Rituximab adása eredményes kezelési stratégia Sj/RA overlap-ben. Sjögren szindrómával társuló SSc-ben a nyálmirigyek fibrosisa okozza a nyáltermelés csökkenését. Sj/SLE Az SLE-ben a leggyakoribb a társulás Sjögren szindrómával. Sj/SLE overlap-ben kórosan emelkedett a RF titer, poliklonalis hypergammaglobulinaemia van, magas az anti-ro/ssa és az anti-la/ssb antitestek prevalenciája (11,16). Az Sj/SLE overlap-ben előtérben állnak a bőrtünetek, a fotoszenzitivitás, malar rash, szájfekély, és gyakoribb az arthritis, Raynaud jelenség és a pszihózis. Az Sj/SLE overlap betegek idősebbek, mint az overlap nélküli SLE-s betegek, és kisebb a glomerulonephritis kialakulásának valószínűsége. Kezelés: HCQ, KS, súlyosabb esetben immunszuppresszív szerek adására van szükség. Az Sj/SLE overlap-ben is a Rituximab a jelenleg legjobban bevált biológiai terápia. Szisztémás autoimmun kórképek autoimmun májbetegségek A szisztémás AI betegségek gyakran társulnak szerv specifikus autoimmun kórképekkel, így autoimmun pajzsmirigybetegséggel, autoimmun májbetegséggel vagy primer biliaris cirrhosissal (4,21). A társulások ismerete azért is fontos, mert az AI kórképek aktivitása gyakran jár a máj enzimek emelkedésével, és nehéz elkülöníteni, hogy az alapbetegség fellángolása vagy önálló májbetegség, autoimmun hepatitis vagy primer biliaris cirrhosis okozza-e a májkárosodást. A hepaticus autoantitestek vizsgálatára van szükség, sz.e. májbiopsziát kell végezni, és a szövettan adja meg a biztos diagnózist. Irodalomjegyzék Autoimmun overlap szindróma 1. Alarcon-Segovia D., Villarreal M.: Classification and diagnostic criteria for mixed connective tissue disease. In: Kasukawa R., Sharp G.C. eds. Mixed connective tissue disease and anti-nuclear antibodies. Elsevier Science (Amsterdam), 33-40, Balbir-Gurman A., Braun-Moscovici Y.: Scleroderma overlap syndrome. Isr. Med. Assoc. J., 13(1), 14-20, Elhai M., Avouac J., Kahan A. et al.: Systemic sclerosis at the crossroad of polyautoimmunity. Autoimm. Rev., 12(11), , Hagymási K., Tulassay Z.: Review of overlap synd romes in autoimmune liver diseases. Diagnostic and therapeutic difficulties. Orv. Hetil., 154(24), , Hemminki K., Li X., Sundquist K. et al.: Shared familial aggregation of susceptibility to autoimmune diseases. Arthr. Rheum., 60(9), , Iaccarino L., Gatto M., Bettio S. et al.: Overlap connective tissue disease syndromes. Autoimm. Rev., 12(3), ,
14 7. Icen M., Nicola P. J., Maradit-Kremers H. et al.: Systemic lupus erythematosus features in rheumatoid arthritis and their effect on overall mortality. J. Rheumatol., 36(1), 50-57, Jury E.C., D'Cruz D., Morrow W.J.: Autoantibodies and overlap syndromes in autoimmune rheumatic disease. J. Clin. Pathol., 54(5), , Lockshin M.D., Levine A.B., Erkan D.: Patients with overlap autoimmune disease differ from those with 'pure' disease. Lupus Sci. Med., 2(1), e000084, Mahler M., Miller F.W., Fritzler M.J.: Idiopathic inflammatory myopathies and the anti-synthetase syndrome: a comprehensive review. Autoimm. Rev., 13(4-5), , Manoussakis M.N., Georgopoulou C., Zintzaras E. et al.: Sjögren's syndrome associated with systemic lupus erythematosus: clinical and laboratory profiles and comparison with primary Sjögren's syndrome. Arthr. Rheum., 50(3), , Meyer A., Lefevre G., Bierry G. et al.: Club Rheumatismes et Inflammation. In antisynthetase syndrome, ACPA are associated with severe and erosive arthritis: an overlapping rheumatoid arthritis and antisynthetase syndrome. Medicine (Baltimore), 94(20), e523, Min J.K., Lee K.A., Kim H.R. et al.: Rhupus syndrome. Kor. J. Intern. Med., 30(1), 131, Muro Y., Hosono Y., Sugiura K. et al.: Anti-PM/Scl antibodies are found in Japanese patients with various systemic autoimmune conditions besides myositis and scleroderma. Arthr. Res. Ther., 17(1), 57, Rodríguez-Reyna T.S., Alarcón-Segovia D.: Overlap syndromes in the context of shared autoimmunity. Autoimmunity, 38(3), , Rúa-Figueroa I., Fernández Castro M., Andreu J.L. et al.: Comorbidities in patients with primary Sjögren's syndrome and systemic lupus erythematosus: A Comparative Registries-Based Study. Arthr. Care Res. (Hoboken), 69(1), 38-45, 2017 Autoimmun overlap szindróma 17. Shiboski C.H., Shiboski S.C., Seror R. et al.: International Sjögren's Syndrome Criteria Working Group American College of Rheumatology/European League Against Rheumatism classification criteria for primary Sjögren's syndrome. A consensus and data-driven methodology involving three international patient cohorts. Ann. Rheum. Dis., 76(1), 9-16, Szücs G., Szekanecz Z., Zilahi E. et al.: Systemic sclerosis-rheumatoid arthritis overlap syndrome: a unique combination of features suggests a distinct genetic, serological and clinical entity. Rheumatology (Oxford), 46(6), , Tani C., D'Aniello D., Delle Sedie A. et al.: Rhupus syndrome: assessment of its prevalence and its clinical and instrumental characteristics in a prospective cohort of 103 SLE patients. Autoimm. Rev., 12(4), , Tiao J., Feng R., Carr K. et al.: Using the American College of Rheumatology (ACR) and Systemic Lupus International Collaborating Clinics (SLICC) criteria to determine the diagnosis of systemic lupus erythematosus (SLE) in patients with subacute cutaneous lupus erythematosus (SCLE). J. Am. Acad. Dermatol., 74(5), , Utiyama S.R., Zenatti K.B., Nóbrega H.A. et al.: Rheumatic Disease Autoantibodies in Autoimmune Liver Diseases. Immunol. Invest., 45(6), , van der Heijde D., van der Helm-van Mil A.H., Aletaha D. et al.: EULAR definition of erosive disease in light of the 2010 ACR/EULAR rheumatoid arthritis classification criteria. Ann. Rheum. Dis., 72(4), , Witt L.J., Curran J.J., Strek M.E.: The diagnosis and treatment of antisynthetase syndrome. Clin. Pulm. Med., 23(5), , Xu D., Hou Y., Zheng Y.: The 2013 American College of Rheumatology/ European League Against Rheumatism. Classification criteria for systemic sclerosis could classify systemic sclerosis patients at earlier stage: Data from a Chinese EUSTAR Center. PLoS One, 11(11), e ,
15 A D-vitamin immunmoduláns hatásai A D-vitamin immunmoduláns hatásai Dr. Zöld Éva DEOEC, Belgyógyászati Intézet, Klinikai Immunológiai Tanszék, Debrecen Összefoglalás: Az aktív D-vitamin klasszikus, calcium- és csontanyagcserére kifejtett hatásán túl, autokrin, illetve parakrin úton befolyásolja az immunrendszer működését, hatással van a sejtek proliferációjára, differenciálódására és működésére. Számos extra-renalis szöveten jelen van a biológiailag aktív 1,25(OH) 2 forma kialakulásához szükséges 1-α hidroxiláz enzim, illetőleg receptora gyakorlatilag az immunrendszer összes sejtjén megtalálható. Az aktív D-vitamin fokozza a makrofágok és természetes ölő sejtek fagocita aktivitását, elősegíti az antimikrobiális peptidek termelődését, gátolja az antigén prezentáló sejtek differenciálódását és érését. Részben direkt módon, részben a citokin miliő befolyásolása révén hat a dendritikus sejtekre (DC), amelyek alapvetőek a T-sejt függő immunválasz beindításában és fenntartásában. Az aktív D-vitamin a Th sejtek differenciálódásának és citokin szintézisének transzkripciós regulátora, befolyásolja az immunológiai válasz szempontjából alapvető T-helper működés egyensúlyának kialakulását, hatással van a Th1 és Th7 sejtek megjelenésére, valamint citokin termelésére. Szerepe a humoralis immunitás tekintetében is megfigyelhető, amely a B-sejtek aktivációjának és differenciálódásának függvényében módosul. Az 1,25(OH) 2 gátolja a B-sejtek proliferációját, a plazmasejtekké történő differenciálódást, az immunglobulin osztályváltást, a memória B-sejtek kialakulását és mindemellett B-sejt apoptosist is indukál. Az aktív D-vitamin immunrendszer működésében való sokrétű jelenléte, valamint epidemiológiai adatok igazolják, hogy a D-vitamin egyike azon környezeti tényezőknek, melyeknek szerepe lehet a különböző autoimmun betegségek kialakulásában vagy progressziójában. Az aktív D-vitamin immunmodulátor hatásának mind jobb megismerése, új terápiás vonalat hozhat az autoimmun betegségek kezelési protokolljában. Kulcsszavak: D-vitamin, immunmoduláció, autoimmunitás Bevezetés Az elmúlt néhány évtized kísérletes és klinikai megfigyelései nyilvánvalóvá tették, hogy a D-vitamin nemcsak a calcium homeostasisban és a csontanyagcserében nélkülözhetetlen, hanem úgynevezett extrasceletalis hatásként fontos szerepe van az immunrendszer szabályozásában. Szerteágazó funkcióját alátámasztja az a felismerés, hogy a 25(OH)D vitamint aktiváló enzim, a 1-α hydroxiláz (CYP27B1-hidroxiláz), számos extra-renalis szöveten jelen van, illetve gyakorlatilag az immunrendszer összes sejtje expresszál D-vitamin kötő receptort (VDR) (10). Az ember számára a D-vitamin két formája alapvető, az egyik a D 2 vitamin (ergocalciferol), míg a másik a vitamin (cholecalciferol). A D 2 vitamin a növényekben szintetizálódik, míg a vitamin az emberben, a bőrben alakul ki a napfény ultraibolya B (UVB) sugárzásának hatására. Summary: Beyond the classic effect on calcium and bone metabolism, active vitamin D affects functionality of the immune system and affects proliferation and differentiation of cells via both autocrine and paracrine pathways. Receptor of vitamin D is found on all of the immune cells and 1-α hydroxylase - essential for the formation of biologically active form of 1,25(OH) 2 - is also presented in extra-renal tissues. Active vitamin D enhances phagocytic activity of the macrophages and natural killer cells, promotes the production of antimicrobial peptides, and regulates or inhibits the differentiation and maturation of the antigen presenting cells. Dendritic cells (DC) are fundamental to set up and maintain the T cell-dependent immune response and part in a direct way, part through the influence of the cytokine milieu, vitamin D has effect on them. Active vitamin D has regulatory effect on Th cells differentiation, and also has a transcriptional regulatory effect on their cytokine synthesis. It affects the formation of the functional equilibrium of T cells - which is essential for immune response- and has influence on the proliferation and cytokine production of both Th1 and Th7 cells. Vitamin D has also role in humoral immunity, depending on the activation and differentiation of B cells. 1,25(OH) 2 inhibits B cell proliferation, differentiation into plasma cells, immunoglobulin class switching, and memory B cell formation and also induces B cell apoptosis. Multiple and multifaceted presence of active vitamin D in the immune system, as well as epidemiological data indicate that vitamin D may have role in developing or progression of various autoimmune diseases as one of the environmental factors. A better understanding of the immunomodulatory effect of active vitamin D may give a new therapeutic way to the treatment protocols of autoimmune diseases. Key words: vitamin D, immunmodulation, autoimmunity Az emberben az elsődleges D-vitamin prekurzor forrás a bőr, ahol az UVB sugárzás hatására, nem enzimatikus úton a 7-dehidrokoleszterol a vitamin elő-vitaminjává, majd egy termalis izomerizáció révén vitaminná alakul. A vitaminból, ezt követően előbb a májban történő hydroxiláció révén 25-hidroxivitamin (25(OH)D), majd a továbbiakban, a vesében történő hydroxiláció révén 1,25-dihidroxivitamin (1,25(OH) 2 ) forma képződik. A D-vitamin összes ismert biológiai hatását, multiplex funkcióját, elsődlegesen az aktív D-vitaminnak, nevezetesen a 1,25(OH) 2 -nak tulajdonítják. Az immunrendszer modulációjában részt vevő aktív D-vitamin elsősorban lokálisan képződik, mint a CYP27B1-hidroxiláz enzim szintetikus terméke, a makrofágok és lymphocyták működése teremtette lokális mikrokörnyezetben és ennek megfelelően az aktív D-vitamin lokális immunregulatív hatása a klinikai mérhető tartomány alatt van. 15
16 A D-vitamin hatása az innate immunrendszerre Az aktív D-vitamin több ponton bekapcsolódik a kórokozók gyors felismerését és a fagocitózist lehetővé tevő innate immunrendszer hálózatába. Modulálja az innate immunrendszert, részben direkt antimikrobiális hatása révén, részben indirekt módon a gyulladásos aktivitás gátlásával, oly módon, hogy gátolja az adaptív immunsejtek, innate immunrendszeren keresztüli aktivációját. Az innate immunrendszer VDR függő mechanizmus révén segíti elő az antigén prezentációt, a fagocitózist, a szuperoxid szintézist, az interleukin 1-béta és a tumor necrosis factor (TNF)-α termelődést. Az 1,25(OH) 2 emeli a savi foszfatáz szintet és fokozza az ún. oxidatív burst-t. A korai gyulladásos immunválasz indukciójában igen fontosak a Toll-like receptorok (TLR) azáltal, hogy felismerik a nem specifikus patogén-asszociált molekuláris mintázatokat (PAMP). Microarray vizsgálatokban azt találták, hogy a bakteriális lipopoliszacharidok által stimulált humán makrofágok TLR1/2 heterodimerjei indukálják mind a CYP27B1 (1 -hidroxiláz) gén, mind a VDR expresszióját (16). A TLR aktiválta makrofágok az inaktív formájú D-vitamint aktív formává alakítják, majd ez utóbbi hatására, autokrin mechanizmussal további antimikrobiális peptideket termelnek. Jól ismert, hogy a D-vitamin fokozza a monocyták és makrofágok antimikobakterális aktivitását is, csökkenti a proinflammatoricus citokinek termelését és fontos szerepe van a tuberculosis és a lepra terápiájában. Liu és mtsai M. tuberculosisból kivont lipoproteinnel csökkentették a human monocytákban és makrofágokban lévő intracellularis mycobaktériumok életképességét a A D-vitamin immunmoduláns hatásai TLR2/1 útvonalon át a VDR és CYP27B1 expressziójának növelésével. In vitro vizsgálatokban, a humán monocyták VDR liganddal való kezelése gátolta a TLR expresszióját, amely következményesen proinflammatoricus TNF-α citokin csökkent termelődéséhez is vezet (24). A D-vitamin elősegíti az antimikrobiális peptidek, mint a cathelicidin, kationos peptidek, defenzinek szintézisét, amelyek különösen a mucosalis immunrendszerben fontos, direkt antimikrobiális hatással rendelkeznek. Az antimikrobiális peptidek két családjának, a CAMP (cathelicidin antimicrobial peptid, hcap18, LL37) és DEFB2 (DEFB4, β-defensin 2) peptidek csoportjának DNS-e, a promoter régió proximális szakaszán természetes DR3-típusú response elemeket (VDREs) tartalmaz (27). In vitro, a humán monocytákban és neutrofilekben, a D-vitamin analóg terápiával indukált cathelicidin megjelenése fokozta az antimikrobiális aktivitást több légúti patogénnel szemben (29). In vitro, humán daganatos sejtvonalakon, az innate immunrendszer fontos regulátorainak tekintett, calprotectin és az S100-fehérje szintje megemelkedik D-vitamin hatására (12). Az adaptív immunitás modulációja A D-vitamin hatása a monocytákra és dendriticus sejtekre Az aktív D-vitamin részben direkt módon, részben a citokin miliő komplex befolyásolása révén hat a dendriticus sejtekre (DC), amelyek mint professzionális antigén prezentáló sejtek esszenciálisak a T-sejt függő immunválasz beindításában és fenntartásában (1) (1. táblázat). A DC sejtek differenciálódását a CD14 mo- Target Antimikrobiális hatás Antigén prezentáló sejtek (monocyták, makrofágok, dendriticus sejtek) T-lymphocyták B-sejtek NK-sejtek Bélbarrier fenntartása 1. táblázat: Az aktív D-vitamin immunmodulatív hatásai 1,25(OH) 2 hatásai Elősegíti az antimikrobiális peptidek, cathelicidin, β-defenzin, TLR-2 megjelenését PPR és γ, valamint glükokortikoidok, androgének aktivációja A dendriticus sejtek érésének gátlása Az MHC II. molekulák expressziójának csökkenése A kostimulációs receptorok (CD40, CD80 és CD86), érést elősegítő és jelző sejtfelszíni molekulák (CD1a, CD83) expressziójának csökkenése A monocyták kemotaktikus és fagocitotikus aktivitásának fokozódása, a monocyták tumor sejt elleni cytotoxicus és mikrobiális aktivitásának fokozódása A tolerogén DC sejtek indukciója, amelyek elősegítik a regulatív T-sejtek kialakulását és működését A DC sejtek IL-12 p70 termelésének gátlása A monocyták és makrofágok proinflammatoricus citokin (IL-1, IL-1β, TNF- ) termelésének gátlása Az IL-12, IFN-γ és IL-2 felszabadulásának gátlása IL-4, IL-5, IL-10 termelődésének fokozódása A humán és rágcsáló T-lymphocyták antigén és lektin stimulált proliferációjának, citokin szekréciójának gátlása Gátolja a Th17 sejtek megjelenését és funkcióját A regulatív T-sejt irányába történő differenciálódás elősegítése Az antigen specifikus T-sejt aktiváció gátlása Gátolja a plazmasejtté történő differenciálódást, a memória B-sejtek kialakulását Az immunglobulin szekréció gátlása B-sejtek VDR expressziója Az IgE szekréció szuppressziója IFN-γ downregulációja tight junction fehérjék expressziójának kontrollja Intestinalis epithelialis sejtek közötti kapcsolat regulációja 16
17 nocyta marker downregulációja és a CD1 felszíni molekula megjelenése jellemzi. Az 1,25(OH) 2 VDR függő folyamat révén hatékonyan gátolja a sejtfelszíni markerek megjelenését, ezáltal a DC sejtek érését és monocytává történő differenciálódását (21). Az aktív D-vitamin hatására gátolt a CD1a+ DC sejtek differenciációja, miközben fennmarad a monocyta markerek expressziója. Másrészt, a DC sejtek és az aktivált makrofágok, a T- és B-sejtekhez hasonlóan hordozzák az 1-α-hidroxilázt, így 1,25(OH) 2 -t tudnak szintetizálni és szekretálni lokálisan, a gyulladás helyszínén. Az 1,25(OH) 2 fiziológiás mértékű jelenléte gátolja a II. osztályba tartozó fő hisztokompatibilitási komplex (MHC-II), a kostimulációs receptorok (CD40, CD80 és CD86) és más sejtfelszíni érést jelző és elősegítő markerek (mint a CD83) megjelenését, melyek révén az aktív D-vitamin befolyásolja az antigén prezentáló sejtek azon másodlagos szignáljait, amelyek a T-sejtek toborzásához és aktivációjához szükségesek (9). Ezen másodlagos szignálok közül kiemelkedő, a T-helper (h) 1 és Th17 irányú differenciálódás fő citokinjeinek, a proinflammatoricus IL-1 és IL-23 citokineknek valamint az IL-12 és IFN-γ képződésének gátlása, valamint az immunszuppressziós hatású citokinek, mint az IL-10 és a kemokin MIP-3 termelődésének fokozása. A kemokin MIP-3 révén, az aktív D-vitamin részt vesz a CCR4-expresszáló regulatív T-sejtek (Tregs) toborzásában (20,25). További hatása az 1,25(OH) 2 vitaminnak, a szuppresszív jellegű prosztaglandin E2 termelődésének elősegítése, a granulocyta-makrofág colonia stimuláló faktor (GM-CSF) gátlása, míg a szintén inflammatoricus hatású TNF- citokin megjelenését, a monocyták és makrofágok érési státuszától és differenciációjától függően módosítja. A makrofágok két csoportba sorolhatóak. Az úgynevezett M1 makrofágokat élénk proinflammatoricus mediátor mint nitrogén-oxid, TNF-, IL-23, IL-12, IL-1β termelés jellemzi, melyek fontosan a patogének elleni küzdelemben és elősegítik a Th1 és Th17 sejt polarizációt. Az M2 makrofágok az antiinflammatoricus hatású IL-10 citokin termelésben, valamint a sebgyógyulásban, szöveti helyreállításban kiemelkedőek. Az immunválasz ezen stádiumában az aktív D-vitamin balanszírozó hatást mutat pro- és antiinflammatoricus hatású makrofágok tekintetében. A D-vitamin hatása a lymphocytákra Számos T-sejt csoport mint a CD4+ Th sejtek, CD8+ cytotoxicus T-sejtek és a TCRγδ sejtek expresszálnak VDR-t, amely által az 1,25(OH) 2 vitamin befolyásolja a T-sejtek citokin szekrécióját, differenciálódását, valamint a TCR szingál rendszeren történő T-sejt aktivációt (6). A különböző T-sejtcsoportokra az aktív D-vitamin eltérő módon hat, ezáltal komplex módon befolyásolja a helper, effektor és regulatív működést. A D-vitamin a Th sejtek differenciálódásának és citokin szintézisének transzkripciós regulátora. A T-sejtek magjában D-vitamin receptorok találhatóak, amelyek a VDR ligand bekötődésekor, a megfelelő A D-vitamin immunmoduláns hatásai gének expresszióját elindítják, vagy leállítják, aminek eredményeképpen a 1,25(OH) 2 a Th1 sejtek kiérését gátolja (T-bet), valamint a Th1-re jellemző citokinek képződését (IFN-γ, IL-2 és a IL-12) megakadályozza (13). Mivel az IFN-γ fontos feedback szignál az APCs számára, az IFN-γ transzkripciójának aktív D-vitamin általi gátlása, termelődésének csökkenése, az APC sejtek antigén prezentáló képességét akadályozza, míg az IL-12 transzkripciójára gyakorolt represszív képességével a Th1 polarizáció elmaradását vagy csökkenését okozza. A D-vitamin direkt hatása és/vagy a Th1 negatív gátlásának kiesése következtében egy relatív Th2 arány eltolódás jön létre. Ez utóbbi hatást erősíti az is, hogy a 1,25(OH) 2 elősegíti az IL-5 és IL-10 termelődését. A Th2 citokinek, mint az IL-4 vonatkozásában az aktív D-vitamin összetett hatást mutat. In vitro naív T-sejt populáción az IL-4 és GATA-3 (Th2 transzkripciós faktor) megjelenését fokozza, ugyanakkor már jelenlévő IL-4 mellett a további IL-4 termelődés gátlása figyelhető meg. Ez a kombinált jelleg arra utal, hogy az aktív D-vitamin nemcsak a Th1 dominanciájú, hanem a Th2 jellegű patogén folyamatokban is kedvező lehet. A Th sejtek speciális szubpopulációját képező Th17 sejtek differenciálódására és aktivitására a 1,25(OH) 2 gátló hatású (5,18). Ezek a sejtek pleiotrop hatású IL- 17, IL-21, IL-22, TNF-α citokineket termelnek, fontosak az epithelium és a mucosalis barrierek antimikrobiális immunitásában. A Th17 sejtek hiánya a szervezet opportunista kórokozókkal szembeni fogékonyságához vezethet, ugyanakkor az excesszív számú Th17 sejtek a gyulladás és a gyulladás mediálta szöveti károsodás fenntartásában lényegesek. In vitro, aktív D-vitamin jelenlétében a Th17 citokinek és transzkripciós faktorok (IL-17A, IL-17F, IL-22, RORC, CCR6) gátlása figyelhető meg, részben direkt úton, részben más gének VDR útvonalon történő gátlása révén (19). Kísérletesen kiváltott colitisben a calcitriol, a bél mucosában csökkentette a Th17 sejtek által termelt IL-17 citokinek mennyiségét, fokozta Th2 sejtek számát, és növelte a regulatorikus T-sejtek aktivitását (Treg) (5). In vitro, D-vitamin analóg hatására az IL-6 citokinek downregulációja és a Th17 sejtek számának csökkenése figyelhető meg. Az aktív D-vitaminnak a TGF-β / IL-6 arány változására kifejtett hatása befolyásolja a prekurzor T-sejtek effektor Th17 sejtek vagy regulatorikus, szuppresszor aktivitású Treg sejtekké való konverzióját. Az 1,25(OH) 2 adaptív immunválaszt szabályozó hatásában igen fontos a regulatív T- sejtes választ befolyásoló, optimalizáló képessége. In vitro, az aktív D-vitamin elősegíti a FoxP3 transzkripcióját, a Treg fenotípus megjelenését, valamint fokozza a CTLA4 és IDO expresszióját, mely utóbbi a dendriticus sejtek indukciójának is kedvez (11). Az aktív D-vitamin cytotoxicus hatású CD8+ T-sejtekre való hatását jelzi, hogy azok a CD4+ T-sejtekhez képest nagyobb mértékű VDR expressziót mutatnak. Sclerosis multiplexben szenvedő betegekben a 1,25(OH) 2 gátolja a CD8+ T sejtek IFN-γ és TNF- szekrécióját, psoriasisban a calcipotriol lokális alkalmazása csökkentette a CD8+ sejtek működését és a betegség aktivitását (8,17). 17
18 A humoralis immunválasz tekintetében kimutatták, hogy az aktív D-vitamin direkt és indirekt módon is befolyásolja az immunglobulin produkciót. Hatása többrétű, a B-sejtek aktivációjának és differenciálódásának függvénye. Lymphoblastoid B-sejtvonalakon VDR kötő régió mutatható ki a gének promoter régiójában. Az 1,25(OH) 2 gátolja a B-sejtek proliferációját, a plazmasejtekké történő differenciálódást, ezáltal az immunglobulin (IgG és IgM) szekréciót, valamint gátolja az immunglobulin osztályváltást, a memória B-sejtek kialakulását és mindemellett B-sejt apoptosist is indukál. A már jelenlévő plazmasejtek vonatkozásában az aktív D-vitamin elősegíti a gyulladás helyére történő vándorlást. Lemire és munkatársai in vitro vizsgálatban igazolták, hogy a normál humán perifériás mononuklearis sejtek általi immunglobulin termelődés direkt módon is csökken az aktív D-vitamin hatására (14). Hasonlóan in vitro vizsgálatban azt találták, hogy a D-vitamin adása mellett az SLE-s betegekből származó perifériás mononuclearis sejtek is csökkentik mind a poliklonális antitest termelést, mind pedig az anti-dsdns autoantitestek termelődését (15). A D-vitamin indirekt immunmodulátor hatásai A szervezet különböző szöveteiben állomásozó, gyulladásos mediátor termelésére képes sejtek, mint a májsejtek perisinusoidalis sejtjei, a pancreas multifunkcionális, myofibroblast-szerű sejtei vagy a synovialis fibroblastsejtek fontos jelentőséggel bírnak az élettani és patogén gyulladásos folyamatokban. A VDR expressziójának ezen szöveti sejteken való kimutatása, az 1,25(OH) 2 indirekt módon kifejtett immunmoduláns hatását igazolta (7,22). Rheumatoid arthritisben a 1,25(OH) 2 terápia hatására az IL-β indukált szöveti mátrix metalloproteáz-1 gátlása és a szöveti fibro blastok infiltrációjának csökkenése volt megfigyelhető (22,26). Az agyi pericyták aktiv D-vitamin jelenlétében csökkent mértékű proinflammatoricus citokintermelést mutattak. Az utóbbi évek vizsgálatai igazolták, hogy az aktív D-vitamin befolyásolja az intestinalis barrier egységét és a mikrobiom összetételét, ezáltal az immun-homeostasist (3). Gyulladásos bélbetegeknél a magasabb plazma 25(OH)D csökkent mértékű Clostridium difficile infekcióval társult. Sclerosis multiplexben szenvedő betegeknél a D-vitamin szupplementáció alkalmazása növelte az Enterobaktériumok arányát. D-vitamin és autoimmunitás Az 1,25(OH) 2 innate és adaptív immunrendszer sejtjeire kifejtett hatása, ezen sejtek élénk VDR expreszsziója, a pro- és antiinflammatoricus működéseket befolyásoló képessége, magában hordozza az autoimmun illetve patológiás immunológiai folyamatokban való aktív részvétel lehetőségét is. Az autoimmun betegségek kialakulását a fiziológiás immuntolerancia károsodása, a regulatív sejtek diszharmóniája képezi, amely szabályozási rendellenességet a genetikai, hormonális és környezeti tényezők együttes hatása idézi elő. A környezeti tényezők autoimmunitással való lehetséges kapcsolatát jól példázza az Epstein-Barr vírus (EBV) VDR downregulációját előidéző hatása (28). Az epidemiológiai és a kísérletes adatok szerint a D-vitamin egyike azoknak a környezeti faktoroknak, melynek hiánya alapvető tényező a különböző autoimmun betegségek kifejlődésében, beleértve a sclerosis multiplexet (SM), I. típusú diabetes mellitust, gyulladásos bélbetegségeket (IBD), rheumatoid arthritist (RA) és az szisztémás lupus erythematosust (SLE) (2,23). Összefüggést találtak az I-es típusú diabetes mellitus, SM, RA, SLE valamint az IBD esetén a D-vitamin-hiányos állapot és e betegségek prevalenciája között. Nagyszámú klinikai vizsgálat szerint, többféle szisztémás autoimmun betegségekben D-vitaminhiány mutatható ki, ugyanakkor nem bizonyított egyértelműen, hogy a megváltozott D-vitamin metabolizmus összefügg-e az autoimmun betegségek immunpatológiai folyamataival, vagy csupán epifenomén. Összefoglalás A 1,25(OH) 2 nemcsak vitamin, hanem az immunrendszer sejteinek növekedését, differenciálódását és működését befolyásoló autocrin, parakrin hormon. Az immunológiai folyamatok minden szintjén megfigyelhető hatása, az innate és adaptív immunrendszert, az immuntoleranciát egyaránt befolyásolja, direkt hatása van az antimikrobiális peptidek szintézisére és a makrofágok működésére. Immunmodulátor hatása révén, hiánya oki tényezőként szerepel a különböző autoimmun kórképek patomechanizmusában és új terápiás vonalat képviselhet ezen betegségek kezelési protokolljában. Irodalomjegyzék A D-vitamin immunmoduláns hatásai 1. Baeke F., Etten E.V., Overbergh L. et al.: Vitamin D3 and the immune system: maintaining the balance in health and disease. Nutr. Res. Rev., 20, , Cantorna M.T., Mahon B.D.: Mounting evidence for vitamin D as an environmental factor affecting autoimmune disease prevalence. Exp. Biol. Med. (Maywood), 229, , Clark A., Mach N.: Role of Vitamin D in the Hygiene Hypothesis: The Interplay between Vitamin D, Vitamin D Receptors, Gut Microbiota, and Immune Response. Front Immunol., 7, 627, Correale J., Ysrraelit M.C., Gaitán M.I.: Immunomodulatory effects of Vitamin D in multiple sclerosis. Brain, 132, , Daniel C., Sartory N.A., Zahn N. et al.: Immune modulatory treatment of trinitrobenzene sulfonic acid colitis with calcitriol is associated with a change of a T helper (Th) 1/Th17 to a Th2 and regulatory T cell profile. J. Pharmacol. Exp. Ther., 324, 23-33, Dankers W., Colin E.M., van Hamburg J.P. et al.: Vitamin D in Autoimmunity: Molecular Mechanisms and Therapeutic Potential. Front Immunol., 7, 697,
19 7. Ding N., Yu R.T., Subramaniam N. et al.: A vitamin D receptor/smad genomic circuit gates hepatic fibrotic response. Cell, 153(3), , Dyring-Andersen B., Bonefeld C.M., Bzorek M. et al.: The Vitamin D Analogue Calcipotriol Reduces the Frequency of CD8+ IL-17+ T Cells in Psoriasis Lesions. Scand. J. Immunol., 82(1), 84-91, Gauzzi M.C., Purificato C., Donato K. et al.: Suppressive effect of 1alpha,25 dihydroxyvitamin D3 on type I IFN-mediated monocyte differentiation into dendritic cells: impairment of functional activities and chemotaxis. J. Immunol., 174, , Fritsche J., Mondal K., Ehrnsperger A. et al.: Regulation of 25-hydroxyvitamin D3-1 alpha-hydroxylase and production of 1 alpha,25-dihydroxyvitamin D3 by human dendritic cells. Blood, 102, , Jeffery L.E., Qureshi O.S., Gardner D. et al.: Vitamin D Antagonises the Suppressive Effect of Inflammatory Cytokines on CTLA-4 Expression and Regulatory Function. PLoS One, 10(7), e , Kuruto-Niwa R., Nakamura M., Takeishi K. et al.: Transcriptional regulation by C/EBP alpha and -beta in the expression of the gene for the MRP14 myeloid calcium binding protein. Cell Struct. Funct., 23, , Lemire J.M.: Immunomodulatory actions of 1,25-dihydroxyvitamin D3. J. Steroid Biochem. Mol. Biol., 53, , Lemire J.M., Adams J.S., Sakai R. et al.: 1 alpha,25-dihydroxyvitamin D3 suppresses proliferation and immunoglobulin production by normal human peripheral blood mononuclear cells. J. Clin. Invest., 74, , Linker-Israeli M., Elstner E., Klinenberg J.R. et al.: Vitamin D(3) and its synthetic analogs inhibit the spontaneous in vitro immunoglobulin production by SLE-derived PBMC. Clin. Immunol., 99, 82-93, Liu P.T., Stenger S., Li H. et al.: Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. Science 311, , Lysandropoulos A.P., Jaquiéry E., Jilek S. et al.: Vitamin D has a direct immunomodulatory effect on CD8+ T cells of patients with early multiple sclerosis and healthy control subjects. J. Neuroimmunol., 233(1-2), , Nakae S., Nambu A., Sudo,K. et al.: Suppression of immune induction of collagen-induced arthritis in IL-17-deficient mice. J. Immunol., 171, , 2003 A D-vitamin immunmoduláns hatásai 19. Palmer M.T., Lee Y.K., Maynard C.L. et al.: Lineage-specific effects of 1,25-dihydroxyvitamin D(3) on the development of effector CD4 T cells. J. Biol. Chem., 286(2), , Pedersen A.W., Holmstrom K., Jensen S.S. et al.: Phenotypic and functional markers for 1alpha,25-dihydroxyvitamin D(3)-modified regulatory dendritic cells. Clin. Exp. Immunol., 157, 48-59, Penna G., Adorini L.: 1 Alpha,25-dihydroxyvitamin D3 inhibits differentiation, maturation, activation, and survival of dendritic cells leading to impaired alloreactive T cell activation. J. Immunol., 164, , Sherman M.H., Yu R.T, Engle D.D. et al.: Vitamin D receptor-mediated stromal reprogramming suppresses pancreatitis and enhances pancreatic cancer therapy. Cell, 159(1), 80-93, Szodoray P., Nakken B., Gaal J. et al.: The complex role of vitamin D in autoimmune diseases. Scand. J. Immunol., 68(3), , Urry Z., Xystrakis E., Richards D.F. et al.: Ligation of TLR9 induced on human IL-10-secreting Tregs by 1alpha,25-dihydroxyvitamin D3 abrogates regulatory function J. Clin. Invest., 119, , van Halteren A.G., van Etten E., de Jong E.C. et al.: Redirection of human autoreactive T-cells Upon interaction with dendritic cells modulated by TX527, an analog of 1,25 dihydroxyvitamin D(3). Diabetes, 51(7), , van Hamburg J.P., Asmawidjaja P.S., Davelaar N. et al.: Th17 cells, but not Th1 cells, from patients with early rheumatoid arthritis are potent inducers of matrix metalloproteinases and proinflammatory cytokines upon synovial fibroblast interaction, including autocrine interleukin-17a production. Arthr. Rheum., 63(1), 73-83, Wang T.T., Nestel F.P., Bourdeau V. et al.: Cutting edge: 1,25-dihydroxyvitamin D3 is a direct inducer of antimicrobial peptide gene expression. J. Immunol., 173, , Yenamandra S.P., Hellman U., Kempkes B. et al.: Epstein-Barr virus encoded EBNA-3 binds to vitamin D receptor and blocks activation of its target genes. Cell Mol. Life Sci., 67(24), , Yim S., Dhawan P., Ragunath C. et al.: Induction of cathelicidin in normal and CF bronchial epithelial cells by 1,25-dihydroxyvitamin D(3). J. Cyst. Fibros., 6, ,
20 Autoimmun bőrbetegségek Autoimmun bőrbetegségek Prof. Bata-Csörgő Zsuzsanna Szegedi Tudományegyetem, Bőrgyógyászati és Allergológiai Klinika, Szeged Összefoglalás: Számos olyan bőrbetegség van, melyben auto immun kóros folyamatok szerepe többé-kevésbé bizonyított vagy nem bizonyított egyelőre, de feltételezett. Ezek közül az autoimmun hólyagos bőrbetegségek azok, melyek a Witebsky által leírt autoimmun betegség kritériumait kimerítik. A dolgozatban ismertetett betegségek a leggyakoribb valódi autoimmun bőrbetegségnek tekinthető kórformák. Kulcsszavak: autoimmun hólyagos bőrbetegségek, pemphigus, pemphigoid, autoantitestek Summary: In many skin diseases autoimmune pathology is suspected, but only the autoimmune blistering skin diseases are the ones in which true autoimmune etiology can be established. These diseases satisfy the criteria defined by Witebsky for an autoimmune disease. Diseases described in the present paper are the most common skin diseases with unquestionable autoimmune pathomechanism. Key words: autoimmune bullous skin diseases, pemphigus, pemphigoid, autoantibodies Bevezetés Witebsky 1957-ben írott dolgozatában a következőképpen határozta meg az autoimmun betegséget: a betegségben autoantitestek vagy autoreaktív T-sejtek azonosíthatók, meghatározható az autoantigén és analóg reakció kiváltható experimentális állatmodellben (15). Az azóta eltelt időben ismereteink az autoimmunitással kapcsolatban jelentősen gazdagodtak és ma már tudjuk, hogy fiziológiás autoimmunitás része az immunrendszer szervezetet egyensúlyban tartó működésének. A bőr az egyik legnagyobb immunológiai szempontból aktív szervünk, a veleszületett immunitás aktív szereplői a bőrben található rezidens szöveti és immunsejtek. A külvilág felől érkező hatások direkt elszenvedője a bőr, a legnagyobb barrier szervünk, mely a szervezet integritását külvilági hatásoktól óvja. A bőr veleszületett immunrendszerének aktiválódása a nyirokszerveken keresztül a szerzett immunfunkciók aktiválódásához vezet. Jól szabályozott immunfunkciók esetén az immunaktivitást reguláló mechanizmusok leállítják. A bőrhöz kapcsolt immunvédekezési mechanizmusok komplexitása azonban számos ponton sérülést szenvedhet, minek következtében a szöveti homeosztázis megbomlik és különböző immunmediált, többnyire krónikus bőrbetegség alakul ki. Intraepidermalis hólyagképződéssel járó betegségek A Witebsky kritériumoknak megfelelő autoimmun bőrbetegségek az autoimmun hólyagos bőrbetegségek. Klasszikus példája ezeknek a pemphigus. Két klinikai formát szokás megkülönböztetni, a pemphigus vulgarist (PV) és a pemphigus foliaceust (PF), bár a betegség fenotipusos megjelenése sokszor nem válik el élesen, átmeneti formák gyakoriak. A bőr hólyagos elfajulását autoantitestek okozzák, melyek a hámsejtek között elhelyezkedő desmosomák két fehérjéje, a desmoglein 1 (Dsg1) és/ vagy a desmoglein 3 (Dsg3) ellen képződnek. A hólyagok intraepidermalisan helyezkednek el, a betegségben többnyire nyálkahártya tüneteket is lehet látni. Főleg a szájnyálkahártya érintett, izolált szájnyálkahártya pemphigus is előfordul. A nyálkahártya tünetek kialakulását a Dsg3 ellenes autoantitestek dominanciájához kötik, mely a pemphigus vulgaris jellemzője, foliaceusban, ahol a Dsg1 dominál nyálkahártya érintettség nem jellemző (13). A betegség diagnózisához a szövet direkt immunfluoreszcens vizsgálata (DIF) szükséges, a patológiás autoantitestek a hámsejtek membránját kirajzolják. Dsg1/3 autoantitestek ELISA teszttel meghatározhatók, a szérum autoantitest titere általában jól követi a betegség aktivitását (5). A szérumban előforduló autoantitestek kimutatására indirekt immunfluoreszcens módszert használunk (IIF), ezzel titert meghatározni nem lehet. Daganatos betegségekhez társulhat pemphigus klinikai megjelenése, ilyenkor Western blot technikával a Dsg1/3 mellett általában más epidermishez kapcsolódó autoantitestek jelenléte is kimutatható. A paraneoplasiás pemphigus ritka. A betegség klinikai megjelenését, fenotípusának kialakítását az autoantitestek mellett számos más faktor is befolyásolja (6). Az autoantitestek IgG típusúak, IgG4 és IgG1 izotípussal, de IgE típusú autoantitestek is előfordulnak. Passzív transzferrel egerekbe átvitt autoantitestek hólyagos elváltozás kialakulásához vezetnek, arra is van adat, hogy a betegség kialakításában az IgG4 típusú autoantitestek játszanak fontosabb szerepet (11). Nagyon érdekes, hogy a PF-nek megfelelő betegség Brazíliában endémiás formában létezik, ez a Fogo Selvagem (FS). Az a feltételezés, hogy az endémiás forma kiváltásában az ottani vidéken honos legyek csípése kiváltó tényező lehet. A legyek csípése IgE típusú allergiás reakciót indukál, majd az ismételt csípések kapcsán ezt blokkoló IgG4 típusú specifikus antitestek képződnek, ami keresztreagál a Dsg1-gyel, így alakul ki a PF-nek megfelelő klinikai tünettan (9). A legújabb kutatások szerint a pemphigus autoantitestek proteomikai analízise sokkal nagyobb, változatosabb dinamikus autoantitest repertoár létét bizonyítja a betegségben, mint azt korábban akár a B-sejt genetikai vizsgálatok mutatták 20
21 (3). Az immunszuppresszív terápiák, a szteroid felfedezése előtt a pemphigus magas mortalitású betegség volt, bizonyítva, hogy sértetlen epidermis/felhám nélkül nincs élet. Az immunszuppresszív terápia hatékony, a betegség általában jól kezelhető. A terápiát érdemes 1-2 mg/ttkg dózisú szisztémás szteroid terápiával indítani és mellé azathioprint ( mg/nap) beállítani. A szteroid gyorsan tünetmentesíti a bőrt, az azathioprin pedig alkalmas fenntartó kezelésre, így a szteroid dózisát viszonylag gyorsan le lehet építeni. A komplikált, kezelésre nem reagáló esetek nagy része azok köréből kerül ki, akik megszakítják a kezelést, a recidívák sokkal makacsabbak és terápia rezisztensek. A másik hiba, amit elkövethetünk a terápiában, ha nem alkalmazunk megfelelően magas dózisú szteroid kezelést a betegség kezelésének indításakor. A terápiát a beteg tüneteihez kell igazítani, az új hólyagok megjelenése pár nappal a szteroid kezelés indítása után megszűnik, ha megfelelő a dózis. A pemphigus azon kórképek közé tartozik, amiben az IVIG (intravénás immunglobulin) terápia hatékonyan alkalmazható, bár a pontos adagolásra vonatkozóan nincsenek egyértelmű javaslatok. Általában 2 g/kg/ciklust alkalmaznak, a ciklusok száma változó, a fenntartó kezelés is nagyon különböző (4). Tartósabb terápiás effektus az IVIG és valamilyen más lokális, illetve szisztémás immunszuppresszív terápia kombinációjával érhető el. A magas költség mind az IVIG, mind a Rituximab terápia közös hátránya, jóllehet az utóbbi is bizonyítottan hatékony a betegség kezelésében, jó eredményekről számolnak be a kettő kombinációjával. A Rituximab dozírozása sem egyértelmű egyelőre, magasabb dózisok talán hosszabb remissziót biztosítanak (10). Arra is van példa, hogy ismételt Rituximab kezelés során a patológiás ellenanyagot termelő B-sejtek eltűntek a betegből, ez azonban hosszú évek múltán történt meg, 11 év egy beteg esetében (7). Subepidermalis hólyagképződéssel járó betegségek Autoimmun bőrbetegségek A pemphigus mellett több hólyagos bőrbetegség ismert, melyek patomechanizmusában az autoantitestek szerepe bizonyított. Leggyakrabban az idősebb korosztályt érintő bullosus pemphigoid fordul elő. Itt az autoantitestek a basalis hámsejteket a basalis membránhoz rögzítő hemidesmosoma fehérje alkotói ellen irányulnak. DIF vizsgálattal a beteg bőrben a basalis membránt lineáris csík formájában rajzolják ki az oda kötődő autoantitestek. A BP180 vagy BPAg2 targetje a kollagén XVII, a BP230 vagy a BPAg1 targetje a dystonin. A BP 180 patológiás volta igazolt, de a BP230 betegségben játszott szerepe nem egyértelmű. Az autoantitesteken kívül a bőrtünet kialakításában jelentős szerepet játszanak az infiltráló neutrofil, mastocyta és makrofág sejtek. A kórfolyamat a basalis membrán és basalis keratinocyta közötti kapcsolat megszakadását eredményezi, a hámsejtek és a basalis membrán között hasadék képződik. Jellemző módon, ellentétben a pemphigus betegséggel, a pemphigoidos hólyagok gyulladt alapon ülnek, sőt sokszor klinikailag hólyag nem is észlelhető, csak viszkető erythaemás plakkok. Idősebb korban kialakuló viszkető, gyulladt bőrelváltozások esetén gondolni kell pemphigoidra, a betegség diagnózisának alapja a DIF vizsgálat. A keringésben itt is ki lehet mutatni az autoantitestek jelenlétét ELISA technikával. Ezek általában IgG típusúak, IgG1 és IgG4 egyaránt előfordul, de BP180 ellenes IgE típusú patológiás autoantitestek is előfordulnak (1,2,14). A BP 180 titere elég jól követi a betegség aktivitását. A pemphigoid tünetei nagyon széles skálán mozognak, lokalizált, minimális bőrérintettséget okozó formáktól az egész testre kiterjedő formákig széles a skála. Nagyon ritkán, de gyermekkorban is előfordulhat, ezek az esetek általában jól kezelhetőek és a gyerekek meggyógyulnak. Az időskori forma krónikus betegség, gyakrabban társul neurológiai betegségekkel, diabetesszel, hematológiai betegségekkel és pikkelysömörrel. A daganatokkal való társulás vitatott, valószínű, hogy a gyakoribb együttes előfordulás elsősorban korfüggő, ezért specifikus tumor kutatást nem is javasolnak, az idős betegeknél egyébként is szükségszerű tumoros szűrővizsgálatokon kívül. A betegség kiváltásában bizonyos gyógyszerek szóba jönnek, bár a gyógyszer kiváltó szerepe nem mindig bizonyítható egyértelműen. Psycholeptikumok, vízhajtók, dipeptyl-peptidase 4 gátlók a betegség kialakításában szóba jött gyógyszerek. A betegség kezelésében a szteroid alapvető, újabb ajánlások lokális alkalmazását preferálják a szisztémás mellékhatások elkerülésére. A hétköznapi klinikai gyakorlatban a helyi kezelés kizárólag a nagyon lokalizált formákban szokott sikeres lenni. Általában a tünetek súlyosságától függően 0,5-1 mg/ttkg szisztémás szteroid terápia elégséges a betegek gyors tünetmentessé tételéhez, 1-2 hét után el lehet kezdeni a szteroid leépítését, minél hamarabb napi 5-10 mg prednisolonnak megfelelő fenntartó dózist igyekszünk elérni a szteroid mellékhatások elkerülésére. Ha nagyon kiterjedt, súlyos a betegség, akkor azathioprinnal egészítjük ki a terápiát. Hasonlóan a pemphigushoz egyéb immunszuppresszív kezelési lehetőségek is vannak, de a szteroid, azathioprin a legtöbb betegnél sikeresen alkalmazható. Rituximab+IVIG kombinációval itt is tartós terápiás effektust lehet elérni. A pemphigoid kialakulásának immunológiai háttere különböző, az IgE típusú ellenanyagok esetén újabban anti-ige kezelés sikeréről is beszámoltak, a pikkelysömörrel társuló eseteknél az ustekinumab terápia mindkét betegséget gyógyítja. Nagy kérdés, hogy a betegek meggyógyulnak-e, átmeneti-e az autoimmunitás. Vannak példák arra, hogy a fenntartó immunszuppresszív terápia elhagyását követően a betegség nem tér vissza, de az ellenkezőjére is sok példa van, sajnos nem lehet megjósolni a betegeknél a kezelés abbahagyásának eredményét. A visszatérő betegség újabb nagyobb dózisú immunszuppresszív kezelést igényel, adott esetben szteroidra sem reagálnak a betegek megfelelően, napi 5-10 mg prednisolon fenntartó terápia elhagyását ezért sok esetben inkább nem ajánljuk. Sajnos nincsenek megfelelő klinikai vizsgálati adatok ebben a kérdésben. 21
22 Egyéb autoimmun hólyagos betegségek A basalis membrán területén más antigének is előfordulnak, melyek autoantitestek képződését indukálják, aminek következtében a bőrben subepidermalis hólyag képződik. Ezek ritka betegségek. A BP antigének mellett a laminin5, a laminin6, az alfa6/béta4 integrin béta lánca és a kollagén VII ellen is képződhetnek ellenanyagok, melyek különböző klinikai viselkedésű subepidermalis hólyagképződéssel járó betegséget okoznak (8). A kollagén VII defektus örökletes formában is előforduló megbetegedés, melynek autoszomális domináns és recesszív öröklésmenetet mutató különböző formái vannak (Epidermolysis bullosa distrophica). A kollagén VII deficiencia autoimmun formája az Epidermolysis bullosa acquisita, ahol kollagén VII ellenes autoantitestek felelősek a bőrben kialakuló hólyagképződésért. IIF módszerrel a kollagén VII autoantitesteket a BP antitestektől meg lehet különböztetni az úgynevezett salt split skin módszert alkalmazva, 1mol/l NaCl oldatban inkubált bőrben hasadék képződik úgy, hogy a BP antigének az epidermalis oldalra, a kollagén VII antigének a dermalis oldalra kerülnek. Ezt az egyszerű módszert alkalmazzuk a napi klinikai gyakorlatban diagnosztikus célból. Jellemzően glutén érzékenységgel és a basalis membrán mentén granularis IgA lerakódással jár a Dermatitis herpetiformis Duhring (DHD) betegség. Itt az autoantigén az epidermális transzglutamináz (TG3) (12). A gluténmentes diéta hatásos, de lassan szűnnek meg a bőrtünetek, a jellemzően viszkető, csoportosan ülő kisebb hólyagok, melyek főleg a könyökök felett és a gluteális területen alakulnak ki. Dapson bevezetése gyorsan tünetmentessé teszi a betegeket, ez azonban csak tüneti terápia, tartós hatás a gluténmentes diétával érhető el. A fiatalabb korosztály betegsége. Irodalomjegyzék 1. Bagci I.S., Horvath O.N., Ruzicka T. et al.: Bullous pemphigoid. Autoimmun. Rev., 2017 [Epub ahead of print] 2. Bernard P., Antonicelli F.: Bullous Pemphigoid: A Review of its Diagnosis, Associations and Treatment. Am. J. Clin. Dermatol., 2017 [Epub ahead of print] 3. Chen J., Zheng Q., Hammers C.M. et al.: Proteomic Analysis of Pemphigus Autoantibodies Indicates a Autoimmun bőrbetegségek Larger, More Diverse, and More Dynamic Repertoire than Determined by B Cell Genetics. Cell Rep.,18(1), , Czernik A., Toosi S., Bystryn J.C. et al.: Intravenous immunoglobulin in the treatment of autoimmune bullous dermatoses: an update. Autoimmunity, 45(1), , Di Zenzo G., Amber K.T., Sayar B.S. et al.: Immune response in pemphigus and beyond: progresses and emerging concepts. Semin. Immunopathol., 38(1), 57-74, Di Zenzo G., Borradori L., Muller E.J.: The pathogenesis of pemphigus: Controversy vs complexity. Exp. Dermatol., 2016 [Ehead of print] 7. Hammers C.M., Chen J., Lin C. et al.: Persistence of anti-desmoglein 3 IgG(+) B-cell clones in pemphigus patients over years. J. Invest. Dermatol., 135(3), , Parker S.R., MacKelfresh J.: Autoimmune blistering diseases in the elderly. Clin. Dermatol., 29(1), 69-79, Qian Y., Culton D.A., Jeong J.S. et al.: Non-infectious environmental antigens as a trigger for the initiation of an autoimmune skin disease. Autoimmun. Rev., 15(9), , Ran N.A., Payne A.S.: Rituximab therapy in pemphigus and other autoantibody-mediated diseases. F1000Res., 683, Rock B., Martins C.R., Theofilopoulos A.N. et al.: The pathogenic effect of IgG4 autoantibodies in endemic pemphigus foliaceus (fogo selvagem). N. Engl. J Med., 320(22), , Sardy M., Karpati S., Merkl B. et al.: Epidermal transglutaminase (TGase 3) is the autoantigen of dermatitis herpetiformis. J. Exp. Med., 195(6), , Shirakata Y., Amagai M., Hanakawa Y. et al.: Lack of mucosal involvement in pemphigus foliaceus may be due to low expression of desmoglein 1. J. Invest. Dermatol.,110(1), 76-78, Ujiie H.: IgE autoantibodies in bullous pemphigoid: supporting role, or leading player? J. Dermatol. Sci., 78(1), 5-10, Witebsky E., Rose N.R., Terplan K. et al.: Chronic thyroiditis and autoimmunization. J. Am. Med. Assoc.,164(13), ,
23 Az allergiás szembetegségek és farmakoterápiájuk Az allergiás szembetegségek és farmakoterápiájuk Dr. Kemény-Beke Ádám Debreceni Egyetem, Klinikai Központ, Szemklinika, Debrecen Összefoglalás: Allergiának nevezzük azt az immunfolyamatot, amely kedvezőtlen a szervezet számára, de nem az immunválasz elégtelen intenzitása miatt. A kiváltó antigéneket allergéneknek nevezzük. Az allergének önmagukban nem veszélyeztetik a szervezetet, tehát az általuk okozott immunválasz szükségtelen és fölösleges terhet ró a szervezetre. A népesség több mint 20%-a szenved az allergia valamely formájától. A szem allergiás tünetei néha önálló kórkép formájában alakulnak ki, de legtöbbször a szervezet más részeit is érintő allergiás megbetegedés részeként jelentkeznek. Az allergiás szembetegség gyakran más allergiás betegséggel együtt figyelhető meg, így sokszor tapasztalunk a betegséggel egyidejűleg allergiás rhinitist (szénanátha), asztma bronchialét, illetve egyes allergiás bőrbetegségeket (pl. ekcéma). Az allergiás szembetegség leggyakoribb okai a levegőben diszpergált hiperszenzibilizáló antigének: tavasszal a virágzó fák pollenjei, nyáron és ősszel a gyomnövények pollenjei, egész évben pedig az állati szőrök és a poratka anyagcseretermékei. A kevésbé gyakori okok közé tartoznak a helyi izgató hatású anyagok, mint például a kozmetikumok és egyes szemcseppek. A szemet érintő allergia számos kellemetlen tünet formájában nyilvánul meg: a szem viszket, bevörösödik, könnyezik, szúró érzés alakul ki, a betegek fáradtnak érzik a szemüket. A betegség krónikus lefolyású, azaz a tünetek jelentkezésének időszakában állandó kezelést igényel. Az allergiás szembetegségben előforduló tünetek és panaszok az egészen enyhétől a komoly elváltozásokig terjedhetnek. Utóbbiak megnehezíthetik a mindennapi életet és munkavégzést, azonban nagyon ritkán érnek el olyan súlyos fokot, amely már a szem egészségét és a látást is károsítja. Enyhe tünetek jelentkezésekor meg lehet próbálni az otthoni kezelést: rendszeres takarítás, az ágynemű gyakori mosása, gyakori kézmosás, a kertészkedés mellőzése, illetve figyelni lehet a pollen előrejelzést és magas pollenkoncentráció esetén zárt nyílászárójú épületben maradni. Ezzel nemcsak szemünk egészségét, látásunkat óvhatjuk meg, hanem szerencsés esetben tünetmentes állapotot is elérhetünk. Súlyosabb esetben ezek a technikák már nem segítenek, és gyógyszeres kezelésre is szükség van. Világszerte és hazánkban is igen sok ember, a felnőtt lakosság 6-30%-a érintett allergiás szembetegségekben, és a prevalencia a gyermekeknél is elérheti a 30%-ot (6). Mivel a rendelkezésünkre álló gyógyszerekkel a betegség tünetmentessé tehető, az allergiás szem farmakoterápiája nagy jelentőséggel bír. Kulcsszavak: allergia, conjunctivitis allergica, diagnózis, kezelés Az immunrendszer hyperszenzitivitása Allergia Az allergia, noha egyszerűen csak orvosi szempontból célszerűtlen immunreakciót jelent, hagyományosan, mint az immunrendszer túlműködése, Summary: The term allergy stands for an immunological process which is unfavorable for the organism, but not because of the insufficient intensity of the immune response. It is induced by antigens, so called allergens. They do not threaten the organism on their own thus the immune response caused by them generates an unnecessary and excessive burden on the body. More than 20% of the population suffers from some form of allergy. Sometimes the allergic eye symptoms occur as an independent disease, but most often they develop in conjunction with other allergic diseases, so ocular allergy is often associated with allergic rhinitis (hay fever), bronchial asthma, or allergic skin diseases (e.g. eczema). The most common causes of the allergic eye disease are dispersed hypersensitizing antigens, like pollens of flowering trees in spring, weed pollens in summer and autumn, and metabolites of animal dander and dust mites during the entire year. Less common causes include local irritating substances, such as cosmetics and some eye drops. Manifestations of the allergic eye are a number of unpleasant symptoms: itchy eyes, redness, watering of the eye, and a stinging sensation; patients feel that their eyes are tired. The disease is chronic, i.e. it requires constant treatment during the period when symptoms are present. Symptoms and complaints range from very mild to severe morbidities. The latter render everyday life and work more difficult, but rarely result in a degree of seriousness that would damage the health of the eye or threaten the vision. Mild symptoms usually call for home remedies; one can try regular cleaning, frequent laundering of bed linen, frequent hand washing, or avoiding gardening. Furthermore one has to pay attention to pollen forecasts and in case of high pollen levels patients have to remain inside with windows closed. This may not only protect the health or vision of our eyes, but in lucky cases a symptom-free state can also be achieved. In severe cases however, these techniques are of no more use, and medication is needed. Quite a lot of people, actually 6-30% of the adult population is affected by the allergic eye disease worldwide, just as in our country, with a prevalence in children also up to 30% (6). Since the available drugs can make the disease symptom free, pharmacotherapy of the allergic eye is of great importance. Key words: allergy, allergic conjunctivitis, diagnosis, treatment túlérzékenysége kerül értelmezésre. Az allergiás betegségeket Gell és Coombs osztályozta 1963-ban (4). A hyperszenzitív válasz mechanizmusa alapján öt típust különítünk el: I. típusú: Ezt a típust nevezik atopiának, anaphylaxiának, vagy korai típusú hyperszenzitivitásnak is. Kialakulása során a célszerű mennyiségnél több im- 23
24 munglobulin E (IgE) termelődik valamely antigénnel szemben. Szenzitizált egyénben az allergénnel való érintkezést követően gyorsan, 4 órán belül a következő tünetek lépnek fel: a conjunctiva belövellése, könnyezés, orrviszketés, orrdugulás, orrfolyás, tüsszögés, súlyosabb esetben nehézlégzés (a bronchusok és bronchiolusok spazmusa következtében). A tünetek közül legalább kettő, hetente több napon át, naponta minimum 1-2 órán át fennáll. Az allergének lehetnek inhalatívak (pollen, háziporatka ürüléke), bejuthatnak sebzés által (rovarok, pókok mérge, nyála; injektált gyógyszerek: penicillin) és a táplálékkal is (gyógyszerek; nutritív allergének: tojás, tej). Az immunmediálta csalánkiütés is ide tartozik. II. típusú: Szükségtelen antitestfüggő sejtpusztulást jelent. Előfordul, hogy az allergének gyógyszerek, amelyek hemolízist okoznak (furosemid, cloramphenicol, szalicilátok), de a nem csoport-azonos transzfúzióval bevitt vörösvérsejtek antitestfüggő, komplement mediálta pusztulása is II. típusú hyperszenzitivitásnak tekinthető. III. típusú: Lényege, hogy antigén-antitest komplexek rakódnak le az erek falára, ami célszerűtlenül helyi gyulladást vált ki. Az allergének lehetnek gyógyszerek (antibiotikumok), baktériumok, vírusok. IV. típusú: Ez a T-lymphocyták aktivációjával és következményes citokin-felszabadulással járó, ún. késői hyperszenzitív válasz. Kifejlődése több napig tart. Elsősorban ez a mechanizmus felelős a transzplantátumok kilökődéséért. V. típusú: Ez a speciális típust egyes osztályozások nem tekintik önálló kategóriának. Lényege, hogy autoantitestek valamely sejtfelszíni receptorhoz kötődve agonistaként vagy antagonistaként viselkednek, amivel stimulálják vagy gátolják a célsejt megfelelő funkcióját. Az allergiás beteg kivizsgálásának ajánlott folyamata az Allergológiai és Klinikai Szakmai Kollégium (KIOSZK) szerint: 1. Az allergiára gyanús betegek kivizsgálását és terápiáját csak azok az orvosok lássák el, akik allergológus vagy klinikai immunológus szakképesítéssel rendelkeznek, vagy belgyógyászok, bőrgyógyászok, szemészek, fül- orr- gégészek, gyerekgyógyászok, illetve tüdőgyógyászok. 2. A diagnosztika alapját az anamnézis képezi, majd az első ajánlottan elvégzendő vizsgálat a bőrpróba. 3. Az in vitro tesztek közül három elvégzése tanácsos azokban az esetekben, amelyekben a bőrpróba vagy nem kivitelezhető, vagy sikertelen: szérum össz IgE meghatározás allergén indukálta T sejt proliferáció mérés szérum allergén-specifikus IgE meghatározás (9). Prevenció Az allergiás betegségek kezelése komplex feladat. Mivel ezt a kóros állapotot környezeti allergének alakítják ki, a kezelés sikerességét a prevenció nagyban befolyásolja (5). A védekezés 3 szintjét különböztetik meg: elsődleges, másodlagos és harmadlagos prevenció. Az allergiás szembetegségek és farmakoterápiájuk A primer prevenció az allergiás betegségek esetén a szenzibilizáció kialakulásának megelőzését jelenti. A szenzitizált szervezetben az immunrendszer már kész az antigénekre adandó válaszra attól függetlenül, hogy klinikai tünetek fennállnak-e vagy sem. A primer prevencióra, vagyis az allergén mennyiségének minimalizálására a következő lehetőségeink vannak: megfelelő környezet kiválasztása (az allergiát okozó növény előfordulási helyeinek kerülése; hegyvidék a poratka-allergiások számára) a szülés időpontjának tervezése (megfigyelések szerint az ősszel született gyerekek között kevesebb az allergiás, mint a tavaszi születésűek között) a terhesség utolsó harmada alatt allergénekben szegény diéta kevés porfogó terület a lakásban, gyakori szellőztetés és takarítás a háziállat-tartás kerülése. A preventív allergén-kerülés csak az első életévekben lehet igazán sikeres, különösen a magas allergia-rizikójú csoportokban. Magas rizikójúak a WHO definíció szerint azok az újszülöttek, akiknek legalább egy igazoltan atopiás szülője és egy ilyen idősebb testvére van, ők teszik ki az újszülöttek kb. 35%-át. Szekunder prevenció azon szenzibilizált egyéneknél jön szóba, akik a betegség korai, panaszt még nem vagy alig okozó stádiumában vannak. Ez az állapot időtartamát tekintve igen változó lehet, eltarthat mindössze néhány naptól évekig is. A tercier prevenció az allergén hatására kifejezett tüneteket produkáló betegek esetében a tünetek kifejlődésének megakadályozását jelenti. Ez a legtöbb esetben a gyógyszeres terápiát, ritkábban a beteg oktatását foglalja magában. A betegoktatás célja, hogy a páciens és környezete megismerje a betegség kialakulásának hátterét, a kórkép lényegét, lefolyását, farmakoterápiáját és annak mellékhatásait. Az I. típusú hyperszenzitivitás patomechanizmusa Atopiában az allergén egy olyan IgE molekulához kötődik, amelyik (utólag vagy már megelőzően is) egy IgE receptorral rendelkező sejt felszínéhez kapcsolódik. Ez a kötődés a sejt (hízósejt, esetleg bazofil granulocyta) degranulációját, vagyis intracellularis vezikulumokban tárolt mediátorainak felszabadulását eredményezi. A korai típusú allergiás reakcióban ezek a mediátorok kemotaktikus anyagok, proteolyticus enzimek és a hisztamin. A proteolyticus enzimek lokális szövetkárosító hatásukkal elősegítik az allergén mélyebbre jutását, a kemotaktikus anyagok az allergiás reakció helyére vonzzák a mobilis immunkompetens sejteket (elsősorban az eozinofil granulocytákat). A felszabaduló hisztamin döntően H 1 receptor mediációval viszketést, hyperszekréciót, vasodilatatiot és a hajszálerek permeabilitásának növekedését váltja ki, ami oedemát és vérbőséget okoz. A H 1 receptor gátlásá- 24
25 val az allergiás tünetek mérsékelhetőek. A H 3 receptor: ingerlése gátolja a norepinephrin felszabadulást az idegvégződésekből, így módosítva az ingerület átvitelét. Gátlói nyálkahártya duzzanat-mérséklő (anticongestiv) hatásuk révén az allergiás rhinitis jövőbeni kiegészítő gyógyszerei lehetnek. A H 4 receptorok az eozinofil sejteken és a mastocytákon helyezkednek el. Ingerlésük a sejteken kemotaxist indukál, ezt H 4 receptor antagonistával meg lehet akadályozni (8). A folyamat lipid-mediátorok képződésével folytatódik (ciklooxigenáz hatására thromboxán és prosztaglandinok, lipoxigenáz hatására pedig lipoxinok és leukotriének keletkeznek), ami tovább fokozza a gyulladást. Keratoconjunctivitis allergica A szemgolyót a szemhéjon belül a vékony kötőhártya védi meg a külső környezettel szemben. A conjunctivát vékony erek sokasága hálózza be, amelyek általában nem láthatóak, mivel normál perfúziójuk alacsony értéken van. Ha azonban a kötőhártyát irritáló hatás éri, ezek az erek kitágulnak, megtelnek vérrel, így a szem bevörösödik. A vörösség legkifejezettebben a kötőhártyának a szem felszínéről a szemhéjra való áthajlásainál észlelhető. Az allergiás szem a legelterjedtebb szembetegség, világszerte valamennyi korcsoportot érinti. Az allergia elsősorban a környezeti allergéneknek legjobban kitett és a keletkező gyulladásos mediátorokkal szemben leginkább válaszképes conjunctivát érinti. Az allergiás conjunctivitisre jellemző panaszok a szemviszketés, égő érzés, vörösség, fényérzékenység és az oedema. Allergiás kötőhártya-gyulladásnál a szem belövelltségére jellemző, hogy a szem felszíne viszonylag halvány, míg az alsó szemhéjat lehúzva az áthajlás kimondottan vörös. Az allergiás kötőhártya-gyulladás rendszerint nem súlyos lefolyású, de túl azon, hogy rontja az életminőséget, kezelés hiányában hosszú távon a szem épségét veszélyeztető szövődményeknek vetheti meg az alapját. Az allergiás kötőhártya-gyulladásra jellemző, hogy általában mindkét szem érintett (1). Diagnosztika és osztályozás A kötőhártya-gyulladást könnyű felismerni, az anamnézis és a szem vizsgálata alapján általában a kötőhártya-gyulladás fajtáját is hamar meg lehet állapítani. A 2015-ben megjelent Conjunctivitis Allergica Consensus Document szerint (10) a szemfelszín megbetegedéseit két nagy szekcióba lehet elkülöníteni: a (A) szemészeti allergiás megbetegedésekre és a (B) nem allergiás hyperszenzitivitás által okozott betegségre. Az előbbi csoporton belül különítjük el: (I) az IgE-mediálta elváltozásokat és a (II) nem IgE-mediálta megbetegedéseket. Az I. csoportba tartoznak: 1. Szezonális/perennialis (SAC/PAC) allergiás conjunctivitis 2. Keratoconjunctivitis vernalis (VKC) 3. Atopiás keratoconjunctivitis (AKC) A II. csoportba az alábbiak tartoznak: 1. Kontakt blepharoconjunctivitis (CBC) 2. Keratoconjunctivitis vernalis (VKC) 3. Atopiás keratoconjunctivitis (AKC) Látható tehát, hogy keratoconjunctivitis vernalis (VKC) és atopiás keratoconjunctivitis (AKC) mind IgE-mediált, mind pedig nem IgE-mediált etiológiával kialakulhat. A (B) nem-allergiás hyperszenzitivitás kategóriájába pedig az alábbi betegségek sorolhatók: 1. Vegyszer által okozott conjunctivitis vagy blepharoconjunctivitis 2. Óriáspapillás conjunctivits (GPC). Az alábbiakban a fent említett elváltozások jellemzőit ismertetjük. Szezonális allergiás conjunctivitis Az allergiás conjunctivitisek 80-90%-át teszi ki, hazánkban mintegy 1 millió embert érint, mely szám napról napra növekszik. A szezonális allergiás conjunctivitis az év egy jellemző időszakában rendszeresen előfordul. A szezonális allergiás conjunctivitis gyakran jár együtt az allergiás rhinitissel. Mechanizmusára nézve döntően I. típusú hyperszenzitivitás, az allergénnel történő expozíció után a tünetek szenzitizált egyénben perceken belül megjelennek, de allergén hiányában hamar el is múlnak. Jellemző tünetei a szem mindkét oldali bevörösödése, viszketés, égő érzés és chemosis rendszerint fehér színű, nyúlós szemváladékkal. A társuló allergiás rhinitist tüsszögés, orrdugulás és garatviszketés jelzi. Perennialis allergiás conjunctivitis A perennialis allergiás kötőhártya-gyulladás tünetei kezelés nélkül folyamatosan fennállnak, mivel az allergén nem szezonálisan, hanem egész évben előfordul (1. kép). A tünetek ugyanazok, mint a szezonális allergiás conjunctivitis esetén tehát szintén I. típusú hyperszenzitivitás, csak általában mérsékeltebb formában jelentkeznek. A leggyakoribb perennialis allergének a háziporatka, illetve annak anyagcsere-termékei és az állatszőr. 1. kép Az allergiás szembetegségek és farmakoterápiájuk 25
26 Vernalis conjunctivitis Szinte kivétel nélkül a tavaszi virágok pollenjei idézik elő. A betegség égő érzéssel, könnyezéssel, tavasszal kezdődik, az esetek 75%-ában 6-10 éves fiúkon. Ősszel és télen a beteg tünetmentes. Mechanizmusa nem teljesen tisztázott. Kiváltói egyes tavaszi virágok pollenjei, de szerepet játszhat a kialakulásában a napfény, a meleg és hormonális tényezők is (ami indokolja elkülönítését a szezonális allergiáktól). Ezt támasztja alá, hogy meleg hatására többnyire súlyosbodnak a tünetek. Valószínűleg az I. és a IV. típusú hyperszenzitivitás kombinációja. Szubjektív tünetek a photophobia, szemviszketés, égő érzés és az idegentest-érzés. Objektív tünetei a conjunctiva diffúz duzzanata, papillaris reakció (a kötőhártya utcakő-rajzolata) (2. kép), a szem mucosus váladékozása. A conjunctiván kialakuló papillák mechanikusan sérthetik a corneát, ezáltal hámhiányokat okozva rajta. 2. kép Atopiás keratoconjunctivitis Az ún. atopiás conjunctivitis és az óriáspapillás conjunctivitis sokkal ritkábban fordul elő, mint a szezonális vagy perenniális forma, viszont sokkal súlyosabb kórlefolyást mutatnak. Ez a betegség főleg a fiatal felnőtteknél fordul elő, általában valamilyen más atopiás betegséggel együtt (ekcéma, asthma bronchiale). Kezdetben a tünetek nem specifikusak, a conjunctiva erei tágabbak a normálisnál, mucosus váladék, enyhe fokú conjunctivalis oedema jelenik meg. A későbbi tünetek a photophobia, extrém viszketés, a szemhéj bőrének dermatitise és elszíneződése, majd szempillavesztés. Ezek a tünetek egész évben fennállnak, a téli hónapokban rosszabbodhatnak. Vegyszer okozta conjunctivitis vagy blepharoconjunctivitis A kötőhártya-gyulladások egyik leggyakoribb kiváltói a kozmetikumok, mint a púder, haj- és arcfestékek és szemhéjfestékek. A tünetek az allergén-expozíció után csak óra múlva jelentkeznek. Kifejlődésében késői típusú, tehát IV. típusú allergia játszik szerepet. Conjunctivitist okozhat néhány, a szemészetben alkalmazott farmakon is. Ezek közül talán az egyik legismertebb az atropin-conjunctivitis. Az alsó áthajlás te- Az allergiás szembetegségek és farmakoterápiájuk rületén folliculus-képződéssel kezdődik, súlyos esetben az alsó szemhéj kifordulását okozhatja. Kevésbé gyakori, de kórlefolyását tekintve hasonló a pilocarpin-conjunctivitis. Súlyos allergiás gyulladást okozhatnak a lokális érzéstelenítők, mint a novocain, tetracain, cocain vagy a helyileg adott jód. Allergiás conjunctivitist válthat ki a szemcseppek indokolatlan használata, illetve ezek gyakori váltogatása. Ennek hátterében általában benzalkonium-klorid allergia áll, mely vegyület a szemcseppek előszeretettel használt tartósítószere. Ez az allergia a beteg szemészeti terápiáját nagyban megnehezíti, mivel jelentősen lecsökkenti a használható szerek spektrumát. Primer prevenció gyanánt szemcseppet csak indokolt esetben tanácsos rendelni. Allergiás kötőhártya-gyulladást számos antibiotikum is okozhat, ezek közül legsúlyosabb a penicillin által kiváltott szem és bőr kontakt dermatitis. Megjegyzendő, hogy a népi gyógymódban kedvelt kamillafőzet alkalmazása csak súlyosbítja a tüneteket, makacs conjunctivitist eredményezve, főként akkor, ha gyakran és melegen alkalmazzák. A gyógyszer indukálta kötőhártya-gyulladás, ha a kiváltó allergént sikerül eliminálni, spontán gyógyul. A javulás lokális kortikoszteroidok alkalmazásával meggyorsítható. Óriáspapillás conjunctivitis Idegentest által indukált I. típusú túlérzékenység, amely három betegcsoportban fordul elő: műszemet viselőknél, olyan műtéten átesett betegeknél, akiknél fel nem szívódó szemsebészeti varratok kerültek alkalmazásra, leggyakrabban pedig tartósan kontaktlencsét viselőknél, különösen a lencse tisztántartásához használt vegyszerek iránti érzékenység esetén. Tünetei a szem mucosus váladékozása, a felső tarsalis conjunctiván óriás papillák megjelenése, valamint nem túl intenzív viszketés. A keratoconjuctivitis allergica kezelése Amennyiben az allergiás kötőhártya-gyulladás egy másik alapbetegség kísérőjelensége, abban az esetben előbb azt kell kezelni, és így a kötőhártya-gyulladás magától is megszűnhet. Az esetek nagy részében azonban csak tüneti kezelést alkalmazhatunk, magát a betegséget megszűntetni nem tudjuk. A keratoconjunctivitis allergica kezelésének módjai: 1. Az allergén kerülése (primer prevenció) 2. Szupportív terápia (műkönny) 3. Antiallergiás gyógyszerek I. Primer prevenció Az allergén kerülése és az allergén-mentesítés a legkézenfekvőbbnek tűnő megoldások az allergiás betegek terápiájában. Ehhez persze tudni kell, hogy mire érzékeny a páciens. Magas pollenkoncentrációjú időszakban ajánlatos a személyes higiéné fokozása (gyakori fürdés, mosdás), ritkábban tartózkodni a szabad 26
Kryoglobulinaemia kezelése. Domján Gyula. Semmelweis Egyetem I. Belklinika. III. Terápiás Aferezis Konferencia, 2014. Debrecen
 Kryoglobulinaemia kezelése Domján Gyula Semmelweis Egyetem I. Belklinika Mi a kryoglobulin? Hidegben kicsapódó immunglobulin Melegben visszaoldódik (37 C-on) Klasszifikáció 3 csoport az Ig komponens
Kryoglobulinaemia kezelése Domján Gyula Semmelweis Egyetem I. Belklinika Mi a kryoglobulin? Hidegben kicsapódó immunglobulin Melegben visszaoldódik (37 C-on) Klasszifikáció 3 csoport az Ig komponens
Katasztrófális antifoszfolipid szindróma
 Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Hepatitis C vírus és cryoglobulinaemia
 Hepatitis C vírus és cryoglobulinaemia Dr Petrovicz Edina 2012.11.10. ESZISZL Kh. és Rendelőintézet Hepatitis C vírus (HCV) Flaviviridae család Hepacivirus nemzetség egyszálú RNS vírus Choo és Kuo 1989.
Hepatitis C vírus és cryoglobulinaemia Dr Petrovicz Edina 2012.11.10. ESZISZL Kh. és Rendelőintézet Hepatitis C vírus (HCV) Flaviviridae család Hepacivirus nemzetség egyszálú RNS vírus Choo és Kuo 1989.
IMMUNOLÓGIA VILÁGNAP 2012. április 26 Prof. Dr. Dankó Katalin DEOEC III. Belklinika Klinikai Immunológiai Tanszék
 A reumatológiai/gyulladásos betegségek felismerése és szövődményei IMMUNOLÓGIA VILÁGNAP 2012. április 26 Prof. Dr. Dankó Katalin DEOEC III. Belklinika Klinikai Immunológiai Tanszék Gyulladásos betegségek
A reumatológiai/gyulladásos betegségek felismerése és szövődményei IMMUNOLÓGIA VILÁGNAP 2012. április 26 Prof. Dr. Dankó Katalin DEOEC III. Belklinika Klinikai Immunológiai Tanszék Gyulladásos betegségek
Klinikai Immunológiai Interdiszciplináris Fórum (KIIF)
 Klinikai Immunológiai Interdiszciplináris Fórum (KIIF) Forró pontok a belgyógyászati és határterületi klinikai immunológiában 2009.09.17 2009.09.19. Kölcsey Ferenc Kongresszusi Központ, Debrecen Főszervező:
Klinikai Immunológiai Interdiszciplináris Fórum (KIIF) Forró pontok a belgyógyászati és határterületi klinikai immunológiában 2009.09.17 2009.09.19. Kölcsey Ferenc Kongresszusi Központ, Debrecen Főszervező:
Újabb eredmények Sjögren-szindrómában. Szántó Antónia DE ÁOK Klinikai Immunológia Tanszék 2019
 Újabb eredmények Sjögren-szindrómában Szántó Antónia DE ÁOK Klinikai Immunológia Tanszék 2019 Vázlat Újdonságok a patogenezisben A klinikai megjelenés etnikai különbségei Újdonságok a diagnosztikában Újdonságok
Újabb eredmények Sjögren-szindrómában Szántó Antónia DE ÁOK Klinikai Immunológia Tanszék 2019 Vázlat Újdonságok a patogenezisben A klinikai megjelenés etnikai különbségei Újdonságok a diagnosztikában Újdonságok
B-sejtek szerepe az RA patológiás folyamataiban
 B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
Klinikai Immunológiai Interdiszciplináris Fórum II. (KIIF)
 Klinikai Immunológiai Interdiszciplináris Fórum II. (KIIF) 2011.11.10 2011.11.12. Hotel Divinus, Debrecen Főszervező: Prof. Dr. Zeher Margit A Magyar Allergológiai és Klinikai Immunológiai Társaság és
Klinikai Immunológiai Interdiszciplináris Fórum II. (KIIF) 2011.11.10 2011.11.12. Hotel Divinus, Debrecen Főszervező: Prof. Dr. Zeher Margit A Magyar Allergológiai és Klinikai Immunológiai Társaság és
A B sejtek érése, aktivációja, az immunglobulin osztályok kialakulása. Uher Ferenc, PhD, DSc
 A B sejtek érése, aktivációja, az immunglobulin osztályok kialakulása Uher Ferenc, PhD, DSc Az immunglobulinok szerkezete Fab V L V H C L C H 1 C H 1 Az egér immunglobulin géncsaládok szerveződése Hlánc
A B sejtek érése, aktivációja, az immunglobulin osztályok kialakulása Uher Ferenc, PhD, DSc Az immunglobulinok szerkezete Fab V L V H C L C H 1 C H 1 Az egér immunglobulin géncsaládok szerveződése Hlánc
A szeronegatív spondylarthritisek és a szisztémás kötőszöveti betegségek
 A szeronegatív spondylarthritisek és a szisztémás kötőszöveti betegségek gasztrointesztinális vonatkozásai OTKA nyilvántartási szám: T046437 Dr. Sütő Gábor Pécsi Tudományegyetem Általános Orvosi Kar Immunológiai
A szeronegatív spondylarthritisek és a szisztémás kötőszöveti betegségek gasztrointesztinális vonatkozásai OTKA nyilvántartási szám: T046437 Dr. Sütő Gábor Pécsi Tudományegyetem Általános Orvosi Kar Immunológiai
Immunpatológia kurzus, - tavaszi szemeszter
 Immunpatológia kurzus, - tavaszi szemeszter Prof. Sármay Gabriella, Dr. Bajtay Zsuzsa, Dr. Józsi Mihály, Prof. Kacskovics Imre Prof. Erdei Anna Szerdánként, 10.00-12.00-ig, 5-202-es terem 1 2016. 02. 17.
Immunpatológia kurzus, - tavaszi szemeszter Prof. Sármay Gabriella, Dr. Bajtay Zsuzsa, Dr. Józsi Mihály, Prof. Kacskovics Imre Prof. Erdei Anna Szerdánként, 10.00-12.00-ig, 5-202-es terem 1 2016. 02. 17.
Immunológia I. 4. előadás. Kacskovics Imre
 Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Immunológia alapjai előadás. A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és
 Immunológia alapjai 15-16. előadás A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és csíracentrum reakció, affinitás-érés és izotípusváltás. A B-sejt fejlődés szakaszai HSC Primer
Immunológia alapjai 15-16. előadás A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és csíracentrum reakció, affinitás-érés és izotípusváltás. A B-sejt fejlődés szakaszai HSC Primer
Prof Dr. Pajor Attila Szülész-nőgyógyász, egyetemi tanár AUTOIMMUN BETEGSÉGEK ÉS TERHESSÉG
 Prof Dr. Pajor Attila Szülész-nőgyógyász, egyetemi tanár AUTOIMMUN BETEGSÉGEK ÉS TERHESSÉG Melyik autoimmun betegség érinti a szülőképes nőket? Izületi betegségek : RA, SLE Pajzsmirigy betegségek: Kevert
Prof Dr. Pajor Attila Szülész-nőgyógyász, egyetemi tanár AUTOIMMUN BETEGSÉGEK ÉS TERHESSÉG Melyik autoimmun betegség érinti a szülőképes nőket? Izületi betegségek : RA, SLE Pajzsmirigy betegségek: Kevert
II. Klinikai Immunológiai Interdiszciplináris Fórum (KIIF)
 II. Klinikai Immunológiai Interdiszciplináris Fórum (KIIF) 2011.11.10 2011.11.12. Hotel Divinus, Debrecen (Debrecen, Nagyerdei krt. 1.) Főszervező: A Magyar Allergológiai és Klinikai Immunológiai Társaság
II. Klinikai Immunológiai Interdiszciplináris Fórum (KIIF) 2011.11.10 2011.11.12. Hotel Divinus, Debrecen (Debrecen, Nagyerdei krt. 1.) Főszervező: A Magyar Allergológiai és Klinikai Immunológiai Társaság
Plazmaferezis kezelések diagnózis szerinti megoszlása az elmúlt 30 évben (1983-2012) Myastenia Gravis 1353 Guillain-Barre 891 CIDP, SM, DEVIC 595
 Szemelvények a Debreceni Egyetem III. számú Belklinikáján az elmúlt 30 évben végzett plazmaferezis kezelésekből Dr. Soltész Pál Debreceni Egyetem Orvos és Egészségtudományi Centrum III. Belklinika Aferezis
Szemelvények a Debreceni Egyetem III. számú Belklinikáján az elmúlt 30 évben végzett plazmaferezis kezelésekből Dr. Soltész Pál Debreceni Egyetem Orvos és Egészségtudományi Centrum III. Belklinika Aferezis
Az intravénás immunglobulin hatásmechanizmusa és alkalmazási köre a klinikai immunológiában
 Az intravénás immunglobulin hatásmechanizmusa és alkalmazási köre a klinikai immunológiában Dr. Bazsó Anna ORFI Klinikai Immunológiai, Felnőtt-és Gyermekreumatológiai Osztály Haladás a reumatológia, immunológia
Az intravénás immunglobulin hatásmechanizmusa és alkalmazási köre a klinikai immunológiában Dr. Bazsó Anna ORFI Klinikai Immunológiai, Felnőtt-és Gyermekreumatológiai Osztály Haladás a reumatológia, immunológia
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS. origamigroup. www.origami.co.hu
 BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
Boehringer Ingelheim Onkológia (BIO)
 Az előadás megjelenését a Boehringer Ingelheim támogatta. Az előadás tartalma az előadó (eredményeit és) önálló szakmai álláspontját tükrözi és nem tekinthető a Boehringer Ingelheim részéről közzétett
Az előadás megjelenését a Boehringer Ingelheim támogatta. Az előadás tartalma az előadó (eredményeit és) önálló szakmai álláspontját tükrözi és nem tekinthető a Boehringer Ingelheim részéről közzétett
A fiziológiás terhesség hátterében álló immunológiai történések
 A fiziológiás terhesség hátterében álló immunológiai történések APAI Ag ANYAI Ag FERTŐZÉS AUTOIMMUNITÁS MAGZATI ANTIGEN ALACSONY P SZINT INFERTILITAS BEÁGYAZÓDÁS ANYAI IMMUNREGULÁCIÓ TROPHOBLAST INVÁZIÓ
A fiziológiás terhesség hátterében álló immunológiai történések APAI Ag ANYAI Ag FERTŐZÉS AUTOIMMUNITÁS MAGZATI ANTIGEN ALACSONY P SZINT INFERTILITAS BEÁGYAZÓDÁS ANYAI IMMUNREGULÁCIÓ TROPHOBLAST INVÁZIÓ
A DE KK Belgyógyászati Klinika Intenzív Osztályán és Terápiás Aferezis Részlegén évi közel 400 db plazmaferezis kezelést végzünk.
 A DE KK Belgyógyászati Klinika Intenzív Osztályán és Terápiás Aferezis Részlegén évi közel 400 db plazmaferezis kezelést végzünk. Az eseteink túlnyomó részét neuro-, immunológiai eredetű kórképek adják.
A DE KK Belgyógyászati Klinika Intenzív Osztályán és Terápiás Aferezis Részlegén évi közel 400 db plazmaferezis kezelést végzünk. Az eseteink túlnyomó részét neuro-, immunológiai eredetű kórképek adják.
INTRACELLULÁRIS PATOGÉNEK
 INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
Immunológia alapjai előadás MHC. szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás.
 Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Antigén felismerés Az ellenanyagok és a B sejt receptorok natív formában
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Antigén felismerés Az ellenanyagok és a B sejt receptorok natív formában
Immunológia Alapjai. 13. előadás. Elsődleges T sejt érés és differenciálódás
 Immunológia Alapjai 13. előadás Elsődleges T sejt érés és differenciálódás A T és B sejt receptor eltérő szerkezetű A T sejt receptor komplex felépítése + DOMÉNES SZERKEZET αβ ΤcR SP(CD4+ vagy CD8+) γδ
Immunológia Alapjai 13. előadás Elsődleges T sejt érés és differenciálódás A T és B sejt receptor eltérő szerkezetű A T sejt receptor komplex felépítése + DOMÉNES SZERKEZET αβ ΤcR SP(CD4+ vagy CD8+) γδ
GYERMEK-TÜDŐGYÓGYÁSZAT
 GYERMEK-TÜDŐGYÓGYÁSZAT I. 1. Légutak és a tüdő fejlődése 2. Légzőrendszer élettani működése 3. Újszülöttkori légzészavarok 4. Bronchopulmonalis dysplasia 5. A gége veleszületett és szerzett rendellenességei
GYERMEK-TÜDŐGYÓGYÁSZAT I. 1. Légutak és a tüdő fejlődése 2. Légzőrendszer élettani működése 3. Újszülöttkori légzészavarok 4. Bronchopulmonalis dysplasia 5. A gége veleszületett és szerzett rendellenességei
Szisztémás Lupusz Eritematózusz (SLE)
 www.printo.it/pediatric-rheumatology/hu/intro Szisztémás Lupusz Eritematózusz (SLE) Verzió 2016 2. DIAGNÓZIS ÉS TERÁPIA 2.1 Hogyan diagnosztizálható? Az SLE diagnózisa a panaszok (mint pl. fájdalom), a
www.printo.it/pediatric-rheumatology/hu/intro Szisztémás Lupusz Eritematózusz (SLE) Verzió 2016 2. DIAGNÓZIS ÉS TERÁPIA 2.1 Hogyan diagnosztizálható? Az SLE diagnózisa a panaszok (mint pl. fájdalom), a
Diagnosztikai kihívások HRCT elemzés
 Az előadás megjelenését a Boehringer Ingelheim támogatta. Az előadás tartalma az előadó (eredményeit és) önálló szakmai álláspontját tükrözi és nem tekinthető a Boehringer Ingelheim részéről közzétett
Az előadás megjelenését a Boehringer Ingelheim támogatta. Az előadás tartalma az előadó (eredményeit és) önálló szakmai álláspontját tükrözi és nem tekinthető a Boehringer Ingelheim részéről közzétett
Humán genom variációk single nucleotide polymorphism (SNP)
 Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
Autoimmun betegségek nefrológiai manifesztációi. Dr. Studinger Péter SEMMELWEIS EGYETEM. Általános Orvostudományi Kar
 Autoimmun betegségek nefrológiai manifesztációi Dr. Studinger Péter 2019. SEMMELWEIS EGYETEM Általános Orvostudományi Kar Semmelweis Egyetem I. sz. Belgyógyászati Klinika http://bel1.semmelweis.hu A nefrológiai
Autoimmun betegségek nefrológiai manifesztációi Dr. Studinger Péter 2019. SEMMELWEIS EGYETEM Általános Orvostudományi Kar Semmelweis Egyetem I. sz. Belgyógyászati Klinika http://bel1.semmelweis.hu A nefrológiai
Új könnyűlánc diagnosztika. Dr. Németh Julianna Országos Gyógyintézeti Központ Immundiagnosztikai Osztály MLDT-MIT Továbbképzés 2006
 Új könnyűlánc diagnosztika Dr. Németh Julianna Országos Gyógyintézeti Központ Immundiagnosztikai Osztály MLDT-MIT Továbbképzés 2006 1845 Bence Jones Protein vizelet fehérje 1922 BJP I-II típus 1956 BJP
Új könnyűlánc diagnosztika Dr. Németh Julianna Országos Gyógyintézeti Központ Immundiagnosztikai Osztály MLDT-MIT Továbbképzés 2006 1845 Bence Jones Protein vizelet fehérje 1922 BJP I-II típus 1956 BJP
Immunológia alapjai előadás. Az immunológiai felismerés molekuláris összetevői.
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai. 23-24. előadás. Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás.
 Immunológia alapjai 23-24. előadás Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás. Tolerált bőr graftok MHC (H2) azonos egereken TOLERANCIA & AUTOIMMUNITÁS Toleranciáról beszélünk, ha
Immunológia alapjai 23-24. előadás Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás. Tolerált bőr graftok MHC (H2) azonos egereken TOLERANCIA & AUTOIMMUNITÁS Toleranciáról beszélünk, ha
Dr. Bazsó Anna. Magyar Lupus Egyesület
 Autoimmun betegségek társulása Dr. Bazsó Anna Magyar Lupus Egyesület 2010.03.27. Az autoimmun betegségek evolúciója és etiopathogenesise Genetikai háttér Beningnus Patológiás Immunszerológiai Autoimmunitás
Autoimmun betegségek társulása Dr. Bazsó Anna Magyar Lupus Egyesület 2010.03.27. Az autoimmun betegségek evolúciója és etiopathogenesise Genetikai háttér Beningnus Patológiás Immunszerológiai Autoimmunitás
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás.
 Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Az immunrendszer felépítése Veleszületett immunitás (komplement, antibakteriális
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Az immunrendszer felépítése Veleszületett immunitás (komplement, antibakteriális
Immunológia alapjai előadás. Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás.
 Immunológia alapjai 24-25. előadás Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás. Tolerált bőr graftok MHC (H2) azonos egereken TOLERANCIA & AUTOIMMUNITÁS Toleranciáról beszélünk, ha
Immunológia alapjai 24-25. előadás Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás. Tolerált bőr graftok MHC (H2) azonos egereken TOLERANCIA & AUTOIMMUNITÁS Toleranciáról beszélünk, ha
A T sejt receptor (TCR) heterodimer
 Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Immunológia alapjai. Az immunválasz szupressziója Előadás. A szupresszióban részt vevő sejtes és molekuláris elemek
 Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
(1) A T sejtek aktiválása (2) Az ön reaktív T sejtek toleranciája. α lánc. β lánc. V α. V β. C β. C α.
 Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Immunológia alapjai előadás. Az immunológiai felismerés molekuláris összetevői
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia 4. A BCR diverzitás kialakulása
 Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Az allergia molekuláris etiopatogenezise
 Az allergia molekuláris etiopatogenezise Müller Veronika Immunológia továbbképzés 2019. 02.28. SEMMELWEIS EGYETEM Pulmonológiai Klinika http://semmelweis.hu/pulmonologia 2017. 03. 08. Immunológia továbbképzés
Az allergia molekuláris etiopatogenezise Müller Veronika Immunológia továbbképzés 2019. 02.28. SEMMELWEIS EGYETEM Pulmonológiai Klinika http://semmelweis.hu/pulmonologia 2017. 03. 08. Immunológia továbbképzés
Májenzim eltérések Psoriasis - szisztémás terápiák a hepatológus szemével
 Májenzim eltérések Psoriasis - szisztémás terápiák a hepatológus szemével Dr. Tornai István DEOEC, Belgyógyászati Intézet Gasztroenterológiai tanszék Debrecen, 2012. október 11. Psoriasis és májbetegség
Májenzim eltérések Psoriasis - szisztémás terápiák a hepatológus szemével Dr. Tornai István DEOEC, Belgyógyászati Intézet Gasztroenterológiai tanszék Debrecen, 2012. október 11. Psoriasis és májbetegség
LUPUSZ KVÍZ. Kérdések, megoldások, ajándéksorsolás. 2012. december 1.
 LUPUSZ KVÍZ Kérdések, megoldások, ajándéksorsolás 2012. december 1. 1. kérdés: Mi történik egy lupuszos beteg immunrendszerében? A Az immunrendszer túl kevés antitestet termel. B Az immunrendszer antitesteket
LUPUSZ KVÍZ Kérdések, megoldások, ajándéksorsolás 2012. december 1. 1. kérdés: Mi történik egy lupuszos beteg immunrendszerében? A Az immunrendszer túl kevés antitestet termel. B Az immunrendszer antitesteket
Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata
 Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata Dr. Nemes Karolina, Márk Ágnes, Dr. Hajdu Melinda, Csorba Gézáné, Dr. Kopper László, Dr. Csóka Monika, Dr.
Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata Dr. Nemes Karolina, Márk Ágnes, Dr. Hajdu Melinda, Csorba Gézáné, Dr. Kopper László, Dr. Csóka Monika, Dr.
XVI. Pécsi Reumatológus Rezidens és Szakorvosjelölt Fórum
 A Magyar Reumatológusok Egyesülete és az Immunológiai Reumatológiai és Rehabilitációs Egyesület szervezésében: XVI. Pécsi Reumatológus Rezidens és Szakorvosjelölt Fórum 2018. április 13-14. A rendezvény
A Magyar Reumatológusok Egyesülete és az Immunológiai Reumatológiai és Rehabilitációs Egyesület szervezésében: XVI. Pécsi Reumatológus Rezidens és Szakorvosjelölt Fórum 2018. április 13-14. A rendezvény
Újabb ismeretek a Graves-ophthalmopathia kórisméjében
 Újabb ismeretek a Graves-ophthalmopathia kórisméjében Dr. Molnár Ildikó 2004 Tézisek Az utóbbi 11 évben végzett tudományos munkám új eredményei 1. Graves-kórhoz társult infiltratív ophthalmopathia kialakulásában
Újabb ismeretek a Graves-ophthalmopathia kórisméjében Dr. Molnár Ildikó 2004 Tézisek Az utóbbi 11 évben végzett tudományos munkám új eredményei 1. Graves-kórhoz társult infiltratív ophthalmopathia kialakulásában
Az előadás megjelenését a Boehringer Ingelheim támogatta. Az előadás tartalma az előadó (eredményeit és) önálló szakmai álláspontját tükrözi és nem
 Az előadás megjelenését a Boehringer Ingelheim támogatta. Az előadás tartalma az előadó (eredményeit és) önálló szakmai álláspontját tükrözi és nem tekinthető a Boehringer Ingelheim részéről közzétett
Az előadás megjelenését a Boehringer Ingelheim támogatta. Az előadás tartalma az előadó (eredményeit és) önálló szakmai álláspontját tükrözi és nem tekinthető a Boehringer Ingelheim részéről közzétett
DOKTORI ÉRTEKEZÉS TÉZISEI AZ OPPORTUNISTA HUMÁNPATOGÉN CANDIDA PARAPSILOSIS ÉLESZTŐGOMBA ELLENI TERMÉSZETES ÉS ADAPTÍV IMMUNVÁLASZ VIZSGÁLATA
 DOKTORI ÉRTEKEZÉS TÉZISEI AZ OPPORTUNISTA HUMÁNPATOGÉN CANDIDA PARAPSILOSIS ÉLESZTŐGOMBA ELLENI TERMÉSZETES ÉS ADAPTÍV IMMUNVÁLASZ VIZSGÁLATA TÓTH ADÉL TÉMAVEZETŐ: DR. GÁCSER ATTILA TUDOMÁNYOS FŐMUNKATÁRS
DOKTORI ÉRTEKEZÉS TÉZISEI AZ OPPORTUNISTA HUMÁNPATOGÉN CANDIDA PARAPSILOSIS ÉLESZTŐGOMBA ELLENI TERMÉSZETES ÉS ADAPTÍV IMMUNVÁLASZ VIZSGÁLATA TÓTH ADÉL TÉMAVEZETŐ: DR. GÁCSER ATTILA TUDOMÁNYOS FŐMUNKATÁRS
Allergia immunológiája 2012.
 Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 6. előadás Humorális és celluláris immunválasz A humorális (B sejtes) immunválasz lépései Antigén felismerés B sejt aktiváció: proliferáció, differenciálódás
Immunológiai módszerek a klinikai kutatásban 6. előadás Humorális és celluláris immunválasz A humorális (B sejtes) immunválasz lépései Antigén felismerés B sejt aktiváció: proliferáció, differenciálódás
Immunitás és evolúció
 Immunitás és evolúció (r)evolúció az immunrendszerben Az immunrendszer evolúciója Müller Viktor ELTE Növényrendszertani, Ökológiai és Elméleti Biológiai Tanszék http://ramet.elte.hu/~viktor Az immunitás
Immunitás és evolúció (r)evolúció az immunrendszerben Az immunrendszer evolúciója Müller Viktor ELTE Növényrendszertani, Ökológiai és Elméleti Biológiai Tanszék http://ramet.elte.hu/~viktor Az immunitás
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a PD-L1 és PD-1 fehérjék túlélésre gyakorolt hatása
 Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
Túlérzékenységi reakciók Gell és Coombs felosztása szerint.
 Túlérzékenységi reakciók Gell és Coombs felosztása szerint. A felosztás mai szemmel nem a leglogikusabb, mert nem tesz különbséget az allergia, az autoimmunitás és a a transzplantációs immunreakciók között.
Túlérzékenységi reakciók Gell és Coombs felosztása szerint. A felosztás mai szemmel nem a leglogikusabb, mert nem tesz különbséget az allergia, az autoimmunitás és a a transzplantációs immunreakciók között.
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
Immunológia alapjai. 16. előadás. Komplement rendszer
 Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
Klinikai Immunológiai Interdiszciplináris Fórum (KIIF)
 Klinikai Immunológiai Interdiszciplináris Fórum (KIIF) Forró pontok a belgyógyászati és határterületi klinikai immunológiában 2009.09.17 2009.09.19. Kongresszusi Központ, Debrecen Főszervező: Prof. Dr.
Klinikai Immunológiai Interdiszciplináris Fórum (KIIF) Forró pontok a belgyógyászati és határterületi klinikai immunológiában 2009.09.17 2009.09.19. Kongresszusi Központ, Debrecen Főszervező: Prof. Dr.
Immunológia alapjai előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok:
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 2. előadás A veleszületett és specifikus immunrendszer sejtjei Vérképzés = Haematopeiesis, differenciálódás Kék: ősssejt Sötétkék: éretlen sejtek Barna: érett
Immunológiai módszerek a klinikai kutatásban 2. előadás A veleszületett és specifikus immunrendszer sejtjei Vérképzés = Haematopeiesis, differenciálódás Kék: ősssejt Sötétkék: éretlen sejtek Barna: érett
NEM DIFFERENCIÁLT COLLAGENOSIS. Prof. Dr. Bodolay Edit
 NEM DIFFERENCIÁLT COLLAGENOSIS Prof. Dr. Bodolay Edit Immunrendszer feladata Védje a szervezetet a veszélyes, káros anyagoktól a saját struktúra ne sérüljön Autoimmun betegség -Patológiás szövet-sejt eltérések
NEM DIFFERENCIÁLT COLLAGENOSIS Prof. Dr. Bodolay Edit Immunrendszer feladata Védje a szervezetet a veszélyes, káros anyagoktól a saját struktúra ne sérüljön Autoimmun betegség -Patológiás szövet-sejt eltérések
Natív antigének felismerése. B sejt receptorok, immunglobulinok
 Natív antigének felismerése B sejt receptorok, immunglobulinok B és T sejt receptorok A B és T sejt receptorok is az immunglobulin fehérje család tagjai A TCR nem ismeri fel az antigéneket, kizárólag az
Natív antigének felismerése B sejt receptorok, immunglobulinok B és T sejt receptorok A B és T sejt receptorok is az immunglobulin fehérje család tagjai A TCR nem ismeri fel az antigéneket, kizárólag az
Válasz Dr. Szűcs Gabriellának Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére
 Válasz Dr. Szűcs Gabriellának Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére Köszönöm Dr. Szűcs Gabriella részletes, bírálatát, megjegyzéseit. A megfogalmazott kérdésekre az alábbiakban
Válasz Dr. Szűcs Gabriellának Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére Köszönöm Dr. Szűcs Gabriella részletes, bírálatát, megjegyzéseit. A megfogalmazott kérdésekre az alábbiakban
KRÓNIKUS ALLERGIÁS PULMONOLÓGIAI KÓRKÉPEK. Dr. Kovács Lajos SE. I. Gyermekklinika Budapest
 KRÓNIKUS ALLERGIÁS PULMONOLÓGIAI KÓRKÉPEK Dr. Kovács Lajos SE. I. Gyermekklinika Budapest ALLERGIÁS REAKCIÓ TÍPUSAI ASZTMA BRONCHIALE AZ ASZTMA BRONCHIALE TERMÉSZETES LEFOLYÁSÁT BEFOLYÁSOLÓ TÉNYEZİK Genetikai
KRÓNIKUS ALLERGIÁS PULMONOLÓGIAI KÓRKÉPEK Dr. Kovács Lajos SE. I. Gyermekklinika Budapest ALLERGIÁS REAKCIÓ TÍPUSAI ASZTMA BRONCHIALE AZ ASZTMA BRONCHIALE TERMÉSZETES LEFOLYÁSÁT BEFOLYÁSOLÓ TÉNYEZİK Genetikai
Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE
 Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2017. Bev. 2. ábra Az immunválasz kialakulása 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán
Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2017. Bev. 2. ábra Az immunválasz kialakulása 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán
Immunológia alapjai. 10. előadás. Komplement rendszer
 Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
KLINIKAI IMMUNOLÓGIAI INTERDISZCIPLINÁRIS FÓRUM
 KLINIKAI IMMUNOLÓGIAI INTERDISZCIPLINÁRIS FÓRUM PROGRAM 2015. NOVEMBER 12 14. DEBRECENI AKADÉMIAI BIZOTTSÁG SZÉKHÁZA 4032 DEBRECEN, THOMAS MANN U. 49. Kedves Kollégák! A Debreceni Egyetem ÁOK Klinikai
KLINIKAI IMMUNOLÓGIAI INTERDISZCIPLINÁRIS FÓRUM PROGRAM 2015. NOVEMBER 12 14. DEBRECENI AKADÉMIAI BIZOTTSÁG SZÉKHÁZA 4032 DEBRECEN, THOMAS MANN U. 49. Kedves Kollégák! A Debreceni Egyetem ÁOK Klinikai
Asthma bronchiale és krónikus obstruktív tüdőbetegség együttes megjelenése
 CSALÁDORVOSI GYAKORLAT Asthma bronchiale és krónikus obstruktív tüdőbetegség együttes megjelenése Müller Veronika dr. Gálffy Gabriella dr. Tamási Lilla dr. Semmelweis Egyetem, Általános Orvostudományi
CSALÁDORVOSI GYAKORLAT Asthma bronchiale és krónikus obstruktív tüdőbetegség együttes megjelenése Müller Veronika dr. Gálffy Gabriella dr. Tamási Lilla dr. Semmelweis Egyetem, Általános Orvostudományi
http://www.rimm.dote.hu Tumor immunológia
 http://www.rimm.dote.hu Tumor immunológia A tumorok és az immunrendszer kapcsolatai Tumorspecifikus és tumorasszociált antigének A tumor sejteket ölő sejtek és mechanizmusok Az immunológiai felügyelet
http://www.rimm.dote.hu Tumor immunológia A tumorok és az immunrendszer kapcsolatai Tumorspecifikus és tumorasszociált antigének A tumor sejteket ölő sejtek és mechanizmusok Az immunológiai felügyelet
Immunológia I. 2. előadás. Kacskovics Imre (imre.kacskovics@ttk.elte.hu)
 Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Prof. dr. Bodolay Edit. 2016. február 24.
 Prof. dr. Bodolay Edit 2016. február 24. Genetikai hajlam Környezet Infekció, gyógyszer, napfény, stressz, műtét Normális immunitás Patológiás immunitás Immunológiai jelek- klinikai tünet nélkül Előfázis
Prof. dr. Bodolay Edit 2016. február 24. Genetikai hajlam Környezet Infekció, gyógyszer, napfény, stressz, műtét Normális immunitás Patológiás immunitás Immunológiai jelek- klinikai tünet nélkül Előfázis
szerepe a gasztrointesztinális
 A calprotectin és egyéb biomarkerek szerepe a gasztrointesztinális gyulladásos betegségek differenciál diagnosztikájában 1 Halmainé Kiss Ilona, 2 Rutka Mariann, 1 Földesi Imre Szegedi Tudományegyetem 1
A calprotectin és egyéb biomarkerek szerepe a gasztrointesztinális gyulladásos betegségek differenciál diagnosztikájában 1 Halmainé Kiss Ilona, 2 Rutka Mariann, 1 Földesi Imre Szegedi Tudományegyetem 1
PDF Compressor Pro. Dr Petrovicz Edina.április.
 Dr Petrovicz Edina.április. Az immunrendszer feladata Saját és idegen felismerése Kórokozó mikroorganizmusok elleni védekezés A szervezet saját, megváltozott sejtjeinek a felismerése, eliminálása Az immunrendszer
Dr Petrovicz Edina.április. Az immunrendszer feladata Saját és idegen felismerése Kórokozó mikroorganizmusok elleni védekezés A szervezet saját, megváltozott sejtjeinek a felismerése, eliminálása Az immunrendszer
AZ IMMUNOLÓGIAI LABORATÓRIUM DIAGNOSZTIKAI LEHETİSÉGEI. http://rimm.dote.hu
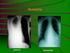 AZ IMMUNOLÓGIAI LABORATÓRIUM DIAGNOSZTIKAI LEHETİSÉGEI http://rimm.dote.hu Az Immunológiai Laboratórium feladata: A, Egy beteg immunrendszerének komplex vizsgálatával adatokat szolgáltatni egy immunológiai
AZ IMMUNOLÓGIAI LABORATÓRIUM DIAGNOSZTIKAI LEHETİSÉGEI http://rimm.dote.hu Az Immunológiai Laboratórium feladata: A, Egy beteg immunrendszerének komplex vizsgálatával adatokat szolgáltatni egy immunológiai
Az ophthalmopathia autoimmun kórfolyamatára utaló tényezôk Bizonyított: A celluláris és humorális autoimmun folyamatok szerepe.
 Az ophthalmopathia autoimmun kórfolyamatára utaló tényezôk Bizonyított: A celluláris és humorális autoimmun folyamatok szerepe. szemizom, retrobulbaris kötôszövet, könnymirigy elleni autoantitestek exophthalmogen
Az ophthalmopathia autoimmun kórfolyamatára utaló tényezôk Bizonyított: A celluláris és humorális autoimmun folyamatok szerepe. szemizom, retrobulbaris kötôszövet, könnymirigy elleni autoantitestek exophthalmogen
A transzplantáció immunológiai vonatkozásai. Transzplantáció alapfogalmak. A transzplantáció sikere. Dr. Nemes Nagy Zsuzsa OVSZ Szakképzés 2012.
 1 A transzplantáció immunológiai vonatkozásai Dr. Nemes Nagy Zsuzsa OVSZ Szakképzés 2012. Transzplantáció alapfogalmak Transzplantáció:szövet/szervátültetés Graft: transzplantátum Allotranszplantáció:
1 A transzplantáció immunológiai vonatkozásai Dr. Nemes Nagy Zsuzsa OVSZ Szakképzés 2012. Transzplantáció alapfogalmak Transzplantáció:szövet/szervátültetés Graft: transzplantátum Allotranszplantáció:
A keringı tumor markerek klinikai alkalmazásának aktuális kérdései és irányelvei
 A keringı tumor markerek klinikai alkalmazásának aktuális kérdései és irányelvei A TM vizsgálatok alapkérdései A vizsgálatok célja, információértéke? Az alkalmazás területei? Hogyan válasszuk ki az alkalmazott
A keringı tumor markerek klinikai alkalmazásának aktuális kérdései és irányelvei A TM vizsgálatok alapkérdései A vizsgálatok célja, információértéke? Az alkalmazás területei? Hogyan válasszuk ki az alkalmazott
Mindennapi pajzsmirigy diagnosztika: antitestek, hormonszintek
 Mindennapi pajzsmirigy diagnosztika: antitestek, hormonszintek Nagy V. Endre Endokrinológia Tanszék Debreceni Egyetem Orvos- és Egészségtudományi Centrum Belgyógyászati Intézet, I. Belklinika A pajzsmirigybetegségek
Mindennapi pajzsmirigy diagnosztika: antitestek, hormonszintek Nagy V. Endre Endokrinológia Tanszék Debreceni Egyetem Orvos- és Egészségtudományi Centrum Belgyógyászati Intézet, I. Belklinika A pajzsmirigybetegségek
A Debreceni Egyetem Gasztroenterológiai Tanszéke az Országos Immonológiai Koordináló Intézet és a MGT Immunológiai Munkacsoportja közös rendezvénye
 A i Egyetem Gasztroenterológiai Tanszéke az Országos Immonológiai Koordináló Intézet és a MGT Immunológiai Munkacsoportja közös rendezvénye III. i Gasztro-Immun Konferencia DEOEC, Auguszta Központ előadóterme
A i Egyetem Gasztroenterológiai Tanszéke az Országos Immonológiai Koordináló Intézet és a MGT Immunológiai Munkacsoportja közös rendezvénye III. i Gasztro-Immun Konferencia DEOEC, Auguszta Központ előadóterme
MI ÁLLHAT A FEJFÁJÁS HÁTTERÉBEN? Dr. HégerJúlia, Dr. BeszterczánPéter, Dr. Deák Veronika, Dr. Szörényi Péter, Dr. Tátrai Ottó, Dr.
 MI ÁLLHAT A FEJFÁJÁS HÁTTERÉBEN? Dr. HégerJúlia, Dr. BeszterczánPéter, Dr. Deák Veronika, Dr. Szörényi Péter, Dr. Tátrai Ottó, Dr. Varga Csaba ESET 46 ÉVES FÉRFI Kórelőzmény kezelt hypertonia kivizsgálás
MI ÁLLHAT A FEJFÁJÁS HÁTTERÉBEN? Dr. HégerJúlia, Dr. BeszterczánPéter, Dr. Deák Veronika, Dr. Szörényi Péter, Dr. Tátrai Ottó, Dr. Varga Csaba ESET 46 ÉVES FÉRFI Kórelőzmény kezelt hypertonia kivizsgálás
Válasz Dr. Kacskovics Imre Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére
 Válasz Dr. Kacskovics Imre Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére Köszönöm Dr. Kacskovics Imre átfogó bírálatát, felvetéseit. A megfogalmazott kérdésekre az alábbiakban válaszolok:
Válasz Dr. Kacskovics Imre Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére Köszönöm Dr. Kacskovics Imre átfogó bírálatát, felvetéseit. A megfogalmazott kérdésekre az alábbiakban válaszolok:
Doktori értekezés tézisei. A komplementrendszer szerepe EAE-ben (Experimental Autoimmune Encephalomyelitis), a sclerosis multiplex egérmodelljében
 Doktori értekezés tézisei A komplementrendszer szerepe EAE-ben (Experimental Autoimmune Encephalomyelitis), a sclerosis multiplex egérmodelljében Készítette: Terényi Nóra Témavezető: Prof. Erdei Anna Biológia
Doktori értekezés tézisei A komplementrendszer szerepe EAE-ben (Experimental Autoimmune Encephalomyelitis), a sclerosis multiplex egérmodelljében Készítette: Terényi Nóra Témavezető: Prof. Erdei Anna Biológia
CD8 pozitív primér bőr T-sejtes limfómák 14 eset kapcsán
 CD8 pozitív primér bőr T-sejtes limfómák 14 eset kapcsán Szepesi Ágota 1, Csomor Judit 1, Marschalkó Márta 2 Erős Nóra 2, Kárpáti Sarolta 2, Matolcsy András 1 Semmelweis Egyetem I. Patológiai és Kísérlet
CD8 pozitív primér bőr T-sejtes limfómák 14 eset kapcsán Szepesi Ágota 1, Csomor Judit 1, Marschalkó Márta 2 Erős Nóra 2, Kárpáti Sarolta 2, Matolcsy András 1 Semmelweis Egyetem I. Patológiai és Kísérlet
A göbös pajzsmirigy kivizsgálása, ellátása. Mészáros Szilvia dr. Semmelweis Egyetem I. sz. Belgyógyászati Klinika
 A göbös pajzsmirigy kivizsgálása, ellátása Mészáros Szilvia dr. Semmelweis Egyetem I. sz. Belgyógyászati Klinika Pajzsmirigy göbök A lakosság 4-8%-ának van tapintható göbe. Ultrahanggal a lakosság közel
A göbös pajzsmirigy kivizsgálása, ellátása Mészáros Szilvia dr. Semmelweis Egyetem I. sz. Belgyógyászati Klinika Pajzsmirigy göbök A lakosság 4-8%-ának van tapintható göbe. Ultrahanggal a lakosság közel
Klinikai immunológia, reumatológia Auguszta tanterem Tematika:
 Az intézet neve: Belgyógyászati Intézet, III. sz. Belgyógyászati Klinika és Reumatológiai Tanszék A tárgy neve: Klinikai immunológia, reumatológia Oktatási év, félév: 2013. III. évfolyam, 2. félév Óraszám/félév:
Az intézet neve: Belgyógyászati Intézet, III. sz. Belgyógyászati Klinika és Reumatológiai Tanszék A tárgy neve: Klinikai immunológia, reumatológia Oktatási év, félév: 2013. III. évfolyam, 2. félév Óraszám/félév:
2006. ZÁRÓJELENTÉS. Amint azt részjelentéseinkben korábban ismertettük, több m3 muscarinszerű
 OTKA Nyilvántartási szám:t 038303 ZÁRÓJELENTÉS 2006. ZÁRÓJELENTÉS Témavezető neve: Dr. Pokorny Gyula A téma címe: Acetilcholin-receptor elleni autoantitestek vizsgálata és pathogenetikai szerepük meghatározása
OTKA Nyilvántartási szám:t 038303 ZÁRÓJELENTÉS 2006. ZÁRÓJELENTÉS Témavezető neve: Dr. Pokorny Gyula A téma címe: Acetilcholin-receptor elleni autoantitestek vizsgálata és pathogenetikai szerepük meghatározása
Autoimmun májbetegségek
 Autoimmun májbetegségek Prof. Dr. Zeher Margit Klinikai Immunológia Tanszék, Debrecen Hallgatói előadás 2011/2012 I. félév Tárgy: Gastroenterológia-hepatológia-anyagcsere betegségek Debrecen, 2011.10.06.
Autoimmun májbetegségek Prof. Dr. Zeher Margit Klinikai Immunológia Tanszék, Debrecen Hallgatói előadás 2011/2012 I. félév Tárgy: Gastroenterológia-hepatológia-anyagcsere betegségek Debrecen, 2011.10.06.
17.2. ábra Az immunválasz kialakulása és lezajlása patogén hatására
 11. 2016. nov 30. 17.2. ábra Az immunválasz kialakulása és lezajlása patogén hatására 17.3. ábra A sejtközötti térben és a sejten belül élő és szaporodó kórokozók ellen kialakuló védekezési mechanizmusok
11. 2016. nov 30. 17.2. ábra Az immunválasz kialakulása és lezajlása patogén hatására 17.3. ábra A sejtközötti térben és a sejten belül élő és szaporodó kórokozók ellen kialakuló védekezési mechanizmusok
Procalcitonin a kritikus állapot prediktora. Fazakas János, PhD, egyetemi docens Semmelweis Egyetem, Transzplantációs és Sebészeti Klinika
 Procalcitonin a kritikus állapot prediktora Fazakas János, PhD, egyetemi docens Semmelweis Egyetem, Transzplantációs és Sebészeti Klinika Procalcitonin a kritikus állapot prediktora PCT abszolút érték
Procalcitonin a kritikus állapot prediktora Fazakas János, PhD, egyetemi docens Semmelweis Egyetem, Transzplantációs és Sebészeti Klinika Procalcitonin a kritikus állapot prediktora PCT abszolút érték
A Petrányi Gyula Klinikai Immunológiai és Allergológiai Doktori Iskola (PGKIADI) képzési terve 2014.
 A Petrányi Gyula Klinikai Immunológiai és Allergológiai Doktori Iskola (PGKIADI) képzési terve 2014. Az orvostudományi területen működő doktori iskolák képzésére vonatkozó alapelveket a Debreceni Egyetem
A Petrányi Gyula Klinikai Immunológiai és Allergológiai Doktori Iskola (PGKIADI) képzési terve 2014. Az orvostudományi területen működő doktori iskolák képzésére vonatkozó alapelveket a Debreceni Egyetem
Új lehetőségek az immunadszorpciós kezelésben. III. Terápiás Aferezis Konferencia, Debrecen Bielik Norbert
 Új lehetőségek az immunadszorpciós kezelésben III. Terápiás Aferezis Konferencia, Debrecen Bielik Norbert TheraSorb aferézis rendszer teljes megoldást kínál a következő applikációkra: Immunadszorpció (totál
Új lehetőségek az immunadszorpciós kezelésben III. Terápiás Aferezis Konferencia, Debrecen Bielik Norbert TheraSorb aferézis rendszer teljes megoldást kínál a következő applikációkra: Immunadszorpció (totál
Immunszerológia I. Agglutináció, Precipitáció. Immunológiai és Biotechnológiai Intézet PTE-KK
 Immunszerológia I. Agglutináció, Precipitáció Immunológiai és Biotechnológiai Intézet PTE-KK Antigén Antitest Alapok Antigén: vvt,, baktérium, latex gyöngy felszínén (µm( m nagyságú partikulum) Antitest:
Immunszerológia I. Agglutináció, Precipitáció Immunológiai és Biotechnológiai Intézet PTE-KK Antigén Antitest Alapok Antigén: vvt,, baktérium, latex gyöngy felszínén (µm( m nagyságú partikulum) Antitest:
Tantermi előadás. Nagy Viktor Semmelweis Egyetem, ÁOK, II. Belgyógyászati Klinika
 Tantermi előadás Nagy Viktor Semmelweis Egyetem, ÁOK, II. Belgyógyászati Klinika Glomerulonephritis acuta, nephrosis syndroma, glomerulonephritis chronica. Budapest, 2015. II. 10. Normális glomerulus
Tantermi előadás Nagy Viktor Semmelweis Egyetem, ÁOK, II. Belgyógyászati Klinika Glomerulonephritis acuta, nephrosis syndroma, glomerulonephritis chronica. Budapest, 2015. II. 10. Normális glomerulus
A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet
 A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet Mi a feladata az Immunrendszernek? 1. Védelem a kórokozók ellen 2. Immuntolerancia fenntartása Mik is azok a kórokozók? Kórokozók alatt
A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet Mi a feladata az Immunrendszernek? 1. Védelem a kórokozók ellen 2. Immuntolerancia fenntartása Mik is azok a kórokozók? Kórokozók alatt
Dengue-láz. Dr. Szabó György Pócsmegyer
 Dengue-láz Dr. Szabó György Pócsmegyer Történelem Az ókori Kínában leírták. 1906-ban igazolták, hogy szúnyog terjeszti a betegséget. 1907-ben igazolták, hogy vírus. A II. világháború után kezdett megvadulni
Dengue-láz Dr. Szabó György Pócsmegyer Történelem Az ókori Kínában leírták. 1906-ban igazolták, hogy szúnyog terjeszti a betegséget. 1907-ben igazolták, hogy vírus. A II. világháború után kezdett megvadulni
4. A humorális immunválasz október 12.
 4. A humorális immunválasz 2016. október 12. A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja a limfocitát A keletkező
4. A humorális immunválasz 2016. október 12. A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja a limfocitát A keletkező
Dr. Szántó Antónia DE KK ÁOK Belgyógyászati Intézet Klinikai Immunológiai Tanszék 2018
 Sjögren-szindróma Dr. Szántó Antónia DE KK ÁOK Belgyógyászati Intézet Klinikai Immunológiai Tanszék 2018 Epidemiológia Prevalencia: 0,5-1% Elsősorban 40-50 év közötti nők Nő: férfi arány = 9:1 Primer Sjögren-szindróma:
Sjögren-szindróma Dr. Szántó Antónia DE KK ÁOK Belgyógyászati Intézet Klinikai Immunológiai Tanszék 2018 Epidemiológia Prevalencia: 0,5-1% Elsősorban 40-50 év közötti nők Nő: férfi arány = 9:1 Primer Sjögren-szindróma:
Csépány Tünde 2014. Október 03.
 Csépány Tünde 2014. Október 03. » 33 éves nő, subacut» Sürgető vizelési inger» Spinalis laesióra gyanús panasz» Előzmény nincs » 51 éves nő, subacut» Járásképtelen, kezei ügyetlenek, lábai érzéketlenek,
Csépány Tünde 2014. Október 03. » 33 éves nő, subacut» Sürgető vizelési inger» Spinalis laesióra gyanús panasz» Előzmény nincs » 51 éves nő, subacut» Járásképtelen, kezei ügyetlenek, lábai érzéketlenek,
A szisztémás autoimmun betegségekkel asszociált interstitialis tüdőbetegségek
 Haladás a reumatológia, immunológia és osteologia területén 2015-2017. Budapest 2018.04.19. A szisztémás autoimmun betegségekkel asszociált interstitialis tüdőbetegségek Dr. Müller Veronika MTA doktora
Haladás a reumatológia, immunológia és osteologia területén 2015-2017. Budapest 2018.04.19. A szisztémás autoimmun betegségekkel asszociált interstitialis tüdőbetegségek Dr. Müller Veronika MTA doktora
A pályázati program megvalósítása közben 2008-2012 között három változtatás történt az eredeti tervhez képest:
 ZÁRÓJELENTÉS (OTKA 71883) Cím: Új terápiás módszerek kifejlesztése és hatásmechanizmusának tanulmányozása poliszisztémás autoimmun kórképekben Vezető kutató: Sipka Sándor (A) Résztvevők: Baráth Sándor
ZÁRÓJELENTÉS (OTKA 71883) Cím: Új terápiás módszerek kifejlesztése és hatásmechanizmusának tanulmányozása poliszisztémás autoimmun kórképekben Vezető kutató: Sipka Sándor (A) Résztvevők: Baráth Sándor
Doktori értekezés tézisei
 Doktori értekezés tézisei A komplement- és a Toll-szerű receptorok kifejeződése és szerepe emberi B-sejteken fiziológiás és autoimmun körülmények között - az adaptív és a természetes immunválasz kapcsolata
Doktori értekezés tézisei A komplement- és a Toll-szerű receptorok kifejeződése és szerepe emberi B-sejteken fiziológiás és autoimmun körülmények között - az adaptív és a természetes immunválasz kapcsolata
MHC-gének jelenléte.célkitűzésünk az volt, hogy megvizsgáljuk, hogy milyen HLA-allélek
 Az idiopathiás inflammatorikus myopathiák (IIM) szisztémás autoimmun betegségek, jellegzetességük a harántcsíkolt izomzat immunmediált gyulladása, amely progresszív izomgyengeséghez vezet. A legtöbb autoimmun
Az idiopathiás inflammatorikus myopathiák (IIM) szisztémás autoimmun betegségek, jellegzetességük a harántcsíkolt izomzat immunmediált gyulladása, amely progresszív izomgyengeséghez vezet. A legtöbb autoimmun
