A KÉMIAI POTENCIÁL A KÉMIAI POTENCIÁL A KÉMIAI POTENCIÁL A KÉMIAI POTENCIÁL A KÉMIAI POTENCIÁL I. A TÖKÉLETES GÁZ KÉMIAI POTENCIÁLJA
|
|
|
- Albert Mészáros
- 6 évvel ezelőtt
- Látták:
Átírás
1 kémiai oteciál fogalma és számítása egy- és többkomoesű redszerekbe. I. tökéletes gázok kémiai oteciálja II. reális gázok kémiai oteciálja. Fugacitás. III. Folyadékok kémiai oteciálja. IV. kémiai oteciál többkomoesű redszerekbe. Gibbs Duhem-egyelet. V. Ideális elegyek. Raoult- és a Hery-törvéy. VI. Reális elegyek és oldatok. z aktivitás termodiamikai jeletősége. Stadard állaot választása. sotá folyamatok iráyáak, mértékéek és az egyesúly helyzetéek meghatározására izoterm, yílt redszerekbe, álladó yomáso a G szabadetalia-függvéyt vezettük be. Jobb áttekitést, összehasolítást és léyegese egyszerűbb számítási lehetőségeket yújt eze feladatok megoldásába elsősorba az egyesúly leírásába, ha kéezzük az adott ayagra a G m függvéy összetétel szeriti arciális differeciálháyadosát. z így kaott arciális moláris szabadetalia általáosa haszált eve a kémiai oteciál. kémiai oteciál [egyeértékű megfogalmazásokba] arciális moláris szabadetalia (álladó - és -): G, az a szabadetalia-változás, amit az adott ayag moljáak hozzáadása eredméyez a redszerbe. a G összetételfüggése. z egyesúly feltétele a legkülöbözőbb redszerekbe: a kémiai oteciál azoossága mide komoesre, mide fázisba. Ebből következőe a sotá folyamatok iráya a kémiai oteciálok kiegyelítődése. tiszta ayag kémiai oteciálja maga a moláris szabadetalia: Gm Gm, z elegy i-edik komoeséek μ i kémiai szabadetaliája a arciális moláris szabadetalia: G i i,, j 3 4 kémiai oteciál külöböző feltételek között: μ J defiíciója G segítségével: (izoterm, izobar) μ J defiíciója U segítségével: (izochor, izoetroikus) μ J defiíciója H segítségével: (izobar, izoetroikus) μ J defiíciója segítségével: (izochor, izoterm) G i J U i J H i J i J,,' V,S,',S,' V,,' Eszerit U, H, és G emcsak állaotfüggvéyek, haem termodiamikai oteciálfüggvéyek is. 5 I. ÖKÉLEES GÁZ KÉMII Legegyszerűbb redszer: a tökéletes gáz. Szabadetaliája yomáso, hőmérséklete: G G Rl ahol G a gáz stadard szabadetaliája (midig = bar stadard yomáso és tetszőleges -). Kémiai oteciálja yomáso az előző egyelet szeriti deriválásával: Rl ahol μ a stadard kémiai oteciál: a tiszta gáz moláris szabadetaliája (midig = bar yomáso és tetszőleges hőmérséklete). 6
2 I. ÖKÉLEES GÁZ KÉMII Grafikusa: a tökéletes gáz kémiai oteciálja ltől függ, aráyossági téyező az R szorzat. stadard állaotot -ba éri el. Ha, akkor μ -. Rl Fotos és otos termodiamikai összefüggések gyakra em teljesülek a mért -értékekkel. Pl. + C + D gázfázisú reakció K = C D /( ) egyesúlyi álladó em ugyaayi külöböző yomásoko, így em haszálható jól K kifejezése. Általáosabba: god va a μ értékével és alkalmazásával. Lehet viszot illesztéssel olya -jellegű értékeket találi [és ezeket táblázatba, grafikoba, kéletbe megjeleítei], melyek agy yomásoko azoos K értékeket eredméyezek, tehát megtarthatjuk K egyszerű és agyszerű egyeletét. Más esetekbe is ez a helyzet: ezért vezették be a fugacitás ( szökési hajlam ) fogalmát. 7 8 fugacitás defiíciója: reális gázok kémiai oteciáljáak yomásfüggését leíró egyeletbe a mérhető yomást az effektív yomással helyettesítjük, amit f fugacitásak evezük: f Rl Rl Két redezedő kérdésük va. a fugacitás és a yomás kacsolata: f = γ ahol γ a dimezió élküli fugacitási együttható a reális gáz stadard állaota: olya hiotetikus állaot, amelybe a gáz yomása θ és tökéletes gázkét viselkedik (kölcsöhatások icseek). Rlγ fejezi az itermolekuláris erőket. Kis yomásoko ez csökke, ezért γ =, amit =. Rl Rl γ a Z komresszibilitási együtthatóval kifejezhető: Z l d 9 Emlékeztetőül: Z értékeket méri kell, de jól mérhetőek. Z-t a yomás függvéyébe ábrázoltuk: hol agyobb, hol kisebb, de ahogy -hoz, úgy Z -hez. (Ezzel csak kimutattuk az eltérést, de em írtuk le és em értelmeztük.) Eek okai: Nagy yomáso a taszítóerők a meghatározók, a reális gáz kémiai oteciálja agyobb, mit a tökéletesé, mert agy a szökési hajlam. Közees yomáso a vozóerők domiálak, így a kémiai oteciál kisebb, mit a tökéletes gázoké, kisebb a molekulák szökési hajlama. hogy, μ egybeesik a tökéletes gázok μ értékeivel, mivel ics számottevő kölcsöhatás a gázmolekulák között.
3 III. FOLYDÉKOK KÉMII Hogya függ µ az elegy összetételétől? la: egyesúlyba a folyadékba és gőzébe a µ kémiai oteciál azoos (ez az egyesúly jellemzője általába is. Lásd a későbbi éldákat!): l g g Rl µ azoossága az oldott ayagra () és az oldószerre () is feáll. IV. ÖKOMPONENSŰ RENDSZEREK. GIS DUHEM-EGYENLE. Egy összetett redszer (l. kétkomoesű elegy) szabadetaliája additíve tevődik össze a komoesek arciális moláris szabadetaliájából (kémiai oteciáljából): G Ha csak az összetételt változtatjuk (, álladó): dg d Álladó és eseté láttuk: dg d d kettőből következőe két komoesre: d d d d d 3 4 IV. ÖKOMPONENSŰ RENDSZEREK. GIS DUHEM-EGYENLE. z általáos, több komoesre érvéyes alak, a Gibbs Duhem-egyelet: J JdJ artalma (modaivalója): bármely komoes kémiai oteciáljáak változása együtt jár a többi komoes kémiai oteciáljáak változásával. V. IDEÁLIS ELEGYEK. ROUL- ÉS HENRY-ÖRVÉNY tiszta ayagra: l g Rl z ayag oldatba: két egyeletet kivova egymásból: l g Rl kísérleti adatokat feldolgozva Raoult l l Rl egy törvéyt fogalmazott meg ( roko vegyületek elegyére ): Ebből ideális elegyekre a következőt kajuk (ami x defiícióak is jó): azaz, a kémiai oteciált az adott ayag (komoes) elegybeli móltörtje határozza meg. l l Rlx 5 6 V. IDEÁLIS ELEGYEK. ROUL- ÉS HENRY-ÖRVÉNY Ideális elegyekbe midkét komoes ( és is) követi Raoult-törvéyét: x és x Vaak olya, ú. ideálisa híg oldatok, ahol kis kocetrációba az oldott ayag gőzyomása aráyos aak móltörtjével, és a tiszta ayag gőzyomása helyett egy yomás jellegű, de más értékű ayagi álladóval: Ez a Hery-törvéy (főleg oldott xkgázokra). K az ú. Hery-álladó (ayagokét egyedi, a tiszta ayag gőzyomásától eltérő érték). 7 Fraçois-Marie Raoult 83 9 fracia kémikus William Hery agol kémikus 8 3
4 V. IDEÁLIS ELEGYEK. ROUL- ÉS HENRY-ÖRVÉNY Két hasoló folyadék elegye: a teljes és a arciális gőzyomások V. IDEÁLIS ELEGYEK. ROUL- ÉS HENRY-ÖRVÉNY Raoult-törvéy és a Hery-törvéy érvéyesüléséek tartomáyai: általába aceto-kloroform elegybe 9 VI. REÁLIS ELEGYEK ÉS OLDOK: KIVIÁSOK reális gázok effektív yomásáak kifejezésére bevezettük az f = γ fugacitás fogalmát. z egyszerű termodiamikai formalizmus megtartása érdekébe a reális elegyek és oldatok leírásába a kocetráció helyett alkalmazzuk az a aktivitást és ezzel együtt a γ aktivitási koefficiest. helyzet itt boyolultabb, ezért külö tárgyaljuk a) az oldószer aktivitását és b) a oldott ayag aktivitását. Fotos kérdés a viszoyítási ala, a stadard állaot defiiálása. (Gázokál ez egyszerűbb: ) VI. REÁLIS ELEGYEK ÉS OLDOK: KIVIÁSOK a) z oldószer aktivitása (móltörtekkel) z oldószer kémiai oteciálja folyadékba a fölötte lévő egyesúlyi gőz yomásából számítható: Ideális elegybe midkét komoes követi l l Rl a Raoulttörvéyt ( ), így: stadard állaot az oldószerre és oldott ayagra is az x l l Rlx x = (a tiszta folyadék, bar yomáso). Reális elegy em követi a Raoult-törvéyt, de megtarthatjuk az összefüggést, ha x helyett a-t alkalmazzuk: l l Rla VI. REÁLIS ELEGYEK ÉS OLDOK: KIVIÁSOK a) z oldószer aktivitása (móltörtekkel) Célszerűe: a = x Értelemszerűe: a x ha x ha x Ebből az oldószer kémiai oteciálja: + Rlx + R l z oldószer stadard állaota: x =, azaz maga a tiszta folyadék (l). Ez fizikailag is megvalósuló állaot. z a aktivitás fukciója: effektív móltört z aktivitás téyleges értéke: a = /, így az értéke gőzyomásméréssel meghatározható. 3 VI. REÁLIS ELEGYEK ÉS OLDOK: KIVIÁSOK b) oldott ayag aktivitása Ideális oldatba az oldott ayag kocetrációja (móltörtje) kicsi (x ), ettől az (x ) tiszta ayag (mit kézefekvő stadard) állaot távol va. Ideálisa híg oldatok (Hery-tv.: xk) Hery-törvéyt követő oldott ayag kémiai oteciálja: + R l( / ) = + Rl(K / ) + Rlx = = + Rlx 4 4
5 VI. REÁLIS ELEGYEK ÉS OLDOK: KIVIÁSOK b) oldott ayag aktivitása Reális oldatokba agyobb kocetrációál a legtöbb oldat em követi a Hery-törvéyt. µ kélet alakját megtartadó alkalmazzuk a (mólkocetrációra voatkozó) aktivitást midkét ayagra: + Rla = + R lx + R lγ stadard állaot ugyaaz mit ideális oldatokba, az eltérést az ideálistól az a, illetve γ tartalmazza: a = /K = γ x Ha x (az oldat -re hígul), úgy a x és γ reális oldat, ahogy hígul, fokozatosa közelíti az 5 ideális viselkedést. VI. REÁLIS ELEGYEK ÉS OLDOK: KIVIÁSOK molalitás-skálájú aktivitás: Elegyekél (oldatokál) gyakra az m molalitást alkalmazzuk. Eek megfelelő aktivitás defiíció szükséges. Ideálisa híg oldatokba oldott ayagra <<, ezért jó közelítéssel x /. Ekkor: + R lk + R l(m /m ). [Itt x = k(m /m ), ahol k dimezió élküli álladó és m = mol kg.] Combiig ad R lk: + R l(m /m ). [Itt a oldott ayag stadard -ja ha, m = m.] Ekkor: a = γ (m /m ), ahol γ amit m. Reális oldatba oldott ayagra: + R la. 6 VI. REÁLIS ELEGYEK ÉS OLDOK: KIVIÁSOK Stadardállaotok (összefoglalás): komoes stadardállaot kémiai oteciál korlátok oldószer (Raoulttörvéy) oldott ayag (Herytörvéy) tiszta oldószer () tiszta oldott ayag hiotetikus állaot () b molalitású oldott ayag állaot + R la a / és ha x (tiszta oldószer) a x + R la a /K és a x + R la a (b/b ) ha x ha b fogalomba beletartozik, hogy a tiszta folyékoy vagy szilárd állaotú ayag aktivitása a =. yomás midkét esetbe bar. EGYKOMPONENSŰ RENDSZEREK ERMODINMIKÁJ I. fázis és komoes fogalma II. Fázisdiagramok. CO, a víz és a He fázisdiagramja. III. Fázisstabilitás és fázisátmeet IV. kémiai oteciál alkalmazása egykomoesű többfázisú redszerek egyesúlyáak leírására V. yomás hatása a fázisegyesúlyokra VI. hőmérséklet hatása a fázisegyesúlyokra. Claeyro-egyelet. VII. Folyadék gőz redszerek: Clausius Claeyroegyelet. Párolgási etróia: a routo-szabály. 7 8 EGYKOMPONENSŰ RENDSZEREK ERMODINMIKÁJ árgyalásuk alaelvei: Egyesúlyi redszereket (állaotokat) vizsgáluk és íruk le. (,, V, x i függvéyébe a fázisok stabilisak vagy átalakulak.) Egyesúlyba bármely komoes kémiai oteciálja (μ) mide fázisba azoos. Egyesúly csak zárt redszerbe alakulhat ki. változások (fázisátmeetek) reverzíbilisek. ( módosulatváltozások gyakra em reverzíbilisek.) z átalakulások időbeliségét em tárgyaljuk. I. FÁZIS ÉS KOMPONENS FOGLM fázis fogalma: egy ayagi redszer makroszkóikus méretű, azoos fizikai tulajdoságokkal bíró része. Egy adott fázisba egy vagy több komoes is lehet (l. tiszta NH 3, illetve a levegő). komoes fogalma: egy ayagi redszer kémiailag megkülöböztethető összetevője, alkotórésze (l. elemek, vegyületek, iook). komoes egy vagy több fázisba is jele lehet az adott redszerbe (l. a H O az egymással éritkező vízgőzbe, folyadékba és jégbe is jele va)
6 I. FÁZIS ÉS KOMPONENS FOGLM II. FÁZISDIGRMOK Fázisok: Gáz (gőz) halmazállaot (g) (gázfázis) tiszta gáz ( komoes) vagy gázelegy (több komoes) egzaktul tárgyalható redszerek. Folyadék halmazállaot (l) (folyadékfázis) tiszta folyadék ( komoes) vagy elegy, ill. oldat ( vagy több komoes). Szilárd halmazállaot (s) (szilárdfázis) komoes gyakra több módosulatba: allotróok, l. C, P, S, jég. több komoes: ötvözetek, szilárd oldatok stb. [Plazma állaot: em hétközai, de fotos.] 3 Kísérleti úto meghatározott ábrák. Egyesúlyi állaotokat tükrözek. Sík részek: csak egy-egy fázis stabilis (a gáztörvéyek egy ilye síko belül érvéyesek). Voalak (fázishatárok): két-két fázis stabilis, egymással egyesúlyba vaak. Hármasot ( 3 ): három fázis stabilis egyesúlyba. Kritikus ot ( c ): eél agyobb hőmérsékleteke csak gázfázis va, kisebb hőmérséklete gőzfázis. Szuerkritikus állaot Suercritical Gas 3 II. FÁZISDIGRMOK II. FÁZISDIGRMOK CO fázisdiagramja: Mivel a hármasot atm felett va, atmoszferikus yomáso a folyadék em létezik. CO -alackba folyadék vagy agyyomású gáz va. szilárd CO szublimál, ezért evezik száraz jég - ek. 33 H O fázisdiagramja: yomást övelve az olvadásot csökke! ( H O(l) sűrűsége agyobb, moltérfogata kisebb mit a jégé.) Nagy yomásoko külöböző szilárd fázikok jeleek meg (II, III, V, VI, VII) htt://leteg.ttk.te.hu/letelog/ blog9.html 34 II. FÁZISDIGRMOK 4 He fázisdiagramja: egyrészt külöleges viselkedést tükröz (folyadékfolyadék átmeet, szuerfolyékoyság), másrészt az alacsoy hőmérsékletek fizikájába élkülözhetetle. III. FÁZISSILIÁS, FÁZIS- ÁLKULÁS (FÁZISÁMENE) aasztalatok: Ezek fizikai (és em kémiai) változások. eve eve Megjegyzés l g árolgás kodezálás s l olvadás fagyás s g szublimálás lerakódás Kétféle forrásot va: ormális: atm stadard: bar Kétféle olvadásot/ fagyásot va: ormális: atm stadard: bar s α s β módosulatváltozás redszerit lassú
7 III. FÁZISSILIÁS, FÁZIS- ÁLKULÁS (FÁZISÁMENE) Fázisátmeetek: Egyesúlyba egy ayag kémiai oteciálja a redszerbe mideütt (mide fázisba) azoos: egyesúly va a fáziso belül és egyesúly va a fázisok között. Ha ez em áll fe, akkor a redszerbe elidulak olya sotá folyamatok, amelyek a kémiai oteciálok kiegyelítődését eredméyezik. Ezek egyike a fázisátmeet (azaz egyik fázis átalakulása a másikba), ami tisztá fizikai változás. IV. LKLM- ZÁS FÁZISÁMENEEK LEÍRÁSÁR Legye, álladó, de a μ em azoos mide fázisba, azaz ics egyesúlyba a redszer. Ha μ > μ, akkor d meyiségű ayag megy át az. helyről a. helyre (ez lehet kémiai átalakulás is). Kezdeti állaot Sotá változás Végső állaot d d d d dg dg IV. LKLM- ZÁS FÁZISÁMENEEK LEÍRÁSÁR IV. LKLM- ZÁS FÁZISÁMENEEK LEÍRÁSÁR Ismerjük a kémiai oteciál változását a körülméyek (, ) függvéyébe: G S Sm G V Vm 39 Összesítve a -függés három görbéjét: a μ kémia oteciál a hatására a szilárd folyadék gázfázis sorredbe egyre meredekebbe csökke (mivel a redszer S etróiája ebbe a sorredbe egyre agyobb). és változásáak hatására a fázisok egymásba oda és vissza átalakulak. fázisátalakulások jól defiiált hőmérséklete következek be és függeek a yomástól. 4 IV. LKLM- ZÁS FÁZISÁMENEEK LEÍRÁSÁR Összesítve a -függés három görbéjét: V. NYOMÁS HÁS FÁZISEGYENSÚLYOKR külső yomás hatása a fus olvadásotra: Általáos termodiamikai ismereteikből tudjuk, hogy övelésével a μ kémiai oteciál is ő: V m azaz dμ = V m d Általába V m (l) > V m (s), ezért ővelésével fus ő, azaz agyobb yomáso agyobb a szilárd ayagok olvadásotja. víz kivétel: V m (l) > V m (s), ezért a yomásövelés hatására a fus olvadásot értéke csökke. (Gyakorlat: gleccserek, korcsolya) 4 4 7
8 V. NYOMÁS HÁS FÁZISEGYENSÚLYOKR V. NYOMÁS HÁS FÁZISEGYENSÚLYOKR külső yomás hatása a fus olvadásotra: Általáos termodiamikai ismereteikből tudjuk, hogy övelésével a μ kémiai oteciál is ő: V m azaz dμ = V m d Általába V m (l) > V m (s), ezért ővelésével fus ő, azaz agyobb yomáso agyobb a szilárd ayagok olvadásotja. víz kivétel: V m (l) > V m (s), ezért a yomásövelés hatására a fus olvadásot értéke csökke. (Gyakorlat: gleccserek, korcsolya) 43 P külső yomás hatása a gőzyomásra: Csak a kodezált (folyadék) fázisra hat a yomás. aasztalat: ΔP külső yomás hatására ő a gőzyomás, mert a molekulák kiréselődek a gőzfázisba. Leírás: Kezdetbe a kémiai oteciál azoos a két fázisba: μ(g) = μ(l) ΔP külső yomásváltozás eseté is azoosak a kémiai oteciálok, azaz: dμ(g) = dμ(l) és dμ(g) = V m (g)d, ill. dμ(l) = V m (l)dp. ökéletes gázra: V m (g) = R/ azaz dμ(g) = Rd/. Itegrálás utá ( a ormális gőzyomás): e Vm l P R VI. HŐMÉRSÉKLE HÁS Z EGYENSÚLYI GŐZNYOMÁSR. CLPEYRON-EGYENLE. két fázis egyesúlyba va: μ α (,) = μ β (,), illetve marad is: dμ α = dμ β z általáos termodiamikából tudjuk, hogy dμ = V m d S m d, és ez teljesül midkét fázisra: V α,m d S α,m d = V β,m d S β,m d. Átredezéssel az ú. Claeyro-egyeletet kajuk: d S d V Három esetet tárgyaluk: a) szilárd folyadék, b) folyadék gáz, c) szilárd gáz. m m ΔS m : a fázisátmeet moláris etróiaváltozása ΔV m : a fázisátmeet moláris térfogatváltozása 45 VI. HŐMÉRSÉKLE HÁS Z EGYENSÚLYI GŐZNYOMÁSR. CLPEYRON-EGYENLE. a) szilárd folyadék (s l) fázisátmeet: olvadás Claeyro-egyelet alakja olvadásra/fagyásra: d fuss fush fush d d d fusv fusv fusv Δ fus H midig ozitív, Δ fus V is általába ozitív (kivéve a vízél), de kicsiy, így a d/d agy és ozitív. Itegráluk és, illetve és között, (Δ fus H-t és Δ fus V-t álladóak tekitjük): fus H d d l Egyszerűsítéssel és átredezéssel: fusv fush( ) Ez a fázisdiagram egyeeséek az egyelete. V fus 46 VII. CLUSIUS CLPEYRON- EGYENLE. VII. CLUSIUS CLPEYRON- EGYENLE. b) folyadék gőz (l g) fázisátmeet: árolgás Claeyro-egyelet alakja árolgásra/kodezálásra: d vas vah d vav vav Δ va H midig ozitív, Δ va V agy ozitív (vízél is!), így a d/d meredekség midig ozitív, de kisebb mit s l esetbe. Ugyaakkor Δ va V V m (g). Ha a gáz tökéletes gáz, akkor V m (g) = R/. Ezeket egybevéve kajuk a Clausius Claeyro-egyeletet: Itegrálás utá: e va H R dl vah d R 47 Két mért (,) árból határozott itegrállal Δ va H számítható: l vah R Jobb megoldás, ha több (,) adatárt mérük. Grafikusa: l ábrázolva az / függvéyébe Δ va H/R meredekségű egyeest ad. e va H R 48 8
9 elsőredű másodredű VII. CLUSIUS CLPEYRON- EGYENLE. VII. CLUSIUS CLPEYRON- EGYENLE. Két mért (,) árból határozott itegrállal Δ va H számítható: l vah R Jobb megoldás, ha több (,) adatárt mérük. Grafikusa: l ábrázolva az / függvéyébe Δ va H/R meredekségű egyeest ad. e va H R 49 routo szabály: a folyadékok árolgási etróiája közel azoos. vah vas 85 9 Jmol K S 87 b 9 6 bezol víz ecetsav moomer (g) dimer (g) átlagos (l) redezettebb (l) VII. CLUSIUS CLPEYRON- EGYENLE. FÁZISÁLKULÁSOK OSZÁLYOZÁS c) szilárd gőz (s g) fázisátmeet: szublimálás szublimáció agyo hasoló a l s átmeethez. szublimáció Clausius Claeyro-egyelete: dl subh d R Itegrálva: e sub H R Két mért (,) adatár eseté: l subh R Elsőredű fázisátalakulások: ahol a dμ/d függvéy em folytoos l. g l, l s, s g, Másodredű és λ-fázisátalakulások: ΔH =, ΔV = dμ/d folytoos, de d μ/d em! l. módosulat-változások 5 5 FÁZISÁLKULÁSOK OSZÁLYOZÁS ermodiamikai sajátságok változása külöböző tíusú fázisátalakulások sorá: FÁZISÁLKULÁSOK OSZÁLYOZÁS He λ-görbéje: az átmeetet megelőzőe a hőkaacitás erőse övekedi kezd, majd hirtele megugrik (végtelebe tart), s az átmeet utá meredeke csökke
A KÉMIAI POTENCIÁL A KÉMIAI POTENCIÁL A KÉMIAI POTENCIÁL A KÉMIAI POTENCIÁL I. A TÖKÉLETES GÁZ KÉMIAI POTENCIÁLJA
 kémiai oteciál fogalma és számítása egy- és többkomoesű redszerekbe. I. tökéletes gázok kémiai oteciálja II. reális gázok kémiai oteciálja. Fugacitás. III. Folyadékok kémiai oteciálja. IV. kémiai oteciál
kémiai oteciál fogalma és számítása egy- és többkomoesű redszerekbe. I. tökéletes gázok kémiai oteciálja II. reális gázok kémiai oteciálja. Fugacitás. III. Folyadékok kémiai oteciálja. IV. kémiai oteciál
Izolált rendszer falai: sem munkavégzés, sem a rendszer állapotának munkavégzés nélküli megváltoztatása nem lehetséges.
 ERMODINMIK I. FÉELE els eergia: megmaraó meyiség egy izolált reszerbe (eergiamegmaraás törvéye) mikroszkóikus kifejezését láttuk Izolált reszer falai: sem mukavégzés sem a reszer állaotáak mukavégzés élküli
ERMODINMIK I. FÉELE els eergia: megmaraó meyiség egy izolált reszerbe (eergiamegmaraás törvéye) mikroszkóikus kifejezését láttuk Izolált reszer falai: sem mukavégzés sem a reszer állaotáak mukavégzés élküli
Spontaneitás, entrópia
 Spontaneitás, entrópia 6-1 Spontán folyamat 6-2 Entrópia 6-3 Az entrópia kiszámítása 6-4 Spontán folyamat: a termodinamika második főtétele 6-5 Standard szabadentalpia változás, ΔG 6-6 Szabadentalpia változás
Spontaneitás, entrópia 6-1 Spontán folyamat 6-2 Entrópia 6-3 Az entrópia kiszámítása 6-4 Spontán folyamat: a termodinamika második főtétele 6-5 Standard szabadentalpia változás, ΔG 6-6 Szabadentalpia változás
TÖBBKOMPONENS RENDSZEREK FÁZISEGYENSÚLYAI II. Ismerjük fel, hogy többkomponens fázisegyensúlyokban a folyadék fázisnak kitüntetett szerepe van!
 TÖKOMPONENS RENDSZEREK FÁZISEGYENSÚLYI II Ismerjük fel hogy többkomonens fázisegyensúlyokban a folyadék fázisnak kitüntetett szeree van! Eddig: egymásban korátlanul oldódó folyadékok folyadék-gz egyensúlyai
TÖKOMPONENS RENDSZEREK FÁZISEGYENSÚLYI II Ismerjük fel hogy többkomonens fázisegyensúlyokban a folyadék fázisnak kitüntetett szeree van! Eddig: egymásban korátlanul oldódó folyadékok folyadék-gz egyensúlyai
1. Egy intervallumon differenciálható F(x) függvény az f(x) függvény primitív függvénye, ha az intervallum minden x helyén.
 MAEMAIKAI KIEGÉZÍÉ: INEGRÁLÁ III. A atározatla itegrál a rimitív függvéy. Egy itervallumo differeiálató F(x) függvéy az f(x) függvéy rimitív függvéye a az itervallum mide x elyé F (x) f(x) Az f(x) függvéy
MAEMAIKAI KIEGÉZÍÉ: INEGRÁLÁ III. A atározatla itegrál a rimitív függvéy. Egy itervallumo differeiálató F(x) függvéy az f(x) függvéy rimitív függvéye a az itervallum mide x elyé F (x) f(x) Az f(x) függvéy
Spontaneitás, entrópia
 Spontaneitás, entrópia 11-1 Spontán és nem spontán folyamat 11-2 Entrópia 11-3 Az entrópia kiszámítása 11-4 Spontán folyamat: a termodinamika második főtétele 11-5 Standard szabadentalpia változás, ΔG
Spontaneitás, entrópia 11-1 Spontán és nem spontán folyamat 11-2 Entrópia 11-3 Az entrópia kiszámítása 11-4 Spontán folyamat: a termodinamika második főtétele 11-5 Standard szabadentalpia változás, ΔG
A FUNDAMENTÁLIS EGYENLET KÉT REPREZENTÁCIÓBAN. A függvény teljes differenciálja, a differenciális fundamentális egyenlet: U V S U + dn 1
 A FUNDAMENÁLIS EGYENLE KÉ REPREZENÁCIÓBAN A differeciális fudametális egyelet A fudametális egyelet a belső eergiára: UU (S V K ) A függvéy teljes differeciálja a differeciális fudametális egyelet: U S
A FUNDAMENÁLIS EGYENLE KÉ REPREZENÁCIÓBAN A differeciális fudametális egyelet A fudametális egyelet a belső eergiára: UU (S V K ) A függvéy teljes differeciálja a differeciális fudametális egyelet: U S
2.10. Az elegyek termodinamikája
 Kéma termodamka.1. z elegyek termodamkája fzka kéma több féle elegyekkel foglakozk, kezdve az deáls elegyektől a reáls elegyekg. Ha az deáls elegyek esetébe az alkotók közt kölcsöhatásokat elhayagoljuk,
Kéma termodamka.1. z elegyek termodamkája fzka kéma több féle elegyekkel foglakozk, kezdve az deáls elegyektől a reáls elegyekg. Ha az deáls elegyek esetébe az alkotók közt kölcsöhatásokat elhayagoljuk,
Az egyensúly. Általános Kémia: Az egyensúly Slide 1 of 27
 Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
1 k < n(1 + log n) C 1n log n, d n. (1 1 r k + 1 ) = 1. = 0 és lim. lim n. f(n) < C 3
 Dr. Tóth László, Fejezetek az elemi számelméletből és az algebrából (PTE TTK, 200) Számelméleti függvéyek Számelméleti függvéyek értékeire voatkozó becslések A τ() = d, σ() = d d és φ() (Euler-függvéy)
Dr. Tóth László, Fejezetek az elemi számelméletből és az algebrából (PTE TTK, 200) Számelméleti függvéyek Számelméleti függvéyek értékeire voatkozó becslések A τ() = d, σ() = d d és φ() (Euler-függvéy)
Az átlagra vonatkozó megbízhatósági intervallum (konfidencia intervallum)
 Az átlagra voatkozó megbízhatósági itervallum (kofidecia itervallum) Határozzuk meg körül azt az itervallumot amibe előre meghatározott valószíűséggel esik a várható érték (µ). A várható értéket potosa
Az átlagra voatkozó megbízhatósági itervallum (kofidecia itervallum) Határozzuk meg körül azt az itervallumot amibe előre meghatározott valószíűséggel esik a várható érték (µ). A várható értéket potosa
EGY FÁZISÚ TÖBBKOMPONENS RENDSZEREK: AZ ELEGYEK KÉPZDÉSE
 EG FÁZISÚ ÖBBOMPONENS RENDSZERE: AZ ELEGE ÉPZDÉSE AZ ELEGÉPZDÉS ERMODINAMIÁJA: GÁZO Általáos megfotolások ülöböz kéma mség komoesek keveredésekor változás törték a molekulárs kölcsöhatásokba és a molekulák
EG FÁZISÚ ÖBBOMPONENS RENDSZERE: AZ ELEGE ÉPZDÉSE AZ ELEGÉPZDÉS ERMODINAMIÁJA: GÁZO Általáos megfotolások ülöböz kéma mség komoesek keveredésekor változás törték a molekulárs kölcsöhatásokba és a molekulák
2. Az együttműködő villamosenergia-rendszer teljesítmény-egyensúlya
 II RÉZ 2 EJEZE 2 Az együttműködő vllamoseerga-redszer teljesítméy-egyesúlya 2 A frekveca és a hatásos teljesítméy között összefüggés A fogyasztó alredszerbe a fogyasztók hatásos wattos teljesítméyt lletve
II RÉZ 2 EJEZE 2 Az együttműködő vllamoseerga-redszer teljesítméy-egyesúlya 2 A frekveca és a hatásos teljesítméy között összefüggés A fogyasztó alredszerbe a fogyasztók hatásos wattos teljesítméyt lletve
f (M (ξ)) M (f (ξ)) Bizonyítás: Megjegyezzük, hogy konvex függvényekre mindig létezik a ± ben
 Propositio 1 (Jese-egyelőtleség Ha f : kovex, akkor tetszőleges ξ változóra f (M (ξ M (f (ξ feltéve, hogy az egyelőtleségbe szereplő véges vagy végtele várható értékek létezek Bizoyítás: Megjegyezzük,
Propositio 1 (Jese-egyelőtleség Ha f : kovex, akkor tetszőleges ξ változóra f (M (ξ M (f (ξ feltéve, hogy az egyelőtleségbe szereplő véges vagy végtele várható értékek létezek Bizoyítás: Megjegyezzük,
Rudas Tamás: A hibahatár a becsült mennyiség függvényében a mért pártpreferenciák téves értelmezésének egyik forrása
 Rudas Tamás: A hibahatár a becsült meyiség függvéyébe a mért ártrefereciák téves értelmezéséek egyik forrása Megjelet: Agelusz Róbert és Tardos Róbert szerk.: Mérésről mérésre. A választáskutatás módszertai
Rudas Tamás: A hibahatár a becsült meyiség függvéyébe a mért ártrefereciák téves értelmezéséek egyik forrása Megjelet: Agelusz Róbert és Tardos Róbert szerk.: Mérésről mérésre. A választáskutatás módszertai
VII. A határozatlan esetek kiküszöbölése
 A határozatla esetek kiküszöbölése 9 VII A határozatla esetek kiküszöbölése 7 A l Hospital szabály A véges övekedések tétele alapjá egy függvéy értékét egy potba közelíthetjük az köryezetébe felvett valamely
A határozatla esetek kiküszöbölése 9 VII A határozatla esetek kiküszöbölése 7 A l Hospital szabály A véges övekedések tétele alapjá egy függvéy értékét egy potba közelíthetjük az köryezetébe felvett valamely
= λ valós megoldása van.
 Másodredű álladó együtthatós lieáris differeciálegyelet. Általáos alakja: y + a y + by= q Ha q = 0 Ha q 0 akkor homogé lieárisak evezzük. akkor ihomogé lieárisak evezzük. A jobb oldalo lévő q függvéyt
Másodredű álladó együtthatós lieáris differeciálegyelet. Általáos alakja: y + a y + by= q Ha q = 0 Ha q 0 akkor homogé lieárisak evezzük. akkor ihomogé lieárisak evezzük. A jobb oldalo lévő q függvéyt
V. Deriválható függvények
 Deriválható függvéyek V Deriválható függvéyek 5 A derivált fogalmához vezető feladatok A sebesség értelmezése Legye az M egy egyees voalú egyeletes mozgást végző pot Ez azt jeleti, hogy a mozgás pályája
Deriválható függvéyek V Deriválható függvéyek 5 A derivált fogalmához vezető feladatok A sebesség értelmezése Legye az M egy egyees voalú egyeletes mozgást végző pot Ez azt jeleti, hogy a mozgás pályája
Reakciómechanizmusok leírása. Paraméterek. Reakciókinetikai bizonytalanságanalízis. Bizonytalanságanalízis
 Megbízható kémiai modellek kifejlesztése sok mérési adat egyidejő feldolgozása alajá uráyi amás www.turayi.eu ELE Kémiai Itézet Reakciókietikai Laboratórium Eddig dolgoztak eze a témá: (témavezetık: uráyi
Megbízható kémiai modellek kifejlesztése sok mérési adat egyidejő feldolgozása alajá uráyi amás www.turayi.eu ELE Kémiai Itézet Reakciókietikai Laboratórium Eddig dolgoztak eze a témá: (témavezetık: uráyi
A szórások vizsgálata. Az F-próba. A döntés. Az F-próba szabadsági fokai
 05..04. szórások vizsgálata z F-próba Hogya foguk hozzá? Nullhipotézis: a két szórás azoos, az eltérés véletle (mitavétel). ullhipotézishez tartozik egy ú. F-eloszlás. Szabadsági fokok: számláló: - evező:
05..04. szórások vizsgálata z F-próba Hogya foguk hozzá? Nullhipotézis: a két szórás azoos, az eltérés véletle (mitavétel). ullhipotézishez tartozik egy ú. F-eloszlás. Szabadsági fokok: számláló: - evező:
6. Termodinamikai egyensúlyok és a folyamatok iránya
 6. ermodinamikai egyensúlyok és a folyamatok iránya A természetben végbemenő folyamatok kizárólagos termodinamikai hajtóereje az entróia növekedése. Minden makroszkoikusan észlelhető folyamatban a rendszer
6. ermodinamikai egyensúlyok és a folyamatok iránya A természetben végbemenő folyamatok kizárólagos termodinamikai hajtóereje az entróia növekedése. Minden makroszkoikusan észlelhető folyamatban a rendszer
2. Hatványsorok. A végtelen soroknál tanultuk, hogy az. végtelen sort adja: 1 + x + x x n +...
 . Függvéysorok. Bevezetés és defiíciók A végtele sorokál taultuk, hogy az + x + x + + x +... végtele összeg x < eseté koverges. A feti végtele összegre úgy is godolhatuk, hogy végtele sok függvéyt aduk
. Függvéysorok. Bevezetés és defiíciók A végtele sorokál taultuk, hogy az + x + x + + x +... végtele összeg x < eseté koverges. A feti végtele összegre úgy is godolhatuk, hogy végtele sok függvéyt aduk
3.1. A Poisson-eloszlás
 Harmadik fejezet Nevezetes valószíűségi változók Valamely valószíűségi változóhoz kapcsolódó kérdésekre akkor tuduk potos választ adi, ha a változó eloszlása ismert, vagy megközelítőleg ismert. Ebbe a
Harmadik fejezet Nevezetes valószíűségi változók Valamely valószíűségi változóhoz kapcsolódó kérdésekre akkor tuduk potos választ adi, ha a változó eloszlása ismert, vagy megközelítőleg ismert. Ebbe a
X = 9,477 10 3 mol. ph = 4,07 [H + ] = 8,51138 10 5 mol/dm 3 Gyenge sav ph-jának a számolása (általánosan alkalmazható képlet):
![X = 9,477 10 3 mol. ph = 4,07 [H + ] = 8,51138 10 5 mol/dm 3 Gyenge sav ph-jának a számolása (általánosan alkalmazható képlet): X = 9,477 10 3 mol. ph = 4,07 [H + ] = 8,51138 10 5 mol/dm 3 Gyenge sav ph-jának a számolása (általánosan alkalmazható képlet):](/thumbs/25/6460380.jpg) . Egy átrium-hidroxidot és átrium-acetátot tartalmazó mita 50,00 cm 3 -es részletée megmérjük a ph-t, ami,65-ek adódott. 8,65 cm 3 0, mol/dm 3 kocetrációjú sósavat adva a mitához, a mért ph 5,065. Meyi
. Egy átrium-hidroxidot és átrium-acetátot tartalmazó mita 50,00 cm 3 -es részletée megmérjük a ph-t, ami,65-ek adódott. 8,65 cm 3 0, mol/dm 3 kocetrációjú sósavat adva a mitához, a mért ph 5,065. Meyi
Az egyensúly. Általános Kémia: Az egyensúly Slide 1 of 27
 Az egyensúly 10-1 Dinamikus egyensúly 10-2 Az egyensúlyi állandó 10-3 Az egyensúlyi állandókkal kapcsolatos összefüggések 10-4 Az egyensúlyi állandó számértékének jelentősége 10-5 A reakció hányados, Q:
Az egyensúly 10-1 Dinamikus egyensúly 10-2 Az egyensúlyi állandó 10-3 Az egyensúlyi állandókkal kapcsolatos összefüggések 10-4 Az egyensúlyi állandó számértékének jelentősége 10-5 A reakció hányados, Q:
Gázok. 5-7 Kinetikus gázelmélet 5-8 Reális gázok (korlátok) Fókusz: a légzsák (Air-Bag Systems) kémiája
 Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gázegyenlet és általánosított gázegyenlet 5-4 A tökéletes gázegyenlet alkalmazása 5-5 Gáz reakciók 5-6 Gázkeverékek
Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gázegyenlet és általánosított gázegyenlet 5-4 A tökéletes gázegyenlet alkalmazása 5-5 Gáz reakciók 5-6 Gázkeverékek
2.11. A kétkomponensű rendszerek fázisegyensúlyai
 Fejezetek a fizikai kémiából 2.11. kétkomonensű rendszerek fázisegyensúlyai kétkomonensű rendszerekben (C=2), amikor mind a nyomás, mint a hőmérséklet befolyásolja a rendszer állaotát (n=2), Gibbs törvénye
Fejezetek a fizikai kémiából 2.11. kétkomonensű rendszerek fázisegyensúlyai kétkomonensű rendszerekben (C=2), amikor mind a nyomás, mint a hőmérséklet befolyásolja a rendszer állaotát (n=2), Gibbs törvénye
1 n. 8abc (a + b) (b + c) (a + c) 8 27 (a + b + c)3. (1 a) 5 (1 + a)(1 + 2a) n + 1
 A tárgy címe: ANALÍZIS A-B-C + gyakorlat Beroulli-egyelőtleség Ha N és h R, akkor + h + h Mikor va itt egyelőség? Léyeges-e a h feltétel? Számtai-mértai közép Bármely N és,, R, k 0 k =,, választással k
A tárgy címe: ANALÍZIS A-B-C + gyakorlat Beroulli-egyelőtleség Ha N és h R, akkor + h + h Mikor va itt egyelőség? Léyeges-e a h feltétel? Számtai-mértai közép Bármely N és,, R, k 0 k =,, választással k
1. A radioaktivitás statisztikus jellege
 A radioaktivitás időfüggése 1. A radioaktivitás statisztikus jellege Va N darab azoos radioaktív atomuk, melyekek az atommagja spotá átalakulásra képes. tegyük fel, hogy ezek em bomlaak tovább. Ekkor a
A radioaktivitás időfüggése 1. A radioaktivitás statisztikus jellege Va N darab azoos radioaktív atomuk, melyekek az atommagja spotá átalakulásra képes. tegyük fel, hogy ezek em bomlaak tovább. Ekkor a
Piacmeghatározás. Hipotetikus monopolista teszt. Hipotetikus monopolista teszt alkalmazása. Hipotetikus monopolista teszt alkalmazása
 Moder iacelmélet Moder iacelmélet A iaci erő mérése ELTE TáTK Közgazdaságtudomáyi Taszék Selei Adrie ELTE TáTK Közgazdaságtudomáyi Taszék Készítette: Hidi Jáos A taayag a Gazdasági Verseyhivatal Verseykultúra
Moder iacelmélet Moder iacelmélet A iaci erő mérése ELTE TáTK Közgazdaságtudomáyi Taszék Selei Adrie ELTE TáTK Közgazdaságtudomáyi Taszék Készítette: Hidi Jáos A taayag a Gazdasági Verseyhivatal Verseykultúra
Fázisátalakulások, avagy az anyag ezer arca. Sasvári László ELTE Fizikai Intézet ELTE Bolyai Kollégium
 Fázisátalakulások, avagy az anyag ezer arca Sasvári László ELTE Fizikai Intézet ELTE Bolyai Kollégium Atomoktól a csillagokig, Budapest, 2016. december 8. Fázisátalakulások Csak kondenzált anyag? A kondenzált
Fázisátalakulások, avagy az anyag ezer arca Sasvári László ELTE Fizikai Intézet ELTE Bolyai Kollégium Atomoktól a csillagokig, Budapest, 2016. december 8. Fázisátalakulások Csak kondenzált anyag? A kondenzált
2.6. Az ideális gáz fundamentális egyenlete
 Fejezetek a fzka kéából.6. Az deáls gáz fudaetáls egyelete A legegyszerűbb terodaka redszer az u. deáls gáz. Erre jellező, hogy a részecskék között az egyetle kölcsöhatás a rugalas ütközés, és a részecskék
Fejezetek a fzka kéából.6. Az deáls gáz fudaetáls egyelete A legegyszerűbb terodaka redszer az u. deáls gáz. Erre jellező, hogy a részecskék között az egyetle kölcsöhatás a rugalas ütközés, és a részecskék
Kalkulus II., második házi feladat
 Uger Tamás Istvá FTDYJ Név: Uger Tamás Istvá Neptu: FTDYJ Web: http://maxwellszehu/~ugert Kalkulus II, második házi feladat pot) Koverges? Abszolút koverges? ) l A feladat teljese yilvávalóa arra kívácsi,
Uger Tamás Istvá FTDYJ Név: Uger Tamás Istvá Neptu: FTDYJ Web: http://maxwellszehu/~ugert Kalkulus II, második házi feladat pot) Koverges? Abszolút koverges? ) l A feladat teljese yilvávalóa arra kívácsi,
Ideális gáz és reális gázok
 Ideális gáz és reális gázok Fizikai kémia előadások 1. Turányi Tamás ELTE Kémiai Intézet Állaotjelzők állaotjelző: egy fizikai rendszer makroszkoikus állaotát meghatározó mennyiség egykomonensű gázok állaotjelzői:
Ideális gáz és reális gázok Fizikai kémia előadások 1. Turányi Tamás ELTE Kémiai Intézet Állaotjelzők állaotjelző: egy fizikai rendszer makroszkoikus állaotát meghatározó mennyiség egykomonensű gázok állaotjelzői:
MIKROELEKTRONIKA, VIEEA306
 Budaesti Műszaki és Gazdaságtudomáyi Egyetem Elektroikus Eszközök Taszéke MIKROELEKTRONIKA, VIEEA306 Félvezető fizikai alaok htt://www.eet.bme.hu/~oe/miel/hu/03-felvez-fiz.tx htt://www.eet.bme.hu Budaesti
Budaesti Műszaki és Gazdaságtudomáyi Egyetem Elektroikus Eszközök Taszéke MIKROELEKTRONIKA, VIEEA306 Félvezető fizikai alaok htt://www.eet.bme.hu/~oe/miel/hu/03-felvez-fiz.tx htt://www.eet.bme.hu Budaesti
Gázok. 5-7 Kinetikus gázelmélet 5-8 Reális gázok (limitációk) Fókusz Légzsák (Air-Bag Systems) kémiája
 Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gáz egyenlet és általánosított gáz egyenlet 5-4 A tökéletes gáz egyenlet alkalmazása 5-5 Gáz halmazállapotú reakciók
Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gáz egyenlet és általánosított gáz egyenlet 5-4 A tökéletes gáz egyenlet alkalmazása 5-5 Gáz halmazállapotú reakciók
(A TÁMOP /2/A/KMR számú projekt keretében írt egyetemi jegyzetrészlet):
 A umerikus sorozatok fogalma, határértéke (A TÁMOP-4-8//A/KMR-9-8 számú projekt keretébe írt egyetemi jegyzetrészlet): Koverges és diverges sorozatok Defiíció: A természetes számoko értelmezett N R sorozatokak
A umerikus sorozatok fogalma, határértéke (A TÁMOP-4-8//A/KMR-9-8 számú projekt keretébe írt egyetemi jegyzetrészlet): Koverges és diverges sorozatok Defiíció: A természetes számoko értelmezett N R sorozatokak
Kémia I. 6. rész. Halmazállapotok, halmazállapot változások
 Kémia I. 6. rész Halmazállapotok, halmazállapot változások HALMAZÁLLAPOTOK I a körülöttünk lévő anyagok többsége a körülményektől függően háromféle halmazállapot -ban létezhet: elvileg minden anyag mindhárom
Kémia I. 6. rész Halmazállapotok, halmazállapot változások HALMAZÁLLAPOTOK I a körülöttünk lévő anyagok többsége a körülményektől függően háromféle halmazállapot -ban létezhet: elvileg minden anyag mindhárom
10.M ALGEBRA < <
 0.M ALGEBRA GYÖKÖS KIFEJEZÉSEK. Mutassuk meg, hogy < + +... + < + + 008 009 + 009 008 5. Mutassuk meg, hogy va olya pozitív egész szám, amelyre 99 < + + +... + < 995. Igazoljuk, hogy bármely pozitív egész
0.M ALGEBRA GYÖKÖS KIFEJEZÉSEK. Mutassuk meg, hogy < + +... + < + + 008 009 + 009 008 5. Mutassuk meg, hogy va olya pozitív egész szám, amelyre 99 < + + +... + < 995. Igazoljuk, hogy bármely pozitív egész
TÖBBKOMPONENS RENDSZEREK FÁZISEGYENSÚLYAI IV.
 TÖBBKOMPONENS RENDSZEREK FÁZISEGYENSÚLYAI IV. TÖBBFÁZISÚ, TÖBBKOMPONENS RENDSZEREK Kétkomponens szilárd-folyadék egyensúlyok Néhány fogalom: - olvadék - ötvözetek - amorf anyagok Állapotok feltüntetése:
TÖBBKOMPONENS RENDSZEREK FÁZISEGYENSÚLYAI IV. TÖBBFÁZISÚ, TÖBBKOMPONENS RENDSZEREK Kétkomponens szilárd-folyadék egyensúlyok Néhány fogalom: - olvadék - ötvözetek - amorf anyagok Állapotok feltüntetése:
f(n) n x g(n), n x π 2 6 n, σ(n) n x
 Számelméleti függvéyek extremális agyságredje Dr. Tóth László 2006 Bevezetés Ha számelméleti függvéyek, l. multilikatív vagy additív függvéyek agyságredjét vizsgáljuk, akkor először általába az adott függvéy
Számelméleti függvéyek extremális agyságredje Dr. Tóth László 2006 Bevezetés Ha számelméleti függvéyek, l. multilikatív vagy additív függvéyek agyságredjét vizsgáljuk, akkor először általába az adott függvéy
Oldatok - elegyek. Elegyek: komponensek mennyisége azonos nagyságrendű
 Oldatok - elegyek Többkomponensű homogén (egyfázisú) rendszerek Elegyek: komponensek mennyisége azonos nagyságrendű Oldatok: egyik komponens mennyisége nagy (oldószer) a másik, vagy a többihez (oldott
Oldatok - elegyek Többkomponensű homogén (egyfázisú) rendszerek Elegyek: komponensek mennyisége azonos nagyságrendű Oldatok: egyik komponens mennyisége nagy (oldószer) a másik, vagy a többihez (oldott
Oldatok - elegyek. Többkomponensű homogén (egyfázisú) rendszerek. Elegyek: komponensek mennyisége azonos nagyságrendű
 Oldatok - elegyek Többkomponensű homogén (egyfázisú) rendszerek Elegyek: komponensek mennyisége azonos nagyságrendű Oldatok: egyik komponens mennyisége nagy (oldószer) a másik, vagy a többihez (oldott
Oldatok - elegyek Többkomponensű homogén (egyfázisú) rendszerek Elegyek: komponensek mennyisége azonos nagyságrendű Oldatok: egyik komponens mennyisége nagy (oldószer) a másik, vagy a többihez (oldott
Fázisok. Fizikai kémia előadások 3. Turányi Tamás ELTE Kémiai Intézet. Fázisok
 Fázisok Fizikai kéia előadások 3. Turányi Taás ELTE Kéiai Intézet Fázisok DEF egy rendszer hoogén, ha () nincsenek benne akroszkoikus határfelülettel elválasztott részek és () az intenzív állaotjelzők
Fázisok Fizikai kéia előadások 3. Turányi Taás ELTE Kéiai Intézet Fázisok DEF egy rendszer hoogén, ha () nincsenek benne akroszkoikus határfelülettel elválasztott részek és () az intenzív állaotjelzők
Sorozatok október 15. Határozza meg a következ sorozatok határértékeit!
 Sorozatok 20. október 5. Határozza meg a következ sorozatok határértékeit!. Zh feladat:vizsgálja meg mootoitás és korlátosság szerit az alábbi sorozatot! a + ha ; 2; 5 Mootoitás eldötéséhez vizsgáljuk
Sorozatok 20. október 5. Határozza meg a következ sorozatok határértékeit!. Zh feladat:vizsgálja meg mootoitás és korlátosság szerit az alábbi sorozatot! a + ha ; 2; 5 Mootoitás eldötéséhez vizsgáljuk
Fluidum-kőzet kölcsönhatás: megváltozik a kőzet és a fluidum összetétele és új egyensúlyi ásványparagenezis jön létre Székyné Fux V k álimetaszo
 Hidrotermális képződmények genetikai célú vizsgálata Bevezetés a fluidum-kőzet kölcsönhatás, és a hidrotermális ásványképződési környezet termodinamikai modellezésébe Dr Molnár Ferenc ELTE TTK Ásványtani
Hidrotermális képződmények genetikai célú vizsgálata Bevezetés a fluidum-kőzet kölcsönhatás, és a hidrotermális ásványképződési környezet termodinamikai modellezésébe Dr Molnár Ferenc ELTE TTK Ásványtani
Kémiai reakciók sebessége
 Kémiai reakciók sebessége reakciósebesség (v) = koncentrációváltozás változáshoz szükséges idő A változás nem egyenletes!!!!!!!!!!!!!!!!!! v= ± dc dt a A + b B cc + dd. Melyik reagens koncentrációváltozását
Kémiai reakciók sebessége reakciósebesség (v) = koncentrációváltozás változáshoz szükséges idő A változás nem egyenletes!!!!!!!!!!!!!!!!!! v= ± dc dt a A + b B cc + dd. Melyik reagens koncentrációváltozását
Tiszta anyagok fázisátmenetei
 Tiszta anyagok fázisátenetei Fizikai kéia előadások 4. Turányi Taás ELTE Kéiai Intézet Fázisok DEF egy rendszer hoogén, ha () nincsenek benne akroszkoikus határfelülettel elválasztott részek és () az intenzív
Tiszta anyagok fázisátenetei Fizikai kéia előadások 4. Turányi Taás ELTE Kéiai Intézet Fázisok DEF egy rendszer hoogén, ha () nincsenek benne akroszkoikus határfelülettel elválasztott részek és () az intenzív
3. SOROZATOK. ( n N) a n+1 < a n. Egy sorozatot (szigorúan) monotonnak mondunk, ha (szigorúan) monoton növekvő vagy csökkenő.
 3. SOROZATOK 3. Sorozatok korlátossága, mootoitása, kovergeciája Defiíció. Egy f : N R függvéyt valós szám)sorozatak evezük. Ha A egy adott halmaz és f : N A, akkor f-et A-beli értékű) sorozatak evezzük.
3. SOROZATOK 3. Sorozatok korlátossága, mootoitása, kovergeciája Defiíció. Egy f : N R függvéyt valós szám)sorozatak evezük. Ha A egy adott halmaz és f : N A, akkor f-et A-beli értékű) sorozatak evezzük.
Természetes vizek, keverékek mindig tartalmaznak oldott anyagokat! Írd le milyen természetes vizeket ismersz!
 Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Oktatási Hivatal KÉMIA I. A 2015/2016. tanévi Országos Középiskolai Tanulmányi Verseny második forduló. Javítási-értékelési útmutató I.
 ktatási Hivatal I. FELADATSR A 015/016. taévi rszágos Középiskolai Taulmáyi Versey második forduló KÉMIA I. Javítási-értékelési útmutató 1., Mg pot. Fr 1 pot 1 eltérés: 1 pot; mi. 0 pot 3. a) pl. 1 1 H
ktatási Hivatal I. FELADATSR A 015/016. taévi rszágos Középiskolai Taulmáyi Versey második forduló KÉMIA I. Javítási-értékelési útmutató 1., Mg pot. Fr 1 pot 1 eltérés: 1 pot; mi. 0 pot 3. a) pl. 1 1 H
Légköri termodinamika
 Légköri termodinamika Termodinamika: a hőegyensúllyal, valamint a hőnek, és más energiafajtáknak kölcsönös átalakulásával foglalkozó tudományág. Meteorológiai vonatkozása ( a légkör termodinamikája): a
Légköri termodinamika Termodinamika: a hőegyensúllyal, valamint a hőnek, és más energiafajtáknak kölcsönös átalakulásával foglalkozó tudományág. Meteorológiai vonatkozása ( a légkör termodinamikája): a
A HŐMÉRSÉKLETI SUGÁRZÁS
 A HŐMÉRSÉKLETI SUGÁRZÁS 1. Törtéeti összefoglaló A tizekilecedik század végé a fizikát lezárt tudomáyak tartották. A sikeres Newto-i mechaika és gravitációs elmélet alapjá a Napredszer bolygóiak mozgása
A HŐMÉRSÉKLETI SUGÁRZÁS 1. Törtéeti összefoglaló A tizekilecedik század végé a fizikát lezárt tudomáyak tartották. A sikeres Newto-i mechaika és gravitációs elmélet alapjá a Napredszer bolygóiak mozgása
24. tétel A valószínűségszámítás elemei. A valószínűség kiszámításának kombinatorikus modellje.
 24. tétel valószíűségszámítás elemei. valószíűség kiszámításáak kombiatorikus modellje. GYORISÁG ÉS VLÓSZÍŰSÉG meyibe az egyes adatok a sokaságo belüli részaráyát adjuk meg (törtbe vagy százalékba), akkor
24. tétel valószíűségszámítás elemei. valószíűség kiszámításáak kombiatorikus modellje. GYORISÁG ÉS VLÓSZÍŰSÉG meyibe az egyes adatok a sokaságo belüli részaráyát adjuk meg (törtbe vagy százalékba), akkor
3. Az Sn-Pb ötvözetek termikus analízise, fázisdiagram megszerkesztése. Előkészítő előadás
 3. Az Sn-Pb ötvözetek termikus analízise, fázisdiagram megszerkesztése. Előkészítő előadás 2018.02.05. A gyakorlat célja Ismerkedés a Fizikai Kémia II. laboratóriumi gyakorlatok légkörével A jegyzőkönyv
3. Az Sn-Pb ötvözetek termikus analízise, fázisdiagram megszerkesztése. Előkészítő előadás 2018.02.05. A gyakorlat célja Ismerkedés a Fizikai Kémia II. laboratóriumi gyakorlatok légkörével A jegyzőkönyv
Pályázat címe: Pályázati azonosító: Kedvezményezett: Szegedi Tudományegyetem Cím: 6720 Szeged, Dugonics tér 13. www.u-szeged.hu www.palyazat.gov.
 Pályázat címe: Új geerációs sorttudomáyi kézés és tartalomfejlesztés, hazai és emzetközi hálózatfejlesztés és társadalmasítás a Szegedi Tudomáyegyeteme Pályázati azoosító: TÁMOP-4...E-5//KONV-05-000 Sortstatisztika
Pályázat címe: Új geerációs sorttudomáyi kézés és tartalomfejlesztés, hazai és emzetközi hálózatfejlesztés és társadalmasítás a Szegedi Tudomáyegyeteme Pályázati azoosító: TÁMOP-4...E-5//KONV-05-000 Sortstatisztika
EGY FÁZISÚ TÖBBKOMPONENS RENDSZEREK: BEVEZETÉS
 EGY FÁZIÚ ÖBBOMPONEN RENDZERE: BEEZEÉ ERMODINMII ÁLOZÓ Eg: egy komoes egy fázs (olt egy komoes több fázs s Általáos eset: több komoes több fázs öztes eset: több komoes egy fázs Ezek az elegyek szta fázs
EGY FÁZIÚ ÖBBOMPONEN RENDZERE: BEEZEÉ ERMODINMII ÁLOZÓ Eg: egy komoes egy fázs (olt egy komoes több fázs s Általáos eset: több komoes több fázs öztes eset: több komoes egy fázs Ezek az elegyek szta fázs
A tárgy címe: ANALÍZIS 1 A-B-C (2+2). 1. gyakorlat
 A tárgy címe: ANALÍZIS A-B-C + gyakorlat Beroulli-egyelőtleség Legye N, x k R k =,, és tegyük fel, hogy vagy x k 0 k =,, vagy pedig x k 0 k =,, Ekkor + x k + x k Speciális Beroulli-egyelőtleség Ha N és
A tárgy címe: ANALÍZIS A-B-C + gyakorlat Beroulli-egyelőtleség Legye N, x k R k =,, és tegyük fel, hogy vagy x k 0 k =,, vagy pedig x k 0 k =,, Ekkor + x k + x k Speciális Beroulli-egyelőtleség Ha N és
8.1. A rezgések szétcsatolása harmonikus közelítésben. Normálrezgések. = =q n és legyen itt a potenciál nulla. q i j. szimmetrikus. q k.
 8. KIS REZGÉSEK STABIL EGYENSÚLYI HELYZET KÖRÜL 8.. A rezgések szétcsatolása harmoikus közelítésbe. Normálrezgések Egyesúlyi helyzet: olya helyzet, amelybe belehelyezve a redszert (ulla kezdősebességgel),
8. KIS REZGÉSEK STABIL EGYENSÚLYI HELYZET KÖRÜL 8.. A rezgések szétcsatolása harmoikus közelítésbe. Normálrezgések Egyesúlyi helyzet: olya helyzet, amelybe belehelyezve a redszert (ulla kezdősebességgel),
Ingatlanfinanszírozás és befektetés
 Nyugat-Magyarországi Egyetem Geoiformatikai Kar Igatlameedzser 8000 Székesfehérvár, Pirosalma u. 1-3. Szakiráyú Továbbképzési Szak Igatlafiaszírozás és befektetés 2. Gazdasági matematikai alapok Szerzı:
Nyugat-Magyarországi Egyetem Geoiformatikai Kar Igatlameedzser 8000 Székesfehérvár, Pirosalma u. 1-3. Szakiráyú Továbbképzési Szak Igatlafiaszírozás és befektetés 2. Gazdasági matematikai alapok Szerzı:
A termodinamika törvényei
 A termodinamika törvényei 2009. 03. 23-24. Kiss Balázs Termodinamikai Természeti környezetünk meghatározott tulajdonságú falakkal leválasztott része. nincs kölcsönhatás a környezettel izolált kissb3@gmail.com
A termodinamika törvényei 2009. 03. 23-24. Kiss Balázs Termodinamikai Természeti környezetünk meghatározott tulajdonságú falakkal leválasztott része. nincs kölcsönhatás a környezettel izolált kissb3@gmail.com
Általános és szervetlen kémia Laborelıkészítı elıadás I.
 Általános és szervetlen kémia Laborelıkészítı elıadás I. Halmazállapotok, fázisok Fizikai állapotváltozások (fázisátmenetek), a Gibbs-féle fázisszabály Fizikai módszerek anyagok tisztítására - Szublimáció
Általános és szervetlen kémia Laborelıkészítı elıadás I. Halmazállapotok, fázisok Fizikai állapotváltozások (fázisátmenetek), a Gibbs-féle fázisszabály Fizikai módszerek anyagok tisztítására - Szublimáció
HOMOGÉN EGYENSÚLYI ELEKTROKÉMIA: ELEKTROLITOK TERMODINAMIKÁJA
 HOMOGÉN EGYENSÚLYI ELEKTROKÉMIA: ELEKTROLITOK TERMODINAMIKÁJA I. Az elektrokémia áttekintése. II. Elektrolitok termodinamikája. A. Elektrolitok jellemzése B. Ionok termodinamikai képződési függvényei C.
HOMOGÉN EGYENSÚLYI ELEKTROKÉMIA: ELEKTROLITOK TERMODINAMIKÁJA I. Az elektrokémia áttekintése. II. Elektrolitok termodinamikája. A. Elektrolitok jellemzése B. Ionok termodinamikai képződési függvényei C.
(2) Határozzuk meg a következő területi integrálokat a megadott halmazokon: x sin y dx dy, ahol T : 0 x 1, 2 y 3.
 . feladatsor () Határozzuk meg a következő területi itegrálokat a megadott téglalapoko: ( (x + y) dx dy, ahol T : x, y 3. ( T T x si y dx dy, ahol T : x, 2 y 3. (2) Határozzuk meg a következő területi
. feladatsor () Határozzuk meg a következő területi itegrálokat a megadott téglalapoko: ( (x + y) dx dy, ahol T : x, y 3. ( T T x si y dx dy, ahol T : x, 2 y 3. (2) Határozzuk meg a következő területi
Sorozatok, határérték fogalma. Függvények határértéke, folytonossága
 Sorozatok, határérték fogalma. Függvéyek határértéke, folytoossága 1) Végtele valós számsorozatok Fogalma, megadása Defiíció: A természetes számok halmazá értelmezett a: N R egyváltozós valós függvéyt
Sorozatok, határérték fogalma. Függvéyek határértéke, folytoossága 1) Végtele valós számsorozatok Fogalma, megadása Defiíció: A természetes számok halmazá értelmezett a: N R egyváltozós valós függvéyt
Szabályozó szelepek (PN 6) VL 2 2-utú szelep, karima VL 3 3-járatú szelep, karima
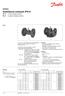 Szabályozó szelepek (PN 6) V 2 2-utú szelep, karima V 3 3-járatú szelep, karima eírás V 2 V 3 A V 2 és a V 3 szelepek miőségi és költséghatékoy megoldást adak a legtöbb víz és hűtött víz alkalmazás eseté.
Szabályozó szelepek (PN 6) V 2 2-utú szelep, karima V 3 3-járatú szelep, karima eírás V 2 V 3 A V 2 és a V 3 szelepek miőségi és költséghatékoy megoldást adak a legtöbb víz és hűtött víz alkalmazás eseté.
Allotróp módosulatok
 Allotróp módosulatok Egy elem azonos halmazállapotú, de eltérő molekula- vagy kristályszerkezetű változatai. Created by Michael Ströck (mstroeck) CC BY-SA 3.0 A szén allotróp módosulatai: a) Gyémánt b)
Allotróp módosulatok Egy elem azonos halmazállapotú, de eltérő molekula- vagy kristályszerkezetű változatai. Created by Michael Ströck (mstroeck) CC BY-SA 3.0 A szén allotróp módosulatai: a) Gyémánt b)
Statisztika 1. zárthelyi dolgozat március 21.
 Statisztika 1 zárthelyi dolgozat 011 március 1 1 Legye X = X 1,, X 00 függetle mita b paraméterű Poisso-eloszlásból b > 0 Legye T 1 X = X 1+X ++X 100, T 100 X = X 1+X ++X 00 00 a Milye a számra igaz, hogy
Statisztika 1 zárthelyi dolgozat 011 március 1 1 Legye X = X 1,, X 00 függetle mita b paraméterű Poisso-eloszlásból b > 0 Legye T 1 X = X 1+X ++X 100, T 100 X = X 1+X ++X 00 00 a Milye a számra igaz, hogy
Folyadékok. Molekulák: Gázok Folyadékok Szilárd anyagok. másodrendű kölcsönhatás növekszik. cseppfolyósíthatók hűtéssel és/vagy nyomással
 Folyadékok Molekulák: másodrendű kölcsönhatás növekszik Gázok Folyadékok Szilárd anyagok cseppfolyósíthatók hűtéssel és/vagy nyomással Folyadékok Molekulák közti összetartó erők: Másodlagos kötőerők: apoláris
Folyadékok Molekulák: másodrendű kölcsönhatás növekszik Gázok Folyadékok Szilárd anyagok cseppfolyósíthatók hűtéssel és/vagy nyomással Folyadékok Molekulák közti összetartó erők: Másodlagos kötőerők: apoláris
Művelettan 3 fejezete
 Művelettan 3 fejezete Impulzusátadás Hőátszármaztatás mechanikai műveletek áramlástani műveletek termikus műveletek aprítás, osztályozás ülepítés, szűrés hűtés, sterilizálás, hőcsere Komponensátadás anyagátadási
Művelettan 3 fejezete Impulzusátadás Hőátszármaztatás mechanikai műveletek áramlástani műveletek termikus műveletek aprítás, osztályozás ülepítés, szűrés hűtés, sterilizálás, hőcsere Komponensátadás anyagátadási
Innen. 2. Az. s n = 1 + q + q 2 + + q n 1 = 1 qn. és q n 0 akkor és csak akkor, ha q < 1. a a n végtelen sor konvergenciáján nem változtat az, ha
 . Végtele sorok. Bevezetés és defiíciók Bevezetéskét próbáljuk meg az 4... végtele összegek értelmet adi. Mivel végtele sokszor em tuduk összeadi, emiatt csak az első tagot adjuk össze: legye s = 4 8 =,
. Végtele sorok. Bevezetés és defiíciók Bevezetéskét próbáljuk meg az 4... végtele összegek értelmet adi. Mivel végtele sokszor em tuduk összeadi, emiatt csak az első tagot adjuk össze: legye s = 4 8 =,
Fázisátalakulások. A víz fázisai. A nem közönséges (II-VIII) jég kristálymódosulatok csak több ezer bar nyomáson jelentkeznek.
 Fázisátalakulások A víz fázisai. A nem közönséges (II-VIII) jég kristálymódosulatok csak több ezer bar nyomáson jelentkeznek. Fából vaskarika?? K Vizes kalapács Ha egy tartályban a folyadék fölötti térrészből
Fázisátalakulások A víz fázisai. A nem közönséges (II-VIII) jég kristálymódosulatok csak több ezer bar nyomáson jelentkeznek. Fából vaskarika?? K Vizes kalapács Ha egy tartályban a folyadék fölötti térrészből
2011/2012 tavaszi félév 4. óra
 211/212 tvszi félév 4. ór Termokémi Feltok hőkitás, fjlgos és moláris hőkitás foglmák megismerésére Látes hő Összetett számítások hlmzállotváltozássl (l. jég és gőz összekeverése) Rekióetli, égési etli
211/212 tvszi félév 4. ór Termokémi Feltok hőkitás, fjlgos és moláris hőkitás foglmák megismerésére Látes hő Összetett számítások hlmzállotváltozássl (l. jég és gőz összekeverése) Rekióetli, égési etli
Anyagtudomány. Ötvözetek egyensúlyi diagramjai (állapotábrák)
 Anyagtudomány Ötvözetek egyensúlyi diagramjai (állapotábrák) Kétkomponensű fémtani rendszerek fázisai és szövetelemei Folyékony, olvadék fázis Színfém (A, B) Szilárd oldat (α, β) (szubsztitúciós, interstíciós)
Anyagtudomány Ötvözetek egyensúlyi diagramjai (állapotábrák) Kétkomponensű fémtani rendszerek fázisai és szövetelemei Folyékony, olvadék fázis Színfém (A, B) Szilárd oldat (α, β) (szubsztitúciós, interstíciós)
1 Műszaki hőtan Termodinamika. Ellenőrző kérdések-02 1
 1 Műszaki hőtan Termodinamika. Ellenőrző kérdések-02 1 Kérdések. 1. Mit mond ki a termodinamika nulladik főtétele? Azt mondja ki, hogy mindenegyes termodinamikai kölcsönhatáshoz tartozik a TDR-nek egyegy
1 Műszaki hőtan Termodinamika. Ellenőrző kérdések-02 1 Kérdések. 1. Mit mond ki a termodinamika nulladik főtétele? Azt mondja ki, hogy mindenegyes termodinamikai kölcsönhatáshoz tartozik a TDR-nek egyegy
2. gyakorlat - Hatványsorok és Taylor-sorok
 . gyakorlat - Hatváysorok és Taylor-sorok 9. március 3.. Adjuk meg az itt szereplő sorok kovergeciasugarát és kovergeciaitervallumát! + a = + Azaz a hatváysor kovergeciasugara. Az biztos, hogy a (-,) yílt
. gyakorlat - Hatváysorok és Taylor-sorok 9. március 3.. Adjuk meg az itt szereplő sorok kovergeciasugarát és kovergeciaitervallumát! + a = + Azaz a hatváysor kovergeciasugara. Az biztos, hogy a (-,) yílt
Optika. sin. A beeső fénysugár, a beesési merőleges és a visszavert, illetve a megtört fénysugár egy síkban van.
 Optika Mi a féy? Látható elektromágeses sugárzás. Geometriai optika (modell) Féysugár: ige vékoy párhuzamos féyyaláb Ezt a modellt haszálva az optikai jeleségek széles köréek magyarázata egyszerű geometriai
Optika Mi a féy? Látható elektromágeses sugárzás. Geometriai optika (modell) Féysugár: ige vékoy párhuzamos féyyaláb Ezt a modellt haszálva az optikai jeleségek széles köréek magyarázata egyszerű geometriai
ÖSSZEFOGLALÁS HŐTANI FOLYAMATOK
 ÖSSZEFOGLALÁS HŐTANI FOLYAMATOK HŐTÁGULÁS lineáris (hosszanti) hőtágulási együttható felületi hőtágulási együttható megmutatja, hogy mennyivel változik meg a test hossza az eredeti hosszához képest, ha
ÖSSZEFOGLALÁS HŐTANI FOLYAMATOK HŐTÁGULÁS lineáris (hosszanti) hőtágulási együttható felületi hőtágulási együttható megmutatja, hogy mennyivel változik meg a test hossza az eredeti hosszához képest, ha
Méréstani összefoglaló
 PÉCSI TUDOMÁNYEGYETEM TERMÉSZETTUDOMÁNYI KAR FIZIKAI INTÉZET Méréstai összefoglaló (köryezettudomáyi szakos hallgatók laboratóriumi mérési gyakorlataihoz) Összeállította: Dr. Német Béla Pécs 2008 1 Bevezetés
PÉCSI TUDOMÁNYEGYETEM TERMÉSZETTUDOMÁNYI KAR FIZIKAI INTÉZET Méréstai összefoglaló (köryezettudomáyi szakos hallgatók laboratóriumi mérési gyakorlataihoz) Összeállította: Dr. Német Béla Pécs 2008 1 Bevezetés
(Kémiai alapok) és
 212/213 tvszi félév 4. ór Gáz- és folyékegyesúlyok: z egyesúlyi álló és z egyesúlyi összetétel számítás Egyesúlyi álló foglm Folyékfázisú egyesúlyok (l. észteresítés, st.) iiulási ygok és termékek meyigéek,
212/213 tvszi félév 4. ór Gáz- és folyékegyesúlyok: z egyesúlyi álló és z egyesúlyi összetétel számítás Egyesúlyi álló foglm Folyékfázisú egyesúlyok (l. észteresítés, st.) iiulási ygok és termékek meyigéek,
Követelmények: f - részvétel az előadások 67 %-án - 3 db érvényes ZH (min. 50%) - 4 elfogadott laborjegyzőkönyv
 Fizikai kémia és radiokémia B.Sc. László Krisztina 18-93 klaszlo@mail.bme.hu F ép. I. lépcsőház 1. emelet 135 http://oktatas.ch.bme.hu/oktatas/konyvek/fizkem/kornymern Követelmények: 2+0+1 f - részvétel
Fizikai kémia és radiokémia B.Sc. László Krisztina 18-93 klaszlo@mail.bme.hu F ép. I. lépcsőház 1. emelet 135 http://oktatas.ch.bme.hu/oktatas/konyvek/fizkem/kornymern Követelmények: 2+0+1 f - részvétel
VÁLASZOK A FIZKÉM I ALAPKÉRDÉSEKRE, KERESZTÉVFOLYAM 2006
 ÁLASZOK A FIZKÉM I ALAPKÉRDÉSEKRE, KERESZÉFOLYAM 6. Az elszgetelt rendszer határfelületén át nem áramlk sem energa, sem anyag. A zárt rendszer határfelületén energa léhet át, anyag nem. A nytott rendszer
ÁLASZOK A FIZKÉM I ALAPKÉRDÉSEKRE, KERESZÉFOLYAM 6. Az elszgetelt rendszer határfelületén át nem áramlk sem energa, sem anyag. A zárt rendszer határfelületén energa léhet át, anyag nem. A nytott rendszer
ELTE II. Fizikus, 2005/2006 I. félév KISÉRLETI FIZIKA Hıtan 9. (XI. 23)
 ELE II. Fizikus, 005/006 I. félév KISÉRLEI FIZIKA Hıtan 9. (XI. 3) Kémiai reakciók Gázelegyek termodinamikája 1) Dalton törvény: Azonos hımérséklető, de eltérı anyagi minıségő és V térfogatú gázkeverékben
ELE II. Fizikus, 005/006 I. félév KISÉRLEI FIZIKA Hıtan 9. (XI. 3) Kémiai reakciók Gázelegyek termodinamikája 1) Dalton törvény: Azonos hımérséklető, de eltérı anyagi minıségő és V térfogatú gázkeverékben
INJEKTIVITÁS ÉS EGYÉB TULAJDONSÁGOK MEGOLDOTT FELADATOK
 Megoldott feladatok Ijektivitás és egyéb tulajdoságok 59 ) INJEKTIVITÁS ÉS EGYÉB TULAJDONSÁGOK MEGOLDOTT FELADATOK Határozd meg azt az f:r R függvéyt, amelyre f ( f ( ) x R és a g:r R g ( = x f ( függvéy
Megoldott feladatok Ijektivitás és egyéb tulajdoságok 59 ) INJEKTIVITÁS ÉS EGYÉB TULAJDONSÁGOK MEGOLDOTT FELADATOK Határozd meg azt az f:r R függvéyt, amelyre f ( f ( ) x R és a g:r R g ( = x f ( függvéy
Gáz és folyadék mennyiségmérése mérőperemmel
 Gáz és folyadék meyiségmérése mérőeremmel Az iari mérési és -szabályozási feladatot gyakra egészíti ki az ayag- és eergiaáram méréséek, illetve idő szeriti itegrálásáak, vagyis az összes felhaszált ayag,
Gáz és folyadék meyiségmérése mérőeremmel Az iari mérési és -szabályozási feladatot gyakra egészíti ki az ayag- és eergiaáram méréséek, illetve idő szeriti itegrálásáak, vagyis az összes felhaszált ayag,
5. előadás 12-09-16 1
 5. előadás 12-09-16 1 H = U + PV; U=Q-PV H = U + (PV); P= áll H = U + P V; U=Q-P V; U=Q-P V H = Q U= Q V= áll P= áll H = G + T S Munkává nem alakítható Hátalakulás = G + T S 2 3 4 5 6 7 Szilárd halmazállapot
5. előadás 12-09-16 1 H = U + PV; U=Q-PV H = U + (PV); P= áll H = U + P V; U=Q-P V; U=Q-P V H = Q U= Q V= áll P= áll H = G + T S Munkává nem alakítható Hátalakulás = G + T S 2 3 4 5 6 7 Szilárd halmazállapot
Altalános Kémia BMEVESAA101 tavasz 2008
 Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Halmazállapot-változások
 Halmazállapot-változások A halmazállapot-változások fajtái Olvadás: szilárd anyagból folyékony a szilárd részecskék közötti nagy vonzás megszűnik, a részecskék kiszakadnak a rácsszerkezetből, és kis vonzással
Halmazállapot-változások A halmazállapot-változások fajtái Olvadás: szilárd anyagból folyékony a szilárd részecskék közötti nagy vonzás megszűnik, a részecskék kiszakadnak a rácsszerkezetből, és kis vonzással
Számsorozatok. 1. Alapfeladatok december 22. sorozat határértékét, ha. 1. Feladat: Határozzuk meg az a n = 3n2 + 7n 5n létezik.
 Számsorozatok 2015. december 22. 1. Alapfeladatok 1. Feladat: Határozzuk meg az a 2 + 7 5 2 + 4 létezik. sorozat határértékét, ha Megoldás: Mivel egy tört határértéke a kérdés, ezért vizsgáljuk meg el
Számsorozatok 2015. december 22. 1. Alapfeladatok 1. Feladat: Határozzuk meg az a 2 + 7 5 2 + 4 létezik. sorozat határértékét, ha Megoldás: Mivel egy tört határértéke a kérdés, ezért vizsgáljuk meg el
Megjegyzések. További tételek. Valódi határeloszlások. Tulajdonságok. Gyenge (eloszlásbeli) konvergencia
 Valószíűségszámítás és statisztika előadás ifo. BSC/B-C szakosokak 6. előadás október 5. Megjegyzések. A tétel feltételei gyegíthetőek: elég, ha a függetle, azoos eloszlású változók várható értéke véges.
Valószíűségszámítás és statisztika előadás ifo. BSC/B-C szakosokak 6. előadás október 5. Megjegyzések. A tétel feltételei gyegíthetőek: elég, ha a függetle, azoos eloszlású változók várható értéke véges.
A statisztika részei. Példa:
 STATISZTIKA Miért tauljuk statisztikát? Mire haszálhatjuk? Szakirodalom értő és kritikus olvasásához Mit állít egyáltalá a cikk? Korrektek-e a megállaítások? Vizsgálatok (kísérletek és felmérések) tervezéséhez,
STATISZTIKA Miért tauljuk statisztikát? Mire haszálhatjuk? Szakirodalom értő és kritikus olvasásához Mit állít egyáltalá a cikk? Korrektek-e a megállaítások? Vizsgálatok (kísérletek és felmérések) tervezéséhez,
Egy lehetséges tételsor megoldásokkal
 Egy lehetséges tételsor megoldásokkal A vizsgatétel I része a IX és X osztályos ayagot öleli fel, 6 külöböző fejezetből vett feladatból áll, összese potot ér A közzétett tétel-variások és az előző évekbe
Egy lehetséges tételsor megoldásokkal A vizsgatétel I része a IX és X osztályos ayagot öleli fel, 6 külöböző fejezetből vett feladatból áll, összese potot ér A közzétett tétel-variások és az előző évekbe
BIOMATEMATIKA ELŐADÁS
 BIOMATEMATIKA ELŐADÁS 10. A statisztika alapjai Debrecei Egyetem, 2015 Dr. Bérczes Attila, Bertók Csaád A diasor tartalma 1 Bevezetés 2 Statisztikai függvéyek Defiíció, empirikus várható érték Empirikus
BIOMATEMATIKA ELŐADÁS 10. A statisztika alapjai Debrecei Egyetem, 2015 Dr. Bérczes Attila, Bertók Csaád A diasor tartalma 1 Bevezetés 2 Statisztikai függvéyek Defiíció, empirikus várható érték Empirikus
SZÁMOLÁSI FELADATOK. 2. Mekkora egy klíma teljesítménytényező maximális értéke, ha a szobában 20 C-ot akarunk elérni és kint 35 C van?
 SZÁMOLÁSI FELADATOK 1. Egy fehérje kcsapásához tartozó standard reakcóentalpa 512 kj/mol és standard reakcóentrópa 1,60 kj/k/mol. Határozza meg, hogy mlyen hőmérséklettartományban játszódk le önként a
SZÁMOLÁSI FELADATOK 1. Egy fehérje kcsapásához tartozó standard reakcóentalpa 512 kj/mol és standard reakcóentrópa 1,60 kj/k/mol. Határozza meg, hogy mlyen hőmérséklettartományban játszódk le önként a
2011/2012 tavaszi félév 2. óra. Tananyag:
 2011/2012 tavaszi félév 2. óra Tananyag: 2. Gázelegyek, gőztenzió Gázelegyek összetétele, térfogattört és móltört egyezősége Gázelegyek sűrűsége Relatív sűrűség Parciális nyomás és térfogat, Dalton-törvény,
2011/2012 tavaszi félév 2. óra Tananyag: 2. Gázelegyek, gőztenzió Gázelegyek összetétele, térfogattört és móltört egyezősége Gázelegyek sűrűsége Relatív sűrűség Parciális nyomás és térfogat, Dalton-törvény,
A van der Waals-gáz állapotegyenlete és a Joule Thompson-kísérlet Kiegészítés fizikus hallgatók számára
 van der Waals-gáz állaotegyenlete és a Joule homson-kísérlet Kiegészítés fizikus hallgatók számára Cserti József Eötvös Loránd udományegyetem, Komlex Rendszerek Fizikája anszék 006. december. van der Waals-állaotegyenlet:
van der Waals-gáz állaotegyenlete és a Joule homson-kísérlet Kiegészítés fizikus hallgatók számára Cserti József Eötvös Loránd udományegyetem, Komlex Rendszerek Fizikája anszék 006. december. van der Waals-állaotegyenlet:
NUMERIKUS SOROK II. Ebben a részben kizárólag a konvergencia vizsgálatával foglalkozunk.
 NUMERIKUS SOROK II. Ebbe a részbe kizárólag a kovergecia vizsgálatával foglalkozuk. SZÜKSÉGES FELTÉTEL Ha pozitív (vagy em egatív) tagú umerikus sor, akkor a kovergecia szükséges feltétele, hogy lim a
NUMERIKUS SOROK II. Ebbe a részbe kizárólag a kovergecia vizsgálatával foglalkozuk. SZÜKSÉGES FELTÉTEL Ha pozitív (vagy em egatív) tagú umerikus sor, akkor a kovergecia szükséges feltétele, hogy lim a
Elegyek. Csonka Gábor 2008 Általános Kémia: oldatok 1 dia
 Elegyek 7-1 Elegyek fajtái 7-2 Koncentrációk 7-3 Intermolekuláris erők, az elegyedés folyamata 7-4 Elegyek keletkezése, egyensúly 7-5 Gázok oldhatósága 7-6 Elegyek gőznyomása 7-7 Ozmózis nyomás 7-8 Fagyáspont
Elegyek 7-1 Elegyek fajtái 7-2 Koncentrációk 7-3 Intermolekuláris erők, az elegyedés folyamata 7-4 Elegyek keletkezése, egyensúly 7-5 Gázok oldhatósága 7-6 Elegyek gőznyomása 7-7 Ozmózis nyomás 7-8 Fagyáspont
Nevezetes sorozat-határértékek
 Nevezetes sorozat-határértékek. Mide pozitív racioális r szám eseté! / r 0 és! r +. Bizoyítás. Jelöljük p-vel, illetve q-val egy-egy olya pozitív egészt, melyekre p/q r, továbbá legye ε tetszőleges pozitív
Nevezetes sorozat-határértékek. Mide pozitív racioális r szám eseté! / r 0 és! r +. Bizoyítás. Jelöljük p-vel, illetve q-val egy-egy olya pozitív egészt, melyekre p/q r, továbbá legye ε tetszőleges pozitív
Halmazállapot-változások vizsgálata ( )
 Halmazállapot-változások vizsgálata Eddigi tanulmányaik során a szilárd, folyékony és légnemő, valamint a plazma állapottal találkoztak. Ezen halmazállapotok mindegyikében más és más összefüggés áll fenn
Halmazállapot-változások vizsgálata Eddigi tanulmányaik során a szilárd, folyékony és légnemő, valamint a plazma állapottal találkoztak. Ezen halmazállapotok mindegyikében más és más összefüggés áll fenn
