A HAEMOCHROMATOSIS ÉS A HAEMOPHILIA A MOLEKULÁRIS GENETIKAI DIAGNOSZTIKÁJA
|
|
|
- Norbert Tamás
- 8 évvel ezelőtt
- Látták:
Átírás
1 A HAEMOCHROMATOSIS ÉS A HAEMOPHILIA A MOLEKULÁRIS GENETIKAI DIAGNOSZTIKÁJA Ph.D. értekezés dr. Andrikovics Hajnalka Témavezetők: Dr. Tordai Attila és dr. Sarkadi Balázs Országos Gyógyintézeti Központ, Haematológiai és Immunológiai Intézet, Budapest, 2003 Semmelweis Egyetem Doktori Iskola Molekuláris Orvostudományok Tudományági Doktori Iskola Szigorlati bizottság: Dr. Fekete György, Dr. Sasvári Mária és Dr. Béres Judit Hivatalos bírálók: Dr. Marcsek Zoltán, Dr. Somogyi Anikó és Dr. Vásáhelyi Barna
2 TARTALOMJEGYZÉK 1. Bevezetés A molekuláris genetikai vizsgálatok alkalmazása az öröklődő betegségek diagnosztikájában _ Öröklődő haemochromatosis - irodalmi háttér Haemophilia A - irodalmi háttér Célkitűzések Öröklődő haemochromatosis Haemophilia A Módszerek Vizsgált egyének DNS izolálás PCR technikán alapuló molekuláris genetikai módszerek Southern blot analízis A vasanyagcsere klinikai paramétereinek mérése Statisztikai feldolgozás Eredmények és megbeszélés Az öröklődő haemochromatosis molekuláris genetikai vizsgálata A haemophilia A molekuláris genetikai vizsgálata Következtetések Öröklődő haemochromatosis Haemophilia A Összefoglalás Angol nyelvű összefoglalás Köszönetnyilvánítás Saját közlemények jegyzéke Irodalomjegyzék 94 2
3 Bevezetés 1. Bevezetés 1.1. A molekuláris genetikai vizsgálatok alkalmazása az öröklődő betegségek diagnosztikájában A molekuláris genetika az orvostudomány, ezen belül a laboratóriumi diagnosztika egyre gyorsabban fejlődő területe, amely segítséget nyújthat a diagnózis felállításában, annak pontosításában, a genotípus-fenotípus összefüggések vizsgálatában, egyes örökletes rizikófaktorok azonosításában, valamint a súlyos, monogénes öröklésmenetű betegségek esetében a prenatális és a hordozó (carrier) diagnosztikában. Jelenleg több mint olyan betegséget (vagy tulajdonságot) ismerünk, amelyek monogénesen, azaz a Mendel-i szabályok szerint öröklődnek (1). Az említett csoportból eddig azonban csak mintegy 1000 kórkép génjét azonosították. A betegség-gén azonosítása során a 3 gigabázisnyi humán genom mintegy harminc-harmincötezer génje közül kell azt az egyet megtalálni, amelynek hibája (eltérése) a kérdéses öröklődő betegség oka (2, 3). A monogénesen öröklődő betegségek génjeinek azonosítása két különböző módszerrel, a funkcionális illetve a pozicionális klónozással valósítható meg. A funkcionális klónozás akkor alkalmazható, ha a betegség tünetei utalnak a betegség kialakulásáért felelős, hibás fehérje élettani funkciójára és ez alapján a fehérje azonosítható. A fehérje aminosav sorrendjének ismeretében meghatározható a gén nukleotid sorrendje és helye megkereshető a megfelelő kromoszómán. A funkcionális klónozásnak köszönhető például a haemophilia A-ért felelős VIII. véralvadási faktor génjének az azonosítása. A pozicionális klónozás elve a funkcionális klónozás gondolat menetének az ellentéte: először a betegség génjének a kromoszómális elhelyezkedését azonosítják. Ha sikerült a gént 1-2 megabázisnyi szakaszon belülre lokalizálni, a következő feladat valamennyi, ezen a területen elhelyezkedő gén azonosítása. Az a gén a keresett betegség génje, amelyről sikerül kimutatni, hogy az egészségesekben és a betegekben különböző formában fordul elő, tehát a betegség megjelenése és az adott gén mutációi között egyértelmű ok-okozati összefüggés áll fenn. A gén nukleotid sorrendjének meghatározása után következik a kódolt fehérje funkciójának megismerése. Pozicionális klónozással azonosították az öröklődő haemochromatosis génjét, amelynek 3
4 Bevezetés kromoszómális elhelyezkedésének azonosításában a HLA antigénekkel való kapcsolt öröklődésének a felismerése nyújtott segítséget. Egy adott gén nukleotid sorrendjének és mutációinak ismerete a molekuláris genetikai diagnosztika alap feltétele. A genetikai vizsgálatok segítséget nyújthatnak a diagnózis felállításában olyan esetekben, ahol a klinikai tünetek és az egyéb laborvizsgálatok nem utalnak egyértelműen az adott örökletes betegségre (pl. szerzett formák elkülönítése). Külön kiemelhető a preszimptomatikus, azaz még a klinikai tünetek előtt végzett diagnosztika is. A DNS-diagnosztika célja az is lehet, hogy a mutáció és a betegség lefolyása között összefüggéseket keressen. Egyes esetekben különböző mutációk azonosítása lehetőséget adnak arra, hogy optimális terápiát ill. életmódot lehessen kialakítani. Ez főként a kevésbé súlyos, (azonban legtöbbször gyakori) kórképek diagnosztikájában és megelőzésében játszik szerepet. Példaként említhető az V. véralvadási faktor Leiden mutációja (c.1691g>a; p.506r>q), amelynek heterozigóta gyakorisága a kaukázusi populációkban mintegy 1-15%. Heterozigóta formában három-nyolcszorosára, homozigóta formában ötvenszázszorosára növeli a mélyvénás trombózis kockázatát (4). Mutáció hordozóknál a trombózisra hajlamosító kockázati tényezők (így pl. orális fogamzásgátló tabletta, tartós immobilizáció) kerülése javasolt. Hasonló példa lehet a metilén-tetrahidrofolát-reduktáz termolabilis variánsa (c.677c>t; p.222a>v). Homozigóta formája (a populáció mintegy 15%-a) hiper-homociszteinémiára, így arterioszklerózisra, terhesség esetén a magzatnál velőcső záródási rendellenességekre hajlamosíthat (5, 6). A hiperhomociszteinémia kialakulása fólsav bevitellel megelőzhető. A súlyosabb, csak igen nehezen vagy egyáltalán nem kezelhető öröklődő betegségek (pl. cisztikus fibrózis, Duchenne féle izomdisztrófia) esetében az érintett családok gyakran igénylik a prenatális, tehát a magzati korban elvégezhető diagnosztikát. A magzat genetikai státusának pontos meghatározása a modern genetikai tanácsadás alapja. Rendkívül fontos a mutációt hordozó, de egészséges családtagok azonosítása is (hordozó [carrier] diagnosztika). A súlyos, örökletes betegségek oki terápiájának, a génterápiának a betegség-gén és mutációinak ismerete szintén alap feltétele. Dolgozatomban a molekuláris genetikai diagnosztika fent említett, kétféle szerepét az öröklődő haemochromatosis és a haemophilia A példáján mutatom be. Mindkét betegségnél (bár eltérő módon) a molekuláris genetikai vizsgálat bevezetése, és 4
5 Bevezetés elérhetősége a rutin laboratóriumi vizsgálatok között jelentős előrelépést jelentett a kórkép diagnosztikájában. Az öröklődő vagy herediter haemochromatosis (HH) a vasanyagcsere betegsége, amelyben a fokozott vasfelszívódás szabályozható kiválasztó mechanizmus hiányában a felszívódott vasfelesleg tárolásához vezet. A lerakódott vas a szervekben parenchymás szövetkárosodást okoz. A leggyakoribb szervi manifesztáció a májcirrhosis, szintén jellemző lehet a diabetes mellitus, a bronzszínű bőrpigmentáció, a cardiomyopathia, illetve az izületi panaszok. Az újabb genetikai kutatások révén vált ismertté, hogy a betegség hátterében az esetek jelentős részében a HFE gén p.282c>y (C282Y) pontmutáció homozigóta formája áll a kaukázusi népcsoportokban. A HFE gén C282Y mutációja által okozott, autoszomális recesszív módon öröklődő haemochromatosis Nyugat-Európában mintegy minden 400-dik, Magyarországon saját vizsgálataink szerint minden 700-dik embert (főként férfit) érinti. Mindezek alapján a haemochromatosis egyike a kaukázusi populáció leggyakoribb örökletes betegségeinek. A tünetek gyakran lappangva alakulnak ki és a betegség korai szakában sem a klinikai kép, sem a laboratóriumi eltérések nem specifikusak. Egyes esetekben az örökletes és a szerzett formák elkülönítése is nehézséget jelenthet. Mindkét esetben segítséget nyújthat a diagnózis kialakításában a molekuláris genetikai vizsgálat. A korai preszimptomatikus (a tünetek megjelenése előtti) diagnosztika az egyszerű preventív terápia lehetősége miatt is kiemelt fontosságú. A haemophilia A (HA) X kromoszómához kötötten, recesszív módon öröklődő vérzékenység, amely minden dik fiúgyermeket érint. Magyarországon mintegy 900 HA-beteget tartanak nyilván. A kórképet a VIII. véralvadási faktor csökkent illetve hiányzó aktivitása okozza. Az elhúzódó vérzések, az izületek és az izmok bevérzésének súlyossága a beteg maradék VIII. faktor aktivitásától függ és különböző mértékben, esetenként jelentősen csökkenti az élettartamot és rontja az életminőséget. A betegség diagnózisa az érintett betegeknél fenotípusos vizsgálatokkal biztonsággal felállítható. A tünetmentes hordozók azonosítása és a hordozók fiúmagzatainál a betegség kimutatása (prenatális vizsgálattal) fenotípus vizsgálatokkal nehézségekbe ütközik, míg molekuláris genetikai vizsgálatokkal könnyen megoldható. 5
6 Bevezetés 1.2. Öröklődő haemochromatosis - irodalmi háttér Az öröklődő haemochromatosis patogenezise A kórkép lényege, hogy egy genetikai eltérés következtében fokozódik az intesztinális vasfelszívódás és ez szabályozható kiválasztó mechanizmus hiányában nagy mennyiségű vas lerakódásához, valamint következményes szövetkárosodáshoz vezet. A vas fehérjékhez kötése nemcsak a metabolikus, a tárolási és a szállítási funkciók szempontjából fontos, hanem a sejtalkotók védelmét is szolgálja a szabad vas toxikus hatásaival szemben (összefoglalásként lásd 7). A vas nagy redoxpotenciálja lehetővé teszi, hogy oldatban szabad oxigén gyököket képezzen. Ezek toxikus hatásúak a biológiai struktúrákra, különösen a membránszerkezetek foszfolipidjeire. A vas toxikus hatása következtében kialakuló lizoszómális membrán fragilitás sejtkárosító enzim kiszabadulást okoz, a mitochondriális membránkárosodás a sejt energia egyensúlyának megbomlását, az endoplazmatikus retikulum sérülése pedig a sejt metabolikus zavarát eredményezi. Mindezek a folyamatok sejtdegenerációhoz, sejthalálhoz és következményes fibrogenezishez vezetnek. A vas a kollagén szintézis legfontosabb enzimjeinek, a prolin- és szerin-hidroxilázoknak a kofaktora, így direkt kollagén szintézist fokozó hatását is megfigyelték. A szabad vas egyrészt közvetlenül, másrészt közvetett módon a szabad oxigéngyökökön keresztül, károsítja a DNS állományt. A szervezet a vasegyensúlyt döntően a vasfelszívódás változtatásával biztosítja. Normális vastelítettség esetén a napi 10 mg vasbevitelnek mintegy 10%-a szívódik fel. Ez az arány akár 30%-ra is emelkedhet vashiányos állapotokban, illetve jelentősen csökken vastúltelítettségben. A felszívódással ellentétben a vaskiválasztás fiziológiásan nem szabályozható. Napi 1 mg vasat veszít egy felnőtt szervezet a gasztrointesztinális, a genitourinális traktusból és a bőrről leváló sejtekkel, amelyhez nőknél további 1 mg vasveszteség társul a menstruáció miatt. Az öröklődő haemochromatosis (HH) egyik jellegzetessége a vastúltelítettség ellenére is megfigyelhető fokozott vasfelszívódás. A betegség korai szakaszában a vasfelszívódás akár napi 3-4 mg-ra is emelkedhet, amely a betegség előrehaladtával csökken. A szervezet normális össz-vastartalma 3-4 g. HH esetében évi 0,5-1 g többlet vas felszívódásával számolhatunk (7). 6
7 Bevezetés Az öröklődő haemochromatosis kialakulásáért felelős gének A HFE gén és fehérje A HH-nak megfelelő klasszikus klinikai és patológiai képet, a májcirrhosissal járó bronz-diabetest 1865-ben Trousseau írta le. A kórkép örökletes természetét 1935-ben Sheldon vetette fel, feltételezését azonban többen kétségbe vonták. Csak 1976-ban, a HH és a HLA-A3 antigén gyakori társulásának és kapcsolt öröklődésének felfedezésekor igazolódott biztosan a kórkép genetikai háttere (8), és ezzel a betegség génjét a 6. kromoszóma rövid karjára, a HLA-A antigént kódoló régió közelébe lokalizálták. A pozicionális klónozás alkalmas olyan gének azonosítására, amelyek génterméke, és annak aminosav sorrendje illetve funkciója ismeretlen. A pozicionális klónozás során a gént feltételezhetően tartalmazó régiót olyan kicsire kell leszűkíteni, amely már lehetővé teszi a teljes bázissorrend meghatározását. A primer haemochromatosist okozó mutáció valószínűleg egy D6S265-1, HLA-A3, D6S105-8 és D6S haplotípusú kromoszómán keletkezett, mivel e DNS markerek nagy allél-asszociációt mutattak a HH-val. A régió alacsony rekombinációs gyakorisága elősegítette a konzervált haplotípus fennmaradását, viszont megnehezítette a pozicionális klónozást. Csak 20 évvel a HLA-antigénekkel való kapcsoltság felismerése után, 1996-ban sikerült Feder és munkatársainak azonosítaniuk egy új gént (HFE), amelynek az egyik pontmutációja a vizsgált haemochromatosisos betegek 83%-ánál homozigóta formában fordult elő, míg a kontrollok egyike sem volt homozigóta (9). Ez a mutáció (c.845g>a) az újonnan felfedezett gén 282. aminosavánál egy cisztein-tirozin cserét (C282Y) eredményez. A C282Y mutáció mellett egy másik polimorfizmust is találtak ezen a génen (c.187c>g), amely a 63. aminosav hisztidin aszparaginsav cseréjét (H63D) eredményezi. Ez a második polimorfizmus a haemochromatosisban szenvedő C282Y-heterozigóta betegek C282Y mutációt nem hordozó kromoszómáján 89%-ban volt kimutatható, a kontroll kromoszómák 17%-os allél-frekvenciájával szemben. A C282Y-negatív betegeknél nem volt gyakoribb a H63D mutáció a kontroll csoporthoz képest. Feder és mtsai ebből arra következtettek, hogy a két mutáció társulása, azaz kettős vagy compound heterozigóta állapot a C282Y és a H63D mutációk szempontjából, növeli a haemochromatosis kialakulásának az esélyét; míg önmagában a H63D mutáció nem okoz 7
8 Bevezetés haemochromatosist. Feder és mtsai az azonosított gént a HLA-A-hoz mutatott hasonlósága alapján HLA-H-nak nevezték el, de jelenleg a WHO ajánlása szerint HFE a hivatalos neve (10). Feder és mtsai felfedezését később több munkacsoport vizsgálata is megerősítette. Valamennyi tanulmány a C282Y-homozigótaság gyakori (64-100%-os) előfordulását igazolta a HH-ban szenvedő kaukázusi betegpopulációkban (11, 12, 13, 14, 15). A haemochromatosisos csoportok eltérései valószínűleg a diagnosztikus kritériumok és a populációk különbségeivel magyarázhatók. Azokban a tanulmányokban, ahol a pozitív családi anamnézis feltétele volt a besorolásnak nagyobb százalékban találtak C282Y homozigótákat, mint azokban a tanulmányokban, ahol csak klinikai diagnosztikai kritériumokat (lásd fejezet) vettek figyelembe. Az észak-európai eredetű haemochromatosisos betegeknél nagyobb százalékban találták meg a mutációt, mint a dél-európai országokban. A kaukázusi népeknél a haemochromatosisban szenvedő betegeknél talált magas C282Y allél-frekvenciával szemben (69-100%) a normál populációban a mutáció allélfrekvenciája 1-10% között mozog, amely 2-19%-os heterozigóta és 0,1-1%-os homozigóta aránynak felel meg. A normál populációból kiszűrt, panaszmentes C282Yhomozigóta egyéneknél a vasfelhalmozódás gyakran laborvizsgálatokkal már kimutatható. A korábbi, vasparaméterek (szérum ferritin koncentráció és transzferrin szaturáció) mérésén alapuló szűrővizsgálatok a haemochromatosis előfordulási gyakoriságát, a homozigóta C282Y prevalenciához hasonlóan, szintén 0,05-0,5% közé tették (16). Merryweather-Clarke és mtsai (17) számos etnikai csoportban, összesen 2978 normál egyénnél vizsgálták a C282Y mutáció prevalenciáját. Azokban a populációkban találtak magas mutáns allél-frekvenciát, ahol az öröklődő haemochromatosis is gyakori, míg azoknál az etnikai csoportoknál, ahonnan eddig a betegség kisebb előfordulási gyakoriságáról számoltak be a C282Y mutációs ráta is alacsonyabb lett. A legmagasabb előfordulási gyakoriságot az ír kromoszómákon találták. Az afrikai, az ázsiai és az ausztráliai bennszülött kromoszómákon a mutáció gyakorlatilag nem fordult elő. A C282Y mutáció előfordulása különböző népcsoportokban alátámasztotta azt a korábbi feltételezést, hogy a mutáció kelta eredetű népcsoportban keletkezett ( founder effect ), és ennek megfelelően az allél-frekvencia nyugatról keletre és északról délre csökkenő tendenciát mutat Európában (1. ábra). A 8
9 Bevezetés mutáns gén magas prevalenciájának oka nem ismert. Feltételezhető, hogy a mutáció jelenléte szelektív előny jelentett, mivel az védelmül szolgálhatott a vashiány ellen. 1. ábra: A HFE C282Y allél-frekvencia alakulása Európában. A HFE H63D mutációjának társulása a C282Y mutációval elősegítheti a haemochromatosis kialakulását (18, 19). A C282Y mutációra nézve nem homozigóta haemochromatosisban szenvedő betegek között kettős C282Y és H63D heterozigóták gyakrabban fordulnak elő, mint a normál populációban. Valószínű, hogy önmagában a kettős heterozigóta állapot nem elég a haemochromatosis kialakulásához, mivel a homozigóták és kettős heterozigóták összesített előfordulása meghaladja az öröklődő haemochromatosis előfordulási arányát, ezen kívül a kettős heterozigóták a normál populáción belül is nagy százalékban fordulnak elő. A C282Y-negatív H63Dheterozigóta és homozigóta egyéneknél is fokozott a haemochromatosis kialakulásának kockázata a normál genotípusú egyénekhez képest, azonban a mutáció penetranciája igen alacsony. A HFE gén aminosav sorrendje alapján az MHC I. osztályba tartozó fehérjékkel mutat rokonságot (2. ábra): egy transzmembrán fehérjét kódol, amelynek három extracelluláris doménje az MHC fehérjék α1, α2 és α3 doménjeivel analóg. A fehérje fontos jellemzője az a négy cisztein aminosav, amelyek az α2 és az α3 domének diszulfid hídjait képezik. Az MHC I-es fehérjék α3 doménjének pontos konfigurációja 9
10 Bevezetés nélkülözhetetlen a β2-mikroglobulinnal történő nem-kovalens kapcsolódáshoz és a sejtfelszíni expresszióhoz. 2. ábra: A HFE gén által kódolt fehérje feltételezett szerkezete (9). Már a HFE gén klónozása előtt is számos indirekt bizonyíték utalt az MHC I-es osztályba tartozó fehérjék vasanyagcserében betöltött szerepére. A β2-mikroglobulinhiányos egerekben nemcsak a membránhoz kötött MHC I-es fehérjék expressziója hiányzik, hanem progresszív, a HH-hoz hasonló szöveti megoszlású vaslerakódás figyelhető meg (20, 21). Santos és mtsai (22) a β2-mikroglobulin-hiányos egereken csontvelő transzplantációt végeztek, így olyan kiméra állatokat hoztak létre, amelyek normál β2-mikroglobulin gént hordoztak a csontvelő eredetű sejtvonalaikban, (a reticuloendothelialis rendszerükben is), míg az összes többi sejtjeik β2-mikroglobulin hiányosak voltak. Ezeknél állatoknál fokozott enterális vasfelszívódást figyeltek meg, viszont a vasat a reticuloendothelialis rendszerhez tartozó, hepatikus makrofágjaik tárolták, nem a májsejtek. Ez arra utalt, hogy β2-mikroglobulin-hiányban (és valószínűleg HFE gén defektusánál is) mind az enterocitákban, mind a reticuloendothelialis rendszer sejtjeiben kóros a vasanyagcsere szabályozása. A HFEhiányos egértörzs létrehozása (23) bizonyította, hogy ennek a fehérjének a mutációja valóban okoz vasfelhalmozódást. A gén klónozása után elvégzett funkcionális vizsgálatok igazolták, hogy a HFE fehérje β2-mikroglobulint köt, valamint a sejtfelszínen komplexet képez a 10
11 Bevezetés vasanyagcsere egyik kulcsfontosságú elemével, a transzferrin receptorral, és csökkenti a receptor transzferrin kötő képességét. A C282Y mutáció az α3 domén egyik cisztein aminosavát érinti, a cisztein hiányában nem jöhet létre diszulfid híd. A mutáns fehérje nem képes a β2-mikroglobulinnal kapcsolódni, transzláció után az endoplazmatikus reticulumban, illetve a Golgi-apparátusban marad és degradálódik, így a sejtfelszínen nem expresszálódik. A H63D mutáció a HFE fehérje α1 doménjét érinti, nem befolyásolja a fehérje sejtfelszíni expresszióját és a transzferrin receptorhoz való kötődését, azonban a vad típusú fehérjével ellentétben, nem csökkenti a receptor ligand kötő képességét (24, 25). A HFE fehérje szabályozó szerepet tölthet be a duodenális transzferrinhez kötött vas felvételben. HFE hiányos egér duodenális transzferrin receptorhoz kötött vasfelvétele csökkent (26). Jelenlegi feltételezések szerint ez a mechanizmus szolgálja a szervezet vasraktárainak érzékelését a duodenumban (27). A szervezet vasraktárainak érzékelése a májban szintén zavart HFE hiányban: az emelkedett vasraktárak ellenére hepcidin expresszió szint csökkenés figyelhető meg, amely szintén fokozott vasfelszívódáshoz vezet (28). Leírtak a H63D mutáció közelében egy másik aminosav cserével járó (missense) mutációt (S65C), amelynél felmerült, hogy szintén rizikófaktor lehet a haemochromatosis kialakulásának szempontjából (29). Ismertek a HFE gén egyéb ritkább mutációi is, amelyek korai stop kodont [E168X, W169X] (30, 31), kóros mrns érést ( splice site mutációk) [IVS3+1G>T, IVS5+1G>A] (32, 33), vagy aminosav cserét eredményeznek [V53M, V59M, Q127H, V212K, E277K, R330M] (34, 35). A leírt missense mutációk funkcionális vizsgálata a legtöbb esetben nem történt meg, így kapcsolatuk az öröklődő haemochromatosissal nem bizonyított Egyéb géndefektusok, amelyek haemochromatosis kialakulásához vezetnek A klinikai kritériumok alapján diagnosztizált haemochromatosisban szenvedő betegek 0-26%-a nem hordozza sem a C282Y, sem más HFE mutációt. Az elmúlt években több haemochromatosis gént is azonosítottak, ezért a HFE génnel kapcsoltan öröklődő haemochromatosist (HH) 1-es típusú, a juvenilis haemochromatosist (JH) 2-es típusú, a transzferrin receptor 2 mutációihoz kötődő haemochromatosist 3-as típusú és a 11
12 Bevezetés ferroportin 1 génjéhez kötődő haemochromatosist 4-es típusú haemochromatosisnak nevezték el (összefoglalásként lásd 27, 36). A JH autoszomális recesszív módon öröklődő, progresszív vasfelhalmozódással jellemzett ritka kórkép, amely a HH-val ellentétben már fiatal felnőttkorban (<30 év) tüneteket okoz és a nőket és a férfiakat egyaránt érinti. A tünetek hasonlóak, azzal a különbséggel, hogy JH-ban a szív és az endokrin szervek érintettsége gyakrabban fordul elő. A betegség génje nem ismert, pozicionális klónozással az 1. kromoszóma hosszú karjára (1q21) lokalizálták (37). Két JH családban a hepcidin peptidet kódoló HAMP gén (19q13) mutációit azonosították (38). A transzferrin receptor 2 (TFR2) gén mutációi által okozott haemochromatosis autoszomális recesszív módon öröklődik. Mutációit (E60X, M172K, Y250X, AVAQ del, Q690P) izolált non-hfe haemochromatosisos családokban azonosították (39, 40, 41, 42). A ferroportin 1 gén mutációi autoszomális domináns módon öröklődő haemochromatosist okoznak. Nemcsak öröklésmenete, hanem a klinikai képe is eltér a HH-tól. A betegség korai szakaszában főként a reticuloendothelialis rendszer sejtjei érintettek. A laboratóriumi eltérések közül a szérum ferritin emelkedés hamarabb kialakul, mint a transzferrin szaturáció emelkedés. A ferroportin 1 gén mutációi (N144H, A77D, Y64N) közül a V162del mutációt több különböző populációban is leírták (43, 44, 45, 46). A 2-4-es típusú HH-ra vonatkozóan pontos epidemiológiai adatok nem ismertek. Az 1-es típusú HH-val szemben ritkán fordulnak elő és izolált, non-hfe HH-ban szenvedő betegeknél azonosították az említett különböző gének mutációit. Egészséges és emelkedett vasparaméterekkel rendelkező véradók (300 illetve 178 fő) ismert TFR2 mutációkra történő szűrése során mutációt hordozó egyéneket nem azonosítottak (31, 47). Esetleg a ferroportin 1 gén V162del mutációja lehet gyakoribb, mivel több populációban is leírták előfordulását (44, 45) Az 1-es típusú öröklődő haemochromatosis klinikai képe, diagnózisa és terápiája Klinikai megjelenés A HFE gén mutációi által okozott 1-es típusú haemochromatosis klinikai tünetei (összefoglalásként lásd: 7, 48, 49) leggyakrabban éves életkorban jelentkeznek. A tünetek súlyosságát számos endogén és exogén faktor befolyásolja (pl. táplálkozási 12
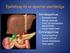
13 Bevezetés szokások, alkoholfogyasztás). Nőknél a menstruáció és a terhesség alatti vasveszteség miatt a haemochromatosis klinikai képe 5-10-szer ritkábban alakul ki. A vastúltelítettség legtöbb tünete nem specifikus. A betegség korai szakaszában a betegek gyakran krónikus fáradtságról, gyengeségről, hasi és izületi fájdalmakról, impotenciáról panaszkodnak (50). A lappangó kezdetet jellemzi, hogy a tünetek megjelenése és a diagnózis felállítása között eltelt idő nőknél átlagosan 5, férfiaknál átlagosan 8 év (51). A klasszikus klinikai triász a bronz-diabetesszel járó májcirrhosis a betegség késői szakaszára jellemző. A máj érintettsége a kórkép egyik legállandóbb jellemzője. Mikroszkóposan a májsejtekben Berlini-kék festéssel nagy mennyiségű vas mutatható ki. A vaslerakódás főként a hepatocitákban mutatkozik és jellemző a reticuloendothelialis rendszerhez tartozó makrofágok (Kupffer-sejtek) relatív megkíméltsége. Szekunder haemochromatosisban a vaslerakódás főleg a Kupffer-sejtekben figyelhető meg. A vaslerakódás fokozódásával először fibrosis, majd cirrhosis alakul ki. Klinikai vizsgálattal hepatomegália a betegek több, mint 90%-ánál észlelhető. A májenzimek közül enyhe aminotranszferáz (AST, ALT) emelkedés gyakran megfigyelhető. A máj érintettség legfőbb komplikációja a hepatocelluláris karcinóma megjelenése, amely fibrosisnál és cirrhosisnál hozzávetőleg az esetek 20-30%-ában alakul ki. A haemochromatosisos betegek 90%-ánál figyelhető meg abnormális bőrpigmentáció. A klasszikus bronzszín ritka, gyakran fémes szürke pigmentáció figyelhető meg főleg a napnak kitett helyeken, a genitálékon és a hegvonalakban. A krónikus vasterhelés a hasnyálmirigy fibrosisához vezethet. A társuló hepatopathia szintén hozzájárul az inzulinrezisztencia kialakulásához. Diabetes mellitus (DM) a haemochromatosisos betegek 65%-ánál, főként a cukorbetegség szempontjából pozitív családi anamnézisűeknél és a cirrhosisban szenvedőknél alakul ki. A diabetes kezelése során nagyobb arányban számolhatunk inzulin rezisztencia megjelenésével. Az exokrin pancreas klinikai érintettsége nem jellemző a kórképre. A vas az izületekben a synoviumot borító epitheliumban rakódik le. Radiológiailag subchondralis csontciszták, izületi porcvesztés izületi rés szűkülettel, diffúz demineralizáció és hipertrófiás csontproliferáció figyelhető meg. Az említett eltérés legtípusosabban a kéz második-harmadik metacarpo-phalangealis izületeinél jelenik meg. Panaszokat okozó arthropathia a betegek 25-50%-ánál alakul ki, és általában 50 év 13
14 Bevezetés felett jelentkezik, de a kórlefolyás bármely szakaszában megjelenhet, akár a betegség első tünete lehet vagy a venoszekciós terápia alatt is elkezdődhet. Kardiális diszfunkció a kezdeti diagnóziskor a betegek kb. 15%-ánál mutatható ki. A leggyakoribb kardiális manifesztáció a dilatatív cardiomyopathia és az ingerületvezetési zavarok. Kardiális tünetek fiatal betegeknél gyakrabban fordulnak elő és esetenként a beteg hirtelen halálát okozhatják. A pajzsmirigyben, a mellékpajzsmirigyekben, a hipofízis elülső lebenyében és a mellékvesék zona glomerulosájában kifejezett vaslerakódás figyelhető meg, míg a herékben nincs vaslerakódás. A hypogonadotrop hypogonadismus libidó csökkenéssel, impotenciával, tesztikuláris atrófiával vagy amenorrhoeaval történő megjelenése megelőzheti az egyéb tünetek jelentkezését. Hypothyreosis, hypoparathyreosis vagy hypadrenia ritkán alakul ki Az öröklődő haemochromatosis diagnózisa A haemochromatosis lehetősége a specifikus tünetek hiánya és a lappangó kezdet miatt minden krónikus parenchymás májbetegség, bőrpigmentáció, diabetes mellitus, cardiomyopathia vagy arrhythmia, arthropathia vagy endokrin diszfunkció diffenciál diagnózisánál fel kell, hogy merüljön, különösen, ha e tünetek társulása figyelhető meg (52). A diagnózis alappillére a szérum vas, illetve ferritin szintek és a transzferrin telítettség (szaturáció) meghatározása (53). A szérum vas szint HH-ban sokáig a normális tartományban marad. A transzferrin szaturáció mérése jobban megfelel szűrővizsgálat céljára, nőknél 50% feletti, férfiaknál 62% feletti érték jellemző a HH-ra. A szérum ferritin koncentráció általában jól jellemzi a szervezet vasraktárainak mennyiségét. Klinikailag manifesztálódott haemochromatosisnál a ferritin szint általában 1000 µg/l felett van, de alacsonyabb értékek lehetségesek a betegség korai szakaszában. Ugyanakkor a ferritin egy akut fázis fehérje és emelkedése nem specifikus a HH-ra. Amennyiben a szérum vas, illetve ferritin szintek vagy a transzferrin szaturáció értékei vastúlterhelésre jellemzők és a vaslerakódáshoz vezető szekunder okok kizárhatók, a diagnózis felállításához májbiopszia szükséges. A szövettani képen 3+, 4+ parenchymás Berlini-kék reakció mutatható ki. Magyarországon nem elterjedt a 14
15 Bevezetés Nyugat-Európában diagnosztikus kritériumként alkalmazott májvas koncentráció (HIC) [>4500 µg/g száraztömeg] és a májvas index [HII=HIC (µg/g)/56 x életkor> 2,0] meghatározása (54, 55). A HH-ra jellemző a mobilizálható vasraktárak emelkedett szintje, azaz terápiás kvantitatív vérlebocsátással több, mint 4 g vas (=16 U vér) távolítható el anaemia kialakulása nélkül. A haemochromatosis fenotípusát mutató egyéneknél a C282Y-homozigóta (esetleg C282Y/H63D) genotípus kimutatása megerősíti a diagnózist, esetleg kiválthatja az invazív májbiopsziát (56), ugyanakkor egy negatív eredményt adó genetikai vizsgálat nem zárja ki a HFE gén másfajta mutációinak és egyéb gének mutációinak következtében kialakuló öröklődő haemochromatosist. Szekunder haemochromatosis alatt olyan vastúltelítettségi állapotokat értünk, amelyek más örökletes vagy szerzett betegségek (pl. diszeritropoetikus vagy hemolítikus anaemiák, különböző eredetű májcirrhosisok) vagy túlzott parenterális vasbevitel, transzfúziók következményei (57). Ezeknél a kórképeknél a kialakult vaslerakódás a HH laboratóriumi leleteit utánozza. A molekuláris diagnosztika ezekben az esetekben is új lehetőséget kínál a differenciál diagnózisban Az öröklődő haemochromatosis terápiája A szervezet vasraktárai hetenkénti ml vér terápiás lebocsátásával csökkenthetők, amíg a szérum ferritin szint az alsó normál értékre süllyed. A betegek általában jól tűrik a vérveszteséget. A szérum ferritin szint normalizálódása kialakult haemochromatosis esetén 25 g-s vasterhelést feltételezve 2-3 évig tartó hetenkénti terápiás vérlebocsátással érhető el. Ekkor a vérlebocsátások közötti időtartam 1-3 hónapra emelhető és ez a teljes életen át folytatható. A vas-kelátor kezelés (desferoxamin) általában csak súlyos, pl. kardiálisan dekompenzált, illetve súlyos anaemiában szenvedő betegeknél szükséges. A hepatomegalia a terápiával párhuzamosan csökken vagy megszűnik. A fibrosis és a cirrhosis viszont irreverzibilis. Az inzulin és a venoszekciós terápia bevezetése óta a HH-ban szenvedő betegek haláloka megváltozott. Jelenleg a májrák tehető felelőssé a betegek körülbelül egyharmadának a haláláért. A hepatocellularis karcinóma kialakulásának valószínűségét a vastelítettség mértéke és fennállásának időtartama 15
16 Bevezetés befolyásolja. Társuló májkárosító faktorok, pl. alkoholfogyasztás, krónikus hepatitis, növelik a daganat kialakulásának valószínűségét. Ha a diagnózis időpontjában már fibrosis vagy cirrhosis áll fenn, akkor a vasraktárak kiürítése nem akadályozza meg a karcinogenezist. Az ilyen betegeknél ajánlott a rendszeres hasi ultrahang vizsgálat és az α-fetoprotein (AFP) szűrés. A venoszekciós terápia csökkenti a bőrpigmentációt, és a betegek negyven százalékánál az inzulin szükségletet. A krónikus polyarthritist általában nem befolyásolja a kezelés, sőt az gyakran rosszabbodik a terápia mellett is. A kardiális funkció az esetek többségében javul, de annak kezelése így is gyakran nehézségekbe ütközik, mert a haemochromatosisos cardiomyopathia általában rosszul reagál a hagyományos antiarrhytmiás vagy a pozitív inotrop gyógyszerekre. A hypogonadismus általában irreverzibilis. Általánosságban elmondható, hogy a májfibrosis és a diabetes kialakulása előtt megkezdett venoszekciós terápiával a betegek várható élettartama nem különbözik a normál populáció várható élettartamától (58, 59) A HFE mutációi myelodysplasiás szindrómában A HFE gén azonosítása előtt az átlag populációban nem volt lehetőség a haemochromatosis gén heterozigóta mutációhordozók kimutatására, így a heterozigóták vasparamétereinek tanulmányozása korábban szűkebb családvizsgálatokra korlátozódott. A HLA-tipizálással azonosított heterozigóta egyéneknél progresszív vasfelhalmozódás nem volt megfigyelhető, de vasparamétereik magasabbak voltak a mutációt nem hordozó családtagjaikhoz viszonyítva. Többségüknél a szérum ferritin szint és a transzferrin szaturáció értéke a normál tartományban maradt, százalékuknál azonban emelkedett vasparamétereket találtak. (60, 61). Hasonlóképpen egy ikertanulmány (62) is emelkedett vasparamétereket talált a HFE C282Y és H63D heterozigóta ikertestvéreknél a normál genotípusú testvérpárokhoz képest. Mindezek alapján felmerült, hogy a HFE viszonylag gyakran előforduló C282Y és H63D heterozigóta genotípusai befolyásolhatják olyan multifaktoriális betegségek kialakulását, illetve progresszióját, amelyekben a vaslerakódás patogenetikai szerepet játszhat. A myelodysplasiás szindróma (MDS) a haematopoetikus őssejtek klonális betegsége, 16
17 Bevezetés amelyben kóros, ineffektív erythropoiesis és myelopoiesis figyelhető meg. A betegségre jellemző a leukémiás transzformációra való hajlam. A betegség, attól függően, hogy milyen fokban zavart a vérképzés, különböző klinikai képpel jelentkezhet. Kezdeti panasz gyakran az anaemiával összefüggő gyengeség és fáradékonyság. A trombociták és a fehérvérsejtek funkcionális és számbeli rendellenességének fokától függően vérzés, illetve fertőzéssel összefüggő láz jelentkezhet. A betegség kezelése jelenleg csak szupportív ellátásra irányul. Csontvelő transzplantáció, mint kóroki terápia az idős életkor és a gyakori társuló betegségek miatt általában nem kerül szóba. A sorozatos vérátömlesztések egyre növekvő vérigénnyel járnak, amelyet a szerológiai inkompabilitás kialakulásával magyarázhatunk. A transzfúziós haemosiderosist vaskelátor terápiával kezelik. A MDS-ben kialakuló haemosiderosis hátterében az ismételt transzfúziók mellett számos egyéb szerzett tényező is feltételezhető: az ineffektív erythropoiesissel járó anaemiákban gyakran megfigyelhető fokozott vasfelszívódás. A kórkép hátterében a mitokondriális vasanyagcserét, vas transzportot és ATP szintézist érintő, szerzett mitochondriális DNS mutációkat feltételeznek (63). A HFE gyakori mutációi nem játszanak elsődleges szerepet a szerzett klonális betegség kialakulásában, mégis feltételezhető, hogy jelenlétük, akár heterozigóta állapotban is súlyosbíthatja a vaslerakódás mértékét. A vasterhelés circulus vitiosus-ként pl. szabadgyökök generálásával, mutációk előidézésével az érintett MDS-ért felelős sejtklónban tovább ronthatja az alapbetegség progresszióját. Klinikai megfigyelések szerint az orális vaskelátor kezelés bevezetése már a korai szakban csökkenti a transzfúziók gyakoriságát. 17
18 Bevezetés 1.3. Haemophilia A - irodalmi háttér A haemophilia A patogenezise A vérzéscsillapításhoz vaszkuláris, trombocita- és plazmafaktorok kombinált aktivitása szükséges. A plazmafaktorok alkotják az ún. véralvadási kaszkádot, amely pontos lezajlásához 12 alvadási faktor fehérje és sok egyéb tényező összehangolt működésére van szükség (összefoglalásként lásd 64). Ezek közül a VIII. alvadási faktor (FVIII) csökkent aktivitása okozza a haemophilia A-t (HA). A klasszikus véralvadási kaszkád két egymástól független úton aktiválódhat (extrinsic és intrinsic), és a FVIII-t az intrinsic oldalon tüntetik fel, a FIX kofaktoraként. Az extrinsic út faktorai (szöveti faktor és FVII) azonban önmagukban nem képesek elegendő protrombint aktiválni a stabil fibrinháló kialakulásához, ehhez a FIX és FVIII megfelelő aktivitása is szükséges (3. ábra). Mindezek alapján állítható, hogy a FIX és a FVIII is központi szerepet töltenek be a véralvadási folyamatban. 3. ábra: A véralvadás folyamata (65). Az extrinsic út aktiválódásakor az aktivált FVII (FVIIa) a FX mellett kis mennyiségű FIX-t is aktivál. FXa jelenlétében a TFPI (tissue factor pathway inhibitor) gátolja a FXa és a FIXa további keletkezését, így a keletkezett FXa nem elegendő a stabil fibrinháló kialakításához. Az eddig keletkezett trombin azonban aktiválja a FVIII és FIX fehérjéket, így további, már megfelelő mennyiségű FXa keletkezhet. (A római számok a megfelelő alvadási faktorokat, a fekete nyilak az aktiválást, a piros nyilak a gátlást, a zöld nyilak a pozitív visszacsatolásként megjelenő aktiválást szemléltetik.) 18
19 Bevezetés A VIII. alvadási faktor génjére és a keletkező fehérjére jellemző sajátosságok Patek és Taylor 1935-ben azonosítottak egy plazma komponenst (az antihaemophiliás globulint), amely az X kromoszómához kötötten öröklődő haemophiliás beteg plazmájának alvadási idejét korrigálta ben három különböző csoport is leírta, hogy a klinikailag azonos tünetekkel bíró haemophiliás betegek plazmája egymás alvadási idejét korrigálhatja. Mindezek alapján derült fény arra, hogy a haemophilia hátterében több alvadási faktor (FVIII és FIX) defektusa állhat, és elkülönítették a haemophilia A-t és B-t (66). A FVIII fehérje tisztítására irányuló kísérletek az 1950-es években kezdődtek. Utólag egyszerű belátni, hogy a kezdeti munkákat miért nem koronázta siker. A FVIII tisztán nehezen izolálható, mivel a von Willebrand faktorhoz (vwf) kötődik, önmagában alacsony koncentrációban van jelen és instabil. A FVIII fehérje tiszta előállítása először 1979-ben sikerült. Elegendő mennyiségű FVIII izolálása után részleges fehérje szekvencia meghatározással lehetőség nyílt (funkcionális klónozással) a FVIII génjének azonosítására (66, 67). A FVIII gén az X kromoszóma hosszú karjának disztális végéhez közel, 1 megabázisra a telomertől található (Xq28). 186 kilobázisos méretével (26 exon) az egyik leghosszabb emberi gén. A génről 9 kilobázis méretű mrns készül, amelyről egy 2351 aminosavból álló fehérje szintetizálódik. A FVIII fehérje endoplazmatikus retikulumba kerülésekor az N-terminális 19 aminosav lehasad és az aszparaginok oldalláncaihoz oligoszacharidok kapcsolódnak. A Golgi rendszerben kihasad a B domén egy része, a szerin és a treonin aminosav oldalláncokhoz szénhidrátok kötődnek és a hat tirozin oldallánc szulfatálódik. Alapállapotban a VIII. faktor a plazmában egy kda-os nehéz láncból, és egy 80 kda-os könnyű láncból áll, amelyet a vwf stabilizál (66). A súlyos HA betegek (a FVIII aktivitás nem éri el a normál aktivitás 1%-át) mintegy 45%-ánál a FVIII gén egy speciális mutációja, a 22. intron inverziója és mintegy 3-5%- ánál az 1. intron inverziója áll a betegség hátterében. A súlyos esetek további 50%-ában és a középsúlyos illetve enyhe esetekben nem ismerünk más mutációs predilekciós helyet. Eddig több mint 700 mutációt írtak le, amelyek a 26 exonon elszórtan helyezkednek el (68). 19
20 Bevezetés A FVIII gén inverziói Higuchi és mtsai 1991-ben genomiális DNS-ről történő exon-amplifikálás és szekvenálás segítségével jellemezték a HA betegek mutációit (69). Meglepő módon az enyhe és a középsúlyos esetekben szinte mindig azonosították a mutációt, míg a súlyos eseteknek csak a felében találtak eltérést a kódoló szekvenciában. Naylor és mtsai reverz transzkripciót követő PCR-rel a súlyos HA betegek mintegy 40%-ánál a FVIII mrns 22. és 23. exonja között az átíródás megszakadását észlelték (70). Ennek hátterében később Lakich és mtsai (71) és Naylor és mtsai (72) azonosították a FVIII gén 22. intronját érintő inverziót. Az inverzió gyakori előfordulásának oka a FVIII gén 22. intronjának és a gént környező telomerikus régió szerkezetében rejlik. A FVIII gén legnagyobb, 32 kilobázis (kb) hosszúságú 22. intronja tartalmaz egy CpG szigetet, amely kétirányú promoterként szolgál két másik átíródó gén, az F8A és az F8B (FVIII asszociált A és B gének) számára. Az F8B gén a FVIII génnel megegyező orientációjú, első exonja a 22. intronban található, míg további exonjait a FVIII gén exonjai adják. Az F8A egy rövid, intronmentes gén, amely a FVIII génnel ellentétes irányban íródik át és egy 9,5 kb nagyságú, repetitív szekvencia része (int22h-1 vagy A1). Az int22h-1 a 22. exontól mintegy 5 kb távolságra helyezkedik el. A FVIII gén 22. intronján kívül ez a repetitív szakasz még két példányban a génen kívül is megtalálható, attól mintegy 300 és 400 kb-nyira 5' (telomerikus) irányban (proximális és disztális kópiák: int22h-3 és int22h-2, más néven A3 és A2). A három homológ kópia DNSszekvenciáját összehasonlítva gyakorlatilag teljes (99,9%-os) azonosságot találtak (73). Az intronikus és az egyik extragenikus kópia között bekövetkező intrakromoszómális homológ rekombináció eredményeként egy speciális mutáció (inverzió) jön létre, ami a FVIII gént két részre osztja: egy exonokat tartalmazó és egy exonokat tartalmazó részre, amelyek ellentétes orientációjúak és mintegy 500 kb távolságban találhatóak egymástól az inverziós kromoszómán. A két telomerikus F8A gén bármelyikével létrejöhet az intrakromoszómális rekombináció, ennek alapján elkülöníthetünk disztális (vagy 1-es típusú) illetve proximális (vagy 2-es típusú) inverziót (4/a ábra). Az esetek kis százalékában az inverzió egy FVIII génen kívül található harmadik extragenikus, vagy csonkolt homológ régióval jön létre (74, 75). Az egyes extragenikus régiók duplikációját az irodalom normál polimorfizmusnak tartja. A szám feletti disztális illetve proximális régióval bekövetkező intrakromoszómális 20
21 Bevezetés rekombináció 3A illetve 3B típusú inverziót eredményez (4/b ábra). Az inverzió által érintett X kromoszómáról teljes hosszúságú FVIII mrns, így FVIII fehérje sem képződhet (76). Férfiaknál az X kromoszóma monoszómiája a gametogenezis során kedvez az intrakromoszómális homológ rekombináció kialakulásának, ezért a 22. intron inverzió szinte mindig (az esetek 98%-ában) a spermatogenezis során alakul ki (77, 78). Egy 1041 bázispár hosszúságú repetitív szekvencia jelenléte az 1. intronban és extragenikusan a géntől telomerikus irányban a 22. intron inverzió keletkezéséhez hasonló mechanizmussal 1. intron inverziót eredményezhet, amelynek gyakorisága a súlyos HA-ban szenvedő betegek között mintegy 3-5% (79, 80, 81) A FVIII gén pontmutációi Az ismert bázis-szubsztitúciók nagy része a missense (aminosav cserével járó) mutációk körébe tartozik. A missense mutációk legtöbbjénél nincs felderítve a struktúra-funkció háttér. Létrehozhatnak vagy kiejthetnek proteolítikus hasítási helyeket, a tirozinokat érintő mutációk gátolhatják a szulfatálódást, illetve túlzott glikozilációt is eredményezhetnek. Számos nonsense, azaz korai stop kodont eredményező, és számos mrns hasítási helyet ( splice-site -ot) érintő mutáció ismert. Ritkán a bázis-szubsztitúció olyan nonsense mutációt eredményez, amely az érintett exon mrns szinten történő kivágódásához vezet az olvasási keret elcsúszása nélkül ( exon skipping ) (82, 83). A FVIII pontmutációk mintegy 35%-a a CpG dinukleotidoknál keletkezik, amelyek ismert mutációs hot spot -ot jelentenek bárhol a genomban. A guanintól 5 irányban található citozin gyökök az emlős sejtekben metilációs helyek. A metiltranszferáz ezeket a citozinokat 5-metilcitozinná metilálja, amelyek spontán, nem-enzimatikus úton deaminálódhatnak timinné. Ilyen esetben a klasszikus nukleotid csere a CG TG vagy a CG CA csere, ha a mutáció az ellentétes (antisense) DNS szálon következik be (66). 21
22 Bevezetés 4/a ábra: Az 1-es típusú (vagy disztális) és a 2-es típusú (vagy proximális) 22. intron inverzió keletkezési mechanizmusa (66, 74). 4/b ábra: A 3A és a 3B típusú 22. intron inverzió keletkezési mechanizmusa (74). Jelmagyarázat: FVIII: a VIII. alvadási faktor génje; 1-22 és felirattal jelölt fehér téglalap: a FVIII gén exonjai; Kék téglalapok: homológ régiók; A1, A2, A3: intronikus, disztális illetve proximális homológ régiók; Vízszintes csíkozású téglalap: a 22. intron homológ régión kívül eső része; Piros színű P, Q, A, B: hosszú PCR primerek; Vékony nyilak: a FVIII gén átíródásának iránya; Vastag nyilak: a homológ régiókban található F8A gének átíródásának iránya; C: centromer; T: telomer; Kb: kilobázis. 22
23 Bevezetés A FVIII gén deléciói Eddig több, mint száz nagyméretű (2-210 kb) deléciót ismertettek az irodalomban, amelyek a HA hátterében álló mutációk mintegy 5%-át képviselik. A legtöbb nagyméretű deléciónál nincs pontosan azonosítva a töréspontok helyzete. A FVIII gén deléciós betegek jelentős hányadánál a szubsztitúciós terápia során inhibitor képződés figyelhető meg. Számos rövid deléció is ismert, amelyek leggyakrabban korai stop kodont, így súlyos HA-t okoznak, egyes esetekben leírtak csak 1-1 kodont érintő, enyhe HA-t okozó deléciót is. Érdekes annak az enyhe HA-ban szenvedő betegnek a mutációja, akinél a 14. exonban található AAAAAAAATAA -szekvenciában a timin delécióját azonosították. A beteg mutációja az olvasási keret elcsúszásával jár, így súlyos HA-t kellene, hogy eredményezzen. A beteg FVIII mrns-ének vizsgálata során kiderült, hogy transzkripciónál bekövetkező hibák során számos ép olvasási keretű mrns is keletkezik. Mivel a 14. exon a B domént kódolja, amely a FVIII fehérje érése során kivágódik, a mutáns, de ép olvasási keretű mrns-ről aktív FVIII keletkezhet (84) A FVIII gén inszerciói Emberben a transzpozon inszerció patogenetikai szerepét először a FVIII génben írták le (85), bár a transzpozonokat korábban már az élőlények széles skálájában azonosították, beleértve az élesztőt, az ecetmuslicát és az egeret is. Az L1 elemek a humán genom körülbelül 5%-át alkotják. Nem ismert a genomban található aktív, teljes hosszúságú L1 elemek pontos száma. A mintegy kópiából 300 teljes hosszúságú potenciálisan ugráló gén (transzpozon) lehet, a legtöbb példány csonkolt. A transzpozonokra jellemző, hogy RNS-re átíródásuk után megszintetizálódik az antisense szál, és duplaszálú DNS-sé alakulva beszúródnak a genom egy más részletébe. Az ismertetett HA beteg esetén egy de novo keletkezett L1 inszerciót találtak, amelynél egy 22. kromoszómán található aktív L1 elem kétharmada szúródott be a FVIII gén 14. exonjába. Azóta a HA-n kívül az L1 elemek retrotranszpozicióját leírták az adenomatosis polyposis coli és a dystrophin génekben is (66). 23
24 Bevezetés A haemophilia A klinikai képe, diagnózisa és terápiája Klinikai megjelenés A betegség súlyossága a keringésben található VIII. faktor mennyiségétől, illetve aktivitásától függ. Súlyos esetben, amikor a VIII. faktor aktivitása alacsonyabb, mint a normál aktivitás 1%-a, a kisebb traumát követő, illetve a spontán bekövetkező ízületi és izomközti vérzések kialakulása a legjellemzőbb tünet. 1-5%-os VIII. faktor-szint esetén (középsúlyos eset) a spontán vérzések előfordulása ritkább, kisebb sérülések után lépnek fel elhúzódó vérzések. Enyhe esetekben (VIII. faktor-szint 5-30%) elhúzódó vérzés csak foghúzás, fogászati illetve sebészeti beavatkozás, vagy nagyobb sérülések után fordul elő. A vérzések során leggyakrabban a könyök-, a térd-, a boka- és a csípőizület érintett. Faktorpótlás nélkül az ízületi intrakapszuláris vérzés komoly duzzanatot, fájdalmat és merevséget okoz. A vér irritálja a synoviumot, amely gyulladáshoz, proliferációhoz, degeneratív arthritis kialakulásához vezet. Izomvérzés bárhol előfordulhat, főként a nagy igénybevételnek kitett helyeken (pl. comb, lábikra és farizomzat). A haematuria nem gyakori, de szinte minden súlyos betegnél előfordul egyszer-kétszer az élete során. Központi idegrendszeri vérzés általában csak fejsérüléskor következik be. Korábban ez okozta a legtöbb halálesetet a haemophiliás betegek között. Műtéteknél nemcsak a vérveszteség, hanem a vérzés elhúzódása is gondot okoz (66, 86). Mivel a VIII. faktor fehérje nem jut át a placentán, ezért a vérzékenység már újszülött korban jelentkezhet. Gyakoriak az injekciók utáni haematomák, vagy a circumcisiót követő vérzések. Születéskor cephalhaematoma, illetve hosszantartó köldökvérzés is előfordulhat. Számos érintett újszülöttnek azonban nincsenek klinikai tünetei. Amint a gyermekek járni tanulnak, kiterjedt zúzódások jelentkeznek. Az ajak és a nyelv egyébként kicsiny sérülése, amely órákig vagy napokig is vérzik, vezet el leggyakrabban a diagnózishoz. A betegség súlyos formájában szenvedők 90%-ánál 1 éves korra a vérzékenység klinikailag már nyilvánvalóvá válik (87) A haemophilia A diagnózisa A vérzékenység hátterében a véralvadási kaszkád faktorai, a trombocita és az érfal szerzett, illetve örökletes betegségei egyaránt állhatnak. A koagulopátiákra jellemző, 24
25 Bevezetés hogy sérülések után a vérzés nem tartós, de újra kezdődik, mivel a plazmafaktorok defektusa miatt nem alakul ki stabil trombus. A felületes sérülések vérzése vagy a purpurák megjelenése nem jellemző, az inkább a trombocita funkció zavarára utal. A laboratóriumi vizsgálatok közül a protrombin idő (PI) vagy az aktivált parciális tromboplasztin idő (apti) megnyúlása utalhat koagulopátia jelenlétére. Izolált PI megnyúlás jellemzi az V. és a VII. faktorok hiányát. Izolált apti megnyúlás a IX. és a VIII. faktorok defektusai esetén fordul elő. Az I., II., X. alvadási faktorok defektusai esetén mind a PI, mind az apti megnyúlik. Ismert faktorhiányos plazmával történő keveréssel állapítható meg, hogy az izolált apti megnyúlás hátterében az FVIII vagy a FIX defektusa áll-e (88). Szerzett koagulopátiát okozhat a májkárosodás, a K-vitamin hiány, az antikoaguláns kezelés, a fokozott faktorfelhasználás (disszeminált intravaszkuláris koagulopátia, [DIC]) és az autoimmun betegségek (inhibitor képződés révén). Az általános laboratóriumi vizsgálatok közül a vérzékenység hátterében meghúzódó betegséget jelezhetnek a vérkép és a májfunkciós vizsgálatok. A haemophilia B (HB) öröklésmenete és klinikai képe megegyezik a HA-val. HB esetén a FIX génjének mutációi okozzák a betegséget (89). A HB a HA-tól csak laboratóriumi módszerrel különíthető el. A HB-ben szenvedő beteg plazmájának aktivált parciális tromboplasztin ideje ismerten VIII. faktor hiányos plazmával történő keverés után normalizálódik, míg ismerten IX. faktor hiányos plazmával történő keverésnél a korrekció elmarad. HA-ban ennek az ellentéte történik. A von Willebrand betegséget a vw faktor (vwf) fehérjét érintő defektusok okozzák. Mivel a vwf a trombociták aktiválásában és a FVIII stabilizálásában is részt vesz, a fehérje különböző régióit érintő mutációk többféle kóros fenotípus kialakulását okozhatják. Trombocita diszfunkcióra, illetve haemophiliára utaló fenotípus egyaránt kialakulhat. A vwf FVIII kötéséért és vérben történő szállításáért felelős régió mutációi a FVIII fél-életidejének csökkenéséhez, akár 10%-os FVIII aktivitáshoz és fenotípusosan enyhe HA-hoz vezet (a von Willebrand kór 2N típusa). A HA-tól az eltérő öröklésmenete (autoszomális recesszív) különítheti el, azonban sporadikus esetekben az öröklésmenet nem ad felvilágosítást. Csak speciális laborvizsgálattal, a vwf és a FVIII kötődésének a vizsgálata különíti el biztonsággal a két kórképet (90). 25
A genetikai lelet értelmezése monogénes betegségekben
 A genetikai lelet értelmezése monogénes betegségekben Tory Kálmán Semmelweis Egyetem, I. sz. Gyermekklinika A ~20 ezer fehérje-kódoló gén a 23 pár kromoszómán A kromoszómán található bázisok száma: 250M
A genetikai lelet értelmezése monogénes betegségekben Tory Kálmán Semmelweis Egyetem, I. sz. Gyermekklinika A ~20 ezer fehérje-kódoló gén a 23 pár kromoszómán A kromoszómán található bázisok száma: 250M
Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály
 Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály Definíció A prenatális diagnosztika a klinikai genetika azon
Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály Definíció A prenatális diagnosztika a klinikai genetika azon
Doktori (Ph.D.) értekezés tézisei A HAEMOCHROMATOSIS ÉS A HAEMOPHILIA A MOLEKULÁRIS GENETIKAI DIAGNOSZTIKÁJA. dr. Andrikovics Hajnalka
 Doktori (Ph.D.) értekezés tézisei A HAEMOCHROMATOSIS ÉS A HAEMOPHILIA A MOLEKULÁRIS GENETIKAI DIAGNOSZTIKÁJA dr. Andrikovics Hajnalka Semmelweis Egyetem, Doktori Iskola, Pathobiokémia Program Programvezető:
Doktori (Ph.D.) értekezés tézisei A HAEMOCHROMATOSIS ÉS A HAEMOPHILIA A MOLEKULÁRIS GENETIKAI DIAGNOSZTIKÁJA dr. Andrikovics Hajnalka Semmelweis Egyetem, Doktori Iskola, Pathobiokémia Program Programvezető:
Molekuláris genetikai vizsgáló. módszerek az immundefektusok. diagnosztikájában
 Molekuláris genetikai vizsgáló módszerek az immundefektusok diagnosztikájában Primer immundefektusok A primer immundeficiencia ritka, veleszületett, monogénes öröklődésű immunhiányos állapot. Családi halmozódást
Molekuláris genetikai vizsgáló módszerek az immundefektusok diagnosztikájában Primer immundefektusok A primer immundeficiencia ritka, veleszületett, monogénes öröklődésű immunhiányos állapot. Családi halmozódást
Doktori (Ph.D.) értekezés tézisei. dr. Klein Izabella 2000.
 Egyes öröklôdô betegségek és rizikófaktorok molekuláris genetikai diagnosztikája Doktori (Ph.D.) értekezés tézisei dr. Klein Izabella 2000. MTA Enzimológiai Intézet, Budapest Semmelweis Egyetem, Budapest,
Egyes öröklôdô betegségek és rizikófaktorok molekuláris genetikai diagnosztikája Doktori (Ph.D.) értekezés tézisei dr. Klein Izabella 2000. MTA Enzimológiai Intézet, Budapest Semmelweis Egyetem, Budapest,
Monogénes recesszív betegségek molekuláris genetikai és populációs vizsgálatai
 Monogénes recesszív betegségek molekuláris genetikai és populációs vizsgálatai Ph.D. értekezés Bors András Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Doktori Iskola Klasszikus és molekuláris
Monogénes recesszív betegségek molekuláris genetikai és populációs vizsgálatai Ph.D. értekezés Bors András Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Doktori Iskola Klasszikus és molekuláris
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
Többgénes jellegek. 1. Klasszikus (poligénes) mennyiségi jellegek. 2.Szinte minden jelleg több gén irányítása alatt áll
 Többgénes jellegek Többgénes jellegek 1. 1. Klasszikus (poligénes) mennyiségi jellegek Multifaktoriális jellegek: több gén és a környezet által meghatározott jellegek 2.Szinte minden jelleg több gén irányítása
Többgénes jellegek Többgénes jellegek 1. 1. Klasszikus (poligénes) mennyiségi jellegek Multifaktoriális jellegek: több gén és a környezet által meghatározott jellegek 2.Szinte minden jelleg több gén irányítása
Az élettani alapfogalmak ismétlése
 Anaemia - vérszegénység Rácz Olivér Miskolci Egyetem Egészségügyi kar 27.9.2009 hematmisk1.ppt Oliver Rácz 1 Az élettani alapfogalmak ismétlése A vér összetétele, vérplazma Hematopoézis A vvs-ek tulajdonsága
Anaemia - vérszegénység Rácz Olivér Miskolci Egyetem Egészségügyi kar 27.9.2009 hematmisk1.ppt Oliver Rácz 1 Az élettani alapfogalmak ismétlése A vér összetétele, vérplazma Hematopoézis A vvs-ek tulajdonsága
Monogénes recesszív betegségek molekuláris genetikai és populációs vizsgálatai
 Monogénes recesszív betegségek molekuláris genetikai és populációs vizsgálatai Ph.D. értekezés tézisei Bors András Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Doktori Iskola Klasszikus
Monogénes recesszív betegségek molekuláris genetikai és populációs vizsgálatai Ph.D. értekezés tézisei Bors András Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Doktori Iskola Klasszikus
Humán genom variációk single nucleotide polymorphism (SNP)
 Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
MUTÁCIÓK. A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik.
 MUTÁCIÓK A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik. Pontmutáció: A kromoszóma egy génjében pár nukleotidnál következik be változás.
MUTÁCIÓK A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik. Pontmutáció: A kromoszóma egy génjében pár nukleotidnál következik be változás.
Hátterükben egyetlen gén áll, melynek általában számottevő a viselkedésre gyakorolt hatása, öröklési mintázata jellegzetes.
 Múlt órán: Lehetséges tesztfeladatok: Kitől származik a variáció-szelekció paradigma, mely szerint az egyéni, javarészt öröklött különbségek között a társadalmi harc válogat? Fromm-Reichmann Mill Gallton
Múlt órán: Lehetséges tesztfeladatok: Kitől származik a variáció-szelekció paradigma, mely szerint az egyéni, javarészt öröklött különbségek között a társadalmi harc válogat? Fromm-Reichmann Mill Gallton
PrenaTest Újgenerációs szekvenálást és z-score
 PrenaTest Újgenerációs szekvenálást és z-score számítást alkalmazó, nem-invazív prenatális molekuláris genetikai teszt a magzati 21-es triszómia észlelésére, anyai vérből végzett DNS izolálást követően
PrenaTest Újgenerációs szekvenálást és z-score számítást alkalmazó, nem-invazív prenatális molekuláris genetikai teszt a magzati 21-es triszómia észlelésére, anyai vérből végzett DNS izolálást követően
Katasztrófális antifoszfolipid szindróma
 Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Állatorvosi kórélettan Hallgatói előadások, 5. szemeszter
 Állatorvosi kórélettan Hallgatói előadások, 5. szemeszter A védekező rendszerek kórélettana A haemostasis zavarai 2. - Coagulopathiák Kórélettani és Onkológiai Tanszék Állatorvos-tudományi Egyetem 1 Az
Állatorvosi kórélettan Hallgatói előadások, 5. szemeszter A védekező rendszerek kórélettana A haemostasis zavarai 2. - Coagulopathiák Kórélettani és Onkológiai Tanszék Állatorvos-tudományi Egyetem 1 Az
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése
 Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
Tudománytörténeti visszatekintés
 GENETIKA I. AZ ÖRÖKLŐDÉS TÖRVÉNYSZERŰSÉGEI Minek köszönhető a biológiai sokféleség? Hogyan történik a tulajdonságok átörökítése? Tudománytörténeti visszatekintés 1. Keveredés alapú öröklődés: (1761-1766,
GENETIKA I. AZ ÖRÖKLŐDÉS TÖRVÉNYSZERŰSÉGEI Minek köszönhető a biológiai sokféleség? Hogyan történik a tulajdonságok átörökítése? Tudománytörténeti visszatekintés 1. Keveredés alapú öröklődés: (1761-1766,
MAGYOT évi Tudományos Szimpóziuma Május 5-6, Budapest
 MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
Molekuláris diagnosztika örökletes betegségekben. gekben. Tordai Attila OVSZ Molekuláris Diagnosztikai Labor
 Molekuláris diagnosztika örökletes betegségekben gekben Tordai Attila OVSZ Molekuláris Diagnosztikai Labor Bp., 2011. április 21. Labordiagnosztikai szinten tartó tanf. Molekuláris Diagnosztika Az orvosi
Molekuláris diagnosztika örökletes betegségekben gekben Tordai Attila OVSZ Molekuláris Diagnosztikai Labor Bp., 2011. április 21. Labordiagnosztikai szinten tartó tanf. Molekuláris Diagnosztika Az orvosi
A PKU azért nem hal ki, mert gyógyítják, és ezzel növelik a mutáns allél gyakoriságát a Huntington kór pedig azért marad fenn, mert csak későn derül
 1 Múlt órán: Genetikai alapelvek, monogénes öröklődés Elgondolkodtató feladat Vajon miért nem halnak ki az olyan mendeli öröklődésű rendellenességek, mint a Phenylketonuria, vagy a Huntington kór? A PKU
1 Múlt órán: Genetikai alapelvek, monogénes öröklődés Elgondolkodtató feladat Vajon miért nem halnak ki az olyan mendeli öröklődésű rendellenességek, mint a Phenylketonuria, vagy a Huntington kór? A PKU
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS. origamigroup. www.origami.co.hu
 BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
A Hardy-Weinberg egyensúly. 2. gyakorlat
 A Hardy-Weinberg egyensúly 2. gyakorlat A Hardy-Weinberg egyensúly feltételei: nincs szelekció nincs migráció nagy populációméret (nincs sodródás) nincs mutáció pánmixis van allélgyakoriság azonos hímekben
A Hardy-Weinberg egyensúly 2. gyakorlat A Hardy-Weinberg egyensúly feltételei: nincs szelekció nincs migráció nagy populációméret (nincs sodródás) nincs mutáció pánmixis van allélgyakoriság azonos hímekben
Genomikai Medicina és Ritka Betegségek Intézete Semmelweis Egyetem
 Tisztelt Hölgyem, Tisztelt Uram! Örömmel jelentjük be Önöknek, hogy a Genomikai Medicina és Ritka Betegségek Intézetének egyik új projektje azon betegségek genetikai hátterének feltérképezésére irányul,
Tisztelt Hölgyem, Tisztelt Uram! Örömmel jelentjük be Önöknek, hogy a Genomikai Medicina és Ritka Betegségek Intézetének egyik új projektje azon betegségek genetikai hátterének feltérképezésére irányul,
Példák a független öröklődésre
 GENETIKAI PROBLÉMÁK Példák a független öröklődésre Az amelogenesis imperfecta egy, a fogzománc gyengeségével és elszíneződésével járó öröklődő betegség, a 4-es kromoszómán lévő enam gén recesszív mutációja
GENETIKAI PROBLÉMÁK Példák a független öröklődésre Az amelogenesis imperfecta egy, a fogzománc gyengeségével és elszíneződésével járó öröklődő betegség, a 4-es kromoszómán lévő enam gén recesszív mutációja
mi a cukorbetegség? DR. TSCHÜRTZ NÁNDOR, DR. HIDVÉGI TIBOR
 mi a cukorbetegség? DR. TSCHÜRTZ NÁNDOR, DR. HIDVÉGI TIBOR az OkTaTÓaNyag a magyar DiabeTes Társaság vezetôsége megbízásából, a sanofi TámOgaTásával készült készítette a magyar DiabeTes Társaság edukációs
mi a cukorbetegség? DR. TSCHÜRTZ NÁNDOR, DR. HIDVÉGI TIBOR az OkTaTÓaNyag a magyar DiabeTes Társaság vezetôsége megbízásából, a sanofi TámOgaTásával készült készítette a magyar DiabeTes Társaság edukációs
Immunológia alapjai. 10. előadás. Komplement rendszer
 Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Domináns-recesszív öröklődésmenet
 Domináns-recesszív öröklődésmenet Domináns recesszív öröklődés esetén tehát a homozigóta domináns és a heterozigóta egyedek fenotípusa megegyezik, így a három lehetséges genotípushoz (példánkban AA, Aa,
Domináns-recesszív öröklődésmenet Domináns recesszív öröklődés esetén tehát a homozigóta domináns és a heterozigóta egyedek fenotípusa megegyezik, így a három lehetséges genotípushoz (példánkban AA, Aa,
Mit tud a genetika. Génterápiás lehetőségek MPS-ben. Dr. Varga Norbert
 Mit tud a genetika Génterápiás lehetőségek MPS-ben Dr. Varga Norbert Oki terápia Terápiás lehetőségek MPS-ben A kiváltó okot gyógyítja meg ERT Enzimpótló kezelés Őssejt transzplantáció Genetikai beavatkozások
Mit tud a genetika Génterápiás lehetőségek MPS-ben Dr. Varga Norbert Oki terápia Terápiás lehetőségek MPS-ben A kiváltó okot gyógyítja meg ERT Enzimpótló kezelés Őssejt transzplantáció Genetikai beavatkozások
Kappelmayer János. Malignus hematológiai megbetegedések molekuláris háttere. MOLSZE IX. Nagygyűlése. Bük, 2005 szeptember
 Kappelmayer János Malignus hematológiai megbetegedések molekuláris háttere MOLSZE IX. Nagygyűlése Bük, 2005 szeptember 29-30. Laboratóriumi vizsgálatok hematológiai malignómákban Általános laboratóriumi
Kappelmayer János Malignus hematológiai megbetegedések molekuláris háttere MOLSZE IX. Nagygyűlése Bük, 2005 szeptember 29-30. Laboratóriumi vizsgálatok hematológiai malignómákban Általános laboratóriumi
HAPMAP -2010 Nemzetközi HapMap Projekt. SNP GWA Haplotípus: egy kromoszóma szegmensen lévő SNP mintázat
 HAPMAP -2010 Nemzetközi HapMap Projekt A Nemzetközi HapMap Project célja az emberi genom haplotípus* térképének(hapmap; haplotype map) megszerkesztése, melynek segítségével katalogizálni tudjuk az ember
HAPMAP -2010 Nemzetközi HapMap Projekt A Nemzetközi HapMap Project célja az emberi genom haplotípus* térképének(hapmap; haplotype map) megszerkesztése, melynek segítségével katalogizálni tudjuk az ember
A véralvadás zavarai I
 A véralvadás zavarai I Rácz Olivér Miskolci Egyetem Egészségügyi kar 27.9.2009 koagmisks1.ppt Oliver Rácz 1 A haemostasis (véralvadás) rendszere Biztosítja a vérrög (véralvadék, trombus) helyi keletkezését
A véralvadás zavarai I Rácz Olivér Miskolci Egyetem Egészségügyi kar 27.9.2009 koagmisks1.ppt Oliver Rácz 1 A haemostasis (véralvadás) rendszere Biztosítja a vérrög (véralvadék, trombus) helyi keletkezését
Az alvadási rendszer fehérjéi. Kappelmayer János DE OEC, KBMPI
 Az alvadási rendszer fehérjéi Kappelmayer János DE OEC, KBMPI Fehérje diagnosztika, Pécs, 2006 1. Az alvadási rendszer fehérjéinek áttekintése 2. Alvadási fehérje abnormalitások 3. Az alvadási rendszer
Az alvadási rendszer fehérjéi Kappelmayer János DE OEC, KBMPI Fehérje diagnosztika, Pécs, 2006 1. Az alvadási rendszer fehérjéinek áttekintése 2. Alvadási fehérje abnormalitások 3. Az alvadási rendszer
PRIMER IMMUNDEFICIENCIA - KOMPLEMENT DEFEKTUS. LABORVIZSGÁLATOK BEMUTATÁSA EGY BETEGÜNK KAPCSÁN
 2014. 1. szám TESZTKÉRDÉSEI: PRIMER IMMUNDEFICIENCIA - KOMPLEMENT DEFEKTUS. LABORVIZSGÁLATOK BEMUTATÁSA EGY BETEGÜNK KAPCSÁN SZILÁGYI ÁGNES 1, VARGA LILIAN 1, PROHÁSZKA ZOLTÁN 1, DÉRFALVI BEÁTA 2 Milyen
2014. 1. szám TESZTKÉRDÉSEI: PRIMER IMMUNDEFICIENCIA - KOMPLEMENT DEFEKTUS. LABORVIZSGÁLATOK BEMUTATÁSA EGY BETEGÜNK KAPCSÁN SZILÁGYI ÁGNES 1, VARGA LILIAN 1, PROHÁSZKA ZOLTÁN 1, DÉRFALVI BEÁTA 2 Milyen
Kryoglobulinaemia kezelése. Domján Gyula. Semmelweis Egyetem I. Belklinika. III. Terápiás Aferezis Konferencia, 2014. Debrecen
 Kryoglobulinaemia kezelése Domján Gyula Semmelweis Egyetem I. Belklinika Mi a kryoglobulin? Hidegben kicsapódó immunglobulin Melegben visszaoldódik (37 C-on) Klasszifikáció 3 csoport az Ig komponens
Kryoglobulinaemia kezelése Domján Gyula Semmelweis Egyetem I. Belklinika Mi a kryoglobulin? Hidegben kicsapódó immunglobulin Melegben visszaoldódik (37 C-on) Klasszifikáció 3 csoport az Ig komponens
Populációgenetikai. alapok
 Populációgenetikai alapok Populáció = egyedek egy adott csoportja Az egyedek eltérnek egymástól morfológiailag, de viselkedésüket tekintve is = genetikai különbségek Fenotípus = külső jellegek morfológia,
Populációgenetikai alapok Populáció = egyedek egy adott csoportja Az egyedek eltérnek egymástól morfológiailag, de viselkedésüket tekintve is = genetikai különbségek Fenotípus = külső jellegek morfológia,
Veleszületett rendellenességek etiológiai csoportjai
 MULTIFAKTORIÁLIS ÖRÖKLŐDÉS PRIMER IZOLÁLT RENDELLENESSÉGEK: MALFORMÁCIÓK ÉS GYAKORI FELNŐTTKORI KOMPLEX BETEGSÉGEK Veleszületett rendellenességek etiológiai csoportjai Kromoszóma rendellenességek és kisméretű
MULTIFAKTORIÁLIS ÖRÖKLŐDÉS PRIMER IZOLÁLT RENDELLENESSÉGEK: MALFORMÁCIÓK ÉS GYAKORI FELNŐTTKORI KOMPLEX BETEGSÉGEK Veleszületett rendellenességek etiológiai csoportjai Kromoszóma rendellenességek és kisméretű
Ferrotone 100% természetes forrásvízből nyert vastartalmú étrendkiegészítő
 Ferrotone 100% természetes forrásvízből nyert vastartalmú étrendkiegészítő Miért fontos a szervezetnek a vas? A vas számos enzim összetevője, így fontos kémiai reakciókban vesz részt. A hemoglobin és a
Ferrotone 100% természetes forrásvízből nyert vastartalmú étrendkiegészítő Miért fontos a szervezetnek a vas? A vas számos enzim összetevője, így fontos kémiai reakciókban vesz részt. A hemoglobin és a
Jurásné Lukovics Mónika, Dr. Bohaty Ilona, Dr. Kozma László PhD OVSz Debreceni RVK
 Jurásné Lukovics Mónika, Dr. Bohaty Ilona, Dr. Kozma László PhD OVSz Debreceni RVK Az újszülöttben kialakuló trombocitopénia (
Jurásné Lukovics Mónika, Dr. Bohaty Ilona, Dr. Kozma László PhD OVSz Debreceni RVK Az újszülöttben kialakuló trombocitopénia (
A T sejt receptor (TCR) heterodimer
 Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
HEMATOLÓGIAI ÉS IMMUNOLÓGIAI BETEGSÉGEK ÖRÖKLETES TÉNYEZŐINEK VIZSGÁLATA. dr. Tordai Attila
 Akadémiai doktori értekezés HEMATOLÓGIAI ÉS IMMUNOLÓGIAI BETEGSÉGEK ÖRÖKLETES TÉNYEZŐINEK VIZSGÁLATA dr. Tordai Attila Országos Gyógyintézeti Központ, Hematológiai és Immunológiai Intézet Budapest, 2005.
Akadémiai doktori értekezés HEMATOLÓGIAI ÉS IMMUNOLÓGIAI BETEGSÉGEK ÖRÖKLETES TÉNYEZŐINEK VIZSGÁLATA dr. Tordai Attila Országos Gyógyintézeti Központ, Hematológiai és Immunológiai Intézet Budapest, 2005.
Minden leendő szülő számára a legfontosabb, hogy születendő gyermeke egészséges legyen. A súlyosan beteg gyermek komoly terheket ró a családra.
 Egészséges magzat, biztonságos jövő Minden leendő szülő számára a legfontosabb, hogy születendő gyermeke egészséges legyen. A súlyosan beteg gyermek komoly terheket ró a családra. A veleszületett fejlődési
Egészséges magzat, biztonságos jövő Minden leendő szülő számára a legfontosabb, hogy születendő gyermeke egészséges legyen. A súlyosan beteg gyermek komoly terheket ró a családra. A veleszületett fejlődési
Microcytaer anaemiák
 Microcytaer anaemiák Herszényi László MTA doktora Semmelweis Egyetem II. sz. Belgyógyászati Klinika 2015. február 19. I. Fokozott vvt-pusztulás a. Haemolysis II. Csökkent vvt-képzés a. Hgb-szintézis zavara
Microcytaer anaemiák Herszényi László MTA doktora Semmelweis Egyetem II. sz. Belgyógyászati Klinika 2015. február 19. I. Fokozott vvt-pusztulás a. Haemolysis II. Csökkent vvt-képzés a. Hgb-szintézis zavara
(1) A T sejtek aktiválása (2) Az ön reaktív T sejtek toleranciája. α lánc. β lánc. V α. V β. C β. C α.
 Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Dr. Nemes Nagy Zsuzsa Szakképzés Karl Landsteiner Karl Landsteiner:
 Az AB0 vércsoport rendszer Dr. Nemes Nagy Zsuzsa Szakképzés 2011 Az AB0 rendszer felfedezése 1901. Karl Landsteiner Landsteiner szabály 1901 Karl Landsteiner: Munkatársai vérmintáit vizsgálva fedezte fel
Az AB0 vércsoport rendszer Dr. Nemes Nagy Zsuzsa Szakképzés 2011 Az AB0 rendszer felfedezése 1901. Karl Landsteiner Landsteiner szabály 1901 Karl Landsteiner: Munkatársai vérmintáit vizsgálva fedezte fel
Johann Gregor Mendel Az olmüci (Olomouc) és bécsi egyetem diákja Brünni ágostonrendi apát (nem szovjet tudós) Tudatos és nagyon alapos kutat
 10.2.2010 genmisk1 1 Áttekintés Mendel és a mendeli törvények Mendel előtt és körül A genetika törvényeinek újbóli felfedezése és a kromoszómák Watson és Crick a molekuláris biológoa központi dogmája 10.2.2010
10.2.2010 genmisk1 1 Áttekintés Mendel és a mendeli törvények Mendel előtt és körül A genetika törvényeinek újbóli felfedezése és a kromoszómák Watson és Crick a molekuláris biológoa központi dogmája 10.2.2010
BIOLÓGIA HÁZIVERSENY 1. FORDULÓ BIOKÉMIA, GENETIKA BIOKÉMIA, GENETIKA
 BIOKÉMIA, GENETIKA 1. Nukleinsavak keresztrejtvény (12+1 p) 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 1. A nukleinsavak a.-ok összekapcsolódásával kialakuló polimerek. 2. Purinvázas szerves bázis, amely az
BIOKÉMIA, GENETIKA 1. Nukleinsavak keresztrejtvény (12+1 p) 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 1. A nukleinsavak a.-ok összekapcsolódásával kialakuló polimerek. 2. Purinvázas szerves bázis, amely az
KARNYÚJTÁSNYIRA, MAGYARORSZÁGI
 KARNYÚJTÁSNYIRA, MAGYARORSZÁGI LABORATÓRIUMMAL KOCKÁZATMENTES GENETIKAI VIZSGÁLAT A MAGZATI KROMOSZÓMA-RENDELLENESSÉGEK KIMUTATÁSÁRA ÚJ KORSZAK A MAGZATI DIAGNOSZTIKÁBAN Ma már a várandós anya vérében
KARNYÚJTÁSNYIRA, MAGYARORSZÁGI LABORATÓRIUMMAL KOCKÁZATMENTES GENETIKAI VIZSGÁLAT A MAGZATI KROMOSZÓMA-RENDELLENESSÉGEK KIMUTATÁSÁRA ÚJ KORSZAK A MAGZATI DIAGNOSZTIKÁBAN Ma már a várandós anya vérében
A szamóca érése során izolált Spiral és Spermidin-szintáz gén jellemzése. Kiss Erzsébet Kovács László
 A szamóca érése során izolált Spiral és Spermidin-szintáz gén jellemzése Kiss Erzsébet Kovács László Bevezetés Nagy gazdasági gi jelentıségük k miatt a gyümölcs lcsök, termések fejlıdésének mechanizmusát
A szamóca érése során izolált Spiral és Spermidin-szintáz gén jellemzése Kiss Erzsébet Kovács László Bevezetés Nagy gazdasági gi jelentıségük k miatt a gyümölcs lcsök, termések fejlıdésének mechanizmusát
Az X kromoszóma inaktívációja. A kromatin szerkezet befolyásolja a génexpressziót
 Az X kromoszóma inaktívációja A kromatin szerkezet befolyásolja a génexpressziót Férfiak: XY Nők: XX X kromoszóma: nagy méretű több mint 1000 gén Y kromoszóma: kis méretű, kevesebb, mint 100 gén Kompenzációs
Az X kromoszóma inaktívációja A kromatin szerkezet befolyásolja a génexpressziót Férfiak: XY Nők: XX X kromoszóma: nagy méretű több mint 1000 gén Y kromoszóma: kis méretű, kevesebb, mint 100 gén Kompenzációs
Citopeniák. Vérszegénységek Neutropéniák Trombocitopeniák
 Citopeniák Vérszegénységek Neutropéniák Trombocitopeniák Anémia okai Fokozott pusztulás-vvt élettartam csökkenés (
Citopeniák Vérszegénységek Neutropéniák Trombocitopeniák Anémia okai Fokozott pusztulás-vvt élettartam csökkenés (
A kromoszómák kialakulása előtt a DNS állomány megkettőződik. A két azonos információ tartalmú DNS egymás mellé rendeződik és egy kromoszómát alkot.
 Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
Dózis-válasz görbe A dózis válasz kapcsolat ábrázolása a legáltalánosabb módja annak, hogy bemutassunk eredményeket a tudományban vagy a klinikai
 Dózis-válasz görbe A dózis válasz kapcsolat ábrázolása a legáltalánosabb módja annak, hogy bemutassunk eredményeket a tudományban vagy a klinikai gyakorlatban. Például egy kísérletben növekvő mennyiségű
Dózis-válasz görbe A dózis válasz kapcsolat ábrázolása a legáltalánosabb módja annak, hogy bemutassunk eredményeket a tudományban vagy a klinikai gyakorlatban. Például egy kísérletben növekvő mennyiségű
A neurofibromatózis idegrendszeri megnyilvánulása
 A neurofibromatózis idegrendszeri megnyilvánulása Molekuláris Medicina Mindenkinek Fókuszban a Neurofibromatózis Varga Edina Tímea SE Genomikai Medicina és Ritka Betegségek Intézete Neurofibromatózis I.
A neurofibromatózis idegrendszeri megnyilvánulása Molekuláris Medicina Mindenkinek Fókuszban a Neurofibromatózis Varga Edina Tímea SE Genomikai Medicina és Ritka Betegségek Intézete Neurofibromatózis I.
Immunológia I. 4. előadás. Kacskovics Imre
 Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
1. ESET DIAGNÓZIS: LYMPHADENITIS MESENTERIALIS. 16 éves nő: görcsös hasi fájdalom, hányinger, hányás, vizes hasmenés, collaptiform rosszullét
 1. ESET 16 éves nő: görcsös hasi fájdalom, hányinger, hányás, vizes hasmenés, collaptiform rosszullét Sebészeti osztály hasi UH: bélfal ödéma, ascites konzervatív kezelés DIAGNÓZIS: LYMPHADENITIS MESENTERIALIS
1. ESET 16 éves nő: görcsös hasi fájdalom, hányinger, hányás, vizes hasmenés, collaptiform rosszullét Sebészeti osztály hasi UH: bélfal ödéma, ascites konzervatív kezelés DIAGNÓZIS: LYMPHADENITIS MESENTERIALIS
Immunológia alapjai. 16. előadás. Komplement rendszer
 Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
A génterápia genetikai anyag bejuttatatása diszfunkcionálisan működő sejtekbe abból a célból, hogy a hibát kijavítsuk.
 A génterápia genetikai anyag bejuttatatása diszfunkcionálisan működő sejtekbe abból a célból, hogy a hibát kijavítsuk. A genetikai betegségek mellett, génterápia alkalmazható szerzett betegségek, mint
A génterápia genetikai anyag bejuttatatása diszfunkcionálisan működő sejtekbe abból a célból, hogy a hibát kijavítsuk. A genetikai betegségek mellett, génterápia alkalmazható szerzett betegségek, mint
NALP-12-Höz Társult Visszatérő Láz
 www.printo.it/pediatric-rheumatology/hu/intro NALP-12-Höz Társult Visszatérő Láz Verzió 2016 1. MI A NALP-12-HÖZ TÁRSULT VISSZATÉRŐ LÁZ 1.1 Mi ez? A NALP-12-höz társult visszatérő láz egy genetikai betegség.
www.printo.it/pediatric-rheumatology/hu/intro NALP-12-Höz Társult Visszatérő Láz Verzió 2016 1. MI A NALP-12-HÖZ TÁRSULT VISSZATÉRŐ LÁZ 1.1 Mi ez? A NALP-12-höz társult visszatérő láz egy genetikai betegség.
KOAGULÁCIÓS FAKTOROK BIOTECHNOLÓGIAI ELŐÁLLÍTÁSA
 Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 KOAGULÁCIÓS FAKTOROK
Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 KOAGULÁCIÓS FAKTOROK
Esetbemutatás. Dr. Iván Mária Uzsoki Kórház 2013.11.07.
 Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
Reumás láz és sztreptokokkusz-fertőzés utáni reaktív artritisz
 www.printo.it/pediatric-rheumatology/hu/intro Reumás láz és sztreptokokkusz-fertőzés utáni reaktív artritisz Verzió 2016 1. MI A REUMÁS LÁZ 1.1 Mi ez? A reumás láz nevű betegséget a sztreptokokkusz baktérium
www.printo.it/pediatric-rheumatology/hu/intro Reumás láz és sztreptokokkusz-fertőzés utáni reaktív artritisz Verzió 2016 1. MI A REUMÁS LÁZ 1.1 Mi ez? A reumás láz nevű betegséget a sztreptokokkusz baktérium
Anaemia súlyossága. Súlyosság. Fokozat
 Anaemia súlyossága Fokozat Súlyosság WHO érték (g/l) 0 norm. tartomány >/=110 1 enyhe 95-109 2 mérs. súlyos 80-94 3 súlyos 65-79 4 életveszélyes < 65 Anaemia (+ egyéb hematológiai eltérés) igen nem csv.
Anaemia súlyossága Fokozat Súlyosság WHO érték (g/l) 0 norm. tartomány >/=110 1 enyhe 95-109 2 mérs. súlyos 80-94 3 súlyos 65-79 4 életveszélyes < 65 Anaemia (+ egyéb hematológiai eltérés) igen nem csv.
Kutatási beszámoló ( )
 Kutatási beszámoló (2008-2012) A thrombocyták aktivációja alapvető jelentőségű a thrombotikus betegségek kialakulása szempontjából. A pályázat során ezen aktivációs folyamatok mechanizmusait vizsgáltuk.
Kutatási beszámoló (2008-2012) A thrombocyták aktivációja alapvető jelentőségű a thrombotikus betegségek kialakulása szempontjából. A pályázat során ezen aktivációs folyamatok mechanizmusait vizsgáltuk.
Mi lenne ha az MPS is része lenne az újszülöttkori tömegszűrésnek?
 Mi lenne ha az MPS is része lenne az újszülöttkori tömegszűrésnek? Dr. Jávorszky Eszter, Kánnai Piroska Dr. Szőnyi László Semmelweis Egyetem, I. Gyermekklinika, Budapest Anyagcsere szűrőközpont 2 Ritka
Mi lenne ha az MPS is része lenne az újszülöttkori tömegszűrésnek? Dr. Jávorszky Eszter, Kánnai Piroska Dr. Szőnyi László Semmelweis Egyetem, I. Gyermekklinika, Budapest Anyagcsere szűrőközpont 2 Ritka
11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban
 11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban HIV fertőzés kimutatása (fiktív) esettanulmány 35 éves nő, HIV fertőzöttség gyanúja. Két partner az elmúlt időszakban. Fertőzött-e
11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban HIV fertőzés kimutatása (fiktív) esettanulmány 35 éves nő, HIV fertőzöttség gyanúja. Két partner az elmúlt időszakban. Fertőzött-e
transzláció DNS RNS Fehérje A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti fehérjék, transzportfehérjék
 Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
III./3.2.3.3. Egyes dystonia szindrómák. III./3.2.3.3.1. Blepharospasmus
 III./3.2.3.3. Egyes dystonia szindrómák III./3.2.3.3.1. Blepharospasmus A blepharospasmus jellemzője a szemrést záró izomzat (m. orbicularis oculi) tartós vagy intermittáló, kétoldali akaratlan kontrakciója.
III./3.2.3.3. Egyes dystonia szindrómák III./3.2.3.3.1. Blepharospasmus A blepharospasmus jellemzője a szemrést záró izomzat (m. orbicularis oculi) tartós vagy intermittáló, kétoldali akaratlan kontrakciója.
Vezetői összefoglaló a Veleszületett Rendellenességek Országos Nyilvántartása (VRONY) évi adataiból készült jelentésről
 Vezetői összefoglaló a Veleszületett Rendellenességek Országos Nyilvántartása (VRONY) 2010. évi adataiból készült jelentésről Veleszületett Rendellenességek Országos Felügyeleti Osztálya Magyarországon
Vezetői összefoglaló a Veleszületett Rendellenességek Országos Nyilvántartása (VRONY) 2010. évi adataiból készült jelentésről Veleszületett Rendellenességek Országos Felügyeleti Osztálya Magyarországon
Dr. Máthéné Dr. Szigeti Zsuzsanna és munkatársai
 Kar: TTK Tantárgy: CITOGENETIKA Kód: AOMBCGE3 ECTS Kredit: 3 A tantárgyat oktató intézet: TTK Mikrobiális Biotechnológiai és Sejtbiológiai Tanszék A tantárgy felvételére ajánlott félév: 3. Melyik félévben
Kar: TTK Tantárgy: CITOGENETIKA Kód: AOMBCGE3 ECTS Kredit: 3 A tantárgyat oktató intézet: TTK Mikrobiális Biotechnológiai és Sejtbiológiai Tanszék A tantárgy felvételére ajánlott félév: 3. Melyik félévben
2354-06 Nőgyógyászati citodiagnosztika követelménymodul szóbeli vizsgafeladatai
 1. feladat A laboratóriumba vendég érkezik. Tájékoztassa a rákmegelőzés lehetőségeiről! Ismertesse a citológiai előszűrő vizsgálatok lényegét! - a primer és szekunder prevenció fogalma, eszközei - a citológia
1. feladat A laboratóriumba vendég érkezik. Tájékoztassa a rákmegelőzés lehetőségeiről! Ismertesse a citológiai előszűrő vizsgálatok lényegét! - a primer és szekunder prevenció fogalma, eszközei - a citológia
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Mixtard 30 40 nemzetközi egység/ml szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 injekciós üveg 10 ml-t tartalmaz, ami 400 NE-gel egyenértékű.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Mixtard 30 40 nemzetközi egység/ml szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 injekciós üveg 10 ml-t tartalmaz, ami 400 NE-gel egyenértékű.
NOAC-kezelés pitvarfibrillációban. Thrombolysis, thrombectomia és kombinációja. Az ischaemiás kórképek szekunder prevenciója. A TIA új, szöveti alapú
 NOAC-kezelés pitvarfibrillációban. Thrombolysis, thrombectomia és kombinációja. Az ischaemiás kórképek szekunder prevenciója. A TIA új, szöveti alapú meghatározása. (Megj.: a felsorolt esetekben meghatározó
NOAC-kezelés pitvarfibrillációban. Thrombolysis, thrombectomia és kombinációja. Az ischaemiás kórképek szekunder prevenciója. A TIA új, szöveti alapú meghatározása. (Megj.: a felsorolt esetekben meghatározó
A diabetes mellitus laboratóriumi diagnosztikája
 A diabetes mellitus laboratóriumi diagnosztikája Laborvizsgálatok célja diabetes mellitusban 1. Diagnózis 2. Monitorozás 3. Metabolikus komplikációk kimutatása és követése Laboratóriumi tesztek a diabetes
A diabetes mellitus laboratóriumi diagnosztikája Laborvizsgálatok célja diabetes mellitusban 1. Diagnózis 2. Monitorozás 3. Metabolikus komplikációk kimutatása és követése Laboratóriumi tesztek a diabetes
Recesszív öröklődés. Tájékoztató a betegek és családtagjaik számára. Fordította: Dr. Komlósi Katalin Orvosi Genetikai Intézet, Pécsi Tudományegyetem
 12 Recesszív öröklődés Fordította: Dr. Komlósi Katalin Orvosi Genetikai Intézet, Pécsi Tudományegyetem 2009. május 15. A londoni Guy s and St Thomas kórház, a Királyi Nőgyógyászati és Szülészeti Társaság
12 Recesszív öröklődés Fordította: Dr. Komlósi Katalin Orvosi Genetikai Intézet, Pécsi Tudományegyetem 2009. május 15. A londoni Guy s and St Thomas kórház, a Királyi Nőgyógyászati és Szülészeti Társaság
ÖREGEDÉS ÉLETTARTAM, EGÉSZSÉGES ÖREGEDÉS
 ÖREGEDÉS ÉLETTARTAM, EGÉSZSÉGES ÖREGEDÉS Mi az öregedés? Egyrészről az idő múlásával definiálható, a születéstől eltelt idővel mérhető, kronológiai sajátosságú, Másrészről az idő múlásához köthető biológiai,
ÖREGEDÉS ÉLETTARTAM, EGÉSZSÉGES ÖREGEDÉS Mi az öregedés? Egyrészről az idő múlásával definiálható, a születéstől eltelt idővel mérhető, kronológiai sajátosságú, Másrészről az idő múlásához köthető biológiai,
VIII./1. fejezet: A láb fejlődési rendellenességei
 VIII./1. fejezet: A láb fejlődési rendellenességei A fejezetben a lábat alkotó csontok számbeli többletét és hiányát, valamint méretbeli túl-, illetve alulnövekedését részletezzük. Az e fejezetben található
VIII./1. fejezet: A láb fejlődési rendellenességei A fejezetben a lábat alkotó csontok számbeli többletét és hiányát, valamint méretbeli túl-, illetve alulnövekedését részletezzük. Az e fejezetben található
Nemekre szabott terápia: NOCDURNA
 Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
Immunológia 4. A BCR diverzitás kialakulása
 Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
ÚJSÁGÍRÓ ISMERETTERJESZTŐ/PROMÓCIÓS HONLAP A MÉHNYAKRÁK MEGELŐZÉSÉÉRT
 ISMERETTERJESZTŐ/PROMÓCIÓS HONLAP A MÉHNYAKRÁK MEGELŐZÉSÉÉRT Dömötörfy Zsolt PÁLYÁZÓ Dömötörfy Zsolt Istenhegyi Géndiagnosztikai Centrum www.hpv-mehnyakrak.hu A méhnyakrák áldozatai Magyarországon napjainkban
ISMERETTERJESZTŐ/PROMÓCIÓS HONLAP A MÉHNYAKRÁK MEGELŐZÉSÉÉRT Dömötörfy Zsolt PÁLYÁZÓ Dömötörfy Zsolt Istenhegyi Géndiagnosztikai Centrum www.hpv-mehnyakrak.hu A méhnyakrák áldozatai Magyarországon napjainkban
Az elhízás hatása az emberi szervezetre. Dr. Polyák József Pharmamedcor Kardiológiai Szakambulancia 1137. Budapest, Katona J. u. 27.
 Az elhízás hatása az emberi szervezetre Dr. Polyák József Pharmamedcor Kardiológiai Szakambulancia 1137. Budapest, Katona J. u. 27. Melyek az élő szervezet elemi életjelenségei közül minőségében testtömeg
Az elhízás hatása az emberi szervezetre Dr. Polyák József Pharmamedcor Kardiológiai Szakambulancia 1137. Budapest, Katona J. u. 27. Melyek az élő szervezet elemi életjelenségei közül minőségében testtömeg
GLUTÉN-SZŰRÉS Vízöntő Gyógyszertár 2015.10.19.
 LISZTÉRZÉKENYSÉG (COELIAKIA) SZŰRÉS (GLUTÉN-SZŰRÉS) VÍZÖNTŐ GYÓGYSZERTÁR MI A LISZTÉRZÉKENYSÉG? A lisztérzékenység a kalászos gabonák fogyasztásával provokált autoimmun betegség, mely a bélrendszer és
LISZTÉRZÉKENYSÉG (COELIAKIA) SZŰRÉS (GLUTÉN-SZŰRÉS) VÍZÖNTŐ GYÓGYSZERTÁR MI A LISZTÉRZÉKENYSÉG? A lisztérzékenység a kalászos gabonák fogyasztásával provokált autoimmun betegség, mely a bélrendszer és
Sarkadi Margit1, Mezősi Emese2, Bajnok László2, Schmidt Erzsébet1, Szabó Zsuzsanna1, Szekeres Sarolta1, Dérczy Katalin3, Molnár Krisztián3,
 Sarkadi Margit1, Mezősi Emese2, Bajnok László2, Schmidt Erzsébet1, Szabó Zsuzsanna1, Szekeres Sarolta1, Dérczy Katalin3, Molnár Krisztián3, Rostás Tamás3, Ritter Zsombor4, Zámbó Katalin1 Pécsi Tudományegyetem
Sarkadi Margit1, Mezősi Emese2, Bajnok László2, Schmidt Erzsébet1, Szabó Zsuzsanna1, Szekeres Sarolta1, Dérczy Katalin3, Molnár Krisztián3, Rostás Tamás3, Ritter Zsombor4, Zámbó Katalin1 Pécsi Tudományegyetem
Gyógyszeres kezelések
 Gyógyszeres kezelések Az osteogenesis imperfecta gyógyszeres kezelésében számos szert kipróbáltak az elmúlt évtizedekben, de átütő eredménnyel egyik se szolgált. A fluorid kezelés alkalmazása osteogenesis
Gyógyszeres kezelések Az osteogenesis imperfecta gyógyszeres kezelésében számos szert kipróbáltak az elmúlt évtizedekben, de átütő eredménnyel egyik se szolgált. A fluorid kezelés alkalmazása osteogenesis
Fehérje expressziós rendszerek. Gyógyszerészi Biotechnológia
 Fehérje expressziós rendszerek Gyógyszerészi Biotechnológia Expressziós rendszerek Cél: rekombináns fehérjék előállítása nagy tisztaságban és nagy mennyiségben kísérleti ill. gyakorlati (therapia) felhasználásokra
Fehérje expressziós rendszerek Gyógyszerészi Biotechnológia Expressziós rendszerek Cél: rekombináns fehérjék előállítása nagy tisztaságban és nagy mennyiségben kísérleti ill. gyakorlati (therapia) felhasználásokra
Immunológia I. 2. előadás. Kacskovics Imre (imre.kacskovics@ttk.elte.hu)
 Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Diagnosztikai irányelvek Paget-kórban
 Diagnosztikai irányelvek Paget-kórban Dr. Donáth Judit Országos Reumatológiai és Fizioterápiás Intézet, Budapest HALADÁS A REUMATOLÓGIA, IMMUNOLÓGIA ÉS OSTEOLÓGIA TERÜLETÉN 2012-2014 2015. ÁPRILIS 17.
Diagnosztikai irányelvek Paget-kórban Dr. Donáth Judit Országos Reumatológiai és Fizioterápiás Intézet, Budapest HALADÁS A REUMATOLÓGIA, IMMUNOLÓGIA ÉS OSTEOLÓGIA TERÜLETÉN 2012-2014 2015. ÁPRILIS 17.
MIDD, MODY, LADA és a többiek
 MIDD, MODY, LADA és a többiek DM etiológiai besorolása 1/3 Diabetes Care January 2004 vol. 27 no. suppl 1 s5-s10 DM etiológiai besorolása 2/3 DM etiológiai besorolása 2/3 Monogénes diabetes formák Inzulin
MIDD, MODY, LADA és a többiek DM etiológiai besorolása 1/3 Diabetes Care January 2004 vol. 27 no. suppl 1 s5-s10 DM etiológiai besorolása 2/3 DM etiológiai besorolása 2/3 Monogénes diabetes formák Inzulin
Az ophthalmopathia autoimmun kórfolyamatára utaló tényezôk Bizonyított: A celluláris és humorális autoimmun folyamatok szerepe.
 Az ophthalmopathia autoimmun kórfolyamatára utaló tényezôk Bizonyított: A celluláris és humorális autoimmun folyamatok szerepe. szemizom, retrobulbaris kötôszövet, könnymirigy elleni autoantitestek exophthalmogen
Az ophthalmopathia autoimmun kórfolyamatára utaló tényezôk Bizonyított: A celluláris és humorális autoimmun folyamatok szerepe. szemizom, retrobulbaris kötôszövet, könnymirigy elleni autoantitestek exophthalmogen
Vizsgálatkérő és adatlapok a Zalaegerszegi Területi Vérellátóban Hatályos szeptember verzió
 Vizsgálatkérő és adatlapok a Zalaegerszegi Területi Vérellátóban Hatályos 2011. szeptember 1-1.1. verzió 1. sz. adatlap Beküldő intézmény/osztály azonosító kódja: Nem választott vérkészítmény igénylőlap
Vizsgálatkérő és adatlapok a Zalaegerszegi Területi Vérellátóban Hatályos 2011. szeptember 1-1.1. verzió 1. sz. adatlap Beküldő intézmény/osztály azonosító kódja: Nem választott vérkészítmény igénylőlap
Kromoszómák, Gének centromer
 Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
Szerkesztette: dr Lázár Sarnyai Nóra
 Szerkesztette: dr Lázár Sarnyai Nóra A cukorbetegség (diabetes mellitus) a szénhidrátanyagcsere zavara, amely a vérben, illetve a testnedvekben megemelkedett cukorszinttel és kóros anyagcseretermékekkel
Szerkesztette: dr Lázár Sarnyai Nóra A cukorbetegség (diabetes mellitus) a szénhidrátanyagcsere zavara, amely a vérben, illetve a testnedvekben megemelkedett cukorszinttel és kóros anyagcseretermékekkel
Kérdőív. Családban előforduló egyéb betegségek: A MAGYAR HASNYÁLMIRIGY MUNKACSOPORT ÉS AZ INTERNATIONAL ASSOCIATION OF PANCREATOLOGY KÖZÖS VIZSGÁLATA
 1. Személyes adatok Kérdőív Név:. Születési dátum:.. KÓRHÁZ TAJ szám:... Nem: Rassz: férfi / nő indiai / ázsiai / fehér / fekete (a megfelelő aláhúzandó) ORVOS Képes-e a gyermek válaszolni a panaszaira,
1. Személyes adatok Kérdőív Név:. Születési dátum:.. KÓRHÁZ TAJ szám:... Nem: Rassz: férfi / nő indiai / ázsiai / fehér / fekete (a megfelelő aláhúzandó) ORVOS Képes-e a gyermek válaszolni a panaszaira,
A korai magömlés diagnózisa és terápiája (ISSM 2014-es ajánlása alapján) Dr. Rosta Gábor Soproni Gyógyközpont
 A korai magömlés diagnózisa és terápiája (ISSM 2014-es ajánlása alapján) Dr. Rosta Gábor Soproni Gyógyközpont ISSM definíció- 2014 Szexuális aktivitás során az ejakuláció állandóan vagy visszatérően bekövetkezik
A korai magömlés diagnózisa és terápiája (ISSM 2014-es ajánlása alapján) Dr. Rosta Gábor Soproni Gyógyközpont ISSM definíció- 2014 Szexuális aktivitás során az ejakuláció állandóan vagy visszatérően bekövetkezik
Biológiai feladatbank 12. évfolyam
 Biológiai feladatbank 12. évfolyam A pedagógus neve: A pedagógus szakja: Az iskola neve: Műveltségi terület: Tantárgy: A tantárgy cél és feladatrendszere: Tantárgyi kapcsolatok: Osztály: 12. Felhasznált
Biológiai feladatbank 12. évfolyam A pedagógus neve: A pedagógus szakja: Az iskola neve: Műveltségi terület: Tantárgy: A tantárgy cél és feladatrendszere: Tantárgyi kapcsolatok: Osztály: 12. Felhasznált
SAJTÓKÖZLEMÉNY Kockázat alapú cukorbeteg szűrés indul Magyarországon idén
 SAJTÓKÖZLEMÉNY Kockázat alapú cukorbeteg szűrés indul Magyarországon idén A cukorbetegség exponenciálisan növekvő előfordulású, az érintettek számát tekintve népbetegség, gyakoriságából, fennállásának
SAJTÓKÖZLEMÉNY Kockázat alapú cukorbeteg szűrés indul Magyarországon idén A cukorbetegség exponenciálisan növekvő előfordulású, az érintettek számát tekintve népbetegség, gyakoriságából, fennállásának
Férfiakban: RBC: < 4,4 T/l HGB: < 135 g/l PCV: < 0,40 l/l. Nőkben: RBC: < 3,8 T/l HGB: < 120 g/l PCV: < 0,37 l/l
 ANÉMIÁK Az anémia ritkán önálló megbetegedés, leggyakrabban valamilyen más egyéb betegség - pl: krónikus gyulladás, malignus megbetegedés kísérőjelensége, könnyen felismerhető tünete. Definíció: A keringő
ANÉMIÁK Az anémia ritkán önálló megbetegedés, leggyakrabban valamilyen más egyéb betegség - pl: krónikus gyulladás, malignus megbetegedés kísérőjelensége, könnyen felismerhető tünete. Definíció: A keringő
Alkohollal kapcsolatos zavarok. Az alkoholbetegség. Általános jellegzetességek
 Alkohollal kapcsolatos zavarok Az alkoholbetegség Az alkoholisták mértéktelen ivók, alkoholfüggőségük olyan szintet ér el, hogy észrevehető mentális zavarokat okoz, károsítja test-lelki egészségüket, interperszonális
Alkohollal kapcsolatos zavarok Az alkoholbetegség Az alkoholisták mértéktelen ivók, alkoholfüggőségük olyan szintet ér el, hogy észrevehető mentális zavarokat okoz, károsítja test-lelki egészségüket, interperszonális
INCZÉDY GYÖRGY SZAKKÖZÉPISKOLA, SZAKISKOLA ÉS KOLLÉGIUM
 INCZÉDY GYÖRGY SZAKKÖZÉPISKOLA, SZAKISKOLA ÉS KOLLÉGIUM Szakközépiskola Tesztlapok Biológia - egészségtan tantárgy 12. évfolyam Készítette: Perinecz Anasztázia Név: Osztály: 1. témakör: Az élet kódja.
INCZÉDY GYÖRGY SZAKKÖZÉPISKOLA, SZAKISKOLA ÉS KOLLÉGIUM Szakközépiskola Tesztlapok Biológia - egészségtan tantárgy 12. évfolyam Készítette: Perinecz Anasztázia Név: Osztály: 1. témakör: Az élet kódja.
