A kostimuláció-gátlás, mint terápiás támadáspont az RA kezelésében
|
|
|
- Liliána Némethné
- 10 évvel ezelőtt
- Látták:
Átírás
1 A kostimuláció-gátlás, mint terápiás támadáspont az RA kezelésében Dr. Penczner Gabriella ORFI - Helia
2 Antigén feldolgozás, T-sejt aktiváció Abbas & Lichtman. Cellular and Molecular Immunology, 5th ed. W. B. Saunders 2003
3 T-sejt aktiváció: kostimuláció CD28 B7 Kostimulációs molekulák T-sejt APC TCR MHC Rövidítések: APC: antigén-prezentáló sejt MHC: major hisztokompatibilitási komplex TCR: T-sejt receptor Adaptálva: Coico et al, 2003; Abbas and Lichtman, 2005
4 Immunológiai szinapszis F. Sánchez-Madrid: Mechanisms of Intercellular communication on through the Immunological synapse - oral presentation 03/06/ Sala d'actes de l'hospital Duran i Reynals (ICO) Stinchcombe JC, Majorovits E, Bossi G, Fuller S, Griffiths GM.: Centrosome polarization delivers secretory granules to the immunological synapse. (Tomography of a cytotoxic T-cell immune synapse) Nature Sep 28;443(7110):
5 Antigén prezentálás és T-sejt aktiválódás 1-4 Antigén prezentáló sejt CD80/86 Ko-stimuláció CD28 Hiszto-kompatibilitási komplex (MHC) 1. szignál T-sejt receptor (TCR) Aktivált T sejt Makrofág Cytokinek felszabadulása TNF-, IL-1, IL-6, gyulladás és szöveti destrukció B sejt 1 Fontenot et al. J Clin Invest 2003: 112: Janeway et al. Immunobiol 2005; 8: , 3 Sharpe et al. Nat Rev Immunol 2002; 2(2): ; 4 Yamada et al. J Am Soc Nephrol 2002; 13(2): , 5 Choy, Panayi.NEJM 2001;344:
6 Antigén prezentálás és T-sejt aktiválódás 1-4 Antigén prezentáló sejt CD80/86 2. szignál CD28 Hiszto-kompatibilitási komplex (MHC) T-sejt receptor (TCR) Aktivált T sejt Makrofág Cytokinek felszabadulása TNF-, IL-1, IL-6, gyulladás és szöveti destrukció B sejt 1 Fontenot et al. J Clin Invest 2003: 112: Janeway et al. Immunobiol 2005; 8: , 3 Sharpe et al. Nat Rev Immunol 2002; 2(2): ; 4 Yamada et al. J Am Soc Nephrol 2002; 13(2): , 5 Choy, Panayi.NEJM 2001;344:
7 A ko-stimuláció eredménye Proliferáció CD28 B7 Ko-stimulációs molekulák Túlélés T-sejt APC T sejt aktiváció TCR MHC Interleukin-2 termelés cyclin-aktiváció Citokin termelés Adaptálva: Coico et al, 2003; Male et al, 2006
8 T-limfocita aktiváció / inaktiváció Apoptózis Anergia Proliferáció Differenciálódás Effektor funkció Sejt-ciklus blokkolása Nature Reviews Immunology 1, (December 2001) Immunological synapse between T-cells and APCs1
9 Abatacept: humán IgG1 CTLA-4 receptor fúziós protein Az ABATACEPT egy szolubilis fúziós protein, mely magában foglalja a humán CTLA-4 extracelluláris doménjét, és a humán IgG1 módosított Fc régióját CTLA-4 ABATACEPT IgG1 Extracelluláris rész Transzmembrán rész Intracelluláris rész Non-komplement rögzítés Linsley. J Exp Med 1991; 174(3): 561 9
10 Gyógyítsuk az RA-t a gyökereitől A T-sejt aktiváció és proliferáció gátlása Az aktivált szinoviális makrofágok által szekretált proinflammatorikus cytokinek csökkentése A patomechanizmussal ellentétes moduláció Auto-antitestek (pl. RF) termelésének redukálása klonális expanzió mérséklése Kaszkádszerű hatás RF=rheuma faktor; APC=antigén-prezentáló sejt; MHC=major hisztokompatabilitási komplex; TCR=T-sejt receptor; MΦ=makrofág Adaptálva: Choy EH, et al. NEJM 2001;344:907 16; Adaptálva: Linsley PS, et al. J Exp Med 1991;174:561 9
11 KORAI HATÁS, ELSŐ VÁLASZTÁS
12 Korai RA-s betegek körében tartós hatékonyság a két éves követés alatt DAS28-CRP remissziót elérő betegek aránya(%, 95% CI) 100 Abatacept kiegészítés a MTX monoterápiához % 46.1% % % Kezelt napok Abatacept + MTX (n=232) Placebo + MTX (n=227) 1év Váltás Abatacept + MTX terápiára (n=227) AGREE Magyarországon az abatacept törzskönyvezett indikációs köre nem terjed ki a korai RA azon eseteire, akik MTX kezelésben még nem részesültek. Bathon J, et al. Ann Rheum Dis. 2011;70:
13 A radiológiai progresszió gátlása Eltérés a Sharp score kiindulási értékétől Abatacept kiegészítés a MTX monoterápiához p=0.004 p<0.001 Yr 1 2 vs BL Yr 1 Évente röntgenfelvétel (n=207) 0.0 Bázisérték 1 év 2 év Kezelt időszak Abatacept + MTX Placebo + MTX Váltás Abatacept + MTX terápiára AGREE p Magyarországon az abatacept törzskönyvezett indikációs köre nem terjed ki a korai RA azon eseteire, akik MTX kezelésben még nem részesültek. Bathon J, et al. Ann Rheum Dis. 2011;70:
14 A strukturális károsodás progressziójának statisztikailag szignifikáns lassulása 1 év Abatacept vs Placebo kezelés mellett Eltérés a Sharp score kiindulási értékétől Abatacept + MTX (n=391) Placebo + MTX (n=195) p=0.029 * Eróziós Score (ES) p= év 1.18 Izületi rés szűkület (JSN) p= Összesített AIM 92% of patients had baseline and post-baseline x-rays; Analysis on all observed data at baseline and at Year 1, with linear extrapolation for discontinued patients for missing annual X-ray data *, p values were calculated using a non-parametric ANCOVA; ES=erosion score; JSN=joint-space narrowing Kremer JM, et al. Ann Intern Med 2006;144:865 76
15 HOSSZÚ TÁVÚ HATÁSOSSÁG
16 Hosszú távon a betegek egyre növekvő hányada jut remisszióba Kettősvak szakasz 100 Nyílt szakasz (LTE) IM Reagáló betegek aránya (%) % (37.4, 58.9) 25.3% (15.9, 34.7) RR (95% CI) Évek LDAS 69.7% (54.0, 85.4) Remisszió 51.5% (34.5, 68.6) Data are based on all patients originally randomized to 10 mg/kg abatacept who entered the LTE, with data available at the visit of interest (asobserved analysis); DAS28 (C-reactive protein [CRP])-defined remission=das28 <2.6; LDAS=DAS28 (CRP) 3.2; DAS28=Disease Activity Score; DB=double-blind; LDAS=Low Disease Activity State; CI=confidence interval; LTE=long-term extension Westhovens R, et al. Ann Rheum Dis 2009;68(Suppl3):577. Poster number SAT0108
17 Radiológiai progresszió gátlás hosszú távon Radiológiai progresszió nélküli betegek %-a* / / / /111 79/ év 1-2 év 2-3 év 3-4 év 4-5 év AIM Data are for patients originally randomized to abatacept, who entered the open-label period, and had evaluable radiographs available at the appropriate time points; *Non-progression is defined as a change from baseline in radiographic total score of 0 Genant HK, et al. Ann Rheum Dis 2009;68(Suppl3):440. Poster FRI0253
18 ANA* és Anti-dsDNA** szerokonverziós arány ANA seroconversion Patients, N (%) Abatacept SC 12 (5.2) Adalimumab 28 (13.3) Anti-dsDNA seroconversion Patients, N (%) Abatacept SC 1 (0.3) Adalimumab 29 (9.9) *Anti-nuclear antibody **Anti-double stranded DNA Schiff M, Weinblatt M, Valente R et al. Arn Rheum Dis. 2014; 73:86-94
19 A KOSTIMULÁCIÓ-GÁTLÁS HATÁSOSSÁGÁNAK ÖSSZEVETÉSE
20 Abatacept IV és SC ACR 20; 50; 70 eredményei 33 hónap kezelés alatt ACQUIRE Genovese M, et al. Arthritis Rheum Vol 63(10):
21 Abatacept és infliximab középtávú hatásának összevetése ACR válaszadási arány (%) ATTEST ACR 20 Abatacept ACR 20 Infliximab ACR 50 Abatacept ACR 50 Infliximab ACR 70 Abatacept ACR 70 Infliximab Terápiás napok ITT population with patients who discontinued considered non-responders; Infliximab was administered on Days 1, 15, 43, 85 and every 56 days thereafter; Abatacept dosing occurred at each visit day presentation following efficacy assessment; ACR=American College of Rheumatology Schiff M, et al. Ann Rheum Dis 2008;67:
22 DAS28 (ESR) érték 6 hónapos és 1 éves csökkenése 22 0 Elsődleges végont Másodlagos végpont Kiterjesztett végpont ATTEST DAS28 (ESR) változások a kindulási értékhez képest * hónap 12 hónap Abatacept + MTX (n=156) Placebo + MTX (n=110) Infliximab + MTX (n=165) *p<0.001 abatacept + MTX vs placebo + MTX (primary endpoint), p<0.001 infliximab + MTX vs placebo + MTX (secondary endpoint), based on ANCOVA; ITT population with LOCF for patients who discontinued; The study was not designed to demonstrate non-inferiority or superiority of abatacept versus infliximab; ITT=intent-to-treat; LOCF=last observation carried forward Schiff M, et al. Ann Rheum Dis 2008;67:
23 ACR értékek összevetése ACR válaszadási arány (%) Abatacept SC Adalimumab AMPLE ACR 20 ACR 50 ACR 70 ACR % 59.7% 46.6% 44.7% 31.1% 29.3% 14.5% 8.2% Terápiás napok Schiff M, et al. Ann Rheum Dis 2014;73:86 94.
24 Radiológiailag nem romló betegek aránya 90 84,8 83,8 AMPLE év Abatacept Adalimumab Radiológiai non-progresszió (%) Schiff M, et al. Ann Rheum Dis 2014;73:86 94.
25 Kevésbé gyakori a terápiaváltás Abatacept, mint TNF gátlók esetén % n=101 MEDICARE Terápiaváltók aránya, % %* n= % n=357 Első vonalbeli bdmard váltók 12.7% n=54 Anti-TNF Abatacept Anti-TNF Abatacept Második vonalbeli bdmard váltók * TNF gátlók: Adalimumab, Etanercept vagy Infliximab. * p= vs first-line switchers on abatacept p< vs second-line switchers on abatacept Rosenblatt L, et al. Ann Rheum Dis 2013;72(Suppl.3):561, Poster number FRI0550.
26 Terápiahűség az előzetes TNF gátlók számának függvényében Terápiahűség, % Biológiai terápia naïve 1 előzetes TNF gátló 2 előzetes TNF gátló ACTION 83.6% (74.9, 89.5) 73.2% (68.8, 77.2) 64.1% (59.5, 68.4) 12 havi terápiahűség (95%CI) Napok 365 Biologiai naïve (n=120) 1 előzetes TNF gátló (n=481) 2 előzetes-tnf gátló (n=501) Napok Patients still exposed Discontinuations Censored Retention rate estimate and its 95% CI were computed using Kaplan Meier method and are presented by line of treatment; An event is a discontinuation reported by the physician at any follow-up visit; Patients who did not reach the considered time point were censored at last infusion date available; Patients with only baseline data have been considered as censored at first infusion date Nüßlein H, Alten R, et al. Arthritis Rheum 2012;64(Suppl.10):S199. Poster 460.
27 BIZTONSÁGI PROFIL ÖSSZEVETÉSE
28 Mellékhatások miatti terápiafelfüggesztés 12 Kalkulált különbség(95% CI): 5.7 ( 9.5, 1.9) Abatacept SC + MTX AMPLE A betegek %-os aránya a 2 éves terápiás idő alatt ,8 9,5 Adalimumab SC + MTX Kalkulált különbség(95% CI): 3.1 ( 9.5, 1.9) 1,6 4,9 0 MH miatti terápia megszakítás (n=318) Súlyos MH miatti terápia megszakítás (n=328) Schiff M, et al. Ann Rheum Dis 2014;73:86 94.
29 Súlyos infekciók aránya Abatacepttel vagy Infliximabbal kezelteknél ATTEST % (betegszám) Abatacept + MTX (n=156) nap Infliximab + MTX (n=165) Súlyos infekciók 1.9 (3) 8.5 (14) Schiff M, et al. Ann Rheum Dis 2008;67:
30 Súlyos infekciók incidenciája Abatacepttel és más biológikumokkal 95% CI Populáció Beteg expozíció (betegév) Adatbázis zárása Súlyos infekciók / 100 betegév (95% CI) META Abatacept MTX-IRs, DMARD-IRs, Anti-TNF-IRs 4149 (11,658) 2008 december 2.87 (2.56, 3.20) Anti-TNF meta-analízis 1 MTX-naïve, MTX-IRs, DMARD-IRs 3729 (3714) Meta-analízis 2008 augusztus 3.67* Adalimumab 2 Bizonyított RA (átlag 10.6 év betegség ) 12,345 (18,284) Összesített analízis 2007 április 4.65* Etanercept 3 DMARD-IRs 2055 (10,495) Összesített analízis 2009 január 4.0* (Észak-Amerika) 6.0* (Európa) Rituximab 4 DMARD-IRs, Anti-TNF-IRs 2578 (5014) Összesített analízis 2007 november 4.31 (3.77, 4.92) Tocilizumab 5 MTX-naive, MTX-IRs, DMARD-IRs, Anti-TNF-IRs 3857 (5590) Összesített analízis 2008 március 4.37* *95% CI nem riportált; CI=konfidencia intervallum; 1 Leombruno JP, et al. Ann Rheum Dis 2009;68: ; 2 Burmester GR, et al. Ann Rheum Dis 2009;68:1863 9; 3 Klareskog L, et al. Ann Rheum Dis 2009;68(Suppl3):424; 4 van Vollenhoven RF, et al. J Rheumatol 2010;37:558 67; 5 van Vollenhoven RF, et al. Ann Rheum Dis 2009;68(Suppl3):578
31 Súlyos mellékhatások gyakorisága a kezelések éveiben 100 betegévre vonatkozó incidencia (95%CI) 4149 beteg; 12,132 betegév Adatbázis zárása: 2009 december ISS Évek Mellékhatást tapasztaló betegek, (n) betegévre vonatkozó incidencia (95% CI) 19.1 ( ) 14.4 ( ) 12.8 ( ) 10.5 ( ) 10.2 ( ) 7.1 ( ) 8.9 ( ) An SAE was defined as an AE that was fatal; life-threatening; resulted in or prolonged hospitalization; resulted in persistent or significant disability or incapacity; cancer; a congenital anomaly/birth defect; resulted in an overdose, development of drug dependency or drug abuse; or thought to be an important medical event. Hochberg M, et al. Arthritis Rheum 2010;62(10Suppl):S142. Poster: 390
32 Malignitások előfordulása Abatacepttel kezelteknél és az átlag populációnál Összes ISS 32 Emlő Colon és rectum Tüdő Lymphoma Standardizált incidencia arányszám Orange lines indicate the standard incidence ratio point estimates and the 95% confidence intervals for abatacept (2006 ISS database lock) compared with the SEER database of the general population; The diamonds represent SIR reported in the literature that compare RA patients with non-ra patients or general populations; SEER=Surveillance, Epidemiology and End Results Simon TA, et al. Ann Rheum Dis 2009;68:
33 A T-sejtek aktiválódása alcsoportonként CD28 kostimuláció Alacsony dependencia Magas dependencia CD8+ CD4+ CD8 T sejtek: peptid + class I CD4 T sejtek: peptid + class II Antivirális / tumorellenes immunitás Gyulladás / antitest képződés Adaptálva: Janeway CA Jr, et al. Immunobiology: The Immune System in Health and Disease, 6th ed. New York, United States: Garland Science Publishing 1994
34 AZ RA KEZELÉSE VÁLTOZIK
35 2013-as EULAR ajánlás ORENCIA: Első vonalbeli biológiai terápiás szerként ajánlott 2013-tól 9.MTX-ra és/vagy más csdmardra (kortikoszteroiddal vagy anélkül) elégtelenül reagáló betegben bdmard (TNF-gátló, abatacept vagy tocilizumab, speciális esetben rituximab) adása ajánlott MTX-szel együtt (1b, A) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update
36 OEP: A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási protokollja A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási protokollja
37 Köszönöm a figyelmet!
38 Orencia SC rövidített alkalmazási előírás Orencia 125 mg oldatos injekció Minőségi és mennyiségi összetétel: Minden előretöltött fecskendő 125 mg abataceptet tartalmaz milliliterenként. Ismert hatású segédanyag: 0,014 mmol (0,322 mg) nátrium előretöltött fecskendőként,azaz gyakorlatilag nátriummentes. Terápiás javallatok: Rheumatoid arthritis: Az ORENCIA metotrexáttal kombinálva olyan közepesen súlyos vagy súlyos aktív rheumatoid arthritisben szenvedő felnőtt betegek kezelésére javallott, akik nem megfelelően reagáltak egy vagy több betegségmódosító antireumatikus gyógyszerre (DMARD-ok), beleértve a metotrexátot (MTX) vagy egy tumor necrosis faktor (TNF)-alfa inhibitort. Adagolás és alkalmazás: Felnőttek: Az ORENCIA sc. alkalmazása elkezdhető intravénás (iv.) telítő adaggal vagy anélkül. A sc. ORENCIA-t tekintet nélkül a testtömegre, egy 125 mg-os dózisban, hetente, subcutan adott injekció formájában kell alkalmazni. Ha a kezelés elkezdéséhez egyszeri iv. infúziót adnak (iv. telítő adag a sc. alkalmazás előtt), akkor az első 125 mg abataceptet az iv. infúzióhoz képest egy napon belül be kell adni, amit hetenkénti sc. adott 125 mg abatacept injekció követ. Az intravénás ORENCIA-kezelésről subcutan alkalmazásra átálló betegeknek az első subcutan dózist a következő, tervezett intravénás dózis helyett kell adni. Nincs szükség a dózis módosítására más DMARD-kal, kortikoszteroidokkal, szalicilátokkal, nem szteroid gyulladásgátlókkal (NSAID-ok) vagy analgetikumokkal kombinált alkalmazás esetén. Az ORENCIA subcutan alkalmazásának biztonságosságát és hatásosságát 18 évesnél fiatalabb gyermekek esetében nem igazolták. Nincsenek rendelkezésre álló adatok. Idős betegek:nincs szükség a dózis módosítására. Vese- és májkárosodás: Az ORENCIA-t nem vizsgálták ezekben a betegpopulációkban. Adagolási javaslat nem adható. Az alkalmazás módja: subcutan alkalmazásra. Az előretöltött fecskendő teljes tartalmát (1 ml) be kell adni, de kizárólag subcutan injekció formájában. Az injekciók beadási helyét változtatni kell, és az injekciókat soha nem szabad olyan helyre adni, ahol a bőr érzékeny, bevérzett, vörös vagy infiltrált. Ellenjavallatok: a készítmény hatóanyagával vagy segédanyagaival szembeni túlérzékenység. Súlyos és nem megfelelően kezelt fertőzések, mint pl. sepsis és opportunista fertőzések. Terhesség és szoptatás: az ORENCIA alkalmazása nem javallt a terhesség alatt kivéve, ha erre egyértelműen szükség van. Fogamzóképes korban lévő nőknek hatékony fogamzásgátlást kell alkalmazniuk az ORENCIA-kezelés alatt és 14 hétig az utolsó abatacept adag alkalmazását követően. Nem szabad szoptatnia az anyának az ORENCIA-kezelés alatt és az utolsó abatacept adag alkalmazásától számított 14 hétig. Nemkívánatos hatások, mellékhatások: Az abatacepttel kezelt betegek körében leggyakrabban jelentett mellékhatások ( 5%) a fejfájás, a hányinger és a felső légúti fertőzések voltak. A klinikai vizsgálatokban és a forgalomba hozatalt követően megfigyelt mellékhatások: nagyon gyakori ( 1/10): felső légúti fertőzés; gyakori ( 1/100 - < 1/10): alsú légúti fertőzés, húgyúti fertőzés, herpes fertőzések, rhinitis, pneumonia, influenza, leukopenia, fejfájás, szédülés, paraesthesia, conjunctivitis, hypertonia, kipirulás, emelkedett vérnyomás, köhögés, hasi fájdalom, hasmenés, hányinger, dyspepsia, a szájüreg kifekélyesedése, stomatitis aphtosa, hányás, kóros májfunkciós vizsgálati eredmények, bőrkiütés, alopecia, pruritus, végtagfájdalom, fáradtság, gyengeség, az injekció helyén fellépő reakciók, injekció beadását követően fellépő reakciók (pruritus, szorító érzés a torokban, dyspnoe). A forgalomba hozatali engedély jogosultja: Bristol-Myers Squibb Pharma EEIG, Uxbridge Business Park, Sanderson Road, Uxbridge, UB8 1DH, Nagy-Britannia Osztályozás: Korlátozott érvényű orvosi rendelvényhez kötött, szakorvosi kórházi diagnózist követően folyamatos szakorvosi ellenőrzés mellett alkalmazható gyógyszer (Sz) Bruttó fogyasztói ár: Orencia 125 mg oldatos injekció, 4x: Ft*. TB támogatás: Az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. melléklet 6/a1. és 6/b. pontok szerint. Tételes elszámolású gyógyszer. (* Publikus gyógyszertörzs(pupha) alpont - Publikus gyógyszertörzs végleges) EU/1/07/389/ Bővebb információért olvassa el a gyógyszer alkalmazási előírását ( Az alkalmazási előírás dátuma: szeptember 25. További információért forduljon a forgalomba hozatali engedély jogosultjának helyi képviseletéhez: Bristol-Myers Squibb Kft., 1024 Budapest, Lövőház u. 39. Tel.:
39 Orencia IV rövidített alkalmazási előírás Orencia 250 mg por oldatos infúzióhoz való koncentrátumhoz Minőségi és mennyiségi összetétel: 250 mg abatacept injekciós üvegenként. Ismert hatású segédanyag: 0,375 mmol (8,625 mg) nátrium. Feloldás után 25 mg abatacept milliliterenként. Terápiás javallatok: Rheumatoid arthritis: Az ORENCIA metotrexáttal kombinálva olyan közepesen súlyos vagy súlyos aktív rheumatoid arthritisben szenvedő felnőtt betegek kezelésére javallott, akik nem megfelelően reagáltak egy vagy több betegségmódosító antireumatikus gyógyszerre (DMARD-ok), beleértve a metotrexátot (MTX) vagy egy tumor necrosis faktor (TNF)-alfa inhibitort. Polyarticularis juvenilis idiopathiás arthritis: Az ORENCIA metotrexáttal kombinálva olyan közepesen súlyos vagy súlyos aktív polyarticularis juvenilis idiopathiás arthritisben (JIA) szenvedő 6 éves és ennél idősebb gyermekek kezelésére javallott, akik nem reagáltak megfelelően az egyéb DMARD gyógyszerekre, beleértve legalább egy TNF-inhibitort is. Adagolás és alkalmazás: Rheumatoid arthritis, Felnőttek: A táblázatban megadott adagokban, 30 perces intravénás infúzióban kell beadni. A kezdeti alkalmazást követően az ORENCIA az első infúzió beadása utáni 2.és 4. héten, majd ezt követően 4 hetenként alkalmazandó. Az ORENCIA adagja a A beteg testtömege Adag Injekciós üvegek száma b < 60 kg 500 mg 2 60 kg, és 100 kg 750 mg 3 > 100 kg 1000 mg 4 a Kb. 10 mg/kg. b injekciós üvegenként 250 mg abatacept adagolását biztosítja. Nincs szükség a dózis módosítására más DMARD-kal, kortikoszteroidokkal, szalicilátokkal, nem szteroid gyulladásgátlókkal (NSAID-ok) vagy analgetikumokkal kombinált alkalmazás esetén. Juvenilis idiopathiás arthritis, Gyermekpopuláció: A 6-17 éves, 75 kg-nál kisebb tömegű, juvenilis idiopathiás arthritisben szenvedő betegek számára javasolt adag 10 mg/kg. A 75 kg-os vagy ennél nagyobb tömegű gyermekek esetén a felnőtt adagolási rendet kell követni az ORENCIA alkalmazásánál, de nem szabad meghaladni az 1000 mg-os maximális dózist. Az ORENCIA-t 30 perces intravénás infúzióban kell alkalmazni. Az első alkalmazást követően az ORENCIA-t 2 és 4 héttel az első infúzió után kell beadni, majd azt követően pedig 4 hetente. Az ORENCIA biztonságosságát és hatásosságát 6 évnél fiatalabb gyermekek esetében nem vizsgálták, ezért az ORENCIA a 6 évnél fiatalabb gyermekek kezelésére nem ajánlott. Speciális populáció Idős betegek: Nincs szükség a dózis módosítására. Vese- és májkárosodás: Az ORENCIA-t nem vizsgálták ezekben a betegpopulációkban. Adagolási javaslat nem adható. Az alkalmazás módja: Az egész, teljesen felhígított ORENCIA oldatot 30 perc alatt egy steril, pirogénmentes, alacsony protein-megkötő képességű filterrel (pórusméret 0,2-1,2 µm) ellátott infúziós szereléken keresztül kell beadni. Ellenjavallatok: a készítmény hatóanyagával vagy segédanyagaival szembeni túlérzékenység. Súlyos és nem megfelelően kezelt fertőzések, mint pl. sepsis és opportunista fertőzések. Terhesség és szoptatás: az ORENCIA alkalmazása nem javallt a terhesség alatt kivéve, ha erre egyértelműen szükség van. Fogamzóképes korban lévő nőknek hatékony fogamzásgátlást kell alkalmazniuk az ORENCIA-kezelés alatt és 14 hétig az utolsó abatacept adag alkalmazását követően. Nem szabad szoptatnia az anyának az ORENCIA-kezelés alatt és az utolsó abatacept adag alkalmazásától számított 14 hétig. Nemkívánatos hatások, mellékhatások: Az abatacepttel kezelt betegek körében leggyakrabban jelentett mellékhatások ( 5%) a fejfájás, a hányinger és a felső légúti fertőzések voltak. A klinikai vizsgálatokban és a forgalomba hozatalt követően megfigyelt mellékhatások: nagyon gyakori: felső légúti fertőzés ( 1/10); gyakori ( 1/100 -< 1/10): alsú légúti fertőzés, húgyúti fertőzés, herpes fertőzések, rhinitis, pneumonia, influenza, leukopenia, fejfájás, szédülés, paraesthesia, conjunctivitis, hypertonia, kipirulás, emelkedett vérnyomás, köhögés, hasi fájdalom, hasmenés, hányinger, dyspepsia, a szájüreg kifekélyesedése, stomatitis aphtosa, hányás, kóros májfunkciós vizsgálati eredmények, bőrkiütés, alopecia, pruritus, végtagfájdalom, fáradtság, gyengeség. Mellékhatások polyarticularis juvenilis idiopathiás arthritisben szenvedő gyermekek esetén: A mellékhatások, melyek előfordultak, hasonló típusúak és gyakoriságúak voltak a felnőttek esetében tapasztaltakéhoz az alábbiak kivételével: gyakori: felső légúti fertőzés (beleértve a sinusitist, nasopharyngitist és rhinitist is), otitis (media és externa), haematuria, láz. A forgalomba hozatali engedély jogosultja: Bristol-Myers Squibb Pharma EEIG, Uxbridge Business Park, Sanderson Road, Uxbridge, UB8 1DH, Nagy-Britannia Osztályozás: rendelőintézeti járóbeteg-szakellátást vagy fekvőbeteg-szakellátást nyújtó szolgáltatók által biztosított körülmények között alkalmazható gyógyszerek (I). Bruttó fogyasztói ár: Orencia 250 mg por oldatos infúzióhoz való koncentrátumhoz,1x: Ft*. TB támogatás: Az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. melléklet 6/a1. és 6/b. pontok szerint. Tételes elszámolású gyógyszer. (* Publikus gyógyszertörzs(pupha) alpont - Publikus gyógyszertörzs végleges) EU/1/07/389/ Bővebb információért olvassa el a gyógyszer alkalmazási előírását ( Az alkalmazási előírás dátuma: szeptember 25. További információért forduljon a forgalomba hozatali engedély jogosultjának helyi képviseletéhez: Bristol-Myers Squibb Kft., 1024 Budapest, Lövőház u. 39. Tel.:
40 A prezentáció a Bristol Myers Squibb felkérése alapján készült 427HU15PR /
Metotrexát és célzott terápiák rheumatoid arthritisben
 + Metotrexát és célzott terápiák rheumatoid arthritisben Dr. Pálinkás Márton ORSZÁGOS REUMATOLÓGIAI ÉS FIZIOTERÁPIÁS INTÉZET + Metotrexát (MTX) mint első választandó szer MTX és célzott terápiák kombinációja
+ Metotrexát és célzott terápiák rheumatoid arthritisben Dr. Pálinkás Márton ORSZÁGOS REUMATOLÓGIAI ÉS FIZIOTERÁPIÁS INTÉZET + Metotrexát (MTX) mint első választandó szer MTX és célzott terápiák kombinációja
JAK kináz-gátlók hatékonysága és biztonságossága
 JAK kináz-gátlók hatékonysága és biztonságossága Juhász Péter Országos Reumatológiai és Fizioterápiás Intézet Haladás a reumatológia, immunológia és osteológia területén 2015-2017 2018. április 19-20.
JAK kináz-gátlók hatékonysága és biztonságossága Juhász Péter Országos Reumatológiai és Fizioterápiás Intézet Haladás a reumatológia, immunológia és osteológia területén 2015-2017 2018. április 19-20.
Országos Egészségbiztosítási Pénztár tájékoztatója a tételes elszámolás alá eső hatóanyagok körének bővítéséről
 Országos Egészségbiztosítási Pénztár tájékoztatója a tételes elszámolás alá eső hatóanyagok körének bővítéséről Az egészségügyért felelős miniszter 2011. december 23-i rendeletében módosította az egészségügyi
Országos Egészségbiztosítási Pénztár tájékoztatója a tételes elszámolás alá eső hatóanyagok körének bővítéséről Az egészségügyért felelős miniszter 2011. december 23-i rendeletében módosította az egészségügyi
PPI VÉDELEM A KEZELÉS SORÁN
 75 mg diclofenák-nátrium, 20 mg omeprazol módosított hatóanyag-leadású kemény kapszula PPI VÉDELEM A KEZELÉS SORÁN Jelentős fájdalom- és gyulladáscsökkentő hatás 1 Savkontroll az omeprazol segítségével
75 mg diclofenák-nátrium, 20 mg omeprazol módosított hatóanyag-leadású kemény kapszula PPI VÉDELEM A KEZELÉS SORÁN Jelentős fájdalom- és gyulladáscsökkentő hatás 1 Savkontroll az omeprazol segítségével
JAK kináz-gátlók biztonságossága
 JAK kináz-gátlók biztonságossága Haladás a reumatológia, immunológia és osteológia területén 2016-2018 2019. április 11-12. Budapest, Hotel Hélia Mellékhatás profil értékelése Klinikai vizsgálatok (RCT,
JAK kináz-gátlók biztonságossága Haladás a reumatológia, immunológia és osteológia területén 2016-2018 2019. április 11-12. Budapest, Hotel Hélia Mellékhatás profil értékelése Klinikai vizsgálatok (RCT,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
A Magyar Allergológiai és Klinikai Immunológiai Társaság 44. Kongresszusa
 A Magyar Allergológiai és Klinikai Immunológiai Társaság 44. Kongresszusa KONGRESSZUSI PROGRAM 2016. május 5-7. Four Points by Sheraton**** Kecskemét Hotel & Conference Center Kecskemét Akkreditált rendezvény
A Magyar Allergológiai és Klinikai Immunológiai Társaság 44. Kongresszusa KONGRESSZUSI PROGRAM 2016. május 5-7. Four Points by Sheraton**** Kecskemét Hotel & Conference Center Kecskemét Akkreditált rendezvény
A Wyeth a Pfizer kizárólagos érdekeltségû leányvállalata.
 A Wyeth a Pfizer kizárólagos érdekeltségû leányvállalata. BIF Budapesti Immunológiai Fórum 2009. november 14. Budapest, Hotel Sofitel Immunmoduláció: elméleti alapok és klinikai alkalmazás a reumatológiában
A Wyeth a Pfizer kizárólagos érdekeltségû leányvállalata. BIF Budapesti Immunológiai Fórum 2009. november 14. Budapest, Hotel Sofitel Immunmoduláció: elméleti alapok és klinikai alkalmazás a reumatológiában
Új (?) törekvések a gyógyszerek költséghatékonyságának. megítélésében
 Új (?) törekvések a gyógyszerek költséghatékonyságának megítélésében Géher Pál dr. Budapest, 2010. május 3. Fekvőbeteg szakellátás Gyógyszertámogatás Összes kiadás 1 800 000 1 600 000 1 400 000 1 200 000
Új (?) törekvések a gyógyszerek költséghatékonyságának megítélésében Géher Pál dr. Budapest, 2010. május 3. Fekvőbeteg szakellátás Gyógyszertámogatás Összes kiadás 1 800 000 1 600 000 1 400 000 1 200 000
Er teljes és tartós vérnyomáscsökkentés 1,2 Kett s kardiovaszkuláris védelem 3 Javuló beteg-együttm ködés 4 Flexibilis alkalmazhatóság 5
 Mesteri kombinációk Er teljes és tartós vérnyomáscsökkentés 1,2 Kett s kardiovaszkuláris védelem 3 Javuló beteg-együttm ködés 4 Flexibilis alkalmazhatóság 5 Rövidített alkalamazási előírás Covercard 5
Mesteri kombinációk Er teljes és tartós vérnyomáscsökkentés 1,2 Kett s kardiovaszkuláris védelem 3 Javuló beteg-együttm ködés 4 Flexibilis alkalmazhatóság 5 Rövidített alkalamazási előírás Covercard 5
Sütő Gábor PTE KK Reumatológiai és Immunológiai klinika
 Biológiai terápiák több éves széles körű alkalmazásának terápiás tapasztalatai, sikerei és kudarcai: Mennyit ment a világ előbbre a biotechnológiai gyógyszeres terápiával? Sütő Gábor PTE KK Reumatológiai
Biológiai terápiák több éves széles körű alkalmazásának terápiás tapasztalatai, sikerei és kudarcai: Mennyit ment a világ előbbre a biotechnológiai gyógyszeres terápiával? Sütő Gábor PTE KK Reumatológiai
 www.printo.it/pediatric-rheumatology/hu/intro Gyógyszeres Kezelés Verzió 2016 13. Biológiai szerek Az elmúlt néhány évben új perspektívákat nyitottak a biológiai szereknek nevezett hatóanyagok. Az orvosok
www.printo.it/pediatric-rheumatology/hu/intro Gyógyszeres Kezelés Verzió 2016 13. Biológiai szerek Az elmúlt néhány évben új perspektívákat nyitottak a biológiai szereknek nevezett hatóanyagok. Az orvosok
Biológiai terápiás lehetőségek rheumatoid arthritisben
 Szisztémás autoimmun kórképek újabb kezelési lehetőségei II. Prof. Dr. Zeher Margit DE OEC Klinikai Immunológiai Tanszék Klinikai Immunológia és Allergológia II. Az immunológia és allergológia klinikuma
Szisztémás autoimmun kórképek újabb kezelési lehetőségei II. Prof. Dr. Zeher Margit DE OEC Klinikai Immunológiai Tanszék Klinikai Immunológia és Allergológia II. Az immunológia és allergológia klinikuma
Ütõs megoldás Szelektivitás finomra hangolva
 Ütõs megoldás Szelektivitás finomra hangolva 1103 Budapest, Gyömrői út 19-21. Szakorvosi Marketing Osztály: +36 1 431 4907, www.richter.hu Gyógyszerbiztonsági Osztály: +36 1 505 7032, Fax: +36 1 431 5954,
Ütõs megoldás Szelektivitás finomra hangolva 1103 Budapest, Gyömrői út 19-21. Szakorvosi Marketing Osztály: +36 1 431 4907, www.richter.hu Gyógyszerbiztonsági Osztály: +36 1 505 7032, Fax: +36 1 431 5954,
Mennyire tükrözik a remissziós kritériumok a kezelés hatását RA-ban?
 Mennyire tükrözik a remissziós kritériumok a kezelés hatását RA-ban? Soroncz-Szabó Tamás dr. 427HU1701689-01 Soroncz-Orfi_20170420 RA = rheumatoid arthritis Érdekeltségi nyilatkozat Tanácsadói megbízások:
Mennyire tükrözik a remissziós kritériumok a kezelés hatását RA-ban? Soroncz-Szabó Tamás dr. 427HU1701689-01 Soroncz-Orfi_20170420 RA = rheumatoid arthritis Érdekeltségi nyilatkozat Tanácsadói megbízások:
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE ORENCIA 250 mg por oldatos infúzióhoz való koncentrátumhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 250 mg abatacept injekciós üvegenként. Feloldás
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE ORENCIA 250 mg por oldatos infúzióhoz való koncentrátumhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 250 mg abatacept injekciós üvegenként. Feloldás
Hogyan gyógyítsuk az RA-t Európában?
 Hogyan gyógyítsuk az RA-t Európában? Dr. Poór Gyula Országos Reumatológiai és Fizioterápiás Intézet Semmelweis Egyetem Reumatológiai és Fizioterápiás Tanszéki Csoport Haladás a reumatológia, immunológia
Hogyan gyógyítsuk az RA-t Európában? Dr. Poór Gyula Országos Reumatológiai és Fizioterápiás Intézet Semmelweis Egyetem Reumatológiai és Fizioterápiás Tanszéki Csoport Haladás a reumatológia, immunológia
Az állapot súlyosságától függően prekóma vagy kóma esetében 24 óra alatt az adag 8 ampulláig emelhető.
 1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend)
 A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest,
A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest,
KETTŐS EREJÉVEL GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ ORRDUGULÁS ORRFOLYÁS IBUPROFÉN ÉS PSZEUDOEFEDRIN A MEGFÁZÁS TÜNETEI ELLEN FEJFÁJÁS TOROKGYULLADÁS
 IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
Etanercept. Finanszírozott indikációk:
 Etanercept Finanszírozott indikációk: 1. Spondylitis ankylopoeticában, amennyiben radiológiailag legalább 2-es stádiumú bilateralis, vagy 3-as, 4-es stádiumú unilateralis sacroileitis, és legalább 3 hónapja
Etanercept Finanszírozott indikációk: 1. Spondylitis ankylopoeticában, amennyiben radiológiailag legalább 2-es stádiumú bilateralis, vagy 3-as, 4-es stádiumú unilateralis sacroileitis, és legalább 3 hónapja
A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási protokollja
 A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009. szeptember
A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009. szeptember
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja
 A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési
A psoriasis biológia terápiájának jelene és jövője. Holló Péter dr
 A psoriasis biológia terápiájának jelene és jövője Holló Péter dr Merre halad a psoriasis biológiai terápiája? Meglévő biológiai szerekkel új eredmények Hosszú távú hatásossági biztonságossági metaanalízisek
A psoriasis biológia terápiájának jelene és jövője Holló Péter dr Merre halad a psoriasis biológiai terápiája? Meglévő biológiai szerekkel új eredmények Hosszú távú hatásossági biztonságossági metaanalízisek
B-sejtek szerepe az RA patológiás folyamataiban
 B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
Spondylitis ankylopoeticahoz társuló osteoporosis
 Spondylitis ankylopoeticahoz társuló osteoporosis Szántó Sándor DE OEC, Reumatológiai Tanszék 2013.11.05. Szeminárium Csontfelszivódás és csontképzés SPA-ban egészséges előrehaladott SPA Spondylitis ankylopoetica
Spondylitis ankylopoeticahoz társuló osteoporosis Szántó Sándor DE OEC, Reumatológiai Tanszék 2013.11.05. Szeminárium Csontfelszivódás és csontképzés SPA-ban egészséges előrehaladott SPA Spondylitis ankylopoetica
A valós életből nyert adatok jelentősége reumatológiai kórképekben
 A valós életből nyert adatok jelentősége reumatológiai kórképekben Dr. Donáth Judit Országos Reumatológiai és Fizioterápiás Intézet, Budapest HALADÁS A REUMATOLÓGIA ÉS OSTEOLÓGIA TERÜLETÉN 2015-2018 2019.
A valós életből nyert adatok jelentősége reumatológiai kórképekben Dr. Donáth Judit Országos Reumatológiai és Fizioterápiás Intézet, Budapest HALADÁS A REUMATOLÓGIA ÉS OSTEOLÓGIA TERÜLETÉN 2015-2018 2019.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE RoActemra 20 mg/ml koncentrátum oldatos infúzióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A koncentrátum 20 mg tocilizumabot* tartalmaz milliliterenként.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE RoActemra 20 mg/ml koncentrátum oldatos infúzióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A koncentrátum 20 mg tocilizumabot* tartalmaz milliliterenként.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
I. melléklet. Az Európai Gyógyszerügynökség által kiadott elutasítással kapcsolatos tudományos következtetések és indoklások
 I. melléklet Az Európai Gyógyszerügynökség által kiadott elutasítással kapcsolatos tudományos következtetések és indoklások 1 Az Európai Gyógyszerügynökség által kiadott elutasítással kapcsolatos tudományos
I. melléklet Az Európai Gyógyszerügynökség által kiadott elutasítással kapcsolatos tudományos következtetések és indoklások 1 Az Európai Gyógyszerügynökség által kiadott elutasítással kapcsolatos tudományos
és biztonságoss Prof. Dr. János J CHMP member Hungary
 Gyógyszerek hatásoss sossága és biztonságoss gosságaga Prof. Dr. János J Borvendég CHMP member Hungary A ma gyógyszerkutat gyszerkutatásának legfontosabb célbetegségei: gei: malignus betegségek gek cardiovascularis
Gyógyszerek hatásoss sossága és biztonságoss gosságaga Prof. Dr. János J Borvendég CHMP member Hungary A ma gyógyszerkutat gyszerkutatásának legfontosabb célbetegségei: gei: malignus betegségek gek cardiovascularis
A Kockázatkezelési Terv Összefoglalója
 1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
ELLENJAVALLAT: Ne alkalmazza a VPRIV-et, ha allergiás a velagluceráz-alfára vagy a gyógyszer egyéb összetevõjére.
 VPRIV 400 EGYSÉG POR OLDATOS INFÚZIÓHOZ VPRIV 400 egység por oldatos infúzióhoz velagluceráz-alfa HATÓANYAG: Velagluceráz-alfa. A 400 egység VPRIV port tartalmazó injekciós üveg 400 egység velagluceráz-alfát
VPRIV 400 EGYSÉG POR OLDATOS INFÚZIÓHOZ VPRIV 400 egység por oldatos infúzióhoz velagluceráz-alfa HATÓANYAG: Velagluceráz-alfa. A 400 egység VPRIV port tartalmazó injekciós üveg 400 egység velagluceráz-alfát
Metotrexát tabletta vagy injekció? Beviteli formák és hatékonyság
 Metotrexát tabletta vagy injekció? Beviteli formák és hatékonyság Dr. Vereckei Edit Országos Reumatológiai és Fizioterápiás Intézet, Budapest Haladás a reumatológia, immunológia és osteológia területén
Metotrexát tabletta vagy injekció? Beviteli formák és hatékonyság Dr. Vereckei Edit Országos Reumatológiai és Fizioterápiás Intézet, Budapest Haladás a reumatológia, immunológia és osteológia területén
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend)
 A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
Együttműködési lehetőségek spondyloarthritises betegek kezelésében
 Együttműködési lehetőségek spondyloarthritises betegek kezelésében A spondyloarthritis (SpA) fogalma Hasonló tünetek: spondyloarthritis, extraartikuláris manifesztációk (EAM), sacroileitis Nem differenciált
Együttműködési lehetőségek spondyloarthritises betegek kezelésében A spondyloarthritis (SpA) fogalma Hasonló tünetek: spondyloarthritis, extraartikuláris manifesztációk (EAM), sacroileitis Nem differenciált
Salmonella typhi (Ty2 törzs) Vi poliszacharidja
 1. A GYÓGYSZER NEVE Typherix oldat injekcióhoz előretöltött fecskendőben Hastífusz elleni poliszacharid vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina egy adagjának (0,5 ml) tartalma: Salmonella
1. A GYÓGYSZER NEVE Typherix oldat injekcióhoz előretöltött fecskendőben Hastífusz elleni poliszacharid vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina egy adagjának (0,5 ml) tartalma: Salmonella
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja
 A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009.
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009.
Gyermekkori Idiopátiás Artritisz
 www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Idiopátiás Artritisz Verzió 2016 3. DIAGNÓZIS ÉS TERÁPIA 3.1 Milyen laboratóriumi vizsgálatok szükségesek? A diagnóziskor bizonyos laboratóriumi
www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Idiopátiás Artritisz Verzió 2016 3. DIAGNÓZIS ÉS TERÁPIA 3.1 Milyen laboratóriumi vizsgálatok szükségesek? A diagnóziskor bizonyos laboratóriumi
Ap A p p e p n e d n i d x i
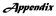 Appendix Infectio RA-ban GilesJT, Bartlett, SJ, Gelber AC, et al. Tumor necrosis factor inhibitor therapy and risk of serious postoperative orthopedic infection in rheumatoid arthritis. Arthritis Rheum.
Appendix Infectio RA-ban GilesJT, Bartlett, SJ, Gelber AC, et al. Tumor necrosis factor inhibitor therapy and risk of serious postoperative orthopedic infection in rheumatoid arthritis. Arthritis Rheum.
INTRACELLULÁRIS PATOGÉNEK
 INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
Biológiai kezelés gyulladásos mozgásszervi kórképekben: Múlt, jelen, jövő
 Biológiai kezelés gyulladásos mozgásszervi kórképekben: Múlt, jelen, jövő Dr. Poór Gyula Országos Reumatológiai és Fizioterápiás Intézet Semmelweis Egyetem Reumatológiai és Fizioterápiás Tanszéki Csoport
Biológiai kezelés gyulladásos mozgásszervi kórképekben: Múlt, jelen, jövő Dr. Poór Gyula Országos Reumatológiai és Fizioterápiás Intézet Semmelweis Egyetem Reumatológiai és Fizioterápiás Tanszéki Csoport
MAGYAR GASZTROENTEROLÓGIAI TÁRSASÁG ENDOSZKÓPOS SZEKCIÓ ÉS AZ ERDÉLYI GASZTROENTEROLÓGUSOK NEGYEDIK KÖZÖS KONGRESSZUSA 2016. ÁPRILIS 22-24.
 MAGYAR GASZTROENTEROLÓGIAI TÁRSASÁG ENDOSZKÓPOS SZEKCIÓ ÉS AZ ERDÉLYI GASZTROENTEROLÓGUSOK NEGYEDIK KÖZÖS KONGRESSZUSA 2016. ÁPRILIS 22-24. Helyszín: Csíkszereda Jakab Antal Konferencia Központ Maros,
MAGYAR GASZTROENTEROLÓGIAI TÁRSASÁG ENDOSZKÓPOS SZEKCIÓ ÉS AZ ERDÉLYI GASZTROENTEROLÓGUSOK NEGYEDIK KÖZÖS KONGRESSZUSA 2016. ÁPRILIS 22-24. Helyszín: Csíkszereda Jakab Antal Konferencia Központ Maros,
Nemekre szabott terápia: NOCDURNA
 Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
Változott-e a fizioterápia jelentősége, a rehabilitáció team szerepe a biológiai terápia bevezetésével SPAban?
 Változott-e a fizioterápia jelentősége, a rehabilitáció team szerepe a biológiai terápia bevezetésével SPAban? Mikó Ibolya Országos Reumatológiai és Fizioterápiás Intézet ORFMMT XXXI. Vándorgyűlése 2012.
Változott-e a fizioterápia jelentősége, a rehabilitáció team szerepe a biológiai terápia bevezetésével SPAban? Mikó Ibolya Országos Reumatológiai és Fizioterápiás Intézet ORFMMT XXXI. Vándorgyűlése 2012.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE STELARA 45 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 45 mg/0,5 ml usztekinumab injekciós üvegenként. Az usztekinumab egér myeloma
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE STELARA 45 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 45 mg/0,5 ml usztekinumab injekciós üvegenként. Az usztekinumab egér myeloma
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE ORENCIA 250 mg por oldatos infúzióhoz való koncentrátumhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 250 mg abatacept injekciós üvegenként. Feloldás után
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE ORENCIA 250 mg por oldatos infúzióhoz való koncentrátumhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 250 mg abatacept injekciós üvegenként. Feloldás után
Fulvesztrant szerepe az előrehaladott emlőrák kezelésében St. Gallen 2013 Dr. Maráz Róbert
 Fulvesztrant szerepe az előrehaladott emlőrák kezelésében St. Gallen 2013 Dr. Maráz Róbert Kecskemét Május 18. Az előadás az AstraZeneca Kft. felkérésére készült Engedélyszám: PEFA0134HU20130516 Kiknél
Fulvesztrant szerepe az előrehaladott emlőrák kezelésében St. Gallen 2013 Dr. Maráz Róbert Kecskemét Május 18. Az előadás az AstraZeneca Kft. felkérésére készült Engedélyszám: PEFA0134HU20130516 Kiknél
A biológiai terápiák biztonságossága
 A biológiai terápiák biztonságossága Juhász Péter Országos Reumatológiai és Fizioterápiás Intézet Haladás a reumatológia, immunológia és osteológia területén 2013-2015 2016. április 14-15. Budapest, Hotel
A biológiai terápiák biztonságossága Juhász Péter Országos Reumatológiai és Fizioterápiás Intézet Haladás a reumatológia, immunológia és osteológia területén 2013-2015 2016. április 14-15. Budapest, Hotel
II. melléklet. Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása
 II. melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 7 Tudományos következtetések A Cymevene i.v. és kapcsolódó nevek (lásd I. melléklet)
II. melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 7 Tudományos következtetések A Cymevene i.v. és kapcsolódó nevek (lásd I. melléklet)
MabThera. rituximab. Milyen típusú gyógyszer a MabThera? Milyen betegségek esetén alkalmazható a MabThera? EPAR-összefoglaló a nyilvánosság számára
 EMA/614203/2010 EMEA/H/C/000165 EPAR-összefoglaló a nyilvánosság számára rituximab Ez a dokumentum a -ra vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az emberi
EMA/614203/2010 EMEA/H/C/000165 EPAR-összefoglaló a nyilvánosság számára rituximab Ez a dokumentum a -ra vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az emberi
I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Xolair 75 mg por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 75 mg omalizumab injekciós üvegenként.
I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Xolair 75 mg por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 75 mg omalizumab injekciós üvegenként.
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
Allergia immunológiája 2012.
 Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Regiszterekből szerzett klinikai tapasztalatok JAK-gátlókkal
 Regiszterekből szerzett klinikai tapasztalatok JAK-gátlókkal Pálinkás Márton Országos Reumatológiai és Fizioterápiás Intézet Haladás a reumatológia, immunológia és az osteológia területén 2016-2018 2019.
Regiszterekből szerzett klinikai tapasztalatok JAK-gátlókkal Pálinkás Márton Országos Reumatológiai és Fizioterápiás Intézet Haladás a reumatológia, immunológia és az osteológia területén 2016-2018 2019.
A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási protokollja
 A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértıi és Szakmai Ellenırzési Fıosztály Budapest, 2010. február
A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértıi és Szakmai Ellenırzési Fıosztály Budapest, 2010. február
Az arthritis psoriatica diagnosztikájának és kezelésének finanszírozási protokollja
 Az arthritis psoriatica diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
Az arthritis psoriatica diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
III. melléklet. Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások
 III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS. origamigroup. www.origami.co.hu
 BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
Az oldat tartalma milliliterenként: humán plazmaprotein... 200 mg (legalább 98%-os tisztaságú IgG)
 1. A GYÓGYSZER MEGNEVEZÉSE Hizentra 200 mg/ml oldatos injekció bőr alá történő beadásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán normál immunglobulin (SCIg). Az oldat tartalma milliliterenként: humán
1. A GYÓGYSZER MEGNEVEZÉSE Hizentra 200 mg/ml oldatos injekció bőr alá történő beadásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán normál immunglobulin (SCIg). Az oldat tartalma milliliterenként: humán
Az intravénás immunglobulin hatásmechanizmusa és alkalmazási köre a klinikai immunológiában
 Az intravénás immunglobulin hatásmechanizmusa és alkalmazási köre a klinikai immunológiában Dr. Bazsó Anna ORFI Klinikai Immunológiai, Felnőtt-és Gyermekreumatológiai Osztály Haladás a reumatológia, immunológia
Az intravénás immunglobulin hatásmechanizmusa és alkalmazási köre a klinikai immunológiában Dr. Bazsó Anna ORFI Klinikai Immunológiai, Felnőtt-és Gyermekreumatológiai Osztály Haladás a reumatológia, immunológia
Tapasztalataink súlyos pikkelysömör adalimumab kezelésével* Adalimumab treatment of severe psoriasis
 BÔRGYÓGYÁSZATI ÉS VENEROLÓGIAI SZEMLE 85. ÉVF. 6. 283 288. Szegedi Tudományegyetem, Általános Orvostudományi Kar, Szent-Györgyi Albert Klinikai Központ, Bôrgyógyászati és Allergológiai Klinika (igazgató:
BÔRGYÓGYÁSZATI ÉS VENEROLÓGIAI SZEMLE 85. ÉVF. 6. 283 288. Szegedi Tudományegyetem, Általános Orvostudományi Kar, Szent-Györgyi Albert Klinikai Központ, Bôrgyógyászati és Allergológiai Klinika (igazgató:
Immunológia alapjai. Az immunválasz szupressziója Előadás. A szupresszióban részt vevő sejtes és molekuláris elemek
 Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
A perzisztencia jelentősége a gyulladásos reumatológiai betegségek kezelésében
 A perzisztencia jelentősége a gyulladásos reumatológiai betegségek kezelésében Dr. Donáth Judit Országos Reumatológiai és Fizioterápiás Intézet, Budapest HALADÁS A REUMATOLÓGIA ÉS OSTEOLÓGIA TERÜLETÉN
A perzisztencia jelentősége a gyulladásos reumatológiai betegségek kezelésében Dr. Donáth Judit Országos Reumatológiai és Fizioterápiás Intézet, Budapest HALADÁS A REUMATOLÓGIA ÉS OSTEOLÓGIA TERÜLETÉN
Az új 223 Ra-s radioizotóppal való kezelés logisztikai feladatai
 MAGYAR HONVÉDSÉG EGÉSZSÉGÜGYI KÖZPONT MH EK Honvédkórház a Semmelweis Egyetem Általános Orvostudományi Kar Oktató Kórháza 1134 Budapest, Róbert Károly krt. 44 Az új 223 Ra-s radioizotóppal való kezelés
MAGYAR HONVÉDSÉG EGÉSZSÉGÜGYI KÖZPONT MH EK Honvédkórház a Semmelweis Egyetem Általános Orvostudományi Kar Oktató Kórháza 1134 Budapest, Róbert Károly krt. 44 Az új 223 Ra-s radioizotóppal való kezelés
VII. szegedi Diabétesz nap. 6722 Szeged, Ady tér 10.
 VII. szegedi Diabétesz nap s z e g e d, 2 01 2. o k t ó b e r 1 2 1 3. SZTE József Attila Tanulmányi és Információs Központ 6722 Szeged, Ady tér 10. PROGRAM VII. SZEGEDI DIABÉTESZ NAP Megújult vércukor
VII. szegedi Diabétesz nap s z e g e d, 2 01 2. o k t ó b e r 1 2 1 3. SZTE József Attila Tanulmányi és Információs Központ 6722 Szeged, Ady tér 10. PROGRAM VII. SZEGEDI DIABÉTESZ NAP Megújult vércukor
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA. RoActemra 20 mg/ml koncentrátum oldatos infúzióhoz Tocilizumab
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA RoActemra 20 mg/ml koncentrátum oldatos infúzióhoz Tocilizumab Mielőtt elkezdené alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA RoActemra 20 mg/ml koncentrátum oldatos infúzióhoz Tocilizumab Mielőtt elkezdené alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót
Teljes élet SPA-ban, új reumatológiai kezelési lehetőségek
 Teljes élet SPA-ban, új reumatológiai kezelési lehetőségek Szántó Sándor Debreceni Egyetem, Orvos- és Egészségtudományi Centrum Reumatológiai Tanszék SPA romlása megfelelő kezelés hiányában Krónikus gerincelváltozások
Teljes élet SPA-ban, új reumatológiai kezelési lehetőségek Szántó Sándor Debreceni Egyetem, Orvos- és Egészségtudományi Centrum Reumatológiai Tanszék SPA romlása megfelelő kezelés hiányában Krónikus gerincelváltozások
942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát mg nátrium-klorid) filmtablettánként.
 1. A GYÓGYSZER MEGNEVEZÉSE Dona 750 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát + 192 mg nátrium-klorid) filmtablettánként. A segédanyagok
1. A GYÓGYSZER MEGNEVEZÉSE Dona 750 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát + 192 mg nátrium-klorid) filmtablettánként. A segédanyagok
ECALTA 100 MG POR ÉS OLDÓSZER OLDATOS INFÚZIÓHOZ VALÓ KONCENTRÁTUMHOZ
 ECALTA 100 MG POR ÉS OLDÓSZER OLDATOS INFÚZIÓHOZ VALÓ KONCENTRÁTUMHOZ ECALTA 100 mg por és oldószer oldatos infúzióhoz való koncentrátumhoz Anidulafungin HATÓANYAG: Anidulafungin. 100 mg anidulafungin
ECALTA 100 MG POR ÉS OLDÓSZER OLDATOS INFÚZIÓHOZ VALÓ KONCENTRÁTUMHOZ ECALTA 100 mg por és oldószer oldatos infúzióhoz való koncentrátumhoz Anidulafungin HATÓANYAG: Anidulafungin. 100 mg anidulafungin
Minden adag Azomyr szájban diszpergálódó tabletta 5 mg dezloratadint tartalmaz.
 1 A GYÓGYSZER MEGNEVEZÉSE Azomyr 5 mg szájban diszpergálódó tabletta 2 MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden adag Azomyr szájban diszpergálódó tabletta 5 mg dezloratadint tartalmaz A segédanyagok teljes
1 A GYÓGYSZER MEGNEVEZÉSE Azomyr 5 mg szájban diszpergálódó tabletta 2 MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden adag Azomyr szájban diszpergálódó tabletta 5 mg dezloratadint tartalmaz A segédanyagok teljes
Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye alapján jött létre.
 II. melléklet Az alkalmazási előírás és a betegtájékoztató módosítása az Európai Gyógyszerügynökség előterjesztésére Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye
II. melléklet Az alkalmazási előírás és a betegtájékoztató módosítása az Európai Gyógyszerügynökség előterjesztésére Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye
Betegtájékoztató CEREZYME 400 E POR OLDATOS INFÚZIÓHOZ VALÓ KONCENTRÁTUMHOZ
 CEREZYME 400 E POR OLDATOS INFÚZIÓHOZ VALÓ KONCENTRÁTUMHOZ Cerezyme 400 egység por oldatos infúzióhoz való koncentrátumhoz Imigluceráz HATÓANYAG: Imigluceráz. Az imigluceráz a savas -glükozidáz emberi
CEREZYME 400 E POR OLDATOS INFÚZIÓHOZ VALÓ KONCENTRÁTUMHOZ Cerezyme 400 egység por oldatos infúzióhoz való koncentrátumhoz Imigluceráz HATÓANYAG: Imigluceráz. Az imigluceráz a savas -glükozidáz emberi
VeyFo. VeyFo Jungtier - Oral Mulgat
 VeyFo VeyFo Jungtier - Oral Mulgat Különleges táplálási igényeket kielégítő/diétás/ kiegészítő takarmány borjak, malacok, bárányok, kecskegidák és kutyák részére Használati utasítás Trimetox 240 oldat
VeyFo VeyFo Jungtier - Oral Mulgat Különleges táplálási igényeket kielégítő/diétás/ kiegészítő takarmány borjak, malacok, bárányok, kecskegidák és kutyák részére Használati utasítás Trimetox 240 oldat
A rheumatoid arthritis diagnosztikája és kezelése
 A rheumatoid arthritis diagnosztikája és kezelése Finanszírozási protokoll háttéranyaga Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009. augusztus
A rheumatoid arthritis diagnosztikája és kezelése Finanszírozási protokoll háttéranyaga Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009. augusztus
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen e gyógyszer körültekintő bevétele.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ACC 100 granulátum BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA ACC
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ACC 100 granulátum BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA ACC
A spondylitis ankylopoetica (SPA) és terápiája. Szántó Sándor
 A spondylitis ankylopoetica (SPA) és terápiája Szántó Sándor DE OEC, Reumatológiai Tanszék Spondylarthritisek (SpA) és spondylitis ankylopoetica (SPA) Nem differenciált SpA Juvenilis SpA Arthritis colitis
A spondylitis ankylopoetica (SPA) és terápiája Szántó Sándor DE OEC, Reumatológiai Tanszék Spondylarthritisek (SpA) és spondylitis ankylopoetica (SPA) Nem differenciált SpA Juvenilis SpA Arthritis colitis
Biológiai terápiák a rheumatoid arthritis kezelésében
 Biológiai terápiák a rheumatoid arthritis kezelésében Dr. Vittay Pál, Dr. Jóna Gabriella, Nádudvari Nóra, Péter Tünde, Egészségügyi Stratégiai Kutatóintézet A rheumatoid arthritis (RA) olyan idült, progresszív,
Biológiai terápiák a rheumatoid arthritis kezelésében Dr. Vittay Pál, Dr. Jóna Gabriella, Nádudvari Nóra, Péter Tünde, Egészségügyi Stratégiai Kutatóintézet A rheumatoid arthritis (RA) olyan idült, progresszív,
Mellékhatás menedzsment költségének változása az onkoterápia fejlődésével nem-kissejtes tüdőrák esetében
 Mellékhatás menedzsment költségének változása az onkoterápia fejlődésével nem-kissejtes tüdőrák esetében 2017. 06. 23. BERKI JÚLIA 1, VÁRNAI MÁTÉ 1, DR. RUMSZAUER ÁGNES 1, DR. GERENCSÉR ZSOLT 1, RÓZSA
Mellékhatás menedzsment költségének változása az onkoterápia fejlődésével nem-kissejtes tüdőrák esetében 2017. 06. 23. BERKI JÚLIA 1, VÁRNAI MÁTÉ 1, DR. RUMSZAUER ÁGNES 1, DR. GERENCSÉR ZSOLT 1, RÓZSA
Újdonságok a krónikus urticaria területén* New aspects in the field of chronic urticara
 BÔRGYÓGYÁSZATI ÉS VENEROLÓGIAI SZEMLE 2014 90. ÉVF. 6. 293 297. Újdonságok a krónikus urticaria területén* New aspects in the field of chronic urticara SZEGEDI ANDREA DR. Debreceni Egyetem, Klinikai Központ,
BÔRGYÓGYÁSZATI ÉS VENEROLÓGIAI SZEMLE 2014 90. ÉVF. 6. 293 297. Újdonságok a krónikus urticaria területén* New aspects in the field of chronic urticara SZEGEDI ANDREA DR. Debreceni Egyetem, Klinikai Központ,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS. A gyógyszerkészítmény forgalomba hozatali engedélye megszűnt
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Trudexa 40 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós üvegben. Az adalimumab
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Trudexa 40 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós üvegben. Az adalimumab
A progresszió megállításának jelentősége és lehetőségei rheumatoid arthritisben: a T2T stratégia aktuális vonatkozásai
 A progresszió megállításának jelentősége és lehetőségei rheumatoid arthritisben: a T2T stratégia aktuális vonatkozásai Polgár Anna Országos Reumatológiai és Fizioterápiás Intézet Haladás a reumatológia,
A progresszió megállításának jelentősége és lehetőségei rheumatoid arthritisben: a T2T stratégia aktuális vonatkozásai Polgár Anna Országos Reumatológiai és Fizioterápiás Intézet Haladás a reumatológia,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
1 Országos Reumatológiai és Fizioterápiás Intézet, Budapest 2 Marosvásárhelyi Orvosi és Gyógyszerészeti Egyetem, Marosvásárhely
 Klinikai tanulmány Clinical study A biológiai és a hagyományos betegségmódosító terápia hatékonyságának összehasonlító vizsgálata magyarországi rheumatoid arthritises betegekben: az ABRAB-vizsgálat első
Klinikai tanulmány Clinical study A biológiai és a hagyományos betegségmódosító terápia hatékonyságának összehasonlító vizsgálata magyarországi rheumatoid arthritises betegekben: az ABRAB-vizsgálat első
Katasztrófális antifoszfolipid szindróma
 Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Simponi 50 mg oldatos injekció előretöltött injekciós tollban. Simponi 50 mg oldatos injekció előretöltött fecskendőben. 2. MINŐSÉGI ÉS MENNYISÉGI
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Simponi 50 mg oldatos injekció előretöltött injekciós tollban. Simponi 50 mg oldatos injekció előretöltött fecskendőben. 2. MINŐSÉGI ÉS MENNYISÉGI
Az immunválasz akadálymentesítése újabb lehetőségek a daganatok a immunterápiájában
 a Magyar Tudományos Akadémia Biológiai Osztály, Immunológiai Bizottsága és a Magyar Immunológiai Társaság Immunológia Világnapja - 2016 Az immunválasz akadálymentesítése újabb lehetőségek a daganatok a
a Magyar Tudományos Akadémia Biológiai Osztály, Immunológiai Bizottsága és a Magyar Immunológiai Társaság Immunológia Világnapja - 2016 Az immunválasz akadálymentesítése újabb lehetőségek a daganatok a
Válasz Dr. Szűcs Gabriellának Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére
 Válasz Dr. Szűcs Gabriellának Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére Köszönöm Dr. Szűcs Gabriella részletes, bírálatát, megjegyzéseit. A megfogalmazott kérdésekre az alábbiakban
Válasz Dr. Szűcs Gabriellának Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére Köszönöm Dr. Szűcs Gabriella részletes, bírálatát, megjegyzéseit. A megfogalmazott kérdésekre az alábbiakban
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Humira 40 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós üvegben. Az adalimumab egy
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Humira 40 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós üvegben. Az adalimumab egy
ÚJ TÁMADÁSPONT A SPONDYLOARTHRITISEK KEZELÉSÉBEN: IL-17 GÁTLÁS SECUKINUMABBAL
 ÚJ TÁMADÁSPONT A SPONDYLOARTHRITISEK KEZELÉSÉBEN: IL-17 GÁTLÁS SECUKINUMABBAL 1 Bálint Péter Országos Reumatológiai és Fizioterápiás Intézet III. Reumatológiai Osztály HALADÁS A REUMATOLÓGIA, IMMUNOLÓGIA
ÚJ TÁMADÁSPONT A SPONDYLOARTHRITISEK KEZELÉSÉBEN: IL-17 GÁTLÁS SECUKINUMABBAL 1 Bálint Péter Országos Reumatológiai és Fizioterápiás Intézet III. Reumatológiai Osztály HALADÁS A REUMATOLÓGIA, IMMUNOLÓGIA
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
Az immunológia alapjai
 Az immunológia alapjai 8. előadás A gyulladásos reakció kialakulása: lokális és szisztémás gyulladás, leukocita migráció Berki Timea Lokális akut gyulladás kialakulása A veleszületeh és szerzeh immunitás
Az immunológia alapjai 8. előadás A gyulladásos reakció kialakulása: lokális és szisztémás gyulladás, leukocita migráció Berki Timea Lokális akut gyulladás kialakulása A veleszületeh és szerzeh immunitás
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 40 mg/0,8 ml oldatos injekció gyermekgyógyászati alkalmazásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 40 mg/0,8 ml oldatos injekció gyermekgyógyászati alkalmazásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
Rheumatoid arthritis kezelésének aktuális kérdései és új útjai
 Rheumatoid arthritis kezelésének aktuális kérdései és új útjai Dr. Kádár Gabriella ÚJDONSÁGOK A REUMATOLÓGIA, IMMUNOLÓGIA ÉS FIZIOTERÁPIA TERÜLETÉN 2018. Január 25-27. Rheumatoid arthritises (RA) betegek
Rheumatoid arthritis kezelésének aktuális kérdései és új útjai Dr. Kádár Gabriella ÚJDONSÁGOK A REUMATOLÓGIA, IMMUNOLÓGIA ÉS FIZIOTERÁPIA TERÜLETÉN 2018. Január 25-27. Rheumatoid arthritises (RA) betegek
