A kémiai kötés A klasszikus alapokon nyugvóelektronoktett- elmélet
|
|
|
- Albert Borbély
- 5 évvel ezelőtt
- Látták:
Átírás
1 A kémiai kötés A klasszikus alapokon nyugvóelektronoktett- elmélet Az atomok többsége a nemesgázok kivétel a Földön instabil. Vegyületeket képeznek úgy, hogy nyílt héjuk lezárttá (nemesgáz elektronkonfigurációjúvá) váljon. ogy érik ezt el? A cél érdekében adott számú elektront A) Az ionos kötés (ha a két atom között az elektronnegatívitás különbsége nagy! ) következmény: igen stabil ionkristály pl. Li (ionkristály op. 680 o ) Li -e Li +e Li -e Li F +e F zárt héj mint a e zárt héj mint a e pl. LiF (ionkristály op. 845 o ) zárt héj mint a e zárt héj mint a Ne Pauling-féle elektronnegativitási érték K-héj e L-héj Li Be B N F Ne adnak le, - vesznek fel vagy - tesznek a közösbe.
2 A litium-hidrid molekula (Li) 3+1 elektron 2 betöltött M = 5.99 Debye (RF/3-21G) Li + Li Jelentős töltés-elkülönülés: EPS töltés Molekulapálya-energia (artree) A litium-fluorid molekula (LiF) 3+9 elektron 6 betöltött M = 5.74 Debye (RF/3-21G) M 2 ( ) M 1 ( ) Pozitív rész : alig van elektronsűrűség Li + F Li Jelentős töltéselkülönülés: 1 4 F EPS töltés memo: EPS := electrostatic potential surface
3 A szén nem tud 4 elektront leadni vagy 4 elektront felvenni ezért másként éri el a neonéhoz hasonló elektronszerkezetet B) A kovalens kötés (ha a két atom között az elektronnegatívitás különbsége kicsi ) 1) F (nem ionos hanem kovalens kötés poláris jelleggel) e + a protonnak nem lenne saját elektronja ezért nem is adja azt teljesen le. F + e F fluorid anion zárt héjú, mint a Ne + F F 2) 4 (kovalens kötés apoláris jelleggel) 4 + további példák: N N + Lewis-féle szerkezet
4 Kémiai reakció hajtóereje lehet pl. az ellentétes töltések vonzása: Li + + Li Li Variáció egy témára: a reakció nem megy, mert se a metán sem a víz nem elég poláris: De a reakció persze eredményes, 1) ha a metánt ammóniára cseréljük: 4 N N 3 + N 4 + 2) vagy ha a vizet mágikus savra cseréljük: A hidridion nehezen viseli a negatív töltést, ezért megkeresi pozitív párját a protont ( + ). A reakció sikeréhez az is kell, hogy 1) a protondonor poláris legyen (víz), valamint 2) deprotonált formában ( ) stabil legyen. 2 S 2 F SbF
5 Li A szén önmagával és egy sor más eltérő elektron negativitású atommal képes kovalens kötéseket létesíteni: Li F Gyémántrács (sp 3 szenek) Grafitrács (sp 2 szenek) 2,3-dimetilpentán 3,3-dimetilhexán Fenantrén 2,3-dimetilpentán 3,3-dimetilhexán
6 A szénvegyületek sikere a lehetséges izomerek nagy számában rejlik: 2 2 2n+2 2 2n+1 X X 1 3 X 2 X 4 X X X fajta 18 fajta 9 fajta 74 fajta
7 feladat: leírni az atommagok elrendeződését, az elektronszerkezetet. A képletírás Gilbert N. Lewis Mielőtt leírjuk a salétromsav Lewis képletét, azelőtt tudnunk kell az atommagok elrendeződését (konnektivitását) pl. N 3 -ban nincs,n kötés. G.N. Lewis és W. Kössel (1916 azaz a kvantummechanika születése előtt ) A Lewis-féle szerkezet: épitőelemek: -az elem vegyjele az atomtörzset jelöli ( azaz vegyértékelektronok számának megfelelő pozitív töltést is a vegyjel szimbolizálja.) pl. a szimbólum négyszeresen pozitív. -a vegyértékelektronokat egy-egy pont jelöli A semleges atom tehát a vegyértékelektronjaival körülvett atomtörzs. N kovalens kötés : egy elektronpár megosztását jelenti két atom között (egyetlen vonallal jelölünk) nemkötő elektronpár : csupán egyetlen atomtörzshöz kapcsolódó két elektron (pontpárként tüntetjük fel).
8 ktettszabály: amikor Lewis-féle szerkezeteket írunk, akkor csak a vegyértékelektronokat tüntetjük fel. A második periódus elemeire a Ne elektronkonfiguráció eléréséhez maximum 8 vegyértékelektron szükséges. Ezt az állapotot a molekulát vagy iont felépítő atomok egyes vegyértékelektronjaik közreadásával érnek el. 2 + Kivételek az oktettszabály alól: - az elektronhiányos atomok esete: pl. BF 3 2 F + + B F F B F F F 6 elektron - a nem második periódusbeli atomok esete: pl. S 2-4 vagy Pl 5 10 elektron l l l P l l P l l l Töltés = (vegyértékelektronok száma) -( asszignált elektronok száma) 1-1=0 töltése 5-5=0 l N töltése N l N S S 12 elektron 5-4= +1 memo: az ammónium N töltése 1-1=0 töltése kationban a nitrogénhez csak 4 e rendelhető
9 +1 töltés zeró töltés -1 töltés B B N N N N N N N N X X X X = F, l, Br, J
10 Rezonancia vagy határszerkezetek: Bizonyos molekulák esetében egyetlen Lewis-képlet nem írja le helyesen az elektronszerkezetet. Ilyenkor jobb híján több Lewis-szerkezetet írunk fel, amelyek között egyenlő értékűek is találhatók. A rezonanciaelmélet szerint ezek a szerkezetek fiktívek, amelyek közül a valóságot önmagában egyikük sem írja le helyesen. Ezeket határszerkezeteknek hívjuk és a tényleges molekulaszerkezetet összességükkel jellemezzük. (Görbe nyilak az elektonpárok mozgatását mutatják, azt ahogy a következő fiktív szerkezethez eljuthatunk.) Ekvivalens határszerkezetek: pl. 3 2 vagy N N N N N rezonancia vagy határszerkezetek hibridszerkezet
11 Nem-ekvivalens határszerkezetek: pl. 2 vagy 2 N 2 + A) neutrális (formaldehid) is is oktett nincs töltésszétválás nem oktett töltésszétválás magyarázza a dipolt B) töltött (metilénammónium kation) fõ határszerkezet N is N is oktett fõ határszerkezet mellék határszerkezet N nem oktett mellék határszerkezet
12 Bevezetés a parányok világba cél: pontszerű részecskék állapotának definiálása: megoldás: két vektor megadása 1. pozíció vektor (r) 2. impulzus (lendület) vektor (p) ahol p = mv memo: az objektum lehet akár a hold, akár egy biliárdgolyó példa: tekintsük egy adott röppályán tovahaladó golyót a Q 1 és Q 2 pontokban ahol Dx = r 1 r 2 és Dp = p 1 p 2 Q 1 p 2 klasszikus világ: rendre megfigyeljük a p és az r vektorok nagyságát és irányát, tehát bármilyen kicsi Dx és Dp értelmezett p 1 Q 2 memo: ezt a megfigyelést megtehetjük akármilyen pontosan a rendszer megzavarása nélkül! a például a megfigyelést fotonokkal végezzük ( tehát nézünk ), amelynek a golyókkal vett kölcsönhatásától eltekinthetünk, mert azok mérete igen különböző, akkor valóban nincs megzavarás. r 2 r 1 Dp Dx
13 atomi világ: a p és az r vektor nagyságának és irányának megfigyelése csak adott pozíciókülönbség (hiba) (Dx és Dp) mellett végezhető el. memo: a rendszer elvileg sem figyelhető meg, annak megzavarása nélkül! A megfigyelést pl. fotonokkal végezzük, amelyeknek az elektronokkal vett kölcsönhatásától nem tekinthetünk el. A mérő-mérendő összevethetősége miatt egy adott szintű bizonytalanság mindig jelen van. eisenberg-féle bizonytalansági reláció : DxDp ћ/2 analógia: sötétben egy biliárdgolyó pozícióját az asztalon úgy szeretnénk meghatározni, hogy egy másik golyót gurítunk és figyelünk a reménybeli ütközéskori koccanásra. Ekkor beavatkozunk a megfigyelés során, s az eredeti állapot megváltozatjuk! a a kölcsönhatás után lámpát gyújtunk akkor láthatjuk hogy elvileg is más kell legyen az új állapot, mint volt a megfigyelendő rendszer a megfigyelés előtt. memo: Planck-féle állandó h 6, Js (ћ = h/2 ) elektron nyugalmi tömege: 9, kg foton tömege adott hullámhosszú fény esetén (h = mc 2 alapján)
14 klasszikus világ a golyó egy s-típusú pálya mentén halad kvantum rendszer az elektron a s-típusú atompálya akár belső akár külső térrészében bárhol lehet, p 1 r 1 r 2 p 2 A hely- és impulzusvektorok összességének ismeretében a golyó előfordulási valószínűsége a pálya egy adott pontján megadható. Pl. kinetikus energia? T = p 2 /2m (mennyiség) de nem azonos valószínűséggel. ullámfüggvényt használunk a helyvektor szerepkörében. T = ½ 2 (operátor) ahol 2 = 2 / x / y / z 2
15 Fizikai modell Állapot Fizikai mennyiség Mérés Időfejlődés Fizikai modell Állapot Fizikai mennyiség Klasszikus mechanika r: koordináta p: lendület f(r,p) <f>=f(r,p) Newton egyenlet: Kvantummechanika fˆ rˆ f r d m dt 2 F 2 Ψ(r 1, r N ), komplex függvény (rˆ, pˆ ) * dr1,..., r pˆ i i 3 1 e N r r Mérés Időfejlődés fˆ * f (rˆ, pˆ) dr Schrödinger egyenlet: i t
16 Sajátérték, sajátfüggvény függvény: egy számhoz egy számot rendel operátor: egy függvényre hatva egy új függvényt hoz létre operátor. (függvény) = új függvény Pl. legyen az operátor a d/dx (memo: deriváljunk x szerint) legyen a függvény a sin(x): d/dx[sin(x)] = cos(x) Egy operátorhoz tartozhatnak olyan függvények is(!), amelyek az operátor hatása után a kiindulási függvénytől csak egy konstansban különböznek. Ezek a függvények az operátor un. sajátfüggvényei. operátor. (függvény) = konst. (függvény) Pl. legyen az operátor a d/dx legyen a függvény az exp(ax) : d/dx[exp(ax)] = a exp(ax) memo: d/dx[sin(ax)] = a cos(ax) konst sin(ax) Tehát a sin(ax) nem sajátfüggvénye a d/dx differenciál operátornak. Viszont az exp(ax) sajátfüggvénye a d/dx operátornak, és az a konstans az operátor sajátértéke.
17 A kémiai kötés leírása kvantumkémiai alapokon Bohr féle atommodell: egy negatív korpuszkula kering a pozitív magok erőterében. megjegyzés: hétköznapi világ: egy test impulzusa és helye egyszerre megadható tetszésszerinti pontossággal en szeres kicsinyítés 1 m 0.1nm=Â az atommagot klasszikus részecskeként kezeljük de az elektront nem! Az elektron nem hagyományos objektum. atomi mérettartomány: egy részecskék impulzusa és helye nem adható meg egyszerre tetszésszerinti pontossággal kísérlet: a rossz kérdés: a jó kérdés: d tegyünk egy elektront egy dobozba (potenciál (V) fal). hol lesz az elektron? mekkora a valószínűsége annak, hogy az elektron a d térfogatelemben van? Mekkora a kinetikus energiája (E)? E=mv 2 /2=p 2 /2m ahol v a részecske sebessége, p annak impulzusa de Broglie: p=nh/2l
18 Az 1D modell V= V=0 d V= peremfeltétel: 0 x L a részecskének a falon belül csak kinetikus energiája van. részecske jellemzése : kinetikus energia E n = n 2 h 2 /8mL 2 n=1,2, hullámfüggvény n = (2/L) 1/2 sin(n x/l) hullámfüggvény négyzete ( n ) 2 ami megadja a d térfogatelemben a részecske tartózkodásának valószínűségét. fizikai állandók: h (Planck állandó = Js) változók: n (kvantumszám), L (1D doboz mérete) és m (részecske tömege) 1 n 2 n n 0 0,2 0,4 0,6 0, x/l n 0 0,2 0,4 0,6 0,8 1 x/l
19 következmények: 1. a részecske mindig mozog (zéró pont energia E n = h 2 /8mL 2 ), 2. a részecske energiája kvantált (nem gerjeszthető akárhogy), 3. az állapotok nem-degeneráltak, n=1 (alapállapot) legnagyobb valószínűséggel középen van a részecske, n=2 (gerjesztett állapot) középen soha nincs a részecske, n=3 (a következő gerjesztett állapot) már két csomósík van, azaz már két hely is van ahol soha sincs a részecske, V= V=0 V= d 0 0,2 0,4 0,6 0,8 1 0 x L 4. ha L csökken akkor a kinetikus energia nő, 5. a n (kvantumszám) értéke nő akkor az L mentén egyre egyenletesebb lesz a részecske eloszlása.
20
21 UV vörös(látható) ibolya(látható) IR megjegyzés: a részecske hullám természetű, ezért tartozik hozzá egy. Az 1D-dobozba akkor fér bele a részecske, ha az n* /2=L feltétel teljesül: stacionárius megoldás; állóhullám. (Furulya: n=1,2,3, felhangok a furulyán ha L a légoszlop hossza.) ullámfüggvény s=asin( t) és =2 /T= 2 f= 2 c/ s=asin(2 ct/ ) de ct=x s=asin(2 x/ ) de =2L/n s=asin( xn/l) tehát ezért ilyen alakú az s=s(x) függvény azaz a részecske hullámfüggvénye n = (2/L) 1/2 sin(n x/l) példa: E n-m = (n 2 -m 2 )(h 2 /8mL 2 ) E n-m n-ről m-re történő gerjesztés energiája csak L-től függ! Delokalizált elektronok száma (dobozhossz [L] ) 2 ( 2Â) 4 ( 5Â) 24 ( 30Â) ( 2n) ( 3nÂ) n 7 ev 5 ev 2-3 ev ev Gerjesztési energia ( M-LUM átmenet)
22 A nem-klasszikus atommodell: az elektronok állapota a magok erőterében térbeli állóhullámok segítségével írható le. Schrödinger féle hullámegyenlet megoldása ad: sajátfüggvényeket sajátértékeket. A közelítő sajátfüggvény ( ) atomok esetén az atompályákból (A [atomic orbital]), molekulák esetén a molekulapályákból (M [molecular orbital]) épülnek fel. 2 előjeles mennyiség a tér minden pontjában van értéke, de nincs fizikai jelentése. mindig pozitív, a tér minden pontjában van értéke, fizikai jelentése az elektronsűrűség. A) Az atomok elektronszerkezete A hidrogén szerű atom (van egzakt megoldás) A hidrogén atomra felírt Schrödinger egyenlet sajátfüggvényei adják a hidrogén atompályáit, sajátértékei a pályaenergiákat.
23 Sajátfüggvények: =R(r)Y(, ) (r,, polárkoordináták) s pályák esetén Y(, )=konstans=(1/4 ) 1/2 = R(r)(1/4 ) 1/2 amiből az R: radiális hullámfüggvények: n=1 1s s(r)=2 (Z/a 0 ) 3/2 exp(-2zr/2a 0 ) n=2 2s s(r)=1/8 1/2 (Z/a 0 ) 3/2 (2- Zr/a 0 )exp(-zr/2a 0 ) n=3 3s... Z= rendszám (atomic number) és a 0 = Bohr rádius ( m) a Z=1akkor : 1s s(r)a 0 3/2 =2exp(- r/a 0 ) 2s s(r)a 0 3/2 =1/8 1/2 (2- r/a 0 )exp(-r/2a 0 ) 1,8 1,3 0,8 0,3-0,2 s(r)a 0 3/2 1s 2s r/a ,30 0,25 0,20 0,15 0,10 0,05 0,00 {s(r)a 0 3/2 } 2 1s 2s r/a következmények: 1. a magnál (r/a 0 =0) mindig nagy az elektronsűrűség, 2. csomósíkok jelennek meg, 3. 2 megadja az elektronsűrűség értékét adott r/a 0 -nál, 4. 2 alatti terület (integrálja) a 0 és r/a 0 érték között megadja az r/a 0 gömbbe eső teljes elektronsűrűség értékét.
24 0,30 0,30 0,25 0,20 0,15 1s 0, ,20 1s 0,15 0,10 0,10 0,05 0,05 0, , Koncentrikus gömbhéjak, ahol az elektronsűrűség a 2 értéke (izofelület). Koncentrikus gömbök amelyen belül az elektronsűrűség a [0, r/a 0 ] értékre számított 2 értéke.
25 Sajátfüggvények: =R(r)Y(, ) (r,, polárkoordináták) p pályák radiális hullámfüggvények: 2p p(r)=1/(2*6 1/2 )(Z/a 0 ) 3/2 (Zr/a 0 ) exp(-zr/2a 0 ) 3p p(r)=1/(9*6 1/2 )(Z/a 0 ) 3/2 (4-2Zr/3a 0 )(2Zr/3a 0 )exp(-zr/3a 0 ) n=4 4p... Z= rendszám (atomic number) és a 0 = Bohr rádius ( m) a Z=1 : n=2 2p p(r)a 0 3/2 =1/(2*6 1/2 ) (r/a 0 ) exp(-r/2a 0 ) n=3 3p p(r)a 0 3/2 =1/(9*6 1/2 )(4-2r/3a 0 )(r/2a 0 ) exp(-r/3a 0 ) 0,16 0,12 0,08 0,04 0,00-0,04 P(r)a 0 3/2 2p 3p 0,025 0,020 0,015 0,010 0,005 {P(r)a 0 3/2 } 2 r/a , r/a 0 2p 3p következmények: 1. a magnál (r/a 0 =0) mindig zéró az elektronsűrűség, 2. csomósíkok jelennek meg. figyelem: 1. ez csak a radiális tényező, ebből még nem lesz súlyzó alak, csak ha az anguláris tényezőt is figyelembe vesszük.
26 Sajátértékek: E n = -(Z 2 e 4 / )1/n 2 n=1,2,3,.. ahol Z; a rendszám, ; a redukált tömeg, e ; az elemi töltés ( ), 0 ; a vákuum permeabilitása ( J -1 2 m -1 ) ; a Planck állandó/2 ( Js). minden energiaszint n 2 -szer degenerált (elfajult) ahol n a főkvantumszám : E 1 1-szeres degeneráltság 1s E 2 4-szeres degeneráltság 2s, 2p x, 2p z, 2p y E 3 9-szeres degeneráltság 3s, 3p x, 3p z, 3p y, 5db. 3d 0 n (főkvantumszám) memo.:ez az elfajulás csak a, e +, Li 2+, sorra igaz, ahol nincs elektron-elektron taszítás. a van, akkor a 2s már nem elfajult a 2p-pályákkal, s a 3s, sem a 3p sem a 3d pályákkal stb. De azok önmagukban (3db. 2p, 5db. 3d, stb.) továbbra is elfajultak maradnak: E 2px =E 2py =E 2pz. E n E 9 az elektron majdnem izolált már a magtól alig van energiacsökkenés. -1
27 A hidrogénatom () 1 elektron 2s 2p x 2p y 2p z 1s A szénatom () 6 elektron 2p x 2p y 2p z 2s 1s
28 A hidrogénatom () : 1 elektron 1 betöltött A 2p z A 3 (+1.069) E(RF/3-21G)= artree 2p y A 3 (+1.069) 4-szeresen degenerált A-k 2p x A 3 (+1.069) 2s A 2 (+1.069) z 1s A 1 ( ) y x
29 Bonyolultabb atomok (nincs egzakt megoldás) Az adott atomra felírt artree-fock egyenlet sajátfüggvényei adják meg az atom atompályáit, sajátértékei a pályaenergiákat. Pauli elv: a -szerű A-ra az elektronok párosával és ellentétes spinnel kerülnek fel, de maximum kettő. und-szabály: degenerált A-k esetén először minden A-ra csupán egy elektron kerül. Born-ppenheimer-közelítés: a magokat nyugvó tömegpontoknak és pontszerű töltésnek tekintjük amelyek erőterében mozognak az elektronok. stratégia: az összelektron-hullámfüggvényt (bonyolult atomok hullámfüggvényeit) egyetlen elektron állapotait leíró úgynevezett egyelektron-hullámfüggvényekből építjük fel. A Born-ppenheimer-közelítés értelmében a hullámfüggvény csak az elektronrendszer állapotaira vonatkozik. molekulapálya-módszer: egy molekula elektronszerkezetét különböző molekulapályákat elfoglaló elektronpárok alkotják. A molekulapályák egyelektron-hullámfüggvények: egyetlen elektron állapotát adják meg az összes mag és az összes többi elektron erőterében.
30 A neonatom (Ne) 10 elektron 5 betöltött A E(RF/3-21G)= artree artree z y x 2p x A 3 2p y A 4 2p z A 5 2s A artree 1s A artree
31 A hidrogénmolekula ( 2 ) 2 elektron 1 betöltött M = 0 Debye EPS töltés E(RF/3-21G)= artree (LUM) hidrogénmolekula lazító pályája * M 2 ( ) M 1 ( ) hidrogénmolekula kötő pályája (M) 1s A 1 ( ) hidrogén atompályája
32 Az N 2 7 (2*(2+5) elektron) M-jának származtatása RF/3-21G szinten számított értékek artree-ban ( ) ( ) ( ) ( ) z * z x * y * x y 2p y 2p z 2p ( ) 3-szorosan degenerált x Ahogy a N atom 3 db p- pályája, úgy az N 2 molekula mindkét -pályája degenerált. A kétatomos molekula betöltött M-i rendre alacsonyabb energiájúak mint a megfelelő A-k. Ezért stabil az N 2. ( ) ( ) ( ) ( ) * zárthéj 2s ( ) 1s ( ) Memo: csak az egyik N atom A-i vannak felrajzolva
33 Kétatomos homonukleáris molekulák:n 2 degenerált M-k x * M 10 EPS töltés = 0 Debye Memo.: 2*(2+5) elektron összesen 7 betöltött M 3 lazító pálya üres azaz hármas kötés van N N LUM M z * M 9 y * M 8 x M 7 z M 6 y M 5 * M 4 M 3 M 2 M 1 zárt héjak
34 Az F 2 7 M-jának származtatása 2*(2+7) elektron összesen 9 betöltött M x * z * Memo.: 1 lazító pálya üres azaz 1-es kötés van F F 2p x y * 2p x 2p z x 2p z 2p y z 2p y degenerált A-k y 2s * 2s z y x
35 Kétatomos homonukleáris molekulák:f 2 EPS töltés = 0 Debye Memo.: (F 2 )18 elektron 9 betöltött M LUM M M x * M 10 z * M 9 y * M 8 x M 7 z M 6 y M 5 * M 4 M 3 M 2 M 1 zárt héjak
36 Multiplicitás (Atkins 235) memo:2s+1 ahol S a párosítatlan e- száma * ½ B 2 : 2 : (pl. desztil. grafit gáz halmazállapotú szén) memo: ezt kiegészíti az a szingulett, amikor az egyik π e- spinje átfordul N 2 : párosítatlan e- száma =0 1 Σ (szingulett) z * z * z x * x 1 Σ (szingulett) x * y * y * y z * z dupla gerjeszt. 3 Σ x * x y * y z * z x * x y * y (triplett 3=2(½+½)+1) z * x * y * z x 1 Σ (szingulett) y dupla gerjeszt. 5 Σ z x y (quintuplett) 5=2(4*½) +1
37 Multiplicitás (Atkins 235) x * x * z * y * z * y * 2 (labilis tehát reaktív) : memo: π y,z és σ x M-k sorrendje felcserélődik. z * z x * x y * y 1 Σ (szingulett) F 2 (labilis, szétszakad és így reaktív) 3 Σ z x y (triplett) 2(2*½)+1) und-szab szerint. alacsony energ. gerjeszt. nincs amitől együtt maradjon két Ne atom (ugyanannyi kötő mint ahány lazító M) de: Ne gáz cseppfolyósítható (fp = 246 o ) (lop egy kevés elektront a szomszédtól) Ne 4 analógja, VDW (hidrofób-hidrofób) kcs. fehérje fold. z y x 1 Σ (szingulett) x * z * y * z y x 1 Σ (szingulett) Ne 2
38 Memo: az oxigén bekötése szerkezeti átrendeződést indukál 2 behúzza a is-t, ami elmozdítja az -helixet, ami további átrendeződéseket indukál. (Streyer 270 ) Az oxigén speciális reaktivitása (élet és halál) A kétatomos oxigén nyílt héjú molekula, amely triplett állapotú és így reaktívabb mint zárthéjú N 2 (N 2 / 2 :78/21) memo: - az oxigén az egy kettős gyök avagy diradikál - oxigén úgy is reaktív hogy nem szakad ketté, mint az F 2 élet (oxigén transzport) 2 2 N N 0.4Å N N N Fe 2+ N N is N is = Fe 2+
39 A fő gond tehát a szabadgyökök képződése A bruttó egyenlet: 2 + 4e A részletek: e e 2 oxigén molekula 2 szuperoxid anion hidrogén peroxid gyök hidrogén peroxid anion hidrogén peroxid e hidrogén peroxid hidroxid gyök e különösen reaktív ágens hidroxid gyök hidroxid anion víz
40 kérdés: hol rombolnak a szabadgyökök? válasz: például a membránban pl. tipikus telítetlen zsírsavrészlet: + 2 különösen reaktív gyökök (a szuperoxid anion és a hidrogénperoxid gyökök) károsítják a membránt z * z x * y * y z * z x * y * y igen reaktív, valódi gyökök x 2. hidrogénperoxid gyök 1 Σ (doublett) x 2 szuperoxid anion 1 Σ (doublett)
41 kérdés: kivédhető-e a rombolás? válasz: igen, pl. - és E-vitamin, szuperoxid dizmutáz ( ) kataláz ( ), peroxidáz ( ) 3 3 E-vitamin vicinális diol dupla enol -vitamin megvalósulás: egy redoxi ciklus NAD - -ból redukált redukélt forma forma nagy szerencse hogy az oxidáció gyökös mechanizmussal, de a redukció ionos mechanizmussal megy. Tehát egy NAD - molekula két gyököt iktat ki. oxidált forma
42 Kétatomos heteronukleáris molekulák (F) 10 elektron 5 betöltött M EPS töltés M 6 LUM ( ) M 5 M ( ) M 3 ( ) M 4 ( ) Degenerált M-k = Debye M 2 ( ) M 1 ( ) zárt héj
43 A összes M-ja (vö. N 2 M-val): RF/3-21G szinten számított értékek artree-ban N 2 ( ) N N x * ( ) ( ) z * y * ( ) ( ) ( ) ( ) z x y * ( ) ( ) ( ) memo: a σ, σ* és a σ x alkotják mindkét molekulában a szigmakötés és a két nemkötő e.pár megfelelőit (kanonikus pályák lokalizált pályák) ( ) ( ) ( ) ( ) zárthéj ( ) ( )
44 Metán ( 4 ) 10 elektron 5 betöltött M E(RF/3-21G)= artree M 6 LUM ( ) EPS töltés = 0 Debye M 3 ( ) M 4 ( ) M 5 M ( ) Degenerált M-k M 2 ( ) M 1 ( ) zárt héj
45 Az elektronrendszer többféle felosztása molekulapályákra: - az elektronpárok mindegyike a molekulát alkotó összes mag erőterében oszlik el más-más szimmetria szerint: ez a kanonikus leírás. - egy-egy elektronpárt nagyjából két-két szomszédos mag erőterébe lokalizálunk: ez a lokalizált leírás. közös a két leírásban: - a molekula összenergiájának és összelektronsűrűségének értéke. eltérő a két leírásban: - a lokalizált leírás során nyert M-khoz nem tartozik pályaenergiaérték.
46 ibridizáció idealizált sémák súlyozás nélkül sp s+p x (p y,p z hibridizálatlan) + + sp 2 s+p x +p y (p z hibridizálatlan) sp 3 s+p x +p y +p z (minden A hibridizált) [ ]
47
48 Telítetlen molekulák: -váz és -elektronrendszer Vannak koordinative telítetlen szénatomokat (sp 2, sp) is tartalmazó molekulák, melyekben az ilyen molekula részek alapállapotban síkalkatúak. Ilyenkor az elektronok feloszthatók a -váz elektronjaira és -elektronrendszer részét képezőekre. (Az előzőek tipikusan atompárokra lokalizált M-k, míg az utóbbiak a delokalizált - molekulapályákat építik fel. A -molekulapályák energiája nagyobb mint a -váz kanonikus M-jainak energiája.) A -elektronok kisebb magvonzás alatt vannak mint a -váz elektronjai ezért a kémiai reakciók és a spektroszkópiai események céltáblái. A-k Az eténmolekula lazító -pályája ( *) M-k Az etén sp 2 szenének p z - atompálya Az eténmolekula kötő -pályája ( )
49 Etén ( 2 4 ) 12+4=16 elektron 8 betöltött M = 0 Debye E(RF/3-21G)= artree TD = a.u. 2* 1 M 9 ( ) (LUM) M 8 ( ) (M) EPS töltés TD:=total electron density ( )
50 E(RF/3-21G)= artree Etin ( 2 2 ) 12+2=14 elektron 7 betöltött M = 0 Debye Degenerált M-k EPS töltés M 8 ( ) (LUM) 3* 4* M 9 ( ) M 6 ( ) 1 2 M 7 ( ) (M) Degenerált M-k
51 Butadién ( 4 6 ) (Bruckner I/1 161) 24+6=30 elektron 15 betöltött M = 0 Debye E(RF/3-21G)= artree TD = a.u. M 17 ( ) 4* 3* M 16 ( ) (LUM) EPS töltés M 15 ( ) (M) 1 M 14 ( )
52 Az allil-rendszerek elektronszerkezete propén /2 1/2 1/2 1/2 1/2 1/ allil kation allil gyök allil anion memo: Virtuális p-pálya M 12 M 13 lazító M 12 nemkötő M 11 kötő M 11
53 Benzol (aromás) August Wilhelm Kekulé (1866) 1.39Å Geometriai adatok: mikrohullámú spektroszkópiai adatok memo: Å = 1.34 Å 1.09Å A benzol planáris és aromás összesen 6 delokalizált -elektronnal. Az aromacitás egyik feltétele a (4n+2) delokalizált -elektron. 120 o 1 db. Kekulé szerkezet Elektronszerkezet: (memo: ogyan rajzoljunk rezonancia hibridet: -kötés érintetlen marad -kötés alternál) Apoláris határszerkezetek: Kekulé-féle képletek (1865) Robinson-féle képlet (1925)
54 Benzol (Bruckner II/1 48) = 0 Debye E(RF/ G(d,p)) = artree M-k izofelülete = 0.02 M 20 Mulliken töltés degenerált M-k M 21 (M) 4 M 17 EPS töltés
55 6 Benzol (Bruckner II/1 48) Virtuális molekulapályák M 29 ( ) M 22 ( ) 4 5 M 23 ( ) 2 M 21 ( ) 3 M 20 ( ) 1 M 17 ( ) Betöltött molekulapályák M energia
56 Aromaticitás A benzol és a belőle levezethető vegyületek különleges fizikai és kémiai tulajdonságainak együttese. Sir Robert Robinson 1) erős telítetlenség, 2) az erős telítetlenség ellenére, a nyíltláncú hexatriéntől eltérően addíciós reakcióra (telítődésre) kevéssé hajlamos, 3) szubsztitúciós reakciók készségesen lejátszódnak érintetlenül hagyva a benzol aromás elektronrendszerét, 4) képződéshője jóval nagyobb, égéshője jóval kisebb mint a Kekulé-képlet alapján számolt érték, 5) a három -kötés nem egymástól független, hanem egy egységes -elektrorendszer ( -szextett) [Sir R. Robinson], 6) a 6 -elektron delokalizációja miatt az aromás gyűrűn diamágneses köráram indukálódik, 7) a ückel-szabály szerint azok a síkalkatú, egy-gyűrűs, folytonosan konjugált kötésrendszerű vegyületek aromásak amelyben a -elektronok száma 4n+2.
57 kérdés: hogyan lehet az aromás rendszerekre jellemző π-elektron-delokalizációt kimutatni? válasz: 1 -NMR spektroszkópiával, az árnyékolási tényező figyelembevételével memo árnyékolás: az atommag körül mozgó elektronok a külső mágneses teret módosító hatása,(oldatban, a molekulák gyors reorientálódása miatt a külső B 0 tér irányától független) kevés -elektr. kis árnyékolás, sok -elektr. nagy árnyékolás 3 pl. aldehhid alkán kevés -elektr. ~10 ppm sok -elektr. ~1 ppm csökkenő árnyékolás 3 növekvő árnyékolás Si 3 3 kérdés: miért van viszonylag alacsony mágneses térerőnél a benzol -jele, ha van sok π-elektron körülötte? megfigyelés: a spektrum egyetlen (hasítatlan) rezonanciafrekvencia, (egyetlen fajta kémiai-környezetben van mind a 6 - atom) válasz: a π-elektron szextett indukálta mágneses tér miatt magyarázat: a benzol -jai úgy helyezkednek el, hogy ott a π-elektronok okozta indukált mágneses tér hatására azok csökkenő árnyékolást éreznek 1 -NMR TMS (ppm) indukált mágneses tér árnyékolatlan proton köráram
58 E(RF/3-21G)= artree iklopropénium kation [ 3 3 ] =21-1=20 elektron 10 betöltött M a legkisebb aromás rendszer a (4n+2) szabállyal összhangban, mivel itt n=0 ezért összesen 2 delokalizált -elektron van a hidrogéneken (Mulliken töltések) EPS töltés Elektronszerkezet: (memo: ogyan rajzoljunk rezonancia hibridet: -kötés-váz érintetlen -kötés alternál) Poláris határszerkezetek 2* M 11 (LUM) 1 M 10 (M)
59 iklopentadienid anion ( 5 5 ) (aromás) Aromacitás: (4n+2) szabállyal összhangban, mivel itt n=1; összesen 6 delokalizált - elektron van. Geometriai adatok: mikrohullámú spektroszkópiai adatok: a molekula síkalkatú 1.41Å Elektronszerkezet: 108 o Poláris határszerkezetek
60 iklopentadienid anion ( 5 5 ) =36 elektron 18 M Mulliken töltés +0.1 minden 6 Virtuális molekulapályák M 20 (0.4798) M 19 (0.4798) -0.3 minden 4 5 M 18 ( ) M 17 ( ) EPS töltés M 16 ( ) E(RF/3-21G) = artree 1 Betöltött molekulapályák
61 Geometriai adatok: mikrohullámú spektroszkópiai adatok: Poláris határszerkezetek a molekula síkalkatú Elektronszerkezet: 129 o 1.38Å iklohepta -1,3,5- trienilium (tropilium) kation ( 7 7 +, aromás, n=1)
62 4 iklohepta -1,3,5- trienilium (tropilium) kation ( 7 7 +, aromás, n=1) =48 elektron 24 M 6 5 Virtuális molekulapályák M 23 M 24 Mulliken töltés minden minden M 20 Betöltött molekulapályák EPS töltés E(RF/3-21G) = artree
63 Elektronszerkezet: Rezonancia hibrid Apoláris határszerkezetek iklodeka-1,3,5,7,9-pentaén aromás, nem aromás? : 4n+2, n=2 (Poláris határszerkezetekre nincs szükség) Ez 2 db.
64 Geometriai adatok:!! alternáló kötéshosszak!! Mono-transz cisz forma E(RF/3-21Gd) = artree  iklodeka-1,3,5,7,9-pentaén aromás, nem aromás? : 4n+2, n=2 memo:  = 1.34 1.39 benzol all -cisz forma E(RF/3-21Gd) = artree 144 o 1.41Å 1.37Å Di-transz cisz forma E(RF/3-21Gd) = artree A molekula planáris hogy a körkörös -kötés kialakuljon, de emiatt nagy lesz a szögfeszültség (144 o )  o 1.33 A molekula nem planáris 1.33 A molekula nem planáris
65 iklodeka-1,3,5,7,9-pentaén all -cis forma EPS töltés M 34 ( ) M 35 ( ) (M) Nincs lyuk a közepén! E(RF/3-21Gd) = artree M 32 ( ) M 33( ) 1 M 27 ( )
66 [N]Annulének N=(4n+2) vagy ückel szabály Annulének = monociklusos telítetlen szénhidrogének, amelyek alternáló egyes és kettes kötések segítségével írhatók le. Ezek egy része aromás molekula. kérdés: melyik annulén aromás? A [4]annulén, [8]annulén, [12]annulén, [16]annulén, [20]annulén, stb. a ückel szabály szerint nemaromás B semleges töltött n=0 [2]annulén= etén (nem gyűrűs) ciklopropenilium kation (igen) n=1 [6]annulén = benzol (igen) ciklopentadienid anion (igen) cikloheptatrienilium kation (igen) n=2 [10]annulén = ciklodekapentaén (nem) n=3 [14]annulén = ciklotetradekaheptaén (igen) n=4 [18]annulén = ciklooktadekanonén (igen) ciklooktatetraén ciklododekahexaén ciklohexadekaoktaén 18 ciklodekapentaén ciklotetradekaheptaén ciklooktadekanonaén Naftalin, antracén, fenantrén stb. nem monociklusos molekulák, s így ückel-szerint nem aromásak, egy sor más kritérium teljesülése miatt ezek a molekulák mégis aromás rendszert alkotnak.
67 Aromás, nemaromás és antiaromás: Aromás rendszerek esetében a gyűrűs forma a stabilabb mint az izoelektronos nyíltláncú rendszer kcal/mol 2 Benzene benzol stabilabb 2 exa-1,3,5-triene hexa-1,3,5-trién labilisabb A molekula akkor aromás ha : 1. ciklusos kvázi planáris szerkezet, adott számú -elektronnal, 2. minden gyűrűs atomnak kell hogy legyen egy hibridizálatlan p-pályája, 3. a p-pályák át kell hogy fedjenek folytonos és körkörös rendszert adva, 4. a -elektronok delokalizálódása energiacsökkenéssel kell járjon RF/3-21G A molekula antiaromás ha: Teljesül de, 4. A -elektronok delokalizálódása energianövekedéssel jár. 2 + A molekula nemaromás ha: a 3. pont nem teljesül. 2 + yclobutadiene ciklobutadién antiaromás labilisabb yclohexa-1,3-diene ciklohexa-1,3-dién -100 kcal/mol összemérhetõ a két molekula stabilitása Buta-1,3-diene buta-1,3-dién stabilabb , RF/3-21G kcal/mol exa-2,4-diene hexa-2,4-dién RF/3-21G
68 ciklobutadién benzol ciklooktatetraén Miért éppen a (4n+2) az aromás és miért pont a (4n) rendszer az antiaromás? A poligon-szabály Kérdés: eldönthető-e az előző vagy más hasonló kérdés kvalitatív szinten, számítások nélkül? n db elektron Lazító pályák nemkötő pálya kötő pályák 4 elektron 2 nemkötő pálya 1 kötő pálya 6 elektron 0 nemkötő pálya 3 kötő pálya 8 elektron 2 nemkötő pálya 3 kötő pálya ciklobuta-1,3-dién antiaromás ciklohexa-1,3,5-trién aromás ciklookta-1,3,5,7-tetraén antiaromás
69 Összefoglaló A) 2 elektron és aromás ciklopropénil kation B) 4 elektron és antiaromás ciklopropenid anion ciklobutadién ciklopentadienium kation ) 6 elektron és aromás Robinson féle jelölés ciklopentadienid anion benzol cikloheptatrienilium kation (tropilium ion) N N pirrol furán piridin
70 D) 8 elektron és antiaromás cikloheptatrienid anion ciklooktatetraén pentalén bár nem annulén E) 10 elektron és aromás (bár nem annulén) N naftalin azulén indol
71 6 Toluol (Bruckner II/1 476) = 0.33 Debye M 26 EPS töltés M 24 M 27 E(RF/3-21G= artree 2 3 M 25 1 M 21
72 Anilin (Bruckner II/1 476) = 1.44 Debye EPS töltés M 25 (M) M 23 M 24 TD = a.u. 4 M E(RF/ G(d,p))= artree
73 Fenol (Bruckner II/1 ) = 1.44 Debye EPS töltés M 25 (M) M 23 M 24 TD = a.u M 18 1 E(RF/ G(d,p))= artree
74 Fenolát anion (Bruckner II/1 311) = 4.98 Debye EPS töltés memo: a benzil anion hasonló delokalizációjú -elektronrendszert tartalmaz M 22 M 25 (M) M 24 TD = a.u M 19 1 E(RF/ G(d,p))= artree
75 Anilinium kation (Bruckner II/1 311) = 7.27 Debye EPS töltés M 24 M 25 (M) TD = a.u. 4 M E(RF/ G(d,p))= artree
76 Piridin (Bruckner III/1 431) = 2.4 Debye M 28 EPS töltés M 22 M Mulliken töltés töltés piros zöld M 20 M M E(RF/3-21G)= artree
77 Elektronszerkezet: Piridin (aromás) Geometriai adatok: mikrohullámú spektroszkópiai adatok 118 o 1.40Å A molekula planáris 119 o 1.39Å 124 o 1.34Å 117 o (memo: ogyan rajzoljunk rezonancia hibridet: -kötés váz érintetlen marad -kötés alternál) Apoláris határszerkezetek N N Poláris határszerkezetek N N N
78 Pirilium kation (Bruckner III/1 341) = 1.2 Debye M 20 M 21 Mulliken töltés töltés M 15 EPS töltés E(RF/3-21G)= artree
79 Pirilium kation (aromás) (Bruk III/1 341) = 1.2 Debye Geometriai adatok: 1.40Å 120 o 118 o A molekula planáris 1.36Å 120 o 1.34Å 123 o Elektronszerkezet: (memo: ogyan rajzoljunk rezonancia hibridet: -kötés érintetlen marad -kötés alternál) Apoláris határszerkezetek: nincs Poláris határszerkezetek:
80 6 Pirrol (Bruckner III/1 121) = 1.92 Debye EPS töltés M 21 M M 17 M 18 Mulliken töltés töltés piros zöld M E(RF/3-21G)= artree
81 Pirrol (aromás) Geometriai adatok: mikrohullámú spektroszkópiai adatok 1.43Å 107 o A molekula planáris 1.36Å 108 o 1.38Å Elektronszerkezet: 109 o Apoláris határszerkezetek Poláris határszerkezetek N N N N N
82 magyarázat: a protonált formák stabilitása eltérő. Mindkét esetben a nitrogén nemkötő elektronpárja szükséges a proton megkötéséhez, de: - piridin esetén megmarad az aromás jelleg, - pirrol esetén megszűnik az aromás jelleg. hf: az imidazol melyik nitrogénje mutat bázisos tulajdonságot és miért? Bázicitás (L.G.Wade Jr. 711) kérdés: miért gyengébb bázis a pirrol (K b =13.6) mint a piridin (K b =8.8)? tapasztalat: N + 2 N + pirrol (K b =13.6) N-protonált pirrol (K a =0.4) gyenge bázis erős sav N + 2 N piridin (K b =8.8) piridinium kation (K a =5.2) + memo: A A - sav bázis konjugált sav-bázis pár K a = [ 3 + ].[A - ]/[A] ahol K a a savi disszociációs állandó; pk a = -log 10 K a
83 Geometriai adatok: memo: Â = 1.34Â Naftalin (aromás) 1.36Å 1.42Å A molekula planáris Elektronszerkezet: 120 o Apoláris határszerkezetek (Poláris határszerkezetekre nincs szükség)
84 Nafatlin ( 10 8 ) 60+8=68 elektron 34 M EPS töltés ( + ) 4 ( + ) M 33 M 34 2 ( +2 ) 3 ( +2 ) M 31 M 32 E(RF/3-21G) = artree 1 ( +4 ) M 27 Betöltött molekulapályák
85 Geometriai adatok: Azulén (aromás) (Bruckner II/2 1375) 1.41Å 1.36Å memo: Â = 1.34Â A molekula planáris 1.49Å 128 o 108 o Elektronszerkezet: Apoláris határszerkezetek: Poláris határszerkezetek: Robinson féle jelölés
86 Azulén ( 10 8 ) 10*6+8*1=68 elektron 34 M EPS töltés M 33 M M 31 M 32 1 E(RF/3-21G) = artree M 27 Betöltött molekulapályák
87 Fullerén ( 60, 70 ) aromás =360 elektron 180 M 60 delokalizálható elektron nem alakul ki teljes delokalizáció 3D ückel: 2(N+1) 2 60, váltakozó kötéshosszak sp 2 hibridállapotú szenek 3 - és 1 -kötés szenenként Robert F. url ötszög és 20 hatszög 12 ötszög és 25 hatszög Lézerrel előállított grafitgőzben (url, Kroto, Smalley 1996 Nobel díj) K 3 60 stabil kristály amely 18K-on szupravezető. arold W. Kroto Richard Buckminster "Bucky" Fuller ( ) Richard E. Smalley
A kémiai kötés A klasszikus alapokon nyugvóelektronoktett- elmélet
 A kémiai kötés A klasszikus alapokon nyugvóelektronoktett- elmélet Az atomok többsége a nemesgázok kivétel a Földön instabil. Vegyületeket képeznek úgy, hogy nyílt héjuk lezárttá (nemesgáz elektronkonfigurációjúvá)
A kémiai kötés A klasszikus alapokon nyugvóelektronoktett- elmélet Az atomok többsége a nemesgázok kivétel a Földön instabil. Vegyületeket képeznek úgy, hogy nyílt héjuk lezárttá (nemesgáz elektronkonfigurációjúvá)
A kémiai kötés. Pauling-féle elektronnegatívitási érték. - K-héj H He L-héj Li Be B C N O F Ne
 A kémiai kötés A klasszikus alapokon nyugvó elektronoktett- elmélet Az atomok többsége a nemesgázok kivétel a Földön instabil. Vegyületeket képeznek úgy, hogy nyílt héjuk lezárttá (nemesgáz elektronkonfigurációjúvá)
A kémiai kötés A klasszikus alapokon nyugvó elektronoktett- elmélet Az atomok többsége a nemesgázok kivétel a Földön instabil. Vegyületeket képeznek úgy, hogy nyílt héjuk lezárttá (nemesgáz elektronkonfigurációjúvá)
Toluol (Bruckner II/1 476) µ= 0.33 Debye
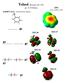 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
A hidrogénmolekula. Energia
 A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula. Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve!
 Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
FELADATMEGOLDÁS. Tesztfeladat: Válaszd ki a helyes megoldást!
 FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Kémiai alapismeretek 3. hét
 Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Periódusos rendszer (Mengyelejev, 1869) nemesgáz csoport: zárt héj, extra stabil
 s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
ORVOSI KÉMIA. Az anyag szerkezete
 ORVOSI KÉMIA Az anyag szerkezete Nagy Veronika PTE ÁOK 2017/18. Egyes ábrákat a Chemistry c. (McMurry & Fay, 4 th ed.) könyvből vettünk át. Tanulási célok Az anyagot felépítő elemi részecskék (atomok,
ORVOSI KÉMIA Az anyag szerkezete Nagy Veronika PTE ÁOK 2017/18. Egyes ábrákat a Chemistry c. (McMurry & Fay, 4 th ed.) könyvből vettünk át. Tanulási célok Az anyagot felépítő elemi részecskék (atomok,
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Az anyagszerkezet alapjai. Az atomok felépítése
 Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Az anyagszerkezet alapjai
 Kérdések Az anyagszerkezet alapjai Az atomok felépítése Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Kérdések Az anyagszerkezet alapjai Az atomok felépítése Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Fizikai kémia 2. Előzmények. A Lewis-féle kötéselmélet A VB- és az MO-elmélet, a H 2+ molekulaion
 06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
Szalai István. ELTE Kémiai Intézet 1/74
 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Molekulák világa 1. kémiai szeminárium
 GoBack Molekulák világa 1. kémiai szeminárium Szilágyi András 2008. október 6. Molekulák világa 1. kémiai szeminárium Molekuláris bionika szak I. év 1 Kvantummechanika Klasszikus fizika eszközei tömegpont
GoBack Molekulák világa 1. kémiai szeminárium Szilágyi András 2008. október 6. Molekulák világa 1. kémiai szeminárium Molekuláris bionika szak I. év 1 Kvantummechanika Klasszikus fizika eszközei tömegpont
Az anyagszerkezet alapjai. Az atomok felépítése
 Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
tema04_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Molekulák világa 2. kémiai szeminárium. Szilágyi András
 Molekulák világa 2. kémiai szeminárium Szilágyi András Kvantummechanikai ismétlés Kvantummechanikai részecskéről csak valószínűségi állítást tehetünk A részecske leírója a hullámfüggvény, ez kódolja a
Molekulák világa 2. kémiai szeminárium Szilágyi András Kvantummechanikai ismétlés Kvantummechanikai részecskéről csak valószínűségi állítást tehetünk A részecske leírója a hullámfüggvény, ez kódolja a
Atomfizika. A hidrogén lámpa színképei. Elektronok H atom. Fényképlemez. emisszió H 2. gáz
 Atomfizika A hidrogén lámpa színképei - Elektronok H atom emisszió Fényképlemez V + H 2 gáz Az atom és kvantumfizika fejlődésének fontos szakasza volt a hidrogén lámpa színképeinek leírása, és a vonalas
Atomfizika A hidrogén lámpa színképei - Elektronok H atom emisszió Fényképlemez V + H 2 gáz Az atom és kvantumfizika fejlődésének fontos szakasza volt a hidrogén lámpa színképeinek leírása, és a vonalas
20/10/2016 tema04_biolf_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
Thomson-modell (puding-modell)
 Atommodellek Thomson-modell (puding-modell) A XX. század elejére világossá vált, hogy az atomban található elektronok ugyanazok, mint a katódsugárzás részecskéi. Magyarázatra várt azonban, hogy mi tartja
Atommodellek Thomson-modell (puding-modell) A XX. század elejére világossá vált, hogy az atomban található elektronok ugyanazok, mint a katódsugárzás részecskéi. Magyarázatra várt azonban, hogy mi tartja
Szilárdtestek el e ek e tr t o r n o s n zer e k r ez e et e e t
 Szilárdtestek elektronszerkezete Kvantummechanikai leírás Ismétlés: Schrödinger egyenlet, hullámfüggvény, hidrogén-atom, spin, Pauli-elv, periódusos rendszer 2 Szilárdtestek egyelektron-modellje a magok
Szilárdtestek elektronszerkezete Kvantummechanikai leírás Ismétlés: Schrödinger egyenlet, hullámfüggvény, hidrogén-atom, spin, Pauli-elv, periódusos rendszer 2 Szilárdtestek egyelektron-modellje a magok
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK
 ÓBUDAI EGYETEM ANYAGTUDOMÁNYI SZEMINÁRIUMOK, 2014. MÁJUS 12. PEKKER SÁNDOR MTA WIGNER SZFI KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK
ÓBUDAI EGYETEM ANYAGTUDOMÁNYI SZEMINÁRIUMOK, 2014. MÁJUS 12. PEKKER SÁNDOR MTA WIGNER SZFI KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK
Modern Fizika Labor. Fizika BSc. Értékelés: A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n. 2008. április 29.
 Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Atommodellek de Broglie hullámhossz Davisson-Germer-kísérlet
 Atommodellek de Broglie hullámhossz Davisson-Germer-kísérlet Utolsó módosítás: 2016. május 4. 1 Előzmények Az atomok színképe (1) A fehér fény komponensekre bontható: http://en.wikipedia.org/wiki/spectrum
Atommodellek de Broglie hullámhossz Davisson-Germer-kísérlet Utolsó módosítás: 2016. május 4. 1 Előzmények Az atomok színképe (1) A fehér fény komponensekre bontható: http://en.wikipedia.org/wiki/spectrum
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai. Kémiai kötés kialakulásának oka: energianyereség.
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett elmélet (1916-19
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett elmélet (1916-19
Kémiai alapismeretek 2. hét
 Kémiai alapismeretek 2. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2014. szeptember 9.-12. 1/13 2014/2015 I. félév, Horváth Attila c Hullámtermészet:
Kémiai alapismeretek 2. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2014. szeptember 9.-12. 1/13 2014/2015 I. félév, Horváth Attila c Hullámtermészet:
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Atomfizika. Fizika kurzus Dr. Seres István
 Atomfizika Fizika kurzus Dr. Seres István Történeti áttekintés J.J. Thomson (1897) Katódsugárcsővel végzett kísérleteket az elektron fajlagos töltésének (e/m) meghatározására. A katódsugarat alkotó részecskét
Atomfizika Fizika kurzus Dr. Seres István Történeti áttekintés J.J. Thomson (1897) Katódsugárcsővel végzett kísérleteket az elektron fajlagos töltésének (e/m) meghatározására. A katódsugarat alkotó részecskét
AZ ATOM. Atom: atommag + elektronfelhő = proton, neutron, elektron. Elemi részecskék
 AZ ATOM Atom: atommag + elektronfelhő = proton, neutron, elektron Elemi részecskék Atomok Dalton elmélete (1805): John DALTON 1766-1844 1. Az elemek apró részecskékből, atomokból állnak. Atom: görög szó
AZ ATOM Atom: atommag + elektronfelhő = proton, neutron, elektron Elemi részecskék Atomok Dalton elmélete (1805): John DALTON 1766-1844 1. Az elemek apró részecskékből, atomokból állnak. Atom: görög szó
Elektronok, atomok. Általános Kémia - Elektronok, Atomok. Dia 1/61
 Elektronok, atomok 2-1 Elektromágneses sugárzás 2-2 Atomi Spektrum 2-3 Kvantumelmélet 2-4 A Bohr Atom 2-5 Az új Kvantummechanika 2-6 Hullámmechanika 2-7 Kvantumszámok Dia 1/61 Tartalom 2-8 Elektronsűrűség
Elektronok, atomok 2-1 Elektromágneses sugárzás 2-2 Atomi Spektrum 2-3 Kvantumelmélet 2-4 A Bohr Atom 2-5 Az új Kvantummechanika 2-6 Hullámmechanika 2-7 Kvantumszámok Dia 1/61 Tartalom 2-8 Elektronsűrűség
ELEMI RÉSZECSKÉK ATOMMODELLEK
 ELEMI RÉSZECSKÉK ATOMMODELLEK Az atomok felépítése Készítette: Horváthné Vlasics Zsuzsanna Mi van az atomok belsejében? DÉMOKRITOSZ (Kr.e. 460-370) az anyag nem folytonos parányi, tovább nem bontható,
ELEMI RÉSZECSKÉK ATOMMODELLEK Az atomok felépítése Készítette: Horváthné Vlasics Zsuzsanna Mi van az atomok belsejében? DÉMOKRITOSZ (Kr.e. 460-370) az anyag nem folytonos parányi, tovább nem bontható,
A SZILÁRDTEST FOGALMA. Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. molekula klaszter szilárdtest > σ λ : rel.
 A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
Általános és szervetlen kémia 3. hét. Kémiai kötések. Kötések kialakítása - oktett elmélet. Az elızı órán elsajátítottuk, hogy.
 Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
FIZIKA. Sugárzunk az elégedettségtől! (Atomfizika) Dr. Seres István
 Sugárzunk az elégedettségtől! () Dr. Seres István atommagfizika Atommodellek 440 IE Democritus, Leucippus, Epicurus 1803 1897 John Dalton J.J. Thomson 1911 Ernest Rutherford 19 Niels Bohr 3 Atommodellek
Sugárzunk az elégedettségtől! () Dr. Seres István atommagfizika Atommodellek 440 IE Democritus, Leucippus, Epicurus 1803 1897 John Dalton J.J. Thomson 1911 Ernest Rutherford 19 Niels Bohr 3 Atommodellek
Mit tanultunk kémiából?2.
 Mit tanultunk kémiából?2. Az anyagok rendkívül kicsi kémiai részecskékből épülnek fel. Több milliárd részecske Mól az anyagmennyiség mértékegysége. 1 mol atom= 6. 10 23 db atom 600.000.000.000.000.000.000.000
Mit tanultunk kémiából?2. Az anyagok rendkívül kicsi kémiai részecskékből épülnek fel. Több milliárd részecske Mól az anyagmennyiség mértékegysége. 1 mol atom= 6. 10 23 db atom 600.000.000.000.000.000.000.000
Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia?
 Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia? Prof. Túri László (ELTE, Kémiai Intézet) turi@chem.elte.hu 2012. november 19. Szent László Gimnázium Önképzőkör 1 Kapcsolódási pontok
Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia? Prof. Túri László (ELTE, Kémiai Intézet) turi@chem.elte.hu 2012. november 19. Szent László Gimnázium Önképzőkör 1 Kapcsolódási pontok
Átmenetifém-komplexek ESR-spektrumának jellemzıi
 Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Periciklusos reakciók
 Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Bevezetés a modern fizika fejezeteibe. 4. (a) Kvantummechanika. Utolsó módosítás: november 15. Dr. Márkus Ferenc BME Fizika Tanszék
 Bevezetés a modern fizika fejezeteibe 4. (a) Kvantummechanika Utolsó módosítás: 2015. november 15. 1 Előzmények Az atomok színképe (1) A fehér fény komponensekre bontható: http://en.wikipedia.org/wiki/spectrum
Bevezetés a modern fizika fejezeteibe 4. (a) Kvantummechanika Utolsó módosítás: 2015. november 15. 1 Előzmények Az atomok színképe (1) A fehér fény komponensekre bontható: http://en.wikipedia.org/wiki/spectrum
Atomok, elektronok. Általános Kémia - Elektronok, Atomok. Dia 1/61
 , elektronok 2-1 Elektromágneses sugárzás 2-2 Atomi spektrum 2-3 Kvantumelmélet 2-4 Bohr-atom 2-5 Az új kvantummechanika 2-6 Hullámmechanika 2-7 A hidrogénatom hullámfüggvényei Dia 1/61 , elektronok 2-8
, elektronok 2-1 Elektromágneses sugárzás 2-2 Atomi spektrum 2-3 Kvantumelmélet 2-4 Bohr-atom 2-5 Az új kvantummechanika 2-6 Hullámmechanika 2-7 A hidrogénatom hullámfüggvényei Dia 1/61 , elektronok 2-8
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
dinamikai tulajdonságai
 Szilárdtest rácsok statikus és dinamikai tulajdonságai Szilárdtestek osztályozása kötéstípusok szerint Kötések eredete: elektronszerkezet k t ionok (atomtörzsek) tö Coulomb- elektronok kölcsönhatás lokalizáltak
Szilárdtest rácsok statikus és dinamikai tulajdonságai Szilárdtestek osztályozása kötéstípusok szerint Kötések eredete: elektronszerkezet k t ionok (atomtörzsek) tö Coulomb- elektronok kölcsönhatás lokalizáltak
2, = 5221 K (7.2)
 7. Gyakorlat 4A-7 Az emberi szem kb. 555 nm hullámhossznál a Iegnagyobb érzékenységű. Adjuk meg annak a fekete testnek a hőmérsékletét, amely sugárzásának a spektrális teljesitménye ezen a hullámhosszon
7. Gyakorlat 4A-7 Az emberi szem kb. 555 nm hullámhossznál a Iegnagyobb érzékenységű. Adjuk meg annak a fekete testnek a hőmérsékletét, amely sugárzásának a spektrális teljesitménye ezen a hullámhosszon
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
2015/16/1 Kvantummechanika B 2.ZH
 2015/16/1 Kvantummechanika B 2.ZH 2015. december 10. Információk 0. A ZH ideje minimum 90 perc, maximum 180 perc. 1. Az összesen elérhet pontszám 270 pont. 2. A jeles érdemjegy eléréséhez nem szükséges
2015/16/1 Kvantummechanika B 2.ZH 2015. december 10. Információk 0. A ZH ideje minimum 90 perc, maximum 180 perc. 1. Az összesen elérhet pontszám 270 pont. 2. A jeles érdemjegy eléréséhez nem szükséges
Mágneses módszerek a mőszeres analitikában
 Mágneses módszerek a mőszeres analitikában NMR, ESR: mágneses momentummal rendelkezı anyagok minıségi és mennyiségi meghatározására alkalmas analitikai módszer Atommag spin állapotok közötti energiaátmenetek:
Mágneses módszerek a mőszeres analitikában NMR, ESR: mágneses momentummal rendelkezı anyagok minıségi és mennyiségi meghatározására alkalmas analitikai módszer Atommag spin állapotok közötti energiaátmenetek:
Atomfizika. Fizika kurzus Dr. Seres István
 Atomfizika Fizika kurzus Dr. Seres István Történeti áttekintés 440 BC Democritus, Leucippus, Epicurus 1660 Pierre Gassendi 1803 1897 1904 1911 19 193 John Dalton Joseph John (J.J.) Thomson J.J. Thomson
Atomfizika Fizika kurzus Dr. Seres István Történeti áttekintés 440 BC Democritus, Leucippus, Epicurus 1660 Pierre Gassendi 1803 1897 1904 1911 19 193 John Dalton Joseph John (J.J.) Thomson J.J. Thomson
1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
Atomok és molekulák elektronszerkezete
 Atomok és molekulák elektronszerkezete Szabad atomok és molekulák Schrödinger egyenlete Tekintsünk egy kvantummechanikai rendszert amely N n magból és N e elektronból áll. Koordinátáikat jelölje rendre
Atomok és molekulák elektronszerkezete Szabad atomok és molekulák Schrödinger egyenlete Tekintsünk egy kvantummechanikai rendszert amely N n magból és N e elektronból áll. Koordinátáikat jelölje rendre
Radiokémia vegyész MSc radiokémia szakirány Kónya József, M. Nagy Noémi: Izotópia I és II. Debreceni Egyetemi Kiadó, 2007, 2008.
 Radiokémia vegyész MSc radiokémia szakirány Kónya József, M. Nagy Noémi: Izotópia I és II. Debreceni Egyetemi Kiadó, 2007, 2008. Kiss István,Vértes Attila: Magkémia (Akadémiai Kiadó) Nagy Lajos György,
Radiokémia vegyész MSc radiokémia szakirány Kónya József, M. Nagy Noémi: Izotópia I és II. Debreceni Egyetemi Kiadó, 2007, 2008. Kiss István,Vértes Attila: Magkémia (Akadémiai Kiadó) Nagy Lajos György,
Lendület. Lendület (impulzus): A test tömegének és sebességének szorzata. vektormennyiség: iránya a sebesség vektor iránya.
 Lendület Lendület (impulzus): A test tömegének és sebességének szorzata. vektormennyiség: iránya a sebesség vektor iránya. Lendülettétel: Az lendület erő hatására változik meg. Az eredő erő határozza meg
Lendület Lendület (impulzus): A test tömegének és sebességének szorzata. vektormennyiség: iránya a sebesség vektor iránya. Lendülettétel: Az lendület erő hatására változik meg. Az eredő erő határozza meg
Mágneses módszerek a műszeres analitikában
 Mágneses módszerek a műszeres analitikában NMR, ESR: mágneses momentummal rendelkező anyagok minőségi és mennyiségi meghatározására alkalmas Atommag spin állapotok közötti energiaátmenetek: NMR (magmágneses
Mágneses módszerek a műszeres analitikában NMR, ESR: mágneses momentummal rendelkező anyagok minőségi és mennyiségi meghatározására alkalmas Atommag spin állapotok közötti energiaátmenetek: NMR (magmágneses
ATOMMODELLEK, SZÍNKÉP, KVANTUMSZÁMOK. Kalocsai Angéla, Kozma Enikő
 ATOMMODELLEK, SZÍNKÉP, KVANTUMSZÁMOK Kalocsai Angéla, Kozma Enikő RUTHERFORD-FÉLE ATOMMODELL HIBÁI Elektromágneses sugárzáselmélettel ellentmondásban van Mivel: a keringő elektronok gyorsulnak Energiamegmaradás
ATOMMODELLEK, SZÍNKÉP, KVANTUMSZÁMOK Kalocsai Angéla, Kozma Enikő RUTHERFORD-FÉLE ATOMMODELL HIBÁI Elektromágneses sugárzáselmélettel ellentmondásban van Mivel: a keringő elektronok gyorsulnak Energiamegmaradás
SCHRÖDINGER-EGYENLET SCHRÖDINGER-EGYENLET
 SCHRÖDINGER-EGYENLET A Scrödinger-egyenlet a kvantummecanika mozgásegyenlet, Newton II. törvényével analóg. Nem vezetető le korábbi elvekből, de intuitívan bevezetető. Egy atározott energiával és impulzussal
SCHRÖDINGER-EGYENLET A Scrödinger-egyenlet a kvantummecanika mozgásegyenlet, Newton II. törvényével analóg. Nem vezetető le korábbi elvekből, de intuitívan bevezetető. Egy atározott energiával és impulzussal
Kvantummechanika gyakorlat Beadandó feladatsor Határid : 4. heti gyakorlatok eleje
 Kvantummechanika gyakorlat 015 1. Beadandó feladatsor Határid : 4. heti gyakorlatok eleje 1. Mutassuk meg, hogy A és B tetsz leges operátorokra igaz, hogy e B A e B = A + [B, A] + 1![ B, [B, A] ] +....
Kvantummechanika gyakorlat 015 1. Beadandó feladatsor Határid : 4. heti gyakorlatok eleje 1. Mutassuk meg, hogy A és B tetsz leges operátorokra igaz, hogy e B A e B = A + [B, A] + 1![ B, [B, A] ] +....
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
A kémiai kötés magasabb szinten
 A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
Az anyagi rendszerek csoportosítása
 Kémia 1 A kémiai ismeretekről A modern technológiai folyamatok és a környezet védelmére tett intézkedések alig érthetőek kémiai tájékozottság nélkül. Ma már minden mérnök számára alapvető fontosságú a
Kémia 1 A kémiai ismeretekről A modern technológiai folyamatok és a környezet védelmére tett intézkedések alig érthetőek kémiai tájékozottság nélkül. Ma már minden mérnök számára alapvető fontosságú a
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Az anyagok kettős (részecske és hullám) természete
 Az anyagok kettős (részecske és hullám) természete de Broglie hipotézise (1924-25): Bármilyen fénysebességgel mozgó részecskére: mc = p E = mc 2 = hn p = hn/c = h/ = h/p - de Broglie-féle hullámhossz Nem
Az anyagok kettős (részecske és hullám) természete de Broglie hipotézise (1924-25): Bármilyen fénysebességgel mozgó részecskére: mc = p E = mc 2 = hn p = hn/c = h/ = h/p - de Broglie-féle hullámhossz Nem
Fizikai kémia 2. ZH II. kérdések I. félévtől
 Fizikai kémia 2. ZH II. kérdések 2018-19 I. félévtől Szükséges adatok, állandók és összefüggések: c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
Fizikai kémia 2. ZH II. kérdések 2018-19 I. félévtől Szükséges adatok, állandók és összefüggések: c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
Azonos és egymással nem kölcsönható részecskékből álló kvantumos rendszer makrókanónikus sokaságban.
 Kvantum statisztika A kvantummechanika előadások során már megtanultuk, hogy az anyagot felépítő részecskék nemklasszikus, hullámtulajdonságokkal is rendelkeznek aminek következtében viselkedésük sok szempontból
Kvantum statisztika A kvantummechanika előadások során már megtanultuk, hogy az anyagot felépítő részecskék nemklasszikus, hullámtulajdonságokkal is rendelkeznek aminek következtében viselkedésük sok szempontból
Bevezetés a modern fizika fejezeteibe. 4. (e) Kvantummechanika. Utolsó módosítás: december 3. Dr. Márkus Ferenc BME Fizika Tanszék
 Bevezetés a modern fizika fejezeteibe 4. (e) Kvantummechanika Utolsó módosítás: 2014. december 3. 1 A Klein-Gordon-egyenlet (1) A relativisztikus dinamikából a tömegnövekedésre és impulzusra vonatkozó
Bevezetés a modern fizika fejezeteibe 4. (e) Kvantummechanika Utolsó módosítás: 2014. december 3. 1 A Klein-Gordon-egyenlet (1) A relativisztikus dinamikából a tömegnövekedésre és impulzusra vonatkozó
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Atommodellek. Az atom szerkezete. Atommodellek. Atommodellek. Atommodellek, A Rutherford-kísérlet. Atommodellek
 Démokritosz: a világot homogén szubsztanciájú oszthatatlan részecskék, atomok és a közöttük lévı őr alkotja. Az atom szerkezete Egy atommodellt akkor fogadunk el érvényesnek, ha megmagyarázza a tapasztalati
Démokritosz: a világot homogén szubsztanciájú oszthatatlan részecskék, atomok és a közöttük lévı őr alkotja. Az atom szerkezete Egy atommodellt akkor fogadunk el érvényesnek, ha megmagyarázza a tapasztalati
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Atomfizika. Az atommag szerkezete. Radioaktivitás Biofizika, Nyitrai Miklós
 Atomfizika. Az atommag szerkezete. Radioaktivitás. 2010. 10. 13. Biofizika, Nyitrai Miklós Összefoglalás Atommag alkotói, szerkezete; Erős vagy magkölcsönhatás; Tömegdefektus. A kölcsönhatások világképe
Atomfizika. Az atommag szerkezete. Radioaktivitás. 2010. 10. 13. Biofizika, Nyitrai Miklós Összefoglalás Atommag alkotói, szerkezete; Erős vagy magkölcsönhatás; Tömegdefektus. A kölcsönhatások világképe
8. Osztály. Kód. Szent-Györgyi Albert kémiavetélkedő
 8. Osztály Kedves Versenyző! A jobb felső sarokban található mezőbe írd fel a verseny lebonyolításáért felelős személytől kapott kódot a feladatlap minden oldalára. A feladatokat lehetőleg a feladatlapon
8. Osztály Kedves Versenyző! A jobb felső sarokban található mezőbe írd fel a verseny lebonyolításáért felelős személytől kapott kódot a feladatlap minden oldalára. A feladatokat lehetőleg a feladatlapon
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS
 Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Szilárdtestek sávelmélete. Sávelmélet a szabadelektron-modell alapján
 Szilárdtestek sávelmélete Sávelmélet a szabadelektron-modell alapján A Fermi Dirac statisztika alapjai Nagy részecskeszámú rendszerek fizikai jellemzéséhez statisztikai leírást kell alkalmazni. (Pl. gázokra
Szilárdtestek sávelmélete Sávelmélet a szabadelektron-modell alapján A Fermi Dirac statisztika alapjai Nagy részecskeszámú rendszerek fizikai jellemzéséhez statisztikai leírást kell alkalmazni. (Pl. gázokra
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
AZ ELEKTRON MÁGNESES MOMENTUMA. H mágneses erœtérben az m mágneses dipólmomentummal jellemzett testre M = m H forgatónyomaték hat.
 AZ ELEKTRON MÁGNESES MOMENTUMA Mágneses dipólmomentum: m H mágneses erœtérben az m mágneses dipólmomentummal jellemzett testre M = m H forgatónyomaték hat. M = m H sinϕ (Elektromos töltés, q: monopólus
AZ ELEKTRON MÁGNESES MOMENTUMA Mágneses dipólmomentum: m H mágneses erœtérben az m mágneses dipólmomentummal jellemzett testre M = m H forgatónyomaték hat. M = m H sinϕ (Elektromos töltés, q: monopólus
Elektronok, atomok. Általános Kémia - Elektronok, Atomok. Slide 1 of 60
 Elektronok, atomok -1 Elektromágneses sugárzás - Atomi Spektrum -3 Kvantumelmélet -4 A Bohr Atom -5 Az új Kvantummechanika -6 Hullámmechanika -7 A hidrogénatom hullámfüggvényei Slide 1 of 60 Tartalom -8
Elektronok, atomok -1 Elektromágneses sugárzás - Atomi Spektrum -3 Kvantumelmélet -4 A Bohr Atom -5 Az új Kvantummechanika -6 Hullámmechanika -7 A hidrogénatom hullámfüggvényei Slide 1 of 60 Tartalom -8
