Szalai István. ELTE Kémiai Intézet 1/74
|
|
|
- Krisztián Kelemen
- 8 évvel ezelőtt
- Látták:
Átírás
1 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74
2 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74
3 Periodikus tulajdonságok (ismétlés) ˆ A periódusos rendszer (Mengyelejev, Moseley) ˆ Periodikus tulajdonságok: ˆ Atomsugár ˆ Ionizációs energia ˆ Elektronaffinitás ˆ Elektronegativitás EN A EN B = ˆ kémiai tulajdonságok 3/74
4 Ionos vegyületek képződése 2 Na(s) + Cl 2 (g) 2 NaCl(s) 4/74
5 Ionos vegyületek képződése 2 Na(s) + Cl 2 (g) 2 NaCl(s) Na [Ne] Na + [Ne] 3s Cl [Ne] Cl [Ne] 3s 3p 3s 3p 4/74
6 Ionos vegyületek képződése 2 Na(s) + Cl 2 (g) 2 NaCl(s) Na [Ne] Na + [Ne] 3s Cl [Ne] Cl [Ne] 3s 3p 3s 3p E B = Q2 α 4πɛ 0 r Elektrosztatikus kölcsönhatás (Coulomb erő) α(nacl) = /74
7 Ionos vegyületek képződése 5/74
8 Ionok típusai ˆ Nemesgáz konfiguráció s 2 : H, Li +, Be 2+ s 2 p 6 : pl. Na +, Ca 2+, Sc 3+, Cl, O /74
9 Ionok típusai ˆ Nemesgáz konfiguráció s 2 : H, Li +, Be 2+ s 2 p 6 : pl. Na +, Ca 2+, Sc 3+, Cl, O 2... ˆ d 10 konfiguráció Zn ([Ar]3d 10 4s 2 ) Zn 2+ ([Ar]3d 10 ) + 2e Cu +, Ag +, Cd 2+, Tl 3+,... 6/74
10 Ionok típusai ˆ Nemesgáz konfiguráció s 2 : H, Li +, Be 2+ s 2 p 6 : pl. Na +, Ca 2+, Sc 3+, Cl, O 2... ˆ d 10 konfiguráció Zn ([Ar]3d 10 4s 2 ) Zn 2+ ([Ar]3d 10 ) + 2e Cu +, Ag +, Cd 2+, Tl 3+,... ˆ d 10 s 2 Sn ([Kr]4d 10 5s 2 5p 2 ) Sn 2+ ([Kr]4d 10 5s 2 ) + 2e Tl +,Pb 2+, Bi 3+,... 6/74
11 Ionok típusai Átmenetifémek ionjai ˆ Ti ([Ar]3d 2 4s 2 ) Ti 3+ ([Ar]3d 1 ) + 3e ˆ V ([Ar]3d 3 4s 2 ) V 3+ ([Ar]3d 2 ) + 3e ˆ Cr ([Ar]3d 5 4s 1 ) Cr 3+ ([Ar]3d 3 ) + 3e ˆ Mn ([Ar]3d 5 4s 2 ) Mn 3+ ([Ar]3d 4 ) + 3e ˆ Mn ([Ar]3d 5 4s 2 ) Mn 2+ ([Ar]3d 5 ) + 2e ˆ Fe ([Ar]3d 6 4s 2 ) Fe 2+ ([Ar]3d 6 ) + 2e ˆ Co ([Ar]3d 7 4s 2 ) Co 2+ ([Ar]3d 7 ) + 2e ˆ Ni ([Ar]3d 8 4s 2 ) Ni 2+ ([Ar]3d 8 ) + 2e ˆ Cu ([Ar]3d 10 4s 1 ) Cu 2+ ([Ar]3d 9 ) + 2e 7/74
12 Ionok típusai 8/74
13 Kovalens kötés 9/74
14 Oktett szabály Az s és p mező elemei vegyületeikben a nemesgáz konfiguráció (8 elektronos) elérésére törekednek. 10/74
15 Rezonancia szerkezetek, delokalizált kötések 11/74
16 Datív kötés 12/74
17 Kötésrend ˆ egyszeres kötés (σ kötés [s s, s p, p p]) ˆ kettős kötés (1 σ kötés + 1 π kötés [p p]) ˆ hármas kötés (1 σ kötés + 2 π kötés) 13/74
18 Kötéstávolság, kötési energia kötéstávolság (pm) kötési energia (kj/mol) H H C C N N O O F F Si Si C=C O=O C C N N /74
19 Eltérések az oktettszabálytól Elektronhiányos vegyületek 15/74
20 Eltérések az oktettszabálytól A központi elem körül 8-nál több elektront tartalmazó vegyületek 16/74
21 Eltérések az oktettszabálytól Páratlan számú elektront tartalmazó vegyületek 17/74
22 Dipólusmomentum µ = Q d φ( r) = 1 µ r 4πɛ 0 r 3 18/74
23 Kötéspolaritás µ = Q d 19/74
24 Molekulapolaritás µ = Q d 20/74
25 Fémes kötés A rácspontokban lévő pozitív töltésű fémionokat közös, delokalizált elektronrendszer tartja össze. 21/74
26 Átmenet a kötéstípusok között EN = 0 apoláros kovalens vagy fémes kötés 0 < EN < 2 poláros kovalens vagy fémes kötés 2 < EN ionos kötés 22/74
27 Mágneses tulajdonságok ˆ Diamágnesesség: olyan elemeknél figyelhető meg, amelyeknek minden elektronja párosított (µ r < 1). Külső mágneses térbe helyezve a diamágneses anyagokon belül gyengül a mágneses tér. Pl.: Cu, Bi, Au, Ag, H 2 ˆ Paramágnesesség: olyan elemeknél figyelhető meg, amelyek párosítatlan elektronnal rendelkeznek (µ r > 1). Külső mágneses térbe helyezve a paramágneses anyagokon belül a rendezetlenül álló atomi mágneses momentumok a külső tér irányába rendeződnek. Pl.: Al, O 2, W, Pt, Sn, Cu 2+, Cr 3+, Fe 3+ ˆ Ferromágnesesség: az ilyen anyagok kristályaiban rendezett atomi mágneses momentumokkal bíró régiók találhatóak (10µm 1mm) amelyek a külső tér hatására annak irányába rendeződnek (µ r 1). Pl.: Fe, Co, Ni 23/74
28 Elektronpártaszítási-elmélet (VSEPR) A központi atom külső elektronhéján lévő (kötő és nemkötő) elektronpárok taszítják egymást. Ez olyan geometriai elrendeződéshez vezet amelyben ezek az elektronpárok a lehető legtávolabb kerülnek egymástól. A: központi atom, X: kötő elektronpárok, E: nemkötő elektronpárok AX n E m 24/74
29 VSEPR elmélet AX 2 BeCl 2, CdI 2, HgBr 2 lineáris 25/74
30 VSEPR elmélet AX 2 BeCl 2, CdI 2, HgBr 2 lineáris AX 3 BF 3, BCl 3, NO 3 síkháromszög 25/74
31 VSEPR elmélet AX 2 BeCl 2, CdI 2, HgBr 2 lineáris AX 3 BF 3, BCl 3, NO 3 síkháromszög AX 2 E SO 2, NO 2 V-alak 25/74
32 VSEPR elmélet AX 4 CH 4, CCl 4, NH + 4 tetraéderes 26/74
33 VSEPR elmélet AX 4 CH 4, CCl 4, NH + 4 tetraéderes AX 3 E NH 3, SO 2 3 trigonális piramis 26/74
34 VSEPR elmélet AX 4 CH 4, CCl 4, NH + 4 tetraéderes AX 3 E NH 3, SO 2 3 trigonális piramis AX 2 E 2 H 2 O V-alak 26/74
35 VSEPR elmélet AX 5 PF 5, SbCl 5 trigonális bipiramis 27/74
36 VSEPR elmélet AX 5 PF 5, SbCl 5 trigonális bipiramis AX 4 E SF 4 libikóka 27/74
37 VSEPR elmélet AX 5 PF 5, SbCl 5 trigonális bipiramis AX 4 E SF 4 libikóka AX 3 E 2 ClF 3 T-alak 27/74
38 VSEPR elmélet AX 5 PF 5, SbCl 5 trigonális bipiramis AX 4 E SF 4 libikóka AX 3 E 2 ClF 3 T-alak AX 2 E 3 XeF 2, I 3 lineáris 27/74
39 VSEPR elmélet AX 6 SF 6, SeF 6 oktaéder 28/74
40 VSEPR elmélet AX 6 SF 6, SeF 6 oktaéder AX 5 E BrF 5 négyzetes piramis 28/74
41 VSEPR elmélet AX 6 SF 6, SeF 6 oktaéder AX 5 E BrF 5 négyzetes piramis AX 4 E 2 XeF 4 négyzetes planáris 28/74
42 VSEPR elmélet 29/74
43 Vegyértékkötés-elmélet (VB) A vegyértékkötés-elmélet szerint kovalens kötés két atom között a két atom félig betöltött, egy párosítatlan elektront tartalmazó vegyértékpályáinak átfedésével jön létre. Az átfedés következtében az elektronok a legnagyobb valószínűséggel a kötés körüli térrészben tartózkodnak. Az atomok közötti kötés jellemzőinek (pl geometria) leírására gyakran az atompályák összekombinálásával új hibridpályákat hozunk létre. 30/74
44 Vegyértékkötés-elmélet (VB) Lineáris geometria BeCl 2 Be [He] 2s 2 Cl [Ne] 3s 2 3p 5 31/74
45 Vegyértékkötés-elmélet (VB) Lineáris geometria BeCl 2 Be [He] 2s 2 Cl [Ne] 3s 2 3p 5 Be 2s 2 hibridizáció sp 31/74
46 Vegyértékkötés-elmélet (VB) Lineáris geometria BeCl 2 Be [He] 2s 2 Cl [Ne] 3s 2 3p 5 Be 2s 2 hibridizáció sp 31/74
47 Vegyértékkötés-elmélet (VB) Lineáris geometria BeCl 2 Be [He] 2s 2 Cl [Ne] 3s 2 3p 5 Be 2s 2 hibridizáció sp 31/74
48 Vegyértékkötés-elmélet (VB) Síkháromszög alakú molekulák BF 3 B [He] 2s 2 2p 1 F [He] 2s 2 2p 5 32/74
49 Vegyértékkötés-elmélet (VB) Síkháromszög alakú molekulák BF 3 B [He] 2s 2 2p 1 F [He] 2s 2 2p 5 B 2s 2 2p 1 hibridizáció sp2 32/74
50 Vegyértékkötés-elmélet (VB) Síkháromszög alakú molekulák BF 3 B [He] 2s 2 2p 1 F [He] 2s 2 2p 5 B 2s 2 2p 1 hibridizáció sp2 32/74
51 Vegyértékkötés-elmélet (VB) Síkháromszög alakú molekulák BF 3 B [He] 2s 2 2p 1 F [He] 2s 2 2p 5 B 2s 2 2p 1 hibridizáció sp2 32/74
52 Vegyértékkötés-elmélet (VB) Tetraéder alakú molekulák CH 4 C [He] 2s 2 2p 2 H 1s 1 33/74
53 Vegyértékkötés-elmélet (VB) Tetraéder alakú molekulák CH 4 C [He] 2s 2 2p 2 H 1s 1 C 2s 2 2p 2 hibridizáció sp3 33/74
54 Vegyértékkötés-elmélet (VB) Tetraéder alakú molekulák CH 4 C [He] 2s 2 2p 2 H 1s 1 C 2s 2 2p 2 hibridizáció sp3 33/74
55 Vegyértékkötés-elmélet (VB) Tetraéder alakú molekulák CH 4 C [He] 2s 2 2p 2 H 1s 1 C 2s 2 2p 2 hibridizáció sp3 33/74
56 Vegyértékkötés-elmélet (VB) Trigonális piramis alakú molekulák NH 3 N [He] 2s 2 2p 3 H 1s 1 N 2s 2 2p 3 hibridizáció sp3 34/74
57 Vegyértékkötés-elmélet (VB) V-alakú molekulák (AX 2 E 2 ) H 2 O O [He] 2s 2 2p 4 H 1s 1 O 2s 2 2p 4 hibridizáció sp3 35/74
58 Vegyértékkötés-elmélet (VB) Trigonális bipiramis alakú molekulák PF 5 P [Ne] 3s 2 3p 3 F [He] 2s 2 2p 5 P 3s 2 3p 3 hibridizáció sp3 d 36/74
59 Vegyértékkötés-elmélet (VB) Oktaéder alakú molekulák SF 6 S [Ne] 3s 2 3p 4 F [He] 2s 2 2p 5 S 3s 2 3p 4 hibridizáció sp3 d 2 37/74
60 Vegyértékkötés-elmélet (VB) Kettős kötés C 2 H 4 A kettős kötés egy szigma és egy pi kötésből áll. A szigma kötés az atompályák,,fej-fej, a pi pályák pedig oldalsó átfedéséből jönnek létre. C 2s 2 2p 2 hibridizáció sp2 38/74
61 Vegyértékkötés-elmélet (VB) Hármas kötés C 2 H 2 C 2s 2 2p 2 hibridizáció sp 39/74
62 Molekulapálya-elmélet (MO) A molekulapálya elmélet szerint az atompályákból olyan molekulapályák jönnek létre amelyeken lévő elektronok a molekula egészéhez tartoznak. 40/74
63 Molekulapálya-elmélet (MO) A molekulapálya elmélet szerint az atompályákból olyan molekulapályák jönnek létre amelyeken lévő elektronok a molekula egészéhez tartoznak. ˆ Kötőpályák: az ilyen pályák energiája kisebb mint azon eredeti atompályáké amelyek kombinációjából kialakultak. 40/74
64 Molekulapálya-elmélet (MO) A molekulapálya elmélet szerint az atompályákból olyan molekulapályák jönnek létre amelyeken lévő elektronok a molekula egészéhez tartoznak. ˆ Kötőpályák: az ilyen pályák energiája kisebb mint azon eredeti atompályáké amelyek kombinációjából kialakultak. ˆ Lazítópályák: az ilyen pályák energiája nagyobb mint azon eredeti atompályáké amelyek kombinációjából kialakultak. 40/74
65 Molekulapálya-elmélet (MO) A molekulapálya elmélet szerint az atompályákból olyan molekulapályák jönnek létre amelyeken lévő elektronok a molekula egészéhez tartoznak. ˆ Kötőpályák: az ilyen pályák energiája kisebb mint azon eredeti atompályáké amelyek kombinációjából kialakultak. ˆ Lazítópályák: az ilyen pályák energiája nagyobb mint azon eredeti atompályáké amelyek kombinációjából kialakultak. ˆ Kötésrend: (kötőpályán lévő elektronok száma) (lazítópályán lévő elektronok száma) 2 A nagyobb kötésrend rövidebb és erősebb kötés kialakulását jelzi. 40/74
66 Molekulapálya-elmélet (MO) 41/74
67 Molekulapálya-elmélet (MO) 42/74
68 Molekulapálya-elmélet (MO) 43/74
69 Molekulapálya-elmélet (MO): H 2 Stabilitás Stabil Kötésrend 1 Mágneses tulajdonság Diamágneses 44/74
70 Molekulapálya-elmélet (MO): He 2 Stabilitás Instabil Kötésrend 0 Mágneses tulajdonság Diamágneses 45/74
71 Molekulapálya-elmélet (MO): Li 2 Stabilitás Stabil (csak gázfázisban létezik) Kötésrend 1 Mágneses tulajdonság Diamágneses 46/74
72 Molekulapálya-elmélet (MO): Be 2 Stabilitás Instabil Kötésrend 0 Mágneses tulajdonság Diamágneses 47/74
73 Molekulapálya-elmélet (MO): B 2 48/74
74 Molekulapálya-elmélet (MO): B 2 Stabilitás Stabil (csak gázfázisban létezik) Kötésrend 1 Mágneses tulajdonság Paramágneses 49/74
75 Molekulapálya-elmélet (MO): C 2 50/74
76 Molekulapálya-elmélet (MO): C 2 Stabilitás Stabil (csak gázfázisban létezik) Kötésrend 2 Mágneses tulajdonság Diamágneses 51/74
77 Molekulapálya-elmélet (MO): N 2 52/74
78 Molekulapálya-elmélet (MO): N 2 Stabilitás Stabil Kötésrend 3 Mágneses tulajdonság Diamágneses 53/74
79 Molekulapálya-elmélet (MO): O 2 54/74
80 Molekulapálya-elmélet (MO): O 2 Stabilitás Stabil Kötésrend 2 Mágneses tulajdonság Paramágneses 55/74
81 Molekulapálya-elmélet (MO): F 2 56/74
82 Molekulapálya-elmélet (MO): F 2 Stabilitás Stabil Kötésrend 1 Mágneses tulajdonság Diamágneses 57/74
83 Molekulapálya-elmélet (MO): Ne 2 58/74
84 Molekulapálya-elmélet (MO): Ne 2 Stabilitás Stabil Kötésrend 0 Mágneses tulajdonság Diamágneses 59/74
85 Molekulapálya-elmélet (MO): HF 60/74
86 Többcentrumú kötés Diborán Elektronpárok száma: 6 Kötések száma:8 W. N. Lipscomb kémiai Nobel díj, /74
87 Többcentrumú kötés Diborán 62/74
88 Kötések 63/74
89 Intermolekuláris kötések ˆ Molekulák közötti kölcsönhatások. ˆ Az anyag makroszkópikus tulajdonságaiért felelősek. ˆ Gyengébbek az elsőrendű kötéseknél. H 2 O 2H(g) + O(g) (+927 kj/mol) H 2 O(l) H 2 O(g) (+40.7 kj/mol 100 C-on) 64/74
90 Dipólus-dipólus és ion-dipólus kölcsönhatás Dipólus-dipóluskölcsönhatás: ˆ Poláris molekulák közötti elektrosztatikus kölcsönhatás, ahol az egyik molekula pozitív polaritású része a másik molekula negatív polaritású részére gyakorol vonzást. ˆ Az átlagos kötési energia 4 kj/mol E dipol dipol µ A 2 µ B 2 (kt )r 6 A B ˆ A dipólus-dipólus kölcsönhatások jelentősége csökken a hőmérséklet növelésével. 65/74
91 Dipólus-dipólus és ion-dipólus kölcsönhatás Ion-dipólus kölcsönhatás: Poláris molekulák és ionok közötti vonzó kölcsönhatás. Az átlagos kötési energia: E ion dipol Q2 A µ B 2 (kt )r 4 A B Hidratáció: 66/74
92 van der Waals-féle erők A van der Waals-féle erőket (diszperziós kölcsönhatás) a molekulák pillanatnyi polarizációja hozza létre. Minél nagyobb egy atom vagy molekula körül az elektronfelhő mérete annál könyebben polarizálható. µ = α E 67/74
93 van der Waals-féle erők Dipólusmomentummal nem rendelkező molekulák közötti kölcsönhatás. A van der Waals-féle erőket (diszperziós kölcsönhatás) a molekulák pillanatnyi polarizációja hozza létre. Minél nagyobb egy atom vagy molekula körül az elektronfelhő mérete annál könyebben polarizálható. ˆ ion-indukált dipólus ˆ dipólus-indukált dipólus (Xe H 2 O) E disp 2α Aµ 2 B R 6 A B ˆ indukált dipólus-indukált dipólus (nemesgázok kondenzációja) E disp α Aα B EI A EI B RA B 6 (EI A + EI B ) 68/74
94 Hidrogénkötés A hidrogénkötés a egy speciális erős dipólus-dipólus kölcsönhatás. Kialakulásának feltétele hogy a molekulákban legyen olyan hidrogén ami egy nagy elektronegativitású de kis méretű atomhoz (F, O, N) kapcsolódik (a kötés rendkívül poláris) amelynek van nemkötő elektronpárja is. δ F δ+ H δ F δ+ H kötés energia (kj/mol) ionos kovalens hidrogénkötés diszperziós erők 0, /74
95 Hidrogénkötés A hidrogénkötések kialakulásának bizonyítéka: Várt viselkedés: a forráspont növekszik a moláris tömeg növekedésével. Tapasztalat: a hidrogénkötésre képes vegyületek forráspontja 70/74
96 Hidrogénkötés ˆ Intermolekuláris hidrogénkötés ˆ Intramolekuláris hidrogénkötés 71/74
97 Hidrogénkötés ˆ A víz szerkezetében és tulajdonságaiban jelentős szerepet játszik. 72/74
98 Hidrogénkötés ˆ A víz szerkezetében és tulajdonságaiban jelentős szerepet játszik. 73/74
99 Hidrogénkötés ˆ Rendkívül fontos a szerepe a biológia rendszerekben:fehérjék, DNS... 74/74
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
Kémiai alapismeretek 3. hét
 Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 3. hét. Kémiai kötések. Kötések kialakítása - oktett elmélet. Az elızı órán elsajátítottuk, hogy.
 Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
A hidrogénmolekula. Energia
 A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
20/10/2016 tema04_biolf_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
A hidrogénmolekula. Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve!
 Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Periódusos rendszer (Mengyelejev, 1869) nemesgáz csoport: zárt héj, extra stabil
 s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
tema04_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai. Kémiai kötés kialakulásának oka: energianyereség.
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett elmélet (1916-19
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett elmélet (1916-19
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS
 Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
A periódusos rendszer, periodikus tulajdonságok
 A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
Az elektronpályák feltöltődési sorrendje
 3. előadás 12-09-17 2 12-09-17 Az elektronpályák feltöltődési sorrendje 3 Az elemek rendszerezése, a periódusos rendszer Elsőként Dimitrij Ivanovics Mengyelejev és Lothar Meyer vette észre az elemek halmazában
3. előadás 12-09-17 2 12-09-17 Az elektronpályák feltöltődési sorrendje 3 Az elemek rendszerezése, a periódusos rendszer Elsőként Dimitrij Ivanovics Mengyelejev és Lothar Meyer vette észre az elemek halmazában
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Altalános Kémia BMEVESAA101 tavasz 2008
 Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Folyadékok és szilárd anyagok
 Folyadékok és szilárd anyagok 7-1 Intermolekuláris erők, folyadékok tulajdonságai 7-2 Folyadékok gőztenziója 7-3 Szilárd anyagok néhány tulajdonsága 7-4 Fázisdiagram 7-5 Van der Waals kölcsönhatások 7-6
Folyadékok és szilárd anyagok 7-1 Intermolekuláris erők, folyadékok tulajdonságai 7-2 Folyadékok gőztenziója 7-3 Szilárd anyagok néhány tulajdonsága 7-4 Fázisdiagram 7-5 Van der Waals kölcsönhatások 7-6
FELADATMEGOLDÁS. Tesztfeladat: Válaszd ki a helyes megoldást!
 FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
Periódusosság. Általános Kémia, Periódikus tulajdonságok. Slide 1 of 35
 Periódusosság 11-1 Az elemek csoportosítása: a periódusos táblázat 11-2 Fémek, nemfémek és ionjaik 11-3 Az atomok és ionok mérete 11-4 Ionizációs energia 11-5 Elektron affinitás 11-6 Mágneses 11-7 Az elemek
Periódusosság 11-1 Az elemek csoportosítása: a periódusos táblázat 11-2 Fémek, nemfémek és ionjaik 11-3 Az atomok és ionok mérete 11-4 Ionizációs energia 11-5 Elektron affinitás 11-6 Mágneses 11-7 Az elemek
Koordinációs vegyületek (komplexek)
 Koordinációs vegyületek (komplexek) ML n M: központi ion/atom L: ligandum n: koordinációs szám Komplexek 1. Nevezéktan 2. Csoportosítás 3. A komplexképzıdés ismérvei 4. Koordinációs szám, geometria 5.
Koordinációs vegyületek (komplexek) ML n M: központi ion/atom L: ligandum n: koordinációs szám Komplexek 1. Nevezéktan 2. Csoportosítás 3. A komplexképzıdés ismérvei 4. Koordinációs szám, geometria 5.
Kémiai kötés: több atom reakcióba lépése során egy közös, stabil (telített) külső elektronhéj alakul ki.
 19. Kémiai kötések (Elsődleges és másodlagos kötések. Elektronegativitás, elektronaffinitás, ionizációs energia. Ionos, fémes és kovalens kötés. A kovalens kötések fajtái, működésük, osztályozásuk, hibridizáció.
19. Kémiai kötések (Elsődleges és másodlagos kötések. Elektronegativitás, elektronaffinitás, ionizációs energia. Ionos, fémes és kovalens kötés. A kovalens kötések fajtái, működésük, osztályozásuk, hibridizáció.
Periódusosság. Általános Kémia, Periódikus tulajdonságok. Slide 1 of 35
 Periódusosság 3-1 Az elemek csoportosítása: a periódusos táblázat 3-2 Fémek, nemfémek és ionjaik 3-3 Az atomok és ionok mérete 3-4 Ionizációs energia 3-5 Elektron affinitás 3-6 Mágneses 3-7 Az elemek periodikus
Periódusosság 3-1 Az elemek csoportosítása: a periódusos táblázat 3-2 Fémek, nemfémek és ionjaik 3-3 Az atomok és ionok mérete 3-4 Ionizációs energia 3-5 Elektron affinitás 3-6 Mágneses 3-7 Az elemek periodikus
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK. Rausch Péter kémia-környezettan
 AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
Az elemek rendszerezése, a periódusos rendszer
 Az elemek rendszerezése, a periódusos rendszer 12-09-16 1 A rendszerezés alapja, az elektronszerkezet kiépülése 12-09-16 2 Csoport 1 2 3 II III IA A B 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 IV V VI VII
Az elemek rendszerezése, a periódusos rendszer 12-09-16 1 A rendszerezés alapja, az elektronszerkezet kiépülése 12-09-16 2 Csoport 1 2 3 II III IA A B 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 IV V VI VII
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában. Szőri Milán: Kolloidkémia
 Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás
 Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás I. Egyatomos molekulák He, Ne, Ar, Kr, Xe, Rn - a molekula alakja: pontszerű - a kovalens kötés polaritása: NINCS kötés
Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás I. Egyatomos molekulák He, Ne, Ar, Kr, Xe, Rn - a molekula alakja: pontszerű - a kovalens kötés polaritása: NINCS kötés
Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik
 Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Bozó Tamás 2012. október 16. Atomi kölcsönhatások Nemesgázok: atomi előfordulás (He, Ne, Ar, Kr, Xe, Rn) Többi elem: molekulákat alkot (pl. H
Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Bozó Tamás 2012. október 16. Atomi kölcsönhatások Nemesgázok: atomi előfordulás (He, Ne, Ar, Kr, Xe, Rn) Többi elem: molekulákat alkot (pl. H
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését!
 I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
ORVOSI KÉMIA. Az anyag szerkezete
 ORVOSI KÉMIA Az anyag szerkezete Nagy Veronika PTE ÁOK 2017/18. Egyes ábrákat a Chemistry c. (McMurry & Fay, 4 th ed.) könyvből vettünk át. Tanulási célok Az anyagot felépítő elemi részecskék (atomok,
ORVOSI KÉMIA Az anyag szerkezete Nagy Veronika PTE ÁOK 2017/18. Egyes ábrákat a Chemistry c. (McMurry & Fay, 4 th ed.) könyvből vettünk át. Tanulási célok Az anyagot felépítő elemi részecskék (atomok,
8. Osztály. Kód. Szent-Györgyi Albert kémiavetélkedő
 8. Osztály Kedves Versenyző! A jobb felső sarokban található mezőbe írd fel a verseny lebonyolításáért felelős személytől kapott kódot a feladatlap minden oldalára. A feladatokat lehetőleg a feladatlapon
8. Osztály Kedves Versenyző! A jobb felső sarokban található mezőbe írd fel a verseny lebonyolításáért felelős személytől kapott kódot a feladatlap minden oldalára. A feladatokat lehetőleg a feladatlapon
Periódusosság. 9-1 Az elemek csoportosítása: a periódusostáblázat
 Periódusosság 9-1 Az elemek csoportosítása: aperiódusos táblázat 9-2 Fémek, nemfémek és ionjaik 9-3 Az atomok és ionok mérete 9-4 Ionizációs energia 9-5 Elektron affinitás 9-6 Mágneses 9-7 Az elemek periódikus
Periódusosság 9-1 Az elemek csoportosítása: aperiódusos táblázat 9-2 Fémek, nemfémek és ionjaik 9-3 Az atomok és ionok mérete 9-4 Ionizációs energia 9-5 Elektron affinitás 9-6 Mágneses 9-7 Az elemek periódikus
Az anyagszerkezet alapjai. Az atomok felépítése
 Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai
 Kérdések Az anyagszerkezet alapjai Az atomok felépítése Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Kérdések Az anyagszerkezet alapjai Az atomok felépítése Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
A SZILÁRDTEST FOGALMA. Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. molekula klaszter szilárdtest > σ λ : rel.
 A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
Fizikai kémia 2. Előzmények. A Lewis-féle kötéselmélet A VB- és az MO-elmélet, a H 2+ molekulaion
 06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
I. ATOMOK, IONOK I. 1 3. FELELETVÁLASZTÁSOS TESZTEK
 I. ATMK, INK I. 1 3. FELELETVÁLASZTÁSS TESZTEK 0 1 2 3 4 5 6 7 8 9 0 A C C D C D A D C 1 C B C E* B E C C ** E 2 D C E D C B D A E C 3 A B D B B B D C D C 4 B B D B B D D C C D 5 D B * a negyedik, vagyis
I. ATMK, INK I. 1 3. FELELETVÁLASZTÁSS TESZTEK 0 1 2 3 4 5 6 7 8 9 0 A C C D C D A D C 1 C B C E* B E C C ** E 2 D C E D C B D A E C 3 A B D B B B D C D C 4 B B D B B D D C C D 5 D B * a negyedik, vagyis
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Az anyagszerkezet alapjai. Az atomok felépítése
 Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekIKözgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekIKözgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Bevezetés a lézeres anyagmegmunkálásba
 Bevezetés a lézeres anyagmegmunkálásba FBN332E-1 Dr. Geretovszky Zsolt 2010. október 6. Anyagcsaládok Fémek Kerámiák, üvegek Műanyagok Kompozitok A családok közti különbségek tárgyalhatóak: atomi szinten
Bevezetés a lézeres anyagmegmunkálásba FBN332E-1 Dr. Geretovszky Zsolt 2010. október 6. Anyagcsaládok Fémek Kerámiák, üvegek Műanyagok Kompozitok A családok közti különbségek tárgyalhatóak: atomi szinten
Atomszerkezet, kötések
 Anyagszerkezettan és anyagvizsgálat 016/17 Atomszerkezet, kötések Dr. Szabó Péter János szpj@eik.bme.hu Az előadás során megismerjük: a két alapvető atommodell alapjait, és a modellek közötti különbségeket;
Anyagszerkezettan és anyagvizsgálat 016/17 Atomszerkezet, kötések Dr. Szabó Péter János szpj@eik.bme.hu Az előadás során megismerjük: a két alapvető atommodell alapjait, és a modellek közötti különbségeket;
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Vegyületek - vegyületmolekulák
 Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
NE FELEJTSÉTEK EL BEÍRNI AZ EREDMÉNYEKET A KIJELÖLT HELYEKRE! A feladatok megoldásához szükséges kerekített értékek a következők:
 A Szerb Köztársaság Oktatási Minisztériuma Szerbiai Kémikusok Egyesülete Köztársasági verseny kémiából Kragujevac, 2008. 05. 24.. Teszt a középiskolák I. osztálya számára Név és utónév Helység és iskola
A Szerb Köztársaság Oktatási Minisztériuma Szerbiai Kémikusok Egyesülete Köztársasági verseny kémiából Kragujevac, 2008. 05. 24.. Teszt a középiskolák I. osztálya számára Név és utónév Helység és iskola
6) Az átmenetifémek szerves származékai
 Rendszeres fémorganikus kémia 2009-2010 (134) Átmenetifém-átmenetifém kötések és klaszterek Történet: A. Werner (1866-1919) oligonukleáris komplexekben ligandum-hidakat tételezett fel: (H 3 N)(Cl)Pt(µ-Cl)
Rendszeres fémorganikus kémia 2009-2010 (134) Átmenetifém-átmenetifém kötések és klaszterek Történet: A. Werner (1866-1919) oligonukleáris komplexekben ligandum-hidakat tételezett fel: (H 3 N)(Cl)Pt(µ-Cl)
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
A kémiai kötés magasabb szinten
 A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
Minta feladatsor. Az ion neve. Az ion képlete O 4. Szulfátion O 3. Alumíniumion S 2 CHH 3 COO. Króm(III)ion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Molekulák világa 2. kémiai szeminárium. Szilágyi András
 Molekulák világa 2. kémiai szeminárium Szilágyi András Kvantummechanikai ismétlés Kvantummechanikai részecskéről csak valószínűségi állítást tehetünk A részecske leírója a hullámfüggvény, ez kódolja a
Molekulák világa 2. kémiai szeminárium Szilágyi András Kvantummechanikai ismétlés Kvantummechanikai részecskéről csak valószínűségi állítást tehetünk A részecske leírója a hullámfüggvény, ez kódolja a
Curie Kémia Emlékverseny 2018/2019. Országos Döntő 9. évfolyam
 A feladatokat írta: Kódszám: Pócsiné Erdei Irén, Debrecen... Lektorálta: Kálnay Istvánné, Nyíregyháza 2019. május 11. Curie Kémia Emlékverseny 2018/2019. Országos Döntő 9. évfolyam A feladatok megoldásához
A feladatokat írta: Kódszám: Pócsiné Erdei Irén, Debrecen... Lektorálta: Kálnay Istvánné, Nyíregyháza 2019. május 11. Curie Kémia Emlékverseny 2018/2019. Országos Döntő 9. évfolyam A feladatok megoldásához
Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia
 Áttekintés Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia Bozó Tamás Nanobiotechnológia és Molekuláris Biofizika Munkacsoport Biofizikai és Sugárbiológiai
Áttekintés Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia Bozó Tamás Nanobiotechnológia és Molekuláris Biofizika Munkacsoport Biofizikai és Sugárbiológiai
Koordinációs (komplex) vegyületek
 Koordinációs (komplex) vegyületek lfred Werner 1893-1913 CoCl 3 + 6 CoCl 3 ٠6 komplex szín régi név CoCl 3 ٠6 CoCl 3 ٠5 CoCl 3 ٠4 sárga bíborvörös zöld Luteo komplex Purpureo komplex Praseo komplex CoCl
Koordinációs (komplex) vegyületek lfred Werner 1893-1913 CoCl 3 + 6 CoCl 3 ٠6 komplex szín régi név CoCl 3 ٠6 CoCl 3 ٠5 CoCl 3 ٠4 sárga bíborvörös zöld Luteo komplex Purpureo komplex Praseo komplex CoCl
Kémiai fizikai alapok I. Vízminőség, vízvédelem 2009-2010. tavasz
 Kémiai fizikai alapok I. Vízminőség, vízvédelem 2009-2010. tavasz 1. A vízmolekula szerkezete Elektronegativitás, polaritás, másodlagos kötések 2. Fizikai tulajdonságok a) Szerkezetből adódó különleges
Kémiai fizikai alapok I. Vízminőség, vízvédelem 2009-2010. tavasz 1. A vízmolekula szerkezete Elektronegativitás, polaritás, másodlagos kötések 2. Fizikai tulajdonságok a) Szerkezetből adódó különleges
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia
 Áttekintés Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia Bozó Tamás Nanobiotechnológia és Molekuláris Biofizika Munkacsoport Biofizikai és Sugárbiológiai
Áttekintés Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia Bozó Tamás Nanobiotechnológia és Molekuláris Biofizika Munkacsoport Biofizikai és Sugárbiológiai
1. változat. 4. Jelöld meg azt az oxidot, melynek megfelelője a vas(iii)-hidroxid! A FeO; Б Fe 2 O 3 ; В OF 2 ; Г Fe 3 O 4.
 1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
Általános kémia Gyógyszerészhallgatók számára (kivonat az előadás anyagából) (nem végleges verzió) december 12.
 Általános kémia Gyógyszerészhallgatók számára (kivonat az előadás anyagából) (nem végleges verzió) 2010 2010. december 12. Tematika Alapismeretek Atom- és molekulaszerekezet Reakciók és egyensúlyok (még
Általános kémia Gyógyszerészhallgatók számára (kivonat az előadás anyagából) (nem végleges verzió) 2010 2010. december 12. Tematika Alapismeretek Atom- és molekulaszerekezet Reakciók és egyensúlyok (még
Az atom- olvasni. 1. ábra Az atom felépítése 1. Az atomot felépítő elemi részecskék. Proton, Jele: (p+) Neutron, Jele: (n o )
 Az atom- olvasni 2.1. Az atom felépítése Az atom pozitív töltésű atommagból és negatív töltésű elektronokból áll. Az atom atommagból és elektronburokból álló semleges kémiai részecske. Az atommag pozitív
Az atom- olvasni 2.1. Az atom felépítése Az atom pozitív töltésű atommagból és negatív töltésű elektronokból áll. Az atom atommagból és elektronburokból álló semleges kémiai részecske. Az atommag pozitív
Bevezetés az általános kémiába
 Bevezetés az általános kémiába 1. előadás (Atomok és molekulák szerkezete) Előadó: Krámos Balázs kramosbalazs@ch.bme.hu Segédanyag: http://www.ch.bme.hu/oktatas/ejegyzet/ Benkő Zoltán és mtsai: Kémiai
Bevezetés az általános kémiába 1. előadás (Atomok és molekulák szerkezete) Előadó: Krámos Balázs kramosbalazs@ch.bme.hu Segédanyag: http://www.ch.bme.hu/oktatas/ejegyzet/ Benkő Zoltán és mtsai: Kémiai
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Szent-Györgyi Albert kémiavetélkedő Kód
 9. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
9. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
5. elıadás KRISTÁLYKÉMIAI ALAPOK
 5. elıadás KRISTÁLYKÉMIAI ALAPOK KRISTÁLYKÉMIAI ALAPFOGALMAK Atomok: az anyag legkisebb olyan részei, amelyek még hordozzák a kémiai elem jellegzetességeit. Részei: atommag (mely protonokból és neutronokból
5. elıadás KRISTÁLYKÉMIAI ALAPOK KRISTÁLYKÉMIAI ALAPFOGALMAK Atomok: az anyag legkisebb olyan részei, amelyek még hordozzák a kémiai elem jellegzetességeit. Részei: atommag (mely protonokból és neutronokból
Toluol (Bruckner II/1 476) µ= 0.33 Debye
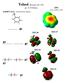 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
Bevezetés az anyagtudományba II. előadás
 Bevezetés az anyagtudományba II. előadás 010. febuá 11. Boh-féle atommodell 1914 Niels Henik David BOHR 1885-196 Posztulátumai: 1) Az elekton a mag köül köpályán keing. ) Az elektonok számáa csak bizonyos
Bevezetés az anyagtudományba II. előadás 010. febuá 11. Boh-féle atommodell 1914 Niels Henik David BOHR 1885-196 Posztulátumai: 1) Az elekton a mag köül köpályán keing. ) Az elektonok számáa csak bizonyos
Atomi és molekuláris kölcsönhatások. Pásztázó tűszondás mikroszkópia.
 Atomi és molekuláris kölcsönhatások. Pásztázó tűszondás mikroszkópia. Kiss Balázs Nanobiotechnológia és Egyedi Molekula Kutatócsoport, Biofizikai és Sugárbiológiai Intézet 2013. november 28. 2 Atomi kölcsönhatások
Atomi és molekuláris kölcsönhatások. Pásztázó tűszondás mikroszkópia. Kiss Balázs Nanobiotechnológia és Egyedi Molekula Kutatócsoport, Biofizikai és Sugárbiológiai Intézet 2013. november 28. 2 Atomi kölcsönhatások
Kolloid állapotjelzők. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek
 Kolloid állapotjelzők. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
Kolloid állapotjelzők. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
Az elemeket 3 csoportba osztjuk: Félfémek vagy átmeneti fémek nemfémek. fémek
 Kémiai kötések Az elemeket 3 csoportba osztjuk: Félfémek vagy átmeneti fémek nemfémek fémek Fémek Szürke színűek, kivétel a színesfémek: arany,réz. Szilárd halmazállapotúak, kivétel a higany. Vezetik az
Kémiai kötések Az elemeket 3 csoportba osztjuk: Félfémek vagy átmeneti fémek nemfémek fémek Fémek Szürke színűek, kivétel a színesfémek: arany,réz. Szilárd halmazállapotúak, kivétel a higany. Vezetik az
Általános kémia Gyógyszerészhallgatók számára (kivonat az előadás anyagából) (nem végleges verzió) november 18.
 Általános kémia Gyógyszerészhallgatók számára (kivonat az előadás anyagából) (nem végleges verzió) 2006 2006. november 18. 1 Tematika Alapismeretek Atom- és molekulaszerekezet Reakciók és egyensúlyok (még
Általános kémia Gyógyszerészhallgatók számára (kivonat az előadás anyagából) (nem végleges verzió) 2006 2006. november 18. 1 Tematika Alapismeretek Atom- és molekulaszerekezet Reakciók és egyensúlyok (még
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Minta vizsgalap I. Karikázza be az egyetlen megfelelő válasz betűjelét! (10x1 pont) 1. Melyik sorban szerepel csak só?
 Minta vizsgalap I. Karikázza be az egyetlen megfelelő válasz betűjelét! (10x) 1. Melyik sorban szerepel csak só? A) CH 3 COONa, K 2 SO 4, Na 3 PO 4, NH 4 Cl B) H 2 SO 4, Na 3 PO 4, NH 4 Cl, NaCl C) Fe(NO
Minta vizsgalap I. Karikázza be az egyetlen megfelelő válasz betűjelét! (10x) 1. Melyik sorban szerepel csak só? A) CH 3 COONa, K 2 SO 4, Na 3 PO 4, NH 4 Cl B) H 2 SO 4, Na 3 PO 4, NH 4 Cl, NaCl C) Fe(NO
a. 35-ös tömegszámú izotópjában 18 neutron található. b. A 3. elektronhéján két vegyértékelektront tartalmaz. c. 2 mól atomjának tömege 32 g.
 MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
Az anyagi rendszerek csoportosítása
 Kémia 1 A kémiai ismeretekről A modern technológiai folyamatok és a környezet védelmére tett intézkedések alig érthetőek kémiai tájékozottság nélkül. Ma már minden mérnök számára alapvető fontosságú a
Kémia 1 A kémiai ismeretekről A modern technológiai folyamatok és a környezet védelmére tett intézkedések alig érthetőek kémiai tájékozottság nélkül. Ma már minden mérnök számára alapvető fontosságú a
Kormeghatározás gyorsítóval
 Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Tartalom Az atom szerkezete... 1 9 Atom. Részecske. Molekula... 1 4 Atommodellek... 4 6 A.) J. Thomson féle atommodell...4 B.) A Rutherford-féle vagy
 Tartalom Az atom szerkezete... 1 9 Atom. Részecske. Molekula... 1 4 Atommodellek... 4 6 A.) J. Thomson féle atommodell...4 B.) A Rutherford-féle vagy bolygó atommodell... 4 5 C.) A Bohr-féle atommodell...
Tartalom Az atom szerkezete... 1 9 Atom. Részecske. Molekula... 1 4 Atommodellek... 4 6 A.) J. Thomson féle atommodell...4 B.) A Rutherford-féle vagy bolygó atommodell... 4 5 C.) A Bohr-féle atommodell...
Minta feladatsor. Az ion képlete. Az ion neve O 4. Foszfátion. Szulfátion CO 3. Karbonátion. Hidrogénkarbonátion O 3. Alumíniumion. Al 3+ + Szulfidion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve Foszfátion Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve Foszfátion Szulfátion
Szigetelők Félvezetők Vezetők
 Dr. Báder Imre: AZ ELEKTROMOS VEZETŐK Az anyagokat elektromos erőtérben tapasztalt viselkedésük alapján két alapvető csoportba soroljuk: szigetelők (vagy dielektrikumok) és vezetők (vagy konduktorok).
Dr. Báder Imre: AZ ELEKTROMOS VEZETŐK Az anyagokat elektromos erőtérben tapasztalt viselkedésük alapján két alapvető csoportba soroljuk: szigetelők (vagy dielektrikumok) és vezetők (vagy konduktorok).
10.) Milyen alakja van az SF 4 molekulának? Rajzolja le és indokolja! (2 pont) libikóka; indoklás: 1 nemkötő és 4 kötő elektronpár
 1.) Írja le az atom definícióját! (2 pont) Kémiai úton tovább nem bontható, pozitív töltésű atommagból és azzal kölcsönhatásban álló egy vagy több negatív töltésű elektronból felépülő részecske, elektromosan
1.) Írja le az atom definícióját! (2 pont) Kémiai úton tovább nem bontható, pozitív töltésű atommagból és azzal kölcsönhatásban álló egy vagy több negatív töltésű elektronból felépülő részecske, elektromosan
Minta vizsgalap (2007/08. I. félév)
 Minta vizsgalap (2007/08. I. félév) I. Karikázza be az egyetlen megfelelő válasz betűjelét! (10x) 1. Melyik sorban szerepel csak só? A) CH 3 COONa, K 2 SO 4, Na 3 PO 4, NH 4 Cl B) H 2 SO 4, Na 3 PO 4,
Minta vizsgalap (2007/08. I. félév) I. Karikázza be az egyetlen megfelelő válasz betűjelét! (10x) 1. Melyik sorban szerepel csak só? A) CH 3 COONa, K 2 SO 4, Na 3 PO 4, NH 4 Cl B) H 2 SO 4, Na 3 PO 4,
Fizikai kémia 2. ZH II. kérdések I. félévtől
 Fizikai kémia 2. ZH II. kérdések 2018-19 I. félévtől Szükséges adatok, állandók és összefüggések: c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
Fizikai kémia 2. ZH II. kérdések 2018-19 I. félévtől Szükséges adatok, állandók és összefüggések: c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
XLVI. Irinyi János Középiskolai Kémiaverseny 2014. február 6. * Iskolai forduló I.a, I.b és III. kategória
 Tanuló neve és kategóriája Iskolája Osztálya XLVI. Irinyi János Középiskolai Kémiaverseny 201. február 6. * Iskolai forduló I.a, I.b és III. kategória Munkaidő: 120 perc Összesen 100 pont A periódusos
Tanuló neve és kategóriája Iskolája Osztálya XLVI. Irinyi János Középiskolai Kémiaverseny 201. február 6. * Iskolai forduló I.a, I.b és III. kategória Munkaidő: 120 perc Összesen 100 pont A periódusos
A fémkomplexek szerkezetéről
 A fémkomplexek szerkezetéről A szerves és a főcsoportbeli szervetlen vegyületek hihetetlenül nagy változatosságról, szerkezetükről, az e vegyületek körében fellépő izomériák típusairól már a középiskolában
A fémkomplexek szerkezetéről A szerves és a főcsoportbeli szervetlen vegyületek hihetetlenül nagy változatosságról, szerkezetükről, az e vegyületek körében fellépő izomériák típusairól már a középiskolában
Fizikai kémia Részecskék mágneses térben, ESR spektroszkópia. Részecskék mágneses térben. Részecskék mágneses térben
 06.08.. Fizikai kémia. 3. Részecskék mágneses térben, ESR spektroszkópia Dr. Berkesi Ottó SZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Részecskék mágneses térben A részecskék mágneses térben ugyanúgy
06.08.. Fizikai kémia. 3. Részecskék mágneses térben, ESR spektroszkópia Dr. Berkesi Ottó SZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Részecskék mágneses térben A részecskék mágneses térben ugyanúgy
Kolloid állapotjelzık. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek
 Kolloid állapotjelzık. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta és Bányai István Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
Kolloid állapotjelzık. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta és Bányai István Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
Szőri Milán: Kolloidkémia
 Kolloidkémia 1. előadás Összetétel megadás és mérési alapismeretek. Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában. Szőri Milán: Kolloidkémia 1 Levelezős Órarend ALKALOM
Kolloidkémia 1. előadás Összetétel megadás és mérési alapismeretek. Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában. Szőri Milán: Kolloidkémia 1 Levelezős Órarend ALKALOM
