A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
|
|
|
- Alexandra Vincze
- 8 évvel ezelőtt
- Látták:
Átírás
1 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi atom körül milyen elektron-csoport elrendeződés alakul ki - szabályos térbeli geometriák nemkötő elektronpárok megléte torzítani fogja a molekulát, a kötésszöget Kovalens kötésű molekulák geometriája elektronpár taszítási elmélet (VSEPR): az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek Molekula geometria AXE jelöléssel a molekulák általános képlete A központi atom X a kapcsolódó további atomok (ligandumok) E a központi atomon lévő nemkötő (magányos) elektronpárok a nemkötő elektronpárnak nagyobb a térigénye 1
2 Vegyértékelektronpár taszítási elmélet (VSEPR) A kovalens kötés elmélete Vegyértékkötés elmélet (VB) a kötés az atompályák átfedésével jön létre egyszeres kötés jöhet létre a kötéstengely mentén, ahol az elektronsűrűség a két atom közötti térben a legnagyobb (σ-kötés) s-s, s-p és p-p átfedés lehetséges Vegyértékkötés elmélet (VB) kettős vagy hármas kötés (π-kötések) szimmetrikusan veszik körül a magokat összekötő tengelyt csak p-p átfedéssel valósulhat meg a molekula alatt és felett, illetve a molekula előtt és mögött a legnagyobb az elektronsűrűség 2
3 Vegyértékkötés elmélet (VB) nagyobb átfedésű kötések jönnek létre, ha az atompályák kombinálódnak hibridizáció A hibridorbitálok önállóan nem léteznek, azonban formális felhasználásuk nagyban megkönnyítik a molekulák elektronhéj szerkezetének leírását. Vegyértékkötés elmélet (VB) az atompályák kombinálódása azok előzetes gerjesztődésével jár annyi hibridpálya keletkezik, ahány atom-pálya vett részt a kombinálódásban a hibridpályák átfedésével a σ- kötések alakulnak ki a maradék p-pályákból jön létre a π-kötés a hibridpályák alakja megszabja a molekula-geometriát Hibridpályák és kötések kialakulása Be-atom hibridizációja Be sp hibridpályái F 2p pályái atompályák közötti átfedés hibridizáció 1 db s-pálya 1 db p-pálya 2 db sp hibrid atompálya A két hibridpálya összege: szimmetrikus lineáris elrendeződés 3
4 Hibridpályák és kötések kialakulása BF 3 B-atom hibridizációja hibridizáció 1 db s-pálya 2db p-pálya 3 db sp 2 hibrid atompálya (trigonális planáris) Hibridpályák és kötések kialakulása CH 4 hibridizáció 1 db s-pálya 3 db p-pálya 4 db sp 3 hibrid atompálya (tetraéderes) Molekulaorbitál-elmélet (MO) az elektronok a molekulákban olyan módosult pályákon helyezkednek el, amelyek a molekula egészéhez tartoznak a molekulapályák az eredeti atompályák kombinálódásával jönnek létre a kapcsolódó elektronok az atompályák felhasadásakor kialakuló kötő és lazító pályákon helyezkednek el LCAO (atompályák lineáris kombinációja) 4
5 Molekulapálya-elmélet (MO) a molekulapályák feltöltődésére ugyanazok a szabályok érvényesek, mint az atompályáknál energiaminimum elve, Pauli-elv, Hund szabály Molekulapálya elmélet Delokalizált kötés az elektronpár nem csak két atom erőterében lokalizálódik (található) csak π kötés lehet rezonancia-képlettel jelölve O 3 NO 3 5
6 Másodlagos kémiai kötések Van der Waals féle kötések - lezárt elektronhéjú atomok vagy molekulák között alakul ki diszperziós hatás (London-féle erők) indukciós effektus orientációs hatás (dipól-dipól kölcsönhatás) Hidrogénkötés N, O vagy F atomhoz kötött hidrogén-atom és egy másik N, O, F magányos elektronpárja között létrejött kapcsolat Diszperziós hatás London-féle erők apoláris molekulák között lép fel molekulák között fellépő pillanatnyi polarizáció okozza annál erősebb, minél könnyebben polarizálható a molekula Indukciós effektus dipólus molekula és apoláris molekula között kialakuló kölcsönhatás - indukált dipólus jön létre rövid távolságokon belül hat nagyon kis energiájú pl. I 2 és H 2 O 6
7 Orientációs hatás dipól-dipól kölcsönhatás állandó dipólusú molekulák között alakul ki az egyik molekula dipólusának tere irányítja a többi molekulát - ellentétes töltésű pólusaik kerüljenek egymás közelébe a molekulák szoros, térben közelebbi kapcsolata meghatározó a dipólusmomentum Hidrogén-kötés nagy EN atomhoz (O, N, F) kötött H-atom és egy másik O, N vagy F-atom magányos elektronpárja között alakul ki donor és akceptor molekulák között - datív kötés A hidrogén-kötés jellemzői térben irányított kötések a központi atomok magányos elektronpárjának iránya miatt a H kötések legtöbbször lieárisak kötéshossza sokkal nagyobb, mint a kovalens N-H, O-H és F-H kötéseké (100, 97, 92 pm) O-H O 276 pm O-H N 288 pm N-H O 304 pm N-H N 310 pm 7
8 A hidrogén-kötés jellemzői a kötés energiája kisebb (10-40 kj/mol), mint a kovalensé ( kj/mol), de nagyobb, mint a Van der Waals kötéseké (1-10 kj/mol) intermolekuláris és intramolekuláris kapcsolat is lehet Hidrogén-kötés hatásai rögzített szerkezetek kialakulása olvadáspont és forráspont módosulása fontos élettani szerep 8
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 3. hét. Kémiai kötések. Kötések kialakítása - oktett elmélet. Az elızı órán elsajátítottuk, hogy.
 Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Szalai István. ELTE Kémiai Intézet 1/74
 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A hidrogénmolekula. Energia
 A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
A hidrogénmolekula. Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve!
 Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Kémiai alapismeretek 3. hét
 Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
20/10/2016 tema04_biolf_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
Periódusos rendszer (Mengyelejev, 1869) nemesgáz csoport: zárt héj, extra stabil
 s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
FELADATMEGOLDÁS. Tesztfeladat: Válaszd ki a helyes megoldást!
 FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Fizikai kémia 2. Előzmények. A Lewis-féle kötéselmélet A VB- és az MO-elmélet, a H 2+ molekulaion
 06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
tema04_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés: több atom reakcióba lépése során egy közös, stabil (telített) külső elektronhéj alakul ki.
 19. Kémiai kötések (Elsődleges és másodlagos kötések. Elektronegativitás, elektronaffinitás, ionizációs energia. Ionos, fémes és kovalens kötés. A kovalens kötések fajtái, működésük, osztályozásuk, hibridizáció.
19. Kémiai kötések (Elsődleges és másodlagos kötések. Elektronegativitás, elektronaffinitás, ionizációs energia. Ionos, fémes és kovalens kötés. A kovalens kötések fajtái, működésük, osztályozásuk, hibridizáció.
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai. Kémiai kötés kialakulásának oka: energianyereség.
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett elmélet (1916-19
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett elmélet (1916-19
A kémiai kötés magasabb szinten
 A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK. Rausch Péter kémia-környezettan
 AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Az anyagszerkezet alapjai. Az atomok felépítése
 Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai
 Kérdések Az anyagszerkezet alapjai Az atomok felépítése Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Kérdések Az anyagszerkezet alapjai Az atomok felépítése Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Altalános Kémia BMEVESAA101 tavasz 2008
 Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Fizikai kémia 2. ZH II. kérdések I. félévtől
 Fizikai kémia 2. ZH II. kérdések 2018-19 I. félévtől Szükséges adatok, állandók és összefüggések: c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
Fizikai kémia 2. ZH II. kérdések 2018-19 I. félévtől Szükséges adatok, állandók és összefüggések: c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában. Szőri Milán: Kolloidkémia
 Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Az anyagszerkezet alapjai. Az atomok felépítése
 Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Folyadékok és szilárd anyagok
 Folyadékok és szilárd anyagok 7-1 Intermolekuláris erők, folyadékok tulajdonságai 7-2 Folyadékok gőztenziója 7-3 Szilárd anyagok néhány tulajdonsága 7-4 Fázisdiagram 7-5 Van der Waals kölcsönhatások 7-6
Folyadékok és szilárd anyagok 7-1 Intermolekuláris erők, folyadékok tulajdonságai 7-2 Folyadékok gőztenziója 7-3 Szilárd anyagok néhány tulajdonsága 7-4 Fázisdiagram 7-5 Van der Waals kölcsönhatások 7-6
ORVOSI KÉMIA. Az anyag szerkezete
 ORVOSI KÉMIA Az anyag szerkezete Nagy Veronika PTE ÁOK 2017/18. Egyes ábrákat a Chemistry c. (McMurry & Fay, 4 th ed.) könyvből vettünk át. Tanulási célok Az anyagot felépítő elemi részecskék (atomok,
ORVOSI KÉMIA Az anyag szerkezete Nagy Veronika PTE ÁOK 2017/18. Egyes ábrákat a Chemistry c. (McMurry & Fay, 4 th ed.) könyvből vettünk át. Tanulási célok Az anyagot felépítő elemi részecskék (atomok,
Bevezetés az általános kémiába
 Bevezetés az általános kémiába 1. előadás (Atomok és molekulák szerkezete) Előadó: Krámos Balázs kramosbalazs@ch.bme.hu Segédanyag: http://www.ch.bme.hu/oktatas/ejegyzet/ Benkő Zoltán és mtsai: Kémiai
Bevezetés az általános kémiába 1. előadás (Atomok és molekulák szerkezete) Előadó: Krámos Balázs kramosbalazs@ch.bme.hu Segédanyag: http://www.ch.bme.hu/oktatas/ejegyzet/ Benkő Zoltán és mtsai: Kémiai
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Az elektronpályák feltöltődési sorrendje
 3. előadás 12-09-17 2 12-09-17 Az elektronpályák feltöltődési sorrendje 3 Az elemek rendszerezése, a periódusos rendszer Elsőként Dimitrij Ivanovics Mengyelejev és Lothar Meyer vette észre az elemek halmazában
3. előadás 12-09-17 2 12-09-17 Az elektronpályák feltöltődési sorrendje 3 Az elemek rendszerezése, a periódusos rendszer Elsőként Dimitrij Ivanovics Mengyelejev és Lothar Meyer vette észre az elemek halmazában
Molekulák világa 2. kémiai szeminárium. Szilágyi András
 Molekulák világa 2. kémiai szeminárium Szilágyi András Kvantummechanikai ismétlés Kvantummechanikai részecskéről csak valószínűségi állítást tehetünk A részecske leírója a hullámfüggvény, ez kódolja a
Molekulák világa 2. kémiai szeminárium Szilágyi András Kvantummechanikai ismétlés Kvantummechanikai részecskéről csak valószínűségi állítást tehetünk A részecske leírója a hullámfüggvény, ez kódolja a
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS
 Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik
 Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Bozó Tamás 2012. október 16. Atomi kölcsönhatások Nemesgázok: atomi előfordulás (He, Ne, Ar, Kr, Xe, Rn) Többi elem: molekulákat alkot (pl. H
Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Bozó Tamás 2012. október 16. Atomi kölcsönhatások Nemesgázok: atomi előfordulás (He, Ne, Ar, Kr, Xe, Rn) Többi elem: molekulákat alkot (pl. H
Vegyületek - vegyületmolekulák
 Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
A molekulák szerkezetének leírásához a kémiai kötés elméletének a kidolgozása a szükséges feltétel, nem véletlen tehát, hogy ez az, ami a kémikust
 A molekulák szerkezetének leírásához a kémiai kötés elméletének a kidolgozása a szükséges feltétel, nem véletlen tehát, hogy ez az, ami a kémikust legjobban izgatja és tanulmányaik során Önök is a legtöbbet
A molekulák szerkezetének leírásához a kémiai kötés elméletének a kidolgozása a szükséges feltétel, nem véletlen tehát, hogy ez az, ami a kémikust legjobban izgatja és tanulmányaik során Önök is a legtöbbet
I. ATOMOK, IONOK I. 1 3. FELELETVÁLASZTÁSOS TESZTEK
 I. ATMK, INK I. 1 3. FELELETVÁLASZTÁSS TESZTEK 0 1 2 3 4 5 6 7 8 9 0 A C C D C D A D C 1 C B C E* B E C C ** E 2 D C E D C B D A E C 3 A B D B B B D C D C 4 B B D B B D D C C D 5 D B * a negyedik, vagyis
I. ATMK, INK I. 1 3. FELELETVÁLASZTÁSS TESZTEK 0 1 2 3 4 5 6 7 8 9 0 A C C D C D A D C 1 C B C E* B E C C ** E 2 D C E D C B D A E C 3 A B D B B B D C D C 4 B B D B B D D C C D 5 D B * a negyedik, vagyis
Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás
 Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás I. Egyatomos molekulák He, Ne, Ar, Kr, Xe, Rn - a molekula alakja: pontszerű - a kovalens kötés polaritása: NINCS kötés
Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás I. Egyatomos molekulák He, Ne, Ar, Kr, Xe, Rn - a molekula alakja: pontszerű - a kovalens kötés polaritása: NINCS kötés
Bevezetés az általános kémiába
 Bevezetés az általános kémiába 1. előadás (Atomok és molekulák szerkezete) Előadó: Krámos Balázs kramosbalazs@ch.bme.hu Segédanyag: http://www.ch.bme.hu/oktatas/ejegyzet/ Benkő Zoltán, Kőmívesné Tamás
Bevezetés az általános kémiába 1. előadás (Atomok és molekulák szerkezete) Előadó: Krámos Balázs kramosbalazs@ch.bme.hu Segédanyag: http://www.ch.bme.hu/oktatas/ejegyzet/ Benkő Zoltán, Kőmívesné Tamás
Kolloid állapotjelzők. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek
 Kolloid állapotjelzők. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
Kolloid állapotjelzők. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Elektronszínképek Ultraibolya- és látható spektroszkópia
 Elektronszínképek Ultraibolya- és látható spektroszkópia Elektronátmenetek elektromos dipólus-átmenetek (a molekula változó dipólusmomentuma lép kölcsönhatásba az elektromágneses sugárzás elektromos terével)
Elektronszínképek Ultraibolya- és látható spektroszkópia Elektronátmenetek elektromos dipólus-átmenetek (a molekula változó dipólusmomentuma lép kölcsönhatásba az elektromágneses sugárzás elektromos terével)
az Anyagtudomány az anyagok szerkezetével, tulajdonságaival, az anyagszerkezet és a tulajdonságok közötti kapcsolatokkal, valamint a tulajdonságok
 az Anyagtudomány az anyagok szerkezetével, tulajdonságaival, az anyagszerkezet és a tulajdonságok közötti kapcsolatokkal, valamint a tulajdonságok megváltoztatásának elvi alapjaival foglalkozó tudomány
az Anyagtudomány az anyagok szerkezetével, tulajdonságaival, az anyagszerkezet és a tulajdonságok közötti kapcsolatokkal, valamint a tulajdonságok megváltoztatásának elvi alapjaival foglalkozó tudomány
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
ÁLTALÁNOS ÉS SZERVETLEN KÉMIA. Előadásanyag 2005/2006. Élelmiszermérnök BSc levelező hallgatóknak
 ÁLTALÁNOS ÉS SZERVETLEN KÉMIA Jókainé Szatura Zsuzsanna Előadásanyag 2005/2006 Élelmiszermérnök BSc levelező hallgatóknak Az anyagban található ábrák forrásai : Dr. Tóth Árpád : Általános és szervetlen
ÁLTALÁNOS ÉS SZERVETLEN KÉMIA Jókainé Szatura Zsuzsanna Előadásanyag 2005/2006 Élelmiszermérnök BSc levelező hallgatóknak Az anyagban található ábrák forrásai : Dr. Tóth Árpád : Általános és szervetlen
A SZILÁRDTEST FOGALMA. Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. molekula klaszter szilárdtest > σ λ : rel.
 A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekIKözgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekIKözgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Kolloid állapotjelzık. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek
 Kolloid állapotjelzık. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta és Bányai István Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
Kolloid állapotjelzık. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta és Bányai István Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
A periódusos rendszer, periodikus tulajdonságok
 A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
Az átlagok jelentése és haszna
 Az átlagok jelentése és haszna A különféle átlagok iránti szükséglet azért alakult ki, mert a különböző kísérleti módszerek eltérő módon érzékelik a polidiszperz rendszereket.a frakciók más-más tulajdonságaira
Az átlagok jelentése és haszna A különféle átlagok iránti szükséglet azért alakult ki, mert a különböző kísérleti módszerek eltérő módon érzékelik a polidiszperz rendszereket.a frakciók más-más tulajdonságaira
Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia
 Áttekintés Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia Bozó Tamás Nanobiotechnológia és Molekuláris Biofizika Munkacsoport Biofizikai és Sugárbiológiai
Áttekintés Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia Bozó Tamás Nanobiotechnológia és Molekuláris Biofizika Munkacsoport Biofizikai és Sugárbiológiai
Periciklusos reakciók
 Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
5. elıadás KRISTÁLYKÉMIAI ALAPOK
 5. elıadás KRISTÁLYKÉMIAI ALAPOK KRISTÁLYKÉMIAI ALAPFOGALMAK Atomok: az anyag legkisebb olyan részei, amelyek még hordozzák a kémiai elem jellegzetességeit. Részei: atommag (mely protonokból és neutronokból
5. elıadás KRISTÁLYKÉMIAI ALAPOK KRISTÁLYKÉMIAI ALAPFOGALMAK Atomok: az anyag legkisebb olyan részei, amelyek még hordozzák a kémiai elem jellegzetességeit. Részei: atommag (mely protonokból és neutronokból
Összefoglaló előadás. Sav-bázis elmélet
 Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia
 Áttekintés Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia Bozó Tamás Nanobiotechnológia és Molekuláris Biofizika Munkacsoport Biofizikai és Sugárbiológiai
Áttekintés Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Példaként: atomi erő mikroszkópia Bozó Tamás Nanobiotechnológia és Molekuláris Biofizika Munkacsoport Biofizikai és Sugárbiológiai
Szerves kémiai és biokémiai alapok:
 Szerves kémiai és biokémiai alapok: Másodlagos kémiai kötések: A másodlagos kötések energiája nagyságrenddel kisebb, mint az elsődlegeseké. Energiaközlés hatására a másodlagos kötések bomlanak fel először,
Szerves kémiai és biokémiai alapok: Másodlagos kémiai kötések: A másodlagos kötések energiája nagyságrenddel kisebb, mint az elsődlegeseké. Energiaközlés hatására a másodlagos kötések bomlanak fel először,
Bevezetés a kémiába. Általános kémia
 Bevezetés a kémiába Általános kémia Fontos tudnivalók Tárgy neve: Általános kémia Neptun kód: SBANKE1111 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
Bevezetés a kémiába Általános kémia Fontos tudnivalók Tárgy neve: Általános kémia Neptun kód: SBANKE1111 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
Atomi és molekuláris kölcsönhatások. Pásztázó tűszondás mikroszkópia.
 Atomi és molekuláris kölcsönhatások. Pásztázó tűszondás mikroszkópia. Kiss Balázs Nanobiotechnológia és Egyedi Molekula Kutatócsoport, Biofizikai és Sugárbiológiai Intézet 2013. november 28. 2 Atomi kölcsönhatások
Atomi és molekuláris kölcsönhatások. Pásztázó tűszondás mikroszkópia. Kiss Balázs Nanobiotechnológia és Egyedi Molekula Kutatócsoport, Biofizikai és Sugárbiológiai Intézet 2013. november 28. 2 Atomi kölcsönhatások
Villamosmérnök MSc, Anyagtudomány
 Anyagszerkezet Villamosmérnök MSc, Anyagtudomány Vázlat Kötéstípusok, rácstípusok (emlékeztető) Molekulaszerkezet, koordináció Kristályszerkezet leírása Elemi cellák Kristálysíkok, Miller-indexindex Kristályhibák
Anyagszerkezet Villamosmérnök MSc, Anyagtudomány Vázlat Kötéstípusok, rácstípusok (emlékeztető) Molekulaszerkezet, koordináció Kristályszerkezet leírása Elemi cellák Kristálysíkok, Miller-indexindex Kristályhibák
KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK
 ÓBUDAI EGYETEM ANYAGTUDOMÁNYI SZEMINÁRIUMOK, 2014. MÁJUS 12. PEKKER SÁNDOR MTA WIGNER SZFI KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK
ÓBUDAI EGYETEM ANYAGTUDOMÁNYI SZEMINÁRIUMOK, 2014. MÁJUS 12. PEKKER SÁNDOR MTA WIGNER SZFI KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK
Koordinációs vegyületek (komplexek)
 Koordinációs vegyületek (komplexek) ML n M: központi ion/atom L: ligandum n: koordinációs szám Komplexek 1. Nevezéktan 2. Csoportosítás 3. A komplexképzıdés ismérvei 4. Koordinációs szám, geometria 5.
Koordinációs vegyületek (komplexek) ML n M: központi ion/atom L: ligandum n: koordinációs szám Komplexek 1. Nevezéktan 2. Csoportosítás 3. A komplexképzıdés ismérvei 4. Koordinációs szám, geometria 5.
Gergely Pál - Erdőd! Ferenc ALTALANOS KÉMIA
 Gergely Pál - Erdőd! Ferenc ALTALANOS KÉMIA TARTALOM KÉMIAI ALAPFOGALMAK 1 Sí rendszer 1 Atomok és elemek 2 Tiszta anyagok és keverékek 3 Az atomok szerkezete 4 Az atom alkotórészei 4 Az atommag felépítése
Gergely Pál - Erdőd! Ferenc ALTALANOS KÉMIA TARTALOM KÉMIAI ALAPFOGALMAK 1 Sí rendszer 1 Atomok és elemek 2 Tiszta anyagok és keverékek 3 Az atomok szerkezete 4 Az atom alkotórészei 4 Az atommag felépítése
Kémiai reakciók. Közös elektronpár létrehozása. Általános és szervetlen kémia 10. hét. Elızı héten elsajátítottuk, hogy.
 Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Kormeghatározás gyorsítóval
 Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
Átmenetifém-komplexek ESR-spektrumának jellemzıi
 Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Atomok. szilárd. elsődleges kölcsönhatás. kovalens ionos fémes. gázok, folyadékok, szilárd anyagok. ionos fémek vegyületek ötvözetek
 Atomok elsődleges kölcsönhatás kovalens ionos fémes véges számú atom térhálós szerkezet 3D ionos fémek vegyületek ötvözetek molekulák atomrácsos vegyületek szilárd gázok, folyadékok, szilárd anyagok Gázok
Atomok elsődleges kölcsönhatás kovalens ionos fémes véges számú atom térhálós szerkezet 3D ionos fémek vegyületek ötvözetek molekulák atomrácsos vegyületek szilárd gázok, folyadékok, szilárd anyagok Gázok
2013.11.24. Villamosmérnök MSc, Anyagtudomány. CaF 2 (fluorit rács) kicsit torzul: pl H 2 O (két nemkötő pár, 105 ), NH 3 (egy nemkötő pár, 107 ).
 Ionos kötés ionrács Anyagszerkezet Tulajdonságok: Erős, elsőrendű, magas olvadáspont Részben irányított kötés, rideg anyagok Koordinációt, térkitöltést a kation/anion méretarány és az ionok töltésaránya
Ionos kötés ionrács Anyagszerkezet Tulajdonságok: Erős, elsőrendű, magas olvadáspont Részben irányított kötés, rideg anyagok Koordinációt, térkitöltést a kation/anion méretarány és az ionok töltésaránya
SZERVES KÉMIA I. ANTUS, SÁNDOR MÁTYUS, PÉTER
 SZERVES KÉMIA I. ANTUS, SÁNDOR MÁTYUS, PÉTER SZERVES KÉMIA I. ANTUS, SÁNDOR MÁTYUS, PÉTER Publication date 2014 Szerzői jog 2014 Antus Sándor, Mátyus Péter, Nemzedékek Tudása Tankönyvkiadó Alkotó szerkesztő:
SZERVES KÉMIA I. ANTUS, SÁNDOR MÁTYUS, PÉTER SZERVES KÉMIA I. ANTUS, SÁNDOR MÁTYUS, PÉTER Publication date 2014 Szerzői jog 2014 Antus Sándor, Mátyus Péter, Nemzedékek Tudása Tankönyvkiadó Alkotó szerkesztő:
Minta vizsgalap I. Karikázza be az egyetlen megfelelő válasz betűjelét! (10x1 pont) 1. Melyik sorban szerepel csak só?
 Minta vizsgalap I. Karikázza be az egyetlen megfelelő válasz betűjelét! (10x) 1. Melyik sorban szerepel csak só? A) CH 3 COONa, K 2 SO 4, Na 3 PO 4, NH 4 Cl B) H 2 SO 4, Na 3 PO 4, NH 4 Cl, NaCl C) Fe(NO
Minta vizsgalap I. Karikázza be az egyetlen megfelelő válasz betűjelét! (10x) 1. Melyik sorban szerepel csak só? A) CH 3 COONa, K 2 SO 4, Na 3 PO 4, NH 4 Cl B) H 2 SO 4, Na 3 PO 4, NH 4 Cl, NaCl C) Fe(NO
Toluol (Bruckner II/1 476) µ= 0.33 Debye
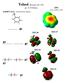 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
Koordinációs (komplex) vegyületek
 Koordinációs (komplex) vegyületek lfred Werner 1893-1913 CoCl 3 + 6 CoCl 3 ٠6 komplex szín régi név CoCl 3 ٠6 CoCl 3 ٠5 CoCl 3 ٠4 sárga bíborvörös zöld Luteo komplex Purpureo komplex Praseo komplex CoCl
Koordinációs (komplex) vegyületek lfred Werner 1893-1913 CoCl 3 + 6 CoCl 3 ٠6 komplex szín régi név CoCl 3 ٠6 CoCl 3 ٠5 CoCl 3 ٠4 sárga bíborvörös zöld Luteo komplex Purpureo komplex Praseo komplex CoCl
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997
 1997 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997 I. Az alábbiakban megadott vázlatpontok alapján írjon 1-1,5 oldalas dolgozatot! Címe: A HIDROGÉN, A HIDRIDEK A hidrogén atomszerkezete (elektronszerkezet,
1997 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997 I. Az alábbiakban megadott vázlatpontok alapján írjon 1-1,5 oldalas dolgozatot! Címe: A HIDROGÉN, A HIDRIDEK A hidrogén atomszerkezete (elektronszerkezet,
Szőri Milán: Kolloidkémia
 Kolloidkémia 1. előadás Összetétel megadás és mérési alapismeretek. Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában. Szőri Milán: Kolloidkémia 1 Levelezős Órarend ALKALOM
Kolloidkémia 1. előadás Összetétel megadás és mérési alapismeretek. Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában. Szőri Milán: Kolloidkémia 1 Levelezős Órarend ALKALOM
10.) Milyen alakja van az SF 4 molekulának? Rajzolja le és indokolja! (2 pont) libikóka; indoklás: 1 nemkötő és 4 kötő elektronpár
 1.) Írja le az atom definícióját! (2 pont) Kémiai úton tovább nem bontható, pozitív töltésű atommagból és azzal kölcsönhatásban álló egy vagy több negatív töltésű elektronból felépülő részecske, elektromosan
1.) Írja le az atom definícióját! (2 pont) Kémiai úton tovább nem bontható, pozitív töltésű atommagból és azzal kölcsönhatásban álló egy vagy több negatív töltésű elektronból felépülő részecske, elektromosan
Megismerhető világ. Bevezetés a kémiába. Hullámok. Ismert kölcsönhatások. EM sugárzás fajtái (spektruma) Az atom felépítése
 Megismerhető világ Bevezetés a kémiába Általános kémia tudományos módszer reprodukálható kísérletek, mérések Világegyetem építőkövei anyagi testek (korpuszkulák)» nem fednek át, véges a sebességük, tömegük
Megismerhető világ Bevezetés a kémiába Általános kémia tudományos módszer reprodukálható kísérletek, mérések Világegyetem építőkövei anyagi testek (korpuszkulák)» nem fednek át, véges a sebességük, tömegük
Equation Chapter 1 Section 1AZ ANYAGOK TULAJDONSÁGAIT BEFOLYÁSOLÓ TÉNYEZŐK. 1. ábra Az anyagok tulajdonságait befolyásoló tényezők
 Equation Chapter 1 Section 1AZ ANYAGOK TULAJDONSÁGAIT BEFOLYÁSOLÓ TÉNYEZŐK Az anyagok viselkedését, tulajdonságait külső hatásokra adott válaszait számos tényező befolyásolja. Ezek közé tartozik az anyagok
Equation Chapter 1 Section 1AZ ANYAGOK TULAJDONSÁGAIT BEFOLYÁSOLÓ TÉNYEZŐK Az anyagok viselkedését, tulajdonságait külső hatásokra adott válaszait számos tényező befolyásolja. Ezek közé tartozik az anyagok
Minta vizsgalap (2007/08. I. félév)
 Minta vizsgalap (2007/08. I. félév) I. Karikázza be az egyetlen megfelelő válasz betűjelét! (10x) 1. Melyik sorban szerepel csak só? A) CH 3 COONa, K 2 SO 4, Na 3 PO 4, NH 4 Cl B) H 2 SO 4, Na 3 PO 4,
Minta vizsgalap (2007/08. I. félév) I. Karikázza be az egyetlen megfelelő válasz betűjelét! (10x) 1. Melyik sorban szerepel csak só? A) CH 3 COONa, K 2 SO 4, Na 3 PO 4, NH 4 Cl B) H 2 SO 4, Na 3 PO 4,
SZERVES KÉMIA. Szerkezet és reaktivitás. dr. Nagy József. egyetemi docens
 SZEVES KÉMIA Szerkezet és reaktivitás dr. Nagy József egyetemi docens Budapesti Mőszaki Egyetem 2000 1. SZEVES ANYAGK SZEKEZETE 1.1. A szerves kémia tárgya A kémia az a tudományág, amely az anyagok szerkezetével,
SZEVES KÉMIA Szerkezet és reaktivitás dr. Nagy József egyetemi docens Budapesti Mőszaki Egyetem 2000 1. SZEVES ANYAGK SZEKEZETE 1.1. A szerves kémia tárgya A kémia az a tudományág, amely az anyagok szerkezetével,
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését!
 I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
SOK ELEKTRONOS ATOMOK.
 3 SOK ELEKTRONOS ATOMOK. Több elektronos atomok esetében már a potenciális kölcsönhatás nem csak atommag és az elektronok között, hanem az elektronok között is fellépnek, mert taszítják egymást. e Ø Z
3 SOK ELEKTRONOS ATOMOK. Több elektronos atomok esetében már a potenciális kölcsönhatás nem csak atommag és az elektronok között, hanem az elektronok között is fellépnek, mert taszítják egymást. e Ø Z
Fizikai kémia Részecskék mágneses térben, ESR spektroszkópia. Részecskék mágneses térben. Részecskék mágneses térben
 06.08.. Fizikai kémia. 3. Részecskék mágneses térben, ESR spektroszkópia Dr. Berkesi Ottó SZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Részecskék mágneses térben A részecskék mágneses térben ugyanúgy
06.08.. Fizikai kémia. 3. Részecskék mágneses térben, ESR spektroszkópia Dr. Berkesi Ottó SZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Részecskék mágneses térben A részecskék mágneses térben ugyanúgy
A karaktertáblákban nem beszéltünk az irreducibilis reprezentációk jelöléséről. Ha a T d -táblában látható jelzéseket megnézzük, nem nehéz rájönni,
 1 A karaktertáblákban nem beszéltünk az irreducibilis reprezentációk jelöléséről. Ha a T d -táblában látható jelzéseket megnézzük, nem nehéz rájönni, hogy azonos fő betű esetén csak az identitás alatt
1 A karaktertáblákban nem beszéltünk az irreducibilis reprezentációk jelöléséről. Ha a T d -táblában látható jelzéseket megnézzük, nem nehéz rájönni, hogy azonos fő betű esetén csak az identitás alatt
Közös elektronpár létrehozása
 Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
