Összefoglaló előadás. Sav-bázis elmélet
|
|
|
- Orsolya Királyné
- 5 évvel ezelőtt
- Látták:
Átírás
1 Összefoglaló előadás Sav-bázis elmélet
2 SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár: A + B A + B sav1 bázis2 bázis1 sav2 A A sav konjugált bázis (pk a ) B B bázis konjugált sav (pk b ) a pk a kicsi, savasság nagy. a pk b kicsi, bázicitás nagy. 2. Lewis elmélet: sav - elektronpár akceptor; bázis - elektronpár donor; BX 3 > AlX 3 > FeX 3 > GaX 3 > SbX 5 > SnX 4 > AsX 5 > ZnX 2 > gx 2 A két elmélet nem mond ellent egymásnak.
3 Elektron eltolódások vagy elektronos effektusok (electrical effects) Induktív (inductive) effektus Tér (field) effektus Mezomer v. rezonancia (mesomeric, resonance) effektus Alap: elektronegativitás
4 +I: > C > CR 3 > CR 2 > C 2 R > C 3 és fémek -I: R 3 N + > N 2 > S 2 R > CN > C > F > > Br > I > R > CR > > C CR > Ar > C=CR 2
5 Az aromás elektrofil szubsztitúció (S E Ar) irányítási szabályai Irányító szubsztituens Effektusai Eredő hatásuk Irányító hatás - - +I, +K -N 2, -NR, -NR 2 -, -R -I < +K -NCR -CR alkil +I, + aril +K -F, -, -Br, -I -I > +K -CN 2, -CNR, -CNR 2 -C, -CR Aktíváló hatás nő orto és para irányító hatás -C, -CR -S 3, -S 2 N 2, -S 3 R -C N -I, -K meta irányító hatás -N 2 -(N N) + -NR 3+, -N 3 + -I, - Dezaktíváló hatás nő
6 2. Konjugációs (mezomer) effektus fajtái: a) π - π konjugáció: - általában: valamilyen delokalizált rendszerhez elektronegatív atomot tartalmazó szubsztituens kapcsolódik - a delokalizált rendszer felett csökken, a szubsztituens felett nő az elektronsűrűség - az effektus iránya rendszerint negatív: -K (-C) vagy M - páros centrumú szubsztituensek: N N > C N > C - páratlan centrumú szubsztituensek: N > C R > C > NR 2 C S
7 b) n - π konjugáció: - általában: valamilyen kettőskötéshez, vagy delokalizált rendszerhez nemkötő elektronpárt tartalmazó szubsztituens kapcsolódik - legtöbbször a hatás elektronküldő, azaz pozitív: +K (+C) vagy +M - a szubsztituens felett csökken, a kettőskötés felett nő az elektronsűrűség +K C > C > -I -I - a nemkötő elektronpár rendszerint egy, a szénatomnál elektronegatívabb atomhoz tartozik +K F > > Br > I ~ > R C > R > N 2 ~ NR 2 N C R
8 c) σ - π konjugáció : - általában: valamilyen kettőskötéshez, vagy delokalizált rendszerhez nemkötő elektronpárt, vagy telítetlen kötést nem tartalmazó szubsztituens kapcsolódik - iperkonjugáció - a hatás lehet elektronküldő, azaz pozitív: +, vagy lehet elektronszívó, azaz negatív: - - gyenge konjugáció, pl. vinil-rendszerek + C C C F - C C C F F C C N
9 iperkonjugáció σ konjugáció a/ Legalább egy hidrogénatomot tartalmazó szénatom egy telítetlen rendszerhez kapcsolódik. R R R R R C C CR 2 R C C A C- σ-kötés átlapol a C-C π-kötéssel CR 2 b/ karbokationoknál: 2 C C 3 C C C C C C 2p C
10 d) σ - σ konjugáció: - általában valamilyen σ kötés kötő, és a vele egy síkban elhelyezkedő másik σ kötés lazító pályája között alakul ki a kölcsönhatás - legtöbb esetben nincs kifejezett irányultsága Példa: bután antiperiplanáris konformerje C C
11 Rezonancia (mezomer) effektus Az elektronpárt viselő heteroatomot tartalmazó csoport közvetlenül kapcsolódik egy telítetlen rendszerhez. - M effektus : a telítetlen rendszerből a csoportra helyeződnek át elektronok. +M effektus : a csoportról a telítetlen rendszerbe helyeződnek át elektronok.
12 +M és -M effektussal rendelkező csoportok +M effektus -M effektus S NR 2 NR SR S Br I N 2 CN C CR C CR S 2 R S 2 R N N 2 NCR R F R Ar CN 2 CNR CNR 2 Ar CR
13 3. Mezőeffektus (elektrosztatikus téreffektus): Figyelem, nem azonos a sztérikus effektussal! A molekulában levő elektromos töltések a téren át, vagy oldószer molekulán át terjednek. Gyakran nehéz megkülönböztetni az induktív effektustól. A molekula geometriájától függ. Példa 1. C C pk a = 6,07 pk a = 5,67 Példa 2. pk a1 = 2,00 pk a1 = 3,03 pk a2 = 6,26 pk a2 = 4,47 maleinsav fumársav
14 1. Jelölje be a heteroatom elektronos hatásait az alábbi vegyületekben. Ennek alapján értelmezze a vegyületek: A/ aciditását B/ bázicitását! A/ B/ a) I 3 C C 2 C 2 I a) 3 C C 2 C 2 N 2 b) +K 3 C C C I +K > I b) +K 3 C C C N 2 I +K +K N 2 c) +K > I c) 1. Megoldás: A/ A -I effektus valamennyi felsorolt vegyületben megközelítőleg azonos mértékű. A +K (mezomer) effektus következtében csökken az adott heteroatom elektronsűrűsége, ezáltal egyrészt lazul a - kötés (enol, fenol esetében), másrészt a képződött oxidion mezoméria révén stabilizálódik (fenol esetében nagyobb mértékig, mint az enolnál). Mindkettő a savasság növekedését eredményezi. Növekvő savassági sorrend A/ esetben: a) < b) < c) B/ A +K mezomer effektus következtében a nitrogénatom (enamin, anilin esetében) nemkötő elektronpárja kisebb mértékben tudja megkötni a protont, ezáltal az amin bázicitása csökken. Csökkenő bázicitási sorrend B/ esetben: a) > b) > c)
15 2. Állítsa növekvő savassági sorrendbe az alábbi vegyületeket! Indokolja a sorrendet. S a) C 3 C 2 S b) C 3 C 2 c) d) 2. Megoldás: Az alkohol / fenol (illetve az ezzel analóg tiol / ariltiol) savasságában való eltérés indoklása az 1. feladat megoldásában található. A tiolok vízben rosszul oldódnak (nincs -kötés). A tiolok savasabbak, mint a nekik megfelelő alkoholok, illetve az ariltiolok savasabbak a nekik megfelelő fenoloknál. Ennek oka az, hogy a kénatom nagyobb méreténél fogva jobban polarizálható, mint az oxigén, és ezért az S- kötés bázisokkal szemben reaktívabb (savasabb a hidrogén), mint az - kötés. savassági sorrend: ariltiol > fenol > tiol > alkohol pk a : Növekvő savassági sorrend: b) < a) < d) < c)
16 3. Állítsa növekvő savassági sorrendbe az alábbi vegyületeket (vizes oldatban vizsgálva): C C 3 C C 3 A/ I. II. C 3 III. N 2 IV. V. VI. F B/ C 2 C C 2 C 2 C FC 2 C F C C C 3 C C 3 C 2 C 2 C 2 C (valeriánsav) I. II. III. F IV. V. VI. 3. Megoldás: savassági sorrend: ásványi savak > karbonsav > szénsav > fenol > alkohol pk a : A/ VI < II < I < III < IV < V B/ VI < V < II < I < III < IV
17 Aminok tulajdonságai 1. Bázicitás: termodinamikai sajátosság; jellemzése pk a vagy pk b értékekkel történik. Minden olyan hatás, amely növeli a nitrogénen az elektronsűrűséget, növeli a bázicitást. Gázfázisban: R 3 N > R 2 N > RN 2 > N 3 Vízben: R 2 N > RN 2 > R 3 N > N 3 >> PhN 2 B: + 2 B + (szolvatált ionok) Minél kevesebb a, annál rosszabbul szolvatálódik (szterikus gátlás következtében). Ammónium sók esetében: érvényesül a dipól-dipól kölcsönhatás és a -kötés hatása. 3 C N X 3 C N X dipól-dipól kölcsönhatás δ δ hidrogénkötés
18 2. Bázicitási sorrend: pk a nagy, bázicitás is nagy (pk b kicsi). A szerves bázisok bázicitását konjugált savuk aciditásával (pk a ) is jellemezhetjük. A pk a és a pk b értékek összege adott vegyületre vonatkoztatva (hőmérsékletfüggés) a törzsoldószer ionszorzatával egyenlő. R R N > R N 2 > R N > N 3 >> N 2 R R amin PhN 2 N 3 (C 3 ) 2 N ammóniumion PhN 3 N 4 (C 3 ) 2 N 2 pk a (vizes oldatban) 4,60 9,24 10,78 C 3 N 2 C 3 N 3 10,63 (C 3 ) 3 N (C 3 ) 3 N 9,80
19 4. Állítsa növekvő bázicitás sorrendjébe az alábbi vegyületeket (vizes oldatban vizsgálva): C 3 C 3 C 3 A/ C 3 C 2 N 2 N 3 C N 3 C N C 3 3 C 3 C C 3 I. II. III. IV. N 2 N 2 N 2 N 2 B/ 4. Megoldás: I. II. III. N 2 IV. (nincs konjugáció) A/ érvényesül az alkil csoport kettős hatása: elektronküldő, tehát stabilizálja a keletkező iont, de nehezíti az oldószer molekulák hozzáférését, azaz a szolvatációt. B/ bázícitás: alkil és cikloalkil-aminok > arilaminok A/ N 3 < III < I < II < IV B/ III < I < II < IV pk a 9,2 9,8 10,6 10,8
20 5. Írja fel anilin esetében azt az egyensúlyt, amely azt mutatja meg, hogy az anilin: A/ bázisként B/ savként viselkedik! N 3 bázis N 2 sav N 5. Megoldás: konj. sav + anilin Az anilin vizes közegben mért bázicitását konjugált savának aciditásával jellemezhetjük. Ennek pk a értéke 4,60. Az anilin savként vizes közegben nem létezik. Nemvízes közegben (pl. folyékony ammóniában) vízre vonatkoztatott savi pk a értéke konj. bázis pk a : 4,6 pk a : 25 (ammóniában)
21 6. Javasoljon reakciókörülményeket az alábbi reakciókra: A/ malononitril alkilezése metil-jodoiddal; B/ nátrium-metanolát előállítása metanolból! A/ pk a 11 N C C 2 C N alkilezés I. 6. Megoldás: B/ vízmentes C 3 II. pk a 16 (Fém Na-mal nem lehet alkoholt abszolutizálni!) A/ B/ N C C 2 C N NaC 2C 3 N C C C N Na Na C 3 C 3 Na RX R: alkil X:, Br R N C C C N 1/ NaC 2 C 3 2/ R'X Malononitril erősebb sav, mint a metanol. Metoxid anion erősebb bázis a malononitril karbanionnál. R N C C C N R'
22 7. Adja meg az alábbi szerkezetek: (A) konjugált savát, (B) konjugált bázisát! a) C 2 5 -N 2 b) C 3 - c) 2 C=C 2 7. Megoldás: pk a 11 A) konjugált savak: a) C 2 5 -N + 3 b) C c) 3 C-C + 2 B) konjugált bázisok: a) C 2 5 -N - b) C c) 2 C=C - pk a Savasságuk alapján (vizes oldatban vizsgálva) állítsa sorrendbe az alábbi vegyületeket! A. p-nitrofenol m-nitrofenol B. m-brómfenol m-krezol m-nitrofenol fenol C. p-klórfenol 2,4-diklórfenol 2,4,6-triklórfenol D. benzil-alkohol p-klórbenzil-alkohol p-etilbenzil-alkohol p-nitrobenzilalkohol
23 8. Megoldás: A. - N + > N + - B. N + - > Br > > C 3 m-krezol - elektronszívó csop. növeli az -csop. savasságát; elektronküldő csop. csökkenti az csop. savasságát. C. > > - minél több elektronszívó csop. van, annál savasabb az -csop. D. - N + > > > 3 C
24 9. Állítsa növekvő savassági sorrendbe a következő vegyületeket (vizes oldatban vizsgálva)! Indokolja meg, hogy milyen, az aciditásra gyakorolt hatások érvényesülnek? 9. Megoldás: 2 N-C 2 -C C 2 =C-C C C C szalicilsav pka: 1,68 pka: 4,25 pka: 1,85 negatív induktív mezomer mezomer C pka: 2,98 intramolekuláris hidrogénhíd C pka: 4,48 mezomer 2 C 3 pka: 6,3 elektronegativitás C 2 C F C C pka: 3,8 pka: 3,2 pka: 0,7 mezomer elektronegativitás negatív induktív glikolsav akrilsav propargilsav 2 C 3 C 2 =C-C C2 C F C C C C C 2 N-C 2 -C C C
25 10. Mi a lehet magyarázata annak, hogy az alábbi szerkezet (hidridszivacs) nagymértékben köt meg hidridiont? B B B B Megoldás: - A hidridszivacsban a hidridion megkötésével egy 3-centrumú 2-elektronos kötés (két bóratom és a belépő hidridion) alakul ki, amelyik viszonylagosan nagyobb stabilitást eredményez ahhoz az állapothoz képest, amelyben csak egy bóratom kötné meg (üres pályáján) a hidridiont. A két bóratom geometriai elhelyezkedése lehetővé teszi az elektronok delokalizációját, és ez stabilizálja a keletkezett ionos szerkezetet. 11. Bázicitásuk alapján (vizes oldatban vizsgálva) állítsa sorrendbe az alábbi vegyületeket! A. ammónia anilin ciklohexil-amin B. anilin p-metoxianilin p-nitroanlin C. benzil-amin m-klórbenzil-amin m-etil-benzilamin D. p-klór-n-metilanilin 2,4-diklór-N-metilanilin 2,4,6-triklóranilin
26 11. Megoldás: A. N 2 > N 3 > N 2 Ar csop. +M effektusa csökkenti az elektronsűrűsséget az N 2 -csoporton. N 2 N 2 N 2 B. 3 C > > - N + +I növeli, míg a I csökkenti az N 2 - csop. bázicitását. C. N 2 > > N 2 N 2 3 C D. N C 3 C 3 N > > N 2 Sok elektronszívó csop. csökkenti az N 2 -csop. bázicitását.
27 12. Mi az oka az alábbi jelenségeknek? a) a fenol nitrálásának sebessége kb. ezerszer akkora, mint a benzolé; b) a klórbenzol nitrálásának sebessége kb. harmincada a benzolénak? 12. Megoldás: a) Az o- és p-irányító csoport a gyűrű S E reakciókkal szembeni reakciókészséget fokozó szubsztituensek körébe tartozik. Az -csoportnál a +M effektus jóval erősebb az elektron-vonzó -atom következtében fellépő -I effektusnál. b) Az ugyancsak o- és p-irányító halogének, amelyek elektronegativitása inkább kisebb, mint az oxigéné és hasonló módon rendelkeznek szabad elektronpárral, mint az oxigén, mégis dezaktiválják az aromás gyűrűt, az elektron akceptor szubsztituensek körébe tartoznak. Ennek oka az, hogy a, Br és I halogének szabad elektronpárja a 3p, 4p, 5p atomi pályákon helyezkednek el és kevésbé, vagy egyáltalán nem tudnak kölcsönhatásba lépni, átfedni a benzol sp 2 szénatomjának 2p pályájával. Ennek következtében a halogének mezomer hatása gyenge, azaz a gyűrű reakciókészségére gyakorolt hatásban a -I effektus dominál, a +M-effektus csak az irányító hatásban jelentkezik. 13. Állítsa oldatfázisban vizsgált növekvő bázicitás szerinti sorrendbe az alábbi vegyületeket! C 3 C 2 N 2 C 3 C 2 N C 3 C N 2 C 3 C 2 C 2 C 2 C 3 C N (A- konj. bázisa) (D- konj. bázisa) A) B) C) D) E) F) 13. Megoldás: D < A < B < F < C < E
Szerves kémiai reakciók csoportosítása Kinetikus és termodinamikus kontroll Szubsztituens hatások Sav-bázis tulajdonságokat befolyásoló tényezők
 Alapismeretek 4. Szerves kémiai reakciók csoportosítása Kinetikus és termodinamikus kontroll Szubsztituens hatások Sav-bázis tulajdonságokat befolyásoló tényezők Reaktivitás és stabilitás Kísérlettervezés
Alapismeretek 4. Szerves kémiai reakciók csoportosítása Kinetikus és termodinamikus kontroll Szubsztituens hatások Sav-bázis tulajdonságokat befolyásoló tényezők Reaktivitás és stabilitás Kísérlettervezés
Reakciók osztályozása
 Reakciók osztályozása 1. Sav-bázis reakciók 2. Funkciós csoport átalakítása 3. Szén-szén kötés képződése A támadó ágens szerint nukleofil N (Nukleofil) elektrofil E (Elektrofil) gyök R (Radikális) 1. Szubsztitúciós
Reakciók osztályozása 1. Sav-bázis reakciók 2. Funkciós csoport átalakítása 3. Szén-szén kötés képződése A támadó ágens szerint nukleofil N (Nukleofil) elektrofil E (Elektrofil) gyök R (Radikális) 1. Szubsztitúciós
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
Aromás vegyületek II. 4. előadás
 Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
Fémorganikus kémia 1
 Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
ALKOHOLOK ÉS SZÁRMAZÉKAIK
 ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
KARBONSAVAK. A) Nyílt láncú telített monokarbonsavak (zsírsavak) O OH. karboxilcsoport. Példák. pl. metánsav, etánsav, propánsav...
 KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Helyettesített Szénhidrogének
 elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
szabad bázis a szerves fázisban oldódik
 1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
Beszélgetés a szerves kémia elméleti alapjairól III.
 Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
CH 2 =CH-CH 2 -S-S-CH 2 -CH=CH 2
 10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
Reagensek Reaktivitás Elektroneffektusok Kinetikus és termodinamikus kontroll Reakciók osztályozása
 Alapismeretek 3. Reagensek Reaktivitás Elektroneffektusok Kinetikus és termodinamikus kontroll Reakciók osztályozása 1. Sav/bázis reakciók 2. Funkciós csoport átalakítása 3. Szén-szén kötés képződése Ad.
Alapismeretek 3. Reagensek Reaktivitás Elektroneffektusok Kinetikus és termodinamikus kontroll Reakciók osztályozása 1. Sav/bázis reakciók 2. Funkciós csoport átalakítása 3. Szén-szén kötés képződése Ad.
Spektroszkópiai módszerek 2.
 Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
IV. Elektrofil addíció
 IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
A tételek: Elméleti témakörök. Általános kémia
 A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Kémiai reakciók. Közös elektronpár létrehozása. Általános és szervetlen kémia 10. hét. Elızı héten elsajátítottuk, hogy.
 Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Közös elektronpár létrehozása
 Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
A hidrogénmolekula. Energia
 A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
Fémorganikus vegyületek
 Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Részletes tematika: I. Félév: 1. Hét (4 óra): 2. hét (4 óra): 3. hét (4 óra): 4. hét (4 óra):
 Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekIKözgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekIKözgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szalai István. ELTE Kémiai Intézet 1/74
 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
HALOGÉNEZETT SZÉNHIDROGÉNEK
 ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk.
 1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Tartalmi követelmények kémia tantárgyból az érettségin K Ö Z É P S Z I N T
 1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
4. változat. 2. Jelöld meg azt a részecskét, amely megőrzi az anyag összes kémiai tulajdonságait! A molekula; Б atom; В gyök; Г ion.
 4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
Tartalomjegyzék. Szénhidrogének... 1
 Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Helyettesített karbonsavak
 elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
O 2 R-H 2 C-OH R-H 2 C-O-CH 2 -R R-HC=O
 Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Toluol (Bruckner II/1 476) µ= 0.33 Debye
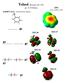 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
Periódusos rendszer (Mengyelejev, 1869) nemesgáz csoport: zárt héj, extra stabil
 s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
szerotonin idegi mûködésben szerpet játszó vegyület
 3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
Oldódás, mint egyensúly
 Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott K
Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott K
Oldódás, mint egyensúly
 Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott =
Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott =
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Vegyületek - vegyületmolekulák
 Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2004.
 KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2004. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2004. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
A hidrogénmolekula. Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve!
 Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Szerves kémia Fontosabb vegyülettípusok
 Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS
 Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit
 SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
R R C X C X R R X + C H R CH CH R H + BH 2 + Eliminációs reakciók
 Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
10. Kémiai reakcióképesség
 4. Előadás Kémiai reakciók leírása. Kémiai reakciók feltételei. Termokémia. A szerves kémiai reakciómechanizmusok felosztása és terminológiája. Sav-bázis reakció. Szubsztitució. Addició és elimináció.
4. Előadás Kémiai reakciók leírása. Kémiai reakciók feltételei. Termokémia. A szerves kémiai reakciómechanizmusok felosztása és terminológiája. Sav-bázis reakció. Szubsztitució. Addició és elimináció.
1. feladat. Versenyző rajtszáma: Mely vegyületek aromásak az alábbiak közül?
 1. feladat / 5 pont Mely vegyületek aromásak az alábbiak közül? 2. feladat / 5 pont Egy C 4 H 8 O összegképletű vegyületről a következő 1 H és 13 C NMR spektrumok készültek. Állapítsa meg a vegyület szerkezetét!
1. feladat / 5 pont Mely vegyületek aromásak az alábbiak közül? 2. feladat / 5 pont Egy C 4 H 8 O összegképletű vegyületről a következő 1 H és 13 C NMR spektrumok készültek. Állapítsa meg a vegyület szerkezetét!
Kémiai alapismeretek 3. hét
 Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Beszélgetés a szerves kémia eméleti alapjairól IV.
 Beszélgetés a szerves kémia eméleti alapjairól IV. Az alkének elektrofil addiciós reakciói Az alkénekben levő kettős kötés pi-elekronrendszerének jellegzetes térbeli orientáltsága kifejezetten nukleofil
Beszélgetés a szerves kémia eméleti alapjairól IV. Az alkének elektrofil addiciós reakciói Az alkénekben levő kettős kötés pi-elekronrendszerének jellegzetes térbeli orientáltsága kifejezetten nukleofil
AMINOK. Aminok rendűsége és típusai. Levezetés. Elnevezés. Alkaloidok (fiziológiailag aktív vegyületek) A. k a. primer RNH 2. szekunder R 2 NH NH 3
 Levezetés AMIK 2 primer 2 2 3 2 3 3 2 3 2 3 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 1aminobután butánamin nbutilamin Aminok rendűsége és típusai 2amino2metilpropán 2metil2propánamin tercierbutilamin
Levezetés AMIK 2 primer 2 2 3 2 3 3 2 3 2 3 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 1aminobután butánamin nbutilamin Aminok rendűsége és típusai 2amino2metilpropán 2metil2propánamin tercierbutilamin
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
tema04_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
Intra- és intermolekuláris reakciók összehasonlítása
 Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Sav bázis egyensúlyok vizes oldatban
 Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK. Rausch Péter kémia-környezettan
 AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
10. Előadás. Heterociklusos vegyületek.
 0. Előadás eterociklusos vegyületek. ETECIKLUSS VEGYÜLETEK Felosztás:. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
0. Előadás eterociklusos vegyületek. ETECIKLUSS VEGYÜLETEK Felosztás:. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
2004.március A magyarországi HPV lista OECD ajánlás szerint 1/6. mennyiség * mennyiség* kategória ** (Use pattern)
 2004.március A magyarországi HPV lista OECD ajánlás szerint 1/6 1 74-86-2 Acetilén Disszugáz 2 107-13-1 Akrilnitril 2-propénnitril Zárt rendszerben használva 3 7664-41-7 Ammónia 1A Nem izolált intermedierek
2004.március A magyarországi HPV lista OECD ajánlás szerint 1/6 1 74-86-2 Acetilén Disszugáz 2 107-13-1 Akrilnitril 2-propénnitril Zárt rendszerben használva 3 7664-41-7 Ammónia 1A Nem izolált intermedierek
SZERVES KÉMIA ANYAGMÉRNÖK BSc NAPPALI TÖRZSANYAG MAKKEM 229BL
 SZERVES KÉMIA ANYAGMÉRNÖK BSc NAPPALI TÖRZSANYAG MAKKEM 229BL TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2011/12. II. félév 1 Tartalomjegyzék 1.
SZERVES KÉMIA ANYAGMÉRNÖK BSc NAPPALI TÖRZSANYAG MAKKEM 229BL TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2011/12. II. félév 1 Tartalomjegyzék 1.
KARBONSAV-SZÁRMAZÉKOK
 KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
1. feladat. Versenyző rajtszáma:
 1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
FELADATMEGOLDÁS. Tesztfeladat: Válaszd ki a helyes megoldást!
 FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
20/10/2016 tema04_biolf_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2000
 Megoldás 000. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 000 JAVÍTÁSI ÚTMUTATÓ I. A NITROGÉN ÉS SZERVES VEGYÜLETEI s s p 3 molekulák között gyenge kölcsönhatás van, ezért alacsony olvadás- és
Megoldás 000. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 000 JAVÍTÁSI ÚTMUTATÓ I. A NITROGÉN ÉS SZERVES VEGYÜLETEI s s p 3 molekulák között gyenge kölcsönhatás van, ezért alacsony olvadás- és
1,3,5-trimetil-benzol. 2 3 m-metil-etil-benzol vagy m-etil-toluol CH3. izopropil-benzol(kumol) 1,8-dimetil-naftalin
 X.-XII. osztály, III. forduló, megoldás 011 / 01 es tanév, XVII. évfolyam 1. a) 1,,-trimetil-benzol o-metil-etil-benzol vagy o-etil-toluol 1,,4-trimetil-benzol 1,,5-trimetil-benzol m-metil-etil-benzol
X.-XII. osztály, III. forduló, megoldás 011 / 01 es tanév, XVII. évfolyam 1. a) 1,,-trimetil-benzol o-metil-etil-benzol vagy o-etil-toluol 1,,4-trimetil-benzol 1,,5-trimetil-benzol m-metil-etil-benzol
Szerves Kémia II. 2016/17
 Szerves Kémia II. 2016/17 TKBE0301 és TKBE0312 4 kr Előfeltétel: TKBE0301 Szerves kémia I. Előadás: 2 óra/hét Dr. Juhász László egyetemi docens E 409 Tel: 22464 juhasz.laszlo@science.unideb.hu A 2016/17.
Szerves Kémia II. 2016/17 TKBE0301 és TKBE0312 4 kr Előfeltétel: TKBE0301 Szerves kémia I. Előadás: 2 óra/hét Dr. Juhász László egyetemi docens E 409 Tel: 22464 juhasz.laszlo@science.unideb.hu A 2016/17.
Kémiai tantárgy középszintű érettségi témakörei
 Kémiai tantárgy középszintű érettségi témakörei Csongrádi Batsányi János Gimnázium, Szakgimnázium és Kollégium Összeállította: Baricsné Kapus Éva, Tábori Levente 1) témakör Mendgyelejev féle periódusos
Kémiai tantárgy középszintű érettségi témakörei Csongrádi Batsányi János Gimnázium, Szakgimnázium és Kollégium Összeállította: Baricsné Kapus Éva, Tábori Levente 1) témakör Mendgyelejev féle periódusos
Kormeghatározás gyorsítóval
 Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Budapest, szeptember 5. Dr. Tóth Tünde egyetemi docens
 SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
Név: Pontszám: 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban
 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
