1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
|
|
|
- Katalin Dobos
- 8 évvel ezelőtt
- Látták:
Átírás
1 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul elő: xovegyületek Karbonsavak és származékaik Szénsavszármazékok A karbonilcsoport elektronszerkezetét a formaldehid példáján mutatjuk be: 2. ábra: A formaldehid A formaldehid szénatomja planáris sp 2 hibridállapotú, míg az oxigénatomja sp hibridállapotú. Ennek megfelelően a szénatom vegyértékhéjának s, p x és p y, az oxigénatom vegyértékhéjának s és p x, valamint a hidrogénatomok s pályáinak kölcsönhatásából jön létre a molekula σ-váza. A σ-váz 8 elektront tartalmaz, ebből 6 elektron képezi a három σ-kötést, 2 elektron pedig az oxigénatom nem reaktív sp-hibrid magányos elektronpárjához tartozik. A szénatom és az oxigénatom vegyértékhéjának p z atompályáinak kölcsönhatásából jön létre a molekula π-váza. A π-kötéshez két elektron tartozik. Az oxigénatom vegyértékhéjának p y atompályája hozza létre a molekula reaktív magányos elektronpárját. A molekula σ-váza, és ennél jelentősebb mértékben a π-váza is polarizált. Ezért az oxigénatomon δ míg a szénatomon δ+ töltés jön létre. 3. ábra: A formaldehid kötésszerkezete σ-kötések: fekete; π-kötés: kék sp-hibrid magányos elektronpár: rózsaszín p y magányos elektronpár: piros Az M elmélet szerint a szénatom négy, az oxigénatom négy és a hidrogénatomok egy-egy vegyértékhéj-atompályái (A) kölcsönhatásából jön létre a molekula 10 molekulapályája (M), melyek közül a legalacsonyabb energiájú 6 db. M-n összesen 12 elektron található, 4 db. M pedig üres lazító pálya. A betöltött molekulapályák az alábbi atompálya-kombinációkból származtathatóak: Molekulapálya A kombinációban résztvevő atompályák Kötésszerkezeti funkció n y (M) 2p y magányos ep. π z (M-1) 2p z 2p z π-kötés σ x (M-2) 2p x 2p x 1s 1s σ-kötés, sp-hibrid magányos ep. σ y (M-3) 2p y 1s 1s σ-kötés σ s (M-4) 2s 2s 1s 1s σ-kötés, sp-hibrid magányos ep. σ s (M-5) 2s 2s 1s 1s σ-kötés 1. táblázat: A formaldehid betöltött molekulapályái (energetikai sorrendben) i i A magányos elektronpárokat nem minden ábrán tüntetjük fel. 1
2 s s ' y x z n y 4. ábra: A formaldehid betöltött molekulapályáit létrehozó atompályák. A szaggatott vonalakkal a csomósíkokat ábrázoltuk A karbonilcsoport reaktivitása A molekula M pályája az n y M, a LUM pálya pedig a π-kötéshez tartozó lazító pálya. Az FM ii elmélet szerint a M pálya a nukleofil, a LUM pálya pedig elektrofil reaktivitásért felelős. Így elektrofil reagensek (pl. a proton) a nukleofil oxigénatomra kapcsolódnak. ukleofilok (pl. a hidroxid-ion) a polaritás-viszonyok miatt az elektrofil szénatomhoz közeledve lépnek a LUMpályával kölcsönhatásba. Ezt a reakciótípust nukleofil addíciónak nevezzük. iii ábra: A formaldehid reakciója vízzel A karbonilcsoport reaktivitását a polarizáció mértéke, azaz a szénatomon létrejövő δ+ töltés nagysága határozza meg. Ennek megfelelően az aceton < acetaldehid < formaldehid < klorál (triklóracetaldehid) irányban nő az addícióra való hajlandóság. hiszen a metilcsoportok +I effektusukkal csökkentik, míg a triklórmetilcsoport I effektussal növeli a szénatomon kifejlődő δ+ töltés értékét. 3 3 < < < 3 6. ábra: xovegyületek reaktivitási sorrendje: aceton < acetaldehid < formaldehid < klorál A reaktivitást jól jellemzi a fenti vegyületek hidrátképző tulajdonsága. A klorál szobahőmérsékleten szilárd állapotban klorál hidrátként létezik, a formaldehid 40%-os vizes oldatban (formalin) gyakorlatilag teljes mértékben kémiailag hidrátként oldódik, de az oldat bepárlásával visszakapjuk az aldehid formát. Míg az acetaldehid és hidrátja híg vizes oldatban egyensúlyi rendszert képez, addig az aceton majdnem teljes mértékben csak fizikailag oldódik a vízben. 7. ábra: A formaldehid és hidrátja egyensúlya, illetve a klorál hidrát A karbonilcsoportot tartalmazó vegyületek másik jellemző kémiai tulajdonsága, hogy a karbonilcsoport elektronszívó tulajdonsága miatt megnöveli a hozzá képest α-helyzetben lévő atomon helyet foglaló hidrogén savasságát. ii FM: Frontier Molecular rbital; az elmélet szerint a molekula reaktivitását a M és a LUM pálya határozza meg. iii Szerves kémiában elsősorban a szénatom szempontjából osztályozzuk a reakciókat. A karbonilcsoport nukleofil addíciója során a karbonil-szénatomra nukleofilok kapcsolódnak. 2
3 Ezért a karbonsavak hidroxilcsoportja savasabb az alkoholok hidroxilcsoportjánál (ΔpK a ~12), a savamidok aminocsoportja savasabb az aminok aminocsoportjánál (ΔpK a ~20), és az oxovegyületek α- helyzetű -csoportja savasabb az alkánok -csoportjánál (ΔpK a ~22) ábra: Saverősségi sorrend: ecetsav: pk a ~ 4,7; acetamid: pk a ~ 16; etanol: pk a ~ 17; aceton: pk a ~ 20; etil-amin: pk a ~ 36; propán: pk a ~ 42 A karbonilcsoportot tartalmazó vegyületek α-helyzetben lévő atomján helyet foglaló hidrogén savasságával összefüggő reaktivitás a prototróp tautomer egyensúly. Az α-helyzetű atomon lévő proton távozásával általában egy kettős reaktivitású (ambidens) anion jön létre, amelyre a proton nemcsak az eredeti helyére, hanem a karbonil-oxigénatomra is visszakapcsolódhat gyors gyors lassú gyors 2 lassú gyors 3 9. ábra: Báziskatalizált prototróp tautomer egyensúlyok: ecetsav: virtuális tautomer egyensúly; acetamid: savamid imidsav egyensúly; aceton: oxo enol egyensúly Míg az acetát-ion két oxigénje egyenértékű, és ezért a proton azonos valószínűséggel kapcsolódik mindkettőhöz, addig az acetamidát és az enolát ambidens reaktivitású. Az oxigén kemény a nitrogén lágyabb, míg a szén egyértelműen lágy nukleofil tulajdonságú. iv Ezért a kemény proton nagyobb valószínűséggel kapcsolódik a kemény oxigénhez, mint lágyabb nitrogénhez, vagy a lágy szénhez. Ellenben a keletkezett imidsav-, illetve enol-alak termodinamikailag kevésbé stabil, v mint a savamid-, illetve oxo-alak, ezért gyors reakcióban visszaalakul az ambidens-anionná. A gyors és a lassú egyensúlyok eredményeként beálló termodinamikai egyensúlyban a termodinamikailag stabilabb savamid-, illetve oxo-alak aránya nagyságrendekkel múlja felül a termodinamikailag kevésbé stabil imidsav-, illetve enol-alak arányát. A tautomer egyensúly jellemzésére szolgál az ún. tautomer egyensúlyi állandó (K T ), amely az oxo-, illetev enol-alak savas disszociációs egyensúlyi állandójának (K a ) a hányadosa. azaz K T = K a oxo K a enol = 2 [ 3 + ] [enolát ] [ 2 ] [oxo] [ 3 + ] [enolát ] [ 2 ] [enol] pk T = pk a oxo pk a enol = [enol] [oxo] Aceton esetén az oxo-alak pk a értéke 20, míg az enol-alak pk a értéke 14,4, így a tautomer egyensúlyi állandó pk T értéke 5,6. Ennek megfelelően a tautomer egyensúlyban az [enol]/[oxo] arány 10 5,6. 2 iv A kemény (hard) és lágy (soft) reaktivitást az ún. SAB elmélet tárgyalja. A kemény reakciócentrumok elsősorban töltéskontrollált, míg a lágy reakciócentrumok elsősorban pályakontrollált reakciókban vesznek részt. v Az imidsav-, illetve enol-alak termodinamikailag kisebb stabilitásából következik, hogy ezen alakok savassága nagyobb, azaz a pk a értékük kisebb, mint a termodinamikailag stabilabb savamid-, illetve oxo-alaké. 3
4 A karbonilcsoport oxigénje δ töltésének megfelelően bázikus tulajdonságú. Prótikus savakkal protonálható, és Lewis-savakkal komplexet képez. + Ph 3 Al 3 Al Ph ábra: Az ecetsav protonálódása, illetve az acetofenon Lewis-sav komplex képződése Az oxo enol, illetve savamid imidsav prototróp tautomer egyensúly savkatalizált körülmények között is létrejön ábra: Savkatalizált prototróp tautomer egyensúlyok: ecetsav: virtuális tautomer egyensúly; acetamid: savamid imidsav egyensúly; aceton: oxo enol egyensúly Az előzőekben tárgyalt sav-bázis egyensúlyok következtében pl. acetaldehid esetén az oldat pértékének függvényében négy, különböző reaktivitású forma jelenlétével kell számolnunk. Az oxoalak karbonil-szénatomja lágy elektrofil tulajdonságú, a metilcsoportja gyengén savas, míg oxigénatomja bázikus és nukleofil tulajdonsággal rendelkezik. A protonált oxo-alak karbonilszénatomja az egységnyi pozitív töltés miatt kemény elektrofil, a metil- és a hidroxilcsoport pedig savas tulajdonságú. Az enol-alak reaktív része a szén-szén kettős kötés π-elektronfelhője, melynek lágy nukleofil reaktivitását a hidroxilcsoport magányos elektronpárja +M effektussal növeli. Mivel az oxigénatomhoz közvetlenül kapcsolódó szénatomra az oxigénatom I effektussal is hat, a nukleofil és enyhén bázikus reaktivitás az oxigéntől távolabbi α-szénatomon jelentkezik. E u - 3 u - E E E ábra: Az acetaldehid oxo-, protonált oxo-, enolát- és enol-alakjának a reaktivitása: oxo-alak: lágy elektrofil és nukleofil; protonált oxo-alak: kemény elektrofil; enolát: ambidens nukleofil; enol: lágy nukleofil 4
5 Az ambidens enolát-anion szénatomjai sp 2 míg az oxigénatomja sp hibridállapotúak. Az anion 12 elektront tartalmazó σ-váza az öt σ-kötésből és az oxigén nem reaktív sp-hibrid magányos elektronpárjából áll. Az anion három atomra kiterjedő, négy elektront tartalmazó három M-ból álló delokalizált π-rendszere a két szénatom valamint az oxigénatom p z atompályáiból jött létre. Az anion két reaktív betöltött molekulapályája az oxigénen található kemény nukleofil n y M és a lágy nukleofil π-rendszer ψ 2 M-ja. Ennek megfelelően az enolát-anion kemény elektrofilekkel (pl. trimetilszililklorid) az oxigénen, lágy elektrofilekkel (pl. bróm) az α-szénatomon reagál el ábra: A acetaldehid-enolát kötésszerkezete σ-kötések: fekete; π-kötés: kék sp-hibrid magányos elektronpár: rózsaszín p y magányos elektronpár: piros Si Si Br Br 2 Br Br ábra: Az acetaldehid enolát-alakjának ambidens reaktivitása Felső sor: töltéskontrollált kemény-reaktivitás Alsó sor: pályakontrollált lágy-reaktivitás Az enolát-anion három π-m-ja közül a ψ 2 M a karbonil szénatomon keresztül menő csomósíkkal rendelkezik. Ezért a negatív töltés az oxigénatom és az α-szénatom között oszlik meg x/(1-x) arányban, ahol az oxigén nagyobb elektronegativitása miatt 0,5<x<1. A valóságos elektroneloszlást leíró φ térbeli elektronsűrűségi függvényt közelítő módszerrel meg lehet kapni két (csak az elektroneloszlásban különböző) lokalizált határszerkezet térbeli elektronsűrűségi függvényének (φ 1 és φ 2 ) a súlyozott átlagával. A súlyozó faktorok a töltéseloszlást leíró x és (1-x) ábra: A acetaldehid-enolát betöltött π-m-i A zöld szaggatott vonal a csomósíkot jelzi ábra: A acetaldehid-enolát határszerkezetei 5
6 1.3. A karbonilcsoport nukleofil addíciós reakciói A nukleofil addíciós reakciók négy fő csoportba sorolhatók. a.) Addíciók: a a karbonil-szénatomra belépő nukleofilnak az addíció után nem marad magányos elektronpárja, a reakció egyirányú, az addukt stabil. Ilyen reakció pl. az oxovegyületek fémhidrides redukciója, vagy Grignard-vegyületekkel történő reakciója: 3 B a 3 B a Br Mg 3 3 Mg Br 3 Br Mg 3 3 Mg Br 17. ábra: Az acetaldehid redukciója és Grignard-reakciója Az enolát-anion támadását fogadó oxovegyület szemszögéből nézve az aldol-dimerizáció is e csoportba tartozik: ábra: Az acetaldehid aldol-dimerizációja. 3 2 a a belépő nukleofil stabil anion, az addíciós reakció megfordíthatóvá válik. Így pl. az oxovegyületek és hidrogén-cianid reakciója savas közegben az addíció, míg lúgos közegben az elimináció irányába tolódik el: ábra: Az acetaldehid addíciója. b.) Addíció-elimináció-addíciós reakciók: a az addíció után a belépő nukleofilnak a karbonil-szénatomhoz kapcsolódó atomján (jellemzően oxigén, kén, nitrogén, stb.) marad még magányos elektronpárja, ez enyhén savas közegben +M effektusával elősegíti az eredetileg karbonil-oxigénatom vízként való távozását. A folyamat egy második nukleofil addíciójával zárul. Ezek a lépések megfordíthatóak, egyensúlyra vezetnek. Ilyen reakció pl. az oxovegyületek és alkoholok acetál-képződést eredményező reakciója. 6
7 M ábra: Az acetaldehid-dimetil-acetál képződése c.) Addíció-eliminációs reakciók: a az addíció után a belépő nukleofilnak a karbonil-szénatomhoz kapcsolódó atomján (jellemzően nitrogén) marad még magányos elektronpárja, ez enyhén savas közegben π-kötés létrehozásával elősegíti az eredetileg karbonil-oxigénatom vízként való távozását. a a belépő nukleofilnak a karbonil-szénatomhoz kapcsolódó atomján marad még savas jellegű hidrogén is, a folyamat a proton leválásával zárul. Ezek a lépések megfordíthatóak, egyensúlyra vezetnek. Ilyen reakció pl. az oxovegyületek és aminok imin-képződést eredményező reakciója ábra: Az acetaldehid-metilimin képződése asonló mechanizmussal játszódnak le az oxim-, hidrazon- és szemikarbazon-képződési reakciók. a az addíció után a belépő nukleofilnak a karbonil-szénatomhoz kapcsolódó atomján (jellemzően nitrogén) marad még magányos elektronpárja, ez enyhén savas közegben π-kötés létrehozásával elősegíti az eredetileg karbonil-oxigénatom vízként való távozását. a a belépő nukleofilnak a karbonil-szénatomhoz kapcsolódó atomján ellenben nem marad savas jellegű hidrogénje, a protonleválás az α-helyzetű szénatomról is megtörténhet. Ezek a lépések megfordíthatóak, egyensúlyra vezetnek. Ilyen reakció pl. a ketonok és szekunder-aminok enamin-képződést eredményező reakciója. a sem a belépő nukleofilnak a karbonil-szénatomhoz kapcsolódó atomjáról, sem az α-helyzetű szénatomról nem tud proton leválni, a reaktív iminium-kation újabb nukleofil addícióját fogadja. vi Ilyen reakció pl. a Mannich-reakció. vii vi Azaz b.) típusú addíció-elimináció-addíciós reakció játszódik le vii Mivel a Mannich-reakció második nukleofil addíciója az a.) típusba tartozik, a reakció egyirányúvá válik. 7
8 ábra: A ciklohexanon és dimetil-amin reakciója ábra: A Mannich-reakció. d.) Acilezési-reakciók: a a karbonil-szénatomhoz távozó-csoport viii kapcsolódik, mint például a savszármazékokban, akkor a nukelofil-addíció a távozó-csoport eliminációjával társul, és a reakció bruttó folyamatban szubsztitúciót eredményez. Ilyen reakció pl. a karbonsavak és ammónia reakciója: ábra: Az ecetsav-amid képződése Az acilezési-reakciók savakkal és bázisokkal is katalizálhatók, a katalízis és a távozó-csoport távozókészsége alapján e reakciók az alábbi jellemző módokon játszódhatnak le: viii Távozó-csoport vagy leváló-csoport (angolul leaving group, jele L) az, amelynek leválása az adott reakciókörülmények között termodinamikailag kedvezményezett. Vizes közegben jellemzően a víz és a víznél erősebb savak (vagy anionjuk) a távozó csoportok. A távozó-csoport pk a értékének csökkenésével növekszik a távozó-készség. 8
9 reakció. Ilyen pl. a savak és alkoholok észter- A Ac 2-mechanizmus: savkatalizált bimolekuláris ix képzése ábra: A metil-acetát képződése B Ac 2-mechanizmus: báziskatalizált bimolekuláris reakció. Ilyen pl. az észterek bázikus hidrolízise. x ábra: A metil-acetát hidrolízise A Ac 1-mechanizmus: acilium-köztiterméken keresztül lejátszódó savkatalizált monomolekuláris reakció. Ilyen reakciók pl. a savkloridok képződése, xi vagy a savkloridok Lewis-sav katalizált acilezési reakciói. xii 3 S 3 S ábra: Az ecetsav-klorid képződése. S Al 3 Al 3 Al 3 Al 28. ábra: A Friedel rafts-acilezés. Ahogy már említettük a karbonilcsoportot tartalmazó vegyületek reaktivitását a karbonil-szénatomon kifejlődő δ+ töltés nagysága határozza meg. Ennek megfelelően az alábbi sorrend állítható fel: ix A reakciók molekularitása a sebességmeghatározó-lépésben résztvevő molekulák számát adja meg. x Az utolsó sav-bázis reakció az ecetsav és metanol közötti nagy pk a különbség miatt egyirányú folyamat. xi A reakciólépéseket a melléktermékek gázként való távozása teszi egyirányú folyamattá. xii A benzol nukleofil támadása a.) típusú egyirányú reakció. 9
10 > > 3 > > > > ~ > > ábra: Egyes karbonilcsoportot tartalmazó vegyületek reaktivitási sorrendje: foszgén > acetil-klorid > ecetsav-anhidrid > formaldehid > acetaldehid > aceton > ecetsav ~ metil-acetát > acetamid > karbamid A reaktivitási sorrendet elsősorban a karbonil-szénatomhoz kapcsolódó csoportok elektronküldő elektronszívó tulajdonságai határozzák meg. xiii A klóratom I effektusa nagyobb, mint a +M effektusa. A metilcsoport +I effektussal rendelkezik. A hidroxil- és a metoxicsoport +M effektusa felülmúlja a I effektust. Az aminocsoport +M effektusa nagyobb és I effektusa kisebb, mint a hidroxilcsoporté. Az aromás-vázzal létrejövő konjugáció jelentősen csökkenti a reaktivitást. Az aromás-váz jelentős +M effektust fejt ki a karbonilcsoportra. xiv > Ph > > 3 Ph > > Ph 30. ábra: Egyes karbonilcsoportot tartalmazó vegyületek reaktivitási sorrendje: acetil-klorid > benzoil-klorid; formaldehid > acetaldehid > benzaldehid; aceton > acetofenon > benzofenon Ph Ph xiii Az I effektus a σ-váz, az M effektus a p π-rendszer polarizációját írja le. xiv Ugyanezt a polarizációt az aromás-váz oldaláról nézve úgy jellemezhetjük, hogy a karbonilcsoport jelentős M effektust fejt ki az aromás π-rendszerre. 10
1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
KARBONIL-VEGY. aldehidek. ketonok O C O. muszkon (pézsmaszarvas)
 KABNIL-VEGY VEGYÜLETEK (XVEGYÜLETEK) aldehidek ketonok ' muszkon (pézsmaszarvas) oxocsoport: karbonilcsoport: Elnevezés Aldehidek szénhidrogén neve + al funkciós csoport neve: formil + triviális nevek
KABNIL-VEGY VEGYÜLETEK (XVEGYÜLETEK) aldehidek ketonok ' muszkon (pézsmaszarvas) oxocsoport: karbonilcsoport: Elnevezés Aldehidek szénhidrogén neve + al funkciós csoport neve: formil + triviális nevek
2. SZÉNSAVSZÁRMAZÉKOK. Szénsav: H 2 CO 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje.
 2. ZÉAVZÁMAZÉKK 2.1. zénsavszármazékok szerkezete, elnevezése zénsav: 2 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje. 2 + 1. ábra: A szénsav szén-dioxid egyensúly A szén-dioxid
2. ZÉAVZÁMAZÉKK 2.1. zénsavszármazékok szerkezete, elnevezése zénsav: 2 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje. 2 + 1. ábra: A szénsav szén-dioxid egyensúly A szén-dioxid
O 2 R-H 2 C-OH R-H 2 C-O-CH 2 -R R-HC=O
 Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
H H 2. ábra: A diazometán kötésszerkezete σ-kötések: fekete; π z -kötés: kék, π y -kötés: piros sp-hibrid magányos elektronpár: rózsaszín
 3. DIAZ- ÉS DIAZÓIUMSPRTT TARTALMAZÓ VEGYÜLETEK 3.1. A diazometán A diazometán ( 2 2 ) egy erősen mérgező (rákkeltő), robbanékony gázhalmazállapotú anyag. 1. ábra: A diazometán határszerkezetei A diazometán
3. DIAZ- ÉS DIAZÓIUMSPRTT TARTALMAZÓ VEGYÜLETEK 3.1. A diazometán A diazometán ( 2 2 ) egy erősen mérgező (rákkeltő), robbanékony gázhalmazállapotú anyag. 1. ábra: A diazometán határszerkezetei A diazometán
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Fémorganikus kémia 1
 Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus vegyületek
 Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
R R C X C X R R X + C H R CH CH R H + BH 2 + Eliminációs reakciók
 Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
OXOVEGYÜLETEK. Levezetés. Elnevezés O CH 2. O R C R' keton. O R C H aldehid. funkciós csoportok O. O CH oxocsoport karbonilcsoport formilcsoport
 XVEGYÜLETEK Levezetés 2 aldehid ' keton funkciós csoportok oxocsoport karbonilcsoport formilcsoport Elnevezés Aldehidek nyíltláncú (racionális név: alkánal) 3 2 2 butánal butiraldehid gyűrűs (cikloalkánkarbaldehid)
XVEGYÜLETEK Levezetés 2 aldehid ' keton funkciós csoportok oxocsoport karbonilcsoport formilcsoport Elnevezés Aldehidek nyíltláncú (racionális név: alkánal) 3 2 2 butánal butiraldehid gyűrűs (cikloalkánkarbaldehid)
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Aldehidek, ketonok és kinonok
 Aldehidek, ketonok és kinonok 3 3 3 innamomum camphora Agócs Attila rvosi Kémia 2018 kámfor Tanulási célok: Az oxovegyületek elnevezése és fizikai tulajdonságai Nukleofil addíció, az oxovegyületek legfontosabb
Aldehidek, ketonok és kinonok 3 3 3 innamomum camphora Agócs Attila rvosi Kémia 2018 kámfor Tanulási célok: Az oxovegyületek elnevezése és fizikai tulajdonságai Nukleofil addíció, az oxovegyületek legfontosabb
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
A tételek: Elméleti témakörök. Általános kémia
 A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
szabad bázis a szerves fázisban oldódik
 1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
OXOVEGYÜLETEK. Levezetés. Elnevezés O CH 2. O R C H aldehid. O R C R' keton. Aldehidek. propán. karbaldehid CH 3 CH 2 CH 2 CH O. butánal butiraldehid
 XVEGYÜLETEK Levezetés 2 aldehid ' keton Elnevezés Aldehidek propán karbaldehid 3 2 2 butánal butiraldehid oxo karbonil formil Példák 3 3 2 metanal etanal propanal formaldehid acetaldehid propionaldehid
XVEGYÜLETEK Levezetés 2 aldehid ' keton Elnevezés Aldehidek propán karbaldehid 3 2 2 butánal butiraldehid oxo karbonil formil Példák 3 3 2 metanal etanal propanal formaldehid acetaldehid propionaldehid
IV. Elektrofil addíció
 IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
Helyettesített karbonsavak
 elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
KARBONSAVSZÁRMAZÉKOK
 KABNSAVSZÁMAZÉKK Levezetés Kémiai rokonság 2 2 2 N 3 N A karbonsavszármazékok típusai l karbonsavklorid karbonsavanhidrid karbonsavészter N N 2 karbonsavnitril karbonsavamid Példák karbonsavkloridok 3
KABNSAVSZÁMAZÉKK Levezetés Kémiai rokonság 2 2 2 N 3 N A karbonsavszármazékok típusai l karbonsavklorid karbonsavanhidrid karbonsavészter N N 2 karbonsavnitril karbonsavamid Példák karbonsavkloridok 3
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
IX. Szénhidrátok - (Polihidroxi-aldehidek és ketonok)
 IX Szénhidrátok - (Polihidroxi-aldehidek és ketonok) A szénhidrátok polihidroxi-aldehidek, polihidroxi-ketonok vagy olyan vegyületek, amelyek hidrolízisekor az előbbi vegyületek keletkeznek Növényi és
IX Szénhidrátok - (Polihidroxi-aldehidek és ketonok) A szénhidrátok polihidroxi-aldehidek, polihidroxi-ketonok vagy olyan vegyületek, amelyek hidrolízisekor az előbbi vegyületek keletkeznek Növényi és
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
VII. Karbonsavak. karbonsav karboxilcsoport karboxilátion. acilátcsoport acilátion acilcsoport. A karbonsavak csoportosítása történhet
 VII. Karbonsavak A disszociáció révén protonszolgáltatásra képes szerves vegyületek jellegzetes és fontos csoportját képezik a -H karboxilcsoportot tartalmazó karbonsavak. A funkciós csoport szerkezete
VII. Karbonsavak A disszociáció révén protonszolgáltatásra képes szerves vegyületek jellegzetes és fontos csoportját képezik a -H karboxilcsoportot tartalmazó karbonsavak. A funkciós csoport szerkezete
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
HALOGÉNEZETT SZÉNHIDROGÉNEK
 ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
Aromás vegyületek II. 4. előadás
 Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
Összefoglaló előadás. Sav-bázis elmélet
 Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
SZERVES KÉMIAI REAKCIÓEGYENLETEK
 SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
Szerves Kémia II. Dr. Patonay Tamás egyetemi tanár E 405 Tel:
 Szerves Kémia II. TKBE0312 Előfeltétel: TKBE03 1 Szerves kémia I. Előadás: 2 óra/hét Dr. Patonay Tamás egyetemi tanár E 405 Tel: 22464 tpatonay@puma.unideb.hu A 2010/11. tanév tavaszi félévében az előadás
Szerves Kémia II. TKBE0312 Előfeltétel: TKBE03 1 Szerves kémia I. Előadás: 2 óra/hét Dr. Patonay Tamás egyetemi tanár E 405 Tel: 22464 tpatonay@puma.unideb.hu A 2010/11. tanév tavaszi félévében az előadás
KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATOK 2003.
 KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATK 2003. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATK 2003. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
KARBONSAV-SZÁRMAZÉKOK
 KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
szerotonin idegi mûködésben szerpet játszó vegyület
 3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Szemináriumi feladatok (kiegészítés) I. félév
 Szemináriumi feladatok (kiegészítés) I. félév I. Szeminárium 1. Rajzolja fel az alábbi ion π-molekulapályáit: N ány centrumú a delokalizált rendszer? ány elektron építi fel a delokalizált rendszert? ány
Szemináriumi feladatok (kiegészítés) I. félév I. Szeminárium 1. Rajzolja fel az alábbi ion π-molekulapályáit: N ány centrumú a delokalizált rendszer? ány elektron építi fel a delokalizált rendszert? ány
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét
 Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Sav bázis egyensúlyok vizes oldatban
 Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz
 Budapesti Műszaki és Gazdaságtudományi Egyetem Vegyészmérnöki és Biomérnöki Kar Szerves Kémia és Technológia Tanszék MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz Készítette: Kormos Attila Lektorálta:
Budapesti Műszaki és Gazdaságtudományi Egyetem Vegyészmérnöki és Biomérnöki Kar Szerves Kémia és Technológia Tanszék MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz Készítette: Kormos Attila Lektorálta:
Beszélgetés a szerves kémia elméleti alapjairól III.
 Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
Szerves Kémia II. 2016/17
 Szerves Kémia II. 2016/17 TKBE0301 és TKBE0312 4 kr Előfeltétel: TKBE0301 Szerves kémia I. Előadás: 2 óra/hét Dr. Juhász László egyetemi docens E 409 Tel: 22464 juhasz.laszlo@science.unideb.hu A 2016/17.
Szerves Kémia II. 2016/17 TKBE0301 és TKBE0312 4 kr Előfeltétel: TKBE0301 Szerves kémia I. Előadás: 2 óra/hét Dr. Juhász László egyetemi docens E 409 Tel: 22464 juhasz.laszlo@science.unideb.hu A 2016/17.
Helyettesített Szénhidrogének
 elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
Tantárgycím: Szerves kémia
 Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk.
 1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
H 3 C H + H 3 C C CH 3 -HX X 2
 1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
KARBONSAVAK. A) Nyílt láncú telített monokarbonsavak (zsírsavak) O OH. karboxilcsoport. Példák. pl. metánsav, etánsav, propánsav...
 KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
ALKOHOLOK ÉS SZÁRMAZÉKAIK
 ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
Intra- és intermolekuláris reakciók összehasonlítása
 Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
1. feladat Maximális pontszám: 5. 2. feladat Maximális pontszám: 8. 3. feladat Maximális pontszám: 7. 4. feladat Maximális pontszám: 9
 1. feladat Maximális pontszám: 5 Mennyi az egyes komponensek parciális nyomása a földből feltörő 202 000 Pa össznyomású földgázban, ha annak térfogatszázalékos összetétele a következő: φ(ch 4 ) = 94,7;
1. feladat Maximális pontszám: 5 Mennyi az egyes komponensek parciális nyomása a földből feltörő 202 000 Pa össznyomású földgázban, ha annak térfogatszázalékos összetétele a következő: φ(ch 4 ) = 94,7;
V. Szénhidrogének hidroxiszármazékai
 V. Szénhidrogének hidroxiszármazékai Szerkezeti jellemzőjük, hogy adott szénváz egy vagy több szénatomjához hidroxilcsoport kapcsolódik. A hidroxilcsoportot kötő szénatom jellege (telített, telítetlen,
V. Szénhidrogének hidroxiszármazékai Szerkezeti jellemzőjük, hogy adott szénváz egy vagy több szénatomjához hidroxilcsoport kapcsolódik. A hidroxilcsoportot kötő szénatom jellege (telített, telítetlen,
Spektroszkópiai módszerek 2.
 Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai reakciók. Közös elektronpár létrehozása. Általános és szervetlen kémia 10. hét. Elızı héten elsajátítottuk, hogy.
 Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
1. feladat. Versenyző rajtszáma:
 1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
Fizikai kémia 2. Előzmények. A Lewis-féle kötéselmélet A VB- és az MO-elmélet, a H 2+ molekulaion
 06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
Közös elektronpár létrehozása
 Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
Név: Pontszám: 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban
 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
Budapest, szeptember 5. Dr. Tóth Tünde egyetemi docens
 SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
Kémia fogorvostan hallgatóknak Munkafüzet 14. hét
 Kémia fogorvostan hallgatóknak Munkafüzet 14. hét Szerves anyagok vizsgálata III. (177-180. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás, Nagy Veronika, Radó-Turcsi
Kémia fogorvostan hallgatóknak Munkafüzet 14. hét Szerves anyagok vizsgálata III. (177-180. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás, Nagy Veronika, Radó-Turcsi
6. 1,3-DIKARBONILVEGYÜLETEK
 6.1. Az 1,3-dikarbonilvegyületek szerkezete 6. 1,3-DIARBNILVEGYÜLETE 1,3-, vagy β-dikarbonilvegyületeknek nevezzük azokat az oxovegyületeket és/vagy savszármazékokat, ahol a második karbonilcsoport az
6.1. Az 1,3-dikarbonilvegyületek szerkezete 6. 1,3-DIARBNILVEGYÜLETE 1,3-, vagy β-dikarbonilvegyületeknek nevezzük azokat az oxovegyületeket és/vagy savszármazékokat, ahol a második karbonilcsoport az
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1999
 1999 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1999 Figyelem! A kidolgozáskor tömör és lényegre törő megfogalmazásra törekedjék. A megadott tematikus sorrendet szigorúan tartsa be! Csak a
1999 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1999 Figyelem! A kidolgozáskor tömör és lényegre törő megfogalmazásra törekedjék. A megadott tematikus sorrendet szigorúan tartsa be! Csak a
Eredményes vizsga esetén a tárggyal 5 kreditpont szerezhető. A félév csak aláírással zárul, ha
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2018/2019 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2018/2019 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
1. feladat Összesen: 8 pont. 2. feladat Összesen: 11 pont. 3. feladat Összesen: 7 pont. 4. feladat Összesen: 14 pont
 1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
6. változat. 3. Jelöld meg a nem molekuláris szerkezetű anyagot! A SO 2 ; Б C 6 H 12 O 6 ; В NaBr; Г CO 2.
 6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ
 1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
FELADATMEGOLDÁS. Tesztfeladat: Válaszd ki a helyes megoldást!
 FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban
 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
Eredményes vizsga esetén a tárggyal 5 kreditpont szerezhető. A félév csak aláírással zárul, ha
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2017/2018 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2017/2018 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
A kémiatanári zárószigorlat tételsora
 1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
10. Előadás. Heterociklusos vegyületek.
 0. Előadás eterociklusos vegyületek. ETECIKLUSS VEGYÜLETEK Felosztás:. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
0. Előadás eterociklusos vegyületek. ETECIKLUSS VEGYÜLETEK Felosztás:. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
Budapest, szeptember 6. Dr. Huszthy Péter egyetemi tanár
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESKA202 és BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2016/2017 tanév I. félév Az alaptárgy heti 3 óra előadásból
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESKA202 és BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2016/2017 tanév I. félév Az alaptárgy heti 3 óra előadásból
Szerves kémia Fontosabb vegyülettípusok
 Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Laboratóriumi technikus laboratóriumi technikus 54 524 01 0010 54 02 Drog és toxikológiai
 A 10/2007 (II. 27.) SzMM rendelettel módosított 1/2006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
A 10/2007 (II. 27.) SzMM rendelettel módosított 1/2006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit
 SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
Oxovegyületek. Nevezéktan. Aldehidek
 Ketonok láncon belül oxocsoportot tartalmaznak xovegyületek karbonilcsoportot tartalmaznak Aldehidek láncvégi - csoport (v. oldalláncban) -atomhoz kapcsolódik a) szubsztitúciós nómenklatúra Nevezéktan
Ketonok láncon belül oxocsoportot tartalmaznak xovegyületek karbonilcsoportot tartalmaznak Aldehidek láncvégi - csoport (v. oldalláncban) -atomhoz kapcsolódik a) szubsztitúciós nómenklatúra Nevezéktan
KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2004.
 KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2004. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2004. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra :
 ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra : H 2 O H + + OH -, (2 H 2 O H 3 O + + 2 OH - ). Semleges oldatban a hidrogén-ion
ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra : H 2 O H + + OH -, (2 H 2 O H 3 O + + 2 OH - ). Semleges oldatban a hidrogén-ion
1. változat. 4. Jelöld meg azt az oxidot, melynek megfelelője a vas(iii)-hidroxid! A FeO; Б Fe 2 O 3 ; В OF 2 ; Г Fe 3 O 4.
 1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
4. változat. 2. Jelöld meg azt a részecskét, amely megőrzi az anyag összes kémiai tulajdonságait! A molekula; Б atom; В gyök; Г ion.
 4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
β-dikarbonil-vegyületek szintetikus alkalmazásai
 β-dikarbonil-vegyületek szintetikus alkalmazásai A β-dikarbonil vegyületek tipikus szerkezeti egysége a két karbonilcsoport, melyeket egy metilén híd köt össze. Ezek a származékok két fontos tulajdonsággal
β-dikarbonil-vegyületek szintetikus alkalmazásai A β-dikarbonil vegyületek tipikus szerkezeti egysége a két karbonilcsoport, melyeket egy metilén híd köt össze. Ezek a származékok két fontos tulajdonsággal
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A hidrogénmolekula. Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve!
 Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Az elemek általános jellemzése
 Az elemek általános jellemzése A periódusos rendszer nemcsak az elemek, hanem az atomok rendszere is. Az atomok tulajdonságait, kémiai reakciókban való viselkedését nagymértékben befolyásolja a vegyértékelektronok
Az elemek általános jellemzése A periódusos rendszer nemcsak az elemek, hanem az atomok rendszere is. Az atomok tulajdonságait, kémiai reakciókban való viselkedését nagymértékben befolyásolja a vegyértékelektronok
KÉMIA PÓTÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK június 6. du.
 KÉMIA PÓTÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2003. június 6. du. I. Ha most érettségizik, az I. feladat kidolgozását karbonlapon végezze el! Figyelem! A kidolgozáskor tömör és lényegretörő megfogalmazásra
KÉMIA PÓTÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2003. június 6. du. I. Ha most érettségizik, az I. feladat kidolgozását karbonlapon végezze el! Figyelem! A kidolgozáskor tömör és lényegretörő megfogalmazásra
Toluol (Bruckner II/1 476) µ= 0.33 Debye
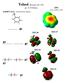 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
