A kémiai kötés. Pauling-féle elektronnegatívitási érték. - K-héj H He L-héj Li Be B C N O F Ne
|
|
|
- Judit Takácsné
- 5 évvel ezelőtt
- Látták:
Átírás
1 A kémiai kötés A klasszikus alapokon nyugvó elektronoktett- elmélet Az atomok többsége a nemesgázok kivétel a Földön instabil. Vegyületeket képeznek úgy, hogy nyílt héjuk lezárttá (nemesgáz elektronkonfigurációjúvá) váljon. 2.1 Pauling-féle elektronnegatívitási érték - K-héj e L-héj Li Be B N F Ne ogy érik ezt el? A cél érdekében adott számú elektront - adnak le, - vesznek fel vagy - tesznek a közösbe. A) Az ionos kötés (ha a két atom között az elektronnegatívitás különbsége nagy! ) következmény: igen stabil ionkristály pl. Li (ionkristály op. 680 o ) Li -e Li +e Li -e Li F +e F zárt héj mint a e zárt héj mint a e pl. LiF (ionkristály op. 845 o ) zárt héj mint a e zárt héj mint a Ne
2 A litium-hidrid molekula (Li) 3+1 elektron 2 betöltött M µ= 5.99 Debye (RF/3-21G) Li + Li Jelentős töltéselkülönülés: EPS töltés Molekulapálya-energia (artree) M 2 ( ) M 1 ( ) Pozitív rész alig van elektronsűrűség A litium-fluorid molekula (LiF) 3+9 elektron 6 betöltött M µ= 5.74 Debye (RF/3-21G) Li + F Li Jelentős töltéselkülönülés: 1 4 F EPS töltés memo: EPS := electrostatic potential surface
3 A szén nem tud 4 elektront leadni vagy 4 elektront felvenni ezért másként éri el a neonéhoz hasonló elektronszerkezetet B) A kovalens kötés (ha a két atom között az elektronnegatívitás különbsége kicsi ) 1) F (nem ionos hanem kovalens kötés poláris jelleggel) e + a protonnak nem lenne saját elektronja ezért nem is adja azt teljesen le. F + e F fluorid anion zárt héjú, mint a Ne + F F 2) 4 (kovalens kötés apoláris jelleggel) 4 + további példák: 3 + N N Lewis-féle szerkezet 2 +
4 Kémiai reakció hajtóereje lehet pl. az ellentétes töltések vonzása: Li + + Li Li A hidridion nehezen viseli a negatív töltést, ezért megkeresi a pozitív párját a protont ( + ). A reakció sikeréhez az is kell, hogy 1) a protondonor poláris legyen (víz), valamint hogy 2) a deprotonált formában ( ) stabil legyen. Variáció egy témára: a reakció nem megy, mert se a metán sem a víz nem elég poláris: De a reakció persze eredményes, 1) ha a metánt ammóniára cseréljük: N 3 N 3 + N 4 + 2) vagy ha a vizet mágikus savra cseréljük: 2 S 2 F SbF
5 A szén önmagával és egy sor más eltérő elektron negativitású atommal képes kovalens kötéseket létesíteni: Li F δ δ+ δ+ δ Gyémántrács (sp 3 szenek) Grafitrács (sp 2 szenek) 2,3-dimetilpentán 3,3-dimetilhexán Fenantrén
6 A szénvegyületek sikere a lehetséges izomerek nagy számában rejlik: 2 2 2n+2 2 2n+1 X X 1 3 X 2 X X 4 X X fajta 18 fajta 9 fajta 74 fajta
7 A képletírás Gilbert N. Lewis feladat: leírni az atommagok elrendeződését, az elektronszerkezetet. Mielőtt leírjuk a salétromsav Lewis képletét, azelőtt tudnunk kell az atommagok elrendeződését (konnektivitását) pl. N 3 -ban nincs,n kötés. G.N. Lewis és W. Kössel (1916 azaz a kvantummechanika születése előtt ) A Lewis-féle szerkezet: épitőelemek: -az elem vegyjele az atomtörzset jelöli ( azaz vegyértékelektronok számának megfelelő pozitív töltést is a vegyjel szimbolizálja.) pl. a szimbólum négyszeresen pozitív. -a vegyértékelektronokat egy-egy pont jelöli A semleges atom tehát a vegyértékelektronjaival körülvett atomtörzs. N kovalens kötés : egy elektronpár megosztását jelenti két atom között (egyetlen vonallal jelölünk) nemkötő elektronpár : csupán egyetlen atomtörzshöz kapcsolódó két elektron (pontpárként tüntetjük fel).
8 ktettszabály: amikor Lewis-féle szerkezeteket írunk, akkor csak a vegyértékelektronokat tüntetjük fel. A második periódus elemeire a Ne elektronkonfiguráció eléréséhez maximum 8 vegyértékelektron szükséges. Ezt az állapotot a molekulát vagy iont felépítő atomok egyes vegyértékelektronjaik közreadásával érnek el Kivételek az oktettszabály alól: - az elektronhiányos atomok esete: pl. BF 3 F F B F 6 elektron - a nem második periódusbeli atomok esete: pl. S 2-4 vagy Pl 5 10 elektron 12 elektron l l P l l l Töltés = (vegyértékelektronok száma) -( asszignált elektronok száma) 1-1=0 töltése 5-5=0 N töltése N 5-4= +1 memo: az ammónium N töltése kationban a nitrogénhez csak 4 e rendelhető N S 1-1=0 töltése
9 +1 töltés zeró töltés -1 töltés B B N N N N N N N N X X X X = F, l, Br, J Rezonancia vagy határszerkezetek: Bizonyos molekulák esetében egyetlen Lewis-képlet nem írja le helyesen az elektronszerkezetet. Ilyenkor jobb híján több Lewis-szerkezetet írunk fel, amelyek között egyenlő értékűek is találhatók. A rezonanciaelmélet szerint ezek a szerkezetek fiktívek, amelyek közül a valóságot önmagában egyikük sem írja le helyesen. Ezeket határszerkezeteknek hívjuk és a tényleges molekulaszerkezetet összességükkel jellemezzük. (Görbe nyilak az elektonpárok mozgatását mutatják, azt ahogy a következő fiktív szerkezethez eljuthatunk.)
10 Ekvivalens határszerkezetek: pl. 3 2 vagy N N N N N rezonancia vagy határszerkezetek hibridszerkezet Nem-ekvivalens határszerkezetek: pl. 2 vagy 2 N 2 + A) neutrális (formaldehid) is is oktett nincs töltésszétválás nem oktett töltésszétválás µ magyarázza a dipolt B) töltött (metilénammónium kation) fõ határszerkezet N is N is oktett fõ határszerkezet mellék határszerkezet N nem oktett mellék határszerkezet
11 Bevezetés a parányok világba cél: pontszerű részecskék állapotának definiálása: megoldás: két vektor megadása 1. pozíció vektor (r) ahol 2. impulzus (lendület) vektor (p) p = mv memo: az objektum lehet akár a hold, akár egy biliárdgolyó példa: tekintsük egy adott röppályán tovahaladó golyót a Q 1 és Q 2 pontokban ahol x = r 1 r 2 és p = p 1 p 2 klasszikus világ: rendre megfigyeljük a p és az r vektorok nagyságát és irányát, tehát bármilyen kicsi x és p értelmezett memo: Q 1 Q 2 ezt a megfigyelést megtehetjük akármilyen pontosan a rendszer megzavarása nélkül! a például a megfigyelést fotonokkal végezzük ( tehát nézünk ), amelynek a golyókkal vett kölcsönhatásától eltekinthetünk, mert azok mérete igen különböző, akkor valóban nincs megzavarás. r 2 r 1 p 1 p 2 p x
12 atomi világ: a p és az r vektor nagyságának és irányának megfigyelése csak adott pozíciókülönbség (hiba) ( x és p) mellett végezhető el. memo: a rendszer elvileg sem figyelhető meg, annak megzavarása nélkül! A megfigyelést pl. fotonokkal végezzük, amelyeknek az elektronokkal vett kölcsönhatásától nem tekinthetünk el. A mérő-mérendő összevethetősége miatt egy adott szintű bizonytalanság mindig jelen van. eisenberg-féle bizonytalansági reláció : x p ћ/2 analógia: sötétben egy biliárdgolyó pozícióját az asztalon úgy szeretnénk meghatározni, hogy egy másik golyót gurítunk és figyelünk a reménybeli ütközéskori koccanásra. Ekkor beavatkozunk a megfigyelés során, s az eredeti állapot megváltozatjuk! a a kölcsönhatás után lámpát gyújtunk akkor láthatjuk hogy elvileg is más kell legyen az új állapot, mint volt a megfigyelendő rendszer a megfigyelés előtt.. memo: Planck-féle állandó h 6, Js (ћ = h/2π) elektron nyugalmi tömege: 9, kg foton tömege adott hullámhosszú fény esetén (hν = mc 2 alapján)
13 klasszikus világ a golyó egy s-típusú pálya mentén halad kvantum rendszer az elektron a s-típusú atompálya akár belső akár külső térrészében bárhol lehet, p 1 r 1 r 2 p 2 A hely- és impulzusvektorok összességének ismeretében a golyó előfordulási valószínűsége a pálya egy adott pontján megadható. de nem azonos valószínűséggel. ullámfüggvényt használunk a helyvektor szerepkörében. Pl. kinetikus energia? T = p 2 /2m (mennyiség) T = ½ 2 (operátor) ahol 2 = 2 / x / y / z 2
14 Fizikai modell Állapot Fizikai mennyiség Klasszikus mechanika r: koordináta p: lendület f(r,p) Mérés <f>=f(r,p) Időfejlődés Newton egyenlet: d m dt 2 F = 2 r Fizikai modell Állapot Fizikai mennyiség fˆ = rˆ Kvantummechanika Ψ(r 1, r N ), komplex függvény f (rˆ, pˆ ) r Ψ Ψdr * 1 pˆ ih = ih,..., r 3 α = 1 e N α < r α Mérés fˆ = Ψ * f (rˆ, pˆ) Ψdr Időfejlődés Schrödinger egyenlet: ih t Ψ = Ψ
15 Sajátérték, sajátfüggvény függvény: egy számhoz egy számot rendel operátor: egy függvényre hatva egy új függvényt hoz létre Pl. operátor. (függvény) = új függvény legyen az operátor a d/dx (memo: deriváljunk x szerint) legyen a függvény a sin(x) d/dx[sin(x)] = cos(x) Egy operátorhoz tartozhatnak olyan függvények, amelyek az operátor hatása után a kiindulási függvénytől csak egy konstansban különböznek. Ezek a függvények az operátor un. sajátfüggvényei. operátor. (függvény) = konst. (függvény) Pl. legyen az operátor a d/dx legyen a függvény az exp(ax) d/dx[exp(ax)] = a exp(ax) memo: d/dx[sin(ax)] = a cos(ax) konst sin(ax) Tehát a sin(ax) nem sajátfüggvénye a d/dx differenciál operátornak. Viszont az exp(ax) sajátfüggvénye a d/dx operátornak, és az a konstans az operátor sajátértéke.
16 A kémiai kötés leírása kvantumkémiai alapokon Bohr féle atommodell: egy negatív korpuszkula kering a pozitív magok erőterében en szeres kicsinyítés 1 m 0.1nm=Â hétköznapi világ: egy test impulzusa és helye egyszerre megadható tetszésszerinti pontossággal megjegyzés: atomi mérettartomány: egy részecskék impulzusa és helye nem adható meg egyszerre tetszésszerinti pontossággal az atommagot klasszikus részecskeként kezeljük de az elektront nem! Az elektron nem hagyományos objektum. kísérlet: a rossz kérdés: a jó kérdés: dτ tegyünk egy elektront egy dobozba (potenciál (V) fal). hol lesz az elektron? mekkora a valószínűsége annak, hogy az elektron a dτ térfogatelemben van? Mekkora a kinetikus energiája (E)? E=mv 2 /2=p 2 /2m ahol v a részecske sebessége, p annak impulzusa de Broglie: p=nh/2l
17 Az 1D modell V= V=0 dτ V= peremfeltétel: 0 x L a részecskének a falon belül csak kinetikus energiája van. részecske : kinetikus energia E n = n 2 h 2 /8mL 2 n=1,2, jellemzése hullámfüggvény ψ n = (2/L) 1/2 sin(nπx/l) hullámfüggvény négyzete (ψ n ) 2 ami megadja a dτ térfogatelemben az részecske tartózkodásának valószínűségét. változók: fizikai állandók: h (Planck állandó = Js) n (kvantumszám), L (1D doboz mérete) és m (részecske tömege) ψ n 0 0,2 0,4 0,6 0, x/l n ψ n n 0 0,2 0,4 0,6 0,8 1 x/l
18 következmények: 1. a részecske mindig mozog (zéró pont energia E n = h 2 /8mL 2 ), 2. a részecske energiája kvantált (nem gerjeszthető akárhogy), 3. az állapotok nem-degeneráltak, n=1 (alapállapot) legnagyobb valószínűséggel középen van a részecske, n=2 (gerjesztett állapot) középen soha nincs a részecske, n=3 (a következő gerjesztett állapot) már két csomósík van, azaz már két hely is van ahol soha sincs a részecske, 0 0,2 0,4 0,6 0,8 1 V= V=0 V= dτ 0 x L 4. ha L csökken akkor a kinetikus energia nő, 5. a n (kvantumszám) értéke nő akkor az L mentén egyre egyenletesebb lesz a részecske eloszlása.
19
20 megjegyzés: a részecske hullám természetű, ezért tartozik hozzá egy λ. Az 1D-dobozba akkor fér bele a részecske, ha az n*λ/2=l feltétel teljesül: stacionárius megoldás; állóhullám. (Furulya: n=1,2,3, felhangok a furulyán ha L a légoszlop hossza.) ullámfüggvény s=asin(ωt) és ω=2π/t= 2πf= 2πc/λ s=asin(2πct/λ) de ct=x s=asin(2πx/λ) de λ=2l/n s=asin(πxn/l) tehát ezért ilyen alakú az s=s(x) függvény azaz a részecske hullámfüggvénye ψ n = (2/L) 1/2 sin(nπx/l) példa: E n-m = (n 2 -m 2 )(h 2 /8m)L 2 E n-m n-ről m-re történő gerjesztés energiája csak L-től függ! Delokalizált elektronok száma (dobozhossz [L] ) 2π( 2Â) 4π ( 5Â) 24π ( 30Â) ( 2n)π ( 3nÂ) 7 ev 5 ev 2-3 ev 1.5 ev Gerjesztési energia ( M-LUM átmenet) 2 n UV vörös ibolya IR látható
21 A nem-klasszikus atommodell: az elektronok állapota a magok erőterében térbeli állóhullámok segítségével írható le. Schrödinger féle hullámegyenlet megoldása ad: sajátfüggvényeket sajátértékeket. A közelítő sajátfüggvény (ψ) atomok esetén az atompályákból (A [atomic orbital]), molekulák esetén a molekulapályákból (M [molecular orbital]) épülnek fel. ψ ψ 2 előjeles mennyiség a tér minden pontjában van értéke, de nincs fizikai jelentése. mindig pozitív, a tér minden pontjában van értéke, fizikai jelentése az elektronsűrűség. A) Az atomok elektronszerkezete A hidrogén szerű atom (van egzakt megoldás) A hidrogén atomra felírt Schrödinger egyenlet sajátfüggvényei adják a hidrogén atompályáit, sajátértékei a pályaenergiákat.
22 Sajátfüggvények: ψ =R(r)Y(Θ,Φ) (r, Θ,Φ polárkoordináták) s pályák esetén Y(Θ,Φ)=konstans=(1/4π) 1/2 ψ = R(r)(1/4π) 1/2 amiből az R: rediális hullámfüggvények: n=1 1s s(r)=2 (Z/a 0 ) 3/2 exp(-2zr/2a 0 ) n=2 2s s(r)=1/8 1/2 (Z/a 0 ) 3/2 (2- Zr/a 0 )exp(-zr/2a 0 ) n=3 3s... Z= rendszám (atomic number) és a 0 = Bohr rádius ( m) a Z=1akkor 1s s(r)a 0 3/2 =2exp(- r/a 0 ) 2s s(r)a 0 3/2 =1/8 1/2 (2- r/a 0 )exp(-r/2a 0 ) 1,8 s(r)a 0 3/2 0,30 {s(r)a 0 3/2 } 2 0,25 1,3 1s 2s 0,20 0,15 1s 2s 0,8 0,10 0,3 0,05 r/a 0 r/a 0-0, , következmények: 1. a magnál (r/a 0 =0) mindig nagy az elektronsűrűség, 2. csomósíkok jelennek meg, 3. ψ 2 megadja az elektronsűrűség értékét adott r/a 0 -nál, 4. ψ 2 alatti terület (integrálja) a 0 és r/a 0 érték között megadja az r/a 0 gömbbe eső teljese elektronsűrűség értékét.
23 0,30 0,30 0,25 0,20 0,15 1s 0,25 ψ 2 ψ 2 0,20 1s 0,15 0,10 0,10 0,05 0,05 0, , Koncentrikus gömbhéjak, ahol az elektronsűrűség a ψ 2 értéke (izofelület). Koncentrikus gömbök amelyen belül az elektronsűrűség a [0, r/a 0 ] értékre számított ψ 2 értéke.
24 Sajátfüggvények: ψ =R(r)Y(Θ,Φ) (r, Θ,Φ polárkoordináták) p pályák radiális hullámfüggvények: 2p p(r)=1/(2*6 1/2 )(Z/a 0 ) 3/2 (Zr/a 0 ) exp(-zr/2a 0 ) 3p p(r)=1/(9*6 1/2 )(Z/a 0 ) 3/2 (4-2Zr/3a 0 )(2Zr/3a 0 )exp(-zr/3a 0 ) n=4 4p... Z= rendszám (atomic number) és a 0 = Bohr rádius ( m) a Z=1 n=2 2p p(r)a 0 3/2 =1/(2*6 1/2 ) (r/a 0 ) exp(-r/2a 0 ) n=3 3p p(r)a 0 3/2 =1/(9*6 1/2 )(4-2r/3a 0 )(r/2a 0 ) exp(-r/3a 0 ) 0,16 0,12 P(r)a 0 3/2 0,025 0,020 {P(r)a 0 3/2 } 2 0,08 0,015 0,04 0,00-0,04 2p 3p 0,010 0, r/a 0 0, r/a 0 2p 3p következmények: 1. a magnál (r/a 0 =0) mindig zéró az elektronsűrűség, 2. csomósíkok jelennek meg. figyelem: 1. ez csak a radiális tényező, ebből még nem lesz súlyzó alak, csak ha az anguláris tényezőt is figyelembe vesszük.
25 Sajátértékek: E n = -(Z 2 µe 4 /32π 2 ε 02 h 2 )1/n 2 n=1,2,3,.. Ahol Z; a rendszám, µ ; a redukált tömeg, e ; az elemi töltés ( ), ε 0 ; a vákuum permeabilitása ( J m -1 ) h ; a Planck állandó/2π ( Js). minden energiaszint n 2 -szer degenerált (elfajult) ahol n a főkvantumszám : E 1 1-szeres degeneráltság E 2 4-szeres degeneráltság E 3 9-szeres degeneráltság memo.:ez az elfajulás csak a, e +, Li 2+, sorra igaz, ahol nincs elektron-elektron taszítás. a van, akkor a 2s már nem elfajult a 2p-pályákkal, s a 3s, sem a 3p sem a 3d pályákkal stb. De azok önmagukban (3db. 2p, 5db. 3d, stb.) továbbra is elfajultak maradnak: E 2px =E 2py =E 2pz. 0 1s 2s, 2p x, 2p z, 2p y 3s, 3p x, 3p z, 3p y, 5db. 3d n (főkvantumszám) E 9 az elektron majdnem izolált már a magtól alig van energiacsökkenés. -1 E n
26 A hidrogénatom () 1 elektron 2s 2p x 2p y 2p z 1s A szénatom () 6 elektron 2p x 2p y 2p z 2s 1s
27 A hidrogénatom () 1 elektron 1 betöltött A E(RF/3-21G)= artree 2p z A 3 (+1.069) 2p y A 3 (+1.069) 4-szeresen degenerált A-k 2p x A 3 (+1.069) 2s A 2 (+1.069) 1s A 1 ( ) z y x
28 Bonyolultabb atomok (nincs egzakt megoldás) Az adott atomra felírt artree-fock egyenlet sajátfüggvényei adják meg az atom atompályáit, sajátértékei a pályaenergiákat. Pauli elv: a -szerű A-ra az elektronok párosával és ellentétes spinnel kerülnek fel, de maximum kettő. und-szabály: degenerált A-k esetén először minden A-ra csupán egy elektron kerül. Born-ppenheimer-közelítés: a magokat nyugvó tömegpontoknak és pontszerű töltésnek tekintjük amelyek erőterében mozognak az elektronok. stratégia: az összelektron-hullámfüggvényt (bonyolult atomok hullámfüggvényeit) egyetlen elektron állapotait leíró úgynevezett egyelektron-hullámfüggvényekből építjük fel. A Born-ppenheimer-közelítés értelmében a hullámfüggvény csak az elektronrendszer állapotaira vonatkozik. molekulapálya-módszer: egy molekula elektronszerkezetét különböző molekulapályákat elfoglaló elektronpárok alkotják. A molekulapályák egyelektron-hullámfüggvények: egyetlen elektron állapotát adják meg az összes mag és az összes többi elektron erőterében.
29 e atom kontra 2 molekula Magkonfiguráció, stabilitás, termodinamika, kinetika, neutronok szerepe, tömegvonzás (hiánya) Mi is történik a Napban, avagy hol létezik egymás mellett a Ne és a 2 molekula hidrogénmolekula lazító pályája σ* M 2 ( ) (LUM) σ M 1 ( ) hidrogénmolekula kötő pályája (M) 1s A 1 ( ) hidrogén atompályája e atom ( ) most of the Sun's li produced by nuclea a series of steps cal (proton proton) ch converts hydrogen
30 A neonatom (Ne) 10 elektron 5 betöltött A E(RF/3-21G)= artree z y x artree 2p x A 3 2p y A 4 2p z A 5 2s A artree 1s A artree
31 A hidrogénmolekula ( 2 ) 2 elektron 1 betöltött M µ= 0 Debye E(RF/3-21G)= artree EPS töltés (LUM) hidrogénmolekula lazító pályája σ* M 2 ( ) σ M 1 ( ) hidrogénmolekula kötő pályája (M) 1s A 1 ( ) hidrogén atompályája
32 Az N 2 5 M-jának származtatása 2*(2+5) elektron összesen 7 betöltött M σ x * Memo.: 3 lazító pálya üres azaz hármas kötés van N N 2p x π z * π y * 2p x 2p z σ x 2p z 2p y π z 2p y π y 2s σ* σ z 2s y x
33 Az N 2 összes M-jának származtatása RF/3-21G szinten számított értékek artree-ban Memo: csak az egyik N atom A-i vannak felrajzolva ( ) ( ) π z * σ x * π y * 2p y 2p z 2p x ( ) ( ) π z σ x π y ( ) 3-szorosan degenerált ( ) σ* 2s ( ) ( ) σ 1s ( ) ( ) ( ) zárthéj Ahogy a N atom 3 db p-pályája, úgy az N 2 molekula mindkét π-pályája degenerált. A kétatomos molekula betöltött M-i rendre alacsonyabb energiájúak mint a megfelelő A-k. Ezért stabil az N 2.
34 EPS töltés Kétatomos homonukleáris molekulák pl. (N 2 )14 elektron 7 betöltött M µ= 0 Debye degenerált M-k LUM M σ x * M 10 π z * M 9 π y * M 8 σ x M 7 π z M 6 π y M 5 σ* M 4 σ M 3 M 2 M 1 zárt héjak
35 Az F 2 7 M-jának származtatása 2*(2+7) elektron összesen 9 betöltött M σ x * Memo.: 1 lazító pálya üres azaz 1-es kötés van F F 2p x π z * π y * 2p x 2p z σ x 2p z 2p y π z 2p y degenerált A-k 2s π y σ* σ z 2s y x
36 EPS töltés degenerált M-k LUM Kétatomos homonukleáris molekulák pl. (F 2 )18 elektron 9 betöltött M µ= 0 Debye M σ x * M 10 π z * M 9 π y * M 8 σ x M 7 π z M 6 π y M 5 σ* M 4 σ M 3 M 2 M 1 zárt héjak
37 Multiplicitás (Atkins 235) memo: csak a kétatomos molekulák megfelelő M-i vannak feltüntetve π z * σ x * π y * B 2 σ x 1 Σ (szingulett) π z π y párosítatlan e. száma =0 π z * σ x * π z σ x π y * 2 (pl. desztil. grafit gáz halmazállapotú szén) π z * σ x * 1 Σ (szingulett) π y π z σ x π y * π z * σ x * π y * dupla gerjeszt. π y 3 Σ (triplett 3=2(½+½)+1) memo: ezt kiegészíti az a szingulett, amikor az egyik π e. spinje átfordul N 2 π z * σ x * π y * π z σ x 1 Σ (szingulett) π y dupla gerjeszt. π z σ x π y 5 Σ (quintuplett) 5=2(4*½) +1 memo:2s+1 ahol S a párosítatlan e. száma * ½
38 Multiplicitás (Atkins 235) Memo: - csak a megfelelő M-k vannak felrajzolva (az A-k nem). - 2 és F 2 esetén a π y,z és σ x M-k sorrendje felcserélődik. 2 (labilis tehát reaktiv) π z * σ x * π y * π z * σ x * π y * π z σx π y alacsony energ. gerjeszt. π z σx π y 3 Σ (triplett) 2(2*½)+1) und-szab szerint. π z * σ x * π y * 1 Σ (szingulett) σ x * π z * π y * π z σx π y 1 Σ (szingulett) F 2 (labilis, szétszakad és így reaktív) π z σx π y 1 Σ (szingulett) Ne 2 nincs amitől együtt maradjon két Ne atom (ugyanannyi kötő mint ahány lazító M) de: Ne gáz cseppfolyósítható (fp = 246 o ) (lop egy kevés elektront a szomszédtól) Ne 4 analógja, VDW (hidrofób-hidrofób) kcs. fehérje fold.
39 Az oxigén speciális reaktivitása (élet és halál) A kétatomos oxigén nyílt héjú molekula, amely triplett állapotú és így reaktívabb mint zárthéjú N 2 (N 2 / 2 :78/21) memo: - az oxigén az egy kettős gyök avagy diradikál - oxigén úgy is reaktív hogy nem szakad ketté, mint az F 2 élet (oxigén transzport) 2 2 N N 0.4Å N N N Fe 2+ N N is N is = Fe 2+ Memo: az oxigén bekötése szerkezeti átrendeződést indukál 2 behúzza a is-t, ami elmozdítja az α-helixet, ami további átrendeződéseket indukál. (Strayer 270 )
40 A fő gond tehát a szabadgyökök képződése A bruttó egyenlet: A részletek: 2 + 4e e e 2 oxigén molekula 2 szuperoxid anion hidrogén peroxid gyök hidrogén peroxid anion hidrogén peroxid e hidrogén peroxid hidroxid gyök e különösen reaktív ágens hidroxid gyök hidroxid anion víz
41 kérdés: válasz: hol rombolnak a szabadgyökök? például a membránban pl. tipikus telítetlen zsírsavrészlet: + 2 különösen reaktív gyökök (a szuperoxid anion és a hidrogénperoxid gyökök) károsítják a membránt σ x * σ x * π z * π y * π z * π y * π z π y π z π y σx 2. hidrogénperoxid gyök 1 Σ (doublett) valódi gyök és igen reaktív σx 2 szuperoxid anion 1 Σ (doublett) valódi gyök és igen reaktív
42 kérdés: kivédhető-e a rombolás? válasz: igen pl. - és E-vitaminnal E-vitamin megvalósulás: egy redoxi ciklus 2 2 vicinális diol dupla enol L-aszkorbinsav NAD - -ból redukélt forma oxidált forma nagy szerencse hogy az oxidáció gyökös mechanizmussal, de a redukció ionos mechanizmussal megy. Tehát egy NAD - molekula két gyököt iktat ki.
43 Kétatomos heteronukleáris molekulák (F) 10 elektron 5 betöltött M µ= Debye M 6 LUM ( ) M 5 M ( ) EPS töltés M 4 ( ) Degenerált M-k M 3 ( ) M 2 ( ) M 1 ( ) zárt héj
44 A összes M-ja (vö. N 2 M-val) RF/3-21G szinten számított értékek artree-ban N 2 ( ) σ x * ( ) ( ) π z * π y * ( ) ( ) σ x ( ) ( ) π z π y ( ) ( ) σ* ( ) ( ) σ ( ) ( ) ( ) zárthéj ( ) ( ) N N memo: a σ, σ* és a σ x alkotják mindkét molekulában a szigmakötés és a két nemkötő e.pár megfelelőit (kanonikus pályák lokalizált pályák)
45 Metán ( 4 ) 10 elektron 5 betöltött M µ= 0 Debye E(RF/3-21G)= artree M 6 LUM ( ) M 5 M ( ) EPS töltés M 4 ( ) Degenerált M-k M 3 ( ) M 2 ( ) M 1 ( ) zárt héj
46 Az elektronrendszer többféle felosztása molekulapályákra: - az elektronpárok mindegyike a molekulát alkotó összes mag erőterében oszlik el más-más szimmetria szerint: ez a kanonikus leírás. - egy-egy elektronpárt nagyjából két-két szomszédos mag erőterébe lokalizálunk: ez a lokalizált leírás. közös a két leírásban: - a molekula összenergiájának és összelektronsűrűségének értéke. eltérő a két leírásban: - a lokalizált leírás során nyert M-khoz nem tartozik pályaenergiaérték.
47 ibridizáció idealizált sémák súlyozás nélkül y sp s+p x (p y,p z hibridizálatlan) z x + + sp 2 s+p x +p y (p z hibridizálatlan) sp 3 s+p x +p y +p z (minden A hibridizált) [ ]
48
49 Telítetlen molekulák: σ-váz és π-elektronrendszer Vannak koordinative telítetlen szénatomokat (sp 2, sp) is tartalmazó molekulák, amelyekben lévő ilyen molekularészek alapállapotban síkalkatúak. Ilyenkor az elektronok feloszthatók a σ-váz elektronjaira és π-elektronrendszer részét képezőekre. (Az előzőek tipikusan atompárokra lokalizált M-k, míg az utóbbiak a delokalizált π-molekulapályákat építik fel. A π-molekulapályák energiája nagyobb mint a σ-váz kanonikus M-jainak energiája.) A π-elektronok kisebb magvonzás alatt vannak mint a σ-váz elektronjai ezért a kémiai reakciók és a spektroszkópiai események céltáblái. A-k Az eténmolekula lazító π-pályája (π*) M-k Az etén sp 2 szenének p z - atompálya Az eténmolekula kötő π-pályája (π)
50 TD ρ= a.u. Etén ( 2 4 ) 12+4=16 elektron 8 betöltött M µ= 0 Debye EPS töltés E(RF/3-21G)= artree π2* M 9 ( ) (LUM) π1 M 8 ( ) (M) TD:=total electron density (ρ)
51 Etin ( 2 2 ) 12+2=14 elektron 7 betöltött M µ= 0 Debye E(RF/3-21G)= artree EPS töltés π4* M 9 ( ) Degenerált M-k π3* M 8 ( ) (LUM) π2 π1 M 7 ( ) (M) M 8 ( ) Degenerált M-k
52 Butadién ( 4 6 ) 24+6=30 elektron 15 betöltött M (Bruckner I/1 161) µ= 0 Debye TD ρ= a.u. EPS töltés E(RF/3-21G)= artree π4* M 17 ( ) π3* M 16 ( ) (LUM) π2 M 15 ( ) (M) π1 M 14 ( )
53 Butadién nagy bázison? E(RF/ Gd,p)= artree Érdekes hogy a bázishatás miatt a LUM és LUM+1 orbitálok teljesen eltérnek a várt kvalitatív képtől. (Diffúz függvények [+ +] nem kell! ) M21 olyan szimmetriájú mint a várt LUM ám itt is eltérőek a koefficiensek. M26 olyan szimmetriájú mint a várt LUM+1 ám itt is eltérőek a koefficiensek M 26 M 17 M 21 π4* π3* M 16 (LUM) π2 π1 M 15 (M) M 14
54 Az allil-rendszerek elektronszerkezete propén /2 1/2 1/2 1/2 1/2 1/ allil kation allil gyök allil anion memo: 2 2 Virtuális p-pálya M M 13 lazító M 12 nemkötő M 11 kötő M 11
55 Benzol (aromás) August Wilhelm Kekulé (1866) Geometriai adatok: mikrohullámú spektroszkópiai adatok memo: Â = 1.34Â 1.39Â 1.09Â 120 o A benzol planáris és aromás összesen 6 delokalizált π-elektronnal. Az aromacitás egyik feltétele a (4n+2) delokalizált π-elektron. 1 db. Kekulé szerkezet Elektronszerkezet: (memo: ogyan rajzoljunk rezonancia hibridet: σ-kötés érintetlen marad π-kötés alternál) Apoláris határszerkezetek: Kekulé-féle képletek (1865) Robinson-féle képlet (1925)
56 Benzol (Bruckner II/1 48) µ= 0 Debye EPS töltés Mulliken töltés E(RF/ G(d,p)) = artree M 20 M 21 (M) M-k izofelülete = 0.02 degenerált M-k φ4 M 17 φ2 φ3 φ1
57 Benzol ( 6 6 ) 36+6=42 elektron 21 M E(RF/3-21G) = artree Virtuális molekulapályák M 29 ( ) φ6 M 22 ( ) M 23 ( ) φ4 φ5 M 21 ( ) M 20 ( ) φ2 φ3 M 17 ( ) φ1 Betöltött molekulapályák M energia
58 Aromaticitás A benzol és a belőle levezethető vegyületek különleges fizikai és kémiai tulajdonságainak együttese. 1) erős telítetlenség, Sir Robert Robinson 2) az erős telítetlenség ellenére, a nyíltláncú hexatriéntől eltérően addíciós reakcióra (telítődésre) kevéssé hajlamos, 3) szubsztitúciós reakciók készségesen lejátszódnak érintetlenül hagyva a benzol aromás elektronrendszerét, 4) képződéshője jóval nagyobb, égéshője jóval kisebb mint a Kekulé-képlet alapján számolt érték, 5) a három π-kötés nem egymástól független, hanem egy egységes π-elektrorendszer (π-szextett) [Sir R. Robinson], 6) a 6 π-elektron delokalizációja miatt az aromás gyűrűn diamágneses köráram indukálódik, 7) a ückel-szabály szerint azok a síkalkatú, egygyűrűs, folytonosan konjugált kötésrendszerű vegyületek aromásak amelyben a π-elektronok száma 4n+2.
59 kérdés: hogyan lehet az aromás rendszerekre jellemzőπ-elektrondelokalizációt kimutatni? válasz: 1 -NMR spektroszkópiával, az árnyékolási tényező figyelembevételével memo árnyékolás: az atommag körül mozgó elektronok a külső mágneses teret módosító hatása,(oldatban, a mol. gyors reorientálódása miatt a külső B 0 tér irányától független) kevés σ-elektr. kis árnyékolás, sok σ-elektr. nagy árnyékolás 3 pl. aldehhid alkán kérdés: miért van viszonylag alacsony mágneses térerőnél a benzol -jele, ha van sok π-elektron körülötte? megfigyelés: a spektrum egyetlen (hasítatlan) rezonanciafrekvencia, (egyetlen fajta kémiaikörnyezetben van mind a 6 hidrogénatom) válasz: a π-elektron szextett indukálta mágneses tér miatt magyarázat: a benzol -jai úgy helyezkednek el, hogy ott a π-elektronok okozta indukált mágneses tér hatására azok csökkenő árnyékolást éreznek kevés σ-elektr. ~10 ppm sok σ-elektr. ~1 ppm csökkenő árnyékolás 1 -NMR 3 növekvő árnyékolás Si TMS δ(ppm) indukált mágneses tér árnyékolatlan proton köráram 3 3
60 iklopropénium kation [ 3 3 ] + Mulliken töltések 18+3=21-1=20 elektron 10 betöltött M a legkisebb aromás rendszer a (4n+2) szabállyal összhangban, mivel itt n=0 ezért összesen 2 delokalizált π-elektron van a hidrogéneken E(RF/3-21G)= artree Elektronszerkezet: (memo: ogyan rajzoljunk rezonancia hibridet: σ-kötés érintetlen marad π-kötés alternál) Poláris határszerkezetek EPS töltés π2* M 11 (LUM) π1 M 10 (M)
61 iklopentadienid anion ( 5 5 ) (aromás) Aromacitás: (4n+2) szabállyal összhangban, mivel itt n=1 ezért összesen 6 delokalizált π-elektron van. Geometriai adatok: mikrohullámú spektroszkópiai adatok A molekula síkalkatú 1.41Â 108 o Elektronszerkezet: (memo: ogyan rajzoljunk rezonancia hibridet: σ-kötés érintetlen marad π-kötés alternál) Poláris határszerkezetek
62 iklopentadienid anion ( 5 5 ) =36 elektron 18 M Mulliken töltés E(RF/3-21G) = artree EPS töltés minden hidrogénen -0.3 minden szénen φ6 Virtuális molekulapályák M 20 (0.4798) M 19 (0.4798) φ4 φ5 M 18 ( ) M 17 ( ) φ2 φ3 M 16 ( ) φ1 Betöltött molekulapályák
63 Poláris határszerkezetek A molekula síkalkatú Elektronszerkezet: (memo: ogyan rajzoljunk rezonancia hibridet: σ-kötés érintetlen marad π-kötés alternál) 129 o 1.38Â Geometriai adatok: mikrohullámú spektroszkópiai adatok iklohepta -1,3,5- trienilium (tropilium) kation ( ) (aromás)
64 iklohepta -1,3,5- trienilium (tropilium) kation ( ) Mulliken töltés (aromás) =48 elektron 24 M minden hidrogénen minden szénen E(RF/3-21G) = artree φ6 Virtuális molekulapályák EPS töltés φ4 φ5 M 23 M 24 φ2 φ3 M 20 φ1 Betöltött molekulapályák
65 Elektronszerkezet: Rezonancia hibrid Apoláris határszerkezetek iklodeka-1,3,5,7,9-pentaén (aromás, nem aromás?) (4n+2, n=2) (Poláris határszerkezetekre nincs szükség) Ez 2 db.
66 iklodeka-1,3,5,7,9-pentaén Geometriai adatok:!! alternáló kötéshosszak!! (aromás, nem aromás?) Mono-transz cisz forma E(RF/3-21Gd) = artree 1.48±0.01Â all -cisz forma 1.41Â E(RF/3-21Gd) = artree memo: Â = 1.34Â a 1.39Â benzol 144 o 1.37Â A molekula planáris hogy a körkörös π-kötés kialakuljon, de emiatt nagy lesz a szögfeszültség (144 o ). Di-transz cisz forma E(RF/3-21Gd) = artree 1.33Â 1.48±0.01Â A molekula nem planáris 121±4 o 1.33Â A molekula nem planáris
67 iklodeka-1,3,5,7,9-pentaén EPS töltés all -cis forma Nincs lyuk a közepén! E(RF/3-21Gd) = artree φ3 φ4 M 34 ( ) M 35 ( ) (M) φ2 φ3 M 32 ( ) M 33( ) φ1 M 27 ( )
68 [N]Annulének N=(4n+2) vagy ückel szabály Annulének = monociklusos telítetlen szénhidrogének, amelyek alternáló egyes és kettes kötések segítségével írhatók le. Ezek egy része aromás molekula. kérdés: melyik annulén aromás? A [4]annulén, [8]annulén, [12]annulén, [16]annulén, [20]annulén, stb. a ückel szabály szerint nemaromás ciklooktatetraén ciklododekahexaén ciklohexadekaoktaén B semleges töltött n=0 [2]annulén= etén (nem gyűrűs) ciklopropenilium kation (igen) n=1 [6]annulén = benzol (igen) ciklopentadienid anion (igen) cikloheptatrienilium kation (igen) n=2 [10]annulén = ciklodekapentaén (nem) n=3 [14]annulén = ciklotetradekahexaén (igen) n=4 [18]annulén = ciklooktadekanonén (igen) ciklodekapentaén ciklotetradekaheptaén ciklooktadekanonaén Naftalin, antracén, fenantrén stb. nem monociklusos molekulák, s így ückel-szerint nem aromásak, egy sor más kritérium teljesülése miatt ezek a molekulák mégis aromás rendszert alkotnak.
69 Aromás, nemaromás és antiaromás A molekula akkor aromás ha : 1. ciklusos kvázi planáris szerkezet, adott számú π-elektronnal, 2. minden gyűrűs atomnak kell hogy legyen egy hibridizálatlan p-pályája, 3. a p-pályák át kell hogy fedjenek folytonos és körkörös rendszert adva, 4. a π-elektronok delokalizálódása energiacsökkenéssel kell járjon. Aromás rendszerek esetében a gyűrűs forma a stabilabb mint az izoelektronos nyíltláncú rendszer kcal/mol Benzene 2 benzol stabilabb 2 exa-1,3,5-triene hexa-1,3,5-trién labilisabb RF/3-21G A molekula antiaromás ha: Teljesül de, 4. A π-elektronok delokalizálódása energianövekedéssel jár. 2 + yclobutadiene ciklobutadién antiaromás labilisabb -100 kcal/mol 2 2 Buta-1,3-diene buta-1,3-dién stabilabb , RF/3-21G A molekula nemaromás ha: a 3. pont nem teljesül. 2 + yclohexa-1,3-diene ciklohexa-1,3-dién -19 kcal/mol 3 3 exa-2,4-diene hexa-2,4-dién összemérhetõ a két molekula stabilitása RF/3-21G
70 Aromás, nemaromás vagy antiaromás a ciklookta-1,3,5,7-tetraén? 2 + yclooctatetraene ciklooktatetraén melyik a stabilabb? 2 2 cta-1,3,5,7-tetraene okta-1,3,5,7-tetraén 1. A ciklusos, kvázi planáris molekula 8π-elektronnal rendelkezik. { } A síkalkatú szerkezet a gyűrűfeszülés miatt kritikuspont, de nem minimum. 2. A 8 gyűrűs atom mindegyikének van hibridizálatlan p-pályája. 3. A p-pályák átfednek egy folytonos és körkörös rendszert alkotva. 4. A π-elektronok delokalizálódása energiacsökkenéssel kell járjon. Add 1) A nyíltláncú all-cisz okta-1,3,5,7-tetraén sem planáris. RF/3-21G 2 + ciklooktatetraén okta-1,3,5,7-tetraén Tehát 81.4 kcal/mol-lal stabilabb a nyíltláncú molekula így az [8]annulén antiaromás jellegű.
71 Miért éppen a (4n+2) az aromás és miért pont a (4n) rendszer az antiaromás? A poligon-szabály Kérdés: eldönthető-e az előző vagy más hasonló kérdés kvalitatív szinten, számítások nélkül? Lazító pályák nemkötő pálya n db. π elektron kötő pályák 4π elektron 2 nemkötő pálya 1 kötő pálya 6π elektron 0 nemkötő pálya 3 kötő pálya 8π elektron 2 nemkötő pálya 3 kötő pálya ciklobuta-1,3-dién antiaromás ciklohexa-1,3,5-trién aromás ciklookta-1,3,5,7-tetraén antiaromás ciklobutadién benzol ciklooktatetraén
72 Összefoglaló A) 2π elektron és aromás ciklopropénil kation B) 4π elektron és antiaromás ciklopropenid anion ciklobutadién ciklopentadienium kation ) 6π elektron és aromás Robinson féle jelölés ciklopentadienid anion benzol cikloheptatrienilium kation (tropilium ion) N N pirrol furán piridin
73 D) 8π elektron és antiaromás cikloheptatrienid anion ciklooktatetraén pentalén bár nem annulén E) 10 π elektron és aromás (bár nem annulén) N naftalin azulén indol
A kémiai kötés A klasszikus alapokon nyugvóelektronoktett- elmélet
 A kémiai kötés A klasszikus alapokon nyugvóelektronoktett- elmélet Az atomok többsége a nemesgázok kivétel a Földön instabil. Vegyületeket képeznek úgy, hogy nyílt héjuk lezárttá (nemesgáz elektronkonfigurációjúvá)
A kémiai kötés A klasszikus alapokon nyugvóelektronoktett- elmélet Az atomok többsége a nemesgázok kivétel a Földön instabil. Vegyületeket képeznek úgy, hogy nyílt héjuk lezárttá (nemesgáz elektronkonfigurációjúvá)
A kémiai kötés A klasszikus alapokon nyugvóelektronoktett- elmélet
 A kémiai kötés A klasszikus alapokon nyugvóelektronoktett- elmélet Az atomok többsége a nemesgázok kivétel a Földön instabil. Vegyületeket képeznek úgy, hogy nyílt héjuk lezárttá (nemesgáz elektronkonfigurációjúvá)
A kémiai kötés A klasszikus alapokon nyugvóelektronoktett- elmélet Az atomok többsége a nemesgázok kivétel a Földön instabil. Vegyületeket képeznek úgy, hogy nyílt héjuk lezárttá (nemesgáz elektronkonfigurációjúvá)
A hidrogénmolekula. Energia
 A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Toluol (Bruckner II/1 476) µ= 0.33 Debye
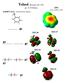 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
A hidrogénmolekula. Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve!
 Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
FELADATMEGOLDÁS. Tesztfeladat: Válaszd ki a helyes megoldást!
 FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
ORVOSI KÉMIA. Az anyag szerkezete
 ORVOSI KÉMIA Az anyag szerkezete Nagy Veronika PTE ÁOK 2017/18. Egyes ábrákat a Chemistry c. (McMurry & Fay, 4 th ed.) könyvből vettünk át. Tanulási célok Az anyagot felépítő elemi részecskék (atomok,
ORVOSI KÉMIA Az anyag szerkezete Nagy Veronika PTE ÁOK 2017/18. Egyes ábrákat a Chemistry c. (McMurry & Fay, 4 th ed.) könyvből vettünk át. Tanulási célok Az anyagot felépítő elemi részecskék (atomok,
Periódusos rendszer (Mengyelejev, 1869) nemesgáz csoport: zárt héj, extra stabil
 s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
Kémiai alapismeretek 3. hét
 Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Fizikai kémia 2. Előzmények. A Lewis-féle kötéselmélet A VB- és az MO-elmélet, a H 2+ molekulaion
 06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Az anyagszerkezet alapjai
 Kérdések Az anyagszerkezet alapjai Az atomok felépítése Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Kérdések Az anyagszerkezet alapjai Az atomok felépítése Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai. Az atomok felépítése
 Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Szalai István. ELTE Kémiai Intézet 1/74
 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Molekulák világa 1. kémiai szeminárium
 GoBack Molekulák világa 1. kémiai szeminárium Szilágyi András 2008. október 6. Molekulák világa 1. kémiai szeminárium Molekuláris bionika szak I. év 1 Kvantummechanika Klasszikus fizika eszközei tömegpont
GoBack Molekulák világa 1. kémiai szeminárium Szilágyi András 2008. október 6. Molekulák világa 1. kémiai szeminárium Molekuláris bionika szak I. év 1 Kvantummechanika Klasszikus fizika eszközei tömegpont
Molekulák világa 2. kémiai szeminárium. Szilágyi András
 Molekulák világa 2. kémiai szeminárium Szilágyi András Kvantummechanikai ismétlés Kvantummechanikai részecskéről csak valószínűségi állítást tehetünk A részecske leírója a hullámfüggvény, ez kódolja a
Molekulák világa 2. kémiai szeminárium Szilágyi András Kvantummechanikai ismétlés Kvantummechanikai részecskéről csak valószínűségi állítást tehetünk A részecske leírója a hullámfüggvény, ez kódolja a
Az anyagszerkezet alapjai. Az atomok felépítése
 Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Az anyagszerkezet alapjai Az atomok felépítése Kérdések Mik az építőelemek? Milyen elvek szerint épül fel az anyag? Milyen szintjei vannak a struktúrának? Van-e végső, legkisebb építőelem? A legkisebbeknél
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Atomfizika. A hidrogén lámpa színképei. Elektronok H atom. Fényképlemez. emisszió H 2. gáz
 Atomfizika A hidrogén lámpa színképei - Elektronok H atom emisszió Fényképlemez V + H 2 gáz Az atom és kvantumfizika fejlődésének fontos szakasza volt a hidrogén lámpa színképeinek leírása, és a vonalas
Atomfizika A hidrogén lámpa színképei - Elektronok H atom emisszió Fényképlemez V + H 2 gáz Az atom és kvantumfizika fejlődésének fontos szakasza volt a hidrogén lámpa színképeinek leírása, és a vonalas
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
tema04_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
Kémiai alapismeretek 2. hét
 Kémiai alapismeretek 2. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2014. szeptember 9.-12. 1/13 2014/2015 I. félév, Horváth Attila c Hullámtermészet:
Kémiai alapismeretek 2. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2014. szeptember 9.-12. 1/13 2014/2015 I. félév, Horváth Attila c Hullámtermészet:
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Atommodellek de Broglie hullámhossz Davisson-Germer-kísérlet
 Atommodellek de Broglie hullámhossz Davisson-Germer-kísérlet Utolsó módosítás: 2016. május 4. 1 Előzmények Az atomok színképe (1) A fehér fény komponensekre bontható: http://en.wikipedia.org/wiki/spectrum
Atommodellek de Broglie hullámhossz Davisson-Germer-kísérlet Utolsó módosítás: 2016. május 4. 1 Előzmények Az atomok színképe (1) A fehér fény komponensekre bontható: http://en.wikipedia.org/wiki/spectrum
Thomson-modell (puding-modell)
 Atommodellek Thomson-modell (puding-modell) A XX. század elejére világossá vált, hogy az atomban található elektronok ugyanazok, mint a katódsugárzás részecskéi. Magyarázatra várt azonban, hogy mi tartja
Atommodellek Thomson-modell (puding-modell) A XX. század elejére világossá vált, hogy az atomban található elektronok ugyanazok, mint a katódsugárzás részecskéi. Magyarázatra várt azonban, hogy mi tartja
20/10/2016 tema04_biolf_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
AZ ATOM. Atom: atommag + elektronfelhő = proton, neutron, elektron. Elemi részecskék
 AZ ATOM Atom: atommag + elektronfelhő = proton, neutron, elektron Elemi részecskék Atomok Dalton elmélete (1805): John DALTON 1766-1844 1. Az elemek apró részecskékből, atomokból állnak. Atom: görög szó
AZ ATOM Atom: atommag + elektronfelhő = proton, neutron, elektron Elemi részecskék Atomok Dalton elmélete (1805): John DALTON 1766-1844 1. Az elemek apró részecskékből, atomokból állnak. Atom: görög szó
2015/16/1 Kvantummechanika B 2.ZH
 2015/16/1 Kvantummechanika B 2.ZH 2015. december 10. Információk 0. A ZH ideje minimum 90 perc, maximum 180 perc. 1. Az összesen elérhet pontszám 270 pont. 2. A jeles érdemjegy eléréséhez nem szükséges
2015/16/1 Kvantummechanika B 2.ZH 2015. december 10. Információk 0. A ZH ideje minimum 90 perc, maximum 180 perc. 1. Az összesen elérhet pontszám 270 pont. 2. A jeles érdemjegy eléréséhez nem szükséges
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Átmenetifém-komplexek mágneses momentuma
 Átmenetifém-komplexek mágneses momentuma Csakspin-momentum μ g e S(S 1) μ B μ n(n 2) μ B A komplexek mágneses momentuma többnyire közel van ahhoz a csakspin-momentum értékhez, ami az adott elektronkonfigurációjú
Átmenetifém-komplexek mágneses momentuma Csakspin-momentum μ g e S(S 1) μ B μ n(n 2) μ B A komplexek mágneses momentuma többnyire közel van ahhoz a csakspin-momentum értékhez, ami az adott elektronkonfigurációjú
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai. Kémiai kötés kialakulásának oka: energianyereség.
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett elmélet (1916-19
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett elmélet (1916-19
Szilárdtestek el e ek e tr t o r n o s n zer e k r ez e et e e t
 Szilárdtestek elektronszerkezete Kvantummechanikai leírás Ismétlés: Schrödinger egyenlet, hullámfüggvény, hidrogén-atom, spin, Pauli-elv, periódusos rendszer 2 Szilárdtestek egyelektron-modellje a magok
Szilárdtestek elektronszerkezete Kvantummechanikai leírás Ismétlés: Schrödinger egyenlet, hullámfüggvény, hidrogén-atom, spin, Pauli-elv, periódusos rendszer 2 Szilárdtestek egyelektron-modellje a magok
Modern Fizika Labor. Fizika BSc. Értékelés: A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n. 2008. április 29.
 Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Átmenetifém-komplexek ESR-spektrumának jellemzıi
 Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Általános és szervetlen kémia 3. hét. Kémiai kötések. Kötések kialakítása - oktett elmélet. Az elızı órán elsajátítottuk, hogy.
 Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
Atomok és molekulák elektronszerkezete
 Atomok és molekulák elektronszerkezete Szabad atomok és molekulák Schrödinger egyenlete Tekintsünk egy kvantummechanikai rendszert amely N n magból és N e elektronból áll. Koordinátáikat jelölje rendre
Atomok és molekulák elektronszerkezete Szabad atomok és molekulák Schrödinger egyenlete Tekintsünk egy kvantummechanikai rendszert amely N n magból és N e elektronból áll. Koordinátáikat jelölje rendre
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK
 ÓBUDAI EGYETEM ANYAGTUDOMÁNYI SZEMINÁRIUMOK, 2014. MÁJUS 12. PEKKER SÁNDOR MTA WIGNER SZFI KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK
ÓBUDAI EGYETEM ANYAGTUDOMÁNYI SZEMINÁRIUMOK, 2014. MÁJUS 12. PEKKER SÁNDOR MTA WIGNER SZFI KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK
AZ ELEKTRON MÁGNESES MOMENTUMA. H mágneses erœtérben az m mágneses dipólmomentummal jellemzett testre M = m H forgatónyomaték hat.
 AZ ELEKTRON MÁGNESES MOMENTUMA Mágneses dipólmomentum: m H mágneses erœtérben az m mágneses dipólmomentummal jellemzett testre M = m H forgatónyomaték hat. M = m H sinϕ (Elektromos töltés, q: monopólus
AZ ELEKTRON MÁGNESES MOMENTUMA Mágneses dipólmomentum: m H mágneses erœtérben az m mágneses dipólmomentummal jellemzett testre M = m H forgatónyomaték hat. M = m H sinϕ (Elektromos töltés, q: monopólus
Mágneses módszerek a mőszeres analitikában
 Mágneses módszerek a mőszeres analitikában NMR, ESR: mágneses momentummal rendelkezı anyagok minıségi és mennyiségi meghatározására alkalmas analitikai módszer Atommag spin állapotok közötti energiaátmenetek:
Mágneses módszerek a mőszeres analitikában NMR, ESR: mágneses momentummal rendelkezı anyagok minıségi és mennyiségi meghatározására alkalmas analitikai módszer Atommag spin állapotok közötti energiaátmenetek:
Mágneses módszerek a műszeres analitikában
 Mágneses módszerek a műszeres analitikában NMR, ESR: mágneses momentummal rendelkező anyagok minőségi és mennyiségi meghatározására alkalmas Atommag spin állapotok közötti energiaátmenetek: NMR (magmágneses
Mágneses módszerek a műszeres analitikában NMR, ESR: mágneses momentummal rendelkező anyagok minőségi és mennyiségi meghatározására alkalmas Atommag spin állapotok közötti energiaátmenetek: NMR (magmágneses
Kvantummechanika gyakorlat Beadandó feladatsor Határid : 4. heti gyakorlatok eleje
 Kvantummechanika gyakorlat 015 1. Beadandó feladatsor Határid : 4. heti gyakorlatok eleje 1. Mutassuk meg, hogy A és B tetsz leges operátorokra igaz, hogy e B A e B = A + [B, A] + 1![ B, [B, A] ] +....
Kvantummechanika gyakorlat 015 1. Beadandó feladatsor Határid : 4. heti gyakorlatok eleje 1. Mutassuk meg, hogy A és B tetsz leges operátorokra igaz, hogy e B A e B = A + [B, A] + 1![ B, [B, A] ] +....
A SZILÁRDTEST FOGALMA. Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. molekula klaszter szilárdtest > σ λ : rel.
 A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
ELEMI RÉSZECSKÉK ATOMMODELLEK
 ELEMI RÉSZECSKÉK ATOMMODELLEK Az atomok felépítése Készítette: Horváthné Vlasics Zsuzsanna Mi van az atomok belsejében? DÉMOKRITOSZ (Kr.e. 460-370) az anyag nem folytonos parányi, tovább nem bontható,
ELEMI RÉSZECSKÉK ATOMMODELLEK Az atomok felépítése Készítette: Horváthné Vlasics Zsuzsanna Mi van az atomok belsejében? DÉMOKRITOSZ (Kr.e. 460-370) az anyag nem folytonos parányi, tovább nem bontható,
 http://www.nature.com 1) Magerő-sugár: a magközéppontból mért távolság, ameddig a magerők hatótávolsága terjed. Rutherford-szórásból határozható meg. R=1,4 x 10-13 A 1/3 cm Az atommag terének potenciálja
http://www.nature.com 1) Magerő-sugár: a magközéppontból mért távolság, ameddig a magerők hatótávolsága terjed. Rutherford-szórásból határozható meg. R=1,4 x 10-13 A 1/3 cm Az atommag terének potenciálja
Atomfizika. Fizika kurzus Dr. Seres István
 Atomfizika Fizika kurzus Dr. Seres István Történeti áttekintés J.J. Thomson (1897) Katódsugárcsővel végzett kísérleteket az elektron fajlagos töltésének (e/m) meghatározására. A katódsugarat alkotó részecskét
Atomfizika Fizika kurzus Dr. Seres István Történeti áttekintés J.J. Thomson (1897) Katódsugárcsővel végzett kísérleteket az elektron fajlagos töltésének (e/m) meghatározására. A katódsugarat alkotó részecskét
Elektronok, atomok. Általános Kémia - Elektronok, Atomok. Dia 1/61
 Elektronok, atomok 2-1 Elektromágneses sugárzás 2-2 Atomi Spektrum 2-3 Kvantumelmélet 2-4 A Bohr Atom 2-5 Az új Kvantummechanika 2-6 Hullámmechanika 2-7 Kvantumszámok Dia 1/61 Tartalom 2-8 Elektronsűrűség
Elektronok, atomok 2-1 Elektromágneses sugárzás 2-2 Atomi Spektrum 2-3 Kvantumelmélet 2-4 A Bohr Atom 2-5 Az új Kvantummechanika 2-6 Hullámmechanika 2-7 Kvantumszámok Dia 1/61 Tartalom 2-8 Elektronsűrűség
2, = 5221 K (7.2)
 7. Gyakorlat 4A-7 Az emberi szem kb. 555 nm hullámhossznál a Iegnagyobb érzékenységű. Adjuk meg annak a fekete testnek a hőmérsékletét, amely sugárzásának a spektrális teljesitménye ezen a hullámhosszon
7. Gyakorlat 4A-7 Az emberi szem kb. 555 nm hullámhossznál a Iegnagyobb érzékenységű. Adjuk meg annak a fekete testnek a hőmérsékletét, amely sugárzásának a spektrális teljesitménye ezen a hullámhosszon
Periciklusos reakciók
 Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Mit tanultunk kémiából?2.
 Mit tanultunk kémiából?2. Az anyagok rendkívül kicsi kémiai részecskékből épülnek fel. Több milliárd részecske Mól az anyagmennyiség mértékegysége. 1 mol atom= 6. 10 23 db atom 600.000.000.000.000.000.000.000
Mit tanultunk kémiából?2. Az anyagok rendkívül kicsi kémiai részecskékből épülnek fel. Több milliárd részecske Mól az anyagmennyiség mértékegysége. 1 mol atom= 6. 10 23 db atom 600.000.000.000.000.000.000.000
A spin. November 28, 2006
 A spin November 28, 2006 1 A spin a kvantummechanikában Az elektronnak és sok más kvantummechanikai részecskének is van egy saját impulzusnyomatéka amely független a mozgásállapottól. (Úgy is mondhatjuk,
A spin November 28, 2006 1 A spin a kvantummechanikában Az elektronnak és sok más kvantummechanikai részecskének is van egy saját impulzusnyomatéka amely független a mozgásállapottól. (Úgy is mondhatjuk,
Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia?
 Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia? Prof. Túri László (ELTE, Kémiai Intézet) turi@chem.elte.hu 2012. november 19. Szent László Gimnázium Önképzőkör 1 Kapcsolódási pontok
Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia? Prof. Túri László (ELTE, Kémiai Intézet) turi@chem.elte.hu 2012. november 19. Szent László Gimnázium Önképzőkör 1 Kapcsolódási pontok
dinamikai tulajdonságai
 Szilárdtest rácsok statikus és dinamikai tulajdonságai Szilárdtestek osztályozása kötéstípusok szerint Kötések eredete: elektronszerkezet k t ionok (atomtörzsek) tö Coulomb- elektronok kölcsönhatás lokalizáltak
Szilárdtest rácsok statikus és dinamikai tulajdonságai Szilárdtestek osztályozása kötéstípusok szerint Kötések eredete: elektronszerkezet k t ionok (atomtörzsek) tö Coulomb- elektronok kölcsönhatás lokalizáltak
Atommodellek. Az atom szerkezete. Atommodellek. Atommodellek. Atommodellek, A Rutherford-kísérlet. Atommodellek
 Démokritosz: a világot homogén szubsztanciájú oszthatatlan részecskék, atomok és a közöttük lévı őr alkotja. Az atom szerkezete Egy atommodellt akkor fogadunk el érvényesnek, ha megmagyarázza a tapasztalati
Démokritosz: a világot homogén szubsztanciájú oszthatatlan részecskék, atomok és a közöttük lévı őr alkotja. Az atom szerkezete Egy atommodellt akkor fogadunk el érvényesnek, ha megmagyarázza a tapasztalati
Atomok, elektronok. Általános Kémia - Elektronok, Atomok. Dia 1/61
 , elektronok 2-1 Elektromágneses sugárzás 2-2 Atomi spektrum 2-3 Kvantumelmélet 2-4 Bohr-atom 2-5 Az új kvantummechanika 2-6 Hullámmechanika 2-7 A hidrogénatom hullámfüggvényei Dia 1/61 , elektronok 2-8
, elektronok 2-1 Elektromágneses sugárzás 2-2 Atomi spektrum 2-3 Kvantumelmélet 2-4 Bohr-atom 2-5 Az új kvantummechanika 2-6 Hullámmechanika 2-7 A hidrogénatom hullámfüggvényei Dia 1/61 , elektronok 2-8
A kémiai kötés magasabb szinten
 A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
FIZIKA. Sugárzunk az elégedettségtől! (Atomfizika) Dr. Seres István
 Sugárzunk az elégedettségtől! () Dr. Seres István atommagfizika Atommodellek 440 IE Democritus, Leucippus, Epicurus 1803 1897 John Dalton J.J. Thomson 1911 Ernest Rutherford 19 Niels Bohr 3 Atommodellek
Sugárzunk az elégedettségtől! () Dr. Seres István atommagfizika Atommodellek 440 IE Democritus, Leucippus, Epicurus 1803 1897 John Dalton J.J. Thomson 1911 Ernest Rutherford 19 Niels Bohr 3 Atommodellek
Fizikai kémia Részecskék mágneses térben, ESR spektroszkópia. Részecskék mágneses térben. Részecskék mágneses térben
 06.08.. Fizikai kémia. 3. Részecskék mágneses térben, ESR spektroszkópia Dr. Berkesi Ottó SZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Részecskék mágneses térben A részecskék mágneses térben ugyanúgy
06.08.. Fizikai kémia. 3. Részecskék mágneses térben, ESR spektroszkópia Dr. Berkesi Ottó SZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Részecskék mágneses térben A részecskék mágneses térben ugyanúgy
Atomfizika. Az atommag szerkezete. Radioaktivitás Biofizika, Nyitrai Miklós
 Atomfizika. Az atommag szerkezete. Radioaktivitás. 2010. 10. 13. Biofizika, Nyitrai Miklós Összefoglalás Atommag alkotói, szerkezete; Erős vagy magkölcsönhatás; Tömegdefektus. A kölcsönhatások világképe
Atomfizika. Az atommag szerkezete. Radioaktivitás. 2010. 10. 13. Biofizika, Nyitrai Miklós Összefoglalás Atommag alkotói, szerkezete; Erős vagy magkölcsönhatás; Tömegdefektus. A kölcsönhatások világképe
8. Osztály. Kód. Szent-Györgyi Albert kémiavetélkedő
 8. Osztály Kedves Versenyző! A jobb felső sarokban található mezőbe írd fel a verseny lebonyolításáért felelős személytől kapott kódot a feladatlap minden oldalára. A feladatokat lehetőleg a feladatlapon
8. Osztály Kedves Versenyző! A jobb felső sarokban található mezőbe írd fel a verseny lebonyolításáért felelős személytől kapott kódot a feladatlap minden oldalára. A feladatokat lehetőleg a feladatlapon
Az anyagi rendszerek csoportosítása
 Kémia 1 A kémiai ismeretekről A modern technológiai folyamatok és a környezet védelmére tett intézkedések alig érthetőek kémiai tájékozottság nélkül. Ma már minden mérnök számára alapvető fontosságú a
Kémia 1 A kémiai ismeretekről A modern technológiai folyamatok és a környezet védelmére tett intézkedések alig érthetőek kémiai tájékozottság nélkül. Ma már minden mérnök számára alapvető fontosságú a
Bevezetés a modern fizika fejezeteibe. 4. (a) Kvantummechanika. Utolsó módosítás: november 15. Dr. Márkus Ferenc BME Fizika Tanszék
 Bevezetés a modern fizika fejezeteibe 4. (a) Kvantummechanika Utolsó módosítás: 2015. november 15. 1 Előzmények Az atomok színképe (1) A fehér fény komponensekre bontható: http://en.wikipedia.org/wiki/spectrum
Bevezetés a modern fizika fejezeteibe 4. (a) Kvantummechanika Utolsó módosítás: 2015. november 15. 1 Előzmények Az atomok színképe (1) A fehér fény komponensekre bontható: http://en.wikipedia.org/wiki/spectrum
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Radiokémia vegyész MSc radiokémia szakirány Kónya József, M. Nagy Noémi: Izotópia I és II. Debreceni Egyetemi Kiadó, 2007, 2008.
 Radiokémia vegyész MSc radiokémia szakirány Kónya József, M. Nagy Noémi: Izotópia I és II. Debreceni Egyetemi Kiadó, 2007, 2008. Kiss István,Vértes Attila: Magkémia (Akadémiai Kiadó) Nagy Lajos György,
Radiokémia vegyész MSc radiokémia szakirány Kónya József, M. Nagy Noémi: Izotópia I és II. Debreceni Egyetemi Kiadó, 2007, 2008. Kiss István,Vértes Attila: Magkémia (Akadémiai Kiadó) Nagy Lajos György,
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
Atomfizika. Fizika kurzus Dr. Seres István
 Atomfizika Fizika kurzus Dr. Seres István Történeti áttekintés 440 BC Democritus, Leucippus, Epicurus 1660 Pierre Gassendi 1803 1897 1904 1911 19 193 John Dalton Joseph John (J.J.) Thomson J.J. Thomson
Atomfizika Fizika kurzus Dr. Seres István Történeti áttekintés 440 BC Democritus, Leucippus, Epicurus 1660 Pierre Gassendi 1803 1897 1904 1911 19 193 John Dalton Joseph John (J.J.) Thomson J.J. Thomson
Fizikai kémia 2. ZH II. kérdések I. félévtől
 Fizikai kémia 2. ZH II. kérdések 2018-19 I. félévtől Szükséges adatok, állandók és összefüggések: c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
Fizikai kémia 2. ZH II. kérdések 2018-19 I. félévtől Szükséges adatok, állandók és összefüggések: c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
Tartalomjegyzék. Emlékeztetõ. Emlékeztetõ. Spektroszkópia. Fényelnyelés híg oldatokban 4/11/2016. A fény; Abszorpciós spektroszkópia
 Tartalomjegyzék PÉCS TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNY KAR A fény; Abszorpciós spektroszkópia Elektromágneses hullám kölcsönhatása anyaggal; (Nyitrai Miklós; 2016 március 1.) Az abszorpció mérése;
Tartalomjegyzék PÉCS TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNY KAR A fény; Abszorpciós spektroszkópia Elektromágneses hullám kölcsönhatása anyaggal; (Nyitrai Miklós; 2016 március 1.) Az abszorpció mérése;
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában. Szőri Milán: Kolloidkémia
 Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Jegyzet. Kémia, BMEVEAAAMM1 Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens.
 Kémia, BMEVEAAAMM Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens Jegyzet dr. Horváth Viola, KÉMIA I. http://oktatas.ch.bme.hu/oktatas/konyvek/anal/
Kémia, BMEVEAAAMM Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens Jegyzet dr. Horváth Viola, KÉMIA I. http://oktatas.ch.bme.hu/oktatas/konyvek/anal/
ATOMMODELLEK, SZÍNKÉP, KVANTUMSZÁMOK. Kalocsai Angéla, Kozma Enikő
 ATOMMODELLEK, SZÍNKÉP, KVANTUMSZÁMOK Kalocsai Angéla, Kozma Enikő RUTHERFORD-FÉLE ATOMMODELL HIBÁI Elektromágneses sugárzáselmélettel ellentmondásban van Mivel: a keringő elektronok gyorsulnak Energiamegmaradás
ATOMMODELLEK, SZÍNKÉP, KVANTUMSZÁMOK Kalocsai Angéla, Kozma Enikő RUTHERFORD-FÉLE ATOMMODELL HIBÁI Elektromágneses sugárzáselmélettel ellentmondásban van Mivel: a keringő elektronok gyorsulnak Energiamegmaradás
January 16, ψ( r, t) ψ( r, t) = 1 (1) ( ψ ( r,
 Közelítő módszerek January 16, 27 1 A variációs módszer A variációs módszer szintén egy analitikus közelítő módszer. Olyan esetekben alkalmazzuk mikor ismert az analitikus alak amelyben keressük a sajátfüggvényt,
Közelítő módszerek January 16, 27 1 A variációs módszer A variációs módszer szintén egy analitikus közelítő módszer. Olyan esetekben alkalmazzuk mikor ismert az analitikus alak amelyben keressük a sajátfüggvényt,
A molekulák szerkezetének leírásához a kémiai kötés elméletének a kidolgozása a szükséges feltétel, nem véletlen tehát, hogy ez az, ami a kémikust
 A molekulák szerkezetének leírásához a kémiai kötés elméletének a kidolgozása a szükséges feltétel, nem véletlen tehát, hogy ez az, ami a kémikust legjobban izgatja és tanulmányaik során Önök is a legtöbbet
A molekulák szerkezetének leírásához a kémiai kötés elméletének a kidolgozása a szükséges feltétel, nem véletlen tehát, hogy ez az, ami a kémikust legjobban izgatja és tanulmányaik során Önök is a legtöbbet
Műszeres analitika II. (TKBE0532)
 Műszeres analitika II. (TKBE0532) 7. előadás NMR spektroszkópia Dr. Andrási Melinda Debreceni Egyetem Természettudományi és Technológiai Kar Szervetlen és Analitikai Kémiai Tanszék NMR, Nuclear Magnetic
Műszeres analitika II. (TKBE0532) 7. előadás NMR spektroszkópia Dr. Andrási Melinda Debreceni Egyetem Természettudományi és Technológiai Kar Szervetlen és Analitikai Kémiai Tanszék NMR, Nuclear Magnetic
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kirchhoff 2. törvénye (huroktörvény) szerint az áramkörben levő elektromotoros erők. E i = U j (3.1)
 3. Gyakorlat 29A-34 Egy C kapacitású kondenzátort R ellenálláson keresztül sütünk ki. Mennyi idő alatt csökken a kondenzátor töltése a kezdeti érték 1/e 2 ed részére? Kirchhoff 2. törvénye (huroktörvény)
3. Gyakorlat 29A-34 Egy C kapacitású kondenzátort R ellenálláson keresztül sütünk ki. Mennyi idő alatt csökken a kondenzátor töltése a kezdeti érték 1/e 2 ed részére? Kirchhoff 2. törvénye (huroktörvény)
Szilárdtestek sávelmélete. Sávelmélet a szabadelektron-modell alapján
 Szilárdtestek sávelmélete Sávelmélet a szabadelektron-modell alapján A Fermi Dirac statisztika alapjai Nagy részecskeszámú rendszerek fizikai jellemzéséhez statisztikai leírást kell alkalmazni. (Pl. gázokra
Szilárdtestek sávelmélete Sávelmélet a szabadelektron-modell alapján A Fermi Dirac statisztika alapjai Nagy részecskeszámú rendszerek fizikai jellemzéséhez statisztikai leírást kell alkalmazni. (Pl. gázokra
Orvosi Biofizika I. 12. vizsgatétel. IsmétlésI. -Fény
 Orvosi iofizika I. Fénysugárzásanyaggalvalókölcsönhatásai. Fényszóródás, fényabszorpció. Az abszorpciós spektrometria alapelvei. (Segítséga 12. tételmegértéséhezésmegtanulásához, továbbá a Fényabszorpció
Orvosi iofizika I. Fénysugárzásanyaggalvalókölcsönhatásai. Fényszóródás, fényabszorpció. Az abszorpciós spektrometria alapelvei. (Segítséga 12. tételmegértéséhezésmegtanulásához, továbbá a Fényabszorpció
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS
 Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
