SEMMELWEIS EGYETEM DOKTORI ISKOLA. Ph.D. értekezés WIENER ZOLTÁN
|
|
|
- Fruzsina Kissné
- 6 évvel ezelőtt
- Látták:
Átírás
1 SEMMELWEIS EGYETEM DOKTORI ISKOLA Ph.D. értekezés WIENER ZOLTÁN Patológiai Tudományok Tudományági Doktori Iskola Sejt-, extracelluláris mátrix-, rostrendszer változások szív- és érrendszeri és egyes daganatos megbetegedésekben. Kísérletes és diagnosztikus pathomorfológiai vizsgálatok doktori program Programvezeto: Prof. Dr. Kádár Anna, egyetemi tanár Témavezeto: Prof. Dr. Falus András, egyetemi tanár, Dr. Tóth Sára, egyetemi docens 1
2 DOKTORI (Ph.D.) ÉRTEKEZÉS A HISZTAMIN HATÁSÁNAK IN VITRO VIZSGÁLATA A HÍZÓSEJTEK KIALAKULÁSÁBAN ÉS MUKÖDÉSÉBEN Wiener Zoltán Készült a Semmelweis Egyetem Genetikai, Sejt- és Immunbiológiai Intézetében Sejt-, extracelluláris mátrix-, rostrendszer változások szívés érrendszeri és egyes daganatos megbetegedésekben. Kísérletes és diagnosztikus pathomorfológiai vizsgálatok doktori program Programvezeto: Prof. Dr. Kádár Anna, egyetemi tanár Témavezeto: Prof. Dr. Falus András, egyetemi tanár, Dr. Tóth Sára, egyetemi docens Budapest,
3 TARTALOMJEGYZÉK ÖSSZEFOGLALÁS 6 SUMMARY BEVEZETÉS IRODALMI ÁTTEKINTÉS A HISZTAMIN A hisztamin bioszintézisének kulcsenzime, a hisztidin dekarboxiláz (HDC) A hisztamin receptorai: a H1R, H2R, H3R és H4R A sokarcú hisztamin egy génkiütött egér fenotípus változásai A HÍZÓSEJTEK Bevezetés A hízósejtek differenciációja Különbözo hízósejttípusok A hízósejtek megkötik és internalizálhatják a baktériumokat A hízósejtek antigénprezentációja és kostimulációs aktivitása A hízósejtek aktiválódnak a kórokozók megkötése után A hízósejtek szerepe az akut gyulladásban A hízósejtek kapcsolata a hiperszenzitivitási reakciókkal és az asztmával A hízósejtek szerepe a baktériumok és férgek elleni immunválaszban AZ IL AZ EMBRIONÁLIS OSSEJTEK DIFFERENCIÁCIÓS POTENCIÁLJA CÉLKITUZÉSEK ANYAGOK ÉS MÓDSZEREK A KÍSÉRLETEK SORÁN FELHASZNÁLT ÁLLATOK REAGENSEK A PERITONEÁLIS SEJTEK KINYERÉSE SEJTTENYÉSZET ALAPÍTÁSA ENZIMHISZTOKÉMIA ÉS ALCIÁNKÉK-SAFRANIN FESTÉS
4 4.6. SZEMISZOLID KOLÓNIA-TESZT A CCE EMBRIONÁLIS OSSEJTVONAL FENNTARTÁSA ÉS DIFFERENCIÁLTATÁSA A 3 H-TIMIDIN INKORPORÁCIÓ MEGHATÁROZÁSA ÁRAMLÁSI CITOMETRIA (FACS) RT-PCR HISZTAMIN ELISA A HÍZÓSEJTEK STIMULÁLÁSA RPA (RNASE PROTECTION ASSAY) STATISZTIKAI ELEMZÉS EREDMÉNYEK A HISZTAMIN SZEREPE A HÍZÓSEJTEK DIFFEREN CIÁCIÓS FOLYAMATAIBA N A hízósejtek csökkent száma a HDC-/- egerek hasüregében Hisztamin hiányában a csontveloi eredetu in vitro hízósejt differenciálódás gátolt Az embrionális ossejtek mind differenciálatlan, mind pedig differenciált állapotban HDC-t és H1R-t expresszálnak A HDC enzim inhibitora gátolja az embrionális ossejtekbol kiinduló hízósejt differenciációt A HISZTAMIN SZEREPE A HÍZÓSEJTEK MUKÖDÉSÉBEN Az IL-9 csak ionomycin jelenlétében indukálja a hízósejtek citokintermelését Az IL-9 antigén-specifikus IgE és antigén stimulussal együtt megnöveli különbözo citokinek expresszióját A citokinexpresszió idobeli változása IL-9 + ionomycin stimulus hatására Különbözo stimulusok hatására a hízósejtekbol felszabaduló hisztamin mérése Az IL-9 + ionomycin stimulus hatását az IL-1? közvetíti Az IL-9 + ionomycin által stimulált HDC-/- hízósejtek kevesebb IL-9-et expresszálnak Az exogén hisztamin nem tudja megváltoztatni az IL-9 + ionomycin által indukált HDC-/- hízósejtek alacsonyabb IL-9 expressziós szintjét
5 Az IL-1? és ionomycin által aktivált HDC-/- hízósejtek kevesebb IL-9-et termelnek, mint a vad típusúak AZ EREDMÉNYEK MEGBESZÉLÉSE A HISZTAMIN SZEREPE A HÍZÓSEJTEK DIFFEREN CIÁCIÓJÁBAN A HISZTAMIN HIÁNYA BEFOLYÁSOLJA A HÍZÓSEJTEK FUNKCIÓIT KÖVETKEZTETÉSEK RÖVIDÍTÉSEK JEGYZÉKE KÖSZÖNETNYILVÁNÍTÁS IRODALOMJEGYZÉK A TÉMÁBAN MEGJELENT SAJÁT KÖZLEMÉNYEK KÜLFÖLDI, IMPAKT FAKTORRAL RENDELKEZO TUDOMÁNYOS FOLYÓIRATOKBAN MEGJELENT PUBLIKÁCIÓK NEMZETKÖZI KONFERENCIÁK HAZAI TUDOMÁNYOS KONFERENCIÁK MAGYAR NYELVU KÖZLEMÉNYEK, KÖNYVFORDÍTÁS
6 ÖSSZEFOGLALÁS A hisztamin szintézisének kulcsfontosságú enzime a hisztidin dekarboxiláz (HDC). A hisztamin hatásainak megismerésében dönto jelentoségu volt a HDC génkiütött egértörzs eloállítása, melyben az azonnali típusú allergiás reakció csökkent mértéke mellett váratlan fenotípusokat is megfigyeltek. Ilyen például a hízósejtek alacsonyabb száma. Vizsgálataink elso részében arra kerestük a választ, hogy a hisztaminhiányos egerekben megfigyelheto alacsonyabb hízósejtszám vajon az eltéro csontveloi differenciációs folyamatokra vezetheto-e vissza. Megállapítottuk, hogy in vitro HDC-/- csontveloi eredetu sejttenyészetekben a kialakuló hízósejtek aránya alacsonyabb, mint a vad típus esetében. Ezt az eltérést a hízósejt-eloalakok (promastocyták) vizsgálatakor is megfigyeltük, és amennyiben a HDC-/- kultúrához hisztamint, illetve a vad tenyészetekhez a HDC gátlószerét,? -fluorometil-hisztidint adtunk, nem tapasztaltunk változást a kezeletlen kontrollokhoz képest. Ezen kísérletek, valamint a csontveloi sejteken elvégzett szemiszolid kolóniateszt eredményei alapján azt a következtetést vontuk le, hogy a HDC-/- egerek csontveloi progenitor összetételének aránya módosult a vad típushoz képest. A hisztaminhiánynak a hízósejtek kialakulásában megfigyelheto gátló hatását az embrionális ossejtekbol kiinduló differenciációs folyamatok során is megfigyelhettük. A HDC-/- szöveti hízósejtekrol leírták, hogy módosult morfológiájú granulumokkal rendelkeznek. Ez felveti azt az érdekes kérdést, hogy ezen sejtek különbözo funkciói a hisztaminhiány következtében eltérnek-e a vad típusú hízósejtekéhez képest. Az IL-9 hatására irányítottuk figyelmünket, melynek túlexpressziója egerekben asztmatikus tüneteket okoz, és az emberi asztmatikus reakciókkal is összefüggésbe hozták. Eloször az IL-9-nek a vad típusú hízósejtek citokinexpressziós mintázatára kifejtett hatására voltunk kíváncsiak. Megállapítottuk, hogy az IL-9 csak ionomycin vagy IgE/antigén jelenlétében hatékony stimulálószer, és az IL- 1?, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-13 és MIF mrns-szintjében jelentos emelkedést okoz. Úgy tunik, hogy a különbözo citokinek expresszióját az IL-1? felszabadításán keresztül éri el. A HDC-/- hízósejtek esetében azt kaptuk, hogy az IL-9 által indukált IL-9 szintézis gátolt volt, továbbá az IL-1? stimulus ionomycin jelenlétében csökkent IL-9 termeléshez vezetett. A HDC-/- hízósejtek tehát végso soron IL-9 vagy IL-1? és IgE/antigén jelenlétében kevesebb IL- 9-et állítanak elo. Kísérleti eredményeink azt mutatják, hogy a hisztamin hiánya jelentosen befolyásolja a hízósejtek differenciációját a progenitor/ossejt populáció méretének szabályozása által. A hisztaminmentes hízósejtek citokinexpressziós mintázata eltér a vad típusétól, ez az egyik magyarázata lehet a HDC-/- egerek esetében megfigyelt csökkent asztmatikus tüneteknek. 6
7 SUMMARY One of the key steps in revealing the effects of histamine was the production of histidine decarboxylase (HDC) deficient mice which are unable to express the only enzyme involved in histamine synthesis. These mice are histamine-free and show unexpected phenotypes, for example less mast cells than the wild type ones. The lower number of mast cells in HDC-/- mice may be the consequence of their disturbed differentiation processes. To test this hypothesis we established in vitro bone marrowderived cell cultures. We observed a lower proportion of mast cells and promastocytes in HDC- /- cultures. However, when adding histamine to HDC-/- cultures or the inhibitor of HDC enzyme,? -fluoromethyl-histidine to wild type cells, we could detect no difference compared to the untreated controls. Based on these experiments and on semisolid colony assays performed with bone marrow-derived cells we concluded that the progenitor cell content in the bone marrow of HDC-/- mice is modified. The effect of histamine on mast cell development was also confirmed by testing embryonic stem cell-derived differentiation processes. HDC-/- tissue mast cells were described to contain granules with abnormal morphology which raises the interesting question whether these cells function in a modified way compared to wild type ones. Our attention turned towards the effect of IL-9, the level of which is elevated during intestinal infections and results in mastocytosis. The overexpression of IL-9 causes asthmatic syndromes in mice and it has been implicated in human asthma, too. First we tested its effect on the cytokine expression profile of wild type mast cells. According to our results IL- 9 is a potent inducing agent only in the presence of ionomycin or IgE/antigen and elevates the mrna level of IL-1?, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-13 and MIF. It seems to act through the production of IL-1?. In HDC-/- mast cells the IL-9-induced IL-9 synthesis is inhibited. IL-1? and ionomycin also results in a lower IL-9 mrna level in histamine-free mast cells. These data show that HDC-/- mast cells are able to produce less IL-9 upon different stimulations compared to wild type controls. Based on our experimental results we conclude that the lack of histamine modifies mast cell differentiation by influencing the size of the progenitor/stem cell population, and the different cytokine expression profile of HDC-/- mast cells may explain the reduced asthmatic symptomes observed in histamine-free mice. 7
8 1. BEVEZETÉS Bár a hisztaminnak az allergiában betöltött szerepe már régóta ismert, az újabb kutatások alapján úgy tunik, hogy számos egyéb folyamatban is fontos funkcióval rendelkezik. Ezt támasztja alá az a megfigyelés is, hogy hisztamin szintézisére a legtöbb sejttípus képes, bár nagy mennyiségu tárolása csak a hízósejtekre és a bazofil granulocitákra jellemzo. A hisztamin hatásainak tanulmányozásában fontos lépést jelentett a képzodésében kizárólagos szereppel rendelkezo hisztidin dekarboxiláz (HDC) enzim génjére nézve deficiens, knock out egerek eloállítása. Ezen állatok egyik nem várt fenotípusa a csökkent hízósejtszám, valamint az, hogy a peritoneális hízósejtek granulumai módosultak a vad típushoz képest. A hízósejtek szerepe az azonnali típusú túlérzékenységi reakcióban és az allergia korai fázisában megkérdojelezhetetlen, elsosorban a granulumokban tárolt nagy mennyiségu hisztamin miatt. Kiderült azonban, hogy a hízósejtek ennél sokkal többet tudnak, stimulálás hatására Th1-es (pl. tumor nekrózis faktor, TNF-? ) és Th2-es (pl. interleukin (IL)-9, IL-13) citokineket termelnek, ezáltal szabályozhatják a lokális immunválasz Th1, ill. Th2 irányát. Hozzájárulnak a kórokozók elleni védekezo mechanizmusok beindításához a neutrofil granulocitáknak a fertozés helyére történo odavonzásával. A bélrendszeri fertozések során felszabaduló jelentos mennyiségu IL-9 pedig serkenti a mastocytosis megjelenését, vagyis a hízósejtek felszaporodását. Napjaink hisztaminkutatásának egyik izgalmas kérdése, hogy e biogén amin miként befolyásolja az immunrendszer muködését, akár a citokinexpresszió, akár a védekezésben szerepet játszó sejttípusok differenciációjának módosítása által. Saját kísérleti eredményeink újabb adatokat szolgáltathatnak a kérdéskör felderítéséhez és megértéséhez. 8
9 2. IRODALMI ÁTTEKINTÉS 2.1. A hisztamin A hisztamin bioszintézisének kulcsenzime, a hisztidin dekarboxiláz (HDC) A hisztamin eloállításának egyetlen, kulcsfontosságú enzime a hisztidin dekarboxiláz (HDC), mely az L-hisztidint CO 2 felszabadulás mellett hisztaminná alakítja át (1. ábra). A HDC szöveti eloszlását tekintve kiderült, hogy az ismerten magas hisztamin tartalmú sejteken kívül szinte minden szövetben kimutatható volt alacsony szintu aktivitása. A hízósejtek, bazofil granulociták és a gyomor-bélrendszer enterokromaffin sejtjeinek magas HDC tartalma (1) nem okozott különösebb meglepetést, ugyanakkor a T-limfocitákban (2), vérlemezkékben (3), a borben a sebgyógyulás során (4), a regenerálódó májban, a csontveloben, az embrionális szövetekben (5), vagy a melanoma sejtekben (6) kimutatott aktivitása igen érdekes kérdéseket vetett fel. Génje emberben a 15-ös kromoszóma 15q21-q22-es régiójában (8, 9), egérben a 2-es kromoszómán található (10), egyetlen példányban. Mindkét fajban 12 exonból és 11 intronból áll, hossza hozzávetolegesen 24 kilobázis. Az enzim muködéséhez a piridoxál-foszfát koenzim kapcsolódása szükséges, ennek konszenzus kötohelyét a 8-as exon kódolja (7). 1. ábra. Az L- hisztidint a hisztidin dekarboxiláz (HDC) alakítja át hisztaminná. A génrol képzodött fehérje hossza mind emberben, mind pedig egérben 662 aminosav, molekulatömege pedig kb. 74 kda, ám poszttranszlációs módosulások során egy kda-os forma is kialakul, mely a legtöbb sejtben homodimert alkot (7, 8). Úgy tunik, hogy a HDC fehérje két formájának aránya, valamint enzimatikus 9
10 aktivitásuk és sejtbeli elhelyezkedésük is sejt- és szövetspecifikus. A cdns által kódolt fehérje két feltételezett camp-tol függo protein kináz (protein kináz A) foszforilációs helyet tartalmaz. Az egyik ilyen hely közvetlenül szomszédos a piridoxál-foszfát koenzim megkötéséért felelos 307-es lizinnel, és foszforilálása az enzim inaktiválódásához vezet (7). A HDC, a többi aminosav dekarboxilázhoz hasonlóan, igen instabil fehérje. Az N-terminális részén található PEST-domén fontosnak tunik az ATPfüggo, proteaszómában végbemeno lebontásában (9). Instabilitása lehet az egyik magyarázat arra nézve, hogy bár a HDC a legtöbb szövetben megtalálható, ugyanakkor igen kis aktivitást lehet csak mérni. A HDC gén promóterében a TATA-box, a CG-box és a CACC-box mellett a GATA konszenzus szekvencia, valamint leader binding protein-1 motívumok is megtalálhatók (10). Deléciós analízissel azonosítottak továbbá a transzkripciós start helytol lefelé, downstream egy 23 nukleotid hosszúságú gasztrin reszponzív elemet (GAS-RE, 11). Az egér HDC promóterben ezen kívül egy IFN-? reszponzív elem, egy glükokortikoid reszponzív elem és egy interleukin-6 nukleáris faktor kötohely is megtalálható (12), melyek a szövetspecifikus expresszióban láthatnak el fontos feladatot. A HDC génexpressziót a gén metiláltsági állapota szintúgy szabályozza (13). A HDC génexpressziót szabályozó szignáltranszdukciós utak közül a leginkább talán a gasztrin által indukált HDC aktiváció mechanizmusa ismert. A gasztrin a CCK-B/gasztrin receptoron keresztül hat, mely egy G-fehérjéhez kapcsolt, hét transzmembrán doménnel rendelkezo receptor (14). A gasztrin a protein kináz C-n keresztül serkenti a HDC gén expresszióját a promóter GAS-RE motívuma által (15). A forbolészter (PMA) szintén a HDC indukciójához vezet, noha deléciós kísérletek eredményei szerint ehhez a GAS-RE motívum nem szükséges. Ugyanakkor gyomorrák sejtvonalakban azt tapasztalták, hogy a GATA-4 és GATA-6 transzkripciós faktorok a HDC gén GATA-kötohelyén keresztül gátolták a génexpressziót (16). A bazofil granulociták és hízósejtek differenciálódásában fontos szereppel bíró c-myb transzkripciós faktor ugyanakkor serkenti a génátírást (13). Egérben LPS-injekciót követoen a májban, a tüdoben, a lépben, a csontveloben és a peritoneális makrofágokban a HDC-aktivitás megemelkedett. Az LPS ezt a hatását több citokinen keresztül fejti ki. Az IL-1?, IL-1?, a TNF-?, a GM-CSF és a G-CSF mind indukálják a HDC-t (17, 18), ez utóbbi ketto a lépben és a csontveloben, ami a 10
11 hisztamin korai hemopoézisben betöltött szerepére utal. Ezzel szemben az IFN-? gátolja a HDC aktivitást, ami magyarázza az allergiás reakciókban tapasztalt gátló hatását (19). Az endokrin rendszer és az immunrendszer közötti kapcsolatra mutat kiváló példát a szteroid hormonok HDC-promóterre kifejtett hatása. Kimutatták, hogy a tüdoben dexametazonnal vagy kortikoszteroiddal való kezelés során a HDC transzkripciója erosen lecsökken (20), ami jól magyarázza ezen vegyületek antiallergiás gyógyszerként való alkalmazását. A HDC fehérjét több szövetbol és sejttípusból sikerült már tisztítani, például embrionális májból (21), gyomor nyálkahártyából (22), bazofil leukémia sejtvonalból, vagy egér mastocytoma sejtekbol (23). A különbözo forrásokból izolált fehérjepreparátumok esetében mind a K m, a V max, mind pedig a ph-optimum és az izoelektromos pont közel azonosnak adódott, ami arra utal, hogy a kisebb különbségeket inkább a kísérleti körülmények eltérései magyarázhatják, semmint fiziológiai különbségek A hisztamin receptorai: a H1R, H2R, H3R és H4R A hisztamin, mint autokrin/parakrin módon ható extracelluláris molekula, sejtfelszíni receptorokon keresztül fejti ki hatását. Valamennyi hisztamin receptor hét transzmembrán doménnel rendelkezik, különbözo G-fehérjékhez kötodve szignáltranszdukciós útvonalakat indítanak be. A hisztamin receptorok számozása felfedezésük sorrendjét tükrözi. A következokben elsosorban az egyes receptorok elofordulására, szerepére és génszerkezetére szeretnék kitérni, az általuk elindított bonyolult jelátviteli útvonalakat vázlatosan a 2. ábra szemlélteti. Ha a hisztamin a legeloször felfedezett H1R-hoz kapcsolódik, akkor a simaizomsejtek kontrakcióját és az endotheliummal való további kölcsönhatási folyamatok során vazodilatációt és megnövekedett vaszkuláris permeabilitást okoz. A H1R az akut gyulladásban és az allergiás elváltozásokban szereplo fo receptortípus. Emellett sokféle szövetben és sejttípusban kifejezodik, például az agyban, a légúti simaizomsejtekben, a gyomor-bélrendszer sejtjeiben, a húgyivarszervekben, a kardiovaszkuláris rendszerben, a mellékveseveloben, az endotheliumban és különbözo immunsejtekben (24). A H1R magas szintje mutatható ki allergiás rhinitisben szenvedo 11
12 betegek orr nyálkahártyájában, vagy reumatoid arthritisben szenvedok gyulladásos ízületeiben. A H1R-t kódoló gén a 3-as kromoszómára lokalizálható ember esetében. Az 5 nem transzlálódó régióban található intronon kívül a gén kódoló régiója egyetlen exonon fekszik. A promóterszekvencia hasonlóságokat mutat más G-fehérjével kapcsolt receptorokéval, például nincs TATA-box és CAAT szekvencia a megfelelo pozíciókban (25, 26). A génben talált SNP-ek atopikus asztmával való kapcsolatát eddig nem sikerült bizonyítani (27). 2. ábra. A hisztamin receptorok által elindított fobb jelátviteli útvonalak vázlatos áttekintése. A humán 5. kromoszómán található H2R eloször a gyomorsav szekréció szabályozásával kapcsolatban vált ismertté. Emellett még egy sor más, a hisztaminhoz kapcsolható fiziológiás eseményben is szerepel, mint a bazofil granulociták kemotaktikus válaszképességének gátlása, a prosztaglandin E 2 által stimulált duodenális hámsejtek bikarbonát szekréciójának gátlása, illetve az immunsejtek muködése (28). Klinikai szempontból minden bizonnyal a gyomorsav szekréció serkentése a legfontosabb. 12
13 A H2R génjét az 1990-es évek elején klónozták. A gén 5 nem kódoló régiójában camp-reszponzív motívum (CRE), GATA-motívumok és AP2 kötohelyek is kimutathatók, ám TATA-box ebben az esetben sem található. A kódoló régió, a H1R génjéhez hasonlóan, egyetlen exonból áll (28). Több SNP-et is felfedeztek, ezek közül az egyiket korábban kapcsolatba hozták a szkizofréniával, késobbi tanulmányok azonban ezt nem igazolták minden kétséget kizáróan (29). A H3R-t farmakológiai mérések során az agyban fedezték fel az 1980-as évek elején. Preszinaptikus autoreceptorként az idegsejtekbol kikerülo hisztamin mennyiségét, ezáltal az idegi muködést szabályozza. Késobbi tanulmányok arra engedtek következtetni, hogy a hisztamin mellett egyéb neurotranszmitterek hatását is befolyásolja (30). A H3R szélesköruen kifejezodik a központi idegrendszer területén, így a hipotalamuszban, a frontális kéreglebenyben, a hippocampusban és a nucleus caudatusban. Kísérletek tanúsága szerint szerepet játszik a napi alvás-ébrenléti ciklus normális muködésében, a kognitív és a memóriával összefüggo folyamatokban, valamint a táplálékfelvétel szabályozásában (30). A H3R génkiütött egerek a legtöbb várt fenotípus-módosulást mutatták, viszont a napi ritmusuk normális maradt (31). A H3R emellett a kardiovaszkuláris rendszer területén is hatást fejt ki azáltal, hogy gátolja a szimpatikus neurotranszmissziót a szív jobb pitvarában (30). Az emberi H3R gén a 20-as kromoszómán fekszik, és 1999-ben klónozták (32). A H1 és H2 receptorral ellentétben négy exonból áll, és egyetlen példányáról több izoforma is képzodik alternatív splicing által. A hisztamin negyedik receptorát in silico számítógépes módszerrel, a H3R-hoz való hasonlósága alapján néhány évvel ezelott azonosították, majd klónozták. A H4R elsosorban a hemopoetikus és immunsejteken fejezodik ki, például az eozinofil és neutrofil granulocitákon, a hízósejteken és a CD4+ T-sejteken. Expressziós elofordulása alapján feltételezheto, hogy a hisztamin vérképzésben kifejtett egyes hatásainak (pl. a mielociták differenciálódása) közvetítoje (33). Emellett a hisztamin a H4R-on át serkenti a hízósejtek pozitív kemotaxisát (34). A H4R gén felépítése a H3R génjéhez hasonló, az emberben a 18. kromoszómán található (35). Bár regulációja még alig-alig ismert, a promóterben lévo, transzkripciót szabályozó kötohelyek (NF-IL6, NF-?B, uteroglobin fehérjék kapcsolódási helyei) arra engednek következtetni, hogy az interferonok, a TNF-? és az IL-6 módosítják a H4R 13
14 expressziót például a gyulladás során, illetve a tüdoben az anti-inflammatorikus uteroglobinszeru fehérjék és a H4R együttes expressziójának szintén fontos szerepe lehet (35). Az immunrendszer sejtjei esetében kimutatták, hogy az aktivált monocitákon a H4R csak neutralizáló IL-10 ellenes ellenanyag jelenlétében mutatható ki, míg az aktivált Th2 sejtekben az expressziója lecsökken, ebben minden bizonnyal az IL-10-nek és IL-13-nak is szerepe lehet. A csontvelobol differenciáltatott hízósejtek felszínén megjeleno H4R mennyisége erosen lecsökken a sejtek ionomycinnel való aktivációja során, és ez a változás párhuzamos az IL-13 emelkedo expressziós szintjével (36) A sokarcú hisztamin egy génkiütött egér fenotípus változásai A hisztamin szervezetben betöltött sokrétu funkcióját talán leginkább a HDC-/- génkiütött, ezért hisztaminmentes egéren tapasztalt fenotípusváltozások illusztrálják (3. ábra). Ezen egereket 2001-ben nemzetközi együttmuködés keretében hoztuk létre (37), és igen sok, a hisztaminnal már korábban összefüggésbe hozott jelenség mellett váratlanul új eredmények is születtek. Az elso csoportba tartoznak például az allergiával és asztmával kapcsolatos vizsgálatok. Passzív bor anafilaxiás teszt során azt tapasztalták, hogy hisztamin hiányában nincs plazma extravazáció. Ugyanerre jutottak a hízósejtek degranulációját okozó ún. 48/80 ionofór vegyület alkalmazásával is, mely csak vad típusú egereknél volt hatásos. Ugyanakkor a késoi típusú hiperszenzitivitás vizsgálatakor nem kaptak eltérést, ami arra utal, hogy a hisztamin az azonnali hiperszenzitivitásban játszik fontos szerepet (38). Ugyancsak érdekes, hogy a HDC-/- egerekben a hízósejtek proteáztartalma alacsonyabb a vad típushoz képest (37). A szisztémás anafilaxiás modellrendszerben IgE-vel történt szenzitizálás, majd antigénnel való stimulálás után a vad egerekben a testhomérséklet és a légzési frekvencia csökkenését lehetett kimutatni, ez a folyamat a hízósejtek hisztamintartalmától függött, és a HDC-/- egerekre nem volt jellemzo. A vérnyomás változását ugyanakkor nem befolyásolta a hisztamin jelenléte/hiánya (39). Asztmatikus reakciókat két kutatócsoport is vizsgált, és azt tapasztalták, hogy a tüdobeli eozinofil-infiltráció és az eotaxin szint alacsonyabb hisztamin hiányában. A légzési elváltozások tekintetében azonban eredményeik nem egyeztek, feltehetoen a kissé eltéro kísérleti módszerek miatt (40, 41). 14
15 Nem okozott nagy meglepetést a HDC-/- egerek gyomorsav-szekréciójának vizsgálata sem. A gasztrin vagy karbachol által indukált gyomorsav szekréciót a hisztamin a H2R-on át befolyásolja, és mértéke alacsonyabb volt hisztamin hiányában (42). Mindezek mellett a hisztamin hiányának több új hatása is napvilágra került, ami arra utal, hogy e biogén amin eddigi vizsgálatai még távolról sem fedték le a teljes spektrumot. Érdekes megfigyelés, hogy a hisztamin serkenti az angiogenezist, és ebben valószínuleg a makrofágoknak jut fontos szerep (43). A HDC-/- egerekben a kérgi EEG-mintázat és az alvás-ébrenléti ciklus is módosult mind alapállapotban, mind pedig farmakológiai stimulus után (44). Ugyancsak az idegrendszer hisztaminerg neuronjainak hibás muködésére vezetheto vissza, hogy a hisztaminmentes állatokban metamphetamin hatására lokomóciós hiperaktivitás figyelheto meg, a spontán lokomóciós aktivitás a sötét periódusok alatt lecsökkent, valamint a középagyi GABAszint sem volt megfelelo (45). Összetettebb fenotípus-változás a HDC-/- egereknél tapasztalt magasabb szérum leptinszint, rendellenes táplálékfelvétel és energiaháztartás, mely szintén részben az agyi hisztaminerg neuronok hibájára vezetheto vissza (46). Pap E. és munkatársai kísérleteik során megmutatták, hogy a hisztamin a hím nemi muködést is befolyásolja: hiányában a tesztoszteron és az androgének szintje magasabb a herében, a szérum ösztradiol koncentrációban nincs eltérés, viszont a herék kisebbek és a Leydig-sejtek morfológiája is módosult (47). Ha egerek hasüregébe E. coli-t juttatunk, akkor a HDC-/- állatok gyorsabban eliminálják a baktériumokat és több neutrofil granulocita vándorol a peritoneális térbe, mint a vad típusúak esetében. Ugyanezt az eltérést H1 és H2 receptor antagonisták alkalmazása során is meg lehetett figyelni (48). A nagyobb neutrofil szám mellett a TNF-?, a monocita kemoattraktáns fehérje (MCP)-1 és a makrofág gyulladásos fehérje (MIP)-2 szintje is magasabb hisztamin hiányában (49). A hisztamin immunmoduláló hatását jellemzi az a megfigyelés, hogy a génkiütött állatokban az IL-6 szintje alacsonyabb (50), valamint megfelelo immunizálás után magasabb IFN-? és kisebb IL-4 expressziót lehetett tapasztalni a vad típusú egerekhez képest, ami arra utal, hogy a hisztamin a Th2-es immunválaszt serkenti. A hisztamin bizonyos akutfázis fehérjék termelodésére is hat: a terpentin által indukált 15
16 haptoglobin-szint kisebb a HDC-/- egerekben, ugyanakkor a bakteriális lipopoliszacharid (LPS) stimuláció esetében nem figyeltek meg különbséget (51). Talán a legmeglepobb felfedezés azonban az volt, hogy a HDC-/- egerek csontjai vastagabbak, a csont ásványi anyagainak surusége nagyobb, az oszteoklasztok száma pedig alacsonyabb. Az ováriumok eltávolítása után, ami a petefészkek által termelt hormonok kiesését jelenti, a csontvesztés és az osteoporosis mértéke is kisebb hisztamin hiányában, a kalcitriol szintézis viszont fokozott. Mindez azt jelenti, hogy a hisztamin valószínuleg hozzájárul az osteoporosis kialakulásához (52). 3. ábra. A hisztamin néhány hatása a HDC-/- génkiütött egereken tapasztalt fenotípus-változások alapján 2.2. A hízósejtek Bevezetés Az 1863-ban felfedezett, citoplazmatikus granulumokkal rendelkezo hízósejtek igen sok szervben megtalálhatók, elsosorban a kötoszövetben és olyan helyeken, melyek a külso környezettel szorosan érintkeznek, például a bor, tüdo és a gyomorbélrendszer. Kék színu anilinfestékkel (pl. toluidinkék) a granulumok lilára festodnek, ezt a jelenséget metakromáziának nevezik. Egy hízósejtben 1000-nél is több granulum 16
17 lehet, ezek átlagos térfogata 0,3? m 3, a hisztamintartalom pedig 0,5-3,0 pg/sejt körüli érték (53). A hízósejtek a korán megjeleno citokinek, pl. a TNF-? és az IL-4 potenciális forrásai, melyek a gazdának a kórokozóra adott gyulladási és immunológiai válaszában az elso lépéseket jelentik. Ezen kívül a hízósejtek sokáig, néha akár évekig is élnek, így ugyanarra a stimlusra ismételten válaszolni tudnak. Mindezek alapján úgy tunik, hogy funkciójuk a gazda védekezo mechanizmusaiban kulcsfontosságú. Aktiváció hatására a hízósejtek többféle, széles biológiai hatásspektrummal jellemezheto mediátorokat bocsátanak ki, melyek közül egyesek eloregyártott formában találhatók meg a granulumokban (hisztamin, proteoglikánok, proteázok, TNF-?, IL-16), míg mások újonnan szintetizálódnak elsosorban a sejtmembránban tárolt prekurzor lipidekbol (leukotriének, prosztaglandinok). A hízósejtek ezen kívül különbözo stimulusok hatására citokinek és kemokinek de novo transzkripciójára, transzlációjára és szekréciójára is képesek (ld. késobb). Sejtfelszínükön nagy mennyiségu magas affinitású IgE receptor (Fc?RI) található, ezek IgE-n át megvalósuló, antigén által eloidézett keresztkötése eredményeként a hízósejtek stimulálódnak. Ezt az aktivációt immunológiai aktivációnak nevezzük, mely fontos az allergiás betegségekben, mint az asztma, az ekcéma és az anafilaxia (54). Citotoxikus hatások következtében, melyek elsosorban a plazmamembránt károsítják (Tween 20, Triton X-100) (55), a mediátorok szintén kikerülhetnek az extracelluláris térbe. Egy másik stimulálási lehetoség a kalcium ionofórok (pl. A23187, ionomycin), vagy alacsony homérséklet alkalmazása. Bizonyos citokinek, neuropeptidek (56), anafilatoxinok, növekedési faktorok szintén a hízósejtek degranulációjához és aktivációjához vezethetnek A hízósejtek differenciációja A hízósejtek a csontvelo ossejtjeibol alakulnak ki, éretlen formában kerülnek ki a perifériás vérbe, terminális differenciációjuk pedig a szövetekben zajlik le. Egér embrionális vérbol sikerült egy CD117 high /Thy1 low sejtpopulációt izolálni (57), mely citoplazmatikus granulumokkal rendelkezik, de a nagy affinitású IgE-receptor még hiányzik a felszínén. In vitro ez a populáció IL-3 és SCF jelenlétében érett hízósejtekké 17
18 differenciálódik, más hemopoetikus sejtekké viszont nem. Az egér csontveloben azonban nem sikerült még a hízósejt progenitorokat azonosítani. Az egér hízósejtek differenciációjában az IL-3-nak és az SCF-nek jut kiemelkedo szerep. Az SCF fontosságát jelzi, hogy receptorára, a c-kit-re (CD117) mutáns (W/W v egértörzs) (58), illetve az SCF membránkötött izoformájára nézve deficiens (Mgf Sl/Sl d ) egértörzsekben alig-alig található hízósejt (59). Ugyanakkor féregfertozés hatására csak T-sejtekbol származó faktorok, így IL-3 hatására alakul ki a jellemzo, a bélrendszer mucosájában megfigyelheto hízósejt hiperplázia. A hízósejteket in vitro általában IL-3, vagy IL-3 és SCF jelenlétében differenciáltatják, fejlodésükre pedig még igen sok egyéb faktor hat, ezek közül talán az egyik legfontosabb serkento interleukin az IL-9 (60), mely in vivo is fontos szereppel rendelkezik. Az SCF és az IL-3 feladata igen sokáig meglehetosen homályosnak bizonyult az egér hízósejtek fejlodésében. Yuan és munkatársai 1998-ban kísérleteik során azt tapasztalták, hogy SCF hatására a csontvelobol egy Thy low /c-kit high promastocyta populáción át elsosorban nagy, viszonylag kevéssé elektrondenz granulumokkal rendelkezo, mmc-cpa-ra nézve (mely a hízósejt érettségi fokának egyik jelzoje) negatív hízósejtek (metamastocyták) keletkeztek. IL-3 jelenlétében a csontvelo elkötelezett sejtfrakciójából sikerült elsosorban hízósejteket differenciáltatni, melyek számban többszörösen meghaladták az SCF jelenlétében tapasztalt sejtmennyiséget, elektrondenz granulumokkal rendelkeztek, és mmc-cpa-ra nézve erosen pozitívaknak bizonyultak, azaz érett sejtek voltak (61). Következtetésük szerint tehát az SCF a hízósejt progenitorokból kialakuló promastocyták (Thy low /c-kit high ) és metamastocyták differenciációjában, illetve ezen sejtpopulációk méretének szabályozásában játszik szerepet, míg az IL-3 elsosorban a csontvelo már elkötelezodött sejtpopulációjában található, késobbi fejlodési stádiumú hízósejt progenitoron hat, és elengedhetetlen az érett hízósejtek kialakulásához. Az SCF és IL-3 tehát a hízósejt fejlodés különbözo fázisaiban fontosak. Az emberi hízósejt-progenitorokról kimutatták, hogy gyakran a CD34 + /CD38 + /HLA-DR - sejtpopuláción belül találhatók, bár a kísérleti eredmények erre nézve nem voltak teljesen meggyozoek (62). Egy másik kutatócsoport viszont szinte ezzel egy idoben megállapította, hogy a humán hízósejtek a csontvelo ill. a köldökvér CD34 + /CD117 + /CD13 + populációjából alakulnak ki (63), és ezek a sejtek 18
19 egyben CD38 + markerrel is jellemezhetok. Az emberi hízósejtek differenciálódásában az elsosorban fibroblasztokból származó SCF-nek van kiemelt szerepe. In vitro ezen kívül az IL-6 (64) és az IL-9 szerepe egyértelmuen bizonyított (65). Kimutatták ezen kívül, hogy az érett emberi hízósejtek proliferációjára az IL-4 is hat (66). A hízósejtek embrionális, korai megjelenésének és differenciálódásának egy további vizsgálati módszere az embrionális ossejtek felhasználásán alapul (ld. késobb) Különbözo hízósejttípusok A hízósejtek granulumaikban az azonnali típusú hiperszenzitivitásban kiemelt szerepet játszó hisztamin mellett egyéb mediátorokat, valamint savas poliszacharidokat is raktároznak. Egérben a bor és a béltraktus mucosájára jellemzo hízósejteket világosan el lehet egymástól különíteni hisztokémiai és szekréciós sajátságok alapján. Az ún. kötoszöveti hízósejtekre jellemzo a magas heparintartalom, ezek alciánkék-safraninnal piros színure festodnek, ellentétben a mucosális típussal, mely kondroitin-szulfát tartalma miatt kék színu lesz. A hízósejtek granulumaiban található heparin szerepét heparin szintézisre képtelen, genetikailag módosított egereken bizonyították. Ezek szerint heparin hiányában a hízósejtek granulumai meglepo morfológiai és biokémiai változásokat mutattak. A heparin negatív töltése által képes szabályozni bizonyos fehérje mediátorok (pl. mmcp6) és biogén aminok (hisztamin) szintjét a granulumokban (67, 68). A hízósejtek granulumaiban a szerin proteáz családba tartozó különbözo enzimek, kimázok (mmcp1-5), triptázok (mmcp6,7), mmcp8 (17) és karboxipeptidáz A (mmc-cpa) is találhatók. A hízósejt granulumok aktuális proteáz tartalma dinamikusan változik a mikrokörnyezettol függoen. Az L138.8A egér éretlen hízósejtvonalban például azt tapasztalták, hogy az SCF növelte az mmcp4, az mmcp6 és mmcp7 expresszióját, ami IL-3 vagy IL-9 jelenlétében kivédheto volt. Az IL-9 viszont az mmcp1 és az mmcp2 szintjét emelte meg (69). A peritoneális hízósejtek esetében az mmcp2, mmcp4, mmcp5 és mmcp6 expresszióját mutatták ki RNSszinten. Ezen sejtek in vitro, aktivált T-sejtekbol származó citokinek jelenlétében történo tenyésztése során az mmcp1 is megjelent (70). Az mmcp-2 mrns a gyomor mucosa rétegében található hízósejtekben expresszálódik, az izom propriában viszont nem. Másfelol az mmcp-4 és mmcp-6 a mucosa hízósejtjeiben nem található meg, 19
20 ellentétben az izom propriával (71). Csontvelobol differenciáltatott hízósejteknél (BMMC) a TGF-? 1 serkenti a bélrendszer mucosális hízósejtjeire jellemzo mmcp-1 expressziót és IgE-tol független extracelluláris szekrécióját (72). Úgy tunik, hogy a kimázok szerepet játszanak a sebgyógyulásban az extracelluláris mátrix újjáépítésének serkentése által (73). Az emberi hízósejtek elsosorban granulumaik proteáz tartalma szerint csoportosíthatók (74). Az ún. MC TC típusban jelentos mennyiségu triptáz, kimáz és karboxipeptidáz aktivitás mutatható ki. Elsosorban a borben és a vékonybél submucosa rétegében figyelhetok meg nagyobb számban (75). Fejlodésük, differenciációjuk kevésbé függ a T-limfocitáktól, amint ezt az immunhiányos betegségekben megfigyelheto normális sejtszámuk is mutatja (76). Ma úgy gondoljuk, hogy ez a csoport foként az angiogenezisben és a szöveti átrendezodésben játszik fontos szerepet. A substance P neuropeptid és a 48/80 ionofór vegyület hatásos stimulálószerük, ellentétben a másik csoporttal, a csak triptázt tartalmazó MC T sejtekkel (76). Ez utóbbi hízósejt típus jellemzo a tüdore és a vékonybél mucosa rétegére. Allergiás reakciók és parazita fertozések során ennek a csoportnak a száma növekszik lokálisan meg, ezért úgy tunik, funkciójuk a paraziták elleni védekezés területén az immunrendszerrel szorosan összefügg (77). Specifikus stimulusok hatására a hízósejtek különbözo citokinek expressziójára képesek. IL-1 és ionomycin vagy antigén specifikus IgE/antigén együttes jelenléte esetén például IL-3, IL-5, IL-6, TNF-? és IL-9 termelése figyelheto meg (78). Az IL-1 és ionomycin által indukált citokin expresszió IL-10 és SCF (kit ligand) jelenlétében tovább fokozható (79). A hízósejtek LPS hatására IL-9, IL-13 és TNF-? expresszióval válaszolnak (80). Számtalan egyéb stimuláló tényezot mutattak még ki, melyek az IL-6 és TNF-? termelést módosítják, ilyen például az IFN-? (81), az IL-10 (82), az NGF (83) és a PGE 2 (84). Emellett különbözo stimulusokra kimutatták már az IL-1?, IL-3, IL-4, IL-5, IL-6, IL-8, IL-10, IL-12p35, IL-13, IL-16, TNF-?, GM- CSF, TGF-?, IFN-? és a VEGF szintézisét, az IL-2 hízósejtbeli expressziójáról viszont még soha nem számoltak be. A pontos citokinexpressziós profil a stimulus mellett a hízósejt típustól is függ. Emberi bor hízósejtek például anti-ige, a kalcium ionofór A23187, vagy a 48/80 20
21 vegyület hatására nem termelnek IL-3-at, IL-4-et, IL-5-öt és IL-13-at, és hasonlót figyeltek meg köldökvérbol differenciáltatott, éretlen hízósejteknél is IgE-függo indukció után (85). Ezzel szemben a nem szenzitizált tüdoben és az orr nyálkahártyájában található emberi hízósejtek, bár kis mennyiségben, de expresszálhatnak IL-4-et, például allergének hatására (86). Egér csontvelobol in vitro differenciáltatott hízósejtek, ha IL-3 jelenlétében tenyésztik, stimulálás után IL-4-et expresszálnak, amennyiben IL-3 helyett SCF van jelen, akkor IL-12-t (87). Ezek az adatok arra utalnak, hogy például az IL-4 termelése igen szigorúan szabályozott a hízósejtekben, és a mikrokörnyezettol függ A hízósejtek megkötik és internalizálhatják a baktériumokat A patogének elleni védekezési reakció során a kórokozó igen gyakran ellenanyagokkal és/vagy komplementfehérjékkel opszonizálódik. A hízósejtek ezeket az opszonizált patogéneket képesek felismerni és hozzájuk kapcsolódni. A C3 komplementfaktor különbözo fragmentjeivel burkolt Salmonella typhimurium-ot például a 3-as komplement receptoron (CR3) át kötik meg, majd ennek következtében a hízósejtek aktiválódnak (88). Ezen kívül a hízósejtek az Fc?RIII-at is expresszálják, így az IgG-vel fedett baktériumok sejtfelszíni megkötésére is van lehetoség (89). Az Escherichia coli és a Leishmania kórokozók felismerése viszont opszonintól független módon zajlik le. A patogének I-es típusú fimbriáin található mannózköto lektin, a FimH megkötésére képes a hízósejtek felszínén megjeleno mannóztartalmú CD48 molekula (90). Ennek a kapcsolatnak a fontosságára utal, hogy anti-cd48 ellenanyagokkal specifikusan meg lehetett akadályozni a FimH pozitív baktériumok és a hízósejtek között kialakuló kapcsolatot (91). A következo lépés során igen gyakran a kórokozó internalizálódik, és a hízósejtek vakuólumaiban mutatható ki. A hagyományos fagocitasejtek, mint a neutrofil granulociták vagy makrofágok a baktériumokat mind oxidatív, mind pedig nem oxidatív módon képesek elpusztítani. Az elobbi móddal kapcsolatban hízósejtekben kimutatták, hogy a FimH pozitív baktériumok serkentették a fagocita aktivitást, és a kórokozók szuperoxid anionok felszabadulása által pusztultak el (91). A nem oxidatív mód esetében különbözo proteázok, mint a kimázok játszanak igen fontos szerepet (92). Bár a legtöbb adat egér hízósejtekkel kapcsolatban látott napvilágot, úgy tunik, hogy emberi 21
22 köldökvér eredetu hízósejtek is képesek különbözo baktériumokat megkötni és internalizálni (93) A hízósejtek antigénprezentációja és kostimulációs aktivitása A hízósejtek képesek a T-sejtek számára antigént prezentálni, amit az MHC II és különbözo kostimulációs molekulák indukálható sejtfelszíni expressziója sejteni enged. A legtöbb egér és emberi hízósejt nyugalmi állapotban nem fejezi ki az MHC II-t. T- sejtek felülúszója, IFN-?, vagy LPS hatására azonban mind az egér in vitro differenciáltatott, mind pedig a patkány peritoneális hízósejteken megjelenik az MHC II (94, 95). A CD34 + /CD117 + /CD13 + humán hízósejt progenitorok egy részén megtalálható a HLA-DR, in vitro differenciáltatásuk során viszont expressziója eltunik (62). Különbözo gyulladásos vagy immunológiai betegségekben, például atopiás dermatitisben szenvedo betegek bormintái esetében ugyanakkor nem sikerült MHC II expressziót kimutatni (96). Ez arra utal, hogy ezen molekulának a hízósejtek felszínén történo megjelenése valószínuleg erosen függ a hízósejt érési és aktiváltsági fokától. A hízósejtek antigénprezentációs hatékonyságát segíti több, a limfocitákkal való kapcsolat kialakítását szolgáló, és a limfociták proliferációját serkento molekula sejtfelszíni megjelenése. Ezek közé tartozik például az ICAM-1, melynek expresszióját patkány, egér, valamint emberi borbol, tüdobol izolált hízósejtekben is leírták. Az ICAM-1 kifejezodését az IL-4, IL-13, TNF-? serkenti, a dexametazon viszont gátolja (97). Egy másik, szintén az immunoglobulin szupercsaládba tartozó adhéziós molekula, az ICAM-3 expressziója csak az immunsejtekre, köztük a hízósejtekre korlátozódik. Sejtfelszíni megjelenése jellemzo a Langerhans és dendritikus sejteken, a nyugvó limfocitákon, neutrofil granulocitákon, monocitákon, és az emberi borbol izolált hízósejteken is (98). A? 2 -integrinek közé tartozó LFA-1 expressziója szintén a leukocitákra korlátozódik, és az ICAM-1 és ICAM-3 ligandjaként szolgál. Sejtfelszíni megjelenését kimutatták peritoneális hízósejteken, borbol izolált, illetve köldökvérbol differenciáltatott humán hízósejteken. Mennyiségét a dexametazon negatívan befolyásolja (99, 100). 22
23 Az antigénprezentációban igen fontos CD80 és CD86 a limfociták CD28 molekulájával hat kölcsön, hízósejtekben pedig GM-CSF hatására jelenik meg (101). Egy másik, a B-sejtek CD40 molekulájához kapcsolódó és a B-sejtek proliferációját serkento kostimulációs molekula, a CD40L hízósejtekben való expresszióját is leírták (102), bár késobbi vizsgálatok csak humán bazofil granulociták felszínén találták meg, köldökvérbol differenciáltatott hízósejteken nem (103). Ugyanakkor az urticariaban, illetve az atopiás dermatitisben szenvedo betegek bormintáiban nem sikerült a jelenlétét kimutatni (97), ami a felfedezés humán vonatkozását megkérdojelezi A hízósejtek aktiválódnak a kórokozók megkötése után Miután a hízósejtek felszínükön az opszonizált kórokozókat megkötötték, különbözo mediátorokat termelnek és szabadítanak fel. A legismertebb ilyen vazoaktív mediátor a hisztamin. Az egér hízósejtekbol TNF-? és IL-6 is felszabadul az opszonizált baktériumokkal való találkozás során (90), humán köldökvérbol differenciáltatott hízósejtek esetében pedig a TNF-? felszabadulását figyelték meg (93). A TNF-? kijutásának két idobeli stádiuma van: a granulumokban eloregyártott formában raktározott fehérje ürítését néhány óra múlva az újonnan expresszálódó molekulák környezetbe való leadása követi (104). A kórokozók mellett azok oldható komponensei, mint az LPS (80) vagy különbözo toxinok is aktiválják a hízósejteket. A Staphylococcus enterotoxinja egér és patkány hízósejtekbol a szerotonin felszabadulását serkenti (105). A gyulladás helyén különbözo, a gazdaszervezet által termelt molekulák is aktiválhatják a hízósejteket: az IL-1 antigénspecifikus IgE és antigén jelenlétében (78), a fibrinogén, fibronektin fragmentjei (106), vagy a komplementaktiválódás során keletkezo C3a (komplement faktor 3a) és C5a is stimuláló hatással bír (88). Fontos továbbá megemlíteni, hogy a hízósejtek differenciálódásában fontos szerepet játszó SCF kemoattraktánsként viselkedik, és a citokintermelést sok körülmény közepette serkenti. Egér vékonybél epitelsejtekben fertozés során az SCF mennyisége megemelkedik, ami a hízósejtek számának lokális emelkedését eredményezi. A hízósejtek ezután proinflammatorikus citokinek termelésével a fagocitáló neutrofilokat odavonzzák (107). Amennyiben azonban az SCF mellett IL-4 is jelen van a környezetben, a hízósejtek inkább Th2-es citokineket expresszálnak (107). 23
24 A hízósejtek szerepe az akut gyulladásban A hízósejtek immunrendszeren belül betöltött szerepét nehéz volt in vivo vizsgálni, hiszen igen heterogének, sokféle mediátor termelésére képesek, melyek gyakran egymással ellentétes hatásúak, és a mediátorok más sejttípusokból is származhatnak. Áttörést jelentett a WBB6F1-W/W v egerek felfedezése, melyekben a c- kit, az SCF receptora hibás (108), ezért hízósejteket csak nagyon alacsony számban tartalmaznak. Ezen egerek vizsgálata során bebizonyosodott, hogy a hízósejtek kulcsszerepet játszanak az akut gyulladásban. A granulumokból felszabaduló hisztamin a lokális véráramlási sebességet és az érfal áteresztoképességét egyaránt megnöveli, ezáltal elosegíti a gyulladásban szerepet játszó vérsejteknek és az ellenanyagoknak a bakteriális fertozés helyére történo odajutását. A neutrofil granulociták megjelenésében a hízósejtekbol immunkomplex által közvetített TNF-? felszabadítás játszik fontos szerepet (109). Ezt igazolja, hogy anti-tnf-? ellenanyaggal a hízósejtek degranulációját 6-12 órával követo késoi borválasz tüneteit, melyre a nagy mennyiségu leukocita szöveti beáramlása jellemzo, jelentosen csökkenteni lehetett (110). A hízósejtekbol származó citokinek befolyásolják ugyanis a leukociták és az endotélsejtek között kialakuló kezdeti, gyenge kapcsolódást. Ebben a hisztamin H1R-on át megvalósuló hatásának is szerepet tulajdonítanak, mely serkenti a P-szelektin expresszióját és a leukociták rolling folyamatát (gördülés) (111). A TNF-? ezen kívül serkenti az endoteliális sejtek E-szelektin expresszióját, valamint atópiás személyekben az allergénnel való találkozást követoen megemelkedett ICAM és VCAM sejtfelszíni megjelenés mutatható ki (112). Az aktivált hízósejtek, vagy kondicionált tápfolyadékuk az ICAM-1 és VCAM-1 expresszió indukciójával elosegítik a T-sejtek és az emberi endotélsejtek, ill. fibroblasztok közötti adhéziót, amely a lokális gyulladás kialakulásának egy további lépését jelenti (lásd korábban, 112). Az MCP-1 kemokin expressziója pedig a polimorfonukleáris sejteknek a helyszínen való feldúsulását okozza (113). A hízósejtek limfocitákra gyakorolt kemotaktikus hatásáról csak az utóbbi idoben szereztünk értékes adatokat. Kimutatták például, hogy a granulumokból felszabaduló triptáz a környezo endotélsejtekben IL-8 szintézist indukál (114). Az aktivált hízósejtek limfotaktint is szecernálnak, egy olyan molekulát, mely elsosorban a 24
25 CD8+ limfocitákra gyakorol kemotaktikus hatást. Emberi differenciáltatott és tüdobol izolált hízósejtek C5a fragment hatására IL-16 expressziót mutatnak, mely fehérje a CD4+ T-sejteket vonzza oda a megfelelo helyre (115) A hízósejtek kapcsolata a hiperszenzitivitási reakciókkal és az asztmával Különbözo kísérletek, amikor W/Wv hízósejthiányos egerekbe hízósejteket injektáltak, megerosítették, hogy ez a sejttípus a passzív kután anafilaxiás reakciókban igen fontos. Több tanulmány utal arra, hogy a hízósejtek az emberi, IgE-vel kapcsolatos I-es típusú túlérzékenységi reakció azonnali fázisában is nélkülözhetetlenek. Több allergiás beteg esetében az allergénnel való találkozás után 4-8 órával a borben egy perzisztens duzzanat és leukocita infiltráció figyelheto meg. Az IgE-tol függo reakciók több, klinikailag fontos, a légzorendszerben, bélrendszerben vagy a borben megfigyelheto következménye valószínuleg inkább az odaérkezo leukociták hatásának, semmint a hízósejtekbol felszabaduló mediátorok közvetlen hatásának tudható be. A hízósejtek ebben az esetben a fehérvérsejtek lokális felgyülemlésében játszanak kulcsszerepet, ebben mind a citokinek, a proteázok (kimázok, triptáz), a biogén aminok, mind pedig a lipid mediátorok részt vesznek. A beérkezo leukociták között pedig bazofilok, eozinofilok, neutrofilok, limfociták és monociták is megtalálhatók (116). Az allergiás és atopiás asztmatikus reakciókban a hízósejtek, úgy tunik, a kötoszöveti elváltozásokban, a nyáktermelés megemelkedésében, az epitelsejtek osztódásának fokozódásában, illetve az eozinofil granulociták infiltrációjában egyaránt szerepelnek (116). Ezzel szemben a légúti hiperreaktivitás kialakulásával kapcsolatban meglehetosen bizonytalanok az adatok. Minden valószínuség szerint ez a tünet két úton is kialakulhat, az egyikben az IgE és a hízósejtek játszanak kulcsszerepet (117), a másikban viszont az IL-5 és az eozinofil granulociták (118). Az, hogy melyik mechanizmus dominál az adott kísérletben, a pontos szenzitizálási protokolltól és a bronchoprovokációk gyakoriságától is függ. Az I-es típusú túlérzékenységi reakcióval ellentétben korántsem ennyire világos a hízósejtek szerepe a késoi hiperszenzitivitási reakcióban. Az egymásnak ellentmondó irodalmi adatok alapján az a kép bontakozik ki, hogy a hízósejtek csak a makrofágoktól nem függo típusban fontosak, melyet albuminnal és inkomplett Freund- 25
26 adjuvánssal szoktak kiváltani. Klasszikus esetben, mint a tuberkulin-reakciónál, a vazoaktív aminokra csak a korai szakaszban van szükség, és ezek más forrásból, például vérlemezkékbol is származhatnak (119) A hízósejtek szerepe a baktériumok és férgek elleni immunválaszban Szintén a c-kit mutáns egértörzsben végzett vizsgálatok derítettek fényt a hízósejtek akut fertozésben betöltött központi szerepére. A hízósejt deficiens egerek tüdejében kísérletesen eloidézett enterobakteriális fertozés során nagyobb halálozási arányt mutattak ki ezen állatoknál, és a kórokozók eliminálásában is kevésbé voltak hatékonyak, mint a vad típusúak. Hízósejtek bejuttatása után viszont ez az eltérés a vad és mutáns állatcsoportok között megszunt. A baktériumok csökkent elpusztítási képessége alacsonyabb TNF-? szinttel és neutrofil granulocita számmal járt együtt (120, 121). A TNF-? egyrészt a hízósejtek és a FimH pozitív baktériumok közötti kapcsolat hatására szabadulhat fel (120), másrészt a komplementrendszer aktiválódása is hasonló eredményhez vezethet. A C3 génkiütött egerekben a hízósejtek csökkent degranulációs képességét, fertozés után alacsonyabb TNF-? szintet és kisebb neutrofil granulocita számot figyeltek meg (122). A bakteriális fertozések során a hízósejtekbol felszabaduló TNF-? a venulák endotélsejtjeinek felszínén fokozza az E-szelektin megjelenését, indukálja a neutrofil kemoattraktánsok, mint például az IL-8 szintézisét, valamint serkenti a fehérvérsejtekben az integrinek expresszióját. Mindez a hatás a neutrofil granulocitáknak a fertozés helyén történo összegyulését eredményezi. A hízósejtek fontosságára utal a differenciálódásukat/kemotaxisukat elosegíto növekedési faktor, az SCF ismételt bejuttatása vad típusú állatokba. Azt tapasztalták, hogy az SCF fokozta a peritoneális baktériumfertozések elleni rezisztenciát, és ez a hatás a hízósejt deficiens egerekben nem volt megfigyelheto (123). Bár a TNF-? központi szerepe az in vivo kísérletek alapján nem vonható kétségbe, a hízósejtekbol még sok más mediátor is felszabadulhat, melyek a baktériumok elleni immunválaszt elosegítik. Ilyen mediátor például a potenciális kemotaktikus faktor, a leukotrién B 4 (LTB4), vagy a simaizomsejtek kontrakcióját eloidézo leukotrién C 4, melyek hatását szintén vad típusú és c-kit mutáns egértörzseken 26
27 vizsgálták. A leukotrién szintézisét gátló anyagok jelenlétében fokozott mortalitást tapasztaltak E. coli peritoneális injekciója után vad típusú egerekben; ez a hatás nem volt kimutatható a hízósejt mentes állatokban (124). Hasonló kísérletek során derült fény arra is, hogy a hízósejtek granulumaiban tárolt triptáz szintén a neutrofilok bevándorlását serkenti (125). Egyéb, a hízósejtek által eloállított kemotaktikus mediátor még a MIP-1?, a MIP-1?, a MIP-2, a RANTES, az IL-8, vagy az IL-16. Régebbi megfigyelés, hogy a féregfertozéseket a hízósejtek számának emelkedése és aktivációjuk kíséri. A hízósejt prekurzorok a perifériás vérbol és a csontvelobol a vékonybélfalba vándorolnak (126), majd T-sejt dependens módon osztódni kezdenek, melyben az IL-3, IL-4, IL-5 és IL-9 citokineknek van kiemelt szerepük (127). A kezdeti fertozés során a hízósejteket a paraziták különbözo komponensei, majd késobb a parazita-specifikus IgE aktiválhatja. A felszabaduló mediátorok egyrészt közvetlenül károsíthatják a férget, illetve a nyák túltermelés, a bélmozgás serkentése (128), vagy az iontranszport módosítása és a bélbe történo folyadékbeáramlás (129) mind a parazita távozását segítik elo Az IL-9 Az IL-9 egy pleiotróp citokin, mely foleg az aktivált T-sejtekbol és hízósejtekbol szabadul fel. Eredetileg egér T-sejt klónok egy alcsoportján ható növekedési faktorként fedezték fel (130), élettani szerepe azonban egészen a legutóbbi idokig homályban maradt, amikor genetikai vizsgálatok és in vivo, valamint in vitro kísérletek rávilágítottak például az asztmában betöltött lehetséges szerepére. Az IL-9-et szisztematikusan (131) vagy tüdospecifikusan (132) túlexpresszáló egerekben az asztmára jellemzo tünetek alakultak ki. A tüdo szöveteiben eozinofil infiltráció, a légútban nyák túltermelés volt megfigyelheto, ezen kívül az intraepiteliális hízósejtek száma és az IgE-szint megemelkedett, valamint fokozott szubepiteliális fibrózist és légúti hiperreaktivitást lehetett kimutatni. Ezzel szemben az IL-4 tüdobeli túlexpresszáltatása esetén az eozinofilok száma csak kissé emelkedett meg, és légúti hiperreaktivitás sem volt megfigyelheto (133). Az IL-9 asztmában betöltött fontos szerepére utalnak a genetikai kapcsoltsági elemzések is, melyek során az emberi 5q31- q33-as kromoszómaterületre figyeltek fel, mint az IL-4, IL-5, IL-9, IL-13, több növekedési faktor és receptorának génjeit tartalmazó régióra (134). Egereken végzett 27
28 vizsgálatok alapján a légúti hiperreaktivitás a 13. kromoszóma egy kis szakaszához kötheto, ahol az IL-9 génje található. Fontos felfedezés, hogy ez a terület homológ az emberi 5q31-q33 régióval, az IL-4, IL-5 és IL-13 génjét tartalmazó szintenikus terület viszont az egér 11. kromoszómáján található (135), ami egyértelmuen az IL-9 szerepét jelzi. További bizonyíték, hogy a C57BL/6 (B6) egértörzsben a légúti hiperreaktivitás alig váltható ki, ezzel párhuzamosan az IL-9 ebben a törzsben nem detektálható. Az IL- 9-et nagy mennyiségben expresszálni képes DBA/2J egerekben viszont jelentos légúti hiperreaktivitás alakulhat ki, míg az IL-9 termelés tekintetében a középúton járó (B6D2)F 1 állatokban csak mérsékelt (135). Ezen három különbözo egértörzsben az IL-4 és az IL-5 expresszió mértékében viszont nem találtak különbséget. Ha a B6 egerek tüdejébe rendszeresen, 10 napon át rekombináns IL-9-et juttattak be, akkor az asztma valamennyi jellemzoje kialakult, köztük a légúti hiperreaktivitás is (136). Egy humán vizsgálatban továbbá az IL-9 expressziós szintje és az asztma, illetve a légúti hiperreaktivitás között magasan szignifikáns és specifikus asszociációt kaptak immunhisztokémiai és in situ hibridizációs kísérletek alapján (137). Mindezen adatok figyelembevételével az IL-9-et tekinthetjük a légúti hiperreaktivitás és az asztma kialakulásában az egyik legfontosabb kulcstényezonek. Az IL-9-rol ugyancsak ismert, hogy serkenti az egér és emberi hízósejtek proliferációját és differenciációját (60, 65), stimulálja a hízósejtre specifikus mmcp- 1, mmcp-2 és mmcp-4 proteázok expresszióját (138), és az IL-9 transzgenikus egerek keringési rendszerében magasabb az mmcp-1 koncentráció (139). Nem meglepo, hogy az IL-9 transzgenikus egerek tüdejében az IL-9 indukciója után több hízósejt mutatható ki (132). Ezen kívül az IL-9 hízósejtvonalakban serkenti a nagy affinitású IgE receptor? -láncának mrns szintézisét (140) és az IL-6 szekréciót. Az IL-9 a hízósejteken kívül az eozinofilok tüdobeli felhalmozódásában is szerepet játszik. Serkenti az eozinofil progenitorok osztódását, felszínükön az IL-5 receptor? -láncának megjelenését, továbbá hatására a tüdo epitelsejtjei eotaxint és egyéb kemokineket termelnek, melyek elosegítik az eozinofil granulociták tüdobe történo bevándorlását (141, 142, 143). Longphre M és munkatársai vizsgálatai során kiderült továbbá, hogy az IL-9 a légút epitelsejtjeiben serkenti a nyáktermelést, és az allergiás légúti megbetegedések során jelentos mértékben felelos ezért (144). 28
29 Az IL-9, bár az adatok alapján indirekt módon, a B-sejtek IgE-termelését is szabályozza. Noha önmagában nem serkenti az ellenanyagtermelést, LPS által in vitro indukált egér B-sejtekben az IL-4-gyel szinergisztikus hatást fejt ki az IgE-termelésre (145). Egér perifériás T-sejtekben úgy tunik, hogy az IL-1 serkenti (146), az IL-12, az IFN-? és az IFN-? /? pedig gátolja az IL-9 expressziót (147, 148). Az IL-9 transzgén egereknél figyelték meg, hogy az IL-9 indukciója után a speciális B1 sejtpopuláció mérete növekedett meg, és ezen sejtek aktiválódtak, ami izgalmas új kérdéseket vet fel a B1 sejtpopuláció szerepét illetoen (149). A féregfertozések elleni immunválasz igen sok hasonlóságot mutat az allergiával, asztmával, például a magas IgE-szint, vagy a hízósejtek és eozinofil granulociták számának növekedése tekintetében. Egerekben megfigyelheto a mucosa réteg hízósejtjeinek felszaporodása tipikusan Th2 citokinek, köztük az IL-9 termelodésének eredményeként például Trichuris muris féregfertozés során (139). Bizonyos egértörzsek ezen fertozéssel szembeni rezisztenciája és a mezenteriális nyirokcsomókban az IL-9 expresszió között szoros korrelációt lehetett kimutatni (150), valamint az IL-9 fokozza az ellenállóképességet (151). Az endogén IL-9 blokkolása esetén az eozinofilok a bélrendszerben nem tudnak felszaporodni, és a szervezet nem képes a parazitától megszabadulni (152). 29
30 2.4. Az embrionális ossejtek differenciációs potenciálja Az embrionális ossejtek (ES sejtek) a blasztociszta embriócsomójából (inner cell mass, ICM) származó pluripotens sejtek, melyek a trofoblasztok kivételével valamennyi differenciálódott sejttípus eloállítására képesek. Ezért a hízósejtek korai embrionális megjelenésének vizsgálatában modellrendszerként jól felhasználhatók. Az egér ES-sejtek leukémia gátló faktor (LIF, 153), az emberiek több más növekedési faktor (154) jelenlétében, sejtvonaltól függoen zselatinon vagy egér embrionális fibroblasztok rétegén tarthatók fenn differenciálatlan állapotban. A LIF elvonása után differenciálódni kezdenek, ez a spontán folyamat azonban nem vezet végdifferenciálódott sejttípusok kialakulásához. A különbözo, a szervezetet felépíto sejttípusok eloállításához speciális környezetre és differenciáltatási technikákra van szükség (4. ábra). 4. ábra. Példák az egér embrionális ossejtek differenciáltatási lehetoségeire. Az egér embrionális ossejtek pluripotens jellegük miatt kiváló modellrendszert biztosítanak az egyes sejttípusok kialakulásának tanulmányozására, illetve az embrionális fejlodés in vitro modellezésére. Számtalan, gyógyászati szempontból is 30
31 érdekes sejttípust állítottak már elo embrionális ossejtekbol, ami segíti a pontos differenciálódási folyamatok megértését és az egyes eloalakok tanulmányozását, ezáltal késobbi potenciális gyógyászati felhasználásuk felbecsülhetetlen értéku. Az egyik elterjedt technika során a differenciáltatás kezdetén az ES-sejteket nem hagyják letapadni a tenyészedény aljához, ezáltal sejtaggregátumokat, ún. embrioid testeket (EB) képeznek. Az EB-k bizonyos ideju szuszpenziós vagy szemiszolid médiumban történt tenyésztése után viszont különbözo anyagokkal bevont aljzatú edényekre tapasztják le oket, és a kivándorlás során megjeleno differenciálódott sejttípusokat elemzik. Ideális esetben sikerül olyan körülményeket találni, hogy a megjeleno sejtek legnagyobb része egyetlen sejttípushoz tartozik. Lényegében ezzel a módszerrel sikerült mind a kamrára, mind pedig a pitvarra jellemzo szívizomsejteket eloállítani (155). A neurális progenitorok keletkezése szempontjából fontos a bfgf növekedési faktor és a nesztin pozitív sejtek kiválogatása, amelyekbol ezután speciális körülmények között glutamát-pozitív és GABA-pozitív érett idegsejtek állíthatók elo (156). Érdekes módon az inzulint szecernáló hasnyálmirigy? -sejtek kialakulásához szintén a nesztin-pozitív sejtekre van szükség, de a végso differenciálódást a nikotinamid segítette elo (157). A gliális sejtek keletkezéséhez több növekedési faktor kombináció megfelelo sorrendu alkalmazása bizonyult szükségesnek: bfgf2 után bfgf2 és epidermális növekedési faktor (EGF) kell, majd az EGF-et PDGF-re kellett lecserélni (158). ES sejtekbol eloállítottak már zsírsejteket is, itt a differenciálódás megfelelo idoszakában retinsavra, majd késobb inzulinra volt szükség. A differenciálódást elosegíto anyagok csak meghatározott idointervallumban bizonyultak hatásosnak (159). Az EB-k belsejében különbözo vérsejt prekurzorok exogén növekedési faktorok jelenléte nélkül is kialakulnak. Ezeknek a prekurzoroknak a megjelenési ideje szigorúan szabályozott: a primitív eritroid prekurzorokat követik a makrofág és a definitív eritroid prekurzorok, majd a neutrofil/makrofág bipotenciális eloalakok után jelennek meg a hízósejt prekurzorok (160). Az érett fehérvérsejtek kialakulását azonban az exogén növekedési faktorok elosegítik. Nemcsak az egér, hanem a humán EB-kon belül is kimutatható a hemopoézis, melyet a csont morfogenetikus fehérje 4 (BMP-4) és különbözo citokinek serkentenek (161). Egér ES sejtekbol IL-3 és SCF segítségével differenciáltatott hízósejtek expresszálták a jellegzetes proteázokat, a c-kit receptort, a 31
32 nagy affinitású IgE receptort, stimulálásra degranulálódtak, W/Wv egerekbe való bejuttatásuk után túléltek és muködoképesek voltak, amint azt tipikus, IgE-tol és hízósejtektol függo immunológiai válaszreakciók tanulmányozása során megállapították (162). Az EB technika alkalmazásával a dendritikus sejtek eloállításánál is jelentos sikereket értek el. Fejlodésükhöz a granulocita-monocita növekedési faktor (GM-CSF) és az IL-3 együttes jelenlétére volt szükség (163). Sokkal nehezebb feladatnak bizonyult a limfoid irány eloállítása. A korai próbálkozások az EB technikát alkalmazták, de a limfoid progenitorok keletkezéséhez olyan speciális körülmények voltak szükségesek, mint például alacsony oxigén koncentráció (164). Éppen ezért újdonságot jelentett az OP9, makrofág kolónia stimuláló faktor (M-CSF) termelésére képtelen sztróma sejtvonal felhasználása az ES sejtbol kiinduló hemopoetikus differenciáltatásban. Nakano és munkatársai kimutatták, hogy az M-CSF jelenléte a makrofágok kivételével a legtöbb fejlodési irány kialakulását meggátolja. Éppen ezért az ES sejteknek az OP9 sztróma sejtvonallal való együtttenyésztése a legtöbb fehérvérsejttípus kialakulását elosegíti (165). Kísérleteik során neutrofil granulocitákat, makrofágokat, eritroid sejteket, hízósejteket, megakariocitákat és pre-b limfocitákat kaptak. A T-sejtek eloállításához az OP9 módszerrel keletkezett pre-hemopoetikus progenitorokat kell izolálni, majd fötális tímusz kultúrában tovább tenyészteni (166). 32
33 3. CÉLKITUZÉSEK A hisztaminnak a hízósejtekre gyakorolt hatását két fontos nézopontból vizsgáltuk meg. Abból az érdekes megfigyelésbol indultunk ki, hogy a genetikailag hisztaminhiányos egerekben a hízósejtek csökkent számban vannak jelen. Feltételeztük, hogy ezen fenotípus módosulás hátterében a hízósejtdifferenciáció változása áll. Így az elso kísérletsorozatban a következo kérdésekre kerestük a választ: Kimutatható-e a csökkent hízósejt arány a HDC-/- egerek csontvelojébol alapított sejttenyészetekben? Ha igen, akkor mely fázisban gátolt a differenciáció? A HDC-gátló? -fluorometil-hisztidin (? -FMH) hatással van-e a vad típusú tenyészetek differenciálódására, ill. ezzel párhuzamosan a hisztamin a HDC-/- sejtekére? Célunk volt a hisztamin hatásának bizonyítása egy másik, független modellrendszerben is az embrionális ossejtek felhasználásával. Ehhez meg kellett határoznunk, hogy a HDC és a hisztamin receptorok a differenciáció melyik fázisában expresszálódnak. Minthogy kimutatták, hogy a HDC-/- peritoneális hízósejtek granulumai kevésbé elektrondenzek, mint a vad típusúaké, ezért a HDC-/- hízósejtek muködésbeli eltérései is érdeklodésünk középpontjába kerültek. Itt elsosorban az IL-9, egy jellegzetesen multifunkcionális, a hízósejtek osztódását serkento citokin hatását vizsgáltuk. Kérdéseink: Milyen citokineket indukál az IL-9 egyedül, vagy IgE/antigénnel ill. ionomycinnel együttesen? Az IL-9 által indukált citokinek milyen idobeli kinetikával jellemezhetok? Hogyan fejti ki hatását az IL-9? Hogyan befolyásolja az IL-9 a hízósejtek hisztamin felszabadítását? Mi a különbség a vad típusú és a HDC-/- hízósejteknek IL-9 stimulusra adott citokinexpressziós válasza között? 33
34 4. ANYAGOK ÉS MÓDSZEREK 4.1. A kísérletek során felhasznált állatok Kísérleteink során 2-4 hónapos hím egereket használtunk. A HDC-/- genetikailag módosított állatok eloállítását Ohtsu és munkatársai intézetünkkel kollaborációban végezték, melynek során a HDC gén 8-as, a piridoxál-foszfát kötohelyet kódoló kulcsfontosságú exonját eltávolították (37). Kísérleteinkben CD1-es és Balb/c genetikai hátteru állatokat vizsgáltunk. Az egereket a kísérletek elott 3 héttel (ez az elozetes vizsgálatok alapján elég a genetikailag módosított egerek esetében arra, hogy a vér hisztaminszintje az alkalmazott hisztamin ELISA kit kimutatási határa alá csökkenjen) hisztaminban szegény diétára (Altromin Gmbh, Németország) tettük Reagensek A kísérletekben az alábbi cégek reagenseit használtuk fel: Rekombináns egér interleukinok és növekedési faktorok: SCF (Serotec, Oxford, UK), IL-3 (Serotec vagy Sigma-Aldrich, St Louis, MO, USA), IL-9 (Sigma-Aldrich), IL-1? (Biosource International, Solingen, Németország), LIF (Sigma-Aldrich), kontroll kecskeszérum (Sigma-Aldrich). Reagensek szövettenyésztéshez: RPMI 1640, DMEM 4500 mg/l glükóztartalommal, IMDM, sztreptomicin és penicillin, nátrium-piruvát, MEM nem esszenciális aminosavak, fehérjementes hibridóma médium II (PFHM II), tripszin, aszkorbinsav (valamennyi a Sigma-Aldrich-tól), FCS (PAA Laboratories, Linz, Ausztria), metilcellulóz (Methocel; Fluka Chemie AG, Buchs, Svájc), zselatin és holo-transzferrin (Sigma-Aldrich). Ellenanyagok: allofikocianinnal jelölt anti-egér c-kit (CD117), fikoeritrinnel jelölt anti-egér Mac1 (CD11b), fikoeritrinnel jelölt anti-egér CD3 és B220, anti-egér Thy1 (Pharmingen, San Diego, CA), biotinnal konjugált anti-egér IgM (Sigma-Aldrich), sztreptavidin-cy5 (DAKO, Dánia), poliklonális antiegér triptáz (Dr. Gunnar Pejler ajándéka, Swedish University of Agricultural Sciences), FITC-cel jelölt anti-egér komplement receptor 1 és 2 (7g6 klón), anti-egér komplement receptor 1 FITC (8c12 klón), FITC-cel jelölt anti-egér Fc?RI ellenanyag (Prof. Dr. Erdei Anna ajándéka, ELTE Immunológia 34
35 Tanszék), neutralizáló anti-egér IL-1? (Sigma-Aldrich), neutralizáló nyúl antiegér IL-3 (Serotec), nyúl anti-hisztamin monoklonális ellenanyag (Sigma- Aldrich), FITC-cel jelölt anti-nyúl IgG (Sigma-Aldrich). Valamennyi ellenanyagot a gyártó által megadott mennyiségben alkalmaztuk, az anti-egér triptáz ellenanyagot 1:50 hígításban, a neutralizáló anti-egér IL-3-at pedig funkcionális tesztekben 5? g/ml koncentrációban. ELISA: hisztamin ELISA (Invitrogen, Carlsbad, CA vagy Immunotech, Marseilles, Franciaország) A hisztamint, a H1R antagonistát (triprolidin) és a HDC gátlószerét, az? - fluorometil-hisztidint a Sigma-Aldrich-tól vásároltuk. Izotópok: a 3 H-timidint az Amersham-tól (Piscataway, NJ, USA), az uridin (? - 33 P)-trifoszfátot pedig az Izotóp Intézettol (Budapest) vettük A peritoneális sejtek kinyerése A peritoneális sejtek kinyeréséhez az állatoknál cervikális diszlokációt hajtottunk végre, majd a hasüregbe kb. 10 ml jéghideg PBS-t injektáltunk. Rövid inkubáció után a folyadékot kiszívtuk, és a folyamatot még egyszer megismételtük. A peritoneális folyadékot további feldolgozásig jégen tartottuk Sejttenyészet alapítása Az egerek combcsontjait steril körülmények között FCS-sel mostuk át, majd a kinyert sejteket PBS-sel 2x megmostuk. A magvas sejtek számának meghatározásához a sejtszuszpenzióból mintát vettünk, ezt 10 percig 3%-os ecetsavban inkubáltuk a vörösvértestek lízise érdekében. A sejteket 1x10 6 sejt/ml koncentrációban RPMI + 10% FCS + 1 mm nátrium-piruvát U/ml penicillin és 0,1 mg/ml sztreptomicin tápoldatban tenyésztettük, mely IL-3 forrásként bizonyos kísérletekben 20% Wehi 3B felülúszót (a Wehi 3B IL-3-at termelo sejtvonal) vagy 2-3 ng/ml rekombináns egér IL- 3-at tartalmazott. Az SCF-et 40 ng/ml, a hisztamint 10-5 M vagy 200?M, az? - fluorometil-hisztidint (? -FMH) pedig az intézet korábbi tapasztalatai alapján hatásosnak bizonyult 5x10-5 M koncentrációban alkalmaztuk. A nem adherens sejteket 5-6 naponként friss tenyészedénybe tettük, közben a tápfolyadék felét lecseréltük. A 35
36 citokinexpressziós vizsgálatokhoz a hízósejteket rekombináns egér IL-3 és SCF jelenlétében napig tenyésztettük Enzimhisztokémia és alciánkék-safranin festés A triptáz aktivitás detektálásához egy enzimhisztokémiai módszert állítottunk be. A citocentrifugált sejteket 0,6%-os paraformaldehid és 0,5% ecetsav keverékében 5 percig fixáltuk, majd 0,5 mg/ml mesterséges szubsztrát (Z-Gly-Pro-Arg-4-M? NA, Bachem AG, Svájc) és 0,5 mg/ml Fast Blue B (Serva, Heidelberg, Németország) jelenlétében 37 o C-on inkubáltuk 90 percig. A triptáz pozitív sejtek arányát azután 6-8 véletlenszeruen kiválasztott látómezoben határoztuk meg. A hízósejtek granulumaiban található savas poliszacharidok alciánkék-safranin festéssel történo kimutatásához a sejteket jéghideg metanolban 10 percig fixáltuk, majd 35 percig a festékoldatban szobahomérsékleten inkubáltuk Szemiszolid kolónia-teszt A csontvelobol kimosott sejteket 1% metilcellulózt tartalmazó médiumban tenyésztettük 1x10 5 sejt/ml induló sejtkoncentrációval. A megjeleno különbözo morfológiájú kolóniákat a 14. napon fáziskontraszt mikroszkóp (Nikon Diaphot, TMD) segítségével számoltuk meg A CCE embrionális ossejtvonal fenntartása és differenciáltatása A kísérletek során az egér embrionális fibroblasztok jelenlétét nem igénylo, és a hemopoézis tanulmányozásában irodalmi adatok alapján gyakran használt CCE egér embrionális ossejtvonalat DMEM (4500 mg/l glükóztartalommal) + 15 % FCS + 1 mm nátrium-piruvát U/ml penicillin és 0,1 mg/ml sztreptomicin + 1 % MEM nem esszenciális aminosavoldat + 0,4 mm?-merkaptoetanol + 10 ng/ml LIF jelenlétében tartottuk fenn differenciálatlan állapotban. A tenyésztéshez használt edényeket 0,1 %-os zselatinnal elokezeltük, majd a felhasználás elott a zselatinoldatot eltávolítottuk és az edényeket 10 percig szárítottuk. Az embrionális ossejtek differenciáltatása során DMEM helyett IMDM-et használtunk, melyet a fentiek mellett még 50? g/ml aszkorbinsavval, 200? g/ml holotranszferrinnel és 5% fehérjementes hibridóma médiummal (PFHM II) is 36
37 kiegészítettünk. A differenciáltatást 2x10 4 /ml sejtkoncentrációval olyan bakteriális petricsészékben indítottuk el, melyben a kialakuló sejtaggregátumok (embrioid testek, EB) nem tudtak letapadni. 12 nap után a vörösvérsejteket tartalmazó (hemopoetikus) EB-kat mikroszkóp alatt kiválogattuk, és zselatinnal elokezelt szövettenyészto edényekbe tettük 3 ng/ml IL-3 és 40 ng/ml SCF jelenlétében. A letapadt EB-ból megjeleno úszó sejteket nap múlva értékeltük A 3 H-timidin inkorporáció meghatározása 4x10 3 CCE ES sejtet tettünk 24-lyukú lemezek minden lyukába 10 ng/ml LIF jelenlétében vagy hiányában, majd 72 óra inkubáció után a 3 H-timidin inkorporációt a (167) leírásával megegyezoen végeztük el. A radioaktivitás kiértékeléséhez a Packard BioScience (Groningen, Hollandia) Ultima Gold szcintillációs folyadékát és a Beckman (USA) LS5000TA készülékét használtunk Áramlási citometria (FACS) A mintákat PBS + 1% BSA oldatban jelöltük meg a megfelelo ellenanyag(ok)kal 20 percig szobahomérsékleten, majd sejtet elemeztünk FACSCalibur áramlási citométerrel (Becton Dickinson, Heidelberg, Németország). A triptáz detektálásához a sejteket eloször 4%-os paraformaldehidben 20 percig fixáltuk, majd 0,1%-os szaponinnal (Sigma-Aldrich) 5 percig permeabilizáltuk. A hisztamin áramlási citometriás kimutatása során a sejteket 4%-os EDAC-kal (Sigma-Aldrich) fixáltuk RT-PCR Az RNS izolálása Chomczyinski módszere (168) szerint történt. Az RNS minoségét 2%-os etidium-bromidos agaróz gélen ellenoriztük. A HDC, H1-receptor és H2-receptor kimutatása során a mintákat a reverz transzkripció elott DN-ázzal emésztettük meg a gyártó ajánlása szerint (Promega, Madison, WI, USA). A reverz transzkripcióhoz 5mM MgCl 2 -ot, 1 mm dntp-t, random hexamer primert (Promega), RNasin RN-áz gátlót (Promega), 50 U/reakció MuLV reverz transzkriptázt (Applied Biosystems, Foster City, CA, USA) és 0,5-2? g RNS-t használtunk 40? l végtérfogatban. A PCR-reakcióhoz használt primerek szekvenciáit, az alkalmazott ciklusszámot, az anellálási homérsékletet és a termékek hosszát az 1. táblázat foglalja 37
38 össze. Valamennyi reakció egy 94 o C-os 4 perces denaturációval kezdodött, és egy 72 o C-os 10 perces lépéssel végzodött. A vizsgált géntermék mmcp-6 mmcp-5 Fc?RI? HDC H1R H2R GAPDH Forward primer ACTGTCCCTCC TGGCTAGTC GTTCCAGCACC AAAGCTGGAG TGCCCAGCTGT GCCTAGCAC GGATGATGGTA CACTTTGACTG CCTCTCCGACT GTCTTCAGC TCCTTCAAGTG GAGGTTTGG CAGTATGACTC CACTCACGGC Reverz primer Anellálási Alkalmazott A termék homérséklet ciklusszám hossza TTCACAGGGAC CTCAAGCTC AGTTGAAGTTG GCAGAGAGTG CCACCTGCCTA AGATAGCCC TGTCTGACATG TGCTTGAAGAT AGGACTGTCG ATCCACCAAG CTGGTCCCATT TCTGCTGTT TCACGCCACAG CTTTCCAGAG 55 o C bp 55 o C bp 55 o C bp 55 o C bp 59 o C bp 58 o C bp 55 o C bp 1. táblázat. Az RT-PCR reakciókban vizsgált géntermékek, a felhasznált primerek szekvenciái, az anellálási homérsékletek, az alkalmazott ciklusszámok és a keletkezett termékek hossza Hisztamin ELISA A stimulált és nem stimulált hízósejttenyészetek (1x10 6 sejt/ml) felülúszójának hisztamintartalmát hisztamin ELISA kittel határoztuk meg. Az eljárást a gyártó leírása alapján végeztük A hízósejtek stimulálása A citokinexpressziós profil meghatározásához a hízósejteket 0,5? g/ml ionomycinnel (Sigma-Aldrich) és/vagy 30 ng/ml IL-9-cel, vagy ionomycin + 10 ng/ml IL-1? -val stimuláltuk 2 ng/ml IL-3 és 30 ng/ml SCF jelenlétében. Néhány kísérletben a sejteket dinitrofenil-bsa-ra (DNP 11 -BSA) specifikus egér IgE-vel (aszciteszbol 38
39 származott, 3? l/10 6 sejt, Prof. Dr. Erdei Anna ajándéka, ELTE Immunológia Tanszék) egy éjszakán át szenzitizáltuk, majd a felesleges IgE-t kétszeri Tyrode pufferben történt mosással távolítottuk el. Ezután a sejteket 37 o C-on 200 ng/ml DNP 11 -BSA antigénnel inkubáltuk 30 ng/ml IL-9 jelenlétében vagy hiányában RPA (RNase protection assay) Az RPA-hoz mintánként kb. 5?g RNS-t használtunk fel. A vizsgálatokhoz az mck1b (IL-4,5,10,13,15,9,2,3,IFN-?) és mck2b (IL-12p35,12p40,10,1a,1b,IL- 1Ra,18/IGIF,6,IFN-?,MIF) multipróba sorozatok, az in vitro transzkripciós kit és az RPA kit a Pharmingen-tol származott. Az eljárást a gyártó leírása szerint végeztük, de? - 32 P-uridin helyett? - 33 P-uridint használtunk. Az izotóppal jelölt, emésztetlen próbákat 5%-os poliakrilamid szekvenálógélen választottuk szét egymástól, az egyes próbákhoz tartozó legerosebb sávok radioaktivitás intenzitását pedig phosphoimager készülékkel (Fuji, Japán) határoztuk meg. Az adatok kiértékeléséhez az AIDA és a Microsoft Excel szoftvereket használtuk. Az intenzitásértékeket az L32 riboszomális fehérjét kódoló háztartási gén intenzitásértékével hasonlítottuk össze, így kaptuk a relatív expressziós szinteket Statisztikai elemzés A statisztikai elemzésekhez a Microsoft Excel és a Sigmastat programokat használtuk. Student t-tesztet, egyutas és kétutas ANOVA-t és Tukey-féle többszörös páronkénti összehasonlítást, Kluskal-Wallis rangszámokon végzett egyszempontos varianciaanalízist és Dunn-féle tesztet, illetve z-tesztet használtunk, a kiértékelendo adatoktól függoen. A statisztikai tesztek elvégzése elott normalitásvizsgálatot hajtottunk végre. 39
40 5. EREDMÉNYEK 5.1. A hisztamin szerepe a hízósejtek differenciációs folyamataiban A hízósejtek csökkent száma a HDC-/- egerek hasüregében Elso lépésként a CD1-es genetikai hátteru HDC-/- és vad típusú egerek peritoneális folyadékában található hízósejtek arányát hasonlítottuk össze. Az 5. ábrán látható, hogy a c-kit + sejtek áramlási citometriás detektálása során a HDC-/- egerekben csökkent hízósejt arányt tapasztaltunk. Emellett a HDC-/- egerek hasüregi hízósejtjének felszínén enyhén csökkent c-kit expressziót mutattunk ki (nem mutatott adatok). 5. ábra. A c-kit + sejtek aránya a vad típusú (n=5) és HDC-/- (n=4) egerek peritoneális mosófolyadékában. Áramlási citometriás elemzés. Reprezentatív kísérlet a három ismétlésbol. A t-próba alapján *p<0, Hisztamin hiányában a csontveloi eredetu in vitro hízósejt differenciálódás gátolt A peritoneális folyadékban tapasztalt kisebb hízósejt arányra egy lehetséges magyarázat, hogy a differenciáció gátolt. Ennek tesztelésére csontvelobol sejttenyészeteket alapítottunk rekombináns IL-3, vagy a Wehi 3B sejtvonal IL-3 tartalmú felülúszójának segítségével. A nem adherens sejtek száma a HDC-/- csontveloi kultúrák esetében 8 napi differenciáció után alacsonyabb volt a vad típushoz képest, és ez a különbség az elso 18 nap során végig megmaradt. Ezzel párhuzamosan enzimhisztokémiai vizsgálatok és áramlási citometriás mérések alapján az alciánkéksafranin pozitív és triptáz pozitív sejtek aránya is alacsonyabb volt (6a. ábra). Az enzimhisztokémiai reakció triptázra való specifitását a tenyészetek adherens sejtjein (ezek nem hízósejtek), illetve más sejtvonalon (Wehi 3B) ellenoriztük, és ekkor nem 40
41 kaptunk pozitív jelet. A HDC-/- tenyészetek csökkent hízósejt-arányát a c-kit pozitív sejtpopuláció vizsgálata is megerosítette (6c. és 6e. ábra). A c-kit és a triptáz enzim expressziójának mértékében azonban az áramlási citometriás mérések alapján nem kaptunk szignifikáns különbséget (6b. és 6d. ábra). Hasonlóan, sem a nagy affinitású IgE-receptor, sem a komplement receptor I, komplement receptor II, sem pedig a Thy1.2 sejtfelszíni markerek expressziós intenzitásában nem tudtunk eltérést kimutatni a hízósejtek/promastocyták esetében (2. táblázat). 6. ábra. 10 napos in vitro differenciáltatás után a triptáz+ sejtek aránya (a), a triptáz expressziós szintje (b), valamint 13 napos tenyésztés után a c-kit (CD117) + sejtek aránya (c), illetve a c-kit expresszió mértéke (d) áramlási citometriás mérések alapján vad típusú (wt) és HDC-/- (KO) sejttenyészetekben (n=5-7). Az áramlási citometriás c-kit-mérés során kapott jellegzetes kép (e) 9 napos differenciáltatás után (az ábrarészleten az A a vad típusra, a B a HDC-/- tenyészetre utal). t-próba alapján *p<0,01. 41
42 A sejtmembrán molekulái HDC+/+ HDC-/- Nagy affinitású IgE-receptor 11,5 13,5 CR1, CR2 (7g6) CR1 (8c12) 3 3 c-kit Thy-1 4,5 5,7 2. táblázat. A csontvelobol in vitro differenciáltatott vad típusú és HDC-/- hízósejtek felszínén megjeleno molekulák expressziójának mértéke. Az adatok az átlagos fluoreszcencia intenzitást mutatják önkényes intenzitásértékekben (a mérés csak a c-kit + sejtek populációján belül történt, és az izotípus kontrollt levontuk). Egy reprezentatív kísérlet eredményei a négybol. CR = komplement receptor. Azt, hogy a hízósejtek differenciáltatása során a Wehi 3B sejtvonal felülúszójának az IL-3 a hatékony komponense, úgy bizonyítottuk, hogy neutralizáló monoklonális anti-il-3 ellenanyagot adtunk 5? g/ml koncentrációban a Wehi 3B felülúszóhoz. Tapasztalatunk szerint ebben az esetben sem a vad típusú, sem pedig a HDC-/- eredetu csontveloi tenyészetekben nem jelentek meg triptáz pozitív sejtek 10 napi differenciáció után sem. Ennek ellenére, bár kis számban, de megfigyelheto volt néhány nem adherens sejt. Ismert, hogy az egér hízósejtek differenciációját az IL-3 mellett egyéb faktorok, például az SCF is befolyásolja. A vad típusú és genetikailag módosított csontveloi tenyészetek differenciálódási potenciálját ezért csak SCF, illetve IL-3 és SCF együttes jelenlétében is megvizsgáltuk. Eredményeink szerint 9 nap alatt csak SCF hatására a triptáz pozitív hízósejtek aránya 2% alatt maradt. IL-3 és SCF együttes jelenlétekor viszont magasabb hízósejt arányt tapasztaltunk az IL-3 egyedüli hatásához képest (7. ábra). A vad típusú és HDC-/- csontveloi tenyészetek hízósejt aránya közötti különbség bár megmaradt, mértéke azonban csökkent. 42
43 7. ábra. A triptáz+ sejtek aránya (enzimhisztokémiai sejtszámolás alapján) HDC-/- (sávozott oszlopok) és vad típusú (sötét oszlopok) egerek csontvelojébol alapított, IL-3 (2 ng/ml), SCF (40 ng/ml), vagy IL-3 és SCF jelenlétében 9 napig differenciáltatott tenyészetekben. n=5-7, t- próba alapján *<0,01. Következo lépésként sejttenyészeteinket további hízósejt-specifikus markerekre nézve szemikvantitatív RT-PCR módszer felhasználásával jellemeztük. Mind az mmcp5 (az egyik kimáz), mmcp6 (triptáz), mind pedig az Fc?RI? (a nagy affinitású IgE-receptor? -lánca) esetében gyengébb jelet kaptunk a hisztaminmentes sejtkultúrák esetében IL-3 jelenlétében 10 napos differenciáltatási idotartam után (8. ábra). Minthogy sem a triptáz, sem pedig a nagy affinitású IgE-receptor áramlási citometriás kimutatása során a sejtfelszíni expresszióban nem tapasztaltunk eltérést (ld. a 2. táblázatot), így az RT-PCR-es vizsgálatok során megfigyelt különbség a génkiütött egerekbol alapított sejttenyészetek alacsonyabb hízósejt arányára utal. 43
44 8. ábra. Az mmcp5, mmcp6, Fc?RI? és a GAPDH mrns mennyiségének elemzése szemikvantitatív RT-PCRrel 10 napos, 20 % Wehi 3B felülúszó (mint IL-3 forrás) jelenlétében differenciáltatott nem adherens sejtekbol. wt = vad típus. Mindezek alapján felvetodik a kérdés: vajon a hízósejt differenciáció melyik fázisa gátolt a hisztaminmentes egerekben? Ezt a promastocyta populáció (Thy1.2 low /Mac1 -/low /c-kit + ) áramlási citometriás jellemzésével közelítettük meg. A 9. ábrán látható, hogy 6 nap, IL-3 jelenlétében történt differenciáció után a HDC-/- tenyészetek Thy1.2 low /Mac1 -/low /c-kit + populációjának aránya szignifikánsan alacsonyabb, míg a c-kit - /Mac1 + egyéb mieloid sejtek aránya magasabb volt a vad típushoz képest. Adataink alapján tehát az eltéro hízósejt differenciációs potenciál valamelyik korai, nem pedig a terminális differenciációs fázishoz kötheto. Tovább erosíti ezen következtetésünket, hogy amennyiben a vad típusú egerek csontveloi tenyészetében a HDC enzim gátlószere, az? -FMH végig jelen volt, illetve a HDC-/- tenyészetekhez hisztamint adtunk, nem tapasztaltunk különbséget a megfelelo kezeletlen kontrollhoz képest (3. táblázat). A metilcellulóz szemiszolid médiumban csontveloi sejtekkel elvégzett kolóniaképzési kísérletek során pedig a makrofágszeru kolóniák aránya magasabb, míg a vegyes sejttípusokból állóké alacsonyabb volt a HDC génkiütött egerek esetében 14 napos, IL-3 jelenlétében történt differenciáció után (10. ábra). Eredményeink tehát arra engednek következtetni, hogy a hisztamin hiánya a csontvelo összetételét megváltoztatja, és így az in vitro differenciáltatás kiindulási pontján a hízósejt-progenitorok aránya alacsonyabb a genetikailag módosított egerekben. 44
45 Minta Triptáz+ sejtek aránya, % (átlag ± SEM) HDC-/- kontroll 2,9? 0,5 HDC-/- + hisztamin 2,6? 0,6 Vad típus, kontroll 14,1 ± 1,4 Vad típus +? -FMH 15,0? 2,7 3. táblázat. A hisztamin hatása a HDC-/-, és az? -FMH hatása a vad típusú 7 napos sejttenyészeteken. A triptáz+ sejtek aránya enzimhisztokémia alapján. n=4-4 kísérleti állat. 9. ábra. A promastocyta (Thy1.2 low /Mac1 -/low /c-kit + ) és Mac-1 + populáció aránya 6 napos, Wehi 3B felülúszó jelenlétében differenciáltatott vad típusú (sötét oszlopok) és HDC-/- (sávozott oszlopok) sejttenyészetekben. n=5, t-próba alapján *p<0, ábra. A vad típusú (sötét oszlopok) és HDC-/- (sávozott oszlopok) csontveloi sejteken elvégzett kolónia-teszt eredményei 14 napos, Wehi 3B felülúszó jelenlétében elvégzett kísérlet után. n=4, a t-teszt alapján *p<0,01. 45
46 Az embrionális ossejtek mind differenciálatlan, mind pedig differenciált állapotban HDC-t és H1R-t expresszálnak A hisztaminnak a hízósejt differenciációban betöltött szerepét egy embrionális modellrendszerben, az embrionális ossejtek esetében is megvizsgáltuk. Elso lépésként arra voltunk kíváncsiak, hogy egyáltalán kimutatható-e a HDC és/vagy a hisztamin valamelyik receptora ezekben a sejtekben. RT-PCR vizsgálataink arra engedtek következtetni, hogy mind a differenciálatlan, mind pedig a differenciált CCE embrionális ossejtekben kifejezodik a HDC és a H1R, a H2R jelenlétét viszont nem tudtuk bizonyítani (11. ábra). A HDC enzim muködoképességét bizonyítja, hogy áramlási citometriával a sejtekben kimutatható volt a hisztamin (12. ábra). 11. ábra. A HDC, H1R és H2R vizsgálata RT-PCR módszerrel nem differenciált CCE sejtekben, valamint különbözo ideig differenciáltatott EBkban. nd: nem differenciált minták; d4: 4 napos EB; d8: 8 napos EB; d16: 16 napos EB; -RT-áz: RT-áz enzim nélküli kontroll minták; k: egér DNSkontroll. 12. ábra. Differenciálatlan CCE ES-sejtek hisztamintartalmának kimutatása áramlási citometriával (szaggatott vonal). A folytonos vonal a kontrollt jelöli, mely esetében az elsodleges ellenanyagot kihagytuk az inkubálás során. 46
47 A HDC jelenléte arra utal, hogy a hisztamin szerepet játszhat az embrionális ossejtek osztódásának szabályozásában. Ennek vizsgálatához a LIF-et elvontuk a sejttenyészetbol, ami a CCE sejtek irányítatlan differenciálódását okozza. Várakozásunknak megfeleloen 72 órás LIF-elvonás után triciált timidines méréseink szerint a sejtek proliferációja lelassult, ám a sejtek hisztamintartalma lényegében változatlan maradt (13. ábra). Amikor LIF jelenlétében vizsgáltuk a HDC-gátló (? - FMH) és a H1R antagonista (triprolidin) hatását több koncentrációban (10-5 M-tól 10-8 M-ig) a differenciálatlan CCE ES sejtek proliferációjára, szintén nem kaptunk különbséget a kezeletlen kontrollhoz képest (nem mutatott adatok). Ezek alapján arra a következtetésre jutottunk, hogy a hisztamin nem befolyásolja jelentosen a CCE embrionális ossejtek proliferációját sem differenciálatlan, sem pedig differenciált állapotban. 13. ábra. 72 óráig 10 ng/ml LIF jelenlétében (nd), illetve hiányában (72 h) tartott CCE ES-sejtek hisztamintartalma (A, áramlási citometriás mérés), illetve osztódási intenzitása (B, 3 H-timidin beépülés meghatározása) A HDC enzim inhibitora gátolja az embrionális ossejtekbol kiinduló hízósejt differenciációt Következo lépésként a CCE ES-sejteket az embrioid test (EB) technika felhasználásával LIF jelenléte nélkül differenciáltattuk, és a HDC-gátlószer, az? -FMH 47
48 hatását vizsgáltuk ebben a folyamatban. Minthogy a HDC már a kezdetektol expresszálódik, így az? -FMH-val a differenciáció elejétol kezeltünk. Az? -FMH-nak nem volt észreveheto hatása az EB sejtaggregátumok méretére, mennyiségére, morfológiájára. 12 nap differenciáció után mikroszkópos számolás alapján nem kaptunk eltérést a vörösvérsejteket tartalmazó hemopoetikus (14. ábra), ezért piros EB-k számában a kontrollhoz képest (4. táblázat). Kísérlet sorszáma Hemopoetikus EB-k aránya a kontroll mintában, % Hemopoetikus EB-k aránya az? - FMH-val kezelt mintában, % táblázat. A hemopoetikus EB-k aránya 12 napos differenciáltatás után. 14. ábra. Vörösvérsejteket is tartalmazó, hemopoetikus 12 napos EB képe. Ha azonban ezeket a piros EB-kat szövettenyészto edényhez letapasztottuk, majd IL-3 és SCF jelenlétében további napig differenciáltattuk, akkor? -FMH jelenlétében szignifikánsan kevesebb alkalommal jelentek meg nem adherens, c-kit pozitív sejtek a tenyészetben (5. táblázat). Ezen sejtek triptázra is pozitívoknak bizonyultak enzimhisztokémiai vizsgálat alapján. A statisztikai elemzés során azokat a kísérleteket vettük figyelembe, amikor az EB-k letapadtak, és a letapadt sejtaggregátumokból a sejtek kivándorlása elindult, ami arra utal, hogy az EB-k túlélték a kísérlet korai fázisát. Eredményeink alapján tehát a HDC gátlószere csökkenti a hízósejtek kialakulásának gyakoriságát. 48
49 Összes kísérlet száma A kísérletek aránya, amikor hízósejt keletkezett (kísérletek száma) Kontroll 17 76,4 % (13)? -FMH-val kezelt % (3) 5. táblázat. A HDC enzimet gátló? -FMH (5x10-5 M) hatása arra, hogy a letapasztott EB-kból milyen gyakran keletkeznek hízósejtek. Minthogy az egyes differenciáltatási kísérletek során a megjeleno hízósejtek száma igen különbözo volt, ezért a statisztika során a hízósejtek megjelenési gyakoriságát vettük figyelembe. A z-teszt alapján a különbség statisztikailag szignifikáns (p<0,02) A hisztamin szerepe a hízósejtek muködésében A vad típusú és hisztaminmentes hízósejtek muködésének kapcsán a stimulált hízósejtek citokinexpressziós profilját vizsgáltuk. Minthogy a HDC-/- egerekre csökkent asztmatikus reakciók jellemzoek, és az IL-9-et igen fontosnak tartják az asztma kialakulásában, ezért vizsgálatainkat az IL-9 stimuláló hatására irányítottuk. Mielott azonban a vad típusú és HDC-/- hízósejtek citokinexpressziós válaszát összehasonlíthattuk volna, eloször az IL-9 citokin indukciós hatását kellett feltérképeznünk Az IL-9 csak ionomycin jelenlétében indukálja a hízósejtek citokintermelését Az IL-9-nek a hízósejtek citokintermelési mintázatában betöltött szerepének vizsgálatához csontvelobol in vitro differenciáltatott vad típusú hízósejttenyészeteket stimuláltunk 30 ng/ml IL-9-cel és 0,5? g/ml ionomycinnel 36 óráig. A differenciáltatás során az IL-3 mellett SCF-et is alkalmaztunk, amely a sejttenyészet érési folyamatait felgyorsítja. Az ionomycin egy jól ismert Ca-ionofór, mely a hízósejtek degranulációját idézi elo. A kísérletekben felhasznált sejttenyészetek homogenitása 90% fölött volt, amint ezt alciánkék-safranin festéssel, illetve ismert, B-sejtre (B220), T-sejtre (CD3) és egyéb mieloid sejtekre (CD11b vagy Mac1) specifikus sejtfelszíni antigének áramlási citometriás vizsgálata során ellenoriztük (15. ábra). Az mck1b és mck2b RPA citokin 49
50 próbasorozatok (IL-1?, IL-1?, IL-2, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-12p35, IL- 12p40, IL-13, IL-15, IL-18, IFN-?, MIF) felhasználásával a stimulálatlan sejtekben alacsony szintu IL-6 és MIF expresszió volt kimutatható. Ionomycin hatására az IL-1?, IL-1?, IL-3, IL-4, IL-5, IL-6, IL-10 és IL-13 termelése indukálódott, míg IL-9 egyedüli jelenlétekor egyik vizsgált citokin esetében sem kaptunk expresszióbeli változást a stimulálatlan kontrollhoz képest. Az IL-9 + ionomycin stimulus azonban jelentos emelkedést okozott az IL-1?, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-13 és MIF relatív expressziós szintjében, ezenkívül megjelent az IL-1Ra átírása (16. ábra). Minthogy az IL-1? termelése nem emelkedett az ionomycinnel kezelt mintákhoz képest, ezért ezt a citokint a továbbiakban nem elemeztük. 15. ábra. A 18 napig IL-3 és SCF jelenlétében differenciáltatott vad típusú hízósejttenyészet tisztaságának ellenorzése áramlási citometriával. 50
51 16. ábra. A nem stimulált (nonstim), a 0,5?g/ml ionomycinnel, 30 ng/ml IL- 9-cel, vagy ionomycin + IL- 9-cel 36 óráig kezelt vad típusú hízósejttenyészetek citokinexpressziós profilja. n=4. Az expresszió mértékét minden esetben az L32 háztartási gén expressziós szintjéhez viszonyítottuk (relatív expresszió). Az ábrán a háromszori ismétlés egyik reprezentatív eredménye látható Az IL-9 antigén-specifikus IgE és antigén stimulussal együtt megnöveli különbözo citokinek expresszióját Az IL-9 + ionomycin stimulus biológiai relevanciájának tesztelése érdekében egy olyan stimulus hatását is megvizsgáltuk, mely a szervezetben fiziológiásan elofordulhat. Ebben a kísérletben az in vitro differenciáltatott hízósejteket anti-dnp 11 - BSA IgE-vel szenzitizáltuk, DNP 11 -BSA antigént és/vagy IL-9-et adtunk 36 órán keresztül, majd a citokinexpressziós mintázatot az mck1b próbakészlettel tanulmányoztuk. Adataink szerint az antigén/ige stimulálás az IL-3, IL-4, IL-5, IL-10 esetében alacsony, míg az IL-9 és IL-13-nál magasabb expressziós szintet indukált. Ha azonban az IgE/antigén stimulust IL-9-cel kombináltuk, akkor az IL-5, IL-10, IL-13 és IL-9 mrns relatív expressziós szintje szignifikánsan megnott, noha nem olyan 51
52 mértékben, mint amit az IL-9 + ionomycin esetében megfigyelhettünk (17. ábra). Minthogy az IL-3 expressziójának mértékében igen nagy eltérést kaptunk az IL-9 + ionomycin és IL-9 + IgE/antigén indukciók között, ami azt jelenti, hogy az ionomycin nem modellezi megfeleloen az IL-3 esetében az IgE/antigén hatását, így ezzel a citokinnel a továbbiakban nem foglalkoztunk. 17. ábra. Az IL-9 serkenti az antigén-specifikus IgE/antigén által indukált IL-5, IL-10, IL-13 és IL-9 expressziót vad típusú hízósejtekben 36 óra stimulus után (n = 4). t-próba alapján *p<0, A citokinexpresszió idobeli változása IL-9 + ionomycin stimulus hatására Következo kísérletként az IL-9 + ionomycin által indukált citokinek expressziós szintjét követtük 36 órán keresztül. A 18. ábra alapján megállapítható, hogy az IL-1Ra, az IL-1?, az IL-5, az IL-6 és a MIF expressziós szintjében nem tapasztalható szignifikáns változás, az IL-13 és az IL-4 expressziójában viszont csökkenés látható a 12 és 36 órás idopont összehasonlításakor. Ezzel szemben az IL-10, és különösen az IL- 9 szintje jelentosen emelkedik az ido elorehaladtával. Az IL-9 esetében 12 óránál például alig kaptunk jelet, majd drámai növekedés figyelheto meg. Ez azt jelenti, hogy az IL-9, az IL-13-hoz és az IL-4-hez képest egy viszonylag késon expresszálódó citokin. 52
53 18. ábra. Az IL-9 (30 ng/ml) és ionomycinnel (0,5?g/ml) stimulált vad típusú hízósejtek citokintermelésének idobeli változása (n=4-5) Különbözo stimulusok hatására a hízósejtekbol felszabaduló hisztamin mérése Bár az IL-9 egyedül nem indukálja citokinek szintézisét, a degranulációt viszont befolyásolhatja, ezért arra is kíváncsiak voltunk, hogy a különbözo stimuláló körülmények hatására a hízósejtekbol mennyi hisztamin szabadul fel (6. táblázat). Várakozásunknak megfeleloen az IL-9 + ionomycin stimulált HDC-/- hízósejtek felülúszójából nem tudtunk hisztamint kimutatni (< 1nM, a hisztamin ELISA kit alsó detektálási küszöbértéke alatt). Statisztikai elemzésünk azt mutatta, hogy az ionomycin megnövelte a vad típusú hízósejtekbol kikerülo hisztamin mennyiségét, az IL-9 viszont nem. IL-9 + ionomycin stimulus hatására azonban a sejtek felülúszójában még nagyobb hisztaminkoncentrációt lehetett mérni. 53
54 A felülúszó hisztamin koncentrációja (? M, átlag ± SD) Nemstimulált 34,4 ± 9,8 Ionomycinnel stimulált 98,7 ± 29,0 IL-9-cel stimulált 9,6 ± 4,4 IL-9 + ionomycinnel stimulált 177,7 ± 49,7 6. táblázat. A hisztamin koncentrációja a vad típusú hízósejttenyészetek (10 6 sejt/ml) felülúszójában. A sejteket 0,5?g/ml ionomycinnel és/vagy 30 ng/ml IL-9-cel stimuláltuk 24 óráig, majd a felülúszót hisztamin ELISA-val vizsgáltuk, melynek az alsó kimutatási határértéke 1 nm. Az adatokat kétutas ANOVA-val elemeztük, ahol a két faktor az IL-9 és az ionomycin stimulus volt (az IL-9 hatása: p<0,186; ionomycin hatása: p<0,001, interakció: p<0,02), majd Tukey-féle többszörös páronkénti összehasonlítást alkalmaztunk (az IL-9 hatása ionomycin nélkül: p<0,366; IL-9 ionomycin jelenlétében: p<0,016; ionomycin IL-9 nélkül: p<0,04; ionomycin IL-9 jelenlétében: p<0,009). A médium és az IL-9 + ionomycinnel stimulált HDC-/- hízósejttenyészetek felülúszójának hisztamintartalma az alsó határérték alatti Az IL-9 + ionomycin stimulus hatását az IL-1? közvetíti Kísérleteinkben arra is választ kerestünk, hogy az IL-9 + ionomycin stimulus milyen mechanizmuson keresztül éri el citokin indukáló hatását. Ha a hízósejteket neutralizáló monoklonális anti-egér IL-1? ellenanyaggal, vagy kontroll IgG-vel 2 órával az IL-9 + ionomycin stimulus alkalmazása elott eloinkubáltuk, majd a citokinexpressziót az mck1b templátkészlettel megvizsgáltuk, dózisfüggo gátlást tapasztaltunk az IL-5, IL-13, IL-10 és IL-9 expressziójában, az IL-4 esetében viszont nem (19. ábra). Eredményeink azt mutatják, hogy az IL-9 + ionomycin kombináció az IL-1? expresszióját serkenti, amely ezután autokrin/parakrin módon további citokinek expresszióját indukálja. 54
55 19. ábra. A vad típusú hízósejtek monoklonális neutralizáló anti-il-1? ellenanyaggal (3 vagy 10?g/ml) való 2 órás eloinkubációja lecsökkentette az IL-9 + ionomycin stimulus (36 óra) által kiváltott IL-5, IL-9, IL-10 és IL-13 expressziót. Az mck1b templátsorozattal elvégzett RPA eredményei (n=4). Az egyutas ANOVA (IL-10, IL-13, IL-9), illetve a Kluskal-Wallis rangszámokon végzett egyszempontos varianciaanalízis (IL-5) alapján az anti-il-1? ellenanyaggal történt kezelés hatásos (p<0,001). A Tukey-féle többszörös páronkénti összehasonlítás (IL-10, IL-13, IL-9) és a Dunn-féle teszt (IL-5) a csoportok között szignifikáns különbséget mutatott ki (p<0,02) Az IL-9 + ionomycin által stimulált HDC-/- hízósejtek kevesebb IL-9-et expresszálnak A vad típusú és HDC-/- hízósejtek citokinexpressziós profiljának összehasonlításához a sejteket IL-9 + ionomycinnel 36 óráig kezeltük. Noha a legtöbb citokin relatív expressziós szintjében nem tapasztaltunk változást hisztamin hiányában, igen jelentos csökkenést lehetett megfigyelni az IL-1?, és különösképpen az IL-9 expressziójában a HDC-/- hízósejtek esetében (20., 21. ábra). Ezen adatok biológiai relevanciáját tovább erosíti, hogy IL-9 + antigén/ige indukció hatására az IL-9 esetében hasonló eredményt kaptunk (nem mutatott adatok). 55
56 20. ábra. Részlet az mck1b templátkészlettel végzett RPA szekvenálógélbol (IL-9 + ionomycinnel stimulált minták). 21. ábra. A HDC-/- hízósejtek csökkent IL-1? (t-próba, *p<0,03) és IL-9 (*p<0,02) expressziót mutatnak 36 órás IL-9 + ionomycin stimulus hatására (RPA, n=4-5). A sötét oszlopok a vad típusú, míg a csíkozottak a HDC-/- mintákra vonatkoznak. Csak azokat a különbségeket tekintettük szignifikánsnak, melyek esetében a kísérlet háromszori ismétlése során mindig p<0,05 adódott Az exogén hisztamin nem tudja megváltoztatni az IL-9 + ionomycin által indukált HDC-/- hízósejtek alacsonyabb IL-9 expressziós szintjét Ha a degranuláció során felszabaduló hisztamin hiánya lenne az egyetlen magyarázat a hisztaminhiányos hízósejtek IL-9 + ionomycinre adott alacsonyabb IL-9 termelésére, akkor a külsoleg adott hisztaminnak csökkentenie kellene ezt a különbözo 56
57 genotípusok között megfigyelheto különbséget. Ennek a lehetoségnek a tesztelésére hisztaminmentes hízósejteknek 2x10-4 M hisztamint adtunk az IL-9 + ionomycin stimulussal egyidejuleg, és 24 óra után a citokinexpressziós profilt a kezeletlen kontrollal hasonlítottuk össze az mck1b templátsorozat segítségével (22. ábra). A 2x10-4 M-os hisztaminkoncentrációt az IL-9 + ionomycin által indukált vad típusú hízósejttenyészetek felülúszójában mért hisztaminszint alapján választottuk (lásd a 6. táblázatot). Várakozásunknak megfeleloen a hisztamin nem változtatta meg a legtöbb citokin (IL-4, IL-5, IL-10, IL-13) expressziójának relatív mértékét a stimulált HDC-/- hízósejtekben. Meglepetésünkre azonban az IL-9 szintjében sem tapasztaltunk növekedést. Így az IL-9 + ionomycin stimulus során felszabaduló/fel nem szabaduló hisztamin nem lehet a magyarázat a vad típusú és HDC-/- hízósejtek között megfigyelheto fenotípusbeli eltérésekért. 22. ábra. A HDC-/- hízósejtek IL-9 + ionomycin által indukált citokinexpressziós profilja nem változik 24 órán át külsoleg adott 200?M hisztamin hatására. RPA eredmények az mck1b templátsorozat felhasználásával (n=5). 57
58 Az IL-1? és ionomycin által aktivált HDC-/- hízósejtek kevesebb IL-9-et termelnek, mint a vad típusúak Megfigyeléseink alapján tehát az IL-9 + ionomycin által aktivált HDC-/- hízósejtek kevesebb IL-1? -t és IL-9-et expresszálnak, mint a vad típusú sejtek, valamint az IL-9 + ionomycin az IL-1? indukcióján keresztül fejti ki hatását. Ezért a hisztaminmentes hízósejteknek az IL-1? + ionomycinre adott citokinexpressziós válaszát is megvizsgáltuk. Érdekes módon az mck1b templátsorozat citokinjei közül csak az IL-9 mrns szintben találtunk következetes különbséget a HDC-/- és vad típusú aktivált hízósejtek között (23. ábra). Következtetésünk szerint tehát az IL-1? + ionomycin által indukált IL-9 termelés gátolt a hisztaminmentes hízósejtekben. 23. ábra. A HDC-/- hízósejtek IL-1? (10 ng/ml) + ionomycin (0,5?g/ml) 36 órás stimulusra csökkent IL-9 (t-próba, *p<0,05) termeléssel válaszolnak a vad típusú kontrollhoz képest. Az RPA mck1b templátkészlet felhasználásával kapott eredmények (n=5). A sötét oszlopok a vad típusra, míg a csíkozottak a HDC-/- sejtekre utalnak. 58
59 6. AZ EREDMÉNYEK MEGBESZÉLÉSE 6.1. A hisztamin szerepe a hízósejtek differenciációjában Bár hisztamin termelésre sokféle sejttípus képes a szervezetben, nagy mennyiségben csak a bazofil granulociták és a hízósejtek tárolják. A hisztamin szintézisére képtelen, HDC-/- egerek egyik legmarkánsabb fenotípusa, hogy a szöveti hízósejtek granulumai elektronmikroszkópos felvételeken kevésbé látszanak elektrondenznek, mint a vad típusú sejtek esetében, ami a csökkent savas proteoglikán (heparin, kondroitin-szulfát) tartalmukra utalhat (37). Vizsgálataink során kimutattuk, hogy a hisztaminhiányos egerek hasüregében a hízósejtek száma szignifikánsan alacsonyabb, mint a vad típusú állatok esetében. Ennek az eltérésnek az egyik lehetséges magyarázata, hogy a csontvelobol kiinduló hízósejt differenciáció valamelyik ponton gátolt a HDC-/- egerekben. Kísérleteink során a HDC-/- egerek csontvelejébol alapított sejttenyészetekben a nem adherens sejteket jellemeztük. A triptáz, mmcp5, c-kit és Fc?RI? expressziójának vizsgálata során azt tapasztaltuk, hogy a pozitív sejtek aránya alacsonyabb a HDC-/- tenyészetekben, ami csökkent hízósejt differenciációs folyamatokra utal. Minthogy a hízósejt eloalakok, melyek a Thy1.2 low /c-kit high /Mac1 -/low markerkombinációval jellemezhetok (61), szintén csökkent arányban voltak jelen a hisztaminmentes tenyészetekben, azt a következtetést vontuk le, hogy a hisztamin a hízósejtek korai differenciációs folyamatait befolyásolja. Ezt megerosítik azon kísérleteink, melyekben vad típusú kultúráknak a HDC enzim gátlószerét,? -FMH-t adtunk, és nem kaptunk változást. Hasonlóan, HDC-/- tenyészetek hisztaminnal való kezelése során sem láttunk emelkedést a triptáz pozitív sejtek arányában. A HDC-/- tenyészetekben a promastocyták (Thy1.2 low /c-kit high /Mac1 -/low ) arányának csökkenésével párhuzamosan a Mac1 high populáció méretének növekedését lehetett kimutatni. Ezenkívül csontveloi sejtek szemiszolid médiumban való kolóniaképzését is megvizsgáltuk (kolónia-teszt), és azt tapasztaltuk, hogy a HDC-/- és a vad típusú csontvelokben a különbözo kolóniaképzo sejtek aránya eltéro, ami arra utal, hogy a kísérletekben tapasztalt, a hízósejtek differenciációját érinto eltérések a hisztaminhiányos és vad típusú egerek csontvelejének eltéro progenitorsejt összetételével magyarázható. 59
60 A hisztaminnak a vérképzésben betöltött szerepérol számos közlemény látott már napvilágot ban írták le, hogy hisztamin hatására a hemopoetikus ossejtek egy csoportja, a kolóniaképzo egységek (CFU) G 0 -ból S-fázisba lépnek be. H1 receptor antagonisták alkalmazásával elvégzett kísérletek alapján arra a következtetésre jutottak, hogy a CFU-k felszínén mind H1R, mind pedig H2R expresszálódik, és ezek ellentétes hatást gyakorolnak a sejtciklusba való belépésre (169). A csontvelo különbözo sejttípusainak hisztamintermelo képességét Dy és munkacsoportja vizsgálta részletesebben. Kísérleteikben azt tapasztalták, hogy a csontvelobol izolált sejtek alacsony szintu hisztamin termelése IL-3, vagy GM-CSF hatására jelentosen fokozódik, és a jelenség a HDC enzim gátlószerével, az? -FMH-val kivédheto. A sejtek Ficoll grádiensen történt elválasztása során a hisztamintermelés indukciója abban a rétegben volt megfigyelheto, ahonnan a különbözo kolóniaképzo hemopoetikus progenitorsejteket lehetett visszanyerni (170). Az IL-3 által indukált hisztamintermelés H2R-tól függo módon a CFU-k S-fázisba történo belépését serkenti (171). Késobb kiderült, hogy a csontvelo IL-3-ra hisztamintermeléssel válaszoló sejtpopulációja a bazofil prekurzorokkal együtt tisztítható ki Ficoll-grádiensbol (172). Az IL-3 hatására bekövetkezo HDC aktivitás növekedést humán csontveloben, a köldökvér és a magzati máj sejtjeiben is kimutatták (173). A HDC vérképzésben való szerepére utal továbbá, hogy LPS injekciót követoen fokozott HDC aktivitás mutatható ki az egerek lépében és csontvelojében, és az LPS valószínuleg GM-CSF és G-CSF felszabadításán át fejti ki hatását (174). A hisztamin különbözo sejttípusok differenciálódását befolyásoló hatását is igen behatóan tanulmányozták. Az UT7D1 humán leukémia sejtvonal például bipotenciális, azaz mind bazofil granulocita, mind pedig megakariocita irányba differenciáltatható. A HDC aktiválódása azonban csak a bazofil irányú differenciálódásra jellemzo, a megakariocita markerek megjelenésével pedig gyakorlatilag eltunik a sejtekbol. A HDC expresszió továbbá IL-6, IL-4 és IL-13 (Th2 citokinek) expresszióval társul (175). Intézetünkben korábban kimutatták, hogy a GM-CSF és az IL-4 a humán monociták dendritikus sejtekké való differenciációja közben fokozza a hisztamin szintézisét, ami felveti a lehetoséget, hogy a hisztamin H1R-on át autokrin faktorként hat a dendritikus sejtek differenciációja során (176). 60
61 Vizsgálataink alapján a hisztamin a csontveloi hízósejt progenitorok kialakulását/arányát is befolyásolja. Minthogy a csontveloben hisztamin elsosorban különbözo citokinek, például IL-3 hatására termelodik, a vad típusú és HDC-/- egerek között tapasztalt eltérés egy lehetséges magyarázata, hogy az IL-3 a génkiütött állatok hízósejt eloalakjaiban hasonlóan a bazofil progenitorokhoz- nem képes hisztaminszintézist indukálni, ami befolyásolja az osztódásukat. Emellett a hisztamin hiánya módosíthatja egyes csontveloi sejttípusok IL-3 érzékenységét is. Az IL-3 mellett a hízósejtek legkorábbi differenciációs lépéseiben fontos szerep jut az SCF-nek is. Kísérleteink szerint SCF egyedüli jelenlétében bár megjelentek nem adherens sejtek, a triptáz pozitív sejtek aránya azonban a differenciáció elso 9 napja során végig 2% alatt maradt. Ez megegyezik korábbi irodalmi adatokkal, mely szerint az SCF-fel kezelt tenyészetekben a nem adherens sejtek száma végig jóval elmaradt az IL-3 jelenlétében tenyésztettekhez képest, és SCF hatására csak éretlen, nagy, kevéssé elektrondenz granulumokkal rendelkezo, bizonyos proteázokra nézve negatív hízósejtek keletkeztek (61). IL-3 és SCF együttes alkalmazásakor viszont a tenyészetekben magasabb hízósejt arányt kaptunk, mint IL-3 egyedüli jelenlétekor, ami azzal magyarázható, hogy az SCF elosegítette a korai hízósejt differenciációs lépéseket. A vad típusú és HDC-/- tenyészetek közti eltérés a hízósejtek arányában azonban ebben az esetben is megmaradt. Ezen kívül a hisztaminmentes és vad típusú hízósejtek c-kit expressziójának mértékében nem találtunk eltérést áramlási citometriás vizsgálataink alapján, ami arra enged következtetni, hogy a HDC-/- egerek csökkent hízósejt differenciációs képességében valószínuleg nem egy SCF-tol, hanem egy IL-3- tól függo folyamatnak jut fontos szerep. A hisztamin és a hízósejtek differenciációja közti kapcsolatot egy másik modellrendszeren, az embrionális ossejtek felhasználásával és a HDC enzim differenciáció során való gátlásával is megpróbáltuk bizonyítani. Eloször azonban a HDC és a hisztamin receptorok expressziós mintázatát kellett felderítenünk. Eredményeink szerint a HDC expresszálódik mind a differenciálatlan CCE ES sejtvonalban, mind pedig a 4, 8 és 16 napos sejtaggregátumban, az ún. embrioid testekben. Differenciálatlan ES sejtekben a H1 receptor jelenléte igazolható volt, a H2 receptoré viszont nem. A H2R expressziójának hiánya jól egyezik Xuemei és munkatársai vizsgálataival, melyek során az implantálódó egér embriók trofoblaszt 61
62 rétegében kimutatták a H2R jelenlétét, az embriócsomó sejtjeiben viszont nem (177). Ugyanitt azonban a H1R expresszióját sem tudták bizonyítani. A H1R tekintetében az ES sejtek és az embriócsomó közötti eltérés azzal magyarázható, hogy az ES sejtvonalakat ún. nyugvó (dormans) blasztociszták embriócsomójából izolálták, melyeknél a beágyazódás késleltetett. Más szerzok az egér preimplantációs embriók hisztamintermelésérol (178), valamint az ES-sejtekhez több tulajdonságban is hasonlító P19 embrionális karcinoma sejtek felszínén megjeleno funkcionális H1R-ról számoltak be (179). Jól ismert, hogy a hisztamin serkenti bizonyos csontveloi CFU-k S-fázisba való belépését (169), így megvizsgáltuk, hogy az embrionális ossejtekben is befolyásolja-e a sejtosztódást. Amikor a H1R antagonistával, triprolidinnal, vagy a HDC gátló? -FMHval kezeltük a sejteket LIF jelenlétében differenciálatlan állapotban, nem kaptunk eltérést sem a sejtek szaporodásában, sem a kolóniaszámban a kontroll mintához képest. A LIF elvonása után az ES-sejtek irányítatlanul kezdenek differenciálódni, ami várakozásunknak megfeleloen a sejtosztódás intenzitásának csökkenését eredményezi, ezt azonban nem követi a sejtek hisztamintartalmának változása. Úgy tunik tehát, hogy a hisztamin nem befolyásolja az ES-sejtek proliferációját sem differenciálatlan, sem pedig differenciált állapotban. Ezt megerosíti, hogy az? -FMH-val kezelt EB-k méretében sem láttunk eltérést a kontrollhoz képest. További kísérleteinkben azon EB-k arányát hasonlítottuk össze, melyek a differenciáció 12. napjára pirosak lettek, azaz vörösvérsejtképzés indult meg bennük. A kontroll és kezelt minták között ebben az esetben sem kaptunk különbséget, ami arra utal, hogy a hisztamin nem befolyásolja a vörösvérsejtképzést. Statisztikai elemzés alapján a hízósejtek ES-sejtekbol való kialakulásában viszont szerepet játszik a hisztamin, hiszen szignifikánsan kevesebb alkalommal jelent meg ez a sejttípus azon EB-k esetében, melyekben a HDC enzimet legátoltuk. Eredményünk alátámasztja a HDC-/- egerek esetében megfigyelteket, miszerint a hisztaminnak jelentos szerepe van a hízósejtek/progenitoraik kialakulásában. 62
63 6.2. A hisztamin hiánya befolyásolja a hízósejtek funkcióit A hízósejtek funkcionális vizsgálata során figyelmünk az IL-9 felé terelodött, mivel genetikai kapcsoltsági analízis alapján valószínunek tunik, hogy az IL-9 fontos szerepet játszik az asztma patogenezisében (180). Az IL-9-et foleg aktivált T-sejtek, hízósejtek termelik (78), és befolyásolja a hízósejtek szaporodását (60, 65) és a hízósejtspecifikus proteázok expresszióját (138). Az IL-9-et túltermelo, genetikailag módosított egerekben (131, 132) más fenotípusok mellett, mint légúti gyulladás és nyák túltermelés, hízósejt hiperplázia is megfigyelheto volt. Az IL-9 stimulálja a hízósejteket a féregfertozések leküzdésében is ( , 132, ). Minthogy az IL-9-nek több ponton is fontos szerepe van a hízósejtek osztódásában/muködésében, így arra voltunk kíváncsiak, hogy IL-9 hatására milyen citokinexpressziós mintázat mutatható ki, illetve van-e ebben eltérés a vad típusú és a HDC-/- hízósejtek között. IL-1 és ionomycin stimulusra a hízósejtek IL-3-at, IL-5-öt, IL-6-ot, IL-9-et és TNF-? -t termelnek, míg sem az IL-1, sem pedig az ionomycin önmagában nem bizonyult hatásos induktornak (78). Vizsgálataink során az IL-9 stimuláló hatása kapcsán meglehetosen hasonló eredményeket kaptunk. A vizsgált citokinek közül (IL- 1?, IL-1?, IL-1Ra, IL-2, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-12p35, IL-12p40, IL-13, IL-15, IL-18, IFN-?, MIF) az IL-1?, IL-1?, IL-1Ra, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-13 és MIF mrns-ét mutattuk ki IL-9 + ionomycin stimulus hatására RNase protection assay módszerrel. Az IL-9, illetve az ionomycin önállóan a mi rendszerünkben nem váltott ki nagymértéku citokinexpressziót. Az IL-1? azonban kivételnek tunik, ugyanis a szintje nem változott, amikor az ionomycin mellett kostimulátorként IL-9 is jelen volt a tenyészetben, ezért a további elemzésben nem vettük figyelembe. Minthogy az ionomycin nem fiziológiás stimulus, az antigén-specifikus IgE/antigén és/vagy IL-9 hatását is megvizsgáltuk bizonyos citokinek expressziós szintje tekintetében. Korábbi irodalmi adatok arra utalnak, hogy az antigén-specifikus IgE/antigén stimulus a hízósejtekben IL-3, IL-4, IL-5, IL-13 és GM-CSF termelést vált ki ( ). Emberi bélbol izolált hízósejtek esetében kimutatták, hogy SCF jelenlétében, további stimulus nélkül is expresszálnak TNF-? -t, IL-1?-t, IL-6-ot, IL-8- at, IL-16-ot és IL-18-at. IgE/antigénnel való in vitro kezelés hatására azonban a TNF-? 63
64 termelése megemelkedik, és az IL-3, IL-5, IL-9 és IL-13 mrns a sejtekben megjelenik (185). Vizsgálataink eredményei jól egyeznek a korábbi irodalmi adatokkal: IgE/antigén stimulus hatására egyes citokinek (pl. IL-3, IL-5, IL-9, IL-13) expressziója kimutatható volt rendszerünkben. Kísérleteinkben IL-9-cel való kostimuláció során az IL-5, IL-9 és IL-13 szintjében tapasztaltunk jelentos emelkedést, ami megerosíti, hogy az IL-9 nemcsak az ionomycin, hanem az IgE/antigén hatását is fokozza bizonyos citokinek expressziója tekintetében. Általánosságban azonban elmondható, hogy IL-9 + ionomycin hatására nagyobb citokintermelést mértünk, mint IL-9 + IgE/antigén esetében, ami a nem fiziológiás Ca-ionofór fokozott stimulációs képességére utal. Korábbi irodalmi adatok arra utalnak, hogy az IL-9 igen gyakran más citokinek vagy faktorok hatásának serkentésében játszik fontos szerepet. Emberi és egér B- sejtekben az IL-4 által indukált IgE-termelést például fokozza (186), az eozinofil granulociták érésében pedig az IL-5-tel muködik együtt (187). Kísérleteinkben azt tapasztaltuk, hogy az IL-9 a hízósejtek citokintermelésében is kostimulátorként hat. Az IL-9 hízósejteket aktiváló hatásáról Patkai és munkatársai is beszámoltak, vizsgálataik során az IL-9-cel kezelt állatok agyi hízósejtjeiben fokozott mmcp-1 proteázexpressziót mutattak ki (188). Az IL-9 + ionomycin stimulus hatására expresszálódó különbözo citokinek idobeli kinetikáját is megvizsgáltuk, és három csoportot tudtunk kialakítani. Míg az IL- 5, IL-6, MIF, IL-1? és az IL-1Ra termelodése a stimuláció elso 12 órája alatt megemelkedett, majd nagyjából állandó maradt, addig az IL-4 és az IL-13 szintjében csökkenést tapasztaltunk 12 óra után. A harmadik csoportba az IL-10 és az IL-9 tartozik; ez utóbbi expressziójában csak 12 óra után lehet drámai emelkedést megfigyelni. Ez arra utal, hogy az IL-9 egy viszonylag késon megjeleno citokin, ami jól egyezik az IL-1 + ionomycin stimulus hatására kapott eredményekkel, mely során az IL-9 fehérjeszinten csak 24 órás stimuláció után volt kimutatható (78). Érdekes jelenség, hogy az IL-9 kostimulációs hatására a hízósejtekben megemelkedett mennyiségben termelodo citokinek között mind proinflammatorikusak (pl. IL-1?, IL-6), mind pedig Th2-es típusúak (IL-3, IL-4, IL-5, IL-9, IL-10, IL-13) is megtalálhatók. Lorentz és munkatársai hasonló eredményre jutottak emberi hízósejtek vizsgálatakor; eredményeik szerint a baktériumok elsosorban proinflammatorikus citokinek termelését aktiválják, IgE/antigén stimulusra emellett Th2-es típusúak is 64
65 megjelennek. Ha azonban ez utóbbi stimulus mellett IL-4 is jelen van, akkor a proinflammatorikus citokinek expressziója csökken, míg a Th2-es típusúaké megemelkedik (185). A hízósejtek által IL-9 + ionomycin vagy IgE/antigén hatására fokozott mértékben expresszált citokinek igen sokféle folyamatot szabályozhatnak. Az IL-4 elosegíti például a keringésben található eozinofil granulocitáknak az érfalon történo megtapadását (189). Az IL-5 az eozinofil (190) és bazofil (191) granulociták proliferációját és aktivációját serkenti, és az érfalon megtapadt eozinofil granulocitákra pozitív kemotaktikus hatást fejt ki. Az asztmában megfigyelheto nyák túltermelésért és a kehelysejtek metapláziájáért részben az IL-13 teheto felelossé (192). Az IL-13 mellett az IL-4 is stimulálja a fibroblasztok osztódását és kemotaxisát, valamint az extracelluláris mátrix fehérjék szintézisét. Emellett az IL-13 túlexpressziója az antigén szenzitizációt követo anafilaxiára hajlamosít (193), igen fontosnak bizonyult a bélrendszeri féregfertozések leküzdésében (194), valamint az IL-4 mellett a B-sejtek IgE expressziójának szabályozásában is részt vesz (194). Az IL-9 hatásairól korábban már esett szó. Az IL-9, mint kostimulátor által a hízósejtekben serkentett citokinexpresszió tehát elosegíti a bélrendszeri fertozések leküzdéséhez szükséges, valamint az allergiás asztmára jellemzo Th2-es citokintúlsúly fenntartását. Ezt erosíti az expresszálódó IL-10, amely a Th1-es sejtek kialakulását gátolja (195). Úgy tunik, hogy az IL-9 hatására ionomycin vagy IgE/antigén jelenlétében fokozott IL-9 expresszió mutatható ki, ami egy autoindukciós kör jelenlétére utal. Ez a kör egészen addig aktív maradhat, amíg IgE/antigén található a hízósejtek környezetében. Hízósejtek citokintermelésével kapcsolatban hasonló autoindukcióra találunk példákat az irodalomban: a HMC-1 emberi hízósejtvonalban az IL-4 kostimulátorként fokozza az IL-3, GM-CSF, IL-8 és saját maga transzkripcióját és szekrécióját (196), a köldökvér eredetu hízósejtek esetében az IL-10 autokrin szabályozásban vesz részt (197), valamint az emberi tüdobol izolált hízósejteknél azt tapasztalták, hogy a TNF-? az NF-?B indukcióján át saját termelodését pozitívan befolyásolja (198). Kísérleteinkkel párhuzamosan Lora és munkatársai humán köldökvérbol differenciáltatott hízósejtek IL-4, IL-5 és IL-9 stimulus hatására IgE/antigén jelenlétében vagy hiányában megfigyelheto génexpressziós mintázatát vizsgálták 65
66 cdns-mikroarray módszerrel. Megállapították, hogy a nem aktivált mintákban mindegyik citokin egy-egy karakterisztikus génaktivációs profillal jellemezheto. IgE/antigén jelenlétében azonban az IL-5 és az IL-9 kostimulációs hatása által aktiválódó, vagy represszálódó gének mintázata egymáshoz nagyo n hasonló, míg az IL- 4 ettol erosen eltéro génexpressziós profilt hoz létre. Érdekes, hogy az aktivált hízósejtekben az IL-4 saját maga transzkripcióját serkenti, ami egy újabb autoindukciós körhöz vezethet. Lora és munkatársai sajnos azonban a teljes adathalmazt elsosorban az IL-4 és kisebb mértékben az IL-5 szempontjából elemezték, így az IL-9-re vonatkozó információ dönto része egyelore nem hozzáférheto (199). Noha az IL-9 önmagában nem képes a hízósejtek nagymértéku citokinexpresszióját kiváltani, ám a degranulációhoz hozzájárulhat. Ezt a lehetoséget úgy vizsgáltuk, hogy különbözo módon kezelt hízósejt tenyészetek felülúszójában a hisztaminkoncentrációt ELISA-val meghatároztuk. Statisztikai analízisünk szerint az IL-9-cel kezelt és a kezeletlen kontroll hízósejtkultúrák felülúszójában nincs szignifikáns eltérés a hisztamintartalomban, így az IL-9 önmagában nem serkenti a hízósejtek degranulációját. Várakozásunknak megfeleloen ionomycin hatására megnott a felszabaduló hisztamin mennyisége, amely azonban IL-9 kostimuláló hatására tovább fokozódott. A tapasztalt jelenség egyik magyarázata lehet, hogy az IL-9 + ionomycin stimulus hatására a HDC enzim aktivitása/expressziója fokozódik. Az IL-1-rol, a TNF-? -ról (17), a GM-CSF-rol, a G-CSF-rol (18), vagy a RANTES-rol (200) már ismert, hogy a HDC-t indukálják. Humán hízósejtekvonalak PMA vagy ionomycin hatására HDC-t fokozott mértékben termelnek (201). A HDC expresszió az egér hízósejtvonalakban peritoneális inkubációt követoen jelentosen megemelkedik (202), valamint a HDC promóter demetilációja az aktiváció elofeltétele (13, 203). Az IL-9 + ionomycin stimuláció és a HDC expresszió közötti kapcsolat vizsgálatát valósideju PCR technika felhasználásával már megkezdtük, elozetes kísérleteink alapján azonban még nem vonhatunk le következtetéseket. Egy másik lehetséges hipotézis, hogy az IL-9 + ionomycin a sejtek teljesebb, komplexebb degranulációjához vezet. Az IL-1 + ionomycin és IL-9 + ionomycin stimulusok hatására a hízósejtekben tapasztalt hasonló citokinexpressziós mintázat arra utalhat, hogy az IL-9 esetleg az IL- 1 indukcióján keresztül fejti ki hatását. Minthogy az IL-1? expressziós szintje nem változott IL-9 + ionomycin hatására, ezért hipotézisünket anti-il-1? neutralizáló 66
67 ellenanyag felhasználásával vizsgáltuk meg. Kísérleteink azt mutatták, hogy legalábbis a citokinek egy részénél az IL-9 + ionomycin stimulus az IL-1? termelodésén át fejti ki hatását. A különbözo citokinek egymás utáni, szekvenciális hatása nem egyedi; Stassen és munkatársai vizsgálataik során például azt tapasztalták, hogy az IL-1? ionomycin jelenlétében serkentette az IL-10 és az IL-9 szintézist, és az IL-9 expresszió az IL-10 gátlásával 50 %-kal csökkentheto volt (79), ami arra utal, hogy az egyes citokinek hálózatszeruen befolyásolják egymás kostimulációs hatását. A hisztamin-deficiens hízósejtek muködése több ponton is eltér a vad típusúakétól. Ohtsu és munkatársai közleménye szerint a HDC-/- hízósejtek proteáztartalma alacsonyabb, és granulumaik nem az érett hízósejtekre hasonlítanak elektronmikroszkópos felvételek alapján (37). Kimutatták továbbá, hogy a HDC-/- hízósejtekben több EST expressziós szintje is módosult (204). Vizsgálataink szerint pedig a hisztaminhiányos hízósejtekben IL-9 + ionomycin stimulus hatására az IL- 1?, de különösen az IL-9 termelodés csökkent mértéku. Lényegében hasonló eredményt kaptunk, amikor az ionomycin helyett IgE/antigént alkalmaztunk, és néhány citokin expresszióját néztük. Meglepetésünkre azonban ha a HDC-/- hízósejteknek hisztamint adtunk akkora koncentrációban, mint amit a vad típusú sejttenyészetek felülúszójában mértünk IL-9 + ionomycin stimulus után, majd a citokinexpressziós profiljukat megvizsgáltuk, egyetlen citokin mrns-szintben sem találtunk lényeges változást. Ez azt jelenti, hogy a hisztaminhiány hatása a stimulus 24 órája alatt külso hisztaminnal már nem módosítható. Ugyanakkor a hízósejtek in vitro differenciációja egy hosszú, hetekig tartó folyamat, melyben az endogén hisztamin is szerepet játszik, így könnyen elképzelheto, hogy ez ido alatt a vad típusú és HDC-/- sejtek között több eltérés is kialakul, mely esetleg a teljes differenciáció ideje alatt külsoleg pótolt hisztaminnal megszüntetheto lenne. A hisztaminhiányos hízósejtek továbbá, az IL-4, IL-5, IL-13-mal ellentétben csökkent IL-9 termeléssel válaszolnak olyan IL-1? + ionomycin koncentrációjú stimulusra, mely esetében irodalmi adatok szerint a hatás maximális (78). Eredményeink alapján tehát azt a következtetést vonhatjuk le, hogy a HDC-/- hízósejtek IL-9 + ionomycin hatására tapasztalt redukált IL-1? termelése, valamint az IL-1? + ionomycin stimulus csökkent IL-9 indukciós képessége együttesen lehetnek felelosek az IL-9 + ionomycin által eloidézett kisebb mértéku IL-9 expresszióért. 67
68 A hisztaminnak a hízósejtek aktivációjára kifejtett serkentésérol már mások is beszámoltak. Az IL-9 hatására újszülött egerek agyában kialakuló léziókban fontos szerep jut a hízósejteknek. A hízósejtek degranulációját gátló vegyületek, vagy H1R és H2R antagonista együttes jelenlétében az indukált léziók mérete csökkent, ami arra utal, hogy a hízósejtekbol felszabaduló hisztaminnak autokrin/parakrin hatása van (188). A hisztamin fontos mediátor az allergiás és asztmatikus reakciókban. Ennek megfeleloen a hisztaminhiányos egerekben megfigyelheto indukált asztmatikus tünetegyüttes kevésbé súlyos, mint a vad típusú állatokban: kevesebb eozinofil granulocita található a tüdoben, és a légúti hiperreaktivitás is csökkent egyes mérések szerint (40, 41). Vizsgálataink során kimutattuk, hogy a hisztaminmentes hízósejtek IL- 9 + ionomycin stimulusra csökkent IL-9 termeléssel válaszolnak, ami nem igaz például az IL-4, vagy az IL-13 expressziójára. Minthogy mind a Th sejtek és az IL-1 által aktivált hízósejtek is képesek IL-9 eloállítására, ez azt mutatja, hogy az IL-9 IgE/antigén jelenlétében autokrin vagy parakrin indukciós faktorként szolgál a hízósejtek számára. Az IL-9-rol szintén leírták, hogy a tüdo epitelsejtjeiben az eotaxin és más kemokinek expresszióját fokozza, ezáltal elosegíti az eozinofil granulociták tüdobe történo bevándorlását (142, 143). Minthogy az IL-9 termelésért felelos pozitív visszacsatolási kör valószínuleg csökkent mértékben muködik a HDC-/- állatokban, ez magyarázattal szolgálhat a hisztaminmentes egerek kevésbé súlyos asztmatikus tüneteire. Kísérleteink alapján az IL-9-nek a vad típusú és HDC-/- aktivált hízósejtekre kifejtett hatását a 24. ábrán egy modell formájában foglaltuk össze. 68
69 24. ábra. Az IL-9 hatása a vad típusú aktivált hízósejtek muködésére (a). A piros nyilak a citokintermeléshez, a sárgák a degranulációhoz vezeto folyamatokat szimbolizálják. A? jel kostimulációs hatásra utal. A HDC-/- hízósejtekben (b) az IL-9 által serkentett IL- 1?, valamint az IL-1? által stimulált IL-9 expresszió kisebb mértéku, ami az IL-9 autoindukciós körének csökkent muködéséhez vezethet. 69
Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE
 Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2017. Bev. 2. ábra Az immunválasz kialakulása 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán
Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2017. Bev. 2. ábra Az immunválasz kialakulása 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán
Allergia immunológiája 2012.
 Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Az immunológia alapjai
 Az immunológia alapjai 8. előadás A gyulladásos reakció kialakulása: lokális és szisztémás gyulladás, leukocita migráció Berki Timea Lokális akut gyulladás kialakulása A veleszületeh és szerzeh immunitás
Az immunológia alapjai 8. előadás A gyulladásos reakció kialakulása: lokális és szisztémás gyulladás, leukocita migráció Berki Timea Lokális akut gyulladás kialakulása A veleszületeh és szerzeh immunitás
Immunológia I. 4. előadás. Kacskovics Imre
 Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Az immunrendszer sejtjei, differenciálódási antigének
 Az immunrendszer sejtjei, differenciálódási antigének Immunológia alapjai 2. hét Immunológiai és Biotechnológiai Intézet Az immunrendszer sejtjei Természetes/Veleszületett Immunitás: Granulociták (Neutrofil,
Az immunrendszer sejtjei, differenciálódási antigének Immunológia alapjai 2. hét Immunológiai és Biotechnológiai Intézet Az immunrendszer sejtjei Természetes/Veleszületett Immunitás: Granulociták (Neutrofil,
Túlérzékenységi reakciók Gell és Coombs felosztása szerint.
 Túlérzékenységi reakciók Gell és Coombs felosztása szerint. A felosztás mai szemmel nem a leglogikusabb, mert nem tesz különbséget az allergia, az autoimmunitás és a a transzplantációs immunreakciók között.
Túlérzékenységi reakciók Gell és Coombs felosztása szerint. A felosztás mai szemmel nem a leglogikusabb, mert nem tesz különbséget az allergia, az autoimmunitás és a a transzplantációs immunreakciók között.
Immunológia alapjai. Az immunválasz szupressziója Előadás. A szupresszióban részt vevő sejtes és molekuláris elemek
 Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 2. előadás A veleszületett és specifikus immunrendszer sejtjei Vérképzés = Haematopeiesis, differenciálódás Kék: ősssejt Sötétkék: éretlen sejtek Barna: érett
Immunológiai módszerek a klinikai kutatásban 2. előadás A veleszületett és specifikus immunrendszer sejtjei Vérképzés = Haematopeiesis, differenciálódás Kék: ősssejt Sötétkék: éretlen sejtek Barna: érett
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnolóiai mesterképzés mefeleltetése az Európai Unió új társadalmi kihívásainak a écsi Tudományeyetemen és a Debreceni Eyetemen Azonosító szám: TÁMO-4.1.2-08/1/A-2009-0011 Az orvosi biotechnolóiai
Az orvosi biotechnolóiai mesterképzés mefeleltetése az Európai Unió új társadalmi kihívásainak a écsi Tudományeyetemen és a Debreceni Eyetemen Azonosító szám: TÁMO-4.1.2-08/1/A-2009-0011 Az orvosi biotechnolóiai
A kemotaxis kiváltására specializálódott molekula-család: Cytokinek
 A kemotaxis kiváltására specializálódott molekula-család: Cytokinek Cytokinek - definíció Cytokin (Cohen 1974): Sejtek közötti kémi miai kommunikációra alkalmas anyagok; legtöbbjük növekedési vagy differenciációs
A kemotaxis kiváltására specializálódott molekula-család: Cytokinek Cytokinek - definíció Cytokin (Cohen 1974): Sejtek közötti kémi miai kommunikációra alkalmas anyagok; legtöbbjük növekedési vagy differenciációs
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
Immunológia alapjai. 10. előadás. Komplement rendszer
 Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Vásárhelyi Barna. Semmelweis Egyetem, Laboratóriumi Medicina Intézet. Az ösztrogénekimmunmoduláns hatásai
 Vásárhelyi Barna Semmelweis Egyetem, Laboratóriumi Medicina Intézet Az ösztrogénekimmunmoduláns hatásai Ösztrogénhatások Ösztrogénhatások Morbiditás és mortalitási profil eltérő nők és férfiak között Autoimmun
Vásárhelyi Barna Semmelweis Egyetem, Laboratóriumi Medicina Intézet Az ösztrogénekimmunmoduláns hatásai Ösztrogénhatások Ösztrogénhatások Morbiditás és mortalitási profil eltérő nők és férfiak között Autoimmun
OTKA ZÁRÓJELENTÉS
 NF-κB aktiváció % Annexin pozitív sejtek, 24h kezelés OTKA 613 ZÁRÓJELENTÉS A nitrogén monoxid (NO) egy rövid féléletidejű, számos szabályozó szabályozó funkciót betöltő molekula, immunmoduláns hatása
NF-κB aktiváció % Annexin pozitív sejtek, 24h kezelés OTKA 613 ZÁRÓJELENTÉS A nitrogén monoxid (NO) egy rövid féléletidejű, számos szabályozó szabályozó funkciót betöltő molekula, immunmoduláns hatása
Immunológia 4. A BCR diverzitás kialakulása
 Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia alapjai előadás. Sej-sejt kommunikációk az immunválaszban.
 Immunológia alapjai 7-8. előadás Sej-sejt kommunikációk az immunválaszban. Koreceptorok és adhéziós molekulák. Cytokinek, chemokinek és receptoraik. A sejt-sejt kapcsolatok mediátorai: cross-talk - Szolubilis
Immunológia alapjai 7-8. előadás Sej-sejt kommunikációk az immunválaszban. Koreceptorok és adhéziós molekulák. Cytokinek, chemokinek és receptoraik. A sejt-sejt kapcsolatok mediátorai: cross-talk - Szolubilis
Immunológia alapjai. 16. előadás. Komplement rendszer
 Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
A KÉMIAI KOMMUNIKÁCIÓ ALAPELVEI. - autokrin. -neurokrin. - parakrin. -térátvitel. - endokrin
 A KÉMIAI KOMMUNIKÁCIÓ ALAPELVEI - autokrin -neurokrin - parakrin -térátvitel - endokrin 3.1. ábra: Az immunreakciók főbb típusai és funkciójuk. IMMUNVÁLASZ TERMÉSZETES ADAPTÍV humorális sejtes HUMORÁLIS
A KÉMIAI KOMMUNIKÁCIÓ ALAPELVEI - autokrin -neurokrin - parakrin -térátvitel - endokrin 3.1. ábra: Az immunreakciók főbb típusai és funkciójuk. IMMUNVÁLASZ TERMÉSZETES ADAPTÍV humorális sejtes HUMORÁLIS
TÚLÉRZÉKENYSÉGI I. TÍPUSÚ TÚLÉRZÉKENYSÉGI REAKCIÓ 2013.04.21. A szenzitizáció folyamata TÚLÉRZÉKENYSÉGI REAKCIÓK ÁTTEKINTÉSE TÚLÉRZÉKENYSÉGI REAKCIÓK
 TÚLÉRZÉKENYSÉGI REAKCIÓK TÚLÉRZÉKENYSÉGI REAKCIÓK Ártalmatlan anyagok bejutása egyes emberekben túlérzékenységi reakciókat válthat ki Nemkívánatos gyulladáshoz, sejtek és szövetek károsodásához vezet Az
TÚLÉRZÉKENYSÉGI REAKCIÓK TÚLÉRZÉKENYSÉGI REAKCIÓK Ártalmatlan anyagok bejutása egyes emberekben túlérzékenységi reakciókat válthat ki Nemkívánatos gyulladáshoz, sejtek és szövetek károsodásához vezet Az
Immunológia alapjai 7-8. előadás Adhéziós molekulák és ko-receptorok.
 Immunológia alapjai 7-8. előadás Adhéziós molekulák és ko-receptorok. Az immunválasz kezdeti lépései: fehérvérsejt migráció, gyulladás, korai T sejt aktiváció, citokinek. T sejt receptor komplex ITAMs
Immunológia alapjai 7-8. előadás Adhéziós molekulák és ko-receptorok. Az immunválasz kezdeti lépései: fehérvérsejt migráció, gyulladás, korai T sejt aktiváció, citokinek. T sejt receptor komplex ITAMs
Vásárhelyi Barna. Semmelweis Egyetem, Laboratóriumi Medicina Intézet. Az ösztrogének immunmoduláns hatásai
 Vásárhelyi Barna Semmelweis Egyetem, Laboratóriumi Medicina Intézet Az ösztrogének immunmoduláns hatásai Ösztrogénhatások Morbiditás és mortalitási profil eltérő nők és férfiak között Autoimmun betegségek,
Vásárhelyi Barna Semmelweis Egyetem, Laboratóriumi Medicina Intézet Az ösztrogének immunmoduláns hatásai Ösztrogénhatások Morbiditás és mortalitási profil eltérő nők és férfiak között Autoimmun betegségek,
Immunológia alapjai előadás. A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és
 Immunológia alapjai 15-16. előadás A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és csíracentrum reakció, affinitás-érés és izotípusváltás. A B-sejt fejlődés szakaszai HSC Primer
Immunológia alapjai 15-16. előadás A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és csíracentrum reakció, affinitás-érés és izotípusváltás. A B-sejt fejlődés szakaszai HSC Primer
4. A humorális immunválasz október 12.
 4. A humorális immunválasz 2016. október 12. A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja a limfocitát A keletkező
4. A humorális immunválasz 2016. október 12. A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja a limfocitát A keletkező
Az atópiás dermatitis pathogenezise. Dr. Kemény Lajos SZTE Bőrgyógyászai és Allergológai Klinika
 Az atópiás dermatitis pathogenezise Dr. Kemény Lajos SZTE Bőrgyógyászai és Allergológai Klinika Az elmúlt 2-3 évtizedben megfigyelhető az allergiás megbetegedések gyakoriságának gyors emelkedése. Az allergiás
Az atópiás dermatitis pathogenezise Dr. Kemény Lajos SZTE Bőrgyógyászai és Allergológai Klinika Az elmúlt 2-3 évtizedben megfigyelhető az allergiás megbetegedések gyakoriságának gyors emelkedése. Az allergiás
Az immunrendszer sejtjei, differenciálódási antigének
 Az immunrendszer sejtjei, differenciálódási antigének Immunológia alapjai 2. hét Immunológiai és Biotechnológiai Intézet Az immunrendszer sejtjei Természetes/Veleszületett Immunitás: Granulociták (Neutrofil,
Az immunrendszer sejtjei, differenciálódási antigének Immunológia alapjai 2. hét Immunológiai és Biotechnológiai Intézet Az immunrendszer sejtjei Természetes/Veleszületett Immunitás: Granulociták (Neutrofil,
Az adaptív immunválasz kialakulása. Erdei Anna Immunológiai Tanszék ELTE
 Az adaptív immunválasz kialakulása Erdei Anna Immunológiai Tanszék ELTE NK sejt T Bev. 1. ábra Immunhomeosztázis A veleszületett immunrendszer elemei nélkül nem alakulhat ki az adaptív immunválasz A veleszületett
Az adaptív immunválasz kialakulása Erdei Anna Immunológiai Tanszék ELTE NK sejt T Bev. 1. ábra Immunhomeosztázis A veleszületett immunrendszer elemei nélkül nem alakulhat ki az adaptív immunválasz A veleszületett
B-sejtek szerepe az RA patológiás folyamataiban
 B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
INTRACELLULÁRIS PATOGÉNEK
 INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
A T sejt receptor (TCR) heterodimer
 Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Doktori értekezés tézisei
 Doktori értekezés tézisei A komplement- és a Toll-szerű receptorok kifejeződése és szerepe emberi B-sejteken fiziológiás és autoimmun körülmények között - az adaptív és a természetes immunválasz kapcsolata
Doktori értekezés tézisei A komplement- és a Toll-szerű receptorok kifejeződése és szerepe emberi B-sejteken fiziológiás és autoimmun körülmények között - az adaptív és a természetes immunválasz kapcsolata
Natív antigének felismerése. B sejt receptorok, immunglobulinok
 Natív antigének felismerése B sejt receptorok, immunglobulinok B és T sejt receptorok A B és T sejt receptorok is az immunglobulin fehérje család tagjai A TCR nem ismeri fel az antigéneket, kizárólag az
Natív antigének felismerése B sejt receptorok, immunglobulinok B és T sejt receptorok A B és T sejt receptorok is az immunglobulin fehérje család tagjai A TCR nem ismeri fel az antigéneket, kizárólag az
Allergológia Kurzus 2011
 Allergológia Kurzus 2011 Kedd, 14.00-15.30 1 kreditpont Hepreszenzitivitás A normális immunrendszer által adott nemkívánatos reakció Ezek a reakciók szövetkárosodást, kellemetlen tüneteket okoznak, ritkán
Allergológia Kurzus 2011 Kedd, 14.00-15.30 1 kreditpont Hepreszenzitivitás A normális immunrendszer által adott nemkívánatos reakció Ezek a reakciók szövetkárosodást, kellemetlen tüneteket okoznak, ritkán
A légutak immunológiája Az allergiás reakciók pathomechanizmusa. Dérfalvi Beáta II.sz. Gyermekklinika Semmelweis Egyetem Budapest
 A légutak immunológiája Az allergiás reakciók pathomechanizmusa Dérfalvi Beáta II.sz. Gyermekklinika Semmelweis Egyetem Budapest Az immunrendszer feladata a szervezet védelme fertızések, tumorok, szövetkárosodás
A légutak immunológiája Az allergiás reakciók pathomechanizmusa Dérfalvi Beáta II.sz. Gyermekklinika Semmelweis Egyetem Budapest Az immunrendszer feladata a szervezet védelme fertızések, tumorok, szövetkárosodás
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
Antigén, Antigén prezentáció
 Antigén, Antigén prezentáció Biológiai Intézet Immunológiai Tanszék Bajtay Zsuzsa ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2019. február. 26 Bev. 2. ábra Az
Antigén, Antigén prezentáció Biológiai Intézet Immunológiai Tanszék Bajtay Zsuzsa ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2019. február. 26 Bev. 2. ábra Az
KERINGŐ EXTRACELLULÁRIS VEZIKULÁK ÁLTAL INDUKÁLT GÉNEXPRESSZIÓS MINTÁZAT VIZSGÁLATA TROPHOBLAST SEJTVONALBAN
 2016. 10. 14. KERINGŐ EXTRACELLULÁRIS VEZIKULÁK ÁLTAL INDUKÁLT GÉNEXPRESSZIÓS MINTÁZAT VIZSGÁLATA TROPHOBLAST SEJTVONALBAN Kovács Árpád Ferenc 1, Pap Erna 1, Fekete Nóra 1, Rigó János 2, Buzás Edit 1,
2016. 10. 14. KERINGŐ EXTRACELLULÁRIS VEZIKULÁK ÁLTAL INDUKÁLT GÉNEXPRESSZIÓS MINTÁZAT VIZSGÁLATA TROPHOBLAST SEJTVONALBAN Kovács Árpád Ferenc 1, Pap Erna 1, Fekete Nóra 1, Rigó János 2, Buzás Edit 1,
Immunológia Alapjai. 13. előadás. Elsődleges T sejt érés és differenciálódás
 Immunológia Alapjai 13. előadás Elsődleges T sejt érés és differenciálódás A T és B sejt receptor eltérő szerkezetű A T sejt receptor komplex felépítése + DOMÉNES SZERKEZET αβ ΤcR SP(CD4+ vagy CD8+) γδ
Immunológia Alapjai 13. előadás Elsődleges T sejt érés és differenciálódás A T és B sejt receptor eltérő szerkezetű A T sejt receptor komplex felépítése + DOMÉNES SZERKEZET αβ ΤcR SP(CD4+ vagy CD8+) γδ
(1) A T sejtek aktiválása (2) Az ön reaktív T sejtek toleranciája. α lánc. β lánc. V α. V β. C β. C α.
 Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Kutatási beszámoló ( )
 Kutatási beszámoló (2008-2012) A thrombocyták aktivációja alapvető jelentőségű a thrombotikus betegségek kialakulása szempontjából. A pályázat során ezen aktivációs folyamatok mechanizmusait vizsgáltuk.
Kutatási beszámoló (2008-2012) A thrombocyták aktivációja alapvető jelentőségű a thrombotikus betegségek kialakulása szempontjából. A pályázat során ezen aktivációs folyamatok mechanizmusait vizsgáltuk.
Immunológia I. 2. előadás. Kacskovics Imre (imre.kacskovics@ttk.elte.hu)
 Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
NÖVÉNYÉLETTAN. Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010
 NÖVÉNYÉLETTAN Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 Sejtfal szintézis és megnyúlás Környezeti tényezők hatása a növények növekedésére és fejlődésére Előadás áttekintése
NÖVÉNYÉLETTAN Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 Sejtfal szintézis és megnyúlás Környezeti tényezők hatása a növények növekedésére és fejlődésére Előadás áttekintése
Környezetegészségtan 2016/2017. Immunológia 1.
 Környezetegészségtan 2016/2017 Immunológia 1. 2016. XI.11. Józsi Mihály ELTE Immunológiai Tanszék http://immunologia.elte.hu email: mihaly.jozsi@freemail.hu Az Immunológia tankönyv elérhető: http://www.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_immunologia/adatok.html
Környezetegészségtan 2016/2017 Immunológia 1. 2016. XI.11. Józsi Mihály ELTE Immunológiai Tanszék http://immunologia.elte.hu email: mihaly.jozsi@freemail.hu Az Immunológia tankönyv elérhető: http://www.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_immunologia/adatok.html
Preeclampsia-asszociált extracelluláris vezikulák
 Preeclampsia-asszociált extracelluláris vezikulák hatása(i) a monocita sejt működésére Kovács Árpád Ferenc 1, Láng Orsolya 1, Kőhidai László 1, Rigó János 2, Turiák Lilla 3, Fekete Nóra 1, Buzás Edit 1,
Preeclampsia-asszociált extracelluláris vezikulák hatása(i) a monocita sejt működésére Kovács Árpád Ferenc 1, Láng Orsolya 1, Kőhidai László 1, Rigó János 2, Turiák Lilla 3, Fekete Nóra 1, Buzás Edit 1,
A fiziológiás terhesség hátterében álló immunológiai történések
 A fiziológiás terhesség hátterében álló immunológiai történések APAI Ag ANYAI Ag FERTŐZÉS AUTOIMMUNITÁS MAGZATI ANTIGEN ALACSONY P SZINT INFERTILITAS BEÁGYAZÓDÁS ANYAI IMMUNREGULÁCIÓ TROPHOBLAST INVÁZIÓ
A fiziológiás terhesség hátterében álló immunológiai történések APAI Ag ANYAI Ag FERTŐZÉS AUTOIMMUNITÁS MAGZATI ANTIGEN ALACSONY P SZINT INFERTILITAS BEÁGYAZÓDÁS ANYAI IMMUNREGULÁCIÓ TROPHOBLAST INVÁZIÓ
Lujber László és a szerző engedélyé
 Allergia genetikai háttere Dr. Szalai Csaba 2012. Szeptember 24. 1 Allergia: multifaktoriális vagy komplex betegség: Genetikai háttér (több száz gén, több ezer genetikai variáció) + környezeti tényezők
Allergia genetikai háttere Dr. Szalai Csaba 2012. Szeptember 24. 1 Allergia: multifaktoriális vagy komplex betegség: Genetikai háttér (több száz gén, több ezer genetikai variáció) + környezeti tényezők
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás.
 Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Az immunrendszer felépítése Veleszületett immunitás (komplement, antibakteriális
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Az immunrendszer felépítése Veleszületett immunitás (komplement, antibakteriális
Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek
 Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek Dr. Németh Péter PTE-KK Immunológiai és Biotechnológiai Intézet Mi az immunrendszer? Az immunrendszer a szervezet
Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek Dr. Németh Péter PTE-KK Immunológiai és Biotechnológiai Intézet Mi az immunrendszer? Az immunrendszer a szervezet
A humán tripszinogén 4 expressziója és eloszlási mintázata az emberi agyban
 A humán tripszinogén 4 expressziója és eloszlási mintázata az emberi agyban Doktori (PhD) értekezés Siklódi Erika Rozália Biológia Doktori Iskola Iskolavezető: Prof. Erdei Anna, tanszékvezető egyetemi
A humán tripszinogén 4 expressziója és eloszlási mintázata az emberi agyban Doktori (PhD) értekezés Siklódi Erika Rozália Biológia Doktori Iskola Iskolavezető: Prof. Erdei Anna, tanszékvezető egyetemi
Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek
 Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek Dr. Németh Péter PTE-KK Immunológiai és Biotechnológiai Intézet Mi az immunrendszer? Az immunrendszer a szervezet
Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek Dr. Németh Péter PTE-KK Immunológiai és Biotechnológiai Intézet Mi az immunrendszer? Az immunrendszer a szervezet
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
Intelligens molekulákkal a rák ellen
 Intelligens molekulákkal a rák ellen Kotschy András Servier Kutatóintézet Rákkutatási kémiai osztály A rákos sejt Miben más Hogyan él túl Áttekintés Rákos sejtek célzott támadása sejtmérgekkel Fehérjék
Intelligens molekulákkal a rák ellen Kotschy András Servier Kutatóintézet Rákkutatási kémiai osztály A rákos sejt Miben más Hogyan él túl Áttekintés Rákos sejtek célzott támadása sejtmérgekkel Fehérjék
Központi idegrendszeri vizsgálatok.
 Központi idegrendszeri vizsgálatok. Újszülött patkány endorfin imprintingje után, felnőtt állatban a szexuális magatartást, szteroid hormon kötést és az agyi szerotonin szinteket vizsgáltuk. A nőstények
Központi idegrendszeri vizsgálatok. Újszülött patkány endorfin imprintingje után, felnőtt állatban a szexuális magatartást, szteroid hormon kötést és az agyi szerotonin szinteket vizsgáltuk. A nőstények
1. előadás Immunológiai alapfogalmak. Immunrendszer felépítése
 1. előadás Immunológiai alapfogalmak. Immunrendszer felépítése Vér alakos elemei: 1mm3 vérben: 4-5 millió vörövértest 6000-9000 fehérvérssejt 200-400 ezer thrombocyta(vérlemezke) Fehérvérsejtek: agranulocyták:
1. előadás Immunológiai alapfogalmak. Immunrendszer felépítése Vér alakos elemei: 1mm3 vérben: 4-5 millió vörövértest 6000-9000 fehérvérssejt 200-400 ezer thrombocyta(vérlemezke) Fehérvérsejtek: agranulocyták:
A CYTOKIN AKTIVÁCIÓ ÉS GÉN-POLIMORFIZMUSOK VIZSGÁLATA HEL1COBACTER PYLORI FERTŐZÉSBEN ÉS CROHN BETEGSÉGBEN
 % A CYTOKIN AKTIVÁCIÓ ÉS GÉN-POLIMORFIZMUSOK VIZSGÁLATA HEL1COBACTER PYLORI FERTŐZÉSBEN ÉS CROHN BETEGSÉGBEN BEVEZETÉS Mind a Helicobacter pylori fertőzésre, mind pedig a gyulladásos bélbetegségekre, mint
% A CYTOKIN AKTIVÁCIÓ ÉS GÉN-POLIMORFIZMUSOK VIZSGÁLATA HEL1COBACTER PYLORI FERTŐZÉSBEN ÉS CROHN BETEGSÉGBEN BEVEZETÉS Mind a Helicobacter pylori fertőzésre, mind pedig a gyulladásos bélbetegségekre, mint
Természetes immunitás
 Természetes immunitás Ősi: Gyors szaporodású mikroorganizmusok ellen azonnali védelem kell Elterjedés megakadályozása különben lehetetlen Azonnali reakciónak köszönhetően a fertőzést sokszor észre sem
Természetes immunitás Ősi: Gyors szaporodású mikroorganizmusok ellen azonnali védelem kell Elterjedés megakadályozása különben lehetetlen Azonnali reakciónak köszönhetően a fertőzést sokszor észre sem
AZ ÖSZTROGÉN ÉS A DEHIDROEPIANDROSZTERON SZEREPE A SZINAPTIKUS ÁTRENDEZŐDÉSBEN
 AZ ÖSZTROGÉN ÉS A DEHIDROEPIANDROSZTERON SZEREPE A SZINAPTIKUS ÁTRENDEZŐDÉSBEN c. PhD-értekezés magyar nyelvű összefoglalója Csákvári Eszter Témavezető: Dr. Párducz Árpád Magyar Tudományos Akadémia Szegedi
AZ ÖSZTROGÉN ÉS A DEHIDROEPIANDROSZTERON SZEREPE A SZINAPTIKUS ÁTRENDEZŐDÉSBEN c. PhD-értekezés magyar nyelvű összefoglalója Csákvári Eszter Témavezető: Dr. Párducz Árpád Magyar Tudományos Akadémia Szegedi
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
Mit lehet tudni az allergiákról általában?
 Az allergiás emberek száma minden generációban évről-évre nő. A sokak életét megkeserítő megbetegedésnek sok formája ismert, bár manapság leginkább a légúti tünetek okozó allergiákról és azok kezelésére
Az allergiás emberek száma minden generációban évről-évre nő. A sokak életét megkeserítő megbetegedésnek sok formája ismert, bár manapság leginkább a légúti tünetek okozó allergiákról és azok kezelésére
Hogyan véd és mikor árt immunrendszerünk?
 ERDEI ANNA Hogyan véd és mikor árt immunrendszerünk? Erdei Anna immunológus egyetemi tanár Az immunrendszer legfontosabb szerepe, hogy védelmet nyújt a különbözô kórokozók vírusok, baktériumok, gombák,
ERDEI ANNA Hogyan véd és mikor árt immunrendszerünk? Erdei Anna immunológus egyetemi tanár Az immunrendszer legfontosabb szerepe, hogy védelmet nyújt a különbözô kórokozók vírusok, baktériumok, gombák,
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a PD-L1 és PD-1 fehérjék túlélésre gyakorolt hatása
 Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
3. Az ellenanyagokra épülő immunválasz. Varga Lilian Semmelweis Egyetem III. Sz. Belgyógyászati Klinika
 3. Az ellenanyagokra épülő immunválasz Varga Lilian emmelweis Egyetem III. z. Belgyógyászati Klinika Az ellenanyag funkciói Molekuláris kölcsönhatások helye az immunglobulinon Paratop specifikus ab Idiotípus
3. Az ellenanyagokra épülő immunválasz Varga Lilian emmelweis Egyetem III. z. Belgyógyászati Klinika Az ellenanyag funkciói Molekuláris kölcsönhatások helye az immunglobulinon Paratop specifikus ab Idiotípus
Az omnipotens kutatónak, Dr. Apáti Ágotának ajánlva, egy hálás ex-őssejtje
 1 Az omnipotens kutatónak, Dr. Apáti Ágotának ajánlva, egy hálás ex-őssejtje Írta és rajzolta: Hargitai Zsófia Ágota Munkában részt vett: Dr. Sarkadi Balázs, Dr. Apáti Ágota A szerkesztésben való segítségért
1 Az omnipotens kutatónak, Dr. Apáti Ágotának ajánlva, egy hálás ex-őssejtje Írta és rajzolta: Hargitai Zsófia Ágota Munkában részt vett: Dr. Sarkadi Balázs, Dr. Apáti Ágota A szerkesztésben való segítségért
Az ellenanyagok szerkezete és funkciója. Erdei Anna Immunológiai Tanszék ELTE
 Az ellenanyagok szerkezete és funkciója Erdei Anna Immunológiai Tanszék ELTE Bev. 1. ábra Immunhomeosztázis A veleszületett és az adaptív immunrendszer szorosan együttműködik az immunhomeosztázis fenntartásáért
Az ellenanyagok szerkezete és funkciója Erdei Anna Immunológiai Tanszék ELTE Bev. 1. ábra Immunhomeosztázis A veleszületett és az adaptív immunrendszer szorosan együttműködik az immunhomeosztázis fenntartásáért
Mikrogliák eredete és differenciációja
 Mikrogliák eredete és differenciációja 2017. 10. 24. Jordán Viktória F. Ginhoux et al. Origin and differentiation of microglia, 2013 F. Ginhoux et al. Fate mapping anaylsis reveals that adult microglia
Mikrogliák eredete és differenciációja 2017. 10. 24. Jordán Viktória F. Ginhoux et al. Origin and differentiation of microglia, 2013 F. Ginhoux et al. Fate mapping anaylsis reveals that adult microglia
A hisztamin és hisztamin H4 receptor hiányának hatása a dendritikus sejtek működésére
 A hisztamin és hisztamin H4 receptor hiányának hatása a dendritikus sejtek működésére Doktori tézisek Jelinek Ivett Semmelweis Egyetem Molekuláris Orvostudományok Doktori Iskola Témavezető: Dr. László
A hisztamin és hisztamin H4 receptor hiányának hatása a dendritikus sejtek működésére Doktori tézisek Jelinek Ivett Semmelweis Egyetem Molekuláris Orvostudományok Doktori Iskola Témavezető: Dr. László
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 6. előadás Humorális és celluláris immunválasz A humorális (B sejtes) immunválasz lépései Antigén felismerés B sejt aktiváció: proliferáció, differenciálódás
Immunológiai módszerek a klinikai kutatásban 6. előadás Humorális és celluláris immunválasz A humorális (B sejtes) immunválasz lépései Antigén felismerés B sejt aktiváció: proliferáció, differenciálódás
Az allergia molekuláris etiopatogenezise
 Az allergia molekuláris etiopatogenezise Müller Veronika Immunológia továbbképzés 2019. 02.28. SEMMELWEIS EGYETEM Pulmonológiai Klinika http://semmelweis.hu/pulmonologia 2017. 03. 08. Immunológia továbbképzés
Az allergia molekuláris etiopatogenezise Müller Veronika Immunológia továbbképzés 2019. 02.28. SEMMELWEIS EGYETEM Pulmonológiai Klinika http://semmelweis.hu/pulmonologia 2017. 03. 08. Immunológia továbbképzés
Doktori értekezés tézisei. Az FcRn transzgén állatok humorális immunválaszát befolyásoló T sejtek és antigén bemutató sejtek funkcionális vizsgálata
 Doktori értekezés tézisei Az FcRn transzgén állatok humorális immunválaszát befolyásoló T sejtek és antigén bemutató sejtek funkcionális vizsgálata Farkas Anita Témavezető: Dr. Kacskovics Imre Prof. Dr.
Doktori értekezés tézisei Az FcRn transzgén állatok humorális immunválaszát befolyásoló T sejtek és antigén bemutató sejtek funkcionális vizsgálata Farkas Anita Témavezető: Dr. Kacskovics Imre Prof. Dr.
Immunológia. Hogyan működik az immunrendszer? http://www.szote.u-szeged.hu/mdbio/oktatás/immunológia password: immun
 Immunológia Hogyan működik az immunrendszer? http://www.szote.u-szeged.hu/mdbio/oktatás/immunológia password: immun Hogyan működik az immunrendszer? Milyen stratégiája van? Milyen szervek / sejtek alkotják?
Immunológia Hogyan működik az immunrendszer? http://www.szote.u-szeged.hu/mdbio/oktatás/immunológia password: immun Hogyan működik az immunrendszer? Milyen stratégiája van? Milyen szervek / sejtek alkotják?
Lukácsi Szilvia
 Immunológia II GY 2018.04.13. Lukácsi Szilvia 7. Sterilitás, in vitro sejttenyésztés Az immunrendszer sejtjeinek izolálása, azonosítása és funkcionális vizsgálata: I. Monociták, makrofágok, dendritikus
Immunológia II GY 2018.04.13. Lukácsi Szilvia 7. Sterilitás, in vitro sejttenyésztés Az immunrendszer sejtjeinek izolálása, azonosítása és funkcionális vizsgálata: I. Monociták, makrofágok, dendritikus
A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet
 A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet Mi a feladata az Immunrendszernek? 1. Védelem a kórokozók ellen 2. Immuntolerancia fenntartása Mik is azok a kórokozók? Kórokozók alatt
A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet Mi a feladata az Immunrendszernek? 1. Védelem a kórokozók ellen 2. Immuntolerancia fenntartása Mik is azok a kórokozók? Kórokozók alatt
1. Bevezetés. Integrinek, Fc-receptorok és G-fehérje-kapcsolt receptorok jelátvitelének mechanizmusa neutrofil granulocitákban
 Integrinek, Fc-receptorok és G-fehérje-kapcsolt receptorok jelátvitelének mechanizmusa neutrofil granulocitákban Doktori tézisek Dr. Jakus Zoltán Semmelweis Egyetem Molekuláris Orvostudományok Doktori
Integrinek, Fc-receptorok és G-fehérje-kapcsolt receptorok jelátvitelének mechanizmusa neutrofil granulocitákban Doktori tézisek Dr. Jakus Zoltán Semmelweis Egyetem Molekuláris Orvostudományok Doktori
A hízósejtek szerepe az immunológiai folyamatokban
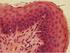 A hízósejtek szerepe az immunológiai folyamatokban Berki Timea Boldizsár F, Bartis D, Talabér G, Szabó M, Németh P, University of Pécs, Department of Immunology & Biotechnology, Pécs, Hungary Additon of
A hízósejtek szerepe az immunológiai folyamatokban Berki Timea Boldizsár F, Bartis D, Talabér G, Szabó M, Németh P, University of Pécs, Department of Immunology & Biotechnology, Pécs, Hungary Additon of
A kemotaxis jelentősége a. betegségek kialakulásában
 A kemotaxis jelentősége a betegségek kialakulásában A kemotaxis jelentősége fertőzések esetén (1) Akut bőrsérülések citokin (IL-8)) felszabadulás TNF ill. IL-6 6 NEM szabadul fel Pseudomonas aeruginosa
A kemotaxis jelentősége a betegségek kialakulásában A kemotaxis jelentősége fertőzések esetén (1) Akut bőrsérülések citokin (IL-8)) felszabadulás TNF ill. IL-6 6 NEM szabadul fel Pseudomonas aeruginosa
Norvég Finanszírozási Mechanizmus által támogatott projekt HU-0115/NA/2008-3/ÖP-9 ÚJ TERÁPIÁS CÉLPONTOK AZONOSÍTÁSA GENOMIKAI MÓDSZEREKKEL
 Norvég Finanszírozási Mechanizmus által támogatott projekt HU-0115/NA/2008-3/ÖP-9 ÚJ TERÁPIÁS CÉLPONTOK AZONOSÍTÁSA GENOMIKAI MÓDSZEREKKEL KÖZÖS STRATÉGIA KIFEJLESZTÉSE MOLEKULÁRIS MÓDSZEREK ALKALMAZÁSÁVAL
Norvég Finanszírozási Mechanizmus által támogatott projekt HU-0115/NA/2008-3/ÖP-9 ÚJ TERÁPIÁS CÉLPONTOK AZONOSÍTÁSA GENOMIKAI MÓDSZEREKKEL KÖZÖS STRATÉGIA KIFEJLESZTÉSE MOLEKULÁRIS MÓDSZEREK ALKALMAZÁSÁVAL
Retinoid X Receptor, egy A-vitamin szenzor a tüdőmetasztázis kontrolljában. Kiss Máté!
 Retinoid X Receptor, egy A-vitamin szenzor a tüdőmetasztázis kontrolljában Kiss Máté! Magreceptor Kutató Laboratórium Biokémiai és Molekuláris Biológiai Intézet Debreceni Egyetem, Általános Orvostudományi
Retinoid X Receptor, egy A-vitamin szenzor a tüdőmetasztázis kontrolljában Kiss Máté! Magreceptor Kutató Laboratórium Biokémiai és Molekuláris Biológiai Intézet Debreceni Egyetem, Általános Orvostudományi
A sejtek közötti közvetett (indirekt) kapcsolatok
 A sejtek közötti közvetett (indirekt) kapcsolatok kémiai anyag közvetítése a jeladó - jel - csatorna - jelfogó rendszerben szöveti hormon hormon szövet közötti tér véráram neurotranszmisszió neurotranszmitter
A sejtek közötti közvetett (indirekt) kapcsolatok kémiai anyag közvetítése a jeladó - jel - csatorna - jelfogó rendszerben szöveti hormon hormon szövet közötti tér véráram neurotranszmisszió neurotranszmitter
Intézeti Beszámoló. Dr. Kovács Árpád Ferenc
 Intézeti Beszámoló Dr. Kovács Árpád Ferenc 2015.12.03 135 millió újszülött 10 millió újszülött Preeclampsia kialakulása kezdetét veszi Preeclampsia tüneteinek megjelenése Preeclampsia okozta koraszülés
Intézeti Beszámoló Dr. Kovács Árpád Ferenc 2015.12.03 135 millió újszülött 10 millió újszülött Preeclampsia kialakulása kezdetét veszi Preeclampsia tüneteinek megjelenése Preeclampsia okozta koraszülés
Sejtek - őssejtek dióhéjban. 2014. február. Sarkadi Balázs, MTA-TTK Molekuláris Farmakológiai Intézet - SE Kutatócsoport, Budapest
 Sejtek - őssejtek dióhéjban 2014. február Sarkadi Balázs, MTA-TTK Molekuláris Farmakológiai Intézet - SE Kutatócsoport, Budapest A legtöbb sejtünk osztódik, differenciálódik, elpusztul... vérsejtek Vannak
Sejtek - őssejtek dióhéjban 2014. február Sarkadi Balázs, MTA-TTK Molekuláris Farmakológiai Intézet - SE Kutatócsoport, Budapest A legtöbb sejtünk osztódik, differenciálódik, elpusztul... vérsejtek Vannak
Ajánlott tankönyvek: Gergely János, Erdei Anna: Immunbiológia. Falus András: Az immunológia élettani és molekuláris alapjai
 Ajánlott tankönyvek: Gergely János, Erdei Anna: Immunbiológia Falus András: Az immunológia élettani és molekuláris alapjai Janeway, Travers, Walport, Schlomchik: Immunobiology Paraziták Virulencia egyes
Ajánlott tankönyvek: Gergely János, Erdei Anna: Immunbiológia Falus András: Az immunológia élettani és molekuláris alapjai Janeway, Travers, Walport, Schlomchik: Immunobiology Paraziták Virulencia egyes
A Globális regulátor mutációknak mint az attenuálás lehetőségének vizsgálata Escherichia coli-ban
 A Globális regulátor mutációknak mint az attenuálás lehetőségének vizsgálata Escherichia coli-ban című támogatott kutatás fő célja az volt, hogy olyan regulációs mechanizmusoknak a virulenciára kifejtett
A Globális regulátor mutációknak mint az attenuálás lehetőségének vizsgálata Escherichia coli-ban című támogatott kutatás fő célja az volt, hogy olyan regulációs mechanizmusoknak a virulenciára kifejtett
T helper és T citotoxikus limfociták szerepének vizsgálata allergológiai és autoimmun bőrgyógyászati kórképekben
 T helper és T citotoxikus limfociták szerepének vizsgálata allergológiai és autoimmun bőrgyógyászati kórképekben A most befejezett OTKA pályázat célkitűzése volt immunmediált bőrgyógyászati ill. bőrgyógyászati
T helper és T citotoxikus limfociták szerepének vizsgálata allergológiai és autoimmun bőrgyógyászati kórképekben A most befejezett OTKA pályázat célkitűzése volt immunmediált bőrgyógyászati ill. bőrgyógyászati
FEHÉRJE VAKCINÁK BIOTECHNOLÓGIAI ELŐÁLLÍTÁSA III.
 Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére FEHÉRJE VAKCINÁK BIOTECHNOLÓGIAI ELŐÁLLÍTÁSA III.
Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére FEHÉRJE VAKCINÁK BIOTECHNOLÓGIAI ELŐÁLLÍTÁSA III.
A preventív vakcináció lényege :
 Vakcináció Célja: antigénspecifkus immunválasz kiváltása a szervezetben A vakcina egy olyan készítmény, amely fokozza az immunitást egy adott betegséggel szemben (aktiválja az immunrendszert). A preventív
Vakcináció Célja: antigénspecifkus immunválasz kiváltása a szervezetben A vakcina egy olyan készítmény, amely fokozza az immunitást egy adott betegséggel szemben (aktiválja az immunrendszert). A preventív
Az asztma (és atópiás ekcéma/dermatitis szindróma) genomikai vizsgálatai; különös tekintettel a hisztamin immunmodulációjára. Kozma Tibor Gergely
 Az asztma (és atópiás ekcéma/dermatitis szindróma) genomikai vizsgálatai; különös tekintettel a hisztamin immunmodulációjára Doktori értekezés Kozma Tibor Gergely Semmelweis Egyetem Doktori Iskola A humán
Az asztma (és atópiás ekcéma/dermatitis szindróma) genomikai vizsgálatai; különös tekintettel a hisztamin immunmodulációjára Doktori értekezés Kozma Tibor Gergely Semmelweis Egyetem Doktori Iskola A humán
Dr. Nemes Nagy Zsuzsa Szakképzés Karl Landsteiner Karl Landsteiner:
 Az AB0 vércsoport rendszer Dr. Nemes Nagy Zsuzsa Szakképzés 2011 Az AB0 rendszer felfedezése 1901. Karl Landsteiner Landsteiner szabály 1901 Karl Landsteiner: Munkatársai vérmintáit vizsgálva fedezte fel
Az AB0 vércsoport rendszer Dr. Nemes Nagy Zsuzsa Szakképzés 2011 Az AB0 rendszer felfedezése 1901. Karl Landsteiner Landsteiner szabály 1901 Karl Landsteiner: Munkatársai vérmintáit vizsgálva fedezte fel
ÖSSZ-TARTALOM 1. Az alapok - 1. előadás 2. A jelutak komponensei 1. előadás 3. Főbb jelutak 2. előadás
 Jelutak ÖSSZ-TARTALOM 1. Az alapok - 1. előadás 2. A jelutak komponensei 1. előadás 3. Főbb jelutak 2. előadás 4. Idegi- és hormonális kommunikáció 3. előadás Jelutak 1. a sejtkommunikáció alapjai 1. Bevezetés
Jelutak ÖSSZ-TARTALOM 1. Az alapok - 1. előadás 2. A jelutak komponensei 1. előadás 3. Főbb jelutak 2. előadás 4. Idegi- és hormonális kommunikáció 3. előadás Jelutak 1. a sejtkommunikáció alapjai 1. Bevezetés
Allergiás reakciók molekuláris mechanizmusa
 Allergiás reakciók molekuláris mechanizmusa Erdei Anna Eötvös Loránd Tudományegyetem Immunológiai Tanszék Biológiai Intézet Immunológiai Tanszék MLDT továbbképzés 2015. április 22., Honvéd Kórház Bp. Az
Allergiás reakciók molekuláris mechanizmusa Erdei Anna Eötvös Loránd Tudományegyetem Immunológiai Tanszék Biológiai Intézet Immunológiai Tanszék MLDT továbbképzés 2015. április 22., Honvéd Kórház Bp. Az
Jelutak ÖSSZ TARTALOM. Jelutak. 1. a sejtkommunikáció alapjai
 Jelutak ÖSSZ TARTALOM 1. Az alapok 1. előadás 2. A jelutak komponensei 1. előadás 3. Főbb jelutak 2. előadás 4. Idegi és hormonális kommunikáció 3. előadás Jelutak 1. a sejtkommunikáció alapjai 1. Bevezetés
Jelutak ÖSSZ TARTALOM 1. Az alapok 1. előadás 2. A jelutak komponensei 1. előadás 3. Főbb jelutak 2. előadás 4. Idegi és hormonális kommunikáció 3. előadás Jelutak 1. a sejtkommunikáció alapjai 1. Bevezetés
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
Doktori értekezés tézisei
 Doktori értekezés tézisei Az asztma (és atópiás ekcéma/dermatitis szindróma) genomikai vizsgálatai; különös tekintettel a hisztamin immunmodulációjára Kozma Tibor Gergely Semmelweis Egyetem Doktori Iskola
Doktori értekezés tézisei Az asztma (és atópiás ekcéma/dermatitis szindróma) genomikai vizsgálatai; különös tekintettel a hisztamin immunmodulációjára Kozma Tibor Gergely Semmelweis Egyetem Doktori Iskola
A szervezet védekezik a belső környezet állandóságát veszélyeztető, úgynevezett testidegen anyagokkal szemben. A szervezet számára idegen anyag lehet
 Immunrendszer Immunitás Az immunrendszer a szervezet önazonosságát és épségét biztosító védekező rendszer. Feladata a szervezet saját anyagainak eltűrése, a nem saját (idegen) anyagok felismerése és eltávolítása.
Immunrendszer Immunitás Az immunrendszer a szervezet önazonosságát és épségét biztosító védekező rendszer. Feladata a szervezet saját anyagainak eltűrése, a nem saját (idegen) anyagok felismerése és eltávolítása.
ELMÉLETI ÖSSZEFOGLALÓ
 ELMÉLETI ÖSSZEFOGLALÓ Előzetes ismeretek: a sejt felépítése sejtalkotók szerepe a sejtmembrán szerkezete sejtfelszíni molekulák szerepe (marker-receptor) fehérjeszintézis alapja, folyamata Megjegyzés:
ELMÉLETI ÖSSZEFOGLALÓ Előzetes ismeretek: a sejt felépítése sejtalkotók szerepe a sejtmembrán szerkezete sejtfelszíni molekulák szerepe (marker-receptor) fehérjeszintézis alapja, folyamata Megjegyzés:
Receptorok és szignalizációs mechanizmusok
 Molekuláris sejtbiológia: Receptorok és szignalizációs mechanizmusok Dr. habil Kőhidai László Semmelweis Egyetem Genetikai, Sejt- és Immunbiológiai Intézet Sejtek szignalizációs kapcsolatai Sejtek szignalizációs
Molekuláris sejtbiológia: Receptorok és szignalizációs mechanizmusok Dr. habil Kőhidai László Semmelweis Egyetem Genetikai, Sejt- és Immunbiológiai Intézet Sejtek szignalizációs kapcsolatai Sejtek szignalizációs
Immunológia alapjai. 8. előadás. Sejtek közötti kommunikáció: citokinek, kemokinek. Dr. Berki Timea
 Immunológia alapjai 8. előadás Sejtek közötti kommunikáció: citokinek, kemokinek Dr. Berki Timea Az immunválasz sejtjeinek párbeszéde 2 mechanizmussal zajlik: 1. Közvetlen sejt-sejt kapcsolódás útján:
Immunológia alapjai 8. előadás Sejtek közötti kommunikáció: citokinek, kemokinek Dr. Berki Timea Az immunválasz sejtjeinek párbeszéde 2 mechanizmussal zajlik: 1. Közvetlen sejt-sejt kapcsolódás útján:
A GYÓGYSZERHATÁST BEFOLYÁSOLÓ TÉNYEZŐK
 A GYÓGYSZERHATÁST BEFOLYÁSOLÓ TÉNYEZŐK A gyógyszerhatást befolyásoló tényezők I. Faj, fajta, vérvonal Receptoriális (farmakodinámiai) Szarvasmarha - Xylazin Macska - Morfin Felszívódás Ló - Ampicillin
A GYÓGYSZERHATÁST BEFOLYÁSOLÓ TÉNYEZŐK A gyógyszerhatást befolyásoló tényezők I. Faj, fajta, vérvonal Receptoriális (farmakodinámiai) Szarvasmarha - Xylazin Macska - Morfin Felszívódás Ló - Ampicillin
A sejtek közötti közvetett (indirekt) kapcsolatok
 A sejtek közötti közvetett (indirekt) kapcsolatok kémiai anyag közvetítése a jeladó - jel - csatorna - jelfogó rendszerben szöveti hormon hormon szövet közötti tér véráram neurotranszmisszió neurotranszmitter
A sejtek közötti közvetett (indirekt) kapcsolatok kémiai anyag közvetítése a jeladó - jel - csatorna - jelfogó rendszerben szöveti hormon hormon szövet közötti tér véráram neurotranszmisszió neurotranszmitter
Immunológia alapjai. Hyperszenzitivitás előadás. Immunglobulin és cytokin mediálta hyperszenzitív reakciók. Allergia. DTH.
 Immunológia alapjai 21 22. előadás Hyperszenzitivitás Immunglobulin és cytokin mediálta hyperszenzitív reakciók. Allergia. DTH. Hyperszenzitivitás Az immunológiai reakciók súlyos szövetkárosodással (nekrózis)
Immunológia alapjai 21 22. előadás Hyperszenzitivitás Immunglobulin és cytokin mediálta hyperszenzitív reakciók. Allergia. DTH. Hyperszenzitivitás Az immunológiai reakciók súlyos szövetkárosodással (nekrózis)
Immunológia alapjai előadás MHC. szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás.
 Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Antigén felismerés Az ellenanyagok és a B sejt receptorok natív formában
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Antigén felismerés Az ellenanyagok és a B sejt receptorok natív formában
