Mágneses magrezonancia (NMR) spektroszkópia a fehérjekutatásban. Dr. Tőke Orsolya MTA Kémiai Kutatóközpont Szerkezeti Kémiai Intézet 2007
|
|
|
- Elemér Pataki
- 5 évvel ezelőtt
- Látták:
Átírás
1 Mágneses magrezonancia (NMR) spektroszkópia a fehérjekutatásban Dr. Tőke Orsolya MTA Kémiai Kutatóközpont Szerkezeti Kémiai Intézet
2 A fehérjék szerkezetének és működésének megértése alapvető fontosságú a biológia és az orvostudomány számára. Az NMR spektroszkópia (Függelék A) azon ritka kísérleti módszerek egyike, mely a molekuláris kölcsönhatásoknak mind a szerkezeti, mind a dinamikai aspektusát képes megvilágítani. A módszer további előnye, hogy az így nyert atomi szintű információ makroszkopikusan mérhető termodinamikai és kinetikai paraméterekkel hozható összefüggésbe. Az alábbiakban áttekintjük az NMR spektroszkópia azon alkalmazási lehetőségeit, melyek napjainkban segítségünkre vannak a biomolekulák vizsgálatában. Összefoglalónk során elsősorban az oldatfázisú vizsgálatokra összpontosítunk (I-IV.), de röviden bepillantást nyújtunk az Olvasó számára azokba a szilárd fázisú NMR technikákba is (V.), melyek lehetővé teszik a rosszul oldódó, nehezen kristályosítható molekuláris rendszerek (pl. membránpeptidek) vizsgálatát. I. Szerkezetmeghatározás Fehérjék oldatfázisú NMR szerkezetvizsgálata során a cél az aminosavszekvencia ismeretében a molekula három dimenziós térbeli szerkezetének a felderítése. Kismolekulák NMR vizsgálatához hasonlóan a szerkezetmeghatározás lépései három fő fázisra tagolódnak: a) jelhozzárendelés, b) 1 H- 1 H távolságkényszerek felállítása és c) szerkezetszámolás. Mivel fehérjék esetében igen nagy számú rezonanciajellel állunk szemben, elengedhetetlen a nagyterű, nagyfelbontású szupravezető mágnesek ( 500 MHz) használata, valamint a molekulamérettől függően izotópjelzés (Függelék B) alkalmazása. Az erre vonatkozó irányelveket az 1. táblázat mutatja. Molekulatömeg < 8 kda 8-12 kda kda > 25 kda Stratégia izotópjelzés nem szükséges (2D 1 H- 1 H homokorrelációs mérések) teljes 15 N-izotópjelzés (3D 15 N-editált 1 H- 1 H korrelációs mérések) teljes 13 C, 15 N izotópjelzés (3D, 4D hármasrezonancia mérések) teljes 2 H, 13 C, 15 N izotópjelzés (3D, 4D négyesrezonancia mérések) 1. tábázat Izotópjelzés teljes szerkezetmeghatározás céljából történő NMR vizsgálatokhoz Míg a 13 C és 15 N izotópjelzés három vagy négy dimenziós spektrumokban szűrőként működve növeli a felbontást (1. ábra), a 2 H izotóp alkalmazása csökkenti azokat a nagy molekulatömegű fehérjékben előtérbe kerülő relaxációs folyamatokat, melyek jelszélesedéshez és ezáltal intenzitáscsökkenéshez vezetnek. Mivel a 2 H-jelzés a szerkezetmeghatározásban nem játszik közvetlen szerepet, a továbbiakban vele nem foglalkozunk. 1. ábra (A) Erős átfedés a rezonanciajelek között a lizozim fehérje (10 kda) 2D homonukleáris NOESY spektrumában. (B) A 15 N-editált 3D NOESY-HSQC spektrum sematikus képe. A 2D spektrumban átfedő rezonanciajelek a 15 N kémiai eltolódásuknak megfelelően szétválnak. 2
3 Jelhozzárendelés. Míg peptidek, kisebb fehérjék rezonanciajeleinek asszignációját 2D homonukleáris mérések kombinációjával nyerjük, nagyobb fehérjék esetén hármasrezonancia mérésekre ( 1 H, 13 C, 15 N) van szükség (1. táblázat). Mindkét esetben a magok között az elektronok közvetítésével működő (tehát kémiai kötések mentén ható) J-csatolások segítségével teremtünk korrelációt az egyes atomok között. Míg homonukleáris mérésekben ez két egymással kötésben levő (jelzetlen) heteroatomhoz kötődő 1 H- 1 H magpár közötti 3 J HH (1-10 Hz) csatolást jelent, hármasrezonancia mérésekben közvetlenül az egymással kémiai kötésben levő 1 H, 13 C, és 15 N magok között lépkedünk (J~ Hz) (2. ábra). Az egykötéses erősebb csatolás hatékonyabb mágnesezettség transzfert eredményez, ami a felbontás növelésén túl, az izotópjelzés másik nagy előnye. A jelhozzárendelés stratégiáját jelzetlen és jelzett fehérjékben a 3. és 5. ábra szemlélteti. Jelzetlen fehérjékben a 1 H rezonanciajelek asszignációját 2D COSY, TOCSY és NOESY homonukleáris korrelációs mérések kombinációjával nyerjük (3. ábra). A COSY ( correlation spectroscopy ) és TOCSY ( total correlation spectroscopy ) spektrumok segítségével spinrendszereket azonosíthatunk, melyek a rezonanciajelek kémiai eltolódásai és korrelációs mintázatai (4. ábra) alapján megfeleltethetők egy-egy aminosavtípusnak. A NOESY ( nuclear Overhauser effect spectroscopy ) mérés szolgáltatta 1 H- 1 H térközelségekből pedig az aminosavszekvencia ismeretében következtethetünk az i-i+1 konnektivitásra. A három mérés kombinációjával a 1 H rezonanciajelek egy az egyben a peptidlánchoz rendelhetők. Hatvan-hetven aminosavnál hosszabb peptidláncok esetében, azaz kb. 8 kda-os molekulatömeg felett célszerű a 1 H- 1 H homonukleáris méréseket 15 N-editált három dimenziós spektrumokkal kiegészíteni. A 2D spektrumokban átfedő rezonanciejelek a 3D 15 N-TOCSY-HSQC és 3D 15 N-NOESY-HSQC spektrumokban a 15 N kémiai eltolódásuk alapján egyértelműen asszignálhatók. Még nagyobb fehérjék esetén (kb kda felett) a jelhozzárendelés már csak három vagy négy dimenziós hármasrezonancia kísérletek kombinációjával oldható meg. Ezek közül néhány mérés korrelációs szabályszerűségeit a 6. ábra mutatja. A peptidgerinc asszignációjának alappillére a HNCACB és a CBCACONNH mérés (5. ábra). Míg a HNCACB pulzusszekvencia az i-dik aminosavegység amidprotonját a saját (i-dik) és őt a szekvenciában eggyel megelőző (i-1-dik) aminosavegység alfa és béta szénatomjával korrelálja, a CBCACONNH mérés az i-dik aminosavegység amidprotonja és az i-1-dik aminosavegység alfa és béta szénatomja között teremt korrelációt. A két spektrum párhuzamos értékelésével a rezonanciajelek dominószerűen az aminosavszekvenciához rendelhetők. A peptidgerinc fennmaradó karbonil szénatomját és alfa hidrogénatomját a HNCO és a CBCACOCAHA mérések segítségével asszignálhatjuk. A peptidgerinc asszignációját követi az oldalláncok jelhozzárendelése, melyet TOCSY-típusú mérések segítségével nyerhetünk. Az asszignáció végeztével rendelkezésünkre áll a fehérjemolekula - szerencsés esetben - valamennyi 1 H, 13 C és 15 N atomjának a kémiai eltolódása. Ezek közül az 1 H α, 13 C α, 13 C β és 13 C=O eltolódások jelentős eltéréseket mutatnak random coil, α-hélix és β-redő esetén, így a másodlagos szerkezeti elemek feltérképezése során diagnosztikusnak tekinthetők. 2. ábra (A) A peptidgerinc asszignációja során alkalmazott 1 H- 13 C- 15 N hármasrezonancia-spektrumokat olyan 3D téglatestként kell elképzelnünk, ahol az egyik dimenzió az amidproton, a másik dimenzió a szén, a harmadik dimenzió pedig a nitrogén kémiai eltolódása. Az adatfeldolgozás során az egyes 15 N-eltolódásoknak megfelelő síkok között lépkedünk a téglatestben. (B) A mágnesezettség parányi szállítóedénykéiként működő skaláris (J) csatolások a 13 C, 15 N-jelzett peptidláncban. 3
4 3. ábra Jelzetlen fehérjék asszignációja 2D homonukleáris korrelációs mérések kombinációjával. Az aminosavak típusát kémiai eltolódásuk és a keresztcsúcsok mintázata alapján COSY és TOCSY mérések segítségével azonosítjuk. Az alsó sorban az egyik valin aminosav asszignációja látható a rubredoxin fehérjében (5 kda). A NOESY 1 H- 1 H távolságkényszerekből meghatározható az egyes aminosavegységeknek megfelelő rezonanciajelek i-i+1 konnektivitása a peptidláncban, valamint a teljes háromdimenziós szerkezet. aminosav αh βh többi valin (Val) γ CH , 0.94 izoleucin (Ile) γ CH , 1.19 γ CH δ CH leucin (Leu) , 1.65 γ CH 1.64 δ CH , 0.90 treonin (Thr) γ CH ábra Néhány aminosav COSY korrelációs mintázata és 1 H kémiai eltolódása. 4
5 5. ábra Asszignációs stratégia 13 C, 15 N-jelzett fehérjékben hármasrezonancia mérések alkalmazásával. 6. ábra Néhány 1 H- 13 C- 15 N hármasrezonancia mérés korrelációs szabályszerűségei. Az egyes mérések az azonos színnel bekeretezett atomok között teremtenek korrelációt. 5
6 Távolságkényszerek. A rezonanciajelek asszignációjának birtokában a szerkezetmeghatározás következő lépése a 1 H- 1 H távolságkényszerek felállítása. A jelhozzárendeléshez hasonlóan ez is többdimenziós, leggyakrabban 13 C- vagy 15 N-editált NOESY mérésekkel történik (1b. ábra). Ezen mérések során szénnel vagy nitrogénnel kémiai kötésben levő H-atomok korrelációját detektáljuk más, vele térközelségben (<6 Å) levő H-atomokkal. Egy jól definiált szerkezet eléréséhez aminosavanként átlagosan kényszerfeltételre van szükség, ami egy kda-os fehérje esetén 3-4 ezer távolságkényszert jelent. Szerkezetszámolás. A szerkezetmeghatározás végső fázisa a szerkezetszámolás. Ennek során az aminosavsorrend ismeretében és a 1 H- 1 H távolságkényszerek birtokában molekuladinamikai módszerek alkalmazásával szerkezeteket generálunk és finomítunk, s a két folyamat között addig iterálunk, míg további érdemi javulást már nem észlelünk. A távolságkényszerek mellett a szerkezetszámolást segíti a kémiai eltolódásból nyert másodlagos szerkezetre vonatkozó információ, valamint - amennyiben rendelkezésre áll - torziós szögek, orientációs kényszerek, ismert H- és diszulfid-kötések pozíciója a molekulában. A szerkezetszámolás eredménye egy a kényszerfeltételeknek eleget tevő tipikusan 10 vagy 20 legalacsonyabb energiájú szerkezetből álló sokaság (7. ábra), valamint az ún. átlagos szerkezet. A szerkezet határozottságát jellemző paraméter az RMSD (root mean square deviation = eltérések négyzetösszegének gyöke), a sokaságnak a fehérje adott típusú atomjaira (pl. C α ) vonatkozóan számított eltérése az átlagos szerkezettől. 7. ábra Az intesztinális zsírsavkötő fehérje apo formájának 20 legalacsonyabb energiájú szerkezete az NMR szerkezetszámítás végén. A C α atomokra számított RMSD érték 1.2 Å. (Hodsdon & Cistola, Biochemistry 1997, 36, ) Molekulakomplexek. Vizsgálódásaink során a fehérjéknek többnyire nem pusztán az önmagukban álló ún. apo (=külön, görög) formájára vagyunk kíváncsiak, hanem valamely ligandummal vagy makromolekulával (másik fehérje, DNS) képzett komplexének, az ún. holo (=teljes, görög) formának a szerkezetére. Konkrétan mire is keressük a választ ezekben a vizsgálatokban? Többek között arra, mely aminosavegységek vesznek részt a kölcsönhatásban, a kölcsönható partnerek között milyen másodlagos kötőerők működnek, mi a kölcsönhatás mechanizmusa és mozgatórugója. Az intermolekuláris határfelüleletek feltérképezésének legegyszerűbb módja a kémiai eltolódás változásának monitorizálása. Kiválóan alkalmasak erre azok a heterokorrelációs ún. 15 N-HSQC ( heteronuclear single quantum coherence ) spektrumok, melyekben minden egyes keresztcsúcs egy-egy NH protonnak, azaz - a néhány NH protont tartalmazó oldallánctól (pl. Asn, Gln) eltekintve - egy-egy aminosavegységnek felel meg a fehérjében. Ezen mérések során tipikusan 15 N-jelzett fehérjét komplexálunk jelzetlen partnerével (8. ábra). Amennyiben nagyobb felbontású, atomi szintű információra van szükségünk a molekulakomplexek szerkezetét illetően, úgy intermolekuláris távolságkényszerek felállítása szükséges. Az intra- és intermolekuláris NOE-k megkülönböztetése azonban gyakran komoly kihívást jelent. Ennek megoldásában segítenek az ún. izotópszűrt NOESY mérések, melyek során a két kölcsönható partner közül csak az egyiket izotópjelezzük, és speciális pulzusszekvenciák alkalmazásával minden egyes jelzett 15 NH vagy 13 CH hidrogénatom számára az egyik molekulában csak olyan H-atomokat láttatunk, amelyek nem jelzett szén- vagy nitrogénatomhoz kötődnek. Mivel ennek a feltételnek csak a jelzetlen partner molekula hidrogénatomjai felelnek meg, az izotópszűrt kísérlet során kizárólagosan intermolekuláris 1 H- 1 H kontaktusból származó rezonanciajelet detektálunk. 6
7 8. ábra (A) A calreticulin (CRT) nevű szénhidrátkötő fehérje 15 N-HSQC spektruma. Balra: apo forma, jobbra: az ERp57 nevű tiol-diszulfid oxidoreduktázzal képzett komplex. A színessel jelölt rezonanciajelek mutatják a legnagyobb kémiai eltolódásváltozást. (B) A kémiai eltolódásváltozások megjelenítése a CRT fehérje modelljén. (Frickel et al. PNAS, 2002, 99, ) Több doménből álló nagyobb fehérjék, molekulakomplexek szerkezetvizsgálata során különlegesen hasznos a távolságkényszereket orientációs feltételekkel kiegészíteni. Amennyiben valamilyen módon a fehérjék izotróp rotációs diffúzióját sikerül lelassítani az oldatban (ez megoldható például bicellák vagy bakteriofágok alkalmazásával az oldatban), a magok közötti dipoláris csatolás nem átlagolódik ki tökéletesen. Az ún. maradék, idegen szóval reziduális dipoláris csatolás, előjelétől függően növeli vagy csökkenti az izotróp oldatban is jelenlevő J csatolást. Erre látunk példát a 9. ábrán egy szénhidrátkötő fehérje 15 N-HSQC spektrumában. A dipoláris csatolás szögfüggéséből (~ 3cos 2 θ-1, ahol θ a dipoláris vektor, azaz jelen esetben a 15 N- 1 H kötésvektor és a külső mágneses tér (B o ) által bezárt szög) meghatározható az egyes N-H kötésvektorok egymáshoz viszonyított iránya, ezáltal molekulaszegmensek, domének relatív orientációja. 9. ábra (A) Orientációs rendezettség indukálása bicellás oldatban. (B) A 15 N -1 H dipoláris vektor a külső mágneses térben. (C) A BLBC nevű szénhidrátkötő fehérje 1 H-lecsatolás nélkül detektált 15 N-HSQC spektruma izotróp (balra) és 5% DMPC/DHPC 3:1 bicellás (jobbra) oldatban. (Prestegard, Nat. Str. Biol. NMR Suppl., July 1998, ) 7
8 Végül, de nem utolsósorban, a molekulakomplexek NMR vizsgálati lehetőségeinek sorában meg kell említenünk az ún. transzfer NOE technikát, mint a kötött ligandum konformációjának meghatározására irányuló vizsgálati módszert. Nagy molekulatömegű fehérjék esetén (MW>50 kda), amennyiben a fehérje-ligandum kölcsönhatás gyenge (K d : µm-mm) és a szabad és a kötött forma között gyors cserefolyamatok működnek, a kötött ligandum 1 H- 1 H térközelségeiből eredő NOE effektus áttevődik a tipikusan nagy feleslegben jelen levő szabad ligandum rezonanciajeleire. A transzfer NOE kísérlet előnye, hogy nincs szükség sem a fehérje, sem a ligandum izotópjelzésére. A 10. ábrán egy, a látásban fontos szerepet játszó fehérje-peptid kölcsönhatásra látunk példát. 10. ábra A fényérzékelés G-fehérjéjének peptid epitópja rodopszinnal komplexálva. A fényaktivált (A) és a fénytől védett forma (B) transzfer NOESY spektruma. Extra keresztcsúcsok az A spektrumban a lizin oldallánc és a közelben levő aromás gyűrű között működő, ún. kation-π kölcsönhatás kulcsszerepére utalnak a fényaktivált komplexben. (Anderson et al., JACS 2006, 128, ) A fentiekben összefoglalt módszerek kombinációjával megfelelő külső mágneses térerő birtokában ( MHz-es szupravezető mágnes), 2 H, 13 C, 15 N-izotópjelzés alkalmazásával, valamint a Nobel-díjas Kurt Wüthrich és kutatócsoportja által kifejlesztett, a relaxációs folyamatok további optimalizálását célzó mérési technikák segítségével (TROSY= transverse relaxation optimized spectroscopy ) napjainkra lehetőség nyílt többszáz kdaos tömegű fehérjék- és fehérjekomplexek NMR spektroszkópiai vizsgálatára. II. Kötődésvizsgálatok, termodinamikai alkalmazások Az előzőekben szó volt a fehérjekomplexek szerkezetvizsgálatáról. Míg a teljes szerkezetmeghatározás ezekben az esetekben hónapokat, gyakran éveket igénybe vevő folyamat, a kötődés puszta tényének igazolása egyszerűbb feladat. Az NMR paraméterek közül a kémiai eltolódás megváltozása a legkézelfoghatóbb jele a komplexképződésnek. Monitorizálása a ligandum koncentrációjának függvényében lehetővé teszi kötődési izotermák felvételét, melyek elemzésével meghatározhatók a fehérje-ligandum komplexek egyensúlyi disszociációs állandói. Különös jelentősége van az NMR spektroszkópiának a több kötőzsebbel rendelkező fehérjék vizsgálatánál, hiszen a kémiai környezet és ezáltal a kémiai eltolódás különbözőségéből adódóan lehetőség nyílik kötőhely specifikus disszociációs állandók meghatározására. Ezek kombinálása más független vizsgálatokból (pl. fluoreszcenciás, kalorimetriás mérések) nyert makroszkópikus állandókkal további részletekkel szolgál a fehérje-ligandum kölcsönhatás termodinamikájára vonatkozóan, lehetővé téve például kooperatív rendszerekben a kooperativitás szabadenergia-járulékának meghatározását. Erre látunk példát a 11. ábrán a humán epesavkötő fehérje vizsgálatának kapcsán. 8
9 11. ábra Glikokólsav kötődés vizsgálata a humán epesavkötő fehérjében. (A) Specifikusan 15 N-jelzett glikokólsav-fehérje komplex 15 N- HSQC spektruma 3:1-es fehérje:ligandum mólaránynál. Három rezonanciajelet látunk. A ligandumok egyik populációja az 1-es számmal jelölt kémiai környezetben (1-es kötőzseb), másik populációja a 2-es számmal jelölt kémiai környezetben (2-es kötőzseb) tartózkodik, harmadik populációja pedig szabadon van az oldatban (U). Ez utóbbi asszignációja fehérjét nem tartalmazó glikokólsav-oldat azonos körülmények között végzett NMR vizsgálatával történt. (B) A három rezonanciajel NMR csúcsintegrálja a teljes ligandumkoncentráció függvényében. A kötődési izotermák elemzésével meghatározhatók a kötőzseb specifikus kötődési állandók (κ 1, κ 2). (C) Fehérje-ligandum kölcsönhatás termodinamikai ciklusa két kötőhellyel rendelkező fehérjében. K 1K 2=κ 1κ 2c 12, ahol K 1 és K 2 a makroszkópikus kötődési állandók (K 1=[FL]/[F][L], K 2=[FL 2]/[FL][L], ahol [F] a szabad fehérje, [L] a szabad ligandum, [FL] és [FL 2] pedig az egy illetve két kötött ligandummal rendelkező fehérjekomplex koncentrációja), κ 1 és κ 2 a kötőhely specifikus kötődési állandók, c 12 pedig a kooperativitási faktor. A makroszkópikus és kötőhely specifikus állandók ismeretében c 12 számítható. Pozitív kooperativitás esetén ligandum kötődése az egyik kötőzsebhez megkönnyíti a másik ligandum molekula számára a másik kötőzseb elfoglalását. (Tochtrop et al. PNAS 2002, 99, ) A kémiai eltolódás mellett számos más fehérje-ligandum kölcsönhatásra érzékeny NMR paraméter van. Ilyen a molekulamérettől függő relaxációs idő és ezzel összefüggésben a vonalszélesség, valamint az intermolekuláris 1 H- 1 H térközelség (NOE) jelenléte. NMR spektroszkópiai módszerekkel szintén meghatározható a diffúziós állandó, melynek szignifikáns csökkenése valamely ligandum (kismolekula) esetében fehérje-ligandum kölcsönhatást indikál. II. Dinamikai vizsgálatok A fehérjékben jelen levő molekuláris mozgások időskáláját a 2. táblázatban foglaltuk össze. A kémiai reakciók lejátszódása szempontjából meghatározó rezgési folyamatok mellett a fehérjékben és kölcsönhatásaikban ahol a gyengébb, másodlagos erők dominálnak -, kiemelkedő szerephez jutnak a lassabb folyamatok. Időskála Mozgásforma Amplitúdó vegyértékrezgés, deformációs s rezgés, torziós mozgások Å szegmensmozgások (terminuszok, s loop-ok), oldallánc rotációk Å peptidek felgombolyodása, s hélix-coil átmenet Å globális konformációs változások, s domén mozgások Å 10-3 fehérjék felgombolyodása 1 s (1000 s) (prolinizomerizáció) Å 2. táblázat Molekuláris mozgások a fehérjékben Ezek közül a ps-ns időskálán zajló folyamatok jól jellemezhetők az NMR relaxációs paraméterekkel, nevezetesen a spin-rács (T 1 ) és spin-spin (T 2 ) relaxációs idővel. Ennek megértése céljából tekintsünk egy 15 N- 1 H kötésvektort a külső mágneses térben (B o ) (12. ábra). A 15 N spin által érzékelt mágneses térerőt a kötésvektor irányától függően a szomszédos 1 H mag mágneses momentuma erősíti illetve gyengíti. A kötésvektor molekuláris mozgások révén történő reorientációja fluktuációt idéz elő a 15 N mag által érzékelhető lokális 9
10 12. ábra 15 N- 1 H kötésvektor a külső statikus mágneses térben. A 15 N spin által érzékelt mágneses térerőt a kötésvektor irányától függően a szomszédos 1 H mag mágneses momentuma (A) erősíti illetve (B) gyengíti. mágneses térben, ami az NMR kísérlet során meggyorsítja a 15 N mag mágnesezettségének csökkenését, relaxációját. A T 1 és T 2 relaxációs időkből számítható ún. általánosított rendezettségi paraméter (S 2 ) a peptidlánc flexibilitásának mérőszáma. A 13. ábrán az intesztinális zsírsavkötő fehérje amidnitrogénjeinek relaxációs ideje alapján számított rendezettségi paraméter látható az aminosavszekvencia függvényében. Az alacsony S 2 értékek a loop régiókban az adott szegmensek erőteljesebb mozgékonyságát tükrözik. Hasonló relaxációs és rendezettségi paraméterek határozhatók meg 13 C mérésekkel az oldalláncokra vonatkozóan. 13. ábra Az intesztinális zsírsavkötő fehérje általánosított rendezettségi paramétere az aminosavszekvencia függvényében (apo fehérje: teli karika, holo fehérje: üres karika) (Hodsdon & Cistola, Biochemistry, 1997, 36, ) Míg a ps-ns időskálán zajló erőteljesebb mozgások általában a szerkezet határozatlanságát jelzik (pl. H-kötések hiánya), a µs-ms időskálán zajló konformációs változások gyakran konkrét összefüggésbe hozhatók a hatásmechanizmussal, így például valamely enzimmolekula ún. átalakítási számával ( turnover ), azaz az egy másodperc alatt egy enzimmolekula által átalakított szubsztrát molekulák számával. A fehérjék másodperceket, perceket, esetenként órákat, napokat is igénybe vevő feltekeredési folyamatainak NMR vizsgálatáról a következő fejezetben lesz szó. IV. A felgombolyodás (folding) vizsgálata A fehérjék kitekeredett peptidláncok formájában szintetizálódnak a riboszómán. Feltekeredésük, felgombolyodásuk mechanizmusa a szerkezeti biológia egyik központi kérdése. Ahogyan összefoglalónk során számos alkalommal utaltunk rá, a kémiai eltolódás az atommagok elektronikus árnyékolásának, ezáltal kémiai környezetének érzékeny mérőszáma. Míg kitekeredett (denaturált) fehérjékben egy adott funkciós csoportnak megfelelő (pl. NH) protonok árnyékolása egy átlagos ( random coil ) értékhez közelít, felgombolyodott (natív) fehérjékben a protonok változatos, egymástól igencsak eltérő kémiai környezetben helyezkedhetnek el. Ennek megfelelően ez utóbbi esetben a kémiai eltolódások eloszlása, diszperzitása szélesebb. 10
11 A kémiai eltolódásváltozás monitorizálása a denaturálószer (pl. urea (=karbamid), guanidium. HCl) koncentrációjának függvényében lehetővé teszi a fehérje stabilitására vonatkozó termodinamikai paraméterek megállapítását, valamint bizonyítékkal szolgálhat a natív és a denaturált állapot közötti intermedierek jelenlétére vonatkozóan. A mágneses momentummal rendelkező magok sorában különösen érzékeny a kémiai környezetben történő változásokra a 19 F mag. Érzékenységének és kis méretének köszönhetően jól alkalmazható fehérjék NMR vizsgálatában. Erre látunk példát a 14. ábrán az uropatogén E. coli adhéziós szervecskéjének (pilus) felgombolyodását segítő chaperon, a PapD fehérje vizsgálata kapcsán. Ez tehát egy feltekeredést segítő fehérje feltekeredés-vizsgálata. 14. ábra (A) A folding vizsgálathoz alkalmazott 19 F-jelzett Trp aminosavak pozíciója a PapD fehérjében. (B) A 19 F-jelzett PapD fehérje 1D 19 F NMR spektruma az urea koncentráció függvényében. A natív (N), denaturált (D) és intermedier (I) állapotnak megfelelő rezonanciajelek asszignációja pontmutánsok ([ 19 F-Trp 128, Trp36Phe]-PapD és [ 19 F-Trp 36, Trp128Phe]-PapD) segítségével történt. (Bann et al. PNAS 2002, 99, ) Az egyensúlyi vizsgálatokat kiegészíthetjük kinetikai, ún. stopped-flow NMR mérésekkel. Ennek alapja, hogy a magas denaturálószer-koncentráció mellett (pl. 7 M urea) kitekeredett fehérjét t=0 időpillanatban hirtelen renaturáló pufferba higítva, feltekeredés indul meg. A denaturált állapotnak megfelelő rezonanciajelek intenzitásának csökkenéséből, illetve a natív állapotnak megfelelő rezonanciajelek kiépüléséből az idő függvényében meghatározható a feltekeredési folyamat sebességi állandója. Aminosav-specifikus izotópjelzéssel a fehérje különböző pontjain következtetések vonhatók le a feltekeredési folyamat mechanizmusára vonatkozóan. Hasonló kinetikai mérésekkel Friedennek és munkatársainak sikerült megállapítania, hogy a PapD fehérjében az N- és C-terminális domén harmadlagos szerkezetének kialakulása előfeltétele a közöttük létrejövő, további stabilizációt eredményező interdomén kölcsönhatásnak, valamint fény derült arra is, hogy a sebességmeghatározó lépés a feltekeredési folyamatban egy transz-cisz prolin izomerizáció az N-terminális doménban. Az előzőekben aminosav-specifikus 19 F-izotópjelzés alkalmazásával példát láttunk a fehérjék felgombolyádásának kinetikai és mechanizmus vizsgálatára. Amennyiben bővebb szerkezeti információra vagyunk kíváncsiak az intermedier állapotok konformációját illetően, úgy egy másik izotóphoz, a deutériumhoz ( 2 D) kell fordulnunk. A kitekeredett fehérjék amidprotonjai ugyanis gyors cserélődésben vannak az oldószerrel, ennek megfelelően nehézvizes pufferoldatban a deutériummal. Ezzel szemben a natív forma amidprotonjai nagyságrendekkel lassabban cserélődnek az oldószerrel. Ennek oka az amidprotonok védettsége a natív szerkezetben, mely egyrészt a szerkezet kompaktságából, másrészt a H-kötések nyújtotta stabilitásból ered. A denaturált és natív állapotok közötti intermedierek részleges védettséggel rendelkeznek, ami lehetővé teszi, hogy H/D cserélődési folyamatok vizsgálatával információt nyerjünk a konformációjukról. Egy tipikus ún. quenched-flow H/D mérés vázlatát a 15. ábrán szemléltetjük. A kísérlet alapja a cserélődési sebesség phfüggése. Míg erősen lúgos közegben a cserefolyamat sebességi állandója akár az 1000 s -1 -et is elérheti, savas közegben mindössze s -1-1 s -1 között változik. A mérés kezdetén a fehérje denaturálószeres D 2 O-oldatban kitekeredett állapotban van, és ennek megfelelően az NH protonok nagy része deuterálódik (ph=6). Ezt 11
12 követően az oldatot renaturáló még mindig D 2 O-os - pufferoldattal t időtartamig keverve a feltekeredés megindul. Ezt megszakítja egy rövid, 5-50 ms-os keveredés könnyűvizes pufferral magas ph-n (ph=9), mely a fehérje még rendezetlen szegmensein visszacseréli a deutériumokat protonra, a már védett amidcsoportok viszont továbbra is deuteráltak maradnak. Az NMR mérés előtt ph=4-es renaturáló pufferban a feltekeredés teljessé válik. Az alacsony ph-nak köszönhetően a H/D cserefolyamat ekkor már olyan lassú, hogy a deuteráció foka tovább nem változik, így az mintegy befagyasztva megőrzi az intermedier konformációjának megfelelő állapotot. Az amidprotonok asszignációjának ismeretében meghatározhatók a H/D-cserélődéssel szemben védettséggel rendelkező aminosavegységek az intermedierben, melyből következtetések vonhatók le az intermedier konformációjára vonatkozóan. A t időtartam változtatásával lehetővé válik a feltekeredés során keletkező intermedier állapotok időbeli követése. 15. ábra Folding intermedierek konformációs vizsgálata H/D kicserélődéssel quench-flow technika alkalmazásával. V. Biomolekulák vizsgálata szilárd fázisú NMR spektroszkópiával A kémiai-, anyag- és biológiai vizsgálatok tárgyát gyakran képezik olyan makromolekuláris rendszerek (pl. szintetikus polimerek az iparban, membránfehérjék a biológiában), melyeknek tulajdonságait, működését a molekulák belső szerkezetén kívül nagymértékben befolyásolja az egymással és környezetükkel történő szerveződésük. A szilárd fázisú NMR spektroszkópia alkalmazásával lehetőség nyílik arra, hogy e makromolekuláris rendszereket a természetes előfordulásukat maximálisan megközelítő fizikai állapotban vizsgálhassuk. Ezen kívül praktikus okai is lehetnek a szilárd fázisú NMR választásának. Rosszul oldódó, 12
13 rosszul kristályosítható molekulák és heterogén rendszerek esetén jelenleg ez az egyetlen fizikai módszer, mellyel nagy pontosságú (Å) molekulaszerkezeti információ nyerhető. Az oldatfázisban jelen levő gyors rotációs diffúziós mozgások hiányában a szilárd fázisú NMR spektrumot a gyakran több száz, több ezer Hz erősségű, irányfüggő (anizotróp) spin-spin kölcsönhatások dominálják. Ilyen például a kémiai eltolódás anizotrópiája, amely az eddig látott oldatfázisú példákban a gyors Brown mozgásnak köszönhetően keskeny jellé, az ún. izotróp kémiai eltolódássá átlagolódott. Nem így a szilárd fázisban (16. ábra felső spektrum). Egy másik, igen fontos irányfüggő kölcsönhatás a magok között fellépő, téren át ható dipoláris csatolás. Távolságfüggő tulajdonságának köszönhetően (~1/r 3, ahol r a két egymással kölcsönhatásban lévő mag közötti távolság) ez a paraméter rendkívüli hasznossággal bír a szerkezetkutatás számára. Ahhoz azonban, hogy ezeket a kölcsönhatásokat a vizsgálódásainkhoz hasznosítani tudjuk, meg kell szabadulnunk a széles, átfedő rezonanciajelektől, hogy láthatóvá váljanak a miniatűr részletek, amelyek az igazi, számunkra fontos szerkezeti információt hordozzák. Az anizotróp kölcsönhatásoktól való megszabadulás egyik módja a minta mechanikus pörgetése egy a külső mágneses térrel ot (ún. mágikus szög) bezáró tengely körül (MAS= magic angle spinning ) (16. ábra). Matematikai levezetéssel igazolható, hogy a MAS pörgetés az oldatfázisú rotációs diffúzióhoz hasonlóan kiátlagolja az irányfüggő spin-spin kölcsönhatásokat, és az oldatfázisú NMR spektrumhoz hasonló, keskeny rezonanciajeleket eredményez. Másik lehetőség az anizotróp kölcsönhatások kiküszöbölésére a spektrumból a minta mechanikus vagy mágneses úton történő orientációja a külső mágneses térben. 16. ábra Speciális mérőfej konstrukcióval az NMR mintatartó (ún. rotor) os szöget zár be a külső mágneses térrel. Szilárd fázisú NMR spektrum felbontásának javítása MAS pörgetéssel. [1-13 C]-alanin porminta szilárd fázisú NMR spektruma MAS nélkül (felső spektrum) és különböző MAS pörgetési sebességek mellett. A pörgetés következtében forgási oldalsávok jelennek meg az izotróp kémiai eltolódás két oldalán. A pörgetési sebesség növelésével a rezonanciajelnek egyre nagyobb hányada koncentrálódik az izotróp kémiai eltolódásban. Ezen technikák alkalmazása mellett is azonban a szilárd fázisú NMR spektrum felbontása jelentősen alulmarad az oldatfázisban megszokottnak. Ennek tudatában nem lepődünk meg azon, hogy bár újabban a szilárd fázisú NMR spektroszkópia területén is vannak törekvések az oldatfázisban megszokott teljes szerkezetmeghatározásra, a hangsúly szilárd fázisban a specifikus szerkezeti információn van. Ennek megfelelően a mintakészítés stratégiája is más: teljes izotópjelzés helyett specifikus izotópjelzés szükséges. Erre látunk két példát az alábbiakban egy membránokban pórust képző peptid vizsgálata kapcsán. Az első példában a lipid kettősrétegbe ágyazott peptid másodlagos szerkezetére voltak kíváncsiak a kutatók. 13 C és 15 N izotópok jól megválasztott helyre történő beépítésével az aminosavszekvenciába (17. ábra), a 13 C- 15 N dipoláris csatolást kihasználva az ún. REDOR ( rotational-echo double resonance ) technika alkalmazásával azonosították az Ala 17 -es aminosavegység karbonilcsoportjának kémiai eltolódását a spektrumban. Mivel α- hélix és β-redő esetén az alanin 13 CO rezonanciajele majdnem 8 ppm különbséget mutat szilárd fázisban, a mérésből egyértelműen kiderült: a vizsgált peptid 17-es pozíciójú alaninja α-hélix konformációban van a membránban. (A mérést a peptidlánc mentén két másik pozícióban is elvégezték, és hasonló eredményre jutottak.) 13
14 17. ábra Balra: Specifikus 13 C- és 15 N-izotópjelzés a KIAGKIAKIAGKIAKIAGKIA (K3) peptid másodlagos szerkezetének meghatározására lipid kettősrétegben. Jobbra: Lipid kettősrétegbe ágyazott K3 peptid teljes echo (S o) és 13 C{ 15 N} REDOR differencia spektruma ( S) 1.6 ms (8 rotor ciklus) dipoláris evolúciós idő elteltével. MAS pörgetés: 5000 Hz. (Toke et al. Biophys. J. 2004, 87, ) 18. ábra Balra: Specifikus 13 C-, 15 N- és 19 F izotópjelzés a KIAGKIAKIAGKIAKIAGKIA (K3) peptid aggregációs tulajdonságainak vizsgálata céljából. Jobbra: Lipid kettősrétegbe ágyazott K3 peptid teljes echo (S o), 4-rotor ciklusos 13 C -> 15 N TEDOR-echo, és 13 C{ 19 F} REDOR differencia spektruma 9.6 ms (48 rotor ciklus) dipoláris evolúciós idő után. MAS pörgetés: 5000 Hz. (Toke et al. Biophys. J. 2004, 87, ) A 18. ábrán ugyanennek a peptidnek egy további vizsgálatát mutatjuk be. A másodlagos szerkezet meghatározását követően a kérdés az volt, aggregálódnak-e egymással a peptidláncok a membránban, és ha igen, milyen mértékben és milyen módon. Ennek a kérdésnek a megközelítésére a peptidláncok felét az előzőekhez hasonlóan specifikus 13 C és 15 N izotópjelzéssel látták el a lánc közepén, a peptidláncok másik felébe pedig a szekvencia ugyanazon pontján egy 19 F izotópot építettek be. A mérés két lépésben történt. Első lépésben az erős 13 C- 15 N dipoláris csatolás segítségével az Ala CO jelet kiválasztották a spektrumból (TEDOR-S o ), majd a következő lépésben meghatározták a 13 C- 19 F intermolekuláris dipoláris csatolást. A kísérletek specifikus kölcsönhatásra utaltak a peptidláncok között a membránban, majd a továbbiakban sikerült azt is kideríteni, hogy monomer és dimer peptidek foszfolipid molekulákkal asszociálódva alkotják a membrán pórust. 14
15 A fenti két példa pusztán illusztrációja a szilárd fázisú NMR spektroszkópia lehetséges alkalmazásainak. Membránpeptideken és -fehérjéken kívül más rosszul oldódó, rosszul kristályosítható molekuláris rendszerek (receptor-ligandum komplexek, aggregációra hajlamos fibrilláris peptidláncok) vizsgálatánál szintén ez az egyetlen olyan szerkezetvizsgálati módszer, mellyel napjainkban atomi szintű molekulaszerkezeti információ nyerhető. 15
16 FÜGGELÉK A. A mágneses magrezonancia spektroszkópia alapjai A mágneses magrezonancia (NMR) kísérlet alapja az a megfigyelés, mely szerint a mágneses momentummal, más néven spinnel rendelkező atommagok (pl. 1 H, 13 C, 15 N, 31 P, 19 F, 113 Cd, 119 Sn) energiaszintjei erős külső mágneses térben (B o ) felhasadnak, és egy újabb, a külső statikus mágneses tér irányára merőleges, szinuszosan váltakozó mágneses tér alkalmazásával (B 1 ) ezen felhasadt energiaszintek között átmeneteket idézhetünk elő. (1. ábra) A felhasadt energiaszintek távolsága, s ennek megfelelően a detektált rezonanciajel frekvenciája (ún. kémiai eltolódás) a szóban forgó atommagot érő mágneses árnyékolás, azaz a kémiai környezet függvénye. 1. ábra Spin-1/2 magok felhasadt (ún. Zeeman) energiaszintjei a külső statikus mágneses térben (B o). Energiakvantum elnyelése a rádiofrekvenciás térből (B 1) átmeneteket idéz elő az energiaszintek között, melynek hatására a minta makroszkópikus mágnesezettsége megváltozik. Az egymással kémiai kötésben levő magok között az elektronok közvetítésével megvalósuló ún. skaláris (J)-csatolás eredményeképpen a rezonanciajel a legtöbb esetben nem szingulett, hanem finomszerkezettel rendelkezik. A multiplett vonalainak távolságából meghatározhatjuk a csatolási állandókat. A kémiai eltolódás és a csatolási állandók ismeretében a vizsgált molekulában funkciós csoportokat, spinrendszereket azonosíthatunk. Ezt a folyamatot hívjuk jelhozzárendelésnek, idegen szóval asszignációnak. A J-csatolás másik fontos tulajdonsága, hogy információval szolgál az illető funkciós csoportok geometriájáról (torziós szögek), valamint hogy segítségével mágnesezettséget vihetünk át egyik spinről a másikra. Az NMR kísérlet során rádiófrekvenciás (rf) pulzusokkal gerjesztett magok relaxációs folyamatok révén igyekeznek visszatérni az alapállapotba. A relaxációs mechanizmusok egyike egy a téren át ható spin-spin kölcsönhatáson, az ún. dipoláris csatoláson alapszik. Ez utóbbi távolságfüggésének köszönhetően mag-mag távolságkényszerek állíthatók fel a molekula egyes szegmensei között. Sőt, mivel a J-csatolással ellentétben a dipoláris kölcsönhatás nem kötések mentén, hanem téren át hat, intermolekuláris távolságkényszerek is megállapíthatók. Az effektus felfedezőjéről ezeket a 6 Å-nél rövidebb 1 H- 1 H térközelségeket NOE (nukeláris Overhauser effektus) kontaktusoknak nevezte el az irodalom. Míg kismolekulák NMR spektroszkópia vizsgálata során gyakran egydimenziós spektrumokból is elegendő információhoz jutunk, nagyobb molekulák vizsgálata esetén a felbontás növelése érdekében két- vagy többdimenziós mérésekhez kell folyamodnunk. Ezek lehetnek homo- ( 1 H- 1 H) vagy heterokorrelációs (pl. 1 H- 15 N) mérések (2.ábra). 2. ábra Jelzetlen rubredoxin fehérje TOCSY ( total correlation spectroscopy ) és 13 C, 15 N-jelzett humán epesavkötő fehérje 15 N-HSQC ( heteronuclear single quantum coherence ) spektruma. 16
17 B. 13 C, 15 N-izotópjelzett fehérjék bioszintetikus úton történő előállítása NMR spektroszkópiai vizsgálatok céljából Az NMR spektroszkópiai vizsgálatokhoz szükséges izotópjelzett fehérjék rekombinációs úton állíthatók elő. Ennek során a vizsgálni kívánt fehérje aminosavszekvenciáját kódoló komplementer DNS-t bakteriális (leggyakrabban E.coli) vagy más organizmusnak (pl. élesztőgomba) megfelelő ún. plazmidvektorba építik be (1a ábra). A plazmidok a kromoszómán kívüli gyűrű alakú DNS molekulák, amelyek könnyen a sejtekbe juttathatók (1b ábra). Számuk egy E.coli sejtben a többszázat is elérheti, így a későbbi kifejtés (expresszió) során fokozottan érvényesül az önsokszorozó hatás. A B 1. ábra (A) Fehérjék bioszintetikus úton történő előállítására kifejlesztett expressziós vektor (ori: a replikáció megindítását kódoló DNS szakasz; teta és amp r : antibiotikummal szembeni rezisztenciát kódoló gének; B: egy ún. restrikciós endonukleáz felismerési pontja a DNS szekvenciában, melynek segítségével a plazmidvektor az adott helyen felhasítható, majd az expresszálni kívánt gén beépítését követően ismét összezárható. (B) Baktériumsejt sematikus képe. Az oldatfázisú NMR vizsgálatok többségéhez szükséges teljes, idegen szóval uniform 15 N/ 13 C izotópjelzés 15 N-jelzett szervetlen ammóniumsó (pl. 15 NH 4 Cl) illetve 13 C-jelzett glükóz, mint kizárólagos nitrogén- illetve szénforrás alkalmazásával valósítható meg a táptalajban. Különböző stratégiák léteznek arra vonatkozóan, hogy a termelékenység maximalizálása (mg célfehérje/l táptalaj) és az izotópveszteség minimalizálása érdekében (hiszen a 15 N és a 13 C izotóp nem pusztán a vizsgálni kívánt fehérjébe épül be, hanem az organizmus valamennyi fehérjéjébe) az izotópjelzett tápanyagot mikor, milyen körülmények között (sejtkoncentráció, hőmérséklet) juttatják a tenyészetbe. Legtöbb esetben elegendő, ha az izotópjelzett tápanyagot csak közvetlenül a fehérjeexpresszió indukálása előtt adják az oldathoz (2. ábra). 2. ábra 13 C, 15 N-jelzett humán epesavkötő fehérje expresszálása MG1655 E. coli sejtekben minimál táptalajon. A baktérium-kultúra 600 nm-nél mért optikai diszperzitása az idő függvényében (növekedési görbe). Maga az indukció egy az alkalmazott plazmidvektorra specifikus anyagnak a tápoldatba adagolásával történik, mely a plazmid megfelelő DNS-szakaszát felismerve, megindítja a fehérjeszintézist. Az indukció időtartama organizmusonként változik. Míg bakteriális expresszió esetében a kívánt sejtsűrűség elérése általában néhány órát vesz igénybe, élesztőgombában történő expresszió esetén a folyamat több hétig is eltarthat. A megfelelő sejtkoncentrációt elérve a tápoldatot centrifugálják, majd a kiülepedett sejtmasszából szuszpenziót képezve a sejteket ozmotikus sokknak vetik alá. A sejtekből kiszabaduló makromolekulák sokaságából a célfehérjét kromatográfiás módszerek kombinációjával tisztítják. Vannak olyan NMR vizsgálatok is, melyekhez nem teljes izotópjelzésre van szükség, hanem csak bizonyos aminosavak izotópjelzésére a fehérjemolekulában. Ebben az esetben az egyes aminosavakat, közöttük a jelezni kívánt aminosavat is külön-külön kell a tápoldatba adagolni. Az izotópjelzés hígulásának elkerülése érdekében ezen fehérjék előállításához speciális, ún. auxotróf baktériumtörzsekre van szükség. Ezek sajátossága, hogy önállóan nem képesek a jelezni kívánt aminosavat előállítani. A mai modern molekuláris biológiai módszerekkel néhány aminosavtípus esetében az is megoldható, hogy a peptidláncban egy bizonyos aminosavegységet lássunk el jelzéssel (pl. Trp 67, Phe 115 ). 17
18 Irodalomjegyzék [1] Wüthrich, K. NMR of Proteins and Nucleic Acids; Wiley: New York, [2] Cavanagh, J., Fairbrother, W. J., Palmer, A. G., Skelton, N. J. Protein NMR Spectroscopy: Principles and Practice; Academic Press: New York 2006 [3] Gardner, K. H., Kay, L. E. The Use of 2 H, 13 C, 15 N Multidimensional NMR to Study the Structure and Dynamics of Proteins; Annu. Rev. Biophys. Biomol. Struct. 1998, 27: [4] Hodsdon, M. E., Cistola, D. P. Ligand Binding Alters the Backbone Mobility of Intestinal Fatty Acid-Binding Protein as Monitored by 15 N Relaxation and 1 H Exchange; Biochemistry 1997, 36, [5] Frickel, E.-M., Riek, R., Jelesarov, I., Helenius, A., Wüthrich, K., Ellgaard, L. TROSY-NMR Reveals Interaction between ERp57 and the Tip of the Calreticulin P-Domain; Proc. Natl. Acad. Sci. USA 2002, 99: [6] Prestegard, J. H. New Techniques in Structural NMR Anisotropic Interactions; Nat. Struct. Biol. NMR Suppl., July 1998, [7] Anderson, M. A., Ogbay, B., Arimoto, R., Sha, W., Kisselev, O. G., Cistola, D. P., Marshall, G. R. Relative Strength of Cation-π vs Salt-Bridge Interactions: The G t α( ) Peptide/Rhodopsin System; J. Am. Chem. Soc. 2006, 128: [8] Tochtrop, G. P.; Richter, K., Tang, C., Toner, J. J., Covey, D. F., Cistola, D. P. Energetics by NMR: Site-Specific Binding in a Positively Cooperative System; Proc. Natl. Acad. Sci. USA 2002, 99: [9] Bann, J. G., Pinkner, J., Hultgren, S. J., Frieden, C. Real-Time and Equilibrium 19 F-NMR Studies Reveal the Role of Domain-Domain Interactions in the Folding of the Chaperone PapD; Proc. Natl. Acad. Sci. USA 2002, 99: [10] Schmidt-Rohr, K., Spiess, H. W. Multidimensional Solid-State NMR and Polymers; Academic Press: New York, 1997 [11] Thompson, L. K. Solid-State NMR Studies of the Structure and Mechanisms of Proteins; Curr. Opin. Struct. Biol. 2002, 12: [12] Toke, O.; Maloy, W. L.; Kim, S.-J.; Blazyk, J.; Schaefer, J. Secondary Structure and Lipid Contact of a Peptide Antibiotic in Phospholipid Bilayers by NMR; Biophys. J. 2004, 87: [13] Toke, O.; O Connor, R. D.; Weldeghiorghis, T. K.; Maloy, W. L.; Glaser, R. W.; Ulrich, A. S.; Schaefer, J. Structure of (KIAGKIA) 3 Aggregates in Phospholipid Bilayers by Solid-State NMR; Biophys J 2004, 87: [14] Turner, P. Instant Notes in Molecular Biology; BIOS Scientific Publ. 3 rd ed
19 Szakkifejezések jegyzéke anizotrópia: irányfüggés, preferencia a tér kitüntetett irányában átlagos szerkezet: a szerkezetszámolás során nyert adott számú legalacsonyabb energiájú konformer X, Y, Z koordinátáinak átlagolásával előálló konformáció bicella: binary bilayered mixed micelles, rövid és hosszú alkillánccal rendelkező foszfolipid molekulák megfelelő arányú összekeverésével előállítható korong alakú, lipid kettősréteggel bíró speciális micella COSY: correlation spectroscopy, kétdimenziós 1 H- 1 H korrelációs spektroszkópia, melynek segítségével azonosíthatjuk az egymással skaláris (J) csatolásban levő protonpárokat CBCACOCAHA: a peptidgerinc asszignációját célzó háromdimenziós mérések egyike, amely az i-dik aminosavegység alfa protonja, karbonil szénatomja, valamint alfa és béta szénatomja között teremt korrelációt CBCACONNH: a peptidgerinc asszignációját célzó hármasrezonancia mérések egyike, amely az i-dik aminosavegység amidprotonja, amidnitrogénje és őt a szekvenciában eggyel megelőző, i-1-dik aminosavegység alfa és béta szénatomja között teremt korrelációt dipoláris csatolás: mágnesesen aktív magok között téren át ható kölcsönhatás, mely függ a kölcsönható magok minőségétől, távolságától (1/r 3 ), valamint az őket összekötő egyenes és a külső mágneses tér által bezárt szögtől HNCACB: a peptidgerinc asszignációját célzó hármasrezonancia mérések egyike, amely az i-dik aminosavegység amidprotonja, amidnitrogénje, valamint a saját és őt a szekvenciában eggyel megelőző, i-1-dik aminosavegység alfa és béta szénatomja között teremt korrelációt HNCO: a peptidgerinc asszignációját célzó hármasrezonancia mérések egyike, amely az i-dik aminosavegység amidprotonja, amidnitrogénje és őt a szekvenciában eggyel megelőző, i-1-dik aminosavegység karbonil szénatomja között teremt korrelációt HSQC: heteronuclear single quantum coherence, kétdimenziós heterokorrelációs mérés, melynek során valamely heteroatommal (pl. 13 C, 15 N) közvetlen kémiai kötésben levő protonokat detektáljuk J-csatolás (skaláris csatolás): mágnesesen aktív magok között az elektronok közvetítésével megvalósuló, azaz kémiai kötések mentén ható spin-spin kölcsönhatás, amely függ a kölcsönható magok minőségétől, helyzetétől (torziós szög), valamint a közöttük lévő kötések számától és jellegétől kémiai eltolódás: a magot körülvevő elektronok mágneses árnyékoló hatásából eredő (ezáltal a kémiai környezetre jellemző) energiahozzájárulás, ami meghatározza a rezonanciajel - valamely referenciaanyaghoz viszonyított pozícióját az NMR spektrumban MAS: magic angle spinning, az anizotróp (irányfüggő) spin kölcsönhatások kiátlagolását célzó, és ezáltal az oldatfázisú NMR-hez hasonló, nagy felbontású spektrumok felvételét lehetővé tevő szilárd fázisú NMR technika, melynek alkalmazása során a mintát a külső állandó mágneses térrel (B o ) os szöget bezáró tengely mentén forgatjuk NOE (nukleáris Overhauser effektus): valamely molekula adott magját gerjesztve a hozzá térben közel levő magok kvantumállapota megváltozik, melynek hatására változik a jelintenzitás; mivel az effektus a kölcsönható magok távolságának függvénye (~1/r 6 ), az intenzitásváltozásokból atom-atom (többnyire 1 H- 1 H) távolságkényszerek nyerhetők NOESY: nuclear Overhauser-effect spectroscopy, az NOE-effektuson alapuló kétdimenziós NMR spektroszkópia mérés, amely az egymáshoz térben közel eső protonok között (< 6 Å) teremt korrelációt REDOR: rotational-echo double resonance, izolált spinek közötti heteronukleáris dipoláris csatolás nagy felbontású, MAS körülmények közötti meghatározását lehetővé tevő szilárd fázisú NMR spektroszkópia mérés; segítségével heteroatomok közötti intra-/intermolekuláris távolságkényszerek állíthatók fel (pl. r 13C-15N valamely specifikusan 13 C, 15 N izotópjelzett rendszerben) S 2 (általánosított rendezettségi paraméter): valamely molekulaszegmens mozgásának térbeli korlátozottságát jellemző paraméter, 0 S 2 1, ahol S=0 az izotróp, S=1 a maximálisan korlátozott mozgás szerkezetszámolás: az NMR spektroszkópiai mérésekből nyert távolság-, orientációs és egyéb kényszerfeltételeknek (pl. diéderes szögek, diszulfidhíd) eleget tevő konformáció meghatározása molekuladinamikai módszerek segítségével T 1 (longitudinális vagy spin-rács) relaxáció: a z irányú mágnesezettség visszatérése az egyensúlyi (Boltzmann-eloszlásnak megfelelő) helyzetbe 19
20 T 2 (transzverz vagy spin-spin) relaxáció: a mágnesezettségnek a spinek egymás közötti energiacseréje, kémiai cserefolyamatok, és egyéb hatások következtében történő csökkenése az x-y síkban; a rezonanciajel félértékszélességét meghatározó paraméter (gyors relaxáció = rövid T 2 = nagy υ) távolságkényszer: a magok közötti távolságfüggő kölcsönhatások (pl. dipoláris csatolás) kiaknázásán alapuló mérési módszerekkel nyert kényszerfeltétel TEDOR: transferred-echo double resonance, izolált spinek közötti heteronukleáris dipoláris csatolást kihasználó spektrumszűrési technika a szilárd fázisú NMR spektroszkópiában TOCSY: total correlation spectroscopy, kétdimenziós teljes 1 H- 1 H korrelációs spektroszkópia, melynek segítségével spinrendszereket azonosíthatunk illetve különíthetünk el TROSY: transverse relaxation optimized spectroscopy, a magok közötti spin-spin (T 2 ) relaxáció optimalizálását célzó és ezáltal a rezonanciajelek félértékszélességét csökkentő speciális mérési technika 20
FEHÉRJÉK A MÁGNESEKBEN. Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium. Alkímia Ma, Budapest,
 FEHÉRJÉK A MÁGNESEKBEN Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium Alkímia Ma, Budapest, 2013.02.28. I. FEHÉRJÉK: L-α aminosavakból felépülő lineáris polimerek α H 2 N CH COOH amino
FEHÉRJÉK A MÁGNESEKBEN Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium Alkímia Ma, Budapest, 2013.02.28. I. FEHÉRJÉK: L-α aminosavakból felépülő lineáris polimerek α H 2 N CH COOH amino
NMR a peptid- és fehérje-kutatásban
 NMR a peptid- és fehérje-kutatásban A PDB adatbázisban megtalálható NMR alapú fehérjeszerkezetek számának alakulása az elmúlt évek során 4000 3500 3000 2500 2000 1500 1000 500 0 1987 1988 1989 1990 1991
NMR a peptid- és fehérje-kutatásban A PDB adatbázisban megtalálható NMR alapú fehérjeszerkezetek számának alakulása az elmúlt évek során 4000 3500 3000 2500 2000 1500 1000 500 0 1987 1988 1989 1990 1991
Az NMR spektroszkópia a fehérjék szolgálatában. Bodor Andrea. ELTE Szerkezeti Kémia és Biológia Laboratórium Visegrád
 Az NMR spektroszkópia a fehérjék szolgálatában Bodor Andrea ELTE Szerkezeti Kémia és Biológia Laboratórium 2011.01.18. Visegrád Nobel díjak tükrében 1952 Fizika: Módszer és elméleti alapok Felix Bloch
Az NMR spektroszkópia a fehérjék szolgálatában Bodor Andrea ELTE Szerkezeti Kémia és Biológia Laboratórium 2011.01.18. Visegrád Nobel díjak tükrében 1952 Fizika: Módszer és elméleti alapok Felix Bloch
1D multipulzus NMR kísérletek
 D multipulzus NMR kísérletek Rohonczy János ELTE, Szervetlen Kémia Tanszék Modern szerkezetkutatási módszerek elıadás 202. . Protonlecsatolt heteronukleáris mérések Elv 3 C mag detektálása alatt a protoncsatornán
D multipulzus NMR kísérletek Rohonczy János ELTE, Szervetlen Kémia Tanszék Modern szerkezetkutatási módszerek elıadás 202. . Protonlecsatolt heteronukleáris mérések Elv 3 C mag detektálása alatt a protoncsatornán
Spektroszkópiai módszerek 2.
 Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Műszeres analitika II. (TKBE0532)
 Műszeres analitika II. (TKBE0532) 7. előadás NMR spektroszkópia Dr. Andrási Melinda Debreceni Egyetem Természettudományi és Technológiai Kar Szervetlen és Analitikai Kémiai Tanszék NMR, Nuclear Magnetic
Műszeres analitika II. (TKBE0532) 7. előadás NMR spektroszkópia Dr. Andrási Melinda Debreceni Egyetem Természettudományi és Technológiai Kar Szervetlen és Analitikai Kémiai Tanszék NMR, Nuclear Magnetic
NMR spektroszkópia a fehérje biokémiában
 NMR spektroszkópia a fehérje biokémiában Závodszky Péter Beinrohr László MTA SzBK Enzimológiai Intézet NMR spektroszkópia a fehérje biokémiában Závodszky Péter Beinrohr László MTA SzBK Enzimológiai Intézet
NMR spektroszkópia a fehérje biokémiában Závodszky Péter Beinrohr László MTA SzBK Enzimológiai Intézet NMR spektroszkópia a fehérje biokémiában Závodszky Péter Beinrohr László MTA SzBK Enzimológiai Intézet
I. Az NMR spektrométer
 I. Az NMR spektrométer I. Az NMR spektrométer fő részei Rádióelektronikai konzol Munkaállomás Mágnes 2 I. Ultra-árnyékolt mágnesek Kettős szupravezető tekerccsel csökkenthető a mágnes szórt tere. Kisebb
I. Az NMR spektrométer I. Az NMR spektrométer fő részei Rádióelektronikai konzol Munkaállomás Mágnes 2 I. Ultra-árnyékolt mágnesek Kettős szupravezető tekerccsel csökkenthető a mágnes szórt tere. Kisebb
Speciális fluoreszcencia spektroszkópiai módszerek
 Speciális fluoreszcencia spektroszkópiai módszerek Fluoreszcencia kioltás Fluoreszcencia Rezonancia Energia Transzfer (FRET), Lumineszcencia A molekuláknak azt a fényemisszióját, melyet a valamilyen módon
Speciális fluoreszcencia spektroszkópiai módszerek Fluoreszcencia kioltás Fluoreszcencia Rezonancia Energia Transzfer (FRET), Lumineszcencia A molekuláknak azt a fényemisszióját, melyet a valamilyen módon
Mi mindenről tanúskodik a Me-OH néhány NMR spektruma
 Mi mindenről tanúskodik a Me-OH néhány NMR spektruma lcélok és fogalmak: l- az NMR-rezonancia frekvencia (jel), a kémiai környezete, a kémiai eltolódás, l- az 1 H-NMR spektrum, l- az -OH és a -CH 3 csoportokban
Mi mindenről tanúskodik a Me-OH néhány NMR spektruma lcélok és fogalmak: l- az NMR-rezonancia frekvencia (jel), a kémiai környezete, a kémiai eltolódás, l- az 1 H-NMR spektrum, l- az -OH és a -CH 3 csoportokban
Mágneses módszerek a műszeres analitikában
 Mágneses módszerek a műszeres analitikában NMR, ESR: mágneses momentummal rendelkező anyagok minőségi és mennyiségi meghatározására alkalmas Atommag spin állapotok közötti energiaátmenetek: NMR (magmágneses
Mágneses módszerek a műszeres analitikában NMR, ESR: mágneses momentummal rendelkező anyagok minőségi és mennyiségi meghatározására alkalmas Atommag spin állapotok közötti energiaátmenetek: NMR (magmágneses
KÖLCSÖNHATÁS ÉS DINAMIKA. az NMR spektroszkópia, mint a modern szem. Bodor Andrea
 KÖLCSÖNHATÁS ÉS DINAMIKA az NMR spektroszkópia, mint a modern szem Bodor Andrea ELTE Szerkezeti Kémiai és Biológiai Laboratórium A Magyar Tudomány Ünnepe, 2012.11.08. Edvard Munch: A Nap (1911-1916) AZ
KÖLCSÖNHATÁS ÉS DINAMIKA az NMR spektroszkópia, mint a modern szem Bodor Andrea ELTE Szerkezeti Kémiai és Biológiai Laboratórium A Magyar Tudomány Ünnepe, 2012.11.08. Edvard Munch: A Nap (1911-1916) AZ
Kémiai reakciók mechanizmusa számítógépes szimulációval
 Kémiai reakciók mechanizmusa számítógépes szimulációval Stirling András stirling@chemres.hu Elméleti Kémiai Osztály Budapest Stirling A. (MTA Kémiai Kutatóközpont) Reakciómechanizmus szimulációból 2007.
Kémiai reakciók mechanizmusa számítógépes szimulációval Stirling András stirling@chemres.hu Elméleti Kémiai Osztály Budapest Stirling A. (MTA Kémiai Kutatóközpont) Reakciómechanizmus szimulációból 2007.
Hemoglobin - myoglobin. Konzultációs e-tananyag Szikla Károly
 Hemoglobin - myoglobin Konzultációs e-tananyag Szikla Károly Myoglobin A váz- és szívizom oxigén tároló fehérjéje Mt.: 17.800 153 aminosavból épül fel A lánc kb 75 % a hélix 8 db hélix, köztük nem helikális
Hemoglobin - myoglobin Konzultációs e-tananyag Szikla Károly Myoglobin A váz- és szívizom oxigén tároló fehérjéje Mt.: 17.800 153 aminosavból épül fel A lánc kb 75 % a hélix 8 db hélix, köztük nem helikális
Mágneses módszerek a mőszeres analitikában
 Mágneses módszerek a mőszeres analitikában NMR, ESR: mágneses momentummal rendelkezı anyagok minıségi és mennyiségi meghatározására alkalmas analitikai módszer Atommag spin állapotok közötti energiaátmenetek:
Mágneses módszerek a mőszeres analitikában NMR, ESR: mágneses momentummal rendelkezı anyagok minıségi és mennyiségi meghatározására alkalmas analitikai módszer Atommag spin állapotok közötti energiaátmenetek:
Vektorok, mátrixok, tenzorok, T (emlékeztető)
 Vektorok, mátrixok, tenzorok, T (emlékeztető) A = T*B Tenzor: lineáris vektorfüggvény, amely két vektormennyiség közötti összefüggést ír le, egy négyzetmátrix, M reprezentálja. M M M M = M M M M M M 11
Vektorok, mátrixok, tenzorok, T (emlékeztető) A = T*B Tenzor: lineáris vektorfüggvény, amely két vektormennyiség közötti összefüggést ír le, egy négyzetmátrix, M reprezentálja. M M M M = M M M M M M 11
A nehézfémek növényi vízháztartásra gyakorolt hatásának vizsgálata Mágneses Rezonancia készülékkel. Készítette: Jakusch Pál Környezettudós
 A nehézfémek növényi vízháztartásra gyakorolt hatásának vizsgálata Mágneses Rezonancia készülékkel Készítette: Jakusch Pál Környezettudós Célkitűzés MR készülék növényélettani célú alkalmazása Kontroll
A nehézfémek növényi vízháztartásra gyakorolt hatásának vizsgálata Mágneses Rezonancia készülékkel Készítette: Jakusch Pál Környezettudós Célkitűzés MR készülék növényélettani célú alkalmazása Kontroll
Fehérjeszerkezet, és tekeredés
 Fehérjeszerkezet, és tekeredés Futó Kinga 2013.10.08. Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983
Fehérjeszerkezet, és tekeredés Futó Kinga 2013.10.08. Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983
Elektronspinrezonancia (ESR) - spektroszkópia
 Elektronspinrezonancia (ESR) - spektroszkópia Paramágneses anyagok vizsgáló módszere. A mágneses momentum iránykvantáltságán alapul. A mágneses momentum energiája B indukciójú mágneses térben E m S μ z
Elektronspinrezonancia (ESR) - spektroszkópia Paramágneses anyagok vizsgáló módszere. A mágneses momentum iránykvantáltságán alapul. A mágneses momentum energiája B indukciójú mágneses térben E m S μ z
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek
 Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Fluoreszcencia módszerek (Kioltás, Anizotrópia, FRET)
 Fluoreszcencia módszerek (Kioltás, Anizotrópia, FRET) Biofizika szeminárium PTE ÁOK Biofizikai Intézet Huber Tamás 2014. 02. 11-13. A gerjesztett állapotú elektron lecsengési lehetőségei Gerjesztés Fluoreszcencia
Fluoreszcencia módszerek (Kioltás, Anizotrópia, FRET) Biofizika szeminárium PTE ÁOK Biofizikai Intézet Huber Tamás 2014. 02. 11-13. A gerjesztett állapotú elektron lecsengési lehetőségei Gerjesztés Fluoreszcencia
4.2. Az Al(III) kölcsönhatása aszparaginsav-tartalmú peptidekkel
 4.2. Az Al(III) kölcsönhatása aszparaginsav-tartalmú peptidekkel A kisméretű peptidek közül az oldalláncban negatív töltésű karboxilcsoportokat tartalmazó AspAsp és AspAspAsp ligandumok komplexképződését
4.2. Az Al(III) kölcsönhatása aszparaginsav-tartalmú peptidekkel A kisméretű peptidek közül az oldalláncban negatív töltésű karboxilcsoportokat tartalmazó AspAsp és AspAspAsp ligandumok komplexképződését
ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén
 ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén A paraméterek anizotrópiája egykristályok rögzített tengely körüli forgatásakor
ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén A paraméterek anizotrópiája egykristályok rögzített tengely körüli forgatásakor
Fluoreszcencia 2. (Kioltás, Anizotrópia, FRET)
 Fluoreszcencia 2. (Kioltás, Anizotrópia, FRET) Gerjesztés A gerjesztett állapotú elektron lecsengési lehetőségei Fluoreszcencia 10-9 s k f Foszforeszcencia 10-3 s k ph 10-15 s Fizika-Biofizika 2. Huber
Fluoreszcencia 2. (Kioltás, Anizotrópia, FRET) Gerjesztés A gerjesztett állapotú elektron lecsengési lehetőségei Fluoreszcencia 10-9 s k f Foszforeszcencia 10-3 s k ph 10-15 s Fizika-Biofizika 2. Huber
(1) A T sejtek aktiválása (2) Az ön reaktív T sejtek toleranciája. α lánc. β lánc. V α. V β. C β. C α.
 Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Fehérjeszerkezet analízis. Fehérjeszerkezet analízis. Fehérjeszerkezet analízis. Fehérjeszerkezet analízis. Fehérjeszerkezet analízis
 Szerkezet Protein Data Bank (PDB) http://www.rcsb.org/pdb ~ 35 701 szerkezet közepes felbontás 1552 szerkezet d 1.5 Å 160 szerkezet d 1.0 Å 10 szerkezet d 0.8 Å (atomi felbontás) E globális minimum? funkció
Szerkezet Protein Data Bank (PDB) http://www.rcsb.org/pdb ~ 35 701 szerkezet közepes felbontás 1552 szerkezet d 1.5 Å 160 szerkezet d 1.0 Å 10 szerkezet d 0.8 Å (atomi felbontás) E globális minimum? funkció
MÁGNESES MAGREZONANCIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN
 MÁGNESES MAGREZONANIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN 1) A jelenség 2) Nuclear Magnetic Resonance (NMR) 3) Magnetic Resonance Imaging (MRI) 4) Magnetic Resonance Spectroscopy (MRS) NMR
MÁGNESES MAGREZONANIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN 1) A jelenség 2) Nuclear Magnetic Resonance (NMR) 3) Magnetic Resonance Imaging (MRI) 4) Magnetic Resonance Spectroscopy (MRS) NMR
MÁGNESES MAGREZONANCIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN
 MÁGNESES MAGREZONANIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN 1) A jelenség 2) Nuclear Magnetic Resonance (NMR) 3) Magnetic Resonance Imaging (MRI) 4) Magnetic Resonance Spectroscopy (MRS) NMR
MÁGNESES MAGREZONANIA A KÉMIÁBAN, GYÓGYSZERÉSZETBEN, ORVOSTUDOMÁNYBAN 1) A jelenség 2) Nuclear Magnetic Resonance (NMR) 3) Magnetic Resonance Imaging (MRI) 4) Magnetic Resonance Spectroscopy (MRS) NMR
Ragyogó molekulák: dióhéjban a fluoreszcenciáról és biológiai alkalmazásairól
 Ragyogó molekulák: dióhéjban a fluoreszcenciáról és biológiai alkalmazásairól Kele Péter egyetemi adjunktus Lumineszcencia jelenségek Biolumineszcencia (biológiai folyamat, pl. luciferin-luciferáz) Kemilumineszcencia
Ragyogó molekulák: dióhéjban a fluoreszcenciáról és biológiai alkalmazásairól Kele Péter egyetemi adjunktus Lumineszcencia jelenségek Biolumineszcencia (biológiai folyamat, pl. luciferin-luciferáz) Kemilumineszcencia
Koherens lézerspektroszkópia adalékolt optikai egykristályokban
 Koherens lézerspektroszkópia adalékolt optikai egykristályokban Kis Zsolt MTA Wigner Fizikai Kutatóközpont H-1121 Budapest, Konkoly-Thege Miklós út 29-33 2015. június 8. Hogyan nyerjünk információt egyes
Koherens lézerspektroszkópia adalékolt optikai egykristályokban Kis Zsolt MTA Wigner Fizikai Kutatóközpont H-1121 Budapest, Konkoly-Thege Miklós út 29-33 2015. június 8. Hogyan nyerjünk információt egyes
Szacharóz OH HO O O OH HO O OH HO OH HO 1
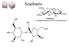 Szacharóz 1 A jelek átfedése miatt oldószer váltás DMS helyett D2 Measured by... Evaluated by... NMR-01 Bruker Avance-500 103.59 92.08 81.28 DEPTq 300K ns=1k D2 115 110 105 100 95 90 85 80 75 70 65 60
Szacharóz 1 A jelek átfedése miatt oldószer váltás DMS helyett D2 Measured by... Evaluated by... NMR-01 Bruker Avance-500 103.59 92.08 81.28 DEPTq 300K ns=1k D2 115 110 105 100 95 90 85 80 75 70 65 60
MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak
 Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
Fluoreszcencia módszerek (Kioltás, Anizotrópia, FRET) Modern Biofizikai Kutatási Módszerek
 Fluoreszcencia módszerek (Kioltás, Anizotrópia, FRET) Modern Biofizikai Kutatási Módszerek 2012. 11. 08. Fotonok és molekulák ütközése Fény (foton) ütközése a molekulákkal fényszóródás abszorpció E=hν
Fluoreszcencia módszerek (Kioltás, Anizotrópia, FRET) Modern Biofizikai Kutatási Módszerek 2012. 11. 08. Fotonok és molekulák ütközése Fény (foton) ütközése a molekulákkal fényszóródás abszorpció E=hν
Orvosi Biofizika I. 12. vizsgatétel. IsmétlésI. -Fény
 Orvosi iofizika I. Fénysugárzásanyaggalvalókölcsönhatásai. Fényszóródás, fényabszorpció. Az abszorpciós spektrometria alapelvei. (Segítséga 12. tételmegértéséhezésmegtanulásához, továbbá a Fényabszorpció
Orvosi iofizika I. Fénysugárzásanyaggalvalókölcsönhatásai. Fényszóródás, fényabszorpció. Az abszorpciós spektrometria alapelvei. (Segítséga 12. tételmegértéséhezésmegtanulásához, továbbá a Fényabszorpció
Mágneses magrezonancia (NMR) spektroszkópiák
 1 A szerves vegyületek szerkezetének meghatározására kezdetben az elemi analízist és az analógiákon alapuló szerkezetbizonyító szintézist illetve lebontást alkalmazták. Bonyolultabb vegyületek szerkezetének
1 A szerves vegyületek szerkezetének meghatározására kezdetben az elemi analízist és az analógiákon alapuló szerkezetbizonyító szintézist illetve lebontást alkalmazták. Bonyolultabb vegyületek szerkezetének
A BioNMR spektroszkópia alapjai
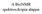 A BioNMR spektroszkópia alapjai Az NMR-spektroszkópia szükséges feltétele a nullától különböző magspin (I 0) 1) I=0, ha mind a protonok mind a neutronok száma páros: ( 12 C, 16 O) 2) I=1/2, ha tömegszáma
A BioNMR spektroszkópia alapjai Az NMR-spektroszkópia szükséges feltétele a nullától különböző magspin (I 0) 1) I=0, ha mind a protonok mind a neutronok száma páros: ( 12 C, 16 O) 2) I=1/2, ha tömegszáma
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése
 Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
A BioNMR spektroszkópia alapjai
 A BioNMR spektroszkópia alapjai Az NMR-spektroszkópia szükséges feltétele a nullától különböző magspin (I 0) 1) I=0, ha mind a protonok mind a neutronok száma páros: ( 12 C, 16 O) 2) I=1/2, ha tömegszáma
A BioNMR spektroszkópia alapjai Az NMR-spektroszkópia szükséges feltétele a nullától különböző magspin (I 0) 1) I=0, ha mind a protonok mind a neutronok száma páros: ( 12 C, 16 O) 2) I=1/2, ha tömegszáma
Fizikai kémia 2. ZH V. kérdések I. félévtől
 Fizikai kémia 2. ZH V. kérdések 2016-17 I. félévtől Szükséges adatok és állandók: k=1,38066 10-23 JK; c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
Fizikai kémia 2. ZH V. kérdések 2016-17 I. félévtől Szükséges adatok és állandók: k=1,38066 10-23 JK; c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
A fehérjék szerkezeti hierarchiája. Fehérje-szerkezetek! Klasszikus szerkezet-funkció paradigma. szekvencia. funkció. szerkezet! Myoglobin.
 Myoglobin Fehérje-szerkezetek! MGLSDGEWQLVLNVWGKVEADIPGGQEVLIRLFK GPETLEKFDKFKLKSEDEMKASE DLKKGATVLTALGGILKKKGEAEIKPLAQSA TKKIPVKYLEFISECIIQVLQSK PGDFGADAQGAMNKALELFRKDMASNYKELGFQG Fuxreiter Mónika! Debreceni
Myoglobin Fehérje-szerkezetek! MGLSDGEWQLVLNVWGKVEADIPGGQEVLIRLFK GPETLEKFDKFKLKSEDEMKASE DLKKGATVLTALGGILKKKGEAEIKPLAQSA TKKIPVKYLEFISECIIQVLQSK PGDFGADAQGAMNKALELFRKDMASNYKELGFQG Fuxreiter Mónika! Debreceni
A fehérjék hierarchikus szerkezete
 Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk.
 1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
4.3. Az AcLysSerProValValGluGly heptapeptid Al(III)-kötő sajátságának jellemzése
 4.3. Az AcLysProValValGly heptapeptid Al(III)-kötő sajátságának jellemzése Az Al(III)fehérje kölcsönhatás megismerése céljából olyan neurofilamentum peptidfragmenst vizsgáltunk, mely az oldalláncban oxigén
4.3. Az AcLysProValValGly heptapeptid Al(III)-kötő sajátságának jellemzése Az Al(III)fehérje kölcsönhatás megismerése céljából olyan neurofilamentum peptidfragmenst vizsgáltunk, mely az oldalláncban oxigén
A fehérjék hierarchikus szerkezete
 Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
A T sejt receptor (TCR) heterodimer
 Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Az élő sejt fizikai Biológiája:
 Az élő sejt fizikai Biológiája: Modellépítés, biológiai rendszerek skálázódása Kellermayer Miklós Fizikai biológia Ma már nem csak kvalitatív megfigyeléseket, hanem kvantitatív méréseket végzünk (biológiai
Az élő sejt fizikai Biológiája: Modellépítés, biológiai rendszerek skálázódása Kellermayer Miklós Fizikai biológia Ma már nem csak kvalitatív megfigyeléseket, hanem kvantitatív méréseket végzünk (biológiai
BIOFIZIKA. Metodika- 4. Liliom Károly. MTA TTK Enzimológiai Intézet liliom@enzim.hu
 BIOFIZIKA 2012 11 26 Metodika- 4 Liliom Károly MTA TTK Enzimológiai Intézet liliom@enzim.hu A biofizika előadások temamkája 1. 09-03 Biofizika: fizikai szemlélet, modellalkotás, biometria 2. 09-10 SZÜNET
BIOFIZIKA 2012 11 26 Metodika- 4 Liliom Károly MTA TTK Enzimológiai Intézet liliom@enzim.hu A biofizika előadások temamkája 1. 09-03 Biofizika: fizikai szemlélet, modellalkotás, biometria 2. 09-10 SZÜNET
Hegedüs Zsófia. Konformációsan diverz -redős szerkezetek utánzása -peptid foldamerek segítségével
 Szegedi Tudományegyetem Gyógyszertudományok Doktori Iskola Ph.D. program: Programvezető: Intézet: Témavezető: Gyógyszerkémia, gyógyszerkutatás Prof. Dr. Fülöp Ferenc Gyógyszeranalitikai Intézet Prof. Dr.
Szegedi Tudományegyetem Gyógyszertudományok Doktori Iskola Ph.D. program: Programvezető: Intézet: Témavezető: Gyógyszerkémia, gyógyszerkutatás Prof. Dr. Fülöp Ferenc Gyógyszeranalitikai Intézet Prof. Dr.
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
A módszerek jelentősége. Gyors-kinetika módszerek. A módszerek közös tulajdonsága. Milyen módszerekről tanulunk?
 Gyors-kinetika módszerek módszerek jelentősége 2010. március 9. Nyitrai Miklós biológiai mechanizmusok megértése; iológiai folyamatok időskálája; Vándorló melanocita (Victor SMLL). ms skálán való mérések.
Gyors-kinetika módszerek módszerek jelentősége 2010. március 9. Nyitrai Miklós biológiai mechanizmusok megértése; iológiai folyamatok időskálája; Vándorló melanocita (Victor SMLL). ms skálán való mérések.
Szerves vegyületek szerkezetfelderítése NMR spektroszkópia
 Szerves vegyületek szerkezetfelderítése NMR spektroszkópia Az anyag összeállításához Krajsovszky Gábor, Mátyus Péter és Perczel András diáit is felhasználtuk. 1 (hullámhossz) -sugárzás röntgensugárzás
Szerves vegyületek szerkezetfelderítése NMR spektroszkópia Az anyag összeállításához Krajsovszky Gábor, Mátyus Péter és Perczel András diáit is felhasználtuk. 1 (hullámhossz) -sugárzás röntgensugárzás
Lehetőségek és kihívások a modern bionmr spektroszkópia területén
 Lehetőségek és kihívások a modern bionmr spektroszkópia területén Perczel András és munkatársai Szerkezeti Kémia és Biológia Laboratórium és ELTE-MTA Fehérjemodellező Kutatócsoport 1 The Nobel Prize in
Lehetőségek és kihívások a modern bionmr spektroszkópia területén Perczel András és munkatársai Szerkezeti Kémia és Biológia Laboratórium és ELTE-MTA Fehérjemodellező Kutatócsoport 1 The Nobel Prize in
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL
 TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
Tartalomjegyzék. Emlékeztetõ. Emlékeztetõ. Spektroszkópia. Fényelnyelés híg oldatokban 4/11/2016. A fény; Abszorpciós spektroszkópia
 Tartalomjegyzék PÉCS TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNY KAR A fény; Abszorpciós spektroszkópia Elektromágneses hullám kölcsönhatása anyaggal; (Nyitrai Miklós; 2016 március 1.) Az abszorpció mérése;
Tartalomjegyzék PÉCS TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNY KAR A fény; Abszorpciós spektroszkópia Elektromágneses hullám kölcsönhatása anyaggal; (Nyitrai Miklós; 2016 március 1.) Az abszorpció mérése;
lásd: enantiotóp, diasztereotóp
 anizokrón anisochronous árnyékolási állandó shielding constant árnyékolási járulékok és empirikus értelmezésük shielding contributions diamágneses és paramágneses árnyékolás diamagnetic and paramagnetic
anizokrón anisochronous árnyékolási állandó shielding constant árnyékolási járulékok és empirikus értelmezésük shielding contributions diamágneses és paramágneses árnyékolás diamagnetic and paramagnetic
Bevezető. 1. ábra. A Trp-kalitka minifehérje szerkezetének szalagmodelje (PDB: 1L2Y).
 Bevezető A mindössze 20 aminosavból felépülő, de novo tervezett Trp-kalitka minifehérje már számos in vitro és in silico vizsgálat tárgyát képezte. Jelen doktori munka ennek a model fehérjecsaládnak a
Bevezető A mindössze 20 aminosavból felépülő, de novo tervezett Trp-kalitka minifehérje már számos in vitro és in silico vizsgálat tárgyát képezte. Jelen doktori munka ennek a model fehérjecsaládnak a
Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai
 Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai Dóczy-Bodnár Andrea 2011. szeptember 28. Magmágneses rezonanciához kapcsolódó Nobel-díjak * Otto Stern, USA: Nobel Prize in Physics
Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai Dóczy-Bodnár Andrea 2011. szeptember 28. Magmágneses rezonanciához kapcsolódó Nobel-díjak * Otto Stern, USA: Nobel Prize in Physics
MedInProt Szinergia IV. program. Szerkezetvizsgáló módszer a rendezetlen fehérjék szerkezetének és kölcsönhatásainak jellemzésére
 MedInProt Szinergia IV. program Szerkezetvizsgáló módszer a rendezetlen fehérjék szerkezetének és kölcsönhatásainak jellemzésére Tantos Ágnes MTA TTK Enzimológiai Intézet, Rendezetlen fehérje kutatócsoport
MedInProt Szinergia IV. program Szerkezetvizsgáló módszer a rendezetlen fehérjék szerkezetének és kölcsönhatásainak jellemzésére Tantos Ágnes MTA TTK Enzimológiai Intézet, Rendezetlen fehérje kutatócsoport
Műszeres analitika. Abrankó László. Molekulaspektroszkópia. Kémiai élelmiszervizsgálati módszerek csoportosítása
 Abrankó László Műszeres analitika Molekulaspektroszkópia Minőségi elemzés Kvalitatív Cél: Meghatározni, hogy egy adott mintában jelen vannak-e bizonyos ismert komponensek. Vagy ismeretlen komponensek azonosítása
Abrankó László Műszeres analitika Molekulaspektroszkópia Minőségi elemzés Kvalitatív Cél: Meghatározni, hogy egy adott mintában jelen vannak-e bizonyos ismert komponensek. Vagy ismeretlen komponensek azonosítása
Sohár Pál Varázslat, amitől láthatóvá válnak és életre kelnek a molekulák: Az NMR spektroszkópia
 MTA -ELTE FEÉRJEMODELLEZŐ KUTATÓCSOPORT - ÁLTALÁNOS ÉS SZERVETLEN KÉMIAI TANSZÉK EÖTVÖS LORÁND TUDOMÁNYEGYETEM Sohár Pál Varázslat, amitől láthatóvá válnak és életre kelnek a molekulák: Az NMR spektroszkópia
MTA -ELTE FEÉRJEMODELLEZŐ KUTATÓCSOPORT - ÁLTALÁNOS ÉS SZERVETLEN KÉMIAI TANSZÉK EÖTVÖS LORÁND TUDOMÁNYEGYETEM Sohár Pál Varázslat, amitől láthatóvá válnak és életre kelnek a molekulák: Az NMR spektroszkópia
Egy antifungális diszulfid fehérje szerkezeti dinamikája és hideg/meleg kitekeredése (avagy PAF, a hűvös sárkány)
 Egy antifungális diszulfid fehérje szerkezeti dinamikája és hideg/meleg kitekeredése (avagy PAF, a hűvös sárkány) Batta Gyula Debreceni Egyetem Szerkezeti Biológiai és Molekuláris Felismerési Műhely structbiol.unideb.hu
Egy antifungális diszulfid fehérje szerkezeti dinamikája és hideg/meleg kitekeredése (avagy PAF, a hűvös sárkány) Batta Gyula Debreceni Egyetem Szerkezeti Biológiai és Molekuláris Felismerési Műhely structbiol.unideb.hu
Elektrosztatikus számítások. Elektrosztatikus számítások. Elektrosztatikus számítások. Elektrosztatikus számítások Definíciók
 Jelentősége szubsztrát kötődés szolvatáció ionizációs állapotok (pka) mechanizmus katalízis ioncsatornák szimulációk (szerkezet) all-atom dipolar fluid dipolar lattice continuum Definíciók töltéseloszlás
Jelentősége szubsztrát kötődés szolvatáció ionizációs állapotok (pka) mechanizmus katalízis ioncsatornák szimulációk (szerkezet) all-atom dipolar fluid dipolar lattice continuum Definíciók töltéseloszlás
Dóczy-Bodnár Andrea október 3. Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai
 Dóczy-Bodnár Andrea 2012. október 3. Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai Atommagok saját impulzusmomentuma (spin) protonok, neutronok (elektronhoz hasonlóan) saját impulzusmomentum
Dóczy-Bodnár Andrea 2012. október 3. Magmágneses rezonancia (NMR) és elektronspinrezonancia (ESR) alapjai Atommagok saját impulzusmomentuma (spin) protonok, neutronok (elektronhoz hasonlóan) saját impulzusmomentum
INTRA- ÉS INTERMOLEKULÁRIS CSEREFOLYAMATOK VIZSGÁLATA OLDAT- ÉS SZILÁRDFÁZISÚ MULTINUKLEÁRIS NMR SPEKTROSZKÓPIÁVAL
 DOKTORI ÉRTEKEZÉS INTRA- ÉS INTERMOLEKULÁRIS CSEREFOLYAMATOK VIZSGÁLATA OLDAT- ÉS SZILÁRDFÁZISÚ MULTINUKLEÁRIS NMR SPEKTROSZKÓPIÁVAL Király Péter Témavezető: Dr. Tárkányi Gábor, tud.főmunkatárs, osztályvezető
DOKTORI ÉRTEKEZÉS INTRA- ÉS INTERMOLEKULÁRIS CSEREFOLYAMATOK VIZSGÁLATA OLDAT- ÉS SZILÁRDFÁZISÚ MULTINUKLEÁRIS NMR SPEKTROSZKÓPIÁVAL Király Péter Témavezető: Dr. Tárkányi Gábor, tud.főmunkatárs, osztályvezető
XXXVII. KÉMIAI ELŐADÓI NAPOK
 Magyar Kémikusok gyesülete songrád Megyei soportja és a Magyar Kémikusok gyesülete rendezvénye XXXVII. KÉMII LŐÓI NPOK Program és előadás-összefoglalók Szegedi kadémiai izottság Székháza Szeged, 2014.
Magyar Kémikusok gyesülete songrád Megyei soportja és a Magyar Kémikusok gyesülete rendezvénye XXXVII. KÉMII LŐÓI NPOK Program és előadás-összefoglalók Szegedi kadémiai izottság Székháza Szeged, 2014.
3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások)
 3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások) 3.1 Fehérjék, enzimek A genetikai információ egyik fő manifesztálódása
3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások) 3.1 Fehérjék, enzimek A genetikai információ egyik fő manifesztálódása
Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia?
 Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia? Prof. Túri László (ELTE, Kémiai Intézet) turi@chem.elte.hu 2012. november 19. Szent László Gimnázium Önképzőkör 1 Kapcsolódási pontok
Hogyan bírhatjuk szóra a molekulákat, avagy mi is az a spektroszkópia? Prof. Túri László (ELTE, Kémiai Intézet) turi@chem.elte.hu 2012. november 19. Szent László Gimnázium Önképzőkör 1 Kapcsolódási pontok
Modern Fizika Labor. A mérés száma és címe: A mérés dátuma: Értékelés: Infravörös spektroszkópia. A beadás dátuma: A mérést végezte:
 Modern Fizika Labor A mérés dátuma: 2005.10.26. A mérés száma és címe: 12. Infravörös spektroszkópia Értékelés: A beadás dátuma: 2005.11.09. A mérést végezte: Orosz Katalin Tóth Bence 1 A mérés során egy
Modern Fizika Labor A mérés dátuma: 2005.10.26. A mérés száma és címe: 12. Infravörös spektroszkópia Értékelés: A beadás dátuma: 2005.11.09. A mérést végezte: Orosz Katalin Tóth Bence 1 A mérés során egy
Biomolekuláris szerkezeti dinamika
 Kísérletek, mérések célja Biomolekuláris szerkezeti dinamika Kellermayer Miklós Biomolekuláris szerkezet és működés pontosabb megismerése (folyamatok, állapotok, átmenetek, kölcsönhatások, stb.) Rádióspektroszkópiák
Kísérletek, mérések célja Biomolekuláris szerkezeti dinamika Kellermayer Miklós Biomolekuláris szerkezet és működés pontosabb megismerése (folyamatok, állapotok, átmenetek, kölcsönhatások, stb.) Rádióspektroszkópiák
0) I=0 I=1/2 I=k (k=1,2,..) töltéssel forog (I=1/2)
 Az NMR-spektroszkópia szükséges feltétele a nullától különbözÿ magspin (I 0) I=0 mind a protonok mind a neutronok száma páros ( 12 C, 16 O) I=1/2 ha tömegszáma páratlan ( 1, 3, 13 C, 15 N, 19 F, 57 Fe,
Az NMR-spektroszkópia szükséges feltétele a nullától különbözÿ magspin (I 0) I=0 mind a protonok mind a neutronok száma páros ( 12 C, 16 O) I=1/2 ha tömegszáma páratlan ( 1, 3, 13 C, 15 N, 19 F, 57 Fe,
CD-spektroszkópia. Az ORD spektroskópia alapja
 CD-spektroszkópia Az ORD spektroskópia alapja - A XIX. század elején Biot megfigyelte, hogy bizonyos, a természetben előforduló szerves anyagok a lineárisan polarizált fény síkját elforgatják. - 1817-ben
CD-spektroszkópia Az ORD spektroskópia alapja - A XIX. század elején Biot megfigyelte, hogy bizonyos, a természetben előforduló szerves anyagok a lineárisan polarizált fény síkját elforgatják. - 1817-ben
transzláció DNS RNS Fehérje A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti fehérjék, transzportfehérjék
 Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Abszorpció, emlékeztetõ
 Hogyan készültek ezek a képek? PÉCI TUDMÁNYEGYETEM ÁLTALÁN RVTUDMÁNYI KAR Fluoreszcencia spektroszkópia (Nyitrai Miklós; február.) Lumineszcencia - elemi lépések Abszorpció, emlékeztetõ Energia elnyelése
Hogyan készültek ezek a képek? PÉCI TUDMÁNYEGYETEM ÁLTALÁN RVTUDMÁNYI KAR Fluoreszcencia spektroszkópia (Nyitrai Miklós; február.) Lumineszcencia - elemi lépések Abszorpció, emlékeztetõ Energia elnyelése
Nukleinsavak építőkövei
 ukleinsavak Szerkezeti hierarchia ukleinsavak építőkövei Pirimidin Purin Pirimidin Purin Timin (T) Adenin (A) Adenin (A) Citozin (C) Guanin (G) DS bázisai bázis Citozin (C) Guanin (G) RS bázisai bázis
ukleinsavak Szerkezeti hierarchia ukleinsavak építőkövei Pirimidin Purin Pirimidin Purin Timin (T) Adenin (A) Adenin (A) Citozin (C) Guanin (G) DS bázisai bázis Citozin (C) Guanin (G) RS bázisai bázis
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Gyors, multidimenzionális mérések adaptálása és tesztelése a p53 fehérje rendezetlen TAD régiójának esetében
 Tudományos Diákköri Dolgozat SEBÁK FANNI Gyors, multidimenzionális mérések adaptálása és tesztelése a p53 fehérje rendezetlen TAD régiójának esetében Témavezető: Dr. Bodor Andrea Analitikai Kémiai Tanszék
Tudományos Diákköri Dolgozat SEBÁK FANNI Gyors, multidimenzionális mérések adaptálása és tesztelése a p53 fehérje rendezetlen TAD régiójának esetében Témavezető: Dr. Bodor Andrea Analitikai Kémiai Tanszék
Bioinformatika 2 6. előadás
 6. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2018.10.08. PDBj: http://www.pdbj.org/ Fehérjék 3D szerkezeti adatbázisai - PDBj 2 2018.10.08.
6. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2018.10.08. PDBj: http://www.pdbj.org/ Fehérjék 3D szerkezeti adatbázisai - PDBj 2 2018.10.08.
Infobionika ROBOTIKA. X. Előadás. Robot manipulátorok II. Direkt és inverz kinematika. Készült a HEFOP P /1.0 projekt keretében
 Infobionika ROBOTIKA X. Előadás Robot manipulátorok II. Direkt és inverz kinematika Készült a HEFOP-3.3.1-P.-2004-06-0018/1.0 projekt keretében Tartalom Direkt kinematikai probléma Denavit-Hartenberg konvenció
Infobionika ROBOTIKA X. Előadás Robot manipulátorok II. Direkt és inverz kinematika Készült a HEFOP-3.3.1-P.-2004-06-0018/1.0 projekt keretében Tartalom Direkt kinematikai probléma Denavit-Hartenberg konvenció
Szimulációk egyszerősített fehérjemodellekkel. Szilágyi András
 Szimulációk egyszerősített fehérjemodellekkel Szilágyi András Szimulációs módszerek alkalmazhatósági tartományai Egyszerősített modellek Három típusát mutatjuk be: Játék rácsmodellek Realisztikusabb rácsmodellek
Szimulációk egyszerősített fehérjemodellekkel Szilágyi András Szimulációs módszerek alkalmazhatósági tartományai Egyszerősített modellek Három típusát mutatjuk be: Játék rácsmodellek Realisztikusabb rácsmodellek
Készítette: NÁDOR JUDIT. Témavezető: Dr. HOMONNAY ZOLTÁN. ELTE TTK, Analitikai Kémia Tanszék 2010
 Készítette: NÁDOR JUDIT Témavezető: Dr. HOMONNAY ZOLTÁN ELTE TTK, Analitikai Kémia Tanszék 2010 Bevezetés, célkitűzés Mössbauer-spektroszkópia Kísérleti előzmények Mérések és eredmények Összefoglalás EDTA
Készítette: NÁDOR JUDIT Témavezető: Dr. HOMONNAY ZOLTÁN ELTE TTK, Analitikai Kémia Tanszék 2010 Bevezetés, célkitűzés Mössbauer-spektroszkópia Kísérleti előzmények Mérések és eredmények Összefoglalás EDTA
A Ca 2+ szerepe a tormaperoxidáz enzim aktív szerkezetében. Szigeti Krisztián
 A Ca 2+ szerepe a tormaperoxidáz enzim aktív szerkezetében Doktori értekezés Szigeti Krisztián Semmelweis Egyetem Gyógyszertudományok Doktori Iskola Témavezető: Hivatalos Bírálók: Szigorlati Bizottság
A Ca 2+ szerepe a tormaperoxidáz enzim aktív szerkezetében Doktori értekezés Szigeti Krisztián Semmelweis Egyetem Gyógyszertudományok Doktori Iskola Témavezető: Hivatalos Bírálók: Szigorlati Bizottság
Az enzimműködés termodinamikai és szerkezeti alapjai
 2017. 02. 23. Dr. Tretter László, Dr. Kolev Kraszimir Az enzimműködés termodinamikai és szerkezeti alapjai 2017. február 27., március 2. 1 Mit kell(ene) tudni az előadás után: 1. Az enzimműködés termodinamikai
2017. 02. 23. Dr. Tretter László, Dr. Kolev Kraszimir Az enzimműködés termodinamikai és szerkezeti alapjai 2017. február 27., március 2. 1 Mit kell(ene) tudni az előadás után: 1. Az enzimműködés termodinamikai
Lehet ségek és kihívások a modern bionmr spektroszkópia területén
 Lehet ségek és kihívások a modern bionmr spektroszkópia területén Perczel András és munkatársai Szerkezeti Kémia és Biológia Laboratórium és ELTE-MTA Fehérjemodellez Kutatócsoport ELTE/TTK/FI/ Ortvay kollokvium
Lehet ségek és kihívások a modern bionmr spektroszkópia területén Perczel András és munkatársai Szerkezeti Kémia és Biológia Laboratórium és ELTE-MTA Fehérjemodellez Kutatócsoport ELTE/TTK/FI/ Ortvay kollokvium
N I. 02 B. Mágneses anyagvizsgálat G ép. 118 2011.11.30. A mérés dátuma: A mérés eszközei: A mérés menetének leírása:
 N I. 02 B A mérés eszközei: Számítógép Gerjesztésszabályzó toroid transzformátor Minták Mágneses anyagvizsgálat G ép. 118 A mérés menetének leírása: Beindítottuk a számtógépet, Behelyeztük a mintát a ferrotestbe.
N I. 02 B A mérés eszközei: Számítógép Gerjesztésszabályzó toroid transzformátor Minták Mágneses anyagvizsgálat G ép. 118 A mérés menetének leírása: Beindítottuk a számtógépet, Behelyeztük a mintát a ferrotestbe.
A sejtek élete. 5. Robotoló törpék és óriások Az aminosavak és fehérjék R C NH 2. C COOH 5.1. A fehérjeépítőaminosavak általános
 A sejtek élete 5. Robotoló törpék és óriások Az aminosavak és fehérjék e csak nézd! Milyen protonátmenetes reakcióra képes egy aminosav? R 2 5.1. A fehérjeépítőaminosavak általános képlete 5.2. A legegyszerűbb
A sejtek élete 5. Robotoló törpék és óriások Az aminosavak és fehérjék e csak nézd! Milyen protonátmenetes reakcióra képes egy aminosav? R 2 5.1. A fehérjeépítőaminosavak általános képlete 5.2. A legegyszerűbb
Biofizika szeminárium. Diffúzió, ozmózis
 Biofizika szeminárium Diffúzió, ozmózis I. DIFFÚZIÓ ORVOSI BIOFIZIKA tankönyv: III./2 fejezet Részecskék mozgása Brown-mozgás Robert Brown o kísérlet: pollenszuszpenzió mikroszkópos vizsgálata o megfigyelés:
Biofizika szeminárium Diffúzió, ozmózis I. DIFFÚZIÓ ORVOSI BIOFIZIKA tankönyv: III./2 fejezet Részecskék mozgása Brown-mozgás Robert Brown o kísérlet: pollenszuszpenzió mikroszkópos vizsgálata o megfigyelés:
A racionális gyógyszertervezés lehetőségei. A racionális gyógyszertervezés lehetőségei. A racionális gyógyszertervezés lehetőségei
 Cél: kis koncentrációban kötődő célvegyület tervezése Agonista: segíti az enzim működését, hatékonyabb, mint a természetes szubsztrát Antagonista: gátolja az enzim működését, ellentétes hatású, mint a
Cél: kis koncentrációban kötődő célvegyület tervezése Agonista: segíti az enzim működését, hatékonyabb, mint a természetes szubsztrát Antagonista: gátolja az enzim működését, ellentétes hatású, mint a
? ligandum kötés konformációs változás aktiválási energia számítás pka számítás kötési energiák
 Szabadenergia Definíció:? ligandum kötés konformációs változás aktiválási energia számítás pka számítás kötési energiák Fázistér teljes térfogatára kell számítani! Mennyiség átlagértéke: Sokaság-átlag
Szabadenergia Definíció:? ligandum kötés konformációs változás aktiválási energia számítás pka számítás kötési energiák Fázistér teljes térfogatára kell számítani! Mennyiség átlagértéke: Sokaság-átlag
Átmenetifém-komplexek ESR-spektrumának jellemzıi
 Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Biopolimer 12/7/09. Makromolekulák szerkezete. Fehérje szerkezet, és tekeredés. DNS. Polimerek. Kardos Roland DNS elsődleges szerkezete
 Biopolimerek Makromolekulák szerkezete. Fehérje szerkezet, és tekeredés. Osztódó sejt magorsófonala Kardos Roland 2009.10.29. Dohány levél epidermális sejtjének aktin hálózat Bakteriofágból kiszabaduló
Biopolimerek Makromolekulák szerkezete. Fehérje szerkezet, és tekeredés. Osztódó sejt magorsófonala Kardos Roland 2009.10.29. Dohány levél epidermális sejtjének aktin hálózat Bakteriofágból kiszabaduló
Versenyző rajtszáma: 1. feladat
 1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
Biomolekuláris szerkezeti dinamika
 Kísérletek, mérések célja Biomolekuláris szerkezeti dinamika Kellermayer Miklós Biomolekuláris szerkezet és működés pontosabb megismerése (folyamatok, állapotok, átmenetek, kölcsönhatások, mozgások, stb.)
Kísérletek, mérések célja Biomolekuláris szerkezeti dinamika Kellermayer Miklós Biomolekuláris szerkezet és működés pontosabb megismerése (folyamatok, állapotok, átmenetek, kölcsönhatások, mozgások, stb.)
Név... intenzitás abszorbancia moláris extinkciós. A Wien-féle eltolódási törvény szerint az abszolút fekete test maximális emisszióképességéhez
 A Név... Válassza ki a helyes mértékegységeket! állandó intenzitás abszorbancia moláris extinkciós A) J s -1 - l mol -1 cm B) W g/cm 3 - C) J s -1 m -2 - l mol -1 cm -1 D) J m -2 cm - A Wien-féle eltolódási
A Név... Válassza ki a helyes mértékegységeket! állandó intenzitás abszorbancia moláris extinkciós A) J s -1 - l mol -1 cm B) W g/cm 3 - C) J s -1 m -2 - l mol -1 cm -1 D) J m -2 cm - A Wien-féle eltolódási
Abszorpciós fotometria
 abszorpció Abszorpciós fotometria Spektroszkópia - Színképvizsgálat Spektro-: görög; jelente kép/szín -szkópia: görög; néz/látás/vizsgálat Ujfalusi Zoltán PTE ÁOK Biofizikai Intézet 2012. február Vizsgálatok
abszorpció Abszorpciós fotometria Spektroszkópia - Színképvizsgálat Spektro-: görög; jelente kép/szín -szkópia: görög; néz/látás/vizsgálat Ujfalusi Zoltán PTE ÁOK Biofizikai Intézet 2012. február Vizsgálatok
ERD14: egy funkcionálisan rendezetlen dehidrin fehérje szerkezeti és funkcionális jellemzése
 Doktori értekezés tézisei ERD14: egy funkcionálisan rendezetlen dehidrin fehérje szerkezeti és funkcionális jellemzése DR. SZALAINÉ ÁGOSTON Bianka Ildikó Témavezetők Dr. PERCZEL András egyetemi tanár és
Doktori értekezés tézisei ERD14: egy funkcionálisan rendezetlen dehidrin fehérje szerkezeti és funkcionális jellemzése DR. SZALAINÉ ÁGOSTON Bianka Ildikó Témavezetők Dr. PERCZEL András egyetemi tanár és
A sztereoizoméria hatása peptidek térszerkezetére és bioaktivitására OTKA PD Szakmai zárójelentés. Dr. Leitgeb Balázs
 A sztereoizoméria hatása peptidek térszerkezetére és bioaktivitására OTKA PD 78554 Szakmai zárójelentés Dr. Leitgeb Balázs A projekt során azt tanulmányoztam, hogy a sztereoizoméria milyen hatásokat fejt
A sztereoizoméria hatása peptidek térszerkezetére és bioaktivitására OTKA PD 78554 Szakmai zárójelentés Dr. Leitgeb Balázs A projekt során azt tanulmányoztam, hogy a sztereoizoméria milyen hatásokat fejt
Alkalmazott spektroszkópia
 Alkalmazott spektroszkópia 009 Bányai István MR és a fémionok: koordinációs kémiai alkalmazások Bányai István Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék A mágnesség A mágneses erő: F pp
Alkalmazott spektroszkópia 009 Bányai István MR és a fémionok: koordinációs kémiai alkalmazások Bányai István Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék A mágnesség A mágneses erő: F pp
Belső molekuláris mozgások vizsgálata a humán epesav-kötő fehérjében NMR-spektroszkópiával
 Belső molekuláris mozgások vizsgálata a humán epesav-kötő fehérjében NMR-spektroszkópiával Doktori értekezés Horváth Gergő Eötvös Loránd Tudományegyetem, Természettudományi Kar, Biológia Doktori Iskola
Belső molekuláris mozgások vizsgálata a humán epesav-kötő fehérjében NMR-spektroszkópiával Doktori értekezés Horváth Gergő Eötvös Loránd Tudományegyetem, Természettudományi Kar, Biológia Doktori Iskola
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
