Tartalomjegyzék FOCUS MEDICINAE. Felelős szerkesztő: Dr. Szolnoky Miklós. Bevezetés...2 /Introduction/ Dr. Ongrádi József
|
|
|
- Anna Enikő Szőke
- 8 évvel ezelőtt
- Látták:
Átírás
1 FOCUS MEDICINAE Felelős szerkesztő: Dr. Szolnoky Miklós Főszerkesztő: Dr. Karabélyos Csaba Szerkesztőbizottság: Dr. Bencsik Krisztina Prof. Czirják László Prof. Horváth Örs Péter Dr. Kalmár Ágnes Dr. Mátrai Zoltán Dr. Nemes László Dr. Paál Mária Dr. Pál Katalin Prof. Zeher Margit Szerkesztőbizottság tanácsadó testülete: Prof. Fekete György Prof. Kiss Attila Prof. Kiss István Prof. Komoly Sámuel Prof. Lipták József Prof. Mándi Yvette Prof. Maródi László Prof. Medgyesi György Dr. Mészner Zsófia Dr. M. Tóth Antal Dr. Nagy Kálmán Prof. Pálóczi Katalin Prof. Perner Ferenc Prof. Pénzes István Prof. Péter Ferenc Prof. Romics Imre Prof. Rozgonyi Ferenc Prof. Sas Géza Prof. Schuler Dezső Dr. Siklós Pál Dr. Szita János Prof. Tekeres Miklós Prof. Tímár László Dr. Trestyánszky Zoltán Prof. Tulassay Tivadar Tartalomjegyzék Focus Medicinae Bevezetés...2 /Introduction/ Dr. Ongrádi József Herpes simplex vírus 1 és 2 által okozott fertőzések és diagnosztikájuk...3 /Herpes simplex virus 1 and 2 caused infections and their diagnostics/ Prof. Deák Judit, Dr. Jakó Mária, Prof. Bártfai György A humán cytomegalovírus fertőzés klinikai jelentősége, immunológiája, diagnosztikai és terápiás lehetőségei...10 /The clinical significance, immunology, diagnostics and therapeutical possibilities of human cytomegalovirus infection/ Dr. Csire Márta EBV fertőzések őssejt-transzplantáltakban: klinikum, diagnosztika és terápiás lehetőségek...16 /EBV infections in stem cell transplanted: clinics, diagnostics and therapeutical possibilities/ Bayer-Dandár Eszter, Dr. Kassa Csaba A bárányhimlő-övsömör vírusának jelentősége immunszupprimált egyénekben...22 /The importance of Varicella zoster virus in immunosuppressed individuums/ Dr. Terhes Gabriella, Dr. Piukovics Klára, Dr. Urbán Edit Az emberi 6-os és 7-es herpesvírus fertőzésekhez társuló agyvelőgyulladás...27 /Encephalitis associated with human Herpesvirus 6 and 7/ Dr. Ongrádi József, Stercz Balázs Az emberi 8-as herpesvírus szerepe Kaposi sarcomában, HIV fertőzöttekben és transzplantált egyénekben...32 /The role of human herpesvirus 8 in Kaposi sarcom at HIV infected and transplanted individuums/ Prof. Nagy Károly Alapító: Biotest Hungaria Kft. Kiadja és a nyomdai munkáért felelős: Dursusz Bt. Szerkesztőség és levelezési cím: 2045 Törökbálint, Torbágy u. 15/A ISSN: Megjelenik: évente négyszer Előfizetési díj: évre 2016,- Ft + 5% áfa 1
2 Focus Medicinae FOCUS MEDICINAE Interdiszciplináris tudományos folyóirat Tisztelt Olvasó! A herpesvírusok rendkívül elterjedtek az állatvilágban. Bonyolult szerkezetük együtt változott a gazdaszervezettel évmilliók során. Eddigi ismereteink szerint kilenc herpesvírus species gazdája az ember, de nem lenne meglepő újabb emberi herpesvírusok felfedezése, vagy egy újabb zoonózis létrejötte. Bár a virionok tulajdonságai nagyrészt ismertek, kórokozó képességük molekuláris alapjai csak részben felfedezettek. A herpesvírusok iránti orvosi, állatorvosi érdeklődés hullámzást mutat; jelenleg újra előtérbe kerültek elsősorban az immunszuppresszált állapotokban kialakuló súlyos szövődmények miatt. Biológiai tulajdonságaik közül legérdekesebb a szervezetben akár élethossziglan történő lappangás képessége, és ebből az állapotból akár többszörös reaktiválódásuk. Jelenleg kérdéses, hogy ez alapján az emberi microbiom részének tekinthetők-e. Az AIDS progressziója során több herpesvírus is jelentős szerepet játszik a HIV reaktiválásában, serkentésében, sőt más vírusfertőzéseket is befolyásolhatnak: ez a jelenség az epidemiológia keresztútjait jelentheti. A heveny kórképek mellett az utóbbi évtizedekben az idült, senyvesztő megbetegedésekben játszott esetleges szerepük kutatása is előtérbe került. Egyik új irányzat az immunrendszer kijátszásának molekuláris alapjait vizsgálja: interleukinek, kemokinek és ezek receptorai homológjainak kódjait azonosították herpesvírusok genomjában. Dogmává merevedett elképzelések is megdőlnek: például a nucleocapsidon kívül korábban tölteléknek vélt tegumentum fehérjék vírusszaporodásban betöltött fontos szerepét írták le, vagy a vírusok latenciája során egy vagy több gén folyamatos kifejeződését találták a vírusszaporodás gátlása, azaz a többi gén expressziójának elnyomása céljából. A herpes simplex vírusok szaporodása során nagy mennyiségben keletkező, módosult vírusfehérjéket tartalmazó könnyű partikulák biológiai szerepe teljesen ismeretlen. Az emberi 6A és 6B herpesvírus speciesek kivételes módon képesek emberi kromoszómák telomer régióiba integrálódni, átöröklődni, súlyos idegrendszeri betegségeket okozni, s talán még az emberi élettartamot is befolyásolhatják. AIDS-hez társuló Kaposi-sarcoma, a Béta- és Gammaherpesvírusok daganatkeltő hatásainak vizsgálata évtizedek óta napirenden van. Mind a hagyományos, mind a molekuláris diagnosztikai eljárások nagyon fejlettek, gyorsdiagnosztikai tesztek is vannak már forgalomban. Mérföldkövet jelentett az acyclovir bevezetése Alphaherpesvírus fertőzések kezelésére. Ezt követően számos gyógyszert hoztak forgalomba főleg a Bétaherpesvírus fertőzések kezelésére, elsősorban súlyos immunszuppresszált betegekben. A rezisztens herpesvírusok megjelenése miatt viszont újabb kémiai gátlószerekre, valamint másfajta kezelési módokra lesz szükség; utóbbi lehet a gén- vagy immunterápia. A bárányhimlő-övsömör vírusfertőzések megelőzésére bevezetett aktív védőoltás alapján remélhető, hogy a többi herpesvírus species esetén is sikerül oltóanyagot kifejleszteni. Dr. Ongrádi József Alcsalád Alphaherpesvirinae Betaherpesvirinae Nemzetség Simplexvírus Humán herpesvírus 1 (HHV-1) Humán herpesvírus 2 (HHV-2) Varicellovírus Humán herpesvírus 3 (HHV-3) Cytomegalovírus Humán herpesvírus 5 (HHV-5) Roseolovírus Gammaherpesvirinae Lymphocryptovírus Az emberi herpesvírusok törzsfája Család: Herpesviridae Vírus Biológiai tulajdonság Hivatalos név Gyakorlatban használt név Cytopathogen hatás Latencia helye Humán herpesvírus 6A (HHV-6A) Humán herpesvírus 6B (HHV-6B) Humán herpesvírus 7 (HHV-7) Humán herpesvírus 4 (HHV-4) Rhadinovírus Humán herpesvírus 8 (HHV-8) Herpes simplex vírus 1 (HSV-1) Herpes simplex vírus 2 (HSV-2) Varicella-zoster vírus (VZV) Cytomegalovírus (CMV) Emberi 6A herpesvírus Emberi 6B herpesvírus Emberi 7-es herpesvírus Epstein-Barr-vírus (EBV) Emberi 8-as herpesvírus vagy Kaposi-sarcomához társult herpesvírus (KSHV) gyors szaporodás hámsejtekben, fibroblastokban, sejtpusztulás (necrosis) lassú szaporodás mirigyekben, vesetubulusokban, cytomegalia lassú szaporodás, sokmagvú óriássejtek, ballon degeneráció, apoptosis B-lympho-proliferáció, immortalizálás CD19+ B-lymphocyták, daganatokban orsósejtek neuronok, lymphocyák monocyták / makrofágok CD4+ immunsejtek, neuroglia CD4+ immunsejtek, nyálmirigy-, idegsejtek CD4+ lymphocyták, nyálmirigy-, bőr-, máj-, vesesejtek B-lymphocyták orsósejtek, lymphocyták 2
3 Herpes simplex vírus 1 és 2 által okozott fertőzések és diagnosztikájuk Herpes simplex vírus 1 és 2 által okozott fertőzések és diagnosztikájuk Prof. Deák Judit 1, Dr. Jakó Mária 2, Prof. Bártfai György 2 1 Klinikai Mikrobiológiai Diagnosztikai Intézet, Szegedi Tudományegyetem, Szeged 2 Szülészeti és Nőgyógyászati Klinika, Szegedi Tudományegyetem, Szeged Összefoglalás: A herpes simplex vírus 1 és 2 (HSV-1 és HSV-2) világszerte elterjedt a humán populációban. A fertőzések többsége tünetmentes, a vírushordozók nagy része nem tud fertőzöttségéről. A horizontális transzmisszió mellett a vertikális átvitel komoly veszélyt jelent az intrauterin fejlődő magzatok és újszülöttek számára. A HSV többszörösére növelheti a HIV átvitelt (transzaktiváció), a nyálkahártya barrier folytonosság megszakadása miatt. Becslések szerint a világszerte előforduló HSV-2 prevalencia a éveseknél 40,4 millió (6,9%), a éves korcsoportban 85,6 millió (24,6%). A földrajzi (Kelet-Ázsia, Szahara alatti övezet) területek között drámai különbségeket tapasztaltak. Az USA-ban folyamatosan növekszik a HSV-2 fertőzöttek száma ban a 110 millió STI fertőzött közül 24 milliónak HSV-2 fertőzése is volt. Az elmúlt évtizedekben számos publikáció jelent meg gyermekek sérelmére elkövetett szexuális abususról, melynek más STI-k között a HSV-1 és HSV-2 kimutatása bizonyíték lehet. A fel nem ismert és nem kezelt intrauterin HSV fertőzések becsült száma 1: élveszülésre, magasabb, mint a neonatalis syphilis és a gonorrhoea okozta ophthalmia neonatorum. Az évente megjelenő terápiás útmutatók kiemelten kezelik a várandósság hónapjai alatt alkalmazható antivirális kezeléseket. Új, jó minőségű, rövid idő alatt kivitelezhető point-of-care diagnosztikai módszereket és az antivirális rezisztencia kimutatására gyorsdiagnosztikai módszereket vezettek be. A vírus nukleinsav kimutatására alkalmazott RT-PCR módszer alkalmas a HSV-1 és HSV-2 megkülönböztetésére, a víruskópiaszám mennyiségi meghatározására és az antivirális terápia hatékonyságának monitorozására. A HIV kockázati csoportba tartozók kötelező HSV szűrését javasoljuk. Az in utero fertőzések egy része felismerhető. A primer prevenció érdekében számos kutatócsoport foglalkozik főleg a HSV-2 vakcina előállításán, melyek között már fázis I, humán kipróbálás alatti vakcinák is léteznek. Kulcsszavak: herpes simplex vírus -1 és - 2 (HSV-1, HSV-2), mintavétel, szindrómák, STD (szexuális úton átvitt betegség), STI (szexuális úton átvitt fertőzés) Történet A herpeses ajakelváltozás már legalább 2000 éve ismert. Az első tudományos adatokat Löwenstein közölte saját kutatásai alapján, 1919-ben (20). A herpesvírusokról az első magyarul megjelent összefoglaló könyvrészlet 1965-ben jelent meg (11). Struktúra Summary: The herpes simplex virus 1 and 2 (HSV-1 and HSV-2) are widespread worldwide. Most of the infections are asymptomatic and the carriers are unaware of their infection. Both horizontal and vertical transmission may pose serious risks for intrauterine embryos and neonates. HSV can increase the risk of HIV infection because of the interruption of the mucous membrane. The worldwide prevalence of HSV-2 is estimated as 40.4 million (6.9%) among year-olds and 85.6 million (24.6%) among year-olds. Geographically, e.g. between East-Asia and the sub-saharan region epidemiologists have experienced dramatic differences. The number of HSV-2 infected individuals is increasing continuously in the USA. 24 million of 110 million STI people proved to be infected by HSV-2 in Numerous research articles have been published on crimes against children and sexual abuse in recent decades. Among other STIs, the detection of HSV-1 and HSV-2 may be used as evidence. The number of unrecognized or untreated intrauterine HSV infections has been estimated as 1 in live births. i.e. higher than for neonatal syphilis or ophthalmia neonatorum caused by gonorrhea. Suitable antiviral treatments are considered to be of high priority in the course of pregnancy. High-quality tests have become available recently not only for the detection of herpes infection, but also for the detection of antiviral resistance. RT-PCR methods are suitable for differentiation between HSV-1 and HSV-2, for quantitative determination of the viral copy number and for monitoring of the efficiency of antiviral therapy. Obligatory screening of HSV is recommended among HIV risk groups. Research is currently ongoing for the processing of vaccines against HSV-2, and the phase I testing of vaccines is under way in humans. Keywords: herpes simplex virus -1 and 2 (HSV-1, HSV-2), sample collection, syndromes, STD (sexually transmitted disease), STI (sexually transmitted infection) A hivatalosan humán herpes vírus 1 (HHV-1), és a humán herpes vírus 2 (HHV-2) a Herpesviridae család, Alphaherpesvirinae alcsalád, humán fertőzésekért felelős vírusainak első két tagja. Strukturáját tekintve az elektronmikroszkópos felvételeken, központi helyen az elektrodenz lineáris, kettősszálú DNS helyezkedik el. Ezt ikozahedralis nucleocapsid és >15 proteinből álló réteg, a tegument borítja. Kívül lipid envelop veszi körül a vírust, melyen ~10 envelop protein (gb-gn) található. Átmérője nm. A triviálisan elnevezett és rövidített herpes simplex vírus (HSV-1) genom 152, a HSV-2 genom 155 kbp (kilobázispár) méretű. 3
4 Herpes simplex vírus 1 és 2 által okozott fertőzések és diagnosztikájuk Életciklus, patogenezis A vírus célpontjai a hám- és idegsejtek. A vírus és gazdasejt összekapcsolódása a vírus envelop és a gazdasejt-membrán fúziója révén valósul meg. A vírus kapszid transzlokálódik a nuclearis pórusokhoz és a virális DNS bejut a nucleusba. Rövid replikációs ciklus után cytolysis alakul ki. A tegument protein az immediate-early, nem sokkal később a korai proteinek megjelenését indukálja. A késői gének indukálta strukturális proteinek után a vírus DNS szintézise, majd a kapszidba épülése következik még a sejtmagban. A nuclearis membrán, mely tegument proteineket és virális glycoproteint tartalmaz, elősegíti a részecskék összerendeződését, a vírus felépítését. Transzmisszió A HSV-1 és -2 világszerte elterjedt a populációban. A fertőzések többsége tünetmentes, a vírushordozók nagy része nem tud fertőzöttségéről. Primer infekciót követően a vírusok a behatolási kapu közelében lévő perifériás neuronok mentén az érzőideg ganglionokba vándorolnak (ganglion trigeminale, ganglion lumbosacrale) és a fertőzöttek élete végéig megtalálhatók. A látens fertőzés azonban különböző ingerekre reaktiválódhat. A rekurrens fertőzések kevésbé súlyos tünetekkel jelentkeznek, mint a primer fertőzés és a gyógyulás rövidebb időt vesz igénybe. Aszimptomatikus, tünetmentes fertőzések Az esetek 70-90%-ában pozitív HSV-2 antitest mellett sem jelentkeznek tünetek. A HSV-2 gyakrabban fordul elő, mint a HSV-1. A látens vírus reaktivációja rekurrens infekciót hoz létre. A reaktivációban nem specifikus trigger mechanizmusok játszanak szerepet, mint például sérülések, emocionális okok, menstruáció, fizikai stressz, UV-hatás, hormonhatás. A vírus direkt kontaktussal terjed, inkubációs ideje 1-26 nap. A HSV-1 és HSV-2 az epithelialis és nyálkahártyasejtekben lévő vírusokkal fertőz. A bőr sérülésein át az idegszövetekhez migrál, ahol látens fertőzést okozva életünk végéig perzisztál. A HSV-1 prevalencia fokozatosan növekszik gyermekkortól felnőtt korig és elérheti a 80%-ot. Cowan már 1994-ben a szexuális élet markerének tekintette a HSV-2 pozitivitást (5). A horizontális transzmisszió mellett a vertikális átvitel komoly veszélyt jelent az anyaméhben fejlődő magzatok és újszülöttek számára. Miért magas a transzmissziós ráta? A primer fertőzés az esetek 70%-ában tünetmentes. A fertőzöttek mindössze 20%-ánál jelenik meg típusos tünet és a vírusürítés a 3. hét után szűnik meg. Az atípusos vagy enyhe tünetek felismerése az orvos és a páciens számára sem könnyű. Gyanú esetén, különösen várandós asszonyok körében laboratóriumi vizsgálat javasolt. Epidemiológia A WHO (Looker és mtsai) becslése szerint a világszerte előforduló HSV-2 prevalencia a éveseknél 40,4 millió (6,9%), a éves korcsoportban 85,6 millió (24,6%) (19). A földrajzi (Kelet-Ázsia, Szahara alatti övezet) területek között drámai különbségeket tapasztaltak. Azokban az országokban, amelyekben a bejelentés kötelező, kizárólag HSV-2 esetére vonatkozik. Az USA-ban folyamatosan növekszik a HSV-2 fertőzöttek száma (1. ábra) ban a 110 millió STI fertőzött közül 24 milliónak HSV-2 fertőzése is volt. Az új esetek száma évente , az átlagos HSV szeroprevalencia 72% a várandós asszonyok között (26). Visits (in thousands) Year 1. ábra: Genitalis herpes fertőzések az USA-ban 1966 és 2013 között (2014. december 16.). Forrás: Pozitív összefüggés mutatkozik a HSV-1 és HSV-2 fertőzések között. A prospektív vizsgálatok eredménye alapján feltételezik, hogy az előzőleg lezajlott HSV-1 fertőzés protektív az azt követő HSV-2 fertőzéssel szemben (19). A HSV-1 okozta elváltozások elsősorban a bőrön, a nyálkahártyán és az agyban manifesztálódnak. A gingivostomatitis kisdedkorban jelentkezik. A klasszikus HSV-1 fertőzés lehet tünetmentes, jelentkezhet láz, szubmandibularis nyirokcsomó megnagyobbodás. A szájnyálkahártya fertőzés ulceralodhat. A gyógyulás 2-3 hetet vesz igénybe. Serdülőknél pharyngitis, mononucleosis is kialakulhat (16). A herpes labialis a bőr és nyálkahártya átmenet területén fordul elő leggyakrabban, hőemelkedés és láz, kísérheti. Autoinokulációval a szem (conjunctivitis, keratitis), bőr és ujjak is fertőződhetnek (herpes whitlow). A keratoconjunctivitis lehet egyoldali, vagy kétoldali. A betegség conjunctivitissel, preauricularis nyirokcsomó duzzanattal kezdődik, mely ulceralodhat. Ennek kiterjedésétől függ a gyógyulás, mely három hetet is igénybe vehet. Kísérheti blepharitis és szem körüli herpeses dermatitis. Lehet primer betegség, vagy rekurrens fertőzés, mely a szemben manifesztálódik (12). A HSV-2 fertőzések főleg a genitáliákon, neonatalisan, és ritka szervi manifesztációk formájában jelentkeznek. Congenitalis, neonatalis, perinatalis fertőzések A várandósság ideje alatt elszenvedett primer anyai HSV-1 vagy HSV-2 fertőzés, koraszülést, idő előtti burokrepedést, ascendalo fertőzést okozhat. Az újszülött már manifesztálódott tüneteket vagy a 3. naptól a 6. hétig megjelenő tüneteket mutat bőrén, szemén és szájában. 4
5 Herpes simplex vírus 1 és 2 által okozott fertőzések és diagnosztikájuk Súlyosabb esetben az előző tünetekhez neurológiai tünetek társulhatnak. A még súlyosabb, disszeminált betegség vesiculakkal vagy anélkül mutatkozik, gyakran központi idegrendszeri elváltozásokkal. A mortalitás a disszeminált betegség esetén a legmagasabb, melyet további tünetek, fulminans májkárosodás és több szervi érintettség kísér. A fel nem ismert és nem kezelt intrauterin HSV fertőzések becsült száma 1: élveszülés, magasabb, mint a neonatalis syphilis és a gonorrhoea okozta ophthalmia neonatorum. Az évente korrigált terápiás útmutatók kiemelten kezelik a várandósság hónapjai alatt alkalmazott antivirális kezeléseket. Genitális fertőzés A klasszikus HSV-2 által okozott primer fertőzés a genitáliákon alakul ki. A kétoldali vesicularis infekció lázzal, ingvinalis nyirokcsomó megnagyobbodással, dysuriával jelentkezik. A genitáliákon ma már gyakran előfordul a HSV-2 mellett a HSV-1 is. Ebben a jelenségben a megváltozott szexuális szokások, az oro-genitális expozíció játszik szerepet (25). Az aszeptikus encephalitis kezelés hiányában súlyos, progrediáló, fatalis kimenetelű, az agy fronto-temporalis és parietalis régióira lokalizálódó folyamat. Az esetek 50%-a 50 év felett, egyharmada 20 év alatt alakul ki. Jellemző a hirtelen, váratlanul kialakuló megváltozott tudatállapot és a gócos neurológiai tünetek. Az influenzaszerű tünetegyüttes előzmény lehet, mely egy héttel a neurológiai tünetek megjelenése előtt jelentkezik. Gyermekeknél sokkal gyakrabban fordulnak elő rohamok. A rekurrens, lymphocytás meningitis fejfájással, merev nyakkal, hányással, fotofóbiával jelentkezik, a liquorban monocytás pleiocytosis látható. A meningitis 2-7 napon belül komplikációk nélkül oldódik. Az esetek 50%-ában neurológiai maradványtünetek maradhatnak, mint vizelet retenció, a lumbosacralis régióba sugárzó fájdalom. A betegség prognózisa jó, a tünetek kiújulásának esélye 1 : 2-20 epizód (Mollaret meningitis). Ritka manifesztációk Periodontitis Felmerült, hogy a Herpesviridae család több tagja etiológiai szerepet játszik az agresszív periodontitisben. Az eddigi eredmények bár figyelemre méltóak, nem meggyőzőek (24). Herpeses ujjfertőzés (herpes whitlow) A herpesvírus okozta körömágygyulladás és ujjgyulladás fájdalmas. Összefüggő vesiculákkal és a közeli nyirokcsomó duzzanatával jár. Általános tünetek lehetnek a gyengeség, hőemelkedés és láz (15). Herpes gladiatorum Sportolók közvetlen bőr-bőr kontaktusa miatt kialakult fertőzés, melyet birkózókon, ökölvívókon és rögbi játékosokon figyeltek meg (29). Herpes oesophagitis Immunkomprimált egyéneknél jelentkezik kemoterápia után, immunszuppresszált állapotban szervátültetést követően és AIDS betegségben, de kialakulhat immunkompetens állapotban is. A tüneteket okozhatják más vírusok, cytomegalovírus, HIV és gomba is (Candida albicans) (22). Herpes folliculitis Ez esetben gyakrabban fordul elő VZV, mint HSV-1 (2). Herpes sycosis Ez a haj, szakáll herpesvírus okozta elváltozása (4). Eczema herpeticum Disseminalt HSV-1 és HSV-2 okozta bőrkiütésekkel járó fertőzés. Ritka, élethosszig tartó vírusinfekció. Az atopiás dermatitis predisponalo tényező lehet az eczema herpeticum kialakulására (9). Bell paresis Felmerül a gyanú, hogy a Bell paresis patogenezisében HSV eredetű általános neurológiai rendellenesség áll, mely akut facialis mononeuropathiával jellemezhető (23). Alzheimer betegség Kimutatható herpesvírusok esetén az agyban, megnövekedett a rizikó az Alzheimer kór kialakulására, szemben a kontrollokkal (27). A Herpes és az immunkomprimált egyén A herpesvírus fertőzés gyakrabban jár együtt olyan tünetekkel, melyek súlyos kimenetelűek, kiterjedt nyálkahártya/bőr necrosissal járnak és vezethetnek oesophagitishez, proctitishez. A disseminalt fertőzés meningoencephalitist, pneumonitist, hepatitist és coagulopathiát okozhat. Sokkal gyakrabban fordul elő, mint ahány esetben felismerik (16). A HSV-ok többszörösére növelhetik a HIV átvitelt a nyálkahártya barrier folytonosság megszakadása miatt. A HSV és várandósság A HSV-1 és HSV-2 látenciát alakít ki az idegsejtekben és reaktiváció során herpes genitalis és labialis formájában manifesztálódik (21). Fagyasztott trophoblast mintákban spontán magzathalál esetén 43,5%-ban (N=95), elektív abortusz során 16,7%-ban (N=35) volt kimutatható a HSV-1 és HSV-2. In situ hybridizációs módszerrel 25 trophoblast mintából 18 bizonyult HSV fertőzöttnek. Kapranos és mtsa szerint a HSV-ok szerepet játszottak a vetélésben, bár a kétféle HSV-t nem különböztették meg (17). Várandósság alatt akvirált HSV fertőzés következménye spontán abortusz, intrauterin növekedésben visszamaradás, koraszülés, congenitalis és neonatalis herpes fertőzés lehet (3). A várandósság késői szakaszában létrejött primer HSV fertőzés esetén 5
6 Herpes simplex vírus 1 és 2 által okozott fertőzések és diagnosztikájuk a neonatalis fertőzés rizikója 30-50% a HSV antitestek kialakulására a szülés előtt, mely gátolhatná a fertőzést, már nincs idő. A transzplacentalis vagy ascendalo fertőzés esélye alacsony. A perinatalis fertőzések többsége (80-90%) a vajúdás, vagy szülés során alakul ki. A neonatalis fertőzések rekurrens infekció során is kialakulhatnak. A várandós fiatal életkorával és/vagy a közelmúltban történt fertőzést követő megnövekedett vírusürüléssel hozhatók kapcsolatba. A szuppresszív terápia mérsékelheti a tünetmentes vírusürítést és a HSV rekurrenciát. A szuppresszív terápia alkalmazása ellenére a vajúdás előtt jelentkező tünetek esetén császármetszés javasolt (26). A HSV és a szexuális abusus Számos publikáció jelent meg gyermekek sérelmére elkövetett szexuális abususról és a vírusnukleinsav kimutatásának bizonyító erejéről (13). Laboratóriumi diagnosztika Direkt kenet fénymikroszkópos, vagy direkt immunfluor eszcens vizsgálatára sejtkaparék vétele alkalmas. Mintavétel speciális vírus transzport folyadékban (VTM) a hólyagbennékből, anatómiai helytől függetlenül a hólyagot megnyitva tamponnal az elváltozás alapjáról, liquorból, székletből, vizeletből. A mintát azonnal érdemes laboratóriumba juttatni (1. táblázat) (16). Natív és EDTA-s vérminta antitest és vírusnukleinsav kimutatása EDTA-s vérmintából Natív kenetben sokmagvú óriássejt látható a hólyagos elváltozásról vett mintából (2. ábra). Immunitás A HSV-1 és HSV-2 fertőzésekre kialakuló immunválaszok és a betegség patogenezise lefolyásában fontos szerepet játszanak a humán leukocyta (HLA) antigének. Neutralizáló antitestek, a sejtes immunitás elemei és az interferon (IFN) védelmet nyújtanak az egészséges populációban a HSV reaktivációval szemben. Immunológiai paradoxonnak tekinthetjük azok megismétlődő fertőzését, akik egyszer már átestek HSV fertőzésen, rendelkeznek HSV specifikus antitesttel, ugyanakkor, akiknek nincs antitestjük, nem estek át primer fertőzésen, nem fogékonyak. A megismétlődő fertőzés hátterében a másik HSV áll. AIDS, súlyos alapbetegségen, szervátültetésen és kemoterápiás kezelésen átesettek, szuppresszív kezelésben részesültek esetében a HSV fertőzések súlyosabb kimenetelűek, gyakoribbak, manifesztációikban is eltérőek (18). Szindróma Orális, genitális lézió Rekurrens genitális tünetek Neonatalis herpes Ocularis herpes Conjunctivitis, cornea ulceratio Klinikai minta Tamponnal vett minta VTM-ben Szérum, tamponnal vett minta VTM-ben Liquor, EDTA-s vér. Szem, nasalis és rectalis törlés VTM-ben Tamponnal vett minta VTM-ben Cornea kaparék Encephalitis Liquor PCR Rekurrens lymphocytás meningitis Liquor PCR 1. táblázat: Klinikai minták herpes fertőzés kimutatására Laboratóriumi módszer Tenyésztés, antigén kimutatás, PCR Western blot ELISA, PCR PCR, tenyésztés, fluoreszcens antigén kimutatás PCR, tenyésztés, antigén kimutatás PCR, tenyésztés, antigén kimutatás 2. ábra: Jellegzetes, a vezikulum alapjáról gyűjtött kenetben sok-magvú HSV-tartalmú óriássejt. Fénymikroszkópos felvétel. Forrás: Az antigén kimutatás direkt fluoreszcens assay-vel (DFA) és ELISA módszerrel is történhet. Előbbi módszer alkalmazásakor az epithel sejt festése FITC-jelölt anti-herpes immunglobulinnal, az értékelése fluoreszcens mikroszkopizálással történt (3. ábra). 3. ábra: Bőrlézióból származó epithel sejt fluoreszcens festéssel. Forrás: Vírustenyésztésre többféle szövetkultúra alkalmas. A HeLa szövetkultúrában tenyésztett klinikai mintában a cytopathiás hatás látható. Inverz fénymikroszkópos felvétel (4. ábra). 6
7 Herpes simplex vírus 1 és 2 által okozott fertőzések és diagnosztikájuk 4. ábra: Tzank sejt, klinikai mintával fertőzött HeLa szövetkultúrában. Dr. Deák Judit fénymikroszkópos felvétele Identifikálás Nukleinsav kimutatás végezhető in situ hybridizációval, in situ PCR, RT-PCR, kvantitatív PCR, multiplex PCR módszerrel különböző klinikai mintákból. Gyorsdiagnosztika A jó minőségű, típus specifikus vizsgálatokra is alkalmas gyorstesztek száma növekedett. Point of care (POC) HSV-2 teszt (5. ábra) és immunkromatográfiás teszt (6. ábra) kereskedelmi forgalomban elérhető. Szerológiai módszerek Natív vérmintából IgM, IgG, IgA antitestek kimutatása komplement kötési reakció (KKR), indirekt immunfluoreszcencia (IIF) és enzyme immune assay (EIA) módszerekkel. A komplement kötési reakciót ma már nem, az IIF módszert ritkán használjuk. Primer infekcióval viszonylag ritkán, a herpesvírus-specifikus IgM és IgG egyidejűleg történő kimutatásával találkozunk. A herpesvírus-specifikus IgM reaktiválódott infekció esetén is megjelenhet. A HSV specifikus antitestek egyedüli jelenléte nem diagnosztikus, származhat HSV okozta látens fertőzés reaktivációja miatt, de függetlenül a neurológiai betegségtől. HSV specifikus IgM jelenléte IgG negativitás, vagy alacsony szintű IgG mellett a primer HSV infekció mellett szól, bár az IgM pozitivitás lehet fals pozitív, mely eredmény csak követéses vizsgálattal zárható ki. A primer és reaktiválódott infekció elkülönítésére az aviditási módszer alkalmazásával nyílt lehetőségünk. HSV-1 és HSV-2 species-specifikus ELISA módszer bevezetésével alkalmunk nyílt a két species meghatározására. Liquor szerológia A központi idegrendszer infekciójának szerológiai diagnózisa a bizonyított intrathecalis specifikus antitest képződésén alapul. A specifikus antitestek intrathecalis képződésének feltétele a vér-liquor barrier integritásának sértetlensége. A liquor/savó vírusspecifikus IgG aránya barrier sérülés esetén >1/100, koponyaűri vírus replikációban herpes simplex vírus okozta encephalitis esetén >1/20. Az egyik módszer, mellyel a vér-liquor barrier állapota jellemezhető, a szérum és liquor antitest arány viszonyítása egy referencia proteinnek, például az albuminnak megoszlásához. A Reiber formula alkalmas az intrathecalisan képződött antitest meghatározására (8). Enzyme immunosorbent assay (ELISA) HSV-1 és HSV-2 speciesek elkülönítésére Focus Diagnostics és más gyártók által bevezetett ELISA módszerek alkalmasak. 5. ábra: Point of care (POC) teszt. Bal oldalon pozitív, jobb oldalon negatív HSV-2 teszt eredmény. Forrás: 6. ábra: HSV-2 immunkromatográfia (C: kontroll, T: teszt) Forrás: Western-blot módszer a HSV-1 és HSV-2 elkülönítésére bevezetett eljárás. Antivirális terápia és várandós és neonatalis infekciók kezelésére és antivirális rezisztencia eseteire Első vonalbeli antivirális gyógyszerek: Acyclovir, Valacyclovir, Penciclovir és Famciclovir. Második vonalbeli antivirális szerek: Ganciclovir, Foscarnet és Cidofovir. Első klinikai epizód terápia, szuppresszív recurrens genitalis herpes terápia (30), Prevenció, profilaktikus vakcinák Szexuális nevelésnek a középpontjában az aquiralható fertőzések elkerülésének lehetőségeivel kell megismertetni a serdülőkorúakat. Szexuális úton történő herpesvírus fertőzés elkerülése érdekében férfi és/vagy 7
8 Herpes simplex vírus 1 és 2 által okozott fertőzések és diagnosztikájuk női kondom használata javasolt. Lokális mikrobicid szerek és kombinált hüvelygyűrűk által redukálhatóak az anogenitalis HSV fertőzések (28). Aktív immunizálás: sterilizáló és immunterápiás vakcina és más vakcinák klinikai kipróbálás alatt állnak. Jelenleg még nem jelent meg FDA által engedélyezett HSV vakcina (1,14). Következtetések A vírus nukleinsav kimutatására alkalmazott RT- PCR módszer alkalmas a HSV speciesek megkülönböztetésére, a víruskópiaszám mennyiségi meghatározására és az antivirális terápia hatékonyságának monitorozására (7,10). A congenitalis- és perinatalis HSV fertőzések csökkentése, egyidejűleg a HIV fertőzések emelkedésének megakadályozása érdekében, hasonlóan a syphilis, gonorrhoea és chlamydia jelentési kötelezettségéhez az anogenitalis HSV fertőzések bejelentését, a HIV kockázati csoportba tartozók kötelező HSV szűrését javasoljuk. Az in utero fertőzések egy része felismerhető, melyre Curtin és mtsai dolgoztak ki algoritmust (6). A primer prevenció érdekében számos kutatócsoport foglalkozik főleg HSV-2 vakcina előállításán, melyek között már fázis I, humán kipróbálás alatti vakcinák is léteznek, de még nem jelent meg FDA által engedélyezett HSV vakcina. Irodalomjegyzék 1. Awasthi S., Shaw C., Friedman H.: Improving immunogenicity and efficacy of vaccines for genital herpes containing herpes simplex virus glycoprotein D. Exp. Rev. Vaccin., 13(12), , Böer A., Herder N., Winter K. et al.: Herpes folliculitis: clinical, histopathological, and molecular pathologic observations. Br. J. Dermatol., 154(4), , Brown Z.A., Selke S., Zeh J. et al.: The acquisition of herpes simplex virus during pregnancy. N. Engl. J. Med., 337(8), , Campanelli A., Marazza G., Stucki L. et al.: Fulminant herpetic sycosis: atypical presentation of primary herpetic infection. Dermatology, 208(3), , Cowan F.M., Johnson A.M., Ashley R. et al.: Antibody to herpes simplex virus type 2 as serological marker of sexual lifestyle in populations. BMJ, 309(6965), , Curtin W.M., Menegus M.A., Patru M.M. et al.: Midtrimester fetal herpes simplex-2 diagnosis by serology, culture and quantitative polymerase chain reaction. Fetal. Diagn. Ther., 33(2), , Deák J.Z., Kozinszky Z., Pál A. et al.: Herpes simplex virus-2 and -1 seroprevalence in select population groups in Hungary. Herpes, 12(3), 80, Djukic M., Schmidt-Samoa C., Lange P. et al.: Cerebrospinal fluid findings in adults with acute Lyme neuroborreliosis. J. Neurol., 259(4), , Dreyfus D.H.: Herpesviruses and the microbiome. J. Allergy Clin. Immunol., 132(6), , Domeika M., Babayan K., Ismailov R. et al.: Survey of diagnostic services for genital herpes in fourteen countries in Eastern Europe. Acta. Derm. Venereol., 91(3), , Farkas E.: Herpesvirusok. In: Orvosi virológia, Szerk: Bakács T., Farkas E. Medicina Könyvkiadó, Budapest, MD-957-j-6569, , Forsgren M., Klapper P.E.: Herpes simplex virus Type 1 and Type 2, In: Principles and Practice of Clinical Virology, 6th ed. ed: Zuckerman A.J., Banatvala J.E., Schoub B.D. et al.: Wiley-Blackwell, Chicester ISBN , , Girardet R.G., Lahoti S., Howard L.A. et al.: The epidemiology of sexually transmitted infections in suspected child victims of sexual assault. Pediatrics, 124, 79-86, Halford W.P.: Antigenic breadth: a missing ingredient in HSV-2 subunit vaccines? Exp. Rev. Vaccin., 13(6), , Izzo S., Ahmed M.: Images in clinical medicine. Herpetic whitlow. N. Engl. J. Med., 371(17), e25, Jerome K.R., Morrow R.A.: Herpes simplex viruses and Herpes B Virus. In: Manuel of Clinical Microbiology Vol 2, 10th ed, Ed: Versalovic J., Carroll K,C., Funke G. et al.: ASM Press, Washington, ISBN , , Kapranos N.C., Kotronias D.C.: Detection of herpes simplex virus in first trimester pregnancy loss using molecular techniques. In Vivo, 23(5), , Kovács J., Ongrádi J.: Herpes simplex vírusfertőzés. Nőgyógy. Onkol., 11, , Looker K.J., Garnett G.P., Schmid G.P.: An estimate of the global prevalence and incidence of herpes simplex virus type 2 infection. Bull. World Health. Organ., 86(10), , Löwenstein A.: Aetiologische untersuchungen über den fieberhaften, Herpes. Münch. Med. Wochenschr., 66, , Margolis T.P., Imai Y., Yang L. et al.: Herpes simplex virus type 2 (HSV-2) establishes latent infection in a different population of ganglionic neurons than HSV-1: role of latency-associated transcripts. J. Virol., 81(4), , Patel N.C., Caicedo R.A.: Esophageal infections: an update. Curr. Opin. Pediatr., 27(5), , Patel D.K., Levin K.H.: Bell palsy: Clinical examination and management. Cleve. Clin. J. Med., 82(7), , Petrović S.M., Zelić K., Milasin J. et al.: Detection of herpes simplex virus type 1 in gingival crevicular fluid of gingival sulcus/periodontal pocket using polymerase chain reaction. Srp. Arh. Celok. Lek., 142(5-6), , Roberts C.: Genital herpes in young adults: changing sexual behaviours, epidemiology and management. Herpes, 12(1), 10-14, Silasi M., Cardenas I., Racicot K. et al.: Viral infections during pregnancy. Am. J. Reprod. Immunol., 73, ,
9 Herpes simplex vírus 1 és 2 által okozott fertőzések és diagnosztikájuk 27. Steel A.J., Eslick G.D.: Herpes viruses increase the risk of Alzheimer's disease. J. Alzheimers Dis., 24, 47(2), , Ugaonkar S.R., Wesenberg A., Wilk J. et al.: A novel intravaginal ring to prevent HIV-1, HSV-2, HPV, and unintended pregnancy. J. Cont. Rel., 213, 57-68, Williams C., Wells J., Klein R.: Centers for Disease Control and Prevention (CDC): Notes from the field: outbreak of skin lesions among high school wrestlers - Arizona, MMWR Morb. Mortal. Wkly. Rep., 64(20), , Workowski K.A., Bolan G.A.: Sexually transmitted diseases treatment guidelines. Morb. Mortal. Wkly. Rep., 64(3), 27-32, 2015 Csaba hirdetés 9
10 A humán cytomegalovírus fertőzés klinikai jelentősége,... A humán cytomegalovírus fertőzés klinikai jelentősége, immunológiája, diagnosztikai és terápiás lehetőségei Dr. Csire Márta Országos Epidemiológiai Központ, Virológiai Főosztály, Budapest Összefoglalás: A humán cytomegalovírus (HCMV vagy humán herpesvírus 5) a Herpesviridae család, Betaherpesvirinae alcsalád, Cytomegalovirus nemzetségbe tartozó vírus. A lineáris (duplaszálú DNS) genomja legnagyobb az emberi herpesvírusok között. Az elsődleges fertőzést követően a HCMV látensen perzisztál a szervezetben és reaktiválódhat. A vírus reaktivációja immunszuppresszált vagy immunhiányos állapotban fontos tényező a HCMV okozta betegségekben. Az immunszupprimáltakban az újabb és gyors diagnosztikai vizsgálatok lehetővé tették a preemptív antivirális kezelést a morbiditás és mortalitás csökkentésére. Világviszonylatban a HCMV a leggyakoribb veleszületett vírusinfekció, vezető oka az újszülötteknél a halláskárosodásnak, látáskárosodásnak, különböző mentális retardációknak. A várandós fertőzése megállapítható HCMV specifikus szerológiai módszerekkel. Jelenleg hatásos vakcina hiányában megfontolandó a veleszületett HCMV fertőzés megelőzésére a szűrővizsgálat beiktatása a terhességvállalást megelőzően, és szükséges az érintett szakmák közötti szorosabb együttműködés. Kulcsszavak: humán cytomegalovírus, humán herpesvírus-5, congenitalis fertőzés, magzati fertőzés, prenatalis diagnosztika, immunszuppresszió, transzplantáció, diagnózis, megelőzés és antivirális terápia Bevezetés A cytomegalovírus (CMV) tanulmányozásával foglalkozó kutatók 2014-ben emlékeztek meg a vírus izolálásának 60. évfordulójáról és Margaret Gladys Smith-ről, mint a cytomegalovírus anyjáról ben született meg a cytomegalovírus Saint Louis (Missouri)-ban (Washington University, School of Medicine, St. Louis), ekkor izolálta Smith először sikeresen egér nyálmirigyéből származó cytomegalovírust (egér nyálmirigy vírus néven) egér fibroblast sejtkultúrán (22). A prototípus törzs neve Smith törzs lett és a mai napig használatban van. Ezt követően 1955-ben Smith-nek sikerült emberi állkapocs alatti nyálmirigyből humán cytomegalovírust (HCMV) is kitenyésztenie emberi fibroblast sejtkultúrán, de a benyújtott kéziratot a szerkesztők elutasították, mert azt gyanították, hogy véletlenül egér nyálmirigy vírus nőtt humán sejteken. Smith azonban reprodukálta az úttörő eredményeket egy generalizált cytomegáliás zárványtest betegségben (CID) elhunyt egy hónapos csecsemő vese mintájából. Akkoriban még a CID ismeretlen etiológiájú volt. Végül publikálta, hogy a HCMV humán sejtkultúrán szaporodik és valószínűsítette, hogy a cytomegalovírus vagy törzs szaporodása faj-specifikus, mivel az összes fertőzési kísérlet egy másik fajban kudarcot vallott (23). Summary: Human cytomegalovirus (HCMV or Human herpesvirus 5) was classified as belonging to the Cytomegalovirus genus within the subfamily Betaherpesvirinae of the Herpesviridae family. Its linear genome (double-stranded DNA) is the largest among human herpesviruses. After the primary infection, HCMV is capable of latency and reactivation. In the immuncompromissed host, novel rapid diagnostic assays have made preemtive treatment feasible to reduce morbidity and mortality. The most common worldwide congenital viral infection is the HCMV infection. Congenital HCMV infection is the leading viral cause of hearing impairment, sight impairment and mental retardation in newborn infants. Maternal HCMV infection is typically diagnosed by serology. Until a HCMV vaccine is available, screening should be considered to be done prior to pregnancy. Strict collaboration between professionals of different medical specialities is necessary. Keywords: human cytomegalovirus, human herpesvirus-5, congential infection, fetal infection, prenatal diagnosis, immunocompromised, transplantation, diagnosis, prevention and antiviral therapy Smith amellett, hogy kiemelkedően fontos eredményt ért el a cytomegalovírus sejtkultúrán történő szaporításával, felismerte a vírus faj-specificitását is, ami kétség kívül molekuláris nézetre vall (17). Smith 1956-ban, Rowe és munkatársai 1956-ban (20) és Weller és mtsai, 1957-ben önállóan izoláltak humán CMV-törzset ban, Weller és munkatársai javasolták a cytomegalovírus elnevezést a nyálmirigy vírus helyett (27). A HCMV-fertőzés a leggyakoribb veleszületett vírusinfekció, az élveszülések 0,2-2,2%-át érinti világszerte. A magzat fertőzése a várandósság bármely trimeszterében bekövetkezhet. A primer anyai HCMV-fertőzés kb. 40%-ban (25-75%) átterjed a magzatra. Recurrens fertőzés után ez az arány 0,5-1%, ami arra utal, hogy az anyai immunitás ha nem is akadályozza meg, de jelentősen csökkenti a vírus átvitelét (18). Kiemelten fontos a vírus diagnosztikája és a kezelése, elkerülhetetlen a korai diagnózisa az immunszuppresszáltaknál, transzplantáltaknál az időben megkezdett antivirális terápiához (16,26). A HCMV fertőzésben a leggyakrabban alkalmazott antivirális szerek a ganciclovir, valganciclovir, foscarnet és a cidofovir. Transzplantáción átesett betegek és postnatalis HCMV fertőzésnek kitett koraszülött gyermekek esetén hyperimmunglobulin kezelés is alkalmazható (16,18). 10
11 A humán cytomegalovírus biológiai tulajdonságai, terjedési módja és a kórképek A humán cytomegalovírus fertőzés klinikai jelentősége,... A HCMV duplaszálú lineáris DNS genommal rendelkező burkos vírus, a HCMV törzsek genetikailag különbözőek lehetnek. A vírus a látenciája vagy a DNS megsokszorozódása során gyűrűvé záródik. A teljes genom hossza kb. 235 kilobázispár, amelyet ikozahedralis kapszid vesz körül. A nucleocapsid és a burok között a tegumentnek nevezett fehérje réteg helyezkedik el. A burok glikoproteinjein (gb, gh és gcii) találhatók a neutralizáló ellenanyagok termelődéséért felelős epitopok. A vírust humán fibroblast tenyészetben lehet izolálni, azonban in vivo epithelsejtekben is szaporodik (14,16). A populációban a fertőzés általában kora gyermekkorban (főleg bölcsődékben, óvodákban) történik, későbbi életkorban pedig, a szexuális aktivitás idején. Az átvészeltség az életkorral arányosan nő, a népesség szeropre valenciája 30-97%-ig terjed, ez függ az életkortól, nemtől, a szociális és gazdasági viszonyoktól (14,18). Magyarországon a felnőtt lakosság körülbelül %-a szeropozitív (26). A fertőzés forrásai a fertőzött egyén testváladékai, így a nyál, vizelet, széklet, könny, vér, méhnyakváladék, ondófolyadék és az anyatej. A vírus terjedhet transzplantált szervvel, csontvelővel, ritkán vértranszfúzióval, a várandósság alatt anyáról magzatra, szüléskor a fertőzött hüvelyváladékkal vagy később az anyatejjel az újszülöttre. A primer fertőzés után a vírusürítés évekig is eltarthat és a vírus életre szóló látenciát alakít ki a gazdaszervezetben. A látensen perzisztáló vírus időnként reaktiválódva újra aktív fertőzést okoz. Előfordulhat reinfekció, amikor egy másik, eltérő antigén-tulajdonságú HCMV-törzzsel a külvilágból fertőződik meg az egyén. A primer fertőzés immunkompetens személyekben gyakran tünetmentes vagy enyhe nem specifikus tünetek jelentkeznek (gyengeség, láz, izzadás, izomfájdalom, atípusos lymphocytosis és hepatitis). A mononucleosis infectiosa esetek kb. 20%-áért a HCMV felelős, amelyre a negatív heterofil agglutinációs teszt (Paul-Bunnel) jellemző (14, 16). A rekurrens fertőzés immunkompetens egyénekben tünetmentes. Ezzel szemben, az immunszuppresszáltakban gyakran súlyos betegségek fordulnak elő, mind a primer fertőzés, mind a reaktiváció során. Transzplantált személyeknél és AIDS stádiumban lévők között növekszik az életet veszélyeztető kórképek száma, HCMV pneumonitis és chorioretinitis, colitis, encephalitis. HCMV által okozott infekció az egyike a leggyakrabban előforduló szervátültetést követő virális fertőzéseknek, amely befolyásolja a transzplantált szerv és a beteg túlélését is. Magyarországon becsült adatok alapján az újszülöttek 1-2%-a születik congenitalis HCMV-fertőzéssel (16), ezen magzatok 10-15%-ában születéskor észlelnek klinikai tüneteket, legsúlyosabb megnyilvánulása a cytomegaliás zárványbetegség. Tünetei a hepatosplenomegalia, sárgaság, petechiák, purpurák, microcephalia, agyi kalcifikáció és chorioretinitis. Ezeknél a csecsemőknél a központi idegrendszer fejlődési zavarainak mértékétől függően szellemi visszamaradottság, progrediáló halláskárosodás és látászavar jelentkezik, a csecsemők egy része meghal. A tünetmentes HCMV-fertőzött újszülöttek 10-15%-ában évek múlva, esetleg csak iskoláskorra alakulnak ki a progrediáló neurológiai elváltozások (7,16,18). A humán cytomegalovírus fertőzés immunológiája A HCMV fertőzésre jellemző, hogy az elsődleges fertőzés után minden esetben látenciát alakít ki a gazdaszervezet CD34+ myeloid prekurzor sejtjeiben (11), további látencia helyek lehetnek a dendritikus sejt-prekurzorok, a perifériás vér monocytái, a nyálmirigyek és a vese epithelialis sejtjei és a fertőzés perzisztenssé válik. Ebben a látens állapotban élethosszig képes megbújni a vírus, a gazdasejt sejtmagjában legtöbbször extrakromoszomálisan perzisztál, majd bizonyos ingerek hatására aktiválódhat és szaporodhat. A vírus látenciája szempontjából azok a proteinek jelentősek, amelyek gátolják az MHC-I (major histocompatibility complex-i.: fő hisztokompatibilitási komplex-i) kifejeződését a sejt felszínen (gp-us3, gp-us6, gp-us2, gp-us11). Ezeket a fehérjéket a vírusgenom rövid egyedi szakasza (unique short) kódolja. MHC-I hiányában a vírusantigének nem kerülnek bemutatásra a felismerő T-sejteknek (CD8+ Tc-sejtek), így nem alakul ki cytotoxicus T-sejt (CTL) válasz. A vírus azonnali-korai (immediate early, IE) proteinjei gátolják az endothel sejtekben az MHC-II molekulák expreszszióját, ezen kívül a HCMV a Jak1 átviteli út gátlásával MHC-II kifejeződését is csökkenti. Az MHC-I és MHC- II down-regulációját CMV fertőzött makrofágokban és dendritikus sejtekeben is kimutatták, így az MHC molekulákhoz kötött antigénprezentáció csökkent, amelynek következtében a CD4+ T-helper (Th) sejtek és a CTL sejtek nem tudják elpusztítani a vírusfertőzött sejteket (1). Elvileg az MHC-I csökkent kifejeződése érzékennyé tenné a sejteket a nem specifikus természetes ölősejtek (natural killer, NK) cytotoxicitása iránt, de a vírus olyan proteineket is kódol a hosszú egyedi (unique long; UL) génszakasz génjeinek (UL40, UL16, UL18) termékeiként, amelyek ezt a hatást megakadályozzák. Az UL 18 gén fehérjéje leköti az NK-sejtek receptorát MHC-I homológként működve, így a fertőzött sejt elkerüli az NK-sejtek általi pusztítást. Mindez azt eredményezi, hogy a vírust látensen hordozó sejtek csökkent érzékenységet mutatnak a specifikus és nem specifikus cytotoxicitásra. Egyes virális géntermékek pedig gátolják a p53 tumorszuppresszor gén működését, és a CMV-vel fertőzött sejt elkerüli a p53 által kiváltott programozott sejthalált (8). A HCMV mononuclearis immunsejteket fertőz, így az akut fertőzés immunszuppresszióval is társul. A vírus genomja immunmoduláló fehérjék kódolásával az immunrendszer működését úgy is manipulálja, hogy befolyásolja a sejtciklus szabályozását (apoptosis, sejtmigráció, angiogenezis, sejtdifferenciálás szabályozása) ami által akár tumornövekedést (oncomodulatio) és autoimmun betegségek kialakulását is elősegítheti (24). 11
12 A fertőzés elleni védelemben döntő fontosságú a veleszületett immunitás elemeinek aktivációja, amely meggátolja a vírus nagymértékű elszaporodását. Fertőzött sejtek azonnali reakcióként I. típusú interferonokat (IFN-α és -β) termelnek, melyek a környező sejtekben antivirális hatást váltanak ki. A fertőzött sejtek gyors elpusztításában az NK-sejtek szerepe döntő, míg a komplementrendszer lektin vagy alternatív úton való aktiválása a vírusok lízisét okozhatja. Az adaptív válasz során aktiválódó és effektor-sejtté differenciálódó CTL sejtek cytotoxicus aktivitásuk révén nagy fajlagossággal pusztítják el a fertőzött sejteket. Az ezzel párhuzamosan kialakuló antitestek a vírushoz kötődve megakadályozzák a további fertőzést, illetve az opszonizáció révén fokozzák a vírus fagocyták általi felvételét és elpusztítását. Mivel az ellenanyaggal fedett vírusok aktiválják a komplementrendszer klasszikus útját, az opszonizált részecskék nemcsak az Fc-, hanem a komplement-receptorokhoz (CR3, CR4) is kötődnek, ami még hatékonyabbá teszi a vírus bekebelezését és eliminálását. Az opszonizácó révén azonban akár fokozódhat is a fertőzés, azáltal, hogy segítik a kórokozó Fc-, és komplementreceptorokon keresztül történő sejtbe jutását. Így a vírus olyan sejtekbe is bejuthat, amelyek nem hordozzák a vírus-specifikus receptort. A HCMV többféle sejt-receptorhoz kapcsolódhat, így például az epidermális növekedési faktoréhoz (EGFR), heparin-szulfát proteinglikánhoz (HSPG) és Toll-like receptorokhoz (TLR), ezért a szervezet csaknem valamennyi sejtjében képes szaporodni. A primer HCMV-fertőzés hatására mind humoralis (HCMV-specifikus IgM, majd IgG) mind cellularis (cytotoxicus T-lymphocyták) immunválasz kialakul. A sejt-közvetített immunitásnak döntő szerepe van az aktív vírusszaporodás megakadályozásában. A szeropozitívitás ugyan védelmet jelent a súlyos betegségek kialakulásával szemben, de a felülfertőzéssel és a reaktivációval szemben nem. A nagy genetikai állománnyal rendelkező HCMV a filogenezis során olyan mechanizmusokat fejlesztett ki, amellyel elkerüli vagy módosítja az immunrendszer működését. A gyulladási folyamatokban központi szerepet játszó kemokinekkel homológ fehérje (US 28 génterméke) szintézisére képes, továbbá Fc-receptor szerű fehérjéket termel és így a sejt felszínén megjelenő Fc-receptorok megkötik a HCMV ellenes IgG-t, ezáltal gátolva az ellenanyag-mediált immunválaszt. Az MHC-I molekulák sejtfelszínre jutását, átírását vagy a TAP (transporters associated with antigen processing; peptidpumpa) fehérjék révén történő peptid ellátást akadályozva elrejtik a fertőzött sejtet a CTL sejtek általi felismeréstől. Immunszuppresszált állapotban, akár elsődleges fertőzés vagy reaktiváció esetén a látens állapot megszűnését kiváltó speciális inger a gyulladásos környezetben nagy mennyiségben termelődő tumor necrosis faktor (TNF)-α, amely kötődik a vírust hordozó sejtek TNF receptoraihoz, ezzel aktiválva a protein kináz C-t és a nukleáris transzkripciós faktort (NF-κB), melynek eredménye egy heterodimer, ami kötődik a HCMV IE génrégióhoz és A humán cytomegalovírus fertőzés klinikai jelentősége,... elindítja a virális replikációt. Másrészt a stressz catecholaminok (adrenalin és noradrenalin) emelik a sejten belüli ciklikus AMP (camp) szintet, amely szintén stimulálja az IE (immediate early) enhancer/promoter régiót. Az utóbbin keresztül hatnak a gyulladásos folyamatokban termelődő proinflammatoricus prosztaglandinok is, ezzel magyarázható, hogy pl. szervtranszplantáltaknál a HCMV fertőzés különböző folyamatokhoz kapcsolódik. A különböző gyulladásos folyamatok kiváltják a HCMV reaktivációját, ugyanakkor a szaporodó HCMV által kiváltott immunválasz tovább erősíti a gyulladásos folyamatot. Továbbá az immunszuppresszív kezelés is befolyásolja a fertőzés kialakulását, például a graft-kilökődés miatt alkalmazott monoklonalis vagy poliklonalis T-lymphocyta ellenanyagok (OKT3, ATG, ALG) fokozzák az infekció kialakulásának veszélyét. A humán cytomegalovírus laboratóriumi diagnosztikai lehetőségei A fertőzés laboratóriumi diagnózisa a klinikai tünetek észlelése mellett a megfelelő virológiai módszerekkel történik. A vírus direkt (vírusizolálás, virális antigén és virális nukleinav kimutatása) és indirekt vizsgálatára (humoralis és cellularis immunválasz vizsgálata) többféle módszer alkalmazható (13, 16). A vírusizolálás torokmosó-folyadékból vagy a vizeletből a legeredményesebb, de vérből vagy a vírussal fertőzött szervek biopsziás anyagából is lehetséges emberi fibroblaszt sejtkultúrákon, amely több hetet is igényelhet az infektív vírus mennyiségétől függően. Gyorsabb eljárás az ún. shell vial módszer, amely a vizsgálati anyag sejtkultúrára vitele után 24 órán belül eredményt ad. Az izolált HCMV törzsek genomja restrikciós enzim analízissel meghatározható és a módszer segítségével a vírustörzsek terjedése követhető (14, 16). A vírus nukleinsav kimutatására és mennyiségének meghatározására a legelterjedtebbek a polimeráz láncreakció (PCR)-n alapuló módszerek (PCR, nested-pcr, real-time vagy kvantitativ PCR, szekvenálás). A HCMV viraemia kimutatása prognosztikai jelentőségű transzplantáltakban, a kvantitativ PCR (Q-PCR) és a HCMV antigenaemia teszt (a pp65 vírusantigén kimutatása perifériás fehérvérsejtekben) megfelelnek a diagnosztikai elvárásoknak. További lehetőségek a virális nukelinsav vizsgálatra az mrns pp67 kimutatása NASBA (nucleic acid sequence-based amplification) módszerrel, és az in situ hibridizációs technikák (19). A humoralis immunválasz vizsgálatára, szerológiai diagnózis felállítására alkalmas érzékeny módszer az enzimhez kötött immunadszorpciós vizsgálat (ELISA; enzyme-linked-immunosorbent assay), további lehetőségek még indirekt immunfluoreszcencián alapuló eljárások, western-blot, line immunassay. Jelenleg a kereskedelmi forgalomból beszerezhető ELISA-készletek specificitása és szenzitivitása igen változó (13). Rekombináns antigének és HCMV peptid-fragmentek használata javíthatja a specificitást. A legjobb érzékenységgel és specificitással a HCMV-specifikus immunoblot rendelkezik. A HCMV-specifikus IgM jelenléte igen 12
13 érzékeny indikátora a folyamatban lévő vagy nem régen lezajlott HCMV-fertőzésnek. Az IgM jelenlétének diagnosztikus értéke azonban korlátolt, mivel nincs megfelelő HCMV-specifikus IgM standard és nagyok a különbségek az egyes cégek által előállított tesztek érzékenysége között. Számos esetben számolnak be álpozitív és álnegatív eredményekről. Ezeken kívül a primer HCMV-fertőzést követően az IgM akár kilenc hónapig is kimutatható lehet a vérsavóban, továbbá megjelenhet a vírus reaktiválódásakor és reinfekciókor is. A HCMV-specifikus IgM immunoblot, amelynek érzékenysége és specificitása 100%, egy jó standard teszt, amely megerősíti a HCMV-specifikus IgM jelenlétét a vérsavóban. A primer fertőzés szerológiai bizonyítékának tekintik a HCMV-specifikus IgG ellenanyag megjelenését (IgG szerokonverzió). A cellularis immunválasz vizsgálata a specifikus CTL sejtek kimutatása, amelyek HCMV aktiváció idején nagy számban jelennek meg és fontos szerepük van a reaktiváció és a betegség visszaszorításában. A celluláris immunválasz 70-90%-ban a pp65, pp50 és gb antigének ellen irányul. A humán leukocyta antigén (HLA) molekulákat és a virális peptideket tartalmazó MHC tetramert konjugálják fluorokrómmal és így teszik láthatóvá a tetramerhez kötődő, antigén specifikus receptort hordozó T-sejteket melynek mérése áramlási cytometriával történik (15). Ha a laboratóriumi vizsgálatok során a gravida HCMV IgM vizsgálati eredménye pozitív, fontos annak a megállapítása, hogy primer vagy rekurrens a fertőzése. A primer anyai HCMV-fertőzés kb. 40%-ban átterjed a magzatra, rekurrens fertőzés esetén ez kb. 0,5 1% ami arra utal, hogy az anyai immunitás ha nem is akadályozza meg, de jelentősen csökkenti a vírus átvitelét. Az IgG pozitivitás esetén további vizsgálatként a HCMV IgG aviditás vizsgálata jön szóba. Az aviditási vizsgálattal a közelmúltban (4 hónapon belül), illetve régebben (4 hónapon túl), történt fertőzésre lehet következtetni. Némely esetben ezzel a vizsgálattal nem lehet kizárni, de megerősíteni sem a várandósság alatti primer HCMV fertőzés lehetőségét. Az aviditási vizsgálatnak igazi jelentősége a korai terhességben van, amikor eldönthető, hogy az anya HCMV fertőzése primer fertőzés vagy reaktiváció következménye-e. Amennyiben a várandós HCMV IgG vizsgálat eredménye negatív, akkor a korszerű szakvélemények a várandós folyamatos ellenőrzését javasolják (9,18). A várandósság során a magzati szövetek vizsgálatára is szükség lehet. A chorion-bolyhokból a terhesség hetében lehet mintát venni. Amniocentesisre a középső trimeszterben (16-28 hét) kerülhet sor. Köldökzsinór vért a 16. terhességi hét után lehet venni. Az amniocentesis során nyert magzatvízből a HCMV specifikus nukleinsav kimutatását PCR módszerrel a 20. gesztációs hét után célszerű elvégezni. Nincs teendő, amennyiben a PCR negatív eredményű, ha viszont pozitív, akkor a Q-PCR a következő lépés HCMV kópia/ml alatti eredménynél alacsony a kockázat a szimptómás magzati fertőzésre; amennyiben CMV kópia/ml feletti az eredmény, a kockázat fokozott (3, 9). A postnatalis diagnosztika mindkét esetben A humán cytomegalovírus fertőzés klinikai jelentősége,... javasolt. A születést követően a két héten belül kimutatott vírus specifikus nukleinsav, vagy a vírus izolálása a vizeletből congenitalis fertőzést igazol, a vírus ürítése a vizelettel akár fél éven túl is (hosszú hónapokig, évekig) lehetséges, így fő fenntartója a vírus cirkulálásának a populációban. Amennyiben a PCR vizsgálat eredménye pozitív, javasolni kell az újszülött ganciclovir vagy valganciclovir kezelését, mert ez megelőzi az újszülöttben később bekövetkező halláskárosodást és egyéb idegrendszeri szövődményeket. Retrospektív congenitalis HCMV fertőzés vizsgálatára a szűrőpapírra levett szárított vércsepp minta (Dried Blood Spot; DBS) amelyet minden újszülöttől az anyagcsere betegség szűrésére vesznek le nagyon jól alkalmazható a HCMV DNS kimutatására is. A fertőzés megelőzése A megbetegedések kivédésére olyan vakcinára lenne szükség, amely egyaránt biztosítja a hatékony humoralis és cellularis immunvédelem kialakítását, amelyet eddig nem sikerült kifejleszteni. Biztató eredmények mutatkoznak néhány virális immunmoduláló fehérjével kapcsolatban. A rekombináns antigéneken alapuló vakcinák egyre nagyobb szerepet kapnak az oltóanyag fejlesztésekben, kiszorítva az elölt kórokozókat vagy alegységeiket tartalmazó hagyományos oltóanyagokat (2). Az attenuált HCMV vakcina a vad törzsektől kevés tulajdonságban eltérő laboratóriumi törzset, Towne-törzset vagy Towne/Toledo rekombináns törzset tartalmaz. A kísérleti oltásokban neutralizáló ellenanyagot és sejtközvetített immunitást is létrehozott, az immunitás azonban nem bizonyult elég erősnek a vad HCMV-törzsekkel szemben. A virális rekombináns vakcina jelöltek (vagy a vírusburok alkotórészeit /gb, gh/ vagy nem szerkezeti fehérjéket tartalmaznak /pl. IE-1 protein/) közül a Canarypox pp65 indukált pp65 specifikus T-sejt választ, Canarypox gb és a Canarypox gb majd gb/mf59 indukált T-sejt választ és neutralizáló ellenanyagot (5). A DNS és alegység vakcinák közül a rekombináns gb+mf59/alum indukált neutralizáló ellenanyagot és valamennyi T-sejt választ is. A pp65 és gb bivalens DNS plazmid vakcina állatkísérletben biztonságos volt és indukált T-sejt választ, a trivalens változata pp65, gb és IE-1 (5). Egyéb vakcina jelöltek, mint például a CTL sejt epitop fúzója a helper epitoppal, HCMV dense bodies (szubvirális partikulák), HCMV poliepitop vakcina (CTL sejt epitopok gyöngysorszerűen kapcsolódnak össze) és új szintetikus DNS vakcinák vizsgálata folyamatban van (2, 28). A legígéretesebb HCMV vakcinák (Towne /attenuált teljes vírus/, gb/ MF59 /gb alegység/, TransVax /gb, pp65 DNS vakcina/) a klinikai vizsgálatok II. fázisába léptek (28). A humán cytomegalovírus fertőzés terápiás lehetőségei A HCMV-betegségek kezelésére jelenleg számos antivirális szer alkalmazására van lehetőség. A ganciclovir a guanin aciklusos nukleozid analógja 13
14 A humán cytomegalovírus fertőzés klinikai jelentősége,... (9-[1,3-dihydroxy-2-propoxymethil] guanin), az acyclovirtől csak abban tér el, hogy az oldalláncon van még egy hidroxil csoport. A valganciclovir pedig a ganciklovir L-valyl észtere és szájon át adható. Elsősorban a HCMV replikációját gátolja. A HCMV nem rendelkezik virális timidinkináz enzimmel. Az első foszforilációt az UL97 gén által kódolt proteinkináz végzi, a további foszforilációt a fertőzött sejt enzimei végzik. A ganciclovir trifoszfát kompetitív gátlással fejti ki a hatását. A ganciclovir nem láncleállító, ellentétben az acyclovirrel, a folyamat további részében is képződnek fertőzésre képtelen HCMV fragmentumok. Rezisztencia kialakulásának lehetőségei az UL97 enzimen és a DNS polimerázon fellépő mutációk. A ganciclovir szájon át történő felszívódása csekély (3-7%), míg a valgancicloviré 60%. Leggyakoribb mellékhatása a csontvelő-szuppresszió, főleg intravénás alkalmazása során gyakran alakul ki neutropenia. Hosszas per os terápia alatt inkább thrombocytopenia és anaemia észlelhető. Állatkísérletekben a ganciclovir teratogénnek és embryotoxikusnak bizonyult (7, 10, 21). A ganciclovir hozzáférhető intravénás, orális valamint intravitrealis transzplantátum formájában. Klinikai alkalmazása elsősorban csökkent immunitású betegek súlyos HCMV fertőzésében, AIDS betegek retinitisében, valamint szervtranszplantáltak és előrehaladott HIV/ AIDS betegek generalizált fertőzésének megelőzésére jön szóba. Egyéb HCMV fertőzések közül a colitis, oesophagitis, pneumonitis kezelésében volt hatásos. Szervátültetések utáni HCMV pneumonitisben a ganciclovir hyperimmunsavóval, vagy nagy adag gamma-globulinnal együtt adva volt hatásos. A foscarnet (trinátrium-foszfoformat-hexahidrát) anorganikus pirofoszfát analóg. Nem kompetitív reverzíbilis gátlója a virális polimerázoknak a pirofoszfát kötőhelyen. In vitro virosztatikus hatása HIV, humán herpesvírusok, hepatitis B-vírus ellen évek óta ismert. Intravénás formában hozzáférhető. Szöveti eloszlása jó, nagy mennyiségben bejut a központi idegrendszerbe, csontszövetben raktározódik. Foscarnet rezisztencia DNS polimeráz enzimen, illetve a HIV reverz transzkriptázon kialakult pontmutációk útján jöhet létre. A vesén át választódik ki, legfőbb mellékhatása a nefrotoxicitás. Gyógyszer-interakciókra és toxicitásra főként a vesén át metabolizálódó szereknél kell számítani, potens kelátképző is. Klinikai felhasználása HIV fertőzöttek HCMV retinitisében, egyéb CMV fertőzésekben és acyclovir rezisztens HSV és VZV fertőzésekben. A cidofovir aciklikus dezoxi-citidin-monofoszfát analóg. Mivel nukleotid analóg, ezért csak két foszforilációs lépés szükséges az aktivációjához. Nem igényel virális timidinkinázt, ezért az esetleges enzimdeficites mutánsokra is hatásos. Igen hatékony a humán herpesvírusok, valamint adeno-, pox-, polyoma- és humán papilloma-vírusok ellen. A cidofovir intravénásan alkalmazható. Központi idegrendszeri penetrációja csekély, vesében aktív tubuláris szekrécióval ürül átalakulás nélkül, dializálható. Mellékhatása a nefrotoxicitás. Okozhat még neutropeniát, carcinogén és teratogén, ezért fogamzóképes korú nő kezelésére csak fogamzásgátlóval alkalmazható. Elsősorban AIDS-betegek HCMV retinitisének kezelésére alkalmazzák. A fomivirsen (21-nukleotid-foszforilált oligonukleotid) antiszensz mechanizmus útján gátolja a HCMV replikációját, úgy, hogy az mrns egy szakaszához kötődik, ami átírja a HCMV IE-2 régiójában a kódoló fehérjét, ezzel megváltoztatja a virális gén expesszióját, így hatékony lehet a ganciclovir, foscarnet és cidofovir rezisztens HCMV törzsekre (12). Fő klinikai alkalmazása a HIV fertőzöttek HCMV retinitisének intravitrealis kezelése. Mellékhatásként dózisfüggő gyulladásos tünetek (iriditis, uveitis, vitritis) előfordulhatnak, melyek jól reagálnak szteroidokra. Nem ajánlott adni fomivirsent azoknak, akik 2-4 héten belül cidofovir kezelést kaptak. Három kísérleti HCMV elleni szer (maribavir, letermovir, brincidofovir) a klinikai vizsgálatok II. és III. fázisába lépett (6). A maribavir UL97 proteinkináz inhibitor, megtartja in vitro aktivitását a legtöbb ganciclovir és cidofovir rezisztens vírussal. Megemlítendő, hogy van egy úgynevezett P-hurok mutáció (F342S), amelyről kimutatták, hogy kettős kereszt-rezisztenciával rendelkezik (maribavir és ganciclovir), de nem befolyásolja a kináz aktivitást vagy a növekedést sejttenyészetben. Az F342S mutációt még nem figyeltek meg in vivo. A letermovir (korábban AIC-246) egy HCMV-specifikus virális termináz inhibitor, orális és intravénás készítményeket fejlesztettek ki. In vitro kialakult rezisztencia az UL56 termináz gén mutációja következtében gátolhatja a hasznosságát. A brincidofovir (korábban CMX-001) egy széles spektrumú, oralisan adható cidofovir lipidkonjugátum, kevésbé vesekárosító (6). További antivirális szerek is kipróbálás alatt vannak (pl.: CMV423, 3-Deaza-HPMPA) és in vitro hatékonynak bizonyultak. Transzplantáltak HCMV okozta betegségeinek megelőzésére két módszert alkalmaznak: az univerzális profilaxist és a preemptiv terápiát (26). Valganciclovirt vagy ganciclovirt használnak a gyógyszeres profilaxisban. Preemptív terápia alkalmazásakor a transzplantáltakat meghatározott időnként ellenőrzik, és pozitív laboratóriumi eredmény esetén a kezelés leggyakrabban intravénás ganciclovirral történik. A passzív immunizálást gamma-globulinnal vagy hyperimmun gammaglobulinnal (CYTOTECT CP Biotest infúzió 100 E/ml megnevezésű intravénás készítmény kizárólag fekvőbeteg-gyógyintézetekben alkalmazható) elsősorban tüdő és szívtranszplantált recipienseknél alkalmazzák a gyógyszeres prevenció kiegészítésére (26). Várandósok primer fertőzésekor hyperimmunglobulin alkalmazása szóba jön, mint lehetséges kezelési mód a magzat fertőződésének a megelőzésére, mivel csökkenti a vírus mennyiségét és így a vírus magzatot károsító hatásait (16). A congenitalis HCMV-fertőzés potenciálisan súlyos következményei ellenére kevés adat áll rendelkezésünkre az antivirális terápiával, mint profilaktikus kezeléssel kapcsolatban. Erre különösen akkor lenne szükség, amikor nagy a veszélye a HCMV-fertőzés magzatra terjedésének. 14
15 Összegzés Hatásos védőoltás hiányában is elkerülhető, illetve csökkenthető a várandósok aktív HCMV-fertőzése, ha felhívjuk a figyelmet a fertőzés forrásaira, veszélyeire, és ismertetjük a fertőzés megelőzésének lehetőségeit. Különösen a kisgyermekekkel foglakozók oktatása fontos. Szeronegatív nő szeropozitív partnerétől szexuális úton is megkaphatja a fertőzést. A szerv és csontvelő traszplantálásokkal kapcsolatos HCMV-fertőzés okozta komplikációk a donorok és recipiensek szűrésével és kiválasztásával csökkenthető. Köszönetnyilvánítás A szerző ezúton is köszönetet mond Dr. Gönczöl Éva egyetemi tanárnak a szakmai segítségéért és a lektori munkájáért. Irodalomjegyzék 1. Barnes P.D., Grundy J.E.: Down-regulation of the class I HLA heterodimer and beta 2 microglobulin on the surface of cells infected with cytomegalovirus. J. Gen. Virol., 73 (9), , Barry P.A.: Exploiting viral natural history for vaccine development. Med. Microbiol. Immunol., 204(3), , Bonalumi S., Trapanese A., Santamaria A. et al.: Cytomegalovirus infection in pregnancy: review of the literature. J. Prenat. Med., 5(1), 1-8, Csire M., Mikala G.: Human Herpesviruses in Hematologic Diseases. Eds: Magel G.D., Tyring S: In: Herpesviridae A look into this unique family of viruses. Rijeka, InTech, , Gandhi M.K., Khanna R.: Human cytomegalovirus: clinical aspects, immune regulation, and emerging treatments. Lancet Infect. Dis., 4(12), , Hanson K.E., Swaminathan S.: Cytomegalovirus antiviral drug resistance: future prospects for prevention,detection and management. Future Microbiol., 10(10), , Ho M.: The history of cytomegalovirus and its diseases. Med. Microbiol. Immunol., 197(2), 65-73, Kubota A., Kubota S., Farrell H.E. et al.: Inhibition of NK cells by murine CMV-encoded class I MHC homologue m144. Cell. Immunol., 191(29), , Ludwig E.: Infektológiai útmutató. Klinikai irányelvek kézikönyve. Medition Kiadó, Budakeszi, Ludwig E., Bánhegyi D., Király K.: Vírusellenes szerek (54. fejezet) In: A farmakológia alapjai. Szerk: Gyires K., Fürst Zs., Medicina Könyvkiadó Zrt., Budapest, , Mendelson M., Monard S., Sissons P. et al.: Detection of endogenous human cytomegalovirus in CD34+ bone marrow progenitors. J. Gen. Virol., 77(12), , Mészner Zs.: Herpeszvírus fertőzések antivirális kemoterápia In: Klinikai és járványügyi virológia. Szerk.: Takács M., Vox Medica Kiadó Kft. Budapest, , 2010 A humán cytomegalovírus fertőzés klinikai jelentősége, Mihály I., Arányi Zs., Princz Gy. et al.: A virológiai vizsgálatok szerepe a terhes nők cytomegalovírus fertőzésének kiderítésében Orv. Hetil., 155(41), , Mocarski E.S.,Shenk T.,Pass R.F.: Cytomegaloviruses In: Fields Virology. 5th ed., Eds.: Knipe D. M., Howley P. M., Griffin, D.E. Philadpelphia, 2007, Lippincott Williams & Wilkins, , Pállinger É.: Áramlási citometria: Újdonság a mikrobiológiai diagnosztika eszköztárában? Orv. Hetil., 154(31), , Pusztai R.: Humán herpesvírus 5 (Humán cytomegalovírus) In: Klinikai és járványügyi virológia. Szerk.: Takács M., Vox Medica Kiadó Kft. Budapest, , Reddehase M.J.: Margaret Gladys Smith, mother of cytomegalovirus: 60th anniversary of cytomegalovirus isolation. Med. Microbiol. Immunol., 204(3), , Revello M.G., Gerna G.: Diagnosis and management of human cytomegalovirus infection in the mother, fetus, and newborn infant. Clin. Microbiol. Rev., 15(4), , Ross S.A., Novak Z., Pati S. et al.: The diagnosis of cytomegalovirus infection. Infect. Disord. Drug. Targets, 11(5), , Rowe W.P., Hartley J.W., Waterman S. et al.: Cytopathogenic agent resembling human salivary gland virus recovered from tissue cultures of human adenoids. Proc. Soc. Exp. Biol. Med., 92(2), , Schreiber A., Háater G., Schuber A. et al.: Antiviral treatment of cytomegalovirus infection and resistant strains. Exp. Opin Pharmacother., 10(2), , Smith M.G.: Propagation of salivary gland virus of the mouse in tissue cultures. Proc. Soc. Exp. Biol. Med., 86(3), , Smith M.G.: Propagation in tissue cultures of a cytopathogenic virus from human salivary gland virus (SGV) disease. Proc. Soc. Exp. Biol. Med., 92, , Söderberg-Nauclér C.: Does cytomegalovirus play a causative role in the development of various inflammatory diseases and cancer? J. Intern. Med. 259(3), , Tokodi I., Pusztai R., Deák J. et al.: A posztnatális congenitális cytomegalovírus fertőzés diagnosztikájának lehetőségei. Orv. Hetil., 145(17), , Varga M., Remport Á., Czebe K. et al.: A cytomegalovírus-fertőzés rizikófaktorai, hatásai és a megelőzés lehetősége transzplantációt követően. Orv. Hetil., 149(12), , Weller T.H., Hanshaw J.B., Scott D.E.: Serological differentiation of viruses responsible for cytomegalic inclusion disease. Virology, 12, , Wu S.J., Villarreal D.O., Shedlock D.J. et al.: Synthetic DNA approach to cytomegalovirus vaccine/immune therapy. Adv. Exp. Med. Biol., 848, ,
16 EBV fertőzések őssejt-transzplantáltakban: klinikum,... EBV fertőzések őssejt-transzplantáltakban: klinikum, diagnosztika és terápiás lehetőségek Bayer-Dandár Eszter, Dr. Kassa Csaba Egyesített Szent István és Szent László Kórház, Budapest Összefoglalás: Az Epstein-Barr vírus (EBV, Humán herpesvírus 4, HHV-4) közel 60 évvel ezelőtti felfedezése óta az egyik legjobban kutatott kórokozónak számít. Az egész világon elterjedt, a teljes felnőtt populáció mintegy 90%-ában kimutatható az ellene termelődő ellenanyag. A vírus cseppfertőzéssel, szoros kontaktussal terjed. A szervezetben a CD21 receptor segítségével jut be a B-lymphocytákba és az epithelialis sejtekbe. Ép immunitásúakban a fertőzés gyakran tünetmentesen zajlik, vagy magától gyógyuló lymphoproliferativ betegséget (mononucleosis infectiosa) okoz. Az akut szak után a vírus élethosszig perzisztál. Tartós és mély T-sejtes immunhiány esetén a perzisztáló vírusok reaktiválódhatnak, és újra képesek megbetegedést okozni. Őssejt- vagy szerv-transzplantáció után ezt a kórképet poszttranszplantációs lymphoproliferatív betegségnek (PTLD) nevezzük. Allogén őssejt-transzplantáció után az első három hónapban kell leginkább számítani PTLD-re. A betegség leggyakrabban lymphadenopathiával, hepatosplenomegaliaval, lázzal kezdődik, melyhez az érintett szerveknek megfelelő eltérések társulhatnak. A diagnosztika gyors és szenzitív eszköze a kvantitatív real-time PCR, amely a magas rizikójú betegek rendszeres szűrésére javasolt. Az EBV ellen direkt hatékony antivirális gyógyszer nincs. Őssejt-transzplantáltak EBV betegsége esetén rituximab adása javasolt, az immunszuppressziót lehetőség szerint csökkenteni kell. Második vonalbeli kezelésként kemoterápia, cytotoxicus sejtterápia jöhet szóba. Kulcsszavak: Epstein-Barr vírus, EBV, Humán herpesvírus 4, HHV-4, latencia, B-lymphocyta, reaktiváció, allogén őssejt-transzplantáció, poszttranszplantációs lymphoproliferatív betegség, rituximab Summary: Since its discovery nearly 60 years ago, the Epstein-Barr virus (EBV, Human herpesvirus 4, HHV-4) is one of the best studied pathogen. The virus occurs all over the world. Approximately 90% of the adult population has antibodies against it. The virus spreads by droplet infection, and with close intercourse. It enters into the B-lymphocytes and the epithelial cells using the CD21 receptors. The infection in immunocompetent patients is often asymptomatic or causes a self-limited lymphoproliferative disease (infectious mononucleosis). After the acute phase, the virus persists lifelong in the human body. It can reactivate in the case of persistent T-cell immunodeficiency, and is able to cause a recurring illness. After a stem cell- or solid organ transplantation, this is called post-transplant lymphoproliferative disease (PTLD). The most of the PTLD cases are expected to be in the first three months after the allogenic stem cell transplantation. Most commonly, the disease starts with lymphadenopathy, hepatosplenomegaly and fever, which can be associated with the dysfunction of the affected organs. Real-time quantitative PCR is a rapid and sensitive diagnostic tool, which is recommended for the regular screening of the high-risk patients. There is no effective antiviral drug against EBV. In case of EBV infection in stem cell transplant patients, the treatment is based on rituximab and the reduction of immunosuppressive therapy. In second line treatment, chemotherapy and cytotoxic cell therapy may be considered. Keywords: Epstein-Barr virus, EBV, Human herpesvirus 4, HHV-4, latency, B-lymphocyte, reactivation, allogeneic stem cell transplantation, posttransplantation lymphoproliferative disease, rituximab Az Epstein-Barr vírusok felfedezése A Burkitt-lymphomát, mely főleg gyermekekben előforduló, a fej-nyak régióban jelentkező malignus megbetegedés, először Denis Burkitt brit orvos írta le 1958-ban (2). Hat év múlva, 1964-ben, Epstein, Achong és Barr szintén brit kutatók a Burkitt-lymphomából kialakított sejtvonal elektronmikroszkópos vizsgálatai során olyan herpes-szerű részecskéket figyeltek meg, amelyek nem hasonlítottak a korábban már leírt egyik herpesvírushoz sem. A felfedezést követően az EBV lett az első olyan humán tumorvírus, amit lymphoma kórokozójaként azonosítottak (14). (1. ábra) Taxonómia A Human herpesvírus 4 (HHV-4), köznapi nevén az Epstein-Barr vírus (EBV) a Herpesviridae családba, 1. ábra: Az Epstein-Barr vírus elektronmikroszkópos képe (forrás: 16
17 a Gammaherpesvirinae alcsalád Lymphocryptovirus nemzetségébe tartozik (13). A vírusnak két altípusa van, az EBV-1 és az EBV-2 (8,16). Az EBV humán patogén kórokozó, annak ellenére, hogy szerológiai vizsgálatokkal főemlősökben is kimutatható a vírus elleni ellenanyag. Mindez azonban valószínűleg csak keresztreakció az állatokban megtalálható, hasonló tulajdonságokkal rendelkező vírusok jelenlétére (12,14). A genus görög elnevezésének ( nyirokszervekben rejtőző ) megfelelően a primer fertőzés után a vírus a B-lymphocytákban látens formában található meg (11), a fertőzőképes virion pedig a gazdasejt genomjába épül be (6). Az EBV morfológiája és genomszerveződése A Herpesvírus családba tartozó nm nagyságú, burkos vírusok (1. ábra). A virionok magból, kapszidból, tegumentből és burokból állnak, melyeken externalis glikoproteid tüskék találhatóak meg (14). A magban található a DNS genom. A kapszid ikozaéderes, átmérője nm nagyságú, amit 20 egyenlő oldalú háromszög határol és 162 kapszomerbe rendeződő fehérje egység alkot (12 penton és 150 hexon). A kapszid és a burok között található a magas fehérjetartalmú tegument, aminek struktúrájáról keveset tudunk. A magas glikoproteid tartalmú sejthártya eredetű burok jelentősége a sejt-vírus kölcsönhatásokban (adszorpció és penetráció) és az immunogenitásban van (2. ábra) (4,12,13,14). 2. ábra: Az EBV felépítésének sematikus ábrája ( alapján) Az EBV a Baltimore-féle vírusrendszer I. csoportjába tartozik: lineáris, duplaszálú DNS vírus (13). Genomja 175 kbp, melynek teljes szekvenciája ismert (1). A virális DNS-ről több, mint 85 gén és 17 mikrorns kódolódik (14). Genetikai állománya közel 60% G+C arányú (9), amin internalis és terminalis repetitív szakaszok egyaránt megtalálhatóak (14). A virális DNS mindkét szála kódol. A kódolt fehérjék kisebb hányada struktúrprotein, nagyobb részükre pedig a replikáció során van szükség (4). Az ismétlődő belső szekvenciák területén történő rekombinációk deletált, átrendezett genomokat hordozó defektív vírusok kialakulását eredményezik. EBV fertőzések őssejt-transzplantáltakban: klinikum,... A vírus DNS-e több, mint egy replikációs origóval rendelkezik (11). A genomban mintegy 40 konzervált gén található. Ezek fehérje termékei a replikáció, a processzálás, a csomagolás folyamataiban, a kapszid felépítésében és a víruspartikulumok sejtbe bejutásában játszanak szerepet (11). (2. ábra) Az EBV replikációs ciklusa Az Epstein-Barr vírus életciklusában a többi herpesvírushoz hasonlóan megkülönböztethetünk egymástól lítikus és látens fázist. A lítikus fázisban a vírus elsősorban a nyugalmi állapotban lévő B-lymphocytákat fertőzi meg, de receptorait cervicalis epithel sejteken, T-sejteken, T0 sejteken, oropharyngealis epithel sejteken és a nyálban talált laphámsejteken is ki tudták már mutatni (14). Látens fázisban a vírus nincs fertőző állapotban, de bármikor aktiválódhat. Az emberi szervezetbe bejutva akár egy virion is képes fertőzést okozni (6). A vírus-gazdasejt kapcsolódás során a vírus gp350/220 glikoproteinje kapcsolódik a sejtek virális CD21 receptoraihoz (10). A vírus a gazdasejtbe a burok és a cytoplasma-membrán fúziója után kerül be, miután a burokfehérjék segítségével a sejtfelszíni receptorokhoz abszorbeálódott. A vírusgenom a víruson belül lineáris formában található, majd a gazdasejtbe jutás után a sejtmagba kerülve episomalis (cirkuláris) alakot vesz fel. Általában az EBV DNS az episzómában perzisztál, de néha rekombinálódik a humán genommal és egy-, vagy több kromoszóma-integrációt hoz létre. Ha a fertőzött sejt ebben a stádiumban malignus transzformáción esik át, akkor a róla transzformálódó sejtek ugyanazt az egyedi episomalis struktúrát fogják tartalmazni, így az EBV genomstruktúrája egyben tumor-markerré is válik (6). A nucleocapsid a sejtmagba transzportálódik, majd a tegument fehérjéi megváltoztatják a sejt metabolizmusát. A sejtmagban megkezdődik az azonnali korai (intermediate early, IE) gének expressziója melyek szabályozzák a korai (early, E) gének transzkripcióját. Ezek a DNS replikációhoz szükséges gének, gazdasejt metabolizmusát megváltoztató enzimek és proteinek. A késői (late, L) gének elsősorban a vírus struktúrfehérjéit fejezik ki. A sejtmagban a virális nukleinsav az éretlen kapszidba csomagolódik, és így hagyja el a sejtmagot. Ezt követően a virion további érési folyamatokon esik át és exocytosissal jut a következő sejtbe (13). A primer fertőzést követő replikáció az epithelialis sejtekben zajlik le (16). A replikáció következtében az utódvírusok bejutnak a lymphoid szövetekben megtalálható naiv B-sejtekbe (14). Az EBV ekkor antigén stimulációt utánoz, így transzformációra és szaporodásra bírja a B-lymphocytákat. Mindez a memória B-sejtek létrejöttét segíti elő. Ezek a sejtek a fertőzés után a szervezetben, látens állapotban perzisztálnak (6,12). A fertőzött sejt homeostasisa megegyezik az egészséges B-sejtekével (14). A reaktiválódást különböző vegyszerek, immunglobulinok indítják be. Ekkor az ún. ZEBRA (Z, EB 17
18 Replication Activator) génről fehérje expresszálódik, az így képződő protein beindítja a replikáció folyamatát és így más IE fehérjék (pl. DNS polimeráz és a timidin kináz) átírását (16). Az immunrendszer a vírusfertőzésre gyorsan reagál. Az EBV aktív replikációja során expresszálódó vírusfehérjék jó célpontot nyújtanak a cytotoxicus T-sejtek és az NK sejtek számára. Így a primer infekció erős immunválaszt vált ki, melynek következtében a fertőzött sejteket az immunrendszer eliminálja. Ezt követően a vírus a memória B-sejtekben látens állapotban található meg, és a testi fehérjékhez hasonló, kevés vírusfehérjét termelve rejtőzik el az immunrendszer elől (14). Minden fertőzött sejt kb. 2-5 intakt, látens állapotban lévő vírust tartalmaz (8). A látens állapotból a vírus reaktiválódhat és viszszatérhet a lítikus fertőzőképes fázisba. Lítikus fázisban a vírus csak akkor kettőződik meg, ha a gazdasejt is kettéosztódik. Ilyenkor 6 nukleáris gén (EBNA-1, EBNA-2, EBNA-3A, EBNA-3B, EBNA-3C, EBNA-LP), három látens membrán protein (LMP-1, LMP-2A, LMP-2B), a genomban kódolt kis RNS-ek (EBV nukleáris antigén 1 és 2; EBER1, EBER2), valamint a BART gének expresszálódnak. A különböző virális génexpressziós mintázat alapján három látencia típus különíthető el (6,18). Az Burkitt-lymphomára az I. latencia típus jellemző. A vírus genomjáról csak az EBNA-1 és EBER1, EBER2 transzkriptumok íródnak át. A II. típus a Hodgkin-lymphomára, perifériás T-sejtes lymphomára és nasopharyngelais carcinomara jellemző. A vírus genomjáról az EBER proteineken kívül az EBNA-1, EBV fertőzések őssejt-transzplantáltakban: klinikum,... LMP-1 és LMP-2 fehérjék expresszálódnak. A III. típus a fertőző mononucleosisra és a lymphoproliferativ megbetegedésekre jellemző. Ebben az esetben minden nuclearis gén, látens membránprotein és az EBER fehérjék is átíródnak (3. ábra). Míg az I- és II. típusban kevés gén expresszálódik, a fertőzött sejtek kikerülik a cytotoxicus T-sejteket és így a szervezet immunválaszát, addig a III. típusnál a jelentős génexpresszió miatt ez nem lehetséges, ezért a vírus gyorsan eliminálódik a szervezetből (18), (3. ábra). Az EBV epidemiológiája Az EBV a Földön mindenhol jelen van, a teljes felnőtt populáció mintegy 90%-ában kimutatható vírusellenes antitest. A vírus által okozott fertőzés infekciozitási indexe magas, kontagiozitási indexe alacsony. A fertőzés szezonális ingadozást nem mutat (14). Az EBV nyállal történő ürítését az egészséges felnőttek 15-20%-ában, az immunkompromittált betegek 50-90%- ában mutatták ki (16). Az EBV-nek két altípusa, az EBV-1 és EBV-2 különíthető el egymástól. Közöttük biológiai, geográfiai és etnikai különbségek egyaránt megfigyelhetőek. Genetikailag a vírus látens ciklusában expresszálódó EBNA-2, EBNA-3A, EBNA-3B és EBNA-3C vírusfehérjéket kódoló szekvencia szakaszokban különböznek egymástól. Emellett a B-lymphocytákra ható transzformációs hatásban is eltérnek (14,16). Az EBV-1 fertőzés leggyakrabban Nyugat-Európában, EBV-2 fertőzés Afrikában fordul elő, míg mindkét típus egyforma mértékben található meg az amerikai kontinensen (16). Emellett EBV-2-vel 3. ábra: Lineáris EBV genomról a három latenciatípus esetében expresszálódó gének. Az egyes promóterek átírásának irányát és elhelyezkedését a nyilak jelzik. A kódoló exonokat fekete-, a nem kódolókat üres nyilak ábrázolják. Az alternatív splicing folyamán kivágódó szakaszokat a vékony vonalak jelölik (17) 18
19 történt nagyobb arányú fertőződést figyeltek meg homoszexuális férfiakban. Mindkét típussal való találkozás során lehetséges felülfertőződés, amely esetben ismételten mononucleosis alakulhat ki (8). A vírus által okozott tünetek súlyosságát befolyásolja az anyatejes táplálás. A valószínűleg maternalis eredetű ellenanyagoknak köszönhetően fiatal korban a fertőzés enyhébb légúti tünetekkel jár, amelyek az életkor előrehaladtával egyre súlyosbodnak (14). A fertőződés nagyban függ az életkörülményektől, a demográfiai valamint a higiéniai viszonyoktól. A fejlődő országokban a gyermekek már életük korai szakaszában megfertőződnek a vírussal. Fertőzésre hajla mosító tényezőnek számít még a sokgyermekes család, több generáció együttélése, illetve ha a szülők előre megrágják az ételt gyermekük számára (14). A fejlettebb országokban a fertőződés leginkább idősebb korban jellemző. Az Amerikai Egyesült Államokban az 5 éves gyermekek 45%-a mutat csak szeropozitivitást (14). Hazánkban a 6 éven aluli korosztály átfertőzöttsége 66%, azonban a 14 éves korosztályban ez a szám már a 91%-ot is elérheti (5). A 60 év felettieknél az átfertőzöttség aránya 90-97%-ot tesz ki (15). Az Epstein-Barr vírus okozta fertőzés fertőző forrása a beteg vagy a vírust hordozó tünetmentes ember. A vírus az emberi szervezetbe leggyakrabban az orr-garat nyálkahártyáján keresztül jut be, de a fertőzés terjedhet orálisan, nyállal, csontvelő-, szervtranszplantációval, transzfúzióval vagy szexuális úton is. A fertőzés elsősorban a B-lymphocytákat érinti, de az oropharynx, parotis és méhnyak epithelialis sejtjei is érintettek lehetnek (6,13,14,16). Anya fertőzheti magzatát, ennek ellenére a congenitalis fertőződés primer infekciónál nagyon ritka (14). A vírus az anyatejben kiválasztódik (6). Az akut infekciót a virális kapszid antigén (VCA) elleni IgM osztályú antitestek jelenléte jelzi, amelyek a fertőzés lezajlását követő 4-6 hét múlva eltűnnek a szervezetből. Az infekció 2-4 hetében jelennek meg az élethosszig kimutatható VCA IgG osztályú antitestek. Az EBNA-val szembeni antitestek a fertőzést követő 2-4 hónappal jelennek meg és élethosszig perzisztálnak (19). (4. ábra) EBV fertőzések őssejt-transzplantáltakban: klinikum,... A fertőzés lezajlását követően a vírusürítés hónapokig fennáll, majd folyamatosan csökken. A betegség kiállása tartós immunitást eredményez, az ismételt megbetegedés ritka, a vírus reaktiválódása azonban bármely életszakaszban (terhesség, stressz) bekövetkezhet (6), de tünetek egészséges egyének esetén nem csak az immunkompromittált betegeknél figyelhetőek meg (16). Laboratóriumi diagnosztika Az EBV jelenlétét a szervezetben tradicionális labordiagnosztikai módszerekkel nem lehet kimutatni, mert nem jól replikálódik sejttenyészeten és nem mutat cytopathiás hatást (8). A molekuláris módszerek elterjedése előtt az EBV jelenlétét vírusizolálással mutatták ki. A laboratóriumi mintákat EBV mentes köldökzsinórvér lymphocytákra oltották, és a sejtekből a fertőzés következtében kialakuló halhatatlan, állandóan növő sejtsorokat vizsgálták (8). Immunkompetensek EBV infekciójának rutin laboratóriumi diagnosztikája elsősorban szerológiával és gyorstesztekkel történik (4. ábra). Az EBV szerológiája a VCA és az EBNA proteinekkel szemben kialakuló antitestek vizsgálatán alapul. A fertőzés alatti és utáni savópárok összehasonlító vizsgálata nem alkalmas a jelenlegi- és a korábbi fertőzések elkülönítésére, mivel a szervezet antitest mintázata a tünetek eltűnéséig nem stabil (18). Ezzel a módszerrel csak a VCA IgM, VCA IgG és EBNA antitestek együttes vizsgálatával állítható fel a pontos laboratóriumi diagnózis, amit az alábbi folyamatábra szemléltet (5. ábra). A diagnosztikában használt gyorstesztek VCA és EBNA antigéneket, valamint heterofil antitesteket (HA) mutatnak ki egy időben (16). VCA IgM Negatív EBV VCA IgM és EBV VCA IgG EBV szerológia VCA IgM Pozitív Negatív EBNA IgG Pozitív Ellenanyag mennyiség VCA IgG elvégzése Pozitív - Régebben lezajlott fertőzés Negatív - Nincs infekció VCA IgG elvégzése Pozitív - Régebben fennálló fertőzés Negatív - Friss fertőzés VCA IgM és VCA IgG vizsgálata szükséges, valószínűsíthető akut fertőzés miatt Korábban lezajlott infekció 4. ábra: Az EBV fertőzést követően a szervezetben megjelenő ellenanyagok 5. ábra: Az EBV szerológia működési elve és a kapott eredmények értékelése 19
20 Sérült humoralis immunitás esetén (beleértve az allogén őssejt-transzplantáltakat is) az elégtelen antitest válasz miatt a szerológiai vizsgálat félrevezető lehet, az EBV infekció diagnosztikájában nem használható (6). Ilyenkor a vírus direkt kimutatásán alapuló tesztek javasoltak. Legelterjedtebb a mennyiségi PCR vizsgálat, mely gyors, érzékeny és nagy specificitású. A vírus a reaktiváció során a teljes vérből, a szérumból és a plazmából egyaránt kimutatható. A rutin diagnosztikában főleg a plazmából mutatjuk ki az EBV-DNS-t, mivel a fehérvérsejtekben perzisztáló vírus reaktiváció nélkül is pozitív eredményt adhat. Idegen donoros (allogén) őssejt-transzplantáltakban a transzplantáció után 3 hónapig javasolt heti rendszerességű real-time kvantitatív EBV PCR szűrés, melynek segítségével a vírus-reaktiváció korán detektálható. Ezen túl a vizsgálat alkalmas lehet EBV-betegségben a terápiás válasz monitorozására (3,6,7). Az őssejt-transzplantációt követően az EBV okozta lymphoproliferatív betegség diagnosztikájában kiemelt szerepe van a szövettani mintavételnek. A biopsziás minták virális nukleinsav tartalmának kimutatására az EBER in situ hibridizáció a gold standard eljárás. A paraffinba ágyazott mintákban a látens és lítikus fázisban expresszálódó géneket egyaránt ki lehet mutatni (3,6). Patogenezis EBV fertőzés során a kórokozók a CD21 fehérjék segítségével jutnak be gazdasejtjeikbe, a B-lymphocytákba és a nyálkahártyák basalis epithelsejtjeibe. A szervezetben lítikus és látens fertőzés egyaránt zajlik, melyek a kiváltott immunválasszal együtt határozzák meg a klinikai képet. Ép immunitásúakban magától gyógyuló lymphoproliferativ betegség zajlik: a fertőzött B-lymphocytákat és epithelialis sejteket az immunrendszer cytotoxicus T-sejtjei eliminálják. Az általános citokin hatások mellett a fertőzött sejtek pusztulását övező gyulladásos reakció vezet a jellegzetes, mononucleosis infectiosában látható képhez: láz, tonsillitis confluáló lepedékkel, nyirokcsomó-megnagyobbodás, máj- és lépmegnagyobbodás. Az akut betegség lezajlása után életre szóló látens vírusfertőzés alakul ki: a kórokozó kevés vírusfehérjét termel és expresszál, így rejtőzködik az immunrendszer elől. A látensen fertőzött gazdasejtek időnként aktiválódhatnak, vírusfehérjék termelődhetnek, melyeket azonban az immunrendszer eliminál. Allogén őssejt-transzplantáció alatt az EBV infekciót legtöbbször az őssejtekkel együtt beadott, látensen fertőzött B-lymphocyták okozzák (reaktiváció útján); primer infekció ritkábban fordul elő. A transzplantációt követően 3-6 hónapon keresztül súlyos T-sejt hiánnyal (CD4+ T-sejt <200/μl) kell számolni, ráadásul a betegek a graft-versus-host betegség (GvHD) megelőzésére T-sejt szuppresszióban részesülnek. A reaktiválódó vírus immortalizálja és klonális expanzióra készteti a B-sejteket, melyeket a súlyosan károsodott cellularis immunitás nem képes megfékezni, és kialakul az úgynevezett EBV fertőzések őssejt-transzplantáltakban: klinikum,... poszttranszplantációs lymphoproliferatív betegség (PTLD). Kezdetben poliklonális B-sejt szaporulat látható mely könnyen transzformálódhat monoklonális (egy malignus klón), illetve biklonális (két malignus klón) betegséggé. A malignitás a nyirokszerveken kívül megjelenhet a gastrointestinalis traktusban (mucosában), a parenchymás szervekben és a központi idegrendszerben is. A PTLD szerv-transzplantáltakban is ismert. Különbség azonban, hogy rendszerint később (általában egy éven belül, de akár évekkel a transzplantáció után) jelentkezik, oka pedig a tartós T-sejt szuppresszió (rejekció profilaxis). Az átültetett szerv érintett a legtöbbször, melynek oka a gyengébb lokális immunválasz lehet. A prognózis kedvezőbb, mint az őssejt-transzplantáltaknál. Klinikum Az őssejt-transzplantáltak EBV fertőzéseiben változatos klinikai képet láthatunk. Előfordul tünetmentes fertőzés: a vérből kimutatható ugyan a vírus, de betegséget nem okoz. Tünetes EBV infekcióban általános, mononucleosis-szerű képet (láz, lymphadenopathia, tonsillitis, hepatosplenomegalia) figyelhető meg, emellett gyakori a fogyás, fáradékonyság és a szerv-specifikus tünetek (máj: májelégtelenség; tüdő: légzési elégtelenség; gastrointestinalis rendszer: vérzés; központi idegrendszer: epilepsia, encephalopathia). A hilaris lymphadenopathia légzészavarhoz, a hasi lymphadenopathia epeúti obstrukcióhoz vezethet. Jellemző laboratóriumi eltérés az emelkedett LDH, de gyakori a máj-nekroenzimek és a CRP emelkedése, a magas immunglobulin szint (fokozott termelés az aktivált B-sejtekben). Előrehaladott betegségben pancytopenia, emelkedő húgysav szint látható. Képalkotó vizsgálatokkal (mellkas CT, hasi CT vagy ultrahang) mediastinalis, hilaris, hasi lymphadenopathia, valamint a fokális szervi érintettség ábrázolódhat. Malignitás esetén PET-CT jöhet szóba állapotfelmérés céljából. Őssejt-transzplantáltakban a PTLD legtöbbször 1-3 hónappal a transzplantáció után jelentkezik. A T-sejtes immunrekonstitúciót követően rendszerint spontán gyógyuló, jó prognózisú primer infekcióra, valamint az ép immunitásúakra jellemző mononucleosisnak megfelelő lefolyásra számíthatunk. A PTLD diagnózisa a klinikumon és az EBV kimutatásán alapul. Valószínűsíthető EBV betegségről beszélünk, amennyiben a megfelelő klinikai tünetek (lymphadenopathia, hepatosplenomegalia, vagy szervi manifesztációk) mellett EBV detektálható a vérben. Bizonyított a betegség, ha a fentiek mellett biopsziával vagy invazív mintavétellel nyert mintából is kimutatható a vírus (17). Terápia Míg az EBV betegség ép immunitásúakban spontán gyógyuló kórkép, addig őssejt-transzplantáltakban gyakran fatális kimenetellel, magas mortalitással kell 20
Herpes Vírus fertőzések. A Herpes Vírus csoportnak 8 tagja van
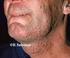 Herpes Vírus fertőzések A Herpes Vírus csoportnak 8 tagja van Herpes Simplex Vírus (HSV) A herpes vírus csoport tagjai DNS vírusok A vírus ikozaeder alakú (12 oldal) A kapsid 162 kapsomerből áll, melyet
Herpes Vírus fertőzések A Herpes Vírus csoportnak 8 tagja van Herpes Simplex Vírus (HSV) A herpes vírus csoport tagjai DNS vírusok A vírus ikozaeder alakú (12 oldal) A kapsid 162 kapsomerből áll, melyet
Általános tulajdonságok
 Herpesvírusok Általános tulajdonságok Herpesviridae család >100 faj fertőzi a gerinceseket burkos dsdns vírus burok a gazdasejt magmembránjából származik tegumentum (matrix proteinek) nucleocapsid (DNS
Herpesvírusok Általános tulajdonságok Herpesviridae család >100 faj fertőzi a gerinceseket burkos dsdns vírus burok a gazdasejt magmembránjából származik tegumentum (matrix proteinek) nucleocapsid (DNS
Herpesvírusok. A herpeszvírus fertőzések általános jellemzői. Herpes simplex vírusok (HSV-1, HSV-2) Herpes simplex vírusok (HSV-1, HSV-2)
 Általános tulajdonságok Herpesvírusok Herpesviridae család >100 faj fertőzi a gerinceseket burkos dsdns vírus burok a gazdasejt magmembránjából származik tegumentum (matrix proteinek) nucleocapsid (DNS
Általános tulajdonságok Herpesvírusok Herpesviridae család >100 faj fertőzi a gerinceseket burkos dsdns vírus burok a gazdasejt magmembránjából származik tegumentum (matrix proteinek) nucleocapsid (DNS
Általános tulajdonságok
 Herpesvírusok Általános tulajdonságok Herpesviridae család >100 faj fertőzi a gerinceseket burkos dsdns vírus burok a gazdasejt magmembránjából származik tegumentum (matrix proteinek) nucleocapsid (DNS
Herpesvírusok Általános tulajdonságok Herpesviridae család >100 faj fertőzi a gerinceseket burkos dsdns vírus burok a gazdasejt magmembránjából származik tegumentum (matrix proteinek) nucleocapsid (DNS
Vírusok Szerk.: Vizkievicz András
 Vírusok Szerk.: Vizkievicz András A vírusok az élő- és az élettelen világ határán állnak. Önmagukban semmilyen életjelenséget nem mutatnak, nincs anyagcseréjük, önálló szaporodásra képtelenek. Paraziták.
Vírusok Szerk.: Vizkievicz András A vírusok az élő- és az élettelen világ határán állnak. Önmagukban semmilyen életjelenséget nem mutatnak, nincs anyagcseréjük, önálló szaporodásra képtelenek. Paraziták.
HUMAN IMMUNODEFICIENCY VIRUS (HIV) ÉS AIDS
 HUMAN IMMUNODEFICIENCY VIRUS (HIV) ÉS AIDS Dr. Mohamed Mahdi MD. MPH. Department of Infectology and Pediatric Immunology University of Debrecen 2010 Történelmi tények a HIV-ről 1981: Első megjelenés San
HUMAN IMMUNODEFICIENCY VIRUS (HIV) ÉS AIDS Dr. Mohamed Mahdi MD. MPH. Department of Infectology and Pediatric Immunology University of Debrecen 2010 Történelmi tények a HIV-ről 1981: Első megjelenés San
December 1. az AIDS világnapja. 1th December is the World AIDS Day. Dr. Forrai Judit
 December 1. az AIDS világnapja 1th December is the World AIDS Day forrai.judit@med.semmelweis-univ.hu Semmelweis Egyetem Népegészségtani Intézet Initially submitted November 15, 2013; accepted for publication
December 1. az AIDS világnapja 1th December is the World AIDS Day forrai.judit@med.semmelweis-univ.hu Semmelweis Egyetem Népegészségtani Intézet Initially submitted November 15, 2013; accepted for publication
3. Kombinált, amelynek van helikális és kubikális szakasza, pl. a bakteriofágok és egyes rákkeltő RNS vírusok.
 Vírusok Szerkesztette: Vizkievicz András A XIX. sz. végén Dmitrij Ivanovszkij orosz biológus a dohány mozaikosodásának kórokozóját próbálta kimutatni. A mozaikosodás a levél foltokban jelentkező sárgulása.
Vírusok Szerkesztette: Vizkievicz András A XIX. sz. végén Dmitrij Ivanovszkij orosz biológus a dohány mozaikosodásának kórokozóját próbálta kimutatni. A mozaikosodás a levél foltokban jelentkező sárgulása.
Ismerni életmentô, oltani ajánlott!
 Ismerni életmentô, oltani ajánlott! Széleskörû védelem a meningococcus betegség ellen Már 2 hónapos kortól Minden korosztálynak. A meningococcus baktérium leggyakoribb, betegséget okozó típusai ellen.
Ismerni életmentô, oltani ajánlott! Széleskörû védelem a meningococcus betegség ellen Már 2 hónapos kortól Minden korosztálynak. A meningococcus baktérium leggyakoribb, betegséget okozó típusai ellen.
22. évfolyam 8. szám 2015. február 27. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT
 22. évfolyam 8. szám 2015. február 27. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo Kanyarójárvány az Egyesült Államokban, 2014-2015 77 Tájékoztatás engedélyezett fertőtlenítőszerekről 83 Fertőző betegségek
22. évfolyam 8. szám 2015. február 27. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo Kanyarójárvány az Egyesült Államokban, 2014-2015 77 Tájékoztatás engedélyezett fertőtlenítőszerekről 83 Fertőző betegségek
a NAT-1-1678/2012 nyilvántartási számú akkreditált státuszhoz
 Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a NAT-1-1678/2012 nyilvántartási számú akkreditált státuszhoz Az Országos Epidemiológiai Központ Bakteriológiai Mikológiai Parazitológiai és Tipizáló fõosztály
Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a NAT-1-1678/2012 nyilvántartási számú akkreditált státuszhoz Az Országos Epidemiológiai Központ Bakteriológiai Mikológiai Parazitológiai és Tipizáló fõosztály
40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban).
 1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
9. Ävfolyam 15. szåm 2002. Åprilis 19.
 9. Ävfolyam 5. szåm 2002. Åprilis 9. A NÄpegÄszsÄgÇgyi TudomÅnyos TÅrsasÅg felhévåsa Candidasis: napjaink problämåja? TÅjÄkoztatÅs a szakmai rendezvänyekről Fertőző betegsägek adatai AerobiolÖgiai jelentäs
9. Ävfolyam 5. szåm 2002. Åprilis 9. A NÄpegÄszsÄgÇgyi TudomÅnyos TÅrsasÅg felhévåsa Candidasis: napjaink problämåja? TÅjÄkoztatÅs a szakmai rendezvänyekről Fertőző betegsägek adatai AerobiolÖgiai jelentäs
Vakcinák 2011. / 9. Immunológiai és Biotechnológiai Intézet PTE KK
 Vakcinák 2011. / 9 Immunológiai és Biotechnológiai Intézet PTE KK Bevezetés Fertőzéses megbetegedések elleni küzdelem Himlő, diphteria, tetanus, poliomyelitis, kanyaró, szamárköhögés, mumpsz, rubeola A
Vakcinák 2011. / 9 Immunológiai és Biotechnológiai Intézet PTE KK Bevezetés Fertőzéses megbetegedések elleni küzdelem Himlő, diphteria, tetanus, poliomyelitis, kanyaró, szamárköhögés, mumpsz, rubeola A
Cutan humán papillomavírus fertôzés (verruca vulgaris, -plana, -filiformis) gyermekekben
 BÔRGYÓGYÁSZATI ÉS VENEROLÓGIAI SZEMLE 2012 88. ÉVF. 1. 46 50. DOI 107188/bvsz.2012.88.2.2 Cutan humán papillomavírus fertôzés (verruca vulgaris, -plana, -filiformis) gyermekekben Cutan human papillomavirus
BÔRGYÓGYÁSZATI ÉS VENEROLÓGIAI SZEMLE 2012 88. ÉVF. 1. 46 50. DOI 107188/bvsz.2012.88.2.2 Cutan humán papillomavírus fertôzés (verruca vulgaris, -plana, -filiformis) gyermekekben Cutan human papillomavirus
IgE mediált allergiák diagnosztikája - áttekintés
 IgE mediált allergiák diagnosztikája - áttekintés Szabó Zsófia MH-EK Honvédkórház, KLDO, Klinikai Immunológiai Részleg MIT-MAKIT Allergiák Laboratóriumi Diagnosztikája, 2015.04.22. Allergia vizsgálat jelentősége
IgE mediált allergiák diagnosztikája - áttekintés Szabó Zsófia MH-EK Honvédkórház, KLDO, Klinikai Immunológiai Részleg MIT-MAKIT Allergiák Laboratóriumi Diagnosztikája, 2015.04.22. Allergia vizsgálat jelentősége
Tyúk vagy tojás? Pék Tamás 2014.12.04.
 Tyúk vagy tojás? Pék Tamás 2014.12.04. terápia: Augmentin, Normaflore 12 éves fiú Panaszok megelőzően betegsége nem volt felvételét megelőzően 5 nappal belázasodott, 2 napig volt lázas fejfájás (kezdetben
Tyúk vagy tojás? Pék Tamás 2014.12.04. terápia: Augmentin, Normaflore 12 éves fiú Panaszok megelőzően betegsége nem volt felvételét megelőzően 5 nappal belázasodott, 2 napig volt lázas fejfájás (kezdetben
Herpesvírus fertőzések klinikuma és terápiája
 Herpesvírus fertőzések klinikuma és terápiája Dr.med. Fekete Gy. László egyetemi adjunktus OGYE, Marosvásárhely Human Herpesvírusok Herpesvírusok családja több, mint 1OO vírust foglal magába, amelyek különböző
Herpesvírus fertőzések klinikuma és terápiája Dr.med. Fekete Gy. László egyetemi adjunktus OGYE, Marosvásárhely Human Herpesvírusok Herpesvírusok családja több, mint 1OO vírust foglal magába, amelyek különböző
AJÁNLÁSOK A KULLANCSCSÍPÉS ÉS A KULLANCS ÁLTAL TERJESZTETT FERTÕZÉSEK ELLÁTÁSÁHOZ
 HÁZIORVOS TOVÁBBKÉPZÕ SZEMLE 2008; 13: 5. AJÁNLÁSOK A KULLANCSCSÍPÉS ÉS A KULLANCS ÁLTAL TERJESZTETT FERTÕZÉSEK ELLÁTÁSÁHOZ Lakos András dr. Kullancsbetegségek Ambulanciája, Budapest A Kullancsbetegségek
HÁZIORVOS TOVÁBBKÉPZÕ SZEMLE 2008; 13: 5. AJÁNLÁSOK A KULLANCSCSÍPÉS ÉS A KULLANCS ÁLTAL TERJESZTETT FERTÕZÉSEK ELLÁTÁSÁHOZ Lakos András dr. Kullancsbetegségek Ambulanciája, Budapest A Kullancsbetegségek
CMV-IgM-ELA Test PKS medac. Magyar 110-PKS-VPU/010512
 CMVIgMELA Test PKS medac Magyar 0123 110PKSVPU/010512 GYÁRTÓ medac Gesellschaft für klinische Spezialpräparate mbh Fehlandtstraße 3 D20354 Hamburg FORGALMAZÓ medac Gesellschaft für klinische Spezialpräparate
CMVIgMELA Test PKS medac Magyar 0123 110PKSVPU/010512 GYÁRTÓ medac Gesellschaft für klinische Spezialpräparate mbh Fehlandtstraße 3 D20354 Hamburg FORGALMAZÓ medac Gesellschaft für klinische Spezialpräparate
A vizsgálatok árai tartalmazzák a mintavevőt és a szakmai konzultáció lehetőségét. Az egészségügyi szolgáltatás tárgyi adómentes.
 Bakteriológiai vizsgálatok (tenyésztés, szerológia) Felső légúti váladék (orr-, torok-, külsőfül-, középfülváladék, nasopharyngealis váladék) aerob kórokozó baktérium és gomba tenyésztése, identifikálás,
Bakteriológiai vizsgálatok (tenyésztés, szerológia) Felső légúti váladék (orr-, torok-, külsőfül-, középfülváladék, nasopharyngealis váladék) aerob kórokozó baktérium és gomba tenyésztése, identifikálás,
AZ IMMUNRENDSZER VÁLASZAI A HPV FERTŐZÉSSEL KAPCSOLATOS KÉRDÉSEINKRE RAJNAVÖLGYI ÉVA DE OEC Immunológiai Intézet
 AZ IMMUNRENDSZER VÁLASZAI A HPV FERTŐZÉSSEL KAPCSOLATOS KÉRDÉSEINKRE RAJNAVÖLGYI ÉVA DE OEC Immunológiai Intézet A méhnyak rák előfordulása / év / 100 000 nő WHO 2005 A KÓROKOZÓK ÉS AZ IMMUNRENDSZER KÉTIRÁNYÚ
AZ IMMUNRENDSZER VÁLASZAI A HPV FERTŐZÉSSEL KAPCSOLATOS KÉRDÉSEINKRE RAJNAVÖLGYI ÉVA DE OEC Immunológiai Intézet A méhnyak rák előfordulása / év / 100 000 nő WHO 2005 A KÓROKOZÓK ÉS AZ IMMUNRENDSZER KÉTIRÁNYÚ
1. Milyen típusú gyógyszer az FSME-IMMUN 0,5 ml felnotteknek vakcina és milyen célra alkalmazható?
 Generated by Unregistered Batch DOC TO PDF Converter 2011.3.827.1514, please register! 4. sz. melléklete az OGYI-T-20063/01-02 Forgalomba hozatali engedélynek Budapest, 2006.február 23. Szám: 19340/41/05
Generated by Unregistered Batch DOC TO PDF Converter 2011.3.827.1514, please register! 4. sz. melléklete az OGYI-T-20063/01-02 Forgalomba hozatali engedélynek Budapest, 2006.február 23. Szám: 19340/41/05
22. évfolyam 41. szám 2015. október 16. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT
 22. évfolyam 41. szám 2015. október 16. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo A nyugat-nílusi láz aktuális járványügyi helyzete Európában és Magyarországon 495 Fertőző betegségek adata 502 E p i d e m
22. évfolyam 41. szám 2015. október 16. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo A nyugat-nílusi láz aktuális járványügyi helyzete Európában és Magyarországon 495 Fertőző betegségek adata 502 E p i d e m
Az emberi 6-os herpeszvírus
 ÖSSZEFOGLALÓ REFERÁTUMOK Az emberi 6-os herpeszvírus ONGRÁDI JÓZSEF DR. 1 KÖVESDI VALÉRIA 1 MEDVECZKY G. PÉTER DR. 2 1 Semmelweis Egyetem, Általános Orvostudományi Kar, Közegészségtani Intézet, Budapest
ÖSSZEFOGLALÓ REFERÁTUMOK Az emberi 6-os herpeszvírus ONGRÁDI JÓZSEF DR. 1 KÖVESDI VALÉRIA 1 MEDVECZKY G. PÉTER DR. 2 1 Semmelweis Egyetem, Általános Orvostudományi Kar, Közegészségtani Intézet, Budapest
H1N1 influenzavírus kialakulása, pandémiák története, várható lefolyása, hatásai, következményei. Dr. Jankovics István
 H1N1 influenzavírus kialakulása, pandémiák története, várható lefolyása, hatásai, következményei Dr. Jankovics István 1 HUMÁN INLUENZA: háromféle megjelenési forma 2 AZ INFLUENZA VÍRUS TÖRTÉNETE 1900-as
H1N1 influenzavírus kialakulása, pandémiák története, várható lefolyása, hatásai, következményei Dr. Jankovics István 1 HUMÁN INLUENZA: háromféle megjelenési forma 2 AZ INFLUENZA VÍRUS TÖRTÉNETE 1900-as
Légzőszervi megbetegedések
 Orrmelléküreg-gyulladás (sinusitis) Légzőszervi megbetegedések Az orr melléküregeinek gyulladása, melyet leggyakrabban baktériumok okoznak. Orrnyálkahártya-gyulladás (rhinitis) Különböző típusú gyulladások
Orrmelléküreg-gyulladás (sinusitis) Légzőszervi megbetegedések Az orr melléküregeinek gyulladása, melyet leggyakrabban baktériumok okoznak. Orrnyálkahártya-gyulladás (rhinitis) Különböző típusú gyulladások
Lyme-kór (lyme-artritisz)
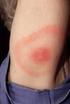 www.printo.it/pediatric-rheumatology/hu/intro Lyme-kór (lyme-artritisz) Verzió 2016 1. MI A LYME-KÓR 1.1 Mi ez? A Lyme-artritisz (Lyme-borreliózis) egyike a Borrelia burgdorferi baktérium által okozott
www.printo.it/pediatric-rheumatology/hu/intro Lyme-kór (lyme-artritisz) Verzió 2016 1. MI A LYME-KÓR 1.1 Mi ez? A Lyme-artritisz (Lyme-borreliózis) egyike a Borrelia burgdorferi baktérium által okozott
Reumás láz és sztreptokokkusz-fertőzés utáni reaktív artritisz
 www.printo.it/pediatric-rheumatology/hu/intro Reumás láz és sztreptokokkusz-fertőzés utáni reaktív artritisz Verzió 2016 1. MI A REUMÁS LÁZ 1.1 Mi ez? A reumás láz nevű betegséget a sztreptokokkusz baktérium
www.printo.it/pediatric-rheumatology/hu/intro Reumás láz és sztreptokokkusz-fertőzés utáni reaktív artritisz Verzió 2016 1. MI A REUMÁS LÁZ 1.1 Mi ez? A reumás láz nevű betegséget a sztreptokokkusz baktérium
23. évfolyam 5. szám 2016. február 12. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT
 23. évfolyam 5. szám 2016. február 12. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo Az OEK által szervezett mikrobiológiai körvizsgálatok 57 Tájékoztatás szakmai továbbképzéről 62 Fertőző betegségek adatai 64
23. évfolyam 5. szám 2016. február 12. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo Az OEK által szervezett mikrobiológiai körvizsgálatok 57 Tájékoztatás szakmai továbbképzéről 62 Fertőző betegségek adatai 64
NemzetkÇzi informåcié Poliomyelitis E.coli O157:H7 jårvåny SpanyolorszÅgban
 8. Ävfolyam 2. szåm 2001. januår 19. NemzetkÇzi informåcié Poliomyelitis E.coli O157:H7 jårvåny SpanyolorszÅgban TÅjÄkoztatÅs szakmai tovåbbkäpzäsről Fertőző betegsägek adatai Impresszum NEMZETKÄZI INFORMÅCIÇ
8. Ävfolyam 2. szåm 2001. januår 19. NemzetkÇzi informåcié Poliomyelitis E.coli O157:H7 jårvåny SpanyolorszÅgban TÅjÄkoztatÅs szakmai tovåbbkäpzäsről Fertőző betegsägek adatai Impresszum NEMZETKÄZI INFORMÅCIÇ
A szervezet immunválasza a vérátömlesztésre
 A szervezet immunválasza a vérátömlesztésre Prohászka Zoltán III. Sz. Belgyógyászati Klinika, Kutatólaboratórium Semmelweis Egyetem, Budapest prohoz@kut.sote.hu Transzfúziós Tanfolyam Szigorló Orvostanhallgatóknak
A szervezet immunválasza a vérátömlesztésre Prohászka Zoltán III. Sz. Belgyógyászati Klinika, Kutatólaboratórium Semmelweis Egyetem, Budapest prohoz@kut.sote.hu Transzfúziós Tanfolyam Szigorló Orvostanhallgatóknak
Henoch Schönlein Purpura
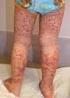 www.printo.it/pediatric-rheumatology/hu/intro Henoch Schönlein Purpura Verzió 2016 1. MI A HENOCH SCHÖNLEIN PURPURA 1.1 Mi ez? A Henoch Schönlein purpura (HSP) a nagyon kis erek (hajszálerek) gyulladásával
www.printo.it/pediatric-rheumatology/hu/intro Henoch Schönlein Purpura Verzió 2016 1. MI A HENOCH SCHÖNLEIN PURPURA 1.1 Mi ez? A Henoch Schönlein purpura (HSP) a nagyon kis erek (hajszálerek) gyulladásával
Molekuláris biológiai diagnosztika alkalmazása
 Molekuláris biológiai diagnosztika alkalmazása (HIV, HCV, HBV szabad vírus mennyiség meghatározás) a napi rutin diagnosztikában Reichenberger Anna Mária, Dr. Sárvári Csilla Dr. Ujhelyi Eszter Fıvárosi
Molekuláris biológiai diagnosztika alkalmazása (HIV, HCV, HBV szabad vírus mennyiség meghatározás) a napi rutin diagnosztikában Reichenberger Anna Mária, Dr. Sárvári Csilla Dr. Ujhelyi Eszter Fıvárosi
MIKR-MM-09 Változat: 06 Kiadva: 2013.03.20.
 1 Vizsgálat neve Mintavétel Mintavétel indikációja Mintavételi eszköz, Tárolás, szállítás Negatív eredmény Pozitív eredmény transzport eszköz és Baktérium Gomba Vírus Parazita Baktérium Gomba Vírus Parazita
1 Vizsgálat neve Mintavétel Mintavétel indikációja Mintavételi eszköz, Tárolás, szállítás Negatív eredmény Pozitív eredmény transzport eszköz és Baktérium Gomba Vírus Parazita Baktérium Gomba Vírus Parazita
17. évfolyam 7. szám 2010. február 26. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT
 7. évfolyam 7. szám 00. február 6. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo Anyatej útján közvetített sárgaláz megbetegedés Brazíliában 8 Tájékoztatás szakmai rendezvényről 8 Szerkesztőségi tájékoztatás
7. évfolyam 7. szám 00. február 6. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo Anyatej útján közvetített sárgaláz megbetegedés Brazíliában 8 Tájékoztatás szakmai rendezvényről 8 Szerkesztőségi tájékoztatás
21. évfolyam 21. szám 2014. május 30. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT
 21. évfolyam 21. szám 2014. május 30. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo Az OEK jelentése a 2014. április hónapban bejelentett fertőző betegségekről 237 Fertőző betegségek adatai 245 E p i d e m i
21. évfolyam 21. szám 2014. május 30. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo Az OEK jelentése a 2014. április hónapban bejelentett fertőző betegségekről 237 Fertőző betegségek adatai 245 E p i d e m i
GONDOLJUNK A LISZTÉRZÉKENYSÉGRE Néhány javaslat a betegség korai kimutatására
 GONDOLJUNK A LISZTÉRZÉKENYSÉGRE Néhány javaslat a betegség korai kimutatására www.lq-celiac.com LQ-CELIAC A LISZTÉRZÉKENY BETEGEK ÉLETMINŐSÉGÉNEK JAVÍTÁSA A SZLOVÉN-MAGYAR HATÁR MENTI TÉRSÉGBEN Az egészségügyi
GONDOLJUNK A LISZTÉRZÉKENYSÉGRE Néhány javaslat a betegség korai kimutatására www.lq-celiac.com LQ-CELIAC A LISZTÉRZÉKENY BETEGEK ÉLETMINŐSÉGÉNEK JAVÍTÁSA A SZLOVÉN-MAGYAR HATÁR MENTI TÉRSÉGBEN Az egészségügyi
14. évfolyam 14. szám 2007. április 13. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT
 14. évfolyam 14. szám 2007. április 13. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo Szerbiai kanyarójárvány 125 Mumpsz járvány Bulgáriában, 2007-ben 127 Fertőző betegségek adatai 128 Epidemiológiai Információs
14. évfolyam 14. szám 2007. április 13. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epinfo Szerbiai kanyarójárvány 125 Mumpsz járvány Bulgáriában, 2007-ben 127 Fertőző betegségek adatai 128 Epidemiológiai Információs
Kongenitális és perinatális vírusfertőzések korszerű mikrobiológiai diagnosztikája
 BŐRGYÓGYÁSZATI ÉS VENEROLÓGIAI SZEMLE 2018 94. ÉVF. 1. 31 35. DOI 10.7188/bvsz.2018.94.1.5 Kongenitális és perinatális vírusfertőzések korszerű mikrobiológiai diagnosztikája Modern laboratory diagnostics
BŐRGYÓGYÁSZATI ÉS VENEROLÓGIAI SZEMLE 2018 94. ÉVF. 1. 31 35. DOI 10.7188/bvsz.2018.94.1.5 Kongenitális és perinatális vírusfertőzések korszerű mikrobiológiai diagnosztikája Modern laboratory diagnostics
Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA)
 www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA) Verzió 2016 1. MI A GYERMEKKORI SPONDILARTRITISZ/ENTEZITISSZEL ÖSSZEFÜGGŐ ARTRITISZ
www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA) Verzió 2016 1. MI A GYERMEKKORI SPONDILARTRITISZ/ENTEZITISSZEL ÖSSZEFÜGGŐ ARTRITISZ
PARADIGMA VÁLTÁS AZ ASZTMA BRONCHIALE MEGÍTÉLÉSÉBEN ÉS KEZELÉSÉBEN. Dr. Kovács Lajos SE. I. sz. Gyermekklinika Budapest
 PARADIGMA VÁLTÁS AZ ASZTMA BRONCHIALE MEGÍTÉLÉSÉBEN ÉS KEZELÉSÉBEN Dr. Kovács Lajos SE. I. sz. Gyermekklinika Budapest ASZTMA GONDOZÁS SZEMPONTJAI Triggerek Aktuális tünetek Légzésfunkció KONTROLLÁLTSÁG
PARADIGMA VÁLTÁS AZ ASZTMA BRONCHIALE MEGÍTÉLÉSÉBEN ÉS KEZELÉSÉBEN Dr. Kovács Lajos SE. I. sz. Gyermekklinika Budapest ASZTMA GONDOZÁS SZEMPONTJAI Triggerek Aktuális tünetek Légzésfunkció KONTROLLÁLTSÁG
Rhinitis allergica elterjedésének vizsgálata hazánk gyermekpopulációjában 1999-2007 között
 Rhinitis allergica elterjedésének vizsgálata hazánk gyermekpopulációjában 1999-2007 között Ovárdics Andrea Alapismereti és Szakmódszertani Intézet, Kecskeméti Főiskola Tanítóképző Főiskolai Kar Összefoglalás:
Rhinitis allergica elterjedésének vizsgálata hazánk gyermekpopulációjában 1999-2007 között Ovárdics Andrea Alapismereti és Szakmódszertani Intézet, Kecskeméti Főiskola Tanítóképző Főiskolai Kar Összefoglalás:
DOKTORI ÉRTEKEZÉS TÉZISEI AZ OPPORTUNISTA HUMÁNPATOGÉN CANDIDA PARAPSILOSIS ÉLESZTŐGOMBA ELLENI TERMÉSZETES ÉS ADAPTÍV IMMUNVÁLASZ VIZSGÁLATA
 DOKTORI ÉRTEKEZÉS TÉZISEI AZ OPPORTUNISTA HUMÁNPATOGÉN CANDIDA PARAPSILOSIS ÉLESZTŐGOMBA ELLENI TERMÉSZETES ÉS ADAPTÍV IMMUNVÁLASZ VIZSGÁLATA TÓTH ADÉL TÉMAVEZETŐ: DR. GÁCSER ATTILA TUDOMÁNYOS FŐMUNKATÁRS
DOKTORI ÉRTEKEZÉS TÉZISEI AZ OPPORTUNISTA HUMÁNPATOGÉN CANDIDA PARAPSILOSIS ÉLESZTŐGOMBA ELLENI TERMÉSZETES ÉS ADAPTÍV IMMUNVÁLASZ VIZSGÁLATA TÓTH ADÉL TÉMAVEZETŐ: DR. GÁCSER ATTILA TUDOMÁNYOS FŐMUNKATÁRS
Paediatrics: introduction. Historical data.
 Paediatrics: introduction. Historical data. Dr. György Fekete Aim of the present lecture To demonstrate: - the wonderful nature of this discipline - the differences as compared to other medical activities,
Paediatrics: introduction. Historical data. Dr. György Fekete Aim of the present lecture To demonstrate: - the wonderful nature of this discipline - the differences as compared to other medical activities,
ált.bakteriológiai tenyésztés baktérium meghatározás és rezisztencia + gomba Ft 5 nap meghatározás
 Mintákból végzett bakteriológiai és mikológiai vizsgálatok Anus ált. bakteriológia + gonorrhoea 6 300 Ft 3-5 nap ált. bakteriológiai + N. gonorrhoea, rezisztencia Bőr (glans, vulva, stb..) 4 500 Ft 3 nap
Mintákból végzett bakteriológiai és mikológiai vizsgálatok Anus ált. bakteriológia + gonorrhoea 6 300 Ft 3-5 nap ált. bakteriológiai + N. gonorrhoea, rezisztencia Bőr (glans, vulva, stb..) 4 500 Ft 3 nap
Tartalomjegyzék FOCUS MEDICINAE. Felelős szerkesztő: Dr. Szolnoky Miklós. Bevezetés...2 /Introduction/ Dr. Jákó Kinga
 FOCUS MEDICINAE Felelős szerkesztő: Dr. Szolnoky Miklós Főszerkesztő: Dr. Karabélyos Csaba Szerkesztőbizottság: Dr. Bencsik Krisztina Prof. Czirják László Prof. Horváth Örs Péter Dr. Kalmár Ágnes Dr. Mátrai
FOCUS MEDICINAE Felelős szerkesztő: Dr. Szolnoky Miklós Főszerkesztő: Dr. Karabélyos Csaba Szerkesztőbizottság: Dr. Bencsik Krisztina Prof. Czirják László Prof. Horváth Örs Péter Dr. Kalmár Ágnes Dr. Mátrai
Válasz Prof. Dr. Szabó János opponensi bírálatára
 Válasz Prof. Dr. Szabó János opponensi bírálatára Szeretném megköszönni Szabó Professzor Úr véleményét, építő jellegű kritikáját és a doktori értekezés elfogadására tett javaslatát. A különböző témakörökkel
Válasz Prof. Dr. Szabó János opponensi bírálatára Szeretném megköszönni Szabó Professzor Úr véleményét, építő jellegű kritikáját és a doktori értekezés elfogadására tett javaslatát. A különböző témakörökkel
A sejtfelszíni FasL és szolubilis vezikulakötött FasL által indukált sejthalál gátlása és jellemzése
 A sejtfelszíni FasL és szolubilis vezikulakötött FasL által indukált sejthalál gátlása és jellemzése Doktori értekezés tézisei Hancz Anikó Témavezetők: Prof. Dr. Sármay Gabriella Dr. Koncz Gábor Biológia
A sejtfelszíni FasL és szolubilis vezikulakötött FasL által indukált sejthalál gátlása és jellemzése Doktori értekezés tézisei Hancz Anikó Témavezetők: Prof. Dr. Sármay Gabriella Dr. Koncz Gábor Biológia
Immunszupprimáltak, transzplantáltak és immunkompromittáltak infekciói. ORFI, 2016 Kádár János
 Immunszupprimáltak, transzplantáltak és immunkompromittáltak infekciói ORFI, 2016 Kádár János Kikről beszélünk malignitás (nem kontrollált) kemo/radioterápia haemopoieticus őssejt / solid szerv átültetés
Immunszupprimáltak, transzplantáltak és immunkompromittáltak infekciói ORFI, 2016 Kádár János Kikről beszélünk malignitás (nem kontrollált) kemo/radioterápia haemopoieticus őssejt / solid szerv átültetés
HUNGARIAN Immunisation for babies just after their first birthday. Védőoltások. Csecsemőknek közvetlenül első születésnapjuk után
 HUNGARIAN Immunisation for babies just after their first birthday Védőoltások Csecsemőknek közvetlenül első születésnapjuk után Bevezető Ez a tájékoztató a gyermekének közvetlenül az első születésnapja
HUNGARIAN Immunisation for babies just after their first birthday Védőoltások Csecsemőknek közvetlenül első születésnapjuk után Bevezető Ez a tájékoztató a gyermekének közvetlenül az első születésnapja
Ismeretlen eredetű tüdőgyulladás megjelenése a SARS kórokozó vírusának azonosítása nemzetközi összefogással
 BIOTECHNOLÓGIA AZ EGÉSZSÉGÜGYBEN Ismeretlen eredetű tüdőgyulladás megjelenése a SARS kórokozó vírusának azonosítása nemzetközi összefogással Tárgyszavak: SARS; vírus; koronavírus; vakcina; kutatás; vírusmutáció.
BIOTECHNOLÓGIA AZ EGÉSZSÉGÜGYBEN Ismeretlen eredetű tüdőgyulladás megjelenése a SARS kórokozó vírusának azonosítása nemzetközi összefogással Tárgyszavak: SARS; vírus; koronavírus; vakcina; kutatás; vírusmutáció.
AIDS Hiradó 11. évfolyam (1997)
 ó 11. évfolyam (1997) Cikk: 1. szám 32 olvasás 1. A 2. Az 4. Egy 5. Kontrollált 7. Egy 8. HIV/S perifériás vér CD8-pozitív T-sejtjeinek gyakori fertõzõdése HIV-vel S-szel asszociált Kaposi szarkómából
ó 11. évfolyam (1997) Cikk: 1. szám 32 olvasás 1. A 2. Az 4. Egy 5. Kontrollált 7. Egy 8. HIV/S perifériás vér CD8-pozitív T-sejtjeinek gyakori fertõzõdése HIV-vel S-szel asszociált Kaposi szarkómából
A DOHÁNYZÁS OKOZTA DNS KÁROSODÁSOK ÉS JAVÍTÁSUK VIZSGÁLATA EMBERI CUMULUS ÉS GRANULOSA SEJTEKBEN. Sinkó Ildikó PH.D.
 A DOHÁNYZÁS OKOZTA DNS KÁROSODÁSOK ÉS JAVÍTÁSUK VIZSGÁLATA EMBERI CUMULUS ÉS GRANULOSA SEJTEKBEN Sinkó Ildikó PH.D. ÉRTEKEZÉS TÉZISEI Témavezető: Dr. Raskó István Az értekezés a Szegedi Tudományegyetem
A DOHÁNYZÁS OKOZTA DNS KÁROSODÁSOK ÉS JAVÍTÁSUK VIZSGÁLATA EMBERI CUMULUS ÉS GRANULOSA SEJTEKBEN Sinkó Ildikó PH.D. ÉRTEKEZÉS TÉZISEI Témavezető: Dr. Raskó István Az értekezés a Szegedi Tudományegyetem
NŐI NEMISZERVEK PATHOLOGIÁJA
 NŐI NEMISZERVEK PATHOLOGIÁJA Vulvitis A vulva finom bőre és nyálkahártyája vulnerabilis számos nem specifikus fertőzésre és egyéb dermatológiai elváltozásokra. Intenzív viszkedés és az ezzel együtt járó
NŐI NEMISZERVEK PATHOLOGIÁJA Vulvitis A vulva finom bőre és nyálkahártyája vulnerabilis számos nem specifikus fertőzésre és egyéb dermatológiai elváltozásokra. Intenzív viszkedés és az ezzel együtt járó
A tényeket többé senki sem hagyhatja figyelmen kívül
 I. A tényeket többé senki sem hagyhatja figyelmen kívül A rák legyőzése - 1. kötet: Az elképzelhetetlen megvalósítható 1. tény: Az iparosodott világban a harmadik leggyakoribb halálozási ok a rák A 21.
I. A tényeket többé senki sem hagyhatja figyelmen kívül A rák legyőzése - 1. kötet: Az elképzelhetetlen megvalósítható 1. tény: Az iparosodott világban a harmadik leggyakoribb halálozási ok a rák A 21.
Népegészségügyi Szakigazgatási Szerve. Tájékoztató Hajdú-Bihar megye lakosságának egészségi állapotáról
 Népegészségügyi Szakigazgatási Szerve Tájékoztató Hajdú-Bihar megye lakosságának egészségi állapotáról T a r t a l o m j e g y z é k 1. BEVEZETÉS... 4 2. ADATFORRÁSOK... 4 3. ELEMZÉSI MÓDSZEREK... 4 4.
Népegészségügyi Szakigazgatási Szerve Tájékoztató Hajdú-Bihar megye lakosságának egészségi állapotáról T a r t a l o m j e g y z é k 1. BEVEZETÉS... 4 2. ADATFORRÁSOK... 4 3. ELEMZÉSI MÓDSZEREK... 4 4.
CMV IgG Avidity. Cytomegalovírus elleni IgG antitestek. Elecsys 2010 MODULAR ANALYTICS E170 cobas e 411 cobas e 602
 REF 05909708 190 100 teszt; 50 CMV IgG aviditás-meghatározásnak felel meg SYSTEM Elecsys 2010 MODULAR ANALYTICS E170 cobas e 411 cobas e 601 cobas e 602 Magyar Alkalmazás Immunkémiai vizsgálat a cytomegalovírus
REF 05909708 190 100 teszt; 50 CMV IgG aviditás-meghatározásnak felel meg SYSTEM Elecsys 2010 MODULAR ANALYTICS E170 cobas e 411 cobas e 601 cobas e 602 Magyar Alkalmazás Immunkémiai vizsgálat a cytomegalovírus
Bevezetés. 2. Rhinitises/asthmás betegek kiemelése 880 dolgozót (695 beköltözot és 185 oslakost) kérdoív alapján emeltem ki ipari populációból Pakson.
 Bevezetés Inhalatív úton a légutakba jutó anyagok sora eredményez az arra érzékeny szervezetben kóros, megváltozott és specifikus légúti rendellenességet. A légúti allergia globális egészségügyi problémát
Bevezetés Inhalatív úton a légutakba jutó anyagok sora eredményez az arra érzékeny szervezetben kóros, megváltozott és specifikus légúti rendellenességet. A légúti allergia globális egészségügyi problémát
TÅjÄkoztatÅs szakmai rendezvänyről Fertőző betegsägek adatai AerobiolÑgiai jelentäs (låsd: www.antsz.hu/oki/nekap/pollen)
 8. Ävfolyam 23. szåm 2001. jçnius 15. KrÉmi-kongÑi låz KoszovÑban TÅjÄkoztatÅs szakmai rendezvänyről Fertőző betegsägek adatai AerobiolÑgiai jelentäs (låsd: www.antsz.hu/oki/nekap/pollen) Impresszum NEMZETKÄZI
8. Ävfolyam 23. szåm 2001. jçnius 15. KrÉmi-kongÑi låz KoszovÑban TÅjÄkoztatÅs szakmai rendezvänyről Fertőző betegsägek adatai AerobiolÑgiai jelentäs (låsd: www.antsz.hu/oki/nekap/pollen) Impresszum NEMZETKÄZI
2004. 4. évfolyam 1. szám. Tartalom: A legionellózis diagnosztikája. A Lyme betegség laboratóriumi diagnosztikájáról
 2004. 4. évfolyam 1. szám Tartalom: A legionellózis diagnosztikája A Lyme betegség laboratóriumi diagnosztikájáról Mycoplasma pneumoniae és Chlamydia pneumoniae fertõzések szerodiagnosztikája A Bordetella
2004. 4. évfolyam 1. szám Tartalom: A legionellózis diagnosztikája A Lyme betegség laboratóriumi diagnosztikájáról Mycoplasma pneumoniae és Chlamydia pneumoniae fertõzések szerodiagnosztikája A Bordetella
Irányelv A heveny tonsillopharyngitis antimikróbás kezeléséhez
 Irányelv A heveny tonsillopharyngitis antimikróbás kezeléséhez Szerkesztette: Mészner Zsófia, Ludwig Endre Készítette: Infektológiai, Gyermekgyógyászati és a Fül-Orr-Gégészeti Szakmai Kollégium Bevezetés
Irányelv A heveny tonsillopharyngitis antimikróbás kezeléséhez Szerkesztette: Mészner Zsófia, Ludwig Endre Készítette: Infektológiai, Gyermekgyógyászati és a Fül-Orr-Gégészeti Szakmai Kollégium Bevezetés
A proteomika új tudománya és alkalmazása a rákdiagnosztikában
 BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK A proteomika új tudománya és alkalmazása a rákdiagnosztikában Tárgyszavak: proteom; proteomika; rák; diagnosztika; molekuláris gyógyászat; biomarker;
BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK A proteomika új tudománya és alkalmazása a rákdiagnosztikában Tárgyszavak: proteom; proteomika; rák; diagnosztika; molekuláris gyógyászat; biomarker;
A HIV pozitívak gondozása és kezelése Magyarországon. Készítette: Liebermann Márta hivpozitivnagymama@gmail.com
 A HIV pozitívak gondozása és kezelése Magyarországon Készítette: Liebermann Márta hivpozitivnagymama@gmail.com 1 Szűrés Törvény által előírt anonimitás, ingyenesség és vérvételkor illetve az eredmény átvételekor
A HIV pozitívak gondozása és kezelése Magyarországon Készítette: Liebermann Márta hivpozitivnagymama@gmail.com 1 Szűrés Törvény által előírt anonimitás, ingyenesség és vérvételkor illetve az eredmény átvételekor
A STRATÉGIAALKOTÁS FOLYAMATA
 BUDAPESTI CORVINUS EGYETEM VÁLLALATGAZDASÁGTAN INTÉZET VERSENYKÉPESSÉG KUTATÓ KÖZPONT Szabó Zsolt Roland: A STRATÉGIAALKOTÁS FOLYAMATA VERSENYBEN A VILÁGGAL 2004 2006 GAZDASÁGI VERSENYKÉPESSÉGÜNK VÁLLALATI
BUDAPESTI CORVINUS EGYETEM VÁLLALATGAZDASÁGTAN INTÉZET VERSENYKÉPESSÉG KUTATÓ KÖZPONT Szabó Zsolt Roland: A STRATÉGIAALKOTÁS FOLYAMATA VERSENYBEN A VILÁGGAL 2004 2006 GAZDASÁGI VERSENYKÉPESSÉGÜNK VÁLLALATI
BCG ÉS AMI MÖGÖTTE VAN
 BCG ÉS AMI MÖGÖTTE VAN Terhes Gabriella, Juhász Hajnalka, Papp Henriett, Tajti Zsanett, Gál Péter, Kovács Tamás, Bartyik Katalin, Reisz Zita, Senoner Zsuzsa, Szabó Nóra, Tiszlavicz László, Iványi Béla,
BCG ÉS AMI MÖGÖTTE VAN Terhes Gabriella, Juhász Hajnalka, Papp Henriett, Tajti Zsanett, Gál Péter, Kovács Tamás, Bartyik Katalin, Reisz Zita, Senoner Zsuzsa, Szabó Nóra, Tiszlavicz László, Iványi Béla,
REGIONÁLIS VIROLÓGIAI LABORATÓRIUM GASTROENTERÁLIS VÍRUSOK NEMZETI REFERENCIA LABORATÓRIUMA
 REGIONÁLIS VIROLÓGIAI LABORATÓRIUM GASTROENTERÁLIS VÍRUSOK NEMZETI REFERENCIA LABORATÓRIUMA Nemzeti Akkreditáló Testület (NAT) által akkreditált vizsgálólaboratórium (NAT-1-1458/2006) Nemzeti Akkreditáló
REGIONÁLIS VIROLÓGIAI LABORATÓRIUM GASTROENTERÁLIS VÍRUSOK NEMZETI REFERENCIA LABORATÓRIUMA Nemzeti Akkreditáló Testület (NAT) által akkreditált vizsgálólaboratórium (NAT-1-1458/2006) Nemzeti Akkreditáló
Stomato-onkológiai szûrôvizsgálatok: a korai diagnózis lehetôségei
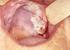 Stomato-onkológiai szûrôvizsgálatok: a korai diagnózis lehetôségei Eredeti közlemény Bánóczy Jolán 1, Bakó Attila 2, Dombi Csaba 3, Ember István 4, Kósa Zsigmond 2, Sándor János 4, Szabó György 5 1 Semmelweis
Stomato-onkológiai szûrôvizsgálatok: a korai diagnózis lehetôségei Eredeti közlemény Bánóczy Jolán 1, Bakó Attila 2, Dombi Csaba 3, Ember István 4, Kósa Zsigmond 2, Sándor János 4, Szabó György 5 1 Semmelweis
A Varilrix megfelel az Egészségügyi Világszervezet (WHO) biológiai anyagokra és a varicella vakcinákra előírt követelményeinek.
 1. A GYÓGYSZER NEVE Varilrix por és oldószer oldatos injekcióhoz Élő, attenuált varicella-zoster vírus (OKA törzs) vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A Varilrix a varicella-zoster vírus élő,
1. A GYÓGYSZER NEVE Varilrix por és oldószer oldatos injekcióhoz Élő, attenuált varicella-zoster vírus (OKA törzs) vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A Varilrix a varicella-zoster vírus élő,
Xenobiotikum transzporterek vizsgálata humán keratinocitákban és bőrben
 DOKTORI (PHD) ÉRTEKEZÉS TÉZISEI Xenobiotikum transzporterek vizsgálata humán keratinocitákban és bőrben Bebes Attila Témavezető: Dr. Széll Márta tudományos tanácsadó Szegedi Tudományegyetem Bőrgyógyászati
DOKTORI (PHD) ÉRTEKEZÉS TÉZISEI Xenobiotikum transzporterek vizsgálata humán keratinocitákban és bőrben Bebes Attila Témavezető: Dr. Széll Márta tudományos tanácsadó Szegedi Tudományegyetem Bőrgyógyászati
Újabb adatok a H1N1 vírusról. Miért hívják H1N1-nekÍ?
 Újabb adatok a H1N1 vírusról Miért hívják H1N1-nekÍ? Az Influenza vírusnak három nagy csoportja van az A, B és C. típus- Ezek közül az A vírus a veszélyesebb és fordul elő gyakrabban emberekben is. A rezervoire
Újabb adatok a H1N1 vírusról Miért hívják H1N1-nekÍ? Az Influenza vírusnak három nagy csoportja van az A, B és C. típus- Ezek közül az A vírus a veszélyesebb és fordul elő gyakrabban emberekben is. A rezervoire
Az oldat tartalma milliliterenként: humán plazmaprotein... 200 mg (legalább 98%-os tisztaságú IgG)
 1. A GYÓGYSZER MEGNEVEZÉSE Hizentra 200 mg/ml oldatos injekció bőr alá történő beadásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán normál immunglobulin (SCIg). Az oldat tartalma milliliterenként: humán
1. A GYÓGYSZER MEGNEVEZÉSE Hizentra 200 mg/ml oldatos injekció bőr alá történő beadásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán normál immunglobulin (SCIg). Az oldat tartalma milliliterenként: humán
Hantavírus (Puumala) IgG/IgM-ELISA. 4. Szükséges anyagok és reagensek, amelyeket a teszt nem tartalmaz. Használati Utasítás /Instruction Sheet/
 Hantavírus (Puumala) IgG/IgM- Enzimes immunvizsgálat az IgG és az IgM Puumala szerotipusú antitestek meghatározására. Kódszám: Tartalom: Tárolás: PR59156 96 teszt +2-8ºC Használati Utasítás /Instruction
Hantavírus (Puumala) IgG/IgM- Enzimes immunvizsgálat az IgG és az IgM Puumala szerotipusú antitestek meghatározására. Kódszám: Tartalom: Tárolás: PR59156 96 teszt +2-8ºC Használati Utasítás /Instruction
Vállalási idő. ált.bakteriológiai tenyésztés baktérium meghatározás és rezisztencia, + gomba Ft 5 nap meghatározás
 Mintákból végzett bakteriológiai és mikológiai vizsgálatok köpet ált. bakteriológiai tenyésztés 3 700 Ft 3 nap ált. bakteriológiai tenyésztés,, rezisztencia köpet ált. bakteriológiai tenyésztés, gomba
Mintákból végzett bakteriológiai és mikológiai vizsgálatok köpet ált. bakteriológiai tenyésztés 3 700 Ft 3 nap ált. bakteriológiai tenyésztés,, rezisztencia köpet ált. bakteriológiai tenyésztés, gomba
KLINIKAI TANULMÁNYOK KLINIKAI TANULMÁNYOK
 KLINIKAI TANULMÁNYOK Syphilis- és gonorrhoeaesetek elemzése, a Semmelweis Egyetem Bőr-, Nemikórtani és Bőronkológiai Klinika Országos STD Centrum adatai alapján (2005 2008) PÓNYAI KATINKA DR. MARSCHALKÓ
KLINIKAI TANULMÁNYOK Syphilis- és gonorrhoeaesetek elemzése, a Semmelweis Egyetem Bőr-, Nemikórtani és Bőronkológiai Klinika Országos STD Centrum adatai alapján (2005 2008) PÓNYAI KATINKA DR. MARSCHALKÓ
1. A GYÓGYSZER NEVE 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL. 1 adag (1 ml) tartalma: Hepatitisz B felszíni antigén 1,2. 20 mikrogramm
 1. A GYÓGYSZER NEVE Engerix-B szuszpenziós injekció felnőtteknek Engerix-B szuszpenziós injekció előretöltött fecskendőben felnőtteknek Hepatitisz B (rekombináns DNS) vakcina (adszorbeált) (HBV) 2. MINŐSÉGI
1. A GYÓGYSZER NEVE Engerix-B szuszpenziós injekció felnőtteknek Engerix-B szuszpenziós injekció előretöltött fecskendőben felnőtteknek Hepatitisz B (rekombináns DNS) vakcina (adszorbeált) (HBV) 2. MINŐSÉGI
A rosszindulatú daganatos halálozás változása 1975 és 2001 között Magyarországon
 A rosszindulatú daganatos halálozás változása és között Eredeti közlemény Gaudi István 1,2, Kásler Miklós 2 1 MTA Számítástechnikai és Automatizálási Kutató Intézete, Budapest 2 Országos Onkológiai Intézet,
A rosszindulatú daganatos halálozás változása és között Eredeti közlemény Gaudi István 1,2, Kásler Miklós 2 1 MTA Számítástechnikai és Automatizálási Kutató Intézete, Budapest 2 Országos Onkológiai Intézet,
A gyász hatása a testi és a lelki egészségi állapotra. Doktori tézisek. Dr. Pilling János
 A gyász hatása a testi és a lelki egészségi állapotra Doktori tézisek Dr. Pilling János Semmelweis Egyetem Mentális Egészségtudományok Doktori Iskola Témavezető: Prof. Kopp Mária, egy. tanár, DSc Hivatalos
A gyász hatása a testi és a lelki egészségi állapotra Doktori tézisek Dr. Pilling János Semmelweis Egyetem Mentális Egészségtudományok Doktori Iskola Témavezető: Prof. Kopp Mária, egy. tanár, DSc Hivatalos
Herpeszvírus (HSV, VZV, EBV, CMV) fertőzések immunmoduláns kezelés során
 Herpeszvírus (HSV, VZV, EBV, CMV) fertőzések immunmoduláns kezelés során Nemes Éva DE Klinikai Központ, Gyermekgyógyászati Intézet, Debrecen Immunmoduláló szerek Monoklonális antitestek: rosszindulatú
Herpeszvírus (HSV, VZV, EBV, CMV) fertőzések immunmoduláns kezelés során Nemes Éva DE Klinikai Központ, Gyermekgyógyászati Intézet, Debrecen Immunmoduláló szerek Monoklonális antitestek: rosszindulatú
Kongenitális enterovírus infekció
 Kongenitális enterovírus infekció Ábrahám Rita dr. 1 egyetemi rezidens Meszes Angéladr. 1 klinikai szakorvos Bakki Judit dr. 2 -klinikai szakorvos Gyurkovits Zita dr. 2 egyetemi adjunktus Terhes Gabriella
Kongenitális enterovírus infekció Ábrahám Rita dr. 1 egyetemi rezidens Meszes Angéladr. 1 klinikai szakorvos Bakki Judit dr. 2 -klinikai szakorvos Gyurkovits Zita dr. 2 egyetemi adjunktus Terhes Gabriella
Az Országos Epidemiológiai Központ Tájékoztatója. a nyugat-afrikai Ebola-láz járványról
 Az Országos Epidemiológiai Központ Tájékoztatója a nyugat-afrikai Ebola-láz járványról Guinea Egészségügyi Minisztériuma április 4-ig összesen 143, a klinikai tünetek alapján Ebola-vírus okozta megbetegedést
Az Országos Epidemiológiai Központ Tájékoztatója a nyugat-afrikai Ebola-láz járványról Guinea Egészségügyi Minisztériuma április 4-ig összesen 143, a klinikai tünetek alapján Ebola-vírus okozta megbetegedést
Gyarmathy V. Anna. Legális és illegális szerek használata, nemi aktivitás, és AIDS oktatás magyar középiskolások körében. Doktori értekezés tézisei
 Gyarmathy V. Anna Legális és illegális szerek használata, nemi aktivitás, és AIDS oktatás magyar középiskolások körében Doktori értekezés tézisei Semmelweis Egyetem Doktori Iskola, Témavezető: Dr. Molnár
Gyarmathy V. Anna Legális és illegális szerek használata, nemi aktivitás, és AIDS oktatás magyar középiskolások körében Doktori értekezés tézisei Semmelweis Egyetem Doktori Iskola, Témavezető: Dr. Molnár
A humán papillomavírusok prognosztikai szerepe a méhnyak rákmegel z elváltozásaiban
 Egyetemi doktori (Ph. D.) értekezés tézisei A humán papillomavírusok prognosztikai szerepe a méhnyak rákmegel z elváltozásaiban Sz ke Krisztina Témavezet : Dr. Kónya József Debreceni Egyetem Orvos- és
Egyetemi doktori (Ph. D.) értekezés tézisei A humán papillomavírusok prognosztikai szerepe a méhnyak rákmegel z elváltozásaiban Sz ke Krisztina Témavezet : Dr. Kónya József Debreceni Egyetem Orvos- és
A Boostrix Polio diphtheria, tetanus, pertussis és poliomyelitis elleni emlékeztető oltásra javasolt 4 éves kortól (lásd 4.2 pont).
 1. A GYÓGYSZER NEVE Boostrix Polio szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus, pertussis (acelluláris összetevő) és (inaktivált) poliomyelitis vakcina (adszorbeált, csökkentett
1. A GYÓGYSZER NEVE Boostrix Polio szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus, pertussis (acelluláris összetevő) és (inaktivált) poliomyelitis vakcina (adszorbeált, csökkentett
NEM NEUTROPENIÁS FELNÕTT BETEGEK INVAZÍV CANDIDA-INFEKCIÓJA
 NEM NEUTROPENIÁS FELNÕTT BETEGEK INVAZÍV CANDIDA-INFEKCIÓJA Infektológiai Szakmai Kollégium Az invazív (akut hematogén) candidiasis bizonyos kockázati csoportba sorolható betegek körében elõforduló súlyos
NEM NEUTROPENIÁS FELNÕTT BETEGEK INVAZÍV CANDIDA-INFEKCIÓJA Infektológiai Szakmai Kollégium Az invazív (akut hematogén) candidiasis bizonyos kockázati csoportba sorolható betegek körében elõforduló súlyos
Chlamydia trachomatis D K szerovariáns által okozott genitourethralis fertőzések
 Chlamydia trachomatis D K szerovariáns által okozott genitourethralis fertőzések Holló Péter dr. Jókai Hajnalka dr. Herszényi Krisztina dr. Kárpáti Sarolta dr. Semmelweis Egyetem, Általános Orvostudományi
Chlamydia trachomatis D K szerovariáns által okozott genitourethralis fertőzések Holló Péter dr. Jókai Hajnalka dr. Herszényi Krisztina dr. Kárpáti Sarolta dr. Semmelweis Egyetem, Általános Orvostudományi
A stresszteli életesemények és a gyermekkori depresszió kapcsolatának vizsgálata populációs és klinikai mintán
 A stresszteli életesemények és a gyermekkori depresszió kapcsolatának vizsgálata populációs és klinikai mintán Doktori értekezés tézisei Dr. Mayer László Semmelweis Egyetem Mentális Egészségtudományok
A stresszteli életesemények és a gyermekkori depresszió kapcsolatának vizsgálata populációs és klinikai mintán Doktori értekezés tézisei Dr. Mayer László Semmelweis Egyetem Mentális Egészségtudományok
kórházba (SBO) kerülés idejének lerövidítése
 AZ ELŐADÁS VÁZLATA Neurológiai katasztrófák Prof. Dr. Komoly Sámuel MTA doktora PTE Neurológiai Klinika Klinikai Idegtudományi Központ Ischaemiás (80%) és vérzéses (20%) stroke Subarachnoidalis vérzés
AZ ELŐADÁS VÁZLATA Neurológiai katasztrófák Prof. Dr. Komoly Sámuel MTA doktora PTE Neurológiai Klinika Klinikai Idegtudományi Központ Ischaemiás (80%) és vérzéses (20%) stroke Subarachnoidalis vérzés
Syphilis. Treponema pallidum (T. pallidum, TP) elleni összes antitest. Elecsys 2010 MODULAR ANALYTICS E170 cobas e 411 cobas e 602
 REF 06923348 190 100 Magyar Alkalmazás Immunkémiai vizsgálati eljárás a Treponema pallidum baktérium elleni összes antitest in vitro kvalitatív meghatározására humán szérumból és plazmából. A vizsgálat
REF 06923348 190 100 Magyar Alkalmazás Immunkémiai vizsgálati eljárás a Treponema pallidum baktérium elleni összes antitest in vitro kvalitatív meghatározására humán szérumból és plazmából. A vizsgálat
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tetanol pur betegtájékoztató - PIL alapján.doc BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tetanol pur betegtájékoztató - PIL alapján.doc BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
ELTE Doktori Iskola Evolúciógenetika, evolúciós ökológia, konzervációbiológia program Programvezető: Dr. Szathmáry Eörs, akadémikus, egyetemi tanár
 ELTE Doktori Iskola Evolúciógenetika, evolúciós ökológia, konzervációbiológia program Programvezető: Dr. Szathmáry Eörs, akadémikus, egyetemi tanár A CSIRKÉK FERTŐZŐ BURSITISÉT OKOZÓ VÍRUSTÖRZSEK GENETIKAI
ELTE Doktori Iskola Evolúciógenetika, evolúciós ökológia, konzervációbiológia program Programvezető: Dr. Szathmáry Eörs, akadémikus, egyetemi tanár A CSIRKÉK FERTŐZŐ BURSITISÉT OKOZÓ VÍRUSTÖRZSEK GENETIKAI
Szakmai protokoll a varicella kezeléséhez és megelőzéséhez Infektológiai Szakmai Kollégium Aktualizált változat (2009)
 1 Szakmai protokoll a varicella kezeléséhez és megelőzéséhez Infektológiai Szakmai Kollégium Aktualizált változat (2009) Az irányelv érvényessége a kihirdetéstől számított 3 év, amennyiben a témakörrel
1 Szakmai protokoll a varicella kezeléséhez és megelőzéséhez Infektológiai Szakmai Kollégium Aktualizált változat (2009) Az irányelv érvényessége a kihirdetéstől számított 3 év, amennyiben a témakörrel
BETEGTÁJÉKOZTATÓ 1. MILYEN TÍPUSÚ GYÓGYSZER A MAGYTAX INJEKCIÓ ÉS MILYEN BETEGSÉGEK ESETÉN ALKALMAZHATÓ?
 4. sz. melléklete az OGYI-T-8224/01, sz. Forgalomba hozatali engedély módosításának Budapest, 2005. december 7. Szám: 21 126/41/2005 Eloadó: dr. Mészáros Gabriella Melléklet: Tárgy: Betegtájékoztató módosítása
4. sz. melléklete az OGYI-T-8224/01, sz. Forgalomba hozatali engedély módosításának Budapest, 2005. december 7. Szám: 21 126/41/2005 Eloadó: dr. Mészáros Gabriella Melléklet: Tárgy: Betegtájékoztató módosítása
Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA)
 www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA) Verzió 2016 1. MI A GYERMEKKORI SPONDILARTRITISZ/ENTEZITISSZEL ÖSSZEFÜGGŐ ARTRITISZ
www.printo.it/pediatric-rheumatology/hu/intro Gyermekkori Spondilartritisz/Entezitisszel Összefüggő Artritisz (SPA-ERA) Verzió 2016 1. MI A GYERMEKKORI SPONDILARTRITISZ/ENTEZITISSZEL ÖSSZEFÜGGŐ ARTRITISZ
Priorix por és oldószer oldatos injekcióhoz előretöltött fecskendőben Kanyaró, mumpsz és rubeola vakcina (élő)
 1. A GYÓGYSZER NEVE Priorix por és oldószer oldatos injekcióhoz előretöltött fecskendőben Kanyaró, mumpsz és rubeola vakcina (élő) 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Feloldást követően 1 adag (0,5 ml)
1. A GYÓGYSZER NEVE Priorix por és oldószer oldatos injekcióhoz előretöltött fecskendőben Kanyaró, mumpsz és rubeola vakcina (élő) 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Feloldást követően 1 adag (0,5 ml)
Betegtájékoztató PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ. Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát
 PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát HATÓANYAG: Milliliterenként 15 mg dinátrium-pamidronát (ami megfelel 12,6 mg pamidronsavnak).
PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát HATÓANYAG: Milliliterenként 15 mg dinátrium-pamidronát (ami megfelel 12,6 mg pamidronsavnak).
14. évfolyam 8. szám 2007. március 2. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT
 14. évfolyam 8. szám 2007. március 2. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Listeriosis járvány a Cseh Köztársaságban 69 Epinfo Tájékoztatás szakmai rendezvényekről 72 Fertőző betegségek adatai 73 Epidemiológiai
14. évfolyam 8. szám 2007. március 2. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Listeriosis járvány a Cseh Köztársaságban 69 Epinfo Tájékoztatás szakmai rendezvényekről 72 Fertőző betegségek adatai 73 Epidemiológiai
Összes laborvizsgálat
 Összes laborvizsgálat Vérvétel díja 1 500 Ft 1 V. faktor Leiden- mutáció vérvétel 12. heti labor (induló/syphilis/hbsag) 18 000 Ft 17 ketoszteroid ürítés (Labor) 24. heti labor (OGTT)+ vércsop+ea. 9 900
Összes laborvizsgálat Vérvétel díja 1 500 Ft 1 V. faktor Leiden- mutáció vérvétel 12. heti labor (induló/syphilis/hbsag) 18 000 Ft 17 ketoszteroid ürítés (Labor) 24. heti labor (OGTT)+ vércsop+ea. 9 900
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 7. előadás Immunizálás. Poliklonális és monoklonális ellenanyag előállítása, tisztítása, alkalmazása Az antigén (haptén + hordozó) sokféle specificitású ellenanyag
Immunológiai módszerek a klinikai kutatásban 7. előadás Immunizálás. Poliklonális és monoklonális ellenanyag előállítása, tisztítása, alkalmazása Az antigén (haptén + hordozó) sokféle specificitású ellenanyag
