I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
|
|
|
- Zsombor Kocsis
- 9 évvel ezelőtt
- Látták:
Átírás
1 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1
2 1. A GYÓGYSZER NEVE Omnitrope 1,3 mg/ml por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Feloldás után egy injekciós üveg 1,3 mg (4 NE) szomatropint* tartalmaz milliliterenként. * genetikailag módosított Escherichia coli törzsben, rekombináns DNS technológiával előállítva A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA Por és oldószer oldatos injekcióhoz. A por fehér színű. Az oldószer átlátszó és színtelen. 4. KLINIKAI JELLEMZŐK 4.1 Terápiás javallatok Csecsemők, gyermekek és serdülők - A növekedési hormon nem megfelelő szekréciója miatt bekövetkező növekedési zavarok (növekedési hormon-hiány [growth hormone deficiency] GHD). - Turner-szindrómával társult növekedési zavar. - Krónikus veseelégtelenséggel társult növekedési zavar. - A gesztációs korhoz képest kicsinek (small for gestational age SGA) született gyermekek/serdülők növekedési zavara (aktuális testmagasság standard deviációs pontszáma [standard deviation score SDS] < -2,5, a szülői korrigált testmagasság SDS < -1), akiknek születési súlya és/vagy testmagassága -2 SD (standard deviáció) alatti, és akik 4 éves korukra vagy később sem zárkóznak fel kortársaikhoz (növekedési ütem [height velocity HV] SDS < 0 a megelőző 4 év folyamán). - Prader-Willi-szindróma (PWS) esetén a növekedés és testfelépítés elősegítése. A PWS diagnózisát megfelelő genetikai vizsgálatnak kell alátámasztania. Felnőttek - Felnőttek hormonpótló terápiája kifejezett növekedési hormon-hiány esetén. - Felnőttkorban kezdődő: Ismert, hypothalamus- vagy hypophysis-rendellenesség eredményeként többféle hormonhiánnyal összefüggő súlyos növekedési hormon-hiányban szenvedő betegek, akiknél a hypophysishormonok közül legalább egynek (kivéve a prolaktint) a hiánya áll fenn. Ezen betegeknél megfelelő dinamikus vizsgálatot kell végezni a növekedési hormon-hiány fennállásának vagy kizárásának megállapítására. - Gyermekkorban kezdődő: Azok a betegek, akik veleszületett, genetikai, szerzett vagy idiopathias ok következtében voltak növekedési hormon-hiányosak gyermekkorukban. Gyermekkorban kezdődő GHD-ban szenvedő betegeknél a hossznövekedés befejeződésével újból értékelni kell a beteg növekedési hormon-elválasztási kapacitását. Azoknál a betegeknél, akiknél nagy a valószínűsége a perzisztáló GHD-nak, például veleszületett ok miatt, vagy ha a GHD szekunder módon, valamilyen hypophysis-/hypothalamus-betegség vagy -inzultus következtében áll fenn, akkor a növekedési hormonnal végzett, legalább 4 hétig tartó kezelést követően az inzulinszerű növekedési faktor I (IGF-I) SDS <-2 értéke elegendő bizonyítékul szolgál a GHD egyértelmű jelenlétére. Minden más betegnél az IGF-I meghatározása és egy növekedési hormon-stimulációs teszt elvégzése szükséges. 2
3 4.2 Adagolás és alkalmazás A diagnózis felállítását, a szomatropin-terápia kezdeményezését és ellenőrzését olyan orvosnak kell végeznie, aki megfelelően képzett és tapasztalt a növekedési zavarokban szenvedő betegek diagnózisának felállításában és kezelésében. Adagolás Gyermekek Az adagolást és alkalmazást egyedileg kell meghatározni. Pediátriai betegek növekedési zavara a növekedési hormon elégtelen termelődése következtében Szokásos adagja 0,025-0,035 mg/testtömeg-kilogramm/nap vagy 0,7-1,0 mg/testfelület m 2 /nap. Ennél nagyobb adagok alkalmazása is ismert. Amikor a gyermekkori GHD serdülőkorban is perzisztál, akkor a teljes testi kifejlődés (például testösszetétel, csonttömeg) elérése érdekében folytatni kell a kezelést. Monitorozáshoz a T-score>-1 (amelyet a kettős energiájú röntgen-abszorpciometriával meghatározott, a nemet és etnikumot figyelembe vevő, az átlagos felnőttkori maximális csonttömeghez standardizálva adnak meg) értéke által meghatározott maximális csonttömeg elérése alkalmazható, ami egyben az egyik terápiás célkitűzés is ebben az átmeneti időszakban. Az adagolással kapcsolatos útmutatásért lásd az alábbi, felnőttekre vonatkozó részt. Prader-Willi-szindróma, a növekedés és testépítés elősegítése pediátriai betegeknél Szokásos ajánlott adagja 0,035 mg/testtömeg-kilogramm/nap vagy 1,0 mg/testfelület m 2 /nap. A napi adag nem haladhatja meg 2,7 mg-ot. Nem kezelhetők azok a pediátriai betegek, akiknél az éves növekedési ráta kisebb mint 1 cm és az epifízisek záródóban vannak. Turner-szindróma okozta növekedési zavar Ajánlott adagja 0,045-0,050 mg/testtömeg-kilogramm/nap vagy 1,4 mg/testfelület m 2 /nap. Növekedési zavar krónikus veseelégtelenség esetén Szokásos ajánlott adagja 0,045-0,050 mg/testtömeg-kilogramm/nap (1,4 mg/testfelület m 2 /nap). Nagyobb adagok alkalmazása is szükségessé válhat, amennyiben a növekedési sebesség túl lassú. Hathavi kezelés után dóziskorrekció válhat szükségessé (lásd 4.4 pont). A gesztációs korhoz képest kicsinek született gyermekek növekedési zavara (SGA) Az ajánlott dózis 0,035 mg/testtömeg-kilogramm/nap (1 mg/testfelület m 2 /nap) a végső testmagasság eléréséig (lásd 5.1 pont). A kezelést a terápia első éve után be kell fejezni, ha a növekedési sebesség SDS +1 alatt van. A kezelést akkor is meg kell szakítani, ha a növekedés üteme < 2 cm/év és, ha szükséges, igazolni kell, hogy az epifízis fugák záródása tekintetében a csontkor meghaladja lányoknál a 14, fiúknál a 16 évet. Adagolási javallatok pediátriai betegeknél Javallat mg/testtömeg-kilogramm/nap mg/testfelület-m 2 /nap Növekedési hormon-hiány gyermekeknél 0,025 0,035 0,7 1,0 Prader-Willi-szindróma gyermekeknél 0,035 1,0 Turner-szindróma 0,045 0,050 1,4 Krónikus veseelégtelenség 0,045 0,050 1,4 Gesztációs korhoz képest kicsinek született gyermekek/serdülők (SGA) 0,035 1,0 Növekedési hormon-hiány felnőtt betegeknél Azoknál a betegeknél, akik a gyermekkori GHD-t követően is folytatják a növekedési hormon alkalmazását, a terápia újrakezdéséhez ajánlott adag 0,2-0,5 mg/nap. Az adagot a beteg egyéni igényeinek megfelelően, fokozatosan kell emelni vagy csökkenteni, alapul véve a beteg IGF-I koncentrációját. 3
4 Felnőttkorban kezdődő GHD esetén a kezelést alacsony dózissal, 0,15-0,3 mg napi adaggal kell kezdeni. Az adagot a beteg egyéni igényeinek megfelelően, fokozatosan kell emelni, alapul véve a beteg IGF-I koncentrációját. A kezelés célja mindkét esetben az, hogy az inzulinszerű növekedési faktor 1 (IGF-I) szérumkoncentrációi az életkorral korrigált értékekhez képest 2 SDS-n belül legyenek. A kezelés megkezdésénél normál IGF-I koncentrációval rendelkező, 2 SDS-t el nem érő betegeknek az IGF-I normálértékének felső határáig kell a növekedési hormont adagolni. A klinikai válasz és a mellékhatások szintén használhatók a dózistitrálás útmutatójaként. Ismeretes, hogy vannak olyan GHD-s betegek, akiknél a jó klinikai válasz ellenére nem normalizálódik az IGF-I szintje, éppen ezért nem szükséges náluk az adag emelése. A napi fenntartó adag ritkán haladja meg az 1,0 mg-ot. A nőknek magasabb dózisra lehet szükségük, mint a férfiaknak, akiknél idővel megnövekedett IGF-I érzékenység tapasztalható. Ez azzal a veszéllyel jár, hogy a nők, különösen akik orális ösztrogén terápiában részesülnek, alulkezeltek, míg a férfiakat túldozírozzák. A növekedési hormon pontos adagolását ezért 6 havonta ellenőrizni kell. Mivel a növekedési hormon normál fiziológiás termelődése általában az életkorral csökken, a szükséges terápiás adag redukálódhat. Különleges betegpopulációk Idősek 60 év feletti betegeknél a kezelést 0,1-0,2 mg/nap adaggal kell kezdeni, amelyet aztán a beteg egyedi igényeihez igazodva, lassan kell növelni. A legkisebb hatásos adagot kell alkalmazni. Ezeknél a betegeknél a fenntartó adag ritkán haladja meg a 0,5 mg/nap értéket. Az alkalmazás módja Az injekciót szubkután kell beadni, és a beadás helyét a lipoatrophia elkerülése céljából változtatni kell. A gyógyszer alkalmazására és kezelésére vonatkozó utasításokat lásd a 6.6 pontban. 4.3 Ellenjavallatok A hatóanyaggal vagy a készítmény bármely segédanyagával szembeni túlérzékenység. Tilos szomatropin alkalmazása, ha bizonyíték van valamilyen tumor aktivitására. Bármilyen intracranialis tumornak inaktívnak kell lennie, továbbá a GH kezelés csak a tumor-ellenes terápia befejezését követően kezdhető el. Ha bizonyíték van a tumor növekedésére, akkor a kezelést be kell fejezni. Tilos szomatropin alkalmazása a növekedés elősegítésére záródott epifízisű gyermekek esetén. Nyílt szívműtétet, hasi műtétet, politraumát, akut légzési elégtelenséget vagy hasonló állapotokat követően fellépő komplikációk esetén, vagy hasonló akut kritikus betegségben szenvedő betegeknél tilos szomatropin-kezelést alkalmazni (hormonpótló terápiában résztvevő betegekre vonatkozóan lásd 4.4 pont). 4.4 Különleges figyelmeztetések és az alkalmazással kapcsolatos óvintézkedések Az ajánlott maximális napi adagot nem szabad meghaladni (lásd 4.2 pont). Inzulinérzékenység A szomatropin csökkentheti az inzulinérzékenységet. Diabetes mellitusban szenvedő betegeknél a szomatropin-kezelés megkezdése után az inzulin adagjának módosítása válhat szükségessé. Diabeteses, glükózintoleranciás vagy a diabetesszel kapcsolatban bármilyen más rizikófaktorral rendelkező beteget fokozott figyelemmel kell kísérni a szomatropinnal végzett kezelés során. 4
5 Pajzsmirigyfunkció A növekedési hormon fokozza a pajzsmirigyen kívül történő T4 - T3 átalakulást, mely a szérum T4 csökkenését és a szérum T3 koncentráció növekedését eredményezheti. Mindeközben a perifériás pajzsmirigy hormonszintek az egészséges egyénekre vonatkozó referenciatartományon belül maradtak. Subclinicus hypothyreosisban szenvedő betegeknél elméletileg hypothyreosis fejlődhet ki. Éppen ezért a pajzsmirigyfunkciót minden betegnél figyelemmel kell kísérni. Standard hormonpótló kezelésben részesülő, hypopituitarismusban szenvedő betegeknél a növekedési hormon pajzsmirigyfunkcióra kifejtett potenciális hatását fokozott figyelemmel kell kísérni. Malignus betegség kezelésekor másodlagosan jelentkező növekedési hormon-elégtelenségben az esetleges relapszus jeleire figyelni kell. Gyermekkori rákbetegségek túlélőinél második daganat kialakulásának fokozott kockázatáról számoltak be az első daganatot követően szomatropinnal kezelt betegek esetében. Azoknál a betegeknél, akiket az első daganat miatt a fej besugárzásával kezeltek, az intracranialis tumorok, különösen a meningeomák voltak a leggyakoribb második daganatok. Endokrin zavarokban szenvedő betegeknél, beleértve a növekedési hormon-elégtelenséget is, a csípőízületi epiphyseolysis kialakulása viszonylag gyakoribb, mint az átlag népességben. Ezért szomatropin-kezelésben részesülő betegeknél fellépő sántítás további vizsgálatok elvégzését teszi szükségessé. Benignus intracranialis hypertensio Erős vagy visszatérő fejfájás, látászavarok, hányinger és/vagy hányás esetén szemfenékvizsgálat javasolt az esetlegesen kialakult papilla-ödéma miatt. Igazolt papilla-ödéma esetén a jóindulatú intracranialis hypertensio diagnózisára gondolni kell, és ha szükséges, a növekedési hormon-kezelést fel kell függeszteni. Jelenleg nincs elegendő bizonyíték, hogy specifikus javaslatot lehessen adni a növekedési hormon-kezelés folytatására, ha az intracranialis hypertensio megszűnt. Ha a növekedési hormon-kezelést újra indítják, az intracranialis hypertensio tüneteinek jelentkezését figyelemmel kell kísérni. Leukaemia Leukaemiáról számoltak be kevés számú, olyan növekedési hormon-hiányos betegnél, akiknek egy részét szomatropinnal kezeltek. Ugyanakkor nincs bizonyíték arra, hogy a leukaemia incidenciája megnő azoknak a növekedési hormont kapó betegeknek a körében, akiknek egyébként nincs hajlamosító tényezőjük. Antitestek A betegek egy kis hányadánál Omnitrope elleni antitestek képződhetnek. Az Omnitrope antitestképződést váltott ki a betegek körülbelül 1%-ánál. Ezeknek az antitesteknek a kötődési képessége alacsony, és nem befolyásolja a növekedés ütemét. A szomatropin elleni antitestek vizsgálatát el kell végezni minden olyan betegnél, akinél másképpen nem magyarázató a terápiára adott válasz hiánya. Idősek 80 év feletti betegek kezelésével kapcsolatban kevés tapasztalat áll rendelkezésre. Az idős betegek érzékenyebbek lehetnek az Omnitrope hatására, ezért hajlamosabbak lehetnek a mellékhatások kialakulására. Akut, kritikus megbetegedés A felépülés időszakában alkalmazott szomatropin hatását 522 olyan, kritikus betegségben szenvedő felnőtt beteg bevonásával végzett, két placebo-kontrollos vizsgálatban értékelték, akiknél nyílt szívműtétet, hasi műtétet, politraumát, illetőleg akut légzési elégtelenséget követően komplikációk léptek fel. A halandóság magasabb volt azoknál a betegeknél, akiket napi 5,3 vagy 8 mg szomatropinnal kezeltek, mint a placebóval kezelteknél (42%, illetve 19%). Következésképpen, az ilyen betegek nem kezelhetők szomatropinnal. Mivel az akut kritikus betegségben szenvedő betegek 5
6 növekedési hormon-pótlásának biztonságosságáról nem áll rendelkezésre információ, ezért ezeknél a betegeknél a kezelés előnyeit mérlegelni kell annak potenciális kockázatával szemben. Minden betegnél, akinél hasonló vagy más akut, kritikus betegség lép fel, a szomatropin-kezelés előnyeit és kockázatait mérlegelni kell. Gyermekek Pancreatitis Bár előfordulása ritka, pancreatitisre kell gyanakodni, ha szomatropin-kezelésben részesülő gyermeknél hasi fájdalom jelentkezik. Prader-Willi-szindróma A Prader-Willi-szindróma (PWS) kezelését mindig kalóriaszegény diétával kell összehangolni. Fatális kimenetelről szóló jelentések érkeztek növekedési hormon alkalmazásával kapcsolatban Prader-Willi-szindrómában (PWS) szenvedő gyermekek körében, akiknél az alábbi egy vagy több kockázati tényező állt fenn: súlyos elhízás (akiknél a testtömeg/testmagasság aránya meghaladja a 200%-ot), a kórtörténetben szereplő légzéskárosodás vagy alvási apnoe vagy azonosítatlan légúti fertőzés. Prader-Willi-szindrómában (PWS) szenvedő betegek, akiknél egy vagy több kockázati tényező jelen van fokozottabban veszélyeztetettek. A szomatropin-kezelés megkezdése előtt, a Prader-Willi-szindrómás (PWS) betegeket felső légúti obstrukció, alvási apnoe és légúti fertőzések irányában ki kell vizsgálni. Amennyiben a felső légúti obstrukció vizsgálata során patológiás elváltozásokat figyelnek meg, akkor a növekedési hormonnal végzett terápia elkezdése előtt, a légzéssel kapcsolatos probléma kezelése és megoldása érdekében a gyermeket fül-orr-gégész szakorvoshoz kell utalni. Az alvási apnoét a növekedési hormon-terápia megkezdése előtt szakmailag elfogadott módszerekkel, például polysomnographiával vagy éjszakai oxymetriával fel kell mérni, és alvási apnoe gyanúja esetén a beteget megfigyelés alatt kell tartani. Ha a szomatropin-terápia során felső légúti obstrukció tünetei jelentkeznek (beleértve a horkolás megjelenését vagy fokozódását), a kezelést meg kell szakítani és új fül-orr-gégészeti vizsgálatot kell végezni a betegen. Minden Prader-Willi-szindrómás (PWS) betegnél ki kell zárni az alvási apnoe-t, illetve apnoe gyanúja esetén a beteget monitorozni kell. A betegeknél folyamatosan monitorozni kell a légúti fertőzés jeleit, a fertőzést a lehető leghamarabb diagnosztizálni és agresszíven kezelni kell. Növekedési hormon-kezelés előtt és alatt a testsúlyt minden Prader-Willi-szindrómás (PWS) betegnél hatékony módszerrel kontrollálni kell. A scoliosis PWS-ben szenvedő betegeknél gyakori. A scoliosis bármely gyermeknél romolhat a gyors növekedés alatt. A kezelés során figyelni kell a scoliosisra utaló jelekre A felnőttek, illetve a PWS-ben szenvedő betegek hosszú távú kezeléséről kevés tapasztalat áll rendelkezésre. A gesztációs korhoz viszonyítva kicsinek születettek (SGA) A gesztációs korhoz képest kicsinek született gyermekek/serdülők esetén a növekedési zavart magyarázó egyéb egészségügyi okokat a kezelés előtt ki kell zárni. 6
7 Gesztációs korhoz képest kicsinek született gyermekek/serdülők (SGA) kezelésének megkezdése előtt, majd azt követően évenként mérni kell az éhgyomri inzulin- és a vércukorszintet. Azoknál a betegeknél, akiknél a diabetes mellitus kockázata fokozott (családi előzmény, elhízás, súlyos inzulinrezisztencia, acanthosis nigricans) orális glükóztolerancia tesztet (OGTT) kell végezni. Ha a diabetes nyilvánvaló, növekedési hormon nem adható. A kezelés elkezdése előtt és azt követően évenként kétszer ajánlott az IGF-I szint mérése a gesztációs korhoz képest kicsinek született gyermekekben/serdülőkben (SGA). Ha az ismételt mérésnél az IGF-I szint meghaladja a referencia korra és pubertás státuszra vonatkoztatott +2 SD értéket, az IGF-I / IGFBP-3 arányt lehet a dózisbeállításnál figyelembe venni. Kevés a tapasztalat a gesztációs korhoz képest kicsinek született gyermekek (SGA) pubertás kezdetéhez közeli időszakában elkezdett kezeléséről. Ezért a pubertás kezdetéhez közel nem ajánlatos a kezelés megindítása. Silver-Russel szindrómás betegek növekedési hormon-kezeléséről kevés tapasztalat áll rendelkezésre. A növekedési hormonnal kezelt, gesztációs korhoz képest kicsinek született gyermek/serdülők (SGA) már elért testmagasság-növekedése elveszhet, ha a kezelést a végső testmagasság elérése előtt abbahagyják. Krónikus veseelégtelenség Krónikus veseelégtelenségben a kezelés megkezdése előtt a normálérték 50%-a alatt kell lennie a vesefunkciónak. A növekedési zavar igazolásához a növekedési ütemet a kezelés megkezdése előtt egy éven át figyelemmel kell kísérni. Ezen időszak alatt a veseelégtelenség konzervatív kezelését (mely magában foglalja az acidosis, a hyperparathyreosis, valamint a tápláltsági állapot ellenőrzését) el kell kezdeni, és a kezelés időtartama alatt mindvégig folytatni kell. Vesetranszplantáció esetén a kezelést abba kell hagyni. Az Omnitrope készítménnyel kezelt, krónikus veseelégtelenségben szenvedő betegek végső testmagasságára vonatkozó adatok ezidáig nem állnak rendelkezésre. 4.5 Gyógyszerkölcsönhatások és egyéb interakciók Az egyidejű glükokortiokoid-kezelés gátolhatja a szomatropint tartalmazó gyógyszerek növekedést elősegítő hatását. Ezért a glükokortikoidokkal kezelt betegek növekedését fokozott figyelemmel kell kísérni a glükokortikoid-kezelés növekedésre kifejtett potenciális hatásának megítélésére. Növekedési hormon-elégtelenségben szenvedő felnőtteken végzett interakciós vizsgálat adatai szerint, a szomatropin adagolása növelheti a citokróm P450 izoenzimek által metabolizált vegyületek clearance-ét. A citokróm P450 3A4 által metabolizált vegyületek clearance-e (pl. nemi hormonok, kortikoszteroidok, görcsgátlószerek és ciklosporin) nagymértékben megnőhet, ezen vegyületek alacsonyabb plazmaszintjét eredményezve. Klinikai jelentősége nem ismeretes. A diabetes mellitusban, illetőleg pajzsmirigy-rendellenességben szenvedő betegekre vonatkozóan lásd még a 4.4 pontot, az orális ösztrogénpótló kezelésben részesülő betegekre vonatkozóan a 4.2 pontot. 4.6 Termékenység, terhesség és szoptatás Terhesség A szomatropin terhes nőknél történő alkalmazása tekintetében nem áll rendelkezésre információ, vagy csak korlátozott mennyiségű információ áll rendelkezésre. Az állatkísérletek során nyert eredmények elégtelenek a reproduktív toxicitás megítélésének tekintetében (lásd 5.3 pont). A szomatropin alkalmazása nem javallt terhesség alatt és olyan fogamzóképes korú nők esetében, akik nem alkalmaznak fogamzásgátlást. 7
8 Szoptatás Szoptató nőkkel nem végeztek klinikai vizsgálatokat szomatropint tartalmazó gyógyszerekkel. Nem ismert, hogy a szomatropin kiválasztódik-e a humán anyatejbe, bár az intakt fehérje felszívódása a csecsemő gyomor-bélrendszeréből teljes mértékben valószínűtlen. Ezért szoptató nők Omnitropekezelését körültekintően kell végezni. Termékenység Termékenységgel kapcsolatos vizsgálatokat nem végeztek az Omnitrope-pal. 4.7 A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre Az Omnitrope nem, vagy csak elhanyagolható mértékben befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket. 4.8 Nemkívánatos hatások, mellékhatások A biztonságossági profil összefoglalása A növekedési hormon-hiányban szenvedő betegekre jellemző az extracelluláris volumenhiány. A szomatropinkezelés megkezdésével ez a deficit igen gyorsan helyreáll. Felnőtt betegeken gyakoriak a folyadékretencióval kapcsolatos mellékhatások, mint a perifériás ödéma, musculoskeletalis merevség, arthralgia, myalgia és paraesthesia. Ezek a kezelés első hónapjaiban megjelenő mellékhatások általában enyhék, közepes fokúak, majd spontán módon vagy a dózis csökkentésével megszűnnek. Ezen mellékhatások előfordulási gyakorisága összefügg az alkalmazott dózissal, valamint a beteg életkorával, és valószínűleg fordítottan arányos a növekedési hormon-hiány kialakulásának időpontjával. Gyermekeknél az ilyen mellékhatások nem gyakoriak. Az Omnitrope antitestképződést váltott ki a betegek 1%-ánál. Ezeknek az antitesteknek a kötődési képessége alacsony volt, és kialakulásuk nem járt klinikai változásokkal, lásd 4.4 pont. A mellékhatások táblázatos felsorolása Az 1-6. táblázatok mutatják be a mellékhatásokat szervrendszerek és a következő gyakorisági kategóriák szerint osztályozva: nagyon gyakori ( 1/10); gyakori ( 1/100 - <1/10); nem gyakori ( 1/ <1/100); ritka ( 1/ <1/1000); nagyon ritka (<1/10 000); nem ismert (a rendelkezésre álló adatokból nem állapítható meg) a jelzett állapotok mindegyikére vonatkozóan. GHD-s gyermekekkel végzett klinikai vizsgálatok 1. táblázat: Elégtelen növekedésihormon-szekréció miatt bekövetkező növekedési zavarban szenvedő gyermekek hosszú távú kezelése Szervrendsze r Jó-, rosszindulatú és nem meghatározott daganatok (beleértve a cisztákat és polipokat is) Nagyon gyakori 1/10 Gyakori 1/100 - <1/10 Nem gyakori 1/ <1 /100 Leukaemia Ritka 1/ < 1/1000 Nagyon ritka < 1/ Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) 8
9 Anyagcsere- é s táplálkozási betegségek és tünetek Idegrendszeri betegségek és tünetek A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános tünetek, az alkalmazás helyén fellépő reakciók Az injekció beadási helyén fellépő reakció $ Arthralgia* 2-es típusú diabetes mellitus Paraesthesia* Benignus intracranialis hypertensio Myalgia* Csont- és izomrendszeri merevség* Perifériás ödéma* Laboratóriumi és egyéb vizsgálatok eredményei Csökkent kortizolszint a vérben *Ezek a mellékhatások általában enyhék vagy közepesen súlyosak voltak, a kezelés első hónapjaiban jelentkeztek, majd spontán módon vagy az adag csökkentésére elmúltak. E mellékhatások incidenciája összefüggésben áll az alkalmazott adaggal és a betegek életkorával, és valószínűleg fordított relációban van a betegek életkorával a növekedésihormon-hiány fellépésekor. $ Az injekció beadási helyén fellépő átmeneti reakciókról számoltak be gyermekeknél. A klinikai jelentőség nem ismert Növekedésihormon-hiányban szenvedő, szomatropinnal kezelt gyermekeknél számoltak be róla, de az incidencia hasonlónak tűnik, mint a növekedésihormon-hiányban nem szenvedő gyermekeknél. Turner-szindrómás gyermekekkel végzett klinikai vizsgálatok 2. táblázat: Turner-szindróma miatt bekövetkező növekedési zavarban szenvedő gyermekek hosszú távú kezelése Szervrendszer Jó-, rosszindulatú és nem meghatározott daganatok (beleértve a cisztákat és polipokat is) Nagyon gyakori 1/10 Gyakori 1/100 - < 1/10 Nem gyakori 1/ < 1/100 Ritka 1/ < 1/1000 Nagyon ritka < 1/ Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) Leukaemia 9
10 Anyagcsere- és táplálkozási betegségek és tünetek Idegrendszeri betegségek és tünetek A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános tünetek, az alkalmazás helyén fellépő reakciók Laboratóriumi és egyéb vizsgálatok eredményei Arthralg ia* 2-es típusú diabetes mellitus Paraesthesia* Benignus intracranialis hypertensio Myalgia* Csont- és izomrendszeri merevség* Perifériás ödéma* Az injekció beadási helyén fellépő reakció $ Csökkent kortizolszint a vérben *Ezek a mellékhatások általában enyhék vagy közepesen súlyosak voltak, a kezelés első hónapjaiban jelentkeztek, majd spontán módon vagy az adag csökkentésére elmúltak. E mellékhatások incidenciája összefüggésben áll az alkalmazott adaggal és a betegek életkorával, és valószínűleg fordított relációban van a betegek életkorával a növekedésihormon-hiány fellépésekor. $ Az injekció beadási helyén fellépő átmeneti reakciókról számoltak be gyermekeknél. A klinikai jelentőség nem ismert Növekedésihormon-hiányban szenvedő, szomatropinnal kezelt gyermekeknél számoltak be róla, de az incidencia hasonlónak tűnik, mint a növekedésihormon-hiányban nem szenvedő gyermekeknél. Krónikus veseelégtelenségben szenvedő gyermekekkel végzett klinikai vizsgálatok 3. táblázat: Krónikus veseelégtelenség miatt bekövetkező növekedési zavarban szenvedő gyermekek hosszú távú kezelése Szervrendsze r Jó-, rosszindulatú és nem meghatározott daganatok (beleértve a cisztákat és polipokat is) Nagyon gyakori 1/10 Gyakori 1/100 - < 1/10 Nem gyakori 1/ <1/100 Ritka 1/ < 1/1000 Nagyon ritka < 1/ Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) Leukaemia Anyagcsere- é 2-es típusú 10
11 s táplálkozási betegségek és tünetek Idegrendszeri betegségek és tünetek A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános tünetek, az alkalmazás helyén fellépő reakciók Laboratóriumi és egyéb vizsgálatok eredményei Az injekció beadási helyén fellépő reakció $ diabetes mellitus Paraesthesia* Benignus intracranialis hypertensio Arthralgia* Myalgia* Csont- és izomrendszeri merevség* Perifériás ödéma* Csökkent kortizolszint a vérben *Ezek a mellékhatások általában enyhék vagy közepesen súlyosak voltak, a kezelés első hónapjaiban jelentkeztek, majd spontán módon vagy az adag csökkentésére elmúltak. E mellékhatások incidenciája összefüggésben áll az alkalmazott adaggal és a betegek életkorával, és valószínűleg fordított relációban van a betegek életkorával a növekedésihormon-hiány fellépésekor. $ Az injekció beadási helyén fellépő átmeneti reakciókról számoltak be gyermekeknél. A klinikai jelentőség nem ismert Növekedésihormon-hiányban szenvedő, szomatropinnal kezelt gyermekeknél számoltak be róla, de az incidencia hasonlónak tűnik, mint a növekedésihormon-hiányban nem szenvedő gyermekeknél. SGA-ban szenvedő gyermekekkel végzett klinikai vizsgálatok 4. táblázat: A gesztációs korhoz képest kis születési testméret okozta növekedési zavarban szenvedő gyermekek hosszú távú kezelése Szervrendszer Nagyon gyakori 1/10 Nagyon ritka <1/ Jó-, rosszindulatú és nem meghatározott daganatok (beleértve a cisztákat és polipokat is) Anyagcsere- és Gyakori 1/100 - < 1/10 Nem gyakori 1/ <1 /1000 Ritka 1/ <1 /1000 Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) Leukaemia 2-es típusú 11
12 táplálkozási betegségek és tünetek Idegrendszeri betegségek és tünetek A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános tünetek, az alkalmazás helyén fellépő reakciók Laboratóriumi és egyéb vizsgálatok eredményei Az injekció beadási helyén fellépő reakció $ Arthralgia* diabetes mellitus Paraesthesia* Benignus intracranialis hypertensio Myalgia* Csont- és izomrendszeri merevség* Perifériás ödéma* Csökkent kortizolszint a vérben *Ezek a mellékhatások általában enyhék vagy közepesen súlyosak voltak, a kezelés első hónapjaiban jelentkeztek, majd spontán módon vagy az adag csökkentésére elmúltak. E mellékhatások incidenciája összefüggésben áll az alkalmazott adaggal és a betegek életkorával, és valószínűleg fordított relációban van a betegek életkorával a növekedésihormon-hiány fellépésekor. $ Az injekció beadási helyén fellépő átmeneti reakciókról számoltak be gyermekeknél. A klinikai jelentőség nem ismert Növekedésihormon-hiányban szenvedő, szomatropinnal kezelt gyermekeknél számoltak be róla, de az incidencia hasonlónak tűnik, mint a növekedésihormon-hiányban nem szenvedő gyermekeknél. Klinikai vizsgálatok PWS-ben 5. táblázat: Prader-Willi-szindróma miatt bekövetkező növekedési zavaros gyermekek hosszú távú kezelése és testösszetételének javulása Szervrendszer Nagyon gyakori 1/10 Gyakori 1/100 - < 1/10 Ritka 1/ < 1/1000 Jó-, rosszindulatú és nem meghatározott daganatok (beleértve a cisztákat és polipokat is) Anyagcsere- és táplálkozási Nem gyakori 1/ <1/ Nagyon ritka < 1/ Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) Leukaemia 2-es típusú diabetes mellitus
13 betegségek és tünetek Idegrendszeri betegségek és tünetek A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános tünetek, az alkalmazás helyén fellépő reakciók Laboratóriumi és egyéb vizsgálatok eredményei Paraesthe sia* Benignus intracrani alis hypertensi o Arthralgia * Myalgia* Perifériás ödéma* Csont- és izomrendszeri merevség* Az injekció beadási helyén fellépő reakció $ Csökkent kortizolszint a vérben *Ezek a mellékhatások általában enyhék vagy közepesen súlyosak voltak, a kezelés első hónapjaiban jelentkeztek, majd spontán módon vagy az adag csökkentésére elmúltak. E mellékhatások incidenciája összefüggésben áll az alkalmazott adaggal és a betegek életkorával, és valószínűleg fordított relációban van a betegek életkorával a növekedésihormon-hiány fellépésekor. $ Az injekció beadási helyén fellépő átmeneti reakciókról számoltak be gyermekeknél. A klinikai jelentőség nem ismert Növekedésihormon-hiányban szenvedő, szomatropinnal kezelt gyermekeknél számoltak be róla, de az incidencia hasonlónak tűnik, mint a növekedésihormon-hiányban nem szenvedő gyermekeknél. Klinikai vizsgálatok GHD-s felnőttekkel 6. táblázat: Növekedésihormon-hiányos felnőtteknél végzett hormonpótló kezelés Szervrendszer Nagyon gyakori 1/10 Gyakori 1/100 - < 1/10 Ritka 1/ < 1/1000 Anyagcsere- és táplálkozási betegségek és tünetek Idegrendszeri betegségek és tünetek Paraesthesi a* Kéztőalag út szindróma Nem gyakori 1/ < 1/100 Nagyon ritka < 1/ Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) 2-es típusú diabetes mellitus Benignus intracranialis hypertensio 13
14 A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános tünetek, az alkalmazás helyén fellépő reakciók Laboratóriumi és egyéb vizsgálatok eredményei Arthralgi a* Perifériás ödéma* Myalgia* Csont- és izomrends zeri merevség* Az injekció beadási helyén fellépő reakci $ Csökkent kortizolszint a vérben *Ezek a mellékhatások általában enyhék vagy közepesen súlyosak voltak, a kezelés első hónapjaiban jelentkeztek, majd spontán módon vagy az adag csökkentésére elmúltak. E mellékhatások incidenciája összefüggésben áll az alkalmazott adaggal és a betegek életkorával, és valószínűleg fordított relációban van a betegek életkorával a növekedésihormon-hiány fellépésekor. $ Az injekció beadási helyén fellépő átmeneti reakciókról számoltak be gyermekeknél. A klinikai jelentőség nem ismertegyes kiválasztott mellékhatások leírása Csökkent szérum kortizolszint Beszámoltak arról, hogy a szomatropin csökkenti a szérum kortizolszintjét, amely valószínűleg a szállítófehérjék befolyásolása vagy a megnövekedett hepaticus clearance révén jön létre. Ezen felfedezés klinikai jelentősége korlátozott lehet. Ugyanakkor a terápia megkezdése előtt a kortikoszteroid-pótló kezelést optimalizálni kell. Prader-Willi-szindróma A forgalomba hozatalt követően beszámoltak Prader-Willi-szindrómában szenvedő, szomatropinnal kezelt betegeknél a hirtelen halál ritka eseteiről, bár ok-okozati összefüggést nem igazoltak. Leukaemia Leukaemiás eseteket (ritkán vagy nagyon ritkán) jelentettek növekedésihormon-hiányos, szomatropinnal kezelt gyermekeknél, valamint szerepeltek ilyen esetek a forgalomba hozatalt követő alkalmazással kapcsolatos adatok között. Ugyanakkor nincs bizonyíték a leukaemia fokozott kockázatára hajlamosító tényezők, például az agyi vagy koponya-besugárzás hiányában. Epiphyseolysis capitis femoris és Legg-Calvé-Perthes-kór Epiphyseolysis capitis femorisról és Legg-Calvé-Perthes-kórról számoltak be GH-val kezelt gyermekeknél. Epiphyseolysis capitis femoris gyakrabban fordul elő endokrin betegségekben, míg a Legg-Calvé-Perthes-kór alacsony növésnél gyakoribb. Ugyanakkor nem ismert, hogy ez a két kórkép gyakoribb-e vagy sem a szomatropinnal történő kezelés alatt. Ezekre a diagnózisokra gondolni kell olyan gyermekeknél, akiknél csípő- vagy térdízületi diszkomfort vagy fájdalom áll fenn. Egyéb gyógyszermellékhatások Az egyéb gyógyszermellékhatások a szomatropin gyógyszerosztály hatásainak tekinthetők, mint például a csökkent inzulinérzékenység okozta lehetséges hyperglykaemia, csökkent szabadtiroxin-szint és a benignus intracranialis hypertensio. 14
15 Feltételezett mellékhatások bejelentése A gyógyszer engedélyezését követően lényeges a feltételezett mellékhatások bejelentése, mert ez fontos eszköze annak, hogy a gyógyszer előny/kockázat profilját folyamatosan figyelemmel lehessen kísérni. Az egészségügyi szakembereket kérjük, hogy jelentsék be a feltételezett mellékhatásokat a hatóság részére az V. függelékben található elérhetőségek valamelyikén keresztül. 4.9 Túladagolás Tünetek: Az akut túladagolás először hypoglykaemiát, azt követően pedig hyperglykaemiát eredményezhet. A hosszantartó túladagolás a növekedési hormon-többlet ismert hatásaival megegyező tüneteket eredményezhet. 5. FARMAKOLÓGIAI TULAJDONSÁGOK 5.1 Farmakodinámiás tulajdonságok Farmakoterápiás csoport: Hypophysis elülső lebenyének hormonjai és analógjai, ATC kód: H01AC01. Az Omnitrope hasonló biológiai gyógyszer. Részletes információ az Európai Gyógyszerügynökség honlapján ( érhető el. Hatásmechanizmus A szomatropin hatékony metabolikus hormon, mely fontos szerepet játszik a zsírok, szénhidrátok és proteinek metabolizmusában. Elégtelen endogén növekedési hormonnal rendelkező gyermekeknél a szomatropin stimulálja a lineáris növekedést és fokozza a növekedési ütemet. Mind felnőtteknél, mind gyermekeknél a szomatropin normális testösszetételt tart fent azáltal, hogy növeli a nitrogén retenciót, stimulálja a vázizomzat növekedését, illetve mobilizálja a test zsírkészletét. Főleg a viscerális zsírszövetek reagálnak a szomatropinra. A hangsúlyozott lipolízis mellett, a szomatropin csökkenti a trigliceridek zsírraktárakba való felvételét. Az IGF-I (Inzulin-like Growth Factor I), valamint az IGFBP3 (Insulin-like Growth Factor-Binding Protein 3) szérumszintet a szomatropin emeli. Ezenkívül még az alábbi hatások mutathatók ki: Farmakodinámiás hatások Zsírmetabolizmus A szomatropin indukálja a máj LDL-koleszterin receptorait, és hatással van a szérumlipidek és lipoproteinek profiljára. A szomatropin alkalmazása növekedési hormon-elégtelenségben szenvedő betegeknél, általában a szérum LDL és az apolipoprotein B csökkenését eredményezi. A szérum összkoleszterin tartalmának csökkenése is megfigyelhető. Szénhidrát metabolizmus A szomatropin növeli az inzulinszintet, de az éhgyomri vércukorszint általában változatlan. Hypopituiter gyermekeknél éhgyomri hipoglikémia tapasztalható. A szomatropin az előbbi jelenséget visszafordítja. Víz és ásványianyag metabolizmus A növekedési hormon-elégtelenség a plazma és az extracelluláris térfogat csökkenésével jár. Mindkettő gyorsan megnő a szomatropin-kezelést követően. A szomatropin indukálja a nátrium, kálium és a foszfor retencióját. Csontmetabolizmus A szomatropin stimulálja a csontozat turnoverét. A szomatropin hosszú távú alkalmazása az osteopeniában szenvedő növekedési hormon-hiányos betegeknél a csontozat ásványianyag tartalmának és sűrűségének a növekedését eredményezi a teherviselő pontoknál. 15
16 Fizikai kapacitás Az izomerő és a fizikai erőnlét tartós szomatropin-kezelés során jelentősen javul. A szomatropin a szív teljesítőképességét szintén növeli, noha a mechanizmus, melynek révén ez megvalósul, még nem teljesen tisztázott. Ehhez a hatáshoz a perifériás vaszkuláris rezisztencia csökkenése hozzájárulhat. Klinikai hatásosság és biztonságosság Klinikai vizsgálatokban a gesztációs korhoz képest kicsinek született gyermekeket/serdülőket (SGA) napi 0,033, ill. 0,067 mg/testtömeg-kilogramm-os adaggal kezeltek a végleges testmagasság eléréséig. Ötvenhat, folyamatosan kezelt, és a végleges testmagasságot elért (vagy ahhoz közeli) betegben a kezdeti magasságtól kiindulva az átlagos változás +1,90 SDS (0,033 mg/testtömeg-kilogramm/nap) és +2,19 SDS (0,067 mg/testtömeg-kilogramm/nap) volt. Irodalmi adatok szerint a kezeletlen gesztációs korhoz képest kicsinek született (SGA), korai spontán növekedést nem mutató gyermekek/serdülők késői növekedése 0,5 SDS. Hosszútávú biztonsági adatok még nem állnak rendelkezésre. 5.2 Farmakokinetikai tulajdonságok Felszívódás A szubkután alkalmazott szomatropin biohasznosulása körülbelül 80%, mind az egészséges egyénekben, mind a növekedési hormon-hiányban szenvedő betegekben. Az Omnitrope por és oldószer oldatos injekcióhoz 5 mg szubkután dózisa 71 ± 24 μg/l (átlag ± szórás) tartományon belüli C max értéket eredményez, a t max átlagos értéke pedig 4 óra (intervallum: 2-8 óra). Elimináció A szomatropin átlagos felezési ideje, intravénás adagolást követően, növekedési hormonelégtelenségben szenvedő felnőtteknél körülbelül 0,4 óra. Az Omnitrope por és oldószer oldatos injekcióhoz szubkután alkalmazást követően azonban 3 órás felezési idő érhető el. A megfigyelhető különbség valószínűleg a szubkután alkalmazást követő, az injekció beadásának helyéről való lassú felszívódás eredménye. Különleges betegpopulációk A szomatropin abszolút biohasznosulása a szubkután alkalmazást követően férfiaknál, illetve nőknél hasonlónak tűnik. Különböző rasszok, gyermekek és időskorúak, valamint vese-, máj- vagy szívelégtelenségben szenvedő betegeknél alkalmazott szomatropin farmakokinetikájáról ismereteink hiányosak vagy nincsenek. 5.3 A preklinikai biztonságossági vizsgálatok eredményei Az Omnitrope-pal végzett vizsgálatok során szubakut toxicitásra, valamint a lokális toleranciára vonatkozó klinikailag releváns hatást nem figyeltek meg. Egyéb, a szomatropinnal történt általános toxicitási, lokális tolerancia és reprodukciós toxicitási vizsgálatok klinikailag releváns hatást nem igazoltak. A génmutációra és kromoszóma rendellenesség indukciójára vonatkozó, szomatropinnal in vitro és in vivo végzett genotoxicitási vizsgálatok negatív eredményt mutattak. Tartósan szomatropinnal kezelt betegeknél, egy in vitro vizsgálat során, a bleomicin hatóanyagú radiomimetikus gyógyszer alkalmazását követően vett vérmintából a limfociták vizsgálata fokozott kromószómatörékenységet mutatott. A megfigyelés klinikai jelentősége nem ismeretes. Egy másik, a szomatropinnal végzett vizsgálat során a hosszantartó szomatropinkezelésben részesült betegek limfocitáiban a kromoszóma-abnormalitás fokozódását nem igazolták. 16
17 6. GYÓGYSZERÉSZETI JELLEMZŐK 6.1 Segédanyagok felsorolása Por: glicin dinátrium-hidrogén-foszfát heptahidrát nátrium-dihidrogén-foszfát dihidrát Oldószer: injekcióhoz való víz 6.2 Inkompatibilitások Kompatibilitási vizsgálatok hiányában ez a gyógyszer nem keverhető más gyógyszerekkel. 6.3 Felhasználhatósági időtartam 2 év. Eltarthatóság feloldást követően Elkészítést követően mikrobiológiai szempontból ajánlott azonnal felhasználni, annak ellenére, hogy az eredeti csomagolásban, 2 C - 8 C hőmérsékleten, 24 óráig tárolt injekciós oldat stabilitását igazolták. Hűtve (2 C - 8 C) tárolandó és szállítandó. Nem fagyasztható! A fénytől való védelem érdekében az eredeti csomagolásban tárolandó. 6.4 Különleges tárolási előírások Bontatlan injekciós üveg Hűtve tárolandó és szállítandó (2 C - 8 C). Nem fagyasztható! A fénytől való védelem érdekében az eredeti csomagolásban tárolandó. A felhasználásra kész gyógyszere vonatkozó tárolási előírásokat lásd a 6.3 pontban. 6.5 Csomagolás típusa és kiszerelése Por (I-es típusú) injekciós üvegben, (fluor gyantával laminált) butil gumidugóval lezárva, (alumínium) szalaggal és (lila, lepattintható polipropilén) kupakkal rögzítve, valamint 1 ml oldószer (I-es típusú) injekciós üvegben, (fluor gyantával laminált klorobutil elasztomer) dugóval lezárva, (lakozott aluminium) szalaggal és (fehér polipropilén lepattintható) kupakkal ellátva. 1 egységes kiszerelés. 6.6 A megsemmisítésre vonatkozó különleges óvintézkedések és egyéb, a készítmény kezelésével kapcsolatos információk Az Omnitrope 1,3 mg/ml készítmény két injekciós üvegben található; az egyik injekciós üveg a por hatóanyagot, a másik egyszerhasználatos injekciós üveg pedig az oldószert tartalmazza. Valamennyi injekciós üveg tartalmát kizárólag a hozzá tartozó oldószerben lehet feloldani. Az elkészített oldatot, steril, egyszerhasználatos fecskendővel kell beadni. A következő rész a feloldás és beadás általános leírását tartalmazza. A készítmény feloldása során kövesse a helyes klinikai gyakorlatot, különös tekintettel az aszepszisre. 1. Mosson kezet! 2. Pattintsa le az injekciós üveg műanyag védőkupakját! 3. A kontamináció elkerülése érdekében törölje le az injekciós üvegek felső részét fertőtlenítő oldattal! 4. Az összes oldószert steril, egyszerhasználatos fecskendővel (pl. 2 ml-es fecskendővel) és tűvel (pl. 0,33 mm x 12,7 mm) szívja ki az injekciós üvegből! 17
18 5. Fogja meg a port tartalmazó injekciós üveget, szúrja keresztül a tűt a gumidugón, és injektálja bele az oldatot lassan, az injekciós üveg fala mentén, így elkerülhető a habzás! 6. Óvatosan mozgassa meg néhányszor az injekciós üveget, hogy elősegítse az oldódást! Ne rázza fel, mert ezzel a hatóanyag denaturálódhat! 7. Ha az oldat zavaros vagy szemcséket tartalmaz, nem szabad felhasználni! Az elkészített oldatnak tisztának és színtelennek kell lennie! 8. Fordítsa az injekciós üveget fejjel lefelé, és megfelelő méretű, steril, egyszerhasználatos fecskendővel (pl. 1 ml-es fecskendő) és tűvel (pl. 0,25 mm x 8 mm) szívjon fel a szükséges dózisnál valamivel nagyob mennyiséget a fecskendőbe! Távolítsa el a légbuborékokat a fecskendőből. Állítsa be a fecskendőn a kívánt mennyiséget! 9. Tisztítsa meg az injekció helyét alkoholos vattával és subcutan adja be a készítményt! Az oldat csak egyszeri használatra való. Bármilyen fel nem használt készítmény, illetve hulladékanyag megsemmisítését a gyógyszerekre vonatkozó előírások szerint kell végrehajtani. 7. A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA Sandoz GmbH Biochemiestrasse 10 A-6250 Kundl Ausztria 8. A FORGALOMBA HOZATALI ENGEDÉLY SZÁMA EU/1/06/332/ A FORGALOMBA HOZATALI ENGEDÉLY ELSŐ KIADÁSÁNAK/ MEGÚJÍTÁSÁNAK DÁTUMA A forgalomba hozatali engedély első kiadásának dátuma: április 12. A forgalomba hozatali engedély legutóbbi megújításának dátuma: április A SZÖVEG ELLENŐRZÉSÉNEK DÁTUMA <{ÉÉÉÉ.HH.> 18
19 1. A GYÓGYSZER NEVE Omnitrope 5 mg/ml por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Elkészítést követően egy injekciós üveg 5 mg (15 NE) szomatropint* tartalmaz, mely 1 ml-nek felel meg. * genetikailag módosított Escherichia coli törzs ben, rekombináns DNS technológiával előállítva Ismert hatású segédanyag(ok): Feloldást követően egy milliliter 15 mg benzil-alkoholt tartalmaz. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA Por és oldószer oldatos injekcióhoz. A por fehér színű. Az oldószer átlátszó és színtelen. 4. KLINIKAI JELLEMZŐK 4.1 Terápiás javallatok Csecsemők, gyermekek és serdülők - A növekedési hormon nem megfelelő szekréciója miatt bekövetkező növekedési zavarok (növekedési hormon-hiány [growth hormone deficiency] GHD). - Turner-szindrómával társult növekedési zavar. - Krónikus veseelégtelenséggel társult növekedési zavar. - A gesztációs korhoz képest kicsinek (small for gestational age SGA) született gyermekek/serdülők növekedési zavara (aktuális testmagasság standard deviációs pontszáma [standard deviation score SDS] < -2,5, a szülői korrigált testmagasság SDS < -1), akiknek születési súlya és/vagy testmagassága -2 SD (standard deviáció) alatti, és akik 4 éves korukra vagy később sem zárkóznak fel kortársaikhoz (növekedési ütem [height velocity HV] SDS < 0 a megelőző 4 év folyamán). - Prader-Willi-szindróma (PWS) esetén a növekedés és testfelépítés elősegítése. A PWS diagnózisát megfelelő genetikai vizsgálatnak kell alátámasztania. Felnőttek - Felnőttek hormonpótló terápiája kifejezett növekedési hormon-hiány esetén. - Felnőttkorban kezdődő: Ismert, hypothalamus- vagy hypophysis-rendellenesség eredményeként többféle hormonhiánnyal összefüggő súlyos növekedési hormon-hiányban szenvedő betegek, akiknél a hypophysishormonok közül legalább egynek (kivéve a prolaktint) a hiánya áll fenn. Ezen betegeknél megfelelő dinamikus vizsgálatot kell végezni a növekedési hormon-hiány fennállásának vagy kizárásának megállapítására. - Gyermekkorban kezdődő: Azok a betegek, akik veleszületett, genetikai, szerzett vagy idiopathias ok következtében voltak növekedési hormon-hiányosak gyermekkorukban. Gyermekkorban kezdődő GHD-ban szenvedő betegeknél a hossznövekedés befejeződésével újból értékelni kell a beteg növekedési hormon-elválasztási kapacitását. Azoknál a betegeknél, akiknél nagy a valószínűsége a perzisztáló GHD-nak, például veleszületett ok miatt, vagy ha a GHD szekunder módon, valamilyen hypophysis-/hypothalamus-betegség vagy -inzultus következtében áll fenn, akkor a növekedési hormonnal végzett, legalább 4 hétig tartó kezelést 19
20 követően az inzulinszerű növekedési faktor I (IGF-I) SDS <-2 értéke elegendő bizonyítékul szolgál a GHD egyértelmű jelenlétére. Minden más betegnél az IGF-I meghatározása és egy növekedési hormon-stimulációs teszt elvégzése szükséges. 4.2 Adagolás és alkalmazás A diagnózis felállítását, a szomatropin-terápia kezdeményezését és ellenőrzését olyan orvosnak kell végeznie, aki megfelelően képzett és tapasztalt a növekedési zavarokban szenvedő betegek diagnózisának felállításában és kezelésében. Adagolás Gyermekek Az adagolást és alkalmazást egyedileg kell meghatározni. Pediátriai betegek növekedési zavara a növekedési hormon elégtelen termelődése következtében Szokásos adagja 0,025-0,035 mg/testtömeg-kilogramm/nap vagy 0,7-1,0 mg/testfelület m 2 /nap. Ennél nagyobb adagok alkalmazása is ismert. Amikor a gyermekkori GHD serdülőkorban is perzisztál, akkor a teljes testi kifejlődés (például testösszetétel, csonttömeg) elérése érdekében folytatni kell a kezelést. Monitorozáshoz a T-score>-1 (amelyet a kettős energiájú röntgen-abszorpciometriával meghatározott, a nemet és etnikumot figyelembe vevő, az átlagos felnőttkori maximális csonttömeghez standardizálva adnak meg) értéke által meghatározott maximális csonttömeg elérése alkalmazható, ami egyben az egyik terápiás célkitűzés is ebben az átmeneti időszakban. Az adagolással kapcsolatos útmutatásért lásd az alábbi, felnőttekre vonatkozó részt. Prader-Willi-szindróma, a növekedés és testépítés elősegítése pediátriai betegeknél Szokásos ajánlott adagja 0,035 mg/testtömeg-kilogramm/nap vagy 1,0 mg/testfelület m 2 /nap. A napi adag nem haladhatja meg 2,7 mg-ot. Nem kezelhetők azok a pediátriai betegek, akiknél az éves növekedési ráta kisebb mint 1 cm és az epifízisek záródóban vannak. Turner-szindróma okozta növekedési zavar Ajánlott adagja 0,045-0,050 mg/testtömeg-kilogramm/nap vagy 1,4 mg/testfelület m 2 /nap. Növekedési zavar krónikus veseelégtelenség esetén Szokásos ajánlott adagja 0,045-0,050 mg/testtömeg-kilogramm/nap (1,4 mg/testfelület m 2 /nap). Nagyobb adagok alkalmazása is szükségessé válhat, amennyiben a növekedési sebesség túl lassú. Hathavi kezelés után dóziskorrekció válhat szükségessé (lásd 4.4 pont). A gesztációs korhoz képest kicsinek született gyermekek növekedési zavara (SGA) Az ajánlott dózis 0,035 mg/testtömeg-kilogramm/nap (1 mg/testfelület m 2 /nap) a végső testmagasság eléréséig (lásd 5.1 pont). A kezelést a terápia első éve után be kell fejezni, ha a növekedési sebesség SDS +1 alatt van. A kezelést akkor is meg kell szakítani, ha a növekedés üteme < 2 cm/év és, ha szükséges, igazolni kell, hogy az epifízis fugák záródása tekintetében a csontkor meghaladja lányoknál a 14, fiúknál a 16 évet. 20
21 Adagolási javallatok pediátriai betegeknél Javallat mg/testtömeg-kilogramm/nap mg/testfelület-m 2 /nap Növekedési hormon-hiány gyermekeknél 0,025 0,035 0,7 1,0 Prader-Willi-szindróma gyermekeknél 0,035 1,0 Turner-szindróma 0,045 0,050 1,4 Krónikus veseelégtelenség 0,045 0,050 1,4 Gesztációs korhoz képest kicsinek született gyermekek/serdülők (SGA) 0,035 1,0 Növekedési hormon-hiány felnőtt betegeknél Azoknál a betegeknél, akik a gyermekkori GHD-t követően is folytatják a növekedési hormon alkalmazását, a terápia újrakezdéséhez ajánlott adag 0,2-0,5 mg/nap. Az adagot a beteg egyéni igényeinek megfelelően, fokozatosan kell emelni vagy csökkenteni, alapul véve a beteg IGF-I koncentrációját. Felnőttkorban kezdődő GHD esetén a kezelést alacsony dózissal, 0,15-0,3 mg napi adaggal kell kezdeni. Az adagot a beteg egyéni igényeinek megfelelően, fokozatosan kell emelni, alapul véve a beteg IGF-I koncentrációját. A kezelés célja mindkét esetben az, hogy az inzulinszerű növekedési faktor 1 (IGF-I) szérumkoncentrációi az életkorral korrigált értékekhez képest 2 SDS-n belül legyenek. A kezelés megkezdésénél normál IGF-I koncentrációval rendelkező, 2 SDS-t el nem érő betegeknek az IGF-I normálértékének felső határáig kell a növekedési hormont adagolni. A klinikai válasz és a mellékhatások szintén használhatók a dózistitrálás útmutatójaként. Ismeretes, hogy vannak olyan GHD-s betegek, akiknél a jó klinikai válasz ellenére nem normalizálódik az IGF-I szintje, éppen ezért nem szükséges náluk az adag emelése. A napi fenntartó adag ritkán haladja meg az 1,0 mg-ot. A nőknek magasabb dózisra lehet szükségük, mint a férfiaknak, akiknél idővel megnövekedett IGF-I érzékenység tapasztalható. Ez azzal a veszéllyel jár, hogy a nők, különösen akik orális ösztrogén terápiában részesülnek, alulkezeltek, míg a férfiakat túldozírozzák. A növekedési hormon pontos adagolását ezért 6 havonta ellenőrizni kell. Mivel a növekedési hormon normál fiziológiás termelődése általában az életkorral csökken, a szükséges terápiás adag redukálódhat. Különleges betegpopulációk Idősek 60 év feletti betegeknél a kezelést 0,1-0,2 mg/nap adaggal kell kezdeni, amelyet aztán a beteg egyedi igényeihez igazodva, lassan kell növelni. A legkisebb hatásos adagot kell alkalmazni. Ezeknél a betegeknél a fenntartó adag ritkán haladja meg a 0,5 mg/nap értéket. Az alkalmazás módja Az injekciót szubkután kell beadni, és a beadás helyét a lipoatrophia elkerülése céljából változtatni kell. A gyógyszer alkalmazására és kezelésére vonatkozó utasításokat lásd a 6.6 pontban. 4.3 Ellenjavallatok A hatóanyaggal vagy a készítmény bármely segédanyagával szembeni túlérzékenység. Tilos szomatropin alkalmazása, ha bizonyíték van valamilyen tumor aktivitására. Bármilyen intracranialis tumornak inaktívnak kell lennie, továbbá a GH kezelés csak a tumor-ellenes terápia befejezését követően kezdhető el. Ha bizonyíték van a tumor növekedésére, akkor a kezelést be kell fejezni. Tilos szomatropin alkalmazása a növekedés elősegítésére záródott epifízisű gyermekek esetén. 21
* genetikailag módosított Escherichia coli törzsben, rekombináns DNS technológiával előállítva
 1. A GYÓGYSZER MEGNEVEZÉSE Omnitrope 5 mg/1,5 ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Az oldat ml-enként 3,3 mg (10 NE) szomatropint tartalmaz* Egy patron 1,5 ml térfogatban 5 mg (15 NE)
1. A GYÓGYSZER MEGNEVEZÉSE Omnitrope 5 mg/1,5 ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Az oldat ml-enként 3,3 mg (10 NE) szomatropint tartalmaz* Egy patron 1,5 ml térfogatban 5 mg (15 NE)
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Omnitrope 1,3 mg/ml por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml kész szuszpenzió 1,3 mg (4 NE) szomatropint*
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Omnitrope 1,3 mg/ml por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml kész szuszpenzió 1,3 mg (4 NE) szomatropint*
Az állapot súlyosságától függően prekóma vagy kóma esetében 24 óra alatt az adag 8 ampulláig emelhető.
 1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
1. A GYÓGYSZER NEVE. GENOTROPIN 5,3 mg por és oldószer oldatos injekcióhoz GENOTROPIN 12 mg por és oldószer oldatos injekcióhoz
 1. A GYÓGYSZER NEVE GENOTROPIN 5,3 mg por és oldószer oldatos injekcióhoz GENOTROPIN 12 mg por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Genotropin 5,3 mg por és oldószer oldatos
1. A GYÓGYSZER NEVE GENOTROPIN 5,3 mg por és oldószer oldatos injekcióhoz GENOTROPIN 12 mg por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Genotropin 5,3 mg por és oldószer oldatos
Salmonella typhi (Ty2 törzs) Vi poliszacharidja
 1. A GYÓGYSZER NEVE Typherix oldat injekcióhoz előretöltött fecskendőben Hastífusz elleni poliszacharid vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina egy adagjának (0,5 ml) tartalma: Salmonella
1. A GYÓGYSZER NEVE Typherix oldat injekcióhoz előretöltött fecskendőben Hastífusz elleni poliszacharid vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina egy adagjának (0,5 ml) tartalma: Salmonella
A Kockázatkezelési Terv Összefoglalója
 1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
Az oldat tartalma milliliterenként: humán plazmaprotein... 200 mg (legalább 98%-os tisztaságú IgG)
 1. A GYÓGYSZER MEGNEVEZÉSE Hizentra 200 mg/ml oldatos injekció bőr alá történő beadásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán normál immunglobulin (SCIg). Az oldat tartalma milliliterenként: humán
1. A GYÓGYSZER MEGNEVEZÉSE Hizentra 200 mg/ml oldatos injekció bőr alá történő beadásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán normál immunglobulin (SCIg). Az oldat tartalma milliliterenként: humán
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Mixtard 30 40 nemzetközi egység/ml szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 injekciós üveg 10 ml-t tartalmaz, ami 400 NE-gel egyenértékű.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Mixtard 30 40 nemzetközi egység/ml szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 injekciós üveg 10 ml-t tartalmaz, ami 400 NE-gel egyenértékű.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Ecoporc SHIGA szuszpenziós injekció sertések számára 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml-es adagonként
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Ecoporc SHIGA szuszpenziós injekció sertések számára 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml-es adagonként
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE NutropinAq 10 mg/2 ml (30 NE) oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy milliliter oldat 5 mg szomatropint* tartalmaz. 10 mg (30 NE)
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE NutropinAq 10 mg/2 ml (30 NE) oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy milliliter oldat 5 mg szomatropint* tartalmaz. 10 mg (30 NE)
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
Nemekre szabott terápia: NOCDURNA
 Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
III. melléklet. Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások
 III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
Betegtájékoztató NUTROPINAQ 10 MG/2 ML (30 NE) OLDATOS INJEKCIÓ. NutropinAq 10 mg/2 ml oldatos injekció patronban.
 NUTROPINAQ 10 MG/2 ML (30 NE) OLDATOS INJEKCIÓ NutropinAq 10 mg/2 ml oldatos injekció patronban. Rekombináns DNS technológiával (Escherichia coli) elõállított szomatropin (INN). A NutropinAq hatóanyaga
NUTROPINAQ 10 MG/2 ML (30 NE) OLDATOS INJEKCIÓ NutropinAq 10 mg/2 ml oldatos injekció patronban. Rekombináns DNS technológiával (Escherichia coli) elõállított szomatropin (INN). A NutropinAq hatóanyaga
III. melléklet. Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai. Megjegyzés:
 III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai Megjegyzés: Az alkalmazási előírás, a címke és a betegtájékoztató a referál eljárás eredménye. Lehetséges,
III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai Megjegyzés: Az alkalmazási előírás, a címke és a betegtájékoztató a referál eljárás eredménye. Lehetséges,
B/Brisbane/60/2008 15,0 mikrogramm HA**
 1. A GYÓGYSZER MEGNEVEZÉSE Influvac szuszpenziós injekció előretöltött fecskendőben (2010/2011) 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy 0,5 ml-es adag vakcina az alábbi törzsekhez tartozó influenzavírusok
1. A GYÓGYSZER MEGNEVEZÉSE Influvac szuszpenziós injekció előretöltött fecskendőben (2010/2011) 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy 0,5 ml-es adag vakcina az alábbi törzsekhez tartozó influenzavírusok
Betegtájékoztató HUMATROPE 18 NE (6 MG) INJEKCIÓ PATRONBAN
 HUMATROPE 18 NE (6 MG) INJEKCIÓ PATRONBAN Humatrope 18 NE (6 mg) injekció patronban Humatrope 36 NE (12 mg) injekció patronban Humatrope 72 NE (24 mg) injekció patronban szomatropin HATÓANYAG: szomatropin.
HUMATROPE 18 NE (6 MG) INJEKCIÓ PATRONBAN Humatrope 18 NE (6 mg) injekció patronban Humatrope 36 NE (12 mg) injekció patronban Humatrope 72 NE (24 mg) injekció patronban szomatropin HATÓANYAG: szomatropin.
ELLENJAVALLAT: Ne alkalmazza a VPRIV-et, ha allergiás a velagluceráz-alfára vagy a gyógyszer egyéb összetevõjére.
 VPRIV 400 EGYSÉG POR OLDATOS INFÚZIÓHOZ VPRIV 400 egység por oldatos infúzióhoz velagluceráz-alfa HATÓANYAG: Velagluceráz-alfa. A 400 egység VPRIV port tartalmazó injekciós üveg 400 egység velagluceráz-alfát
VPRIV 400 EGYSÉG POR OLDATOS INFÚZIÓHOZ VPRIV 400 egység por oldatos infúzióhoz velagluceráz-alfa HATÓANYAG: Velagluceráz-alfa. A 400 egység VPRIV port tartalmazó injekciós üveg 400 egység velagluceráz-alfát
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Eporatio 1000 NE /0,5 ml oldatos injekció előretöltött fecskendőben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Előretöltött fecskendőnként 1000 nemzetközi
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Eporatio 1000 NE /0,5 ml oldatos injekció előretöltött fecskendőben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Előretöltött fecskendőnként 1000 nemzetközi
Az Insuman Rapid egy semleges inzulin oldat (reguláris inzulin)
 1. A GYÓGYSZER MEGNEVEZÉSE Insuman Rapid 100 NE/ml oldatos injekció injekciós üvegben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 NE humán inzulin (mely 3,5 mg-mal egyenértékű) mililiterenként. Az injekciós
1. A GYÓGYSZER MEGNEVEZÉSE Insuman Rapid 100 NE/ml oldatos injekció injekciós üvegben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 NE humán inzulin (mely 3,5 mg-mal egyenértékű) mililiterenként. Az injekciós
942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát mg nátrium-klorid) filmtablettánként.
 1. A GYÓGYSZER MEGNEVEZÉSE Dona 750 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát + 192 mg nátrium-klorid) filmtablettánként. A segédanyagok
1. A GYÓGYSZER MEGNEVEZÉSE Dona 750 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát + 192 mg nátrium-klorid) filmtablettánként. A segédanyagok
MELLÉKLET FELTÉTELEK VAGY KORLÁTOZÁSOK, TEKINTETTEL A GYÓGYSZER BIZTONSÁGOS ÉS HATÁSOS HASZNÁLATÁRA, MELYEKET A TAGÁLLAMOKNAK TELJESÍTENIÜK KELL
 MELLÉKLET FELTÉTELEK VAGY KORLÁTOZÁSOK, TEKINTETTEL A GYÓGYSZER BIZTONSÁGOS ÉS HATÁSOS HASZNÁLATÁRA, MELYEKET A TAGÁLLAMOKNAK TELJESÍTENIÜK KELL FELTÉTELEK VAGY KORLÁTOZÁSOK, TEKINTETTEL A GYÓGYSZER BIZTONSÁGOS
MELLÉKLET FELTÉTELEK VAGY KORLÁTOZÁSOK, TEKINTETTEL A GYÓGYSZER BIZTONSÁGOS ÉS HATÁSOS HASZNÁLATÁRA, MELYEKET A TAGÁLLAMOKNAK TELJESÍTENIÜK KELL FELTÉTELEK VAGY KORLÁTOZÁSOK, TEKINTETTEL A GYÓGYSZER BIZTONSÁGOS
Maprelin. Maprelin 75µg/ml oldat injekciós sertések számára A.U.V. Biotechnikai felhasználásra, csoportok vagy állományok kezelésére.
 Maprelin Maprelin 75µg/ml oldat injekciós sertések számára A.U.V Biotechnikai felhasználásra, csoportok vagy állományok kezelésére. Maprelin 75 μg/ml 1.A FORGALOMBA HOZATALI ENGEDÉLY JOOSULTJÁNAK, TOVÁBBÁ
Maprelin Maprelin 75µg/ml oldat injekciós sertések számára A.U.V Biotechnikai felhasználásra, csoportok vagy állományok kezelésére. Maprelin 75 μg/ml 1.A FORGALOMBA HOZATALI ENGEDÉLY JOOSULTJÁNAK, TOVÁBBÁ
Humán inzulin, rdns (rekombináns DNS technológiával, Saccharomyces cerevisiae-ben előállított).
 1. A GYÓGYSZER MEGNEVEZÉSE Actraphane 30 InnoLet 100 NE/ml szuszpenziós injekció előretöltött injekciós tollban 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán inzulin, rdns (rekombináns DNS technológiával,
1. A GYÓGYSZER MEGNEVEZÉSE Actraphane 30 InnoLet 100 NE/ml szuszpenziós injekció előretöltött injekciós tollban 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán inzulin, rdns (rekombináns DNS technológiával,
A gyermekek növekedése és fejlődése
 A gyermekek növekedése és fejlődése Körner Anna Gyermekpszichiáter rezidensképzés, 2006. Alacsonynövés Testmagasság a korspecifikus 3-as percentilis (-2 SD) alatt Lassú növekedés A növekedési sebesség
A gyermekek növekedése és fejlődése Körner Anna Gyermekpszichiáter rezidensképzés, 2006. Alacsonynövés Testmagasság a korspecifikus 3-as percentilis (-2 SD) alatt Lassú növekedés A növekedési sebesség
500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb flavonoidot tartalmaz).
 1. A GYÓGYSZER NEVE VenoprotEP 500 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb
1. A GYÓGYSZER NEVE VenoprotEP 500 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb
Alsó és felső részén fehér, átlátszatlan, 4-es méretű, kemény zselatin kapszula, amely 155 mg fehér színű, szagtalan port tartalmaz.
 1. A GYÓGYSZER NEVE Tramalgic 50 mg kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: 50 mg tramadol-hidroklorid kapszulánként. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA
1. A GYÓGYSZER NEVE Tramalgic 50 mg kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: 50 mg tramadol-hidroklorid kapszulánként. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Tresiba 100 egység/ml oldatos injekció előretöltött injekciós tollban 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml oldat 100 egység degludek inzulint
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Tresiba 100 egység/ml oldatos injekció előretöltött injekciós tollban 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml oldat 100 egység degludek inzulint
40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban).
 1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE. Remacycline L.A. 200 mg/ml oldatos injekció A.U.V. Oxitetraciklin 2. HATÓ- ÉS SEGÉDANYAGOK MEGNEVEZÉSE
 A KÜLSŐ CSOMAGOLÁSON ÉS A KÖZVETLEN CSOMAGOLÁSON FELTÜNTETENDŐ ADATOK Papírdoboz 50 ml-es, 100 ml-es, 250 ml-es és 500 ml-es injekciós üvegnek és címke 100 ml, 250 ml, 500 ml üvegre 1. AZ ÁLLATGYÓGYÁSZATI
A KÜLSŐ CSOMAGOLÁSON ÉS A KÖZVETLEN CSOMAGOLÁSON FELTÜNTETENDŐ ADATOK Papírdoboz 50 ml-es, 100 ml-es, 250 ml-es és 500 ml-es injekciós üvegnek és címke 100 ml, 250 ml, 500 ml üvegre 1. AZ ÁLLATGYÓGYÁSZATI
VeyFo. VeyFo Jungtier - Oral Mulgat
 VeyFo VeyFo Jungtier - Oral Mulgat Különleges táplálási igényeket kielégítő/diétás/ kiegészítő takarmány borjak, malacok, bárányok, kecskegidák és kutyák részére Használati utasítás Trimetox 240 oldat
VeyFo VeyFo Jungtier - Oral Mulgat Különleges táplálási igényeket kielégítő/diétás/ kiegészítő takarmány borjak, malacok, bárányok, kecskegidák és kutyák részére Használati utasítás Trimetox 240 oldat
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Allergodil orrspray 4. sz. melléklete az OGYI-T- 5334/01-04 sz. Forgalomba
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Allergodil orrspray 4. sz. melléklete az OGYI-T- 5334/01-04 sz. Forgalomba
Betegtájékoztató SAIZEN CLICK.EASY 8 MG POR ÉS OLDÓSZER O. Saizen click.easy 8 mg por és oldószer oldatos injekcióhoz szomatropin
 SAIZEN CLICK.EASY 8 MG POR ÉS OLDÓSZER O Saizen click.easy 8 mg por és oldószer oldatos injekcióhoz szomatropin HATÓANYAG: 8 mg szomatropin (rekombináns humán növekedési hormon). SEGÉDANYAG: Szacharóz,
SAIZEN CLICK.EASY 8 MG POR ÉS OLDÓSZER O Saizen click.easy 8 mg por és oldószer oldatos injekcióhoz szomatropin HATÓANYAG: 8 mg szomatropin (rekombináns humán növekedési hormon). SEGÉDANYAG: Szacharóz,
Átmenet a gyermekkorból - felnőttkori növekedési hormon kezelés
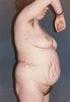 Átmenet a gyermekkorból - felnőttkori növekedési hormon kezelés Dr. Magony Sándor Szegedi Tudományegyetem Általános Orvostudományi Kar SzentGyörgyi Albert Általános és Gyógyszerésztudományi Centrum Endokrinológiai
Átmenet a gyermekkorból - felnőttkori növekedési hormon kezelés Dr. Magony Sándor Szegedi Tudományegyetem Általános Orvostudományi Kar SzentGyörgyi Albert Általános és Gyógyszerésztudományi Centrum Endokrinológiai
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1/33 1. A GYÓGYSZER MEGNEVEZÉSE Resolor 1 mg-os filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 mg prukaloprid filmtablettánként (prukaloprid-szukcinát formájában).
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1/33 1. A GYÓGYSZER MEGNEVEZÉSE Resolor 1 mg-os filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 mg prukaloprid filmtablettánként (prukaloprid-szukcinát formájában).
A Puregon-kezelést a fertilitási problémák kezelésében jártas orvos felügyelete alatt kell elkezdeni.
 1. A GYÓGYSZER MEGNEVEZÉSE Puregon 200 NE/0,5 ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 NE rekombináns follikulus stimuláló hormon (FSH) tartalmaz 0,5 ml vizes oldatban.
1. A GYÓGYSZER MEGNEVEZÉSE Puregon 200 NE/0,5 ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 NE rekombináns follikulus stimuláló hormon (FSH) tartalmaz 0,5 ml vizes oldatban.
6 mg szumatriptán (8,4 mg szumatriptán-szukcinát formájában) izotóniás oldatban, előretöltött injekciós patronban (0,5 ml).
 1. A GYÓGYSZER NEVE Imigran oldatos injekció + autoinjektor 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 6 mg szumatriptán (8,4 mg szumatriptán-szukcinát formájában) izotóniás oldatban, előretöltött injekciós
1. A GYÓGYSZER NEVE Imigran oldatos injekció + autoinjektor 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 6 mg szumatriptán (8,4 mg szumatriptán-szukcinát formájában) izotóniás oldatban, előretöltött injekciós
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humalog 100 Egység/ml oldatos injekció üvegben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 2.1 Általános leírás A Humalog steril, tiszta, színtelen, vizes
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humalog 100 Egység/ml oldatos injekció üvegben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 2.1 Általános leírás A Humalog steril, tiszta, színtelen, vizes
Kenőcs A kenőcs különösen alkalmas a száraz, lichenifikált és pikkelyesen hámló elváltozásokra.
 1. A GYÓGYSZER NEVE Dermovate krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg klobetazol-propionát 1 g 0,05%-os kenőcsben. Dermovate krém 0,5 mg klobetazol-propionát 1 g 0,05%-os krémben. A segédanyagok
1. A GYÓGYSZER NEVE Dermovate krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg klobetazol-propionát 1 g 0,05%-os kenőcsben. Dermovate krém 0,5 mg klobetazol-propionát 1 g 0,05%-os krémben. A segédanyagok
Betegtájékoztató PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ. Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát
 PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát HATÓANYAG: Milliliterenként 15 mg dinátrium-pamidronát (ami megfelel 12,6 mg pamidronsavnak).
PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát HATÓANYAG: Milliliterenként 15 mg dinátrium-pamidronát (ami megfelel 12,6 mg pamidronsavnak).
I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Melovem 5 mg/ml oldatos injekció szarvasmarháknak és sertéseknek 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Melovem 5 mg/ml oldatos injekció szarvasmarháknak és sertéseknek 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
A Boostrix Polio diphtheria, tetanus, pertussis és poliomyelitis elleni emlékeztető oltásra javasolt 4 éves kortól (lásd 4.2 pont).
 1. A GYÓGYSZER NEVE Boostrix Polio szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus, pertussis (acelluláris összetevő) és (inaktivált) poliomyelitis vakcina (adszorbeált, csökkentett
1. A GYÓGYSZER NEVE Boostrix Polio szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus, pertussis (acelluláris összetevő) és (inaktivált) poliomyelitis vakcina (adszorbeált, csökkentett
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
1. A GYÓGYSZER NEVE 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL. 1 adag (1 ml) tartalma: Hepatitisz B felszíni antigén 1,2. 20 mikrogramm
 1. A GYÓGYSZER NEVE Engerix-B szuszpenziós injekció felnőtteknek Engerix-B szuszpenziós injekció előretöltött fecskendőben felnőtteknek Hepatitisz B (rekombináns DNS) vakcina (adszorbeált) (HBV) 2. MINŐSÉGI
1. A GYÓGYSZER NEVE Engerix-B szuszpenziós injekció felnőtteknek Engerix-B szuszpenziós injekció előretöltött fecskendőben felnőtteknek Hepatitisz B (rekombináns DNS) vakcina (adszorbeált) (HBV) 2. MINŐSÉGI
Nanosomia A kivizsgálás indikációi, irányai. Dr. Halász Zita egyetemi docens Semmelweis Egyetem I. sz. Gyermekklinika, Budapest
 Nanosomia A kivizsgálás indikációi, irányai Dr. Halász Zita egyetemi docens Semmelweis Egyetem I. sz. Gyermekklinika, Budapest Az ideális növekedés alapfeltétele adequat táplálkozás, energia bevitel krónikus
Nanosomia A kivizsgálás indikációi, irányai Dr. Halász Zita egyetemi docens Semmelweis Egyetem I. sz. Gyermekklinika, Budapest Az ideális növekedés alapfeltétele adequat táplálkozás, energia bevitel krónikus
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Termék neve (gyártó megnevezése) BETEGTÁJÉKOZTTÓ Mielőtt elkezdené gyógyszerét
FIGYELEM!!! alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Termék neve (gyártó megnevezése) BETEGTÁJÉKOZTTÓ Mielőtt elkezdené gyógyszerét
PGF Veyx. PGF Veyx 0,0875 mg/ml injekció szarvasmarháknak és sertéseknek A.U.V. Tervezett idejű ivarzás és ovuláció kiváltása
 PGF Veyx PGF Veyx 0,0875 mg/ml injekció szarvasmarháknak és sertéseknek A.U.V Tervezett idejű ivarzás és ovuláció kiváltása Vetélés kiváltása a vemhesség 150. napjáig Az ellés megindítása PGF Veyx 0,0875
PGF Veyx PGF Veyx 0,0875 mg/ml injekció szarvasmarháknak és sertéseknek A.U.V Tervezett idejű ivarzás és ovuláció kiváltása Vetélés kiváltása a vemhesség 150. napjáig Az ellés megindítása PGF Veyx 0,0875
PPI VÉDELEM A KEZELÉS SORÁN
 75 mg diclofenák-nátrium, 20 mg omeprazol módosított hatóanyag-leadású kemény kapszula PPI VÉDELEM A KEZELÉS SORÁN Jelentős fájdalom- és gyulladáscsökkentő hatás 1 Savkontroll az omeprazol segítségével
75 mg diclofenák-nátrium, 20 mg omeprazol módosított hatóanyag-leadású kemény kapszula PPI VÉDELEM A KEZELÉS SORÁN Jelentős fájdalom- és gyulladáscsökkentő hatás 1 Savkontroll az omeprazol segítségével
314 mg kristályos glükózamin-szulfát (250 mg glükózamin-szulfát + 64 mg nátrium-klorid) kapszulánként.
 1. A GYÓGYSZER MEGNEVEZÉSE Dona 250 mg kemény kapszula Dona 1500 mg por belsőleges oldathoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Dona 250 mg kemény kapszula 314 mg kristályos glükózamin-szulfát (250 mg
1. A GYÓGYSZER MEGNEVEZÉSE Dona 250 mg kemény kapszula Dona 1500 mg por belsőleges oldathoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Dona 250 mg kemény kapszula 314 mg kristályos glükózamin-szulfát (250 mg
Egy immunizáló dózis (0,5 ml) 1,5 μg inaktivált kullancsencephalitis-vírust (törzs K23; csirkeembrio fibroblast sejtkultúrán tenyésztett) tartalmaz.
 1. A GYÓGYSZER NEVE ENCEPUR ADULTS szuszpenziós injekció előretöltött fecskendőben kullancsencephalitis vakcina, inaktivált. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy immunizáló dózis (0,5 ml) 1,5 μg inaktivált
1. A GYÓGYSZER NEVE ENCEPUR ADULTS szuszpenziós injekció előretöltött fecskendőben kullancsencephalitis vakcina, inaktivált. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy immunizáló dózis (0,5 ml) 1,5 μg inaktivált
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Fabrazyme 35 mg por oldatos infúzióhoz való koncentrátumhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg Fabrazyme 35 mg névleges
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Fabrazyme 35 mg por oldatos infúzióhoz való koncentrátumhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg Fabrazyme 35 mg névleges
II. melléklet. Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása
 II. melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 7 Tudományos következtetések A Cymevene i.v. és kapcsolódó nevek (lásd I. melléklet)
II. melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 7 Tudományos következtetések A Cymevene i.v. és kapcsolódó nevek (lásd I. melléklet)
I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14
 I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14 1. AZ ÁLLATGYÓGYÁSZATI GYÓGYSZERKÉSZÍTMÉNY NEVE INCURIN 1 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: ösztriol 1 mg/tabletta
I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14 1. AZ ÁLLATGYÓGYÁSZATI GYÓGYSZERKÉSZÍTMÉNY NEVE INCURIN 1 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: ösztriol 1 mg/tabletta
I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása
 I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilancia Kockázatértékelő
I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilancia Kockázatértékelő
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Equilis West Nile szuszpenziós injekció lovak számára 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina adagonként
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Equilis West Nile szuszpenziós injekció lovak számára 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina adagonként
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Magnesium 250 mg Pharmavit pezsgőtabletta Magnesium Pharmavit 250 mg pezsgőtabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Magnesium 250 mg Pharmavit pezsgőtabletta Magnesium Pharmavit 250 mg pezsgőtabletta
1. A GYÓGYSZER NEVE 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL. 100 mikrogramm flutikazon-propionát (mikronizált) adagonként.
 1. A GYÓGYSZER NEVE Flixotide Diskus 100 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 250 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 500 mikrogramm/adag adagolt inhalációs por 2.
1. A GYÓGYSZER NEVE Flixotide Diskus 100 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 250 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 500 mikrogramm/adag adagolt inhalációs por 2.
Tudományos következtetések
 II. melléklet Tudományos következtetések, a forgalomba hozatali engedélyek visszavonásának illetve a forgalomba hozatali engedélyek feltételeit érintő változásnak az indoklása, valamint a PRAC ajánlásaitól
II. melléklet Tudományos következtetések, a forgalomba hozatali engedélyek visszavonásának illetve a forgalomba hozatali engedélyek feltételeit érintő változásnak az indoklása, valamint a PRAC ajánlásaitól
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE STELARA 45 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 45 mg/0,5 ml usztekinumab injekciós üvegenként. Az usztekinumab egér myeloma
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE STELARA 45 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 45 mg/0,5 ml usztekinumab injekciós üvegenként. Az usztekinumab egér myeloma
A Havrix megfelel az Egészségügyi Világszervezet (WHO) biológiai anyagokra előírt követelményeinek.
 1. A GYÓGYSZER MEGNEVEZÉSE Havrix 1440 Elisa Egység szuszpenziós injekció előretöltött fecskendőben Havrix 720 Elisa Egység Junior szuszpenziós injekció előretöltött fecskendőben Hepatitis A vakcina antigén
1. A GYÓGYSZER MEGNEVEZÉSE Havrix 1440 Elisa Egység szuszpenziós injekció előretöltött fecskendőben Havrix 720 Elisa Egység Junior szuszpenziós injekció előretöltött fecskendőben Hepatitis A vakcina antigén
Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye alapján jött létre.
 II. melléklet Az alkalmazási előírás és a betegtájékoztató módosítása az Európai Gyógyszerügynökség előterjesztésére Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye
II. melléklet Az alkalmazási előírás és a betegtájékoztató módosítása az Európai Gyógyszerügynökség előterjesztésére Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Sevelamer carbonate Zentiva 800 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy tabletta 800 mg szevelamer-karbonátot tartalmaz. A segédanyagok
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Sevelamer carbonate Zentiva 800 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy tabletta 800 mg szevelamer-karbonátot tartalmaz. A segédanyagok
KETTŐS EREJÉVEL GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ ORRDUGULÁS ORRFOLYÁS IBUPROFÉN ÉS PSZEUDOEFEDRIN A MEGFÁZÁS TÜNETEI ELLEN FEJFÁJÁS TOROKGYULLADÁS
 IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Xolair 75 mg por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 75 mg omalizumab injekciós üvegenként.
I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Xolair 75 mg por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 75 mg omalizumab injekciós üvegenként.
Alkalmazás: A tasakok tartalmát 125 ml vízben kell feloldani. Impaktálódott széklet esetén 8 tasakot lehet oldani 1 liter vízben.
 1. A GYÓGYSZER MEGNEVEZÉSE Moxalole por belsőleges oldathoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden egyes tasak az alábbi hatóanyagokat tartalmazza: Makrogol 3350 Nátrium-klorid Kálium-klorid Nátrium-hidrogénkarbonát
1. A GYÓGYSZER MEGNEVEZÉSE Moxalole por belsőleges oldathoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden egyes tasak az alábbi hatóanyagokat tartalmazza: Makrogol 3350 Nátrium-klorid Kálium-klorid Nátrium-hidrogénkarbonát
A Puregon-kezelést a fertilitási problémák kezelésében jártas orvos felügyelete alatt kell elkezdeni.
 1. A GYÓGYSZER MEGNEVEZÉSE Puregon 150 NE/0,18 ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy patron összesen nettó 150 NE rekombináns follikulus stimuláló hormon (FSH) adagot tartalmaz 0,18
1. A GYÓGYSZER MEGNEVEZÉSE Puregon 150 NE/0,18 ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy patron összesen nettó 150 NE rekombináns follikulus stimuláló hormon (FSH) adagot tartalmaz 0,18
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tabletta Magnesii Citrici 500 mg Fono VII. Parma Mielőtt elkezdené gyógyszerét
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tabletta Magnesii Citrici 500 mg Fono VII. Parma Mielőtt elkezdené gyógyszerét
4.3 Ellenjavallatok A terhesség második és harmadik trimesztere (lásd 4.4 és 4.6 pont) (Megjegyzés: szoptatásban nem ellenjavallt, lásd: 4.3 pont.
 ACE-gátlók és angiotenzin II antagonisták: alkalmazás terhességben és szoptatás alatt A PhVWP által 2008 októberben jóváhagyott alkalmazási előírás és betegtájékoztató szöveg ACE-gátlók Lisinopril, Fosinopril,
ACE-gátlók és angiotenzin II antagonisták: alkalmazás terhességben és szoptatás alatt A PhVWP által 2008 októberben jóváhagyott alkalmazási előírás és betegtájékoztató szöveg ACE-gátlók Lisinopril, Fosinopril,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
Betegtájékoztató: Információk a felhasználó számára. Rabipur por és oldószer oldatos injekcióhoz Inaktivált veszettség elleni vakcina
 Betegtájékoztató: Információk a felhasználó számára Rabipur por és oldószer oldatos injekcióhoz Inaktivált veszettség elleni vakcina Mielőtt beadnák Önnek vagy gyermekének a Rabipur-t, olvassa el figyelmesen
Betegtájékoztató: Információk a felhasználó számára Rabipur por és oldószer oldatos injekcióhoz Inaktivált veszettség elleni vakcina Mielőtt beadnák Önnek vagy gyermekének a Rabipur-t, olvassa el figyelmesen
Alkalmazási előírás. 4.2 Adagolás és alkalmazás. 4.3 Ellenjavallatok
 A Strattera (atomoxetine) hatásai a vérnyomásra és a szívfrekvenciára a forgalomba hozatali engedély jogosultja (MAH) által végzett klinikai vizsgálat adatainak felülvizsgálata alapján. Végleges SPC és
A Strattera (atomoxetine) hatásai a vérnyomásra és a szívfrekvenciára a forgalomba hozatali engedély jogosultja (MAH) által végzett klinikai vizsgálat adatainak felülvizsgálata alapján. Végleges SPC és
4.4 Különleges figyelmeztetések minden célállat fajra vonatkozóan
 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Flexicam 5 mg/ml oldatos injekció kutyáknak és macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy ml tartalmaz Hatóanyag: 5 mg meloxicam Segédanyagok: 150 mg vízmentes
1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Flexicam 5 mg/ml oldatos injekció kutyáknak és macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy ml tartalmaz Hatóanyag: 5 mg meloxicam Segédanyagok: 150 mg vízmentes
II. melléklet. Tudományos következtetések
 II. melléklet Tudományos következtetések 14 Tudományos következtetések A Haldol, amelynek hatóanyaga a haloperidol, a butirofenon csoportba tartozó antipszichotikum. Erős központi 2-es típusú dopamin receptor
II. melléklet Tudományos következtetések 14 Tudományos következtetések A Haldol, amelynek hatóanyaga a haloperidol, a butirofenon csoportba tartozó antipszichotikum. Erős központi 2-es típusú dopamin receptor
A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE
 ALKALMAZÁSI ELOÍRÁS 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE FOSAMAX 70 mg tabletta 2. MINOSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 70 mg alendronsavval egyenértéku 91,37 mg alendronát-nátrium-trihidrát tablettánként.
ALKALMAZÁSI ELOÍRÁS 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE FOSAMAX 70 mg tabletta 2. MINOSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 70 mg alendronsavval egyenértéku 91,37 mg alendronát-nátrium-trihidrát tablettánként.
I.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 I.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE ProZinc 40 NE/ml szuszpenziós injekció macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml tartalmaz:
I.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE ProZinc 40 NE/ml szuszpenziós injekció macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml tartalmaz:
Ez a gyógyszer orvosi vény nélkül kapható. Az optimális hatás érdekében azonban elengedhetetlen e gyógyszer körültekintő alkalmazása.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Coldastop orrcsepp PIL új BETEGTÁJÉKOZTATÓ Coldastop orrcsepp A-vitamin-palmitát
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Coldastop orrcsepp PIL új BETEGTÁJÉKOZTATÓ Coldastop orrcsepp A-vitamin-palmitát
Radioizotópos fájdalomcsillapítás MULTIBONE. in vivo készlet. 153 Sm-EDTMP és 90 Y-EDTMP. injekciók
 Radioizotópos fájdalomcsillapítás MULTIBONE in vivo készlet 153 Sm-EDTMP és 90 Y-EDTMP injekciók 153 Sm-MULTIBONE készlet (Sm-IK-26) összetétele 90 Y-MULTIBONE készlet (Y-IK-26) összetétele Multibone por
Radioizotópos fájdalomcsillapítás MULTIBONE in vivo készlet 153 Sm-EDTMP és 90 Y-EDTMP injekciók 153 Sm-MULTIBONE készlet (Sm-IK-26) összetétele 90 Y-MULTIBONE készlet (Y-IK-26) összetétele Multibone por
SEGÉDANYAG: Por: glicin (E 640), mannit (E421), vízmentes dinátrium-hidrogén-foszfát (E 339), vízmentes nátrium-dihidrogénfoszfát
 GENOTROPIN 5,3 MG POR ÉS OLDÓSZER OLDATOS INJEKCIÓHOZ GENOTROPIN 5,3 mg por és oldószer oldatos injekcióhoz szomatropin HATÓANYAG: Szomatropin*. Egy injekciós patron 5,3 mg (16 NE) szomatropint* tartalmaz.
GENOTROPIN 5,3 MG POR ÉS OLDÓSZER OLDATOS INJEKCIÓHOZ GENOTROPIN 5,3 mg por és oldószer oldatos injekcióhoz szomatropin HATÓANYAG: Szomatropin*. Egy injekciós patron 5,3 mg (16 NE) szomatropint* tartalmaz.
MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZER HATÁSERŐSSÉG, ALKALMAZÁSI MÓD, A FORGALOMBA HOZATALI ENGEDÉLY KÉRELMEZŐI ÉS JOGOSULTJAI A TAGÁLLAMOKBAN
 I. MELLÉKLET MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZER HATÁSERŐSSÉG, ALKALMAZÁSI MÓD, A FORGALOMBA HOZATALI ENGEDÉLY KÉRELMEZŐI ÉS JOGOSULTJAI A TAGÁLLAMOKBAN Tagállam Forgalomba hozatali engedély jogosultja
I. MELLÉKLET MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZER HATÁSERŐSSÉG, ALKALMAZÁSI MÓD, A FORGALOMBA HOZATALI ENGEDÉLY KÉRELMEZŐI ÉS JOGOSULTJAI A TAGÁLLAMOKBAN Tagállam Forgalomba hozatali engedély jogosultja
III. melléklet. A kísérőiratok vonatkozó pontjaiba bevezetendő módosítások
 III. melléklet A kísérőiratok vonatkozó pontjaiba bevezetendő módosítások Megjegyzés: Ezen kísérőiratok annak a referál eljárásnak az eredményeként készültek, amelyre a Bizottság e döntése vonatkozik.
III. melléklet A kísérőiratok vonatkozó pontjaiba bevezetendő módosítások Megjegyzés: Ezen kísérőiratok annak a referál eljárásnak az eredményeként készültek, amelyre a Bizottság e döntése vonatkozik.
Kemény kapszula Fehér, átlátszatlan kemény kapsula, a kapszula alsó részén CYSTAGON 150, felső részén MYLAN felirattal.
 1. A GYÓGYSZER MEGNEVEZÉSE CYSTAGON 150 mg kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy kemény kapszula 150 mg ciszteamin-bitartarátot tartalmaz (merkaptamin-bitartarát formájában). A segédanyagok
1. A GYÓGYSZER MEGNEVEZÉSE CYSTAGON 150 mg kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy kemény kapszula 150 mg ciszteamin-bitartarátot tartalmaz (merkaptamin-bitartarát formájában). A segédanyagok
Flexove 625 mg Tabletta Szájon át történő alkalmazás 1327 Lysaker, Norvégia Belgium - Navamedic ASA Vollsveien 13 C 1327 Lysaker, Norvégia
 I. MELLÉKLET FELSOROLÁS: MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZERKÉSZÍTMÉNY- DÓZISOK, ALKALMAZÁSI MÓDOK, KÉRELMEZŐ, FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA A TAGÁLLAMOKBAN 1 Tagállam Forgalomba hozatali engedély
I. MELLÉKLET FELSOROLÁS: MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZERKÉSZÍTMÉNY- DÓZISOK, ALKALMAZÁSI MÓDOK, KÉRELMEZŐ, FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA A TAGÁLLAMOKBAN 1 Tagállam Forgalomba hozatali engedély
1. A GYÓGYSZER MEGNEVEZÉSE. Cutivate 0,5 mg/g krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
 1. A GYÓGYSZER MEGNEVEZÉSE Cutivate 0,5 mg/g krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg flutikazon-propionát (mikronizált) 1 gramm krémben. 7,5 mg flutikazon-propionát (mikronizált) 15 g krémben.
1. A GYÓGYSZER MEGNEVEZÉSE Cutivate 0,5 mg/g krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg flutikazon-propionát (mikronizált) 1 gramm krémben. 7,5 mg flutikazon-propionát (mikronizált) 15 g krémben.
A tabletta csaknem fehér színű, ovális és UCY 500 kódjelzéssel van ellátva.
 1. A GYÓGYSZER MEGNEVEZÉSE AMMONAPS 500 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg nátrium-fenil-butirát tablettánként. Minden AMMONAPS tabletta 62 mg nátriumot tartalmaz. A segédanyagok teljes
1. A GYÓGYSZER MEGNEVEZÉSE AMMONAPS 500 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg nátrium-fenil-butirát tablettánként. Minden AMMONAPS tabletta 62 mg nátriumot tartalmaz. A segédanyagok teljes
III. melléklet. Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral eljárás eredményeként jöttek létre.
 III. melléklet Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak módosításai Megjegyzés: Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral
III. melléklet Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak módosításai Megjegyzés: Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral
I. melléklet. Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása
 I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilanciai Kockázatértékelő
I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilanciai Kockázatértékelő
alumínium-hidroxidhoz adszorbeálva 0,3-0,4 mg Al 3+
 1. A GYÓGYSZER NEVE Menjugate 10 mikrogramm por és oldószer szuszpenziós injekcióhoz C-csoportú meningococcus konjugált vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy adag (0,5 ml,előkészített) vakcina
1. A GYÓGYSZER NEVE Menjugate 10 mikrogramm por és oldószer szuszpenziós injekcióhoz C-csoportú meningococcus konjugált vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy adag (0,5 ml,előkészített) vakcina
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMENY NEVE Locatim belsőleges oldat 12 órásnál fiatalabb újszülött borjak részére. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMENY NEVE Locatim belsőleges oldat 12 órásnál fiatalabb újszülött borjak részére. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
Betegtájékoztató: Információk a felhasználó számára. Gentos tabletta Homeopátiás gyógyszer
 Betegtájékoztató: Információk a felhasználó számára Gentos tabletta Homeopátiás gyógyszer Hatóanyagok: Populus tremuloides (Populus) trit. D1, Sabal serrulatum (Serenoa repens) trit. D6, Conium maculatum
Betegtájékoztató: Információk a felhasználó számára Gentos tabletta Homeopátiás gyógyszer Hatóanyagok: Populus tremuloides (Populus) trit. D1, Sabal serrulatum (Serenoa repens) trit. D6, Conium maculatum
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-8/1/A-29-11 Az orvosi biotechnológiai
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-8/1/A-29-11 Az orvosi biotechnológiai
Gyógyszeres tapaszonként 10% metil-szalicilátot (105 mg) és 3% levomentolt (31,5 mg) tartalmaz.
 1. A GYÓGYSZER NEVE Salonpas 105 mg/31,5 mg gyógyszeres tapasz metil-szalicilát/levomentol 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Gyógyszeres tapaszonként 10% metil-szalicilátot (105 mg) és 3% levomentolt
1. A GYÓGYSZER NEVE Salonpas 105 mg/31,5 mg gyógyszeres tapasz metil-szalicilát/levomentol 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Gyógyszeres tapaszonként 10% metil-szalicilátot (105 mg) és 3% levomentolt
HASZNÁLATI UTASÍTÁS Veraflox 25 mg/ml belsőleges szuszpenzió macskák részére
 HASZNÁLATI UTASÍTÁS Veraflox 25 mg/ml belsőleges szuszpenzió macskák részére 1. A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJÁNAK, TOVÁBBÁ AMENNYIBEN ETTŐL ELTÉR, A GYÁRTÁSI TÉTELEK FELSZABADÍTÁSÁÉRT FELELŐS-GYÁRTÓ
HASZNÁLATI UTASÍTÁS Veraflox 25 mg/ml belsőleges szuszpenzió macskák részére 1. A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJÁNAK, TOVÁBBÁ AMENNYIBEN ETTŐL ELTÉR, A GYÁRTÁSI TÉTELEK FELSZABADÍTÁSÁÉRT FELELŐS-GYÁRTÓ
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Nobivac L4 szuszpenziós injekció kutyák számára 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Adagonként (1 ml)
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Nobivac L4 szuszpenziós injekció kutyák számára 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Adagonként (1 ml)
mi a cukorbetegség? DR. TSCHÜRTZ NÁNDOR, DR. HIDVÉGI TIBOR
 mi a cukorbetegség? DR. TSCHÜRTZ NÁNDOR, DR. HIDVÉGI TIBOR az OkTaTÓaNyag a magyar DiabeTes Társaság vezetôsége megbízásából, a sanofi TámOgaTásával készült készítette a magyar DiabeTes Társaság edukációs
mi a cukorbetegség? DR. TSCHÜRTZ NÁNDOR, DR. HIDVÉGI TIBOR az OkTaTÓaNyag a magyar DiabeTes Társaság vezetôsége megbízásából, a sanofi TámOgaTásával készült készítette a magyar DiabeTes Társaság edukációs
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Cetirizin-ratiopharm 10 mg filmtabletta Cetirizin-ratiopharm 10 mg filmtabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Cetirizin-ratiopharm 10 mg filmtabletta Cetirizin-ratiopharm 10 mg filmtabletta
Filmtabletta (tabletta) Fehér csaknem fehér színű, ovális alakú tabletták egyik oldalon Renagel 800 felirattal ellátva.
 1. A GYÓGYSZER MEGNEVEZÉSE Renagel 800 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 800 mg szevelamer-hidroklorid tablettánként. A segédanyagok teljes listáját lásd a 6.1. pontban. 3. GYÓGYSZERFORMA
1. A GYÓGYSZER MEGNEVEZÉSE Renagel 800 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 800 mg szevelamer-hidroklorid tablettánként. A segédanyagok teljes listáját lásd a 6.1. pontban. 3. GYÓGYSZERFORMA
