1. A GYÓGYSZER NEVE. GENOTROPIN 5,3 mg por és oldószer oldatos injekcióhoz GENOTROPIN 12 mg por és oldószer oldatos injekcióhoz
|
|
|
- Zsuzsanna Fülöpné
- 7 évvel ezelőtt
- Látták:
Átírás
1 1. A GYÓGYSZER NEVE GENOTROPIN 5,3 mg por és oldószer oldatos injekcióhoz GENOTROPIN 12 mg por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Genotropin 5,3 mg por és oldószer oldatos injekcióhoz: 5,3 mg (16 NE) szomatropin* injekciós patrononként. Elkészítés után a szomatropin koncentráció 5,3 mg/ml. Genotropin 12 mg por és oldószer oldatos injekcióhoz: 12 mg (36 NE) szomatropin* injekciós patrononként. Elkészítés után a szomatropin koncentráció 12 mg/ml. *Rekombináns DNS technológiával, E. coli sejtekben kerül előállításra. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA Por és oldószer oldatos injekcióhoz Genotropin 5,3 mg por és oldószer oldatos injekcióhoz: Injekciós tollban alkalmazandó kétrekeszes patron, mely egy 10,85 mg fehér, steril liofilizátumot tartalmazó első részből és a liofilizátum feloldásához (az 1,15 ml össztérfogatú oldat elkészítéséhez) szükséges 1,14 ml oldószert tartalmazó hátsó részből áll. Genotropin 12 mg por és oldószer oldatos injekcióhoz: Injekciós tollban alkalmazandó kétrekeszes patron, mely egy 31,03 mg fehér, steril liofilizátumot tartalmazó első részből és a liofilizátum feloldásához szükséges 1,15 ml oldószert tartalmazó hátsó részből áll. 4. KLINIKAI JELLEMZŐK 4.1 Terápiás javallatok Gyermekeknél: Az endogén növekedési hormon elégtelen termelődése (növekedésihormon-hiány) következtében kialakult növekedési zavar, valamint a Turner-szindrómával vagy krónikus veseelégtelenséggel társult növekedési zavar. A gesztációs korhoz képest kicsinek (small for gestational age SGA) született gyermekek/serdülők növekedési zavara (aktuális testmagasság standard deviációs pontszáma [standard deviation score SDS] < -2,5, a szülői korrigált testmagasság SDS < -1), akiknek születési súlya és/vagy testmagassága -2 SD (standard deviáció) alatti, és akik 4 éves korukra vagy később sem zárkóznak fel kortársaikhoz (növekedési ütem [height velocity HV] SDS < 0 a megelőző 4 év folyamán). Prader-Willi-szindróma (PWS) esetén a növekedés és testfelépítés elősegítése. A PWS diagnózisát megfelelő genetikai vizsgálatnak kell alátámasztania. Felnőtteknél: Felnőttek hormonpótló terápiája kifejezett növekedési hormon-hiány esetén. OGYI/50555/2014 OGYI/50559/2014
2 2 Felnőttkorban kialakult növekedési hormon hiány: Ismert hypothalamus vagy hypophysis rendellenesség következtében többszörös hormonhiánnyal társuló súlyos növekedési hormon hiányban szenvedő felnőtt betegek, valamint akiknél a prolaktin kivételével legalább egy ismert hypophysis hormon hiánya áll fenn. Ezen betegeknél a megfelelő növekedési hormon stimulációs tesztet kell elvégezni a növekedési hormon hiányának igazolása vagy kizárása céljából. Gyermekkorban kialakult növekedési hormon hiány: Gyermekkoruk alatt kongenitális, genetikus, szerzett vagy idiopátiás okból növekedési hormon hiányban szenvedő betegek. A hosszirányú növekedés befejeztekor a gyermekkorban kialakult növekedési hormon hiányban szenvedő betegek ismételt kivizsgálása szükséges a növekedési hormon szekréció kapacitásának megítélése céljából. Azoknál a betegeknél, akiknél nagy valószínűséggel perzisztens növekedési hormon hiány áll fenn, például kongenitális ok vagy a hypothalamus/hypophysis másodlagos betegsége illetve sérülése miatt, az IGF-I szintjének hormonkezelés nélküli SDS <-2 érték legalább 4 héten át történő fennállását elegendő bizonyítékként kell tekinteni a súlyos GHD megállapításához. Az összes többi betegnél szükséges az IGF-I szintjének meghatározása valamint egy növekedési hormon stimulációs teszt elvégzése. 4.2 Adagolás és alkalmazás Adagolás Gyermekek növekedési zavara a növekedési hormon elégtelen termelődése következtében: Az általában javasolt adag 0,025 0,035 mg/ttkg/nap vagy 0,7 1,0 mg/m 2 testfelület/nap. Ennél nagyobb adagok alkalmazása is ismert. Ha a gyermekkorban kialakult növekedési hormon hiány a kamaszkorban is fennáll, a teljes testi fejlődés (pl. testfelépítés, csonttömeg) elérése céljából folytatni kell a hormonpótló kezelést. Ellenőrzésként a T-score >-1 (kettős energiájú röntgen-abszorpciómetriás eljárással meghatározott, a nemek és az etnikai eltérések szerint korrigált egységes átlagos felnőtt maximális csonttömeg) értékben meghatározott normális maximális csonttömeg elérése a terápiás célkitűzések egyike az átmeneti periódus során. Az adagolásra vonatkozó információ megtalálható alább a felnőttekre vonatkozó résznél. Prader-Willi szindróma esetén, a növekedés és a testépítés elősegítése gyermekeknél: Az általában ajánlott dózis 0,035 mg/ttkg/nap vagy 1,0 mg/m 2 testfelület/nap. A napi adag nem haladhatja meg a 2,7 mg-ot. A kezelés nem alkalmazható azoknál a gyermekeknél, akiknél az éves növekedési ráta kisebb mint 1 cm és az epifízis fugák záródóban vannak. Turner-szindróma okozta növekedési zavar: A javasolt adag 0,045 0,050 mg/ttkg/nap vagy 1,4 mg/m 2 testfelület/nap. Növekedési zavar krónikus veseelégtelenség esetén: A javasolt adag 1,4 mg/m 2 testfelület/nap (azaz kb. 0,045-0,050 mg/ttkg/nap). Nagyobb adag alkalmazása is szükségessé válhat, amennyiben a növekedési sebesség nem kielégítő. Hat havi kezelés után dóziskorrekció válhat szükségessé. A gesztációs időhöz képest kis súllyal és testhosszal született gyermekek növekedési zavara: Az általában ajánlott dózis 0,035 mg/ttkg/nap (1 mg/m 2 testfelület/nap) a végső testhossz eléréséig (lásd 5.1 pont). A kezelést a terápia első éve után be kell fejezni, ha a növekedési sebesség SDS +1 alatt van. A kezelést akkor is meg kell szakítani, ha a növekedés üteme <2 cm/év és ha szükséges igazolni kell, hogy a csontkor lányoknál a 14, fiúknál a 16 évet meghaladja az epifízis fugák záródásának megfelelően.
3 3 Javallat Adagolási javallatok gyermekgyógyászati betegeknél Napi adag Napi adag mg/ttkg mg/m 2 testfelület Növekedési hormon hiány 0,025 0,035 0,7 1,0 gyermekeknél Prader-Willi szindróma gyermekeknél 0,035 1,0 Turner szindróma 0,045 0,050 1,4 Krónikus veseelégtelenség 0,045 0,050 1,4 A gesztációs időhöz képest kis súllyal és testhosszal született gyermekek 0,035 1,0 Növekedési hormon hiány felnőtt betegeknél: Azoknál a betegeknél, akiknél a növekedési hormon kezelést folytatják a gyermekkorban kialakult növekedési hormon hiány perzisztálásának következtében, az újrakezdő dózis javasolt napi adagja 0,2 0,5 mg. A dózis fokozatos emelése vagy csökkentése az IGF-I koncentráció szerint meghatározott egyéni szükségletnek megfelelően szükséges. Felnőttkorban kialakult növekedési hormon hiány esetén a kezelést alacsony dózissal, napi 0,15-0,3 mg adaggal kell kezdeni. Az adagot az IGF-I koncentráció szerint meghatározott egyéni igényeknek megfelelően kell fokozatosan emelni. Mindkét esetben a kezelés célja a beteg korához igazított, az átlag 2 SDS-n belüli inzulinszerű növekedési faktor-i (IGF-I) koncentrációk elérése. A kezelés megkezdésénél normál IGF-I koncentrációval rendelkező betegeknél a 2 SDS-t el nem érő normál IGF-I felső értékéig kell a növekedési hormont adagolni. A klinikai válasz és mellékhatások szintén használhatók a dózistitrálás útmutatójaként. Elfogadott, hogy egyes növekedési hormon hiányban szenvedő betegek IGF-I szintje nem normalizálódik annak ellenére, hogy klinikailag jól reagálnak a kezelésre, és így náluk nem szükséges a dózis emelése. A napi fenntartó adag ritkán haladja meg az 1,0 mg-ot. A nőknek magasabb dózisra lehet szükségük, mint a férfiaknak, akiknél idővel megnövekedett IGF-I érzékenység tapasztalható. Ez azt jelenti, hogy fennáll annak a veszélye, hogy a nők, különösen, a per os ösztrogén terápiában részesülők, alulkezeltek, míg a férfiakat túlkezelik. A növekedési hormon pontos adagolását hathavonta ellenőrizni kell. Mivel a növekedési hormon normál fiziológiás termelődése általában az életkorral csökken, a szükséges dózismennyiség csökkenhet. A 60 évnél idősebb betegeknél a kezelést napi 0,1 0,2 mg-mal kell kezdeni, és az egyéni szükségleteknek megfelelően kell az adagot lassan emelni. A növekedési hormon kezelés során a legkisebb hatásos adagot kell alkalmazni. Ezeknél a betegeknél a napi fenntartó adag ritkán haladja meg a 0,5 mg-ot. Az alkalmazás módja Az adagolást és az alkalmazás módját egyedileg kell meghatározni. Az injekció subcutan adandó és a beadás helyét a lipoatrophia elkerülése céljából változtatni kell. 4.3 Ellenjavallatok A készítmény hatóanyagával, vagy a 6.1 pontban felsorolt bármely segédanyagával szembeni túlérzékenység. A szomatropin nem alkalmazható igazolt daganat aktivitás esetén. A növekedési hormon terápia megkezdése előtt az intracranialis daganatoknak inaktívnak kell lenniük és a daganatellenes terápiát be kell fejezni. A kezelést le kell állítani bizonyított daganatnövekedés esetén. Genotropin nem alkalmazható gyermekeknél a növekedés elősegítésére záródott epifízis fugák esetén. Akut, kritikus állapotú, nyitott szívműtét, hasi műtét, többszörös baleseti trauma, akut légzési elégtelenség vagy hasonló kórképek szövődményeiben szenvedő betegek Genotropinnal nem kezelhetők. (Hormonpótló terápiában résztvevő betegekre vonatkozóan lásd 4.4 pont).
4 4.4 Különleges figyelmeztetések és az alkalmazással kapcsolatos óvintézkedések A diagnózis felállítását és a Genotropin kezelést csak az erre megfelelően képzett, a terápiás indikációknak megfelelő betegségek diagnosztizálásában és a betegek ellátásában tapasztalt orvosok végezhetik. 4 A myositis egy nagyon ritkán előforduló nemkívánatos esemény, ami a tartósítószer metakrezollal társulhat. Myalgia vagy az injekció alkalmazásának helyén érzett aránytalan fájdalom esetén gondolni kell a myositisre. A javasolt napi maximális adagot nem szabad túllépni (lásd 4.2 pont). Inzulinérzékenység A szomatropin csökkentheti az inzulinérzékenységet. A diabetes mellitusban szenvedő betegeknél az inzulin dózisának módosítására lehet szükség a szomatropin-kezelés megkezdését követően. A diabetesben vagy glükóz intoleranciában szenvedő betegeket, illetve akiknél a diabetes további rizikófaktorai állnak fenn, szoros megfigyelés alatt kell tartani a szomatropin-kezelés ideje alatt. Pajzsmirigyműködés A növekedési hormon növeli a pajzsmirigyen kívüli/extrathyroidalis T4-T3 átalakulást, mely a szérum T4 csökkenését és a szérum T3 koncentráció növekedését eredményezheti. Míg a perifériás pajzsmirigy hormonszintek az egészséges egyének többségénél a referenciatartományán belül maradtak, szubklinikus hypothyreosisban szenvedő személyeknél elméletileg kialakulhat hypothyreosis. Ebből következően a pajzsmirigyműködést minden betegnél ellenőrizni kell. A hypopituitarismusban szenvedő, standard hormonpótló terápiában részesülő betegeknél a növekedési hormon-kezelés pajzsmirigyműködésre gyakorolt lehetséges hatását szorosan monitorozni kell. Malignus betegség kezelésekor másodlagosan jelentkező növekedési hormon elégtelenségben a malignus betegség relapszusának jeleire figyelmet kell fordítani. Rákos megbetegedést túlélő gyermekek körében az első daganat kialakulása után szomatropinnal kezelt betegeknél egy második daganat kialakulásának megnövekedett kockázatáról számoltak be. Ezek közül a második daganatok közül az intracraniális tumorok voltak a legbbak, elsősorban meningeomák, azoknál a betegeknél, akik a fej területén kaptak besugárzást az első daganat kezelésekor. Endokrin zavarokban szenvedő betegek esetén, beleértve a növekedési hormon elégtelenséget is, a csípőízületi epiphyseolysis kialakulása viszonylag bb, mint az átlag népességben. Ezért szomatropin-kezelésben részesülő gyermekeknél fellépő sántítás további vizsgálatok elvégzését teszi szükségessé. Benignus intracranialis hypertensio Erős vagy visszatérő fejfájás, látászavar, hányinger és/vagy hányás esetén szemfenék vizsgálat javasolt az esetlegesen kialakult papillaödéma miatt. Igazolt papillaödéma esetén a jóindulatú intracranialis hypertensio diagnózisára gondolni kell, és ha szükséges, a növekedési hormon-kezelést fel kell függeszteni. Jelenleg nincs elegendő bizonyíték, hogy specifikus javaslatot lehessen tenni a növekedési hormonkezelés folytatására, ha az intracranialis hypertensio megszűnt. Ha a növekedési hormon-kezelést újraindítják, az intracranialis hypertensio tüneteinek jelentkezését figyelemmel kell kísérni. Leukaemia Néhány szomatropin-kezelést kapó, növekedési hormon-hiányban szenvedő betegnél leukaemia kialakulását jelentették. Ennek ellenére nincs bizonyíték arra, hogy a leukaemia előfordulása növekszik a hajlamosító tényezőkkel nem rendelkező, növekedési hormont kapó betegeknél. Antitestek Mint ahogy minden szomatropint tartalmazó készítmény ellen, a betegek kis százalékánál a Genotropin ellen is termelődhetnek antitestek. A betegek kb. 1%-ánál a Genotropin-kezelés antitestek képződését váltotta ki. Ezen antitestek kötődéséi kapacitása alacsony volt, és nem befolyásolta a
5 növekedés ütemét. A kezelésre ismeretlen okból nem válaszoló betegeknél a szomatropin-ellenes antitestek kimutatására alkalmas tesztet kell elvégezni. Időskorú betegek Nyolcvan év feletti betegek kezelésével kapcsolatban kevés tapasztalat áll rendelkezésre. Az idős betegek fokozottan érzékenyek lehetnek a Genotropin hatására, és ezért hajlamosabbak lehetnek a mellékhatások megjelenésére is. 5 Akut kritikus betegségek A felépülés időszakában alkalmazott Genotropin hatását két placebo kontrollált kísérletben vizsgálták 522 kritikus betegségben szenvedő felnőtt beteg bevonásával, akiknél nyílt szívműtét, hasi műtétet, többszörös baleseti traumát illetőleg akut légzőszervi betegséget követően komplikációk léptek fel. A halandóság magasabb volt azoknál a betegeknél, akiket napi 5,3 vagy 8 mg Genotropinnal kezeltek, mint a placebóval kezelteknél (42%, illetve 19%). Következésképpen, az ilyen betegek nem kezelhetők Genotropinnal. Mivel az akut kritikus betegségben szenvedő betegek növekedési hormonpótlási kezelésének biztonságosságáról nem áll rendelkezésre információ, ezért ezeknél a betegeknél, a Genotropinnal folytatott kezelés előnyeit mérlegelni kell, annak potenciális kockázatával szemben. Minden beteg esetén, akiknél hasonló vagy más akut, kritikus betegség lép fel, a Genotropin kezelés előnyeit és kockázatait mérlegelni kell. Pancreatitis Bár ritka, a pancreatitis lehetőségét figyelembe kell venni szomatropinnal kezelt betegek esetén, különösen olyan gyermekeknél, akiknél hasi fájdalom jelentkezik. Prader-Willi-szindróma: A Prader-Willi-szindróma kezelését mindig kalóriaszegény diétával kell kiegészíteni. Halálos kimenetelű esetekről számoltak be a növekedési hormon alkalmazásával kapcsolatban Prader- Willi-szindrómában szenvedő gyermekgyógyászati betegeknél, akiknél az alábbi egy vagy több kockázati tényező állt fenn: súlyos elhízás (a testtömeg/testmagasság aránya meghaladja a 200%-ot), a kórtörténetben szereplő légzési károsodás vagy alvási apnoe, vagy ismeretlen eredetű légúti fertőzés. Azok a betegek, akiknél egy vagy több kockázati tényező jelen van, fokozottabban veszélyeztetettek. A szomatropin-kezelés elkezdése előtt a Prader-Willi-szindrómás betegeknél a felső légúti obstrukció, alvási apnoe vagy légúti fertőzésekre utaló jeleket ki kell vizsgálni. A növekedési hormon kezelés megkezdése előtt, ha a felső légúti obstrukció kivizsgálása során patológiás eltérést észlelnek, a gyermeket a légzőszervi betegség kezelése és megszüntetése céljából fül-orr-gégész szakorvoshoz kell irányítani. Az alvási apnoét a növekedési hormon kezelés megkezdése előtt ki kell vizsgálni szakmailag elismert módszerekkel/eljárással, mint például polysomnographiával vagy éjszakai oximetriával, illetve alvási apnoe gyanúja esetén a beteget monitorozni kell. Ha szomatropin-kezelés során a betegnél felső légúti obstrukció tünetei jelentkeznek (beleértve a horkolás megjelenését vagy fokozódását), a kezelést fel kell függeszteni és újabb fül-orr-gégészeti szakorvosi vizsgálat elvégzése szükséges. Minden Prader-Willi-szindrómás beteget alvási apnoe gyanúja esetén monitorozni kell. A betegeknél a légúti fertőzés jeleit folyamatosan monitorozni kell, a fertőzést a lehető leghamarabb kell diagnosztizálni és agresszíven kezelni kell (lásd 4.3 pont). Továbbá, minden Prader-Willi-szindrómás betegnél a testsúlyt hatékony módszerrel kontrollálni kell a hormonkezelés megkezdése előtt és a kezelés folyamán.
6 A scoliosis Prader-Willi-szindrómás betegeknél. A scoliosis bármely gyermeknél progrediálhat gyors növekedés esetén. A kezelés során ellenőrizni kell a scoliosisra utaló jeleket. A felnőttek, illetve a Prader-Willi-szindrómás betegek tartós kezeléséről kevés tapasztalat áll rendelkezésre. 6 Kis súllyal és hosszal született alacsony gyermekek A gesztációs időre vonatkoztatva kis súllyal és hosszal született (SGA-s) alacsony gyermekek esetén a növekedési zavart magyarázó egyéb egészségügyi okokat vagy terápiát a hormonkezelés előtt ki kell zárni. SGA-s gyermekeknél a kezelés megkezdése előtt, majd azt követően évenként mérni kell az éhgyomri inzulint és a vércukorszintet. A diabetes mellitus fokozott kockázatának kitett betegeknél (diabetes a családi kórtörténetben, elhízás, súlyos inzulinrezisztencia, acanthosis nigricans) orális glükóz tolerancia tesztet (OGTT) kell végezni. Ha egyértelműen diabetes alakul ki, a növekedési hormon nem adható. A kezelés elkezdése előtt és azt követően évenként kétszer ajánlott az SGA-s gyermekeknél az IGF-I szint mérése. Ha az ismételt méréseknél az IGF-I szint meghaladja a referencia korra és érettségi fokra vonatkoztatott +2 SD értéket, az IGF-I/ IGFBP-3 arányt kell figyelembe venni a dózisbeállítás megfontolásakor. Kevés a tapasztalat az SGA-s gyermekek pubertásközeli időszakában elkezdett kezeléséről. Ezért a pubertás kezdetén nem ajánlatos a kezelés megindítása. Silver-Russel-szindrómás betegek növekedési hormon kezeléséről kevés tapasztalat áll rendelkezésre. Az alacsony SGA-s gyermekeknél a növekedési hormon kezelés hatására elért testmagasság növekedés részben elveszhet, ha a kezelést a végső testmagasság elérése előtt abbahagyják. Krónikus veseelégtelenség Krónikus veseelégtelenségben a vesefunkciónak az egészséges érték 50%-aalatt kell lennie a kezelés megkezdése előtt. A növekedési zavar igazolásához a növekedési ütemet a kezelés beállítása előtt egy éven át figyelemmel kell kísérni. Ezen időszak alatt a veseelégtelenség konzervatív kezelését (mely magában foglalja az acidosis, a mellékpajzsmirigy-túlműködés, valamint a táplálkozási állapot ellenőrzését) el kell kezdeni, majd a hormonkezelés egész ideje alatt fenn kell tartani. Vesetranszplantáció esetén a kezelést abba kell hagyni. A Genotropinnal kezelt krónikus veseelégtelenségben szenvedő betegek végső testmagasságára vonatkozó adatok ezidáig nem állnak rendelkezésre. 4.5 Gyógyszerkölcsönhatások és egyéb interakciók A glükokortikoidokkal való egyidejű kezelés gátolhatja a szomatropin-tartalmú készítmények növekedést elősegítő hatásait. Ezért a glükokortikoid-kezelésben részesülő betegek növekedését szigorú megfigyelés alatt kell tartani, a glükokortikoid-kezelés növekedésre gyakorolt lehetséges befolyásának felmérésére. Növekedési hormon-elégtelenségben szenvedő felnőtteknél végzett interakciós vizsgálat adatai arra utalnak, hogy a szomatropin alkalmazása növelheti az ismerten a citokróm P450 izoenzimek által metabolizált vegyületek clearance-ét. A citokróm P450 3A4 által metabolizált vegyületek clearance-e (pl. nemi hormonok, kortikoszteroidok, görcsgátló szerek és ciklosporin) nagy mértékben megnőhet, ezen vegyületek alacsonyabb plazmaszintjét eredményezve. Ennek a klinikai jelentősége nem ismert. A diabetes mellitusban, illetőleg pajzsmirigy-rendellenességben szenvedő betegekre vonatkozóan lásd a 4.4 pontot, valamint a per os ösztrogénpótló kezelésben részesülő betegekkel kapcsolatban lásd a 4.2 pontot.
7 7 4.6 Termékenység, terhesség és szoptatás Terhesség Az állatkísérletes adatok nem elegendőek a terhességre, az embriofoetalis fejlődésre, a vajúdásra vagy a postnatalis növekedésre gyakorolt hatás megállapításához (lásd 5.3 pont). Nem állnak rendelkezésre olyan klinikai vizsgálatok, ahol a terhesség alatt szomatropin-kezelést alkalmaztak. Ezért a szomatropin-tartalmú készítmények alkalmazása a terhesség alatt, illetve fogamzóképes, fogamzásgátló módszert nem alkalmazó nőknél nem ajánlott. Szoptatás Szoptató nőknél alkalmazott szomatropin-tartalmú készítményekkel klinikai vizsgálatokat nem végeztek. Nem ismert, hogy a szomatropin kiválasztódik-e az anyatejbe, de az intakt fehérje felszívódása a csecsemő gyomor-bélrendszeréből igen valószínűtlen. Ezért a szomatropin-tartalmú készítmények szoptató nőknél való alkalmazása során óvatosság ajánlott. 4.7 A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre A genotropin nem befolyásolja a gépjárművezetéshez, illetve a gépek kezeléséhez szükséges képességeket. 4.8 Nemkívánatos hatások, mellékhatások A növekedési hormon elégtelenségben szenvedő betegekre jellemző az extracelluláris volumenhiány. A szomatropin-kezelés megkezdésével ez a deficit igen gyorsan helyreáll. Felnőtteknél ak a folyadékretencióval kapcsolatos nemkívánatos hatások, mint például a perifériás oedema, vázizomrendszeri merevség, arthralgia, myalgia és paraesthesia. Ezek a nemkívánatos hatások általában enyhék közepesen súlyosak, a kezelés első hónapjaiban alakulnak ki, és spontán vagy a dózis csökkentésével megszűnnek. Ezen nemkívánatos hatások előfordulása összefügg az alkalmazott dózissal, a beteg életkorával és valószínűleg fordítottan arányos a növekedési hormonhiány fennállásának időtartamával. Gyermekek esetén hasonló nemkívánatos hatások megjelenése nem. A betegek közel egy százalékánál a Genotropin-kezelés antitestek képződését váltotta ki. Ezen antitestek kötődési kapacitása kismértékű volt és képződésük klinikai változást nem eredményezett, lásd 4.4 pont. Mellékhatások táblázatos felsorolása Az 1 6. táblázatokban a javallatokban leírt egyes állapotokra vonatkozó mellékhatások szerepelnek, szervrendszerenként csoportosítva, előfordulási ság szerint rangsorolva, a következő kategóriák szerint: nagyon ( 1/10), ( 1/100 <1/10), nem ( 1/1000 <1/100), ritka ( 1/ <1/1000), nagyon ritka (<1/10 000) és nem ismert (a rendelkezésre álló adatokból nem állapítható meg).
8 Növekedésihormon-hiányban szenvedő gyermekek körében végzett klinikai vizsgálatok 1. táblázat A növekedési hormon elégtelen termelődése következtében kialakult növekedési zavarban szenvedő gyermekek hosszú távú kezelése Szervrendszer Jó-, rosszindulatú és nem meghatározott daganatok (beleértve a cisztákat és a polipokat is) Anyagcsere- és táplálkozási Idegrendszeri A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános, az alkalmazás helyén fellépő reakciók Laboratóriumi és egyéb vizsgálatok eredményei 1/10 Reakció az injekció beadásán ak helyén $ Gyakori 1/100 <1/10 8 Nem 1/1000 <1/100 Leukaemia Arthralgia* Ritka 1/ <1/1000 ritka <1/ Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) 2-es típusú diabetes mellitus Paraesthesia* Benignus intracranialis hypertensio Myalgia* Vázizomrendszeri merevség* Perifériás oedema* Csökkent szérumkortizolszint *Ezek a mellékhatások általában enyhék vagy mérsékelten súlyosak, a kezelés első hónapjaiban jelentkeznek, és spontán módon vagy dóziscsökkentés hatására megszűnnek. Ezen mellékhatások incidenciája függ a beadott dózistól, valamint a beteg életkorától, és valószínűleg fordítottan arányos azzal az életkorral, amelynél a növekedésihormon-hiány jelentkezett. $ Gyermekek esetében beszámoltak az injekció beadásának helyén jelentkező, múló reakciókról. Klinikai jelentősége nem ismert. Növekedésihormon-hiányban szenvedő, szomatropinnal kezelt gyermekek esetében beszámoltak ilyen mellékhatásról, de úgy tűnik, hogy az incidenciája a növekedésihormon-hiányban nem szenvedő gyermekek esetében megfigyelthez hasonló.
9 Turner-szindrómában szenvedő gyermekek körében végzett klinikai vizsgálatok 2. táblázat Turner-szindróma következtében kialakult növekedési zavarban szenvedő gyermekek hosszú távú kezelése Szervrendszer Jó-, rosszindulatú és nem meghatározott daganatok (beleértve a cisztákat és a polipokat is) Anyagcsere- és táplálkozási Idegrendszeri A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános, az alkalmazás helyén fellépő reakciók Laboratóriumi és egyéb vizsgálatok eredményei 1/10 Arthralgia* Gyakori 1/100 <1/10 9 Nem 1/1000 <1/100 Ritka 1/ <1/1000 ritka <1/ Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) Leukaemia 2-es típusú diabetes mellitus Paraesthesia* Benignus intracranialis hypertensio Myalgia* Vázizomrendszeri merevség* Perifériás oedema* Reakció az injekció beadásának helyén $ Csökkent szérumkortizolszint *Ezek a mellékhatások általában enyhék vagy mérsékelten súlyosak, a kezelés első hónapjaiban jelentkeznek, és spontán módon vagy dóziscsökkentés hatására megszűnnek. Ezen mellékhatások incidenciája függ a beadott dózistól, valamint a beteg életkorától, és valószínűleg fordítottan arányos azzal az életkorral, amelynél a növekedésihormon-hiány jelentkezett. $ Gyermekek esetében beszámoltak az injekció beadásának helyén jelentkező, múló reakciókról. Klinikai jelentősége nem ismert. Növekedésihormon-hiányban szenvedő, szomatropinnal kezelt gyermekek esetében beszámoltak ilyen mellékhatásról, de úgy tűnik, hogy az incidenciája a növekedésihormon-hiányban nem szenvedő gyermekek esetében megfigyelthez hasonló.
10 10 Krónikus veseelégtelenségben szenvedő gyermekek körében végzett klinikai vizsgálatok 3. táblázat Krónikus veseelégtelenség következtében kialakult növekedési zavarban szenvedő gyermekek hosszú távú kezelése Szervrendszer Jó-, rosszindulatú és nem meghatározott daganatok (beleértve a cisztákat és a polipokat is) Anyagcsere- és táplálkozási Idegrendszeri A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános, az alkalmazás helyén fellépő reakciók Laboratóriumi és egyéb vizsgálatok eredményei 1/10 Gyakori 1/100 <1/10 Reakció az injekció beadásának helyén $ Nem 1/1000 <1/100 Ritka 1/ <1/1000 ritka <1/ Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) Leukaemia 2-es típusú diabetes mellitus Paraesthesia* Benignus intracranialis hypertensio Arthralgia* Myalgia* Vázizomrendszeri merevség* Perifériás oedema* Csökkent szérumkortizolszint *Ezek a mellékhatások általában enyhék vagy mérsékelten súlyosak, a kezelés első hónapjaiban jelentkeznek, és spontán módon vagy dóziscsökkentés hatására megszűnnek. Ezen mellékhatások incidenciája függ a beadott dózistól, valamint a beteg életkorától, és valószínűleg fordítottan arányos azzal az életkorral, amelynél a növekedésihormon-hiány jelentkezett. $ Gyermekek esetében beszámoltak az injekció beadásának helyén jelentkező, múló reakciókról. Klinikai jelentősége nem ismert. Növekedésihormon-hiányban szenvedő, szomatropinnal kezelt gyermekek esetében beszámoltak ilyen mellékhatásról, de úgy tűnik, hogy az incidenciája a növekedésihormon-hiányban nem szenvedő gyermekek esetében megfigyelthez hasonló.
11 11 SGA-s gyermekek körében végzett klinikai vizsgálatok 4. táblázat SGA következtében kialakult növekedési zavarban szenvedő gyermekek hosszú távú kezelése Szervrendszer Jó-, rosszindulatú és nem meghatározott daganatok (beleértve a cisztákat és a polipokat is) Anyagcsere- és táplálkozási Idegrendszeri A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános, az alkalmazás helyén fellépő reakciók Laboratóriumi és egyéb vizsgálatok eredményei 1/10 Gyakori 1/100 <1/10 Reakció az injekció beadásának helyén $ Nem 1/1000 <1/100 Arthralgia* Ritka 1/ <1/1000 ritka <1/ Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) Leukaemia 2-es típusú diabetes mellitus Paraesthesia* Benignus intracranialis hypertensio Myalgia* Vázizomrendszeri merevség* Perifériás oedema* Csökkent szérumkortizolszint *Ezek a mellékhatások általában enyhék vagy mérsékelten súlyosak, a kezelés első hónapjaiban jelentkeznek, és spontán módon vagy dóziscsökkentés hatására megszűnnek. Ezen mellékhatások incidenciája függ a beadott dózistól, valamint a beteg életkorától, és valószínűleg fordítottan arányos azzal az életkorral, amelynél a növekedésihormon-hiány jelentkezett. $ Gyermekek esetében beszámoltak az injekció beadásának helyén jelentkező, múló reakciókról. Klinikai jelentősége nem ismert. Növekedésihormon-hiányban szenvedő, szomatropinnal kezelt gyermekek esetében beszámoltak ilyen mellékhatásról, de úgy tűnik, hogy az incidenciája a növekedésihormon-hiányban nem szenvedő gyermekek esetében megfigyelthez hasonló.
12 12 Prader-Willi-szindrómában szenvedő gyermekek körében végzett klinikai vizsgálatok 5. táblázat Prader-Willi-szindróma következtében kialakult növekedési zavarban szenvedő gyermekek hosszú távú kezelése és testfelépítésének javítása Szervrendszer Jó-, rosszindulatú és nem meghatározott daganatok (beleértve a cisztákat és a polipokat is) Anyagcsere- és táplálkozási Idegrendszeri A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános, az alkalmazás helyén fellépő reakciók Laboratóriumi és egyéb vizsgálatok eredményei 1/10 Gyakori 1/100 <1/10 Paraesthesia* Benignus intracranialis hypertensio Arthralgia* Myalgia* Perifériás oedema* Nem 1/1000 <1/100 Ritka 1/ <1/1000 ritka <1/ Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) Leukaemia 2-es típusú diabetes mellitus Vázizomrendszeri merevség* Reakció az injekció beadásának helyén $ Csökkent szérumkortizol -szint *Ezek a mellékhatások általában enyhék vagy mérsékelten súlyosak, a kezelés első hónapjaiban jelentkeznek, és spontán módon vagy dóziscsökkentés hatására megszűnnek. Ezen mellékhatások incidenciája függ a beadott dózistól, valamint a beteg életkorától, és valószínűleg fordítottan arányos azzal az életkorral, amelynél a növekedésihormon-hiány jelentkezett. $ Gyermekek esetében beszámoltak az injekció beadásának helyén jelentkező, múló reakciókról. Klinikai jelentősége nem ismert. Növekedésihormon-hiányban szenvedő, szomatropinnal kezelt gyermekek esetében beszámoltak ilyen mellékhatásról, de úgy tűnik, hogy az incidenciája a növekedésihormon-hiányban nem szenvedő gyermekek esetében megfigyelthez hasonló.
13 Növekedésihormon-hiányban szenvedő felnőttek körében végzett klinikai vizsgálatok 6. táblázat Növekedésihormon-hiányban szenvedő felnőttek hormonpótló kezelése Szervrendszer Anyagcsere- és táplálkozási Idegrendszeri A csont- és izomrendszer, valamint a kötőszövet betegségei és tünetei Általános, az alkalmazás helyén fellépő reakciók Laboratóriumi és egyéb vizsgálatok eredményei 1/10 Arthralgia* Perifériás oedema* Gyakori 1/100 <1/10 Paraesthesia* Kéztőalagútszindróma Myalgia* Vázizomrendszeri merevség* 13 Nem 1/1000 <1/100 Ritka 1/ <1/1000 ritka <1/ Nem ismert (a rendelkezésre álló adatokból nem állapítható meg) 2-es típusú diabetes mellitus Benignus intracranialis hypertensio Reakció az injekció beadásának helyén $ Csökkent szérumkortizolszint *Ezek a mellékhatások általában enyhék vagy mérsékelten súlyosak, a kezelés első hónapjaiban jelentkeznek, és spontán módon vagy dóziscsökkentés hatására megszűnnek. Ezen mellékhatások incidenciája függ a beadott dózistól, valamint a beteg életkorától, és valószínűleg fordítottan arányos azzal az életkorral, amelynél a növekedésihormon-hiány jelentkezett. $ Gyermekek esetében beszámoltak az injekció beadásának helyén jelentkező, múló reakciókról. Klinikai jelentősége nem ismert. Csökkent szérumkortizol-szint Beszámoltak arról, hogy a szomatropin csökkenti a szérumkortizol-szintet, valószínűleg a carrier fehérjékre gyakorolt hatás vagy a megnövekedett hepatikus clearance által. Ezen megfigyelések klinikai jelentősége valószínűleg korlátozott. Mindazonáltal a Genotropin-terápia megkezdése előtt a glükokortikoid-terápia optimalizálása szükséges. Prader-Willi-szindróma A forgalomba hozatalt követő tapasztalatok során a hirtelen halál ritka eseteit jelentették szomatropinnal kezelt Prader-Willi-szindrómás betegeknél, bár ok-okozati összefüggés nem igazolódott. Ritka, illetve nagyon ritka sággal beszámoltak leukaemia eseteiről növekedésihormonhiányban szenvedő gyermekeknél, akik közül néhányan szomatropin-kezelést kaptak és ez bekerült a forgalomba hozatal utáni megfigyelések közé. Nincs azonban olyan bizonyíték, amely arra utalna, hogy prediszponáló tényezők például az agyat vagy a fejet ért sugárzás nélkül is fokozott lenne a leukaemia kockázata.
14 14 Félrecsúszott femorális fej epiphysis és Legg-Calvé-Perthes-betegség Növekedési hormonnal kezelt gyermekek esetében beszámoltak félrecsúszott femorális fej epiphysisről és Legg-Calvé-Perthes-betegségről. A félrecsúszott femorális fej epiphysis anyagcserebetegségek esetében fordul elő nagyobb sággal, a Legg-Calvé-Perthes-betegség pedig alacsony testmagasság esetén bb. Nem ismert azonban, hogy ez a két kórkép bb-e vagy sem a szomatropin-kezelés alatt. Erre a két betegségre is gondolni kell, ha egy gyermek csípőben vagy térdben jelentkező kellemetlenséget vagy fájdalmat panaszol. Egyéb nemkívánatos gyógyszerreakciók Egyéb nemkívánatos gyógyszerreakcióknak tekinthetők a szomatropin osztály hatásai, például a csökkent inzulin-érzékenység által okozott hyperglykaemia, a csökkent szabad tiroxin szint és a benignus intracranialis hypertensio. Feltételezett mellékhatások bejelentése A gyógyszer engedélyezését követően lényeges a feltételezett mellékhatások bejelentése, mert ez fontos eszköze annak, hogy a gyógyszer előny/kockázat profilját folyamatosan figyelemmel lehessen kísérni. Az egészségügyi szakembereket kérjük, hogy jelentsék be a feltételezett mellékhatásokat a hatóság részére az V. függelékben található elérhetőségek valamelyikén keresztül. 4.9 Túladagolás Tünetek: Az akut túladagolás kezdetben hypoglykaemiát, azt követően pedig hyperglykaemiát eredményezhet. A hosszantartó túladagolás a növekedési hormon többlet ismert hatásaival megegyező et eredményez. 5. FARMAKOLÓGIAI TULAJDONSÁGOK 5.1 Farmakodinámiás tulajdonságok Farmakoterápiás csoport: hypophysis elülső lebeny hormonok és analógjaik, ATC-kód: H01A C01 A szomatropin erős metabolikus hatású hormon, mely fontos szerepet játszik a zsírok, szénhidrátok és proteinek metabolizmusában. Elégtelen endogén növekedési hormonnal rendelkező gyermekeknél a szomatropin stimulálja a lineáris növekedést és fokozza a növekedés sebességét. Mind felnőtteknél, mind gyermekeknél a szomatropin biztosítja a normál testösszetételt azáltal, hogy növeli a nitrogén retenciót, stimulálja a vázizomzat növekedését, illetve mobilizálja a test zsírszöveteit. Főleg a viscerális zsírszövetek reagálnak a szomatropinra. A fokozott lipolízis mellett, a szomatropin csökkenti a trigliceridek zsírraktárakba való felvételét. Az IGF-I (Insulin-like Growth Factor I), valamint az IGFBP3 (Insulin-like Growth Factor-Binding Pprotein 3) szérum szintet a szomatropin megemeli. Ezenkívül még az alábbi hatások mutathatók ki: Zsíranyagcsere: A szomatropin indukálja a máj LDL koleszterin receptorait és hatással van a szérum lipidek és lipoproteinek profiljára. A szomatropin alkalmazása növekedési hormon elégtelenségben szenvedő betegek esetében általában a szérum LDL és az apolipoprotein-b csökkenését eredményezi. A szérum teljes koleszterin tartalmának csökkenése is megfigyelhető. Szénhidrát-anyagcsere: A szomatropin növeli az inzulin szintet, de az éhgyomri vércukor általában változatlan. Hypopituiter gyermekeknél éhgyomri hypoglykaemia tapasztalható. A szomatropin az előbbi jelenséget megszünteti.
15 Víz- és ásványianyag metabolizmus: A növekedési hormon hiány a plazma és az extracelluláris térfogat csökkenésével társul. Mindkettő gyorsan megnő a szomatropin-kezelést követően. A szomatropin nátrium-, kálium- és a foszfor retenciót okoz. 15 Csontanyagcsere: A szomatropin stimulálja a csontozat turnoverét. A szomatropin hosszú távú alkalmazása az osteopeniában szenvedő növekedési hormonhiányos betegeknél a csontozat ásványi anyag tartalmának és sűrűségének a növekedését eredményezi a teherviselő területeken. Fizikai kapacitás: Az izomerő és a fizikai terhelési kapacitás tartós szomatropin-kezelést követően javul. A szomatropin a szív perctérfogatát szintén növeli, de ennek a mechanizmusát még tisztázni kell. Ehhez a hatáshoz a perifériás vaszkuláris rezisztencia csökkenése hozzájárulhat. Klinikai vizsgálatokban az alacsony SGA-s gyermekek kezelésénél napi 0,033 mg/ttkg ill. 0,067 mg/ttkg szomatropin t alkalmaztak a végső testmagasság eléréséig. Az 56 betegnél, akiket folyamatosan kezeltek és akik elérték a közel végső testmagasságot, a kezelés kezdetén meglévő testmagassághoz viszonyított átlagos változás +1,90 SDS (0,033 mg/ttkg/nap) és +2,19 SDS (0,067 mg/ttkg/nap) volt. Irodalmi adatok szerint a kezeletlen SGA-s, korai spontán növekedést nem mutató gyermekek késői növekedése 0,5 SDS. Hosszú távú biztonságossági adatok még nem állnak rendelkezésre. 5.2 Farmakokinetikai tulajdonságok Felszívódás A subcutan alkalmazott szomatropin biohasznosulása körülbelül 80% mind az egészséges egyénekben, mind a növekedési hormon hiányban szenvedő betegeknél. A szomatropin 0,035 mg/kg subcutan dózisa ng/ml tartományon belüli plazma csúcskoncentrációt eredményez (C max ), a t max pedig 3-6 órás időintervallumban mozog. Elimináció A szomatropin átlagos terminális felezési ideje intravénás adagolást követően növekedési hormon elégtelenségben szenvedő felnőtteknél körülbelül 0,4 óra. Subcutan alkalmazást követően 2-3 órás felezési idő érhető el. A megfigyelhető különbség valószínűleg a subcutan injekció beadásának helyéről való lassú felszívódás eredménye. Szub-populációk A szomatropin abszolút biohasznosulása a subcutan alkalmazást követően férfiaknál és nőknél hasonlónak tűnik. Időskorú és gyermekgyógyászati betegeknél, különböző etnikumok, valamint vese-, máj, vagy szívelégtelenségben szenvedő betegek esetében a szomatropin farmakokinetikájára vonatkozó adatok hiányosak vagy nincsenek. 5.3 A preklinikai biztonságossági vizsgálatok eredményei Az általános toxicitásra, valamint a lokális toleranciára és a reprodukcióra vonatkozó toxicitási vizsgálatok során klinikailag releváns hatást nem figyeltek meg. A génmutációra és kromoszóma rendellenesség indukciójára vonatkozó in vitro és in vivo genotoxicitási vizsgálatok negatív eredményt mutattak. Egy tartósan szomatropinnal, majd azt követően bleomicin hatóanyagú radiomimetikus gyógyszerrel kezelt betegekből vett lymphocytákkal végzett in vitro vizsgálatban fokozott kromószóma törékenységet figyeltek meg. A megfigyelés klinikai jelentősége nem ismert.
16 16 Egy másik vizsgálat során a hosszan tartó szomatropin-kezelésben részesült betegek lymphocytáiban a kromoszóma-abnormalitás fokozódását nem észlelték. 6. GYÓGYSZERÉSZETI JELLEMZŐK 6.1 Segédanyagok felsorolása Első rekesz: Glicin (E 640), Mannit (E 421), Vízmentes nátrium-dihidrogén-foszfát (E 339), Vízmentes dinátrium-dihidrogén-foszfát (E 339). Hátsó rekesz: Metakrezol, Mannit (E 421), Injekcióhoz való víz. 6.2 Inkompatibilitások Kompatibilitási vizsgálatok hiányában ez a gyógyszer nem keverhető más gyógyszerekkel. 6.3 Felhasználhatósági időtartam 3 év Elkészített oldat: Az elkészített oldat beadás előtti kémiai és fizikai stabilitása 2 C 8 C-on 4 héten át igazolt. Mikrobiológiai szempontból a készítmény a feloldást követően 2 C 8 C-on 4 hétig tárolható. Egyéb, a beadásra kész állapotban történő tárolás idejéért és annak körülményeiért a felhasználó a felelős. 6.4 Különleges tárolási előírások Elkészítés előtt: Hűtőszekrényben (2 C 8 C) tárolandó, vagy a lejárati időn belül egy hónapig legfeljebb 25 C-on tárolható. A fénytől való védelem érdekében a gyógyszert tartsa a dobozában. Elkészítés után: Hűtőszekrényben (2 C 8 C) tárolandó. Nem fagyasztható! A fénytől való védelem érdekében a gyógyszert tartsa a dobozában. A feloldott gyógyszerre vonatkozó tárolási előírásokat lásd a 6.3 pontban. 6.5 Csomagolás típusa és kiszerelése A Genotropin kétféle kiszerelésben kerül forgalomba: (1) Kétrekeszes patron, amely csak az injekció beadására szolgáló eszközzel (Genotropin Pen) alkalmazható. (2) Kétrekeszes patron előretöltött injekciós tollban. Kétrekeszes patron A kétrekeszes patron csak az injekció beadására szolgáló eszközzel (Genotropin Pen) együtt alkalmazható.
17 17 A patron egy kétrekeszes, I-es típusú üvegből készült henger, melynek egyik oldalát egy brómbutil zárókorong és egy rollnizott alumíniumkupak, másik oldalát pedig egy brómbutil gumidugattyú zárja. A két rekeszt brómbutil gumidugattyú választja el egymástól. Az injekció beadására szolgáló eszközök (Genotropin Pen) mindegyike színkóddal van ellátva, és a helyes dózis beadásához minden esetben a megegyező színű kóddal ellátott kétrekeszes patronnal együtt kell őket használni. Az 5,3 mg hatáserősségű patron hátsó részén világoskék jelzés található, és csak a világoskék színnel jelölt eszközzel (Genotropin Pen) együtt alkalmazható. Az 12 mg hatáserősségű patron hátsó részén lila jelzés található, és csak a lila színnel jelölt eszközzel (Genotropin Pen) együtt alkalmazható. A steril liofilizátum a patron injekciós tollba helyezésekor oldható. 1 darab 5,3 mg hatáserősségű patron egyadagos buborékcsomagolásban, 5 buborékcsomagolás dobozban. 1 darab 12 mg hatáserősségű patron egyadagos buborékcsomagolásban, 1 vagy 5 buborékcsomagolás dobozban. Kétrekeszes patron előretöltött injekciós tollban Az 5,3 mg hatáserősségű előretöltött injekciós tollon kék jelzés található. A 12 mg hatáserősségű előretöltött injekciós tollon lila jelzés található. 1 vagy 5 darab kétrekeszes patron előretöltött injekciós tollban. Előre csomagolt injekciós tollak dobozban. 6.6 A megsemmisítésre vonatkozó különleges óvintézkedések és egyéb, a készítmény kezelésével kapcsolatos információk Kétrekeszes patron az injekciós oldat elkészítésére és beadására tervezett eszközben: Genotropin Pen. A szomatropint és az oldószert tartalmazó kétrekeszes patront a Genotropin Pen-be kell helyezni. A liofilizált por és az oldószer az injektor elemeinek vagy az előretöltött injekciós toll részeinek összecsavarásakor keveredik. A por feloldását az eszköz óvatos, körkörös mozgatásával lehet elősegíteni. Erősen nem szabad felrázni, mert az a hatóanyag denaturálódását eredményezheti. Az elkészített oldat majdnem színtelen vagy enyhén opálos. Az elkészített oldatot a beadás előtt vizuálisan ellenőrizni kell, és csak a tiszta, részecskéktől mentes oldat alkalmazható. A Genotropin elkészítésére és az elkészített Genotropin beadására vonatkozó részletes információkat lásd a Betegtájékoztató 3. pontjában, A Genotropin injekció beadása részben, valamint a Genotropin Pen-hez vagy az előretöltött injekciós tollra vonatkozó használati utasításban. A csomagolásban található steril injekciós tű a túlnyomás megszüntetésére és az injekció beadására szolgál. A tűt az oldat elkészítése előtt kell a Pen-re, illetve az előretöltött injekciós tollra illeszteni. (lásd még a Betegtájékoztatót is). Bármilyen fel nem használt készítmény, illetve hulladékanyag megsemmisítését a gyógyszerekre vonatkozó helyi előírások szerint kell végrehajtani. Az üres előretöltött injekciós tollat nem szabad újratölteni, és a megfelelő módon kell megsemmisíteni.
18 18 Megjegyzés: (két keresztes) Osztályozás: II./2 csoport Korlátozott érvényű orvosi rendelvényhez kötött, szakorvosi kórházi diagnózist követően folyamatos szakorvosi ellenőrzés mellett alkalmazható gyógyszer (Sz). 7. A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA Pfizer Kft Budapest Alkotás utca A FORGALOMBA HOZATALI ENGEDÉLY SZÁMA(I) OGYI-T-2050/01 GENOTROPIN 5,3 mg 5 db patron injekcióhoz OGYI-T-2050/02 GENOTROPIN 12 mg 1 db patron injekcióhoz OGYI-T-2050/03 GENOTROPIN 12 mg 5 db patron injekcióhoz OGYI-T-2050/04 GENOTROPIN 5,3 mg 1 db előretöltött injekciós toll OGYI-T-2050/05 GENOTROPIN 5,3 mg 5 db előretöltött injekciós toll OGYI-T-2050/06 GENOTROPIN 12 mg 1 db előretöltött injekciós toll OGYI-T-2050/07 GENOTROPIN 12 mg 5 db előretöltött injekciós toll 9. A FORGALOMBA HOZATALI ENGEDÉLY ELSŐ KIADÁSÁNAK / MEGÚJÍTÁSÁNAK DÁTUMA GENOTROPIN 5,3 mg por és oldószer oldatos injekcióhoz A forgalomba hozatali engedély első kiadásának dátuma:1993. február 5. A forgalomba hozatali engedély legutóbbi megújításának dátuma:2009. július 9. GENOTROPIN 12 mg por és oldószer oldatos injekcióhoz A forgalomba hozatali engedély első kiadásának dátuma:1996. november 5. A forgalomba hozatali engedély legutóbbi megújításának dátuma:2009. július A SZÖVEG ELLENŐRZÉSÉNEK DÁTUMA február 16.
* genetikailag módosított Escherichia coli törzsben, rekombináns DNS technológiával előállítva
 1. A GYÓGYSZER MEGNEVEZÉSE Omnitrope 5 mg/1,5 ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Az oldat ml-enként 3,3 mg (10 NE) szomatropint tartalmaz* Egy patron 1,5 ml térfogatban 5 mg (15 NE)
1. A GYÓGYSZER MEGNEVEZÉSE Omnitrope 5 mg/1,5 ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Az oldat ml-enként 3,3 mg (10 NE) szomatropint tartalmaz* Egy patron 1,5 ml térfogatban 5 mg (15 NE)
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Omnitrope 1,3 mg/ml por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml kész szuszpenzió 1,3 mg (4 NE) szomatropint*
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Omnitrope 1,3 mg/ml por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml kész szuszpenzió 1,3 mg (4 NE) szomatropint*
Az állapot súlyosságától függően prekóma vagy kóma esetében 24 óra alatt az adag 8 ampulláig emelhető.
 1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Omnitrope 1,3 mg/ml por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Feloldás után egy injekciós üveg 1,3 mg (4 NE) szomatropint*
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Omnitrope 1,3 mg/ml por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Feloldás után egy injekciós üveg 1,3 mg (4 NE) szomatropint*
Nemekre szabott terápia: NOCDURNA
 Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
Salmonella typhi (Ty2 törzs) Vi poliszacharidja
 1. A GYÓGYSZER NEVE Typherix oldat injekcióhoz előretöltött fecskendőben Hastífusz elleni poliszacharid vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina egy adagjának (0,5 ml) tartalma: Salmonella
1. A GYÓGYSZER NEVE Typherix oldat injekcióhoz előretöltött fecskendőben Hastífusz elleni poliszacharid vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina egy adagjának (0,5 ml) tartalma: Salmonella
Betegtájékoztató NUTROPINAQ 10 MG/2 ML (30 NE) OLDATOS INJEKCIÓ. NutropinAq 10 mg/2 ml oldatos injekció patronban.
 NUTROPINAQ 10 MG/2 ML (30 NE) OLDATOS INJEKCIÓ NutropinAq 10 mg/2 ml oldatos injekció patronban. Rekombináns DNS technológiával (Escherichia coli) elõállított szomatropin (INN). A NutropinAq hatóanyaga
NUTROPINAQ 10 MG/2 ML (30 NE) OLDATOS INJEKCIÓ NutropinAq 10 mg/2 ml oldatos injekció patronban. Rekombináns DNS technológiával (Escherichia coli) elõállított szomatropin (INN). A NutropinAq hatóanyaga
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
A Kockázatkezelési Terv Összefoglalója
 1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
A gyermekek növekedése és fejlődése
 A gyermekek növekedése és fejlődése Körner Anna Gyermekpszichiáter rezidensképzés, 2006. Alacsonynövés Testmagasság a korspecifikus 3-as percentilis (-2 SD) alatt Lassú növekedés A növekedési sebesség
A gyermekek növekedése és fejlődése Körner Anna Gyermekpszichiáter rezidensképzés, 2006. Alacsonynövés Testmagasság a korspecifikus 3-as percentilis (-2 SD) alatt Lassú növekedés A növekedési sebesség
III. melléklet. Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások
 III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
III. melléklet. Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai. Megjegyzés:
 III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai Megjegyzés: Az alkalmazási előírás, a címke és a betegtájékoztató a referál eljárás eredménye. Lehetséges,
III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai Megjegyzés: Az alkalmazási előírás, a címke és a betegtájékoztató a referál eljárás eredménye. Lehetséges,
SEGÉDANYAG: Por: glicin (E 640), mannit (E421), vízmentes dinátrium-hidrogén-foszfát (E 339), vízmentes nátrium-dihidrogénfoszfát
 GENOTROPIN 5,3 MG POR ÉS OLDÓSZER OLDATOS INJEKCIÓHOZ GENOTROPIN 5,3 mg por és oldószer oldatos injekcióhoz szomatropin HATÓANYAG: Szomatropin*. Egy injekciós patron 5,3 mg (16 NE) szomatropint* tartalmaz.
GENOTROPIN 5,3 MG POR ÉS OLDÓSZER OLDATOS INJEKCIÓHOZ GENOTROPIN 5,3 mg por és oldószer oldatos injekcióhoz szomatropin HATÓANYAG: Szomatropin*. Egy injekciós patron 5,3 mg (16 NE) szomatropint* tartalmaz.
Betegtájékoztató HUMATROPE 18 NE (6 MG) INJEKCIÓ PATRONBAN
 HUMATROPE 18 NE (6 MG) INJEKCIÓ PATRONBAN Humatrope 18 NE (6 mg) injekció patronban Humatrope 36 NE (12 mg) injekció patronban Humatrope 72 NE (24 mg) injekció patronban szomatropin HATÓANYAG: szomatropin.
HUMATROPE 18 NE (6 MG) INJEKCIÓ PATRONBAN Humatrope 18 NE (6 mg) injekció patronban Humatrope 36 NE (12 mg) injekció patronban Humatrope 72 NE (24 mg) injekció patronban szomatropin HATÓANYAG: szomatropin.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Mixtard 30 40 nemzetközi egység/ml szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 injekciós üveg 10 ml-t tartalmaz, ami 400 NE-gel egyenértékű.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Mixtard 30 40 nemzetközi egység/ml szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 injekciós üveg 10 ml-t tartalmaz, ami 400 NE-gel egyenértékű.
Alsó és felső részén fehér, átlátszatlan, 4-es méretű, kemény zselatin kapszula, amely 155 mg fehér színű, szagtalan port tartalmaz.
 1. A GYÓGYSZER NEVE Tramalgic 50 mg kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: 50 mg tramadol-hidroklorid kapszulánként. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA
1. A GYÓGYSZER NEVE Tramalgic 50 mg kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: 50 mg tramadol-hidroklorid kapszulánként. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA
B/Brisbane/60/2008 15,0 mikrogramm HA**
 1. A GYÓGYSZER MEGNEVEZÉSE Influvac szuszpenziós injekció előretöltött fecskendőben (2010/2011) 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy 0,5 ml-es adag vakcina az alábbi törzsekhez tartozó influenzavírusok
1. A GYÓGYSZER MEGNEVEZÉSE Influvac szuszpenziós injekció előretöltött fecskendőben (2010/2011) 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy 0,5 ml-es adag vakcina az alábbi törzsekhez tartozó influenzavírusok
6 mg szumatriptán (8,4 mg szumatriptán-szukcinát formájában) izotóniás oldatban, előretöltött injekciós patronban (0,5 ml).
 1. A GYÓGYSZER NEVE Imigran oldatos injekció + autoinjektor 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 6 mg szumatriptán (8,4 mg szumatriptán-szukcinát formájában) izotóniás oldatban, előretöltött injekciós
1. A GYÓGYSZER NEVE Imigran oldatos injekció + autoinjektor 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 6 mg szumatriptán (8,4 mg szumatriptán-szukcinát formájában) izotóniás oldatban, előretöltött injekciós
1. A GYÓGYSZER NEVE 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL. 1 adag (1 ml) tartalma: Hepatitisz B felszíni antigén 1,2. 20 mikrogramm
 1. A GYÓGYSZER NEVE Engerix-B szuszpenziós injekció felnőtteknek Engerix-B szuszpenziós injekció előretöltött fecskendőben felnőtteknek Hepatitisz B (rekombináns DNS) vakcina (adszorbeált) (HBV) 2. MINŐSÉGI
1. A GYÓGYSZER NEVE Engerix-B szuszpenziós injekció felnőtteknek Engerix-B szuszpenziós injekció előretöltött fecskendőben felnőtteknek Hepatitisz B (rekombináns DNS) vakcina (adszorbeált) (HBV) 2. MINŐSÉGI
MELLÉKLET FELTÉTELEK VAGY KORLÁTOZÁSOK, TEKINTETTEL A GYÓGYSZER BIZTONSÁGOS ÉS HATÁSOS HASZNÁLATÁRA, MELYEKET A TAGÁLLAMOKNAK TELJESÍTENIÜK KELL
 MELLÉKLET FELTÉTELEK VAGY KORLÁTOZÁSOK, TEKINTETTEL A GYÓGYSZER BIZTONSÁGOS ÉS HATÁSOS HASZNÁLATÁRA, MELYEKET A TAGÁLLAMOKNAK TELJESÍTENIÜK KELL FELTÉTELEK VAGY KORLÁTOZÁSOK, TEKINTETTEL A GYÓGYSZER BIZTONSÁGOS
MELLÉKLET FELTÉTELEK VAGY KORLÁTOZÁSOK, TEKINTETTEL A GYÓGYSZER BIZTONSÁGOS ÉS HATÁSOS HASZNÁLATÁRA, MELYEKET A TAGÁLLAMOKNAK TELJESÍTENIÜK KELL FELTÉTELEK VAGY KORLÁTOZÁSOK, TEKINTETTEL A GYÓGYSZER BIZTONSÁGOS
Maprelin. Maprelin 75µg/ml oldat injekciós sertések számára A.U.V. Biotechnikai felhasználásra, csoportok vagy állományok kezelésére.
 Maprelin Maprelin 75µg/ml oldat injekciós sertések számára A.U.V Biotechnikai felhasználásra, csoportok vagy állományok kezelésére. Maprelin 75 μg/ml 1.A FORGALOMBA HOZATALI ENGEDÉLY JOOSULTJÁNAK, TOVÁBBÁ
Maprelin Maprelin 75µg/ml oldat injekciós sertések számára A.U.V Biotechnikai felhasználásra, csoportok vagy állományok kezelésére. Maprelin 75 μg/ml 1.A FORGALOMBA HOZATALI ENGEDÉLY JOOSULTJÁNAK, TOVÁBBÁ
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban).
 1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Tresiba 100 egység/ml oldatos injekció előretöltött injekciós tollban 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml oldat 100 egység degludek inzulint
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Tresiba 100 egység/ml oldatos injekció előretöltött injekciós tollban 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml oldat 100 egység degludek inzulint
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Magnesium 250 mg Pharmavit pezsgőtabletta Magnesium Pharmavit 250 mg pezsgőtabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Magnesium 250 mg Pharmavit pezsgőtabletta Magnesium Pharmavit 250 mg pezsgőtabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Allergodil orrspray 4. sz. melléklete az OGYI-T- 5334/01-04 sz. Forgalomba
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Allergodil orrspray 4. sz. melléklete az OGYI-T- 5334/01-04 sz. Forgalomba
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14
 I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14 1. AZ ÁLLATGYÓGYÁSZATI GYÓGYSZERKÉSZÍTMÉNY NEVE INCURIN 1 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: ösztriol 1 mg/tabletta
I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14 1. AZ ÁLLATGYÓGYÁSZATI GYÓGYSZERKÉSZÍTMÉNY NEVE INCURIN 1 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: ösztriol 1 mg/tabletta
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Ecoporc SHIGA szuszpenziós injekció sertések számára 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml-es adagonként
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Ecoporc SHIGA szuszpenziós injekció sertések számára 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml-es adagonként
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tabletta Magnesii Citrici 500 mg Fono VII. Parma Mielőtt elkezdené gyógyszerét
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tabletta Magnesii Citrici 500 mg Fono VII. Parma Mielőtt elkezdené gyógyszerét
VeyFo. VeyFo Jungtier - Oral Mulgat
 VeyFo VeyFo Jungtier - Oral Mulgat Különleges táplálási igényeket kielégítő/diétás/ kiegészítő takarmány borjak, malacok, bárányok, kecskegidák és kutyák részére Használati utasítás Trimetox 240 oldat
VeyFo VeyFo Jungtier - Oral Mulgat Különleges táplálási igényeket kielégítő/diétás/ kiegészítő takarmány borjak, malacok, bárányok, kecskegidák és kutyák részére Használati utasítás Trimetox 240 oldat
I. melléklet. Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása
 I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilanciai Kockázatértékelő
I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilanciai Kockázatértékelő
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1/33 1. A GYÓGYSZER MEGNEVEZÉSE Resolor 1 mg-os filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 mg prukaloprid filmtablettánként (prukaloprid-szukcinát formájában).
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1/33 1. A GYÓGYSZER MEGNEVEZÉSE Resolor 1 mg-os filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 mg prukaloprid filmtablettánként (prukaloprid-szukcinát formájában).
4.3 Ellenjavallatok A terhesség második és harmadik trimesztere (lásd 4.4 és 4.6 pont) (Megjegyzés: szoptatásban nem ellenjavallt, lásd: 4.3 pont.
 ACE-gátlók és angiotenzin II antagonisták: alkalmazás terhességben és szoptatás alatt A PhVWP által 2008 októberben jóváhagyott alkalmazási előírás és betegtájékoztató szöveg ACE-gátlók Lisinopril, Fosinopril,
ACE-gátlók és angiotenzin II antagonisták: alkalmazás terhességben és szoptatás alatt A PhVWP által 2008 októberben jóváhagyott alkalmazási előírás és betegtájékoztató szöveg ACE-gátlók Lisinopril, Fosinopril,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmese BETEGTÁJÉKOZTTÓ:
FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmese BETEGTÁJÉKOZTTÓ:
Humán inzulin, rdns (rekombináns DNS technológiával, Saccharomyces cerevisiae-ben előállított).
 1. A GYÓGYSZER MEGNEVEZÉSE Actraphane 30 InnoLet 100 NE/ml szuszpenziós injekció előretöltött injekciós tollban 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán inzulin, rdns (rekombináns DNS technológiával,
1. A GYÓGYSZER MEGNEVEZÉSE Actraphane 30 InnoLet 100 NE/ml szuszpenziós injekció előretöltött injekciós tollban 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán inzulin, rdns (rekombináns DNS technológiával,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE NutropinAq 10 mg/2 ml (30 NE) oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy milliliter oldat 5 mg szomatropint* tartalmaz. 10 mg (30 NE)
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE NutropinAq 10 mg/2 ml (30 NE) oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy milliliter oldat 5 mg szomatropint* tartalmaz. 10 mg (30 NE)
Az oldat tartalma milliliterenként: humán plazmaprotein... 200 mg (legalább 98%-os tisztaságú IgG)
 1. A GYÓGYSZER MEGNEVEZÉSE Hizentra 200 mg/ml oldatos injekció bőr alá történő beadásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán normál immunglobulin (SCIg). Az oldat tartalma milliliterenként: humán
1. A GYÓGYSZER MEGNEVEZÉSE Hizentra 200 mg/ml oldatos injekció bőr alá történő beadásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán normál immunglobulin (SCIg). Az oldat tartalma milliliterenként: humán
1. A GYÓGYSZER NEVE 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL. 100 mikrogramm flutikazon-propionát (mikronizált) adagonként.
 1. A GYÓGYSZER NEVE Flixotide Diskus 100 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 250 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 500 mikrogramm/adag adagolt inhalációs por 2.
1. A GYÓGYSZER NEVE Flixotide Diskus 100 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 250 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 500 mikrogramm/adag adagolt inhalációs por 2.
Tudományos következtetések
 II. melléklet Tudományos következtetések, a forgalomba hozatali engedélyek visszavonásának illetve a forgalomba hozatali engedélyek feltételeit érintő változásnak az indoklása, valamint a PRAC ajánlásaitól
II. melléklet Tudományos következtetések, a forgalomba hozatali engedélyek visszavonásának illetve a forgalomba hozatali engedélyek feltételeit érintő változásnak az indoklása, valamint a PRAC ajánlásaitól
ELLENJAVALLAT: Ne alkalmazza a VPRIV-et, ha allergiás a velagluceráz-alfára vagy a gyógyszer egyéb összetevõjére.
 VPRIV 400 EGYSÉG POR OLDATOS INFÚZIÓHOZ VPRIV 400 egység por oldatos infúzióhoz velagluceráz-alfa HATÓANYAG: Velagluceráz-alfa. A 400 egység VPRIV port tartalmazó injekciós üveg 400 egység velagluceráz-alfát
VPRIV 400 EGYSÉG POR OLDATOS INFÚZIÓHOZ VPRIV 400 egység por oldatos infúzióhoz velagluceráz-alfa HATÓANYAG: Velagluceráz-alfa. A 400 egység VPRIV port tartalmazó injekciós üveg 400 egység velagluceráz-alfát
KETTŐS EREJÉVEL GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ ORRDUGULÁS ORRFOLYÁS IBUPROFÉN ÉS PSZEUDOEFEDRIN A MEGFÁZÁS TÜNETEI ELLEN FEJFÁJÁS TOROKGYULLADÁS
 IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát mg nátrium-klorid) filmtablettánként.
 1. A GYÓGYSZER MEGNEVEZÉSE Dona 750 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát + 192 mg nátrium-klorid) filmtablettánként. A segédanyagok
1. A GYÓGYSZER MEGNEVEZÉSE Dona 750 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát + 192 mg nátrium-klorid) filmtablettánként. A segédanyagok
Nanosomia A kivizsgálás indikációi, irányai. Dr. Halász Zita egyetemi docens Semmelweis Egyetem I. sz. Gyermekklinika, Budapest
 Nanosomia A kivizsgálás indikációi, irányai Dr. Halász Zita egyetemi docens Semmelweis Egyetem I. sz. Gyermekklinika, Budapest Az ideális növekedés alapfeltétele adequat táplálkozás, energia bevitel krónikus
Nanosomia A kivizsgálás indikációi, irányai Dr. Halász Zita egyetemi docens Semmelweis Egyetem I. sz. Gyermekklinika, Budapest Az ideális növekedés alapfeltétele adequat táplálkozás, energia bevitel krónikus
1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE. Remacycline L.A. 200 mg/ml oldatos injekció A.U.V. Oxitetraciklin 2. HATÓ- ÉS SEGÉDANYAGOK MEGNEVEZÉSE
 A KÜLSŐ CSOMAGOLÁSON ÉS A KÖZVETLEN CSOMAGOLÁSON FELTÜNTETENDŐ ADATOK Papírdoboz 50 ml-es, 100 ml-es, 250 ml-es és 500 ml-es injekciós üvegnek és címke 100 ml, 250 ml, 500 ml üvegre 1. AZ ÁLLATGYÓGYÁSZATI
A KÜLSŐ CSOMAGOLÁSON ÉS A KÖZVETLEN CSOMAGOLÁSON FELTÜNTETENDŐ ADATOK Papírdoboz 50 ml-es, 100 ml-es, 250 ml-es és 500 ml-es injekciós üvegnek és címke 100 ml, 250 ml, 500 ml üvegre 1. AZ ÁLLATGYÓGYÁSZATI
500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb flavonoidot tartalmaz).
 1. A GYÓGYSZER NEVE VenoprotEP 500 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb
1. A GYÓGYSZER NEVE VenoprotEP 500 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb
II. melléklet. Tudományos következtetések
 II. melléklet Tudományos következtetések 14 Tudományos következtetések A Haldol, amelynek hatóanyaga a haloperidol, a butirofenon csoportba tartozó antipszichotikum. Erős központi 2-es típusú dopamin receptor
II. melléklet Tudományos következtetések 14 Tudományos következtetések A Haldol, amelynek hatóanyaga a haloperidol, a butirofenon csoportba tartozó antipszichotikum. Erős központi 2-es típusú dopamin receptor
Az Insuman Rapid egy semleges inzulin oldat (reguláris inzulin)
 1. A GYÓGYSZER MEGNEVEZÉSE Insuman Rapid 100 NE/ml oldatos injekció injekciós üvegben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 NE humán inzulin (mely 3,5 mg-mal egyenértékű) mililiterenként. Az injekciós
1. A GYÓGYSZER MEGNEVEZÉSE Insuman Rapid 100 NE/ml oldatos injekció injekciós üvegben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 NE humán inzulin (mely 3,5 mg-mal egyenértékű) mililiterenként. Az injekciós
Betegtájékoztató SAIZEN CLICK.EASY 8 MG POR ÉS OLDÓSZER O. Saizen click.easy 8 mg por és oldószer oldatos injekcióhoz szomatropin
 SAIZEN CLICK.EASY 8 MG POR ÉS OLDÓSZER O Saizen click.easy 8 mg por és oldószer oldatos injekcióhoz szomatropin HATÓANYAG: 8 mg szomatropin (rekombináns humán növekedési hormon). SEGÉDANYAG: Szacharóz,
SAIZEN CLICK.EASY 8 MG POR ÉS OLDÓSZER O Saizen click.easy 8 mg por és oldószer oldatos injekcióhoz szomatropin HATÓANYAG: 8 mg szomatropin (rekombináns humán növekedési hormon). SEGÉDANYAG: Szacharóz,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Cetirizin-ratiopharm 10 mg filmtabletta Cetirizin-ratiopharm 10 mg filmtabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Cetirizin-ratiopharm 10 mg filmtabletta Cetirizin-ratiopharm 10 mg filmtabletta
314 mg kristályos glükózamin-szulfát (250 mg glükózamin-szulfát + 64 mg nátrium-klorid) kapszulánként.
 1. A GYÓGYSZER MEGNEVEZÉSE Dona 250 mg kemény kapszula Dona 1500 mg por belsőleges oldathoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Dona 250 mg kemény kapszula 314 mg kristályos glükózamin-szulfát (250 mg
1. A GYÓGYSZER MEGNEVEZÉSE Dona 250 mg kemény kapszula Dona 1500 mg por belsőleges oldathoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Dona 250 mg kemény kapszula 314 mg kristályos glükózamin-szulfát (250 mg
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Eporatio 1000 NE /0,5 ml oldatos injekció előretöltött fecskendőben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Előretöltött fecskendőnként 1000 nemzetközi
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Eporatio 1000 NE /0,5 ml oldatos injekció előretöltött fecskendőben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Előretöltött fecskendőnként 1000 nemzetközi
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
Olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára fontos információkat tartalmaz.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Plavix 75 mg filmtabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Plavix 75 mg filmtabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
PPI VÉDELEM A KEZELÉS SORÁN
 75 mg diclofenák-nátrium, 20 mg omeprazol módosított hatóanyag-leadású kemény kapszula PPI VÉDELEM A KEZELÉS SORÁN Jelentős fájdalom- és gyulladáscsökkentő hatás 1 Savkontroll az omeprazol segítségével
75 mg diclofenák-nátrium, 20 mg omeprazol módosított hatóanyag-leadású kemény kapszula PPI VÉDELEM A KEZELÉS SORÁN Jelentős fájdalom- és gyulladáscsökkentő hatás 1 Savkontroll az omeprazol segítségével
III. melléklet. A kísérőiratok vonatkozó pontjaiba bevezetendő módosítások
 III. melléklet A kísérőiratok vonatkozó pontjaiba bevezetendő módosítások Megjegyzés: Ezen kísérőiratok annak a referál eljárásnak az eredményeként készültek, amelyre a Bizottság e döntése vonatkozik.
III. melléklet A kísérőiratok vonatkozó pontjaiba bevezetendő módosítások Megjegyzés: Ezen kísérőiratok annak a referál eljárásnak az eredményeként készültek, amelyre a Bizottság e döntése vonatkozik.
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen e gyógyszer körültekintő bevétele.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
Alkalmazás: A tasakok tartalmát 125 ml vízben kell feloldani. Impaktálódott széklet esetén 8 tasakot lehet oldani 1 liter vízben.
 1. A GYÓGYSZER MEGNEVEZÉSE Moxalole por belsőleges oldathoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden egyes tasak az alábbi hatóanyagokat tartalmazza: Makrogol 3350 Nátrium-klorid Kálium-klorid Nátrium-hidrogénkarbonát
1. A GYÓGYSZER MEGNEVEZÉSE Moxalole por belsőleges oldathoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden egyes tasak az alábbi hatóanyagokat tartalmazza: Makrogol 3350 Nátrium-klorid Kálium-klorid Nátrium-hidrogénkarbonát
Átmenet a gyermekkorból - felnőttkori növekedési hormon kezelés
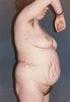 Átmenet a gyermekkorból - felnőttkori növekedési hormon kezelés Dr. Magony Sándor Szegedi Tudományegyetem Általános Orvostudományi Kar SzentGyörgyi Albert Általános és Gyógyszerésztudományi Centrum Endokrinológiai
Átmenet a gyermekkorból - felnőttkori növekedési hormon kezelés Dr. Magony Sándor Szegedi Tudományegyetem Általános Orvostudományi Kar SzentGyörgyi Albert Általános és Gyógyszerésztudományi Centrum Endokrinológiai
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
III. melléklet. Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral eljárás eredményeként jöttek létre.
 III. melléklet Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak módosításai Megjegyzés: Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral
III. melléklet Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak módosításai Megjegyzés: Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral
I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Melovem 5 mg/ml oldatos injekció szarvasmarháknak és sertéseknek 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Melovem 5 mg/ml oldatos injekció szarvasmarháknak és sertéseknek 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
Ismert hatású segédanyag: 0,61 mmol (1,41 mg) nátriumot tartalmaz milliliterenként.
 1. A GYÓGYSZER NEVE Zantac 25 mg/ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 25 mg ranitidin (28 mg ranitidin-hidroklorid formájában) milliliterenként. 50 mg ranitidin 2 ml oldatban ampullánként.
1. A GYÓGYSZER NEVE Zantac 25 mg/ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 25 mg ranitidin (28 mg ranitidin-hidroklorid formájában) milliliterenként. 50 mg ranitidin 2 ml oldatban ampullánként.
Kenőcs A kenőcs különösen alkalmas a száraz, lichenifikált és pikkelyesen hámló elváltozásokra.
 1. A GYÓGYSZER NEVE Dermovate krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg klobetazol-propionát 1 g 0,05%-os kenőcsben. Dermovate krém 0,5 mg klobetazol-propionát 1 g 0,05%-os krémben. A segédanyagok
1. A GYÓGYSZER NEVE Dermovate krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg klobetazol-propionát 1 g 0,05%-os kenőcsben. Dermovate krém 0,5 mg klobetazol-propionát 1 g 0,05%-os krémben. A segédanyagok
Betegtájékoztató: Információk a felhasználó számára. Gentos tabletta Homeopátiás gyógyszer
 Betegtájékoztató: Információk a felhasználó számára Gentos tabletta Homeopátiás gyógyszer Hatóanyagok: Populus tremuloides (Populus) trit. D1, Sabal serrulatum (Serenoa repens) trit. D6, Conium maculatum
Betegtájékoztató: Információk a felhasználó számára Gentos tabletta Homeopátiás gyógyszer Hatóanyagok: Populus tremuloides (Populus) trit. D1, Sabal serrulatum (Serenoa repens) trit. D6, Conium maculatum
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Duphalac szirup Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Duphalac szirup Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen
Ez a gyógyszer orvosi vény nélkül kapható. Az optimális hatás érdekében azonban elengedhetetlen e gyógyszer körültekintő alkalmazása.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Coldastop orrcsepp PIL új BETEGTÁJÉKOZTATÓ Coldastop orrcsepp A-vitamin-palmitát
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Coldastop orrcsepp PIL új BETEGTÁJÉKOZTATÓ Coldastop orrcsepp A-vitamin-palmitát
4.4 Különleges figyelmeztetések minden célállat fajra vonatkozóan
 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Flexicam 5 mg/ml oldatos injekció kutyáknak és macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy ml tartalmaz Hatóanyag: 5 mg meloxicam Segédanyagok: 150 mg vízmentes
1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Flexicam 5 mg/ml oldatos injekció kutyáknak és macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy ml tartalmaz Hatóanyag: 5 mg meloxicam Segédanyagok: 150 mg vízmentes
PGF Veyx. PGF Veyx 0,0875 mg/ml injekció szarvasmarháknak és sertéseknek A.U.V. Tervezett idejű ivarzás és ovuláció kiváltása
 PGF Veyx PGF Veyx 0,0875 mg/ml injekció szarvasmarháknak és sertéseknek A.U.V Tervezett idejű ivarzás és ovuláció kiváltása Vetélés kiváltása a vemhesség 150. napjáig Az ellés megindítása PGF Veyx 0,0875
PGF Veyx PGF Veyx 0,0875 mg/ml injekció szarvasmarháknak és sertéseknek A.U.V Tervezett idejű ivarzás és ovuláció kiváltása Vetélés kiváltása a vemhesség 150. napjáig Az ellés megindítása PGF Veyx 0,0875
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni,
Betegtájékoztató FUROSEMID-CHINOIN OLDATOS INJEKCIÓ. Furosemid-Chinoin oldatos injekció furoszemid. HATÓANYAG: 20 mg furoszemid 2 ml-es ampullánként.
 FUROSEMID-CHINOIN OLDATOS INJEKCIÓ Furosemid-Chinoin oldatos injekció furoszemid HATÓANYAG: 20 mg furoszemid 2 ml-es ampullánként. SEGÉDANYAG: Nátrium-klorid, trometamol, nátrium-hidroxid, injekcióhoz
FUROSEMID-CHINOIN OLDATOS INJEKCIÓ Furosemid-Chinoin oldatos injekció furoszemid HATÓANYAG: 20 mg furoszemid 2 ml-es ampullánként. SEGÉDANYAG: Nátrium-klorid, trometamol, nátrium-hidroxid, injekcióhoz
5. AZ ALKALMAZÁSSAL KAPCSOLATOS TUDNIVALÓK ÉS AZ ALKALMAZÁS MÓDJA(I)
 A KÜLSŐ CSOMAGOLÁSON FELTÜNTETENDŐ ADATOK {DOBOZ} 1. A GYÓGYSZER MEGNEVEZÉSE Chinofungin külsőleges oldatos spray tolnaftát 100 g 2. HATÓANYAG(OK) MEGNEVEZÉSE Hatóanyagok: 2 g tolnaftát 100 g folyadékban
A KÜLSŐ CSOMAGOLÁSON FELTÜNTETENDŐ ADATOK {DOBOZ} 1. A GYÓGYSZER MEGNEVEZÉSE Chinofungin külsőleges oldatos spray tolnaftát 100 g 2. HATÓANYAG(OK) MEGNEVEZÉSE Hatóanyagok: 2 g tolnaftát 100 g folyadékban
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Purevax Rabies szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden adag (1 ml) tartalmaz:
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Purevax Rabies szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden adag (1 ml) tartalmaz:
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen az alábbi
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen az alábbi
Egy immunizáló dózis (0,5 ml) 1,5 μg inaktivált kullancsencephalitis-vírust (törzs K23; csirkeembrio fibroblast sejtkultúrán tenyésztett) tartalmaz.
 1. A GYÓGYSZER NEVE ENCEPUR ADULTS szuszpenziós injekció előretöltött fecskendőben kullancsencephalitis vakcina, inaktivált. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy immunizáló dózis (0,5 ml) 1,5 μg inaktivált
1. A GYÓGYSZER NEVE ENCEPUR ADULTS szuszpenziós injekció előretöltött fecskendőben kullancsencephalitis vakcina, inaktivált. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy immunizáló dózis (0,5 ml) 1,5 μg inaktivált
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Fabrazyme 35 mg por oldatos infúzióhoz való koncentrátumhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg Fabrazyme 35 mg névleges
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Fabrazyme 35 mg por oldatos infúzióhoz való koncentrátumhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg Fabrazyme 35 mg névleges
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE SOMAVERT 10 mg por és oldószer oldatos injekcióhoz SOMAVERT 15 mg por és oldószer oldatos injekcióhoz SOMAVERT 20 mg por és oldószer oldatos injekcióhoz
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE SOMAVERT 10 mg por és oldószer oldatos injekcióhoz SOMAVERT 15 mg por és oldószer oldatos injekcióhoz SOMAVERT 20 mg por és oldószer oldatos injekcióhoz
A tabletta csaknem fehér színű, ovális és UCY 500 kódjelzéssel van ellátva.
 1. A GYÓGYSZER MEGNEVEZÉSE AMMONAPS 500 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg nátrium-fenil-butirát tablettánként. Minden AMMONAPS tabletta 62 mg nátriumot tartalmaz. A segédanyagok teljes
1. A GYÓGYSZER MEGNEVEZÉSE AMMONAPS 500 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg nátrium-fenil-butirát tablettánként. Minden AMMONAPS tabletta 62 mg nátriumot tartalmaz. A segédanyagok teljes
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! B BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Jumex 5 mg tabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! B BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Jumex 5 mg tabletta
Betegtájékoztató ALGOPYRIN 1 G/2 ML OLDATOS INJEKCIÓ. Algopyrin 1 g/2 ml oldatos injekció metamizol-nátrium
 ALGOPYRIN 1 G/2 ML OLDATOS INJEKCIÓ Algopyrin 1 g/2 ml oldatos injekció metamizol-nátrium HATÓANYAG: 1 g metamizol-nátrium 2 ml-es ampullánként. SEGÉDANYAG: Injekcióhoz való víz. JAVALLAT: Erõs vagy egyéb
ALGOPYRIN 1 G/2 ML OLDATOS INJEKCIÓ Algopyrin 1 g/2 ml oldatos injekció metamizol-nátrium HATÓANYAG: 1 g metamizol-nátrium 2 ml-es ampullánként. SEGÉDANYAG: Injekcióhoz való víz. JAVALLAT: Erõs vagy egyéb
Rovarméreg (méh, darázs) - allergia
 Rovarméreg (méh, darázs) - allergia Herjavecz Irén Országos Korányi TBC és Pulmonológiai Intézet Epidemiológia I. Prevalencia: - nagy helyi reakció: felnőtt 10-15 % - szisztémás reakció: gyerek 0.4-0.8
Rovarméreg (méh, darázs) - allergia Herjavecz Irén Országos Korányi TBC és Pulmonológiai Intézet Epidemiológia I. Prevalencia: - nagy helyi reakció: felnőtt 10-15 % - szisztémás reakció: gyerek 0.4-0.8
Kemény kapszula Fehér, átlátszatlan kemény kapsula, a kapszula alsó részén CYSTAGON 150, felső részén MYLAN felirattal.
 1. A GYÓGYSZER MEGNEVEZÉSE CYSTAGON 150 mg kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy kemény kapszula 150 mg ciszteamin-bitartarátot tartalmaz (merkaptamin-bitartarát formájában). A segédanyagok
1. A GYÓGYSZER MEGNEVEZÉSE CYSTAGON 150 mg kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy kemény kapszula 150 mg ciszteamin-bitartarátot tartalmaz (merkaptamin-bitartarát formájában). A segédanyagok
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Termék neve (gyártó megnevezése) BETEGTÁJÉKOZTTÓ Mielőtt elkezdené gyógyszerét
FIGYELEM!!! alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Termék neve (gyártó megnevezése) BETEGTÁJÉKOZTTÓ Mielőtt elkezdené gyógyszerét
II. melléklet. Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása
 II. melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 7 Tudományos következtetések A Cymevene i.v. és kapcsolódó nevek (lásd I. melléklet)
II. melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 7 Tudományos következtetések A Cymevene i.v. és kapcsolódó nevek (lásd I. melléklet)
A Havrix megfelel az Egészségügyi Világszervezet (WHO) biológiai anyagokra előírt követelményeinek.
 1. A GYÓGYSZER MEGNEVEZÉSE Havrix 1440 Elisa Egység szuszpenziós injekció előretöltött fecskendőben Havrix 720 Elisa Egység Junior szuszpenziós injekció előretöltött fecskendőben Hepatitis A vakcina antigén
1. A GYÓGYSZER MEGNEVEZÉSE Havrix 1440 Elisa Egység szuszpenziós injekció előretöltött fecskendőben Havrix 720 Elisa Egység Junior szuszpenziós injekció előretöltött fecskendőben Hepatitis A vakcina antigén
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR Béres B1-vitamin
FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR Béres B1-vitamin
Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye alapján jött létre.
 II. melléklet Az alkalmazási előírás és a betegtájékoztató módosítása az Európai Gyógyszerügynökség előterjesztésére Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye
II. melléklet Az alkalmazási előírás és a betegtájékoztató módosítása az Európai Gyógyszerügynökség előterjesztésére Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye
Sárga-halványsárga színű, kapszula alakú tabletta, az egyik oldalán 93 -as, a másik oldalán 211 -es mélynyomású jelzéssel.
 1. A GYÓGYSZER MEGNEVEZÉSE Repaglinide Teva 1 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 mg repaglinidet tartalmaz tablettánként. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA
1. A GYÓGYSZER MEGNEVEZÉSE Repaglinide Teva 1 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 mg repaglinidet tartalmaz tablettánként. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
GYŰJTŐDOBOZ, AMELY 1 DOBOZBAN 50 DB SZUSZPENZIÓT TARTALMAZÓ INJEKCIÓS ÜVEGET ÉS 2 1 DOBOZBAN 25 DB EMULZIÓT TARTALMAZÓ INJEKCIÓS ÜVEGET TARTALMAZ
 A. CÍMKESZÖVEG 1 A KÜLSŐ CSOMAGOLÁSON FELTÜNTETENDŐ ADATOK GYŰJTŐDOBOZ, AMELY 1 DOBOZBAN 50 DB SZUSZPENZIÓT TARTALMAZÓ INJEKCIÓS ÜVEGET ÉS 2 1 DOBOZBAN 25 DB EMULZIÓT TARTALMAZÓ INJEKCIÓS ÜVEGET TARTALMAZ
A. CÍMKESZÖVEG 1 A KÜLSŐ CSOMAGOLÁSON FELTÜNTETENDŐ ADATOK GYŰJTŐDOBOZ, AMELY 1 DOBOZBAN 50 DB SZUSZPENZIÓT TARTALMAZÓ INJEKCIÓS ÜVEGET ÉS 2 1 DOBOZBAN 25 DB EMULZIÓT TARTALMAZÓ INJEKCIÓS ÜVEGET TARTALMAZ
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Purevax FeLV szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden adag (1 ml) tartalmaz: Hatóanyag
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Purevax FeLV szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden adag (1 ml) tartalmaz: Hatóanyag
Betegtájékoztató: Információk a felhasználó számára
 Betegtájékoztató: Információk a felhasználó számára PARAMAX Junior 250 mg tabletta PARAMAX Rapid 500 mg tabletta PARAMAX Forte 1 g tabletta paracetamol Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa
Betegtájékoztató: Információk a felhasználó számára PARAMAX Junior 250 mg tabletta PARAMAX Rapid 500 mg tabletta PARAMAX Forte 1 g tabletta paracetamol Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa
A 2-es típusú cukorbetegség
 A 2-es típusú cukorbetegség tablettás kezelése DR. FÖLDESI IRÉN, DR. FARKAS KLÁRA Az oktatóanyag A MAgyAr DiAbetes társaság vezetôsége Megbízásából, A sanofi támogatásával készült készítette A MAgyAr DiAbetes
A 2-es típusú cukorbetegség tablettás kezelése DR. FÖLDESI IRÉN, DR. FARKAS KLÁRA Az oktatóanyag A MAgyAr DiAbetes társaság vezetôsége Megbízásából, A sanofi támogatásával készült készítette A MAgyAr DiAbetes
III. MELLÉKLET. Az Alkalmazási előírások és Betegtájékoztatók vonatkozó részeiben szükséges módosítások
 III. MELLÉKLET Az Alkalmazási előírások és Betegtájékoztatók vonatkozó részeiben szükséges módosítások Megjegyzés: A későbbiekben szükség lehet arra, hogy adott esetben a Referencia-tagállammal együttműködve,
III. MELLÉKLET Az Alkalmazási előírások és Betegtájékoztatók vonatkozó részeiben szükséges módosítások Megjegyzés: A későbbiekben szükség lehet arra, hogy adott esetben a Referencia-tagállammal együttműködve,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató tervezet Naphazolin orrcsepp Mielőtt elkezdené gyógyszerét
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató tervezet Naphazolin orrcsepp Mielőtt elkezdené gyógyszerét
I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása
 I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilancia Kockázatértékelő
I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilancia Kockázatértékelő
A Boostrix Polio diphtheria, tetanus, pertussis és poliomyelitis elleni emlékeztető oltásra javasolt 4 éves kortól (lásd 4.2 pont).
 1. A GYÓGYSZER NEVE Boostrix Polio szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus, pertussis (acelluláris összetevő) és (inaktivált) poliomyelitis vakcina (adszorbeált, csökkentett
1. A GYÓGYSZER NEVE Boostrix Polio szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus, pertussis (acelluláris összetevő) és (inaktivált) poliomyelitis vakcina (adszorbeált, csökkentett
A Puregon-kezelést a fertilitási problémák kezelésében jártas orvos felügyelete alatt kell elkezdeni.
 1. A GYÓGYSZER MEGNEVEZÉSE Puregon 150 NE/0,18 ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy patron összesen nettó 150 NE rekombináns follikulus stimuláló hormon (FSH) adagot tartalmaz 0,18
1. A GYÓGYSZER MEGNEVEZÉSE Puregon 150 NE/0,18 ml oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy patron összesen nettó 150 NE rekombináns follikulus stimuláló hormon (FSH) adagot tartalmaz 0,18
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humalog 100 Egység/ml oldatos injekció üvegben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 2.1 Általános leírás A Humalog steril, tiszta, színtelen, vizes
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humalog 100 Egység/ml oldatos injekció üvegben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 2.1 Általános leírás A Humalog steril, tiszta, színtelen, vizes
