A TÖMEGSPEKTROMETRIA ALAPJAI
|
|
|
- András Illés
- 8 évvel ezelőtt
- Látták:
Átírás
1 A TÖMEGSPEKTROMETRIA ALAPJAI Jegyzet Szerzők: Bóna Ágnes, Jámbor Éva, Márk László Pécsi Tudományegyetem Általános Orvostudományi Kar 2015 A jegyzet a TÁMOP C-13/1/KONV számú, Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőműhelyek nemzetközi versenyképességének erősítésére című projekt keretében készült.
2 Tartalomjegyzék 1. Bevezetés 3 2. A tömegspektrométer elvi felépítése 4 3. A vákuumrendszer 5 4. Mintabevitel 6 5. Ionforrások Elektron ionizáció Lágy ionizáció Kémiai ionizáció Szekunder ion tömegspektrometria Elektrospray ionizáció Légköri nyomású kémiai ionizáció Mátrix-segített lézer deszorpció/ionizáció Analizátorok Szektoros analizátor Kvadrupól analizátor Ioncsapda analizátor Repülési idő analizátor Detektor Fragmentálás és tandem tömegspektrometria A tömegspektrum A tömegspektrometria főbb alkalmazási területei Rövidítések Irodalomjegyzék 35 2
3 1. Bevezetés A tömegspektrometria (Mass Spectrometry, MS) az egyik legáltalánosabban alkalmazott analitikai eljárás, amely alkalmas szerves és szervetlen komponensekből képződött ionok tömeg/töltés (m/z) arányának nagyhatékonyságú meghatározására. Kezdetben az eljárást tömegspektroszkópiának nevezték, hiszen az ionok detektálása egy fluoreszkáló ernyőn történt, azonban ez az elnevezés napjainkban már nem használatos. A tömegspektrometria lényege, hogy a vizsgálandó vegyületek gáz halmazállapotú részecskéiből ionokat állít elő, majd ezeket relatív tömegük és töltésük hányadosa szerint elektromos és/vagy mágneses térben szétválasztja, végül detektálja. A tömegspektrometriás eljárások közel 100 éve járulnak hozzá a fizikai, kémiai, biológiai és orvostudományi kutatások rohamos fejlődéséhez. Napjainkban a tömegspektrométerek méretének és árának jelentős csökkenése nagyban elősegíti ezen módszerek elterjedését, így jelenleg ez az egyik legdinamikusabban fejlődő és legtöbbet alkalmazott analitikai eljárás. Rutinszerűen alkalmazható széles tömeg- és polaritás-tartományban különféle vegyületek tömegének és szerkezetének vizsgálatára. Intenzív a fejlesztések folynak a különböző ionforrások területén is, amelynek eredményeként jött létre a két leggyakrabban alkalmazott: mátrix-segített lézer deszorpciós (MALDI, Matrix-Assisted Laser Desorption/Ionization) és az elektrospray ionizációs (ESI, Electrospray Ionization) technika. Ezek kifejlesztése alapvető fontosságú volt a modern tömegspektrometria fejlődésében, hiszen segítségükkel lehetőség nyílt nagy molekulatömegű, nem illékony biopolimerek, peptidek, fehérjék valamint szintetikus rendszerek szerkezetének komplex tanulmányozására. Általánosan kijelenthetjük, hogy tömegspektrométerek rendkívül kis anyagmennyiségű minták (subfemtomol) gyors, pontos, megbízható analízisére alkalmas, az elválasztás-technikában használatos 3
4 módszerekkel (HPLC, UPLC, nanolc, nanouplc, GC, 1D/2D PAGE) jól kombinálható készülékek. 2. A tömegspektrométer elvi felépítése A tömegspektrométer készüléknek rendelkeznie kell mintabevivő rendszerrel, ionforrással, analizátorral és detektorral, valamint az ezekhez kapcsolódó számítógépes adatfeldolgozó és irányító rendszerrel (1. ábra). Az analizátor, a detektor és a nem légköri nyomáson működő ún. vákuum-ionforrások (pl. vákuum-maldi) viszonylag jelentős vákuum ( mbar) mellett üzemeltethetők megfelelően. A nagyvákuum az ion-molekula ütközések valamint az analizátor illetve a detektor falával történő ütközések minimalizálását szolgálja, hozzájárulva az ionizáció és a fragmentáció hatékonyságához. A nem kívánt kinetikai kölcsönhatások ugyanis módosíthatják az ionok repülési pályáit, részben vagy teljesen kiolthatják töltésüket, így reprodukálhatatlanná teszik a tömegspektrumot valamint csökkentik a műszer érzékenységét és felbontását. 1. ábra: A tömegspektrométer általános felépítése 4
5 3. A vákuumrendszer Az ionforrást elhagyó töltéssel rendelkező részecskék m/z értékének pontos meghatározása csak akkor lehetséges, ha az analizátorban és a detektorban az ionok energiája (a nem kívánt ütközések miatt) nem változik meg. Ennek érdekében a tömegspektrométer ezen részeiből el kell távolítani a gázmolekulákat. A modern tömegspektrométerekben a nagyvákuum előállítása két lépésben történik. Először egy elővákuum szivattyú mbar vákuumot hoz létre, erre a célra általában rotációs szivattyút alkalmaznak, de használható olajmentes csavarszivattyú is. A mbar nagyvákuumot egy vagy több turbómolekuláris szivattyú biztosítja. A tömegspektrométerben kialakuló tipikus nyomásértékeket a 2. ábra szemlélteti. A vákuumrendszer stabilitása és megbízható működése elengedhetetlen a tömegspektrométer megfelelő működéséhez, meghibásodásuk a tömegspektrométer számára végzetes lehet, mivel a nagyvákuumba hirtelen beáramló anyagok (olajgőz, vízpára) súlyosan károsítják a műszert és tartozékait. Ennek elkerülése érdekében a vákuumrendszer gondos karbantartást és folyamatos áramellátást igényel. 2. ábra: A tömegspektrométerben uralkodó nyomásviszonyok 5
6 4. Mintabevitel Tömegspektrometriával elméletileg bármilyen halmazállapotú sokkomponensű rendszer vizsgálható, azonban ezt nagyban befolyásolja az alkalmazott mintabeviteli és ionizációs technika. Általános szabály, hogy a mintát a tömegspektrométerbe való bevezetése előtt mindenképp gázhalmazállapotba kell juttatni, az ott uralkodó nagyvákuum miatt. Illékony vegyületeket (pl. gázok, könnyen párolgó anyagok) közvetlenül be lehet vezetni az ionforrásba, ahol az ionizáció megtörténik. Ha a vegyület nem illékony, akkor először fel kell oldani, majd valamilyen alkalmas megoldással gázfázisba juttatni, amely történhet pl. elektromos erőtér vagy porlasztás és szárítógáz segítségével. Az oldószer helyes megválasztása alapvetően befolyásolja a tömegspektrum minőségét. Általánosságban kerülendő a pufferek és a nem illékony sók alkalmazása. Egyszerű, néhány komponensű minták illetve kalibrációs standardok esetében alkalmazhatunk közvetlen adagolást, amely során egy automata infúziós pumpa és egy fecskendő segítségével juttatjuk a mintát tartalmazó oldatot az ionforrásba. Komplex biológiai mintáknál szinte minden esetben szükség van a komponensek előzetes elválasztásra is, amely során alkalmazhatunk többek között gázkromatográfot vagy HPLC készüléket. A fejlesztések folyamán, a folyadékkromatográfia és a tömegspektrometria összekapcsolása során a legnagyobb megoldandó probléma a vákuum stabilitásának megőrzése volt, hiszen az ionforrásba bekerülő mintamolekulák és oldószergőzök rontják a vákuumot. Azonban napjainkban a nagyhatékonyságú vákuum- és zsiliprendszerek használatával illetve a mikroés nano áramlási sebességek alkalmazásával ez a probléma kiküszöbölhető. A modern tömegspektrometriában a minta bevezetése és ionizációja párhuzamosan megy végbe, például a mátrix-segített lézer deszorpció/ionizáció (MALDI), az elektrospray ionizáció (ESI) valamint az atmoszférikus nyomású kémiai ionizáció (APCI) esetén is. A 6
7 lézer deszorpcióra épülő ionizációs eljárások során a mintabevitel szilárd állapotban történik, amelynek során a vizsgálandó mintát általában egy mátrix jelenlétében egy mintatartó tálcára kristályosítják. A mintatartók mérete és kialakítása igen változatos lehet, azonban a legelterjedtebb a 384 férőhelyes well-plate méretű formátum, amely könnyen lehetővé teszi a módszerek automatizálását. A mintatartók anyaga is eltérhet, általában valamilyen kémiai szempontból ellenálló fémből készülnek, így igen elterjedtek a rozsdamentes acél, alumínium és arany bevonattal ellátott tálcák, de léteznek egyszer használatos műanyag változatok is (3. ábra). Néhány klinikai (pl. lézersebészet) és gyógyszergyári alkalmazásnál elterjedőben van a közvetlen deszorpción alapuló ionizáció is, amely során a minta pl. gyógyszer tabletta, szövetminta közvetlenül érintkezik az ionizációt kiváltó lézerrel. 3. ábra: A MALDI TOF tömegspektrometriánál használatos, a minta töményítésére is alkalmas rozsdamentes acél mintatartó tálca 7
8 5. Ionforrások A tömegspektrometriában szükség van a vizsgált részecskék hatékony ionizálására, mivel a részecskék készülékben való mozgatása és szétválasztása az elektromos töltésükre gyakorolt hatás alapján történik. A megfelelő érzékenység eléréséhez elengedhetetlen az ionizációs paraméterek optimalizálása. Az ionizációs technika megválasztását főként a vizsgálandó molekula és az azt körülvevő mátrix határozza meg. Mivel univerzálisan alkalmazható ionizációs technika nincs, így a készülékek fejlődésénél meghatározó szerepű a különböző ionforrások cseréjének gyorsasága és egyszerűsége. Ennek következtében főként az atmoszférikus nyomású ionforrások terjedtek el, hiszen azok függetlenek a készülék vákuumrendszerétől így cseréjük, tisztításuk, karbantartásuk gyorsan és könnyen elvégezhető. A vákuum-ionforrások közül a legjelentősebb a MALDI, amely karbantartási igénye jóval kisebb a folyadékkromatográfiával kapcsolt változatokénál. 5.1 Elektron ionizáció A legrégebbi és igen gyakran alkalmazott eljárás az elektron ionizáció (EI). Ebben az esetben a minta egy fűtött katódból kilépő elektronnyalábbal találkozik és az ütközések révén elektronok lépnek ki, ezáltal pozitív ionok jönnek létre. Az elektronok ideális gyorsító feszültsége jellemzően 70 ev (elektronvolt). A módszer jól alkalmazható a könnyen gázfázisba vihető szerves vegyületek széles körének vizsgálatára kb Da molekulatömegig. Előnye, hogy intenzív, stabil, könnyen reprodukálható ionáramot biztosít és kompatibilis a legtöbb tömeganalizátorral. Hátránya azonban, hogy megfelelő eredményességgel csak a viszonylag illékony, kis molekulatömegű, stabil vegyületek esetében alkalmazható és a jelentős fragmentáció miatt a tömegspektrum bonyolult, a 8
9 molekulaion gyakran nem is jelentkezik. Az elektron ionizáció során alkalmazott magasabb hőmérsékleten egyes anyagok bomlást szenvedhetnek az alkalmazott ionizáló energiától függő mértékben. Ez a jelenség, a forrásban történő bomlás (In Source Decay, ISD), megfelelően alkalmazva hasznos szerkezetvizsgálati módszer, mivel további elemzésre felhasználható, anyagi minőségre jellemző töredékionok (fragmensek) képződnek. 5.2 Lágy ionizáció Az intenzív fragmentáció elkerülése érdekében alakultak ki az ún. kíméletes vagy lágy (soft) ionizációs technikák, amelyek kevesebb fragmentumot hoznak létre, így a spektrum egyszerűbb, könnyebben értékelhető. A lágy ionizációs módszereket három csoportba soroljuk úgy, mint részecske ütközéses technikák, párolgáson-porlasztáson alapuló módszerek és lézer deszorpciós módszerek. A részecske ütközésen alapuló technikák közé tartozik a kémiai ionizáció (CI), a szekunder ion tömegspektrometria (SIMS), a gyors atom- és ion ütköztetés (FAB, FIB) valamint a plazma deszorpció (PD). A párolgáson-porlasztáson alapuló eljárások a térdeszorpció (FD) és térionizáció (FI), a termikus porlasztásos (TS) továbbá atmoszférikus nyomáson lejátszódó kémiai- és fotoionizáció (APCI, APPI) valamint az elektroporlasztásos (ESI, nanoesi, DESI) ionizáció. A lézer deszorpciós (LDI) technikák közül jelentősebbek a mátrix-segített lézer deszorpció/ionizáció (MALDI) és a felület-segített lézer deszorpció/ionizáció (SELDI) Kémiai ionizáció Kíméletes eljárást jelent a kémiai ionizáció (Chemical Ionization, CI), melynek lényege, hogy először egy nagy feleslegben jelenlévő reagens gázt ionizálunk, azután az így képződött ionok 9
10 a minta molekuláival reagálva azokat ionizálják. A reagens gáz feleslegben történő alkalmazása megvédi a minta molekuláit az elektronokkal történő közvetlen ionizációjától. Azt a jelenséget, amikor az ionizáció ion-molekula kölcsönhatás eredményeként jön létre, először J. J. Thomson figyelte meg hidrogén gázban 1913-ban. A leggyakoribb reagens gázok: metán, izo-bután, ammónia, klór, dinitrogén-oxid. Mivel a kölcsönhatások valószínűsége arányos a nyomással, ezeket az ionforrásokat általában légköri nyomáson működtetik. Ennek a módszernek az előnye a kíméletes ionizáció, így kevesebb fragmens ion képződik, valamint általában megjelenik a spektrumban a pozitív vagy negatív töltésű molekulaion. Pozitív ionizáció esetén gyakori a [M+H] + protonált kvázi-molekulaion megjelenése is. Azonban a detektálhatóság felső tömeghatára (hasonlóan az elektron ionizációhoz) megközelítőleg 1000 Da Szekunder ion tömegspektrometria A szekunder ion tömegspektrometria (SIMS) esetében a sík általában fém felületen elhelyezett mintát részecske- vagy ionnyalábbal bombázzuk és a mintából kibocsátott szekunder ionokat analizáljuk. Ide tartozik a plazma deszorpció és a folyadék szekunderion tömegspektrometria (LSIMS). A plazma deszorpció (PD) elve, hogy a vizsgálandó mintát vékony filmrétegre viszik fel, és e mögé, a mintával ellentétes oldalra, helyezik el az erősen α-sugárzó 252 Cf radioaktív izotópot. Az izotópból kilépő nagy energiájú hasadási termékek a mintán történő áthaladáskor helyi felmelegedést okoznak és mikroplazmát hoznak létre; így energiát adnak át a minta molekuláinak, amelyek ionizálódnak és deszorbeálódnak. A PD MS volt az első módszer, amelynek segítségével lehetővé vált a nagy molekulatömegű fehérjék, illetve az összetett antibiotikumok vizsgálata. 10
11 A folyadék szekunderion tömegspektrometria (LSIMS) technika napjainkban is használatos elsősorban a hőre érzékeny, vagy nem illékony kis és közepes molekulatömeggel rendelkező anyagok esetében. A technikán belül két alapvető módszert különíthetünk el. A gyors atombombázás (Fast Atom Bombardment, FAB) során egy atomágyúból gyors argon vagy xenon nyalábot bocsátanak a mintára, mely egy viszkózus, kevéssé illékony folyadékban, többnyire glicerinben van oldva. A gyors ionbombázás (Fast Ion Bombardment, FIB) esetében céziumionokat (Cs + ) alkalmaznak. A részecskék a folyadékfelszínbe ütközve energiát adnak át a felszínnek, ami eloszlik a felületi réteg minta-mátrix molekulái között, azok ionizációját eredményezve. A képződő minta és mátrix ionok kiszakadnak a felszínről és az így létrejött szekunderionokat analizáljuk. A folyadékfilm felületi rétege diffúziós folyamatok révén állandóan pótlódik, frissül, ennek köszönhetően az analizált felület folyamatosan regenerálódik. A FAB hőérzékeny, poláros, Da tömegű molekulák, a FIB elsősorban nagyobb részecsketömegek (akár Da) vizsgálatára alkalmas. A módszer szerkezeti információkat is nyújt, mivel jellegzetes fragmensionok is képződnek. Napjainkban is folyamatos a módszer fejlesztése, többek között nagyon ígéretes eredményeket értek el fullerénionok (C + 60 ) ionizáló részecskeként történő alkalmazásával. A térdeszorpció és a térionizáció a deszorpciós módszerek közé tartozó rokon ionizációs technikák, melyek főként történelmi jelentőséggel bírnak. Mindkét esetben a minta ionizációját erős elektromos tér váltja ki, a módszerek tulajdonképpen csak a mintabeviteli módban különböznek egymástól. Ugyan a vizsgált részecskék szerkezetéről kevés információt szolgáltatnak, azonban tömegpontosságúk jó. 11
12 5.2.3 Elektrospray ionizáció A porlasztáson alapuló ionizációs eljárások különösképpen a folyadékkromatográfiával kapcsolt tömegspektrométerek esetében számítanak nélkülözhetetlen megoldásnak. A módszer elvét már az 1960-as években kigondolták, de a megvalósítás az 1980-as évekig váratott magára. A termikus porlasztás jelentette az első igazi előrelépést a hőre érzékeny, nem illékony anyagok MS, illetve LC-MS vizsgálatának területén. Elve, hogy a folyadékkromatográfiás oszlopon szétválasztott komponenseket és a mozgófázist nagy nyomással egy elektromosan melegített ( ºC) fém kapillárisba juttatják, amelynek a vége a tömegspektrométer ionforrásában van, így a minta és az oldószergőzök nagy sebességű ionizált spray formájában kerülnek be a tömegspektrométerbe. Ebben az esetben az ionizációt az oldószer (mozgófázis) illékony elektrolitjai valósítják meg. A leggyakrabban alkalmazott porlasztásos ionizációs forma az elekrospray (ESI, nanoesi), melynek során a kromatográfról lejövő minta egy fém vagy fémbevonatú szilika kapillárison halad keresztül, melyre 2-5 kv feszültséget kapcsolnak. A kapilláristól és a tőle 1-2 cm-re, nanoesi esetén néhány mm-re elhelyezett, ellentétes töltésű elektród között erős elektrosztatikus tér képződik, melynek hatására a kapillárisból kilépő folyadék kúpszerűen kicsúcsosodik (Taylor-kúp). Ezután a Taylor-kúpból egy vékony folyadéksugár lép ki az ellentétes töltésű elektród felé. Az így keletkezett folyadéksugár töltéssűrűsége igen nagy, instabil, ezért kisebb töltéssel rendelkező folyadékcseppekre bomlik. Az azonos töltésű cseppek között Coulomb-féle taszító erő lép fel, melynek eredményeként finom eloszlású elektrospray jön létre. A technika továbbfejlesztése nagyobb áramlási sebességek ( μl/perc) mellett is jól alkalmazható. Itt a kapilláris körül elhelyezkedő külső csőben vezetett inert porlasztógázzal, mely többnyire nitrogén, pneumatikusan hozzuk létre a töltött aeroszolt a folyadékmintából. A folyadékcseppekből az oldószer párolását egy további, nagy 12
13 mennyiségű, fűtött ( ºC) nitrogén árammal segítjük elő. A párolgás során a cseppecskék térfogata csökken, így a felületi töltéssűrűség egyre nagyobb lesz. Ez a folyamat egészen addig folytatódik, amíg az elektrosztatikus taszítás értéke eléri a felületi feszültség értékét (Rayleigh-határ), ami végül a cseppek felbomlását (Coulomb-robbanás) okozza. A folyamat végén a mintából származó kompakt, többszörösen töltött ionokat kapunk (4. ábra), mely lehetővé teszi a nagyobb molekula tömegű ionok, kisebb tömegtartománnyal rendelkező tömegspektrométerekkel történő mérését is, mivel az egyes ionok töltésétől függően az m/z értéke a felére, harmadára stb. csökken. Az ESI elsősorban a nem illékony, poláros, bázikus csoportot hordozó molekulák vizsgálatához ideális. 4.ábra: Az elektrospray ionforrás (ESI) vázlatos működési elve Légköri nyomású kémiai ionizáció A porlasztásos és a kémiai ionizációs eljárások kombinációja a légköri nyomású kémiai ionizáció (Atmospheric Pressure Chemical Ionization, APCI). Az aeroszol képződése és elpárologtatása az ESI-nél ismertetett módon történik, de itt nem a kapilláris, hanem a mintaárammal szemben elhelyezkedő elektród áll nagyfeszültség alatt (korona feszültség). A 13
14 koronakisülések hatására az elpárolgott víz- és egyéb oldószer-molekulák ionizálódnak ezáltal protonálják az itt áthaladó mintát is (5. ábra). Ezt a folyamatot az ellenáramban áramoltatott nitrogén gáz is segíti. A módszer nagy előnye, hogy lényegében bármilyen oldószer és puffer mellett használható, hátránya az alacsony kimutatási határa (<1000 Da) valamint, hogy csak közepesen poláros anyagok esetén alkalmazható megfelelően. 5. ábra: Atmoszférikus nyomású kémiai ionforrás (APCI) vázlatos felépítése Mátrix-segített lézer deszorpció/ionizáció A lézer deszorpció/ionizáció (LDI) lényege a mintamolekulák lézersugárral történő elpárologtatása és ionizációja, azonban ilyenkor gyakran keletkeznek rövid élettartalmú fragmens ionok. A probléma megoldását a 1980-as évek végén kifejlesztett mátrix-segített lézer deszorpció/ionizáció (MALDI) jelentette. Ezen ionizációs technika során a mintamolekulákhoz kis molekulatömegű szerves ún. mátrix anyagot keverünk, amely elnyeli és közvetíti a lézer energiáját a vizsgálandó anyagnak, illetve ionizálja azt, miközben meggátolja a keletkezett ionok fragmentációját. A módszer egyik legkényesebb pontja az adott vizsgálathoz optimális mátrix kiválasztása, általában mustársavat (SA), α-ciano-4- hidroxi-fahéjsavat (HCCA, CHCA), 2,5-dihidroxi-benzoesavat (DHB) alkalmazunk. A mintaelőkészítés során a mátrix és a mintaoldat keverékét (0,2 2 μl) a mintatartóra szárítjuk úgy, 14
15 hogy lehetőleg homogén mikrokristályos szilárd elegyet kapjunk. A gyors lézer impulzusok ( Hz) ebből a szilárd felületből párologtatnak el anyagot, és ez az ionizált részecskefelhő kerül az analizátorba (6. ábra). Az alkalmazott lézererősség nem csak a mátrix típusától, hanem a mátrix és a minta arányától is függ. Ha a minta aránya a mátrixnál sokkal kisebb, a megfelelő jelintenzitás eléréséhez jóval több minta elpárologtatására van szükség, ami a lézerintenzitás növelésével érhető el. Ugyanez igaz fordított esetben is, csak ekkor a mátrix alacsony koncentrációja okozza a jelintenzitás csökkenést a detektorban. A MALDI mérések során a lézer erősségét úgy választjuk meg, hogy az éppen az ionizációhoz szükséges küszöbértéket elérje, ezért az egyes mérések során legalább lézerlövés összesített átlaga adja a végső tömegspektrumot. A MALDI segítségével igen kíméletesen, de hatékonyan ionizálhatóak még a nagy tömegű, bomlékony molekulák is (fehérjék, szénhidrátok, oligonukleotidok, polimerek), így igen elterjedt módszer a biológiai és orvostudományi kutatásokban. További előnye az óriási mintaáteresztő képessége, amely napi több ezer minta automatizált vizsgálatát is jelentheti. 6. ábra: A mátrix-segített lézer deszorpció/ionizáció elve 15
16 6. Analizátorok Az analizátorban történik a képződött ionok szétválasztása a tömegük és a töltésük hányadosa (m/z) szerint. Minél kisebb az ion tömege illetve minél nagyobb a töltése, annál nagyobb sebességre képes szert tenni egy adott elektromágneses erőtér hatására. Lényegében ezt használják ki az ionok transzportján alapuló módszerek. Az újabb, modernebb készülékek inkább az ionok szelektív tárolása révén választják szét a részecskéket. Az analizátor jellemző paraméterei: a maximális vizsgálható m/z érték, az áteresztőképesség (a detektált és a képződött ionok számának hányadosa), illetve egy adott tömegre jellemző maximális felbontóképesség (molekulatömeg/csúcsszélesség). A Fourier-transzformációs tömegspektrométerek esetében az utóbbi érték elérheti akár az egymilliót is. 6.1 Szektoros analizátor A legrégebbi típusok a szektoros analizátorok, ahol az ionok a haladásukra merőleges mágneses térbe jutnak. Itt az elektromágneses impulzusuk és a töltésük szerint különböző sugarú körpályákra térülnek. A mágneses térerősség értékét változtatva más és más ionok juttathatók a detektorra. Az ionnyalábot ezt követően egy elektrosztatikus analizátorban sebesség szerint fókuszálják, ahol az ionok a haladásukra merőleges elektromos térerősség mellett, a kinetikus energiájuknak megfelelő körpályát követnek (7. ábra). A szektoros készülékeket a nagy felbontás, nagy érzékenység és széles mérési tartomány jellemzi. Hátrányuk, hogy drágák, lassúak, nagy a technikai háttérigényük, napjainkban az izotóparány méréseknél van gyakorlati jelentőségük. 16
17 7. ábra: Kettős fókuszálású szektoros analizátor felépítése 6.2 Kvadrupól analizátor Az egyik legelterjedtebb analizátor típus az ún. kvadrupól (quadrupol, Q). Itt az ionok négy párhuzamos henger alakú rúd között haladnak, amelyekre egyenáramot és nagyfrekvenciás váltóáramot kapcsolnak. A szemben lévő rudak azonos, a szomszédosak ellentétes polaritásúak, így közöttük oszcilláló elektromágneses tér alakul ki. A kvadrupólba bejutó különböző m/z értékkel rendelkező ionok különböző amplitúdójú kitéréseket végezve haladnak, azonban a rudak közti ideális pályát csak meghatározott m/z értékű ionok képesek tartani, a többi ion vagy elveszti a kinetikus energiáját vagy a rudakba csapódik (8. ábra). A rudakra kapcsolt váltóáram frekvenciáját változtatva a kvadrupól mindig más-más m/z értékkel rendelkező ionokat enged a detektorba, így a teljes tömegtartomány végig pásztázható. A kvadrupól készülékek viszonylag egyszerűbben működtethetők, gyorsak, mennyiségi vizsgálatokra kiválóan használhatóak, mivel lineáris tartományuk
18 nagyságrend, valamint jól kombinálhatók különféle ionforrásokkal és analizátorokkal. Hátrányuk, hogy tömegpontosságuk és felbontóképességük viszonylag alacsony. 8. ábra: A kvadrupól analizátor felépítése és működési elve 6.3 Ioncsapda analizátor Hasonló elven működik az ioncsapda (iontrap, IT), amelynél egy gyűrű alakú, és két másik elektród között jön létre az oszcilláló háromdimenziós elektromágneses tér. A bejutott ionok ebben az erőtérben haladnak egy körpályára kényszerítve, míg a körre merőleges irányban rezgéseket végeznek (9. ábra). 9. ábra: Lineáris (2D) ioncsapda analizátor felépítése 18
19 Lényeges újítás, hogy itt az ionok szétválasztása nem térben, hanem időben történik, ha növeljük a váltóáram amplitúdóját, akkor az ionok rezgőmozgása egyre fokozottabb lesz, és növekvő m/z sorrendben távoznak a kilépési elektród nyílásán a detektor felé (ún. tömegszelektív instabilitási üzemmód). Az ioncsapda előnye a nagyobb érzékenység és felbontóképesség, a gyorsabb működés, szélesebb mérési tömegtartomány és a többszörös fragmentáció (MS n ) lehetősége. Hátránya a mennyiségi mérések korlátozott lehetősége (lineáris tartomány kb. 4 nagyságrend). Az ioncsapdás készülékek sikerét reprezentálja, hogy kereskedelmi forgalomban számos típusuk érhető el, így léteznek lineáris (2D, LTQ) és 3D ioncsapdák illetve (10. ábra) ún. orbitrap analizátoros (11. ábra) készülékek. Ez utóbbiakra jellemző a rendkívüli tömegpontosság és felbontóképesség. 10. ábra: 3D ioncsapda analizátor felépítése 11. ábra: Az orbitrap analizátor vázlatos felépítése 19
20 6.4 Repülési idő analizátor Az elektrotechnika fejlődésével lehetővé vált igen kicsiny időkülönbségek pontos észlelése, amely a repülési időn (Time-of-Flight, TOF) alapuló elválasztás alapját képezi. A megoldás lényege, hogy az elektromosan térmentes repülési csőbe azonos időpillanatban, azonos kinetikai energiával rendelkező ionok kis csomagjai érkeznek, és a detektort az m/z értékükkel arányos repülési idő után érik el (12. ábra). A kisebb m/z értékkel rendelkező ionok előbb, a nagyobb tömegű ionok később érik el a detektort. Megfelelő ionforrással (MALDI) kombinálva a nagyobb biomolekulák vizsgálatában nélkülözhetetlenek. A MALDIhoz ideális a repülési idő analizátor, mivel általa kihasználható a több száz Da-os felső tömeghatár, valamint nagy felbontás és érzékenység érhető el. A modern TOF analizátorokban a kisebb tömegű ionokat (pl. peptidek) egy iontükör (reflektron) kinetikus energiájuk (m/z értékük) szerint újrafókuszálja. Az ionok addig hatolnak be a reflektronba, míg kinetikus energiájuk nulla nem lesz, így a nagyobb kinetikus energiával rendelkező ionok hosszabb, a kisebb energiájú ionok rövidebb utat tesznek meg, mielőtt az ellenkező irányban elhagynák a reflektront és a detektorba csapódnának. A reflektron révén a TOF készülékekkel ma már igen jó felbontóképesség, széles mérési tartomány érhető el illetve alkalmazásukkal megvalósítható többféle fragmentációs lehetőség is. 12. ábra: A repülési idő analizátor felépítése és működési elve 20
21 7. Detektor A tömegspektrométerben haladó ionok csoportja lényegében a forrástól a detektorig tartó elektromos áramot jelent. A készülékek detektorai a hozzájuk érkező rendkívül kis ionáramot ( A) érzékelik, és értékével arányos analóg elektromos jelet képeznek. A pontdetektorok az időben szétválasztott, a sordetektorok pedig a térben elkülönített ionok érzékeléséhez használatosak. Alapvető követelmény, hogy a detektorok képesek legyenek követni az ionáramok igen gyors változásait, tehát memória-effektusuk kicsi legyen. A legelterjedtebben alkalmazott típus a mikrocsatornás detektor (14. ábra). A kapott kis jeleket többnyire elektron- vagy foton-sokszorozókkal felerősítik, majd számítógépes feldolgozás céljából digitalizálják. 14. ábra: Mikrocsatornás detektor vázlatos működési elve 21
22 8. Fragmentálás és tandem tömegspektrometria Ha viszonylag kis energiával ionizáljuk a vizsgálandó anyagunkat, akkor a molekulák egészben maradnak, és a tömegükre és töltésükre jellemző ún. molekulacsúcsot [M +, M - ] kapunk. Többnyire azonban jóval nagyobb mennyiségű információ nyerhető, speciális problémákra (pl. több anyag elkülönítése, szekvenálás) jobb megoldást jelent, ha a részecskéket kinetikus energia hozzáadásával pontosan szabályzott módon széttördeljük, fragmentáljuk. Ez a folyamat történhet az ionizációs folyamat során, illetve röviddel utána (in source és post source decay, ISD, PSD), vagy az analizátorban egy inert gázzal való ütközés révén (collision induced dissociation, CID és electron transfer dissociation, ETD). A keletkező fragmentumok kémiai felépítése és aránya az anyaion anyagi minőségétől és az alkalmazott energiától függ, így további tömegspektrometriás vizsgálatra használható fel. Természetesen ilyenkor csak azok a fragmentumok, más szóval leányionok jönnek szóba, amelyek az eredeti töltést tovább hordozzák. Ezt a jelenséget használják ki a tandem tömegspektrometria jelölése: MS/MS vagy MS n - esetében, amikor két egymás után kapcsolt analizátor közé egy jellemzően argon, hélium vagy nitrogén gázzal működtetett ütközési cellát (collision cell) iktatnak. Itt lehetőség van az első analizátorban szétválasztott ionok egyenkénti fragmentálására, és a leányionok szelektív vizsgálatára. Tipikus megoldás a QqQ elrendezés, ahol két kvadrupol analizátor közé kerül a cella. Az ioncsapda esetén kissé más a helyzet: itt a fragmentációt megelőző és követő folyamatok nem térben, hanem időben válnak szét egymástól egyetlen analizátorban. Fontos tudni, hogy a rutinszerűen használt készüléktípusokban a fragmentáció az ionintenzitás 1-2 nagyságrenddel való csökkenését okozza, így tényleges gyakorlati haszna az MS/MS és MS 3 méréseknek van. 22
23 Mérési üzemmódok tandem tömegspektrométerrel: Egyedi ion vizsgálat (single ion recording): az egyik analizátor egy bizonyos m/z értéknél enged át, a másik nem aktív (15. ábra). 15. ábra: Az egyedi ionkiválasztás sematikus működése Pásztázás (scan): az egyik analizátor egy bizonyos m/z tartományt pásztáz, a másik nem aktív (16. ábra). 16. ábra: A teljes pásztázás elvi működése 23
24 Többszörös reakció megfigyelés (multiple reaction monitoring): mindkét analizátor egy-egy bizonyos m/z értéknél enged át; általában egy iont és valamely fragmentumát. Több, független fragmentációs átmenet vizsgálható így (17. ábra). 17. ábra: A többszörös reakció megfigyelés elve Anyaion pásztázás (parent ion scan): az első analizátor egy tartományt pásztáz, a második pedig egy bizonyos m/z értéknél enged át. Azokat az ionokat vizsgálhatjuk, amelyek egy bizonyos méretű töltött fragmentumot adnak (18. ábra). 18. ábra: Prekurzor ion pásztázás 24
25 Leányion pásztázás (daughter ion scan): az első analizátor egy bizonyos m/z értéknél enged át, a második pedig egy tartományt pásztáz. Megvizsgálhatjuk, hogy egy bizonyos méretű ion milyen fragmentumokra esik szét (19. ábra). 19. ábra: A fragmens ion pásztázás elvi működése Állandó semleges vesztés (constant neutral loss): mindkét analizátor pásztázó módban működik, de a második egy állandó m/z értékkel lejjebb. Azok az ionok vizsgálhatók, amelyek egy bizonyos méretű semleges fragmentumot képeznek (20. ábra). 20. ábra: A semleges vesztéses pásztázás elve 25
26 Az analizátor típusok bármilyen kombinációja (MS/MS) elképzelhető az ún. hibrid készülékekben, amelyek két, vagy több különböző típusú analizátor összekapcsolásából jönnek létre. A rutin vizsgálatok során leggyakrabban hibrid típusú készülékeket alkalmaznak, amelyek közül a legelterjedtebb kombinációk a Q-TOF, Q-IT, IT-TOF megoldások (13. ábra). Az MS/MS készülékekben az első analizátor általában az ionok kiválasztásáért, míg a második, nagyobb felbontóképességgel rendelkező analizátor a pontos m/z érték meghatározásáért felelős. 13. ábra: Példák hibrid tömegspektrométerekre: a) Q-TOF kombinált analizátor b) Q-IT hibrid MS 26
27 9. A tömegspektrum A tömegspektrum a tömeg/töltés (m/z) arány és az ionintenzitás függvényszerű ábrázolása. A tömegspektrometriában leggyakrabban használt tömegegység a dalton (Da), amely a 12 C atom tömegének egy tizenketted része. A legintenzívebb csúcs a báziscsúcs, ehhez viszonyítjuk az összes többi komponenst. Az abszolút ionmennyiség arányos a mintában jelenlévő anyagmennyiséggel, a fragmentumok relatív ionintenzitásai pedig a molekulatípusra és az alkalmazott mérési eljárásra jellemzőek. A készülékre, így a kapott tömegspektrumra is jellemző a felbontóképesség, amely azt a R=m/Δm értéket jelenti, ahol m a tömegszám, melytől egy szomszédos csúcsot még éppen el tudunk különíteni. Ehhez meg kell adni, hogy a két csúcs közös átfedő szakasza legfeljebb milyen relatív magasságú lehet, Δm a két csúcs tömegének különbsége (illetve helyesebb m/z és Δ[m/z] értékekről beszélni). A felbontóképesség a nagyobb tömegek felé haladva általában csökken, tipikusan értékű. 10. A tömegspektrometria főbb alkalmazási területei Minél többet tudunk a gének szerepéről, annál világosabbá válik a fehérjék és azok módosításainak szerepe a patológiás folyamatokban. A proteomika összetett fehérjekeverékek valamint azok enzimatikus emésztményeinek egyidejű vizsgálatát jelenti. A proteom kutatás módszertana egyszerű: az egészséges és a beteg rendszer fehérje készletét összehasonlítva olyan markereket fedezhetünk fel, amelyek egyértelmű diagnózis felállítását teszik lehetővé. Tehát az adott pillanatban minőségi és lehetőleg mennyiségi vizsgálatot kell végezni az adott fiziológiás állapotú sejt teljes fehérjeállományáról és azt össze kell vetni a kísérletesen manipulált, vagy beteg sejt proteomjával. A különbséget okozó fehérjék vagy fehérje 27
28 töredékek mennyiségi és minőségi analízise, pontos szekvenciájának és kovalens módosításainak meghatározása diagnosztikai célokat szolgálhat. A MALDI TOF tömegspektrometria által biztosított széles tömegtartomány miatt célszerűen két detektort alkalmazunk. A kis tömegű ionokat a nagyobb úthosszat biztosító reflektron detektorban, míg a nagyobb tömegűeket lineáris módban mérjük. A kimutatási határ rutinszerűen femtomol nagyságrendű. A készülékkel megvalósítható tandem tömegspektrometria (TOF/TOF) is, melynek során az ionforrásból kilépő részecskéket két módon fragmentálhatjuk: közvetlenül az ionforrás után (PSD) vagy argongáz segítségével egy erre a célra kialakított ütközési cellában (CID, ETD). A valóságban ez a megoldás azért bonyolult, mert több tízezer fehérje vagy peptid egyszerre történő analíziséről van szó. Ma a legelterjedtebb módszer az, hogy valamilyen elválasztás technikai módszerrel a több tízezer fehérje, peptid közül kiválasztják azt a nagyobb csoportot (szubproteomot), amelyben az összehasonlítani kívánt peptidek, fehérjék megtalálhatók. Erre a célra a gélelektroforézis vagy a nagyhatékonyságú folyadékkromatográfia a legalkalmasabb, ezt követően a frakciókat tisztítjuk és enzimatikusan emésztjük. Az így kapott peptid keverékhez meghatározott arányban mátrix-oldatot keverünk és az elegyet mintatartó tálcára szárítjuk. A mátrix kiválasztásánál a molekula típusát, polaritását valamint molekulatömegét is figyelembe kell venni. Ennek megfelelően a fehérje emésztmények (molekulatömeg < 5 kda) elemzéséhez ideális mátrix az α-ciano-4-hidroxifahéjsav (HCCA, CHCA). A vizsgálat során rögzítjük a peptid keverékre jellemző tömegspektrumot, majd a kiértékelés során megfelelő matematikai átalakítások után az eredményeket elküldjük egy fehérje szekvenciákat tartalmazó adatbázisba (Mascot, SwissProt, NCBInr). A keresés eredményeként megkaphatjuk az adott tömegspektrum által meghatározott fehérjét vagy fehérjéket. Ezt a meghatározási módszert Peptide Mass Fingerprinting-nek (PMF) nevezzük. 28
29 A gyulladásos betegségek laboratóriumi diagnosztikájában alapvető jelentősége van a sejten belüli jelátviteli utak monitorozásának. A patológiás folyamatok detektálásának leggyorsabb módja a jelátviteli utak fontosabb enzimjeinek, fehérjéinek kovalens módosításának meghatározása, mely többek között jelenthet foszforilációt, farnezilációt, lizin oldal-láncok acetilezését és fehérjék ADP-ribozilezését is. A MALDI TOF tömegspektrometria segítségével azonosíthatjuk a különböző fehérje módosításokat valamint azokat a fehérjéket, melyek fontos szerepet játszhatnak különböző folyamatok patomechanizmusában illetve a diagnosztikus értékű fehérjéket egyaránt. A meghatározás során a PMF-hez hasonlóan rögzítjük az elsődleges tömegspektrumot, majd ezt követően a nagyobb intenzitású vagy diagnosztikailag jelentős peptideket PSD vagy CID fragmentációval tovább bontjuk. Így meghatározható a peptidek pontos elsődleges szerkezete és annak módosulása valamint eddig ismeretlen peptidek és proteinek felépítése (De Novo szekvenálás). A diagnosztikai jelentőségű peptidek és fehérjék kimutatására viszonylag kevés példát találunk. Utóbbiban jelentős szerepet játszhat a központi idegrendszerben, igen kis mennyiségben előforduló hipofízis adenilát-cikláz aktiváló polipeptid (PACAP) jelenlétének, lokalizációjának és mennyiségének MALDI TOF és LC-MS tömegspektrometriás vizsgálata (21. ábra). A PACAP nagyobb mennyiségben a központi és perifériás idegrendszerben fordul elő, de megtalálható többek között az endokrin mirigyekben, az ivarszervekben, a gasztrointesztinális traktus teljes hosszában valamint a kardiovaszkuláris rendszerben egyaránt. A PACAP számos, az endokrin rendszert érintő hatása mellett antiapoptotikus valamint neuroprotektív, az idegrendszer fejlődését befolyásoló szerepe is jelentős. 29
30 21. ábra: A hipofízis adenilát-cikláz-aktiváló polipeptidjének (PACAP-38) MALDI TOF tömegspektrometriás vizsgálata a) A PACAP-38 protonált kvázimolekula ionja lineáris detektálási módban b) A PACAP-38 nátriummal képzett kvázimolekula ionja lineáris detektálási módban c) A PACAP-38 triptikus peptidjének azonosítása reflektron módban 30
31 A tömegspektrometriára épülő peptidomika és proteomika egyik legnagyobb felhasználási területe az onkológia. A belignus és malignus elváltozások korai fázisban történő diagnosztizálása és megkülönböztetése valamint a gyógyszeres- és sugárterápia hatásának nyomon követése egyaránt elvégezhető a modern tömegspektrometria segítségével. Az irodalomban számos olyan közleményt találunk, amelyekben proteomikai vizsgálat segítségével, a tumorra jellemző, korai fázisban is kimutatható biomarkereket azonosítottak különböző testfolyadékokból (vér, szérum, vizelet, nyál stb.). Potenciális tumorbiomarkerek lehet például az annexin 1 és 2 valamint a peroxiredoxin-2 fehérjék, amelyek hatékonyan mutathatóak ki kíméletes módon, például a betegek nyálából. A tömegspektrometria igen gyors és hatékony diagnosztikai módszer lehet a fertőző humán patogének kimutatására egyaránt. A Mycobacteriumok sejtmembránjában nagy mennyiségben jelen levő mikolsavak jelenléte igen jól vizsgálható MALDI TOF tömegspektrometriával. A módszer érzékenységét jellemzi, hogy még több száz éves Mycobacterium tuberculosis-sal fertőzött csontminták esetében is eredményesen alkalmazható. Napjaink egyik legizgalmasabb fejlesztése a MALDI TOF tömegspektrometria képalkotó módszerként történő alkalmazása (MALDI Imaging), melynek során egy speciális mintatartóra mikronos szövettani metszetet és mátrixot szárítunk. Ezt követően a mintáról előre meghatározott módon és lézerintenzitással több ezer tömegspektrumot veszünk fel, amelyeket a megfelelő szoftver, az egyes m/z értékekhez tartozó intenzitások eloszlása alapján képként jeleníti meg. A gyógyszergyárak számára rendkívüli jelentősséggel bír a felhasznált vegyületek lehetséges bomlástermékeinek ismerete. A MALDI TOF tömegspektrometria segítségével a gyógyszerhatóanyagok stabilitásvizsgálata is elvégezhető. Ilyenkor a minták azonos mennyiségeit speciálisan előkészített mintatartó tálcára cseppentjük, majd analizáljuk. A 31
32 vizsgálatok után a hatóanyagokat tartalmazó tálcákat akár -70 C-on tárolhatjuk és a későbbiek folyamán mérhetjük a molekulák szerkezetében bekövetkező változásokat. A tömegspektrometria alkalmazása az orvosi laboratóriumi diagnosztikában már eddig is számos, a medicina számára nagy fontosságú anyag vizsgálatát tette lehetővé, vagy éppen egyszerűbbé, pontosabbá. Az elemzés alá vont molekulák köre folyamatosan bővül, gyakran egész betegségcsoportokat lefedő tematikus panelekbe rendeződik. Nem elhanyagolható körülmény, hogy a tömegspektrometriás eljárások sok esetben gazdaságilag is a legkedvezőbb megoldást kínálják más, hagyományosabb technikákkal összehasonlítva. Természetesen arról sem szabad megfeledkezni, hogy az alapberuházás és a szervizelés költségei igen magasak. Az MS, különösképpen megfelelő kromatográfiás elválasztással és tandem mérési módozattal kombinálva, az egyik leghatékonyabb technológia jelenleg a szerves molekulák vizsgálata terén. Óriási előnye, hogy egyetlen rövid méréssel, melyet gyakran csak egyszerű mintaelőkészítés előz meg, nagyszámú vegyület elemzésére van lehetőség, továbbá ez a repertoár viszonylag könnyen és olcsón bővíthető. A jövőben várhatóan egyre több módszer fog átvándorolni az MS alkalmazások területére. 32
33 11. Rövidítések APCI: légköri nyomású kémiai ionizáció (Atmospheric Pressure Photoionization) APPI: légköri nyomású fotoionizáció (Atmospheric Pressure Chemical Ionization) CHCA, HCCA: α-ciano-4-hidroxifahéjsav (α-cyano-4-hydroxycinnamic Acid) CI: kémiai ionizáció (Chemical Ionizaiton) CID: ütközés indukált disszociáció (Collision Induced Dissociation) DESI: deszorpciós elektrospray ionizáció (Desorption Electrospray Ionization) DHB: 2,5-dihidroxi-benzoesav (2,5-Dihydroxybenzoic Acid) EI: elektron ionizáció (Electron Ionization) ESI: elektrospray ionizáció (Electrospray Ionization) ETD: elektron átadásos dissziociáció (Electron Transfer Dissociation) FAB: gyors atomütköztetés (Fast Atom Bombardment) FD: térdeszorpció (Field Desorption) FI: térionizáció (Field Ionization) FIB: gyors ionütköztetés (Fast Ion Bombardment) GC-MS: gázkromatográfiával kapcsolt tömegspektrometria (Gas Chromatography-Mass Spectrometry) HPLC: nagyhatékonyságú folyadékkromatográfia (High Pressure Liquid Chromatography) ISD: forrásban történő bomlás (In Source Decay) LC-ESI: folyadékkromatográfiás elektrospray ionizáció (Liquid Chromatography Electronspray Ionization) LC-ESI-MS: folyadékkromatográfiás elektrospray tömegspektrométer (Liquid Chromatography Electronspray Ionization Mass Spectrometry) LC-MS/MS: folyadékkromatográfiával kapcsolt tandem tömegspektrometria (Liquid Chromatography-Tandem Mass Spectrometry) LDI: lézer deszorpció/ionizáció (Laser Desorption/Ionisation) LSIMS: folyadék szekunderion tömegspektrometria (Liquid Secondary Ion Mass Spectrometry) 33
34 MALDI: mátrix-segített lézer deszorpció/ionizáció (Matrix-Assisted Laser Desorption/Ionization) MALDI-TOF MS: mátrix-segített lézer deszorpció/ionizációt alkalmazó repülési idő tömegspektrometria (Matrix-Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry) MS: tömegspektrometria (Mass Spectrometry) PAGE: poliakrilamid gélelektroforézis (Polyacrylamide Gel Electrophoresis) PD: plazma deszorpció (Plasma Desorption) PSD: forrás után történő bomlás (Post Source Decay) SA: mustársav (Sinapic Acid) SELDI-MS: felület-segített lézer deszorpció/ionizáció tömegspektrometria (Surface- Enhanced Laser Desorption/Ionization Mass Spectrometry) SIMS: szekunder ion tömegspektrometria (Secondary Ion Mass Spectrometry) TOF: repülési idő analizátor (Time-of-Flight) TS: termikus porlasztás (Thermospray ionization) UPLC-MS/MS: ultrahatékonyságú folyadékkromatográfiás tandem tömegspektrometria (Ultra Performance Liquid Chromatography Tandem Mass Spectrometry) 34
35 12. Irodalomjegyzék Greaves J., Roboz J.: Mass Spectrometry for Novice. CRC Press, Boca Raton (2014) Gross J.H.: Mass Spectrometry: A Textbook. Springer, Heidelberg (2004) Hoffmann E., Stroobant V.: Mass spectrometry: Principles and Applications. Wiley, Chichester (2007) Lipton M.S., Pasa-Tolic L.: Mass Spectrometry of Proteins and Peptides. Humana Press, New York (2009) Berki T., Kellermayer M., Ludány A. (szerk.) és mtsai: A fehérjekutatás modern módszertana. Medicina Kiadó, Budapest, (2011) Debreczeni L., Kovács L.G. (szerk.) Gyakorlati Laboratóriumi Medicina. Literatura Medica Kiadó, Budapest, pp (2008) Vékey K., Telekes A., Vértes Á. (szerkesztők): Medical Applications of Mass Spectrometry. Elsevier, Amsterdam (2008) 35
Anyagszerkezet vizsgálati módszerek
 Kromatográfia Folyadékkromatográfia-tömegspektrometria Anyagszerkezet vizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagszerkezet vizsgálati módszerek Kromatográfia 1/ 25 Folyadékkromatográfia-tömegspektrometria
Kromatográfia Folyadékkromatográfia-tömegspektrometria Anyagszerkezet vizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagszerkezet vizsgálati módszerek Kromatográfia 1/ 25 Folyadékkromatográfia-tömegspektrometria
Korszerű tömegspektrometria a. Szabó Pál MTA Kémiai Kutatóközpont
 Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Tematika Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Tematika Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
Tömegspektrometria. Tömeganalizátorok
 Tömegspektrometria Tömeganalizátorok Mintabeviteli rendszer Működési elv Vákuumrendszer Ionforrás Tömeganalizátor Detektor Electron impact (EI) Chemical ionization (CI) Atmospheric pressure (API) Electrospray
Tömegspektrometria Tömeganalizátorok Mintabeviteli rendszer Működési elv Vákuumrendszer Ionforrás Tömeganalizátor Detektor Electron impact (EI) Chemical ionization (CI) Atmospheric pressure (API) Electrospray
A TÖMEGSPEKTROMETRIA ALAPJAI
 A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
Tömegspektrometria. Bevezetés és Ionizációs módszerek
 Tömegspektrometria Bevezetés és Ionizációs módszerek Tömegspektrometria A tömegspektrometria, különösen korszerű elválasztási módszerekkel kapcsolva, a mai analitikai gyakorlat leghatékonyabb módszere.
Tömegspektrometria Bevezetés és Ionizációs módszerek Tömegspektrometria A tömegspektrometria, különösen korszerű elválasztási módszerekkel kapcsolva, a mai analitikai gyakorlat leghatékonyabb módszere.
A tömegspektrometria alapjai és alkalmazási köre a laboratóriumi diagnosztikában. Dr. Karvaly Gellért Balázs SE Laboratóriumi Medicina Intézet
 A tömegspektrometria alapjai és alkalmazási köre a laboratóriumi diagnosztikában Dr. Karvaly Gellért Balázs SE Laboratóriumi Medicina Intézet tömegspektrográfia ez az ős. tömegspektroszkópia elavult kifejezés
A tömegspektrometria alapjai és alkalmazási köre a laboratóriumi diagnosztikában Dr. Karvaly Gellért Balázs SE Laboratóriumi Medicina Intézet tömegspektrográfia ez az ős. tömegspektroszkópia elavult kifejezés
Tematika. Korszerű tömegspektrometria a. Ionforrás. Gyors atom bombázás. Szabó Pál MTA Kémiai Kutatóközpont. Cél: Töltött részecskék előállítása
 Tematika Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
Tematika Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
HPLC MS és HPLC MS/MS. Bobály Balázs, Fekete Jenő
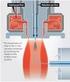 HPLC MS és HPLC MS/MS Bobály Balázs, Fekete Jenő Készülék felépítése (melyik a műszer?) MS LC ionforrás tömeganalizátor detektor P atm 10-3 torr 10-6 torr 1 ml mozgófázisból keletkező gáz atm nyomáson
HPLC MS és HPLC MS/MS Bobály Balázs, Fekete Jenő Készülék felépítése (melyik a műszer?) MS LC ionforrás tömeganalizátor detektor P atm 10-3 torr 10-6 torr 1 ml mozgófázisból keletkező gáz atm nyomáson
Tömegspektrometria. (alapok) Dr. Abrankó László
 Dr. Abrankó László Tömegspektrometria (alapok) Kémiai vizsgálati módszerek csoportosítása: 1. Klasszikus módszerek Térfogatos módszerek Gravimetriás 2. Műszeres analitikai vizsgálatok (. vezetőkép.stb
Dr. Abrankó László Tömegspektrometria (alapok) Kémiai vizsgálati módszerek csoportosítása: 1. Klasszikus módszerek Térfogatos módszerek Gravimetriás 2. Műszeres analitikai vizsgálatok (. vezetőkép.stb
A tömegspektrometria az endokrinológiai vizsgálatokban
 A tömegspektrometria az endokrinológiai vizsgálatokban Márk László PTE ÁOK Biokémiai és Orvosi Kémiai Intézet Bevezetés Milyen adatokat szolgáltat az MS? Pontos részecsketömeg Fragmentációs ujjlenyomat
A tömegspektrometria az endokrinológiai vizsgálatokban Márk László PTE ÁOK Biokémiai és Orvosi Kémiai Intézet Bevezetés Milyen adatokat szolgáltat az MS? Pontos részecsketömeg Fragmentációs ujjlenyomat
Tömegspektrometria A tömegspektrometria. Az n-dekán tömegspektruma. A tömegspektrometria rövid története: Biofizika szeminárium
 Tömegspektrometria Biofizika szeminárium Huber Tamás PTE ÁOK Biofizikai Intézet A tömegspektrometria Definíció: térben és időben szétválasztott részecskék egymás utáni elektromos detektálása. Alapelvek:
Tömegspektrometria Biofizika szeminárium Huber Tamás PTE ÁOK Biofizikai Intézet A tömegspektrometria Definíció: térben és időben szétválasztott részecskék egymás utáni elektromos detektálása. Alapelvek:
Áttekintő tartalomjegyzék
 4 Áttekintő tartalomjegyzék Új trendek a kromatográfiában (Gyémánt Gyöngyi, Kurtán Tibor, Lázár István) 5 Új technikák és alkalmazási területek a tömegspektrometriában (Gyémánt Gyöngyi, Kéki Sándor, Kuki
4 Áttekintő tartalomjegyzék Új trendek a kromatográfiában (Gyémánt Gyöngyi, Kurtán Tibor, Lázár István) 5 Új technikák és alkalmazási területek a tömegspektrometriában (Gyémánt Gyöngyi, Kéki Sándor, Kuki
Analizátorok. Cél: Töltött részecskék szétválasztása
 Analizátorok Cél: Töltött részecskék szétválasztása Analizátor típusok: mágnes (B) elektrosztatikus (ESA) kvadrupol (Q) ioncsapda (trap) repülési idő (TOF) lineáris ioncsapda (LIT) Fourier transzformációs
Analizátorok Cél: Töltött részecskék szétválasztása Analizátor típusok: mágnes (B) elektrosztatikus (ESA) kvadrupol (Q) ioncsapda (trap) repülési idő (TOF) lineáris ioncsapda (LIT) Fourier transzformációs
5/11/2015 TÖMEGSPEKTROMETRIA. Tömegspektrometria - áttekintés. Ionizáció és analizátor. Tömegspektrométer. Analizátor: KVADRUPOL
 PÉCSI TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNYI KAR www.aok.pte.hu TÖMEGSPEKTROMETRIA Tömegspektrometria - áttekintés VIZSGÁLHATÓ MINTA: töltéssel rendelkezik (folyékony biológiai minták, fehérjék, peptidek,
PÉCSI TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNYI KAR www.aok.pte.hu TÖMEGSPEKTROMETRIA Tömegspektrometria - áttekintés VIZSGÁLHATÓ MINTA: töltéssel rendelkezik (folyékony biológiai minták, fehérjék, peptidek,
Tömegspektrometria. Talián Csaba Gábor PTE Biofizikai Intézet február 27.
 Tömegspektrometria Talián Csaba Gábor PTE Biofizikai Intézet 2008. február 27. A tömegspektrometria 0-dik törvénye Nem tömegspektroszkópia! Vagy mégis? Tömegspektroszkópia: különböző tömegű és töltésű
Tömegspektrometria Talián Csaba Gábor PTE Biofizikai Intézet 2008. február 27. A tömegspektrometria 0-dik törvénye Nem tömegspektroszkópia! Vagy mégis? Tömegspektroszkópia: különböző tömegű és töltésű
Tömegspektrometria. Mintaelőkészítés, Kapcsolt technikák OKLA 2017
 Tömegspektrometria Mintaelőkészítés, Kapcsolt technikák OKLA 2017 Mintabeviteli rendszer Működési elv Vákuumrendszer Ionforrás Tömeganalizátor Detektor Electron impact (EI) Chemical ionization (CI) Atmospheric
Tömegspektrometria Mintaelőkészítés, Kapcsolt technikák OKLA 2017 Mintabeviteli rendszer Működési elv Vákuumrendszer Ionforrás Tömeganalizátor Detektor Electron impact (EI) Chemical ionization (CI) Atmospheric
Tömegspektrometria. Ez a tömegspektrum a minőségi információ alapja - fingerprint.
 Tömegspektrometria A tömegspektrometria olyan vizsgálati módszer, amelynél ionos részecskéket választunk el fajlagos tömegük (töltésegységre eső tömegük: m/z) szerint, csökkentett nyomáson, elektromos,
Tömegspektrometria A tömegspektrometria olyan vizsgálati módszer, amelynél ionos részecskéket választunk el fajlagos tömegük (töltésegységre eső tömegük: m/z) szerint, csökkentett nyomáson, elektromos,
Szakmai cikkek 1. Szakmai cikkek. Tömegspektrometria. Stáray Judit. vákuumrendszer. Adatfeldolgozó rendszer
 1 2 Stáray Judit Tömegspektrometria 1. Bevezetés A szerkezetkutatás, azaz az ismeretlen vegyületek azonosítása, egy adott molekula szerkezetének meghatározása a kémia egyik igen speciális és érdekes szakterülete.
1 2 Stáray Judit Tömegspektrometria 1. Bevezetés A szerkezetkutatás, azaz az ismeretlen vegyületek azonosítása, egy adott molekula szerkezetének meghatározása a kémia egyik igen speciális és érdekes szakterülete.
Kromatográfiás módszerek
 Kromatográfiás módszerek Mi a kromatográfia? Kromatográfia ugyanazon az elven működik, mint az extrakció, csak az egyik fázis rögzített ( állófázis ) és a másik elhalad mellette ( mozgófázis ). Az elválasztást
Kromatográfiás módszerek Mi a kromatográfia? Kromatográfia ugyanazon az elven működik, mint az extrakció, csak az egyik fázis rögzített ( állófázis ) és a másik elhalad mellette ( mozgófázis ). Az elválasztást
Endogén szteroidprofil vizsgálata folyadékkromatográfiával és tandem tömegspektrométerrel. Karvaly Gellért
 Endogén szteroidprofil vizsgálata folyadékkromatográfiával és tandem tömegspektrométerrel Karvaly Gellért Miért hasznos a vegyületprofilok vizsgálata? 1 mintából, kis mintatérfogatból, gyorsan nyerhető
Endogén szteroidprofil vizsgálata folyadékkromatográfiával és tandem tömegspektrométerrel Karvaly Gellért Miért hasznos a vegyületprofilok vizsgálata? 1 mintából, kis mintatérfogatból, gyorsan nyerhető
A kromatográfia és szerepe a sokalkotós rendszerek minőségi és mennyiségi jellemzésében. Dr. Balla József 2019.
 A kromatográfia és szerepe a sokalkotós rendszerek minőségi és mennyiségi jellemzésében. Dr. Balla József 2019. 1 Kromatográfia 2 3 A kromatográfia definíciója 1. 1993 IUPAC: New Unified Nomenclature for
A kromatográfia és szerepe a sokalkotós rendszerek minőségi és mennyiségi jellemzésében. Dr. Balla József 2019. 1 Kromatográfia 2 3 A kromatográfia definíciója 1. 1993 IUPAC: New Unified Nomenclature for
Nagyhatékonyságú folyadékkromatográfia (HPLC)
 Nagyhatékonyságú folyadékkromatográfia (HPLC) Kromatográfiás módszerek osztályba sorolása 2 Elúciós technika A mintabevitel ún. dugószerűen történik A mozgófázis a kromatogram kifejlesztése alatt folyamatosan
Nagyhatékonyságú folyadékkromatográfia (HPLC) Kromatográfiás módszerek osztályba sorolása 2 Elúciós technika A mintabevitel ún. dugószerűen történik A mozgófázis a kromatogram kifejlesztése alatt folyamatosan
KATIONIZÁCIÓ VIZSGÁLATA MALDI KÖRÜLMÉNYEK KÖZÖTT
 KATINIZÁIÓ VIZSGÁLATA MALDI KÖRÜLMÉNYEK KÖZÖTT Doktori (PhD) értekezés Szilágyi László Témavezető: Dr. Zsuga Miklós egyetemi tanár a kémia tudomány doktora Debreceni Egyetem, Alkalmazott Kémiai Tanszék
KATINIZÁIÓ VIZSGÁLATA MALDI KÖRÜLMÉNYEK KÖZÖTT Doktori (PhD) értekezés Szilágyi László Témavezető: Dr. Zsuga Miklós egyetemi tanár a kémia tudomány doktora Debreceni Egyetem, Alkalmazott Kémiai Tanszék
Folyadékkromatográfiával kapcsolt elektrospray ionizációs tandem tömegspektrometria (HPLC-ESI-MS/MS) alkalmazása analitikai célokra 1
 Folyadékkromatográfiával kapcsolt elektrospray ionizációs tandem tömegspektrometria (HPLC-ESI-MS/MS) alkalmazása analitikai célokra 1 A HPLC-MS/MS a mai nagyműszeres analitika egyik legnépszerűbb és egyre
Folyadékkromatográfiával kapcsolt elektrospray ionizációs tandem tömegspektrometria (HPLC-ESI-MS/MS) alkalmazása analitikai célokra 1 A HPLC-MS/MS a mai nagyműszeres analitika egyik legnépszerűbb és egyre
KIS MOLEKULATÖMEGŰ ANYAGOK SZERKEZETFELDERÍTÉSE LÁGYIONIZÁCIÓS TÖMEGSPEKTROMETRIAI MÓDSZEREKKEL
 ar s Te r Te ud zett omán és y l o n óg iai K ch ié m KIS MOLEKULATÖMEGŰ AYAGOK SZERKEZETFELDERÍTÉSE LÁGYIOIZÁCIÓS TÖMEGSPEKTROMETRIAI MÓDSZEREKKEL Doktori (Ph.D.) értekezés agy Lajos Témavezető: Dr. Kéki
ar s Te r Te ud zett omán és y l o n óg iai K ch ié m KIS MOLEKULATÖMEGŰ AYAGOK SZERKEZETFELDERÍTÉSE LÁGYIOIZÁCIÓS TÖMEGSPEKTROMETRIAI MÓDSZEREKKEL Doktori (Ph.D.) értekezés agy Lajos Témavezető: Dr. Kéki
Lakos István WESSLING Hungary Kft. Zavaró hatások kezelése a fémanalitikában
 Lakos István WESSLING Hungary Kft. Zavaró hatások kezelése a fémanalitikában AAS ICP-MS ICP-AES ICP-AES-sel mérhető elemek ICP-MS-sel mérhető elemek A zavarások felléphetnek: Mintabevitel közben Lángban/Plazmában
Lakos István WESSLING Hungary Kft. Zavaró hatások kezelése a fémanalitikában AAS ICP-MS ICP-AES ICP-AES-sel mérhető elemek ICP-MS-sel mérhető elemek A zavarások felléphetnek: Mintabevitel közben Lángban/Plazmában
A MALDI-TOF tömegspektrometria alkalmazási és fejlesztési lehetőségei a patogén mikroorganizmusok vizsgálatában
 A MALDI-TOF tömegspektrometria alkalmazási és fejlesztési lehetőségei a patogén mikroorganizmusok vizsgálatában Gorka Ágnes Lovász Csaba VolkDátum Gábor Hungalimentaria 2017.04.27. MALDI-TOF tömegspektrometria
A MALDI-TOF tömegspektrometria alkalmazási és fejlesztési lehetőségei a patogén mikroorganizmusok vizsgálatában Gorka Ágnes Lovász Csaba VolkDátum Gábor Hungalimentaria 2017.04.27. MALDI-TOF tömegspektrometria
Mágneses analizátor. Analizátorok. Felbontás. Kvadrupol analizátor. Cél: Töltött részecskék szétválasztása
 Analizátorok Cél: Töltött részecskék szétválasztása Analizátor típusok: ágnes (B) elektrosztatikus (ESA) kvadrupol (Q) ioncsapda (trap) repülési idő (TOF) lineáris ioncsapda (LIT) Fourier transzforációs
Analizátorok Cél: Töltött részecskék szétválasztása Analizátor típusok: ágnes (B) elektrosztatikus (ESA) kvadrupol (Q) ioncsapda (trap) repülési idő (TOF) lineáris ioncsapda (LIT) Fourier transzforációs
Fehérjék elválasztására alkalmazható mikrofludikai rendszerek Bioanalyzer, LabChip rendszerek. A készülékek működési elve, felépítésük, alkalmazásuk.
 Fehérjék elválasztására alkalmazható mikrofludikai rendszerek Bioanalyzer, LabChip rendszerek. A készülékek működési elve, felépítésük, alkalmazásuk. Kapilláris elektroforézis tömegspektrometriás detektálással
Fehérjék elválasztására alkalmazható mikrofludikai rendszerek Bioanalyzer, LabChip rendszerek. A készülékek működési elve, felépítésük, alkalmazásuk. Kapilláris elektroforézis tömegspektrometriás detektálással
Igény a pontos minőségi és mennyiségi vizsgálatokra: LC-MS/MS módszerek gyakorlati alkalmazása az élelmiszer-analitikában
 : LC-MS/MS módszerek gyakorlati alkalmazása az élelmiszer-analitikában Tölgyesi Ádám Hungalimentária, Budapest 2017. április 26-27. Folyadékkromatográfiás hármas kvadrupol rendszerű tandem tömegspektrometria
: LC-MS/MS módszerek gyakorlati alkalmazása az élelmiszer-analitikában Tölgyesi Ádám Hungalimentária, Budapest 2017. április 26-27. Folyadékkromatográfiás hármas kvadrupol rendszerű tandem tömegspektrometria
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Tömegspektrometria. Science and Technology of gas-phase ions. Dr. Drahos László MTA Természettudományi Kutatóközpont
 Tömegspektrometria Science and Technology of gas-phase ions Dr. Drahos László MTA Természettudományi Kutatóközpont e-mail: drahos.laszlo@ttk.mta.hu Tartalom Bevezetés: MS alapok Ionforrások Készülék típusok
Tömegspektrometria Science and Technology of gas-phase ions Dr. Drahos László MTA Természettudományi Kutatóközpont e-mail: drahos.laszlo@ttk.mta.hu Tartalom Bevezetés: MS alapok Ionforrások Készülék típusok
Mérési feladat: Illékony szerves komponensek meghatározása GC-MS módszerrel
 Kromatográfia A műszeres analízis kromatográfiás módszereinek feladata, hogy a vizsgálandó minta komponenseit egymástól elválassza, és azok minőségét, valamint mennyiségi viszonyait megállapítsa. Az elválasztás
Kromatográfia A műszeres analízis kromatográfiás módszereinek feladata, hogy a vizsgálandó minta komponenseit egymástól elválassza, és azok minőségét, valamint mennyiségi viszonyait megállapítsa. Az elválasztás
Anyagvizsgálati módszerek Elemanalitika. Anyagvizsgálati módszerek
 Anyagvizsgálati módszerek Elemanalitika Anyagvizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagvizsgálati módszerek Kémiai szenzorok 1/ 18 Elemanalitika Elemek minőségi és mennyiségi meghatározására
Anyagvizsgálati módszerek Elemanalitika Anyagvizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagvizsgálati módszerek Kémiai szenzorok 1/ 18 Elemanalitika Elemek minőségi és mennyiségi meghatározására
Az ideális mintaelőkészítés
 Tömegspektrometria Az ideális mintaelőkészítés Idő és költségtakarékos Szelektív a molekulák széles spektrumára (csökkenti az interferenciákat, általános screenelésre is alkalmas) Környezetbarát: minimális
Tömegspektrometria Az ideális mintaelőkészítés Idő és költségtakarékos Szelektív a molekulák széles spektrumára (csökkenti az interferenciákat, általános screenelésre is alkalmas) Környezetbarát: minimális
DOKTORI ÉRTEKEZÉS. Közvetlen ionizációs tömegspektrometriás módszerek fejlesztése Biomedicinális alkalmazások
 DOKTORI ÉRTEKEZÉS Közvetlen ionizációs tömegspektrometriás módszerek fejlesztése Biomedicinális alkalmazások Dénes Júlia Eötvös Loránd Tudományegyetem, Természettudományi Kar, Kémia Doktori Iskola Vezető:
DOKTORI ÉRTEKEZÉS Közvetlen ionizációs tömegspektrometriás módszerek fejlesztése Biomedicinális alkalmazások Dénes Júlia Eötvös Loránd Tudományegyetem, Természettudományi Kar, Kémia Doktori Iskola Vezető:
KATIONIZÁCIÓ VIZSGÁLATA MALDI KÖRÜLMÉNYEK KÖZÖTT
 KATIONIZÁCIÓ VIZSGÁLATA MALDI KÖRÜLMÉNYEK KÖZÖTT Investigation of cationization under MALDI conditions Doktori (PhD) értekezés tézisei Szilágyi László Témavezető: Dr. Zsuga Miklós Debreceni Egyetem, Alkalmazott
KATIONIZÁCIÓ VIZSGÁLATA MALDI KÖRÜLMÉNYEK KÖZÖTT Investigation of cationization under MALDI conditions Doktori (PhD) értekezés tézisei Szilágyi László Témavezető: Dr. Zsuga Miklós Debreceni Egyetem, Alkalmazott
Bioinformatika előadás
 10. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat Genomika vs. proteomika A genomika módszereivel nem a tényleges fehérjéket vizsgáljuk,
10. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat Genomika vs. proteomika A genomika módszereivel nem a tényleges fehérjéket vizsgáljuk,
ATOMEMISSZIÓS SPEKTROSZKÓPIA
 ATOMEMISSZIÓS SPEKTROSZKÓPIA Elvi jellemzők, amelyek meghatározzák a készülék felépítését magas hőmérsékletű fényforrás (elsősorban plazma, szikra, stb.) kis méretű sugárforrás (az önabszorpció csökkentése
ATOMEMISSZIÓS SPEKTROSZKÓPIA Elvi jellemzők, amelyek meghatározzák a készülék felépítését magas hőmérsékletű fényforrás (elsősorban plazma, szikra, stb.) kis méretű sugárforrás (az önabszorpció csökkentése
Gyógyszerkészítmények hatóanyagtartalmának meghatározása nagyhatékonyságú folyadékkromatográfiával csatolt tömegspektrometriával
 Gyógyszerkészítmények hatóanyagtartalmának meghatározása nagyhatékonyságú folyadékkromatográfiával csatolt tömegspektrometriával Gyakorlatvezető: Nász Szilárd szilard.nasz@ekol.chem.elte.hu 1 TARTALOMJEGYZÉK
Gyógyszerkészítmények hatóanyagtartalmának meghatározása nagyhatékonyságú folyadékkromatográfiával csatolt tömegspektrometriával Gyakorlatvezető: Nász Szilárd szilard.nasz@ekol.chem.elte.hu 1 TARTALOMJEGYZÉK
Az atommag összetétele, radioaktivitás
 Az atommag összetétele, radioaktivitás Az atommag alkotórészei proton: pozitív töltésű részecske, töltése egyenlő az elektron töltésével, csak nem negatív, hanem pozitív: 1,6 10-19 C tömege az elektron
Az atommag összetétele, radioaktivitás Az atommag alkotórészei proton: pozitív töltésű részecske, töltése egyenlő az elektron töltésével, csak nem negatív, hanem pozitív: 1,6 10-19 C tömege az elektron
Humán maradványok molekuláris diagnosztikája
 Humán maradványok molekuláris diagnosztikája Márk László PTE ÁOK Biokémiai és Orvosi Kémiai Intézet Antropológia módszerei Nem Életkor Elhalálozási idő Igazságügyi vonatkozások Patológiás és traumás elváltozások
Humán maradványok molekuláris diagnosztikája Márk László PTE ÁOK Biokémiai és Orvosi Kémiai Intézet Antropológia módszerei Nem Életkor Elhalálozási idő Igazságügyi vonatkozások Patológiás és traumás elváltozások
Peptidek LC-MS/MS karakterisztikájának javítása fluoros kémiai módosítással, proteomikai alkalmazásokhoz
 Peptidek LC-MS/MS karakterisztikájának javítása fluoros kémiai módosítással, proteomikai alkalmazásokhoz Dr. Schlosser Gitta tudományos munkatárs MTA-ELTE Peptidkémiai Kutatócsoport MedInProt Tavaszi Konferencia
Peptidek LC-MS/MS karakterisztikájának javítása fluoros kémiai módosítással, proteomikai alkalmazásokhoz Dr. Schlosser Gitta tudományos munkatárs MTA-ELTE Peptidkémiai Kutatócsoport MedInProt Tavaszi Konferencia
Ionforrások és analizátorok GC-MS módszernél
 BUDAPESTI MŰSZAKI ÉS GAZDASÁGTUDOMÁNYI EGYETEM Ionforrások és analizátorok GC-MS módszernél Az elválasztástechnika korszerű módszerei Tárgyfelelős: Dr. Fekete Jenő Készítette: Kovács Edina Hegedűs Bogárka
BUDAPESTI MŰSZAKI ÉS GAZDASÁGTUDOMÁNYI EGYETEM Ionforrások és analizátorok GC-MS módszernél Az elválasztástechnika korszerű módszerei Tárgyfelelős: Dr. Fekete Jenő Készítette: Kovács Edina Hegedűs Bogárka
ELTE Fizikai Intézet. FEI Quanta 3D FEG kétsugaras pásztázó elektronmikroszkóp
 ELTE Fizikai Intézet FEI Quanta 3D FEG kétsugaras pásztázó elektronmikroszkóp mintatartó mikroszkóp nyitott ajtóval Fő egységek 1. Elektron forrás 10-7 Pa 2. Mágneses lencsék 10-5 Pa 3. Pásztázó mágnesek
ELTE Fizikai Intézet FEI Quanta 3D FEG kétsugaras pásztázó elektronmikroszkóp mintatartó mikroszkóp nyitott ajtóval Fő egységek 1. Elektron forrás 10-7 Pa 2. Mágneses lencsék 10-5 Pa 3. Pásztázó mágnesek
Bioinformatika 2 10.el
 10.el őadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2009. 04. 24. Genomikavs. proteomika A genomika módszereivel nem a tényleges fehérjéket
10.el őadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2009. 04. 24. Genomikavs. proteomika A genomika módszereivel nem a tényleges fehérjéket
A tömegspektrometria kvalitatív és kvantitatív proteomikai alkalmazása
 A tömegspektrometria kvalitatív és kvantitatív proteomikai alkalmazása Ph.D. értekezés Szájli Emília Dr. Medzihradszky-Fölkl Katalin Témavezető Kémia Doktori Iskola SZTE TTIK Magyar Tudományos Akadémia,
A tömegspektrometria kvalitatív és kvantitatív proteomikai alkalmazása Ph.D. értekezés Szájli Emília Dr. Medzihradszky-Fölkl Katalin Témavezető Kémia Doktori Iskola SZTE TTIK Magyar Tudományos Akadémia,
Vezetők elektrosztatikus térben
 Vezetők elektrosztatikus térben Vezető: a töltések szabadon elmozdulhatnak Ha a vezető belsejében a térerősség nem lenne nulla akkor áram folyna. Ha a felületen a térerősségnek lenne tangenciális (párhuzamos)
Vezetők elektrosztatikus térben Vezető: a töltések szabadon elmozdulhatnak Ha a vezető belsejében a térerősség nem lenne nulla akkor áram folyna. Ha a felületen a térerősségnek lenne tangenciális (párhuzamos)
Az új Thermo Scientific icap TQ ICP-MS bemutatása és alkalmazási lehetőségei. Nyerges László Unicam Magyarország Kft április 27.
 Az új Thermo Scientific icap TQ ICP-MS bemutatása és alkalmazási lehetőségei Nyerges László Unicam Magyarország Kft. 2017. április 27. Thermo Scientific ICP-MS készülékek 2001-2012 2012-2016 icap Q 2016-
Az új Thermo Scientific icap TQ ICP-MS bemutatása és alkalmazási lehetőségei Nyerges László Unicam Magyarország Kft. 2017. április 27. Thermo Scientific ICP-MS készülékek 2001-2012 2012-2016 icap Q 2016-
Fókuszált ionsugaras megmunkálás
 FEI Quanta 3D SEM/FIB Dankházi Zoltán 2016. március 1 FIB = Focused Ion Beam (Fókuszált ionnyaláb) Miből áll egy SEM/FIB berendezés? elektron oszlop ion oszlop gáz injektorok detektor CDEM (SE, SI) 2 Dual-Beam
FEI Quanta 3D SEM/FIB Dankházi Zoltán 2016. március 1 FIB = Focused Ion Beam (Fókuszált ionnyaláb) Miből áll egy SEM/FIB berendezés? elektron oszlop ion oszlop gáz injektorok detektor CDEM (SE, SI) 2 Dual-Beam
Gázok. 5-7 Kinetikus gázelmélet 5-8 Reális gázok (korlátok) Fókusz: a légzsák (Air-Bag Systems) kémiája
 Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gázegyenlet és általánosított gázegyenlet 5-4 A tökéletes gázegyenlet alkalmazása 5-5 Gáz reakciók 5-6 Gázkeverékek
Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gázegyenlet és általánosított gázegyenlet 5-4 A tökéletes gázegyenlet alkalmazása 5-5 Gáz reakciók 5-6 Gázkeverékek
Jegyzet. Kémia, BMEVEAAAMM1 Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens.
 Kémia, BMEVEAAAMM Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens Jegyzet dr. Horváth Viola, KÉMIA I. http://oktatas.ch.bme.hu/oktatas/konyvek/anal/
Kémia, BMEVEAAAMM Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens Jegyzet dr. Horváth Viola, KÉMIA I. http://oktatas.ch.bme.hu/oktatas/konyvek/anal/
ANALITIKAI MŰSZEREK LABORATÓRIUMI BERENDEZÉSEK, ESZKÖZÖK, KOMPLETT LABORATÓRIUMOK TERVEZÉS, SZERVIZ, TANÁCSADÁS
 ANALITIKAI MŰSZEREK LABORATÓRIUMI BERENDEZÉSEK, ESZKÖZÖK, KOMPLETT LABORATÓRIUMOK TERVEZÉS, SZERVIZ, TANÁCSADÁS RÖVID TERMÉK- ISMERTETŐ LABOREXPORT Kft. 1993 óta az Ön laborpartnere 1113 Budapest, Ibrahim
ANALITIKAI MŰSZEREK LABORATÓRIUMI BERENDEZÉSEK, ESZKÖZÖK, KOMPLETT LABORATÓRIUMOK TERVEZÉS, SZERVIZ, TANÁCSADÁS RÖVID TERMÉK- ISMERTETŐ LABOREXPORT Kft. 1993 óta az Ön laborpartnere 1113 Budapest, Ibrahim
BIOLÓGIAI JELENTŐSÉGŰ VEGYÜLETEK MODERN TÖMEGSPEKTROMETRIAI VIZSGÁLATA
 DE TTK 1949 BILÓGIAI JELENTŐSÉGŰ VEGYÜLETEK MDERN TÖMEGSPEKTRMETRIAI VIZSGÁLATA Egyetemi doktori (PhD) értekezés Kalmár-Biri Bernadett témavezető: Dr. Kéki Sándor DEBRECENI EGYETEM Természettudományi Doktori
DE TTK 1949 BILÓGIAI JELENTŐSÉGŰ VEGYÜLETEK MDERN TÖMEGSPEKTRMETRIAI VIZSGÁLATA Egyetemi doktori (PhD) értekezés Kalmár-Biri Bernadett témavezető: Dr. Kéki Sándor DEBRECENI EGYETEM Természettudományi Doktori
Biocidok és kábítószerek mérési tanulmánya a gázkromatográfia- tömegspektrometria felhasználásával: elemzésük környezeti vízmintákban
 Biocidok és kábítószerek mérési tanulmánya a gázkromatográfia- tömegspektrometria felhasználásával: elemzésük környezeti vízmintákban Készítette: Balogh Zsanett Edit Környezettudomány MSc Témavezető: Perlné
Biocidok és kábítószerek mérési tanulmánya a gázkromatográfia- tömegspektrometria felhasználásával: elemzésük környezeti vízmintákban Készítette: Balogh Zsanett Edit Környezettudomány MSc Témavezető: Perlné
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL
 TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
9. Hét. Műszeres analitika Folyadékkromatográfia Ionkromatográfia Gélkromatográfia Affinitás kromatográfia Gázkromatográfia. Dr.
 Bioanalitika előadás 9. Hét Műszeres analitika Folyadékkromatográfia Ionkromatográfia Gélkromatográfia Affinitás kromatográfia Gázkromatográfia Dr. Andrási Melinda Kromatográfia Nagy hatékonyságú, dinamikus
Bioanalitika előadás 9. Hét Műszeres analitika Folyadékkromatográfia Ionkromatográfia Gélkromatográfia Affinitás kromatográfia Gázkromatográfia Dr. Andrási Melinda Kromatográfia Nagy hatékonyságú, dinamikus
Fókuszált ionsugaras megmunkálás
 1 FEI Quanta 3D SEM/FIB Fókuszált ionsugaras megmunkálás Ratter Kitti 2011. január 19-21. 2 FIB = Focused Ion Beam (Fókuszált ionnyaláb) Miből áll egy SEM/FIB berendezés? elektron oszlop ion oszlop gáz
1 FEI Quanta 3D SEM/FIB Fókuszált ionsugaras megmunkálás Ratter Kitti 2011. január 19-21. 2 FIB = Focused Ion Beam (Fókuszált ionnyaláb) Miből áll egy SEM/FIB berendezés? elektron oszlop ion oszlop gáz
A nanotechnológia mikroszkópja
 1 Havancsák Károly, ELTE Fizikai Intézet A nanotechnológia mikroszkópja EGIS 2011. június 1. FEI Quanta 3D SEM/FIB 2 Havancsák Károly, ELTE Fizikai Intézet A nanotechnológia mikroszkópja EGIS 2011. június
1 Havancsák Károly, ELTE Fizikai Intézet A nanotechnológia mikroszkópja EGIS 2011. június 1. FEI Quanta 3D SEM/FIB 2 Havancsák Károly, ELTE Fizikai Intézet A nanotechnológia mikroszkópja EGIS 2011. június
Duna-víz extrahálható komponenseinek meghatározása GC-MSD rendszerrel. I. Elméleti áttekintés
 Duna-víz extrahálható komponenseinek meghatározása GC-MSD rendszerrel A gyakorlat az előző évi kötelező műszeres analitika laborgyakorlat gázkromatográfiás laborjára épít. Az ott szerzett ismeretek a gyakorlat
Duna-víz extrahálható komponenseinek meghatározása GC-MSD rendszerrel A gyakorlat az előző évi kötelező műszeres analitika laborgyakorlat gázkromatográfiás laborjára épít. Az ott szerzett ismeretek a gyakorlat
Elektromos áram. Vezetési jelenségek
 Elektromos áram. Vezetési jelenségek Emlékeztető Elektromos áram: töltéshordozók egyirányú áramlása Áramkör részei: áramforrás, vezető, fogyasztó Áramköri jelek Emlékeztető Elektromos áram hatásai: Kémiai
Elektromos áram. Vezetési jelenségek Emlékeztető Elektromos áram: töltéshordozók egyirányú áramlása Áramkör részei: áramforrás, vezető, fogyasztó Áramköri jelek Emlékeztető Elektromos áram hatásai: Kémiai
Gázok. 5-7 Kinetikus gázelmélet 5-8 Reális gázok (limitációk) Fókusz Légzsák (Air-Bag Systems) kémiája
 Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gáz egyenlet és általánosított gáz egyenlet 5-4 A tökéletes gáz egyenlet alkalmazása 5-5 Gáz halmazállapotú reakciók
Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gáz egyenlet és általánosított gáz egyenlet 5-4 A tökéletes gáz egyenlet alkalmazása 5-5 Gáz halmazállapotú reakciók
Sugárzások kölcsönhatása az anyaggal
 Radioaktivitás Biofizika előadások 2013 december Sugárzások kölcsönhatása az anyaggal PTE ÁOK Biofizikai Intézet, Orbán József Összefoglaló radioaktivitás alapok Nukleononkénti kötési energia (MeV) Egy
Radioaktivitás Biofizika előadások 2013 december Sugárzások kölcsönhatása az anyaggal PTE ÁOK Biofizikai Intézet, Orbán József Összefoglaló radioaktivitás alapok Nukleononkénti kötési energia (MeV) Egy
Molekulavadászat. Schlosser Gitta. MTA-ELTE Peptidkémiai Kutatócsoport
 Molekulavadászat Schlosser Gitta MTA-ELTE Peptidkémiai Kutatócsoport Tömegspektrometria A tömegspektrometria (MS, mass spectrometry) olyan analitikai módszer, amellyel meghatározható atomok és molekulák,
Molekulavadászat Schlosser Gitta MTA-ELTE Peptidkémiai Kutatócsoport Tömegspektrometria A tömegspektrometria (MS, mass spectrometry) olyan analitikai módszer, amellyel meghatározható atomok és molekulák,
Egyetemi doktori (PhD) értekezés tézisei. Mono és dimer addukt ionok felhasználása apoláris polimerek és királis molekulák MS szerkezetvizsgálatára
 Egyetemi doktori (PhD) értekezés tézisei Mono és dimer addukt ionok felhasználása apoláris polimerek és királis molekulák MS Nagy Tibor Témavezető: Dr. Kéki Sándor Debreceni Egyetem Kémiai Tudományok Doktori
Egyetemi doktori (PhD) értekezés tézisei Mono és dimer addukt ionok felhasználása apoláris polimerek és királis molekulák MS Nagy Tibor Témavezető: Dr. Kéki Sándor Debreceni Egyetem Kémiai Tudományok Doktori
Sciex X500R készülék bemutatása a SWATH alkalmazásai tükrében. Szabó Pál, MTA TTK
 Sciex X500R készülék bemutatása a SWATH alkalmazásai tükrében Szabó Pál, MTA TTK Hagyományos QTOF rendszer Aggályok: Termetes Bonyolultnak tűnő Nem rutin feladatokra való Következmény: Nem merjük megvenni
Sciex X500R készülék bemutatása a SWATH alkalmazásai tükrében Szabó Pál, MTA TTK Hagyományos QTOF rendszer Aggályok: Termetes Bonyolultnak tűnő Nem rutin feladatokra való Következmény: Nem merjük megvenni
Röntgensugárzás. Röntgensugárzás
 Röntgensugárzás 2012.11.21. Röntgensugárzás Elektromágneses sugárzás (f=10 16 10 19 Hz, E=120eV 120keV (1.9*10-17 10-14 J), λ
Röntgensugárzás 2012.11.21. Röntgensugárzás Elektromágneses sugárzás (f=10 16 10 19 Hz, E=120eV 120keV (1.9*10-17 10-14 J), λ
Az áramlási citométer és sejtszorter felépítése és működése, diagnosztikai alkalmazásai
 Az áramlási citométer és sejtszorter felépítése és működése, diagnosztikai alkalmazásai Az áramlási citométer és sejtszorter felépítése és működése Kereskedelmi forgalomban kapható készülékek 1 Fogalmak
Az áramlási citométer és sejtszorter felépítése és működése, diagnosztikai alkalmazásai Az áramlási citométer és sejtszorter felépítése és működése Kereskedelmi forgalomban kapható készülékek 1 Fogalmak
Folyadékkromatográfia kapcsolt tandem tömegspektrometria (HPLC-MS/MS) alkalmazása a bioanalitikában. Tananyag és leirat a laboratóriumi gyakorlathoz
 Folyadékkromatográfia kapcsolt tandem tömegspektrometria (HPLC-MS/MS) alkalmazása a bioanalitikában Tananyag és leirat a laboratóriumi gyakorlathoz Összeállította: Renkecz Tibor, Dr. Horváth Viola A HPLC-MS/MS
Folyadékkromatográfia kapcsolt tandem tömegspektrometria (HPLC-MS/MS) alkalmazása a bioanalitikában Tananyag és leirat a laboratóriumi gyakorlathoz Összeállította: Renkecz Tibor, Dr. Horváth Viola A HPLC-MS/MS
LC-MS QQQ alkalmazása a hatósági gyógyszerellenőrzésben
 LC-MS QQQ alkalmazása a hatósági gyógyszerellenőrzésben Jankovics Péter Országos Gyógyszerészeti Intézet Gyógyszerminőségi Főosztály 2010. január 14. A QQQ analizátor felépítése Forrás: Introducing the
LC-MS QQQ alkalmazása a hatósági gyógyszerellenőrzésben Jankovics Péter Országos Gyógyszerészeti Intézet Gyógyszerminőségi Főosztály 2010. január 14. A QQQ analizátor felépítése Forrás: Introducing the
4.3. Mikrofluidikai csipek analitikai alkalmazásai
 367 4.3. Mikrofluidikai csipek analitikai alkalmazásai 4.3.1. DNS meghatározása A kettős szálú DNS példáján kiválóan demonstrálhatók a mikrofluidikai eszközökön (csip, lab-on-a-chip) elérhető gyors és
367 4.3. Mikrofluidikai csipek analitikai alkalmazásai 4.3.1. DNS meghatározása A kettős szálú DNS példáján kiválóan demonstrálhatók a mikrofluidikai eszközökön (csip, lab-on-a-chip) elérhető gyors és
KÖRNYEZETI VIZEK SZERVES SZENNYEZŐINEK ELEMZÉSE GC- MS/MS MÓDSZERREL
 KÖRNYEZETI VIZEK SZERVES SZENNYEZŐINEK ELEMZÉSE GC- MS/MS MÓDSZERREL Készítette: Vannai Mariann Környezettudomány MSc. Témavezető: Perlné Dr. Molnár Ibolya 2012. Vázlat 1. Bevezetés 2. Irodalmi áttekintés
KÖRNYEZETI VIZEK SZERVES SZENNYEZŐINEK ELEMZÉSE GC- MS/MS MÓDSZERREL Készítette: Vannai Mariann Környezettudomány MSc. Témavezető: Perlné Dr. Molnár Ibolya 2012. Vázlat 1. Bevezetés 2. Irodalmi áttekintés
Radionuklidok meghatározása környezeti mintákban induktív csatolású plazma tömegspektrometria segítségével lehetőségek és korlátok
 Radionuklidok meghatározása környezeti mintákban induktív csatolású plazma tömegspektrometria segítségével lehetőségek és korlátok Stefánka Zsolt, Varga Zsolt, Széles Éva MTA Izotópkutató Intézet 1121
Radionuklidok meghatározása környezeti mintákban induktív csatolású plazma tömegspektrometria segítségével lehetőségek és korlátok Stefánka Zsolt, Varga Zsolt, Széles Éva MTA Izotópkutató Intézet 1121
Tömegspektrometria. Talián Csaba Gábor PTE Biofizikai Intézet
 Tömegspektrometria Talián Csaba Gábor PTE Biofizikai Intézet Alapelvek Ionok képzése bármely alkalmas anyagból Ionok szétválasztása m/z alapján Ionok minőségi és mennyiségi detektálása az m/z gyakoriság
Tömegspektrometria Talián Csaba Gábor PTE Biofizikai Intézet Alapelvek Ionok képzése bármely alkalmas anyagból Ionok szétválasztása m/z alapján Ionok minőségi és mennyiségi detektálása az m/z gyakoriság
TÖMEGSPEKTROMÉTEREK SZEREPE A FÖLDTUDOMÁNYBAN. Palcsu László MTA Atommagkutató Intézet (Atomki) Környezet- és Földtudományi Laboratórium, Debrecen
 TÖMEGSPEKTROMÉTEREK SZEREPE A FÖLDTUDOMÁNYBAN Palcsu László MTA Atommagkutató Intézet (Atomki) Környezet- és Földtudományi Laboratórium, Debrecen Miről lesz szó? - Előzmények - Meglévő, hamarosan beszerzendő
TÖMEGSPEKTROMÉTEREK SZEREPE A FÖLDTUDOMÁNYBAN Palcsu László MTA Atommagkutató Intézet (Atomki) Környezet- és Földtudományi Laboratórium, Debrecen Miről lesz szó? - Előzmények - Meglévő, hamarosan beszerzendő
Theory hungarian (Hungary)
 Q3-1 A Nagy Hadronütköztető (10 pont) Mielőtt elkezded a feladat megoldását, olvasd el a külön borítékban lévő általános utasításokat! Ez a feladat a CERN-ben működő részecskegyorsító, a Nagy Hadronütköztető
Q3-1 A Nagy Hadronütköztető (10 pont) Mielőtt elkezded a feladat megoldását, olvasd el a külön borítékban lévő általános utasításokat! Ez a feladat a CERN-ben működő részecskegyorsító, a Nagy Hadronütköztető
Röntgendiagnosztikai alapok
 Röntgendiagnosztikai alapok Dr. Voszka István A röntgensugárzás keltésének alternatív lehetőségei (röntgensugárzás keletkezik nagy sebességű, töltéssel rendelkező részecskék lefékeződésekor) Röntgencső:
Röntgendiagnosztikai alapok Dr. Voszka István A röntgensugárzás keltésének alternatív lehetőségei (röntgensugárzás keletkezik nagy sebességű, töltéssel rendelkező részecskék lefékeződésekor) Röntgencső:
Tömegspektrometria. Talián Csaba Gábor PTE Biofizikai Intézet
 Tömegspektrometria Talián Csaba Gábor PTE Biofizikai Intézet A tömegspektrometria 0-dik törvénye Nem tömegspektroszkópia! Vagy mégis? Tömegspektroszkópia: különböző tömegű és töltésű részecskék szétválasztása
Tömegspektrometria Talián Csaba Gábor PTE Biofizikai Intézet A tömegspektrometria 0-dik törvénye Nem tömegspektroszkópia! Vagy mégis? Tömegspektroszkópia: különböző tömegű és töltésű részecskék szétválasztása
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Scientific új j lineáris ioncsapda
 The world leader in serving science Ideális csapdázás és s detektálás megvalósítása sa a Thermo Scientific új j lineáris ioncsapda tömegspektrométerében Józsa Tibor Unicam Magyarország Kft. Budapest, 21.
The world leader in serving science Ideális csapdázás és s detektálás megvalósítása sa a Thermo Scientific új j lineáris ioncsapda tömegspektrométerében Józsa Tibor Unicam Magyarország Kft. Budapest, 21.
Általános Kémia, BMEVESAA101
 Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Óravázlatok:
Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Óravázlatok:
IONFORRÁSOK AZ LC-MS MÓDSZERBEN
 IONFORRÁSOK AZ LC-MS MÓDSZERBEN Készítette: Dancza Márta vegyészmérnök Msc, analitika és szerkezetviszgálati szakirány 2012 / 2013. tavaszi félév 1 / 20 1. Bevezetés A GC-s mintaelőkészítés során alkalmazott
IONFORRÁSOK AZ LC-MS MÓDSZERBEN Készítette: Dancza Márta vegyészmérnök Msc, analitika és szerkezetviszgálati szakirány 2012 / 2013. tavaszi félév 1 / 20 1. Bevezetés A GC-s mintaelőkészítés során alkalmazott
Részecske azonosítás kísérleti módszerei
 Részecske azonosítás kísérleti módszerei Galgóczi Gábor Előadás vázlata A részecske azonosítás létjogosultsága Részecske azonosítás: Módszerek Detektorok ALICE-ból példa A részecskeazonosítás létjogosultsága
Részecske azonosítás kísérleti módszerei Galgóczi Gábor Előadás vázlata A részecske azonosítás létjogosultsága Részecske azonosítás: Módszerek Detektorok ALICE-ból példa A részecskeazonosítás létjogosultsága
A proteomika új tudománya és alkalmazása a rákdiagnosztikában
 BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK A proteomika új tudománya és alkalmazása a rákdiagnosztikában Tárgyszavak: proteom; proteomika; rák; diagnosztika; molekuláris gyógyászat; biomarker;
BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK A proteomika új tudománya és alkalmazása a rákdiagnosztikában Tárgyszavak: proteom; proteomika; rák; diagnosztika; molekuláris gyógyászat; biomarker;
A feladatra legalkalmasabb készülék kiválasztásának szempontjai. Szabó Pál MTA TTK
 1 A feladatra legalkalmasabb készülék kiválasztásának szempontjai Szabó Pál MTA TTK Szempontok 2 Feladat Ionizáció Analizátor Felbontás Tandem funkció Tömegtartomány Sebesség/kromatográfia Optikai detektorok
1 A feladatra legalkalmasabb készülék kiválasztásának szempontjai Szabó Pál MTA TTK Szempontok 2 Feladat Ionizáció Analizátor Felbontás Tandem funkció Tömegtartomány Sebesség/kromatográfia Optikai detektorok
Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár. Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár,
 Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Facebook,
Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Facebook,
meghatároz lete és sa Szabó Pál MTA TTK
 1 LC-MS/MS alapú mennyiségi meghatároz rozásokok elmélete lete és megvalósítása sa Szabó Pál MTA TTK Követelmények 2 Érzékenység Szelektivitás Gyorsaság Magas komponensszám/injektálás Mennyiségi meghatároz
1 LC-MS/MS alapú mennyiségi meghatároz rozásokok elmélete lete és megvalósítása sa Szabó Pál MTA TTK Követelmények 2 Érzékenység Szelektivitás Gyorsaság Magas komponensszám/injektálás Mennyiségi meghatároz
9. Hét. Dr. Kállay Csilla (Dr. Andrási Melinda)
 Bioanalitika előadás 9. Hét Műszeres analitika Gázkromatográfia Folyadékkromatográfia Ionkromatográfia Gélkromatográfia Affinitás kromatográfia Szuperkritikus folyadékkromatográfia Tömegspekrometria Dr.
Bioanalitika előadás 9. Hét Műszeres analitika Gázkromatográfia Folyadékkromatográfia Ionkromatográfia Gélkromatográfia Affinitás kromatográfia Szuperkritikus folyadékkromatográfia Tömegspekrometria Dr.
Az ICP-MS módszer alapjai
 Az ICP-MS módszer alapjai Az ICP-MS módszer/készülék az ICP forrást használja MS-ionforrásként. Az ICP-be porlasztással bevitt oldat mintában lévő elemekből a plazma 6000-8000 K hőmérsékletétén szabad
Az ICP-MS módszer alapjai Az ICP-MS módszer/készülék az ICP forrást használja MS-ionforrásként. Az ICP-be porlasztással bevitt oldat mintában lévő elemekből a plazma 6000-8000 K hőmérsékletétén szabad
Közvetlen ionizációs tömegspektrometriás módszerek fejlesztése Biomedicinális alkalmazások
 Közvetlen ionizációs tömegspektrometriás módszerek fejlesztése Biomedicinális alkalmazások Doktori értekezés tézisei Dénes Júlia Eötvös Loránd Tudományegyetem, Természettudományi Kar, Kémia Doktori Iskola
Közvetlen ionizációs tömegspektrometriás módszerek fejlesztése Biomedicinális alkalmazások Doktori értekezés tézisei Dénes Júlia Eötvös Loránd Tudományegyetem, Természettudományi Kar, Kémia Doktori Iskola
Használt, újraforgalmazott analitikai műszerek, berendezések, laborbútorok, építőelemek, egységek, alkatrészek
 Használt, újraforgalmazott analitikai műszerek, berendezések, laborbútorok, építőelemek, egységek, alkatrészek Megjegyzés: az alábbi tételeket az adott állapotukban ( as is ) és az első megrendelő viheti
Használt, újraforgalmazott analitikai műszerek, berendezések, laborbútorok, építőelemek, egységek, alkatrészek Megjegyzés: az alábbi tételeket az adott állapotukban ( as is ) és az első megrendelő viheti
Problémás regressziók
 Universitas Eotvos Nominata 74 203-4 - II Problémás regressziók A közönséges (OLS) és a súlyozott (WLS) legkisebb négyzetes lineáris regresszió egy p- változós lineáris egyenletrendszer megoldása. Az egyenletrendszer
Universitas Eotvos Nominata 74 203-4 - II Problémás regressziók A közönséges (OLS) és a súlyozott (WLS) legkisebb négyzetes lineáris regresszió egy p- változós lineáris egyenletrendszer megoldása. Az egyenletrendszer
Modern fizika vegyes tesztek
 Modern fizika vegyes tesztek 1. Egy fotonnak és egy elektronnak ugyanakkora a hullámhossza. Melyik a helyes állítás? a) A foton lendülete (impulzusa) kisebb, mint az elektroné. b) A fotonnak és az elektronnak
Modern fizika vegyes tesztek 1. Egy fotonnak és egy elektronnak ugyanakkora a hullámhossza. Melyik a helyes állítás? a) A foton lendülete (impulzusa) kisebb, mint az elektroné. b) A fotonnak és az elektronnak
A gáz halmazállapot. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 A gáz halmazállapot A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 0 Halmazállapotok, állapotjelzők Az anyagi rendszerek a részecskék közötti kölcsönhatásoktól és az állapotjelzőktől függően
A gáz halmazállapot A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 0 Halmazállapotok, állapotjelzők Az anyagi rendszerek a részecskék közötti kölcsönhatásoktól és az állapotjelzőktől függően
Mivel foglalkozik a hőtan?
 Hőtan Gáztörvények Mivel foglalkozik a hőtan? A hőtan a rendszerek hőmérsékletével, munkavégzésével, és energiájával foglalkozik. A rendszerek stabilitása áll a fókuszpontjában. Képes megválaszolni a kérdést:
Hőtan Gáztörvények Mivel foglalkozik a hőtan? A hőtan a rendszerek hőmérsékletével, munkavégzésével, és energiájával foglalkozik. A rendszerek stabilitása áll a fókuszpontjában. Képes megválaszolni a kérdést:
Műszeres analitika. Abrankó László. Molekulaspektroszkópia. Kémiai élelmiszervizsgálati módszerek csoportosítása
 Abrankó László Műszeres analitika Molekulaspektroszkópia Minőségi elemzés Kvalitatív Cél: Meghatározni, hogy egy adott mintában jelen vannak-e bizonyos ismert komponensek. Vagy ismeretlen komponensek azonosítása
Abrankó László Műszeres analitika Molekulaspektroszkópia Minőségi elemzés Kvalitatív Cél: Meghatározni, hogy egy adott mintában jelen vannak-e bizonyos ismert komponensek. Vagy ismeretlen komponensek azonosítása
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása.
 Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása. Adszorpció oldatból szilárd felületre Adszorpció oldatból Nem-elektrolitok
Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása. Adszorpció oldatból szilárd felületre Adszorpció oldatból Nem-elektrolitok
Az expanziós ködkamra
 A ködkamra Mi az a ködkamra? Olyan nyomvonaljelző detektor, mely képes ionizáló sugárzások és töltött részecskék útját kimutatni. A kamrában túlhűtött gáz található, mely a részecskék által keltett ionokon
A ködkamra Mi az a ködkamra? Olyan nyomvonaljelző detektor, mely képes ionizáló sugárzások és töltött részecskék útját kimutatni. A kamrában túlhűtött gáz található, mely a részecskék által keltett ionokon
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
