A TITRÁLÁSOK GYAKORLATA
|
|
|
- Eszter Lakatos
- 9 évvel ezelőtt
- Látták:
Átírás
1 A TITRÁLÁSOK GYAKORLATA készült a DE és SZTE Szervetlen és Analitikai Kémiai tanszékeinek oktatási segédanyagai, illetve Lengyel B.: Általános és Szervetlen Kémiai Praktikum alapján Előkészületek a térfogatos elemzéshez Feladatunkat azzal kezdjük, hogy az eszközeinket ellenőrizzük. Mindig tiszta, zsírtalan eszközzel dolgozzunk, mert a térfogatmérésünk csak így lesz pontos. A büretta zsírtalanítására használhatunk krómkénsavat. Zsírtalanítás után a bürettát többször átmossuk csapvízzel, végül desztillált vízzel. Ellenőrizni kell a büretta csapját is, a csiszolatnak akadásmentesen kell elfordulni és jól kell zárnia. A csapot lemossuk, (szénterakloriddal zsírtalanítjuk, ha szükséges) a furatot is kitisztítjuk, szárazra töröljük papírvattával. Majd a csapot vazelinnal vékonyan bekenjük, és visszahelyezzük a csiszolatba és néhányszor megforgatjuk. a zsírozás akkor jó, ha a csiszolat átlátszó lesz. A pipettákat is ellenőrizni kell, szükség esetén azokat is alaposan el kell mosni, kitisztítani. A titráláshoz használjunk széles szájú talpas lombikot, vagy Erlenmeyer-lombikot! Főzőpoharat ne használjunk titráláshoz. A bürettát fogjuk állványba, kevés mérőoldattal néhányszor öblítsük át, utána teljesen feltölthetjük úgy, hogy a furatában ne maradjon légbuborék. A beállítást (0-ra állítást) csak közvetlenül a titrálás megkezdése előtt végezzük el. Mielőtt a pipettába a vizsgálandó oldatot felszívnánk töröljük szárazra papírvattával, és néhányszor öblítsük át a mérendő oldattal. Az oldatból egy keveset a pipettába szívunk és megforgatva végigcsorgatjuk a pipetta falán. A pipettázáskor mindig nyomjuk mélyen az oldatba a pipettát, mert ha az oldat kifogy alóla, a bekerülő levegőtől az oldat a szánkba szökhet. Titráláskor az oldatot jobb kezünkben tartva és állandó rázogatás közben addig csepegtetjük hozzá a bürettából a mérőoldatot, míg átmeneti színű nem lesz. A elején nagyobb részletekben is egedhetjük a mérőoldatot a végén inkább (tört)cseppenként. A büretta csapjáról az utolsó (tört)cseppet a lombik falához érintve vesszük le és belemossuk az oldatba. A titrálás vége felé a lombikot megdöntve forgassuk meg, hogy a falára fröccsent apró cseppeket is belemossuk. A színváltozást jobban látjuk, ha a lombik alá fehér papírlapot, csempét rakunk. A mérés akkor jó, ha az első titrálás (tájékozódó mérés) után úgy választjuk meg a bürettát, vagy a vizsgálandó oldatból annyit mérünk be, hogy a büretta térfogatának kb. 2/3-ad része fogy a titráláskor. Térfogatmérő eszközök kalibrálása Tömegmérésre a mérendő anyag tömegétől és a megkívánt bemérési pontosságtól függően táramérleget vagy analitikai mérleget használhatunk. A táramérleggel g méréshatárig 0,01 g pontossággal az analitikai mérleggel néhány 100 g-ig 0,0001 g pontosságig mérhetünk. Speciális mérlegek lehetővé tesznek olyan bemérést, amikor 5 vagy 6 tizedes jegy olvasható le. Térfogatmérő eszközeink lehetnek kiöntésre, vagy kifolyásra hitelesítettek, ilyenek a mérőhenger a pipetta, a büretta. Vannak beöntésre hiteles térfogatmérő eszközök, ilyen a mérőlombik. Mérőeszközeink pontosságát kalibrációval kell meghatározni. A térfogatmérő eszközök pontos térfogatának meghatározását tömegmérésre visszavezetve végezhetjük. Ilyenkor a mérőeszközzel kimért desztillált víz tömegét megmérve az adott hőmérséklethez tartozó víz sűrűség ismeretében számíthatjuk ki a térfogatot. Hitelesítéskor mindig több párhuzamos mérést végzünk és a mérés eredményét ezek átlaga és az átlag körüli szórást kiszámolva adhatjuk meg. Ha mérés eredménye V 1, V 2, V 3, a V átlag az alábbi módon számítható:
2 V átlag = (V 1 + V 2 +V 3 )/3 A szórás: ΔV = ((V átlag -V 1 ) 2 + ((V átlag -V 2 ) 2 ((V átlag -V 3 ) 2 ) 0,5 / 3 A mérési eredményt az alábbi formában adjuk meg: V = V átlag ± ΔV A mérőlombikot betöltésre kalibráljuk, azaz a betölthető folyadék pontos térfogatát kell ismerni, ezért csak száraz eszköz hitelesíthető. A következőképpen járunk el: a tiszta, száraz mérőlombikot (névleges térfogata 100 cm 3 ) dugójával együtt a digitális táramérleg serpenyőjére helyezzük, és feljegyezzük a tömegét centigramm pontossággal. Ezután a mérőlombikot jelig töltjük ismert hőmérsékletű desztillált vízzel, gondosan ügyelve arra, hogy a jel feletti részen vízcseppek ne maradjanak (szükség esetén szűrőpapírcsíkkal távolítjuk el azokat). A mérőlombikot dugójával lezárjuk, és visszahelyezve a serpenyőre tömegét újra megmérjük. A két mérés különbsége megadja a lombikban lévő víz tömegét. A kalibrálás műveletét háromszor megismételjük, a pontos térfogatokat kiszámítjuk, és középértéküket képezzük, ha a legnagyobb és a legkisebb érték között az eltérés 0,05 cm 3 -nél nem nagyobb. A bürettát és a pipettát kifolyásra kalibráljuk, ezért itt nem szükséges száraz eszközt használni. A 10,00 cm 3 -es pipetta és a 10,00 cm 3 -es büretta hitelesítésekor a pipettából kifolyt, illetve a bürettából cm 3 -enként (mindig a 0-ponttól) leengedett folyadékrészletek tömegét csiszolt fedővel ellátott bemérőedényben (vagy csiszolt dugós Erlenmeyerlombikban) mérjük le (max. 0,05 g eltérés fogadható el). A megfelelő térfogatokat kiszámítjuk. A büretta korrekciós értékeit a névleges térfogat függvényében milliméterpapíron ábrázoljuk. Az analitikai minták tömegének mérése Az analitikai munka során a mérendő anyag mennyiségétől és a mérés pontosságigényétől függően különféle érzékenységű mérlegeket használunk. A tömegmérés elvéről, a mérlegek különböző típusairól és azok használatáról különböző praktikumokban részletes leírás található, a következőkben csak az analitikai (0,1 mg) pontosságú mérést részletezzük. A mérések célja kétféle lehet: ismeretlen tömeget kell pontosan mérnünk, gondosan előkészített anyagból kell meghatározott mennyiséget lemérnünk, ez a művelet az úgynevezett bemérés. A mérés módja attól függ, milyen analitikai mérleg áll rendelkezésünkre. A gyakorlatok során a hallgatók digitális kijelzésű analitikai mérleget használnak. Ismeretlen tömeg mérésénél a mérleg bekapcsolása után megvárjuk, amíg a kijelzőn a nulla érték ( g mértékegységben) megjelenik. Ezután a mérendő tárgyat a mérleg serpenyőjére helyezzük, és a mérlegszekrény ajtaját becsukjuk. A kijelzőn megjelenik a mérendő tárgy tömege 0,1 mg pontossággal, amelyet az egyensúly beállta után a jegyzőkönyvbe feljegyzünk. Bemérésnél kétféle módon is eljárhatunk. Az egyik a visszaméréses módszer, amelyet akkor alkalmazhatunk, ha pl. pontos beméréssel készítünk mérőoldatot. Visszamérésnél a megfelelően előkészített, exszikkátorban tárolt anyagot csiszolatos fedelű bemérőedényben tesszük a mérleg serpenyőjére. Az egyensúly beállta után a megfelelő gomb megnyomásával a mérleget tárázzuk. A kijelzőn a nulla érték jelenik meg, vagyis a további mérés során ezt tekintjük kiinduló állapotnak. A bemérőedényt a mérleg mellé készített főzőpohár felett
3 óvatosan kinyitjuk, és a pohárba szórunk az anyagból, majd az edényt visszahelyezzük a mérlegre. A kijelzőn megjelenő negatív érték mutatja a pohárba szórt anyagmennyiséget. A műveletet addig ismételjük, míg ± 10% eltérést megengedve, de 0,1 mg pontossággal sikerül a kívánt anyagmennyiséget bemérni. A főzőpohárban lévő anyagot vízben oldjuk, és veszteség nélkül átvisszük a megfelelő mérőlombikba. Analitikai pontossággal mérhetünk bemérőcsónakban (1 g-nál kisebb tömegeket), vagy kisebb méretű főzőpohárban is. A tiszta száraz edényt a mérlegre helyezzük, és a mérleget tárázzuk. A mérlegről levéve kis részletekben rászórjuk a mérendő anyagot, majd az edényt visszahelyezzük a mérleg serpenyőjére, és leolvassuk a bemért anyag tömegét. Mindezt addig folytatjuk, míg elérjük a kívánt tömeget. A bemérőcsónakról (a gyakorlaton műanyag bemérőcsónakokat használnak a hallgatók) az anyagot vízzel, tölcséren keresztül, veszteség nélkül mérőlombikba mossuk. A térfogatmérő eszközök használata A mennyiségi analízisben közelítő pontosságú térfogatmérésre mérőhengert és osztott pipettát (esetleg főzőpoharat), a térfogat pontos mérésére hiteles (A jelű) mérőlombikot, bürettát és kétjelű hasas pipettát használunk. A hiteles térfogatmérő eszközöket sohasem szabad melegíteni, mert csak hosszú idő után nyerik vissza eredeti térfogatukat. A mérőlombik: hosszú nyakú, csiszolt dugóval és körkörös jellel ellátott, betöltésre kalibrált állólombik. Mérőoldatok készítésére és oldatok ismert térfogatra való hígítására használjuk. Feltöltésnél a folyadék meniszkuszának alsó része a jel síkját érintse. Ezután bedugjuk, tartalmát alaposan összerázzuk. A (hasas) pipetta: meghatározott folyadékrészletek mérésére szolgáló, kifolyásra kalibrált eszköz. Kétjelű és egyjelű pipettákat használhatunk, de pontosabbak a kétjelűek. A kétjelű pipetta szabályos használata: a pipettázó labdával lassan felszívjuk a folyadékot kevéssel a jel fölé; kívülről a szárára tapadt folyadékcseppeket szűrőpapírral letöröljük; a pipetta végét az edény falához érintjük, és a folyadék meniszkuszát a felső jelre állítjuk, a leolvasási (parallaxis) hiba csökkentése érdekében a pipettát úgy tartjuk, hogy a jel mindig a szemünkkel egy magasságban legyen leolvasáskor; a folyadék lassú kiengedésekor a függőlegesen tartott pipetta csúcsát a kb. 45 fokos szögben megdöntött pohár száraz falához érintjük, a folyadéknívó alsó meniszkuszát a körkörös jel síkjára állítjuk; az ún. utánfolyás miatt a pipettázás ne legyen rövidebb, mint legalább másodperc. Az egyjelű pipettát ugyanúgy használjuk, mint a kétjelűt, de a folyadékot hagyjuk teljesen kifolyni, és végül csak néhány másodperces várakozás után emeljük el a pohár falától a pipettát. A pipetta csúcsában maradt folyadékot nem szabad kifújni! A büretta: tetszés szerinti folyadéktérfogatok mérésére alkalmas, beosztással és csappal ellátott, kifolyásra kalibrált üvegcső. A bürettákat hosszuk alsó harmadánál állványba fogva függőleges helyzetben rögzítjük. A büretta csiszolatos csapját, amelyet tisztítás után szárazra töröltünk, csapzsírral vagy vazelinnel vékonyan bekenjük. A jól zsírozott csaptest átlátszó és a csap furata zsírmentes. A büretta feltöltésekor ügyeljünk arra, hogy levegőbuborék ne maradjon sehol a büretta szárában. A bürettát 4-5 mm-rel a 0-jel fölé töltjük, és a csap óvatos nyitásával a térfogatskála 0-pontjára állítjuk a folyadéknívót (átlátszó folyadék esetén az alsó meniszkuszt, sötét mérőoldatnál a felső meniszkuszt). A leolvasás előtt a büretta csapján függő cseppet az edény felemelésével az edény falához érintve mindig levesszük. A büretta használatakor az utánfolyásra és a leolvasás pontosságára is ügyeljünk. Az
4 osztásnak megfelelő térfogatot közvetlen leolvasással, a köztiértékeket becsléssel állapítjuk meg. A leolvasás parallaxis hibáját itt is elkerülhetjük, ha szemünk azonos magasságban van a folyadéknívóval. Az ún. Schellbach-bürettát (hátsó, tejüveggel bevont oldalának közepén sötétkék csík van) könnyebb leolvasni, mert a folyadék alsó meniszkuszánál a kék csíkot elvékonyodva látjuk. A térfogatos analízis: titrimetria A térfogatos analízis, titrálás során addig adagoljuk az ismert koncentrációjú ún. mérőoldatot a vizsgálandó anyag oldatához, míg el nem érjük a végpontot. A végpontot hagyományos módon indikátorral, vagy műszeres módszerrel jelezzük, illetve bizonyos esetekben nincs szükség külön indikátorra (mint pl. permanganometria). A titrálás végpontjáig elhasznált mérőoldat térfogata (fogyás), koncentrációja és a lejátszódó kémiai reakció egyenlete segítségével számoljuk ki a meghatározandó anyag anyagmennyiségét. A megbízható eredményhez minimum három párhuzamos mérésre van szükség. A végpont nem azonos az ekvivalenciaponttal. A titrálás ekvivalenciapontjában a kémiai reakció sztöchiometriájának pontosan megfelelő arányban reagál egymással a mérőoldat és a titrált minta reagensei. Az indikálási módszert (indikátor típusa, koncentrációja) úgy kell megválasztani, hogy az általa jelzett végpont minél közelebb essen a titrálás ekvivalenciapontjához. A végpontban mért és az ekvivalenciapontnak megfelelő fogyás %-os különbsége a titrálás elvi hibája. A titrimetriát a meghatározás alapját képező reakciók típusa, ezen belül a felhasznált mérőoldat hatóanyaga szerint osztjuk fel (csapadékos titrálás, sav-bázis titrálás, komplexometria és redoxititrálás: azon belül oxidimetria (permanganometria, jodometria, bromatometria, cerimetria, kromatometria), reduktometria (jodometria)). Az előírásoknak megfelelően, gondosan elvégzett mérésekkel általában 0,1%-os pontosság érhető el. A mérőoldatok koncentrációját az analitikában mol/dm 3 -ben fejezzük ki. Az így megadott koncentrációt molaritásnak (M) is nevezzük. 1 mólos az az oldat, amelynek 1 dm 3 -e 1 mol oldott anyagot tartalmaz. Sav-bázis reakciókon alapuló titrálásoknál ismerni kell az ekvivalenciapont várható ph-ját, amit egyeztetni kell az indikátor átcsapási ph-tartományával (pkind ± 1): erős sav - erős bázis reakciónál ph = 7, gyenge savat erős bázissal titrálva ph > 7, gyenge bázist erős savval titrálva ph < 7, többértékű savak/bázisok meghatározásánál ha az egyes lépcsők elválóak a köztes protonáltságú forma (amfolit) gyakorlatilag 100%-ban létezik az ekvivalenciapontban, és ez határozza meg a ph-t). Mérőoldatok készítése és koncentrációjuk meghatározása A mérőoldatok koncentrációját a lehető legnagyobb pontossággal kell ismernünk. Mérőoldatot ismert mennyiségű hatóanyag pontos bemérésével készíthetünk, vagy a közelítő pontossággal készült mérőoldat hatóértékét utólagosan állapítjuk meg. Pontos beméréssel készíthető a mérőoldat, ha alapanyagunk kellő tisztaságú, pontosan ismert összetételű, és mérés vagy tárolás közben nem bomlik. A mérőoldat készítéséhez használt alapanyag molekulatömegének ismeretében kiszámítjuk, hogy a kívánt molaritású oldat elkészítéséhez mennyi anyag szükséges. Ezt a mennyiséget ± 5% eltérést megengedve, de analitikai pontossággal bemérjük egy főzőpohárba, a bemért tömeg pontos értékét a jegyzőkönyvbe feljegyezzük. A mérőlombikba tölcsért helyezünk el úgy, hogy a lombik nyaka és a tölcsér szára között a légmozgásnak utat biztosítunk. A főzőpohárba kimért anyagot kevés desztillált vízben oldjuk, majd a tölcséren keresztül a lombikba öntjük. Bemérőcsónak
5 használata esetén desztillált vízzel a tölcsérre mossuk az anyagot. A főzőpoharat, a tölcsért, végül a tölcsér kiemelésekor annak szárát is desztillált vízzel gondosan leöblítjük, a lombikot jelig töltjük, és jól összerázzuk. A mérőoldat koncentrációjának megőrzése miatt cm 3 - es részleteivel kiöblítjük a tiszta, jól záró (erről még a mérőoldat betöltése előtt győződjünk meg) tárolóedényt, és csak ezután töltjük át a mérőoldatot. Az oldat pontos koncentrációját mol/dm 3 -ben kifejezve, számítással határozzuk meg. Az üveget felcímkézzük, ráírjuk a mérőoldat nevét, pontos koncentrációját, készítésének időpontját és a készítőjének nevét. Közelítő pontosságú beméréssel készítünk mérőoldatot, ha az előzőleg ismertetett feltételek nem teljesülnek. A mérőoldat koncentrációját ilyenkor utólag állapítjuk meg. Pontos megállapítása kétféle módon történhet: (1) szilárd anyag közvetlen mérésével, (2) segédmérőoldattal. Az első esetben jól mérhető, ismert összetételű szilárd anyag pontosan bemért mennyiségét közvetlenül titráljuk a mérőoldattal. A lejátszódó reakció sztöchiometriájának ismeretében előzetesen kiszámítjuk, hány grammot kell bemérni ahhoz, hogy az oldatunkból az optimális mennyiség fogyjon (pl. 10 cm 3 -es büretta esetén kb. 8-9 cm 3 ). A megfelelő mennyiséget, ± 5% eltérést megengedve, de analitikai pontossággal titráló lombikba mérjük, kevés vízben oldjuk, és az előírásnak megfelelően elvégezzük a titrálást. A hatóérték megállapításának másik módja az, hogy ismert, pontos koncentrációjú mérőoldat, ún. segédmérőoldat gondosan kimért részleteit titráljuk a beállítandó mérőoldattal. Mind a kétféle módszer esetén a párhuzamos titrálások közül azoknak a mérőoldatfogyásoknak (legalább háromnak) a középértékét fogadhatjuk el a helyes értéknek, amelyek relatív eltérése 0,5%-nál nem nagyobb. Ennél nagyobb eltérésnél még legalább egy újabb mérést végzünk. A mérőoldatok pontos koncentrációját négy értékes számjegyre kerekítetten adjuk meg. Fontos tudni, hogy használat előtt a mérőoldatot mindig jól összerázzuk, száraz főzőpohárba öntünk ki belőle a büretta feltöltéséhez vagy a pipettázáshoz, és a fel nem használt részt nem öntjük vissza a tárolóedénybe. A titrálások kivitelezése A megfelelően előkészített vagy ampullázott vizsgálandó anyag oldatát tölcséren át desztillált vízzel kvantitatíven (általában 100,00 cm 3 -es) mérőlombikba mossuk át, majd a lombikot jelre töltjük. Az így készült törzsoldatot alaposan homogenizáljuk. A törzsoldatból pipettával pontosan mért, arányos (ún. alikvot) részleteket veszünk ki (többnyire 100 cm 3 -es) titráló lombikokba. Az előírásnak megfelelően hígítjuk, hozzáadjuk a szükséges segédanyagokat, indikátort stb. Minimálisan 3 mintarészletet készítünk elő. A bürettát alaposan átöblítjük a mérőoldat kis részleteivel, majd feltöltjük azzal, és a meniszkuszt a 0 jelre állítjuk. A titrálás során egyik kezünkkel szabályozzuk a büretta csapját, másik kezünkkel a titráló lombikot mozgatjuk, hogy a becsepegő mérőoldat folyamatosan elegyedjen a vizsgálandó oldattal. Az első titrálás csak tájékozódás a végpont helyéről, a bekövetkező színváltozásról stb. A következő titrálásnál a végpont előtt már lassan, cseppenként adagoljuk a mérőoldatot. A titrálás végén kb. 30 másodperc utánfolyási idő után olvassuk le a bürettát. A kipipettázott részletekre kapott fogyások átlaga képezi a számítás alapját. A titrálás eredményének kiszámítása A titrálási eredmények kiszámítása az analízis alapjául szolgáló reakcióegyenlet figyelembevételével történik. Ezért a számítás során az első lépés mindig a reakcióegyenlet felírása! Az aa + bb cc + dd általános reakcióegyenletet alapul véve igaz az, hogy ha A a titrálásnál használt mérőoldat, B pedig a meghatározandó anyag, akkor a titrálás végpontjában: b n A = a n B, ahol n a megfelelő anyagok móljainak számát jelöli. Ennek alapján, valamint a mérőoldat koncentrációja (c A ) és a mérőoldatfogyás (V f ) ismeretében
6 először kiszámítjuk, hogy a pipettával mért térfogatban (V p ) mennyi a vizsgálandó anyag mennyisége (molban). n B b c A V f = a Ezután kiszámítjuk a törzsoldatban (V l ) a vizsgálandó anyag móljainak számát, majd ezt megszorozva az anyag molekulatömegével (M B ) megkapjuk az analízishez bemért vagy az ampullába zárt teljes anyag mennyiségét, melyet leggyakrabban mg-ban adunk meg. Az anyagtartalmat 0,1-0,01 mg pontossággal adjuk meg. Ennek alapján kiszámíthatjuk a törzsoldat koncentrációját is (pl. mol/dm 3 -ben) vagy por alakú minta esetében az összetételt tömegszázalékban. SAV-BÁZIS TITRÁLÁSOK Az acidi-alkalimetriás titrálásokkal meghatározhatók erős vagy gyenge savak, illetve bázisok, valamint olyan vegyületek, amelyekből valamilyen kémiai reakció során ekvivalens mennyiségű sav vagy bázis állítható elő. Mérőoldatként erős savat, illetve erős bázist alkalmazunk. Vizes közegben végzett titrálásoknál sav mérőoldatként általában sósavat, lúg mérőoldatként pedig nátrium-hidroxidot használunk, melyek koncentrációja nem kisebb mint 0,05 mol/dm 3. Végpontjelzésre sav-bázis indikátorokat használunk. Ezek olyan gyenge szerves savak vagy bázisok, melyek disszociálatlan formájának színe más, mint a disszociált alaknak. Ha az indikátor mindkét formája színes, akkor kétszínű indikátorról, ha az egyik forma színtelen, akkor egyszínű indikátorról beszélünk. A színváltozás oka a disszociációval párhuzamosan lejátszódó szerkezeti átrendeződés. A titrálás végpontjában, ami megegyezik az indikátor átcsapási pontjával, a mérőoldat feleslege protonálja vagy deprotonálja az indikátort, (attól függően, hogy savval vagy lúggal titrálunk), ami színváltozást eredményez. Az indikátor átcsapási pontjában a két indikátorforma koncentrációja megegyezik (ez azt is jelenti, hogy az átcsapási pont ph-ja megegyezik az indikátor pk ind -jával). Ezért a sav-bázis titrálásoknál mindig átmeneti színig titrálunk! Mivel az emberi szem nem tudja pontosan észlelni az indikátor átcsapási pontját, hanem csak egy olyan intervallumban képes érzékelni a színváltozást, amikor a két szín egymáshoz viszonyítva legalább tízszeres feleslegben van, vagyis az indikátor disszociálatlan és disszociált formájának a koncentrációja 1:10, illetve 10:1 arányú, ezért minden sav-bázis indikátort egy átcsapási tartománnyal jellemzünk, amit ph egységben fejezünk ki: ΔpH = pk ind ± 1. Az átcsapási tartományt szűkíteni lehetne, ha az indikátor két formája komplementer színű volna, mert ekkor az átcsapási pontban az indikátor színe szürke lenne, amit a szemünk sokkal élesebben észlel. Mivel ilyen indikátor nem létezik, ezt a hatást és így a végpontjelzés pontosabbá tételét keverékindikátorokkal érhetjük el. A keverékindikátoroknak két csoportja van. Az első csoport tagjai olyan indikátorok elegyei, amelyek átcsapási ph-tartománya közel áll egymáshoz, és a két indikátor legalább egyik alakjának (protonált vagy deprotonált) a színe komplementer vagy ahhoz közeli. Ilyen pl. a metilvörös-brómkrezolzöld. A második csoportba tartoznak egy indikátor és egy festékanyag oldatának keverékéből előállított keverékindikátorok, ahol a festék az indikátor egyik formájának a színével komplementer, mint pl. a metilvörös-metilénkék. A keverékindikátorok átcsapási tartománya ±0,1-0,2 ph egység.
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
OKTATÁSI SEGÉDLET. az Általános kémia III. tantárgy laboratóriumi gyakorlatához
 OKTATÁSI SEGÉDLET az Általános kémia III. tantárgy laboratóriumi gyakorlatához II. éves nappali tagozatos, környezetmérnök (BSc) szakos hallgatók számára Készítette: Dr. Bodnár Ildikó főiskolai tanár DE-MK,
OKTATÁSI SEGÉDLET az Általános kémia III. tantárgy laboratóriumi gyakorlatához II. éves nappali tagozatos, környezetmérnök (BSc) szakos hallgatók számára Készítette: Dr. Bodnár Ildikó főiskolai tanár DE-MK,
KONDUKTOMETRIÁS MÉRÉSEK
 A környezetvédelem analitikája KON KONDUKTOMETRIÁS MÉRÉSEK A GYAKORLAT CÉLJA: A konduktometria alapjainak megismerése. Elektrolitoldatok vezetőképességének vizsgálata. Oxálsav titrálása N-metil-glükamin
A környezetvédelem analitikája KON KONDUKTOMETRIÁS MÉRÉSEK A GYAKORLAT CÉLJA: A konduktometria alapjainak megismerése. Elektrolitoldatok vezetőképességének vizsgálata. Oxálsav titrálása N-metil-glükamin
1. sz. melléklet 1. rész. I. Általános előírások. 1. A gyógyszerek hatáserősségét megkülönböztető jelek. 2. A gyógyszerek adagolása. 3.
 1. sz. melléklet 1. rész I. Általános előírások 1. A gyógyszerek hatáserősségét megkülönböztető jelek A hatóanyagok és gyógyszerkészítmények hatáserősségére, korlátozott adagolására utaló úgynevezett erős
1. sz. melléklet 1. rész I. Általános előírások 1. A gyógyszerek hatáserősségét megkülönböztető jelek A hatóanyagok és gyógyszerkészítmények hatáserősségére, korlátozott adagolására utaló úgynevezett erős
UV-LÁTHATÓ ABSZORPCIÓS SPEKTROFOTOMETRIA
 SPF UV-LÁTHATÓ ABSZORPCIÓS SPEKTROFOTOMETRIA A GYAKORLAT CÉLJA: AZ UV-látható abszorpciós spektrofotométer működésének megismerése és a Lambert-Beer törvény alkalmazása. Szalicilsav meghatározása egy vizes
SPF UV-LÁTHATÓ ABSZORPCIÓS SPEKTROFOTOMETRIA A GYAKORLAT CÉLJA: AZ UV-látható abszorpciós spektrofotométer működésének megismerése és a Lambert-Beer törvény alkalmazása. Szalicilsav meghatározása egy vizes
Általános kémiai munkafüzet Kémia BSc és Gyógyszerész hallgatók számára
 DEBRECENI EGYETEM TERMÉSZETTUDOMÁNYI KAR Szervetlen és Analitikai Kémiai Tanszék Várnagy Katalin Általános kémiai munkafüzet Kémia BSc és Gyógyszerész hallgatók számára Oktatási segédanyag A munkafüzet
DEBRECENI EGYETEM TERMÉSZETTUDOMÁNYI KAR Szervetlen és Analitikai Kémiai Tanszék Várnagy Katalin Általános kémiai munkafüzet Kémia BSc és Gyógyszerész hallgatók számára Oktatási segédanyag A munkafüzet
1. Kolorimetriás mérések A sav-bázis indikátorok olyan "festékek", melyek színüket a ph függvényében
 ph-mérés Egy savat vagy lúgot tartalmazó vizes oldat savasságának vagy lúgosságának erősségét a H + vagy a OH - ion aktivitással lehet jellemezni. A víz ionszorzatának következtében a két ion aktivitása
ph-mérés Egy savat vagy lúgot tartalmazó vizes oldat savasságának vagy lúgosságának erősségét a H + vagy a OH - ion aktivitással lehet jellemezni. A víz ionszorzatának következtében a két ion aktivitása
A XVII. VegyÉSZtorna I. fordulójának feladatai és megoldásai
 Megoldások: 1. Mekkora a ph-ja annak a sósavoldatnak, amelyben a kloridion koncentrációja 0,01 mol/dm 3? (ph =?,??) A sósav a hidrogén-klorid (HCl) vizes oldata, amelyben a HCl teljesen disszociál, mivel
Megoldások: 1. Mekkora a ph-ja annak a sósavoldatnak, amelyben a kloridion koncentrációja 0,01 mol/dm 3? (ph =?,??) A sósav a hidrogén-klorid (HCl) vizes oldata, amelyben a HCl teljesen disszociál, mivel
Kémia OKTV döntő forduló II. kategória, 1. feladat Budapest, 2011. április 9.
 Oktatási Hivatal Kémia OKTV döntő forduló II. kategória, 1. feladat Budapest, 2011. április 9. A feladat elolvasására 15 perc áll rendelkezésre. A feladathoz csak a 15 perc letelte után szabad hozzákezdeni.
Oktatási Hivatal Kémia OKTV döntő forduló II. kategória, 1. feladat Budapest, 2011. április 9. A feladat elolvasására 15 perc áll rendelkezésre. A feladathoz csak a 15 perc letelte után szabad hozzákezdeni.
v1.04 Analitika példatár
 Bevezető A példatár azért készült, hogy segítséget kapjon az a tanuló, aki eredményesen akarja elsajátítatni az analitikai számítások alapjait. Minden feladat végén dőlt karakterekkel megtalálható az eredmény.
Bevezető A példatár azért készült, hogy segítséget kapjon az a tanuló, aki eredményesen akarja elsajátítatni az analitikai számítások alapjait. Minden feladat végén dőlt karakterekkel megtalálható az eredmény.
Laboratóriumi gyakorlat kémia OKTV Budapest, 2009. április 18. I. kategória 1. feladat
 Oktatási Hivatal Laboratóriumi gyakorlat kémia OKTV Budapest, 2009. április 18. I. kategória 1. feladat A feladathoz kérdések társulnak, amelyek külön lapon vannak, a válaszokat erre a lapra kérjük megadni.
Oktatási Hivatal Laboratóriumi gyakorlat kémia OKTV Budapest, 2009. április 18. I. kategória 1. feladat A feladathoz kérdések társulnak, amelyek külön lapon vannak, a válaszokat erre a lapra kérjük megadni.
1. Laboratóriumi gyakorlat A laborgyakorlatok anyagát összeállította: dr. Pasinszki Tibor egyetemi tanár
 1. Laboratóriumi gyakorlat A laborgyakorlatok anyagát összeállította: dr. Pasinszki Tibor egyetemi tanár Laboratóriumi üvegedények A laboratóriumban többféle üvegedény található, melyek a felhasználás
1. Laboratóriumi gyakorlat A laborgyakorlatok anyagát összeállította: dr. Pasinszki Tibor egyetemi tanár Laboratóriumi üvegedények A laboratóriumban többféle üvegedény található, melyek a felhasználás
Kémia OKTV döntő I. kategória, 1. feladat Budapest, 2012. március 31. Titrálások hipoklorittal
 Oktatási Hivatal KÓDSZÁM: Kémia OKTV döntő I. kategória, 1. feladat Budapest, 2012. március 31. Titrálások hipoklorittal A hipoklorition erélyes oxidálószer. Reakciói általában gyorsan és egyértelmű sztöchiometria
Oktatási Hivatal KÓDSZÁM: Kémia OKTV döntő I. kategória, 1. feladat Budapest, 2012. március 31. Titrálások hipoklorittal A hipoklorition erélyes oxidálószer. Reakciói általában gyorsan és egyértelmű sztöchiometria
Gyógyszerhatóanyagok azonosítása és kioldódási vizsgálata tablettából
 Gyógyszerhatóanyagok azonosítása és kioldódási vizsgálata tablettából ELTE TTK Szerves Kémiai Tanszék 2015 1 I. Elméleti bevezető 1.1. Gyógyszerkönyv A Magyar gyógyszerkönyv (Pharmacopoea Hungarica) első
Gyógyszerhatóanyagok azonosítása és kioldódási vizsgálata tablettából ELTE TTK Szerves Kémiai Tanszék 2015 1 I. Elméleti bevezető 1.1. Gyógyszerkönyv A Magyar gyógyszerkönyv (Pharmacopoea Hungarica) első
ANALITIKAI KÉMIA. Oktatási segédanyag. Kvantitatív analitikai kémiai laboratóriumi gyakorlathoz. Szerkesztő: Farkas Etelka és Lente Gábor
 ANALITIKAI KÉMIA ktatási segédanyag Kvantitatív analitikai kémiai laboratóriumi gyakorlathoz Szerkesztő: Farkas Etelka és Lente Gábor Debreceni Egyetem, Tudományegyetemi Karok, Szervetlen és Analitikai
ANALITIKAI KÉMIA ktatási segédanyag Kvantitatív analitikai kémiai laboratóriumi gyakorlathoz Szerkesztő: Farkas Etelka és Lente Gábor Debreceni Egyetem, Tudományegyetemi Karok, Szervetlen és Analitikai
O k t a t á si Hivatal
 O k t a t á si Hivatal Országos Középiskolai Tanulmányi Verseny Kémia I. kategória 3. forduló Budapest, 2015. március 21. A verseny döntője három mérési feladatból áll. Mindhárom feladat szövege, valamint
O k t a t á si Hivatal Országos Középiskolai Tanulmányi Verseny Kémia I. kategória 3. forduló Budapest, 2015. március 21. A verseny döntője három mérési feladatból áll. Mindhárom feladat szövege, valamint
GYÓGYSZERTECHNOLÓGIA 1. MUNKAFÜZET
 GYÓGYSZERTECHNOLÓGIA 1. MUNKAFÜZET 0 TARTALOMJEGYZÉK FELADATLAPOK 1 Vizek paramétereinek vizsgálata és összehasonlítása 1 A ph befolyása az oldékonyságra 3 Hidrotróp és komplexképző anyagok oldásközvetítése
GYÓGYSZERTECHNOLÓGIA 1. MUNKAFÜZET 0 TARTALOMJEGYZÉK FELADATLAPOK 1 Vizek paramétereinek vizsgálata és összehasonlítása 1 A ph befolyása az oldékonyságra 3 Hidrotróp és komplexképző anyagok oldásközvetítése
O k t a t á si Hivatal
 O k t a t á si Hivatal : Országos Középiskolai Tanulmányi Verseny Kémia II. kategória 3. forduló Budapest, 2015. március 21. A verseny döntője három feladatból áll. Mindhárom feladat szövege, valamint
O k t a t á si Hivatal : Országos Középiskolai Tanulmányi Verseny Kémia II. kategória 3. forduló Budapest, 2015. március 21. A verseny döntője három feladatból áll. Mindhárom feladat szövege, valamint
Klasszikus analitikai módszerek:
 Klasszikus analitikai módszerek: Azok a módszerek, melyek kémiai reakciókon alapszanak, de az elemzéshez csupán a tömeg és térfogat pontos mérésére van szükség. A legfontosabb klasszikus analitikai módszerek
Klasszikus analitikai módszerek: Azok a módszerek, melyek kémiai reakciókon alapszanak, de az elemzéshez csupán a tömeg és térfogat pontos mérésére van szükség. A legfontosabb klasszikus analitikai módszerek
Kémia OKTV döntő forduló I. kategória, 1. feladat Budapest, 2011. április 9.
 Oktatási Hivatal Kémia OKTV döntő forduló I. kategória, 1. feladat Budapest, 2011. április 9. A feladathoz egy külön lapon kérdések társulnak, a válaszokat arra a lapra kérjük megadni. A feladat megkezdése
Oktatási Hivatal Kémia OKTV döntő forduló I. kategória, 1. feladat Budapest, 2011. április 9. A feladathoz egy külön lapon kérdések társulnak, a válaszokat arra a lapra kérjük megadni. A feladat megkezdése
EMELT SZINTŰ ÍRÁSBELI VIZSGA
 ÉRETTSÉGI VIZSGA 2016. május 13. KÉMIA EMELT SZINTŰ ÍRÁSBELI VIZSGA 2016. május 13. 8:00 Az írásbeli vizsga időtartama: 240 perc Pótlapok száma Tisztázati Piszkozati EMBERI ERŐFORRÁSOK MINISZTÉRIUMA Kémia
ÉRETTSÉGI VIZSGA 2016. május 13. KÉMIA EMELT SZINTŰ ÍRÁSBELI VIZSGA 2016. május 13. 8:00 Az írásbeli vizsga időtartama: 240 perc Pótlapok száma Tisztázati Piszkozati EMBERI ERŐFORRÁSOK MINISZTÉRIUMA Kémia
Ivóvíz savasságának meghatározása sav-bázis titrálással (SGM)
 Ivóvíz savasságának meghatározása sav-bázis titrálással (SGM) I. Elméleti alapok: A vizek savasságát a savasan hidrolizáló sók és savak okozzák. A savasságot a semlegesítéshez szükséges erős bázis mennyiségével
Ivóvíz savasságának meghatározása sav-bázis titrálással (SGM) I. Elméleti alapok: A vizek savasságát a savasan hidrolizáló sók és savak okozzák. A savasságot a semlegesítéshez szükséges erős bázis mennyiségével
Felszíni vizek oldott oxigéntartalmának és kémiai oxigénigényének vizsgálata
 1. Gyakorlat Felszíni vizek oldott oxigéntartalmának és kémiai oxigénigényének vizsgálata 1. A gyakorlat célja A természetes vizek oldott oxigéntartalma jelentősen befolyásolhatja a vízben végbemenő folyamatokat.
1. Gyakorlat Felszíni vizek oldott oxigéntartalmának és kémiai oxigénigényének vizsgálata 1. A gyakorlat célja A természetes vizek oldott oxigéntartalma jelentősen befolyásolhatja a vízben végbemenő folyamatokat.
Gyémánt Mihály 2-14-B Cukorinverzio sebesse gi á llándo já nák meghátá rozá sá polárimetriá s me re ssel
 Cukorinverzio sebesse gi á llándo já nák meghátá rozá sá polárimetriá s me re ssel Bevezetés A szacharóz inverziója szőlőcukorrá (D-glükóz) és gyümölcscukorrá (D-fruktóz) vizes közegben lassú folyamat.
Cukorinverzio sebesse gi á llándo já nák meghátá rozá sá polárimetriá s me re ssel Bevezetés A szacharóz inverziója szőlőcukorrá (D-glükóz) és gyümölcscukorrá (D-fruktóz) vizes közegben lassú folyamat.
A REAKCIÓKINETIKA ALAPJAI
 A REAKCIÓKINETIKA ALAPJAI Egy kémiai reakció sztöchiometriai egyenletének általános alakja a következő formában adható meg k i=1 ν i A i = 0, (1) ahol A i a reakcióban résztvevő i-edik részecske, ν i pedig
A REAKCIÓKINETIKA ALAPJAI Egy kémiai reakció sztöchiometriai egyenletének általános alakja a következő formában adható meg k i=1 ν i A i = 0, (1) ahol A i a reakcióban résztvevő i-edik részecske, ν i pedig
A 2007/2008. tanévi Országos Középiskolai Tanulmányi Verseny második fordulójának feladatlapja. KÉMIÁBÓL I. kategóriában ÚTMUTATÓ
 Oktatási ivatal A versenyző kódszáma: A 2007/2008. tanévi Országos Középiskolai Tanulmányi Verseny második fordulójának feladatlapja Munkaidő: 300 perc Elérhető pontszám: 100 pont KÉMIÁBÓL I. kategóriában
Oktatási ivatal A versenyző kódszáma: A 2007/2008. tanévi Országos Középiskolai Tanulmányi Verseny második fordulójának feladatlapja Munkaidő: 300 perc Elérhető pontszám: 100 pont KÉMIÁBÓL I. kategóriában
01/2008:40202 4.2.2. MÉRŐOLDATOK
 Ph.Hg.VIII. Ph.Eur.5.6-6.0-1 4.2.2. MÉRŐOLDATOK 01/2008:40202 A mérőoldatokat a szokásos kémiai analitikai eljárások szabályai szerint készítjük. A mérőoldatok előállításához használt eszközök megfelelő
Ph.Hg.VIII. Ph.Eur.5.6-6.0-1 4.2.2. MÉRŐOLDATOK 01/2008:40202 A mérőoldatokat a szokásos kémiai analitikai eljárások szabályai szerint készítjük. A mérőoldatok előállításához használt eszközök megfelelő
Elektrolitok nem elektrolitok, vezetőképesség mérése
 Elektrolitok nem elektrolitok, vezetőképesség mérése Név: Neptun-kód: mérőhely: Labor előzetes feladatok A vezetőképesség változása kémiai reakció közben 10,00 cm 3 ismeretlen koncentrációjú sósav oldatához
Elektrolitok nem elektrolitok, vezetőképesség mérése Név: Neptun-kód: mérőhely: Labor előzetes feladatok A vezetőképesség változása kémiai reakció közben 10,00 cm 3 ismeretlen koncentrációjú sósav oldatához
Titrálás Elmélet és gyakorlat
 Titrálás Elmélet és gyakorlat A titrálás elmélete Bevezetés Jelen füzet történeti, elméleti és gyakorlati szempontból mutatja be a titrálást; először a végponttitrálással, majd pedig az átcsapási pontos
Titrálás Elmélet és gyakorlat A titrálás elmélete Bevezetés Jelen füzet történeti, elméleti és gyakorlati szempontból mutatja be a titrálást; először a végponttitrálással, majd pedig az átcsapási pontos
BIZTONSÁGI TUDNIVALÓK
 H A készülék beállítása és használata előtt figyelmesen olvassa el a használati utasítást. A készülék csak így tudja a legjobb szolgáltatást és a maximális biztonságot nyújtani. A KÉSZÜLÉK LEÍRÁSA (lásd
H A készülék beállítása és használata előtt figyelmesen olvassa el a használati utasítást. A készülék csak így tudja a legjobb szolgáltatást és a maximális biztonságot nyújtani. A KÉSZÜLÉK LEÍRÁSA (lásd
A kenyerek savfokának meghatározási problémái Dr. Szalai Lajos
 SÜTİIPAROSOK, PÉKEK 50. évf. 2003. 6. sz. 55-56.o A kenyerek savfokának meghatározási problémái Dr. Szalai Lajos A gyakorló élelmiszerkémikusok az élelmiszerek savtartalmának, savasságának kifejezésére
SÜTİIPAROSOK, PÉKEK 50. évf. 2003. 6. sz. 55-56.o A kenyerek savfokának meghatározási problémái Dr. Szalai Lajos A gyakorló élelmiszerkémikusok az élelmiszerek savtartalmának, savasságának kifejezésére
MAGYAR ÉLELMISZERKÖNYV Hivatalos Élelmiszervizsgálati Módszergyűjtemény. Codex Alimentarius Hungaricus
 MAGYAR ÉLELMISZERKÖNYV Hivatalos Élelmiszervizsgálati Módszergyűjtemény Codex Alimentarius Hungaricus 3-1-870/000 számú előírás Analitikai referencia-módszerek szeszesitalok vizsgálatára Analytical reference
MAGYAR ÉLELMISZERKÖNYV Hivatalos Élelmiszervizsgálati Módszergyűjtemény Codex Alimentarius Hungaricus 3-1-870/000 számú előírás Analitikai referencia-módszerek szeszesitalok vizsgálatára Analytical reference
1969R1265 HU 04.02.1999 001.001 1
 1969R1265 HU 04.02.1999 001.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B A BIZOTTSÁG 1265/69/EGK RENDELETE (1969. július 1.)
1969R1265 HU 04.02.1999 001.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B A BIZOTTSÁG 1265/69/EGK RENDELETE (1969. július 1.)
XANTHANI GUMMI. Xantán gumi
 Xanthani gummi Ph.Hg.VIII. Ph.Eur.6.4-1 [11138-66-2] DEFINÍCIÓ XANTHANI GUMMI Xantán gumi 04/2009:1277 A xantán gumi nagy molekulatömegű anionos poliszacharid, melyet szénhidrátok Xanthomonas campestris-szel
Xanthani gummi Ph.Hg.VIII. Ph.Eur.6.4-1 [11138-66-2] DEFINÍCIÓ XANTHANI GUMMI Xantán gumi 04/2009:1277 A xantán gumi nagy molekulatömegű anionos poliszacharid, melyet szénhidrátok Xanthomonas campestris-szel
Ecetsav koncentrációjának meghatározása titrálással
 Ecetsav koncentrációjának meghatározása titrálással A titrálás lényege, hogy a meghatározandó komponenst tartalmazó oldathoz olyan ismert koncentrációjú oldatot adagolunk, amely a reakcióegyenlet szerint
Ecetsav koncentrációjának meghatározása titrálással A titrálás lényege, hogy a meghatározandó komponenst tartalmazó oldathoz olyan ismert koncentrációjú oldatot adagolunk, amely a reakcióegyenlet szerint
MIT TUDOK A TERMÉSZETRŐL? INTERNETES VETÉLKEDŐ KÉMIA FELADATMEGOLDÓ VERSENY
 JAVÍTÓKULCS Elérhető összes pontszám: 115 pont 1.) Nyelvészkedjünk! (10 pont) Az alábbiakban kémiai elemek magyar névváltozatai vannak felsorolva a nyelvújítás korából. Írd a megfelelő kifejezések mellé
JAVÍTÓKULCS Elérhető összes pontszám: 115 pont 1.) Nyelvészkedjünk! (10 pont) Az alábbiakban kémiai elemek magyar névváltozatai vannak felsorolva a nyelvújítás korából. Írd a megfelelő kifejezések mellé
EÖTVÖS LABOR EÖTVÖS JÓZSEF GIMNÁZIUM TATA FELADATLAPOK KÉMIA. TT csoport Tanári segédanyag. Szeidemann Ákos
 FELADATLAPOK KÉMIA TT csoport Tanári segédanyag Szeidemann Ákos 1/3 TERMÉSZETTUDOMÁNYI CSOPORT (BIOLÓGIA-KÉMIA TAGOZAT) LABORGYAKORLATAI KÉMIÁBÓL Tanári 2/3 Cím: Természettudományi csoport (biológia-kémia
FELADATLAPOK KÉMIA TT csoport Tanári segédanyag Szeidemann Ákos 1/3 TERMÉSZETTUDOMÁNYI CSOPORT (BIOLÓGIA-KÉMIA TAGOZAT) LABORGYAKORLATAI KÉMIÁBÓL Tanári 2/3 Cím: Természettudományi csoport (biológia-kémia
7.4. Tömény szuszpenziók vizsgálata
 ahol t a szuszpenzió, t o a diszperzióközeg kifolyási ideje, k a szuszpenzió, k o pedig a diszperzióközeg sárásége. Kis szuszpenziókoncentrációnál a sáráségek hányadosa elhanyagolható. A mérési eredményeket
ahol t a szuszpenzió, t o a diszperzióközeg kifolyási ideje, k a szuszpenzió, k o pedig a diszperzióközeg sárásége. Kis szuszpenziókoncentrációnál a sáráségek hányadosa elhanyagolható. A mérési eredményeket
FLUORESZCENCIA SPEKTROSZKÓPIA
 FLS FLUORESZCENCIA SPEKTROSZKÓPIA A GYAKORLAT CÉLJA: A fluoreszcencia spektroszkópia módszerének megismerése és alkalmazása kininszulfát meghatározására vizes közegű oldatmintákban. A MÉRÉSI MÓDSZER ELVE
FLS FLUORESZCENCIA SPEKTROSZKÓPIA A GYAKORLAT CÉLJA: A fluoreszcencia spektroszkópia módszerének megismerése és alkalmazása kininszulfát meghatározására vizes közegű oldatmintákban. A MÉRÉSI MÓDSZER ELVE
1. Melyik az az elem, amelynek csak egy természetes izotópja van? 2. Melyik vegyület molekulájában van az összes atom egy síkban?
 A 2004/2005. tanévi Országos Középiskolai Tanulmányi Verseny második fordulójának feladatlapja KÉMIA (II. kategória) I. FELADATSOR 1. Melyik az az elem, amelynek csak egy természetes izotópja van? A) Na
A 2004/2005. tanévi Országos Középiskolai Tanulmányi Verseny második fordulójának feladatlapja KÉMIA (II. kategória) I. FELADATSOR 1. Melyik az az elem, amelynek csak egy természetes izotópja van? A) Na
800-5000 Hz U. oldat. R κ=l/ra. 1.ábra Az oldatok vezetőképességének mérése
 8 gyak. Konduktometria A gyakorlat célja: Az oldat ionos alkotóinak összegző, nem specifikus mérése (a víz tisztasága), a konduktometria felhasználása titrálás végpontjelzésére. A módszer elve Elektrolitok
8 gyak. Konduktometria A gyakorlat célja: Az oldat ionos alkotóinak összegző, nem specifikus mérése (a víz tisztasága), a konduktometria felhasználása titrálás végpontjelzésére. A módszer elve Elektrolitok
Általános kémia gyakorlat (TKBL0101)
 Általános kémia gyakorlat (TKBL0101) A tantárgyfelelős neve: Várnagy Katalin A tárgy oktatójának neve/tanszéke: Várnagy Katalin, Lente Gábor, Sebestyén Annamária (Szervetlen és Analitikai Kémiai Tanszék)
Általános kémia gyakorlat (TKBL0101) A tantárgyfelelős neve: Várnagy Katalin A tárgy oktatójának neve/tanszéke: Várnagy Katalin, Lente Gábor, Sebestyén Annamária (Szervetlen és Analitikai Kémiai Tanszék)
Javítókulcs (Kémia emelt szintű feladatsor)
 Javítókulcs (Kémia emelt szintű feladatsor) I. feladat 1. A katalizátorok a kémiai reakciót gyorsítják azáltal, hogy az aktiválási energiát csökkentik, a reakció végén változatlanul megmaradnak. 2. Biológiai
Javítókulcs (Kémia emelt szintű feladatsor) I. feladat 1. A katalizátorok a kémiai reakciót gyorsítják azáltal, hogy az aktiválási energiát csökkentik, a reakció végén változatlanul megmaradnak. 2. Biológiai
A tételhez használható segédeszközöket a vizsgaszervező biztosítja. Jogszabályi változás esetén a vizsgaszervező aktualizálja a mellékleteket.
 A vizsgafeladat ismertetése: Elmagyarázza, és konkrét példákon bemutatja a legfontosabb vegyipari laboratóriumi műveleteket, bemutatja azok végrehajtásának körülményeit, az eredmények kiértékelését Elmagyarázza,
A vizsgafeladat ismertetése: Elmagyarázza, és konkrét példákon bemutatja a legfontosabb vegyipari laboratóriumi műveleteket, bemutatja azok végrehajtásának körülményeit, az eredmények kiértékelését Elmagyarázza,
LÁNGATOMABSZORPCIÓS MÉRÉSEK
 AAS LÁNGATOMABSZORPCIÓS MÉRÉSEK A GYAKORLAT CÉLJA: A lángatomabszorpciós spektrometria (FAAS) módszerének tanulmányozása és alkalmazása fémek vizes közegű mintában való meghatározására. A MÉRÉSI MÓDSZER
AAS LÁNGATOMABSZORPCIÓS MÉRÉSEK A GYAKORLAT CÉLJA: A lángatomabszorpciós spektrometria (FAAS) módszerének tanulmányozása és alkalmazása fémek vizes közegű mintában való meghatározására. A MÉRÉSI MÓDSZER
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2001 (pótfeladatsor)
 2001 pótfeladatsor 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2001 (pótfeladatsor) Útmutató! Ha most érettségizik, az I. feladat kidolgozását karbonlapon végezze el! Figyelem! A kidolgozáskor
2001 pótfeladatsor 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2001 (pótfeladatsor) Útmutató! Ha most érettségizik, az I. feladat kidolgozását karbonlapon végezze el! Figyelem! A kidolgozáskor
Indikátor izobesztikus pontjának és koncentrációjának meghatározása
 Indikátor izobesztikus pontjának és koncentrációjának meghatározása Mérési elv: a sav-bázis indikátorok savas és lúgos formájának spektruma metszi egymást. Ez az izobesztikus pont. Ezen a hullámhosszon
Indikátor izobesztikus pontjának és koncentrációjának meghatározása Mérési elv: a sav-bázis indikátorok savas és lúgos formájának spektruma metszi egymást. Ez az izobesztikus pont. Ezen a hullámhosszon
Eljárási utasítás FINEAMIN
 Eljárási utasítás Gőzkazánok kifőzéséhez ill. kifúvatásához FINEAMIN vegyszerrel Tartalomjegyzék: 1. Falazat szárítása 2. A kazán kifőzése 3. A kifőzés előfeltételei 4. A kazán ellenőrzése és feltöltése
Eljárási utasítás Gőzkazánok kifőzéséhez ill. kifúvatásához FINEAMIN vegyszerrel Tartalomjegyzék: 1. Falazat szárítása 2. A kazán kifőzése 3. A kifőzés előfeltételei 4. A kazán ellenőrzése és feltöltése
MUNKAANYAG. Dzúró Zoltán. Tengelyszerű munkadarab készítése XY típusú. esztergagépen, a munkafolyamat, a méret-, alakpontosság
 Dzúró Zoltán Tengelyszerű munkadarab készítése XY típusú esztergagépen, a munkafolyamat, a méret-, alakpontosság és felületminőség ellenőrzése, dokumentálása A követelménymodul megnevezése: Általános gépészeti
Dzúró Zoltán Tengelyszerű munkadarab készítése XY típusú esztergagépen, a munkafolyamat, a méret-, alakpontosság és felületminőség ellenőrzése, dokumentálása A követelménymodul megnevezése: Általános gépészeti
HITELESÍTÉSI ELŐÍRÁS VÍZMÉRŐ HITELESÍTŐ BERENDEZÉS HE 111-2003
 1/oldal HITELESÍTÉSI ELŐÍRÁS VÍZMÉRŐ HITELESÍTŐ BERENDEZÉS HE 111-2003 FIGYELEM! Az előírás kinyomtatott formája tájékoztató jellegű. Érvényes változata Az OMH minőségirányítási rendszerének elektronikus
1/oldal HITELESÍTÉSI ELŐÍRÁS VÍZMÉRŐ HITELESÍTŐ BERENDEZÉS HE 111-2003 FIGYELEM! Az előírás kinyomtatott formája tájékoztató jellegű. Érvényes változata Az OMH minőségirányítási rendszerének elektronikus
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1998
 1998 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1998 I. Az alábbiakban megadott vázlatpontok alapján írjon 1-1,5 oldalas dolgozatot! A hibátlan dolgozattal 15 pont szerezhető. Címe: KARBONÁTOK,
1998 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1998 I. Az alábbiakban megadott vázlatpontok alapján írjon 1-1,5 oldalas dolgozatot! A hibátlan dolgozattal 15 pont szerezhető. Címe: KARBONÁTOK,
Talcum Ph.Hg.VIII. Ph.Eur.6.6-1 TALCUM. Talkum
 Talcum Ph.Hg.VIII. Ph.Eur.6.6-1 TALCUM Talkum 01/2009:0438 javított 6.6 [14807-96-6] DEFINÍCIÓ A talkum porított, válogatott, természetes eredetű, hidratált magnézium-szilikát. A tiszta talkum összegképlete
Talcum Ph.Hg.VIII. Ph.Eur.6.6-1 TALCUM Talkum 01/2009:0438 javított 6.6 [14807-96-6] DEFINÍCIÓ A talkum porított, válogatott, természetes eredetű, hidratált magnézium-szilikát. A tiszta talkum összegképlete
- 2 db Erlenmeyer-lombik - 2 db mérőhenger - 2 db tölcsér - labormérleg - szűrőpapír
 1. A talaj vízmegkötő képességének vizsgálata Kötelező védőeszközök Szükséges eszközök - 2 db Erlenmeyer-lombik - 2 db mérőhenger - 2 db tölcsér - labormérleg - szűrőpapír Szükséges anyagok - talajminták
1. A talaj vízmegkötő képességének vizsgálata Kötelező védőeszközök Szükséges eszközök - 2 db Erlenmeyer-lombik - 2 db mérőhenger - 2 db tölcsér - labormérleg - szűrőpapír Szükséges anyagok - talajminták
1. gy. SÓ OLDÁSHŐJÉNEK MEGHATÁROZÁSA. Kalorimetriás mérések
 1. gy. SÓ OLDÁSHŐJÉNEK MEGHATÁROZÁSA Kalorimetriás mérések A fizikai és kémiai folyamatokat energiaváltozások kísérik, melynek egyik megnyilvánulása a hőeffektus. A rendszerben ilyen esetekben észlelhető
1. gy. SÓ OLDÁSHŐJÉNEK MEGHATÁROZÁSA Kalorimetriás mérések A fizikai és kémiai folyamatokat energiaváltozások kísérik, melynek egyik megnyilvánulása a hőeffektus. A rendszerben ilyen esetekben észlelhető
TALCUM. Talkum 01/2011:0438 [14807-96-6] DEFINÍCIÓ
![TALCUM. Talkum 01/2011:0438 [14807-96-6] DEFINÍCIÓ TALCUM. Talkum 01/2011:0438 [14807-96-6] DEFINÍCIÓ](/thumbs/29/13790744.jpg) 01/2011:0438 TALCUM Talkum [14807-96-6] DEFINÍCIÓ A talkum porított, válogatott, természetes eredetű, hidratált magnézium-szilikát. A tiszta talkum összegképlete [Mg 3 Si 4 O 10 (OH) 2 ; M r 379,3]. Változó
01/2011:0438 TALCUM Talkum [14807-96-6] DEFINÍCIÓ A talkum porított, válogatott, természetes eredetű, hidratált magnézium-szilikát. A tiszta talkum összegképlete [Mg 3 Si 4 O 10 (OH) 2 ; M r 379,3]. Változó
Kémia 12. osztály. 1. Kísérletek hidrogéngázzal... 2. 2. Klór reakciója nátriummal... 4. 3. Ammónium-klorid termikus bomlása... 6
 Kémia 12. osztály 1 Kémia 12. osztály Tartalom 1. Kísérletek hidrogéngázzal..................................................... 2 2. Klór reakciója nátriummal.....................................................
Kémia 12. osztály 1 Kémia 12. osztály Tartalom 1. Kísérletek hidrogéngázzal..................................................... 2 2. Klór reakciója nátriummal.....................................................
T I T - M T T. Hevesy György Kémiaverseny. országos döntő. Az írásbeli forduló feladatlapja. 8. osztály. 2. feladat:... pont. 3. feladat:...
 T I T - M T T Hevesy György Kémiaverseny országos döntő Az írásbeli forduló feladatlapja 8. osztály A versenyző azonosítási száma:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:...
T I T - M T T Hevesy György Kémiaverseny országos döntő Az írásbeli forduló feladatlapja 8. osztály A versenyző azonosítási száma:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:...
Az Országos Képzési Jegyzékről és az Országos Képzési Jegyzék módosításának eljárásrendjéről szóló 133/2010. (IV. 22.) Korm.
 Az Országos Képzési Jegyzékről és az Országos Képzési Jegyzék módosításának eljárásrendjéről szóló 133/2010. (IV. 22.) Korm. rendelet alapján: Szakképesítés, szakképesítés-elágazás, rész-szakképesítés,
Az Országos Képzési Jegyzékről és az Országos Képzési Jegyzék módosításának eljárásrendjéről szóló 133/2010. (IV. 22.) Korm. rendelet alapján: Szakképesítés, szakképesítés-elágazás, rész-szakképesítés,
A kémiai egyensúlyi rendszerek
 A kémiai egyensúlyi rendszerek HenryLouis Le Chatelier (1850196) Karl Ferdinand Braun (18501918) A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 011 A kémiai egyensúly A kémiai egyensúlyok
A kémiai egyensúlyi rendszerek HenryLouis Le Chatelier (1850196) Karl Ferdinand Braun (18501918) A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 011 A kémiai egyensúly A kémiai egyensúlyok
ph mérés indikátorokkal
 ph mérés indikátorokkal Általános tudnivalók a ph értékéről és méréséről Egy savat vagy lúgot tartalmazó vizes oldat savasságának vagy lúgosságának erősségét a H + vagy a OH - ion koncentrációval lehet
ph mérés indikátorokkal Általános tudnivalók a ph értékéről és méréséről Egy savat vagy lúgot tartalmazó vizes oldat savasságának vagy lúgosságának erősségét a H + vagy a OH - ion koncentrációval lehet
A vér vizsgálata. 12. B. biológia fakultációsainak projektje 2015.03.30-31.
 A vér vizsgálata 12. B. biológia fakultációsainak projektje 2015.03.30-31. Vérkenet készítése Menete: Alkoholos vattával letörölt ujjbegyünket szúrjuk meg steril tűvel.töröljük le az első vércseppet, majd
A vér vizsgálata 12. B. biológia fakultációsainak projektje 2015.03.30-31. Vérkenet készítése Menete: Alkoholos vattával letörölt ujjbegyünket szúrjuk meg steril tűvel.töröljük le az első vércseppet, majd
Használati útmutató beépíthető sütőhöz
 Használati útmutató beépíthető sütőhöz használati útmutató Köszönjük, hogy termékünket választotta. Bízunk benne, hogy a megvásárolt háztartási készülék megfelel majd elvárásainak. Ennek érdekében kérjük
Használati útmutató beépíthető sütőhöz használati útmutató Köszönjük, hogy termékünket választotta. Bízunk benne, hogy a megvásárolt háztartási készülék megfelel majd elvárásainak. Ennek érdekében kérjük
O k t a t á si Hivatal
 O k t a t á si Hivatal A versenyző kódszáma: 2015/2016. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. kategória FELADATLAP Munkaidő: 300 perc Elérhető pontszám: 100 pont ÚTMUTATÓ
O k t a t á si Hivatal A versenyző kódszáma: 2015/2016. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. kategória FELADATLAP Munkaidő: 300 perc Elérhető pontszám: 100 pont ÚTMUTATÓ
A VÍZ OLDOTT SZENNYEZŐANYAG-TARTALMÁNAK ELTÁVOLÍTÁSA IONCSERÉVEL
 A VÍZ OLDOTT SZENNYEZŐANYAG-TARTALMÁNAK ELTÁVOLÍTÁSA IONCSERÉVEL ELTE Szerves Kémiai Tanszék A VÍZ OLDOTT SZENNYEZŐANYAG -TARTALMÁNAK ELTÁVOLÍTÁSA IONCSERÉVEL Bevezetés A természetes vizeket (felszíni
A VÍZ OLDOTT SZENNYEZŐANYAG-TARTALMÁNAK ELTÁVOLÍTÁSA IONCSERÉVEL ELTE Szerves Kémiai Tanszék A VÍZ OLDOTT SZENNYEZŐANYAG -TARTALMÁNAK ELTÁVOLÍTÁSA IONCSERÉVEL Bevezetés A természetes vizeket (felszíni
HInd Ind + H + A ph érzékelése indikátorokkal
 A ph érzékelése indikátorokkal A sav-bázis indikátorok olyan "festékek", melyek színüket a ph függvényében változtatják. Ennek alapja az, hogy egy HB indikátor maga is H+ kationra és B- anionra disszociál,
A ph érzékelése indikátorokkal A sav-bázis indikátorok olyan "festékek", melyek színüket a ph függvényében változtatják. Ennek alapja az, hogy egy HB indikátor maga is H+ kationra és B- anionra disszociál,
Dürer Kémiaverseny 2015 2016 K+ kategória, Helyi forduló
 Dürer Kémiaverseny 2015 2016 K+ kategória, Helyi forduló 1. feladat Régóta ismert tény, hogy a tiszta oldószerek és az oldatok fizikai tulajdonságai között eltérés lehet. Ennek egyik példája, hogy az oldatok
Dürer Kémiaverseny 2015 2016 K+ kategória, Helyi forduló 1. feladat Régóta ismert tény, hogy a tiszta oldószerek és az oldatok fizikai tulajdonságai között eltérés lehet. Ennek egyik példája, hogy az oldatok
4. gyakorlat. Mosószóda nátrium-karbonát-tartalmának meghatározása potenciometrikus titrálással
 4. gyakorlat Mosószóda nátrium-karbonát-tartalmának meghatározása potenciometrikus titrálással Név, osztály:... Mérés dátuma:... Feladat Ön egy mosószóda kiszerelő üzemben dolgozik. A beérkezett nátrium-karbonátot
4. gyakorlat Mosószóda nátrium-karbonát-tartalmának meghatározása potenciometrikus titrálással Név, osztály:... Mérés dátuma:... Feladat Ön egy mosószóda kiszerelő üzemben dolgozik. A beérkezett nátrium-karbonátot
SPEKTROFOTOMETRIAI MÉRÉSEK
 SPEKTROFOTOMETRIAI MÉRÉSEK Elméleti bevezetés Ha egy anyagot a kezünkbe veszünk (valamilyen technológiai céllal alkalmazni szeretnénk), elsı kérdésünk valószínőleg az lesz, hogy mi ez az anyag, milyen
SPEKTROFOTOMETRIAI MÉRÉSEK Elméleti bevezetés Ha egy anyagot a kezünkbe veszünk (valamilyen technológiai céllal alkalmazni szeretnénk), elsı kérdésünk valószínőleg az lesz, hogy mi ez az anyag, milyen
B. feladat elvégzendő és nem elvégzendő kísérletei, kísérletleírásai. 1. Cink reakciói
 B. feladat elvégzendő és nem elvégzendő kísérletei, kísérletleírásai 1. Cink reakciói Három kémcsőbe öntsön rendre 2cm 3-2cm 3 vizet, 2 mol/dm 3 koncentrációjú sósavat, rézszulfát-oldatot, és mindegyik
B. feladat elvégzendő és nem elvégzendő kísérletei, kísérletleírásai 1. Cink reakciói Három kémcsőbe öntsön rendre 2cm 3-2cm 3 vizet, 2 mol/dm 3 koncentrációjú sósavat, rézszulfát-oldatot, és mindegyik
Mérési jegyzőkönyv. Coulter számláló és áramlási citometria. 1. mérés: Semmelweis Egyetem, Elméleti Orvostudományi Központ Biofizika laboratórium
 Mérési jegyzőkönyv 1. mérés: Coulter számláló és áramlási citometria A mérés helyszíne: Semmelweis Egyetem, Elméleti Orvostudományi Központ Biofizika laboratórium A mérés időpontja: 2013.02.13. A mérést
Mérési jegyzőkönyv 1. mérés: Coulter számláló és áramlási citometria A mérés helyszíne: Semmelweis Egyetem, Elméleti Orvostudományi Központ Biofizika laboratórium A mérés időpontja: 2013.02.13. A mérést
Állományvédelem Lengyelországban. Beszámoló egy lengyelországi tanulmányútról
 Beszámoló egy lengyelországi tanulmányútról A tanulmányútra 2006. május 15. és 19. között került sor Kastaly Beatrix (az Országos Széchényi Könyvtár Restauráló osztályának vezetője), Orosz Katalin (főrestaurátor,
Beszámoló egy lengyelországi tanulmányútról A tanulmányútra 2006. május 15. és 19. között került sor Kastaly Beatrix (az Országos Széchényi Könyvtár Restauráló osztályának vezetője), Orosz Katalin (főrestaurátor,
Síkkromatográfia. Kapacitásaránynak (kapacitási tényezőnek): a mérendő komponens állófázisában (n S ) és mozgófázisában (n M ) lévő anyagmennyiségei.
 Síkkromatográfia A kromatográfia a többfokozatú, nagyhatékonyságú, dinamikus elválasztási módszerek gyűjtőneve: közös alapjuk az, hogy az elválasztandó komponensek egy állófázis és egy azon, meghatározott
Síkkromatográfia A kromatográfia a többfokozatú, nagyhatékonyságú, dinamikus elválasztási módszerek gyűjtőneve: közös alapjuk az, hogy az elválasztandó komponensek egy állófázis és egy azon, meghatározott
Új vizsgálóberendezés duzzadó agyagásvány-tartalom meghatározására a Colas Északkő Kft. Központi Laboratóriumában Tállyán
 Új vizsgálóberendezés duzzadó agyagásvány-tartalom meghatározására a Colas Északkő Kft. Központi Laboratóriumában Tállyán Ézsiás László 1, Tompa Richárd 2 1 okl. építőmérnök, minőségellenőrzési vezető,
Új vizsgálóberendezés duzzadó agyagásvány-tartalom meghatározására a Colas Északkő Kft. Központi Laboratóriumában Tállyán Ézsiás László 1, Tompa Richárd 2 1 okl. építőmérnök, minőségellenőrzési vezető,
Kémia 7. osztály. 1. Keverék és vegyület tulajdonságainak tanulmányozása... 2
 Kémia 7. osztály 1 Kémia 7. osztály Tartalom 1. Keverék és vegyület tulajdonságainak tanulmányozása............................. 2 2. Szétválasztási eljárások I. Ülepítés, szűrés, kristályosítás, szublimáció,
Kémia 7. osztály 1 Kémia 7. osztály Tartalom 1. Keverék és vegyület tulajdonságainak tanulmányozása............................. 2 2. Szétválasztási eljárások I. Ülepítés, szűrés, kristályosítás, szublimáció,
Trypsinum Ph.Hg.VIII. Ph.Eur.6.3-1 TRYPSINUM. Tripszin
 1 TRYPSINUM Tripszin 01/2009:0694 [9002-07-7] DEFINÍCIÓ A tripszin proteolitikus enzim, melyet az egészséges emlõsök hasnyálmirigyébõl kivont tripszinogén aktiválásával nyernek. Szárított anyagra vonatkoztatott
1 TRYPSINUM Tripszin 01/2009:0694 [9002-07-7] DEFINÍCIÓ A tripszin proteolitikus enzim, melyet az egészséges emlõsök hasnyálmirigyébõl kivont tripszinogén aktiválásával nyernek. Szárított anyagra vonatkoztatott
Model AX-7531. Használati útmutató A B C. FIGYELEM: Ez a használati útmutató három különféle modellt ismertet, a modellek jelölései A, B és C.
 Model AX-7531 FIGYELEM: Ez a használati útmutató három különféle modellt ismertet, a modellek jelölései A, B és C. A B C Szabályozható emisszióérték Hőmérséklet riasztás Használati útmutató Tartalomjegyzék
Model AX-7531 FIGYELEM: Ez a használati útmutató három különféle modellt ismertet, a modellek jelölései A, B és C. A B C Szabályozható emisszióérték Hőmérséklet riasztás Használati útmutató Tartalomjegyzék
Kémia OKTV 2005/2006. II. forduló. Az I. kategória feladatlapja
 Kémia OKTV 2005/2006 II. forduló Az I. kategória feladatlapja Kémia OKTV 2005/2006. II. forduló 2 T/15/A I. FELADATSOR Az I. feladatsorban húsz kérdés szerepel. Minden kérdés után 5 választ tüntettünk
Kémia OKTV 2005/2006 II. forduló Az I. kategória feladatlapja Kémia OKTV 2005/2006. II. forduló 2 T/15/A I. FELADATSOR Az I. feladatsorban húsz kérdés szerepel. Minden kérdés után 5 választ tüntettünk
Kémia emelt szintű érettségi írásbeli vizsga ELEMZÉS (BARANYA) ÉS AJÁNLÁS KÉSZÍTETTE: NAGY MÁRIA
 Kémia emelt szintű érettségi írásbeli vizsga ELEMZÉS (BARANYA) ÉS AJÁNLÁS KÉSZÍTETTE: NAGY MÁRIA Idei gyorsjelentés http://eduline.hu/erettsegi_felveteli/2 015/7/16/Az_elmult_7_ev_legrosszab b_eredmenye_szulet_azozlb
Kémia emelt szintű érettségi írásbeli vizsga ELEMZÉS (BARANYA) ÉS AJÁNLÁS KÉSZÍTETTE: NAGY MÁRIA Idei gyorsjelentés http://eduline.hu/erettsegi_felveteli/2 015/7/16/Az_elmult_7_ev_legrosszab b_eredmenye_szulet_azozlb
Adatok: Δ k H (kj/mol) metán 74,4. butadién 110,0. szén-dioxid 393,5. víz 285,8
 Relay feladatok 1. 24,5 dm 3 25 C-os, standardállapotú metán butadién gázelegyet oxigénfeleslegben elégettünk (a keletkező vízgőz lecsapódott). A folyamat során 1716 kj hő szabadult fel. Mennyi volt a
Relay feladatok 1. 24,5 dm 3 25 C-os, standardállapotú metán butadién gázelegyet oxigénfeleslegben elégettünk (a keletkező vízgőz lecsapódott). A folyamat során 1716 kj hő szabadult fel. Mennyi volt a
Az oldott oxigén mérés módszereinek, eszközeinek tanulmányozása
 Környezet minősítése gyakorlat 1 Az oldott oxigén mérés módszereinek, eszközeinek tanulmányozása Amint azt tudjuk az oldott oxigéntartalom (DO) nagy jelentőségű a felszíni vizek és néhány esetben a szennyvizek
Környezet minősítése gyakorlat 1 Az oldott oxigén mérés módszereinek, eszközeinek tanulmányozása Amint azt tudjuk az oldott oxigéntartalom (DO) nagy jelentőségű a felszíni vizek és néhány esetben a szennyvizek
Feladatok haladóknak
 Feladatok haladóknak Szerkesztő: Magyarfalvi Gábor és Varga Szilárd (gmagyarf@chem.elte.hu, szilard.varga@bolyai.elte.hu) A formai követelményeknek megfelelő dolgozatokat a következő címen várjuk 2009.
Feladatok haladóknak Szerkesztő: Magyarfalvi Gábor és Varga Szilárd (gmagyarf@chem.elte.hu, szilard.varga@bolyai.elte.hu) A formai követelményeknek megfelelő dolgozatokat a következő címen várjuk 2009.
KULTIVÁTOR. WingMaster. 2012-től Eredeti kézikönyv, 2012.01. hó
 ÜZEMELTETÉSI ÉS KARBANTARTÁSI KÉZIKÖNYV KULTIVÁTOR WingMaster 2012-től Eredeti kézikönyv, 2012.01. hó Tartalomjegyzék 1. ELŐSZÓ... 1 1.1. A gép rendeltetésszerű használata... 1 1.2. Műszaki adatok...
ÜZEMELTETÉSI ÉS KARBANTARTÁSI KÉZIKÖNYV KULTIVÁTOR WingMaster 2012-től Eredeti kézikönyv, 2012.01. hó Tartalomjegyzék 1. ELŐSZÓ... 1 1.1. A gép rendeltetésszerű használata... 1 1.2. Műszaki adatok...
Kosztolányi József Kovács István Pintér Klára Urbán János Vincze István. tankönyv. Mozaik Kiadó Szeged, 2013
 Kosztolányi József Kovács István Pintér Klára Urbán János Vincze István tankönyv 0 Mozaik Kiadó Szeged, 03 TARTALOMJEGYZÉK Gondolkodási módszerek. Mi következik ebbõl?... 0. A skatulyaelv... 3. Sorba rendezési
Kosztolányi József Kovács István Pintér Klára Urbán János Vincze István tankönyv 0 Mozaik Kiadó Szeged, 03 TARTALOMJEGYZÉK Gondolkodási módszerek. Mi következik ebbõl?... 0. A skatulyaelv... 3. Sorba rendezési
KÖZÉPSZINTŰ ÍRÁSBELI VIZSGA
 ÉRETTSÉGI VIZSGA 2016. május 13. KÉMIA KÖZÉPSZINTŰ ÍRÁSBELI VIZSGA 2016. május 13. 8:00 Az írásbeli vizsga időtartama: 120 perc Pótlapok száma Tisztázati Piszkozati EMBERI ERŐFORRÁSOK MINISZTÉRIUMA Kémia
ÉRETTSÉGI VIZSGA 2016. május 13. KÉMIA KÖZÉPSZINTŰ ÍRÁSBELI VIZSGA 2016. május 13. 8:00 Az írásbeli vizsga időtartama: 120 perc Pótlapok száma Tisztázati Piszkozati EMBERI ERŐFORRÁSOK MINISZTÉRIUMA Kémia
O k t a t á si Hivatal
 O k t a t á si Hivatal KÓDSZÁM: Kémia OKTV döntő I. kategória, 1. feladat Budapest, 2013. április 6. Réz(II)-ionok vizsgálata komplexometriával A komplexometria reagenseként használt EDTA (az etilén-diamin-tetraecetsav
O k t a t á si Hivatal KÓDSZÁM: Kémia OKTV döntő I. kategória, 1. feladat Budapest, 2013. április 6. Réz(II)-ionok vizsgálata komplexometriával A komplexometria reagenseként használt EDTA (az etilén-diamin-tetraecetsav
OKTATÁSI SEGÉDLET Környezeti analízis II. c.
 OKTATÁSI SEGÉDLET a Környezeti analízis II. c. tantárgyhoz kapcsolódó laboratóriumi gyakorlat feladataihoz Nappali és levelező tagozatos környezetmérnök (BSc) szakos hallgatók számára Készítette: Dr. Bodnár
OKTATÁSI SEGÉDLET a Környezeti analízis II. c. tantárgyhoz kapcsolódó laboratóriumi gyakorlat feladataihoz Nappali és levelező tagozatos környezetmérnök (BSc) szakos hallgatók számára Készítette: Dr. Bodnár
Elsôfokú egyenletek, egyenletrendszerek, egyenlôtlenségek
 Elsôfokú egyváltozós egyenletek 6 Elsôfokú egyenletek, egyenletrendszerek, egyenlôtlenségek. Elsôfokú egyváltozós egyenletek 000. Érdemes egyes tagokat, illetve tényezôket alkalmasan csoportosítani, valamint
Elsôfokú egyváltozós egyenletek 6 Elsôfokú egyenletek, egyenletrendszerek, egyenlôtlenségek. Elsôfokú egyváltozós egyenletek 000. Érdemes egyes tagokat, illetve tényezôket alkalmasan csoportosítani, valamint
NE FELEJTSÉTEK EL BEÍRNI AZ EREDMÉNYEKET A KIJELÖLT HELYEKRE! A feladatok megoldásához szükséges kerekített értékek a következők:
 A Szerb Köztársaság Oktatási Minisztériuma Szerbiai Kémikusok Egyesülete Köztársasági verseny kémiából Kragujevac, 2008. 05. 24.. Teszt a középiskolák I. osztálya számára Név és utónév Helység és iskola
A Szerb Köztársaság Oktatási Minisztériuma Szerbiai Kémikusok Egyesülete Köztársasági verseny kémiából Kragujevac, 2008. 05. 24.. Teszt a középiskolák I. osztálya számára Név és utónév Helység és iskola
Használati utasítás DOSATRON D25 RE2 gyógyszeradagolóhoz
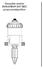 Használati utasítás DOSATRON D25 RE2 gyógyszeradagolóhoz 2 Műszaki adatok: DOSATRON D25 RE2 gyógyszeradagoló beállítható töménység: 0,2 2 % átfolyó vízmennyiség: 10 l/óra 2,5 m 3 /óra víznyomás: 0,3 6
Használati utasítás DOSATRON D25 RE2 gyógyszeradagolóhoz 2 Műszaki adatok: DOSATRON D25 RE2 gyógyszeradagoló beállítható töménység: 0,2 2 % átfolyó vízmennyiség: 10 l/óra 2,5 m 3 /óra víznyomás: 0,3 6
Az Országos Képzési Jegyzékről és az Országos Képzési Jegyzék módosításának eljárásrendjéről szóló 133/2010. (IV. 22.) Korm.
 Az Országos Képzési Jegyzékről és az Országos Képzési Jegyzék módosításának eljárásrendjéről szóló 133/2010. (IV. 22.) Korm. rendelet alapján: Szakképesítés, szakképesítés-elágazás, rész-szakképesítés,
Az Országos Képzési Jegyzékről és az Országos Képzési Jegyzék módosításának eljárásrendjéről szóló 133/2010. (IV. 22.) Korm. rendelet alapján: Szakképesítés, szakképesítés-elágazás, rész-szakképesítés,
Középszintű érettségi témakörök
 Általános kémia Középszintű érettségi témakörök 1. Atomszerkezet 2. A periódusos rendszer 3. Kémiai kötések 4. Molekulák, összetett ionok 5. Anyagi halmazok 6. Egykomponensű anyagi rendszerek 7. Többkomponensű
Általános kémia Középszintű érettségi témakörök 1. Atomszerkezet 2. A periódusos rendszer 3. Kémiai kötések 4. Molekulák, összetett ionok 5. Anyagi halmazok 6. Egykomponensű anyagi rendszerek 7. Többkomponensű
ÜZEMMÓD A KIJELZŐ MEGVILÁGÍTÁSÁNAK MŰKÖDTETÉSE. Outbreaker Plus Megrend. szám: 84 00 90
 Conrad Vevőszolgálat, 1124 Budapest, Jagelló út 30. Tel: 319 0250 Outbreaker Plus Megrend. szám: 84 00 90 1. fejezet: Bevezetés A jelen Outbreaker sorozathoz három típus tartozik: OUTBREAKER SMART OUTBREAKER
Conrad Vevőszolgálat, 1124 Budapest, Jagelló út 30. Tel: 319 0250 Outbreaker Plus Megrend. szám: 84 00 90 1. fejezet: Bevezetés A jelen Outbreaker sorozathoz három típus tartozik: OUTBREAKER SMART OUTBREAKER
AQUA AD INIECTABILIA. Injekcióhoz való víz. Letöltetlen, injekcióhoz való víz
 Aqua ad iniectabilia Ph.Hg.VIII. Ph.Eur.6.3-1 AQUA AD INIECTABILIA Injekcióhoz való víz 01/2009:0169 H 2 O M r 18,02 DEFINÍCIÓ Az injekcióhoz való vizet parenterális felhasználásra szánt gyógyszerek előállításához
Aqua ad iniectabilia Ph.Hg.VIII. Ph.Eur.6.3-1 AQUA AD INIECTABILIA Injekcióhoz való víz 01/2009:0169 H 2 O M r 18,02 DEFINÍCIÓ Az injekcióhoz való vizet parenterális felhasználásra szánt gyógyszerek előállításához
MÓDSZERTANI KÖZLEMÉNYEK II. KÖTET 1973. 77. IV. rész VIZELEMZES
 MÓDSZERTANI KÖZLEMÉNYEK II. KÖTET 973. 77 IV. rész VIZELEMZES A vizminták elemzése a Földtani Intézet vízkémiai laboratóriumában általában az ivóvizvizsgálati szabvány /MSz. 448./ szerint történik. Egyes
MÓDSZERTANI KÖZLEMÉNYEK II. KÖTET 973. 77 IV. rész VIZELEMZES A vizminták elemzése a Földtani Intézet vízkémiai laboratóriumában általában az ivóvizvizsgálati szabvány /MSz. 448./ szerint történik. Egyes
ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra :
 ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra : H 2 O H + + OH -, (2 H 2 O H 3 O + + 2 OH - ). Semleges oldatban a hidrogén-ion
ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra : H 2 O H + + OH -, (2 H 2 O H 3 O + + 2 OH - ). Semleges oldatban a hidrogén-ion
Mosogatógépek Használati utasítás
 Mosogatógépek Használati utasítás GS61110BW 1 Olvassa el a használati utasítást! Ez a kézikönyv biztonsági, működési, beszerelési utasításokat, valamint hibaelhárítási ötleteket, stb. tartalmaz. A mosogatógép
Mosogatógépek Használati utasítás GS61110BW 1 Olvassa el a használati utasítást! Ez a kézikönyv biztonsági, működési, beszerelési utasításokat, valamint hibaelhárítási ötleteket, stb. tartalmaz. A mosogatógép
Azonosító jel: KÉMIA EMELT SZINTŰ ÍRÁSBELI VIZSGA. 2006. október 31. 14:00. Az írásbeli vizsga időtartama: 240 perc
 É RETTSÉGI VIZSGA 2006. október 31. KÉMIA EMELT SZINTŰ ÍRÁSBELI VIZSGA 2006. október 31. 14:00 Az írásbeli vizsga időtartama: 240 perc Pótlapok száma Tisztázati Piszkozati OKTATÁSI ÉS KULTURÁLIS MINISZTÉRIUM
É RETTSÉGI VIZSGA 2006. október 31. KÉMIA EMELT SZINTŰ ÍRÁSBELI VIZSGA 2006. október 31. 14:00 Az írásbeli vizsga időtartama: 240 perc Pótlapok száma Tisztázati Piszkozati OKTATÁSI ÉS KULTURÁLIS MINISZTÉRIUM
1. feladat Összesen: 10 pont. 2. feladat Összesen: 6 pont. 3. feladat Összesen: 18 pont
 1. feladat Összesen: 10 pont Etil-acetátot állítunk elő 1 mol ecetsav és 1 mol etil-alkohol felhasználásával. Az egyensúlyi helyzet beálltakor a reakciót leállítjuk, és az elegyet 1 dm 3 -re töltjük fel.
1. feladat Összesen: 10 pont Etil-acetátot állítunk elő 1 mol ecetsav és 1 mol etil-alkohol felhasználásával. Az egyensúlyi helyzet beálltakor a reakciót leállítjuk, és az elegyet 1 dm 3 -re töltjük fel.
Tanulói munkafüzet. FIZIKA 9. évfolyam 2015. egyetemi docens
 Tanulói munkafüzet FIZIKA 9. évfolyam 2015. Összeállította: Scitovszky Szilvia Lektorálta: Dr. Kornis János egyetemi docens Tartalomjegyzék 1. Az egyenletes mozgás vizsgálata... 3 2. Az egyenes vonalú
Tanulói munkafüzet FIZIKA 9. évfolyam 2015. Összeállította: Scitovszky Szilvia Lektorálta: Dr. Kornis János egyetemi docens Tartalomjegyzék 1. Az egyenletes mozgás vizsgálata... 3 2. Az egyenes vonalú
