A DOPAMIN D4-ES RECEPTOR GÉN PROMOTER RÉGIÓJÁNAK FUNKCIONÁLIS VIZSGÁLATA
|
|
|
- Zita Csonkané
- 7 évvel ezelőtt
- Látták:
Átírás
1 A DOPAMIN D4-ES RECEPTOR GÉN PROMOTER RÉGIÓJÁNAK FUNKCIONÁLIS VIZSGÁLATA Doktori értekezés Kereszturi Éva Semmelweis Egyetem Molekuláris Orvostudományok Doktori Iskola Pathobiokémia Doktori Program Témavezető: Dr. Sasvári Mária Hivatalos bírálók: Dr. Szalai Csaba Dr. Váradi András Szigorlati bizottság elnöke: Dr. Enyedi Péter Szigorlati bizottság tagjai: Dr. Müllner Nándor Dr. Hegyi György Budapest 2007
2 Tartalomjegyzék TARTALOMJEGYZÉK Tartalomjegyzék... 1 Táblázatjegyzék... 3 Ábrajegyzék... 4 Rövidítésjegyzék Bevezetés Irodalmi áttekintés Genetikai polimorfizmusok A dopamin-rendszer A dopamin D4-es receptor (DRD4) Génszerkezet Fehérjeszerkezet Előfordulása a szervezetben Funkció A dopamin D4-es receptor gén polimorfizmusai Az 5 szabályozó régió polimorfizmusai A kódoló régió polimorfizmusai Asszociáció-vizsgálat A figyelemhiányos hiperaktivitási zavar (ADHD) Az ADHD klinikai jellemzői Asszociáció-vizsgálatok ADHD-ban Promoter polimorfizmusok funkcionális vizsgálata Riporter gén rendszerek Dopaminerg polimorfizmusok funkcionális vizsgálata Célkitűzések Módszerek A vizsgálatban résztvevő személyek Mintavétel és DNS-izolálás Genotípus- és haplotípus-meghatározás Hosszúság-polimorfizmus genotípus-meghatározása Egypontos nukleotid polimorfizmusok (SNP) genotípus-meghatározása Kétirányú allél-specifikus amplifikáció (ASA) Restrikciós fragmentum hosszúság-polimorfizmus (PCR-RFLP) Haplotípus-meghatározás Haplotípus-meghatározás ASÁ-val Haplotípus-meghatározás PCR-RFLP-vel Az amplifikáció körülményei A PCR elegy összetétele A PCR termociklus A PCR termékek restrikciós emésztésének körülményei A PCR termékek elektroforetikus elválasztása RNS izolálás, RT-PCR, qpcr Tranziens transzfekció Luciferáz riporter rendszer Transzfekciós kontroll Plazmid konstruktumok deléciós sorozat
3 Tartalomjegyzék Irányított mutagenezis Sejtvonalak Tranziens transzfekció Transzfekciós módszerek Luciferáz és β-galaktozidáz enzimaktivitás mérése Statisztikai módszerek Eredmények A 120 bp duplikáció új alléljának azonosítása a DRD4 gén promoterében A DRD4 gén promoter polimorfizmusainak asszociáció-vizsgálata ADHD-ban Eset-kontroll vizsgálat Eset-kontroll vizsgálat a DRD4 gén promoter polimorfizmusaira Eset-kontroll vizsgálat a DRD4 gén promoter haplotípusaira Család-analízis (Transmission Disequilibrium Test, TDT) ADHD-ban Család-analízis a DRD4 gén promoter polimorfizmusaira Család-analízis a DRD4 gén promoter haplotípusaira A DRD4 gén 5 szabályozó régiójának karakterizálása A DRD4 gén expressziója idegi eredetű és HeLa sejtvonalakban A DRD4 gén expressziójának vizsgálata RT-PCR-rel A DRD4 gén expressziójának vizsgálata qpcr módszerrel A DRD4 promoter 5 deléciós sorozata A DRD4 promoter deléciós analízise tranziens transzfekcióval négy sejtvonalban A DRD4 gén promoterében található polimorfizmusok funkcionális vizsgálata A promoterben található SNP-k hatása a DRD4 gén expressziójára A 120 bp duplikáció hatása a DRD4 gén expressziójára A különböző promoter haplotípusok hatása a DRD4 gén expressziójára Eredmények megbeszélése A DRD4 promoter polimorfizmusainak asszociáció-vizsgálata ADHD-ban A promoter polimorfizmusok asszociáció-vizsgálata ADHD-ban A promoter haplotípusok asszociáció-vizsgálata ADHD-ban A DRD4 endogén expressziójának vizsgálata öt sejtvonalban A DRD4 gén promoterének karakterizálása A DRD4 promoter polimorfizmusok hatása a génexpresszióra SNP-k hatása Hosszúság-polimorfizmus hatása Promoter haplotípusok hatása a DRD4 gén expressziójára Kitekintés Összefoglalás Summary Köszönetnyilvánítás Saját közlemények Irodalomjegyzék
4 Táblázatjegyzék TÁBLÁZATJEGYZÉK 1. táblázat: A dopamin receptorok főbb típusai és azok jellemzői táblázat: A polimorfizmus-meghatározáshoz használt primerek fontosabb jellemzői táblázat: A haplotípus-meghatározáshoz használt primerek fontosabb jellemzői táblázat: A 616 C/G és 615 A/G SNP-k haplotipizálása során használt restrikciós enzimek táblázat: Az 5 deléciós sorozat készítéséhez használt primerek fontosabb jellemzői táblázat: A transzfekciók során használt DRD4 promoter konstruktumok jellemzői táblázat: A mutagenezis során használt primerek jellemzői táblázat: Az általunk használt sejtvonalak jellemzői és a fenntartásukhoz használt médiumok összetétele táblázat: A promoter polimorfizmusok allél-gyakoriságai egészséges és ADHD-s populációban táblázat: A promoter polimorfizmusok genotípus-gyakoriságai egészséges és ADHD-s populációban táblázat: A 120 bp duplikáció összevont genotípus-gyakoriságai egészséges és ADHD-s populációban táblázat: Haplotípus-frekvenciák a DRD4 promoter négy polimorfizmusára egészséges és ADHD-s populációban táblázat: Az EH becslő programmal számolt haplotípus-frekvenciák a DRD4 promoter négy polimorfizmusára egészséges és ADHD-s populációban táblázat: A négyes haplotípusra számolt preferenciális allél-átadás táblázat: A pdrd4 konstruktumok relatív luciferáz aktivitása táblázat: Az endogén DRD4 expresszió relatív mértéke öt sejtvonalban
5 Ábrajegyzék ÁBRAJEGYZÉK 1. ábra: A dopamin D4-es receptor szerkezete és a ligandum kötésében szerepet játszó aminosavak ábra: A dopamin D4-es receptor gén főbb polimorfizmusai ábra: A 120 bp duplikáció 4-es allélja egy ADHD-s családi trióban ábra: A 120 bp dup és a 521 C/T SNP relatív haplotípus-gyakoriságai az ADHD-s populációban 616 C és 615 A háttér mellett ábra: A DRD4 mrns expressziójának vizsgálata öt sejtvonalban ábra: Öt sejtvonal által expresszált DRD4 mrns mennyiségének vizsgálata ábra: A DRD4 gén promoterének 5 deléciós variánsai ábra: Az 5 deléciók hatása a DRD4 gén promoter aktivitására négy sejtvonalban ábra: A 521 C/T SNP hatása a DRD4 gén promoter aktivitására ábra: A 120 bp duplikáció hatása a DRD4 gén expressziójára ábra: A 120 bp duplikáció és a 521 C/T SNP haplotípusainak funkcionális analízise ábra: A 616 C/G és 615 A/G SNP-k haplotípusainak funkcionális analízise ábra: A DRD4 promoter karakterizálása során használt fragmentumok ábra: A kis aktivitású DRD4 promoter konstruktumok elemzése ábra: A 521 C/T SNP gén expresszióra gyakorolt hatásának vizsgálata két különböző rendszerben ábra: A 120 bp duplikáció funkcionális vizsgálata során alkalmazott vektorok szerkezete
6 Rövidítésjegyzék RÖVIDÍTÉSJEGYZÉK (G) n a guanin 6-10 ismétlődésével kialakuló polimorfizmus 12 bp dup a DRD4 gén I. exonjában elhelyezkedő 12 bp ismétlődése 120 bp dup a DRD4 gén promoterében elhelyezkedő 120 bp ismétlődése 13 bp del a DRD4 gén I. exonjának 13 bp deléciót hordozó variánsa 21 bp del a DRD4 gén I. exonjának 21 bp deléciót hordozó variánsa 27 bp del a DRD4 gén promotrének 27 bp deléciót hordozó variánsa 48 bp VNTR a DRD4 gén III. exonjában elhelyezkedő 48 bp hosszú szekvencia, amely 2-10-szer ismétlődhet 521 C/T SNP A DRD4 gén promoter régiójában a 521. pozícióban kétféle nukleotid fordulhat elő (C vagy T). 615 A/G SNP A DRD4 gén promoter régiójában a 615. pozícióban kétféle nukleotid fordulhat elő (A vagy G). 616 C/G SNP A DRD4 gén promoter régiójában a 616. pozícióban kétféle nukleotid fordulhat elő (C vagy G). A adenine ADHD Attention Deficit Hyperactivity Disorder, figyelemhiányos hiperaktivitási zavar Ala alanin Arg arginin AS antiszensz ASA allél-specifikus amplifikációs Asn aszparagin Asp aszparaginsav ATP adenozin-trifoszfát bp bázispár BSA marhaszérum-albumin (Bovine Serum Albumin) C citozin camp ciklikus adenozin-monofoszfát CCF-STTG1 asztrocitóma sejtvonal ChIP Chromatin ImmunoPrecipitation, kromatin-immunprecipitáció Cys cisztein DAT dopamin transzporter datp dezoxi-adezin-trifoszfát dctp dezoxi-citidin-trifoszfát df degree of freedom, szabadsági fok dgtp dezoxi-guanozin-trifoszfát ditp dezoxi-inozin-trifoszfát DNS dezoxiribonukleinsav dntp a négy különböző dezoxi-ribonukleozid-trifoszfát 1:1:1:1 arányú keveréke DRD4 dopamin D4-es receptor DRD4 / DRD4 génkiütött homozigóta DSM-IV Diagnostic and Statistical Manual of Mental Disorders 5
7 Rövidítésjegyzék DTT ditiotreitol dttp dezoxi-timidin-trifoszfát dutp dezoxi-uridin-trifoszfát E. coli Escherichia coli, bacterium EDTA etilén-diamin-tetraecetsav EH Estimated Haplotype, haplotípus-frekvencia becslő program FBS Foetal Bovine Serum, fötális marhaszérum G guanine GABA γ-aminovajsav Gly glicin GTP guanozin-trifoszfát HAPFR haplotípus-frekvencia számolására alkalmas program HeLa epithel karcinóma sejtvonal HEPES hidroxietil-piperazinetanolszulfonsav HUGO Human Genom Project IGF2 Insulin-like Growth Factor II, inzulinszerű növekedési faktor II IMR32 neuroblasztóma sejtvonal kb kilobázis Leu leucin LINEs Long Interspersed Nuclear Elements M A vagy C nukleotid MAO-A monoamino-oxidáz A MAO-B monoamino-oxidáz B mrns messenger RNS, hírvivő RNS N A, G, C vagy T nukleotid N.E.A.A. Non-essential aminoacid, nem esszenciális aminosavak OMPG o-nitrofenil-β-d-galaktopiranozid, β-galaktozidáz mesterséges szubsztrátja pcmv Citomegalo-vírus promoterét tartalmazó vector PCR Polimerase Chain Reaction, polimeráz láncreakció pdrd4-a F a DRD4 promoterének különböző hosszúságú szakaszait tartalmazó riporter vektorok pgl3-b pgl3-basic, promoter nélküli riporter vector ptk a timidin kináz promoterét tartalmazó riporter vektor qpcr kvantitatív vagy real-time PCR R A vagy G nukleotid RFLP Restriction Fragment Length Polymorpism (restrikciós fragmentum hosszúság polimorfizmus) RNS ribonukleinsav RT-PCR Reverse Transcriptase-Polymerase Chain Reaction S szensz SDS Sodium Dodecyl Sulfate (Na-lauril-szulfát) Ser szerin SINEs Short Interspersed Nuclear Elements SK-N-FI neuroblasztóma sejtvonal 6
8 Rövidítésjegyzék SNP Single Nucleotide Polymorphism, egypontos nukleotid variáció STR Short Tandem Repeat T timin TAE Tris-acetát-EDTA pufferoldat (10mM Tris, 2mM EDTA, ph = 8,0) TDT Transmission Disequilibrium Test (preferenciális allél-/haplotípus-átadás vizsgálat) TF transzkripciós faktor Val valin VNTR Variable Number of Tandem Repeats, hosszúság-polimorfizmus W A vagy T nukleotid Y C vagy T nukleotid Y79 retinoblasztóma sejtvonal β-gal β-galaktozidáz χ 2 -próba statisztikai próba 7
9 Bevezetés 1 BEVEZETÉS Az utóbbi évtizedben a pszichiátria és a pszichológia területén is egyre nagyobb hangsúlyt kapott a genetikai hatások vizsgálata. A figyelemhiányos hiperaktivitási zavar (ADHD: Attention Deficit Hyperactivity Disorder) kapcsán végzett ikervizsgálatok eredményei azt mutatták, hogy a rendellenesség becsült örökölhetősége igen nagy, 0,7 0,8 közötti. A kórkép tehát genetikailag meghatározott, de komplex öröklődésű, poligénes jelleg, így feltehetőleg számos gén kis hatású változatának együttes előfordulása szerepel a zavar kialakulásának hátterében. A korszerű pszichogenetikai vizsgálatok ezen poligénes jellegek genetikai hátterének felderítésére leggyakrabban a kandidáns gének asszociáció-analízisét végzik. A kandidáns gének általában a neurotranszmitterek képződésében, lebontásában, illetve a receptorhatásban résztvevő fehérjék génjei közül kerülnek ki. A dopamin rendszer az ösztönös magatartások, érzelmek, motiváció kialakításában, valamint a kognitív funkciókban betöltött szerepe miatt sokszor áll a pszichológiai vonatkozású kutatások középpontjában. Az asszociáció-vizsgálat során azt elemzik, hogy a vizsgált populációban a kiválasztott gén bizonyos változatai összefüggésbe hozhatók-e az adott fenotípusos sajátossággal. A pszichogenetika egyik első jelentős eredménye az újdonságkereső személyiségjegy és a dopamin D4-es receptor gén kódoló régiójában található, úgynevezett hosszú génváltozat asszociációja volt. A figyelemhiányos hiperaktivitási zavar kórképében az újdonságkeresés egyes jellemvonásai, mint például az impulzivitás is fellelhetők. Így nem meglepő, hogy a dopamin D4-es receptor hosszú változata azóta is az egyik legszélesebb körben vizsgált genetikai marker, amelyet többek között az ADHD egyik rizikófaktoraként valószínűsítenek. A humán genom polimorfizmusainak feltérképezése azonban jóval nagyobb ütemben zajlik, mint azok funkcionális vizsgálata, így a polimorfizmusok nagy részéről még nem tudjuk pontosan, hogy hatással vannak-e egy adott fehérje expressziójára vagy működésére. A funkcionális polimorfizmusokat alapvetően két fő típusra bonthatjuk: a gén exonjaiban található változatok a géntermék szerkezetét, a nem-kódoló szakaszok polimorfizmusai pedig a gén kifejeződésének mértékét határozhatják meg. Receptorok esetében a kódoló régió polimorfizmusai érinthetik a ligandkötés erősségét és/vagy a jeltovábbítás mértékét. 8
10 Bevezetés A utóbbi évek kutatásai egyre nagyobb figyelmet szentelnek a kandidáns gének nemkódoló régióiban található polimorfizmusainak vizsgálatára. Ez elsősorban az 5 és 3 szabályozó szekvenciákat jelenti, melyek végső soron a gén által kódolt fehérje mennyiségére hatnak az adott sejtben vagy szövetben. A promoter régió polimorfizmusainak vizsgálata során ezért fontos annak bizonyítása, hogy az egyes szekvencia-variánsok hatással vannak-e a transzkripció folyamatára és így a képződő receptor fehérje mennyiségén keresztül a jeltovábbítás hatékonyságára és erősségére. Ennek megfelelően a dopamin D4-es receptor 5 szabályozó régiójában található polimorfizmusokra is egyre nagyobb figyelem irányul, bár a transzkripció szabályozásában esetlegesen betöltött szerepükről még viszonylag kevés irodalmi adat áll rendelkezésünkre. A polimorf változatok hatása a fehérje mennyiségére vagy minőségére azonban a legtöbb esetben meglehetősen kicsi, sok esetben a rendelkezésre álló in vitro rendszerekkel nem, vagy csak alig detektálható. Ezen kívül, mivel a kandidáns gén többféle polimorfizmust hordozhat, elképzelhető, hogy ezek egymás génexpresszióra gyakorolt hatását erősítik, de ki is olthatják azt. Így mind az asszociáció-analízis, mind pedig a funkcionális vizsgálat során hasznosnak bizonyulhat, ha nem csupán egyetlen allél változatát vizsgáljuk, hanem a génben található polimorfizmusok együttesét, azaz a haplotípusát is meghatározzuk. 9
11 Irodalmi áttekintés 2 IRODALMI ÁTTEKINTÉS 2.1 Genetikai polimorfizmusok A humán genom igen nagyfokú variabilitása tette lehetővé az állandóan változó környezeti feltételekhez való alkalmazkodást az evolúció során. Ez a változatosság a genetikai állomány folyamatos módosulásával, mutációkkal jött létre és jön létre ma is. Ha egy mutáció hátrányos tulajdonságokat okoz, akkor kiszelektálódik, azonban ha nem nyilvánul meg negatív hatásokban (semleges, esetleg előnyös tulajdonságot hoz létre), akkor idővel felszaporodhat a populációban. A természetes szelekción kívül allélváltozat feldúsulhat úgy is, ha egy hozzá közeli lókuszon semleges vagy pozitív hatású tulajdonság génjéhez kapcsolt. 1 A Human Genom Project (HUGO) eredményeinek ismeretében ma már tudjuk, hogy bármely, egymással nem rokon személy DNS-szekvenciája kb. 0,1%-ban különbözik. 2 A HUGO kezdeti szakaszában ezeket a változatokat mutációknak tartották, amelyek különböző megbetegedések hátterében állhatnak. Mára a különböző genom-programok befejeztével nyilvánvalóvá vált, hogy ezen hatalmas mennyiségű 1000 bázispáronként előforduló mutáció nagy része önmagában nem okoz betegséget, hanem összetett mechanizmussal befolyásolja a fenotípust. Mindezek ismeretében nem helyénvaló minden allélvariációt mutációnak nevezni. Polimorfizmusnak hívjuk azokat az allélváltozatokat, amelyek gyakorisága nem túl alacsony, legalább 1 2% az adott populációban. A szakirodalomban létezik ennél szigorúbb kritérium is, amely szerint a genetikai polimorfizmus gyakoribb alléljának frekvenciája legfeljebb 95% a vizsgált populációban. 3 A polimorfizmusok szerkezetileg két nagy csoportba oszthatók: a báziscserék és a hosszúság-polimorfizmusok csoportjára. Az egy bázist érintő változatokat egypontos nukleotid variációnak (Single Nucleotide Polymorphism, SNP) szokás nevezni. Jelenlegi tudásunk szerint az egyedek közötti DNS-szekvenciabeli különbség nagy részét az SNP-k adják februárjáig 1,42 millió SNP-t térképeztek fel a humán genomban, amelyek az NCBI (National Center of Biotechnology Information) adatbázisában megtalálhatók. 4,5 Így kb bázispáronkét található egy-egy SNP, amelyek közül mintegy helyezkedik el exonokban. Az így létrejött szekvencia-módosulások kialakulhattak inszercióval, delécióval, szubsztitúcióval. Ezek a variációk lehetnek felelősek a populáció diverzitásáért, a különböző betegségekre való 10
12 Irodalmi áttekintés eltérő hajlamért. Kandidáns SNP-ket számos népbetegség (cukorbetegség, magas vérnyomás, szkizofrénia, szívbetegségek) esetében vizsgáltak. 6,7,8 A polimorfizmusok másik nagy csoportját a hosszúság-polimorfizmusok alkotják. Mai tudásunk szerint a humán genom információtartalmának kevesebb, mint 5%-a fejeződik ki fehérjékben. A fennmaradó 95% egy része szintén informatív, de nem fehérjét kódoló szekvencia, ilyenek az RNS-ek génjei, a génexpressziót szabályozó enhancer és silencer régiók, valamint a promoterek. Azonban még így is a genom mintegy 45%-át nagyrészt ismeretlen funkciójú ismétlődő szekvenciák alkotják. A humán genetikai állomány repetitív szekvenciái két csoportba sorolhatók: bizonyos ismétlődő szakaszok a genomban elszórtan, mások a kromoszómák adott régióiban lokalizáltan fordulnak elő. Az elszórtan elhelyezkedő repetitív szakaszok nagy része retrovírus retropozon eredetű. Ezek lehetnek rövid ismétlődő régiók (Short Interspersed Nuclear Elements, SINEs), amelyek hossza bp, 1 2 millió példány található belőlük, és a genom 10 15%-át teszik ki. A legismertebb ilyen szekvencia az Alu I restrikciós endonukleáz hasítási helyét is tartalmazó, 300 bp hosszúságú repetitív elem. Az Alu szekvencia a humán genomban akár példányban is jelen lehet, megtalálható az intronokban, a határoló szekvenciákban, valamint egyes gének 5 szabályozó régiójában. A hosszabb ismétlődésű régiók (Long Interspersed Nuclear Elements, LINEs) mérete 6 8 kb, kb példányban találhatók meg a humán genomban, melynek mintegy 20 25%-át alkotják. A hosszúság-polimorfizmusok másik nagy csoportját, a genom adott területén felsokszorozódó tandem ismétlődéseket gyakran szatellita DNS-nek is nevezik. Ezek nagyrészt a kromoszóma centromer vagy telomer régiójában, valamint az akrocentrikus kromoszómák rövidebb karján helyezkednek el. A tandem ismétlődések szintén több csoportba sorolhatók az ismétlődő szekvencia hossza és száma alapján. A hosszabb szekvencia ismétlődését nevezzük ismétlési-szám polimorfizmusnak (Variable Number of Tandem Repeats, VNTR). A VNTR esetében bp hosszúságú szakasz ismétlődik szor, méretük alapján miniszatellitáknak is nevezik ezeket. Általában nem-kódoló régiókban találhatók (ez alól az általunk vizsgált egyik VNTR kivételt képez, hiszen exonban helyezkedik el), ennek ellenére nagy jelentőséget tulajdonítanak nekik a transzkripció szabályozásában, valamint egyes elképzelések szerint a transzlációra és az mrns-ek stabilitására is hatással vannak. 9 A rövidebb szakaszok (1 6 bp) ismétlődésével kialakuló 11
13 Irodalmi áttekintés mikroszatelliták az STR-ek (Short Tandem Repeat). Nagyrészük szintén nem-kódoló DNS-szakaszokon található, ezek főleg semleges variánsok, szelekciós előnyük általában nincs (bár néhány kivétel ismert). Néhány esetben azonban kódoló régióban is előfordulnak, főleg idegrendszeri betegségek vezethetők vissza trinukleotid ismétlődésekre (Huntington-kór, fragilis X-szindróma). A VNTR-ek és az STR-ek esetében is az adott lókuszon nagy variabilitás jellemző. Mivel ezek mendeli öröklődést mutatnak, így különböző betegségek genetikai komponenseinek vizsgálata során markerként alkalmazhatók, valamint családfa-analízisben és kriminalisztikában is felhasználhatók. 10 Ugyanakkor ezen polimorf szekvenciák bizonyos alléljai komplex öröklődésmenetű betegségek hátterében is meghúzódhatnak. 2.2 A dopamin-rendszer A dopamin a katekolaminok közé tartozó ingerületátvivő anyag, amelynek részvétele számos folyamatban bizonyított. Az agy dopamin rendszere három anatómiailag körülhatárolható pályarendszerből áll. Ezek közül pszichológiai-pszichiátriai vonatkozásban a középagy ventrális tegmentumából induló mesolimbikus és mesokortikális pályák a legfontosabbak. A mesolimbikus pálya a limbikus rendszer (nucleus accumbens, amygdala, hippocampus) felé irányul, az érzelmek, ösztönös magatartások, motiváció kialakításában vesz részt. A mesokortikális pálya a prefrontális kéreghez vezet, a kognitív folyamatokban játszik szerepet. A harmadik pályarendszer a substantia nigrából, a putamen és a nucleus caudatus felé vezető nigrostriatális pálya, amely a mozgáskordinációért felelős, és a dopaminerg rostok 70 75%-át tartalmazza. Az öttagú (D1, D2, D3, D4, D5) dopamin receptor-család általunk vizsgált, dopamin D4-es típusa ezen redszerek közül leginkább a mesokortikális pálya végterületein fordul elő. A D2-es alcsalád dopamin receptorai általában lassú, inhibitoros hatást közvetítenek (1. táblázat). 2.3 A dopamin D4-es receptor (DRD4) A dopamin receptorok a G-fehérjéhez kapcsolt receptorok családjába tartoznak, amelynek tagjai az ősi opszin génből fejlődtek ki. A receptor-család tagjai a fehérjestruktúra tekintetében nagyfokú hasonlóságot mutatnak, hét transzmembrán domént tartalmaznak, valamint a GTP-kötő fehérjéhez kapcsolt jelátviteli mechanizmusokban vesznek részt. A receptor-család hatalmas diverzitásának 12
14 Irodalmi áttekintés kialakulásában nagyrészt a génduplikáció folyamata játszott szerepet. A család legismertebb tagjai közé olyan fehérjék tartoznak, mint a rodopszin ill. az α- és β- adrenerg receptorok. Család D1-szerű család D2-szerű család Típus D1 D5 D2 D3 D4 Jelátvitel 5q35.1 camp Ca 2+ Kromoszómalokalizáció 4p camp 11q q p15.5 camp Ca 2+ K + camp camp K + Génszerkezet intron nélküli gén szabályos exon-intron szerkezet 1. táblázat: A dopamin receptorok főbb típusai és azok jellemzői. A ma ismert öt különböző dopamin receptor két szubtípusba sorolható az adenilát ciklázra gyakorolt ellentétes hatásuk alapján. Főbb jellemzőiket az 1. táblázat mutatja. A D1-szerű receptorok (dopamin D1-es és D5-ös) növelik, míg a D2-szerűek (dopamin D2-es, D3-as és D4-es) csökkentik az intracelluláris camp-szintet, így lassú inhibitoros hatást közvetítenek. 11,12 Ezen kívül a két szubtípus exon-intron szerkezetében is jelentős eltérés mutatkozik, a D1 család tagjainak génjei nem tartalmaznak intronokat szemben a D2-szerű receptorok génjeivel. Ez a génstruktúrabeli különbség a két géncsalád divergens fejlődésével jött létre Génszerkezet A dopamin receptor-család negyedik tagjának mrns-ét először humán neuroblasztóma sejtekből izolálták, majd szekvenálták. 14 Később a gén kromoszómális lokalizációját is meghatározták. A dopamin D4-es receptor (DRD4) a 11. kromoszóma rövid karjának telomerhez közeli régiójában (11p15.5) helyezkedik el, a Harvey Ras és a tirozin hidroxiláz gének között. 15 A 11-es kromoszóma ezen régiója több imprintált gént is tartalmaz, mint például a H19 és az IGF2 (inzulinszerű növekedési faktor) gének. A DRD4 génre azonban az imprinting nem jellemző. Ennek megállapítására az I. exonban található, vagyis a transzlátumban megjelenő, 12 bp-os duplikácót vizsgálták. Egy homozigóta és egy heterozigóta személy agyszövetéből (temporolaterális kortex) készült DRD4 mrns kivonat mennyiségi összehasonlítása során bizonyítást nyert, hogy mindkét kromoszóma-készletről történik génátírás
15 Irodalmi áttekintés A DRD4 génje négy exont és három intront tartalmaz. Az intronok elhelyezkedése az opszin génben találhatóéval nagyfokú hasonlóságot mutat. A gén feltehetően kromoszómális lokalizációjából kifolyólag nagyon variábilis. Polimorfizmusai megtalálhatók az exonokban, az intronokban és az 5 szabályozó régióban is. Ezen kívül két Alu szekvenciát azonosítottak a promoter régióban ( 2219 és 1981, valamint 1923 és 1717 között), ezek azonban a génexpressziós vizsgálatok szerint a transzkripciót nem befolyásolják. Az 5 határoló régióban egy GC-gazdag szakasz helyezkedik el, amelynek funkcionális hatása még nem bizonyított. Idegi eredetű humán sejtvonalakon végzett funkcionális vizsgálatok egy kb. 100 bp-os ( 770 és 679 között), a transzkripció mértékét csökkentő, ún. negatív modulátor (silencer) jelenlétét feltételezik. A promoter régió vizsgálata során több, a génexpresszió szabályozásában fontos szerepet játszó transzkripciós faktor (SP-1, GATA-1, GATA-2, MZF1, N-Myc) kötődési helyét azonosították in silico vizsgálatokaban. A housekeeping génekre jellemző TATA és CAAT konszenzus iniciációs helyek a DRD4 promoteréből hiányoznak, ez egyébként a többi, D1 és D2 szubtípusba tartozó dopamin receptorra is jellemző. Kamakura és munkacsoportja a szűkebb értelemben vett, a transzkripció közvetlen indításáért felelős core promotert a 591 és 123 bázispárok közötti régióban azonosította Fehérjeszerkezet A dopamin D4-es receptor a hét transzmembrán doménnel rendelkező G-fehérjét kötő receptorok közé tartozik, bár röntgenkrisztallográfiás szerkezete még nem ismert. Aminosav-sorrendjének hidrofóbicitási analízise és a másik két D2-szerű dopamin receptorral (D2, D3) mutatott nagyfokú homológiája (~40%) azonban ezt a fehérjeszerkezetet valószínűsíti (1. ábra). A dopamin D2-es, D3-as és D4-es receptorok között a legnagyobb mértékű homológia (60 80%) a III., VI. és VII. transzmembrán régióban figyelhető meg. Feltehetően ezen konzervatív szekvenciáknak szerepe van az agonista kötésében. 14
16 Irodalmi áttekintés A 12 bp dup Gly11Arg Val194Gly 21 bp del B β α 13 bp del 48 bp VNTR η ε β ε Asp 115 Ser 197 Ser 200 ζ Asp 80 α 48 bp VNTR 1. ábra: A dopamin D4-es receptor szerkezete és a ligandum kötésében szerepet játszó aminosavak. A: A receptor 48 bp-os VNTR-jének 7x ismétlődés tartalmazó változata, valamint a fehérje szerkezetében is kifejeződő polimorfizmusok. B: A receptor 4x ismétlődésű izoformája és a ligandum kötésében nélkülözhetetlen aminosavak. A DRD4 aminosav-szekvenciájának részletes vizsgálata során több poszttranszlációsan módosítható konszenzus szekvenciát azonosítottak. Az amino-terminálison egy N- glikozilációs hely (Asn-Arg-Ser) található. Az N-glikozilációs helyek jelenléte a dopamin receptor család minden tagjára jellemző, számuk azonban fehérjénként eltérő. 18 A natív DRD4 fehérje glikoziláltsága még nem bizonyított. Az N-glikozilációs helyek mellet több foszforilációs szekvenciát is leírták, melyeknek a receptor szenzitizációjában lehet kiemelt szerepük. A DRD4 C-terminális régiója szerinben és treoninban gazdag, valamint egy, az összes ismert G-fehérjét kötő receptorra jellemző konzervatív ciszteint is hordoz. Ez a Cys a DRD4 esetében a karboxil-terminális utolsó aminosava, amely más G-fehérjét kötő receptorokban (β-adrenerg receptor, rodopszin) bizonyítottan palmitinsavhoz kapcsolt, melynek szerepe lehet a fehérje membránban való lehorgonyzásában, valamint a receptor nagy affinitású formájának létrehozásában. 19 A második és harmadik extracelluláris hurokban szintén leírtak konzervatív cisztein aminosavakat, melyek β θ ζ 15
17 Irodalmi áttekintés diszulfid-kötéssel stabilizálják a fehérjét, valamint az agonista ligandum kötésében is fontos szerepet játszanak, ahogy ezt a β-adrenerg receptor esetében irányított mutagenezis kísérletekkel már bizonyították. 20 A ligandum-kötésben a már említett diszulfid-híd és a hidrofób karakterű transzmembrán domének mellet számos konzervatív aminosav játszik szerepet. Irányított mutagenezissel a fehérje belsejében meghatároztak egy viszonylag kis kötőzsebet, amely nagy valószínűséggel az agonista kötődési helye. A kötésben három igen fontos, minden katekolaminerg receptorban konzervált aminosav vesz részt. A III. transzmembrán (TM) domén egy aszparaginsavja (Asp 115 ) a dopamin amino-csoportját köti. Az V. TM doménben található két szerin (Ser 197 és Ser 200 ) hidrogén-donorként viselkedik a dopaminnal szemben (1. ábra). 21,22 Fontos szerepet tulajdonítanak a VI. TM régió egy konzervatív fenilalaninjének is, amely a ligandum aromás régiójának kötésében vesz részt. Egy további aminosav (Asp 80 ) a II. TM doménben központi funkciót tölt be a receptoraktivációban és az agonista kötésében. 23 Számos egyéb, a fehérje citoplazmatikus régiójában elhelyezkedő aminosav is szerepet játszik a receptoraktivációban, mint például a második intracelluláris hurok DRY (Asp-Arg-Phe) szekvenciája, vagy a harmadik citoplazmatikus hurokban lévő konzervált alanin. Ezek pontos funkciójáról azonban még igen keveset tudunk. A DRD4 harmadik citoplazmatikus hurka, amely a fehérje (és a gén) leggyakrabban vizsgált hosszúság-polimorfizmusát (48 bp-os VNTR, lásd 1. ábra) is tartalmazza, prolinban gazdag (~40%), benne több PXXP motívumot azonosítottak, amely az SH3 (Src Homológia 3) domén kötőhelye. 24 A DRD4 esetében ugyan még nem, de az α-adrenerg receptornál már bizonyították az SH3 domén kötődését a harmadik citoplazmatikus hurokhoz Előfordulása a szervezetben A dopamin D4-es receptor expresszióját az agy számos területén kimutatták Northern blot és RT-PCR (Reverse Transcriptase-Polymerase Chain Reaction) módszerekkel, az expresszió mértéke azonban a D2-es receptoréhoz viszonyítva meglehetősen alacsony. Legnagyobb mennyiségben a retinában, 25 majd a prefrontális kéregben, az amygdalában, a hypothalamusban és a hypophysisben mutatták ki, de alacsony szintű expresszió a bazális ganglionok területén is megfigyelhető. Egyedül a prefrontális kéregben sikerült a D2-es receptoréhoz hasonló mennyiségű DRD4 mrns jelenlétét 16
18 Irodalmi áttekintés igazolni. Ezeket az eredményeket in situ hibridizációs technikával ill. radioaktívan jelölt ligandumok affinitás-vizsgálatával végzett kísérletek is alátámasztják. 26 Western blottal azt is igazolták, hogy a D4-es receptor a hippocampus egyes sejtjein, és az agykéreg piramidális, valamint bizonyos nem-piramidális neuronjain egyaránt jelen van. A legtöbb nem-piramidális D4-es receptor-pozitív kérgi és hippocampalis sejt GABA-erg gátló interneuron, hasonlóan a thalamus, a globus pallidus és a substantia nigra pars reticulata területén található, ugyancsak DRD4-pozitív neuronokhoz. 27 A DRD4 expresszió azonban más szervekben is megfigyelhető. Állatkísérletek viszonylag nagy mennyiségű D4-es receptort mutattak ki a szívpitvar és a vese sejtjeiben. 28,29 Ezen kívül humán limfocitákban is megfigyelték a DRD4 fehérje expresszióját Funkció A dopamin D4-es receptor szervezetben betöltött funkciója ma még nem teljesen tisztázott. Ennek egyik oka a D4-es receptorra szelektív antagonista hiánya, bár újabban a clozapine-hoz nagy reményeket fűznek, amelyet a DRD4 egy nagyságrenddel nagyobb affinitással köt, mint bármely másik dopamin receptor. A DRD4 génkiütött homozigóta (DRD4 / ) egereknél nem találtak az agyban sem anatómiai elváltozást, sem számottevő [ 3 H]nemonapride (a D2-szerű receptorok egy antagonistája) kötés csökkenést, ami a D2 és D3 receptorok dominanciáját bizonyítja a központi idegrendszerben. A DRD4 / egerek azonban számos olyan fenotípusos jegyet mutattak, amely a D4-es receptor fiziológiás szerepét feltételezi a mozgásszabályozásban. A génkiütött állatok kevesebb spontán lokomotoros aktivitást, felágaskodást mutattak vad típusú társaikhoz képest, viszont jobb eredményeket értek el a koordinációs készséget mérő tesztekben. Mindez a DRD4 / egerekben kimutatható nagyobb mértékű dopamin szintézis eredménye lehet. Ezen kívül a DRD4-nek szerepe szerepe lehet a gyógyszerérzékenységben is. Kis mennyiségű clozapine a génkiütött állatoknál nem volt hatással a lokomotoros aktivitásra, szemben a DRD4+/+ egerekkel, ahol jelentős csökkenést okozott. Magasabb clozapine dózis alkalmazása mellett mind a mutáns, mind a vad-típusú állatoknál akinéziát tapasztaltak feltételezhetően azért, mert az antagonista ilyen nagy koncentrációban az összes D2-szerű receptorra kifejtette gátló hatását. Ezen felül a DRD4 génkiütött egerek hiperérzékennyé váltak a kokain, metamfetamin és az etanol lokomotoros stimuláló hatására. Ezek az mrns hibridizációs és immunhisztokémiai módszerekkel alátámasztott eredmények arra 17
19 Irodalmi áttekintés hívják fel a figyelmet, hogy a dopamin D4-es receptor posztszinaptikus gátló receptorként erőteljes kontrollt tart fenn a prefrontális kéreg neuronjain. 31 A dopamin D4-es receptor szignáltranszdukciós mechanizmusokban való részvétele egyértelműen bizonyított, bár a szerteágazó jelátviteli utak sora teljes mértékben még nem ismert. A D2-szerű receptorok, így a DRD4, legfontosabb hatása az intracelluláris camp mennyiségének csökkentésében van, amely az adenilát cikláz gátlásán keresztül valósul meg. 25 A gátlási folyamat közvetítésében a pertussis toxinra (PTX) érzékeny inhibitor GTP-kötő protein (G i ) vesz részt. A G i -fehérje nagy valószínűséggel a 48 bp-os VNTR-t is tartalmazó harmadik citoplazmatikus hurok területén kötődik a DRD4-hez. A dopamin D4-es receptor ezen kívül befolyásolja az intracelluláris Ca 2+ - és arachidonsav-szintet, valamint hatással van a sejt K + transzportjára, ami a Na + /K + -ATP-áz működésének gátlásán keresztül valósul meg. 32,33, A dopamin D4-es receptor gén polimorfizmusai A DRD4 génje a 11. kromoszóma rövidebb karjának telomer régiójában található (11p15.5). Feltehetően kromoszómális lokalizációjából adódóan rendkívül polimorf (2. ábra). 27 bp del Gly11Arg 616 C/G 521 C/T 21 bp del +1 I (G) n Val194Gly II III IV 120 bp dup 615 A/G 12 bp dup 13 bp del 48 bp VNTR 2. ábra: A dopamin D4-es receptor gén főbb polimorfizmusai. A rövidítések magyarázata a szövegben megtalálható. A szürke téglalapok a gén exonjait jelölik. A kódoló régió allélváltozatainak feltérképezése gyakorlatilag megtörtént, így a figyelem egyre inkább a génexpresszió szabályozásában szerepet játszó promoter régió felé irányul. A direkt szekvenálási lehetőségeknek köszönhetően az SNP-k azonosítása jóval nagyobb ütemben zajlik, semhogy a funkcionalitásukat vizsgáló tanulmányok ezzel lépést tudjanak tartani. 18
20 Irodalmi áttekintés Az 5 szabályozó régió polimorfizmusai 120 bp duplikáció A nem kódoló régió egyetlen hosszúság-polimorfizmusa a start kodontól 1,2 kb távolságra, upstream irányban elhelyezkedő 120 bp-os duplikáció (120 bp dup) (2. ábra), melynek ezidáig két egy egyszeres és egy kétszeres ismétlődésű variánsát írták le. A polimorfizmus széles körű, főemlősökre is kiterjedő vizsgálata során a duplikált allélt csak emberben sikerült kimutatni, így feltehetően az egyetlen 120 bp-os egységet hordozó változat az ősi forma. A 2x-es ismétlődés allél-frekvenciája 11 különböző populáció vizsgálata során 40 81% között adódott, az európai népcsoportok esetében egységesen 80% körüli volt. A régió szekvencia-analízise során a polimorfizmus területén számos transzkripciós faktor (GR, MEP-1, Rad-1, Zeste, Sp-1, myogenin, MBF-1) konszenzus szekvenciáját azonosították in silico, ill. az Sp-1 transzkripciós faktor kötődését sikerült kimutatni az ismétlődő szakasz területén kapilláris elektroforézis segítségével. 35,36 Mindez felveti a polimorfizmus génexpressziót befolyásló szerepét, melyet mindössze egy munkacsoport vizsgált: D Souza és munkatársai szerint a 120 bp dup rövidebb változatát nagyobb transzkripciós aktivitás jellemzi a duplikált változathoz képest C/T SNP A DRD4 gén promoterének legszélesebb körben vizsgált polimorfizmusa a 521 C/T SNP (2. ábra), amelynek funkcionális vizsgálatát egy japán kutatócsoport végezte in vitro retinoblasztóma sejteken (Y79), riporter gén vizsgálatokkal. A T allél 40%-kal kisebb transzkripciós aktivitást mutatott a C allélhoz képest kloramfenikol acetiltranszferáz rendszerben. 38 A két forma gyakorisága hasonló a japán (C: 41%, T: 59%) 38 és a magyar (C: 43%, T: 57%) populációban A/G SNP A munkacsoportunk által a közelmúltban azonosított polimorfizmus G alléljának frekvenciája magyar populációban 13,21%. Esetleges hatása a gén expressziójára még nem ismert (2. ábra). 40,III 616 C/G SNP A polimorfizmus a szövetspecifikus expresszióért felelős régió és a negatív regulátor között helyezkedik el a génben (2. ábra). Vizsgálatát az 5 régió direkt szekvenálásával, valamint Ava II (G allél esetén hasít) restrikciós endonukleázos emésztéssel 19
21 Irodalmi áttekintés végezték. 41,42 Ez utóbbi módszerrel azonban nem minden esetben lehet a genotípust megbízhatóan megállapítani, ez a tapasztalt hibaforrás vezetett a fentebb említett 615 A/G SNP felfedezéséhez is. Munkacsoportunk az RFLP mellett egy allél-specifikus amplifikációs (ASA) módszert is kidolgozott a 616 C/G SNP genotípusának megállapítására. A két technikát párhuzamosan alkalmazva kiderült, hogy az emésztés néhány esetben nem hasította az ASÁ-val G-nek adódó allélt. A kérdéses mintákat megszekvenálva kiderült, hogy a 615. pozíció is polimorf, amely genotípusától függően befolyásolja a 616. pozíció vizsgálatára eddig használt Ava II restrikciós enzim felismerő helyét. Az Ava II a GGWCC szekvenciánál hasít, ahol a 615. pozíciót jelentő W A vagy T bázist jelent. Ebből adódik, hogy az enzim csak a 616 G A haplotípus esetén fejti ki hatását. Így az Ava II a 616 G G haplotípus esetén a 616. pozíciót tévesen C allélnak genotipizálja, így a C allél-gyakoriságát túlbecsüli. Ezért a már meglévő ASA mellett kifejlesztésre került egy újabb RFLP módszer is, amelyben a hasítás a Sau96 I restrikciós endonukleázzal történik. Ezen enzim felismerő helye a GGNCC szekvencia, ahol a 615. pozícióban N, azaz bármilyen bázis előfordulhat, így a hasítást csak a 616. pozíció nukleotidja befolyásolja. Az így kidolgozott ASA és RFLP módszerekkel a 616 G allél-gyakorisága 48%-nak, a C allélgyakorisága 52%-nak adódott a magyar populációban. 40 Felmerül a C G csere funkcionális jelentősége is, mert létrehozhat egy AP-2 transzkripciós faktor kötőhelyet. 43 A további kutatások szempontjából érdekes lehetőségként merül fel a 615. és 616. pozíció SNP-inek együttes vizsgálata. 27 bp deléció Munkacsoportunk a 615 A/G SNP-n kívül azonosított egy 27 bp deleléciót is a DRD4 5 szabályozó régiójában. Ez a polimorfizmus a már említett 521 C/T SNP szomszédságában, attól upsteram irányban helyezkedik el. A deléció allél-frekvenciája mindössze 0,16% a magyar populációban, így inkább a mutációnak nevezhető. A 27 bp deléció csak heterozigóta fomában fordult elő a vizsgált populációban, homozigóta mintát ezidáig nem azonosítottunk. 44 A promoter régió egyéb polimorfizmusai A promoter régió direkt szekvenálásával további nyolc SNP-t azonosítottak. Ezek 809 G/A, 768 G/A, 603 T/del, 602 G/del, 600 G/C, 376 C/T, 291 C/T és 128 G/T. Szélesebb körű funkcionális vizsgálatuk még várat magára
22 Irodalmi áttekintés A kódoló régió polimorfizmusai Az I. exon polimorfizmusai Az I. exon 31-es pozíciójában található SNP G C nukleotid szubsztitúció (transzverzió) következményeként jött létre. A kódoló régió 11. aminosava így glicinről (GGG triplet) argininre (CGG triplet) változott (Gly11Arg) (1. ábra). A ritkább, C allélgyakorisága a német populációban mindössze 1%. 45 Ugyanez a német kutatócsoport az I. exon 21 bp-os delécióját is leírta, amely a receptor első transzmembrán régióját érinti és hét aminosav (Ala 36 -Ala 37 -Leu 38 -Val 39 -Gly 40 - Gly 41 -Val 42 ) kiesését eredményezi (1. és 2. ábra). Ez a deléció igen ritka, eddig mindössze egy pánik- és kényszerbetegségben szenvedő személynél sikerült kimutatni, egyéb pszichés zavarokkal küzdő betegeknél, valamint az egészséges populáció tagjainál nem fordult elő. 45 Ezen régió másik deléciós variánsa 13 nukleotid kiesésével jön létre, az előbbinél gyakoribb (2%) (1. és 2. ábra). Ez a 13 bp-os deléció leolvasási keret eltolódást (frame shiftet) okoz, ennek hatására egy stop kodon jön létre, amely funkcióképtelen, csonka fehérjét eredményez. Az a tény, hogy a deléciós allél heterozigóta formában mind az egészséges kontroll populációban, mind a különböző pszichiátriai rendellenességekben szenvedők csoportjában (szkizofrénia, Tourette-szindróma) azonos gyakorisággal van jelen, arra enged következtetni, hogy ennek az allélváltozatnak heterozigócia esetében nincs különösebb betegségre hajlamosító hatása. Ezidáig egy homozigóta deléciós személyt írtak le, aki a DRD4 génre gyakorlatilag génkiütöttnek tekinthető. Bár semmilyen súlyosabb pszichiátriai betegségben nem szenvedett, de akusztikus neurinomája és autonóm idegrendszeri zavarai voltak. 46 Ezen kívül az I. exonban található egy 12 bp-os duplikáció, amely négy aminosav (Ala- Ser-Ala-Gly) ismétlődését jelenti (1. és 2. ábra). A polimorfizmus a receptor extracalluláris N-terminálisán, az első transzmembrán határoló régiójában helyezkedik el. Egészséges populációban a kétszeres ismétlődést jóval gyakoribbnak (92%) találták a rövidebb variánssal szemben (8%), homozigócia csak a hosszabb allél esetében fordult elő. A hosszabb és a rövidebb allélt hordozó fehérjén is elvégzett hibrofóbicitási analízis nem mutatott számottevő különbséget a receptor feltételezett G-fehérje kötő régiójában, így a rövidebb allél is funkcióképesnek mondható
23 Irodalmi áttekintés Végül bár nem a kódoló régióban, hanem az I. intronban található megemlíthető a (G) n -mononukleotid polimorfizmus, ahol a guanin 6 10-szer ismétlődhet (2. ábra). Lokalizációja miatt feltehetően nincs hatással sem a natív fehérjére sem a transzkripcióra. 48 A III. exon polimorfizmusai A III. exon elején, a pozícióban bekövetkező T G csere a receptor ötödik transzmembrán régiójában található 194-es valint (GTC) glicinre (GGC) cseréli (1. és 2. ábra). Mivel ez az aminosav közel helyezkedik el a ligandum kötésében központi szerepet játszó szerinhez, a bekövetkező szubsztitúció hatással van receptor működésére. A G allélt tartalmazó fehérje kisebb affinitással köti a ligandumot, amely gyengébb jelátvitelt, kisebb mértékű camp-szint csökkenést eredményez. Ezt az SNP-t ezidáig csak afrikai populációkban írták le, ott a G allél-frekvenciája 12,5%. 49 A dopamin D4-es receptor kódoló régiójának legszélesebb körben vizsgált polimorfizmusa a III. exonban található 48 bázispárnyi, 2 10-szer ismétlődő hosszúságpolimorfizmus, ez a génszakasz a harmadik citoplazmatikus hurok kódolásáért felelős (1. és 2. ábra). 50 Mivel kettőnél kevesebb ismétlődést tartalmazó genotípust ezidáig nem találtak, feltételezik, hogy az első és az utolsó egység (α és ς szekvenciák) szükséges a fehérje funkciójához. Több különböző populáció vizsgálata során kiderült, hogy az allél-gyakoriságok igen eltérőek lehetnek. A natív dél-amerikai népcsoportok kivételével minden vizsgált populációban a 4-es ismétlődés (1B. ábra) adódott a leggyakoribbnak, bár az allél-frekvenciája igen széles skálán mozog a különböző populációkon belül (16% 96%). Kaukázusi populációban ezt követi a 7-es (20,6%) (1A. ábra) és a 2-es (8,2%) allél, a többi változat meglehetősen ritka. 51 Az ismétlődő szekvenciák nukleotid sorrendje azonban nem azonos, mostanáig összesen 35 változatot írtak le (az 1. ábrán görög betűkkel jelzett ismétlődő szakaszok a leggyakoribb szekvenciákat jelzik). Az evolúciósan legfiatalabbnak tartott 7-es allél széleskörű elterjedését pozitív szelekciós mechanizmussal magyarázzák. 52 A 48 bp-os VNTR funkcionális szerepe valószínű, de kellőképpen még nem bizonyított. Feltételezhető, hogy a különböző számú ismétlődést tartalmazó D4-es receptor a hosszával és térszerkezetével befolyásolja a hozzáférési felületet a jelátviteli mechanizmusokban szerepet játszó fehérjék számára, 53 bár ennek ellentmondó adatok is ismertek a szakirodalomban
24 Irodalmi áttekintés 2.5 Asszociáció-vizsgálat A polimorfizmusok az egyes emberek genetikai információjának különbségeit jelentik. Egyes gének szekvenciabeli eltérései okozhatnak betegségeket, funkció-kiesést, de ekkor inkább mutációról beszélhetünk. Az ilyen monogénes betegségek azonban ritkák, a kialakulásukban szerepet játszó génváltozatok a populáció kis részében vannak csak jelen. A polimorfizmusok többsége viszont vagy semleges, vagy csak kis mértékben hat a fenotípusra, így ezek komplex öröklődésű jellegek és rendellenességek genetikai hátterében szerepelhetnek. A nagy populációt érintő népbetegségek (szív- és érrendszeri problémák, mozgásszervi, neurológiai és pszichiátriai betegségek) genetikai hátterében feltehetően komplex, poligénes rendszerek állnak. A komplex öröklődésű betegségek vizsgálatára többféle stratégiát használnak. Egyrészt itt is alkalmazható a betegség fő komponenseinek kromoszómális lokalizálása (linkage analysis), ez azonban csak akkor vezet eredményre, ha az adott betegségben kimutatható néhány fő génhatás. Ezen kívül az eredményességhez kiterjedt családvizsgálat is szükséges olyan családokban, ahol a betegség halmozottan fordul elő, és a családtagok DNS-mintája mellett a fenotípusra jellemző diagnosztikus adatok is rendelkezésre állnak. Ezek a feltételek nem mindig valósulnak meg, ezért ma a komplex genetikai háttérrel rendelkező betegségek örökletes faktorainak azonosítására használt legelterjedtebb módszer a kandidáns gének asszociáció-analízise. 55 A vizsgálat során az adott betegségre fennálló tudományos hipotézisekre támaszkodva kiválasztásra kerül egy vagy néhány kandidáns gén, amelyekről feltételezhető, hogy szerepet játszanak a rendellenesség kialakításában. Pszichológiai és pszichiátriai zavarok esetében a kandidáns gén általában a neurotranszmitterek képződésében, lebontásában, valamint a receptorok hatásában szerepet játszó fehérjék génjei közül kerül ki. Az asszociációvizsgálat során megállapítjuk, hogy a kiválasztott gén adott allélváltozata hozzárendelhető-e a vizsgált rendellenesség előfordulásához. Ennek egyik lehetséges módja az eset-kontroll vizsgálat, amelynek során a polimorf kandidáns gén allélváltozatainak gyakoriságát megmérjük a beteg és az egészséges populációban is. A két populáció allél- ill. genotípus-frekvenciái statisztikai módszerekkel összehasonlíthatók. Ha a beteg és a kontroll populáció allél- ill. genotípus-gyakoriságai között szignifikáns eltérés mutatkozik, akkor az adott génvariáns és a betegség között asszociáció tételezhető fel. 56 Szemben a linkage analysisszel, az asszociáció-vizsgálat 23
25 Irodalmi áttekintés során gyenge génhatások is kimutathatók, így elvben bármilyen komplex a betegség genetikája, előbb vagy utóbb az összes érintett génvariáns kimutatására sor kerülhet. Itt a probléma inkább az ál-pozitív eredményekben keresendő, hiszen a gyenge génhatások miatt néha nehéz különbséget tenni a valódi, ám gyenge asszociáció és a véletlen hatások között. A másik jelenség, amivel a populáció-vizsgálatoknak számolniuk kell, az a populáció genetikai rétegződése (populáció stratifikáció). Ennek értelmében ha a vizsgált alpopulációk genetikai összetétele a vizsgált jellegtől függetlenül különbözik, ál-pozitív asszociációt kaphatunk. 57 A populáció startifikáció kimutatásának ill. kiküszöbölésének egyik módja a genom kontroll vizsgálat. Ennek lényege, hogy véletlenszerűen kiválasztanak a genomban szétszórtan elhelyezkedő genetikai markereket, SNP-ket vagy gyakrabban mikroszatellitákat (dinukleotid ismétlődés polimorfizmusokat) és ezek genotípusát is meghatározzák a vizsgált populációkban. Negyven ilyen polimorfizmussal (kromoszómánként 1 3 azok méretétől függően) a genom már megfelelően reprezentálható. A vizsgálat elve az, hogy ezen véletlenszerűen kiválasztott és elszórtan elhelyezkedő polimorfizmusok ( null-lókuszok ) legnagyobb része nem állhat összefüggésben a vizsgált fenotípussal, így ha a vizsgált és a kontroll populációk között mégis jelentős eltérés mutatkozik, akkor az csak a két populáció genetikai különbözőségével, azaz a populáció stratifikáció jelenségével magyarázható, és ezt az eltérést figyelembe kell venni a kandidáns gének polimorfizmusaival kapcsolatban kapott eredmény értékelése során. A genom kontroll vizsgálat hátránya azonban, hogy sokszoros genotipizáló munkát igényel (a kandidáns gének mellett további 40 lókusz genotípusának meghatározása mintánként), így azokban az esetekben, amikor a biológiai szülők DNS-mintái rendelkezésre állnak, célszerűbb a családanalízist alkalmazni. 58 A Transmission Disequilibrium Test (TDT) azt vizsgálja, hogy a heterozigóta szülő nagyobb gyakorisággal adja-e át a kandidáns allélját a beteg gyermeknek. Ha az egyik allél preferenciális átadása megfelelő statisztikai módszerekkel kimutatható, akkor az adott polimorf allélváltozat a betegség rizikófaktorának tekinthető. A rizikófaktor jelenléte nem feltétlenül okoz betegséget, de megnöveli annak kialakulási valószínűségét. Az asszociáció-vizsgálatok végső célja a környezeti és genetikai rizikófaktorok teljes feltérképezése, amelyek ismeretében az adott betegség kialakulása valószínűsíthető vagy elvethető
26 Irodalmi áttekintés 2.6 A figyelemhiányos hiperaktivitási zavar (ADHD) Az ADHD klinikai jellemzői A figyelemhiányos hiperaktivitási zavar elsősorban gyermekkori probléma, amelynek jellegzetes tünetegyüttese több, mint száz éve ismert a szakirodalomban. Gyakran társulnak hozzá egyéb rendellenességek is, úgy mint tanulási zavarok, mozgás- és beszédfejlődési nehézségek, magatartásbeli és érzelmi téren megnyilvánuló problémák. Az ADHD prevalenciáját 1 és 3% közé teszik, és bár a betegek kis része fordul csak szakemberhez, a gyermekpszichiáterek praxisában ez az egyik leggyakoribb kórkép. A nemek aránya 3 6:1 a fiúk és a lányok között, aminek egyik magyarázata lehet, hogy az érintett lányokkal kevésbé fordulnak orvoshoz, mert náluk ritkább az ADHD-hoz társuló zavar, gyakoribb a tisztán figylemhiányos forma, amelynek hatása a társas viselkedésre kevésbé zavaró. A DSM-IV (Diagnostic and Statistical Manual of Mental Disorders) 60 szerint az ADHD-nak három altípusa van: 1. ADHD figyelemzavarral 2. ADHD hiperaktivitással és impulzivitással 3. ADHD figyelemzavarral és hiperaktivitással (kevert típus) A figyelemzavar tünetegyüttes jellemzői, hogy a gyermek nem képes a részletekre koncentrálni; munkája közben sokat hibázik; ha beszélnek hozzá, úgy tűnik, nem figyel; nem követi az utasításokat; feledékeny; elhagyja a rábízott eszközöket. A másik fő tünetcsoport a hiperaktivitás. Ilyenkor a gyermek nem képes nyugodtan a helyén maradni, állandóan mocorog, nem tud a társaival együtt játszani. Jellemző még az impulzivitás vagy lobbanékonyság, amikor a gyermek nem tud várni a sorára, közbekiabál, közbeszól mielőtt kérdeznék. A kevert csoportban az összes tünet együttesen jelentkezhet. A diagnózis felállításának kritériuma, hogy a rendellenesség tünetei 7 éves kor előtt jelenjenek meg és legalább 6 hónapig álljanak fenn olyan mértékben, amely már problémát okoz a környezetének, valamint nem felel meg a gyermek fejlődési szintjének. Sok ADHD-s gyermek édesanyja már csecsemőkori problémákról is beszámol. A későbbiekben egyértelműen hiperkinetikus zavarral diagnosztizált gyermekek nagy része kifejezetten problémás csecsemő volt, amely evési- és alvási nehézségekben, nyugtalanságban, sok sírásban, ingerlékenységben nyilvánult meg. Az ilyen hiperkinetikus zavarral rendelkező gyermekek esetében gyakori a pszichomotoros fejlődés gyorsabb üteme, amelynek egy jellemző példája, 25
27 Irodalmi áttekintés hogy a gyermek hirtelen áll fel, kihagyva a mászás szakaszát. A zavar korai tünetei már egy éves kor előtt is mutatkozhatnak, de az ADHD biztonsággal csak a második életév körül diagnosztizálható. Óvodás korban jellemző a fizikai vagy verbális agresszivitás, indulatkitörés. Túlzottan mozgékonyak, engedetlenek, a társas játékhoz szükséges együttműködésre nem alkalmasak. Iskolai felkészítőn, kötöttebb helyzetekben nem teljesítenek jól, figyelmük elkalandozik, nyugtalanok. Legtöbb esetben felmerül az iskolaéretlenség kérdése megfelelő kognitív képességeik ellenére is. A pontos diagnózis legkésőbb iskolakezdéskor felállítható. Az ADHD-s gyermekek képtelenek végigülni egy tanórát, a teljesítményük elmarad a képességeik mögött. Szófogadatlanság, az önkontroll hiánya jellemzi őket. Sokszor akaratosak, időnkénti agresszív viselkedésük miatt társaikkal sem tudnak megfelelő kapcsolatot kialakítani. Iskolai kudarcaik hatással vannak az otthoni életre és az önértékelésükre is. A sorozatos kudarcot nagyzolással, vakmerőséggel, bohóckodással, szemtelenséggel igyekeznek kompenzálni. Negatív énképük következtében gyakran sodródhatnak deviáns társaságba. Fiatal felnőtt korra a tünetek jelentősen csökkennek, sőt teljesen meg is szűnhetnek. Ha a gyermekkorból hozott másodlagos nehézségekkel is sikerül megküzdeni, az érintettek a társadalom teljesértékű tagjaivá válhatnak. Sok esetben azonban az iskoláskor alatt felgyülemlett tanulási és szociális hátrányok megnehezíthetik számukra az életkezdést. 61 Az ADHD nagyon gyakran társul egyéb tanulási és viselkedési zavarokkal, ami nehezíti a diagnózist és a kezelést is. A tanulási nehézségek 20 25%-ában ADHD is diagnosztizálható, míg az ADHD-sok 10 50%-ának van valamilyen tanulási problémája. A hiperkinetikus zavar genetikai meghatározottságáról, valamint a környezeti tényezők szerepéről az egy- és kétpetéjű ikrek összehasonlításán alapuló vizsgálatok adnak információt. A betegségnek akkor van genetikai komponense, ha a monozigóta ikrek vizsgálata során kapott konkordancia nagyobb a dizigóták esetében tapasztaltnál. Az eltérés mértéke arányos a genetikai meghatározottsággal. A legtöbb ilyen ikervizsgálat nagyfokú örökölhetőséget (0,7 0,8) 62,63 mutatott ki, amely a genetikai háttér jelentős szerepére enged következtetni Asszociáció-vizsgálatok ADHD-ban Neurobiológiai modellek alapján a figyelemhiányos hiperaktivitási zavar kandidáns génjei elsősorban a dopamin rendszer tagjai (receptorok, transzporterek, szintetizáló és 26
28 Irodalmi áttekintés lebontó enzimek) közül kerülnek ki. Az utóbbi időben ennek megfelelően nagy figyelem irányul az erősen polimorf dopamin D4-es receptor génjére. A DRD4 gén legszélesebb körben vizsgált polimorfizmusa a III. exonban található 48 bp VNTR. Egy meta-analízis, mely a szakirodalomban eddig megjelent eset-kontroll és család alapú vizsgálatokat együttesen dolgozta fel, egyértelmű összefüggést talált a VNTR és az ADHD között. 64 Emellett egyre több, az 5 szabályozó régió polimorfizmusait vizsgáló tanulmány jelenik meg. Család-vizsgálatok során McCracken és munkatársai a 120 bp duplikáció kétszeres ismétlődési variánsát kétszer gyakoribbnak találták ADHD-s gyermekek körében a kontrollhoz viszonyítva. 65 A vizsgálatot később egy nagyobb mintaszámon megismételve hasonló eredményt kaptak. 66 Egy másik munkacsoport azonban ikreket vizsgálva nem talált asszociációt az ADHD és a hosszúság-polimorfizmus között. 67 Érdekes módon egyértelmű összefüggést mutattak ki az egyszeres ismétlődési változat és az újdonságkereső magatartás között, amely személyiségjegy közös vonásokat mutat az ADHD bizonyos jellemzőivel. 68 A DRD4 promoter régiójában található számos SNP közül a 616 C/G és a 521 C/T változatok asszociációját vizsgálták ADHD-val. 43,69,70,71 A polimorfizmusokat különkülön elemezve egyetlen tanulmány tudott szignifikáns összefüggést kimutatni a figyelemzavar és a 616 C/G SNP között ír populációban, ez az összefüggés a 521 C/T esetén már csak tendencia szintűnek adódott. 70 A 521 C/T SNP-t az újdonságkereső személyiségjeggyel összefüggésben is vizsgálták. Összefüggést találtak ezen jelleg és a 521 CC genotípus között egy japán populációban. 72 Ezt az eredményt később kaukázusi populáción sikeresen megismételték, 73 bár negatív eredmények szintén ismertek. 74,75 Egy számos tanulmányt összefoglaló meta-analízis azonban gyenge, de pozitív asszociációt mutatott ki az újdonságkeresés és a 521 C/T SNP között. 76 Ezt a polimorfizmust a csecsemőkori kötődéssel kapcsolatban is vizsgálták, ahol a T allélt hozták összefüggésbe a jelleggel, de csak a 48 bp VNTR 7-es alléljával kombinációban. 77 Ezen kívül pozitív asszociációt találtak a 521 C allél és a szkizofrénia között. 38 Szkizofréniás betegekben a prefrontális kortex DRD4 mrns szintjét is magasabbnak találták az egészséges kontrollhoz képest, 78 bár ezt az eredményt mások nem tudták megismételni
29 Irodalmi áttekintés Az asszociáció-vizsgálatokban azonban egyre nagyobb szerepet kapnak az ún. haplotípus-vizsgálatok. Az ADHD ill. a DRD4 gén vonatkozásában is a figyelem egyre inkább a polimorfizmusok együttes vizsgálatára, ezen belül is a promoter régióban található SNP-k közös hatásának kiderítésére összpontosul, amely reményeink szerint egyértelműbb eredményekkel szolgál majd. 43,69,70, Promoter polimorfizmusok funkcionális vizsgálata Riporter gén rendszerek A szakirodalomban számos génexpresszió mérésére alkalmas módszer áll rendelkezésre. Ezek többségével azonban két vagy több minta transzkripciós profiljának eltéréseit, expresszióbeli különbségeit mérhetjük. Ilyenek például a szubsztraktív hibridizációs technika, az EST (Expresssed Sequence Tag) szekvenálás, a SAGE (Serial Analysis of Gene Expression), qpcr, valamint az utóbbi időben igen elterjedt chip alapú módszerek (cdns alapú expressziós chip, ChIP-on-chip). 81 Ezek a technikák azonban nem, vagy csak korlátozott mértékben alkalmasak a különböző polimorf változatok transzkripcióra gyakorolt hatásának vizsgálatára, különösen akkor, ha az allélváltozatok a promoter régiót érintik. Ezért az 5 szabályozó régió in vitro funkcionális vizsgálatához számos riporter gén rendszer került kifejlesztésre. A módszer lényege, hogy a vizsgálni kívánt promoter szakaszt egy ún. riporter gén elé plazmidba klónozzák, melynek a terméke egy kvantitatívan mérhető fehérje. A plazmidot eukarióta sejtekbe transzfektálva megindul a transzkripció. A riporter gén expressziója, így a róla készülő fehérje mennyisége a vizsgált szakasz milyenségétől függ. Legtöbb esetben egy enzim génjét alkalmazzák ezekben a rendszerekben, mert az enzimaktivitás mérés segítségével jól követhető a vizsgált szabályozó szakasz transzkripciót befolyásoló képessége. Az első leírt és emlős sejtekben széles körben használt riporter a kloramfenikol-acetiltranszferáz enzim génje. 82 A módszer bár rendkívül érzékeny, de idő- és munkaigényes, valamint radioaktív technika. Emellett még számos gén használható hasonló célokra, ilyen a β-galaktozidáz, melynek többféle alkalmazása ismert, gyors és olcsó módszer. Igen elterjedt még a GFP (Green Fluorescent protein) alapú riporter rendszer, mely szintén gyors és olcsó, de bizonyos esetekben nehezen kvantifikálható, ezért kevésbé reprodukálható eredményeket ad. Az utóbbi időben leginkább a luciferáz riporter 28
30 Irodalmi áttekintés rendszert használják. A módszer rendkívül egyszerű, érzékeny, széles tartományban ad jól mérhető, releváns fluoreszcens jelet. 83 Számos módszer ismert a riporter konstruktum eukarióta sejttenyészetbe történő bejuttatására, azaz transzfekciójára. A transzfekció lehet tranziens, ekkor a bejuttatott plazmid nem épül be a sejt genomjába, de a kódolt gének expresszálódnak. Az osztódás során a vektor nem osztódik a sejttel, néhány ciklus elteltével a sejtkultúra nagy része elveszíti a riporter plazmidot. A tranziens transzfekció sokféle technikával elvégezhető. Legismertebb a kalcium-foszfát módszer, amikor a kalcium-foszfáttal együtt kicsapott plazmid DNS-t adszorbeáljuk a sejtek felszínére. Ezen kívül igen elterjedt, új módszer a liposzóma-mediált transzfekció. A liposzómák szintetikus lipidek komplexei, melyek pozitív töltést hordoznak, így kötik a negatív töltésű DNS szekvenciákat, valamint a sejtek felszínén található sziálsavat, elősegítve ezzel az endocitózist. A módszer nagy hatékonyságú, egyszerű és rendkívül sokoldalúan alkalmazható. Gyakran alkalmazzák továbbá az elektroporálást és a mikroinjekciót is. Az előbbinél egy elektromos impulzus hatására átmenetileg permeabilizálódik a membrán. Ezzel a technikával nagy hatásfokkal juttatható linearizált DNS a sejtbe, mely nagyobb eséllyel stabilan integrálódhat a sejt genomjába. A mikroinjekció melynek során mikrokapilláris segítségével juttatható a vektor a sejtbe azzal az előnnyel jár, hogy ismert számú DNS kópia transzfektálható. 83, Dopaminerg polimorfizmusok funkcionális vizsgálata A dopamin neurotranszmisszióban szereplő, így az ADHD kandidáns génjeként is számontartott receptororok, transzporterek, lebontó és szintetizáló enzimek szabályozó régiójában található polimorfizmusait az asszociáció-analízis mellett egyre inkább funkcionális szempontból vizsgálja a szakirodalom. A dopamin transzporter (DAT) a dopamin szinaptikus résből való visszavételéért, így a jel megszűntetéséért felelős. A gén 5 és 3 régiója is gazdag polimorfizmusokban. A leggyakrabban vizsgált változata a géntől downstream irányban található 3 uvntr, mely egy 40 bp-nyi szakasz 9-szeres és 10-szeres ismétlődését jelenti. Fuke és munkacsoportja a hosszabb változatot transzkripciósan aktívabbnak találta in vitro riporter rendszerben. 85 Ezt az eredményt egyes vizsgálatok megerősítették, 86 míg más vizsgálati rendszerekben nem tudtak kimutatni számottevő polimorfizmustól függő különbséget a DAT génexpressziójában 87,88 29
31 Irodalmi áttekintés A dopamin transzporteren kívül a neurotranszmitter intracelluláris lebontásában szerepet játszó monoamino-oxidáz A és B (MAO-A és MAO-B) gének promoter polimorfizmusait vizsgálták. A MAO-A promoterében található ismétlődési szám polimorfizmus hosszabb, 4-szer ismétlődő allélja erősebb transzkripcióval jellemezhető a rövidebb, 3-szor ismétlődő változathoz képest. 89 A MAO-B esetén két promoter SNP-t vizsgáltak, mindkettő erőteljesen módosította az expressziós szintet. 90 Ahogy az asszociáció-analízisben, úgy a funkcionális elemzésben is egyre nagyobb hangsúlyt kap a haplotípus-vizsgálat. Egy polimorfizmus, különösen egy SNP, legtöbbször csupán kismértékben modulálja az expresszió szintjét. Több polimorfizmus együttes vizsgálatával azonban ezek a hatások összeadódhatnak, in vitro rendszerben is mérhetővé válhatnak. Ezidáig kevés a dopamin rendszer tagjaira vonatkozó, funkcionális szempontból végzett haplotípus-vizsgálat ismert a szakirodalomban. A DAT 5 szabályozó régiójában számos SNP-t leírtak, melyek transzkripcióban betöltött szerepét csak az utóbbi időben kezdték el vizsgálani. Egy tanulmány 14 SNP-t és azok haplotípusait elemzve olyan kombinációt azonosított, amely igen erőteljesen növelte a génexpresszió mértékét. 88 Egy másik, szintén a DAT génjével foglalkozó munka 22 SNP-t vizsgált a promoter régióban. Hat kölönböző haplotípus-blokkot írtak le, melyek szignifikánsan eltérő promoter aktivitással jellemezhetők. 91 A dopamin D4-es receptor gén esetén a 521 C/T SNP és a 120 bp duplikáció transzkripciós aktivitását vizsgálták. Az SNP esetén a C allél, 38 a hosszúságpolimorfizmusnál a rövidebb változat mutatkozott transzkripciósan aktívabbnak. 37 A DRD4 5 szabályozó régió haplotípusainak génexpresszióra gyakorolt hatását azonban ezidáig még nem vizsgálták. 30
32 Célkitűzések 3 CÉLKITŰZÉSEK A figyelemhiányos hiperaktivitási zavar genetikai hátterének kutatása évek óta zajlik laboratóriumunkban. Vizsgálataink elsősorban a dopamin és a szerotonin rendszer génjeinek polimorfizmusaira irányulnak. Munkánkban az asszociáció-analízis mellett nagy szerepet kapott a polimorf változatok funkcionális vizsgálata. A jelen dolgozatban bemutatott munka egyik fő célja a DRD4 promoterében található polimorfizmusok és az ADHD esetleges kapcsolatának vizsgálata volt: 1. A DRD4 gén 5 szabályozó régiójában található 120 bp duplikáció és három SNP ( 616 C/G, 615 A/G és 521 C/T) vizsgálata. A négy polimorfizmus allél- és genotípus-frekvenciáinak összevetése eset-kontroll vizsgálatban és a preferenciális allél- ill. genotípus-átadás (Transmission Disequilibrium Test, TDT) analízise családi triókban. 2. A 120 bp duplikáció és a három promoter SNP ( 616 C/G, 615 A/G és 521 C/T) haplotípusainak analízise. A laboratóriumunkban előzetesen kidolgozott molekuláris haplotipizáló módszerek felhasználása a családi triók DRD4 promoter haplotípusának meghatározására, és a haplotípusok vizsgálata eset-kontroll, illetve TDT analízissel. A jelen vizsgálatok másik fő célkitűzése a dopamin D4-es receptor gén 5 szabályozó régiójának karakterizálása volt: 1. A DRD4 5 szabályozó régiójának részletes karakterizálása. Endogén DRD4 mrns expresszió kimutatása neuronális eredetű sejtvonalakban, és az endogén expressziót mutató sejtvonalak felhasználása a DRD4 promoter konstruktumok transzkripciós aktivitásának mérésére luciferáz riporter rendszert segítségével. 2. A DRD4 promoter polimorfizmusok és haplotípusaik funkcionális vizsgálata. A 120 bp duplikáció és a 521 C/T SNP kombinációinak molekuláris vizsgálata, valamint annak elemzése, hogy a két egymás melletti pozícióban található SNP ( 616 C/G és 615 A/G) haplotípusai hogyan befolyásolják a génexpressziót. 31
33 Módszerek 4 MÓDSZEREK 4.1 A vizsgálatban résztvevő személyek Az általunk vizsgált beteg populációt a Vadaskert Gyermekpszichiátriai Kórház és Szakambulancián ADHD-val diagnosztizált gyermekek alkották. A diagnózis felállítása Dr. Gádoros Júlia vezetésével a DSM-IV (Diagnostic and Statistical Manual of Mental Disorders) szerint történt, 60 a diagnózis megerősítésére az ADHD Rating Scale (ADHD becslő skála), 92 a Conners Rating Scale 93 és a Child Behaviour Checklist 94 teszteket használták. A betegek átlag életkora 9,1 ± 2,6 év. Az alacsony IQ pontszámmal (IQ < 80), valamint egyéb neurológiai zavarokkal vagy pszichiátriai betegséggel rendelkező gyermekeket kizártuk a vizsgálatból. DNS-mintát a gyermekektől és a szüleiktől egyaránt gyűjtöttünk, a vizsgálat menetének ismeretéről a szülők írásos beleegyezést adtak. A vizsgálatban 173 gyermek vett részt. 99 esetben mindkét szülő, 59 esetben csak az egyik szülő DNS-mintája állt rendelkezésünkre. Mindössze 15 esetben fordult elő, hogy egyik szülőtől sem tudtunk DNS-mintát venni. A vizsgálatokhoz az ETT-TUKEB adott etikai engedélyt. A nemben illesztett kontroll csoportot a korábban leírt 604 fős egészséges magyar populációból választottuk. III 284 egészséges személy genetikai adatait használtuk fel a statisztikai elemzéshez. Mind a klinikai, mind az egészséges csoport etnikailag homogén, kaukázusi eredetű, egymással nem rokon mintákból állt. 4.2 Mintavétel és DNS-izolálás A DNS-mintavétel a laboratóriumunkban kidolgozott non-invazív módon történt. 95 Vattapálcával másodperces dörzsöléssel az íny és a bucca területéről szájnyálkahártya-sejteket gyűjtöttünk. Ez elegendő mennyiségű DNS-t biztosított a genotipizáláshoz. Egy személytől két mintát vettünk. A mintát 400 μl össztérfogatú mintavevő pufferbe helyeztük, amelynek összetétele: 0,1 M NaCl, 0,01 M Tris-HCI, ph = 8,0, 0,5% SDS, 0,2 mg/ml proteináz K. A mintákat izolálásig 20 C-on tároltuk. A DNS-izolálást egy éjszakán át tartó 56 C-os inkubálás előzte meg, ezalatt a sejtek lizáltak, az SDS denaturálta, a proteináz K pedig megemésztette a fehérjéket. A lizátum centrifugálással eltávolítható a vattapálcáról (2000 g, 10 perc). A DNS-izolálás az így kapott oldat 400 μl-éből történt, melyet kezdetben a hagyományos fenol-kloroformos módszerrel, 96 később a Puregene DNS izoláló kit (Gentra) segítségével végeztünk. 32
34 Módszerek 4.3 Genotípus- és haplotípus-meghatározás Hosszúság-polimorfizmus genotípus-meghatározása A 120 bp duplikáció genotípusának meghatározása során a PCR-elegy két, a hosszúságpolimorfizmust közrefogó primert tartalmazott (2. táblázat). A PCR-termék hosszából következtettünk a genotípusra Egypontos nukleotid polimorfizmusok (SNP) genotípus-meghatározása Az egypontos nukleotid polimorfizmusok meghatározására kétféle módszert használtunk: a restrikciós fragmentumok hosszúság polimorfizmusának analízisét (PCR-RFLP), és a kétirányú allél-specifikus amplifikációt (ASA). A felhasznált primereket a 2. táblázat tartalmazza. Az eredmények megbízhatóságának növelése céljából a vizsgált SNP-k genotípusát mindkét módszerrel meghatároztuk Kétirányú allél-specifikus amplifikáció (ASA) A kétirányú ASA esetében két allél-specifikus reakció zajlott egy csőben. A reakcióelegy tartalmazta mindkét allél-specifikus (azaz 3 végén a polimorfizmus egyik alléljával komplementer bázist tartalmazó) primert, amelyek ellentétes irányúak, valamint tartalmazta a két külső primert is. A külső primerek a vizsgált polimorfizmustól eltérő távolságban helyezkedtek el, így elektroforetikusan jól elkülöníthető allél-specifikus termékek jöttek létre. A 616 C/G és 521 C/T SNP-k genotipizálása során használt primereket a 2. táblázat foglalja össze Restrikciós fragmentum hosszúság-polimorfizmus (PCR-RFLP) Ez a módszer akkor alkalmazható, ha a vizsgált SNP egy restrikciós endonukleáz hasítási helyére esik. A vizsgálni kívánt szakaszt PCR-rel felsokszoroztuk melyet egy restrikciós emésztési lépés követett. A módszer lényege, hogy hasítás akkor és csak akkor történt, ha a polimorf gén egyik meghatározott allélváltozata volt jelen, a másik allél esetén a hasítási vagy felismerő hely megszűnt. Így az adott allélra jellemző hosszúságú terméket kaptunk. Általában követelmény, hogy az amplifikált DNSszakasz egy kontroll hasítási helyet is tartalmazzon, mert ennek segítségével ellenőrizhető a restrikciós endonukleáz megfelelő működése. A 616 C/G és 521 C/T SNP-k PCR-RFLP alapú genotipizálása során használt primerek a 2. táblázatban 33
35 Módszerek láthatók, az emésztés során az Fsp I és a Sau96 I restrikciós enzimeket használtuk, az emésztés a fejezetben leírtak szerint zajlott. Primer név Szekvencia (5 3 ) 5 3 T m ( C) 120 bp-os duplikáció 120dup1c GTT GGC TGT CTT TTC TCA TTG TTT CCA TTG ,6 120dup2c GAA GGA GCA GGC ACC GTG AGC ,7 616 C/G SNP, ASA 616cgk1a GAA CCT ACC CCG GCC TGT CGT ,9 616cgk2a AGA CGG GAA TGA AGC GAG GTG G ,1 616c1 TGG TCG CGG GGG CTG AGC ,8 616g2ag CCC CCC MGC AGC CTC TGG YC ,2 616 C/G SNP, PCR-RFLP 521ctk1 GGA ATG GAG GAG GGA GCG GG ,4 521ctk2 CGC TCC ACC GTG AGC CCA GTA T ,0 521 C/T SNP, ASA 521ctk1 GGA ATG GAG GAG GGA GCG GG ,4 521ctk2 CGC TCC ACC GTG AGC CCA GTA T ,0 521c1 GGA GCG GGC GTG GAG GGC ,3 521t2 GCC TCG ACC TCG TGC GCA ,4 521 C/T SNP, PCR-RFLP 521ctk1 GGA ATG GAG GAG GGA GCG GG ,4 521ctk2 CGC TCC ACC GTG AGC CCA GTA T ,0 2. táblázat: A polimorfizmus-meghatározáshoz használt primerek fontosabb jellemzői. (M = A vagy C, Y = C vagy T) Haplotípus-meghatározás A DRD4 gén promoter polimorfizmusok genotipizálása után az egyes allélok relatív kromoszómális elhelyezkedését, azaz a haplotípusát is meghatároztuk. A haplotipizálás közvetlen amplifikációs módszerekkel történt, amelyet molekuláris vagy direkt haplotípus-meghatározásnak is neveznek, megkülönböztetve ezzel a családok vizsgálatán alapuló, számított (vagy indirekt) haplotípus-meghatározástól. A felhasznált primereket a 3. táblázat tartalmazza. 34
36 Módszerek Primer név Szekvencia (5 3 ) 5 3 T m ( C) 120 bp-os duplikáció és 616 C/G SNP haplotípus-meghatározása 120dup1b GGC TGG ACT CGC CGT TTG G ,0 616cgk2a AGA CGG GAA TGA AGC GAG GTG G ,1 616c2ag CCC CCC MGC AGC CTC TGG YG ,4 616g2ag CCC CCC MGC AGC CTC TGG YC ,5 120 bp-os duplikáció és 521 C/T SNP haplotípus-meghatározása 120dup1b GGC TGG ACT CGC CGT TTG G ,0 521ctk2 CGC TCC ACC GTG AGC CCA GTA T ,0 521c2 GCC TCG ACC TCG TGC GCG ,4 521t2 GCC TCG ACC TCG TGC GCA ,4 616 C/G, 615 A/G és 521 C/T SNP-k haplotípus-meghatározása 521ctk1 GGA ATG GAG GAG GGA GCG GG ,4 521ctk2 CGC TCC ACC GTG AGC CCA GTA T ,0 521c2 GCC TCG ACC TCG TGC GCG ,4 521t2 GCC TCG ACC TCG TGC GCA ,4 3. táblázat: A haplotípus-meghatározáshoz használt primerek fontosabb jellemzői. (M = A vagy C, Y = C vagy T) Haplotípus-meghatározás ASÁ-val Erre a módszerre a 120 bp-os duplikációra és a vizsgált SNP-re ( 616 C/G vagy 521 C/T) egyaránt heterozigóta egyedeknél volt szükség (kettős heterozigóták pl. 1x/2x és C/G). A haplotípus-meghatározás két csőben, két reakcióeleggyel, reakciónként 3 primerrel (egy allél-specifikus primer, és két külső primer, amelyek a 120 bp dup-ot és az SNP-t is közrefogják) történt (3. táblázat). 97 A haplotipizáláshoz egyetlen, az allélspecifikus primerrel ellentétes irányú külső primer is elég lett volna, de a második (az elsővel ellentétes irányú) külső primer segítségével kontroll fragmentum képződött. Az egyes reakcióelegyekben meginduló DNS amplifikáció az SNP, míg az így keletkező PCR termékek hossza a 120 bp dup genotípusáról nyújtott információt Haplotípus-meghatározás PCR-RFLP-vel Egy a laboratóriumunkban kifejlesztett technika a DRD4 promoterében található három SNP ( 616 C/G A/G C/T) kromoszómális lokalizációjának megállapítására alkalmas. III A már bemutatott (lásd fejezet) módszerek 35
37 Módszerek alkalmazásával a minták 521 C/T SNP-re vonatkozó genotípusa a rendelkezésünkre állt. A továbbiakban a homozigóta ( 521 CC és TT) és heterozigóta ( 521 CT) mintákat külön kezeltük, ugyanis a PCR során más primerekkel történt az amplifikációjuk, valamint egy illetve két PCR-re volt szükség. A homozigótáknál a régió felsokszorozása két, a három polimorfizmust közrefogó primer segítségével történt (521ctk1 és 521ctk2, 3. táblázat). Mivel a heterozigótáknál a két kromoszómán különböző allél volt jelen, így a két kromoszóma-szakasz felszaporítása eltérő primereket kívánt. A 521 T allélt hordozó régió 521 T specifikus primerrel (521t2) az egyik, míg az 521 C allélt tartalmazó szakasz 521 C specifikus primerrel (521c2, 3. táblázat) a másik elegyben került amplifikációra. Haplotípus DNS szekvencia Restrikciós enzim Felismerési szekvencia 616 G ~ 615 A TGAGGACCA Ava II GGWCC 616 C ~ 615 A TGAGCACCA BsiHKA I GWGCWC 616 G ~ 615 G TGAGGGCCA Hae III GGCC 616 C ~ 615 G TGAGCGCCA Hae II RGCGCY 4. táblázat: A 616 C/G és 615 A/G SNP-k haplotipizálása során használt restrikciós enzimek. A táblázat tartalmazza az enzimek nevét, általános felismerési szekvenciáját, a DRD4 gén promoterében található hasítási helyet és az általuk meghatározott haplotípust. A DNS szekvenciában vastagon szedve a 616. és 615. pozícióban található nukleotidok láthatók. (W=A+T, R=A+G, Y=C+T) A következő lépésben a PCR-terméket a 521 C/T SNP genotípusától függetlenül a reakcióelegy négy részre osztása után négy különböző restrikciós endonukleázzal (Ava II, BsiHKA I, Hae III, Hae II) emésztettük. Mind a négy enzim felismerő helye a 616 és 615 SNP-ket is tartalmazó régióba esett. Az SNP-k által kialakított négyféle dinukleotid kombináció egyike a négy restrikciós enzim egyikének hasítási helyét hozta létre. Így a négy enzimből mindegyik egy és kizárólag egy dinukleotid kombinációban volt képes hasítani (4. táblázat). Az általunk beállított rendszer kontroll hasítási helyeket is tartalmazott. Az emésztés után a kapott termékek hossza informált az adott minta geno-, ill. haplotípusáról. Egy minta esetén mind a négy emésztés elektroforetikus képének együttes kiértékelésére volt szükség a haplotípus megállapításához. 36
38 Módszerek Az amplifikáció körülményei A PCR elegy összetétele A polimeráz láncreakció μl-es térfogatban zajlott, a reakcióelegy a következő összetevőket tartalmazta: 200 µm dntp (lásd alább), mindegyik használt primerből (lásd 2. és 3. táblázat) 1 1 µm, 0,25 U Qiagen HotStarTaq DNS polimeráz, a gyártó által forgalmazott 1 puffer (1,5 mm Mg 2+ ) és 1 Qiagen Q-oldat, valamint kb. 5 ng DNS templát. A dntp összetétele 200 µm datp, dttp, dctp és dgtp az SNP-k és a 120 bp dup vizsgálatánál, illetve 200 µm datp, dttp, dctp, 100 µm dgtp és ditp a haplotípus-meghatározás esetén. A DNS magas GC-tartalmú szakaszairól készült PCR vagy a keletkező termékek közötti jelentős méretbeli különbség (haplotípus-meghatározás esetén) előidézhetik az allél kiesés jelenségét. 98 Ez azt jelenti, hogy a denaturáció során a magas GC-tartalmú, valamint a több ismétlődést tartalmazó szálak nehezebben válnak szét, így egyes allélok preferenciálisan amplifikálódhatnak. Ennek kivédésére néhány esetben a PCR-mixben ditp-t (dezoxi-inozin-trifoszfát) használunk. Ez egy dgtp analóg, amely csak két H-kötés kialakítására képes, így a régió olvadáspontja csökken és a GC-gazdag, valamint a hosszabb fragmentum szakasz felsokszorozása is kielégítően zajlik A PCR termociklus A termociklus első lépése a 95 C-on 15 percig tartó kezdeti denaturáció volt, melynek során szétváltak a DNS szálai és aktiválódott a HotStarTaq polimeráz enzim. Ezt termociklus követte, ciklusonként három lépéssel: 1 perc denaturálás 94 C-on, 30 sec anneálás polimorfizmusonként különböző hőmérsékleten (65 C: 521 C/T, 616 C/G SNP-k és a haplotípus-meghatározások, 58 C: 120 bp dup) és végül 1 perc extenzió 72 C-on. A PCR lezárásaként a 72 C-on történő 10 perces végső extenzió után a mintákat 8 C-ra hűtöttük le, majd a további vizsgálatokig 20 C-on tároltuk A PCR termékek restrikciós emésztésének körülményei Az amplifikációt követő restrikciós emésztés során a restrikciós enzim keveréket 1:2,5 arányban adtunk a PCR termékekhez. Az enzim keverék 0,6 U (Fsp I, Sau96 I, Ava II, Hae II és BsiHKA I), vagy 1,2 U (Hae III) mennyiségű enzimet tartalmazott, a ditiotreitol (DTT) végső koncentrációját 1 mm-ra, a MgCl 2 -ét 10 mm-ra állítottuk be. A 37
39 Módszerek Hae II és BsiHKA I enzimekhez a leírásuknak megfelelően 0,1 g/l BSA-t is adtunk. Az emésztés a BsiHKA I enzim esetén 65 C-on, a többi enzimnél 37 C-on zajlott 3 órán keresztül vagy egy éjszakán át A PCR termékek elektroforetikus elválasztása A PCR fragmentumok elválasztása hagyományos, alámerülő agaróz gélelektroforézissel történt. Az elválasztáshoz 2,5%-os agaróz gélt használtunk, a futtató puffer 10 mm Trisacetátot (ph = 8,5) és 2 mm Na 2 EDTA-t tartalmazott (1 TAE). Az elektroforézis 6,6 V/cm térerő alkalmazásával történt, szobahőmérsékleten, egy órán át. Az elektroforézis befejezése után a gélt 10 percig 1 µg/ml etidium bromidot tartalmazó TAE pufferoldatban festettük. Az értékelés BioRad GelDoc 1000 géldokumentációs rendszerrel történt. 4.4 RNS izolálás, RT-PCR, qpcr Az összrns izolálást az RT-PCR-hez TRIzol reagenssel (Invitrogen), a qpcr-hez RNeasy Mini Kittel (Qiagen) végeztük a gyártók protokollja alapján. Az esetleges DNS szennyezést DNázos emésztéssel elimináltuk (DNase I, Ambion, RNase-Free DNase Set, Qiagen). Az RT-PCR (Reverz Transzkriptáz PCR) kb. 3 μg összrns-t, 0,2 μg random primert (Promega) és 8 U RNasin RNáz inhibitort (Promega) tartalmazott, az elegy térfogatát RNáz-mentes vízzel 10 μl-re egészítettük ki. A reakcióelegyet 4 percig 70 C-on inkubáltuk, majd 4 μl M-MuLV 5 puffert, 24 U RNasint, 0,5 mm dntp-t és 100 U RevertAid M-MuLV reverz transzkriptázt (Fermentas) adtunk a mixhez, RNáz-mentes vízzel a térfogatot 20 μl-re kiegészítettük. A reakcióelegyet 40 percig 37 C-on, 20 percig 42 C-on, végül 5 percig 99 C-on inkubáltuk. A cdns-ből a DRD4 mrnsspecifikus fragmentum aplifikálását a DART-3 (5 GCA CCG CCT CCA TCT TCA ACC 3 ) és DART-4 (5 CGG AAC GTG GCC CAG TAG AGC 3 ) primerekkel végeztük. A PCR összetétele és termociklusa a fejezetben leírtakkal megegyező, az anneálás 68 C-on történt, 27 cikluson keresztül. A humán β-aktin kontroll gén esetén az amplifikációs körülmények a Raff és munkatársai által leírtakéval megegyeztek. 99 A qpcr (kvantitatív vagy real-time PCR) 25 μl-es térfogatban zajlott, a reakcióelegy a következő összetevőket tartalmazta: 1 TaqMan PCR Master Mix (AmpliTaq Gold 38
40 Módszerek DNS Polimeráz, AmpErase UNG, dntp Mix dutp-vel, TaqMan PCR Puffer és MgCl 2 ), 1 DRD4 illetve β-aktin pecifikus TaqMan próba, valamint kb. 1 ng cdnstemplát. Az amplifikáció és a detektálás ABI 7300 Real Time PCR készülékben zajlott, a kezdeti 95 C 10 perces elődenaturálást 40 kétlépcsős ciklus követte: 95 C 15 másodpercig és 60 C 1 percig. A detektálás minden ciklusban a 60 C-os szakaszok alatt történt. 4.5 Tranziens transzfekció A különböző promoter szakaszok, valamint az 5 szabályozó régióban található polimorfizmusok génexpresszióra gyakorolt hatásának igen elterjedt vizsgáló módszere a tranziens transzfekció. A módszer lényege, hogy a vizsgálni kívánt génszakaszt riporter gént tartalmazó plazmidba klónozva, az adott sejtvonalakba juttatjuk majd a riporter gén expressziós szintet mérjük. A transzfektált DNS nem épül be a genomba, néhány osztódás után eltűnik a sejtből Luciferáz riporter rendszer A DRD4 5 szabályozó régiójának vizsgálatához a pgl3 luciferáz riporter rendszert használtuk (Promega). A vizsgálni kívánt promoter szakaszt Xho I és Hind III hasítóhelyet hordozó primerek segítségével (lásd 5. táblázat) a pgl3-basic promoter nélküli vektorba klónoztuk a luciferáz riporter gén elé. Így a luciferáz gén átíródása, a termelődött enzimfehérje mennyisége egyedül az általunk vizsgált promoter milyenségétől függött Transzfekciós kontroll A tranziens transzfekció hatékonysága a módszer körültekintő standardizálása ellenére sok esetben az egyes kísérleteken belül is igen nagy szórást mutat. Ennek kiküszöbölésére elterjedt a másodlagos riporter plazmidok belső transzfekciós kontrollként való használata. A módszer lényege, hogy a kotranszfektált másodlagos riporter gén expressziója az adott sejtvonalban állandó, egyedül a transzfektált sejtek arányától függ. A kísérletben a vizsgálni kívánt gén promoterének aktivitását a kontroll riporter plazmid aktivitására normalizáljuk, kiküszöbölve így a transzfekciós hatékonyság eltéréséből adódó hibát. 100 Rendszerünkben a másodlagos kontroll 39
41 Módszerek vektornak leggyakrabban alkalmazott E. coli-ból származó, pcmv promoterű β-galaktozidáz gént tartalmazó expressziós plazmidot használtuk. Ezen kívül a pgl3-basic promoter nélküli vektort minden transzfekciós kísérletben használtuk, ez adta meg az üres vektorra jellemző alap transzkripciós aktivitást. Bizonyos esetekben pozitív kontrollként használtuk a ptk-luc plazmidot is, mely az erős transzkripciót indító és konstitutívan aktív timidin kináz promoterét tartalmazta Plazmid konstruktumok Az általunk használt összes plazmidot E. coli DH5α sejtekbe transzformáltuk és termeltettük. A vektorokat Qiagen Plasmid Midi Kit segítségével tisztítottuk. A szekvencia helyességéről minden estben szekvenálással győződtünk meg deléciós sorozat Az 5 deléciós sorozat elkészítéséhez hat átfedő szakaszt amplifikáltunk egy személy DRD4 gén promoteréről az 5. táblázatban felsorolt primerek segítségével. A forward klónozó primerek Xho I restrikciós enzim hasítási helyet, a reverse primerek Hind III adapter szekvenciákat hordoztak. A 120 bp duplikáció 1-szeres, 2-szeres és 4-szeres változatát hordozó vektorokat (lásd 6. táblázat) hasonló módszerrel, de a megfelelő allélt hordozó személy genomiális mintáját felhasználva készítettük el. Primer név Szekvencia (5 3 ) 5 3 DR4-S1 ACC ACT CGA GTG GGC TGG ACT CGC CGT TTG GC DR4-S2 AAG GCT CGA GCC CGG GAC CCC CTG CCC AGG DR4-S3 GGT TCT CGA GAA CTG TGC AAC GGG TGG GGC CG DR4-AS1 AAG GAA GCT TCC CTC GGG CGC TCA CCC TAG TCC DR4-AS2 AAG GAA GCT TCC CGC GGC GCT CCA CCG TGA táblázat: Az 5 deléciós sorozat készítéséhez használt primerek fontosabb jellemzői. A kiemelt bázisok a primerek szekvenciájában az Xho I és Hind III hasítóhelyeket jelölik. Minden klónozó primer T m értéke 69 C körüli volt. S: szensz/forward primer, AS: antiszensz/reverse primer. A polimeráz láncreakció 10 μl-es térfogatban zajlott, a reakcióelegy a következő összetevőket tartalmazta: 200 µm dntp, mindegyik használt primerből 1 1 µm, 0,25 U Pfu DNS polimeráz (Fermentas), 1 Pfu PCR puffer 2,5 mm MgSO 4 -tal kiegészítve, 1 40
42 Módszerek Qiagen Q-oldat, valamint kb. 1 ng DNS templát. A PCR termociklusa a fejezetben leírtakkal megegyező, az anneálás 70 C-on zajlott. A PCR-termékeket agaróz gélen futtattuk, kivágtuk, tisztítottuk (QIAquick Nucleotide Removal Kit, Qiagen), majd Xho I és Hind III restrikciós endonukleázokkal emésztettük, végül a hasonlóképpen emésztett pgl3-basic riporter plazmidba ligáltuk (T4 DNA ligase, Fermentas). Az így elkészült plazmidok pontos haplotípusa és a beklónozott szakasz hossza és pozíciója a 6. táblázatban látható. Plazmid név Haplotípus DRD4 promoter 120 bp dup, 616 C/G, 615 A/G, 521 C/T deléciós sorozat pdrd4-a 2 C A C pdrd4-b C A C pdrd4-c C A C pdrd4-d 2 C A C pdrd4-e C A C pdrd4-f C A C A 521 C/T SNP hatásának vizsgálata pdrd4-c-521c C A C pdrd4-c-521t C A T A 120 bp dup hatásának vizsgálata pdrd4-a-1x 1 C A C pdrd4-a-2x 2 C A C pdrd4-a-4x 4 C A C A 120 bp dup és a 521 C/T SNP-k haplotípusainak vizsgálata pdrd4-a-1c 1 C A C pdrd4-a-1t 1 C A T pdrd4-a-2c 2 C A C pdrd4-a-2t 2 C A T A 616 C/G és 615 A/G SNP-k haplotípusainak vizgálata pdrd4-ca C A C pdrd4-ga G A C pdrd4-cg C G C pdrd4-gg G G C táblázat: A transzfekciók során használt DRD4 promoter konstruktumok jellemzői. 41
43 Módszerek Irányított mutagenezis A polimorfizmusok DRD4 expresszióra gyakorolt hatásait a pdrd4-a és C konstruktumokon vizsgáltuk (lásd eredmények fejezet). A megfelelő haplotípusú promoter szakaszt irányított mutagenezissel hoztuk létre (QuickChange Site-Directed Mutagenesis Kit, Stratagene). A módszer során dupla szálú plazmid DNS-sel dolgozunk, mely tartalmazza az általunk vizsgált génszakaszt. Ezen kívül egyenként bázis hosszúságú primert tervezünk a szensz és antiszensz DNS szálra egyaránt úgy, hogy a cserélni kívánt nukleotid, így a mismatch, az oligonukleotid közepére essen. Egy hosszú anneálási idejű PCR-ben felsokszorozzuk a mutációt hordozó plazmidot, majd Dpn I restrikciós endonukleázzal elimináljuk az eredeti, nem mutáns és nagyrészt metilált anyai plazmidok jelentős részét, feldúsítva így az általunk létrehozott változatot. Az irányított mutagenezissel létrehozott vektorokat a 6. táblázat, az ehhez használt mutagén primereket a 7. táblázat foglalja össze. Mutagén primerek Szekvencia (5 3 ) c521t-s c521t-as c616g(615a)-s c616g(615a)-as c616g(615g)-s c616g(615g)-as a615g(616c)-s a615g(616c)-as a615g(616g)-s a615g(616g)-as 521 C/T SNP mutagenezise GGC GTG GAG GGT GCG CAC GAG GTC GAC CTC GTG CGC ACC CTC CAC GCC 616 C/G SNP mutagenezise CGG GGG CTG AGC AGC AGA GGC TGC GCA GCC TCT GCT GCT CAG CCC CCG CGG GGG CTG AGC GGC AGA GGC TGC GCA GCC TCT GCC GCT CAG CCC CCG 615 A/G SNP mutagenezise CGG GGG CTG AGC GCC AGA GGC TGC GCA GCC TCT GGC GCT CAG CCC CCG CGG GGG CTG AGC GGC AGA GGC TGC GCA GCC TCT GCC GCT CAG CCC CCG 7. táblázat: A mutagenezis során használt primerek jellemzői. A primerek nevében a szám a kicserélni kívánt nukleotid pozícióját jelzi, a szám előtt az eredeti allélt, a szám mögött a létrehozni kívánt allélt tüntettem fel. Zárójelben a mutagenezist befolyásoló közeli polimorfizmus allélja látható. Pl. a c616g(615a)-s mutagén primerrel a 616. pozícióban a citozin cserélhető guaninra olyan mintákban, ahol a 615. helyen adenin található. S: szensz primer, AS: antiszensz primer. A szekvenciában a cserélni kívánt nukleotid pozícióját aláhúzott, a közeli polimorfizmust dőlt betű mutatja. 42
44 Módszerek A mutagenezis 50 μl-es térfogatban zajlott, a reakcióelegy a következő összetevőket tartalmazta: 200 µm dntp, a szensz és antiszensz mutagén primerből 1,25 1,25 ng/μl, 0,25 U Pfu DNS polimeráz (Fermentas), 1 Pfu PCR puffer, valamint kb. 25 ng plazmid DNS templát. A PCR termociklus első lépése egy 30 másodperces kezdeti denaturáció volt 95 C-on. Ezt 12 termociklus követte: 30 sec denaturálás 95 C-on, 1 perc anneálás 55 C-on, végül 9 perc extenzió 68 C-on. Végső extenzió nem volt szükséges a hosszú elongációs periódusok miatt. A PCR elegyet 1 μl Dpn I restrikciós endonukleáz hozzáadása után 2 óra hosszat 37 C-on inkubáltuk Sejtvonalak A kísérleteink során használt sejtvonalak jellemzőit és a fenntartáshoz szükséges médiumok összetevőit a 8. táblázat foglalja össze. Minden sejtvonalat 37 C-os termosztátban, 5% CO 2 tartalom mellett növesztettük. Sejtvonal SK-N-FI Y79 IMR32 HeLa CCF-STTG1 Eredet neuroblasztóma retinoblasztóma neuroblasztóma epithel karcinóma asztrocitóma Típus letapadó úszó letapadó letapadó letapadó Médium D-MEM RPMI 1640 MEM MEM RPMI 1640 FBS 10% 20% 10% 10% 10% N.E.A.A 1% 1% 1% Na-piruvát 1% 1% 1% 1% HEPES 1% 8. táblázat: Az általunk használt sejtvonalak jellemzői és a fenntartásukhoz használt médiumok összetétele. FBS: magzati marhaszérum (Fetal Bovine Serum), N.E.A.A.: nem esszenciális aminosavak, HEPES: hidroxietil-piperazinetanolszulfonsav Tranziens transzfekció Transzfekciós módszerek Az SK-N-FI, Y79 és IMR32 sejtvonalak esetén kb 1,5 10 6, HeLa-ból kb. 0, sejtet szélesztettük ki 6, illetve 12 osztatú lemezre 24 órával a kísérlet előtt. Az SK-N-FI és HeLa sejtvonalak tranziens transzfekcióját Lipofectamin 2000 reagenssel (Invitrogen), az Y79 és IMR32 sejteket Lipofectamin és Plus reagens (Invitrogen) keverékével végeztük a gyártó protokollja alapján. A riporter plazmidokból 1 5 μg-ot, a kontrollként 43
45 Módszerek használt pcmv-β-gal vektorból 0,2 2,5 μg-ot juttattunk a sejtekbe. A transzfekció után 5 órával 1 1,2 ml friss médiumot adtunk a sejtkultúrákhoz, majd a begyűjtésig további 48 óráig inkubáltuk. Minden kísérleti pontot három ismétlésben végeztünk Luciferáz és β-galaktozidáz enzimaktivitás mérése A transzfektált sejteket 100 μl 250 mm Tris-HCl-ban (ph = 8,0) vettük fel. A sejtfeltárást három egymást követő fagyasztás-olvasztás ciklussal végeztük, melyet centrifugálás követett. Az enzimaktivitás mérése a felülúszóból történt. A luciferáz enzimaktivitását a Luciferase Assay System kit (Promega) segítségével határoztuk meg, a lumineszcencia méréséhez Mithras LB940 leolvasót használtunk. A β-galaktozidáz enzimaktivitását spektrofotometriával mértük az optikailag aktív OMPG (o-nitrofenil-β- D-galaktopiranozid, mesterséges szubsztrát) hasítási rátája alapján. A promoterekre jellemző luciferáz aktivitásokat a transzfekciós kontrollként használt β-galaktozidáz aktivitrásokkal normalizáltuk. 4.6 Statisztikai módszerek A genetikai asszociáció-vizsgálatoknál az SPSS 10.0 statisztikai programcsomagot használtuk, amely a beteg illetve a kontroll populáció allél-, genotípus- és haplotípusfrekvenciáit χ 2 -próba segítségével hasonlítja össze. A család-analízis során a beteg populációban található esetleges preferenciális allél-, illetve haplotípus-átadást az ETDT (Extended Transmission/Disequilibrium Test) program segítségével tanulmányoztuk. 101 A várható értéktől való eltérést χ 2 -próbával vizsgáltuk. A haplotípus-frekvenciákat kétféle program segítségével számítottunk. Az EH (Estimated Haplotype) genotípus adatokkal dolgozik, 102 a munkacsoportunkban kifejlesztett HAPFR program azonban haplotípus adatok alapján számol. A kétféleképpen kapott haplotípus-frekvencia értékeket χ 2 -próbával vetettük össze. A transzfekciós kísérletek kiértékelése során egy-utas ANOVÁ-t használtunk, melyet a Tukey-Kramer féle páronkénti összehasonlítási teszt követett (GraphPad InStat). 44
46 Eredmények 5 EREDMÉNYEK 5.1 A 120 bp duplikáció új alléljának azonosítása a DRD4 gén promoterében Munkánk során a 120 bp duplikáció egy új allélját azonosítottuk. Egy ADHD-s gyermek mintájának vizsgálata során rendellenes méretű fragmentumot kaptunk a gélelektroforetikus képen. Ez a PCR-termék jóval hosszabb volt, mint a már jól ismert 1-szeres (428 bp) és 2-szeres (548 bp) változat (3. ábra). A minta genotípusa többszöri ismétlés során sem tisztázódott. A PCR termék mérete felvetette annak a lehetőségét, hogy esetleg egy nagyobb inszerciót tartalmazhat a gén ebben a régióban. A B 120dup2c 120dup1c 788 bp 548 bp 428 bp M genotípus 3. ábra: A 120 bp duplikáció 4-es allélja egy ADHD-s családi trióban. A: A használt PCRalapú genotipizáló módszer elvi vázlata. A nyilak jelölik a használt primereket, a szürke téglalapok pedig a 120 bp dup lehetséges ismétlődési számát. B: Az új allél elektroforetikus képe. M: 100 bp-os létra, majd az ADHD-s gyermek, az apa és az anya mintája. A rendellenes PCR-terméket megszekvenáltattuk. A szekvencia analízise során kiderült, hogy a DRD4 gén promoterében a 120 bázispáros szakasz négyszeri ismétlődéséről van szó. Az ismétlődési egységek tandem helyezkednek el egymáshoz képest és szekvenciájuk pontosan megegyezik. A genotípus tisztázása érdekében a gyermek szüleitől is mintát vettünk és az apánál szintén azonosítottuk ezt az új allélt (3B. ábra, 2. minta). A szakirodalomban ez az első eset, hogy a 120 bp duplikáció kétszeres változatánál hosszabb allélt írtak le. A 4-es allél az általunk vizsgált egészséges kontroll csoportban egyáltalán nem fordult elő. Az ADHD-s populációban is meglehetősen ritka, 173 vizsgált személyből mindössze egynél azonosítottuk, ennek alapján a becsült allélgyakorisága 0,3% (9. táblázat). II 5.2 A DRD4 gén promoter polimorfizmusainak asszociáció-vizsgálata ADHD-ban A laboratóriumunkban kidolgozott módszerek genotípus és haplotípus eredményeket adnak a dopamin D4-es receptor gén 5 szabályozó régiójában található négy 45
47 Eredmények polimorfizmusra. A 120 bp duplikációt, a 616 C/G, a 521 C/T és az utóbbi időben felfedezett 615 A/G SNP-ket vizsgáltuk 173 fős beteg populációban. Az allél- és genotípus-frekvenciákat egy korábban genotipizált, nemben illesztett kontroll csoporttal vetettük össze. III Az eset-kontroll vizsgálaton kívül preferenciális allél-átadás analízist is végeztünk, ahol a szülőből a beteg gyermekbe szignifikánsan gyakrabban vagy ritkábban átadódó allélt vagy haplotípust kerestünk. Annak ellenére, hogy ezek a polimorf változatok egymáshoz közeli pozícióban helyezkednek el a génben, kapcsoltság nem mutatható ki közöttük. III A Hardy-Weinberg egyensúly teljesül mind a négy polimorfizmusra mind az ADHD-s, mind a kontroll populációban Eset-kontroll vizsgálat Az asszociáció-analízis során azt vizsgáljuk, hogy a kiválasztott gén valamely allélváltozata hozzárendelhető-e az adott jelleghez, betegséghez. Ennek egy lehetséges módja az eset-kontroll vizsgálat. Ennek során meghatározzuk a polimorf kandidáns gén allélváltozatainak gyakoriságát a beteg és a kontroll csoportban. A két populáció allél-, genotípus- vagy haplotípus-frekvenciái statisztikai módszerekkel leggyakrabban χ 2 - próbával összehasonlíthatók. Ha a beteg és a kontroll csoport között szignifikáns eltérés mutatkozik, akkor az adott génvariáns és a betegség között asszociáció áll fenn. Vizsgálataink során 173 beteg és 284 egészséges személy genotípusát és haplotípusát határoztuk meg a dopamin D4-es receptor gén 5 szabályozó régiójában található hosszúság-polimorfizmusra, valamint a három SNP-re Eset-kontroll vizsgálat a DRD4 gén promoter polimorfizmusaira Összehasonlítottuk az ADHD-s és az egészséges populáció allél-gyakoriságait a promoter polimorfizmusaira. Az allél-frekvenciák a 9. táblázatban láthatók. A kontroll populációban az allélvariánsok gyakoriságai megfelelnek az irodalmi adatoknak mind a hosszúság-polimorfizmus, mind pedig a három SNP esetén. A vizsgált SNP-k közül egyik sem mutatott statisztikailag szignifikáns eltérést a két populációban. A 120 bp duplikáció allél-gyakoriságai azonban szignifikáns mértékben különböztek az eset és a kontroll csoportban (χ 2 = 3,928; df = 1; P = 0,047). A χ 2 -próbát csak a gyakoribb allélokra végeztük (várható érték 5). Így a 120 bp hosszúság-polimorfizmus általunk azonosított 4-szeres ismétlődési változata nem szerepelt a statisztikai elemzésben, hiszen nagyon ritka, a kontroll populációban egyáltalán nem fordul elő, az ADHD-s 46
48 Eredmények populációban is mindössze egy gyermek mintájában tudtuk kimutatni heterozigóta formában (lásd 5.1 fejezet). Polimorfizmus 120 bp dup 616 C/G SNP 615 A/G SNP 521 C/T SNP Allél C G A G C T Kontroll (2N = 568) * gyakoriság (%) 16,0 84,0 0,0 51,6 48,5 87,7 12,3 56,2 43,8 ADHD (2N = 346) * gyakoriság (%) 21,4 78,3 0,3 49,7 50,3 84,1 15,9 42,2 57,8 χ 2 3,928 0,302 2,324 0,236 P (df = 1) 0,047 0,583 0,127 0, táblázat: A promoter polimorfizmusok allél-gyakoriságai egészséges és ADHD-s populációban. A vastagbetűvel jelölt számok a számított gyakoriságértékeket, a normál betűs számok a ténylegesen mért adatokat mutatják. *A statisztikai értékelésnél nem vettük figyelembe azokat a kategóriákat, ahol a várható érték < 5. Az eset és a kontroll populáció DRD4 promoter genotípus-gyakoriságait a 10. táblázat mutatja. Polimorfizmus 120 bp dup 616 C/G SNP 615 A/G SNP 521 C/T SNP Genotípus Kontroll ADHD N = 284 Fr (%) N = 173 Fr (%) ,2 14 8, , , * 0,0 1* 0, , ,3 CC 81 28, ,9 CG , ,7 GG 72 25, ,4 AA , ,9 AG 62 21, ,3 GG 4* 1,4 3* 1,7 CC 55 19, ,6 CT , ,2 TT 90 31, ,2 χ 2 P (df = 2) 5,713 0,057 0,824 0,662 2,614 0,271 2,164 0, táblázat: A promoter polimorfizmusok genotípus-gyakoriságai egészséges és ADHD-s populációban. A vastagbetűvel jelölt számok a számított gyakoriságértékeket (Fr %), a normál betűs számok a ténylegesen mért adatokat mutatják. *A statisztikai értékelésnél nem vettük figyelembe azokat a kategóriákat, ahol a várható érték < 5. 47
49 Eredmények Ahogy az allél-eloszlás vizsgálatánál, úgy a genotípusok tekintetében is egyedül a 120 bp duplikáció esetén találtunk statisztikai értelemben vett eltérést a vizsgált populációk között (χ 2 = 5,713; df = 2; P = 0,057). A különbség azonban nem éri el a P < 0,05 szignifikancia szintet, de közelíti azt, így tendenciózus eltérésről beszélhetünk. A statisztikai elemzésnél itt is kihagytuk az 5-nél kisebb várható értékű genotípus csoportokat. A 120 bp duplikáció genotípus-frekvencia értékei azt mutatják, hogy az 1-1 változat az ADHD-sok körében több mint kétszer gyakoribb, mint a kontroll populációban (8,1% vs 3,2%, 10. táblázat). Ennek megfelelően a szakirodalomban jól ismert és elfogadott összevonást alkalmaztuk a hosszúság-polimorfizmus genotípuskategóriái között. Mivel az összes előforduló genotípusra végzett statisztikai vizsgálat alapján is kimutatható különbség az eset és kontroll populáció között a 120 bp dup polimorfizmus tekintetében (10. táblázat), statisztikai szempontból elfogadható a hasonló gyakoriságú csoportok összevonása és összehasonlítása az 1-1 genotípuskategóriával (11. táblázat). Biológiai értelemben ez azt jelenti, hogy a DRD4 promoter 120 bp dup 2-es allélját hatásában dominánsnak tételezzük fel az 1-es felett, ezért az 1-2 és a 2-2 genotípus-kategóriák összevonhatók. Polimorfizmus Genotípus 120 bp dup Kontroll ADHD N = 284 Fr (%) N = 173 Fr (%) ,2 14 8,1 más , ,9 χ 2 P (df = 1) 5,456 0, táblázat: A 120 bp duplikáció összevont genotípus-gyakoriságai egészséges és ADHD-s populációban. A vastagbetűvel jelölt számok a számított gyakoriságértékeket (Fr %), a normál betűs számok a ténylegesen mért adatokat mutatják. A χ 2 -próbát elvégezve azt találtuk, hogy szignifikáns eltérés mutatható ki az ADHD-s és egészséges csoportok összevont genotípus-eloszlásában (χ 2 = 5,456; df = 1; P = 0,019), mely eredmény jól összecseng az allél-gyakoriságok összehasonlításánál kapott adatokkal. Az 1-1 genotípusra számolt esélyhányados értéke (odds ratio, OR) 2,71, ami azt jelenti, hogy az 1-1 genotípus megléte egy adott személy genomjában 2,71-szer nagyobb rizikót jelent az ADHD kialakulására, mint a polimorfizmus bármely más genotípusa. II 48
50 Eredmények Eset-kontroll vizsgálat a DRD4 gén promoter haplotípusaira A továbbiakban a korábban leírt molekuláris haplotipizáló módszereket használtuk fel a vizsgált négy promoter polimorfizmus allél-kombinációinak meghatározására. III Ezen technikák egyike a 521 C/T SNP és a 120 bp dup együttes detektálására alkalmas, ugyanezt az elvet követve azonban a 616 C/G SNP és a 120 bp duplikáció haplotípusát is sikerült molekuláris szinten meghatározni. 97 Haplotípus Kontroll ADHD 2N = 568 Fr (%) 2N = 346 Fr (%) 1-C-A-C 22 3,9 14 4,0 1-C-A-T 23 4,0 31 9,0 1-G-A-C 17 3,0 11 3,2 1-G-A-T 24 4,2 8 2,3 1-G-G-C 3* 0,5 5* 1,4 1-G-G-T 3* 0,5 5* 1,4 2-C-A-C 86 15, ,6 2-C-A-T , ,1 2-G-A-C 76 13, ,1 2-G-A-T 88 15, ,5 2-G-G-C 46 8,1 33 9,5 2-G-G-T 18 3,2 12 3,5 4-G-A-C 0* 0,0 1* 0,3 χ 2 P (df = 9) 14,905 0, táblázat: Haplotípus-frekvenciák a DRD4 promoter négy polimorfizmusára egészséges és ADHD-s populációban. A vastagbetűvel jelölt számok a számított gyakoriságértékeket (Fr %), a normál betűs számok a ténylegesen mért adatokat mutatják. A haplotípus jelölésében a 120 bp dup (1 vagy 2), a 616 C/G (C vagy G), a 615 A/G (A vagy G) és a 521 C/T (C vagy T) megfelelő alléljai követik egymást. *A statisztikai elemzést azokra a haplotípus-kategóriákra végeztük el, amelyek várható értéke >5. A rendelkezésünkre álló direkt haplotipizáló módszerek segítségével határoztuk meg 173 ADHD-s gyermek és 284 egészséges személy négyes allél-kombinációit a 120 bp duplikációra és a 616 C/G, 615 A/G és 521 C/T SNP-kre. Az így kapott haplotípus adatokból a munkacsoportunk által kifejlesztett HAPFR programmal haplotípusfrekvenciát számoltunk. A vizsgálat során előforduló kombinációk és gyakoriságaik a 12. táblázatban láthatók. A két populáció haplotípus-gyakoriságait χ 2 -próbával hasonlítottuk össze, melynek során tendenciózus eltérést találtunk az eset és a kontroll csoport allél-kombinációi között (χ 2 = 14,905; df = 9; P = 0,093; 12. táblázat). Az 49
51 Eredmények 1-C-A-T haplotípus (120 bp dup 1-es allél C A T) az ADHD-sok körében feldúsúlni látszik, hiszen ezen kombináció több, mint kétszer gyakrabban fordul elő a kontroll csoportban tapasztalthoz képest (9% vs 4%, 12. táblázat). A fejezetben bemutatott elv alapján összevontuk az összes előforduló haplotípust az 1-C-A-T kombinációval szemben mindkét populációban. Az így elvégzett összehasonlítás szignifikáns különbséget mutatott, ezen haplotípus statisztikailag gyakoribb a beteg populációban (χ 2 = 9,326; df = 1; P = 0,002), ez a változat az ADHD kialakulásának rizikóját 2,33-szorosára növelheti (OR: 2,33). A többi haplotípus gyakoriságát vizsgálva még a 2-C-A-C esetén kaptunk gyenge tendenciózus eltérést a két populáció között (χ 2 = 2,319; df = 1; P = 0,128), ez a változat ritkábban fordul elő az ADHD-s populációban. Az, hogy a fenti két haplotípusban ugyanaz a 616 C és 615 A allél fordul elő, azt jelezheti, hogy ez a C-A háttér szükséges lehet a két haplotípus hatásának megnyilvánulásához. II C-A-C 1-C-A-T 2-C-A-C 2-C-A-T 4. ábra: A 120 bp dup és a 521 C/T SNP relatív haplotípus-gyakoriságai az ADHD-s populációban 616 C és 615 A háttér mellett. Az eset és kontroll csoportban az azonos haplotípus-gyakoriságot vettük egynek, az azonosságtól való eltérést ábrázoltuk négy haplotípusra. A haplotípus jelölésében a 120 bp dup (1 vagy 2), a 616 C/G (C vagy G), a 615 A/G (A vagy G) és a 521 C/T (C vagy T) megfelelő változatai követik egymást. A 4. ábra az ADHD-s populációban előforduló relatív haplotípus-gyakoriságokat ábrázolja (azonos gyakoriság az eset és a kontroll populációban = 1) a kontrollhoz képest, 616 C A háttér mellett. Az ábrán jól látható a 120 bp duplikáció és a 521 C/T SNP kölcsönhatása. Eredményeink alapján úgy tűnik, hogy a 120 bp duplikáció feldúsulása elsősorban a 521 T variánssal együttesen jelentkezik gyakrabban az ADHD-s populációban (1-C-A-T), míg a 120 bp duplikáció előfordulásának csökkenése elsősorban a 521 C variáns esetében (2-C-A-C) jelentős. Ez az eredmény alátámasztja a 120 bp duplikáció rövid változatának szerepét az ADHD-ban, de felhívja a figyelmet arra, hogy a vizsgált promoter polimorfizmus 50
52 Eredmények hatását a környező polimorfizmusok is befolyásolják, így azokat együtt érdemes tanulmányozni. Haplotípus EH Kontroll EH ADHD 2N = 568 Fr (%) 2N = 346 Fr (%) 1-C-A-C 28 4,9 11 3,3 1-C-A-T 35 6,1 33 9,7 1-G-A-C 11 2,0 12 3,6 1-G-A-T 15 2,7 6 1,7 1-G-G-C 2* 0,3 3* 1,0 1-G-G-T 0* 0,0 7* 2,0 2-C-A-C 90 15,9 34 9,8 2-C-A-T , ,3 2-G-A-C 72 12, ,7 2-G-A-T , ,2 2-G-G-C 46 8,1 30 8,8 2-G-G-T 22 3,9 13 3,9 4-G-A-C 0* 0,0 0* 0,0 χ 2 P (df = 9) 19,550 0, táblázat: Az EH becslő programmal számolt haplotípus-frekvenciák a DRD4 promoter négy polimorfizmusára egészséges és ADHD-s populációban. A haplotípus meghatározása az EH becslő programmal történt. A kromoszómák száma (2N) 568 az egészséges, 346 a beteg populációban. A haplotípus jelölésében a 120 bp dup (1 vagy 2), a 616 C/G (C vagy G), a 615 A/G (A vagy G) és a 521 C/T (C vagy T) megfelelő változatai követik egymást. *A statisztikai elemzést azokra a haplotípus-kategóriákra végeztük el, amelyek várható értéke >5. Fr: frekvencia A szakirodalomban számos statisztikai program ismert, melyekkel az adott polimorfizmusok genotípus adataiból haplotípus-frekvencia becsülhető. Ezen programok általában a genotípus-gyakoriságok értékei alapján számolják egy adott haplotípus előfordulási valószínűségét az adott populációban. Felvetődhet a kérdés, hogy ilyen statisztikai elemzési lehetőségek mellett miért van szükség a sokszor fáradtságos, munka- és időigényes molekuláris haplotípus-meghatározásra. Az esetkontroll vizsgálatot éppezért megismételtük az irodalomban ismert és gyakran használt Estimated Haplotype (EH) haplotípus-gyakoriság becslő program segítségével (13. táblázat). Az ADHD-s és egészséges populációk genotípus adataiból kiszámoltuk az allél-kombinációk frekvenciáit. Ez után χ 2 -próbával összevetettük a becsült és valós haplotípus-gyakoriságokat mind az ADHD-s, mind az egészséges populáción belül. Az 51
53 Eredmények EH-val becsült haplotípus-gyakoriságok sem a beteg, sem a kontroll populációban nem tértek el szignifikánsan a molekuláris haplotipizálás során kapott értékektől (ADHD-s csoport: χ 2 = 4,915; df = 10; P = 0,897; egészséges csoport: χ 2 = 9,450; df = 9; P = 0,397). Végül a becsült eset és kontroll haplotípus-frekvenciák összehasonlítása során szignifikáns különbséget találtunk a két csoport haplotípus-eloszlásában (χ 2 = 19,550; df = 9; P = 0,021; 13. táblázat), míg a direkt haplotipizáló módszerekkel kapott, a populációra ténylegesen jellemző haplotípus vizsgálat esetében ez az eltérés csak tendenciózus volt (P = 0,093, 12. táblázat). Ez azt jelenti, hogy a két populáció közötti, valójában csupán trend szintű különbséget a haplotípus becslése szignifikáns különbséggé torzítja. Ez a megfigyelés alátámasztja a direkt haplotipizáló módszerek fontosságát. II Család-analízis (Transmission Disequilibrium Test, TDT) ADHD-ban Az asszociáció-analízis egy másik megközelítési módja a családon belüli esetleges preferenciális allél-, ill. haplotípus-átadás vizsgálata, azaz a Transmission Disequilibrium Test (TDT). Ehhez az ADHD-val diagnosztizált gyermekek szüleinek genotípus és haplotípus adataira is szükségünk volt, így családi triókkal, duókkal dolgoztunk. Ez a módszer azonban nem kívánja meg kontroll populáció vizsgálatát, így a populáció stratifikációból adódó estleges hibák kiküszöbölhetők. A statisztikai analízist az ETDT programmal végeztük. A vizsgálat célja olyan allél-, és haplotípuskombinációk keresése volt, amelyek szignifikánsan többször vagy kevesebbszer adódnak át a heterozigóta szülőtől az érintett gyermeknek. Ennek megfelelően 173 gyermek DNS-mintáját vizsgáltuk. Közülük 99 esetében mindkét szülő, 59 esetében az egyik szülő mintája állt rendelkezésünkre. 15 gyermek mintáját nem tudtuk felhasználni ebben a vizsgálatban, mert nem volt elérhető egyik szülő DNS-e sem Család-analízis a DRD4 gén promoter polimorfizmusaira A preferenciális allél-átadás analízist elvégeztük a DRD4 gén 5 szabályozó régió négy polimorfizmusára. Az allélvariációkat egyenként elemezve nem találtunk gyakrabban átadódó vagy nem-átadódó allélt sem a három SNP ( 616 C/G, 615 A/G, 521 C/T), sem a 120 bp duplikáció esetében. 52
54 Eredmények Család-analízis a DRD4 gén promoter haplotípusaira A család-analízist elvégeztük a DRD4 gén promoter haplotípusaival is. A vizsgálat eredményét az 14. táblázat foglalja össze. A statisztikai értékelésbe csak az 5-nél nagyobb várható értékű kategóriákat vontuk be. Haplotípuskatergóriák 1-C-A-C 1-C-A-T 1-G-A-C 1-G-A-T 1-G-G-C 1-G-G-T Átadott Nem-átadott χ 2 1,333 1,400 1,087 0,286 P (df = 2) 0,248 0,237 0,297 0,593 2-C-A-C 2-C-A-T 2-G-A-C 2-G-A-T 2-G-G-C 2-G-G-T 4-G-A-C ,970 0,871 0,071 0,362 1,400 1,000 0,085 0,351 0,789 0,547 0,237 0, táblázat: A négyes haplotípusra számolt preferenciális allél-átadás. A táblázat tartalmazza az egyes haplotípus-kategóriákhoz tartozó átadott és nem-átadott esetszámot ill. az erre számolt χ 2 és P értékeket. A haplotípus jelölésében a 120 bp dup (1 vagy 2), a 616 C/G (C vagy G), a 615 A/G (A vagy G) és a 521 C/T (C vagy T) megfelelő változatai követik egymást. Nem találtunk preferenciális transzmissziót egyik haplotípus esetén sem. Mindez következhet abból, hogy a haplotípus-kategóriákhoz képest viszonylag kis esetszámú populációt vizsgáltunk. Tovább csökkentette a vizsgálat erejét, hogy az analízis természetéből adódóan csak a négyes haplotípusra heterozigóta szülők és azok gyermekei kerülhettek bele a vizsgálatba. Mindazonáltal az eset-kontroll vizsgálat során a beteg populációban gyakoribbnak mutatkozó 1-C-A-T (120 bp dup- 616 C/G A/G C/T) haplotípus 21-szer adódott át az érintett gyermekbe és csak 14-szer nem. Ugyanígy a 2-C-A-C kombináció, mely ritkább az ADHD-sok körében 26 esetben adódott át, míg 40 esetben nem (14. táblázat). Az esetszám növelésével ezek az eredmények azonban elérhetik a statisztikai szignifikancia szintet. 53
55 Eredmények 5.3 A DRD4 gén 5 szabályozó régiójának karakterizálása Mint azt az eddigi eredmények és számos irodalmi adat bizonyítja, sok esetben kimutatható asszociáció bizonyos génvariánsok és fenotípusos jegyek között. Érdekes kérdés azonban, hogy milyen út vezet a genotípustól a megfigyelhető tulajdonságokig, azaz mi lehet egy-egy génpolimorfizmus biokémiai, élettani jelentősége. A promoter régió polimorfizmusok esetében ez a szerep azonban szorosan összefügg a gén transzkripcionális szabályozásával, expressziójának mértékével, így a DRD4 tekintetében a sejt felszínén megjelenő receptorok mennyiségével. A DRD4 génexpressziójának szabályozásáról, a promoter régió szerkezetéről azonban ezidáig keveset tudunk, mindössze egy tanulmány foglalkozott a gén szabályozó régiójának feltérképezésével. 17 A DRD4 gén promoter polimorfizmusainak funkcionális szerepe pozíciójuknál fogva feltételezhető, bár specifikus vizsgálatok korlátozott mértékben állnak rendelkezésre a szakirodalomban. 37, A DRD4 gén expressziója idegi eredetű és HeLa sejtvonalakban A tervezett transzfekciós kísérleteinkhez szükségünk volt néhány, a DRD4 gént endogén módon is expresszáló sejtvonalra. Mivel a D4-es receptor elsősorban az agy bizonyos területein és a retinában fejeződik ki, vizsgálatainkhoz neuroblasztóma (IMR32, SK-N-FI), retinoblaszóma (Y79) és asztrocitóma sejtvonalakat választottunk (CCF-STTG1). Ezek a sejtek feltehetően tartalmazzák a génátíráshoz szükséges faktorokat, valamint a teljes transzkripciós apparátust. Nem neuronális típusú sejtek közül az epithel karcinóma eredetű HeLa sejtvonalat teszteltük A DRD4 gén expressziójának vizsgálata RT-PCR-rel Kísérleteinket öt különböző humán eredetű sejtvonalon végeztük. Az elsősorban agyban expresszálódó DRD4 gén vizsgálatára idegi eredetű neuroblasztóma (IMR32, SK-N-FI), retinoblasztóma (Y79) és asztrocitóma (CCF-STTG1) sejtvonalakat választottunk. Kontrollként a nem neuronális eredetű HeLa sejteket használtuk. Az IMR32 és Y79 sejtek endogén DRD4 mrns expresszióját korábban bizonyították, 17 az SK-N-FI és CCF-STTG1 sejtvonalakat ebből a szempontból eddig még nem vizsgálták. A HeLa sejttípus egyes adatok szerint expresszálja, 37 míg más megfigyelések szerint nem fejezi ki a D4-es receptort. 17 Ezen ellentmondásos adatok ismeretében a transzkripciós analízis 54
56 Eredmények előtt fontosnak tartottuk, hogy kísérletesen meghatározzuk ezen sejttípusok endogén DRD4 expresszióját (5. ábra). Mind az öt sejtvonalból összrns-t izoláltunk, majd a minőségi kontrollnak alávetett mintákat cdns-be írtuk át. A cdns-ből történő amplifikáció során a DRD4 3. és 4. exonjára tervezett primereket használtunk. Így a DRD4 cdns-éről rövidebb, a genomiális DNS-ről hosszabb szakaszt amplifikáltak a primerek (5A. ábra). A cdns szintézise során minden mintából reverz transzkriptázt nem tartalmazó kontroll is készült (5B. ábra: (-)). Ez a negatív kontroll a cdns preparátum genomi DNS szennyezését mutatná, azonban ilyet egy esetben sem találtunk. A PCR alacsony ciklusszámával biztosítottuk, hogy a képződött DRD4-specifikus termékek mennyisége korreláljon a kiindulási mrns mennyiségekkel. A PCR során a mintáinkban esetlegesen jelen lévő genomiális DNS-ről nem képződött termék, így a kapott fragmentum erőssége valóban csak a kiindulási DRD4 mrns illetve cdns mennyiségétől függött. Az amplifikáció során kapott termékeket agaróz gélen választottuk el, a termékek mennyiségét denzitometriával számszerűsítettük (5A. ábra). Belső kontrollként a konstitutívan expresszálódó β-aktin génjét választottuk (5B. ábra), melynek amplifikációja során az irodalomban leírt körülményeket alkalmaztuk. 99 A IMR-32 HeLa SK-N-FI Y79 CCF-STTG1 genomiális DNS víz B IMR-32 HeLa SK-N-FI Y79 víz CCF-STTG1 RT + RT + RT + RT + RT + RT + DRD4 expresszió β-aktin kontroll 5. ábra: A DRD4 mrns expressziójának vizsgálata öt sejtvonalban. A: A DRD4-specifikus RT-PCR eredménye öt sejtvonalban. Az elektroferogram első oszlopa 100 bp létra. Az öt sejtvonalból készült RT-PCR eredménye az ezt követő oszlopokban látható. A cdns preparátumok mellet összehasonlításképpen egy genomiális DNS mintát is vizsgáltunk. B: A β- aktin specifikus RT-PCR eredménye öt sejtvonalban. Az elektroferogram első oszlopa 1 kb-os és 100 bp létra keveréke. A cdns szintézis során kontrollként reverz transzkriptázt nem tartalmazó reakció is készült (-). A PCR termékeket mindkét esetben 2%-os agaróz gélen futtattuk. 55
57 Eredmények A különböző sejtvonalakra kapott DRD4 intenzitás értékeket a referencia gén értékeivel osztottuk el (6A. ábra). Vizsgálatainkban azt találtuk, hogy az irodalomban ezidáig kontrollként használt HeLa sejtvonal bár kis mértékben, de kifejezi a DRD4-et. Mindez a nem túl érzékeny gélelektroforetikus módszerrel is kimutatható (5A. ábra, nyomtatásban kevésbé látható). A többi sejtvonal endogén DRD4 expresszióját a HeLa sejtekhez viszonyítottuk. Az idegi eredetű sejtvonalak relatív expressziós szintje a 6A. ábrán látható. A legerősebb expressziót az IMR32 neuroblasztóma (8,3-szoros a HeLa-hoz képest) és a CCF-STTG1 asztrocitóma (8,8-szoros) sejtek mutatták. Az Y79 és SK-N-FI sejtvonalakban szintén van DRD4 transzkripció, bár kisebb mértékű (5,6- és 4,4-szeres). I A DRD4 gén expressziójának vizsgálata qpcr módszerrel A TaqMan rendszerű génexpressziós mérések során a kiindulási mrns mennyiség meghatározására szekvencia specifikus jelölt próbákat alkalmaznak. Maga a TaqMan próba a primereknél rendszerint hosszabb oligonukleotid, melynek 5 végére fluoreszcens festéket, 3 végére pedig egy ún. csillapító (quencher) molekulát kötnek, a próba a két primer közötti DNS-szakasszal komplementer. Megvilágítás hatására a fluoreszcens festék gerjesztődik, de intakt próba esetén az így keletkező többlet energiát a közeli quencher elnyeli, így a készülék nem detektál fluoreszcens jelet. A PCR során viszont az 5 nukleáz aktivitású DNS-polimeráz elhasítja a cdns-hez betapadó próbát, ezáltal a festék eltávolodik a quenchertől, így a szekvencia-specifikus jel intenzitása megnő. A qpcr-rel történő kvantitatív mérés elvi alapja, hogy a PCR kezdeti, exponenciális szakaszában a keletkező termék mennyisége arányos a kiindulási DNS-, cdnskoncentrációval. A későbbiekben a reakció egyre kisebb hatásfokkal megy végbe, míg végül eléri a végső, ún. plató fázist. A PCR termék mennyiségének növekedésével arányosan nő az emittált fény intenzitása, így folyamatos detektálással nyomon követhető a reakció dinamikája. A kezdeti DNS koncentráció meghatározására egy olyan fluoreszcencia küszöb értéket választunk, amelyet minden reakció az exponenciális fázisban ér el. Így minden mintához hozzárendelhető egy küszöbciklusszám (C T ), melynek segítségével meghatározható a kiindulási DNS-templát abszolút vagy relatív mennyisége. 56
58 Eredmények A vizsgálatban használt sejtvonalak által termelt DRD4 mrns mennyiségét tehát qpcr módszerrel is meghatároztuk. Relatív expressziós szintet mértünk, így kontrollként a denzitometriás kísérlet során is használt β-aktin gén expresszióját használtuk, melyre specifikus TaqMan (ABI) génexpressziós kit állt rendelkezésünkre. Ez kizárólag az mrns meghatározására szolgál, mert a fluoreszcens próba két exon határán tapad, így az esetleges genomiális DNS szennyezés nem zavarja a kvantitatív mérést. A DRD4 mrns mennyiségi vizsgálatához azonban csak olyan kit állt rendelkezésre, mely a genomiális szennyezést is méri, a PCR primerek két egymás melletti exonon tapadnak, a próba szekvenciája azonban teljes egészében az egyik exon egy részével komplementer. Így a qpcr során a cdns-ről és a genomiális DNS-ről is képződik termék. Bár ezek hossza természetesen a közrefogott intron miatt eltérő, a TaqMan kit mindkettő mennyiségét méri a próba tapadási helye miatt. Ezért a kísérlethez nagyon jó minőségű, DNS-mentes RNS-ből indultunk ki, valamint a qpcr után a mintákat gélen is megfuttattuk. Mivel az elektroferogramon csak a cdns-nek megfelelő rövidebb fragmentumot detektáltuk, a mintát genomiális DNS-től mentesnek találtuk, és a qpcr-t kiértékeltük. A kiértékelés során a ΔC T módszert használtuk. A denzitometriás kísérlethez hasonlóan, ebben a rendszerben is detektáltunk DRD4 expressziót a HeLa sejtekben. A HeLa sejtvonalra jellemző mrns mennyiséget egynek vettük és ehhez viszonyítottuk a többi, idegi eredetű sejtvonal endogén DRD4 expresszióját (6B. ábra). A denzitometriás kísérlethez hasonló expressziós sort tudtunk felállítani a qpcr alapján is. Legerősebb expresszió az IMR32 és CCF-STTG1 sejteket jellemezte. Az Y79 szintén jelentős DRD4 transzkripciót mutatott. Az SK-N-FI sejtvonal is expresszál DRD4-et, bár a többi sejttípushoz viszonyítva meglehetősen keveset (CCF-STTG1 = IMR32 > Y79 > SK-N-FI >> HeLa 6. ábra A és B). A HeLahoz viszonyított expressziós arány számértékei qpcr módszerrel mérve azonban jelentősen eltérnek a denzitometriával kapott adatokhoz képest. Az IMR32 és CCF- STTG1 sejtek 45-ször, az Y79 24-szer, míg az SK-N-FI 5-ször több endogén DRD4 transzkriptumot tartalmaz a HeLa-hoz képest. Ez egy nagyságrendbeli különbség a denzitometriás eredményekhez viszonyítva. 57
59 Eredmények relatív DRD4 expresszió A IMR32 HeLa SK-N-FI Y79 CCF-STTG1 relatív 2 -ΔΔC T B IMR32 HeLa SK-N-FI Y79 CCF-STTG1 6. ábra: Öt sejtvonal által expresszált DRD4 mrns mennyiségének vizsgálata. A: DRD4 gén expressziójának vizsgálata RT-PCR-rel. Az mrns kivonatokból cdns-t készítettünk, melyből alacsony ciklusszámú PCR készült (27 ciklus). A gélen megfuttatott termékek kvantifikálása denzitometriával történt. Kontrollként a β-aktin szolgált. Az ábra a HeLa-ban detektált expressziós szintet ábrázolja egynek, a többi sejtvonal DRD4 mrns szintjét ennek függvényében fejeztük ki. B: A DRD4 gén expressziójának vizsgálata qpcr-rel. A cdns preparátumokból qpcr készült, kontrollként ismét a β-aktin gént használtuk. Az idegi eredetű sejtvonalak DRD4 mrns mennyiségét szintén a HeLa expressziós szintjének függvényében fejeztük ki A DRD4 promoter 5 deléciós sorozata Egy japán munkacsoport negatív szabályozó elemet azonosított a DRD4 gén promoterében. A silencer szakasz a transzkripciós starthelytől 5 irányban a 770. és 679. nukleotidok között helyezkedik el. 17 A DRD4 5 szabályozó régiójának jobb megismerése és a japán tanulmány eredményeinek igazolása érdekében 5 deléciós sorozatot készítettünk, melyek mindegyike a DRD4 promoterének egy adott részét tartalmazta (7. ábra). Az 5 szabályozó régió ezen szakaszait pgl3-basic (pgl3-b) promoter nélküli riporter plazmidba klónoztuk a luciferáz riporter gén elé, így a vizsgált régiók a DRD4 helyett a luciferáz enzim génjét szabályozzák, annak az expressziós szintjére hatnak. A képződött luciferáz enzim mennyisége tehát a vizsgált promoter vagy szabályozó régió minőségéről, annak a transzkripcióra gyakorolt hatásáról ad információt. Minden transzfekciós kísérletben a pgl3-b promoter nélküli üres vektort használtuk kontrollnak, az itt mért luciferáz aktivitást vettük alap aktivitásnak, illetve egynek. Az ettől eltérő értékek az adott, éppen vizsgált promoter szekvenciára jellemzőek. Bizonyos kísérletekben a timidin-kináz erősen expresszáló promoterét tartalmazó konstruktum (ptk-luc) pozitív kontrollként szolgált. Munkánk során hat (A F), a DRD4 gén 5 szabályozó régiójának különböző hosszúságú szakaszait tartalmazó riporter konstruktumot hoztunk létre (7A. ábra), melyek a 3 végi pozíciója alapján két vektor sorozatra oszthatók. Az első három vektor 3 vége a
60 Eredmények es pozícióra esik, míg upsteram irányban eltérő hosszúságúak. Az A fragmentum (pdrd4-a riporter vektor) a promoter egy 1183 bp-os szakaszát jelenti ( 1571-től 389-ig), mely így magában foglalja a 616., a 615., és a 521. pozíciók SNP-i mellett a 120 bp dup hosszúság-polimorfizmust is. A B szakasz ( 799-től 389-ig) tartalmazza, a C fragmentumból ( ) azonban már hiányzik a Kamakura és munkatársai által leírt és fentebb említett negatív modulátor régió. A második vektor-trióba a D, E és F vektorok tartoznak, melyek 5 vége az A, B és C fragmentumokéval páronként megegyező, azonban 3 irányban a poromoter régió nagyobb szakaszát hordozzák, a 127-es pozícióban végződnek. Ennek megfelelően a D és E vektor hordozza, míg az F- ből hiányzik a feltételezett szabályozó elem. A 616 C/G, 615 A/G 120 bp dup 521 C/T ( 1479 / 1240) ATG B pdrd4-a pdrd4-d pdrd4-b pdrd4-e ( 1571 / 389) ( 799 / 389) ( 668 / 389) pdrd4-c pdrd4-f ( / 127) ( 799 / 127) ( 668 / 127) DR4-S1 DR4-S2 DR4-S3 DR4-AS1 DR4-AS2 7. ábra: A DRD4 gén promoterének 5 deléciós variánsai. A: A DRD4 gén promoterének különböző szakaszait tartalmazó fragmentumok. Az ábrán látható a DRD4 gén 5 szabályozó régiójának sematikus rajza néhány fontosabb polimorfizmus pozíciójával együtt. A világos téglalap a Kamakura és mtsai, a sötétebb pedig az általunk behatárolt negatív szabályozó régiót mutatja. Ezen kívül az A F promoter variánsok pontos helyzete is látható. B: A klónozó primerek. Az öt klónozó primer helyzetét, irányát és nevét mutatja a rajz. Az így megtervezett promoter konstruktumok mindössze öt klónozó primer segítségével létrehozhatók, melyek nevét, orientációját és pozíciójaát a 7B. ábra ás az 5. táblázat mutatja. A PCR körülmények optimalizálása után szensz és antiszensz primerek minden kombinációban használhatók egymással. I 59
61 Eredmények A DRD4 promoter deléciós analízise tranziens transzfekcióval négy sejtvonalban A DRD4 gén 5 szabályozó régiójának hat különböző hosszúságú változatát tartalmazó luciferáz riporter konstruktumokat (pdrd4-a-f) tranziensen transzfektáltuk SK-N-FI, Y79, IMR32 és HeLa sejtvonalakba. Az adott promoter szakasztól függő luciferáz enzim-aktivitást mértük, melyet a transzfekciós kontrollként használt β-galaktozidáz aktivitás értékekre normalizáltunk. A 15. táblázat a hat konstruktum relatív (β-galaktozidázra normalizált) luciferáz aktivitás értékeit mutatja a négy sejtvonalban. A kísérletek során a plazmid sorozat tagjai közül a pdrd4-b és C konstruktumokat jellemezte a legnagyobb luciferáz riporter fehérje szint. Ez a hatás mind a négy általunk vizsgált sejtvonalban megfigyelhető. Meg kell jegyezni, hogy a ptk-luc erős promoter tartalmú vektorhoz viszonyítva a pdrd4 konstruktumok relatív promoter aktivitása a HeLa sejtvonalban jóval kisebb volt az idegi eredetű sejtekhez képest. Ez összhangban van azzal a megfigyelésünkkel, hogy a HeLa sejtekben bár van, de nagyon kis mértékű az endogén DRD4 expresszió (lásd 5. és 6. ábra, 15. táblázat). Luciferáz/ β-gal arány SK-N-FI Y79 IMR32 HeLa pgl3-basic 3,52 ± 1,43 3,87 ± 0,09 3,7 ± 0,29 3,59 ± 0,13 pdrd4-a 10,35 ± 1 8,8 ± 1,29 6,77 ± 0,86 8,71 ± 0,78 pdrd4-b 31,63 ± 4,7 26,89 ± 4,51 10,56 ± 0,52 27,08 ± 1,54 pdrd4-c 34,09 ± 3,34 28,98 ± 4,61 9,45 ± 0,46 21,89 ± 0,99 pdrd4-d 0,42 ± 0,02 1,75 ± 0,15 1,97 ± 0,12 2,56 ± 0,14 pdrd4-e 1,66 ± 0,2 4,18 ± 0,38 1,76 ± 0,22 2,51 ± 0,31 pdrd4-f 1,75 ± 0,17 4,21 ± 0,23 1,77 ± 0,16 2,63 ± 0,3 ptk-luc 84,21 ± 10,76 114,97 ± 10,5 28,73 ± 2,29 172,35 ± 2, táblázat: A pdrd4 konstruktumok relatív luciferáz aktivitása. A relatív luciferáz aktivitás értékei három párhuzamos kísérlet átlagából adódnak. A táblázat a normalizált, így egymással összehasonlítható adatokat tartalmaz átlag + szórás formában. A kiemelt sorok a legnagyobb expressziójú konstruktumokat és a ptk-luc-hoz tartozó értékeket jelölik. A hat konstruktum mind a négy általunk vizsgált sejtvonalban egymáshoz nagyon hasonló expressziós mintázatot mutatott (8. ábra). Meglepő módon a pdrd4-d, E és F vektorok aktivitása alig volt mérhető, míg a pdrd4-a, B és C konstrukciók relatív luciferáz aktivitása jelentősen nagyobb volt a promoter nélküli pgl3-b-hez képest (P < 0,05). A 15. táblázat és a 8. ábra adatai alapján a B és C vektorok expressziót 60
62 Eredmények szabályozó hatása között nincs statisztikailag szignifikáns különbség annak ellenére, hogy a két vektor csupán a feltételezett negatív modulátor régió meglétében (B) illetve hiányában (C) különbözik egymástól. Másfelől viszont a pdrd4-a luciferáz aktivitása lényegesen alacsonyabb volt, mint a B konstruktumhoz tartozó értékek (P < 0,001, 8. ábra). Ez a megfigyelés arra enged következtetni, hogy egy negatív szabályozó szakasz a és 800. nukleotidok között helyezkedik el, szemben a korábban leírt 770 és 679 közötti pozícióval. 17,I relatív Relative luciferáz luciferase aktivitás activity SK-N-FI P< *** *** * relatív Relative luciferáz luciferase aktivitás activity Y79 P< *** *** * 0 pgl3-basic pdrd4-a pdrd4-b pdrd4-c pdrd4-d pdrd4-e pdrd4-f 0 pgl3-basic pdrd4-a pdrd4-b pdrd4-c pdrd4-d pdrd4-e pdrd4-f relatív Relative luciferáz luciferase aktivitás activity IMR32 P< *** *** *** Relative relatív luciferáz luciferase aktivitás activity HeLa P< *** *** ** 0 pgl3-basic pdrd4-a pdrd4-b pdrd4-c pdrd4-d pdrd4-e pdrd4-f 0 pgl3-basic pdrd4-a pdrd4-b pdrd4-c pdrd4-d pdrd4-e pdrd4-f 8. ábra: Az 5 deléciók hatása a DRD4 gén promoter aktivitására négy sejtvonalban. Az ábrán négy sejtvonalban mért, a pdrd4-a-f konstruktumokhoz tartozó relatív luciferáz aktivitások szerepelnek. A diagram egy reprezentatív kísérlet eredményét mutatja, ahol a pgl3- Basic aktivitását vettük 1-nek. *P < 0,05, **P < 0,01, ***P < 0,001. Az alacsony transzkripciós aktivitás ellenére a pdrd4-d, E és F vektorok expressziós mintázata nagyon hasonlít az A, B és C konstruktumokéra az SK-N-FI és Y79 sejtvonalakban (lásd 15. táblázat). Ez tehát azt jelenti, hogy azok a vektorok, amelyek a és 800. pozíció közötti szakaszt tartalmazzák, (A és D) alacsonyabb transzkripciós aktivitást mutatnak a fenti szakaszt nem tartalmazókhoz képest (B, C és E, F), azaz adataink alapján a és 800. pozíció között egy silencer régió feltételezhető. I 61
63 Eredmények 5.4 A DRD4 gén promoterében található polimorfizmusok funkcionális vizsgálata A dopamin D4-es receptor gén 5 szabályozó régiója rendkívül polimorf. Ezen allélvariációk helyzetüknél fogva befolyással lehetnek a gén transzkripciójára. Munkánk során három SNP ( 616 C/G, 615 A/G, 521 C/T) és egy hosszúság polimorfizmus (120 bp dup) génexpresszióra gyakorolt hatását vizsgáltuk. Egy-egy polimorfizmus hatása azonban rendkívül kicsi lehet, és feltehető, hogy hatásuk egyenként az in vitro sejtes rendszerben nem minding mérhető. Ezért, ahogy az asszociáció-analízisekben, úgy a funkcionális vizsgálatoknál is egyre inkább előtérbe kerül a különböző allélvariációk haplotípus elemzése A promoterben található SNP-k hatása a DRD4 gén expressziójára A 521 C/T SNP funkcionális hatásának vizsgálatára a pdrd4-c fragmentumot választottuk, mert ez a konstruktum mutatta a legnagyobb transzkripciós aktivitást minden általunk használt sejtvonalban. A C és T allélokat tartalmazó vektorokat irányított mutagenezissel hoztuk létre. A pdrd4-c a 616. és a 615. pozíció polimorfizmusait is tartalmazza, ezért a 521 C/T változatait a gyakoribb allélokkal együtt, azaz 616 C és 615 A háttér mellett vizsgáltuk. A pdrd4-c( 521C) és ( 521T) vektorok tehát csak a vizsgált polimorfizmusban tértek el egymástól, amit szekvenálással ellenőriztünk. A tranziens transzfekciót idegi eredetű, SK-N-FI, Y79 és IMR32 sejtvonalakon végeztük. Mindhárom sejtvonalban a pgl3-b promoter nélküli kontroll vektorhoz viszonyítva magas β-galaktozidázra normalizált luciferáz aktivitást mértünk mindkét, a különböző allélokat hordozó konstruktum esetén (9. ábra). relatív luciferáz aktivitás SK-N-FI relatív luciferáz aktivitás Y79 relatív luciferáz aktivitás IMR pgl3- Basic pdrd4-c 521C pdrd4-c 521T pgl3- Basic pdrd4-c pdrd4-c 521C 521T pgl3- Basic pdrd4-c pdrd4-c 521C 521T 9. ábra: A 521 C/T SNP hatása a DRD4 gén promoter aktivitására. Az ábra az SK-N-FI, az Y79 és az IMR32 idegi eredetű sejteken végzett transzfekciós kísérletek eredményeit ábrázolja. A pdrd4-c konstruktumok relatív luciferáz aktivitása a pgl3-b kontroll vektor aktivitásának függvényében látható. A diagram egy reprezentetív kísérlet eredményét mutatja. 62
64 Eredmények Azaz nem találtunk szignifikáns különbséget a 521 C és T allélváltozatot tartalmazó konstruktumok promoter aktivitása között egyik általunk vizsgált sejtvonalban sem. I Ugyan az Y79 sejtek esetén némi eltérés látható a két allél között, a C allél magasabb aktivitásúnak tűnik, ez azonban csak tendencia szintű eltérést jelent, a különbség nem szignifikáns. A 521 C/T SNP expresszióra gyakorolt hatásának vizsgálatát elvégeztük 616 G A és 616 G G háttér mellett is SK-N-FI sejtvonalban, azonban itt sem találtunk eltérést a két allél transzkripciós aktivitásai között (ezeket a kísérleteket nem mutatom be részletesen). Megkezdtünk néhány előkísérletet a 616 C/G és a 615 A/G SNP-k transzkripciós szabályozásban betöltött szerepének vizsgálatára. Kísérleteinket elsősorban SK-N-FI sejtvonalon végeztük. A 616 C/G polimorfizmust több haplotípus háttér mellett is vizsgáltuk, ezidáig azonban nem találtunk különbséget az egyes alléloknak megfelelő konstruktumok transzkripciós aktivitása között (ezeket az eredményeket dolgozatomban nem részletezem) A 120 bp duplikáció hatása a DRD4 gén expressziójára A 5.2. fejezetben bemutatott genetikai asszociáció-vizsgálataink eredményei a 120 bp duplikáció fontosságára utaltak a figyelemhiányos hiperaktivitási zavar hátterében. A DRD4 gén pontos szerepe ebben a rendellenességben még nem ismert, arra azonban vannak irodalmi adatok, hogy a 120 bp hosszúság-polimorfizmus részt vehet a DRD4 gén transzkripciójának szabályozásában. A 120 bp dup génexpresszióra gyakorolt hatásának vizsgálatára három különböző plazmid konstruktumot hoztunk létre. A hosszúság-polimorfizmus hatása a pdrd4-a és a D fragmentumokon vizsgálható (lásd 7A. ábra), mert csak ezek tartalmazzák ezt az ismétlődési variációt. A választásunk az A fragmentumra esett, melynél az előzőekben azonosított negatív moduláló szakasz ellenére is jól mérhető a transzkripciós aktivitása (lásd 15. táblázat, 8. ábra). A 120 bp dup 1-szeres, 2-szeres és az általunk leírt 4-szeres változatát pgl3-basic riporter plazmidba klónoztuk a DR4-S1 és DR4-AS1 primerpár segítségével. A riporter vektorok a gyakran vizsgált SNP-k gyakoribb allélját hordozták, azaz 616 C, 615 A és 521 C háttérrel készültek. 63
65 Eredmények relatív luciferáz aktivitás Y79 ** *** relatív luciferáz aktivitás 2,5 2 1,5 1 0,5 SK-N-FI *** *** 0 pgl3-b pgl3-b relatív luciferáz aktivitás HeLa * 0 pgl3-b ábra: A 120 bp duplikáció hatása a DRD4 gén expressziójára. A pdrd4-a konstruktumok relatív luciferáz aktivitása a pgl3-b kontroll vektor aktivitásának függvényében látható. A diagram egy reprezentetív kísérlet eredményét mutatja, az 1, 2, 4 a 120 bp dup előfordulási számát jelenti a promoterben.* P < 0,05; ** P < 0,01; *** P < 0,001 Mindhárom vizsgált sejtvonalban (két idegi eredetű sejtvonalban és HeLa sejtekben) kimutatható volt a 120 bp dup dózis-függő hatása, azaz minél több példányban volt jelen a 120 bp-nyi szakasz a promoter-konstruktumban, annál erősebben csökkent a DRD4 promoter in vitro mért transzkripciós aktivitása. A 120 bp szekvencia egyszeres kópiáját tartalmazó DRD4 szabályozó régió szignifikánsan nagyobb luciferáz aktivitást váltott ki az Y79 (P < 0,01), SK-N-FI (P < 0,001) és HeLa (P < 0,05) sejtvonalakban, mint a kétszeres 120 bp változatot hordozó konstruktumok (10. ábra). Szignifikáns különbséget találtunk továbbá a 2-szeres és 4-szeres változat transzkripcióra gyakorolt hatása között is. A 120 bp-nyi szakaszt négyszer tartalmazó promoter régió mutatta a legalacsonyabb aktivitást az SK-N-FI és az Y79 (P < 0,001) sejtekben. Ezen eredmények alapján a 120 bp-nyi régió a DRD4 promoterben represszor hatású, és a növekvő ismétlődési szám erősebb csökkenést eredményez a promoter szakasz transzkripciós aktivitásában (1-szeres > 2-szeres > 4-szeres ismétlődés). Munkánk során tehát in vitro rendszerben sikerült bizonyítanunk a 120 bp ismétlődési polimorfizmus 64
66 Eredmények funkcionális hatását. Megállapítottuk, hogy ez a hatás dózis-függő módon nyilvánul meg, azaz minél nagyobb az ismétlődési szám, annál jobban csökken a promoter aktivitása. II A különböző promoter haplotípusok hatása a DRD4 gén expressziójára Az asszociáció-vizsgálatok során megfigyeltük, hogy az 1-C-A-T (120 bp dup C/G A/G C/T) haplotípus gyakrabban fordul elő az ADHD-s gyerekek csoportjában, mint a kontroll populációban. Ezen kívül gyenge összefüggést találtunk az ADHD előfordulása és a 2-C-A-C kombináció hiánya között is (lásd fejezet). A 120 bp dup 616 C/G 615 A/G 521 C/T 2 C A T Luc B IMR32 Y79 2 C A C Luc 1 C A T Luc 1 C A C Luc P < 0,1 pgl3-basic Luc DRD4 promoter, A fragmentum relatív luciferáz aktivitás 11. ábra: A 120 bp duplikáció és a 521 C/T SNP haplotípusainak funkcionális analízise. A: A promoter konstruktumok vizsgált haplotípusai. A haplotípus jelölésében a 120 bp dup (1 vagy 2), a 616 C/G (C vagy G), a 615 A/G (A vagy G) és a 521 C/T (C vagy T) megfelelő alléljai követik egymást. B: A négy promoter haplotípus relatív luciferáz aktivitása. Világos oszlopok: IMR32 sejtvonalon kapott adatok; sötét oszlopok: Y79 sejteken kapott eredmények. Az adatokat a pgl3-basic vektor alap aktivitására normalizáltuk. A diagram egy reprezentatív kísérlet eredményét mutatja. Ezért a 120 bp dup és a 521 C/T SNP által alkotott promoter haplotípusok molekuláris szinten kifejtett funkcionális hatását is megvizsgáltuk. Olyan pdrd4-a konstruktumokat hoztunk létre, melyek csupán a 120 bp duplikáció és a 521 C/T SNP szempontjából különböztek egymástól (11A. ábra). A 120 bp dup C/T különböző kombinációit hordozó vektorokat 616 C és 615 A háttérrel készítettük el (11A. ábra), mert ezek az SNP-k gyakoribb alléljai, valamint ezeket tartalmazták azok a haplotípusok, melyek az asszociáció-analízisben összefüggést mutattak az ADHD előfordulásával. A transzfekciós kísérleteket két idegi eredetű sejtvonalon (IMR32 neuroblasztóma és Y79 retinoblasztóma) luciferáz riporter rendszerben végeztük. A
67 Eredmények bp dup és a 521 C/T SNP összes lehetséges variációjaként négy haplotípust hoztuk létre pgl3 luciferáz riporter vektorban, mely a DRD4 promoter egy adott szakaszát ( 1571 és 389 között) tartalmazza 616 C és 615 A háttér mellett. Viszonyítási alapkét a pgl3-basic promoter nélküli vektor szolgált. A 11B. ábra a promoter konstruktumok pgl3-b-re normalizált relatív luciferáz aktivitásait mutatja két sejtvonalban megmérve. Ebben a kísérleti felállásban nem találtunk szignifikáns különbséget a négy haplotípus transzkripciós aktivitása között, bár a 120 bp dup hosszabb allélját hordozó konstruktumok tendenciózusan alacsonyabb expressziót eredményeztek (1-C-A-C > 2-C-A-C, 11B. ábra). II A 616 C/G 615 A/G 521 C/T C A C Luc B SK-N-FI Y79 G A C Luc G G C Luc * C G C Luc pgl3-basic Luc DRD4 promoter, C fragmentum relatív luciferáz aktivitás 12. ábra: A 616 C/G és 615 A/G SNP-k haplotípusainak funkcionális analízise. A: A promoter konstruktumok vizsgált haplotípusai. A 616 C/G és a 615 A/G SNP-k négy haplotípusát hoztuk létre pgl3 luciferáz riporter vektorban, mely a DRD4 promoter egy adott szakaszát ( 668 és 389 között) tartalmazza 521 C háttér mellett. A haplotípus jelölésében a 616 C/G, a 615 A/G és a 521 C/T megfelelő alléljai követik egymást. B: A négy promoter haplotípus relatív luciferáz aktivitása. A kísérletet SK-N-FI és Y79 sejtekben végeztük, az adatokat a pgl3-basic vektor alap aktivitására normalizáltuk. *Az SK-N-FI sejtvonalban a G- G-C haplotípus transzkripciós aktivitása szignifikánsan kisebb (P < 0,01), mint bármely más kombinációé. A diagram egy reprezentatív kísérlet eredményét mutatja. A 120 bp duplikáción és a 521 C/T SNP-n kívül megvizsgáltuk a 616 C/G és 615 A/G SNP-k kombinációinak a DRD4 transzkripciójára gyakorolt esetleges módosító hatását is. A négy haplotípus vizsgálatához a pdrd4-c fragmentumot választottuk, mert ez mutatta a legnagyobb, legjobban mérhető transzkripciós aktivitást a vizsgált sejtvonalakban. Mivel a C fragmentum ( 668 és 389 között) a vizsgált két SNP-n kívül a 521 C/T polimorfizmust is tartalmazza, a 521 C hátteret választottuk mind a négy vektor esetén (12A. ábra). A tranziens transzfekciót SK-N-FI neuroblasztóma és Y79 retinoblasztóma sejtvonalakon végeztük. A kísérlet eredményeit a 12B. ábra mutataja.
68 Eredmények Az SK-N-FI és az Y79 sejtek esetén is jól látható, hogy a G-G haplotípus ( 616 G G) relatív luciferáz aktivitása kisebb a másik három változathoz képest. Az Y79 sejtvonalban ez a különbség statisztikailag nem jelentős, valószínűleg a mérési eredmények viszonylag nagy szórása miatt. Ezzel szemben az SK-N-FI sejtvonalban a G-G haplotípusra jellemző transzkripciós aktivitás szignifikánsan kisebb (P < 0,01), mint bármely más kombinációé. Mivel a két SNP egymás melletti pozícióban helyezkedik el a kromoszómán, feltehetően nagyobb hatással lehetnek a gén expressziójára egy esetleges transzkripciós faktor kötőhelyének viszonylag nagy mértékű módosításán keresztül. 67
69 Eredmények megbeszélése 6 EREDMÉNYEK MEGBESZÉLÉSE 6.1 A DRD4 promoter polimorfizmusainak asszociáció-vizsgálata ADHD-ban Munkánk során genetikai asszociáció-analízist végeztünk a dopamin D4-es receptor gén promoterének négy polimorfizmusa és az ADHD előfordulása között. A 120 bp duplikáció, a 521 C/T SNP és a 616 C/G SNP mellett a nemrég leírt 615 A/G változatot is vizsgáltuk külön-külön és haplotípusban. 40 Az eset-kontroll vizsgálat mellett preferenciális allél-átadás analízist is végeztünk A promoter polimorfizmusok asszociáció-vizsgálata ADHD-ban Az eset-kontroll megközelítést alkalmazva nem találtunk összefüggést sem az allélgyakoriság, sem a genotípus-frekvencia esetén a vizsgált SNP-k és az ADHD között. Ennek megfelelően a család-analízis módszere sem adott statisztikailag értékelhető eredményt. Ezzel szemben a 120 bp duplikáció 1-szeres, rövid változata szignifikánsan gyakoribb volt a beteg csoportban, mind allél-, mind pedig genotípus-gyakoriság tekintetében. II Ezt a preferenciális allél-átadás vizsgálat (TDT) azonban nem erősítette meg, valószínűleg azért, mert az elemzésben csak a heterozigóta szülők vesznek részt, így lényegesen lecsökken az értékelhető esetek száma. Bár egy közelmúltban megjelent tanulmány pozitív asszociációt talált a DRD4 promoter SNP-k és az ADHD között, 70 néhány negatív eredmény is ismert. 43,69 Ehhez hasonlóan a 120 bp duplikációról szóló irodalomi adatok is ellentmondásosak. Néhány munka a 2-szeres ismétlődési formát tartja a figyelemhiányos hiperaktivitási zavar rizikófaktorának, 65,66 míg mások ezt nem erősítik meg. 43,67,69,103 Eredményeink alapján mi azt feltételezzük, hogy a 120 bp dup rövid formája az ADHD egy lehetséges genetikai rizikófaktora. Ezt az elképzelést támasztja alá a 120 bp dup 1-szeres változata és az újdonságkereső személyiségjegy közötti pozitív asszociáció is, ugyanis az újdonságkeresés személyiségjegy és az ADHD bizonyos tünetei között közös jellemzők fordulnak elő A promoter haplotípusok asszociáció-vizsgálata ADHD-ban Az asszociáció-vizsgálatok erősen ellentmondásos eredményei újabb megközelítési módokat tesznek szükségessé. Feltételezhető, hogy az egyes allél-variációk esetleges hatása meglehetősen kicsi és ezt az effektust más polimorf változatok befolyásolhatják, 68
70 Eredmények megbeszélése növelve vagy kioltva ezzel azok hatását. 104 Ennek megfelelően az allél-variációk egyenkénti vizsgálata helyett egyre inkább előtérbe kerülnek az ún. haplotípuselemzések. A haplotípus a szomszédos polimorfizmusok adott kromoszómára vonatkozó relatív helyzetét írja le. A legtöbb, DRD4 haplotípusokkal foglalkozó tanulmány elsősorban a preferenciális allél-átadás vizsgálattal dolgozik, azaz a haplotípusokat a családfa elemzése alapján határozza meg. Barr és munkacsoportja a TDT módszerével nem talált összefüggést a DRD4 promoter haplotípusai és az ADHD között. 80 A harmadik exonban található 48 bp VNTR haplotípushoz kapcsolása után azonban egy kombináció (120 bp dup 2-szeres ismétlődés C T - 48 bp VNTR 7-szeres ismétlődés) preferenciális transzmisszióját figyelték meg a szülőkből a beteg gyermekekbe. Egy másik munka a 120 bp dup 2-szeres ismétlődését és a 616 C C allélokat tartalmazó kombinációval talált gyenge, de szignifikáns asszociációt. 69 Lowe és munkatársai csak a 120 bp duplikáció és a 616 C/G SNP haplotípusát vizsgálták és a 2-C haplotípust preferenciális átadódását mutatták ki. 70 A dolgozatban bemutatott vizsgálatok során nem tudtuk megismételni egyik előző eredményt sem. Meg kell azonban említeni, hogy a felsorolt haplotípus tanulmányok mindegyike vagy statisztikai programokat használt a haplotípus-gyakoriságok meghatározására, vagy családi triók genotípus adataiból számolta azt. A becslő programok által kapott haplotípusgyakoriság csak közelítő érték, az egyes személyekhez tartozó pontos haplotípuskombinációkról nem tudnak adatot szolgáltatni. A családi triók használatának hátránya, hogy egy családi hármas genotípus adataiból nem minden esetben határozható meg a haplotípus, ami így adatvesztést eredményez. Az adatvesztés ráadásul szelektív: nem véletlenszerűen esnek ki családok a vizsgálatokból, hanem éppen azok, akiknél több polimorfizmus esetén is heterozigócia fordul elő. Azért, hogy a becslő módszerek és a család-vizsgálatok alapján létrehozott haplotípus-elemzések hibáit elkerüljük, a dolgozatban bemutatott vizsgálatokban megfelelő PCR-módszerekkel közvetlenül határoztuk meg a szomszédos polimorfizmusok haplotípusait (molekuláris haplotipizáló módszerek). 97,III Így biztosítottuk, hogy minden egyes személyhez a valós DRD4 promoter haplotípust rendeljük, és kísérletileg meghatározott haplotípusgyakoriságokkal számoljunk. A molekuláris haplotípus meghatározó módszerek felhasználásával sikerült statisztikai szempontból szignifikáns asszociációt kimutatnunk 69
71 Eredmények megbeszélése az ADHD és az 1-C-A-T (120 bp dup 1-szeres ismétlődés C A T) haplotípus előfordulása között. II 6.2 A DRD4 endogén expressziójának vizsgálata öt sejtvonalban A transzfekciós kísérletek előtt két különböző módszerrel megvizsgáltuk a használni kívánt sejtvonalak endogén DRD4 expresszióját. Mind az RT-PCR, mind a qpcr módszerrel jelentős mennyiségű DRD4 mrns-t mutattunk ki az SK-N-FI, Y79, IMR32 és CCF-STTG1 sejtekben (lásd 5. és 6. ábra). Ezen kívül a HeLa sejtekben is találtunk kis mértékű, de jól detektálható transzkripciót. Ez megerősíti egy a közelmúltban publikált közlemény eredményeit, 37 de ellentmond egy korábbi irodalmi adatnak. 17 D Souza és munkacsoportja hozzánk hasonlóan qpcr módszerével mutatott ki jól mérhető DRD4 expressziót HeLa sejtekben. 37 Ezzel szemben Kamakura és munkatársai RT-PCR technikát alkalmazva vizsgálták a DRD4 mrns szintet, és nem találtak kimutatható mértékű endogén expressziót ebben a sejtvonalban. 17 Vizsgálatainkban mindkét módszert használtuk, és mindkettővel detektálható mértékű DRD4 transzkriptumot tudtunk kimutatni, bár a DRD4 expresszió mértéke nem érte el az angol tanulmányban közölt szintet. DRD4 expresszió HeLa SK-N-FI Y79 IMR32 CCF- STTG1 RT-PCR 1,0 4,4 5,6 8,3 8,8 qpcr 1,0 4,7 23,5 44,7 46,0 16. táblázat: Az endogén DRD4 expresszió relatív mértéke öt sejtvonalban. A sejtvonalak DRD4 mrns mennyiségét mindkét módszer esetén a HeLa által expresszált DRD4 szintre normalizáltuk. A táblázat értékei így azt mutatják, hogy hányszoros az expresszió a HeLában mérthez képest. Az öt sejtvonalon RT-PCR-rel és a qpcr-rel mért endogén DRD4 expressziós szintek HeLa-ra vonatkoztatott értékeit a 16. táblázat foglalja össze. Mindkét módszerrel közepes expressziós szintet mértünk az SK-N-FI és Y79 sejtvonalakban. Nagymértékű DRD4 transzkripciót az IMR32 és CCF-STTG1 sejtekben detektáltunk. A két módszer érzékenysége közti különbség jól látszik az 16. táblázatban feltűntetett értékekből. A viszonylag gyengén expresszáló SK-N-FI sejtek esetén mindkét mérés hasonló értékeket mutatott. A nagyobb mértékű endogén DRD4 expresszióval rendelkező sejttípusoknál azonban a két módszer által detektált értékek egyre jobban eltértek 70
72 Eredmények megbeszélése egymástól annak ellenére, hogy a sorrend nem változott. Ez a jelentős különbség azzal magyarázható, hogy az RT-PCR esetén a denzitometriás mérés már a PCR plató fázisában vagy ahhoz közel történik, ahol a kiindulási mrns mennyiség és a képződött PCR-termék mennyisége nem arányos egymással. Ezzel szemben a qpcr során az amplifikáció exponenciális szakaszában mértünk, vagyis jóval azelőtt, hogy a reakció a telítési szakaszba kerülne, így a kezdeti mrns-mennyiség megbízhatóan megállapítható. Mindennek ellenére mindkét módszerrel ugyanazt a sorrendet tudtunk felállítani a vizsgált sejttípusok endogén DRD4 expressziós szintjét tekintve (HeLa << SK-N-FI < Y79 < IMR32 = CCF-STTG1, 16. táblázat). 6.3 A DRD4 gén promoterének karakterizálása A dopamin D4-es receptor gén expressziójának szabályozása rendkívül nagy jelentőségű, hiszen a receptor által közvetített neurotranszmisszió fontossága az agyban igen jól ismert. Ezen kívül a gén nagymértékben polimorf. Ez a változatosság érinti a kódoló és nem-kódoló régiót, ezen belül az 5 szabályozó szekvenciát is. A promoter polimorfizmusok számos asszociáció-vizsgálatban szerepelnek, de funkcionális hatásuk ezidáig még egyértelműen nem tisztázott. A DRD4 transzkripció szabályozásának megismérésében a kezdeti lépéseket Kamakura és munkacsoportja tette meg. 17 A DRD4 promoter karakterizálását kloramfenikol-acetiltranszferáz riporter rendszerben, IMR32, Y79 és HeLa sejteken végezték. Meghatároztak egy szövet-specificitásért felelős minimál promotert a 591 és 123 régióban, mi azonban nem tudtunk kimutatni sejttípustól függő expressziót a vizsgált konstruktumokban az általunk alkalmazott in vitro kísérleti rendszerben. A promoter konstruktumok transzkripciós aktivitása nagyon hasonló expressziós mintázatot mutatott minden általunk használt sejtvonalban, beleértve a nem neuronális eredetű HeLa sejteket is (8. ábra). I Azt azonban meg kell említeni, hogy a szövet-specifikus génexpresszió általános a dopamin receptor család többi tagjánál. 105,106,107,108,109,110 Ez felveti annak a lehetőségét, hogy a DRD4 gén esetében szintén létezhet valamiféle a szöveti megoszlásért felelős szabályozó mechanizmus, amely azonban még nem ismert, feltárására további vizsgálatok szükségesek. Az általunk előállított DRD4 promoter szakaszokat tartalmazó vektorok két fő csoportra oszthatók, a pdrd4-a, B és C plazmidok csoportja közel tízszer nagyobb transzkripciós aktivitással rendelkezik, mint a D, E és F vektorok csoportja. 71
73 Eredmények megbeszélése Pontosabban a D, E és F konstruktumok aktivitása a pgl3-b üres vektoréhoz volt hasonló, bizonyos esetekben még azt sem érte el (lásd 15. táblázat). Ez igen meglepő eredmény annak ismeretében, hogy a D F plazmid sorozat igen hasonló a japán tanulmányban szereplőkhöz (13. ábra). Némi eltérés azonban adódott, mert az általunk vizsgált három plazmid 3 vége a 127. pozícióba esik, míg a japán kutatócsoporté a 123. nukleotidra. Az 5 végek között valamivel nagyobb eltérés található a fragmentumok méretében (13. ábra), ez azonban nem indokol ilyen markáns transzkripciós szintbeli eltérést. A B ábra: A DRD4 promoter karakterizálása során használt fragmentumok. A: Kamakura és munkatársai által készített promoter fragmentumok. Az ábrán a promoter szakaszok pozíciója látható. A szürke téglalap az általuk meghatározott represszor feltételezett helyzetét mutatja. B: Munkacsoportunk által használt promoter fragmentumok. Az ábra a szakaszok pontos pozícióját mutatja. A fekete téglalap a mi rendszerünkben azonosított negatív szabályozó szakasz helyzetét jeleníti meg. Egy lehetséges magyarázat a D F promoter fragmentumok inaktivitására az lehet, hogy a 389. és 127. nukleotidok között (ezen szakasz megléte a különbség az A C és D F konstruktumok között, lásd 7. ábra) négy start kodon (ATG) található a szekvenciában ( 361, 346, ), melyek közül három nem a luciferáz enzim génjének leolvasási keretébe esik. Így előfordulhat, hogy bár a transzkripciós apparátus felépül, az mrns átíródik, de az innen induló transzláció eredményeként funkcióképtelen enzim képződik, így annak aktivitása sem mérhető. I Az is elképzelhető azonban, hogy ez a A B C D E F 72
74 Eredmények megbeszélése szakasz egy rendkívül erős silencert tartalmaz, ez a feltételezés azonban még további megerősítésre szorul. A pdrd4-b ( ) és C ( ) konstruktumok transzkripciós aktivitásának összehasonlító analízise kiemelkedően fontos volt a Kamakura és mukacsoportja által leírt negatív szabályozó elem ( ) vizsgálata szempontjából. 17 Kísérleteink során azonban nem tudtunk különbséget kimutatni a két promoter régió között egyik sejtvonalban sem. A B és C konstruktumok által kiváltott génexpresszió gyakorlatilag egyforma volt (lásd 15. táblázat), ezzel szemben az A ( ) és B ( ) promoter szakaszok között szignifikáns in vitro transzkripciós aktivitásbeli különbséget tapasztaltunk. Az A fragmentum minden vizsgált sejtvonalban jóval gyengébben expresszálódott a B változathoz képest. Ez a megfigyelés arra enged következtetni, hogy az A és B fragmentumok által kijelölt és 800. nukleotidok között egy negatív szabályozó szakasz helyezkedik el. I Az általunk használt kísérleti felépítésből kitűnik, hogy ez egy, a japán kutatócsoport által talált szabályozó elemtől eltérő, újonnan leírt reguláló szekvencia. relatív luciferáz aktivitás 1,5 1 0,5 0 pgl3- Basic SK-N-FI P< 0,001 pdrd4-d pdrd4-e pdrd4-f relatív luciferáz aktivitás 1,5 1 0,5 0 pgl3- Basic Y79 P < 0,001 pdrd4-d pdrd4-e pdrd4-f 14. ábra: A kis aktivitású DRD4 promoter konstruktumok elemzése. A kísérleteket SK-N- FI és Y79 sejteken végeztük. A pdrd4-d, E és F konstruktumok relatív luciferáz aktivitása a pgl3-b kontroll vektor aktivitásának függvényében ábrázolva. A diagram egy reprezentetív kísérlet eredményét mutatja. Érdekes módon az inhibitoros szakasz hatása a gyengén expresszálódó D, E és F fargmentumok transzkripciós aktivitásában is megmutatkozik. Két sejtvonalban (SK-N- FI és Y79) a represszort tartalmazó D fragmentum transzkripciója közel felére csökkent a silencert nem tartalmazókhoz képest (E, F, lásd 15. táblázat és 14. ábra). Ez a hatás a HeLa és IMR32 sejtekben már nem figyelhető meg, feltételezhetően a pgl3-b üres vektorhoz hasonló kis aktivitásuk miatt. Arra azonban nem találtunk magyarázatot, hogy az általunk használt kísérleti rendszerben miért nem tudtuk kimutatni a korábban 73
75 Eredmények megbeszélése leírt silencer szakaszt. Összességében ezen eredmények alapján a DRD4 gén promoterében két negatív szabályozó szekvencia megléte valószínűsíthető, bár ezek közül csak egyik működött az általunk használt sejtes rendszerben. Ez a feltételezett génszerkezet nem egyedülálló a dopamin receptorok körében, hiszen a patkány dopamin D2-es és D3-as, valamint a Drosophila Dmdop1 receptor gén promotere szintén tartalmaz két inhibitor tulajdonságú szakaszt. 106,111,112 Természetesen a kép nem ennyire egyszerű, hiszen a dopamin receptorok promoter szerkezete jelentős heterogenitást mutat a szabályozó elemek száma és minősége szempontjából. A már említett patkány dopamin D2-es és a Drosophila Dmdop1 receptora például a két silencer mellett egy további aktiváló régiót is hordoz. 108,112 Ezen kívül ismert még a humán dopamin D1A és D5-ös receptorok promoter szerkezete, melyekben számos pozitív és negatív reguláló elemet azonosítottak. 105,109 A szabályozó elemek száma és szerkezete mellett azonban a DRD4 gén 5 szabályozó régiójának pontos határai sem teljesen tisztázottak. Egy tanulmány szerint a fentiekben leírt, a DRD4 promotereként ismert szekvencia egy intronikus régióban helyezkedik el. 113 Ez az elképzelés azon alapul, hogy különböző tanulmányok különböző hosszúságú DRD4 mrns-t azonosítottak. Egy humán retinoblasztóma (SK-N-MC) sejtvonalból, valamint patkány és majom agy különböző területeiről (striatum, medulla, frontális kéreg, limbikus rendszer) izolált sejtekben a DRD4 mrns 5,3 kb hosszúságúnak adódott. 114 Ezzel szemben egy másik vizsgálat rövidebb DRD4 transzkriptumot azonosított (1,5 kb), mely nagy mennyiségben a corpus callosumban, a medulla és a subthalamicus magok területén, valamint a mesolimbicus régióban expresszálódik nagyobb mennyiségben, a striatumban és a frontális kéregben azonban, a korábbi eredményekkel ellentétben, alig detektálható. 115 Így elképzelhető, hogy a génben alternatív transzkripciós start helyek találhatók, melyek közül az egyik egy intron része, amely így rövidebb transzkriptumot eredményez. Az ehhez hasonló gén szerkezet nem egyedülálló a neurotranszmisszióban résztvevő fehérjék esetén, hiszen például a katekol-o-metiltranszferáz transzkripciója nagyon hasonló mechanizmussal történik, mely szintén két különböző hosszúságú mrns-t eredményez. 116 Todd és O Malley szerint az is elképzelhető, hogy az a szakasz, amelyet a szakirodalom a DRD4 gén promotereként tart számon és vizsgál, valójában egy nagy kiterjedésű intronban található, mely a kódoló és a nem transzlálódó exonokat választja el. 113 Ez a feltételezés 74
76 Eredmények megbeszélése még nem bizonyított, azonban hasonló promoter struktúrát már leírtak mind a dopamin D2-es, 110,111,117 mind a D3-as receptor esetén. 106 Összességében a DRD4 gén 5 szabályozó régióját nagyfokú komplexitás jellemzi, melyet minden részletében még nem ismerünk, így a gén további karakterizálása, a core promoter pontosabb behatárolása és a transzkripciós start hely vagy helyek pontos meghatározása további kutatásokat igényel. 6.4 A DRD4 promoter polimorfizmusok hatása a génexpresszióra A szakirodalomban egyre inkább előtérbe kerül az asszociáció-vizsgálatok mellett a polimorfizmusok funkcionális analízise. Különösen nagy figyelmet fordítanak a szabályozó régiókban taláható SNP-kre és hosszúság-polimorfizmusokra. Egy-egy ilyen allélváltozat transzkripciót befolyásoló hatása ugyanis könnyen elképzelhető elsősorban a transzkripciós apparátus bizonyos elemeinek az adott szekvenciához való kötődési affinitásának megváltoztatásán keresztül. Mivel ezek viszonylag jól elterjedt allélváltozatok, az egyes variánsoknál drasztikusan eltérő hatás nem várható. A kis különbségek megbízható vizsgálatához azonban jól kidolgozott, kontrollokkal megfelelően ellátott kísérleti rendszerekre és számos ismétlésre van szükség SNP-k hatása Munkánk egyik célja a dopamin D4-es receptor promoterében található, asszociációvizsgálatokban gyakran szereplő 521 C/T SNP génexpresszióra gyakorolt hatásának összehasonlító vizsgálata volt. Okuyama és munkatársai előzetesen kimutattott némi transzkripciót moduláló hatást, mely szerint a T allélt 40%-kal kisebb aktivitás jellemzi a C allélhoz képest. 38 Ezt azonban mindössze egy sejtvonalon (Y79 retinoblasztóma) vizsgálták. Kísérleti rendszerünkben azonban nem találtunk szignifikáns különbséget a két allél génátírásra gyakorolt szerepében, sem a már vizsgált Y79, sem az újonnan tesztelt SK-N-FI és IMR32 sejtvonalakban (lásd 9. ábra). I Érdekes megfigyelés azonban, hogy az Y79 sejteken végzett transzfekció eredménye hasonlóságot mutat a japán tanulmányban leírtakhoz, de ez a különbség nem szignifikáns. (15. ábra). Felvetődhet az a lehetőség, hogy a 521 C/T SNP hatása a vizsgált sejttípusok közül egyedül az Y79 retinoblasztóma sejtvonalban fejeződik ki, előfordulhat, hogy az adott transzkripciós apparátus bizonyos elemei, melyek a promoter ezen szakaszához kötődhet, csak ebben a retinoblasztóma sejtvonalban vannak jelen. 75
77 Eredmények megbeszélése A B 14 relatív luciferáz aktivitás relatív luciferáz aktivitás pcat- D4C pcat- D4T pcat- D4R pgl3- Basic pdrd4-c pdrd4-c 521C 521T ábra: A 521 C/T SNP gén expresszióra gyakorolt hatásának vizsgálata két különböző rendszerben. A: Okuyama és munkatársai eredményei. A vizsgálatot kloramfenikolacetiltranszferáz riporter rendszerben végezték egy 591 és 123 közötti szekvencián. A pcat- D4C a 521 C, a pcat-d4t a T allélt hordozza. A relatív luciferáz aktivitásokat a C allélt hordozó, fordított orientációjú fragmentumot tartalmazó (pcat-d4r) vektorra normalizálták. B: Munkacsoportunk eredményei. A vizsgálatot luciferáz riporter rendszerben végeztük egy 668 és 389 közötti szekvencián. A pdrd4-c 521C a 521 C, a pdrd4-c 521T a T allélt hordozza. A relatív luciferáz aktivitásokat a pgl3-b promoter nélküli vektorra normalizáltuk. A két tanulmány eredménye közötti ellentmondás adódhat azonban az eltérő kísérleti körülményekből is. A két munka különböző hosszúságú és helyzetű DRD4 promoter konstruktumokon vizsgálta a 521 C/T SNP hatását. A japán munkacsoport egy közötti szakaszt használt, míg mi a 668 és 389. nukleotidok közötti régiót klónoztuk riporter plazmidba (15. ábra). Ez meglehetősen nagy különbség a plazmid kostruktumok között, hiszen a szakirodalomban ismert, hogy a plazmidba klónozott promoter szakasz hossza, az 5 és a 3 végének pozíciója erősen befolyásolja az adott polimorfizmus vagy mutáció mérhető hatását. 118 Ezen kívül az alkalmazott riporter rendszer is eltérő volt, míg a japán csoport kloramfenikol-acetil-transzferáz alapú módszerrel dolgozott, mi a valamivel érzékenyebb luciferáz riporter rendszert használtuk. Természetesen azt sem lehet kizárni, hogy a vizsgált SNP-nek nincs különösebb expressziót befolyásoló szerepe, hiszen egyetlen nukleotid csere a nem kódoló régióban nem feltétlenül nyilvánul meg, illetve a hatás lehet olyan kicsi, hogy azt az általunk használt kísérleti rendszerekben nem mérhető. Nem szabad megfeledkezni ezen kívül arról sem, hogy a DRD4 5 szabályozó régiója rendkívül polimorf, számos SNP-t tartalmaz ( 1216, 1106, 809, 768, 616, 615, 603, 600, 376 pozíciók). Ezeket a 616 C/G és 615 A/G SNP-k kivételével, amelyeknek 76
A genetikai lelet értelmezése monogénes betegségekben
 A genetikai lelet értelmezése monogénes betegségekben Tory Kálmán Semmelweis Egyetem, I. sz. Gyermekklinika A ~20 ezer fehérje-kódoló gén a 23 pár kromoszómán A kromoszómán található bázisok száma: 250M
A genetikai lelet értelmezése monogénes betegségekben Tory Kálmán Semmelweis Egyetem, I. sz. Gyermekklinika A ~20 ezer fehérje-kódoló gén a 23 pár kromoszómán A kromoszómán található bázisok száma: 250M
Tartalomjegyzék TARTALOMJEGYZÉK
 Tartalomjegyzék TARTALOMJEGYZÉK Tartalomjegyzék... 1 Rövidítések jegyzéke... 3 Ábrák és táblázatok jegyzéke... 5 Ábrák... 5 Táblázatok... 5 Bevezetés... 6 Irodalmi háttér... 8 Komplex öröklõdésû jellegek
Tartalomjegyzék TARTALOMJEGYZÉK Tartalomjegyzék... 1 Rövidítések jegyzéke... 3 Ábrák és táblázatok jegyzéke... 5 Ábrák... 5 Táblázatok... 5 Bevezetés... 6 Irodalmi háttér... 8 Komplex öröklõdésû jellegek
Zárójelentés. A D4-es dopamin receptor gén 5 régiójának haplotípus szerkezete: molekuláris és pszichiátriai vonatkozások (2003 2006) F042730
 Zárójelentés A D4-es dopamin receptor gén 5 régiójának haplotípus szerkezete: molekuláris és pszichiátriai vonatkozások (2003 2006) F042730 Betegségeink kialakításában két f etiológiai faktor, a környezeti
Zárójelentés A D4-es dopamin receptor gén 5 régiójának haplotípus szerkezete: molekuláris és pszichiátriai vonatkozások (2003 2006) F042730 Betegségeink kialakításában két f etiológiai faktor, a környezeti
Többgénes jellegek. 1. Klasszikus (poligénes) mennyiségi jellegek. 2.Szinte minden jelleg több gén irányítása alatt áll
 Többgénes jellegek Többgénes jellegek 1. 1. Klasszikus (poligénes) mennyiségi jellegek Multifaktoriális jellegek: több gén és a környezet által meghatározott jellegek 2.Szinte minden jelleg több gén irányítása
Többgénes jellegek Többgénes jellegek 1. 1. Klasszikus (poligénes) mennyiségi jellegek Multifaktoriális jellegek: több gén és a környezet által meghatározott jellegek 2.Szinte minden jelleg több gén irányítása
Molekuláris genetikai vizsgáló. módszerek az immundefektusok. diagnosztikájában
 Molekuláris genetikai vizsgáló módszerek az immundefektusok diagnosztikájában Primer immundefektusok A primer immundeficiencia ritka, veleszületett, monogénes öröklődésű immunhiányos állapot. Családi halmozódást
Molekuláris genetikai vizsgáló módszerek az immundefektusok diagnosztikájában Primer immundefektusok A primer immundeficiencia ritka, veleszületett, monogénes öröklődésű immunhiányos állapot. Családi halmozódást
HAPMAP -2010 Nemzetközi HapMap Projekt. SNP GWA Haplotípus: egy kromoszóma szegmensen lévő SNP mintázat
 HAPMAP -2010 Nemzetközi HapMap Projekt A Nemzetközi HapMap Project célja az emberi genom haplotípus* térképének(hapmap; haplotype map) megszerkesztése, melynek segítségével katalogizálni tudjuk az ember
HAPMAP -2010 Nemzetközi HapMap Projekt A Nemzetközi HapMap Project célja az emberi genom haplotípus* térképének(hapmap; haplotype map) megszerkesztése, melynek segítségével katalogizálni tudjuk az ember
10. CSI. A molekuláris biológiai technikák alkalmazásai
 10. CSI. A molekuláris biológiai technikák alkalmazásai A DNS mint azonosító 3 milliárd bázispár az emberi DNS-ben (99.9%-ban azonos) 0.1%-nyi különbség elegendő az egyedek megkülönböztetéséhez Genetikai
10. CSI. A molekuláris biológiai technikák alkalmazásai A DNS mint azonosító 3 milliárd bázispár az emberi DNS-ben (99.9%-ban azonos) 0.1%-nyi különbség elegendő az egyedek megkülönböztetéséhez Genetikai
T 038407 1. Zárójelentés
 T 038407 1 Zárójelentés OTKA támogatással 1996-ban indítottuk az MTA Pszichológiai Intézetében a Budapesti Családvizsgálatot (BCsV), amelynek fő célja a szülő-gyermek kapcsolat és a gyermekek érzelmi-szociális
T 038407 1 Zárójelentés OTKA támogatással 1996-ban indítottuk az MTA Pszichológiai Intézetében a Budapesti Családvizsgálatot (BCsV), amelynek fő célja a szülő-gyermek kapcsolat és a gyermekek érzelmi-szociális
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
A Hardy-Weinberg egyensúly. 2. gyakorlat
 A Hardy-Weinberg egyensúly 2. gyakorlat A Hardy-Weinberg egyensúly feltételei: nincs szelekció nincs migráció nagy populációméret (nincs sodródás) nincs mutáció pánmixis van allélgyakoriság azonos hímekben
A Hardy-Weinberg egyensúly 2. gyakorlat A Hardy-Weinberg egyensúly feltételei: nincs szelekció nincs migráció nagy populációméret (nincs sodródás) nincs mutáció pánmixis van allélgyakoriság azonos hímekben
DNS-szekvencia meghatározás
 DNS-szekvencia meghatározás Gilbert 1980 (1958) Sanger 3-1 A DNS-polimerázok jellemzői 5'-3' polimeráz aktivitás 5'-3' exonukleáz 3'-5' exonukleáz aktivitás Az új szál szintéziséhez kell: templát DNS primer
DNS-szekvencia meghatározás Gilbert 1980 (1958) Sanger 3-1 A DNS-polimerázok jellemzői 5'-3' polimeráz aktivitás 5'-3' exonukleáz 3'-5' exonukleáz aktivitás Az új szál szintéziséhez kell: templát DNS primer
A kromoszómák kialakulása előtt a DNS állomány megkettőződik. A két azonos információ tartalmú DNS egymás mellé rendeződik és egy kromoszómát alkot.
 Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
Hátterükben egyetlen gén áll, melynek általában számottevő a viselkedésre gyakorolt hatása, öröklési mintázata jellegzetes.
 Múlt órán: Lehetséges tesztfeladatok: Kitől származik a variáció-szelekció paradigma, mely szerint az egyéni, javarészt öröklött különbségek között a társadalmi harc válogat? Fromm-Reichmann Mill Gallton
Múlt órán: Lehetséges tesztfeladatok: Kitől származik a variáció-szelekció paradigma, mely szerint az egyéni, javarészt öröklött különbségek között a társadalmi harc válogat? Fromm-Reichmann Mill Gallton
Temperamentum, kognitív teljesítmény és hipnábilitás pszichogenetikai asszociációvizsgálatai
 Temperamentum, kognitív teljesítmény és hipnábilitás pszichogenetikai asszociációvizsgálatai Habilitációs dolgozat Veres-Székely Anna, Ph.D. 2010 TARTALOMJEGYZÉK BEVEZETÉS... 4 Ábrajegyzék... 6 Táblázatok
Temperamentum, kognitív teljesítmény és hipnábilitás pszichogenetikai asszociációvizsgálatai Habilitációs dolgozat Veres-Székely Anna, Ph.D. 2010 TARTALOMJEGYZÉK BEVEZETÉS... 4 Ábrajegyzék... 6 Táblázatok
Figyelemhiány/Hiperaktivitás Zavar - ADHD TÁJÉKOZTATÓ FÜZET. ADHD-s gyermekek családjai részére
 Figyelemhiány/Hiperaktivitás Zavar - ADHD TÁJÉKOZTATÓ FÜZET ADHD-s gyermekek családjai részére KEZELÉSI TÁJÉKOZTATÓ FÜZET Ezt a tájékoztató füzetet azért készítettük, hogy segítsünk a FIGYELEMHIÁNY/HIPERAKTIVITÁS
Figyelemhiány/Hiperaktivitás Zavar - ADHD TÁJÉKOZTATÓ FÜZET ADHD-s gyermekek családjai részére KEZELÉSI TÁJÉKOZTATÓ FÜZET Ezt a tájékoztató füzetet azért készítettük, hogy segítsünk a FIGYELEMHIÁNY/HIPERAKTIVITÁS
ISMÉTLDÉSI POLIMORFIZMUSOK A KUTYA DOPAMINERG GÉNJEIBEN
 ISMÉTLDÉSI POLIMORFIZMUSOK A KUTYA DOPAMINERG GÉNJEIBEN Biológia Doktori Iskola Vezet: Prof. Erdei Anna Doktori tézisek Héjjas Krisztina Eötvös Loránd Tudományegyetem Szerkezeti Biokémia Doktori Program
ISMÉTLDÉSI POLIMORFIZMUSOK A KUTYA DOPAMINERG GÉNJEIBEN Biológia Doktori Iskola Vezet: Prof. Erdei Anna Doktori tézisek Héjjas Krisztina Eötvös Loránd Tudományegyetem Szerkezeti Biokémia Doktori Program
ISMÉTLDÉSI POLIMORFIZMUSOK A KUTYA DOPAMINERG GÉNJEIBEN
 ISMÉTLDÉSI POLIMORFIZMUSOK A KUTYA DOPAMINERG GÉNJEIBEN Doktori értekezés Héjjas Krisztina Biológia Doktori Iskola Vezet: Prof Erdei Anna Eötvös Loránd Tudományegyetem Szerkezeti Biokémia Doktori Program
ISMÉTLDÉSI POLIMORFIZMUSOK A KUTYA DOPAMINERG GÉNJEIBEN Doktori értekezés Héjjas Krisztina Biológia Doktori Iskola Vezet: Prof Erdei Anna Eötvös Loránd Tudományegyetem Szerkezeti Biokémia Doktori Program
I. A sejttől a génekig
 Gén A gének olyan nukleinsav-szakaszok a sejtek magjainak kromoszómáiban, melyek a szervezet működését és növekedését befolyásoló fehérjék szabályozásához és előállításához szükséges információkat tartalmazzák.
Gén A gének olyan nukleinsav-szakaszok a sejtek magjainak kromoszómáiban, melyek a szervezet működését és növekedését befolyásoló fehérjék szabályozásához és előállításához szükséges információkat tartalmazzák.
Kromoszómák, Gének centromer
 Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
Kromoszómák, Gének A kromoszóma egy hosszú DNS szakasz, amely a sejt életének bizonyos szakaszában (a sejtosztódás előkészítéseként) tömörödik, így fénymikroszkóppal láthatóvá válik. A kromoszómák két
TÉMAKÖRÖK. Ősi RNS világ BEVEZETÉS. RNS-ek tradicionális szerepben
 esirna mirtron BEVEZETÉS TÉMAKÖRÖK Ősi RNS világ RNS-ek tradicionális szerepben bevezetés BIOLÓGIAI MOLEKULÁK FEHÉRJÉK NUKLEINSAVAK DNS-ek RNS-ek BIOLÓGIAI MOLEKULÁK FEHÉRJÉK NUKLEINSAVAK DNS-ek RNS-ek
esirna mirtron BEVEZETÉS TÉMAKÖRÖK Ősi RNS világ RNS-ek tradicionális szerepben bevezetés BIOLÓGIAI MOLEKULÁK FEHÉRJÉK NUKLEINSAVAK DNS-ek RNS-ek BIOLÓGIAI MOLEKULÁK FEHÉRJÉK NUKLEINSAVAK DNS-ek RNS-ek
Biológus MSc. Molekuláris biológiai alapismeretek
 Biológus MSc Molekuláris biológiai alapismeretek A nukleotidok építőkövei A nukleotidok szerkezete Nukleotid = N-tartalmú szerves bázis + pentóz + foszfát N-glikozidos kötés 5 1 4 2 3 (Foszfát)észter-kötés
Biológus MSc Molekuláris biológiai alapismeretek A nukleotidok építőkövei A nukleotidok szerkezete Nukleotid = N-tartalmú szerves bázis + pentóz + foszfát N-glikozidos kötés 5 1 4 2 3 (Foszfát)észter-kötés
GENOMIKA TÖBBFÉLE MAKROMOLEKULA VIZSGÁLATA EGYIDŐBEN
 GENOMIKA TÖBBFÉLE MAKROMOLEKULA VIZSGÁLATA EGYIDŐBEN Strukturális genomika Genomkönyvtárak DNS szekvenálás Genom programok Polimorfizmusok RFLP DNS könyvtár készítés humán genom 1. Emésztés RE-kal Emberi
GENOMIKA TÖBBFÉLE MAKROMOLEKULA VIZSGÁLATA EGYIDŐBEN Strukturális genomika Genomkönyvtárak DNS szekvenálás Genom programok Polimorfizmusok RFLP DNS könyvtár készítés humán genom 1. Emésztés RE-kal Emberi
In Situ Hibridizáció a pathologiai diagnosztikában és ami mögötte van.
 In Situ Hibridizáció a pathologiai diagnosztikában és ami mögötte van. Kneif Józsefné PTE KK Pathologiai Intézet Budapest 2017. 05. 26 Kromoszóma rendellenesség kimutatás PCR technika: izolált nukleinsavak
In Situ Hibridizáció a pathologiai diagnosztikában és ami mögötte van. Kneif Józsefné PTE KK Pathologiai Intézet Budapest 2017. 05. 26 Kromoszóma rendellenesség kimutatás PCR technika: izolált nukleinsavak
Rh VÉRCSOPORT RENDSZER GENETIKÁJA. Rh ANTIGÉNEK ÉS ANTITESTEK. EGYÉB VÉRCSOPORTRENDSZEREK
 Rh VÉRCSOPORT RENDSZER GENETIKÁJA. Rh ANTIGÉNEK ÉS ANTITESTEK. EGYÉB VÉRCSOPORTRENDSZEREK HISTORY Antitestet találtak egy koraszülött gyermek anyjának szérumában; ez lenne felelős a gyermek haláláért?
Rh VÉRCSOPORT RENDSZER GENETIKÁJA. Rh ANTIGÉNEK ÉS ANTITESTEK. EGYÉB VÉRCSOPORTRENDSZEREK HISTORY Antitestet találtak egy koraszülött gyermek anyjának szérumában; ez lenne felelős a gyermek haláláért?
(1) A T sejtek aktiválása (2) Az ön reaktív T sejtek toleranciája. α lánc. β lánc. V α. V β. C β. C α.
 Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
A DOPAMIN D4-ES RECEPTOR GÉNVARIÁNSOK VIZSGÁLATA FIGYELEMHIÁNYOS HIPERAKTIVITÁSI ZAVARBAN
 A DOPAMIN D4-ES RECEPTOR GÉNVARIÁNSOK VIZSGÁLATA FIGYELEMHIÁNYOS HIPERAKTIVITÁSI ZAVARBAN Kereszturi Éva 1, Király Orsolya 1, Csapó Zsolt 1, Tárnok Zsanett 2, Gádoros Júlia 2, Sasvári-Székely Mária 1 és
A DOPAMIN D4-ES RECEPTOR GÉNVARIÁNSOK VIZSGÁLATA FIGYELEMHIÁNYOS HIPERAKTIVITÁSI ZAVARBAN Kereszturi Éva 1, Király Orsolya 1, Csapó Zsolt 1, Tárnok Zsanett 2, Gádoros Júlia 2, Sasvári-Székely Mária 1 és
A DNS szerkezete. Genom kromoszóma gén DNS genotípus - allél. Pontos méretek Watson genomja. J. D. Watson F. H. C. Crick. 2 nm C G.
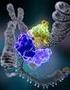 1955: 46 emberi kromoszóma van 1961: mrns 1975: DNS szekvenálás 1982: gén-bank adatbázisok 1983: R (polymerase chain reaction) Mérföldkövek 1 J. D. Watson F. H.. rick 2008 1953 2003 Watson genomja DNS
1955: 46 emberi kromoszóma van 1961: mrns 1975: DNS szekvenálás 1982: gén-bank adatbázisok 1983: R (polymerase chain reaction) Mérföldkövek 1 J. D. Watson F. H.. rick 2008 1953 2003 Watson genomja DNS
A szamóca érése során izolált Spiral és Spermidin-szintáz gén jellemzése. Kiss Erzsébet Kovács László
 A szamóca érése során izolált Spiral és Spermidin-szintáz gén jellemzése Kiss Erzsébet Kovács László Bevezetés Nagy gazdasági gi jelentıségük k miatt a gyümölcs lcsök, termések fejlıdésének mechanizmusát
A szamóca érése során izolált Spiral és Spermidin-szintáz gén jellemzése Kiss Erzsébet Kovács László Bevezetés Nagy gazdasági gi jelentıségük k miatt a gyümölcs lcsök, termések fejlıdésének mechanizmusát
transzláció DNS RNS Fehérje A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti fehérjék, transzportfehérjék
 Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Tudománytörténeti visszatekintés
 GENETIKA I. AZ ÖRÖKLŐDÉS TÖRVÉNYSZERŰSÉGEI Minek köszönhető a biológiai sokféleség? Hogyan történik a tulajdonságok átörökítése? Tudománytörténeti visszatekintés 1. Keveredés alapú öröklődés: (1761-1766,
GENETIKA I. AZ ÖRÖKLŐDÉS TÖRVÉNYSZERŰSÉGEI Minek köszönhető a biológiai sokféleség? Hogyan történik a tulajdonságok átörökítése? Tudománytörténeti visszatekintés 1. Keveredés alapú öröklődés: (1761-1766,
Genomika. Mutációk (SNP-k) és vizsgálatuk egyszerű módszerekkel. DNS szekvenálási eljárások. DNS ujjlenyomat (VNTR)
 Genomika (A genom, génállomány vizsgálata) Mutációk (SNP-k) és vizsgálatuk egyszerű módszerekkel DNS szekvenálási eljárások DNS ujjlenyomat (VNTR) DNS chipek statikus és dinamikus információk vizsgálata
Genomika (A genom, génállomány vizsgálata) Mutációk (SNP-k) és vizsgálatuk egyszerű módszerekkel DNS szekvenálási eljárások DNS ujjlenyomat (VNTR) DNS chipek statikus és dinamikus információk vizsgálata
Populációgenetikai. alapok
 Populációgenetikai alapok Populáció = egyedek egy adott csoportja Az egyedek eltérnek egymástól morfológiailag, de viselkedésüket tekintve is = genetikai különbségek Fenotípus = külső jellegek morfológia,
Populációgenetikai alapok Populáció = egyedek egy adott csoportja Az egyedek eltérnek egymástól morfológiailag, de viselkedésüket tekintve is = genetikai különbségek Fenotípus = külső jellegek morfológia,
Fehérje expressziós rendszerek. Gyógyszerészi Biotechnológia
 Fehérje expressziós rendszerek Gyógyszerészi Biotechnológia Expressziós rendszerek Cél: rekombináns fehérjék előállítása nagy tisztaságban és nagy mennyiségben kísérleti ill. gyakorlati (therapia) felhasználásokra
Fehérje expressziós rendszerek Gyógyszerészi Biotechnológia Expressziós rendszerek Cél: rekombináns fehérjék előállítása nagy tisztaságban és nagy mennyiségben kísérleti ill. gyakorlati (therapia) felhasználásokra
ADATBÁNYÁSZAT I. ÉS OMICS
 Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 ADATBÁNYÁSZAT
Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 ADATBÁNYÁSZAT
Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály
 Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály Definíció A prenatális diagnosztika a klinikai genetika azon
Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály Definíció A prenatális diagnosztika a klinikai genetika azon
NÖVÉNYGENETIKA. Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP /1/A
 NÖVÉNYGENETIKA Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 A citológia és a genetika társtudománya Citogenetika A kromoszómák eredetét, szerkezetét, genetikai funkcióját,
NÖVÉNYGENETIKA Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 A citológia és a genetika társtudománya Citogenetika A kromoszómák eredetét, szerkezetét, genetikai funkcióját,
Az agy betegségeinek molekuláris biológiája. 1. Prion betegség 2. Trinukleotid ripít betegségek 3. ALS 4. Parkinson kór 5.
 Az agy betegségeinek molekuláris biológiája 1. Prion betegség 2. Trinukleotid ripít betegségek 3. ALS 4. Parkinson kór 5. Alzheimer kór 28 Prion betegség A prion betegség fertőző formáját nem egy genetikai
Az agy betegségeinek molekuláris biológiája 1. Prion betegség 2. Trinukleotid ripít betegségek 3. ALS 4. Parkinson kór 5. Alzheimer kór 28 Prion betegség A prion betegség fertőző formáját nem egy genetikai
OTKA ZÁRÓJELENTÉS
 NF-κB aktiváció % Annexin pozitív sejtek, 24h kezelés OTKA 613 ZÁRÓJELENTÉS A nitrogén monoxid (NO) egy rövid féléletidejű, számos szabályozó szabályozó funkciót betöltő molekula, immunmoduláns hatása
NF-κB aktiváció % Annexin pozitív sejtek, 24h kezelés OTKA 613 ZÁRÓJELENTÉS A nitrogén monoxid (NO) egy rövid féléletidejű, számos szabályozó szabályozó funkciót betöltő molekula, immunmoduláns hatása
A T sejt receptor (TCR) heterodimer
 Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
a. Szinaptikus jelátvitel b. Receptorok c. Szignál transzdukció neuronokban d. Neuromoduláció. Szinaptikus jelátvitel.
 Az idegsejtek kommunikációja a. Szinaptikus jelátvitel b. eceptorok c. Szignál transzdukció neuronokban d. Neuromoduláció Szinaptikus jelátvitel Terjedő szignál 35. Stimulus eceptor végződések Érző neuron
Az idegsejtek kommunikációja a. Szinaptikus jelátvitel b. eceptorok c. Szignál transzdukció neuronokban d. Neuromoduláció Szinaptikus jelátvitel Terjedő szignál 35. Stimulus eceptor végződések Érző neuron
A HUMÁNGENETIKA LEGÚJABB EREDMÉNYEI Péterfy Miklós
 A HUMÁNGENETIKA LEGÚJABB EREDMÉNYEI Péterfy Miklós Összefoglalás A humángenetika korunk egyik legdinamikusabban fejlődő tudományága. Ennek a fejlődésnek legfőbb mozgatórugója az, hogy a humángenetika,
A HUMÁNGENETIKA LEGÚJABB EREDMÉNYEI Péterfy Miklós Összefoglalás A humángenetika korunk egyik legdinamikusabban fejlődő tudományága. Ennek a fejlődésnek legfőbb mozgatórugója az, hogy a humángenetika,
A HUMÁN GENOM PROJEKT Sasvári-Székely Mária* Semmelweis Egyetem, Orvosi Vegytani, Molekuláris Biológiai és Pathobiokémiai Intézet
 A HUMÁN GENOM PROJEKT Sasvári-Székely Mária* Semmelweis Egyetem, Orvosi Vegytani, Molekuláris Biológiai és Pathobiokémiai Intézet *Levelezési cím: Dr. Sasvári-Székely Mária, Semmelweis Egyetem, Orvosi
A HUMÁN GENOM PROJEKT Sasvári-Székely Mária* Semmelweis Egyetem, Orvosi Vegytani, Molekuláris Biológiai és Pathobiokémiai Intézet *Levelezési cím: Dr. Sasvári-Székely Mária, Semmelweis Egyetem, Orvosi
Norvég Finanszírozási Mechanizmus által támogatott projekt HU-0115/NA/2008-3/ÖP-9 ÚJ TERÁPIÁS CÉLPONTOK AZONOSÍTÁSA GENOMIKAI MÓDSZEREKKEL
 Norvég Finanszírozási Mechanizmus által támogatott projekt HU-0115/NA/2008-3/ÖP-9 ÚJ TERÁPIÁS CÉLPONTOK AZONOSÍTÁSA GENOMIKAI MÓDSZEREKKEL KÖZÖS STRATÉGIA KIFEJLESZTÉSE MOLEKULÁRIS MÓDSZEREK ALKALMAZÁSÁVAL
Norvég Finanszírozási Mechanizmus által támogatott projekt HU-0115/NA/2008-3/ÖP-9 ÚJ TERÁPIÁS CÉLPONTOK AZONOSÍTÁSA GENOMIKAI MÓDSZEREKKEL KÖZÖS STRATÉGIA KIFEJLESZTÉSE MOLEKULÁRIS MÓDSZEREK ALKALMAZÁSÁVAL
3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások)
 3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások) 3.1 Fehérjék, enzimek A genetikai információ egyik fő manifesztálódása
3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások) 3.1 Fehérjék, enzimek A genetikai információ egyik fő manifesztálódása
Gén kópiaszám és mikrorns kötőhely polimorfizmusok vizsgálata
 Gén kópiaszám és mikrorns kötőhely polimorfizmusok vizsgálata Doktori tézisek Dr. Kovács-Nagy Réka Semmelweis Egyetem Molekuláris Orvostudományok Doktori Iskola Témavezető: Dr. Rónai Zsolt egyetemi adjunktus,
Gén kópiaszám és mikrorns kötőhely polimorfizmusok vizsgálata Doktori tézisek Dr. Kovács-Nagy Réka Semmelweis Egyetem Molekuláris Orvostudományok Doktori Iskola Témavezető: Dr. Rónai Zsolt egyetemi adjunktus,
Receptorok és szignalizációs mechanizmusok
 Molekuláris sejtbiológia: Receptorok és szignalizációs mechanizmusok Dr. habil Kőhidai László Semmelweis Egyetem Genetikai, Sejt- és Immunbiológiai Intézet Sejtek szignalizációs kapcsolatai Sejtek szignalizációs
Molekuláris sejtbiológia: Receptorok és szignalizációs mechanizmusok Dr. habil Kőhidai László Semmelweis Egyetem Genetikai, Sejt- és Immunbiológiai Intézet Sejtek szignalizációs kapcsolatai Sejtek szignalizációs
Transzláció. Szintetikus folyamatok Energiájának 90%-a
 Transzláció Transzláció Fehérje bioszintézis a genetikai információ kifejeződése Szükséges: mrns: trns: ~40 Riboszóma: 4 rrns + ~ 70 protein 20 Aminosav aktiváló enzim ~12 egyéb enzim Szintetikus folyamatok
Transzláció Transzláció Fehérje bioszintézis a genetikai információ kifejeződése Szükséges: mrns: trns: ~40 Riboszóma: 4 rrns + ~ 70 protein 20 Aminosav aktiváló enzim ~12 egyéb enzim Szintetikus folyamatok
Az ABCG2 multidrog transzporter fehérje szerkezetének és működésének vizsgálata
 Az ABCG2 multidrog transzporter fehérje szerkezetének és működésének Kutatási előzmények Az ABC transzporter membránfehérjék az ATP elhasítása (ATPáz aktivitás) révén nyerik az energiát az általuk végzett
Az ABCG2 multidrog transzporter fehérje szerkezetének és működésének Kutatási előzmények Az ABC transzporter membránfehérjék az ATP elhasítása (ATPáz aktivitás) révén nyerik az energiát az általuk végzett
A replikáció mechanizmusa
 Az öröklődés molekuláris alapjai A DNS megkettőződése, a replikáció Szerk.: Vizkievicz András A DNS-molekula az élőlények örökítő anyaga, kódolt formában tartalmazza mindazon információkat, amelyek a sejt,
Az öröklődés molekuláris alapjai A DNS megkettőződése, a replikáció Szerk.: Vizkievicz András A DNS-molekula az élőlények örökítő anyaga, kódolt formában tartalmazza mindazon információkat, amelyek a sejt,
13. RNS szintézis és splicing
 13. RNS szintézis és splicing 1 Visszatekintés: Az RNS típusai és szerkezete Hírvivő RNS = mrns (messenger RNA = mrna) : fehérjeszintézis pre-mrns érett mrns (intronok kivágódnak = splicing) Transzfer
13. RNS szintézis és splicing 1 Visszatekintés: Az RNS típusai és szerkezete Hírvivő RNS = mrns (messenger RNA = mrna) : fehérjeszintézis pre-mrns érett mrns (intronok kivágódnak = splicing) Transzfer
Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 projekt
 Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 projekt ÁLLATGENETIKA Debreceni Egyetem Nyugat-magyarországi Egyetem Pannon Egyetem A projekt az Európai Unió támogatásával, az
Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 projekt ÁLLATGENETIKA Debreceni Egyetem Nyugat-magyarországi Egyetem Pannon Egyetem A projekt az Európai Unió támogatásával, az
Johann Gregor Mendel Az olmüci (Olomouc) és bécsi egyetem diákja Brünni ágostonrendi apát (nem szovjet tudós) Tudatos és nagyon alapos kutat
 10.2.2010 genmisk1 1 Áttekintés Mendel és a mendeli törvények Mendel előtt és körül A genetika törvényeinek újbóli felfedezése és a kromoszómák Watson és Crick a molekuláris biológoa központi dogmája 10.2.2010
10.2.2010 genmisk1 1 Áttekintés Mendel és a mendeli törvények Mendel előtt és körül A genetika törvényeinek újbóli felfedezése és a kromoszómák Watson és Crick a molekuláris biológoa központi dogmája 10.2.2010
2006 1. Nemszinaptikus receptorok és szubmikronos Ca2+ válaszok: A két-foton lézermikroszkópia felhasználása a farmakológiai vizsgálatokra.
 2006 1. Nemszinaptikus receptorok és szubmikronos Ca 2+ válaszok: A két-foton lézermikroszkópia felhasználása a farmakológiai vizsgálatokra. A kutatócsoportunkban Közép Európában elsőként bevezetett két-foton
2006 1. Nemszinaptikus receptorok és szubmikronos Ca 2+ válaszok: A két-foton lézermikroszkópia felhasználása a farmakológiai vizsgálatokra. A kutatócsoportunkban Közép Európában elsőként bevezetett két-foton
Az idegsejtek kommunikációja. a. Szinaptikus jelátvitel b. Receptorok c. Szignál transzdukció neuronokban d. Neuromoduláció
 Az idegsejtek kommunikációja a. Szinaptikus jelátvitel b. Receptorok c. Szignál transzdukció neuronokban d. Neuromoduláció Szinaptikus jelátvitel Terjedő szignál 35. Stimulus PERIFÉRIÁS IDEGRENDSZER Receptor
Az idegsejtek kommunikációja a. Szinaptikus jelátvitel b. Receptorok c. Szignál transzdukció neuronokban d. Neuromoduláció Szinaptikus jelátvitel Terjedő szignál 35. Stimulus PERIFÉRIÁS IDEGRENDSZER Receptor
Intelligens Rendszerek Elmélete. Párhuzamos keresés genetikus algoritmusokkal
 Intelligens Rendszerek Elmélete Dr. Kutor László Párhuzamos keresés genetikus algoritmusokkal http://mobil.nik.bmf.hu/tantargyak/ire.html login: ire jelszó: IRE0 IRE / A természet általános kereső algoritmusa:
Intelligens Rendszerek Elmélete Dr. Kutor László Párhuzamos keresés genetikus algoritmusokkal http://mobil.nik.bmf.hu/tantargyak/ire.html login: ire jelszó: IRE0 IRE / A természet általános kereső algoritmusa:
11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban
 11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban HIV fertőzés kimutatása - (fiktív) esettanulmány 35 éves nő, HIV fertőzöttség gyanúja. Két partner az elmúlt időszakban. Fertőzött-e
11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban HIV fertőzés kimutatása - (fiktív) esettanulmány 35 éves nő, HIV fertőzöttség gyanúja. Két partner az elmúlt időszakban. Fertőzött-e
Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén
 Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén Dr. Dallmann Klára A molekuláris biológia célja az élőlények és sejtek működésének molekuláris szintű
Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén Dr. Dallmann Klára A molekuláris biológia célja az élőlények és sejtek működésének molekuláris szintű
11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban
 11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban HIV fertőzés kimutatása (fiktív) esettanulmány 35 éves nő, HIV fertőzöttség gyanúja. Két partner az elmúlt időszakban. Fertőzött-e
11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban HIV fertőzés kimutatása (fiktív) esettanulmány 35 éves nő, HIV fertőzöttség gyanúja. Két partner az elmúlt időszakban. Fertőzött-e
Antiszenz hatás és RNS interferencia (a génexpresszió befolyásolásának régi és legújabb lehetőségei)
 Antiszenz hatás és RNS interferencia (a génexpresszió befolyásolásának régi és legújabb lehetőségei) Az antiszenz elv története Reverz transzkripció replikáció transzkripció transzláció DNS DNS RNS Fehérje
Antiszenz hatás és RNS interferencia (a génexpresszió befolyásolásának régi és legújabb lehetőségei) Az antiszenz elv története Reverz transzkripció replikáció transzkripció transzláció DNS DNS RNS Fehérje
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek
 Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Szakmai zárójelentés A kutyaszemélyiség mint az emberi személyiségvizsgálatok modellje: etológiai, pszichológiai és genetikai megközelítés
 Szakmai zárójelentés A kutyaszemélyiség mint az emberi személyiségvizsgálatok modellje: etológiai, pszichológiai és genetikai megközelítés Bevezetés Korábbi támogatott pályázatok etológiai kutatatásai
Szakmai zárójelentés A kutyaszemélyiség mint az emberi személyiségvizsgálatok modellje: etológiai, pszichológiai és genetikai megközelítés Bevezetés Korábbi támogatott pályázatok etológiai kutatatásai
2. A jelutak komponensei. 1. Egy tipikus jelösvény sémája 2. Ligandok 3. Receptorok 4. Intracelluláris jelfehérjék
 Jelutak 2. A jelutak komponensei 1. Egy tipikus jelösvény sémája 2. Ligandok 3. Receptorok 4. Intracelluláris jelfehérjék Egy tipikus jelösvény sémája 1. Receptor fehérje Jel molekula (ligand; elsődleges
Jelutak 2. A jelutak komponensei 1. Egy tipikus jelösvény sémája 2. Ligandok 3. Receptorok 4. Intracelluláris jelfehérjék Egy tipikus jelösvény sémája 1. Receptor fehérje Jel molekula (ligand; elsődleges
NUKLEINSAVAK. Nukleinsav: az élő szervezetek sejtmagvában és a citoplazmában található, az átöröklésben szerepet játszó, nagy molekulájú anyag
 NUKLEINSAVAK Nukleinsav: az élő szervezetek sejtmagvában és a citoplazmában található, az átöröklésben szerepet játszó, nagy molekulájú anyag RNS = Ribonukleinsav DNS = Dezoxi-ribonukleinsav A nukleinsavak
NUKLEINSAVAK Nukleinsav: az élő szervezetek sejtmagvában és a citoplazmában található, az átöröklésben szerepet játszó, nagy molekulájú anyag RNS = Ribonukleinsav DNS = Dezoxi-ribonukleinsav A nukleinsavak
Az addikció molekuláris neurobiológiája. Barta Csaba
 Az addikció molekuláris neurobiológiája Barta Csaba Komplex jelleg: A szerfüggés etiológiája genetikai faktorok + környezeti tényezők és interakcióik családi halmozódás (Rounsaville, 1991; Luthar, 1992;
Az addikció molekuláris neurobiológiája Barta Csaba Komplex jelleg: A szerfüggés etiológiája genetikai faktorok + környezeti tényezők és interakcióik családi halmozódás (Rounsaville, 1991; Luthar, 1992;
Az evolúció folyamatos változások olyan sorozata, melynek során bizonyos populációk öröklődő jellegei nemzedékről nemzedékre változnak.
 Evolúció Az evolúció folyamatos változások olyan sorozata, melynek során bizonyos populációk öröklődő jellegei nemzedékről nemzedékre változnak. Latin eredetű szó, jelentése: kibontakozás Időben egymást
Evolúció Az evolúció folyamatos változások olyan sorozata, melynek során bizonyos populációk öröklődő jellegei nemzedékről nemzedékre változnak. Latin eredetű szó, jelentése: kibontakozás Időben egymást
3. Sejtalkotó molekulák III.
 3. Sejtalkotó molekulák III. Fehérjék, fehérjeszintézis (transzkripció, transzláció, posztszintetikus módosítások). Enzimműködés 3.1 Fehérjék A genetikai információ egyik fő manifesztálódása Számos funkció
3. Sejtalkotó molekulák III. Fehérjék, fehérjeszintézis (transzkripció, transzláció, posztszintetikus módosítások). Enzimműködés 3.1 Fehérjék A genetikai információ egyik fő manifesztálódása Számos funkció
Sodródás Evolúció neutrális elmélete
 Sodródás Evolúció neutrális elmélete Egy kísérlet Drosophila Drosophila pseudoobscura 8 hím + 8 nőstény/tenyészet 107 darab tenyészet Minden tenyészet csak heterozigóta egyedekkel indul a neutrális szemszín
Sodródás Evolúció neutrális elmélete Egy kísérlet Drosophila Drosophila pseudoobscura 8 hím + 8 nőstény/tenyészet 107 darab tenyészet Minden tenyészet csak heterozigóta egyedekkel indul a neutrális szemszín
Az X kromoszóma inaktívációja. A kromatin szerkezet befolyásolja a génexpressziót
 Az X kromoszóma inaktívációja A kromatin szerkezet befolyásolja a génexpressziót Férfiak: XY Nők: XX X kromoszóma: nagy méretű több mint 1000 gén Y kromoszóma: kis méretű, kevesebb, mint 100 gén Kompenzációs
Az X kromoszóma inaktívációja A kromatin szerkezet befolyásolja a génexpressziót Férfiak: XY Nők: XX X kromoszóma: nagy méretű több mint 1000 gén Y kromoszóma: kis méretű, kevesebb, mint 100 gén Kompenzációs
A Caskin1 állványfehérje vizsgálata
 A Caskin1 állványfehérje vizsgálata Doktori tézisek Balázs Annamária Semmelweis Egyetem Molekuláris Orvostudományok Doktori Iskola Témavezeto: Dr. Buday László egyetemi tanár, az orvostudományok doktora
A Caskin1 állványfehérje vizsgálata Doktori tézisek Balázs Annamária Semmelweis Egyetem Molekuláris Orvostudományok Doktori Iskola Témavezeto: Dr. Buday László egyetemi tanár, az orvostudományok doktora
A PKU azért nem hal ki, mert gyógyítják, és ezzel növelik a mutáns allél gyakoriságát a Huntington kór pedig azért marad fenn, mert csak későn derül
 1 Múlt órán: Genetikai alapelvek, monogénes öröklődés Elgondolkodtató feladat Vajon miért nem halnak ki az olyan mendeli öröklődésű rendellenességek, mint a Phenylketonuria, vagy a Huntington kór? A PKU
1 Múlt órán: Genetikai alapelvek, monogénes öröklődés Elgondolkodtató feladat Vajon miért nem halnak ki az olyan mendeli öröklődésű rendellenességek, mint a Phenylketonuria, vagy a Huntington kór? A PKU
Diagnosztikai célú molekuláris biológiai vizsgálatok
 Diagnosztikai célú molekuláris biológiai vizsgálatok Dr. Patócs Attila, PhD MTA-SE Molekuláris Medicina Kutatócsoport, Semmelweis Egyetem II. sz. Belgyógyászati Klinika Laboratóriumi Medicina Intézet Genetikai
Diagnosztikai célú molekuláris biológiai vizsgálatok Dr. Patócs Attila, PhD MTA-SE Molekuláris Medicina Kutatócsoport, Semmelweis Egyetem II. sz. Belgyógyászati Klinika Laboratóriumi Medicina Intézet Genetikai
CzB 2010. Élettan: a sejt
 CzB 2010. Élettan: a sejt Sejt - az élet alapvető egysége Prokaryota -egysejtű -nincs sejtmag -nincsenek sejtszervecskék -DNS = egy gyűrű - pl., bactériumok Eukaryota -egy-/többsejtű -sejmag membránnal
CzB 2010. Élettan: a sejt Sejt - az élet alapvető egysége Prokaryota -egysejtű -nincs sejtmag -nincsenek sejtszervecskék -DNS = egy gyűrű - pl., bactériumok Eukaryota -egy-/többsejtű -sejmag membránnal
MUTÁCIÓK. A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik.
 MUTÁCIÓK A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik. Pontmutáció: A kromoszóma egy génjében pár nukleotidnál következik be változás.
MUTÁCIÓK A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik. Pontmutáció: A kromoszóma egy génjében pár nukleotidnál következik be változás.
Kutatási beszámoló ( )
 Kutatási beszámoló (2008-2012) A thrombocyták aktivációja alapvető jelentőségű a thrombotikus betegségek kialakulása szempontjából. A pályázat során ezen aktivációs folyamatok mechanizmusait vizsgáltuk.
Kutatási beszámoló (2008-2012) A thrombocyták aktivációja alapvető jelentőségű a thrombotikus betegségek kialakulása szempontjából. A pályázat során ezen aktivációs folyamatok mechanizmusait vizsgáltuk.
A TATA-kötő fehérje asszociált faktor 3 (TAF3) p53-mal való kölcsönhatásának funkcionális vizsgálata
 Ph.D. ÉRTEKEZÉS TÉZISEI A TATA-kötő fehérje asszociált faktor 3 (TAF3) p53-mal való kölcsönhatásának funkcionális vizsgálata Buzás-Bereczki Orsolya Témavezetők: Dr. Bálint Éva Dr. Boros Imre Miklós Biológia
Ph.D. ÉRTEKEZÉS TÉZISEI A TATA-kötő fehérje asszociált faktor 3 (TAF3) p53-mal való kölcsönhatásának funkcionális vizsgálata Buzás-Bereczki Orsolya Témavezetők: Dr. Bálint Éva Dr. Boros Imre Miklós Biológia
mangalica sertésn Prof. dr. Bali Papp Ágnes TÁMOP-4.2.1/B Szellemi, szervezeti és K+F infrastruktúra fejlesztés a Nyugatmagyarországi
 élelmiszer-előá őshonos mangalica sertésn Prof.dr. Bali Papp Ágnes TÁMOP-4.2.1/B Szellemi, szervezeti és K+F infrastruktúra fejlesztés a Nyugatmagyarországi Egyetemen c. kutatási projekt A SZÁNTÓFÖLDTŐL
élelmiszer-előá őshonos mangalica sertésn Prof.dr. Bali Papp Ágnes TÁMOP-4.2.1/B Szellemi, szervezeti és K+F infrastruktúra fejlesztés a Nyugatmagyarországi Egyetemen c. kutatási projekt A SZÁNTÓFÖLDTŐL
10. Genomika 2. Microarrayek és típusaik
 10. Genomika 2. 1. Microarray technikák és bioinformatikai vonatkozásaik Microarrayek és típusaik Korrelált génexpresszió mint a funkcionális genomika eszköze 2. Kombinált megközelítés a funkcionális genomikában
10. Genomika 2. 1. Microarray technikák és bioinformatikai vonatkozásaik Microarrayek és típusaik Korrelált génexpresszió mint a funkcionális genomika eszköze 2. Kombinált megközelítés a funkcionális genomikában
A molekuláris biológia eszközei
 A molekuláris biológia eszközei I. Nukleinsavak az élő szervezetekben Reverz transzkripció replikáció transzkripció transzláció DNS DNS RNS Fehérje DNS feladata: információ tárolása és a transzkripció
A molekuláris biológia eszközei I. Nukleinsavak az élő szervezetekben Reverz transzkripció replikáció transzkripció transzláció DNS DNS RNS Fehérje DNS feladata: információ tárolása és a transzkripció
A sejtfelszíni receptorok három fő kategóriája
 A sejtfelszíni receptorok három fő kategóriája 1. Saját enzimaktivitás nélküli receptorok 1a. G proteinhez kapcsolt pl. adrenalin, szerotonin, glukagon, bradikinin receptorok 1b. Tirozin kinázhoz kapcsolt
A sejtfelszíni receptorok három fő kategóriája 1. Saját enzimaktivitás nélküli receptorok 1a. G proteinhez kapcsolt pl. adrenalin, szerotonin, glukagon, bradikinin receptorok 1b. Tirozin kinázhoz kapcsolt
A nukleinsavak polimer vegyületek. Mint polimerek, monomerekből épülnek fel, melyeket nukleotidoknak nevezünk.
 Nukleinsavak Szerkesztette: Vizkievicz András A nukleinsavakat először a sejtek magjából sikerült tiszta állapotban kivonni. Innen a név: nucleus = mag (lat.), a sav a kémhatásukra utal. Azonban nukleinsavak
Nukleinsavak Szerkesztette: Vizkievicz András A nukleinsavakat először a sejtek magjából sikerült tiszta állapotban kivonni. Innen a név: nucleus = mag (lat.), a sav a kémhatásukra utal. Azonban nukleinsavak
Genomikai Medicina és Ritka Betegségek Intézete Semmelweis Egyetem
 Tisztelt Hölgyem, Tisztelt Uram! Örömmel jelentjük be Önöknek, hogy a Genomikai Medicina és Ritka Betegségek Intézetének egyik új projektje azon betegségek genetikai hátterének feltérképezésére irányul,
Tisztelt Hölgyem, Tisztelt Uram! Örömmel jelentjük be Önöknek, hogy a Genomikai Medicina és Ritka Betegségek Intézetének egyik új projektje azon betegségek genetikai hátterének feltérképezésére irányul,
Humán genom variációk single nucleotide polymorphism (SNP)
 Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
Jelutak. 2. A jelutak komponensei Egy tipikus jelösvény sémája. 2. Ligandok 3. Receptorok 4. Intracelluláris jelfehérjék
 Jelutak 2. A jelutak komponensei 1. Egy tipikus jelösvény sémája 2. Ligandok 3. Receptorok 4. Intracelluláris jelfehérjék Egy tipikus jelösvény sémája Receptor fehérje Jel molekula (ligand; elsődleges
Jelutak 2. A jelutak komponensei 1. Egy tipikus jelösvény sémája 2. Ligandok 3. Receptorok 4. Intracelluláris jelfehérjék Egy tipikus jelösvény sémája Receptor fehérje Jel molekula (ligand; elsődleges
Genetika 3 ea. Bevezetés
 Genetika 3 ea. Mendel törvényeinek a kiegészítése: Egygénes öröklődés Többtényezős öröklődés Bevezetés Mendel által vizsgált tulajdonságok: diszkrétek, két különböző fenotípus Humán tulajdonságok nagy
Genetika 3 ea. Mendel törvényeinek a kiegészítése: Egygénes öröklődés Többtényezős öröklődés Bevezetés Mendel által vizsgált tulajdonságok: diszkrétek, két különböző fenotípus Humán tulajdonságok nagy
Human genome project
 Human genome project Pataki Bálint Ármin 2017.03.14. Pataki Bálint Ármin Human genome project 2017.03.14. 1 / 14 Agenda 1 Biológiai bevezető 2 A human genome project lefolyása 3 Alkalmazások, kitekintés
Human genome project Pataki Bálint Ármin 2017.03.14. Pataki Bálint Ármin Human genome project 2017.03.14. 1 / 14 Agenda 1 Biológiai bevezető 2 A human genome project lefolyása 3 Alkalmazások, kitekintés
1.1. A Humán Genom Projekt A Humán Genom Projekt célja A humán genom elsõ munkapéldányából levonható következtetések
 VIII. 1. A GENETIKAI POLIMORFIZMUSOK PSZICHOLÓGIAI ÉS PSZICHIÁTRIAI VONATKOZÁSAI Sasvári-Székely Mária 1, Székely Anna 2, Nemoda Zsófia 1 és Rónai Zsolt 1 1 Semmelweis Egyetem, Orvosi Vegytani, Molekuláris
VIII. 1. A GENETIKAI POLIMORFIZMUSOK PSZICHOLÓGIAI ÉS PSZICHIÁTRIAI VONATKOZÁSAI Sasvári-Székely Mária 1, Székely Anna 2, Nemoda Zsófia 1 és Rónai Zsolt 1 1 Semmelweis Egyetem, Orvosi Vegytani, Molekuláris
Példák a független öröklődésre
 GENETIKAI PROBLÉMÁK Példák a független öröklődésre Az amelogenesis imperfecta egy, a fogzománc gyengeségével és elszíneződésével járó öröklődő betegség, a 4-es kromoszómán lévő enam gén recesszív mutációja
GENETIKAI PROBLÉMÁK Példák a független öröklődésre Az amelogenesis imperfecta egy, a fogzománc gyengeségével és elszíneződésével járó öröklődő betegség, a 4-es kromoszómán lévő enam gén recesszív mutációja
7. SOKFÉLESÉG. Sokféleség
 Sokféleség DIA 1 Egy populáció egyedei fenotípusos jegyeikben különböznek egymástól. Az egypetéjű ikreket leszámítva, nincs két egyforma egyed. A fenotípusos változékonyságot a genetikai változékonyság
Sokféleség DIA 1 Egy populáció egyedei fenotípusos jegyeikben különböznek egymástól. Az egypetéjű ikreket leszámítva, nincs két egyforma egyed. A fenotípusos változékonyságot a genetikai változékonyság
II. Glukokortikoid receptor gén polimorfizmusok fiziologiás és pathofiziologiás szerepének vizsgálata
 1 A kutatások célpontját a glükokortikoid hatás pre-receptor szabályozásában kulcsszerepet játszó 11β-hidoxiszteroid dehidrogenáz (11β-HSD) enzimet kódoló, illetve a glükokortikoidok hatását közvetítő
1 A kutatások célpontját a glükokortikoid hatás pre-receptor szabályozásában kulcsszerepet játszó 11β-hidoxiszteroid dehidrogenáz (11β-HSD) enzimet kódoló, illetve a glükokortikoidok hatását közvetítő
Egy 10,3 kb méretű, lineáris, a mitokondriumban lokalizált DNS-plazmidot izoláltunk a
 Egy 10,3 kb méretű, lineáris, a mitokondriumban lokalizált DNS-plazmidot izoláltunk a Fusarium proliferatum (Gibberella intermedia) ITEM 2337-es törzséből, és a plazmidot pfp1- nek neveztük el. Proteináz
Egy 10,3 kb méretű, lineáris, a mitokondriumban lokalizált DNS-plazmidot izoláltunk a Fusarium proliferatum (Gibberella intermedia) ITEM 2337-es törzséből, és a plazmidot pfp1- nek neveztük el. Proteináz
RNS-ek. 1. Az ősi RNS Világ: - az élet hajnalán. 2. Egy már ismert RNS Világ: - a fehérjeszintézis ben résztvevő RNS-ek
 RNS-ek RNS-ek 1. Az ősi RNS Világ: - az élet hajnalán 2. Egy már ismert RNS Világ: - a fehérjeszintézis ben résztvevő RNS-ek 3. Egy újonnan felfedezett RNS Világ: - szabályozó RNS-ek 4. Transzkripció Ősi
RNS-ek RNS-ek 1. Az ősi RNS Világ: - az élet hajnalán 2. Egy már ismert RNS Világ: - a fehérjeszintézis ben résztvevő RNS-ek 3. Egy újonnan felfedezett RNS Világ: - szabályozó RNS-ek 4. Transzkripció Ősi
A növény inváziójában szerepet játszó bakteriális gének
 A növény inváziójában szerepet játszó bakteriális gének merisztéma korai szimbiotikus zóna késői szimbiotikus zóna öregedési zóna gyökér keresztmetszet NODULÁCIÓ növényi jel Rhizobium meliloti rhizobium
A növény inváziójában szerepet játszó bakteriális gének merisztéma korai szimbiotikus zóna késői szimbiotikus zóna öregedési zóna gyökér keresztmetszet NODULÁCIÓ növényi jel Rhizobium meliloti rhizobium
MOLEKULÁRIS GENETIKA A LABORATÓRIUMI MEDICINÁBAN. Laboratóriumi Medicina Intézet 2017.
 MOLEKULÁRIS GENETIKA A LABORATÓRIUMI MEDICINÁBAN Laboratóriumi Medicina Intézet 2017. 1 Történeti áttekintés Humán genom projekt 20-25 000 gén azonosítása 1,800 betegséghez köthető gén 1000 genetikai teszt
MOLEKULÁRIS GENETIKA A LABORATÓRIUMI MEDICINÁBAN Laboratóriumi Medicina Intézet 2017. 1 Történeti áttekintés Humán genom projekt 20-25 000 gén azonosítása 1,800 betegséghez köthető gén 1000 genetikai teszt
Evolúcióbiológia. Biológus B.Sc tavaszi félév
 Evolúcióbiológia Biológus B.Sc. 2011. tavaszi félév A biológiában minden csak az evolúció fényében válik érthetővé Theodosius Dobzhansky : Nothing in biology makes sense except in the light of evolution.
Evolúcióbiológia Biológus B.Sc. 2011. tavaszi félév A biológiában minden csak az evolúció fényében válik érthetővé Theodosius Dobzhansky : Nothing in biology makes sense except in the light of evolution.
A metabolikus szindróma genetikai háttere. Kappelmayer János, Balogh István (www.kbmpi.hu)
 A metabolikus szindróma genetikai háttere Kappelmayer János, Balogh István (www.kbmpi.hu) Definíció WHO, 1999 EGIR, 1999 ATP III, 2001 Ha három vagy több komponens jelen van a betegben: Vérnyomás: > 135/85
A metabolikus szindróma genetikai háttere Kappelmayer János, Balogh István (www.kbmpi.hu) Definíció WHO, 1999 EGIR, 1999 ATP III, 2001 Ha három vagy több komponens jelen van a betegben: Vérnyomás: > 135/85
POLIMORFIZMUSOK ÉS HAPLOTÍPUSOK KLINIKAI VONATKOZÁSAI
 POLIMORFIZMUSOK ÉS HAPLOTÍPUSOK KLINIKAI VONATKOZÁSAI Doktori értekezés Szilágyi Ágnes Semmelweis Egyetem Gyógyszertudományok Doktori Iskola Témavezető: Dr. Kalász Huba Hivatalos bírálók: Dr. Bagdy György
POLIMORFIZMUSOK ÉS HAPLOTÍPUSOK KLINIKAI VONATKOZÁSAI Doktori értekezés Szilágyi Ágnes Semmelweis Egyetem Gyógyszertudományok Doktori Iskola Témavezető: Dr. Kalász Huba Hivatalos bírálók: Dr. Bagdy György
Engedélyszám: 18211-2/2011-EAHUF Verziószám: 1. 2460-06 Humángenetikai vizsgálatok követelménymodul szóbeli vizsgafeladatai
 1. feladat Ismertesse a gyakorlaton lévő szakasszisztens hallgatóknak a PCR termékek elválasztása céljából végzett analitikai agaróz gélelektroforézis során használt puffert! Az ismertetés során az alábbi
1. feladat Ismertesse a gyakorlaton lévő szakasszisztens hallgatóknak a PCR termékek elválasztása céljából végzett analitikai agaróz gélelektroforézis során használt puffert! Az ismertetés során az alábbi
Mit tud a genetika. Génterápiás lehetőségek MPS-ben. Dr. Varga Norbert
 Mit tud a genetika Génterápiás lehetőségek MPS-ben Dr. Varga Norbert Oki terápia Terápiás lehetőségek MPS-ben A kiváltó okot gyógyítja meg ERT Enzimpótló kezelés Őssejt transzplantáció Genetikai beavatkozások
Mit tud a genetika Génterápiás lehetőségek MPS-ben Dr. Varga Norbert Oki terápia Terápiás lehetőségek MPS-ben A kiváltó okot gyógyítja meg ERT Enzimpótló kezelés Őssejt transzplantáció Genetikai beavatkozások
Preeclampsia-asszociált extracelluláris vezikulák
 Preeclampsia-asszociált extracelluláris vezikulák hatása(i) a monocita sejt működésére Kovács Árpád Ferenc 1, Láng Orsolya 1, Kőhidai László 1, Rigó János 2, Turiák Lilla 3, Fekete Nóra 1, Buzás Edit 1,
Preeclampsia-asszociált extracelluláris vezikulák hatása(i) a monocita sejt működésére Kovács Árpád Ferenc 1, Láng Orsolya 1, Kőhidai László 1, Rigó János 2, Turiák Lilla 3, Fekete Nóra 1, Buzás Edit 1,
Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata
 Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata Dr. Nemes Karolina, Márk Ágnes, Dr. Hajdu Melinda, Csorba Gézáné, Dr. Kopper László, Dr. Csóka Monika, Dr.
Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata Dr. Nemes Karolina, Márk Ágnes, Dr. Hajdu Melinda, Csorba Gézáné, Dr. Kopper László, Dr. Csóka Monika, Dr.
