A neoadjuváns terápia szerepe a lokálisan elôrehaladott, III. stádiumú nem kissejtes tüdôrákos betegek kezelésében
|
|
|
- Kornél Pásztor
- 9 évvel ezelőtt
- Látták:
Átírás
1 A neoadjuváns terápia szerepe a lokálisan elôrehaladott, III. stádiumú nem kissejtes tüdôrákos betegek kezelésében Eredeti közlemény Balikó Zoltán, Sárosi Veronika Baranya Megyei Kórház, Tüdôgyógyászat, Pécs A dolgozat célja: elsôsorban az elmúlt 10 év során a lokálisan kiterjedt, III. stádiumú nem kissejtes tüdôrákban (NSCLC) szenvedô betegek neoadjuváns kezelésével nyert tapasztalatok elemzése. Módszer: 51 közlemény (elsôsorban retrospektív és prospektív tanulmányok, valamint review-k) áttekintése a neoadjuváns kezelések hatásosságának megítélése céljából. Eredmények: A III. stádiumú NSCLC betegségben a tanulmányok eltérô neoadjuváns kezelési módokról számolnak be. A közleményekben nemcsak a betegek beválogatása, hanem a kemoterápiás protokollok, a radioterápiával történô kombinálás idôzítése és a radioterápia dózisai is heterogének. A legtöbb tanulmány a konkurráló kemoradioterápia elônye mellett szól. A kemoterápiának platina-bázisúnak kell lennie, melyet az újabb szerekkel javasolnak kombinálni. A neoadjuváns kezelést követô mûtét biztosítja a legjobb lokális kontrollt. A mûtét során lobektómiára, pulmonektómia helyett lehetôség szerint sleeve reszekcióra kell törekedni. A legjobb prognosztikai tényezô az R0 mûtét és a mediastinalis nyirokcsomó-státus alacsonyabb stádiumba kerülése, a downstaging. A betegek legtöbbször távoli áttétek, gyakran agyi áttétek következtében halnak meg, ezért egyre többen javasolják a preventív koponyairradiációt. Következtetések: A jobb összehasonlíthatóság és az egységes terápiára törekvés céljából a III. stádiumú NSCLC esetekben alcsoportok képzésére van szükség. A T4 daganat (a pleuritis carcinomatosa kivételével) inkább lokoregionális betegségnek, az N2/N3 csoport inkább szisztémás megbetegedésnek felel meg. A betegek várható 5 éves túlélésében a bi- vagy trimodalitású kezelésekkel további 3-7% körüli javulást lehet elérni. Az eredmények értékelésénél figyelembe kell venni a III. stádium heterogenitását. Nyitott kérdés, hogy a III. stádiumon belül kik járnak jobban a neoadjuváns kezelést követô mûtéttel, és mikor kell csak kemoradioterápiát alkalmazni. A downstagingnél külön kell választani a T és az N státust. Itt az ideje a nagy randomizált tanulmányoknak. Magyar Onkológia 49: , 2005 Objective: to review the progress achieved in the neoadjuvant treatment of patients with locally advanced NSCLC by evaluating the articles published during the last 10 years. Method: altogether 51 articles (including prospective and retrospective studies, and reviews) were analysed with the intention to evaluate the efficacy of the different neoadjuvant modalities. Results: different types of neoadjuvant treatments were reported. The articles were heterogenous not only in the aspect of the patient populations but also in regard to the treament modalities and schedules, the mode and timing of combination of chemotherapy with radiotherapy. Most studies support the advantage of chemoradiotherapy. The chemotherapy should be platinum based, and combination with modern drugs as gemcitabine is recommended. Surgery provides the best local control of the disease. Lobectomy, and in special circumstances sleeve resection, are preferred. The best prognostic factors are the R0 resection and the downstaging of the mediastinal lymph nodes. The cause of death is usually progressive disease, often brain metastases. Because of frequent occurrence of brain metastases, preventive cranial irradiation is recommended by many authors. Conclusion: to be able to compare different treatment modalities with consistent patient groups, patients should be classified into well-defined subgroups. T4 tumours (except pleuritis carcinomatosa) behave as locoregional disease, N2/N3 tumours, however, resemble more to systemic diseases. With two- or three-modality treatment, 3-7% improvement can be achieved in the 5-year survival time of patients. Evaluating the results, the heterogenity of stage III NSCLC should always be kept in mind. It is still unkown to which patients should surgery be offered after neoadjuvant therapy, and who will benefit more from chemoradiotherapy alone. Considering the downstaging effect of the therapy, the tumour and nodal state should be evaluated separately. To answer these questions, it is time to start large randomised studies. Balikó Z, Sárosi V. The role of neoadjuvant therapy in the treatment of locally advanced, stage III non-small-cell lung cancer. Hungarian Oncology 49: , 2005 Közlésre érkezett: március 4. Elfogadva: június 1. Levelezési cím: Dr. Balikó Zoltán, Baranya Megyei Kórház, Tüdôgyógyászat, 7635 Pécs, Ángyán János u.2., Telefon: , Fax: , bmktudo@enternet.hu MagyAR ONKOLÓGUSOK Társasága Magyar Onkológia 49. évfolyam 2. szám
2 Bevezetés A nem kissejtes tüdôrák (NSCLC) patológiai IA., IB., IIA. és IIB. stádiumai esetén mûtéti ellátást követôen az 5 éves túlélés 70%, 60%, 55% és 40%. A IIIA. és IIIB. stádiumú betegek csak mûtéti kezelésével az 5 éves túlélés 15%, csak sugárterápiával 5% (26). Bár a betegség kiterjedése a III. stádiumban is a mellkasra korlátozódik, önmagában alkalmazott mûtét esetén nagy a daganat lokális kiújulásának a veszélye, és a betegek többnyire távoli áttétek következtében halnak meg (25). A mai napig a lokálisan elôrehaladott NSCLC esetek terápiás kihívást jelentenek, és a state of the art még nem határozható meg. A távoli áttétek jelentkezése miatt a csak sebészi vagy a csak radioterápia elégtelen, egyetlen kezelési módnál a gyógyulási arány igen csekély. A különbözô kezelési módok kombinálásának az értelmét a lokális kontroll és a távoli áttétek elpusztítása adja, ezért már az 1980-as évektôl mind helyi, mind szisztémás kezelésre törekedtek (21). Kemoterápiára, mely a III. stádiumban hatásosabb, mint a IV. stádiumban (50), a mikrometasztázisok elpusztulhatnak, a lokoregionális daganat zsugorodhat és a daganat reszekábilissá válhat. A neoadjuváns kezelési módok (preoperatív kemoterápia, kemoradioterápia, radioterápia) melyeket a magasabbnak talált posztoperatív morbiditás (30 38,5%) és mortalitás (2,5 8%) miatt kezdetben sokat kritizáltak mára széles körben elterjedtek (45). A kezelés hatásának megítélésére különbözô végpontokat ajánlanak. Van, aki a kezelés eredményének megítélésére nem javasolja a betegek 5 éves túlélési arányát figyelembe venni, mert az elsô 3 évben sokan meghalnak (45), a terápia hatásának megítélésében azonban az 5 éves túlélési arányt mégsem lehet mellôzni (11). A legtöbben a neoadjuváns kezelés hatására bekövetkezô tumorregressziót (a T = tumor megkisebbedését, ill. az N = nyirokcsomó-státusban történô kedvezô változást), a downstaginget, mint korai kedvezô prognosztikai jelet ajánlják végpontnak. Ma még mindig nincs határozott vélemény a legjobb neoadjuváns kezelési módról. A következôkben az NSCLC lokoregionálisan kiterjedt formáinak neoadjuváns kezeléseit, elsôsorban az utóbbi 10 évet átfogó irodalmi adatok alapján foglaljuk össze; 3 prospektív randomizált, 1 fázis I, 1 fázis I/II, 26 fázis II, 8 retrospektív tanulmány, 7 review, 1 ajánlás, 1 metaanalízis és 2 kommentár Rövidítések: CR = komplett remisszió, downstaging = alacsonyabb stádiumba jutás, MS = median survival (átlagos túlélés), OS = overall survival (összesített túlélési idô), pcr = patológiailag komplett remisszió, PFS = progression-free survival (progresszió mentes túlélés), PR = parciális remisszió, PS = patológiai stádium, RR = response rate (terápiás válasz), SD = stable disease (stabil állapotú betegség) szerepel a közlemények között. A Pancoasttumorral jelen munkánkban nem foglalkozunk. Az NSCLC stádiumozásának jelentôsége A várható hosszú túlélés szempontjából a legfontosabb prognosztikai tényezô a betegség stádiuma (17) óta a T3N0 már nem a IIIA. stádiumba, hanem a IIB. stádiumba sorolandó (26). IIIA. stádium: T1-3N2M0, T3N1M0; IIIB. stádium: T4N0M0, T1-4N3M0. Miután a regionális nyirokcsomók érintettsége jobban rontja a prognózist, mint magának a primer tumornak a kiterjedtsége (4), fontos, hogy meghatározzuk a mediastinoscopia helyét a stádiumozásban. Ez azért is fontos, mert a CT diagnosztikus hibahatára elég nagy, a mediastinalis nyirokcsomók tekintetében 30% fals pozitivitásról és 20% fals negativitásról számolnak be (32). Trodella és mtsai kategorikusan kiállnak a preoperatív mediastinoscopia mellett (45). Yang és mtsai ugyanakkor nem végezték el a mediastinoscopiát akkor, ha több nyirokcsomó megnagyobbodása volt látható CT-vel, ill. ha legalább egy nyirokcsomó átmérôje meghaladta a 15 mm-t (49). Ma általában az a vélemény, hogy a mediastinais nyirokcsomók daganatos érintettségét lehetôleg mediastinoscopiával kell igazolni (4, 34). Ezt az álláspontot az mn2l2/cn2 (minimál N2 = sebészi N2 = a mûtét során derül ki a nyirokcsomó-érintettség, okkult N2-nek is nevezik; L2 = két nyirokcsomó-állomás érintett, cn2 = klinikai N2) és az mn2l1 stádium prognosztikai különbözôsége is támogatja (2). Machtay és mtsai a mediastinoscopiától csak akkor tekintettek el, ha az N2 nyirokcsomó átmérôje meghaladta a 4 cm-t, vagy ha a betegek klinikailag T3-4 N1-2 stádiumban voltak (24). Több esetben a mûtét elôtt ismételt (re-do) mediastinoscopiát végeznek (14, 20), amit Pitz és mtsai a neoadjuváns kezelés hatására fellépô, az értékelést nehezítô fibrózis miatt határozottan elleneznek (29). Vannak, akik a pontos stádiummeghatározás érdekében thoracotomiát (12), mások thoracoscopiát végeznek (31). A pontosabb preoperatív staging céljából újabban PETtel folynak vizsgálatok (10, 29, 47). A III. stádiumú NSCLC neoadjuváns kezelésével szerzett tapasztalatok Többféle gyógyszer-kombináció, változó dózisok és sémák, eltérô számú preoperatív és posztoperatív ciklusok, a kemo- és a radioterápia változó idôzítései kerültek kipróbálásra. Az optimális kezelési mód a III. stádiumban még várat magára (47). A besorolás szerint a T3N1M0 is ebbe a stádiumba tartozik, de a kezelése a IIB. stádiummal egyezik meg (34). IIIA. stádium Bár az elôbbi megállapítás szerint a IIIA. stádiumról csak mint IIIA. N2 stádiumról beszélhetünk, a tüdôrák-stádiumok 1997-es revíziója elôtti megfi- 162 Magyar Onkológia 49. évfolyam 2. szám 2005 MagyAR ONKOLÓGUSOK Társasága
3 gyeléseket is felhasználva összefoglalóan a IIIA. stádiumról a következôk mondhatók el: A IIIA. stádiumú daganatok reszekálhatóak, de a betegek mûtét utáni túlélése a gyakran elôforduló mikrometasztázisok miatt rossz. Azok a beszámolók, melyek a IIIA. stádiumú betegek csak mûtéti kezelésével 30%-os 5 éves túlélésérôl számoltak be, nagy fokban szelektált esetekrôl szóltak (13). Szigorú feltételek mellett végzett tanulmányok alapján a kombinált modalitású kezelés elônyös lehet IIIA. stádiumban (34). A cisplatin-alapú kemoterápia az 5 éves túlélési idôt 10 15%-ról 40%-ig is növelheti (4). Korábban kimutatták, hogy a CEP (cyclophosphamid, etoposid, cisplatin) kezelés 38%-ban okoz terápiás választ, késôbb számos experimentális és klinikai megfigyelés is arra utalt, hogy a lokális kezelés (mûtét, radioterápia) elôtt adott szisztémás kezelés növelni tudja az RR-t és megnöveli a túlélést (36). Több II. fázisú tanulmány is a preoperatív kemoterápia elônyét bizonyította, mely jól alkalmazható, toxicitása elfogadható, az RR 50 80% közötti. A kezelésre reagálók több mint 60%-a mûtétre kerül, az OS 18 hónap, az MS 27 hónap (5). A III. fázisú vizsgálatok is amellett szóltak, hogy a legjobb eredmény akkor várható, ha szelektált betegeknél neoadjuváns kezelést adunk kemoterápia vagy kemoradioterápia formájában, melyet mûtét követ (34). Mûtétnél a legkiterjedtebb mediastinalis nyirokcsomó-samplingre (mintavétel) vagy -disszekcióra (az összes fellelhetô nyirokcsomó eltávolítása) kell törekedni (34). A neoadjuváns terápia 39 77%-os reszekabilitáshoz vezethet, pcr 10 20%-ban fordul elô. A túlélési elôny mintegy háromszorosára, az MS hónapra növekszik (5, 42, 46). Az 5 éves túlélés komplett reszekció esetén 35% körüli. Ennek ellenére sok az ellentmondás, mert a tanulmányokban kevés (30 50 körüli) a bevont beteg és kiegyensúlyozatlan a karok között a prognózis (24, 42, 46). A korai és reszekábilis IIIA. stádiumban (T3N1) a mûtét a választandó eljárás. Ezzel szemben az alábbiakban részletesen tárgyalt IIIA. N2 stádiumban az indukciós kemo- vagy kemoradioterápa a standard kezelési mód (11). IIIA. N2 stádium Az összes NSCLC-s beteg kb. 10%-a az ún. N2 betegség, mely a lokálisan elôrehaladott tüdôrák talán legnagyobb kihívása. Mouantain közleménye szerint az 5 éves túlélésük csupán 23% (26). Mások csak mûtéti eljárással az 5 éves túlélést 13%- nak találták (25), vannak, akik úgy fogalmaznak, hogy a IIIA. N2 betegek csak mûtéti kezelése esetén csupán néhány beteg éli meg az ötödik évet (4, 47). Ezek az ellentmondó adatok arra hívják fel a figyelmet, hogy az N2 betegségen belül homogén alcsoportok kialakítására kell törekedni. Eberhardt és mtsai áttekintô tanulmánya (10) alapján, ha a mediastinoscopiával bizonyított N2 betegeket vesszük csak figyelembe, akkor a csak kemoradioterápiával szemben a mûtéti kiegészítés csekély, de mérhetô, 3%-os 5 éves túlélési többletet jelent. A progressziómentes túlélést tekintve a mûtéti kiegészítés mindenképpen elônyös. Megjegyzik, hogy az OS és a gyógyulási arány a csak kemoradioterápiával kezeltekben nem tér el a mûtéti ellátásban is részesülôk (trimodalitású kezelés) eredményeitôl. Lehet, hogy van egy alcsoport, akik már a kemoradioterápiától meggyógyulnak, de ezt ma még nem tudjuk meghatározni. Végül is a trimodalitású eljárás trendje jobb, de törekedni kell a minél több tüdôt megtartó mûtétekre, kivéve a bulky N2-t (bulky N2 = kiterjedt mediastinalis nyirokcsomó-konglomerátumok), ahol mûtét nem javasolt. A bimodális kezelés downstaging hatása jelentôs, ilyenkor kevesebb pulmonektómiára kerül sor. Ha neoadjuváns kezelés nem történik, akkor az N2 betegség komplett reszekciós aránya a jelenlegi 70% helyett csak 18 65% közötti (47). Mivel a CT csak durva tájékozódásra alkalmas, ezért szövettani bizonyíték szükséges az N2 státus bizonyítására (28). Az N2 csoporton belül több alcsoport különíthetô el. A legkedvezôbb forma az m (minimál-) N2, ami alatt a szerzôk ebben az esetben azt értik, hogy csak egy pozitív alsó mediastinalis nyirokcsomószint érintett, kivételt képez a subcarinalis régió és a daganat extracapsularis terjedése. Ebben az esetben a csak mûtéti kezeléssel az 5 éves túlélés 30% is lehet. Ezzel szemben a bulky vagy több nyirokcsomószintet érintô daganatterjedés a legrosszabb kórforma (47). Robinson és mtsai a heterogén N2 betegséget a következô alcsoportokba javasolják sorolni (34): IIIA1: csak a sebészi minta patológiai feldolgozása során (patológiai staging) mutatható ki nodális érintettség, IIIA2: a mûtét során (sebészi staging) egyetlen nodális érintettség derül ki, IIIA3: nodális metasztázis (egy vagy több), mely már a preoperatív staging során kiderül, IIIA4: bulky N2. Az alcsoportokhoz illeszkedô kezelésre tett javaslatuk: IIIA1-2: ún. incidentális (a reszekált specimenben a szövettani feldolgozás során derül ki a daganatos érintettség) vagy okkult (a mûtét alatt derül ki az egyetlen nyirokcsomó-állomást érintô daganatosan involvált nyirokcsomó) N2. A tervezett tüdômûtét során mediastinalis lymphadenectomiát kell végezni (C evidencia). Egyébként minden tüdôreszekciós mûtétnél el kell végezni a legteljesebb nyirokcsomó-diszekciót (A evidencia) (34). Mûtéti N2 esetén a posztoperatív mediastinalis radioterápia jó lokális kontrollt biztosít. Bunn és mtsai szerint (4) a posztoperatív sugárterápia a daganatos kiújulást 20-ról 5%-ra csökkenti, de a PORT study-ra (40) hivatkozva elfogadhatónak tartják a várakozó álláspontot is. Potenciálisan reszekábilis N2: IIIA3: a nyirokcsomó-érintettséget mediastinoscopiával kell igazolni, és ha így derül ki az N2 státus, akkor a mûtét elôtt mindenképpen neoadjuváns kezelést neoadjuváns terápia nem kissejtes tüdôrákban Magyar Onkológia 49. évfolyam 2. szám
4 kell alkalmazni, melyet késôbb, szelektált esetben, definitív mûtét követ (a bimodalitású és a trimodalitású kezelés jobb, mint a csak mûtéti ellátás A evidencia) (34). Kombinált kemoés/vagy kemoradioterápia javasolt, mellyel megnôhet az operabilitási arány és a túlélés. A subcarinalis nyirokcsomó daganatos érintettsége esetén általában rosszabb a prognózis, és akkor is rosszabb, ha magas lokalizácójú nyirokcsomó érintett. A többszintû nyirokcsomó-érintettség rossz prognózist jelent, viszont ha csak egy nyirokcsomó érintett, akkor ennek a lokalizációja nem tûnik prognosztikailag fontosnak (kivétel a subcarinalis nyirokcsomó). A betegeket célszerûnek tartják klinikai tanulmányokban kezelni (B evidencia) (34). A neoadjuváns kezelés után több mûtéti szövôdmény várható. Ha inkomplett reszekció történik, akkor a betegek prognózisa rossz, mindenképpen el kell kerülni a debulking eljárásokat. Ahol a mûtét során nem lehet eltávolítani a tumort, vagy ahol reziduális nyirokcsomó-érintettségre derül fény, ott posztoperatív radioterápia javasolt. Bulky N2 esetén reszekció ne történjen, a mûtéttel nem jár jobban a beteg. Ilyenkor kombinált kemoradioterápia a választandó kezelés (A evidencia) (34). Andre és mtsai is az N2 stádium szubklasszifikációjának a jelentôségét hangsúlyozzák (2). Tanulmányukban 702 franciaországi beteg retrospektív elemzése alapján az mn2 stádiumú betegeik 5 éves túlélése 30% volt. A daganatosan érintett mediastinalis nyirokcsomók számára és szintjére, mint fontos prognosztikai tényezôre, hívják fel a figyelmet. Szerintük az mn2l2 (L2 = két nyirokcsomó-állomás érintett) prognózisa a cn2 (CT alapján, azaz klinikai N2)-höz hasonlóan alacsony (5 éves túlélés 11% és 7%), és eltér az mn2l1-tôl, ahol a csak sebészi ellátással az 5 éves túlélés 34%. Ezért a nyirokcsomó-érintettség preoperatív meghatározását igen fontosnak tartják. Véleményük szerint mn2l1 esetében a csak sebészi ellátás a választandó modalitás. A másik két esetben a neoadjuváns kemoterápia javítja a túlélést (az 5 éves túlélés a csak sebészi ellátás 5%-áról 18%-ra emelkedik). Ezzel együtt ezeknek az alcsoportoknak a kórlefolyása inkább a IIIB. stádiumhoz hasonlít, azaz ezek a betegek valószínûleg csak kemoradioterápiára szorulnak. Grannis a közleményhez csatlakozó kommentárjában is az alcsoportok képzésének fontosságát emeli ki (18). A heterogénnek minôsített N2 betegség esetén Suzuki és mtsai is hangsúlyozzák az alcsoportképzés jelentôségét (43). Szerintük az alsó mediastinalis szintek nyirokcsomó-érintettsége az alsó lebenyi daganatokhoz hasonlóan rosszabb prognózisú. Homogén csoportú IIIA. N2 betegség kezelésérôl számolnak be Voltolini és mtsai (47). Az 1997-es TNM beosztás alapján T1-3N2, cn2 alapján választották ki a betegeket. 3 ciklus gemcitabin/cisplatin indukciós kezelést adtak, majd 2-4 hét múlva restaging történt. Ha a reszekció komplett volt és a nyirokcsomók tumormentesnek bizonyultak, akkor további kezelés nem történt. Inkomplett reszekció vagy nodális pozitivitás esetén radioterápiát alkalmaztak (59,4 Gy). A mûtét során nyirokcsomó-disszekcióra törekedtek. Aki nem volt alkalmas mûtétre, azok 59,4 Gy dózis radioterápiában részesültek. Az OMS 18 hónap, a mûtétre kerültek MS ideje 21 hónap volt. Akiknél nem került sor mûtétre, 27 hónapon belül valamennyien meghaltak. Ahol a mûtétnél az N státusban downstaging következett be, ott sokkal jobbak voltak az eredmények (a 3 éves túlélés 59% volt a másik csoport 0%-ával szemben). A legfontosabb prognosztikai jel a patológiai downstaging volt. Akiknél a mûtét során nem találtak daganatosan érintett nyirokcsomót, azoknál a túlélés négyszer jobb volt, mint akiknél találtak. Azoknál, akiknél nem találtak patológiai downstaginget, a sebészi ellátás semmilyen elônnyel nem járt. Eredményeik biztatóak voltak, a cn2 státus és a patológiailag többszörös nyirokcsomóérintettség esetén a csak sebészi vagy csak radioterápia melletti 15%-os 2 éves túléléssel szemben az általuk alkalmazott kezeléssel a betegek 3 éves túlélése 30% volt (47). Sonett és mtsai heterogén N2 csoportban konkurráló kemoradioterápiával (túlnyomórészt carboplatin/paclitaxel), kuratív dózisú sugáradagokkal kezelték a betegeket. A patológiailag negatív mediastinalis nyirokcsomó-státus esetén az átlagos túlélés 53 hónap, az 5 éves túlélés 46,2% volt. A mediastinalis nyirokcsomók sterilizálását találták az egyedül hatásos jó prognosztikai jelnek (39). Hasonlóan jó eredményt értek el az EORTC II fázisú tanulmányban is (50). Az N2 státust biopsziával bizonyították. A kemoterápia után nem ismételték meg a mediastinoscopiát. Neoadjuvánsként csak kemoterápiát (gemcitabin/cisplatin) alkalmaztak, az RR 70,2%, a reszekabilitás 94%-os volt, 71%-ban komplett reszekció történt. Ebben az esetben is a nyirokcsomó-downstaging volt a legfontosabb prognosztikai tényezô. Az átlagos túlélés 18,9 hónapnak bizonyult. Lorent és mtsai (23) 7 éves prospektív tanulmányukban 3 ciklus kemoterápiát (vindesin/ ifosfamid/cisplatin) adtak a mûtét elôtt, a kemoterápia RR-je 54% volt. A mûtétre került betegeknél 89%-os volt a komplett reszekció. Az összesített átlagos túlélés 24 hónap, a 2 éves túlélés 51%, az 5 éves túlélés 21% volt. Az indukciós terápiára választ adók esetében az eredmények lényegesen jobbak voltak, az átlagos túlélés 38 hónap, a 2 és az 5 éves túlélés 68 és 30% volt. A mûtétre kerülteknél még jobb értékeket találtak, ebben az esetben az MS 45 hónap, a 2 és az 5 éves túlélés 68% és 35% volt. Véleményük szerint cisplatinnak korszerûbb kemoterápiás szerekkel (gemcitabin, docetaxel, paclitaxel) való kombinálásától az eredmények további javulása várható. A kemoterápiára a mellkasi CT alapján stabil állapotú esetekben is tudtak reszekciót végezni, tehát SD-nél is mûtétet kell választani. Azokban az esetekben, amikor nem értek el mediastinalis downstaginget vagy subcarinalis nyirokcsomóérintettséget találtak, ott radioterápiát végeztek. A downstaging mellett fontos prognosztikai té- 164 Magyar Onkológia 49. évfolyam 2. szám 2005 MagyAR ONKOLÓGUSOK Társasága
5 nyezônek tartják az indukciós kemoterápiára adott választ (az indukciós kezelésre reagálók 5 éves túlélése 30% volt a nem reagálók 9%-ával szemben). A késôi távoli áttétek közül kiemelik az agyi áttétek jelentôségét. Bueno és mtsai cervikális mediastinoscopiával, bal felsô lebeny daganata esetén anterior mediastinotomiával bizonyított N2 stádiumú betegeik többségénél neoadjuváns kemoterápiát alkalmaztak, radikális mûtétet és mediastinalis nyirokcsomó-diszekciót végeztek. Az N0 downstage esetekben az 5 éves túlélés 35,8% volt, az MS 21,3 hónap. A lobektómiában részesült betegek prognózisa jobb volt. Szerintük a hosszú túlélés szempontjából a sebészi reszekciónak meghatározó szerepe van (3). Meglepô módon Nagai és mtsai a neoadjuváns (3 ciklus cisplatin/vindesin) kemoterápiának randomizált tanulmányban nem találták elônyét (27). IIIB. stádium Az 1990-es évek végéig a sebészi vagy belgyógyászati okokból nem reszekábilis III. stádiumú betegeket csak sugárkezelésben részesítették, mellyel a hosszú túlélésük 3 7% volt. Ezeknél a betegeknél az utóbbi években már kombinált modalitású kezelést alkalmaznak. A kemoradioterápia elônyét a csak sugárkezeléssel szemben több tanulmány bizonyította (A evidencia) (19), 3 további tanulmány pedig a konkurráló kemoradioterápia elônyét mutatta ki (22). Vokes és mtsai empirikusan meghatározott adagban adtak gemcitabint (48). A szövôdmények közül a szignifikáns oesophagitisre hívják fel a figyelmet. Gandara és mtsai jónak találták a konszolidációs kezelést; radioterápiával konkurrálóan alkalmazott cisplatin/etoposid után konszolidációs kezelésként docetaxelt adtak (15, 16). Galetta és mtsai prospektív II. fázisú vizsgálat keretében trimodalitású kezelésben részesítették IIIB. stádiumú betegeiket. A kemoterápia (cisplatin/5-fluorouracil) után teljes dózisú radioterápiát, majd ismét kemoterápiát adtak. N3 (ellenoldali nyirokcsomó-érintettség) esetben re-do (ismételt) mediastinoscopiát végeztek. A teljes populációra nézve a reszekabilitási arány 53,8% volt. A mûtétre kerültek reszekabilitása 95,4% volt. Az 5 éves túlélés a reszekciós mûtétben részesültek esetében 38%, az MS 31,2 hónap volt (14). Pitz és mtsai IIIB. stádiumú betegeknél 3 ciklus gemcitabin/cisplatin kezelést adtak, majd restaging történt, melynek re-do mediastinoscopia is része volt. Ha ez pozitívnak bizonyult, akkor 54 Gy radioterápiát alkalmaztak, ha negatív, akkor mûtétet végeztek. Az OMS 15,1 hónap, az 1, 2 és 3 éves túlélés 60%, 25% és 15% volt. Ha CR/PR esetben történt mûtét, akkor az MS 21,5 hónap volt. A neoadjuváns kemoterápiában részesült T4N0 (kivéve a pleuritis carcinomatosát) és az N2/3 csoport között a túlélésében nem találtak szignifikáns eltérést (29). Gondosan válogatott esetben IIIB. stádiumban is sor kerülhet mûtétre, egyébként a kemoradioterápia a választandó kezelési mód. Ma azonban még nem ismert olyan III. fázisú tanulmány, amely alapján eldönthetô lenne, hogy a neoadjuváns kezelés mûtéttel jobb eredményhez vezet-e, mint önmagában a kemoradioterápia. Ezzel szemben T4 (kivéve a pleuritis carcinomatosát), esetleg azonos lebenyi nyirokcsomó-érintettség esetében esetleges reszekció megítélése céljából sebészi konzultációt javasolnak (B evidencia) (19). Rendia és mtsai centrális lokalizációjú T4 stádiumú esetekben az indukciós kemoterápia (mitomycin/vinblastin/cisplatin) eredményességérôl számoltak be (31). 73%-ban tudtak mûtétet végezni, 63%-ban komplett reszekció történt. A komplett reszekción átesett betegek 4 éves túlélése 30,4% volt az összes beteg 19,8%-os túlélésével szemben. Ma még mindig kérdéses ezeknek a betegeknek az optimális ellátása, de az már megállapítható, hogy önmagában a radioterápiától nem várható jó eredmény. Az összevontan IIIA. és IIIB. stádiumú betegekkel végzett tanulmányok eredményei Mivel Rossell et al (35) 1994-es anyagában mûtét után gyakori volt a daganat lokális kiújulása, ezért már korán felmerült, hogy a kemoterápia mellé a radioterápiát is célszerû bevonni a preoperatív kezelésbe (21). Ennek ellentmondtak Martin és mtsai megfigyelései, akik azt találták, hogy bár a radioterápia mellett több volt a patológiai komplett remisszió és csökkent a daganat lokoregionális visszatérése, a radioterápia nem befolyásolta a túlélést (25). Ma a lokálisan kiterjedt, III. stádiumú NSCLC neoadjuváns kezeléseként a legjobb modalitásnak a kemoradioterápiát tartják (1, 6, 8-10, 14, 20, 21, 24, 25, 30, 32, 34, 39, 41, 42, 44, 45, 49, 51). Az ún. N2 betegségben (IIIA. N2) sokan önmagában adtak kemoterápiát (34, 47, 50), de ezekben a kórformákban is látványosan a legjobb eredményt a preoperatív kemoradioterápiával érték el (39). A radioterápia a lokális kontroll miatt fontos, a kemoterápia pedig csökkenti a távoli áttétek fellépésének gyakoriságát, az agyi metasztázisok kivételével (6, 8). A késôi agyi metasztázisok miatt egyre többen hangsúlyozzák a preventív koponyabesugárzás jelentôségét (5, 6, 16, 29, 47). A kemoterápiát illetôen megoszlanak a beszámolók: neoadjuváns kemoterápiaként cisplatin/ elnyújtott adagolású orális etoposid (6), ifosfamid/carboplatin/etoposid (44), mitomycin/ vinblastin/cisplatin (25), gemcitabin/cisplatin (5, 49); radioterápiával együtt (konkurráló módon) adva napi kisadagú cisplatin (49), cisplatin/ etoposid (30), carboplatin/ifosfamid/etoposid (20), cisplatin/vinblastin/fluorouracil (41), docetaxel/ cisplatin (21), cisplatin/paclitaxel (8, 32) docetaxel/carboplatin (51) szerepelnek a közleményekben. A kemoterápiás ciklusok száma 2 (20) és 3 (30) között változik. A kemoterápia és a radioterápia egymáshoz viszonyított adásának a módja is változó. Volt, ahol az indukciós kemoterápiát konkurráló ke- neoadjuváns terápia nem kissejtes tüdôrákban Magyar Onkológia 49. évfolyam 2. szám
6 moradioterápia követte (6, 8, 20), volt, ahol a kemoterápiát és a radioterápiát szekvenciálisan adták (44). Vannak, akik a konkurráló kemoradioterápia elôtt azért nem javasolják az indukciós kemoterápiát, mert ilyenkor már nem lehet a szükséges dózisokat megadni (16). Jónak tûnik a konkurráló kemoradioterápia után alkalmazott konszolidációs kezelés docetaxellel (10, 15, 16). Vannak, akik határozottan ellenzik a kemoés a radioterápia egyidôben (konkurráló módon) való adását, a besugárzás befejezése után egy héten belül nem adnak kemoterápiát (5). Ennek ellenére legtöbben ma már konkurráló kemoradioterápiát alkalmaznak, egyre többször konformális módon 3D tervezéssel (10). Ezzel a modalitással jobb a lokoregionális kontroll, javul a túlélés, de a kezelés toxicitása, bár elviselhetô mértékben, megnô (10). A radioterápia dózisa változó, legtöbben Gy-t javasolnak (20, 32). Vannak azonban, akik kuratív dózisú radioterápiát adnak kemoterápiával konkurráló módon (39, 30). Több közlemény szerint a hiperfrakcionált radioterápia a betegeknek további elônyt nem jelent (21, 32, 49), és a CHART (continuous hyperfractionated accelerated radiation therapy) sémát sem tartják elônyösnek (19). Thomas és mtsai tanulmányában (44) a neoadjuváns kezelés mortalitása indukciós (carboplatin/ifosfamid/etoposid), majd konkurráló kemoradioterápia (radioterápia 45 Gy) esetében 9% volt (44), más esetben sem közöltek 10%-ot meghaladó mortalitást. A radikális sebészi ellátástól várható a legjobb lokális kontroll. Azoknál a betegeknél várható a legjobb túlélés, akiknél a mûtét során a legkifejezettebb a downstaging. A mûtét során a lobektómiát preferálják (45). Miután a patológiai feldolgozás nem korrelál a mellkasi CT-lelettel, a stabil állapotú betegek mûtéte is indokolt (8). Mindazonáltal a heterogén III. stádiumú betegek vizsgálataiból nem lehet meggyôzô eredményre jutni, amit az is igazol, hogy voltak, akik a sebészi terápiától nem láttak elônyt (41). Eberhardt és mtsai áttekintô tanulmányukban megállapítják, hogy amellett, hogy a III. stádiumban a legjobb eredmények konkurráló kemoradioterápiával érhetôk el, a sebészi terápia hatásossága ma még nem ítélhetô meg (10). A neoadjuváns kezelés RR-je a közleményekben 63,5 és 73% között változik (20, 21, 45, 49). A mûtétre került betegek aránya is igen változó, 31% és 69% közötti (5, 49). A komplett reszekciós arány is szélsôséges, 27%-50%-tól (30, 49) 92,5%- ig (20) változik, többnyire 70% felett van (5, 8, 9, 21, 25, 32, 41, 45). A mûtét során észlelt downstaging arányát 31% és 75% között találták (20, 21, 32, 45). Az OMS szélsô értékei 16 és 37 hónap (6, 8, 20, 30, 49). A mûtétre kerültek MS értékei is szórnak, van, ahol 10 hónapnak találták (1), a legtöbb esetben hónap (20, 25, 32, 44), pn0 (downstage) esetben 30 hónap (1), p0-i (downstage) stádiumban 32,5 hónap volt (45). Az elôrehaladottabb kórformákban az MS érthetôen alacsonyabb volt (25, 41, 44). Az 1 éves túlélés 65% körüli (6, 8, 30, 41, 49), a 2 éves túlélés 34 és 61% közötti (6, 30, 32, 49), ahol külön értékelték a IIIB. stádiumot, ott a 2 éves túlélés rövidebb, 17% volt (32). A 3 éves túlélés operáltak esetében jóval magasabb, mint a mûtétre nem kerülô eseteké, 22% és 66%(!) között változik (1, 6, 8, 20, 21, 30, 45), pn2 esetén alacsonyabb, 18% volt (1). Volt, ahol az összesített túlélés elérte a 30%-ot is (20). Megbeszélés A III. stádiumú NSCLC optimális kezelési módját még meg kell határozni. A legtöbb esetben kevés a bevont beteg, és a követési idô sem elégséges ahhoz, hogy a multimodalitású kezelés elônyeit meg tudjuk ítélni. Mivel a betegek többsége távoli metasztázisban hal meg, ezért növelni kellene a kemoterápia hatékonyságát (25). Melyik a választandó kemoterápia? Mindenképpen platina-alapú legyen, melyet az újabb kemoterápiás szerekkel, pl. gemcitabinnal (5, 29, 49) célszerû kombinálni. Az is kérdéses, hogy hány ciklusban adjuk a kemoterápiát. A legtöbb esetben 3 ciklus kemoterápiát adnak. Általában a neoadjuváns kezelés befejezése után nappal kerül sor mûtétre (45). Kérdés, hogy a neoadjuváns kemoterápia fokozza-e a mûtéti szövôdményeket? Voltak, akik az infekciós szövôdmények növekedését találták (33). Mások nem tapasztalták a mûtéti szövôdmények halmozódását (34, 37). Nem várható több mûtéti szövôdmény akkor, ha a súlyos komorbiditásban szenvedô betegeket kizárják a mûtétbôl. Sonett és mtsai még a kemoterápia után adott kuratív dózisú radioterápiában részesülô betegeknél sem találtak több mûtéti szövôdményt (38). Ezzel szemben, éppen a várható mûtéti szövôdmények miatt Rendina és mtsai T4 betegek esetében kifejezetten ellenzik a preoperatív radioterápiát (31). A mûtéti szövôdmények közül kiemelhetô a bronchopleuralis fistula, többek között ezért is javasolják, hogy a pulmonektómia helyett lehetôség szerint sleeve reszekció történjen (32). Mi legyen a tanulmány végpontja? Lehet a reszekabilitás, lehet a patológiai komplett válasz. A reszekabilitás fontos, azonban a legkövetkezetesebb jó prognosztikai végpontnak a primer tumor vagy a mediastinalis nyirokcsomók pcr-je bizonyult (13, 32). Helyettesítô végpontnak legtöbben a downstaginget javasolják (7, 11, 29). Ismételten felvetik a profilaktikus agyi besugárzás fontosságát, mivel a legtöbb távoli áttét agyi metasztázis (5, 6, 16, 29, 47). Mivel a CT nem igazán alkalmas a neoadjuváns kezelést követô restagingre, ezért a stabil állapotú betegeket is meg kell operálni (23). A preoperatív sugárterápia dózisában sincs egyetértés. Van, aki szerint 45 Gy fölé semmiképpen nem szabad menni (4). 45 Gy-t adtak mûtét elôtt Thomas és mtsai (44), D Angelillo és mtsai (7), valamint Machtay és mtsai (24). A konkurráló radioterápia során általában Gy-t adnak (13). Ettôl eltérôen voltak, akik kuratív dózisú (59 Gy) radioterápia után is különösebb szövôd- 166 Magyar Onkológia 49. évfolyam 2. szám 2005 MagyAR ONKOLÓGUSOK Társasága
7 mény nélkül végeztek mûtétet (14, 38, 39). A hiperfrakcionált radioterápia nem vált be (13), a CHART kezelést sem javasolják (19). Még mindig nem ismeretes, hogy kik azok a IIIA., IIIB. stádiumú betegek, akiknek a neoadjuváns kemoradioterápiával javul a betegségmentes túlélése. Számos tanulmány alapján azonban már megállapítható, hogy akiknél a mediastinumban pcr-t érnek el, és akiknél R0 reszekciót tudnak végezni indukciós kezelés után, azok járnak a legjobban a sebészi ellátással (30, 32). A IIIB. stádiumú betegeknél a neoadjuváns kemoterápiát követô ellátásban a mûtét szerepe azonban ma még tisztázatlan (29). Konklúzió Az elmúlt 10 évben megtanultuk, hogy a jobb összehasonlíthatóság és az egységes terápiára törekvés céljából a III. stádiumú NSCLC esetekben alcsoportok képzésére kell törekedni. Az alcsoportok képzésére jó példa a IIIA. N2 stádium (34). A T4 (a pleuritis carcinomatosát kivéve) inkább lokoregionális betegségnek, az N2/N3 csoport inkább szisztémás megbetegedésnek tartandó (11). Történtek elôrelépések az elmúlt 10 évben a lokálisan elôrehaladott III. stádiumú NSCLC kezelésében? Igen, a betegek várható 5 éves túlélésében a bi- vagy trimodalitású kezelésekkel 3-7% körüli javulást értek el. Az agresszív kezeléseknek azonban nagyobb a kockázata. Meg kellene határozni, melyik betegcsoport jár jobban a sebészi kiegészítéssel, és melyik a csak kemoradioterápiával. A downstagingnél külön kell választani a T és az N státust. Az eredmények értékelésénél figyelembe kell venni a III. stádium heterogenitását. Itt az ideje a nagy randomizált tanulmányoknak. Irodalom 1. Albain KS, Rusch VW, Crowley JJ, et al. Concurrent cisplatin/etoposide plus chest radiotherapy followed by surgery for stages IIIA (N2) and IIIB non-small-cell lung cancer: mature results of Southwest Oncology Group phase II study J Clin Oncol 13: , Andre F, Grunenwald D, Pignon JP, et al. Survival of patients With resected N2 non-small-cell lung cancer: Evidence for a subclassification and implications. J Clin Oncol 18: , Bueno R, Richards WG, Swanson SJ, et al. Nodal stage after induction therapy for stage IIIA lung cancer determines patient survival. Ann Thorac Surg 70: , Bunn PA, Mault J, Kelly K. Adjuvant and neoadjuvant chemotherapy for non-small cell lung cancer: A time for reassessment? Chest 117(Suppl.):119S-122S, Cappuzzo F, Selvaggi G, Gregorc V, et al. Gemcitabine and cisplatin as induction chemotherapy for patients with unresectable stage IIIA-bulky N2 and stage IIIB nonsmall cell lung carcinoma. Cancer 98: , Cyjon A, Nili M, Fink G, et al. Advanced non-small cell lung cancer: induction chemotherapy and chemoradiation before operation. Ann Thorac Surg 74: , D Angelillo RM, Trodella L, Ramella S, et al. Assessing the value of neoadjuvant chemoradiotherapy and pathologic downstaging in the treatment of non-small cell lung cancer. J Thorac Cardiovasc Surg 128: , DeCamp MM, Rice TW, Adelstein DJ et al. Value of accelerated multimodality therapy in stage IIIA and IIIB non-small cell lung cancer. J Thorac Cardiovasc Surg 126: 17-27, Eberhardt W, Whilke H, Stamatis G, et al. Preoperative chemotherapy followed by concurrent chemoradiation therapy based on hyperfractionated accelerated radiotherapy and definitive surgery in locally advanced nonsmall-cell lung cancer: mature results of a phase II trial. J Clin Oncol 16: , Eberhardt W, Gauler T, Hepp R, et al. The role of chemoradiotherapy in the treatment of stage III nonsmall-cell lung cancer. Ann Oncol 15(Suppl.):iv71-iv80, Eberhardt W, Stuschke M, Stamatis G. Preoperative chemoradiation approaches to locally advanced nonsmall-cell lung cancer: one man s pride, another man s burden? Ann Oncol 15: , De Giacomo T, Rendina EA, Venuta F, et al. Thoracoscopic staging of IIIB non-small cell lung cancer before neoadjuvant therapy. Ann Thorac Surg 64: , Edelman MJ, Gandara DR, Roach III M et al. Multimodality therapy in stage III non-small cell lung cancer. Ann Thorac Surg 61: , Galetta D, Cesario A, Margaritora S, et al. Enduring challenge in the treatment of nonsmall cell lung cancer with clinical stage IIIB: results of a trimodality approach. Ann Thorac Surg 76: , Gandara DR, Lovato LC, Albain KS et al. Prolonged survival in pathologic stage IIIB non-small cell lung cancer (NSCLC) with concurrent chemoradiotherapy followed by consolidation docetaxel: a phase II study (S9504) of the Southwest Oncology Group (SWOG). Proc Am Soc Clin Oncol 19:490a(abstract 1916), Gandara DR, Chansky K, Albain KS, et al. Consolidation docetaxel after concurrent chemoradiotherapy in stage IIIB non-small-cell lung cancer: phase II Southwest Oncology Group Study S9504. J Clin Oncol 21: , Granetzky A, Striehn E, Bosse U, et al. A phase II singleinstitution study of neoadjuvant stage IIIA/B chemotherapy and radiochemotherapy in non-small cell lung cancer. Ann Thorac Surg 75: , Grannis FW. Subclassification of N2 non-small-cell lung cancer. J Clin Oncol 19: , Jett JR, Scott WJ, Rivera MP, et al. Guidelines on treatment of stage IIIB non-small cell lung cancer. Chest 123:221S-225S, Junker K, Langner K, Klinke F et al. Grading of tumor regression in non-small cell lung cancer. Chest 120: , Katayama H, Ueoka H, Kiura K, et al. Preoperative concurrent chemoradiotherapy with cisplatin and docetaxel in patients with locally advanced non-smallcell lung cancer. Br J Cancer 90: , Langer CJ. The emerging role of gemcitabine in combination with radiation in locally advanced, unresectable non-small-cell lung cancer. Clin Lung Cancer 4(Suppl.):S45-S49, Lorent N, De Leyn P, Lievens Y, et al. Long-term survival of surgically staged IIIA-N2 non-small-cell lung cancer treated with surgical combined modality approach: analysis of a 7-year prospective experience. Ann Oncol 15: , Machtay M, Lee JH, Stevenson JP, et al. Two commonly used neoadjuvant chemoradiotherapy regimens for locally advanced stage III non-small cell lung carcinoma: Long-term results and associations with pathologic response. J Thorac Cardiovasc Surg 127: , Martin J, Ginsberg RJ, Venkatraman ES, et al. Longterm results of combined-modality therapy in resectable non-small-cell lung cancer. J Clin Oncol 20: , Mountain CF. Revision of the international system for staging lung cancer. Chest 111: , Nagai K, Tsuchiya R, Mori T, et al. A randomized trial comparing induction chemotherapy followed by surgery neoadjuváns terápia nem kissejtes tüdôrákban Magyar Onkológia 49. évfolyam 2. szám
8 with surgery alone for patients with stage IIIA N2 nonsmall cell lung cancer (JCOG 9209). J Thorac Cardiovasc Surg 125: , Ostoros Gy, Heiler Z, Beálló E, et al. A lokálisan kiterjedt primer hörgôrák N2-es stádiumáról, az N2 betegségrôl. Med Thor 50: , Pitz CCM, Maas KW, Van Swieten HA, et al. Surgery as part of combined modality treatment in stage IIIB nonsmall cell lung cancer. Ann Thorac Surg 74: , Pöttgen C, Eberhardt W, Bildat S, et al. Induction chemotherapy followed by concurrent chemotherapy and definitive high-dose radiotherapy for patients with locally advanced non-small-cell lung cancer (stages IIIa/IIIb): a pilot phase I/II trial. Ann Oncol 13: , Rendina EA, Venuta F, De Giacomo T, et al. Induction chemotherapy for T4 centrally located non-small cell lung cancer. J Thorac Cardiovasc Surg 117: , Rice TW, Adelstein DJ, Ciezki JP et al. Short-course induction chemoradiotherapy with paclitaxel for stage III non-small-cell lung cancer. Ann Thorac Surg 66: , Roberts JR, Eustis C, Devore R, et al. Induction chemotherapy increases perioperative complications in patients undergoing resection for non-small cell lung cancer. Ann Thorac Surg 72: , Robinson LA, Wagner H, Ruckdeschel JC. Treatment of stage IIIA non-small cell lung cancer. Chest 123:202S- 220S, Rosell R, Gomez-Cordina J, Comps R, et al. A randomized trial comparing preoperative chemotherapy plus surgery with surgery alone in patients with nonsmall cell lung cancer. N Engl J Med 330: , Roth JA, Fossella F, Komaki R, et al. A randomized trial comparing perioperative chemotherapy and surgery with surgery alone in resectable stage IIIA non-smallcell lung cancer. J Natl Cancer Inst 86: , Siegenthaler MP, Pisters KM, Merriman KW, et al. Preoperative chemotherapy for lung cancer does not increase surgical morbidity. Ann Thorac Surg 71: , Sonett JR, Krasna MJ, Suntharalingam M, et al. Safe pulmonary resection after chemotherapy and high-dose thoracic radiation. Ann Thorac Surg 68: , Sonett JR, Suntharalingam M, Edelman MJ, et al. Pulmonary resection after curative intent radiotherapy (>59 Gy) and concurrent chemotherapy in non-smallcell lung cancer. Ann Thorac Surg 78: , Stewart LA, Burdett S, Sonhami RL. Postoperative radiotherapy (PORT) in non-small cell lung cancer (NSCLC). A meta-analysis using individual patient data (IPD) from randomized clinical trials (RLTS). MRC cancer trials office. Proc Am Soc Clin Oncol 17:457A (abstract 1760) Strauss GM, Herndon JE, Sherman DD, et al. Neoadjuvant chemotherapy and radiotherapy followed by surgery in stage IIIA non-small-cell carcinoma of the lung: report of a Cancer and Leukemia Group B phase II study. J Clin Oncol 10: , Strauss GM. Role of chemotherapy in stages I to III nonsmall cell lung cancer. Chest 116:509S-516S, Suzuki K, Nagai K, Yoshida J, et al. The prognosis of surgically resected N2 non-small cell lung cancer: the importance of clinical N status. J Thorac Cardiovasc Surg 118: , Thomas M, Rübe C, Semik M, et al. Impact of preoperative bimodality induction including twice-daily radiation on tumor regression and survival in stage III non-small-cell lung cancer. J Clin Oncol 17: , Trodella L, Granone P, Valente S, et al. Neoadjuvant concurrent radiochemotherapy in locally advanced (IIIA-IIIB) non-small-cell lung cancer: long term results according to downstaging. Ann Oncol 15: , Van Kooten M, Rosenberg M, Orlando M, et al. Neoadjuvant chemotherapy with gemcitabine and cisplatin in stage IIIA/B non-small cell lung cancer. Invest New Drugs 20: , Voltolini L, Luzzi L, Ghiribelli C, et al. Results of induction chemotherapy followed by surgical resection in patients with stage IIIA (N2) non-small cell lung cancer: the importance of the nodal down-staging after chemotherapy. Eur J Cardio-thor Surg 20: , Vokes EE, Herndon II JE, Crawford J, et al. Randomized phase II study of cisplatin with gemcitabine or paclitaxel or vinorelbin as induction chemotherapy followed by concomitant chemoradiotherapy for stage IIIB nonsmall-cell lung cancer: Cancer and Leukemia Group B Study J Clin Oncol 20: , Yang CH, Tsai CM, Wang LS, et al. Gemcitabine and cisplatin in a multimodality treatment for locally advanced non-small cell lung cancer. Br J Cancer 86: , Zandwijk Van N, Smit EF, Kramer GWP, et al. Gemcitabine and cisplatin as induction regimen for patients with biopsy-proven stage IIIA N2 non-small-cell lung cancer: a phase II study of the European Organization for Research and Treatment of Cancer Lung Cancer Cooperative Group (EORTC 08955). J Clin Oncol 18: , Wirth LJ, Lucca J, Ostler P, et al. Induction docetaxel and carboplatin followed by weekly docetaxel and carboplatin with concurrent radiotherapy, then surgery in stage III non-small cell lung cancer: a phase I study. Clin Cancer Res 9: , Magyar Onkológia 49. évfolyam 2. szám 2005 MagyAR ONKOLÓGUSOK Társasága
A tüdőrák agyi metasztázisainak komplex kezelése az onkopulmonológus szemszögéből
 A tüdőrák agyi metasztázisainak komplex kezelése az onkopulmonológus szemszögéből Ostoros Gyula Országos Korányi TBC és Pulmonológiai Intézet 2007. október 6. Az onkológia jelenlegi legnagyobb kihívása
A tüdőrák agyi metasztázisainak komplex kezelése az onkopulmonológus szemszögéből Ostoros Gyula Országos Korányi TBC és Pulmonológiai Intézet 2007. október 6. Az onkológia jelenlegi legnagyobb kihívása
XIII./5. fejezet: Terápia
 XIII./5. fejezet: Terápia A betegek kezelésekor a sebészi kezelés, a kemoterápia (klasszikus citotoxikus és a biológiai terápia), a radioterápia és ezek együttes alkalmazása egyaránt szóba jön. A gégének
XIII./5. fejezet: Terápia A betegek kezelésekor a sebészi kezelés, a kemoterápia (klasszikus citotoxikus és a biológiai terápia), a radioterápia és ezek együttes alkalmazása egyaránt szóba jön. A gégének
 Sebész szerepe az axilla ellátásában Mersich Tamás Uzsoki utcai Kórház Sebészeti-onkosebészeti Osztály 2014. május 24. Kecskemét Bevezetés A nyirokcsomók sebészi eltávolítása felel a legtöbb szövődményért
Sebész szerepe az axilla ellátásában Mersich Tamás Uzsoki utcai Kórház Sebészeti-onkosebészeti Osztály 2014. május 24. Kecskemét Bevezetés A nyirokcsomók sebészi eltávolítása felel a legtöbb szövődményért
A nagy dilemma: a nem kissejtes tüdôrák kemoterápiája
 A nagy dilemma: a nem kissejtes tüdôrák kemoterápiája Onkopulmonológia Ostoros Gyula Országos Korányi TBC és Pulmonológiai Intézet, IV-es Tüdôbelgyógyászat, Budapest A tüdôgyógyászati onkológiai talán
A nagy dilemma: a nem kissejtes tüdôrák kemoterápiája Onkopulmonológia Ostoros Gyula Országos Korányi TBC és Pulmonológiai Intézet, IV-es Tüdôbelgyógyászat, Budapest A tüdôgyógyászati onkológiai talán
A tüdőrák hazai gyógyszeres kezelésének elemzése
 Eredeti közlemény 33 A tüdőrák hazai gyógyszeres kezelésének elemzése Moldvay Judit 1, Rokszin György 2, Abonyi-Tóth Zsolt 2, Katona Lajos 3, Kovács Gábor 4 1 Semmelweis Egyetem Pulmonológiai Klinika,
Eredeti közlemény 33 A tüdőrák hazai gyógyszeres kezelésének elemzése Moldvay Judit 1, Rokszin György 2, Abonyi-Tóth Zsolt 2, Katona Lajos 3, Kovács Gábor 4 1 Semmelweis Egyetem Pulmonológiai Klinika,
Intrapulmonális metasztázisok prognosztikai jelentôsége operált tüdôrákos esetekben
 Intrapulmonális metasztázisok prognosztikai jelentôsége operált tüdôrákos esetekben Szôke Tamás, 1 Troján Imre, 1 Furák József, 1 Tiszlavicz László, 2 Balogh Ádám 1 Szegedi Tudományegyetem, Sebészeti Klinika,
Intrapulmonális metasztázisok prognosztikai jelentôsége operált tüdôrákos esetekben Szôke Tamás, 1 Troján Imre, 1 Furák József, 1 Tiszlavicz László, 2 Balogh Ádám 1 Szegedi Tudományegyetem, Sebészeti Klinika,
OncotypeDX az emlőrák kezelésében
 OncotypeDX az emlőrák kezelésében Dr. Nagy Zoltán Med Gen-Sol Kft. Szenológiai Kongresszus Kecskemét 2018. 04. 13-14. Slide 1 Az Oncotype DX korai emlőrák teszt 16 tumorral kapcsolatos gén Ösztrogén csoprt
OncotypeDX az emlőrák kezelésében Dr. Nagy Zoltán Med Gen-Sol Kft. Szenológiai Kongresszus Kecskemét 2018. 04. 13-14. Slide 1 Az Oncotype DX korai emlőrák teszt 16 tumorral kapcsolatos gén Ösztrogén csoprt
PUBLICATIONS. doctorandus: Júlia Vízkeleti
 PUBLICATIONS doctorandus: Júlia Vízkeleti Articles in the subject of the dissertation: 1. Vízkeleti J., Vereczkey I., Fröhlich G., Varga S., Horváth K., Pulay T., Pete I.,,Kásler M., Polgár C.: Pathologic
PUBLICATIONS doctorandus: Júlia Vízkeleti Articles in the subject of the dissertation: 1. Vízkeleti J., Vereczkey I., Fröhlich G., Varga S., Horváth K., Pulay T., Pete I.,,Kásler M., Polgár C.: Pathologic
A vesedaganatok sebészi kezelése
 A vesedaganatok sebészi kezelése Szendrői Attila Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum Az Európai Urológus Testület képzőhelye Robson elvek (1963) Nincs szisztémás kezelés -radikális
A vesedaganatok sebészi kezelése Szendrői Attila Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum Az Európai Urológus Testület képzőhelye Robson elvek (1963) Nincs szisztémás kezelés -radikális
Pathologiai lelet értéke a tüdőrákok kezelésének megválasztásában. Nagy Tünde Országos Onkológiai Intézet B belosztály
 Pathologiai lelet értéke a tüdőrákok kezelésének megválasztásában Nagy Tünde Országos Onkológiai Intézet B belosztály A tüdőrák a vezető daganatos halálok USA-ban: férfiak daganatos mortalitása 1930-2000*
Pathologiai lelet értéke a tüdőrákok kezelésének megválasztásában Nagy Tünde Országos Onkológiai Intézet B belosztály A tüdőrák a vezető daganatos halálok USA-ban: férfiak daganatos mortalitása 1930-2000*
ÚJDONSÁGOK ELŐREHALADOTT NEM KISSEJTES TÜDŐRÁK KOMPLEX ONKOLÓGIAI KEZELÉSÉBEN
 ÚJDONSÁGOK ELŐREHALADOTT NEM KISSEJTES TÜDŐRÁK KOMPLEX ONKOLÓGIAI KEZELÉSÉBEN Ph.D. Tézis /rövidített változat/ Dr. Maráz Anikó Témavezető: Dr. Hideghéty Katalin, Ph.D. Szegedi Tudományegyetem Általános
ÚJDONSÁGOK ELŐREHALADOTT NEM KISSEJTES TÜDŐRÁK KOMPLEX ONKOLÓGIAI KEZELÉSÉBEN Ph.D. Tézis /rövidített változat/ Dr. Maráz Anikó Témavezető: Dr. Hideghéty Katalin, Ph.D. Szegedi Tudományegyetem Általános
ALK+ tüdőrák a klinikai gyakorlatban. Dr. Ostoros Gyula Országos Korányi Pulmonológiai Intézet Budapest
 ALK+ tüdőrák a klinikai gyakorlatban Dr. Ostoros Gyula Országos Korányi Pulmonológiai Intézet Budapest Előadói megjegyzés Az előadás az előadó független szakmai véleményét tükrözi, ami nem feltétlenül
ALK+ tüdőrák a klinikai gyakorlatban Dr. Ostoros Gyula Országos Korányi Pulmonológiai Intézet Budapest Előadói megjegyzés Az előadás az előadó független szakmai véleményét tükrözi, ami nem feltétlenül
A rosszindulatú daganatos halálozás változása 1975 és 2001 között Magyarországon
 A rosszindulatú daganatos halálozás változása és között Eredeti közlemény Gaudi István 1,2, Kásler Miklós 2 1 MTA Számítástechnikai és Automatizálási Kutató Intézete, Budapest 2 Országos Onkológiai Intézet,
A rosszindulatú daganatos halálozás változása és között Eredeti közlemény Gaudi István 1,2, Kásler Miklós 2 1 MTA Számítástechnikai és Automatizálási Kutató Intézete, Budapest 2 Országos Onkológiai Intézet,
TÜDİRÁKOK ONKOLÓGIÁJA
 TÜDİRÁKOK ONKOLÓGIÁJA Dr. Maráz Anikó Szegedi Tudományegyetem Onkoterápiás Klinika 2012. november 14. Daganatos halálozás Európában, 1955-2015 Daganatos betegségek incidenciája /WHO, 2006/ Tüdı 1 200 000
TÜDİRÁKOK ONKOLÓGIÁJA Dr. Maráz Anikó Szegedi Tudományegyetem Onkoterápiás Klinika 2012. november 14. Daganatos halálozás Európában, 1955-2015 Daganatos betegségek incidenciája /WHO, 2006/ Tüdı 1 200 000
Változások a nem kissejtes tüdôrák (NSCLC) sebészi kezelésének algoritmusában
 Változások a nem kissejtes tüdôrák (NSCLC) sebészi kezelésének algoritmusában Onkopulmonológia Csekeô Attila Országos Korányi Intézet Mellkassebészeti Osztály és Semmelweis Egyetem Egészségtudományi Kar
Változások a nem kissejtes tüdôrák (NSCLC) sebészi kezelésének algoritmusában Onkopulmonológia Csekeô Attila Országos Korányi Intézet Mellkassebészeti Osztály és Semmelweis Egyetem Egészségtudományi Kar
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend)
 A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
A kemoterápia idôtartama elôrehaladott nem kissejtes tüdôrákban: véletlen besorolásos vizsgálatok áttekintése és metaanalízise
 5. ÉVFOLYAM, 5. SZÁM 2009. OKTÓBER JOURNAL OF CLINICAL ONCOLOGY EREDETI KÖZLEMÉNY A kemoterápia idôtartama elôrehaladott nem kissejtes tüdôrákban: véletlen besorolásos vizsgálatok áttekintése és metaanalízise
5. ÉVFOLYAM, 5. SZÁM 2009. OKTÓBER JOURNAL OF CLINICAL ONCOLOGY EREDETI KÖZLEMÉNY A kemoterápia idôtartama elôrehaladott nem kissejtes tüdôrákban: véletlen besorolásos vizsgálatok áttekintése és metaanalízise
A sugárterápia szerepe a daganatok kezelésében
 A sugárterápia szerepe a daganatok kezelésében Dr. Horváth Ákos DEOEC Sugárterápia Tanszék A sugárterápia szerepe a daganatok kezelésében Onkoterápiás lehetőségek: Lokális: - sebészet - sugárterápia -
A sugárterápia szerepe a daganatok kezelésében Dr. Horváth Ákos DEOEC Sugárterápia Tanszék A sugárterápia szerepe a daganatok kezelésében Onkoterápiás lehetőségek: Lokális: - sebészet - sugárterápia -
A lokális vagy helyileg előrehaladott nyelőcsőrák gyógyszeres és kombinált kezeléseinek áttekintése
 288 ÖSSZEFOGLALÓ KÖZLEMÉNY A lokális vagy helyileg előrehaladott nyelőcsőrák gyógyszeres és kombinált kezeléseinek áttekintése NAGY TÜNDE, RUBOVSZKY GÁBOR Országos Onkológiai Intézet, Budapest Levelezési
288 ÖSSZEFOGLALÓ KÖZLEMÉNY A lokális vagy helyileg előrehaladott nyelőcsőrák gyógyszeres és kombinált kezeléseinek áttekintése NAGY TÜNDE, RUBOVSZKY GÁBOR Országos Onkológiai Intézet, Budapest Levelezési
Bevacizumab kombinációval elért hosszútávú remissziók metasztatikus colorectális carcinomában
 Bevacizumab kombinációval elért hosszútávú remissziók metasztatikus colorectális carcinomában G E LE N C S É R V I K TÓ R I A, B O É R K ATA LI N SZ E N T MA RGIT KÓ RH Á Z, O N KO LÓ GIA MAGYOT, 2016.05.05
Bevacizumab kombinációval elért hosszútávú remissziók metasztatikus colorectális carcinomában G E LE N C S É R V I K TÓ R I A, B O É R K ATA LI N SZ E N T MA RGIT KÓ RH Á Z, O N KO LÓ GIA MAGYOT, 2016.05.05
Korai tripla negatív emlődaganat gyógyszeres kezelése. Rubovszky Gábor Magyar Szenológiai Társaság Tudományos Ülése Kecskemét, 2018.április
 Korai tripla negatív emlődaganat gyógyszeres kezelése Rubovszky Gábor Magyar Szenológiai Társaság Tudományos Ülése Kecskemét, 2018.április 13-14. Mi az, amit tudunk? Prognózisa rossz. Heterogén. Általában
Korai tripla negatív emlődaganat gyógyszeres kezelése Rubovszky Gábor Magyar Szenológiai Társaság Tudományos Ülése Kecskemét, 2018.április 13-14. Mi az, amit tudunk? Prognózisa rossz. Heterogén. Általában
Az emlő betegek ellátása során elért eredmények, tapasztalataink
 Az emlő betegek ellátása során elért eredmények, tapasztalataink 2005.-2015. Szerző: Dinka Tibor, Abasiute A. George, Bodócs Ildikó, Kiss Csaba, Kelemen János, Kovács László, Kovács Ottó, Szántó Zoltán,
Az emlő betegek ellátása során elért eredmények, tapasztalataink 2005.-2015. Szerző: Dinka Tibor, Abasiute A. George, Bodócs Ildikó, Kiss Csaba, Kelemen János, Kovács László, Kovács Ottó, Szántó Zoltán,
A tüdôrák sugárkezelése: visszatekintés és a legújabb evidenciák
 A tüdôrák sugárkezelése: visszatekintés és a legújabb evidenciák Eredeti közlemény Horváth Ákos 1, Bajcsay András 2 1 Debreceni Egyetem Orvos- és Egészségtudományi Centrum Sugárterápia Tanszék, Debrecen,
A tüdôrák sugárkezelése: visszatekintés és a legújabb evidenciák Eredeti közlemény Horváth Ákos 1, Bajcsay András 2 1 Debreceni Egyetem Orvos- és Egészségtudományi Centrum Sugárterápia Tanszék, Debrecen,
Nyelőcső tumorok kezelésének (új) lehetőségei
 Nyelőcső tumorok kezelésének (új) lehetőségei Dr. Csenki Melinda SZTE Onkoterápiás Klinika Kötelelező szintentartó tanfolyam 2018. Szeptember 12-15. Szeged Világszerte növekvő incidencia (Kelet-Ázsia-squamous
Nyelőcső tumorok kezelésének (új) lehetőségei Dr. Csenki Melinda SZTE Onkoterápiás Klinika Kötelelező szintentartó tanfolyam 2018. Szeptember 12-15. Szeged Világszerte növekvő incidencia (Kelet-Ázsia-squamous
A kissejtes tüdôrák kemoterápiája
 A kissejtes tüdôrák kemoterápiája Onkopulmonológia Szondy Klára Semmelweis Egyetem, Pulmonológiai Klinika, Budapest A szerzô a kissejtes tüdôrákkal kapcsolatos legújabb ismereteket foglalja össze. Rövid
A kissejtes tüdôrák kemoterápiája Onkopulmonológia Szondy Klára Semmelweis Egyetem, Pulmonológiai Klinika, Budapest A szerzô a kissejtes tüdôrákkal kapcsolatos legújabb ismereteket foglalja össze. Rövid
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja
 A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési
Sentinel nyirokcsomó biopszia szájüregi laphámrák esetén
 Sentinel nyirokcsomó biopszia szájüregi laphámrák esetén Dr. Patkó Tamás, dr. Koltai Pál, dr. Remenár Éva, dr. Boér András Országos Onkológiai Intézet Fej-nyak-állcsont és Rekonstrukciós Sebészeti Osztály
Sentinel nyirokcsomó biopszia szájüregi laphámrák esetén Dr. Patkó Tamás, dr. Koltai Pál, dr. Remenár Éva, dr. Boér András Országos Onkológiai Intézet Fej-nyak-állcsont és Rekonstrukciós Sebészeti Osztály
Emlômegtartó kezelés korai invazív emlôrákban: a lokális recidíva kezelése utáni túlélés prognosztikai faktorai
 Emlômegtartó kezelés korai invazív emlôrákban: a lokális recidíva kezelése utáni túlélés prognosztikai faktorai Fodor János Országos Onkológiai Intézet, Sugárterápiás Osztály, Budapest Invazív emlôrák
Emlômegtartó kezelés korai invazív emlôrákban: a lokális recidíva kezelése utáni túlélés prognosztikai faktorai Fodor János Országos Onkológiai Intézet, Sugárterápiás Osztály, Budapest Invazív emlôrák
A GÉGE DAGANATOK ELLÁTÁSA
 A GÉGE DAGANATOK ELLÁTÁSA Sugárterápiás és Onkológiai Szakmai Kollégium, a témában érintett Fül-orr-gégészeti, Nukleáris Medicina, Radiológiai Szakmai Kollégiumok jóváhagyásával Az Egészségügyi Minisztérium
A GÉGE DAGANATOK ELLÁTÁSA Sugárterápiás és Onkológiai Szakmai Kollégium, a témában érintett Fül-orr-gégészeti, Nukleáris Medicina, Radiológiai Szakmai Kollégiumok jóváhagyásával Az Egészségügyi Minisztérium
III./8.3. Lokálisan előrehaladott emlőrák. A fejezet felépítése
 III./8.3. Lokálisan előrehaladott emlőrák Kocsis Judit A fejezet célja, hogy megismerje a hallgató a helyileg előrehaladott emlődaganat fogalmát, diagnózisát és a terápiás lehetőségeket. A fejezet teljesítését
III./8.3. Lokálisan előrehaladott emlőrák Kocsis Judit A fejezet célja, hogy megismerje a hallgató a helyileg előrehaladott emlődaganat fogalmát, diagnózisát és a terápiás lehetőségeket. A fejezet teljesítését
Hazai tapasztalatok nintedanib kezeléssel. Dr. Gálffy Gabriella Semmelweis Egyetem Pulmonológiai Klinika BIO, október 28.
 Az előadás megjelenését a Boehringer Ingelheim támogatta. Az előadás tartalma az előadó (eredményeit és) önálló szakmai álláspontját tükrözi és nem tekinthető a Boehringer Ingelheim részéről közzétett
Az előadás megjelenését a Boehringer Ingelheim támogatta. Az előadás tartalma az előadó (eredményeit és) önálló szakmai álláspontját tükrözi és nem tekinthető a Boehringer Ingelheim részéről közzétett
Dr Csőszi Tibor Hetenyi G. Kórház, Onkológiai Központ
 Dr Csőszi Tibor Hetenyi G. Kórház, Onkológiai Központ Azért, mert a kemoterápia bizonyított módon fokozza a gyógyulás esélyét! A kemoterápiának az a célja, hogy az esetleg, vagy biztosan visszamaradt daganatsejtek
Dr Csőszi Tibor Hetenyi G. Kórház, Onkológiai Központ Azért, mert a kemoterápia bizonyított módon fokozza a gyógyulás esélyét! A kemoterápiának az a célja, hogy az esetleg, vagy biztosan visszamaradt daganatsejtek
IPF és tüdőrák együttes előfordulása. Dr Bohács Anikó Ph.D. egyetemi docens Semmelweis Egyetem, Pulmonológiai Klinika
 IPF és tüdőrák együttes előfordulása Dr Bohács Anikó Ph.D. egyetemi docens Semmelweis Egyetem, Pulmonológiai Klinika Kivizsgálás Endobronchialis eltérés nem volt. Mikrobiológia tenyésztés negatív. BAL:
IPF és tüdőrák együttes előfordulása Dr Bohács Anikó Ph.D. egyetemi docens Semmelweis Egyetem, Pulmonológiai Klinika Kivizsgálás Endobronchialis eltérés nem volt. Mikrobiológia tenyésztés negatív. BAL:
Az invazív húgyhólyagdaganatok korszerû kemoterápiás kezelése
 Az invazív húgyhólyagdaganatok korszerû kemoterápiás kezelése Eredeti közlemény Géczi Lajos Országos Onkológiai Intézet, Kemoterápia C és Klinikai Farmakológiai Osztály, Budapest A szerzô célja: az invazív
Az invazív húgyhólyagdaganatok korszerû kemoterápiás kezelése Eredeti közlemény Géczi Lajos Országos Onkológiai Intézet, Kemoterápia C és Klinikai Farmakológiai Osztály, Budapest A szerzô célja: az invazív
Gemcitabin platina kombináció a nem kissejtes tüdôrákos betegek elsô vonalbeli kezelésében
 Gemcitabin platina kombináció a nem kissejtes tüdôrákos betegek elsô vonalbeli kezelésében Helyi tapasztalatok és kockázat/haszon elemzés Gyógyszeripari Sárosi Veronika, Lénárt Timea Baranya Megyei Kórház,
Gemcitabin platina kombináció a nem kissejtes tüdôrákos betegek elsô vonalbeli kezelésében Helyi tapasztalatok és kockázat/haszon elemzés Gyógyszeripari Sárosi Veronika, Lénárt Timea Baranya Megyei Kórház,
Gasztrointesztinális tumorok. Esetbemutatások
 Gasztrointesztinális tumorok Esetbemutatások 1. Eset: 54 éves férfibeteg 1997 jul.-ban sigma tumor miatt sigma resectio. Szövettan: adenocc. G3, pt3, pn0 (5 nyirokcsomóból) pn0, kevés eltávolított nycs.
Gasztrointesztinális tumorok Esetbemutatások 1. Eset: 54 éves férfibeteg 1997 jul.-ban sigma tumor miatt sigma resectio. Szövettan: adenocc. G3, pt3, pn0 (5 nyirokcsomóból) pn0, kevés eltávolított nycs.
Remenár Éva 1, Lövey József 2, Koronczay Krisztina 2, Csuka Orsolya 3, Németh György. Eredeti közlemény
 Komplex onkoterápia eredményei elôrehaladott stádiumú fej-nyaki laphámrákos betegek Taxol-sugárérzékenyítéssel és anélkül végzett primer sugárkezelését követôen Remenár Éva 1, Lövey József 2, Koronczay
Komplex onkoterápia eredményei elôrehaladott stádiumú fej-nyaki laphámrákos betegek Taxol-sugárérzékenyítéssel és anélkül végzett primer sugárkezelését követôen Remenár Éva 1, Lövey József 2, Koronczay
A tüdőcitológia jelentősége a tüdődaganatok neoadjuváns kezelésének tervezésében
 A tüdőcitológia jelentősége a tüdődaganatok neoadjuváns kezelésének tervezésében Pápay Judit SE, I.sz.Patológiai és Kísérleti Rákkutató Intézet 70. Patológus Kongresszus Siófok 2011. szept. 29 - okt.1.
A tüdőcitológia jelentősége a tüdődaganatok neoadjuváns kezelésének tervezésében Pápay Judit SE, I.sz.Patológiai és Kísérleti Rákkutató Intézet 70. Patológus Kongresszus Siófok 2011. szept. 29 - okt.1.
A neoadjuváns kezelés mint a rectalis ultrahangvizsgálat korlátozó tényezője
 EREDETI KÖZLEMÉNY A neoadjuváns kezelés mint a rectalis ultrahangvizsgálat korlátozó tényezője Fábián Anna dr. 1 Bor Renáta dr. 1 Bálint Anita dr. 1 Farkas Klaudia dr. 1 Milassin Ágnes dr. 1 Rutka Mariann
EREDETI KÖZLEMÉNY A neoadjuváns kezelés mint a rectalis ultrahangvizsgálat korlátozó tényezője Fábián Anna dr. 1 Bor Renáta dr. 1 Bálint Anita dr. 1 Farkas Klaudia dr. 1 Milassin Ágnes dr. 1 Rutka Mariann
Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán
 Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán Dr. Gelencsér Viktória, Dr. Boér Katalin Szent Margit Kórház, Onkológiai
Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán Dr. Gelencsér Viktória, Dr. Boér Katalin Szent Margit Kórház, Onkológiai
Eredményes temozolamid kezelés 2 esete glioblasztómás betegeknél
 Eredményes temozolamid kezelés 2 esete glioblasztómás betegeknél Dr. Mangel László 1,2, Prof. Dr. Dóczi Tamás 3, Dr. Balogh Zsolt 4, Dr. Lövey József 2, Dr. Sipos László 5 Pécsi Tudományegyetem, Onkoterápiás
Eredményes temozolamid kezelés 2 esete glioblasztómás betegeknél Dr. Mangel László 1,2, Prof. Dr. Dóczi Tamás 3, Dr. Balogh Zsolt 4, Dr. Lövey József 2, Dr. Sipos László 5 Pécsi Tudományegyetem, Onkoterápiás
A bőrmelanoma kezelésének módjai. Dr. Forgács Balázs Bőrgyógyászati Osztály
 A bőrmelanoma kezelésének módjai Dr. Forgács Balázs Bőrgyógyászati Osztály Melanoma TNM (AJCC VIII.) A melanoma kezelés alapja (T:tumor, N:nyirokcsomó, M:metasztázis) T: Breslow érték a legközelebbi 0,1
A bőrmelanoma kezelésének módjai Dr. Forgács Balázs Bőrgyógyászati Osztály Melanoma TNM (AJCC VIII.) A melanoma kezelés alapja (T:tumor, N:nyirokcsomó, M:metasztázis) T: Breslow érték a legközelebbi 0,1
Esetbemutatás. Dr. Iván Mária Uzsoki Kórház 2013.11.07.
 Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
Fulvesztrant szerepe az előrehaladott emlőrák kezelésében St. Gallen 2013 Dr. Maráz Róbert
 Fulvesztrant szerepe az előrehaladott emlőrák kezelésében St. Gallen 2013 Dr. Maráz Róbert Kecskemét Május 18. Az előadás az AstraZeneca Kft. felkérésére készült Engedélyszám: PEFA0134HU20130516 Kiknél
Fulvesztrant szerepe az előrehaladott emlőrák kezelésében St. Gallen 2013 Dr. Maráz Róbert Kecskemét Május 18. Az előadás az AstraZeneca Kft. felkérésére készült Engedélyszám: PEFA0134HU20130516 Kiknél
Preoperatív kemoterápia a colorectalis májáttétes betegek sebészi kezelésében
 Magyar Sebészet 2013; 66(6): 325 330 DOI: 10.1556/MaSeb.66.2013.6.4 KÖSZÖNTŐ Preoperatív kemoterápia a colorectalis májáttétes betegek sebészi kezelésében Preoperative chemotherapy in the surgical treatment
Magyar Sebészet 2013; 66(6): 325 330 DOI: 10.1556/MaSeb.66.2013.6.4 KÖSZÖNTŐ Preoperatív kemoterápia a colorectalis májáttétes betegek sebészi kezelésében Preoperative chemotherapy in the surgical treatment
KLINIKAI ÉS HISZTOPATOLÓGIAI EREDMÉNYEK ELŐREHALADOTT RECTUMTUMOROK NEOADJUVÁNS KEZELÉSE UTÁN
 KLINIKAI ÉS HISZTOPATOLÓGIAI EREDMÉNYEK ELŐREHALADOTT RECTUMTUMOROK NEOADJUVÁNS KEZELÉSE UTÁN Varga László, Baradnay Gellért, Hőhn József, Simonka Zsolt, Hideghéthy Katalin 2, Maráz Anikó 2, Nikolényi
KLINIKAI ÉS HISZTOPATOLÓGIAI EREDMÉNYEK ELŐREHALADOTT RECTUMTUMOROK NEOADJUVÁNS KEZELÉSE UTÁN Varga László, Baradnay Gellért, Hőhn József, Simonka Zsolt, Hideghéthy Katalin 2, Maráz Anikó 2, Nikolényi
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a PD-L1 és PD-1 fehérjék túlélésre gyakorolt hatása
 Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
A Her2 pozitív áttétesemlőrák. emlőrák kezelése napjainkban
 A Her2 pozitív áttétesemlőrák emlőrák kezelése napjainkban Szentmártoni Gyöngyvér Semmelweis Egyetem Onkológiai Központ Magyar Szenológiai Társaság Tudományos Ülése Kecskemét, 2018 április 13-14 A Herceptinmegváltoztatta
A Her2 pozitív áttétesemlőrák emlőrák kezelése napjainkban Szentmártoni Gyöngyvér Semmelweis Egyetem Onkológiai Központ Magyar Szenológiai Társaság Tudományos Ülése Kecskemét, 2018 április 13-14 A Herceptinmegváltoztatta
Fejezetek a klinikai onkológiából
 Fejezetek a klinikai onkológiából Előadás jegyzet Szegedi Tudományegyetem Általános Orvosi Kar Onkoterápiás Klinika 2012. A patológiai, képalkotó és laboratóriumi diagnosztika jelentősége az onkológiában.
Fejezetek a klinikai onkológiából Előadás jegyzet Szegedi Tudományegyetem Általános Orvosi Kar Onkoterápiás Klinika 2012. A patológiai, képalkotó és laboratóriumi diagnosztika jelentősége az onkológiában.
Neoadjuváns- és adjuváns kemoterápia szerepe radikális cystectomiára alkalmas urotheliális tumoros betegeknél
 Neoadjuváns- és adjuváns kemoterápia szerepe radikális cystectomiára alkalmas urotheliális tumoros betegeknél Maráz Anikó dr., Varga Linda dr. Szegedi Tudományegyetem, Onkoterápiás Klinika, Szeged (igazgató:
Neoadjuváns- és adjuváns kemoterápia szerepe radikális cystectomiára alkalmas urotheliális tumoros betegeknél Maráz Anikó dr., Varga Linda dr. Szegedi Tudományegyetem, Onkoterápiás Klinika, Szeged (igazgató:
San Antonio Breast Cancer Symposium. Dr. Tőkés Tímea
 San Antonio Breast Cancer Symposium Dr. Tőkés Tímea San Antonio, Texas, USA Henry B. Gonzalez Convention Center December 10-14, 2013 SABCS 2013 Több, mint 7500 résztvevő, több, mint 70 országból Továbbképzések,
San Antonio Breast Cancer Symposium Dr. Tőkés Tímea San Antonio, Texas, USA Henry B. Gonzalez Convention Center December 10-14, 2013 SABCS 2013 Több, mint 7500 résztvevő, több, mint 70 országból Továbbképzések,
Epithelialis-mesenchymalis átmenet vastagbél daganatokban
 Epithelialis-mesenchymalis átmenet vastagbél daganatokban Éles Klára Országos Onkológiai Intézet Sebészi és Molekuláris Daganatpatológiai Centrum Budapest, 2010. 12. 03. Epithelialis-mesenchymalis átmenet
Epithelialis-mesenchymalis átmenet vastagbél daganatokban Éles Klára Országos Onkológiai Intézet Sebészi és Molekuláris Daganatpatológiai Centrum Budapest, 2010. 12. 03. Epithelialis-mesenchymalis átmenet
A fejezet felépítése. A.) Általános nevezéktan
 II./1.4. fejezet: Nevezéktan, stádiumbeosztás Torgyík László, Dank Magdolna A fejezet áttekintése során a hallgató megismerkedik az onkológiai kezelések során használatos kifejezések értemével és a TNM-osztályozás
II./1.4. fejezet: Nevezéktan, stádiumbeosztás Torgyík László, Dank Magdolna A fejezet áttekintése során a hallgató megismerkedik az onkológiai kezelések során használatos kifejezések értemével és a TNM-osztályozás
MAGYOT évi Tudományos Szimpóziuma Május 5-6, Budapest
 MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
NEOADJUVÁNS RADIOKEMOTERÁPIA A LOKOREGIONÁLISAN ELŐREHALADOTT RECTUMTUMOROK ELLÁTÁSÁBAN
 NEOADJUVÁNS RADIOKEMOTERÁPIA A LOKOREGIONÁLISAN ELŐREHALADOTT RECTUMTUMOROK ELLÁTÁSÁBAN Rápolti Edit 1, Szigeti András 1, Farkas Róbert 1, Bellyei Szabolcs 1, Boronkai Árpád 1, Papp András 2, Gömöri Éva
NEOADJUVÁNS RADIOKEMOTERÁPIA A LOKOREGIONÁLISAN ELŐREHALADOTT RECTUMTUMOROK ELLÁTÁSÁBAN Rápolti Edit 1, Szigeti András 1, Farkas Róbert 1, Bellyei Szabolcs 1, Boronkai Árpád 1, Papp András 2, Gömöri Éva
Publication list. List of papers published in extenso. Other publications
 Publication list List of papers published in extenso 1. Horváth K, Gődény M: Képalkotó vizsgálatok a nőgyógyászati daganatok stádium meghatározásában. Magyar Radiológia 2004; 78(6):284-292. 2. Horváth
Publication list List of papers published in extenso 1. Horváth K, Gődény M: Képalkotó vizsgálatok a nőgyógyászati daganatok stádium meghatározásában. Magyar Radiológia 2004; 78(6):284-292. 2. Horváth
Lohe mûtét hosszú távú eredményei a metatarsalgia kezelésében
 POTE Ortopédiai Klinika közleménye Lohe mûtét hosszú távú eredményei a metatarsalgia kezelésében DR. LOVÁSZ GYÖRGY, DR. KRÁNICZ JÁNOS, DR. SCHMIDT BÉLA Érkezett: 1995. április 11. ÖSSZEFOGLALÁS A szerzôk
POTE Ortopédiai Klinika közleménye Lohe mûtét hosszú távú eredményei a metatarsalgia kezelésében DR. LOVÁSZ GYÖRGY, DR. KRÁNICZ JÁNOS, DR. SCHMIDT BÉLA Érkezett: 1995. április 11. ÖSSZEFOGLALÁS A szerzôk
Postterápiás követés daganatos betegségekben: mellkasi szerveket érintő korai és késői szövődmények
 Postterápiás követés daganatos betegségekben: mellkasi szerveket érintő korai és késői szövődmények Lipták Zsuzsanna, Bajcsay András, Molnár Zsuzsa, Küronya Zsófia, Nagy Tünde, Ganovszky Erna, Monostori
Postterápiás követés daganatos betegségekben: mellkasi szerveket érintő korai és késői szövődmények Lipták Zsuzsanna, Bajcsay András, Molnár Zsuzsa, Küronya Zsófia, Nagy Tünde, Ganovszky Erna, Monostori
Palliatív mellkasi besugárzás tüdôrákban: szisztematikus áttekintô közlemény
 5. ÉVFOLYAM, 1. SZÁM 2009. FEBRUÁR JOURNAL OF CLINICAL ONCOLOGY ÖSSZEFOGLALÓ KÖZLEMÉNY Palliatív mellkasi besugárzás tüdôrákban: szisztematikus áttekintô közlemény Alysa Fairchild, Kristin Harris, Elizabeth
5. ÉVFOLYAM, 1. SZÁM 2009. FEBRUÁR JOURNAL OF CLINICAL ONCOLOGY ÖSSZEFOGLALÓ KÖZLEMÉNY Palliatív mellkasi besugárzás tüdôrákban: szisztematikus áttekintô közlemény Alysa Fairchild, Kristin Harris, Elizabeth
A gyomorrák sebészi kezelése. Vereczkei András PTE KK Sebészeti Klinika
 A gyomorrák sebészi kezelése Vereczkei András PTE KK Sebészeti Klinika Gyomorrák epidemiológiája Magas incidenciájú területek Alacsony incidenciájú területek Japán, Chile Észak-Amerika, Európa incidencia
A gyomorrák sebészi kezelése Vereczkei András PTE KK Sebészeti Klinika Gyomorrák epidemiológiája Magas incidenciájú területek Alacsony incidenciájú területek Japán, Chile Észak-Amerika, Európa incidencia
Neoadjuváns- és adjuváns kemoterápia szerepe radikális cystectomiára alkalmas urotheliális tumoros betegeknél
 Uroonkológia : 2. Neoadjuváns- és adjuváns kemoterápia szerepe radikális cystectomiára alkalmas urotheliális tumoros betegeknél Maráz Anikó dr., Varga Linda dr. Szegedi Tudományegyetem Onkoterápiás Klinika,
Uroonkológia : 2. Neoadjuváns- és adjuváns kemoterápia szerepe radikális cystectomiára alkalmas urotheliális tumoros betegeknél Maráz Anikó dr., Varga Linda dr. Szegedi Tudományegyetem Onkoterápiás Klinika,
A sugárterápia változó szerepe és indikációi a mammográfiás szűrés bevezetése óta
 A sugárterápia változó szerepe és indikációi a mammográfiás szűrés bevezetése óta Polgár Cs. Mészáros N. Országos Onkológiai Intézet, Sugárterápiás Centrum Mammográfiás szűrés harmadik szűrési ciklus (2006-2007)
A sugárterápia változó szerepe és indikációi a mammográfiás szűrés bevezetése óta Polgár Cs. Mészáros N. Országos Onkológiai Intézet, Sugárterápiás Centrum Mammográfiás szűrés harmadik szűrési ciklus (2006-2007)
Az első vonalban alkalmazott afatinib versus kemoterápia hatásossága EGFRmutáció-pozitív
 Gyógyszergyári közlemény 325 Az első vonalban alkalmazott afatinib versus kemoterápia hatásossága EGFRmutáció-pozitív tüdő-adenokarcinómában Sárosi Veronika, Balikó Zoltán Pécsi Tudományegyetem Klinikai
Gyógyszergyári közlemény 325 Az első vonalban alkalmazott afatinib versus kemoterápia hatásossága EGFRmutáció-pozitív tüdő-adenokarcinómában Sárosi Veronika, Balikó Zoltán Pécsi Tudományegyetem Klinikai
A sejt és szövettani diagnosztika modern eszközei a diagnosztikában és terápiában. Cifra János. Tolna Megyei Balassa János Kórház, Pathologia Osztály
 A sejt és szövettani diagnosztika modern eszközei a diagnosztikában és terápiában Cifra János Tolna Megyei Balassa János Kórház, Pathologia Osztály Szekszárd 2016. Május 6. Patológus feladatai Preoperatív
A sejt és szövettani diagnosztika modern eszközei a diagnosztikában és terápiában Cifra János Tolna Megyei Balassa János Kórház, Pathologia Osztály Szekszárd 2016. Május 6. Patológus feladatai Preoperatív
A nyelôcsôrák szimultán radio-kemoterápiája (saját eredményeink alapján)
 A nyelôcsôrák szimultán radio-kemoterápiája (saját eredményeink alapján) Eredeti közlemény Patonay Péter, Naszály Attila, Mayer Árpád Fôvárosi Önkormányzat Uzsoki utcai Kórháza, Fôvárosi Onkoradiológiai
A nyelôcsôrák szimultán radio-kemoterápiája (saját eredményeink alapján) Eredeti közlemény Patonay Péter, Naszály Attila, Mayer Árpád Fôvárosi Önkormányzat Uzsoki utcai Kórháza, Fôvárosi Onkoradiológiai
Grádus rendszerek vizsgálata IAés IB stádiumú adenocarcinomákban
 Grádus rendszerek vizsgálata IAés IB stádiumú adenocarcinomákban Zombori Tamás, Furák József, Urbán Dániel, Némedi Réka, Nyári Tibor, Cserni Gábor, TiszlaviczLászló Pathologiai Intézet, ÁOK Szegedi Tudományegyetem
Grádus rendszerek vizsgálata IAés IB stádiumú adenocarcinomákban Zombori Tamás, Furák József, Urbán Dániel, Némedi Réka, Nyári Tibor, Cserni Gábor, TiszlaviczLászló Pathologiai Intézet, ÁOK Szegedi Tudományegyetem
A göbös pajzsmirigy kivizsgálása, ellátása. Mészáros Szilvia dr. Semmelweis Egyetem I. sz. Belgyógyászati Klinika
 A göbös pajzsmirigy kivizsgálása, ellátása Mészáros Szilvia dr. Semmelweis Egyetem I. sz. Belgyógyászati Klinika Pajzsmirigy göbök A lakosság 4-8%-ának van tapintható göbe. Ultrahanggal a lakosság közel
A göbös pajzsmirigy kivizsgálása, ellátása Mészáros Szilvia dr. Semmelweis Egyetem I. sz. Belgyógyászati Klinika Pajzsmirigy göbök A lakosság 4-8%-ának van tapintható göbe. Ultrahanggal a lakosság közel
A GYŰRŰSZERŰ KONTRASZTHALMOZÁS JELENTŐSÉGE A RECTUM TUMOROK MÁJMETASZTÁZISAINAK MEGÍTÉLÉSÉNÉL
 Egészségtudományi Közlemények, 3. kötet, 1. szám (2013), pp. 83 90. A GYŰRŰSZERŰ KONTRASZTHALMOZÁS JELENTŐSÉGE A RECTUM TUMOROK MÁJMETASZTÁZISAINAK MEGÍTÉLÉSÉNÉL KISS MÁTÉ 1,2, DR. SHAIKH M. SHOAIB 1,
Egészségtudományi Közlemények, 3. kötet, 1. szám (2013), pp. 83 90. A GYŰRŰSZERŰ KONTRASZTHALMOZÁS JELENTŐSÉGE A RECTUM TUMOROK MÁJMETASZTÁZISAINAK MEGÍTÉLÉSÉNÉL KISS MÁTÉ 1,2, DR. SHAIKH M. SHOAIB 1,
VÁLTOZÁSOK A NEM-KISSEJTES TÜDŐRÁK DIAGNOSZTIKUS ÉS TERÁPIÁS STRATÉGIÁJÁBAN
 VÁLTOZÁSOK A NEM-KISSEJTES TÜDŐRÁK DIAGNOSZTIKUS ÉS TERÁPIÁS STRATÉGIÁJÁBAN Ostoros Gyula 1, Döme Balázs 1, Strausz János 1, Tímár József 2 1 Országos Korányi Tbc és Pulmonológiai Intézet, 2 Semmelweis
VÁLTOZÁSOK A NEM-KISSEJTES TÜDŐRÁK DIAGNOSZTIKUS ÉS TERÁPIÁS STRATÉGIÁJÁBAN Ostoros Gyula 1, Döme Balázs 1, Strausz János 1, Tímár József 2 1 Országos Korányi Tbc és Pulmonológiai Intézet, 2 Semmelweis
Változások az emlő sebészetében
 Változások az emlő sebészetében Maráz Róbert, Boross Gábor Bács-Kiskun Megyei Kórház Kecskemét Általános Sebészeti Osztály, Onkoradiológiai Központ Sebészet fejlődése Elméleti ismeretek fejlődése Diagnosztika
Változások az emlő sebészetében Maráz Róbert, Boross Gábor Bács-Kiskun Megyei Kórház Kecskemét Általános Sebészeti Osztály, Onkoradiológiai Központ Sebészet fejlődése Elméleti ismeretek fejlődése Diagnosztika
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése
 Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
Hypopharynx tumorok diagnosztikája és terápiája
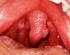 Hypopharynx tumorok diagnosztikája és terápiája Dr. Répássy Gábor Semmelweis Egyetem ÁOK Fül-Orr-Gégészeti és Fej-nyaksebészeti Klinika Anatómiai régiók és alrégiók Pharyngooesophagealis határ, postcricoid
Hypopharynx tumorok diagnosztikája és terápiája Dr. Répássy Gábor Semmelweis Egyetem ÁOK Fül-Orr-Gégészeti és Fej-nyaksebészeti Klinika Anatómiai régiók és alrégiók Pharyngooesophagealis határ, postcricoid
Országos Egészségbiztosítási Pénztár
 Lokálisan kiterjedt inoperábilis és áttétes nem kissejtes tüdőrák (NSCLC) diagnosztikájának és kezelésének 2014.08.08. Országos Egészségbiztosítási Pénztár Egészség, biztonság! 1. Azonosítószám: 44/2013.
Lokálisan kiterjedt inoperábilis és áttétes nem kissejtes tüdőrák (NSCLC) diagnosztikájának és kezelésének 2014.08.08. Országos Egészségbiztosítási Pénztár Egészség, biztonság! 1. Azonosítószám: 44/2013.
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja
 A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértıi és Szakmai Ellenırzési Fıosztály Budapest, 2010.
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértıi és Szakmai Ellenırzési Fıosztály Budapest, 2010.
Sugárterápia minőségbiztosításának alapelvei Dr. Szabó Imre (DE OEC Onkológiai Intézet)
 Sugárterápia minőségbiztosításának alapelvei Dr. Szabó Imre (DE OEC Onkológiai Intézet) I. Irányelvek WHO 1988: Mindazon tevékenység, amely biztosítja a céltérfogatra leadott megfelelő sugárdózist az ép
Sugárterápia minőségbiztosításának alapelvei Dr. Szabó Imre (DE OEC Onkológiai Intézet) I. Irányelvek WHO 1988: Mindazon tevékenység, amely biztosítja a céltérfogatra leadott megfelelő sugárdózist az ép
Docetaxel kombinációs kezeléssel (TAC) szerzett tapasztalataink az emlôrák adjuváns kemoterápiájában
 Docetaxel kombinációs kezeléssel () szerzett tapasztalataink az emlôrák adjuváns kemoterápiájában BCIRG 001 randomizált, multicentrikus fázis III vizsgálat hazai eredményei Boér Katalin, 1 Láng István,
Docetaxel kombinációs kezeléssel () szerzett tapasztalataink az emlôrák adjuváns kemoterápiájában BCIRG 001 randomizált, multicentrikus fázis III vizsgálat hazai eredményei Boér Katalin, 1 Láng István,
Cervixcarcinomadefinitív radiokemoterápia. Kahán Zsuzsanna
 Cervixcarcinomadefinitív radiokemoterápia Kahán Zsuzsanna SZTE Onkoterápiás Klinika, Szeged Méhnyakrák: definitív radiokemoterápia Igen sugár-és kemoszenzitívdaganat kemoradioterápia platina készítménnyel!
Cervixcarcinomadefinitív radiokemoterápia Kahán Zsuzsanna SZTE Onkoterápiás Klinika, Szeged Méhnyakrák: definitív radiokemoterápia Igen sugár-és kemoszenzitívdaganat kemoradioterápia platina készítménnyel!
Publications: 4. Nagykálnai T, Landherr L, Németh GY: Recidiváló epipharynx tumorok lokális rádiumkezelése. Fül-Orr-Gégegyógyászat 31: 97-101, 1985.
 1 Publications: 1. Landherr L, Siminszky M, Patonay P, Patyánik M, Stumpf J. Bucca tumoros betegeink 3 és 5 éves túlélési eredményei 285 kezelt esetnél. MFE Szájsebészeti Szekció Kongresszusának gyűjteményes
1 Publications: 1. Landherr L, Siminszky M, Patonay P, Patyánik M, Stumpf J. Bucca tumoros betegeink 3 és 5 éves túlélési eredményei 285 kezelt esetnél. MFE Szájsebészeti Szekció Kongresszusának gyűjteményes
A kemoterápia bevezetésének hatása a méhnyakrák kimenetelére: egy populációs alapú kohorszvizsgálat eredményei Ontarióban
 3. ÉVFOLYAM, 4. SZÁM 27. AUGUSZTUS JOURNAL OF CLINICAL ONCOLOGY EREDETI KÖZLEMÉNY Division of Cancer Care and Epidemiology, Queen s University Cancer Research Institute, Kingston, Ontario; Cross Cancer
3. ÉVFOLYAM, 4. SZÁM 27. AUGUSZTUS JOURNAL OF CLINICAL ONCOLOGY EREDETI KÖZLEMÉNY Division of Cancer Care and Epidemiology, Queen s University Cancer Research Institute, Kingston, Ontario; Cross Cancer
Önéletrajz. 1. Személyi adatok
 Önéletrajz 1. Személyi adatok Név: Dr.Takácsi-Nagy Zoltán Születési idő: 1969.06.05. Születési hely: Székesfehérvár Családi állapot: nős Munkahely: Országos Onkológiai Intézet, Sugárterápiás Osztály 1122
Önéletrajz 1. Személyi adatok Név: Dr.Takácsi-Nagy Zoltán Születési idő: 1969.06.05. Születési hely: Székesfehérvár Családi állapot: nős Munkahely: Országos Onkológiai Intézet, Sugárterápiás Osztály 1122
Cetuximab. Finanszírozott indikációk:
 Cetuximab Finanszírozott indikációk: 1. Lokálisan előrehaladott fej-nyak carcinoma kezelésére radioterápiával kombinálva, a készítmény alkalmazása a docetaxel-tartalmú kemoterápia és cisplatin-tartalmú
Cetuximab Finanszírozott indikációk: 1. Lokálisan előrehaladott fej-nyak carcinoma kezelésére radioterápiával kombinálva, a készítmény alkalmazása a docetaxel-tartalmú kemoterápia és cisplatin-tartalmú
Katasztrófális antifoszfolipid szindróma
 Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Tumorprogresszió és előrejelzése. Statisztikák. Statisztika - USA Megbetegedés / 10 leggyakoribb (2012)
 Tumorprogresszió és előrejelzése 1. Statisztikák 2. Kezelési protokollok 3. Jövő 4. Teszt írása Megbetegedés / 1 leggyakoribb (212) Statisztikák Forrás: CA Halálozás / 1 leggyakoribb (212) Statisztika
Tumorprogresszió és előrejelzése 1. Statisztikák 2. Kezelési protokollok 3. Jövő 4. Teszt írása Megbetegedés / 1 leggyakoribb (212) Statisztikák Forrás: CA Halálozás / 1 leggyakoribb (212) Statisztika
67. Pathologus Kongresszus
 A kemoirradiáció okozta oncocytás átalakulás szövettani, immunhisztokémiai, ultrastruktúrális jellemzői és lehetséges prognosztikus jelentősége rectum adenocarcinomákban 67. Pathologus Kongresszus Bogner
A kemoirradiáció okozta oncocytás átalakulás szövettani, immunhisztokémiai, ultrastruktúrális jellemzői és lehetséges prognosztikus jelentősége rectum adenocarcinomákban 67. Pathologus Kongresszus Bogner
A világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje
 MGYRKÖZLÖNY 2010. évi 77. szám 16751 2. melléklet a 31/2010. (V. 13.) EüM rendelethez világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje 1. z eljárásrend tárgyát
MGYRKÖZLÖNY 2010. évi 77. szám 16751 2. melléklet a 31/2010. (V. 13.) EüM rendelethez világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje 1. z eljárásrend tárgyát
PROGNOSZTIKAI FAKTOROK VIZSGÁLATA ÉS ÚJABB GYÓGYSZERES KEZELÉSI LEHETÕSÉGEK ROSSZINDULATÚ TÁMASZTÓSZÖVETI DAGANATOK ESETÉN. Ph. D.
 PROGNOSZTIKAI FAKTOROK VIZSGÁLATA ÉS ÚJABB GYÓGYSZERES KEZELÉSI LEHETÕSÉGEK ROSSZINDULATÚ TÁMASZTÓSZÖVETI DAGANATOK ESETÉN Ph. D. Értekezés Tézisei Dr. Pápai Zsuzsanna Témavezetõ: Dr. Kopper László egyetemi
PROGNOSZTIKAI FAKTOROK VIZSGÁLATA ÉS ÚJABB GYÓGYSZERES KEZELÉSI LEHETÕSÉGEK ROSSZINDULATÚ TÁMASZTÓSZÖVETI DAGANATOK ESETÉN Ph. D. Értekezés Tézisei Dr. Pápai Zsuzsanna Témavezetõ: Dr. Kopper László egyetemi
Bronchioloalveolaris tüdôrák elôfordulása klinikai anyagunkban
 Bronchioloalveolaris tüdôrák elôfordulása klinikai anyagunkban Eredeti közlemény Furák József, Troján Imre, Szôke Tamás, Tiszlavicz László, 1 Morvay Zita, 2 Balogh Ádám Szegedi Tudományegyetem, Sebészeti
Bronchioloalveolaris tüdôrák elôfordulása klinikai anyagunkban Eredeti közlemény Furák József, Troján Imre, Szôke Tamás, Tiszlavicz László, 1 Morvay Zita, 2 Balogh Ádám Szegedi Tudományegyetem, Sebészeti
A korai emlőrák lokoregionális kezelésének fejlődése
 A korai emlőrák tudományos bizonyítékon alapuló lokoregionális kezelése Polgár Csaba Országos Onkológiai Intézet, Sugárterápiás Központ; Semmelweis Egyetem, ÁOK, Onkológiai Tanszék A korai emlőrák lokoregionális
A korai emlőrák tudományos bizonyítékon alapuló lokoregionális kezelése Polgár Csaba Országos Onkológiai Intézet, Sugárterápiás Központ; Semmelweis Egyetem, ÁOK, Onkológiai Tanszék A korai emlőrák lokoregionális
A világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja
 A világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009.
A világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009.
Újdonságok a hasnyálmirigyrák kezelésében
 378 Gastro Update 2009 Dr. Pintér Tamás Petz Aladár Megyei Oktató Kórház, Onkoradiológiai Osztály Gyõr Újdonságok a hasnyálmirigyrák kezelésében A hasnyálmirigyrák kezelésében 2008 sem hozott áttörést.
378 Gastro Update 2009 Dr. Pintér Tamás Petz Aladár Megyei Oktató Kórház, Onkoradiológiai Osztály Gyõr Újdonságok a hasnyálmirigyrák kezelésében A hasnyálmirigyrák kezelésében 2008 sem hozott áttörést.
Eredeti közlemény. Országos Onkológiai Intézet, 1 Sugárterápiás Központ, 2 Nőgyógyászati Osztály, 3 Sebészeti és Molekuláris Patológiai Osztály, 4
 Eredeti közlemény 171 Patológiai komplett remisszió preoperatív, nagy dózisteljesítményű brachyterápiát követően operábilis méhnyakdaganatos betegeknél: egy prospektív, randomizált vizsgálat előzetes eredményei
Eredeti közlemény 171 Patológiai komplett remisszió preoperatív, nagy dózisteljesítményű brachyterápiát követően operábilis méhnyakdaganatos betegeknél: egy prospektív, randomizált vizsgálat előzetes eredményei
Pajzsmirigy carcinomák nyaki nyirokcsomó metastasisainak percutan ethanol infiltrációs ( PEI ) kezelése
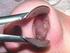 Pajzsmirigy carcinomák nyaki nyirokcsomó metastasisainak percutan ethanol infiltrációs ( PEI ) kezelése Dr. Molnár Krisztián PTE Radiológiai Klinika Prof. Dr. Mezősi Emese PTE I. Belgyógyászati Klinika
Pajzsmirigy carcinomák nyaki nyirokcsomó metastasisainak percutan ethanol infiltrációs ( PEI ) kezelése Dr. Molnár Krisztián PTE Radiológiai Klinika Prof. Dr. Mezősi Emese PTE I. Belgyógyászati Klinika
A tüdő tumorok mozgásainak CT-MR alapú vizsgálata, a daganatmozgások jelentősége a tüdőrák sugárkezelésében. PhD Tézis. dr.
 A tüdő tumorok mozgásainak CT-MR alapú vizsgálata, a daganatmozgások jelentősége a tüdőrák sugárkezelésében PhD Tézis dr. Kovács Árpád Doktori Iskola vezető: Prof. Dr. Bódis József Programvezető: Prof.Dr.Ember
A tüdő tumorok mozgásainak CT-MR alapú vizsgálata, a daganatmozgások jelentősége a tüdőrák sugárkezelésében PhD Tézis dr. Kovács Árpád Doktori Iskola vezető: Prof. Dr. Bódis József Programvezető: Prof.Dr.Ember
III./10.3. A hímvesszőrák. Bevezetés. A fejezet felépítése. A./ Etiológia. B./ Patológia. Nyirády Péter
 III./10.3. A hímvesszőrák Nyirády Péter A fejezet célja, hogy a hallgató megismerje a hímvesszőrák előfordulásával, diagnosztikájával és kezelésével kapcsolatos ismereteket. A fejezet elsajátítása során
III./10.3. A hímvesszőrák Nyirády Péter A fejezet célja, hogy a hallgató megismerje a hímvesszőrák előfordulásával, diagnosztikájával és kezelésével kapcsolatos ismereteket. A fejezet elsajátítása során
Az osteosarcoma kezelésének eredményei gyermekkorban hazai adatok
 30 Eredeti közlemény Az osteosarcoma kezelésének eredményei gyermekkorban hazai adatok Hegyi Márta 1, Félné Semsei Ágnes 2, Jakab Zsuzsanna 1, Antal mre 3, Kiss János 3, Szendrői Miklós 3, Csóka Monika
30 Eredeti közlemény Az osteosarcoma kezelésének eredményei gyermekkorban hazai adatok Hegyi Márta 1, Félné Semsei Ágnes 2, Jakab Zsuzsanna 1, Antal mre 3, Kiss János 3, Szendrői Miklós 3, Csóka Monika
Minőségbiztosítás a sugárterápiában
 Minőségbiztosítás a sugárterápiában Dr. Szabó Imre DEOEC Onkológiai Intézet Sugárterápia Tanszék Irányelvek WHO 1988: Mindazon tevékenység, amely biztosítja a céltérfogatra leadott megfelelő sugárdózist
Minőségbiztosítás a sugárterápiában Dr. Szabó Imre DEOEC Onkológiai Intézet Sugárterápia Tanszék Irányelvek WHO 1988: Mindazon tevékenység, amely biztosítja a céltérfogatra leadott megfelelő sugárdózist
Evidencia vagy ígéret? Evidencián alapuló orvoslás a haematológiában
 Evidencia vagy ígéret? Evidencián alapuló orvoslás a haematológiában Dr. Mikala Gábor Egy. Szt István és Szent László Kórház Haematológiai és Őssejt-Transzplantációs Osztály Lymphoma és Myeloma Terápiás
Evidencia vagy ígéret? Evidencián alapuló orvoslás a haematológiában Dr. Mikala Gábor Egy. Szt István és Szent László Kórház Haematológiai és Őssejt-Transzplantációs Osztály Lymphoma és Myeloma Terápiás
A sigma és colon daganatok diagnosztikájának és kezelésének finanszírozási protokollja
 A sigma és colon daganatok diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009. szeptember
A sigma és colon daganatok diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009. szeptember
Nukleáris onkológiai vizsgálatok. Pajzsmirigyrák terápiák és utánkövetése. Dr. Földes Iván 2013, 2014
 Nukleáris onkológiai vizsgálatok Pajzsmirigyrák terápiák és utánkövetése Dr. Földes Iván 2013, 2014 A pajzsmirigyrák előfordulásának gyakorisága Magyarországon (2010 évi rákregiszter alapján) A rosszindulatú
Nukleáris onkológiai vizsgálatok Pajzsmirigyrák terápiák és utánkövetése Dr. Földes Iván 2013, 2014 A pajzsmirigyrák előfordulásának gyakorisága Magyarországon (2010 évi rákregiszter alapján) A rosszindulatú
