Traumás asphyxia maradandó látásvesztéssel
|
|
|
- Regina Fábián
- 6 évvel ezelőtt
- Látták:
Átírás
1 ESETISMERTETÉS Traumás asphyxia maradandó látásvesztéssel Kántor Tibor PhD-hallgató 1 Grigorescu Bianca dr. 2 Popescu Gabriel dr. 5 Ferencz Attila dr. 6 Nagy Örs dr. 3 Jung János dr. 4 Gergely István dr. 3 1 Marosvásárhelyi Orvosi és Gyógyszerészeti Egyetem, Marosvásárhely Marosvásárhelyi Orvosi és Gyógyszerészeti Egyetem, 2 Kórélettani Tanszék, 3 I. Ortopédia-Traumatológia Tanszék, 4 Patológia Tanszék, Marosvásárhely 5 Maros Megyei Sürgősségi Kórház, II. Sz. Sebészeti Klinika, Marosvásárhely 6 Dora Optics, Marosvásárhely A traumás asphyxia egy olyan ritka állapot, amely kompressziós mellkasi-hasi trauma után következik be. Cervicofacialis cyanosissal, oedemával, petechiákkal és kötőhártya-bevérzéssel jelentkezik. Súlyos, életveszélyes mellkasi és hasi sérülésekkel is társulhat. Az esetek többségében konzervatív kezelést követően a felépülés teljes, de ritkán maradandó idegrendszeri elváltozások léphetnek fel. Egy 39 éves férfi beteg esetét mutatjuk be, aki kompressziós mellkasi-hasi sérülést szenvedett. A traumát követően a jellegzetes ecchymosisos maszk alakult ki. A hasi sérülések sebészi ellátása és az intenzív terápia után a beteg maradandó látásvesztéssel hagyta el a kórházat. A fej-nyak szintjén kialakuló retrográd vénás nyomás növekedése idegsejt-ischaemiával társulhat, amely maradandó látóideg-sorvadást idézhet elő. Ezért fontos, a szupportív terápia mellett, a rutinszerű, korai és teljes szemészeti vizsgálat, különösen az intubált, illetve nehezen kooperáló betegeknél. Orv Hetil. 2017; 158(22): Kulcsszavak: asphyxia, kompresszív trauma, látásvesztés Traumatic asphyxia with permanent visual loss Case report Traumatic asphyxia is a rare condition that occurs after compressive thoracoabdominal trauma, which is characterized by subconjunctival hemorrhage, cervicofacial cyanosis, edema and petechiae. Serious life-threatening thoracic and abdominal injuries may coexist. After conservatory treatment in most cases complete recovery is achieved, but in isolated cases permanent neurological lesions may occur. We present the case of the 39-year-old male patient who suffered a compressive thoracoabdominal trauma. The physical examination showed the characteristic ecchymotic mask. After surgical treatment of the abdominal injuries and intensive therapy the patient was discharged with permanent vision loss. The high retrograde venous pressure in the head and neck may be associated with neuronal ischemia, which can lead to irreversible optic nerve atrophy. It is therefore important to carry out an early, routine and complete ophtalmologic examination, especially in the intubated and poorly cooperative patients. Keywords: asphyxia, compressive trauma, visual loss Kántor T, Grigorescu B, Popescu G, Ferencz A, Nagy Ö, Jung J, Gergely I. [Traumatic asphyxia with permanent visual loss. Case report]. Orv Hetil. 2017; 158(22): (Beérkezett: március 3.; elfogadva: március 30.) Rövidítések OCT = optikaikoherencia-tomográf; RNFL = retinal nerve fiber layer A traumás asphyxia kompressziós mellkasi-hasi trauma után jelentkező állapot, és cervicofacialis cyanosissal, oedemával, kötőhártya-bevérzéssel és petechiákkal je- DOI: / évfolyam, 22. szám
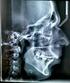
2 lentkezik az arc, nyak és a mellkas felső részén [1]. A szakirodalom szerint ezen ritka állapot egyszer észlelhető súlyos traumában [2]. Több súlyos, életet veszélyeztető sérülés együttes fennállása jellemzi. Mivel a trauma érinti a mellkast, a mediastinumot és a hasüreg felső régióját, tüdőcontusiót, haemopneumothoraxot, ablakos bordatörést, máj- és léplaceratiót okozhat [3, 4]. Myoglobinuria, rhabdomyolysis és akut vese tubulushám nekrózis akkor fordul elő, ha nagyobb izomcsoportok zúzódása is társul [1]. Traumás asphyxiában a vena cava superior szintjén hirtelen megemelkedő nyomás átmeneti látászavarhoz vezethet, ritka esetben vakságot is okozhat [5]. Esetismertetés 39 éves, krónikus alkoholista férfi beteget munkabaleset következtében szállítottak a sürgősségi osztályra. Többszörös mellkasi és hasi sérüléseket szenvedett, miután áthaladt rajta egy traktor első kereke. Az objektív vizsgálat során kötőhártya-bevérzést, periorbitalisan, valamint a nyak és felső mellkas szintjén többszörös zúzódást, oedemát és petechiákat észleltünk. Felvételkor a beteg beszűkült tudatállapotú, tachypnoés, oxigénszaturációja oxigénterápiával 100%, noninvazív vérnyomás 103/83 Hgmm, szívfrekvenciája 110 ütés/perc volt. Laborvizsgálatok: hemoglobin 7,7 mg/dl, hematokrit 23,3%, szérumkálium 4,9 mmol/l, szérumkreatinin 0,94 mg/dl, AST 2239 U/L, ALT 776 U/L. A CT-vizsgálat jobb haemopneumothoraxot, többszörös bordatörést, haemoperitoneumot, illetve a máj hatodik és hetedik szegmensének laceratióját mutatta ki. Jobb oldali pleurostomia után, általános érzéstelenítésben, sürgősségi kétoldali subcostalis laparotomiát, a máj hatodik és hetedik szegmentumának atípusos reszekcióját és cholecystectomiát végeztünk. Műtétet követően a beteget az intenzív osztályra szállították, ahol folytatták a folyadék- és elektrolitpótlást, valamint a sav-bázis egyensúly helyreállító kezelést. Állandó szedáció alatt (midazolam és fentanyl) gépi lélegeztetést alkalmaztunk a bordatörés rögzítése érdekében. Profilaktikusan protonpumpagátlót, antibiotikumot és vitaminokat adagoltunk. Az egyik legfontosabb kezelés a vizeletalkalinizálás volt nátriumhidrogén-karbonát oldattal, hogy megelőzzük az akut veseelégtelenséget. Kezelésünk célkitűzései az arteriális oxigén parciális nyomása >100 Hgmm, az artériás középnyomás >70 Hgmm és a vizeletürítés >1,5 ml/kg/h elérése volt. A kedvező lefolyás megengedte, hogy a műtétet követő hetedik napon megszüntessük a gépi lélegeztetést és a tizedik napon eltávolítsuk a mellkasi és hasi dréneket. A tizenkettedik napra normalizálodtak a biokémiai paraméterek (1. táblázat), valamint felszívódtak a facialis és thoracalis petechiák. A szedáció megszüntetése után a betegnél akut pszichosis alakult ki, amely háromnapi kezelést (diazepam, haloperidol, cerebrolysin) követően megszűnt. Mindezek ellenére a látása fokozatosan romlott, a csökkent látástól a teljes vakságig. Az ismételt szemészeti vizsgálat oedemás, elmosódott szélű látóidegfőt írt le. A páciens a 20. napon hagyta el az intenzív terápiás osztályt. A balesetet követő 18. hónapban a beteg szemészeti vizsgálatra jelentkezett. A képalkotó eljárások közül szemészeti OCT (optikaikoherencia-tomográf) készült (1. ábra). Részletes elemzés során az idegrostréteg (retinal nerve fiber layer RNFL) fokozott elvékonyodása mérhető: a beteg korának megfelelő normális idegrostréteg vastagsága 105 µm, a felvételen viszont az átlagos érték 70 µm. Ezek az elváltozások megegyeznek a beteg klinikai állapotával és megmagyarázzák a látásvesztést. Megbeszélés A traumás asphyxiát először Olivier d Angers írta le ben ecchymosisos maszk néven. Ezenkívül használatosak a traumás cyanosis, kompressziós cyanosis, traumás apnoea, Oliver-szindróma és Perth-szindróma megnevezések [1, 3]. Az esetek többségében súlyos mellkasi-hasi traumák következtében alakul ki, de megjelenhet asthmás és epilepsziás roham, erős hányás, paroxysmalis köhögés vagy venajugularis-obstrukció következményeként is [3, 4]. A traumás asphyxiát cervicofacialis cyanosis és oedema, kötőhártya-bevérzés, a fej, a nyak, illetve a felső mellkas szintjén jelentkező petechiák jellemzik, amelyek a 1. táblázat Laboratóriumi paraméterek a beteg intenzív osztályon való tartózkodása alatt Nap CK (U/L) MB (ng/ml) >500 > Crea (mg/dl) 0,94 1,57 1,43 1,14 0,97 1,05 0,83 0,65 0,61 K + (mmol/l) 4,9 5,58 4,4 4,3 4,21 4,31 3,3 3,37 4,18 4,36 AST (U/L) ALT (U/L) Diuresis (ml/24h) ALT = alanin-aminotranszferáz; AST = aszpartát-aminotranszferáz; CK = kreatinkináz, Crea = kreatinin; K + = kálium; MB = myoglobin évfolyam, 22. szám
3 1. ábra A szemfenéki felvételen jól kivehető a látóidegfő teljes decolorisatiója. Az OCT-felvétel bilateralis látóideg-sorvadást mutatott. Jelentős idegrostvastagság-csökkenés mutatható ki a felső és alsó kvadránsokban OCT = optikaikoherencia-tomográf 2. ábra A szérumkreatinin- és -káliumértékek korrelálva diuresissel kompressziós erő hatására alakulnak ki [6]. Leggyakrabban közlekedési balesetekben, ritkábban földcsuszamlás, épületek összeomlása során fordul elő [1]. Crush-szindróma csak azon esetekben alakul ki, ha nagyobb izomcsoportok zúzódása és ischaemiája is társul [1]. Ezen szindróma traumás rhabdomyolysis néven is ismert, az izmok súlyos ischaemiáját követő reperfúzió okozza, amelynek későbbi szisztémás hatásai is vannak. Sajátos következményei a hyperkalaemia és akut veseelégtelenség, amelyet súlyosbít a hypovolaemiás sokk, akut cardiomyopathia, intravascularis disszeminált coagulatio, hypothermia, akut légzési elégtelenség, szepszis, évfolyam, 22. szám 866
4 illetve pszichés trauma [7 9]. A rhabdomyolysises esetek egyharmadában fellép a myoglobinuriás akut veseelégtelenség, és a statisztikai adatok szerint 50%-a halálos kimenetelű [10]. A magas kreatinkináz- és myoglobinértékek ellenére a mi esetünkben sikerült megelőzni az akut veseelégtelenség kialakulását a megfelelő folyadékpótlással, a vizelet alkalinizálásával és az optimális diuresis (>1,5 ml/kg/h) biztosításával (2. ábra). Oliguriás veseelégtelenség esetén a hemodialízis kötelező. A mellkasi és hasi kompresszió következtében hirtelen kialakuló intrathoracalis nyomás áttevődik a mediastinumra is. Ennek következtében a nyaki vénákon keresztül a vér kipréselődik a jobb pitvarból a fej és a nyak irányába. Az eszméletüket megtartó betegek esetében feljegyezték, hogy hajlamosak visszatartani a lélegzetüket a glottis bezárásával, ezáltal tovább növelve az intrathoracalis nyomást. Az így kialakuló magas nyomás a kis vénák és kapillárisok hirtelen tágulását és rupturáját okozza, amelynek következtében petechiák jelennek meg [1]. Mivel a kötőhártya és szájnyálkahártya szintjén az erek laza kötőszövetben helyezkednek el, a retrográd hirtelen magas nyomás a vér extravasatióját eredményezi petechiák és ecchymosisok kialakulásával [5]. Az agy, a nyak mélyebb lágyszövetei és a légutak részben védettek a retrográd emelkedett vénás nyomással szemben, mert az itt található vénák billentyűkkel rendelkeznek [3]. Ugyancsak a vénás billentyűk jelenlétének köszönhetően ezen jelenség ritkán észlelhető a test alsó részén [2]. A többszervi elégtelenség regressziója és a szedáció megszakítása után a neurológiai állapot és a látás progresszív romlása jelentkezett. Annak ellenére, hogy a kognitív funkció három napon belül teljesen visszaállt, a látás fokozatosan csökkent a teljes vakságig. Neurológiai szempontból a traumás asphyxia egyaránt károsítja az agyszövetet és az agyidegeket, főként a látóideget. Az intracranialis és retinabevérzések ritkák, amely az intracranialis és intraocularis nyomás növekedésével magyarázható. A CT-vizsgálatok többsége nem mutat ki agyszöveti károsodásokat, viszont az elhunytak boncolása során oedemát és petechiákat figyeltek meg, alátámasztva az idegsejt szintjén bekövetkezett elváltozásokat [2]. A kompresszió okozta vénás pangás nyomán létrejött hypoxia felelős a legtöbb neurológiai tünetért, mint az eszméletvesztés, hosszabb ideig tartó confusio, izgatottság, görcsroham és látáscsökkenés (homályos látás, papillaelváltozások, látóideg-sorvadás). A retinahypoxia és az ezt követő degeneratív elváltozások a vasospasmus és kapilláris stasis következményei [5]. Ez a folyamat magyarázhatja a mi esetünkben is a látóidegrostok elhalását és a vakság kialakulását. Ebben az esetben fontosnak tartjuk a látóideg funkciójának, károsodásának, illetve a látópálya-laesióknak elektrofiziológiai felmérését: elektroretinográfia (ERG) és látókérgi kiváltott válaszok (VEP) [11]. Súlyos, életveszélyes trauma esetében a sürgősségi kezelés elsődleges célja a vitális funkciók fenntartása. Miután a beteg állapota stabilizálódott, következhet a látás vizsgálata, amelyet gyakran késleltet a beszűkült tudatállapot vagy az együttműködés hiánya [12]. Ha fennáll az indirekt látóideg-trauma, célzott kezelés hiányában szupportív kezelést alkalmazhatunk: adekvát szöveti perfúzió fenntartása, az idegsejt metabolizmusának csökkentése és vitaminterápia. Randomizált tanulmányok igazolták, hogy trauma okozta látóideg-oedemában sem nagy dózisú kortikoszteroidkezelés (30 mg/kg IV töltődózis és ezt követően 5,4 mg/kg/h folyamatos infúzió óráig), sem műtéti látóideg-dekompresszió nem befolyásolták a látáscsökkenés kimenetelét [12, 13]. Esetünkben szedációt alkalmaztunk, folyadékpótlással és inotropikumok alkalmazásával fenntartottuk a >70 Hgmm artériás középnyomást, valamint intravénás B 1 - és B 6 -vitamint adagoltunk. Esetünkben a quo ad vitam prognózis kedvező volt, de a restitutio ad integrum elmaradt, amely nagymértékben befolyásolja a beteg életminőségét. Következtetés A mellkasi-hasi kompressziós trauma egy súlyos, életveszélyes állapot, amelyhez többszervi elégtelenség társulhat. Ennek megelőzése érdekében korai és célzott intenzív terápiás kezelés szükséges. Többnyire a neurológiai tünetek is reverzibilisek, de izolált esetekben, ha a kompresszió ereje nagy vagy elhúzódó, maradandó idegi sérülések alakulhatnak ki. Anyagi támogatás: A kapcsolódó kutatómunka anyagi támogatásban nem részesült. Szerzői munkamegosztás: K. T., G. B., P. G., F. A: Szakirodalom kutatása, feldolgozása, a kézirat megfogalmazása. G. I., J. J., N. Ö.: A kézirat tartalmának átvizsgálása, kézirat-korrektúra. A cikk végleges változatát valamennyi szerző elolvasta és jóváhagyta. Érdekeltségek: A szerzőknek nincsenek érdekeltségeik. Irodalom [1] Sah B, Yadav BN, Jha S. A case report of traumatic asphyxia. J Coll Med Sci-Nepal. 2014; 10: [2] Sertaridou E, Papaioannou V, Kouliatsis G, et al. Traumatic asphyxia due to blunt chest trauma: a case report and literature review. J Med Case Rep. 2012; 6: 257. [3] Uzkeser M, Aydin Y, Emet M, et al. Traumatic asphyxia. Hong Kong J Emerg Med. 2011; 18: [4] Gulbahar G, Kaplan T, Gundogdu AG, et al. A rare and serious syndrome that requires attention in emergency service: traumatic asphyxia. Case Rep Emerg Med. 2015; 2015: [5] Choi YJ, Lee SJ, Kim HJ, et al. Bilateral retrobulbar hemorrhage and visual loss following traumatic asphyxia. Korean J Ophthalmol. 2010; 24: [6] Shiber JR, Fontane E, Monroe B. Olivier syndrome: traumatic asphyxia. West J Emerg Med. 2013; 14: 653. [7] Gonzalez D. Crush syndrome. Crit Care Med. 2005; 33(1 Suppl): S34 S évfolyam, 22. szám
5 [8] Jagodzinski NA, Weerasinghe C, Porter K. Crush injuries and crush syndrome a review. Part 1: the systemic injury. Trauma. 2010; 12: [9] Mardones A, Arellano P, Rojas C, et al. Prevention of crush syndrome through aggressive early resuscitation: clinical case in a buried worker. Prehosp Disaster Med. 2016; 31: [10] Better OS, Abassi ZA. Early fluid resuscitation in patients with rhabdomyolysis. Nat Rev Nephrol. 2011; 7: [11] Fejes I, Kocsis PB, Benedek G, et al. Interocular amplitude and latency differences of pattern ERG and pattern VEP parameters. Optom Vis Sci. 2014; 91: [12] Atkins EJ, Newman NJ, Biousse V. Post-traumatic visual loss. Rev Neurol Dis Spring; 5: [13] Jacobs SM, Van Stavern GP. Neuro-ophthalmic deficits after head trauma. Curr Neurol Neurosci Rep. 2013; 13: 389. (Grigorescu Bianca dr., Bărdești, str. Ghiocelului nr. 8, biancagrigorescu20@yahoo.com) A GYÓGYSZER NEVE: Pentasa 500 mg retard tabletta; Pentasa 1 g retard tabletta; Pentasa 2 g retard granulátum; Pentasa 4 g retard granulátum; Pentasa 1 g végbélkúp; Pentasa 1 g végbélszuszpenzió. MINÕSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL: 500 mg retard tabletta: 500 mg meszalazin tablettánként; 1 g retard tabletta: 1000 mg meszalazin tablettánként; 2 g retard granulátum: 2000 mg meszalazin tasakonként; 4 g retard granulátum: 4000 mg meszalazin tasakonként; 1 g végbélkúp: 1000 mg meszalazin kúponként; 1 g végbélszuszpenzió: 1000 mg meszalazin 100 ml szuszpenzióban. TERÁPIÁS JAVALLATOK: Pentasa 500 mg és 1 g retard tabletta; Pentasa 2 g és 4 g retard (elhúzódó hatóanyag-leadású) granulátum: Enyhe vagy középsúlyos colitis ulcerosa (colitis, proctosigmoiditis, proctitis) akut fellobbanásának (schub) kezelése, ill. a recidiva megelõzése. Aktív morbus Crohn tüneti kezelése. Pentasa 1 g végbélkúp: Végbélre korlátozódó colitis ulcerosa kezelése. Pentasa 1 g végbélszuszpenzió: ulcerativ proctosigmoiditis, enyhe és mérsékelt baloldali colitis akut és fenntartó kezelése. ADAGOLÁS ÉS ALKALMAZÁS: Adagolás: Pentasa 500 mg és Pentasa 1 g retard tabletta és Pentasa 2 g és 4 g retard (elhúzódó hatóanyag-felszabadulású) granulátum: Az adagolás egyéni, a betegség lefolyásától függ. Colitis ulcerosa: Akut kezelés: Felnõttek: maximum 4 g meszalazin naponta egyszer vagy 2 részre elosztva. Fenntartó kezelés: Felnõttek: 2 g meszalazin naponta egyszer. Az adagot naponta több részre elosztva is be lehet venni. Crohn betegség: Akut kezelés: Felnõttek: maximum 4 g meszalazin naponta 2 3 részre elosztva. Fenntartó kezelés: Felnõttek: maximum 4g meszalazin naponta több részre elosztva. Gyermekek: Gyermekek 6 18 éves korcsoportjában a hatásosságot igazoló dokumentumok csak korlátozott számban állnak rendelkezésre. 6 éves vagy ennél idõsebb gyermekek: Akut betegség esetén: Egyedileg kell meghatározni a kezelést mg/ttkg napi adaggal kezdve, amelyet naponta több részre elosztva kell beadni. A maximális dózis 75 mg/ttkg/nap, amelyet több részre elosztva kell beadni. A napi teljes dózis nem haladhatja meg a 4 g/nap-ot (a maximális felnõtt dózist). Fenntartó kezelés: Egyedileg kell meghatározni mg/ttkg napi adaggal kezdve, amelyet naponta több részre elosztva kell beadni. A napi teljes dózis a nem haladhatja meg a 2 g/napot (az ajánlott felnõtt dózist). Általában gyermekek esetén 40 ttkg és ez alatt a felnõtt dózis fele, míg 40 ttkg felett felnõtt dózis javasolt. AZ ALKALMAZÁS MÓDJA: A Pentasa tablettát és granulátumot szétrágás nélkül, lehetõleg étkezés közben, sok folyadékkal kell bevenni. A Pentasa 500 mg retard tabletta a bemetszésnél kézi töréssel egyenlõ adagokra osztható. Éles eszközzel elvágni nem szabad, mert a granulátumok bevonata sérül és a hatóanyag felszabadulása károsodik. A Pentasa retard granulátumot a nyelvre kell önteni, és sok vízzel vagy gyümölcslével kell lenyelni. A tabletta bevételének megkönnyítésére a tablettát bele lehet tenni kb. 50 ml hideg vízbe, majd elkeverés után azonnal meg kell inni. A tabletta gyakorlatilag azonnal granulátumokra esik szét. A granulátumok nem oldódnak fel, és elkeverés után azokat azonnal meg kell inni. A kezelés idõtartama a betegség lefolyásához igazodik. Tartós kezelésre alkalmas. Pentasa 1 g végbélkúp: Szokásos adagja felnõtteknek: 1 kúpot naponta a végbélbe kell helyezni. Az akut kezelés idõtartama általában 2 4 hétre terjed ki. Esetleg hosszabb alkalmazási idõtartam a betegség lefolyásához igazodik. Pentasa 1 g végbélszuszpenzió: 1 adag végbélszuszpenzió lefekvés elõtt. A Pentasa 1 g végbélkúp és 1 g végbél szuszpenzió gyermekeknél történõ alkalmazásáról kevés a tapasztalat, és a hatásosságot igazoló dokumentumok csak korlátozott számban állnak rendelkezésre. A végbélszuszpenziót használat elõtt alaposan fel kell rázni. A védõ alumínium fóliát közvetlenül a felnyitás elõtt kell eltávolítani. A végbélkúp és a végbélszuszpenzió beadása elõtt ajánlatos a székletürítés. ELLENJAVALLATOK: Meszalazinnal, szalicilátokkal vagy a készítmény bármely segédanyagával szembeni túlérzékenység. Súlyos máj-és vesekárosodás. KÜLÖNLEGES FIGYELMEZTETÉSEK ÉS AZ ALKALMAZÁSSAL KAP- CSOLATOS ÓVINTÉZKEDÉSEK: Csak orvosi ellenõrzés mellett szabad alkalmazni. A legtöbb beteg, akik szulfaszalazinnal szemben intoleránsak vagy szulfaszalazinre túlérzékenyek, a Pentasa-t hasonló reakció veszélye nélkül szedhetik. Szalicilát-allergia veszélye miatt azonban a szulfaszalazinra érzékeny betegeket különös figyelemmel kell kísérni. Akut intolerancia, mint pl. hasi görcsök, heveny hasi fájdalom, láz, súlyos fejfájás és kiütések esetén a kezelést azonnal abba kell hagyni. Fokozott figyelemmel kell kísérni a májkárosodásban szenvedõ betegeket. A kezelést megelõzõen valamint a kezelés alatt a kezelõorvos döntése alapján májfunkciós vizsgálatokat, mint ALAT vagy ASAT vizsgálatot kell végezni. A készítmény alkalmazása nem javasolt vesekárosodásban és vérzési hajlammal rendelkezõ betegeknél. A vesemûködést rendszeresen ellenõrizni kell. Az ellenõrzésre fõleg a kezelés kezdeti szakaszában kell fokozott figyelmet fordítani. A kezelést megelõzõen és a kezelés során az orvos döntése alapján vizeletvizsgálatot (tesztcsík) kell végezni. A kezelés során a vesemûködésben kialakult zavarok a meszalazin nephrotoxikus hatása miatt alakulnak ki. Ismerten vesekárosító hatású készítmények, mint NSAID-ek és azatioprin együttes adása a vesén kialakuló reakciók veszélyét növelheti. Fokozott figyelemmel kell kísérni az aktív peptikus fekélyben szenvedõ betegeket. Tüdõbetegségben szenvedõ betegeket, különösen az asztmásokat a kezelés alatt szoros megfigyelés alatt kell tartani. Meszalazin hatására kialakult túlérzékenységi reakciók, mint myo- és pericarditis ritkán fordultak elõ. Súlyos vér dyscrasia meszalazin-kezelés következtében nagyon ritkán alakul ki. A kezelést megelõzõen valamint a kezelés alatt a kezelõorvos döntése alapján a vérkép vizsgálatot kell végezni. Azatioprin és 6-merkaptopurin vagy tioguanin meszalazinnal történõ együttes adása emelheti a vér dyscrasia kialakulásának veszélyét. Amennyiben a fenti reakciók meszalazin hatására történõ kialakulásának gyanúja felmerül, a kezelést abba kell hagyni. A terápia elõtt és közben a vér-és vizelet ellenõrzése szükséges. Általában az ellenõrzõ vizsgálatokat 14 nappal a kezelés megkezdése után, majd ezt követõen 2 3 alkalommal havonta egyszer célszerû elvégezni. Kontrollvizsgálatok újabb tünetek fellépésekor és normális leletek esetén negyedévenként szükségesek. Ha újabb tünetek jelentkeznek, a vizsgálatokat azonnal el kell végezni. Vesemûködés vizsgálatához célszerû a szérumkarbamid- és kreatinin szint ellenõrzése, valamint a vizelet üledékvizsgálata. Tartós kezelés esetén a máj-, vesefunkció, a vérkép és véralvadási paraméterek ellenõrzése szükséges. GYÓGYSZERKÖLCSÖNHATÁSOK ÉS EGYÉB INTERAKCIÓK: Gyógyszerkölcsönhatásokkal kapcsolatos vizsgálatokat nem végeztek. Számos klinikai vizsgálat kimutatta, hogy az azatioprin és 6-merkaptopurin vagy tioguanin Pentasával történõ együttes adása esetén emelkedett a myelosuppressiv hatás elõfordulásának aránya, amely azt mutatja, hogy létezik ez a típusú gyógyszerkölcsönhatás, de a kölcsönhatás mechanizmusa nem teljesen ismert. A fehérvérsejtek folyamatos ellenõrzése javasolt, és a tiopurinok dózisát az eredmények tükrében módosítani kell. Gyengék a bizonyítékok arra vonatkozóan, hogy a meszalazin esetlegesen csökkenti a warfarin véralvadásgátló hatását. TERMÉKENYSÉG, TERHESSÉG ÉS SZOPTATÁS: A készítmény terhesség és szoptatás alatt akkor adható, ha a kezelõorvos gondosan mérlegeli a terápiás elõny/kockázat arányát. LEGGYAKORIBB MELLÉKHATÁSOK: A klinikai vizsgálatokban megfigyelt leggyakoribb mellékhatások a hasmenés (3%), hányinger (3%), hasi fájdalom (3%), fejfájás (3%), hányás (1%), kiütés (1%). Túlérzékenységi reakciók és gyógyszerláz esetenként fordulhat elõ. TÚLADAGOLÁS: Akut toxicitás állatokon: 5 g/ttkg egyszeri orális adag meszalazin disznókon, vagy 920 mg/ttkg egyszeri intravénás adag meszalazin patkányokon nem volt halálos. Akut toxicitás emberen: A Pentasa túladagolásáról csak korlátozott számban állnak rendelkezésre klinikai adatok, amelyek nem utalnak máj- vagy vesetoxicitásra. Speciális antidótuma nincs, kezelése tüneti, támogató kezelés. Egy esetet jelentettek, amikor a beteg egy hónapon keresztül naponta 8 g meszalazint vette be minden mellékhatás jelentkezése nélkül. Kezelés Túladagolás esetén a vesefunkció ellenõrzése mellett tüneti kezelést kell végezni. INKOMPATIBILITÁSOK: Nem értelmezhetõ. MEGJEGYZÉS: (egy kereszt). OSZTÁLYOZÁS: II./1csoport. Korlátozott érvényû orvosi rendelvényhez kötött, szakorvosi/kórházi diagnózist követõ járóbeteg-ellátásban alkalmazható gyógyszer (J). A FORGALOM- BAHOZATALI ENGEDÉLY JOGOSULTJA: Ferring Magyarország Gyógyszerkereskedelmi Kft., 1138 Budapest, Tomori u. 34. Magyarország. A FORGALOMBAHOZATALI ENGEDÉLY SZÁMA: Pentasa 500mg retard tabletta: OGYI-T-4798/01; Pentasa 1g retard tabletta: OGYI-T- 4798/05; Pentasa 2g retard granulátum: OGYI-T-4798/04; Pentasa 4g retard granulátum: OGYI-T-4798/06; Pentasa 1g végbélkúp: OGYI-T- 4798/02; Pentasa 1g végbélszuszpenzió: OGYI-T-4798/03. A SZÖVEG ELLENÕRZÉSÉNEK DÁTUMA: KÉRJÜK OLVASSA EL FIGYELMESEN A RÉSZLETES ALKALMAZÁSI ELÕÍRÁST! COR/492/2017/HU PENTASA 4 g retard granulátum EGYESÍTETT ERÓ KKEL A NYÁLKAHÁRTYA-GYÓGYULÁSÉRT Enyhe- középsúlyos colitis ulcerosa akut fellángolásának kezelésére A GYÓGYSZER NEVE: Cortiment 9 mg retard tabletta. Egy tabletta 9 mg budezonidot tartalmaz. TERÁPIÁS JAVALLATOK: A Cortiment tabletta remisszió kiváltására javallott enyhe-középsúlyos, aktív colitis ulcerosában (CU) szenvedõ betegeknél amennyiben az 5-ASA kezelés nem elegendõ. ADAGOLÁS ÉS ALKALMAZÁS: A remisszió kiváltására javasolt napi adag egy 9 mg-os tabletta reggelente, legfeljebb 8 héten át. ELLENJAVALLATOK: Szójaolajjal, mogyoróolajjal, készítmény hatóanyagával vagy bármely segédanyagával szembeni túlérzékenység. KÜLÖNLEGES FIGYELMEZTETÉSEK ÉS AZ ALKALMAZÁSSAL KAPCSOLATOS ÓVINTÉZKEDÉSEK: A Cortiment tablettát körültekintõen kell alkalmazni fertõzésekben, hypertoniában, diabetes mellitusban, osteoporosisban, peptikus fekélyben szenvedõkön, glaucomás, vagy cataractás betegeken, és azokon, akiknek családi kórelõzményében diabetes, glaucoma, vagy bármilyen más, olyan állapot szerepel, amelyben a glükokortikoid alkalmazása nem kívánt hatásokat válthat ki. A csökkent májmûködés hatással lehet a glükokortikoidok, köztük a budezonid eliminációjára, megnövekedett szisztémás hatást eredményezve. Figyelni kell a szisztémás mellékhatások megjelenésére. A várható szisztémás hatások közé értendõ a glaucoma. Ha a kezelést abba kell hagyni, hasznos lehet a kezelõorvos javaslata szerint fokozatosan csökkenteni az adagot. A Cortiment tablettával végzett kezelés alacsonyabb szisztémás szteroid szinteket eredményez, mint a hagyományos, orális glükokortikoid terápia. Az egyéb szteroid terápiáról történõ váltás a szisztémás szteroid szintek változásával összefüggõ tüneteket eredményezhet. Egyes betegek a megvonási szakaszban bizonytalan rosszullétet, pl. izom- és ízületi fájdalmat érezhetnek. Egy általános, elégtelen glükokortikoid hatásra kell gyanakodni, ha ritka esetben tünetként fáradtság, fejfájás, hányinger és hányás lépne fel. Ezekben az esetekben néha szükséges a szisztémásan ható szteroid dózisának átmeneti emelése. Mivel ismert, hogy a kortikoszteroidok immunológiai hatásokkal rendelkeznek, a Cortiment tabletta vakcinákkal történõ egyidejû alkalmazása valószínûleg csökkenti a vakcinákra adott immunválaszt. Ketokonazol vagy más hatékony CYP3A4 gátlók egyidejû alkalmazását el kell kerülni. Ha ez nem lehetséges, a kezelések között eltelt idõszaknak a lehetõ leghosszabbnak kell lenni és a Cortiment adagjának a csökkentése is megfontolandó. Nagy mennyiségû grépfrútlé (mely túlnyomórészt a bélnyálkahártyában gátolja a CYP3A4 aktivitását) fogyasztása után, a szájon át adott budezonid szisztémás hatása hozzávetõleg a kétszeresére nõtt. Mint más, elsõsorban a CYP3A4 által metabolizált gyógyszerek esetében, a budezonid alkalmazásával egyidejûleg kerülni kell a grépfrút, vagy a levének a fogyasztását (más gyümölcslevek, pl. a narancs-, vagy az almalé nem gátolják a CYP3A4 aktivitását). A Cortiment szójaolajból származó lecitint tartalmaz. Szójával vagy mogyoróval szembeni túlérzékenység esetén ez a gyógyszer nem adható. A Cortiment tabletta laktóz-monohidrátot tartalmaz. Ritkán elõforduló, örökletes galaktóz intoleranciában, laktóz-intoleranciában vagy glükóz-galaktóz malabszorpcióban a készítmény nem szedhetõ. TERMÉKENYSÉG, TERHESSÉG ÉS SZOPTATÁS: Az inhalációs budezonid rendkívül nagyszámú terhességben történt alkalmazásáról rendelkezésre álló adatok nem utalnak káros hatásokra. Bár orális alkalmazást követõen nincs adat a terhességek kimenetelérõl, a biohasznosulás szájon át adva alacsony. A kortikoszteroidok állatkísérletekben, nagy dózisok alkalmazásakor ártalmasnak bizonyultak. A Cortiment csak akkor alkalmazható terhesség során, ha a várható elõnye a kockázatokkal szemben egyértelmûen igazolt. A budezonid kis mennyiségben kiválasztódik az anyatejbe. A budezonid vérbõl történõ, gyors clearance miatt, elméletileg a szoptatott csecsemõ expozíciója várhatóan csekély. Azonban nem állnak rendelkezésre adatok. Arról kell döntést hozni, hogy a szoptatást kell-e felfüggeszteni vagy a budezonid kezelést kell megszakítani. A döntés meghozatalakor azt kell mérlegelni, hogy milyen elõnnyel jár a szoptatás a gyermekre nézve, illetve hogy milyen elõnnyel jár a kezelés az anyára nézve. Emberben nincs adat a Cortiment termékenységre kifejtett hatásáról. Patkányokon végzett budezonid kezelés után fertilitásra kifejtett hatásokat nem figyeltek meg. NEMKÍVÁNATOS HATÁSOK, MELLÉKHATÁSOK: Olykor szisztémás glükokortikoszteroidokra jellemzõ mellékhatások jelentkezhetnek. Ezek a mellékhatások függenek az adagolástól, a kezelés idõtartamától, más glükokortikoszteroidokkal folytatott egyidejû vagy megelõzõ kezeléstõl és az egyéni érzékenységtõl. A szteroidok osztályának mellékhatásai többek között a következõk: A bõr és a bõr alatti szövet betegségei és tünetei: Allergiás bõrkiütés, piros striák, petechiák, ecchymosis, szteroid akné, elhúzódó sebgyógyulás, kontakt dermatitis. A csontés izomrendszer, valamint a kötõszövet betegségei és tünetei: Aszeptikus csontelhalás (femur- és humerusfej necrosis). TÚLADAGOLÁS: A Cortiment tabletta alacsony szisztémás biohasznosulása miatt, a heveny túladagolás várhatóan még rendkívül nagy dózisok esetén sem vezet akut klinikai vészhelyzethez. Heveny túladagolás esetére nem áll rendelkezésre specifikus ellenszer. A kezelés támogató és tüneti terápiából áll. FARMAKODINÁMIÁS TULAJDONSÁGOK: Enyhe vagy középsúlyos megbetegedésben az 5-ASA-val történõ kezelés az irányadó. A Cortiment és az 5-ASA közvetlen összehasonlításáról eredmények nem állnak rendelkezésre. Így, a terápiás alkalmazásban betöltött helye megállapítandó. Néhány betegnél elõnyös lehet a kezelést Cortimenttel kezdeni. A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA: Ferring Magyarország Gyógyszerkereskedelmi Kft Budapest, Tomori u. 34. Magyarország. A FORGALOMBA HOZATALI ENGEDÉLY SZÁMA: OGYI-T-22753/01, 30, buborékcsomagolásban. A FORGALOMBA HOZATALI ENGEDÉLY ELSÕ KIADÁSÁNAK DÁTUMA: november 19. A SZÖVEG ELLENÕRZÉSÉNEK DÁTUMA: november 19. KÉRJÜK OLVASSA EL FIGYELMESEN A RÉSZLETES ALKAL- MAZÁSI ELÕÍRÁST! termék közfinanszírozás a támogatás térítési díj alapjául összege elfogadott ár (EÜ90%,11/b) Pentasa g retard granulátum 30 tasakban Cortiment 9 mg retard tabletta A dokumentum lezárásának idõpontja: Ferring Magyarország Kft Budapest, Tomori utca 34. Tel.: , Fax: CORTIMENT 9 mg retard tabletta évfolyam, 22. szám 868
4g PENTASA NAPONTA EGYSZER enyhe-középsúlyos aktív colitis ulcerosa kezelésére
 4g NAPONTA EGYSZER enyhe-középsúlyos aktív colitis ulcerosa kezelésére 4g PENTASA NAPONTA EGYSZERI ADAGOLÁSA AZONOS MÉRTÉKBEN INDUKÁL REMISSZIÓT, MINT A NAPONTA 2 2g-os ADAGOLÁS 4g PENTASA naponta egyszeri
4g NAPONTA EGYSZER enyhe-középsúlyos aktív colitis ulcerosa kezelésére 4g PENTASA NAPONTA EGYSZERI ADAGOLÁSA AZONOS MÉRTÉKBEN INDUKÁL REMISSZIÓT, MINT A NAPONTA 2 2g-os ADAGOLÁS 4g PENTASA naponta egyszeri
EGYESÍTETT ERO KKEL A NYÁLKAHÁRTYA-GYÓGYULÁSÉRT
 EGYESÍTETT ERO KKEL A NYÁLKAHÁRTYA-GYÓGYULÁSÉRT PENTASA 2 g retard granulátum 4 g retard granulátum CORTIMENT 9 mg retard tabletta Enyhe-középsúlyos colitis ulcerosa akut fellángolásának kezelésére PENTASA
EGYESÍTETT ERO KKEL A NYÁLKAHÁRTYA-GYÓGYULÁSÉRT PENTASA 2 g retard granulátum 4 g retard granulátum CORTIMENT 9 mg retard tabletta Enyhe-középsúlyos colitis ulcerosa akut fellángolásának kezelésére PENTASA
KÜLÖNBÖZÕ BETEGEK KÜLÖNBÖZÕ IGÉNYEK KÜLÖNBÖZÕ GYÓGYSZERFORMÁK
 AZ ÚJ PENTASA VÉGBÉLSZUSZPENZIÓ TARTÁLYÁT KÖNNYEBB KIÜRÍTENI A MEGÚJULT FORMA SOKKAL EGYSZERÛBBÉ ÉS KÉNYELMESEBBÉ TESZI A KEZELÉST REFERENCIÁK 1. Kornbluth A, Sachar DB. Ulcerative colitis practice guidelines
AZ ÚJ PENTASA VÉGBÉLSZUSZPENZIÓ TARTÁLYÁT KÖNNYEBB KIÜRÍTENI A MEGÚJULT FORMA SOKKAL EGYSZERÛBBÉ ÉS KÉNYELMESEBBÉ TESZI A KEZELÉST REFERENCIÁK 1. Kornbluth A, Sachar DB. Ulcerative colitis practice guidelines
CORTIMENT 9 mg retard tabletta KORTIKOSZTEROID-HATÉKONYSÁG, ALACSONY SZISZTÉMÁS MELLÉKHATÁSOK COLITIS ULCEROSA KEZELÉSÉBEN
 cortiment_a5f_150914a.qxd 9/14/2015 11:41 AM Page 1 CORTIMENT 9 mg retard tabletta KORTIKOSZTEROID-HATÉKONYSÁG, ALACSONY SZISZTÉMÁS MELLÉKHATÁSOK COLITIS ULCEROSA KEZELÉSÉBEN A COLITIS ULCEROSA KEZELÉSÉNEK
cortiment_a5f_150914a.qxd 9/14/2015 11:41 AM Page 1 CORTIMENT 9 mg retard tabletta KORTIKOSZTEROID-HATÉKONYSÁG, ALACSONY SZISZTÉMÁS MELLÉKHATÁSOK COLITIS ULCEROSA KEZELÉSÉBEN A COLITIS ULCEROSA KEZELÉSÉNEK
MAGYAR GASZTROENTEROLÓGIAI TÁRSASÁG ENDOSZKÓPOS SZEKCIÓ ÉS AZ ERDÉLYI GASZTROENTEROLÓGUSOK NEGYEDIK KÖZÖS KONGRESSZUSA 2016. ÁPRILIS 22-24.
 MAGYAR GASZTROENTEROLÓGIAI TÁRSASÁG ENDOSZKÓPOS SZEKCIÓ ÉS AZ ERDÉLYI GASZTROENTEROLÓGUSOK NEGYEDIK KÖZÖS KONGRESSZUSA 2016. ÁPRILIS 22-24. Helyszín: Csíkszereda Jakab Antal Konferencia Központ Maros,
MAGYAR GASZTROENTEROLÓGIAI TÁRSASÁG ENDOSZKÓPOS SZEKCIÓ ÉS AZ ERDÉLYI GASZTROENTEROLÓGUSOK NEGYEDIK KÖZÖS KONGRESSZUSA 2016. ÁPRILIS 22-24. Helyszín: Csíkszereda Jakab Antal Konferencia Központ Maros,
2017. évi Kongresszusa
 Magyar Mesterséges Táplálási Társaság 2017. évi Kongresszusa Programfüzet Mátraháza, 2017. október 12-14. A MAGYAR MESTERSÉGES TÁPLÁLÁSI TÁRSASÁG VEZETŐSÉGE Elnök Dr. Tomsits Erika Tiszteletbeli elnök
Magyar Mesterséges Táplálási Társaság 2017. évi Kongresszusa Programfüzet Mátraháza, 2017. október 12-14. A MAGYAR MESTERSÉGES TÁPLÁLÁSI TÁRSASÁG VEZETŐSÉGE Elnök Dr. Tomsits Erika Tiszteletbeli elnök
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Cetirizin-ratiopharm 10 mg filmtabletta Cetirizin-ratiopharm 10 mg filmtabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Cetirizin-ratiopharm 10 mg filmtabletta Cetirizin-ratiopharm 10 mg filmtabletta
KETTŐS EREJÉVEL GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ ORRDUGULÁS ORRFOLYÁS IBUPROFÉN ÉS PSZEUDOEFEDRIN A MEGFÁZÁS TÜNETEI ELLEN FEJFÁJÁS TOROKGYULLADÁS
 IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
A Kockázatkezelési Terv Összefoglalója
 1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Magnesium 250 mg Pharmavit pezsgőtabletta Magnesium Pharmavit 250 mg pezsgőtabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Magnesium 250 mg Pharmavit pezsgőtabletta Magnesium Pharmavit 250 mg pezsgőtabletta
PPI VÉDELEM A KEZELÉS SORÁN
 75 mg diclofenák-nátrium, 20 mg omeprazol módosított hatóanyag-leadású kemény kapszula PPI VÉDELEM A KEZELÉS SORÁN Jelentős fájdalom- és gyulladáscsökkentő hatás 1 Savkontroll az omeprazol segítségével
75 mg diclofenák-nátrium, 20 mg omeprazol módosított hatóanyag-leadású kemény kapszula PPI VÉDELEM A KEZELÉS SORÁN Jelentős fájdalom- és gyulladáscsökkentő hatás 1 Savkontroll az omeprazol segítségével
VeyFo. VeyFo Jungtier - Oral Mulgat
 VeyFo VeyFo Jungtier - Oral Mulgat Különleges táplálási igényeket kielégítő/diétás/ kiegészítő takarmány borjak, malacok, bárányok, kecskegidák és kutyák részére Használati utasítás Trimetox 240 oldat
VeyFo VeyFo Jungtier - Oral Mulgat Különleges táplálási igényeket kielégítő/diétás/ kiegészítő takarmány borjak, malacok, bárányok, kecskegidák és kutyák részére Használati utasítás Trimetox 240 oldat
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Allergodil orrspray 4. sz. melléklete az OGYI-T- 5334/01-04 sz. Forgalomba
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Allergodil orrspray 4. sz. melléklete az OGYI-T- 5334/01-04 sz. Forgalomba
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen e gyógyszer körültekintő bevétele.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
III. melléklet. Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai. Megjegyzés:
 III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai Megjegyzés: Az alkalmazási előírás, a címke és a betegtájékoztató a referál eljárás eredménye. Lehetséges,
III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai Megjegyzés: Az alkalmazási előírás, a címke és a betegtájékoztató a referál eljárás eredménye. Lehetséges,
Nemekre szabott terápia: NOCDURNA
 Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
Betegtájékoztató: Információk a felhasználó számára
 Betegtájékoztató: Információk a felhasználó számára PARAMAX Junior 250 mg tabletta PARAMAX Rapid 500 mg tabletta PARAMAX Forte 1 g tabletta paracetamol Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa
Betegtájékoztató: Információk a felhasználó számára PARAMAX Junior 250 mg tabletta PARAMAX Rapid 500 mg tabletta PARAMAX Forte 1 g tabletta paracetamol Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató Betegtájékoztató Lioton 100 000 gél Mielőtt elkezdené gyógyszerét
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató Betegtájékoztató Lioton 100 000 gél Mielőtt elkezdené gyógyszerét
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen e gyógyszer körültekintő alkalmazása.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
Ez a gyógyszer orvosi vény nélkül kapható. Az optimális hatás érdekében azonban elengedhetetlen e gyógyszer körültekintő alkalmazása.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Ibuprofen- Ethypharm 300 mg retard SR kapszula BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Ibuprofen- Ethypharm 300 mg retard SR kapszula BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR Béres B1-vitamin
FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR Béres B1-vitamin
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Duphalac szirup Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Duphalac szirup Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! B BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Jumex 5 mg tabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! B BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Jumex 5 mg tabletta
Er teljes és tartós vérnyomáscsökkentés 1,2 Kett s kardiovaszkuláris védelem 3 Javuló beteg-együttm ködés 4 Flexibilis alkalmazhatóság 5
 Mesteri kombinációk Er teljes és tartós vérnyomáscsökkentés 1,2 Kett s kardiovaszkuláris védelem 3 Javuló beteg-együttm ködés 4 Flexibilis alkalmazhatóság 5 Rövidített alkalamazási előírás Covercard 5
Mesteri kombinációk Er teljes és tartós vérnyomáscsökkentés 1,2 Kett s kardiovaszkuláris védelem 3 Javuló beteg-együttm ködés 4 Flexibilis alkalmazhatóság 5 Rövidített alkalamazási előírás Covercard 5
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Alkalmazási előírás (javasolt szöveg) Luffeel szublingvális tabletta Homeopátiás
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Alkalmazási előírás (javasolt szöveg) Luffeel szublingvális tabletta Homeopátiás
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
Betegtájékoztató: Információk a felhasználó számára. Gentos tabletta Homeopátiás gyógyszer
 Betegtájékoztató: Információk a felhasználó számára Gentos tabletta Homeopátiás gyógyszer Hatóanyagok: Populus tremuloides (Populus) trit. D1, Sabal serrulatum (Serenoa repens) trit. D6, Conium maculatum
Betegtájékoztató: Információk a felhasználó számára Gentos tabletta Homeopátiás gyógyszer Hatóanyagok: Populus tremuloides (Populus) trit. D1, Sabal serrulatum (Serenoa repens) trit. D6, Conium maculatum
III. melléklet. Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások
 III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tabletta Magnesii Citrici 500 mg Fono VII. Parma Mielőtt elkezdené gyógyszerét
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tabletta Magnesii Citrici 500 mg Fono VII. Parma Mielőtt elkezdené gyógyszerét
HATÓANYAG: 250, ill. 500 mg mesalazinum /meszalazin/ (5-aminoszalicilsav) bélben oldódó tablettánként.
 SALOFALK 250 MG BÉLBEN OLDÓDÓ TABLETTA Salofalk 250 mg bélben oldódó tabletta Salofalk 500 mg bélben oldódó tabletta meszalazin HATÓANYAG: 250, ill. 500 mg mesalazinum /meszalazin/ (5-aminoszalicilsav)
SALOFALK 250 MG BÉLBEN OLDÓDÓ TABLETTA Salofalk 250 mg bélben oldódó tabletta Salofalk 500 mg bélben oldódó tabletta meszalazin HATÓANYAG: 250, ill. 500 mg mesalazinum /meszalazin/ (5-aminoszalicilsav)
Olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára fontos információkat tartalmaz.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Plavix 75 mg filmtabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Plavix 75 mg filmtabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Termék neve (gyártó megnevezése) BETEGTÁJÉKOZTTÓ Mielőtt elkezdené gyógyszerét
FIGYELEM!!! alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Termék neve (gyártó megnevezése) BETEGTÁJÉKOZTTÓ Mielőtt elkezdené gyógyszerét
500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb flavonoidot tartalmaz).
 1. A GYÓGYSZER NEVE VenoprotEP 500 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb
1. A GYÓGYSZER NEVE VenoprotEP 500 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Alkalmazási előírás (javasolt szöveg) Klimakt-Heel szublingvális tabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Alkalmazási előírás (javasolt szöveg) Klimakt-Heel szublingvális tabletta
BETEGTÁJÉKOZTATÓ 1. MILYEN TÍPUSÚ GYÓGYSZER A CIRKULIN VALERIÁNA KOMLÓVAL MITE/FORTE BEVONT TABLETTA, ÉS MILYEN BETEGSÉGEK ESETÉN ALKALMAZHATÓ?
 BETEGTÁJÉKOZTATÓ Cirkulin Valeriana komlóval 80 mg/20 mg mite bevont tabletta Cirkulin Valeriana komlóval 160 mg/40 mg forte bevont tabletta macskagyökér száraz kivonata és komlótoboz száraz kivonata Olvassa
BETEGTÁJÉKOZTATÓ Cirkulin Valeriana komlóval 80 mg/20 mg mite bevont tabletta Cirkulin Valeriana komlóval 160 mg/40 mg forte bevont tabletta macskagyökér száraz kivonata és komlótoboz száraz kivonata Olvassa
Flexove 625 mg Tabletta Szájon át történő alkalmazás 1327 Lysaker, Norvégia Belgium - Navamedic ASA Vollsveien 13 C 1327 Lysaker, Norvégia
 I. MELLÉKLET FELSOROLÁS: MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZERKÉSZÍTMÉNY- DÓZISOK, ALKALMAZÁSI MÓDOK, KÉRELMEZŐ, FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA A TAGÁLLAMOKBAN 1 Tagállam Forgalomba hozatali engedély
I. MELLÉKLET FELSOROLÁS: MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZERKÉSZÍTMÉNY- DÓZISOK, ALKALMAZÁSI MÓDOK, KÉRELMEZŐ, FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA A TAGÁLLAMOKBAN 1 Tagállam Forgalomba hozatali engedély
Ez a gyógyszer orvosi vény nélkül kapható. Az optimális hatás érdekében azonban elengedhetetlen e gyógyszer körültekintő alkalmazása.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Coldastop orrcsepp PIL új BETEGTÁJÉKOZTATÓ Coldastop orrcsepp A-vitamin-palmitát
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Coldastop orrcsepp PIL új BETEGTÁJÉKOZTATÓ Coldastop orrcsepp A-vitamin-palmitát
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen
Olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára fontos információkat tartalmaz.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen az alábbi
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen az alábbi
Betegtájékoztató: Információk a felhasználó számára. Rubophen 500 mg tabletta paracetamol
 Betegtájékoztató: Információk a felhasználó számára Rubophen 500 mg tabletta paracetamol Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára
Betegtájékoztató: Információk a felhasználó számára Rubophen 500 mg tabletta paracetamol Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára
A rotavírus a gyomor és a belek fertőzését előidéző vírus, amely súlyos gyomor-bélhurutot okozhat.
 A rotavírus a gyomor és a belek fertőzését előidéző vírus, amely súlyos gyomor-bélhurutot okozhat. A rotavírus az egyik leggyakoribb okozója a súlyos hasmenésnek csecsemő és kisdedkorban. Évente világszerte
A rotavírus a gyomor és a belek fertőzését előidéző vírus, amely súlyos gyomor-bélhurutot okozhat. A rotavírus az egyik leggyakoribb okozója a súlyos hasmenésnek csecsemő és kisdedkorban. Évente világszerte
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
Kerek, fehér, bikonvex tabletta, egyik oldalán Clonmel cégjelzéssel, másik oldalán DSR jelzéssel ellátva. Törési felülete fehér színő.
 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Diclomel SR 100 retard tabletta 2. MINİSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 mg diclofenacum natricum (diklofenák-nátrium) retard tablettánként. 3. GYÓGYSZERFORMA Kerek,
1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Diclomel SR 100 retard tabletta 2. MINİSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 mg diclofenacum natricum (diklofenák-nátrium) retard tablettánként. 3. GYÓGYSZERFORMA Kerek,
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA. Daedalon 50 mg tabletta. dimenhidrinát
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Daedalon 50 mg tabletta dimenhidrinát Olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára fontos információkat tartalmaz. Ez a gyógyszer
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Daedalon 50 mg tabletta dimenhidrinát Olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára fontos információkat tartalmaz. Ez a gyógyszer
Alsó és felső részén fehér, átlátszatlan, 4-es méretű, kemény zselatin kapszula, amely 155 mg fehér színű, szagtalan port tartalmaz.
 1. A GYÓGYSZER NEVE Tramalgic 50 mg kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: 50 mg tramadol-hidroklorid kapszulánként. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA
1. A GYÓGYSZER NEVE Tramalgic 50 mg kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: 50 mg tramadol-hidroklorid kapszulánként. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA
40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban).
 1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen az alábbi
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen az alábbi
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA. Salofalk 250 mg végbélkúp Salofalk 500 mg végbélkúp. meszalazin
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Salofalk 250 mg végbélkúp Salofalk 500 mg végbélkúp meszalazin Mielott elkezdené alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót.
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Salofalk 250 mg végbélkúp Salofalk 500 mg végbélkúp meszalazin Mielott elkezdené alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót.
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
Salmonella typhi (Ty2 törzs) Vi poliszacharidja
 1. A GYÓGYSZER NEVE Typherix oldat injekcióhoz előretöltött fecskendőben Hastífusz elleni poliszacharid vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina egy adagjának (0,5 ml) tartalma: Salmonella
1. A GYÓGYSZER NEVE Typherix oldat injekcióhoz előretöltött fecskendőben Hastífusz elleni poliszacharid vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina egy adagjának (0,5 ml) tartalma: Salmonella
Az állapot súlyosságától függően prekóma vagy kóma esetében 24 óra alatt az adag 8 ampulláig emelhető.
 1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! PANADOL*BABY AND INFANT Szuszpenzió (Paracetamol) BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! PANADOL*BABY AND INFANT Szuszpenzió (Paracetamol) BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen e gyógyszer körültekintő alkalmazása.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Aprovel 75 mg, 150 mg, 300 mg tabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Aprovel 75 mg, 150 mg, 300 mg tabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ
Betegtájékoztató DICLOFENAC-RATIOPHARM 50 MG FILMTABLETTA. Diclofenac-ratiopharm 50 mg filmtabletta diklofenák-nátrium
 DICLOFENAC-RATIOPHARM 50 MG FILMTABLETTA Diclofenac-ratiopharm 50 mg filmtabletta diklofenák-nátrium HATÓANYAG: 50,0 mg diklofenák-nátrium filmtablettánként. SEGÉDANYAG: Tablettamag: vízmentes kolloid
DICLOFENAC-RATIOPHARM 50 MG FILMTABLETTA Diclofenac-ratiopharm 50 mg filmtabletta diklofenák-nátrium HATÓANYAG: 50,0 mg diklofenák-nátrium filmtablettánként. SEGÉDANYAG: Tablettamag: vízmentes kolloid
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Ramace
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Ramace
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A BETEG SZÁMÁRA BODY BALANCE ÍZÜLETI VITAMIN
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A BETEG SZÁMÁRA BODY BALANCE ÍZÜLETI VITAMIN MSM (Metil-Szulfonil-Metán), glükozamin szulfát, kondroitin szulfát, magnézium, kurkuma, gyömbér, boswelia, quercetin, bromelain,
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A BETEG SZÁMÁRA BODY BALANCE ÍZÜLETI VITAMIN MSM (Metil-Szulfonil-Metán), glükozamin szulfát, kondroitin szulfát, magnézium, kurkuma, gyömbér, boswelia, quercetin, bromelain,
- Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet.
 FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató (etikus) BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR Nitrofurantoin-CHINOIN
FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató (etikus) BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR Nitrofurantoin-CHINOIN
Kenőcs A kenőcs különösen alkalmas a száraz, lichenifikált és pikkelyesen hámló elváltozásokra.
 1. A GYÓGYSZER NEVE Dermovate krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg klobetazol-propionát 1 g 0,05%-os kenőcsben. Dermovate krém 0,5 mg klobetazol-propionát 1 g 0,05%-os krémben. A segédanyagok
1. A GYÓGYSZER NEVE Dermovate krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg klobetazol-propionát 1 g 0,05%-os kenőcsben. Dermovate krém 0,5 mg klobetazol-propionát 1 g 0,05%-os krémben. A segédanyagok
A NIMESULID TARTALMÚ GYÓGYSZEREK (SZISZTÉMÁS GYÓGYSZERFORMÁK) ALKALMAZÁSI ELŐÍRÁSÁNAK MEGFELELŐ SZAKASZAIBA BEILLESZTENDŐ MÓDOSÍTÁSOK
 III. MELLÉKLET 1 A NIMESULID TARTALMÚ GYÓGYSZEREK (SZISZTÉMÁS GYÓGYSZERFORMÁK) ALKALMAZÁSI ELŐÍRÁSÁNAK MEGFELELŐ SZAKASZAIBA BEILLESZTENDŐ MÓDOSÍTÁSOK A kiegészítések dőlt betűvel szedve és aláhúzva, a
III. MELLÉKLET 1 A NIMESULID TARTALMÚ GYÓGYSZEREK (SZISZTÉMÁS GYÓGYSZERFORMÁK) ALKALMAZÁSI ELŐÍRÁSÁNAK MEGFELELŐ SZAKASZAIBA BEILLESZTENDŐ MÓDOSÍTÁSOK A kiegészítések dőlt betűvel szedve és aláhúzva, a
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen e gyógyszer körültekintő bevétele.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ACC 100 granulátum BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA ACC
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ACC 100 granulátum BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA ACC
Betegtájékoztató: Információk a felhasználó számára. Aspirin 500 mg tabletta acetilszalicilsav
 Betegtájékoztató: Információk a felhasználó számára Aspirin 500 mg tabletta acetilszalicilsav Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára
Betegtájékoztató: Információk a felhasználó számára Aspirin 500 mg tabletta acetilszalicilsav Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára
Ütõs megoldás Szelektivitás finomra hangolva
 Ütõs megoldás Szelektivitás finomra hangolva 1103 Budapest, Gyömrői út 19-21. Szakorvosi Marketing Osztály: +36 1 431 4907, www.richter.hu Gyógyszerbiztonsági Osztály: +36 1 505 7032, Fax: +36 1 431 5954,
Ütõs megoldás Szelektivitás finomra hangolva 1103 Budapest, Gyömrői út 19-21. Szakorvosi Marketing Osztály: +36 1 431 4907, www.richter.hu Gyógyszerbiztonsági Osztály: +36 1 505 7032, Fax: +36 1 431 5954,
III. melléklet. Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral eljárás eredményeként jöttek létre.
 III. melléklet Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak módosításai Megjegyzés: Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral
III. melléklet Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak módosításai Megjegyzés: Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral
Betegtájékoztató: Információk a felhasználó számára. Imigran 50 mg tabletta Imigran 100 mg tabletta szumatriptán
 Betegtájékoztató: Információk a felhasználó számára Imigran 50 mg tabletta Imigran 100 mg tabletta szumatriptán Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót,
Betegtájékoztató: Információk a felhasználó számára Imigran 50 mg tabletta Imigran 100 mg tabletta szumatriptán Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót,
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Aveksin 37,5 mg retard kemény kapszula Aveksin 75 mg retard kemény kapszula Aveksin 150 mg retard kemény kapszula venlafaxin Mielott elkezdené szedni
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Aveksin 37,5 mg retard kemény kapszula Aveksin 75 mg retard kemény kapszula Aveksin 150 mg retard kemény kapszula venlafaxin Mielott elkezdené szedni
Betegtájékoztató: Információk a felhasználó számára. Revicet 10 mg préselt szopogató tabletta cetirizin-dihidroklorid
 Betegtájékoztató: Információk a felhasználó számára Revicet 10 mg préselt szopogató tabletta cetirizin-dihidroklorid Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót,
Betegtájékoztató: Információk a felhasználó számára Revicet 10 mg préselt szopogató tabletta cetirizin-dihidroklorid Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1/33 1. A GYÓGYSZER MEGNEVEZÉSE Resolor 1 mg-os filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 mg prukaloprid filmtablettánként (prukaloprid-szukcinát formájában).
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1/33 1. A GYÓGYSZER MEGNEVEZÉSE Resolor 1 mg-os filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 mg prukaloprid filmtablettánként (prukaloprid-szukcinát formájában).
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK
FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK
Betegtájékoztató: Információk a felhasználó számára. Algoflex forte filmtabletta ibuprofén
 Betegtájékoztató: Információk a felhasználó számára Algoflex forte filmtabletta ibuprofén Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára
Betegtájékoztató: Információk a felhasználó számára Algoflex forte filmtabletta ibuprofén Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Mixtard 30 40 nemzetközi egység/ml szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 injekciós üveg 10 ml-t tartalmaz, ami 400 NE-gel egyenértékű.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Mixtard 30 40 nemzetközi egység/ml szuszpenziós injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 injekciós üveg 10 ml-t tartalmaz, ami 400 NE-gel egyenértékű.
Generated by Unregistered Batch DOC TO PDF Converter 2011.3.827.1514, please register! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
 Generated by Unregistered Batch DOC TO PDF Converter 2011.3.827.1514, please register! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Bromocriptin-Richter 2,5 mg tabletta bromokriptin Mielott elkezdené
Generated by Unregistered Batch DOC TO PDF Converter 2011.3.827.1514, please register! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Bromocriptin-Richter 2,5 mg tabletta bromokriptin Mielott elkezdené
Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Voltaren
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Voltaren
1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE. Remacycline L.A. 200 mg/ml oldatos injekció A.U.V. Oxitetraciklin 2. HATÓ- ÉS SEGÉDANYAGOK MEGNEVEZÉSE
 A KÜLSŐ CSOMAGOLÁSON ÉS A KÖZVETLEN CSOMAGOLÁSON FELTÜNTETENDŐ ADATOK Papírdoboz 50 ml-es, 100 ml-es, 250 ml-es és 500 ml-es injekciós üvegnek és címke 100 ml, 250 ml, 500 ml üvegre 1. AZ ÁLLATGYÓGYÁSZATI
A KÜLSŐ CSOMAGOLÁSON ÉS A KÖZVETLEN CSOMAGOLÁSON FELTÜNTETENDŐ ADATOK Papírdoboz 50 ml-es, 100 ml-es, 250 ml-es és 500 ml-es injekciós üvegnek és címke 100 ml, 250 ml, 500 ml üvegre 1. AZ ÁLLATGYÓGYÁSZATI
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA. DHC Continus 60 mg retard tabletta dihidrokodein-hidrogén-tartarát
 Generated by Unregistered Batch DOC TO PDF Converter 2011.3.827.1514, please register! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA DHC Continus 60 mg retard tabletta dihidrokodein-hidrogén-tartarát
Generated by Unregistered Batch DOC TO PDF Converter 2011.3.827.1514, please register! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA DHC Continus 60 mg retard tabletta dihidrokodein-hidrogén-tartarát
1. A GYÓGYSZER NEVE 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL. 100 mikrogramm flutikazon-propionát (mikronizált) adagonként.
 1. A GYÓGYSZER NEVE Flixotide Diskus 100 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 250 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 500 mikrogramm/adag adagolt inhalációs por 2.
1. A GYÓGYSZER NEVE Flixotide Diskus 100 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 250 mikrogramm/adag adagolt inhalációs por Flixotide Diskus 500 mikrogramm/adag adagolt inhalációs por 2.
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! 4 sz BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! 4 sz BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el
Betegtájékoztató: Információk a beteg számára. Mexalen 125 mg végbélkúp csecsemőknek paracetamol
 Betegtájékoztató: Információk a beteg számára Mexalen 125 mg végbélkúp csecsemőknek paracetamol Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mely az
Betegtájékoztató: Információk a beteg számára Mexalen 125 mg végbélkúp csecsemőknek paracetamol Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mely az
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA. Daedalon 50 mg tabletta. dimenhidrinát
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Daedalon 50 mg tabletta dimenhidrinát Olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára fontos információkat tartalmaz. Ez a gyógyszer
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Daedalon 50 mg tabletta dimenhidrinát Olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára fontos információkat tartalmaz. Ez a gyógyszer
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmese BETEGTÁJÉKOZTTÓ:
FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmese BETEGTÁJÉKOZTTÓ:
III. melléklet. Javasolt szöveg az alkalmazási előírásba és a betegtájékoztatóba
 III. melléklet Javasolt szöveg az alkalmazási előírásba és a betegtájékoztatóba 11 ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ 12 ALKALMAZÁSI ELŐÍRÁS 13 1. A GYÓGYSZER MEGNEVEZÉSE Tranexámsav tartalmú gyógyszerek
III. melléklet Javasolt szöveg az alkalmazási előírásba és a betegtájékoztatóba 11 ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ 12 ALKALMAZÁSI ELŐÍRÁS 13 1. A GYÓGYSZER MEGNEVEZÉSE Tranexámsav tartalmú gyógyszerek
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ALKALMAZÁSI ELŐIRAT BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Glucobay
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ALKALMAZÁSI ELŐIRAT BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Glucobay
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA. Irtucalan 75 mg filmtabletta Irtucalan 150 mg filmtabletta Irtucalan 300 mg filmtabletta
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA 75 mg filmtabletta 150 mg filmtabletta 300 mg filmtabletta Irbezartán Mielott elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót.
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA 75 mg filmtabletta 150 mg filmtabletta 300 mg filmtabletta Irbezartán Mielott elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót.
- Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
Betegtájékoztató XALAZIN 500 MG VÉGBÉLKÚP. Xalazin 250 mg végbélkúp Xalazin 500 mg végbélkúp meszalazin
 XALAZIN 500 MG VÉGBÉLKÚP Xalazin 250 mg végbélkúp Xalazin 500 mg végbélkúp meszalazin HATÓANYAG: 250 mg, illetve 500 mg meszalazin végbélkúponként. SEGÉDANYAG: Dokuzát-nátrium, cetil-alkohol, szilárd zsír.
XALAZIN 500 MG VÉGBÉLKÚP Xalazin 250 mg végbélkúp Xalazin 500 mg végbélkúp meszalazin HATÓANYAG: 250 mg, illetve 500 mg meszalazin végbélkúponként. SEGÉDANYAG: Dokuzát-nátrium, cetil-alkohol, szilárd zsír.
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! 1 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Drill rózsaméz 3 mg/0,2
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! 1 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Drill rózsaméz 3 mg/0,2
- Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ALKALMAZÁSI ELŐÍRÁS, BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ALKALMAZÁSI ELŐÍRÁS, BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
Olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára fontos információkat tartalmaz.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Ambrobene 30 mg tabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Ambrobene 30 mg tabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14
 I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14 1. AZ ÁLLATGYÓGYÁSZATI GYÓGYSZERKÉSZÍTMÉNY NEVE INCURIN 1 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: ösztriol 1 mg/tabletta
I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14 1. AZ ÁLLATGYÓGYÁSZATI GYÓGYSZERKÉSZÍTMÉNY NEVE INCURIN 1 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: ösztriol 1 mg/tabletta
A tabletta csaknem fehér színű, ovális és UCY 500 kódjelzéssel van ellátva.
 1. A GYÓGYSZER MEGNEVEZÉSE AMMONAPS 500 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg nátrium-fenil-butirát tablettánként. Minden AMMONAPS tabletta 62 mg nátriumot tartalmaz. A segédanyagok teljes
1. A GYÓGYSZER MEGNEVEZÉSE AMMONAPS 500 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg nátrium-fenil-butirát tablettánként. Minden AMMONAPS tabletta 62 mg nátriumot tartalmaz. A segédanyagok teljes
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
MEDA FÁJDALOMCSILLAPÍTÓK
 MEDA FÁJDALOMCSILLAPÍTÓK Activon Extra gél (etofenamát 10%) Extra magas hatóanyagkoncentráció (10%) Extra magas felszívódás a bőrön át (21%) 1 Rheumon gél (etofenamát 5%) Extra magas felszívódás a bőrön
MEDA FÁJDALOMCSILLAPÍTÓK Activon Extra gél (etofenamát 10%) Extra magas hatóanyagkoncentráció (10%) Extra magas felszívódás a bőrön át (21%) 1 Rheumon gél (etofenamát 5%) Extra magas felszívódás a bőrön
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! OGYI fejléces papír BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Sanval
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! OGYI fejléces papír BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Sanval
III. melléklet. Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteit érintő módosítások
 III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteit érintő módosítások Megjegyzés: Az alkalmazási előírás és a betegtájékoztató módosításait értelemszerűen a referencia-tagállammal
III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteit érintő módosítások Megjegyzés: Az alkalmazási előírás és a betegtájékoztató módosításait értelemszerűen a referencia-tagállammal
C. melléklet. (nemzeti szinten engedélyezett gyógyszerkészítményekre vonatkozó módosítás)
 C. melléklet (nemzeti szinten engedélyezett gyógyszerkészítményekre vonatkozó módosítás) I. MELLÉKLET TUDOMÁNYOS KÖVETKEZTETÉSEK ÉS A FORGALOMBA HOZATALI ENGEDÉLY(EK) FELTÉTELEIT ÉRINTŐ VÁLTOZTATÁSOK INDOKLÁSA
C. melléklet (nemzeti szinten engedélyezett gyógyszerkészítményekre vonatkozó módosítás) I. MELLÉKLET TUDOMÁNYOS KÖVETKEZTETÉSEK ÉS A FORGALOMBA HOZATALI ENGEDÉLY(EK) FELTÉTELEIT ÉRINTŐ VÁLTOZTATÁSOK INDOKLÁSA
942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát mg nátrium-klorid) filmtablettánként.
 1. A GYÓGYSZER MEGNEVEZÉSE Dona 750 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát + 192 mg nátrium-klorid) filmtablettánként. A segédanyagok
1. A GYÓGYSZER MEGNEVEZÉSE Dona 750 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát + 192 mg nátrium-klorid) filmtablettánként. A segédanyagok
