Radioizotópos sebészeti lehetőségek a korai emlőrák kezelésében. Doktori (PhD) értekezés
|
|
|
- Amanda Boros
- 9 évvel ezelőtt
- Látták:
Átírás
1 Radioizotópos sebészeti lehetőségek a korai emlőrák kezelésében Doktori (PhD) értekezés Péley Gábor dr. Országos Onkológiai Intézet, Általános-és Mellkassebészeti Osztály 2005 Témavezető: Prof. Dr. Kopper László Semmelweis Egyetem, I. sz. Patológiai és Kisérleti Rákkutattó Intézet Semmelweis Egyetem Doktori Iskola Patológiai tudományok (Multidiszciplináris orvostudományok) Onkológia Programvezető: Prof. Dr. Kopper László Semmelweis Egyetem, I. sz. Patológiai és Kisérleti Rákkutattó Intézet A szigorlati bizottság tagjai: Elnök: Dr. Járay Jenő, egyetemi tanár, az orvotudományok doktora Tagok: Dr. Kulka Janina, egyetemi docens, PhD Dr. Cserni Gábor, osztályvezető főorvos, az orvostudományok doktora Opponensek: Dr. Kulka Janina, egyetemi docens, PhD Dr. Cserni Gábor, osztályvezető főorvos, az orvostudományok doktora 1
2 TARTALOMJEGYZÉK BEVEZETÉS 3 CÉLKITŰZÉSEK 17 BETEGEK ÉS MÓDSZER 20 EREDMÉNYEK 35 MEGBESZÉLÉS 52 KÖVETKEZTETÉSEK 68 KÖSZÖNETNYILVÁNÍTÁS 71 IRODALOMJEGYZÉK 72 SAJÁT KÖZLEMÉNYEK JEGYZÉKE 90 ÖSSZEFOGLALÓ 94 SUMMARY 95 FÜGGELÉK 96 Táblázatok 96 Ábrák 125 2
3 BEVEZETÉS A radioizotópos sebészet fejlődésének történeti áttekintése A radioizotópok műtét közbeni alkalmazásának története több mint 50 éves múltra tekint vissza. Selverstone B (1) 1949-ben számolt be agydaganatok műtéteinél radioizotóp ( 32 P) alkalmazásáról. Harris CC (2) 1956-ban, majd Morris AC (3) ben pajzsmirigyműtéteknél alkalmazott radioizotópokat ( 131 I és 125 I). Harvey WC (4) 1981-ben csontdaganatok műtéteinél használt izotópot ( 99m Tc). Ezeknél a műtéteknél különböző, általában házilag előállított radioaktivitásmérő eszközöket, kezdetben kisméretű Geiger-Müller számlálókat, majd később szcintillációs detektorokat (CsI) használtak az izotópot felvevő szövetek lokalizálására. A modern radioizotópos sebészi technika jelentős fejlődését először alapvetően négy dolognak köszönhette. Az első a kézi gamma detektorok, az úgynevezett gammaszondák kereskedelmi forgalomba kerülése, a második a monoklonális antitestekkel való jelölés módszerének kidolgozása volt. Ezekről az eredményekről először Aitken DR (5) számolt be az irodalomban 1984-ben. A harmadik, az előzőeknél is jelentősebb lépés az izotópos jelöléses őrszemnyirokcsomó-biopszia technikájának kidolgozása volt, amelyről Alex J (6) számolt be először 1993-ban. A negyedik lépést az elváltozások képalkotók által vezérelt, illetve endoszkópos direkt radioizotópos jelölése jelentette, amelyről Luini A (7) számolt be először 1998-ban, majd Rezzo S (8) 2002-ben. A fentiek alapján a radioizotópok által vezérelt sebészeti eljárásokat jelenleg az alábbi módon csoportosíthatjuk: I. Indirekt lokalizáció, amelynek lényege, hogy a radioizotópot nem közvetlenül az eltávolítani kívánt szövetbe adjuk, hanem 1) szisztémásan (intravénásan) a) antigén-antitest kötődésen alapuló módszer, radioimmun vezérelt sebészet (Radioimmunoguided Surgery RIGS) b) egyéb, nem antigén-antitest kötődésen alapuló módszerek (pl.: receptor-ligand kötődés) 2) a daganatba vagy a daganatos szervbe a nyirokelvezetés és az őrszemnyirokcsomó meghatározása céljából. 3
4 II. Direkt elváltozás lokalizáció, amelynek lényege, hogy a nem tapintható elváltozásba adjuk a radioizotópot képalkotók vezérlésével (Radioguided Occult Lesion Localization ROLL) vagy endoszkóposan (Radioguided Occult Colonic Lesion Identification ROCLI). Ezek a módszerek egyben alkalmasak lehetnek az őrszemnyirokcsomó-biopszia egyidejű elvégzésére is. Az indirekt lokalizációs technikáknál a leggyakrabban alkalmazott radioizotópok a következők: 125 I, 131 I, 111 In, 99m Tc. Őrszemnyirokcsomó-biopszia és direkt elváltozás jelölés esetén az alkalmazott izotóp kizárólag a 99m Tc. Az antigén-antitest kötődésen alapuló módszert a daganat kiterjedésének műtét közbeni meghatározására ( staging ) alkalmazzák. Segítségével nem tapintható daganatos szövetek (microdisseminatio) azonosíthatók, és a resectio kiterjesztése pontosítható. Speciális alkalmazási területe lehet intraoperativ radioterápia esetén a besugarazni kívánt céltérfogat pontos meghatározása (9). Egy további alkalmazási lehetőséget az jelenheti, hogy a RIGS során eltávolított, antitest által megjelölt nyirokcsomókból limfocitákat izolálnak, amelyeket megfelelő módszerekkel szelektálnak, és tenyésztenek, majd visszaadják a betegnek (adoptiv immunkezelés) (10). A RIGS-et legkiterjedtebben primer és recidiv colo-rectalis daganatok esetén használják (11-19), de beszámoltak alkalmazásáról gyomorrákban (20, 21), hasnyálmirigyrákban (22), emlőrákban (23-25), medullaris pajzsmirigyrákban (26), a bőr laphámrákjában (27), tüdőrákban (28), petefészekrákban (29, 30), prostata carcinomában (31) és peritonealis carcinomatosisban (32). Az irodalomban közölt kedvező tapasztalatok ellenére a RIGS nem terjedt el széles körben, néhány onkológiai centrumot kivéve rutinszerűen nem alkalmazzák. Ennek több oka is lehet: 1. A módszer alkalmazása technikai és szervezési szempontokból is meglehetősen körülményes. 2. Egyetlen daganattípus esetén sem ismert olyan antigén, amely minden daganatban, illetve daganatos sejtben jelen lenne (a daganatok genetikailag heterogén sejtpopulációk), ezért a technika nem minden esetben működik. 3. A kis áttétes gócok sok esetben nem azonosíthatók. 4. A jelölésre használt monoklonális antitestek és az izotópok (kivéve a 99m Tc-t) meglehetősen drágák. A nem antigén-antitest kötésen alapuló radioizotópos technika egyik alkalmazási területe a neuroendocrin daganatok műtét közbeni lokalizálása. A módszer lényege, hogy a neuroendocrin tumorok jelentős része fokozottan expresszálja a somatostatin 4
5 receptort, ezért radioizotóppal ( 111 In) jelzett somatostatin analóggal (octreotid) kimutathatók, és műtét közben lokalizálhatók. A módszer alkalmazását az irodalomban sikerrel ismertették (33, 34). A sarcomák egy jelentős része is (kivéve a chondrosarcomát) expresszálja a somatostatin receptort, így ezeknél a daganatoknál is alkalmazható a fenti technika (35). A mellékpajzsmirigy adenomák intraoperativ lokalizálásáról a 99m Tc-sestamibi jelölést követően szintén kedvező tapasztalatokról számoltak be (36, 37). A nem antigén-antitest kötődésen alapuló radioizotópos sebészi eljárást alkalmazzák még pajzsmirigydaganatok műtéténél ( 131 I) a mirigy eltávolítása teljességének ellenőrzésére, valamint a nyirokcsomó áttétek lokalizálására (38). További alkalmazási lehetőségek még a nem tapintható csontelváltozások jelölése ( 99m Tcfoszfonát) (39-41), illetve melléklép lokalizálása ( 99m Tc-vel jelölt hőkezelt vörösvértest) visszatérő idiopathiás thrombocytopeniás purpurában (42). Az őrszemnyirokcsomó és a direkt tumor lokalizáció kérdésével még később részletesen foglalkozom, azonban előtte néhány szót szükséges ejteni a jelenleg használt gamma-szondákról. A radioizotópos sebészet egyik legfontosabb technikai alapfeltétele a műtét közben alalmazható kézi gamma detektor, az úgynevezett gamma-szonda (1. ábra). A jelenleg kereskedelmi forgalomban lévő gamma-szondáknak alapvetően két típusa van. Az egyik a szcintillációs detektor, amelynek anyaga a NaI vagy a CsI. A másik típus a félvezető detektor, amelynek anyaga CdZnTe vagy gyakrabban a CdTe. A gyakorlatban leggyakrabban használt radioizotópok ( 99m Tc és 125 I) esetén a félvezető detektorok igen jól alkalmazhatók. Műtéteink során mi kizárólag félvezető szondákat alkalmazunk. Előnyük, hogy a szonda fejének átmérője kisebb, így pontosabb lokalizálást tesz lehetővé. A szondák lehetnek szögletesek vagy egyenesek. A szögletes szondák előnyösek a felszíni nyirokrégiókban (axilla, inguinalis régió) történő műtéteknél, de használhatók a nyaki nyirokcsomó régiókban is. Az egyenes szondákat leginkább a fejnyaki és a testüregi (mellkas, has, kismedence) régiókban alkalmazzuk. Az újabb típusú eszközök már rendelkeznek laparo-, illetve torakoszkópos szondákkal is, amelyeknek szintén két típusa van attól függően, hogy a detektor a szonda végén vagy az oldalán helyezkedik el (előretekintő vagy oldalra tekintő szondák). 5
6 A regionális nyirokcsomók sebészetének jelentősége Ebben a részben a regionális nyirokcsomók sebészetének kérdéseit általánosságban tekintem át, illetve az emlőrákot kivéve néhány szerv daganatának kezelésében betöltött klinikai szerepét tárgyalom röviden. A solid rosszindulatú daganatok többségében az elvezető nyirokcsomórégió műtéti eltávolítása, az úgynevezett regionális nyirokcsomó blokkdisszekció vagy lymphadenectomia a sebészi kezelés fontos része volt, és maradt még napjainkban is. Moynihan BGA (43) 1908-ban a rosszindulatú daganatok sebészeti kezelésénél elengedhetetlennek tartotta az elvezető régió nyirokcsomóinak eltávolítását is a gyógyulás érdekében. Ebben az időszakban azonban az adjuváns onkológiai kezelési lehetőségek (sugárkezelés, kemoterápia, endokrin kezelés, stb.) lényegében még nem léteztek. Napjainkban a beavatkozást egyrészt a lokoregionális kontroll biztosítása céljából végezzük, másrészt viszont az elvezető nyirokcsomók daganatos státuszának ismerete lényegében minden solid tumor esetén az egyik legfontosabb független prognosztikai tényező, és egyben az adjuváns szisztémás kezelés szükségességének egyik meghatározója is, bár ezt a szerepét az utóbbi években fokozatosan kezdi elveszteni (44, 45). A regionális lymphadenectomiának a regiótól és a disszekció mértékétől függően különböző súlyosságú szövődményei, illetve a beteg életminőségét jelentősen és kedvezőtlenül befolyásoló következményei is lehetnek. Ez különösen kedvezőtlen azoknál a betegeknél, akiknek az eltávolított nyirokcsomói a szövettani vizsgálat során áttétmentesnek bizonyulnak, így ők a beavatkozásnak csak a szövődményeit és kedvezőtlen hatásait kénytelenek elviselni anélkül, hogy életkilátásaik javulnának. Az elektív (klinikailag negatív nyirokcsomók esetén végzett műtét) és ezen belül is különösképpen a kiterjesztett regionális nyirokcsomó blokkdisszekciónak szerepe a betegek túlélésére több prospektív randomizált tanulmány szerint sincs. Ezt igazolták melanoma malignum (46-52), nyelőcsőrák (53), tüdőrák (54), gyomorrák (55, 56), hasnyálmirigyrák (57), vastag-végbélrák (58) és anus carcinoma (59, 60) esetén is. Az eltávolított nyirokcsomók rutin szövettani feldolgozása során a patológiai nyirokcsomó negatív kategóriába sorolt betegek nem elhanyagolható részében a betegség a későbbiekben disszeminálódik. Ennek a jelenségnek az egyik lehetséges oka 6
7 a szövettani regionális staging elégtelensége. A másik ok lehet, hogy az áttét kihagyja a nyirokcsomót és közvetlenül hematogén disszeminációként jelentkezik. A regionális lymphadenectomia során eltávolított nyirokcsomók részletes patológiai feldolgozása munka- és költségigényessége miatt a klinikai gyakorlatban nem megoldható feladat. Az előbbiek alapján felmerült az igény újabb a betegeket kevésbé megterhelő és ugyanakkor érzékenyebb sebészi-patológiai regionális staging módszer kidolgozására. Ennek egyik célja az, hogy a szövettanilag nyirokcsomó negatív betegeket megkíméljük a nyirokrégió kezelésének (blokkdisszekció vagy sugárkezelés) szövődményeitől és kellemetlenségeitől, ugyanakkor a nyirokcsomó pozitív betegek viszont megkapják a régió szükséges kezelését. A második cél pedig a pontosabb regionális kategóriába sorolás, és ebből következően a prognózis és a szisztémás adjuváns kezelés pontosabb meghatározása. Az őrszemnyirokcsomó elmélete. Történeti áttekintés. A módszer klinikai és daganatkutatási jelentősége A nyirokcsomó áttétek keletkezésének és a daganatok nyirokelvezetésének vizsgálata már a múlt század első évtizedeiben megkezdődött. A század első felében egyértelműen tisztázták, hogy a nyirokcsomó metastasisok a daganatból leszakadó tumorsejt embolusokból alakulnak ki, amelyek a nyirokutakon keresztül érik el a nyirokcsomókat (61, 62). Az 1950-es és 60-as években a vitális festékes és a radioizotópos (limfoszcintigráfia) technikák alkalmazása jelentős fejlődést hozott a daganatok regionális nyirokelvezetésének vizsgálatában. Leginkább az emlőt vizsgálták (63-66), de a gyomor (67), a tüdő (68) és a bőr nyirokkeringését is többen tanulmányozták. Ezek a technikák és az eredmények később a funkcionális anatómiai őrszemnyirokcsomó elmélet megalkotása szempontjából váltak alapvető jelentőségűvé. Az őrszemmirigy (glands sentinel) kifejezést Braithwaite LR (69) használta először 1923-ban, aki az ileocoecalis terület nyirokelvezetését vizsgálta gyulladásos folyamatokban. Gould EA (70) 1960-ban közölte 28 parotisdaganatos beteg műtétével kapcsolatos eredményeit, és megállapította, hogy az elülső és a hátsó facialis vena közötti szögletben található, úgynevezett angularis nyirokcsomó szövettani lelete jelzi a regionális nyirokcsomók daganatos státuszát. Ezt a nyirokcsomót őrszemcsomónak 7
8 (sentinel node) nevezte el, és javasolta ennek eltávolítását és intraoperativ szövettani vizsgálatát a radikális nyaki blokkdisszekció szükségességének eldöntésére. Ez az elmélet azonban nem funkcionális, hanem anatómiai alapokon nyugszik, ezért nem tekinthető a modern őrszemnyirokcsomó elmélet első leírásának. A mai értelemben vett funkcionális őrszemnyirokcsomó elmélet kidolgozása, illetve az őrszemnyirokcsomó (sentinel lymph node) elnevezés Cabanas RM (71) nevéhez fűződik, aki 1977-ben közölte peniscarcinomás betegein végzett röntgen limfangiográfiás vizsgálatainak eredményeit, és megállapította, hogy létezik egy meghatározható nyirokcsomó, az őrszemnyirokcsomó, amely a regionális áttétképződés első helye. Javasolta ennek a nyirokcsomónak az eltávolítását (sentinel lymph node biopsy) és szövettani vizsgálatát az ilio-inguinalis blokkdisszekció szükségességének meghatározása céljából. Morton DL munkacsoportjából Wong JH (72) 1991-ben a bőr nyirokkeringésének állatkísérletes vizsgálata alapján igazolta az őrszemnyirokcsomó elmélet helyességét. Morton DL (73) 1992-ben melanomás betegeken végzett limfoszcintigráfia és kék festékkel végzett intraoperativ nyirokrendszer feltérképezés és biopszia eredményeit ismertette. Kísérletes és klinikai eredményeik alapján pontosan definiálták az őrszemnyirokcsomó fogalmát. Ez a két tanulmány jelentős lökést adott a módszer további fejlődésének. Azóta többszáz őrszemnyirokcsomóval kapcsolatos közlemény jelent meg az irodalomban, megalakult a nemzetközi őrszemnyirokcsomó társaság, és napjainkig már négy őrszemnyirokcsomó világkongresszust is rendeztek. Az őrszemnyirokcsomó elmélet lényege, hogy a daganatok nyirokelvezetése nem véletlenszerű, hanem szekvenciális és előre meghatározható. A daganat nyirokelvezetésének első állomását nevezzük őrszemnyirokcsomónak (2. ábra). Az őrszemnyirokcsomó részletes szövettani feldolgozásának eredménye érzékenyen mutatja a regionális nyirokcsomó státuszt. Ennek a nyirokcsomónak az áttétmentessége nagy pontossággal jelzi a régio többi nyirokcsomójának daganatmentességét. Az elmélet egyik legfontosabb pontja, hogy az őrszemnyirokcsomó különböző funkcionális vizsgálatokkal meghatározható. A meghatározás elvi alapja, hogy a vizsgálandó daganatos szervbe (területbe) olyan anyagot fecskendezünk, amely döntően a nyirokrendszeren keresztül vezetődik el, és műtét közben a nyirokutakban és/vagy a nyirokcsomókban kimutatható. Napjainkra két alapvető technika, illetve ezek kombinációja terjedt el. Az egyik lehetőség a Morton DL által ismertetett vitális 8
9 festékes eljárás. Ebben az esetben a daganatos szervbe olyan festéket fecskendezünk, amely a nyirokutakat és a nyirokcsomókat festi meg (3. ábra). Festékként leggyakrabban az úgynevezett kék festékeket (patent-kék, izoszulfán-kék) használják, de történtek próbálkozások más anyagokkal is, például fluoreszceinnel. A kimutatás másik lehetősége az Alex J (6) által 1993-ban ismertetett radioizotóppal jelzett kolloid és intraoperativ gamma-szonda által vezérelt módszer (4. ábra). Az eljárás lényege, hogy a daganatos szervbe gammasugárzó izotóppal jelölt kolloidot fecskendezünk, amely a nyirokutakon keresztül vándorolva eljut az első, az őrszemnyirokcsomó(k)ig, ott fagocitálódik, és hosszabb ideig tárolódik. Jelölő anyagként a 99m Tc lágy gammasugárzó (140 kev), hat órás felezési idejű izotópot használjuk, amelyet kolloidhoz kötünk. A használt kolloidokról később, az emlőrák kapcsán fogok majd írni. Krag DN (74) 1995-ben közölte az úgynevezett kettős jelöléses eljárást, amely egyesíti az előbb említett két technikát, és az eddigi vizsgálatok alapján úgy tűnik, hogy a legtöbb daganat esetén ez a leginkább célravezető módszer. A kék festék használata megkönnyíti a preparálást azzal, hogy a módszert a hagyományos sebészi gondolkodásmódhoz közelíti, az izotóp alkalmazása pedig pontosabbá és ellenőrizhetőbbé teszi a beavatkozást, illetve lehetővé teszi a biopsziát akkor is, amikor a kék festék áramlását nem észleljük. Az izotóp használata célzott, kisebb feltárást tesz lehetővé, így a szövetek műtéti károsodása is jelentősen csökken. Az őrszemnyirokcsomó-biopszia technikája jelenleg még nem teljesen egyezményes, néhány technikai részlete még nem egyértelműen tisztázott. Az őrszemnyirokcsomó elmélet ugyan a peniscarcinoma kapcsán került kidolgozásra, azonban az eljárás ugrásszerű elterjedése a klinikai gyakorlatban a melanoma malignumban való alkalmazással indult meg. Ezt rövidesen követte az emlőrákos betegeken történő alkalmazás, azonban ezt a kérdéskört majd csak a későbbiekben fogom részletesen ismertetni. Ebben a két daganattípusban az őrszemnyirokcsomó-biopszia napjainkra lényegében rutin eljárássá vált (75-84). Azóta a módszer alkalmazhatóságát, pontosságát és klinikai jelentőségét kiterjedten vizsgálták tápcsatornai daganatokban (85-102), de beszámoltak már használatáról Merkel-sejtes bőrdaganatokban (103), tűdőrákban ( ), fej-nyaki- ( ), urológiai- ( ) és nőgyógyászati ( ) tumorokban is. 9
10 Az őrszemnyirokcsomó-biopszia tehát egy minimálisan invasiv sebészi regionális staging beavatkozás. Az eljárás klinikai jelentőségét az egyes daganat lokalizációkban részletesen nem tárgyalom. Általánosságban az őrszemnyirokcsomóbiopszia klinikai jelentősége az alábbiakban foglalható össze: 1. Pontos és költséghatékony stádiumbesorolási lehetőséget nyújt azáltal, hogy a patológus számára biztosítja az áttétképződés szempontjából első nyirokcsomót részletes szövettani vizsgálat céljára. A pontosabb staging a prognózis és a szisztémás adjuváns onkológiai kezelés szempontjából döntő jelentőségű. 2. Kimutatja a nyirokelvezetés egyéni variációit, ezáltal módosíthatja a műtéti és a lokoregionális kezelési tervet. 3. Lehetővé teszi a régió szelektív kezelését (őrszemnyirokcsomó pozitív esetben kezelés, negatívban szoros megfigyelés), így a nyirokcsomó negatív betegek elkerülhetik a kezelés kellemetlenségeit és szövődményeit. Testüregi nyirokelvezetés esetén természetesen, egyes speciális eseteket kivéve (korai gyomorrák és Barrett carcinoma esetén végzett laparoszkópos őrszemnyirokcsomó-biopszia), ez a lehetőség jelenleg még nem jön szóba, ugyanis egy második ülésben végzett komplettáló lymphadenectomia műtéti kockázata aránytalanul magas. Ezen a helyzeten a jövőben a laparo-és torakoszkópos technikák, illetve a részletes intraoperativ szövettani eljárások fejlődése változtathat. Az indikációval kapcsolatosan általánosságban elmondható, hogy az eljárás azokban a korai esetekben javasolható, amikor a regionális és a távoli áttétek kockázata még kicsi. A patológiai feldolgozás kérdésével az emlőrák kapcsán később fogok foglalkozni, bevezetőül csak annyit érdemes megjegyezni, hogy az őrszemnyirokcsomókat mindenképpen a rutin szövettani feldolgozásnál részletesebb vizsgálatnak kell alávetni. A módszer alkalmazhatóságának és megbízhatóságának két legfontosabb jellemzője a sikerességi és a téves negatív arány. Sikerességi arányon a sikeres beavatkozások arányát értjük az összes biopszia kísérlethez viszonyítva. Téves negatív arányon a biopsziával tévesen negatívnak minősített esetek arányát értjük az összes nyirokcsomó pozitív betegre vonatkoztatva. Ez az utóbbi arány természetesen csak akkor adható meg pontosan, ha elvégezzük a komplettáló regionális blokkdisszekciót minden esetben a megbízhatósági tanulmány keretén belül (például emlőrák), illetve a 10
11 későbbiekben sem tervezzük annak elhagyását (például tápcsatornai daganatok). Azokban az esetekben, amikor komplettáló lymphadenectomiát szövettanilag negatív őrszemnyirokcsomó esetén még a tanulási fázisban sem végzünk (például melanoma malignum, pajzsmirigyrák, anus daganatok), csak a klinikai követés adataiból (regionális recidiva) következtethetünk erre az arányra. A téves negatív biopsziáknak több oka lehet: jelölés- vagy sebésztechnikai hiba, a patológiai feldolgozás hibája, illetve valódi átugró (skip) metastasis. Saját tapasztalataink szerint a leggyakoribb ok a daganatos nyirokelzáródás jelensége (62). Ez azt jelenti, hogy a daganatos nyirokcsomó elzáródik, amelynek következtében a nyirokkeringés iránya megváltozik, és a biopszia során tévesen egy másik, még nem áttétes nyirokcsomót azonosítunk őrszemnyirokcsomóként. Ennek a lehetőségét a megfelelően kritikus indikáció alkalmazásával a minimálisra csökkenthetjük. A téves negatív biopsziákkal az érzékenyebb staging lehetősége állítható szembe a módszer értékére vonatkozóan. A részletes patológiai vizsgálattal felismert úgynevezett micrometastasisok klinikai jelentősége ma még nem teljesen tisztázott, bár több tanulmány szerint ezek az áttétek kedvezőtlen prognosztikai tényezőnek tekinthetők, és módosíthatják az eddigi onkológiai kezelési gyakorlatot. Ezt a kérdést az emlőrák vonatkozásában még részletesebben fogom tárgyalni. A fenti klinikai jelentőségen kívül az őrszemnyirokcsomó-biopszia a daganatkutatásban is egyre fontosabb szerepet kap. Az 1960-as évek óta a daganatok aktív specifikus immunkezelési lehetőségeit kiterjedten vizsgálják, különösen a kemoterápiára nem érzékeny tumorok (például melanoma malignum) esetén. Az őrszemnyirokcsomó nemcsak a regionális áttétképződés, hanem a daganatellenes immunválasz szempontjából is első állomásnak tekinthető. Ebben a nyirokcsomóban kialakuló immunológiai folyamatok tanulmányozásának a jövőben feltehetően nagy hatása lesz az egyre hatékonyabb immunkezelési lehetőségek kidolgozására. Kísérletes körülmények között az őrszemnyirokcsomó-biopszia technikája lehetőséget teremt a daganat vaccinát draináló nyirokcsomók meghatározására, célzott eltávolítására és részletes tanulmányozására is ( ). Az axillaris blokkdisszekció jelentősége emlőrákban 11
12 Az emlőrák kezelése az utóbbi évtizedekben jelentősen változott. A változás egyik oka, hogy a betegek egyre koraibb stádiumban jelentkeznek. Ez a mammográfiás szűrés elterjedésével párhuzamosan még szembetűnőbbé vált. A másik ok, hogy a daganat terjedésének korábbi szekvenciális elképzelését (Halsted) (127) a biológiai szemlélet (Fisher) (128, 129) váltotta fel, amely szerint az emlőrák már kialakulásának pillanatában szisztémás betegségnek tekinthető, ezért a lokális kezelés radikalitása nem befolyásolja a túlélést. Ennek a szemléletnek a hatásaként az utóbbi időben egyre több emlőrákos beteg részesül szisztémás onkológiai kezelésben, illetve megfelelő indikációval egyre több beteget kezelünk emlőmegtartó műtéttel és irradiációval. Annak ellenére, hogy a biológiai szemlélet a lokoregionális kezelést másodlagos fontosságúnak tekinti, a daganat lokoregionális kontrollja a betegség kezelésének alapvető része maradt, és az utóbbi időben egyre több adat szól amellett, hogy a helyi-környéki kiújulások nemcsak indikátorai, hanem okai is lehetnek a rossz prognózisnak ( ). Másrészt viszont az a tény, hogy a korai stádiumú emlőrákos betegek jelentős része megfelelő lokoregionális ellátással szisztémás kezelés nélkül is meggyógyulhat, a biológiai szemlélet módosításához vezetett (spektrum teória, Harris) (135). Az elmélet szerint az emlőrák kialakulásának kezdetén még döntően lokális vagy lokoregionális betegség, és csak kisebb részük tekinthető szisztémás folyamatnak. A regionális nyirokcsomók daganatos érintettsége azonban az okkult távoli áttétek vonatkozásában mindenképpen kockázati tényező. Ezt a klinikai tapasztalat és a csontvelőminták vizsgálatainak eredményei is alátámasztják, amelyek igazolták, hogy pozitív axillaris nyirokcsomó státusz mellett a klinikailag okkult áttétek (minimális residualis betegség) gyakorisága jelentősen magasabb, mint negatív nyirokcsomók esetén (136). Az emlőrák regionális kezelésével kapcsolatban szólnunk kell még a parasternalis nyirokelvezetésről, amelynek klinikai jelentősége még napjainkban is vitatott. A korábbi prospektiv randomizált klinikai vizsgálatok nem igazoltak túlélési előnyt a parasternalis lymphadenectomián (kiterjesztett radikális mastectomia) átesett betegeknél. Ráadásul ez a beavatkozás jelentősen növeli a műtét nagyságát és kockázatát, ezért a klinikai gyakorlatban soha nem terjedt el ( ). A hónalji nyirokcsomók daganatos érintettsége jelenlegi ismereteink szerint az emlőrák legfontosabb önálló prognosztikai faktora (130, 132), és az esetek egy részében (különösen a 2 cm-nél kisebb és alacsony szövettani malignitású daganatok esetén) 12
13 döntő jelentősége van az adjuváns szisztémás onkológiai kezelés javallatának felállításában (143). A daganatosan érintett hónalji nyirokcsomókat a lokoregionális kontroll szempontjából kezelni kell ( , 134, 144). Korábbi klinikai vizsgálatok igazolták, hogy ha klinikailag negatív régiót kezelés nélkül hagyunk, akkor a túlélés ugyan nem változik, de 20-25%-ban később regionális recidiva alakul ki (145), és ezek nem elhanyagolható része kontrollálhatatlan. Ha a régiót sebészileg vagy irradiációval kezeljük, akkor a regionális recidivák kockázata 5% alatt van (130, 132). A jelenleg rendelkezésre álló nem invasiv vizsgálómódszerek (130, 132), illetve a primer tumor szövettani jellemzői valamint a klinikai adatok alapján kalkulált prediktiv modellek (146) érzékenysége és fajlagossága nem kielégítő az axillaris státusz meghatározására, ezért nem mondhatunk le a hónalji nyirokcsomók sebészi eltávolításáról és szövettani feldolgozásáról. Az utóbbi években kiterjedten vizsgálták a pozitron emissziós tomográfia (PET) prediktív értékét emlőrák esetében a szövettani regionális státusz vonatkozásában, azonban jelenleg még ennek a módszernek az érzékenysége sem éri el a kielégítő szintet (147, 148). A regionális kontroll szempontjából klinikailag hónalji nyirokcsomó negatív esetekben az axilla irradiációja mint választható kezelés szóba jöhetne, azonban ebben az esetben egyrészt lemondunk a szövettani regionális staging lehetőségéről, amely különösen az alacsony malignitású és kisméretű daganatok esetén a szisztémás kezelés javallata szempontjából döntő jelentőségű, másrészt a betegek 50-80%-át (szövettanilag is negatív axilla) feleslegesen tesszük ki a besugárzás kellemetlenségeinek és szövődményeinek ( ). Ezért az utóbbi évtizedig a hónalji nyirokcsomólánc eltávolítása, az axillaris blokkdisszekció maradt a rutineljárás. Azonban ez a műtét maga is szövődmények és kellemetlen következmények forrása lehet (paraesthesia, mozgásbeszűkülés, fájdalom, elhúzódó seroma képződés, infectio, cellulitis a felső végtagon és az emlőben, lymphoedema, Stewart-Treves syndroma). Irodalmi adatok szerint szinte az összes axillaris blokkdisszekción átesett betegnek vannak enyhébb-súlyosabb panaszai, ami az esetek több mint egyharmadában a mindennapi tevékenységet is jelentősen korlátozza (130, 132). A korai emlőrákos esetek több mint kétharmad részében ugyanakkor a hónalji nyirokcsomók a rutin szövettani feldolgozás során áttétmentesnek bizonyulnak. Daganatmentes hónalji nyirokcsomók eltávolítása viszont sem a betegek túlélését, sem a 13
14 betegség lokoregionális kontrollját nem befolyásolja, csak a postoperativ morbiditást növeli. A fenti okok miatt az 1980-as években jelentős vizsgálatok folytak kevésbé invasiv regionális staging eljárások kidolgozására. Az egyik ilyen lehetőség az úgynevezett nyirokcsomó mintavétel (sampling) volt. Attól függően, hogy hány nyirokcsomót távolítanak el, beszélünk egy-, két-, három-, négy- és öt nyirokcsomós mintavételről. Leginkább a négy nyirokcsomós sampling terjedt el, amely az Egyesült Királyság sok intézményében klinikai rutineljárássá is vált. Széleskörben azonban nem terjedt el, ugyanis nem célzott, hanem random mintavételről van szó, és a kielégítő pontosságú staging érdekében a teljes hónalji régiót szükséges explorálni, valamint mindenképpen több nyirokcsomót kell eltávolítani (legalább 4-et), az érzékenység és a beavatkozás minimális invasivitása így megkérdőjelezhető ( ). Az őrszemnyirokcsomó-biopszia emlőrákban Az 1950-es, 60-as és 70-es években az emlő nyirokelvezetését kiterjedten tanulmányozták (63-66). Kidolgozták a vitális festéses eljárást és a limfoszcintigráfiát. Ezek az eredmények és a minimálisan invasiv regionális staging igénye vezettek végül emlrőrákban is az őrszemnyirokcsomó-biopszia gyakorlatának kidolgozásához és elterjedéséhez. Emlőrák vonatkozásában először a radioizotópos eljárásról számoltak be a nemzetközi irodalomban, Krag DN munkacsoportja (162) 1993-ban. Giuliano AE (163) 1994-ben közölte eredményeit a vitális festéses eljárásról, majd 1996-ban Albertini JJ munkacsoportja (164) számolt be a két módszer együttes alkalmazásáról, az úgynevezett kettős jelöléses őrszemnyirokcsomó-biopsziáról. Az őrszemnyirokcsomó meghatározásának alapja, hogy az emlőbe a nyirokutakon keresztül vándorló anyagot adunk. Ez az anyag lehet valamilyen festék, például kék festék (patent-kék vagy izoszulfán-kék), radioizotóppal ( 99m Tc) jelzett kolloid (leggyakrabban kolloidális humán szérum albumin vagy kénkolloid), illetve mindkettő. Mivel az emlőbe adott jelölő anyagok ugyanazt az utat teszik meg, amelyet a nyirokkeringésbe került daganatsejtek, ezért ezek követésével a gyakorlatban is meghatározható és eltávolítható az áttétképződés szempontjából első regionális nyirokcsomó (őrszem). 14
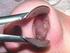
15 Az őrszemnyirokcsomó-biopszia technikája és az indikáció emlőrákban még jelenleg sem egységes ( ). További megválaszolandó kérdések, hogy elhagyhatóe a komplettáló axillaris blokkdisszekció szövettanilag negatív őrszemnyirokcsomó esetén, illetve szükséges-e minden őrszemnyirokcsomó pozitív esetben elvégezni az axillaris blokkdisszekciót (165, 166), vagy az axilla sugárkezelése esetleg kezelés nélkül hagyása is elégséges lehet (165, ). Mivel az értekezés tárgyát is ezek a kérdések képezik, ezért a részletekkel saját eredményeink ismeretének tükrében a Megbeszélés fejezetben fogok foglalkozni. A nem tapintható emlőelváltozások jelölése radiokolloiddal A szervezett mammográfiás emlőrák szűrési programok következtében jelentősen nő az emlődaganatok száma, miközben jelentősen, körülbelül 30-40%-kal csökken a betegség abszolút halálozása (172). Ennek oka, hogy a szűréssel felismert daganatok döntő többsége nem tapintható, nem invasiv (in situ) vagy korai stádiumú invasiv emlőrák (173). A nem tapintható emlőelváltozások kezelése kapcsán alapvető klinikai kérdések merülnek fel. A legfontosabb technikai probléma az elváltozás műtét előtti és közbeni lokalizálása. A nem tapintható emlőelváltozások diagnosztikus vagy terápiás célú eltávolítása előtti jelölésére számos módszert dolgoztak ki, és alkalmaztak már napjainkig (jelölés a bőrfelszínen; festékes jelölés; jelölés egyenes, merev tűvel; jelölés dróthurokkal; és intraoperatív ultrahang) ( ). A bőrfelszínen történő jelölés pontatlan, csak a felületesen (bőrhöz közel) elhelyezkedő elváltozásoknál alkalmazható elfogadható eredménnyel. A festék nagyon gyorsan diffundál a szövetek közé (kivétel a szénszuszpenzió, amely akár egy hónapig is a beadás helyén maradhat), ezért a műtétet a jelölés után azonnal el kell végezni. A műtét technikailag is nagyon körülményes, jelentős szövetkárosítással jár. A merev eszköz a beteg számára nagyon kényelmetlen, ráadásul nagyon könnyen elvándorolhat a szövetekben, így félrevezetheti a sebészt a műtét közben. A fentiek miatt a dróthurkos jelöléses módszer terjedt el legszélesebb körben a rutin klinikai gyakorlatban (179). Ennek a módszernek is vannak azonban hátrányai. A kiálló drótvég a beteg számára kényelmetlen. Tömött, fibroticus emlő esetén a jelölés dróthurokkal komoly nehézségekbe ütközhet, mert a drótot a szövetek 15
16 eltéríthetik bevezetés közben. Zsíros involutioban lévő emlők esetén viszont a drót nagyon könnyen elvándorolhat. További nehézséget jelent, hogy a drót bevezetési helye a bőrön sokszor távol esik az elváltozástól, jelentős műtét közbeni szövetkárosítást okozva ezzel. A dróthurkos jelöléssel kapcsolatos tapasztalatainkról már munkacsoportunk is beszámolt a hazai irodalomban (180). Az őrszemnyirokcsomó-biopszia során az intraoperativ gamma-szondával szerzett tapasztalataik alapján Luini A munkacsoportja 1998-ban (7) közölte eredményeit egy új jelölési és műtéti technikáról (radioizotópos nem tapintható elváltozás lokalizálás - Radioguided Occult Lesion Localization - ROLL), amely lehetővé teszi a nem tapintható emlő elváltozások egyszerű, gyors és pontos eltávolítását. Radioizotópos jelöléses emlő excisiot azoknál a nőbetegeknél végzünk, akiknél mammográfiás és/vagy ultrahang vizsgálattal, nem tapintható, malignitásra gyanús emlőelváltozást észlelünk. A legtöbb esetben a műtét előtt citológiai és/vagy core biopsziás vizsgálat történik, amelyek szintén malignitás lehetőségét vetik fel, vagy igazolják. Egyidejű őrszemnyirokcsomó-biopsziát azoknál a betegeknél végzünk, akiknél a preoperativ vizsgálatok egyértelműen rosszindulatú elváltozást igazolnak (C4, C5, vagy a core biopszia carcinomát igazol), és hónalji nyirokcsomó áttét gyanúja klinikailag nem merül fel. 16
17 CÉLKITŰZÉSEK Munkám célja a radioizotópos sebészi lehetőségek vizsgálata volt különböző típusú daganatokban (emlőrák, melanoma malignum, tápcsatornai daganatok). Az értekezésben csak az emlőrákkal kapcsolatos kérdésekkel foglalkoztam. A vizsgálatsorozat 3 szakaszra osztható: 1. szakasz: Technikai alkalmazhatósági és megbízhatósági tanulmánysorozat (a célkitűzések 1-6. pontjai). 2. szakasz: Prospektív nem randomizált klinikai vizsgálat (7. pont). 3. szakasz: Prospektív randomizált klinikai vizsgálat (8. pont). Az 1. szakasz lényegében lezárult, bár az in situ ductalis carcinoma és a neoadjuváns kezelés esetén végzett őrszemnyirokcsomó-biopszia klinikai jelentőségével kapcsolatban még további vizsgálatokat tervezünk. A 2. szakaszban operált betegek követését a továbbiakban is folytatjuk. A 3. szakasz jelenleg folyamatban van, a betegek besorolását még nem fejeztük be. 1. (Technikai tanulmány) Ebben a tanulmányban vizsgáltuk a limfoszcintigráfiával kiegészített kettős jelöléses őrszemnyirokcsomó-biopszia sebészi alkalmazhatóságát valamint a módszer érzékenységét és pontosságát a hónalji nyirokcsomó áttétek felismerésében. Vizsgáltuk a tanulási folyamat, különböző szemcsenagyságú kolloidok, jelölő anyag beadási helyek, a daganat jellemzőinek, illetve a műtét időpontjának hatását a módszer érzékenységére és pontosságára. Célul tűztük ki könnyen reprodukálható, egységesíthető és sugárvédelmi szempontból biztonságos technika kidolgozását. 2. (Patológiai tanulmány) Ebben a fejezetben az őrszemnyirokcsomók különböző szövettani feldolgozásának hatását vizsgáltuk a módszer érzékenységére. Emellett tanulmányoztuk egy molekuláris biológiai módszer (RT-PCR) alkalmazhatóságát és pontosságát az őrszemnyirokcsomó áttétek felismerésében. Összehasonlítottuk 4 szóba jöhető sebészipatológiai staging lehetőség érzékenységét a hónalji nyirokcsomó státusz vonatkozásában. 17
18 3. (ROLL tanulmány) Ennek a tanulmánynak a célkitűzése kettős, vizsgáltuk: a) a nem tapintható emlő daganatok radioizotópos jelöléses eltávolításának technikai alkalmazhatóságát; b) az egyidejű őrszemnyirokcsomó-biopszia elvégezhetőségének lehetőségét. Továbbá vizsgáltuk a módszer alkalmazásának lehetőségét többgócú nem tapintható emlőrák esetén is. 4. (Ductalis in situ emlőrák tanulmány) Ebben a részben az őrszemnyirokcsomó-biopszia klinikai jelentőségét vizsgáltuk ductalis in situ emlőrák esetén. Meghatároztuk az őrszemnyirokcsomó áttét kockázatát különböző klinikai és szövettani jellemzők függvényében. 5. (Neoadjuváns kemoterápia tanulmány) Ennek a fejezetnek a célkitűzése az őrszemnyirokcsomó-biopszia alkalmazhatóságának, pontosságának és klinikai jelentőségének vizsgálata volt neoadjuváns kemoterápia után. 6. (Negatív axillaris limfoszcintigráfia tanulmány) Ebben a tanulmányban vizsgáltuk a negatív axillaris limfoszcintigráfia prediktív értékét a patológiai hónalji nyirokcsomó státusz előrejelzésében a gyakorlatunkban alkalmazott két különböző radiokolloid beadási hely (subareolaris és intratumoralis) függvényében. 7. (Követéses tanulmány) Az őrszemnyirokcsomó-biopszia utáni rutinszerű komplettáló axillaris blokkdisszekciót intézetünkben a nemzetközi és saját kedvező tapasztalataink, illetve az Egerben (1999) megrendezett 1. Nemzeti Emlőrák Konszenzus Konferencia állásfoglalása alapján 2000 márciusában elhagytuk. Ettől kezdve axillaris blokkdisszekciót csak az őrszemnyirokcsomó pozitív betegeknél végeztünk, őrszemnyirokcsomó negatív betegeinket pedig az axilla vonatkozásában megfigyeltük. Ebben a követéses tanulmányban azt vizsgáltuk, hogy biztonsággal elhagyható-e az axilla további kezelése őrszemnyirokcsomó negatív betegeknél. 8. (Prospektív randomizált tanulmány) Ennek a prospektív randomizált klinikai vizsgálatnak több célkitűzése is van. a) Az emlőrákos betegeknek az őrszemnyirokcsomó szövettani eredményére alapozott kezelésének bevezetése. 18
19 b) Az axillaris blokkdisszekció szövődményeinek és következményeinek elkerülése a kezelés eredményességének megőrzése (esetleg javítása) mellett őrszemnyirokcsomó negatív betegekben. c) A régió legoptimálisabb kezelési taktikájának meghatározása őrszemnyirokcsomó pozitív betegekben. d) Az életminőség javítása a kezelés eredményességének megőrzése, illetve a pontosabb stádium-besorolásból adódóan esetleg javítása mellett őrszemnyirokcsomó pozitív betegekben. e) A fenti célok elérése az emlőrákos betegek kezelési költségeinek szinten tartása (esetleg csökkentése) mellett. f) Prognosztikai tanulmány, új prognosztikai index kidolgozása. Ez a tanulmány jelenleg is folyamatban van, az eddigi eredmények részletes ismertetése nem célja az értekezésnek. A vizsgálatsorozat teljességének bemutatása céljából a protokollt részletesen ismertetem, az eddigi eredményekről viszont csak néhány mondatban számolok be. 19
20 BETEGEK ÉS MÓDSZER 1. (Technikai tanulmány) Az Országos Onkológiai Intézet Általános-és Mellkassebészeti Osztályán 1997 decembere és 2000 márciusa között 110 primer, klinikailag nyirokcsomó negatív emlőrákos nőbetegen végzünk limfoszcintigráfiával kiegészített intraoperatív gammaszonda által vezérelt kettős jelöléses őrszemnyirokcsomó-biopsziát technikaialkalmazhatósági tanulmány keretében. A betegséget az őrszemnyirokcsomó-biopszia elvégzése előtt aspirációs citológiai vagy a core, illetve excisionalis biopszia szövettani vizsgálatával igazoltuk. A tanulmányban résztvevő betegek a beavatkozás lényegéről szóbeli felvilágosítást kaptak, és a műtét elvégzéséhez hozzájárultak. A limfoszcintigráfiás vizsgálathoz az értekezésben szereplő összes betegnél 99m Tc-pertechnetáttal jelölt humán kolloidális szérum albumint használtunk, az első 32 betegnél a nm-es szemcsenagyságú NANO-ALBUMON-t (Medi-Radiopharma Kft, Érd), majd a további 78 betegnél a nm-es szemcsenagyságú SENTI- SCINT-et (Medi-Radiopharma Kft, Érd). A beadott aktivitás 30 MBq volt. A kolloidot minden esetben kis térfogatban (0,4 ml) adtuk (5. ábra). A statikus limfoszcintigráfiás vizsgálat az izotóppal jelölt kolloid beadása után 2 órával (első 32 beteg), illetve órával (utolsó 78 beteg) történt meg (6-9. ábrák). A vizsgálathoz TOSHIBA GCA- 7100A (Toshiba Corp., Shimoishigami, Japán) gamma-kamerát használtunk LEHR (low energy high resolution) kollimátorral. Kétirányú (antero-posterior és lateralis) statikus felvételeket készítettünk (10. ábra), illetve a kamera oszcilloszkóp képének segítségével az őrszemnyirokcsomók vetületét a bőrön szintén két irányból (antero-posterior és lateralis) megjelöltük. Az őrszemnyirokcsomó-biopsziát a radiokolloid beadásának napján (első 32 beteg), illetve másnap (utolsó 78 beteg) végeztük el. Kék festékként minden esetben patent-kéket (PATENTBLAU V 2,5%, Byk Gulden Konstanz, Németország) használtunk, amelyet 2 ml térfogatban a műtét kezdete előtt 10 perccel adtunk be (11. ábra). A kolloidot az első 67 betegnél peritumoralisan, illetve a megelőző kimetszés hege köré adtuk 3-4 depót képezve, majd az utolsó 43 betegnél subareolarisan fecskendeztük be. A patent-kéket az első 32 betegnél periareolarisan adtuk intracutan, 20
21 majd a további 78 betegnél peritumoralisan, illetve a megelőző kimetszés helye köré injektáltuk 3-4 depót képezve. Műtéteink során 70 esetben a NEOPROBE 1000 (Neoprobe Corp. Dublin, OH, Amerikai Egyesült Államok), 31 esetben a NAVIGATOR GPS (USSC Norwalk, CO, Amerikai Egyesült Államok), illetve 9 esetben a EUROPROBE (Eurorad, Strasbourg, Franciaország) típusú kézi sugárdetektorokat (gamma-szonda) használtuk. A kettős jelöléses módszer technikája: Az izotópos módszer technikáját külön nem ismertetem, ugyanis alapjaiban nem tér el a kettős jelöléses módszertől. Mindössze annyiban különbözik, hogy a műtét során a kékre festődő nyirokutak észlelésének a nyirokcsomó lokalizálását jelentősen segítő szerepe ennél a módszernél nem érvényesül, így a műtét során kizárólag a gammaszondára vagyunk utalva. Ez a helyzet egyébként azokban az esetekben is, amikor a kék festék áramlását nem észleljük műtét során. Az izotópos és a kettős jelöléses módszer alkalmazásának alapfeltétele az intraoperative használható (sterilen izolálható) kézi gammasugárzást érzékelő készülék, az úgynevezett gamma-szonda. A műtét előtt a gamma-szonda segítségével meghatároztuk az őrszemnyirokcsomó vetületét a bőrön, majd itt kis bőrmetszést ejtettünk. Az őrszemnyirokcsomót a kékre festődő nyirokutak megkeresésével és az első nyirokcsomóig való követésével és/vagy az izotópot halmozó nyirokcsomó meghatározásával (gamma-szonda segítségével) azonosítottuk. Az őrszemnyirokcsomó eltávolítása után ellenőriztük a régióban a maradék háttéraktivitást, és az izotópot halmozó nyirokcsomók ( a kékre festődéstől függetlenül) eltávolítását addig folytattuk, amíg a háttéraktivitás egyenletesen lecsökkent, és a legmagasabb aktivitású nyirokcsomó ex vivo mért aktivitásának 10%-ánál magasabb fokális aktivitást nem észleltünk. Nagyon ritkán előfordult, hogy az aktív, de kékre nem festődött nyirokcsomó mellett kékre festődött, de nem aktív nyirokcsomót is találtunk. Ilyenkor mindkét nyirokcsomót eltávolítottuk, és őrszemnyirokcsomónak tekintettük. Ezután elvégeztük az emlőműtétet (87 emlőmegtartó műtét és 23 mastectomia). Emlőmegtartó műtét után a tumorágyat 3-5 fémklippel jelöltük a műtét utáni sugárkezelés tervezése céljából. A beavatkozást formális axillaris blokkdisszekcióval fejeztük be. A műtét végén gamma-szondával ellenőriztük az axillaris sebüreget és a műtéti speciment. 21
22 A kék festékes módszer technikája: Bár nem tartozik szorosan az értekezésnek ehhez a pontjához, mégis itt tartottam logikailag célszerűnek ismertetni ennek a módszernek a technikáját is, amelyre a későbbi pontokban még hivatkozni fogok. A festék beadása után (subareolaris vagy peritumoralis, esetleg a korábbi kimetszés hege köré) 5-10 perccel (a várakozási időben a festék áramlásának elősegítésére az emlőt óvatosan masszírozzuk) ívelt metszésből feltárjuk az axillát. Óvatos preparálással megkeressük a kékre festődő nyirokuta(ka)t, majd azokat követjük az első kékre festődő nyirokcsomó(k)ig, az őrszemnyirokcsomó(k)ig, amelyeket eltávolítunk. A nyirokutakat retrográd irányban is szükséges követni az emlőállomány széléig, hogy meggyőződjünk minden kétséget kizáróan arról, hogy az eltávolított nyirokcsomó valóban a nyirokelvezetés irányába eső első nyirokcsomó. Az eltávolított őrszemnyirokcsomókat egyenként, külön jelzéssel ellátva küldtük szövettani vizsgálatra. Az őrszemnyirokcsomók feldolgozása sorozatmetszetekben (2 mm-es szintenként) rutin hematoxilin-eozin (HE) festéssel történt. A nem őrszemnyirokcsomókat az intézeti rutin szerint vizsgáltuk (1-3 szint, HE festés). A módszer szenzitivitását, specificitását, pozitív és negatív prediktív értékét, a téves negatív arányt és a pontosságot Krag DN (181) szerint számítottuk ki. A téves negatív prediktív értéket Abramson LR (182) meghatározása alapján adtuk meg. A sikerességi, a téves negatív és a kék festékáramlási arányok összehasonlítására a chinégyzet és a Fisher exakt próbákat alkalmaztuk. 2. (Patológiai tanulmány) Az előzőleg ismertetett betegcsoportból az utolsó 69 beteg (B és C csoport) közül kiválasztottuk további vizsgálatra azt a 68-at, akiknél az őrszemnyirokcsomóbiopszia sikeres volt. A műtéti technikát korábban már részletesen ismertettük. A radiokolloidot 38 betegnél subareolarisan, 30 betegnél pedig peritumoralisan adtuk. Azoknak a betegeknek az őrszemnyirokcsomóit vizsgáltuk tovább, akiknél az előzőekben ismertetett szövettani vizsgálattal (2 mm-es szintek, HE festés) az őrszemnyirokcsomóban nem mutattunk ki áttétet (47 beteg). A kiegészítő HE és 22
23 citokeratin (AE1/AE3) immunhisztokémiai vizsgálatot 250 μm-es szinteken végeztük el a teljes nyirokcsomót feldolgozva. A 68 beteg közül 14 esetben az őrszemnyirokcsomó(k) felét a fent ismertetett szövettani protokoll szerint, míg a másik felét molekuláris biológiai módszerrel (CK20 mrns RT-PCR) vizsgáltuk. Az RT-PCR vizsgálat protokollja a következő volt: Az őrszemnyirokcsomó(k) felét TRI REAGENT (Sigma, St. Louis, MO, Amerikai Egyesült Államok) tartalmú csövekben tároltuk 80 C-on az RNS izolálásáig. A teljes RNS-t egylépcsős TRI REAGENT-et használó módszerrel izoláltuk. Az RNS tisztaságát ultraibolya spektrofotometriával határoztuk meg. A komplementáris DNS (cdns) létrehozása madár myeloblastosis vírus reverz-transzkriptáz (Promega, Madison, WI, Amerikai Egyesült Államok) felhasználásával történt, amelyet a gyártó által megadott protokoll szerint alkalmaztunk. A polimeráz láncreakciót 25 μl-es reakció oldatban végeztük, amely 2 μl cdns templátot, 1,5 mm MgCl 2 -t, mindegyik deoxinukleotid trifoszfátból 0,8 mm-t, 0,2 μm CK20 primert és 1 egység RED TAQ POLYMERASE-t (Sigma, St. Louis, MO, Amerikai Egyesült Államok) tartalmazott. A CK20 cdns meghatározására a következő primert használtuk: sense 5 -TCTTTGATGACCTAACCCTAC anti-sense 5 -CTACTTCTTGCACGACTGTCTTA. A ciklusok jellemzői a következők voltak: bevezető denaturáció 94 C-on 5 percig, 45 ciklus (mindegyik ciklus 94 C-on 1 perc, 58 C-on 1 perc és 72 C-on 1 perc), végül 72 C-on 7 percig. A láncreakció termékből 5 μl-t 2%-os agaróz gélen elektroforetizáltunk, és etidium bromiddal megfestettük. A módszer szenzitivitását, specificitását, pozitív és negatív prediktív értékét, a téves negatív arányt, a pontosságot és a téves negatív prediktív értéket a korábban idézettek alapján határoztuk meg. Az adatok statisztikai vizsgálatára a chi-négyzet próbát alkalmaztuk. 3. (ROLL tanulmány) Az Országos Onkológiai Intézet Általános-és Mellkassebészeti Osztályán 2000 októbere és 2003 októbere között 208 nőbetegnél terveztünk radioizotópos jelöléses emlő excisiot (ROLL) egyidejű őrszemnyirokcsomó eltávolítással nem tapintható, 23
24 citológiai vagy core biopsziás vizsgálattal igazolt, klinikailag nyirokcsomó negatív emlőrák miatt. Összesen 211 emlőn végeztük el a beavatkozást, mivel 3 betegnek szinkron bilateralis emlőrákja volt. Az emlő elváltozásba képalkotó (ultrahang vagy mammográfia) vezérléssel radioiokolloidot adtunk (12. ábra), a nm-es szemcsenagyságú NANO- ALBUMONT (Medi-Radiopharma Kft, Érd) vagy a nm-es szemcsenagyságú SENTI-SCINT-et (Medi-Radiopharma Kft, Érd) 0,4 ml térfogatban. A beadott aktivitás 30 MBq volt. A korábbi közleményben (7) leírt egymásra filmezéses mammográfiás vizsgálatot egyáltalán nem végeztünk. Az anyag beadását a műtét előtti napon végeztük el. Az ultrahangos lokalizálást részesítettük előnyben, ez alól csak a parenchyma elváltozás nélküli microcalcificatiók, illetve az ultrahanggal nem észlelhető parenchyma laesiók voltak a kivételek. A műtét napján reggel statikus limfoszcintigráfiát végeztünk két irányból (antero-posterior és oldalirány) ( ábrák). Az őrszemnyirokcsomók vetületét a bőrön szintén két irányból megjelöltük. A műtét megkezdése előtt 5-10 perccel subareolarisan 2 ml patent-kéket (PATENTBLAU V 2,5%, Guerbet, Roissy CdG cedex, Franciaország) is adtunk második jelölő anyagként. A műtétre a jelölő anyag beadása után óra múlva került sor. Műtét során gamma-szondával (EUROPROBE, Eurorad, Strasbourg, Franciaország) meghatároztuk az aktivitás csúcspontját (15. ábra), és egy kis metszésből (16. ábra) a preoperatív képalkotó vizsgálatok eredményeit figyelembe véve megfelelő átmérőjű szövethengert távolítottunk el (17. ábra). A kimetszést a pectoralis fascia szintjéig végeztük. (Ha az izotópos jelöléses excisiot diagnosztikus célból végeztük, akkor a lehető legkisebb szövetmennyiséget próbáltuk meg eltávolítani.) Műtét közben a gamma-szondát folyamatosan használtuk az excisio nagyságának meghatározására. A műtéti preparátumot egyezményesen fonalakkal orientáltuk. A sebüreget gamma-szondával ellenőriztük (18. ábra). A háttéraktivitás a beavatkozás végén nulla közeli értékre esett vissza, és fokális aktivitás sem volt észlelhető. Az excisio végén fokális aktivitás abban az esetben maradhatott vissza, ha külső-felső negyedben elhelyezkedő elváltozás esetén az excisiot az őrszemnyirokcsomó eltávolítása előtt végeztük el (a zavaró háttéraktivitás kiküszöbölése céljából). Ilyenkor a hónalj irányában néha észlelhető volt az őrszemnyirokcsomó aktivitása. Előfordult, hogy a radiokolloid beadása során jelentős anyagmennyiség került a pectoralis izom fasciájára vagy az alá. Ilyenkor a fascián 24
25 jelentős maradék aktivitás volt észlelhető az excisio végén. Az excisio teljességét specimen radiográfiával ellenőriztük (19. ábra). A kimetszés széleit a patológiai feldolgozás előtt tintával megfestettük. Intraoperativ szövettani vizsgálatot nem végeztünk. Ha a specimen radiográfia inkomplett excisiot vagy keskeny ép szélt igazolt, akkor a megfelelő irány(ok)ban további kimetszés(eke)t végeztünk. Az excisio után visszamaradt sebüreg széleit 3-5 fémklippel jelöltük a műtét utáni sugárkezelés tervezése céljából. Az őrszemnyirokcsomó-biopsziát a korábban ismertetett kettős jelöléses módszerrel végeztük el. Negatív axillaris limfoszcintigráfia esetén a már szintén ismertetett kék festék által vezérelt technikával távolítottuk el az őrszemnyirokcsomót. Parasternalis őrszemnyirokcsomó-biopsziát nem végeztünk. Többgócú elváltozások esetén a jelölési technika módosult (20. ábra). Ha az elváltozások az emlőben egymástól távol (> 3 cm) helyezkedtek el, akkor a jelölő anyag mennyiségét elosztottuk, és külön-külön jelöltük azokat (3 beteg). Egymáshoz közel elhelyezkedő kicsi elváltozásokat az elváltozások közé adott kolloiddal jelöltünk (4 beteg), nagy elváltozások esetén pedig a tervezett kimetszés széleit jelöltük 2-4 ponton a jelölő anyagot elosztva (2 beteg) (ugyanezt a megoldást alkalmaztuk nagykiterjedésű (> 3 cm) egygócú elváltozások (pl. microcalcificatiok) jelölésére is). Az eltávolított őrszemnyirokcsomó(k)ból műtét közben lenyomati citológiai vizsgálatot végeztünk rutin fixálással és festéssel. Pozitív esetben egy ülésben elvégeztük a komplettáló axillaris blokkdisszekciót. Az őrszemnyirokcsomó(k)at fixálás és beágyazás után 0,5-1 mm-es szinteken rutin HE festéssel vizsgáltuk. A blokkdisszekcióval eltávolított nyirokcsomókat nagyságuktól függően 1-3 szinten vizsgáltuk rutin HE festéssel. Az egyes csoportok statisztikai összehasonlítására a chi-négyzet és a kétmintás t- próbákat alkalmaztuk. 4. (Ductalis in situ emlőrák tanulmány) Az Országos Onkológiai Intézet Általános-és Mellkassebészeti Osztályán 2001 januárja és 2004 márciusa között 36 nőbetegnél végeztünk őrszemnyirokcsomó- 25
Radioizotópos sebészeti lehetőségek a korai emlőrák kezelésében
 Radioizotópos sebészeti lehetőségek a korai emlőrák kezelésében Doktori (PhD) értekezés tézisei Dr. Péley Gábor Témavezető: Prof. Dr. Kopper László Semmelweis Egyetem Doktori Iskola Patológiai Tudományok
Radioizotópos sebészeti lehetőségek a korai emlőrák kezelésében Doktori (PhD) értekezés tézisei Dr. Péley Gábor Témavezető: Prof. Dr. Kopper László Semmelweis Egyetem Doktori Iskola Patológiai Tudományok
Sentinel nyirokcsomó biopszia szájüregi laphámrák esetén
 Sentinel nyirokcsomó biopszia szájüregi laphámrák esetén Dr. Patkó Tamás, dr. Koltai Pál, dr. Remenár Éva, dr. Boér András Országos Onkológiai Intézet Fej-nyak-állcsont és Rekonstrukciós Sebészeti Osztály
Sentinel nyirokcsomó biopszia szájüregi laphámrák esetén Dr. Patkó Tamás, dr. Koltai Pál, dr. Remenár Éva, dr. Boér András Országos Onkológiai Intézet Fej-nyak-állcsont és Rekonstrukciós Sebészeti Osztály
Az emlő betegek ellátása során elért eredmények, tapasztalataink
 Az emlő betegek ellátása során elért eredmények, tapasztalataink 2005.-2015. Szerző: Dinka Tibor, Abasiute A. George, Bodócs Ildikó, Kiss Csaba, Kelemen János, Kovács László, Kovács Ottó, Szántó Zoltán,
Az emlő betegek ellátása során elért eredmények, tapasztalataink 2005.-2015. Szerző: Dinka Tibor, Abasiute A. George, Bodócs Ildikó, Kiss Csaba, Kelemen János, Kovács László, Kovács Ottó, Szántó Zoltán,
Változások az emlő sebészetében
 Változások az emlő sebészetében Maráz Róbert, Boross Gábor Bács-Kiskun Megyei Kórház Kecskemét Általános Sebészeti Osztály, Onkoradiológiai Központ Sebészet fejlődése Elméleti ismeretek fejlődése Diagnosztika
Változások az emlő sebészetében Maráz Róbert, Boross Gábor Bács-Kiskun Megyei Kórház Kecskemét Általános Sebészeti Osztály, Onkoradiológiai Központ Sebészet fejlődése Elméleti ismeretek fejlődése Diagnosztika
 Sebész szerepe az axilla ellátásában Mersich Tamás Uzsoki utcai Kórház Sebészeti-onkosebészeti Osztály 2014. május 24. Kecskemét Bevezetés A nyirokcsomók sebészi eltávolítása felel a legtöbb szövődményért
Sebész szerepe az axilla ellátásában Mersich Tamás Uzsoki utcai Kórház Sebészeti-onkosebészeti Osztály 2014. május 24. Kecskemét Bevezetés A nyirokcsomók sebészi eltávolítása felel a legtöbb szövődményért
Új lehetőségek a tumoros emlőanyagok patológiai feldolgozásában
 Új lehetőségek a tumoros emlőanyagok patológiai feldolgozásában Dr. Lippai Norbert Hetényi Géza Kórház, Szolnok Múlt és jelen Szakmai irányelvek a műtéti preparátumot az eltávolítás után azonnal (maximum
Új lehetőségek a tumoros emlőanyagok patológiai feldolgozásában Dr. Lippai Norbert Hetényi Géza Kórház, Szolnok Múlt és jelen Szakmai irányelvek a műtéti preparátumot az eltávolítás után azonnal (maximum
XIII./5. fejezet: Terápia
 XIII./5. fejezet: Terápia A betegek kezelésekor a sebészi kezelés, a kemoterápia (klasszikus citotoxikus és a biológiai terápia), a radioterápia és ezek együttes alkalmazása egyaránt szóba jön. A gégének
XIII./5. fejezet: Terápia A betegek kezelésekor a sebészi kezelés, a kemoterápia (klasszikus citotoxikus és a biológiai terápia), a radioterápia és ezek együttes alkalmazása egyaránt szóba jön. A gégének
A mammográfiás szűrővizsgálat és Z0011 vizsgálat hatása az emlőrák sebészetére (és komplex kezelésére). Kecskeméti tapasztalatok.
 A mammográfiás szűrővizsgálat és Z0011 vizsgálat hatása az emlőrák sebészetére (és komplex kezelésére). Kecskeméti tapasztalatok. Markó László 1,2 Pajkos Gábor 1, Maráz Róbert 2,1, Boross Gábor 2, Svébis
A mammográfiás szűrővizsgálat és Z0011 vizsgálat hatása az emlőrák sebészetére (és komplex kezelésére). Kecskeméti tapasztalatok. Markó László 1,2 Pajkos Gábor 1, Maráz Róbert 2,1, Boross Gábor 2, Svébis
A nem tapintható emlôtumorok és az ôrszemnyirokcsomók izotópos jelölése
 EMLÔDIAGNOSZTIKA Klinikoradiológiai tanulmány A nem tapintható emlôtumorok és az ôrszemnyirokcsomók izotópos jelölése Monoki Erzsébet, Varga Erika, Szabó Tünde, Tarján Tibor, Petri István, Zs. Tóth Endre,
EMLÔDIAGNOSZTIKA Klinikoradiológiai tanulmány A nem tapintható emlôtumorok és az ôrszemnyirokcsomók izotópos jelölése Monoki Erzsébet, Varga Erika, Szabó Tünde, Tarján Tibor, Petri István, Zs. Tóth Endre,
DR. HAJNAL KLÁRA / DR. NAHM KRISZTINA KÖZPONTI RÖNTGEN DIAGNOSZTIKA Uzsoki utcai kórház. Emlő MR vizsgálatok korai eredményei kórházunkban
 DR. HAJNAL KLÁRA / DR. NAHM KRISZTINA KÖZPONTI RÖNTGEN DIAGNOSZTIKA Uzsoki utcai kórház Emlő MR vizsgálatok korai eredményei kórházunkban 2015.01.01-2016.04.30 között kórházunkban végzett emlő MR vizsgálatok
DR. HAJNAL KLÁRA / DR. NAHM KRISZTINA KÖZPONTI RÖNTGEN DIAGNOSZTIKA Uzsoki utcai kórház Emlő MR vizsgálatok korai eredményei kórházunkban 2015.01.01-2016.04.30 között kórházunkban végzett emlő MR vizsgálatok
Sarkadi Margit1, Mezősi Emese2, Bajnok László2, Schmidt Erzsébet1, Szabó Zsuzsanna1, Szekeres Sarolta1, Dérczy Katalin3, Molnár Krisztián3,
 Sarkadi Margit1, Mezősi Emese2, Bajnok László2, Schmidt Erzsébet1, Szabó Zsuzsanna1, Szekeres Sarolta1, Dérczy Katalin3, Molnár Krisztián3, Rostás Tamás3, Ritter Zsombor4, Zámbó Katalin1 Pécsi Tudományegyetem
Sarkadi Margit1, Mezősi Emese2, Bajnok László2, Schmidt Erzsébet1, Szabó Zsuzsanna1, Szekeres Sarolta1, Dérczy Katalin3, Molnár Krisztián3, Rostás Tamás3, Ritter Zsombor4, Zámbó Katalin1 Pécsi Tudományegyetem
A vesedaganatok sebészi kezelése
 A vesedaganatok sebészi kezelése Szendrői Attila Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum Az Európai Urológus Testület képzőhelye Robson elvek (1963) Nincs szisztémás kezelés -radikális
A vesedaganatok sebészi kezelése Szendrői Attila Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum Az Európai Urológus Testület képzőhelye Robson elvek (1963) Nincs szisztémás kezelés -radikális
Új elvek a sebészi ellátásban Az emlőrák korszerű sebészi kezelése
 Új elvek a sebészi ellátásban Az emlőrák korszerű sebészi kezelése Simonka Zs SZTE ÁOK Sebészeti Klinika, Szeged 2018. Szeptember 13. Szeged Kötelező Szintentartó Onkológiai Továbbképzés Lázár Gy., Bursics
Új elvek a sebészi ellátásban Az emlőrák korszerű sebészi kezelése Simonka Zs SZTE ÁOK Sebészeti Klinika, Szeged 2018. Szeptember 13. Szeged Kötelező Szintentartó Onkológiai Továbbképzés Lázár Gy., Bursics
III./8.3. Lokálisan előrehaladott emlőrák. A fejezet felépítése
 III./8.3. Lokálisan előrehaladott emlőrák Kocsis Judit A fejezet célja, hogy megismerje a hallgató a helyileg előrehaladott emlődaganat fogalmát, diagnózisát és a terápiás lehetőségeket. A fejezet teljesítését
III./8.3. Lokálisan előrehaladott emlőrák Kocsis Judit A fejezet célja, hogy megismerje a hallgató a helyileg előrehaladott emlődaganat fogalmát, diagnózisát és a terápiás lehetőségeket. A fejezet teljesítését
Diagnosztikai problémák onkoplasztikai műtétek után a radiológus szemszögéből
 Diagnosztikai problémák onkoplasztikai műtétek után a radiológus szemszögéből Bidlek M., Kovács E. Országos Onkológiai Intézet 2013. május 17-18 Szenológiai Kongresszus Kecskemét Műtéti típusok Kozmetikai
Diagnosztikai problémák onkoplasztikai műtétek után a radiológus szemszögéből Bidlek M., Kovács E. Országos Onkológiai Intézet 2013. május 17-18 Szenológiai Kongresszus Kecskemét Műtéti típusok Kozmetikai
SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA EMLŐRÁKBAN- MÓDSZERTANI ÚTMUTATÓ
 SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA EMLŐRÁKBAN- MÓDSZERTANI ÚTMUTATÓ Írta: Rajtár Mária 1. Háttér információk és definíciók Az emlőrák sebészi kezelése során az axillaris blockdissectióval eltávolított
SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA EMLŐRÁKBAN- MÓDSZERTANI ÚTMUTATÓ Írta: Rajtár Mária 1. Háttér információk és definíciók Az emlőrák sebészi kezelése során az axillaris blockdissectióval eltávolított
Az ôrszemnyirokcsomó-biopszia alkalmazhatósága és jelentôsége neoadjuváns kemoterápia után emlôrákban
 Az ôrszemnyirokcsomó-biopszia alkalmazhatósága és jelentôsége neoadjuváns kemoterápia után emlôrákban Eredeti közlemény Péley Gábor, 1 Török Klára, 1 Farkas Emil, 1 Mátrai Zoltán, 1 Horváth Zsolt, 2 Sinkovics
Az ôrszemnyirokcsomó-biopszia alkalmazhatósága és jelentôsége neoadjuváns kemoterápia után emlôrákban Eredeti közlemény Péley Gábor, 1 Török Klára, 1 Farkas Emil, 1 Mátrai Zoltán, 1 Horváth Zsolt, 2 Sinkovics
SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA MELANOMA MALIGNUMBAN- MÓDSZERTANI ÚTMUTATÓ
 SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA MELANOMA MALIGNUMBAN- MÓDSZERTANI ÚTMUTATÓ Írta: Rajtár Mária 1. Háttér információk és definíciók A melanoma malignum sebészi kezelésében nem tapintható nyirokcsomók
SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA MELANOMA MALIGNUMBAN- MÓDSZERTANI ÚTMUTATÓ Írta: Rajtár Mária 1. Háttér információk és definíciók A melanoma malignum sebészi kezelésében nem tapintható nyirokcsomók
A bőrmelanoma kezelésének módjai. Dr. Forgács Balázs Bőrgyógyászati Osztály
 A bőrmelanoma kezelésének módjai Dr. Forgács Balázs Bőrgyógyászati Osztály Melanoma TNM (AJCC VIII.) A melanoma kezelés alapja (T:tumor, N:nyirokcsomó, M:metasztázis) T: Breslow érték a legközelebbi 0,1
A bőrmelanoma kezelésének módjai Dr. Forgács Balázs Bőrgyógyászati Osztály Melanoma TNM (AJCC VIII.) A melanoma kezelés alapja (T:tumor, N:nyirokcsomó, M:metasztázis) T: Breslow érték a legközelebbi 0,1
A fejezet felépítése. A.) Általános nevezéktan
 II./1.4. fejezet: Nevezéktan, stádiumbeosztás Torgyík László, Dank Magdolna A fejezet áttekintése során a hallgató megismerkedik az onkológiai kezelések során használatos kifejezések értemével és a TNM-osztályozás
II./1.4. fejezet: Nevezéktan, stádiumbeosztás Torgyík László, Dank Magdolna A fejezet áttekintése során a hallgató megismerkedik az onkológiai kezelések során használatos kifejezések értemével és a TNM-osztályozás
Az ôrszem (sentinel) nyirokcsomó jelentôsége in situ emlôcarcinoma sebészi kezelésében
 Az ôrszem (sentinel) nyirokcsomó jelentôsége in situ emlôcarcinoma sebészi kezelésében Eredeti közlemény Takács Tibor 1, Szentpáli Károly 1, Paszt Attila 1, Ormándi Katalin 4, Lázár Máté 5, Pálka István
Az ôrszem (sentinel) nyirokcsomó jelentôsége in situ emlôcarcinoma sebészi kezelésében Eredeti közlemény Takács Tibor 1, Szentpáli Károly 1, Paszt Attila 1, Ormándi Katalin 4, Lázár Máté 5, Pálka István
KLINIKAI ONKOLÓGIA ÁLTALÁNOS ONKOLÓGIA, EPIDEMIOLÓGIA, ETIOLÓGIA, DIAGNOSZTIKA ÉS SZŰRÉS
 KLINIKAI ONKOLÓGIA ÁLTALÁNOS ONKOLÓGIA, EPIDEMIOLÓGIA, ETIOLÓGIA, DIAGNOSZTIKA ÉS SZŰRÉS 1. Daganatos morbiditás és mortalitás Magyarországon 2. Kémiai és fizikai tényezők szerepe a daganatok kialakulásában
KLINIKAI ONKOLÓGIA ÁLTALÁNOS ONKOLÓGIA, EPIDEMIOLÓGIA, ETIOLÓGIA, DIAGNOSZTIKA ÉS SZŰRÉS 1. Daganatos morbiditás és mortalitás Magyarországon 2. Kémiai és fizikai tényezők szerepe a daganatok kialakulásában
A KÜLÖNBÖZŐ KÉPALKOTÓ ELJÁRÁSOK SZEREPE AZ EMLŐRÁK DIAGNOSZTIKÁJÁBAN ÉS KÖVETÉSÉBEN
 A KÜLÖNBÖZŐ KÉPALKOTÓ ELJÁRÁSOK SZEREPE AZ EMLŐRÁK DIAGNOSZTIKÁJÁBAN ÉS KÖVETÉSÉBEN Dr. Ormándi Katalin Affidea Diagnosztika SZTE Radiológiai Klinika Szeged MAGYAR SZENOLÓGIAI TÁRSASÁG TUDOMÁNYOS ÜLÉSE
A KÜLÖNBÖZŐ KÉPALKOTÓ ELJÁRÁSOK SZEREPE AZ EMLŐRÁK DIAGNOSZTIKÁJÁBAN ÉS KÖVETÉSÉBEN Dr. Ormándi Katalin Affidea Diagnosztika SZTE Radiológiai Klinika Szeged MAGYAR SZENOLÓGIAI TÁRSASÁG TUDOMÁNYOS ÜLÉSE
Emlődaganatok multidiszciplináris kezelése. Polgár Cs. Országos Onkológiai Intézet, Semmelweis Egyetem ÁOK, Onkológiai Tanszék
 Emlődaganatok multidiszciplináris kezelése Polgár Cs. Országos Onkológiai Intézet, Semmelweis Egyetem ÁOK, Onkológiai Tanszék Emlőrák gyakorisága Magyarországon 2014 Női lakosság 1. Emlő 7911 (21%) 2.
Emlődaganatok multidiszciplináris kezelése Polgár Cs. Országos Onkológiai Intézet, Semmelweis Egyetem ÁOK, Onkológiai Tanszék Emlőrák gyakorisága Magyarországon 2014 Női lakosság 1. Emlő 7911 (21%) 2.
Hivatalos Bírálat Dr. Gődény Mária
 Hivatalos Bírálat Dr. Gődény Mária:,,Multiparametrikus MR vizsgálat prognosztikai és prediktív faktorokat meghatározó szerepe fej-nyaki tumoroknál, valamint a kismedence főbb daganat csoportjaiban című
Hivatalos Bírálat Dr. Gődény Mária:,,Multiparametrikus MR vizsgálat prognosztikai és prediktív faktorokat meghatározó szerepe fej-nyaki tumoroknál, valamint a kismedence főbb daganat csoportjaiban című
Intraocularis tumorok
 Intraocularis tumorok 25 évvel ezelőtt, ha egy szemben chorioidea melanomát találtunk, akkor a szemet enucleáltuk. Szemben lévő festékes daganat (melanoma chorioideae) Chorioidea melanoma miatt eltávolított,
Intraocularis tumorok 25 évvel ezelőtt, ha egy szemben chorioidea melanomát találtunk, akkor a szemet enucleáltuk. Szemben lévő festékes daganat (melanoma chorioideae) Chorioidea melanoma miatt eltávolított,
Esetbemutatás. Dr. Iván Mária Uzsoki Kórház 2013.11.07.
 Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
OPPONENSI VÉLEMÉNY. Dr. Kulka Janina MTA doktori értekezéséről
 1 OPPONENSI VÉLEMÉNY Dr. Kulka Janina MTA doktori értekezéséről Az értekezés témaválasztása korszerű és megfelel a XXI. századi emlő onkológia elvárásainak. A patológusok szerepe az emlőrák kórismézésében
1 OPPONENSI VÉLEMÉNY Dr. Kulka Janina MTA doktori értekezéséről Az értekezés témaválasztása korszerű és megfelel a XXI. századi emlő onkológia elvárásainak. A patológusok szerepe az emlőrák kórismézésében
III./8.1. In situ emlőcarcinomák
 III./8.1. In situ emlőcarcinomák Korompay Anna, Dank Magdolna Ebben a fejezetben egy 57 éves nőbeteg in situ ductalis emlőcarcinomájának kórtörténetén keresztül ismertetjük az emlő in situ rosszindulatú
III./8.1. In situ emlőcarcinomák Korompay Anna, Dank Magdolna Ebben a fejezetben egy 57 éves nőbeteg in situ ductalis emlőcarcinomájának kórtörténetén keresztül ismertetjük az emlő in situ rosszindulatú
patológi Klinikum Az emlımirigytumorok szövettani csoportosítása: Malignus tumorok Benignus tumorok Dysplasiák/hyperplasiák
 A kutyák emlıtumorainak patológi giája Dr. Jakab Csaba SZIE - ÁOTK Kórbonctani és Igazságügyi Állatorvostani Tanszék Budapest 1078 István u. 2. 2012 A kutyák emlıtumorainak patológi giája Klinikum Az emlımirigytumorok
A kutyák emlıtumorainak patológi giája Dr. Jakab Csaba SZIE - ÁOTK Kórbonctani és Igazságügyi Állatorvostani Tanszék Budapest 1078 István u. 2. 2012 A kutyák emlıtumorainak patológi giája Klinikum Az emlımirigytumorok
Bár az emlőrák elsősorban a posztmenopauzális nők betegsége, a betegek mintegy 5,5%-a 40 évesnél, 2%-a 35 évesnél fiatalabb a diagnózis idején. Ezekbe
 Bár az emlőrák elsősorban a posztmenopauzális nők betegsége, a betegek mintegy 5,5%-a 40 évesnél, 2%-a 35 évesnél fiatalabb a diagnózis idején. Ezekben a korcsoportokban ez a leggyakoribb daganatos halálozási
Bár az emlőrák elsősorban a posztmenopauzális nők betegsége, a betegek mintegy 5,5%-a 40 évesnél, 2%-a 35 évesnél fiatalabb a diagnózis idején. Ezekben a korcsoportokban ez a leggyakoribb daganatos halálozási
Aktuális kérdések az emlőrák sebészetében. Ph. D. Tézis. Maráz Róbert, M.D.
 Aktuális kérdések az emlőrák sebészetében Ph. D. Tézis Maráz Róbert, M.D. Bács-Kiskun Megyei Kórház, Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza, Sebészeti és Onkoradiológiai Osztály,
Aktuális kérdések az emlőrák sebészetében Ph. D. Tézis Maráz Róbert, M.D. Bács-Kiskun Megyei Kórház, Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza, Sebészeti és Onkoradiológiai Osztály,
A nem tapintható emlődaganatok sebészete
 A nem tapintható emlődaganatok sebészete Lázár György SZTE ÁOK Sebészeti Klinika, Szeged A Magyar Szenológiai Társaság Tudományos Fóruma, Kecskemét, 2013. május 17-18. Paradigma váltás Maximálisan tolerálható
A nem tapintható emlődaganatok sebészete Lázár György SZTE ÁOK Sebészeti Klinika, Szeged A Magyar Szenológiai Társaság Tudományos Fóruma, Kecskemét, 2013. május 17-18. Paradigma váltás Maximálisan tolerálható
AZ EMLÔRÁK KORSZERÛ SEBÉSZI KEZELÉSE
 AZ EMLÔRÁK KORSZERÛ SEBÉSZI KEZELÉSE Lázár György 1, Besznyák István 2, Boross Gábor 3, Farsang Zoltán 4, Gulyás Gusztáv 2, Jakab Ferenc 5, Maráz Róbert 3, Márkus Béla 6, Tóth László 2 1 Szegedi Tudományegyetem,
AZ EMLÔRÁK KORSZERÛ SEBÉSZI KEZELÉSE Lázár György 1, Besznyák István 2, Boross Gábor 3, Farsang Zoltán 4, Gulyás Gusztáv 2, Jakab Ferenc 5, Maráz Róbert 3, Márkus Béla 6, Tóth László 2 1 Szegedi Tudományegyetem,
Semmelweis Egyetem, Általános Orvostudományi Kar, I. sz. Sebészeti Klinika Sebészeti onkológia
 Sebészeti onkológia Dr. Kupcsulik Péter A daganatsebészet úttörői Sebész Billroth Halsted Kocher Miles Whipple Graham Torek Wertheim Daganat gyomor emlő pajzsmirigy végbél pancreas tüdő nyelőcső méh TNM
Sebészeti onkológia Dr. Kupcsulik Péter A daganatsebészet úttörői Sebész Billroth Halsted Kocher Miles Whipple Graham Torek Wertheim Daganat gyomor emlő pajzsmirigy végbél pancreas tüdő nyelőcső méh TNM
A tüdőcitológia jelentősége a tüdődaganatok neoadjuváns kezelésének tervezésében
 A tüdőcitológia jelentősége a tüdődaganatok neoadjuváns kezelésének tervezésében Pápay Judit SE, I.sz.Patológiai és Kísérleti Rákkutató Intézet 70. Patológus Kongresszus Siófok 2011. szept. 29 - okt.1.
A tüdőcitológia jelentősége a tüdődaganatok neoadjuváns kezelésének tervezésében Pápay Judit SE, I.sz.Patológiai és Kísérleti Rákkutató Intézet 70. Patológus Kongresszus Siófok 2011. szept. 29 - okt.1.
Nukleáris medicina a fejnyak régió betegségeinek diagnosztikájában. PTE KK Nukleáris Medicina Intézet Dr. Bán Zsuzsanna
 Nukleáris medicina a fejnyak régió betegségeinek diagnosztikájában PTE KK Nukleáris Medicina Intézet Dr. Bán Zsuzsanna Érintett témák: Pajzsmirigy szcintigráfia Mellékpajzsmirigy szcintigráfia F18-FDG
Nukleáris medicina a fejnyak régió betegségeinek diagnosztikájában PTE KK Nukleáris Medicina Intézet Dr. Bán Zsuzsanna Érintett témák: Pajzsmirigy szcintigráfia Mellékpajzsmirigy szcintigráfia F18-FDG
2355-06 Egyéb citológiai vizsgálatok követelménymodul szóbeli vizsgafeladatai
 1. feladat Tájékoztassa a munkahelyére érkező vendégeket a különféle szervekből nyert citológiai anyagok feldolgozásáról, diagnosztikára való előkészítéséről! Tájékoztatója során az alábbi szempontokra
1. feladat Tájékoztassa a munkahelyére érkező vendégeket a különféle szervekből nyert citológiai anyagok feldolgozásáról, diagnosztikára való előkészítéséről! Tájékoztatója során az alábbi szempontokra
Fejezetek a klinikai onkológiából
 Fejezetek a klinikai onkológiából Előadás jegyzet Szegedi Tudományegyetem Általános Orvosi Kar Onkoterápiás Klinika 2012. Az emlőrák komplex onkológiai kezelése Az emlőrák progresszív és heterogén betegség.
Fejezetek a klinikai onkológiából Előadás jegyzet Szegedi Tudományegyetem Általános Orvosi Kar Onkoterápiás Klinika 2012. Az emlőrák komplex onkológiai kezelése Az emlőrák progresszív és heterogén betegség.
SUPRACLAVICULARIS NYIROKCSOMÓ DAGANATOK DIFFERENCIÁLDIAGNOSZTIKÁJA CSAPDÁK
 SUPRACLAVICULARIS NYIROKCSOMÓ DAGANATOK DIFFERENCIÁLDIAGNOSZTIKÁJA CSAPDÁK Péter Ilona¹, Boér András² és Orosz Zsolt¹ Országos Onkológiai Intézet, Humán és Kísérletes Daganatpatológiai Osztály¹ és Fej-Nyak,
SUPRACLAVICULARIS NYIROKCSOMÓ DAGANATOK DIFFERENCIÁLDIAGNOSZTIKÁJA CSAPDÁK Péter Ilona¹, Boér András² és Orosz Zsolt¹ Országos Onkológiai Intézet, Humán és Kísérletes Daganatpatológiai Osztály¹ és Fej-Nyak,
Emlőbetegségek komplex diagnosztikája
 Emlőbetegségek komplex diagnosztikája Preoperatív citológiai-patológiai diagnosztika Dr. Hamar Sándor SZTE ÁOK Patológiai Intézet Emlőbetegségek diagnosztikája Az emlőbetegségek diagnosztikájában a nem
Emlőbetegségek komplex diagnosztikája Preoperatív citológiai-patológiai diagnosztika Dr. Hamar Sándor SZTE ÁOK Patológiai Intézet Emlőbetegségek diagnosztikája Az emlőbetegségek diagnosztikájában a nem
A.) Biopsziás mintavétel lehetőségei és a biopsziás anyagok kezelésével kapcsolatos tudnivalók.
 II./2.5. fejezet: Daganatok szövettani diagnosztikája Kulka Janina Ebben a fejezetben a daganatból történő szövettani mintavétel lehetőségeit és értékelését, illetve értékének korlátait, valamint a sebészeti
II./2.5. fejezet: Daganatok szövettani diagnosztikája Kulka Janina Ebben a fejezetben a daganatból történő szövettani mintavétel lehetőségeit és értékelését, illetve értékének korlátait, valamint a sebészeti
A terhesség és a laktáció alatt kialakult emlőrák sebészeti vonatkozásai
 A terhesség és a laktáció alatt kialakult emlőrák sebészeti vonatkozásai Maráz Róbert Bács-Kiskun Megyei Kórház Kecskemét Általános Sebészeti Osztály, Onkoradiológiai Központ A terhességi emlőrák a várandósság
A terhesség és a laktáció alatt kialakult emlőrák sebészeti vonatkozásai Maráz Róbert Bács-Kiskun Megyei Kórház Kecskemét Általános Sebészeti Osztály, Onkoradiológiai Központ A terhességi emlőrák a várandósság
Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán
 Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán Dr. Gelencsér Viktória, Dr. Boér Katalin Szent Margit Kórház, Onkológiai
Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán Dr. Gelencsér Viktória, Dr. Boér Katalin Szent Margit Kórház, Onkológiai
Daganatsebészet. Klinika onkológia kurzus. Dr. Végső Gyula
 Daganatsebészet Klinika onkológia kurzus Dr. Végső Gyula A daganatok komplex kezelése Sebészi kezelés Chemotherápia Sugártherápia Hormontherápia Biológiai (target) terápia Angiogenesis gátlás Rehabilitáció
Daganatsebészet Klinika onkológia kurzus Dr. Végső Gyula A daganatok komplex kezelése Sebészi kezelés Chemotherápia Sugártherápia Hormontherápia Biológiai (target) terápia Angiogenesis gátlás Rehabilitáció
Pajzsmirigy carcinomák nyaki nyirokcsomó metastasisainak percutan ethanol infiltrációs ( PEI ) kezelése
 Pajzsmirigy carcinomák nyaki nyirokcsomó metastasisainak percutan ethanol infiltrációs ( PEI ) kezelése Dr. Molnár Krisztián PTE Radiológiai Klinika Prof. Dr. Mezősi Emese PTE I. Belgyógyászati Klinika
Pajzsmirigy carcinomák nyaki nyirokcsomó metastasisainak percutan ethanol infiltrációs ( PEI ) kezelése Dr. Molnár Krisztián PTE Radiológiai Klinika Prof. Dr. Mezősi Emese PTE I. Belgyógyászati Klinika
A göbös pajzsmirigy kivizsgálása, ellátása. Mészáros Szilvia dr. Semmelweis Egyetem I. sz. Belgyógyászati Klinika
 A göbös pajzsmirigy kivizsgálása, ellátása Mészáros Szilvia dr. Semmelweis Egyetem I. sz. Belgyógyászati Klinika Pajzsmirigy göbök A lakosság 4-8%-ának van tapintható göbe. Ultrahanggal a lakosság közel
A göbös pajzsmirigy kivizsgálása, ellátása Mészáros Szilvia dr. Semmelweis Egyetem I. sz. Belgyógyászati Klinika Pajzsmirigy göbök A lakosság 4-8%-ának van tapintható göbe. Ultrahanggal a lakosság közel
Szcintimammográfia, sentinel nyirokcsomó vizsgálat emlő- és nőgyógyászati tumorokban, PET. dr. Schmidt Erzsébet PTE KK Nukleáris Medicina Intézet
 Szcintimammográfia, sentinel nyirokcsomó vizsgálat emlő- és nőgyógyászati tumorokban, PET dr. Schmidt Erzsébet PTE KK Nukleáris Medicina Intézet Tumorokban nem specifikus módon dúsuló radiofarmakonok -
Szcintimammográfia, sentinel nyirokcsomó vizsgálat emlő- és nőgyógyászati tumorokban, PET dr. Schmidt Erzsébet PTE KK Nukleáris Medicina Intézet Tumorokban nem specifikus módon dúsuló radiofarmakonok -
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a PD-L1 és PD-1 fehérjék túlélésre gyakorolt hatása
 Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
III./10.3. A hímvesszőrák. Bevezetés. A fejezet felépítése. A./ Etiológia. B./ Patológia. Nyirády Péter
 III./10.3. A hímvesszőrák Nyirády Péter A fejezet célja, hogy a hallgató megismerje a hímvesszőrák előfordulásával, diagnosztikájával és kezelésével kapcsolatos ismereteket. A fejezet elsajátítása során
III./10.3. A hímvesszőrák Nyirády Péter A fejezet célja, hogy a hallgató megismerje a hímvesszőrák előfordulásával, diagnosztikájával és kezelésével kapcsolatos ismereteket. A fejezet elsajátítása során
A tananyag tanulási egységei I. Általános elméleti onkológia I/1. Jelátviteli utak szerepe a daganatok kialakulásában I/2.
 A tananyag tanulási egységei I. Általános elméleti onkológia I/1. Jelátviteli utak szerepe a daganatok kialakulásában I/2. Vírusok szerepe a daganatok kialakulásában I/3. A környezet hatása a daganatok
A tananyag tanulási egységei I. Általános elméleti onkológia I/1. Jelátviteli utak szerepe a daganatok kialakulásában I/2. Vírusok szerepe a daganatok kialakulásában I/3. A környezet hatása a daganatok
Szemeszter 2014.I.félév Jelleg. Semmelweis Egyetem Továbbképzési Központ Akkr.pont 50. 2014.01.20 Vége 2014.01.24 Tanácsterem Napok 5.
 Tanfolyam adatlap Alapadatok Kódszám Főcím Állapot Szervező Partner SE- TK/2014.I./00079 Szemeszter 2014.I.félév Jelleg Daganatok és komplex terápiája A tanfolyam akkreditálásra került Országos Onkológiai
Tanfolyam adatlap Alapadatok Kódszám Főcím Állapot Szervező Partner SE- TK/2014.I./00079 Szemeszter 2014.I.félév Jelleg Daganatok és komplex terápiája A tanfolyam akkreditálásra került Országos Onkológiai
Szolid tumorok limfogén metasztázisainak vizsgálata
 EGYETEMI DOKTORI (Ph.D.) ÉRTEKEZÉS Szolid tumorok limfogén metasztázisainak vizsgálata az őrszemnyirokcsomó jelölés Dr. Tóth Dezső Témavezető: Prof. Dr. Damjanovich László DEBRECENI EGYETEM KLINIKAI ORVOSTUDOMÁNYOK
EGYETEMI DOKTORI (Ph.D.) ÉRTEKEZÉS Szolid tumorok limfogén metasztázisainak vizsgálata az őrszemnyirokcsomó jelölés Dr. Tóth Dezső Témavezető: Prof. Dr. Damjanovich László DEBRECENI EGYETEM KLINIKAI ORVOSTUDOMÁNYOK
1. Emlődaganatok neoadjuváns kezelésének hatása a műtéti technikára Témavezető: Dr. Harsányi László PhD egyetemi docens
 SZAKDOLGOZAT TÉMAJAVASLATOK A 2012/2013 tanévre Semmelweis Egyetem Általános Orvostudományi Kar I. sz. Sebészeti Klinika SEBÉSZET 1. Emlődaganatok neoadjuváns kezelésének hatása a műtéti technikára 2.
SZAKDOLGOZAT TÉMAJAVASLATOK A 2012/2013 tanévre Semmelweis Egyetem Általános Orvostudományi Kar I. sz. Sebészeti Klinika SEBÉSZET 1. Emlődaganatok neoadjuváns kezelésének hatása a műtéti technikára 2.
A korai emlőrák lokoregionális kezelésének fejlődése
 A korai emlőrák tudományos bizonyítékon alapuló lokoregionális kezelése Polgár Csaba Országos Onkológiai Intézet, Sugárterápiás Központ; Semmelweis Egyetem, ÁOK, Onkológiai Tanszék A korai emlőrák lokoregionális
A korai emlőrák tudományos bizonyítékon alapuló lokoregionális kezelése Polgár Csaba Országos Onkológiai Intézet, Sugárterápiás Központ; Semmelweis Egyetem, ÁOK, Onkológiai Tanszék A korai emlőrák lokoregionális
Magyar ILCO Szövetség. 7400 Kaposvár, Szent Imre u. 14. Alapítva 1983.
 Magyar ILCO Szövetség 7400 Kaposvár, Szent Imre u. 14. Alapítva 1983. Komplex kezelés Szűrés A felismert daganatos beteg kivizsgálása Labor Colonoscópia Szövettan RTG UH CT MR Neoadjuvans kezelés Komplex
Magyar ILCO Szövetség 7400 Kaposvár, Szent Imre u. 14. Alapítva 1983. Komplex kezelés Szűrés A felismert daganatos beteg kivizsgálása Labor Colonoscópia Szövettan RTG UH CT MR Neoadjuvans kezelés Komplex
Fejezetek a klinikai onkológiából
 Fejezetek a klinikai onkológiából Előadás jegyzet Szegedi Tudományegyetem Általános Orvosi Kar Onkoterápiás Klinika 2012. A patológiai, képalkotó és laboratóriumi diagnosztika jelentősége az onkológiában.
Fejezetek a klinikai onkológiából Előadás jegyzet Szegedi Tudományegyetem Általános Orvosi Kar Onkoterápiás Klinika 2012. A patológiai, képalkotó és laboratóriumi diagnosztika jelentősége az onkológiában.
MODERN KÉPALKOTÓ DIAGNOSZTIKA, PATOLÓGIAI-RADIOLÓGIAI ELEMZÉS
 MODERN KÉPALKOTÓ DIAGNOSZTIKA, PATOLÓGIAI-RADIOLÓGIAI ELEMZÉS Dr. Ormándi Katalin Affidea Diagnosztika, SZTE Radiológiai Klinika Szeged KÖTELEZİ SZINTENTARTÓ TANFOLYAM KLINIKAI ONKOLÓGIÁBÓL, SUGÁRTERÁPIÁBÓL
MODERN KÉPALKOTÓ DIAGNOSZTIKA, PATOLÓGIAI-RADIOLÓGIAI ELEMZÉS Dr. Ormándi Katalin Affidea Diagnosztika, SZTE Radiológiai Klinika Szeged KÖTELEZİ SZINTENTARTÓ TANFOLYAM KLINIKAI ONKOLÓGIÁBÓL, SUGÁRTERÁPIÁBÓL
Jelentkezési hat.idő 2011.03.01. Sorsz. Nap Időpont Hossz Előadás címe Előadó Minősítése
 Tanfolyam adatlap Kódszám SE-TK/2011.I./00339 Szemeszter 2011.I.félév Jelleg Kötelezően választható Főcím Állapot A nőgyógyászati daganatok korai diagnosztikája és komplex kezelése. Kolposzkópos tanfolyam
Tanfolyam adatlap Kódszám SE-TK/2011.I./00339 Szemeszter 2011.I.félév Jelleg Kötelezően választható Főcím Állapot A nőgyógyászati daganatok korai diagnosztikája és komplex kezelése. Kolposzkópos tanfolyam
JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ. Onkológiai szakápoló szakképesítés. 3155-10 Onkológiai szakápolás modul. 1. vizsgafeladat. 2012. szeptember 11.
 Emberi Erőforrások Minisztériuma Érvényességi idő: az írásbeli vizsgatevékenység befejezésének időpontjáig A minősítő neve: Rauh Edit A minősítő beosztása: mb. főigazgató-helyettes JAVÍTÁSI-ÉRTÉKELÉSI
Emberi Erőforrások Minisztériuma Érvényességi idő: az írásbeli vizsgatevékenység befejezésének időpontjáig A minősítő neve: Rauh Edit A minősítő beosztása: mb. főigazgató-helyettes JAVÍTÁSI-ÉRTÉKELÉSI
1. eset. Dr. Strausz Tamás Országos Onkológiai Intézet Sebészeti és Molekuláris Patológiai Osztály
 1. eset Dr. Strausz Tamás Országos Onkológiai Intézet Sebészeti és Molekuláris Patológiai Osztály Anamnézis 42 éves férfi véres széklet hátterében más intézetben az anustól3 cm-re kezdődően 11-12 cm hosszan
1. eset Dr. Strausz Tamás Országos Onkológiai Intézet Sebészeti és Molekuláris Patológiai Osztály Anamnézis 42 éves férfi véres széklet hátterében más intézetben az anustól3 cm-re kezdődően 11-12 cm hosszan
Szemeszter 2015.I.félév Jelleg
 Tanfolyam adatlap Alapadatok Kódszám Főcím Állapot Szervező Partner Szemeszter 2015.I.félév Jelleg Szabadon választható SE- TK/2015.I./00099 Daganatok és komplex terápiája A tanfolyamot az EEKH elfogadta,
Tanfolyam adatlap Alapadatok Kódszám Főcím Állapot Szervező Partner Szemeszter 2015.I.félév Jelleg Szabadon választható SE- TK/2015.I./00099 Daganatok és komplex terápiája A tanfolyamot az EEKH elfogadta,
Klinikai Központ Elnök. A Semmelweis Egyetem K l i n i k a i K ö z p o n t E l n ö k é n e k 1/2017. (I.30.) számú U T A S Í T Á S A
 Ikt.szám:10230/KLINK/2017 egészségügyi szolgáltató jellegére, társadalmi felelősségvállalására, valamint a lakosság egészségi állapota iránt érzett felelősségére tekintettel, orvosszakmai szempontok messze
Ikt.szám:10230/KLINK/2017 egészségügyi szolgáltató jellegére, társadalmi felelősségvállalására, valamint a lakosság egészségi állapota iránt érzett felelősségére tekintettel, orvosszakmai szempontok messze
Egyetemi doktori (Ph.D.) értekezés tézisei SZOLID TUMOROK LIMFOGÉN METASZTÁZISAINAK VIZSGÁLATA. Dr. Tóth Dezső
 Egyetemi doktori (Ph.D.) értekezés tézisei SZOLID TUMOROK LIMFOGÉN METASZTÁZISAINAK VIZSGÁLATA AZ ŐRSZEMNYIROKCSOMÓ JELÖLÉS Dr. Tóth Dezső Témavezető: Prof. Dr. Damjanovich László DEBRECENI EGYETEM Klinikai
Egyetemi doktori (Ph.D.) értekezés tézisei SZOLID TUMOROK LIMFOGÉN METASZTÁZISAINAK VIZSGÁLATA AZ ŐRSZEMNYIROKCSOMÓ JELÖLÉS Dr. Tóth Dezső Témavezető: Prof. Dr. Damjanovich László DEBRECENI EGYETEM Klinikai
A sejt és szövettani diagnosztika modern eszközei a diagnosztikában és terápiában. Cifra János. Tolna Megyei Balassa János Kórház, Pathologia Osztály
 A sejt és szövettani diagnosztika modern eszközei a diagnosztikában és terápiában Cifra János Tolna Megyei Balassa János Kórház, Pathologia Osztály Szekszárd 2016. Május 6. Patológus feladatai Preoperatív
A sejt és szövettani diagnosztika modern eszközei a diagnosztikában és terápiában Cifra János Tolna Megyei Balassa János Kórház, Pathologia Osztály Szekszárd 2016. Május 6. Patológus feladatai Preoperatív
2354-06 Nőgyógyászati citodiagnosztika követelménymodul szóbeli vizsgafeladatai
 1. feladat A laboratóriumba vendég érkezik. Tájékoztassa a rákmegelőzés lehetőségeiről! Ismertesse a citológiai előszűrő vizsgálatok lényegét! - a primer és szekunder prevenció fogalma, eszközei - a citológia
1. feladat A laboratóriumba vendég érkezik. Tájékoztassa a rákmegelőzés lehetőségeiről! Ismertesse a citológiai előszűrő vizsgálatok lényegét! - a primer és szekunder prevenció fogalma, eszközei - a citológia
III./9.6. Vulva daganatai. Bevezetés. A fejezet felépítése. A.) Panaszok. B.) Anamnézis. Tömösváry Zoltán, Langmár Zoltán, Bánhidy Ferenc
 III./9.6. Vulva daganatai Tömösváry Zoltán, Langmár Zoltán, Bánhidy Ferenc A fejezet célja a szeméremtest daganatai közül a rosszindulatú daganatok ismertetetése. Egy beteg bemutatásán keresztül körüljárjuk,
III./9.6. Vulva daganatai Tömösváry Zoltán, Langmár Zoltán, Bánhidy Ferenc A fejezet célja a szeméremtest daganatai közül a rosszindulatú daganatok ismertetetése. Egy beteg bemutatásán keresztül körüljárjuk,
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése
 Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
Eredményes temozolamid kezelés 2 esete glioblasztómás betegeknél
 Eredményes temozolamid kezelés 2 esete glioblasztómás betegeknél Dr. Mangel László 1,2, Prof. Dr. Dóczi Tamás 3, Dr. Balogh Zsolt 4, Dr. Lövey József 2, Dr. Sipos László 5 Pécsi Tudományegyetem, Onkoterápiás
Eredményes temozolamid kezelés 2 esete glioblasztómás betegeknél Dr. Mangel László 1,2, Prof. Dr. Dóczi Tamás 3, Dr. Balogh Zsolt 4, Dr. Lövey József 2, Dr. Sipos László 5 Pécsi Tudományegyetem, Onkoterápiás
San Antonio Breast Cancer Symposium. Dr. Tőkés Tímea
 San Antonio Breast Cancer Symposium Dr. Tőkés Tímea San Antonio, Texas, USA Henry B. Gonzalez Convention Center December 10-14, 2013 SABCS 2013 Több, mint 7500 résztvevő, több, mint 70 országból Továbbképzések,
San Antonio Breast Cancer Symposium Dr. Tőkés Tímea San Antonio, Texas, USA Henry B. Gonzalez Convention Center December 10-14, 2013 SABCS 2013 Több, mint 7500 résztvevő, több, mint 70 országból Továbbképzések,
Esetismertetés II. Dr. Bekő Gabriella Uzsoki Kórház Központi Laboratórium 2013.11.08.
 Esetismertetés II. Dr. Bekő Gabriella Uzsoki Kórház Központi Laboratórium 2013.11.08. Anamnézis K.Z-né 51 éves nőbeteg Egyéb irányú orvosi beavatkozás során osteoporosis szakrendelésen észlelték hypercalcaemiáját
Esetismertetés II. Dr. Bekő Gabriella Uzsoki Kórház Központi Laboratórium 2013.11.08. Anamnézis K.Z-né 51 éves nőbeteg Egyéb irányú orvosi beavatkozás során osteoporosis szakrendelésen észlelték hypercalcaemiáját
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend)
 A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
EMLŐDAGANATOK KOMPLEX DIAGNOSZTIKÁJA, KEZELÉSE. Szeged, 2013. október 17. Dr. Valicsek Erzsébet SZTE Onkoterápiás Klinika
 EMLŐDAGANATOK KOMPLEX DIAGNOSZTIKÁJA, KEZELÉSE Szeged, 2013. október 17. Dr. Valicsek Erzsébet SZTE Onkoterápiás Klinika AZ EMLŐRÁK ETIOLÓGIÁJA A nők leggyakoribb rosszindulatú daganata Az összes carcinoma
EMLŐDAGANATOK KOMPLEX DIAGNOSZTIKÁJA, KEZELÉSE Szeged, 2013. október 17. Dr. Valicsek Erzsébet SZTE Onkoterápiás Klinika AZ EMLŐRÁK ETIOLÓGIÁJA A nők leggyakoribb rosszindulatú daganata Az összes carcinoma
Gasztrointesztinális tumorok. Esetbemutatások
 Gasztrointesztinális tumorok Esetbemutatások 1. Eset: 54 éves férfibeteg 1997 jul.-ban sigma tumor miatt sigma resectio. Szövettan: adenocc. G3, pt3, pn0 (5 nyirokcsomóból) pn0, kevés eltávolított nycs.
Gasztrointesztinális tumorok Esetbemutatások 1. Eset: 54 éves férfibeteg 1997 jul.-ban sigma tumor miatt sigma resectio. Szövettan: adenocc. G3, pt3, pn0 (5 nyirokcsomóból) pn0, kevés eltávolított nycs.
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja
 A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési
OPPONENSI VÉLEMÉNY. Dr. Lakatos Péter László köztestületi azonosító: 15893 az MTA Doktora cím elnyerése érdekében benyújtott,
 OPPONENSI VÉLEMÉNY Dr. Lakatos Péter László köztestületi azonosító: 15893 az MTA Doktora cím elnyerése érdekében benyújtott, GENETIKAI, SZEROLÓGIAI ÉS KLINIKAI TÉNYEZŐK SZEREPE A GYULLADÁSOS BÉLBETEGSÉGEK
OPPONENSI VÉLEMÉNY Dr. Lakatos Péter László köztestületi azonosító: 15893 az MTA Doktora cím elnyerése érdekében benyújtott, GENETIKAI, SZEROLÓGIAI ÉS KLINIKAI TÉNYEZŐK SZEREPE A GYULLADÁSOS BÉLBETEGSÉGEK
MULTIDISCIPLINARIS ONKOLÓGIA
 MULTIDISCIPLINARIS ONKOLÓGIA 2011. szeptember 5-9. Országos Onkológiai Intézet Kötelező szintentartó tanfolyam onkológus és sugárterápiás szakorvosoknak PATOLÓGUS NAP KÉPALKOTÓ NAP SEBÉSZETI NAP KEMOTERÁPIÁS
MULTIDISCIPLINARIS ONKOLÓGIA 2011. szeptember 5-9. Országos Onkológiai Intézet Kötelező szintentartó tanfolyam onkológus és sugárterápiás szakorvosoknak PATOLÓGUS NAP KÉPALKOTÓ NAP SEBÉSZETI NAP KEMOTERÁPIÁS
III./12.4. Lágyrészdaganatok
 III./12.4. Lágyrészdaganatok Szendrői Miklós, Perlaky Tamás, Pápai Zsuzsa Ebben a tanulási egységben a lágyrész daganatok klinikai tüneteinek, diagnosztikai algoritmusának, valamint a kezelési lehetőségek
III./12.4. Lágyrészdaganatok Szendrői Miklós, Perlaky Tamás, Pápai Zsuzsa Ebben a tanulási egységben a lágyrész daganatok klinikai tüneteinek, diagnosztikai algoritmusának, valamint a kezelési lehetőségek
NŐGYÓGYÁSZATI DAGANATSEBÉSZET
 NŐGYÓGYÁSZATI DAGANATSEBÉSZET A SZEMÉREMTEST KRÓNIKUS BŐRBETEGSÉGEI 1. Szeméremtest és hüvely daganat megelőző állapotai (etiológia, diagnosztika, terápia) 2. A méhnyak rákmegelőző állapota (CIN) 3. Méhnyak
NŐGYÓGYÁSZATI DAGANATSEBÉSZET A SZEMÉREMTEST KRÓNIKUS BŐRBETEGSÉGEI 1. Szeméremtest és hüvely daganat megelőző állapotai (etiológia, diagnosztika, terápia) 2. A méhnyak rákmegelőző állapota (CIN) 3. Méhnyak
Tanfolyami órák Jelentkezési hat.idő 2013.01.11. www.oncol.hu. Sorsz. Nap Időpont Hossz Előadás címe Előadó Minősítése
 Tanfolyam adatlap Alapadatok Kódszám SE- TK/2013.I./00025 Szemeszter 2013.I.félév Jelleg Főcím Daganatok és komplex terápiája Állapot Tanfolyam adatok még változtathatóak a szervező által Szervező Országos
Tanfolyam adatlap Alapadatok Kódszám SE- TK/2013.I./00025 Szemeszter 2013.I.félév Jelleg Főcím Daganatok és komplex terápiája Állapot Tanfolyam adatok még változtathatóak a szervező által Szervező Országos
III./8.2. Korai emlőrák
 III./8.2. Korai emlőrák Kocsis Judit A fejezet a korai emlődaganatok diagnosztikáját és terápiás ellátási algoritmusát tárgyalja egy típusos eset bemutatásán keresztül. A fejezet tanulmányozása után a
III./8.2. Korai emlőrák Kocsis Judit A fejezet a korai emlődaganatok diagnosztikáját és terápiás ellátási algoritmusát tárgyalja egy típusos eset bemutatásán keresztül. A fejezet tanulmányozása után a
Mit is csinál pontosan a patológus?
 Szász A. Marcell Mit is csinál pontosan a patológus? Ceglédi Kossuth Lajos Gimnázium Cegléd, 2015. március 19. www.meetthescientist.hu 1 26 Google - patológus www.meetthescientist.hu 2 26 Google - patológia
Szász A. Marcell Mit is csinál pontosan a patológus? Ceglédi Kossuth Lajos Gimnázium Cegléd, 2015. március 19. www.meetthescientist.hu 1 26 Google - patológus www.meetthescientist.hu 2 26 Google - patológia
A nőgyógyászati daganatok korai diagnosztikája és komplex kezelése. Kolposzkópos tanfolyam A tanfolyam akkreditálásra került
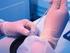 Tanfolyam adatlap Alapadatok Kódszám Főcím Állapot Szervező Partner Célcsoport SE- Szabadon Szemeszter 2017.I.félév Jelleg TK/2017.I./00259 választható A nőgyógyászati daganatok korai diagnosztikája és
Tanfolyam adatlap Alapadatok Kódszám Főcím Állapot Szervező Partner Célcsoport SE- Szabadon Szemeszter 2017.I.félév Jelleg TK/2017.I./00259 választható A nőgyógyászati daganatok korai diagnosztikája és
Regionális onkológiai centrum fejlesztése a markusovszky kórházban
 Regionális onkológiai centrum fejlesztése a markusovszky kórházban Regionális onkológiai centrum fejlesztése TIOp-2.2.6-12/1a-2013-0002 A megvalósult Fejlesztés célja: olyan komprehenzív Regionális Onkológiai
Regionális onkológiai centrum fejlesztése a markusovszky kórházban Regionális onkológiai centrum fejlesztése TIOp-2.2.6-12/1a-2013-0002 A megvalósult Fejlesztés célja: olyan komprehenzív Regionális Onkológiai
Immunológia I. 2. előadás. Kacskovics Imre (imre.kacskovics@ttk.elte.hu)
 Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Semmelweis Egyetem Urológiai Klinika Budapest. European Board of Urology Certified Department
 Nem-izominvazív hólyagrák terápiája Dr. Riesz Péter Semmelweis Egyetem Urológiai Klinika Budapest European Board of Urology Certified Department A hólyagrák halálozása Magyarországon Halálesetek száma
Nem-izominvazív hólyagrák terápiája Dr. Riesz Péter Semmelweis Egyetem Urológiai Klinika Budapest European Board of Urology Certified Department A hólyagrák halálozása Magyarországon Halálesetek száma
67. Pathologus Kongresszus
 A kemoirradiáció okozta oncocytás átalakulás szövettani, immunhisztokémiai, ultrastruktúrális jellemzői és lehetséges prognosztikus jelentősége rectum adenocarcinomákban 67. Pathologus Kongresszus Bogner
A kemoirradiáció okozta oncocytás átalakulás szövettani, immunhisztokémiai, ultrastruktúrális jellemzői és lehetséges prognosztikus jelentősége rectum adenocarcinomákban 67. Pathologus Kongresszus Bogner
Leukocyta scintigraphia - a gyulladásos bélbetegségek noninvazív vizsgálómódszereinek gold standard - je?
 Leukocyta scintigraphia - a gyulladásos bélbetegségek noninvazív vizsgálómódszereinek gold standard - je? Bevezetés Dr. Salamon Ágnes Szekszárd A gyulladásos bélbetegségek (inflammatory bowel diseases,
Leukocyta scintigraphia - a gyulladásos bélbetegségek noninvazív vizsgálómódszereinek gold standard - je? Bevezetés Dr. Salamon Ágnes Szekszárd A gyulladásos bélbetegségek (inflammatory bowel diseases,
MAGYOT évi Tudományos Szimpóziuma Május 5-6, Budapest
 MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
Országos Onkológiai Intézet, Sugárterápiás Centrum 2. Országos Onkológiai Intézet, Nukleáris Medicina Osztály 4
 99m Tc-MDP hatására kialakuló dózistér mérése csontszcintigráfia esetén a beteg közvetlen közelében Király R. 1, Pesznyák Cs. 1,2,Sinkovics I. 3, Kanyár B. 4 1 Országos Onkológiai Intézet, Sugárterápiás
99m Tc-MDP hatására kialakuló dózistér mérése csontszcintigráfia esetén a beteg közvetlen közelében Király R. 1, Pesznyák Cs. 1,2,Sinkovics I. 3, Kanyár B. 4 1 Országos Onkológiai Intézet, Sugárterápiás
Lehetőségek és korlátok a core-biopszián alapuló limfóma diagnosztikában
 Lehetőségek és korlátok a core-biopszián alapuló limfóma diagnosztikában Strausz Tamás Tóth Erika Országos Onkológiai Intézet Sebészeti és Molekuláris Patológiai Osztály FiPaT 2012 Elvi alapok WHO klasszifikáció
Lehetőségek és korlátok a core-biopszián alapuló limfóma diagnosztikában Strausz Tamás Tóth Erika Országos Onkológiai Intézet Sebészeti és Molekuláris Patológiai Osztály FiPaT 2012 Elvi alapok WHO klasszifikáció
Kreditpontos. Laparoszkópos varrástanfolyam. 2012. október 8 20.
 Kreditpontos laparoszkópos tanfolyamok 2012. október 8 20. Semmelweis Egyetem Kísérletes és Sebészeti Műtéttani Intézet George Berci Laparoszkópos Tréning Centrum Herceghalom Október 8-9. Október 10-11.
Kreditpontos laparoszkópos tanfolyamok 2012. október 8 20. Semmelweis Egyetem Kísérletes és Sebészeti Műtéttani Intézet George Berci Laparoszkópos Tréning Centrum Herceghalom Október 8-9. Október 10-11.
LAM-TUDOMÁNY TOVÁBBKÉPZÉS A TÁRSSZAKMÁK HALADÁSA 18 LAM 2002;12(1):18-26.
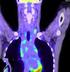 TOVÁBBKÉPZÉS A TÁRSSZAKMÁK HALADÁSA Az ôrszemnyirokcsomó-biopszia jelentôsége a daganatsebészetben Péley Gábor, Köves István, Sinkovics István, Farkas Emil, Dubecz Sándor, Kovács Tibor, Keresztes Sándor,
TOVÁBBKÉPZÉS A TÁRSSZAKMÁK HALADÁSA Az ôrszemnyirokcsomó-biopszia jelentôsége a daganatsebészetben Péley Gábor, Köves István, Sinkovics István, Farkas Emil, Dubecz Sándor, Kovács Tibor, Keresztes Sándor,
Sugárterápia minőségbiztosításának alapelvei Dr. Szabó Imre (DE OEC Onkológiai Intézet)
 Sugárterápia minőségbiztosításának alapelvei Dr. Szabó Imre (DE OEC Onkológiai Intézet) I. Irányelvek WHO 1988: Mindazon tevékenység, amely biztosítja a céltérfogatra leadott megfelelő sugárdózist az ép
Sugárterápia minőségbiztosításának alapelvei Dr. Szabó Imre (DE OEC Onkológiai Intézet) I. Irányelvek WHO 1988: Mindazon tevékenység, amely biztosítja a céltérfogatra leadott megfelelő sugárdózist az ép
