A fehérjék szerkezetét fenntartó kölcsönhatások
|
|
|
- Ilona Bogdán
- 5 évvel ezelőtt
- Látták:
Átírás
1 A fehérjék szerkezetét fenntartó kölcsönhatások Bionanorendszerek A fehérjék szerkezetét fenntartó kölcsönhatások alapvetően négy nagyobb csoportba oszthatók: 1. elektrosztatikus kölcsönhatások (sóhíd: 4-6 kcal/m, dipól-dipól ~ 10-1 kcal/m) 2. diszperziós erők (10-2 kcal/m) 3. H-hidak (2-4 kcal/m) 4. hidrofób kölcsönhatások (-24 cal/m/å 2 ) 1.Elektrosztatikus kölcsönhatások Az elektrosztatikus kölcsönhatásokat alapvetően a Coulomb törvény írja le. Ez mondja meg, hogy két töltés között mekkora erő ébred. SI rendszer szerint: F: erő [N] Q 1, Q 2 : töltésmennyiség [C] F = 1 4πε Q Q 1 2 r 2 r: távolság [m] ε: vákuum permittivitása (vákuum dielektromos állandója) K = 1 4 πε arányossági tényező A képletből is látni, hogy az F erő fordítottan arányos az r távolság négyzetével. A fehérjékben is vannak töltött csoportok, s ezek kétfélék lehetnek. Az egyik amikor megjelennek eredő töltések, ugyanis vannak olyan oldalláncok amelyek fiziológiás körülmények között ionizáltak, s ezek között alakulnak ki az úgynevezett sóhidak. (pl.: lizin-arginin oldallánc protonált -> pozitívan töltött ; gutadin-aszparagin sav lead egy protont, így negatívan töltött) Egy elektronnyi töltés van az oldalláncokon, és ha ezek térben elég közel kerülnek, akkor 1
2 számottevő kölcsönhatás léphet fel közöttük. Előfordulhat az is, hogy egy fehérje belsejében töltés van, s akkor annak van egy párja is, ami valójában sóhidat képez, és ilyenkor a Coulomb törvény alapján ki lehet számolni az erőt és a kölcsönhatást. Jellemzőjük még,hogy erősek és kevés van belőlük. Dipól-dipól kölcsönhatások A dipólus egy olyan töltéselrendeződés, hogy az eredő töltés nulla, de van egy töltéseloszlás a molekulán belül. Amikor két dipólusmolekula közel kerül egymáshoz, az azonos töltésű pólusok vonzani, az ellentétesek taszítani kezdik egymást. A kölcsönhatás eredményeképpen vagy ellentétes töltésű végükkel illeszkednek egymáshoz, vagy párhuzamosan állnak be. Minden peptidcsoport is dipólusként viselkedik. Ezeknek gyengébb az energiája, mivel a részleges töltések kisebbek, s ellentétes hatások érvényesülnek. A dipólusoknál a távolságfüggés is meredekebben csökken, ebből adódóan több van belőlük, mint sóhidakból. A víznek is erős dipólmomentuma van, ha kitekerem a láncot, akkor a vízben is ki tudnak dipól-dipól kölcsönhatások alakulni. 2. Diszperziós erők A diszperziós erők is valahol elektrosztatikus jellegűek, de ezek már úgy is létrejöhetnek, hogy parciális töltések nincsenek. Szokták úgy is hívni,hogy indukált dipól-dipól kölcsönhatás. Sokkal gyengébb mint az elektrosztatikus,mert véletlen folyamatok révén egymást mindig egy kicsit orientálják. Mindig egy vonzó kölcsönhatás, ami akkor a leggyengébb ha mind a két partner olyan,hogy nincsen állandó dipólmomentuma. 2
3 Lenard- Jones potenciál : Bionanorendszerek Olyan potenciál, ami közelítő leírást ad a molekulák potenciális energia kölcsönhatásáról (V), a molekulák közti távolság (r), függvényében. Az általános formája: V = C n r C 6 n r 6 ahol C n és C 6 az adott molekulától függő koefficiensek, n nagyobb 6-nál, úgy, hogy a kis távolságoknál a taszító kifejezés dominál a kölcsönhatásokban, lévén az r -6 kifejezés a vonzó. A választott érték gyakran n=12. Ebben az esetben a Lennard Jones-potenciál a következő: V =4W r 0 r 12 r 0 r 6 ahol W, a potenciálgödör mélysége, r 0 az a távolság, amelynél V=0. A potenciálgödör minimum értéke a r e =2 1/6 r 0 távolságnál van. A kölcsönhatás taszítás részének 1/r 12 -vel történő kifejezése nem reális, sokkal reálisabb az exponenciális kifejezés: exp(-r/r 0 ). elektorsztatikus + diszperziós kölcsönhatás Van der Waals kölcsönhatás Ezek az erők sokkal gyengébbek a vegyértékkötésből származó erőknél, és fordítottan arányosak az atomok vagy molekulák közötti távolság hetedik hatványával. Ezek az erők, okozzák a gázok ideálistól eltérő viselkedését és a molekularácsos kristályok rácsenergiáját. Háromféle kölcsönhatás eredményeként jönnek létre: (1) dipól-dipól kölcsönhatás, azaz elektrosztatikus vonzás két állandó dipólusmomentummal rendelkező molekula között; (2) dipólus-indukált dipólus kölcsönhatás, amelyben az egyik molekula dipólusa polarizálja a szomszédos molekulát; (3) diszperziós erők, amelyek az atomok kis, pillanatszerű dipólusából származnak. E r = A r 12 B r C q q r 3
4 3. H-hidak Egy erős dipólus-dipólus kölcsönhatásnak tekinthető, amelyet az elektronegatív atom, elektron-visszatartó képessége hoz létre. Egyfajta átmenet az elektorsztatikus és a kovalens kölcsönhatás között, amit az is mutat, hogy pl. a peptid csoport karboxilcsoportja, ha közelébe kerül egy másik peptid aminocsoportjához, akkor kialakul egy úgynevezett H-híd. A részleges kovalens kötést onnan is lehet látni,hogy ennek a tipikus távolsága 1,9 Å. Az energia erősen függ attól, hogy milyen elrendezésben vannak az atomok. Akkora a legnagyobb, ha lineáris az elrendeződésük. Más esetben is stabilizáltak, de gyengébb a kölcsönhatás. Akkor alakul ki H-híd, ha egyrészt van egy akceptor atom, ami egy erős elektronegativitású atom vagy csoport, mely lehet O, N, S A donorok gyakorlatilag ugyanezek protonálva: OH, NH, NH 2, SH csoporttal. Ezek lehetnek peptid, oldalláncok vagy lehet vegyesen H-hidak között. A víz is ki tud alakítani H-hidakat ezekkel a fehérjecsoportokkal. (Szerkezetében alapvető fontosságú.) A hidrogénkötés erőssége körülbelül az egytizede a kovalens kötés erősségének. A hidrogénkötés nagy hatással van a fizikai tulajdonságokra, ez okozza a víz különleges tulajdonságait, a H 2 O, HF és az NH 3 viszonylagosan magas olvadáspontját (H 2 S, HCl és PH 3 -hoz viszonyítva). Nagy fontosságú az élő szervezetekben is. Hidrogénkötés található a DNS láncok bázisai között. Előfordul a fehérjékben a C=O és N-H csoportok között, és ez felel a másodlagos szerkezet fenntartásáért. A hidrogénkötések nem kizárólagosan elektrosztatikusak, kimutatható hogy van némi kovalens jellegük. 4
5 Víz A vízmolekulában az oxigénatom magához vonzza az elektronokat az O-H kötésekben. A hidrogén atomban nincs az elektronoknak belső héja, ami leárnyékolná a magot, így elektrosztatikus hatás jön létre a mag és a szomszédos molekula oxigénatom magányos elektronpárja között. Minden oxigénatomnak két magányos elektronpárja van, így két különböző hidrogénatommal képes hidrogénkötést létrehozni. Két irányból is tud H-hidakat fogadni és két irányból is tud H-t berakni H-hidba. A víz nagyon erős dipólmomentummal rendelkezik. Molekulájában jelentős töltésszeparáció figyelhető meg. Rövid távú lokális rendezettsége hasonlít a jégre. A víz szerkezetében mindig ott vannak a H-hidak. 4.Hidrofob kölcsönhatások Azzal kapcsolatos,hogy hogy viselkednek a vízben más molekulák, hogy viselkednek apoláros molekulák a vízben. (pl. forró vízben olaj...miért szeretik egymást az olajrészecskék? ) Mindenki tapasztalhatta, hogy forró vízbe olajat cseppentve, olajfolt keletkezik a víz tetején, vagyis az olajmolekulák nem oszlanak el szépen a vízben. De mi ennek az oka? Úgy tűnik, hogy az olajrészecskék valamiért szeretik egymást, s egy helyre mennek. De miért van ez? Gondolhatjuk, hogy biztos van köztük valami nagyon kedvező kölcsönhatás, és ez kedvezőbb mint vízzel, ezért vonzzák egymást. Ha megnézzük az olajrészecskék tulajdonságait, akkor látjuk,hogy apoláros molekulák, tehát nincs töltésszeparáció, nincs dipólmomentum, amit tudnak egymást közt kölcsönhatást csinálni az maximum a diszperziós erő, de ez a lehető leggyengébb kölcsönhatás. Ha kiszemelek egy olajmolekulát és a vizet, akkor sokkal nagyobb lesz a kölcsönhatás, hiszen a víznek van egy állandó nagy dipólmomentuma, s az jóval nagyobb indukált dipólmomentumot hoz létre az olajmolekulán, mint két olajmolekula egymásban. Ebből azt gondolnánk, hogy az a jó, ha eloszlik a vízben, hiszen így számottevő kölcsönhatás lesz benne, mert ha egy kupacban maradnak, akkor gyakorlatilag nincs közöttük kölcsönhatás. A tapasztalat mégis azt mutatja,hogy összemennek egy helyre. De akkor mi az ok? Ennek valójában nem energetikai oka van, hanem az entrópiával magyarázható. Entrópia: adott folyamat hányféleképpen valósítható meg mikróállapoton keresztül. (mikróállapot: adott atomok hányféleképpen helyezkedhetnek el.) 5
6 S ~ - ln N, ahol N a mikróállapotok száma, S az entrópia ΔG = ΔH TΔS, ahol ΔG, a Gibbs-féle szabadenergia, ΔH a kötési energia, T az abszolút hőmérséklet, ΔS az entrópia Hogy egy makroszkopikus folyamat lejátszódik-e, azt nem csak az energiától függ, hanem az úgynevezett szabadenergia változás mondja meg, hogy merre megy egy folyamat. Vagyis a folyamatok irányát két dolog szabja meg, vagy az, hogy energetikailag kedvezőbbek, vagy az hogy, többféleképpen megvalósíthatók. Visszatérve a hidrofób kölcsönhatásra láthatjuk, hogy ott nem a kötési energia, hanem az entrópikus tag a fontos. Ha valaki egy apoláros molekulát vízbe diszpergál, akkor a mérések azt mutatják, hogy ekörül kialakul egy néhány rétegnyi rendezett hidrát burok. Oka: az apoláros molekula nem tud H-hidat kialakítani, s ez azt eredményezi, hogy azok a vízmolekulák, melyek az apoláros molekula környezetében vannak, abba az irányba nem tudnak H-hidat kialakítani. A többi irányba megnő a H-híd képző képességük (nincsen lefoglalva), lesz 2-3 molekulányi része ahol rendezettebb lesz a víz és kialakul a hidrát burok. Ez mit eredményez? Ha elosztom az apoláros anyagomat a vízben molekulánként, akkor mindegyik körül kialakul egy hidrát burok, lényegében minden egyes apoláros molekula egy tucat vízmolekulát rendezettebbé tett. Összességében nagyon sok vízmolekula rendeződik, vagyis a víz entrópiája csökken, kedvezőtlenné válik. Ha ezeket az apoláros molekulákat összehozom egy nagy apoláros fórba, akkor ekörül is kialakul a burok, de kevesebb a rendezett vízmolekulák száma. 6
7 Fehérjék stabilitása A fehérjék térszerkezetének kialakításában és rögzítésében nagy szerepe van a fentebb említett hidrofób kölcsönhatásoknak. Ez valójában nem is annyira a CH csoportok közötti van der Waals vonzásra, hanem inkább a víz taszító szerepére vezethető vissza. A vizes közeg kiszorítja magából az apoláros CH csoportokat, s ezért ezek egymás közelében helyezkednek el, egymáshoz tapadnak. Ez a hatás a következőképpen magyarázható. A vizes közegbe merülő CH láncot a vízmolekulák hidrogénhíd kötésekkel összetartott szabályos szerkezetű burka veszi körül. Ez a kalitkaszerű, szinte kristályosan szabályos elrendeződés akadályozza a vízmolekulák szabad mozgását, a vizes oldat rendezetlenségét, vagyis csökkenti a víz entrópiáját. Ez makroszkopikus méretben a fázisok szétválásához vezet, molekuláris méretben pedig az apoláros molekularészek egymáshoz tapadnak. Energetikai számítások szerint a hélixek stabilizálódása elsősorban nem a hidrogénkötésektől, hanem az apoláros oldalláncok hidrofób kölcsönhatásától származnak. Ha egy fehérje szintetizálódik, akkor lineáris láncot alkot. Azt szeretnénk megérteni, hogy ez miért alakul ki egy jól definiált kompakt térszerkezeten, miért nem úgy viselkedik mint egy ember által csinált polimer, ami össze-vissza mozog a vízben és nincs egy jól definiált stabil szerkezete. A feltekeredett állapotot hívják úgy, hogy natív állapot, amikor a vízzel van kontaktusban, akkor denaturált állapotról beszélünk. A kettő szabad energiáját kell összevetni. A denaturált állapotot nem egy jól definiált konformáció jellemzi, hanem össze-vissza csapong a molekula. Általában a csoportjai (peptidcsoport, oldalláncok) a vízzel vannak kontaktusban, a vízzel alakítanak ki H-hidat, illetve ha van egy olyan szegmens, ami a fehérjében alfa-hélixet szeret felvenni, akkor azt látni, hogy időlegesen kialakul egy alfa- helikális szerkezet, amit rövidtávon H- hidak stabilizálnak, majd kicsit később felbomlanak, mert azokért a H-hidakért vetélkedik a víz. Ebből lehet látni, hogy vannak instabil másodlagos szerkezeti elemek is. Ilyen denaturált állapotot többféleképpen létre lehet hozni pl. fehérje felmelegítés, szélsőséges ph változtatással, detergensekkel (pl. GnHCl). ΔG = ΔH lánc + ΔH oldószer TΔS lánc TΔS oldószer ΔG ~ kcal/m Δh lánc ~ 10 3 kcal/m entrópikusan a kitekert állapot kedvező a lánc szempontjából 7
8 Kaliometriás módszerekkel meg is tudjuk mérni,hogy mennyire stabil egy fehérje. Ha veszek egy fehérjeoldatot és elkezdem melegíteni akkor azt látom,hogy egy darabig nem történik semmi, majd egy nagyon szűk hőmérséklet tartományban kitekeredik a fehérje. Ha megnézem a görbe alatti területet, akkor megtudom,hogy mennyi energiát kell betáplálni a rendszerbe és lényegében megkapjuk azt a kötési energiát amivel a rendszer jellemezhető. A módszer neve pásztázó mikrokaliometria. (direkt módszer) Egy egy doménes fehérje esetén általában egy csúcsot látunk. Kooperatív folyamat, vagy natív vagy denaturált állapotban van a fehérje, s egy nagyon szűk hőmérséklet-tartományban megolvad és átalakul. Az olvadási hőmérséklet fehérjénként változó, általában 40, 50, 60 fok környéken van. 8
9 Térszerkezet kialakulása (folding) hogyan tekeredik fel a polipeptid lánc - A peptidlánc menetét, vagyis lokális konformációit az egyes aminosavrészekhez tartozó szakaszokban az oldalláncok, azaz az egyes aminosav részek minősége szabja meg. Egy-egy aminsav rész többféle konformációt is felvehet. Adott fehérjemolekula esetében a szomszédos, vagy esetleg a láncban távolabbi, de a lánc csavarodottsága következtében a térben mégis közel álló aminosav részek oldalláncainak befolyása dönti el,hogy a lehetőségek közül, melyik a legkedvezőbb, melyik realizálódik. Az egész fehérjemolekula térszerkezete tehát végeredményeben a molekulát felépítő aminosavrészek kooperatív kölcsönhatásának eredményeképpen jön létre. Ez egyúttal azt is jelenti, hogy a fehérjemolekula térszerkezetét az aminosav-szekvencia, vagyis a primer struktúra határozza meg. A globuláris fehérjék peptidláncának egyes szakaszai többféle alaptípusnak megfelelő konformációt vesznek fel: α-hélix, β-redőzött szalag és ún. rendezetlen konformáció. Az előbbi kettő azt jelenti,hogy a lánc rövidebb-hosszabb szakaszán az egymás után kapcsolódó aminosav részek lokális konformációja azonos; az azonos lokális konformációjú elemek ismétlődésével a lánc egy szakaszán periodikus, rendezett struktúra jön létre, mégpedig α-hélix, β-szalag. A peptidlánc különböző részein lévő β-konformációjú szakaszok paralel vagy antiparalel illeszkedésben hidrogénhidakon keresztül kapcsolódnak egymáshoz, így a molekulában redőzött réteg jellegű struktúrarészlet alakulhat ki. Rendezetlen konformáció esetén a molekulának nincsen periodikusan rendezett konformációja, s az egész molekula globuláris alkata éppen a rendezetlen szakaszoknak köszönhető. Általában a folding gyorsabb, mint a szintézis. Maga a folyamat külső segítség nélkül történik, de segítő mechanizmusok vannak. Ilyenek a dajkafehérjék. Ha kiteszünk egy sejtet valami stressznek, ami a fehérje kitekeredéséhez vezethet, akkor egy bizonyos fehérjék elszaporodnak, és 9
10 ezek képesek segíteni a fehérjék újra feltekeredését. A lineáris láncban minden információ benne van, hogy fel tudjon tekeredni. Sokféle denaturált állapot natív állapot energetikailag legstabilabb állapot. Anfinsen kísérlet (dán kutató) : Vette a ribonukleáz fehérjét, amiben öt pár diszulfid híd van. Ezt denaturálta redukáló körülmények között. Ennek az a lényege, hogy redukáló körülmények között felszakadnak a diszulfid hidak. Ha csak felmelegítette volna, akkor csak kitekeredik, de megmaradnak a hidak. Először visszatette oxidáló körülmények közé, ahol ezek találkoztak ott hidak újraformálódnak, de nem a jó párokban. Ezután jött a renaturáció. Visszatette a jó körülmények közé, és kialakult a helyes szerkezet, mégpedig úgy, hogy felszakadtak a hibás diszulfidhidak, és újraformálódtak, s ebből kialakult a natív szerkezet. Ez arra utal,hogy a natív szerkezete megfelel a globális energiaminimumnak. DE! Levinthal- paradoxon azt mondja, hogy ez lehet, hogy a globális, de ezt csak akkor tudom megmondani biztosan, ha bejárom a konformációs teret, vagyis kipróbálok minden lehetséges állapotot és megnézem,hogy melyik a legmegfelelőbb. A lehetséges konformációk száma azonban óriási. Egy átlagos fehérje esetén, ha minden aminosavnak csak 2 konformációját veszem, akkor N >> 2^300. Az ellentmondás itt adódik, hogy nem tudjuk bejárni az összes állapotot, és talán arra utal, hogy itt mégis csak valami lokális minimum van. A kettő feloldása: a natív szerkezet dinamikailag meghatározott. Úgy következnek egymás után az események,hogy leszűkítik a konformációs teret, így mégiscsak megtalálható, anélkül,hogy be kellene járni az egészet. Folding kinetikája és energetikai sémája: Kezdetben van egy denaturált állapot. Ha megváltoztatom a körülményeket,hogy a natívnak kedvezzenek, akkor lesz egy gyors átmenet az úgynevezett intermedier állapotba (ez a milliszekundumos skálán mérhető), reverzíbilis átmenet, és az az állapot messziről a natívra hasonlít, jóval kompaktabb mint a denaturált, pl. a másodlagos elemek aránya is hasonlít a denaturálthoz, de még nem működőképes a fehérje. Ha itt eleget várok, akkor képes átalakulni natív szerkezetté szekundumos időskálán, ez már egy lassú folyamat, vagyis termodinamikailag a két 10
11 folyamat között van egy nagy energiagát. Itt már működőképes a fehérje. Folding modellek: Az egyik a hidrofób kölcsönhatásra helyezi a hangsúlyt, a másik a H-hidakra. 1. Olajcsepp modell Ha a denaturált fehérjét natív jellegű körülmények közé teszem, akkor a hidrofób kölcsönhatás dominál, összeesik egy kompakt állapotba, kialakul egy hidrofób mag, ezt követi az átrendeződés, és ez vezet el a natív állapotig. 2. Vázmodell Van a denaturált állapot, ami olyan, hogy vannak benne instabil másodlagos szerkezeti elemek, de ha kedvezővé teszem a körülményeket, akkor ezek stabilabbá válnak és ezek lépnek egymással kölcsönhatásba. Ezután jön az átrendeződés és kialakul a natív állapot. 11
12 Források: -Előadásjegyzet - -Szerves kémia tankönyv 12
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Altalános Kémia BMEVESAA101 tavasz 2008
 Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Fehérjeszerkezet, és tekeredés
 Fehérjeszerkezet, és tekeredés Futó Kinga 2013.10.08. Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983
Fehérjeszerkezet, és tekeredés Futó Kinga 2013.10.08. Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
Folyadékok és szilárd anyagok
 Folyadékok és szilárd anyagok 7-1 Intermolekuláris erők, folyadékok tulajdonságai 7-2 Folyadékok gőztenziója 7-3 Szilárd anyagok néhány tulajdonsága 7-4 Fázisdiagram 7-5 Van der Waals kölcsönhatások 7-6
Folyadékok és szilárd anyagok 7-1 Intermolekuláris erők, folyadékok tulajdonságai 7-2 Folyadékok gőztenziója 7-3 Szilárd anyagok néhány tulajdonsága 7-4 Fázisdiagram 7-5 Van der Waals kölcsönhatások 7-6
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK. Rausch Péter kémia-környezettan
 AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A fehérjéket felépítő húsz standard aminosav Fehérjék szerkezetének kialakulása
 A fehérjéket felépítő húsz standard aminosav Fehérjék szerkezetének kialakulása Osváth Szabolcs Semmelweis Egyetem szabolcs.osvath@eok.sote.hu reakció t 1/2 25 ºC-on t 1/2 100 ºC-on DNS hidrolízis Biopolimerek
A fehérjéket felépítő húsz standard aminosav Fehérjék szerkezetének kialakulása Osváth Szabolcs Semmelweis Egyetem szabolcs.osvath@eok.sote.hu reakció t 1/2 25 ºC-on t 1/2 100 ºC-on DNS hidrolízis Biopolimerek
A fehérjéket felépítő húsz standard aminosav
 Fehérjék szerkezetének kialakulása Osváth Szabolcs Semmelweis Egyetem szabolcs.osvath@eok.sote.hu Biopolimerek reakció t 1/2 25 ºC-on t 1/2 100 ºC-on egy polimerben lévő kötések tipikus száma hányfajta
Fehérjék szerkezetének kialakulása Osváth Szabolcs Semmelweis Egyetem szabolcs.osvath@eok.sote.hu Biopolimerek reakció t 1/2 25 ºC-on t 1/2 100 ºC-on egy polimerben lévő kötések tipikus száma hányfajta
A fehérjék szerkezeti hierarchiája. Fehérje-szerkezetek! Klasszikus szerkezet-funkció paradigma. szekvencia. funkció. szerkezet! Myoglobin.
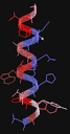 Myoglobin Fehérje-szerkezetek! MGLSDGEWQLVLNVWGKVEADIPGGQEVLIRLFK GPETLEKFDKFKLKSEDEMKASE DLKKGATVLTALGGILKKKGEAEIKPLAQSA TKKIPVKYLEFISECIIQVLQSK PGDFGADAQGAMNKALELFRKDMASNYKELGFQG Fuxreiter Mónika! Debreceni
Myoglobin Fehérje-szerkezetek! MGLSDGEWQLVLNVWGKVEADIPGGQEVLIRLFK GPETLEKFDKFKLKSEDEMKASE DLKKGATVLTALGGILKKKGEAEIKPLAQSA TKKIPVKYLEFISECIIQVLQSK PGDFGADAQGAMNKALELFRKDMASNYKELGFQG Fuxreiter Mónika! Debreceni
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Vezetők elektrosztatikus térben
 Vezetők elektrosztatikus térben Vezető: a töltések szabadon elmozdulhatnak Ha a vezető belsejében a térerősség nem lenne nulla akkor áram folyna. Ha a felületen a térerősségnek lenne tangenciális (párhuzamos)
Vezetők elektrosztatikus térben Vezető: a töltések szabadon elmozdulhatnak Ha a vezető belsejében a térerősség nem lenne nulla akkor áram folyna. Ha a felületen a térerősségnek lenne tangenciális (párhuzamos)
Kolloid állapotjelzők. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek
 Kolloid állapotjelzők. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
Kolloid állapotjelzők. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Elektrosztatikus számítások. Elektrosztatikus számítások. Elektrosztatikus számítások. Elektrosztatikus számítások Definíciók
 Jelentősége szubsztrát kötődés szolvatáció ionizációs állapotok (pka) mechanizmus katalízis ioncsatornák szimulációk (szerkezet) all-atom dipolar fluid dipolar lattice continuum Definíciók töltéseloszlás
Jelentősége szubsztrát kötődés szolvatáció ionizációs állapotok (pka) mechanizmus katalízis ioncsatornák szimulációk (szerkezet) all-atom dipolar fluid dipolar lattice continuum Definíciók töltéseloszlás
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kolloid állapotjelzık. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek
 Kolloid állapotjelzık. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta és Bányai István Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
Kolloid állapotjelzık. Molekuláris kölcsönhatások. Határfelületi jelenségek: fluid határfelületek Dr. Berka Márta és Bányai István Debreceni Egyetem TEK Kolloid- és Környezetkémiai Tanszék http://dragon.unideb.hu/~kolloid/
Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik
 Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Bozó Tamás 2012. október 16. Atomi kölcsönhatások Nemesgázok: atomi előfordulás (He, Ne, Ar, Kr, Xe, Rn) Többi elem: molekulákat alkot (pl. H
Atomi, illetve molekuláris kölcsönhatások és alkalmazásaik Bozó Tamás 2012. október 16. Atomi kölcsönhatások Nemesgázok: atomi előfordulás (He, Ne, Ar, Kr, Xe, Rn) Többi elem: molekulákat alkot (pl. H
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Szerkesztette: Vizkievicz András
 Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
Az élő anyag szerkezeti egységei: víz, nukleinsavak, fehérjék. elrendeződés, rend, rendszer, periodikus ismétlődés
 Az élő anyag szerkezeti egységei: víz, nukleinsavak, fehérjék Agócs Gergely 2013. december 3. kedd 10:00 11:40 1. Mit értünk élő anyag alatt? Az élő szervezetet felépítő anyagok. Az anyag azonban nem csupán
Az élő anyag szerkezeti egységei: víz, nukleinsavak, fehérjék Agócs Gergely 2013. december 3. kedd 10:00 11:40 1. Mit értünk élő anyag alatt? Az élő szervezetet felépítő anyagok. Az anyag azonban nem csupán
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Szalai István. ELTE Kémiai Intézet 1/74
 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
Hemoglobin - myoglobin. Konzultációs e-tananyag Szikla Károly
 Hemoglobin - myoglobin Konzultációs e-tananyag Szikla Károly Myoglobin A váz- és szívizom oxigén tároló fehérjéje Mt.: 17.800 153 aminosavból épül fel A lánc kb 75 % a hélix 8 db hélix, köztük nem helikális
Hemoglobin - myoglobin Konzultációs e-tananyag Szikla Károly Myoglobin A váz- és szívizom oxigén tároló fehérjéje Mt.: 17.800 153 aminosavból épül fel A lánc kb 75 % a hélix 8 db hélix, köztük nem helikális
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában. Szőri Milán: Kolloidkémia
 Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekIKözgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekIKözgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Modern Fizika Labor. Fizika BSc. Értékelés: A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n. 2008. április 29.
 Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
BIOFIZIKA Egészségügyi Mérnök MSc
 BIOFIZIKA Egészségügyi Mérnök MSc A tárgy felelős előadója: Dr. Fidy Judit egyetemi tanár judit.fidy@eok.sote.hu SE Biofizikai és Sugárbiológiai Intézet Két aspektus 1. Molekuláris biofizika molekulaszerkezetek
BIOFIZIKA Egészségügyi Mérnök MSc A tárgy felelős előadója: Dr. Fidy Judit egyetemi tanár judit.fidy@eok.sote.hu SE Biofizikai és Sugárbiológiai Intézet Két aspektus 1. Molekuláris biofizika molekulaszerkezetek
Elektromosság, áram, feszültség
 Elektromosság, áram, feszültség Elektromos alapjelenségek Egymással szorosan érintkező ( pl. megdörzsölt) felületű anyagok a szétválás után elektromos állapotba kerülnek. Azonos elektromos állapotú anyagok
Elektromosság, áram, feszültség Elektromos alapjelenségek Egymással szorosan érintkező ( pl. megdörzsölt) felületű anyagok a szétválás után elektromos állapotba kerülnek. Azonos elektromos állapotú anyagok
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Biológiai makromolekulák szerkezete
 Biológiai makromolekulák szerkezete Biomolekuláris nemkovalens kölcsönhatások Elektrosztatikus kölcsönhatások (sóhidak: 4-6 kcal/m, dipól-dipól: ~10-1 kcal/m Diszperziós erők (~10-2 kcal/m) Hidrogén hidak
Biológiai makromolekulák szerkezete Biomolekuláris nemkovalens kölcsönhatások Elektrosztatikus kölcsönhatások (sóhidak: 4-6 kcal/m, dipól-dipól: ~10-1 kcal/m Diszperziós erők (~10-2 kcal/m) Hidrogén hidak
Intra- és intermolekuláris reakciók összehasonlítása
 Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Víz. Az élő anyag szerkezeti egységei. A vízmolekula szerkezete. Olyan mindennapi, hogy fel sem tűnik, milyen különleges
 Az élő anyag szerkezeti egységei víz nukleinsavak fehérjék membránok Olyan mindennapi, hogy fel sem tűnik, milyen különleges A Föld felszínének 2/3-át borítja Előfordulása az emberi szövetek felépítésében
Az élő anyag szerkezeti egységei víz nukleinsavak fehérjék membránok Olyan mindennapi, hogy fel sem tűnik, milyen különleges A Föld felszínének 2/3-át borítja Előfordulása az emberi szövetek felépítésében
A SZILÁRDTEST FOGALMA. Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. molekula klaszter szilárdtest > σ λ : rel.
 A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
DNS, RNS, Fehérjék. makromolekulák biofizikája. Biológiai makromolekulák. A makromolekulák TÖMEG szerinti mennyisége a sejtben NAGY
 makromolekulák biofizikája DNS, RNS, Fehérjék Kellermayer Miklós Tér Méret, alak, lokális és globális szerkezet Idő Fluktuációk, szerkezetváltozások, gombolyodás Kölcsönhatások Belső és külső kölcsöhatások,
makromolekulák biofizikája DNS, RNS, Fehérjék Kellermayer Miklós Tér Méret, alak, lokális és globális szerkezet Idő Fluktuációk, szerkezetváltozások, gombolyodás Kölcsönhatások Belső és külső kölcsöhatások,
Biomolekulák nanomechanikája A biomolekuláris rugalmasság alapjai
 Fogorvosi Anyagtan Fizikai Alapjai Biomolekulák nanomechanikája A biomolekuláris rugalmasság alapjai Mártonfalvi Zsolt Biofizikai és Sugárbiológiai Intézet Semmelweis Egyetem Budapest Biomolekulák mint
Fogorvosi Anyagtan Fizikai Alapjai Biomolekulák nanomechanikája A biomolekuláris rugalmasság alapjai Mártonfalvi Zsolt Biofizikai és Sugárbiológiai Intézet Semmelweis Egyetem Budapest Biomolekulák mint
A fehérjék szerkezete és az azt meghatározó kölcsönhatások
 A fehérjék szerkezete és az azt meghatározó kölcsönhatások 1. A fehérjék szerepe az élõlényekben 2. A fehérjék szerkezetének szintjei 3. A fehérjék konformációs stabilitásáért felelõs kölcsönhatások 4.
A fehérjék szerkezete és az azt meghatározó kölcsönhatások 1. A fehérjék szerepe az élõlényekben 2. A fehérjék szerkezetének szintjei 3. A fehérjék konformációs stabilitásáért felelõs kölcsönhatások 4.
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS
 Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Határfelületi jelenségek. Fogorvosi anyagtan fizikai alapjai 3. Általános anyagszerkezeti ismeretek. N m J 2
 Határelületi jelenségek 1. Felületi eszültség Fogorvosi anyagtan izikai alapjai 3. Általános anyagszerkezeti ismeretek Határelületi jelenségek Kiemelt témák: elületi eszültség adhézió nedvesítés ázis ázisdiagramm
Határelületi jelenségek 1. Felületi eszültség Fogorvosi anyagtan izikai alapjai 3. Általános anyagszerkezeti ismeretek Határelületi jelenségek Kiemelt témák: elületi eszültség adhézió nedvesítés ázis ázisdiagramm
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését!
 I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
Fizika minta feladatsor
 Fizika minta feladatsor 10. évf. vizsgára 1. A test egyenes vonalúan egyenletesen mozog, ha A) a testre ható összes erő eredője nullával egyenlő B) a testre állandó értékű erő hat C) a testre erő hat,
Fizika minta feladatsor 10. évf. vizsgára 1. A test egyenes vonalúan egyenletesen mozog, ha A) a testre ható összes erő eredője nullával egyenlő B) a testre állandó értékű erő hat C) a testre erő hat,
Biopolimer 12/7/09. Makromolekulák szerkezete. Fehérje szerkezet, és tekeredés. DNS. Polimerek. Kardos Roland DNS elsődleges szerkezete
 Biopolimerek Makromolekulák szerkezete. Fehérje szerkezet, és tekeredés. Osztódó sejt magorsófonala Kardos Roland 2009.10.29. Dohány levél epidermális sejtjének aktin hálózat Bakteriofágból kiszabaduló
Biopolimerek Makromolekulák szerkezete. Fehérje szerkezet, és tekeredés. Osztódó sejt magorsófonala Kardos Roland 2009.10.29. Dohány levél epidermális sejtjének aktin hálózat Bakteriofágból kiszabaduló
Mi mekkora? Fehérjék a Biológiába és a Nanotechnológiában. Plenty of Room at the Bottom. Hullám részecske kettősség 2/15/17
 Fehérjék a Biológiába és a Nanotechnológiában Mi mekkora? Osváth Szabolcs Semmelweis Egyetem osvath.szabolcs@med.semmelweis-univ.hu Plenty of Room at the Bottom " The principles of physics, as far as I
Fehérjék a Biológiába és a Nanotechnológiában Mi mekkora? Osváth Szabolcs Semmelweis Egyetem osvath.szabolcs@med.semmelweis-univ.hu Plenty of Room at the Bottom " The principles of physics, as far as I
FEHÉRJÉK A MÁGNESEKBEN. Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium. Alkímia Ma, Budapest,
 FEHÉRJÉK A MÁGNESEKBEN Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium Alkímia Ma, Budapest, 2013.02.28. I. FEHÉRJÉK: L-α aminosavakból felépülő lineáris polimerek α H 2 N CH COOH amino
FEHÉRJÉK A MÁGNESEKBEN Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium Alkímia Ma, Budapest, 2013.02.28. I. FEHÉRJÉK: L-α aminosavakból felépülő lineáris polimerek α H 2 N CH COOH amino
Katalízis. Tungler Antal Emeritus professzor 2017
 Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása.
 Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása. Adszorpció oldatból szilárd felületre Adszorpció oldatból Nem-elektrolitok
Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása. Adszorpció oldatból szilárd felületre Adszorpció oldatból Nem-elektrolitok
Atomok. szilárd. elsődleges kölcsönhatás. kovalens ionos fémes. gázok, folyadékok, szilárd anyagok. ionos fémek vegyületek ötvözetek
 Atomok elsődleges kölcsönhatás kovalens ionos fémes véges számú atom térhálós szerkezet 3D ionos fémek vegyületek ötvözetek molekulák atomrácsos vegyületek szilárd gázok, folyadékok, szilárd anyagok Gázok
Atomok elsődleges kölcsönhatás kovalens ionos fémes véges számú atom térhálós szerkezet 3D ionos fémek vegyületek ötvözetek molekulák atomrácsos vegyületek szilárd gázok, folyadékok, szilárd anyagok Gázok
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Fehérjeszerkezet, fehérjetekeredés
 Fehérjeszerkezet, fehérjetekeredés A fehérjeszerkezet szintjei A fehérjetekeredés elmélete: Anfinsen kísérlet Levinthal paradoxon A feltekeredés tölcsér elmélet 2014.11.05. Aminosavak és fehérjeszerkezet
Fehérjeszerkezet, fehérjetekeredés A fehérjeszerkezet szintjei A fehérjetekeredés elmélete: Anfinsen kísérlet Levinthal paradoxon A feltekeredés tölcsér elmélet 2014.11.05. Aminosavak és fehérjeszerkezet
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
5. elıadás KRISTÁLYKÉMIAI ALAPOK
 5. elıadás KRISTÁLYKÉMIAI ALAPOK KRISTÁLYKÉMIAI ALAPFOGALMAK Atomok: az anyag legkisebb olyan részei, amelyek még hordozzák a kémiai elem jellegzetességeit. Részei: atommag (mely protonokból és neutronokból
5. elıadás KRISTÁLYKÉMIAI ALAPOK KRISTÁLYKÉMIAI ALAPFOGALMAK Atomok: az anyag legkisebb olyan részei, amelyek még hordozzák a kémiai elem jellegzetességeit. Részei: atommag (mely protonokból és neutronokból
Fehérjeszerkezet, és tekeredés. Futó Kinga
 Fehérjeszerkezet, és tekeredés Futó Kinga Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983 H 211861 N
Fehérjeszerkezet, és tekeredés Futó Kinga Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983 H 211861 N
Peptidek és fehérjék 1. Fehérjék Fehérjetekeredés. Fehérje (protein) Fehérje (protein) Aminosavak. Aminosavak
 Fehérjék Fehérjetekeredés Peptidek és fehérjék 1 peptid: rövid, peptid kötéssel összekapcsolt aminosavakból álló polimer (< ~50 aminosav) fehérje: hosszú, peptid kötéssel összekapcsolt aminosavakból álló
Fehérjék Fehérjetekeredés Peptidek és fehérjék 1 peptid: rövid, peptid kötéssel összekapcsolt aminosavakból álló polimer (< ~50 aminosav) fehérje: hosszú, peptid kötéssel összekapcsolt aminosavakból álló
6. Zárványtestek feldolgozása
 6. Zárványtestek feldolgozása... 1 6.1. A zárványtestek... 1 6.1.1. A zárványtestek kialakulása... 2 6.1.2. A feldolgozási technológia... 3 6.1.2.1. Sejtfeltárás... 3 6.1.2.2. Centrifugálás, tisztítás...
6. Zárványtestek feldolgozása... 1 6.1. A zárványtestek... 1 6.1.1. A zárványtestek kialakulása... 2 6.1.2. A feldolgozási technológia... 3 6.1.2.1. Sejtfeltárás... 3 6.1.2.2. Centrifugálás, tisztítás...
Spontaneitás, entrópia
 Spontaneitás, entrópia 6-1 Spontán folyamat 6-2 Entrópia 6-3 Az entrópia kiszámítása 6-4 Spontán folyamat: a termodinamika második főtétele 6-5 Standard szabadentalpia változás, ΔG 6-6 Szabadentalpia változás
Spontaneitás, entrópia 6-1 Spontán folyamat 6-2 Entrópia 6-3 Az entrópia kiszámítása 6-4 Spontán folyamat: a termodinamika második főtétele 6-5 Standard szabadentalpia változás, ΔG 6-6 Szabadentalpia változás
MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak
 Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
Fizikai kémia 2. Előzmények. A Lewis-féle kötéselmélet A VB- és az MO-elmélet, a H 2+ molekulaion
 06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
Az élethez szükséges elemek
 Az élethez szükséges elemek 92 elemből kb. 25 szükséges az élethez Szén (C), hidrogén (H), oxigén (O) és nitrogén (N) alkotja az élő szervezetekben előforduló anyag 96%-t A fennmaradó 4% legnagyobb része
Az élethez szükséges elemek 92 elemből kb. 25 szükséges az élethez Szén (C), hidrogén (H), oxigén (O) és nitrogén (N) alkotja az élő szervezetekben előforduló anyag 96%-t A fennmaradó 4% legnagyobb része
Szerves kémiai és biokémiai alapok:
 Szerves kémiai és biokémiai alapok: Másodlagos kémiai kötések: A másodlagos kötések energiája nagyságrenddel kisebb, mint az elsődlegeseké. Energiaközlés hatására a másodlagos kötések bomlanak fel először,
Szerves kémiai és biokémiai alapok: Másodlagos kémiai kötések: A másodlagos kötések energiája nagyságrenddel kisebb, mint az elsődlegeseké. Energiaközlés hatására a másodlagos kötések bomlanak fel először,
FELADATMEGOLDÁS. Tesztfeladat: Válaszd ki a helyes megoldást!
 FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
R R C X C X R R X + C H R CH CH R H + BH 2 + Eliminációs reakciók
 Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek
 Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
20/10/2016 tema04_biolf_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
Az átlagok jelentése és haszna
 Az átlagok jelentése és haszna A különféle átlagok iránti szükséglet azért alakult ki, mert a különböző kísérleti módszerek eltérő módon érzékelik a polidiszperz rendszereket.a frakciók más-más tulajdonságaira
Az átlagok jelentése és haszna A különféle átlagok iránti szükséglet azért alakult ki, mert a különböző kísérleti módszerek eltérő módon érzékelik a polidiszperz rendszereket.a frakciók más-más tulajdonságaira
1 Műszaki hőtan Termodinamika. Ellenőrző kérdések-02 1
 1 Műszaki hőtan Termodinamika. Ellenőrző kérdések-02 1 Kérdések. 1. Mit mond ki a termodinamika nulladik főtétele? Azt mondja ki, hogy mindenegyes termodinamikai kölcsönhatáshoz tartozik a TDR-nek egyegy
1 Műszaki hőtan Termodinamika. Ellenőrző kérdések-02 1 Kérdések. 1. Mit mond ki a termodinamika nulladik főtétele? Azt mondja ki, hogy mindenegyes termodinamikai kölcsönhatáshoz tartozik a TDR-nek egyegy
A BIOLÓGIAI JELENSÉGEK FIZIKAI HÁTTERE Zimányi László
 A BIOLÓGIAI JELENSÉGEK FIZIKAI HÁTTERE Zimányi László Összefoglalás A négy alapvető fizikai kölcsönhatás közül az elektromágneses kölcsönhatásnak van fontos szerepe a biológiában. Atomi és molekuláris
A BIOLÓGIAI JELENSÉGEK FIZIKAI HÁTTERE Zimányi László Összefoglalás A négy alapvető fizikai kölcsönhatás közül az elektromágneses kölcsönhatásnak van fontos szerepe a biológiában. Atomi és molekuláris
Spontaneitás, entrópia
 Spontaneitás, entrópia 11-1 Spontán és nem spontán folyamat 11-2 Entrópia 11-3 Az entrópia kiszámítása 11-4 Spontán folyamat: a termodinamika második főtétele 11-5 Standard szabadentalpia változás, ΔG
Spontaneitás, entrópia 11-1 Spontán és nem spontán folyamat 11-2 Entrópia 11-3 Az entrópia kiszámítása 11-4 Spontán folyamat: a termodinamika második főtétele 11-5 Standard szabadentalpia változás, ΔG
Tevékenység: Olvassa el a fejezetet! Gyűjtse ki és jegyezze meg a ragasztás előnyeit és a hátrányait! VIDEO (A ragasztás ereje)
 lvassa el a fejezetet! Gyűjtse ki és jegyezze meg a ragasztás előnyeit és a hátrányait! VIDE (A ragasztás ereje) A ragasztás egyre gyakrabban alkalmazott kötéstechnológia az ipari gyakorlatban. Ennek oka,
lvassa el a fejezetet! Gyűjtse ki és jegyezze meg a ragasztás előnyeit és a hátrányait! VIDE (A ragasztás ereje) A ragasztás egyre gyakrabban alkalmazott kötéstechnológia az ipari gyakorlatban. Ennek oka,
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
Mivel foglalkozik a hőtan?
 Hőtan Gáztörvények Mivel foglalkozik a hőtan? A hőtan a rendszerek hőmérsékletével, munkavégzésével, és energiájával foglalkozik. A rendszerek stabilitása áll a fókuszpontjában. Képes megválaszolni a kérdést:
Hőtan Gáztörvények Mivel foglalkozik a hőtan? A hőtan a rendszerek hőmérsékletével, munkavégzésével, és energiájával foglalkozik. A rendszerek stabilitása áll a fókuszpontjában. Képes megválaszolni a kérdést:
Villamos tér. Elektrosztatika. A térnek az a része, amelyben a. érvényesülnek.
 III. VILLAMOS TÉR Villamos tér A térnek az a része, amelyben a villamos erőhatások érvényesülnek. Elektrosztatika A nyugvó és időben állandó villamos töltések által keltett villamos tér törvényeivel foglalkozik.
III. VILLAMOS TÉR Villamos tér A térnek az a része, amelyben a villamos erőhatások érvényesülnek. Elektrosztatika A nyugvó és időben állandó villamos töltések által keltett villamos tér törvényeivel foglalkozik.
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Vegyületek - vegyületmolekulák
 Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
tema04_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
Atomok. szilárd. elsődleges kölcsönhatás. kovalens ionos fémes. gázok, folyadékok, szilárd anyagok. ionos fémek vegyületek ötvözetek
 Atomok elsődleges kölcsönhatás kovalens ionos fémes véges számú atom térhálós szerkezet 3D ionos fémek vegyületek ötvözetek molekulák atomrácsos vegyületek szilárd gázok, folyadékok, szilárd anyagok Gázok
Atomok elsődleges kölcsönhatás kovalens ionos fémes véges számú atom térhálós szerkezet 3D ionos fémek vegyületek ötvözetek molekulák atomrácsos vegyületek szilárd gázok, folyadékok, szilárd anyagok Gázok
A kémiai kötés eredete; viriál tétel 1
 A kémiai kötés ereete; viriál tétel 1 Probléma felvetés Ha egy molekula atommagjai közötti távolság csökken, akkor a közöttük fellép elektrosztatikus taszításhoz tartozó energia n. Ugyanez igaz az elektronokra
A kémiai kötés ereete; viriál tétel 1 Probléma felvetés Ha egy molekula atommagjai közötti távolság csökken, akkor a közöttük fellép elektrosztatikus taszításhoz tartozó energia n. Ugyanez igaz az elektronokra
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ
 1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
Az atom- olvasni. 1. ábra Az atom felépítése 1. Az atomot felépítő elemi részecskék. Proton, Jele: (p+) Neutron, Jele: (n o )
 Az atom- olvasni 2.1. Az atom felépítése Az atom pozitív töltésű atommagból és negatív töltésű elektronokból áll. Az atom atommagból és elektronburokból álló semleges kémiai részecske. Az atommag pozitív
Az atom- olvasni 2.1. Az atom felépítése Az atom pozitív töltésű atommagból és negatív töltésű elektronokból áll. Az atom atommagból és elektronburokból álló semleges kémiai részecske. Az atommag pozitív
Atomi és molekuláris kölcsönhatások. Pásztázó tűszondás mikroszkópia.
 Atomi és molekuláris kölcsönhatások. Pásztázó tűszondás mikroszkópia. Kiss Balázs Nanobiotechnológia és Egyedi Molekula Kutatócsoport, Biofizikai és Sugárbiológiai Intézet 2013. november 28. 2 Atomi kölcsönhatások
Atomi és molekuláris kölcsönhatások. Pásztázó tűszondás mikroszkópia. Kiss Balázs Nanobiotechnológia és Egyedi Molekula Kutatócsoport, Biofizikai és Sugárbiológiai Intézet 2013. november 28. 2 Atomi kölcsönhatások
Elektromos alapjelenségek
 Elektrosztatika Elektromos alapjelenségek Dörzselektromos jelenség: egymással szorosan érintkező, vagy egymáshoz dörzsölt testek a szétválasztásuk után vonzó, vagy taszító kölcsönhatást mutatnak. Ilyenkor
Elektrosztatika Elektromos alapjelenségek Dörzselektromos jelenség: egymással szorosan érintkező, vagy egymáshoz dörzsölt testek a szétválasztásuk után vonzó, vagy taszító kölcsönhatást mutatnak. Ilyenkor
Fázisátalakulások, avagy az anyag ezer arca. Sasvári László ELTE Fizikai Intézet ELTE Bolyai Kollégium
 Fázisátalakulások, avagy az anyag ezer arca Sasvári László ELTE Fizikai Intézet ELTE Bolyai Kollégium Atomoktól a csillagokig, Budapest, 2016. december 8. Fázisátalakulások Csak kondenzált anyag? A kondenzált
Fázisátalakulások, avagy az anyag ezer arca Sasvári László ELTE Fizikai Intézet ELTE Bolyai Kollégium Atomoktól a csillagokig, Budapest, 2016. december 8. Fázisátalakulások Csak kondenzált anyag? A kondenzált
Fehérjeszerkezet analízis. Fehérjeszerkezet analízis. Fehérjeszerkezet analízis. Fehérjeszerkezet analízis. Fehérjeszerkezet analízis
 Szerkezet Protein Data Bank (PDB) http://www.rcsb.org/pdb ~ 35 701 szerkezet közepes felbontás 1552 szerkezet d 1.5 Å 160 szerkezet d 1.0 Å 10 szerkezet d 0.8 Å (atomi felbontás) E globális minimum? funkció
Szerkezet Protein Data Bank (PDB) http://www.rcsb.org/pdb ~ 35 701 szerkezet közepes felbontás 1552 szerkezet d 1.5 Å 160 szerkezet d 1.0 Å 10 szerkezet d 0.8 Å (atomi felbontás) E globális minimum? funkció
Kémiai reakciók. Közös elektronpár létrehozása. Általános és szervetlen kémia 10. hét. Elızı héten elsajátítottuk, hogy.
 Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
VÍZ. Egy különleges folyadék biofizikája. Talián Csaba Gábor Biofizika előadások, PTE ÁOK október 27.
 VÍZ Egy különleges folyadék biofizikája Talián Csaba Gábor Biofizika előadások, PTE ÁOK 2010. október 27. Az Eagle Rock középiskola diákja nyerte el az első díjat az április 26-án megrendezett Idaho Falls
VÍZ Egy különleges folyadék biofizikája Talián Csaba Gábor Biofizika előadások, PTE ÁOK 2010. október 27. Az Eagle Rock középiskola diákja nyerte el az első díjat az április 26-án megrendezett Idaho Falls
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése
 Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
MÉRNÖKI ANYAGISMERET AJ002_1 Közlekedésmérnöki BSc szak Csizmazia Ferencné dr. főiskolai docens B 403. Dr. Dogossy Gábor Egyetemi adjunktus B 408
 MÉRNÖKI ANYAGISMERET AJ002_1 Közlekedésmérnöki BSc szak Csizmazia Ferencné dr. főiskolai docens B 403 Dr. Dogossy Gábor Egyetemi adjunktus B 408 Az anyag Az anyagot az ember nyeri ki a természetből és
MÉRNÖKI ANYAGISMERET AJ002_1 Közlekedésmérnöki BSc szak Csizmazia Ferencné dr. főiskolai docens B 403 Dr. Dogossy Gábor Egyetemi adjunktus B 408 Az anyag Az anyagot az ember nyeri ki a természetből és
Elektrosztatikai alapismeretek
 Elektrosztatikai alapismeretek THALÉSZ: a borostyánt (élektron) megdörzsölve az a könnyebb testeket magához vonzza. Az egymással szorosan érintkező anyagok elektromosan feltöltődnek, elektromos állapotba
Elektrosztatikai alapismeretek THALÉSZ: a borostyánt (élektron) megdörzsölve az a könnyebb testeket magához vonzza. Az egymással szorosan érintkező anyagok elektromosan feltöltődnek, elektromos állapotba
Határfelületi jelenségek. Fogorvosi anyagtan fizikai alapjai 3. Általános anyagszerkezeti ismeretek E A J 2. N m
 Határelületi jelenségek 1. Felületi eültség Fogorvosi anyagtan izikai alapjai 3. Általános anyagerkezeti ismeretek Határelületi jelenségek Kiemelt témák: elületi eültség adhézió nedvesítés ázis ázisdiagramm
Határelületi jelenségek 1. Felületi eültség Fogorvosi anyagtan izikai alapjai 3. Általános anyagerkezeti ismeretek Határelületi jelenségek Kiemelt témák: elületi eültség adhézió nedvesítés ázis ázisdiagramm
Elektrotechnika. Ballagi Áron
 Elektrotechnika Ballagi Áron Mágneses tér Elektrotechnika x/2 Mágneses indukció kísérlet Állandó mágneses térben helyezzünk el egy l hosszúságú vezetőt, és bocsássunk a vezetőbe I áramot! Tapasztalat:
Elektrotechnika Ballagi Áron Mágneses tér Elektrotechnika x/2 Mágneses indukció kísérlet Állandó mágneses térben helyezzünk el egy l hosszúságú vezetőt, és bocsássunk a vezetőbe I áramot! Tapasztalat:
Kolloidstabilitás. Berka Márta 2010/2011/II
 Kolloidstabilitás Berka Márta 2010/2011/II Kolloid stabilitáshoz taszítás kell. Sztérikus stabilizálás V R V S sztérikus stabilizálás: liofil kolloidok alkalmazása védőhatás adszorpció révén (természetes
Kolloidstabilitás Berka Márta 2010/2011/II Kolloid stabilitáshoz taszítás kell. Sztérikus stabilizálás V R V S sztérikus stabilizálás: liofil kolloidok alkalmazása védőhatás adszorpció révén (természetes
Az elektromágneses tér energiája
 Az elektromágneses tér energiája Az elektromos tér energiasűrűsége korábbról: Hasonlóképpen, a mágneses tér energiája: A tér egy adott pontjában az elektromos és mágneses terek együttes energiasűrűsége
Az elektromágneses tér energiája Az elektromos tér energiasűrűsége korábbról: Hasonlóképpen, a mágneses tér energiája: A tér egy adott pontjában az elektromos és mágneses terek együttes energiasűrűsége
