1. Összefoglalás A doktori munka alapvető kérdése az általunk molekuladinamikai szimulációval vizsgált mindkét fehérjekomplex rendszer esetén az
|
|
|
- Krisztián Balla
- 7 évvel ezelőtt
- Látták:
Átírás
1 1. Összefoglalás A doktori munka alapvető kérdése az általunk molekuladinamikai szimulációval vizsgált mindkét fehérjekomplex rendszer esetén az volt, hogy hogyan hatnak a funkcionális szempontból jelentős kis molekulák (antagonisták, allosztérikus effektorok) a fehérjekonformációra. 1. Allosztérikus effektorok humán hemoglobinra (HbA) gyakorolt hatása. Mivel az allosztérikus effektort kötő oxy-hba ról nem állt rendelkezésre röntgenkrisztallográfiás szerkezet, a csoport korábbi dokkolással előállított komplex szerkezetein vizsgáltuk meg molekuladinamikai szimulációval, hogy ki tud-e alakulni stabilis oxy-hba allosztérikus effektor komplex. A szimuláció során a három effektorral alkotott komplex szerkezetek stabilisnak bizonyultak. Az effektorkötőhely analízisekor kiderült, hogy az oxy (R) állapotú HbA -n a deoxy (T) állapotú HbA hoz hasonlóan specifikus kötőhely alakul ki, de ez különbözik a T állapotban megismert kötőhelytől. Az alegységek határfelületeinek vizsgálata során megállapítottuk, hogy az effektorkötés a HbA alegységek közti határfelületek stabilitását T állapotban csökkentette, R állapotban növelte. 2. Antagonistakötés hatása a Ca kalmodulin (CaM) TFP vel és DPD vel alkotott complex szerkezetére és funkciójára. A munka fő kérdése az volt, hogy a két komplex (CaM-2TFP, CaM-2DPD) röntgenkrisztallográfiás szerkezete hasonló, azonban a disszociációs konstansai két nagyságrendben különböznek. A DPD hatékonyabb antagonistának bizonyult. Ez ellentétben van az irodalmi röntgenkrisztallográfiás szerkezetekkel. A 12ns os szimulációk analízise megmutatta, hogy az antagonistákkal kölcsönható aminosavak nem azonosak a dinamika során kapott és a röntgenkrisztallográfiás szerkezetekben. A CaM-2DPD komplex szerkezete kompaktabbá vált a dinamika során. A Poisson- Boltzmann elektrosztatikus számítások szerint a deszolvatációs tag a DPD esetében kedvezőbb. Azaz hiába van a TFP molekulának pozitív töltése, ami elektrosztatikus kölcsönhatással kötődne a kötőhelyhez, ez nem képes a CaM negatív töltésű aminosavaival kellően szoros töltés-töltés kölcsönhatást kialakítani, mert közben meggátolja a környező poláros csoportok kedvezőbb oldószerrel való kölcsönhatását
2 2. Summary The problems studied in this work are related to the question how small molecules affect the conformation of proteins upon functional binding. The complexes of two proteins were examined by molecular dynamics simulation. 1. The conformational effects of binding allosteric effectors on human hemoglobin (HbA). Lacking crystallographic data, we examined whether oxy-hba is also able to bind allosteric effectors. We successfully determined the structure of the complex, and unraveled significant tertiary changes due to effector binding in the case of three allosteric effectors. The stability of the structures shows that the models are reliable. The analysis of the binding site in oxy-hba showed specific like in the deoxy (T) state, but different in structure from it. The analysis of the subunit interfaces showed that effector binding decreased the stability of the HbA tetramer in the deoxy(t) and increased in the oxy(r) state. 2. The effects of binding antagonists in complexes in two kinds of Ca-Calmodulin (CaM) complexes: CaM-2TFP and CaM-2DPD. The x-ray structures of the two complexes were similar in the literature, but the dissociation constants differed by two orders of magnitude showing DPD a better antagonist. This contradicted the x-ray results. Based on the analysis of the structures of 12ns molecular dynamics simulations we found out, that the residues interacting with antagonists differ from those in the x-ray structure: the structure of the CaM-2DPD complex became more compact during the dynamics. According to electrostatic Poisson-Boltzmann calculations the desolvation terms are more favourable in case of DPD. Analysing the interactions of the amino acids, we can tell that the reason of the TFP s less efficiency is that its positive charge cannot form charge-charge interaction with the surrounding polar amino acids because the charged group is on a too short carbon chain. Therefore TFP molecule blocks these polar parts to interact with the solvent
3 3. Bevezetés A számítógépes szimulációs módszerek egyre szélesebb körben nyernek alkalmazást kondenzált rendszerek szilárd testek, folyadékok kémiai és fizikai tulajdonságainak értelmezésére atomi szintű szerkezetük alapján. Különösen fontos szerepük van a molekuladinamikai szimulációs (MDS) módszereknek a biomolekulák szerkezetének és kölcsönhatásainak atomi szintű vizsgálataiban, ami egyben a dolgozat tárgyát is képezi. Ezen számítások kiindulópontja a molekulák röntgenkrisztallográfiai vagy NMR spektroszkópiai módszerrel meghatározott atomi szerkezete. Erre alapozva, a klasszikus fizika mozgásegyenleteit felhasználva lehetőség van az atomi hőmozgások szimulálciójára valós körülmények között. Így az MDS számítások révén lehetőség van az atomi szerkezet meghatározására alkalmas fizikai módszerek speciális kísérleti körülményeinek korrekciójára és ezáltal a natív környezetre jellemző molekulaszerkezet meghatározására. A szimulációs munkának azonban ez csupán az egyik eredménye. Talán még fontosabb, hogy a módszer lényegéből adódóan eredményként megkapjuk minden egyes atomi kötésnek a hőmérséklet által lehetővé váló időbeli változását fluktuációját. A molekulaszerkezetek atomi mozgásainak, a konformációs dinamikának speciális vonásai vannak, amelyek jellemzőek egy-egy molekulára illetve molekularészletre. A biológiai makromolekulák konformációs dinamikájának speciális vonásai meghatározóak a biokémiai aktivitás szempontjából. A munkacsoport, ahol a PhD munkámat végeztem, fehérjék konformációs dinamikájának kísérleti és számítógépes vizsgálatával foglalkozik. Munkám során két fehérjemolekula esetén vizsgáltam antagonisták ill. allosztérikus effektorok hatását a molekulaszerkezetre és ezen keresztül a biológiai funkcióra. Az egyik vizsgált fehérje a humán hemoglobin (HbA) volt, ahol a fontos biológiai funkció a hemoglobin oxigén kötése. Ismeretes, hogy a HbA oxigénkötését a tetramer szerkezetű molekula alegységei közötti központi üregbe kötődő kis molekulák, allosztérikus effektorok módosítják. Korábban röntgenkrisztallográfiai eredmények alapján feltételezték, hogy az effektorok az oxigénmentes T állapotban kötődnek és gátolják az oxigénaffinitást. Irodalmi eredmények azt mutatják, hogy az allosztérikus effektorok képesek oxigént kötő R állapotú HbA komplexben is regulálni az oxigén
4 affinitást. R-állapotú HbA-effektor komplexről azonban nem sikerült röntgenkrisztallográfiai szerkezetvizsgálati eredményt nyerni. Munkám kezdetén bekapcsolódtam azokba a vizsgálatokba, amelyek során mind az R, mind a T állapotban vizsgáltuk az allosztérikus effektorok kötődésének hatását a molekulaszerkezetre és a konformációs dinamikára. A másik fehérje a kalmodulin (CaM) volt. Ez egy kalcium jelátvivő, amely sokféle enzimet képes aktiválni és ezáltal számos biokémiai és élettani folyamatban vesz részt. A CaM target-molekulához való kötődésének gátlása a gyógyszeres terápia egyik eszköze. Munkámban CaM-antagonisták optimális tulajdonságait vizsgáltam molekuladinamikai szimulációs és Poisson Boltzmann szabadentalpia számításokkal
5 4. Célkitűzések A doktori munka során az alapvető kérdés az volt, hogy hogyan változtatják meg a funkcionálisan kötődő kis molekulák (antagonisták, effektorok) a fehérjék tulajdonságait. A munkám során két rendszert vizsgáltam: allosztérikus effektoroknak a humán hemoglobin szerkezetére és az antagonistáknak a Ca-kalmodulinra szerkezetére kifejtett hatását HbA-alloszterikus effektor komplexek Ebben a munkában a célunk az volt, hogy megvizsgáljuk vajon ki tud e stabil szerkezet alakulni, ha a T-állapotú (oxigénmentes) HbA komplexek szerkezetéhez hasonlóan a molekula R állapotú (oxigéntartalmú) szerkezetének központi üregébe alloszterikus effektor kötődik. Három jelentősebb effektor esetén vizsgáltuk a kérdést: DPG, IHP és RSR13. Amennyiben a dokkolással meghatározott szerkezetből kiindulva energetikailag és dinamikailag stabil szerkezetet sikerül meghatározni, ezt tekintjük az R állapotú HbA effektorokkal alkotott komplexének. Ezután a célunk az volt, hogy az így kapott komplex szerkezeteket összehasonlítva a röntgenkrisztallográfiás mérésekből ismert T állapotú komplexek szerkezetével, olyan paramétereket találjunk, amelyek funkcionális szempontból fontos jellemzést adhatnak az új szerkezetre nézve. A kooperatív oxigénkötésben fontos szerep tulajdonítható a HbA alegységek határfelületi csatolásának. Ezért a határfelületi kölcsönhatásokat elemeztük a hidrogén-hidak, a hidrofóbicitás és a kötött vízmolekulák szempontjából. 4.2 CaM-antagonista komplexek A munkám során két CaM-antagonista komplex szerkezetét vizsgáltam: a CaM komplexét az ideggyógyászatban már ismert TFP vel, és az újabban szívritmusszabályozásra javasolt DPD-vel. Mindkét szerkezet két antagonista molekulát kötött. A munka onnan indult ki, hogy irodalmi adatok alapján a két CaMantagonista 1:2 arányú komplex röntgendiffrakciós szerkezete igen hasonló, de a két komplex disszociációs állandója jelentősen különböző. A CaM-2TFP komplexben a - 5 -
6 disszociációs állandó 1-8μM, a CaM-2DPD-ben 18 nm. Az antagonisták szerkezetéből következik, hogy a DPD molekulák csak van der Waals és hidrofób kölcsönhatások révén képesek kötődni, míg a TFP kötődését direkt elektrosztatikus kölcsönhatás is segíti. A disszociációs állandó mégis az utóbbinál jelentősen kisebb. Egyedül a röntgenkrisztallográfiai eredmények alapján ezt a különbséget nem lehet értelmezni. Elsőként arra kerestem a választ, hogy a két szerkezet vizes oldatban, 300 K en és ellenionok jelenlétében is hasonló e. Másodszor, a natív körülményeket szimuláló szerkezet és dinamika alapján meg akartuk vizsgálni, hogy miért kötődik gyengébben a TFP, holott pozitív töltésű csoportja is van, a DPD -nek pedig csak hidrofób és poláros részei vannak. Azt reméltük, hogy az eredményekből általános következtetéseket is le lehet majd vonni arra nézve, hogy milyen optimális szerkezeti tulajdonságokkal kell rendelkeznie egy molekulának ahhoz, hogy funkcionálisan gátolni tudja a CaM-t
7 5. Módszerek 5.1 A molekulamechanika és molekuladinamika közelítés A közelítésben az energiát atom-párok közötti kölcsönhatási energiák összegeként adjuk meg, tehát az eljárás kiindulópontja a molekula atomi részletességű szerkezetének ismerete, amelyet röntgendiffrakciós vagy NMR spektroszkópiai mérések adatai szolgáltatnak. A molekulamechanika módszerben az atomok elektronállapotaitól eltekintünk és az atomtörzseket gömbökkel reprezentáljuk. Az atomok között háromféle kölcsönhatást tételezünk fel: kovalens, elektrosztatikus és van der Waals kölcsönhatást. Ezen tagok összességei az erőterek, melyek közül a legismertebbek a GROMOS, AMBER, CVFF, ESFF, CHARMM. Mi a számítás során a CHARMM (Chemistry at HARvard of Molecular Mechanics) erőteret használtuk, ami a potenciális energiát (φ) a következő alakban veszi figyelembe: φ = E + E + E + E + E + b θ ϕ ϖ vdw E el (1) ahol az első négy tag a kovalens kötéseknek megfelelő potenciális energiát adja meg rugalmas közelítésben (b a kötéstávolság, θ a kötésszög, ϕ a diéderes szög, ϖ a síkból való kilépési szög), az utolsó két tag a van der Waals és az elektrosztatikus kölcsönhatásoknak megfelelő potenciális energia. A molekuladinamika során az atommmagok mozgására vonatkozó klasszikus mozgásegyenleteket oldjuk meg minden egyes időpillanatban atomokra és molekulákra azért, hogy megkapjuk a rendszer időbeli változását. A termodinamikai jellemzőket a Maxwell-Boltzmann közelítéssel vesszük tekintetbe. A mozgásegyenlet Newton második törvényéből levezetve a következőképpen alakul: 2 d r () r m i 2 φ 1 i N (2) r = j Ahol a φ(r) a fenti potenciális energiafüggvény, a dt φ r j a potenciális energiafüggvény gradiense, mi az i-edik atom tömege. A 2. egyenlet a potenciális energia és a Newton féle mozgásegyenlet közti kapcsolatot mutatja be. Ez az összefüggés ad lehetőséget - 7 -
8 arra, hogy a hőmérsékletnek megfelelő atomi kezdősebességekből kiindulva az időfüggő atomi potenciálfüggvénynek megfelelő koordinátákat meghatározzuk. 5.2 A trajektória és analízise Az MD szimuláció elsődleges eredménye a molekula atomi koordinátáinak változása a szimulációs időtartamon belül, az idő függvényében. Ezt az adatsort trajektóriának nevezzük és különféle paraméterekkel jellemezzük. Az első fontos paraméter a root mean square deviation (RMSD), amely a szimuláció során az atomok átlagos elmozdulását adja meg egy referenciaszerkezethez képest. Egyensúly esetén a trajektória mentén ábrázolva az RMSD egy időben állandó érték körül ingadozik. A girációs rádiusz megmutatja, hogy az atomok átlagosan mekkora távolságra helyezkednek el a tömegközépponttól. Ez a paraméter a molekula méretéről ad felvilágosítást. Az egyes molekularészletek fluktuációját az RMSF (root mean square fluctuation) paraméter jellemzi. Ez közvetlenül összevethető a röntgendiffrakciós mérések kiértékelésekor nyert B-faktor értékekkel. Így, ez módot ad a kísérleti eredményekkel való összehasonlításra. Egy másik fontos paraméter az oldószer által elérhető felületet (SASA=solvent accessible surface area), amit úgy számítunk ki, hogy a molekula felületén egy meghatározott sugarú gömböt végiggörgetünk - esetünkben a sugár 1.4 Å, ami megfelel egy vízmolekula méretének. Amekkora felületen érintkezett a gömb a molekulával azzal a területtel definiáljuk az oldószer által elérhető felületet. A kötődés szabadentalpiaváltozását úgy számítottuk, hogy a szolvatált fehérje és a szolvatált antagonista szabadentalpiáját kivontuk a szolvatált komplex szabadentalpiájából. Ilyen módon, közvetve ugyan, de lehetőség van a szolvatáción keresztül a hidrofóbicitás figyelembevételére is. A fenti definíció alapján történő számítás azonban igényelné az abszolút szabadentalpia-függvények ismeretét. Ehelyett a szabadentalpiaváltozást a Karplus és munkatársai által leírt módszer segítségével határoztuk meg. A számításokhoz szükség volt a parciális töltések mellett az elektrosztatikus potenciálfüggvényekre, amelyeket a Poisson-Boltzmann egyenlet alapján határoztunk meg. A számításokat többféle belső dielektromos állandó érték mellett végeztük el. Az analízis során megvizsgáltuk, hogy milyen - 8 -
9 módon tér el a két különböző antagonista kötődési szabadentalpiája az MDS során kapott szerkezetben és a röntgendiffrakciós szerkezetben
10 6. Eredmények (az alábbiakban csak a dolgozatból levonható legfontosabb következtetéseket sorolom fel) 6.1 HbA n végzett számítások eredményei A HbA n végzett munka első lépése a DPG, IHP, RSR13 effektoroknak az R állapotú HbA hoz történő kapcsolódásának vizsgálata volt. Munkám kezdetén a munkacsoport már rendelkezett az allosztérikus effektor-hba komplexek dokkolás után nyert szerkezetével, amelyeken 500ps ill. 2ns időtartamú molekuladinamikai szimulációt végeztünk. A szimuláció során a komplex szerkezetén átrendeződés figyelhető meg a röntgen -diffrakciós szerkezethez viszonyított RMSD adatok szerint. A nagy RMSD értékek azt mutatják, hogy mindegyik alloszterikus effektor nagymértékben megváltoztatta a saját konformációját és a fehérje szerkezete egészében is jelentősen változott a röntgendiffrakciós szerkezethez képest. A DPG és az IHP az R-HbA központi üregében ugyanarra a helyre kötődik. A komplex szerkezetét az α2-arg141, α1-arg141, α2-lys99, α1-lys99 el és a központi üregben található vízmolekulákkal alkotott hidrogénkötések stabilizálják. Ez utóbbiak hídként szerepelnek az effektorok és az aminosavak között. A kötőhely analóg a T-állapotú hemoglobin β-alegységei közötti kötőhelyével. Az RSR-13 kötőhelye különbözik a két természetes alloszterikus effektor kötőhelyétől. Csak a metil-propionilsav csoport alkot néhány hidrogénkötést az α2-arg141 és az α1-lys99 el és az üregben található vízmolekulákkal. Az aromás gyűrű a β2-tyr35 aromás gyűrűjével van kapcsolatban. Továbbá az α2-leu29, α2-leu34, és a β2-val34 el hidrofób kölcsönhatásban van, és a két α és egy β alegységen lévő kötőhely analóg a T HbA ban lévő RSR13 kötőhellyel. Az 500 ps szimuláció alatt a komplexben egyik effektor sem mozdul el a kötőhelyről, ami a szerkezet stabilitását mutatta. Az aminosavakra vonatkozó RMSD időátlagokon látszik, hogy az alegységek terminálisain kívül még az α 1 36-α 1 51, β β 1 53, β 1 81-β 1 87, α 2 37-α 2 75, és a β 2 47-β 2 92 tartományok a DPG komplexben, β β 1 49, β 1 79-β 1 84, és α 2 50-α 2 64 tartományok az IHP komplexen mozgékonyabbak a többi aminosavnál. Ez azt mutatja, hogy az effektor kötődés hatására harmadlagos szerkezetváltozás következik be. Az RSR13 komplex esetében a fluktuációk a β
11 β 1 87 és a β 2 50-β 2 80 régiókban maximálisak. Összehasonlítva az effektormentes HbA fluktuációival megállapítható, hogy effektorok nélkül a fluktuációk kisebbek. 1 Ezek az eredmények azt jelentik, hogy az effektorok hatására harmadlagos szerkezetváltozás és a dinamika megváltozása következik be. Véleményünk szerint ennek fontos szerepe van az oxigénaffinitás szabályozásában. A HbA n végzett munka következő lépéseként 2ns molekuladinamika szimulációt végeztünk az R és a T állapotú HbA-n kloridionos és kloridmentes környezetben továbbá a DPG vel alkotott komplexeiken. A szimuláció legfontosabb eredménye az volt, hogy a DPG kötődésének hatására megváltozik a dimerek közti határfelületek szerkezete illetve a határfelületet alkotó aminosavak és vízmolekulák közti kölcsönhatások. A molekuladinamikai szimuláció során kapott szerkezetekből az tűnik ki, hogy R állapotban, kloridionmentes környezetben az alegységek határfelületei közti üreg térfogata nagy, sok vízmolekulát és kevés hidrogénkötést tartalmaz. Kloridionok jelenlétében a két alegység közti térfogat az átrendeződések következtében csökken, az alegységek közt a hidrogénkötések száma nő. DPG hatására még jobban megnövekszik a hidrogénkötések száma az alegységek közt, azonban a hídként funkcionáló vízmolekulák száma csökken, az üregtérfogat és a SASA nem változik jelentős mértékben. Az effektorkötés tehát egy kisebb perturbációt okoz az R-HbA szerkezetében. A T-állapotban ellenkező tendencia figyelhető meg, nevezetesen az alegységek közti üreg térfogata és a határfelületek közti vízmolekulák száma nő az alloszterikus effektor kötődésének hatására, így csökkentve a tetramer szerkezet stabilitását, ahogy az a munkacsoport kísérleti K d eredményeiből is látszik A CaM on végzett számítások eredményei A CaM molekula szerkezetét az RMSD, a girációs rádiusz és az atomi fluktuációk segítségével vizsgáltuk. A két vizsgált kalmodulin antagonista komplex idő függvényében vett energiaminimalizált szerkezethez viszonyított RMSD i szerint a protein váza mindkét komplex esetében ~5ns után lesz stabilis. A központi hélix mindkét komplex esetében stabilitást mutat a teljes 12ns szimuláció alatt. A két kalciumkötő doménben azonban jelentős átrendeződések játszódnak le főleg a TFP
12 komplex esetében. Figyelemreméltó, hogy az antagonisták szerkezete is jelentősen megváltozik. A DPD esetében ez a változás nagyobb mértékű mint a TFP esetén. Ezután megvizsgáltuk az RMSD k utolsó nanoszekundumon vett átlagát is az egyes aminosavak atomjaira nézve. A két komplex esetén a dinamikai jellemzők jelentős mértékben eltérnek egymástól; a kétféle antagonista kötődése különböző helyeken befolyásolja a fehérjelánc dinamikáját. Az atomi fluktuációk (RMSF) és a röntgenkrisztallográfiai mérésekkel kapott B-faktorok szerint a trajektóriából számított RMSF értékek szerint a CaM-TFP mutatott nagyobb mozgékonyságot. Mind a CaM TFP mind a CaM DPD esetén megvizsgáltuk a girációs rádiuszokat. A két komplex girációs rádiuszainak eltérése jelentős. A dinamika során a DPD komplex girációs rádiusza nagymértékben változott, kompaktabb lett a röntgendiffrakciós szerkezethez képest. A TFP esetén a változás nem jelentős. A TFP pozitív töltése miatt a CHARMM kölcsönhatási energiák a CaM-TFP komplex esetén nagyobbak, mivel az elektrosztatikus kölcsönhatás adja a legnagyobb hozzájárulást. Ez a term a semleges DPD esetén sokkal alacsonyabb. Viszont a van der Waals term a CaM DPD komplex esetén nagyobb. Ezután a H-hidas és a hidrofób kapcsolatokat határoztuk meg. Ez azt mutatja, hogy a dinamika során a kötőhely megváltozik mindkét antagonista esetében. A TFP vel alkotott komplex esetében a változás szembetűnőbb, mivel a TFP1 elhagyja a C domént és csak az N doménhez és a központi hélixhez kapcsolódik, míg a TFP2 molekula egyedül a C-doménhez kapcsolódik. Az N doménen kiemelkedő szerepe van a Glu11 nek és a Glu14 nek. A Poisson-Boltzmann szabadentalpia számítások szerint mind a három dielektromos állandó esetén a dinamika után a CaM-TFP komplexben a kötődési szabadentalpiaváltozás kedvezőbbnek mutatkozott. A TFP direkt töltés-töltés kölcsönhatásban felülmúlja a DPD t, mind a röntgendiffrakciós, mind a dinamika során kapott szerkezetben. Azonban, a nagy deszolvatációs tag a TFP-nél csaknem kompenzálja a direkt kölcsönhatás járulékát. Összességében az energiaértékek nem igazolják, hogy a DPD kötődése lenne kedvezőbb. Ezért megvizsgáltuk részletesebben, hogy a kötőhely környezetében levő aminosavak hogyan járulnak
13 hozzá a teljes ΔG értékekhez. A TFP molekulák közvetlen környezetéből az tűnik ki, hogy a CaM Glu11 és a Glu14 es aminosavai megközelítik a TFP1 és TFP2 piridin nitrogénjét. Az is észrevehető, hogy az ugyanahhoz a nitrogénhez egy polarizált metil csoport is tartozik, amely a direkt töltés-töltés kölcsönhatást lerontja. Erre a hatásra utal a viszonylag nagy fehérje deszolvatációs tag is, amely azt mutatja, hogy a glutaminsavaknak a vízzel való kapcsolat kedvezőbb lenne. A szerkezet további részletes vizsgálata azt mutatja, hogy Glu10 karboxil oxigénjét a TFP2 a pozitív töltésével közelebb vonzza, de így a Met124 oldalláncához is közelebb kerül ami ismételten egy kedvezőtlen hatás. Ezért van az, hogy a TFP szerkezetben a direkt töltés-töltés kölcsönhatást a kedvezőtlen deszolvatáció lerontja. A két TFP molekula illeszkedése emiatt problematikus. Ugyan a dinamika során az illeszkedés kedvezőbbé válik, de az a probléma, hogy a TFP molekula nem tud megfelelően beilleszkedni a kötőhelyre, megmarad. A TFP molekula kötődése mellett a DPD kötődése is kedvezőbbé válik a dinamika során. Ugyan a direkt töltés-töltés kölcsönhatások kedvezőtlenebbek mint a TFP komplex esetén, azonban ezt ellensúlyozza a protein deszolvatációs tag. Érdekes módon a deszolvatációs tag kedvezőbb volt a poláris aminosavak esetén, ahol a szimuláció során kialakulhattak a megfelelő oldószer kontaktusok. Ahhoz, hogy meghatározzuk a hidrofób kölcsönhatás mértékét, meghatároztuk az aminosavak oldószer által elérhető felületét antagonista kötődés esetén, antagonista kötődés nélkül, illetve a kettő különbségét, különös tekintettel a hidrofób aminosavakra. A nagy SASA különbségek jelentős hidrofób kölcsönhatási effektust mutatnak. Látható, hogy a DPD több hidrofób kapcsolatot létesít mint a TFP, továbbá a dinamika során ezek a kapcsolatok a DPD esetén erősebbé válnak, míg a TFP esetén gyengülnek
14 7. Következtetések 7.1 HbA n végzett munka eredményeiből levont következtetések Szimulációs módszerekkel megvizsgáltuk, hogy az R állapotú HbA ki tud e alakítani stabil komplex szerkezetet az allosztérikus effektorokkal, illetve, hogy ki tud e alakulni specifikus effektorkötőhely és milyen eltérést mutat a T állapotbú HbA kötőhelyéhez képest? Ezután az alegységek közti határfelületi kölcsönhatásokat elemeztük a hidrogén-hidak, a hidrofóbicitás és a kötött vízmolekulák szempontjából. Az R állapotú HbA effektor komplexek stabilisak, és ebben az állapotban is kialakul a specifikus kötőhely a HbA központi üregében A specifikus kötőhely nem azonos a T állapotú HbA effektorkötőhelyével. Az alloszterikus effektorkötés különbözőképpen hatott a tetramer stabilitására R és T állapotban. T állapotban csökkentette, R állapotban növelte a stabilitást. A dimér határfelületeken jelentős átrendeződés történt. 7.2 CaM-n végzett munka eredményeiből levont következtetések Irodalmi adatok alapján a két CaM-antagonista 1:2 arányú komplex röntgendiffrakciós szerkezete igen hasonló, de a két komplex disszociációs állandója jelentősen eltér egymástól. Ezen eltérés okának kiderítése volt a cél. Továbbá, célul tűztük ki, hogy az eredményekből általános következtetéseket vonjunk le arra nézve, hogy milyen optimális szerkezeti tulajdonságokkal kell rendelkeznie egy molekulának ahhoz, hogy funkcionálisan gátolni tudja a CaM-t. A szimulációs eredmények (RMSD és a két szerkezet) jól mutatják, hogy a két CaM-antagonista szerkezet közt jelentős az eltérés. A DPD molekula, a kedvező hidrofób kapcsolatainak köszönhetően szerkezetileg jobban illeszkedik a CaM aktív centrumába mint a TFP. A kötőhely aminosavjainak deszolvatációs energiája is a DPD jóval szorosabb illeszkedését mutatja. 3 A TFP molekulák kedvezőtlen illeszkedése nem teszi lehetővé a szorosabb töltés-töltés kölcsönhatást a CaM kötőhelyével. Mind szerkezeti, mind a szabad energia szempontjából
15 kedvezőbb lenne olyan antagonista szerkezet, amely hosszabb lánc végén hordozna elektrosztatikusan töltött csoportot
16 8. Saját közlemények 8.1 Dolgozat alapjául szolgáló saját közlemények 1. M. Laberge, I. Kövesi, T. Yonetani, J. Fidy. R-state hemoglobin bound to heterotropic effectors: models of the DPG, IHP and RSR13 binding sites FEBS Letters 579, I. Kövesi, G. Schay, M. Laberge, T. Yonetani, J. Fidy. High pressure reveals that the stability of interdimeric contacts in the R- and T-state of HbA is influenced by allosteric effectors: Insights from computational simulations Biochimica et Biophysica Acta-Proteins and Proteomics 1764 (3): I. Kövesi, D. K. Menyhard, M. Laberge, J. Fidy. Interaction of antagonists with calmodulin: insights from molecular dynamics simulations. J. Med.Chem 51(11): Egyéb közlemény Laberge M, Kovesi I, Yonetani T, Fidy J. Normal mode analysis of the horseradish peroxidase collective motions: correlation with spectroscopically observed heme distortions. Biopolymers. 82(4):
Hemoglobin - myoglobin. Konzultációs e-tananyag Szikla Károly
 Hemoglobin - myoglobin Konzultációs e-tananyag Szikla Károly Myoglobin A váz- és szívizom oxigén tároló fehérjéje Mt.: 17.800 153 aminosavból épül fel A lánc kb 75 % a hélix 8 db hélix, köztük nem helikális
Hemoglobin - myoglobin Konzultációs e-tananyag Szikla Károly Myoglobin A váz- és szívizom oxigén tároló fehérjéje Mt.: 17.800 153 aminosavból épül fel A lánc kb 75 % a hélix 8 db hélix, köztük nem helikális
A Genomikától a proteomikáig és a molekuláris dinamikáig
 A Genomikától a proteomikáig és a molekuláris dinamikáig Balog Erika tudományos fõmunkatárs, Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet és MTA Biofizikai Kutatócsoport, Budapest Fidy Judit
A Genomikától a proteomikáig és a molekuláris dinamikáig Balog Erika tudományos fõmunkatárs, Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet és MTA Biofizikai Kutatócsoport, Budapest Fidy Judit
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése
 Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
Elektrosztatikus számítások. Elektrosztatikus számítások. Elektrosztatikus számítások. Elektrosztatikus számítások Definíciók
 Jelentősége szubsztrát kötődés szolvatáció ionizációs állapotok (pka) mechanizmus katalízis ioncsatornák szimulációk (szerkezet) all-atom dipolar fluid dipolar lattice continuum Definíciók töltéseloszlás
Jelentősége szubsztrát kötődés szolvatáció ionizációs állapotok (pka) mechanizmus katalízis ioncsatornák szimulációk (szerkezet) all-atom dipolar fluid dipolar lattice continuum Definíciók töltéseloszlás
Molekuláris dinamika I. 10. előadás
 Molekuláris dinamika I. 10. előadás Miről is szól a MD? nagy részecskeszámú rendszerek ismerjük a törvényeket mikroszkópikus szinten minden részecske mozgását szimuláljuk? Hogyan tudjuk megérteni a folyadékok,
Molekuláris dinamika I. 10. előadás Miről is szól a MD? nagy részecskeszámú rendszerek ismerjük a törvényeket mikroszkópikus szinten minden részecske mozgását szimuláljuk? Hogyan tudjuk megérteni a folyadékok,
ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával.
 ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával www.chem.elte.hu/pr Kvíz az előző előadáshoz Programajánlatok október 18. 16:00 ELTE Kémiai Intézet 065-ös terem Észbontogató (www.chem.elte.hu/pr)
ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával www.chem.elte.hu/pr Kvíz az előző előadáshoz Programajánlatok október 18. 16:00 ELTE Kémiai Intézet 065-ös terem Észbontogató (www.chem.elte.hu/pr)
MedInProt Szinergia IV. program. Szerkezetvizsgáló módszer a rendezetlen fehérjék szerkezetének és kölcsönhatásainak jellemzésére
 MedInProt Szinergia IV. program Szerkezetvizsgáló módszer a rendezetlen fehérjék szerkezetének és kölcsönhatásainak jellemzésére Tantos Ágnes MTA TTK Enzimológiai Intézet, Rendezetlen fehérje kutatócsoport
MedInProt Szinergia IV. program Szerkezetvizsgáló módszer a rendezetlen fehérjék szerkezetének és kölcsönhatásainak jellemzésére Tantos Ágnes MTA TTK Enzimológiai Intézet, Rendezetlen fehérje kutatócsoport
FEHÉRJÉK A MÁGNESEKBEN. Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium. Alkímia Ma, Budapest,
 FEHÉRJÉK A MÁGNESEKBEN Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium Alkímia Ma, Budapest, 2013.02.28. I. FEHÉRJÉK: L-α aminosavakból felépülő lineáris polimerek α H 2 N CH COOH amino
FEHÉRJÉK A MÁGNESEKBEN Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium Alkímia Ma, Budapest, 2013.02.28. I. FEHÉRJÉK: L-α aminosavakból felépülő lineáris polimerek α H 2 N CH COOH amino
A fehérjék hierarchikus szerkezete
 Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
? ligandum kötés konformációs változás aktiválási energia számítás pka számítás kötési energiák
 Szabadenergia Definíció:? ligandum kötés konformációs változás aktiválási energia számítás pka számítás kötési energiák Fázistér teljes térfogatára kell számítani! Mennyiség átlagértéke: Sokaság-átlag
Szabadenergia Definíció:? ligandum kötés konformációs változás aktiválási energia számítás pka számítás kötési energiák Fázistér teljes térfogatára kell számítani! Mennyiség átlagértéke: Sokaság-átlag
LIE. Lineáris Kölcsönhatás Módszere. Vázlat LIE. Fehérje-ligandum kölcsönhatás kvantitatív jellemzése számítógépes modellezéssel 2.
 Fehérje-ligandum kölcsönhatás kvantitatív jellemzése számítógépes modellezéssel 2. rész Ferenczy György MTA-SE Molekuláris Biofizikai Kutatócsoport ferenczy.gyorgy@med.semmelweis-univ.hu Vázlat Kötődési
Fehérje-ligandum kölcsönhatás kvantitatív jellemzése számítógépes modellezéssel 2. rész Ferenczy György MTA-SE Molekuláris Biofizikai Kutatócsoport ferenczy.gyorgy@med.semmelweis-univ.hu Vázlat Kötődési
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
A racionális gyógyszertervezés lehetőségei. A racionális gyógyszertervezés lehetőségei. A racionális gyógyszertervezés lehetőségei
 Cél: kis koncentrációban kötődő célvegyület tervezése Agonista: segíti az enzim működését, hatékonyabb, mint a természetes szubsztrát Antagonista: gátolja az enzim működését, ellentétes hatású, mint a
Cél: kis koncentrációban kötődő célvegyület tervezése Agonista: segíti az enzim működését, hatékonyabb, mint a természetes szubsztrát Antagonista: gátolja az enzim működését, ellentétes hatású, mint a
A fehérjék hierarchikus szerkezete
 Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK. Rausch Péter kémia-környezettan
 AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Kémiai reakciók mechanizmusa számítógépes szimulációval
 Kémiai reakciók mechanizmusa számítógépes szimulációval Stirling András stirling@chemres.hu Elméleti Kémiai Osztály Budapest Stirling A. (MTA Kémiai Kutatóközpont) Reakciómechanizmus szimulációból 2007.
Kémiai reakciók mechanizmusa számítógépes szimulációval Stirling András stirling@chemres.hu Elméleti Kémiai Osztály Budapest Stirling A. (MTA Kémiai Kutatóközpont) Reakciómechanizmus szimulációból 2007.
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Számítógépek és modellezés a kémiai kutatásokban
 Számítógépek és modellezés a kémiai kutatásokban Jedlovszky Pál Határfelületek és nanorendszerek laboratóriuma Alkímia ma 214 április 3. VALÓDI RENDSZEREK MODELL- ALKOTÁS MODELL- RENDSZEREK KÍSÉRLETEK
Számítógépek és modellezés a kémiai kutatásokban Jedlovszky Pál Határfelületek és nanorendszerek laboratóriuma Alkímia ma 214 április 3. VALÓDI RENDSZEREK MODELL- ALKOTÁS MODELL- RENDSZEREK KÍSÉRLETEK
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Atomok. szilárd. elsődleges kölcsönhatás. kovalens ionos fémes. gázok, folyadékok, szilárd anyagok. ionos fémek vegyületek ötvözetek
 Atomok elsődleges kölcsönhatás kovalens ionos fémes véges számú atom térhálós szerkezet 3D ionos fémek vegyületek ötvözetek molekulák atomrácsos vegyületek szilárd gázok, folyadékok, szilárd anyagok Gázok
Atomok elsődleges kölcsönhatás kovalens ionos fémes véges számú atom térhálós szerkezet 3D ionos fémek vegyületek ötvözetek molekulák atomrácsos vegyületek szilárd gázok, folyadékok, szilárd anyagok Gázok
Molekuláris dinamika. 10. előadás
 Molekuláris dinamika 10. előadás Mirőlis szól a MD? nagy részecskeszámú rendszerek ismerjük a törvényeket mikroszkópikus szinten? Hogyan tudjuk megérteni a folyadékok, gázok, szilárdtestek makroszkópikus
Molekuláris dinamika 10. előadás Mirőlis szól a MD? nagy részecskeszámú rendszerek ismerjük a törvényeket mikroszkópikus szinten? Hogyan tudjuk megérteni a folyadékok, gázok, szilárdtestek makroszkópikus
Fehérjeszerkezet analízis. Fehérjeszerkezet analízis. Fehérjeszerkezet analízis. Fehérjeszerkezet analízis. Fehérjeszerkezet analízis
 Szerkezet Protein Data Bank (PDB) http://www.rcsb.org/pdb ~ 35 701 szerkezet közepes felbontás 1552 szerkezet d 1.5 Å 160 szerkezet d 1.0 Å 10 szerkezet d 0.8 Å (atomi felbontás) E globális minimum? funkció
Szerkezet Protein Data Bank (PDB) http://www.rcsb.org/pdb ~ 35 701 szerkezet közepes felbontás 1552 szerkezet d 1.5 Å 160 szerkezet d 1.0 Å 10 szerkezet d 0.8 Å (atomi felbontás) E globális minimum? funkció
Bioinformatika 2 6. előadás
 6. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2018.10.08. PDBj: http://www.pdbj.org/ Fehérjék 3D szerkezeti adatbázisai - PDBj 2 2018.10.08.
6. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2018.10.08. PDBj: http://www.pdbj.org/ Fehérjék 3D szerkezeti adatbázisai - PDBj 2 2018.10.08.
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek
 Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Víz. Az élő anyag szerkezeti egységei. A vízmolekula szerkezete. Olyan mindennapi, hogy fel sem tűnik, milyen különleges
 Az élő anyag szerkezeti egységei víz nukleinsavak fehérjék membránok Olyan mindennapi, hogy fel sem tűnik, milyen különleges A Föld felszínének 2/3-át borítja Előfordulása az emberi szövetek felépítésében
Az élő anyag szerkezeti egységei víz nukleinsavak fehérjék membránok Olyan mindennapi, hogy fel sem tűnik, milyen különleges A Föld felszínének 2/3-át borítja Előfordulása az emberi szövetek felépítésében
Modern fizika laboratórium
 Modern fizika laboratórium 11. Az I 2 molekula disszociációs energiája Készítette: Hagymási Imre A mérés dátuma: 2007. október 3. A beadás dátuma: 2007. október xx. 1. Bevezetés Ebben a mérésben egy kétatomos
Modern fizika laboratórium 11. Az I 2 molekula disszociációs energiája Készítette: Hagymási Imre A mérés dátuma: 2007. október 3. A beadás dátuma: 2007. október xx. 1. Bevezetés Ebben a mérésben egy kétatomos
BIOFIZIKA Egészségügyi Mérnök MSc
 BIOFIZIKA Egészségügyi Mérnök MSc A tárgy felelős előadója: Dr. Fidy Judit egyetemi tanár judit.fidy@eok.sote.hu SE Biofizikai és Sugárbiológiai Intézet Két aspektus 1. Molekuláris biofizika molekulaszerkezetek
BIOFIZIKA Egészségügyi Mérnök MSc A tárgy felelős előadója: Dr. Fidy Judit egyetemi tanár judit.fidy@eok.sote.hu SE Biofizikai és Sugárbiológiai Intézet Két aspektus 1. Molekuláris biofizika molekulaszerkezetek
A fehérjék szerkezeti hierarchiája. Fehérje-szerkezetek! Klasszikus szerkezet-funkció paradigma. szekvencia. funkció. szerkezet! Myoglobin.
 Myoglobin Fehérje-szerkezetek! MGLSDGEWQLVLNVWGKVEADIPGGQEVLIRLFK GPETLEKFDKFKLKSEDEMKASE DLKKGATVLTALGGILKKKGEAEIKPLAQSA TKKIPVKYLEFISECIIQVLQSK PGDFGADAQGAMNKALELFRKDMASNYKELGFQG Fuxreiter Mónika! Debreceni
Myoglobin Fehérje-szerkezetek! MGLSDGEWQLVLNVWGKVEADIPGGQEVLIRLFK GPETLEKFDKFKLKSEDEMKASE DLKKGATVLTALGGILKKKGEAEIKPLAQSA TKKIPVKYLEFISECIIQVLQSK PGDFGADAQGAMNKALELFRKDMASNYKELGFQG Fuxreiter Mónika! Debreceni
A KAR-2, egy antimitotikus ágens egyedi farmakológiájának atomi és molekuláris alapjai
 A KAR-2, egy antimitotikus ágens egyedi farmakológiájának atomi és molekuláris alapjai A doktori értekezés tézisei Horváth István Eötvös Loránd Tudományegyetem Biológia Doktori Iskola (A Doktori Iskola
A KAR-2, egy antimitotikus ágens egyedi farmakológiájának atomi és molekuláris alapjai A doktori értekezés tézisei Horváth István Eötvös Loránd Tudományegyetem Biológia Doktori Iskola (A Doktori Iskola
8. A fehérjék térszerkezetének jóslása
 8. A fehérjék térszerkezetének jóslása A probléma bonyolultsága Általánosságban: találjuk meg egy tetszõleges szekvencia azon konformációját, amely a szabadentalpia globális minimumát adja. Egyszerû modellekben
8. A fehérjék térszerkezetének jóslása A probléma bonyolultsága Általánosságban: találjuk meg egy tetszõleges szekvencia azon konformációját, amely a szabadentalpia globális minimumát adja. Egyszerû modellekben
Biológiai makromolekulák szerkezete
 Biológiai makromolekulák szerkezete Biomolekuláris nemkovalens kölcsönhatások Elektrosztatikus kölcsönhatások (sóhidak: 4-6 kcal/m, dipól-dipól: ~10-1 kcal/m Diszperziós erők (~10-2 kcal/m) Hidrogén hidak
Biológiai makromolekulák szerkezete Biomolekuláris nemkovalens kölcsönhatások Elektrosztatikus kölcsönhatások (sóhidak: 4-6 kcal/m, dipól-dipól: ~10-1 kcal/m Diszperziós erők (~10-2 kcal/m) Hidrogén hidak
Fehérjeszerkezet, és tekeredés
 Fehérjeszerkezet, és tekeredés Futó Kinga 2013.10.08. Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983
Fehérjeszerkezet, és tekeredés Futó Kinga 2013.10.08. Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983
A fehérjék szerkezete és az azt meghatározó kölcsönhatások
 A fehérjék szerkezete és az azt meghatározó kölcsönhatások 1. A fehérjék szerepe az élõlényekben 2. A fehérjék szerkezetének szintjei 3. A fehérjék konformációs stabilitásáért felelõs kölcsönhatások 4.
A fehérjék szerkezete és az azt meghatározó kölcsönhatások 1. A fehérjék szerepe az élõlényekben 2. A fehérjék szerkezetének szintjei 3. A fehérjék konformációs stabilitásáért felelõs kölcsönhatások 4.
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak
 Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
A SZILÁRDTEST FOGALMA. Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. molekula klaszter szilárdtest > σ λ : rel.
 A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
A fehérjék térszerkezetének jóslása
 A fehérjék térszerkezetének jóslása 1. A probléma bonyolultsága 2. A predikció szintjei 3. 1D predikciók (másodlagos szerkezet, hozzáférhetõség, transzmembrán hélixek 4. 2D predikciók (oldallánc kontaktusok,
A fehérjék térszerkezetének jóslása 1. A probléma bonyolultsága 2. A predikció szintjei 3. 1D predikciók (másodlagos szerkezet, hozzáférhetõség, transzmembrán hélixek 4. 2D predikciók (oldallánc kontaktusok,
Kolloidstabilitás. Berka Márta 2010/2011/II
 Kolloidstabilitás Berka Márta 2010/2011/II Kolloid stabilitáshoz taszítás kell. Sztérikus stabilizálás V R V S sztérikus stabilizálás: liofil kolloidok alkalmazása védőhatás adszorpció révén (természetes
Kolloidstabilitás Berka Márta 2010/2011/II Kolloid stabilitáshoz taszítás kell. Sztérikus stabilizálás V R V S sztérikus stabilizálás: liofil kolloidok alkalmazása védőhatás adszorpció révén (természetes
Erőterek. Erőterek. Erőterek. Erőterek. Erőterek. Erőterek. Probléma: fehérjéknél nagy dimenziók értelmetlen QM eredmények.
 fehérjéknél nagy dimenziók értelmetlen QM eredmények Megoldás: egyszerűsítés dimenzió-csökkentés Közelítések Born-Oppenheimer közelítés (Ψ mol = Ψ el Ψ mag ; E tot =E el +E mag ) az energia párkölcsönhatások
fehérjéknél nagy dimenziók értelmetlen QM eredmények Megoldás: egyszerűsítés dimenzió-csökkentés Közelítések Born-Oppenheimer közelítés (Ψ mol = Ψ el Ψ mag ; E tot =E el +E mag ) az energia párkölcsönhatások
Az élethez szükséges elemek
 Az élethez szükséges elemek 92 elemből kb. 25 szükséges az élethez Szén (C), hidrogén (H), oxigén (O) és nitrogén (N) alkotja az élő szervezetekben előforduló anyag 96%-t A fennmaradó 4% legnagyobb része
Az élethez szükséges elemek 92 elemből kb. 25 szükséges az élethez Szén (C), hidrogén (H), oxigén (O) és nitrogén (N) alkotja az élő szervezetekben előforduló anyag 96%-t A fennmaradó 4% legnagyobb része
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása.
 Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása. Adszorpció oldatból szilárd felületre Adszorpció oldatból Nem-elektrolitok
Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása. Adszorpció oldatból szilárd felületre Adszorpció oldatból Nem-elektrolitok
Altalános Kémia BMEVESAA101 tavasz 2008
 Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások)
 3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások) 3.1 Fehérjék, enzimek A genetikai információ egyik fő manifesztálódása
3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások) 3.1 Fehérjék, enzimek A genetikai információ egyik fő manifesztálódása
Al-Mg-Si háromalkotós egyensúlyi fázisdiagram közelítő számítása
 l--si háromalkotós egyensúlyi fázisdiagram közelítő számítása evezetés Farkas János 1, Dr. Roósz ndrás 1 doktorandusz, tanszékvezető egyetemi tanár Miskolci Egyetem nyag- és Kohómérnöki Kar Fémtani Tanszék
l--si háromalkotós egyensúlyi fázisdiagram közelítő számítása evezetés Farkas János 1, Dr. Roósz ndrás 1 doktorandusz, tanszékvezető egyetemi tanár Miskolci Egyetem nyag- és Kohómérnöki Kar Fémtani Tanszék
Speciális fluoreszcencia spektroszkópiai módszerek
 Speciális fluoreszcencia spektroszkópiai módszerek Fluoreszcencia kioltás Fluoreszcencia Rezonancia Energia Transzfer (FRET), Lumineszcencia A molekuláknak azt a fényemisszióját, melyet a valamilyen módon
Speciális fluoreszcencia spektroszkópiai módszerek Fluoreszcencia kioltás Fluoreszcencia Rezonancia Energia Transzfer (FRET), Lumineszcencia A molekuláknak azt a fényemisszióját, melyet a valamilyen módon
ERD14: egy funkcionálisan rendezetlen dehidrin fehérje szerkezeti és funkcionális jellemzése
 Doktori értekezés tézisei ERD14: egy funkcionálisan rendezetlen dehidrin fehérje szerkezeti és funkcionális jellemzése DR. SZALAINÉ ÁGOSTON Bianka Ildikó Témavezetők Dr. PERCZEL András egyetemi tanár és
Doktori értekezés tézisei ERD14: egy funkcionálisan rendezetlen dehidrin fehérje szerkezeti és funkcionális jellemzése DR. SZALAINÉ ÁGOSTON Bianka Ildikó Témavezetők Dr. PERCZEL András egyetemi tanár és
Bevezetés a bioinformatikába. Harangi János DE, TEK, TTK Biokémiai Tanszék
 Bevezetés a bioinformatikába Harangi János DE, TEK, TTK Biokémiai Tanszék Bioinformatika Interdiszciplináris tudomány, amely magába foglalja a biológiai adatok gyűjtésének,feldolgozásának, tárolásának,
Bevezetés a bioinformatikába Harangi János DE, TEK, TTK Biokémiai Tanszék Bioinformatika Interdiszciplináris tudomány, amely magába foglalja a biológiai adatok gyűjtésének,feldolgozásának, tárolásának,
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
Nukleinsavak építőkövei
 ukleinsavak Szerkezeti hierarchia ukleinsavak építőkövei Pirimidin Purin Pirimidin Purin Timin (T) Adenin (A) Adenin (A) Citozin (C) Guanin (G) DS bázisai bázis Citozin (C) Guanin (G) RS bázisai bázis
ukleinsavak Szerkezeti hierarchia ukleinsavak építőkövei Pirimidin Purin Pirimidin Purin Timin (T) Adenin (A) Adenin (A) Citozin (C) Guanin (G) DS bázisai bázis Citozin (C) Guanin (G) RS bázisai bázis
Termodinamikai bevezető
 Termodinamikai bevezető Alapfogalmak Termodinamikai rendszer: Az univerzumnak az a részhalmaza, amit egy termodinamikai vizsgálat során vizsgálunk. Termodinamikai környezet: Az univerzumnak a rendszeren
Termodinamikai bevezető Alapfogalmak Termodinamikai rendszer: Az univerzumnak az a részhalmaza, amit egy termodinamikai vizsgálat során vizsgálunk. Termodinamikai környezet: Az univerzumnak a rendszeren
Vezetők elektrosztatikus térben
 Vezetők elektrosztatikus térben Vezető: a töltések szabadon elmozdulhatnak Ha a vezető belsejében a térerősség nem lenne nulla akkor áram folyna. Ha a felületen a térerősségnek lenne tangenciális (párhuzamos)
Vezetők elektrosztatikus térben Vezető: a töltések szabadon elmozdulhatnak Ha a vezető belsejében a térerősség nem lenne nulla akkor áram folyna. Ha a felületen a térerősségnek lenne tangenciális (párhuzamos)
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Mivel foglalkozik a hőtan?
 Hőtan Gáztörvények Mivel foglalkozik a hőtan? A hőtan a rendszerek hőmérsékletével, munkavégzésével, és energiájával foglalkozik. A rendszerek stabilitása áll a fókuszpontjában. Képes megválaszolni a kérdést:
Hőtan Gáztörvények Mivel foglalkozik a hőtan? A hőtan a rendszerek hőmérsékletével, munkavégzésével, és energiájával foglalkozik. A rendszerek stabilitása áll a fókuszpontjában. Képes megválaszolni a kérdést:
A rosszindulatú daganatos halálozás változása 1975 és 2001 között Magyarországon
 A rosszindulatú daganatos halálozás változása és között Eredeti közlemény Gaudi István 1,2, Kásler Miklós 2 1 MTA Számítástechnikai és Automatizálási Kutató Intézete, Budapest 2 Országos Onkológiai Intézet,
A rosszindulatú daganatos halálozás változása és között Eredeti közlemény Gaudi István 1,2, Kásler Miklós 2 1 MTA Számítástechnikai és Automatizálási Kutató Intézete, Budapest 2 Országos Onkológiai Intézet,
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában. Szőri Milán: Kolloidkémia
 Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Vegyületek - vegyületmolekulák
 Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Modern Fizika Labor. Fizika BSc. Értékelés: A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n. 2008. április 29.
 Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Atomok és molekulák elektronszerkezete
 Atomok és molekulák elektronszerkezete Szabad atomok és molekulák Schrödinger egyenlete Tekintsünk egy kvantummechanikai rendszert amely N n magból és N e elektronból áll. Koordinátáikat jelölje rendre
Atomok és molekulák elektronszerkezete Szabad atomok és molekulák Schrödinger egyenlete Tekintsünk egy kvantummechanikai rendszert amely N n magból és N e elektronból áll. Koordinátáikat jelölje rendre
A SZUBSZTRÁTKÖTŐDÉS ÉS SZUBSZTRÁTKIRALITÁS SZEREPE A HUMÁN 3-FOSZFOGLICERÁT KINÁZ DINAMIKÁJÁBAN. Pálmai Zoltán
 A SZUBSZTRÁTKÖTŐDÉS ÉS SZUBSZTRÁTKIRALITÁS SZEREPE A HUMÁN 3-FOSZFOGLICERÁT KINÁZ DINAMIKÁJÁBAN Doktori tézisek Pálmai Zoltán Semmelweis Egyetem Gyógyszertudományok Doktori Iskola Témavezető: Dr. Balog
A SZUBSZTRÁTKÖTŐDÉS ÉS SZUBSZTRÁTKIRALITÁS SZEREPE A HUMÁN 3-FOSZFOGLICERÁT KINÁZ DINAMIKÁJÁBAN Doktori tézisek Pálmai Zoltán Semmelweis Egyetem Gyógyszertudományok Doktori Iskola Témavezető: Dr. Balog
A BÜKKI KARSZTVÍZSZINT ÉSZLELŐ RENDSZER KERETÉBEN GYŰJTÖTT HIDROMETEOROLÓGIAI ADATOK ELEMZÉSE
 KARSZTFEJLŐDÉS XIX. Szombathely, 2014. pp. 137-146. A BÜKKI KARSZTVÍZSZINT ÉSZLELŐ RENDSZER KERETÉBEN GYŰJTÖTT HIDROMETEOROLÓGIAI ADATOK ELEMZÉSE ANALYSIS OF HYDROMETEOROLIGYCAL DATA OF BÜKK WATER LEVEL
KARSZTFEJLŐDÉS XIX. Szombathely, 2014. pp. 137-146. A BÜKKI KARSZTVÍZSZINT ÉSZLELŐ RENDSZER KERETÉBEN GYŰJTÖTT HIDROMETEOROLÓGIAI ADATOK ELEMZÉSE ANALYSIS OF HYDROMETEOROLIGYCAL DATA OF BÜKK WATER LEVEL
Az élő sejt fizikai Biológiája:
 Az élő sejt fizikai Biológiája: Modellépítés, biológiai rendszerek skálázódása Kellermayer Miklós Fizikai biológia Ma már nem csak kvalitatív megfigyeléseket, hanem kvantitatív méréseket végzünk (biológiai
Az élő sejt fizikai Biológiája: Modellépítés, biológiai rendszerek skálázódása Kellermayer Miklós Fizikai biológia Ma már nem csak kvalitatív megfigyeléseket, hanem kvantitatív méréseket végzünk (biológiai
Atomok. szilárd. elsődleges kölcsönhatás. kovalens ionos fémes. gázok, folyadékok, szilárd anyagok. ionos fémek vegyületek ötvözetek
 Atomok elsődleges kölcsönhatás kovalens ionos fémes véges számú atom térhálós szerkezet 3D ionos fémek vegyületek ötvözetek molekulák atomrácsos vegyületek szilárd gázok, folyadékok, szilárd anyagok Gázok
Atomok elsődleges kölcsönhatás kovalens ionos fémes véges számú atom térhálós szerkezet 3D ionos fémek vegyületek ötvözetek molekulák atomrácsos vegyületek szilárd gázok, folyadékok, szilárd anyagok Gázok
kutatás során legfőbb eredményeinket a szerin proteázok aktiválódásának mechanizmusával és az aktiválódás fiziológiai következményeinek
 Fehérjék konformációs flexibilitása mint a biomolekuláris felismerés és a jeltovábbítás alapvető eleme (OTKA NK 77978) Zárójelentés (2009. ápr. 1-től 2013. márc. 31-ig) A biológiai rendszerek önszerveződésének
Fehérjék konformációs flexibilitása mint a biomolekuláris felismerés és a jeltovábbítás alapvető eleme (OTKA NK 77978) Zárójelentés (2009. ápr. 1-től 2013. márc. 31-ig) A biológiai rendszerek önszerveződésének
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Előszó.. Bevezetés. 1. A fizikai megismerés alapjai Tér is idő. Hosszúság- és időmérés.
 SZABÓ JÁNOS: Fizika (Mechanika, hőtan) I. TARTALOMJEGYZÉK Előszó.. Bevezetés. 1. A fizikai megismerés alapjai... 2. Tér is idő. Hosszúság- és időmérés. MECHANIKA I. Az anyagi pont mechanikája 1. Az anyagi
SZABÓ JÁNOS: Fizika (Mechanika, hőtan) I. TARTALOMJEGYZÉK Előszó.. Bevezetés. 1. A fizikai megismerés alapjai... 2. Tér is idő. Hosszúság- és időmérés. MECHANIKA I. Az anyagi pont mechanikája 1. Az anyagi
Membrántranszport. Gyógyszerész előadás Dr. Barkó Szilvia
 Membrántranszport Gyógyszerész előadás 2017.04.10 Dr. Barkó Szilvia Sejt membránok A sejtmembrán funkciói Védelem Kommunikáció Molekulák importja és exportja Sejtmozgás Általános szerkezet Lipid kettősréteg
Membrántranszport Gyógyszerész előadás 2017.04.10 Dr. Barkó Szilvia Sejt membránok A sejtmembrán funkciói Védelem Kommunikáció Molekulák importja és exportja Sejtmozgás Általános szerkezet Lipid kettősréteg
Fotovillamos és fotovillamos-termikus modulok energetikai modellezése
 Fotovillamos és fotovillamos-termikus modulok energetikai modellezése Háber István Ervin Nap Napja Gödöllő, 2016. 06. 12. Bevezetés A fotovillamos modulok hatásfoka jelentősen függ a működési hőmérséklettől.
Fotovillamos és fotovillamos-termikus modulok energetikai modellezése Háber István Ervin Nap Napja Gödöllő, 2016. 06. 12. Bevezetés A fotovillamos modulok hatásfoka jelentősen függ a működési hőmérséklettől.
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Dózis-válasz görbe A dózis válasz kapcsolat ábrázolása a legáltalánosabb módja annak, hogy bemutassunk eredményeket a tudományban vagy a klinikai
 Dózis-válasz görbe A dózis válasz kapcsolat ábrázolása a legáltalánosabb módja annak, hogy bemutassunk eredményeket a tudományban vagy a klinikai gyakorlatban. Például egy kísérletben növekvő mennyiségű
Dózis-válasz görbe A dózis válasz kapcsolat ábrázolása a legáltalánosabb módja annak, hogy bemutassunk eredményeket a tudományban vagy a klinikai gyakorlatban. Például egy kísérletben növekvő mennyiségű
A sztereoizoméria hatása peptidek térszerkezetére és bioaktivitására OTKA PD Szakmai zárójelentés. Dr. Leitgeb Balázs
 A sztereoizoméria hatása peptidek térszerkezetére és bioaktivitására OTKA PD 78554 Szakmai zárójelentés Dr. Leitgeb Balázs A projekt során azt tanulmányoztam, hogy a sztereoizoméria milyen hatásokat fejt
A sztereoizoméria hatása peptidek térszerkezetére és bioaktivitására OTKA PD 78554 Szakmai zárójelentés Dr. Leitgeb Balázs A projekt során azt tanulmányoztam, hogy a sztereoizoméria milyen hatásokat fejt
Modern Fizika Labor Fizika BSC
 Modern Fizika Labor Fizika BSC A mérés dátuma: 2009. május 4. A mérés száma és címe: 9. Röntgen-fluoreszencia analízis Értékelés: A beadás dátuma: 2009. május 13. A mérést végezte: Márton Krisztina Zsigmond
Modern Fizika Labor Fizika BSC A mérés dátuma: 2009. május 4. A mérés száma és címe: 9. Röntgen-fluoreszencia analízis Értékelés: A beadás dátuma: 2009. május 13. A mérést végezte: Márton Krisztina Zsigmond
Atomfizika. A hidrogén lámpa színképei. Elektronok H atom. Fényképlemez. emisszió H 2. gáz
 Atomfizika A hidrogén lámpa színképei - Elektronok H atom emisszió Fényképlemez V + H 2 gáz Az atom és kvantumfizika fejlődésének fontos szakasza volt a hidrogén lámpa színképeinek leírása, és a vonalas
Atomfizika A hidrogén lámpa színképei - Elektronok H atom emisszió Fényképlemez V + H 2 gáz Az atom és kvantumfizika fejlődésének fontos szakasza volt a hidrogén lámpa színképeinek leírása, és a vonalas
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Folyadékok és szilárd anyagok
 Folyadékok és szilárd anyagok 7-1 Intermolekuláris erők, folyadékok tulajdonságai 7-2 Folyadékok gőztenziója 7-3 Szilárd anyagok néhány tulajdonsága 7-4 Fázisdiagram 7-5 Van der Waals kölcsönhatások 7-6
Folyadékok és szilárd anyagok 7-1 Intermolekuláris erők, folyadékok tulajdonságai 7-2 Folyadékok gőztenziója 7-3 Szilárd anyagok néhány tulajdonsága 7-4 Fázisdiagram 7-5 Van der Waals kölcsönhatások 7-6
Kolloidkémia 5. előadás Határfelületi jelenségek II. Folyadék-folyadék, szilárd-folyadék határfelületek. Szőri Milán: Kolloidkémia
 Kolloidkémia 5. előadás Határfelületi jelenségek II. Folyadék-folyadék, szilárd-folyadék határfelületek 1 Határfelületi rétegek 2 Pavel Jungwirth, Nature, 2011, 474, 168 169. / határfelületi jelenségek
Kolloidkémia 5. előadás Határfelületi jelenségek II. Folyadék-folyadék, szilárd-folyadék határfelületek 1 Határfelületi rétegek 2 Pavel Jungwirth, Nature, 2011, 474, 168 169. / határfelületi jelenségek
Összefoglalók Kémia BSc 2012/2013 I. félév
 Összefoglalók Kémia BSc 2012/2013 I. félév Készült: Eötvös Loránd Tudományegyetem Kémiai Intézet Szerves Kémiai Tanszékén 2012.12.17. Összeállította Szilvágyi Gábor PhD hallgató Tartalomjegyzék Orgován
Összefoglalók Kémia BSc 2012/2013 I. félév Készült: Eötvös Loránd Tudományegyetem Kémiai Intézet Szerves Kémiai Tanszékén 2012.12.17. Összeállította Szilvágyi Gábor PhD hallgató Tartalomjegyzék Orgován
Fizikai kémia 2. Előzmények. A Lewis-féle kötéselmélet A VB- és az MO-elmélet, a H 2+ molekulaion
 06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
Az atom- olvasni. 1. ábra Az atom felépítése 1. Az atomot felépítő elemi részecskék. Proton, Jele: (p+) Neutron, Jele: (n o )
 Az atom- olvasni 2.1. Az atom felépítése Az atom pozitív töltésű atommagból és negatív töltésű elektronokból áll. Az atom atommagból és elektronburokból álló semleges kémiai részecske. Az atommag pozitív
Az atom- olvasni 2.1. Az atom felépítése Az atom pozitív töltésű atommagból és negatív töltésű elektronokból áll. Az atom atommagból és elektronburokból álló semleges kémiai részecske. Az atommag pozitív
F E H É R J E D I N A M I K A V I Z S G Á L ATA Ú J F O S Z F O R E S Z C E N C I Á N A L A P U L Ó E L J Á R Á S S A L Doktori dolgozat tézisei
 F E H É R J E D I N A M I K A V I Z S G Á L ATA Ú J F O S Z F O R E S Z C E N C I Á N A L A P U L Ó E L J Á R Á S S A L Doktori dolgozat tézisei schay gusztáv témavezető: prof. fidy judit d.sc. Biológia
F E H É R J E D I N A M I K A V I Z S G Á L ATA Ú J F O S Z F O R E S Z C E N C I Á N A L A P U L Ó E L J Á R Á S S A L Doktori dolgozat tézisei schay gusztáv témavezető: prof. fidy judit d.sc. Biológia
Doktori értekezés. Kövesi István. Semmelweis Egyetem Gyógyszertudományi Doktori Iskola. Témavezető: Dr. Fidy Judit egyetemi tanár, az MTA tagja
 Funkconáls jelentőségű ks molekulák (antagonsták és alloszterkus effektorok) kötődésének hatása a fehérjeszerkezetre. Számítógépes szmulácós vzsgálatok Doktor értekezés Köves István Semmelwes Egyetem Gyógyszertudomány
Funkconáls jelentőségű ks molekulák (antagonsták és alloszterkus effektorok) kötődésének hatása a fehérjeszerkezetre. Számítógépes szmulácós vzsgálatok Doktor értekezés Köves István Semmelwes Egyetem Gyógyszertudomány
A fel és legombolyodás molekuladinamikai szimulációi
 A fel és legombolyodás molekuladinamikai szimulációi 1. Mi a molekuladinamika? 2. Modern módszerek a molekuladinamikában 3. Peptidek vizsgálata MD vel 4. Fehérjék natív szerkezetének MD szimulációi 5.
A fel és legombolyodás molekuladinamikai szimulációi 1. Mi a molekuladinamika? 2. Modern módszerek a molekuladinamikában 3. Peptidek vizsgálata MD vel 4. Fehérjék natív szerkezetének MD szimulációi 5.
A fehérjék hierarchikus szerkezete. Szerkezeti hierarchia. A fehérjék építőkövei az aminosavak. Fehérjék felosztása
 Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
A MASP-1 dózis-függő módon vazorelaxációt. okoz egér aortában
 Analog input Analog input 157.34272 167.83224 178.32175 188.81127 Relaxáció (prekontrakció %) Channel 8 Channel 8 Analog input Volts Volts Channel 12 A dózis-függő módon vazorelaxációt Vehikulum 15.80
Analog input Analog input 157.34272 167.83224 178.32175 188.81127 Relaxáció (prekontrakció %) Channel 8 Channel 8 Analog input Volts Volts Channel 12 A dózis-függő módon vazorelaxációt Vehikulum 15.80
 http://www.nature.com 1) Magerő-sugár: a magközéppontból mért távolság, ameddig a magerők hatótávolsága terjed. Rutherford-szórásból határozható meg. R=1,4 x 10-13 A 1/3 cm Az atommag terének potenciálja
http://www.nature.com 1) Magerő-sugár: a magközéppontból mért távolság, ameddig a magerők hatótávolsága terjed. Rutherford-szórásból határozható meg. R=1,4 x 10-13 A 1/3 cm Az atommag terének potenciálja
Modern Fizika Labor. 12. Infravörös spektroszkópia. Fizika BSc. A mérés dátuma: okt. 04. A mérés száma és címe: Értékelés:
 Modern Fizika Labor Fizika BSc A mérés dátuma: 011. okt. 04. A mérés száma és címe: 1. Infravörös spektroszkópia Értékelés: A beadás dátuma: 011. dec. 1. A mérést végezte: Domokos Zoltán Szőke Kálmán Benjamin
Modern Fizika Labor Fizika BSc A mérés dátuma: 011. okt. 04. A mérés száma és címe: 1. Infravörös spektroszkópia Értékelés: A beadás dátuma: 011. dec. 1. A mérést végezte: Domokos Zoltán Szőke Kálmán Benjamin
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Fehérjék felépítése és struktúrája. Aminosav oldalláncok. A fehérjék királis elemekből (α-l-aminosavakból) épülnek fel
 Fehérjék felépítése és struktúrája Aminosav oldalláncok A fehérjék királis elemekből (α-l-aminosavakból) épülnek fel Fehérjék szerkezete Anfinsen dogmája Anfinsen dogmája (vagy: termodinamikus hipotézis)
Fehérjék felépítése és struktúrája Aminosav oldalláncok A fehérjék királis elemekből (α-l-aminosavakból) épülnek fel Fehérjék szerkezete Anfinsen dogmája Anfinsen dogmája (vagy: termodinamikus hipotézis)
Evans-Searles fluktuációs tétel Crooks fluktuációs tétel Jarzynski egyenlőség
 Evans-Searles fluktuációs tétel Crooks fluktuációs tétel Jarzynski egyenlőség Osváth Szabolcs Evans-Searles fluktuációs tétel Denis J Evans, Ezechiel DG Cohen, Gary P Morriss (1993) Denis J Evans, Debra
Evans-Searles fluktuációs tétel Crooks fluktuációs tétel Jarzynski egyenlőség Osváth Szabolcs Evans-Searles fluktuációs tétel Denis J Evans, Ezechiel DG Cohen, Gary P Morriss (1993) Denis J Evans, Debra
1. Feladatok a dinamika tárgyköréből
 1. Feladatok a dinamika tárgyköréből Newton három törvénye 1.1. Feladat: Három azonos m tömegű gyöngyszemet fonálra fűzünk, egymástól kis távolságokban a fonálhoz rögzítünk, és az elhanyagolható tömegű
1. Feladatok a dinamika tárgyköréből Newton három törvénye 1.1. Feladat: Három azonos m tömegű gyöngyszemet fonálra fűzünk, egymástól kis távolságokban a fonálhoz rögzítünk, és az elhanyagolható tömegű
MOLEKULÁRIS FOLYADÉKOK SZERKEZETÉNEK VIZSGÁLATA DIFFRAKCIÓS MÓDSZEREKKEL ÉS SZÁMÍTÓGÉPES SZIMULÁCIÓVAL. PhD tézisfüzet
 MOLEKULÁRIS FOLYADÉKOK SZERKEZETÉNEK VIZSGÁLATA DIFFRAKCIÓS MÓDSZEREKKEL ÉS SZÁMÍTÓGÉPES SZIMULÁCIÓVAL PhD tézisfüzet POTHOCZKI SZILVIA TÉMAVEZETİ: DR. PUSZTAI LÁSZLÓ MTA SZFKI, NEUTRONFIZIKAI OSZTÁLY
MOLEKULÁRIS FOLYADÉKOK SZERKEZETÉNEK VIZSGÁLATA DIFFRAKCIÓS MÓDSZEREKKEL ÉS SZÁMÍTÓGÉPES SZIMULÁCIÓVAL PhD tézisfüzet POTHOCZKI SZILVIA TÉMAVEZETİ: DR. PUSZTAI LÁSZLÓ MTA SZFKI, NEUTRONFIZIKAI OSZTÁLY
Szakértesítő 1 Interkerám szakmai füzetek A folyósító szerek viselkedése a kerámia anyagokban
 Szakértesítő 1 Interkerám szakmai füzetek A folyósító szerek viselkedése a kerámia anyagokban A folyósító szerek viselkedése a kerámia anyagokban Bevezetés A kerámia masszák folyósításkor fő cél az anyag
Szakértesítő 1 Interkerám szakmai füzetek A folyósító szerek viselkedése a kerámia anyagokban A folyósító szerek viselkedése a kerámia anyagokban Bevezetés A kerámia masszák folyósításkor fő cél az anyag
Toluol (Bruckner II/1 476) µ= 0.33 Debye
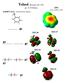 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
Az egyensúly. Általános Kémia: Az egyensúly Slide 1 of 27
 Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Azonos és egymással nem kölcsönható részecskékből álló kvantumos rendszer makrókanónikus sokaságban.
 Kvantum statisztika A kvantummechanika előadások során már megtanultuk, hogy az anyagot felépítő részecskék nemklasszikus, hullámtulajdonságokkal is rendelkeznek aminek következtében viselkedésük sok szempontból
Kvantum statisztika A kvantummechanika előadások során már megtanultuk, hogy az anyagot felépítő részecskék nemklasszikus, hullámtulajdonságokkal is rendelkeznek aminek következtében viselkedésük sok szempontból
