leírás: típusai: memo:
|
|
|
- Dezső Balázs
- 6 évvel ezelőtt
- Látták:
Átírás
1 VI. Bázissal (nukleofillal) -kiváltott elimináció (E) definíció: A molekula két vagy több szubsztituensét úgy távolítjuk el, hogy azok helyére új szubsztituens nem kerül. Két szubsztituens eltávolítása az addíció fordítottja. leírás: típusai: A folyamat leggyakrabban egymással szomszédos két szénatomon következik be, aminek eredményeként = kettős kötés alakul ki. Az elimináció gyakran egy hidrogénatom elvesztésével indul, amit elektrondús, bázisos tulajdonságú ágensek okoznak. - szén-szén kettős kötés kialakulását eredményező elimináció, - szén-szén hármas kötés kialakulását eredményező elimináció, - szén-oxigén kettős kötés kialakulását eredményező elimináció, - 1,1 (α ) elimináció. nukleofil: olyan szénen és heteroatomon (N, S,..) támadó reagens, amely nemkötő elektronpárt tartalmaz. bázis: ugyanaz mint a nukleofil csak hidrogénen támad (ne feledjük hogy a sohasem nukleofil!) erős bázis, de rossz nukleofil:, N 2 (azonnal támad egy hidrogént és 2 -t, N 3 -at eredményez) közepes bázis, közepes nukleofil:, Et,, SEt, gyenge bázis,de jó nukleofil: F, l, Br, I a I = + + I egyensúly el van tolódva jobbra (nem kell a proton, avagy a I sav erős)
2 Szén-szén kettős kötés kialakulását eredményező elimináció válasz: Tudunk-e szelektíven eltávolítani a szénláncról egy és egy Y szubsztituenst, ha azok vicinális helyzetűek? Igen, ha Y például halogén (mondjuk Br atom): kísérlet: Tekintsük az etil-bromid (tehát Y := Br) viselkedését lúgban. leírás: és Y eltávolítása vicinális helyzetből történik. Ezért 1,2- vagy α,β (röviden β ) eliminációról beszélünk. példa: A Na-etilát (Et Na + ) mint közepesen erős bázis hatására könnyedén megy végbe az elimináció: Igen hasonló módon történik a megfelelő alkilklorid (-l) vagy alkilfluorid (-F) kiindulási anyagok esetében is az elimináció.
3 Már láttuk olyan reakciót, amikor az kölcsönhatásba lépett egy alkil-halogeniddel (pl. EtBr-dal egy S N 2-reakció során). tt az mint nukleofil, itt mint bázis fejti ki hatását: válasz: onnan tudja az hogy mikor nukleofil és mikor bázis? Nem tudja! A különbségtétel a szubsztrátum (EtBr) oldalán, illetve a reakciók kinetikai paramétereiben keresendő. Az - az EtBr-ot kerülgeti mint macska a forró kását 2 Br példa: Etl + főleg Et (99%) és csak kevés (1%) 2 = 2 eredményez, a domináns reakció tehát az S N 2 i Prl + kevés ipr--t (20%) és főleg (80%) 3-2 = 2 eredményez, így itt a jellemző reakció az E2 Az eliminációs reakció egy vagy esetleg több lépésben zajlik? válasz: Elvben lehet - egylépéses (szimultán hasad - és Y-) E2 - kétlépéses amelynek során először hasad Y- és azután - E1 amelynek során először hasad - és azután Y- E1cB
4 Az E2 erős bázissal kiváltott reakcióút (bimolekuláris elimináció) egyformán befolyásolja-e mind a reagens mind a szubsztrátum koncentrációja az eredményes reakciót? válasz: igen módszer: mint az S N reakció során, most is megfigyeljük a résztvevő molekulák koncentrációinak alakulását az idő függvényében. tapasztalat: mind a reagens ( ) mind a szubsztrátum ( 2 5 Br) moláris koncentrációja befolyásolja a reakciósebességet, azaz d[ 2 = 2 ]/dt = k[ 2 5 Br][ - ] (másodrendű reakció sebességi egyenlete, ahol k a reakció sebességi együtthatója) módszer: hogyan lehet bizonyítani hogy a bázis hatására a reakció során egyszerre hasad-e el a - és az Y- (pl. Br-) kötés? deutérium-helyettesítés okozta kinetikus izotóp effektus D D D 2 2 D 2 2 Br háttér: azonos molekuláris környezetben a D erősebb mint a kötés 1. tapasztalat: a nehezebb izotóp, a D jelenléte miatt a reakció lassabban megy: d[d 2 = 2 ]/dt = k[ 2 2 D 3 Br][ - ]<d[ 2 = 2 ]/dt = k[ 2 5 Br][ - ] következtetés: a D kötéshasadás része a sebességmeghatározó lépésnek, 2. tapasztalat: ha a Br-ot más távozó csoportra cseréljük (pl. l) az is befolyásolja a reakciósebességet. végkövetkeztetés: tehát a kinetikusan mérhető lépés során megy végbe, azaz egyszerre zajlik mindkét (- és Y-) hasadás. Br
5 mechanizmus: a folyamat bimolekuláris (szinkronizált) a hiroxidion egyik nemkötő elektronpárjának segítségével elkezdi leszakítani a β egyik hidrogénatomját. Az említett nemkötő elektronpár segítségével kovalens kötés kialakulása kezdődik az és a atom között. Közben a szakadó - kötés során felszabaduló elektronpár megkezdi a π kötés kialakítását.minek hatására a távozó csoport távozni kezd. A köztitermékben az elektronsűrűség mintegy áramlik a bázis felől a távozó csoport felé, amely folyamat közben kialakul a π kötés és elhasad 2 szigmakötés.
6 Az E1 reakcióút (unimolekuláris elimináció amit nem bázis hanem a megfelelő oldószer vált ki) ugyanazzal a mechanizmussal megy erős bázis jelenlétében az etil-bromid mint a terc-butil-bromid? válasz: Nem kell hozzá, már a vízzel önmagában is megy a reakció. magyarázat: elimináció kapcsán nincs sztérikus gátlás, hiszen nem a szénatomon megy a reakció, mert akkor szubsztitúció volna-, hanem külső protonon. módszer: mint az E2 reakció során, most is megfigyeljük a résztvevő molekulák koncentrációinak alakulását az idő függvényében. tapasztalat: csak a szubsztrátum ( t BuBr) moláris koncentrációja befolyásolja a reakciósebességet, azaz d[ 2 = 2 ]/dt = k[ 3-2 Br] (elsőrendű reakció sebességi egyenlete, ahol k a reakció sebességi együtthatója) (A sebességmeghatározó lépés az ionizáció (a karbokation képződése) E1 csináld magad amit az oldószer (víz) vált ki. Miután lehasadt az anion, a karbokation úgy stabilizálódik hogy lead egy protont egy környezetei víznek. mechanizmus: β következtetés: A víz koncentrációja irreleváns [ 2 ] (mint az S N 1-nél) A bróm lehasadása (1. lépés) és így a karbokation képződése a sebességmeghatározó lépés. gint itt a talány, hogy honnan tudja az 2 hogy mikor nukleofil és hogy mikor a szerepe csupán szolvolízis, mint most? Nem tudja, ezért is kapunk gyakran vegyes terméket. példa: t Bul vizes alkoholban 17% izobutilén és 83% t Bu eredményez. A 2. lépésben dől el hogy a víz a karbokationra vagy a β-ra támad.
7 G Y 2 2 Y Y reakciókoordináta mitől függ hogy az eliminációs lépés E1- vagy E2-mechanizmus szerint megy? tapasztalat: E1 lesz a mechanizmus, ha valami segíti a -Y kötés heterolitikus hasadását, azaz ha - Y jó távozócsoport, - az ionos szerkezetet stabilizáló oldószerben kivitelezzük a reakciót - az oldószer szolvatációval elősegíti a -Y heterolitikus hasadást, - az alkil-csoport konstitúciója kedvező. karbokationok stabilitása a rendűséggel fokozatosan nő: 2 3 legstabilabb példa: A következő alkil-halogenid sorban balról jobbra nő az E1- mechanizmusú reakció sebessége: 2 < < 2 Br Br Br
8 Az E1cB reakcióút (eliminatio via conjugated base) a monomolekuláris elimináció (E1) során mindig az Y- kötés kell először elhasadjon? válasz: nem, van amikor a - kötés hasad először (bár ez a ritkább). a - kovalens kötés heterolitikus hasadása után visszamaradó anion a -sav konjugált bázisa. a ez viszonylag stabilis (pl. elektronos vagy sztérikus faktorok révén), akkor a -sav erősebb lesz, azaz a - kötés könnyebben hasad. konjugált bázis, karbanion, köztitermék mi stabilizálja a kialakult konjugált bázist (a karbaniont)? X 2 2 β Y válasz: megfelelő szubsztitúció a β- szénatomon, azaz ha - ezáltal nő a -atom savanyú karaktere, - a visszamaradó konjugált bázis stabilitása fokozódik. megoldás: elektronszívó szubsztituens (pl. X = l)
9 kísérlet: két geminális helyzetű klóratom a β- szénen már elegendő: leírás: a két geminális klór hatására elsőként lehasadó proton (gyors lépés), visszahagy egy olyan karbaniont (konjugált bázist), amely egy F leadásával stabilizálódik a megfelelő alkén formájában. Vegyük észre hogy a gyenge távozócsoport (F ) ellenére is végbemegy az elimináció! mono- vagy bimolekuláris-e az E1cB reakció mechanizmusa? módszer:mint mindig, most is megfigyeljük a résztvevő molekulák koncentrációinak alakulását az idő függvényében. tapasztalat: mind a reagens ( ) mind a szubsztrátum (-X 2-2 Y) moláris koncentrációja befolyásolja a reakciósebességet, azaz d[x 2 = 2 ]/dt = k[-x 2-2 Y][ - ] (másodrendű reakció sebességi egyenlete, ahol k a reakció sebességi együtthatója) Tehát az E1cB az E2-höz hasonlít, azaz bimolekuláris az elimináció!
10 hogyan tudnánk különbséget tenni az E1cB és az E2 mechanizmusok között? módszer:reakciókinetikai méréssel kísérlet: reagens: Et -, szubsztrát: -l 2 -F 3 (1,1,1-triflór-2,2-diklóretán) oldószer EtD kívitelezés: következtetés: indítsuk el a reakciót, de állítsuk le az elimináció teljessé válása előtt! A termékanalízis során látjuk hogy bőven képződött a D-l 2 -F 3 (1,1,1-triflór-2,2-diklór-2-deuteroetán) Tehát az elimináció nem egy lépésben megy, hiszen akkor Dl 2 -F 3 nem lenne a rendszerben, tehát nem E2 a mechanizmus.
11 1. memo profiknak: E1cB mechanizmussal megy végbe az alábbi α,β-telítetlen aldehid képződése, a megfelelő aldehidalkohol dehidratálódása során: β α ahol Y= és X= a kialakuló konjugált bázis negatív töltése az α szénről delokalizálódhat az oxigénre, amit egy stabilabb határszerkezet fejez ki. Ám a végtermék (az α,β-telítetlen aldehid) képződése csak a labilisabb határszerkezet figyelembevételével értelmezhető. 2. memo profiknak: E1cB mechanizmussal képződik az arin F 2 N 2 N F F ahol Y=F konjugált bázis (karbanion) az amid anion először lehasítja a protont (N 3 -lesz belőle), majd a fluorid anion távozásával kialakul az arin köztitermék. N 2 arin dehidrobenzol intermedier F N 2 F N 3 38% elimináció (E1cB) N 3 N 2 addició (Ad N ) 62%
12 Az E2 elimináció sztereokémiája az α,β-diszubsztituált alkán - kötése mentén szabad a rotáció, de a konformerek (minimális energiájú szerkezetek) nem egyforma valószínűségűek: Y A és Y azonos (szin) oldalon, vagy ellentétes (anti) oldalon helyezkedik el. (periplanáris a ---Y négy atom, azaz egy síkban vannak). a periplanaritást feltételezve a szin vagy az anti térszerkezetből indul-e az elimináció? lehetőségek: legyenek az és szubsztituensek megkülönböztethetőek és végezzük el a termékanalízist: szin-periplanáris konf ormáció Br Y anti-periplanáris konf ormáció anti-periplanáris konf ormáció transz alkén Br szin-periplanáris konf ormáció cisz alkén érvelés: az anti-periplanáris támadása mellett szól, hogy 1) az ilyenkor van a legmesszebb a nagy térigényű Br-től. 2) Továbbá, a karbanion nemkötő (magános) elektronpárja (amely még mindig anti-periplanáris) ebben az esetben tudja hátulról leszorítani a távozó csoportot.
13 nyilván mindez a sztereokémia az E2 egylépéses mechanizmusra igaz. (asonlóan mint az S N 2 és S N 1 reakciók sztereokémiájánál.) konkluzió: E 2 transz termék keletkezik túlsúlyban E 1 cisz és transz termék vegyesen képződik E 1 cb cisz és transz termék vegyesen képződik válasz: lehet-e mást mint hidrogén-halogenidet (X-et ahol X=hal) eliminálni? igen, ha X helyett más megfelelő távozó csoport van jelen (pl. 3 N eliminálható a [ N 3 ] + molekulából ) érdekesség: (híg vizes bázis, szobahőmérsékleten) leírás: a bázis hatására keletkező konjugált bázis dekarboxileződés után veszi fel a szokásos karbanion formát. Ezután már a normális úton lehasad a bromid anion.
14 honnan lehet tudni, hogy elimináció vagy szubsztitúció fog bekövetkezni? mind az E1 mind az S N 1 reakció során ugyanaz a karbokation alakul ki és csak a rákövetkező (gyors) lépésben dől el a végeredmény: az E2 és az S N 2 reakciók összevetése során nagyobb különbség adódik:
15 hogyan lehet befolyásolni azt, hogy a kívánt típusú reakció menjen végbe? válasz: 1. minden szubsztituens az α- és/vagy β-szénatomon, a kettős kötés kialakulását kedvezményezi, ezért E2-körülmények között az elimináció kerül előtérbe a szubsztitúció rovására. ( nem fér könnyedén a szénhez mint nukleofil, ezért leszakítja a protont mint bázis.) 2. E1-körülmények között az alkilcsoportok növekvő száma fokozza a szubsztitúció esélyét: 3 2 Br 3 Br 3 2 Br primer < szekunder < tercier ( egyre stabilabb a karbokation és a reakció töltéskontrolált.) 3. Primer alkil-bromid esetében a β-szénatomhoz füződő arilcsoport konjugáció révén stabilizálja a kialakuló π-kötést, így jelentősen növeli az elimináció esélyét.
16 4. minél nagyobb az alkalmazott bázis/nukleofil térigénye, annál nagyobb az elimináció valószínűsége a szubsztitúcióhoz képest o o karbokation intermedier - E1 - S N o o elimináció szubsztitúció E1/S N 1 reakcióknál a nagy méretű bázis eltérő helyen támad: E1 esetben a nem zsúfolt részen S N 1 esetben a sztérikusan zsúfolt szénen (ahova nehezen fér). Tehát a nagy méretű bázis az eliminációt segíti elő: 3 - [terc-butoxid] méretesebb mint a 3 - [metoxid] 3 N [trialkil-amin] bár nem túl erős bázis, mégis E1-et indukál
17 metil- Összefoglalás: az alkil halogenid rendűségének függvényében a helyzet a következő: 3 X S N 2 eredményez. primer szekunder 2 X X sak bimolekuláris reakció, tipikusan S N 2. Kivéve ha erős és térgátolt a bázis (pl. t Bu ), mert akkor E2. Gyenge bázis (pl. I, N, 2 ) esetén főleg SN 2, erős bázis esetén (pl. ) főleg E2. tercier X Példák: Na Br primer S N 2 soha nem megy végbe. Szolvolízis az SN1/E1-t, míg alacsony hőmérséklet az SN1-et kedvezményezi. Erős bázis esetén E Et 55 o -NaBr és 2 2 S N 2 90% E2 10% 3 2-etoxipropán 2 szekunder 3 2 Na Br Et 55 o -NaBr 3 és 2 erős bázis + szterikus gátlás elimináció Na tercier 3 3 Et és 25 o 3 -NaBr 2 Br prop-1-én 2-etoxi-2-metilpropán S N 2 21% E2 79% S N 1 9% E2 91% 2-metilprop-1-én Na tercier Br Et 55 o -NaBr és E1+ E2 100% 2-metilprop-1-én
18 Szén-szén hármas kötés kialakulását eredményező elimináció válasz: El tudunk-e szelektíven távolítani ugyanarról a két szénatomról akár két /Y szubsztituenspárt is, ha azok vicinális helyzetűek? Igen, ha Y mondjuk halogén (pl. Br) és erős bázist használunk: N 2 2 Br 2 megjegyzés: a második /Y szubsztituenspár is eliminálható a dihidrogén alkénről. Br Br Br szin-periplanáris térállás Br Br Br Br Br anti-periplanáris térállás konklúzió: a szin- illetve az anti-periplanáris elrendeződésből kiinduló második eliminációs lépés sebessége az anti esetben gyorsabb, ahogy azt várjuk (a különbség több ezerszeres!)
19 Szén-oxigén kettős kötés kialakulását eredményező elimináció Az Ad N reakcióknál láttuk azok reverzibilis jellegét, azaz hogy addíciós és eliminációs reakciópár egyensúlyáról van szó. N E deprotonálódás leírás: A bázis a cianohidrint oxianionná alakítja majd a cianid, mint jó távozó csoport lehasad, hátrahagyva a karbonil vegyületet. El tudjuk-e távolítani -t és Y-t, ahol Y = N? válasz: Igen, pusztán az egyensúlyt kell célszerűen eltolni. Savas közegben az Ad N, bázisos környezetben az E preferált. N E Ad N N IV. 1,1-(α) elimináció Idáig az eliminációk rendre vicinális (1,2-) helyzetű szubsztituenseket érintettek. El tudunk-e távolítani egyazon szénről (geminális vagy 1,1- helyzetből egy -t és Y-t? válasz: Igen, például kloroformból erős bázis hatására tapasztalat: mind a reagens ( - ) mind a szubsztrátum (l 3 ) moláris koncentrációja befolyásolja a reakciósebességet. Azaz d[l 2 ]/dt = k[l 3 ][ - ] másodrendű reakció sebességi egyenlete, ahol k a reakció sebességi együtthatója
20 mechanizmus: A bázis hatására egyensúlyi reakcióban képződő karbanion kloridion leadásával stabilizálódik diklórkarbénné, amely az ezt követő lépésben szén-monoxiddá és formiát-anionná hidrolizál: Bizonyítható-e az α-elimináció mechanizmus? válasz: Igen, ha a reakciót D 2 -ban végezzük és leállítjuk annak teljessé válása előtt. D l 2 D 2 l l 2 2 l + 2 l 2 l Milyen molekula a diklórkarbén? válasz: Elektronhiányos (oktett helyett csak sextett van a vegyértékhéjon!). ogyan bizonyíthatjuk a diklórkarbén létezését? válasz: Vigyük in situ reakcióba egy elektronban gazdag reakció partnerrel (pl. alkén): l 2 l benzol l 2 l l válasz: a reakció megy karbénekkel általában, nem csak a diklórkarbénnel.
21 VII. Savval-kiváltott (elektrofil) elimináció (E) definíció: A molekula két szubsztituensét sav közreműködésével úgy távolítjuk el, hogy azok helyére új szubsztituens nem kerül. leírás: típusai: A folyamat leggyakrabban egymással szomszédos két szénatomon következik be, aminek eredményeként = kettős kötés alakul ki. Az eliminációt itt nem bázis, vagy bázisos oldószer hanem sav iniciálja. - szén-szén kettős kötés kialakulását eredményező elimináció - szén-szén hármas kötés kialakulását eredményező elimináció - szén-oxigén kettős kötés kialakulását eredményező elimináció - szén-nitrogén kettős kötés kialakulását eredményező elimináció - szén-nitrogén hármas kötés kialakulását eredményező elimináció TD ρ= a.u. EPS töltés EPS töltés EPS töltés EPS töltés EPS töltés. 0.06
22 Szén-szén kettős kötés kialakulását eredményező elimináció válasz: El tudunk-e szelektíven távolítani a szénláncról egy Y és egy szubsztituenst savkatalízissel, ha azok vicinális helyzetűek? Igen, ha Y pl. hidroxilcsoport kísérlet: Tekintsük az etanol savas oldatát. leírás: Y és eltávolítása most is vicinális helyzetből történik. Ezért itt is 1,2- vagy α,β (röviden csak β) eliminációról beszélünk. mechanizmus: a protonálodó hidroxilcsoport (- + 2 ) víz formájában távozik, hátrahagyva egy karbokationt, amely protonleadással stabilizálódik: példa: a sav csak katalizátora az eliminációnak, nem fogy el! Az alkohol rendűségével nő az elimináció sebessége éppen úgy mint azt a oldószerrel kiváltott E1-mechanizmus során láttuk:
23 A potonált alkoholokból képződő különböző rendű karbokationak képződésének szabadentalpia diagramjai Az aktivációs szabadentalpia érték ( G # ) a primer alkohol esetében a legnagyobb, mivel az itt keletkező karbokation stabilitása a legkisebb. Az alkohol rendűségével nő az elimináció sebessége primer < szekunder stabilabb < tercier legstabilabb
24 példa: 2 onnan választ partnert a savkatalizált El során a hidroxilcsoport, ha kétféle vicinális helyzetű (megkülönböztethető) proton közül választhat? db hidrogén válasz: Az a kettős kötés fog kialakulni amelyikhez több alkilszubsztituens kapcsolódik. ez a Zajcev-szabály (akinek van annak adnak [Markovnyikov szabály] akinek nincs attól még az is elveszik [Zajcev-szabály ]) (Mk 4,21-25 ) El tudunk-e szelektíven távolítani a szénláncról egy -t (és egy ) szubsztituenst úgy, hogy a hidroxilcsoportot előzőleg átalakítottuk? a protonált hidroxilcsoport ( + 2 ) eltávolítása nehéz lehet (erélyes körülményeket igényel) 2 db hidrogén but-2-én 2 but-1-én válasz: Igen, pl. az alkoholt kénsav-monoészterré alakítjuk és az -S 2 csoportot elimináljuk, mivel ez utóbbi jobb távozó csoport. S2 23 S S 2 szulfátészter 2 2 S S 2 2 2
25 Mi történik ha a kénsav-monoészter nem spontán hasad, hanem egy másik nukleofil alkoholmolekulával reagál? válasz: Nem elimináció, hanem szubsztitúció fog lezajlani. (A termék a dietil-éter lesz.) Ez a mellékreakció a kénsav-monoésztertől függetlenül is bekövetkezhet: válasz: ogyan befolyásolható a termékarány? Milyen kísérleti körülmények kedveznek az egyik és milyen a másik reakciónak? Az eliminációnak kedvez a magasabb hőmérséklet, illetve az alkoholhoz viszonyított magasabb savkoncentráció.
26 Szén-szén hármas kötés kialakulását eredményező elimináció (karbonilképző elimináció) válasz: El tudunk-e szelektíven távolítani két vicinális hidroxilcsoportot alkin kialakításával? A báziskatalizált eliminációnál tapasztaltaktól eltérően (18. oldal) itt nem válik be az elgondolás: leírás: A várt hármas kötés helyett = kettős kötés lesz. Az első hidroxilcsoport protonkatalizált eliminációja egy karbokationhoz vezet, amely hidridtranszferrel stabilizálódik acetaldehid képződése közben.
27 Szén-oxigén kettős kötés kialakulását eredményező elimináció válasz: Elvileg a korábban leírt Ad N reakciók megfordításával, azaz eliminációs reakcióval karbonilvegyületeket állíthatunk elő. gfordítható-e a félacetál- illetve acetál képző reakció, hiszen a karbonil csoport visszaalakulását eredményezheti? Elvileg egy félacetál eléggé labilis ahhoz, hogy izolálás során spontán elbomoljon, és karbonilvegyületet eredményezzen: Egy acetál már jóval stabilabb mint egy félacetál, mi a helyzet ebben az esetben? válasz: íg vizes savval egy acetál visszaalakítható karbonil csoportot tartalmazó vegyületté. Tehát így nyerhetünk eliminációval = csoportot tartalmazó vegyületet. Pontosan ez a reverzibilitás (Ad N E) teszi lehetővé, hogy az acetálképzés a karbonilcsoport védésére szolgáljon.
28 Észterek savkatalizálta hidrolízisénél már láttuk, hogy az első addíciós lépést (Ad N reakció =-ra ), egy eliminációs lépés követi: leírás: A protonálódást követő vízaddíció során kialakul a tetraéderes szerkezetű szénatom (sp 2 sp 3 ). Ez utóbbi egy köztitermék (három heteroatom geminális helyzetben egyetlen szénen!), ha ez az alkoholt elimináció során (két lépésben) elveszíti, akkor visszaalakul az eredeti karbonil csoport (sp 3 sp 2 ). A reakció minden lépése reverzibilis! kisérlet: A sav- és vízfelesleg a hidrolizist (Ad N + E irányt), az alkoholfelesleg (és vízmentes sav) az észterképződést (E + Ad N irányt) segíti. Észterek lúgos hidrolízise az utolsó lépés miatt nem reverzibilis (lásd korábban). konklúzió: Észterek (-Q) savas hidrolízisével (ahol van eliminációs lépés is) kaphatunk karbonil vegyületeket de mind mind Q befolyásolja a végkifejletet!
29 válasz: ogyan befolyásolja -Q (az észterező csoport) jellege a hidrolízist? Az Q-csoport típusa döntő a mechanizmusra nézve. a Q alifás és a képződő alkohol szekunder vagy tercier, akkor a reakció protonkatalizált eliminációval indul és a víz addíciója csak a karbokation köztiterméket érinti (E + Ad N ) : leírás: válasz: Vízfelvétel nélkül, pusztán a = protonálódása miatt, a relatíve stabil karbokation eliminációja bekövetkezik. Lehet-e ezt a mechanizmust igazolni? Azaz, hogy ebben az észterben az -(-alkil) és nem az -(-acil) kötés hasad, mint Ad N + E esetben. Igen, 18 -észter alkalmazásával. kísérlet: megfigyelés: alkil--hasadás analizáljuk a végtermékeket az alkoholban csupa könnyű oxigén található, míg az összes nehéz oxigén a savban jelenik meg.
30 a Q alifás és a képződő alkohol primer Ad N +E -mechanizmus esetén minden nehéz oxigén az alkoholban jelenik meg. (Polányi-Szabó 1934) (Bruckner I/1 616) ogyan befolyásolja - (az acil csoport) jellege a hidrolízis menetét? a - aromás akkor a hidrolízis a szokásos Ad N +E -mechanizmus szerint lejátszódhat: Et Et 2 Et 2 2 protonálódás addíció Et Et tetraéderes köztitermék - Et - protontranszf er elimináció kísérlet: Etil-benzoát, híg vizes savban, melegítéssel. deprotonálódás karbonsav
31 megfigyelés: a etil-(2,4,6-trimetilbenzoát)-ot híg vizes savban napokig forralunk, akkor sem következik be hidrolízis. Miért? válasz: a tehát az -csoport aromás és az acil-szénatom sztérikusan árnyékolt, akkor a reakció nem következik be: zsúfoltság Et Et tetraéderes köztitermék leírás: Nem tud sztérikus okok miatt kialakulni a tertaéderes köztitermék megfigyelés: a viszont az észtert kevés cc. 2 S 4 -ben feloldjuk, majd vízre öntjük, a reakció azonnal végbemegy. Et Et - Et elimináció észter planáris acil kation karbonsav
32 ogyan lehetséges ez? válasz: más a mechanizmus, amelyben ismét nincs kezdeti addíciós lépés. értelmezés: mivel az etoxi-csoport eliminációja miatt megszűnik a zsúfoltság az acilszén körül, a hidrolízist többé nem gátolják az orto-helyzetű szubsztituensek. következtetés: az acilkation lineáris geometriájú kell legyen, amelyet szinte bárhonnan támadhat egy vízmolekula. Ezért ilyen gyors a reakció! válasz: Tényleg a két orto-helyzetű szubsztituens okozza a galibát? igen, hiszen a etil-(3,4,5-trimetilbenzoát) híg vizes savban normálisan hidrolizál: Et Et 2 2 S 4 válasz: ogyan lehetne bizonyítani hogy az acilkation lineáris geometriájú? növeljük a sztérikus gátlást: a három metilcsoport helyett szerepeljen három fenilcsoport: Et
33 tapasztalat: az etil-(2,4,6-trifenilbenzoát)-ot tömény kénsavban feloldva egy színes oldatot kapunk. a vízre öntjük, az oldat elszíntelenedik. megfigyelés: nem kapjuk a várt savat, hanem egy belső Friedel-rafts-acilezési reakcióval egy fluorénvázas vegyületet kapunk. (Befogtuk az acilkationt!) Et Et Ph Ph Ph - Et elimináció Ph észter Ph Ph belsõ Friedel-rafts acilezés Ph Ph acilkation Ph - Ph következtetés: a befogott acilkation valószínűsíti a mechanizmust és a lineáris acilkationt. Ph 1,3-difenilfluorenon
34 Szén-nitrogén kettős kötés kialakulását eredményező elimináció ámutattunk korábban arra, hogy az oximképződés hidroxilaminnal erősen függ a p-tól. Ad N +E -mechanizmus p 4-5 esetén N 2 +N 2 addíció N protontranszf er oxiamin intermedier N + N - / 2 elimináció N oxim Szén-nitrogén hármas kötés kialakulását eredményező elimináció megfigyelés: leírás: savamidok kénsav katalizálta eliminációja a savamid enol-formája protonáldóik, majd víz eliminálódik vízmegkötésre P 2 5 használata szükséges
IV. Elektrofil addíció
 IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
VI. Bázissal (nukleofillal) kiváltott elimináció ( definíció: távolítjuk el nem kerül leírás: szomszédos hidrogénatom elvesztésével indul típusai:
 VI. Bázissal (nukleofillal) kiváltott elimináció (E) definíció: Az elimináció során egy molekula két, vagy több szubsztituensét úgy távolítjuk el, hogy azok helyére új szubsztituens nem kerül. A két szubsztituens
VI. Bázissal (nukleofillal) kiváltott elimináció (E) definíció: Az elimináció során egy molekula két, vagy több szubsztituensét úgy távolítjuk el, hogy azok helyére új szubsztituens nem kerül. A két szubsztituens
R R C X C X R R X + C H R CH CH R H + BH 2 + Eliminációs reakciók
 Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
HALOGÉNEZETT SZÉNHIDROGÉNEK
 ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
Fémorganikus vegyületek
 Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Helyettesített Szénhidrogének
 elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
szabad bázis a szerves fázisban oldódik
 1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
H 3 C H + H 3 C C CH 3 -HX X 2
 1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
O 2 R-H 2 C-OH R-H 2 C-O-CH 2 -R R-HC=O
 Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk.
 1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
Fémorganikus kémia 1
 Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
ALKOHOLOK ÉS SZÁRMAZÉKAIK
 ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
Aromás vegyületek II. 4. előadás
 Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Összefoglaló előadás. Sav-bázis elmélet
 Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
szerotonin idegi mûködésben szerpet játszó vegyület
 3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
10. Kémiai reakcióképesség
 4. Előadás Kémiai reakciók leírása. Kémiai reakciók feltételei. Termokémia. A szerves kémiai reakciómechanizmusok felosztása és terminológiája. Sav-bázis reakció. Szubsztitució. Addició és elimináció.
4. Előadás Kémiai reakciók leírása. Kémiai reakciók feltételei. Termokémia. A szerves kémiai reakciómechanizmusok felosztása és terminológiája. Sav-bázis reakció. Szubsztitució. Addició és elimináció.
Beszélgetés a szerves kémia eméleti alapjairól IV.
 Beszélgetés a szerves kémia eméleti alapjairól IV. Az alkének elektrofil addiciós reakciói Az alkénekben levő kettős kötés pi-elekronrendszerének jellegzetes térbeli orientáltsága kifejezetten nukleofil
Beszélgetés a szerves kémia eméleti alapjairól IV. Az alkének elektrofil addiciós reakciói Az alkénekben levő kettős kötés pi-elekronrendszerének jellegzetes térbeli orientáltsága kifejezetten nukleofil
Intra- és intermolekuláris reakciók összehasonlítása
 Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Beszélgetés a szerves kémia elméleti
 Beszélgetés a szerves kémia elméleti alapjairól V. Az alkének eiektrofil addiciójának irányítottsága: Markovnikov szabály vagy anti-markovnyikov "szabály"? 1. kérdés Mint elméleti, mint gyakorlati szempontból
Beszélgetés a szerves kémia elméleti alapjairól V. Az alkének eiektrofil addiciójának irányítottsága: Markovnikov szabály vagy anti-markovnyikov "szabály"? 1. kérdés Mint elméleti, mint gyakorlati szempontból
O S O. a konfiguráció nem változik O C CH 3 O
 () ()-butanol [α] D = a konfiguráció nem változik () 6 4 ()--butil-tozilát [α] D = 1 a konfiguráció nem változik inverzió Na () () ()--butil-acetát [α] D = 7 ()--butil-acetát [α] D = - 7 1. Feladat: Milyen
() ()-butanol [α] D = a konfiguráció nem változik () 6 4 ()--butil-tozilát [α] D = 1 a konfiguráció nem változik inverzió Na () () ()--butil-acetát [α] D = 7 ()--butil-acetát [α] D = - 7 1. Feladat: Milyen
IX. Szénhidrátok - (Polihidroxi-aldehidek és ketonok)
 IX Szénhidrátok - (Polihidroxi-aldehidek és ketonok) A szénhidrátok polihidroxi-aldehidek, polihidroxi-ketonok vagy olyan vegyületek, amelyek hidrolízisekor az előbbi vegyületek keletkeznek Növényi és
IX Szénhidrátok - (Polihidroxi-aldehidek és ketonok) A szénhidrátok polihidroxi-aldehidek, polihidroxi-ketonok vagy olyan vegyületek, amelyek hidrolízisekor az előbbi vegyületek keletkeznek Növényi és
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Spektroszkópiai módszerek 2.
 Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Addíció + + π2* megfigyelés: memo: MO 9 ( ) (LUMO) MO 8 ( ) (HOMO)
 Addíció megfigyelés: Mind az elektrofil (E + ), mind a nukleofil (Nu ) addíció elektronban gazdag molekularészen következik be. a π-kötés (sp 2 hibridállapotú atomok s+p x +p y [p z hibridizálatlan]):
Addíció megfigyelés: Mind az elektrofil (E + ), mind a nukleofil (Nu ) addíció elektronban gazdag molekularészen következik be. a π-kötés (sp 2 hibridállapotú atomok s+p x +p y [p z hibridizálatlan]):
Helyettesített karbonsavak
 elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Helyettesített Szénhidrogének
 elyettesített Szénhidrogének alogénezett szénhidrogének Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br 1,91 66
elyettesített Szénhidrogének alogénezett szénhidrogének Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br 1,91 66
KARBONIL-VEGY. aldehidek. ketonok O C O. muszkon (pézsmaszarvas)
 KABNIL-VEGY VEGYÜLETEK (XVEGYÜLETEK) aldehidek ketonok ' muszkon (pézsmaszarvas) oxocsoport: karbonilcsoport: Elnevezés Aldehidek szénhidrogén neve + al funkciós csoport neve: formil + triviális nevek
KABNIL-VEGY VEGYÜLETEK (XVEGYÜLETEK) aldehidek ketonok ' muszkon (pézsmaszarvas) oxocsoport: karbonilcsoport: Elnevezés Aldehidek szénhidrogén neve + al funkciós csoport neve: formil + triviális nevek
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét
 Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
Beszélgetés a szerves kémia elméleti alapjairól III.
 Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
Részletes tematika: I. Félév: 1. Hét (4 óra): 2. hét (4 óra): 3. hét (4 óra): 4. hét (4 óra):
 Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
H H 2. ábra: A diazometán kötésszerkezete σ-kötések: fekete; π z -kötés: kék, π y -kötés: piros sp-hibrid magányos elektronpár: rózsaszín
 3. DIAZ- ÉS DIAZÓIUMSPRTT TARTALMAZÓ VEGYÜLETEK 3.1. A diazometán A diazometán ( 2 2 ) egy erősen mérgező (rákkeltő), robbanékony gázhalmazállapotú anyag. 1. ábra: A diazometán határszerkezetei A diazometán
3. DIAZ- ÉS DIAZÓIUMSPRTT TARTALMAZÓ VEGYÜLETEK 3.1. A diazometán A diazometán ( 2 2 ) egy erősen mérgező (rákkeltő), robbanékony gázhalmazállapotú anyag. 1. ábra: A diazometán határszerkezetei A diazometán
KARBONSAV-SZÁRMAZÉKOK
 KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
Zárójelentés a. című pályázatról ( , )
 Zárójelentés a Reakciósorozatokban érvényesülő szubsztituens és oldószerhatás elemzése aktiválási paraméterekből leszármaztatott reakciókonstansok alkalmazásával című pályázatról (2006-2009, 060889) A
Zárójelentés a Reakciósorozatokban érvényesülő szubsztituens és oldószerhatás elemzése aktiválási paraméterekből leszármaztatott reakciókonstansok alkalmazásával című pályázatról (2006-2009, 060889) A
Aldehidek, ketonok és kinonok
 Aldehidek, ketonok és kinonok 3 3 3 innamomum camphora Agócs Attila rvosi Kémia 2018 kámfor Tanulási célok: Az oxovegyületek elnevezése és fizikai tulajdonságai Nukleofil addíció, az oxovegyületek legfontosabb
Aldehidek, ketonok és kinonok 3 3 3 innamomum camphora Agócs Attila rvosi Kémia 2018 kámfor Tanulási célok: Az oxovegyületek elnevezése és fizikai tulajdonságai Nukleofil addíció, az oxovegyületek legfontosabb
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások
 Oktatási Hivatal Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások I. FELADATSOR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D
Oktatási Hivatal Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások I. FELADATSOR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D
Az enzimműködés termodinamikai és szerkezeti alapjai
 2017. 02. 23. Dr. Tretter László, Dr. Kolev Kraszimir Az enzimműködés termodinamikai és szerkezeti alapjai 2017. február 27., március 2. 1 Mit kell(ene) tudni az előadás után: 1. Az enzimműködés termodinamikai
2017. 02. 23. Dr. Tretter László, Dr. Kolev Kraszimir Az enzimműködés termodinamikai és szerkezeti alapjai 2017. február 27., március 2. 1 Mit kell(ene) tudni az előadás után: 1. Az enzimműködés termodinamikai
Laboratóriumi technikus laboratóriumi technikus Drog és toxikológiai
 A 10/2007 (II. 27.) SzMM rendelettel módosított 1/2006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
A 10/2007 (II. 27.) SzMM rendelettel módosított 1/2006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
CH 2 =CH-CH 2 -S-S-CH 2 -CH=CH 2
 10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
1. feladat. Versenyző rajtszáma:
 1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
6. változat. 3. Jelöld meg a nem molekuláris szerkezetű anyagot! A SO 2 ; Б C 6 H 12 O 6 ; В NaBr; Г CO 2.
 6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
A tételek: Elméleti témakörök. Általános kémia
 A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
Alap szerves kémiai reakciók szisztematikus tárgyalása
 Alap szerves kémiai reakciók szisztematikus tárgyalása A biokémia is a szerves molekulák kémiája Egy példa arra, hogy a szerves kémiai reakciók és az enzimkatalizált biokémiai reakciók hasonló alapelvek
Alap szerves kémiai reakciók szisztematikus tárgyalása A biokémia is a szerves molekulák kémiája Egy példa arra, hogy a szerves kémiai reakciók és az enzimkatalizált biokémiai reakciók hasonló alapelvek
SZERVES KÉMIAI REAKCIÓEGYENLETEK
 SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
VII. Karbonsavak. karbonsav karboxilcsoport karboxilátion. acilátcsoport acilátion acilcsoport. A karbonsavak csoportosítása történhet
 VII. Karbonsavak A disszociáció révén protonszolgáltatásra képes szerves vegyületek jellegzetes és fontos csoportját képezik a -H karboxilcsoportot tartalmazó karbonsavak. A funkciós csoport szerkezete
VII. Karbonsavak A disszociáció révén protonszolgáltatásra képes szerves vegyületek jellegzetes és fontos csoportját képezik a -H karboxilcsoportot tartalmazó karbonsavak. A funkciós csoport szerkezete
Reakciókinetika és katalízis
 Reakciókinetika és katalízis 2. előadás: 1/18 Kinetika: Kísérletekkel megállapított sebességi egyenlet(ek). A kémiai reakció makroszkópikus, fenomenológikus jellemzése. 1 Mechanizmus: Az elemi lépések
Reakciókinetika és katalízis 2. előadás: 1/18 Kinetika: Kísérletekkel megállapított sebességi egyenlet(ek). A kémiai reakció makroszkópikus, fenomenológikus jellemzése. 1 Mechanizmus: Az elemi lépések
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Versenyző rajtszáma: 1. feladat
 1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
2. SZÉNSAVSZÁRMAZÉKOK. Szénsav: H 2 CO 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje.
 2. ZÉAVZÁMAZÉKK 2.1. zénsavszármazékok szerkezete, elnevezése zénsav: 2 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje. 2 + 1. ábra: A szénsav szén-dioxid egyensúly A szén-dioxid
2. ZÉAVZÁMAZÉKK 2.1. zénsavszármazékok szerkezete, elnevezése zénsav: 2 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje. 2 + 1. ábra: A szénsav szén-dioxid egyensúly A szén-dioxid
Szemináriumi feladatok (kiegészítés) I. félév
 Szemináriumi feladatok (kiegészítés) I. félév I. Szeminárium 1. Rajzolja fel az alábbi ion π-molekulapályáit: N ány centrumú a delokalizált rendszer? ány elektron építi fel a delokalizált rendszert? ány
Szemináriumi feladatok (kiegészítés) I. félév I. Szeminárium 1. Rajzolja fel az alábbi ion π-molekulapályáit: N ány centrumú a delokalizált rendszer? ány elektron építi fel a delokalizált rendszert? ány
Szerves kémia Fontosabb vegyülettípusok
 Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2018/2019tanév II. félév
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2018/2019tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2018/2019tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2016/2017tanév II. félév
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2016/2017tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2016/2017tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
Reakciókinetika. Általános Kémia, kinetika Dia: 1 /53
 Reakciókinetika 9-1 A reakciók sebessége 9-2 A reakciósebesség mérése 9-3 A koncentráció hatása: a sebességtörvény 9-4 Nulladrendű reakció 9-5 Elsőrendű reakció 9-6 Másodrendű reakció 9-7 A reakciókinetika
Reakciókinetika 9-1 A reakciók sebessége 9-2 A reakciósebesség mérése 9-3 A koncentráció hatása: a sebességtörvény 9-4 Nulladrendű reakció 9-5 Elsőrendű reakció 9-6 Másodrendű reakció 9-7 A reakciókinetika
4. változat. 2. Jelöld meg azt a részecskét, amely megőrzi az anyag összes kémiai tulajdonságait! A molekula; Б atom; В gyök; Г ion.
 4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Reakciók osztályozása
 Reakciók osztályozása 1. Sav-bázis reakciók 2. Funkciós csoport átalakítása 3. Szén-szén kötés képződése A támadó ágens szerint nukleofil N (Nukleofil) elektrofil E (Elektrofil) gyök R (Radikális) 1. Szubsztitúciós
Reakciók osztályozása 1. Sav-bázis reakciók 2. Funkciós csoport átalakítása 3. Szén-szén kötés képződése A támadó ágens szerint nukleofil N (Nukleofil) elektrofil E (Elektrofil) gyök R (Radikális) 1. Szubsztitúciós
β-dikarbonil-vegyületek szintetikus alkalmazásai
 β-dikarbonil-vegyületek szintetikus alkalmazásai A β-dikarbonil vegyületek tipikus szerkezeti egysége a két karbonilcsoport, melyeket egy metilén híd köt össze. Ezek a származékok két fontos tulajdonsággal
β-dikarbonil-vegyületek szintetikus alkalmazásai A β-dikarbonil vegyületek tipikus szerkezeti egysége a két karbonilcsoport, melyeket egy metilén híd köt össze. Ezek a származékok két fontos tulajdonsággal
1. feladat. Versenyző rajtszáma: Mely vegyületek aromásak az alábbiak közül?
 1. feladat / 5 pont Mely vegyületek aromásak az alábbiak közül? 2. feladat / 5 pont Egy C 4 H 8 O összegképletű vegyületről a következő 1 H és 13 C NMR spektrumok készültek. Állapítsa meg a vegyület szerkezetét!
1. feladat / 5 pont Mely vegyületek aromásak az alábbiak közül? 2. feladat / 5 pont Egy C 4 H 8 O összegképletű vegyületről a következő 1 H és 13 C NMR spektrumok készültek. Állapítsa meg a vegyület szerkezetét!
Toluol (Bruckner II/1 476) µ= 0.33 Debye
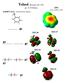 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
KÉMIA PÓTÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK június 6. du.
 KÉMIA PÓTÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2003. június 6. du. I. Ha most érettségizik, az I. feladat kidolgozását karbonlapon végezze el! Figyelem! A kidolgozáskor tömör és lényegretörő megfogalmazásra
KÉMIA PÓTÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2003. június 6. du. I. Ha most érettségizik, az I. feladat kidolgozását karbonlapon végezze el! Figyelem! A kidolgozáskor tömör és lényegretörő megfogalmazásra
Szerves kémiai reakciók csoportosítása Kinetikus és termodinamikus kontroll Szubsztituens hatások Sav-bázis tulajdonságokat befolyásoló tényezők
 Alapismeretek 4. Szerves kémiai reakciók csoportosítása Kinetikus és termodinamikus kontroll Szubsztituens hatások Sav-bázis tulajdonságokat befolyásoló tényezők Reaktivitás és stabilitás Kísérlettervezés
Alapismeretek 4. Szerves kémiai reakciók csoportosítása Kinetikus és termodinamikus kontroll Szubsztituens hatások Sav-bázis tulajdonságokat befolyásoló tényezők Reaktivitás és stabilitás Kísérlettervezés
Curie Kémia Emlékverseny 10. évfolyam országos döntő 2018/2019. A feladatok megoldásához csak periódusos rendszer és zsebszámológép használható!
 A feladatokat írta: Kódszám: Horváth Balázs, Szeged Lektorálta: 2019. május 11. Széchenyi Gábor, Budapest Curie Kémia Emlékverseny 10. évfolyam országos döntő 2018/2019. A feladatok megoldásához csak periódusos
A feladatokat írta: Kódszám: Horváth Balázs, Szeged Lektorálta: 2019. május 11. Széchenyi Gábor, Budapest Curie Kémia Emlékverseny 10. évfolyam országos döntő 2018/2019. A feladatok megoldásához csak periódusos
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
7. Előadás. Alkoholok, éterek. Oxovegyületek.
 7. Előadás Alkoholok, éterek. xovegyületek. 22. Alkoholok, fenolok, éterek Faszesz ( 3 ) Toxikus: 30ml vakság LD 50 érték patkányokban LD 50 = A populáció 50%-ának elhullásához szükséges dózis [g/kg] LD
7. Előadás Alkoholok, éterek. xovegyületek. 22. Alkoholok, fenolok, éterek Faszesz ( 3 ) Toxikus: 30ml vakság LD 50 érték patkányokban LD 50 = A populáció 50%-ának elhullásához szükséges dózis [g/kg] LD
Kémiai reakciók sebessége
 Kémiai reakciók sebessége reakciósebesség (v) = koncentrációváltozás változáshoz szükséges idő A változás nem egyenletes!!!!!!!!!!!!!!!!!! v= ± dc dt a A + b B cc + dd. Melyik reagens koncentrációváltozását
Kémiai reakciók sebessége reakciósebesség (v) = koncentrációváltozás változáshoz szükséges idő A változás nem egyenletes!!!!!!!!!!!!!!!!!! v= ± dc dt a A + b B cc + dd. Melyik reagens koncentrációváltozását
KARBONSAVAK. A) Nyílt láncú telített monokarbonsavak (zsírsavak) O OH. karboxilcsoport. Példák. pl. metánsav, etánsav, propánsav...
 KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
Javítókulcs (Kémia emelt szintű feladatsor)
 Javítókulcs (Kémia emelt szintű feladatsor) I. feladat 1. C 2. B. fenolos hidroxilcsoport, éter, tercier amin db. ; 2 db. 4. észter 5. E 6. A tercier amino-nitrogén. 7. Pl. a trimetil-amin reakciója HCl-dal.
Javítókulcs (Kémia emelt szintű feladatsor) I. feladat 1. C 2. B. fenolos hidroxilcsoport, éter, tercier amin db. ; 2 db. 4. észter 5. E 6. A tercier amino-nitrogén. 7. Pl. a trimetil-amin reakciója HCl-dal.
Szabó Dénes Molekulák és reakciók három dimenzióban
 Szabó Dénes Molekulák és reakciók három dimenzióban Alkímia ma, 2012. április 19. Egy kis tudománytörténet -O azonos kémiai szerkezet -O Scheele (1769) -O különböző tulajdonságok -O Kestner (1822) borkősav
Szabó Dénes Molekulák és reakciók három dimenzióban Alkímia ma, 2012. április 19. Egy kis tudománytörténet -O azonos kémiai szerkezet -O Scheele (1769) -O különböző tulajdonságok -O Kestner (1822) borkősav
1. feladat Összesen: 8 pont. 2. feladat Összesen: 12 pont. 3. feladat Összesen: 14 pont. 4. feladat Összesen: 15 pont
 1. feladat Összesen: 8 pont Az autók légzsákját ütközéskor a nátrium-azid bomlásakor keletkező nitrogéngáz tölti fel. A folyamat a következő reakcióegyenlet szerint játszódik le: 2 NaN 3(s) 2 Na (s) +
1. feladat Összesen: 8 pont Az autók légzsákját ütközéskor a nátrium-azid bomlásakor keletkező nitrogéngáz tölti fel. A folyamat a következő reakcióegyenlet szerint játszódik le: 2 NaN 3(s) 2 Na (s) +
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
Szerves kémiai szintézismódszerek
 Szerves kémiai szintézismódszerek 3. Alifás szén-szén egyszeres kötések kialakítása báziskatalizált reakciókban Kovács Lajos 1 C-H savak Savas hidrogént tartalmazó szerves vegyületek H H 2 C α C -H H 2
Szerves kémiai szintézismódszerek 3. Alifás szén-szén egyszeres kötések kialakítása báziskatalizált reakciókban Kovács Lajos 1 C-H savak Savas hidrogént tartalmazó szerves vegyületek H H 2 C α C -H H 2
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
OXOVEGYÜLETEK. Levezetés. Elnevezés O CH 2. O R C H aldehid. O R C R' keton. Aldehidek. propán. karbaldehid CH 3 CH 2 CH 2 CH O. butánal butiraldehid
 XVEGYÜLETEK Levezetés 2 aldehid ' keton Elnevezés Aldehidek propán karbaldehid 3 2 2 butánal butiraldehid oxo karbonil formil Példák 3 3 2 metanal etanal propanal formaldehid acetaldehid propionaldehid
XVEGYÜLETEK Levezetés 2 aldehid ' keton Elnevezés Aldehidek propán karbaldehid 3 2 2 butánal butiraldehid oxo karbonil formil Példák 3 3 2 metanal etanal propanal formaldehid acetaldehid propionaldehid
Szerves kémiai szintézismódszerek
 Szerves kémiai szintézismódszerek 7. Átrendez dések. Szén-nitrogén kötések kialakítása. Kovács Lajos 1 Átrendez dések elektronhiányos szénre 1. A Wagner-erwein-átrendez ı dés 3 C 3 C 3 C 1 3 C 3 C 3 C
Szerves kémiai szintézismódszerek 7. Átrendez dések. Szén-nitrogén kötések kialakítása. Kovács Lajos 1 Átrendez dések elektronhiányos szénre 1. A Wagner-erwein-átrendez ı dés 3 C 3 C 3 C 1 3 C 3 C 3 C
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Név: Pontszám: / 3 pont. 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét!
 Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét! Név: Pontszám: / 4 pont 2. feladat Az ábrán látható vegyületnek a) hány sztereoizomerje, b) hány enantiomerje van?
Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét! Név: Pontszám: / 4 pont 2. feladat Az ábrán látható vegyületnek a) hány sztereoizomerje, b) hány enantiomerje van?
MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz
 Budapesti Műszaki és Gazdaságtudományi Egyetem Vegyészmérnöki és Biomérnöki Kar Szerves Kémia és Technológia Tanszék MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz Készítette: Kormos Attila Lektorálta:
Budapesti Műszaki és Gazdaságtudományi Egyetem Vegyészmérnöki és Biomérnöki Kar Szerves Kémia és Technológia Tanszék MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz Készítette: Kormos Attila Lektorálta:
Reakciókinetika. aktiválási energia. felszabaduló energia. kiindulási állapot. energia nyereség. végállapot
 Reakiókinetika aktiválási energia kiindulási állapot energia nyereség felszabaduló energia végállapot Reakiókinetika kinetika: mozgástan reakiókinetika (kémiai kinetika): - reakiók időbeli leírása - reakiómehanizmusok
Reakiókinetika aktiválási energia kiindulási állapot energia nyereség felszabaduló energia végállapot Reakiókinetika kinetika: mozgástan reakiókinetika (kémiai kinetika): - reakiók időbeli leírása - reakiómehanizmusok
Szemináriumi feladatok megoldása (kiegészítés) I. félév
 Szemináriumi feldtok megoldás (kiegészítés) I. félév VI. Szeminárium 1. Frncis kísérlet (1925). Az ionos mechnizmus indirekt zzl támszthtó lá, hogy sem mgs hőmérsékletre, sem ultriboly fényre nincs szükség
Szemináriumi feldtok megoldás (kiegészítés) I. félév VI. Szeminárium 1. Frncis kísérlet (1925). Az ionos mechnizmus indirekt zzl támszthtó lá, hogy sem mgs hőmérsékletre, sem ultriboly fényre nincs szükség
Szerves Kémia II. 2016/17
 Szerves Kémia II. 2016/17 TKBE0301 és TKBE0312 4 kr Előfeltétel: TKBE0301 Szerves kémia I. Előadás: 2 óra/hét Dr. Juhász László egyetemi docens E 409 Tel: 22464 juhasz.laszlo@science.unideb.hu A 2016/17.
Szerves Kémia II. 2016/17 TKBE0301 és TKBE0312 4 kr Előfeltétel: TKBE0301 Szerves kémia I. Előadás: 2 óra/hét Dr. Juhász László egyetemi docens E 409 Tel: 22464 juhasz.laszlo@science.unideb.hu A 2016/17.
Indikátorok. brómtimolkék
 Indikátorok brómtimolkék A vöröskáposzta kivonat, mint indikátor Antociánok 12 40 mg/100 g ph Bodzában, ribizliben is! A szupersavak Szupersav: a kénsavnál erősebb sav Hammett savassági függvény: a savak
Indikátorok brómtimolkék A vöröskáposzta kivonat, mint indikátor Antociánok 12 40 mg/100 g ph Bodzában, ribizliben is! A szupersavak Szupersav: a kénsavnál erősebb sav Hammett savassági függvény: a savak
Minta feladatsor. Az ion képlete. Az ion neve O 4. Foszfátion. Szulfátion CO 3. Karbonátion. Hidrogénkarbonátion O 3. Alumíniumion. Al 3+ + Szulfidion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve Foszfátion Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve Foszfátion Szulfátion
Budapest, szeptember 5. Dr. Tóth Tünde egyetemi docens
 SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
