H H 2. ábra: A diazometán kötésszerkezete σ-kötések: fekete; π z -kötés: kék, π y -kötés: piros sp-hibrid magányos elektronpár: rózsaszín
|
|
|
- Karola Juhász
- 9 évvel ezelőtt
- Látták:
Átírás
1 3. DIAZ- ÉS DIAZÓIUMSPRTT TARTALMAZÓ VEGYÜLETEK 3.1. A diazometán A diazometán ( 2 2 ) egy erősen mérgező (rákkeltő), robbanékony gázhalmazállapotú anyag. 1. ábra: A diazometán határszerkezetei A diazometán elektronszerkezete: A diazometán szénatomja planáris sp 2 hibridállapotú, míg a két nitrogénatomja sp hibridállapotú. Ennek megfelelően a szénatom vegyértékhéjának s, p x és p y, a nitrogénatomok vegyértékhéjának s és p x, valamint a hidrogénatomok s pályáinak kölcsönhatásából jön létre a molekula σ-váza. A σ-váz 10 elektront tartalmaz, ebből 8 elektron képezi a négy σ-kötést, 2 elektron pedig az nitrogénatom nem reaktív sp-hibrid magányos elektronpárjához tartozik. A szénatom és a két nitrogénatom vegyértékhéjának p z atompályáinak kölcsönhatásából jön létre a molekula 4 elektront tartalmazó delokalizált π-kötése. A nitrogénatomok p y atompályáinak kölcsönhatásából két elektront tartalmazó π- kötés jön létre. A molekula σ-váza, és ennél jelentősebb mértékben a π-váza is polarizált. Ezért a középső nitrogénatomon δ+ míg a szénatomon és a szélső nitrogénatomon δ töltés jön létre. 2. ábra: A diazometán kötésszerkezete σ-kötések: fekete; π z -kötés: kék, π y -kötés: piros sp-hibrid magányos elektronpár: rózsaszín A diazometánt -metilkarbamidból kiindulva lehet előállítani. Első lépésben az -metilkarbamidot nitrozálni kell. A nitrozáláshoz szükséges nitrozil-kationt ( + ) in situ i állítjuk elő nátrium-nitritből sósavas közegben. A nátrium-nitritből, amely a gyenge salétromossav sója, a sósav felszabadítja a salétromossavat. A salétromossav a szénsavhoz, illetve kénessavhoz hasonlóan nem stabil, vízvesztéssel dinitrogén-trioxiddá, magasabb hőmérsékleten nitrogén-monoxid nitrogén-dioxid gázeleggyé ii alakul. a a 3. ábra: A nátrium-nitrit sósav reakció i In situ: em külön lépésben előállítva, hanem abban a reakcióelegyben, ahol azonnal továbbreagál. ii Az / 2 barnás színű gázelegyet nevezzük nitrózus gőzöknek. 1
2 a ellenben a a 2 / reakcióelegybe 5 alatti hőmérsékleten nukleofil tulajdonságú anyagot (pl. aminok, reaktív aromás vegyületek, stb.) helyezünk, az reagál el a nitrozil-kationnal. Az - metilkarbamid metilcsoportot tartalmazó nitrogénje a nukleofilabb centrum, így ebben a közegben az nitrozálódik, a termék -metil--nitrozokarbamid szilárdan hűtve tárolható. a a ábra: Az -metil--nitrozokarbamid képződése a az -metil--nitrozokarbamidot lúgos vizes közegben kevertetjük, és a vizes fázist a vízzel nem elegyedő dietil-éterrel fedjük le, a fejlődő diazometán gáz az éterben elnyelődik, és a szárított éteres oldatot lehet a továbbiakban felhasználni. iii K K 3 K ábra: A diazometán képződése K 2 A diazometán felhasználható víznél savasabb funkciós csoportok (pl. fenolok, karbonsavak) enyhe körülmények közötti (5 alatti hőmérsékleten) gyors kvantitatív metilezésére ábra: A fenol és az ecetsav metilezése diazometánnal A reakció során a diazometán szénatomját a fenol megprotonálja, a képződő metándiazónium-kation nitrogénképződés mellett azonnal bomlik, miközben a fenolát-ion és a képződő metil-kationra támad. asonló módon játszódik le a karbonsavak metilezése is. iii A diazometán gáz robbanékony tulajdonsága miatt, gázként tárolni nem lehet. 2
3 3.2. Az alifás primer aminok szubsztitúciós és eliminációs reakciói Az alifás primer aminokból a a 2 / reakcióeleggyel képződő -alkil--nitrozoammónium-ion kétszeres protonvándorlás után vizet veszítve alkándiazónium-kationná alakul, amely nitrogénképződés mellett azonnal bomlik. a a reakcióelegy nem tartalmaz víznél nukleofilabb aniont, a képződő alkil-kationra a víz támad rá, alkohol terméket eredményezve. a a víznél nukleofilabb aniont is tartalmaz a reakcióelegy (pl. amikor sósav helyett kénsav segítségével nitrozálunk és az elegyhez nátrium-bromidot is adagolunk), a képződő alkil-kationra a nukleofil anion kapcsolódik. Végeredményét tekintve a nem-távozó aminocsoportot jól-távozó diazóniumcsoporttá alakítva nukleofil szubsztitúció játszódik le. Magasabb hőmérsékleten, ha szerkezeti okok ezt lehetővé teszik, elimináció játszódik le, olefineket eredményezve. A reakció szintetikus jelentősége, hogy e reakciókkal lehetőség nyílik aminok alkoholokká, halogén-vegyületekké, illetve olefinekké történő átalakítására. a A A a A A 3 3 A A A A ha A = ha A = S 4 a ha A = as ábra: Az izopropil-amin átalakításai 3.3. Savhidrazidok nitrozálása savazidok előállítás emcsak primer aminok, hanem más reaktív aminocsoportot tartalmazó vegyületek is reagáltathatóak a a 2 / reakcióeleggyel. Pl. savhidrazidok nitrozálásával az előzőekkel analóg módon savazidok állíthatók elő. 3
4 a a ábra: Az acetil-azid előállítása és -nitrozálási reakciók -nitrozálás: A szekunder aminokból képződő,-diszubsztituált--nitrozoammónium-ion protonvesztéssel,-diszubsztituált--nitrozoaminokká alakul. a Ph 3 3 Ph ábra: Az -metilanilin nitrozálása 3 Ph a + 2 Tulajdonképpen ilyen reakció a diazometán előállítás első lépése, az -metilkarbamid nitrozálása is. -nitrozálás: Az aromás tercier aminok illetve további aktivált aromás vegyületek, pl. fenolok, fenoléterek, S E Ar reakcióban p-helyzetben nitrozálhatóak. a a ábra: Az,-dimetilanilin nitrozálása 3 emcsak +M effektussal aktivált aromás vegyületek, hanem +M effektussal aktivált olefinek, pl. enolok, is nitrozálhatóak. Ez esetben a nitrozo-származék a termodinamikailag stabilabb oximszármazékká izomerizálódik. itrozáló reagensként, nemcsak a 2 / reagenselegy használható vizes közegben, hanem szerves oldószerekben a salétromossav észterei is, amelyeket alkoholokból a 2 / 2 S 4 reagenseleggyel lehet előállítani, és szerves oldószerben oldott állapotban hűtve tárolni. 4
5 a S 4 S 4 as Bu Bu 3 S Bu S ábra: Az acetofenon nitrozálása butil-nitrittel 3.5. Aromás diazónium-sók előállítása és szubsztitúciós reakciói Aromás primer aminok nitrozálása során keletkező aromás diazónium-sók a keletkezés körülményei között, híg vizes oldatban 5 alatti hőmérsékleten stabilak. a a ábra: A benzoldiazónium-klorid, illetve az 1,3-difeniltriazén képződése A reakció során képződő benzoldiazónium-kation azonban a még el nem reagált anilinnel 1,3- difeniltriazén képződést eredményezve reakcióba léphet. E mellékreakció visszaszorítása érdekében a sósavat a sztöchiometrikusan szükséges 2 mol-nál nagyobb mennyiségben kell alkalmazni, hogy az anilin egy része egyensúlyi mértékben anilinium-kloridként legyen jelen, így csökkentve a reaktív anilin mennyiségét. A sósav mennyiségét úgy kell megválasztani, hogy a nitrozáláshoz ellenben maradjon elég mennyiségben szabad anilin jelen. Az aromás diazónium-só oldatában lúgosítás hatására egyensúlyi reakcióban arildiazenol-származék keletkezik, amely további lúgosítás hatására protonvesztéssel arildiazotát sóvá alakul. Az alkalmazott 5 alatti hőmérsékleten (Z)-termék keletkezik, amely melegítés hatására izomerizálódva a termodinamikailag stabilabb (E)-diazotáttá alakul. Az (E)-diazotát oldata szobahőmérsékleten is 5
6 tárolható. Az (E)-diazotát oldatát 5 alatti hőmérsékleten savanyítva visszakapjuk az aromás diazónium-só oldatát. iv a (E/Z) a a a (Z) (E) a 2 a ábra: A benzoldiazónium-klorid nátrium-benzoldiazotát sav-bázis egyensúly Az aromás diazónium-sók szubsztitúciós reakciókban nitrogénfejlődés mellett más funkciós csoportot tartalmazó aromás vegyületekké alakíthatóak. S 1 mechanizmussal lejátszódó szubsztitúciók A diazónium-só oldatot melegítve a vegyület nitrogénfejlődés mellett bomlik, és a keletkező fenilkation a jelenlevő vízzel elreagálva fenollá alakul. Mivel a klorid-ion jelenléte klórbenzol melléktermékhez vezet, a fenolt jó termeléssel aromás diazónium-hidrogén-szulfát sóból lehet előállítani. Jó nukleofil-anion (pl. azid) jelenlétében az reagál el az aril-kationnal. A diazotáláshoz kénsav helyett p-toluolszulfonsav is használható. a RS 2 2 RS 3 RS 3 a R=Ar R= 3 ArS 3 a 3 RS S ábra: Az anilin fenol, illetve anilin azidobenzol átalakítás Termodinamikaliag nagyon stabil anion (pl. tetrafluoroborát) esetén a diazónium-só szilárd halmazállapotban izolálható, és tárolható. A diazónium-tetrafluoroborát pirolízisével fluorozott aromás vegyület állítható elő. iv E reakciót használták a színezékiparban a diazoszínezékek előállításához szükséges aromás diazónium-sók tárolásának és szállításának a megoldására. A sav-bázis egyensúly eltolása érdekében az aromás diazónium-só oldatát először ezüsthidroxid oldattal reagáltatták, így a klorid-ion ezüst-kloridként leválasztható volt, majd a diazenol-oldatot lúgosították tovább nátrium-hidroxid oldattal. 6
7 a BF 4 2 BF 4 abf F 3 B F 3 F BF ábra: Az anilin fluorbenzol átalakítás SET/S R mechanizmussal lejátszódó szubsztitúciók Aromás diazónium-sók szubsztitúciós reakciói nemcsak az előzőekben ismertetett S 1 mechanizmussal játszódhatnak le. Jó elektrondonor anion (pl. jodid) jelenlétében SET reakció v játszódik le, nitrogénfejlődés mellett fenil-gyök képződik, amely a jód-gyökkel reakcióba lépve jódbenzollá alakul. a a keletkező gyökök a közös oldószerkalickából kiszabadulnak jód, és bifenil melléktermékek képződnek. 2 a SET a K I I I I K I 16. ábra: Az anilin jódbenzol átalakítás A klorid- és a bromid-anion katalízis nélkül nem ad át elektront a diazónium-kationnak. Ezért az ún. Sandmeyer-reakcióban SET-katalizátort kell alkalmazni. Katalizátorként a megfelelő halogén réz(i)- vegyületét, a diazónium-só képzéshez pedig a megfelelő hidrogén-halogenid-oldatot alkalmazzuk. A u 2 lg 2 halogenid-ion jelenlétében [ulg 2 ] komplex-anionként oldódik, és ez a komplex-anion fejti ki a katalitikus hatást. u 2 lg lg 2 [ulg 2 ] Katalitikus ciklus SET reakciólépései: [ulg 2 ] ulg 2 + e ulg 2 + e [ulg 2 ] v A SET (single electron transfer) = egy-elektron-átmenet reakció a redox reakciók elemi lépése. 7
8 2 a lg SET [ulg 2 ] lg alg ulg 2 SET lg lg 17. ábra: Az anilin klór- ill. brómbenzol átalakítás A katalizált reakció nemcsak halogenidekkel, hanem pszeudohalogenidekkel (pl. cianid) is végbemegy. Ez esetben a diazónium-só képzéshez kénsavat alkalmazunk, és a diazónium-só oldatába adagoljuk a a reagenst és a u 2 () 2 katalizátort. a S 4 as SET [u() 2 ] S 4 a u() 2 SET as ábra: Az anilin benzonitril átalakítás Szulfid-anionok a jodid-anionhoz hasonlóan katalízis nélkül képesek SET-reakcióban részt venni. A diazónium-só és as reakciójából ellenben nem lehet tisztán a tiofenolt kinyerni, mert a tiofenol gyökös reagensek hatására további melléktermékek képződése mellett diszulfiddá oxidálódik. K S S S S + K + / 2 S S S 1 Ph S S Ph as S a S S 2 S S 19. ábra: A tiofenol előállítása 8
9 Ezért a tiofenol előállításához védett szulfid-aniont kell használni. E célra alkalmas pl. a széndiszulfidból és etanolból K hatására előállítható szénsavszármazék, a kálium--etil-xantogenát. A nem gyökös, hanem S 1 mechanizmussal keletkező ditioszénsav-észter savas hidrolízisével a tiofenol kinyerhető Aromás diazónium-sók redukciója A szubsztitúciós reakciókhoz hasonlóan nitrogén-fejlődés mellett reagál el a foszfinsav is a diazóniumsókkal. A foszfinsav végeredményben hidrid-aniont ad át a diazónium-sónak a nitrogénfejlődést követően. A reakció szintetikus jelentősége az irányítóhatás kedvéért beépített aminocsoport eltávolításának lehetősége, amit az 1,3,5-tribrómbenzol előállításának a példáján mutatunk be Ac 2 a P P ábra: Az 1,3,5-tribrómbenzol előállítása Az aromás diazónium-sók SET-mechanizmusú redukciójával arilhidrazinok állíthatók elő. Redukálószerként az ón(ii)-klorid alkalmazható Sn Sn ábra: A fenilhidrazin előállítása 3.7. Azo-kapcsolás, diazének előállítása, azoszínezékek A diazónium-kation +M effektussal aktivált aromás vegyületekkel szemben elektrofilként viselkedik, és az aromás vegyületen aromás elektrofil-szubsztitúció játszódik le. Az ún. azokapcsolási reakcióban diarildiazének keletkeznek. 3 3 aac a ábra: Az,-dimetilanilin reakciója benzoldiazónium-kloriddal 9
10 a a 2 3 a + a 3 a 23. ábra: A nátrium-fenolát reakciója benzoldiazónium-kloriddal emcsak +M effektussal aktivált aromás vegyületek, hanem +M effektussal aktivált olefinek, pl. enolátok, is elreagálnak aromás diazónium-sókkal. E reakciót aminosavak előállításánál használhatjuk fel. A termék a termodinamikailag stabilabb hidrazon-származékká izomerizálódik. a 2 3 a a + a ábra: A malonészter reakciója benzoldiazónium-kloriddal A diarildiazének (más néven azoszínezékek) legfontosabb felhasználási területe a színezékipar. Az azoszínezékek egyik aromás csoportján jellemzően elektronszívó, míg a másikon elektronküldő szubsztituens található. Általában a diazónium-só aromás csoportja tartalmazza a végtermék elektronszívó csoportját. A részvevő aromás vegyületek sokszor kondenzált gyűrűrendszerek (jellemzően naftalin) a a a a 2 a 25. ábra: Az 1-(p-nitrofenildiazenil)-2-naftol (paravörös) előállítása A színlátás bonyolult fiziológiai folyamat, amelynek fotokémiai alapja röviden a következő. A molekulák M vi pályáján lévő egyik elektron megfelelő energiájú foton energiáját elnyelve a LUM pályára gerjesztődik. A molekulák alapállapotát S 0, az első gerjesztett állapotot S 1 állapotnak nevezzük. A gerjesztett S 1 állapot élettartama kicsi, általában a nanoszekundum tartományba esik, és a gerjeszett molekula foton kibocsátásával megszabadulva felesleges energiájától újra alapállapotúvá válik. Az elnyelt (abszorbeált) fény és a kibocsátott (fluoreszkált) fény hullámhossza ellenben nem egyezik meg. Ennek oka, hogy szobahőmérsékleten az alapállapotú molekula rezgési energiaszintjét tekintve is alapállapotú (v 0 ). A fotonelnyelés hatására végbemenő gerjesztés során azonban nemcsak vi M: legmagasabb energiájú betöltött molekulapálya, LUM: legalacsonyabb energiájú betöltetlen molekulapálya 10
11 egy elektron kerül át a M pályáról a LUM pályára, hanem a molekula rezgési állapota is gerjesztődik (v x ). A rezgésileg is gerjesztett S 1 állapotú molekula a fölös rezgési energiáját hőként (Q 1 ) adja át a környezetének. A fénykibocsátás (fluoresszencia) az S 1 állapot rezgési alapállapotából (v 0 ) következik be, és a molekula az S 0 állapot valamelyik rezgésileg gerjesztett állapotába kerül (v y ). A fölös rezgési energia ez esetben is hőként (Q 2 ) távozik. Azaz a fluoreszkált foton energiája (hν Flu ) a két hőleadás együttes energiájával kisebb, mint az abszorbeált foton energiája (hν Abs ). vii Energia (relatív skála) hν Abs = hν Flu + Q 1 + Q 2 S 1 v x S 1 v 0 hν Flu hν Abs S 0 v y S 0 v ábra: A fényabszorbció és fluoresszencia sematikus ábrázolása a színes anyag oldatát a láthatófény teljes hullámhossztartományát felölelő (színtelen) fénnyel világítjuk meg, az oldatot elhagyó fényből hiányozni fog az elnyelt fotonoknak megfelelő hullámhossztartomány, ellenben a nagyobb hullámhosszú emissziós (fluoresszencia) tartományban többletfény jelentkezik. E két hatás eredőjének megfelelő színérzékelés jön létre a szemünkben. Aromás π-rendszert Abszorbancia Elnyelt szín Érzékelt szín alkotó M-k száma maximum, λ max nm ibolya sárgás-zöld nm indigó-kék sárga nm kék narancs nm kékes-zöld vörös 510 nm zöld lila 530 nm sárgás-zöld ibolya 550 nm sárga indigó-kék 590 nm narancs kék 640 nm vörös kékes-zöld 730 nm lila zöld 1. táblázat: A színérzékelés az elnyelt fény hullámhosszának függvényében (hozzávetőleges skála) A delokalizált π-rendszert tartalmazó molekulák M-LUM energiakülönbsége elsősorban a π- rendszert alkotó M-k számától függ. Minél több M tartozik a π-rendszerhez, annál kisebb a M-LUM energiakülönbség. viii Másrészt az M energiák függnek az aromás rendszerhez kapcsolódó szubsztituensek elektronküldő-elektronszívó tulajdonságaitól. Az elektronküldő szubsztituensek növelik a M-, az elektronszívó szubsztituensek csökkentik a LUM-energiát. ix vii A foton energiája a h (Planck-állandó) és fényhullám frekvenciájának a szorzata: E f = hν. A fény hullámhossza (λ) és frekvenciája (ν) közötti összefüggés: c = λν, ahol c a fénysebesség. viii A delokalizált π-rendszert alkotó M-k száma megegyezik a delokalizált π-rendszerben résztvevő atomok számával. ix Az 500 nm feletti elnyelés jellemzően több funkciós csoportot tartalmazó aromás rendszerekre jellemző. 11
12 Az azoszínezékek esetén legtöbbször az egyik arilcsoport elektronküldő, míg a másik arilcsoport elektronszívó szubsztituenst tartalmaz, így jelentősen csökken a gerjesztéshez szükséges energia, azaz növekszik az elnyelt fény hullámhossza max = 400 nm max = 320 nm max = 488 nm max = 597 nm 27. ábra: 4-nitroanolin, 2-naftol, 1-(p-nitrofenildiazenil)-2-naftol, és 4-(p-nitrofenildiazenil)-1-naftol Az előzőekben bemutatott színezék, a paravörös delokalizált π-rendszere 18 atomra terjed ki (naftalin: 10; benzol: 6; diazén: 2) és a M-energiát a hidroxilcsoport +M effektussal növeli, míg a LUMenergiát a nitrocsoport M effektussal csökkenti. Ennek eredményeképp a paravörös abszorbancia maximuma (λ max ) 488 nm-nél található, és a látható színe vörös. A paravörös prekurzora a sárga színű 4-nitroanilin aromás π-rendszere csak 6 atomra terjed ki, de a +M effektusú aminocsoport és a para helyzetben lévő M effektusú nitrocsoport jelentős kölcsönhatásának az eredményeképpen az abszorbancia maximum 400 nm-nél jelentkezik. A másik prekurzor, a 2-naftol kondenzált aromás π- rendszere 10 atomra terjed ki, de csak egy +M effektusú szubsztituens található rajta, amely egyedül nem csökkenti nagymértékben a gerjesztéshez szükséges energiát, így a λ max értéke az UV tartományba esik, 320 nm. Enyhén ibolyás színét az okozza, hogy ibolyaszínű fényt (410 nm) emittál. A +M és M effektusú szubsztituensek kölcsönhatása az aromás gyűrűn lévő helyzetüktől is függ. Legnagyobb mértékű kölcsönhatás a para helyzetben lévő szubsztituensek között alakul ki. Ezt jól mutatja, hogy a hidroxilcsoportot para helyzetben tartalmazó 4-(p-nitrofenildiazenil)-1-naftol abszorbancia maximuma 109 nm-rel nagyobb értéknél (597 nm) jelentkezik, mint az orto-helyzetű hidroxilcsoportot tartalmazó paravörös izomeré Több nitrogénatomot tartalmazó vegyületek elnevezése A több nitrogénatomból álló láncok elnevezésében a nitrogénatomok számát jelző (di-, tri) előtagot a nitrogénatomot jelölő az-tag, majd a telítettséget/telítetlenséget és töltést jelölő utótagok követik. Pl.: diazán, diazén, triazén, diazónium. A diazán triviális neve a hidrazin, és jellemzően ez használatos szisztematikus név helyett ábra: A fenilhidrazin (fenildiazán), difenildiazén, 1,3-difeniltriazén, illetve a benzoldiazónium-klorid A megfelelő csoportnevet a szisztematikus nevekből képezzük. Pl.: 2-fenildiazanil (Ph ); fenildiazenil (Ph = ). a a nitrogénvázhoz főcsoport kapcsolódik, akkor a szokásos módon képezzük a nevet. Pl.: fenildiazenol (Ph = ). A diazónium sók nevében a gyűrű alapnevéhez kapcsoljuk a diazónium utótagot, ezért benzoldiazónium-klorid és nem fenildiazónium-klorid a helyes név. 12
2. SZÉNSAVSZÁRMAZÉKOK. Szénsav: H 2 CO 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje.
 2. ZÉAVZÁMAZÉKK 2.1. zénsavszármazékok szerkezete, elnevezése zénsav: 2 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje. 2 + 1. ábra: A szénsav szén-dioxid egyensúly A szén-dioxid
2. ZÉAVZÁMAZÉKK 2.1. zénsavszármazékok szerkezete, elnevezése zénsav: 2 3 Vízvesztéssel szén-dioxiddá alakul, a szén-dioxid a szénsav valódi anhidridje. 2 + 1. ábra: A szénsav szén-dioxid egyensúly A szén-dioxid
IX. Szénhidrátok - (Polihidroxi-aldehidek és ketonok)
 IX Szénhidrátok - (Polihidroxi-aldehidek és ketonok) A szénhidrátok polihidroxi-aldehidek, polihidroxi-ketonok vagy olyan vegyületek, amelyek hidrolízisekor az előbbi vegyületek keletkeznek Növényi és
IX Szénhidrátok - (Polihidroxi-aldehidek és ketonok) A szénhidrátok polihidroxi-aldehidek, polihidroxi-ketonok vagy olyan vegyületek, amelyek hidrolízisekor az előbbi vegyületek keletkeznek Növényi és
Tartalomjegyzék. Szénhidrogének... 1
 Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Részletes tematika: I. Félév: 1. Hét (4 óra): 2. hét (4 óra): 3. hét (4 óra): 4. hét (4 óra):
 Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Fizikai kémia és radiokémia labor II, Laboratóriumi gyakorlat: Spektroszkópia mérés
 Fizikai kémia és radiokémia labor II, Laboratóriumi gyakorlat: Spektroszkópia mérés A gyakorlatra vigyenek magukkal pendrive-ot, amire a mérési adatokat átvehetik. Ajánlott irodalom: P. W. Atkins: Fizikai
Fizikai kémia és radiokémia labor II, Laboratóriumi gyakorlat: Spektroszkópia mérés A gyakorlatra vigyenek magukkal pendrive-ot, amire a mérési adatokat átvehetik. Ajánlott irodalom: P. W. Atkins: Fizikai
Feladatok haladóknak
 Feladatok haladóknak Szerkesztő: Magyarfalvi Gábor és Varga Szilárd (gmagyarf@chem.elte.hu, szilard.varga@bolyai.elte.hu) Feladatok A formai követelményeknek megfelelő dolgozatokat a nevezési lappal együtt
Feladatok haladóknak Szerkesztő: Magyarfalvi Gábor és Varga Szilárd (gmagyarf@chem.elte.hu, szilard.varga@bolyai.elte.hu) Feladatok A formai követelményeknek megfelelő dolgozatokat a nevezési lappal együtt
Adatok: Δ k H (kj/mol) metán 74,4. butadién 110,0. szén-dioxid 393,5. víz 285,8
 Relay feladatok 1. 24,5 dm 3 25 C-os, standardállapotú metán butadién gázelegyet oxigénfeleslegben elégettünk (a keletkező vízgőz lecsapódott). A folyamat során 1716 kj hő szabadult fel. Mennyi volt a
Relay feladatok 1. 24,5 dm 3 25 C-os, standardállapotú metán butadién gázelegyet oxigénfeleslegben elégettünk (a keletkező vízgőz lecsapódott). A folyamat során 1716 kj hő szabadult fel. Mennyi volt a
Kétfogú N-donor ligandumok által irányított C-H aktiválási reakciók vizsgálata
 Tudományos Diákköri Dolgozat ZWILLINGER MÁRTON Kétfogú N-donor ligandumok által irányított C-H aktiválási reakciók vizsgálata Témavezetők: Dr. Novák Zoltán, egyetemi adjunktus Dr. Kovács Szabolcs, tudományos
Tudományos Diákköri Dolgozat ZWILLINGER MÁRTON Kétfogú N-donor ligandumok által irányított C-H aktiválási reakciók vizsgálata Témavezetők: Dr. Novák Zoltán, egyetemi adjunktus Dr. Kovács Szabolcs, tudományos
1. Melyik az az elem, amelynek csak egy természetes izotópja van? 2. Melyik vegyület molekulájában van az összes atom egy síkban?
 A 2004/2005. tanévi Országos Középiskolai Tanulmányi Verseny második fordulójának feladatlapja KÉMIA (II. kategória) I. FELADATSOR 1. Melyik az az elem, amelynek csak egy természetes izotópja van? A) Na
A 2004/2005. tanévi Országos Középiskolai Tanulmányi Verseny második fordulójának feladatlapja KÉMIA (II. kategória) I. FELADATSOR 1. Melyik az az elem, amelynek csak egy természetes izotópja van? A) Na
1. Kolorimetriás mérések A sav-bázis indikátorok olyan "festékek", melyek színüket a ph függvényében
 ph-mérés Egy savat vagy lúgot tartalmazó vizes oldat savasságának vagy lúgosságának erősségét a H + vagy a OH - ion aktivitással lehet jellemezni. A víz ionszorzatának következtében a két ion aktivitása
ph-mérés Egy savat vagy lúgot tartalmazó vizes oldat savasságának vagy lúgosságának erősségét a H + vagy a OH - ion aktivitással lehet jellemezni. A víz ionszorzatának következtében a két ion aktivitása
SZERVES KÉMIA ANYAGMÉRNÖK BSc NAPPALI TÖRZSANYAG MAKKEM229B
 SZERVES KÉMIA ANYAGMÉRNÖK BSc NAPPALI TÖRZSANYAG MAKKEM229B TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET 2013/14. II. félév 1 Tartalomjegyzék 1. Tantárgyleírás,
SZERVES KÉMIA ANYAGMÉRNÖK BSc NAPPALI TÖRZSANYAG MAKKEM229B TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET 2013/14. II. félév 1 Tartalomjegyzék 1. Tantárgyleírás,
TERMÉSZETTUDOMÁNY JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ
 Természettudomány középszint 1311 ÉRETTSÉGI VIZSGA 2013. május 27. TERMÉSZETTUDOMÁNY KÖZÉPSZINTŰ ÍRÁSBELI ÉRETTSÉGI VIZSGA JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ EMBERI ERŐFORRÁSOK MINISZTÉRIUMA Útmutató a dolgozatok
Természettudomány középszint 1311 ÉRETTSÉGI VIZSGA 2013. május 27. TERMÉSZETTUDOMÁNY KÖZÉPSZINTŰ ÍRÁSBELI ÉRETTSÉGI VIZSGA JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ EMBERI ERŐFORRÁSOK MINISZTÉRIUMA Útmutató a dolgozatok
Az infravörös spektroszkópia analitikai alkalmazása
 Az infravörös spektroszkópia analitikai alkalmazása Egy molekula nemcsak haladó mozgást végez, de az atomjai (atomcsoportjai) egymáshoz képest is állandó mozgásban vannak. Tételezzünk fel egy olyan mechanikai
Az infravörös spektroszkópia analitikai alkalmazása Egy molekula nemcsak haladó mozgást végez, de az atomjai (atomcsoportjai) egymáshoz képest is állandó mozgásban vannak. Tételezzünk fel egy olyan mechanikai
SPEKTROFOTOMETRIAI MÉRÉSEK
 SPEKTROFOTOMETRIAI MÉRÉSEK Elméleti bevezetés Ha egy anyagot a kezünkbe veszünk (valamilyen technológiai céllal alkalmazni szeretnénk), elsı kérdésünk valószínőleg az lesz, hogy mi ez az anyag, milyen
SPEKTROFOTOMETRIAI MÉRÉSEK Elméleti bevezetés Ha egy anyagot a kezünkbe veszünk (valamilyen technológiai céllal alkalmazni szeretnénk), elsı kérdésünk valószínőleg az lesz, hogy mi ez az anyag, milyen
ПРОГРАМА ВСТУПНОГО ВИПРОБУВАННЯ З ХІМІЇ Для вступників на ІІ курс навчання за освітньо-кваліфікаційним рівнем «бакалавр»
 ЗАКАРПАТСЬКИЙ УГОРСЬКИЙ ІНСТИТУТ ІМ. Ф. РАКОЦІ ІІ КАФЕДРА МАТЕМАТИКИ ТА ІНФОРМАТИКИ II. RÁKÓCZI FERENC KÁRPÁTALJAI MAGYAR FŐISKOLA MATEMATIKA ÉS INFORMATIKA TANSZÉK ПРОГРАМА ВСТУПНОГО ВИПРОБУВАННЯ З ХІМІЇ
ЗАКАРПАТСЬКИЙ УГОРСЬКИЙ ІНСТИТУТ ІМ. Ф. РАКОЦІ ІІ КАФЕДРА МАТЕМАТИКИ ТА ІНФОРМАТИКИ II. RÁKÓCZI FERENC KÁRPÁTALJAI MAGYAR FŐISKOLA MATEMATIKA ÉS INFORMATIKA TANSZÉK ПРОГРАМА ВСТУПНОГО ВИПРОБУВАННЯ З ХІМІЇ
UV-LÁTHATÓ ABSZORPCIÓS SPEKTROFOTOMETRIA
 SPF UV-LÁTHATÓ ABSZORPCIÓS SPEKTROFOTOMETRIA A GYAKORLAT CÉLJA: AZ UV-látható abszorpciós spektrofotométer működésének megismerése és a Lambert-Beer törvény alkalmazása. Szalicilsav meghatározása egy vizes
SPF UV-LÁTHATÓ ABSZORPCIÓS SPEKTROFOTOMETRIA A GYAKORLAT CÉLJA: AZ UV-látható abszorpciós spektrofotométer működésének megismerése és a Lambert-Beer törvény alkalmazása. Szalicilsav meghatározása egy vizes
Lumineszcencia Fényforrások
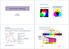 Kiegészítés: színkeverés Lumineszcencia Fényforrások Alapszinek additív keverése Alapszinek kiegészítő szineinek keverése: Szubtraktív keverés Fidy udit Egyetemi tanár 2015, November 5 Emlékeztető.. Abszorpciós
Kiegészítés: színkeverés Lumineszcencia Fényforrások Alapszinek additív keverése Alapszinek kiegészítő szineinek keverése: Szubtraktív keverés Fidy udit Egyetemi tanár 2015, November 5 Emlékeztető.. Abszorpciós
1. ábra. Jellegzetes heteropolisav-szerkezetek, a Keggin-, illetve Dawson-anion
 A szerves kémiai reakciók igen nagy hányadában egyes statisztikai adatok szerint kb. 80%-ában valamilyen katalizátorra van szükség a megfelelő konverzió eléréséhez. Eltekintve a katalitikus redukciótól,
A szerves kémiai reakciók igen nagy hányadában egyes statisztikai adatok szerint kb. 80%-ában valamilyen katalizátorra van szükség a megfelelő konverzió eléréséhez. Eltekintve a katalitikus redukciótól,
RAJZOLATI ÉS MÉLYSÉGI MINTÁZATKIALAKÍTÁS II:
 RAJZOLATI ÉS MÉLYSÉGI MINTÁZATKIALAKÍTÁS II: Üveg és PMMA struktúrák CO 2 és Nd:YAG lézeres megmunkálással Készítette: Nagy Péter dr. és Varga Máté A mérés célja: CO 2 és Nd:YAG lézerek fontosabb tulajdonságainak
RAJZOLATI ÉS MÉLYSÉGI MINTÁZATKIALAKÍTÁS II: Üveg és PMMA struktúrák CO 2 és Nd:YAG lézeres megmunkálással Készítette: Nagy Péter dr. és Varga Máté A mérés célja: CO 2 és Nd:YAG lézerek fontosabb tulajdonságainak
KÉMIA Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003
 KÉMIA Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003 I. RÉSZLETES ÉRETTSÉGI VIZSGAKÖVETELMÉNY A) KOMPETENCIÁK A vizsgázónak a követelményrendszerben és a vizsgaleírásban
KÉMIA Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003 I. RÉSZLETES ÉRETTSÉGI VIZSGAKÖVETELMÉNY A) KOMPETENCIÁK A vizsgázónak a követelményrendszerben és a vizsgaleírásban
KONDUKTOMETRIÁS MÉRÉSEK
 A környezetvédelem analitikája KON KONDUKTOMETRIÁS MÉRÉSEK A GYAKORLAT CÉLJA: A konduktometria alapjainak megismerése. Elektrolitoldatok vezetőképességének vizsgálata. Oxálsav titrálása N-metil-glükamin
A környezetvédelem analitikája KON KONDUKTOMETRIÁS MÉRÉSEK A GYAKORLAT CÉLJA: A konduktometria alapjainak megismerése. Elektrolitoldatok vezetőképességének vizsgálata. Oxálsav titrálása N-metil-glükamin
1. feladat Összesen: 10 pont
 1. feladat Összesen: 10 pont A következő feladatokban jelölje meg az egyetlen helyes választ! I. Az aromás szénhidrogénekben A) a gyűrűt alkotó szénatomok között delokalizált kötés is van. B) a hidrogének
1. feladat Összesen: 10 pont A következő feladatokban jelölje meg az egyetlen helyes választ! I. Az aromás szénhidrogénekben A) a gyűrűt alkotó szénatomok között delokalizált kötés is van. B) a hidrogének
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Halogéntartalmú szerves vegyületek. 7. előadás
 Halogéntartalmú szerves vegyületek 7. előadás Halogéntartalmú szerves vegyületek Funkciós csoport: -X (X = F, Cl, Br, I) Természetben is előfordulnak (algák, erdőtüzek, vulkánok) Széleskörű alkalmazás
Halogéntartalmú szerves vegyületek 7. előadás Halogéntartalmú szerves vegyületek Funkciós csoport: -X (X = F, Cl, Br, I) Természetben is előfordulnak (algák, erdőtüzek, vulkánok) Széleskörű alkalmazás
Tevékenység: Olvassa el a fejezetet! Gyűjtse ki és jegyezze meg a ragasztás előnyeit és a hátrányait! VIDEO (A ragasztás ereje)
 lvassa el a fejezetet! Gyűjtse ki és jegyezze meg a ragasztás előnyeit és a hátrányait! VIDE (A ragasztás ereje) A ragasztás egyre gyakrabban alkalmazott kötéstechnológia az ipari gyakorlatban. Ennek oka,
lvassa el a fejezetet! Gyűjtse ki és jegyezze meg a ragasztás előnyeit és a hátrányait! VIDE (A ragasztás ereje) A ragasztás egyre gyakrabban alkalmazott kötéstechnológia az ipari gyakorlatban. Ennek oka,
XII. Reakciók mikrohullámú térben
 XII. Reakciók mikrohullámú térben Szervetlen, fémorganikus és katalízis gyakorlatok 1. BEVEZETÉS A mikrohullámú (továbbiakban mw) technikát manapság a kémia számos területen használják, pl. analízishez
XII. Reakciók mikrohullámú térben Szervetlen, fémorganikus és katalízis gyakorlatok 1. BEVEZETÉS A mikrohullámú (továbbiakban mw) technikát manapság a kémia számos területen használják, pl. analízishez
KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2002.
 5 KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2002. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
5 KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2002. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
Szerves kémiai alapfogalmak
 BEVEZETÉS A kémiai tudományok fejlődését végigtekintve látható, hogy közöttük a szerves kémia az egyik legfiatalabb. Bár a természetet figyelő ember első tapasztalata között már évezredekkel ezelőtt is
BEVEZETÉS A kémiai tudományok fejlődését végigtekintve látható, hogy közöttük a szerves kémia az egyik legfiatalabb. Bár a természetet figyelő ember első tapasztalata között már évezredekkel ezelőtt is
A szénhidrátok lebomlása
 A disszimiláció Szerk.: Vizkievicz András A disszimiláció, vagy lebontás az autotróf, ill. a heterotróf élőlényekben lényegében azonos módon zajlik. A disszimilációs - katabolikus - folyamatok mindig valamilyen
A disszimiláció Szerk.: Vizkievicz András A disszimiláció, vagy lebontás az autotróf, ill. a heterotróf élőlényekben lényegében azonos módon zajlik. A disszimilációs - katabolikus - folyamatok mindig valamilyen
(11) Lajstromszám: E 007 404 (13) T2 EURÓPAI SZABADALOM SZÖVEGÉNEK FORDÍTÁSA
 !HU0000074T2! (19) HU (11) Lajstromszám: E 007 4 (13) T2 MAGYAR KÖZTÁRSASÁG Magyar Szabadalmi Hivatal EURÓPAI SZABADALOM SZÖVEGÉNEK FORDÍTÁSA (21) Magyar ügyszám: E 03 7796 (22) A bejelentés napja: 03.
!HU0000074T2! (19) HU (11) Lajstromszám: E 007 4 (13) T2 MAGYAR KÖZTÁRSASÁG Magyar Szabadalmi Hivatal EURÓPAI SZABADALOM SZÖVEGÉNEK FORDÍTÁSA (21) Magyar ügyszám: E 03 7796 (22) A bejelentés napja: 03.
A szénhidrátok lebomlása
 A disszimiláció Szerk.: Vizkievicz András A disszimiláció, vagy lebontás az autotróf, ill. a heterotróf élőlényekben lényegében azonos módon zajlik. A disszimilációs - katabolikus - folyamatok mindig valamilyen
A disszimiláció Szerk.: Vizkievicz András A disszimiláció, vagy lebontás az autotróf, ill. a heterotróf élőlényekben lényegében azonos módon zajlik. A disszimilációs - katabolikus - folyamatok mindig valamilyen
Laboratóriumi technikus laboratóriumi technikus 54 524 01 0010 54 02 Drog és toxikológiai
 É 049-06/1/3 A 10/007 (II. 7.) SzMM rendelettel módosított 1/006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján.
É 049-06/1/3 A 10/007 (II. 7.) SzMM rendelettel módosított 1/006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján.
L Ph 1. Az Egyenlítő fölötti közelítőleg homogén földi mágneses térben a proton (a mágneses indukció
 A 2008-as bajor fizika érettségi feladatok (Leistungskurs) Munkaidő: 240 perc (A vizsgázónak két, a szakbizottság által kiválasztott feladatsort kell kidolgoznia) L Ph 1 1. Kozmikus részecskék mozgása
A 2008-as bajor fizika érettségi feladatok (Leistungskurs) Munkaidő: 240 perc (A vizsgázónak két, a szakbizottság által kiválasztott feladatsort kell kidolgoznia) L Ph 1 1. Kozmikus részecskék mozgása
Elektrokémia. A nemesfém elemek és egymással képzett vegyületeik
 Elektrokémia Redoxireakciók: Minden olyan reakciót, amelyben elektron leadás és elektronfelvétel történik, redoxi reakciónak nevezünk. Az elektronleadás és -felvétel egyidejűleg játszódik le. Oxidálószer
Elektrokémia Redoxireakciók: Minden olyan reakciót, amelyben elektron leadás és elektronfelvétel történik, redoxi reakciónak nevezünk. Az elektronleadás és -felvétel egyidejűleg játszódik le. Oxidálószer
A kén tartalmú vegyületeket lúggal főzve szulfid ionok keletkeznek, amelyek az Pb(II) ionokkal a korábban tanultak szerint fekete csapadékot adnak.
 Egy homokot tartalmazó tál tetejére teszünk a pépből egy kanállal majd meggyújtjuk az alkoholt. Az alkohol égésekor keletkező hőtől mind a cukor, mind a szódabikarbóna bomlani kezd. Az előbbiből szén az
Egy homokot tartalmazó tál tetejére teszünk a pépből egy kanállal majd meggyújtjuk az alkoholt. Az alkohol égésekor keletkező hőtől mind a cukor, mind a szódabikarbóna bomlani kezd. Az előbbiből szén az
Az elemeket 3 csoportba osztjuk: Félfémek vagy átmeneti fémek nemfémek. fémek
 Kémiai kötések Az elemeket 3 csoportba osztjuk: Félfémek vagy átmeneti fémek nemfémek fémek Fémek Szürke színűek, kivétel a színesfémek: arany,réz. Szilárd halmazállapotúak, kivétel a higany. Vezetik az
Kémiai kötések Az elemeket 3 csoportba osztjuk: Félfémek vagy átmeneti fémek nemfémek fémek Fémek Szürke színűek, kivétel a színesfémek: arany,réz. Szilárd halmazállapotúak, kivétel a higany. Vezetik az
Mit mond ki a Huygens elv, és miben több ehhez képest a Huygens Fresnel-elv?
 Ismertesse az optika fejlődésének legjelentősebb mérföldköveit! - Ókor: korai megfigyelések - Euklidész (i.e. 280) A fény homogén közegben egyenes vonalban terjed. Legrövidebb út elve (!) Tulajdonképpen
Ismertesse az optika fejlődésének legjelentősebb mérföldköveit! - Ókor: korai megfigyelések - Euklidész (i.e. 280) A fény homogén közegben egyenes vonalban terjed. Legrövidebb út elve (!) Tulajdonképpen
1. feladat Összesen: 10 pont. 2. feladat Összesen: 6 pont. 3. feladat Összesen: 18 pont
 1. feladat Összesen: 10 pont Etil-acetátot állítunk elő 1 mol ecetsav és 1 mol etil-alkohol felhasználásával. Az egyensúlyi helyzet beálltakor a reakciót leállítjuk, és az elegyet 1 dm 3 -re töltjük fel.
1. feladat Összesen: 10 pont Etil-acetátot állítunk elő 1 mol ecetsav és 1 mol etil-alkohol felhasználásával. Az egyensúlyi helyzet beálltakor a reakciót leállítjuk, és az elegyet 1 dm 3 -re töltjük fel.
KÉMIA I. RÉSZLETES ÉRETTSÉGIVIZSGA-KÖVETELMÉNY A) KOMPETENCIÁK
 KÉMIA I. RÉSZLETES ÉRETTSÉGIVIZSGA-KÖVETELMÉNY A) KOMPETENCIÁK A vizsgázónak a követelményrendszerben és a vizsgaleírásban meghatározott módon, az alábbi kompetenciák meglétét kell bizonyítania: - a természettudományos
KÉMIA I. RÉSZLETES ÉRETTSÉGIVIZSGA-KÖVETELMÉNY A) KOMPETENCIÁK A vizsgázónak a követelményrendszerben és a vizsgaleírásban meghatározott módon, az alábbi kompetenciák meglétét kell bizonyítania: - a természettudományos
Fény kölcsönhatása az anyaggal:
 Fény kölcsönhatása az Fény kölcsönhatása az : szórás, abszorpció, emisszió Kellermayer Miklós Fényszórás A fényszórás mérése, orvosi alkalmazásai Lord Rayleigh (1842-1919) J 0 Light Fényforrás source Rayleigh
Fény kölcsönhatása az Fény kölcsönhatása az : szórás, abszorpció, emisszió Kellermayer Miklós Fényszórás A fényszórás mérése, orvosi alkalmazásai Lord Rayleigh (1842-1919) J 0 Light Fényforrás source Rayleigh
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését!
 I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
KÉMIA. Általános érettségi tantárgyi vizsgakatalógus Splošna matura
 Ljubljana 2015 KÉMIA Általános érettségi tantárgyi vizsgakatalógus Splošna matura A tantárgyi vizsgakatalógus a 2017. évi tavaszi vizsgaidőszaktól érvényes az új megjelenéséig. A katalógus érvényességéről
Ljubljana 2015 KÉMIA Általános érettségi tantárgyi vizsgakatalógus Splošna matura A tantárgyi vizsgakatalógus a 2017. évi tavaszi vizsgaidőszaktól érvényes az új megjelenéséig. A katalógus érvényességéről
KÉMIA. Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003
 KÉMIA Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003 ű érettségire felkészítő tananyag tanterve /11-12. ill. 12-13. évfolyam/ Elérendő célok: a természettudományos gondolkodás
KÉMIA Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003 ű érettségire felkészítő tananyag tanterve /11-12. ill. 12-13. évfolyam/ Elérendő célok: a természettudományos gondolkodás
A víz kondicionálása. Dr. İsz János, BME EGR Tsz. Tajti Tivadar, LG Energia Kft. 2008. 03. 13. Atomerımővek BME NTI
 A víz kondicionálása Dr. İsz János, BME EGR Tsz. Tajti Tivadar, LG Energia Kft. 2008. 03. 13. Atomerımővek BME NTI Tartalom 1. Lúgos vízkémia. 2. Semleges vízkémia 3. Kondicionáló vegyszerek. 3.1. Ammónia.
A víz kondicionálása Dr. İsz János, BME EGR Tsz. Tajti Tivadar, LG Energia Kft. 2008. 03. 13. Atomerımővek BME NTI Tartalom 1. Lúgos vízkémia. 2. Semleges vízkémia 3. Kondicionáló vegyszerek. 3.1. Ammónia.
KÉMIA 10. Osztály I. FORDULÓ
 KÉMIA 10. Osztály I. FORDULÓ 1) A rejtvény egy híres ember nevét és halálának évszámát rejti. Nevét megtudod, ha a részmegoldások betűit a számozott négyzetekbe írod, halálának évszámát pedig pici számolással.
KÉMIA 10. Osztály I. FORDULÓ 1) A rejtvény egy híres ember nevét és halálának évszámát rejti. Nevét megtudod, ha a részmegoldások betűit a számozott négyzetekbe írod, halálának évszámát pedig pici számolással.
Kémiai és fizikai kémiai ismeretek és számítások
 Kémiai és fizikai kémiai ismeretek és számítások 1. A) A hidrogén és vegyületei a hidrogén atomszerkezete, molekulaszerkezete, izotópjai színe, halmazállapota, oldhatósága, sűrűsége reakciója halogénekkel,
Kémiai és fizikai kémiai ismeretek és számítások 1. A) A hidrogén és vegyületei a hidrogén atomszerkezete, molekulaszerkezete, izotópjai színe, halmazállapota, oldhatósága, sűrűsége reakciója halogénekkel,
1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
Alkalmazott kémia. Tantárgy neve Alkalmazott kémia 1.
 Alkalmazott kémia A tárgy a kémia alapszak (BSC) szakmai törzsanyagának része, melynek teljesítésével két szemeszter alatt 8 kreditet lehet összegyűjteni. Az előadások száma 8. Tantárgy neve Alkalmazott
Alkalmazott kémia A tárgy a kémia alapszak (BSC) szakmai törzsanyagának része, melynek teljesítésével két szemeszter alatt 8 kreditet lehet összegyűjteni. Az előadások száma 8. Tantárgy neve Alkalmazott
Az időtől független Schrödinger-egyenlet (energia sajátértékegyenlet), A Laplace operátor derékszögű koordinátarendszerben
 Atomfizika ψ ψ ψ ψ ψ E z y x U z y x m = + + + ),, ( h ) ( ) ( ) ( ) ( r r r r ψ ψ ψ E U m = + Δ h z y x + + = Δ ),, ( ) ( z y x ψ =ψ r Az időtől független Schrödinger-egyenlet (energia sajátértékegyenlet),
Atomfizika ψ ψ ψ ψ ψ E z y x U z y x m = + + + ),, ( h ) ( ) ( ) ( ) ( r r r r ψ ψ ψ E U m = + Δ h z y x + + = Δ ),, ( ) ( z y x ψ =ψ r Az időtől független Schrödinger-egyenlet (energia sajátértékegyenlet),
EMELT SZINTŰ ÍRÁSBELI VIZSGA
 ÉRETTSÉGI VIZSGA 2013. október 22. KÉMIA EMELT SZINTŰ ÍRÁSBELI VIZSGA 2013. október 22. 14:00 Az írásbeli vizsga időtartama: 240 perc Pótlapok száma Tisztázati Piszkozati EMBERI ERŐFORRÁSOK MINISZTÉRIUMA
ÉRETTSÉGI VIZSGA 2013. október 22. KÉMIA EMELT SZINTŰ ÍRÁSBELI VIZSGA 2013. október 22. 14:00 Az írásbeli vizsga időtartama: 240 perc Pótlapok száma Tisztázati Piszkozati EMBERI ERŐFORRÁSOK MINISZTÉRIUMA
JÁTÉK KISMOLEKULÁKKAL: TELÍTETT HETEROCIKLUSOKTÓL A FOLDAMEREKIG*
 JÁTÉK KISMLEKULÁKKAL: TELÍTETT ETERCIKLUSKTÓL A FLDAMEREKIG* FÜLÖP FEREC, a Magyar Tudományos Akadémia levelező tagja Szegedi Tudományegyetem, Gyógyszerésztudományi Kar, Gyógyszerkémiai Intézet, Szeged,
JÁTÉK KISMLEKULÁKKAL: TELÍTETT ETERCIKLUSKTÓL A FLDAMEREKIG* FÜLÖP FEREC, a Magyar Tudományos Akadémia levelező tagja Szegedi Tudományegyetem, Gyógyszerésztudományi Kar, Gyógyszerkémiai Intézet, Szeged,
Gyógyszerhatóanyagok azonosítása és kioldódási vizsgálata tablettából
 Gyógyszerhatóanyagok azonosítása és kioldódási vizsgálata tablettából ELTE TTK Szerves Kémiai Tanszék 2015 1 I. Elméleti bevezető 1.1. Gyógyszerkönyv A Magyar gyógyszerkönyv (Pharmacopoea Hungarica) első
Gyógyszerhatóanyagok azonosítása és kioldódási vizsgálata tablettából ELTE TTK Szerves Kémiai Tanszék 2015 1 I. Elméleti bevezető 1.1. Gyógyszerkönyv A Magyar gyógyszerkönyv (Pharmacopoea Hungarica) első
100% = 100 pont A VIZSGAFELADAT MEGOLDÁSÁRA JAVASOLT %-OS EREDMÉNY: EBBEN A VIZSGARÉSZBEN A VIZSGAFELADAT ARÁNYA 40%.
 Az Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről szóló 133/2010. (IV. 22.) Korm. rendelet alapján. Szakképesítés, szakképesítés-elágazás, rész-szakképesítés,
Az Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről szóló 133/2010. (IV. 22.) Korm. rendelet alapján. Szakképesítés, szakképesítés-elágazás, rész-szakképesítés,
SZERVES KÉMIA ANYAGMÉRNÖK BSc NAPPALI TÖRZSANYAG MAKKEM 229BL
 SZERVES KÉMIA ANYAGMÉRNÖK BSc NAPPALI TÖRZSANYAG MAKKEM 229BL TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2011/12. II. félév 1 Tartalomjegyzék 1.
SZERVES KÉMIA ANYAGMÉRNÖK BSc NAPPALI TÖRZSANYAG MAKKEM 229BL TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2011/12. II. félév 1 Tartalomjegyzék 1.
Kristályos fullerénszármazékok topokémiai reakciói
 Kristályos fullerénszármazékok topokémiai reakciói Doktori értekezés Kováts Éva MTA Szilárdtestfizikai és Optikai Kutatóintézet Témavezető: Dr. Pekker Sándor Tudományos tanácsadó, a kémiai tudomány doktora
Kristályos fullerénszármazékok topokémiai reakciói Doktori értekezés Kováts Éva MTA Szilárdtestfizikai és Optikai Kutatóintézet Témavezető: Dr. Pekker Sándor Tudományos tanácsadó, a kémiai tudomány doktora
KÉMIA HELYI TANTERV A 10. ÉVFOLYAM
 KÉMIA HELYI TANTERV A 10. ÉVFOLYAM KÉTTANNYELVŰ ÉS NYELVI ELŐKÉSZÍTŐ OSZTÁLY SZÁMÁRA Károlyi Mihály Fővárosi Gyakorló Kéttannyelvű Közgazdasági Szakközépiskola 1 KÉMIA A nevelőtestület határozata alapján
KÉMIA HELYI TANTERV A 10. ÉVFOLYAM KÉTTANNYELVŰ ÉS NYELVI ELŐKÉSZÍTŐ OSZTÁLY SZÁMÁRA Károlyi Mihály Fővárosi Gyakorló Kéttannyelvű Közgazdasági Szakközépiskola 1 KÉMIA A nevelőtestület határozata alapján
b./ Hány gramm szénatomban van ugyanannyi proton, mint 8g oxigénatomban? Hogyan jelöljük ezeket az anyagokat? Egyforma-e minden atom a 8g szénben?
 1. Az atommag. a./ Az atommag és az atom méretének, tömegének és töltésének összehasonlítása, a nukleonok jellemzése, rendszám, tömegszám, izotópok, nuklidok, jelölések. b./ Jelöld a Ca atom 20 neutront
1. Az atommag. a./ Az atommag és az atom méretének, tömegének és töltésének összehasonlítása, a nukleonok jellemzése, rendszám, tömegszám, izotópok, nuklidok, jelölések. b./ Jelöld a Ca atom 20 neutront
Síkkromatográfia. Kapacitásaránynak (kapacitási tényezőnek): a mérendő komponens állófázisában (n S ) és mozgófázisában (n M ) lévő anyagmennyiségei.
 Síkkromatográfia A kromatográfia a többfokozatú, nagyhatékonyságú, dinamikus elválasztási módszerek gyűjtőneve: közös alapjuk az, hogy az elválasztandó komponensek egy állófázis és egy azon, meghatározott
Síkkromatográfia A kromatográfia a többfokozatú, nagyhatékonyságú, dinamikus elválasztási módszerek gyűjtőneve: közös alapjuk az, hogy az elválasztandó komponensek egy állófázis és egy azon, meghatározott
KÉMIA I. RÉSZLETES ÉRETTSÉGI VIZSGAKÖVETELMÉNY A) KOMPETENCIÁK
 KÉMIA Elvárt kompetenciák: I. RÉSZLETES ÉRETTSÉGI VIZSGAKÖVETELMÉNY A) KOMPETENCIÁK induktív következtetés (egyedi tényekből az általános törvényszerűségekre) deduktív következtetés (az általános törvényszerűségekből
KÉMIA Elvárt kompetenciák: I. RÉSZLETES ÉRETTSÉGI VIZSGAKÖVETELMÉNY A) KOMPETENCIÁK induktív következtetés (egyedi tényekből az általános törvényszerűségekre) deduktív következtetés (az általános törvényszerűségekből
A fejlődés szakaszai magasabbrendű növények esetében:
 Fejlődésélettani lettani és speciális növényi nyi anyagcsere vizsgálatok 2005 Cz P T Fejlődésélettan lettan I. A növények egyedfejlődése során minőségi (fejlődés) és mennyiségi (növekedés) változások egyaránt
Fejlődésélettani lettani és speciális növényi nyi anyagcsere vizsgálatok 2005 Cz P T Fejlődésélettan lettan I. A növények egyedfejlődése során minőségi (fejlődés) és mennyiségi (növekedés) változások egyaránt
Karbonsavak. Karbonsavaknak nevezzük azokat a vegyületeket melyek COOH funkciós csoportot tartalmaznak.
 Szerves kémia Karbonsavaknak nevezzük azokat a vegyületeket melyek COOH funkciós csoportot tartalmaznak. Ecetsav Funkciós csoport: Karboxil- Számos biológiailag aktív vegyület karbonsav jellegű vegyület.
Szerves kémia Karbonsavaknak nevezzük azokat a vegyületeket melyek COOH funkciós csoportot tartalmaznak. Ecetsav Funkciós csoport: Karboxil- Számos biológiailag aktív vegyület karbonsav jellegű vegyület.
A felvétel és a leadás közötti átalakító folyamatok összességét intermedier - köztes anyagcserének nevezzük.
 1 Az anyagcsere Szerk.: Vizkievicz András Általános bevezető Az élő sejtekben zajló biokémiai folyamatok összességét anyagcserének nevezzük. Az élő sejtek nyílt anyagi rendszerek, azaz környezetükkel állandó
1 Az anyagcsere Szerk.: Vizkievicz András Általános bevezető Az élő sejtekben zajló biokémiai folyamatok összességét anyagcserének nevezzük. Az élő sejtek nyílt anyagi rendszerek, azaz környezetükkel állandó
O k t a t á si Hivatal
 O k t a t á si Hivatal A versenyző kódszáma: 2015/2016. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. kategória FELADATLAP Munkaidő: 300 perc Elérhető pontszám: 100 pont ÚTMUTATÓ
O k t a t á si Hivatal A versenyző kódszáma: 2015/2016. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. kategória FELADATLAP Munkaidő: 300 perc Elérhető pontszám: 100 pont ÚTMUTATÓ
Fizika 2 (Modern fizika szemlélete) feladatsor
 Fizika 2 (Modern fizika szemlélete) feladatsor 1. Speciális relativitáselmélet 1. A Majmok bolygója című mozifilm és könyv szerint hibernált asztronauták a Föld távoli jövőjébe utaznak, amikorra az emberi
Fizika 2 (Modern fizika szemlélete) feladatsor 1. Speciális relativitáselmélet 1. A Majmok bolygója című mozifilm és könyv szerint hibernált asztronauták a Föld távoli jövőjébe utaznak, amikorra az emberi
MÉRNÖKI METEOROLÓGIA
 MÉRNÖKI METEOROLÓGIA (BME GEÁT 5128) A légkör kémiája Sztratoszférikus ózon és kénvegyületek 1 Dr. Goricsán István, 2008 Balczó Márton, Balogh Miklós, 2009 Budapesti Műszaki és Gazdaságtudományi Egyetem,
MÉRNÖKI METEOROLÓGIA (BME GEÁT 5128) A légkör kémiája Sztratoszférikus ózon és kénvegyületek 1 Dr. Goricsán István, 2008 Balczó Márton, Balogh Miklós, 2009 Budapesti Műszaki és Gazdaságtudományi Egyetem,
1. Atomspektroszkópia
 1. Atomspektroszkópia 1.1. Bevezetés Az atomspektroszkópia az optikai spektroszkópiai módszerek csoportjába tartozó olyan analitikai eljárás, mellyel az anyagok elemi összetételét határozhatjuk meg. Az
1. Atomspektroszkópia 1.1. Bevezetés Az atomspektroszkópia az optikai spektroszkópiai módszerek csoportjába tartozó olyan analitikai eljárás, mellyel az anyagok elemi összetételét határozhatjuk meg. Az
Környezettechnológia. Dr. Kardos Levente adjunktus Budapesti Corvinus Egyetem Talajtan és Vízgazdálkodás Tanszék
 Környezettechnológia Dr. Kardos Levente adjunktus Budapesti Corvinus Egyetem Talajtan és Vízgazdálkodás Tanszék Szennyvíz Minden olyan víz, ami valamilyen módon felhasználásra került. Hulladéktörvény szerint:
Környezettechnológia Dr. Kardos Levente adjunktus Budapesti Corvinus Egyetem Talajtan és Vízgazdálkodás Tanszék Szennyvíz Minden olyan víz, ami valamilyen módon felhasználásra került. Hulladéktörvény szerint:
Nehéz töltött részecskék (pl. α-sugárzás) kölcsönhatása
 Az ionizáló sugárzások kölcsönhatása anyaggal, nehéz és könnyű töltött részek kölcsönhatása, röntgen és γ-sugárzás kölcsönhatása Az ionizáló sugárzások mérése, gáztöltésű detektorok (ionizációs kamra,
Az ionizáló sugárzások kölcsönhatása anyaggal, nehéz és könnyű töltött részek kölcsönhatása, röntgen és γ-sugárzás kölcsönhatása Az ionizáló sugárzások mérése, gáztöltésű detektorok (ionizációs kamra,
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Laboratóriumi gyakorlat kémia OKTV Budapest, 2009. április 18. I. kategória 1. feladat
 Oktatási Hivatal Laboratóriumi gyakorlat kémia OKTV Budapest, 2009. április 18. I. kategória 1. feladat A feladathoz kérdések társulnak, amelyek külön lapon vannak, a válaszokat erre a lapra kérjük megadni.
Oktatási Hivatal Laboratóriumi gyakorlat kémia OKTV Budapest, 2009. április 18. I. kategória 1. feladat A feladathoz kérdések társulnak, amelyek külön lapon vannak, a válaszokat erre a lapra kérjük megadni.
ZÁRÓJELENTÉS. Fény hatására végbemenő folyamatok önszerveződő rendszerekben
 ZÁRÓJELENTÉS Fény hatására végbemenő folyamatok önszerveződő rendszerekben Jól megválasztott anyagok elegyítésekor, megfelelő körülmények között másodlagos kötésekkel összetartott szupramolekuláris rendszerek
ZÁRÓJELENTÉS Fény hatására végbemenő folyamatok önszerveződő rendszerekben Jól megválasztott anyagok elegyítésekor, megfelelő körülmények között másodlagos kötésekkel összetartott szupramolekuláris rendszerek
NANOTECHNOLÓGIA - KÖZÉPISKOLÁSOKNAK NAOTECHNOLOGY FOR STUDENTS
 NANOTECNOLÓGIA - KÖZÉPISKOLÁSOKNAK NAOTECNOLOGY FOR STUDENTS Sinkó Katalin 1 1 Eötvös Loránd Tudományegyetem, TTK, Kémiai Intézet ÖSSZEFOGLALÁS Jelen ismertetı a nanoszerkezetek (nanaoszemcsék, nanoszálak,
NANOTECNOLÓGIA - KÖZÉPISKOLÁSOKNAK NAOTECNOLOGY FOR STUDENTS Sinkó Katalin 1 1 Eötvös Loránd Tudományegyetem, TTK, Kémiai Intézet ÖSSZEFOGLALÁS Jelen ismertetı a nanoszerkezetek (nanaoszemcsék, nanoszálak,
Környezetvédelmi mérések fotoakusztikus FTIR műszerrel
 Környezetvédelmi mérések fotoakusztikus FTIR műszerrel A légszennyezés mérése nem könnyű méréstechnikai feladat. Az eszközök széles skáláját fejlesztették ki, hagyományosan az emissziómérésre, ezen belül
Környezetvédelmi mérések fotoakusztikus FTIR műszerrel A légszennyezés mérése nem könnyű méréstechnikai feladat. Az eszközök széles skáláját fejlesztették ki, hagyományosan az emissziómérésre, ezen belül
Feladatok haladóknak
 Feladatok haladóknak Szerkesztő: Magyarfalvi Gábor és Varga Szilárd (gmagyarf@chem.elte.hu, szilard.varga@bolyai.elte.hu) A formai követelményeknek megfelelő dolgozatokat a következő címen várjuk 2009.
Feladatok haladóknak Szerkesztő: Magyarfalvi Gábor és Varga Szilárd (gmagyarf@chem.elte.hu, szilard.varga@bolyai.elte.hu) A formai követelményeknek megfelelő dolgozatokat a következő címen várjuk 2009.
Azonosító jel: KÉMIA EMELT SZINTŰ ÍRÁSBELI VIZSGA. 2006. október 31. 14:00. Az írásbeli vizsga időtartama: 240 perc
 É RETTSÉGI VIZSGA 2006. október 31. KÉMIA EMELT SZINTŰ ÍRÁSBELI VIZSGA 2006. október 31. 14:00 Az írásbeli vizsga időtartama: 240 perc Pótlapok száma Tisztázati Piszkozati OKTATÁSI ÉS KULTURÁLIS MINISZTÉRIUM
É RETTSÉGI VIZSGA 2006. október 31. KÉMIA EMELT SZINTŰ ÍRÁSBELI VIZSGA 2006. október 31. 14:00 Az írásbeli vizsga időtartama: 240 perc Pótlapok száma Tisztázati Piszkozati OKTATÁSI ÉS KULTURÁLIS MINISZTÉRIUM
01/2008:40202 4.2.2. MÉRŐOLDATOK
 Ph.Hg.VIII. Ph.Eur.5.6-6.0-1 4.2.2. MÉRŐOLDATOK 01/2008:40202 A mérőoldatokat a szokásos kémiai analitikai eljárások szabályai szerint készítjük. A mérőoldatok előállításához használt eszközök megfelelő
Ph.Hg.VIII. Ph.Eur.5.6-6.0-1 4.2.2. MÉRŐOLDATOK 01/2008:40202 A mérőoldatokat a szokásos kémiai analitikai eljárások szabályai szerint készítjük. A mérőoldatok előállításához használt eszközök megfelelő
A szénhidrátok az élet szempontjából rendkívül fontos, nélkülözhetetlen vegyületek. A bioszféra szerves anyagainak fő tömegét adó vegyületek.
 Szénhidrátok Szerkesztette: Vizkievicz András A szénhidrátok az élet szempontjából rendkívül fontos, nélkülözhetetlen vegyületek. A bioszféra szerves anyagainak fő tömegét adó vegyületek. A szénhidrátok
Szénhidrátok Szerkesztette: Vizkievicz András A szénhidrátok az élet szempontjából rendkívül fontos, nélkülözhetetlen vegyületek. A bioszféra szerves anyagainak fő tömegét adó vegyületek. A szénhidrátok
Lumineszcencia alapjelenségek
 Lumineszcencia alapjelenségek (Nyitrai Miklós; 211 február 7.) Lumineszcencia Definíció: Egyes anyagok spontán fénykibocsátása, a termikus fényemissziótól függetlenül, elektrongerjesztést követően. Lumineszcens
Lumineszcencia alapjelenségek (Nyitrai Miklós; 211 február 7.) Lumineszcencia Definíció: Egyes anyagok spontán fénykibocsátása, a termikus fényemissziótól függetlenül, elektrongerjesztést követően. Lumineszcens
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Vöröskáposztalé tartalmú természetes indikátor jellemzése és analitikai alkalmazhatósága
 X. Erdélyi Tudományos Diákköri Konferencia Kolozsvár, 27. május 26 27 Vöröskáposztalé tartalmú természetes indikátor jellemzése és analitikai alkalmazhatósága Szerző: Albert Emőke Babeş- Bolyai Tudományegyetem,
X. Erdélyi Tudományos Diákköri Konferencia Kolozsvár, 27. május 26 27 Vöröskáposztalé tartalmú természetes indikátor jellemzése és analitikai alkalmazhatósága Szerző: Albert Emőke Babeş- Bolyai Tudományegyetem,
A talliummal szennyezett NaI egykristály, mint gammasugárzás-detektor
 Bevezetés talliummal szennyezett NaI egykristály, mint gammasugárzás-detektor z ember már õsidõk óta ki van téve a radioaktív sugárzásoknak 1 1 ( α, β, γ, n, p, ν, ~,... ). Egy személy évi sugárterhelésének
Bevezetés talliummal szennyezett NaI egykristály, mint gammasugárzás-detektor z ember már õsidõk óta ki van téve a radioaktív sugárzásoknak 1 1 ( α, β, γ, n, p, ν, ~,... ). Egy személy évi sugárterhelésének
ATTOSZEKUNDUMOS IMPULZUSOK
 ATTOSZEKUNDUMOS IMPULZUSOK Varjú Katalin Szegedi Tudományegyetem Optikai és Kvantumelektronikai Tanszék Generating high-order harmonics is experimentally simple. Anne L Huillier 1 Mivel a Fizikai Szemlében
ATTOSZEKUNDUMOS IMPULZUSOK Varjú Katalin Szegedi Tudományegyetem Optikai és Kvantumelektronikai Tanszék Generating high-order harmonics is experimentally simple. Anne L Huillier 1 Mivel a Fizikai Szemlében
módszerrel Témavezető: Dr. Farkas Viktor Szerves Kémiai Tanszék
 Tudományos Diákköri Dolgozat CSRDÁS BARBARA Királis koronaéterek enantiomerfelismerésének vizsgálata kiroptikai módszerrel Témavezető: Dr. Farkas Viktor Szerves Kémiai Tanszék Eötvös Loránd Tudományegyetem
Tudományos Diákköri Dolgozat CSRDÁS BARBARA Királis koronaéterek enantiomerfelismerésének vizsgálata kiroptikai módszerrel Témavezető: Dr. Farkas Viktor Szerves Kémiai Tanszék Eötvös Loránd Tudományegyetem
Olyan magkedvelő részecske, amely (legalább) két különböző atomján képes kötést létesíteni a(z elektrofil) reakciópartnerrel.
 akceptorszám (akceptivitás) aktiválási energia (E a ) activation energy aktiválási szabadentalpia (ΔG ) Gibbs energy of activation aktivált komplex activated complex ambidens nukleofil amfiprotikus (oldószer)
akceptorszám (akceptivitás) aktiválási energia (E a ) activation energy aktiválási szabadentalpia (ΔG ) Gibbs energy of activation aktivált komplex activated complex ambidens nukleofil amfiprotikus (oldószer)
Szerkesztette: Vizkievicz András
 Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
A fehérje triptofán enantiomereinek meghatározása
 A fehérje triptofán enantiomereinek meghatározása Dr. Csapó János A kutatás célja megfelelő analitikai módszer kidolgozása a triptofán-enantiomerek meghatározására, és a módszer alkalmazhatóságának vizsgálata.
A fehérje triptofán enantiomereinek meghatározása Dr. Csapó János A kutatás célja megfelelő analitikai módszer kidolgozása a triptofán-enantiomerek meghatározására, és a módszer alkalmazhatóságának vizsgálata.
Röntgensugárzás 9/21/2014. Röntgen sugárzás keltése: Röntgen katódsugárcső. Röntgensugárzás keletkezése Tulajdonságok Anyaggal való kölcsönhatás
 9/1/014 Röntgen Röntgen keletkezése Tulajdonságok Anyaggal való kölcsönhatás Hand mit Ringen: print of Wilhelm Röntgen's first "medical" x-ray, of his wife's hand, taken on December 1895 and presented
9/1/014 Röntgen Röntgen keletkezése Tulajdonságok Anyaggal való kölcsönhatás Hand mit Ringen: print of Wilhelm Röntgen's first "medical" x-ray, of his wife's hand, taken on December 1895 and presented
Klasszikus analitikai módszerek:
 Klasszikus analitikai módszerek: Azok a módszerek, melyek kémiai reakciókon alapszanak, de az elemzéshez csupán a tömeg és térfogat pontos mérésére van szükség. A legfontosabb klasszikus analitikai módszerek
Klasszikus analitikai módszerek: Azok a módszerek, melyek kémiai reakciókon alapszanak, de az elemzéshez csupán a tömeg és térfogat pontos mérésére van szükség. A legfontosabb klasszikus analitikai módszerek
3 He ionokat pedig elektron-sokszorozóval számlálja. A héliummérést ismert mennyiségű
 Nagytisztaságú 4 He-es izotóphígítás alkalmazása vízminták tríciumkoncentrációjának meghatározására a 3 He leányelem tömegspektrométeres mérésén alapuló módszerhez Az édesvízkészletek felmérésében, a rétegvizek
Nagytisztaságú 4 He-es izotóphígítás alkalmazása vízminták tríciumkoncentrációjának meghatározására a 3 He leányelem tömegspektrométeres mérésén alapuló módszerhez Az édesvízkészletek felmérésében, a rétegvizek
Javítóvizsga. Kalász László ÁMK - Izsó Miklós Általános Iskola Elérhető pont: 235 p
 Név: Elérhető pont: 5 p Dátum: Elért pont: Javítóvizsga A teszthez tollat használj! Figyelmesen olvasd el a feladatokat! Jó munkát.. Mi a neve az anyag alkotórészeinek? A. részecskék B. összetevők C. picurkák
Név: Elérhető pont: 5 p Dátum: Elért pont: Javítóvizsga A teszthez tollat használj! Figyelmesen olvasd el a feladatokat! Jó munkát.. Mi a neve az anyag alkotórészeinek? A. részecskék B. összetevők C. picurkák
Elektronspinrezonancia (ESR) - spektroszkópia
 E m S Elektronspinrezonancia (ESR) - spektroszkópia Paramágneses anyagok vizsgáló módszere. A mágneses momentum iránykvantáltságán alapul. A mágneses momentum energiája B indukciójú mágneses térben = µ
E m S Elektronspinrezonancia (ESR) - spektroszkópia Paramágneses anyagok vizsgáló módszere. A mágneses momentum iránykvantáltságán alapul. A mágneses momentum energiája B indukciójú mágneses térben = µ
Kémia emelt szintű érettségi írásbeli vizsga ELEMZÉS (BARANYA) ÉS AJÁNLÁS KÉSZÍTETTE: NAGY MÁRIA
 Kémia emelt szintű érettségi írásbeli vizsga ELEMZÉS (BARANYA) ÉS AJÁNLÁS KÉSZÍTETTE: NAGY MÁRIA Idei gyorsjelentés http://eduline.hu/erettsegi_felveteli/2 015/7/16/Az_elmult_7_ev_legrosszab b_eredmenye_szulet_azozlb
Kémia emelt szintű érettségi írásbeli vizsga ELEMZÉS (BARANYA) ÉS AJÁNLÁS KÉSZÍTETTE: NAGY MÁRIA Idei gyorsjelentés http://eduline.hu/erettsegi_felveteli/2 015/7/16/Az_elmult_7_ev_legrosszab b_eredmenye_szulet_azozlb
Műanyagok galvanizálása
 BAJOR ANDRÁS Dr. FARKAS SÁNDOR ORION Műanyagok galvanizálása ETO 678.029.665 A műanyagok az ipari termelés legkülönbözőbb területein speciális tulajdonságaik révén kiszorították az egyéb anyagokat. A hőre
BAJOR ANDRÁS Dr. FARKAS SÁNDOR ORION Műanyagok galvanizálása ETO 678.029.665 A műanyagok az ipari termelés legkülönbözőbb területein speciális tulajdonságaik révén kiszorították az egyéb anyagokat. A hőre
Gördülőcsapágyak kenése nagy fordulatszámok esetén
 ÜZEMFENNTARTÁSI TEVÉKENYSÉGEK 3.3 5.16 5.3 Gördülőcsapágyak kenése nagy fordulatszámok esetén Tárgyszavak: gördülőcsapágyak; szerszámgép-csapágyazások; zsírkenés; olajkenés; minimálkenés; kenéstechnika.
ÜZEMFENNTARTÁSI TEVÉKENYSÉGEK 3.3 5.16 5.3 Gördülőcsapágyak kenése nagy fordulatszámok esetén Tárgyszavak: gördülőcsapágyak; szerszámgép-csapágyazások; zsírkenés; olajkenés; minimálkenés; kenéstechnika.
9. Radioaktív sugárzás mérése Geiger-Müller-csővel. Preparátum helyének meghatározása. Aktivitás mérés.
 9. Radioaktív sugárzás mérése Geiger-Müller-csővel. Preparátum helyének meghatározása. ktivitás mérés. MÉRÉS CÉLJ: Megismerkedni a radioaktív sugárzás jellemzésére szolgáló mértékegységekkel, és a sugárzás
9. Radioaktív sugárzás mérése Geiger-Müller-csővel. Preparátum helyének meghatározása. ktivitás mérés. MÉRÉS CÉLJ: Megismerkedni a radioaktív sugárzás jellemzésére szolgáló mértékegységekkel, és a sugárzás
Kémia kerettanterve a Német Nemzetiségi Gimnázium és Kollégium 9 10. évfolyama számára
 Kémia kerettanterve a Német Nemzetiségi Gimnázium és Kollégium 9 10. évfolyama számára (az EMMI kerettanterv 51/2012. (XII. 21.) EMMI rendelet 3. sz. melléklet 3.2.09.2 (B) változata alapján) A kémia tanításának
Kémia kerettanterve a Német Nemzetiségi Gimnázium és Kollégium 9 10. évfolyama számára (az EMMI kerettanterv 51/2012. (XII. 21.) EMMI rendelet 3. sz. melléklet 3.2.09.2 (B) változata alapján) A kémia tanításának
A kémiai egyensúlyi rendszerek
 A kémiai egyensúlyi rendszerek HenryLouis Le Chatelier (1850196) Karl Ferdinand Braun (18501918) A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 011 A kémiai egyensúly A kémiai egyensúlyok
A kémiai egyensúlyi rendszerek HenryLouis Le Chatelier (1850196) Karl Ferdinand Braun (18501918) A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 011 A kémiai egyensúly A kémiai egyensúlyok
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2001 (pótfeladatsor)
 2001 pótfeladatsor 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2001 (pótfeladatsor) Útmutató! Ha most érettségizik, az I. feladat kidolgozását karbonlapon végezze el! Figyelem! A kidolgozáskor
2001 pótfeladatsor 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2001 (pótfeladatsor) Útmutató! Ha most érettségizik, az I. feladat kidolgozását karbonlapon végezze el! Figyelem! A kidolgozáskor
Eötvös József Általános Iskola és AMI Helyi tanterv 2013
 Kerettantervi megfelelés Eötvös József Általános Iskola és AMI KÉMIA 1.5 órára 7.osztály Jelen helyi tanterv-ajánlás az 51/2012. (XII.21.) EMMI rendelet: 2. melléklet 2.2.10.1 Kémia 7-8. alapján készült.
Kerettantervi megfelelés Eötvös József Általános Iskola és AMI KÉMIA 1.5 órára 7.osztály Jelen helyi tanterv-ajánlás az 51/2012. (XII.21.) EMMI rendelet: 2. melléklet 2.2.10.1 Kémia 7-8. alapján készült.
