Cikloalkánok és származékaik konformációja
|
|
|
- Katalin Balog
- 10 évvel ezelőtt
- Látták:
Átírás
1 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek el. molekula kötésszögei jelentősen (49,5 O -kal) eltérnek a tetraéderes vegyértékszögtől, így a molekulában szögfeszültség (aeyer-feszültség) lép fel. ciklopropángyűrűhöz kapcsolódó hidrogének fedő állásban vannak, ami további feszültséget (Pitzer-feszültség vagy más néven torziós feszültség) eredményez (lásd a jobb oldali Newman-projekciót). ciklopropán ennek megfelelően nagy energiatartalmú, egy 2 csoportra jutó égéshője 9,2 kcal / móllal nagyobb a paraffinok megfelelő adatánál. 2 síkalkatú ciklobutángyűrűben a négyzet átellenes csúcsain található, egymással kötésben nem lévő szénatomok túl közel kerülnének egymáshoz, ami kedvezőtlen nemkötő kölcsönhatást (taszítást) eredményezne. Ezt elkerülendő, a - kötések kissé meghosszabbodnak a telített vegyületekre jellemző egyensúlyi kötéshosszhoz képest: ennek következtében kötési feszültség lép fel, de ez még mindig kisebb, mint a rövidebb kötések esetében megnyilvánuló kedvezőtlen nemkötő kölcsönhatás. ciklobután atomjainak elrendeződése valamelyest csökkenti a ciklopropánnál említett torziós feszültséget: a gyűrű 4 szénatomja nincs egy síkban, így a fedő állású hidrogének száma csökken a síkalkatú gyűrűhöz képest. Mivel a kötésszögek a ciklobutánban is eltérnek a tetraéderestől, a molekulában szögfeszültség is fellép. ciklobután a fellépő feszültségek miatt a ciklopropánhoz hasonló energiatöbblettel rendelkezik, ami a vártnál nagyobb égéshőben is megnyilvánul. Sem a ciklopropán, sem a ciklobután kötésrendszere nem írható le jól sp 3 hibridállapotú szénatomokkal: más modellek alkalmazása szükséges ciklopentánban síkalkatú gyűrű esetén elsősorban torziós feszültség lépne fel. Ez alól a rendszer konformációs mozgásokkal tér ki. ciklopentánnak két konformerje vezethető le: a boríték és a félszék alkatú konformer. boríték alkatú konformerben 4 szénatom található egy síkban. félszék alkatú konformerben 3 szénatom található egy síkban, 1 szénatom a sík felett, 1 szénatom pedig a sík alatt helyezkedik el. szubsztituált ciklopentán-származékok vagy a boríték, vagy a félszék alkathoz hasonlítanak jobban, de tökéletesen általában
2 2 egyiknek sem feleltethetők meg. ( további ábrákon a hidrogéneket vagy a szubsztituenseket csak a kötésvonalakkal jelképezzük, magukat az atomokat csak akkor írjuk ki, ha a mondanivaló szempontjából fontosak). oríték konformáció Félszék konformáció ciklohexán molekulája a lehetséges feszültségek fellépését szék-konformáció felvételével csökkenti, illetve kerüli el. Szék-konformációjú ciklohexán szék-konformációjú ciklohexánban kétféle térállású hidrogént különböztetünk meg: függőleges kötésekkel kapcsolódnak az axiális helyzetű hidrogének (vagy szubsztituensek), a nem függőleges irányú kötésvonalak pedig az ekvatoriális térhelyzetű hidrogének (vagy szubsztituensek) kapcsolódási módját ábrázolják. xiális kötések Ekvatoriális kötések
3 3 z a megfigyelés, hogy szobahőmérsékleten folyadékfázisban nem lehet a ciklohexánban kétféle térállású hidrogént detektálni, arra utal, hogy az axiális és ekvatoriális hidrogének kis energiát igénylő konformációs mozgások révén gyorsan pozíciót cserélnek. két szék-konformer egymásba alakulása több lépésben játszódik le, de a kis aktiválási energia miatt szobahőmérsékleten rendkívül gyors. mennyiben a ciklohexánvázra olyan szubsztituenst helyezünk, amelyik vagy az axiális, vagy az ekvatoriális pozíciót preferálja, a fenti egyensúlyban a kétféle szék-konformer eltérő arányban lesz jelen, sőt az egyensúly eltolódhat gyakorlatilag az egyik konformer irányába. Ez valósul meg abban az esetben, ha a ciklohexánvázra nagy térigényű alkilcsoportot (pl. tercier-butil csoportot) helyezünk: ilyenkor csaknem kizárólag az a konformáció valósul meg, amiben a nagy térigényű alkilcsoport ekvatoriális térhelyzetű (axiális térhelyzetben taszító jellegű 1,3 diaxiális kölcsönhatás valósulna meg az axiális helyzetű hidrogénekkel).
4 4 Preferált konformer: nagy térigényű alkilcsoport ekvatoriális Kedvezőtlen konformer: nagy térigényű alkilcsoport axiális Diszubsztituált cikloalkánok sztereokémiája két azonos szubsztituenst tartalmazó 1,2-diszubsztituált cikloalkánok sztereoizomériai viszonyai jól demonstrálhatók az alábbi (tulajdonképpen síkalkatú gyűrűt feltételező) összevont képletekkel: ( 2 ) n ( 2 ) n isz-izomer Transz-izomer királis (belső tükörsík) Királis (enantiomerek léteznek) Tudjuk, hogy a ciklopropánon kívül egyik cikloalkán gyűrű sem síkalkatú, de ez esetben a sztereoizomériai viszonyok tisztázásához elegendő a legszimmetrikusabb, gyakorlatilag soha meg nem valósuló konformációkat figyelembe venni: ez a nem gátolt konformációs mozgásoknak köszönhető. valós sztereokémiai viszonyokat a diszubsztituált ciklohexánok példáján mutatjuk be.
5 5 cisz-1,2-diszubsztituált ciklohexánokban a szubsztituensek térállása axiális-ekvatoriális (1a,2e vagy 1e,2a). (kimerevített) modellek alapján belátható, hogy az ábra felső sorában szereplő tükörképi pár egymással fedésbe nem hozható és nincs belső tükörsíkjuk. valóságban az cisz-1,2-diszubsztituált ciklohexánok a szobahőmérsékleten szabadon lejátszódó konformációs mozgások miatt viselkednek akirális vegyületként: a bal felső konformer szabadon átalakul a bal alsóvá, amiről viszont egyszerű elforgatás alapján belátható, hogy azonos a jobb felső enantiomerrel. Lévén az enantiomerek (a szerves kémikus számára) gyakorlatilag azonos energiatartalmúak, a felső sorban szereplő 2 enantiomer mindig 1 : 1 arányban van jelen és folyamatosan egymásba alakulnak: ez okozza az akirális viselkedést. 2 azonos szubsztituenst tartalmazó transz-1,2-diszubsztituált ciklohexánok enantiomerjei konformációs mozgásokkal szobahőmérsékleten egymásba nem konvertálhatók, így az említett transz-izomerek ilyen körülmények között egymásba nem alakuló enantiomerekként léteznek, tehát királis származéknak tekinthetők. z 1,2-transz-diszubsztitúció egyébként 1a,2a- vagy 1e,2e- térhelyzetet jelent. z 1,3-diszubsztituált ciklohexánok esetében 1a,3a- vagy 1e,3e- térhelyzet a cisz-izomernek felel meg, míg a transz-izomerhez 1a,3e- vagy 1e,3a- térállás tartozik. z 1,4-diszubsztituált ciklohexánokban a cisz-izomerek 1a,4e- vagy 1e,4a-térállású csoportokat, míg a transz-izomerek 1a,4a- vagy 1e,4e-térállású csoportokat tartalmaznak.
6 6 Transz-1,2-di--ciklohexánok enantiomerjeinek konformációs viszonyai isz-1,3-di--ciklohexán konformerjei Transz-1,3-di--ciklohexán konformerjei isz-1,4-di--ciklohexán konformerjei
7 7 Transz-1,4-di--ciklohexán konformerjei Fontos 1,2-diszubsztituált ciklohexánszármazéknak tekinthető a szteroidokban gyűrűrendszer részeként előforduló cisz- és transz-dekalin. többtagú 1a,2e-diszubsztitúció: cisz-dekalin 1e,2e-diszubsztitúció: transz-dekalin több ciklohexángyűrűből álló adamantánváz szerkesztését az alábbi ábra mutatja:
8 8 llén-izoméria Enantiomerek Geometriai (Z-, E-) izomerek
Szabó Dénes Molekulák és reakciók három dimenzióban
 Szabó Dénes Molekulák és reakciók három dimenzióban Alkímia ma, 2012. április 19. Egy kis tudománytörténet -O azonos kémiai szerkezet -O Scheele (1769) -O különböző tulajdonságok -O Kestner (1822) borkősav
Szabó Dénes Molekulák és reakciók három dimenzióban Alkímia ma, 2012. április 19. Egy kis tudománytörténet -O azonos kémiai szerkezet -O Scheele (1769) -O különböző tulajdonságok -O Kestner (1822) borkősav
Bevezetés a biokémiába fogorvostan hallgatóknak - Munkafüzet 2. hét
 Bevezetés a biokémiába fogorvostan hallgatóknak - Munkafüzet 2. hét Sztereokémia (Bevezetés a biokémiába gyakorlatok, 4-6. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás,
Bevezetés a biokémiába fogorvostan hallgatóknak - Munkafüzet 2. hét Sztereokémia (Bevezetés a biokémiába gyakorlatok, 4-6. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás,
H 3 C CH 2 CH 2 CH 3
 3. Előadás Konstitució, konfiguráció, konformáció. Az izoméria fajtái. A sztereoizoméria. A kettős kötéshez kapcsolódó izoméria jelenségek. Az optikai izoméria. Az optikai aktivitás és mérése. 9. Konstitúció,
3. Előadás Konstitució, konfiguráció, konformáció. Az izoméria fajtái. A sztereoizoméria. A kettős kötéshez kapcsolódó izoméria jelenségek. Az optikai izoméria. Az optikai aktivitás és mérése. 9. Konstitúció,
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
SZÉNHIDRÁTOK. 3. Válogasd szét a képleteket aszerint, hogy aldóz, vagy ketózmolekulát ábrázolnak! Írd a fenti táblázat utolsó sorába a betűjeleket!
 funkciós kimutatása molekulák csoport betűjele neve képlete helye 1. Írd a táblázatba a szénhidrátok összegképletét! általános képlet trióz tetróz 2. Mi a különbség az aldózok és a ketózok között? ALDÓZ
funkciós kimutatása molekulák csoport betűjele neve képlete helye 1. Írd a táblázatba a szénhidrátok összegképletét! általános képlet trióz tetróz 2. Mi a különbség az aldózok és a ketózok között? ALDÓZ
A szén tetraéderes vegyérték-orientációja (van t Hoff, Le Bel, 1874)
 A szén tetraéderes vegyérték-orientációja (van t off, Le Bel, 874) Perspektivikus ábrázolásmód: a központi szénatomtól indulva vonal a papír síkjában halad (ezek az ábrán az egyenletes vastagságúak), egy
A szén tetraéderes vegyérték-orientációja (van t off, Le Bel, 874) Perspektivikus ábrázolásmód: a központi szénatomtól indulva vonal a papír síkjában halad (ezek az ábrán az egyenletes vastagságúak), egy
Alkánok összefoglalás
 Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
Periciklusos reakciók
 Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) [email protected] sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) [email protected] sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
SZERVES VEGYÜLETEK IZOMÉRIÁJA
 SEMMELWEIS EGYETEM GYÓGYSZERÉSZTUDMÁNYI KAR SZERVES VEGYTANI INTÉZET Szabó László Krajsovszky Gábor SZERVES VEGYÜLETEK IZMÉRIÁJA Budapest 2017 Szabó László Krajsovszky Gábor ISBN 978-963-12-8995-4 Felelős
SEMMELWEIS EGYETEM GYÓGYSZERÉSZTUDMÁNYI KAR SZERVES VEGYTANI INTÉZET Szabó László Krajsovszky Gábor SZERVES VEGYÜLETEK IZMÉRIÁJA Budapest 2017 Szabó László Krajsovszky Gábor ISBN 978-963-12-8995-4 Felelős
fehérvérsejtek Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben.
 Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. Sérülés esetén a helyszínen megjelenő szelektin nevű fehérjék a LewisX glikopeptidek segítségével fehérvérsejtek (leukociták) kötnek
Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. Sérülés esetén a helyszínen megjelenő szelektin nevű fehérjék a LewisX glikopeptidek segítségével fehérvérsejtek (leukociták) kötnek
Táptalaj E. coli számára (1000 ml vízben) H 2 O 70% Fehérje 15% Nukleinsav 7% (1+6) Szénhidrát 3% Lipid 2% Szervetlen ion 1%
 Az E. coli kémiai összetétele Táptalaj E. coli számára (1000 ml vízben) Na 2 P 4 6,0 g K 2 P 4 3,0 g Glükóz 4,0 g N 4 l 1,0 g MgS 4 0,13g 2 70% Fehérje 15% Nukleinsav 7% (1+6) Szénhidrát 3% Lipid 2% Szervetlen
Az E. coli kémiai összetétele Táptalaj E. coli számára (1000 ml vízben) Na 2 P 4 6,0 g K 2 P 4 3,0 g Glükóz 4,0 g N 4 l 1,0 g MgS 4 0,13g 2 70% Fehérje 15% Nukleinsav 7% (1+6) Szénhidrát 3% Lipid 2% Szervetlen
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
Szerves kémia II. kommunikációs dosszié SZERVES KÉMIA II. ANYAGMÉRNÖK MESTERKÉPZÉS TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ
 SZERVES KÉMIA II. ANYAGMÉRNÖK MESTERKÉPZÉS TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŐSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI TANSZÉK Miskolc, 2008 Tartalomjegyzék 1. Tantárgyleírás, tárgyjegyzı, óraszám,
SZERVES KÉMIA II. ANYAGMÉRNÖK MESTERKÉPZÉS TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŐSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI TANSZÉK Miskolc, 2008 Tartalomjegyzék 1. Tantárgyleírás, tárgyjegyzı, óraszám,
A cukrok szerkezetkémiája
 A cukrok szerkezetkémiája A cukrokról,szénhidrátokról általánosan o o o Kémiailag a cukrok a szénhidrátok,vagy szacharidok csoportjába tartozó vegyületek. A szacharid arab eredetű szó,jelentése: édes.
A cukrok szerkezetkémiája A cukrokról,szénhidrátokról általánosan o o o Kémiailag a cukrok a szénhidrátok,vagy szacharidok csoportjába tartozó vegyületek. A szacharid arab eredetű szó,jelentése: édes.
H 3 C H + H 3 C C CH 3 -HX X 2
 1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. vörösvértest
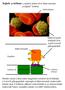 Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. vörösvértest fehérvérsejtek fehérvérsejtek felületén lévő szialil LewisX glikopeptidek Kapilláris kapiláris fal endotél sejtek szelektin
Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. vörösvértest fehérvérsejtek fehérvérsejtek felületén lévő szialil LewisX glikopeptidek Kapilláris kapiláris fal endotél sejtek szelektin
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Szerves kémia A szerves kémia a kémia azon ága, mely a széntartalmú vegyületekkel foglalkozik. Az elnevezés onnan ered, hogy sokáig azt hitték csak az
 Szerves kémia Szerves kémia A szerves kémia a kémia azon ága, mely a széntartalmú vegyületekkel foglalkozik. Az elnevezés onnan ered, hogy sokáig azt hitték csak az élő szervezet képes előállítani az őket
Szerves kémia Szerves kémia A szerves kémia a kémia azon ága, mely a széntartalmú vegyületekkel foglalkozik. Az elnevezés onnan ered, hogy sokáig azt hitték csak az élő szervezet képes előállítani az őket
SZERVES KÉMIA: BEVEZETÉS SZTEREOKÉMIA. Debreceni Egyetem ÁOK Orvosi Vegytani Intézet
 SZERVES KÉMIA: BEVEZETÉS SZTEREOKÉMIA Debreceni Egyetem ÁOK Orvosi Vegytani Intézet www.medchem.unideb.hu A szén allotróp módusulatai a) gyémánt b) grafit c) amorf szén (nincs ábrázolva) A grafénő egyetlen
SZERVES KÉMIA: BEVEZETÉS SZTEREOKÉMIA Debreceni Egyetem ÁOK Orvosi Vegytani Intézet www.medchem.unideb.hu A szén allotróp módusulatai a) gyémánt b) grafit c) amorf szén (nincs ábrázolva) A grafénő egyetlen
SZERVES VEGYÜLETEK SZTEREOKÉMIÁJA*
 Ne feledd, nemcsak hecc az adatlopás, hanem hatalmi téboly, és a terrorista őrület is fel tudja használni ezeket az adatokat, s téged is kényszeríthetnek tudásod kiadására. Egy esetleges atom, vagy biológiai
Ne feledd, nemcsak hecc az adatlopás, hanem hatalmi téboly, és a terrorista őrület is fel tudja használni ezeket az adatokat, s téged is kényszeríthetnek tudásod kiadására. Egy esetleges atom, vagy biológiai
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
A szervetlen vegyületek
 5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
Szerves vegyületek csoportosítása. Izoméria
 Szerves vegyületek csoportosítása Izoméria Szerves vegyületek csoportosítása -jellemző atomcsoportok -váz (szénváz) Nyílt láncúak (alifások) Gyűrűsek (ciklusosak) karbo- és heterociklusos vegyületek monociklus
Szerves vegyületek csoportosítása Izoméria Szerves vegyületek csoportosítása -jellemző atomcsoportok -váz (szénváz) Nyílt láncúak (alifások) Gyűrűsek (ciklusosak) karbo- és heterociklusos vegyületek monociklus
SZERVES KÉMIA. Szerkezet és reaktivitás. dr. Nagy József. egyetemi docens
 SZEVES KÉMIA Szerkezet és reaktivitás dr. Nagy József egyetemi docens Budapesti Mőszaki Egyetem 2000 1. SZEVES ANYAGK SZEKEZETE 1.1. A szerves kémia tárgya A kémia az a tudományág, amely az anyagok szerkezetével,
SZEVES KÉMIA Szerkezet és reaktivitás dr. Nagy József egyetemi docens Budapesti Mőszaki Egyetem 2000 1. SZEVES ANYAGK SZEKEZETE 1.1. A szerves kémia tárgya A kémia az a tudományág, amely az anyagok szerkezetével,
Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk.
 1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
C N H H C O C C O H O O O O C C O C
 X.-XII. osztály, IV. forduló - megoldás 010 / 011 es tanév, XVI. évfolyam 1. a) Az alkánok telítettsége - maximális. Az alkánok azért maximális telítettségüeg, mert a -atomok mind a 4 vegyértékükkel külön-külön
X.-XII. osztály, IV. forduló - megoldás 010 / 011 es tanév, XVI. évfolyam 1. a) Az alkánok telítettsége - maximális. Az alkánok azért maximális telítettségüeg, mert a -atomok mind a 4 vegyértékükkel külön-külön
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
A szervetlen vegyületek
 5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
5. Előadás. Szénhidrogének: alkánok, alkének, alkinek
 5. Előadás Szénhidrogének: alkánok, alkének, alkinek 17. Szénhidrogének 17.1.Alkánok (paraffinok), cikloalkánok omológ sor: eltérés egyetlen metilén ( ) csoportban metán 4 1 etán 6 1 propán 3 8 1 ciklopropán
5. Előadás Szénhidrogének: alkánok, alkének, alkinek 17. Szénhidrogének 17.1.Alkánok (paraffinok), cikloalkánok omológ sor: eltérés egyetlen metilén ( ) csoportban metán 4 1 etán 6 1 propán 3 8 1 ciklopropán
Tartalmi követelmények kémia tantárgyból az érettségin K Ö Z É P S Z I N T
 1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
5. Előadás. Szénhidrogének: alkánok, alkének, alkinek
 5. Előadás Szénhidrogének: alkánok, alkének, alkinek 19. Szénhidrogének 19.1.Alkánok (paraffinok), cikloalkánok omológ sor: eltérés egyetlen metilén ( 2 ) csoportban metán 4 1 etán 2 6 1 propán 3 8 1 ciklopropán
5. Előadás Szénhidrogének: alkánok, alkének, alkinek 19. Szénhidrogének 19.1.Alkánok (paraffinok), cikloalkánok omológ sor: eltérés egyetlen metilén ( 2 ) csoportban metán 4 1 etán 2 6 1 propán 3 8 1 ciklopropán
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Sztereokémia, királis molekulák: (királis univerzum, tükörképi világ?) Izomerek felosztása
 Sztereokémia, királis molekulák: (királis univerzum, tükörképi világ?) memo: a földi élet királis! Pl. a földön az L-aminosavak vannak túlnyomó többségben. - Az enantiomer szelekció, módját idejét és okát
Sztereokémia, királis molekulák: (királis univerzum, tükörképi világ?) memo: a földi élet királis! Pl. a földön az L-aminosavak vannak túlnyomó többségben. - Az enantiomer szelekció, módját idejét és okát
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
A szén molekulaképző sajátságai. Kémia 1 Szerves kémia. A szerves kémiai reakciók jellege. Szerves kémiai reakciók felosztása
 Kémia 1 Szerves kémia Tárgya: a szénvegyületek szerkezetének, tulajdonságainak és átalakulásainak a vizsgálata. A szerves vegyületek összetételükben és kémiai viselkedésükben jelentősen eltérnek a szervetlen
Kémia 1 Szerves kémia Tárgya: a szénvegyületek szerkezetének, tulajdonságainak és átalakulásainak a vizsgálata. A szerves vegyületek összetételükben és kémiai viselkedésükben jelentősen eltérnek a szervetlen
Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások
 Oktatási Hivatal Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások I. FELADATSOR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D
Oktatási Hivatal Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások I. FELADATSOR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D
Szénhidrátok. Szénhidrátok. Szénhidrátok. Csoportosítás
 Szénhidrátok Definíció: Szénhidrátok Polihidroxi aldehidek vagy ketonok, vagy olyan vegyületek, melyek hidrolízisével polihidroxi aldehidek vagy ketonok keletkeznek. Elemi összetétel: - Mindegyik tartalmaz
Szénhidrátok Definíció: Szénhidrátok Polihidroxi aldehidek vagy ketonok, vagy olyan vegyületek, melyek hidrolízisével polihidroxi aldehidek vagy ketonok keletkeznek. Elemi összetétel: - Mindegyik tartalmaz
Spektroszkópiai módszerek 2.
 Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
 Á É ő é ü ö á á ö é á é ö á á é ő á á ő á á á ő á ő é á é ő ö ó é ő é é á ó á á á á ó á á ö ö é á é Ó É á á ő á á ú ü ö á á á á é á á á á é é ő á á á á é ü á á ő ú á é á á ü ö á á á á é é á á á á ő á ő
Á É ő é ü ö á á ö é á é ö á á é ő á á ő á á á ő á ő é á é ő ö ó é ő é é á ó á á á á ó á á ö ö é á é Ó É á á ő á á ú ü ö á á á á é á á á á é é ő á á á á é ü á á ő ú á é á á ü ö á á á á é é á á á á ő á ő
Összefoglalás. Telített Telítetlen Aromás Kötések Csak -kötések és -kötések és delokalizáció. Kötéshossz Nagyobb Kisebb Átmenet a kettő között
 Összefoglalás Telített Telítetlen Aromás Kötések Csak -kötések és -kötések és delokalizáció Kötéshossz Nagyobb Kisebb Átmenet a kettő között Reakciókészség Paraffin (legkevésbé) Nagy Átmenet a kettő között
Összefoglalás Telített Telítetlen Aromás Kötések Csak -kötések és -kötések és delokalizáció Kötéshossz Nagyobb Kisebb Átmenet a kettő között Reakciókészség Paraffin (legkevésbé) Nagy Átmenet a kettő között
Tantárgycím: Szerves kémia
 Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
Szerves vegyületek nevezéktana
 A main metódusnak mindig van egy paramétere az args, amely a parancssorban megadott argumentumokat tartalmazza szöveges formában. Az argumentumok számát az args tömb length metódusa segítségével lehet
A main metódusnak mindig van egy paramétere az args, amely a parancssorban megadott argumentumokat tartalmazza szöveges formában. Az argumentumok számát az args tömb length metódusa segítségével lehet
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Intra- és intermolekuláris reakciók összehasonlítása
 Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Javító vizsga követelményei kémia tantárgyból augusztus osztály
 Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
Sztereokémia II. Sztereokémia III.
 Szerves Kémia (1) kv1n1es1/1, kredit: 4; Jalsovszky István Sztereokémia I. Sztatikus sztereokémia. A szén tetraéderes vegyértékorientációja és ennek következményei. Molekulamodellek használata a sztereokémia
Szerves Kémia (1) kv1n1es1/1, kredit: 4; Jalsovszky István Sztereokémia I. Sztatikus sztereokémia. A szén tetraéderes vegyértékorientációja és ennek következményei. Molekulamodellek használata a sztereokémia
Modern Fizika Labor. Fizika BSc. Értékelés: A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n. 2008. április 29.
 Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Kémia (K kategória) Levelező forduló Beküldési határidő : 2013. November 25.
 Kémia (K kategória) Levelező forduló Beküldési határidő : 2013. November 25. 1. feladat Egy alkáliföldfém ötvözet alkotói a periódusos rendszerben közvetlenül egymás alatt találhatóak. Az ötvözet 12,83
Kémia (K kategória) Levelező forduló Beküldési határidő : 2013. November 25. 1. feladat Egy alkáliföldfém ötvözet alkotói a periódusos rendszerben közvetlenül egymás alatt találhatóak. Az ötvözet 12,83
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
Az oktanol-víz megoszlási hányados és a ciklodextrin komplex asszociációs állandó közötti összefüggés vizsgálata modell szennyezıanyagok esetén
 Az oktanol-víz megoszlási hányados és a ciklodextrin komplex asszociációs állandó közötti összefüggés vizsgálata modell szennyezıanyagok esetén 1. Bevezetés Korábbi jelentésünkben (IV. szakmai részjelentés)
Az oktanol-víz megoszlási hányados és a ciklodextrin komplex asszociációs állandó közötti összefüggés vizsgálata modell szennyezıanyagok esetén 1. Bevezetés Korábbi jelentésünkben (IV. szakmai részjelentés)
Szemináriumi feladatok megoldása (kiegészítés) I. félév
 Szemináriumi feladatok megoldása (kiegészítés) I. félév I. Szeminárium 1. N Ebben a delokalizált rendszerben 5 sp 2 -centrum található, a mozgékony (p és nemkötő) elektronok össz-száma 12. Ezek közül 6
Szemináriumi feladatok megoldása (kiegészítés) I. félév I. Szeminárium 1. N Ebben a delokalizált rendszerben 5 sp 2 -centrum található, a mozgékony (p és nemkötő) elektronok össz-száma 12. Ezek közül 6
Beszélgetés a szerves kémia elméleti alapjairól III.
 Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
A fémkomplexek szerkezetéről
 A fémkomplexek szerkezetéről A szerves és a főcsoportbeli szervetlen vegyületek hihetetlenül nagy változatosságról, szerkezetükről, az e vegyületek körében fellépő izomériák típusairól már a középiskolában
A fémkomplexek szerkezetéről A szerves és a főcsoportbeli szervetlen vegyületek hihetetlenül nagy változatosságról, szerkezetükről, az e vegyületek körében fellépő izomériák típusairól már a középiskolában
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Konstitúció, izoméria, konfiguráció, konformáció
 Konstitúció, izoméria, konfiguráció, konformáció Konstitúció: A molekula színezett gráffal leírható szerkezete De: a konstitúciós képlet kifejezhet egyéb információt is: cisz-transz izomériát (Z - zusammen,
Konstitúció, izoméria, konfiguráció, konformáció Konstitúció: A molekula színezett gráffal leírható szerkezete De: a konstitúciós képlet kifejezhet egyéb információt is: cisz-transz izomériát (Z - zusammen,
Kormeghatározás gyorsítóval
 Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 10. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 10. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Vegyületek - vegyületmolekulák
 Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
SZEGEDI TUDOMÁNYEGYETEM TTIK SZERVES KÉMIA. I. éves biológia alapszakos hallgatók számára. Dr. Notheisz Ferenc egyetemi tanár
 1 SZEGEDI TUDMÁYEGYETEM TTIK SZEVES KÉMIA I. éves biológia alapszakos hallgatók számára Dr. otheisz Ferenc egyetemi tanár Dr. Zsigmond Ágnes egyetemi docens Szerves Kémiai Tanszék 2008 1 Bevezetés égebben
1 SZEGEDI TUDMÁYEGYETEM TTIK SZEVES KÉMIA I. éves biológia alapszakos hallgatók számára Dr. otheisz Ferenc egyetemi tanár Dr. Zsigmond Ágnes egyetemi docens Szerves Kémiai Tanszék 2008 1 Bevezetés égebben
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Bevezetés. Tanítani haszontalan, kivéve, ha felesleges. Rausch Péter kémia-környezettan tanár. Richard Feynman
 Bevezetés Tanítani haszontalan, kivéve, ha felesleges. Richard Feynman Rausch Péter -környezettan tanár Általános Szerves Analitikai Szervetlen KÉMIA Elméleti Mag Fizikai A szerves kialakulása 1773-ban
Bevezetés Tanítani haszontalan, kivéve, ha felesleges. Richard Feynman Rausch Péter -környezettan tanár Általános Szerves Analitikai Szervetlen KÉMIA Elméleti Mag Fizikai A szerves kialakulása 1773-ban
ÚJ NAFTOXAZIN-SZÁRMAZÉKOK SZINTÉZISE ÉS SZTEREOKÉMIÁJA
 PhD értekezés tézisei ÚJ AFTXAZI-SZÁMAZÉKK SZITÉZISE ÉS SZTEEKÉMIÁJA Tóth Diána Szegedi Tudományegyetem Gyógyszerkémiai Intézet Szeged 2010 Szegedi Tudományegyetem Gyógyszertudományok Doktori Iskola Ph.D
PhD értekezés tézisei ÚJ AFTXAZI-SZÁMAZÉKK SZITÉZISE ÉS SZTEEKÉMIÁJA Tóth Diána Szegedi Tudományegyetem Gyógyszerkémiai Intézet Szeged 2010 Szegedi Tudományegyetem Gyógyszertudományok Doktori Iskola Ph.D
Miért más egy kicsit a szerves kémia?
 Miért más egy kicsit a szerves kémia? I. 5 kemia_10mf-9.indd 5 2018. 01. 11. 21:37:01 1. Szervetlen és szerves vegyületek Létezhet-e szilíciumalapú élet? 1. A táblázat a szerves és a szervetlen anyagok
Miért más egy kicsit a szerves kémia? I. 5 kemia_10mf-9.indd 5 2018. 01. 11. 21:37:01 1. Szervetlen és szerves vegyületek Létezhet-e szilíciumalapú élet? 1. A táblázat a szerves és a szervetlen anyagok
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Semmelweis Egyetem Szerves Vegytani Intézet. Kiralitás január 29.
 emmelweis Egyetem zerves Vegytani Intézet Izoméria Mezoméria Kiralitás 0. január 9. Izoméria Azonos összegképlet: azonos kvalitatív összetétel azonos kvantitatív összetétel azonos relatív molekulatömeg
emmelweis Egyetem zerves Vegytani Intézet Izoméria Mezoméria Kiralitás 0. január 9. Izoméria Azonos összegképlet: azonos kvalitatív összetétel azonos kvantitatív összetétel azonos relatív molekulatömeg
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
3.6. Szénidrátok szacharidok
 3.6. Szénidrátok szacharidok általános összegképlet: C n (H 2 O) m > a szén hidrátjai elsődleges szerves anyagok mert az élő sejt minden más szerves anyagot a szénhidrátok további átalakításával állít
3.6. Szénidrátok szacharidok általános összegképlet: C n (H 2 O) m > a szén hidrátjai elsődleges szerves anyagok mert az élő sejt minden más szerves anyagot a szénhidrátok további átalakításával állít
Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások
 ktatási Hivatal rszágos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások I. FELADATSR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D 9.
ktatási Hivatal rszágos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások I. FELADATSR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D 9.
feladatmegoldásai K É M I Á B Ó L
 A 2006/2007. tanévi ORSZÁGOS KÖZÉPISKOLAI TANULMÁNYI VERSENY első (iskolai) fordulójának Az értékelés szempontjai feladatmegoldásai K É M I Á B Ó L Egy-egy feladat összes pontszáma a részpontokból tevődik
A 2006/2007. tanévi ORSZÁGOS KÖZÉPISKOLAI TANULMÁNYI VERSENY első (iskolai) fordulójának Az értékelés szempontjai feladatmegoldásai K É M I Á B Ó L Egy-egy feladat összes pontszáma a részpontokból tevődik
 Í ÍÍÍ Í Í Í Ö Ö Ö Ö Ö Ö Ö Ö Ú É Í Ö Á Á É Ö É Ö É É Á Á Ö Ú Ö Ö Í Á É É Í Á É Í Ö Ö Á Á É Í Ö Ö Ö Ö Ö Ö Á É Ö É É Ö É Ö Í Á É É Ö Ö É Ö Í Í Í Í Ö Ö Ö Í Ö É Ö É É Ö Ö Í É Ö Í É É Ö Í É Á É É Ű Ö Í É É Ö
Í ÍÍÍ Í Í Í Ö Ö Ö Ö Ö Ö Ö Ö Ú É Í Ö Á Á É Ö É Ö É É Á Á Ö Ú Ö Ö Í Á É É Í Á É Í Ö Ö Á Á É Í Ö Ö Ö Ö Ö Ö Á É Ö É É Ö É Ö Í Á É É Ö Ö É Ö Í Í Í Í Ö Ö Ö Í Ö É Ö É É Ö Ö Í É Ö Í É É Ö Í É Á É É Ű Ö Í É É Ö
Szerves kémiai összefoglaló. Szerkesztette: Varga Szilárd
 Szerves kémiai összefoglaló Szerkesztette: Varga Szilárd 2 Bevezetés Az alábbi szerves kémiai összefoglaló a emzetközi Kémiai Diákolimpián résztvevő magyar csapat felkészítésére készült. Két részből áll:
Szerves kémiai összefoglaló Szerkesztette: Varga Szilárd 2 Bevezetés Az alábbi szerves kémiai összefoglaló a emzetközi Kémiai Diákolimpián résztvevő magyar csapat felkészítésére készült. Két részből áll:
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
1. Hibás mondatok. Magyarázd meg, hogy miért hibásak az alábbi kijelentések.
 Név:........................Helység / Iskola............................... Kémiatanár neve:...................................... Beküldési határidő: 2008. dec. 15 TAKÁCS CSABA KÉMIA EMLÉKVERSENY, X.-XII.
Név:........................Helység / Iskola............................... Kémiatanár neve:...................................... Beküldési határidő: 2008. dec. 15 TAKÁCS CSABA KÉMIA EMLÉKVERSENY, X.-XII.
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Newman-projekció: háromdimenziós szerkezetet úgy ábrázol, hogy két egymáshoz kapcsolódó atomot egymás mögé helyez:
 11. Szerves kémia 601 Síkképlet: Ábrázolásmódok: Fűrészbak-projekció: perspektivikus ábrázolásmód: l Br F ewman-projekció: háromdimenziós szerkezetet úgy ábrázol, hogy két egymáshoz kapcsolódó atomot egymás
11. Szerves kémia 601 Síkképlet: Ábrázolásmódok: Fűrészbak-projekció: perspektivikus ábrázolásmód: l Br F ewman-projekció: háromdimenziós szerkezetet úgy ábrázol, hogy két egymáshoz kapcsolódó atomot egymás
 ú Ú Ö É ú ü í í ü í í í í ü Ú í ű í ú ü ü í í ü ü í ü ü ú Í í ű í ü ü Ü í í ü í ú ű ú ú í í ü ú í ü É ü Ö í í ü ú ű í í ü í ű í í Í Ö í í ü Ö ú É Í í í í ü ű ü ű ü ü ü ü í í í í ú í ü í ú É ü ü ü ü í ü
ú Ú Ö É ú ü í í ü í í í í ü Ú í ű í ú ü ü í í ü ü í ü ü ú Í í ű í ü ü Ü í í ü í ú ű ú ú í í ü ú í ü É ü Ö í í ü ú ű í í ü í ű í í Í Ö í í ü Ö ú É Í í í í ü ű ü ű ü ü ü ü í í í í ú í ü í ú É ü ü ü ü í ü
 Ü Éü É ü í í Í ö Ü Ú ú Ó í ő í Ö ű ö Ó ú Ű ü í Ó ö Ó Ü Ó Ó í í ú í Ü Ü ő Ú Ó Ó í ú É ÉÉ É Á Ü Ü Ü Ú ő í Ő Ó Ü ő ö ü ő ü ö ú ő ő ő ü ö ő ű ö ő ü ő ő ü ú ü ő ü ü Í ü Í Á Ö Í É Ú ö Í Á Ö í É ö í ő ő í ö ü
Ü Éü É ü í í Í ö Ü Ú ú Ó í ő í Ö ű ö Ó ú Ű ü í Ó ö Ó Ü Ó Ó í í ú í Ü Ü ő Ú Ó Ó í ú É ÉÉ É Á Ü Ü Ü Ú ő í Ő Ó Ü ő ö ü ő ü ö ú ő ő ő ü ö ő ű ö ő ü ő ő ü ú ü ő ü ü Í ü Í Á Ö Í É Ú ö Í Á Ö í É ö í ő ő í ö ü
 ó ó ú ú ó ó ó ü ó ü Á Á ü É ó ü ü ü ú ü ó ó ü ó ü ó ó ú ú ú ü Ü ú ú ó ó ü ó ü ü Ü ü ú ó Ü ü ű ű ü ó ü ű ü ó ú ó ú ú ú ó ú ü ü ű ó ú ó ó ü ó ó ó ó ú ó ü ó ó ü ü ó ü ü Ü ü ó ü ü ü ó Ü ó ű ü ó ü ü ü ú ó ü
ó ó ú ú ó ó ó ü ó ü Á Á ü É ó ü ü ü ú ü ó ó ü ó ü ó ó ú ú ú ü Ü ú ú ó ó ü ó ü ü Ü ü ú ó Ü ü ű ű ü ó ü ű ü ó ú ó ú ú ú ó ú ü ü ű ó ú ó ó ü ó ó ó ó ú ó ü ó ó ü ü ó ü ü Ü ü ó ü ü ü ó Ü ó ű ü ó ü ü ü ú ó ü
 Á ű ő ö Í é é ő Ö Ö é ő Ö ő ö é é Ö ü é ó Ő é é ó é ó é é é é Ö ó ó ő é Ü é ó ö ó ö é é Ő ú é é é é ő Ú é ó Ő ö Ő é é é é ű ö é Ö é é ó ű ö é ő é é é é é é é é é Ö é Ö ü é é é é ö ü é ó é ó ó é ü ó é é
Á ű ő ö Í é é ő Ö Ö é ő Ö ő ö é é Ö ü é ó Ő é é ó é ó é é é é Ö ó ó ő é Ü é ó ö ó ö é é Ő ú é é é é ő Ú é ó Ő ö Ő é é é é ű ö é Ö é é ó ű ö é ő é é é é é é é é é Ö é Ö ü é é é é ö ü é ó é ó ó é ü ó é é
 Ü Ö Á Á Á Á Á É ű Ü Ú ű ű Á É ű Ú Ü ű Ü Ü Ü Ü Ü Ü Ü Ü Ü Á Ü Ü Ü Ö Ö Ú Ö Ü Ö ű ű ű ű ű Á ű Ú ű ű ű ű ű É Á Ö Ö Ö ű ű ű Á ű ű ű ű ű ű ű ű ű ű Ü Ü Ü Ü ű ű ű ű ű ű ű ű ű ű ű Ú ű ű ű ű ű ű Ü Ö Ü Ó Ö ű ű ű
Ü Ö Á Á Á Á Á É ű Ü Ú ű ű Á É ű Ú Ü ű Ü Ü Ü Ü Ü Ü Ü Ü Ü Á Ü Ü Ü Ö Ö Ú Ö Ü Ö ű ű ű ű ű Á ű Ú ű ű ű ű ű É Á Ö Ö Ö ű ű ű Á ű ű ű ű ű ű ű ű ű ű Ü Ü Ü Ü ű ű ű ű ű ű ű ű ű ű ű Ú ű ű ű ű ű ű Ü Ö Ü Ó Ö ű ű ű

