Szerves vegyületek csoportosítása. Izoméria
|
|
|
- Domokos Balázs
- 6 évvel ezelőtt
- Látták:
Átírás
1 Szerves vegyületek csoportosítása Izoméria
2 Szerves vegyületek csoportosítása -jellemző atomcsoportok -váz (szénváz) Nyílt láncúak (alifások) Gyűrűsek (ciklusosak) karbo- és heterociklusos vegyületek monociklus policiklus -izolált policiklusos -spirociklusos (1 közös atom) -kondenzált (2 közös atom) -áthidalt (kettőnél több közös atom) Szénhidrogének Szénhidrogének helyettesített származékai eterociklusos vegyületek
3 Szerves vegyületek Nyíltláncú vegyületek Gyűrűs vegyületek Karbociklusok eterociklusok Telített: alkánok Telítetlen: alkének, alkinek Aliciklusok Aromás vegyületek Telített Telítetlen Aromás
4 Telítetlen vegyületek = kettőskötést tartalmazóak hármaskötést tartalmazóak Alkének Poliének Alkinek Poliinek propén buta-1,3-dién etin buta-1,3-diin
5 Aliciklusok ikloalkánok Policiklusos alkánok ikloalkének ikloalkinek ciklohexán spiropentán ciklohexén ciklooktin
6 Aromás vegyületek Monociklusok Kondenzált gyűrűs vegyületek Monoszubsztituált benzolszármazékok R Többszörösen szubsztituált benzolszármazékok R Lineáris anelláció Anguláris anelláció orto meta antracén fenantrén para
7 eterociklusok Telített Aromás O tetrahidrofurán Telítetlen (mono- és policiklus) 4 5 N S 1 3,6-dihidro-2-[1,3]-tiazin Monociklusok N piridin N N imidazol Kondenzált gyűrűs vegyületek N indol N purin N N N
8 Izoméria
9 Izoméria (isos: azonos; méros: rész) Azonos összegképlet: azonos kvalitatív összetétel azonos kvantitatív összetétel azonos relatív molekulatömeg Különböző szerkezet l nem izomerek nem izomerek 3 2 nem izomerek : = 1: izomerek 3 9
10 Izomériák csoportosítása Szerkezeti izoméria Funkciós csoport izoméria Különleges típusok szénváz izoméria helyzeti izoméria tautoméria Sztereoizoméria konformációs (rotációs) izoméria geometriai izoméria (cisz-transz izoméria, Z-E izoméria) optikai izoméria Szerkezeti izoméria: különböző összekapcsoltság (konnektivitás) Sztereoizoméria: azonos konnektivitás különböző térszerkezet A királis (kheir: kéz) tárgyak tükörképükkel nem hozhatók fedésbe sem rotációs, sem transzlációs mozgással (kivéve a molekulán belüli rotáció lehetőségét). A kiralitás szerkezeti feltétele: a tárgynak ne legyen tükrözési szimmetriatengelye. 10
11 1. Konstitúciós (szerkezeti) izoméria azonos összegképletű, de különböző szerkezetű vegyületek ebben az esetben különböző szerkezetű két molekula, ha bennük az atomok kapcsolódási sorrendje különböző 2D-szerkezetben való különbözőség: különböző kapcsolódási sorrend (különböző konstitúció) 2. Sztereoizoméria azonos összegképlet, de eltérő térszerkezet 3D-szerkezetben való különbözőség: azonos konstitúció, de különböző térszerkezet 11
12 azonos atomkonnektivitás sztereoizomerek 3 Br l 3 3 l l Br Br E Z E eltérõ atomkonnektivitás nem sztereoizomerek szerkezeti izomerek 12
13 Enantiomerek egymással fedésbe nem hozható tükörképi párok azonos internukleáris távolság különböző csoportsorrend (konfiguráció) Diasztereomerek nem enantiomerek (lehetnek akirálisak is), nincsenek egymással tükörképi viszonyban azonos összekapcsoltság különböző internukleáris távolság Konformációs és konfigurációs enantiomerek diasztereomerek 13
14 Konstitúciós izomerek Azonos összegképlet, különböző összekapcsoltság. Konformációs izomerek A konformációs izomerek egyszeres kötés(ek) körüli rotációval (vagy pszeudorotációval) egymásba alakíthatók. Két szomszédos (szén)atom szubsztituenseinek egymáshoz való viszonya. Konfigurációs izomerek A konfigurációs izomerek egyszeres kötés(ek) körüli rotációval nem alakíthatók egymásba. Egy adott (szén)atomon levő csoportsorrend. 14
15 Konstitúció Konformáció axiális pszeudorotáció pszeudorotáció ekvatoriális Konfiguráció Alfa helyzetű szubsztituens Béta helyzetű szubsztituens 15
16 Konfiguráció transz 1,2-dimetilciklohexán cisz transz dekalin cisz 16
17 OO S * O 3 L-(+)-tejsav izomszövet OO R * O 3 D-(-)-tejsav tejsavas erjedés OO OO OO OO maleinsav fumársav itromsav ciklus (Szent-Györgyi-Krebs ciklus) 17
18 Izoméria Különböző vegyületek azonos összegképlettel KONSTITÚIÓS IZOMEREK (szerkezeti, vagy struktúrizomerek) Az atomok kapcsolódási sorrendje eltérő SZTEREOIZOMEREK Azonos konstitúció, eltérõ térbeli elrendeződés TAUTOMEREK Ugyanaz a vegyület kétféle szerkezettel reagál keto-enol tautoméria laktim-laktám tautoméria gyűrű-lánc tautoméria DIASZTEREOMEREK Nem enantiomerek ENANTIOMEREK Fedésbe nem hozható tükörképi párok KONFIGURÁIÓS DIASZTEREOMEREK Kötésmenti rotációval nem alakíthatók egymásba KONFORMÁIÓS DIASZTEREOMEREK Kötésmenti rotációval egymásba alakíthatók Alkánok rotációs izomerei iklohexán szék-kád izomerei KONFORMÁIÓS ENANTIOMEREK Kötésmenti rotációval egymásba alakíthatók KONFIGURÁIÓS ENANTIOMEREK Kötésmenti rotációval nem alakíthatók egymásba (Optikai izomerek) Királis vegyületek AKIRÁLIS DIASZTEREOMEREK isz-transz (geometriai) izomerek Bizonyos atomoknak egy meghatározott síkhoz viszonyított relatív helyzetében különböznek KIRÁLIS DIASZTEREOMEREK Több kiralitáscentrumot tartalmazó vegyületek Kettős kötéses vegyületek Z - E izomériája Diszubsztituált cikloalkánok cisz - transz izomériája Kondenzált gyűrűs bicikloalkánok cisz - transz izomériája Atropizoméria savart kádak Gauche konformerek Antiklinális konformerek (Az izomerek létképessége függ a köztük lévő energiagát nagyságától) entrális kiralitás elikális kiralitás Axiális kiralitás Allénizomerek Spirovegyületek 18
19 Szerkezeti izoméria 19
20 Szerkezeti izoméria Funkciós csoport izoméria 3 O O Regioizoméria l 3 3 l 3 Szénváz izoméria
21 O 3 Br Regioizoméria Br két regioizomer termék Két regioizomer termék keletkezhet, de Szelektivitás + Br 3 Br 3 3 árom három regioizomer regioizomer termék termék keletkezhet, de Szelektivitás O 3 O 3 O 3 Br 2 FeBr Br Br 21
22 n-bután i-bután metilciklopr opán ciklobután 22
23 A compound with the general formula n 2n contains one double-bond equivalent either one double bond or one ring an alkane a cycloalkane A compound with the general formula n 2n-2 might have one triple bond, two rings, two double bonds, or one ring plus one double bond. We can say that the formula n 2n-2 represents a structure with two double-bond equivalents. Three of many possible structural isomers for ( 2 ) one triple bond two rings one double bond and one ring 23
24 Tautoméria Tautoméria egy hidrogénatom és egy kettőskötés helyzetében különböznek a hidrogénatom mozgékony, így gyors és reverzíbilis protoncsere valósul meg Protoméria és elektroméria egyszerre van jelen O OO OO O Oxo-enol tautomerek Kezelhető szerkezeti izomerként 24
25 A tautoméria típusai 25
26 O 2 O oxo enol 99,99975% 0,00025% pk a 20 Oxo-enol tautoméria pk a 9 O O O O 20% 80% O O 3 3 F 2 O F o 3ó F 2 O F 3 1) alacsonyabb pk a érték 2) konjugált rendszer 3) hidrogén kelát (6 elektron) O O O O O O 26
27 Savamid-imidsav és rokon rendszerek tautomériája a) R Y Y R N N 2 Y= O, S, NR 1 b) R 2 N NR 1 N 2 R 2 N NR 1 N R 2 N NR 1 N 2 Guanidin-származék 27
28 Prototrópia (hetrociklusoknál) X X X X N N N N N N N N X X domináns forma N N N N X X 28
29 O 2 O O O α O O α -D-Glcp Gyűrű-lánc tautoméria O 2 O O β D-Glcp O O β O O 2 O O O O O O 2 O O O α O O α-d-glcf anomer izáció De nem közvetlenül O 2 O O O O O β -D-Glcf β 29
30 Szubsztituens tautomerizáció N O O 3 O N O 3 Vegyérték izomerizáció N N N N N N N N N N N N Ø 30
31 Sztereoizoméria 31
32 Sztereoizoméria Konfiguráció az atomok kölcsönös térbeli elrendeződése, az egyszeres kötések körüli elfordulást (általában) nem veszi figyelembe Konformáció egyszeres kötések körüli elforgatás, amelynek során konformerek jönnek létre Konfigurációs és konformációs enantiomerek diasztereomerek 32
33 optikai izoméria OO OO OO OO OO OO OO OO cisz transz transz m elyzeti pozíciós izoméria geometriai izoméria Szerkezeti izoméria Sztereoizoméria 33
34 Enantiomerek egymással fedésbe nem hozható tükörképi párok azonos internukleáris távolság különböző csoportsorrend (konfiguráció) Diasztereomerek nem enantiomerek (lehetnek akirálisak is), nincsenek egymással tükörképi viszonyban azonos összekapcsoltság különböző internukleáris távolság 34
35 3 3 3 l Br Diasztereomerek l 3 Br E, R Diasztereomerek Z, R Enantiomerek 3 l 3 Diasztereomerek Br l Diasztereomerek 3 Enantiomerek 3 Br E, S Z, S Ø 35
36 Sztereokémia jelentősége Királis vegyületek, királis kölcsönhatások természetes aminosavak (főként L konfiguráció) peptidek, enzimek természetes szénhidrátok (D konfiguráció) gyógyszerek (sok esetben királis molekulák) gyógyszer-receptor kölcsönhatás Ø 36
37 Journal of ISSN Volume 73, Number 6 June 1996 hemical Education Ø 37
38 Ø38
39 Kiralitás A királis tárgyak tükörképükkel nem hozhatók fedésbe sem rotációs, sem transzlációs mozgással (kivéve a molekulán belüli rotáció lehetőségét). A kiralitás szerkezeti feltétele: a tárgynak ne legyen tükrözési szimmetriatengelye. Típusok entrális kiralitás sztereogén centrum (R, S, D, L) egy királis (szén)atom több királis szénatom Axiális kiralitás tengely körüli elhelyezkedés (R, S) allénizoméria, spirovegyületek, atropizoméria Planáris kiralitás síkhoz viszonyított helyzet (P; pr, M; ps) csavart kádak, transz cikloalkén elikális kiralitás nem síkbeli csavarvonalak (P, M) alkán konformerek (gauche, antiklinális) helicének 39
40 Azonos minőségi, mennyiségi összetétel, móltömeg, konstitúció, de különböző térbeli sorrend. Br l R F konfigurációjelölés: F (+), ( ) = d, l D, L R, S l S Br 40
41 X X 4 X (R) (S) O 1 O I 1 4 T 2 D 3 T D F 4 l 2 Br 3 (S) (R) 41
42 1. övezet 2. övezet O 4 2 l 3. övezet 4. övezet (R) 42
43 entrális kiralitás A kiralitás az atomok egy pont (sztereogén centrum, kiralitáscentrum, aszimmetriacentrum)* körüli elrendeződésének következménye. A kiralitást létrehozó szerkezeti elemek elrendeződése egy központra vonatkoztatható. Egy X centrális atomhoz négy különböző ligandum kapcsolódik, a tükörképek nem hozhatók fedésbe, a két konfigurációs izomer enantiomer viszonyban van egymással. *Sztereogén centrum Egy sp 3 szénatom (vagy más atom) 4 különböző ligandumot tartalmaz O (R)-bután-2-ol O (S)-bután-2-ol 180 o -os forgatás O O O 43
44 Optikai izoméria Optikai izomerek: olyan sztereoizomerek, amelyek optikai forgatóképességben különböznek. entrális kiralitás Sztereogén centrum ábrázolása perspektívikus (térszerkezeti) proiciált (vetített) képlettel (Fischer projekció) OO OO OO OO 2 N R 3 N N 3 3 N 2 S D L intermolekuláris tükörsík 44
45 Optikai aktivitás Azok a vegyületek, melyek a síkban polarizált fény síkját elforgatják, optikailag aktívak. Jobbra forgatás (óramutatóval azonos) jele: (+); balra forgatás (óramutatóval ellentétes) jele: (-). Azok a molekulák képesek optikai forgatóképesség létrehozására, melyek minden konformációja királis. a egy királis vegyületnek csak egyik enantiomerje van jelen, a vegyület optikailag aktív (elforgatja a polarizált fény síkját). a a két enantimer ekvimoláris elegye (racemát) van jelen, a tükörképi párok kompenzációja miatt nincs makroszkópikus forgatás. Ø 45
46 Fresnel elmélete szerint a síkban polarizált fény két ellentétes irányába cirkulárisan polarizált komponensből tevődik össze. Optikailag aktív közegben az egyik cirkuláris komponens lassabban halad, mint a másik, ezért aztán amikor kilépnek a közegből, eltolódott fázisban összegeződnek újra, s ez a polarizáció síkjának elfordulásában nyilvánul meg. Az optikailag aktív anyag molekulái különböző mértékű kölcsönhatásba lépnek a jobbra és a balra cirkuláris fénysugárral. A cirkulárisan polározott fény úgy jellemezhető, hogy a fénysugár mentén az elektromágneses teret leíró elektromos és mágneses vektorok végpontjai egy jobb vagy bal menetű csavarvonalon helyezkednek el. Optikai aktivitás mérése polarimeter tube Unpolarized light from source Polarizer; fixed Nicol prism Planepolarized light Solution of optically active material Plane of polarization has undergone a rotation Analyizer; movable Nicol prism Viewer Ø 46
47 a) normál fény polarizáló lencse (Nicol prizma) síkban polarizált fény x z b) z z síkban polározott fény P és M helicitású cirkulárisan polározott fény x x α c) z minta z Ø 47
48 További kiralitás típusok 48
49 Sztereogén centrum jelenléte nem szükséges sem nem elégséges feltétele a kiralitásnak. Nem szükséges: például axiális kiralitás, planáris kiralitás Axiális kiralitás: A kiralitás az atomok egy tengely körüli elrendeződésének következménye. Allének kiralitása: l l l l Planáris kiralitás: A kiralitás az atomok egy sík körüli elhelyezkedésének következménye. OO OO O O r O 3 3 r O O O elikális kiralitás: savarvonal (spirális) szerkezetű molekulák. Pl.: DNS kettős hélixe, polipeptidek kettős α-hélixe 49
50 Atropizoméria 2 OO OO 2 ' OO OO 6 Br 6 ' Br Br Br tükörsík c 2 4 OO 2 1 OO Br 3 Br Br OO Br 1 c 2 OO R S 50
51 Axiális kiralitás R-konfiguráció 51
52 Nem minden királis molekula rendelkezik aszimmetria centrummal N N N N tükörsík 52
53 ukor Foszfor atom Ø53
54 elikális kiralitás eptahelicén n-bután Konfigurációs enantiomerek Konformációs enantiomerek P M P M 54
55 Ø55
56 Fehérjék térszerkezete Ø 56
57 Nukleinsavak térszerkezete Ø 57
58 Több kiralitásközpont 58
59 Több aszimmetria centrumot tartalmazó vegyületek lehetséges sztereoizomereinek száma: 2 n A nem enantioméria viszonyban álló sztereoizomerek: diasztereomerek a az n db aszimmetria centrum között vannak azonosak, a független sztereoizomerek száma < 2 n mezo-forma: nem királis 59
60 Egyetlen sztereogén centrumot tartalmazó molekula mindig királis, de sztereogén centrum jelenléte nem szükséges sem nem elégséges feltétele a kiralitásnak. Nem elégséges: több sztereogén centrumot tartalmazó molekula lehet akirális Példa: O 3 3 O 3 O O o forgatás O 3 3 O mezo-2,3-butándiol tükörképi párok fedésbe hozhatók - akirális O 3 3 O 3 O O 3 O O 3 3 (2R,3R)-2,3-butándiol (2S,3S)-2,3-butándiol 60
61 Nem minden olyan molekula királis, amely aszimmetria centrumokkal rendelkezik mezo vegyületek cisz-1,2-azonosan diszubsztituált ciklopropán Nem minden királis molekula rendelkezik aszimmetria centrummal axiális kiralitás planáris kiralitás 1,3-diszubsztituált allén spirovegyületek körében Ø 61
62 OO OO OO Newman (fűrészbak) projekció Konformatív OO 3 O S 2 S 2 3 O OO OO borkősav 62
63 Fisher projekcióval ábrázolt L- és D-borkősav OO OO OO OO O O O O O O O O OO OO OO OO L-(+)-borkõsav D-(-)-borkõsav mezo-borkõsav szõlõsav 63
64 Ø 64
65 Nem minden olyan molekula királis, amely aszimmetria centrumokkal rendelkezik l l * * l l l l mezo SS RR cisz transz 65
66 Szimmeriaelemek (szimmetria: azonos méret) Akkor mondjuk, hogy egy tárgy szimmetriaelemmel rendelkezik, ha a megfelelő szimmetriaművelet (tükrözés, forgatás, inverzió) a tárgyat az eredetivel fedésbe hozható alakzattá konvertálja. Pontcsoport meghatározott tárgyra vonatkozó szimmetriaműveletek összessége. szimmetriasík (σ): a molekulát két olyan félre bontja, amelyek egymásnak pontos tükörképei. (Szimmetriasíkot tartalmazó molekula akirális, de a sík hiánya nem okoz kiralitást.) n-ed rendű forgási szimmetriatengely ( n ): a molekulát a tengely körül 360 /n szöggel elforgatva az eredetitől megkülönbözhetetlen molekulát kapunk. szimmetriacentrum (inverziós centrum) ( i ): a molekula bármely elemét a szimmetriacentrummal összekötve és az ellenkező irányba azonos távolságra meghosszabbítva azonos elemhez jutunk. (Szimmetriacentrumot tartalmazó molekula akirális, de hiánya nem okoz kiralitást.) n-ed rendű tükrözési szimmetriatengely (S n ): a molekulát 360 /n szöggel elforgatva és a tengelyre merőleges síkra tükrözve az eredetitől megkülönbözhetetlen molekulát kapunk. (Tükrözési szimmetriatengelyt tartalmazó molekula akirális, hiányában a molekula királis.) 66
67 sík sík tengely o tengely o Akirális molekulák Kétfogású tükrözési szimmetriatengely Szimmetriacentrum Egyfogású tükrözési szimmetriatengely Szimmetriasík Tükrözési szimmetriatengely Valamely tárgy akkor jellemezhető S n, azaz n-ed rendű tükrözési szimmetriatengellyel, ha annak bármely pontját a tengely körül 360/n fokos szöggel elfordítva és a tengelyre merőlegesen fektetett síkon keresztül tükrözve az eredeti objektumot kapjuk meg (n szükségképpen páros vagy 1). Az S 1 -tengely szimmetriasíkkal (σ), az S 2 -tengely viszont szimmetriacentrummal ( i ) egyenértékű. A szimmetriacentrumon áthaladó bármely egyenesen a centrumtól egyenlő távolságban azonos elemek találhatók. 67
68 szimmetriasík (m, S 1 ) forgási szimmetriatengely ( n ) szimmetriacentrum ( i, S 2 ) Szimmetrikus + + Szimmetrikus + - Középpontosan - + szimmetrikus Disszimetrikus (királis) Aszimmetrikus (királis) Szimmetriaelem művelet Szimmetriaelem művelet Szimmetriasík Szimmetriatengely Szimmetriacentrum tükrözés forgatás inverzió Azonosság változatlanul hagyás Tükrözési forgatás és szimmetriatengely (giroid) tengelyre merőleges tükrözés Ø 68
69 Ø 69
70 Ø 70
71 Ø 71
72 Ø 72
73 Sequence rules for order of priority ahn-ingold-prelog nomenclature system 1. Atomic number 2. Atomic mass 3. Z > E 4. R > S 5. Spheres 6. Single-bond equivalencies 1. If the atoms in question are different, the sequence order is by atomic number, with the atom of highest atomic number receiving the highest priority. F < l < Br < I increasing priority 2. If two isotopes of the same element are present, the isotope of higher mass receives the higher priority. < D increasing priority 73
74 5. If two atoms are identical, the atomic numbers of the next atoms are used for priority assignment. If these atoms also have identical atoms attached to them, priority is determined at the first point of difference along the chain. The atom that has attached to it an atom of higher priority has the higher priority. (Do not use the sums of the atomic numbers, But look for the single atom of highest priority.) 74
75 6. Atoms attached by double or triple bond are given single-bond equivalencies so that they can be treated like single-bonded groups in determining priority. Each doubly bonded atom is duplicated (or triplicated for triple bonds). Structure Equivalent for priority determination O O R O R O O R N R N N N 75
76 Konfigurációs izoméria Ugyanaz a váz, konnektivitás, de eltérő térbeli elrendeződés (valamilyen szimmetria-rendezőhöz való viszony) Nem alakíthatók egymásba kovalens kötés elszakítása és újraképződése nélkül. optikai izomerek (optikai aktivitás) R, S geometriai izomerek cisz-transz; E-Z 76
77 Konfigurációs diasztereomerek Fizikai és kémia tulajdonságaik eltérnek. Konfigurációs enantiomerek Fizikai és kémiai tulajdonságaik azonosak, kivéve: azonos mértékű, de ellentétes irányú optikai forgatóképesség eltérő reaktivitás más királis vegyületekkel való reakcióban l l l l O (R)-bután-2-ol O (S)-bután-2-ol cisz-1,2-diklóretén transz-1,2-diklóretén 180 o -os forgatás Br l l Br F l F Br F Br l F (R) (R) (S) (R) O (R)-bután-2-ol O O (S)-bután-2-ol fp 99,5 o 99,5 o 20 d 4 0,808 0, n D 1,397 1, o [α] D -13,52 +13,52 o 77
78 Enantiomerek akirális körülmények között megegyező fizikai és kémiai tulajdonságok királis körülmények között eltérő (királis molekulák, polarizált fény) enantiomerek közötti 3 fő kölcsönhatás: Elegykristály elegykristály képzés konglomerátum képzés molekulavegyület képzés véletlenszerűen tartalmazza mindkét enantiomert a tiszta enantiomerek és az enantiomer keverékek tulajdonságai azonosak Konglomerátum csak az egyik vagy a másik enantiomert tartalmazza az enantiomerek mechanikusan is elkülöníthetők egymástól Molekulavegyület a két enantiomer a kristályban 1:1 arányban fordul elő (racém elegy) a racém elegy és az enantiomerek olvadáspontja különböző 78
79 Enantiomer felesleg ee = (R) - (S) (R) + (S) 100% Enantiomerek egyéb keverékeit az úgynevezett enantiomeric excess (ee) [enantiomer felesleg] értékkel jellemezzük. (R) és (S) a megfelelő enantiomerek mennyisége a keverékben. A komponensek mennyiségének meghatározása: Királis oszlopkromatigráfia (enantiomerek elválasztása) NMR spektroszkópia Az enantiomerfelesleg az aszimmetrikus szintézis sikerességének egyik mérőszáma. Diasztereomerek keveréke esetén hasonló módon definiálják és használják a diasztereomer felesleg és a százalékos diasztereomer felesleg fogalmát. Egy 70% R és 30% S izomert tartalmazó minta enantiomerfeleslege például 40%. Ezt az anyagot úgy is tekinthetjük, mint 40% tiszta R izomer és 60% racém elegy (mely a teljes mennyiséghez 30% R és 30% S izomerrel járul hozzá) keveréke. 79
80 Enantiomerek és diasztereomerek enantiomerek OO OO 2 N R 3 3 N 2 S diasztereomerek diasztereomerek O O OO S S OO OO S OO R O O intramolekuláris tükörsík OO OO R R O O enantiomerek 80
81 Ábrázolja Fischer képlettel az alábbi, perspektivikus képlettel megadott aminosavakat: N 2 2 S 3 OO 2 N OO S Ala R ys OO OO 2 N 2 N 3 2 S L Ala L ys 81
82 N 2 2 S 3 OO 2 N OO OO OO 3 N 2 2 N 2 S OO OO 2 N 3 2 N 2 S OO OO 2 N 2 N 3 2 S 82
83 Enantiomerek és mezo vegyületek Pszeudoaszimmetria OO OO O O S R OO OO O O R R OO OO O O S S intramolekuláris tükörsík diasztereomerek diasztereomerek enantiomerek OO OO O O O R R OO OO O O O S S enantiomerek optikailag aktívak OO OO O O O R S OO OO O O O R S optikailag inaktívak r s 83
84 optikai izoméria OO OO OO OO OO OO OO OO cisz transz transz m szerkezeti izoméria geometriai izoméria 84
85 Br OO OO OO OO OO m pszeudoaszimmetriás szénatom akirális molekula m mezo vegyület akirális OO 2 forgási szimmetriatengely királis pro-pszeudoaszimmetriás szénatom O R (S) R (S) O R r S O S s R akirális szénatom R>S r, s 85
86 Királis molekulákon belül is sok esetben található pszeudoaszimmetriacentrum, amennyiben a két enantiomorf ligandum mellett további aszimmetrikus ligandum is kapcsolódik a centrumhoz (például atropin és származékai). gytsz.pte.hu/hu/download/index/16630 Ø 86
87 Mezo-forma: a) mindig akirális b) mindig kell lennie királis disztereomerjének is diasztereomerek diasztereomerek O O OO S S OO OO S O R OO O intramolekuláris tükörsík OO R R OO O O enantiomerek gytsz.pte.hu/hu/download/index/16630 Ø 87
88 A pszeudo-aszimmetriacentrumok konfigurációjában eltérő izomerek egymással diasztereoizomer viszonyban állnak. gytsz.pte.hu/hu/download/index/16630 R OO O R OO O O s r O S O OO S O OO Ø 88
89 Geometriai izoméria Diasztereomerek kettős kötésű vegyületeknél ciklusos vegyületeknél Feltétel (olefineknél): egy adott pillératomon nem lehet két azonos helyettesítő, de adott kettőskötés két különböző pillératomján lehet egy-egy azonos helyettesítő (de ezeknek sem kell szükségképpen azonosaknak lenniük). Alfa helyzetű szubsztituens Béta helyzetű szubsztituens 89
90 onfigurational isomers The particular arrangement of atoms (or goups) in space that is characteristic of a given streoisomer. The configurational isomers can not be transformed into each other without breaking and making a covalent bond. OO OO OO OO Z E - cis-trans; Z-E designations; geometric isomers - optical isomerism (cf. chirality) Ø 90
91 The requirement for geometric isomerism in alkenes is that each carbon atom involved in the pi bond have two different groups attached to it, such as and l, or 3 and l. 3 Z 2 3 geometric isomers 3 3 E igher priority atoms or groups are on the same side of the pi bond: Z together igher priority atoms or groups are on opposite sides of the pi bond: E across (Look at the single atoms directly attached to the double-bond carbon:, and not entire group.) If one of the carbons of the double bond has two identical groups, such as two atoms or two 3 groups, the geometric isomerism is not possible. 2 3 is the same as Ø91
92 ahn-ingold-prelog szekvenciaszabályok alkénekre vonatkozóan Rendszám Tömegszám Br I F l Z D T D E Z > E R>S (D>L) 3 Z N E Z E N R S 3 Br Br 3 92
93 Z < 2 o () o ,,,,,,,(),,,(),, o () o o (,O,N): adott atom ismételt megjelenítése; ---o : fantomatom o 3 2 Br 3 2 E 3 2 Br > o () o Br o () o o ,,, Br,,,; >,,,,(),,,(),, 93 o
94 Br transz E transz Z Br cisz Z cisz E Ø 94
95 Konformációs izoméria Ugyanaz a váz, konnektivitás, de eltérő térbeli elrendeződés (valamilyen szimmetria-rendezőhöz való viszony) Kovalens kötés elszakítása és újraképződése nélkül egymásba alakíthatók. Rotációs izoméria Különböző konformáció (konformerek, rotamerek) Axiális kiralitás R, S elikális kiralitás P, M 95
96 Konformációs diasztereomerek Konformációs enantiomerek P M 96
97 Konformerek szinperiplanáris szinklinális antiklinális antiperiplanáris antiklinális szinklinális akirális királis akirális királis axiális ekvatoriális pszeudorotáció 97
98 Konformációs diasztereomerek Konfigurációs diasztereomerek 98
99 - húzás (stretch) r 2 O O r r hajlítás (bend) O α O - csavarás (torsion) O τ (φ) O Ø 99
100 úzás (nyújtás) str etch disszociáció E OO + O + O ~ 90 ~ 50 kcal/mol E ajlítás bend O O O O O O r α 30 kcal/mol Ø 100
101 Newman pr ojekció (torziós szög) τ O O 0 o 60 o 180 o 300 o 360 o ~ 10 kcal/mol O O 1 kcal/mol Ø 101
102 Y 2 2 Z Y = Z = Y = Z = 3 etán n-bután YZ Z Y Z Z Z Y Z ZY Y Y Y 0 o 60 o 120 o 180 o 240 o 300 o 360 o óra járásával megegyező -360 o -300 o -240 o -180 o -120 o -60 o 0 o óra járásával ellentétes synperiplanar synklinal antiklinal antiperiplanar antiklinal synklinal "syn" "anti" 102
103 minimum E(Θ) M 1/2 M M 1/2 M m m m 0o 120o Θ 240o 360o Maximum M = m 103
104 E (kcal) 5,8 E: szabadentalpia-különbség , , diéderes szög szinperiplanáris szinklinális antiklinális antiperiplanáris antiklinális szinklinális 104
105 gauche anti arány G 0 = G G 0 2 K = e G 0 RT G = - RT ln K G = - T S = 0,74 S = 2 K = 1,9 minden gauche konformerre két anti forma jut K= [a]/[g] Ø 105
106 0o 0o 60o 60o 120o 120o 180o 180o 240o 240o 300o 300o 360o 360o R E L A T Í V E N E R G I A ANTI EFFEKTUS GAUE EFFEKTUS EXTRÉM GAUE EFFEKTUS 3 3 TORZIÓS SZÖG Z Y Z Y Z Y Z Y Z Y ZY ZY F O repulsions F 106
107 Anti-effect antiperiplanar position orbital attractive interactions interactions 107
108 Extrem gauche effect repulsions F repulsions F O 108
109 F -F Ø 109
110 Gyűrűfeszültség ikloalkánok ipotetikus planáris rendszerek Baeyer vegyértékszög-deformáció (anguláris/gyűrű feszülés) Pitzer anti-álláshoz képesti energiatöbblet (torziós feszülés) Nem planáris vegyületek van der Waals nemkötő atomok szterikus kölcsönhatása V-alakú boríték twist szék pszeudorotáció 110
111 kcal/mol Gy ű r ű f e sz ü l é s határérték Gyűrűtagszám 111
112 l l l l l l mezo SS RR cisz transz * * iklopropán OO OO O O S R OO OO O O R R OO OO O O S S intramolekuláris tükörsík diasztereomerek diasztereomerek enantiomerek 112
113 Z iklohexán félszék kád Ea+ E Z félszék csavart kád Ea(a e) csavart kád Ea(a e) Z E kb. 2 kcal szék kb. 5% kb. 95% szék Z 113
114 A 3-3 nemszomszédos szénatom által definiált síkokra merőleges kötésirányok: axiális A többi kötés e két sík között van: ekvatoriális Pszeudorotáció: a gyűrűs vegyületek konformerjei szögfeszültség nélkül alakulnak egymásba 114
115 transz 1,2-diszubsztituált ciklohexán a Z Z a e Z e Z cisz 1,2-diszubsztituált ciklohexán Z a Z e Z a e Z 115
116 transz 1,3-diszubsztituált ciklohexán Z e Z a a Z e Z cisz 1,3-diszubsztituált ciklohexán Z a Z a Z e e Z 116
117 transz 1,4-diszubsztituált ciklohexán a Z Z a Z e e Z cisz 1,4-diszubsztituált ciklohexán Z e Z a Z e a Z 117
118 Ø 118
119 cisz-1,2-dimetilciklohexán O 2 transz-1,2-dimetilciklohexán 3 3 1,5 kcal/mol + 12 O ,3 kcal/mol ,8 kcal/mol 8 O O 119
120 Diszubsztituált ciklohexánok szerkezeti izomerjeinek konformációs viszonyai Szerkezeti izomer cisz Geometriai izomer transz 1,2 1,4 a,e e,a a,a e,e 1,3 a,a e,e a,e e,a 120
121 Ø 121
122 1,2-helyzetben különböző helyettesítőket tartalmazó ciklohexán származékok konfigurációs és konformációs viszonyai Konfigurációs enantiomerek Konfigurációs enantiomerek Konfigurációs Konfigurációs Konfigurációs diasztereomerek diasztereomerek Konfigurációs diasztereomerek Konformációs Konformációs diasztereomerek diasztereomerek diasztereomerek Br N 2 Br N 2 Br N 2 Br N 2 1a 4b 1b 4a N 2 N 2 Br 2a Br 3b N 2 2b Br Br 3a N 2 Br N 2 Br N 2 Br Br 3a 2b N 2 3b 2a N 2 N 2 Br N 2 4a Br 1b N 2 4b Br Br 1a N 2 Ø 122
123 Dekalin cisz transz 123
124 transz-transz-transz anelláció cisz-transz-transz anelláció D B A D B A R R D B A R D B A R Ø 124
125 A kiralitás kialakulása és biológiai jelentősége Királis vegyületek természetes aminosavak (elsősorban L konfiguráció) peptidek, enzimek természetes szénhidrátok (elsősorban D konfiguráció) gyógyszerek Az első királis vegyület kialakulása az elemi részek gyenge kölcsönhatásának irányfüggésével van kapcsolatban autokatalízis a természet nem tükörszimmetrikus (a természet homokirális) Ø 125
126 Az optikai aktivitás eredete, szénhidrátok kiralitáscentrumának kiépülése a természetben Ø 126
127 Ø127
Szabó Dénes Molekulák és reakciók három dimenzióban
 Szabó Dénes Molekulák és reakciók három dimenzióban Alkímia ma, 2012. április 19. Egy kis tudománytörténet -O azonos kémiai szerkezet -O Scheele (1769) -O különböző tulajdonságok -O Kestner (1822) borkősav
Szabó Dénes Molekulák és reakciók három dimenzióban Alkímia ma, 2012. április 19. Egy kis tudománytörténet -O azonos kémiai szerkezet -O Scheele (1769) -O különböző tulajdonságok -O Kestner (1822) borkősav
Semmelweis Egyetem Szerves Vegytani Intézet. Kiralitás január 29.
 emmelweis Egyetem zerves Vegytani Intézet Izoméria Mezoméria Kiralitás 0. január 9. Izoméria Azonos összegképlet: azonos kvalitatív összetétel azonos kvantitatív összetétel azonos relatív molekulatömeg
emmelweis Egyetem zerves Vegytani Intézet Izoméria Mezoméria Kiralitás 0. január 9. Izoméria Azonos összegképlet: azonos kvalitatív összetétel azonos kvantitatív összetétel azonos relatív molekulatömeg
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
H 3 C CH 2 CH 2 CH 3
 3. Előadás Konstitució, konfiguráció, konformáció. Az izoméria fajtái. A sztereoizoméria. A kettős kötéshez kapcsolódó izoméria jelenségek. Az optikai izoméria. Az optikai aktivitás és mérése. 9. Konstitúció,
3. Előadás Konstitució, konfiguráció, konformáció. Az izoméria fajtái. A sztereoizoméria. A kettős kötéshez kapcsolódó izoméria jelenségek. Az optikai izoméria. Az optikai aktivitás és mérése. 9. Konstitúció,
SZERVES VEGYÜLETEK IZOMÉRIÁJA
 SEMMELWEIS EGYETEM GYÓGYSZERÉSZTUDMÁNYI KAR SZERVES VEGYTANI INTÉZET Szabó László Krajsovszky Gábor SZERVES VEGYÜLETEK IZMÉRIÁJA Budapest 2017 Szabó László Krajsovszky Gábor ISBN 978-963-12-8995-4 Felelős
SEMMELWEIS EGYETEM GYÓGYSZERÉSZTUDMÁNYI KAR SZERVES VEGYTANI INTÉZET Szabó László Krajsovszky Gábor SZERVES VEGYÜLETEK IZMÉRIÁJA Budapest 2017 Szabó László Krajsovszky Gábor ISBN 978-963-12-8995-4 Felelős
A szén tetraéderes vegyérték-orientációja (van t Hoff, Le Bel, 1874)
 A szén tetraéderes vegyérték-orientációja (van t off, Le Bel, 874) Perspektivikus ábrázolásmód: a központi szénatomtól indulva vonal a papír síkjában halad (ezek az ábrán az egyenletes vastagságúak), egy
A szén tetraéderes vegyérték-orientációja (van t off, Le Bel, 874) Perspektivikus ábrázolásmód: a központi szénatomtól indulva vonal a papír síkjában halad (ezek az ábrán az egyenletes vastagságúak), egy
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Bevezetés a biokémiába fogorvostan hallgatóknak - Munkafüzet 2. hét
 Bevezetés a biokémiába fogorvostan hallgatóknak - Munkafüzet 2. hét Sztereokémia (Bevezetés a biokémiába gyakorlatok, 4-6. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás,
Bevezetés a biokémiába fogorvostan hallgatóknak - Munkafüzet 2. hét Sztereokémia (Bevezetés a biokémiába gyakorlatok, 4-6. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás,
PETER PAZMANY CATHOLIC UNIVERSITY Consortium members SEMMELWEIS UNIVERSITY, DIALOG CAMPUS PUBLISHER
 SEMMELWEIS UNIVERSITY PETER PAMANY CATLIC UNIVERSITY Development of Complex Curricula for Molecular Bionics and Infobionics Programs within a consortial* framework** Consortium leader PETER PAMANY CATLIC
SEMMELWEIS UNIVERSITY PETER PAMANY CATLIC UNIVERSITY Development of Complex Curricula for Molecular Bionics and Infobionics Programs within a consortial* framework** Consortium leader PETER PAMANY CATLIC
Sztereokémia, királis molekulák: (királis univerzum, tükörképi világ?) Izomerek felosztása
 Sztereokémia, királis molekulák: (királis univerzum, tükörképi világ?) memo: a földi élet királis! Pl. a földön az L-aminosavak vannak túlnyomó többségben. - Az enantiomer szelekció, módját idejét és okát
Sztereokémia, királis molekulák: (királis univerzum, tükörképi világ?) memo: a földi élet királis! Pl. a földön az L-aminosavak vannak túlnyomó többségben. - Az enantiomer szelekció, módját idejét és okát
Olyan magkedvelő részecske, amely (legalább) két különböző atomján képes kötést létesíteni a(z elektrofil) reakciópartnerrel.
 akceptorszám (akceptivitás) aktiválási energia (E a ) activation energy aktiválási szabadentalpia (ΔG ) Gibbs energy of activation aktivált komplex activated complex ambidens nukleofil amfiprotikus (oldószer)
akceptorszám (akceptivitás) aktiválási energia (E a ) activation energy aktiválási szabadentalpia (ΔG ) Gibbs energy of activation aktivált komplex activated complex ambidens nukleofil amfiprotikus (oldószer)
SZERVES KÉMIA: BEVEZETÉS SZTEREOKÉMIA. Debreceni Egyetem ÁOK Orvosi Vegytani Intézet
 SZERVES KÉMIA: BEVEZETÉS SZTEREOKÉMIA Debreceni Egyetem ÁOK Orvosi Vegytani Intézet www.medchem.unideb.hu A szén allotróp módusulatai a) gyémánt b) grafit c) amorf szén (nincs ábrázolva) A grafénő egyetlen
SZERVES KÉMIA: BEVEZETÉS SZTEREOKÉMIA Debreceni Egyetem ÁOK Orvosi Vegytani Intézet www.medchem.unideb.hu A szén allotróp módusulatai a) gyémánt b) grafit c) amorf szén (nincs ábrázolva) A grafénő egyetlen
Sztereokémia, királis molekulák: (királis univerzum, tükörképi világ?) memo: a földi élet királis elemek sokasága!
 Sztereokémia, királis molekulák: (királis univerzum, tükörképi világ?) memo: a földi élet királis elemek sokasága! (pl. a földön az L-aminosavak vannak túlnyomó többségben. - Az enantiomer szelekció, módját
Sztereokémia, királis molekulák: (királis univerzum, tükörképi világ?) memo: a földi élet királis elemek sokasága! (pl. a földön az L-aminosavak vannak túlnyomó többségben. - Az enantiomer szelekció, módját
Konstitúció, izoméria, konfiguráció, konformáció
 Konstitúció, izoméria, konfiguráció, konformáció Konstitúció: A molekula színezett gráffal leírható szerkezete De: a konstitúciós képlet kifejezhet egyéb információt is: cisz-transz izomériát (Z - zusammen,
Konstitúció, izoméria, konfiguráció, konformáció Konstitúció: A molekula színezett gráffal leírható szerkezete De: a konstitúciós képlet kifejezhet egyéb információt is: cisz-transz izomériát (Z - zusammen,
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Táptalaj E. coli számára (1000 ml vízben) H 2 O 70% Fehérje 15% Nukleinsav 7% (1+6) Szénhidrát 3% Lipid 2% Szervetlen ion 1%
 Az E. coli kémiai összetétele Táptalaj E. coli számára (1000 ml vízben) Na 2 P 4 6,0 g K 2 P 4 3,0 g Glükóz 4,0 g N 4 l 1,0 g MgS 4 0,13g 2 70% Fehérje 15% Nukleinsav 7% (1+6) Szénhidrát 3% Lipid 2% Szervetlen
Az E. coli kémiai összetétele Táptalaj E. coli számára (1000 ml vízben) Na 2 P 4 6,0 g K 2 P 4 3,0 g Glükóz 4,0 g N 4 l 1,0 g MgS 4 0,13g 2 70% Fehérje 15% Nukleinsav 7% (1+6) Szénhidrát 3% Lipid 2% Szervetlen
H 3 CH 2 C H 2 N HS CH 3 H CH 3 HO CH 2 CH 3. CHBr 2 CH 2 OH SCH H 3 CH 2 CH 3 H 3 C OH NH 2 OH CH 2CH 3 (R) (R) (S) O CH 3 SCH 3 SCH
 Állapítsa meg az alábbi modellek kiralitáscentrumának konfigurációját! (A megoldások a képletek alatt zárójelben találhatók.) Az első három modellen bemutattuk egy-egy lehetséges ischer-projekció elkészítését.
Állapítsa meg az alábbi modellek kiralitáscentrumának konfigurációját! (A megoldások a képletek alatt zárójelben találhatók.) Az első három modellen bemutattuk egy-egy lehetséges ischer-projekció elkészítését.
Sztereokémia. Történet 1874 van t Hoff (holland), Le Bel (francia): a szénatom tetraéderes 1901 van t Hoff Nobel-díj
 Sztereokémia Történet 1874 van t off (holland), Le Bel (francia): a szénatom tetraéderes 1901 van t off Nobel-díj A limonén egyik enantiomerje citromillatú, a másik narancsillatú Contergan (Thalidomide)
Sztereokémia Történet 1874 van t off (holland), Le Bel (francia): a szénatom tetraéderes 1901 van t off Nobel-díj A limonén egyik enantiomerje citromillatú, a másik narancsillatú Contergan (Thalidomide)
SZÉNHIDRÁTOK. 3. Válogasd szét a képleteket aszerint, hogy aldóz, vagy ketózmolekulát ábrázolnak! Írd a fenti táblázat utolsó sorába a betűjeleket!
 funkciós kimutatása molekulák csoport betűjele neve képlete helye 1. Írd a táblázatba a szénhidrátok összegképletét! általános képlet trióz tetróz 2. Mi a különbség az aldózok és a ketózok között? ALDÓZ
funkciós kimutatása molekulák csoport betűjele neve képlete helye 1. Írd a táblázatba a szénhidrátok összegképletét! általános képlet trióz tetróz 2. Mi a különbség az aldózok és a ketózok között? ALDÓZ
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Részletes tematika: I. Félév: 1. Hét (4 óra): 2. hét (4 óra): 3. hét (4 óra): 4. hét (4 óra):
 Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Makromolekulák. I. A -vázas polimerek szerkezete és fizikai tulajdonságai. Pekker Sándor
 Makromolekulák I. A -vázas polimerek szerkezete és fizikai tulajdonságai Pekker Sándor MTA SZFKI Telefon:392-2222/845, Fax:392-229, Email: pekker@szfki.hu SZFKI tanfolyam: www.szfki.hu/moodle/course/ a
Makromolekulák I. A -vázas polimerek szerkezete és fizikai tulajdonságai Pekker Sándor MTA SZFKI Telefon:392-2222/845, Fax:392-229, Email: pekker@szfki.hu SZFKI tanfolyam: www.szfki.hu/moodle/course/ a
SZERVES VEGYÜLETEK SZTEREOKÉMIÁJA*
 Ne feledd, nemcsak hecc az adatlopás, hanem hatalmi téboly, és a terrorista őrület is fel tudja használni ezeket az adatokat, s téged is kényszeríthetnek tudásod kiadására. Egy esetleges atom, vagy biológiai
Ne feledd, nemcsak hecc az adatlopás, hanem hatalmi téboly, és a terrorista őrület is fel tudja használni ezeket az adatokat, s téged is kényszeríthetnek tudásod kiadására. Egy esetleges atom, vagy biológiai
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Periciklusos reakciók
 Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Történet van t Hoff (holland), Le Bel (francia): a szénatom tetraéderes 1901 van t Hoff Nobel-díj
 Sztereokémia Történet 1874 van t off (holland), Le Bel (francia): a szénatom tetraéderes 1901 van t off Nobel-díj A limonén egyik enantiomerje citromillatú, a másik narancsillatú ontergan (Thalidomide)
Sztereokémia Történet 1874 van t off (holland), Le Bel (francia): a szénatom tetraéderes 1901 van t off Nobel-díj A limonén egyik enantiomerje citromillatú, a másik narancsillatú ontergan (Thalidomide)
Helyettesített karbonsavak
 elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
Tantárgycím: Szerves kémia
 Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. vörösvértest
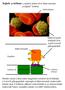 Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. vörösvértest fehérvérsejtek fehérvérsejtek felületén lévő szialil LewisX glikopeptidek Kapilláris kapiláris fal endotél sejtek szelektin
Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. vörösvértest fehérvérsejtek fehérvérsejtek felületén lévő szialil LewisX glikopeptidek Kapilláris kapiláris fal endotél sejtek szelektin
Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk.
 1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
Szemináriumi feladatok megoldása (kiegészítés) I. félév
 Szemináriumi feladatok megoldása (kiegészítés) I. félév I. Szeminárium 1. N Ebben a delokalizált rendszerben 5 sp 2 -centrum található, a mozgékony (p és nemkötő) elektronok össz-száma 12. Ezek közül 6
Szemináriumi feladatok megoldása (kiegészítés) I. félév I. Szeminárium 1. N Ebben a delokalizált rendszerben 5 sp 2 -centrum található, a mozgékony (p és nemkötő) elektronok össz-száma 12. Ezek közül 6
Bevezetés. Szénvegyületek kémiája Organogén elemek (C, H, O, N) Életerő (vis vitalis)
 Szerves kémia Fontos tudnivalók Tárgy neve: Kémia alapjai I. Neptun kód: SBANKE1050 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
Szerves kémia Fontos tudnivalók Tárgy neve: Kémia alapjai I. Neptun kód: SBANKE1050 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
Kémia (K kategória) Levelező forduló Beküldési határidő : 2013. November 25.
 Kémia (K kategória) Levelező forduló Beküldési határidő : 2013. November 25. 1. feladat Egy alkáliföldfém ötvözet alkotói a periódusos rendszerben közvetlenül egymás alatt találhatóak. Az ötvözet 12,83
Kémia (K kategória) Levelező forduló Beküldési határidő : 2013. November 25. 1. feladat Egy alkáliföldfém ötvözet alkotói a periódusos rendszerben közvetlenül egymás alatt találhatóak. Az ötvözet 12,83
A cukrok szerkezetkémiája
 A cukrok szerkezetkémiája A cukrokról,szénhidrátokról általánosan o o o Kémiailag a cukrok a szénhidrátok,vagy szacharidok csoportjába tartozó vegyületek. A szacharid arab eredetű szó,jelentése: édes.
A cukrok szerkezetkémiája A cukrokról,szénhidrátokról általánosan o o o Kémiailag a cukrok a szénhidrátok,vagy szacharidok csoportjába tartozó vegyületek. A szacharid arab eredetű szó,jelentése: édes.
Spektroszkópiai módszerek 2.
 Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Szerves kémia II. kommunikációs dosszié SZERVES KÉMIA II. ANYAGMÉRNÖK MESTERKÉPZÉS TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ
 SZERVES KÉMIA II. ANYAGMÉRNÖK MESTERKÉPZÉS TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŐSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI TANSZÉK Miskolc, 2008 Tartalomjegyzék 1. Tantárgyleírás, tárgyjegyzı, óraszám,
SZERVES KÉMIA II. ANYAGMÉRNÖK MESTERKÉPZÉS TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŐSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI TANSZÉK Miskolc, 2008 Tartalomjegyzék 1. Tantárgyleírás, tárgyjegyzı, óraszám,
2 TULAJDONSÁGOK ANYAGI HALMAZOK SZINTJÉN
 1 Sztereoszelektív szintézisek 2 TULAJDONSÁGOK ANYAGI HALMAZOK SZINTJÉN 2.3 Abszolút konfiguráció Az 1.2.2 fejezetben már tárgyaltuk a sztereokémia alapvető fogalmait, amelyek összefüggésben állnak egy
1 Sztereoszelektív szintézisek 2 TULAJDONSÁGOK ANYAGI HALMAZOK SZINTJÉN 2.3 Abszolút konfiguráció Az 1.2.2 fejezetben már tárgyaltuk a sztereokémia alapvető fogalmait, amelyek összefüggésben állnak egy
1. feladat (3 pont) Az 1,2-dibrómetán főként az anti-periplanáris konformációban létezik, így A C-Br dipólok kioltják egymást, a molekula apoláris.
 1. feladat (3 pont) Az 1,2-dibrómetán apoláris molekula. Az etilénglikol (etán-1,2-diol) molekulának azonban mérhető dipólusmomentuma van. Mi ennek a magyarázata? Az 1,2-dibrómetán főként az anti-periplanáris
1. feladat (3 pont) Az 1,2-dibrómetán apoláris molekula. Az etilénglikol (etán-1,2-diol) molekulának azonban mérhető dipólusmomentuma van. Mi ennek a magyarázata? Az 1,2-dibrómetán főként az anti-periplanáris
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
Táptalaj E. coli számára (1000 ml vízben) H 2 O 70% Fehérje 15% Nukleinsav 7% (1+6) Szénhidrát 3% Lipid 2% Szervetlen ion 1%
 Követelmények a Természetes szénvegyületek tárgyból 1. A félév végén az előadás vizsgával zárul. Ez írásbeli és szóbeli részből áll.az irásbeli vizsga eredményes, ha az elért eredmény 50 %-nál jobb. Amennyiben
Követelmények a Természetes szénvegyületek tárgyból 1. A félév végén az előadás vizsgával zárul. Ez írásbeli és szóbeli részből áll.az irásbeli vizsga eredményes, ha az elért eredmény 50 %-nál jobb. Amennyiben
Intra- és intermolekuláris reakciók összehasonlítása
 Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Egybevágósági transzformációk. A geometriai transzformációk olyan függvények, amelyek ponthoz pontot rendelnek hozzá.
 Egybevágósági transzformációk A geometriai transzformációk olyan függvények, amelyek ponthoz pontot rendelnek hozzá. Egybevágósági transzformációk azok a geometriai transzformációk, amelyeknél bármely
Egybevágósági transzformációk A geometriai transzformációk olyan függvények, amelyek ponthoz pontot rendelnek hozzá. Egybevágósági transzformációk azok a geometriai transzformációk, amelyeknél bármely
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
Optikai spektroszkópia az anyagtudományban 8. Raman spektroszkópia Anizotrópia IR és Raman spektrumokban
 Optikai spektroszkópia az anyagtudományban 8. Raman spektroszkópia Anizotrópia IR és Raman spektrumokban Kamarás Katalin MTA Wigner FK kamaras.katalin@wigner.mta.hu Optkai spektroszkópia az anyagtudományban
Optikai spektroszkópia az anyagtudományban 8. Raman spektroszkópia Anizotrópia IR és Raman spektrumokban Kamarás Katalin MTA Wigner FK kamaras.katalin@wigner.mta.hu Optkai spektroszkópia az anyagtudományban
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét
 Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
Versenyző rajtszáma: 1. feladat
 1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiatanári zárószigorlat tételsora
 1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
fehérvérsejtek Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben.
 Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. Sérülés esetén a helyszínen megjelenő szelektin nevű fehérjék a LewisX glikopeptidek segítségével fehérvérsejtek (leukociták) kötnek
Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. Sérülés esetén a helyszínen megjelenő szelektin nevű fehérjék a LewisX glikopeptidek segítségével fehérvérsejtek (leukociták) kötnek
Szerves spektroszkópia
 Szerves spektroszkópia ETR kód: kv1n1es5 Típus: kötelezően választható előadás (BSC, 5. félév) Heti óraszám: 2, Kreditérték: 2 Tantárgyfelelős: Vass Elemér Az előadás célkitűzése A szerves vegyületek szerkezetvizsgálatában
Szerves spektroszkópia ETR kód: kv1n1es5 Típus: kötelezően választható előadás (BSC, 5. félév) Heti óraszám: 2, Kreditérték: 2 Tantárgyfelelős: Vass Elemér Az előadás célkitűzése A szerves vegyületek szerkezetvizsgálatában
Alkánok összefoglalás
 Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
16. tétel Egybevágósági transzformációk. Konvex sokszögek tulajdonságai, szimmetrikus sokszögek
 16. tétel Egybevágósági transzformációk. Konvex sokszögek tulajdonságai, szimmetrikus sokszögek EGYBEVÁGÓSÁGI TRANSZFORMÁCIÓK Geometriai transzformáció Def:Olyan speciális függvény, melynek értelmezési
16. tétel Egybevágósági transzformációk. Konvex sokszögek tulajdonságai, szimmetrikus sokszögek EGYBEVÁGÓSÁGI TRANSZFORMÁCIÓK Geometriai transzformáció Def:Olyan speciális függvény, melynek értelmezési
SZERVES KÉMIA. ANYAGMÉRNÖK BSc KÉPZÉS SZAKMAI TÖRZSANYAG (nappali munkarendben, ózdi kihelyezett képzés) TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ
 SZERVES KÉMIA ANYAGMÉRNÖK BSc KÉPZÉS SZAKMAI TÖRZSANYAG (nappali munkarendben, ózdi kihelyezett képzés) TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET 2017/18.
SZERVES KÉMIA ANYAGMÉRNÖK BSc KÉPZÉS SZAKMAI TÖRZSANYAG (nappali munkarendben, ózdi kihelyezett képzés) TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET 2017/18.
Szemináriumi feladatok (kiegészítés) I. félév
 Szemináriumi feladatok (kiegészítés) I. félév I. Szeminárium 1. Rajzolja fel az alábbi ion π-molekulapályáit: N ány centrumú a delokalizált rendszer? ány elektron építi fel a delokalizált rendszert? ány
Szemináriumi feladatok (kiegészítés) I. félév I. Szeminárium 1. Rajzolja fel az alábbi ion π-molekulapályáit: N ány centrumú a delokalizált rendszer? ány elektron építi fel a delokalizált rendszert? ány
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI
 SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 7 KRISTÁLYTAN VII. A KRIsTÁLYOK szimmetriája 1. BEVEZETÉs Az elemi cella és ebből eredően a térrácsnak a szimmetriáját a kristályok esetében az atomok, ionok
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 7 KRISTÁLYTAN VII. A KRIsTÁLYOK szimmetriája 1. BEVEZETÉs Az elemi cella és ebből eredően a térrácsnak a szimmetriáját a kristályok esetében az atomok, ionok
Javító vizsga követelményei kémia tantárgyból augusztus osztály
 Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
Tartalmi követelmények kémia tantárgyból az érettségin K Ö Z É P S Z I N T
 1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
1. feladat. Versenyző rajtszáma:
 1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
Szerves kémiai összefoglaló. Szerkesztette: Varga Szilárd
 Szerves kémiai összefoglaló Szerkesztette: Varga Szilárd 2 Bevezetés Az alábbi szerves kémiai összefoglaló a emzetközi Kémiai Diákolimpián résztvevő magyar csapat felkészítésére készült. Két részből áll:
Szerves kémiai összefoglaló Szerkesztette: Varga Szilárd 2 Bevezetés Az alábbi szerves kémiai összefoglaló a emzetközi Kémiai Diákolimpián résztvevő magyar csapat felkészítésére készült. Két részből áll:
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
3.6. Szénidrátok szacharidok
 3.6. Szénidrátok szacharidok általános összegképlet: C n (H 2 O) m > a szén hidrátjai elsődleges szerves anyagok mert az élő sejt minden más szerves anyagot a szénhidrátok további átalakításával állít
3.6. Szénidrátok szacharidok általános összegképlet: C n (H 2 O) m > a szén hidrátjai elsődleges szerves anyagok mert az élő sejt minden más szerves anyagot a szénhidrátok további átalakításával állít
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Toluol (Bruckner II/1 476) µ= 0.33 Debye
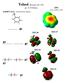 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2014. április 25. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét!
Szerves Kémiai Problémamegoldó Verseny 2014. április 25. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét!
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Név: Pontszám: / 3 pont. 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét!
 Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét! Név: Pontszám: / 4 pont 2. feladat Az ábrán látható vegyületnek a) hány sztereoizomerje, b) hány enantiomerje van?
Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét! Név: Pontszám: / 4 pont 2. feladat Az ábrán látható vegyületnek a) hány sztereoizomerje, b) hány enantiomerje van?
Sztereokémia II. Sztereokémia III.
 Szerves Kémia (1) kv1n1es1/1, kredit: 4; Jalsovszky István Sztereokémia I. Sztatikus sztereokémia. A szén tetraéderes vegyértékorientációja és ennek következményei. Molekulamodellek használata a sztereokémia
Szerves Kémia (1) kv1n1es1/1, kredit: 4; Jalsovszky István Sztereokémia I. Sztatikus sztereokémia. A szén tetraéderes vegyértékorientációja és ennek következményei. Molekulamodellek használata a sztereokémia
Szerves kémiai összefoglaló. Szerkesztette: Varga Szilárd
 Szerves kémiai összefoglaló Szerkesztette: Varga Szilárd 2 Bevezetés Az alábbi szerves kémiai összefoglaló a mezetközi Kémiai Diákolimpián résztvevő magyar csapat felkészítésére készült. Két részből áll:
Szerves kémiai összefoglaló Szerkesztette: Varga Szilárd 2 Bevezetés Az alábbi szerves kémiai összefoglaló a mezetközi Kémiai Diákolimpián résztvevő magyar csapat felkészítésére készült. Két részből áll:
C N H H C O C C O H O O O O C C O C
 X.-XII. osztály, IV. forduló - megoldás 010 / 011 es tanév, XVI. évfolyam 1. a) Az alkánok telítettsége - maximális. Az alkánok azért maximális telítettségüeg, mert a -atomok mind a 4 vegyértékükkel külön-külön
X.-XII. osztály, IV. forduló - megoldás 010 / 011 es tanév, XVI. évfolyam 1. a) Az alkánok telítettsége - maximális. Az alkánok azért maximális telítettségüeg, mert a -atomok mind a 4 vegyértékükkel külön-külön
Halogéntartalmú szerves vegyületek. 7. előadás
 Halogéntartalmú szerves vegyületek 7. előadás Halogéntartalmú szerves vegyületek Funkciós csoport: -X (X = F, Cl, Br, I) Természetben is előfordulnak (algák, erdőtüzek, vulkánok) Széleskörű alkalmazás
Halogéntartalmú szerves vegyületek 7. előadás Halogéntartalmú szerves vegyületek Funkciós csoport: -X (X = F, Cl, Br, I) Természetben is előfordulnak (algák, erdőtüzek, vulkánok) Széleskörű alkalmazás
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Nukleinsavak építőkövei
 ukleinsavak Szerkezeti hierarchia ukleinsavak építőkövei Pirimidin Purin Pirimidin Purin Timin (T) Adenin (A) Adenin (A) Citozin (C) Guanin (G) DS bázisai bázis Citozin (C) Guanin (G) RS bázisai bázis
ukleinsavak Szerkezeti hierarchia ukleinsavak építőkövei Pirimidin Purin Pirimidin Purin Timin (T) Adenin (A) Adenin (A) Citozin (C) Guanin (G) DS bázisai bázis Citozin (C) Guanin (G) RS bázisai bázis
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
szabad bázis a szerves fázisban oldódik
 1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
KARBONSAVAK. A) Nyílt láncú telített monokarbonsavak (zsírsavak) O OH. karboxilcsoport. Példák. pl. metánsav, etánsav, propánsav...
 KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
Kristályok optikai tulajdonságai. Debrecen, december 06.
 Kristályok optikai tulajdonságai Debrecen, 2018. december 06. A kristályok fizikai tulajdonságai Anizotrópia - kristályos anyagokban az egyes irányokban az eltérő rácspontsűrűség miatt a fizikai tulajdonságaik
Kristályok optikai tulajdonságai Debrecen, 2018. december 06. A kristályok fizikai tulajdonságai Anizotrópia - kristályos anyagokban az egyes irányokban az eltérő rácspontsűrűség miatt a fizikai tulajdonságaik
A folyadékkristály állapot
 Ismerd meg! A folyadékkristály állapot (folytatás) Újra korszerű a ph fogalom,... Milyen standardokkal bővítheted ismereteid Vírusprogramok... Vírusnaptár a számítógép tesztelésére... A folyadékkristály
Ismerd meg! A folyadékkristály állapot (folytatás) Újra korszerű a ph fogalom,... Milyen standardokkal bővítheted ismereteid Vírusprogramok... Vírusnaptár a számítógép tesztelésére... A folyadékkristály
Környezetvédelmi analitika - Rezgési spektroszkópia Billes, Ferenc
 Környezetvédelmi analitika - Rezgési spektroszkópia Billes, Ferenc Környezetvédelmi analitika - Rezgési spektroszkópia Billes, Ferenc Tartalom Előszó... xi 1. A MOLEKULÁK SZIMMETRIAVISZONYAI... 1 1. 1.1
Környezetvédelmi analitika - Rezgési spektroszkópia Billes, Ferenc Környezetvédelmi analitika - Rezgési spektroszkópia Billes, Ferenc Tartalom Előszó... xi 1. A MOLEKULÁK SZIMMETRIAVISZONYAI... 1 1. 1.1
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Szénhidrátok. Szénhidrátok. Szénhidrátok. Csoportosítás
 Szénhidrátok Definíció: Szénhidrátok Polihidroxi aldehidek vagy ketonok, vagy olyan vegyületek, melyek hidrolízisével polihidroxi aldehidek vagy ketonok keletkeznek. Elemi összetétel: - Mindegyik tartalmaz
Szénhidrátok Definíció: Szénhidrátok Polihidroxi aldehidek vagy ketonok, vagy olyan vegyületek, melyek hidrolízisével polihidroxi aldehidek vagy ketonok keletkeznek. Elemi összetétel: - Mindegyik tartalmaz
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek
 Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Szerves kémia Fontosabb vegyülettípusok
 Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
CD-spektroszkópia. Az ORD spektroskópia alapja
 CD-spektroszkópia Az ORD spektroskópia alapja - A XIX. század elején Biot megfigyelte, hogy bizonyos, a természetben előforduló szerves anyagok a lineárisan polarizált fény síkját elforgatják. - 1817-ben
CD-spektroszkópia Az ORD spektroskópia alapja - A XIX. század elején Biot megfigyelte, hogy bizonyos, a természetben előforduló szerves anyagok a lineárisan polarizált fény síkját elforgatják. - 1817-ben
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit
 SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
Brósch Zoltán (Debreceni Egyetem Kossuth Lajos Gyakorló Gimnáziuma) Geometria III.
 Geometria III. DEFINÍCIÓ: (Vektor) Az egyenlő hosszúságú és egyirányú irányított szakaszoknak a halmazát vektornak nevezzük. Jele: v. DEFINÍCIÓ: (Geometriai transzformáció) Geometriai transzformációnak
Geometria III. DEFINÍCIÓ: (Vektor) Az egyenlő hosszúságú és egyirányú irányított szakaszoknak a halmazát vektornak nevezzük. Jele: v. DEFINÍCIÓ: (Geometriai transzformáció) Geometriai transzformációnak
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
A gyógyszerek és a kiralitás
 Szent László TÖK A gyógyszerek és a kiralitás Dr. Zsigmond Ágnes SZTE Szerves Kémiai Tanszék Budapest, 2012.04.26. Vázlat Mi az a kiralitás? A kiralitás és a gyógyszerek. A királis katalizátorok alkalmazása.
Szent László TÖK A gyógyszerek és a kiralitás Dr. Zsigmond Ágnes SZTE Szerves Kémiai Tanszék Budapest, 2012.04.26. Vázlat Mi az a kiralitás? A kiralitás és a gyógyszerek. A királis katalizátorok alkalmazása.
Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások
 Oktatási Hivatal Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások I. FELADATSOR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D
Oktatási Hivatal Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások I. FELADATSOR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D
Fogalomtár Szerves kémia kollokviumhoz Semmelweis Egyetem Szerves Vegytani Intézet 2018.
 Fogalomtár Szerves kémia kollokviumhoz Semmelweis Egyetem Szerves Vegytani Intézet 2018. A vizsgaanyagot a teljes előadási anyag, valamint az előadó által kijelölt egyéb anyagrészek képezik, tehát azok
Fogalomtár Szerves kémia kollokviumhoz Semmelweis Egyetem Szerves Vegytani Intézet 2018. A vizsgaanyagot a teljes előadási anyag, valamint az előadó által kijelölt egyéb anyagrészek képezik, tehát azok
Farkas Ödön és Gáspári Zoltán Molekuláris informatika előadás és gyakorlat. Tematika
 Farkas Ödön és Gáspári Zoltán Molekuláris informatika előadás és gyakorlat Tematika 1., történet; Molekulák reprezentációja I. 2. Molekulák reprezentációja II. 3. Reakciók reprezentációja; Kémiai adatbázisok
Farkas Ödön és Gáspári Zoltán Molekuláris informatika előadás és gyakorlat Tematika 1., történet; Molekulák reprezentációja I. 2. Molekulák reprezentációja II. 3. Reakciók reprezentációja; Kémiai adatbázisok
A szervetlen vegyületek
 5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
