Radioaktív gyógyszerek engedélyezése: a múlt és a jelen 1
|
|
|
- Zsolt Orbán
- 8 évvel ezelőtt
- Látták:
Átírás
1 200 GYÓGYSZERÉSZET április Gyógyszerészet Radioaktív gyógyszerek engedélyezése: a múlt és a jelen 1 Rakiás Ferenc Bevezetés A gyógyszerek engedélyezésére a korábbi törzskönyvezés fogalma helyett a forgalomba hozatali engedélyezés kifejezést használjuk, jóllehet a törzskönyv fizikailag még mindig létezik. A radiogyógyszereket a korábbi az egyéb gyógyszerektől eltérő engedélyezési szabályok miatt külön törzskönyvbe jegyezték be, amiben az első bejegyzés 1968-ban született (a Ri NaCl oldat). Érdekes, hogy a sokkal nagyobb jelentőséggel bíró 125 Jód izotóp oldatot Na 125 I, Ri-14 szám alatt két évvel később, március 19-én törzskönyvezték. Az OGYI-ban a törzskönyv mellett az elektronikus nyilvántartás ma már teljes jogú, sőt előnyösebb, mint a kézzel írott törzskönyv. Néhány fogalmat bevezetőként tisztázni kell. Elsőként azt, hogy mit értünk izotóp és mit radioaktív gyógyszer alatt? Izotópoknak [1] azokat az elemeket nevezzük, amelyek atommagjai azonos számú protonból, de eltérő számú neutronból épülnek fel. Természetesen egy adott elem izotópjai ugyanazon a helyen vannak a periódusos rendszerben (innen az elnevezés is: izotóp = azonos hely), csupán a tömegszámuk különbözik. Egy elem izotópjainak kémiai tulajdonságai gyakorlatilag azonosak (kivéve a hidrogént). Azok az izotópok, amelyeknél nincs radioaktív bomlás, stabil izotópok. Az azonos elemek különböző izotópjai eltérő energiaszintet képviselnek, és arra törekednek, hogy a legalacsonyabb energiaszinten stabilizálódjanak. Ez tulajdonképpen a radioaktív bomlás, amikor is egy elem adott izotópja minden külső ráhatás nélkül energiát veszít és stabil izotópformába kerül. Ez az energiavesztés radioaktív sugárzás formájában valósul meg. Három fajta radioaktív bomlást ismerünk, mégpedig, alfa, béta és gamma bomlást / sugárzást. Alfa bomlás [2]: az atommagból két protonból és két neutronból álló, úgynevezett alfa-részecske válik ki. Az alfa-részecske tulajdonképpen azonos a hélium 4-es tömegszámú izotópjával. Alfa-sugárzást csak nagy, 82-nél nagyobb rendszámú izotópok bocsátanak ki. Ez erősen ionizáló sugárzás, viszont a levegőben 1 cm hatótávolságú, vagyis könnyen elnyelődik. Béta-sugárzás [2]: tipikusan a neutron felesleggel 1 A jogszabályi rendelkezések ismertetése során a szerző elsődleges fontosságúnak tartotta a kodifikált szövegekre történő precíz hivatkozást, azonban sem a közlemény jellege, sem a vonatkozó jogszabályok nem indokolják sem a -ok és bekezdések számszerű hivatkozását, sem pedig a jogszabályi hivatkozások idézőjeles megjelenítését. rendelkező atommagok bomlási módja. Ekkor ugyanis egy neutron átalakul protonná, miközben egy elektron keletkezik. Az így felszabaduló energia jelentős részét az elektron mozgási energiája viszi el. Az atomból nagy sebességgel kilépő elektron a béta-részecske. Vagyis a béta-sugárzás nem más, mint elektronsugárzás. Ebben az esetben az atom tömegszáma változatlan marad, viszont a rendszáma eggyel nő. A kibocsájtott béta -sugárzás közepesen ionizáló hatású, hatótávolsága a levegőben tíz centiméterekben mérhető, közepesen roncsoló hatású. Gamma-sugárzás [2]: ebben az esetben energia távozik az atomból fotonként, nem változik meg az atommag összetétele. Többnyire az előbbi két sugárzás kísérő jelensége, hatótávolsága igen nagy. Az alfa és a béta sugárzás során ugyanis az új atommag gerjesztett állapotban van, és ezt az energiáját egyben vagy lépésenként, elektromágneses sugárzás formájában adja le. Ezt a sugárzást nevezzük gamma-sugárzásnak. A radioaktív bomlás [3] mértékegysége az aktivitás, ami alatt az egy másodperc alatt lezajló bomlások számát értjük, mértékegysége a Becqurel, jele Bq. Minden izotóp saját jellemzője a felezési idő, ami alatt azt az időtartamot értjük, ami alatt az aktivitása a felére lecsökken. A bomlás ideje szerint megkülönböztetünk hosszú, rövid és ultrarövid idejű felezési idővel bomló izotópokat. Felhasználásuk szerint a radiogyógyszerek nagy része, mintegy 90%-a in vivo diagnosztikum, elsősorban gammasugárzó izotóp, kisebb részüket terápiás céllal alkalmazzák, és többnyire alfa sugárzók. Az in vivo diagnosztikumok olyan, izotópot, vagy izotóppal jelzett molekulát tartalmazó készítmények, amelyek az emberi szervezet fiziológiás folyamataiban részt vesznek, de azokat nem változtatják meg, viszont az izotóp jelenléte miatt ez a fiziológiás folyamat nyomon követhető. Az izotóp sugárzása a szervezetben kívülről detektálható és a szervezetben megtett útvonal nyomon követhető. A radioaktív gyógyszerek kifejlesztése elképzelhetetlen lett volna Hevesy György Nobel-díjas magyar származású vegyész munkája nélkül. Hevesy dolgozta ki a nyomjelzés technikáját, és ennek alkalmazásával a növények és állatok anyagcsere-folyamatait tanulmányozta. A mai nukleáris medicina ezen eljárás kidolgozásán alapul. A radioaktív gyógyszerek fajtái Radioaktív gyógyszer minden olyan gyógyszer, amely
2 2014. április GYÓGYSZERÉSZET 201 felhasználásra kész állapotában, valamilyen gyógyászati cél elérése érdekében egy vagy több radionuklidot (radioaktív izotópot) tartalmaz. Ezen kívül az alábbi termékek is radiogyógyszernek minősülnek: Izotóp generátor [4]: anyaizotópot tartalmazó rendszer, amelyből radioaktív bomlás során leányelem keletkezik. Ezt a leányelemet elúcióval, vagy más módszerrel elválasztják az anyaelemtől és steril formában kinyerik. A nukleáris medicinai laborokban legelterjedtebben használt generátor a 99 Mo/ 99m Tc generátor. A kinyert 99m Tc steril, fiziológiás konyhasóoldatban van, és az ún. inaktív készletek jelzésére, vagy diagnosz tikumként használják fel. Radioaktív készlet vagy kit [5]: olyan készítmény, amelyet a felhasználás helyén a radioaktív izotóppal jeleznek és így in vitro jelzett radiogyógyszer keletkezik. Ez a jelzési folyamat kritikus, többnyire egy lépésben zajlik, de többlépcsős helyszíni jelzés is ismert. Radioaktív prekurzor: egy másik anyag izotópos jelölésére használt radionuklid. Magyarországon az izotóp előállítást az Országos Atomenergia Bizottság által 1959-ben alapított, később a Magyar Tudományos Akadémiához került Izotóp Intézet 1964-ben kezdte meg. Az első gyógyászati szempontból jelentős izotópok a 131 I, ill. 125 I izotópok voltak, amelyeket az OGYI 1970-ben vette nyilvántartásba. Ahogy rendelkezésre álltak a különféle izotópok, az OSSKI-ban (Országos Frederick Joliot Curie Sugárbiológiai és Sugár egészségügyi Kutató Intézet) megindult a különböző molekulák jelzése, és ennek eredményeként vette nyilvántartásba az OGYI a 131 I, ill. 125 I jelzett Hippuránt a vese statikus és dinamikus vizsgálatára, majd később a különböző fehérjék (Humán szérum albumin) jelzése következett, amit aztán egy sor vegyület követett. Törzskönyvezés A múlt A radioaktív gyógyszerek előállítására, forgalomba hozatalára és ellenőrzésére korábban a sugárzó (radioaktív) anyagokról és készítményekről szóló 10/1964. (V. 7.) Korm. rendelet, valamint a 8/1965 (Eü. K. 5.) sz. EüM számú utasítás volt az irányadó. A 19/1970. (Eü. K. 10.) EüM utasítás a radioaktív gyógyszerek előállításával, minőségi követelményeivel és forgalomba hozatalával kapcsolatos egyes rendelkezésekről volt a következő jogforrás, amely hatálya alá a gyógyászati cél elérésére illetve az emberi szervezetbe bevitt, valamint embergyógyászati célra in vitro vizsgálatokhoz használatos nyitott radioaktív gyógyszerkészítmények (radioaktív gyógyszerek), ill. a radioaktív gyógyszer előállítására szolgáló úgynevezett izotóp generátorok tartoztak. A szabályok értelmében radioaktív gyógyszert csak engedély alapján lehetett gyártani. Az engedély iránti kérelmet az MTA Izotóp Intézetén keresztül az Egészségügyi Minisztériumhoz kellett benyújtani. A kérelemhez csatolni kellett az előállításra vonatkozó dokumentációt, valamint egy izotóp alkalmazási munkabizottság véleményét. Az előállítás engedélyezésének kérdésében az Egészségügyi Minisztérium döntött és döntéséről értesítette az OGYI-t. Az OGYI helyszíni ellenőrzést tar tott a gyártóhelyen (bár akkor még a GMP elvek itt nem érvényesültek), valamint folyamatosan ellenőrizte a radioaktív gyógyszer minőségét (amelyhez a mintát az előállító díjmentesen bocsájtotta az OGYI részére) és ha annak minőségében eltérést észlelt, értesítette az Egészségügyi Minisztériumot. Vagyis az OGYI, mint hatóság, független minőségellenőrző szerepet töltött be, amire abban az időben nagy szükség volt! Nem egyszer kellett az OGYI-nak változtatásokat kérni, mert pl. a megadott lejárati időn belül nem tartotta az előírt minőségi követelményeket a termék. Másrészről nem szabad megfeledkezni az izotóp azon tulajdonságáról, hogy gyorsan bomlik, emiatt sok esetben a jelzés utáni lejárati idő, ami alatt a radio gyógyszernek a rögzített minőségi követelményt tartani kell, gyakran csak pár óra! A szabályozás értelmében az Egészségügyi Minisztérium adta ki a forgalomba hozatali engedélyt az OGYI javaslata alapján. A 19/1970. EüM utasítás hatálya alatt in vivo diagnosztikumokról beszéltünk és a forgalomba hozatali engedély kiadása eltért a gyógyszerekétől. Igazából a 12/2001. (IV. 12.) EüM rendelet az emberi felhasználásra kerülő gyógyszerek törzskönyvezéséről és a forgalomba hozataluk engedélyezéséről c. rendelet volt az első, amely a gyógyszereket szabályozó rendelet hatálya alá vonta az in vivo radioaktív diagnoszti kumokat és mint radiogyógyszereket nevesítette ezeket. Miután addig csak Ri jelöléssel, számmal jelzett in vivo diagnosztikumokról beszéltünk, ekkor kezdődött meg az úgynevezett áttörzskönyvezés, aminek során elsődleges cél volt, hogy a radiofarmakonok egységesen a gyógyszer törzskönyvezési eljárásba illeszkedjenek be. Vagyis, több mint 30 éven keresztül annak ellenére, hogy a radioaktív gyógyszerek nagy része injekciós készítmény volt, mégsem a gyógy szerekre vonatkozó törzskönyvezési eljárás szerint kerültek forgalomba. Mindebben megkülönböztetett szerepe volt a sugárzásnak, az izotópnak és annak, hogy ezek a termékek in vivo diagnosztikumoknak számítottak! A 12/2001. (IV. 12.) EüM rendelet alapján mindegyik radiofarmakon OGYI-T számot kapott és a forgalomba hozatali engedélyeket annak mellékleteivel együtt [alkalmazási előírás (SmPC), beteg tájékoztató (PIL), címkeszöveg] adta ki az OGYI. Ezzel párhuzamosan visszaszorult az OGYI minőségellenőrző
3 202 GYÓGYSZERÉSZET április szerepe (egyre kevesebb radiofarmakon vizsgálata zajlott az OGYI-ban!). Izotóppal jelzett gyógyszerek forgalomba hozatala esetén a 12/2001. (IV. 12.) EüM rendelet szerint nem kell külön engedélyezés, ha a forgalomba hozatalra engedélyezett izotópgenerátor, készlet vagy radioaktív-perkurzor alkalmazásával közvetlenül a felhasználás előtt a gyártó használati utasítása szerint állítják elő az izotóp gyógyszert, több nyire kórházi izotópdiagnosztikai laboratóriumokban. Ez azt jelenti, hogy az inaktív kit, az izotóp vagy a prekurzor külön-külön rendelkeznek forgalomba hozatali engedéllyel, pusztán a radioaktív jelölést végzik a helyszínen, ami egyes esetektől eltekintve többnyire egyszerű folyamatból áll [mint inkubáció (melegítés) stb.]. Az izotópgenerátor forgalomba hozatali engedélye iránti kérelemhez mellékelni kell: a) a rendszer általános leírását azoknak az alkotó elemeknek a részletes leírásával, amelyek a leányizotóp-készítmény minőségét vagy összetételét befolyásolhatják, b) az eluátum vagy szublimátum mennyiségi és minőségi jellemzését. Radioizotópot tartalmazó gyógyszer alkalmazási előírásában fel kell tüntetni a) a belső sugár dozimetria részletes leírását, b) a részletes előírásokat az ilyen módon felhasználandó készítmények alkalmazás előtti előállítására és minőség-ellenőrzésére, c) azt a felhasználhatósági időtartamot ha ez a követelmény alkalmazható, amelyen belül bármely köztitermék (pl. az eluátum), vagy a felhasználásra kész gyógyszerkészítmény megfelel a követelményeknek. A radioizotópot tartalmazó tartályon és csomagoláson az akkori Gytv ában meghatározott adatokon túl 2 fel kell tüntetni a) a külső csomagoláson az árnyékoláson található címkén a részletes magyarázatot az edényen található valamennyi kódról, valamint ahol ez a követelmény alkalmazható, megadott felhasználhatósági időtartamon belül az adagra és a csomagolási egységre vonatkozó radioaktivitást, a kapszulák, illetve folyadékok esetén a milliliterek mennyiségét a tartályban, valamint b) a közvetlen csomagoláson a gyógyszerkészítmény nevét vagy kódját, a radioizotóp nevének vagy vegyjelének feltüntetésével, a gyártási sorozat azonosító adatát, 2 A gyógyszer csomagolásán magyar nyelven, közérthetően fel kell tüntetni: a gyógyszer nevét, a forgalomba hozatali engedély jogosultjának nevét és székhelyét, a gyógyszer törzskönyvi számát, a gyártási tétel számát, a gyártás időpontját, a hatóanyagok nevét és adagolási egységenkénti mennyiségét, az alkalmazás módját, a gyógyszer eltarthatósági idejét,a szükséges tárolási intézkedések megjelölését, a gyógyszerre vonatkozó alkalmazási utasításokat. (Gytv 11. ) a felhasználhatóság időtartamát, a radioaktivitás nemzetközi piktogramját, a radioaktivitás mennyiségét az a) pont alatt rögzített módon. A betegtájékoztatónak a Gytv ában meghatározott adatokon túl 3 tartalmaznia kell a felhasználónak szóló biztonsági intézkedéseket, valamint a tartály és a benne maradó fel nem használt anyag ártalmatlanítására vonatkozó speciális előírásokat. A 83/2004 (IX. 28.) EszCsM rendelet hatályon kívül helyezte a 19/1970 EüM utasítást. Vagyis egyfajta kettősség alakult ki, mert a 12/2001. (IV. 12.) EüM rendelet egyértelműen hatálya alá vonta az in vivo radioaktív diagnosztikumokat és nevesítette ezeket, mint radiogyógyszereket, de ugyanakkor maradt az Ri jelölés és a külön törzskönyv! A jelen Míg a 12/2001. (IV. 12.) EüM rendelet a radioaktív gyógyszerek törzskönyvezését a gyógyszerekével azonos módon rendelte el, addig az 52/2005 (XI. 18) EüM rendelet az emberi alkalmazásra kerülő gyógyszerek forgalomba hozataláról c. rendelet a gyógyszerek, beleértve most már a radioaktív készítményeket is, EU szerinti egységes forgalomba hozataláról rendelkezik. E rendelet hatálya a következő radioaktív gyógyszerekre terjed ki: minden olyan gyógyszer, amely emberi felhasználásra kész formájában egy, vagy több radioizotópot tartalmaz, izotópgenerátor: olyan kötött anyaizotópot tartalmazó rendszer, amelyből a radioaktív bomlás során olyan leányizotóp keletkezik, amely leoldással vagy más elválasztási módszerrel kinyerhető és gyógyszerként vagy más anyagok radioaktív jelölésére felhasználható; radioaktív készlet (kit): olyan gyógyszer, amely általában közvetlenül felhasználás előtt radioizotóppal történő jelöléssel radioaktív gyógyszer készítésére alkalmas; radioizotóp-perkurzor: olyan radioizotóp, amellyel más anyagokat jelölnek felhasználásuk előtt. A gyógyszer forgalomba hozatali engedély kiadását megelőző értékelésének több szempontja van. Radiogyógyszerek estében új gyógyszernek minősül az olyan radiogyógyszer, amelyet Magyarországon 3 Tartalmaznia kell a gyógyszer nevét, a gyógyszerforma vagy erősség megjelölését, a forgalomba hozatali engedély jogosultjának nevét és székhelyét, a hatóanyagok és egyéb összetevők teljes felsorolását adagolási egységenkénti mennyiségét, a terápiás csoport vagy hatástípus megnevezését, eltarthatósági idejét, tárolási intézkedések megjelölését, a gyógyszer terápiás javallatait és ellenjavallatait, az alkalmazás során betartandó megfelelő óvintézkedéseket, a más gyógyszerekkel való kölcsönhatások megjelölését, mellékhatások leírását, amelyek a gyógyszer rendes alkalmazása során előfordulhatnak a gyógyszerre vonatkozó alkalmazási utasításokat, ideértve az adagolás gyakoriságát és az alkalmazás módját, a kezelés időtartamát, a túladagolás esetén foganatosítandó intézkedéseket. (Gysztv 12. )
4 2014. április GYÓGYSZERÉSZET 203 humán gyógyászati felhasználásra még nem engedélyeztek, az olyan radiogyógyszer, amely alkalmazásának módja, gyógyszerformája, hatáserőssége, aktivitása, előállításához használt segédanyagai a terápiás alkalmazást befolyásoló módon a már engedélyezettől eltér, az új radiogyógyszer-kombináció; az olyan radiogyógyszer, amelynek adagolása, javallata, vagy gyártásának módja a már engedélyezettől eltér. A rendelet szerint a gyógyszer forgalomba hozatalának engedélyezése ha jogszabály eltérően nem rendelkezik kérelemre indul. A kérelemnek a kérelmet benyújtó adminisztratív adatain (számlázási és levelezési cím stb.) túl, tartalmaznia kell: a radiogyógyszer nevét; a radiogyógyszer összetevőinek megnevezését, ideértve a nemzetközi szabadnevét ha ilyen név létezik, minőségi és mennyiségi adatait gyógyszerforma-egységenként illetve tömeg- vagy térfogategységre vonatkoztatva (radioaktív készlet esetében amelynek a radiojelzése a felhasználás előtt, nem pedig a gyártás során történik hatóanyagon az összetevők azon részét értjük, amely hordozza, vagy megköti a radioaktív izotópot); a radiogyógyszer jelentette potenciális környezeti veszélyekre vonatkozó, megfelelő vizsgálatra alapozott értékelést, a veszély csökkentésére esetlegesen megteendő intézkedéseket; a diagnosztikai, esetlegesen terápiás javallatokat, ellenjavallatokat, mellékhatásokat, sugárterhelést, az adagolást és a gyógyszerformát, valamint az alkalmazás módját és az alkalmazással kapcsolatos tudnivalókat; a felhasználhatóság javasolt időtartamát és a tárolás körülményeit; a készítmény tárolásánál, alkalmazásánál, valamint az ártalmatlanításánál betartandó elővigyázatossági és biztonsági intézkedéseket, valamint a készítmény környezetre gyakorolt bármely lehetséges kockázatának feltüntetését; a gyártási eljárás leírását; radioaktív készletek esetében a gyártás leírásának tartalmaznia kell a készlet gyártásának módját és a radiojelzés részletes leírását; az izotópra vonatkozó szükséges jellemzőket, lehetőleg az Európai Gyógyszerkönyv általános és egyedi cikkelyeivel összhangban, továbbá le kell írni minden, a radioizotópos jelzéshez felhasznált anyagot. A radioizotóppal jelzett vegyület szerkezetét is ismertetni kell. Radioizotópok esetében tárgyalni kell a végbemenő magreakciót. Az izotópgenerátorokban anya- és az ebből képződő leányelem hatóanyagnak számít; meg kell adni a radioizotóp jellegét, az izotóp azonosítására szolgáló adatokat (felezési idő), várható szennyezőit, a hordozót, az alkalmazást és a fajlagos aktivitást. A besugárzás célanyagai is kiindulási anyagnak számítanak ; a gyártó által alkalmazott minőség-ellenőrző eljárások leírását; a kémiai és radiokémiai tisztaságra vonatkozó megfontolásokat, valamint az alkalmazott vizsgálati módszereket és azt, hogy ez mennyiben befolyásolja a szerv megoszlást. A radioizotópos tisztaságot, a radiokémiai tisztaságot és a fajlagos aktivitást meg kell adni; az izotópgenerátorok esetében mind az anyaelem mind a leányelem vizsgálatait meg kell adni. A generátor eluátumokra vonatkozóan az anyaelem és a generátor egyéb komponenseinek vizsgálatára vonatkozó részletes adatokat szintén le kell írni; az a követelmény, hogy a hatóanyagok mennyiségét a hatást valójában hordozó alkotórészek tömegével jellemezzük, csak radioaktív készletek esetén alkalmazható. A radioizotópok adott napra, és ha szükséges, órára vagy percre vonatkozó radioaktivitását Becquerel-ben kell kifejezni. Az időpont megadásánál az időzónára is hivatkozni kell. A sugárzás fajtáját szintén jelezni kell; készletek esetében a végtermék minőségi követelményeinek tartalmaznia kell a termék, jelzés utáni hatékonyságára vonatkozó vizsgálatokat. Le kell írni a radioaktív izotóppal jelzett termék radiokémiai és radioizotópos tisztaságára vonatkozó megfelelő ellenőrző módszereket. A radioaktív jelzés szempontjából lényeges valamennyi anyagot azonosítani kell és tartalmát meg kell határozni; radioizotóppal jelzett gyógyszerek esetében a stabilitásra vonatkozóan információt kell adni az izotópgenerátorokról, a radioaktív készletekről és a radioaktív izotóppal jelzett termékekről. Ha a kiszerelés úgy történt, hogy egy üveg több adagot tartalmaz, az alkalmazás tartama alatti stabilitást dokumentálni kell ; össze kell foglalni a farmakológiai, toxikológiai és más preklinikai vizsgálatokat. Izotóppal jelzett gyógyszerek esetében elfogadható közelítés, hogy a toxicitás a sugárdózisból ered. Diagnosztikumok esetében ez az izotóppal jelzett gyógyszer alkalmazásának a következménye, míg terápiás célból történő alkalmazáskor ez maga a kívánt hatás. Ezért az izotóppal jelzett gyógyszerek ártalmatlanságának és hatásosságának értékelésekor mind a gyógyszerre, mind a sugárzásra (dozimetriai) vonatkozó szempontokat figyelembe kell venni. A szervek és szövetek sugárzásnak való kitettségét dokumentálni kell. A becsült elnyelt sugárdózis mennyiségét részleteiben bemutatott, a gyógyszerbeviteli módra vonatkozó, nemzetközileg elfogadott módszerrel kell kiszámítani; a klinikai vizsgálatok eredményeit ahol csak lehet be kell nyújtani, eltérő esetben hiányukat a klinikai áttekintésekben kell megindokolni;
5 204 GYÓGYSZERÉSZET április abban a különleges esetben, ha a radioaktív prekurzort kizárólag jelzési célra akarják felhasználni, az első számú cél, hogy adatokat szolgáltassanak arról, mik a várható következményei. Ha a jelzés hatékonysága alacsony, vagy ha az izotóppal jelzett konjugátum in vivo disszociál, meg kell adni, hogy milyen hatásai lesznek a szabad radioizotópnak a beteg szervezetére nézve. Továbbá ki kell térni a foglalkozási veszélyekre vonatkozó információkra is, mint a kórházi személyzet és a környezet sugárzás expozíciója. Az alkalmazási előírás tervezetét, valamint a gyógyszer külső csomagolásának, közvetlen csomagolásának és betegtájékoztatójának tervezetét az emberi alkalmazásra kerülő gyógyszerek címkéjéről és betegtájékoztatójáról szóló rendeletnek megfelelően a GYEMSZI-OGYI részére meg kell küldeni; be kell adni a készítmény és a hatóanyag(ok) minőség értékeléséhez szükséges, de legalább három teljes analízisre alkalmas mennyiségű (értékelési) mintát, és amennyiben az értékeléshez különleges, kereskedelmi forgalomban nem beszerezhető referencia anyagra is szükség van, ebből az előzőeknek megfelelő mennyiségű mintát ; be kell adni továbbá a tervezett csomagolás mintadarabját vagy annak (színes csomagolás esetén színes) grafikáját; írásos nyilatkozatot arról, hogy a gyógyszer gyártója az emberi alkalmazásra kerülő gyógyszerek gyártásának személyi és tárgyi feltételeiről szóló miniszteri rendeletben foglaltakkal összhangban elvégzett ellenőrzések során meggyőződött arról, hogy a hatóanyag gyártója eleget tett a helyes gyártási gyakorlatra vonatkozó elveknek és iránymutatásoknak, valamint az ellenőrzés napjára való utalást és annak kifejezett rögzítését, hogy az ellenőrzés eredménye megerősíti, hogy a gyártás megfelel a helyes gyártási gyakorlatra vonatkozó elveknek és iránymutatásoknak. Értékelés és engedélyezés A forgalomba hozatali engedély iránti kérelem értékelése során a GYEMSZI-OGYI elrendelheti az egyes minőségvizsgálati eljárások laboratóriumi megismétlését. Az értékelést megelőzően a már korábban felsorolt adatokon kívül csatolni kell, a gyártási szándékról szóló nyilatkozatot, ha a radiogyógyszer gyártása Magyarországon történik, a gyártásra vonatkozó engedély másolatát, ha a radiogyógyszer gyártása valamelyik tagállamban történik, ha a radiogyógyszer gyártása EGT tagállamon kívül történik, ha más tagállam már a gyártási tevékenységet ellenőrizte, az erről szóló igazolást, abban az esetben, ha Magyarországgal GMP elfogadásáról kölcsönös elismerési megállapodást aláírt országban történik a gyártás, az ország illetékes hatóságának a gyártásra vonatkozó igazolás másolatát. Ezek alapján a GYEMSZI-OGYI értékelő jelentést készít a kérelmezett radiogyógyszer gyógyszerészeti, preklinikai, valamint klinikai vizsgálatainak eredményei, kockázatkezelési rendszere és farmakovigilanciarendszere tekintetében összeállított dokumentációról. Az értékelő jelentést valahányszor új, a készítmény minőségét, biztonságosságát vagy hatásosságát érintő adat jut tudomására megfelelően módosítja. Ha a GYEMSZI-OGYI az értékelés során megállapítja, hogy a radiogyógyszer megfelel a gyógyszertörvény előírásainak, valamint a fent ismertetett rendeletben meghatározott feltételeknek, a radiogyógyszer forgalomba hozatalát engedélyezi. A forgalomba hozatali engedély megadását követően a jogosult tájékoztatja a GYEMSZI-OGYI-t a radiogyógyszer Magyarországon történő forgalomba hozatalának tényleges időpontjáról, figyelembe véve a különböző engedélyezett kiszereléseket, aktivitási egységeket. Alkalmazási előírás Az alkalmazási előírás a forgalomba hozatali engedély része. Radioizotópot tartalmazó gyógyszer alkalmazási előírásában az általános részek mellett fel kell tüntetni a belső sugár dozimetria részletes leírását, további részletes előírásokat az ilyen módon felhasználandó készítmények alkalmazása előtti előállítására és minőség-ellenőrzésére, azt a felhasználhatósági időtartamot ha ez a követelmény alkalmazható, amelyen belül bármely köztitermék (pl. az eluátum), vagy a felhasználásra kész gyógyszer megfelel a követelményeknek. A radiogyógyszer esetében a feltételezett mellékhatások jelentési módjára vonatkozó eljárási rendet is ismertetni kell! A forgalomba hozatali engedély nyilvántartása A radiogyógyszer nyilvántartási számot kap. A nyilvántartási szám az OGYI-T-jelzésből, sorszámból, / (per) jelzésből, gyógyszerformánként, hatáserősségenként, csomagolási egységenként, illetve csomagolási módonként 01-essel kezdődő sorszámból áll. A forgalomba hozatali engedélyezési eljárás során a szakmai hatóság Magyarországon a GYEMSZI-OGYI értékeli az új szer minőségét, relatív ártalmatlanságát és hatásosságát. Megfelelés esetén pedig a készítményt államigazgatási határozattal gyógyszerré nyilvánítja. Magyarországon, akárcsak az EGT más tagállamaiban is, a gyógyszerek forgalomba hozatali engedélyezése négyféle módon lehetséges:
6 2014. április GYÓGYSZERÉSZET kölcsönös elismerési eljárás, 2. decentralizált eljárás, 3. nemzeti eljárás, 4. centralizált eljárás. ad 1. és 2.) Kölcsönös elismerési eljárás (Mutual Recog nition Procedure/MRP): olyan készítmény esetén, amely a beadás időpontjában már legalább egy tagországban rendelkezik forgalomba hozatali engedéllyel. Az értékelésre és az engedélyezésre a GYEMSZI- OGYI jogosult. Decentralizált eljárás (Decentralised Proce dure/ DCP): olyan készítmény esetén, amely a beadás időpontjában még egyetlen tagországban sem rendelkezik forgalomba hozatali engedéllyel. Az értékelésre és az engedélyezésre a GYEMSZI-OGYI jogosult. A gyógyszer forgalomba hozatali engedélyének több tagállamban történő megadása céljából a kérelmező a kölcsönös elismerési (MRP), illetve a decentralizált (DCP) eljárás megindítása érdekében kérelmet nyújt be az adott tagállamokban. A benyújtott dokumentumok tartalmazzák a kérelem által érintett tagállamok jegyzékét. Kölcsönös elismerési eljárás esetében, amennyiben a jogosult más tagállamban kívánja kezdeményezni a GYEMSZI- OGYI által forgalomba hozatalra engedélyezett gyógyszer forgalomba hozatali engedélyének kiadását, erről a tényről a GYEMSZI-OGYI-t mint a referencia-tagállam megfelelő hatáskörrel rendelkező hatóságát előzetesen értesíti. Az értesítés tartalmazza, hogy a GYEMSZI- OGYI-nak korábban benyújtott dokumentációhoz képest a másik tagállamban milyen további vagy módosított dokumentációt kíván benyújtani. A GYEMSZI-OGYI ilyen esetben kérheti az új vagy módosult dokumentumok benyújtását. A kérelmező a dokumentumok benyújtásával egyidejűleg felkéri a GYEMSZI-OGYI-t a radio gyógyszerre vonatkozó értékelő jelentés kiadására, vagy frissítésére. A GYEMSZI-OGYI ezt ami az esetleges új adatokat is tartalmazza a kérelem beérkezésétől számított 90 napon belül angol nyelven elkészíti és a jogosultnak, valamint annak a tagállamnak, amelyben a jogosult kezdeményezni kívánja a GYEMSZI-OGYI által forgalomba hozatalra engedélyezett gyógyszer forgalomba hozatali engedélyének kiadását, megküldi. Decentralizált eljárás esetén, amely esetben a gyógyszer nem rendelkezik az EGT-n belül forgalomba hozatali engedéllyel, a kérelmező a kérelmezett tagállamok közül felkér egy tagállamot, hogy mint referencia-tagállam működjön közre és készítse el a gyógy szer értékelő jelentésének tervezetét. Ha ez a referenciahatóság a GYEMSZI-OGYI, úgy az a kérelem benyújtását követő 120 napon belül elkészíti az értékelő jelentést, az alkalmazási előírást, a címkét és betegtájékoztató tervezetét, és megküldi az érintett tagállamoknak és a kérelmezőnek. Ha nem a GYEMSZI-OGYI a kölcsönös elismerési, illetve a decentralizált eljárás esetében a referenciahatóság, úgy a referencia tagállam által elkészített értékelő jelentés, vagy az értékelő jelentés tervezetének kézhezvételét követő 90 napon belül jóváhagyja az értékelő jelentést, az alkalmazási előírást, valamint a címkét és betegtájékoztatót vagy azok tervezetét, és erről tájékoztatja a referencia-tagállamot. Kölcsönös elismerési, illetve a decentralizált eljárás esetében, ha a GYEMSZI-OGYI a referenciahatóság, lezárja az engedélyezési folyamatot, írásban összesíti valamennyi tagország jóváhagyását a forgalomba hozatali engedély kiadására, és értesíti a kérelmezőt és az érintett tagállamokat. Kölcsönös elismerési eljárás esetében, amennyiben a GYEMSZI-OGYI a referenciahatóság, az eljárást követő 30 napon belül a korábban kiadott forgalomba hozatali engedélyt szükség esetén módosítja. Kölcsönös elismerési eljárás esetében, amennyiben nem a GYEMSZI-OGYI a referenciahatóság, az eljárás lezárása után, az értékelő jelentésnek megfelelő magyar nyelvű dokumentumok benyújtását követő 30 napon belül, amennyiben a gyógyszer Magyarországon nem rendelkezett forgalomba hozatali engedéllyel, azt kiadja, vagy ha már rendelkez ett, azt módosítja. Decentralizált eljárás esetében, amennyiben a GYEMSZI-OGYI a referenciahatóság, az eljárást lezárja, az értékelő jelentésnek megfelelő magyar nyelvű dokumentumok benyújtását követő 30 napon belül a GYEMSZI-OGYI kiadja a forgalomba hozatali engedélyt. Decentralizált eljárás esetében, amennyiben nem a GYEMSZI-OGYI a referenciahatóság, az eljárás lezárása után, az értékelő jelentésnek megfelelő magyar nyelvű dokumentumok benyújtását követő 30 napon belül a GYEMSZI-OGYI kiadja a forgalomba hozatali engedélyt. Módosítás A jogosult a radiogyógyszer gyártásával, minőségével, annak ellenőrzésével, valamint a készítmény alkalmazásával kapcsolatban a tudomány és a technika új eredményei felhasználásával a tudomására jutott új tényt vagy adatot köteles a GYEMSZI-OGYI-nak haladéktalanul bejelenteni. Ha a jogosultnak olyan adat jut tudomására, amely nem felel meg a forgalomba hozatali engedély alapjául szolgáló dokumentációban foglaltaknak, arról tájékoztatnia kell a GYEMSZI-OGYI-t és kérelmeznie kell a forgalomba hozatali engedély módosítását. Ennek a tájékoztatásnak ki kell terjednie a klinikai és egyéb vizsgálatok mind pozitív, mind negatív eredményeire valamennyi javallat és betegcsoport vonatkozásában, függetlenül attól, hogy a forgalomba hozatali engedély tartalmazza-e azokat, valamint ki kell terjednie a gyógyszer alkalmazására vonatkozó adatokra akkor is, ha az alkalmazás kívül esik a forgalomba hozatali engedélyben foglaltakon. A forgalomba hozatali engedély jogosultja gondos-
7 206 GYÓGYSZERÉSZET április kodik az alkalmazási előírás, a betegtájékoztató és a címkeszöveg naprakészen tartásáról, figyelembe véve a legújabb tudományos ismereteket is. A módosítási kérelemhez mellékelni kell a módosítás szükségességét igazoló adatokat, vizsgálati eredményeket, valamint szükség esetén a vizsgálatokhoz szükséges gyógyszermintát. Egyazon módosítási kérelem nem vonatkozhat egynél több módosítására, kivéve, ha a módosítás egy vagy több módosítást von maga után. Ebben az esetben egy kérelemben kell előterjeszteni valamennyi módosítási kérelmet. A változás bejegyzése, illetve a forgalomba hozatali engedély módosítása iránti kérelemhez mellékelni kell a jogosultság megváltozását igazoló nyilatkozatok, illetve egyéb okiratok másolatát is. Amennyiben a gyógyszer Magyarországon történő forgalomba hozatalának engedélyezése kölcsönös elismerési vagy decentralizált eljárás alapján történt, a jogosult minden módosítási kérelmet először a referencia-tagállamhoz nyújt be, s az így jóváhagyott módosítás jóváhagyását kell az erre vonatkozó, a referencia-tagállam által készített értékelő jelentés alapjául szolgáló dokumentáció benyújtásával a GYEMSZI -OGYI-tól kérni. Megújítás A forgalomba hozatali engedély megújítását a jogosult a szükséges aktualizált dokumentáció benyújtásával kérelmezi, vagy nyilatkozik, hogy az engedélyt nem kívánja megújítani. A megújításhoz az alábbi dokumentumokat kell beadni: a minőségre, biztonságosságra és hatásosságra vonatkozó dokumentáció egységes szerkezetbe foglalt változatát, beleértve az emberi alkalmazásra kerülő gyógyszerek farmakovigilanciájáról szóló miniszteri rendelet alapján benyújtott, feltételezett mellékhatásokra vonatkozó jelentések és időszakos gyógyszerbiztonsági jelentések adatainak értékelését, a forgalomba hozatali engedély megadása után végrehajtott valamennyi módosítást. A forgalomba hozatali engedély akkor újítható meg, ha a GYEMSZI-OGYI újraértékelte a gyógyszer minőségére, hatásosságára és relatív ártalmatlanságára, kockázat/előny arányára, valamint a bejelentett mellékhatásokra vonatkozó legújabb adatokat. A GYEMSZI- OGYI a forgalomba hozatali engedély megújítását kivételesen indokolt esetben további vizsgálatok elvégzéséhez kötheti. ad 3.) Nemzeti eljárás: A gyógyszer dokumentációjának értékelését a GYEMSZI-OGYI végzi, a forgalomba hozatali engedély csak Magyarországra érvényes. ad 4.) Centralizált eljárás. Az új gyógyszer dokumentációjának értékelését az EMA-CHMP végzi, az összes tagállamban érvényes engedélyt pedig az Európai Bizottság adja ki. A gyógyszer tényleges forgalmazásáról azonban a gyártó maga dönthet. A centralizált értékelésre és törzskönyvezésre kötelezett potenciális gyógyszerek körét a 726/2004 rendelet melléklete tartalmazza. Ezek köre egyébként egyre bővül, és ma már gyakorlatilag bármely gyógyszert centrális eljárással lehet értékelni, ha a londoni székhelyű Európai Gyógyszerügynökség úgy ítéli meg, hogy a készítmény bevezetésének nagy a társadalmi jelentősége. Összefoglalás A radioaktív gyógyszerek forgalomba hozatali eljárását tekintettük át az első Magyarországon megjelent radioaktív készítmény törzskönyvi bejegyzésétől napjainkig. Kezdetekben in vivo diagnosztikumoknak tekintették a radioaktív gyógyszereket. Törzskönyvezésük külön utat járt a gyógyszerekétől. Kiemelkedő szerepe volt az emberi felhasználásra kerülő gyógyszerek törzskönyvezéséről és a forgalomba hozataluk engedélyezéséről szóló 12/2001. EüM rendeletnek, amely nevesítette a radioaktív izotópos készítményeket, mint gyógyszereket. Ezt követte az egységes Európai Unión belüli forgalomba hozatali eljárási rend átvétele. IRODALOM 1. Nagy Lajos György: Radiokémia és Izotoptechnika, Műegyetemi Kiadó Radiochemistry and Nuclear Chemitry, Third Edition Gregory Choppin; Author, Jan Rydberg; Author november Radiation Detection and Measurement; Glenn F. Knoll 2012, March Radionuclide Generator Technology: Boyd RE, Herterington ELR, Moore OW; 1984, IAEA Viena Technetium- 99m Pharmaceuticals: Ilze Zolle Editor, Spingler 2007 JOGFORRÁSOK Sugárzó (radioaktív) anyagokról és készítményekről szóló 10/1964 (V. 7.) Korm. rendelet, valamint a 8/1965 (Eü. K. 5.) sz. EüM számú utasítás (hatályon kívül helyezve: 1970). 19/1970 (Eü. K. 10.) EüM utasítás a radioaktív gyógyszerek előállításával, minőségi követelményeivel és forgalomba hozatalával kapcsolatos egyes rendelkezésekről (A 83/2004 (IX.28) EszCsM rendelet hatályon kívül helyezte a 19/1970 EüM utasítást) 12/2001. (IV. 12.) EüM rendelet az emberi felhasználásra kerülő gyógyszerek törzskönyvezéséről és a forgalomba hozataluk engedélyezéséről. 52/2005 (XI. 18.) EüM rendelet az emberi alkalmazásra kerülő gyógyszerek forgalomba hozataláról. Rakiás, F.: Registration of Radiopharmaceuticals, Past and Present. Rakiás Ferenc, Budapest, Bezerédi u
Magyar joganyagok - 30/2005. (VIII. 2.) EüM rendelet - az emberi alkalmazásra kerül 2. oldal g) szükség esetén egyéb különleges figyelmeztetést; h) a
 Magyar joganyagok - 30/2005. (VIII. 2.) EüM rendelet - az emberi alkalmazásra kerül 1. oldal 30/2005. (VIII. 2.) EüM rendelet az emberi alkalmazásra kerülő gyógyszerek címkéjéről és betegtájékoztatójáról
Magyar joganyagok - 30/2005. (VIII. 2.) EüM rendelet - az emberi alkalmazásra kerül 1. oldal 30/2005. (VIII. 2.) EüM rendelet az emberi alkalmazásra kerülő gyógyszerek címkéjéről és betegtájékoztatójáról
450/2017. (XII. 27.) Korm. rendelet az emberi felhasználásra kerülő gyógyszerek forgalomba hozatalának és gyártásának engedélyezéséről
 450/2017. (XII. 27.) Korm. rendelet az emberi felhasználásra kerülő gyógyszerek forgalomba hozatalának és gyártásának engedélyezéséről hatályos: 2018.01.01 - ) A Kormány az emberi alkalmazásra kerülő gyógyszerekről
450/2017. (XII. 27.) Korm. rendelet az emberi felhasználásra kerülő gyógyszerek forgalomba hozatalának és gyártásának engedélyezéséről hatályos: 2018.01.01 - ) A Kormány az emberi alkalmazásra kerülő gyógyszerekről
449/2017. (XII. 27.) Korm. rendelet a gyógyszerekkel folytatott nagykereskedelmi és párhuzamos importtevékenység végzésének engedélyezéséről
 449/2017. (XII. 27.) Korm. rendelet a gyógyszerekkel folytatott nagykereskedelmi és párhuzamos importtevékenység végzésének engedélyezéséről hatályos: 2018.01.01 - A Kormány az emberi alkalmazásra kerülő
449/2017. (XII. 27.) Korm. rendelet a gyógyszerekkel folytatott nagykereskedelmi és párhuzamos importtevékenység végzésének engedélyezéséről hatályos: 2018.01.01 - A Kormány az emberi alkalmazásra kerülő
GYÓGYTERMÉKEK JELENE ÉS JÖVŐJE
 GYÓGYTERMÉKEK JELENE ÉS JÖVŐJE Sárvár 2011. március 24. Országos Gyógyszerészeti Intézet Dr. Szepezdi Zsuzsanna főigazgató A természetes anyagok (növényi szerek) szabályozására 1987-ben került sor elsőként
GYÓGYTERMÉKEK JELENE ÉS JÖVŐJE Sárvár 2011. március 24. Országos Gyógyszerészeti Intézet Dr. Szepezdi Zsuzsanna főigazgató A természetes anyagok (növényi szerek) szabályozására 1987-ben került sor elsőként
-A radioaktivitás a nem stabil (úgynevezett radioaktív) atommagok bomlásának folyamata. -Nagyenergiájú ionizáló sugárzást kelt Az elnevezés: - radio
 -A radioaktivitás a nem stabil (úgynevezett radioaktív) atommagok bomlásának folyamata. -Nagyenergiájú ionizáló sugárzást kelt Az elnevezés: - radio (sugároz) - activus (cselekvő) Különféle foszforeszkáló
-A radioaktivitás a nem stabil (úgynevezett radioaktív) atommagok bomlásának folyamata. -Nagyenergiájú ionizáló sugárzást kelt Az elnevezés: - radio (sugároz) - activus (cselekvő) Különféle foszforeszkáló
52/2005. (XI. 18.) EüM rendelet. az emberi alkalmazásra kerülő gyógyszerek forgalomba hozataláról. A rendelet alkalmazási köre
 52/2005. (XI. 18.) EüM rendelet az emberi alkalmazásra kerülő gyógyszerek forgalomba hozataláról Az emberi alkalmazásra kerülő gyógyszerekről és egyéb, a gyógyszerpiacot szabályozó törvények módosításáról
52/2005. (XI. 18.) EüM rendelet az emberi alkalmazásra kerülő gyógyszerek forgalomba hozataláról Az emberi alkalmazásra kerülő gyógyszerekről és egyéb, a gyógyszerpiacot szabályozó törvények módosításáról
Az atommag összetétele, radioaktivitás
 Az atommag összetétele, radioaktivitás Az atommag alkotórészei proton: pozitív töltésű részecske, töltése egyenlő az elektron töltésével, csak nem negatív, hanem pozitív: 1,6 10-19 C tömege az elektron
Az atommag összetétele, radioaktivitás Az atommag alkotórészei proton: pozitív töltésű részecske, töltése egyenlő az elektron töltésével, csak nem negatív, hanem pozitív: 1,6 10-19 C tömege az elektron
Izotóp geológia: Elemek izotópjainak használata geológiai folyamatok értelmezéséhez.
 Radioaktív izotópok Izotópok Egy elem különböző tömegű (tömegszámú - A) formái; Egy elem izotópjainak a magjai azonos számú protont (rendszám - Z) és különböző számú neutront (N) tartalmaznak; Egy elem
Radioaktív izotópok Izotópok Egy elem különböző tömegű (tömegszámú - A) formái; Egy elem izotópjainak a magjai azonos számú protont (rendszám - Z) és különböző számú neutront (N) tartalmaznak; Egy elem
Magyar joganyagok - 52/2005. (XI. 18.) EüM rendelet - az emberi alkalmazásra kerül 2. oldal 14. Ügynökség Koordinációs Csoportja: a 2004/27/EK irányel
 Magyar joganyagok - 52/2005. (XI. 18.) EüM rendelet - az emberi alkalmazásra kerül 1. oldal 52/2005. (XI. 18.) EüM rendelet az emberi alkalmazásra kerülő gyógyszerek forgalomba hozataláról Az emberi alkalmazásra
Magyar joganyagok - 52/2005. (XI. 18.) EüM rendelet - az emberi alkalmazásra kerül 1. oldal 52/2005. (XI. 18.) EüM rendelet az emberi alkalmazásra kerülő gyógyszerek forgalomba hozataláról Az emberi alkalmazásra
316/2013. (VIII. 28.) Korm. rendelet. a biocid termékek engedélyezésének és forgalomba hozatalának egyes szabályairól
 316/2013. (VIII. 28.) Korm. rendelet a biocid termékek engedélyezésének és forgalomba hozatalának egyes szabályairól Hatályos:2013. 09. 02-től A Kormány a kémiai biztonságról szóló 2000. évi XXV. törvény
316/2013. (VIII. 28.) Korm. rendelet a biocid termékek engedélyezésének és forgalomba hozatalának egyes szabályairól Hatályos:2013. 09. 02-től A Kormány a kémiai biztonságról szóló 2000. évi XXV. törvény
448/2017. (XII. 27.) Korm. rendelet az emberi felhasználásra kerülő gyógyszerek egyedi rendelésének és felhasználásának engedélyezéséről
 448/2017. (XII. 27.) Korm. rendelet az emberi felhasználásra kerülő gyógyszerek egyedi rendelésének és felhasználásának engedélyezéséről hatályos: 2018.01.01-2018.01.01 A Kormány az emberi alkalmazásra
448/2017. (XII. 27.) Korm. rendelet az emberi felhasználásra kerülő gyógyszerek egyedi rendelésének és felhasználásának engedélyezéséről hatályos: 2018.01.01-2018.01.01 A Kormány az emberi alkalmazásra
Dr. Kőszeginé dr. Szalai Hilda Főigazgató-helyettes november
 Gyógyszerengedélyezés az Európai Unióban és hazánkban Dr. Kőszeginé dr. Szalai Hilda Főigazgató-helyettes 2014. november Témakörök A gyógyszerengedélyezés, mint a gyógyszerpiac szabályozásának kulcseleme
Gyógyszerengedélyezés az Európai Unióban és hazánkban Dr. Kőszeginé dr. Szalai Hilda Főigazgató-helyettes 2014. november Témakörök A gyógyszerengedélyezés, mint a gyógyszerpiac szabályozásának kulcseleme
Segédlet a gyógyszertári nyilvántartások ellenőrzésére
 Segédlet a gyógyszertári nyilvántartások ellenőrzésére Hitelesített nyilvántartások: Vizsgálati napló Munkafüzet Impleálási napló Laboratóriumi napló Kiszerelési napló Belső minőségellenőrzési napló Sterilezési
Segédlet a gyógyszertári nyilvántartások ellenőrzésére Hitelesített nyilvántartások: Vizsgálati napló Munkafüzet Impleálási napló Laboratóriumi napló Kiszerelési napló Belső minőségellenőrzési napló Sterilezési
52/2005. (XI. 18.) EüM rendelet. A rendelet alkalmazási köre
 Az emberi alkalmazásra kerülő gyógyszerekről és egyéb, a gyógyszerpiacot szabályozó törvények módosításáról szóló 2005. évi XCV. törvény (a továbbiakban: Gytv.) 32. -a (5) bekezdésének a) pontjában kapott
Az emberi alkalmazásra kerülő gyógyszerekről és egyéb, a gyógyszerpiacot szabályozó törvények módosításáról szóló 2005. évi XCV. törvény (a továbbiakban: Gytv.) 32. -a (5) bekezdésének a) pontjában kapott
Az atommag összetétele, radioaktivitás
 Az atommag összetétele, radioaktivitás Az atommag alkotórészei proton: pozitív töltésű részecske, töltése egyenlő az elektron töltésével, csak nem negatív, hanem pozitív: 1,6 10-19 C tömege az elektron
Az atommag összetétele, radioaktivitás Az atommag alkotórészei proton: pozitív töltésű részecske, töltése egyenlő az elektron töltésével, csak nem negatív, hanem pozitív: 1,6 10-19 C tömege az elektron
I. fejezet. Általános rendelkezések. II. fejezet
 78/2004. (IV. 19.) Korm. rendelet a mezőgazdasági termékek és az élelmiszerek földrajzi árujelzőinek oltalmára vonatkozó részletes szabályokról 2005. november 1-jétől hatályos szöveg A védjegyek és a földrajzi
78/2004. (IV. 19.) Korm. rendelet a mezőgazdasági termékek és az élelmiszerek földrajzi árujelzőinek oltalmára vonatkozó részletes szabályokról 2005. november 1-jétől hatályos szöveg A védjegyek és a földrajzi
Bővített fokozatú SUGÁRVÉDELMI TANFOLYAM
 Bővített fokozatú SUGÁRVÉDELMI TANFOLYAM Sugárfizikai alapismeretek. A röntgen sugárzás keletkezése és tulajdonságai. Salik Ádám, sugárvédelmi szakértő salik.adam@osski.hu, 30-349-9300 ORSZÁGOS SUGÁRBIOLÓGIAI
Bővített fokozatú SUGÁRVÉDELMI TANFOLYAM Sugárfizikai alapismeretek. A röntgen sugárzás keletkezése és tulajdonságai. Salik Ádám, sugárvédelmi szakértő salik.adam@osski.hu, 30-349-9300 ORSZÁGOS SUGÁRBIOLÓGIAI
Az emberi erõforrások minisztere 15/2012. (VIII. 22.) EMMI rendelete az emberi alkalmazásra kerülõ gyógyszerek farmakovigilanciájáról
 M A G Y A R K Ö Z L Ö N Y 2012. évi 109. szám 18509 Az emberi erõforrások minisztere 15/2012. (VIII. 22.) EMMI rendelete az emberi alkalmazásra kerülõ gyógyszerek farmakovigilanciájáról Az emberi alkalmazásra
M A G Y A R K Ö Z L Ö N Y 2012. évi 109. szám 18509 Az emberi erõforrások minisztere 15/2012. (VIII. 22.) EMMI rendelete az emberi alkalmazásra kerülõ gyógyszerek farmakovigilanciájáról Az emberi alkalmazásra
A BIZOTTSÁG 712/2012/EU RENDELETE
 L 209/4 Az Európai Unió Hivatalos Lapja 2012.8.4. A BIZOTTSÁG 712/2012/EU RENDELETE (2012. augusztus 3.) az emberi, illetve állatgyógyászati felhasználásra szánt gyógyszerkészítmények forgalombahozatali
L 209/4 Az Európai Unió Hivatalos Lapja 2012.8.4. A BIZOTTSÁG 712/2012/EU RENDELETE (2012. augusztus 3.) az emberi, illetve állatgyógyászati felhasználásra szánt gyógyszerkészítmények forgalombahozatali
Fertőtlenítőszerek engedélyezése/engedély módosítása az átmeneti időszakban
 Fertőtlenítőszerek engedélyezése/engedély módosítása az átmeneti időszakban Cserháti Pálma MSc, biológus Országos Epidemiológiai Központ, Dezinfekciós osztály Biocidok és szabályozásuk Biocid termék: hatóanyag,
Fertőtlenítőszerek engedélyezése/engedély módosítása az átmeneti időszakban Cserháti Pálma MSc, biológus Országos Epidemiológiai Központ, Dezinfekciós osztály Biocidok és szabályozásuk Biocid termék: hatóanyag,
Megehetők-e az orvostechnikai eszközök?
 Megehetők-e az orvostechnikai eszközök? Az orvostechnikai eszközök fogalmi és besorolási szabályai 2014. március 28., Budapest Balázs György Ferenc, GYEMSZI- EMKI Főosztályvezető Az egészségügyről szóló
Megehetők-e az orvostechnikai eszközök? Az orvostechnikai eszközök fogalmi és besorolási szabályai 2014. március 28., Budapest Balázs György Ferenc, GYEMSZI- EMKI Főosztályvezető Az egészségügyről szóló
2346-06 Radiofarmakológiai vizsgálatok követelménymodul szóbeli vizsgafeladatai
 1. feladat: Munkabeosztása szerint hétfőtől Ön a meleglaboratóriumban fog dolgozni. Vegye át a meleglaboratóriumot a munkatársától! Az ellenőrzésnél térjen ki a dokumentációra és a radiofarmakonok leltározására
1. feladat: Munkabeosztása szerint hétfőtől Ön a meleglaboratóriumban fog dolgozni. Vegye át a meleglaboratóriumot a munkatársától! Az ellenőrzésnél térjen ki a dokumentációra és a radiofarmakonok leltározására
Az Európai Parlament és a Tanács 2004/24/EK irányelve. (2004. március 31.)
 Az Európai Parlament és a Tanács 2004/24/EK irányelve (2004. március 31.) az emberi felhasználásra szánt gyógyszerek közösségi kódexéről szóló 2001/83/EK irányelvnek a hagyományos növényi gyógyszerek tekintetében
Az Európai Parlament és a Tanács 2004/24/EK irányelve (2004. március 31.) az emberi felhasználásra szánt gyógyszerek közösségi kódexéről szóló 2001/83/EK irányelvnek a hagyományos növényi gyógyszerek tekintetében
(2014/434/EU) 1. CÍM A SZOROS EGYÜTTMŰKÖDÉS LÉTESÍTÉSÉRE VONATKOZÓ ELJÁRÁS. 1. cikk. Fogalommeghatározások
 2014.7.5. L 198/7 AZ EURÓPAI KÖZPONTI BANK HATÁROZATA (2014. január 31.) a mechanizmusban részt vevő azon tagállamok illetékes hatóságaival folytatott szoros együttműködésről, amelyek pénzneme nem az euro
2014.7.5. L 198/7 AZ EURÓPAI KÖZPONTI BANK HATÁROZATA (2014. január 31.) a mechanizmusban részt vevő azon tagállamok illetékes hatóságaival folytatott szoros együttműködésről, amelyek pénzneme nem az euro
EURÓPAI BIZOTTSÁG EGÉSZSÉGÜGYI ÉS ÉLELMISZERBIZTONSÁGI FŐIGAZGATÓSÁG
 EURÓPAI BIZOTTSÁG EGÉSZSÉGÜGYI ÉS ÉLELMISZERBIZTONSÁGI FŐIGAZGATÓSÁG Brüsszel, 2019. február 18. REV2 A 2018. október 2-án közzétett kérdések és válaszok (REV1) helyébe lép KÉRDÉSEK ÉS VÁLASZOK AZ EGYESÜLT
EURÓPAI BIZOTTSÁG EGÉSZSÉGÜGYI ÉS ÉLELMISZERBIZTONSÁGI FŐIGAZGATÓSÁG Brüsszel, 2019. február 18. REV2 A 2018. október 2-án közzétett kérdések és válaszok (REV1) helyébe lép KÉRDÉSEK ÉS VÁLASZOK AZ EGYESÜLT
Gyógyszerengedélyezés hazánkban és az Európai Unióban. Dr. Kıszeginé dr. Szalai Hilda Fıigazgató-helyettes
 Gyógyszerengedélyezés hazánkban és az Európai Unióban Dr. Kıszeginé dr. Szalai Hilda Fıigazgató-helyettes Témakörök A gyógyszerengedélyezés, mint a gyógyszerpiac szabályozásának kulcseleme A gyógyszerengedélyezés
Gyógyszerengedélyezés hazánkban és az Európai Unióban Dr. Kıszeginé dr. Szalai Hilda Fıigazgató-helyettes Témakörök A gyógyszerengedélyezés, mint a gyógyszerpiac szabályozásának kulcseleme A gyógyszerengedélyezés
Gyógyászati segédeszközök műszaki dokumentációja
 Gyógyászati segédeszközök műszaki dokumentációja B u d a p e s t, 2 0 1 3. s z e p t e m b e r 2 7. Orvostechnikai eszköz vs. Gyógyászati segédeszköz Az egészségügyről szóló 1997. évi CLIV. törvény 3.
Gyógyászati segédeszközök műszaki dokumentációja B u d a p e s t, 2 0 1 3. s z e p t e m b e r 2 7. Orvostechnikai eszköz vs. Gyógyászati segédeszköz Az egészségügyről szóló 1997. évi CLIV. törvény 3.
FIZIKA. Radioaktív sugárzás
 Radioaktív sugárzás Atommag összetétele: Hélium atommag : 2 proton + 2 neutron 4 He 2 A He Z 4 2 A- tömegszám proton neutron együttesszáma Z- rendszám protonok száma 2 Atommag összetétele: Izotópok: azonos
Radioaktív sugárzás Atommag összetétele: Hélium atommag : 2 proton + 2 neutron 4 He 2 A He Z 4 2 A- tömegszám proton neutron együttesszáma Z- rendszám protonok száma 2 Atommag összetétele: Izotópok: azonos
A klinikai vizsgálatokról. Dr Kriván Gergely
 A klinikai vizsgálatokról Dr Kriván Gergely Mi a klinikai vizsgálat? Olyan emberen végzett orvostudományi kutatás, amely egy vagy több vizsgálati készítmény klinikai, farmakológiai, illetőleg más farmakodinámiás
A klinikai vizsgálatokról Dr Kriván Gergely Mi a klinikai vizsgálat? Olyan emberen végzett orvostudományi kutatás, amely egy vagy több vizsgálati készítmény klinikai, farmakológiai, illetőleg más farmakodinámiás
Gyógyszernek nem minősülő kiegészítő termékek adatbázisa (Data base of non medication products)
 Gyógyszernek nem minősülő kiegészítő termékek adatbázisa (Data base of non medication products) A regisztrációt követően lesz lehetőségük a termékek adatainak megtekintésére. Főoldal Kereső ablakok, szűrési
Gyógyszernek nem minősülő kiegészítő termékek adatbázisa (Data base of non medication products) A regisztrációt követően lesz lehetőségük a termékek adatainak megtekintésére. Főoldal Kereső ablakok, szűrési
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
1 MUNKAANYAG A MINISZTÉRIUM VÉGSŐ ÁLLÁSPONTJÁT NEM TÜKRÖZI A földművelésügyi és vidékfejlesztési miniszter
 1 A földművelésügyi és vidékfejlesztési miniszter /2008. ( ) FVM rendelete a növényvédő szerek forgalomba hozatalának és felhasználásának engedélyezéséről, valamint a növényvédő szerek csomagolásáról,
1 A földművelésügyi és vidékfejlesztési miniszter /2008. ( ) FVM rendelete a növényvédő szerek forgalomba hozatalának és felhasználásának engedélyezéséről, valamint a növényvédő szerek csomagolásáról,
Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért
 2008R1234 HU 04.08.2013 002.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B A BIZOTTSÁG 1234/2008/EK RENDELETE (2008. november 24.)
2008R1234 HU 04.08.2013 002.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B A BIZOTTSÁG 1234/2008/EK RENDELETE (2008. november 24.)
Az atommagtól a konnektorig
 Az atommagtól a konnektorig (Az atomenergetika alapjai) Dr. Aszódi Attila, Boros Ildikó BME Nukleáris Technikai Intézet Pázmándi Tamás KFKI Atomenergia Kutatóintézet Szervező: 1 Az atom felépítése kb.
Az atommagtól a konnektorig (Az atomenergetika alapjai) Dr. Aszódi Attila, Boros Ildikó BME Nukleáris Technikai Intézet Pázmándi Tamás KFKI Atomenergia Kutatóintézet Szervező: 1 Az atom felépítése kb.
(EGT-vonatkozású szöveg)
 L 77/6 2018.3.20. A BIZOTTSÁG (EU) 2018/456 VÉGREHAJTÁSI RENDELETE (2018. március 19.) az új élelmiszerré történő minősítésre irányuló, az új élelmiszerekről szóló (EU) 2015/2283 európai parlamenti és
L 77/6 2018.3.20. A BIZOTTSÁG (EU) 2018/456 VÉGREHAJTÁSI RENDELETE (2018. március 19.) az új élelmiszerré történő minősítésre irányuló, az új élelmiszerekről szóló (EU) 2015/2283 európai parlamenti és
Magfizika tesztek. 1. Melyik részecske nem tartozik a nukleonok közé? a) elektron b) proton c) neutron d) egyik sem
 1. Melyik részecske nem tartozik a nukleonok közé? a) elektron b) proton c) neutron d) egyik sem 2. Mit nevezünk az atom tömegszámának? a) a protonok számát b) a neutronok számát c) a protonok és neutronok
1. Melyik részecske nem tartozik a nukleonok közé? a) elektron b) proton c) neutron d) egyik sem 2. Mit nevezünk az atom tömegszámának? a) a protonok számát b) a neutronok számát c) a protonok és neutronok
Maprelin. Maprelin 75µg/ml oldat injekciós sertések számára A.U.V. Biotechnikai felhasználásra, csoportok vagy állományok kezelésére.
 Maprelin Maprelin 75µg/ml oldat injekciós sertések számára A.U.V Biotechnikai felhasználásra, csoportok vagy állományok kezelésére. Maprelin 75 μg/ml 1.A FORGALOMBA HOZATALI ENGEDÉLY JOOSULTJÁNAK, TOVÁBBÁ
Maprelin Maprelin 75µg/ml oldat injekciós sertések számára A.U.V Biotechnikai felhasználásra, csoportok vagy állományok kezelésére. Maprelin 75 μg/ml 1.A FORGALOMBA HOZATALI ENGEDÉLY JOOSULTJÁNAK, TOVÁBBÁ
A törzskönyvezési munka tapasztalatai az elmúlt 10 évben a kezdő törzskönyvező visszatekintése ( irodalmi adatok feldolgozása) PÁLYÁZAT
 A törzskönyvezési munka tapasztalatai az elmúlt 10 évben a kezdő törzskönyvező visszatekintése ( irodalmi adatok feldolgozása) PÁLYÁZAT Név: dr. Németh Csenge e-mail: nemeth-csenge@hotmail.hu /nemeth.csenge@beres.hu
A törzskönyvezési munka tapasztalatai az elmúlt 10 évben a kezdő törzskönyvező visszatekintése ( irodalmi adatok feldolgozása) PÁLYÁZAT Név: dr. Németh Csenge e-mail: nemeth-csenge@hotmail.hu /nemeth.csenge@beres.hu
MÉKISZ KONFERENCIA AZ ÉTREND-KIEGÉSZÍTŐK BEFOGADÁSÁNAK MINŐSÉGI FELTÉTELEI A GYÓGYSZER-NAGYKERESKEDELEMBEN
 MÉKISZ KONFERENCIA AZ ÉTREND-KIEGÉSZÍTŐK BEFOGADÁSÁNAK MINŐSÉGI FELTÉTELEI A GYÓGYSZER-NAGYKERESKEDELEMBEN BÜKFÜRDŐ, 2017. 03. 30. Kertesyné dr. Fülöp Márta Bevezetés Bemutatkozás Eddig is így csináltuk
MÉKISZ KONFERENCIA AZ ÉTREND-KIEGÉSZÍTŐK BEFOGADÁSÁNAK MINŐSÉGI FELTÉTELEI A GYÓGYSZER-NAGYKERESKEDELEMBEN BÜKFÜRDŐ, 2017. 03. 30. Kertesyné dr. Fülöp Márta Bevezetés Bemutatkozás Eddig is így csináltuk
Engedély kell! Gyógyszernagykereskedelem. párhuzamos import. Honnan szerezhet be gyógyszert a nagykeresked-? Gyógyszer-nagyker.
 Gyógyszernagykereskedelem és párhuzamos import 53/2004. (VI. 2.) ESzCsM rendelet + Engedély kell! Fontos: nem elegend- a cégbejegyzés, gyógyszernagykereskedelmet csak az a gazdálkodó szervezet folytathat,
Gyógyszernagykereskedelem és párhuzamos import 53/2004. (VI. 2.) ESzCsM rendelet + Engedély kell! Fontos: nem elegend- a cégbejegyzés, gyógyszernagykereskedelmet csak az a gazdálkodó szervezet folytathat,
Országos Onkológiai Intézet, Sugárterápiás Centrum 2. Országos Onkológiai Intézet, Nukleáris Medicina Osztály 4
 99m Tc-MDP hatására kialakuló dózistér mérése csontszcintigráfia esetén a beteg közvetlen közelében Király R. 1, Pesznyák Cs. 1,2,Sinkovics I. 3, Kanyár B. 4 1 Országos Onkológiai Intézet, Sugárterápiás
99m Tc-MDP hatására kialakuló dózistér mérése csontszcintigráfia esetén a beteg közvetlen közelében Király R. 1, Pesznyák Cs. 1,2,Sinkovics I. 3, Kanyár B. 4 1 Országos Onkológiai Intézet, Sugárterápiás
2014/4. Prof. dr. Lipták Pál. A tar ta lom ból. A gyermekgyógyászati. gyógyszerhasználat engedélyezése. Radioaktív gyógyszerek engedélyezése
 GYÓGYSZERÉSZET A MAGYAR GYÓGYSZERÉSZTUDOMÁNYI TÁRSASÁG LAPJA A tar ta lom ból A gyermekgyógyászati gyógyszerhasználat engedélyezése Néhai elnökeink Radioaktív gyógyszerek engedélyezése Biológiai gyógyszerek
GYÓGYSZERÉSZET A MAGYAR GYÓGYSZERÉSZTUDOMÁNYI TÁRSASÁG LAPJA A tar ta lom ból A gyermekgyógyászati gyógyszerhasználat engedélyezése Néhai elnökeink Radioaktív gyógyszerek engedélyezése Biológiai gyógyszerek
2/2008. (I. 8.) EüM rendelet a gyógyszertárban forgalmazható, valamint kötelezően készletben tartandó termékekről
 2/2008. (I. 8.) EüM rendelet a gyógyszertárban forgalmazható, valamint kötelezően készletben tartandó termékekről A biztonságos és gazdaságos gyógyszer- és gyógyászatisegédeszköz-ellátás, valamint a gyógyszerforgalmazás
2/2008. (I. 8.) EüM rendelet a gyógyszertárban forgalmazható, valamint kötelezően készletben tartandó termékekről A biztonságos és gazdaságos gyógyszer- és gyógyászatisegédeszköz-ellátás, valamint a gyógyszerforgalmazás
3/2009. (II. 25.) EüM rendelet
 az emberi felhasználásra kerülő gyógyszer, illetve gyógyászati segédeszköz ismertetésére, az ismertetői tevékenységet végző személyek nyilvántartására, és a gyógyszerrel, gyógyászati segédeszközzel kapcsolatos,
az emberi felhasználásra kerülő gyógyszer, illetve gyógyászati segédeszköz ismertetésére, az ismertetői tevékenységet végző személyek nyilvántartására, és a gyógyszerrel, gyógyászati segédeszközzel kapcsolatos,
(Közlemények) AZ EURÓPAI UNIÓ INTÉZMÉNYEITŐL, SZERVEITŐL, HIVATALAITÓL ÉS ÜGYNÖKSÉGEITŐL SZÁRMAZÓ KÖZLEMÉNYEK EURÓPAI BIZOTTSÁG
 2013.8.2. Az Európai Unió Hivatalos Lapja C 223/1 II (Közlemények) AZ EURÓPAI UNIÓ INTÉZMÉNYEITŐL, SZERVEITŐL, HIVATALAITÓL ÉS ÜGYNÖKSÉGEITŐL SZÁRMAZÓ KÖZLEMÉNYEK EURÓPAI BIZOTTSÁG Iránymutatás a különböző
2013.8.2. Az Európai Unió Hivatalos Lapja C 223/1 II (Közlemények) AZ EURÓPAI UNIÓ INTÉZMÉNYEITŐL, SZERVEITŐL, HIVATALAITÓL ÉS ÜGYNÖKSÉGEITŐL SZÁRMAZÓ KÖZLEMÉNYEK EURÓPAI BIZOTTSÁG Iránymutatás a különböző
IPARI KÖTELEZETTSÉGEK I. 2. Fenntartás - Módosítások. Módosítások. Módosítás típusai
 IPARI KÖTELEZETTSÉGEK I Gyógyszerek törzskönyvezése: 1. új gyógyszer tk beadványa 2. fenntartás 3. felújítás 4. kivonás Dr Szabó Mónika BAYER Hungária Kft Törzskönyvezési vezetı 2. Fenntartás - Módosítások
IPARI KÖTELEZETTSÉGEK I Gyógyszerek törzskönyvezése: 1. új gyógyszer tk beadványa 2. fenntartás 3. felújítás 4. kivonás Dr Szabó Mónika BAYER Hungária Kft Törzskönyvezési vezetı 2. Fenntartás - Módosítások
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Ecoporc SHIGA szuszpenziós injekció sertések számára 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml-es adagonként
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Ecoporc SHIGA szuszpenziós injekció sertések számára 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml-es adagonként
Magyar joganyagok - 28/2015. (II. 25.) Korm. rendelet - az Országos Gyógyszerészeti 2. oldal j) ellátja a kozmetikai termékekkel kapcsolatosan a kozme
 Magyar joganyagok - 28/2015. (II. 25.) Korm. rendelet - az Országos Gyógyszerészeti 1. oldal 28/2015. (II. 25.) Korm. rendelet az Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézetről A Kormány
Magyar joganyagok - 28/2015. (II. 25.) Korm. rendelet - az Országos Gyógyszerészeti 1. oldal 28/2015. (II. 25.) Korm. rendelet az Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézetről A Kormány
Gyógyászati segédeszközök vs sporteszközök
 Egészségügyi Engedélyezési és Közigazgatási Hivatal 1051 Budapest, Zrínyi utca 3. Gyógyászati segédeszközök vs sporteszközök P a r á d f ü r d ő, F E S Z K o n g r e s s z u s - 2 0 1 4. s z e p t e m
Egészségügyi Engedélyezési és Közigazgatási Hivatal 1051 Budapest, Zrínyi utca 3. Gyógyászati segédeszközök vs sporteszközök P a r á d f ü r d ő, F E S Z K o n g r e s s z u s - 2 0 1 4. s z e p t e m
KITÖLTÉSI ÚTMUTATÓ Adatlap különleges táplálkozási célú élelmiszer bejelentéséhez 36/2004. (IV.26.) ESzCsM r. 8..(1) bek. és 4.
 KITÖLTÉSI ÚTMUTATÓ Adatlap különleges táplálkozási célú élelmiszer bejelentéséhez 36/2004. (IV.26.) ESzCsM r. 8..(1) bek. és 4. számú melléklet Általános tudnivalók Az Adatlap különleges táplálkozási célú
KITÖLTÉSI ÚTMUTATÓ Adatlap különleges táplálkozási célú élelmiszer bejelentéséhez 36/2004. (IV.26.) ESzCsM r. 8..(1) bek. és 4. számú melléklet Általános tudnivalók Az Adatlap különleges táplálkozási célú
RADIOAKTÍV GYÓGYSZERKÉSZÍTMÉNYEK. Radiopharmaceutica
 Radioaktív gyógyszerkészítmények Ph.Hg.VIII. Ph.Eur. 8.0. -1 01/2014:0125 RADIOAKTÍV GYÓGYSZERKÉSZÍTMÉNYEK Radiopharmaceutica DEFINÍCIÓ Radioaktív gyógyszerkészítménynek vagy radiogyógyszereknek nevezünk
Radioaktív gyógyszerkészítmények Ph.Hg.VIII. Ph.Eur. 8.0. -1 01/2014:0125 RADIOAKTÍV GYÓGYSZERKÉSZÍTMÉNYEK Radiopharmaceutica DEFINÍCIÓ Radioaktív gyógyszerkészítménynek vagy radiogyógyszereknek nevezünk
I. MELLÉKLET GYÓGYSZERKÉSZÍTMÉNYEK NEVE, GYÓGYSZERFORMÁJA, HATÁSERŐSSÉGE, ÁLLATFAJOK, ALKALMAZÁSI MÓDOK ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA
 I. MELLÉKLET GYÓGYSZERKÉSZÍTMÉNYEK NEVE, GYÓGYSZERFORMÁJA, HATÁSERŐSSÉGE, ÁLLATFAJOK, ALKALMAZÁSI MÓDOK ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA EMEA/CVMP/166766/2006-HU 2006 májusban 1/7 Tagállam
I. MELLÉKLET GYÓGYSZERKÉSZÍTMÉNYEK NEVE, GYÓGYSZERFORMÁJA, HATÁSERŐSSÉGE, ÁLLATFAJOK, ALKALMAZÁSI MÓDOK ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA EMEA/CVMP/166766/2006-HU 2006 májusban 1/7 Tagállam
Radioaktív nyomjelzés analitikai kémiai alkalmazásai
 Radioaktív nyomjelzés analitikai kémiai alkalmazásai Nyomjelzés az élő szervezetben In vitro diagnosztika: a vizsgálandó személy nem érintkezik közvetlenül radioaktív anyaggal, hanem a tőle levett (általában
Radioaktív nyomjelzés analitikai kémiai alkalmazásai Nyomjelzés az élő szervezetben In vitro diagnosztika: a vizsgálandó személy nem érintkezik közvetlenül radioaktív anyaggal, hanem a tőle levett (általában
Magyar joganyagok - 3/2009. (II. 25.) EüM rendelet - az emberi felhasználásra kerülő 2. oldal (4) A (3) bekezdésben foglalt rendelkezést televízióban
 Magyar joganyagok - 3/2009. (II. 25.) EüM rendelet - az emberi felhasználásra kerülő 1. oldal 3/2009. (II. 25.) EüM rendelet az emberi felhasználásra kerülő gyógyszer, illetve gyógyászati segédeszköz ismertetésére,
Magyar joganyagok - 3/2009. (II. 25.) EüM rendelet - az emberi felhasználásra kerülő 1. oldal 3/2009. (II. 25.) EüM rendelet az emberi felhasználásra kerülő gyógyszer, illetve gyógyászati segédeszköz ismertetésére,
Orvostechnikai eszközök az egészségügyi szolgáltatóknál
 Orvostechnikai eszközök az egészségügyi szolgáltatóknál (szigorodó szabályozások, egyértelmű felelősség) Balázs György Ferenc EMKI főosztályvezető DEMIN 2013. május Eszközminősítő és Kórháztechnikai Igazgatóság
Orvostechnikai eszközök az egészségügyi szolgáltatóknál (szigorodó szabályozások, egyértelmű felelősség) Balázs György Ferenc EMKI főosztályvezető DEMIN 2013. május Eszközminősítő és Kórháztechnikai Igazgatóság
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
I. MELLÉKLET MEGNEVEZÉSEK, GYÓGYSZERFORMÁK, HATÁSERŐSSÉGEK, ÁLLATFAJOK, AZ ALKALMAZÁS MÓDJAI ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJAI 1/7
 I. MELLÉKLET MEGNEVEZÉSEK, GYÓGYSZERFORMÁK, HATÁSERŐSSÉGEK, ÁLLATFAJOK, AZ ALKALMAZÁS MÓDJAI ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJAI 1/7 Tagállam Kérelmező vagy a forgalomba hozatali engedély jogosultja
I. MELLÉKLET MEGNEVEZÉSEK, GYÓGYSZERFORMÁK, HATÁSERŐSSÉGEK, ÁLLATFAJOK, AZ ALKALMAZÁS MÓDJAI ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJAI 1/7 Tagállam Kérelmező vagy a forgalomba hozatali engedély jogosultja
I. MELLÉKLET. ELNEVEZÉS PDO/PGI-XX-XXXX A kérelem benyújtásának időpontja: XXXX-XX-XX
 HU I. MELLÉKLET EGYSÉGES DOKUMENTUM ELNEVEZÉS PDO/PGI-XX-XXXX A kérelem benyújtásának időpontja: XXXX-XX-XX 1. BEJEGYZENDŐ ELNEVEZÉS(EK): 2. AZ A HARMADIK ORSZÁG, AMELYHEZ A KÖRÜLHATÁROLT TERÜLET TARTOZIK:
HU I. MELLÉKLET EGYSÉGES DOKUMENTUM ELNEVEZÉS PDO/PGI-XX-XXXX A kérelem benyújtásának időpontja: XXXX-XX-XX 1. BEJEGYZENDŐ ELNEVEZÉS(EK): 2. AZ A HARMADIK ORSZÁG, AMELYHEZ A KÖRÜLHATÁROLT TERÜLET TARTOZIK:
Az Európai Parlament és a Tanács 2004/27/EK irányelve. (2004. március 31.)
 Az Európai Parlament és a Tanács 2004/27/EK irányelve (2004. március 31.) az emberi felhasználásra szánt gyógyszerek közösségi kódexéről szóló 2001/83/EK irányelv módosításáról (EGT vonatkozású szöveg)
Az Európai Parlament és a Tanács 2004/27/EK irányelve (2004. március 31.) az emberi felhasználásra szánt gyógyszerek közösségi kódexéről szóló 2001/83/EK irányelv módosításáról (EGT vonatkozású szöveg)
MAGYAR KÖZLÖNY. 109. szám. MAGYARORSZÁG HIVATALOS LAPJA 2012. augusztus 22., szerda. Tartalomjegyzék
 MAGYAR KÖZLÖNY MAGYARORSZÁG HIVATALOS LAPJA 2012. augusztus 22., szerda 109. szám Tartalomjegyzék 41/2012. (VIII. 22.) BM rendelet 15/2012. (VIII. 22.) EMMI rendelet 18/2012. (VIII. 22.) HM rendelet 36/2012.
MAGYAR KÖZLÖNY MAGYARORSZÁG HIVATALOS LAPJA 2012. augusztus 22., szerda 109. szám Tartalomjegyzék 41/2012. (VIII. 22.) BM rendelet 15/2012. (VIII. 22.) EMMI rendelet 18/2012. (VIII. 22.) HM rendelet 36/2012.
(HL L 384., , 75. o.)
 2006R2023 HU 17.04.2008 001.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B A BIZOTTSÁG 2023/2006/EK RENDELETE (2006. december 22.)
2006R2023 HU 17.04.2008 001.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B A BIZOTTSÁG 2023/2006/EK RENDELETE (2006. december 22.)
Gyógyszerkutatás és gyógyszerfejlesztés. Az új molekulától a gyógyszerig
 Gyógyszerkutatás és gyógyszerfejlesztés Az új molekulától a gyógyszerig A gyógyszerkutatás idő-és költségigénye 10-14 évi kutató-és fejlesztő munka mintegy egymilliárd dollár ráfordítás (egy 2001-ben induló
Gyógyszerkutatás és gyógyszerfejlesztés Az új molekulától a gyógyszerig A gyógyszerkutatás idő-és költségigénye 10-14 évi kutató-és fejlesztő munka mintegy egymilliárd dollár ráfordítás (egy 2001-ben induló
JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ. Nukleáris medicina szakasszisztens szakképesítés Klinikai nukleáris medicina (diagnosztika és terápia) modul
 Emberi Erőforrások Minisztériuma Korlátozott terjesztésű! Érvényességi idő: az írásbeli vizsgatevékenység befejezésének időpontjáig A minősítő neve: Rauh Edit A minősítő beosztása: mb. főigazgató-helyettes
Emberi Erőforrások Minisztériuma Korlátozott terjesztésű! Érvényességi idő: az írásbeli vizsgatevékenység befejezésének időpontjáig A minősítő neve: Rauh Edit A minősítő beosztása: mb. főigazgató-helyettes
Dózis Gyógyszerforma Alkalmazási mód Tartalom (koncentráció) megnevezés. engedély jogosultja
 I. MELLÉKLET FELSOROLÁS: MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZERKÉSZÍTMÉNY- DÓZIS, ALKALMAZÁSI MÓD, KÉRELMEZŐ ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA A TAGÁLLAMOKBAN Tagállam Forgalomba hozatali engedély
I. MELLÉKLET FELSOROLÁS: MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZERKÉSZÍTMÉNY- DÓZIS, ALKALMAZÁSI MÓD, KÉRELMEZŐ ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA A TAGÁLLAMOKBAN Tagállam Forgalomba hozatali engedély
HU-Budapest: Diagnosztikumok 2012/S 149-248140
 1/7 Ez a hirdetmény a TED weboldalán: http://ted.europa.eu/udl?uri=ted:notice:248140-2012:text:hu:html HU-Budapest: Diagnosztikumok 2012/S 149-248140 Országos Vérellátó Szolgálat, Karolina út 19-21., attn:
1/7 Ez a hirdetmény a TED weboldalán: http://ted.europa.eu/udl?uri=ted:notice:248140-2012:text:hu:html HU-Budapest: Diagnosztikumok 2012/S 149-248140 Országos Vérellátó Szolgálat, Karolina út 19-21., attn:
39/1997. (XII. 19.) KTM-IKIM együttes rendelet
 39/1997. (XII. 19.) KTM-IKIM együttes rendelet - Az építési célra szolgáló anyagok. 1 39/1997. (XII. 19.) KTM-IKIM együttes rendelet az építési célra szolgáló anyagok, szerkezetek és berendezések mûszaki
39/1997. (XII. 19.) KTM-IKIM együttes rendelet - Az építési célra szolgáló anyagok. 1 39/1997. (XII. 19.) KTM-IKIM együttes rendelet az építési célra szolgáló anyagok, szerkezetek és berendezések mûszaki
KTI KÖZLEKEDÉSTUDOMÁNYI INTÉZET NONPROFIT KFT. 1119 BUDAPEST, THAN KÁROLY U. 3-5. TELEFON: 371-5936 TELEFAX: 205-5951
 KTI KÖZLEKEDÉSTUDOMÁNYI INTÉZET NONPROFIT KFT. 1119 BUDAPEST, THAN KÁROLY U. 3-5. TELEFON: 371-5936 TELEFAX: 205-5951 TÁJÉKOZATÓ T-1-03-02 A kölcsönös átjárhatóságot biztosító infrastruktúra alrendszer
KTI KÖZLEKEDÉSTUDOMÁNYI INTÉZET NONPROFIT KFT. 1119 BUDAPEST, THAN KÁROLY U. 3-5. TELEFON: 371-5936 TELEFAX: 205-5951 TÁJÉKOZATÓ T-1-03-02 A kölcsönös átjárhatóságot biztosító infrastruktúra alrendszer
Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért
 2008R1234 HU 02.11.2012 001.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B A BIZOTTSÁG 1234/2008/EK RENDELETE (2008. november 24.)
2008R1234 HU 02.11.2012 001.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B A BIZOTTSÁG 1234/2008/EK RENDELETE (2008. november 24.)
EURÓPAI BIZOTTSÁG VÁLLALKOZÁSPOLITIKAI ÉS IPARI FŐIGAZGATÓSÁG
 EURÓPAI BIZOTTSÁG VÁLLALKOZÁSPOLITIKAI ÉS IPARI FŐIGAZGATÓSÁG Fogyasztási cikkek Gyógyszerkészítmények Brüsszel, 9/1/2008 ENTR NR D(2007) Nyilvános pályázati felhívás az Európai Gyógyszerügynökség fejlett
EURÓPAI BIZOTTSÁG VÁLLALKOZÁSPOLITIKAI ÉS IPARI FŐIGAZGATÓSÁG Fogyasztási cikkek Gyógyszerkészítmények Brüsszel, 9/1/2008 ENTR NR D(2007) Nyilvános pályázati felhívás az Európai Gyógyszerügynökség fejlett
I. melléklet. Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása
 I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilancia Kockázatértékelő
I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilancia Kockázatértékelő
/2006. ( ) FVM rendelete
 A földművelésügyi és vidékfejlesztési miniszter Tervezet! /2006. ( ) FVM rendelete a takarmányok előállításáról, forgalomba hozataláról és felhasználásáról szóló 2001. évi CXIX törvény végrehajtásáról
A földművelésügyi és vidékfejlesztési miniszter Tervezet! /2006. ( ) FVM rendelete a takarmányok előállításáról, forgalomba hozataláról és felhasználásáról szóló 2001. évi CXIX törvény végrehajtásáról
52/2005. (XI. 18.) EüM rendelet. A rendelet alkalmazási köre
 52/2005. (XI. 18.) EüM rendelet az emberi alkalmazásra kerülı gyógyszerek forgalomba hozataláról Az emberi alkalmazásra kerülı gyógyszerekrıl és egyéb, a gyógyszerpiacot szabályozó törvények módosításáról
52/2005. (XI. 18.) EüM rendelet az emberi alkalmazásra kerülı gyógyszerek forgalomba hozataláról Az emberi alkalmazásra kerülı gyógyszerekrıl és egyéb, a gyógyszerpiacot szabályozó törvények módosításáról
3/2009. (II. 25.) EüM rendelet
 Hatályos: 2011.1.1-től 64/2003 (X.31.) ESzCsM rendelet helyett 3/2009. (II. 25.) EüM rendelet az emberi felhasználásra kerülő gyógyszer, illetve gyógyászati segédeszköz ismertetésére, az ismertetői tevékenységet
Hatályos: 2011.1.1-től 64/2003 (X.31.) ESzCsM rendelet helyett 3/2009. (II. 25.) EüM rendelet az emberi felhasználásra kerülő gyógyszer, illetve gyógyászati segédeszköz ismertetésére, az ismertetői tevékenységet
A sugárvédelem rendszere, mentességi, dóziskorlátozási, beavatkozási, cselekvési és más vonatkoztatási szintek
 A sugárvédelem rendszere, mentességi, dóziskorlátozási, beavatkozási, cselekvési és más vonatkoztatási szintek Dr. Voszka István 487/2015. (XII. 30.) Korm. rendelet az ionizáló sugárzás elleni védelemről
A sugárvédelem rendszere, mentességi, dóziskorlátozási, beavatkozási, cselekvési és más vonatkoztatási szintek Dr. Voszka István 487/2015. (XII. 30.) Korm. rendelet az ionizáló sugárzás elleni védelemről
Sugárzások kölcsönhatása az anyaggal
 Radioaktivitás Biofizika előadások 2013 december Sugárzások kölcsönhatása az anyaggal PTE ÁOK Biofizikai Intézet, Orbán József Összefoglaló radioaktivitás alapok Nukleononkénti kötési energia (MeV) Egy
Radioaktivitás Biofizika előadások 2013 december Sugárzások kölcsönhatása az anyaggal PTE ÁOK Biofizikai Intézet, Orbán József Összefoglaló radioaktivitás alapok Nukleononkénti kötési energia (MeV) Egy
A BIZOTTSÁG 574/2014/EU FELHATALMAZÁSON ALAPULÓ RENDELETE
 2014.5.28. L 159/41 RENDELETEK A BIZOTTSÁG 574/2014/EU FELHATALMAZÁSON ALAPULÓ RENDELETE (2014. február 21.) a 305/2011/EU európai parlamenti és tanácsi rendelet III. mellékletének az építési termékekre
2014.5.28. L 159/41 RENDELETEK A BIZOTTSÁG 574/2014/EU FELHATALMAZÁSON ALAPULÓ RENDELETE (2014. február 21.) a 305/2011/EU európai parlamenti és tanácsi rendelet III. mellékletének az építési termékekre
Az ionizáló sugárzások fajtái, forrásai
 Az ionizáló sugárzások fajtái, forrásai magsugárzás Magsugárzások Röntgensugárzás Függelék. Intenzitás 2. Spektrum 3. Atom Repetitio est mater studiorum. Röntgen Ionizációnak nevezzük azt a folyamatot,
Az ionizáló sugárzások fajtái, forrásai magsugárzás Magsugárzások Röntgensugárzás Függelék. Intenzitás 2. Spektrum 3. Atom Repetitio est mater studiorum. Röntgen Ionizációnak nevezzük azt a folyamatot,
6/a. számú melléklet a 32/2004. (IV. 26.) ESzCsM rendelethez 1
 6/a. számú melléklet a 32/2004. (IV. 26.) ESzCsM rendelethez 1 Képviselő cég neve, címe:... Beadás dátuma: (OEP tölti ki) Ügyintéző neve, elérhetősége:... Munkahelyi telefon (fax, e-mail, mobiltel.):...
6/a. számú melléklet a 32/2004. (IV. 26.) ESzCsM rendelethez 1 Képviselő cég neve, címe:... Beadás dátuma: (OEP tölti ki) Ügyintéző neve, elérhetősége:... Munkahelyi telefon (fax, e-mail, mobiltel.):...
Az Európai Unió Tanácsa Brüsszel, október 13. (OR. en) Jeppe TRANHOLM-MIKKELSEN, az Európai Unió Tanácsának főtitkára
 Az Európai Unió Tanácsa Brüsszel, 2016. október 13. (OR. en) 13212/16 FEDŐLAP Küldi: Az átvétel dátuma: 2016. október 11. Címzett: Biz. dok. sz.: Tárgy: az Európai Bizottság főtitkára részéről Jordi AYET
Az Európai Unió Tanácsa Brüsszel, 2016. október 13. (OR. en) 13212/16 FEDŐLAP Küldi: Az átvétel dátuma: 2016. október 11. Címzett: Biz. dok. sz.: Tárgy: az Európai Bizottság főtitkára részéről Jordi AYET
13/13. kötet HU. Az Európai Unió Hivatalos Lapja
 113 31994D0023 L 17/34 AZ EURÓPAI KÖZÖSSÉGEK HIVATALOS LAPJA 1994.1.20. A BIZOTTSÁG HATÁROZATA (1994. január 17.) az európai műszaki engedélyre vonatkozó közös eljárási szabályokról (94/23/EK) AZ EURÓPAI
113 31994D0023 L 17/34 AZ EURÓPAI KÖZÖSSÉGEK HIVATALOS LAPJA 1994.1.20. A BIZOTTSÁG HATÁROZATA (1994. január 17.) az európai műszaki engedélyre vonatkozó közös eljárási szabályokról (94/23/EK) AZ EURÓPAI
SZLMK Gyógyszer. Közbeszerzési Értesítő száma: 2017/223. Eljárás fajtája: Közzététel dátuma: Iktatószám: 17822/2017 CPV Kód:
 SZLMK Gyógyszer Közbeszerzési Értesítő száma: 2017/223 Beszerzés tárgya: Árubeszerzés Hirdetmény típusa: Helyesbítés/2015 EUHL Eljárás fajtája: Közzététel dátuma: 2017.12.08. Iktatószám: 17822/2017 CPV
SZLMK Gyógyszer Közbeszerzési Értesítő száma: 2017/223 Beszerzés tárgya: Árubeszerzés Hirdetmény típusa: Helyesbítés/2015 EUHL Eljárás fajtája: Közzététel dátuma: 2017.12.08. Iktatószám: 17822/2017 CPV
AZ EURÓPAI KÖZÖSSÉGEK BIZOTTSÁGA A BIZOTTSÁG HATÁROZATA 11.2.2009
 AZ EURÓPAI KÖZÖSSÉGEK BIZOTTSÁGA Brüsszel, 11.2.2009 C(2009)1056 NEM KÖZZÉTÉTELRE A BIZOTTSÁG HATÁROZATA 11.2.2009 a(z) "STARTVAC" állatgyógyászati készítmény forgalomba hozatalának a 726/2004/EK európai
AZ EURÓPAI KÖZÖSSÉGEK BIZOTTSÁGA Brüsszel, 11.2.2009 C(2009)1056 NEM KÖZZÉTÉTELRE A BIZOTTSÁG HATÁROZATA 11.2.2009 a(z) "STARTVAC" állatgyógyászati készítmény forgalomba hozatalának a 726/2004/EK európai
a 14/2007. (III. 14.) EüM rendelet 4. számú mellékletében meghatározott adattartalom alapján
 Kérelem a gyógyászati segédeszközök forgalmazásának, javításának, kölcsönzésének szakmai követelményeiről szóló miniszteri rendelet szerint kölcsönzött eszközök társadalombiztosítási támogatással történő
Kérelem a gyógyászati segédeszközök forgalmazásának, javításának, kölcsönzésének szakmai követelményeiről szóló miniszteri rendelet szerint kölcsönzött eszközök társadalombiztosítási támogatással történő
Izotóp geológia: Elemek izotópjainak használata geológiai folyamatok értelmezéséhez.
 Radioaktív izotópok Izotópok Egy elem különböző tömegű (tömegszámú - A) formái; Egy elem izotópjainak a magjai azonos számú protont (rendszám - Z) és különböző számú neutront (N) tartalmaznak; Egy elem
Radioaktív izotópok Izotópok Egy elem különböző tömegű (tömegszámú - A) formái; Egy elem izotópjainak a magjai azonos számú protont (rendszám - Z) és különböző számú neutront (N) tartalmaznak; Egy elem
A Nukleáris Medicina alapjai
 A Nukleáris Medicina alapjai Szegedi Tudományegyetem Nukleáris Medicina Intézet Történet 1. 1896 Henri Becquerel titokzatos sugár (Urán) 1897 Marie and Pierre Curie - radioaktivitás 1901-1914 Rádium terápia
A Nukleáris Medicina alapjai Szegedi Tudományegyetem Nukleáris Medicina Intézet Történet 1. 1896 Henri Becquerel titokzatos sugár (Urán) 1897 Marie and Pierre Curie - radioaktivitás 1901-1914 Rádium terápia
I. MELLÉKLET MEGNEVEZÉS, GYÓGYSZERFORMA, HATÁSERŐSSÉG, ÁLLATFAJOK, ALKALMAZÁSI MÓDOK ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA/KÉRELMEZŐ 1/9
 I. MELLÉKLET MEGNEVEZÉS, GYÓGYSZERFORMA, HATÁSERŐSSÉG, ÁLLATFAJOK, ALKALMAZÁSI MÓDOK ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA/KÉRELMEZŐ 1/9 Tagállam/forgalomba hozatali engedély száma Forgalomba hozatali
I. MELLÉKLET MEGNEVEZÉS, GYÓGYSZERFORMA, HATÁSERŐSSÉG, ÁLLATFAJOK, ALKALMAZÁSI MÓDOK ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA/KÉRELMEZŐ 1/9 Tagállam/forgalomba hozatali engedély száma Forgalomba hozatali
AZ EURÓPAI PARLAMENT ÉS A TANÁCS IRÁNYELVE (2001. november 6.) az emberi felhasználásra szánt gyógyszerek közösségi kódexéről (2001/83/EK)
 2001L0083 HU 16.11.2012 011.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B AZ EURÓPAI PARLAMENT ÉS A TANÁCS IRÁNYELVE (2001. november
2001L0083 HU 16.11.2012 011.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B AZ EURÓPAI PARLAMENT ÉS A TANÁCS IRÁNYELVE (2001. november
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
ORRÜREGBEN ALKALMAZOTT (NAZÁLIS) GYÓGYSZERKÉSZÍTMÉNYEK. Nasalia
 Orrüregben alkalmazott (nazális) Ph.Hg.VIII. Ph.Eur.5.4-1 ORRÜREGBEN ALKALMAZOTT (NAZÁLIS) GYÓGYSZERKÉSZÍTMÉNYEK Nasalia 04/2006:0676 Az orrüregben alkalmazott (nazális) szisztémás vagy helyi hatás elérésére
Orrüregben alkalmazott (nazális) Ph.Hg.VIII. Ph.Eur.5.4-1 ORRÜREGBEN ALKALMAZOTT (NAZÁLIS) GYÓGYSZERKÉSZÍTMÉNYEK Nasalia 04/2006:0676 Az orrüregben alkalmazott (nazális) szisztémás vagy helyi hatás elérésére
A BIZOTTSÁG VÉGREHAJTÁSI HATÁROZATA (EGT vonatkozású szöveg) (CSAK A DÁN NYELVŰ SZÖVEG HITELES)
 EURÓPAI BIZOTTSÁG Brüsszel, 29.6.2011 C(2011)4837 végleges A BIZOTTSÁG VÉGREHAJTÁSI HATÁROZATA 29.6.2011 az emberi felhasználásra szánt "Instanyl - Fentanil" gyógyszer számára a C(2009)5900 határozat alapján
EURÓPAI BIZOTTSÁG Brüsszel, 29.6.2011 C(2011)4837 végleges A BIZOTTSÁG VÉGREHAJTÁSI HATÁROZATA 29.6.2011 az emberi felhasználásra szánt "Instanyl - Fentanil" gyógyszer számára a C(2009)5900 határozat alapján
I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14
 I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14 1. AZ ÁLLATGYÓGYÁSZATI GYÓGYSZERKÉSZÍTMÉNY NEVE INCURIN 1 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: ösztriol 1 mg/tabletta
I.SZ. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/14 1. AZ ÁLLATGYÓGYÁSZATI GYÓGYSZERKÉSZÍTMÉNY NEVE INCURIN 1 mg tabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: ösztriol 1 mg/tabletta
JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ. Gyógyszertári asszisztens szakképesítés
 Nemzeti Erőforrás Minisztérium Korlátozott terjesztésű! Érvényességi idő: az írásbeli vizsgatevékenység befejezésének időpontjáig A minősítő neve: Rauh Edit A minősítő beosztása: mb. főigazgató-helyettes
Nemzeti Erőforrás Minisztérium Korlátozott terjesztésű! Érvényességi idő: az írásbeli vizsgatevékenység befejezésének időpontjáig A minősítő neve: Rauh Edit A minősítő beosztása: mb. főigazgató-helyettes
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Magsugárzások, Radioaktív izotópok. Az atom alkotórészei. Az atom felépítése. A radioaktivitás : energia kibocsátása
 Magsugárzások, Radioaktív izotópok radioaktivitás : energia kibocsátása az atommagból részecskék vagy elektromágneses sugárzás formájában z atom felépítése z atom alkotórészei protonok neutronok nukleonok
Magsugárzások, Radioaktív izotópok radioaktivitás : energia kibocsátása az atommagból részecskék vagy elektromágneses sugárzás formájában z atom felépítése z atom alkotórészei protonok neutronok nukleonok
Atomerőművi dekontamináló berendezés gépész. Atomerőművi gépész
 A 10/07 (II. 27.) SzMM rendelettel módosított 1/06 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
A 10/07 (II. 27.) SzMM rendelettel módosított 1/06 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
2008.12.12. Az Európai Unió Hivatalos Lapja L 334/7
 2008.12.12. Az Európai Unió Hivatalos Lapja L 334/7 A BIZOTTSÁG 1234/2008/EK RENDELETE (2008. november 24.) az emberi, illetve állatgyógyászati felhasználásra szánt gyógyszerkészítmények forgalomba hozatali
2008.12.12. Az Európai Unió Hivatalos Lapja L 334/7 A BIZOTTSÁG 1234/2008/EK RENDELETE (2008. november 24.) az emberi, illetve állatgyógyászati felhasználásra szánt gyógyszerkészítmények forgalomba hozatali
A BIZOTTSÁG 354/2013/EU VÉGREHAJTÁSI RENDELETE
 L 109/4 Az Európai Unió Hivatalos Lapja 2013.4.19. A BIZOTTSÁG 354/2013/EU VÉGREHAJTÁSI RENDELETE (2013. április 18.) az Európai Parlament és a Tanács 528/2012/EU rendeletének megfelelően engedélyezett
L 109/4 Az Európai Unió Hivatalos Lapja 2013.4.19. A BIZOTTSÁG 354/2013/EU VÉGREHAJTÁSI RENDELETE (2013. április 18.) az Európai Parlament és a Tanács 528/2012/EU rendeletének megfelelően engedélyezett
az energiával kapcsolatos termékek energia- és egyéb erőforrás-fogyasztásának címkézéssel
 Megjelent az energiával kapcsolatos termékek kötelező címkézésére vonatkozó kormányrendelet, mely alapján energiával kapcsolatos termék akkor hozható forgalomba vagy helyezhető üzembe, ha megfelel az adott
Megjelent az energiával kapcsolatos termékek kötelező címkézésére vonatkozó kormányrendelet, mely alapján energiával kapcsolatos termék akkor hozható forgalomba vagy helyezhető üzembe, ha megfelel az adott
Az állapot súlyosságától függően prekóma vagy kóma esetében 24 óra alatt az adag 8 ampulláig emelhető.
 1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
Radioaktív nyomjelzés
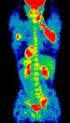 Radioaktív nyomjelzés A radioaktív nyomjelzés alapelve Kémiai indikátorok: ugyanazoknak a követelményeknek kell eleget tenniük, mint az indikátoroknak általában: jelezniük kell valamely elemnek ill. vegyületnek
Radioaktív nyomjelzés A radioaktív nyomjelzés alapelve Kémiai indikátorok: ugyanazoknak a követelményeknek kell eleget tenniük, mint az indikátoroknak általában: jelezniük kell valamely elemnek ill. vegyületnek
