Aminosavak, peptidek, fehérjék
|
|
|
- Szebasztián Bodnár
- 8 évvel ezelőtt
- Látták:
Átírás
1 Aminosavak, peptidek, fehérjék
2 Aminosavak NH 2, NH, N, N C Amino- és karboxilcsoport egy molekulában. H Csoportosítás - az amin rendűsége szerint (első, másod, harmad, negyedrendű) - az amino- és karboxil-csoportok száma szerint monoamino-monokarbonsav diamino-monokarbonsav monoamino-dikarbonsav, stb - a szénlánc szerkezete szerint nyíltláncú, gyűrűs, alifás, aromás
3 Nyíltláncú, alifás, monoamino-monokarbonsavak H 2 N CH 2 CH H 3 C CH CH 3 β 2 α NH 2 1 Amino-ecetsav Amino-etánsav Glicin α-amino-propionsav 2-amino-propánsav Alanin H 2 N CH 2 CH 2 CH H 2 N (CH 2 ) 5 CH β-amino-propionsav 3-amino-propánsav β-alanin ε-amino kapronsav 6-amino-hexánsav
4 H 2 N-CH 2 -CH Glicin (Gly) G Glycin Fehérjealkotó aminosavak R H H 2 N CH α-c-n helyettesített α-aminosavak N CH H Prolin (Pro) P R = CH 3 CH 3 CH 3 CH 3 CH 3 CH 3 CH 3 Alanin (Ala) A Valin (Val) V Leucin (Leu) L Izoleucin (Ile) I Isoleucin Fenilalanin (Phe) F Phenylalanin H Szerin (Ser) S Serin CH 3 H SH Cisztein (Cys) C Cystein Treonin (Thr) T Threonin S CH3 Metionin (Met) M Methionin -S-S- Cisztin
5 R = H Tirozin (Tyr) Y Tyrosin H Aszparaginsav (Asp) D Aspartic acid NH 2 N H Triptofán (Trp) W Tryptophan NH 2 H Glutaminsav (Glu) E Glutamic acid N N H Hisztidin (His) H Histidin N H NH 3 Lizin (Lys) K Lysin NH 2 NH 2 Arginin (Arg) R Arginin Fehérjealkotó aminosavak: glicin, alanin + 18 alaninszármazék Aszparagin (Asn) N Asparagin Glutamin (Gln) Q Glutamin királisak, L konfiguráció, S(Cys R)
6
7 1. Sav-bázis jelleg H N CH 2 C H H aminoecetsav gyakorlatilag nem létezik Kémiai tulajdonságok H H N CH 2 C H glicin ikerion gyenge sav gyenge bázis pi=6 izoelektromos pont alanin pufferhatása
8 2. Karboxilcsoportra jellemző tulajdonságok savszármazékok amidok 3. Aminocsoportra jellemző tulajdonságok acilezhető α-aminosavval acilezett α-aminosav peptid α-aminosavak előállítása: 1. Kinyerés fehérje hidrolizátumból, vagy fermentléből pl. lizin (Lys) cukorgyári melaszból 2. Kémiai szintézis β α c. Strecker szintézis a. ammónia b. Gabriel szintézis d. malonészter szintézis
9 a. Halogénezett karbonsavból ammóniával Cl CH 2 CH + NH 3 H 2 N CH 2 CH + NH 4 Cl b. Gabriel-szintézissel glicin c. Strecker-Zelinszkij szintézis aldehidből CH 2 C α H NH 4 Cl NH 4 CN -H 2 CH 2 CH CN H H 2 NH 2 CH 2 CH CH NH 2 α-aminonitril DL-fenilalanin
10 d. Malonészterből α β malonsavdietilészter acetamino-malonészter malonészter DL-szerin hidroklorid
11 Peptidek peptidkötés H 2 N CH CH H 2 N CH CH -H 2 H 2 N CH C NH CH CH R 1 α-aminosavak R 2 R 1 peptid R 2 H 2 N CH C NH CH C NH CH CH n Q Q Q N-terminus (amino láncvég) polipeptid (fehérjelánc) (a Q húszféle csoportot jelenthet!) C-terminus (karboxil láncvég) polikondenzáció, poliamid
12 CH 3 H 2 N-CH 2 -C-NH-CH-C-NH-CH 2 -CH glicil - alanil - glicin H-Gly-Ala-Gly-H GAG
13 Peptidek szerkezetmeghatározása 1. Aminosav összetétel: hidrolízis aminosav analízis a. papírkromatográfia, vékonyréteg-kromatográfia előhívás b. oszlopkromatogáfia - ioncserélő - RP-HPLC származék képzés elválasztás után elválasztás előtt
14 2. Peptid szekvenciameghatározás R 1 R 3 a. Edman lebontás N C S fenil-izotiocianát + H 2 N _ H NH R 2 NH NH S NH R 1 NH R 2 NH R 3 H + R 1 N NH S 2-anilino-tiazolidin-5-on vizes HCl H + fenil-tiokarbamoil-peptid TFA H 2 N NH R 2 R 3 NH S NH R 1 H _ H2 NH S 3-fenil-2-tiohidantoin (PTH-aminosav) NH feniltiokarbamoil-aminosav R 1
15 Peptidszekvencia meghatározás tömegspektrométerrel Tömegspektrométer: 1. a vizsgált molekulákat ionizálja 2. az elektromos térben felgyorsított ionokat m/z értékük szerint szétválasztja VSPTDIEEGMR a. fragmentálódás b. y fragmensek
16 + Peptidszintézis H H H H-N-CH-C-H + H-N-CH-C-H + H-N-CH-C-H + Q 1 Q 2 Q 3... H H H... - N-CH-C-N-CH-C-N-CH-C-... Q 1 Q 2 Q 3
17 Dipeptid szintézis R 1 R 1 N H 2 H N H 2 H N H 2 NH H védés R 2 R 2 R 1 YHN H védés védőcsoport eltávolítás aktíválás YHN R 1 X N H 2 Z kapcsolás YHN R 1 NH Z R 2 R 2 Védőcsoport: átmenetileg megszünteti egy funkciós csoport reaktivitását, legyen könnyen, jó hozammal bevihető és enyhe körülmények közt eltávolítható X = aktíváló csoport Y = amino-védőcsoport, Z = karboxil-védőcsoport
18 N H 2 H R3 YNH H R3 YNH R3 X YNH R1 N H Z R2 N H 2 R1 N H Z R2 YNH R1 N H H R2 YNH R1 N H X R2 Z YNH R1 N H R2 N H R3 Z YNH R3 N H R1 N H R2 N H 2 Z R3 N H 2 H R3 C N N C szelektív védőcsoport hasítás racemizáció! Tripeptid szintézis, lánchosszabbítás
19 Uretán típusú aminovédőcsoportok szénsav félamid-félészter uretán C 2 H 5 CNH 2 fluoren Z -, N-karbonsav PhCH 2 --C-Cl + H 2 N-CH 2 -CH PhCH 2 --C-NH-CH 2 -CNa Z = benziloxi-karbonil, Boc = terc.-butiloxi-karbonil, Fmoc = 9-fluorenilmetiloxi-karbonil
20 Karboxil védőcsoport: benzil-észter, terc.-butil-észter ldallánc védőcsoport: Asp, Glu, Lys, Cys (Arg, His, Ser, Thr, Tyr, Asn, Gln) A védőcsoportokra a szintézis végéig szükségünk van az oldalláncokon és a felépítendő molekula láncvégein (tartós védelem), a továbbépülő láncvégeken a védőcsoportot minden láchosszabbítás előtt szelektíven el kell távolítani (átmeneti védelem).
21 Aktiváló csoportok: aktív észterek p-nitrofenil-észter N-hidroxi-szukcinimid- észter kondenzálószerek diciklohexil-karbodiimid (DCC) DCU
22 védőcsoportok: átmeneti: Boc tartós: Z, Cys(Bzl) C-term.- on nem kell, mert amid Peptidek az élő szervezetben: hormonok, neurotranszmitterek xitocin szintézis M. Bodánszky, V. du Vigneaud aminosav, 8 peptidkötés láncépítés: 2x7+1 reakciólépés + 1 végső védőcsop. eltáv. + 1 diszulfid képzés = 17 reakciólépés, 15 izolált intermedier
23 Szilárd fázisú peptidszintézis polimer hordozó 1. funkcionalizálás polisztirol- 0,5% DVB 2. az első védett aminosav kapcsolása 3. az átmeneti védőcsoport eltávolítása 4. a következő védett aminosav kapcsolása R R 5. a 3. és 4. lépés ismétlése szükség szerinti számban Cl R'-CH 6. a peptid lehasítása a gyantáról, az összes védőcsoport eltávolítása R' R R. B. Merrifield 1963
24 nagy reagens felesleg: gyors reakció, 100% konverzió izolálás: mosással tisztítás: HPLC (csak a végtermék tisztítható) miniatürizálás automatizálás hagyományos (oldatfázisú) peptidszintézis vegyszerigény kicsi nagy oldószerigény kicsi nagy szilárdfázisú hozam közepes magas (>90%) sarzsméret g-tól több kgig (>0,1g) automatizálható nem igen időigény nagy kicsi néhány mg-tól több g-ig munkaigény nagy igen kicsi intermedier izolált, tisztítható nem izolálható ezért nem tisztítható
25 Fehérjék több száz (ritkán több ezer) aminosavból álló polipeptidlánc, többnyire stabil konformáció (a felületi hurkok, oldalláncok mozgékonyak, a vázelemek is elmozdulhatnak egymás mellett) A fehérjék szerepe az élő anyagban alapvető protein (proteosz = első) proteom: egy sejt, szövet, vagy egy élőlény teljes fehérjekészlete (vö. gén genom)
26 Fehérjék molekulaszerkezete KNSTITÚCIÓ 1. Elsődleges szerkezet: aminosav sorrend (szekvencia), meghatározása tömegspektrometriával, DNS szekvencia alapján KNFRMÁCIÓ (meghatározása Röntgen diffrakcióval, NMR-rel) 2. Másodlagos szerkezet: periodikusan rendezett szakaszok 3. Harmadlagos szerkezet: jellemzően gombolyagszerkezet: periodikusan és nem periodikusan rendezett szakaszokból áll Szerkezeti típusok: - fonal (fibrilláris) - gombolyag (globuláris) sokszor egy láncon több gombolyag (domének) - membránfehérje, transzmembrán szakasz(ok) - eredendően rendezetlen fehérje (nincs stabilis konformációja, IDP, IUP) 4. Negyedleges szerkezet: több láncból álló fehérje asszociátum szerkezete
27 1. Fehérjék molekulatömeg meghatározása tömegspektrométerrel a. Elektroporlasztásos ionizálás : a többszörösen töltött molekulaionok képződése kiterjeszti a méréshatárt, növeli a pontosságot +16 mioglobin mt: Da b. Mátrixszal segített lézerdeszorbciós ionizálás (MALDI-TF) : a lézerfénnyel gerjesztett mátrix ionizálja a mintát, repülési időből határozza meg a tömeget, fmol (10-18 mol) mintaméret
28 2. Fehérjék aminosavsorrendjének meghatározása (elsődleges szerkezet) A. a. enzimes hidrolízis b. a peptid keverék szétválasztása, a komponensek aminosavsorrendjének meghatározása (LC-MS) c. a szerkezet részletek összeillesztése átfedő szekvenciák segítségével B. Ha ismert a fehérjét termelő szervezet genomja, a fehérjéből nyert peptid aminosavsorrendjének segítségével azonosítható az őt kódoló gén, és ezzel a fehérje teljes aminosavsorrendje is megismerhető.
29 Fehérjekeverék komponenseinek azonosítása Előkészítés: 1.Fehérjekeverék elválasztása 2D gélelektroforézissel (izoelektromos fókuszálás + SDS-gélelktroforézis), utána enzimes hasítás 2. Enzimes hasítás, utána fordított fázisú kromatográfia (RPHPLC) LC-MS Tandem tömegspektrométer (MS/MS) : elválasztás fragmentálás szekvencia meghatározás azonosítás kda 100 ioncsapda detektor szeres felbontás! (Nature szerző) 30 7 ph3 10 enzimes emésztésre kivett minták 2D elektroferogram Ezen az úton a vizsgált minta, több mintából a vizsgált szervezet teljes fehérje készlete (proteom) azonositható (bioinformatika, nincs szükség a teljes aminosavsorrend meghatározására!). A minta fehérjéinek rendszer szintű vizsgálata is megvalósítható.
30 Humán proteom DNS pre-mrns mrns fehérje fehérje átírás érés, splicing transzláció transzláció utáni módosulások ~ gén több százezer egy génből többféle mrns polipeptidek módosított polipeptidek Transzláció utáni módosulások: - diszulfid kötések Cys SH-csoportok között - peptidlánc hasadás - láncvég módosulások (N-terminális Glu - piroglutamil, C-terminális amid Gly lebomlásával) - acetilezés - foszforilezés - glikozilezés Ser, Thr, Asn - fém ionok, kis molekulák kapcsolódása (pl. hem) - stb. összesen ~50-féle glükóz N-acetil-glükozamin mannóz galaktóz 5-acetil-neuraminsav fukóz N-acetil-galaktozamin
31 a. Röntgen diffrakció: 3. A fehérjék térszerkezetének meghatározása (másod- és harmadlagos szerkezet) A Röntgen sugarak a kristályok rácsán áthatolva szóródnak. Ez a visszavert sugarak interferenciája miatt csak meghatározott irányokban észlelhető. A szóródott hullámok intenzitása (és a beeső sugárhoz viszonyított fázisa) a rácsot felépítő molekuláknak az elhelyezkedésétől függ. Értékükből a rács elemi cellájának elektronsűrűség térképe kiszámítható, ezzel a rácsot felépítő molekulák térbeli szerkezete meghatározható. b. NMR spektroszkópia: A térben egymáshoz közel álló atomok közti távolságokra nyerhető NMR adatokból is meg lehet határozni a fehérjék térszerkezetét. Ebben segítséget jelent, ha a hidrogén atomokon kívül más NMR jelet adó atom pl. 15 N is van a molekulában. Ehhez a fehérjét jelzett aminosavakat tartalmazó táptalajon baktériummal kell szintetizáltatni. A távolságadatokból több egymáshoz közel álló alternatív szerkezet nyerhető. c. Elektron mikroszkópia szinkrotron röntgensugárzással kapott diffrakciós kép
32 ~ új szerkezet/év > Fehérje és nukleinsav térszerkezetek a Fehérje Adatbankban (Protein Data Bank) február 28.
33 A fehérje konformáció meghatározói: 1. mozgási (forgási) lehetőségek (a lánc gerince, oldalláncok) 2. konformációt stabilizáló, molekulán belüli (intramolekuláris) kölcsönhatások - poláris hidrogénkötés sókötés - apoláris hidrofób kölcsönhatások a peptidlánc gerince: poláris N - H hidrogén donor C = hidrogén akceptor az aminosav oldalláncok: kétfélék poláris (hidrofil) D, E, K, R; S, T, N, Q, Y, W apoláris (hidrofób) A, V, L, I, F, P, M nem kategorizálható G, C
34 Apoláris (hidrofób) kölcsönhatás P P dipól-dipól kölcsönhatás A P indukált dipól kölcsönhatás A A diszperziós erők A P A P A A P P AP AP AA PP H 2 A fehérje konformációt nagyszámú, kisenergiájú kölcsönhatás együttesen hozza létre. Egy tagú peptidláncból akkor képződik stabilis gombolyag, ha a belsejében az apoláris oldalláncok halmozódnak és a lánc gerincének poláris csoportjai egymással le vannak kötve. Ilyenkor a vízmolekulák a gombolyag belsejéből kiszöknek.
35 A fehérjemolekula konformációját a peptidlánc gerincének konformációja határozza meg -C-NH-C α HR-C-NH-C α HR-C-NH- a peptidlánc gerince a gerinc görbületét az ω, φ és ψ diéderszögek értékei írják le C α NH C C α NH C C C α NH C C α ω φ ψ NH torziós v. diéder szög
36 a C-NH konjugáció miatt ω mentén nincs szabad forgás C α C N C α ω = 180 o ω = ~ 180 o ω = ~ 0 o
37 N Cα - C - N ψ ψ = 180 o C N C α C φ φ = 180 o
38 Φ = 180 o ψ = 180 o Φ = 0 o ψ = 180 o R = H! ψ L Φ = 180 o ψ = 0 o Ramachandran diagram nincs szabad körbe forgás Φ Φ = 0 o ψ =0 o
39 lepke Φ = o ψ = +135 o ψ NH C Φ csavart NH C Φ = - 57 o ψ = - 47 o előnyös helyzetek
40 Másodlagos szerkezetek keratin dimer mikrofibrillum protofilament a hajszál szerkezete α-hélix csavart elemek egymás fölött mikrofibrillum makrof. H-kötések 5,47 A = = 3,61. 1,50 A peptidlánc
41 H- kötések párhuzamos láncok 6,95 A = 2. 3,47 A β-redőzött réteg váltakozó lepke elemek szalagot képeznek H- kötések az R-csoportok az alsó és a felső oldalon a törésvonalakon sorokat alkotnak ellentétes láncok
42 egymásra halmozott β-rétegek GAGAGAGAGA Selyem fibroin
43 Harmadlagos szerkezet másodlagos szerkezetű szakaszok + összekötő szakaszok, hurkok α-szerkezetek mioglobin 153 as
44 α/β-szerkezetek aszpartát karbamoiltranszferáz flavodoxin plasztocianin
45 hidrofób csoportok hidrofil csoportok α-szénatomok hálózata olaj szappan micella citokróm c - a gombolyag belsejéből kiszorul a víz - A H-donorok és akceptorok egymással vannak lekötve
46 Ámbrás cet mioglobinjának H-hélixe hidrofób csoportok 18 as > 5 menet hidrofil csoportok AQGAM NKAL E LFRKDI AA
47 Antiparallel β-réteg a concanavalin-a felületén a peptidláncok gerince fehér hidrofil csoportok hidrofób csoportok
48 denaturált állapot rendezetlen lánc (random coil) mozgási szabadság Felgombolyodás, összetekeredés (folding) energiatölcsér E intramolekuláris kontaktusok száma H-kötések száma (szekunder struktúra) natív szerkezet felgombolyodott állapot hidrofób kontaktusok száma (apoláris kölcsönhatás) elfoglalt térfogat Az elsődleges szerkezet egyértelműen meghatározza a fehérjemolekula térszerkezetét (ez lehet rendezetlen is!). Biztosítja ebben az irányban a gyors felgombolyodást (msec!).
49 Negyedleges szerkezet fehérje asszociátumok hemoglobin
50 Fehérjék működés közben kovalens szerkezet? térszerkezet? funkció 1. HIV proteáz (homodimer) enzim-szubsztrát komplex oldallánc zsebek hasadó kötés
51 Pepszin monomer, 2 domén
52 2. Hemoglobin β 146 as α 141 as mioglobin 154 as
53
54 szövetek tüdő mioglobin hemoglobin
55 Membrán fehérjék: transzport fehérjék, receptorok
56 befelé nyitott foszforilezett kifelé nyitott 3. Nátrium-kálium pumpa E 1 E 2 Na+ -kötő K+ -kötő E 2 E 1 E 1
Aminosavak, peptidek, fehérjék
 Aminosavak, peptidek, fehérjék Jelentőség Protein (Berzelius: protos, proteios) ligo- és polipepitdek (hormonok) Önmagában hormon és neurotranszmitter Aminosav bifunkciós vegyület Aminocsoport Karboxilcsoport
Aminosavak, peptidek, fehérjék Jelentőség Protein (Berzelius: protos, proteios) ligo- és polipepitdek (hormonok) Önmagában hormon és neurotranszmitter Aminosav bifunkciós vegyület Aminocsoport Karboxilcsoport
MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak
 Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek
 Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
A sejtek élete. 5. Robotoló törpék és óriások Az aminosavak és fehérjék R C NH 2. C COOH 5.1. A fehérjeépítőaminosavak általános
 A sejtek élete 5. Robotoló törpék és óriások Az aminosavak és fehérjék e csak nézd! Milyen protonátmenetes reakcióra képes egy aminosav? R 2 5.1. A fehérjeépítőaminosavak általános képlete 5.2. A legegyszerűbb
A sejtek élete 5. Robotoló törpék és óriások Az aminosavak és fehérjék e csak nézd! Milyen protonátmenetes reakcióra képes egy aminosav? R 2 5.1. A fehérjeépítőaminosavak általános képlete 5.2. A legegyszerűbb
Aminosavak általános képlete NH 2. Csoportosítás: R oldallánc szerkezete alapján: Semleges. Esszenciális aminosavak
 Aminosavak 1 Aminosavak általános képlete N 2 soportosítás: oldallánc szerkezete alapján: Apoláris Poláris Bázikus Savas Semleges Esszenciális aminosavak 2 (apoláris) Glicin Név Gly 3 Alanin Ala 3 3 Valin
Aminosavak 1 Aminosavak általános képlete N 2 soportosítás: oldallánc szerkezete alapján: Apoláris Poláris Bázikus Savas Semleges Esszenciális aminosavak 2 (apoláris) Glicin Név Gly 3 Alanin Ala 3 3 Valin
3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások)
 3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások) 3.1 Fehérjék, enzimek A genetikai információ egyik fő manifesztálódása
3. Sejtalkotó molekulák III. Fehérjék, enzimműködés, fehérjeszintézis (transzkripció, transzláció, poszt szintetikus módosítások) 3.1 Fehérjék, enzimek A genetikai információ egyik fő manifesztálódása
A fehérjék hierarchikus szerkezete
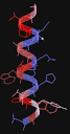 Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
Szerkesztette: Vizkievicz András
 Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
 9. Előadás Fehérjék Előzmények Peptidkémia Analitikai kémia Protein kémia 1901 E.Fischer : Gly-Gly 1923 F. Pregl : Mikroanalitika 1952 Stein and Moore : Aminosav analizis 1932 Bergman és Zervas : Benziloxikarbonil
9. Előadás Fehérjék Előzmények Peptidkémia Analitikai kémia Protein kémia 1901 E.Fischer : Gly-Gly 1923 F. Pregl : Mikroanalitika 1952 Stein and Moore : Aminosav analizis 1932 Bergman és Zervas : Benziloxikarbonil
A fehérjék hierarchikus szerkezete
 Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
9. Szilárdfázisú szintézisek. oligopeptidek, oligonukleotidok
 9. Szilárdfázisú szintézisek oligopeptidek, oligonukleotidok Peptidszintézis Amidkötés kialakítása R H + H 2 Q R Q + H 2 H R H + H 2 Q R + H 3 Q sav-bázis reakció már nem nukleofil Amidkötés kialakítása
9. Szilárdfázisú szintézisek oligopeptidek, oligonukleotidok Peptidszintézis Amidkötés kialakítása R H + H 2 Q R Q + H 2 H R H + H 2 Q R + H 3 Q sav-bázis reakció már nem nukleofil Amidkötés kialakítása
3. Sejtalkotó molekulák III.
 3. Sejtalkotó molekulák III. Fehérjék, fehérjeszintézis (transzkripció, transzláció, posztszintetikus módosítások). Enzimműködés 3.1 Fehérjék A genetikai információ egyik fő manifesztálódása Számos funkció
3. Sejtalkotó molekulák III. Fehérjék, fehérjeszintézis (transzkripció, transzláció, posztszintetikus módosítások). Enzimműködés 3.1 Fehérjék A genetikai információ egyik fő manifesztálódása Számos funkció
Aminosavak, peptidek, fehérjék. Béres Csilla
 Aminosavak, peptidek, fehérjék Béres Csilla Aminosavak Az aminosavak (más néven aminokarbonsavak) olyan szerves vegyületek, amelyek molekulájában aminocsoport (- NH 2 ) és karboxilcsoport (-COOH) egyaránt
Aminosavak, peptidek, fehérjék Béres Csilla Aminosavak Az aminosavak (más néven aminokarbonsavak) olyan szerves vegyületek, amelyek molekulájában aminocsoport (- NH 2 ) és karboxilcsoport (-COOH) egyaránt
A fehérjék szerkezeti hierarchiája. Fehérje-szerkezetek! Klasszikus szerkezet-funkció paradigma. szekvencia. funkció. szerkezet! Myoglobin.
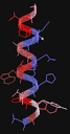 Myoglobin Fehérje-szerkezetek! MGLSDGEWQLVLNVWGKVEADIPGGQEVLIRLFK GPETLEKFDKFKLKSEDEMKASE DLKKGATVLTALGGILKKKGEAEIKPLAQSA TKKIPVKYLEFISECIIQVLQSK PGDFGADAQGAMNKALELFRKDMASNYKELGFQG Fuxreiter Mónika! Debreceni
Myoglobin Fehérje-szerkezetek! MGLSDGEWQLVLNVWGKVEADIPGGQEVLIRLFK GPETLEKFDKFKLKSEDEMKASE DLKKGATVLTALGGILKKKGEAEIKPLAQSA TKKIPVKYLEFISECIIQVLQSK PGDFGADAQGAMNKALELFRKDMASNYKELGFQG Fuxreiter Mónika! Debreceni
A fehérjék szerkezete és az azt meghatározó kölcsönhatások
 A fehérjék szerkezete és az azt meghatározó kölcsönhatások 1. A fehérjék szerepe az élõlényekben 2. A fehérjék szerkezetének szintjei 3. A fehérjék konformációs stabilitásáért felelõs kölcsönhatások 4.
A fehérjék szerkezete és az azt meghatározó kölcsönhatások 1. A fehérjék szerepe az élõlényekben 2. A fehérjék szerkezetének szintjei 3. A fehérjék konformációs stabilitásáért felelõs kölcsönhatások 4.
Fehérjeszerkezet, és tekeredés
 Fehérjeszerkezet, és tekeredés Futó Kinga 2013.10.08. Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983
Fehérjeszerkezet, és tekeredés Futó Kinga 2013.10.08. Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983
4. FEHÉRJÉK. 2. Vázanyagok. Az izmok alkotórésze (pl.: a miozin). Inak, izületek, csontok szerves komponensei, az ún. vázfehérjék (szkleroproteinek).
 4. FEÉRJÉK 4.0. Bevezetés A fehérjék elsısorban α-l-aminosavakból felépülı biopolimerek. A csak α-laminosavakat tartalmazó fehérjék a proteinek. evüket a görög proteios szóból kapták, ami elsırangút jelent.
4. FEÉRJÉK 4.0. Bevezetés A fehérjék elsısorban α-l-aminosavakból felépülı biopolimerek. A csak α-laminosavakat tartalmazó fehérjék a proteinek. evüket a görög proteios szóból kapták, ami elsırangút jelent.
9. Előadás. Fehérjék
 9. Előadás Fehérjék Előzmények Peptidkémia Analitikai kémia Protein kémia 1901 E. Fischer : Gly-Gly 1932 Max Bergman és Leonidas Zervas : Benziloxi-karbonil csoport 1963 B. Merrifield : Szilárd fázisú
9. Előadás Fehérjék Előzmények Peptidkémia Analitikai kémia Protein kémia 1901 E. Fischer : Gly-Gly 1932 Max Bergman és Leonidas Zervas : Benziloxi-karbonil csoport 1963 B. Merrifield : Szilárd fázisú
FEHÉRJÉK A MÁGNESEKBEN. Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium. Alkímia Ma, Budapest,
 FEHÉRJÉK A MÁGNESEKBEN Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium Alkímia Ma, Budapest, 2013.02.28. I. FEHÉRJÉK: L-α aminosavakból felépülő lineáris polimerek α H 2 N CH COOH amino
FEHÉRJÉK A MÁGNESEKBEN Bodor Andrea ELTE, Szerkezeti Kémiai és Biológiai Laboratórium Alkímia Ma, Budapest, 2013.02.28. I. FEHÉRJÉK: L-α aminosavakból felépülő lineáris polimerek α H 2 N CH COOH amino
INFORMATIKA EMELT SZINT%
 Szövegszerkesztés, prezentáció, grafika, weblapkészítés 1. A fényképezés története Táblázatkezelés 2. Maradékos összeadás Adatbázis-kezelés 3. Érettségi Algoritmizálás, adatmodellezés 4. Fehérje Maximális
Szövegszerkesztés, prezentáció, grafika, weblapkészítés 1. A fényképezés története Táblázatkezelés 2. Maradékos összeadás Adatbázis-kezelés 3. Érettségi Algoritmizálás, adatmodellezés 4. Fehérje Maximális
Bioinformatika 2 5.. előad
 5.. előad adás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2009. 03. 21. Fehérje térszerkezet t megjelenítése A fehérjék meglehetősen összetett
5.. előad adás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2009. 03. 21. Fehérje térszerkezet t megjelenítése A fehérjék meglehetősen összetett
9. Szilárdfázisú szintézisek. oligopeptidek, oligonukleotidok
 9. Szilárdfázisú szintézisek oligopeptidek, oligonukleotidok Peptidszintézis Amidkötés kialakítása R O OH + H 2 N Q R O Q N + H 2 O H R O OH + H 2 N Q R O O + H 3 N Q sav-bázis reakció már nem nukleofil
9. Szilárdfázisú szintézisek oligopeptidek, oligonukleotidok Peptidszintézis Amidkötés kialakítása R O OH + H 2 N Q R O Q N + H 2 O H R O OH + H 2 N Q R O O + H 3 N Q sav-bázis reakció már nem nukleofil
A fehérjék hierarchikus szerkezete. Szerkezeti hierarchia. A fehérjék építőkövei az aminosavak. Fehérjék felosztása
 Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
Fehérjék felosztása A fehérjék hierarchikus szerkezete Smeller László Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biológiai funkció alapján Enzimek (pl.: tripszin, citokróm-c ) Transzportfehérjék
Glükoproteinek (GP) ELŐADÁSVÁZLAT ORVOSTANHALLGATÓK RÉSZÉRE
 Glükoproteinek (GP) ELŐADÁSVÁZLAT ORVOSTANHALLGATÓK RÉSZÉRE SZTE ÁOK Biokémia Intézet összeállította: dr Keresztes Margit Jellemzők - relative rövid oligoszacharid láncok ( 30) (sok elágazás) (1-85% GP
Glükoproteinek (GP) ELŐADÁSVÁZLAT ORVOSTANHALLGATÓK RÉSZÉRE SZTE ÁOK Biokémia Intézet összeállította: dr Keresztes Margit Jellemzők - relative rövid oligoszacharid láncok ( 30) (sok elágazás) (1-85% GP
KARBONSAVAK. A) Nyílt láncú telített monokarbonsavak (zsírsavak) O OH. karboxilcsoport. Példák. pl. metánsav, etánsav, propánsav...
 KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
Peptidek (savamidok) szintézise. feladat: a szintéziskor elvben csak egy mól vizet kell elvonni peptidkötésenként, ám az ördög a részletekben rejlik.
 Peptidek (savamidok) szintézise feladat: a szintéziskor elvben csak egy mól vizet kell elvonni peptidkötésenként, ám az ördög a részletekben rejlik. 1 avamidok (peptidek) szintézise és hidrolízise megfigyelés:
Peptidek (savamidok) szintézise feladat: a szintéziskor elvben csak egy mól vizet kell elvonni peptidkötésenként, ám az ördög a részletekben rejlik. 1 avamidok (peptidek) szintézise és hidrolízise megfigyelés:
Az élő anyag szerkezeti egységei: víz, nukleinsavak, fehérjék. elrendeződés, rend, rendszer, periodikus ismétlődés
 Az élő anyag szerkezeti egységei: víz, nukleinsavak, fehérjék Agócs Gergely 2013. december 3. kedd 10:00 11:40 1. Mit értünk élő anyag alatt? Az élő szervezetet felépítő anyagok. Az anyag azonban nem csupán
Az élő anyag szerkezeti egységei: víz, nukleinsavak, fehérjék Agócs Gergely 2013. december 3. kedd 10:00 11:40 1. Mit értünk élő anyag alatt? Az élő szervezetet felépítő anyagok. Az anyag azonban nem csupán
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Hemoglobin - myoglobin. Konzultációs e-tananyag Szikla Károly
 Hemoglobin - myoglobin Konzultációs e-tananyag Szikla Károly Myoglobin A váz- és szívizom oxigén tároló fehérjéje Mt.: 17.800 153 aminosavból épül fel A lánc kb 75 % a hélix 8 db hélix, köztük nem helikális
Hemoglobin - myoglobin Konzultációs e-tananyag Szikla Károly Myoglobin A váz- és szívizom oxigén tároló fehérjéje Mt.: 17.800 153 aminosavból épül fel A lánc kb 75 % a hélix 8 db hélix, köztük nem helikális
Bioinformatika 2 5. előadás
 5. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2018.10.01. Fehérje térszerkezet megjelenítése A fehérjék meglehetősen összetett szerkezetek,
5. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2018.10.01. Fehérje térszerkezet megjelenítése A fehérjék meglehetősen összetett szerkezetek,
AMINOSAVAK, PEPTIDEK, FEHÉRJÉK
 AMISAVAK, PEPTIDEK, FEÉJÉK Aminosavak szerkezete, fizikai, kémiai tulajdonságai, biokémiai szerepük. Konvenció szerinti rövidítések. Aminosavak szintézise. A kötés szerkezete. Peptidszintézisek, védőcsoportok,
AMISAVAK, PEPTIDEK, FEÉJÉK Aminosavak szerkezete, fizikai, kémiai tulajdonságai, biokémiai szerepük. Konvenció szerinti rövidítések. Aminosavak szintézise. A kötés szerkezete. Peptidszintézisek, védőcsoportok,
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS
 Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Fehérjék felépítése és struktúrája. Aminosav oldalláncok. A fehérjék királis elemekből (α-l-aminosavakból) épülnek fel
 Fehérjék felépítése és struktúrája Aminosav oldalláncok A fehérjék királis elemekből (α-l-aminosavakból) épülnek fel Fehérjék szerkezete Anfinsen dogmája Anfinsen dogmája (vagy: termodinamikus hipotézis)
Fehérjék felépítése és struktúrája Aminosav oldalláncok A fehérjék királis elemekből (α-l-aminosavakból) épülnek fel Fehérjék szerkezete Anfinsen dogmája Anfinsen dogmája (vagy: termodinamikus hipotézis)
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerkesztette: Vizkievicz András
 Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
(11) Lajstromszám: E 007 952 (13) T2 EURÓPAI SZABADALOM SZÖVEGÉNEK FORDÍTÁSA
 !HU00000792T2! (19) HU (11) Lajstromszám: E 007 92 (13) T2 MAGYAR KÖZTÁRSASÁG Magyar Szabadalmi Hivatal EURÓPAI SZABADALOM SZÖVEGÉNEK FORDÍTÁSA (21) Magyar ügyszám: E 04 73892 (22) A bejelentés napja:
!HU00000792T2! (19) HU (11) Lajstromszám: E 007 92 (13) T2 MAGYAR KÖZTÁRSASÁG Magyar Szabadalmi Hivatal EURÓPAI SZABADALOM SZÖVEGÉNEK FORDÍTÁSA (21) Magyar ügyszám: E 04 73892 (22) A bejelentés napja:
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét
 Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
Integráció. Csala Miklós. Semmelweis Egyetem Orvosi Vegytani, Molekuláris Biológiai és Patobiokémiai Intézet
 Integráció Csala Miklós Semmelweis Egyetem Orvosi Vegytani, Molekuláris Biológiai és Patobiokémiai Intézet Anyagcsere jóllakott állapotban Táplálékkal felvett anyagok sorsa szénhidrátok fehérjék lipidek
Integráció Csala Miklós Semmelweis Egyetem Orvosi Vegytani, Molekuláris Biológiai és Patobiokémiai Intézet Anyagcsere jóllakott állapotban Táplálékkal felvett anyagok sorsa szénhidrátok fehérjék lipidek
A tejfehérje és a fehérjeellátás
 A tejfehérje A tejfehérje és a fehérjeellátás Fejlődő országok: a lakosság 20 30%-a hiányosan ellátott fehérjével. Fejlett ipari országok: fehérje túlfogyasztás. Az emberiség éves fehérjeszükséglete: 60
A tejfehérje A tejfehérje és a fehérjeellátás Fejlődő országok: a lakosság 20 30%-a hiányosan ellátott fehérjével. Fejlett ipari országok: fehérje túlfogyasztás. Az emberiség éves fehérjeszükséglete: 60
3. Aminosavak gyártása
 3. Aminosavak gyártása Előállításuk Fehérje-hidrolizátumokból: cisztein, leucin, aszparaginsav, tirozin, glutaminsav Kémiai szintézissel: metionin, glicin, alanin, triptofán (reszolválás szükséges) Biotechnológiai
3. Aminosavak gyártása Előállításuk Fehérje-hidrolizátumokból: cisztein, leucin, aszparaginsav, tirozin, glutaminsav Kémiai szintézissel: metionin, glicin, alanin, triptofán (reszolválás szükséges) Biotechnológiai
2. Aminosavak - Treonin
 Az aminosavak felhasználása nátrium-glutamát ízfokozó (Delikát, Vegeta) lizin, metionin, treonin, triptofán takarmány- és élelmiszerkiegészítő aszparaginsav és fenilalanin aszpartám édesítőszer gyártásához
Az aminosavak felhasználása nátrium-glutamát ízfokozó (Delikát, Vegeta) lizin, metionin, treonin, triptofán takarmány- és élelmiszerkiegészítő aszparaginsav és fenilalanin aszpartám édesítőszer gyártásához
Fehérjeszerkezet, fehérjetekeredés
 Fehérjeszerkezet, fehérjetekeredés A fehérjeszerkezet szintjei A fehérjetekeredés elmélete: Anfinsen kísérlet Levinthal paradoxon A feltekeredés tölcsér elmélet 2014.11.05. Aminosavak és fehérjeszerkezet
Fehérjeszerkezet, fehérjetekeredés A fehérjeszerkezet szintjei A fehérjetekeredés elmélete: Anfinsen kísérlet Levinthal paradoxon A feltekeredés tölcsér elmélet 2014.11.05. Aminosavak és fehérjeszerkezet
Aminosavak, peptidek, fehérjék
 Aminosavak, peptidek, fehérjék Az aminosavak a fehérjék építőkövei. A fehérjék felépítésében mindössze 20- féle aminosav vesz részt. Ezek általános képlete: Az aminosavakban, mint arra nevük is utal van
Aminosavak, peptidek, fehérjék Az aminosavak a fehérjék építőkövei. A fehérjék felépítésében mindössze 20- féle aminosav vesz részt. Ezek általános képlete: Az aminosavakban, mint arra nevük is utal van
Transzláció. Szintetikus folyamatok Energiájának 90%-a
 Transzláció Transzláció Fehérje bioszintézis a genetikai információ kifejeződése Szükséges: mrns: trns: ~40 Riboszóma: 4 rrns + ~ 70 protein 20 Aminosav aktiváló enzim ~12 egyéb enzim Szintetikus folyamatok
Transzláció Transzláció Fehérje bioszintézis a genetikai információ kifejeződése Szükséges: mrns: trns: ~40 Riboszóma: 4 rrns + ~ 70 protein 20 Aminosav aktiváló enzim ~12 egyéb enzim Szintetikus folyamatok
Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk.
 1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
Peptid- és fehérjék másodlagos-, harmadlagos- és negyedleges szerkezete
 Peptid- és fehérjék másodlagos-, harmadlagos- és negyedleges szerkezete Polipeptidek térszerkezete Tipikus (rendezett) konformerek em tipikus (rendezetlen) konformerek Periodikus vagy homokonformerek Aperiodikus
Peptid- és fehérjék másodlagos-, harmadlagos- és negyedleges szerkezete Polipeptidek térszerkezete Tipikus (rendezett) konformerek em tipikus (rendezetlen) konformerek Periodikus vagy homokonformerek Aperiodikus
AMINOSAVAK, FEHÉRJÉK
 AMINOSAVAK, FEHÉRJÉK Az aminosavak olyan szerves vegyületek, amelyek molekulájában aminocsoport (-NH2) és karboxilcsoport (-COOH) egyaránt előfordul. Felosztás A fehérjéket feloszthatjuk aszerint, hogy
AMINOSAVAK, FEHÉRJÉK Az aminosavak olyan szerves vegyületek, amelyek molekulájában aminocsoport (-NH2) és karboxilcsoport (-COOH) egyaránt előfordul. Felosztás A fehérjéket feloszthatjuk aszerint, hogy
Aminosavak, peptidek, fehérjék. Szerkezet, előállítás, kémiai tulajdonság
 Aminosavak, peptidek, fehérjék Szerkezet, előállítás, kémiai tulajdonság Aminosavak Aminosavaknak nevezzük azokat a karbonsavakat, amelyekben a szénlánc egy vagy több hidrogénjét amino (NH 2 ) csoportra
Aminosavak, peptidek, fehérjék Szerkezet, előállítás, kémiai tulajdonság Aminosavak Aminosavaknak nevezzük azokat a karbonsavakat, amelyekben a szénlánc egy vagy több hidrogénjét amino (NH 2 ) csoportra
Citrátkör, terminális oxidáció, oxidatív foszforiláció
 Citrátkör, terminális oxidáció, oxidatív foszforiláció A citrátkör jelentősége tápanyagok oxidációjának közös szakasza anyag- és energiaforgalom központja sejtek anyagcseréjében elosztórendszerként működik:
Citrátkör, terminális oxidáció, oxidatív foszforiláció A citrátkör jelentősége tápanyagok oxidációjának közös szakasza anyag- és energiaforgalom központja sejtek anyagcseréjében elosztórendszerként működik:
Peptid- és fehérjék másodlagos-, harmadlagos- és negyedleges szerkezete
 Peptid- és fehérjék másodlagos-, harmadlagos- és negyedleges szerkezete Polipeptidek térszerkezete Tipikus (rendezett) konformerek em tipikus (rendezetlen) konformerek Periodikus vagy homokonformerek Aperiodikus
Peptid- és fehérjék másodlagos-, harmadlagos- és negyedleges szerkezete Polipeptidek térszerkezete Tipikus (rendezett) konformerek em tipikus (rendezetlen) konformerek Periodikus vagy homokonformerek Aperiodikus
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Peptidek és fehérjék szerkezetvizsgálata spektroszkópia és in silico módszerekkel
 Peptidek és fehérjék szerkezetvizsgálata spektroszkópia és in silico módszerekkel Mik a peptidek és fehérjék? L-konfigurációjú a-aminosavakból felépülő lineáris polimerek 3 betűs kód: -Thr-His-Ile-Ser-Ser-Ile-Met-Pro-Leu-Glu-
Peptidek és fehérjék szerkezetvizsgálata spektroszkópia és in silico módszerekkel Mik a peptidek és fehérjék? L-konfigurációjú a-aminosavakból felépülő lineáris polimerek 3 betűs kód: -Thr-His-Ile-Ser-Ser-Ile-Met-Pro-Leu-Glu-
CHO CH 2 H 2 H HO H H O H OH OH OH H
 2. Előadás A szénhidrátok kémiai reakciói, szénhidrátszármazékok Áttekintés 1. Redukció 2. xidáció 3. Észter képzés 4. Reakciók a karbonil atomon 4.1. iklusos félacetál képzés 4.2. Reakció N-nukleofillel
2. Előadás A szénhidrátok kémiai reakciói, szénhidrátszármazékok Áttekintés 1. Redukció 2. xidáció 3. Észter képzés 4. Reakciók a karbonil atomon 4.1. iklusos félacetál képzés 4.2. Reakció N-nukleofillel
TAKARMÁNYOZÁSTAN. Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010
 TAKARMÁNYOZÁSTAN Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 Takarmányok fehérjetartalma Az állati szervezet létfontosságú vegyületei fehérje természetűek Az állati termékek
TAKARMÁNYOZÁSTAN Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 Takarmányok fehérjetartalma Az állati szervezet létfontosságú vegyületei fehérje természetűek Az állati termékek
Versenyző rajtszáma: 1. feladat
 1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
A fehérjék harmadlagos vagy térszerkezete. Még a globuláris fehérjék térszerkezete is sokféle lehet.
 A fehérjék harmadlagos vagy térszerkezete Még a globuláris fehérjék térszerkezete is sokféle lehet. A ribonukleáz redukciója és denaturálódása Chrisian B. Anfinsen A ribonukleáz renaturálódása 1972 obel-díj
A fehérjék harmadlagos vagy térszerkezete Még a globuláris fehérjék térszerkezete is sokféle lehet. A ribonukleáz redukciója és denaturálódása Chrisian B. Anfinsen A ribonukleáz renaturálódása 1972 obel-díj
transzláció DNS RNS Fehérje A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti fehérjék, transzportfehérjék
 Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Peptidek és fehérjék 1. Fehérjék Fehérjetekeredés. Fehérje (protein) Fehérje (protein) Aminosavak. Aminosavak
 Fehérjék Fehérjetekeredés Peptidek és fehérjék 1 peptid: rövid, peptid kötéssel összekapcsolt aminosavakból álló polimer (< ~50 aminosav) fehérje: hosszú, peptid kötéssel összekapcsolt aminosavakból álló
Fehérjék Fehérjetekeredés Peptidek és fehérjék 1 peptid: rövid, peptid kötéssel összekapcsolt aminosavakból álló polimer (< ~50 aminosav) fehérje: hosszú, peptid kötéssel összekapcsolt aminosavakból álló
Helyettesített karbonsavak
 elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
Név: Pontszám: 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban
 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
Bioinformatika 2 6. előadás
 6. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2018.10.08. PDBj: http://www.pdbj.org/ Fehérjék 3D szerkezeti adatbázisai - PDBj 2 2018.10.08.
6. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2018.10.08. PDBj: http://www.pdbj.org/ Fehérjék 3D szerkezeti adatbázisai - PDBj 2 2018.10.08.
Aminosavak, peptidek
 Aminosavak, peptidek Aminosavak Neutrális aminosavak + H 3 N C O O - C H + H 3 N + H 3 N COO- COO- C H CH H CH 3 CH 3 CH 3 H 3 N glicin (Gly) alanin (Ala) valin (Val) C O O - + + C C H 2 H H 3 N H COO-
Aminosavak, peptidek Aminosavak Neutrális aminosavak + H 3 N C O O - C H + H 3 N + H 3 N COO- COO- C H CH H CH 3 CH 3 CH 3 H 3 N glicin (Gly) alanin (Ala) valin (Val) C O O - + + C C H 2 H H 3 N H COO-
Oligo- és polipeptidek:
 ligo- és polipeptidek: 1) Amid kötés hidrolízise és szintézise 2) Amid kötés kialakítása: preparatív lehetőségek 2.1) savkloridok 2.2) savanhidridek 2.3) aktívészterek 3) Aminosavak összekapcsolása 4)
ligo- és polipeptidek: 1) Amid kötés hidrolízise és szintézise 2) Amid kötés kialakítása: preparatív lehetőségek 2.1) savkloridok 2.2) savanhidridek 2.3) aktívészterek 3) Aminosavak összekapcsolása 4)
Táplálkozási ismeretek. Fehérjék. fehérjéinek és egyéb. amelyeket
 Táplálkozási ismeretek haladóknak I. Az előző három fejezetben megismerkedtünk az alapokkal (táplálék-piramis, alapanyag-csere, napi energiaszükséglet, tápanyagok energiatartalma, naponta szükséges fehérje,
Táplálkozási ismeretek haladóknak I. Az előző három fejezetben megismerkedtünk az alapokkal (táplálék-piramis, alapanyag-csere, napi energiaszükséglet, tápanyagok energiatartalma, naponta szükséges fehérje,
Az aminosavak peptidek és fehérjék koronázatlan királyai, kémiai Nobel-díjak:
 Az aminosavak peptidek és fehérjék koronázatlan királyai, kémiai obel-díjak: Linus Pauling 1954 obel-díj fehérje szerkezet alapjai Frederick Sanger 1958 obel-díj Az inzulin szekvenálása Sir. John owdery
Az aminosavak peptidek és fehérjék koronázatlan királyai, kémiai obel-díjak: Linus Pauling 1954 obel-díj fehérje szerkezet alapjai Frederick Sanger 1958 obel-díj Az inzulin szekvenálása Sir. John owdery
1. változat. 4. Jelöld meg azt az oxidot, melynek megfelelője a vas(iii)-hidroxid! A FeO; Б Fe 2 O 3 ; В OF 2 ; Г Fe 3 O 4.
 1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
6. változat. 3. Jelöld meg a nem molekuláris szerkezetű anyagot! A SO 2 ; Б C 6 H 12 O 6 ; В NaBr; Г CO 2.
 6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Korszerű tömegspektrometria a. Szabó Pál MTA Kémiai Kutatóközpont
 Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Tematika Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Tematika Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Tel: ;
 BIOLÓGIA ALAPJAI (BMEVEMKAKM1; BMEVEMKAMM1) Előadói: Dr. Bakos Vince, Kormosné Dr. Bugyi Zsuzsanna, Dr. Török Kitti, Nagy Kinga (BME ABÉT) Előadások anyaga: Dr. Pécs Miklós, Dr. Bakos Vince, Kormosné Dr.
BIOLÓGIA ALAPJAI (BMEVEMKAKM1; BMEVEMKAMM1) Előadói: Dr. Bakos Vince, Kormosné Dr. Bugyi Zsuzsanna, Dr. Török Kitti, Nagy Kinga (BME ABÉT) Előadások anyaga: Dr. Pécs Miklós, Dr. Bakos Vince, Kormosné Dr.
1. feladat. Versenyző rajtszáma: Mely vegyületek aromásak az alábbiak közül?
 1. feladat / 5 pont Mely vegyületek aromásak az alábbiak közül? 2. feladat / 5 pont Egy C 4 H 8 O összegképletű vegyületről a következő 1 H és 13 C NMR spektrumok készültek. Állapítsa meg a vegyület szerkezetét!
1. feladat / 5 pont Mely vegyületek aromásak az alábbiak közül? 2. feladat / 5 pont Egy C 4 H 8 O összegképletű vegyületről a következő 1 H és 13 C NMR spektrumok készültek. Állapítsa meg a vegyület szerkezetét!
Vizsgakövetelmények Ismerje a fehérjék biológiai szerepét (enzimek, összehúzékony fehérje-rendszerek aktin és miozin -, vázanyagok, receptorok,
 1 Vizsgakövetelmények Ismerje a fehérjék biológiai szerepét (enzimek, összehúzékony fehérje-rendszerek aktin és miozin -, vázanyagok, receptorok, szállítófehérjék, tartalék tápanyagok, antitestek, jelölő
1 Vizsgakövetelmények Ismerje a fehérjék biológiai szerepét (enzimek, összehúzékony fehérje-rendszerek aktin és miozin -, vázanyagok, receptorok, szállítófehérjék, tartalék tápanyagok, antitestek, jelölő
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Aminosavak és aminok meghatározása biológiai és természetes mintákban, HPLC eljárással
 Aminosavak és aminok meghatározása biológiai és természetes mintákban, HPLC eljárással Doktori értekezés Kőrös Ágnes Semmelweis Egyetem Gyógyszertudományok Doktori Iskola Témavezető: Perlné Dr. Molnár
Aminosavak és aminok meghatározása biológiai és természetes mintákban, HPLC eljárással Doktori értekezés Kőrös Ágnes Semmelweis Egyetem Gyógyszertudományok Doktori Iskola Témavezető: Perlné Dr. Molnár
NMR a peptid- és fehérje-kutatásban
 NMR a peptid- és fehérje-kutatásban A PDB adatbázisban megtalálható NMR alapú fehérjeszerkezetek számának alakulása az elmúlt évek során 4000 3500 3000 2500 2000 1500 1000 500 0 1987 1988 1989 1990 1991
NMR a peptid- és fehérje-kutatásban A PDB adatbázisban megtalálható NMR alapú fehérjeszerkezetek számának alakulása az elmúlt évek során 4000 3500 3000 2500 2000 1500 1000 500 0 1987 1988 1989 1990 1991
Fehérjeszerkezet, és tekeredés. Futó Kinga
 Fehérjeszerkezet, és tekeredés Futó Kinga Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983 H 211861 N
Fehérjeszerkezet, és tekeredés Futó Kinga Polimerek Polimer: hasonló alegységekből (monomer) felépülő makromolekulák Alegységek száma: tipikusan 10 2-10 4 Titin: 3,435*10 4 aminosav C 132983 H 211861 N
A biokémia alapjai. Typotex Kiadó. Wunderlich Lívius Szarka András
 A biokémia alapjai Wunderlich Lívius Szarka András Összefoglaló: A jegyzet elsősorban egészségügyi mérnök MSc. hallgatók részére íródott, de hasznos segítség lehet biomérnök és vegyészmérnök hallgatók
A biokémia alapjai Wunderlich Lívius Szarka András Összefoglaló: A jegyzet elsősorban egészségügyi mérnök MSc. hallgatók részére íródott, de hasznos segítség lehet biomérnök és vegyészmérnök hallgatók
hosszú szénláncú, telített vagy telítetlen karbonsavak palmitinsav (hexadekánsav) olajsav (cisz-9 oktadecénsav) néhány, állatokban előforduló zsírsav
 Lipidek: zsírsavak hosszú szénláncú, telített vagy telítetlen karbonsavak palmitinsav (hexadekánsav) sztearinsav (oktadekánsav) olajsav (cisz-9 oktadecénsav) Szénatomszám Kettős kötések száma néhány, állatokban
Lipidek: zsírsavak hosszú szénláncú, telített vagy telítetlen karbonsavak palmitinsav (hexadekánsav) sztearinsav (oktadekánsav) olajsav (cisz-9 oktadecénsav) Szénatomszám Kettős kötések száma néhány, állatokban
Bioinformatika előadás
 10. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat Genomika vs. proteomika A genomika módszereivel nem a tényleges fehérjéket vizsgáljuk,
10. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat Genomika vs. proteomika A genomika módszereivel nem a tényleges fehérjéket vizsgáljuk,
Anyagszerkezet vizsgálati módszerek
 Kromatográfia Folyadékkromatográfia-tömegspektrometria Anyagszerkezet vizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagszerkezet vizsgálati módszerek Kromatográfia 1/ 25 Folyadékkromatográfia-tömegspektrometria
Kromatográfia Folyadékkromatográfia-tömegspektrometria Anyagszerkezet vizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagszerkezet vizsgálati módszerek Kromatográfia 1/ 25 Folyadékkromatográfia-tömegspektrometria
1b. Fehérje transzport
 1b. Fehérje transzport Fehérje transzport CITOSZÓL Nem-szekretoros útvonal sejtmag mitokondrium plasztid peroxiszóma endoplazmás retikulum Szekretoros útvonal lizoszóma endoszóma Golgi sejtfelszín szekretoros
1b. Fehérje transzport Fehérje transzport CITOSZÓL Nem-szekretoros útvonal sejtmag mitokondrium plasztid peroxiszóma endoplazmás retikulum Szekretoros útvonal lizoszóma endoszóma Golgi sejtfelszín szekretoros
,:/ " \ OH OH OH - 6 - / \ O / H / H HO-CH, O, CH CH - OH ,\ / "CH - ~(H CH,-OH \OH. ,-\ ce/luló z 5zer.~ezere
 - 6 - o / \ \ o / \ / \ () /,-\ ce/luló z 5zer.~ezere " C=,1 -- J - 1 - - ---,:/ " - -,,\ / " - ~( / \ J,-\ ribóz: a) r.yílt 12"('.1, b) gyürus íormája ~.. ~ en;én'. fu5 héli'(ef1e~: egy menete - 7-5.
- 6 - o / \ \ o / \ / \ () /,-\ ce/luló z 5zer.~ezere " C=,1 -- J - 1 - - ---,:/ " - -,,\ / " - ~( / \ J,-\ ribóz: a) r.yílt 12"('.1, b) gyürus íormája ~.. ~ en;én'. fu5 héli'(ef1e~: egy menete - 7-5.
A bórsavtól a lipofil karboránt tartalmazó peptidomimetikumokig
 A bórsavtól a lipofil karboránt tartalmazó peptidomimetikumokig Egy "új" elem" " a növényvédelmi kémiában? Ujváry István MTA Növényvédelmi Kutatóintézete Bruckner-termi előadások,, 1999. október 29. ELTE,
A bórsavtól a lipofil karboránt tartalmazó peptidomimetikumokig Egy "új" elem" " a növényvédelmi kémiában? Ujváry István MTA Növényvédelmi Kutatóintézete Bruckner-termi előadások,, 1999. október 29. ELTE,
Elválasztástechnikai és bioinformatikai kutatások. Dr. Harangi János DE, TTK, Biokémiai Tanszék
 Elválasztástechnikai és bioinformatikai kutatások Dr. Harangi János DE, TTK, Biokémiai Tanszék Fő kutatási területek Enzimek vizsgálata mannozidáz amiláz OGT Analitikai kutatások Élelmiszer analitika Magas
Elválasztástechnikai és bioinformatikai kutatások Dr. Harangi János DE, TTK, Biokémiai Tanszék Fő kutatási területek Enzimek vizsgálata mannozidáz amiláz OGT Analitikai kutatások Élelmiszer analitika Magas
A TÖMEGSPEKTROMETRIA ALAPJAI
 A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
Biopolimer 12/7/09. Makromolekulák szerkezete. Fehérje szerkezet, és tekeredés. DNS. Polimerek. Kardos Roland DNS elsődleges szerkezete
 Biopolimerek Makromolekulák szerkezete. Fehérje szerkezet, és tekeredés. Osztódó sejt magorsófonala Kardos Roland 2009.10.29. Dohány levél epidermális sejtjének aktin hálózat Bakteriofágból kiszabaduló
Biopolimerek Makromolekulák szerkezete. Fehérje szerkezet, és tekeredés. Osztódó sejt magorsófonala Kardos Roland 2009.10.29. Dohány levél epidermális sejtjének aktin hálózat Bakteriofágból kiszabaduló
BIOGÉN ELEMEK Azok a kémiai elemek, amelyek az élőlények számára létfontosságúak
 BIOGÉN ELEMEK Azok a kémiai elemek, amelyek az élőlények számára létfontosságúak A több mint száz ismert kémiai elem nagyobbik hányada megtalálható az élőlények testében is, de sokuknak nincsen kimutatható
BIOGÉN ELEMEK Azok a kémiai elemek, amelyek az élőlények számára létfontosságúak A több mint száz ismert kémiai elem nagyobbik hányada megtalálható az élőlények testében is, de sokuknak nincsen kimutatható
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
KARBONSAV-SZÁRMAZÉKOK
 KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
BIOLÓGIA ALAPJAI (BMEVEMKAKM1; BMEVEMKAMM1) Előadói: Dr. Bakos Vince, Kormosné Dr. Bugyi Zsuzsanna, Dr. Török Kitti, Nagy Kinga (BME ABÉT)
 BIOLÓGIA ALAPJAI (BMEVEMKAKM1; BMEVEMKAMM1) Előadói: Dr. Bakos Vince, Kormosné Dr. Bugyi Zsuzsanna, Dr. Török Kitti, Nagy Kinga (BME ABÉT) Előadások anyaga: Dr. Pécs Miklós, Dr. Bakos Vince, Kormosné Dr.
BIOLÓGIA ALAPJAI (BMEVEMKAKM1; BMEVEMKAMM1) Előadói: Dr. Bakos Vince, Kormosné Dr. Bugyi Zsuzsanna, Dr. Török Kitti, Nagy Kinga (BME ABÉT) Előadások anyaga: Dr. Pécs Miklós, Dr. Bakos Vince, Kormosné Dr.
Az aminosav anyagcsere orvosi vonatkozásai Csősz Éva
 Az aminosav anyagcsere orvosi vonatkozásai Csősz Éva E-mail: cseva@med.unideb.hu Általános reakciók az aminosav anyagcserében 1. Nitrogén eltávolítás: transzaminálás dezaminálás: oxidatív nem oxidatív
Az aminosav anyagcsere orvosi vonatkozásai Csősz Éva E-mail: cseva@med.unideb.hu Általános reakciók az aminosav anyagcserében 1. Nitrogén eltávolítás: transzaminálás dezaminálás: oxidatív nem oxidatív
ZÁRÓJELENTÉS. OAc. COOMe. N Br
 ZÁRÓJELETÉS A kutatás előzményeként az L-treoninból kiindulva előállított metil-[(2s,3r, R)-3-( acetoxi)etil-1-(3-bróm-4-metoxifenil)-4-oxoazetidin-2-karboxilát] 1a röntgendiffrakciós vizsgálatával bizonyítottuk,
ZÁRÓJELETÉS A kutatás előzményeként az L-treoninból kiindulva előállított metil-[(2s,3r, R)-3-( acetoxi)etil-1-(3-bróm-4-metoxifenil)-4-oxoazetidin-2-karboxilát] 1a röntgendiffrakciós vizsgálatával bizonyítottuk,
Zsírsav szintézis. Az acetil-coa aktivációja: Acetil-CoA + CO + ATP = Malonil-CoA + ADP + P. 2 i
 Zsírsav szintézis Az acetil-coa aktivációja: Acetil-CoA + CO + ATP = Malonil-CoA + ADP + P 2 i A zsírsav szintáz reakciói Acetil-CoA + 7 Malonil-CoA + 14 NADPH + 14 H = Palmitát + 8 CoA-SH + 7 CO 2 + 7
Zsírsav szintézis Az acetil-coa aktivációja: Acetil-CoA + CO + ATP = Malonil-CoA + ADP + P 2 i A zsírsav szintáz reakciói Acetil-CoA + 7 Malonil-CoA + 14 NADPH + 14 H = Palmitát + 8 CoA-SH + 7 CO 2 + 7
Élettan. előadás tárgykód: bf1c1b10 ELTE TTK, fizika BSc félév: 2015/2016., I. időpont: csütörtök, 8:15 9:45
 Élettan előadás tárgykód: bf1c1b10 ELTE TTK, fizika BSc félév: 2015/2016., I. időpont: csütörtök, 8:15 9:45 oktató: Dr. Tóth Attila, adjunktus ELTE TTK Biológiai Intézet, Élettani és Neurobiológiai tanszék
Élettan előadás tárgykód: bf1c1b10 ELTE TTK, fizika BSc félév: 2015/2016., I. időpont: csütörtök, 8:15 9:45 oktató: Dr. Tóth Attila, adjunktus ELTE TTK Biológiai Intézet, Élettani és Neurobiológiai tanszék
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
