5.2.6 ÁLLATGYÓGYÁSZATI VAKCINÁK ÉS IMMUNSZÉRUMOK ÁRTALMATLANSÁGÁNAK ÉRTÉKELÉSE
|
|
|
- Andrea Kissné
- 9 évvel ezelőtt
- Látták:
Átírás
1 5.2.6 ÁLLATGYÓGYÁSZATI VAKCINÁK ÉS IMMUNSZÉRUMOK ÁRTALMATLANSÁGÁNAK ÉRTÉKELÉSE A készítmény kifejezés alatt a teljes szövegben vakcina, illetve immunszérum értendő. 04/2013:50206 A készítményfejlesztés során, a célállatfajon ártalmatlansági vizsgálatokat kell végezni a készítmény alkalmazásával járó kockázatok felderítése érdekében. A vakcinavizsgálatokra használt állatok immunológiai állapota. Az ártalmatlansági vizsgálatokra felhasznált állatok immunológiai állapotát a megfelelő egyedi cikkely írja elő. A legtöbb cikkelyre vonatkozóan a következő három kategóriát szabják meg: 1) az állatoknak a vakcinában jelen levő vírusok/baktériumok/toxinok stb. elleni ellenanyagoktól mentesnek kell lenniük; 2) az állatok lehetőség szerint a vakcinában jelen levő vírusok/baktériumok/toxinok stb. elleni ellenanyagoktól mentesek legyenek, de alacsony ellenanyagszinttel rendelkező állatok is felhasználhatók, abban az esetben, ha az állatokat előzetesen nem oltották, és a vakcina beadása nem idéz elő anamnesztikus reakciót; 3) az állatok nem lehetnek előzetesen az ellen a betegség ellen oltva, amelynek megelőzésére a vakcinát szánják. Általános szabályként az első kategória az élő kórokozót tartalmazó vakcinákra vonatkozik. Egyéb vakcinákra általában a második kategóriát határozzák meg, de amennyiben a vizsgálatra rendelkezésre álló állatok többsége megfelel az első kategóriának is, inaktivált vakcinák esetében is az utóbbi kategória írható elő. A harmadik kategóriát néhány olyan inaktivált vakcinára határozzák meg, ahol a vizsgálatot megelőző ellenanyag-meghatározás szükségtelen vagy nem célravezető. Baromfi vakcinák esetében általános szabályként a meghatározott kórokozóktól mentes (SPF) madarak használatát írják elő. Madár vakcinák esetében az ártalmatlansági vizsgálatot általában SPF (5.2.2) csirkéken végzik, kivéve azokat a vakcinákat, amelyeket nem ajánlanak csirkék kezelésére. Utóbbi esetben a vizsgálatot egy, a vakcina javallatában szereplő madárfajon végzik el, olyan madarakon, amelyek mentesek azon betegségség kórokozója elleni ellenanyagoktól, amely elleni védelemre a vakcinát szánják. Vakcinák. A laboratóriumi vizsgálatokban az adag a felhasználási javallatban szereplő, a gyártási tételekben feltételezhetően jelen levő legmagasabb titerű vagy hatóértékű készítmény mennyiségét jelenti. Élő vakcinák az organizmusoknak csak bizonyítottan ártalmatlan törzseiből állíthatók elő. Élő vakcinák esetében a vakcina egy tételében jelen levő legkevésbé gyengített passzázsszintű vírust/baktériumot tartalmazó gyártási tételt vagy gyártási tételeket használunk. Kombinált vakcinák esetében az ártalmatlanságot igazolni kell. A kombinált vakcinák élő komponensei esetében az élő vakcinákra vonatkozó, az alábbiakban megadott speciális követelményeknek való megfelelést minden egyes vakcinatörzsre külön-külön kell bizonyítani. Inaktivált vakcinák esetében a kombinált vakcina ártalmatlansági vizsgálatainak elvégzése elegendőnek tekinthető az egyes komponensek ártalmatlanságának bizonyítására. Immunszérumok. A vizsgálatokban az adag a készítménynek azt a felhasználásra ajánlott legnagyobb mennyiségét jelenti, amely a gyártási tételekben feltételezhetően előforduló legnagyobb hatóértékű és összfehérje-tartalmú. Ezenfelül, indokolt esetekben, a vizsgált adag a legnagyobb mennyiségű immunglobulint vagy gammaglobulint is tartalmazza.
2 Az alábbiakban leírt vizsgálatok, a vonatkozó cikkely Előállítás szakaszában előírt vizsgálatokkal módosítva vagy kiegészítve, a fejlesztés során a készítmény ártalmatlanságának igazolására szükséges vizsgálatok részét képezhetik. 1. LABORATÓRIUMI VIZSGÁLATOK 1-1. ÁRTALMATLANSÁGI VIZSGÁLAT EGY ADAG VAKCINA BEADÁSÁVAL A készítmény egy adagját minden egyes ajánlott alkalmazási módon, a készítmény javallatában szereplő minden egyes állatfaj és kategória egyedeinek beadjuk. A vizsgálatba az ajánlott legfiatalabb korcsoportot, és indokolt esetben vemhes állatokat is be kell vonni. Az emlősöknek szánt vakcinák esetében csoportonként általában nyolc állatot használunk fel, kivéve, ha az adott cikkely ezt másképpen indokolja vagy határozza meg. Halaknak bemerítéses alkalmazásra szánt vakcinák esetében a halakat az ajánlott koncentráció kétszeresének megfelelő koncentrációjú fürdőben, az ajánlott bemerítési idő kétszereséig fürdetjük. Halaknak szánt vakcinák esetében, kivéve, ha egyedi cikkely ezt másképpen indokolja vagy határozza meg, csoportonként általában ötven halat használunk fel. Három hetesnél idősebb korú madaraknak szánt vakcinák esetében csoportonként általában nyolc madarat használunk fel, kivéve, ha az adott egyedi cikkely ezt másképpen indokolja vagy határozza meg,. Három hetesnél fiatalabb korú madaraknak szánt vakcinák esetében csoportonként általában tíz madarat használunk fel, kivéve, ha az adott egyedi cikkely ezt másképpen indokolja vagy határozza meg. Az állatokat a rendellenes helyi és általános tünetek szempontjából legalább napi gyakorisággal kell megfigyelni és vizsgálni. Indokolt esetben ezt ki kell terjeszteni az injekciós helyek boncoláskor elvégzett részletes makroszkópos és mikroszkópos vizsgálatára is. Egyéb objektív jellegzetességeket például a testhőmérsékletet (emlősök esetében) és bizonyos teljesítménymutatókat szintén feljegyzünk. A testhőmérsékletet legalább a készítmény beadása előtti napon, a készítmény beadásának időpontjában, azt követően 4 órával, valamint a következő 4 napon át fel kell jegyezni. Az állatokat legalább napi rendszerességgel megfigyeljük, mindaddig, amíg reakcióra már nem kell számítani, azonban a megfigyelés és a vizsgálat időtartama semmi esetre sem lehet rövidebb, mint a beadást követő 14 nap. Ha az egyedi cikkely nem rendelkezik másképpen, illetve egyedi cikkely hiányában indokolt és engedélyezett esetek kivételével a vakcina megfelel a vizsgálat követelményeinek, ha egyetlen állat sem mutat abnormális helyi vagy általános reakciót, vagy a betegség tüneteit, illetve hullik el a vakcinának tulajdonítható okokból ÁRTALMATLANSÁGI VIZSGÁLAT A VAKCINA EGYSZERI TÚLADAGOLÁSÁVAL A túladagolási vizsgálatot csak élő vakcináknál végezzük el. A készítmény túladagolt adagját minden egyes alkalmazási módon a célállatfaj várhatóan legérzékenyebb kategóriáiba, mint például a legfiatalabb korcsoportba tartozó állatokba adjuk be. Ha az adott készítményre több alkalmazási módot és formát is meghatároztak, ajánlott minden egyes alkalmazási módot vizsgálni. Ha az egyik alkalmazási mód esetében igazolták, hogy az okozza a legsúlyosabb hatásokat, a vizsgálat céljára ez az egyetlen beadási mód is választható. A túladagolás általában az élő vakcina tízszeres adagjából áll. A fagyasztva szárított élő vakcinák esetében a vizsgálat céljára a tíz adagot megfelelő térfogatú oldószerben oldjuk fel. Az emlősöknek szánt vakcinák esetében, általában csoportonként 8 állatot használunk fel, kivéve, ha az egyedi cikkely másképpen indokolja vagy írja elő. Halaknak szánt vakcinák esetében, csoportonként általában 50 halat használunk fel, kivéve, ha az egyedi cikkely másképpen indokolja vagy írja elő. Három hetesnél idősebb korú madaraknak szánt vakcinák esetében, csoportonként általában 8 madarat használunk fel, kivéve, ha az egyedi cikkely másképpen indokolja vagy írja elő. Három hetesnél fiatalabb korú madaraknak szánt vakcinák
3 esetében általában csoportonként 10 madarat használunk fel, kivéve, ha egyedi cikkely másképpen indokolja vagy írja elő. Az állatokat a rendellenes helyi és általános tünetek szempontjából legalább napi rendszerességgel kell megfigyelni és vizsgálni. Egyéb objektív jellemzőket, például a testhőmérsékletet (emlősök esetében) és bizonyos teljesítménymutatókat, szintén feljegyzünk. Az állatokat a beadás után legalább 14 napon át megfigyeljük és vizsgáljuk. Ha az egyedi cikkely nem rendelkezik másképpen, illetve egyedi cikkely hiányában indokolt és engedélyezett esetek kivételével a termék megfelel a vizsgálat követelményeinek, ha egyetlen állat sem mutat abnormális helyi vagy általános reakciót, vagy a betegség tüneteit, illetve hullik el a vakcinának tulajdonítható okokból ÁRTALMATLANSÁGI VIZSGÁLAT EGY ADAG ISMÉTELT BEADÁSÁVAL Egy adott alkalmazás által kiváltott mellékhatások észlelése céljából szükséges lehet egy adag ismételt beadása az adott módon. Ezeknek a vizsgálatoknak az elvégzése különösen fontos, ha a készítményt, nevezetesen egy immunszérumot, viszonylag rövid időn belül több alkalommal kell beadni. Ezeket a vizsgálatokat a célállatfaj legérzékenyebb csoportjain végezzük el, minden egyes javasolt alkalmazási módon. Ha az adott készítményre több alkalmazási módot és formát is meghatároztak, ajánlott minden egyes alkalmazási módot vizsgálni. Ha az egyik egy alkalmazási mód esetében igazolták, hogy az okozza a legsúlyosabb hatásokat, a vizsgálat céljára ez az egyetlen beadási mód is választható. A beadások száma nem lehet kisebb az ajánlott maximálisnál; vakcinák esetében az első oltást és az első újraoltás során végzett oltások számát, immunszérumok esetében pedig a kezeléshez szükséges beadások számát kell figyelembe venni. A kezelések között eltelt időnek megfelelőnek kell lennie (pl. a kockázat időszaka vagy a kezeléshez szükséges idő), és meg kell felelnie az ajánlott felhasználási módnak. Bár a vakcinák esetében a vizsgálatok során, célszerűségi okok miatt, a gyakorlati felhasználásban ajánlott időközhöz képest rövidebb időközt is lehet alkalmazni, a beadások között, az esetleges túlérzékenységi reakció kialakulása érdekében, legalább 14 napnak mindenképpen el kell telnie. Immunszérumok esetén ugyanakkor a kezelésnek az ajánlott programot kell követnie. Az emlősöknek szánt vakcinák esetében, általában csoportonként 8 állatot használunk fel, kivéve, ha az egyedi cikkely másképpen indokolja vagy írja elő. Halaknak szánt vakcinák esetében, csoportonként általában 50 halat használunk fel, kivéve, ha az egyedi cikkely másképpen indokolja vagy írja elő. Három hetesnél idősebb korú madaraknak szánt vakcinák esetében, csoportonként általában 8 madarat használunk fel, kivéve, ha az egyedi cikkely másképpen indokolja vagy írja elő. Három hetesnél fiatalabb korú madaraknak szánt vakcinák esetében általában csoportonként 10 madarat használunk fel, kivéve, ha egyedi cikkely másképpen indokolja vagy írja elő. Az állatokat a rendellenes helyi és általános tünetek szempontjából az utolsó beadást követő legalább 14 napon át, legalább napi rendszerességgel megfigyeljük és vizsgáljuk. Egyéb objektív jellemzőket, például a testhőmérsékletet és bizonyos teljesítménymutatókat, feljegyzünk. Ha az egyedi cikkely nem rendelkezik másképpen, illetve egyedi cikkely hiányában indokolt és engedélyezett esetek kivételével a vakcina megfelel a vizsgálat követelményeinek, ha egyetlen állat sem mutat abnormális helyi vagy általános reakciót, vagy a betegség tüneteit, illetve hullik el a vakcinának tulajdonítható okokból SZAPORODÁSI TELJESÍTMÉNYMUTATÓK VIZSGÁLATA Amennyiben a vakcina javallatában vemhes állatokban, vagy tojó madarakban való alkalmazás is szerepel, vagy a vakcina ezekben is alkalmazható, a vizsgálatokat az ezekbe a csoportokba tartozó állatokon is elvégezzük. Ha szaporodási ártalmatlanságra vonatkozó vizsgálatokat nem végezték el, a feliraton nyilatkozatni kell arról, hogy a vakcina ezekben az esetekben nem alkalmazható, kivéve, ha a kockázat tudományos indokok alapján kizárható. A szaporodási teljesítménymutatók vizsgálatának elvégzését akkor is megfontolás tárgyává kell tenni, ha az adatok alapján az a kiinduló anyag, amelyből a készítmény készül, kockázati tényező lehet. Adott esetben a hím és nőstény állatok szaporodási teljesítménymutatóinak, valamint az utódra vonatkozó káros hatásoknak, beleértve a teratogén vagy a vetélést előidéző hatásokat, a vizsgálatát minden egyes ajánlott alkalmazási mód esetében elvégezzük. Ha az adott készítményre több alkalmazási módot és formát is meghatároztak, ajánlott minden egyes
4 alkalmazási vizsgálni. Ha az egyik alkalmazási mód esetében igazolták, hogy az okozza a legsúlyosabb hatásokat, a vizsgálat céljára ez az egyetlen beadási mód is választható. Az emlősöknek szánt vakcinák esetében csoportonként általában nyolc állatot használunk fel, kivéve, ha az egyedi cikkely másképpen indokolja vagy írja elő. Vemhes állatban való felhasználásra javallott vakcinák esetében, vagy olyan vakcinák esetében, amelyek vemhes állatban is alkalmazhatók, a vakcina vizsgálatát a vemhesség minden olyan szakaszában elvégezzük, amely a vakcina felhasználási javallatára vonatkozóan a feliraton szerepel. A vemhesség nem vizsgált szakaszaira vonatkozóan nyilatkozatni kell arról, hogy a vakcina ezekben nem alkalmazható. A vemhességre illetőleg az utódokra gyakorolt káros hatás vizsgálata céljából a megfigyelési időszakot az ellést követő időszakra is kiterjesztjük, kivéve, ha ezt az egyedi cikkely másképpen indokolja vagy határozza meg. Az alábbi eljárás a vakcinák megfelelő módon végzett vizsgálatára példaként szerepel. Ártalmatlanság vemhes állatokban. A vemhesség ajánlott szakaszában vagy szakaszaiban csoportonként legalább nyolc állatot használunk fel, az ajánlott program szerint. Legalább nyolc állatot használunk fel a vemhesség minden időszakában (azaz szarvasmarha esetén 24 állatot a vemhesség három trimeszterének esetében). Minden egyes állatot a vakcina ajánlott adagjával oltjuk. Amennyiben az ajánlott program második adagot is előír, azt legalább 14 nappal az első adag után adjuk be. Ha az egyedi cikkely nem rendelkezik másképpen, illetve egyedi cikkely hiányában, az állatokat legalább az ellés utáni első napig naponta megfigyeljük. Ha az egyedi cikkely nem írja elő másképpen, illetve egyedi cikkely hiányában indokolt és engedélyezett esetek kivételével a vakcina megfelel a vizsgálat követelményeinek, ha egyetlen állat sem mutat abnormális helyi vagy általános reakciót, vagy a betegség tüneteit, illetve hullik el a vakcinának tulajdonítható okokból, és ha káros hatás sem a vemhesség során, sem az utódokon nem figyelhető meg MARADVÁNYOK A közismerten emberre is átterjedő megbetegedések (zoonózisok) elleni élő vakcinák esetében az alábbiakban előírt, a vakcina szóródására vonatkozó vizsgálatokon túlmenően szükség lehet a vakcinában levő organizmus maradványainak az injekció helyén való meghatározására is AZ IMMUNRENDSZER MŰKÖDÉSÉRE GYAKOROLT KÁROS HATÁSOK Ha fennáll annak a veszélye, hogy a készítmény károsan befolyásolhatja a készítménnyel kezelt állat vagy az utódok immunválaszát, az immunrendszer működésére vonatkozó, megfelelő vizsgálatokat kell elvégezni KÖLCSÖNHATÁSOKBÓL EREDŐ KÁROS HATÁSOK Vizsgálatokat kell végezni annak igazolására, hogy ha több készítmény egyidejű beadása javallott, vagy a készítmény beadása rövid időszakon belül, több készítmény beadását tartalmazó kezelési program részeként javallott, ez nem befolyásolja károsan a készítmény ártalmatlanságát ÉLŐ VAKCINÁKRA VONATKOZÓ KÜLÖNLEGES KÖVETELMÉNYEK Az élő vakcinák vizsgálatára a következő laboratóriumi vizsgálatokat is elvégezzük. A következő vizsgálatokat, a virulencia fokozódására ( szakasz) vonatkozó vizsgálat kivételével, az oltócsíra-törzstétel és a vakcina gyártási tétele közötti legkevésbé legyengített passzázsszintű vakcinatörzzsel végezzük A vakcinatörzs terjedése. A vakcinatörzsnek az oltott célállatokról a nem oltott célállatokra történő terjedésének vizsgálatát azzal az ajánlott alkalmazási móddal vizsgáljuk, amely legvalószínűbben
5 eredményezi a vakcinatörzs terjedését. Szükséges lehet továbbá az átterjedés ártalmatlanságának vizsgálatára olyan, nem célállatfajok esetében is, amelyek nagymértékben fogékonyak lehetnek az élő vakcinatörzs iránt. Értékelni kell, hogy normális körülmények között várhatóan hány állatról állatra történő passzázs tartható fenn, továbbá értékelni kell azt is, hogy ennek milyen valószínű következményei lehetnek Szóródás az oltott állatokban. A székletet, vizeletet, tejet, tojásokat, nyálat, orr- és egyéb váladékokat a vakcinatörzs jelenlétére vonatkozóan az előirányzottnak megfelelően vizsgálni kell. Ezen túlmenően szükséges lehet a vakcinatörzs állati szervezeten belüli szóródásának vizsgálata is, különös tekintettel a vakcinatörzs szervezeten belüli szaporodásának predilekciós (hajlammal rendelkező) helyeire. Élelmiszertermelő állatok kezelésére szánt, az emberre is bizonyítottan átterjedő megbetegedések (zoonózisok) elleni élő vakcinák esetében ezeket a vizsgálatokat kötelező elvégezni, és kiemelten figyelembe kell venni a törzs megmaradását az injekció beadásának helyén A virulencia fokozódása. Ha az egyedi cikkely nem rendelkezik másképpen, illetve egyedi cikkely hiányában indokolt és engedélyezett esetek kivételével a vizsgálatra a következők vonatkoznak. A vizsgálatot az oltócsíra-törzstételen végezzük el. Ha az oltócsíra-törzstételből nem áll elegendő mennyiség rendelkezésre a vizsgálat elvégzéséhez, azt az előállításhoz használt legkisebb passzázsszintű anyagot lehet felhasználni, amelyből elegendő mennyiség áll rendelkezésre. Az oltás időpontjában az állatoknak minden csoportban a törzs visszanyerése szempontjából megfelelő korúaknak kell lenniük. A célállatokban, öt csoportot felhasználva, sorozatos átoltásokat végzünk, kivéve, ha több átoltás indokolt, vagy ha a törzs hamarabb eltűnik a vizsgált állatból. Az oltótörzs mennyiségének fokozása céljából in vitro szaporítás nem végezhető. Az átoltásokat olyan állatokon végezzük, amelyek a lehetséges kockázat felmérésére a legmegfelelőbbek. Az első beadást azon az ajánlott alkalmazási módon végezzük, amely a legnagyobb valószínűséggel eredményezi a virulencia visszatérését; kiinduló inokulumként a felszabadításkor legnagyobb titerű mintát használjuk. Ezt követően a célállatfaj egyedeiben legalább négy sorozatos továbboltást végzünk. Az átoltásokat azon az ajánlott alkalmazási módon végezzük, amely a legnagyobb valószínűséggel eredményezi a virulencia visszatérését. Ha a törzs tulajdonságai lehetővé teszik a sorozatos átoltást természetes terjedés útján, ez a módszer is alkalmazható, egyébként az adott egyedi cikkelyben előírt átoltást végezzük el, és azokat a mikroorganizmusokat vizsgáljuk a virulencia fokozódására vonatkozóan, amelyeket az utolsó átoltásból nyerünk vissza. Az első négy csoportban az emlős vakcinák esetében legalább két állatot, madár vakcinák esetében legalább öt madarat használunk fel. Az utolsó csoport legalább nyolc emlősből, illetve legalább tíz madárból álljon. Minden egyes átoltás esetében igazolni kell az átoltásra felhasznált anyagban a vakcinából származó élő mikroorganizmusok jelenlétét. Figyelmet kell fordítani az előző átoltásokból származó mikroorganizmusokkal való szennyeződés elkerülésére. Amennyiben a mikroorganizmus valamelyik közbülső in vivo átoltásból nem nyerhető vissza, ezt az átoltást tíz állaton megismételjük olyan in vivo átoltásból nyert anyaggal, amely abból az utolsó átoltásból származik, amelyben a mikroorganizmus visszanyerhető volt. A visszanyert mikroorganizmust használjuk fel a következő átoltás inokulumaként. Ha a cél-mikroorganizmus nem nyerhető vissza, a kísérletet befejezettnek nyilvánítjuk, azzal a következtetéssel, hogy a mikroorganizmus nem mutatja a virulencia fokozódását. A vizsgálat során általános klinikai megfigyeléseket végzünk. Ha másképpen nem indokolt, az utolsó csoport állatait 21 napon át tartjuk megfigyelés alatt. E megfigyelések magukban foglalják a betegségre vonatkozó összes tipikus paramétert, amely a virulencia fokozódásának indikátora lehet. Összehasonlítjuk a klinikai tüneteket és egyéb releváns paramétereket azokkal a megfelelő adatokkal, amelyeket az egy adag vakcina beadásának ártalmatlansági vizsgálatára felhasznált állatokban (1-1. szakasz) kaptunk. Ha az utolsó csoport állatai nem mutatják a virulencia fokozódását, további vizsgálatok elvégzése nem szükséges. Egyéb esetekben a klinikai tünetek és egyéb releváns paraméterek közvetlen összehasonlítására az első átoltáshoz használt anyagot és az utolsó passzázsból visszanyert mikroorganizmust különálló kísérletben vizsgáljuk, emlős vakcinák esetében csoportonként legalább nyolc állatot, madár vakcinák
6 esetében csoportonként legalább tíz madarat felhasználva. Ezt a vizsgálatot azon az alkalmazási módon végezzük, amelyet az előző átoltásokban használtunk. Indokolt esetben más alkalmazási mód is használható. Indokolt és engedélyezett esetek kivételével, a termék megfelel a vizsgálat követelményeinek, ha egyetlen állat sem pusztul el vagy mutat a vakcina törzsre jellemző tüneteket, és ha az utolsó csoport állataiban a virulencia fokozódásának jelei nem mutathatók ki A vakcinatörzs biológiai tulajdonságai. A vakcinatörzs belső biológiai tulajdonságainak (pl. a neurotropizmusnak) lehető legpontosabb meghatározásához egyéb vizsgálatok is szükségesek lehetnek. Vektorvakcinák esetében értékelni kell a törzs tropizmusában vagy virulenciájában bekövetkező változás kockázatát, és, ha szükséges, külön vizsgálatokat is kell végezni. Ilyen vizsgálatokat módszeresen el kell végezni, ha egy idegen gén terméke szerkezeti fehérjeként beépül a törzsbe Rekombináció vagy génkeveredés a vakcinatörzsben. A rekombináció, illetve a vad vírusokkal vagy más törzsekkel való génkeveredés valószínűségét mérlegelni kell. 2. GYAKORLATI KIPRÓBÁLÁS A laboratóriumi vizsgálatok eredményeit általában gyakorlati körülmények között végzett kísérletek adataival kell kiegészíteni és alátámasztani. Amennyiben a legnagyobb és a legkisebb titerű, illetve hatóértékű vakcinával végzett laboratóriumi vizsgálatok egyértelműen megállapították egy készítmény ártalmatlanságát és hatékonyságát kísérleti körülmények között, akkor a készítmény egyetlen gyártási tétele használható a vakcina gyakorlati körülmények közötti ártalmatlanságának és hatékonyságának megítélésére. Ezekben az esetekben egy közepes titerű, illetve hatóértékű, tipikus rutin gyártási tételt lehet használni. Élelmiszertermelő emlős állatok esetében a vizsgálatok során megfelelő számú állatban mérni kell a testhőmérsékletet is, a termék beadása előtt és után; más emlős állatok esetében ilyen mérésekre csak akkor van szükség, ha a laboratóriumi eredmények valamilyen problémát jeleznek. Mindennemű helyi reakció méretét és tartós fennállását, valamint a helyi vagy általános reakciókat mutató állatok arányát fel kell jegyezni. Adott esetben teljesítményméréseket is kell végezni. Broiler csirkék esetében a teljesítménymutatók mérése magában foglalja a heti elhullást, a tápanyaghasznosítási hányadost, vágáskor az életkort és a testsúlyt, a leminősítést és a feldolgozó üzemben történő selejtezést. A tojástermelő és a tojónak nevelt madarak kezelésére szánt vakcinák esetében az előírt módon vizsgálni kell a vakcina hatását a tojásrakási teljesítményre és a keltethetőségre. 3. KÖRNYEZETKÁROSÍTÓ HATÁS A készítmény lehetséges környezetkárosító hatásait fel kell mérni, és a kockázatok csökkentése céljából szükséges óvintézkedéseket meg kell határozni. Megbecsüljük a készítmény környezetterhelésének valószínűsíthető mértékét, figyelembe véve a célállatfajt, az alkalmazás módját, a készítmény kiürülését, valamint a fel nem használt készítmény megsemmisítésének módját. Amennyiben e tényezők azt jelzik, hogy a készítmény esetében számottevő környezetterheléssel kell számolni, a készítmény tulajdonságainak figyelembevételével megbecsüljük annak lehetséges környezetkárosító hatását.
VACCINUM COCCIDIOSIDIS VIVUM AD PULLUM. Csirke kokcidiózis vakcina (élő)
 Vaccinum coccidiosidis vivum ad pullum Ph.Hg.VIII. Ph.Eur.7.7-1 04/2013:2326 VACCINUM COCCIDIOSIDIS VIVUM AD PULLUM Csirke kokcidiózis vakcina (élő) 1. DEFINÍCIÓ A csirkék kezelésére szánt, kokcidiózis
Vaccinum coccidiosidis vivum ad pullum Ph.Hg.VIII. Ph.Eur.7.7-1 04/2013:2326 VACCINUM COCCIDIOSIDIS VIVUM AD PULLUM Csirke kokcidiózis vakcina (élő) 1. DEFINÍCIÓ A csirkék kezelésére szánt, kokcidiózis
VACCINUM FEBRIS FLAVAE VIVUM. Sárgaláz vakcina (élő)
 Vaccinum febris flavae vivum Ph.Hg.VIII. Ph.Eur.7.5-1 07/2012:0537 VACCINUM FEBRIS FLAVAE VIVUM Sárgaláz vakcina (élő) DEFINÍCIÓ A sárgaláz vakcina (élő) a sárgaláz vírus 17D törzséből készített, előkeltetett
Vaccinum febris flavae vivum Ph.Hg.VIII. Ph.Eur.7.5-1 07/2012:0537 VACCINUM FEBRIS FLAVAE VIVUM Sárgaláz vakcina (élő) DEFINÍCIÓ A sárgaláz vakcina (élő) a sárgaláz vírus 17D törzséből készített, előkeltetett
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tetanol pur betegtájékoztató - PIL alapján.doc BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tetanol pur betegtájékoztató - PIL alapján.doc BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
65/2002. (VIII. 9.) FVM rendelet a gümőkór elleni védekezésről
 65/2002. (VIII. 9.) FVM rendelet a gümőkór elleni védekezésről Az állategészségügyről szóló 1995. évi XCI. törvény 45. -ának 11. pontjában kapott felhatalmazás alapján a következőket rendelem el: A rendelet
65/2002. (VIII. 9.) FVM rendelet a gümőkór elleni védekezésről Az állategészségügyről szóló 1995. évi XCI. törvény 45. -ának 11. pontjában kapott felhatalmazás alapján a következőket rendelem el: A rendelet
143/2007. (XII. 4.) FVM rendelet. a madárinfluenza elleni védekezés részletes szabályairól. I. Fejezet ÁLTALÁNOS RENDELKEZÉSEK. Fogalommeghatározások
 143/2007. (XII. 4.) FVM rendelet a madárinfluenza elleni védekezés részletes szabályairól Az állategészségügyről szóló 2005. évi CLXXVI. törvény 47. (2) bekezdése 2., 15. és 25. pontjában kapott felhatalmazás
143/2007. (XII. 4.) FVM rendelet a madárinfluenza elleni védekezés részletes szabályairól Az állategészségügyről szóló 2005. évi CLXXVI. törvény 47. (2) bekezdése 2., 15. és 25. pontjában kapott felhatalmazás
19/2002. (III. 8.) FVM rendelet a szarvasmarhák fertőző rhinotracheitise elleni mentesítés szabályairól
 19/2002. (III. 8.) FVM rendelet a szarvasmarhák fertőző rhinotracheitise elleni mentesítés szabályairól Az állategészségügyről szóló 1995. évi XCI. törvény 45. -ának 11. pontjában kapott felhatalmazás
19/2002. (III. 8.) FVM rendelet a szarvasmarhák fertőző rhinotracheitise elleni mentesítés szabályairól Az állategészségügyről szóló 1995. évi XCI. törvény 45. -ának 11. pontjában kapott felhatalmazás
I.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 I.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Aivlosin 42,5 mg/g gyógypremix sertések részére 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: Tilvalozin
I.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Aivlosin 42,5 mg/g gyógypremix sertések részére 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Hatóanyag: Tilvalozin
88/2004. (V. 15.) FVM rendelet. az állatgyógyászati készítményekről
 88/2004. (V. 15.) FVM rendelet az állatgyógyászati készítményekről módosította: 97/2005. (X. 28.) FVM rendelet - barna háttérrel és fehér betűkkel /50. (2)/ a szövegben! Az állategészségügyről szóló 1995.
88/2004. (V. 15.) FVM rendelet az állatgyógyászati készítményekről módosította: 97/2005. (X. 28.) FVM rendelet - barna háttérrel és fehér betűkkel /50. (2)/ a szövegben! Az állategészségügyről szóló 1995.
Betegtájékoztató: Információk a felhasználó számára. Rabipur por és oldószer oldatos injekcióhoz Inaktivált veszettség elleni vakcina
 Betegtájékoztató: Információk a felhasználó számára Rabipur por és oldószer oldatos injekcióhoz Inaktivált veszettség elleni vakcina Mielőtt beadnák Önnek vagy gyermekének a Rabipur-t, olvassa el figyelmesen
Betegtájékoztató: Információk a felhasználó számára Rabipur por és oldószer oldatos injekcióhoz Inaktivált veszettség elleni vakcina Mielőtt beadnák Önnek vagy gyermekének a Rabipur-t, olvassa el figyelmesen
A Boostrix Polio diphtheria, tetanus, pertussis és poliomyelitis elleni emlékeztető oltásra javasolt 4 éves kortól (lásd 4.2 pont).
 1. A GYÓGYSZER NEVE Boostrix Polio szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus, pertussis (acelluláris összetevő) és (inaktivált) poliomyelitis vakcina (adszorbeált, csökkentett
1. A GYÓGYSZER NEVE Boostrix Polio szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus, pertussis (acelluláris összetevő) és (inaktivált) poliomyelitis vakcina (adszorbeált, csökkentett
I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY MEGNEVEZÉSE MASIVET 50 mg-os filmbevonatú tabletta kutyák számára MASIVET 150 mg-os filmbevonatú tabletta kutyák
I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY MEGNEVEZÉSE MASIVET 50 mg-os filmbevonatú tabletta kutyák számára MASIVET 150 mg-os filmbevonatú tabletta kutyák
ÁLLATEGÉSZSÉGÜGYI, ÁLLATJÓLÉTI KÖVETELMÉNYEK Állatjólét
 Az FVM Vidékfejlesztési, Képzési és Szaktanácsadási Intézet megbízásából készült ÁLLATEGÉSZSÉGÜGYI, ÁLLATJÓLÉTI KÖVETELMÉNYEK Állatjólét Szerző: Dr. Buri Antal Lektorok: Dr. Péter Katalin Dr. Hanzséros
Az FVM Vidékfejlesztési, Képzési és Szaktanácsadási Intézet megbízásából készült ÁLLATEGÉSZSÉGÜGYI, ÁLLATJÓLÉTI KÖVETELMÉNYEK Állatjólét Szerző: Dr. Buri Antal Lektorok: Dr. Péter Katalin Dr. Hanzséros
Törvényességi Ellenőrzési és Felügyeleti Főosztály
 Törvényességi Ellenőrzési és Felügyeleti Főosztály Magyarország helyi önkormányzatairól szóló 2011. évi CLXXXIX. törvény szabályozza a törvényességi felügyelet rendjét, a 132. -tól kezdődően A helyi önkormányzatok
Törvényességi Ellenőrzési és Felügyeleti Főosztály Magyarország helyi önkormányzatairól szóló 2011. évi CLXXXIX. törvény szabályozza a törvényességi felügyelet rendjét, a 132. -tól kezdődően A helyi önkormányzatok
ÁLLATI EREDETŰ, EMBERGYÓGYÁSZATI IMMUNSZÉRUMOK. Immunosera ex animale ad usum humanum
 Immunosera ex animale ad usum humanum Ph.Hg.VIII. Ph.Eur.5.8-1 ÁLLATI EREDETŰ, EMBERGYÓGYÁSZATI IMMUNSZÉRUMOK Immunosera ex animale ad usum humanum 07/2007:0084 DEFINÍCIÓ Az állati eredetű, embergyógyászati
Immunosera ex animale ad usum humanum Ph.Hg.VIII. Ph.Eur.5.8-1 ÁLLATI EREDETŰ, EMBERGYÓGYÁSZATI IMMUNSZÉRUMOK Immunosera ex animale ad usum humanum 07/2007:0084 DEFINÍCIÓ Az állati eredetű, embergyógyászati
AJÁNLÁSOK BIZOTTSÁG A BIZOTTSÁG AJÁNLÁSA. (2007. június 18.)
 2007.7.30. HU Az Európai Unió Hivatalos Lapja L 197/1 II (Az EK-Szerződés/Euratom-Szerződés alapján elfogadott jogi aktusok, amelyek közzététele nem kötelező) AJÁNLÁSOK BIZOTTSÁG A BIZOTTSÁG AJÁNLÁSA (2007.
2007.7.30. HU Az Európai Unió Hivatalos Lapja L 197/1 II (Az EK-Szerződés/Euratom-Szerződés alapján elfogadott jogi aktusok, amelyek közzététele nem kötelező) AJÁNLÁSOK BIZOTTSÁG A BIZOTTSÁG AJÁNLÁSA (2007.
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA. Coxevac d232 PI HU 2010-09-06 clean.doc
 1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE COXEVAC szuszpenziós injekció szarvasmarhának és kecskének 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml tartalmaz:
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE COXEVAC szuszpenziós injekció szarvasmarhának és kecskének 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml tartalmaz:
Beszámoló feltöltése (zárójelentés)
 Beszámoló feltöltése (zárójelentés) Az OTKA kutatási feladat keretében született eredményeket folyamatosan publikáltuk, ezért e helyen a beszámolási útmutató szerint az elvégzett munkát csupán röviden
Beszámoló feltöltése (zárójelentés) Az OTKA kutatási feladat keretében született eredményeket folyamatosan publikáltuk, ezért e helyen a beszámolási útmutató szerint az elvégzett munkát csupán röviden
50/2006. (VI. 28.) FVM rendelet. az állatgyógyászati készítményekről. Általános rendelkezések
 50/2006. (VI. 28.) FVM rendelet az állatgyógyászati készítményekről Az állategészségügyről szóló 2005. évi CLXXVI. törvény (a továbbiakban: Áeü.) 47. -a (2) bekezdésének 10. pontjában, a gyógyszertárak
50/2006. (VI. 28.) FVM rendelet az állatgyógyászati készítményekről Az állategészségügyről szóló 2005. évi CLXXVI. törvény (a továbbiakban: Áeü.) 47. -a (2) bekezdésének 10. pontjában, a gyógyszertárak
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK AZ OLTANDÓK SZÁMÁRA
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK AZ OLTANDÓK SZÁMÁRA Tetanol pur szuszpenziós injekció előretöltött fecskendőben adszorbeált tetanusz toxoid vakcina, tartósítószer nélkül Mielőtt beadnák Önnek ezt a vakcinát,
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK AZ OLTANDÓK SZÁMÁRA Tetanol pur szuszpenziós injekció előretöltött fecskendőben adszorbeált tetanusz toxoid vakcina, tartósítószer nélkül Mielőtt beadnák Önnek ezt a vakcinát,
A Mencevax ACWY megfelel a WHO biológiai készítményekre és a meningococcus meningitis vakcinákra vonatkozó előírásainak.
 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE MENCEVAX ACWY135 Y egy adagos vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Összetétel dózisonként: Neisseria meningitidis poliszacharid A típusú, tisztított 50,0 μg
1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE MENCEVAX ACWY135 Y egy adagos vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Összetétel dózisonként: Neisseria meningitidis poliszacharid A típusú, tisztított 50,0 μg
I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Meloxidyl 1,5 mg/ml belsőleges szuszpenzió kutyáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml tartalmaz
I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Meloxidyl 1,5 mg/ml belsőleges szuszpenzió kutyáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 ml tartalmaz
14/2006. (II. 16.) FVM-EüM-ICsSzEM együttes rendelet. a kistermelői élelmiszer-termelés, -előállítás és -értékesítés feltételeiről
 14/2006. (II. 16.) FVM-EüM-ICsSzEM együttes rendelet a kistermelői élelmiszer-termelés, -előállítás és -értékesítés feltételeiről Az élelmiszerekről szóló 2003. évi LXXXII. törvény 20. -a (3) bekezdésének
14/2006. (II. 16.) FVM-EüM-ICsSzEM együttes rendelet a kistermelői élelmiszer-termelés, -előállítás és -értékesítés feltételeiről Az élelmiszerekről szóló 2003. évi LXXXII. törvény 20. -a (3) bekezdésének
20. évfolyam 1. KÜLÖNSZÁM 2013. február 12. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT. Epinfo AZ ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT MÓDSZERTANI LEVELE
 20. évfolyam 1. KÜLÖNSZÁM 2013. február 12. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT E p i d e m i o l ó g i a i I n f o r m á c i ó s H e t i l a p AZ ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT MÓDSZERTANI LEVELE A 2013.
20. évfolyam 1. KÜLÖNSZÁM 2013. február 12. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT E p i d e m i o l ó g i a i I n f o r m á c i ó s H e t i l a p AZ ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT MÓDSZERTANI LEVELE A 2013.
Az Országos Epidemiológiai Központ módszertani levele a 2016. évi védőoltásokról. 2016. EüK. 4. szám közlemény 3 (hatályos: 2016.02.
 I. BEVEZETÉS Az Országos Epidemiológiai Központ módszertani levele a 2016. évi védőoltásokról 2016. EüK. 4. szám közlemény 3 (hatályos: 2016.02.15 - ) A Védőoltási Módszertani Levél a fertőző betegségek
I. BEVEZETÉS Az Országos Epidemiológiai Központ módszertani levele a 2016. évi védőoltásokról 2016. EüK. 4. szám közlemény 3 (hatályos: 2016.02.15 - ) A Védőoltási Módszertani Levél a fertőző betegségek
Az antimikrobiális szerek élelmiszertermelő állatokban való alkalmazására vonatkozó legjobb gyakorlat keretei az Európai Unióban
 Európai Platform az Állatgyógyszerek Felelős Alkalmazásáért Az antimikrobiális szerek élelmiszertermelő állatokban való alkalmazására vonatkozó legjobb gyakorlat keretei az Európai Unióban Tartalomjegyzék
Európai Platform az Állatgyógyszerek Felelős Alkalmazásáért Az antimikrobiális szerek élelmiszertermelő állatokban való alkalmazására vonatkozó legjobb gyakorlat keretei az Európai Unióban Tartalomjegyzék
1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE. Metacam 0,5 mg/ml belsőleges szuszpenzió macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL.
 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Metacam 0,5 mg/ml belsőleges szuszpenzió macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy ml tartalmaz: Hatóanyag: Meloxicam Segédanyag: Nátrium-benzoát 0,5 mg
1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Metacam 0,5 mg/ml belsőleges szuszpenzió macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy ml tartalmaz: Hatóanyag: Meloxicam Segédanyag: Nátrium-benzoát 0,5 mg
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Sevelamer carbonate Zentiva 800 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy tabletta 800 mg szevelamer-karbonátot tartalmaz. A segédanyagok
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Sevelamer carbonate Zentiva 800 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy tabletta 800 mg szevelamer-karbonátot tartalmaz. A segédanyagok
Kenőcs A kenőcs különösen alkalmas a száraz, lichenifikált és pikkelyesen hámló elváltozásokra.
 1. A GYÓGYSZER NEVE Dermovate krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg klobetazol-propionát 1 g 0,05%-os kenőcsben. Dermovate krém 0,5 mg klobetazol-propionát 1 g 0,05%-os krémben. A segédanyagok
1. A GYÓGYSZER NEVE Dermovate krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg klobetazol-propionát 1 g 0,05%-os kenőcsben. Dermovate krém 0,5 mg klobetazol-propionát 1 g 0,05%-os krémben. A segédanyagok
Hydrocortison-Wagner
 Nyilvános Értékelő Jelentés Gyógyszernév: (hidokortizon-acetát) Nemzeti eljárás A forgalomba hozatali engedély jogosultja: Wagner-Pharma Gyógyszerfejlesztő, Gyártó és Forgalmazó Kft. Kelt: 2015. december
Nyilvános Értékelő Jelentés Gyógyszernév: (hidokortizon-acetát) Nemzeti eljárás A forgalomba hozatali engedély jogosultja: Wagner-Pharma Gyógyszerfejlesztő, Gyártó és Forgalmazó Kft. Kelt: 2015. december
Nyilvános Értékelő Jelentés. Alleopti Komfort. 20 mg/ml oldatos szemcsepp egyadagos tartályban. (nátrium-kromoglikát)
 Nyilvános Értékelő Jelentés Gyógyszernév: (nátrium-kromoglikát) Nemzeti eljárás A forgalomba hozatali engedély jogosultja: Sanofi-aventis Zrt. Kelt: 2014. november 11. TARTALOM NEM EGÉSZSÉGÜGYI SZAKEMBEREKNEK
Nyilvános Értékelő Jelentés Gyógyszernév: (nátrium-kromoglikát) Nemzeti eljárás A forgalomba hozatali engedély jogosultja: Sanofi-aventis Zrt. Kelt: 2014. november 11. TARTALOM NEM EGÉSZSÉGÜGYI SZAKEMBEREKNEK
1. A GYÓGYSZER MEGNEVEZÉSE. Cutivate 0,5 mg/g krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
 1. A GYÓGYSZER MEGNEVEZÉSE Cutivate 0,5 mg/g krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg flutikazon-propionát (mikronizált) 1 gramm krémben. 7,5 mg flutikazon-propionát (mikronizált) 15 g krémben.
1. A GYÓGYSZER MEGNEVEZÉSE Cutivate 0,5 mg/g krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg flutikazon-propionát (mikronizált) 1 gramm krémben. 7,5 mg flutikazon-propionát (mikronizált) 15 g krémben.
0,3 milligramm Al 3+ [Al(OH) 3 ] és alumínium-foszfáthoz (AlPO 4 ) kötött 0,2 milligramm Al 3+
![0,3 milligramm Al 3+ [Al(OH) 3 ] és alumínium-foszfáthoz (AlPO 4 ) kötött 0,2 milligramm Al 3+ 0,3 milligramm Al 3+ [Al(OH) 3 ] és alumínium-foszfáthoz (AlPO 4 ) kötött 0,2 milligramm Al 3+](/thumbs/39/18583412.jpg) 1. A GYÓGYSZER NEVE Boostrix szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus és pertussis (acelluláris összetevő) vakcina (adszorbeált, csökkentett antigén tartalmú) 2. MINŐSÉGI ÉS
1. A GYÓGYSZER NEVE Boostrix szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus és pertussis (acelluláris összetevő) vakcina (adszorbeált, csökkentett antigén tartalmú) 2. MINŐSÉGI ÉS
KÖLCSÖNÖS MEGFELELTETÉS 2013. évi új előírásai
 KÖLCSÖNÖS MEGFELELTETÉS 2013. évi új előírásai JFGK 16.: BORJAK VÉDELME A követelmények célja: Az állattartót terheli a felelősség azért, hogy a borjak tartási körülményei minden szempontból megfeleljenek
KÖLCSÖNÖS MEGFELELTETÉS 2013. évi új előírásai JFGK 16.: BORJAK VÉDELME A követelmények célja: Az állattartót terheli a felelősség azért, hogy a borjak tartási körülményei minden szempontból megfeleljenek
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
Az egészségbiztosítási ellátások
 Az egészségbiztosítási ellátások Biczók Gyöngyi 1 Tartalom Oldal 1. Ellátásokra jogosultság 2 2. A legfontosabb fogalmak meghatározása 2 2.1 Biztosítási jogviszony 2 2.2 Egészségbiztosítási ellátás 3 3.
Az egészségbiztosítási ellátások Biczók Gyöngyi 1 Tartalom Oldal 1. Ellátásokra jogosultság 2 2. A legfontosabb fogalmak meghatározása 2 2.1 Biztosítási jogviszony 2 2.2 Egészségbiztosítási ellátás 3 3.
OROSZLÁNY ÉS TÉRSÉGE EGÉSZSÉGFEJLESZTÉSI TERVE
 OROSZLÁNY ÉS TÉRSÉGE EGÉSZSÉGFEJLESZTÉSI TERVE Tartalom 1. Az egészségfejlesztési tervet megalapozó háttérkutatás... 3 A térség demográfiai szerkezete... 3 A térség lakosságának szociális-gazdasági helyzete...
OROSZLÁNY ÉS TÉRSÉGE EGÉSZSÉGFEJLESZTÉSI TERVE Tartalom 1. Az egészségfejlesztési tervet megalapozó háttérkutatás... 3 A térség demográfiai szerkezete... 3 A térség lakosságának szociális-gazdasági helyzete...
2012. évi CXXVIII. törvény
 1. oldal 2012. évi CXXVIII. törvény a szakmaközi szervezetekről és az agrárpiaci szabályozás egyes kérdéseiről 1 1. A törvény hatálya 1. (1) E törvény hatálya kiterjed a) a mezőgazdasági és élelmiszer-ipari
1. oldal 2012. évi CXXVIII. törvény a szakmaközi szervezetekről és az agrárpiaci szabályozás egyes kérdéseiről 1 1. A törvény hatálya 1. (1) E törvény hatálya kiterjed a) a mezőgazdasági és élelmiszer-ipari
Flexove 625 mg Tabletta Szájon át történő alkalmazás 1327 Lysaker, Norvégia Belgium - Navamedic ASA Vollsveien 13 C 1327 Lysaker, Norvégia
 I. MELLÉKLET FELSOROLÁS: MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZERKÉSZÍTMÉNY- DÓZISOK, ALKALMAZÁSI MÓDOK, KÉRELMEZŐ, FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA A TAGÁLLAMOKBAN 1 Tagállam Forgalomba hozatali engedély
I. MELLÉKLET FELSOROLÁS: MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZERKÉSZÍTMÉNY- DÓZISOK, ALKALMAZÁSI MÓDOK, KÉRELMEZŐ, FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJA A TAGÁLLAMOKBAN 1 Tagállam Forgalomba hozatali engedély
2/1998. (I. 16.) MüM rendelet
 2/1998. (I. 16.) MüM rendelet 2004.05.01-től hatályos szöveg! a munkahelyen alkalmazandó biztonsági és egészségvédelmi jelzésekről A munkavédelemről szóló 1993. évi XCIII. törvény (a továbbiakban: Mvt.)
2/1998. (I. 16.) MüM rendelet 2004.05.01-től hatályos szöveg! a munkahelyen alkalmazandó biztonsági és egészségvédelmi jelzésekről A munkavédelemről szóló 1993. évi XCIII. törvény (a továbbiakban: Mvt.)
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Td-pur szuszpenziós injekció előretöltött fecskendőben tetanusz/diftéria adszorbeált vakcina tartósítószer nélkül, 5 éven felüliek számára Mielőtt beadják
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Td-pur szuszpenziós injekció előretöltött fecskendőben tetanusz/diftéria adszorbeált vakcina tartósítószer nélkül, 5 éven felüliek számára Mielőtt beadják
Kutatási beszámoló. a KDOP-3.1.1/D2/13-k2-2013-0004 jelű, Szociális város-rehabilitáció Szárazréten elnevezésű projekt hatásának mérése
 Kutatási beszámoló a KDOP-3.1.1/D2/13-k2-2013-0004 jelű, Szociális város-rehabilitáció Szárazréten elnevezésű projekt hatásának mérése 2015. május Tartalomjegyzék I. A kutatás háttere... 3 II. Az empirikus
Kutatási beszámoló a KDOP-3.1.1/D2/13-k2-2013-0004 jelű, Szociális város-rehabilitáció Szárazréten elnevezésű projekt hatásának mérése 2015. május Tartalomjegyzék I. A kutatás háttere... 3 II. Az empirikus
Tömörkény Községi Önkormányzat. Képviselő-testületének. 22/2000. (XI. 29.) ÖKt. számú. R e n d e l e t e
 Tömörkény Községi Önkormányzat Képviselő-testületének 22/2000. (XI. 29.) ÖKt. számú R e n d e l e t e az Önkormányzati tulajdonú víziközműből szolgáltatott ivóvíz díjáról Egységes szerkezetben Tömörkény
Tömörkény Községi Önkormányzat Képviselő-testületének 22/2000. (XI. 29.) ÖKt. számú R e n d e l e t e az Önkormányzati tulajdonú víziközműből szolgáltatott ivóvíz díjáról Egységes szerkezetben Tömörkény
A BIZOTTSÁG 2009/120/EK IRÁNYELVE
 2009.9.15. Az Európai Unió Hivatalos Lapja L 242/3 IRÁNYELVEK A BIZOTTSÁG 2009/120/EK IRÁNYELVE (2009. szeptember 14.) a fejlett terápiás gyógyszerkészítmények tekintetében az emberi felhasználásra szánt
2009.9.15. Az Európai Unió Hivatalos Lapja L 242/3 IRÁNYELVEK A BIZOTTSÁG 2009/120/EK IRÁNYELVE (2009. szeptember 14.) a fejlett terápiás gyógyszerkészítmények tekintetében az emberi felhasználásra szánt
GYÓGYSZERANYAGOK. Corpora ad usum pharmaceuticum
 Corpora ad usum pharmaceuticum Ph.Hg.VIII. Ph.Eur.6.3-1 DEFINÍCIÓ GYÓGYSZERANYAGOK Corpora ad usum pharmaceuticum 01/2009:2034 Gyógyszeranyagnak nevezünk minden olyan szerves és szervetlen anyagot, amelyet
Corpora ad usum pharmaceuticum Ph.Hg.VIII. Ph.Eur.6.3-1 DEFINÍCIÓ GYÓGYSZERANYAGOK Corpora ad usum pharmaceuticum 01/2009:2034 Gyógyszeranyagnak nevezünk minden olyan szerves és szervetlen anyagot, amelyet
AZ EURÓPAI PARLAMENT ÉS A TANÁCS IRÁNYELVE (2001. november 6.) az emberi felhasználásra szánt gyógyszerek közösségi kódexéről (2001/83/EK)
 2001L0083 HU 05.10.2009 008.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B AZ EURÓPAI PARLAMENT ÉS A TANÁCS IRÁNYELVE (2001. november
2001L0083 HU 05.10.2009 008.001 1 Ez a dokumentum kizárólag tájékoztató jellegű, az intézmények semmiféle felelősséget nem vállalnak a tartalmáért B AZ EURÓPAI PARLAMENT ÉS A TANÁCS IRÁNYELVE (2001. november
I. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/25
 I. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/25 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Previcox 57 mg rágótabletta kutyák részére Previcox 227 mg rágótabletta kutyák részére 2. MINŐSÉGI ÉS MENNYISÉGI
I. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1/25 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Previcox 57 mg rágótabletta kutyák részére Previcox 227 mg rágótabletta kutyák részére 2. MINŐSÉGI ÉS MENNYISÉGI
40/2013. (II. 14.) Korm. rendelet az állatkísérletekről 2014.03.26 2016.12.31 4 40/2013. (II. 14.) Korm. rendelet az állatkísérletekről
 40/2013. (II. 14.) Korm. rendelet az állatkísérletekről 2014.03.26 2016.12.31 4 40/2013. (II. 14.) Korm. rendelet az állatkísérletekről A Kormány az állatok védelméről és kíméletéről szóló 1998. évi XXVIII.
40/2013. (II. 14.) Korm. rendelet az állatkísérletekről 2014.03.26 2016.12.31 4 40/2013. (II. 14.) Korm. rendelet az állatkísérletekről A Kormány az állatok védelméről és kíméletéről szóló 1998. évi XXVIII.
I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Loxicom 0,5 mg/ml belsőleges szuszpenzió kutyáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1,0 ml készítmény
I. sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Loxicom 0,5 mg/ml belsőleges szuszpenzió kutyáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1,0 ml készítmény
1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE. Melosus 0,5 mg/ml belsőleges szuszpenzió macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL.
 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Melosus 0,5 mg/ml belsőleges szuszpenzió macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy ml tartalmaz: Hatóanyag: Meloxicam 0,5 mg Segédanyag: Nátrium-benzoát
1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE Melosus 0,5 mg/ml belsőleges szuszpenzió macskáknak 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy ml tartalmaz: Hatóanyag: Meloxicam 0,5 mg Segédanyag: Nátrium-benzoát
AJÁNLATI DOKUMENTÁCIÓ
 Balassi Intézet 1016 Budapest Somlói út 51. AJÁNLATI DOKUMENTÁCIÓ A Párizsi Magyar Intézet (92, rue Bonaparte 75006 Paris) épületének állapotrögzítő felmérési tervdokumentációja Az Ajánlati Dokumentáció
Balassi Intézet 1016 Budapest Somlói út 51. AJÁNLATI DOKUMENTÁCIÓ A Párizsi Magyar Intézet (92, rue Bonaparte 75006 Paris) épületének állapotrögzítő felmérési tervdokumentációja Az Ajánlati Dokumentáció
5.10. GYÓGYSZERANYAGOK SZENNYEZÉSVIZSGÁLATA
 5.10. Gyógyszeranyagok szennyezésvizsgálata Ph.Hg.VIII. Ph.Eur.6.5-1 Bevezetés 5.10. GYÓGYSZERANYAGOK SZENNYEZÉSVIZSGÁLATA 01/2008:51000 javított 6.5 Az Európai Gyógyszerkönyv gyógyszeranyag-cikkelyeit
5.10. Gyógyszeranyagok szennyezésvizsgálata Ph.Hg.VIII. Ph.Eur.6.5-1 Bevezetés 5.10. GYÓGYSZERANYAGOK SZENNYEZÉSVIZSGÁLATA 01/2008:51000 javított 6.5 Az Európai Gyógyszerkönyv gyógyszeranyag-cikkelyeit
50 mikrogramm flutikazon-propionát adagonként. (Az adagolópumpa 100 milligramm szuszpenziót bocsájt ki adagonként.)
 1. A GYÓGYSZER NEVE Flixonase szuszpenziós orrspray 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 50 mikrogramm flutikazon-propionát adagonként. (Az adagolópumpa 100 milligramm szuszpenziót bocsájt ki adagonként.)
1. A GYÓGYSZER NEVE Flixonase szuszpenziós orrspray 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 50 mikrogramm flutikazon-propionát adagonként. (Az adagolópumpa 100 milligramm szuszpenziót bocsájt ki adagonként.)
 ű ű ű ű ű ű ű ű Ö Ö ű ű ű ű ű ű ű ű ű ű Á ű ű ű ű ű ű ű ű ű Ő ű Á ű ű Á ű Á ű ű ű Ő ű ű ű ű ű ű ű ű ű ű ű ű ű Á ű ű Á ű ű Ő ű ű ű ű ű Á ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű
ű ű ű ű ű ű ű ű Ö Ö ű ű ű ű ű ű ű ű ű ű Á ű ű ű ű ű ű ű ű ű Ő ű Á ű ű Á ű Á ű ű ű Ő ű ű ű ű ű ű ű ű ű ű ű ű ű Á ű ű Á ű ű Ő ű ű ű ű ű Á ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű ű
BALATONFÖLDVÁR VÁROS ÖNKORMÁNYZATÁNAK 14/2007. (X.31.) ÖNKORMÁNYZATI R E N D E L E T E AZ ÁLLATTARTÁSRÓL 1
 BALATONFÖLDVÁR VÁROS ÖNKORMÁNYZATÁNAK 14/2007. (X.31.) ÖNKORMÁNYZATI R E N D E L E T E AZ ÁLLATTARTÁSRÓL 1 Balatonföldvár Város Képviselő-testülete (a továbbiakban: képviselő-testület) a helyi önkormányzatokról
BALATONFÖLDVÁR VÁROS ÖNKORMÁNYZATÁNAK 14/2007. (X.31.) ÖNKORMÁNYZATI R E N D E L E T E AZ ÁLLATTARTÁSRÓL 1 Balatonföldvár Város Képviselő-testülete (a továbbiakban: képviselő-testület) a helyi önkormányzatokról
11. évfolyam 1. KÜLÖNSZÁM 2004. január 27. JOHAN BÉLA ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT. Epinfo A "JOHAN BÉLA" ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT
 11. évfolyam 1. KÜLÖNSZÁM 2004. január 27. JOHAN BÉLA ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epidemiológiai Információs Hetilap A "JOHAN BÉLA" ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT MÓDSZERTANI LEVELE A 2004. ÉVI VÉDŐOLTÁSOKRÓL
11. évfolyam 1. KÜLÖNSZÁM 2004. január 27. JOHAN BÉLA ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT Epidemiológiai Információs Hetilap A "JOHAN BÉLA" ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT MÓDSZERTANI LEVELE A 2004. ÉVI VÉDŐOLTÁSOKRÓL
II. Melléklet. Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása
 II. Melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 6 Tudományos következtetések Az EMLA krém és kapcsolódó nevek (lásd I. melléklet) tudományos
II. Melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 6 Tudományos következtetések Az EMLA krém és kapcsolódó nevek (lásd I. melléklet) tudományos
AZ EURÓPAI KÖZÖSSÉGEK BIZOTTSÁGA. Javaslat: A TANÁCS IRÁNYELVE
 HU HU HU AZ EURÓPAI KÖZÖSSÉGEK BIZOTTSÁGA Brüsszel, 28.4.2005 COM(2005) 171 végleges 2005/0062 (CNS) 2005/0063 (CNS) Javaslat: A TANÁCS IRÁNYELVE a madárinfluenza (klasszikus baromfipestis) elleni védekezésre
HU HU HU AZ EURÓPAI KÖZÖSSÉGEK BIZOTTSÁGA Brüsszel, 28.4.2005 COM(2005) 171 végleges 2005/0062 (CNS) 2005/0063 (CNS) Javaslat: A TANÁCS IRÁNYELVE a madárinfluenza (klasszikus baromfipestis) elleni védekezésre
8/2004. (III. 25.) AB határozat
 8/2004. (III. 25.) AB határozat A MAGYAR KÖZTÁRSASÁG NEVÉBEN! Az Alkotmánybíróság jogszabály alkotmányellenességének utólagos vizsgálatára irányuló indítványok tárgyában meghozta a következő határozatot:
8/2004. (III. 25.) AB határozat A MAGYAR KÖZTÁRSASÁG NEVÉBEN! Az Alkotmánybíróság jogszabály alkotmányellenességének utólagos vizsgálatára irányuló indítványok tárgyában meghozta a következő határozatot:
TÁMOP-4.1.1.F-14/1/KONV-2015-0006 Egység, alprojekt/alprogram neve Rendezvény cím, dátum
 TÁMOP-4.1.1.F-14/1/KONV-2015-0006 Egység, alprojekt/alprogram neve Rendezvény cím, dátum AZ ÉLŐ ÁLLATOK BELFÖLDI SZÁLLÍTÁSÁNAK ÁLLAT- EGÉSZSÉGÜGYI SZABÁLYAIRÓL Előadó neve AZ ÁLLATSZÁLLÍTÁS ÁLTALÁNOS SZABÁLYAI
TÁMOP-4.1.1.F-14/1/KONV-2015-0006 Egység, alprojekt/alprogram neve Rendezvény cím, dátum AZ ÉLŐ ÁLLATOK BELFÖLDI SZÁLLÍTÁSÁNAK ÁLLAT- EGÉSZSÉGÜGYI SZABÁLYAIRÓL Előadó neve AZ ÁLLATSZÁLLÍTÁS ÁLTALÁNOS SZABÁLYAI
TABLETTÁK. Compressi
 Ph.Hg.VIII. Ph.Eur.8.0-1 01/2014:0478 TABLETTÁK Compressi E cikkely követelményeit a nem bevételre szánt tablettákra nem kell feltétlenül alkalmazni. Ezekre a készítményekre esetenként más általános cikkelyek,
Ph.Hg.VIII. Ph.Eur.8.0-1 01/2014:0478 TABLETTÁK Compressi E cikkely követelményeit a nem bevételre szánt tablettákra nem kell feltétlenül alkalmazni. Ezekre a készítményekre esetenként más általános cikkelyek,
III. melléklet. Az alkalmazási előírás és a betegtájékoztató egyes fejezeteinek módosításai
 III. melléklet Az alkalmazási előírás és a betegtájékoztató egyes fejezeteinek módosításai 49 Metoklopramid-tartalmú termékek Az alábbi szövegrészek a megfelelő módon beillesztendők a forgalomba hozatali
III. melléklet Az alkalmazási előírás és a betegtájékoztató egyes fejezeteinek módosításai 49 Metoklopramid-tartalmú termékek Az alábbi szövegrészek a megfelelő módon beillesztendők a forgalomba hozatali
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA
 1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE HIPRABOVIS IBR MARKER LIVE liofilizátum és oldószer szuszpenziós injekcióhoz szarvasmarháknak. 2. MINŐSÉGI
1.sz. MELLÉKLET A KÉSZÍTMÉNY JELLEMZŐINEK ÖSSZEFOGLALÓJA 1 1. AZ ÁLLATGYÓGYÁSZATI KÉSZÍTMÉNY NEVE HIPRABOVIS IBR MARKER LIVE liofilizátum és oldószer szuszpenziós injekcióhoz szarvasmarháknak. 2. MINŐSÉGI
2.6.13. NEM STERIL TERMÉKEK MIKROBIOLÓGIAI VIZSGÁLATA: VIZSGÁLAT MEGHATÁROZOTT MIKROORGANIZMUSOKRA
 2.6.13. Nem steril termékek mikrobiológiai vizsgálata Ph.Hg.VIII. - Ph.Eur.6.0. 1 01/2008:20613 javított 6.0 2.6.13. NEM STERIL TERMÉKEK MIKROBIOLÓGIAI VIZSGÁLATA: VIZSGÁLAT MEGHATÁROZOTT MIKROORGANIZMUSOKRA
2.6.13. Nem steril termékek mikrobiológiai vizsgálata Ph.Hg.VIII. - Ph.Eur.6.0. 1 01/2008:20613 javított 6.0 2.6.13. NEM STERIL TERMÉKEK MIKROBIOLÓGIAI VIZSGÁLATA: VIZSGÁLAT MEGHATÁROZOTT MIKROORGANIZMUSOKRA
39/1994. (VI. 28.) FM rendelet. Mesterséges termékenyítés. Mesterséges termékenyítő állomások
 39/1994. (VI. 28.) FM rendelet a mesterséges termékenyítésről, az embrióátültetésről, az állati szaporítóanyagok előállításáról, felkínálásáról, forgalmazásáról és felhasználásáról Az állattenyésztésről
39/1994. (VI. 28.) FM rendelet a mesterséges termékenyítésről, az embrióátültetésről, az állati szaporítóanyagok előállításáról, felkínálásáról, forgalmazásáról és felhasználásáról Az állattenyésztésről
22. évfolyam 1. KÜLÖNSZÁM 2015. március 30. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT. Epinfo AZ ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT MÓDSZERTANI LEVELE
 22. évfolyam 1. KÜLÖNSZÁM 2015. március 30. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT E p i d e m i o l ó g i a i I n f o r m á c i ó s H e t i l a p AZ ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT MÓDSZERTANI LEVELE A 2015.
22. évfolyam 1. KÜLÖNSZÁM 2015. március 30. ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT E p i d e m i o l ó g i a i I n f o r m á c i ó s H e t i l a p AZ ORSZÁGOS EPIDEMIOLÓGIAI KÖZPONT MÓDSZERTANI LEVELE A 2015.
40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban).
 1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
Változások az ingatlan-nyilvántartási törvényben és a földforgalom szabályozásában
 Dr. Bá bits K r isztina jogász Nemzeti Agrárgazdasági Kamara Változások az ingatlan-nyilvántartási törvényben és a földforgalom szabályozásában 54 1. A bürokráciacsökkentéssel összefüggő törvénymódosítások
Dr. Bá bits K r isztina jogász Nemzeti Agrárgazdasági Kamara Változások az ingatlan-nyilvántartási törvényben és a földforgalom szabályozásában 54 1. A bürokráciacsökkentéssel összefüggő törvénymódosítások
UTASBIZTOSÍTÁS. ÁLTALÁNOS SZERZŐDÉSI FELTÉTELEK Classic, Fiesta és Superior módozatokhoz
 Mapfre Asistencia S.A. Magyarországi Fióktelepe 1146 Budapest, Hermina út 17. Telefon: (06 40) 200 521, fax: (06 1) 461 0624 Adószám: 22157629-1-42 1. cikkely FOGALMAK UTASBIZTOSÍTÁS ÁLTALÁNOS SZERZŐDÉSI
Mapfre Asistencia S.A. Magyarországi Fióktelepe 1146 Budapest, Hermina út 17. Telefon: (06 40) 200 521, fax: (06 1) 461 0624 Adószám: 22157629-1-42 1. cikkely FOGALMAK UTASBIZTOSÍTÁS ÁLTALÁNOS SZERZŐDÉSI
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Prepandrix szuszpenzió és emulzió emulziós injekcióhoz Prepandémiás influenza (H5N1) vakcina (split virion, inaktivált, adjuvánshoz kötött) Mielőtt elkezdené
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Prepandrix szuszpenzió és emulzió emulziós injekcióhoz Prepandémiás influenza (H5N1) vakcina (split virion, inaktivált, adjuvánshoz kötött) Mielőtt elkezdené
ÚTMUTATÓ. A KEDVTELÉSBŐL TARTOTT ÁLLATOK MOZGÁSÁNAK HATÓSÁGI ELLENŐRZÉSÉHEZ (6. Módosított változat)
 ÚTMUTATÓ A KEDVTELÉSBŐL TARTOTT ÁLLATOK MOZGÁSÁNAK HATÓSÁGI ELLENŐRZÉSÉHEZ (6. Módosított változat) I. FOGALOM-MEGHATÁROZÁSOK Listán szereplő/nem szereplő harmadik ország: a kedvtelésből tartott állatok
ÚTMUTATÓ A KEDVTELÉSBŐL TARTOTT ÁLLATOK MOZGÁSÁNAK HATÓSÁGI ELLENŐRZÉSÉHEZ (6. Módosított változat) I. FOGALOM-MEGHATÁROZÁSOK Listán szereplő/nem szereplő harmadik ország: a kedvtelésből tartott állatok
Pincehely Nagyközség Önkormányzata Képviselő-testületének 10/2003.(XII.31.) önkormányzatai rendelete A helyi építési szabályzatról
 Pincehely Nagyközség Önkormányzata Képviselő-testületének 10/2003.(XII.31.) önkormányzatai rendelete A helyi építési szabályzatról (egységes szerkezetben a módosításáról szóló 5/2014.(VII.22.) önkormányzati
Pincehely Nagyközség Önkormányzata Képviselő-testületének 10/2003.(XII.31.) önkormányzatai rendelete A helyi építési szabályzatról (egységes szerkezetben a módosításáról szóló 5/2014.(VII.22.) önkormányzati
Az Áldozatsegítő Szolgálat Missziója
 AZ ÁLDOZATSEGÍTŐ SZOLGÁLAT TEVÉKENYSÉGE 2009. Az Áldozatsegítő Szolgálat Missziója A jogállam feladata biztosítani a bűncselekmények felderítését és üldözését, a bűnösség kérdésének tisztességes eljárásban
AZ ÁLDOZATSEGÍTŐ SZOLGÁLAT TEVÉKENYSÉGE 2009. Az Áldozatsegítő Szolgálat Missziója A jogállam feladata biztosítani a bűncselekmények felderítését és üldözését, a bűnösség kérdésének tisztességes eljárásban
DOKUMENTÁCIÓ PÉCS MEGYEI JOGÚ VÁROS ÖNKORMÁNYZATA ADÁSVÉTELI SZERZŐDÉS KERETÉBEN SZOFTVEREK ÉS 2014.
 DOKUMENTÁCIÓ PÉCS MEGYEI JOGÚ VÁROS ÖNKORMÁNYZATA ADÁSVÉTELI SZERZŐDÉS KERETÉBEN SZOFTVEREK ÉS HARDVEREK (OBU) SZÁLLÍTÁSA TÁRGYÁBAN INDÍTOTT KÖZBESZERZÉSI ELJÁRÁSÁHOZ 2014. 2/64 BEVEZETÉS Ön a Pécs Megyei
DOKUMENTÁCIÓ PÉCS MEGYEI JOGÚ VÁROS ÖNKORMÁNYZATA ADÁSVÉTELI SZERZŐDÉS KERETÉBEN SZOFTVEREK ÉS HARDVEREK (OBU) SZÁLLÍTÁSA TÁRGYÁBAN INDÍTOTT KÖZBESZERZÉSI ELJÁRÁSÁHOZ 2014. 2/64 BEVEZETÉS Ön a Pécs Megyei
B. BETEGTÁJÉKOZTATÓ 1
 B. BETEGTÁJÉKOZTATÓ 1 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Pandemrix szuszpenzió és emulzió emulziós injekcióhoz Pandémiás influenza (H1N1) vakcina (split virion, inaktivált, adjuvánshoz
B. BETEGTÁJÉKOZTATÓ 1 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Pandemrix szuszpenzió és emulzió emulziós injekcióhoz Pandémiás influenza (H1N1) vakcina (split virion, inaktivált, adjuvánshoz
E L Ő T E R J E S Z T É S
 E L Ő T E R J E S Z T É S Zirc Városi Önkormányzat Képviselő-testülete 2016. január 28.-i ülésére Tárgy: Tájékoztató Zirc közbiztonsági helyzetének javítási lehetőségeiről, figyelembe véve a megvalósított
E L Ő T E R J E S Z T É S Zirc Városi Önkormányzat Képviselő-testülete 2016. január 28.-i ülésére Tárgy: Tájékoztató Zirc közbiztonsági helyzetének javítási lehetőségeiről, figyelembe véve a megvalósított
ADATKEZELÉSI TÁJÉKOZTATÓ
 Hírlevélgyár.hu ADATKEZELÉSI TÁJÉKOZTATÓ 2006. október 1. 1. BEVEZETÉS...2 2. DEFINÍCIÓK...3 3. ALAPELVEK A HÍRLEVÉLGYÁR.HU ADATKEZELÉSE SORÁN...4 4. A SZEMÉLYES ADATOK KÖRE, AZ ADATKEZELÉS CÉLJA, JOGCÍME
Hírlevélgyár.hu ADATKEZELÉSI TÁJÉKOZTATÓ 2006. október 1. 1. BEVEZETÉS...2 2. DEFINÍCIÓK...3 3. ALAPELVEK A HÍRLEVÉLGYÁR.HU ADATKEZELÉSE SORÁN...4 4. A SZEMÉLYES ADATOK KÖRE, AZ ADATKEZELÉS CÉLJA, JOGCÍME
128/2009. (X. 6.) FVM rendelet
 128/2009. (X. 6.) FVM rendelet az állatgyógyászati termékekről Az élelmiszerláncról és hatósági felügyeletéről szóló 2008. évi XLVI. törvény 76. - a (2) bekezdésének 24. pontjában, valamint (5) bekezdésének
128/2009. (X. 6.) FVM rendelet az állatgyógyászati termékekről Az élelmiszerláncról és hatósági felügyeletéről szóló 2008. évi XLVI. törvény 76. - a (2) bekezdésének 24. pontjában, valamint (5) bekezdésének
A Havrix megfelel az Egészségügyi Világszervezet (WHO) biológiai anyagokra előírt követelményeinek.
 1. A GYÓGYSZER MEGNEVEZÉSE Havrix 1440 Elisa Egység szuszpenziós injekció előretöltött fecskendőben Havrix 720 Elisa Egység Junior szuszpenziós injekció előretöltött fecskendőben Hepatitis A vakcina antigén
1. A GYÓGYSZER MEGNEVEZÉSE Havrix 1440 Elisa Egység szuszpenziós injekció előretöltött fecskendőben Havrix 720 Elisa Egység Junior szuszpenziós injekció előretöltött fecskendőben Hepatitis A vakcina antigén
Debrecen Megyei Jogú Város Önkormányzata szolgáltatástervezési koncepciójának 2015. évi felülvizsgálata
 Debrecen Megyei Jogú Város Önkormányzata szolgáltatástervezési koncepciójának 2015. évi felülvizsgálata DEBRECEN 2015 Tartalomjegyzék I. Bevezetés 5 II. Helyzetkép 8 1. Debrecen város helyzetét bemutató
Debrecen Megyei Jogú Város Önkormányzata szolgáltatástervezési koncepciójának 2015. évi felülvizsgálata DEBRECEN 2015 Tartalomjegyzék I. Bevezetés 5 II. Helyzetkép 8 1. Debrecen város helyzetét bemutató
A földművelésügyi miniszter 17/2015. (IV. 9.) FM rendelete az egyes agrár-támogatási tárgyú miniszteri rendeletek módosításáról
 M A G Y A R K Ö Z L Ö N Y 2015. évi 48. szám 4723 A földművelésügyi miniszter 17/2015. (IV. 9.) FM rendelete az egyes agrár-támogatási tárgyú miniszteri rendeletek módosításáról A mezőgazdasági, agrár-vidékfejlesztési,
M A G Y A R K Ö Z L Ö N Y 2015. évi 48. szám 4723 A földművelésügyi miniszter 17/2015. (IV. 9.) FM rendelete az egyes agrár-támogatási tárgyú miniszteri rendeletek módosításáról A mezőgazdasági, agrár-vidékfejlesztési,
EURÓPAI PARLAMENT. Ülésdokumentum
 EURÓPAI PARLAMENT 2004 Ülésdokumentum 2009 C6-0268/2005 2003/0282(COD) 08/09/2005 Közös álláspont A Tanács által 2005. július 18-án elfogadott közös álláspont az elemekről és akkumulátorokról, valamint
EURÓPAI PARLAMENT 2004 Ülésdokumentum 2009 C6-0268/2005 2003/0282(COD) 08/09/2005 Közös álláspont A Tanács által 2005. július 18-án elfogadott közös álláspont az elemekről és akkumulátorokról, valamint
14/2006. (II.16.) FVM-EüM-ICSSZEM együttes rendelet. a kistermelői élelmiszer-termelés, -előállítás és -értékesítés feltételeiről
 14/2006. (II.16.) FVM-EüM-ICSSZEM együttes rendelet a kistermelői élelmiszer-termelés, -előállítás és -értékesítés feltételeiről Alapfogalmak Kistermelő: aki saját maga által, kis mennyiségben termelt
14/2006. (II.16.) FVM-EüM-ICSSZEM együttes rendelet a kistermelői élelmiszer-termelés, -előállítás és -értékesítés feltételeiről Alapfogalmak Kistermelő: aki saját maga által, kis mennyiségben termelt
Lyme-kór (lyme-artritisz)
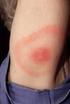 www.printo.it/pediatric-rheumatology/hu/intro Lyme-kór (lyme-artritisz) Verzió 2016 1. MI A LYME-KÓR 1.1 Mi ez? A Lyme-artritisz (Lyme-borreliózis) egyike a Borrelia burgdorferi baktérium által okozott
www.printo.it/pediatric-rheumatology/hu/intro Lyme-kór (lyme-artritisz) Verzió 2016 1. MI A LYME-KÓR 1.1 Mi ez? A Lyme-artritisz (Lyme-borreliózis) egyike a Borrelia burgdorferi baktérium által okozott
Salgótarján Megyei Jogú Város Polgármestere. Javaslat a Salgótarján Jövőjéért Közalapítvánnyal kapcsolatos döntés meghozatalára
 Salgótarján Megyei Jogú Város Polgármestere Szám: 14509/2015. Javaslat a Salgótarján Jövőjéért Közalapítvánnyal kapcsolatos döntés meghozatalára Tisztelt Közgyűlés! 2014. március 15-én hatályba lépett
Salgótarján Megyei Jogú Város Polgármestere Szám: 14509/2015. Javaslat a Salgótarján Jövőjéért Közalapítvánnyal kapcsolatos döntés meghozatalára Tisztelt Közgyűlés! 2014. március 15-én hatályba lépett
A MAGYAR FÖLDGÁZKERESKEDŐ ZRT. ADATVÉDELMI SZABÁLYZATA
 A MAGYAR FÖLDGÁZKERESKEDŐ ZRT. ADATVÉDELMI SZABÁLYZATA Tartalom 1. Cél... 2 2. A szabályzat hatálya... 2 2.1. Időbeli hatálya... 2 2.2. Személyi hatály... 2 2.3. Tárgyi hatály... 2 43 Meghatározások...
A MAGYAR FÖLDGÁZKERESKEDŐ ZRT. ADATVÉDELMI SZABÁLYZATA Tartalom 1. Cél... 2 2. A szabályzat hatálya... 2 2.1. Időbeli hatálya... 2 2.2. Személyi hatály... 2 2.3. Tárgyi hatály... 2 43 Meghatározások...
Ercsi Város Önkormányzat Képviselőtestületének. 18/2003. (V.27.) Kt. számú rendelete. Az önkormányzati tulajdon álló lakások és helyiségek bérletéről
 Ercsi Város Önkormányzat Képviselőtestületének 18/2003. (V.27.) Kt. számú rendelete Az önkormányzati tulajdon álló lakások és helyiségek bérletéről Ercsi Város Önkormányzata a helyi önkormányzatokról szóló
Ercsi Város Önkormányzat Képviselőtestületének 18/2003. (V.27.) Kt. számú rendelete Az önkormányzati tulajdon álló lakások és helyiségek bérletéről Ercsi Város Önkormányzata a helyi önkormányzatokról szóló
ÉRB Észak-magyarországi Regionális Bank Zrt.
 ÉRB Észak-magyarországi Regionális Bank Zrt. Postacím: 3525 Miskolc, Dózsa György út 12. Tel.: +36 48 510 000, +36 48 512 530 Fax: +36 48 510 001 web: www.erbbank.hu e-mail: info@erbbank.hu TÁJÉKOZTATÓ
ÉRB Észak-magyarországi Regionális Bank Zrt. Postacím: 3525 Miskolc, Dózsa György út 12. Tel.: +36 48 510 000, +36 48 512 530 Fax: +36 48 510 001 web: www.erbbank.hu e-mail: info@erbbank.hu TÁJÉKOZTATÓ
A vemhes kancák és a csikók fontosabb féregélősködők okozta fertőzöttségei
 A vemhes kancák és a csikók fontosabb féregélősködők okozta fertőzöttségei Farkas Róbert SZIE ÁOTK Parazitológiai és Állattani Tanszék, 1078 Budapest, István u. 2. Farkas.Robert@aotk.szie.hu Az utóbbi
A vemhes kancák és a csikók fontosabb féregélősködők okozta fertőzöttségei Farkas Róbert SZIE ÁOTK Parazitológiai és Állattani Tanszék, 1078 Budapest, István u. 2. Farkas.Robert@aotk.szie.hu Az utóbbi
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. FEJEZET 4 A SZABADALMI ELJÁRÁSOK ÁLTALÁNOS SZABÁLYAI 4. I.1. A Szellemi Tulajdon Nemzeti Hivatalának hatásköre szabadalmi ügyekben 4
 I. FEJEZET 4 A SZABADALMI ELJÁRÁSOK ÁLTALÁNOS SZABÁLYAI 4 I.1. A Szellemi Tulajdon Nemzeti Hivatalának hatásköre szabadalmi ügyekben 4 I.2. A közigazgatási hatósági eljárás általános szabályainak alkalmazása
I. FEJEZET 4 A SZABADALMI ELJÁRÁSOK ÁLTALÁNOS SZABÁLYAI 4 I.1. A Szellemi Tulajdon Nemzeti Hivatalának hatásköre szabadalmi ügyekben 4 I.2. A közigazgatási hatósági eljárás általános szabályainak alkalmazása
KÖZPONTI STATISZTIKAI HIVATAL GYŐRI IGAZGATÓSÁGA NYUGAT-DUNÁNTÚL MUNKAERŐ-PIACI HELYZETE
 KÖZPONTI STATISZTIKAI HIVATAL GYŐRI IGAZGATÓSÁGA NYUGAT-DUNÁNTÚL MUNKAERŐ-PIACI HELYZETE Győr 2006 Központi Statisztikai Hivatal Győri Igazgatósága, 2006 ISBN-10: 963-235-050-2 ISBN-13: 978-963-235-050-9
KÖZPONTI STATISZTIKAI HIVATAL GYŐRI IGAZGATÓSÁGA NYUGAT-DUNÁNTÚL MUNKAERŐ-PIACI HELYZETE Győr 2006 Központi Statisztikai Hivatal Győri Igazgatósága, 2006 ISBN-10: 963-235-050-2 ISBN-13: 978-963-235-050-9
Időszerű állategészségügyi kérdések. Országos Húsmarhaágazati Konferencia 2015. December 3.
 Időszerű állategészségügyi kérdések Országos Húsmarhaágazati Konferencia 2015. December 3. Bőrcsomósodáskór Lumpy skin disease (LSD) Bejelentési kötelezettség (HU, EU és OIE listás) Morbiditás 5-45%, mortalitás
Időszerű állategészségügyi kérdések Országos Húsmarhaágazati Konferencia 2015. December 3. Bőrcsomósodáskór Lumpy skin disease (LSD) Bejelentési kötelezettség (HU, EU és OIE listás) Morbiditás 5-45%, mortalitás
PILIS VÁROS ÖNKORMÁNYZATÁNAK SZOCIÁLIS SZOLGÁLTATÁS TERVEZÉSI KONCEPCIÓJA (2015. január 01-2016. december 31. közötti időszakra vonatkozólag)
 1 (Tervezett verzió!) PILIS VÁROS ÖNKORMÁNYZATÁNAK SZOCIÁLIS SZOLGÁLTATÁS TERVEZÉSI KONCEPCIÓJA (2015. január 01-2016. december 31. közötti időszakra vonatkozólag) Pilis Város Önkormányzatának Képviselő-testülete
1 (Tervezett verzió!) PILIS VÁROS ÖNKORMÁNYZATÁNAK SZOCIÁLIS SZOLGÁLTATÁS TERVEZÉSI KONCEPCIÓJA (2015. január 01-2016. december 31. közötti időszakra vonatkozólag) Pilis Város Önkormányzatának Képviselő-testülete
(Nem jogalkotási aktusok) RENDELETEK
 2013.3.22. Az Európai Unió Hivatalos Lapja L 83/1 II (Nem jogalkotási aktusok) RENDELETEK A BIZOTTSÁG 231/2013/EU FELHATALMAZÁSON ALAPULÓ RENDELETE (2012. december 19.) a 2011/61/EU európai parlamenti
2013.3.22. Az Európai Unió Hivatalos Lapja L 83/1 II (Nem jogalkotási aktusok) RENDELETEK A BIZOTTSÁG 231/2013/EU FELHATALMAZÁSON ALAPULÓ RENDELETE (2012. december 19.) a 2011/61/EU európai parlamenti
A KOCZÁZAT-KEZELÉSI TERV ÖSSZEFOGLALÁSA
 NIMEZULID SZISZTÉMÁS ALKALMAZÁSRA (100 mg-os TABLETTA és GRANULÁTUM, 200 mg-os KÚP) (Magyarországon törzskönyvezve: Xilox 50 mg/g granulátum belsőleges szuszpenzióhoz) A KOCZÁZAT-KEZELÉSI TERV ÖSSZEFOGLALÁSA
NIMEZULID SZISZTÉMÁS ALKALMAZÁSRA (100 mg-os TABLETTA és GRANULÁTUM, 200 mg-os KÚP) (Magyarországon törzskönyvezve: Xilox 50 mg/g granulátum belsőleges szuszpenzióhoz) A KOCZÁZAT-KEZELÉSI TERV ÖSSZEFOGLALÁSA
2006.12.16. Az Európai Unió Hivatalos Lapja L 358/3
 2006.12.16. Az Európai Unió Hivatalos Lapja L 358/3 A BIZOTTSÁG 1857/2006/EK RENDELETE (2006. december 15.) a Szerződés 87. és 88. cikkének a mezőgazdasági termékek előállításával foglalkozó kis- és középvállalkozásoknak
2006.12.16. Az Európai Unió Hivatalos Lapja L 358/3 A BIZOTTSÁG 1857/2006/EK RENDELETE (2006. december 15.) a Szerződés 87. és 88. cikkének a mezőgazdasági termékek előállításával foglalkozó kis- és középvállalkozásoknak
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Prevenar 13 szuszpenziós injekció Pneumococcus poliszacharid konjugált vakcina (13-valens, adszorbeált). 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Prevenar 13 szuszpenziós injekció Pneumococcus poliszacharid konjugált vakcina (13-valens, adszorbeált). 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy
Az Országos Rádió és Televízió Testület. 836/2007. (IV. 4.) sz. Határozata
 Az Országos Rádió és Televízió Testület 836/2007. (IV. 4.) sz. Határozata Az Országos Rádió és Televízió Testület (a továbbiakban: Testület) a rádiózásról és televíziózásról szóló 1996. évi I. törvény
Az Országos Rádió és Televízió Testület 836/2007. (IV. 4.) sz. Határozata Az Országos Rádió és Televízió Testület (a továbbiakban: Testület) a rádiózásról és televíziózásról szóló 1996. évi I. törvény
Levélcím: Telefon: Fax: Ügyszám: Iktatószám: Axel Springer- Magyarország Kft. v é g z é s t. változtatja meg
 1054 Budapest, Alkotmány u. 5. Levélcím: 1245, Budapest 5. Pf. 1036 Telefon: (06-1) 472-8865, Fax: (06-1) 472-8860 Ügyszám: Vj/23/2011. Iktatószám: Vj/23-211/2011. A Gazdasági Versenyhivatal eljáró versenytanácsa
1054 Budapest, Alkotmány u. 5. Levélcím: 1245, Budapest 5. Pf. 1036 Telefon: (06-1) 472-8865, Fax: (06-1) 472-8860 Ügyszám: Vj/23/2011. Iktatószám: Vj/23-211/2011. A Gazdasági Versenyhivatal eljáró versenytanácsa

