A. Az előadás áttekintése
|
|
|
- Andor Varga
- 7 évvel ezelőtt
- Látták:
Átírás
1 Rendszeres fémorganikus kémia (1) A. Az előadás áttekintése 1) Bevezetés és definíciók 2) A fém-szén kötés 2.1 Kötéstípusok és osztályozás 2.2 Energia, polaritás, reaktivitás (stabilitás) 2.3 Termokémia 3) Fontosabb ligandumok 3.1 CO (CS, CSe, CTe) 3.2 CNR,CN- és N NO (NS) 3.4 Nem aromás π-donorok (alkén, alkin, π-donorok) 3.5 Aromás π-donor ligandumok (Cp, C n H +0- n ) 3.6 M-C, M=C, M C kötésű ligandumok (alkil, karbén, karbin komplexek) 3.7 Egyéb szerves ligandumok 3.8.a Hidrid és dihidrogén komplexek 3.8.b Foszfánok és rokon vegyületek 4) Osztályozás a ligandumok donor-akceptor tulajdonsága alapján 5) Főcsoportbeli elemek szerves származékai 5.1 Bevezetés, általános előállítási módszerek 5.2 Poláris fémorganikus vegyületek Alkálifémek Alkáliföldfémek csoport (Zn, Cd, Hg) csoport (Cu, Ag, Au)
2 Rendszeres fémorganikus kémia (2) B. Az előadás áttekintése (folyt.) 5.3 Kovalens fémorganikus vegyületek csoport (B, Al, Ga, In, Tl) csoport (Si, Ge, Sn, Pb) csoport (P, As, Sb, Bi) csoport (Se, Te) 6. Átmenetifémek szerves vegyületei VE szabály 6.2 Fém-C(sp 3 ) kötést tartalmazó vegyületek 6.3 Fém-C(sp 2 ) kötést tartalmazó vegyületek 6.4 Fém-C(sp) kötést tartalmazó vegyületek 6.5 σ-donor/π-akceptor ligandumok 6.6 σ/π-donor/π-akceptor ligandumok 6.6 Reakciók A fém környezetében lejátszódó reakciók A ligandumok átalakulásával járó reakciók
3 Rendszeres fémorganikus kémia (3) 1) Bevezetés és definíciók Fémorganikus vegyületek: közvetlen fém-szén kötést tartalmaznak (nem soroljuk ide a cianidokat és karbidokat, de ide soroljuk a karbonilokat). Fém: EN<2,5 (???) Szerves molekularész: karbanion, gyök, molekula (CO és CO-analógok) Néhány tudománytörténeti érdekesség Zeise (1827), Na[PtCl 3 C 2 H 4 ], az első olefin komplex; Frankland (1849), (C 2 H 5 ) 2 Zn ; Mond (1890), Ni(CO) 4, az első biner karbonil; Grignard (1899)!!!; Schlenk (1917), litium-alkilek: 2 Li + R 2 Hg 2 LiR + Hg; Paneth (1929), PbR 4 pirolízise; Rochow, Müller (1943), klórszilánok direkt szintézise; Pauson, Miller (1951), Cp 2 Fe, az első szendvics komplex; Ziegler, Natta (1955), poliolefinek átmenetifém-katalizált kisnyomású polimerizációja!!! Fischer (1964 és 1973) átmenetifém karbén- és karbin-komplexek!!! Wilkinson (1965) (PPh 3 ) 3 RhCl!!! West (1981) Si=Si kötésű vegyületek Chauvin, Schrock és Grubbs (2005) alkén metatézis!!!
4 Rendszeres fémorganikus kémia (4) 2) A fém-szén kötés 2.1 Kötéstípusok és osztályozás a) ionos (Na, K, Rb, Cs, Ca, Sr, Ba, lantanoidák, aktinoidák) b) kovalens (p- és d-mező) c) elektronhiányos, többcentrumú kötések (Li, Be, Mg, B, Al) d) fém (elem)-szén többszörös kötések (p- és d-mező) 2.2 Energia, polaritás és reaktivitás A M-C kötések általában gyengébbek, mint a megfelelő M-N, M-O és M-halogén kötések Általános megjegyzések: polaritás: M δ+ -C δ- a M-C kötési energia széles tartományban változik; a M-C átlagos kötési energia a főcsoportokban felülről-lefele csökken, átmenetifémek esetén nő; ionos M-C kötést elektropozitív fémek képeznek; elektronhiányos, többcentrumú kötést tartalmazó vegyületek akkor képződnek, ha M vegyértékhéja kevesebb, mint 50%-ban telített és nagy a töltés/sugár arány. Reaktivitás/stabilitás: oxigénnel, vízzel és termikus behatással szemben általában nem stabilisak (termodinamikai labilitás). Viszonylagos stabilitás kinetikai okokra vezethető vissza. Homolitikus hasadás vs. β-elimináció 2.3 Termokémiai adatok hozzáférhetősége: kalorimetria: égetés, specifikus reakciók hője; gázfázisú ionkémia (MS, UPS-PEPICO) kvantumkémiai számítások
5 Rendszeres fémorganikus kémia (5) 3) Fontosabb ligandumok 3.1 Karbonil ligandum (CO) Terminális, vagy hídhelyzetű egyetlen, vagy több fématomhoz kapcsolódik (jelölése: μ n, n=2,3). σ - donor és π - akceptor Ábra: a CO és N 2 néhány nagyobb energiájú molekulapályája
6 Rendszeres fémorganikus kémia (6) 3. Fontosabb ligandumok A fém CO kötés
7 Rendszeres fémorganikus kémia (7) 3. Fontosabb ligandumok A fém CO kötés oxigén kötésű ligandumok: fémkarbonil oxigénatomja Lewis - savhoz kapcsolódik
8 Rendszeres fémorganikus kémia (8) 3. Fontosabb ligandumok 3.2 CO - analóg ligandumok Izonitrilek (RNC:) A CO - nál erősebb donorok és gyengébb akceptorok; több olyan ionos és magas oxidációs állapotú fémkomplexet stabilizálnak, pl.[pt(cnph) 4 ] 2+, amelyeknek nem ismeretesek a karbonil analógjai. Hidképzésre kevésbé hajlamosak, ugyanakkor nukleofil támadásra jobban érzékenyek és így aminokarbéneket képeznek: [(MeNC) 4 Pt] MeNH 2 [Pt{=C(NHMe) 2 } 4 ] 2+
9 Rendszeres fémorganikus kémia (9) 3. Fontosabb ligandumok CS, CSe és CTe (tio-, szeleno- és tellurokarbonil) Nem stabilis molekulák, átmenetifémkomplexek koordinációs szférájában stabilizálhatók, a CO-hoz hasonlítva erősebb σ-donor és π-akceptor ligandumok, terminális és híd helyzet. CN- és N 2 (bár nem szerves ligandumok), CO-dal izoelektronosak. A CN - ligandum erősebb σ-donor és gyengébb π- akceptor, mint a CO; ennek következtében magasabb oxidációs állapotú központi fémionhoz kapcsolódnak; alacsonyabb oxidációs állapotú fémionokat nem képesek stabilizálni (gyenge viszontkoordináció). N 2 gyengén kötődő ligandum; jelentőség: ammónia szintézis, N 2 -fixálás. 3.3 NO/ nitrozil, (NS/ tionitrozil) ligandumok. Lineáris (3e)-hajlott (1e) térszerkezet; terminális-híd helyzet
10 Rendszeres fémorganikus kémia (10) 3. Fontosabb ligandumok 3.4 Nem aromás π-donorok -π-etilén: elektronsűrűség σ-jellegű donációja a fém felé, ugyanakkor viszontkoordináció a ligandum π* pályájára. A végeredmény a C-C kötés gyengülése, azaz megnyúlása a szabad ligandumhoz képest. - az allilcsoport lehet trihapto (4e) ligandum, amely a delokalizált π- pályái révén létesít kötést a fentiekhez hasonlóan; lehet monohapto (2e), azaz σ-kötésű és lehet hídhelyzetben is.
11 Rendszeres fémorganikus kémia (11) 3. Fontosabb ligandumok Egyéb π - rendszerek
12 Rendszeres fémorganikus kémia (12) 3. Fontosabb ligandumok 3.5 Aromás π-rendszerek: ciklopentadienil-csoport (Cp, C 5 H 5- ) Változatos kötésmódók: η 1 -, η 3 -, η 5 - (a leggyakoribb). Tipikus képviselő a ferrocén, metallocének. Számos egyéb, szubsztituált Cp-származék, pl.: C 5 Me 5 (Cp*); C 5 (benzil) 5
13 Rendszeres fémorganikus kémia (13) 3. Fontosabb ligandumok Komplexek Cp és CO ligandumokkal: változatos szerkezetek
14 Rendszeres fémorganikus kémia (14) 3. Fontosabb ligandumok Egyéb gyűrűs π-donor ligandumok
15 Rendszeres fémorganikus kémia (15) 3. Fontosabb ligandumok 3.6 σ - kötésű ligandumok M C, M=C, M C kötésű komplexek 3.7 Egyéb szerves σ - donorok (továbbá acil -, perfluoroalkil - és vinilidén származékok)
16 Rendszeres fémorganikus kémia (16) 3. Fontosabb ligandumok 3.8 Egyéb, nem szerves ligandumok a) H (hidrid): anionos σ- donor (homogén katalízis!!!) H 2 (dihidrogén): σ-donor és σ*-akceptor kölcsönhatás b) Szerves foszfor(iii)- vegyületek: foszfánok - σ- donor és P(3d+σ*)-akceptor kötés
17 Rendszeres fémorganikus kémia (17) 3. Fontosabb ligandumok (foszfánok, folyt.)
18 Rendszeres fémorganikus kémia (18) 3. Fontosabb ligandumok A ligandumok elektron donor és akceptor képessége jól jellemezhető gázfázisú spektroszkópiai mérési adatokkal. Donor képesség ionizációs energia UPS Akceptor képesség elektronaffinitás ETS UPS = UV fotoelektron-spektroszkópia ETS = elektrontranszmissziós spektroszkópia
19 Rendszeres fémorganikus kémia (19) Photoelectron Spectroscopy Basic phenomenon is the photoionization: M(g) + hν = M + (g) + e - The energetics of the process are defined by the Einstein Relation (1905!): hν = IE i + E kin
20 Rendszeres fémorganikus kémia (20) Processes associated with electron-molecule collision (Modelli, A. Trends in Chemical Physics 1997, 6, 57)
21 Rendszeres fémorganikus kémia (21) ETS: experimental setup
22 Rendszeres fémorganikus kémia (22) Diagram of measured VAEs and IEs (Csonka, I., P., Szepes, L., Modelli, A. J. Mass Spec. 2004, 39, 1456) π* CO a N 2 b π* π* π* π* π* CH 3 CN c CH 3 NC d i PrNC (I) t BuNC (II) n BuNC e (III) n PeNC e (IV) π* CyNC (V) 2,6-Me 2 - PhNC f (VI) π Φ * π Φ * π NC *,π Φ * 4-MeO- PhNC (VII) π Φ * 4-Cl- PhNC f (VII) -5-7 ev -9 π Φ ;π NC,π Φ π NC,π Φ, n O π Φ π NC,π Φ, n Cl π Φ n C,σ CO π σ CN,n N n C,σ NC n C,σ NC n C,σ NC nc,σ NC n C,σ NC n C,σ NC n C,σ NC n C,σ NC n C,σ NC π π π π π π π σ NN,n N π σ-donor: RNC > RCN > CO > N 2 π -acceptor: RNC (R=aromtic) > CO > N 2 > RNC (R=aliphatic) ~ RCN π -donor: RNC (R=aromatic) > RNC (R=aliphatic) > RCN (>> CO ~ N 2 )
23 Rendszeres fémorganikus kémia (23) PEPICO Photoionization Mass Spectrometry M + hν M + + e Information: dissociation of the ion Ultraviolet Photoelectron Spectroscopy M + hν M + + e Information: ionization energies (MO energies) Photoelectron-Photoion Coincidence Spectroscopy M + hν M + + e L. Szepes: Structure, Bonding and Energetics of Organometallic Compounds as Studied by UV Photoelectron Spectroscopy and Related Techniques
24 Rendszeres fémorganikus kémia (24) Threshold PEPICO (TPEPICO) Only zero kinetic energy electrons are detected in coincidence with ions Energetics: hν = IE ad + E int (ion) E int (ion) = hν - IE ad (plus thermal energy) L. Szepes: Structure, Bonding and Energetics of Organometallic Compounds as Studied by UV Photoelectron Spectroscopy and Related Techniques
25 Rendszeres fémorganikus kémia (25) TPEPICO: experimental setup Start: zero KE electron Stop: ion L. Szepes: Structure, Bonding and Energetics of Organometallic Compounds as Studied by UV Photoelectron Spectroscopy and Related Techniques
26 Rendszeres fémorganikus kémia (26) Breakdown curves of CpCo(CO) 2 (Sztáray, B., Szepes, L., Baer, T. J. Phys. Chem. A 2003, 107, 9486) relative ion abundance CpCoCO + CpCo(CO) 2 + CpCo photon energy (ev) L. Szepes: Structure, Bonding and Energetics of Organometallic Compounds as Studied by UV Photoelectron Spectroscopy and Related Techniques
27 Rendszeres fémorganikus kémia (27) Pyrolysis PE spectra photoelectron intensity 25ºC 100ºC 150ºC 200ºC 250ºC 275ºC 300ºC IE (ev) L. Szepes: Structure, Bonding and Energetics of Organometallic Compounds as Studied by UV Photoelectron Spectroscopy and Related Techniques
28 Obtaining neutral bond energy 1000 CpCoCO + fh 0 0K CpCo(CO) 2 + IE 1 BE + CpCoCO IE 2 TPEPICO: IE 1 = 7.35eV BE + = 1.53eV Pyrolysis UPS: IE 2 = 6.97eV 0 CpCo(CO) 2 BE 0 Neutral bond energy: 1.91eV -200 L. Szepes: Structure, Bonding and Energetics of Organometallic Compounds as Studied by UV Photoelectron Spectroscopy and Related Techniques
29 Rendszeres fémorganikus kémia (29) 4. Szerves fémvegyületek osztályozása a ligandumok donor-akceptor tulajdonságai alapján 1) Vegyületek anionos σ-donorokkal (fémalkilok, -arilok ) s-, p- és d- mező; 2) Vegyületek semleges σ-donorokkal és π-akceptorokkal (karbonilok, karbének és karbinek) d-mező; 3) Vegyületek π-donorokkal (π-komplexek) s-, p- és d-mező.
30 Rendszeres fémorganikus kémia (30) 5) A főcsoportbeli elemek szerves származékai 5.1 Általános előállítási módszerek a) Közvetlen (direkt) szintézis, oxidatív reakció (a fém szempontjából), reduktív helyettesítés (szerves csoport szempontjából) n R δ+ -Z δ- + 2 M R δ- n -M δ+ + MZ n (Z = -Cl, -Br, -I, -OR, -SR ) (Wittig: Umpolung ) b) Kicserélési reakciók Transzmetallálás (CH 3 ) 2 Hg + Zn (CH 3 ) 2 Zn + Hg (gyenge Hg-C kötés) Fémkicserélés 4 PhLi + (CH 2 =CH) 4 Sn Ph 4 Sn + 4 (CH 2 =CH)Li (Ph 4 Sn csapadék kiválás!) Metatézis 3 CH 3 Li + SbCl 3 (CH 3 ) 3 Sb + 3 LiCl (energianyereség: sóképzés!) Fém-halogén kicserélés C 4 H 9 Li + PhBr C 4 H 9 Br + PhLi (erősebb bázis felszabadítja a gyengébbet) Fém-hidrogén kicserélés (metallálás) C 6 H 5 Na + PhCH 3 C 6 H 6 + Ph-CH 2 Na (C-H-savasság, sav-bázis reakció) c) Beékelődéses reakciók Addíció szén-szén többszörös kötésre M-R, vagy M-H + >C=C< M-C-C-R, vagy M-C-C-H Karbén beékelődés (CH 3 ) 2 SnCl 2 + CH 2 N 2 (CH 3 ) 2 Sn(CH 2 Cl)Cl + N 2 d) Eliminációs reakciók Dekarboxilezés (RCOO) 2 Hg R 2 Hg + 2 CO 2 Diazónimsók bontása ArN 2+ X - + HgCl 2 Ar-HgCl + Ar 2 Hg (+ N 2 + HgClX + HgX 2 )
31 Rendszeres fémorganikus kémia (31) 5) A főcsoportbeli elemek szerves származékai 5.2 Poláris fo vegyületek Az ionos jelző erős sarkítás nem vonható éles határ az ionos és poláris kovalens kötésű vegyületek között. Az M δ+ -C δ- kötés polározottsága folyamatosan változik. A fém-szén kötésben a pillératomok parciális töltését a fématom, a szerves molekularész, az oldószer és egyéb koordinációra képes reagensek határozzák meg. Az ionos és kovalens kötés dominanciájára vonatkozó példa.: ciklopropil-difenil-metán fo származékai. Fontos tényezők - a (4) és (5) vegyületek termodinamikai stabilitása; - C 3 - gyűrűfeszültség; - kettőskötések konjugációja; - negatív töltés delokalizációja. - oldószerhatás: Ha M=Li és S=Et 2 O (5) vegyület, ha S=THF (4) vegyület
32 Rendszeres fémorganikus kémia (32) 5) A főcsoportbeli elemek szerves származékai Szerves alkálifémvegyületek Előállítások Reduktív helyettesítés R-X + 2 M R-M + M-X Mellékreakciók: R-X + R-M R-R + M-X (Wurtz); R -CH 2 -CH 2 -X + R-M R -CH=CH 2 + R-H + M-X Alkálifémek reakcióképessége: Li<Na<K<Rb<Cs Halogenidek: Cl<Br<I R-csop: primer<sec<terc (Ugyanígy nő a mellékreakciók lejátszódásának valószínűsége is.) Reakciókörülmények: fémdiszperzió, vízmentes oldószer, inert atmoszféra (Ar, N 2 ) Mellékreakciók visszaszorítása: fém fajlagos felülete (nagy!!!), R-X adagolási sebessége Li O.K. Na, K problematikus (pentil-na/ ~35%-os termelés; finom diszperzió, ultragyors keverés, csökkentett T). Fémek felületének további növelése: - - reduktív fémporok: fémsó + oldószer + redukálószer; - oldott fémek : alkálifém + arén (bifenil, naftalin, antracén) + oldószer addíciós vegyület
33 Rendszeres fémorganikus kémia (33) 5) A főcsoportbeli elemek szerves származékai Éterek és tioéterek reduktív hasítása - Nyilt és telített szénláncú éterek (Bár!) - Feszült gyűrűs oxiránok, oxetánok hasítás (Lewis-savval regioszelektivitás) - Diaril- és aril-alkil éterek hasítás (apoláris közegben a kevésbé bázikus fo vegyület képződik) - Tioéterek esetében a hasítás könnyebben megy. ( A S elektronaffinitása nagyobb, a C-S kötés gyengébb.) Hidrogén reduktív helyettesítése Savas szénhidrogénekben (pk a ~ 18-20) H/Mcsere. acetilén, 1-alkil-, 1-aril-alkin + M alkinid 2 RC CH + 2 Na/NH 3 (l) 2 RC CNa + H 2 Redukciók cseppfolyós ammóniában (Birch-r.)
34 Rendszeres fémorganikus kémia (34) 5) A főcsoportbeli elemek szerves származékai Birch-redukció: aromás vegyületek gyűrűs mono- és diénekké redukálhatók. Szénatom reduktív helyettesítése (szén-szén σ-kötés hasítása alkálifémekkel; trifenilmetán-dimer hasítása: Schlenk/ 1914) Fémek reduktív helyettesítése (fém-fém csere) R 2 Hg + 2 Na 2 NaR + Hg (oldószermentes eljárás!)
35 Rendszeres fémorganikus kémia (35) 5) A főcsoportbeli elemek szerves származékai Kicseréléses módszerek Leggyakrabban használt reagensek a kereskedelemben kapható BuLi és izomerjei. Vigyázat!!! Balesetveszély! Latest News May 11, 2009 Volume 87, Number 19 p. 7 First appeared online May 5, 2009 SAFETY Negligence Caused UCLA Death State safety and health agency faults university for training lapses, unsafe practices Jyllian N. Kemsley Courtesy of Naveen Sangji Sangji Negligence of lab safety by the department of chemistry and biochemistry at the University of California, Los Angeles, led to the Dec. 29, 2008, accident and subsequent death of researcher Sheharbano (Sheri) Sangji, says the state agency charged with investigating the incident. In particular, the California Division of Occupational Safety & Health (Cal/OSHA) cited the department in a report released on May 4 for lacking both safety training and training documentation; failing to ensure employees wore appropriate personal protective equipment (PPE), such as lab coats; and failing to correct unsafe conditions and work practices identified in an Oct. 30, 2008, laboratory safety inspection. Among the findings of the October lab inspection was that PPE was not fully used in the lab in which the 23-year-old Sangji worked. She was not wearing a lab coat in December when pyrophoric material she was handling splashed and ignited her clothing. Sangji's supervisor, professor Patrick Harran, says that he did address the PPE issues with his group. "My expectation is that everyone is to wear a lab coat and wear protective gear. The Cal/OSHA report says that, when the incident occurred, Sangji was drawing approximately 20 ml of 1.7 mol/l tertbutyllithium in pentane into a 60-mL syringe when the syringe plunger was either ejected or pulled out of the syringe. An undetermined amount of the liquid splashed onto her hands, arms, and torso. The ensuing fire burned more than 40% of her body. One of the postdoctoral researchers used his lab coat to extinguish the flames and called for help. Sangji died of her injuries on Jan. 16 (C&EN Online Latest News, Jan. 22).
36 Rendszeres fémorganikus kémia (36) 5) A főcsoportbeli elemek szerves származékai Kicseréléses módszerek Fém-fém kicserélési reakciók Alkil-Li + kevésbé elektropozitív fémek (pl. Sn, Hg) szerves származékai. Pl. α-alkoxi-alkillítium-vegyület előállítása: C 6 H 5 -CH 2 -O-CH 2 -SnBu 3 + RLi C 6 H 5 -CH 2 -O-CH 2 -Li + RSnBu 3 Fémsók is használhatók: All-K + LiBr All-Li + KBr Szén-fém kicserélési reakció (addíció szén-szén telítetlen kötésre - polimerizáció) H 2 C=CH 2 + Li-C(CH 3 ) 3 Li-CH 2 -CH 2 -C(CH 3 ) 3...s.i.t. Halogén-fém kicserélési reakció R-X + R -Li R-Li + R -X Mellékreakció R-Li + R -X R-R + Li-X A mellékreakció visszaszorítása: hőmérséklet, R-X adagolási sebessége, vagy + 1 mól R -Li R -X + R -Li LiX + alkén Hidrogén-fém kicserélési reakció (metallálás) R-H + M-R R-M + R -H
37 Rendszeres fémorganikus kémia (37) 5) A főcsoportbeli elemek szerves származékai A metallálást Schorigin fedezte fel a XX. szd. elején: dietil-higany fémnátriumos hasítása benzolban: (C 2 H 5 ) 2 Hg + Na C 2 H 5 Na + C 6 H 6 C 6 H 5 Na + C 2 H 6 Gyenge C-H-savak (pk a : 32-43) átalakítása reaktív intermedierekké. A butil-lítium-izomerek előnye a könnyű kezelhetőség, viszont csak a benzolnál savasabb szénhidrogéneket támadják meg (pl.: 1,4-pentadién, vagy ciklopentadién) Ok: asszociáció Megoldás: Lewis-bázis adalékok; pl.: TMEDA, PMDTA (pentametil-dietilén-triamin).
38 Rendszeres fémorganikus kémia (38) 5) A főcsoportbeli elemek szerves származékai Szuperbázisok (Lochmann 1966) A LiC-TMEDA-reagens gyenge C-H-savak lítiálására nem alkalmas. Megoldás: szuperbázisok, amelyek alkáli-alkil-vegyület (R-M) és alkáli-alkoholát (R -OM) keveréke. Pl.: LiC-KOR Jellemzők: - erősen polarizált fém-szén kötést tartalmazó, nagy reaktivitású keverék aggregátumok, - metallálás után a termék a nagyobb tömegszámú fémet tartalmazza, - nagyobb stabilitás és szelektivitás, mint a megfelelő alkil-kálium, vagy alkil-nátrium vegyületek esetén. Nem fémorganikus szuperbázisok Lítium-diizopropilamid (LDA) és kálium-terc-butilát (KOR) keveréke i Pr 2 N-H + C 4 H 9 Li i Pr 2 N-Li + C 4 H 10 2 i Pr 2 N-H + 2 Li + C 6 H 5 -CH=CH 2 (forralás) 2 i Pr 2 N-Li + C 6 H 5 -CH 2 -CH 3 Szerkezet, kötés Asszociátumok: monomer, dimer, tetramer, hexamer. Négycentrumú-kételektronos kötésmodell.
39 Rendszeres fémorganikus kémia (39) 5) A főcsoportbeli elemek szerves származékai Reakciók Bázikus karakter, deprotonálási reakciók Metallálás (ld. előbb) Foszfóniumsó foszforán alkén: Ph 3 P + CH 3 + RLi RH + {Ph 3 P + C - H 2 Ph 3 P=CH 2 } + Li + (Wittig-reagens) {Ph 3 P + C - H 2 Ph 3 P=CH 2 } + R 2 CO Ph 3 P=O + R 2 C=CH 2 Si=C kötés (ld. később) Nukleofil karakter, addíciós és szubsztitúciós reakciók R-M + CO 2 RCOOH + R CHO (R )(R)CHOH + R R C=O (R)(R )(R )COH + HCOH R-CH 2 OH + R COCl (R )(R)C=O n RLi + MX n R n M + n LiX Addíciós vegyületek aromás szénhidrogénekkel (Birch-readukció) ld. előbb.
40 Rendszeres fémorganikus kémia (40) 5) A főcsoportbeli elemek szerves származékai Az alkáliföldfémek szerves vegyületei A csoport tagjainak elektropozitivitása és a szerves származékok ionos karaktere a Ba>Sr>Ca>Mg>Be sorrendben csökken. A Be és Mg elektronhiányos vegyületeket képeznek, A Sr- és Ba-vegyületek sok tekintetben az alkáliorganikusokkal mutatnak rokonságot. Legfontosabb vegyületcsalád a szerves magnéziumvegyületek. Legfontosabb előállítási módszerek: reduktív helyettesítés, illetve a kicseréléses módszerek közül a transzmetallálás és metatézis. Reduktív helyettesítés (Grignard-vegyületek/ SET reakció) R-X + Mg (+ net 2 O) [R-X] - + Mg + [R-X] - R + X - X - + Mg + MgX R + MgX R-MgX (Et 2 O) n R-X + Mg (+net 2 O) R-MgX (Et 2 O) n Mellékreakciók: R + H / oldószer R-H R + R R-R (R = szek- és terc-alkilgyök) Kiküszöbölés: MeMgI + R R-MgI + Me Schlenk-egyensúly (1929)
41 Rendszeres fémorganikus kémia (41) 5) A főcsoportbeli elemek szerves származékai Transzmetallálás R 2 Hg + Be R 2 Be + Hg (oldószermentes eljárás!) Metatézis 2 R-Li + BeCl 2 R 2 Be + 2 LiCl Szerkezet, kötés, komplexek Me 2 Be(s) polimer (2e-3c) Me 2 Be(g) monomer (lineáris), dimer, trimer (2e-3c) egyensúlyi elegye. Grignard vegyületek: szolvatált molekulák halogén hidakkal összekapcsolt oligomereket képeznek, amely függ a szerves csoporttól, a halogéntől, az oldószertől és a koncentrációtól. Vegyületek gyűrűs π-donor ligandumokkal (Cp, Cp*) Reakciók
42 Rendszeres fémorganikus kémia (42) 5) A főcsoportbeli elemek szerves származékai A 12. csoport (Zn, Cd, Hg) szerves vegyületei Betöltött d-pályákkal rendelkeznek, amelyek így nem vesznek részt donor-akceptor kölcsönhatásokban NEM valódi átmenetifémek. Szerves vegyületeik: tiszták (R 2 M), vagy vegyesek (RMX) Az M-C kötés polárossága a Zn>Cd>Hg sorrendben csökken; a dialkil-higany-vegyületeket gyenge kovalens kötés tartja össze. Előállítások Zn-org: C 2 H 5 I + Zn(Cu) C 2 H 5 ZnI (C 2 H 5 ) 2 Zn + ZnI 2 (reduktív helyettesítés) 3 Me 2 Zn + 2 R 3 B 3 R 2 Zn + 2 Me 3 B (transzmetallálás) ZnCl 2 + RLi (RMgX) R 2 Zn + LiCl (MgXCl) (metatézis) Cd-org: CdCl 2 + RLi (RMgX) R 2 Cd + LiCl (MgXCl) (metatézis) Hg-org: R-I + Hg RHgI (reduktív helyettesítés/ direkt szintézis) R-Li + HgCl 2 RHgCl + LiCl (metatézis) 2 R-Li + HgCl 2 R 2 Hg + 2LiCl Szerkezet, kötés, fizikai tulajdonságok R-MX vegyületek kristályos, szilárd anyagok. R 2 M vegyületek folyadékok, nem asszociálódnak (nincs fém-alkil-fém asszociációs kapcsolat) monomerek a fém lineáris koordinációjú. Fém-hidrogén-fém hidak viszont léteznek: Et 2 Zn + ZnH 2 + (Py oldószer) H 3 Et 3 Zn 3 Py 3 (Zn---H---Zn kapcsolat). Alkil-cink-halogenidek dimer, trimer, tetramer képzés (Zn---X---Zn kapcsolat) Cp* 2 Zn, érdekes szerkezet: η 5, η 1 - koordináció, 18 VE a 1 H NMR spektrumban csak egy jel, haptotropikus csere, gyors η 5 η 1 haptocitásváltozás. A Cd-organikusok szerkezete és tulajdonságai hasonlók a Zn-organikusokhoz. Az R-Hg-X és R-Hg-R lineáris kötéseket tartalmaznak (sp-hibrid).
43 Rendszeres fémorganikus kémia (43) 5) A főcsoportbeli elemek szerves származékai Kémiai tulajdonságok és reakciók A cinkvegyületek hasonlóak a Li- és Mg-organikusokhoz (anionos σ-donorok), de bázicitásuk és nukleofil reaktivitásuk kisebb. Ezért enyhe, nem bázikus körülmények között használhatók. Pl.: részlegesen alkilezett átmenetifém-származékok előállítása: Me 2 Zn + NbCl 5 Me 2 NbCl 3 + ZnCl 2 Hatékony fémorganikus reakciókomponensek Ni- és Pd-katalizált kapcsolási reakciókban (jó termelés!): C 6 H 5 -ZnCl + C 6 H 5 -CH 2 -Br/ NiCl 2 (PPh 3 ) 2 C 6 H 5 -CH 2 -C 5 H 5 A kadmiumorganikus vegyületek (szemben a Mg-vegyületekkel) szén-dioxiddal és ketonokkal nem reagálnak, Lewis-savasságuk kisebb, mint a Zn-vegyületeké. Karbonsav-kloridokkal szelektíven ketonokká alakulnak: R-CdCl + R COCl RCOR + CdCl 2 A higanyvegyületek széleskörű felhasználása elsősorban abból adódik, hogy a Hg-C kötés gyenge és homolitikus hasadásra hajlamos. Példák: ld. Az előbbiek és a későbbiek során.
44 Rendszeres fémorganikus kémia (44) 5) A főcsoportbeli elemek szerves származékai A 11. csoport (Cu, Ag, Au) szerves vegyületei Az ezüst és arany szerves származékainak gyakorlati jelentősége szerény, a rézorganikusok között számos hatékony reagens és katalizátor található; ez jelenti a kapcsolatot a szerves Li- és Mg-vegyületek kémiájához (ezért itt tárgyaljuk.) Előállítás, pl: metatézis, transzmetallálás, addíció. Az M-C kötés kovalens, a +1 oxidációs állapotú fémet tartalmazó származékok nem stabilisak. Néhány előállítási példa: AgF + CF 2 =CF-CF 3 (acetonitril) AgCF(CF 3 ) 2 CH 3 CN LiAr + AgX Li[AgR 2 ] + LiX (X = NO 3- ) Au-származékok: AuR 3 (stabilisak), AuR 2 X, AuRX 2. Szerves rézvegyületek - R-Mg(Cu I ) n X (n<0,5): Grignard reagens+katalitikus mennyiségű Cu(I)-só; - R-Cu: bomlékonyak; levegőre, vizre érzékenyek; a stabilitás más ligandumokkal növelhető (RCu L). - kuprátok (Gilman-reagensek) - alacsonyabb rendű: RR CuLi (homo-/hetero-); - magasabb rendű: RR Cu(CN)Li 2 (homo-/hetero-) Előállítások Szerves rézvegyületek (metatézis): R-M + CuX R-Cu + MX (probléma a rézsók oldhatóvá tétele elektrondonor ligandumok aminok, foszfánok, szulfidok) Vegyületek alkinekkel (metallálás): R-C CH + [Cu(NH 3 ) 2 ] + R-C C-Cu + NH 3 + NH 4 + Kuprátok (metatézis): 2 R-M + CuX R 2 CuM + MX CuCN + 2 R-Li (vagy R-Li + R -Li) R 2 Cu(CN)Li 2 (vagy RR Cu(CN)Li 2 )
45 Rendszeres fémorganikus kémia (45) 5) A főcsoportbeli elemek szerves származékai Szerkezet A szerves rézvegyületek aggregációra és polimerizációra hajlamosak. Pl.: fenil-réz polimer Cu-C-Cu hidak, 2e-3c kötés. Az organokuprátok dimerképzésre hajlamosak. Pl.: (LiCuMe 2 ) 2 -ben Li 2 Cu 2 gyűrűk (ld. Lentebb). Reakciók Nukleofil szubsztitúció Kuprátok reaktivitási sora: R 2 Cu(CN)Li 2 > R 2 CuLi > RCuLi ligandum > RCu Kapcsolások: primer > szekunder > tercier-alkil ~ aril-halogenidekkel. 1,4-konjugált addíció 1,2-telitetlen karbonil vegyületekre
46 Rendszeres fémorganikus kémia (46) 5) A főcsoportbeli elemek szerves származékai Nukleofil szubsztitúciós reakciók 1,4 addíció α,β - telitetlen karbonil vegyületekre
47 Rendszeres fémorganikus kémia (47) 5) A főcsoportbeli elemek szerves származékai 5.3 Kovalens fémorganikus vegyületek csoport (B, Al, Ga, In, Tl) Szerves bórvegyületek Csoportosítás a) Szerves boránok: R 3 B, R 4 B -, R n BX 3-n b) Bór-heterociklusok: boracikloalkánok, boracikloalkének (borarének) c) Poliéderes bórvegyületek: karboránok, heterokarboránok Előállítások 3 RMgX + BF 3 Et 2 O R 3 B + 3 MgFX + Et 2 O (metatézis) Ph 4 Sn + BCl 3 PhBCl 2 + Ph 3 SnCl Li(CH 2 ) 4 Li + PhBF 2 [CH 2 ] 4 B-Ph + 2 LiF R-CH=CH 2 + H-BR 2 R-CH 2 -CH 2 -BR 2 HC CH + BCl 3 Cl 2 B-CH=CH-Cl (hidroborálás) (haloborálás) Szerkezet R 3 B szerkezetű vegyületek monomerek. Organobór-hidridek: B-H-B hidak; 3c,2e kötések (diborán!) Reakciók R 2 BX + Li-R R 2 BR + + LiAlH 4 (R 2 BH) R 2 NH R 2 BNR Cu* R 2 BBR ROH R 2 BOR +
48 Rendszeres fémorganikus kémia (48) 5) A főcsoportbeli elemek szerves származékai Al-organikus vegyületek (R 3 Al, R n AlX m ) Előállítások 3 R 2 Hg + 2 Al 2 AlR Hg (transzmetallálás) 3 PhLi + AlCl 3 Ph 3 Al + 3 LiCl (metatézis) 6 MeCl + 4 Al 2 Me 3 Al 2 Cl 3 Me 4 Al 2 Cl 2 + Me 2 Al 2 Cl 4 (direkt szintézis) 3 Me 4 Al 2 Cl Na 2 Me 6 Al Al + 6 NaCl Al + 3/2 H Et 3 Al (P,T) 3 Et 2 AlH 3 Et 2 AlH + 3 H 2 C=CH 2 (P) 3 Et 3 Al Al + 3/2 H H 2 C=CH 2 3 Et 3 Al (direkt szintézis, Ziegler) Szerkezet: oldat és gázfázisban dimerek (Al-C-Al elektronhiányos kötések) Reakciók Aluminium-trialkilek addíciója izolált kettőskötésű alkénekre karboaluminálás Dialkil-aluminium-hidridek addíciója kettős kötésekre hidroaluminálás Pl.: lineáris polietilén származékok (C 20 ) előállítása (Ziegler)
49 Rendszeres fémorganikus kémia (49) 5) A főcsoportbeli elemek szerves származékai Ziegler r. propénnel dimer (2-Me-pentén) izoprén
50 Rendszeres fémorganikus kémia (50) 5) A főcsoportbeli elemek szerves származékai 5.3 Kovalens fémorganikus vegyületek csoport (B, Al, Ga, In, Tl) Ga-, In-, Tl-organikusok Kisebb gyakorlati jelentőség. Me 3 Ga, Me 3 In III-V félvezetők gyártásánál: (CH 3 ) 3 Ga + AsH 3 GaAs + 3 CH 4 (MOCVD) Tipikus előállítások: transzmetallálás, metatézis, M-H addíció telítetlen kötésre (anti-markovnyikov-szabály szerint): Et 2 GaH + H 2 C=CH-CH 3 Et 2 GaCH 2 -CH 2 -CH 3 Π-komplexek: Cp-származékok C 5 H 5 Na + InCl 3 (η 1 -C 5 H 5 ) 3 In (η 5 -C 5 H 5 )In + C 10 H 10 Tl 2 SO C 5 H NaOH 2 (η 5 -C 5 H 5 )Tl + Na 2 SO 4 + H 2 O CpTl enyhe, Cp-átvivő, félszendvics szerkezetű vegyület. (Erősen toxikus!!!)
Fémorganikus kémia 1
 Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus vegyületek
 Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Palládium-organikus vegyületek
 Palládium-organikus vegyületek 1894 Phillips: C 2 H 4 + PdCl 2 + H 2 O CH 3 CHO + Pd + 2 HCl 1938 Karasch: (C 6 H 5 CN) 2 PdCl 2 + RCH=CHR [(π-rhc=chr)pdcl 2 ] 2 Cl - Cl Pd 2+ Pd 2+ Cl - - Cl - H O 2 2
Palládium-organikus vegyületek 1894 Phillips: C 2 H 4 + PdCl 2 + H 2 O CH 3 CHO + Pd + 2 HCl 1938 Karasch: (C 6 H 5 CN) 2 PdCl 2 + RCH=CHR [(π-rhc=chr)pdcl 2 ] 2 Cl - Cl Pd 2+ Pd 2+ Cl - - Cl - H O 2 2
Szepes László ELTE Kémiai Intézet
 Szepes László ELTE Kémiai Intézet Félúton a szerves és szervetlen kémia között ALKÍMIA MA c. előadássorozat 2009. április 2. Az előadás vázlata Néhány hasznos alapfogalom π-komplexek Zeise-só és a Dewar-Chatt-Duncanson-f.
Szepes László ELTE Kémiai Intézet Félúton a szerves és szervetlen kémia között ALKÍMIA MA c. előadássorozat 2009. április 2. Az előadás vázlata Néhány hasznos alapfogalom π-komplexek Zeise-só és a Dewar-Chatt-Duncanson-f.
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
6) Az átmenetifémek szerves származékai
 Rendszeres fémorganikus kémia 2009-2010 (134) Átmenetifém-átmenetifém kötések és klaszterek Történet: A. Werner (1866-1919) oligonukleáris komplexekben ligandum-hidakat tételezett fel: (H 3 N)(Cl)Pt(µ-Cl)
Rendszeres fémorganikus kémia 2009-2010 (134) Átmenetifém-átmenetifém kötések és klaszterek Történet: A. Werner (1866-1919) oligonukleáris komplexekben ligandum-hidakat tételezett fel: (H 3 N)(Cl)Pt(µ-Cl)
ALKOHOLOK ÉS SZÁRMAZÉKAIK
 ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
Szerves kémiai szintézismódszerek
 Szerves kémiai szintézismódszerek 5. Szén-szén többszörös kötések kialakítása: alkének Kovács Lajos 1 Alkének el állítása X Y FGI C C C C C C C C = = a d C O + X C X C X = PR 3 P(O)(OR) 2 SiR 3 SO 2 R
Szerves kémiai szintézismódszerek 5. Szén-szén többszörös kötések kialakítása: alkének Kovács Lajos 1 Alkének el állítása X Y FGI C C C C C C C C = = a d C O + X C X C X = PR 3 P(O)(OR) 2 SiR 3 SO 2 R
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
SZERVES KÉMIAI REAKCIÓEGYENLETEK
 SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS
 Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit
 SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
CH 2 =CH-CH 2 -S-S-CH 2 -CH=CH 2
 10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
5) A főcsoportbeli elemek szerves származékai
 Rendszeres fémorganikus kémia 2009-2010 (51) 5.3 Kovalens fémorganikus vegyületek 5.3.2 14. csoport (Si, Ge, Sn, Pb) Klasszikus elem/fémorganikus kémia (ksz: 4) Szerves Si-vegyületek Részletesen nem tárgyaljuk!
Rendszeres fémorganikus kémia 2009-2010 (51) 5.3 Kovalens fémorganikus vegyületek 5.3.2 14. csoport (Si, Ge, Sn, Pb) Klasszikus elem/fémorganikus kémia (ksz: 4) Szerves Si-vegyületek Részletesen nem tárgyaljuk!
Helyettesített Szénhidrogének
 elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
Aromás vegyületek II. 4. előadás
 Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
6) Az átmenetifémek szerves származékai
 Rendszeres fémorganikus kémia 2009-2010 (111) 6.6 σ,π-donor/ π-akceptor ligandumok (π-komplexek) L M és L M kölcsönhatások. Az L M kölcsönhatás következtében σ-, vagy σ- és π- szimmetriájú kötések alakulhanak
Rendszeres fémorganikus kémia 2009-2010 (111) 6.6 σ,π-donor/ π-akceptor ligandumok (π-komplexek) L M és L M kölcsönhatások. Az L M kölcsönhatás következtében σ-, vagy σ- és π- szimmetriájú kötések alakulhanak
1. változat. 4. Jelöld meg azt az oxidot, melynek megfelelője a vas(iii)-hidroxid! A FeO; Б Fe 2 O 3 ; В OF 2 ; Г Fe 3 O 4.
 1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
4. változat. 2. Jelöld meg azt a részecskét, amely megőrzi az anyag összes kémiai tulajdonságait! A molekula; Б atom; В gyök; Г ion.
 4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
HALOGÉNEZETT SZÉNHIDROGÉNEK
 ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
Helyettesített karbonsavak
 elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Kémiai reakciók. Közös elektronpár létrehozása. Általános és szervetlen kémia 10. hét. Elızı héten elsajátítottuk, hogy.
 Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
SZERVETLEN KÉMIAI REAKCIÓEGYENLETEK
 SZERVETLEN KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Zárójel jelzi a reakciót, ami más témakörnél található meg. REAKCIÓK FÉMEKKEL fém
SZERVETLEN KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Zárójel jelzi a reakciót, ami más témakörnél található meg. REAKCIÓK FÉMEKKEL fém
ALPHA spektroszkópiai (ICP és AA) standard oldatok
 Jelen kiadvány megjelenése után történõ termékváltozásokról, új standardokról a katalógus internetes oldalán, a www.laboreszközkatalogus.hu-n tájékozódhat. ALPHA Az alábbi standard oldatok fémek, fém-sók
Jelen kiadvány megjelenése után történõ termékváltozásokról, új standardokról a katalógus internetes oldalán, a www.laboreszközkatalogus.hu-n tájékozódhat. ALPHA Az alábbi standard oldatok fémek, fém-sók
A kémiatanári zárószigorlat tételsora
 1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
Koordinációs (komplex) vegyületek
 Koordinációs (komplex) vegyületek lfred Werner 1893-1913 CoCl 3 + 6 CoCl 3 ٠6 komplex szín régi név CoCl 3 ٠6 CoCl 3 ٠5 CoCl 3 ٠4 sárga bíborvörös zöld Luteo komplex Purpureo komplex Praseo komplex CoCl
Koordinációs (komplex) vegyületek lfred Werner 1893-1913 CoCl 3 + 6 CoCl 3 ٠6 komplex szín régi név CoCl 3 ٠6 CoCl 3 ٠5 CoCl 3 ٠4 sárga bíborvörös zöld Luteo komplex Purpureo komplex Praseo komplex CoCl
Az elektronpályák feltöltődési sorrendje
 3. előadás 12-09-17 2 12-09-17 Az elektronpályák feltöltődési sorrendje 3 Az elemek rendszerezése, a periódusos rendszer Elsőként Dimitrij Ivanovics Mengyelejev és Lothar Meyer vette észre az elemek halmazában
3. előadás 12-09-17 2 12-09-17 Az elektronpályák feltöltődési sorrendje 3 Az elemek rendszerezése, a periódusos rendszer Elsőként Dimitrij Ivanovics Mengyelejev és Lothar Meyer vette észre az elemek halmazában
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai fizikai alapok I. Vízminőség, vízvédelem 2009-2010. tavasz
 Kémiai fizikai alapok I. Vízminőség, vízvédelem 2009-2010. tavasz 1. A vízmolekula szerkezete Elektronegativitás, polaritás, másodlagos kötések 2. Fizikai tulajdonságok a) Szerkezetből adódó különleges
Kémiai fizikai alapok I. Vízminőség, vízvédelem 2009-2010. tavasz 1. A vízmolekula szerkezete Elektronegativitás, polaritás, másodlagos kötések 2. Fizikai tulajdonságok a) Szerkezetből adódó különleges
6. változat. 3. Jelöld meg a nem molekuláris szerkezetű anyagot! A SO 2 ; Б C 6 H 12 O 6 ; В NaBr; Г CO 2.
 6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
NE FELEJTSÉTEK EL BEÍRNI AZ EREDMÉNYEKET A KIJELÖLT HELYEKRE! A feladatok megoldásához szükséges kerekített értékek a következők:
 A Szerb Köztársaság Oktatási Minisztériuma Szerbiai Kémikusok Egyesülete Köztársasági verseny kémiából Kragujevac, 2008. 05. 24.. Teszt a középiskolák I. osztálya számára Név és utónév Helység és iskola
A Szerb Köztársaság Oktatási Minisztériuma Szerbiai Kémikusok Egyesülete Köztársasági verseny kémiából Kragujevac, 2008. 05. 24.. Teszt a középiskolák I. osztálya számára Név és utónév Helység és iskola
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997
 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997 JAVÍTÁSI ÚTMUTATÓ I. A HIDROGÉN, A HIDRIDEK 1s 1, EN=2,1; izotópok:,, deutérium,, trícium. Kétatomos molekula, H 2, apoláris. Szobahőmérsékleten
1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997 JAVÍTÁSI ÚTMUTATÓ I. A HIDROGÉN, A HIDRIDEK 1s 1, EN=2,1; izotópok:,, deutérium,, trícium. Kétatomos molekula, H 2, apoláris. Szobahőmérsékleten
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2000
 Megoldás 000. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 000 JAVÍTÁSI ÚTMUTATÓ I. A NITROGÉN ÉS SZERVES VEGYÜLETEI s s p 3 molekulák között gyenge kölcsönhatás van, ezért alacsony olvadás- és
Megoldás 000. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 000 JAVÍTÁSI ÚTMUTATÓ I. A NITROGÉN ÉS SZERVES VEGYÜLETEI s s p 3 molekulák között gyenge kölcsönhatás van, ezért alacsony olvadás- és
KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATOK (1997)
 KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATOK (1997) MEGOLDÁSOK I. 1. A hidrogén, a hidridek 1s 1 EN=2,1 izotópok: 1 1 H, 2 1 H deutérium 1 H trícium, sajátosságai eltérőek A trícium,- atommagja nagy neutrontartalma
KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATOK (1997) MEGOLDÁSOK I. 1. A hidrogén, a hidridek 1s 1 EN=2,1 izotópok: 1 1 H, 2 1 H deutérium 1 H trícium, sajátosságai eltérőek A trícium,- atommagja nagy neutrontartalma
Közös elektronpár létrehozása
 Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
Szalai István. ELTE Kémiai Intézet 1/74
 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
R R C X C X R R X + C H R CH CH R H + BH 2 + Eliminációs reakciók
 Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Összesen: 20 pont. 1,120 mol gázelegy anyagmennyisége: 0,560 mol H 2 és 0,560 mol Cl 2 tömege: 1,120 g 39,76 g (2)
 I. FELADATSOR (KÖZÖS) 1. B 6. C 11. D 16. A 2. B 7. E 12. C 17. E 3. A 8. A 13. D 18. C 4. E 9. A 14. B 19. B 5. B (E is) 10. C 15. C 20. D 20 pont II. FELADATSOR 1. feladat (közös) 1,120 mol gázelegy
I. FELADATSOR (KÖZÖS) 1. B 6. C 11. D 16. A 2. B 7. E 12. C 17. E 3. A 8. A 13. D 18. C 4. E 9. A 14. B 19. B 5. B (E is) 10. C 15. C 20. D 20 pont II. FELADATSOR 1. feladat (közös) 1,120 mol gázelegy
Összefoglaló előadás. Sav-bázis elmélet
 Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Szerves Kémia II. 2016/17
 Szerves Kémia II. 2016/17 TKBE0301 és TKBE0312 4 kr Előfeltétel: TKBE0301 Szerves kémia I. Előadás: 2 óra/hét Dr. Juhász László egyetemi docens E 409 Tel: 22464 juhasz.laszlo@science.unideb.hu A 2016/17.
Szerves Kémia II. 2016/17 TKBE0301 és TKBE0312 4 kr Előfeltétel: TKBE0301 Szerves kémia I. Előadás: 2 óra/hét Dr. Juhász László egyetemi docens E 409 Tel: 22464 juhasz.laszlo@science.unideb.hu A 2016/17.
Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás
 Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás I. Egyatomos molekulák He, Ne, Ar, Kr, Xe, Rn - a molekula alakja: pontszerű - a kovalens kötés polaritása: NINCS kötés
Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás I. Egyatomos molekulák He, Ne, Ar, Kr, Xe, Rn - a molekula alakja: pontszerű - a kovalens kötés polaritása: NINCS kötés
Szerves kémia Fontosabb vegyülettípusok
 Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
A periódusos rendszer, periodikus tulajdonságok
 A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
szabad bázis a szerves fázisban oldódik
 1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
O 2 R-H 2 C-OH R-H 2 C-O-CH 2 -R R-HC=O
 Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Halogénezett szénhidrogének
 Halogénezett szénhidrogének - Jellemző kötés (funkciós csoport): X X = halogén, F, l, Br, I - soportosítás: - halogénatom(ok) minősége szerint (X = F, l, Br, I) - halogénatom(ok) száma szerint (egy-, két-
Halogénezett szénhidrogének - Jellemző kötés (funkciós csoport): X X = halogén, F, l, Br, I - soportosítás: - halogénatom(ok) minősége szerint (X = F, l, Br, I) - halogénatom(ok) száma szerint (egy-, két-
Kémiai alapismeretek 6. hét
 Kémiai alapismeretek 6. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék biner 2013. október 7-11. 1/15 2013/2014 I. félév, Horváth Attila c Egyensúly:
Kémiai alapismeretek 6. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék biner 2013. október 7-11. 1/15 2013/2014 I. félév, Horváth Attila c Egyensúly:
A KÉMIA ÚJABB EREDMÉNYEI
 A KÉMIA ÚJABB EREDMÉNYEI A KÉMIA ÚJABB EREDMÉNYEI 98. kötet Szerkeszti CSÁKVÁRI BÉLA A szerkeszt bizottság tagjai DÉKÁNY IMRE, FARKAS JÓZSEF, FONYÓ ZSOLT, FÜLÖP FERENC, GÖRÖG SÁNDOR, PUKÁNSZKY BÉLA, TÓTH
A KÉMIA ÚJABB EREDMÉNYEI A KÉMIA ÚJABB EREDMÉNYEI 98. kötet Szerkeszti CSÁKVÁRI BÉLA A szerkeszt bizottság tagjai DÉKÁNY IMRE, FARKAS JÓZSEF, FONYÓ ZSOLT, FÜLÖP FERENC, GÖRÖG SÁNDOR, PUKÁNSZKY BÉLA, TÓTH
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Bemutatkozás, a tárgy bemutatása, követelmények. Munkavédelmi tájékoztatás.
 Részletes tematika (14 hetes szorgalmi időszak figyelembe vételével): 1. hét (2 óra) Bemutatkozás, a tárgy bemutatása, követelmények. Munkavédelmi tájékoztatás. Kémiai alapjelenségek ismétlése, sav-bázis,
Részletes tematika (14 hetes szorgalmi időszak figyelembe vételével): 1. hét (2 óra) Bemutatkozás, a tárgy bemutatása, követelmények. Munkavédelmi tájékoztatás. Kémiai alapjelenségek ismétlése, sav-bázis,
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Javítókulcs (Kémia emelt szintű feladatsor)
 Javítókulcs (Kémia emelt szintű feladatsor) I. feladat 1. C 2. B. fenolos hidroxilcsoport, éter, tercier amin db. ; 2 db. 4. észter 5. E 6. A tercier amino-nitrogén. 7. Pl. a trimetil-amin reakciója HCl-dal.
Javítókulcs (Kémia emelt szintű feladatsor) I. feladat 1. C 2. B. fenolos hidroxilcsoport, éter, tercier amin db. ; 2 db. 4. észter 5. E 6. A tercier amino-nitrogén. 7. Pl. a trimetil-amin reakciója HCl-dal.
(11) Lajstromszám: E 007 404 (13) T2 EURÓPAI SZABADALOM SZÖVEGÉNEK FORDÍTÁSA
 !HU0000074T2! (19) HU (11) Lajstromszám: E 007 4 (13) T2 MAGYAR KÖZTÁRSASÁG Magyar Szabadalmi Hivatal EURÓPAI SZABADALOM SZÖVEGÉNEK FORDÍTÁSA (21) Magyar ügyszám: E 03 7796 (22) A bejelentés napja: 03.
!HU0000074T2! (19) HU (11) Lajstromszám: E 007 4 (13) T2 MAGYAR KÖZTÁRSASÁG Magyar Szabadalmi Hivatal EURÓPAI SZABADALOM SZÖVEGÉNEK FORDÍTÁSA (21) Magyar ügyszám: E 03 7796 (22) A bejelentés napja: 03.
A tételek: Elméleti témakörök. Általános kémia
 A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Minta feladatsor. Az ion neve. Az ion képlete O 4. Szulfátion O 3. Alumíniumion S 2 CHH 3 COO. Króm(III)ion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
KARBONSAVAK. A) Nyílt láncú telített monokarbonsavak (zsírsavak) O OH. karboxilcsoport. Példák. pl. metánsav, etánsav, propánsav...
 KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
Oldódás, mint egyensúly
 Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott K
Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott K
Intra- és intermolekuláris reakciók összehasonlítása
 Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Toluol (Bruckner II/1 476) µ= 0.33 Debye
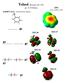 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
1. feladat Összesen: 8 pont. 2. feladat Összesen: 11 pont. 3. feladat Összesen: 7 pont. 4. feladat Összesen: 14 pont
 1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
OXOVEGYÜLETEK. Levezetés. Elnevezés O CH 2. O R C R' keton. O R C H aldehid. funkciós csoportok O. O CH oxocsoport karbonilcsoport formilcsoport
 XVEGYÜLETEK Levezetés 2 aldehid ' keton funkciós csoportok oxocsoport karbonilcsoport formilcsoport Elnevezés Aldehidek nyíltláncú (racionális név: alkánal) 3 2 2 butánal butiraldehid gyűrűs (cikloalkánkarbaldehid)
XVEGYÜLETEK Levezetés 2 aldehid ' keton funkciós csoportok oxocsoport karbonilcsoport formilcsoport Elnevezés Aldehidek nyíltláncú (racionális név: alkánal) 3 2 2 butánal butiraldehid gyűrűs (cikloalkánkarbaldehid)
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
Tartalomjegyzék. Szénhidrogének... 1
 Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Indikátorok. brómtimolkék
 Indikátorok brómtimolkék A vöröskáposzta kivonat, mint indikátor Antociánok 12 40 mg/100 g ph Bodzában, ribizliben is! A szupersavak Szupersav: a kénsavnál erősebb sav Hammett savassági függvény: a savak
Indikátorok brómtimolkék A vöröskáposzta kivonat, mint indikátor Antociánok 12 40 mg/100 g ph Bodzában, ribizliben is! A szupersavak Szupersav: a kénsavnál erősebb sav Hammett savassági függvény: a savak
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Gyenge kölcsönhatások karbonilezési reakciók során Záróbeszámoló (2007)
 Gyenge kölcsönhatások karbonilezési reakciók során Záróbeszámoló (2007) Az olefinek hidroformilezése több mint 50 éve ismert ipari jelentőségű homogénkatalitikus eljárás, melynek során az átmenetifém katalizátor
Gyenge kölcsönhatások karbonilezési reakciók során Záróbeszámoló (2007) Az olefinek hidroformilezése több mint 50 éve ismert ipari jelentőségű homogénkatalitikus eljárás, melynek során az átmenetifém katalizátor
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Sav bázis egyensúlyok vizes oldatban
 Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
Ciklusok bűvöletében Katalizátorok a szintetikus kémia szolgálatában
 Ciklusok bűvöletében Katalizátorok a szintetikus kémia szolgálatában Novák Zoltán Eötvös oránd Tudományegyetem, Kémiai Intézet Szerves Kémiai Tanszék Alkímiai Ma, 2011. Március 17. Ciklusok - Katalízis
Ciklusok bűvöletében Katalizátorok a szintetikus kémia szolgálatában Novák Zoltán Eötvös oránd Tudományegyetem, Kémiai Intézet Szerves Kémiai Tanszék Alkímiai Ma, 2011. Március 17. Ciklusok - Katalízis
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Minőségi kémiai analízis
 Minőségi kémiai analízis Szalai István ELTE Kémiai Intézet 2016 Szalai István (ELTE Kémiai Intézet) Minőségi kémiai analízis 2016 1 / 32 Lewis-Pearson elmélet Bázisok Kemény Lágy Határestek H 2 O, OH,
Minőségi kémiai analízis Szalai István ELTE Kémiai Intézet 2016 Szalai István (ELTE Kémiai Intézet) Minőségi kémiai analízis 2016 1 / 32 Lewis-Pearson elmélet Bázisok Kemény Lágy Határestek H 2 O, OH,
Katalízis. Tungler Antal Emeritus professzor 2017
 Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
Poliaddíció. Polimerek kémiai reakciói. Poliaddíciós folyamatok felosztása. Addíció: két molekula egyesülése egyetlen fıtermék keletkezése közben
 Polimerek kémiai reakciói 6. hét Addíció: két molekula egyesülése egyetlen fıtermék keletkezése közben Poliaddíció bi- vagy polifunkciós monomerek lépésenkénti összekapcsolódása: dimerek, trimerek oligomerek
Polimerek kémiai reakciói 6. hét Addíció: két molekula egyesülése egyetlen fıtermék keletkezése közben Poliaddíció bi- vagy polifunkciós monomerek lépésenkénti összekapcsolódása: dimerek, trimerek oligomerek
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Redoxi reakciók Elektrokémiai alapok Műszaki kémia, Anyagtan I. 12-13. előadás
 Redoxi reakciók Elektrokémiai alapok Műszaki kémia, Anyagtan I. 12-13. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Redoxi reakciók Például: 2Mg + O 2 = 2MgO Részfolyamatok:
Redoxi reakciók Elektrokémiai alapok Műszaki kémia, Anyagtan I. 12-13. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Redoxi reakciók Például: 2Mg + O 2 = 2MgO Részfolyamatok:
A hidrogénmolekula. Energia
 A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
Oldódás, mint egyensúly
 Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott =
Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott =
H 3 C H + H 3 C C CH 3 -HX X 2
 1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
Minta feladatsor. Az ion képlete. Az ion neve O 4. Foszfátion. Szulfátion CO 3. Karbonátion. Hidrogénkarbonátion O 3. Alumíniumion. Al 3+ + Szulfidion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve Foszfátion Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve Foszfátion Szulfátion
Jegyzet. Kémia, BMEVEAAAMM1 Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens.
 Kémia, BMEVEAAAMM Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens Jegyzet dr. Horváth Viola, KÉMIA I. http://oktatas.ch.bme.hu/oktatas/konyvek/anal/
Kémia, BMEVEAAAMM Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens Jegyzet dr. Horváth Viola, KÉMIA I. http://oktatas.ch.bme.hu/oktatas/konyvek/anal/
1. mintatétel. A) Elektrolízis vizes oldatokban
 1. mintatétel A) Elektrolízis vizes oldatokban Értelmezze az egyes elektródokon bekövetkező kémiai változásokat az alábbi oldatok, grafit elektródok között végzett elektrolízise esetén: réz(ii)-szulfát-
1. mintatétel A) Elektrolízis vizes oldatokban Értelmezze az egyes elektródokon bekövetkező kémiai változásokat az alábbi oldatok, grafit elektródok között végzett elektrolízise esetén: réz(ii)-szulfát-
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1999
 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1999 JAVÍTÁSI ÚTMUTATÓ I. HALOGÉNTARTALMÚ SZÉNVEGYÜLETEK A szénhidrogén és a halogén nevének összekapcsolásával Pl. CH 3 Cl metil-klorid, klór-metán
1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1999 JAVÍTÁSI ÚTMUTATÓ I. HALOGÉNTARTALMÚ SZÉNVEGYÜLETEK A szénhidrogén és a halogén nevének összekapcsolásával Pl. CH 3 Cl metil-klorid, klór-metán
Részletes tematika: I. Félév: 1. Hét (4 óra): 2. hét (4 óra): 3. hét (4 óra): 4. hét (4 óra):
 Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
