ACTA GGM DEBRECINA Geology, Geomorphology, Physical Geography Series DEBRECEN Vol.: 1. pp
|
|
|
- Nikolett Kerekes
- 8 évvel ezelőtt
- Látták:
Átírás
1 ACTA GGM DEBRECINA Geology, Geomorphology, Physical Geography Series DEBRECEN Vol.: 1. pp A LIPPMANN-féle stabilitási diagramok jelentősége az agyagásványok képződési viszonyainak értelmezésében The importance of LIPPMANN s stability diagrams in the interpretation of the genetic relations of clay minerals Viczián István Magyar Állami Földtani Intézet, viczian@mafi.hu Összefoglalás Az üledékes tartományban sok a mobilis komponens, gyakoriak a nem-egyensúlyi ásványparagenezisek, aminek következtében nem teljesül az ásványtani fázisszabály (LIPPMANN 1981). Az agyagásványok legnagyobb része ideális szélső tagok szilárd oldata, ezért felszíni körülmények között metastabil fázis. A diagenezis a stabil fázisok felé visz. A bemutatott diagramok a K +, Na +, Mg 2+, H +, (OH) -, valamint a kovasavat (H 4 SiO 4 ) aktivitásának függvényében ábrázolják a stabilitási tartományokat. Ezek segítségével sok földtani jelenség jól értelmezhető, pl. a mállás, stabilitás a tengervízben, autigén ásványkiválás, evaporitok. Abstract In the sedimentary realm there are a high number of mobile components and non-equilibrium mineral parageneses are common. Consequently the mineralogical phase rule is often violated (LIPPMANN 1979). The majority of clay minerals are solid solutions of ideal end members, therefore metastable phases in ambient conditions. Diagenesis leads toward the crystallisation of stable phases. In the diagrams the fields of stability are plotted in terms of the activities of K +, Na +, Mg 2+, H +, (OH) - and silicic acid (H 4 SiO 4 ). The diagrams can be applied to the interpretation of several geological phenomena, such as weathering, stability in sea water, formation of authigenic minerals, hydrothermal deposits, etc. Tárgyszavak Termodinamika, metastabil fázisok, stabilitási diagramok, agyagásványok, kémiai üledékek, mállás. Bevezetés A földkéregben található kőzetek, ásványok kémiai rendszereknek tekinthetők, amelyekre érvényesek a fizika és a kémia általános törvényei. Ily módon a kőzettan és ásványtan a fizika és kémia speciális ágának tekinthetők. Különös sajátságukat mégis az adja, hogy meg kell keresni, hogy ezek az általános törvények hogyan érvényesülnek a földkéreg adott viszonyai között. Ezt a sajátos szemléletet az alábbiakban az agyagásványok kémiai termodinamikai stabilitási viszonyai példáján szeretném bemutatni, elsősorban LIPPMANN munkásságát alapul véve. Előzőleg azonban meghatározok néhány alapfogalmat és ismertetem a témakör történeti fejlődésének főbb állomásait. Különböző, a földkéregben előforduló egyensúlyi rendszerek termodinamikai leírása Az energiafajták képletében a másik tényező olyan, amely nem az anyagmennyiséggel arányos, hanem annak mintegy az állapotát fejezi ki. Ezek a tényezők két rendszer egyesítésekor nem összeadódnak, hanem kiátlagolódnak. Ezek a következők: T: a hőenergia képletében a hőmérséklet, p: a mechanikai energia képletében a nyomás, µ a, µ k : a kémiai energia képletében pedig a rendszert alkotó a, k kémiai komponensek kémiai potenciáljai. Ezeket a rendszer intenzív paramétereinek nevezzük. A kémiai komponensek között KORZSINSZKIJ (1936) megkülönböztetett inert komponenseket, amelyek mennyisége egy adott kémiai reakcióban, illetve egy adott földtani folyamat során nem változik, és tökéletesen mobilis komponenseket, amelyek kicserélődnek a kőzetben (ilyenek pl. oldódási-kicsapódási reakciókban a vízben oldott komponensek). Ha a kőzetet alkotó fázisok egyensúlyban vannak, a tényezőket így osztályozta: S, V, N a, N i : az egyensúly belső tényezői, T, p, µ j, µ t : az egyensúly külső tényezői, ahol N a, N i : az inert komponensek mennyiségei, µ j, µ t : pedig a tökéletesen mobilis komponensek kémiai potenciáljai. A lehetséges egyensúlyi ásványparageneziseket az egyensúly külső tényezőinek függvényében szokás ábrázolni. Hogy melyek azok a külső tényezők, amelyek egy adott földtani környezetben szerepet játszanak, bizonyos megfigyeléseken alapuló elvonatkoztatással állapították meg. Általános fogalmak Néhány általános fogalmat, amely az ásványparagenezisek modelljéül szolgáló kémiai rendszerek leírásával kapcsolatos, az alábbiakban KORZSINSZKIJ (1957, 1959, 1973) nyomán ismertetek. Egy kémiai rendszer belső energiájának megváltozását az alábbi egyenlettel lehet leírni: du = TdS pdv + µ a dn a + + µ k dn k. Ez az egyenlet azt fejezi ki, hogy a belső energia három energiafajtából tevődik össze, ezek a hő-, a mechanikai és kémiai energia. Minden energiafajta kifejezésében van egy olyan tényező, amelynek nagysága a rendszerben levő anyagmennyiséggel arányos, ha két rendszert egyesítünk, ezek a tényezők összeadódnak. Ezek a következők: S: a hőenergia képletében az entrópia, V: a mechanikai energia képletében a térfogat, N a, N k : a kémiai energia képletében pedig a rendszert alkotó a, k kémiai komponensek mennyiségei. Ezeket a rendszer extenzív paramétereinek nevezzük. összetétele nem változik, nincsenek tökéletesen mobilis komponensek, minden komponens inert. Az inert kompo- Történeti áttekintés 1. A kőzettanban először a legegyszerűbbnek tekinthető esetben, az izokémikus regionális metamorfózis esetében kezdték alkalmazni az egyensúlyi diagramokat (ESKOLA 1921). Itt feltételezik, hogy az ásványok átalakulási reakciói csak a hőmérséklet és nyomás következtében mennek végbe, és a kőzet általános nensek és az ásványfázisok viszonyát az u. n. ásványfáciesek (= egyensúlyi ásványegyüttesek) mutatják, 39
2 ACTA GGM DEBRECINA Geology, Geomorphology, Physical Geography Series Vol.: 1. amelyeket célszerűen az ACF háromszögdiagramokon lehet ábrázolni (1. ábra). Ilyen ásványfáciesek pl. a zöldpala, vagy az amfibolit fácies. 1. ábra. A zöldpala-fácies stabil ásványparageneziseinek ábrázolása ACF háromszögben (ESKOLA in BARTH et al. 1939, Abb. 58). Ha egy kémiai reakció bekövetkezik, és új fázisok jönnek létre, egy új ásványfáciesbe jutunk. Itt tehát az egyensúly belső tényezői: S, V, N a, N i, az egyensúly külső tényezői: p, T. ESKOLA a külső tényezők hatását még csak minőségileg tudta ábrázolni (ábrák: BARTH et al. 1939), később a kísérleti kőzettan eredményei segítségével ezeknek a p T diagramoknak pontos számszerű skálát lehetett adni. 2. A következő lépést KORZSINSZKIJ (1936) tette meg, aki felismerte, hogy vannak olyan metamorf folyamatok, amelyekben bizonyos kémiai komponensek kicserélődnek, tehát tökéletesen mobilisnek tekinthetők. Ekkor a kőzet fázisösszetétele teljesen megváltozhat, miközben egyszerűbb esetben a hőmérséklet és a nyomás nem változik lényegesen. Az ilyen folyamatokat nevezzük metaszomatózisnak. Ilyen elméleti háttérrel elemzett KORZSINSZKIJ pl. metaszomatikus lazuritos, flogopitos, valamint szkarnos parageneziseket. Itt általánosságban az egyensúly belső tényezői: S, V, N a, N i, az egyensúly külső tényezői: µ j, µ t. A 2. ábrán bemutatott konkrét esetben (KORZSINSZKIJ 1973) pl. az egyensúly belső tényezői: MgO, Al 2 O 3, SiO 2 (inert komponensek mennyisége), az egyensúly külső tényezői: µ K2 O, µ Na 2 O (a tökéletesen mobilis komponensek kémiai potenciáljai). Eredetileg Korzsinszkij sem tudott még kísérleti paramétereket megadni, ezért az egyes kémiai reakcióknak megfelelő egyeneseket úgy tolta el, hogy egy pontban metsszék egymást. Ezek az u. n. köteg-diagramok (pucskovüje diagrammü) is jól érzékeltetik a fázisviszonyokat a kőzetet átjáró oldatok K 2 O és Na 2 O tartalma függvényében (2. ábra). 3. Még több külső tényező határozza meg a hidrotermális rendszerek viselkedését, mert itt az oldódási-kicsapódási folyamatokban részt vevő mobilis ionok kémiai potenciálja mellett a hőmérsékletet, és ritkábban a nyomást is külső tényezőnek kell tekinteni. Itt tehát az egyensúly belső tényezői: S, V, N a, N i, az egyensúly külső tényezői: (p), T, µ j, µ t. 2. ábra. Példa metaszomatikus ásványparageneziseket ábrázoló stabilitási diagramra. Stabil ásványparageneziseket ábrázoló háromszög-diagramok a K 2 O és Na 2 O kémiai potenciáljának függvényében. A kémiai reakciókat ábrázoló egyenesek metszéspontja egy pontba van hozva. Tökéletesen mobilis komponensek: H 2 O, CO 2, K 2 O és Na 2 O, feleslegben: CaCO 3. Metaszomatikus lazuritos telepek fáciesei (KORZSINSZKIJ 1973, 82. ábra). Ásványok rövidítései: Дол: dolomit, Фл: flogopit, Шп: spinell, Фор: forsterit, Не: nefelin. A hidrotermális rendszerekre vonatkozó stabilitási diagramok szerkesztésének két útja alakult ki. Elméleti, termodinamikai adatokból való számolással, vagy modellkísérletek eredményei alapján. Már a számítógépes lehetőségek bevetésével nagy mennyiségű elméleti, számított diagramot publikáltak hidrotermális rendszerekre a C tartományban HELGESON et al. (1969) és HELGESON (1970). Később a nyomást is bevették a külső tényezők közé, 5 atm határig (BOWERS et al. 1984). A kísérleti hidrotermális rendszerek vizsgálata területén két iskolát érdemes megemlíteni: Franciaországban VELDE (pl. 1977, 1985), a Szovjetunióban, Leningrádban FRANK-KAMENYECKIJ és tanítványai (pl. 1972, 1988) értek el jelentős kísérleti eredményeket. Ilyen hidrotermális kísérletek Magyarországon is folytak (SZÁDECZKY-KARDOSS et al. 1968, 1972). A kísérleti alapon kapott diagramok általában jól tükrözik az oldat összetételének hatását, de a hőmérsékleti adataik a természetes folyamatoknál jóval magasabbak, mivel a kísérletek eléggé gyors lefolyása érdekében a természetes lassú folyamatoknál nagyobb hőmérsékleteket kellett alkalmazni. 4. Végül a felszíni körülmények között, üledékes környezetekben lejátszódó folyamatokat tekintve a külső tényezők közül a hőmérséklet és a nyomás változását már nem kell figyelembe venni. A metaszomatózishoz hasonlóan: az egyensúly belső tényezői: S, V, N a, N i, az egyensúly külső tényezői: µ j, µ t. Különbség, hogy a folyamatok első közelítésben 1 atm nyomáson és 25 C hőmérsékleten mennek végbe, másrészt alig marad olyan N a, N i komponens, amely ne cserélődhetne ki, vagyis amely inertnek lenne tekinthető. Az igen gazdag irodalomból, amely ezzel a témával foglalkozik, itt csak két úttörő munkát emelek ki: FETH et al. (1964) voltak az elsők, akik ilyen stabilitási diagramokat alkalmaztak talajvíz hatására végbemenő mállás magyarázatára. GARRELS és CHRIST (1965) adtak ki először olyan, 40
3 Viczián I.: A Lippmann-féle stabilitási diagramok jelentősége az agyagásványok képződési viszonyainak értelmezésében főleg az üledékes viszonyokra vonatkozó stabilitási diagram-gyűjteményt, amelyben már számos agyagásvány is szerepel. Agyagásványok és rokon fázisok stabilitási viszonyai üledékes körülmények között Az egyensúly tényezői A téma talán termodinamikailag legmegalapozottabb elméleti tárgyalását mind az agyagásványokra, kova- és földpát-ásványokra, oxi-hidroxidokra, mind az üledékes karbonát-ásványokra vonatkozólag LIPPMANN munkáiban találjuk (5-8. ábra). Szerinte az agyagásványokban leggyakrabban szereplő komponensek a következők: K 2 O, Na 2 O, MgO, FeO, Al 2 O 3, SiO 2, H 2 O. Ezek közül a H 2 O mennyisége változásának hatását nem kell vizsgálnunk, mert a víz feleslegben van mint oldószer. Az egyes szilikát-fázisok vizes oldatból kristályosodnak ki, és vízben oldódnak fel. Ha a vastartalmú agyagásványoktól eltekintünk, az átalakulási reakciókban a fenti komponensek közül vízben oldott ionok formájában megtaláljuk a következőket: K +, Na +, Mg 2+, H +, (OH) -, valamint a kovasavat (H 4 SiO 4 ), ezek tehát mind mobilis komponenseknek tekinthetők (LIPPMANN 1979, 1982). Üledékes környezetben tehát az agyagásványok egyensúlyi viszonyaira nézve: az egyensúly belső tényezői: S, V és N i, ahol N i az egyetlen immobilis komponens, az Al 2 O 3 mennyiségi hányada a rendszerben, az egyensúly külső tényezői: µ j, µ t, vagyis a felsorolt mobilis komponensek kémiai potenciáljai. Ionok kémiai potenciálja (µ) vizes oldatokban az aktivitásukkal egyenlő (jele: a, vagy [ ]). Az aktivitás viszont az ion koncentrációjával arányos. A stabilitási viszonyok tehát aktivitási diagramokon tanulmányozhatók, amelyeket termodinamikai adatokból lehet számolni az egyes reakciók lefolyásának ismeretében. A fenti módon egyszerűsített rendszerben még mindig túl sok, 6 a mobilis komponensek száma, tehát ennyi változó függvényében kellene az ásványok stabilitási viszonyait vizsgálni. Ha figyelembe vesszük, hogy a H + és (OH) - ionok koncentrációja átszámítható egymásba, még mindig 5 független változónk marad. Ezért a kétdimenziós ábrázolás céljából további egyszerűsítéseket szoktak bevezetni. LIPPMANN az alábbi részrendszereket tárgyalta, amelyekben már csak egy-egy jellegzetes kation maradt: K 2 O + Al 2 O 3 + SiO 2 + H 2 O (LIPPMANN 1982) Na 2 O + Al 2 O 3 + SiO 2 + H 2 O (LIPPMANN, lásd VICZIÁN 1992) MgO+ Al 2 O 3 + SiO 2 + H 2 O (LIPPMANN 1981) Ezekben a részrendszerekben a kation (pl. K + ) aktivitását a kovasav aktivitásának függvényében ábrázolják (5. ábra). Mivel a koncentrációk tág határok között változnak, célszerű tízes alapú logaritmikus skálát alkalmazni. Azért, hogy a H + és (OH) - ionok hatását is figyelembe vegyük, a függőleges tengelyen a kiválasztott ion aktivitását a hidrogén-ion aktivitásához viszonyítva ábrázolják. Ez azért is indokolt, mert ezek az ionok legtöbbször a hidrogén-ionnal való ioncsere-reakciókban vesznek részt. Végül is tehát a következő típusú diagramokat kapjuk: a függőleges tengelyen: log[k + ]/[H + ] vagy log[na + ]/[H + ] vagy log[mg 2+ ]/[H + ] 2, a vízszintes tengelyen mindig: log[h 4 SiO 4 ]. Mivel [H + ] negatív, tízes alapú logaritmusa nem más, mint a ph, a diagramok a ph hatását is mutatják. A víz disszociációját figyelembe véve a hidrogén ion aktivitásából a hidroxil ion aktivitása is könnyen számolható, ezért a függőleges tengely skáláját a következő módon is meg lehet adni: log[k + ]. [OH - ] stb. A diagramokról tehát azt lehet leolvasni, hogy melyik agyagásvány milyen ion-koncentráció, milyen savasság vagy lúgosság, valamint milyen kovasav-koncentráció mellett stabilis. A vízszintes tengelyen balról jobb felé haladva növekvő kovasav-koncentrációkat kapunk, a függőleges tengelyeken felfelé az adott ion koncentrációja és a ph növekszik, vagyis alul a savas, felül a lúgos környezetek helyezkednek el. Az egyes ásványok stabilitási mezőit egyenesek határolják, amelyek a két szomszédos ásvány egymásba való átalakulási reakciójának felelnek meg. Pl. a mikroklin és muszkovit mezők határán a mikroklin muszkovitba megy át, a földpát szericitesedik a következő egyenlet szerint: 3 KAlSi 3 O H 2 O mikroklin KAl 2 Si 3 AlO 10 (OH) H 4 SiO K OH -. muszkovit Ebben az esetben a viszonylag híg oldat részlegesen feloldja a káliföldpátot, és eközben mind a három mobilis komponens egy része oldatba megy. A fenti reakció fordítottja játszódhat le egy illitet tartalmazó üledékes kőzetben, ha autigén káliföldpát képződik annak hatására, hogy az oldatban a fenti három mobilis komponens koncentrációja megnő. Szemléletesen is belátható, hogy az itt felsorolt komponenseknek kell lenni az egyes agyagásványok képződése fő tényezőinek, ha nagy vonalakban áttekintjük az agyagásványok kémiai összetételét: Az egyes agyagásvány-fajtákban az alumíniumon és szilíciumon kívül egy-két további jellegzetes kation van. Így pl. a csillámokban K +, illetve ritkábban Na + van, a klorit- és szerpentin-ásványokban Fe 2+, Fe 3+, és Mg 2+, a paligorszkitban és szepiolitban, valamint a talkban Mg 2+, a kaolin-csoportban és a pirofillitben egyik sem. Mivel Si csak a tetraéderes (T) rétegben, OH viszont csak az oktaéderes (O) rétegben van, a TO és TOTO szerkezetekben viszonylag sokkal kevesebb a Si és több az OH, mint a TOT szerkezetekben. Az alumínium oxi-hidroxidjai nem tartalmaznak Si-t, de sok bennük az OH, míg a földpátokban, és különösen az opálban és kvarcban több a Si, mint az agyagásványokban, de nincs OH. Stabil és metastabil fázisok, metastabil reakciók az üledékekben LIPPMANN érdeme, hogy elődeinél következetesebben rámutatott az üledékes tartománynak arra a jellegzetességére, hogy az ott előforduló fázisok nagy része termodinamikai értelemben nem stabil, hanem metastabil állapotban van. Mivel egyértelmű megfelelés csak a stabil fázisok és az egyensúly tényezői között van, a stabilitási diagramok szerkesztésekor ezeket meg kell különböztetni a nem stabil fázisoktól. Egy adott összetételű vegyület többféle kristályos formában fordulhat elő, amelyek közül az adott hőmérsékleten és nyomáson csak az egyik polimorf vagy 41
4 ACTA GGM DEBRECINA Geology, Geomorphology, Physical Geography Series Vol.: 1. politíp módosulat van stabil állapotban, a többi metastabilnak tekinthető. Az alábbiakban az üledékes kőzetekben előforduló gyakoribb ásványok közül mutatunk be néhány példát. Elöl vastag betűvel az adott összetételű stabil fázist tüntetjük fel, majd a növekvő metastabilitás sorrendjében a metastabil fázisokat: mikroklin, ortoklász, magas-szanidin, adulár, KAlSi 3 O 8 üveg kvarc, cristobalit, opál diaszpor, böhmit, ( ) gibbsit hematit, goethit, ferrihidrit, amorf Fe-oxi-hidroxidok rutil, anatáz kalcit, aragonit dickit, ( ) kaolinit-t, kaolinit-d (=rendezetlen kaolinit), halloysit-7å, halloysit-10å, allofán muszkovit-2m, muszkovit-1md (illit-1md). Az azonos összetételű fázisok közül az a legstabilabb, amelynek az 1 atm nyomásra és 25 C hőmérsékletre számított GIBBS-féle képződési szabadenergiája (szabadentalpiája), G o 298 a legkisebb. Pl. a káliföldpát- módosulatok oxidjaikból való képződése esetén: mikroklin: kj/mol, magas-szanidin: kj/mol, KAlSi 3 O 8 üveg: kj/mol, tehát a stabil fázis a mikroklin. A legfontosabb ásványok G o 298 adatai megtalálhatók LIPPMANN (1979, 1981) cikkeiben, de általában csak a stabil módosulatra vonatkozólag. Az egyes módosulatok GIBBS-féle képződési energia-értékei összehasonlíthatók pl. ROBIE és WALDBAUM (1968) táblázataiban, amely ezen a téren az első komolyabb, földtudományi célú gyűjtemény volt, és tíz év múlva újabb, bővített kiadást ért meg: Robie et al. (1978, innen valók a káliföldpátra vonatkozó fenti adatok). Azóta ezeket az adatokat is sokszorosan pontosították és kiegészítették. A fenti metastabilitási sorok részint ezeken a kísérleti adatokon, részint más, rácsszerkezeti és földtani előfordulási meggondolásokon alapulnak. Ha a termodinamikai stabilitás rácsszerkezeti okait tekintjük, azt mondhatjuk, hogy általában a lazább térkitöltésű rácsok a kevésbé stabilak, és még kevésbé stabilak az ugyanolyan összetételű amorf anyagok. Ha a kristályszerkezet ugyanaz, csak a rendezettség különböző, a szerkezetileg rendezetlen fázisok metastabilak a rendezett fázishoz képest. Ha azonosnak tekintjük azoknak a fázisoknak az összetételét, amelyek csak a H 2 O tartalomban különböznek egymástól, a víztartalmú szerkezetek általában metastabilak a megfelelő vízmentes szerkezet+folyékony víz rendszerhez képest (pl. a gibbsit metastabil a diaszpor+víz rendszerhez képest). Üledékes környezetben nemcsak metastabil fázisok, hanem metastabil reakciók is gyakran előfordulnak. Ennek egyik esete az, amikor egy fázis a vele érintkező oldat összetételének hatására nem a megfelelő stabilis fázissá alakul át, hanem egy hasonló összetételű metastabil fázissá. Erre példa, amikor a kaolinitből a kovasav kioldásával nem diaszpor, hanem gibbsit keletkezik: Al 2 Si 2 O 5 (OH) H 2 O 2 Al(OH) H 4 SiO 4. kaolinit gibbsit A metastabil reakciók másik esete az lehet, amikor egy fázis nem a vele szomszédos stabilitási mező ásványává alakul át, hanem a gyors reakció következtében azt mintegy átugorva, közvetlenül egy távolabbi mező ásványává alakul át, pl. ha a káliföldpát először nem illitté alakul át, és utána kaolinitté, hanem a gyors oldódás következtében közvetlenül kaolinitté: 2 KAlSi 3 O H 2 O mikroklin Al 2 Si 2 O 5 (OH) H 4 SiO K OH -. kaolinit Az ilyen reakciók is egyértelműen lehatárolnak egy mezőt az aktivitási diagramokon egyes ásványok számára, azonban ezek a mezők nem igazi stabilitási tartományok, csak metastabil perzisztencia- (fennmaradási) tartományok. Ilyen értelemben pl. a gibbsitnek is van bizonyos perzisztencia-tartománya, vagy a kaolinit perzisztenciatartománya is nagyobb lehet, mint a tulajdonképpeni stabilitási mezeje. Az ásványtani fázisszabály érvényesülése Az ásványtani fázisszabály azt mondja ki, hogy ha a rendszer kémiai egyensúlyban van, a kőzet fázisainak száma (F) nem lehet nagyobb, mint a komponensek száma (K): F K (lásd pl. KOCH - SZTRÓKAY 1967, I. kötet, Ásványkémia fejezet, írta GRASSELLY GY.). Ebből következik, hogy egyensúlyi viszonyok között nem lehetnének együtt ugyanannak a vegyületnek metastabil és stabil változatai, pl. opál és kvarc, gibbsit és diaszpor, illit-1md és muszkovit-2m. Valójában az ásványtani fázisszabály fenti megfogalmazása csak az ESKOLA-féle ásványfácies-fogalomra érvényes, amikor az egyensúly külső tényezői csak a hőmérséklet és a nyomás. KORZSINSZKIJ mutatta ki, hogy metaszomatikus rendszerekben különbséget kell tennünk a komponensek között. Ha a komponensek között tökéletesen mobilis komponensek is vannak, azok számát le kell vonni az összes komponens számából, és a fázisszabály úgy módosul, hogy a kőzet fázisainak száma nem lehet nagyobb, mint az inert komponensek száma (K i ): F K i. Metaszomatikus rendszerekben az inert komponensek száma is elég sok, így a külső tényezők egy-egy meghatározott értékének több fázis paragenezise felel meg, amit az ásványfáciesekhez hasonlóan szintén háromszögdiagramokban szoktak ábrázolni. Mivel az üledékes agyagásvány-képződést leíró, most tárgyalt részrendszerekben csak egy immobilis, azaz inert komponens van, az Al 2 O 3, a mobilis komponensek aktivitásának egy adott értéke esetén a fázisok száma sem lehet nagyobb, mint egy: F = 1. Ennek következtében egy egyensúlyi állapotot elért üledékben nem lehetne egyszerre együtt többféle szilikátfázis sem, pl. földpát, kaolinit és muszkovit, mivel egy tetszés szerinti összetételű oldattal érintkezve ezek közül egyszerre csak az egyik lehet stabilis (kivéve a három fázis stabilitási mezejének érintkezésénél levő pontot). Mivel tudjuk, hogy a legtöbb esetben ez viszont így van, vagyis a fázisok száma jóval meghaladja a komponensek számát, ez a körülmény is arra utal, hogy a legtöbb üledék, talaj és üledékes kőzet még nem érte el a kémiai egyensúlyi állapotot. Külön kell foglalkozni a kvarc megjelenésével, mert az az egyik mobilis komponensnek, a kovasavnak a kiválásával keletkezik. Az olyan fázisokat, amelyek kizárólag a tökéletesen mobilis komponensekből állanak, KORZSINSZKIJ (1973, pp ) tökéletesen mobilis ásványoknak nevezi, és egyik 42
5 Viczián I.: A Lippmann-féle stabilitási diagramok jelentősége az agyagásványok képződési viszonyainak értelmezésében példának ő is a kvarcot említi. Ez a fázis még hozzáadódhat a fázisok maximális számához, tehát végeredményben a fent tárgyalt rendszerekben F 2, ahol a második fázis a kvarc lehet. Természetesen egy-egy valóságos kőzetösszetételt több részrendszer modellez, így ha több kation is nagy töménységben van az oldatokban, elképzelhető olyan eset, hogy külön megjelenik K-ban, Na-ban, Mg-ban, esetleg más kationban dús fázis, plusz kvarc is. De ekkor sem lehet az egyensúlyban levő fázisok száma több, mint 4-5. Ha eltekintünk attól, hogy egy komponens inert, vagy mobilis-e, és az összes kémiai komponenst tekintjük, akkor is fennáll, hogy a legtöbb üledék több fázist tartalmaz, mint komponenst. Ez egyszersmind azt is jelenti, hogy nincs egyértelmű megfelelés a kémiai összetétel és az ásványtani összetétel között, és a kémiai összetételt nem csak egyféleképpen lehet átszámolni ásványtani összetételre (VICZIÁN 1968). Metastabil szilárd oldatok Eddig a metastabilis állapot olyan eseteivel foglalkoztunk, amikor az összetétel közel állandó volt, és közel állt az ideálishoz, csak a kristályszerkezet változott. Az agyagásványok egy további tulajdonsága, ami a metastabilis állapotot elősegíti, az hogy legtöbbször nem ideális összetételűek, hanem kiterjedt mértékben izomorf helyettesítéseket tartalmaznak. A tetraéderes rétegben a Si és Al, az oktaéderes rétegben a Mg, Fe és Al, a rétegközi térben a K és Na helyettesíthetik egymást. Ez a kémiai képletben úgy mutatkozik meg, hogy az egyes elemek együtthatói nem kis egész számok, hanem tört számok. A legtisztább összetételű a kaolinit-csoport, a legnagyobb mértékű a helyettesítés a TOT-szerkezetű ásványok között, a csillám-, szmektit- és vermikulit-csoportban, de hasonlóan nagy a kloritok között is. A TOT-szerkezetű ásványok szinte folyamatosan kitöltik három szélső tag, a muszkovit, KAl 2 Si 3 AlO 10 (OH) 2, a pirofillit, Al 2 Si 4 O 10 (OH) 2 és a szeladonit, KFe 3+ MgSi 4 O 10 (OH) 2 közötti összetételi tartományt. Ezt LIPPMANN még WEAVER és POLLARD (1973) háromszögdiagramján tudta bizonyítani (3. ábra). Újabban az IMA Nevezéktani Bizottságának ajánlása a csillámokra nézve az összetételt hat sarokpont között, egy térbeli, háromszög alapú hasábban ábrázolja (RIEDER et al. 1998), de ennek sarokpontjai közül is az a három, amely a természetben is előforduló ásványfázis, ugyanez, a muszkovit, a pirofillit és a szeladonit (4. ábra). Bár az ajánlás csak a csillámásványokra vonatkozik, a szmektitek és vermikulitok is jól ábrázolhatók ugyanebben a rendszerben, ha rétegközti kationtól eltekintünk, és itt is szinte folyamatosan ki van töltve az egész összetételi tartomány. A vastartalmú csillámok folytonos összetételbeli változékonyságára vonatkozólag újabban WEISZBURG T. (2006) is szolgáltatott adatokat. A kloritok szinte folyamatos öszszetételbeli változékonysága miatt sokáig kísérleteztek különféle nevezéktani rendszerek felállításával (lásd pl. KOCH - SZTRÓKAY 1967, II. kötet, 607. ábra). Bár most már ezeknek az ásványneveknek a nagy része nem érvényes, de az összetételbeli változékonyság ténye továbbra is fennmarad. 3. ábra. A dioktaéderes TOT típusú agyagásványok szilikátrétegének összetétele a szeladonit muszkovit pirofillit háromszögben (WEAVER-POLLARD 1973). 4. ábra. A dioktaéderes csillámok összetételének ábrázolása térbeli diagramban. Sarokpontok: szeladonit - ferri-muszkovit - ferripirofillit és aluminoszeladonit muszkovit pirofillit (RIEDER et al. 1998, Fig. 1b). A dioktaéderes szmektitek szilikát-rétege a vastagon kihúzott rész alatt, a pirofillit közelében helyezkedik el. Az agyagásványok körében észlelhető nagymértékű elegyedés annál inkább érdekes, mert különben az alacsony hőmérsékletű tartományra inkább az ideálist megközelítő kémiai összetételű ásványok a jellemzők, mint pl. a sóásványok, gipsz, anhidrit, a karbonátok nagy része, a kaolinit stb. A nagymértékű szilárd oldat képződés inkább a magas hőmérsékletekre jellemző. Így pl. a magas hőmérsékleten szinte korlátlanul elegyedő K- és Na-földpátok, vagy a muszkovit-paragonit páros lehűlve szételegyedik az ideálist megközelítő összetételű fázisokra. Az agyagásványokra inkább a fordítottja vonatkozik: a nagyobb hőmérsékletek felé haladva, kb. az anchizóna eléréséig a fázisok összetétele inkább tisztul, és mindinkább megközelíti a szélső tagok, a muszkovit és a pirofillit összetételét, míg a szeladonit maga is szétesik a biotit + földpát + kvarc együttesre. Míg a nagyhőmérsékletű szilárd oldatok termodinamikailag stabil fázisoknak tekinthetők, az agyagásványok kishőmérsékletű szilárd oldatai nem, hanem a szélső tagok mechanikai elegyéhez képest metastabil állapotban levő keverék- 43
6 ACTA GGM DEBRECINA Geology, Geomorphology, Physical Geography Series Vol.: 1. kristályok. A keverék-kristályok képződésének az az oka, hogy az agyagásványok kiválása a vizes oldatokból csak nagymértékű túltelítettség esetén indul meg, amit a finom szemcseméretben is megnyilvánuló nagyfokú nukleáció is bizonyít. Ekkor viszont a kristályosodás olyan gyors, hogy a szerkezet nem tud eléggé válogatni, és a kiváló komponensek oda nem egészen illő ionokat is magukkal ragadnak. Így kerül pl. a muszkovit rácsában az oktaéderes pozícióba a Mg és Fe, vagy pl. így alakulnak ki azok a helyettesítések a rácsban, amelyek a szmektitek duzzadóképességét és ioncserélő képességét okozzák. Tehát az olyan ásványok, amelyek csak bizonyos öszszetételi tartománnyal adhatók meg, mint pl. a montmorillonit, beidellit, illit, glaukonit, mind metastabil fázisok, és a fázisdiagramon nem ábrázolható a stabilitási mezejük. Ennek fő oka az, hogy a szilárd oldat bonyolult, és a kísérleti adatok hiánya miatt egyelőre kiszámíthatatlan módon befolyásolja az oldékonysági szorzatokat. Ennek kimutatására és az irodalomban megjelent hibás számítások bírálatára LIPPMANN külön cíkket szentelt (1977). Gyakorlatilag tehát majdnem minden agyagásvány metastabil néhány egyszerű összetételű, de főleg a nagyobb hőmérsékletű diagenezis anchimetamorfózis tartományából ismert szilikát-ásványhoz képest (dickit, muszkovit, pirofillit, klinoklor). Meg kell említeni, hogy később Amerikában többen megtámadták ezt a felfogást a szilárd oldat összetételű agyagásványok metastabil voltáról. A PEACORféle iskola viszont közvetlen elektronmikroszkópos megfigyelésekkel is bizonyította LIPPMANN elméletének helyességét (JIANG et al. 1990). Még ezekhez a diszkrét fázisoknak tartott agyagásványokhoz képest is inkább metastabilak azok a kevert szerkezetek, amelyeknek komponenseit ezek az agyagásványok alkotják, mint pl. az illit/montmorillonit, vagy a klorit/montmorillonit. A kevert szerkezetek között valamivel stabilisabbak lehetnek a szabályos rétegsorrendű kevert szerkezetek, pl. a rectorit és corrensit, és a legkevésbé stabilak a véletlen rétegsorrendűek. Itt is kimutatható, hogy a hőhatás a szabályosabb kevert szerkezet megjelenésének kedvez, mint pl. a corrensit megjelenésének a gerecsei alsókrétában. Ugyanitt a fiatalabb, hőhatást feltehetőleg nem szenvedett képződményekben a megfelelő szabálytalan rétegsorrendű kevert szerkezetet találjuk (VICZIÁN - KOVÁCS-PÁLFFY 1997, Fig. 4). A stabilitási diagramok használata szempontjából ez azt jelenti, hogy ezeknek a fázisoknak még annyira sem lehet határozott perzisztencia-tartományt kijelölni, mint a metastabil reakciókkal lehatárolható fázisoknak. Körülbelüli helyüket a diagramokon azon az alapon lehet megadni, hogy melyik stabilis szélső tag összetételéhez állnak legközelebb, így a diagramokon a kaolinit a dickit, az illit a muszkovit, a montmorillonit a pirofillit, a Mg-ban dús kloritok a klinoklor közelében helyezkednek el, kevert szerkezeteik pedig valahol ezek között. LIPPMANN diagramjaiban ez az egyik újdonság más szerzők hasonló diagramjaihoz képest, amelyek közvetlenül az agyagásványok (pl. illit, montmorillonit) és más metastabil fázisok (pl. gibbsit) stabilitási mezejét ábrázolják mint láttuk, elméletileg helytelenül. A legszokatlanabbnak az tűnik, hogy a diagramokban a dioktaéderes szmektiteket a pirofillit képviseli mint legközelebbi stabil fázis. Ennek jogosultságát azonban a sokkal később elfogadott csillám-nevezéktan is alátámasztja (RIEDER et al. 1998). Ebben a dioktaéderes csillámok összetételét ábrázoló térbeli diagramban a szmektiteknek megfelelő összetételű (a kálium nélkül tekintett) szilikát-egységek valóban a pirofillit közelébe esnek. Ezen belül - a montmorillonitok a pirofillit, Al 2 Si 4 O 10 (OH) 2 és aluminoszeladonit, [AlMgSi 4 O 10 (OH) 2 ] - pontjait összekötő egyenes mentén, - a beidellitek a pirofillit, Al 2 Si 4 O 10 (OH) 2 és muszkovit, [Al 2 Si 3 AlO 10 (OH) 2 ] - pontjait összekötő egyenes mentén helyezkednek el 0,6-nál kisebb rétegtöltés értékeknél, míg a pirofillit rétegtöltése: 0. A nem-egyensúlyi fázisok jelentősége az üledékes tartományban Arra nézve, hogy a nem-egyensúlyi, metastabil fázisoknak mi a jelentősége az üledékek földtani értelmezése szempontjából, LIPPMANN (1982, pp ) néhány gondolatébresztő sorát érdemes szóról-szóra lefordítva idézni: A termodinamikai instabilitást nem kell hátránynak tekintenünk. Gondoljunk csak arra, hogy a szerves vegyületek legnagyobb része, és gyakorlatilag minden biokémiai anyag szintén metastabil. Csak metastabil rendszerek képesek információt hordozni. Az agyagásványok metastabil jellegük következtében alkalmazhatók mint rétegtani jelző-ásványok, mint a kezdődő metamorfózis, vagy a metamorfózistól megkülönböztethető diagenezis jellemzői. Ha a szilikátok közönséges hőmérsékleten könnyen elérnék az egyensúlyt, sem talaj, sem agyag nem létezhetne, és a földet olyan terméketlen kőzetek borítanák, amelyek összetétele körülbelül a zöldpala-fáciesnek felelne meg. Tehát a metastabil állapot teremti meg a föld felszínén az élet lehetőségét, amely maga is metastabil jelenség. Másrészt a metastabil állapotok megléte teszi lehetővé a földtani múlt feltárását. Az egyensúlyi állapot nem függ a rendszer történetétől, csak az egyensúly tényezőinek adott értékétől, tehát elmossa az információkat e tényezőknek az egyensúly beálltát megelőző értékeire vonatkozólag. A nem-egyensúlyi állapot viszont a nemcsak az egyensúlyi tényezők jelenlegi értékeitől függ, hanem a rendszer történetétől is, tehát információkat hordoz a megelőző állapotokról is. Termodinamikailag kifejezve tulajdonképpen ez adja meg a kőzetek történeti elemzésének lehetőségét (VICZIÁN 1976). Erre leginkább az üledékes kőzetek, ezen belül többek között - az agyagásványok tanulmányozásával nyílik lehetőség. A metastabil fázisok fennmaradása és átalakulása A metastabil fázisok idővel spontán módon kevésbé metastabil fázisokká, végül a stabil fázissá kristályosodnak át (pl. opálból opál-ct, majd kvarc lesz, aragonitból kalcit, rendezetlen kaolinitből több fokozaton keresztül jól kristályos kaolinit-t stb.). Üledékes körülmények között azonban még földtani időket tekintve is csak nagyon lassan mennek végbe azok az átalakulási reakciók, amelyek a stabil fázis kialakulását eredményeznék. Ennek egyik oka lehet az, hogy sokszor nem áll rendelkezésre elég oldószer, azaz víz, amelyben a reakció végbemehetne. A stabil, vagy ahhoz közeli fázisok megjelenését tehát főleg hosszú idő után, pl. hosszú idejű talajosodási folyamat eredményeképpen, jól 44
7 Viczián I.: A Lippmann-féle stabilitási diagramok jelentősége az agyagásványok képződési viszonyainak értelmezésében átmosott szelvényekben, pl. trópusi esőerdők övében és jó vízvezető alapkőzet esetén (kaolinit), vagy pl. porózus kőzetek pórusterében (autigén földpátok, kvarc, kaolinit, illit stb.) lehet várni. A másik ok az alacsony hőmérséklet, ami miatt nincs elég aktiválási energia a reakciók megindulására. A tapasztalat az, hogy egyensúlyt jobban megközelítő ásványegyütteseket kissé megemelt hőmérsékleti viszonyok között, tehát betemetődéses diagenezisen átesett üledékekben, vagy forróvizes feláramlások környezetében lehet várni. Itt az átalakulások fő oka nem az, hogy a megemelkedett hőmérséklet következtében megváltozott volna az egyes fázisok stabilitási sorrendje (mint pl. a kvarc krisztobalit átalakulás esetében lenne), hanem az, hogy a legfeljebb C-kal megemelkedett hőmérséklet hatására könnyebben végbemennek azok az átalakulási reakciók, amelyek már szobahőmérsékleten is esedékesek lettek volna, és létrejön az az ásványtársulás, amely már szobahőmérsékleten is stabilis lett volna. A kevert szerkezetű illit/szmektit összetételét és szerkezeti állapotát széles körben használják mint geotermométert a diagenetikus tartományban (lásd pl. POLLASTRO 1990, ESSENE - PEACOR 1995). Egy hőmérőtől elvárjuk, hogy termikusan egyensúlyba kerüljön a mérendő rendszerrel. A fent közölt gondolatmenet viszont megmutatta, hogy az illit/szmektit kevert szerkezet sokszorosan metastabil fázis. Itt tehát nem lehet szó a kevert rétegű fázis összetétele és a hőmérséklet közötti, termodinamikai értelemben vett szigorú megfelelésről, hanem csak olyan tapasztalati összefüggésekről, amelyeket az oldatok összetétele mellett számos kinetikai paraméter, és a kőzet egész hőtörténete is befolyásol. Mégis, ezek az ásványok hasonló hőtörténetű rendszerekben, tapasztalati alapon jól használhatók lehetnek a hőmérséklet múltbeli értékeinek becslésére (JIANG et al. 1990, VICZIÁN 1994, MÁTYÁS 1994). Az egyes részrendszerek néhány földtani vonatkozása Az eddigiekben ismertetett elvi alapokon szerkesztett stabilitási diagramok számos érdekes földtani összefüggésre világítanak rá. Az alábbiakban szintén elsősorban LIPPMANN munkáit idézve - ezek közül említünk meg néhányat. Al 2 O 3 + SiO 2 + H 2 O alrendszer Ha az üledékkel vagy kőzettel érintkező oldatban gyakorlatilag csak a kovasav és az alumínium van jelentős mennyiségben, a fenti egyszerű rendszer alkalmas a jellemzésére. Ez tulajdonképpen mind a most következő káliumos diagram (5. ábra) vízszintes tengelye. Kis kovasav-koncentrációnál először csak Al-oxihidroxidok válnak ki, melyek közül a stabil fázis a diaszpor, melynek széles stabilitási tartománya van. A gibbsit-kaolinit metastabil fázishatárt tekintve viszont a gibbsit sokkal kisebb kovasav-koncentrációknál jelenik meg, mint a diaszpor. Ezek az összefüggések a bauxitosodás során valósulnak meg. Ha azt tekintjük, hogy a gibbsithez és böhmithez képest a diaszpor a stabilis fázis, azt kell kapnunk, hogy kisebb hőhatáson átesett bauxitokban a diaszpor feldúsul a gibbsit rovására. 5. ábra. Ásványok stabilitási viszonyai a K 2 O + Al 2 O 3 + SiO 2 + H 2 O rendszerben 25 C-on. Al 2 O 3 : immobilis komponens. Változók: log[k + ]/[H + ], ill. log[k + ].[OH - ] és log[h 4 SiO 4 ] (LIPPMANN 1982). Kvarc is stabil fázis log[h 4 SiO 4 ] -4,0 nél nagyobb aktivitások esetén, amorf kovasav válik ki log[h 4 SiO 4 ] - 2,7 nél nagyobb aktivitások esetén. Betűjelek: stabil fázisok: nyomtatott nagybetűk (pl. MUSCOVITE), metastabil reakcióban résztvevő fázisok: dőlt, kisbetűs, nagy kezdőbetűvel (pl. Kaolinite/Gibbsite), metastabil fázisok körülbelüli kristályosodási mezővel: dőlt, kisbetűs (pl. illite). A stabil reakciókat folytonos vonal, a metastabil reakciókat szaggatott vonal jelzi. A nyilak a számítások maximális hibáját jelzik. Ez jól látható, ha a Dunántúli-középhegység uralkodóan gibbsites középső-kréta eocén bauxitját összehasonlítjuk a valamivel idősebb, és tektonikailag jobban igénybevett villányi bauxittal, amely kisebb mennyiségű diaszport tartalmaz, és a bihari bauxittal, amely már uralkodóan diaszporos (DUDICH - MINDSZENTY 1984). Ugyanakkor a villányi ú.n. felső bauxit-szint, amely már nyilván ez után a tektonikai fázis után keletkezett, ismét csak gibbsitet tartalmaz (CSÁSZÁR - FARKAS 1984). A kaolinitnek a természetes elterjedéséhez képest csak szűk tartomány jutott az első számolások szerint (LIPPMANN 1981). Később újabb számítások szerint ez a tartomány jelentősen kiszélesedett (LIPPMANN 1982), ami jobban megfelel a természetes viszonyoknak. Ha a kovasav-tartalom növekszik, a pirofillit tartományába jutunk, amelynek kissé megnövekedett kationtartalom (K, Na, Mg) mellett a természetben sokszor a szmektit felel meg. Kis kation-tartalom mellett ezen a tájon kell a víztartalmú kaolin-ásványoknak, a rendezetlen kaolinitnek, a halloysitnek és az allofánnak elhelyezkedni. Ha a kova-változatok kiválását tekintjük, azt látjuk, hogy kb. log[h 4 SiO 4 ] = -4,0 aktivitástól kezdve kezd kiválni a kvarc is, kb. log[h 4 SiO 4 ] = -2,6 aktivitási értéknél pedig már olyan tömény a kovasav-oldat, hogy nem kvarc, hanem amorf kovasav válik ki, ami már más szilikát-ásvány képződését lehetetlenné teszi. A kovasav-tengelyen ez az aktivitás-érték jelenti különben a stabilitási diagramok használhatóságának természetes felső határát. Érdekes megfigyelni, hogy a kaolinit tágabb stabilitási mezejét tekintve egyidejűleg keletkezhet kvarc és kaolinit, valamint még inkább kvarc és szmektitek. A szmektitek az amorf kovasav kiválásával is 45
8 ACTA GGM DEBRECINA Geology, Geomorphology, Physical Geography Series Vol.: 1. határosak. Ez megfelel annak a gyakori megfigyelésnek, hogy a montmorillonit gyakran szoros összenövésben található opállal vagy cristobalittal (NEMECZ - VARJÚ 1973), valamint hogy a bentonitok mikrokristályos kovaüledékekkel váltakoznak, sőt a kisebb kovasav-koncentrációk irányában kaolinittel is társulhatnak. Erre jó példa a Szerencsiöbölben a rátkai szarmata limnikus medence (MÁTYÁS 1966). K 2 O + Al 2 O 3 + SiO 2 + H 2 O rendszer Ha az előbb tárgyalt alrendszert kiegészítjük a függőleges tengelyen a K + és H + ionok aktivitása hányadosával, az 5. ábrán látható stabilitási diagramot kapjuk, amelyben a K- tartalmú ásványokat lehet ábrázolni. Ebben a rendszerben lehet a káliföldpát mállását tárgyalni, amint arról már fentebb a metastabil egyensúlyok ismertetésénél említést tettünk. A káliföldpát a kisebb koncentrációjú édesvizek, pl. esővíz, talajvíz hatására alakul át agyagásványokká. A kaolinit mezeje felfelé, a nagyobb K-koncentrációk felé a muszkovit stabilitási mezejével határos, amelyben a neki megfelelő agyagásvány, az illit keletkezik. A muszkovit stabilitási mezejébe esik a tengervíz összetétele. Ez azt jelenti, hogy a tengervízben, és még inkább az annál töményebb pórusvizekben a muszkovit korlátlan, az illit szinte korlátlan ideig fennmaradó fázisnak tekinthető. Ennek ellenére az óceánok fenekén halmirolízissel autigén módon nem illit, hanem szmektit keletkezik nagy mennyiségben. A mikroklin (káliföldpát) nagy kovasav- és káliumaktivitások és lúgos ph mellett keletkezik, egyszerre válhat ki kvarccal. Ennek jellegzetes példái a mészkövek autigén földpát és kvarc kristályai, amelyek pl. a Germán típusú triász Muschelkalk képződményeire jellemzők, és a mecseki középső triászban is gyakoriak (LELKESNÉ FELVÁRI 1979, 1985, VICZIÁN 1992). Itt a szükséges kovasavat gyakran a kovavázas élő szervezetek szolgáltatják, amelyek amorf szerkezetük és finom morfológiájuk miatt viszonylag jól oldódnak. A káliföldpát, kvarc és szmektitek, valamint a szintén metastabilnak tekinthető zeolit, a klinoptilolit együttes előfordulása riolittufa halmirolitikus elváltozására is jellemző. Ennek jó példáit láthatjuk szintén a Szerencsiöböl területén (NEMECZ - VARJÚ 1963). A diagenetikus szmektit-illit átalakulás tényezői közül ebben a diagramban csak a kémiai összetétel ábrázolható. Egyéb hatótényezőiről a metastabil állapot fokozatos megszűnésével kapcsolatban már említést tettünk. Itt érdemes megfigyelni azt, hogy az illit felé haladó átalakulás közben az ásvány káliumot vesz fel, de ugyanakkor kovasavat ad le. Ez a kovasav bár nem túl jelentős mértékben - hozzájárulhat az agyagokkal váltakozó homokkő kvarccementációjához (FÜCHTBAUER 1988, p. 165). Szintén a kovasav hiánya vagy jelenléte szabhatja meg mállási folyamatok irányát. Így a mállás során az említett diagenetikus reakció fordítottja, tehát a muszkovit szmektitesedése csak nagyon nehezen mehet végbe, mert nem áll rendelkezésre a szükséges felvehető kovasav. Lehet, hogy ezért jönnek létre mérsékeltövi talajokban csak kilúgzott, nagy rétegtöltésű illit/szmektit, vagy illit/vermikulit kevert szerkezetek, és nem tiszta szmektitek (VARJÚ - STEFANOVITS 1979). Ugyanígy a trópusi mállás során, vagy a kőszénláp humuszsavas környezetében a montmorillonitnak montmorillonit/kaolinit kevert szerkezeteken keresztül megvalósuló átmenete kaolinitbe, kovasav felszabadulása mellett gyakori lehet, de a fordított folyamat nehezen valósul meg (pl. a Sajó-medencében: VICZIÁN et al. 1997). Na 2 O + Al 2 O 3 + SiO 2 + H 2 O rendszer Az ezt a rendszert ábrázoló stabilitási diagram (6. ábra) nagyon hasonló az előző, káliumot tartalmazó rendszerhez, csak itt a kálium-ásványok nátriumos megfelelői, pl. az albit és a paragonit jelennek meg. Itt is készült egy első változat keskeny kaolinit-mezővel (LIPPMANN 1981), és egy újabb, amelyet azonban ő nem publikált. Ez nyomtatásban az ő engedélyével VICZIÁN (1992) dolgozatában jelent meg. A tengervíz összetétele a nagy Na-koncentráció miatt itt sokkal lejjebbre kerül, mint a káliumos diagramon, a diaszpor stabil mezejébe, illetve a kaolinit metastabil előfordulásának mezejébe. Ez nehezen értelmezhető, mindenesetre még nem a tektoszilikátok képződési területére, hanem az agyagásványok közelébe esik. Igen fontos viszont, hogy a Na-csillámnak, a paragonitnak a muszkovittal ellentétben alig jut egy kis stabilitási mező, sőt ha az adatok hibáját is figyelembe vesszük, még ennek megléte is kétséges. Ez megfelel annak a természetben megfigyelt ténynek, hogy míg a K-csillám, a muszkovit és illit a leggyakoribb ásványok közé tartozik, Na-csillámot vagy Na-illitet az üledékekben nagyon ritkán lehet találni (Egy ritka kivétel: kaolin-telepben a Losoncimedencében, KRAUS 1989, p. 93). A stabil Na-tartalmú agyagásvány hiányának is következménye a tengervíz nagy Na-tartalma. A nátrium a káliummal ellentétben nem épül be kristályrácsba, hanem oldatban marad a tengervízben. 46
9 Viczián I.: A Lippmann-féle stabilitási diagramok jelentősége az agyagásványok képződési viszonyainak értelmezésében 7. ábra. Ásványok stabilitási viszonyai a K 2 O + Na 2 O + Al 2 O 3 + SiO 2 + H 2 O rendszerben 25 C-on. Al 2 O 3 : immobilis komponens. Változók: log[na + ]/[H + ], ill. log[na + ].[OH - ] és log[k + ]/[H + ], ill. log[k + ].[OH - ]. A rögzített log[h 4 SiO 4 ] = -3,3. (LIPPMANN, lásd VICZIÁN 1992). Egyéb megjegyzések: lásd 5. ábra. Az albit kaolinosodása itt is, a káliföldpáthoz hasonlóan a szmektit fázis kihagyásával, metastabil egyensúly révén valósulhat meg. 6. ábra. Ásványok stabilitási viszonyai a Na 2 O + Al 2 O 3 + SiO 2 + H 2 O rendszerben 25 C-on. Al 2 O 3 : immobilis komponens. Változók: log[na + ]/[H + ], ill. log[na + ].[OH - ] és log[h 4 SiO 4 ] (LIPPMANN, lásd VICZIÁN 1992). Egyéb megjegyzések: lásd 5. ábra. A csillámnak megfelelő mezőt nagy Na-tartalmak és lúgos kémhatás esetén az analcim és nefelin foglalják el. Egy példa kémiai üledékként keletkezett analcimra a Green River Formáció Utah államban (REMY - FERRELL 1989). Az analcim stabilabb, mint a klinoptilolit és mordenit típusú zeolitok, és hidrotermális mezőkön ezek előfordulása alatt, a nagyobb hőmérsékletű zóna jellegzetes ásványa. Magyarországon így keletkezhetett a mecseki alsó-kréta tenger alatti bazalt-breccsájának pórusterében (VICZIÁN 1966). A Somlyó és Szamárhegy fonolitjában szintén hidrotermás elváltozásként az analcim a nefelin + albit együttest helyettesíti (VICZIÁN 1971). Az albit nagy Na-koncentráció és elegendő, főleg biogén kovasav megléte esetén szintén autigén kiválásokat alkot mészkőben, a káliföldpáthoz hasonlóan, és szintén autigén kvarc kristályosodásával társulhat. Ha az albit és a mikroklin stabilitási mezejét a log[k + ]/[H + ] versus log[na + ]/[H + ] diagramban ábrázoljuk rögzített log[h 4 SiO 4 ] érték mellett, a tengervíz K és Na tartalmának megfelelő pont majdnem pontosan a két földpát közötti fázishatárra esik. Ezt mutatja LIPPMANN egy másik nem publikált és később VICZIÁN (1992) cikkében megjelentetett diagramja (7. ábra). Eszerint, ha a tengervízben található K/Na arány közel állandó marad, csak a kovasav aktivitása nő, elérhetünk mindkét földpát kiválásához. A K/Na arány kismértékű megváltoztatásával egyaránt kristályosodhat nátriumföldpát és káli-földpát is. Ez az oka, hogy mészkövek autigén földpátjai között gyakran található együtt, vagy egymással váltakozva mind az albit, mind a káliföldpát, és mivel ez a kvarc telítési határa fölé esik, az autigén kvarc is. MgO + Al 2 O 3 + SiO 2 + H 2 O rendszer Kis Mg-koncentrációk mellett ez a rendszer is hasonlóan viselkedik, mint az eddig tárgyaltak a megfelelő kation kis koncentrációja mellett. A kovasav-tengely mentén ugyanazok a fázisok sorakoznak A nagy Mg-koncentráció és alkalinitás értékek mellett viszont csak egyetlen stabil fázis van, a tiszta Mg-klorit, a klinoklor. A többi klorit rendszerint Fe-Al-Mg tartalmú, és metastabilnak tekintendő, mert szilárd oldatokat alkot. Ezeknek az előfordulási területe valahol a klinoklor mezején belül van. K 2 O + MgO + Al 2 O 3 + SiO 2 + H 2 O rendszer A 8. ábrán már az összetettebb K 2 O + MgO + Al 2 O 3 + SiO 2 + H 2 O rendszert ábrázoljuk, a kovasav aktivitásának egy olyan rögzített értéke mellett, ahol már minden fázis mellett másodiknak megjelenhet a kvarc is. Itt a változók a két tengelyen: log[mg 2+ ]/[H + ] 2, ill. log[mg 2+ ].[OH - ] 2 és log[k + ]/[H + ], ill. log[k + ].[OH - ]. A rögzített log[h 4 SiO 4 ] megfelel a kvarccal való telítettség értékének, kb. -3,95). A 8. ábrán is látható, hogy a tengervíz összetétele bőven benn van a klinoklor mezejében (amikor csak a K + aktivitását néztük, a muszkovit mezejébe esett, lásd 5. ábra). Ez azt jelenti, hogy a klinoklor stabil a tengervízben, sőt annál jóval kisebb Mg-koncentrációjú vízben is. Általában a klorit korlátlan ideig fennmaradhat a tengervízben. A tengeri üledékek valóban tartalmaznak is kloritot, de legtöbbször behordott, metamorf eredetű, és nem helyben kristályosodott ásványt. Ennek összetételében általában több a Fe, mint a Mg. Ritka körülmények között Mg-dús kloritok kristályosodnak tengeri környezetben is, erre egy példa a mecseki középső triász alsó részén levő evaporitos és lagunás üledékekben van, de hasonló Mg-dús kiválások a Germán típusú triászban máshol is gyakoriak (VICZIÁN 1993, JEANS 1978). 47
10 ACTA GGM DEBRECINA Geology, Geomorphology, Physical Geography Vol.: 1. A flogopit képződését is az ötkomponensű K 2 O + MgO + Al 2 O 3 + SiO 2 + H 2 O rendszerben lehet vizsgálni. A flogopit képződési tartománya olyan nagy K és Mg koncentrációkra tolódik ki, amelyek üledékes környezetben a hiperszalin tavakban sem szoktak kialakulni. Ez az oka, hogy üledékes körülmények között nem keletkeznek trioktaéderes, Mg-tartalmú csillámok, és a biotit, amelynek a flogopit egyik komponense, ezért bomlik el olyan könynyen felszíni körülmények között. Meg kell azonban jegyezni, hogy a biotit bomlásának a fő tényezője nem a Mgos komponensében van, hanem elsősorban a vas-tartalom oxidációja bontja meg a rács elektrosztatikai egyensúlyát. Következtetések 8. ábra. Ásványok stabilitási viszonyai a K 2 O + Mg 2 O + Al 2 O 3 + SiO 2 + H 2 O rendszerben 25 C-on. Al 2 O 3 : immobilis komponens. Változók: log[mg 2+ ]/[H + ] 2, ill. log[mg 2+ ].[OH - ] 2 és log[k + ]/[H + ], ill. log[k + ].[OH - ]. A kvarccal való telítettségnek megfelelően a rögzített log[h 4 SiO 4 ] -3,95 (LIPPMANN 1981). Egyéb megjegyzések: lásd 5. ábra. A klinoklor mezejében lehet elhelyezni a corrensitet, amely a Germán triász jellemző ásványa, és szintén megvan a Mecsekben is (VICZIÁN 1993). Keletkezésében nincs szükség különösebb Mg-dúsulásra, hiszen a tengervíznél hígabb oldatban is fennmarad. LIPPMANN és PANKAU (1988), valamint LIPPMANN (1987) inkább azt hangsúlyozzák, hogy a corrensit keletkezésében a [Mg 2+ ].[OH - ] 2 szorzaton belül az bázicitás, azaz az [OH - ] megfelelően nagy értéke játszik szerepet. A klorit tengervízben való képződésének viszonylag ritka voltát LIPPMANN két okkal magyarázza. Az egyik ok a Mg 2+ ion erős hidratációja, ami kinetikai akadályt képez a különben termodinamikailag stabilis vegyületek kiválása előtt. Ezért nem képződik dolomit és magnezit sem a tengervízben, pedig mind a kettő stabilis volna. A másik ok a karbonátok konkurenciája: a Mg a tengeri üledékben elsősorban a kalcit dolomitosodására használódik fel, és csak ha nincs elég karbonát, vagy túl sok a Mg, akkor keletkezik Mg-klorit is. Ezeket a kalcit/dolomit és dolomit/magnezit egyensúlyi átmeneteket fejezik ki a diagramban a megfelelő vízszintes vonalak, részben bent a klinoklor stabilitási mezejében. Néhány más, metastabil agyagásvány körülbelüli képződési tartománya is elhelyezhető a diagramban. A szaponit Mg-szmektit, a sudoit vegyes Al-Mg-klorit, a tosudit kloritkomponense is az, így érthető, hogy ez a három ásvány a klinoklor és a pirofillit stabilitási mezejének a határterületén helyezkednek el. A talk és a szepiolit azért számítanak ebben a rendszerben metastabilnak, mert nincs bennük Al. A diagramon nem ábrázolt paligorszkit valószínűleg még metastabilabb, mint a szepiolit, mindkettő nagy Mgkoncentrációt elért bepárlódó tavak jellemző agyagásványa (pl. IRKEÇ 1988, COLSON et al. 1998). 1. Kémiai egyensúlyban lévő, vagy azt jól megközelítő ásványtársulások keletkezési körülményeit jól meg lehet határozni, mert ekkor adott kémiai összetétel mellett az egyensúly külső tényezői egyértelműen meghatározzák, hogy mely fázisok alakulhatnak ki. A külső tényezők a hőmérséklet, a nyomás, valamint a kőzetet átjáró oldatokban levő ionok kémiai potenciálja, azaz aktivitása, ami a koncentrációval arányos. 2. A kőzettanban először a regionális metamorf kőzetek ásvány-együtteseire alkalmazták az egyensúlyi modelleket, ahol a külső tényezők a hőmérséklet és a nyomás voltak (ESKOLA 1921). Az oldatok összetételét először a metaszomatikus képződmények elemzésénél vették tekintetben (KORZSINSZKIJ 1936). A 20. század hatvanas éveitől kezdve kezdték az egyensúlyi modelleket hidrotermális és üledékes képződményekre is alkalmazni. 3. Az üledékes kőzetek, ezen belül az agyagásványok keletkezésére vonatkozó stabilitási diagramok kidolgozásában számos kutató vett részt. LIPPMANN az as években az elméleti tárgyalás szigorúságával és a földtani példák sokoldalúságával tűnt ki. Agyagásványokra, és más, üledékes tartományban gyakori szilikát- és hidroxid fázisokra vonatkozólag kimutatta, hogy az egyensúlyi diagramok alkalmazásának három tényező szab korlátokat: - nagy számban vannak metastabil fázisok, - ennek következtében az ásványtani fázisszabály nem érvényesül, - az agyagásványok között gyakoriak a nem ideális öszszetételű szilárd oldatok, valamint a kevert rétegű szerkezetek, amelyek nem tekinthetők egyensúlyi fázisoknak. 4. E korlátozó szempontok figyelembe vételével mégis számos közelítő összetételű kémiai rendszerre szerkeszthetők olyan diagramok, amelyek a mobilis komponensek aktivitásának függvényében bemutatják az egyes fázisok pontos stabilitási mezejét, vagy körülbelüli kristályosodási tartományát. Ezek segítségével számos fontos üledékes és diagenetikus jelenség értelmezhető. 5. A metastabil állapot jelentősége a földtani múlt feltárása szempontjából abban van, hogy információt hordoz régebbi fizikai-kémiai körülményekről is. 48
NEM KONSZOLIDÁLT ÜLEDÉKEK
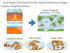
 NEM KONSZOLIDÁLT ÜLEDÉKEK Fekete-tenger Vörös-tenger Nem konszolidált üledékek Az elsődleges kőzetek a felszínen mállásnak indulnak. Nem konszolidált üledékek: a mállási folyamatok és a kőzettéválás közötti
NEM KONSZOLIDÁLT ÜLEDÉKEK Fekete-tenger Vörös-tenger Nem konszolidált üledékek Az elsődleges kőzetek a felszínen mállásnak indulnak. Nem konszolidált üledékek: a mállási folyamatok és a kőzettéválás közötti
a.) filloszilikátok b.) inoszilikátok c.) nezoszilikátok a.) tektoszilikátok b.) filloszilikátok c.) inoszilikátok
 1. Melyik összetett anion a szilikátok jellemzője? a.) SO 4 b.) SiO 4 c.) PO 4 2. Milyen ásványok a csillámok? a.) filloszilikátok b.) inoszilikátok c.) nezoszilikátok 3. Milyen ásványok az amfibolok?
1. Melyik összetett anion a szilikátok jellemzője? a.) SO 4 b.) SiO 4 c.) PO 4 2. Milyen ásványok a csillámok? a.) filloszilikátok b.) inoszilikátok c.) nezoszilikátok 3. Milyen ásványok az amfibolok?
Fluidum-kőzet kölcsönhatás: megváltozik a kőzet és a fluidum összetétele és új egyensúlyi ásványparagenezis jön létre Székyné Fux V k álimetaszo
 Hidrotermális képződmények genetikai célú vizsgálata Bevezetés a fluidum-kőzet kölcsönhatás, és a hidrotermális ásványképződési környezet termodinamikai modellezésébe Dr Molnár Ferenc ELTE TTK Ásványtani
Hidrotermális képződmények genetikai célú vizsgálata Bevezetés a fluidum-kőzet kölcsönhatás, és a hidrotermális ásványképződési környezet termodinamikai modellezésébe Dr Molnár Ferenc ELTE TTK Ásványtani
Metamorf kőzettan. Magmás (olvadék, kristályosodás, T, p) szerpentinit. zeolit Üledékes (törmelék oldatok kicsapódása; szerves eredetű, T, p)
 Metamorf kőzettan Metamorfózis (átalakulás, átkristályosodás): ha a kőzetek keletkezési körülményeiktől eltérő nyomású és/vagy hőmérsékletű környezetbe kerülve szilárd fázisban átkristályosodnak és/vagy
Metamorf kőzettan Metamorfózis (átalakulás, átkristályosodás): ha a kőzetek keletkezési körülményeiktől eltérő nyomású és/vagy hőmérsékletű környezetbe kerülve szilárd fázisban átkristályosodnak és/vagy
Polimorfia Egy bizonyos szilárd anyag a külső körülmények függvényében különböző belső szerkezettel rendelkezhet. A grafit kristályrácsa A gyémánt kri
 Ásványtani alapismeretek 3. előadás Polimorfia Egy bizonyos szilárd anyag a külső körülmények függvényében különböző belső szerkezettel rendelkezhet. A grafit kristályrácsa A gyémánt kristályrácsa Polimorf
Ásványtani alapismeretek 3. előadás Polimorfia Egy bizonyos szilárd anyag a külső körülmények függvényében különböző belső szerkezettel rendelkezhet. A grafit kristályrácsa A gyémánt kristályrácsa Polimorf
9. előadás Fillo (réteg-) szilikátok és tekto- (térhálós) szilikátok
 9. előadás Fillo (réteg-) szilikátok és tekto- (térhálós) szilikátok Fillo- vagy rétegszilikátok Az SiO 4 -tetraéderek három irányban történő összekapcsolódásával végtelen réteg jön létre, melynek gyöke
9. előadás Fillo (réteg-) szilikátok és tekto- (térhálós) szilikátok Fillo- vagy rétegszilikátok Az SiO 4 -tetraéderek három irányban történő összekapcsolódásával végtelen réteg jön létre, melynek gyöke
Az ásványok rendszerezése Az ásványok osztályokba sorolásának alapelvei: - Összetétel - Kristályszerkezet - Előfordulás Összesen 9 osztályba soroljuk
 Ásványtani alapismeretek 4. előadás Az ásványok rendszerezése Az ásványok osztályokba sorolásának alapelvei: - Összetétel - Kristályszerkezet - Előfordulás Összesen 9 osztályba soroljuk az ásványokat,
Ásványtani alapismeretek 4. előadás Az ásványok rendszerezése Az ásványok osztályokba sorolásának alapelvei: - Összetétel - Kristályszerkezet - Előfordulás Összesen 9 osztályba soroljuk az ásványokat,
2. Talajképző ásványok és kőzetek. Dr. Varga Csaba
 2. Talajképző ásványok és kőzetek Dr. Varga Csaba Talajképző ásványok A földkéreg egynemű szilárd alkotórészei, melyeknek többsége szabályos, kristályos felépítésű. A bennük az építőelemek szabályosan
2. Talajképző ásványok és kőzetek Dr. Varga Csaba Talajképző ásványok A földkéreg egynemű szilárd alkotórészei, melyeknek többsége szabályos, kristályos felépítésű. A bennük az építőelemek szabályosan
1. Terméselemek 2. Szulfidook 3. Oxidok, hidroxidok 4. Szilikátok 5. Foszfátok 6. Szulfátok 7. Karbonátok 8. Halogenidek 9.
 1. Terméselemek 2. Szulfidook 3. Oxidok, hidroxidok 4. Szilikátok 5. Foszfátok 6. Szulfátok 7. Karbonátok 8. Halogenidek 9. Szerves ásványok 1. Terméselemek 26 fajta - fémes: Au(szab) arany tisztán található
1. Terméselemek 2. Szulfidook 3. Oxidok, hidroxidok 4. Szilikátok 5. Foszfátok 6. Szulfátok 7. Karbonátok 8. Halogenidek 9. Szerves ásványok 1. Terméselemek 26 fajta - fémes: Au(szab) arany tisztán található
ezetés a kőzettanba Földtudományi BSc szak Dr. Harangi Szabolcs tanszékvezető egyetemi tanár ELTE FFI Kőzettan-Geokémiai geology.elte.
 Bevezetés ezetés a kőzettanba 6. Üledékes kőzetek Földtudományi BSc szak Dr. Harangi Szabolcs tanszékvezető egyetemi tanár ELTE FFI Kőzettan-Geokémiai Tanszék 0-502 szoba, e-mail: szabolcs.harangi@geology.elte.hu
Bevezetés ezetés a kőzettanba 6. Üledékes kőzetek Földtudományi BSc szak Dr. Harangi Szabolcs tanszékvezető egyetemi tanár ELTE FFI Kőzettan-Geokémiai Tanszék 0-502 szoba, e-mail: szabolcs.harangi@geology.elte.hu
Törmelékkızetek. Törmelékes kızet. Legalább 50%-ban törmelékes alkotórészek. Szemcseméret alapján. kızettöredékek ásványtöredékek detritális mátrix
 Törmelékkızetek Törmelékes kızet Legalább 50%-ban törmelékes alkotórészek kızettöredékek ásványtöredékek detritális mátrix Szemcseméret alapján agyag kızetliszt homok durvatörmelék 1 Szemcseméreti skála
Törmelékkızetek Törmelékes kızet Legalább 50%-ban törmelékes alkotórészek kızettöredékek ásványtöredékek detritális mátrix Szemcseméret alapján agyag kızetliszt homok durvatörmelék 1 Szemcseméreti skála
Törmelékes kızet. Legalább 50%-ban törmelékes alkotórészek. Szemcseméret alapján. kızettöredékek ásványtöredékek detritális mátrix
 Törmelékkızetek Törmelékes kızet Legalább 50%-ban törmelékes alkotórészek kızettöredékek ásványtöredékek detritális mátrix Szemcseméret alapján agyag kızetliszt homok durvatörmelék Szemcseméreti skála
Törmelékkızetek Törmelékes kızet Legalább 50%-ban törmelékes alkotórészek kızettöredékek ásványtöredékek detritális mátrix Szemcseméret alapján agyag kızetliszt homok durvatörmelék Szemcseméreti skála
KŐZETEK ELŐKÉSZÍTÉSE A LEPUSZTULÁSRA. Aprózódás-mállás
 KŐZETEK ELŐKÉSZÍTÉSE A LEPUSZTULÁSRA Aprózódás-mállás Az ásványok és kőzet jelentős része olyan környezetben képződött, ahol a hőmérsékleti, nedvességei, nyomási és biológiai viszonyok jelentősen különböznek
KŐZETEK ELŐKÉSZÍTÉSE A LEPUSZTULÁSRA Aprózódás-mállás Az ásványok és kőzet jelentős része olyan környezetben képződött, ahol a hőmérsékleti, nedvességei, nyomási és biológiai viszonyok jelentősen különböznek
P és/vagy T változás (emelkedés vagy csökkenés) mellett a:
 Metamorf kőzettan Metamorfózis (átalakulás, átkristályosodás): ha a kőzetek keletkezési körülményeiktől eltérő nyomású és/vagy hőmérsékletű környezetbe kerülve szilárd fázisban átkristályosodnak. P és/vagy
Metamorf kőzettan Metamorfózis (átalakulás, átkristályosodás): ha a kőzetek keletkezési körülményeiktől eltérő nyomású és/vagy hőmérsékletű környezetbe kerülve szilárd fázisban átkristályosodnak. P és/vagy
Tesztkérdések az Ásványtani és kızettani alapismeretek tárgyhoz
 Tesztkérdések az Ásványtani és kızettani alapismeretek tárgyhoz 1. Mi a drágakı? a. ásványváltozat b. biogén eredető anyag lehet 2. Mit nevezünk ércnek? a. ásvány, amibıl fémet nyerhetünk ki b. kızet,
Tesztkérdések az Ásványtani és kızettani alapismeretek tárgyhoz 1. Mi a drágakı? a. ásványváltozat b. biogén eredető anyag lehet 2. Mit nevezünk ércnek? a. ásvány, amibıl fémet nyerhetünk ki b. kızet,
Al-Mg-Si háromalkotós egyensúlyi fázisdiagram közelítő számítása
 l--si háromalkotós egyensúlyi fázisdiagram közelítő számítása evezetés Farkas János 1, Dr. Roósz ndrás 1 doktorandusz, tanszékvezető egyetemi tanár Miskolci Egyetem nyag- és Kohómérnöki Kar Fémtani Tanszék
l--si háromalkotós egyensúlyi fázisdiagram közelítő számítása evezetés Farkas János 1, Dr. Roósz ndrás 1 doktorandusz, tanszékvezető egyetemi tanár Miskolci Egyetem nyag- és Kohómérnöki Kar Fémtani Tanszék
1. A VÍZ SZÉNSAV-TARTALMA. A víz szénsav-tartalma és annak eltávolítása
 1. A VÍZ SZÉNSAV-TARTALMA A víz szénsav-tartalma és annak eltávolítása A természetes vizek mindig tartalmaznak oldott széndioxidot, CO 2 -t. A CO 2 a vizekbe elsősor-ban a levegő CO 2 -tartalmának beoldódásával
1. A VÍZ SZÉNSAV-TARTALMA A víz szénsav-tartalma és annak eltávolítása A természetes vizek mindig tartalmaznak oldott széndioxidot, CO 2 -t. A CO 2 a vizekbe elsősor-ban a levegő CO 2 -tartalmának beoldódásával
6. előadás AZ ÁSVÁNYOK RENDSZEREZÉSE OXIDOK, HIDROXIDOK, KARBONÁTOK
 6. előadás AZ ÁSVÁNYOK RENDSZEREZÉSE OXIDOK, HIDROXIDOK, KARBONÁTOK Oxidok Fémeknek oxigénnel alkotott vegyületei. Szerkezetükben főleg ionos kötés érvényesül. Az összetett oxidokban két vagy több kation
6. előadás AZ ÁSVÁNYOK RENDSZEREZÉSE OXIDOK, HIDROXIDOK, KARBONÁTOK Oxidok Fémeknek oxigénnel alkotott vegyületei. Szerkezetükben főleg ionos kötés érvényesül. Az összetett oxidokban két vagy több kation
A metastabilis Fe-Fe 3 C ikerdiagram (Heyn - Charpy - diagram)
 A metastabilis Fe-Fe 3 C ikerdiagram (Heyn - Charpy - diagram) A vas-karbon egyensúlyi diagram alapvető fontosságú a vasötvözetek tárgyalásánál. Az Fe-C ötvözetekre vonatkozó ismereteket általában kettős
A metastabilis Fe-Fe 3 C ikerdiagram (Heyn - Charpy - diagram) A vas-karbon egyensúlyi diagram alapvető fontosságú a vasötvözetek tárgyalásánál. Az Fe-C ötvözetekre vonatkozó ismereteket általában kettős
A Föld kéreg: elemek, ásványok és kőzetek
 A Föld kéreg: elemek, ásványok és kőzetek A Föld szerkezete: réteges felépítés... Litoszféra: kéreg + felső köpeny legfelső része Kéreg: elemi, ásványos és kőzettani összetétel A Föld különböző elemekből
A Föld kéreg: elemek, ásványok és kőzetek A Föld szerkezete: réteges felépítés... Litoszféra: kéreg + felső köpeny legfelső része Kéreg: elemi, ásványos és kőzettani összetétel A Föld különböző elemekből
Litoszféra fő-, mikro- és nyomelemgeokémiája
 Litoszféra fő-, mikro- és nyomelemgeokémiája Elemek >1.0 tömeg%-ban főelemek (főleg litofil, refrakter és illó) 0.1-1.0 tömeg%-ban mikroelemek < 0.1 tömeg% nyomelemek A kontinentális kéreg főelemei, (Winter,
Litoszféra fő-, mikro- és nyomelemgeokémiája Elemek >1.0 tömeg%-ban főelemek (főleg litofil, refrakter és illó) 0.1-1.0 tömeg%-ban mikroelemek < 0.1 tömeg% nyomelemek A kontinentális kéreg főelemei, (Winter,
 Ásványtani alapismeretek 6. előadás Kőzetalkotó ásványok Az ásványok olvadékból történő kristályosodásának sorrendje Bowen szerint Kőzetalkotó ásványok: SiO 2 ásványok Kvarc: hexagonális és trigonális
Ásványtani alapismeretek 6. előadás Kőzetalkotó ásványok Az ásványok olvadékból történő kristályosodásának sorrendje Bowen szerint Kőzetalkotó ásványok: SiO 2 ásványok Kvarc: hexagonális és trigonális
Vas- karbon ötvözetrendszer
 Vas- karbon ötvözetrendszer Vas- Karbon diagram Eltérések az eddig tárgyalt diagramokhoz képest a diagramot csak 6,67 C %-ig ábrázolják, bizonyos vonalak folyamatos, és szaggatott vonallal is fel vannak
Vas- karbon ötvözetrendszer Vas- Karbon diagram Eltérések az eddig tárgyalt diagramokhoz képest a diagramot csak 6,67 C %-ig ábrázolják, bizonyos vonalak folyamatos, és szaggatott vonallal is fel vannak
10. A földtani térkép (Budai Tamás, Konrád Gyula)
 10. A földtani térkép (Budai Tamás, Konrád Gyula) A földtani térképek a tematikus térképek családjába tartoznak. Feladatuk, hogy a méretarányuk által meghatározott felbontásnak megfelelő pontossággal és
10. A földtani térkép (Budai Tamás, Konrád Gyula) A földtani térképek a tematikus térképek családjába tartoznak. Feladatuk, hogy a méretarányuk által meghatározott felbontásnak megfelelő pontossággal és
7. elıadás AZ ÁSVÁNYOK RENDSZEREZÉSE OXIDOK, HIDROXIDOK, KARBONÁTOK
 7. elıadás AZ ÁSVÁNYOK RENDSZEREZÉSE OXIDOK, HIDROXIDOK, KARBONÁTOK Oxidok Fémeknek oxigénnel alkotott vegyületei. Szerkezetükben fıleg ionos kötés érvényesül. A koordinációt tekintve a nagy koordinációs
7. elıadás AZ ÁSVÁNYOK RENDSZEREZÉSE OXIDOK, HIDROXIDOK, KARBONÁTOK Oxidok Fémeknek oxigénnel alkotott vegyületei. Szerkezetükben fıleg ionos kötés érvényesül. A koordinációt tekintve a nagy koordinációs
Ércteleptan IV. 4/20/2012. Intermedier és savanyú intrúziók ásványi nyersanyagai. Babeş-Bolyai Tudományegyetem, Geológia Szak, 3.
 4/0/01 Ércteleptan IV. Dr. MÁRTON ISTVÁN Istvan.Marton@stockwork.ro Intermedier és savanyú intrúziók ásványi nyersanyagai Fanerites szövettel rendelkező intrúziók: Pegmatitok Greizen telepek (pneumatolitok)
4/0/01 Ércteleptan IV. Dr. MÁRTON ISTVÁN Istvan.Marton@stockwork.ro Intermedier és savanyú intrúziók ásványi nyersanyagai Fanerites szövettel rendelkező intrúziók: Pegmatitok Greizen telepek (pneumatolitok)
11. előadás MAGMÁS KŐZETEK
 11. előadás MAGMÁS KŐZETEK MAGMÁS KŐZETEK A FÖLDKÉREGBEN A magmából képződnek az elő- és főkristályosodás során. A megszilárdulás helye szerint: Intruzív (mélységi) kőzetek (5-20 km mélységben) Szubvulkáni
11. előadás MAGMÁS KŐZETEK MAGMÁS KŐZETEK A FÖLDKÉREGBEN A magmából képződnek az elő- és főkristályosodás során. A megszilárdulás helye szerint: Intruzív (mélységi) kőzetek (5-20 km mélységben) Szubvulkáni
10. elıadás Filloszilikátok és tektoszilikátok
 10. elıadás Filloszilikátok és tektoszilikátok Fillo- vagy rétegszilikátok Az SiO 4 -tetraéderek három irányban történı összekapcsolódásával végtelen réteg jön létre, melynek gyöke (Si 2 O 5 ) 2. A töltések
10. elıadás Filloszilikátok és tektoszilikátok Fillo- vagy rétegszilikátok Az SiO 4 -tetraéderek három irányban történı összekapcsolódásával végtelen réteg jön létre, melynek gyöke (Si 2 O 5 ) 2. A töltések
Vályogfalazat nyomószilárdsági vizsgálata
 Vályogfalazat nyomószilárdsági vizsgálata Csicsely Ágnes * Témavezetõ: dr. Józsa Zsuzsanna ** és dr. Sajtos István *** 1. A vályog bemutatása A vályog a természetben elõforduló szervetlen alkotórészek
Vályogfalazat nyomószilárdsági vizsgálata Csicsely Ágnes * Témavezetõ: dr. Józsa Zsuzsanna ** és dr. Sajtos István *** 1. A vályog bemutatása A vályog a természetben elõforduló szervetlen alkotórészek
10. előadás Kőzettani bevezetés
 10. előadás Kőzettani bevezetés Mi a kőzet? Döntően nagy földtani folyamatok során képződik. Elsősorban ásványok keveréke. Kőzetalkotó ásványok építik fel. A kőzetalkotó komponensek azonban nemcsak ásványok,
10. előadás Kőzettani bevezetés Mi a kőzet? Döntően nagy földtani folyamatok során képződik. Elsősorban ásványok keveréke. Kőzetalkotó ásványok építik fel. A kőzetalkotó komponensek azonban nemcsak ásványok,
TÖBBKOMPONENS RENDSZEREK FÁZISEGYENSÚLYAI IV.
 TÖBBKOMPONENS RENDSZEREK FÁZISEGYENSÚLYAI IV. TÖBBFÁZISÚ, TÖBBKOMPONENS RENDSZEREK Kétkomponens szilárd-folyadék egyensúlyok Néhány fogalom: - olvadék - ötvözetek - amorf anyagok Állapotok feltüntetése:
TÖBBKOMPONENS RENDSZEREK FÁZISEGYENSÚLYAI IV. TÖBBFÁZISÚ, TÖBBKOMPONENS RENDSZEREK Kétkomponens szilárd-folyadék egyensúlyok Néhány fogalom: - olvadék - ötvözetek - amorf anyagok Állapotok feltüntetése:
Karbonát és szilikát fázisok átalakulása a kerámia kiégetése során (Esettanulmány Cultrone et al alapján)
 Karbonát és szilikát fázisok átalakulása a kerámia kiégetése során (Esettanulmány Cultrone et al. 2001 alapján) Kő-, kerámia- és fémek archeometriája Kürthy Dóra 2015. 12. 11. 1 Kerámia geológus szemmel
Karbonát és szilikát fázisok átalakulása a kerámia kiégetése során (Esettanulmány Cultrone et al. 2001 alapján) Kő-, kerámia- és fémek archeometriája Kürthy Dóra 2015. 12. 11. 1 Kerámia geológus szemmel
EGY SPECIÁLIS, NEM KONSZOLIDÁLT ÜLEDÉK: A TALAJ
 EGY SPECIÁLIS, NEM KONSZOLIDÁLT ÜLEDÉK: A TALAJ A TALAJ FELÉPÍTÉSE A talaj olyan, nem konszolidált üledék a Föld felszínén, mely életteret ad az élővilág számára (litoszféra bioszféra határa). Részei:
EGY SPECIÁLIS, NEM KONSZOLIDÁLT ÜLEDÉK: A TALAJ A TALAJ FELÉPÍTÉSE A talaj olyan, nem konszolidált üledék a Föld felszínén, mely életteret ad az élővilág számára (litoszféra bioszféra határa). Részei:
A VÍZ OLDOTT SZENNYEZŐANYAG-TARTALMÁNAK ELTÁVOLÍTÁSA IONCSERÉVEL
 A VÍZ OLDOTT SZENNYEZŐANYAG-TARTALMÁNAK ELTÁVOLÍTÁSA IONCSERÉVEL ELTE Szerves Kémiai Tanszék A VÍZ OLDOTT SZENNYEZŐANYAG -TARTALMÁNAK ELTÁVOLÍTÁSA IONCSERÉVEL Bevezetés A természetes vizeket (felszíni
A VÍZ OLDOTT SZENNYEZŐANYAG-TARTALMÁNAK ELTÁVOLÍTÁSA IONCSERÉVEL ELTE Szerves Kémiai Tanszék A VÍZ OLDOTT SZENNYEZŐANYAG -TARTALMÁNAK ELTÁVOLÍTÁSA IONCSERÉVEL Bevezetés A természetes vizeket (felszíni
Karbonát és szilikát fázisok átalakulása a kerámia kiégetés során (Esettanulmány Cultrone et al alapján)
 Karbonát és szilikát fázisok átalakulása a kerámia kiégetés során (Esettanulmány Cultrone et al. 2001 alapján) Kő-, kerámia- és fémek archeometriája Kürthy Dóra 2014. 12. 12. 1 Miért fontos? ősi kerámiák
Karbonát és szilikát fázisok átalakulása a kerámia kiégetés során (Esettanulmány Cultrone et al. 2001 alapján) Kő-, kerámia- és fémek archeometriája Kürthy Dóra 2014. 12. 12. 1 Miért fontos? ősi kerámiák
kvarc..vannak magasabb hőmérsékletű hidrotermális folyamatok is
 Hidrotermális ásványképződés különös tekintettel a vulkáni-hidrotermális rendszerekre Molnár Ferenc Eötvös Loránd Tudományegyetem Ásványtani Tanszék Kalcit Hidroterma -Magmás eredetű víz -Metamorf eredetű
Hidrotermális ásványképződés különös tekintettel a vulkáni-hidrotermális rendszerekre Molnár Ferenc Eötvös Loránd Tudományegyetem Ásványtani Tanszék Kalcit Hidroterma -Magmás eredetű víz -Metamorf eredetű
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI
 SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 30 Műszeres ÁSVÁNYHATÁROZÁS XXX. Műszeres ÁsVÁNYHATÁROZÁs 1. BEVEZETÉs Az ásványok természetes úton, a kémiai elemek kombinálódásával keletkezett (és ma is keletkező),
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 30 Műszeres ÁSVÁNYHATÁROZÁS XXX. Műszeres ÁsVÁNYHATÁROZÁs 1. BEVEZETÉs Az ásványok természetes úton, a kémiai elemek kombinálódásával keletkezett (és ma is keletkező),
Makroszkópos tulajdonságok, jelenségek, közvetlenül mérhető mennyiségek leírásával foglalkozik (például: P, V, T, összetétel).
 Mire kell? A mindennapi gyakorlatban előforduló jelenségek (például fázisátalakulások, olvadás, dermedés, párolgás) értelmezéséhez, kvantitatív leírásához. Szerkezeti anyagok tulajdonságainak változása
Mire kell? A mindennapi gyakorlatban előforduló jelenségek (például fázisátalakulások, olvadás, dermedés, párolgás) értelmezéséhez, kvantitatív leírásához. Szerkezeti anyagok tulajdonságainak változása
1. feladat Összesen: 8 pont. 2. feladat Összesen: 11 pont. 3. feladat Összesen: 7 pont. 4. feladat Összesen: 14 pont
 1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
5 előadás. Anyagismeret
 5 előadás Anyagismeret Ötvözet Legalább látszatra egynemű fémes anyag, amit két vagy több alkotó különböző módszerekkel való egyesítése után állítunk elő. Alapötvöző minden esetben fémes anyag. Ötvöző
5 előadás Anyagismeret Ötvözet Legalább látszatra egynemű fémes anyag, amit két vagy több alkotó különböző módszerekkel való egyesítése után állítunk elő. Alapötvöző minden esetben fémes anyag. Ötvöző
Termodinamikai bevezető
 Termodinamikai bevezető Alapfogalmak Termodinamikai rendszer: Az univerzumnak az a részhalmaza, amit egy termodinamikai vizsgálat során vizsgálunk. Termodinamikai környezet: Az univerzumnak a rendszeren
Termodinamikai bevezető Alapfogalmak Termodinamikai rendszer: Az univerzumnak az a részhalmaza, amit egy termodinamikai vizsgálat során vizsgálunk. Termodinamikai környezet: Az univerzumnak a rendszeren
Zeolitos tufa alapú nanodiszperz rendszer tápelem hordozó mátrixnak
 Zeolitos tufa alapú nanodiszperz rendszer tápelem hordozó mátrixnak Mucsi Gábor, Bohács Katalin, Kristály Ferenc (Miskolci Egyetem), Dallos Zsolt (Eötvös Loránd Tudományegyetem) Bevezető Zeolitos savanyú
Zeolitos tufa alapú nanodiszperz rendszer tápelem hordozó mátrixnak Mucsi Gábor, Bohács Katalin, Kristály Ferenc (Miskolci Egyetem), Dallos Zsolt (Eötvös Loránd Tudományegyetem) Bevezető Zeolitos savanyú
Geokémia
 Geokémia 2016.12.05. A Föld szerkezete, a földkéreg felépítése földkéreg: a Föld legkülső, szilárd halmazállapotú rétege, amely kőzetekből áll. A földkéreg bolygónk sugarával összehasonlítva nagyon vékony,
Geokémia 2016.12.05. A Föld szerkezete, a földkéreg felépítése földkéreg: a Föld legkülső, szilárd halmazállapotú rétege, amely kőzetekből áll. A földkéreg bolygónk sugarával összehasonlítva nagyon vékony,
Litoszféra fő-, mikro- és nyomelemgeokémiája
 Litoszféra fő-, mikro- és nyomelemgeokémiája Elemek csoportosítása (gyakoriságuk szerint) Főelemek (>1 tömeg%), pl. O, Si, Fe, Al, Ca, Mg, Na, K (major) Mikroelemek (kis mennyiségben jelen lévő főelemek)
Litoszféra fő-, mikro- és nyomelemgeokémiája Elemek csoportosítása (gyakoriságuk szerint) Főelemek (>1 tömeg%), pl. O, Si, Fe, Al, Ca, Mg, Na, K (major) Mikroelemek (kis mennyiségben jelen lévő főelemek)
Ásványok. Az ásványok a kőzetek építő elemei.
 Ásványok Az ásványok a kőzetek építő elemei. Az ásványok örzik a kőzetek keletkezési történetét, továbbá meghatározzák a fizikai és kémiai jellemvonásaikat 1 Minden ásványt jellemez egy sajátos - összetétel
Ásványok Az ásványok a kőzetek építő elemei. Az ásványok örzik a kőzetek keletkezési történetét, továbbá meghatározzák a fizikai és kémiai jellemvonásaikat 1 Minden ásványt jellemez egy sajátos - összetétel
ÉRCEK ércnek ércásványok
 ÉRCEK Minden olyan kőzetet ércnek nevezünk, melyből azadottkor technológiai szintjén gazdaságosan fémet nyerhetünk ki. Az érc azon komponensei, melyek az adott fémet (fémeket) tartalmazzák az ércásványok.
ÉRCEK Minden olyan kőzetet ércnek nevezünk, melyből azadottkor technológiai szintjén gazdaságosan fémet nyerhetünk ki. Az érc azon komponensei, melyek az adott fémet (fémeket) tartalmazzák az ércásványok.
Bevezetés a talajtanba VIII. Talajkolloidok
 Bevezetés a talajtanba VIII. Talajkolloidok Kolloid rendszerek (kolloid mérető részecskékbıl felépült anyagok): Olyan két- vagy többfázisú rendszer, amelyben valamely anyag mérete a tér valamely irányában
Bevezetés a talajtanba VIII. Talajkolloidok Kolloid rendszerek (kolloid mérető részecskékbıl felépült anyagok): Olyan két- vagy többfázisú rendszer, amelyben valamely anyag mérete a tér valamely irányában
Környezeti kémia: A termodinamika főtételei, a kémiai egyensúly
 Környezeti kémia: A termodinamika főtételei, a kémiai egyensúly Bányai István DE TTK Kolloid- és Környezetkémiai Tanszék 2013.01.11. Környezeti fizikai kémia 1 A fizikai-kémia és környezeti kémia I. A
Környezeti kémia: A termodinamika főtételei, a kémiai egyensúly Bányai István DE TTK Kolloid- és Környezetkémiai Tanszék 2013.01.11. Környezeti fizikai kémia 1 A fizikai-kémia és környezeti kémia I. A
Az endogén erők felszínformáló hatásai-tektonikus mozgás
 Az endogén erők felszínformáló hatásai-tektonikus mozgás A köpeny anyagának áramlása Lemez mozgások (tektonika) 1-10 cm/év Gravitációs hatás Kambrium (550m) Perm (270m) Eocén (50m) Az endogén erők felszínformáló
Az endogén erők felszínformáló hatásai-tektonikus mozgás A köpeny anyagának áramlása Lemez mozgások (tektonika) 1-10 cm/év Gravitációs hatás Kambrium (550m) Perm (270m) Eocén (50m) Az endogén erők felszínformáló
Kémiai reakciók sebessége
 Kémiai reakciók sebessége reakciósebesség (v) = koncentrációváltozás változáshoz szükséges idő A változás nem egyenletes!!!!!!!!!!!!!!!!!! v= ± dc dt a A + b B cc + dd. Melyik reagens koncentrációváltozását
Kémiai reakciók sebessége reakciósebesség (v) = koncentrációváltozás változáshoz szükséges idő A változás nem egyenletes!!!!!!!!!!!!!!!!!! v= ± dc dt a A + b B cc + dd. Melyik reagens koncentrációváltozását
I. ANALITIKAI ADATOK MEGADÁSA, KONVERZIÓK
 I. ANALITIKAI ADATOK MEGADÁSA, KONVERZIÓK I.2. Konverziók Geokémiai vizsgálatok során gyakran kényszerülünk arra, hogy különböző kémiai koncentrációegységben megadott adatokat hasonlítsunk össze vagy alakítsuk
I. ANALITIKAI ADATOK MEGADÁSA, KONVERZIÓK I.2. Konverziók Geokémiai vizsgálatok során gyakran kényszerülünk arra, hogy különböző kémiai koncentrációegységben megadott adatokat hasonlítsunk össze vagy alakítsuk
ÁSVÁNYOK ÉS MÁS SZILÁRD RÉSZECSKÉK AZ ATMOSZFÉRÁBAN
 ÁSVÁNYOK ÉS MÁS SZILÁRD RÉSZECSKÉK AZ ATMOSZFÉRÁBAN A Föld atmoszférája kolloid rendszerként fogható fel, melyben szilárd és folyékony részecskék vannak gázfázisú komponensben. Az aeroszolok kolloidális
ÁSVÁNYOK ÉS MÁS SZILÁRD RÉSZECSKÉK AZ ATMOSZFÉRÁBAN A Föld atmoszférája kolloid rendszerként fogható fel, melyben szilárd és folyékony részecskék vannak gázfázisú komponensben. Az aeroszolok kolloidális
A vas-oxidok redukciós folyamatainak termodinamikája
 BUDAESTI MŰSZAKI EGYETEM Anyagtudomány és Technológia Tanszék Anyag- és gyártástechnológia (hd) féléves házi feladat A vas-oxidok redukciós folyamatainak termodinamikája Thiele Ádám WTOSJ Budapest, 11
BUDAESTI MŰSZAKI EGYETEM Anyagtudomány és Technológia Tanszék Anyag- és gyártástechnológia (hd) féléves házi feladat A vas-oxidok redukciós folyamatainak termodinamikája Thiele Ádám WTOSJ Budapest, 11
6 Ionszelektív elektródok. elektródokat kiterjedten alkalmazzák a klinikai gyakorlatban: az automata analizátorokban
 6. Szelektivitási együttható meghatározása 6.1. Bevezetés Az ionszelektív elektródok olyan potenciometriás érzékelők, melyek valamely ion aktivitásának többé-kevésbé szelektív meghatározását teszik lehetővé.
6. Szelektivitási együttható meghatározása 6.1. Bevezetés Az ionszelektív elektródok olyan potenciometriás érzékelők, melyek valamely ion aktivitásának többé-kevésbé szelektív meghatározását teszik lehetővé.
Agyagkızetek. Alkotórészek
 Agyagkızetek Alkotórészek Elsıdlegesen agyagásványok + kvarc, földpát, karbonátok Agyagásványok: d < 2 µm szemcseméret, lemezszilikátok magas adszorpciós képesség magas ioncserélı képesség kis permeábilitás
Agyagkızetek Alkotórészek Elsıdlegesen agyagásványok + kvarc, földpát, karbonátok Agyagásványok: d < 2 µm szemcseméret, lemezszilikátok magas adszorpciós képesség magas ioncserélı képesség kis permeábilitás
AZ ÉLETTELEN ÉS AZ ÉLŐ TERMÉSZET
 AZ ÉLŐ ÉS AZ ÉLETTELEN TERMÉSZET MEGISMERÉSE AZ ÉLETTELEN ÉS AZ ÉLŐ TERMÉSZET Az élőlények és az élettelen természet kapcsolata. Az élettelen természet megismerése. A Földdel foglalkozó tudományok. 1.
AZ ÉLŐ ÉS AZ ÉLETTELEN TERMÉSZET MEGISMERÉSE AZ ÉLETTELEN ÉS AZ ÉLŐ TERMÉSZET Az élőlények és az élettelen természet kapcsolata. Az élettelen természet megismerése. A Földdel foglalkozó tudományok. 1.
Kémiai átalakulások. A kémiai reakciók körülményei. A rendszer energiaviszonyai
 Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
Kétalkotós ötvözetek. Vasalapú ötvözetek. Egyensúlyi átalakulások.
 Kétalkotós ötvözetek. Vasalapú ötvözetek. Egyensúlyi átalakulások. dr. Fábián Enikő Réka fabianr@eik.bme.hu BMEGEMTAGM3-HŐKEZELÉS 2016/2017 Kétalkotós ötvözetrendszerekkel kapcsolatos alapfogalmak Az alkotók
Kétalkotós ötvözetek. Vasalapú ötvözetek. Egyensúlyi átalakulások. dr. Fábián Enikő Réka fabianr@eik.bme.hu BMEGEMTAGM3-HŐKEZELÉS 2016/2017 Kétalkotós ötvözetrendszerekkel kapcsolatos alapfogalmak Az alkotók
A TERMODINAMIKA I. AXIÓMÁJA. Egyszerű rendszerek egyensúlya. Első észrevétel: egyszerű rendszerekről beszélünk.
 A TERMODINAMIKA I. AXIÓMÁJA Egyszerű rendszerek egyensúlya Első észrevétel: egyszerű rendszerekről beszélünk. Második észrevétel: egyensúlyban lévő egyszerű rendszerekről beszélünk. Mi is tehát az egyensúly?
A TERMODINAMIKA I. AXIÓMÁJA Egyszerű rendszerek egyensúlya Első észrevétel: egyszerű rendszerekről beszélünk. Második észrevétel: egyensúlyban lévő egyszerű rendszerekről beszélünk. Mi is tehát az egyensúly?
TÖBBKOMPONENS RENDSZEREK FÁZISEGYENSÚLYAI II. Ismerjük fel, hogy többkomponens fázisegyensúlyokban a folyadék fázisnak kitüntetett szerepe van!
 TÖKOMPONENS RENDSZEREK FÁZISEGYENSÚLYI II Ismerjük fel hogy többkomonens fázisegyensúlyokban a folyadék fázisnak kitüntetett szeree van! Eddig: egymásban korátlanul oldódó folyadékok folyadék-gz egyensúlyai
TÖKOMPONENS RENDSZEREK FÁZISEGYENSÚLYI II Ismerjük fel hogy többkomonens fázisegyensúlyokban a folyadék fázisnak kitüntetett szeree van! Eddig: egymásban korátlanul oldódó folyadékok folyadék-gz egyensúlyai
Anyagtudomány. Ötvözetek egyensúlyi diagramjai (állapotábrák)
 Anyagtudomány Ötvözetek egyensúlyi diagramjai (állapotábrák) Kétkomponensű fémtani rendszerek fázisai és szövetelemei Folyékony, olvadék fázis Színfém (A, B) Szilárd oldat (α, β) (szubsztitúciós, interstíciós)
Anyagtudomány Ötvözetek egyensúlyi diagramjai (állapotábrák) Kétkomponensű fémtani rendszerek fázisai és szövetelemei Folyékony, olvadék fázis Színfém (A, B) Szilárd oldat (α, β) (szubsztitúciós, interstíciós)
Megjegyzések (észrevételek) a szabad energia és a szabad entalpia fogalmához
 Dr. Pósa Mihály Megjegyzések (észrevételek) a szabad energia és a szabad entalpia fogalmához 1. Bevezetés Shillady Don professzor az Amerikai Kémiai Szövetség egyik tanácskozásán felhívta a figyelmet a
Dr. Pósa Mihály Megjegyzések (észrevételek) a szabad energia és a szabad entalpia fogalmához 1. Bevezetés Shillady Don professzor az Amerikai Kémiai Szövetség egyik tanácskozásán felhívta a figyelmet a
A TALAJOK PUFFERKÉPESSÉGÉT BEFOLYÁSOLÓ TÉNYEZŐK ÉS JELENTŐSÉGÜK A KERTÉSZETI TERMESZTÉSBEN
 A TALAJOK PUFFERKÉPESSÉGÉT BEFOLYÁSOLÓ TÉNYEZŐK ÉS JELENTŐSÉGÜK A KERTÉSZETI TERMESZTÉSBEN DOKTORI ÉRTEKEZÉS TÉZISEI Csoma Zoltán Budapest 2010 A doktori iskola megnevezése: tudományága: vezetője: Témavezető:
A TALAJOK PUFFERKÉPESSÉGÉT BEFOLYÁSOLÓ TÉNYEZŐK ÉS JELENTŐSÉGÜK A KERTÉSZETI TERMESZTÉSBEN DOKTORI ÉRTEKEZÉS TÉZISEI Csoma Zoltán Budapest 2010 A doktori iskola megnevezése: tudományága: vezetője: Témavezető:
Minta feladatsor. Az ion neve. Az ion képlete O 4. Szulfátion O 3. Alumíniumion S 2 CHH 3 COO. Króm(III)ion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Többértékű savak és bázisok Többértékű savnak/lúgnak azokat az oldatokat nevezzük, amelyek több protont képesek leadni/felvenni.
 ELEKTROLIT EGYENSÚLYOK : ph SZÁMITÁS Általános ismeretek A savak vizes oldatban protont adnak át a vízmolekuláknak és így megnövelik az oldat H + (pontosabban oxónium - H 3 O + ) ion koncentrációját. Erős
ELEKTROLIT EGYENSÚLYOK : ph SZÁMITÁS Általános ismeretek A savak vizes oldatban protont adnak át a vízmolekuláknak és így megnövelik az oldat H + (pontosabban oxónium - H 3 O + ) ion koncentrációját. Erős
ÜLEDÉKES EREDETŰ VASÉRCTELEPEK. Szallagos Vas Formáció (BIF) eredete, típusai, geológiája és gazdasági jelentősége
 ÜLEDÉKES EREDETŰ VASÉRCTELEPEK Szallagos Vas Formáció (BIF) eredete, típusai, geológiája és gazdasági jelentősége Tomas Róbert, Stockwork Exploration Kolozsvár, BBTE III. év ELŐADÁS TARTALMA 1. BEVEZETŐ:
ÜLEDÉKES EREDETŰ VASÉRCTELEPEK Szallagos Vas Formáció (BIF) eredete, típusai, geológiája és gazdasági jelentősége Tomas Róbert, Stockwork Exploration Kolozsvár, BBTE III. év ELŐADÁS TARTALMA 1. BEVEZETŐ:
Az ásványtan tárgya, az ásvány fogalma. Geometriai kristálytan. A kristály fogalma. A Bravais-féle elemi cellák.
 Tantárgy neve Fejezetek az általános földtan témaköreiből I-II. Tantárgy kódja FDB1307; FDB1308 Meghirdetés féléve 1-2 Kreditpont 3-3 Összóraszám (elm.+gyak.) 2+0 Számonkérés módja kollokvium Előfeltétel
Tantárgy neve Fejezetek az általános földtan témaköreiből I-II. Tantárgy kódja FDB1307; FDB1308 Meghirdetés féléve 1-2 Kreditpont 3-3 Összóraszám (elm.+gyak.) 2+0 Számonkérés módja kollokvium Előfeltétel
Készítette: GOMBÁS MÁRTA KÖRNYEZETTAN ALAPSZAKOS HALLGATÓ
 Készítette: GOMBÁS MÁRTA KÖRNYEZETTAN ALAPSZAKOS HALLGATÓ A dolgozat felépítése *Bevezetés *A mélyföldtani viszonyok vázlatos ismertetése *Süllyedés történet *Hő történet *Szervesanyag érés- történet *Diszkusszió
Készítette: GOMBÁS MÁRTA KÖRNYEZETTAN ALAPSZAKOS HALLGATÓ A dolgozat felépítése *Bevezetés *A mélyföldtani viszonyok vázlatos ismertetése *Süllyedés történet *Hő történet *Szervesanyag érés- történet *Diszkusszió
Radioaktív nyomjelzés
 Radioaktív nyomjelzés A radioaktív nyomjelzés alapelve Kémiai indikátorok: ugyanazoknak a követelményeknek kell eleget tenniük, mint az indikátoroknak általában: jelezniük kell valamely elemnek ill. vegyületnek
Radioaktív nyomjelzés A radioaktív nyomjelzés alapelve Kémiai indikátorok: ugyanazoknak a követelményeknek kell eleget tenniük, mint az indikátoroknak általában: jelezniük kell valamely elemnek ill. vegyületnek
MAGYARORSZÁGI VÖRÖSAGYAGOK, VÖRÖS TALAJOK
 Fekete József MAGYARORSZÁGI VÖRÖSAGYAGOK, VÖRÖS TALAJOK Fekete József Szent István Egyetem Mezőgazdaság- és Környezettudományi Kar Környezettudományi Intézet Talajtani és Agrokémiai Tanszék Tájökológiai
Fekete József MAGYARORSZÁGI VÖRÖSAGYAGOK, VÖRÖS TALAJOK Fekete József Szent István Egyetem Mezőgazdaság- és Környezettudományi Kar Környezettudományi Intézet Talajtani és Agrokémiai Tanszék Tájökológiai
 Anyagos rész: Lásd: állapotábrás pdf. Ha többet akarsz tudni a metallográfiai vizsgálatok csodáiról, akkor: http://testorg.eu/editor_up/up/egyeb/2012_01/16/132671554730168934/metallografia.pdf
Anyagos rész: Lásd: állapotábrás pdf. Ha többet akarsz tudni a metallográfiai vizsgálatok csodáiról, akkor: http://testorg.eu/editor_up/up/egyeb/2012_01/16/132671554730168934/metallografia.pdf
Természetes vizek, keverékek mindig tartalmaznak oldott anyagokat! Írd le milyen természetes vizeket ismersz!
 Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Ásványosztályok. Bidló A.: Ásvány- és kzettan
 Ásványosztályok 1. Termésemelek 2. Szulfidok 3. Halogenidek 4. Oxidok és hidroxidok 5. Nitrátok, karbonátok, borátok 6. Szulfátok, kromátok, molibdenátok, wolframátok 7. Foszfátok, arzenátok, vanadátok
Ásványosztályok 1. Termésemelek 2. Szulfidok 3. Halogenidek 4. Oxidok és hidroxidok 5. Nitrátok, karbonátok, borátok 6. Szulfátok, kromátok, molibdenátok, wolframátok 7. Foszfátok, arzenátok, vanadátok
Az egyensúly. Általános Kémia: Az egyensúly Slide 1 of 27
 Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Szent-Györgyi Albert kémiavetélkedő Kód
 9. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
9. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
A Föld folyamatai. Atmoszféra
 Földtan A Föld folyamatai Atmoszféra A karbon-kőzet ciklus E_ki E_be E_föld_ki Exogén energiaforrás - fúziós energia Endogén energiaforrás - maghasadás, tárolt energia ÁSVÁNYOK Az ásványok olyan, a
Földtan A Föld folyamatai Atmoszféra A karbon-kőzet ciklus E_ki E_be E_föld_ki Exogén energiaforrás - fúziós energia Endogén energiaforrás - maghasadás, tárolt energia ÁSVÁNYOK Az ásványok olyan, a
1 Műszaki hőtan Termodinamika. Ellenőrző kérdések-02 1
 1 Műszaki hőtan Termodinamika. Ellenőrző kérdések-02 1 Kérdések. 1. Mit mond ki a termodinamika nulladik főtétele? Azt mondja ki, hogy mindenegyes termodinamikai kölcsönhatáshoz tartozik a TDR-nek egyegy
1 Műszaki hőtan Termodinamika. Ellenőrző kérdések-02 1 Kérdések. 1. Mit mond ki a termodinamika nulladik főtétele? Azt mondja ki, hogy mindenegyes termodinamikai kölcsönhatáshoz tartozik a TDR-nek egyegy
1. feladat Összesen: 18 pont. 2. feladat Összesen: 9 pont
 1. feladat Összesen: 18 pont Különböző anyagok vízzel való kölcsönhatását vizsgáljuk. Töltse ki a táblázatot! második oszlopba írja, hogy oldódik-e vagy nem oldódik vízben az anyag, illetve ha reagál,
1. feladat Összesen: 18 pont Különböző anyagok vízzel való kölcsönhatását vizsgáljuk. Töltse ki a táblázatot! második oszlopba írja, hogy oldódik-e vagy nem oldódik vízben az anyag, illetve ha reagál,
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Légköri termodinamika
 Légköri termodinamika Termodinamika: a hőegyensúllyal, valamint a hőnek, és más energiafajtáknak kölcsönös átalakulásával foglalkozó tudományág. Meteorológiai vonatkozása ( a légkör termodinamikája): a
Légköri termodinamika Termodinamika: a hőegyensúllyal, valamint a hőnek, és más energiafajtáknak kölcsönös átalakulásával foglalkozó tudományág. Meteorológiai vonatkozása ( a légkör termodinamikája): a
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI
 SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 3 AZ ÁSVÁNYTaN ÉS kőzettan TÁRGYa, alapfogalmak III. ALAPFOGALMAK 1. MI AZ ÁsVÁNY? Nem véletlen, hogy a bevezető gondolatokban a kémiai elemekkel, azok elterjedésével
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 3 AZ ÁSVÁNYTaN ÉS kőzettan TÁRGYa, alapfogalmak III. ALAPFOGALMAK 1. MI AZ ÁsVÁNY? Nem véletlen, hogy a bevezető gondolatokban a kémiai elemekkel, azok elterjedésével
7. osztály 2 Hevesy verseny, országos döntő, 2004.
 7. osztály 2 Hevesy verseny, országos döntő, 2004. Kedves Versenyző! Köszöntünk a Hevesy György kémiaverseny országos döntőjének írásbeli fordulóján. A következő tíz feladat megoldására 90 perc áll rendelkezésedre.
7. osztály 2 Hevesy verseny, országos döntő, 2004. Kedves Versenyző! Köszöntünk a Hevesy György kémiaverseny országos döntőjének írásbeli fordulóján. A következő tíz feladat megoldására 90 perc áll rendelkezésedre.
A JÁSZSÁGI MEDENCE TANULMÁNYOZÁSA SZÉN-DIOXID FELSZÍN ALATTI ELHELYEZÉSÉNEK CÉLJÁRA Berta Márton
 A JÁSZSÁGI MEDENCE TANULMÁNYOZÁSA SZÉN-DIOXID FELSZÍN ALATTI ELHELYEZÉSÉNEK CÉLJÁRA Berta Márton Litoszféra Fluidum Kutató Labor, Kőzettani és Geokémiai Tanszék, Eötvös Loránd Tudományegyetem Témavezetők:
A JÁSZSÁGI MEDENCE TANULMÁNYOZÁSA SZÉN-DIOXID FELSZÍN ALATTI ELHELYEZÉSÉNEK CÉLJÁRA Berta Márton Litoszféra Fluidum Kutató Labor, Kőzettani és Geokémiai Tanszék, Eötvös Loránd Tudományegyetem Témavezetők:
1. ábra. Jellegzetes heteropolisav-szerkezetek, a Keggin-, illetve Dawson-anion
 A szerves kémiai reakciók igen nagy hányadában egyes statisztikai adatok szerint kb. 80%-ában valamilyen katalizátorra van szükség a megfelelő konverzió eléréséhez. Eltekintve a katalitikus redukciótól,
A szerves kémiai reakciók igen nagy hányadában egyes statisztikai adatok szerint kb. 80%-ában valamilyen katalizátorra van szükség a megfelelő konverzió eléréséhez. Eltekintve a katalitikus redukciótól,
O k t a t á si Hivatal
 O k t a t á si Hivatal 0/0. tanévi Országos Középiskolai Tanulmányi Verseny Kémia II. kategória. forduló I. FELADATSOR Megoldások. A helyes válasz(ok) betűjele: B, D, E. A legnagyobb elektromotoros erejű
O k t a t á si Hivatal 0/0. tanévi Országos Középiskolai Tanulmányi Verseny Kémia II. kategória. forduló I. FELADATSOR Megoldások. A helyes válasz(ok) betűjele: B, D, E. A legnagyobb elektromotoros erejű
A POLGÁRDI SZÁR-HEGY WOLLASTONITOS SZKARNJA: A SZKARN ÁLTALÁNOS JELLEMZÉSE ÉS A BENNE LÉVŐ APOFILLIT ÁSVÁNYTANI VIZSGÁLATA
 20 A POLGÁRDI SZÁR-HEGY WOLLASTONITOS SZKARNJA: A SZKARN ÁLTALÁNOS JELLEMZÉSE ÉS A BENNE LÉVŐ APOFILLIT ÁSVÁNYTANI VIZSGÁLATA BEVEZETÉS Fehér Béla muzeológus Herman Ottó Múzeum, Ásványtár (Miskolc) A Polgárdi,
20 A POLGÁRDI SZÁR-HEGY WOLLASTONITOS SZKARNJA: A SZKARN ÁLTALÁNOS JELLEMZÉSE ÉS A BENNE LÉVŐ APOFILLIT ÁSVÁNYTANI VIZSGÁLATA BEVEZETÉS Fehér Béla muzeológus Herman Ottó Múzeum, Ásványtár (Miskolc) A Polgárdi,
a. 35-ös tömegszámú izotópjában 18 neutron található. b. A 3. elektronhéján két vegyértékelektront tartalmaz. c. 2 mól atomjának tömege 32 g.
 MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
Általános Kémia GY, 2. tantermi gyakorlat
 Általános Kémia GY, 2. tantermi gyakorlat Sztöchiometriai számítások -titrálás: ld. : a 2. laborgyakorlat leírásánál Gáztörvények A kémhatás fogalma -ld.: a 2. laborgyakorlat leírásánál Honlap: http://harmatv.web.elte.hu
Általános Kémia GY, 2. tantermi gyakorlat Sztöchiometriai számítások -titrálás: ld. : a 2. laborgyakorlat leírásánál Gáztörvények A kémhatás fogalma -ld.: a 2. laborgyakorlat leírásánál Honlap: http://harmatv.web.elte.hu
Curie Kémia Emlékverseny 2018/2019. Országos Döntő 7. évfolyam
 A feladatokat írta: Kódszám: Harkai Jánosné, Szeged... Lektorálta: Kovács Lászlóné, Szolnok 2019. május 11. Curie Kémia Emlékverseny 2018/2019. Országos Döntő 7. évfolyam A feladatok megoldásához csak
A feladatokat írta: Kódszám: Harkai Jánosné, Szeged... Lektorálta: Kovács Lászlóné, Szolnok 2019. május 11. Curie Kémia Emlékverseny 2018/2019. Országos Döntő 7. évfolyam A feladatok megoldásához csak
A feladatok megoldásához csak a kiadott periódusos rendszer és számológép használható!
 1 MŰVELTSÉGI VERSENY KÉMIA TERMÉSZETTUDOMÁNYI KATEGÓRIA Kedves Versenyző! A versenyen szereplő kérdések egy része általad már tanult tananyaghoz kapcsolódik, ugyanakkor a kérdések másik része olyan ismereteket
1 MŰVELTSÉGI VERSENY KÉMIA TERMÉSZETTUDOMÁNYI KATEGÓRIA Kedves Versenyző! A versenyen szereplő kérdések egy része általad már tanult tananyaghoz kapcsolódik, ugyanakkor a kérdések másik része olyan ismereteket
Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása.
 Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása. Adszorpció oldatból szilárd felületre Adszorpció oldatból Nem-elektrolitok
Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása. Adszorpció oldatból szilárd felületre Adszorpció oldatból Nem-elektrolitok
Röntgen-pordiffrakció (XRD) Kő-, kerámia- és fémek archeometriája Kürthy Dóra
 Röntgen-pordiffrakció (XRD) Kő-, kerámia- és fémek archeometriája Kürthy Dóra 2016. 11. 21. 1 Kerámia geológus szemmel T nő egyensúlyi rendszer felborul ásványos összetétel és szövet változik Kis léptékű,
Röntgen-pordiffrakció (XRD) Kő-, kerámia- és fémek archeometriája Kürthy Dóra 2016. 11. 21. 1 Kerámia geológus szemmel T nő egyensúlyi rendszer felborul ásványos összetétel és szövet változik Kis léptékű,
Spontaneitás, entrópia
 Spontaneitás, entrópia 6-1 Spontán folyamat 6-2 Entrópia 6-3 Az entrópia kiszámítása 6-4 Spontán folyamat: a termodinamika második főtétele 6-5 Standard szabadentalpia változás, ΔG 6-6 Szabadentalpia változás
Spontaneitás, entrópia 6-1 Spontán folyamat 6-2 Entrópia 6-3 Az entrópia kiszámítása 6-4 Spontán folyamat: a termodinamika második főtétele 6-5 Standard szabadentalpia változás, ΔG 6-6 Szabadentalpia változás
Egy nyíllövéses feladat
 1 Egy nyíllövéses feladat Az [ 1 ] munkában találtuk az alábbi feladatot 1. ábra. 1. ábra forrása: [ 1 / 1 ] Igencsak tanulságos, ezért részletesen bemutatjuk a megoldását. A feladat Egy sportíjjal nyilat
1 Egy nyíllövéses feladat Az [ 1 ] munkában találtuk az alábbi feladatot 1. ábra. 1. ábra forrása: [ 1 / 1 ] Igencsak tanulságos, ezért részletesen bemutatjuk a megoldását. A feladat Egy sportíjjal nyilat
Sav bázis egyensúlyok vizes oldatban
 Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
ISMÉTLÉS, RENDSZEREZÉS
 ISMÉTLÉS, RENDSZEREZÉS A) változat 1. Egészítsd ki az ábrát a hiányzó anyagcsoportokkal és példákkal! ANYAGOK (összetétel szerint) egyszerű anyagok összetett anyagok......... oldat pl.... pl.... pl. levegő
ISMÉTLÉS, RENDSZEREZÉS A) változat 1. Egészítsd ki az ábrát a hiányzó anyagcsoportokkal és példákkal! ANYAGOK (összetétel szerint) egyszerű anyagok összetett anyagok......... oldat pl.... pl.... pl. levegő
5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével
 5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével 5.1. Átismétlendő anyag 1. Adszorpció (előadás) 2. Langmuir-izoterma (előadás) 3. Spektrofotometria és Lambert Beer-törvény
5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével 5.1. Átismétlendő anyag 1. Adszorpció (előadás) 2. Langmuir-izoterma (előadás) 3. Spektrofotometria és Lambert Beer-törvény
6. Függvények. 1. Az alábbi függvények közül melyik szigorúan monoton növekvő a 0;1 intervallumban?
 6. Függvények I. Nulladik ZH-ban láttuk: 1. Az alábbi függvények közül melyik szigorúan monoton növekvő a 0;1 intervallumban? f x g x cos x h x x ( ) sin x (A) Az f és a h. (B) Mindhárom. (C) Csak az f.
6. Függvények I. Nulladik ZH-ban láttuk: 1. Az alábbi függvények közül melyik szigorúan monoton növekvő a 0;1 intervallumban? f x g x cos x h x x ( ) sin x (A) Az f és a h. (B) Mindhárom. (C) Csak az f.
6. változat. 3. Jelöld meg a nem molekuláris szerkezetű anyagot! A SO 2 ; Б C 6 H 12 O 6 ; В NaBr; Г CO 2.
 6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
