Készült:
|
|
|
- Frigyes Pintér
- 6 évvel ezelőtt
- Látták:
Átírás
1 Tananyag címe: Transzaminázok vizsgálata Szerző: Dr. Mótyán János András egyetemi tanársegéd Biokémiai és Molekuláris Biológiai Intézet Általános Orvostudományi Kar Debreceni Egyetem Készült: A tananyag elkészítését "Az élettudományi- klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére" TÁMOP C-13/1/KONV számú projekt támogatta. A projekt az Európai Unió támogatásával, az Európai Szociális Alap társfinanszírozásával valósult meg. 1
2 ELMÉLETI BEVEZETŐ 1. TRANSZAMINÁZOK A Transzaminázok vizsgálata című gyakorlat tartalmazza a transzamináz reakció megfordíthatóságának vizsgálatát, a szérum glutamát-oxálacetát-transzamináz (GOT) és a glutamát-piruvát-transzamináz (GPT) aktivitásának optikai teszttel történő meghatározását és a szérum és vizelet aminosav-tartalmának vizsgálatát egy anyagcserezavar (fenilketonúria) esetében. Ezért a transzaminálási reakciók és a fenilalanin és a tirozin lebontási folyamatai kerülnek részletesebben megtárgyalásra, valamint a gyakorlatok elméleti hátterének bemutatása. 1.1 Bevezetés Az emberi szervezet fehérjéi 20 különböző aminosavból épülnek fel (1. ábra). A fehérjéket alkotó aminosavak mind L-konfigurációjúak (a glicin kivételével) és mind α- aminosavak (a prolin kivételével, amely iminosav). Minden aminosav tartalmaz karboxilcsoportot és aminocsoportot is az α-szénatomon (α-aminosavak), továbbá különböző oldalláncokat. Az oldalláncok tulajdonságai alapján megkülönböztethetünk apoláros, aromás, poláros és töltéssel nem rendelkező, savas valamint bázikus oldalláncú aminosavakat. 2
3 1. ábra. A fehérjéket alkotó aminosavak. Az aminosavak lebontása során megkülönböztetünk általános reakciótípusokat, melyek fontosak mind a lebontó mind a felépítő folyamatok szempontjából. Ilyen jellemző reakciók a transzaminálás, a dezaminálás (oxidatív és nem oxidatív), a dekarboxilálás (oxidatív és nem oxidatív), a monooxigenálás, a dioxigenálás és az egy szénatomos egységek transzfer-reakciói. Az enzimek besorolása a Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB) nevezéktani bizottság szerint hat osztályba történik az általuk katalizált reakció típusa alapján: 1. oxidoreduktázok 2. transzferázok 3. hidrolázok 4. liázok 5. izomerázok 6. ligázok A transzferázok a 2. enzimosztályba tartoznak (EC 2), valamilyen funkciós csoport átviteli reakcióját katalizálják a donor és az akceptor molekula között. A nitrogén-tartalmú csoport átvitelét katalizáló enzimek (EC 2.6) közül az aminotranszferázok, vagy más néven transzaminázok (EC 2.6.1), aminocsoport átvitelét katalizálják aminosavról ketosavra, mely reakció egy új aminosavat és új ketosavat eredményez. 1.2 A transzaminálási reakciók 3
4 A transzaminálási reakciók feladata az aminosavak nitrogénjének eltávolítása. Míg a dezaminálási reakciókban a nitrogén eltávolításra kerül a szervezet aminosav-készletéből (aminosav pool), addig a transzaminálási reakciók során a nitrogén az aminosav pool-ban marad. A transzaminálási reakciók mennyiségileg az aminosav metabolizmus legjelentősebb reakciói. Minden aminosavra vannak transzamináz enzimek, a lizin és a treonin kivételével. Az aminosavak lebontása általában a transzaminálással kezdődik. A transzamináz enzimek csoportosíthatóak a sejten belüli lokalizáció (citoplazmatikus vagy mitokondriális), az aminocsoport helyzete (α, β, stb.) vagy a szubsztrátpartner szerint is. A transzaminálási reakcióban az aminosav szubsztrát aminocsoportja átadódik a transzamináz enzim piridoxál foszfát kofaktorának, majd a ketosav szubsztrátnak. Termékként a reakcióban ketosav és aminosav keletkezik. A transzamináz által katalizált reakció reverzibilis. A piridoxál foszfát a megfordított reakcióban regenerálódik, melynek során ketosav használódik fel szubsztrátként, aminosav terméket eredményezve (2. ábra). 2. ábra. A transzaminálás általános sémája. PLP = piridoxál foszfát, PMP = piridoxamin foszfát. Minden transzamináz piridoxál foszfátot (PLP) használ kofaktorként (3. ábra). A piridoxál foszfát a B 6 -vitamin származéka. 4
5 3. ábra. A piridoxin és a piridoxál foszfát kofaktor szerkezete A transzaminálás mechanizmusa A piridoxál foszfát kofaktor Schiff-bázist képez az enzim lizil oldalláncával, mely helyettesíthető aminosavval. A piridoxál foszfát kofaktor kovalensen kapcsolódik az enzimhez. Az aminosav szubsztrát bekötődése után a kofaktor az aminosavhoz kötődik, az enzimmel való kovalens kapcsolat megszűnik, de nem kovalens kölcsönhatásokkal továbbra is kapcsolódik az enzimhez. A transzaminálás során az aminosav szubsztrát aminocsoportja támadja az enzimkofaktor Schiff-bázist, melynek során aminosav-plp aldimin keletkezik. Ezt követően kinoidális intermedieren keresztül az aminosav és a piridoxál foszfát közötti kötések átrendeződnek, a Schiff-bázis hidrolízisével pedig piridoxamin foszfát jön létre és ketosav szabadul fel (4. ábra). A 4. ábra az aminotranszferázok által katalizált reakció teljes katalitikus folyamatának első részét mutatja, mely során aminosav szubsztrátból ketosav termék keletkezik (balról jobbra mutató nyilak irányba). A PLP-enzim regenerálása során, a ciklus második felében a termékként felszabaduló első ketosav helyére a második ketosav lép be, mely szubsztrátként használódik fel a reakcióban (jobbról balra mutató nyilak irányba) és az aminocsoportot a piridoxaminfoszfáttól átveszi, így a reakció aminosav terméket eredményez. 4. ábra. A transzaminálás mechanizmusa A transzaminálás jelentősége Redukáló ekvivalensek transzportja a citoszolból a mitokondriumba 5
6 A redukált elektronszállítók a terminális oxidáció során adják le hidrogénjeiket és elektronjaikat. A citrátköri reakciókban és a piruvát dehidrogenáz által katalizált reakció során keletkező redukált ekvivalensek a mitokondriumon belül oxidálódhatnak. A glikolízis során (a glicerinaldehid-3-foszfát-dehidrogenáz által katalizált reakcióban) keletkező NADH számára transzport mechanizmusra van szükség, mert a belső mitokondriális membrán nem permeábilis a NAD + és a NADH+H + számára sem. A citoszolban keletkező NADH-t két fő transzport mechanizmus juttathatja a mitokondriumba. Az egyik a malát-aszpartát inga, a másik a glicerofoszfát inga. Mindkét inga alkalmas a redukáló ekvivalensek transzportjára. A malát-aszpartát inga reverzibilis, magas citoszolikus NADH koncentráció esetén lép működésbe, a glicerol-3-foszfát inga működése irreverzibilis, a koncentráció viszonyok nem befolyásolják a működését. A glicerofoszfát inga esetében a glicerol-3-foszfát-dehidrogenáz a citoszolban a dihidroxiaceton-foszfátot glicerin-3-foszfáttá alakítja, miközben a NADH oxidálódik. A mitokondriumba jutást követően az enzim mitokondriális izoformája FAD kofaktora redukálása mellett alakítja vissza a glicerin-3-foszfátot dihidroxiaceton-foszfáttá. Ezen inga használatával a citoszolban keletkezett NADH tehát FADH 2 útján kerül a légzési láncba. A malát-aszpartát inga is a redukált elektronhordozók transzportját végzi a mitokondrium belső membránján keresztül. Ezen transzportmechanizmus használatával a citoszolban keletkezett NADH az elektrontranszport láncot NADH-ként éri el. Ennek során a malát-dehidrogenáz enzim által katalizált reakcióban a NADH az oxálacetátot redukálja maláttá a membránközti térben. A malát a malát-α-ketoglutarát transzporter segítségével jut a mátrixba, ahol oxálacetáttá alakulása közben a malát-dehidrogenáz NAD kofaktora redukálódik és NADH szabadul fel. Transzaminálási reakcióban (a glutamát α-ketoglutaráttá alakulása mellett) az oxálacetát aszpartáttá alakul az aszpartát-aminotranszferáz (glutamát-oxálacetát transzamináz) által katalizált reakcióban. Az aszpartát a glutamát-aszpartát cseretranszport segítségével jut ki a membránközti térbe. Itt ismételt transzaminálási reakció során α-ketoglutarátból oxálacetát keletkezik, mely újra részt vehet a NADH mitokondriális transzportjában, úgy, hogy a malát dehidrogenáz által katalizált reakcióban redukálódik (5. ábra). 6
7 5. ábra. A malát-aszpartát inga Nitrogén gyűjtése glutamátba A transzaminálás fő szerepe az aminosavak amino nitrogénjének gyűjtése glutamátba. A glutamát dezaminálódhat (lásd 3. pont) és a glutamátba gyűjtött nitrogén felhasználódhat az urea szintéziséhez, mely által a nitrogén eltávolításra kerül az aminosav pool-ból (lásd 5. pont). A legjelentősebb dezaminálási reakció a glutamát dehidrogenáz által katalizált reakció. A dezaminálást követően az aminosavak szénlánca energiatermelésre használódhat fel. A glutamát jelentősége továbbá, hogy a glutamát-α-ketoglutarát a leggyakoribb aminosav-ketosav pár, mely számos transzaminálási reakcióban vesz részt Transz-dezaminálás A transz-dezaminálás esetében a közös intermedier a glutamát, mely a transzaminálást követően oxidatív dezaminálással alakul tovább. A glutamát dehidrogenáz (GDH) által katalizált reakcióban α-ketoglutarát keletkezik és ammónia szabadul fel (6. ábra). Ebben az oxidatív folyamatban NAD kofaktor használódik fel, a reakcióban az ammónia felszabadulása révén az amino nitrogén kikerül az aminosav pool-ból. A glutamát dehidrogenáz által katalizált reakció in vitro reverzibilis, in vivo azonban az ammónia keletkezés irányába zajlik. A megfordított reakcióban glutamát keletkezik és a kofaktor NADPH. 7
8 6. ábra. Transzdezaminálás A glükóz-alanin ciklus A glükóz-alanin ciklus a szervek közötti nitrogén transzportban jelentős szerepet tölt be. Ez a ciklus a máj és az izom között működik. Jelentősége, hogy a glükoneogenezis révén glükózt szolgáltat az izom számára. Az izomszövet igen nagy transzaminációs kapacitással rendelkezik, ugyanis az itt keletkező piruvát (mely a glikolízisben keletkezik) transzaminálással alaninná alakul. A keletkező alanin a vérkeringéssel a májba szállítódik, ahol transzaminálással piruváttá alakul. A piruvát a glükoneogenezis számára szolgáltat szubsztrátot, glükózzá alakulva ismét energiaforrást biztosít úgy, hogy a vérkeringéssel az izomszövetbe szállítódik (7. ábra). A glükóz piruváttá alakulása során ugyan keletkezik NADH, azonban ez nem használódik fel a piruvát laktáttá történő átalakítására normoxiás állapotban, ugyanis ez a reakció elhasználná a piruvátot, mely nem lenne képes transzaminálási reakcióban alaninná alakulni. Relatív hipoxia esetén azonban (például fokozott izommunka esetén) nem történik meg a glükóz teljes eloxidálása vízzé és CO 2 -dá, az anaerob glikolízis következtében így nagyobb mennyiségű laktát keletkezik. 8
9 7. ábra. A glükóz-alanin ciklus Urea szintézis Az urea szintézis számára a dezaminálási reakciók mellett transzaminálási reakciók is biztosíthatják a nitrogént, így a keletkező urea mindkét nitrogénje származhat glutamátból. Az urea szintézishez szükséges aszpartátot transzaminálási reakció szolgáltatja. A glutamát dehidrogenáz (GDH) által katalizált reakcióban keletkező ammónia az urea ciklus előkészítő lépésében használódik fel, a karbamoil foszfát szintetáz I (CPS I) használja fel karbamoil-foszfát szintézisére. Az urea ciklusba belépő aszpartát az oxálacetátnak a glutamáttal való transzaminálása során keletkezik, tehát az urea ciklus és a citrát ciklus egymással szoros kapcsolatban állnak (8. ábra). 8. ábra. Az urea ciklus és a citrát ciklus kapcsolata. 9
10 Az aminosavak átalakulásai Az aminosavak lebontása általában a transzaminálással kezdődik, melyekben a glutamát és az α-ketoglutarát aminosav-ketosav pár vesz részt. A treonin és a lizin kivételével minden aminosavra van transzamináz reakció. Amennyiben szükséges, a nem esszenciális aminosavak szintézise történhet aminotranszferázok által katalizált reakcióban. Ilyenkor az α-ketosavak használódnak fel prekurzorként és aminocsoport transzfere valósul meg. Azok a transzaminálási reakciók, amelyekben esszenciális aminosavak vesznek részt, általában egyirányúak, mert az ekvivalens α- ketosavakat a szervezet nem képes előállítani Klinikai vonatkozások Kevés, a transzaminázokkal kapcsolatos anyagcserezavar ismert, ugyanis a transzaminázok teljes hiánya az élettel nem összeegyeztethető. Például, a valin és az izoleucin lebontásának is első lépése transzaminálási reakció. Ezen enzimek enzimopátiái ismertek, a transzaminázok hiánya hipervalinémiát, hiperleucinizoleucinémiát okoz. A transzaminázoknak fontos diagnosztikai jelentősége van, ugyanis a szérumban kimutatható mennyiségük fontos információt nyújthat az orvos számára. A transzaminázok jellemzően intracelluláris enzimek, így koncentrációjuk a szérumban alacsony. Normál értékük szérumban a glutamát-oxálacetát-transzamináz (GOT) esetében nkat/l (3,8-15,8 U/l), míg a glutamát-piruvát-transzamináz (GPT) esetében nkat/l (0,5-17,3 U/l). Szövetkárosodás (például sejt-nekrózis, membrán permeabilitás-változás, stb.) esetén azonban a sejtekből kiszabaduló enzim koncentrációja megnő. Mivel a GOT legnagyobb mennyiségben a szívizomban, a GPT pedig a májban található, a transzaminázok mérése a májszövet vagy a szívizomszövet károsodása esetén bír diagnosztikai jelentőséggel. A szérum GOT-aktivitás megnövekedése például szívizom-infarktus után 4-6 órával megnő és kb. 24 óra alatt éri el a maximumot (akár 1700 nkat/l is lehet). Ezt követően az érték csökken, a normál értéket kb. egy hét alatt éri el. Ez alatt a GPT-aktivitás nem változik. A szérum GPT-aktivitás elsősorban májkárosodás esetén növekedik meg. Különösen magas értékek mérhetők fertőzéses májgyulladásos betegek szérumában. Szívinfarktus után is megnőhet a GPTaktivitás a szérumban, ha a máj rossz vérellátása miatt a májsejtek károsodnak. 1.3 Aminosavak reackiói: fenilalanin és tirozin A fenilalanin és a tirozin lebontása döntően a májban történik. 10
11 A lebontás fő útvonalának első reakciója során a fenilalanin monooxigenálási lépésben alakul tirozinná (9. ábra). A fenilalanin lebontás mellékútvonala transzaminálási lépéssel indul, azonban ezen útvonal kapacitása kicsi. A mellékutak a fenilalanin koncentráció megemelkedése esetén kapnak szerepet a fenilalanin lebontásában, mely során a fenilalanin transzaminálással fenilpiruváttá alakul. További mellékutak még a fenillaktáttá vagy fenilacetáttá való átalakulás (lásd később) (11. ábra). A fenilalanin hidroxiláz által katalizált reakció monooxigenálási reakció, melynek során a molekuláris oxigén egyik atomja a fenilalaninra kerül, a másik pedig víz formájában szabadul fel. A reakcióban tirozin keletkezik, ezt követően a fenilalanin és a tirozin metabolizmusa közös (9. ábra). 9. ábra. A fenilalanin és a tirozin átalakulása homogentizinsavvá. A fenilalanin hidroxiláz által katalizált monooxigenálási lépés oxigént és kofaktorként tetrahidrobiopterint (BH 4 ) igényel. A tetrahidrobiopterin GTP-ből szintetizálódik a GTP ciklohidroláz I. által katalizált reakcióban. A BH 4 a fenilalanin hidroxiláz reakcióban oxidálódik és dihidrobiopterinné (BH 2 ) alakul. A BH 2 visszaredukálódhat a dihidrobiopterin reduktáz által katalizált reakcióban (10. ábra). 10. ábra. A dihidrobiopterin reduktáz által katalizált reakció. A fenilalanin és tirozin lebontás második lépésében, egy aminotranszferáz reakcióban tirozinból p-hidroxi-fenilpiruvát keletkezik, eközben α-ketoglutarátból glutamát jön létre (9. ábra). A p-hidroxi-fenilpiruvátot dioxigenáz enzim alakítja homogentizinsavvá. Az ezt követő reakciók eredményeképpen a homogentizinsavból acetoacetát és fumarát keletkezik. 11
12 1.3.1 A fenilketonúria és lehetséges okai A fenilalaninnak és a tirozinnak számos prekurzor funkciója van. Fontosak például a neurotranszmitterek (katekolaminok: dopamin, noradrenalin, adrenalin) és a tiroxin szintézisében is. A tirozináz által katalizált reakcióban tirozinból dopa keletkezik, mely a melanin (pigment) szintézisében használódik fel. A fenilketonúria az aminosav anyagcsere leggyakoribb betegsége. A fenilalanin és a tirozin metabolizmusát érintő hiánybetegségek különböző anyagcserezavarok kialakulásához vezethetnek, így például a csökkent tirozinképződés miatt korlátozott a katecholaminok szintézise és a melanin termelése is Klasszikus fenilketonúria - fenilalanin hidroxiláz hiány A fenilalanin hidroxiláz gén mutációinak következménye a fenilketonúria (PKU) kialakulása. Autoszómálisan recesszíven öröklődik és a fenilalanin-tirozin átalakulást érinti. Az enzimhiány következtében a fenilalanin nem tud továbbalakulni és felhalmozódik. A fenilalanin hidroxiláz enzim hiánya a klasszikus fenilketonúria kialakulásához vezet. A PKU esetében az enzimdefektus a vérben magas fenilalanin koncentráció kialakulását okozza. Jellemző tünete a melaninszintézis zavara miatt kialakuló világos bőrszín és a szellemi visszamaradottság kialakulása. A PKU esetében fontos a korai diagnózis, ugyanis az időben felismert betegség esetén olyan diéta alkalmazható terápiásan, mely minimális mennyiségben tartalmaz fenilalanint a többi esszenciális aminosav biztosítása mellett. A diéta alkalmazásával elkerülhető az idegsejtek károsodása és a szellemi fejlődés zavara, valamint a súlyos tünetek kialakulása. A fenilketonúria szűrővizsgálat Magyarországon kötelező Kofaktor defektusos fenilketonúria - dihidrobiopterin reduktáz hiány A klasszikus fenilketonúriával szemben a kofaktor defektusos fenilketonúria a PKU esetek kb. 3%-át teszik ki. A kofaktor elégtelenség következtében fenilalanin tirozinná alakulását katalizáló fenilalanin hidroxiláz reakció érintett, mely tetrahidrobiopterin kofaktorkt igénylő monooxigenálási lépés. Kofaktor elégtelenség esetében sem tud a fenilalanin tirozinná alakulni, így felhalmozódik és transzaminálási fenilpiruváttá alakul reakcióban (miközben piruvát alakul alaninná) (11. ábra). 12
13 11. ábra. A fenilpiruvát, fenillaktát és fenilacetát kialakulása. A fenilpiruvát és a belőle kialakuló anyagok (fenillaktát és fenilacetát) (11. ábra) felhalmozódnak és a központi idegrendszeri problémák kialakulásához vezetnek. Ezek az anyagok károsítják az idegsejtek mielinhüvelyét így szellemi visszamaradottság alakulhat ki a kofaktor defektusos PKU esetében is. Ez a fajta PKU a kofaktor hiánya miatt nem csak a fenilalanin degradációt, hanem más reakciókat is érint (pl. dopamin szintézis). Ez a három metabolit egészséges emberek vizeletében csak kis mennyiségben van jelen, míg fenilketonúriás beteg esetében koncentrációjuk megnő, a vizelettel fokozottan ürülnek. A betegség jellemzője az egérszagú vizelet. A szellemi visszamaradottságért fenilalanin toxikus hatása felelős, ugyanis magas koncentrációja miatt csökken más aromás aminosavak transzportja az agyba. A terápia ebben az esetben is jelenthet csökkenetett fenilalanin tartalmú diétát (mely azonban tirozint tartalmaz). A biopterin hiány kezelhető biopterin adásával. A reduktáz hiánya súlyosabb tüneteket okoz, ugyanis a katekolamin és szerotonin termelés csökken, ez felelős az idegrendszeri tünetekért Anyai fenilketonúria Abban az esetben, ha a magzat heterozigóta, akkor az anya vérének magas fenilalanin koncentrációja a magzatot károsíthatja, agykárosodást és a szív fejlődési rendellenességét okozva Tirozin aminotranszferáz hiány 13
14 Ritka, de súlyos betegség. Jellemző tünete a tirozinémia, szellemi visszamaradottság is kialakul általában. Az idegrendszer károsodása mellett a szem és a bőr károsodása is jellemzi, egyik jellemző tünete a káposztaszagú lehelet A BH 4 szintézis útvonal enzimjeinek érintettsége Ritka esetekben a GTP-ből történő kofaktor szintézis is érintett lehet a lépéseket katalizáló enzimek valamelyikének defektusa miatt. 1.4 Gyakorlat elméleti alapjai: A transzamináz-reakció megfordíthatóságának vizsgálata Az aminosavak kimutatása ninhidrin próba segítségével történik. A ninhidrin-reakció valamennyi α-aminosavra pozitív. A ninhidrin reagens a terminális aminocsoporttal reagál, majd a ninhidrin az α-aminosavakból képződő ammóniával lilás színű festékké kondenzálódik (12. ábra). 12. ábra. Aminosavak kimutatása ninhidrin reakcióval Szérum GOT és GPT aktivitásának meghatározása optikai teszttel A gyakorlaton a glutamát-oxálacetát-transzamináz (GOT) és a glutamát-piruváttranszamináz (GPT) aktivitásának (13. ábra) szérumból történő meghatározására Warburg-féle optikai tesztet használunk. 14
15 13. ábra. A GOT és a GPT által katalizált reakciók. A Warburg-féle optikai tesztet Warburg 1936-ban írta le. A mérési módszer a NAD + (NADP + ) és NADH (NADPH) eltérő abszorpciós tulajdonságain alapul. A reakcióközegben lévő redukált formák, azaz a NADH vagy NADPH koncentrációjának változása fotometriásan mérhető, ugyanis a mérés során használt 366 nm hullámhosszon az oxidált formák nem nyelnek el fényt, míg a redukált formák abszorpciója jelentős (14. ábra). A mérést nm hullámhosszon tartományában végezzük, ezért a tesztet UV-tesztnek is nevezzük. A módszer felhasználható enzimek aktivitásának mérésére. 14. ábra. A NAD + (NADP + ) és NADH (NADPH) abszorpciója különböző hullámhosszokon. A gyakorlaton a GOT és a GPT aktivitásának mérésére is ezt az UV-tesztet használjuk. Ezen enzimek aktivitása nem határozható meg közvetlenül, mert az általuk katalizált reakcióban nem keletkezik vagy használódik fel NAD + vagy NADH. Annak érdekében, hogy aktivitásukat meghatározhassuk, ún. összetett optikai tesztet kell alkalmaznunk, azaz a transzamináz reakciót 15
16 (mérőreakciót) szükséges egy olyan reakcióval kiegészíteni, melyben NADH (vagy NADPH) képződése vagy felhasználása történik (indikátor reakció) egy segédenzim által. A GOT által katalizált mérőreakcióban aszpartát és α-ketoglutarát szubsztrátokból glutamát és oxálacetát termékek keletkeznek. Ezt követően az oxálacetát maláttá alakul a malát dehidrogenáz (MDH) segédenzim által katalizált indikátor reakcióban, melynek során NAD + keletkezik (15. ábra). A teszt során az abszorpció csökkenését mérjük, ugyanis a MDH elhasználja a NADH-t, így a NADH koncentrációjának csökkenésével a 366 nm-en mért abszorpció is csökken. A Lambert-Beer törvény, a fotometria alaptörvénye segítségével az abszorbeált fény mennyiségéből kiszámítható az abszorbeáló molekula koncentrációja. A = Ɛ * c * l A - abszorpció Ɛ - moláris extinkciós koefficiens c - az abszorbeáló molekula koncentrációja l - az optikai úthossz 15. ábra. A GOT mérése során használt mérőreakció és indikátor reakció. A GPT által katalizált mérőreakcióban alanin és α-ketoglutarát szubsztrátokból glutamát és piruvát termékek keletkeznek. Ezt követően a piruvát laktáttá alakul a laktát dehidrogenáz (LDH) segédenzim által katalizált indikátor reakcióban, melynek során NAD + keletkezik (16. ábra). 16
17 16. ábra. A GPT mérése során használt mérőreakció és indikátor reakció. Annak érdekében, hogy a mérőreakció legyen az egész reakciósor sebességmeghatározója, a MDH és LDH segédenzimeket feleslegben kell alkalmazni. Az abszorbancia változásából meghatározható az enzimaktivitás. Másodpercenként 1 mol NADH képződése (vagy felhasználása) 1 katal, míg a percenként 1 µmol NADH képződése (vagy felhasználása) 1 U enzimaktivitást jelent Aminosavak reakcióinak vizsgálata: fenilketonúria. Szérum és vizelet aminosavtartalmának vizsgálata vékonyrétegű ioncserélő kromatográfiával A vékonyréteg-kromatoráfia gyors és egyszerű analitikai módszer. Alkalmas aminosavak, kis tagszámú peptidek, antibiotikumok, stb., vizsgálatára, így felhasználható a szérum és a vizelet aminosav-összetételének meghatározására. A gyakorlaton ezt a módszert egy anyagcserezavar betegség kimutatására használjuk fel. A gyakorlaton Polygram (Ionex-25 SA-Na) lemezt használunk, mely műanyag fóliára rögzített kationcserélő vékonyréteg, amely poliakrilamid hordozóhoz rögzített szulfátcsoportokat tartalmaz, az ellenion Na +. Az aminosavak elválaszthatósága függ a puffer összetételétől (ph, ionerősség, stb.), mert adott puffer esetén az aminosavak vándorlási sebessége töltéseik számától és a disszociábilis csoportok pk értékeitől függ. A gyakorlaton alkalmazott pufferben a bázikus és aromás aminosavak választhatók el jól egymástól. Az ioncserélő vékonyréteggel bevont lemezre mikropipettával kell felvinni a mintákat. A minta felcseppentésének helyét ceruzával kell bejelölni a lemezen, a lemez aljától kb. 1 cm távolságra úgy, hogy a felcseppentett minták ne érintkezzenek egymással. Annak érdekében, hogy minél kisebb foltokat kapjunk felcseppentéskor, meleg levegőárammal (hajszárítóval) száríthatjuk a mintákat a felvitel során. A mintafelvitelt követően a kromatográfiás lemezt 17
18 zárható edénybe (futtatókádba) helyezzük úgy, hogy az oldószer ne érintkezzen a felcseppentett mintákkal. A kapilláris hatás következtében az oldószer vándorol a rétegen. Az oldószert a lemez tetejétől 1-1,5 cm távolságig kell hagyni felfutni. A lemezt ezt követően ismét meg kell szárítani hajszárítóval, majd a foltok láthatóvá tételéhez előhívó reagenssel kell bepermetezni a lemezt, majd a foltok előtűnéséhez ismét megszárítani. Az értékelés során meg kell figyelni a minta foltjainak a felcseppentés helyétől számított távolságát, amennyiben szükséges a foltok átmérőit is. 18
19 Önellenőrző kérdések 1. Hogyan vesznek részt transzaminálási reakciók a citoszolban keletkező redukált elektronszállítóknak a mitokondriumba történő transzportjában? 2. Hogyan vesznek részt transzaminálási reakciók a glükóz-alanin ciklusban? 3. Milyen diagnózis állítható fel 260 nkat/l-nél magasabb GOT (glutamát-oxálacetáttranszamináz) szérum koncentráció érték esetén? 4. Milyen diagnózis állítható fel 290 nkat/l-nél magasabb GPT (glutamát-oxálacetáttranszamináz) szérum koncentráció érték esetén? 5. Mi a különbség a klasszikus és a kofaktor defektusos fenilketonúria között? 19
20 IRODALOMJEGYZÉK 1. Biokémia és molekuláris biológia. II. Anyagcsere. Harmadik kiadás. Debrecen, Szerkesztette: Fésüs László. Írták: Aradi János, Fésüs László, Punyiczki Mária, Sümegi Balázs, Szondy Zsuzsa és Tőzsér József. 2. Orvosi biokémia. Szerkesztette: Ádám Veronika. Második kiadás. Budapest, Medicina Könyvkiadó Rt. 3. Textbook of Biochemistry with clinical correlations. Ötödik kiadás. Szerkesztette: Thomas M. Devlin, Wiley-Liss, Biokémiai gyakorlatok évi változatlan utánnyomás. Szerkesztette: Teichmann Farkas. Debreceni Egyetem, Orvos- és Egészségtudományi Centrum, Biokémiai és Molekuláris biológiai Intézet. Debreceni Egyetemi Kiadó, A Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB) honlapja URL: 20
Készült:
 Tananyag címe: Transzaminázok vizsgálata Szerző: Dr. Mótyán János András, egyetemi tanársegéd Biokémiai és Molekuláris Biológiai Intézet Általános Orvostudományi Kar Debreceni Egyetem Készült: 2014.12.01-2015.01.31.
Tananyag címe: Transzaminázok vizsgálata Szerző: Dr. Mótyán János András, egyetemi tanársegéd Biokémiai és Molekuláris Biológiai Intézet Általános Orvostudományi Kar Debreceni Egyetem Készült: 2014.12.01-2015.01.31.
A glükóz reszintézise.
 A glükóz reszintézise. A glükóz reszintézise. A reszintézis nem egyszerű megfordítása a glikolízisnek. A glikolízis 3 irrevezibilis lépése más úton játszódik le. Ennek oka egyrészt energetikai, másrészt
A glükóz reszintézise. A glükóz reszintézise. A reszintézis nem egyszerű megfordítása a glikolízisnek. A glikolízis 3 irrevezibilis lépése más úton játszódik le. Ennek oka egyrészt energetikai, másrészt
MEDICINÁLIS ALAPISMERETEK BIOKÉMIA AZ AMINOSAVAK ANYAGCSERÉJE 1. kulcsszó cím: Az aminosavak szerepe a szervezetben
 Modul cím: MEDICINÁLIS ALAPISMERETEK BIOKÉMIA AZ AMINOSAVAK ANYAGCSERÉJE 1. kulcsszó cím: Az aminosavak szerepe a szervezetben A szénhidrátokkal és a lipidekkel ellentétben szervezetünkben nincsenek aminosavakból
Modul cím: MEDICINÁLIS ALAPISMERETEK BIOKÉMIA AZ AMINOSAVAK ANYAGCSERÉJE 1. kulcsszó cím: Az aminosavak szerepe a szervezetben A szénhidrátokkal és a lipidekkel ellentétben szervezetünkben nincsenek aminosavakból
A bioenergetika a biokémiai folyamatok során lezajló energiaváltozásokkal foglalkozik.
 Modul cím: MEDICINÁLIS ALAPISMERETEK BIOKÉMIA BIOENERGETIKA I. 1. kulcsszó cím: Energia A termodinamika első főtétele kimondja, hogy a különböző energiafajták átalakulhatnak egymásba ez az energia megmaradásának
Modul cím: MEDICINÁLIS ALAPISMERETEK BIOKÉMIA BIOENERGETIKA I. 1. kulcsszó cím: Energia A termodinamika első főtétele kimondja, hogy a különböző energiafajták átalakulhatnak egymásba ez az energia megmaradásának
Készült: Módosítva: július
 Tananyag címe: Transzaminázok vizsgálata Szerző: Dr. Mótyán János András egyetemi tanársegéd Biokémiai és Molekuláris Biológiai Intézet Általános Orvostudományi Kar Debreceni Egyetem Készült: 2014.12.01-2015.01.31.
Tananyag címe: Transzaminázok vizsgálata Szerző: Dr. Mótyán János András egyetemi tanársegéd Biokémiai és Molekuláris Biológiai Intézet Általános Orvostudományi Kar Debreceni Egyetem Készült: 2014.12.01-2015.01.31.
Zsírsav szintézis. Az acetil-coa aktivációja: Acetil-CoA + CO + ATP = Malonil-CoA + ADP + P. 2 i
 Zsírsav szintézis Az acetil-coa aktivációja: Acetil-CoA + CO + ATP = Malonil-CoA + ADP + P 2 i A zsírsav szintáz reakciói Acetil-CoA + 7 Malonil-CoA + 14 NADPH + 14 H = Palmitát + 8 CoA-SH + 7 CO 2 + 7
Zsírsav szintézis Az acetil-coa aktivációja: Acetil-CoA + CO + ATP = Malonil-CoA + ADP + P 2 i A zsírsav szintáz reakciói Acetil-CoA + 7 Malonil-CoA + 14 NADPH + 14 H = Palmitát + 8 CoA-SH + 7 CO 2 + 7
A piruvát-dehidrogenáz komplex. Csala Miklós
 A piruvát-dehidrogenáz komplex Csala Miklós szénhidrátok fehérjék lipidek glikolízis glukóz aminosavak zsírsavak acil-koa szintetáz e - piruvát acil-koa légz. lánc H + H + H + O 2 ATP szint. piruvát H
A piruvát-dehidrogenáz komplex Csala Miklós szénhidrátok fehérjék lipidek glikolízis glukóz aminosavak zsírsavak acil-koa szintetáz e - piruvát acil-koa légz. lánc H + H + H + O 2 ATP szint. piruvát H
A MITOKONDRIÁLIS ENERGIATERMELŐ FOLYAMATOK VIZSGÁLATA
 Biokémiai és Molekuláris Biológiai Intézet Általános Orvostudományi Kar Debreceni Egyetem BIOKÉMIA GYAKORLAT A MITOKONDRIÁLIS ENERGIATERMELŐ FOLYAMATOK VIZSGÁLATA Elméleti háttér Dr. Kádas János 2015 A
Biokémiai és Molekuláris Biológiai Intézet Általános Orvostudományi Kar Debreceni Egyetem BIOKÉMIA GYAKORLAT A MITOKONDRIÁLIS ENERGIATERMELŐ FOLYAMATOK VIZSGÁLATA Elméleti háttér Dr. Kádas János 2015 A
Citrátkör, terminális oxidáció, oxidatív foszforiláció
 Citrátkör, terminális oxidáció, oxidatív foszforiláció A citrátkör jelentősége tápanyagok oxidációjának közös szakasza anyag- és energiaforgalom központja sejtek anyagcseréjében elosztórendszerként működik:
Citrátkör, terminális oxidáció, oxidatív foszforiláció A citrátkör jelentősége tápanyagok oxidációjának közös szakasza anyag- és energiaforgalom központja sejtek anyagcseréjében elosztórendszerként működik:
Az aminosav anyagcsere orvosi vonatkozásai Csősz Éva
 Az aminosav anyagcsere orvosi vonatkozásai Csősz Éva E-mail: cseva@med.unideb.hu Általános reakciók az aminosav anyagcserében 1. Nitrogén eltávolítás: transzaminálás dezaminálás: oxidatív nem oxidatív
Az aminosav anyagcsere orvosi vonatkozásai Csősz Éva E-mail: cseva@med.unideb.hu Általános reakciók az aminosav anyagcserében 1. Nitrogén eltávolítás: transzaminálás dezaminálás: oxidatív nem oxidatív
Az AS nitrogénjének eltávolítása
 AMINOSAV ANYAGCSERE Az AS nitrogénjének eltávolítása 1. Hidrolízis (NH 3 eltávolítás az Asn és Gln amid csoportjából) 2. Transzamináció (amino és oxo csoport cseréje; AS és ketosav párok, transzamináz
AMINOSAV ANYAGCSERE Az AS nitrogénjének eltávolítása 1. Hidrolízis (NH 3 eltávolítás az Asn és Gln amid csoportjából) 2. Transzamináció (amino és oxo csoport cseréje; AS és ketosav párok, transzamináz
Bevezetés a biokémiába fogorvostan hallgatóknak
 Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 14. hét METABOLIZMUS III. LIPIDEK, ZSÍRSAVAK β-oxidációja Szerkesztette: Jakus Péter Név: Csoport: Dátum: Labor dolgozat kérdések 1.) ATP mennyiségének
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 14. hét METABOLIZMUS III. LIPIDEK, ZSÍRSAVAK β-oxidációja Szerkesztette: Jakus Péter Név: Csoport: Dátum: Labor dolgozat kérdések 1.) ATP mennyiségének
Szénhidrátok monoszacharidok formájában szívódnak fel a vékonybélből.
 Vércukorszint szabályozása: Szénhidrátok monoszacharidok formájában szívódnak fel a vékonybélből. Szövetekben monoszacharid átalakítás enzimjei: Szénhidrát anyagcserében máj központi szerepű. Szénhidrát
Vércukorszint szabályozása: Szénhidrátok monoszacharidok formájában szívódnak fel a vékonybélből. Szövetekben monoszacharid átalakítás enzimjei: Szénhidrát anyagcserében máj központi szerepű. Szénhidrát
A felépítő és lebontó folyamatok. Biológiai alapismeretek
 A felépítő és lebontó folyamatok Biológiai alapismeretek Anyagforgalom: Lebontó Felépítő Lebontó folyamatok csoportosítása: Biológiai oxidáció Erjedés Lebontó folyamatok összehasonlítása Szénhidrátok
A felépítő és lebontó folyamatok Biológiai alapismeretek Anyagforgalom: Lebontó Felépítő Lebontó folyamatok csoportosítása: Biológiai oxidáció Erjedés Lebontó folyamatok összehasonlítása Szénhidrátok
09. A citromsav ciklus
 09. A citromsav ciklus 1 Alternatív nevek: Citromsav ciklus Citrát kör Trikarbonsav ciklus Szent-Györgyi Albert Krebs ciklus Szent-Györgyi Krebs ciklus Hans Adolf Krebs 2 Áttekintés 1 + 8 lépés 0: piruvát
09. A citromsav ciklus 1 Alternatív nevek: Citromsav ciklus Citrát kör Trikarbonsav ciklus Szent-Györgyi Albert Krebs ciklus Szent-Györgyi Krebs ciklus Hans Adolf Krebs 2 Áttekintés 1 + 8 lépés 0: piruvát
Glikolízis. Csala Miklós
 Glikolízis Csala Miklós Szubsztrát szintű (SZF) és oxidatív foszforiláció (OF) katabolizmus Redukált tápanyag-molekulák Szállító ADP + P i ATP ADP + P i ATP SZF SZF Szállító-H 2 Szállító ATP Szállító-H
Glikolízis Csala Miklós Szubsztrát szintű (SZF) és oxidatív foszforiláció (OF) katabolizmus Redukált tápanyag-molekulák Szállító ADP + P i ATP ADP + P i ATP SZF SZF Szállító-H 2 Szállító ATP Szállító-H
Biokémiai és Molekuláris Biológiai Intézet. Mitokondrium. Fésüs László, Sarang Zsolt
 Biokémiai és Molekuláris Biológiai Intézet Mitokondrium Fésüs László, Sarang Zsolt Energiát (ATP) termelő sejtorganellum. Az ATP termelés oxigén fogyasztással (légzési lánc) és széndioxid termeléssel (molekulák
Biokémiai és Molekuláris Biológiai Intézet Mitokondrium Fésüs László, Sarang Zsolt Energiát (ATP) termelő sejtorganellum. Az ATP termelés oxigén fogyasztással (légzési lánc) és széndioxid termeléssel (molekulák
Integráció. Csala Miklós. Semmelweis Egyetem Orvosi Vegytani, Molekuláris Biológiai és Patobiokémiai Intézet
 Integráció Csala Miklós Semmelweis Egyetem Orvosi Vegytani, Molekuláris Biológiai és Patobiokémiai Intézet Anyagcsere jóllakott állapotban Táplálékkal felvett anyagok sorsa szénhidrátok fehérjék lipidek
Integráció Csala Miklós Semmelweis Egyetem Orvosi Vegytani, Molekuláris Biológiai és Patobiokémiai Intézet Anyagcsere jóllakott állapotban Táplálékkal felvett anyagok sorsa szénhidrátok fehérjék lipidek
Glikolízis. emberi szervezet napi glukózigénye: kb. 160 g
 Glikolízis Minden emberi sejt képes glikolízisre. A glukóz a metabolizmus központi tápanyaga, minden sejt képes hasznosítani. glykys = édes, lysis = hasítás emberi szervezet napi glukózigénye: kb. 160
Glikolízis Minden emberi sejt képes glikolízisre. A glukóz a metabolizmus központi tápanyaga, minden sejt képes hasznosítani. glykys = édes, lysis = hasítás emberi szervezet napi glukózigénye: kb. 160
Energiatermelés a sejtekben, katabolizmus. Az energiaközvetítő molekula: ATP
 Energiatermelés a sejtekben, katabolizmus Az energiaközvetítő molekula: ATP Elektrontranszfer, a fontosabb elektronszállító molekulák NAD: nikotinamid adenin-dinukleotid FAD: flavin adenin-dinukleotid
Energiatermelés a sejtekben, katabolizmus Az energiaközvetítő molekula: ATP Elektrontranszfer, a fontosabb elektronszállító molekulák NAD: nikotinamid adenin-dinukleotid FAD: flavin adenin-dinukleotid
ZSÍRSAVAK OXIDÁCIÓJA. FRANZ KNOOP német biokémikus írta le először a mechanizmusát. R C ~S KoA. a, R-COOH + ATP + KoA R C ~S KoA + AMP + PP i
 máj, vese, szív, vázizom ZSÍRSAVAK XIDÁCIÓJA FRANZ KNP német biokémikus írta le először a mechanizmusát 1 lépés: a zsírsavak aktivációja ( a sejt citoplazmájában, rövid zsírsavak < C12 nem aktiválódnak)
máj, vese, szív, vázizom ZSÍRSAVAK XIDÁCIÓJA FRANZ KNP német biokémikus írta le először a mechanizmusát 1 lépés: a zsírsavak aktivációja ( a sejt citoplazmájában, rövid zsírsavak < C12 nem aktiválódnak)
Mire költi a szervezet energiáját?
 Glükóz lebontás Lebontó folyamatok A szénhidrátok és zsírok lebontása során széndioxid és víz keletkezése közben energia keletkezik (a széndioxidot kilélegezzük, a vizet pedig szervezetünkben felhasználjuk).
Glükóz lebontás Lebontó folyamatok A szénhidrátok és zsírok lebontása során széndioxid és víz keletkezése közben energia keletkezik (a széndioxidot kilélegezzük, a vizet pedig szervezetünkben felhasználjuk).
A légzési lánc és az oxidatív foszforiláció
 A légzési lánc és az oxidatív foszforiláció Csala Miklós Semmelweis Egyetem Orvosi Vegytani, Molekuláris Biológiai és Patobiokémiai Intézet intermembrán tér Fe-S FMN NADH mátrix I. komplex: NADH-KoQ reduktáz
A légzési lánc és az oxidatív foszforiláció Csala Miklós Semmelweis Egyetem Orvosi Vegytani, Molekuláris Biológiai és Patobiokémiai Intézet intermembrán tér Fe-S FMN NADH mátrix I. komplex: NADH-KoQ reduktáz
Növényélettani Gyakorlatok A légzés vizsgálata
 Növényélettani Gyakorlatok A légzés vizsgálata /Bevezető/ Fotoszintézis Fény-szakasz: O 2, NADPH, ATP Sötétszakasz: Cellulóz keményítő C 5 2 C 3 (-COOH) 2 C 3 (-CHO) CO 2 Nukleotid/nukleinsav anyagcsere
Növényélettani Gyakorlatok A légzés vizsgálata /Bevezető/ Fotoszintézis Fény-szakasz: O 2, NADPH, ATP Sötétszakasz: Cellulóz keményítő C 5 2 C 3 (-COOH) 2 C 3 (-CHO) CO 2 Nukleotid/nukleinsav anyagcsere
A biokémia alapjai. Typotex Kiadó. Wunderlich Lívius Szarka András
 A biokémia alapjai Wunderlich Lívius Szarka András Összefoglaló: A jegyzet elsősorban egészségügyi mérnök MSc. hallgatók részére íródott, de hasznos segítség lehet biomérnök és vegyészmérnök hallgatók
A biokémia alapjai Wunderlich Lívius Szarka András Összefoglaló: A jegyzet elsősorban egészségügyi mérnök MSc. hallgatók részére íródott, de hasznos segítség lehet biomérnök és vegyészmérnök hallgatók
1. A nitrogén körforgása
 1. A nitrogén körforgása 2. Fehérjék lebontása Táplálékfehérjék lebontása aminosavakká Saját fehérjék lebontása Féléletidő szabályozása Ubikvitin konjugáció Proteaszómális lebontás 3. Aminosavak lebontása
1. A nitrogén körforgása 2. Fehérjék lebontása Táplálékfehérjék lebontása aminosavakká Saját fehérjék lebontása Féléletidő szabályozása Ubikvitin konjugáció Proteaszómális lebontás 3. Aminosavak lebontása
1. Piroszőlősavvá bomló aminosavak
 A szénlánc sorsa Lebontási sorozatok 1. Piroszőlősav csoport 2. Acetoacetil-CoA csoport 3. α- keto-glutársav csoport 4. Szukcinil-CoA csoport 5. Fumársav csoport 6. Oxálecetsav csoport 1. Piroszőlősavvá
A szénlánc sorsa Lebontási sorozatok 1. Piroszőlősav csoport 2. Acetoacetil-CoA csoport 3. α- keto-glutársav csoport 4. Szukcinil-CoA csoport 5. Fumársav csoport 6. Oxálecetsav csoport 1. Piroszőlősavvá
SZABVÁNYMŰVELETI ELŐÍRÁS
 SEMMELWEIS EGYETEM Orvosi Biokémiai Intézet 1094 Budapest, Tű zoltó u. 37-47. SZABVÁNYMŰVELETI ELŐÍRÁS című gyakorlat előkészítése Készítette: 2009.02.24. A dokumentáció kódja: SE-OBI-OKT-MU- 07 Dr. Bartha
SEMMELWEIS EGYETEM Orvosi Biokémiai Intézet 1094 Budapest, Tű zoltó u. 37-47. SZABVÁNYMŰVELETI ELŐÍRÁS című gyakorlat előkészítése Készítette: 2009.02.24. A dokumentáció kódja: SE-OBI-OKT-MU- 07 Dr. Bartha
ALLOSZTÉRIKUSAN SZABÁLYOZÓ METABOLITOK HATÁSA A PIRUVÁT-KINÁZ L és M IZOENZIMRE
 ALLOSZTÉRIKUSAN SZABÁLYOZÓ METABOLITOK HATÁSA A PIRUVÁT-KINÁZ L és M IZOENZIMRE A glukóz piruváttá (illetve laktáttá) történő átalakulása során (glikolízis), illetve a glukóz reszintézisben (glukoneogenezis)
ALLOSZTÉRIKUSAN SZABÁLYOZÓ METABOLITOK HATÁSA A PIRUVÁT-KINÁZ L és M IZOENZIMRE A glukóz piruváttá (illetve laktáttá) történő átalakulása során (glikolízis), illetve a glukóz reszintézisben (glukoneogenezis)
A szénhidrátok anyagcseréje. SZTE AOK Biokémiai Intézet Gyógyszerész hallgatók számára 2014.
 A szénhidrátok anyagcseréje SZTE AOK Biokémiai Intézet Gyógyszerész hallgatók számára 2014. A szénhidrátok emésztése és felszívódása Táplálkozás: növényi keményítő, szacharóz, laktóz (tej, tejtermékek)
A szénhidrátok anyagcseréje SZTE AOK Biokémiai Intézet Gyógyszerész hallgatók számára 2014. A szénhidrátok emésztése és felszívódása Táplálkozás: növényi keményítő, szacharóz, laktóz (tej, tejtermékek)
MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak
 Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
A szénhidrátok lebomlása
 A disszimiláció Szerk.: Vizkievicz András A disszimiláció, vagy lebontás az autotróf, ill. a heterotróf élőlényekben lényegében azonos módon zajlik. A disszimilációs - katabolikus - folyamatok mindig valamilyen
A disszimiláció Szerk.: Vizkievicz András A disszimiláció, vagy lebontás az autotróf, ill. a heterotróf élőlényekben lényegében azonos módon zajlik. A disszimilációs - katabolikus - folyamatok mindig valamilyen
Energiaforrásaink Szénvegyületek forrása
 Energiaforrásaink Fototróf: fotoszintetizáló élőlények, szerves vegyületeket állítanak elő napenergia segítségével (a fényenergiát kémiai energiává alakítják át) Kemotróf: nem képes a fényenergiát megkötni,
Energiaforrásaink Fototróf: fotoszintetizáló élőlények, szerves vegyületeket állítanak elő napenergia segítségével (a fényenergiát kémiai energiává alakítják át) Kemotróf: nem képes a fényenergiát megkötni,
A METABOLIZMUS ENERGETIKÁJA
 A METABOLIZMUS ENERGETIKÁJA Futó Kinga 2014.10.01. Metabolizmus Metabolizmus = reakciók együttese, melyek a sejtekben lejátszódnak. Energia nyerés szempontjából vannak fototrófok ill. kemotrófok. szervesanyag
A METABOLIZMUS ENERGETIKÁJA Futó Kinga 2014.10.01. Metabolizmus Metabolizmus = reakciók együttese, melyek a sejtekben lejátszódnak. Energia nyerés szempontjából vannak fototrófok ill. kemotrófok. szervesanyag
A METABOLIZMUS ENERGETIKÁJA
 A METABOLIZMUS ENERGETIKÁJA Futó Kinga 2013.10.02. Metabolizmus Metabolizmus = reakciók együttese, melyek a sejtekben lejátszódnak. Energia nyerés szempontjából vannak fototrófok ill. kemotrófok. szervesanyag
A METABOLIZMUS ENERGETIKÁJA Futó Kinga 2013.10.02. Metabolizmus Metabolizmus = reakciók együttese, melyek a sejtekben lejátszódnak. Energia nyerés szempontjából vannak fototrófok ill. kemotrófok. szervesanyag
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek
 Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
Több oxigéntartalmú funkciós csoportot tartalmazó vegyületek Hidroxikarbonsavak α-hidroxi karbonsavak -Glikolsav (kézkrémek) - Tejsav (tejtermékek, izomláz, fogszuvasodás) - Citromsav (citrusfélékben,
A biokémiai folyamatokat enzimek (biokatalizátorok) viszik véghez. Minden enzim. tartalmaz fehérjét. Két csoportjukat különböztetjük meg az enzimeknek
 1 A biokémiai folyamatokat enzimek (biokatalizátorok) viszik véghez. Minden enzim tartalmaz fehérjét. Két csoportjukat különböztetjük meg az enzimeknek a./ Csak fehérjébıl állók b./ Fehérjébıl (apoenzim)
1 A biokémiai folyamatokat enzimek (biokatalizátorok) viszik véghez. Minden enzim tartalmaz fehérjét. Két csoportjukat különböztetjük meg az enzimeknek a./ Csak fehérjébıl állók b./ Fehérjébıl (apoenzim)
jobb a sejtszintű acs!!
 Metabolikus stresszválasz jobb a sejtszintű acs!! dr. Ökrös Ilona B-A-Z Megyei Kórház és Egyetemi Oktató Kórház Miskolc Központi Aneszteziológiai és Intenzív Terápiás Osztály Az alkoholizmus, A fiziológiás
Metabolikus stresszválasz jobb a sejtszintű acs!! dr. Ökrös Ilona B-A-Z Megyei Kórház és Egyetemi Oktató Kórház Miskolc Központi Aneszteziológiai és Intenzív Terápiás Osztály Az alkoholizmus, A fiziológiás
Az enzimműködés termodinamikai és szerkezeti alapjai
 2017. 02. 23. Dr. Tretter László, Dr. Kolev Kraszimir Az enzimműködés termodinamikai és szerkezeti alapjai 2017. február 27., március 2. 1 Mit kell(ene) tudni az előadás után: 1. Az enzimműködés termodinamikai
2017. 02. 23. Dr. Tretter László, Dr. Kolev Kraszimir Az enzimműködés termodinamikai és szerkezeti alapjai 2017. február 27., március 2. 1 Mit kell(ene) tudni az előadás után: 1. Az enzimműködés termodinamikai
MEDICINÁLIS ALAPISMERETEK BIOKÉMIA A SZÉNHIDRÁTOK ANYAGCSERÉJE 1. kulcsszó cím: A szénhidrátok anyagcseréje
 Modul cím: MEDICINÁLIS ALAPISMERETEK BIOKÉMIA A SZÉNHIDRÁTOK ANYAGCSERÉJE 1. kulcsszó cím: A szénhidrátok anyagcseréje A szénhidrátok a szervezet számára fontos, alapvető tápanyagok. Az emberi szervezetben
Modul cím: MEDICINÁLIS ALAPISMERETEK BIOKÉMIA A SZÉNHIDRÁTOK ANYAGCSERÉJE 1. kulcsszó cím: A szénhidrátok anyagcseréje A szénhidrátok a szervezet számára fontos, alapvető tápanyagok. Az emberi szervezetben
ENZIMSZINTŰ SZABÁLYOZÁS
 ENZIMEK 1833.: Sörfőzés kapcsán kezdtek el vele foglalkozni (csírázó árpa vizsgálata) valamilyen anyag katalizátorként működik (Berzelius, 1835.) 1850. körül: ez valamilyen N-tartalmú szervesanyag 1874.:
ENZIMEK 1833.: Sörfőzés kapcsán kezdtek el vele foglalkozni (csírázó árpa vizsgálata) valamilyen anyag katalizátorként működik (Berzelius, 1835.) 1850. körül: ez valamilyen N-tartalmú szervesanyag 1874.:
BIOKÉMIA GYAKORLÓ TESZT 1. DEMO (FEHÉRJÉK, ENZIMEK, TERMODINAMIKA, SZÉNHIDRÁTOK, LIPIDEK)
 BIOKÉMIA GYAKORLÓ TESZT 1. DEMO (FEHÉRJÉK, ENZIMEK, TERMODINAMIKA, SZÉNHIDRÁTOK, LIPIDEK) 1. Keresse meg a baloldali oszlopban található fehérje szerkezeti szintekre jellemző a jobboldali oszlopban lévő
BIOKÉMIA GYAKORLÓ TESZT 1. DEMO (FEHÉRJÉK, ENZIMEK, TERMODINAMIKA, SZÉNHIDRÁTOK, LIPIDEK) 1. Keresse meg a baloldali oszlopban található fehérje szerkezeti szintekre jellemző a jobboldali oszlopban lévő
Kollokviumi vizsgakérdések biokémiából humánkineziológia levelező (BSc) 2015
 Kollokviumi vizsgakérdések biokémiából humánkineziológia levelező (BSc) 2015 A kérdés 1. A sejtről általában, a szervetlen alkotórészeiről, a vízről részletesen. 2. A sejtről általában, a szervetlen alkotórészeiről,
Kollokviumi vizsgakérdések biokémiából humánkineziológia levelező (BSc) 2015 A kérdés 1. A sejtről általában, a szervetlen alkotórészeiről, a vízről részletesen. 2. A sejtről általában, a szervetlen alkotórészeiről,
Az eukarióta sejt energiaátalakító organellumai
 A mitokondrium és a kloroplasztisz hasonlósága Az eukarióta sejt energiaátalakító organellumai mitokondrium kloroplasztisz eukarióta sejtek energiaátalakító és konzerváló organellumai Működésükben alapvető
A mitokondrium és a kloroplasztisz hasonlósága Az eukarióta sejt energiaátalakító organellumai mitokondrium kloroplasztisz eukarióta sejtek energiaátalakító és konzerváló organellumai Működésükben alapvető
Modul cím: MEDICINÁLIS ALAPISMERETEK BIOKÉMIA LIPIDEK ANYAGCSERÉJE 1. kulcsszó cím: A lipidek szerepe az emberi szervezetben
 Modul cím: MEDICINÁLIS ALAPISMERETEK BIOKÉMIA LIPIDEK ANYAGCSERÉJE 1. kulcsszó cím: A lipidek szerepe az emberi szervezetben Tartalék energiaforrás, membránstruktúra alkotása, mechanikai védelem, hőszigetelés,
Modul cím: MEDICINÁLIS ALAPISMERETEK BIOKÉMIA LIPIDEK ANYAGCSERÉJE 1. kulcsszó cím: A lipidek szerepe az emberi szervezetben Tartalék energiaforrás, membránstruktúra alkotása, mechanikai védelem, hőszigetelés,
SZÉNHIDRÁT ANYAGCSERE ENZIMHIÁNYOS BETEGSÉGEI (konzultáció, Buday László) I, Monoszacharid anyagcseréhez kapcsolt genetikai betegségek
 SZÉNHIDRÁT ANYAGCSERE ENZIMHIÁNYOS BETEGSÉGEI (konzultáció, Buday László) Irodalmi adatok alapján a szénhidrát anyagcserében szerepet játszó enzimek közül napjainkig már több tucat defektusát leírták,
SZÉNHIDRÁT ANYAGCSERE ENZIMHIÁNYOS BETEGSÉGEI (konzultáció, Buday László) Irodalmi adatok alapján a szénhidrát anyagcserében szerepet játszó enzimek közül napjainkig már több tucat defektusát leírták,
Fehérjék. SZTE ÁOK Biokémiai Intézet
 Fehérjék Csoportosítás Funkció alapján Szerkezetük alapján Kapcsolódó nem peptid részek alapján Szintézisük Transzkripció - sejtmag Transzláció - citoplazma Poszttranszlációs módosítások (folding) - endoplazmatikus
Fehérjék Csoportosítás Funkció alapján Szerkezetük alapján Kapcsolódó nem peptid részek alapján Szintézisük Transzkripció - sejtmag Transzláció - citoplazma Poszttranszlációs módosítások (folding) - endoplazmatikus
A szénhidrátok lebomlása
 A disszimiláció Szerk.: Vizkievicz András A disszimiláció, vagy lebontás az autotróf, ill. a heterotróf élőlényekben lényegében azonos módon zajlik. A disszimilációs - katabolikus - folyamatok mindig valamilyen
A disszimiláció Szerk.: Vizkievicz András A disszimiláció, vagy lebontás az autotróf, ill. a heterotróf élőlényekben lényegében azonos módon zajlik. A disszimilációs - katabolikus - folyamatok mindig valamilyen
A KOLESZTERIN SZERKEZETE. (koleszterin v. koleszterol)
 19 11 12 13 C 21 22 20 18 D 17 16 23 24 25 26 27 HO 2 3 1 A 4 5 10 9 B 6 8 7 14 15 A KOLESZTERIN SZERKEZETE (koleszterin v. koleszterol) - a koleszterin vízben rosszul oldódik - szabad formában vagy koleszterin-észterként
19 11 12 13 C 21 22 20 18 D 17 16 23 24 25 26 27 HO 2 3 1 A 4 5 10 9 B 6 8 7 14 15 A KOLESZTERIN SZERKEZETE (koleszterin v. koleszterol) - a koleszterin vízben rosszul oldódik - szabad formában vagy koleszterin-észterként
, mitokondriumban (peroxiszóma) citoplazmában
 -helye: máj, zsírszövet, vese, agy, tüdő, stb. - nem a β-oxidáció megfordítása!!! β-oxidáció Zsírsav-szintézis -------------------------------------------------------------------------------------------
-helye: máj, zsírszövet, vese, agy, tüdő, stb. - nem a β-oxidáció megfordítása!!! β-oxidáció Zsírsav-szintézis -------------------------------------------------------------------------------------------
Sejtszintű anyagcsere Ökrös Ilona
 Sejtszintű anyagcsere Ökrös Ilona B-A-Z Megyei Kórház és Egyetemi Oktató Kórház Miskolc Központi Aneszteziológiai és Intenzív Terápiás Osztály Az A alkoholizmus, fiziológiás sejtműködés mint probléma Feltételei:
Sejtszintű anyagcsere Ökrös Ilona B-A-Z Megyei Kórház és Egyetemi Oktató Kórház Miskolc Központi Aneszteziológiai és Intenzív Terápiás Osztály Az A alkoholizmus, fiziológiás sejtműködés mint probléma Feltételei:
A FAD transzportjának szerepe az oxidatív fehérje foldingban patkány máj mikroszómákban
 A FAD transzportjának szerepe az oxidatív fehérje foldingban patkány máj mikroszómákban PhD értekezés tézisek Varsányi Marianne 2005 Témavezető: Dr. Bánhegyi Gábor Semmelweis Egyetem Orvosi Vegytani, Molekuláris
A FAD transzportjának szerepe az oxidatív fehérje foldingban patkány máj mikroszómákban PhD értekezés tézisek Varsányi Marianne 2005 Témavezető: Dr. Bánhegyi Gábor Semmelweis Egyetem Orvosi Vegytani, Molekuláris
A citoszolikus NADH mitokondriumba jutása
 A citoszolikus NADH mitokondriumba jutása Energiaforrásaink Fototróf: fotoszintetizáló élőlények, szerves vegyületeket állítanak elő napenergia segítségével (a fényenergiát kémiai energiává alakítják át)
A citoszolikus NADH mitokondriumba jutása Energiaforrásaink Fototróf: fotoszintetizáló élőlények, szerves vegyületeket állítanak elő napenergia segítségével (a fényenergiát kémiai energiává alakítják át)
Fotoszintézis. fotoszintetikus pigmentek Fényszakasz - gránum/sztrómalamella. Sötétszakasz - sztróma
 Fotoszintézis fotoszintetikus pigmentek Fényszakasz - gránum/sztrómalamella Sötétszakasz - sztróma A növényeket érı hatások a pigmentösszetétel változását okozhatják I. Mintavétel (inhomogén minta) II.
Fotoszintézis fotoszintetikus pigmentek Fényszakasz - gránum/sztrómalamella Sötétszakasz - sztróma A növényeket érı hatások a pigmentösszetétel változását okozhatják I. Mintavétel (inhomogén minta) II.
Hiperammonémiák. Támpontok az egyes célkitűzések tárgyalásához
 Hiperammonémiák Felnőtt emberi szervezetben átlagos fehérjefogyasztás mellett naponta 20 g ammónia keletkezik az aminosavak lebontása során. Ennek eliminációja a szervezetből főleg urea formájában történik
Hiperammonémiák Felnőtt emberi szervezetben átlagos fehérjefogyasztás mellett naponta 20 g ammónia keletkezik az aminosavak lebontása során. Ennek eliminációja a szervezetből főleg urea formájában történik
Az újszülöttkori galactosaemia szűrés eredményei és differenciáldiagnosztikai lehetőségei
 Az újszülöttkori galactosaemia szűrés eredményei és differenciáldiagnosztikai lehetőségei Balázs Imre SZTE ÁOK Gyermekgyógyászati Klinika és Gyermekegészségügyi Centrum Anyagcsere-Szűrő Laboratórium Magyar
Az újszülöttkori galactosaemia szűrés eredményei és differenciáldiagnosztikai lehetőségei Balázs Imre SZTE ÁOK Gyermekgyógyászati Klinika és Gyermekegészségügyi Centrum Anyagcsere-Szűrő Laboratórium Magyar
1. A nitrogén körforgása
 1. A nitrogén körforgása 2. Fehérjék lebontása Táplálékfehérjék lebontása aminosavakká Saját fehérjék lebontása Féléletidő szabályozása Ubikvitin konjugáció Proteaszómális lebontás 3. Aminosavak lebontása
1. A nitrogén körforgása 2. Fehérjék lebontása Táplálékfehérjék lebontása aminosavakká Saját fehérjék lebontása Féléletidő szabályozása Ubikvitin konjugáció Proteaszómális lebontás 3. Aminosavak lebontása
transzláció DNS RNS Fehérje A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti fehérjék, transzportfehérjék
 Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Az Etanol Metabolizmusa és az Alkoholos Májkárosodás Biokémiája
 Az Etanol Metabolizmusa és az Alkoholos Májkárosodás Biokémiája A) Az etanol metabolizmusa emberben A metabolizmus átlagos sebessége: 10 g etanol/óra Az etanol energiatartalma: 30 kj/g (7,1 kcal/g) Az
Az Etanol Metabolizmusa és az Alkoholos Májkárosodás Biokémiája A) Az etanol metabolizmusa emberben A metabolizmus átlagos sebessége: 10 g etanol/óra Az etanol energiatartalma: 30 kj/g (7,1 kcal/g) Az
Dr. Mandl József BIOKÉMIA. Aminosavak, peptidek, szénhidrátok, lipidek, nukleotidok, nukleinsavak, vitaminok és koenzimek.
 Dr. Mandl József BIOKÉMIA Aminosavak, peptidek, szénhidrátok, lipidek, nukleotidok, nukleinsavak, vitaminok és koenzimek Semmelweis Kiadó Semmelweis Orvostudományi Egyetem Orvosi Vegytani, Molekuláris
Dr. Mandl József BIOKÉMIA Aminosavak, peptidek, szénhidrátok, lipidek, nukleotidok, nukleinsavak, vitaminok és koenzimek Semmelweis Kiadó Semmelweis Orvostudományi Egyetem Orvosi Vegytani, Molekuláris
AMINOSAVAK, FEHÉRJÉK
 AMINOSAVAK, FEHÉRJÉK Az aminosavak olyan szerves vegyületek, amelyek molekulájában aminocsoport (-NH2) és karboxilcsoport (-COOH) egyaránt előfordul. Felosztás A fehérjéket feloszthatjuk aszerint, hogy
AMINOSAVAK, FEHÉRJÉK Az aminosavak olyan szerves vegyületek, amelyek molekulájában aminocsoport (-NH2) és karboxilcsoport (-COOH) egyaránt előfordul. Felosztás A fehérjéket feloszthatjuk aszerint, hogy
Szerkesztette: Vizkievicz András
 A mitokondrium Szerkesztette: Vizkievicz András Eukarióta sejtekben a lebontó folyamatok biológiai oxidáció - nagy része külön sejtszervecskékben, a mitokondriumokban zajlik. A mitokondriumokban folyik
A mitokondrium Szerkesztette: Vizkievicz András Eukarióta sejtekben a lebontó folyamatok biológiai oxidáció - nagy része külön sejtszervecskékben, a mitokondriumokban zajlik. A mitokondriumokban folyik
Alapanyagcsere: Herris-Benedict Férfi: 66,5 +(13,8x ttkg)+(5xtmcm) 655+(9,5xTTkg)+(1,9xTmcm)-(4,7x
 Alapanyagcsere: Herris-Benedict Férfi: 66,5 +(13,8x ttkg)+(5xtmcm) )+(5xTmcm)-(6,7xÉK év) NŐ: 655+(9,5xTTkg)+(1,9xTmcm)-(4,7x (4,7xÉKév) Súlyzófaktorok: Könnyű fizikai munka: 1,7 Közepesen nehéz z fizikai
Alapanyagcsere: Herris-Benedict Férfi: 66,5 +(13,8x ttkg)+(5xtmcm) )+(5xTmcm)-(6,7xÉK év) NŐ: 655+(9,5xTTkg)+(1,9xTmcm)-(4,7x (4,7xÉKév) Súlyzófaktorok: Könnyű fizikai munka: 1,7 Közepesen nehéz z fizikai
Javítási nap:
 Javítási nap: 2016.05.03 zöld: helyes válasz, piros: a tesztbankban hibásan szerepelt 1386. Glükóz-6-foszfát-dehidrogenáz (G-6-PD) a. Fontos redox reakciókat katalizáló enzim b. Glükóz-6-foszfátról H átvétellel
Javítási nap: 2016.05.03 zöld: helyes válasz, piros: a tesztbankban hibásan szerepelt 1386. Glükóz-6-foszfát-dehidrogenáz (G-6-PD) a. Fontos redox reakciókat katalizáló enzim b. Glükóz-6-foszfátról H átvétellel
Fotoszintézis. 2. A kloroplasztisz felépítése 1. A fotoszintézis lényege és jelentısége
 Fotoszintézis 2. A kloroplasztisz felépítése 1. A fotoszintézis lényege és jelentısége Szerves anyagok képzıdése energia felhasználásával Az élıvilág szerves anyag és oxigénszükségletét biztosítja H2 D
Fotoszintézis 2. A kloroplasztisz felépítése 1. A fotoszintézis lényege és jelentısége Szerves anyagok képzıdése energia felhasználásával Az élıvilág szerves anyag és oxigénszükségletét biztosítja H2 D
Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk.
 1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
A felvétel és a leadás közötti átalakító folyamatok összességét intermedier - köztes anyagcserének nevezzük.
 1 Az anyagcsere Szerk.: Vizkievicz András Általános bevezető Az élő sejtekben zajló biokémiai folyamatok összességét anyagcserének nevezzük. Az élő sejtek nyílt anyagi rendszerek, azaz környezetükkel állandó
1 Az anyagcsere Szerk.: Vizkievicz András Általános bevezető Az élő sejtekben zajló biokémiai folyamatok összességét anyagcserének nevezzük. Az élő sejtek nyílt anyagi rendszerek, azaz környezetükkel állandó
A sejtek élete. 5. Robotoló törpék és óriások Az aminosavak és fehérjék R C NH 2. C COOH 5.1. A fehérjeépítőaminosavak általános
 A sejtek élete 5. Robotoló törpék és óriások Az aminosavak és fehérjék e csak nézd! Milyen protonátmenetes reakcióra képes egy aminosav? R 2 5.1. A fehérjeépítőaminosavak általános képlete 5.2. A legegyszerűbb
A sejtek élete 5. Robotoló törpék és óriások Az aminosavak és fehérjék e csak nézd! Milyen protonátmenetes reakcióra képes egy aminosav? R 2 5.1. A fehérjeépítőaminosavak általános képlete 5.2. A legegyszerűbb
A fogorvostanhallgatók önálló orvosi kémia és biokémia képzésének kidolgozása
 Az élettudományi- klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 A fogorvostanhallgatók
Az élettudományi- klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 A fogorvostanhallgatók
1. Az élő szervezetek felépítése és az életfolyamatok 17
 Élődi Pál BIOKÉMIA vomo; Akadémiai Kiadó, Budapest 1980 Tartalom Bevezetés 1. Az élő szervezetek felépítése és az életfolyamatok 17 Mi jellemző az élőre? 17. Biogén elemek 20. Biomolekulák 23. A víz 26.
Élődi Pál BIOKÉMIA vomo; Akadémiai Kiadó, Budapest 1980 Tartalom Bevezetés 1. Az élő szervezetek felépítése és az életfolyamatok 17 Mi jellemző az élőre? 17. Biogén elemek 20. Biomolekulák 23. A víz 26.
Anaerob fermentált szennyvíziszap jellemzése enzimaktivitás-mérésekkel
 Eötvös Loránd Tudományegyetem Természettudományi Kar Környezettudományi Centrum Anaerob fermentált szennyvíziszap jellemzése enzimaktivitás-mérésekkel készítette: Felföldi Edit környezettudomány szakos
Eötvös Loránd Tudományegyetem Természettudományi Kar Környezettudományi Centrum Anaerob fermentált szennyvíziszap jellemzése enzimaktivitás-mérésekkel készítette: Felföldi Edit környezettudomány szakos
MUTÁCIÓK. A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik.
 MUTÁCIÓK A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik. Pontmutáció: A kromoszóma egy génjében pár nukleotidnál következik be változás.
MUTÁCIÓK A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik. Pontmutáció: A kromoszóma egy génjében pár nukleotidnál következik be változás.
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét
 Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
Elválasztástechnikai és bioinformatikai kutatások. Dr. Harangi János DE, TTK, Biokémiai Tanszék
 Elválasztástechnikai és bioinformatikai kutatások Dr. Harangi János DE, TTK, Biokémiai Tanszék Fő kutatási területek Enzimek vizsgálata mannozidáz amiláz OGT Analitikai kutatások Élelmiszer analitika Magas
Elválasztástechnikai és bioinformatikai kutatások Dr. Harangi János DE, TTK, Biokémiai Tanszék Fő kutatási területek Enzimek vizsgálata mannozidáz amiláz OGT Analitikai kutatások Élelmiszer analitika Magas
A cukrok szerkezetkémiája
 A cukrok szerkezetkémiája A cukrokról,szénhidrátokról általánosan o o o Kémiailag a cukrok a szénhidrátok,vagy szacharidok csoportjába tartozó vegyületek. A szacharid arab eredetű szó,jelentése: édes.
A cukrok szerkezetkémiája A cukrokról,szénhidrátokról általánosan o o o Kémiailag a cukrok a szénhidrátok,vagy szacharidok csoportjába tartozó vegyületek. A szacharid arab eredetű szó,jelentése: édes.
TEJSAVAS (LAKTÁT) ACIDÓZIS Csala Miklós
 TEJSAVAS (LAKTÁT) ACIDÓZIS Csala Miklós A vérplazma normális ph-ja, az ún. fiziológiás ph 7,4 körül van az artériás véré kicsit magasabb, a vénásé alacsonyabb. A sejtek citoplazmája általában ettől az
TEJSAVAS (LAKTÁT) ACIDÓZIS Csala Miklós A vérplazma normális ph-ja, az ún. fiziológiás ph 7,4 körül van az artériás véré kicsit magasabb, a vénásé alacsonyabb. A sejtek citoplazmája általában ettől az
Zsírsavoxidációs zavarok klinikuma és kezelése. Papp Ferenc
 Zsírsavoxidációs zavarok klinikuma és kezelése Papp Ferenc Zsírsavak mitochondriális β-oxidációja A zsírsavak fontos energiaforrásai a szervezetnek Éhezés Szívizomnak állandó energiaforrás Vázizmok tartós
Zsírsavoxidációs zavarok klinikuma és kezelése Papp Ferenc Zsírsavak mitochondriális β-oxidációja A zsírsavak fontos energiaforrásai a szervezetnek Éhezés Szívizomnak állandó energiaforrás Vázizmok tartós
Szénhidrát anyagcsere. Kőszegi Tamás, Lakatos Ágnes PTE Laboratóriumi Medicina Intézet
 Szénhidrát anyagcsere Kőszegi Tamás, Lakatos Ágnes PTE Laboratóriumi Medicina Intézet Szénhidrát anyagcsere sommásan Izomszövet Zsírszövet Máj Homeosztázis Hormon Hatás Szerv Inzulin Glukagon Sejtek glükóz
Szénhidrát anyagcsere Kőszegi Tamás, Lakatos Ágnes PTE Laboratóriumi Medicina Intézet Szénhidrát anyagcsere sommásan Izomszövet Zsírszövet Máj Homeosztázis Hormon Hatás Szerv Inzulin Glukagon Sejtek glükóz
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL
 TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
Példák a független öröklődésre
 GENETIKAI PROBLÉMÁK Példák a független öröklődésre Az amelogenesis imperfecta egy, a fogzománc gyengeségével és elszíneződésével járó öröklődő betegség, a 4-es kromoszómán lévő enam gén recesszív mutációja
GENETIKAI PROBLÉMÁK Példák a független öröklődésre Az amelogenesis imperfecta egy, a fogzománc gyengeségével és elszíneződésével járó öröklődő betegség, a 4-es kromoszómán lévő enam gén recesszív mutációja
Vércukorszint szabályozás
 Vércukorszint szabályozás Raktározás: Szénhidrátok: glikogén formájában (máj, izom) Zsírok: zsírsejtek zsírszövet Fehérje: bőr alatti lazarostos kötőszövet Szénhidrát metabolizmus Szénhidrátok a bélben
Vércukorszint szabályozás Raktározás: Szénhidrátok: glikogén formájában (máj, izom) Zsírok: zsírsejtek zsírszövet Fehérje: bőr alatti lazarostos kötőszövet Szénhidrát metabolizmus Szénhidrátok a bélben
A felvétel és a leadás közötti átalakító folyamatok összességét intermedier - köztes anyagcserének nevezzük.
 1 Az anyagcsere Szerk.: Vizkievicz András Általános bevezető Az élő sejtekben zajló biokémiai folyamatok összességét anyagcserének nevezzük. Az élő sejtek nyílt anyagi rendszerek, azaz környezetükkel állandó
1 Az anyagcsere Szerk.: Vizkievicz András Általános bevezető Az élő sejtekben zajló biokémiai folyamatok összességét anyagcserének nevezzük. Az élő sejtek nyílt anyagi rendszerek, azaz környezetükkel állandó
Aminosav anyagcsere. Dr. Vér Ágota Egyetemi docens 2012
 Aminosav anyagcsere Dr. Vér Ágota Egyetemi docens 2012 A NITROGÉN EGYENSÚLY Esszenciális és nem esszenciális aminosavak 1. Mennyiségi szükséglet Fehérje bevitel: 0,8 g/ts.kg /nap 1,0-1,1 g/ts.kg /nap :
Aminosav anyagcsere Dr. Vér Ágota Egyetemi docens 2012 A NITROGÉN EGYENSÚLY Esszenciális és nem esszenciális aminosavak 1. Mennyiségi szükséglet Fehérje bevitel: 0,8 g/ts.kg /nap 1,0-1,1 g/ts.kg /nap :
Engedélyszám: 18211-2/2011-EAHUF Verziószám: 1. 2447-06 Kémiai vizsgálatok követelménymodul szóbeli vizsgafeladatai
 1. feladat Új kollégája a mai napon átveszi Öntől a fehérje ELFO vizsgálatokat. Magyarázza el kollégájának a vizsgálathoz szükséges tudnivalókat! Magyarázatában térjen ki a következőkre: - a szérum fehérje
1. feladat Új kollégája a mai napon átveszi Öntől a fehérje ELFO vizsgálatokat. Magyarázza el kollégájának a vizsgálathoz szükséges tudnivalókat! Magyarázatában térjen ki a következőkre: - a szérum fehérje
Az endomembránrendszer részei.
 Az endomembránrendszer Szerkesztette: Vizkievicz András Az eukarióta sejtek prokarióta sejtektől megkülönböztető egyik alapvető sajátságuk a belső membránrendszerük. A belső membránrendszer szerkezete
Az endomembránrendszer Szerkesztette: Vizkievicz András Az eukarióta sejtek prokarióta sejtektől megkülönböztető egyik alapvető sajátságuk a belső membránrendszerük. A belső membránrendszer szerkezete
1b. Fehérje transzport
 1b. Fehérje transzport Fehérje transzport CITOSZÓL Nem-szekretoros útvonal sejtmag mitokondrium plasztid peroxiszóma endoplazmás retikulum Szekretoros útvonal lizoszóma endoszóma Golgi sejtfelszín szekretoros
1b. Fehérje transzport Fehérje transzport CITOSZÓL Nem-szekretoros útvonal sejtmag mitokondrium plasztid peroxiszóma endoplazmás retikulum Szekretoros útvonal lizoszóma endoszóma Golgi sejtfelszín szekretoros
BIOLÓGIA ALAPJAI. Sejttan. Anyagcsere folyamatok 1. (Lebontó folyamatok)
 BIOLÓGIA ALAPJAI Sejttan Anyagcsere folyamatok 1. (Lebontó folyamatok) (Az ábrák egy része Dr. Lénárd Gábor Biológia 11. c. könyvéből való) Dr. Bakos Vince 2017/18. ősz 1 Prokarióták és eukarióták Karyon
BIOLÓGIA ALAPJAI Sejttan Anyagcsere folyamatok 1. (Lebontó folyamatok) (Az ábrák egy része Dr. Lénárd Gábor Biológia 11. c. könyvéből való) Dr. Bakos Vince 2017/18. ősz 1 Prokarióták és eukarióták Karyon
A VÉRALVADÁS VIZSGÁLATA
 A VÉRALVADÁS VIZSGÁLATA A Véralvadás vizsgálata című gyakorlat tartalmazza 1) a teljes vér megalvasztása rekalcifikálással, 2) a fehérjeméréshez szükséges referenciasor készítése, 3) a fibrinogén jelenlétének
A VÉRALVADÁS VIZSGÁLATA A Véralvadás vizsgálata című gyakorlat tartalmazza 1) a teljes vér megalvasztása rekalcifikálással, 2) a fehérjeméréshez szükséges referenciasor készítése, 3) a fibrinogén jelenlétének
Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások
 ktatási Hivatal rszágos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások I. FELADATSR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D 9.
ktatási Hivatal rszágos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások I. FELADATSR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D 9.
SZEMÉLYRE SZABOTT ORVOSLÁS II.
 Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 SZEMÉLYRE SZABOTT
Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 SZEMÉLYRE SZABOTT
A téma címe: Mikroszómális glukóz-6-foszfát szerepe granulocita apoptózisában
 Témavezető neve: Dr. Kardon Tamás Zoltán A téma címe: Mikroszómális glukóz-6-foszfát szerepe granulocita apoptózisában A kutatás időtartama: 2004-2007 Tudományos háttér A glukóz-6-foszfatáz multienzim-komplex
Témavezető neve: Dr. Kardon Tamás Zoltán A téma címe: Mikroszómális glukóz-6-foszfát szerepe granulocita apoptózisában A kutatás időtartama: 2004-2007 Tudományos háttér A glukóz-6-foszfatáz multienzim-komplex
DER (Felületén riboszómák találhatók) Feladata a biológiai fehérjeszintézis Riboszómák. Az endoplazmatikus membránrendszer. A kódszótár.
 Az endoplazmatikus membránrendszer Részei: DER /durva (szemcsés) endoplazmatikus retikulum/ SER /sima felszínű endoplazmatikus retikulum/ Golgi készülék Lizoszómák Peroxiszómák Szekréciós granulumok (váladékszemcsék)
Az endoplazmatikus membránrendszer Részei: DER /durva (szemcsés) endoplazmatikus retikulum/ SER /sima felszínű endoplazmatikus retikulum/ Golgi készülék Lizoszómák Peroxiszómák Szekréciós granulumok (váladékszemcsék)
Szerkesztette: Vizkievicz András
 Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
23. Indikátorok disszociációs állandójának meghatározása spektrofotometriásan
 23. Indikátorok disszociációs állandójának meghatározása spektrofotometriásan 1. Bevezetés Sav-bázis titrálások végpontjelzésére (a mőszeres indikáció mellett) ma is gyakran alkalmazunk festék indikátorokat.
23. Indikátorok disszociációs állandójának meghatározása spektrofotometriásan 1. Bevezetés Sav-bázis titrálások végpontjelzésére (a mőszeres indikáció mellett) ma is gyakran alkalmazunk festék indikátorokat.
BIOGÉN ELEMEK MÁSODLAGOS BIOGÉN ELEMEK (> 0,005 %)
 BIOGÉN ELEMEK ELSŐDLEGES BIOGÉN ELEMEK(kb. 95%) ÁLLANDÓ BIOGÉN ELEMEK MAKROELEMEK MÁSODLAGOS BIOGÉN ELEMEK (> 0,005 %) C, H, O, N P, S, Cl, Na, K, Ca, Mg MIKROELEMEK (NYOMELEMEK) (< 0,005%) I, Fe, Cu,
BIOGÉN ELEMEK ELSŐDLEGES BIOGÉN ELEMEK(kb. 95%) ÁLLANDÓ BIOGÉN ELEMEK MAKROELEMEK MÁSODLAGOS BIOGÉN ELEMEK (> 0,005 %) C, H, O, N P, S, Cl, Na, K, Ca, Mg MIKROELEMEK (NYOMELEMEK) (< 0,005%) I, Fe, Cu,
ÁGAZATI SZAKMAI ÉRETTSÉGI VIZSGA KOZMETIKAI ISMERETEK KÖZÉPSZINTŰ SZÓBELI VIZSGA MINTAFELADATOK ÉS ÉRTÉKELÉSÜK
 KOZMETIKAI ISMERETEK KÖZÉPSZINTŰ SZÓBELI VIZSGA MINTAFELADATOK ÉS ÉRTÉKELÉSÜK MINTATÉTEL. tétel A feladat: Nevezze meg és jellemezze a képen látható bőrelváltozást, mint a bőr szerkezetében bekövetkezett
KOZMETIKAI ISMERETEK KÖZÉPSZINTŰ SZÓBELI VIZSGA MINTAFELADATOK ÉS ÉRTÉKELÉSÜK MINTATÉTEL. tétel A feladat: Nevezze meg és jellemezze a képen látható bőrelváltozást, mint a bőr szerkezetében bekövetkezett
A gasztrointesztinális (GI) rendszer élettana IV. Táplálkozás élettan.
 A gasztrointesztinális (GI) rendszer élettana IV. Táplálkozás élettan. A táplálékfelvétel célja: Nyersanyagok biztosítása a test számára a növekedéshez a szöveti regenerációhoz az ivarsejtek képzéséhez
A gasztrointesztinális (GI) rendszer élettana IV. Táplálkozás élettan. A táplálékfelvétel célja: Nyersanyagok biztosítása a test számára a növekedéshez a szöveti regenerációhoz az ivarsejtek képzéséhez
1. előadás Membránok felépítése, mebrán raftok, caveolák jellemzője, funkciói
 1. előadás Membránok felépítése, mebrán raftok, caveolák jellemzője, funkciói Plazmamembrán Membrán funkciói: sejt integritásának fenntartása állandó hő, energia, és információcsere biztosítása homeosztázis
1. előadás Membránok felépítése, mebrán raftok, caveolák jellemzője, funkciói Plazmamembrán Membrán funkciói: sejt integritásának fenntartása állandó hő, energia, és információcsere biztosítása homeosztázis
Valin H 3 C. Treonin. Aszpartát S OH
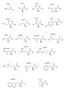 2 Glicin C 3 Alanin C 3 Valin 3 C Leucin 2 2 2 C 3 Izoleucin 2 zerin 2 Treonin 2 Tirozin 2 Cisztein Metionin Aszpartát 2 C 3 2 Glutamát 2 2 Aszparagin 2 Glutamin 2 Arginin 2 2 2 2 2 Lizin isztidin Fenilalanin
2 Glicin C 3 Alanin C 3 Valin 3 C Leucin 2 2 2 C 3 Izoleucin 2 zerin 2 Treonin 2 Tirozin 2 Cisztein Metionin Aszpartát 2 C 3 2 Glutamát 2 2 Aszparagin 2 Glutamin 2 Arginin 2 2 2 2 2 Lizin isztidin Fenilalanin
Abszorpciós fotometria
 A fény Abszorpciós fotometria Ujfalusi Zoltán PTE ÁOK Biofizikai ntézet 2011. szeptember 15. E B x x Transzverzális hullám A fény elektromos térerősségvektor hullámhossz Az elektromos a mágneses térerősség
A fény Abszorpciós fotometria Ujfalusi Zoltán PTE ÁOK Biofizikai ntézet 2011. szeptember 15. E B x x Transzverzális hullám A fény elektromos térerősségvektor hullámhossz Az elektromos a mágneses térerősség
