A nitrogén-monoxid adszorpciója és katalitikus redukciója ón-dioxid-katalizátoron*
|
|
|
- Alexandra Horváth
- 6 évvel ezelőtt
- Látták:
Átírás
1 MAGYAR KÉMIAI FOLYÓIRAT 81. évfolyam Különlevonat A nitrogén-monoxid adszorpciója és katalitikus redukciója ón-dioxid-katalizátoron* SOLYMOSI FRIGYES és KISS JÁNOS Az utóbbi években világszerte nagy figyelem fordítódik a környezet szennyeződésének megakadályozására. A környezetvédelem legfontosabb területe a levegőszennyeződés csökkentése. A kémiai üzemek és az autók által kibocsátott mérgező anyagok (szén-monoxid, szénhidrogének, nitrogén- -oxidok stb.) eltávolításában nagy szerep jut az említett termékek katalitikus úton való átalakításának. Mivel a szén-monoxid és a szénhidrogének oxidációjáról nagyszámú kísérleti adat áll rendelkezésünkre, ezek katalitikus utánégetésének gyakorlati megvalósítása igen előrehaladott állapotban van. Az autókipufogó gázban szintén jelenlevő NO katalitikus eltávolítása azonban még messze van a gyakorlatban használható formától, így ez a terület még jelentős kutatást kíván. Az elmaradás elsődleges oka, hogy rendkívül keveset tudunk a NO és a szilárd anyagok (oxidok és fémek) közötti kölcsönhatásról. A NO eltávolításának egyik lehetséges módja a NO katalitikus elbontása. A különböző katalizátorokon eddig végzett mérések azonban azt mutatták, hogy a reakció sebessége még magas hőmérsékleten is rendkívül kicsi, így ez a reakció a gyakorlatban egyelőre nem alkalmazható. Megvalósíthatónak látszik viszont a második módszer: a NO-nak a kipufogó gázban szintén jelenlevő redukáló gázokkal, elsősorban a CO-dal katalitikus reakcióban történő eltávolítása. Mivel eddigi vizsgálatokból kitűnt, hogy a NO redukciójában katalizátorok felületén lejátszódó oxidációs és redukciós lépések jelentős szerepet * A dolgozat részét képezte a 15. International Combustion szimpóziumon (Tokio, augusztus ) elhangzott előadásnak. játszanak1-3, figyelmünket olyan katalizátorok kialakítására és vizsgálatára fordítottuk, amelyeken ezek a lépések különösen kedvezményezettek. Ebből a szempontból alkalmas katalizátornak látszott a kevés króm-oxiddal adalékolt ón-dioxid, melynek fizikai-kémiai sajátságait a közelmúltban behatóan tanulmányoztuk4 5. E témával foglalkozó előzetes közleményünkben bemutattuk, hogy a kevés Cr20 3-t tartalmazó Sn02 kitűnő katalizátora az NO CO, NO H2 és NO C2H4 reakcióknak6 7. A jelen dolgozatban a NO és az Sn02 közötti kölcsönhatásról és a tiszta Sn02 által katalizált NO CO reakció vizsgálatáról számolunk be. A Cr20 3 beépítésének hatását a reakció lefutására a következő közleményünkben ismertetjük. Anyagok Kísérleti rész Az ón-dioxidot Merck granulált p. a. fémónnak koncentrált salétromsavban történő oldásával állítottuk elő. A képződött ón-hidroxidot kétszer desztillált vízzel savmentessé- 1 M. Shelef and J. T. Kummer: Chem. Eng. Prog. Symp. Series, F. G. Dwyer: Cat. Rév., K. Ottó and M. Shelef: J. Catal., Solymosi F., Hess A. és Bozsó F.: Magy. Kém. Folyóirat, F. Solymosi and T. Bánsági: Proceedings of the 2nd International Conference on Space Engineering. D. Reidel Publ., Dordrecht-Holland, o. 6 F. Solymosi, J. Kiss and F. Bozsó: Paper presented at Euchem Conference on the Role of Catalysis in Problem of Pollution, Santander, July 13 15, F. Solymosi and J. K iss: J. C. S. Chem. Comm.,
2 Magyar Kémiai Folyóirat 81. évf sz. Solymosi F. és Kiss J.i A NO adszorpciója és katalitikus redukciója Sn02-katalizátoron 451 gig mostuk, a szuszpenziót 110 C-on szárítottuk, majd 500 C-on 5 óráig bontottuk. Az oxid végső égetése 900 C-on 5 óráig történt. Az oxid felülete 5,8 m2/g volt. Vizsgálatainkhoz három különbözőképpen előkezelt ón-dioxidot alkalmaztunk: a) 400 C-on 60 percig vákuumban aktivált mintát, b) 400 C-on szén-monoxiddal 60 percig redukált oxidot, c) 200 C-on 60 percig oxigénnel oxidált katalizátort. A nitrogén-oxidot (Matheson Ltd.) a vizsgálatok előtt frakcionált desztillációval tisztítottuk. A tisztított minta tömegspektrometriás analízise szerint a gáz N 02-ot és N20 3-ot nem tartalmazott. A szén-monoxidot koncentrált kénsav és hangyasav reakciójával állítottuk elő. Mérési módszerek A kinetikai vizsgálatokat zárt cirkulációs reaktorban (térfogata 277 cm3) végeztük. A kísérletekhez 1,5 g 8 10 db tablettatöredékből álló katalizátort használtunk. A reakció előrehaladását a nyomásváltozás mérésével követtük. A reakciótermékek analízisét esetenként a katalitikus reaktorhoz kapcsolt A. E. I. MS-10 tömegspektrométerrel végeztük. Az elektromos vezetőképességi méréseket a kinetikai reaktorban hajtottuk végre. A vizsgálatokhoz 8 mm átmérőjű 6 7 mm hosszúságú, 40 atm nyomással összepréselt tablettákat használtunk. Az adszorpciós méréseket Sartorius-vákuümmikromérlegben végeztük. A kísérleti eredmények ismertetése 1. A NO adszorpciója a) Freundlich-izotermák A nitrogén-monoxid adszorpciója diamágneses oxidokon rendkívül lassú. Alumínium-oxidon például jelentős adszorpció játszódik le még 100 nap után is8* 9. Bár az adszorpciós hő értéke meglehetősen kicsi volt, Solbakken8 arra a következtetésre jutott, hogy a NO adszorpciója az alumínium- -oxidon kemiszorpciós folyamat. Mágneses mérések bizonyították, hogy a nitrogén-monoxid adszorpciója során elveszti paramágnesességét; a párosítatlan elektronja az alumínium-oxid elektronjával párosodik. A nitrogén-monoxid adszorpciója meglehetősen lassú volt a 400 C-on aktivált ón-dioxidon is, annak ellenére, hogy nincs kísérleti bizonyítékunk arra, hogy a folyamat jelentősebb aktiválási energiát igényelne. Arra lehet következtetni, hogy az adszorpciós folyamatnak meglehetősen kicsi a preexponenciális tényezője. Az adszorpciós izotermákat és az adszorpció sebességét C hőmérséklet-tartományban határoztuk meg. Az adszorpciós adatok a vizsgált nyomástartományban (5 150 Torr) követték a Freundlich-egyenletet, q c p 1/ (ahol q az adszorheált NO mennyisége, p a NO nyomása, c és n pedig a hőmérséklettől függő állandók) amint ezt az 1. ábrán feltüntetett adatok bizonyít j ák. A Freundlich-izoterma legfontosabb paramétereit az 1. táblázatban foglaltuk össze. A mono- 1. ábra A NO adszorpciójának Freundlich-izotermái 1. táblázat A Freundlich-izoterma jellemző adatai T, C n * m * kcal/mól Aktivált Sn02 C anól/g -Pm* Torr 25 16,6 9,7 36, ,87 8,8 34,5 Ad ,5 9,2 32, ,3 30,75 Redukált Sn02 T, ^ m * Pm* C kcal/mól /xmól/g Torr 25 46,3 27,3 42, ,0 25,0 41, ,1 23,0 40,4 C 46, qma monomolekuláris borítottsághoz szükséges NO mennyisége pmól/g-ban. pm a monomolekuláris borítottsághoz szükséges egyensúlyi nyomás. A qm értéket a Freundlich-izotermák metszéspontjából határoztuk meg. Az ehhez tartozó abszcisszaérték a pm. molekuláris adszorpciós réteg kialakulásához a számítások szerint 18,6 ^mól/g nitrogén-monoxid szükséges. A monomolekuláris borítottsághoz tartozó nyomás értéke 64 Torr-nak adódott. A Freundlich-egyenlet c és n koefficiensei a hőmérséklettel csökkennek, hasonlóképpen, mint azt már Shelef más oxidfelületeken tapasztalta Az adszorpciós hő értékeit, Hm-et az n exponensből számítottuk ki 0 = 0,37 horítottságnál. Az átlag adszorpciós hő értékére G között az aktivált ón-dioxidon 9 kcal/mól értéket kaptunk. Megemlítjük, hogy hasonlóan kis értéket kapott 8 A. Solbakken and L. H. Reyerson: J. Phys. Chem., A. Solbakken and L. H. Reyerson: J. Phys. Chem., K. Ottó and M. Shelef: J. Catal., M. Shelef and K. Ottó: J. Catal, M. S. Gandhi and M. Shelef: J. Catal., M. S. Gandhi and M. Shelef: J. Catal.,
3 452 Solymosi F. és Kiss J.: A NO adszorpciója és katalitikus redukciója Sn02-kat&liz&toron Magyar Kémiai Folyóirat 81. évf sz* Shelef is az átmenetifém-oxidokon, 5,1 kcal/mól-t a Cr20 3/Al203-oii, 3,5 kcal/mól-t a Fe20 3-on, 8,6 kcal/mól-t a NiO-on és 5,1 kcal/mól-t a CuO-on. Előzőekkel hasonló méréseket végeztünk a szén-monoxiddal 400 C-on részlegesen redukált ón-dioxidon is. A nitrogén-monoxid adszorpciója a redukált felületen sokkal erősebb, amint ezt az adszorpciós hő megnövekedett értéke (a Hmátlagértéke 25,1 kcal/mól) és az adszorbeálódott NO lassúbb deszorpciója is bizonyítja. b) Az adszorpció kinetikája A nitrogén-monoxid kemiszorpciójának kinetikáját C között vizsgáltuk 10 Torr nyomásnál. A kísérleti eredményeket az Elovichegyenlet integrált formájával értékeltük, q = (2,3/a)lg(í + f0) (2,3/a)lg t0 ahol t0 = 1/a az integrációs állandó. Mivel f0 sokkal kisebb, mint í, a fenti egyenlet a következő formában írható: q = (2,3/a)lg t (2,3/a) lg í0 Mint a 2. ábrán látható, az Elovich-egyenlet két szakaszból álló függvényt adott. A függvény töréspontja a hőmérséklet emelésével nagyobb borítottságok felé tolódik el. A töréspont egyik lehetséges oka az, hogy a felületen két különböző jellegű adszorpciós hely található. Az Elovich-egyenlet alapján számított állandók értékeit a 2. táblázatban közöljük. A táblázat adataiból kitűnik, hogy a NO pillanatszerű adszorpciója növekszik a hőmérséklettel. Az ay értéke gyorsan csökken a hőmérséklettel, jelezvén, hogy az adszorpció hőmérsékleti koefficiense pozitív. a2 értéke a hőmérséklettel nem változik. A részlegesen redukált ón-dioxidon a nitrogén- -monoxid pillanatszerű adszorpciója jelentősen nagyobb, mint a vákuumban aktivált mintán és a hőmérséklet növelésével szintén nő. Az Elovichfüggvények hasonló jellegűek, mint az előző esetben. Az a koefficiens értéke kisebb, mint az aktivált ón-dioxidon, ami arra mutat, hogy a NO adszorpciójának sebessége a redukált felületen nagyobb. Az oí1 értékei itt is csökkennek a hőmér -dioxidon 105 C-on 10 Torr NO-nyomásnál T, C 2. táblázat Az Elovich-egyenlet jellemző adatai 9o> fimól/g Aktivált S n 0 2 i 2 (/ m ól/g) ,8 4,45 0,35 0, ,91 3,45 0,47 0, ,1 0,46 0, ,16 1,6 0,46 0,047 T, C 9o> fimóljg Redukált S n 0 2 i «2 (Atmól/g) ,9 4,1 0,13 0, ,35 1,3 0,14 0, ,15 0,76 0,15 0,115 q0 a pillanatszerűen adszorbeált NO mennyisége. az Elovich-görbék töréspontjához tartozó borítottság értéke séklet növelésével. Nem találtunk jelentős különbséget az <%2-értékek között. A nitrogén-monoxid adszorpciójának vizsgálatát megkíséreltük az oxidált ón-dioxid-felületen is. A nitrogén-monoxid adszorpciója ezen a felületen rendkívül csekély és lassú. A különböző ón-dioxid-felületeken meghatározott adszorpciós sebességek összehasonlítására közöljük a 3. táblázatot, amely 0,065-es borított - ságoknál számított sebességértékeket tartalmazza. T, C 3. táblázat A NO-adszorpció sebessége Sn02-on = 0,065-néZ Oxidált, w ftmól/g min Aktivált, w ttnól/g min 0 0 Redukált, w jumól/g min 25 0, ,266 0, ,0070 0,730 3, ,300 c),4 NO adszorpciójának irreverzibilitása Reverzibilis adszorpciót csak az oxidált felületen találtunk. Az aktivált felületen a NO adszorpciója kismértékben irreverzibilis volt. A Freundlich-izoterma felvétele után 105 C-on a két óráig tartó folyamatos szívatás hatására az adszorbeált NO-nak 75%-a távolítható el. 200 C-on két órás szívatás után az adszorbeált mennyiségnek kevesebb, mint 15%-a maradt az aktivált felületen. Meghatároztuk az irreverzibilitás mértékét az Elővich-függvények első és második szakaszában. Az aktivált felületen 105 C-on az Elovich-függvények törése előtt adszorbeálódott NO 85%-a erősen kötődik a felülethez. A második szakaszban adszorbeálódott mennyiségnek csak 30%-a kötődik irreverzibilisen az oxidhoz.
4 Magyar Kémiai Folyóirat 81. évi sz. Sólymost F. és Kiss J.t A NO adszorpciója és katalitikus redukciója SnO,-katalizátoron 453 d) Együttes adszorpció és promotált adszorpció A NO -j- CO együttes adszorpcióját 100 C-on tanulmányoztuk a 400 C-on vákuumban kezelt ón-dioxidon. Az 1 : 1 mólarányú gázkeverék adszorpciójának mértéke közel 10-szer volt nagyobb, mint a gázok külön-külön végzett adszorpciójakor talált értékek összege. A további vizsgálatokból kitűnt, hogy az előzetesen adszorbeálódott nitrogén-monoxid megnöveli a CO adszorpciójának sebességét és mértékét is. Ennek bemutatására közöljük a 3. ábrát. Az előzetesen adszorbeálódott képes. A gázállapotú NO elektronaffinitása 0,65 ev 14. A 4. ábrán közölt mérési eredmények szerint a NO-adszorpció hatására az aktivált ón-dioxid elektromos ellenállása nő, ami negatív töltésű adszorbátumok képződésével magyarázható a következő egyenletek szerint: NO(g) + eö = NO(kem.) (1) 2 NO(g) + e0 N O (kém.) (2) Meglepő és eddig általunk sohasem tapasztalt jelenség, hogy a mérőcella szívatásakor, ugyanazon hőmérsékleten, az ón-dioxid elektromos ellenállása kismértékben tovább nőtt. Ez a viselkedés azt jelzi, hogy a fenti adszorpciós módok mellett, a nitrogén-monoxid egy része a párosítatlan elektronjának az oxid felületére való átadásával pozitív töltésű ionként is adszorbeálódik NO(g) íí NOfkem.) + eö (3) A NO adszorpciójának ez a módja a NO-nak a cellába történő bevezetésekor részlegesen kompenzálta az elektronakceptor jellegű adszorpciós folyamatok hatását. A NO-nak ez az utóbbi adszorpciója azonban jelentősen gyengébb az előzőeknél, a minta szívatásakor a NO^em^ deszorbeálódik a felületről 3. ábra A CO adszorpciója aktivált Sn02-on, 100 C-on, az előzetesen adszorbeálódott NO mennyiségének függvényében NOfkem.) + eö ^ NO(g) (4) nitrogén-monoxid és a promotált szén-monoxid adszorpciójának a viszonya megközelíti az 1-et, látszólag azt jelezvén, hogy a felületi komplex azonos számú NO- és CO-molekulából áll. A szén- -monoxid promotált adszorpciója azonban csak az előzetesen adszorbeálódott NO megbatározott értékéig, kb. 13 [jlg-ig (0 = 0,03) nő, ezután csökken, sőt az adszorbeálódott NO mennyiségének további növelésével kevesebb szén-monoxid adszorbeálódik, mint a tiszta felületen. A 13 fj,g-os érték jól megközelíti azt a NO-mennyiséget, amely a hasonló kísérleti körülmények között erősen kötődött a katalizátor felületéhez. Fontosnak látszik annak megemlítése, hogy az előzetesen adszorbeálódott CO a NO adszorpcióját gyakorlatilag nem befolyásolta és az oxidált felületen az előzetesen adszorbeálódott NO a szén- -monoxid adszorpcióját nem segítette elő. 2. A NO és CO adszorpciójának követése elektromos vezetöképességi mérésekkel A NO és az Sn02 közötti elektromos kölcsönhatás természetének megismerése érdekében néhány elektromos ellenállásmérést végeztünk a nitrogén-monoxid adszorpciója közben. A NO alacsony ionizációs potenciálja, 9,5 Y, lehetővé teszi, hogy a NO-molekula nitrozoniumion, NO+, formában adszorbeálódjék. A nitrogén-monoxid azonban, elektronszerkezetéből adódóan, nitrozilion, NO -, képződése közben elektronfelvételre is 4. ábra A NO adszorpciójának és az ezt követő szívatásnak a hatása az aktivált ón-dioxid elektromos ellenállására. A nyíl a minta szívatásának kezdetét jelzi 14 J. A. D. Stockdale, R. N. Compton, G. S. Hurst and P. W. Reinhardt: J. Chem. Phys.,
5 454 Solymosi F. és Kiss J.: A NO adszorpciója és katalitikus redukciója Sn02-katalizátoron Magyar Kémiai Folyóirat 81. évf sz. ennek eredményeként az ón-dioxid elektromos ellenállása tovább nő. Kvalitatíve hasonló viselkedést tapasztaltunk magasabb hőmérsékleten, 300 C-ig. 300 C felett a NO + képződését az elektromos vezetőképességi mérések már nem jelezték. Amikor a NO-ot a katalizátorok felületére dózisokban adagoltuk (25 Torr NO-dózisokat használtunk), már a második dózis hatása különbözött az elsőétől. Az első ellenállás-növekedés mértéke kisebb volt, mint az első NO-dóziskor, míg a második mértéke nagyobb. A harmadik dózis bevezetésekor a minta ellenállása először csökkent, szívatás hatására azonban az ellenállás nagyobb lett, mint a harmadik dózis bevezetése előtt, bizonyítván, hogy a NO bevezetésekor mindkét típusú kemiszorpciós folyamat lejátszódott, de a NO + képződésének hatása meghaladta a NO és az O képződésének hatását. További NO-dózis hatására a minta ellenállása ismét csökkent, a gáz kiszívatásakor az ón-dioxid ellenállása azonban már alig haladta meg a dózis beadagolása előtti értéket. Nagyon valószínűnek látszik, hogy ebben az esetben már a negatív töltésű adszorbátumok képződése nagyon csekély az előző dózisokhoz és az NO+ képződéséhez képest. Ez a kísérletsorozat meggyőzően mutatja, hogy az aktivált ón-dioxid felületén a negatív töltésű adszorbátumok képződéséhez szükséges aktív helyek száma meglehetősen korlátozott. Ha az ón-dioxidot 400 C-on nem aktiváltuk, hanem csupán az adszorpciós kísérlet hőmérsékletén szívattuk ( C), a minta ellenállása csak kismértékben csökkent a NO bevezetésekor. Ebből arra lehet következtetni, hogy az ón-dioxid az aktiválási folyamat alatt részlegesen redukálódott, és a redukált centrumok felelősek a NO ~ és az O ~ képződéséért. Néhány tájékozódó jellegű tömegspektrometriás analízist végeztünk az ón-dioxid felületéről deszorbeálódó gázok összetételének megállapítása érdekében. Kísérleteink előtt a nitrogén-monoxidot az aktivált ón-dioxidon 100 G-on 60 percig adszorbeáltattuk, a gázállapotú és gyengén kötött NO-ot leszívattuk (5 perc) és a mintát ugyanezen hőmérsékleten 60 percig tartottuk. A 100 C-on deszorbeálódó gázokban NO-ot (30%), N2-t (40%) és NaO-ot (28%) találtunk. A minta felfűtésekor vákuumban 180 C-on a deszorbeálódó termékek csak NO-ot (80%) és N2-t (20%) tartalmaztak, míg 240 C-on NO (36%), N2 (53%) és 0 2 (11%) volt a gáz összetétele. A minta további melegítésekor 320 C-ra, majd 360 C-ra, csak a N2 és az 0 2 parciális nyomása nőtt. 320 C-on a N2 és 0 2 mólaránya 3, 360 C-on pedig 1 volt. Az eredményekből arra következtethetünk, hogy a NO egy része disszociatíve adszorbeálódik az aktivált felületen és a disszociáció mértéke a hőmérséklettel nő. Bár az aktivált ón-dioxidon a legerősebben kötött adszorbeátum az oxigén nagyon valószínű, hogy O -ion formában, kísérleteink alapján nem lehet kizárni azt a lehetőséget sem, hogy az átmenetileg képződött NO -ion szintén hozzájárult az ón-dioxid elektromos ellenállásának megnöveléséhez. Amikor a NO -f- CO 1 : 1 arányú keverékét 100 C-on adszorbeáltattuk az aktivált mintára, az elektromos ellenállás-növekedés valamivel nagyobb volt, mint NO alkalmazásakor, annak ellenére, 5. ábra A NO-dózisok (25 Torr) hatása az aktivált Sn02 elektromos ellenállására 100 C-on A NO : CO 1 : 1 mólarányú keverékének hatása az aktivált SnOa elektromos ellenállására
6 Magyar Kémiai Folyóirat 81. évf. 197S. 10. sz. Solymosi F. és Kiss J.t A NO adszorpciója és katalitikus redukciója Sn02-katalizátorou 455 hogy a CO egyedül az ón-dioxid ellenállását az alábbi egyenlet szerint csökkenti CO(g) -> COftem.) + (5) A cella szívatásakor a minta ellenállása tovább nőtt. Méréseink eredményeit a 6. ábrán mutatjuk be C hőmérséklet-tartományban a helyzet valamivel megváltozott; a minta ellenállása a gázkeverék bevezetésekor először nőtt, majd csökkent, végül állandó értéket ért el. 250 C felett a kezdeti ellenállás-növekedés nem jelentkezett. A katalitikus reakció hőmérséklet-tartományában, C között, az ón-dioxid elektromos ellenállása kb. egy nagyságrenddel csökkent és a katalitikus reakció lejátszódásáig ezen az értéken maradt. Hasonló viselkedést figyeltünk meg NOfelesleget tartalmazó gázkeverékben (NO : CO mólarány 2,5 : 1) is. Ez azt jelzi, hogy ezen a hőmérsékleten a CO redukáló hatása az uralkodó és a katalizátor a katalitikus reakció alatt részlegesen redukált állapotban van. Azonos típusú ellenállás idő görbéket kaptunk szén-monoxid jelenlétében azzal a különbséggel, hogy a kezdeti ellenállás-növekedés nem lépett fel. gyors súlycsökkenés itt is fellépett, hasonlóan, mint a tiszta szén-monoxid alkalmazásakor. A súlycsökkenés mértéke gyakorlatilag megegyezett a NO távollétében mért súlycsökkenéssel. Szén- -monoxid-felesleg alkalmazásakor, a nitrogén-monoxid redukciójának előrehaladásával, további súlycsökkenést tapasztaltunk, míg NO-felesleget tartalmazó gázkeverékben a katalitikus reakció előrehaladásával a katalizátor súlya lassan nőtt, amíg a kiindulási értéket el nem érte. 4. Kinetikai mérések A NO redukciója CO-dal reprodukálható sebességgel és teljes konverzióval vákuumban csak 360 C felett játszódott le. A kezdeti csekély aktivitáscsökkenés után a katalizátor aktivitása állandó maradt. A NO redukciója nitrogénné gyakorlatilag teljes, csupán néhány százalék NaO átmeneti képződését tapasztaltuk. A N20 menynyisége a reakció előrehaladásával először nőtt, majd csökkent (8. ábra). A reakció sebességét 360 C felett a reakciótermékek (C02, N2) nem befolyásolták. 3. A katalizátor redukciója és visszaoxidációja A következőkben megvizsgáltuk a katalizátor redukcióját és visszaoxidációját a katalitikus reakció hőmérsékletén. A méréseket Sartoriusmikromérlegen végeztük. Amikor az aktivált mintára 400 C-on szén-monoxidot engedtünk, egy kezdeti gyors, majd egy lassúbb súlycsökkenést kaptunk (7. ábra). A kezdeti folyamat sebessége gyakorlatilag független volt a hőmérséklettől. A redukált minta visszaoxidációja NO-dal szintén két lépésben ment végbe. Megjegyezzük, hogy a redukált minta visszaoxidációja azonos mennyiségű oxigénnel pillanatszerűen lejátszódott még abban az esetben is, amikor a visszaoxidáció hőmérsékletét 200 C-kal csökkentettük. A NO és CO 1 : 1 arányú keverékének hatására a kezdeti 7. ábra Az Sn02 katalizátor redukciója és visszaoxidációja CO-dal, NO CO (1 : 1) gázkeverékkel és NO-dal 418 C-on. Az ordinátán az Sn02 súlyváltozását tüntettük fel analízissel Az ón-dioxid hatásosságát megvizsgáltuk alacsonyabb hőmérsékleteken ( C-on) is, ahol a NO redukciójának sebessége és mértéke érzékenyen változott a katalizátor előkezelésével. A 400 C-on aktivált ón-dioxidon, vákuumban, csekély reakciót (5% konverziót) már 155 C-on is tapasztaltunk. A második, megismételt mérésben azonban az ón-dioxid már gyakorlatilag inaktív volt. Hasonló viselkedést tapasztaltunk magasabb hőmérsékleten 360 C-ig azzal a különbséggel, hogy a kezdeti sebesség és a konverzió nagyobb volt. Amikor az ón-dioxidot előzőleg szén-monoxiddal 400 C-on redukáltuk és a katalitikus reakciót C között mértük, a kezdeti sebesség és a konverzió mértéke valamivel nagyobb, mint az aktivált katalizátoron. Ha az aktivált katalizátort NO-dal vagy 0 2-nel C között 1 óráig kezeltük, a katalizátor kezdeti aktivitása ugyanazon a hőmérsékleten mérve jelentősen csökkent. Részletes kinetikai méréseket C között végeztünk sztöchiometrikus összetételű gáz
7 456 Solymosi F. és Kiss J.: A NO adszorpciója és katalitikus redukciója SnO: -katalizátoron Magyar Kémiai Folyóirat 81. éyf sz. keverékkel. Mint a 9. ábrán közölt adatokból kitűnik, a reakció szén-monoxidra zérusrendű, nitrogén-monoxidra pedig elsőrendű. Az aktiválási energia értéke 36,6 kcal/mól, jelentősen nagyobb, mint az Sn 02 által katalizált CO 0 2 reakcióé15. dik az adszorpció során, ennek következményeként a katalizátor felülete oxidálódik és inaktiválódik. Elektromos ellenállásmérésekből kitűnt, hogy a NO adszorpciója negatív és pozitív töltésű adszorbátumok képződéséhez vezet. Mivel a NO + - ion képződése a N O kötés erősödéséhez, míg az elektronnak a NO-ra történő átmenete (NO _-ion képződés) a kötés legnagyobb mértékű gyengüléséhez vezet, plauzibilisnek látszik, hogy a katalizátorfelület oxidációja a NO ~ átmeneti képződésének és disszociációjának az eredménye, melynek során adszorbeálódott nitrogénatomok is képződnek. Nagyon valószínű, hogy az adszorbeált nitrogén jelenléte felelős a szén-monoxid promotált adszorpciójáért, feltehetően felületi izocianátkomplex képződésén keresztül M N + CO 5ü M+NCO- (6) A NO CO reakció kezdeti sebességének függése 420 C-on a NO, illetve a CO parciális nyomásától Ugyanezt az értéket kaptuk az 5 : 1 mólarányú CO NO gázkeverék alkalmazásakor is. A kinetikai adatokat a 4. táblázatban foglaltuk össze. 4. táblázat A NO redukciójának kinetikai adatai T, C 10^ s p e c , , , , , ,5 E, kcal/mól 36,6 Frekvenciafaktor, min-1m~2 9, A kísérleti eredmények értelmezése Az adszorpciós méréseink során kitűnt, hogy a NO adszorpciójának mértéke és sebessége a különböző felületeken az alábbi sorrendben változik: S n 0 2(Oxidáit) < S n 0 2(aktiváit) < S n 0 2(redukáit) A NO adszorpciójának irreverzibilitása hasonló irányban nő. Ez arra enged következtetni, hogy az ón-dioxid redukált centrumai, valószínűleg az Sn3+-ionok, jelentős szerepet játszanak a NOmolekula adszorpciójában es aktiválásában. Az aktivált oxidról deszorbealódott gázok tömegspektrometriás analízise szerint a NO disszociáló- M az aktív felületi helyet, Sn3 + -iont jelenti. A fentiek alapján lehetséges, hogy a 100 C-on, NO CO gázkeverék jelenlétében tapasztalt ellenállás-növekedés, mely jelentősen meghaladta a tiszta NO jelenlétében mért értéket, szintén a felületi izocianátkomplex képződésének eredménye. Izocianát felületi komplexet ez ideig infravörösspektroszkópiával a nemesfém katalizátorokon16, valamint a hordozott réz-oxidon17 sikerült azonosítani. Az a tény, hogy a promotált adszorpció mértéke az előzetesen adszorbeálódott NO függvényében maximumgörbe szerint változik, azzal értelmezhető, hogy a NO-molekula aktiválására és az adszorbeálódott N-atomok képződésére alkalmas Sn3+ aktív helyek száma korlátozott. Az ón- -dioxid elektromos ellenállásának változása a NOdózisok hatására szintén ezt a következtetést támasztja alá. A promotált adszorpció mértékének csökkenése a nagyobb felületi NO-koncentráció felett azzal magyarázható, hogy a NO egy része az adszorbeálódott nitrogénnel kapcsolódott M - N + NO 5= M - N NO (7) csökkentve ezáltal az izocianát képződésének lehetőségét. Az a megfigyelés, hogy az előzetesen adszorbeálódott NO koncentrációjának további növelése már inhibiálta a CO adszorpcióját (kevesebb adszorbeálódott, mint a NO-ot nem tartalmazó felületen) azt jelenti, hogy a NO ekkor már azokat az adszorpciós helyeket, feltehetően az Sn4+-ionokat, is elfoglalta, M+ + NO íí N NO+ (8) amelyek egyébként a CO-adszorpció számára rendelkezésre állnak. Az a megfigyelésünk, hogy az oxidált felületen a CO promotált adszorpciója nem lép fel, megegyezésben van ezzel a képpel, A reagáló keverék és a katalizátor közötti kölcsönhatás tanulmányozásából kitűnt, hogy az Sn 0 2 felületi redukciója gyorsabb, mint a redukált centrumok visszaoxidációja nitrogén-monoxiddal, 16 M. L. Unland: J. Catal., Solymosi F. és K iss J. : megjelenés alatt. 17 J. London and A. T. Bell: J. Catal.,
8 Magyar Kémiai Folyóirat 81. évf sz. Solymosi F. és Kiss J.: A NO adszorpciója és katalitikus redukciója Sn02-katalízátoron 457 és ezzel egyezésben a CO oxidációja NO-dal gyengén redukált felületen megy végbe. Mindezen eredmények és megfigyelések alapján az Sn02 által katalizált NO CO reakció a következő elemi lépésekből tevődhet össze: M +O -+ CO-> M + C02 (9) M + N O? M+NO- M+NO- + M + M -N + M+O- (10a) (11a) vagy M -f NO M NO (10b) M N O + M -* M N + M+O- (11b) M N + NO M NNO (12) M-NNO + M-> M + N2 + M+O- (13) M+O- + C O ^ M + COa (14).2 NO + 2 CO N2 + 2 C02 (15) A N20 átmeneti megjelenése a gázfázisban az alábbi reakció eredménye M NNO M + N20 (16) A N20 bomlása a következő reakciók szerint já t szódhat le M + N20 3tM ONN (17) M ONN-v M+O-+ N2 (18) A (12) (14) reakciók változata, hogy a szén- -monoxid az adszorbeálódott nitrogénatommal reagál és a reakció felületi izocianát képződésén keresztül játszódik le: M -N + CO s: M+NCO- (19) M+NCO- + NO -s- M + N2 + C02 (20) összefoglalás A NO adszorpcióját különbözőképpen előkezelt Sn 02-mintákon tanulmányoztuk, C között. Az adszorpciós izotermák Torr nyomástartományban Freundlich-típusúak voltak. A kemiszorpció sebességét az Elővich-egyenlet írta le. A kinetikai mérések szerint a NO adszorpciójának mértéke és sebessége a különböző felületeken a következő sorrendben nő: S n 0 2(oxidált) S n 0 2(aktivált) ^ S n O 2(redukált) Kimutattuk, hogy az előzetesen adszorbeált NO elősegíti a CO adszorpcióját, amit felületi izocianátkomplex képződéséhez rendeltünk. Elektromos vezetőképességi mérésekből kitűnt, hogy a NO adszorpciójakor negatív és pozitív töltésű adszorbátumok képződnek az aktivált felületen. A NO katalitikus redukciója az ón-dioxidon CO-dal reprodukálható sebességgel csak 360 C felett játszódik le. A reakció CO-ra zérusrendű, NO-ra pedig elsőrendű. Az aktiválási energia értéke 36,6 kcal/mól. Megállapítottuk, hogy a redukált centrumok jelentős szerepet játszanak a NO aktiválásában és a NO disszociálódik az adszorpció során. A katalitikus reakció gyengén redukált felületen játszódik le. A katalitikus reakció lehetséges mechanizmusát megadtuk. Adsorption and reduction of nitrogen monoxide on tin(iv) oxide catalysts. F. Solymosi and J. Kiss The rates of the chemisorption of nitrogen monoxide were measured on different samples of Sn02 in the C temperature range. Kinetic measurements have revealed that the extent and the rate of NO adsorption on different surface increase in the following order: SllO(oxidized) 'is SnO (activated) SnO(reduced) It has been found that preadsorbed NO promotes the adsorption of CO, which is attributed to the formation of a surface isocyanate complex. Electric conductivity measurements during the NO adsorption have shown that negatively and positively adsorbed species are both present on the activated surface. The catalytic reduction of NO with CO on Sn02 proceeded with reproducible rates only above 360 C. The reaction was of zero order with respect to CO and first order with respect to NO. The value of activation energy is 36.6 kcal/mole. It has been found that the catalytic reaction takes place on the weakly reduced surface. It is postulated that the reduced centres play an important role in the activation of NO, and the NO undergoes dissociation during adsorption. A possible mechanism of the catalytic reduction of NO is discussed. Szeged, József Attila Tudományegyetem Általános- és Fizikai-Kémiai Tanszéke, Magyar Tudományos Akadémia Gázreakciókinetikai Tanszéki Kutató Csoportja. Érkezett: IV. 14.
Katalízis. Tungler Antal Emeritus professzor 2017
 Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
Kémiai átalakulások. A kémiai reakciók körülményei. A rendszer energiaviszonyai
 Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
Reakciókinetika. Általános Kémia, kinetika Dia: 1 /53
 Reakciókinetika 9-1 A reakciók sebessége 9-2 A reakciósebesség mérése 9-3 A koncentráció hatása: a sebességtörvény 9-4 Nulladrendű reakció 9-5 Elsőrendű reakció 9-6 Másodrendű reakció 9-7 A reakciókinetika
Reakciókinetika 9-1 A reakciók sebessége 9-2 A reakciósebesség mérése 9-3 A koncentráció hatása: a sebességtörvény 9-4 Nulladrendű reakció 9-5 Elsőrendű reakció 9-6 Másodrendű reakció 9-7 A reakciókinetika
Az egyensúly. Általános Kémia: Az egyensúly Slide 1 of 27
 Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Arany katalizátorokon lejátszódó heterogén katalitikus folyamatok IR és XPS vizsgálata
 OTKA Zárójelentés: T043251 Arany katalizátorokon lejátszódó heterogén katalitikus folyamatok IR és XPS vizsgálata A kutatás eredményeinek ismertetése Számos heterogén katalitikus folyamatban fémtartalmú
OTKA Zárójelentés: T043251 Arany katalizátorokon lejátszódó heterogén katalitikus folyamatok IR és XPS vizsgálata A kutatás eredményeinek ismertetése Számos heterogén katalitikus folyamatban fémtartalmú
Az egyensúly. Általános Kémia: Az egyensúly Slide 1 of 27
 Az egyensúly 10-1 Dinamikus egyensúly 10-2 Az egyensúlyi állandó 10-3 Az egyensúlyi állandókkal kapcsolatos összefüggések 10-4 Az egyensúlyi állandó számértékének jelentősége 10-5 A reakció hányados, Q:
Az egyensúly 10-1 Dinamikus egyensúly 10-2 Az egyensúlyi állandó 10-3 Az egyensúlyi állandókkal kapcsolatos összefüggések 10-4 Az egyensúlyi állandó számértékének jelentősége 10-5 A reakció hányados, Q:
Kinetika. Általános Kémia, kinetika Dia: 1 /53
 Kinetika 15-1 A reakciók sebessége 15-2 Reakciósebesség mérése 15-3 A koncentráció hatása: a sebességtörvény 15-4 Nulladrendű reakció 15-5 Elsőrendű reakció 15-6 Másodrendű reakció 15-7 A reakció kinetika
Kinetika 15-1 A reakciók sebessége 15-2 Reakciósebesség mérése 15-3 A koncentráció hatása: a sebességtörvény 15-4 Nulladrendű reakció 15-5 Elsőrendű reakció 15-6 Másodrendű reakció 15-7 A reakció kinetika
Minta feladatsor. Az ion neve. Az ion képlete O 4. Szulfátion O 3. Alumíniumion S 2 CHH 3 COO. Króm(III)ion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Kémiai reakciók sebessége
 Kémiai reakciók sebessége reakciósebesség (v) = koncentrációváltozás változáshoz szükséges idő A változás nem egyenletes!!!!!!!!!!!!!!!!!! v= ± dc dt a A + b B cc + dd. Melyik reagens koncentrációváltozását
Kémiai reakciók sebessége reakciósebesség (v) = koncentrációváltozás változáshoz szükséges idő A változás nem egyenletes!!!!!!!!!!!!!!!!!! v= ± dc dt a A + b B cc + dd. Melyik reagens koncentrációváltozását
1. változat. 4. Jelöld meg azt az oxidot, melynek megfelelője a vas(iii)-hidroxid! A FeO; Б Fe 2 O 3 ; В OF 2 ; Г Fe 3 O 4.
 1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
a. 35-ös tömegszámú izotópjában 18 neutron található. b. A 3. elektronhéján két vegyértékelektront tartalmaz. c. 2 mól atomjának tömege 32 g.
 MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
1. feladat Összesen: 8 pont. 2. feladat Összesen: 11 pont. 3. feladat Összesen: 7 pont. 4. feladat Összesen: 14 pont
 1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
FELÜLETI FORMÁK ÉS GÁZFÁZISÚ TERMÉKEK A HANGYASAV KATALITIKUS BOMLÁSÁBAN. Jaksáné Kecskés Tamara
 FELÜLETI FORMÁK ÉS GÁZFÁZISÚ TERMÉKEK A HANGYASAV KATALITIKUS BOMLÁSÁBAN Ph. D. értekezés Jaksáné Kecskés Tamara Témavezető: Dr. Kiss János Szegedi Tudományegyetem Szilárdtest- és Radiokémiai Tanszék Szeged
FELÜLETI FORMÁK ÉS GÁZFÁZISÚ TERMÉKEK A HANGYASAV KATALITIKUS BOMLÁSÁBAN Ph. D. értekezés Jaksáné Kecskés Tamara Témavezető: Dr. Kiss János Szegedi Tudományegyetem Szilárdtest- és Radiokémiai Tanszék Szeged
XXXVI. KÉMIAI ELŐADÓI NAPOK
 Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVI. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVI. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
ETÁN ÉS PROPÁN ÁTALAKÍTÁSA HORDOZÓS PLATINAFÉM- ÉS RÉNIUM- KATALIZÁTOROKON
 ETÁN ÉS PROPÁN ÁTALAKÍTÁSA HORDOZÓS PLATINAFÉM- ÉS RÉNIUM- KATALIZÁTOROKON Ph.D. értekezés Tolmacsov Péter Témavezető: Dr. Solymosi Frigyes az MTA rendes tagja Szegedi Tudományegyetem Szilárdtest- és Radiokémiai
ETÁN ÉS PROPÁN ÁTALAKÍTÁSA HORDOZÓS PLATINAFÉM- ÉS RÉNIUM- KATALIZÁTOROKON Ph.D. értekezés Tolmacsov Péter Témavezető: Dr. Solymosi Frigyes az MTA rendes tagja Szegedi Tudományegyetem Szilárdtest- és Radiokémiai
6. változat. 3. Jelöld meg a nem molekuláris szerkezetű anyagot! A SO 2 ; Б C 6 H 12 O 6 ; В NaBr; Г CO 2.
 6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
NEHÉZFÉMEK ELTÁVOLÍTÁSA IPARI SZENNYVIZEKBŐL Modell kísérletek Cr(VI) alkalmazásával növényi hulladékokból nyert aktív szénen
 NEHÉZFÉMEK ELTÁVOLÍTÁSA IPARI SZENNYVIZEKBŐL Modell kísérletek Cr(VI) alkalmazásával növényi hulladékokból nyert aktív szénen Készítette: Battistig Nóra Környezettudomány mesterszakos hallgató A DOLGOZAT
NEHÉZFÉMEK ELTÁVOLÍTÁSA IPARI SZENNYVIZEKBŐL Modell kísérletek Cr(VI) alkalmazásával növényi hulladékokból nyert aktív szénen Készítette: Battistig Nóra Környezettudomány mesterszakos hallgató A DOLGOZAT
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével
 5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével 5.1. Átismétlendő anyag 1. Adszorpció (előadás) 2. Langmuir-izoterma (előadás) 3. Spektrofotometria és Lambert Beer-törvény
5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével 5.1. Átismétlendő anyag 1. Adszorpció (előadás) 2. Langmuir-izoterma (előadás) 3. Spektrofotometria és Lambert Beer-törvény
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 8. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 8. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 8. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
Kémiai átalakulások. A kémiai reakciók körülményei. A rendszer energiaviszonyai
 Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
5. Laboratóriumi gyakorlat
 5. Laboratóriumi gyakorlat HETEROGÉN KÉMIAI REAKCIÓ SEBESSÉGÉNEK VIZSGÁLATA A CO 2 -nak vízben történő oldódása és az azt követő egyensúlyra vezető kémiai reakció az alábbi reakcióegyenlettel írható le:
5. Laboratóriumi gyakorlat HETEROGÉN KÉMIAI REAKCIÓ SEBESSÉGÉNEK VIZSGÁLATA A CO 2 -nak vízben történő oldódása és az azt követő egyensúlyra vezető kémiai reakció az alábbi reakcióegyenlettel írható le:
Fizikai kémia 2 Reakciókinetika házi feladatok 2016 ősz
 Fizikai kémia 2 Reakciókinetika házi feladatok 2016 ősz A házi feladatok beadhatóak vagy papír alapon (ez a preferált), vagy e-mail formájában is az rkinhazi@gmail.com címre. E-mail esetén ügyeljetek a
Fizikai kémia 2 Reakciókinetika házi feladatok 2016 ősz A házi feladatok beadhatóak vagy papír alapon (ez a preferált), vagy e-mail formájában is az rkinhazi@gmail.com címre. E-mail esetén ügyeljetek a
c A Kiindulási anyag koncentrációja c A0 idő t 1/2 A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 c A Kiindulási anyag koncentrációja c A0 c A0 2 t 1/2 idő A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 A reakciókinetika tárgya A reakciókinetika a fizikai kémia egyik részterülete.
c A Kiindulási anyag koncentrációja c A0 c A0 2 t 1/2 idő A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 A reakciókinetika tárgya A reakciókinetika a fizikai kémia egyik részterülete.
A feladatok megoldásához csak a kiadott periódusos rendszer és számológép használható!
 1 MŰVELTSÉGI VERSENY KÉMIA TERMÉSZETTUDOMÁNYI KATEGÓRIA Kedves Versenyző! A versenyen szereplő kérdések egy része általad már tanult tananyaghoz kapcsolódik, ugyanakkor a kérdések másik része olyan ismereteket
1 MŰVELTSÉGI VERSENY KÉMIA TERMÉSZETTUDOMÁNYI KATEGÓRIA Kedves Versenyző! A versenyen szereplő kérdések egy része általad már tanult tananyaghoz kapcsolódik, ugyanakkor a kérdések másik része olyan ismereteket
Reakciókinetika és katalízis
 Reakciókinetika és katalízis 2. előadás: 1/18 Kinetika: Kísérletekkel megállapított sebességi egyenlet(ek). A kémiai reakció makroszkópikus, fenomenológikus jellemzése. 1 Mechanizmus: Az elemi lépések
Reakciókinetika és katalízis 2. előadás: 1/18 Kinetika: Kísérletekkel megállapított sebességi egyenlet(ek). A kémiai reakció makroszkópikus, fenomenológikus jellemzése. 1 Mechanizmus: Az elemi lépések
Al-Mg-Si háromalkotós egyensúlyi fázisdiagram közelítő számítása
 l--si háromalkotós egyensúlyi fázisdiagram közelítő számítása evezetés Farkas János 1, Dr. Roósz ndrás 1 doktorandusz, tanszékvezető egyetemi tanár Miskolci Egyetem nyag- és Kohómérnöki Kar Fémtani Tanszék
l--si háromalkotós egyensúlyi fázisdiagram közelítő számítása evezetés Farkas János 1, Dr. Roósz ndrás 1 doktorandusz, tanszékvezető egyetemi tanár Miskolci Egyetem nyag- és Kohómérnöki Kar Fémtani Tanszék
Országos Középiskolai Tanulmányi Verseny 2009/2010. Kémia I. kategória II. forduló A feladatok megoldása
 Oktatási Hivatal I. FELADATSOR Országos Középiskolai Tanulmányi Verseny 2009/2010. Kémia I. kategória II. forduló A feladatok megoldása 1. B 6. E 11. A 16. E 2. A 7. D 12. A 17. C 3. B 8. A 13. A 18. C
Oktatási Hivatal I. FELADATSOR Országos Középiskolai Tanulmányi Verseny 2009/2010. Kémia I. kategória II. forduló A feladatok megoldása 1. B 6. E 11. A 16. E 2. A 7. D 12. A 17. C 3. B 8. A 13. A 18. C
O k t a t á si Hivatal
 k t a t á si Hivatal I. FELADATSR 2013/2014. tanévi rszágos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. KATEGÓRIA Javítási-értékelési útmutató A következő kérdésekre az egyetlen helyes választ
k t a t á si Hivatal I. FELADATSR 2013/2014. tanévi rszágos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. KATEGÓRIA Javítási-értékelési útmutató A következő kérdésekre az egyetlen helyes választ
A tudós neve: Mit tudsz róla:
 8. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
8. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
I. ANALITIKAI ADATOK MEGADÁSA, KONVERZIÓK
 I. ANALITIKAI ADATOK MEGADÁSA, KONVERZIÓK I.2. Konverziók Geokémiai vizsgálatok során gyakran kényszerülünk arra, hogy különböző kémiai koncentrációegységben megadott adatokat hasonlítsunk össze vagy alakítsuk
I. ANALITIKAI ADATOK MEGADÁSA, KONVERZIÓK I.2. Konverziók Geokémiai vizsgálatok során gyakran kényszerülünk arra, hogy különböző kémiai koncentrációegységben megadott adatokat hasonlítsunk össze vagy alakítsuk
A sz. OTKA pályázat (In situ és operando vizsgálatok az NO x szelektív katalitikus átalakításában) zárójelentése.
 A 69052 sz. OTKA pályázat (In situ és operando vizsgálatok az NO x szelektív katalitikus átalakításában) zárójelentése. A kutatások elsődleges célja a metánnal végzett szelektív katalitikus NO redukció
A 69052 sz. OTKA pályázat (In situ és operando vizsgálatok az NO x szelektív katalitikus átalakításában) zárójelentése. A kutatások elsődleges célja a metánnal végzett szelektív katalitikus NO redukció
Mekkora az égés utáni elegy térfogatszázalékos összetétele
 1) PB-gázelegy levegőre 1 vonatkoztatott sűrűsége: 1,77. Hányszoros térfogatú levegőben égessük, ha 1.1. sztöchiometrikus mennyiségben adjuk a levegőt? 1.2. 100 % levegőfelesleget alkalmazunk? Mekkora
1) PB-gázelegy levegőre 1 vonatkoztatott sűrűsége: 1,77. Hányszoros térfogatú levegőben égessük, ha 1.1. sztöchiometrikus mennyiségben adjuk a levegőt? 1.2. 100 % levegőfelesleget alkalmazunk? Mekkora
Curie Kémia Emlékverseny 2016/2017. Országos Döntő 9. évfolyam
 A feladatokat írta: Baglyas Márton, Dunaföldvár Lektorálta: Dr. Várallyainé Balázs Judit, Debrecen Kódszám:... Curie Kémia Emlékverseny 2016/2017. Országos Döntő 9. évfolyam A feladatok megoldásához periódusos
A feladatokat írta: Baglyas Márton, Dunaföldvár Lektorálta: Dr. Várallyainé Balázs Judit, Debrecen Kódszám:... Curie Kémia Emlékverseny 2016/2017. Országos Döntő 9. évfolyam A feladatok megoldásához periódusos
Badari Andrea Cecília
 Nagy nitrogéntartalmú bio-olajokra jellemző modellvegyületek katalitikus hidrodenitrogénezése Badari Andrea Cecília MTA Természettudományi Kutatóközpont, Anyag- és Környezetkémiai Intézet, Környezetkémiai
Nagy nitrogéntartalmú bio-olajokra jellemző modellvegyületek katalitikus hidrodenitrogénezése Badari Andrea Cecília MTA Természettudományi Kutatóközpont, Anyag- és Környezetkémiai Intézet, Környezetkémiai
Ni 2+ Reakciósebesség mol. A mérés sorszáma
 1. feladat Összesen 10 pont Egy kén-dioxidot és kén-trioxidot tartalmazó gázelegyben a kén és oxigén tömegaránya 1,0:1,4. A) Számítsa ki a gázelegy térfogatszázalékos összetételét! B) Számítsa ki 1,0 mol
1. feladat Összesen 10 pont Egy kén-dioxidot és kén-trioxidot tartalmazó gázelegyben a kén és oxigén tömegaránya 1,0:1,4. A) Számítsa ki a gázelegy térfogatszázalékos összetételét! B) Számítsa ki 1,0 mol
SZENNYVÍZKEZELÉS NAGYHATÉKONYSÁGÚ OXIDÁCIÓS ELJÁRÁSSAL
 SZENNYVÍZKEZELÉS NAGYHATÉKONYSÁGÚ OXIDÁCIÓS ELJÁRÁSSAL Kander Dávid Környezettudomány MSc Témavezető: Dr. Barkács Katalin Konzulens: Gombos Erzsébet Tartalom Ferrát tulajdonságainak bemutatása Ferrát optimális
SZENNYVÍZKEZELÉS NAGYHATÉKONYSÁGÚ OXIDÁCIÓS ELJÁRÁSSAL Kander Dávid Környezettudomány MSc Témavezető: Dr. Barkács Katalin Konzulens: Gombos Erzsébet Tartalom Ferrát tulajdonságainak bemutatása Ferrát optimális
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Periódusosság. Általános Kémia, Periódikus tulajdonságok. Slide 1 of 35
 Periódusosság 3-1 Az elemek csoportosítása: a periódusos táblázat 3-2 Fémek, nemfémek és ionjaik 3-3 Az atomok és ionok mérete 3-4 Ionizációs energia 3-5 Elektron affinitás 3-6 Mágneses 3-7 Az elemek periodikus
Periódusosság 3-1 Az elemek csoportosítása: a periódusos táblázat 3-2 Fémek, nemfémek és ionjaik 3-3 Az atomok és ionok mérete 3-4 Ionizációs energia 3-5 Elektron affinitás 3-6 Mágneses 3-7 Az elemek periodikus
Reakciókinetika és katalízis
 Reakciókinetika és katalízis k 4. előadás: 1/14 Különbségek a gázfázisú és az oldatreakciók között: 1 Reaktáns molekulák által betöltött térfogat az oldatreakciónál jóval nagyobb. Nincs akadálytalan mozgás.
Reakciókinetika és katalízis k 4. előadás: 1/14 Különbségek a gázfázisú és az oldatreakciók között: 1 Reaktáns molekulák által betöltött térfogat az oldatreakciónál jóval nagyobb. Nincs akadálytalan mozgás.
RÉSZLETEZŐ OKIRAT (2) a NAH /2016 nyilvántartási számú akkreditált státuszhoz
 RÉSZLETEZŐ OKIRAT (2) a NAH-1-1795/2016 nyilvántartási számú akkreditált státuszhoz 1) Az akkreditált szervezet neve és címe: AIRMON Levegőszennyezés Monitoring Kft. (1112 Budapest, Repülőtéri út 6. 27.
RÉSZLETEZŐ OKIRAT (2) a NAH-1-1795/2016 nyilvántartási számú akkreditált státuszhoz 1) Az akkreditált szervezet neve és címe: AIRMON Levegőszennyezés Monitoring Kft. (1112 Budapest, Repülőtéri út 6. 27.
Számítástudományi Tanszék Eszterházy Károly Főiskola.
 Networkshop 2005 k Geda,, GáborG Számítástudományi Tanszék Eszterházy Károly Főiskola gedag@aries.ektf.hu 1 k A mérés szempontjából a számítógép aktív: mintavételezés, kiértékelés passzív: szerepe megjelenítés
Networkshop 2005 k Geda,, GáborG Számítástudományi Tanszék Eszterházy Károly Főiskola gedag@aries.ektf.hu 1 k A mérés szempontjából a számítógép aktív: mintavételezés, kiértékelés passzív: szerepe megjelenítés
Anyagismeret 2016/17. Diffúzió. Dr. Mészáros István Diffúzió
 Anyagismeret 6/7 Diffúzió Dr. Mészáros István meszaros@eik.bme.hu Diffúzió Különféle anyagi részecskék anyagon belüli helyváltoztatása Az anyag lehet gáznemű, folyékony vagy szilárd Diffúzió Diffúzió -
Anyagismeret 6/7 Diffúzió Dr. Mészáros István meszaros@eik.bme.hu Diffúzió Különféle anyagi részecskék anyagon belüli helyváltoztatása Az anyag lehet gáznemű, folyékony vagy szilárd Diffúzió Diffúzió -
X. FIATAL MŰSZAKIAK TUDOMÁNYOS ÜLÉSSZAKA
 X. FIATAL ŰSZAKIAK TUDOÁNYOS ÜLÉSSZAKA Kolozsvár, 2005. március 18-19. AZ 123 FÁZISÚ SZINTRLÉSSL LŐÁLLÍTOTT YBa 2 Cu 3 O x TÍPUSÚ SZUPRAVZTŐ VIZSGÁLATA Kósa János Végvári Ferenc Kecskeméti Főiskola GAF
X. FIATAL ŰSZAKIAK TUDOÁNYOS ÜLÉSSZAKA Kolozsvár, 2005. március 18-19. AZ 123 FÁZISÚ SZINTRLÉSSL LŐÁLLÍTOTT YBa 2 Cu 3 O x TÍPUSÚ SZUPRAVZTŐ VIZSGÁLATA Kósa János Végvári Ferenc Kecskeméti Főiskola GAF
LABORATÓRIUMI PIROLÍZIS ÉS A PIROLÍZIS-TERMÉKEK NÉHÁNY JELLEMZŐJÉNEK VIZSGÁLATA
 LABORATÓRIUMI PIROLÍZIS ÉS A PIROLÍZIS-TERMÉKEK NÉHÁNY JELLEMZŐJÉNEK VIZSGÁLATA TOLNERLászló -CZINKOTAImre -SIMÁNDIPéter RÁCZ Istvánné - SOMOGYI Ferenc Mit vizsgáltunk? TSZH - Települési szilárd hulladék,
LABORATÓRIUMI PIROLÍZIS ÉS A PIROLÍZIS-TERMÉKEK NÉHÁNY JELLEMZŐJÉNEK VIZSGÁLATA TOLNERLászló -CZINKOTAImre -SIMÁNDIPéter RÁCZ Istvánné - SOMOGYI Ferenc Mit vizsgáltunk? TSZH - Települési szilárd hulladék,
Diffúzió. Diffúzió sebessége: gáz > folyadék > szilárd (kötőerő)
 Diffúzió Diffúzió - traszportfolyamat (fonon, elektron, atom, ion, hőmennyiség...) Elektromos vezetés (Ohm) töltés áram elektr. potenciál grad. Hővezetés (Fourier) energia áram hőmérséklet különbség Kémiai
Diffúzió Diffúzió - traszportfolyamat (fonon, elektron, atom, ion, hőmennyiség...) Elektromos vezetés (Ohm) töltés áram elektr. potenciál grad. Hővezetés (Fourier) energia áram hőmérséklet különbség Kémiai
MEMBRÁNKONTAKTOR ALKALMAZÁSA AMMÓNIA IPARI SZENNYVÍZBŐL VALÓ KINYERÉSÉRE
 MEMBRÁNKONTAKTOR ALKALMAZÁSA AMMÓNIA IPARI SZENNYVÍZBŐL VALÓ MASZESZ Ipari Szennyvíztisztítás Szakmai Nap 2017. November 30 Lakner Gábor Okleveles Környezetmérnök Témavezető: Bélafiné Dr. Bakó Katalin
MEMBRÁNKONTAKTOR ALKALMAZÁSA AMMÓNIA IPARI SZENNYVÍZBŐL VALÓ MASZESZ Ipari Szennyvíztisztítás Szakmai Nap 2017. November 30 Lakner Gábor Okleveles Környezetmérnök Témavezető: Bélafiné Dr. Bakó Katalin
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997
 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997 JAVÍTÁSI ÚTMUTATÓ I. A HIDROGÉN, A HIDRIDEK 1s 1, EN=2,1; izotópok:,, deutérium,, trícium. Kétatomos molekula, H 2, apoláris. Szobahőmérsékleten
1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1997 JAVÍTÁSI ÚTMUTATÓ I. A HIDROGÉN, A HIDRIDEK 1s 1, EN=2,1; izotópok:,, deutérium,, trícium. Kétatomos molekula, H 2, apoláris. Szobahőmérsékleten
RÉSZLETEZŐ OKIRAT a NAH /2016 nyilvántartási számú akkreditált státuszhoz
 RÉSZLETEZŐ OKIRAT a NAH-1-1795/2016 nyilvántartási számú akkreditált státuszhoz Az AIRMON Levegőszennyezés Monitoring Kft. (1112 Budapest, Repülőtéri út 6. 27. ép.) akkreditált területe: I. Az akkreditált
RÉSZLETEZŐ OKIRAT a NAH-1-1795/2016 nyilvántartási számú akkreditált státuszhoz Az AIRMON Levegőszennyezés Monitoring Kft. (1112 Budapest, Repülőtéri út 6. 27. ép.) akkreditált területe: I. Az akkreditált
13 Elektrokémia. Elektrokémia Dia 1 /52
 13 Elektrokémia 13-1 Elektródpotenciálok mérése 13-2 Standard elektródpotenciálok 13-3 E cella, ΔG és K eq 13-4 E cella koncentráció függése 13-5 Elemek: áramtermelés kémiai reakciókkal 13-6 Korrózió:
13 Elektrokémia 13-1 Elektródpotenciálok mérése 13-2 Standard elektródpotenciálok 13-3 E cella, ΔG és K eq 13-4 E cella koncentráció függése 13-5 Elemek: áramtermelés kémiai reakciókkal 13-6 Korrózió:
7. Kémia egyenletek rendezése, sztöchiometria
 7. Kémia egyenletek rendezése, sztöchiometria A kémiai egyenletírás szabályai (ajánlott irodalom: Villányi Attila: Ötösöm lesz kémiából, Példatár) 1.tömegmegmaradás, elemek átalakíthatatlansága az egyenlet
7. Kémia egyenletek rendezése, sztöchiometria A kémiai egyenletírás szabályai (ajánlott irodalom: Villányi Attila: Ötösöm lesz kémiából, Példatár) 1.tömegmegmaradás, elemek átalakíthatatlansága az egyenlet
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
A HNCO adszorpciójának és bom lásának vizsgálata C u ( ll l) felületen Aug er-, elektron energiaveszteségi és term ikus deszorpciós spektroszkópiával*
 Magyar Kémiai Folyóirat 88. évf. 1982. 3. sz. 131 A HNCO adszorpciójának és bom lásának vizsgálata C u ( ll l) felületen Aug er-, elektron energiaveszteségi és term ikus deszorpciós spektroszkópiával*
Magyar Kémiai Folyóirat 88. évf. 1982. 3. sz. 131 A HNCO adszorpciójának és bom lásának vizsgálata C u ( ll l) felületen Aug er-, elektron energiaveszteségi és term ikus deszorpciós spektroszkópiával*
Rezervoár kőzetek gázáteresztőképességének. fotoakusztikus detektálási módszer segítségével
 Rezervoár kőzetek gázáteresztőképességének vizsgálata fotoakusztikus detektálási módszer segítségével Tóth Nikolett II. PhD hallgató SZTE Környezettudományi Doktori Iskola 2012. augusztus 30. Budapest,
Rezervoár kőzetek gázáteresztőképességének vizsgálata fotoakusztikus detektálási módszer segítségével Tóth Nikolett II. PhD hallgató SZTE Környezettudományi Doktori Iskola 2012. augusztus 30. Budapest,
7.1. Al2O3 95%+MLG 5% ; 3h; 4000rpm; Etanol; ZrO2 G1 (1312 keverék)
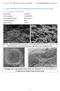 7.1. Al2O3 95%+MLG 5% ; 3h; 4000rpm; Etanol; ZrO2 G1 (1312 keverék) 7.1.1. SPS: 1150 C; 5 (1312 K1) Mért sűrűség: 3,795 g/cm 3 3,62 0,14 GPa Három pontos törés teszt: 105 4,2 GPa Súrlódási együttható:
7.1. Al2O3 95%+MLG 5% ; 3h; 4000rpm; Etanol; ZrO2 G1 (1312 keverék) 7.1.1. SPS: 1150 C; 5 (1312 K1) Mért sűrűség: 3,795 g/cm 3 3,62 0,14 GPa Három pontos törés teszt: 105 4,2 GPa Súrlódási együttható:
Hevesy György Országos Kémiaverseny Kerületi forduló február évfolyam
 Hevesy György Országos Kémiaverseny Kerületi forduló 2013. február 20. 8. évfolyam A feladatlap megoldásához kizárólag periódusos rendszert és elektronikus adatok tárolására nem alkalmas zsebszámológép
Hevesy György Országos Kémiaverseny Kerületi forduló 2013. február 20. 8. évfolyam A feladatlap megoldásához kizárólag periódusos rendszert és elektronikus adatok tárolására nem alkalmas zsebszámológép
Modern Fizika Labor. 2. Elemi töltés meghatározása
 Modern Fizika Labor Fizika BSC A mérés dátuma: 2011.09.27. A mérés száma és címe: 2. Elemi töltés meghatározása Értékelés: A beadás dátuma: 2011.10.11. A mérést végezte: Kalas György Benjámin Németh Gergely
Modern Fizika Labor Fizika BSC A mérés dátuma: 2011.09.27. A mérés száma és címe: 2. Elemi töltés meghatározása Értékelés: A beadás dátuma: 2011.10.11. A mérést végezte: Kalas György Benjámin Németh Gergely
Energia. Energia: munkavégző, vagy hőközlő képesség. Kinetikus energia: a mozgási energia
 Kémiai változások Energia Energia: munkavégző, vagy hőközlő képesség. Kinetikus energia: a mozgási energia Potenciális (helyzeti) energia: a részecskék kölcsönhatásából származó energia. Energiamegmaradás
Kémiai változások Energia Energia: munkavégző, vagy hőközlő képesség. Kinetikus energia: a mozgási energia Potenciális (helyzeti) energia: a részecskék kölcsönhatásából származó energia. Energiamegmaradás
4. változat. 2. Jelöld meg azt a részecskét, amely megőrzi az anyag összes kémiai tulajdonságait! A molekula; Б atom; В gyök; Г ion.
 4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
KÉMIA FELVÉTELI KÖVETELMÉNYEK
 KÉMIA FELVÉTELI KÖVETELMÉNYEK Atomszerkezettel kapcsolatos feladatok megoldása a periódusos rendszer segítségével, illetve megadott elemi részecskék alapján. Az atomszerkezet és a periódusos rendszer kapcsolata.
KÉMIA FELVÉTELI KÖVETELMÉNYEK Atomszerkezettel kapcsolatos feladatok megoldása a periódusos rendszer segítségével, illetve megadott elemi részecskék alapján. Az atomszerkezet és a periódusos rendszer kapcsolata.
Diffúzió. Diffúzió. Diffúzió. Különféle anyagi részecskék anyagon belüli helyváltoztatása Az anyag lehet gáznemű, folyékony vagy szilárd
 Anyagszerkezettan és anyagvizsgálat 5/6 Diffúzió Dr. Szabó Péter János szpj@eik.bme.hu Diffúzió Különféle anyagi részecskék anyagon belüli helyváltoztatása Az anyag lehet gáznemű, folyékony vagy szilárd
Anyagszerkezettan és anyagvizsgálat 5/6 Diffúzió Dr. Szabó Péter János szpj@eik.bme.hu Diffúzió Különféle anyagi részecskék anyagon belüli helyváltoztatása Az anyag lehet gáznemű, folyékony vagy szilárd
Periódusosság. Általános Kémia, Periódikus tulajdonságok. Slide 1 of 35
 Periódusosság 11-1 Az elemek csoportosítása: a periódusos táblázat 11-2 Fémek, nemfémek és ionjaik 11-3 Az atomok és ionok mérete 11-4 Ionizációs energia 11-5 Elektron affinitás 11-6 Mágneses 11-7 Az elemek
Periódusosság 11-1 Az elemek csoportosítása: a periódusos táblázat 11-2 Fémek, nemfémek és ionjaik 11-3 Az atomok és ionok mérete 11-4 Ionizációs energia 11-5 Elektron affinitás 11-6 Mágneses 11-7 Az elemek
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Gázok. 5-7 Kinetikus gázelmélet 5-8 Reális gázok (limitációk) Fókusz Légzsák (Air-Bag Systems) kémiája
 Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gáz egyenlet és általánosított gáz egyenlet 5-4 A tökéletes gáz egyenlet alkalmazása 5-5 Gáz halmazállapotú reakciók
Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gáz egyenlet és általánosított gáz egyenlet 5-4 A tökéletes gáz egyenlet alkalmazása 5-5 Gáz halmazállapotú reakciók
[S] v' [I] [1] Kompetitív gátlás
![[S] v' [I] [1] Kompetitív gátlás [S] v' [I] [1] Kompetitív gátlás](/thumbs/93/114506146.jpg) 8. Szeminárium Enzimkinetika II. Jelen szeminárium során az enzimaktivitás szabályozásával foglalkozunk. Mivel a klinikai gyakorlatban használt gyógyszerhatóanyagok jelentős része enzimgátló hatással bír
8. Szeminárium Enzimkinetika II. Jelen szeminárium során az enzimaktivitás szabályozásával foglalkozunk. Mivel a klinikai gyakorlatban használt gyógyszerhatóanyagok jelentős része enzimgátló hatással bír
A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján.
 A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. Szakképesítés azonosítószáma és megnevezése 54 524 03 Vegyész technikus Tájékoztató
A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. Szakképesítés azonosítószáma és megnevezése 54 524 03 Vegyész technikus Tájékoztató
Laboratóriumi technikus laboratóriumi technikus Drog és toxikológiai
 A 10/2007 (II. 27.) SzMM rendelettel módosított 1/2006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
A 10/2007 (II. 27.) SzMM rendelettel módosított 1/2006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
KÉMIA A KÉMIÁT SZERETŐK SZÁMÁRA
 XXI. Századi Közoktatás (fejlesztés, koordináció) II. szakasz TÁMOP-3.1.1-11/1-2012-0001 KÉMIA A KÉMIÁT SZERETŐK SZÁMÁRA A művelődési anyag tematikájának összeállítása a Nemzeti Alaptanterv és a kapcsolódó
XXI. Századi Közoktatás (fejlesztés, koordináció) II. szakasz TÁMOP-3.1.1-11/1-2012-0001 KÉMIA A KÉMIÁT SZERETŐK SZÁMÁRA A művelődési anyag tematikájának összeállítása a Nemzeti Alaptanterv és a kapcsolódó
Kémiai energia - elektromos energia
 Általános és szervetlen kémia 12. hét Elızı héten elsajátítottuk, hogy a redoxi reakciók lejátszódásának milyen feltételei vannak a galvánelemek hogyan mőködnek Mai témakörök az elektrolízis és alkalmazása
Általános és szervetlen kémia 12. hét Elızı héten elsajátítottuk, hogy a redoxi reakciók lejátszódásának milyen feltételei vannak a galvánelemek hogyan mőködnek Mai témakörök az elektrolízis és alkalmazása
8. osztály 2 Hevesy verseny, megyei forduló, 2009.
 8. osztály 2 Hevesy verseny, megyei forduló, 2009. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthet legyen! A feladatok megoldásában a gondolatmeneted követhet
8. osztály 2 Hevesy verseny, megyei forduló, 2009. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthet legyen! A feladatok megoldásában a gondolatmeneted követhet
Általános kémia képletgyűjtemény. Atomszerkezet Tömegszám (A) A = Z + N Rendszám (Z) Neutronok száma (N) Mólok száma (n)
 Általános kémia képletgyűjtemény (Vizsgára megkövetelt egyenletek a szimbólumok értelmezésével, illetve az egyenletek megfelelő alkalmazása is követelmény) Atomszerkezet Tömegszám (A) A = Z + N Rendszám
Általános kémia képletgyűjtemény (Vizsgára megkövetelt egyenletek a szimbólumok értelmezésével, illetve az egyenletek megfelelő alkalmazása is követelmény) Atomszerkezet Tömegszám (A) A = Z + N Rendszám
Általános Kémia, 2008 tavasz
 9 Elektrokémia 9-1 Elektródpotenciálok mérése 9-1 Elektródpotenciálok mérése 9-2 Standard elektródpotenciálok 9-3 E cell, ΔG, és K eq 9-4 E cell koncentráció függése 9-5 Elemek: áramtermelés kémiai reakciókkal
9 Elektrokémia 9-1 Elektródpotenciálok mérése 9-1 Elektródpotenciálok mérése 9-2 Standard elektródpotenciálok 9-3 E cell, ΔG, és K eq 9-4 E cell koncentráció függése 9-5 Elemek: áramtermelés kémiai reakciókkal
Gázok. 5-7 Kinetikus gázelmélet 5-8 Reális gázok (korlátok) Fókusz: a légzsák (Air-Bag Systems) kémiája
 Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gázegyenlet és általánosított gázegyenlet 5-4 A tökéletes gázegyenlet alkalmazása 5-5 Gáz reakciók 5-6 Gázkeverékek
Gázok 5-1 Gáznyomás 5-2 Egyszerű gáztörvények 5-3 Gáztörvények egyesítése: Tökéletes gázegyenlet és általánosított gázegyenlet 5-4 A tökéletes gázegyenlet alkalmazása 5-5 Gáz reakciók 5-6 Gázkeverékek
8. osztály 2 Hevesy verseny, megyei forduló, 2008.
 8. osztály 2 Hevesy verseny, megyei forduló, 2008. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthető legyen! A feladatok megoldásában a gondolatmeneted követhető
8. osztály 2 Hevesy verseny, megyei forduló, 2008. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthető legyen! A feladatok megoldásában a gondolatmeneted követhető
Minta feladatsor. Az ion képlete. Az ion neve O 4. Foszfátion. Szulfátion CO 3. Karbonátion. Hidrogénkarbonátion O 3. Alumíniumion. Al 3+ + Szulfidion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve Foszfátion Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve Foszfátion Szulfátion
T I T M T T. Hevesy György Kémiaverseny. országos döntő. Az írásbeli forduló feladatlapja. 8. osztály
 T I T M T T Hevesy György Kémiaverseny országos döntő Az írásbeli forduló feladatlapja 8. osztály A versenyző azonosítási száma:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:...
T I T M T T Hevesy György Kémiaverseny országos döntő Az írásbeli forduló feladatlapja 8. osztály A versenyző azonosítási száma:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:...
a NAT /2010 nyilvántartási számú akkreditált státuszhoz
 Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a NAT-1-1494/2010 nyilvántartási számú akkreditált státuszhoz A PAMET Mérnökiroda Kft. (7623 Pécs, Tüzér u. 13.) akkreditált területe I. az akkreditált területhez
Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a NAT-1-1494/2010 nyilvántartási számú akkreditált státuszhoz A PAMET Mérnökiroda Kft. (7623 Pécs, Tüzér u. 13.) akkreditált területe I. az akkreditált területhez
Kémia OKTV I. kategória II. forduló A feladatok megoldása
 ktatási ivatal Kémia KTV I. kategória 2008-2009. II. forduló A feladatok megoldása I. FELADATSR 1. A 6. E 11. A 16. C 2. A 7. C 12. D 17. B 3. E 8. D 13. A 18. C 4. D 9. C 14. B 19. C 5. B 10. E 15. E
ktatási ivatal Kémia KTV I. kategória 2008-2009. II. forduló A feladatok megoldása I. FELADATSR 1. A 6. E 11. A 16. C 2. A 7. C 12. D 17. B 3. E 8. D 13. A 18. C 4. D 9. C 14. B 19. C 5. B 10. E 15. E
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
A gáz halmazállapot. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 A gáz halmazállapot A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 0 Halmazállapotok, állapotjelzők Az anyagi rendszerek a részecskék közötti kölcsönhatásoktól és az állapotjelzőktől függően
A gáz halmazállapot A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 0 Halmazállapotok, állapotjelzők Az anyagi rendszerek a részecskék közötti kölcsönhatásoktól és az állapotjelzőktől függően
Ipari vizek tisztítási lehetőségei rövid összefoglalás. Székely Edit BME Kémiai és Környezeti Folyamatmérnöki Tanszék
 Ipari vizek tisztítási lehetőségei rövid összefoglalás Székely Edit BME Kémiai és Környezeti Folyamatmérnöki Tanszék Kezelés Fizikai, fizikai-kémiai Biológiai Kémiai Szennyezők típusai Módszerek Előnyök
Ipari vizek tisztítási lehetőségei rövid összefoglalás Székely Edit BME Kémiai és Környezeti Folyamatmérnöki Tanszék Kezelés Fizikai, fizikai-kémiai Biológiai Kémiai Szennyezők típusai Módszerek Előnyök
Periódusosság. 9-1 Az elemek csoportosítása: a periódusostáblázat
 Periódusosság 9-1 Az elemek csoportosítása: aperiódusos táblázat 9-2 Fémek, nemfémek és ionjaik 9-3 Az atomok és ionok mérete 9-4 Ionizációs energia 9-5 Elektron affinitás 9-6 Mágneses 9-7 Az elemek periódikus
Periódusosság 9-1 Az elemek csoportosítása: aperiódusos táblázat 9-2 Fémek, nemfémek és ionjaik 9-3 Az atomok és ionok mérete 9-4 Ionizációs energia 9-5 Elektron affinitás 9-6 Mágneses 9-7 Az elemek periódikus
XL. KÉMIAI ELŐADÓI NAPOK
 Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XL. KÉMIAI ELŐADÓI NAPOK Szegedi Akadémiai Bizottság Székháza Szeged, 2017. október 16-18. Szerkesztették:
Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XL. KÉMIAI ELŐADÓI NAPOK Szegedi Akadémiai Bizottság Székháza Szeged, 2017. október 16-18. Szerkesztették:
A hordozós nemesfémeken adszorbeált etanol infravörös (IR) spektruma
 Mindenki számára közismertek az iparosodással és a motorizáció elképesztő mértékű fejlődésével együtt járó környezetszennyezési problémák. A Kyoto-i egyezményben az európai államok összességében azt vállalták,
Mindenki számára közismertek az iparosodással és a motorizáció elképesztő mértékű fejlődésével együtt járó környezetszennyezési problémák. A Kyoto-i egyezményben az európai államok összességében azt vállalták,
Reakciókinetika. aktiválási energia. felszabaduló energia. kiindulási állapot. energia nyereség. végállapot
 Reakiókinetika aktiválási energia kiindulási állapot energia nyereség felszabaduló energia végállapot Reakiókinetika kinetika: mozgástan reakiókinetika (kémiai kinetika): - reakiók időbeli leírása - reakiómehanizmusok
Reakiókinetika aktiválási energia kiindulási állapot energia nyereség felszabaduló energia végállapot Reakiókinetika kinetika: mozgástan reakiókinetika (kémiai kinetika): - reakiók időbeli leírása - reakiómehanizmusok
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
KÖRNYEZETVÉDELMI- VÍZGAZDÁLKODÁSI ALAPISMERETEK
 Környezetvédelmi-vízgazdálkodási alapismeretek középszint 1521 ÉRETTSÉGI VIZSGA 2015. október 12. KÖRNYEZETVÉDELMI- VÍZGAZDÁLKODÁSI ALAPISMERETEK KÖZÉPSZINTŰ ÍRÁSBELI ÉRETTSÉGI VIZSGA JAVÍTÁSI-ÉRTÉKELÉSI
Környezetvédelmi-vízgazdálkodási alapismeretek középszint 1521 ÉRETTSÉGI VIZSGA 2015. október 12. KÖRNYEZETVÉDELMI- VÍZGAZDÁLKODÁSI ALAPISMERETEK KÖZÉPSZINTŰ ÍRÁSBELI ÉRETTSÉGI VIZSGA JAVÍTÁSI-ÉRTÉKELÉSI
Készítette: NÁDOR JUDIT. Témavezető: Dr. HOMONNAY ZOLTÁN. ELTE TTK, Analitikai Kémia Tanszék 2010
 Készítette: NÁDOR JUDIT Témavezető: Dr. HOMONNAY ZOLTÁN ELTE TTK, Analitikai Kémia Tanszék 2010 Bevezetés, célkitűzés Mössbauer-spektroszkópia Kísérleti előzmények Mérések és eredmények Összefoglalás EDTA
Készítette: NÁDOR JUDIT Témavezető: Dr. HOMONNAY ZOLTÁN ELTE TTK, Analitikai Kémia Tanszék 2010 Bevezetés, célkitűzés Mössbauer-spektroszkópia Kísérleti előzmények Mérések és eredmények Összefoglalás EDTA
Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások
 ktatási Hivatal rszágos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások I. FELADATSR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D 9.
ktatási Hivatal rszágos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások I. FELADATSR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D 9.
A II. kategória Fizika OKTV mérési feladatainak megoldása
 Nyomaték (x 0 Nm) O k t a t á si Hivatal A II. kategória Fizika OKTV mérési feladatainak megoldása./ A mágnes-gyűrűket a feladatban meghatározott sorrendbe és helyre rögzítve az alábbi táblázatban feltüntetett
Nyomaték (x 0 Nm) O k t a t á si Hivatal A II. kategória Fizika OKTV mérési feladatainak megoldása./ A mágnes-gyűrűket a feladatban meghatározott sorrendbe és helyre rögzítve az alábbi táblázatban feltüntetett
Mikroszennyezők az ivóvízben és az Ivóvízminőség-javító Program
 Mikroszennyezők az ivóvízben és az Ivóvízminőség-javító Program Dr. Czégény Ildikó, TRV (HAJDÚVÍZ) Sonia Al Heboos, BME VKKT Dr. Laky Dóra, BME VKKT Dr. Licskó István BME VKKT Mikroszennyezők Mikroszennyezőknek
Mikroszennyezők az ivóvízben és az Ivóvízminőség-javító Program Dr. Czégény Ildikó, TRV (HAJDÚVÍZ) Sonia Al Heboos, BME VKKT Dr. Laky Dóra, BME VKKT Dr. Licskó István BME VKKT Mikroszennyezők Mikroszennyezőknek
KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATOK 2003.
 KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATK 2003. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
KÉMIA ÍRÁSBELI ÉRETTSÉGI-FELVÉTELI FELADATK 2003. JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden megítélt
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
MEGOLDÁS. 4. D 8. C 12. E 16. B 16 pont
 A 2004/2005. tanévi rszágos Középiskolai Tanulmányi Verseny második fordulójának feladatmegoldásai KÉMIA (I-II. kategóri MEGLDÁS I. feladatsor 1. A 5. E 9. A 13. E 2. C 6. A 10. E 14. D 3. A 7. B 11. B
A 2004/2005. tanévi rszágos Középiskolai Tanulmányi Verseny második fordulójának feladatmegoldásai KÉMIA (I-II. kategóri MEGLDÁS I. feladatsor 1. A 5. E 9. A 13. E 2. C 6. A 10. E 14. D 3. A 7. B 11. B
2018/2019. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA. I. KATEGÓRIA Javítási-értékelési útmutató
 ktatási Hivatal 2018/2019. tanévi rszágos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. KATEGÓRIA Javítási-értékelési útmutató + 1. PF6 < NF3 < NF4 = BF4 < BF3 hibátlan sorrend: 2 pont 2. Fe
ktatási Hivatal 2018/2019. tanévi rszágos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. KATEGÓRIA Javítási-értékelési útmutató + 1. PF6 < NF3 < NF4 = BF4 < BF3 hibátlan sorrend: 2 pont 2. Fe
2011/2012 tavaszi félév 3. óra
 2011/2012 tavaszi félév 3. óra Redoxegyenletek rendezése (diszproporció, szinproporció, stb.); Sztöchiometria Vegyületek sztöchiometriai együtthatóinak meghatározása elemösszetétel alapján Adott rendezendő
2011/2012 tavaszi félév 3. óra Redoxegyenletek rendezése (diszproporció, szinproporció, stb.); Sztöchiometria Vegyületek sztöchiometriai együtthatóinak meghatározása elemösszetétel alapján Adott rendezendő
1./ Jellemezd az anyagokat! Írd az A oszlop kipontozott helyére a B oszlopból arra az anyagra jellemző tulajdonságok számát! /10
 Név:.. Osztály.. 1./ Jellemezd az anyagokat! Írd az A oszlop kipontozott helyére a B oszlopból arra az anyagra jellemző tulajdonságok számát! /10 A B a) hidrogén... 1. sárga, szilárd anyag b) oxigén...
Név:.. Osztály.. 1./ Jellemezd az anyagokat! Írd az A oszlop kipontozott helyére a B oszlopból arra az anyagra jellemző tulajdonságok számát! /10 A B a) hidrogén... 1. sárga, szilárd anyag b) oxigén...
Általános Kémia GY, 2. tantermi gyakorlat
 Általános Kémia GY, 2. tantermi gyakorlat Sztöchiometriai számítások -titrálás: ld. : a 2. laborgyakorlat leírásánál Gáztörvények A kémhatás fogalma -ld.: a 2. laborgyakorlat leírásánál Honlap: http://harmatv.web.elte.hu
Általános Kémia GY, 2. tantermi gyakorlat Sztöchiometriai számítások -titrálás: ld. : a 2. laborgyakorlat leírásánál Gáztörvények A kémhatás fogalma -ld.: a 2. laborgyakorlat leírásánál Honlap: http://harmatv.web.elte.hu
ROMAVERSITAS 2017/2018. tanév. Kémia. Számítási feladatok (oldatok összetétele) 4. alkalom. Összeállította: Balázs Katalin kémia vezetőtanár
 ROMAVERSITAS 2017/2018. tanév Kémia Számítási feladatok (oldatok összetétele) 4. alkalom Összeállította: Balázs Katalin kémia vezetőtanár 1 Számítási feladatok OLDATOK ÖSSZETÉTELE Összeállította: Balázs
ROMAVERSITAS 2017/2018. tanév Kémia Számítási feladatok (oldatok összetétele) 4. alkalom Összeállította: Balázs Katalin kémia vezetőtanár 1 Számítási feladatok OLDATOK ÖSSZETÉTELE Összeállította: Balázs
