DOKTORI ÉRTEKEZÉS. Szarka Eszter. Témavezető: Prof. Sármay Gabriella, egyetemi tanár
|
|
|
- Ervin Gáspár
- 10 évvel ezelőtt
- Látták:
Átírás
1 Autoantitest profil és B-sejt epitópok vizsgálata citrullinált peptidek segítségével rheumatoid arthritisben és a patomechanizmus vizsgálata a betegség egér modelljében DOKTORI ÉRTEKEZÉS Szarka Eszter Témavezető: Prof. Sármay Gabriella, egyetemi tanár ELTE TTK Biológia Doktori Iskola, Immunológia Program Programvezető: Prof. Erdei Anna, egyetemi tanár ELTE TTK, Immunológiai Tanszék 2014
2 Tartalom 1. Rövidítésjegyzék Bevezetés Irodalmi áttekintés A rheumatoid arthritis A citrullináció fiziológiás funkciója és szerepe rheumatoid arthritisben A rheumatoid arthritis patogenezise ACPA-k fajtái és felfedezésük története Genetikai háttér és környezeti faktorok szerepe A vizsgált, citrullinációs célpontként szereplő fehérjék biológiai funkciója Vizsgálatok a rheumatoid arthritis egér modelljében, a kollagén indukált arthritis (CIA) modellen Az Fcγ receptorok szerepe a CIA kialakulásában Célkitűzések: Anyagok és módszertan Anyagok és reagensek A vizsgált peptidek Betegcsoportok Multipin ELISA Indirekt ELISA Kompetitív ELISA a peptid-specifikus ellenanyagok közötti keresztreakció kimutatására Humán B-sejtek izolálása vérből, tenyésztés Peptid specifikus ellenanyagtermelő sejtek kimutatása ELISpot módszerrel Peptid-specifikus B-sejtek kimutatása áramlási citometriával (FACS) Peptidek hatása RA betegekből szeparált PBMC citokintermelésére Kollagén indukált arthritis indukciója, a betegség fokának nyomonkövetése A 2.4G egyláncú ellenanyag (ScFv) tisztítása Áramlási citometriás mérések Extravidin-FITC tartalmú komplexek in vivo immunofluoreszcens lokalizációja Kollagén- és kollagén peptid specifikus ellenanyagok kimutatása Citokin- és kemokinszint meghatározása Citokinszint meghatározása lépsejtkultúra felülúszójából Statisztikai analízis Eredmények A rheumatoid arthritis diagnosztizálása során alkalmazható, új citrullin tartalmú peptidek azonosítása 34 2
3 6.1.1 Citrullin tartalmú peptidek szűrése RA beteg és egészséges szérummintákkal Kompetíció vizsgálata az egyes citrullin tartalmú peptidekre specifikus szérummintákal _ Citrullin tartalmú peptidekre specifikus ellenanyagtermelés vizsgálata ELISpot módszerrel Peptid-specifikus B-sejtek kimutatása áramlási citometriával In vitro citokintermelés vizsgálata citrullin tartalmú peptidekkel való aktiváció hatására A 2.4G2 scfv és a kollagén CII-peptid által alkotott komplexek hatása a CIA súlyosságára és lefolyására egerekben Kollagén specifikus ellenanyagtermelés vizsgálata a különböző komplexekkel kezelt CIA egerekben A komplexek in vitro kötődése lépsejtekhez és in vivo lokalizációja a lépben Citokin/kemokinszekréció kiváltása az Fc RII/III célzásával Diszkusszió Új tudományos eredmények Összefoglalás Summary Köszönetnyilvánítás Saját közlemények jegyzéke Közlemények az értekezéssel kapcsolódó témában Egyéb közlemények Konferenciaközlemények, absztraktok Irodalomjegyzék
4 1. Rövidítésjegyzék ACPA: anti-citrullinated protein/peptid antibodies / anti-citrullinált fehérje/peptid antitestek AKA: anti-keratin antibody / anti-keratin antitest APC: allophycocyanin / allofikocianin APF: anti-perinuclear factor / anti-perinukleáris faktor AUC: area under curve / görbe alatti terület BLC: B lymphocyte chemoattractant / B limfocita kemoattraktáns BSA: bovine serum albumin / szarvasmarha szérum albumin CD: cluster of differentiation CIA: collagen-induced arthritis / kollagénindukált arthritis CCP: citrulline containing protein/peptide / citrullin tartalmú fehérje/peptid CR: complement receptor / komplement receptor CRP: C-reactive protein / C-reaktív fehérje CII: type II collagen / II típusú kollagén DAS: disease activity score ELISA: enzyme-linked immunosorbent assay / enzimkapcsolt immunszorbens esszé FACS: fluorescent activated cell sorter / fluoreszcencia aktivált sejt szorter FcγR: Fc gamma receptor FITC: fluorescein isothiocyanate Fmoc: fluorenylmethoxycarbonyl G-CSF: granulocyte colony stimulating factor / granulocita kolónia stimuláló faktor IFNγ: interferon gamma ITAM: immunoreceptor tyrosine-based activation motif ITIM: immunoreceptor tyrosine-based inhibition motif LC-biotin: biotinyl-6-aminohexanoic acid (long-chain biotin) / hosszú láncú biotin MARCO: macrophage receptor with collagenous structure MCV: mutated citrullinated vimentin MHC: major histocompatibility complex MIP: macrophage inflammatory protein MMP: matrix metalloprotease MRI: magnetic resonance imaging 4
5 OD: optical density/ optikai denzitás HLA: human leukocyte antigen HRPO: horse radix peroxidase / tormaperoxidáz PAD: peptidyl arginine deiminase PBMC: peripheral blood mononuclear cells RA: rheumatoid arthritis RF: rheumatoid factor / reumafaktor ROC: receiver operating characteristic ScFv: single chain Fv fragment / egyláncú Fv fragmens SD: standard deviation SLE: systemic lupus erythematosus TLR: toll-like receptor TMB: 3,3,5,5 tetramethylbenidine TNFα: tumor necrosis facor alpha t Bu: terc-butiloxicarbonyl Ttds: 4,7,10-trioxa-1,13-tridecanediamino succinic acid 5
6 2. Bevezetés Az autoimmun betegségek a világ népességének jelentős hányadát sújtják. Autoimmun betegségnek nevezünk minden olyan folyamatot, amelyben félresiklott immunválasz alakul ki a szervezetben normálisan jelen lévő struktúrákkal, szövetekkel szemben. A betegség lehet szervspecifikus, vagy szisztémás, érinthet egy vagy több szervet, szövetet is. Egy személy több autoimmun betegségben is szenvedhet. A tünetek változatosak a kórkép kialakulásának az abnormális immunválasznak a helyétől függően, az általános tünetek a krónikus fáradtság, láz, rossz közérzet. A betegség lefolyása során előfordulhatnak fellángolások ( flare-up, relapszus), amikor a tünetek súlyosbodnak, illetve a remisszió fázisában a tünetek enyhülése, esetleg átmeneti megszűnése tapasztalható. A félresiklott immunreakció során gyulladás alakul ki az érintett szövetben, idővel az érintett szövet károsodhat, vagy el is pusztulhat. Az autoimmun betegség kritériumait a Witebsky-féle posztulátum [1] írja le: 1, Közvetlen bizonyíték: a betegség átvihető patogén ellenanyagokkal vagy patogén T-sejtekkel 2, Közvetett bizonyíték: a betegség reprodukálható kísérletes állatmodellekben 3, Másodlagos bizonyítékok: limfocita infiltráció a célszervben, társulás más autoimmun betegségekkel, korreláció bizonyos HLA antigének kifejeződésével, az immunreguláció kedvező terápiás hatása. Az autoimmun betegségek besorolhatók a II, a III vagy a IV típusú túlérzékenységi reakciók közé. Jellemző a nemek közti eltérés a betegség előfordulását illetően. Kialakulásának okai összetettek, általában különböző genetikai, infektológiai és környezeti faktorok játszanak szerepet. A perifériás tolerancia (klonális deléció, anergia, szuppresszió) nem megfelelő működése a betegségek gyakori kiváltó okának számít. Manapság nagyon vitatott terület, hogy mikortól tekinthető autoimmun betegségnek a folyamat. Az adott genetikai háttér szükséges, de önmagában nem elégséges feltétele a kórkép kialakulásának, további környezeti hatások (dohányzás, stressz, fertőzések) indítják el az autoreaktív ellenanyagok termelődését. A különféle infekciók szerepe nagyon fontos, változatos mechanizmusok vezethetnek az autoimmun kórkép kiváltásához molekuláris mimikri, epitóp spreading, bystander hatás, a természetes immunrendszer aktiválása, a citokinkörnyezet megváltozása vagy poliklonális sejtaktiváció révén. A folyamat hosszú időn át tünetmentes lehet, a lassú progresszió sokszor megnehezíti a pontos diagnózis felállítását. Általánosságban elmondható, hogy a kórképek 6
7 rendkívüli összetettsége miatt igen nagy szükség van a témában folytatott alapkutatásokra, amelyek a betegségek hátterét, patomechanizmusát derítik fel. A posztulátum második pontjában említett kísérletes állatmodellek jól alkalmazhatók az autoimmun kórképekben mind alapkutatásra, mind terápiás szerek vizsgálatára, miközben nem szabad figyelmen kívül hagyni az ember és a modellállat között meglévő genetikai-immunológiai sajátosságokat, különbségeket. Szintén a kórképek összetettségéből következően szükséges az újabb és újabb diagnosztikai markerek felkutatása, megkönnyítendő a hasonló kórképek egymástól való elkülönítését, a terápia mielőbbi elkezdését, illetve a megfelelő kezelés kiválasztását. Doktori munkám célja egyrészt a rheumatoid arthritis újabb diagnosztikai lehetőségeinek felkutatása, másrészt a betegség patomechanizmusának vizsgálata kollagén indukált arthritisben, az RA egér modelljében. 7
8 3. Irodalmi áttekintés 3.1 A rheumatoid arthritis A rheumatoid arthritis (RA) krónikus, autoimmun betegség. Világviszonylatban körülbelül 1% a prevalenciája, háromszor annyi nő érintett, mint férfi. A betegség fő jellemzője elsősorban a kéz és láb kisízületeiben szimmetrikusan jelentkező ízületi gyulladás. A patológiás folyamat előrehaladtával a gyulladás továbbterjedhet a nagy ízületekre, majd a csigolyákra is. A betegség súlyossága, kimenetele az enyhe betegségtől a súlyos ízületi gyulladásig széles skálán mozog. Súlyosabb lefolyású esetekben a beteg teljesen mozgásképtelenné válhat, tolókocsiba kényszerülhet. Az autoimmun folyamat lényege, hogy bizonyos saját ízületi fehérjék ellen immunválasz alakul ki, ennek következménye az ízületi csont és porc degradációja. A betegség kezdetén fellépő fáradékonyság, láz és testsúlycsökkenés után az ízületi gyulladás első tünete, hogy az ízületet borító membrán megvastagszik, vérbővé válik, és nagy mennyiségben termeli az ízületi folyadékot. Ettől jelentős mértékű duzzanat jön létre, ez akadályozza az ízületi mozgást, az izmok görcsbe rándulhatnak és az ízület behajlított állapota állandósulhat. Közben ínhüvelygyulladás, a bőrben reumás csomók és csontelváltozások keletkezhetnek. A betegség előrehaladtával fájdalmas kötőszövetes vagy csontos ízületi merevség alakul ki az adott ízület torzulásával. Az RA átlagosan 3-7 évvel megrövidítheti a várható élettartamot, miután megnő az ilyen betegek hajlama a fertőzésekre és az érelmeszesedésre is. Kialakulásában genetikai tényezőknek, környezeti hatásoknak (dohányzás, stressz), fertőzéseknek is egyaránt szerepük van, vagyis multifaktoriális betegségről beszélünk. A rheumatoid arthritis jelenleg nem gyógyítható véglegesen, de hatékony kezelésére van lehetőség. A gyógyszeres kezelés két nagyobb csoportra bontható. Az egyik a tünetek megszüntetésére, fájdalomcsillapításra irányul. A kezelés nem szteroid gyulladáscsökkentőkkel, illetve szteroidokkal történik. A másik nagy csoportba azok a gyógyszerek tartoznak, melyek a betegség lefolyását tudják módosítani. Ezek az úgynevezett bázisterápiás, azaz DMARD (Disease-Modifying Antirheumatic Drugs) szerek. Amennyiben valamelyik gyógyszer szedése nem eredményez javulást, vagy mellékhatások jelentkeznek, úgy lehetőség van egy másik bázisterápiás szerre való váltásra, de lehetséges több szer kombinált alkalmazása is. Ha így sem érhető el a kívánt hatást, akkor a jelenlegi legfejlettebb, úgynevezett biológiai terápia segíthet. Számos biológiai terápiás szer (Mabthera/Rituxan anti CD 20, Humira anti- TNFα, Embrel TNFαR-IgG1 fúziós fehérje, Cimzia anti- TNFα, Remicade anti- TNFα, Tocilizumab anti-il-6 8
9 receptor) alkalmazásával elérhetők tünetmentes időszakok, illetve remisszió. Sajnos azonban ezek a szerek egy idő után hatástalanná válnak hozzászokás vagy immunreakció kialakulása miatt így újabb és újabb gyógyszerek alkalmazására van szükség. A gyógyszeres kezelés mellett egyéb lehetőségek is rendelkezésre állnak, mint például gyógytorna, fizikoterápia és UV-fény terápia, illetve súlyosabb esetben akár ortopédsebészeti műtéti beavatkozásra kerülhet sor. A kezelés hatékonyságának növelésében, a szövetkárosodás elkerülése érdekében fontos tehát a betegség mielőbbi diagnosztizálása. Ma olyan érzékeny, a betegség korai felismerésére alkalmas laboratóriumi és képalkotó (röntgen, izotópvizsgálat, MRI) eljárások állnak rendelkezésre, melyekkel a betegséget a tünetek megjelenése után heteken belül diagnosztizálni lehet. Mivel azonban a kóros folyamat, az autoantitestek termelődése már évekkel a tünetek megjelenése előtt elindul, szükséges volna ezen korai stádium diagnosztizálása, amely ma még nem teljesen megoldott feladat. A rheumatoid arthritis a III. típusú, azaz immunkomplex-mediált túlérzékenységi reakciók csoportjába sorolható be. Az RA-ban szenvedő betegek szérumából az autoantitestek két jelentős csoportja mutatható ki [2]. A reumafaktor (RF) a humán IgG Fc régiójával reagáló, IgM, IgG valamint IgA izotípusú ellenanyag, amely a betegek 80 százalékában jelen van. Megemlítendő, hogy az RF más autoimmun betegségben szenvedőkben, sőt egészséges emberek 15 százalékában is kimutatható. Az anti-citrullinált protein autoantitestek (ACPA) egyes citrullinált fehérjéket felismerő IgG, IgM vagy IgA izotípusú ellenanyagok. Az ACPA-ra jellemző, hogy jobban prognosztizálnak, a szintjük stabilabb, mint az RF-é. Az ACPA-k jelenléte RA-ban más autoimmun betegségben szenvedők szérummintáival összehasonlítva a reumafaktornál nagyobb szenzitivitást és specificitást mutat [3], [4]. A betegség kialakulása előtt akár 5-10 évvel kimutathatók a szérumból, ezért a betegség előrejelzésére már tünetmentes állapotban is alkalmazhatók. 3.2 A citrullináció fiziológiás funkciója és szerepe rheumatoid arthritisben A citrullináció a szervezetben fiziológiásan is lejátszódó reakció, melyben peptidil arginin deimináz (PAD) enzimek aktiválódása következtében, poszttranszlációs módosulásként egyes fehérjék bizonyos argininjei citrullinná módosulnak. Az arginin erős bázikus tulajdonságával ellentétben a citrullin semleges, így a módosulás befolyásolja a fehérje össztöltését, a 9
10 töltéseloszlást, megváltozik az izoelektromos pont, illetve változások lépnek fel az ionos és hidrogénkötések erősségében. Ezen változások összességének hatására módosulhat a fehérje elsődleges, másodlagos és harmadlagos szerkezete (1. ábra), de bekövetkezhet denaturáció is. A szerkezetváltozás jelentős befolyást gyakorolhat más fehérjékkel történő interakciókra [3], [5]. A PAD a Ca 2+ -kötő enzimek csoportjába tartozik, aktivációjához magas Ca 2+ koncentráció szükséges. Normális körülmények között az enzim inaktív, aktivitást csak extrém körülmények között (pl. gyulladás, apoptózis) mutat [6]. A PAD szerepet játszik többek között az epitél sejtek terminális differenciációjában, a génexpresszió szabályozásában, valamint az apoptózis folyamatában. A terminális differenciáció során a citokeratin polimerizációjáért illetve a filaggrin profilaggrinból való kialakulásáért felelős. Apoptóziskor a vimentin citrullinációja miatt annak depolimerizációja következik be, a sejt elveszíti az intermedier filamentum hálózatát, ezáltal a sejtalak megváltozik. A génexpresszió szabályozásában a hisztonfehérjék, illetve nukleofozmin citrullinációja játszik szerepet [6]. A nukleofozmin ribonukleoprotein struktúrákhoz kapcsolódó fehérje, a riboszóma létrehozásában és a nukleoluszban zajló transzprotfolymatokban van szerepe. Fehérjék citrullinációja szerepet játszik patológiás körülmények között különböző kórképek kialakulásában is, így a multiplex sclerosisban, Alzheimer-kórban, és a rheumatoid arthritisben. RA betegek %-ánál az ízületi saját antigének citrullinációja lehet felelős az immunológiai tolerancia áttöréséért (1. ábra). 10
11 Arginin Citrullin Aktív enzim PADI Citrullináció A harmadlagos szerkezet megváltozása Negatív töltésű aminosav T-sejt aktiváció 1. ábra: A citrullináció következtében a fehérjék harmadlagos szerkezete megváltozik, a Arginin megváltozott saját felismerése felelős az immunológiai tolerancia áttöréséért [3] (módosítva) Citrullin 3.3 A rheumatoid arthritis patogenezise A betegség kialakulásának hátterében az immunrendszer kóros működése áll, melynek lényege, hogy az a saját fehérjék ellen indít támadást, de mivel azok végleges eliminácója nem következhet be, krónikus gyulladás alakul ki. A shared epitóp elmélet szerint a folyamat kialakulásában olyan, az MHC II HLA-DRB1 alléljei által kódolt shared epitóp (QKRAA/QRRAA/RRRAA) által felismert peptidszekvenciák játszanak szerepet, amelyek a saját epitópokhoz igen hasonlóak. Ezek a szekvenciák számos krónikus fertőzésért felelős mikroorganizmusban is kifejeződnek. Ezzel magyarázható, hogy bizonyos bakteriális fertőzéseket követően, molekuláris mimikri révén autoimmun betegség alakulhat ki. Az ACPA-k akár évekkel a tünetek megjelenése előtt kimutathatók a később RA-ban szenvedő betegek szérumából. Ha egyszer megjelennek, nagy valószínűséggel kialakul a betegség, ami arra utal, hogy fontos kapcsolat van a citrullinált antigének ellen kialakult immunválasz és az RA között. Valószínű, hogy az antitest termelés és a betegség kialakulása két külön esemény [7]. Ugyanakkor meg kell jegyeznünk, hogy az RA betegek körülbelül egyharmada ACPA negatív. A jelenlegi feltételezés szerint az RA kialakulásához szükséges 11
12 egy második hatás is. Például egy trauma, vagy átmeneti fertőzés, mely együtt jár az ízületek gyulladásával. Ez kiváltja a PAD enzim aktivációját és ennek következtében az ízületi peptidek/fehérjék citrullinációját [8]. ACPA-pozitív RA kialakulása során, a citrullinált saját molekulákra specifikus ellenanyagok először az ízületen kívül (pl. a tüdőben) alakulnak ki, ahol a dohányzás és szennyező anyagok hatására a PAD enzim aktivitása fokozott mértékű. Az ACPA és az ízületi citrullinált antigének immunkomplexeket képeznek, amelyek gyulladási folyamatokat indítanak el az ízületekben [8], [9](2. ábra). Önmagában sem a dohányzás, sem a PAD aktiváció nem vezet ACPA termelődéshez [10]. Immunkomplex képződés 2. ábra: A betegség kialakulásának modellje [9] (módosítva) RA-ban az ízület gyulladása során az ízületi hártya sejtjei számos osztódáson mennek keresztül, kialakul a pannus, amely ráterjed a porc felszínére és annak károsodását idézi elő. A folyamat során új erek képződnek, melyekből fehérvérsejtek képesek az ízületi térbe vándorolni [7]. A stimulált rétegbe diffúz módon beszűrődnek a T- és B-sejtek. Follikuláris struktúrában felhalmozódnak a limfociták, majd granulomaszerű reakció alakul ki az ízületi membránban. Az aktivált T-sejtek gyulladási citokineket termelnek [11], és részt vesznek a makrofágok aktivációjában, illetve a T-sejtektől függő B-sejt aktivációban. Egyes citokinek (IL-1, TNF-α) hatására az ízületi fibroblasztokban a mátrix metalloproteinázok 12
13 termelése jelentősen fokozódik, melyek aktivitása következtében a mátrix degradálódik [12]. A mátrix metalloproteinázok (MMP) szubsztrátjai a fibrilláris kollagén, fibronektin, laminin és a fibrin. Az MMP-k egymás aktivációjáért is felelősek. Szintén az IL-1, TNF-α illetve az IL-17 hatására a RANKL upregulációja következik be, amely kiemelt szerepet játszik az oszteoklasztok differenciálódásában, aktivációjában. A fokozott oszteoklaszt aktivitás a csont eróziójához (3. ábra) vezet [2], [13]. A hyalinporc és csontszövet ezúton történő károsodása felelős a betegek mozgáskorlátozottá válásáért. 3. ábra: Röntgenfelvétel a kéz csontjainak eróziójáról [1] 3.4 ACPA-k fajtái és felfedezésük története Az első ACPA-t anti-perinuclear factor (APF) néven 1964-ben detektálták. Az ellenanyag a humán nyelőcső nyálkahártya membrán epitél sejtjeinek keratohialin szemcséivel reagált 13
14 [4]. RA-s betegek %-ban volt kimutatható, szenzitivitása alacsonynak adódott ben detektálták az anti-keratin antibody -t (AKA), humán és patkány nyelőcső minták vizsgálatakor, az ellenanyag a nyelőcső elszarusodó hámrétegével reagált [4, 7], [14]. Valamivel alacsonyabb szenzitivitása volt (kb %), mint az APF-nek (kb. 90 %). A két ellenanyag specificitása viszont hasonló mértékű volt [14] ban azonosították mindkét ellenanyag antigénjét, amit nem a keratin, hanem a filaggrin. A filaggrin a keratin-filamentumokhoz kapcsoltan helyezkedik el elszarusodó hámsejtekben [4]. További kutatások során kimutatták, hogy az APF olyan fehérjéket ismer fel, mely az arginin helyett egy szokatlan aminosavat tartalmaztak, a citrullint. Ezt más RA-specifikus ellenanyagok által felismert fehérjékben is azonosították. Bár a specificitása eltérő ezen antitesteknek, és valószínűleg a citrullináltság mértéke is befolyásolja a felismerést, de abban megegyeznek, hogy mindegyikük citrullinált antigéneket ismer fel. Ezért a megnevezésük anti-citrullinated protein/peptide antibody (ACPA) [7]. A továbbiakban két irányba indult el a diagnosztikai kitek létrehozása, a citrullinált protein illetve a citrullinált peptid alapú kitek fejlesztése indult el [4]. A peptid alapú tesztekben a citrullin beépítése peptid szintézis közben zajlik, míg a protein alapú tesztekben a citrullináció szintézis után, izolált PAD enzim általi deiminálással történik. Az első generációs anti-ciklikus citrullinált peptid (anti-ccp) tesztek alapját a humán filaggrinból származó szintetikus, lineáris peptidek alkották, melyek szenzitivitását ciklizálással növelték meg [15]. A második és harmadik generációs tesztekben (CCP2 és CCP3) antigénként a filaggrinnal nem homológ peptidek keveréke szolgált [3]. Az anti-ccp2 tesztek specificitása az RA szérum ellenanyagok kimutatásában kb %, szenzitivitása % körüli [14, 16]. A protein alapú tesztek közül kiemelendő az MCV (mutated citrullinated vimentin) teszt, melynek antigénje a citrullinált vimentin ben egy új RA-specifikus antitestet írtak le, melyet az első beteg neve alapján (Savoie) anti-sa-nak neveztek el. Ennek az új ellenanyagnak a jelenléte RA-ban igen magas specificitást mutatott (kb %) és már nem csak diagnosztikai, hanem prognosztikai jelentőséggel is rendelkezett. Az anti-sa szeropozitív egyénekben súlyosabb lefolyású betegség alakult ki ben azonosították, hogy az anti-sa antitest szubsztrátja nem más, mint a citrullinált vimentin. Az RF negatív RA betegek kb. 27%-ában kimutatható volt anti-sa. RA betegek ízületeiben az eredetitől eltérő, módosított citrullinált vimentint mutattak ki, ezért mutáns citrullinált vimentint használnak antigénként az ELISA tesztben anti-sa detektálására (MCV teszt) [14], [17] (4. ábra). 14
15 Anti- Perinukleáris Faktor Anti- Keratin Antitestek Anti- Filaggrin Antitestek Anti- Citrullin Származék Antitestek Anti- Citrullinált Protein Antitestek Anti- Citrullinált Peptid Antitestek Deiminált Rekombináns Filaggrin Deiminált Vimentin Vossenaar 2004 Deiminált Fibrin Szintetikus Ciklikus Citrullinált Peptidek EBNA-1 Peptid 4. ábra: ACPA autoantitestek és az eddig kifejlesztett diagnosztikai kitek összefoglalása [3] 3.5 Genetikai háttér és környezeti faktorok szerepe A rheumatoid arthritis kialakulási kockázata körülbelül 50 %-ban genetikailag meghatározott. A betegségben háromszor annyi nő érintett, mint férfi. A betegség tényleges kialakulásában a genetikai háttér, és számos környezeti faktor interakciója egyaránt szerepet játszik. Régóta 15
16 ismert, hogy bizonyos, MHC II osztályba tartozó HLA allélek (HLA-DRB1) összefüggésbe hozhatóak a kórral. Az RA megjelenése korrelációt mutat a HLA-DRB1 β-láncában expresszálódó specifikus, konszenzus aminosav szekvenciával (QKRAA/QRRAA/RRRAA), ez a shared epitóp [18]. Ez a struktúra az MHC molekula peptidkötő zsebének kialakításában vesz részt. A kaukázusi népcsoporthoz tartozó RA betegek %-ánál kimutatható a shared epitóp. Azt is kimutatták, hogy a HLA-DR1 és HLA-DR4 alléljának jelenléte ACPA pozitivitásra hajlamosít az azt hordozó egyedekben, ugyanakkor a HLA-DR3 allél hordozói ACPA negatívak [19]. Bizonyos környezeti faktorok, például a hosszú távú dohányzás jelentős kockázati tényező a betegség kialakulásában. A dohányzás következtében a tüdőbe jutott toxikus anyagok a sejtek apoptózisához vezetnek. Az apoptotizáló sejtekben a PAD aktiválódik, ennek következtében fokozódik a citrullináció, ami a shared epitópot hordozó egyénekben fokozottan növeli az RA kialakulásának rizikóját [20]. A citrullináció több fehérje esetében lehetővé teszi az antigénfelismerést, ugyanis egyes citrullinált peptidek tökéletesen illenek a shared epitóp P4- es zsebébe, míg az arginintartalmú peptidek nem [5]. Feltehetően fertőző ágensek, mint Epstein-Barr vírus (EBV), Mycobacterium tuberculosis, Escherichia coli, Proteus mirabilis, retrovírusok és Parvovírus B19 szintén szerepet játszhatnak a kóros folyamat elindításában, egyrészt molekuláris mimikri, másrészt gyulladási citokinek fokozott termeltetése következtében [20]. Ugyancsak szoros kapcsolat mutatkozik az RA és a periodontitisz betegség között, melynek kórokozója, a Porphyromonas gingivalis - a baktériumok közt egyedülálló módon - PAD enzimet expresszál. A két betegség együttes jelenléte esetén a P. gingivalis elleni antitestek erős korrelációt mutatnak az anti-ccp antitestekkel [21]. Az is ismert, hogy sérüléskor, illetve más behatásokra fellépő nekrózis esetén a membránintegritás megszűntével a PAD kiáramlik az intersticiális térbe, majd aktiválódik az ott jelenlévő magas Ca 2+ -szint következtében. Ez a jelenlevő fehérjék citrullinációját okozhatja. Összefoglalva, a shared epitóp hordozó egyénekben a fertőző ágensekkel való fertőzést követően bekövetkezhet a saját, citrullinált fehérjék felismerése, ami az RA kialakulásához vezet. 16
17 3.6 A vizsgált, citrullinációs célpontként szereplő fehérjék biológiai funkciója A vimentin főleg mezenchimális sejtekben lévő intermedier filamentum, aminek fontos szerepe van a sejt szerkezetének fenntartásában [17]. Megtalálható az ízületi membránban és extracellulárisan is, ezért RA-ban fontos autoantigénnek tartják. Kutatások szerint az anti-citrullinált vimentin ellenanyagok nem csak érzékeny és specifikus szerológiai markerei az RA-nak, hanem közvetlenül részt is vesznek a betegség patogenezisében [17], [22]. A PAD enzim fontos a vimentin filamentum depolimerzációjában. Az enzim indukálja a filamentum szétszerelődését (pl. apoptóziskor). Ennek eredményeként a finom vimentin filamentum hálózat átalakul, és amorf klaszterek keletkeznek a sejtmag körül. Ez a sejtmag körüli kondenzáció kiváltja a kromatin szerkezet sérülését. Kísérlettel is kimutatták, hogy ha monocitáknál és makrofágoknál apoptózist indukálnak, akkor szelektív vimentin citrullináció figyelhető meg. Gyulladt ízületben a hosszú ideje aktiválódott makrofágok apoptózissal elpusztulnak, melynek következtében az intracelluláris vimentin citrullinálódik bennük. Az extracelluláris proteinek - mint például a fibrin - később módosulnak, miután a PAD enzim kiszivárgott a haldokló makrofágokból [8]. A vimentin fehérje fontos molekula a T-sejt válasz kiváltásában: összehasonlították a vimentin és fibrinogén peptid T-sejt aktivációra kiváltott hatását HLA-DR4 transzgénikus egerekben. A két peptid közül a vimentin esetében csak a citrullinált változat váltott ki nagyobb T-sejt aktivációt és IFNγ termelést, míg fibrinogén esetében nem volt szignifikáns különbség a natív és a citrullinált forma között. Tehát elmondható, hogy a citrullinált vimentin fontosabb a T-sejt válasz kiváltásában, mint a fibrinogén [8], [23]. A filaggrin a humán epidermisz keratinfilamentumaihoz kapcsolódó fehérje, a profilaggrinból alakul ki az epitheliális terminális differenciálódás során, és a sejtek keratohyalin granulumaiban raktározódik. A profilaggrin tandem filaggrin egységet tartalmaz, az elszarusodás folyamata alatt válik elérhetővé a proteázok számára. A filaggrin egységek felszabadulnak, majd citrullinálódnak [24]. A filaggrin szerepe az RA kialakulásában még nem tisztázott, mivel a filaggrin nem található meg az ízületekben. A citrullinált filaggrint felismerő ACPA esetében valószínűleg keresztreakcióról van szó [25]. A kollagén a kötőszövet egyik fő alkotója, három hélixből (két α1 és egy α2 láncból) felépülő fehérje. A kollagén rost tropokollagén alegységekből áll, azok kovalens kapcsolódásával jön létre. A II típusú kollagén az ízület fő alkotóeleme, a hyalinporc kollagéntartalmának 80-90%- a, kollagén elleni autoantitestek a betegek közel 30 százalékából kimutathatóak [26], [27]. A 17
18 szinoviális membránban kollagén specifikus T-sejtek jelenlétét is sikerült igazolni [28], [29]. Azonban ebben az esetben sem tisztázott, hogy az ellenanyagok jelenléte és a betegség kialakulása között van-e valós összefüggés, ugyanis az anti-kollagén autoantitestek nem csupán a kollagén citrullinált formájával reagálnak [30], [31]. 3.7 Vizsgálatok a rheumatoid arthritis egér modelljében, a kollagén indukált arthritis (CIA) modellen A rheumatoid arthritis kísérletes állatmodelljei rendkívül fontos szerepet játszanak a betegség patomechanizmusának jobb megértésében, valamint a hatékony és biztonságos terápia fejlesztésében. A rágcsáló modellek számos fontos információt tártak fel a betegség mechanizmusáról, még az eltérő genetikai háttér ellenére is. A kollagén indukált arthritis a humán rheumatoid arthritis széles körűen alkalmazott állatmodellje, annak rendkívül hasonló immunológiai háttere miatt: jellemző a rendkívül magas autoantitest-termelés és a kollagén-specifikus T-sejtek jelenléte [32]. Mivel a CIA a II típusú kollagén MHC-korlátozott felismerésétől függő modell, az immunválasz mértéke jelentősen eltér az egyes egértörzsek között. A betegség DBA/1 egértörzsben váltható ki II típusú szarvasmarha kollagén oltásával [33]. A II típusú kollagénben a aminosavak között leírtak egy immunodomináns, triplahelikális B-sejt epitópot, amely az arthritissel összefüggésbe hozható [34]. Az arthritogén anti-kollagén immunkomplex kristályszerkezetének megoldása arra utal, hogy az autoantitestek a CII egy konzervált régiójához kötődnek [35]. Kimutatták, hogy ezt az epitópot felismerik RA betegekből származó szérumok, de ez nem tapasztalható más donorokból származó szérummal. Továbbá két, erre a triplahelikális epitópra specifikus monoklonális ellenanyaggal sikerült arthritist kiváltani az arra nem hajlamos BALB/c egerekben [36, 37]. Az is ismert, hogy az anti-cii IgG tartalmú immunkomplex képes a betegség lefolyását módosítani az aktiváló Fcγ receptorhoz kötődésen keresztül [38], [39]. Az IgG tartalmú immunkomplexek nagyon fontos tényezők az arthritis pathogenezisében: szabályozó szerepük van mind a CIA centrális, mind pedig az effektor fázisában [40]. 3.8 Az Fcγ receptorok szerepe a CIA kialakulásában 18
19 Az egérben az IgG receptorok négy csoportja került azonosításra: FcγRI, FcγRIIb, FcγRIII és FcγRIV [41, 42]. Ezek közül az FcγRI, FcγRIII és FcγRIV széles körűen expresszálódnak különféle fehérvérsejteken: neutrofil granulocitákon, makrofágokon, NK sejteken és dendritikus sejteken. Képesek sejtaktivációs szignálok közvetítésére az ITAM (immunoreceptor tyrosine-based activation motif ) motívumukon keresztül [41, 43-45]. Ezzel ellentétben, az FcγRIIb ITIM motívumot (immunoreceptor tyrosine-based inhibition motif) tartalmazó, gátló receptor [46-48]. Az FcγRIIb B-sejteken, makrofágokon, dendritikus sejteken és hízósejteken is expresszálódik. Az FcγRIIb hiánya fogékonnyá teszi a normális körülmények között ellenálló egértörzseket különböző, ellenanyag vagy immunkomplex-függő autoimmun betegségekre [49-51]. Az aktiváló és gátló FcγR szignálok egyensúlya messzemenően befolyásolja a betegség kimenetelét: az FcγRIIb gátol, míg az aktiváló Fcγ receptorok serkentik a CIA kialakulását [42, 52, 53]. Ezt alátámasztja, hogy FcR γ lánc-deficiens egerek teljes mértékben rezisztensek az ellenanyag-mediált arthitisre [38]. 4. Célkitűzések: A doktori munkám célja A) a rheumatoid arthritis diagnosztizálása és prognosztizálása során alkalmazható, új citrullin tartalmú peptidek azonosítása, amelyek egyben alkalmasak egy jövőbeni terápia fejlesztésére. B), További célunk volt a rheumatoid arthritis egér modelljén, a kollagén indukált arthritisben (CIA) a kollagén peptidből és az FcγRII-höz irányító egyláncú 19
20 ellenanyag molekulából álló mesterséges komplexek hatását tanulmányozni a CIA lefolyására és patomechanizmusára. A következő kérdéseket tettük fel: A) 4.1. Az RA betegek szérum mintáiban jelenlevő ACPA által felismert fehérjék (filaggrin, vimentin, kollagén) előzőleg - részben általunk - feltérképezett szekvenciáinak megfelelő citrullinált peptidek, illetve az ezekből álló peptid-panel alkalmas-e az autoantitest profil meghatározására, és ad-e többletinformációt a betegekről a jelenleg elérhető, az ACPA kimutatásra alkalmas kitekkel (anti-ccp2) összehasonlítva? 4.2. Felismerik-e az RA betegek B-sejtjeinek receptorai (BCR) az előző vizsgálatok során azonosított citrullin tartalmú peptideket? Alkalmasak-e a citrullinált epitópok az autoreaktív B-sejtek izolálására? 4.3. Alkalmasak-e a citrullin tartalmú peptidek a B-sejtek autoantitest termelésének vizsgálatára? B) További célunk a betegség patomechanizmusának vizsgálata, különös tekintettel az immunkomlplex-mediált folyamatokra CIA modellben. A kezelés során négy csoportot vizsgáltunk: a kontroll CIA állatokat, a kollagén peptid-extravidin tetramerrel oltott állatokat, a 2.4G2 egyláncú (FcγRII/III specifikus) ellenanyag extravidin tetramerel oltott állatokat, ill. a mesterséges immunkomplexszel (kollagén peptid extravidin- 2.4G2) kezelt állatokat Eltér-e a CIA-ban a betegség kialakulása és lefolyása a fenti állatcsoportokban a különböző komplexekkel való kezelés hatására? 4.5. Milyen az extravidin-fitc tartalmú komplexek lépben való eloszlása, milyen sejtekhez kötődnek a komplexek in vitro és in vivo? 4.6. Hogyan befolyásolják a komplexek a kollagén fehérje elleni és a kollagén peptid elleni ellenanyagtermelést? 20
21 4.7. Változik-e a citokin- és kemokintermelés a különböző komplexek hatására CIA egerekben? 5. Anyagok és módszertan 5.1 Anyagok és reagensek Ellenanyagok: Rabbit Anti-Human IgG HRPO konjugátum (Dako), Mouse Anti-Human CD 19 APC (BD Pharmingen), Mouse Anti-Human CD 27 PE (BD Pharmingen), Mouse Anti-Human CD 3 FITC (BD Pharmingen),Mouse Anti-Human CD 14 APC (BD Pharmingen), Goat Anti- Mouse IgG HRPO (Southern Biotech), Goat Anti-Mouse IgG2a (Southern Biotech), Rat Anti- 21
22 Mouse MARCO ( IBL-12 klón, Pécs), Goat Anti-Rat IgG Cy3 (7G6 klón, Pécs), Rat Anti- Mouse CR1/2 PE (Soft Flow Inc.), Rat Anti-Mouse CD45R (B220)- PerCP/Cy5.5 (AbD Serotec), Hamster Anti-Mouse CD11c-Alexa 647 (AbD Serotec), Rat Anti-Mouse F4/80- Alexa 647 (ebioscence Ltd.) Reagensek: Ficoll-Paque (GE Healthcare), CpG (Sigma), Rh-IL-2 (Immunotools), NeutrAvidin (Thermo Scientific), BSA (Sigma), cryostat-embedding medium (Killik; Bio-Optica), BirA (Avidity LLC ), bovine type II kollagén (Chondrex Inc.), komplett Freund adjuváns (Chondrex Inc.) FluoSpheres NeutrAvidin 1,0 µm, yellow-green fluorescent (Invitrogen), RosetteSep Human B Cell Enrichment Cocktail (Stemcell), MACS CD 19 MicroBeads, human (Miltenyi Biotec) Human IgG ELISpot Plus kit (MabTech), Anti-MCV (Orgentec), CCPlus IMMUNOSCAN (Euro Diagnostica), Quantikine ELISA kitek TNFα, IL-17, IFNγ, IL-10 (R&D Systems), Mouse Cytokine Array, Panel A (R&D Systems), FlowCytomix (Bender Med Systems) 5.2 A vizsgált peptidek Vizsgálataink során szintetikus peptid párokat teszteltünk, az egyik arginint, a másik citrullint tartalmazott. A peptidszekvenciákat egyrészt az irodalomban megjelent eredmények [54], [55] másrészt saját előzetes eredményeink alapján választottuk ki. Mivel az ELISA módszer során a peptideket a szilárd fázishoz neutravidin-biotin kölcsönhatás segítségével kötjük ki, vizsgáltuk, hogy milyen hatással van a kölcsönhatásra, hogy a peptid a C- vagy az N- terminálison tartalmazza a biotint. Azt tapasztaltuk, hogy a rövid peptidek csak akkor kötődtek ki megfelelően, ha a C-terminálison voltak biotinálva. A másik szempont, a linker és biotin optimalizálása volt. A biotint vagy lizinen (K) keresztül vagy egy plusz linker (Ttds - 4,7,10-trioxa-1,13-tridekándiamino borostyánkősav) segítségével kapcsoltatták a peptidekhez, illetve a biotin két változatát használva, az egyik a molekula hosszabb láncú formája (LC biotin, biotinhexánsav). A hosszabb láncú biotin nagyobb teret biztosít a peptidnek, hogy az ellenanyag molekulák jól megközelítsék az oldatban [56]. A csoport által legjobbnak talált optimalizált peptid párokat használtuk vizsgálataink során (1. táblázat). A peptidek szintézisét az MTA-ELTE Peptidkémiai Kutatócsoportjában Dr. Magyar Anna vezetésével végezték. 22
23 1. táblázat: Az optimalizált peptidpárok és szekvenciáik 5.3 Betegcsoportok A vizsgálatokhoz 156 RA betegből származó 209 szérum és vérmintáit használtuk fel, melyet a Budai Irgalmasrendi Kórházból Dr. Nagy György és Dr. Rojkovich Bernadette bocsátott Peptid Kontroll szekvencia Citrullin tartalmú szekvencia Filaggrin (19-mer) 306 SHQESTRGRSRGRSGRSGS 326 SHQESTXGXSXGRSGRSGS C-term. LC- biotin Filaggrin 311 (5-mer) C-term. TRGRS 315 TXGRS Ttds-biotin Vimentin C-term. 65 SAVRARSSVPGVR 77 SAVRAXSSVPGVR biotin II típusú kollagén 359 ARGLTGRPGDA 369 AXGLTGXPGDA C-term. biotin rendelkezésünkre. A betegek közül 140 nő és 26 férfi volt, átlagéletkoruk (±SD) 57 ± 14 év (tartomány: év) volt. Összehasonlításul 164 kontroll (H) (ezeket Dr. Prohászka Zoltán, a Semmelweis Egyetem III. sz. Belgyógyászati Klinika munkatársa bocsátotta rendelkezésünkre) személy szérum és vérmintáit vizsgáltuk meg, ezek közül 16 kontroll személy SLE-ben (systemic lupus erythematosus) szenvedett, a fennmaradó 148 személy önkéntes egészséges egyén volt. Az etikai engedély száma: 376/PI/10.,5257-0/ EKU. A szérumot natív csőbe levett vérből készítettük. Az alvadási reakció lejátszódása után, az alvadékot centrifugálással választottuk el a szérumtól (2000 g, 4ºC, 10 perc). A szérummintákat felhasználásig -20 és -70º C-on tároltuk. Az általunk vizsgált betegek B-sejt depletáló biológiai terápiában (Rituximab/MabThera) nem részesültek, de gyulladáscsökkentő, immunszuppresszív kezeléseket, és egyes esetekben biológiai terápiát kaptak (Metotrexát, Medrol, Humira, Enbrel, Infliximab). A betegeknek ismert volt az RF titere, az Anti-MCV (Orgentec) és anti-ccp2 tesztet (CCPlus IMMUNOSCAN, Euro 23
24 Diagnostica) a laborban végeztük. Az általunk, peptidekkel kapott eredményeket ezekkel a tesztekkel kapott értékekkel hasonlítottuk össze. Eredményeinket szintén összevetettük a betegség aktivitásáról információt adó DAS28 index- szel (DAS = disease activity score). Az index értékelése során megszámolják a duzzadt és nyomásérzékeny ízületek számát, mérik az akut fázisfehérjék termelődését jelző CRP (C-reaktív protein) szintet vagy vörösvérsejt süllyedés mértékét és vizsgálják a fájdalom intenzitását. DAS28 index 3,2 alatt mérsékelt, 3,2 és 5,1 között közepes, míg 5,1 feletti értéke kifejezett gyulladási aktivitásra utal. 5.4 Multipin ELISA Munkánk legelején Multipin ELISA módszerrel kerestük a filaggrin minimál epitópját, illetve a vimentin fehérjét is feltérképeztük átlapoló szekvenciák segítségével. A Multipin NCP (non cleveable peptid) szintézis szilárd fázisú peptid szintézis megfelelően derivált tűhegyeken végzett szilárd fázisú peptid szintézist jelent, a szintézis végén a peptidek 96 tűn, a biológiában használatos standard 8 x 12-es szabványos mikrotitráló lemeznek megfeleltethető elhelyezkedésben állnak rendelkezésre. A szilárd fázisú peptidszintézis alapelve, hogy a peptid C-terminálisán lévő aminosav karboxil csoportját a szintézis végéig kovalens kötéssel egy oldhatatlan hordozóhoz, a megfelelően kiválasztott gyantához kapcsolják. A Multipin NCP technika alkalmazása esetén, a szintézis végén a peptidek kovalensen kötve maradnak a tűhegyen. A peptidek szintézisét az MTA-ELTE Peptidkémiai Kutatócsoportjában Dr. Magyar Anna vezetésével végezték. Az általunk használt tesztben (2. táblázat) az 5 tagú filaggrin peptiden szitematikus arginin-citrullin csere lett végrehajtva, így valamennyi lehetséges variáció felismerése összevethető volt (filaggrinxx, filaggrin RX, filaggrin XR). A tűhegyeket 2% BSA, 0,1% Tween PBS-ben blokkoltuk 1 órán át rázatóasztalon, szobahőmérsékleten. A szérumot ötvenszeresére hígítottuk (2% BSA, 0,1% Tween-PBS) oldatban, 200 μl oldatot mértünk be a mikrotitráló lemez lyukaiba, ebbe mártva inkubáltuk a tűhegyeket rázatóasztalon, 4 C-on egy éjszakán át. Mosást követően 1:2000 HRPO enzimkapcsolt nyúl anti-humán IgG specifikus másodlagos ellenanyaggal inkubáltunk a tűhegyeket (2% BSA, 0,1% Tween tartalmú PBS oldatban). A színreakciót TMB enzimszubsztrát (0,1 mg/ml) hozzáadása után, 5-10 perc elteltével detektáltuk ELISA Reader segítségével (450 nm). Az enzimreakciót 2 N H2SO4-val állítottuk le (50 μl/lyuk). 24
25 Regeneráció: a polietilén tűhegyre kötődött ellenanyagok eltávolítása céljából 1 l PBS-hez kimért 100 ml 10% SDS oldatot és 1 ml 2-merkaptoetanolt tartalmazó oldatban, 65 C-on szonikáltuk 20 percig, majd desztillált vízben inkubáltuk fél órán át rázótermosztátban 60 Con. Az inkubációs idő lejártával 15 másodpercre 60 C-os metanolba mártottuk a tűhegyeket, majd 10 percig hagytuk száradni. Minden 5. teszt után TMB szubsztrátba mártással ellenőriztük a regeneráció megfelelő voltát. Vizsgált peptid Normál szekvencia Citrullinált szekvencia Filaggrin19-mer Kollagén (II típus) Fibrin alfa Fibrin béta Vimentin Vimentin65-77 FilaggrinXX FilaggrinRX FilaggrinXR SHQESTRGRSRGRSGRSGS ARGLTGRPGDA GPRVVERHQSACKDS RPAPPPISGGGYRAR STRSVSSSSYRRMFG SAVRARSSVPGVR TRGRS TRGRS TRGRS SHQESTXGXSXGRSGRSGS AXGLTGXPGDA GPXVVEXHQSACKDS XPAPPPISGGGYXAX STXSVSSSSYXXMFG SAVRAXSSVPGVR TXGXS TRGXS TXGRS 2. táblázat: A Multipin ELISA-ban a tűhegyre kötött peptidek szekvenciái 5.5 Indirekt ELISA 96 lyukú ELISA mikrotitráló lemezeket fedtünk 5 μg/ml neutravidinnel, 4 ºC-n inkubáltuk egy éjszakán át. Háromszori mosás (0,05 % Tween 20 / PBS) után a lemezeket fedtük a 25
26 peptidekkel (1 μg/ml) 37ºC-on, 1 óráig. Háromszori mosás után a lemezeket fél óráig, 37ºC-on blokkoltuk 200 μl/lyuk blokkoló oldattal (2 % BSA / 150 mm NaCl / PBS). A szérumokat 1:100 hígításban vittük fel a lemezre (100 μl/lyuk, 2% BSA / 2 M NaCl / PBS-ben oldva), majd 4 ºC-on, rázatva inkubáltuk egy éjszakán át. Háromszori mosást követően, a lemezt 1 óráig fedtük, 37º C-on nyúl anti-humán IgG-HRPO másodlagos ellenanyaggal 1:2000 hígításban, (2 % BSA /150 mm NaCl / PBS-ben oldva, 100 μl/lyuk). A színreakciót TMB enzim-szubsztrát (0,1 mg/ml) hozzáadása után, 5-10 perc elteltével detektáltuk ELISA Reader segítségével (450 nm). Az enzimreakciót 2 N H2SO4-val állítottuk le (50 μl/lyuk). 5.6 Kompetitív ELISA a peptid-specifikus ellenanyagok közötti keresztreakció kimutatására A módszer során a szilárd fázishoz kötött antigént együtt inkubáltuk a szérumminta peptid keverékével. A protokoll megegyezik a 3.3 pontban lévő indirekt peptid ELISA protokollal, azzal a kivétellel, hogy a lemezre kötött peptid és a szérumhoz adott peptid koncentrációja ennél a protokollnál 1 μm volt. A vizsgálatokhoz a betegcsoportból 8 RA beteg és a kontroll csoportból 6 szérum mintát használtunk fel. 5.7 Humán B-sejtek izolálása vérből, tenyésztés RA-s és egészséges egyének véréből tisztítottunk B-sejteket két féle módszerrel: - RosetteSep Human B Cell Enrichment Cocktail (Stemcell) segítségével (negatív szelekciós ellenanyag-koktél): a vérmintát kétszeresére hígítottuk 2% FCS-PBS-sel, majd a minta minden ml-éhez 25 μl RosettSepet adtunk, és 20 percig szobahőmérsékleten inkubáltuk. Inkubálás után 15 ml Ficoll-Paque PLUS (GE Healthcare) oldatot rétegeztünk a vér alá, majd 2300 rpm-n centrifugáltuk 30 percig (RT), fék nélkül. A negatív szelekciós ellenanyagkoktél a B-sejteken kívül minden egyéb-sejtet a vörösvértestekhez kapcsol, így azok a sűrűséggradiens centrifugálás után a centrifugacső alján találhatóak. A ficoll és szérum közti felülethatárról leszívtuk a B-sejteket, majd kétszer mostuk steril PBS-2% FCS-sel (1300 rpm, 10 perc, RT). 26
27 - Szintén izoláltunk sejteket MACS CD 19 MicroBeads, human (Miltenyi Biotec) mágneses mikrogyönygök segítségével. A vérből ficollon történő centrifugálással elkülönítettük a perifériás mononukleáris sejteket (PBMC). Sejtszámolás után a sejteket megjelöltük negatív B-sejt szelekciós biotin-ellenanyag koktéllal (10µl/10 7 sejt), majd 10 perc 4ºC-on történő inkubáció után 20µl anti-biotin mikrogyöngyöt adtunk a mintákhoz (/10 7 sejt). A jelölés Macs pufferben történt. 15 perc után a sejteket mostuk Macs pufferben (300g, 10 perc), majd a felülúszó leöntése után 500 µl pufferben vettük fel. Az oszlopot előzőleg mostuk 3 ml pufferrel, majd a sejtek felvitele után elkezdtük gyűjteni az átfolyó frakciókat. Az oszlopot tovább mostuk 3*3 ml pufferrel. A negatív szeparálás végén a tisztított B-sejteket megszámoltuk, és RPMI I 10% FCS médiumban vettük fel. A sejtfrakció tisztaságát áramlási citometriás módszerrel, anti-cd19 és anti-cd3 ellenanyagok segítségével ellenőriztük. Sejttenyésztés: a sejteket 3 napig tenyésztettük CO2 termosztátban, 50 ng/ml rh-il 2 és 1 µg/ml CpG jelenlétében. A beállított koncentráció sejt/ml volt. 5.8 Peptid specifikus ellenanyagtermelő sejtek kimutatása ELISpot módszerrel Az ellenanyagtermelő B-sejtek kimutatásához a Mabtech human IgG ELISpot kitet használtuk. A lemez lyukait 70% EtOH-val nedvesítettük 2 percig, majd 5x mostuk steril vízzel, és humán IgG specifikus csapdázó ellenanyaggal (15 µg/ml) illetve neutravidinnel (5 µg/ml) fedtük. 2 óra inkubáció után a lemezt mostuk, majd fedtük biotinált petidekkel (10 µg/ml) egy órán át, 37ºC-os termosztátban. Blokkoláshoz RPMI I 10% FCS tartalmú médiumot használtunk. A 4.5 fejezet szerint izolált és 72 órán át 1 µg/ml R848-cal és 10 ng/ml Il-2-vel előzetesen aktivált sejteket sejt/lyuk koncentrációban tettük ki a lemezre peptid specifikus ellenanyagtermelés vizsgálatához, teljes IgG termelés mérésénél ennek tizedét alkalmaztuk. A sejteket 22 órán át inkubáltuk CO2 termosztátban. A lemez mosása után azt fedtük anti-humán IgG-biotinnal (1 µg/ml), majd Streptavidin HRP-val. A lemezt TMB szubsztráttal hívtuk elő, majd 5 perc után vízzel állítottuk le a reakciót. A lemez szárítása után a kiértékelés ImmunoSpot programmal történt, az értékeket normalizáltuk 10 5 sejtre. Az eredmények 10 beteg és 10 egészséges egyén vérmintáinak felhasználásával készültek. 27
28 5.9 Peptid-specifikus B-sejtek kimutatása áramlási citometriával (FACS) Neutravidinnel fedett, fluoreszcens festékkel jelölt yellowgreen gyöngyöket (Invitrogen) (0,5 μl /minta) inkubáltunk a biotinált peptidekkel (15μg/ml) 1 órán keresztül, 37 ºC, rázatva, sötétben. A gyöngy-peptid komplexeket 3-szor mostuk 1 % BSA / PBS-sel (1 ml) rpm-n centrifugálva, 4 percig. Mintánként 3,5-4 x 10 5 előzőleg szeparált B-sejtet inkubáltunk a peptid-gyöngy komplexszel 1/2 órán keresztül, enyhén rázatva, 4 ºC-on, sötétben. A B-sejt tisztaság ellenőrzésre CD3-APC (T-sejt marker), CD14-APC (monocita marker), illetve CD 20 APC (B-sejt marker) jelölés történt (5-5 μl /minta). A memóriasejtek elkülönítésére CD27- APC-t használtunk. A fluoreszcensen jelölt ellenanyagokkal 20 percig inkubáltuk a sejteket, jégen, sötétben, majd 2-szer mostuk FACS pufferrel (PBS + 5 % FCS + 0,1 % azid), végül a mintákat 200 μl FACS pufferben vettük fel. Az ellenanyagok kötődésének mértékét FACSCalibur áramlási citométerrel mértük meg ( sejt adatait gyűjtöttük be). A kiértékelés FlowJo programmal (TreeStar Inc.) történt. A gyöngyöket megkötő pozitív sejteket az FSC / SSC alapján felállított limfocita kapuból, a CD20 B-sejt marker segítségével kapuzott B-sejtek közül a gyöngy fluoreszcens csatornájában (FL1) detektáltuk. Az eredményekben a jelölődött (pozitív) sejtek százalékos arányát adtuk meg Peptidek hatása RA betegekből szeparált PBMC citokintermelésére RA betegekből izolált PBMC sejteket tenyésztettünk 4 napig, 30 μg/ml peptid, illetve pozitív kontrollként 1 μg/ml LPS és PHA jelenlétében. A negyedik napon a sejtek felülúszójában vizsgáltuk a peptidek hatását a citokintermelődésre. Áramlási citometriás módszerrel, a FlowCytomixszel (Bender MedSystems) vizsgáltuk a TNFα, IFNγ, IL-10 és IL-17 citokinek mennyiségét. A minták elkészítése a gyártó által ajánlott protokoll alapján történt. A módszer előnye, hogy egyetlen, kis térfogatú mintából (25 μl), több citokin koncentrációja is megállapítható, a biztosított standard sor alkalmazásával. 28
29 5.11 Kollagén indukált arthritis indukciója, a betegség fokának nyomonkövetése A DBA/1 egerek a Charles River Laboratories-ból származnak (Budapest, Magyarország), a CD16 és a CD64 KO egerek Dr. Mócsai Attilától kaptuk (Semmelweis Egyetem, Budapest, Magyarország) [57],[58]. Az egereket 8 16 hetes koruk közt használtuk a kísérletekre. Az állatkísérleteket az etikai engedélyeknek megfelelően (engedély száma: 21.2/828/003/2007) végeztük. A betegséget az alábbiak szerint indukáltuk: hathetes DBA/1 nőstény egereket immunizáltunk 100 μg CII - komplett Freund adjuváns (CFA) emulziójával. Az oltás szubkután, faroktőbe történt. A CII előzőekben 0.1M ecetsavban került beoldásra, 2 mg/ml koncentrációban. Az oltás utáni 30., 45. és 70. napon különböző komplexek kerültek ráoltásra, amelyeket az állatok intravénásan kaptak. A kollagén-peptid tetramer csoport 2.6 μg biotinilált CII-peptid (ARGLTGRPGDA) és 30 μg extravidin (4:1 moláris arányú) keverékével lett beoltva. A 2.4G2 scfv tetramer csoport 60 μg biotinilált 2.4G2 scfv és 30 μg extravidin keverékét kapta (4:1 moláris arány). Az immunkomplex csoport 60 μg biotinilált 2.4G2 scfv, 2.6 μg biotinilált kollagén peptid (CII-peptid) és 60 μg extravidin (2:2:1 moláris arányú) keverékét kapta. A megadott mennyiségek egy-egy állatra vonatkoznak, PBS-ben oldva. A kontollcsoport csak PBS oltást kapott. Vérvételre a CIA indukciója utáni 35., 55. és a 70. napon került sor (5. ábra) 5. ábra: A komplex ráoltások és a vérvételek időrendje Minden állaton egyedileg követtük a betegség előrehaladtát. A CIA kialakulását vizuális skálán értékeltük [59]. A pontok 0-3 értékűek lehetnek végtagonként, az adott végtag megjelenésétől függően. Az értékelésnél figyelembe vettük a duzzanatot, a végtag vörösségét, valamint a szemmel is látható ízületi elváltozásokat. Egy állatra nézve a végtagonkénti pontokat összeadtuk, így a végső érték 0-12 értéket vehetett fel. A betegség előrehaladtát hetente kétszer értékeltük. 29
30 5.12 A 2.4G egyláncú ellenanyag (ScFv) tisztítása A 2.4G2 scfv plazmidja BL41 E. coli sejtekbe hősokkal lett transzformálva. A fehérjetermelés indukciója 0.5 mm IPTG hozzádásával történt. A sejteket 1 mg/ml lizozimmel és ultrahangos szonikálással tártuk fel. A His-taget tartalmazó egyláncú ellenanyagot 6 M ureában renaturáltuk, majd nikkel-oszlopon, affinitás kromatográfia segítségével tisztítottuk [60, 61]. A fehérjekonstukció tartalmaz egy címkét, amelyet az E.coliból származó BirA biotin ligáz képes felismerni. A biotinilálás a gyártó utasításai szerint történt [62, 63]. Az elkészült fehérje funkcionális integritását minden esetben ellenőriztük egér lépsejtekhez való kötődéssel, áramlási citometriás méréssel Áramlási citometriás mérések A különböző, extravidin-fitc tartalmú komplexek in vitro kötődési tesztje lépsejt szuszpenzión történt, három független kísérletben sejtet jelöltünk az előre elkészített komplexszekkel: biotinilált 2.4G2 scfv-vel és/vagy biotinilált CII-peptiddel, és extravidin-fitc-el 15 percig, jégen. A sejtek egyidejűleg jelöltük az alábbi ellenanyagokkal: anti-egér CD45R (B220)- PerCP/Cy5.5 (B-sejt marker), anti-egér CD11c-Alexa 647 (dendritikus sejt marker), anti-egér F4/80-Alexa 647 (makrofág jelölés). A mintaanalízist FACSCalibur áramlási citométerrel végeztük (Becton-Dickinson), az adatok értékelése FCS Express 3 szoftverrel történt (De Novo Software, Los Angeles, CA) Extravidin-FITC tartalmú komplexek in vivo immunofluoreszcens lokalizációja A kollagénnel már immunizált állatokból eltávolítottuk a lépet az extravidin-fitc tartalmú komplexszekkel való oltást követő 15. percben, és fagyaszás közbeni beágyazó médiumba tettük őket, folyékony nitrogénben fagyasztottuk, majd -80 o C-on tároltuk felhasználásig. A lefagyasztott lépekből 8µm vastag metszetek készültek, amelyek hideg acetonban lettek fixálva 10 percig. A blokkolás nedves kamrában, 5% BSA-PBS oldattal történt, fél órán át. A 30
31 metszetek jelölése marginális zóna makrofág specifikus ellenanyaggal (MARCO, patkány IBL-12 klón [64]), történt, amit Cy3-jelölt kecske anti-patkány IgG-vel hívtunk elő. A metszeteket PE konjugált, anti-egér CR1/2 specifikus ellenanyaggal is jelöltük. A felvételek Olympus BX61 fluoreszcens mikroszkóppal készültek. A munkát Dr. Balogh Péter és Neer Zsuzsanna végezte Kollagén- és kollagén peptid specifikus ellenanyagok kimutatása A CII- és CII-peptid-specifikus IgG titert indirekt ELISA módszerrel határoztuk meg az állatok szérumából. Kollagén specifikus ellenanyagok detektálása esetén a lemezeket 5μg/ml szarvasmarha kollagénnel fedtük egy éjszakán át. A blokkolás 1% BSA-PBS-sel történt. A felvitt szérumokat 1:200 kiinduló hígításban, majd négyszeres hígítási sorban alkalmaztuk. A kollagén peptid specifikus ellenanyagszint meghatázozásához 5μg/ml neutravidinnel fedett lemezre vittük fel a biotinilált kollagén peptidet, 1μg/ml koncentrációban. A blokkoló puffer összetétele ez esetben 40 mm TRIS-HCl, 150 mm NaCl, 0,5 % BSA and 0,1% Tween volt A kiinduló szérumhígítás 1:100 volt, majd ötszörös hígítási sort alkalmaztunk. A lemezeket mindkét esetben HRPO konjugált anti-egér IgG-vel, illetve anti-egér IgG2a-val inkubáltuk, az előhívás TMB szubsztráttal történt. A reakciót 2 N H2SO4-val állítottuk le. Az egyes hígítási pontokból végpont-titert számoltunk Citokin- és kemokinszint meghatározása A citokinek és kemokinek kimutatásához egér citokin array-t alkalmaztunk (Mouse Cytokine Array, Panel A, R&D Systems), a gyártó utasításai szerint. Minden oltási csoportból az összes állat szérumát összekevertük, a vérvétel a 70. napon, az i.v. komplex oltások után 2 órával történt. A kísérlet kivitelezése a gyártó útmutatása szerint történt: a 40 különböző citokin ill. kemokin-specifikus ellenanyagot tartalmazó membránokat inkubáltuk a 31
32 szérummintákkal, majd mosás után a detektáló, biotinált ellenanyag koktéllal. Az előhívás streptavidin-hrpo-val történt inkubálást követően, kemilumineszcens reagenssel végeztük, a jeleket röntgenfilmen detektáltuk. Az egyes pontokban a pixeldenzitás kiértékelését GenePix Pro 6.0 programmal végeztük, a párhuzamos értékeket átlagoltuk, és összehasonlítottuk a különböző csoportokban kapott értékeket Citokinszint meghatározása lépsejtkultúra felülúszójából Az állatok lépét a második komplex oltást követően egy héttel eltávolítottuk, minden csoportból egy-egy állatot áldoztunk fel. A lépsejtek izolálása után a csoportnak megfelelő komplex oltóanyag 1/10-ét adtuk a sejtkultúrához. 24, 48 és 72 óra elteltével a felülúszóból citokintermelődést néztünk. A 2.4G2 scfv in vitro hatását a citokintermelődésre az alábbiak szerint vizsgáltuk: C57BL/6 vad, CD16 KO, vagy CD64 KO egerekből származó lépsejteket (2,5 x 10 6 sejt/ml) tenyésztettünk RPMI-1640 médiumban vagy streptavidinnel majd biotinilált 2.4G2 scfv-vel fedett lemezeken (Millipore), 72 órán át, 37 ºC-on. A TNFα, IL-17, IFNγ, és IL-10 citokinek mennyiségének meghatározása Quantikine ELISA kitek (R&D Systems, Minneapolis, USA) segítségével történt, a gyártó útmutatása szerint. Az adott citokinkoncentrációt a standard sor segítségével számítottuk ki Statisztikai analízis A különböző peptidekre kapott OD (optikai denzitás) értékek hányadosát, az ELISA indexet (citrullin/arginin tartalmú peptiddel kapott OD érték) ábrázoltuk. A különböző szérumcsoportok peptid felismerésének eltérését egyváltozós ANOVA analízissel és Kruskal- Wallis teszttel vizsgáltuk. A különböző csoportok közötti antitest szinteket Dunn s Multiple Comparison Testtel hasonlítottuk össze. A peptidekre kapott OD indexek és a klinikai tesztek kapcsolatának vizsgálatát Spearman-féle korrelációs teszttel végeztük. Az antitest tesztek diagnosztikus hatékonyságát ROC (Receiver 32
33 Operator Characteristic) görbe analízis segítségével vizsgáltuk. Ezzel a módszerrel számolható a diagnosztikai teszt szenzitivitása és specificitása. A szenzitivitás érték a határérték feletti RA betegek száma százalékosan az összes RA beteghez képest. A specificitás a határérték alatti, illetve az összes kontroll aránya százalékosan kifejezve. A szenzitivitás és specificitás értékét két módon számoltuk. Egyrészről az adott definíció szerint számoltuk a határértéket: az egészséges kontroll csoport átlagához hozzáadva a kétszeres SD-t. Másrészről a ROC analízis eredményeinek alapján az egyes tesztek specificitás értékeit egységesítettük, ezáltal szenzitivitási értékük egyértelműben összemérhetővé vált. Autoellenanyagok esetében a 95%-os specificitás általánosan elfogadott diagnosztikailag optimalizált érték. Meghatároztuk a definíció szerinti pozitív és negatív prediktív értékeket (PPV és NPV). PPV megadja a betegség jelenlétének a valószínűségét, ha a teszt pozitív, vagyis a valódi betegek számát a pozitívak között. Megadható a határérték feletti betegek és a határérték feletti betegek és egészségesek arányával százalékosan kifejezve. A NPV a betegség hiányának a valószínűsége, ha a teszt negatív. Tehát, ha a teszt negatív, akkor mennyi az esélye annak, hogy a vizsgált egyén nem beteg. Megadható a határérték alatti egészségesek és a határérték alatti egészségesek és betegek arányával, százalékosan kifejezve. A CIA kísérletek során a különböző állatcsoportok arthritis pontjait permutációs teszttel értékeltük ki, az alacsony mintaszám miatt. Az ELISA mérésekhez Kruskal-Wallis tesztet alkalmaztunk. Minden statisztikai analízis elvégzéséhez a GraphPad Prism 4 (GraphPad Software, Inc.) programot használtuk. 33
34 6. Eredmények 6.1 A rheumatoid arthritis diagnosztizálása során alkalmazható, új citrullin tartalmú peptidek azonosítása Célunk volt az általunk beállított peptid-panellel az autoantitest profil meghatározása RA betegek szérumából, a kötődés vizsgálata RA betegek B-sejtjeihez, illetve a B-sejtek autoantitest termelésének vizsgálata Citrullin tartalmú peptidek szűrése RA beteg és egészséges szérummintákkal A Multipin ELISA kísérletek során megállapítottuk, hogy a filaggrin peptidből a 15-mer nem bizonyult elég hatékonynak az RA betegek és egészségesek elkülönítésében. Ezzel ellentétben az 5-mer filaggrin peptideket rövidségük ellenére is felismerték az RA betegek autoantitestjei. Az arginin-citrullin szisztematikus cseréje ezekben a peptidekben arra az eredményre vezetett, hogy a TXGRS (filaggrin XR) peptid esetén adódott a legmarkánsabb különbség az RA és egészséges csoport között, így a további kísérleteinkhez ezt a peptidet választottuk ki. A vimentin fehérje feltérképezése nem hozott új áttörést az irodalomból már ismert adatokhoz képest. Előkísérleteink során filaggrin peptid esetében vizsgáltuk a biotinálás pozícióját, illetve a biotin és peptidek közé beépített linkerek szerepét (3. táblázat). A rövidebb, 5-mer filaggrin epitópokat vizsgálva azt tapasztaltuk, hogy csak a C-terminálisukon biotinált peptidek esetében tapasztalható reakció az RA betegek szérumaival (6.ábra), míg a hosszabb, 19-mer peptidek esetében a biotinálás pozíciója nem befolyásolta a peptid felismerését [65]. 34
35 Filaggrin 5-mer Filaggrin 19-mer LC-biotin-TXGRS (kód: p3,p4) Biotin-TXGRS (kód: p5, p6) TXGRS-K-LC biotin (kód: p7, p8) TXGRS-K-Ttds biotin (kód: p9, p10) TXGRS-Ttds-K-LC biotin (kód: p11, p12) LC-biotin-SHQESTXGXSXGRSGRSGS SHQESTXGXSXGRSGRSGS-K-LC biotin SHQESTXGXSXGRSGRSGS-K-Ttds-LC biotin SHQESTXGXSXGRSGRSGS-Ttds-K-LC biotin 3. táblázat: Az előkísérlet során vizsgált filaggrin peptidek, kiemelve a legjobbnak talált peptidek 35
36 RA szérumok SLE szérumok Egészséges szérumok ELISA index 6. ábra: Az 5-mer filaggrin peptidek felismerése a biotin elhelyezkedésének függvényében p3-p6: N-terminálison biotinált TRGRS/TXGRS peptidek (ld. 2. táblázat) p7-p12: C-terminálison biotinált TRGRS/TXGRS peptidek (ld. 2. táblázat) Előzetes eredményeink alapján a továbbiakban két filaggrin, egy vimentin és egy kollagén epitópot vizsgáltunk, mindegyikük C-terminálison biotinált. Az 5-mer filaggrin peptid esetében hatékonyabb linkernek bizonyult a Ttds, a többi peptid esetében a hosszú láncú biotin (LC biotin) volt a legalkalmasabb. Mind a négy, optimalizált peptid esetében azt tapasztaltuk, hogy az RA szérumminták specifikusan felismerik a citrullintartalmú peptidet, amíg az egészséges és SLE kontrollok nem. Az ELISA indexek eltérése a különböző betegilletve kontrollcsoportok között szignifikánsnak adódott (7. ábra). A négy legjobbnak ítélt peptidet a szenzitivitás és specificitás értékeik alapján választottuk ki. Vizsgáltuk mind a definíció szerinti értékeket (ekkor a diagnosztikai határértéket az egészséges mintákból állapítottuk meg: ELISA index átlag + 2 SD). Másrészt a könnyebb összehasonlíthatóság végett a specificitást rögzítettük 95%-on, és az ehhez tartozó szenzitivitás értékeket vizsgáltuk (4. táblázat). A peptid-panel össz-szenzitivitása 80 %-nak adódott. ROC-görbe analíziskor (a program az összes lehetséges határértékhez tartozó szenzitivitást és specificitást számolja) a görbe alatti terület információt ad a leendő diagnosztikai teszt minőségéről. 0,5, illetve az alatti érték esetén a teszt nem használható a diagnosztikában, mivel nem elég hatékony az 36
37 egészségesek és a betegek elkülönítése. Általánosságban elmondható, hogy minél közelebb van a görbe alatti terület értéke 1-hez, annál megbízhatóbb tesztről van szó. Eredményeink alapján a 19-mer filaggrin görbe alatti területe a legnagyobb: Hasonló értékeket kaptunk a vimentin (0.787) és 5-mer filaggrin (0.7593) esetében is, míg a kollagén értéke gyengébbnek adódott (0.6258). 37
38 ELISA index Filaggrin 19-mer *** *** Szenzitivitás % ELISA index ELISA index ELISA index 0 RA SLE H *** *** RA SLE H 20 *** Filaggrin 5-mer *** *** RA SLE H Kollagén Vimentin Szenzitivitás % Szenzitivitás % Szenzitivitás% % - Specificitás% % - Specificitás% % - Specificitás% RA SLE H % - Specificiás% 7. ábra: Az optimalizált peptidek ELISA index értékei és ROC görbéi (H: egészséges minták) 38
39 Definíció szerint Diagnosztikailag optimalizálva peptid specificitás (%) szenzitivitás (%) specificitás (%) szenzitivitás (%) PPV (%) NPV (%) Filaggrin 19-mer Filaggrin 5-mer Vimentin Kollagén 98, táblázat: A peptidek specificitás, szenzitivitás, pozitív és negatív prediktív értékei A tesztben pozitívnak bizonyult szérumokat csoportokba rendeztük az alapján, hogy az adott szérum hány peptidet ismert fel. A csoportokon belül vizsgáltuk a peptid-epitópok felismerésének eloszlását, illetve a csoportok közötti különbséget a CCP, MCV titerben, a DAS 28 indexben, vagy a betegség időtartamában (8. ábra) 39
40 8. ábra: A: Összefüggések a CCP, MCV titer értékek és a betegség fennállásának ideje, valamint a felismert peptidek száma között B: A csoportokon belüli peptidfelismerés eloszlása (balról jobbra: 1, 2 és 3 peptidet felismerő szérumok) A CCP, illetve MCV titerrel egyértelmű összefüggést tapasztaltunk: minél több peptidet ismert fel egy adott szérum, átlagosan annál magasabbnak adódott a CCP vagy MCV titere (8. A ábra). Ugyanakkor nem találtunk összefüggést sem a betegség hosszával (bár a legrégebben betegek ismerték fel a legtöbb peptidet), sem pedig a betegség aktivitását jelző DAS 28 indexszel. Az egy peptidet felismerő szérumok fele a vimentin peptiddel reagált, körülbelül 30%-uk bizonyult filaggrin pozitívnak, míg csak körülbelül 20%-uk ismerte fel a kollagén citrullinált epitópját. A két peptidet felismerők esetében inkább a filaggrin epitópok dominálnak, a három peptiddel reagáló szérumok közel fele filaggrin és/vagy vimentin pozitív, a kollagénnel a szérumminták kevesebb, mint 20 %-a reagált (8. B ábra). A továbbiakban vizsgáltuk azon szérumminták peptid felismerését, amelyek CCP2 és/vagy MCV és/vagy RF negatívnak bizonyultak. Bár ezeknek a szérumoknak a száma nem volt magas, az általunk használt peptid-panellel még a tripla negatív szérumok is közel 20%-ban pozitivitást mutattak (9. ábra). 40
41 9. ábra: A konvencionális tesztekkel negatívnak bizonyult szérumok kimutathatósága a peptid-panel segítségével Kompetíció vizsgálata az egyes citrullin tartalmú peptidekre specifikus szérummintákal A Prof. Georg Schetttel (Erlangen, Németország) végzett kollaborációs munka során CCP pozitív szérummintát, illetve az abból citrullinált vimentin fehérjével affinitás-tisztított ellenanyagot hasonlítottunk össze az általunk beállított peptid-panelen [66]. Azt tapasztaltuk, hogy nem csak a CCP pozitív szérum, de a belőle tisztított, vimentin fehérjére specifikus ellenanyag is felismerte a filaggrin peptidet (10. ábra). Ezért kompetitív ELISA méréseket végeztünk, hogy a peptideket felismerő ellenanyagok közti esetleges keresztreakciót ellenőrizzük. 41
42 CCP+ szérum anti-vimentin ELISA ratio ELISA index Vimentin Kollagén Filaggrin 19-mer Vimentin Kollagén Filaggrin 19-mer 10. ábra: A CCP pozitív szérum és az ebből affinitás-tisztított vimentin-specifikus IgG peptidfelismerése [66] (módosítva) Vimentin ELISA Filaggrin ELISA 4 25 ELISA index ELISA index RA H RA H RA H 0 RA H RA H RA H szérum+ filaggrin szérum+ vimentin szérum szérum+ filaggrin szérum+ vimentin szérum 11. ábra: Kompetitív ELISA vizsgálat vimentin és filaggrin peptidek között (H: egészséges minták) 42
43 Ehhez a teszthez csak olyan szérumokat használtunk, amelyek mindkét vizsgált peptidre (19-mer filaggrin, vimentin) pozitívak voltak. A szérumokat előinkubáltuk a szilárd fázishoz kikötöttnek megfelelő mennyiségű, oldott peptiddel. Mindkét esetben azt tapasztaltuk, hogy a vizsgálni kívánt peptiddel azonos oldott peptiddel való előinkubáció csökkentette az RA szérumok által adott jel erősségét, míg a más peptiddel történő előkezelés nem okozott jelentős változást. Egészséges szérumok esetében nem tapasztaltunk változást egyik peptid esetében sem (11. ábra) Citrullin tartalmú peptidekre specifikus ellenanyagtermelés vizsgálata ELISpot módszerrel Annak eldöntésére, hogy a citrullin tartalmú peptidek, amelyeket az RA szérummintákban levő autoantitestek felismernek, alkalmasak-e az ellenanyagtermelő B-sejtek kimutatására, in vitro aktivált memória B-sejtek peptid-specifikus válaszát vizsgáltuk. 2-5x10 6 /ml egészségesekből illetve RA betegekből tisztított B-sejt ellenanyagtermelő sejtté való diferenciálódását követtük nyomon az aktivációt követően. Mind az egészséges, mind az RA betegekből származó sejtek esetében vizsgáltuk az össz-igg termelést és a peptid-specifikus ellenanyagtermelő sejteket is. A nem aktivált mintákban egyáltalán nem termelődött kimutatható mennyiségű ellenanyag. Nem tapasztaltunk eltérést az egészséges és beteg B- sejtek össz IgG termelésében. A peptid-specifikus ellenanyagtermelő sejtek száma egészségesekben minden esetben 10/10 5 B sejt alatti volt, függetlenül a peptid citrullintartalmától. A vimentin és a 19-mer filaggrin peptiddel vizsgálva szignifikáns különbséget tapasztaltunk az ellenanyagtermelő sejtek számában a citrullintartalmú peptid javára (12. A ábra). 5-mer filaggrin peptid esetében is láttunk különbséget, noha ez nem szignifikáns, míg a kollagén peptidek esetében nem mutatkozott eltérés az arginin és citrullin tartalmú peptidek között (12. B ábra) 43
44 A B ellenanyagtermelő sejtek száma (10 5 sejtre normalizálva) ellenanyagtermelő sejtek száma (10 5 sejtre normalizálva) * ** Total IgG RA RA vim R RA vim X RA fil-19-r RA fil-19-x Total IgG H H vim R H vim X H fil-19-r H fil-19-x Total IgG RA RA fil-5-r RA fil-5-x RA coll R RA coll X Total IgG H H fil-5-r H fil-5-x H coll R H coll X 12. ábra: Egészséges és RA betegekből tisztított, aktivált B-sejtek ellenanyagtermelő képességének összehasonlítása ELISpot módszerrel (H: egészséges minták) Peptid-specifikus B-sejtek kimutatása áramlási citometriával Az egészséges és RA beteg vérmintákból szeparált B-sejtekhez való peptidkötődést neutravidinnel burkolt Yellowgreen mikrogyöngyök segítségével vizsgáltuk, amelyekre biotinilált peptideket kötöttünk. Előzetes kísérletek során PBMC-hez való kötődést is vizsgáltunk CD3 és CD14 marker mellett, de nem tudtunk kimutatni kötődést sem a monocitákhoz, sem a T-sejtekhez, sem a peptiddel fedett, sem pedig a peptid nélküli kontroll gyöngyökkel sem. Az izolált B-sejteket vizsgáltuk aktiválás nélkül, illetve 3 napos aktiváció után, a 4.5 fejezetben leírtaknak megfelelően. A kiértékelés az alábbiak szerint zajlott: pozitív kapuzással elkülönítettük az élő sejteket, majd a CD20 pozitív sejteket autofluoreszcencia és izotípus-kontroll alapján. A Yellowgreen gyöngyöt kötött sejteket az FL-1 csatornában különítettük el (13. ábra). 44
45 13. ábra: A citometriás mérések kiértékelése-egy reprezentatív kísérlet alapján FSC: előre irányuló fényszórás, SSC: oldalra irányuló fényszórás, FL-4: a CD20-APC mérési csatornája, FL-1: a Yellowgreen gyöngy mérési csatornája. A középső ábrán feketével az autofluoreszcencia, pirossal patkány IgG1-APC izotípus kontroll, a kék görbe a CD 20- APC ellenanyag kötődését jelzi. Előzetes aktiválással és a nélkül is 8-8 RA beteg B-sejtjeit vizsgáltuk. Általánosságban elmondható, hogy a peptiddel nem fedett gyöngy a blokkolás ellenére igen magas hátteret adott (a sejtek körülbelül 10 százalékánál volt megfigyelhető kötődés), illetve minden esetben tapasztaltunk kötődést az arginintartalmú peptiddel fedett gyöngy esetében is. Ez a két tényező megnehezítette a kiértékelést, hiszen a detektálni kívánt autoreaktív sejtek csak néhány százalékát jelentik a keringő limfocitáknak. A sejtek előzetes aktiválása nélkül a betegek fele reagált egy-egy peptiddel, a különbség viszont jelentős az arginin- és citrullintartalmú peptidek között. Míg az aktivált sejtekhez több féle peptid is kötődött, kisebb volt a citrullinált peptid javára adódó különbség. 45
46 nem aktivált minták aktivált minták Kötődés mértéke, % Filaggrin 5R Filaggrin 5X Vimentin R Vimentin X 40 háttér Kötődés mértéke, % egészséges 0 Filaggrin 5R Filaggrin 5X Filaggrin 19R Filaggrin 19X Vimentin R Vimentin X Kollagén R Kollagén X háttér Kötődés mértéke, % Filaggrin 19R Filaggrin 19X Vimentin R Vimentin X Kollagén R Kollagén X háttér 14. ábra: A Yellowgreen gyöngyökre kötött peptidek kötődése B-sejtekhez. Az aktivált mintákat CpG és rh-il-2 jelenlétében tenyésztettük a kötődési vizsgálatok előtt. A háttér a peptiddel nem fedett gyöngyök aspecifikus kötődését mutatja. További különbség, hogy az aktiválatlan mintákban a filaggrin 19-mer peptid kötődését nem vizsgáltuk, a kollagén peptid esetében pedig nem tapasztaltunk a háttértől való eltérést. A legjelentősebb különbségeket mindkét esetben az 5-mer filaggrin peptiddel tapasztaltuk, míg az egészséges egyénekből származó B-sejtek esetében nem volt jelentős eltérés a háttérhez képest egyik vizsgált peptid esetében sem (14. ábra). 46
47 6.1.5 In vitro citokintermelés vizsgálata citrullin tartalmú peptidekkel való aktiváció hatására Funkcionális kísérleteink során vizsgáltuk a peptidek hatását RA betegekből izolált PBMC citokintermelésére is. A sejteket 4 napig tenyésztettük a peptidek jelenlétében, majd Flow Cytomix Multiplex gyöngy-alapú array segítségével, áramlási citometriás módszerrel meghatároztuk a vizsgált citokinek koncentrációját a felülúszóból. A kísérletek során az IFNγ, a TNFα, az IL-10 és IL-17 mennyiségét vizsgáltuk. Az arginin- és citrullintartalmú peptidekre adott válasz különbségét akkor tekintettük pozitívnak, ha legalább kétszeres eltérés mutatkozott a citrullintartalmú peptid javára. A TNFα szintjében nem tapasztaltunk jelentős választ egyik vizsgált betegnél sem. A többi citokin esetében a vizsgált betegek körülbelül fele termelt jelentős mennyiségű IFNγ és IL-17 citokint a citrullin tartalmú peptidek hatására, míg a betegek másik fele IL-10 termeléssel válaszolt. A gyulladásos citokinek termelődését a 19-mer filaggrin és/vagy a vimentin peptidek esetében tapasztaltuk, míg az immunszuppresszáns IL-10 termelődését a 19-mer filaggrin és/vagy kollagén peptid hatására figyeltük meg (15. ábra). IFN termelés (pg/ml) fil 19 R fil 19 X vim R vim X IL-17 termelés (pg/ml) fil 19 R fil 19 X vim R vim X 300 IL-10 termelés (pg/ml) fil 19 R fil 19 X koll R koll X 15. ábra: A peptidek hatására termelődött citokinek RA PBMC kultúra felülúszójában (R: arginin tartalmú peptid, X: citrullin tartalmú peptid) 47
48 6.2 Kollagén indukált arthritises vizsgálatok A továbbiakban az RA egérmodelljén, kollagén indukált arthritises egereken végeztünk vizsgálatokat annak kiderítésére, hogy a betegség kiváltásában szerepet játszó kollagén peptid epitóp egymagában vagy FcγR-hez irányítva, mintegy az immunkomplexek hatását mímelve, befolyásolja-e a betegség lefolyását, valamint az ellenanyag- és citokintermelést A 2.4G2 scfv és a kollagén CII-peptid által alkotott komplexek hatása a CIA súlyosságára és lefolyására egerekben A 2.4G2 és CII peptid-komplexek CIA módosító hatását a II típusú szarvasmarha kollagénnel előzetesen beoltott egereken vizsgáltuk. A DBA/1 egerek először csak egy szarvasmarha kollagén és CFA oltást kaptak (0.nap), majd az előzőekben leírt komplexekkel oltottuk őket intravénásan a 28. napon. Az állatok arthritis pontjait (arthritis score) hetente kétszer monitoroztuk. Négy héttel a kezdeti oltás után az arthritis tünetei még nem kezdtek mutatkozni. Az extravidin-cii peptid komplex ( kollagén peptid tetramer ) és az extravidin- 2.4G2 ScFv komlpex ( ScFv tetramer ) kezelés hatására már az oltás után 5 nappal megemelkedtek a csoportban lévő állatok arthritis score értékei. A csak puffert kapott kontroll csoportnál ekkor az ízületi gyulladás tünetei még csak elvétve mutatkoztak (0-2,5). A komplex ráoltás utáni 10. napon (vagyis a kezdő oltástól számított 40. napon) már szignifikáns eltérés mutatkozott a kontroll csoporthoz képest mind a kollagén peptid tetramerrel, mind az ScFv tetramerrel, mind pedig az immunkomplexszel oltott csoportban. Nem tapasztaltunk eltérést a kontroll csoporttól abban az esetben, ha a megfelelő mennyiségű CII peptid, vagy az egyláncú ellenanyag extravidin nélkül, monomer formában lett oltva. Az 55. napon, a második komplex ráoltás után 10 nappal az arthritis pontokban talált szignifikáns különbség megmaradt a kontroll csoport és az immunkomplex valamint a peptid tetramer csoportok között, jelezve ezzel a betegség súlyosbodását (16. ábra). 48
49 35. nap 40. nap 55. nap ** ** *** 12.5 ** ** score Score Score Kontroll Komplex CII Peptid tetramer ScFv tetramer Peptid monomer + ScFv monomer 0.0 Kontroll Komplex CII Peptid tetramer ScFv tetramer Peptid monomer + ScFv monomer 0.0 Kontroll Komplex CII Peptid tetramer ScFv tetramer Peptid monomer + ScFv monomer 16. ábra: A komplex kezelések hatása az arthritis score-ra. Az eredmények két kísérlet összegzéséből származnak, csoportonként 8-12 állat pontszámait hasonlítottuk össze Kollagén specifikus ellenanyagtermelés vizsgálata a különböző komplexekkel kezelt CIA egerekben A CIA-ban szenvedő állatok szérummintáiban összehasonlítottuk mind a kollagén, mind pedig a kollagén peptid-specifikus ellenanyagok szintjét, 5 nappal az első (a kísérlet 35. napja), majd 10 nappal a második komplex oltást követően (a kísérlet 55. napja). A teljes kollagén ellenes ellenanyagszintek az alábbiak szerint alakultak: az első komplex oltást követő 5. napon a kollagén peptid tetramer csoportban kissé megemelkedett a specifikus ellenanyagtiter a kontroll csoporttal összevetve. A többi kezelésnél nem tapasztaltunk eltérést az anti-kollagén IgG szintek között. A második komplex oltást követő 10. napi vérvételből származó minták között nem volt különbség a kollagén specifikus IgG titerek között. (17. ábra bal oldala). Ezzel ellentétes módon, a kollagén peptid-specifikus IgG titerben szignifikáns különbség mutatkozott az Fc RII/III-hoz irányított CII peptiddel ( immunkomplex kezelés) oltott állatok javára a többi csoporthoz képest. Ez a magasabb peptid specifikus ellenanyagválasz mindkét időpontban megfigyelhető. A kollagén peptid tetramer és az ScFv tetramer csoportban is van peptid-specifikus ellenanyagtermelés, ezek szintje azonban csak kis mértékben haladja meg a kontrollcsoport által termelt peptid specifikus IgG szintjét. A CII peptid specifikus IgG2a titer ehhez hasonló megoszlást mutat. (17. ábra jobb oldala). 49
50 17. ábra: Kollagén és kollagén-peptid specifikus IgG titerek a kísérlet 35. napján (fent) és 55. napján (lent) A komplexek in vitro kötődése lépsejtekhez és in vivo lokalizációja a lépben Áramlási citometriás és immunohisztokémiás kísérleteket is végeztünk annak kiderítése érdekében, hogy az adott komplex kostrukciók mely sejtekhez kötődnek. A peptid tetramer, ScFv tetramer, ill. immunkomplex in vitro kötődési tesztjében CIA egerek lépsejtjeit vizsgáltuk. A citometriás mérések során a 2.4G2 ScFv-t és CII peptidet is tartalmazó immunkomplex a B220 pozitív sejtek (B-sejtek) 47 %-hoz, a CD11c pozitív sejtek (dendritikus sejtek) 41 %-hoz, és az F4/80 pozitív sejtek 60 %-hoz kötődött. Az F4/80 sejtfelszíni marker a mieloid sejtek egyes alpopulációin expresszálódik, beleértve a makrofágokat és dendritikus sejteket [67]. A 2.4G2 tetramer kötődése hasonló, a B-sejtek 40 %-a, a dendritikus sejtek 36 %-a, és az F4/80 pozitív sejtek 55 %-a kötötte a komplexet. Teljesen eltérő kötődési profilt tapasztaltunk a CII peptid tetramer esetén: a komplex a B- sejtek 10%-hoz, a DC-k 30%-hoz, illetve az F4/80 pozitív sejtek 40%-hoz kötődött. (18. ábra) 50
51 Ez azt jelentheti, hogy a CII peptid képes a makrofágok és dendritikus sejtek Fcγ receptoraihoz kötődni az egerekben termelődött, peptid specifikus IgG segítségével. A nem immunizált állatokból származó lépsejtek esetében nem tapasztaltunk kötődést az immunkomplex esetében. Kontroll Immunkomplex 2.4G2 tetramer CII peptid tetramer B CD11C F4/ Izotípus kontroll Extravidin -FITC 18. ábra: A 2.4G2 ScFv-CII peptid komplex, a CII peptid tetramer és a 2.4G2 ScFv tetramer kötődése in vitro, lépsejtekhez. A komplexek extravidin-fitc jelölést tartalmaztak, az egyes lépsejtpopulációk CD45R (B220) PerCP/Cy5.5 (B-sejt), CD11c Alexa 647 (dendritikus sejt), F4/80 Alexa 647 (makrofág) jelöléssel lettek elkülönítve. A kontroll mintában extravidin- FITC háttér, illetve Alexa 647 konjugált patkány IgG2b-t izotípus kontroll kötődése látható. Az ábrán három, független kísérletből származó reprezentatív mérések vannak feltüntetve. Az in vivo lokalizációs kísérletekhez az állatokat extravidin-fitc tartalmú komplexekkel oltottuk. 15 perccel az intravénás oltás után a 2.4G2 ScFv- CII peptid komplexek leginkább a lép marginális zónájában voltak megfigyelhetőek, ko-lokalizációt mutatva a marginális zóna makrofág markerrel (MARCO). Néhány esetben CR1/2 pozitív, follikuláris sejtekkel is ko- 51
52 lokalizáció tapasztalható, valószínűleg dendritikus sejtekről van szó. Az IgM, vagy IgD pozitív B-sejtekkel nem tapasztaltunk ko-lokalizációt. A 2.4G2 tetramerrel oltott állatokban az előzőekhez hasonló kötődést tapasztaltunk, azzal a különbséggel, hogy a 2.4G2 tetramer kevesebb B-sejtet jelölt meg, mint az immunkomplex. A CII-peptid tetramer ezektől eltérő módon, leginkább a lép T-sejtes zónájában mutatott kötődést. (19. ábra) Immunkomplex CII peptid tetramer 2.4G2 ScFv tetramer 100 μm 100 μm 100 μm 100 μm 100 μm 100 μm 19. ábra: A komplexek in vivo lokalizációja 15 perccel az oltás után. A metszetek komplement receptor (CR1/CR2) specifikus antitesttel, vagy MZ makrofág marker (MARCO) specifikus antitesttel lettek festve. A komplexek a zöld csatornában, a CR1/2 illetve MARCO a piros csatornában látható. Az átfedés sárga színnel jelenik meg. Összefoglalva az in vivo és in vitro kötődési kísérleteket, elmondható, hogy a 2.4G2 egyláncú ellenanyagot tartalmazó konstrukciók kötődnek a B-sejtek egy részéhez, röviddel az oltás után a komplexek zöme a marginális zóna makrofágokhoz kötődik, illetve kisebb mértékben a fehér pulpában található dendritikus sejtekhez asszociálódik. A CII-peptid tetramerek elsősorban az utóbbi sejtpopulációhoz mutatnak kötődést. 52
53 6.2.4 Citokin/kemokinszekréció kiváltása az Fc RII/III célzásával Két különböző kísérletet végeztünk abból a célból, hogy megvizsgálhassuk, hogy a komplex konstrukciók oltása vált-e ki valamilyen eltérést a citokinek és kemokinek termelődése szempontjából a CIA állatok mintáiban. Először a komplexekkel oltott állatokból származó lépsejtkultúrákat kezeltünk in vitro a különböző konstrukciókkal, majd a sejtek felülúszóját teszteltük 24, 48 és 72 óra eltelte után. Csak az immunkomplexszel kezelt lépsejtek felülúszójában találtunk különbséget a TNFα, IL-17, IFNγ, és IL-10 citokinek termelődésében, időfüggés is megfigyelhető volt. A 2.4G2 tetramerrel kezelt sejtek jóval alacsonyabb mértékben termeltek csak citokineket, míg a CII-peptid tetramer kezelés egyáltalán nem váltott ki citokintermelést. (20. ábra) A TH2 immunválaszra jellemző citokin, az IL-4 egyik kultúrában sem termelődött kimutatható mennyiségben. Ez egybecseng azzal, hogy a 2.4G2-CII peptid komplex képes stimulálni pro-inflammatórikus citokinek termelődését in vitro. Az ezek közé tartozó IL-17 szerepe kritikus az arthritis kialakulásában. 53
54 IFN termelés (pg/ml) Kontroll Immunkomplex CII peptid tetramer ScFv tetramer Kontroll Immunkomplex CII peptid tetramer ScFv tetramer Kontroll Immunkomplex CII peptid tetramer ScFv tetramer 24h 48h 72h TNF termelés (pg/ml) Kontroll Immunkomplex CII peptid tetramer ScFv tetramer Kontroll Immunkomplex CII peptid tetramer ScFv tetramer Kontroll Immunkomplex CII peptid tetramer ScFv tetramer 24h 48h 72h IL-10 termelés (pg/ml) IL-17 termelés (pg/ml) Kontroll Immunkomplex CII peptid tetramer ScFv tetramer Kontroll Immunkomplex CII peptid tetramer ScFv tetramer Kontroll Immunkomplex CII peptid tetramer ScFv tetramer 0 Kontroll Immunkomplex CII peptid tetramer ScFv tetramer Kontroll Immunkomplex CII peptid tetramer ScFv tetramer Kontroll Immunkomplex CII peptid tetramer ScFv tetramer 24h 48h 72h 24h 48h 72h 20. ábra: In vitro citokintermelés. A citokinek mennyiségét a lépsejt kultúra felülúszójából határoztuk meg, a komplexszekkel való kezelés után 24, 48 és 72 órával. A 2.4G2 scfv mind az FcγRII mind az FcγRIII pozitív sejtekhez képes kötődni. Annak tisztázására, hogy valóban az FcγRIII felelős-e a fokozott citokintermelődésért, összehasonlítottuk a 2.4G2 indukálta TNFα és IL-17 produkcióját vad típusú, CD16 KO és CD64 KO C57BL/6 egerek lépéből származó kultúrákban. Az eredményeink szerint a CD64 KO egér lépsejtjei képesek voltak ezen citokinek szekréciójára a 2.4G2 stimuláció után, ezzel ellentétben a CD16 KO egér lépsejtjei nem. Ezzel bizonyítottuk az FcγRIII szerepét, amelynek hiányát nem kompenzálja sem az FcγRI sem az FcγRII. (21. ábra) 54
55 TNF koncentráció (pg/ml) vad típus CD 16 KO CD 64 KO kontroll 2.4G2 21. ábra: TNFα és IL-17 produkció a 2.4G2 ScFv tetramerrel kezelt állatokban, 72 órával a kezelés után. IL-17 koncentráció (pg/ml) vad típus CD 16 KO CD 64 KO kontroll 2.4G2 Annak eldöntésére, hogy a komplexek képesek-e in vivo kemokin- illetve citokintermelést kiváltani, az alábbi kísérletet végeztük: a kollagén indukált arthritises állatok a harmadik komplex ráoltást a kísérlet 70. napján kapták. Az oltás után 2 órával az állatokból vért vettünk, majd a szérumokat csoportonként összegyűjtöttük. Minden csoport szérumaiból citokin/kemokin fehérje mikro-array alkalmazásával mutattuk ki a citokineket, kemokineket. A kapott értékeket normalizáltuk a kontroll csoporthoz viszonyítva. (22. ábra) A kontrollal összevetve, az immunkomplex oltás számos citokin és kemokin fokozott termelődését indukálta. A 2.4G2 ScFv-CII peptid komplex kiváltotta a BLC (CXCL13, B limfocita kemoattraktáns), a G-CSF (granulocita kolónia stimuláló faktor), az IL-1, IL-3, IL- 6, IL-7, IL-10, IL-12, IL-16, IL-17, IL-23, a MIP-1 és MIP-2 (makrofág gyulladási protein) és a TNFα fokozott szekrécióját. Az IL-10 és a MIP-2 szintje az immunkomplexszel kezelt állatokban körülbelül a kontroll csoport által termelt mennyiség 2500-szorosa. A CII-peptid-tetramert kapott állatok szérumából az alábbi faktorok szintjének emelkedése volt kimutatható: IL-10, IL-17, IL-23 és MIP-2, míg a 2.4G2 tetramerrel kezelt csoportban az Fc RII/III keresztkötése a G-CSF, IL-6, IL-10 és MIP-2 termelődését fokozta in vivo. 55
56 2.4G2 ScFv tetramer CII peptid komplex Immunkomplex 22. ábra: A szérumok kemokin és citokinprofilja 2 órával a booster oltás után. A mikro-array-vel kapott eredményeket (pixel denzitás), normalizáltuk a kontroll csoportra. A vonal a tízszeres különbséget jelöli, e fölött tekintetük lényeges különbségnek a kezelés hatására bekövetkezett változást. Eredményeink azt jelzik, hogy mind a Fc RII/III célzott CII peptid, mind pedig a CII-peptid tetramer stimulálja a CIA kialakulásában és fenntartásában kritikus szerepet játszó gyulladási citokinek szekrécióját.[68-71] 56
Doktori értekezés tézisei. Szarka Eszter. Témavezető: Prof. Sármay Gabriella, egyetemi tanár
 Doktori értekezés tézisei Autoantitest profil és B sejt epitópok vizsgálata citrullinált peptidek segítségével rheumatoid arthritisben és a patomechanizmus vizsgálata a betegség egér modelljében Szarka
Doktori értekezés tézisei Autoantitest profil és B sejt epitópok vizsgálata citrullinált peptidek segítségével rheumatoid arthritisben és a patomechanizmus vizsgálata a betegség egér modelljében Szarka
B-sejtek szerepe az RA patológiás folyamataiban
 B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS. origamigroup. www.origami.co.hu
 BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
OTKA ZÁRÓJELENTÉS
 NF-κB aktiváció % Annexin pozitív sejtek, 24h kezelés OTKA 613 ZÁRÓJELENTÉS A nitrogén monoxid (NO) egy rövid féléletidejű, számos szabályozó szabályozó funkciót betöltő molekula, immunmoduláns hatása
NF-κB aktiváció % Annexin pozitív sejtek, 24h kezelés OTKA 613 ZÁRÓJELENTÉS A nitrogén monoxid (NO) egy rövid féléletidejű, számos szabályozó szabályozó funkciót betöltő molekula, immunmoduláns hatása
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
Immunológia I. 4. előadás. Kacskovics Imre
 Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE
 Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2017. Bev. 2. ábra Az immunválasz kialakulása 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán
Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2017. Bev. 2. ábra Az immunválasz kialakulása 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán
Immunológia alapjai. Az immunválasz szupressziója Előadás. A szupresszióban részt vevő sejtes és molekuláris elemek
 Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
Az adaptív immunválasz kialakulása. Erdei Anna Immunológiai Tanszék ELTE
 Az adaptív immunválasz kialakulása Erdei Anna Immunológiai Tanszék ELTE NK sejt T Bev. 1. ábra Immunhomeosztázis A veleszületett immunrendszer elemei nélkül nem alakulhat ki az adaptív immunválasz A veleszületett
Az adaptív immunválasz kialakulása Erdei Anna Immunológiai Tanszék ELTE NK sejt T Bev. 1. ábra Immunhomeosztázis A veleszületett immunrendszer elemei nélkül nem alakulhat ki az adaptív immunválasz A veleszületett
Immunológia alapjai. 10. előadás. Komplement rendszer
 Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Áramlási citometria 2011. / 4. Immunológiai és Biotechnológiai Intézet PTE KK
 Áramlási citometria 2011. / 4 Immunológiai és Biotechnológiai Intézet PTE KK Az áramlási citometria elve Az áramlási citometria ( Flow cytometria ) sejtek gyors, multiparaméteres vizsgálatára alkalmas
Áramlási citometria 2011. / 4 Immunológiai és Biotechnológiai Intézet PTE KK Az áramlási citometria elve Az áramlási citometria ( Flow cytometria ) sejtek gyors, multiparaméteres vizsgálatára alkalmas
Áramlási citometria, sejtszeparációs technikák. Immunológiai és Biotechnológiai Intézet ÁOK, PTE
 Áramlási citometria, sejtszeparációs technikák Immunológiai és Biotechnológiai Intézet ÁOK, PTE Az áramlási citometria elve Az áramlási citometria ( Flow cytometria ) sejtek gyors, multiparaméteres vizsgálatára
Áramlási citometria, sejtszeparációs technikák Immunológiai és Biotechnológiai Intézet ÁOK, PTE Az áramlási citometria elve Az áramlási citometria ( Flow cytometria ) sejtek gyors, multiparaméteres vizsgálatára
Immunológia alapjai előadás. Az immunológiai felismerés molekuláris összetevői.
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás.
 Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Az immunrendszer felépítése Veleszületett immunitás (komplement, antibakteriális
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Az immunrendszer felépítése Veleszületett immunitás (komplement, antibakteriális
Korunk betegsége: a Rheumatoid Arthritis
 Korunk betegsége: a Rheumatoid Arthritis Babos Fruzsina Dr. Magyar Anna 2011.12.09. Rheumatoid Arthritis (1000 fő) nincs adat kevesebb, mint 40 40-50 50-60 60-70 70-80 80-90 90-100 100-110 110-120 120-130
Korunk betegsége: a Rheumatoid Arthritis Babos Fruzsina Dr. Magyar Anna 2011.12.09. Rheumatoid Arthritis (1000 fő) nincs adat kevesebb, mint 40 40-50 50-60 60-70 70-80 80-90 90-100 100-110 110-120 120-130
A T sejt receptor (TCR) heterodimer
 Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Immunológia alapjai. 16. előadás. Komplement rendszer
 Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
(1) A T sejtek aktiválása (2) Az ön reaktív T sejtek toleranciája. α lánc. β lánc. V α. V β. C β. C α.
 Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Doktori értekezés tézisei
 Doktori értekezés tézisei A komplement- és a Toll-szerű receptorok kifejeződése és szerepe emberi B-sejteken fiziológiás és autoimmun körülmények között - az adaptív és a természetes immunválasz kapcsolata
Doktori értekezés tézisei A komplement- és a Toll-szerű receptorok kifejeződése és szerepe emberi B-sejteken fiziológiás és autoimmun körülmények között - az adaptív és a természetes immunválasz kapcsolata
Immunológia 4. A BCR diverzitás kialakulása
 Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia alapjai előadás. Az immunológiai felismerés molekuláris összetevői
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Antigén, Antigén prezentáció
 Antigén, Antigén prezentáció Biológiai Intézet Immunológiai Tanszék Bajtay Zsuzsa ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2019. február. 26 Bev. 2. ábra Az
Antigén, Antigén prezentáció Biológiai Intézet Immunológiai Tanszék Bajtay Zsuzsa ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2019. február. 26 Bev. 2. ábra Az
Immunológia alapjai előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok:
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
szerzett tapasztalataink
 Anti-CCP mérése során szerzett tapasztalataink Geider Viola,Piros Alfrédn dné Baranya Megyei KórhK rház z Klinikai és Mikrobiológiai Laboratórium rium MOLSZE Kongresszus Pécs 2009 Bevezetı A rheumatoid
Anti-CCP mérése során szerzett tapasztalataink Geider Viola,Piros Alfrédn dné Baranya Megyei KórhK rház z Klinikai és Mikrobiológiai Laboratórium rium MOLSZE Kongresszus Pécs 2009 Bevezetı A rheumatoid
4. A humorális immunválasz október 12.
 4. A humorális immunválasz 2016. október 12. A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja a limfocitát A keletkező
4. A humorális immunválasz 2016. október 12. A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja a limfocitát A keletkező
Immunológia alapjai előadás. Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás.
 Immunológia alapjai 24-25. előadás Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás. Tolerált bőr graftok MHC (H2) azonos egereken TOLERANCIA & AUTOIMMUNITÁS Toleranciáról beszélünk, ha
Immunológia alapjai 24-25. előadás Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás. Tolerált bőr graftok MHC (H2) azonos egereken TOLERANCIA & AUTOIMMUNITÁS Toleranciáról beszélünk, ha
A KÉMIAI KOMMUNIKÁCIÓ ALAPELVEI. - autokrin. -neurokrin. - parakrin. -térátvitel. - endokrin
 A KÉMIAI KOMMUNIKÁCIÓ ALAPELVEI - autokrin -neurokrin - parakrin -térátvitel - endokrin 3.1. ábra: Az immunreakciók főbb típusai és funkciójuk. IMMUNVÁLASZ TERMÉSZETES ADAPTÍV humorális sejtes HUMORÁLIS
A KÉMIAI KOMMUNIKÁCIÓ ALAPELVEI - autokrin -neurokrin - parakrin -térátvitel - endokrin 3.1. ábra: Az immunreakciók főbb típusai és funkciójuk. IMMUNVÁLASZ TERMÉSZETES ADAPTÍV humorális sejtes HUMORÁLIS
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 7. előadás Immunizálás. Poliklonális és monoklonális ellenanyag előállítása, tisztítása, alkalmazása Az antigén (haptén + hordozó) sokféle specificitású ellenanyag
Immunológiai módszerek a klinikai kutatásban 7. előadás Immunizálás. Poliklonális és monoklonális ellenanyag előállítása, tisztítása, alkalmazása Az antigén (haptén + hordozó) sokféle specificitású ellenanyag
Fenti előzmények alapján kutatásunk során alapvetően három témakört vizsgáltunk:
 Szakami összefoglaló jelentés a T/F 037876 számú,,deiminált fehérjeantigének szerepének vizsgálata a rheumatoid arthritis patomechanizmusában és diagnosztikájában" kutatási terv 2002-2005 év során elért
Szakami összefoglaló jelentés a T/F 037876 számú,,deiminált fehérjeantigének szerepének vizsgálata a rheumatoid arthritis patomechanizmusában és diagnosztikájában" kutatási terv 2002-2005 év során elért
Az ellenanyagok szerkezete és funkciója. Erdei Anna Immunológiai Tanszék ELTE
 Az ellenanyagok szerkezete és funkciója Erdei Anna Immunológiai Tanszék ELTE Bev. 1. ábra Immunhomeosztázis A veleszületett és az adaptív immunrendszer szorosan együttműködik az immunhomeosztázis fenntartásáért
Az ellenanyagok szerkezete és funkciója Erdei Anna Immunológiai Tanszék ELTE Bev. 1. ábra Immunhomeosztázis A veleszületett és az adaptív immunrendszer szorosan együttműködik az immunhomeosztázis fenntartásáért
Fehérje alapú módszerek a Rheumatoid arthritis kimutatására
 Fehérje alapú módszerek a Rheumatoid arthritis kimutatására Doktori értekezés tézisei Készítette: Babos Fruzsina MTA-ELTE Peptidkémiai Kutatócsoport Témavezető: Dr. Magyar Anna Kémia Doktori Iskola Iskolavezető:
Fehérje alapú módszerek a Rheumatoid arthritis kimutatására Doktori értekezés tézisei Készítette: Babos Fruzsina MTA-ELTE Peptidkémiai Kutatócsoport Témavezető: Dr. Magyar Anna Kémia Doktori Iskola Iskolavezető:
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 2. előadás A veleszületett és specifikus immunrendszer sejtjei Vérképzés = Haematopeiesis, differenciálódás Kék: ősssejt Sötétkék: éretlen sejtek Barna: érett
Immunológiai módszerek a klinikai kutatásban 2. előadás A veleszületett és specifikus immunrendszer sejtjei Vérképzés = Haematopeiesis, differenciálódás Kék: ősssejt Sötétkék: éretlen sejtek Barna: érett
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 8. előadás Immunszerológia, immunkémia Az immunoassay-k érzékenysége A fő szérumfehérje frakciók és az ahhoz tartozó fehérjék Az Ig valencia és aviditás viszonya
Immunológiai módszerek a klinikai kutatásban 8. előadás Immunszerológia, immunkémia Az immunoassay-k érzékenysége A fő szérumfehérje frakciók és az ahhoz tartozó fehérjék Az Ig valencia és aviditás viszonya
INTRACELLULÁRIS PATOGÉNEK
 INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
FEHÉRJE VAKCINÁK BIOTECHNOLÓGIAI ELŐÁLLÍTÁSA III.
 Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére FEHÉRJE VAKCINÁK BIOTECHNOLÓGIAI ELŐÁLLÍTÁSA III.
Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére FEHÉRJE VAKCINÁK BIOTECHNOLÓGIAI ELŐÁLLÍTÁSA III.
Immunológia I. 2. előadás. Kacskovics Imre (imre.kacskovics@ttk.elte.hu)
 Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Az immunológia alapjai
 Az immunológia alapjai 8. előadás A gyulladásos reakció kialakulása: lokális és szisztémás gyulladás, leukocita migráció Berki Timea Lokális akut gyulladás kialakulása A veleszületeh és szerzeh immunitás
Az immunológia alapjai 8. előadás A gyulladásos reakció kialakulása: lokális és szisztémás gyulladás, leukocita migráció Berki Timea Lokális akut gyulladás kialakulása A veleszületeh és szerzeh immunitás
Szervezetünk védelmének alapja: az immunológiai felismerés
 Szervezetünk védelmének alapja: az immunológiai felismerés Erdei Anna ELTE, TTK, Biológiai Intézet Immunológiai Tanszék ELTE, Pázmány-nap, 2012. Az immunrendszer fő feladata a gazdaszervezet védelme a
Szervezetünk védelmének alapja: az immunológiai felismerés Erdei Anna ELTE, TTK, Biológiai Intézet Immunológiai Tanszék ELTE, Pázmány-nap, 2012. Az immunrendszer fő feladata a gazdaszervezet védelme a
Immunológia alapjai előadás MHC. szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás.
 Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Antigén felismerés Az ellenanyagok és a B sejt receptorok natív formában
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Antigén felismerés Az ellenanyagok és a B sejt receptorok natív formában
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL
 TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
Ellenanyag reagensek előállítása II Sándor Noémi
 Ellenanyag reagensek előállítása II 2019.03.04. Sándor Noémi noemi.sandor@ttk.elte.hu Ellenanyagok módosítása 1. Kémiai módosítás Részleges redukció láncok közötti diszulfid hidak megszűnnek, szabad SH
Ellenanyag reagensek előállítása II 2019.03.04. Sándor Noémi noemi.sandor@ttk.elte.hu Ellenanyagok módosítása 1. Kémiai módosítás Részleges redukció láncok közötti diszulfid hidak megszűnnek, szabad SH
Az ophthalmopathia autoimmun kórfolyamatára utaló tényezôk Bizonyított: A celluláris és humorális autoimmun folyamatok szerepe.
 Az ophthalmopathia autoimmun kórfolyamatára utaló tényezôk Bizonyított: A celluláris és humorális autoimmun folyamatok szerepe. szemizom, retrobulbaris kötôszövet, könnymirigy elleni autoantitestek exophthalmogen
Az ophthalmopathia autoimmun kórfolyamatára utaló tényezôk Bizonyított: A celluláris és humorális autoimmun folyamatok szerepe. szemizom, retrobulbaris kötôszövet, könnymirigy elleni autoantitestek exophthalmogen
Antigén szervezetbe bejutó mindazon corpuscularis vagy solubilis idegen struktúra, amely immunreakciót vált ki Antitest az antigénekkel szemben az
 Antigén szervezetbe bejutó mindazon corpuscularis vagy solubilis idegen struktúra, amely immunreakciót vált ki Antitest az antigénekkel szemben az immunválasz során termelődött fehérjék (immunglobulinok)
Antigén szervezetbe bejutó mindazon corpuscularis vagy solubilis idegen struktúra, amely immunreakciót vált ki Antitest az antigénekkel szemben az immunválasz során termelődött fehérjék (immunglobulinok)
Natív antigének felismerése. B sejt receptorok, immunglobulinok
 Natív antigének felismerése B sejt receptorok, immunglobulinok B és T sejt receptorok A B és T sejt receptorok is az immunglobulin fehérje család tagjai A TCR nem ismeri fel az antigéneket, kizárólag az
Natív antigének felismerése B sejt receptorok, immunglobulinok B és T sejt receptorok A B és T sejt receptorok is az immunglobulin fehérje család tagjai A TCR nem ismeri fel az antigéneket, kizárólag az
Az ellenanyagok orvosbiológiai. PhD kurzus 2011/2012 II. félév
 Az ellenanyagok orvosbiológiai alkalmazása PhD kurzus 2011/2012 II. félév Ellenanyaggal működő módszerek Analitikai felhasználás Analitikai felhasználás Ellenanyag / antigén kapcsolódás Az Ab/Ag kapcsolat
Az ellenanyagok orvosbiológiai alkalmazása PhD kurzus 2011/2012 II. félév Ellenanyaggal működő módszerek Analitikai felhasználás Analitikai felhasználás Ellenanyag / antigén kapcsolódás Az Ab/Ag kapcsolat
Válasz Dr. Kacskovics Imre Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére
 Válasz Dr. Kacskovics Imre Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére Köszönöm Dr. Kacskovics Imre átfogó bírálatát, felvetéseit. A megfogalmazott kérdésekre az alábbiakban válaszolok:
Válasz Dr. Kacskovics Imre Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére Köszönöm Dr. Kacskovics Imre átfogó bírálatát, felvetéseit. A megfogalmazott kérdésekre az alábbiakban válaszolok:
Immunpatológia kurzus, - tavaszi szemeszter
 Immunpatológia kurzus, - tavaszi szemeszter Prof. Sármay Gabriella, Dr. Bajtay Zsuzsa, Dr. Józsi Mihály, Prof. Kacskovics Imre Prof. Erdei Anna Szerdánként, 10.00-12.00-ig, 5-202-es terem 1 2016. 02. 17.
Immunpatológia kurzus, - tavaszi szemeszter Prof. Sármay Gabriella, Dr. Bajtay Zsuzsa, Dr. Józsi Mihály, Prof. Kacskovics Imre Prof. Erdei Anna Szerdánként, 10.00-12.00-ig, 5-202-es terem 1 2016. 02. 17.
Immunológia Világnapja
 a Magyar Tudományos Akadémia Biológiai Osztály, Immunológiai Bizottsága és a Magyar Immunológiai Társaság Immunológia Világnapja - 2016 Tumorbiológia Dr. Tóvári József, Országos Onkológiai Intézet Mágikus
a Magyar Tudományos Akadémia Biológiai Osztály, Immunológiai Bizottsága és a Magyar Immunológiai Társaság Immunológia Világnapja - 2016 Tumorbiológia Dr. Tóvári József, Országos Onkológiai Intézet Mágikus
Immunszerológia I. Agglutináció, Precipitáció. Immunológiai és Biotechnológiai Intézet PTE-KK
 Immunszerológia I. Agglutináció, Precipitáció Immunológiai és Biotechnológiai Intézet PTE-KK Antigén Antitest Alapok Antigén: vvt,, baktérium, latex gyöngy felszínén (µm( m nagyságú partikulum) Antitest:
Immunszerológia I. Agglutináció, Precipitáció Immunológiai és Biotechnológiai Intézet PTE-KK Antigén Antitest Alapok Antigén: vvt,, baktérium, latex gyöngy felszínén (µm( m nagyságú partikulum) Antitest:
11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban
 11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban HIV fertőzés kimutatása (fiktív) esettanulmány 35 éves nő, HIV fertőzöttség gyanúja. Két partner az elmúlt időszakban. Fertőzött-e
11. Dr. House. Biokémiai és sejtbiológiai módszerek alkalmazása az orvoslásban HIV fertőzés kimutatása (fiktív) esettanulmány 35 éves nő, HIV fertőzöttség gyanúja. Két partner az elmúlt időszakban. Fertőzött-e
Újabb ismeretek a Graves-ophthalmopathia kórisméjében
 Újabb ismeretek a Graves-ophthalmopathia kórisméjében Dr. Molnár Ildikó 2004 Tézisek Az utóbbi 11 évben végzett tudományos munkám új eredményei 1. Graves-kórhoz társult infiltratív ophthalmopathia kialakulásában
Újabb ismeretek a Graves-ophthalmopathia kórisméjében Dr. Molnár Ildikó 2004 Tézisek Az utóbbi 11 évben végzett tudományos munkám új eredményei 1. Graves-kórhoz társult infiltratív ophthalmopathia kialakulásában
Az áramlási citométer és sejtszorter felépítése és működése, diagnosztikai alkalmazásai
 Az áramlási citométer és sejtszorter felépítése és működése, diagnosztikai alkalmazásai Az áramlási citométer és sejtszorter felépítése és működése Kereskedelmi forgalomban kapható készülékek 1 Fogalmak
Az áramlási citométer és sejtszorter felépítése és működése, diagnosztikai alkalmazásai Az áramlási citométer és sejtszorter felépítése és működése Kereskedelmi forgalomban kapható készülékek 1 Fogalmak
1. EGFP transzfektált HEK sejtek sortolása NFAT jelátviteli vizsgálatokhoz.
 Elemi kutatási témák a Multiparaméteres Fluoreszcencia Aktivált Sejtanalízis és Szortírozás (FACS) 2.4. TÁMOP részprojekt keretében: 2011-02-05 és 2011-07-07 között 1. EGFP transzfektált HEK sejtek sortolása
Elemi kutatási témák a Multiparaméteres Fluoreszcencia Aktivált Sejtanalízis és Szortírozás (FACS) 2.4. TÁMOP részprojekt keretében: 2011-02-05 és 2011-07-07 között 1. EGFP transzfektált HEK sejtek sortolása
Doktori értekezés tézisei. A komplementrendszer szerepe EAE-ben (Experimental Autoimmune Encephalomyelitis), a sclerosis multiplex egérmodelljében
 Doktori értekezés tézisei A komplementrendszer szerepe EAE-ben (Experimental Autoimmune Encephalomyelitis), a sclerosis multiplex egérmodelljében Készítette: Terényi Nóra Témavezető: Prof. Erdei Anna Biológia
Doktori értekezés tézisei A komplementrendszer szerepe EAE-ben (Experimental Autoimmune Encephalomyelitis), a sclerosis multiplex egérmodelljében Készítette: Terényi Nóra Témavezető: Prof. Erdei Anna Biológia
Doktori (Ph.D.) értekezés tézisei. Isaák Andrea
 Doktori (Ph.D.) értekezés tézisei Immunkomplex-kötő receptorok kifejeződése és szerepe B-limfocitákon fiziológiás és autoimmun állapotokban Isaák Andrea Témavezetők: Prof. Erdei Anna D.Sc. és Prof. Gergely
Doktori (Ph.D.) értekezés tézisei Immunkomplex-kötő receptorok kifejeződése és szerepe B-limfocitákon fiziológiás és autoimmun állapotokban Isaák Andrea Témavezetők: Prof. Erdei Anna D.Sc. és Prof. Gergely
Vásárhelyi Barna. Semmelweis Egyetem, Laboratóriumi Medicina Intézet. Az ösztrogénekimmunmoduláns hatásai
 Vásárhelyi Barna Semmelweis Egyetem, Laboratóriumi Medicina Intézet Az ösztrogénekimmunmoduláns hatásai Ösztrogénhatások Ösztrogénhatások Morbiditás és mortalitási profil eltérő nők és férfiak között Autoimmun
Vásárhelyi Barna Semmelweis Egyetem, Laboratóriumi Medicina Intézet Az ösztrogénekimmunmoduláns hatásai Ösztrogénhatások Ösztrogénhatások Morbiditás és mortalitási profil eltérő nők és férfiak között Autoimmun
A plazminogén metilglioxál módosítása csökkenti a fibrinolízis hatékonyságát. Léránt István, Kolev Kraszimir, Gombás Judit és Machovich Raymund
 A plazminogén metilglioxál módosítása csökkenti a fibrinolízis hatékonyságát Léránt István, Kolev Kraszimir, Gombás Judit és Machovich Raymund Semmelweis Egyetem Orvosi Biokémia Intézet, Budapest Fehérjék
A plazminogén metilglioxál módosítása csökkenti a fibrinolízis hatékonyságát Léránt István, Kolev Kraszimir, Gombás Judit és Machovich Raymund Semmelweis Egyetem Orvosi Biokémia Intézet, Budapest Fehérjék
Monoklonális antitestek előállítása, jellemzői
 Monoklonális antitestek előállítása, jellemzői 2011. / 3 Immunológiai és Biotechnológiai Intézet PTE KK Antitestek szerkezete IgG Monoklonális ellenanyag előállítás: Hybridoma technika Lehetővé teszi kezdetben
Monoklonális antitestek előállítása, jellemzői 2011. / 3 Immunológiai és Biotechnológiai Intézet PTE KK Antitestek szerkezete IgG Monoklonális ellenanyag előállítás: Hybridoma technika Lehetővé teszi kezdetben
Immunológia alapjai előadás. A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és
 Immunológia alapjai 15-16. előadás A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és csíracentrum reakció, affinitás-érés és izotípusváltás. A B-sejt fejlődés szakaszai HSC Primer
Immunológia alapjai 15-16. előadás A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és csíracentrum reakció, affinitás-érés és izotípusváltás. A B-sejt fejlődés szakaszai HSC Primer
Vörösvérsejt ellenes autoantitestek. Dr. Toldi József OVSZ Szegedi Regionális Vérellátó Központ
 Vörösvérsejt ellenes autoantitestek Dr. Toldi József OVSZ Szegedi Regionális Vérellátó Központ Vörösvérsejt ellenes autoantitestek Fogalom meghatározás - Vörösvérsejt ellenes antitest (autoantitest) az,
Vörösvérsejt ellenes autoantitestek Dr. Toldi József OVSZ Szegedi Regionális Vérellátó Központ Vörösvérsejt ellenes autoantitestek Fogalom meghatározás - Vörösvérsejt ellenes antitest (autoantitest) az,
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a PD-L1 és PD-1 fehérjék túlélésre gyakorolt hatása
 Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
Tolerancia és autoimmunitás
 Tolerancia és autoimmunitás A tankönyben (http://immunologia.elte.hu/oktatas.php): Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2016 Bev. 3. ábra Az immunrendszer kétélű kard F i z i o l ó g i á
Tolerancia és autoimmunitás A tankönyben (http://immunologia.elte.hu/oktatas.php): Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2016 Bev. 3. ábra Az immunrendszer kétélű kard F i z i o l ó g i á
Bajtay Zsuzsa
 Immunológia II GY 2018.03.09. Bajtay Zsuzsa 4. Antigén-ellenanyag kapcsolódás kimutatásán alapuló jelöléses módszerek ELISA, ELISPOT, Western blot, Immunhisztokémia Antigén-ellenanyag kapcsolódáson alapuló
Immunológia II GY 2018.03.09. Bajtay Zsuzsa 4. Antigén-ellenanyag kapcsolódás kimutatásán alapuló jelöléses módszerek ELISA, ELISPOT, Western blot, Immunhisztokémia Antigén-ellenanyag kapcsolódáson alapuló
2.6.16. VIZSGÁLATOK IDEGEN KÓROKOZÓKRA HUMÁN ÉLŐVÍRUS-VAKCINÁKBAN
 2.6.16. Vizsgálatok idegen kórokozókra Ph.Hg.VIII. - Ph.Eur.7.0 1 2.6.16. VIZSGÁLATOK IDEGEN KÓROKOZÓKRA HUMÁN ÉLŐVÍRUS-VAKCINÁKBAN 01/2011:20616 Azokhoz a vizsgálatokhoz, amelyekhez a vírust előzőleg
2.6.16. Vizsgálatok idegen kórokozókra Ph.Hg.VIII. - Ph.Eur.7.0 1 2.6.16. VIZSGÁLATOK IDEGEN KÓROKOZÓKRA HUMÁN ÉLŐVÍRUS-VAKCINÁKBAN 01/2011:20616 Azokhoz a vizsgálatokhoz, amelyekhez a vírust előzőleg
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 6. előadás Humorális és celluláris immunválasz A humorális (B sejtes) immunválasz lépései Antigén felismerés B sejt aktiváció: proliferáció, differenciálódás
Immunológiai módszerek a klinikai kutatásban 6. előadás Humorális és celluláris immunválasz A humorális (B sejtes) immunválasz lépései Antigén felismerés B sejt aktiváció: proliferáció, differenciálódás
A kemotaxis kiváltására specializálódott molekula-család: Cytokinek
 A kemotaxis kiváltására specializálódott molekula-család: Cytokinek Cytokinek - definíció Cytokin (Cohen 1974): Sejtek közötti kémi miai kommunikációra alkalmas anyagok; legtöbbjük növekedési vagy differenciációs
A kemotaxis kiváltására specializálódott molekula-család: Cytokinek Cytokinek - definíció Cytokin (Cohen 1974): Sejtek közötti kémi miai kommunikációra alkalmas anyagok; legtöbbjük növekedési vagy differenciációs
ELLENANYAGOK ÉS SZÁRMAZÉKAIK
 Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 ELLENANYAGOK
Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére TÁMOP-4.1.1.C-13/1/KONV-2014-0001 ELLENANYAGOK
A harkányi gyógyvízzel végzett vizsgálataink eredményei psoriasisban között. Dr. Hortobágyi Judit
 A harkányi gyógyvízzel végzett vizsgálataink eredményei psoriasisban 2007-2011 között Dr. Hortobágyi Judit Pikkelysömörre gyakorolt hatása 2007-től 2009-ig 1. Lokális hatása 2. Szisztémás hatása 3. Állatkísérlet
A harkányi gyógyvízzel végzett vizsgálataink eredményei psoriasisban 2007-2011 között Dr. Hortobágyi Judit Pikkelysömörre gyakorolt hatása 2007-től 2009-ig 1. Lokális hatása 2. Szisztémás hatása 3. Állatkísérlet
Katasztrófális antifoszfolipid szindróma
 Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
HLA-B27 pozitivitás vizsgálati lehetőségei
 HLA-B27 pozitivitás vizsgálati lehetőségei Pálinkás László, Uherkovichné Paál Mária, Berki Timea Pécsi Tudományegyetem Klinikai Központ Immunológiai és Biotechnológiai Intézet HLA-B27 Humán Leukocita Antigén
HLA-B27 pozitivitás vizsgálati lehetőségei Pálinkás László, Uherkovichné Paál Mária, Berki Timea Pécsi Tudományegyetem Klinikai Központ Immunológiai és Biotechnológiai Intézet HLA-B27 Humán Leukocita Antigén
Túlérzékenységi reakciók Gell és Coombs felosztása szerint.
 Túlérzékenységi reakciók Gell és Coombs felosztása szerint. A felosztás mai szemmel nem a leglogikusabb, mert nem tesz különbséget az allergia, az autoimmunitás és a a transzplantációs immunreakciók között.
Túlérzékenységi reakciók Gell és Coombs felosztása szerint. A felosztás mai szemmel nem a leglogikusabb, mert nem tesz különbséget az allergia, az autoimmunitás és a a transzplantációs immunreakciók között.
Súlyos infekciók differenciálása a rendelőben. Dr. Fekete Ferenc Heim Pál Gyermekkórház Madarász utcai Gyermekkórháza
 Súlyos infekciók differenciálása a rendelőben Dr. Fekete Ferenc Heim Pál Gyermekkórház Madarász utcai Gyermekkórháza Miért probléma a lázas gyermek a rendelőben? nem beteg - súlyos beteg otthon ellátható
Súlyos infekciók differenciálása a rendelőben Dr. Fekete Ferenc Heim Pál Gyermekkórház Madarász utcai Gyermekkórháza Miért probléma a lázas gyermek a rendelőben? nem beteg - súlyos beteg otthon ellátható
Szőlőmag extraktum hatása makrofág immunsejtek által indukált gyulladásos folyamatokra Radnai Balázs, Antus Csenge, Sümegi Balázs
 Szőlőmag extraktum hatása makrofág immunsejtek által indukált gyulladásos folyamatokra Radnai Balázs, Antus Csenge, Sümegi Balázs Pécsi Tudományegytem Általános Orvostudományi Kar Biokémiai és Orvosi Kémiai
Szőlőmag extraktum hatása makrofág immunsejtek által indukált gyulladásos folyamatokra Radnai Balázs, Antus Csenge, Sümegi Balázs Pécsi Tudományegytem Általános Orvostudományi Kar Biokémiai és Orvosi Kémiai
1. Bevezetés. Integrinek, Fc-receptorok és G-fehérje-kapcsolt receptorok jelátvitelének mechanizmusa neutrofil granulocitákban
 Integrinek, Fc-receptorok és G-fehérje-kapcsolt receptorok jelátvitelének mechanizmusa neutrofil granulocitákban Doktori tézisek Dr. Jakus Zoltán Semmelweis Egyetem Molekuláris Orvostudományok Doktori
Integrinek, Fc-receptorok és G-fehérje-kapcsolt receptorok jelátvitelének mechanizmusa neutrofil granulocitákban Doktori tézisek Dr. Jakus Zoltán Semmelweis Egyetem Molekuláris Orvostudományok Doktori
Immunkomplexek által elindított gyulladási folyamatok követésére alkalmas mikrofluidikai rendszer fejlesztése
 1 Immunkomplexek által elindított gyulladási folyamatok követésére alkalmas mikrofluidikai rendszer fejlesztése Fürjes Péter MTA Energiatudományi Kutatóközpont MEMS Lab és Papp Krisztián MTA-ELTE Immunológia
1 Immunkomplexek által elindított gyulladási folyamatok követésére alkalmas mikrofluidikai rendszer fejlesztése Fürjes Péter MTA Energiatudományi Kutatóközpont MEMS Lab és Papp Krisztián MTA-ELTE Immunológia
A fiziológiás terhesség hátterében álló immunológiai történések
 A fiziológiás terhesség hátterében álló immunológiai történések APAI Ag ANYAI Ag FERTŐZÉS AUTOIMMUNITÁS MAGZATI ANTIGEN ALACSONY P SZINT INFERTILITAS BEÁGYAZÓDÁS ANYAI IMMUNREGULÁCIÓ TROPHOBLAST INVÁZIÓ
A fiziológiás terhesség hátterében álló immunológiai történések APAI Ag ANYAI Ag FERTŐZÉS AUTOIMMUNITÁS MAGZATI ANTIGEN ALACSONY P SZINT INFERTILITAS BEÁGYAZÓDÁS ANYAI IMMUNREGULÁCIÓ TROPHOBLAST INVÁZIÓ
Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén
 Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén Dr. Dallmann Klára A molekuláris biológia célja az élőlények és sejtek működésének molekuláris szintű
Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén Dr. Dallmann Klára A molekuláris biológia célja az élőlények és sejtek működésének molekuláris szintű
Hogyan véd és mikor árt immunrendszerünk?
 ERDEI ANNA Hogyan véd és mikor árt immunrendszerünk? Erdei Anna immunológus egyetemi tanár Az immunrendszer legfontosabb szerepe, hogy védelmet nyújt a különbözô kórokozók vírusok, baktériumok, gombák,
ERDEI ANNA Hogyan véd és mikor árt immunrendszerünk? Erdei Anna immunológus egyetemi tanár Az immunrendszer legfontosabb szerepe, hogy védelmet nyújt a különbözô kórokozók vírusok, baktériumok, gombák,
Spondylitis ankylopoeticahoz társuló osteoporosis
 Spondylitis ankylopoeticahoz társuló osteoporosis Szántó Sándor DE OEC, Reumatológiai Tanszék 2013.11.05. Szeminárium Csontfelszivódás és csontképzés SPA-ban egészséges előrehaladott SPA Spondylitis ankylopoetica
Spondylitis ankylopoeticahoz társuló osteoporosis Szántó Sándor DE OEC, Reumatológiai Tanszék 2013.11.05. Szeminárium Csontfelszivódás és csontképzés SPA-ban egészséges előrehaladott SPA Spondylitis ankylopoetica
A preventív vakcináció lényege :
 Vakcináció Célja: antigénspecifkus immunválasz kiváltása a szervezetben A vakcina egy olyan készítmény, amely fokozza az immunitást egy adott betegséggel szemben (aktiválja az immunrendszert). A preventív
Vakcináció Célja: antigénspecifkus immunválasz kiváltása a szervezetben A vakcina egy olyan készítmény, amely fokozza az immunitást egy adott betegséggel szemben (aktiválja az immunrendszert). A preventív
Rövid és hosszútávú sejtkultúrák, funkcionális tesztek. Immunológiai és Biotechnológiai Intézet Pécsi Tudományegyetem
 Rövid és hosszútávú sejtkultúrák, funkcionális tesztek Immunológiai és Biotechnológiai Intézet Pécsi Tudományegyetem Bevezetés Definíció: az élő szervezeten kívül (in( vitro) ) tartunk élő sejteket Cél:
Rövid és hosszútávú sejtkultúrák, funkcionális tesztek Immunológiai és Biotechnológiai Intézet Pécsi Tudományegyetem Bevezetés Definíció: az élő szervezeten kívül (in( vitro) ) tartunk élő sejteket Cél:
TÚLÉRZÉKENYSÉGI I. TÍPUSÚ TÚLÉRZÉKENYSÉGI REAKCIÓ 2013.04.21. A szenzitizáció folyamata TÚLÉRZÉKENYSÉGI REAKCIÓK ÁTTEKINTÉSE TÚLÉRZÉKENYSÉGI REAKCIÓK
 TÚLÉRZÉKENYSÉGI REAKCIÓK TÚLÉRZÉKENYSÉGI REAKCIÓK Ártalmatlan anyagok bejutása egyes emberekben túlérzékenységi reakciókat válthat ki Nemkívánatos gyulladáshoz, sejtek és szövetek károsodásához vezet Az
TÚLÉRZÉKENYSÉGI REAKCIÓK TÚLÉRZÉKENYSÉGI REAKCIÓK Ártalmatlan anyagok bejutása egyes emberekben túlérzékenységi reakciókat válthat ki Nemkívánatos gyulladáshoz, sejtek és szövetek károsodásához vezet Az
Szerológiai vizsgálatok APPvel kapcsolatban
 Szerológiai vizsgálatok APPvel kapcsolatban Kiss István Tudományos Támogató Igazgatóság Ceva-Phylaxia Tudományos támogató igazgatóság Termék támogatás Diagnosztika Módszer átadás Vázlat APX toxinok Szerológiai
Szerológiai vizsgálatok APPvel kapcsolatban Kiss István Tudományos Támogató Igazgatóság Ceva-Phylaxia Tudományos támogató igazgatóság Termék támogatás Diagnosztika Módszer átadás Vázlat APX toxinok Szerológiai
Biológiai módszerek alkalmazása környezeti hatások okozta terhelések kimutatására
 Szalma Katalin Biológiai módszerek alkalmazása környezeti hatások okozta terhelések kimutatására Témavezető: Dr. Turai István, OSSKI Budapest, 2010. október 4. Az ionizáló sugárzás sejt kölcsönhatása Antone
Szalma Katalin Biológiai módszerek alkalmazása környezeti hatások okozta terhelések kimutatására Témavezető: Dr. Turai István, OSSKI Budapest, 2010. október 4. Az ionizáló sugárzás sejt kölcsönhatása Antone
Az immunrendszer sejtjei, differenciálódási antigének
 Az immunrendszer sejtjei, differenciálódási antigének Immunológia alapjai 2. hét Immunológiai és Biotechnológiai Intézet Az immunrendszer sejtjei Természetes/Veleszületett Immunitás: Granulociták (Neutrofil,
Az immunrendszer sejtjei, differenciálódási antigének Immunológia alapjai 2. hét Immunológiai és Biotechnológiai Intézet Az immunrendszer sejtjei Természetes/Veleszületett Immunitás: Granulociták (Neutrofil,
Bírálat Dr. Nagy György Patogenetikai tényezők vizsgálata rheumatoid arthritisben és szisztémás lupus erythematosusban c. MTA doktori értekezéséről
 Bírálat Dr. Nagy György Patogenetikai tényezők vizsgálata rheumatoid arthritisben és szisztémás lupus erythematosusban c. MTA doktori értekezéséről A disszertáció a Semmelweis Egyetem Genetikai, Sejt-
Bírálat Dr. Nagy György Patogenetikai tényezők vizsgálata rheumatoid arthritisben és szisztémás lupus erythematosusban c. MTA doktori értekezéséről A disszertáció a Semmelweis Egyetem Genetikai, Sejt-
Mikrobiális antigének
 Mikrobiális antigének Dr. Pusztai Rozália SZTE, ÁOK, Orvosi Mikrobiológiai és Immunbiológiai Intézet 2008. november 17. Antigének Konvencionális antigének Superantigének Antigén - az érett immunrendszer
Mikrobiális antigének Dr. Pusztai Rozália SZTE, ÁOK, Orvosi Mikrobiológiai és Immunbiológiai Intézet 2008. november 17. Antigének Konvencionális antigének Superantigének Antigén - az érett immunrendszer
Allergia immunológiája 2012.
 Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Válasz Dr. Szűcs Gabriellának Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére
 Válasz Dr. Szűcs Gabriellának Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére Köszönöm Dr. Szűcs Gabriella részletes, bírálatát, megjegyzéseit. A megfogalmazott kérdésekre az alábbiakban
Válasz Dr. Szűcs Gabriellának Dr. Nagy György MTA Doktori Értekezésére adott opponensi véleményére Köszönöm Dr. Szűcs Gabriella részletes, bírálatát, megjegyzéseit. A megfogalmazott kérdésekre az alábbiakban
II. A RHEUMATOID ARTHRITIS KEZELÉSÉNEK ÁLTALÁNOS ELVEI. origamigroup BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA
 BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA II. A RHEUMATOID ARTHRITIS KEZELÉSÉNEK ÁLTALÁNOS ELVEI origamigroup www.origami.co.hu II. A rheumatoid arthritis kezelésének általános
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA II. A RHEUMATOID ARTHRITIS KEZELÉSÉNEK ÁLTALÁNOS ELVEI origamigroup www.origami.co.hu II. A rheumatoid arthritis kezelésének általános
Immunitás és evolúció
 Immunitás és evolúció (r)evolúció az immunrendszerben Az immunrendszer evolúciója Müller Viktor ELTE Növényrendszertani, Ökológiai és Elméleti Biológiai Tanszék http://ramet.elte.hu/~viktor Az immunitás
Immunitás és evolúció (r)evolúció az immunrendszerben Az immunrendszer evolúciója Müller Viktor ELTE Növényrendszertani, Ökológiai és Elméleti Biológiai Tanszék http://ramet.elte.hu/~viktor Az immunitás
2012.02.24. Immunrendszer. Immunrendszer. Immunológiai alapfogalmak Vércsoport antigének,antitestek Alloimmunizáció mechanizmusa Agglutináció
 VÉRCSOPORTSZEROLÓGIA Immunológiai alapfogalmak Vércsoport antigének,antitestek Alloimmunizáció mechanizmusa Agglutináció Dr. Nemes Nagy Zsuzsa Szakképzés 2011. Immunrendszer Immunrendszer védi a szervezet
VÉRCSOPORTSZEROLÓGIA Immunológiai alapfogalmak Vércsoport antigének,antitestek Alloimmunizáció mechanizmusa Agglutináció Dr. Nemes Nagy Zsuzsa Szakképzés 2011. Immunrendszer Immunrendszer védi a szervezet
A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet
 A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet Mi a feladata az Immunrendszernek? 1. Védelem a kórokozók ellen 2. Immuntolerancia fenntartása Mik is azok a kórokozók? Kórokozók alatt
A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet Mi a feladata az Immunrendszernek? 1. Védelem a kórokozók ellen 2. Immuntolerancia fenntartása Mik is azok a kórokozók? Kórokozók alatt
AZ IMMUNOLÓGIAI LABORATÓRIUM DIAGNOSZTIKAI LEHETİSÉGEI. http://rimm.dote.hu
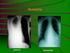 AZ IMMUNOLÓGIAI LABORATÓRIUM DIAGNOSZTIKAI LEHETİSÉGEI http://rimm.dote.hu Az Immunológiai Laboratórium feladata: A, Egy beteg immunrendszerének komplex vizsgálatával adatokat szolgáltatni egy immunológiai
AZ IMMUNOLÓGIAI LABORATÓRIUM DIAGNOSZTIKAI LEHETİSÉGEI http://rimm.dote.hu Az Immunológiai Laboratórium feladata: A, Egy beteg immunrendszerének komplex vizsgálatával adatokat szolgáltatni egy immunológiai
Autoimmun vizsgálatok (ML AU)
 mennyisége Autoimmun vizsgálatok (ML AU) ML AU 1.100 ANA ELISA(QuantaLite) ELISA - Szérum 200 l < 20 U/ml ML AU 1.200 Anti-dsDNA ELISA Szérum 200 l < 20 IU/ml ML AU 1.210 Anti-dsDNA IgG (Alegria) ELISA
mennyisége Autoimmun vizsgálatok (ML AU) ML AU 1.100 ANA ELISA(QuantaLite) ELISA - Szérum 200 l < 20 U/ml ML AU 1.200 Anti-dsDNA ELISA Szérum 200 l < 20 IU/ml ML AU 1.210 Anti-dsDNA IgG (Alegria) ELISA
In vivo szövetanalízis. Különös tekintettel a biolumineszcens és fluoreszcens képalkotási eljárásokra
 In vivo szövetanalízis Különös tekintettel a biolumineszcens és fluoreszcens képalkotási eljárásokra In vivo képalkotó rendszerek Célja Noninvazív módon Biológiai folyamatokat képes rögzíteni Élő egyedekben
In vivo szövetanalízis Különös tekintettel a biolumineszcens és fluoreszcens képalkotási eljárásokra In vivo képalkotó rendszerek Célja Noninvazív módon Biológiai folyamatokat képes rögzíteni Élő egyedekben
Jelátviteli útvonalak kapcsolata és azok gátlása egészséges és RA-s B sejtekben
 Doktori értekezés tézisei Jelátviteli útvonalak kapcsolata és azok gátlása egészséges és RA-s B sejtekben Szili Dániel Témavezető: Prof. Sármay Gabriella Biológiai Doktori Iskola Immunológia doktori program
Doktori értekezés tézisei Jelátviteli útvonalak kapcsolata és azok gátlása egészséges és RA-s B sejtekben Szili Dániel Témavezető: Prof. Sármay Gabriella Biológiai Doktori Iskola Immunológia doktori program
Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata
 Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata Dr. Nemes Karolina, Márk Ágnes, Dr. Hajdu Melinda, Csorba Gézáné, Dr. Kopper László, Dr. Csóka Monika, Dr.
Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata Dr. Nemes Karolina, Márk Ágnes, Dr. Hajdu Melinda, Csorba Gézáné, Dr. Kopper László, Dr. Csóka Monika, Dr.
Immunológiai Gyakorlatok II. 2016. április 20-26.
 Immunológiai Gyakorlatok II. 2016. április 20-26. T- és B-limfociták szeparálása (dúsítása) egér lépsejt-szuszpenzióból; neutrofil extracelluláris csapda (NET) vizsgálata Anyagok: steril fülke, olló, csipesz,
Immunológiai Gyakorlatok II. 2016. április 20-26. T- és B-limfociták szeparálása (dúsítása) egér lépsejt-szuszpenzióból; neutrofil extracelluláris csapda (NET) vizsgálata Anyagok: steril fülke, olló, csipesz,
Immunológia. Hogyan működik az immunrendszer? http://www.szote.u-szeged.hu/mdbio/oktatás/immunológia password: immun
 Immunológia Hogyan működik az immunrendszer? http://www.szote.u-szeged.hu/mdbio/oktatás/immunológia password: immun Hogyan működik az immunrendszer? Milyen stratégiája van? Milyen szervek / sejtek alkotják?
Immunológia Hogyan működik az immunrendszer? http://www.szote.u-szeged.hu/mdbio/oktatás/immunológia password: immun Hogyan működik az immunrendszer? Milyen stratégiája van? Milyen szervek / sejtek alkotják?
