Szakmai zárójelentés
|
|
|
- Borbála Kelemenné
- 5 évvel ezelőtt
- Látták:
Átírás
1 Szakmai zárójelentés HUMÁN DENDRITIKUS SEJTEK MŰKÖDÉSÉNEK SZABÁLYOZÁSA KOMPLEMENTFEHÉRJÉK ÉS RECEPTORAIK ÁLTAL; EXOSOMÁK JELENTŐSÉGE A T-SEJT VÁLASZ KIALAKULÁSÁBAN I. BEVEZETÉS, ELŐZMÉNYEK A dendritikus sejtek szerepe az immunválasz során Szervezetünkben a dendritikus sejtek (DC-k) a leukociták mintegy 1%-át teszik ki és egészséges szervezetben az agy kivételével valamennyi szervben megtalálhatók. Nagy mennyiségben vannak jelen az antigén támadás szempontjából kitűntetett helyeken, úgymint a légutak és tápcsatorna nyálkahártyájában vagy a bőr környzetében. A DC-k származásuk, szöveti előfordulásuk, aktiváltságuk és funkcionális tulajdonságaik alapján az egyik legheterogénebb sejtpopulációt jelentik. Fejlődésük csontvelői előalakokból két úton történhet. A mieloid fejlődési vonalat képviselik pl. a bőr alatti rétegben nagy számban előforduló Langerhans sejtek és a több szervben előforduló intersticiális DC-k (1). A másik fejlődési utat az ún. limfoid DC-k képviselik, amelyek vírusfertőzés következtében aktiválódnak és nagy mennyiségben termelnek I. típusú interferonokat. A mieloid DC-ek számos patogén eredetű anyag pl. LPS, vagy citokinek pl. TNF-α és gyulladási citokinek hatására aktiválódnak és differenciálódnak. Az így kialakuló érett DC-k, mint antigénbemutató sejtek a T limfociták, elsősorban a naív T-sejtek leghatékonyabb aktiválói. Az aktiváció mechanizmusát meghatározza az antigén által stimulált DC-kből származó citokinek mintázata, ez határozza meg azt is, hogy melyik T-sejt alpopuláció aktivációja következik be. Az eredet és fenotípus alapján történő osztályozással szemben nemrég vezették be az újabb, funkcionális különbségeken nyugvó DC neveztéktant (2). Eszerint megkülönböztetik a pre-dc, a konvencionális DC valamint a gyulladási DC sejttípusokat. A különböző pre-dc alakok differenciálódást követően tesznek szert a DC-kre jellemző morfológiai jegyekre és funkcionális aktivitásra. A konvencionális DC-k (cdc-k) már a jellegzetes nyúlványos alakkal rendelkeznek és DC funkciókat látnak el. A cdc-k további felosztását biztosítja lokalizációjuk; egyes sejtek az érésük helyszínén maradnak, míg mások migráló fenotípusúak. A migráló fenotípusú sejtek feladata a perifériás szövetek folyamatos ellenőrzése, az antigén felismerése és felvétele. Ezután a nyirokereken keresztül a nyirokcsomókba vándorolnak. Ilyen vándorló DC-k például az epidermiszben található Langerhans sejtek (LC). Ezzel ellentétben, a limfoid szövetekben előforduló DC-kre nem jellemző a migráció, ezek a limfoid szövetekben található antigéneket veszik fel és prezentálják az adott nyirokszervben. Zömében ide sorolhatók a csecsemőmirigyben és a lépben található DC-k. A nyirokcsomókban előforduló DC-k mintegy a fele rezidens sejt. Ezek a sejtek éretlen DC-k, aktívan antigént vesznek fel és dolgoznak fel, ellentétben azokkal a DC-kkel amelyek érett fenotípusúak és a nyirokereken keresztül érkeztek a szövetbe a periférián felvett antigénnel. A gyulladási DC-k nyugalmi állapotban nem mutathatók ki a szervezetben, ezek gyulladásos stimulus hatására monocitákból differenciálódnak. A mieloid eredetű, nyugvó, éretlen DC-k elsődleges feladata a szöveti környezet folyamatos megfigyelése, a szervezetbe jutó antigén azonnali felismerése. A környezetükből folyamatosan veszik fel pinocitozissal, receptor mediált endocitózissal és fagocitózissal az oldott részecskéket, partikulumokat, valamint a megváltozott vagy apoptotikus sejteket (3). A
2 DC-k számos receptort hordoznak felszínükön, mely lehetővé teszi a legkülönbözőbb antigének illetve opszonizált antigének felismerését: ezek a scavenger receptorok, a Toll-like receptorok (TLR), a C-típusú lektin receptorok, a komplement receptorok és az Fc-receptorok (4,5). Az antigén felismerése, megkötése és felvétele után a DC-k a nyirokcsomóba szállítják az antigént. Vándorlásuk során és a nyirokcsomóban töltött idő alatt válnak érett, teljes mértékben differenciálódott DC-é. Az aktiválódott DC-k antigén felvétele jelentős mértékben csökken, viszont fokozódik a felvett anyagok lebontása, és az antigénbemutató funkciójuk. A nyirokcsomóba érkező madc-k felszínén ugrásszerűen megnő az MHCII peptid komplexek és a CD40 molekulák száma, illetve azoknak a kostimulátoroknak (CD80, CD86) a mennyisége, amelyek más immunsejtekkel való kölcsönhatást biztosítanak. Az emberi érett DC-k jellemző markere a CD83 is. A sejtfelszíni molekulák mennyiségének változása mellett a sejt morfológiája is megváltozik, és fokozódik a migrációra való képessége. Az érés során a DC-k citokintermelése is megváltozik; más immunsejteket aktiváló IL-12-t és egyéb citokineket választanak ki, és a nyirokcsomóban lévő T-sejt eredetű faktorok hatására érésük teljessé válik. Mindemellett megnő a sejtek CCR7 kemokinreceptor expressziója, és ezáltal fogékonnyá válnak olyan kemokin-ingerekre, amelyek elősegítik a nyirokcsomóba történő vándorlásukat. Ennek a receptornak a liganduma a MIP-3β a kemotaktikus gradiensnek megfelelően a DC-ket a nyirokcsomó parakortikális részébe irányítja, ahol a naív T-sejtek is jelen vannak. Az érett DC-k sejtfelszínén expresszált kostimulátor molekulák segítik a kapcsolat kialakítását az antigénspecifikus T-sejtekkel, citokinjeikkel is elősegítve azok aktiválódását, effektor T limfocitákká differenciálódásukat. A DC-k az aktiváció típusától függően különböző citokineket termelnek, amelyek Th1 vagy a Th2 sejtek differenciálódását képesek kiváltani. Így, az adott antigén a DC-k stimulálása révén meghatározza a kialakuló immunválasz típusát, az IL-12 elsősorban Th1 választ, míg az IL-4 döntően Th2 választ indukál. Az immunológiai tolerancia fenntartásában fontos szerepet töltenek be a regulátor T limfociták (Treg), amelyek gátolják a sejtes immunválasz kialakulását (6). Újabb kutatások eredményei azt mutatják, hogy bizonyos regulátor DC-k (DCreg) által közvetített jelek szükségesek, az IL-10-et és TGFβ-t nagy mennyiségben szekretáló Treg sejtek aktiválódásához (7,8). Az exosomák 50 nm-nél kisebb átmérőjű membrán vezikulumok, jelenlétüket különböző eredetű sejtek kultúráiban, így DC felülúszójában is kimutatták (9). Az exosomák akkor kerültek a tudományos érdeklődés középpontjába, amikor kiderült, hogy antigénprezentáló sejtekből ultracentrifugálással elkülönített kisméretű vezikulumoknak in vivo immunválaszt stimuláló hatása van (10). Ma már az ismert, hogy az exosomák endocitotikus vezikulumokból származtathatók, amint azt az citoplazmatikus transzfer folyamatokat jellemző marker fehérjék, pl. a transferrin molekula jelenléte bizonyít (9). Az exosomákat, ellentétben az apoptotikus vezikulumokkal, kizárólag élő sejtek hozzák létre. A DC eredetű exosomákból jellegzetes alkotóelemeket sikerült azonosítani, ezek; MHC molekulák, adhéziós fehérjék, peptidázok, hősokk-fehérjék, citoszkeletális és transzport fehérjék valamint bizonyos szignál fehérjék (11,12). Az exosomák funkciója, az exosomaeredetű fehérjék szabályozó szerepe a DC-k funkcióban intenzív kutatások alapját jelenti napjainkban. Feltételezik, hogy az exosomák szerepet játszanak DC-k stimulálásában, ami ezeken a sejteken további sejtfelszíni molekulák expresszióját stimulálhatja, de a sejtek közötti információcserét is biztosíthatja membrán- és citoszól fehérjék átadásával. Az elmúlt években a professzionális antigénprezentáló DC-k a tudományos érdeklődés középpontjába kerültek, természetes adjuvánsként alkalmazzák tumor-ellenes terápiában (13) és vizsgálják szerepüket Treg sejtek kiváltotta kóros folyamatokban is (14). Ígéretes klinikai eredmények születtek a vírus fertőzések befolyásolása, a tumorok immunterápiája továbbá a vakcina tervezés területén.
3 A komplementfehérjék és receptoraik dendritikus sejteken A komplementrendszert alkotó fehérjék a tesnedvekben inaktív formában találhatók meg. A komplementrendszer lektin-függő módon és az alternatív úton aktiválódva a veleszületett immunitás nélkülözhetetlen eleme, ellenanyag jelenlétében pedig a klasszikus úton indul meg aktivációja. A komplementrendszer az immunrendszer működése során alapvetően fontos effektor funkciókat lát el, ezen túl bizonyos komplementfehérjék és komplementreceptorok (CR) szabályozó szereppel is rendelkeznek az immunválasz különböző fázisaiban. A C1q a komplementaktiváció klasszikus útja során elõször aktiválódó C1-komplex felismerő alegysége. A klasszikus út aktivációját elindító C1 komponens három alegységből álló, Ca 2+ -ionokkal stabilizált makromolekula, amely a C1q mellett enzimatikus aktivitással is rendelkező C1r és C1s alegységeket is tartalmaz. A 450 kda-os C1q molekula 18 hármasával összefonódott polipeptidláncból épül fel. Tulipáncsokorszerű hexamer szerkezetét három szerkezeti egység alkotja, melyeknek két-két alegységét diszulfid hidak kapcsolják össze. Az alegységek három különböző (A, B és C) polipeptidláncból állnak. A molekula N-terminális részén kollagénszerű motívumok (Gly- Xaa-Yaa) hármas hélix szerkezetet alakítanak ki. A C-terminális részén lévő hat globuláris fejen keresztül, a C1q az immunkomplexben lévő IgM, IgG1, IgG2, IgG3 molekula CH2 és CH3 doménjét ismeri fel (15). A C1q molekulához két C1r és két C1s szerin-proteáz molekula kötődik. Ezek aktiválódása a C1q aktiváló felszínhez való kötődését követő konformáció változás hatására következik be. Az aktiválódott C1-komplexről a C1-inhibitor hatására a C1r 2 és C1s 2 disszociál, így az immunkomplexhez továbbra is kötött C1q molekula kollagénszerű doménje révén C1q-receptorokhoz kapcsolódik. A teljes C1-komplex nem tud C1q-receptorhoz kötődni, mivel a C1r és C1s alegységek elfedik a kollagén részen található kötőhelyet. A C1q molekula szoros szerkezeti hasonlóságot mutat a kollektin családba tartozó fehérjékkel - MBL, SP-A, SP-D, CL-43, conglutinin -, amelyekben szintén kollagénszerű rész és globuláris egység található. A kollektinek közé tartozó mannózkötő lektin, az MBL strukturális és funkcionális analógiát mutat a C1q komponenssel. A komplementrendszert szabályozó fehérjék a szerin-proteáz alegységeket lehasítva lehetővé teszik, hogy a molekula sejtfelszíni receptorokhoz kötődjön. A szérumban az MBL dimer, trimer vagy tetramer alakban van jelen. Az egyes alegységeket három azonos felépítésű 32 kda méretű peptidlánc alkotja. Az MBL a baktériumok, gombákhoz és vírusokhoz sejtfalában lévő mannóz-, N- acetil-glükózamin-, N-acetil-mannózamin, és fukóz-csoportokhoz kötődik. Irodalmi adatok szerint a C1q molekula, a komplement aktivációban betöltött felismerő szerepe mellett, fokozza a makrofágok antigén felvételét és az apoptotikus sejtek fagocitózisát (16). A közlemények több, a globuláris- és a kollagén-domén megkötésére alkalmas C1qreceptort írnak le. A kollagén-c1q-receptort (cc1qr) MBL kötésére is alkalmasnak tartják, viszont ezt újabb eredmények nem erősítik meg. A leginkább elfogadott cc1qr a membránkötött kalretikulin CD91 molekulával alkotott komplexe (17). Korábbi OTKA pályázatainkhoz kapcsolódóan vizsgáltuk az MBL molekula kötődését különböző leukocitákhoz. Megállapítottuk, hogy az MBL elsősorban monocita-makrofág sejtekhez kapcsolódik, T és B limfocitákhoz nem, ellentétben a C1q molekulával, továbbá az MBL molekula a C1q molekulától eltérő receptorhoz kapcsolódik monocita/makrofág sejtek felszínén (18). A C3, C4, és C5 komplementfehérjék az α 2 -makroglobulin család tagjai. Ezek a fehérjék mintegy 700 millió éve jelentek meg a többsejtű szervezetekben. A molekulacsalád tagjaira jellemző a molekulaláncon belüli tioészter csoport (TED), valamint a funkcionálisan
4 fontos makroglobulin domének (MG). A C3 187 kda tömegű, két diszulfid híddal kapcsolt láncból; az α és β láncokból álló molekula. A C3 aktivációja proteolitikus hasítás révén valósul meg (19). A C3a lehasításának hatására C3b fragmentum és feltárul az eddig rejtett helyzetű, igen reaktív tioészter kötés, melyen keresztül a molekula az aktiváló felszínhez kovalensen képes kapcsolódni. A C3b fragmentum az aktivációt elindító sejt, részecske vagy molekula, a környezetében levő ún. akceptor struktúrák OH-csoportjaival észter-, NH 2 -csoportjaival pedig amidkötést alakít ki. Amennyiben a C3b kialakítja a C5 konvertázt, akkor a kaszkád a membránkárosító komplex (MAC) kialakulásához vezet. Abban az esetben viszont, ha az I faktor szolubilis vagy membránkötött kofaktorral tovább hasítja a C3b molekulát, akkor kialakul az inaktivált C3b (ic3b), amely a kaszkád továbbvitelére már nem alkalmas, de komplementreceptorhoz való kapcsolódásra igen. Következő hasítási lépésben az ic3b-ből kihasad a C3c fragmentum. Ezt követően a target felszínéhez kötötten a 40 kda tömegű C3dg fragmentum marad A C3 komponens központi szerepet játszik a komplementrendszer működése során, az aktiválása eredményeként keletkező fragmentumok sokoldalú biológiai funkciókat látnak el Az antigén felszínéhez kovalensen kötődött C3b, C3d és ic3b fragmentumok CR1, CR2 és CR3 komplementreceptort hordozó sejtekhez kapcsolódhatnak. A CR1 (CD35) C3b/C4b fragmentumokkal reagáló komplementreceptor. A lép és a nyirokcsomók csíraközpontjaiban jelenlevő follikuláris dendritikus sejteken a CR1 és a CR2, főleg B-limfocitákon expresszálódik, az előbbi a BCR-en keresztüli aktivációt negatívan, míg az utóbbi pozitívan befolyásolja, az immunológiai memória kialakulásában játszanak szerepet. A vörösvértesteken jelenlévő CR1 alapvető funkciója immunkomplexek eltávolítása a keringésből. A komplementfehérje-fragmentumokkal opszonizált immunkomplex a vörösvértesteken található CR1-el kölcsonhatásban elősegíti azok elszállítását a máj makrofágjai és dendritikus sejtjei által (20). A CR2 (CD21) B-limfocitákon, aktivált T- sejteken, hízósejteken és follikuláris dendritikus sejteken jelenik meg, DC-en jelenlétét nem sikerült igazolni. A CR3 (CD11b/CD18) és ligandumai közötti reakció Ca 2+ -és Mg 2+ -ionokat igényel. A CR4 receptor CD18 és CD11c láncból áll. A CR3 és CR4 receptorok az opszonizált részecskék valamint az apoptotikus sejtek fagocitózisában játszanak szerepet (21,22). Kemotaktikus faktorok jelentősen fokozzák expressziójukat neutrofil granulocitákon valamint monocitákon és makrofágokon. A C3aR és C5aR az anafilatoxikus hatású C3a és C5a peptidet kötésére képes 7 transzmembrán régiót tartalmazó receptor. Előbbiről kimutatták, hogy dendritikus sejtek kemotaxisában és aktivációjában játszik szerepet, de az általunk is használt monocita eredetű dendritikus sejteken nem expresszálódik (23). A C3- receptorok mellett a C1q komponenst kötő C1qR-ok jelenléte ismert dendritikus sejteken (24) A legújabban leírt Ig domént tartalmazó CRIg-t csak makrofágokon mutatták ki, szerepük a komplementfehérjével opszonizált partikulumok fagogitózisa (25). II. ALKALMAZOTT VIZSGÁLATI MÓDSZEREK Vizsgalatainkban emberi monocitákból in vitro differenciáltatott dendritikus sejteket (MDC) használtunk. Az MDC-ket emberi egészséges donorok véréből sűrűség-gradiens centrifugálással és adherencia módszerrel izolált monocitákból állítottuk elő (26). A monociták rekombináns humán IL-4 és GM-CSF jelenlétében, savó-mentes médiumban tenyésztve, 5 nap múlva éretlen DC-é (immdc) differenciálódnak és további stimulus LPS vagy TNF - hatására érett DC-é (mamdc) alakulnak (27,28). Kísérleteinkben MDC kultúrák sejtjein meghatároztuk komplementfehérjék kötődésének mértékét, jelzett ellenanyag segítségével, citofluorimetriával. Előkísérletben beállított szendvics ELISA módszer segítségével, MDC-k felülúszóiból határoztunk meg komplementfehérje és citokin termelést. Az MDC-k aktiválódásának nyomovkövetésére vizsgáltuk az NF-κB magi transzlokációját
5 Western blot módszerrel, illetve konfokális lézer scanning mikroszkópiával (CLM). A sejtmembránhoz kötödött fehérje-fragmentumok internalizációját FACS és CLM segítségével követtük nyomon. Sejtfelszíni receptorok működésének jellemzésére géncsendesítés módszerét alkalmaztuk. Az allogén T-sejtek proliferációját 3 H-timidin beépülés vizsgálatával és CFSE módszerrel határoztuk meg. III. EREDMÉNYEK A C1q komplementfehérje szerepe MDC-k funkcióira A komplementaktiváció klasszikus útjának aktiválása mellett a C1q számos immunológiai folyamat résztvevője, mint a baktériumok és vírusok fagocitózisa és neutralizációja és az immunológiai tolerancia biztosítása az apoptótikus sejtek clearance révén (29). Mivel a C1q komplementfehérje kimutatható a szervezetben jelenlévő immunkomplexekben valamint a kórokozók és apoptótikus sejtek felszínéhez is kötődik, ezért megvizsgáltuk, hogy vajon ez a komplementfehérje képes-e befolyásolni a DC-k különböző funkcióit. A tisztított C1q koncentráció függő módon kötődik az immdc-khez, viszont ez a kötődés a sejtek differenciációja során visszaszorul. Ezzel ellentétben, a C1q szerkezeti homológja; az MBL nem kötődik sem az éretlen, sem az érett MDC-khez. Humán dendritikus sejteken kétféle C1q-kötő struktúrát azonosítottak; a kollagénrészt (cc1q) megkötő cc1qr-t, valamint a globuláris-részt (gc1q) megkötő gc1qr-t (30). Korábban kimutatták, hogy az MDC-k mindkét típusú C1qR-t expresszálják (16). Vizsgálatainkban az MDC-ket C1q-val fedett felszínen inkubáltuk, majd megvizsgáltuk a sejtek CD80, CD83, CD86, MHCII és CCR7 expresszióját. Valamennyi membránfehérje esetében növekedést tapasztaltunk. Abból a célból, hogy tisztázzuk, a C1q kollagén-szerű része, vagy a globuláris doménje közvetíti-e az aktivációt, az MDC-ket kezeltünk tisztított cc1q-val és gc1q-val. Eredményeink azt mutatták, hogy mindkét fragmentummal történő kezelés fokozta a sejtfelszíni CD83, CD86 és MHCII mennyiségét, vagyis mind a cc1qr, mind a gc1qr résztvesz az MDC aktivációjában. Az MDC-k funkcionális aktivitását az NF-κB transzlokáció nyomonkövetésével, a sejtfelülúszóból citokinek mennyiségi meghatározásával és az allogén T-sejt aktiváló képesség mérésével jellemeztük. A C1q kezelés hatására az immdc-kben az NF-κB gyors magi transzlokációját mutattuk ki. Az aktivált MDC-kből származó citokinek célzottan stimulálják a különböző T-sejt alpopulációkat. Az IL-12-t termelő MDC-k főképp Th1, az IL- 4 elsősorban Th2 választ vált ki (1). Az is ismert, hogy bizonyos DC-k képesek a tolerancia kialakításában meghatározó szerepet játszó Treg sejtek aktiválására, ezek jellemzően IL-10-t szekretáló DC-k (7). A C1q-val kezelt MDC-k fokozott mennyiségben termeltek IL-12-t és TNFα-t, a C1q kezelt MDC-T-sejt kokultúrák felülúszójában pedig fokozott IFNγ szekréciót mértünk. Feltételezhetően, az aktivált MDC-kből származó IL-12 által stimulált Th1 sejtek felelősek a megövekedett IFNγ szintézisért. Ezután meghatároztuk a C1q-val aktivált MDC-k allogén T-sejt aktiváló képességét, proliferációs teszt segítségével, 3 H-timidin beépülés mérésével. Eredményeink azt mutatták, hogy a C1q kezelés következtében, az immdc-k T- sejt proliferációt kiváltó képessége szignifikánsan megnőtt. HANO betegek szérum MBL mennyiségének meghatározása A herediter angioneurotikus ödéma (HANO) egy ritka (1/10000 és 1/50000 között), de potenciálisan életet veszélyeztető betegség, amit a C1 inhibitor fehérje (C1INH) csökkent szintje vagy abnormális funkciója okoz. A HANO-ra jellemző a visszatérő, rohamokban
6 jelentkező ödéma, ami leggyakrabban a bőrön, a légutak vagy a tápcsatorna nyálkahártyájában jelenik meg. A C1INH hiánya miatt a komplementrendszer klasszikus útjának autoaktivációja jön létre. A HANO kialakulását tekintve, öröklött és szerzett formája egyaránt ismert. A lektin-függő útvonal aktiválódásának jelentősége HANO betegek eseteben nem ismert. Ennek tisztázása volt a célja annak a munkának, amelyben kollaborációs partnerként vettünk részt. Eredményeink a kollaborációban készült közlemény részét képezik. Az intézetünkben korábban kifejlesztett ELISA módszer alkalmazásával határoztuk meg az MBL koncentrációját HANO betegek vérszérumában. Méréseink szerint, a HANO páciensek szérum MBL szintje és a komplementkaszkád MBL-függő aktivációja nem mutatott eltérést a normál értékhez képest (31). A C3 komplementfehérje hatása MDC-k érésére és működésére A C3 komplementfehérje sejtekhez kötődésére két egymástól eltérő út kínálkozik; ezek a komplementreceptorhoz kapcsolódás, valamint a kovalens fixáció. A humán MDC-k in vitro differenciálódása során a sejtek komplementreceptor mintázata gyökeresen átalakul. Ismert, hogy a CR1 molekulák a monociták és makrofágok esetében fontos szerepet játszanak az opszonizált antigén megkötésében és fagocitózisában. Ezzel szemben a CR1 expresszióját az in vitro MDC érés során nem jellemezték. Munkánk során kimutattuk, hogy a monocitákból történő differenciáltatás alatt a CR1 mennyisége a sejtek felszínén folyamatosan csökken, majd a tenyésztés 5. napjától, az immdc-ken nem mutatható ki a receptor, továbbá nem detektálható CR1 az aktivációs stimulus hatására éretté váló mamdck sejtmembránjában sem (32). A mieloid eredetű dendritikus sejtek esetében ismert, hogy felszínükön a CD11c és CD11b konstitutív módon expresszálódik, valamint a CD11c a mieloid sejtekre jellemző marker molekula is. A CR3 és CR4 elsődleges liganduma a C3 molekula aktiválódása során keletkező ic3b-fragmentum (24). A CR-ok mellett további lehetőség a C3 molekula megkötésére a naszcensz C3bfragmentum sejtmembránhoz való kovalens kapcsolódása, ezt a folyamatot munkacsoportunk korábban monociták és makrofágok esetében részletesen jellemezte. Sajnos, a kovalens kötésért felelős struktúrát, a C3b akceptort - bár számos kutatócsoport próbálkozott vele -, máig nem sikerült azonosítani. Kutatócsoportunk az 1980-as évek elején leírta, hogy a B-sejtek 57%-a kötött C3 fragmentumot hordoz, ellentétben a nyugvó T-sejtekkel (33). Az aktivált C3b elméletileg bármilyen nukleofil csoportokhoz kapcsolódhat, viszont a sejtek felszínén jelenlevő C3b akceptor struktúrák telíthetőnek mutatkoztak. Kísérleteinkben ugyanerre az eredményekre jutottunk MDC-k esetében; a sejtek a natív, tisztított C3-at dózisfüggő módon, kovalensen fixálják felszínükön. Hasonló eredményt tapasztaltunk, ha normál humán savót (NHS) alkalmaztunk komplement forrásként. A kizárólag komplement receptorokhoz kötődni képes, metilaminnal (MA) kezelt C3 esetében kötődést nem tudtunk kimutatni. Ez arra utal, hogy az MDC-khez a C3 túlnyomórészt kovalensen fixált. Mivel az MDC-k CR3-at és CR4-et is kifejeznek, ellenőriztük a CR3-on keresztül történő kötődés lehetőségét egy további kísérletben; a ligandumkötőhelyre specifikus monoklonális ellenanyaggal - TMG6-5, Dr Andó István ajándéka -, inkubálva a sejteket a natív C3 kezelést megelőzően, a C3b depozíciót nem sikerült visszaszorítani, ami megerősíti, hogy fragmentum kovalensen kötött. A felszínhez kapcsolódó C3 fragmentumok mennyiségét vissza tudtuk szorítani, ha a natív C3 kezelés előtt a sejteket szerin-észteráz gátló PMSF-el előinkubáltuk. Ez, a más sejtek esetében is tapasztalt megfigyelésünk alátámasztja, hogy a C3 elhasításában, a kovalensen kötődő C3b fragmentumok előállításában, a sejtek által termelt proteázoknak szerepük van.
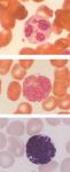
7 Tanulmányoztuk a natív C3 MDC-khez kötődését konfokális mikroszkópiával is. Jelöltük a C3-al kezelt, majd feltárt mintákon a C3-at (zöld) és a lizoszómák LAMP-1 fehérjéjét (vörös). Az 1. ábrán látható, hogy a kötődött C3 fragmentumok erős festődést mutatnak mind a sejtek felszínén, mind a sejtek belsejében. A felszínen nagyjából egyenletes eloszlást láttunk, viszont intracellulárisan vezikulumok formájában volt jelen a fehérje. A vezikulumok részben lizoszómával asszociáltak, részben nem. Annak megállapítása, hogy a kétféle vezikulum populáció hogyan alakul ki, további vizsgálatokat igényel. 1. ábra C3 fragmentumok kötődése és internalizációja immdc-ken, CLM vizsgálat A natív C3-al kezelt, majd feltárt immdc-k anti-c3-fitc (zöld) jelölve (bal oldal), anti-lamp-1-pe (vörös) jelölve (középen) Megvizsgáltuk a C3 kezelés hatását az MDC-k érésére, FACS vizsgálattal nyomonkövetve a sejtfelszíni membránfehérjék expresszióját. Rendszerünkben a natív C3- mal kezelt MDC-k esetében szignifikánsan megnőtt a CD83, a CD86 és az MHCII molekulák expressziója, így az LPS jelenlétében teljesen éretté vált mamdc-khez hasonló fenotípust nyertek. Viszont különböztek az LPS kezelt sejtektől abban, hogy a kezelés a CD80 és MR molekulákra nem volt hatással. Abban az esetben, ha az MDC-k csak CR révén köthették meg a műanyag felszínhez kötődőtt, ezáltal kovalens kapcsolódásra már nem képes, immobilizált C3 fragmentumokat, akkor a sejtek fenotípusa nem változott. Kíváncsiak voltunk arra, hogy a CR3-nak van-e közvetett szerepe a kovalensen kapcsolódó C3b aktivációs stimulusának közvetítésében. Ehhez RNS silencing technikával csökkentettük a CD11b, ezáltal a CR3 mennyiségét a MDC-ken. A kontroll sirns szekvencia nem befolyásolja a receptor expresszióját. A normál és a csökkent CR3-at hordozó sejteket kezeltük natív C3-mal. Az eredmények azt mutatják, hogy a szignifikánsan kevesebb CR3-at expresszáló sejtek natív C3-mal kezelve ugyanolyan hatékony aktivátorai voltak az allogén T-sejteknek, mint a kontroll, a CR3-at normális mennyiségben kifejező, natív C3 kezelt MDC-k. Mindezekből arra következtethetünk, hogy a CR3 indukció nem aktiválja a sejteket, ellentétben a kovalensen megkötött C3b hatásával. Egy nemrég megjelent közlemény adatai szerint az MDC-k igen jelentős mennyiségben szintetizálnak C1q-t, ami - hasonló koncentrációban -, korábban csak aktivált makrofágok esetében volt ismert (34). Ezért tartottuk érdekesnek megvizsgálni azt, hogy a C3 kötődése vajon befolyásolja-e egy másik komplementfehérje, a C1q termelését. Kísérleteink szerint a C3 fixációja nem okozott szignifikáns változást a sejtek C1q termelésében. A T-sejtek aktiválásában fontos szerepet játszanak a DC-k által szekretált citokinek. Vizsgálatainkban HS/C3 kezelt MDC kultúrák illetve MDC-T-limfocita kokultúrák felülúszóiból meghatározzuk a termelt citokineket, amit Th1/Th2 microbead assay segítségével citofluoriméterrel, valamint ELISA teszttel mérünk meg. Méréseink szerint, a
8 natív C3 kezelés dózis-függő módon fokozta az immdc-k IL-6, TNFα és IL-8 gyulladási citokin szekrécióját, viszont az immobilizált C3 kezelésnek nem volt hatása. A dendritikus sejtek fő feladata a T-limfociták aktivációja, ezért vizsgáltuk, hogy a C3 hogyan vesz részt ebben a folyamatban. Korábbi eredményeink szerint az APC-hez kötődő C3-fragmentumok megerősítik T-sejtekkel való kölcsönhatásukat, így fokozva a T-sejtek aktiválhatóságát (35). Kísérleteinkkel alátámasztottuk, hogy a C3 a MDC-k felszínéhez kovalensen kapcsolódva, elősegíti azok allogén T-sejt stimulációját (2. ábra). Bizonyítottuk, hogy ezért nemcsak a C3 által a DC-kben előidézett változások; úgymint fokozott kostimulátor és MHCII expresszió felelősek, hanem a sejtek felszínéhez kapcsolódó C3 által létrehozott kölcsönhatás. Ezen eredményeink, más adatokkal összhangban arra utalnak, hogy valószínűleg a DC-k felszínéhez kovalensen kötődött C3 a T-sejteken jelen levő komplement receptorokhoz kapcsolódva stabilizálhatja a két sejt kapcsolatát, és jelátviteli folyamatokat is beindíthat (36). 2. ábra Natív C3-mal kezelt és immobilizált C3-al fedett felszínen tartott MDC-k allogén T- sejt stimuláló képessége Tisztázni kívántuk, hogy a natív C3-al kezelt MDC-k vajon nem szolubilis faktorok (pl. citokinek) közvetítésével aktiválják-e a limfocitákat. A C3-al kezelt MDC-k sejtmentes felülúszóját az immdc-khez adva nem fokozódott a sejtek T-sejt stimuláló képessége. Másik kísérletben azt vizsgáltuk, hogy a C3 kezelés után még 48 órával is az MDC felszínén kimutatható C3 fragmentumok milyen szerepet töltenek be T-sejt osztódás fokozásában. Ehhez, a MDC-ket fixáltuk a C3 kezelés után, így a kostimulátor fokozó hatás nem érvényesülhetett. Eredményeink alapján az ilyen módon kezelt MDC-k szignifikánsan fokozták a T-sejtek proliferációját összehasonlítva a kezeletlen immdc-khez. Mindez bizonyítja, hogy az MDC-ken fixált C3 által közvetített aktivációs jel meghatározó a T limfociták stimulálásában. Végül, bizonyítottuk azt is, hogy a C3 váltja ki az MDC-k funkcionális változását, ugyanis ha egyidejűleg a C3 kezeléssel, anti-c3 F(ab ) 2 ellenanyagfragmentumok hozzáadásával blokkoljuk a C3 közvetített aktivációt, akkor a stimuláló hatás elmaradt. Az immunsejtek számos komplementfehérje szintézisére képesek, a C3 elsődleges előállítói a makrofágok (37). A szakirodalom nem volt egységes atekintetben, hogy a DC-k képesek-e C3-t termelni. Az erre vonatkozó vizsgálatok C3 mrns kimutatásával történtek (38,39). Saját eredményeink szeint, az MDC kultúrák felülúszójából nem mutatható ki
9 szekretált C3. Ezzel ellentétben, az aktivált monocita eredetű makrofágok nagy mennyiségben termelnek C3-t. Az immunszervekben makrofágok és dendritikus sejtek egymás közvetlen környezetében fordulnak elő. Abból a célból, hogy megvizsgáljuk a makrofágok és DC-k közti kölcsönhatásban a C3 szerepét, beállítottunk egy fiziológiás körülményeket modellező kísérleti rendszert. Vizsgátatunkban ugyanannak a donornak a monocitáiból in vitro makrofágokat (MM) és MDC-ket differenciáltattunk és azokból kokultúrákat készítettünk. A sejteket szérummentes közegben tartottuk, így rendszerünkben a MM-ok jelenthették a kizárólagos C3 forrást. Eredményeink szerint, az MDC-k képesek az aktivált makrofágok által termelt C3-at felszínükön kovalensen megkötni. A PMA-val történő aktiváció a MM-ok C3 termelését fokozta a nyugalmi állapothoz képest. Mivel a C3 differenciálódást kiváltó hatását az MDC-k esetében igazoltuk, ezért feltételezzük, hogy az aktivált makrofágokból felszabaduló és dendritikus sejtekhez kötődő C3, mint gyulladásos folyamatot jelző stimulus, fontos szerepet játszhat a DC-k in vivo differenciációjában és aktivációjában. A nem aktivált MM-ok által termelt C3 mennyisége nem volt elegendő az MDC-k aktiválásához. Feltételezésünk szerint, a gyulladásos stimulus hatására lépi át a C3 szint azt a kritikus küszöbértéket, ami már kiváltja az MDC-k aktivációját. Ghannam és munkatársai nemrég megjelent közleményükben a C3 deficiencia következményeit vizsgálták (40). Egy C3 hiánnyal rendelkező homozigota gyermeket és heterozigota szüleit vizsgálták A gyermek szérum C3 szintje és CH50 értéke a detektálási küszöb alatt volt, szüleinél mindkét érték a normális felének adódott. A beteg perifériás mononukleáris sejtjeit elemezve megállapították, hogy azok nem képesek normális antigénprezentáló funkciót ellátni. Mindez magyarázat arra, hogy ezekben a betegekben súlyos, visszatérő baktrerialis fertőzések alakulnak ki, ami a beteg halálához vezet. Vizsgálták a homozigota gyermek monocitáiból differenciáltatott dendritikus sejtek működését. Súlyos differenciálódási zavart állapítottak meg, mert az egészséges donorok monocitáihoz képest, amelyek 90%-ban alakultak MDC-vé, a beteg sejtjeinek csak töredéke volt erre képes. Ezek az eredmények összhangban állnak vizsgálatainkkal és erősen alátámasztják azt a megfigyelésünket, hogy a C3 kivételesen fontos szerepet tölt be, nemcsak az immunválasz szabályozásában, hanem a dendritikus sejtek megfelelő fejlődésében is. Az MDC eredetű exosomák vizsgálata Amint korábbi közleményeinkben leírtuk, a C3-fragmentumok fokozzák a T-sejt választ (35). A DC-k által közvetített aktivációs folyamatokban az exosomákhoz kapcsolódott komplementfragmentumok szerepét korábban nem vizsgálták. Feltételeztük, hogy a komplementfehérje mediált aktiváció az antigénprezentáló sejtek által szekretált exosomák közvetítésével is megvalósulhat. Vizsgáltuk a P388D1 egér makrofág továbbá B sejtvonal sejtjeit szérummal történő kezelés után. Kimutattuk, hogy a kezelés hatására a sejtek felszínén megnőtt a fixált C3-eredetű fragmentumok mennyisége (41). A szérum kezelést követően, az idő előrehaladtával a sejtfelszínen fixált komplementfragmentumok mennyisége csökkent, ezzel párhuzamosan viszont a sejtek felülúszójában kimutatott C3-fragmentumok mennyisége szignifikánsan megnőtt. Ezeknek a C3-eredetű fragmentumoknak a túlnyomó része, az ultracentrifugálással elkülönített exosoma frakcióban volt azonosítható. Az exosomák jelenlétét és a felszínükön fixált C3-fragmentumokat elektromikroszkópos vizsgalattal is megerősítettük. A fehérje antigénnel és szérummal kezelt makrofágokból exosoma frakciót különítettünk el. Az izolált, C3 fragmenumokat tartalmazó exosoma frakcióval kezelt makrofágok fokozott mértékben tudták stimulálni a specifius T sejtek proliferációját.
10 Az elmúlt évben beállítottuk intézetünkben az egér csontvelőből történő DC tenyésztés in vitro módszerét. Az in vitro differenciáltatott egér DC-k estében igazoltuk, hogy a sejtek fixálják felszínükön a savóból származó C3 fragmentumokat és ez kimutatható a sejtek által szekretált exosomák frakciójában. Mivel azt is kimutattuk, hogy az emberi MDC-k is megkötik kovalensen a C3b-t ezért megvizsgáltuk, hogy a kezelést követően a sejtek felülúszójának exosomákat tartalmazó frakciójában is megjelenik-e a C3b, úgy mint a másik két sejttípus esetén. Ennek érdekében a natív C3 kezelés után a sejteket különböző ideig inkubáltuk, a felülúszót ultracentrifugálással ülepítettük és C3 tartalmát ELISA módszerrel mértük. Eredményeink szerint, a natív C3-al kezelt MDC-k által termelt nanopartikulum frakcióban megjelenik a C3 molekula. A nanopartikulumok jellemzésére és funkcionális vizsgálatára további kísérleteket tervezünk elvégezni laboratóriumunkban. A módszer lehetőséget nyújt arra is, hogy a jövőben megvizsgálhassuk a DC érést C3 hiányos környezetben, C3 KO állatokban. A pályázat témakörében készült dolgozatok: TDK dolgozat Kristóf Katalin: A komplementrendszer lektinfüggő aktivációs útjának vizsgálata herediter angioneuroticus oedemában. TDK I Díj, Paréj Katalin: C3 komplementfehérje hatása egér dendritikus sejtek érésére és funkcióira. TDK Különdíj, Pap Domonkos: CR3 komplementreceptor vizsgálata humán dendritikus sejteken. TDK I. Díj, Szakdolgozat Paréj Katalin: C3 komplementfehérje hatása egér dendritikus sejtek érésére és funkcióira Pap Domonkos: C3 komplementfehérje szerepe emberi monocita eredetű dendritikus sejtek (MDC-k) működésére. Várható befejezés PhD értekezés Csomor Eszter: The effect of complement C1q and Toll-like receptor ligands on human monocyte-derived dendritic cells; immunity versus tolerance Sándor Noémi: A C3 komplementfehérje hatása humán monocita eredetű dendritikus sejtek funkcióira Hivatkozások 1. Banchereau, J., F. Briere, C. Caux, J. Davoust, S. Lebecque, Y. J. Liu, B. Pulendran, K. Palucka Immunobiology of dendritic cells. Annu. Rev. Immunol. 18:767. Review. 2. Shortman, K. & Naik, S. H. Steady-state and inflammatory dendritic-cell development. Nat. Rev. Immunol. 7, (2007). 3. Gordon, S Pattern recognition receptors: doubling up for the innate immune response. Cell. 111(7):927. Review 4. Iwasaki A, Medzhitov R. Toll-like receptor control of the adaptive immune responses. Nat Immunol Oct;5(10): Review 5. Kaisho T, Akira S. Regulation of dendritic cell function through toll-like receptors. Curr Mol Med Dec;3(8): Review
11 6. Pulendran B. Variegation of the immune response with dendritic cells and pathogen recognition receptors. J Immunol Mar 1;174(5): Review 7. Mills KH. Regulatory T cells: friend or foe in immunity to infection? Nat Rev Immunol Nov;4(11): Review 8. Smits HH, de Jong EC, Wierenga EA, Kapsenberg ML. Different faces of regulatory DCs in homeostasis and immunity. Trends Immunol Mar;26(3): Review. 9. Thery C, Zitvogel L, Amigorena S. Exosomes: composition, biogenesis and function. Nat Rev Immunol Aug;2(8): Thery C, Duban L, Segura E, Veron P, Lantz O, Amigorena S. Indirect activation of naive CD4+ T cells by dendritic cell-derived exosomes.nat Immunol Dec;3(12): Segura E, Nicco C, Lombard B, Veron P, Raposo G, Batteux F, Amigorena S, Thery C ICAM-1 on exosomes from mature dendritic cells is critical for efficient naive T cell priming. Blood Mar Morelli AE, Larregina AT, Shufesky WJ, Sullivan ML, Stolz DB, Papworth GD, Zahorchak AF, Logar AJ, Wang Z, Watkins SC, Falo LD Jr, Thomson AW Endocytosis, intracellular sorting, and processing of exosomes by dendritic cells. Blood Nov 15;104(10): Escudier B, Dorval T, Chaput N, Andre F, Caby MP, Novault S, Flament C, Leboulaire C, Borg C, Amigorena S, Boccaccio C, Bonnerot C, Dhellin O, Movassagh M, Piperno S, Robert C, Serra V, Valente N, Le Pecq JB, Spatz A, Lantz O, Tursz T, Angevin E, Zitvogel L.Vaccination of metastatic melanoma patients with autologous dendritic cell (DC) derivedexosomes: results of thefirst phase I clinical trial. J Transl Med Mar 2;3(1): Akbari O, Umetsu DT. Role of regulatory dendritic cells in allergy and asthma.curr Allergy Asthma Rep Jan;5(1): Review. 15. Gaboriaud C, Thielens NM, Gregory LA, Rossi V, Fontecilla-Camps JC, Arlaud GJ. Structure and activation of the C1 complex of complement: unraveling the puzzle. Trends Immunol Jul;25(7): Nauta AJ, Castellano G, Xu W, Woltman AM, Borrias MC, Daha MR, van Kooten C, Roos A. Opsonization with C1q and mannose-binding lectin targets apoptotic cells to dendritic cells. J Immunol Sep 1;173(5): Sim RB, Moestrup SK, Stuart GR, Lynch NJ, Lu J, Schwaeble WJ, Malhotra R Interaction of C1q and the collectins with the potential receptors calreticulin (cc1qr/collectin receptor) and megalin. Immunobiology Aug;199(2): Review 18. Bajtay Zs, Józsi M, Bánki Z, Thiel S, Thielens N, Erdei A. MBL and C1q bind to distinct structures on lymphocytes and macrophages and mediate differential effects. European Journal of Immunology, Janssen BJ, Christodoulidou A, McCarthy A, Lambris JD, Gros P. Structure of C3b reveals conformational changes that underlie complement activity. Nature Nov 9;444(7116): Erdei A, Isaák A, Török K, Sándor N, Kremlitzka M, Prechl J, Bajtay Z: Expression and role of CR1 and CR2 on B and T lymphocytes under physiological and autoimmune conditions Mol. Immunol Sep;46(14): Epub 2009 Jun 25. Review. 21. Le Cabec V, Carreno S, Moisand A, Bordier C, Maridonneau-Parini I. Complement receptor 3 (CD11b/CD18) mediates type I and type II phagocytosis during nonopsonic and opsonic phagocytosis, respectively.j Immunol Aug 15;169(4): Morelli AE, Larregina AT, Shufesky WJ, Zahorchak AF, Logar AJ, Papworth GD, Wang Z, Watkins SC, Falo LD Jr, Thomson AW. Internalization of circulating apoptotic cells by splenic marginal zone dendritic cells: dependence on complement receptors and effect on cytokine production. Blood Jan 15;101(2):
12 23. Soruri, A. et al. IL-4 down-regulates anaphylatoxin receptors in monocytes and dendritic cells and impairs anaphylatoxin-induced migration in vivo. J. Immunol. 170, (2003). 24. Bajtay, Z., Csomor, E., Sandor, N. & Erdei, A. Expression and role of Fc- and complement-receptors on human dendritic cells. Immunol. Lett. 104, Helmy, K. Y. et al. CRIg: a macrophage complement receptor required for phagocytosis of circulating pathogens. Cell 124, Freundlich, B., N. Avdalovic Use of gelatin/plasma coated flasks for isolating human peripleral blood monocytes. J. Immunol. Meth. 62: Romani, N., S. Gruner, D. Brang, E. Kampgen, A. Lenz, B. Trockenbacher, G. Konwalinka, P. O. Fritsch, R. M. Steinman, G. Schuler Proliferating dendritic cell progenitors in human blood. J. Exp. Med. 180(1): Sallusto, F., Lanzavecchia A Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha. J. Exp. Med. 179(4): Kishore U, Gaboriaud C, Waters P, Shrive AK, Greenhough TJ, Reid KB, Sim RB, Arlaud GJ. C1q and tumor necrosis factor superfamily: modularity and versatility. Trends Immunol Oct;25(10): Review 30. Vegh Z, Goyarts EC, Rozengarten K, Mazumder A, Ghebrehiwet B.Maturation-dependent expression of C1q-binding proteins on the cell surface of human monocyte-derived dendritic cells. Int Immunopharmacol Mar;3(3): Varga, Lilian; Széplaki, Gábor; Laki, Judit; Kocsis, Andrea; Kristóf, Katalin; Gál, Péter; Bajtay, Zsuzsa; Wieslander, J; Daha, M R; Garred, P; Madsen, H; Fust, George; Farkas, Henriette: Depressed activation of the lectin pathway of complement in hereditary angioedema. Clin Exp Immunol Jul;153(1): Sándor N, Pap D, Prechl J, Erdei A, Bajtay Z. A novel, complement-mediated way to enhance the interplay between macrophages, dendritic cells and T lymphocytes Mol Immunol Dec;47(2-3): Erdei, A., Fust, G., Gyenes, J., Fabry, Z. & Gergely, J. C3b acceptors on human peripheral blood mononuclear cells; characterization and functional role. Immunology 49, (1983). 34. Castellano G, Woltman AM, Nauta AJ, Roos A, Trouw LA, Seelen MA, Schena FP, Daha MR, van Kooten C. Maturation of dendritic cells abrogates C1q production in vivo and in vitro. Blood May 15;103(10): Krisztina Kerekes, József Prechl, Zsuzsa Bajtay, Mihály Józsi, Anna Erdei:A further link between innate and adaptive immunity: C3-deposition on antigenpresenting cells enhances the proliferation of antigen-specific T cells International Journal of Immunology, , Longo, A. et al. C3-induced 3LL cell proliferation is mediated by C kinase. J. Cell Biochem. 94, Colten, H. R., Strunk, R. C., Perlmutter, D. H. & Cole, F. S. Regulation of complement protein biosynthesis in mononuclear phagocytes 10. Ciba Found. Symp. 118, Peng, Q., Li, K., Patel, H., Sacks, S. H. & Zhou, W. Dendritic cell synthesis of C3 is required for full T cell activation and development of a Th1 phenotype. J. Immunol. 176, Reis, E. S., Barbuto, J. A. & Isaac, L. Human monocyte-derived dendritic cells are a source of several complement proteins. Inflamm. Res. 55, Ghannam, A. et al. Human C3 deficiency associated with impairments in dendritic cell differentiation, memory B cells, and regulatory T cells. J. Immunol. 181,
13 41. Krisztián Papp, Péter Végh, József Prechl, Krisztina Kerekes, János Kovács, György Csikós, Zsuzsa Bajtay, Anna Erdei: B lymphocytes and macrophages eliminate cell membrane deposited C3 fragments by forming exosomes with immune response enhancing activity.mol Immunol Apr;45(8):
Bevezetés A komplementrendszer természetes immunitás fontos eleme. A kaszkád elsődleges szerepe a patogén mikróbák opszonizációja, fagocitózisa és
 Bevezetés A komplementrendszer természetes immunitás fontos eleme. A kaszkád elsődleges szerepe a patogén mikróbák opszonizációja, fagocitózisa és komplement-függő sejtlízise. A rendszer aktivációja eredményeként
Bevezetés A komplementrendszer természetes immunitás fontos eleme. A kaszkád elsődleges szerepe a patogén mikróbák opszonizációja, fagocitózisa és komplement-függő sejtlízise. A rendszer aktivációja eredményeként
Doktori értekezés tézisei
 Doktori értekezés tézisei A komplement- és a Toll-szerű receptorok kifejeződése és szerepe emberi B-sejteken fiziológiás és autoimmun körülmények között - az adaptív és a természetes immunválasz kapcsolata
Doktori értekezés tézisei A komplement- és a Toll-szerű receptorok kifejeződése és szerepe emberi B-sejteken fiziológiás és autoimmun körülmények között - az adaptív és a természetes immunválasz kapcsolata
Immunológia alapjai. 10. előadás. Komplement rendszer
 Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE
 Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2017. Bev. 2. ábra Az immunválasz kialakulása 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán
Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2017. Bev. 2. ábra Az immunválasz kialakulása 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán
2016. nov. 8. Bajtay Zsuzsa
 6. Komplementreceptorok fajtái és szerepük az immunválasz során 2016. nov. 8. Bajtay Zsuzsa A komplementrendszer - Vérben, testnedvekben inaktív állapotban jelenlévő - egymást láncreakcióban aktiváló faktorok
6. Komplementreceptorok fajtái és szerepük az immunválasz során 2016. nov. 8. Bajtay Zsuzsa A komplementrendszer - Vérben, testnedvekben inaktív állapotban jelenlévő - egymást láncreakcióban aktiváló faktorok
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 2. előadás A veleszületett és specifikus immunrendszer sejtjei Vérképzés = Haematopeiesis, differenciálódás Kék: ősssejt Sötétkék: éretlen sejtek Barna: érett
Immunológiai módszerek a klinikai kutatásban 2. előadás A veleszületett és specifikus immunrendszer sejtjei Vérképzés = Haematopeiesis, differenciálódás Kék: ősssejt Sötétkék: éretlen sejtek Barna: érett
Immunológia alapjai. 16. előadás. Komplement rendszer
 Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
Komplementfehérjék szabályozó szerepe monociták, makrofágok és dendritikus sejtek funkcióiban
 MTA DOKTORI ÉRTEKEZÉS TÉZISEI Komplementfehérjék szabályozó szerepe monociták, makrofágok és dendritikus sejtek funkcióiban Dr. Bajtay Zsuzsanna ELTE TTK Biológiai Intézet Immunológiai Tanszék 2014. Bevezetés
MTA DOKTORI ÉRTEKEZÉS TÉZISEI Komplementfehérjék szabályozó szerepe monociták, makrofágok és dendritikus sejtek funkcióiban Dr. Bajtay Zsuzsanna ELTE TTK Biológiai Intézet Immunológiai Tanszék 2014. Bevezetés
Immunológia alapjai. Az immunválasz szupressziója Előadás. A szupresszióban részt vevő sejtes és molekuláris elemek
 Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
Antigén, Antigén prezentáció
 Antigén, Antigén prezentáció Biológiai Intézet Immunológiai Tanszék Bajtay Zsuzsa ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2019. február. 26 Bev. 2. ábra Az
Antigén, Antigén prezentáció Biológiai Intézet Immunológiai Tanszék Bajtay Zsuzsa ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2019. február. 26 Bev. 2. ábra Az
OTKA ZÁRÓJELENTÉS
 NF-κB aktiváció % Annexin pozitív sejtek, 24h kezelés OTKA 613 ZÁRÓJELENTÉS A nitrogén monoxid (NO) egy rövid féléletidejű, számos szabályozó szabályozó funkciót betöltő molekula, immunmoduláns hatása
NF-κB aktiváció % Annexin pozitív sejtek, 24h kezelés OTKA 613 ZÁRÓJELENTÉS A nitrogén monoxid (NO) egy rövid féléletidejű, számos szabályozó szabályozó funkciót betöltő molekula, immunmoduláns hatása
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
B-sejtek szerepe az RA patológiás folyamataiban
 B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
B-sejtek szerepe az RA patológiás folyamataiban Erdei Anna Biológiai Intézet Immunológiai Tanszék Eötvös Loránd Tudományegyetem Immunológiai Tanszék ORFI, Helia, 2015 április 17. RA kialakulása Gary S.
Az immunrendszer sejtjei, differenciálódási antigének
 Az immunrendszer sejtjei, differenciálódási antigének Immunológia alapjai 2. hét Immunológiai és Biotechnológiai Intézet Az immunrendszer sejtjei Természetes/Veleszületett Immunitás: Granulociták (Neutrofil,
Az immunrendszer sejtjei, differenciálódási antigének Immunológia alapjai 2. hét Immunológiai és Biotechnológiai Intézet Az immunrendszer sejtjei Természetes/Veleszületett Immunitás: Granulociták (Neutrofil,
dc_818_13 Komplementfehérjék szabályozó szerepe monociták, makrofágok és dendritikus sejtek funkcióiban MTA doktori értekezés Dr.
 Komplementfehérjék szabályozó szerepe monociták, makrofágok és dendritikus sejtek funkcióiban MTA doktori értekezés Dr. Bajtay Zsuzsanna ELTE TTK Biológiai Intézet Immunológiai Tanszék 2014. Tartalomjegyzék
Komplementfehérjék szabályozó szerepe monociták, makrofágok és dendritikus sejtek funkcióiban MTA doktori értekezés Dr. Bajtay Zsuzsanna ELTE TTK Biológiai Intézet Immunológiai Tanszék 2014. Tartalomjegyzék
(1) A T sejtek aktiválása (2) Az ön reaktív T sejtek toleranciája. α lánc. β lánc. V α. V β. C β. C α.
 Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Lukácsi Szilvia
 Immunológia II GY 2018.04.13. Lukácsi Szilvia 7. Sterilitás, in vitro sejttenyésztés Az immunrendszer sejtjeinek izolálása, azonosítása és funkcionális vizsgálata: I. Monociták, makrofágok, dendritikus
Immunológia II GY 2018.04.13. Lukácsi Szilvia 7. Sterilitás, in vitro sejttenyésztés Az immunrendszer sejtjeinek izolálása, azonosítása és funkcionális vizsgálata: I. Monociták, makrofágok, dendritikus
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás.
 Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Az immunrendszer felépítése Veleszületett immunitás (komplement, antibakteriális
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Az immunrendszer felépítése Veleszületett immunitás (komplement, antibakteriális
A T sejt receptor (TCR) heterodimer
 Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Az adaptív immunválasz kialakulása. Erdei Anna Immunológiai Tanszék ELTE
 Az adaptív immunválasz kialakulása Erdei Anna Immunológiai Tanszék ELTE NK sejt T Bev. 1. ábra Immunhomeosztázis A veleszületett immunrendszer elemei nélkül nem alakulhat ki az adaptív immunválasz A veleszületett
Az adaptív immunválasz kialakulása Erdei Anna Immunológiai Tanszék ELTE NK sejt T Bev. 1. ábra Immunhomeosztázis A veleszületett immunrendszer elemei nélkül nem alakulhat ki az adaptív immunválasz A veleszületett
Natív antigének felismerése. B sejt receptorok, immunglobulinok
 Natív antigének felismerése B sejt receptorok, immunglobulinok B és T sejt receptorok A B és T sejt receptorok is az immunglobulin fehérje család tagjai A TCR nem ismeri fel az antigéneket, kizárólag az
Natív antigének felismerése B sejt receptorok, immunglobulinok B és T sejt receptorok A B és T sejt receptorok is az immunglobulin fehérje család tagjai A TCR nem ismeri fel az antigéneket, kizárólag az
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
INTRACELLULÁRIS PATOGÉNEK
 INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
Immunológia I. 4. előadás. Kacskovics Imre
 Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Az immunrendszer sejtjei, differenciálódási antigének
 Az immunrendszer sejtjei, differenciálódási antigének Immunológia alapjai 2. hét Immunológiai és Biotechnológiai Intézet Az immunrendszer sejtjei Természetes/Veleszületett Immunitás: Granulociták (Neutrofil,
Az immunrendszer sejtjei, differenciálódási antigének Immunológia alapjai 2. hét Immunológiai és Biotechnológiai Intézet Az immunrendszer sejtjei Természetes/Veleszületett Immunitás: Granulociták (Neutrofil,
Immunológia alapjai előadás. Az immunológiai felismerés molekuláris összetevői.
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
3. Az ellenanyagokra épülő immunválasz. Varga Lilian Semmelweis Egyetem III. Sz. Belgyógyászati Klinika
 3. Az ellenanyagokra épülő immunválasz Varga Lilian emmelweis Egyetem III. z. Belgyógyászati Klinika Az ellenanyag funkciói Molekuláris kölcsönhatások helye az immunglobulinon Paratop specifikus ab Idiotípus
3. Az ellenanyagokra épülő immunválasz Varga Lilian emmelweis Egyetem III. z. Belgyógyászati Klinika Az ellenanyag funkciói Molekuláris kölcsönhatások helye az immunglobulinon Paratop specifikus ab Idiotípus
Az immunológia alapjai
 Az immunológia alapjai 8. előadás A gyulladásos reakció kialakulása: lokális és szisztémás gyulladás, leukocita migráció Berki Timea Lokális akut gyulladás kialakulása A veleszületeh és szerzeh immunitás
Az immunológia alapjai 8. előadás A gyulladásos reakció kialakulása: lokális és szisztémás gyulladás, leukocita migráció Berki Timea Lokális akut gyulladás kialakulása A veleszületeh és szerzeh immunitás
Immunológia alapjai előadás. Az immunológiai felismerés molekuláris összetevői
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 6. előadás Humorális és celluláris immunválasz A humorális (B sejtes) immunválasz lépései Antigén felismerés B sejt aktiváció: proliferáció, differenciálódás
Immunológiai módszerek a klinikai kutatásban 6. előadás Humorális és celluláris immunválasz A humorális (B sejtes) immunválasz lépései Antigén felismerés B sejt aktiváció: proliferáció, differenciálódás
A veleszületett (természetes) immunrendszer. PAMPs = pathogen-associated molecular patterns. A fajspecifikus szignálok hiányának felismerése
 A veleszületett (természetes) immunrendszer PAMPs = pathogen-associated molecular patterns PRRs = pattern recognition receptors A fajspecifikus szignálok hiányának felismerése Eukariota sejtmembrán Az
A veleszületett (természetes) immunrendszer PAMPs = pathogen-associated molecular patterns PRRs = pattern recognition receptors A fajspecifikus szignálok hiányának felismerése Eukariota sejtmembrán Az
A C3 komplementfehérje hatása humán monocita eredetű dendritikus sejtek funkcióira
 A C3 komplementfehérje hatása humán monocita eredetű dendritikus sejtek funkcióira Sándor Noémi Témavezető: Bajtay Zsuzsa PhD, habilitált adjunktus ELTE TTK Biológiai Intézet Immunológia Tanszék ELTE TTK
A C3 komplementfehérje hatása humán monocita eredetű dendritikus sejtek funkcióira Sándor Noémi Témavezető: Bajtay Zsuzsa PhD, habilitált adjunktus ELTE TTK Biológiai Intézet Immunológia Tanszék ELTE TTK
Immunológia Alapjai. 13. előadás. Elsődleges T sejt érés és differenciálódás
 Immunológia Alapjai 13. előadás Elsődleges T sejt érés és differenciálódás A T és B sejt receptor eltérő szerkezetű A T sejt receptor komplex felépítése + DOMÉNES SZERKEZET αβ ΤcR SP(CD4+ vagy CD8+) γδ
Immunológia Alapjai 13. előadás Elsődleges T sejt érés és differenciálódás A T és B sejt receptor eltérő szerkezetű A T sejt receptor komplex felépítése + DOMÉNES SZERKEZET αβ ΤcR SP(CD4+ vagy CD8+) γδ
Doktori (Ph.D.) értekezés tézisei. Isaák Andrea
 Doktori (Ph.D.) értekezés tézisei Immunkomplex-kötő receptorok kifejeződése és szerepe B-limfocitákon fiziológiás és autoimmun állapotokban Isaák Andrea Témavezetők: Prof. Erdei Anna D.Sc. és Prof. Gergely
Doktori (Ph.D.) értekezés tézisei Immunkomplex-kötő receptorok kifejeződése és szerepe B-limfocitákon fiziológiás és autoimmun állapotokban Isaák Andrea Témavezetők: Prof. Erdei Anna D.Sc. és Prof. Gergely
Immunológia alapjai előadás MHC. szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás.
 Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Antigén felismerés Az ellenanyagok és a B sejt receptorok natív formában
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Antigén felismerés Az ellenanyagok és a B sejt receptorok natív formában
Természetes immunitás
 Természetes immunitás Ősi: Gyors szaporodású mikroorganizmusok ellen azonnali védelem kell Elterjedés megakadályozása különben lehetetlen Azonnali reakciónak köszönhetően a fertőzést sokszor észre sem
Természetes immunitás Ősi: Gyors szaporodású mikroorganizmusok ellen azonnali védelem kell Elterjedés megakadályozása különben lehetetlen Azonnali reakciónak köszönhetően a fertőzést sokszor észre sem
Immunológia alapjai előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok:
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Doktori értekezés tézisei. Az FcRn transzgén állatok humorális immunválaszát befolyásoló T sejtek és antigén bemutató sejtek funkcionális vizsgálata
 Doktori értekezés tézisei Az FcRn transzgén állatok humorális immunválaszát befolyásoló T sejtek és antigén bemutató sejtek funkcionális vizsgálata Farkas Anita Témavezető: Dr. Kacskovics Imre Prof. Dr.
Doktori értekezés tézisei Az FcRn transzgén állatok humorális immunválaszát befolyásoló T sejtek és antigén bemutató sejtek funkcionális vizsgálata Farkas Anita Témavezető: Dr. Kacskovics Imre Prof. Dr.
Immunológia alapjai előadás. A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és
 Immunológia alapjai 15-16. előadás A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és csíracentrum reakció, affinitás-érés és izotípusváltás. A B-sejt fejlődés szakaszai HSC Primer
Immunológia alapjai 15-16. előadás A humorális immunválasz formái és lefolyása: extrafollikuláris reakció és csíracentrum reakció, affinitás-érés és izotípusváltás. A B-sejt fejlődés szakaszai HSC Primer
Immunológia alapjai 7-8. előadás Adhéziós molekulák és ko-receptorok.
 Immunológia alapjai 7-8. előadás Adhéziós molekulák és ko-receptorok. Az immunválasz kezdeti lépései: fehérvérsejt migráció, gyulladás, korai T sejt aktiváció, citokinek. T sejt receptor komplex ITAMs
Immunológia alapjai 7-8. előadás Adhéziós molekulák és ko-receptorok. Az immunválasz kezdeti lépései: fehérvérsejt migráció, gyulladás, korai T sejt aktiváció, citokinek. T sejt receptor komplex ITAMs
Kutatási beszámoló ( )
 Kutatási beszámoló (2008-2012) A thrombocyták aktivációja alapvető jelentőségű a thrombotikus betegségek kialakulása szempontjából. A pályázat során ezen aktivációs folyamatok mechanizmusait vizsgáltuk.
Kutatási beszámoló (2008-2012) A thrombocyták aktivációja alapvető jelentőségű a thrombotikus betegségek kialakulása szempontjából. A pályázat során ezen aktivációs folyamatok mechanizmusait vizsgáltuk.
Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek
 Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek Dr. Németh Péter PTE-KK Immunológiai és Biotechnológiai Intézet Mi az immunrendszer? Az immunrendszer a szervezet
Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek Dr. Németh Péter PTE-KK Immunológiai és Biotechnológiai Intézet Mi az immunrendszer? Az immunrendszer a szervezet
Immunkomplexek kialakulása, immunkomplexek által okozott patológiás folyamatok
 Immunkomplexek kialakulása, immunkomplexek által okozott patológiás folyamatok 2016. április 20. Bajtay Zsuzsa Az ellenanyag molekula felépítése antigénfelismerés Variábilis Konstans effektor-funkciók
Immunkomplexek kialakulása, immunkomplexek által okozott patológiás folyamatok 2016. április 20. Bajtay Zsuzsa Az ellenanyag molekula felépítése antigénfelismerés Variábilis Konstans effektor-funkciók
Allergia immunológiája 2012.
 Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Környezetegészségtan 2016/2017. Immunológia 1.
 Környezetegészségtan 2016/2017 Immunológia 1. 2016. XI.11. Józsi Mihály ELTE Immunológiai Tanszék http://immunologia.elte.hu email: mihaly.jozsi@freemail.hu Az Immunológia tankönyv elérhető: http://www.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_immunologia/adatok.html
Környezetegészségtan 2016/2017 Immunológia 1. 2016. XI.11. Józsi Mihály ELTE Immunológiai Tanszék http://immunologia.elte.hu email: mihaly.jozsi@freemail.hu Az Immunológia tankönyv elérhető: http://www.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_immunologia/adatok.html
Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek
 Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek Dr. Németh Péter PTE-KK Immunológiai és Biotechnológiai Intézet Mi az immunrendszer? Az immunrendszer a szervezet
Az immunrendszer ontogenezise, sejtjei, differenciálódási antigének és az immunszervek Dr. Németh Péter PTE-KK Immunológiai és Biotechnológiai Intézet Mi az immunrendszer? Az immunrendszer a szervezet
A sejtfelszíni FasL és szolubilis vezikulakötött FasL által indukált sejthalál gátlása és jellemzése
 A sejtfelszíni FasL és szolubilis vezikulakötött FasL által indukált sejthalál gátlása és jellemzése Doktori értekezés tézisei Hancz Anikó Témavezetők: Prof. Dr. Sármay Gabriella Dr. Koncz Gábor Biológia
A sejtfelszíni FasL és szolubilis vezikulakötött FasL által indukált sejthalál gátlása és jellemzése Doktori értekezés tézisei Hancz Anikó Témavezetők: Prof. Dr. Sármay Gabriella Dr. Koncz Gábor Biológia
A hízósejtek szerepe az immunológiai folyamatokban
 A hízósejtek szerepe az immunológiai folyamatokban Berki Timea Boldizsár F, Bartis D, Talabér G, Szabó M, Németh P, University of Pécs, Department of Immunology & Biotechnology, Pécs, Hungary Additon of
A hízósejtek szerepe az immunológiai folyamatokban Berki Timea Boldizsár F, Bartis D, Talabér G, Szabó M, Németh P, University of Pécs, Department of Immunology & Biotechnology, Pécs, Hungary Additon of
A fiziológiás terhesség hátterében álló immunológiai történések
 A fiziológiás terhesség hátterében álló immunológiai történések APAI Ag ANYAI Ag FERTŐZÉS AUTOIMMUNITÁS MAGZATI ANTIGEN ALACSONY P SZINT INFERTILITAS BEÁGYAZÓDÁS ANYAI IMMUNREGULÁCIÓ TROPHOBLAST INVÁZIÓ
A fiziológiás terhesség hátterében álló immunológiai történések APAI Ag ANYAI Ag FERTŐZÉS AUTOIMMUNITÁS MAGZATI ANTIGEN ALACSONY P SZINT INFERTILITAS BEÁGYAZÓDÁS ANYAI IMMUNREGULÁCIÓ TROPHOBLAST INVÁZIÓ
Komplementrendszer, fagociták, opszonizáció
 Komplementrendszer, fagociták, opszonizáció Biológiai Intézet Immunológiai Tanszék Bajtay Zsuzsa ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2018. február 26.
Komplementrendszer, fagociták, opszonizáció Biológiai Intézet Immunológiai Tanszék Bajtay Zsuzsa ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2018. február 26.
Mikrogliák eredete és differenciációja
 Mikrogliák eredete és differenciációja 2017. 10. 24. Jordán Viktória F. Ginhoux et al. Origin and differentiation of microglia, 2013 F. Ginhoux et al. Fate mapping anaylsis reveals that adult microglia
Mikrogliák eredete és differenciációja 2017. 10. 24. Jordán Viktória F. Ginhoux et al. Origin and differentiation of microglia, 2013 F. Ginhoux et al. Fate mapping anaylsis reveals that adult microglia
A KÉMIAI KOMMUNIKÁCIÓ ALAPELVEI. - autokrin. -neurokrin. - parakrin. -térátvitel. - endokrin
 A KÉMIAI KOMMUNIKÁCIÓ ALAPELVEI - autokrin -neurokrin - parakrin -térátvitel - endokrin 3.1. ábra: Az immunreakciók főbb típusai és funkciójuk. IMMUNVÁLASZ TERMÉSZETES ADAPTÍV humorális sejtes HUMORÁLIS
A KÉMIAI KOMMUNIKÁCIÓ ALAPELVEI - autokrin -neurokrin - parakrin -térátvitel - endokrin 3.1. ábra: Az immunreakciók főbb típusai és funkciójuk. IMMUNVÁLASZ TERMÉSZETES ADAPTÍV humorális sejtes HUMORÁLIS
A kemotaxis kiváltására specializálódott molekula-család: Cytokinek
 A kemotaxis kiváltására specializálódott molekula-család: Cytokinek Cytokinek - definíció Cytokin (Cohen 1974): Sejtek közötti kémi miai kommunikációra alkalmas anyagok; legtöbbjük növekedési vagy differenciációs
A kemotaxis kiváltására specializálódott molekula-család: Cytokinek Cytokinek - definíció Cytokin (Cohen 1974): Sejtek közötti kémi miai kommunikációra alkalmas anyagok; legtöbbjük növekedési vagy differenciációs
Komplementaktiválás, a C3 komplementfehérje szerkezete és működése
 Veleszületett immunitás, Az immunrendszer evolúciója Komplementaktiválás, a C3 komplementfehérje szerkezete és működése Papp Krisztián Papp Krisztián Immunválasz Kórokozó Veleszületett immunválasz Adaptív
Veleszületett immunitás, Az immunrendszer evolúciója Komplementaktiválás, a C3 komplementfehérje szerkezete és működése Papp Krisztián Papp Krisztián Immunválasz Kórokozó Veleszületett immunválasz Adaptív
Szervezetünk védelmének alapja: az immunológiai felismerés
 Szervezetünk védelmének alapja: az immunológiai felismerés Erdei Anna ELTE, TTK, Biológiai Intézet Immunológiai Tanszék ELTE, Pázmány-nap, 2012. Az immunrendszer fő feladata a gazdaszervezet védelme a
Szervezetünk védelmének alapja: az immunológiai felismerés Erdei Anna ELTE, TTK, Biológiai Intézet Immunológiai Tanszék ELTE, Pázmány-nap, 2012. Az immunrendszer fő feladata a gazdaszervezet védelme a
Túlérzékenységi reakciók Gell és Coombs felosztása szerint.
 Túlérzékenységi reakciók Gell és Coombs felosztása szerint. A felosztás mai szemmel nem a leglogikusabb, mert nem tesz különbséget az allergia, az autoimmunitás és a a transzplantációs immunreakciók között.
Túlérzékenységi reakciók Gell és Coombs felosztása szerint. A felosztás mai szemmel nem a leglogikusabb, mert nem tesz különbséget az allergia, az autoimmunitás és a a transzplantációs immunreakciók között.
A veleszületett és az adaptív immunválasz áttekintése
 A veleszületett és az adaptív immunválasz áttekintése Erdei Anna ELTE, TTK Biológiai Intézet Immunológiai Tanszék Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2019. február
A veleszületett és az adaptív immunválasz áttekintése Erdei Anna ELTE, TTK Biológiai Intézet Immunológiai Tanszék Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2019. február
Komplementrendszer, fagociták, opszonizáció
 Komplementrendszer, fagociták, opszonizáció Biológiai Intézet Immunológiai Tanszék Erdei Anna ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2017. január 31. Az immunválasz
Komplementrendszer, fagociták, opszonizáció Biológiai Intézet Immunológiai Tanszék Erdei Anna ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2017. január 31. Az immunválasz
Immunológia alapjai előadás. Sej-sejt kommunikációk az immunválaszban.
 Immunológia alapjai 7-8. előadás Sej-sejt kommunikációk az immunválaszban. Koreceptorok és adhéziós molekulák. Cytokinek, chemokinek és receptoraik. A sejt-sejt kapcsolatok mediátorai: cross-talk - Szolubilis
Immunológia alapjai 7-8. előadás Sej-sejt kommunikációk az immunválaszban. Koreceptorok és adhéziós molekulák. Cytokinek, chemokinek és receptoraik. A sejt-sejt kapcsolatok mediátorai: cross-talk - Szolubilis
Az immunológia alapjai
 Az immunológia alapjai Kacskovics Imre Eötvös Loránd Tudományegyetem Immunológiai Tanszék Budapest Citokinek Kisméretű, szolubilis proteinek és glikoproteinek. Hírvivő és szabályozó szereppel rendelkeznek.
Az immunológia alapjai Kacskovics Imre Eötvös Loránd Tudományegyetem Immunológiai Tanszék Budapest Citokinek Kisméretű, szolubilis proteinek és glikoproteinek. Hírvivő és szabályozó szereppel rendelkeznek.
1. előadás Immunológiai alapfogalmak. Immunrendszer felépítése
 1. előadás Immunológiai alapfogalmak. Immunrendszer felépítése Vér alakos elemei: 1mm3 vérben: 4-5 millió vörövértest 6000-9000 fehérvérssejt 200-400 ezer thrombocyta(vérlemezke) Fehérvérsejtek: agranulocyták:
1. előadás Immunológiai alapfogalmak. Immunrendszer felépítése Vér alakos elemei: 1mm3 vérben: 4-5 millió vörövértest 6000-9000 fehérvérssejt 200-400 ezer thrombocyta(vérlemezke) Fehérvérsejtek: agranulocyták:
Doktori értekezés tézisei. A komplementrendszer szerepe EAE-ben (Experimental Autoimmune Encephalomyelitis), a sclerosis multiplex egérmodelljében
 Doktori értekezés tézisei A komplementrendszer szerepe EAE-ben (Experimental Autoimmune Encephalomyelitis), a sclerosis multiplex egérmodelljében Készítette: Terényi Nóra Témavezető: Prof. Erdei Anna Biológia
Doktori értekezés tézisei A komplementrendszer szerepe EAE-ben (Experimental Autoimmune Encephalomyelitis), a sclerosis multiplex egérmodelljében Készítette: Terényi Nóra Témavezető: Prof. Erdei Anna Biológia
Az ellenanyagok szerkezete és funkciója. Erdei Anna Immunológiai Tanszék ELTE
 Az ellenanyagok szerkezete és funkciója Erdei Anna Immunológiai Tanszék ELTE Bev. 1. ábra Immunhomeosztázis A veleszületett és az adaptív immunrendszer szorosan együttműködik az immunhomeosztázis fenntartásáért
Az ellenanyagok szerkezete és funkciója Erdei Anna Immunológiai Tanszék ELTE Bev. 1. ábra Immunhomeosztázis A veleszületett és az adaptív immunrendszer szorosan együttműködik az immunhomeosztázis fenntartásáért
A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet
 A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet Mi a feladata az Immunrendszernek? 1. Védelem a kórokozók ellen 2. Immuntolerancia fenntartása Mik is azok a kórokozók? Kórokozók alatt
A csodálatos Immunrendszer Lányi Árpád, DE, Immunológiai Intézet Mi a feladata az Immunrendszernek? 1. Védelem a kórokozók ellen 2. Immuntolerancia fenntartása Mik is azok a kórokozók? Kórokozók alatt
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 7. előadás Immunizálás. Poliklonális és monoklonális ellenanyag előállítása, tisztítása, alkalmazása Az antigén (haptén + hordozó) sokféle specificitású ellenanyag
Immunológiai módszerek a klinikai kutatásban 7. előadás Immunizálás. Poliklonális és monoklonális ellenanyag előállítása, tisztítása, alkalmazása Az antigén (haptén + hordozó) sokféle specificitású ellenanyag
Immunológia 4. A BCR diverzitás kialakulása
 Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia. Hogyan működik az immunrendszer? http://www.szote.u-szeged.hu/mdbio/oktatás/immunológia password: immun
 Immunológia Hogyan működik az immunrendszer? http://www.szote.u-szeged.hu/mdbio/oktatás/immunológia password: immun Hogyan működik az immunrendszer? Milyen stratégiája van? Milyen szervek / sejtek alkotják?
Immunológia Hogyan működik az immunrendszer? http://www.szote.u-szeged.hu/mdbio/oktatás/immunológia password: immun Hogyan működik az immunrendszer? Milyen stratégiája van? Milyen szervek / sejtek alkotják?
Jelutak. Apoptózis. Apoptózis Bevezetés 2. Külső jelút 3. Belső jelút. apoptózis autofágia nekrózis. Sejtmag. Kondenzálódó sejtmag
 Jelutak Apoptózis 1. Bevezetés 2. Külső jelút 3. Belső jelút Apoptózis Sejtmag Kondenzálódó sejtmag 1. autofágia nekrózis Lefűződések Összezsugorodás Fragmentálódó sejtmag Apoptotikus test Fagocita bekebelezi
Jelutak Apoptózis 1. Bevezetés 2. Külső jelút 3. Belső jelút Apoptózis Sejtmag Kondenzálódó sejtmag 1. autofágia nekrózis Lefűződések Összezsugorodás Fragmentálódó sejtmag Apoptotikus test Fagocita bekebelezi
Áramlási citometria, sejtszeparációs technikák. Immunológiai és Biotechnológiai Intézet ÁOK, PTE
 Áramlási citometria, sejtszeparációs technikák Immunológiai és Biotechnológiai Intézet ÁOK, PTE Az áramlási citometria elve Az áramlási citometria ( Flow cytometria ) sejtek gyors, multiparaméteres vizsgálatára
Áramlási citometria, sejtszeparációs technikák Immunológiai és Biotechnológiai Intézet ÁOK, PTE Az áramlási citometria elve Az áramlási citometria ( Flow cytometria ) sejtek gyors, multiparaméteres vizsgálatára
FEHÉRJE VAKCINÁK BIOTECHNOLÓGIAI ELŐÁLLÍTÁSA III.
 Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére FEHÉRJE VAKCINÁK BIOTECHNOLÓGIAI ELŐÁLLÍTÁSA III.
Az élettudományi-klinikai felsőoktatás gyakorlatorientált és hallgatóbarát korszerűsítése a vidéki képzőhelyek nemzetközi versenyképességének erősítésére FEHÉRJE VAKCINÁK BIOTECHNOLÓGIAI ELŐÁLLÍTÁSA III.
A pollenek által indukált oxidatív stressz hatása a humán dendritikus sejtek működésére OTKA 73347 Zárójelentés
 A pollenek által indukált oxidatív stressz hatása a humán dendritikus sejtek működésére OTKA 73347 Zárójelentés I. A pollenszemek által termelt reaktív oxigéngyökök szerepe a humán mieloid dendritikus
A pollenek által indukált oxidatív stressz hatása a humán dendritikus sejtek működésére OTKA 73347 Zárójelentés I. A pollenszemek által termelt reaktív oxigéngyökök szerepe a humán mieloid dendritikus
ELMÉLETI ÖSSZEFOGLALÓ
 ELMÉLETI ÖSSZEFOGLALÓ Előzetes ismeretek: a sejt felépítése sejtalkotók szerepe a sejtmembrán szerkezete sejtfelszíni molekulák szerepe (marker-receptor) fehérjeszintézis alapja, folyamata Megjegyzés:
ELMÉLETI ÖSSZEFOGLALÓ Előzetes ismeretek: a sejt felépítése sejtalkotók szerepe a sejtmembrán szerkezete sejtfelszíni molekulák szerepe (marker-receptor) fehérjeszintézis alapja, folyamata Megjegyzés:
Sejt - kölcsönhatások az idegrendszerben
 Sejt - kölcsönhatások az idegrendszerben dendrit Sejttest Axon sejtmag Axon domb Schwann sejt Ranvier mielinhüvely csomó (befűződés) terminális Sejt - kölcsönhatások az idegrendszerben Szinapszis típusok
Sejt - kölcsönhatások az idegrendszerben dendrit Sejttest Axon sejtmag Axon domb Schwann sejt Ranvier mielinhüvely csomó (befűződés) terminális Sejt - kölcsönhatások az idegrendszerben Szinapszis típusok
Immunológia Világnapja
 a Magyar Tudományos Akadémia Biológiai Osztály, Immunológiai Bizottsága és a Magyar Immunológiai Társaság Immunológia Világnapja - 2016 Tumorbiológia Dr. Tóvári József, Országos Onkológiai Intézet Mágikus
a Magyar Tudományos Akadémia Biológiai Osztály, Immunológiai Bizottsága és a Magyar Immunológiai Társaság Immunológia Világnapja - 2016 Tumorbiológia Dr. Tóvári József, Országos Onkológiai Intézet Mágikus
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a PD-L1 és PD-1 fehérjék túlélésre gyakorolt hatása
 Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
1b. Fehérje transzport
 1b. Fehérje transzport Fehérje transzport CITOSZÓL Nem-szekretoros útvonal sejtmag mitokondrium plasztid peroxiszóma endoplazmás retikulum Szekretoros útvonal lizoszóma endoszóma Golgi sejtfelszín szekretoros
1b. Fehérje transzport Fehérje transzport CITOSZÓL Nem-szekretoros útvonal sejtmag mitokondrium plasztid peroxiszóma endoplazmás retikulum Szekretoros útvonal lizoszóma endoszóma Golgi sejtfelszín szekretoros
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
Apoptózis. 1. Bevezetés 2. Külső jelút 3. Belső jelút
 Jelutak Apoptózis 1. Bevezetés 2. Külső jelút 3. Belső jelút Apoptózis Sejtmag 1. Kondenzálódó sejtmag apoptózis autofágia nekrózis Lefűződések Összezsugorodás Fragmentálódó sejtmag Apoptotikus test Fagocita
Jelutak Apoptózis 1. Bevezetés 2. Külső jelút 3. Belső jelút Apoptózis Sejtmag 1. Kondenzálódó sejtmag apoptózis autofágia nekrózis Lefűződések Összezsugorodás Fragmentálódó sejtmag Apoptotikus test Fagocita
Immunológia alapjai. Hyperszenzitivitás előadás. Immunglobulin és cytokin mediálta hyperszenzitív reakciók. Allergia. DTH.
 Immunológia alapjai 21 22. előadás Hyperszenzitivitás Immunglobulin és cytokin mediálta hyperszenzitív reakciók. Allergia. DTH. Hyperszenzitivitás Az immunológiai reakciók súlyos szövetkárosodással (nekrózis)
Immunológia alapjai 21 22. előadás Hyperszenzitivitás Immunglobulin és cytokin mediálta hyperszenzitív reakciók. Allergia. DTH. Hyperszenzitivitás Az immunológiai reakciók súlyos szövetkárosodással (nekrózis)
A hisztamin és hisztamin H4 receptor hiányának hatása a dendritikus sejtek működésére
 A hisztamin és hisztamin H4 receptor hiányának hatása a dendritikus sejtek működésére Doktori tézisek Jelinek Ivett Semmelweis Egyetem Molekuláris Orvostudományok Doktori Iskola Témavezető: Dr. László
A hisztamin és hisztamin H4 receptor hiányának hatása a dendritikus sejtek működésére Doktori tézisek Jelinek Ivett Semmelweis Egyetem Molekuláris Orvostudományok Doktori Iskola Témavezető: Dr. László
Környezetegészségtan 2018/2019. Immunológia 1.
 Környezetegészségtan 2018/2019 Immunológia 1. 2018. XI.12. Józsi Mihály ELTE Immunológiai Tanszék http://immunologia.elte.hu email: mihaly.jozsi@ttk.elte.hu Az Immunológia tankönyv elérhető: http://www.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_immunologia/adatok.html
Környezetegészségtan 2018/2019 Immunológia 1. 2018. XI.12. Józsi Mihály ELTE Immunológiai Tanszék http://immunologia.elte.hu email: mihaly.jozsi@ttk.elte.hu Az Immunológia tankönyv elérhető: http://www.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_immunologia/adatok.html
Dendritikus sejtek differenciálódásának szabályozása hormonreceptorok által című OTKA pályázat záró jelentése.
 F38347 Dendritikus sejtek differenciálódásának szabályozása hormonreceptorok által című OTKA pályázat záró jelentése. A kutatás időtartama: 2002-2005 Témavezető neve: Dr. Szatmári István Jelen OTKA pályázatunkban
F38347 Dendritikus sejtek differenciálódásának szabályozása hormonreceptorok által című OTKA pályázat záró jelentése. A kutatás időtartama: 2002-2005 Témavezető neve: Dr. Szatmári István Jelen OTKA pályázatunkban
Immunkomplexek által elindított gyulladási folyamatok követésére alkalmas mikrofluidikai rendszer fejlesztése
 1 Immunkomplexek által elindított gyulladási folyamatok követésére alkalmas mikrofluidikai rendszer fejlesztése Fürjes Péter MTA Energiatudományi Kutatóközpont MEMS Lab és Papp Krisztián MTA-ELTE Immunológia
1 Immunkomplexek által elindított gyulladási folyamatok követésére alkalmas mikrofluidikai rendszer fejlesztése Fürjes Péter MTA Energiatudományi Kutatóközpont MEMS Lab és Papp Krisztián MTA-ELTE Immunológia
Környezetegészségtan 2016/2017. Immunológia 1.
 Környezetegészségtan 2016/2017 Immunológia 1. 2016. XI.11. Józsi Mihály ELTE Immunológiai Tanszék http://immunologia.elte.hu email: mihaly.jozsi@freemail.hu Az Immunológia tankönyv elérhető: http://www.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_immunologia/adatok.html
Környezetegészségtan 2016/2017 Immunológia 1. 2016. XI.11. Józsi Mihály ELTE Immunológiai Tanszék http://immunologia.elte.hu email: mihaly.jozsi@freemail.hu Az Immunológia tankönyv elérhető: http://www.tankonyvtar.hu/hu/tartalom/tamop425/2011_0001_524_immunologia/adatok.html
Immunológia alapjai. 8. előadás. Sejtek közötti kommunikáció: citokinek, kemokinek. Dr. Berki Timea
 Immunológia alapjai 8. előadás Sejtek közötti kommunikáció: citokinek, kemokinek Dr. Berki Timea Az immunválasz sejtjeinek párbeszéde 2 mechanizmussal zajlik: 1. Közvetlen sejt-sejt kapcsolódás útján:
Immunológia alapjai 8. előadás Sejtek közötti kommunikáció: citokinek, kemokinek Dr. Berki Timea Az immunválasz sejtjeinek párbeszéde 2 mechanizmussal zajlik: 1. Közvetlen sejt-sejt kapcsolódás útján:
AZ IMMUNRENDSZER VÁLASZAI A HPV FERTŐZÉSSEL KAPCSOLATOS KÉRDÉSEINKRE RAJNAVÖLGYI ÉVA DE OEC Immunológiai Intézet
 AZ IMMUNRENDSZER VÁLASZAI A HPV FERTŐZÉSSEL KAPCSOLATOS KÉRDÉSEINKRE RAJNAVÖLGYI ÉVA DE OEC Immunológiai Intézet A méhnyak rák előfordulása / év / 100 000 nő WHO 2005 A KÓROKOZÓK ÉS AZ IMMUNRENDSZER KÉTIRÁNYÚ
AZ IMMUNRENDSZER VÁLASZAI A HPV FERTŐZÉSSEL KAPCSOLATOS KÉRDÉSEINKRE RAJNAVÖLGYI ÉVA DE OEC Immunológiai Intézet A méhnyak rák előfordulása / év / 100 000 nő WHO 2005 A KÓROKOZÓK ÉS AZ IMMUNRENDSZER KÉTIRÁNYÚ
DOKTORI ÉRTEKEZÉS TÉZISEI AZ OPPORTUNISTA HUMÁNPATOGÉN CANDIDA PARAPSILOSIS ÉLESZTŐGOMBA ELLENI TERMÉSZETES ÉS ADAPTÍV IMMUNVÁLASZ VIZSGÁLATA
 DOKTORI ÉRTEKEZÉS TÉZISEI AZ OPPORTUNISTA HUMÁNPATOGÉN CANDIDA PARAPSILOSIS ÉLESZTŐGOMBA ELLENI TERMÉSZETES ÉS ADAPTÍV IMMUNVÁLASZ VIZSGÁLATA TÓTH ADÉL TÉMAVEZETŐ: DR. GÁCSER ATTILA TUDOMÁNYOS FŐMUNKATÁRS
DOKTORI ÉRTEKEZÉS TÉZISEI AZ OPPORTUNISTA HUMÁNPATOGÉN CANDIDA PARAPSILOSIS ÉLESZTŐGOMBA ELLENI TERMÉSZETES ÉS ADAPTÍV IMMUNVÁLASZ VIZSGÁLATA TÓTH ADÉL TÉMAVEZETŐ: DR. GÁCSER ATTILA TUDOMÁNYOS FŐMUNKATÁRS
TÚLÉRZÉKENYSÉGI I. TÍPUSÚ TÚLÉRZÉKENYSÉGI REAKCIÓ 2013.04.21. A szenzitizáció folyamata TÚLÉRZÉKENYSÉGI REAKCIÓK ÁTTEKINTÉSE TÚLÉRZÉKENYSÉGI REAKCIÓK
 TÚLÉRZÉKENYSÉGI REAKCIÓK TÚLÉRZÉKENYSÉGI REAKCIÓK Ártalmatlan anyagok bejutása egyes emberekben túlérzékenységi reakciókat válthat ki Nemkívánatos gyulladáshoz, sejtek és szövetek károsodásához vezet Az
TÚLÉRZÉKENYSÉGI REAKCIÓK TÚLÉRZÉKENYSÉGI REAKCIÓK Ártalmatlan anyagok bejutása egyes emberekben túlérzékenységi reakciókat válthat ki Nemkívánatos gyulladáshoz, sejtek és szövetek károsodásához vezet Az
Allergológia Kurzus 2011
 Allergológia Kurzus 2011 Kedd, 14.00-15.30 1 kreditpont Hepreszenzitivitás A normális immunrendszer által adott nemkívánatos reakció Ezek a reakciók szövetkárosodást, kellemetlen tüneteket okoznak, ritkán
Allergológia Kurzus 2011 Kedd, 14.00-15.30 1 kreditpont Hepreszenzitivitás A normális immunrendszer által adott nemkívánatos reakció Ezek a reakciók szövetkárosodást, kellemetlen tüneteket okoznak, ritkán
Immunológia I. 2. előadás. Kacskovics Imre (imre.kacskovics@ttk.elte.hu)
 Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
KLINIKAI IMMUNOLÓGIA I.
 Kórházhigienikus képzés, DE OEC KLINIKAI IMMUNOLÓGIA I. AZ IMMUNRENDSZER MŰKÖDÉSE Dr. Sipka Sándor DE OEC III. sz. Belgyógyászati Klinika Regionális Immunológiai Laboratórium A főbb ábrák és táblázatok
Kórházhigienikus képzés, DE OEC KLINIKAI IMMUNOLÓGIA I. AZ IMMUNRENDSZER MŰKÖDÉSE Dr. Sipka Sándor DE OEC III. sz. Belgyógyászati Klinika Regionális Immunológiai Laboratórium A főbb ábrák és táblázatok
AZ ADENOZIN HATÁSA A PERIFÉRIÁS CD4 + T-LIMFOCITÁK AKTIVÁCIÓJÁRA. Balicza-Himer Leonóra. Doktori értekezés tézisei
 AZ ADENOZIN HATÁSA A PERIFÉRIÁS CD4 + T-LIMFOCITÁK AKTIVÁCIÓJÁRA Doktori értekezés tézisei Balicza-Himer Leonóra Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Doktori Iskola / Immunológia
AZ ADENOZIN HATÁSA A PERIFÉRIÁS CD4 + T-LIMFOCITÁK AKTIVÁCIÓJÁRA Doktori értekezés tézisei Balicza-Himer Leonóra Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Doktori Iskola / Immunológia
Áramlási citometria 2011. / 4. Immunológiai és Biotechnológiai Intézet PTE KK
 Áramlási citometria 2011. / 4 Immunológiai és Biotechnológiai Intézet PTE KK Az áramlási citometria elve Az áramlási citometria ( Flow cytometria ) sejtek gyors, multiparaméteres vizsgálatára alkalmas
Áramlási citometria 2011. / 4 Immunológiai és Biotechnológiai Intézet PTE KK Az áramlási citometria elve Az áramlási citometria ( Flow cytometria ) sejtek gyors, multiparaméteres vizsgálatára alkalmas
1. Bevezetés. Integrinek, Fc-receptorok és G-fehérje-kapcsolt receptorok jelátvitelének mechanizmusa neutrofil granulocitákban
 Integrinek, Fc-receptorok és G-fehérje-kapcsolt receptorok jelátvitelének mechanizmusa neutrofil granulocitákban Doktori tézisek Dr. Jakus Zoltán Semmelweis Egyetem Molekuláris Orvostudományok Doktori
Integrinek, Fc-receptorok és G-fehérje-kapcsolt receptorok jelátvitelének mechanizmusa neutrofil granulocitákban Doktori tézisek Dr. Jakus Zoltán Semmelweis Egyetem Molekuláris Orvostudományok Doktori
3. Az alábbi citokinek közül melyiket NEM szekretálja az aktivált Th sejt? A IFN-γ B interleukin-10 C interleukin-2 D interleukin-1 E interleukin-4
 A Név: Csoportszám: EGYSZERŰ VÁLASZTÁS 1. Mi atlr-5 legfontosabb ligandja? A endospóra B flagellin C poliszacharid tok D DNS E pilus 2. Mi alkotja az ellenanyag antigénkötő helyét? A a H és L láncok konstans
A Név: Csoportszám: EGYSZERŰ VÁLASZTÁS 1. Mi atlr-5 legfontosabb ligandja? A endospóra B flagellin C poliszacharid tok D DNS E pilus 2. Mi alkotja az ellenanyag antigénkötő helyét? A a H és L láncok konstans
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
A veleszületett és az adaptív immunválasz áttekintése
 A veleszületett és az adaptív immunválasz áttekintése Erdei Anna ELTE, TTK Biológiai Intézet Immunológiai Tanszék Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2017. január
A veleszületett és az adaptív immunválasz áttekintése Erdei Anna ELTE, TTK Biológiai Intézet Immunológiai Tanszék Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2017. január
Vásárhelyi Barna. Semmelweis Egyetem, Laboratóriumi Medicina Intézet. Az ösztrogénekimmunmoduláns hatásai
 Vásárhelyi Barna Semmelweis Egyetem, Laboratóriumi Medicina Intézet Az ösztrogénekimmunmoduláns hatásai Ösztrogénhatások Ösztrogénhatások Morbiditás és mortalitási profil eltérő nők és férfiak között Autoimmun
Vásárhelyi Barna Semmelweis Egyetem, Laboratóriumi Medicina Intézet Az ösztrogénekimmunmoduláns hatásai Ösztrogénhatások Ösztrogénhatások Morbiditás és mortalitási profil eltérő nők és férfiak között Autoimmun
Immunpatológia kurzus, - tavaszi szemeszter
 Immunpatológia kurzus, - tavaszi szemeszter Prof. Sármay Gabriella, Dr. Bajtay Zsuzsa, Dr. Józsi Mihály, Prof. Kacskovics Imre Prof. Erdei Anna Szerdánként, 10.00-12.00-ig, 5-202-es terem 1 2016. 02. 17.
Immunpatológia kurzus, - tavaszi szemeszter Prof. Sármay Gabriella, Dr. Bajtay Zsuzsa, Dr. Józsi Mihály, Prof. Kacskovics Imre Prof. Erdei Anna Szerdánként, 10.00-12.00-ig, 5-202-es terem 1 2016. 02. 17.
Doktori értekezés tézisei. Szarka Eszter. Témavezető: Prof. Sármay Gabriella, egyetemi tanár
 Doktori értekezés tézisei Autoantitest profil és B sejt epitópok vizsgálata citrullinált peptidek segítségével rheumatoid arthritisben és a patomechanizmus vizsgálata a betegség egér modelljében Szarka
Doktori értekezés tézisei Autoantitest profil és B sejt epitópok vizsgálata citrullinált peptidek segítségével rheumatoid arthritisben és a patomechanizmus vizsgálata a betegség egér modelljében Szarka
