Metallilének, Ciklotrimetallének, Trimetallaallének, Metallilónok, Híd Szerkezetek és 2-Kalkogén-trimetallabiciklo[1.1.0]butánok.
|
|
|
- Gusztáv Papp
- 7 évvel ezelőtt
- Látták:
Átírás
1 BUDAPESTI MŰSZAKI ÉS GAZDASÁGTUDOMÁNYI EGYETEM VEGYÉSZMÉRNÖKI ÉS BIOMÉRNÖKI KAR OLÁ GYÖRGY DOKTORI ISKOLA Szokatlan Kötésszerkezetek Szilícium és Germánium Vegyületekben Metallilének, Ciklotrimetallének, Trimetallaallének, Metallilónok, íd Szerkezetek és 2-Kalkogén-trimetallabiciklo[1.1.0]butánok Tézisfüzet Szerző: Témavezető: Tarcsayné Petrov Klára Veszprémi Tamás Szervetlen- és Analitikai Kémia Tanszék Budapest, 2012.
2
3 1 1. Előszó A Budapesti Műszaki és Gazdaságtudományi Egyetem Szervetlen Kémia Tanszékének hosszú idő óta egyik fő kutatási irányvonala a szilícium kémia. A Veszprémi Tamás által vezetett elméleti kémiai kutatócsoport ezen terület egy speciális ágával, a hipovalens és/vagy telítetlen szilícium és nehezebb IV. főcsoportbeli elemek vegyületeinek vizsgálatával foglalkozik. Doktori munkám során számos érdekes és szokatlan kötésszerkezetű szilícium és germánium vegyület geometriájának, elektronszerkezetének és termodinamikai stabilitásának felderítésével foglalkoztam, melyhez a modern kvantum kémia eszköztárát használtam fel. Első kutatási témám a nemrégiben előállított triszilaallén és analóg háromtagú gyűrűs- és nyílt láncú szerkezetek átfogó vizsgálata volt. Második témám során szubsztituens hidakat tartalmazó nehezebb III. és IV. főcsoportbeli elemek vegyületeivel foglalkoztam. Végezetül, a 2-kalkogéntriszilabiciklo[1.1.0]butánok ciklobutén analóggá történő vegyérték-izomerizációjának mechanizmusát derítettem fel. Ehhez kapcsolódóan pedig vizsgáltam a 2-kalkogén-trimetallabiciklo- [1.1.0]butánok kötés-nyújtási izomerjeinek, valamint egy ezidáig ismeretlen harmadik izomer létezésének és stabilitásának feltételeit. 2. Irodalmi áttekintés A IV. főcsoport elemeinek azon vegyületeit, melyek kétértékűek, kettes koordinációval és formálisan kettes oxidációs fokkal rendelkeznek, metalliléneknek nevezzük. Ezek a szerkezetek általában szingulett alapállapotúak, minek következtében a központi nehéz atom egy s karakterű nemkötő elektronpárral, valamint egy üres p pályával rendelkezik. A reaktív szililének fontos köztitermékei számos termikus és fotokémiai reakciónak. Az első stabilis szililént Denk és munkatársai izolálták 1994-ben, melynek stabilitásában nagy szerepet játszanak a szililén elektronegatív, de π-donor nitrogén szubsztituensei. Azóta számos N-heterociklusos szililént állítottak elő és vizsgáltak átfogóan. 1 Az egyetlen előállított dialkil-szililén stabilitása az α helyzetű trimetilszilil szubsztituensek sztérikus és elektronikus hatásának tulajdonítható. 2 Az előállított szililének stabilitásáért felelős tényezők közül a legfontosabbak belesűríthetőek egy háromtagú gyűrűs szerkezetbe. Ennek megfelelően ez a vegyületcsoport ígéretes szintetikus célpont lehet. 3,4 Az első stabilis szilícium-szilícium kettős kötést tartalmazó vegyületet 1981-ben állították elő. Azóta legalább 73 kettőskötéses szilíciumvegyület kristályszerkezete ismert, melyek 1 Asay, M.; Jones, C. és Driess, M. Chem. Rev., 2011, 111, Mizuhata, Y.; Sasamori, T. és Tokitoh, N. Chem. Rev., 2009, 109, Petrov, K.; Nguyen, C. T. és Veszprémi, T. Organometallics, 2006, 25(6), Petrov, K. T. és Veszprémi, T. Int. J. Chem. Model., 2011, 3(3), 309.
4 2 között találhatóak 1-szilaallének, tetraszilaciklobutének, triszilaciklopropének, egy pentaszilaspiropentadién és egy triszilaallén származék is. 5 A vegyületcsoport egyik érdekes szerkezeti tulajdonsága, hogy a kettős kötés és szubsztituensei a legritkább esetben vesznek fel sík konformációt, energetikailag kedvezőbb a trans-hajlított elrendeződés. A ciklopropén nehéz származékai, a ciklotrimetallének, az erősen feszült háromtagű gyűrűben egy igen reaktív kettős kötést is tartalmaznak, mégis számos stabilis származékukat előállították. Legérdekesebb reakciójuk közé tartoznak az 1,2-szubsztituens vándorlással járó izomerizációs reakciók. Ilyen izomerizációt figyeltek meg egy diszilagermirén gyűrűn mind termikus, mind fotoindukált körülmények között. 6 A kétlépéses reakció egy híd szerkezetű köztiterméken keresztül játszódik le. 7 A szubsztituens hidat tartalmazó vegyületek vizsgálata tehát igen fontos az ehhez hasonló reakciók mechanizmusának megértésében. 8,9 A nehéz IV. főcsoportbeli heteroallének számos érdekes tulajdonsággal bírnak: vázuk erősen hajlott, valamint a szélső heteroatomok piramidalizáltak. Ezek a tulajdonságok a kettős kötések trans-hajlított elrendeződésére utalnak. Ugyanakkor, ezek a geometriai sajátságok eredményezik, hogy a heteroallének négy különböző konformációja létezhet. Mitöbb, a Kira és csoportja által előállított triszilaallén származék 10 négy konformere könnyedén átalakulhat egymásba a központi atomnak a szélső szilíciumok által meghatározott tengely körüli forgásával. Ezek az érdekes szerkezeti tulajdonságok követelték meg a nehéz allén szerkezetek kötésszerkezetének részletesebb vizsgálatát. 3,4,11,12 Nemrégiben fedezték fel a IV. főcsoport olyan vegyületeit (EL 2, ahol E= C,, Ge, Sn, Pb), melyekben a központi atom megtartja négy vegyérték elektronját egy σ és egy π karakterű nemkötő pár formájában, a két σ kötést pedig két ligandum szolgáltatja donor-akceptor kölcsönhatás révén. 4,13,14,15 Ezek az úgynevezett metallilónok vagy divalens E(0) vegyületek jó σ és π donorként szolgálnak, így kettős Lewis bázisoknak tekinthetők. Felmerült egy elmélet, mely szerint az előállított triszilaallén elektronszerkezetét is a legjobban sziliónként lehet értelmezni 14, azonban ez a feltételezés megkérdőjelezhető. 4,12 A stabilis, előállítható nehéz biciklo[1.1.0]bután származékok igen ritkák. Egyik legérdeke- 5 Fischer, R. C. és Power, P. P. Chem. Rev., 2010, 110, Lee, V. Ya.; Ichinohe, M.; Sekiguchi, A.; Takagi, N. és Nagase, S. J. Am. Chem. Soc., 2000, 122, Veszprémi, T.; Olasz, A. és Pintér, B. licon Chem., 2005, 3, Pintér, B.; Olasz, A.; Petrov, K. és Veszprémi, T. Organometallics, 2007, 26(15), Petrov, K. T. és Veszprémi, T. Int. J. Quant. Chem., 2009, 109(11), Ishida, S.; Iwamoto, T. és Kira, M. Nature, 2003, 421, Kosa, M.; Karni, M. és Apeloig, Y. J. Chem Theory Comput., 2006, 2, Kira, M. Chem. Commun., 2010, 46, Tonner, R. ; Öxler, F.; Neumüller, B.; Petz, W. és Frenking, G. Angew. Chem. Int. Ed., 2006, 45, Takagi, N.; Shimizu, T. és Frenking, G. Chem. Eur. J., 2009, 15, Takagi, N.; Shimizu, T. és Frenking, G. Chem. Eur. J., 2009, 15, 8593.
5 3 sebb tulajdonságuk, hogy kvantumkémiai számítások alapján létezhetnek kötés-nyújtási izomerjeik. A rövid-kötésű izomerekben rövidebb a hidaló kötéstávolság, nagyobb a hidban lévő atomok szubsztituenseinek híddal bezárt szöge, illetve kisebb a háromtagú gyűrűk közötti torziós szög a hosszú-kötésű konformerhez képest. A 2-kalkogén-triszilabiciklo[1.1.0]bután származékokat ( 3 XR 4, ahol X= S, Se, Te és R= Me t Bu 2 ) nemrégiben Sekiguchi és munkatársai állították elő a kalkogén elemek egy triszilirén származék = kettős kötésébe történő inzertációjával. 16 Ugyanakkor megfigyelték az előállított szerkezetek fotoindukált vegyérték-izomerizációját a megfelelő ciklobutén analógokká. A kalkogén elemek ily módon történő aktivációjának megértése nagy mértékben hozzájárul az átmeneti fém mentes katalizátorok fejlesztéséhez, ezért mind a kalkogén elemet tartalmazó biciklobután származékok vizgálata, mind pedig izomerizációjuk mechanizmusának megértése elengedhetetlenül fontos. 17,18 3. Számítási módszerek A doktori munkám során végzett kvantumkémiai számításokat a Gaussian03, Gaussian09 és a QChem 3.2 programcsomagokkal végeztem. A geometriák optimálását, a frekvencia analízist, az IRC számításokat, a hullámfüggvény stabilitásának ellenőrzését és a különböző kémiai mennyiségek számítását a B3LYP DFT sűrűségfunkcionállal végeztem a cc-pvtz, aug-ccpvtz, aug-cc-pvdz vagy 6-31g* bázis használatával. Számításaim kvalitatív és kvantitatív helyességét számos esetben ellenőriztem magasabb szintű kvantumkémiai módszerek alkalmazásával (MP2/aug-ccpVDZ, CCSD/aug-cc-pVTZ, CBS-QB3, CASSCF/aug-cc-pVTZ). Az elektronszerkezet felderítésére általánosan a következő négy módszert használtam: Bader-analízis, amely az elektronsűrűség topológiai analízise (AIM2000 program), a molekulapályák vizuális és kvantitatív vizsgálata, a Becke-Edgecombe elektron-lokalizációs függvény vizsgálata (ELF) (TOPMOD program), valamint a természetes pályák populációs analizise (NPA) és a természetes kötőpályák (NBO) vizsgálata (NBO 3.1 programcsomag). A kötések erősségét négy különböző kötésrend segítségével jellemeztem: Wiberg kötésindex (WBI), Mayer kötésrend (MBO), átfedéssel súlyozott NAO kötésrend (NAO BO) és a fuzzy atoms kötésrend (FABO) (FUZZY program). 16 Lee, V. Ya.; Miyazaki, S.; Yasuda,. és Sekiguchi, A. J. Am. Chem. Soc., 2008, 130, Petrov, K. T.; Pintér, B. és Veszprémi, T. J. Organomet. Chem., 2012, /j.jorganchem Pintér, B.; Petrov, K. T. és Veszprémi, T. Organometallics, prepared for publication.
6 4 4. Eredmények Stabilis metallaallének és metallilének tervezése A 3 4 összegképletű szerkezetek szingulett potenciális energia hiperfelületén (PEF) a szén analóghoz képest igen kis energiasávban számos érdekes izomer létezik, melyek valamilyen szokatlan elektronszerkezettel rendelkeznek (például hidrogén hidakat, delokalizált elektronrendszert vagy elkent vegyértékállapotokat tartalmaznak). A nemrégiben előállított triszilaallén elektronszerkezetének felderítéséhez azt a potenciális energia görbét (PEG) vizsgáltam, amelynek független változója a háromtagú szilícium váz központi kötésszöge (α) (4.1. ábra). Ezen a PEG-en két minimum létezik (1a és 1b), a lineáris triszilaallén (1c) azonban egy másodrendű nyeregpont. Az 1a szerkezet egy igen kis központi kötésszöggel (α = 55, 7 ), C 2 szimmetriával és parciálisan pozitív töltésű központi atommal rendelkező gyűrűs szililén. Az 1b izomer C s szimmetriával rendelkező, nyílt láncú szililén (α = 70.2 ) erősen negatív központi atommal. Elektronszerkezete a szilícium váz feletti 3 centrumos-2 elektronos delokalizált π-rendszerrel jellemezhető, mely elektronszerkezet a 70 < α < 100 központi szög tartományban a leghangsúlyosabb. Az energetikailag kedvezőtlen, D 2h szimmetriájú, lineáris triszilaallén (1c) elektronszerkezete két, egymásra merőleges π-kötéssel írható le ábra A 3 4 kiválasztott PEG-jei. Folytonos vonal: rögzített α mellett optimált szerkezetek; szagatott vonal: sík szerkezetek rögzített α szöggel; pontozott vonal: a szélső 2 csoportok merőleges konformációja rögzített α szöggel. (CBS-QB3) [fok kcal/mol] A központi szög hajlítása során 1c-től 1b-ig a degenerált OMO felhasad (4.2. ábra). Az átmenet során a delokalizált π-rendszert jelképező OMO energiája nem változik jelentős mértékben. A központi atomon elhelyezkedő nemkötő párt jelképező OMO-1 pálya energiája viszont csökken. Másrészt, a OMO-2 energiája növekszik a szélső csoportok közötti növekvő nemkötő kölcsönhatás miatt. A központi kötésszög további csökkentése során
7 5 kialakul az 1a-ra jellemző 1 3 kötés, amely a OMO-ban és a OMO-2-ben követhető nyomon. 1a 1b-sík 1c OMO OMO-1 OMO ábra Fontosabb molekulapályák alakulása az 1a c átmenet során. A Ge 2 4 (2), Ge 2 4 (3), Ge 3 4 (4), C 2 4 (5), N 2 2 (6) és P 2 2 (7) összegképlettel rendelkező szerkezetek fentihez hasonló PEG-je két fajta lehet. Az első típus a 2, 3, 4 szerkezetekre jellemző és 1-hez hasonlóan a PEG-en az a és b izomerek minimumok, de a c szerkezet magasabb energiával rendelkező másodrendű nyeregpont. A második típusú PEG az 5, 6, 7 vegyületekre jellemző, és rajta az a és c izomerek minimumok, míg a b elektronszerkezet igen kedvezőtlen. Izodezmikus reakciók reakcióhőjének vizsgálata alapján a háromtagú szililén gyűrű stabilitása a tetravalens szilícium atomok germániumra, szénre, foszforra vagy nitrogénre való cseréjével növelhető. A háromtagú germilén gyűrűk és nyílt láncú szerkezetek stabilitása nagyobb, mint az analóg szililéneké. A vizsgált három különböző elektronszerkezet relatív stabilitása a szilícium vázon lévő hidrogének cseréjével is változtatható. Elektronegatív, π-donor szubsztituensek a b típusú elektronszerkezet stabilitását mélyítik el. Gyűrűs csoportok alkalmazásával csökkenthető, illetve meggátolható a szubsztituensek sztérikus zsúfoltság miatti elfordulása az ideális sík konformációtól. Szintézis szempontjából különösen kedvező szubsztituensek az N-heterociklusos metallilén csoportok (4.3. ábra). A triafulvének egyik érdekes rezonancia határszerkezete miatt az 1D vegyület is b-típusú elektronszerkezettel rendelkezik. A szilícium váz elektropozitív, t Bu N X N t Bu.. Y X t Bu N N t Bu.... 1(C- t Bu): X, Y= 2(C- t Bu): X= Ge, Y= 3(C- t Bu): X=, Y= Ge 1(D) 1(E) 4.3. ábra Szililének stabilizálására tervezett szubsztituensek.
8 6 de nem π-akceptor tulajdonságú szubsztituensei az a-típusú gyűrűs szililén stabilitását növelik a b-típusú szililén és a c-típusú allén szerkezetekhez képest (4.3. ábra). Munkám során megvizsgáltam, milyen tulajdonságokkal jellemezhető a kétértékű szilícium(0) vegyületek elektroszerkezete (L 2, ahol L= N 3 (8) vagy P 3 (9)). Arra a következtetésre jutottam, hogy a vizsgált jellemzők gyökeresen megkülönböztetik a szililónokat a fent vizsgált a-típusú gyűrűs szililénektől, a b-típusú nyílt láncú szililénektől és a c-típusú allén elektronszerkezettől egyaránt. Vizsgálataim alapján az előállított triszilaallén szerkezet sokkal inkább leírható kumulált kettős kötést tartalmazó rendszerként, mint szililónként. Szubsztituens hidat tartalmazó vegyületek Az X1 R b X2 (X= B, Al,, Ge, R=, 3 ) kölcsönhatást valódi híd kötésnek tekinthetjük, ha az R b atom jól meghatározott kölcsönhatásban áll mindkét pillératommal (X1, X2). Vannak esetek, amikor az egyik hidaló kötés hiányában erősen torzult geometriájú, de híd szerkezetnek nem nevezhető szerkezet alakul ki. A kismolekulás X 2 n (10a-13c, ahol X= B, Al és n= 2, 4, 6) szerkezetek részletes vizsgálatából azt a következtetést vontam le, hogy a valódi szubsztituens hidak megtalálásához és jellemzéséhez nem elég csupán egy módszer eredményeinek kiértékelése. Az NBO és ELF analízis igen hasznos módszerek a szubsztituens hidak megtalálásához, mivel a hidakat 3 centrumos-2 elektronos (3c-2e) kötésekként lokalizálják. A Bader-analízis azonban számos esetben értelmezhetetlen eredményeket szolgáltat ezen nem-klasszikus szerkezetek esetén. Mind a négy típusú kötésrend vizsgálata hasonló trendeket eredményez, ezért a további vizsgálatokhoz a fuzzy atoms kötésrendet (FABO) választottam. 1f 1f( 3 ) R R 3 V(1,2,3) V(1,2,3) V(1,2) V(2) b V(1,2, b ) R R b 3 b 3 1 b b 1 2 b 4.4. ábra Az 1f 0.85 ELF izofelülete, az 1f( 3 ) AIM molekulagráfja és ezen szerkezetek Laplace kontúrtérképe a szilíciumok síkjában (bal) és a szubsztituens híd síkjában (jobb) ábrázolva.
9 7 A szilícium és germánium tartalmú X 2 n (14a-19b, ahol X=, Ge és n= 2, 4) hidridek vizsgálatából megállapítható, hogy a híd kötésekre jellemző FABO intervallum 0,5-0,6, valamint az X1 b és X2 b kötések kötésrendjeinek összege 1,1. A hidakra jellemző kötéstávolságok 1,62-1,75 Å illetve 1,71-1,81 Å a b és Ge b kölcsönhatásokra. A hidrogén hidat tartalmazó X 3 4 gyűrűk (1f-4f, ahol X=, Ge) sematikusan felépíthetőek két X részből (melyek egyenként egy nemkötő elektronpárral, egy párosítatlan elektronnal és egy üres p-pályával rendelkeznek) és egy sp 2 hibridállapotú X 2 részből. A kismolekulás III. és IV. főcsoportbeli elemek hidridjeire felállított kritériumrendszer alapján ezen vegyületek között 6 egyszeres híd szerkezet található (pl ábra), de kétszeres hidrogén hidak nem léteznek. Ugyanakkor megmutattam egyszeres szilil hidak létezését is az X 3 ( 3 ) 4 gyűrűkben (pl ábra). A 2-kalkogén-trimetallabiciklo[1.1.0]butánok kötés-nyújtási izomerjei A legjellemzőbb geometriai paraméterek, amelyek megkülönböztetik a rövid- (a) és hosszúkötésű (b) 2-kalkogén-triszilabiciklo[1.1.0]bután (X= S (20) vagy Se (21)) izomereket a hidaló kötés hossza (d), a híd atomokon lévő szubsztituensek híddal bezárt szöge (α) és a háromtagú gyűrűk által bezárt torziós szög (δ) (4.5. ábra). A híd atomokon lévő szubsztituensektől (R=, Me, 3, t Bu, Me 3 ) függően a hosszúkötésű izomerben d 0,3-0,6 Å-mel hosszabb, α kal kisebb, valamint δ kal nagyobb a rövidkötésű izomerhez képest. A híd atomok szubsztituensei mindkét izomer esetén szin konformációban helyezkednek el. Számításaim során találtam egy ezidáig ismeretlen izomert (c), melynek gyűrűatomjai egy síkban vannak, a szubsztituensek anti helyzetűek és a központi híd rendkívűl hosszú, 3,1-3,3 Å ábra A 2-tia- (20, X= S) és 2-szelena- (21, X= Se) triszilabiciklo[1.1.0]butánok kötés-nyújtási izomerjei: rövidkötésű (a), hosszúkötésű (b) és anti (c) izomer. A három izomer relatív stabilitását három tényező határozza meg. Egyrészt, a híd kölcsönhatás erőssége, amely körülbelül azonos a rövid- és hosszúkötésű izomerben, de igen gyenge az anti izomer esetén. Másrészt, a négytagú vázban felmerülő gyűrűfeszültség, amely geometriai megfontolások alapján a c<b<a irányban nő. Végül, a híd atomokon lévő csoportok sztérikus taszítása, amelyet az α paraméter határoz meg, és a c<a<b sorban növekvő mértékű.
10 8 Izodezmikus reakciók reakcióhője alapján a triszilirén germánium analógjai (a sziladigermirén, a diszilagermirén és a trigermirén) hasonló mértékben reagálnak elemi kénnel, így a 2-tia-triszilabiciklo[1.1.0]bután germánium származékai (22-24) is előállítható szerkezetek. A négyes koordinációjú 3 atomot germániumra cserélve (22) csökken a gyűrűfeszültség értéke, amely a legnagyobb mértékben a legfeszültebb rövidkötésű izomert stabilizálja. A germánium hidat tartalmazó molekulákban (23, 24) a nagyobb d távolság gyengébb híd kötést eredményez a szilícium hidat tartalmazó szerkezetekhez képest, ugyanakkor a híd atomokon lévő szubsztituensek nagyobb távolsága kedvez a hosszúkötésű izomereknek. A négytagú gyűrű pillératomjainak és a híd atomokon lévő szubsztituensek szisztematikus változtatásával arra a következtetésre jutottam, hogy az új, anti izomer germánium hidas szerkezetek esetén, szén kontakt atomot tartalmazó szubsztituensekkel (pl. t Bu) ígéretes szintetikus célpont lehet. A 2-kalkogén-triszilabiciklo[1.1.0]butánok izomerizációjának mechanizmusa A 2-kalkogén-triszilabiciklo[1.1.0]butánok (X= S, Se és R, R =, 3 ) vegyérték-izomerizációja a megfelelő ciklobutén származékokká a vártakkal ellentétben egy kétlépéses folyamat a szingulett PEF-en (4.6. ábra). A reakciómechanizmus reaktánsa a rövidkötésű izomer (20a, 21a). Az első, sebességmehatározó lépésben a két háromtagú gyűrű egyszerre nyílik fel és szolgáltatja az s-cisz konformációjú butadiénszerű köztiterméket (20d, 21d). A második lépésben a négytagú váz gyűrűvé záródik (20e, 21e), melyet a kén atomnak a szélső 2 csoport felé történő nukleofil támadása indít. Ennek a lépésnek két különböző átmeneti állapota létezik. A reakció exoterm ábra A 2-kalkogén-triszilabiciklo[1.1.0]butánok vegyérték-izomerizációjának mechanizmusa (R, R = 3 ). (CBS-QB3) [kcal/mol]
11 9 5. Tézisek 1. A 3 4 (1) potenciális energia görbéinek (PEG) vizsgálata alapján megállapítottam, hogy az optimált PEG-en két minimum létezik (1a és 1b), míg a lineáris triszilaallén (1c) csupán másodrendű nyeregpont. Felderítettem a fenti molekulák elektronszerkezetét, mely szerint 1a egy kis központi kötésszöggel rendelkező gyűrűs szililén, melynek központi szilícium atomja parciálisan pozitív töltésű. 1b egy nyílt láncú szililén, mely erősen negatív központi atommal rendelkezik. Elektronszerkezete a szilícium váz feletti 3 centrumos-2 elektronos delokalizált π-rendszerrel jellemezhető, mely elektronszerkezet a 70 <α<100 központi szög tartományban sík konformáció esetén a leghangsúlyosabb. Az energetikailag kedvezőtlen lineáris triszilaallén (1c) elektronszerkezete két egymásra merőleges π-kötéssel írható le. K1 2. Az XY 2 4 (X=, Ge, Y= Ge, C) és az XY 2 2 (X=, Y= N, P) szerkezetek izodezmikus reakcióinak vizsgálatán keresztül megmutattam, hogy a háromtagú szililén gyűrű (a) stabilitása növelhető a tetravalens pillératomok germániumra, szénre, foszforra vagy nitrogénre való cseréjével. Eredményeim alapján a háromtagú germilén gyűrűk (a) és nyílt láncú (b) szerkezetek stabilitása nagyobb, mint az analóg szililéneké. K4 3. Megmutattam, hogy a háromtagú szilícium vázon elektronegatív, π-donor szubsztituenseket alkalmazva a b-típusú elektronszerkezet stabilitása mélyül el. Gyűrűs csoportokkal meggátolható a szubsztituensek sztérikus zsúfoltság miatti elfordulása az ideális sík konformációtól. A szilícium váz elektropozitív, de nem π-akceptor tulajdonságú szubsztituensei az a-típusú gyűrűs szililén stabilitását növelik a b-típusú szililén és c- típusú allén szerkezetekhez képest. Ezen eredmények alapján terveztem meg a b-típusú szililén két, illetve az a-típusú szililén egy stabilis származékát. K1,K4 4. A nehéz III. és IV. főcsoportbeli hidridek (X 2 n, ahol X= B, Al,, Ge, n= 2, 4, 6 és X 3 4, ahol X=, Ge) stabilis izomerjei gyakran tartalmaznak híd szerkezetet. asonlóan kimutatható stabilis szilil hidak létezése is X 3 R 4 (X=, Ge, R= 3 ) gyűrűkben. Az X1 R b X2 (X= B, Al,, Ge, R=, 3 ) kölcsönhatást valódi híd kötésnek tekinthetjük, ha az R b atom jól meghatározott kölcsönhatásban áll mindkét (X1, X2) pillératommal. Vannak esetek, amikor az egyik hidaló kötés hiányában erősen torzult geometriájú, de híd szerkezetnek nem nevezhető szerkezet alakul ki. K2,K3 5. A valódi szubsztituens hidak megtalálásához és jellemzéséhez elengedhetetlen több módszer eredményének együttes vizsgálata. Eredményeim alapján egy szubsztituens híd leírható:
12 10 az NBO analízis segítségével, mint egy 3 centrumos 2 elektronos kötő kölcsönhatás a pillératomok és a hidaló atom között, az ELF X1-R b -X2 triszinaptikus vegyérték medencéjeként, a Bader-analízisben a molekulagráfon két kötéskritikus pontként a pillératomok és a hidaló atom között (X1 R b, X2 R b ), a Laplace-eloszlás segítségével, mint az X1 R b és X2 R b kötések helyén megjelenő töltés-felhalmozódás, hidrogén híd estén 0,5-0,6-os fuzzy atoms kötésrenddel (FABO), ahol a X1 b és X2 b kötésrendek összege mindig 1,1. Valamint 0,5-0,8-as FABO-val szilil hid esetén, ahol a két híd kötésrendjének összege 1,3. K3 6. Megmutattam, hogy a 2-kalkogén-trimetallabiciklo[1.1.0]bután származékok (X 2 YZR 4, ahol X, Y=, Ge, Z= S, Se és R=, Me, 3, t Bu, Me 3 ) rendelkeznek kötésinyújtási izomerekkel. A rövid- és hosszúkötésű izomeren kívül találtam egy ezidáig ismeretlen, anti izomert. Megállapítottam, hogy a híd kölcsönhatás erőssége körülbelül azonos a rövid- és hosszúkötésű izomerben. Így a hídatomokon lévő szubsztituensek sztérikus taszítása és a gyűrűfeszültségben mutatkozó különbségek határozzák meg ezen izomerek relatív stabilitását. A gyűrűfeszültség a hosszúkötésű izomerben kisebb, míg a szubsztituensek konformációja a rövidkötésű izomernek kedvez. Az anti izomerben a híd kölcsönhatás igen gyenge, viszont a gyűrűfeszültség mértéke és a nagy térkitöltésű szubsztituensek elrendeződése ezen izomer esetén a legkedvezőbbek. A négytagú gyűrű pillératomjainak és a híd atomokon lévő szubsztituenseknek szisztematikus változtatásával arra a következtetésre jutottam, hogy germánium hidas szerkezetek esetén, szén kontakt atomot tartalmazó szubsztituensekkel (pl. t Bu) az új, anti izomer ígéretes szintetikus célpont lehet. K5 7. A várakozásokkal ellentétben a 2-kalkogén-triszilabiciklo[1.1.0]butánok (X= S, Se és R, R =, 3 ) fotoindukált vegyérték-izomerizációja a megfelelő ciklobutén származékokká egy kétlépéses folyamat a szingulett PEF-en. A reakciómechanizmus reaktánsa a rövidkötésű izomer. Az első, sebességmehatározó lépésben a két háromtagú gyűrű egyszerre nyílik fel heterolitikusan és szolgáltatja az s-cisz konformációjú butadiénszerű köztiterméket. A második lépésben a négytagú váz gyűrűvé záródik, melyet a kén atomnak a szélső 2 csoport felé történő nukleofil támadása indít. K6
13 11 Az értekezés tárgyát képező közlemények: K1: Petrov Klára; Nguyen, Chinh T. és Veszprémi Tamás, From silaallene to Cyclosilanylidene Organometallics, 2006, 25(6), (IF:3.632, I:14) K2: Pintér Balázs; Olasz András; Petrov Klára és Veszprémi Tamás, Trimetallenes: Bridged and distorted structures Organometallics, 2007, 26(15), (IF:3.833, I:3) K3: Tarcsayné Petrov Klára és Veszprémi Tamás, ydrogen and lyl Bridges in Group 13 and 14 Atom Containing Molecules Int. J. Quant. Chem., 2009, 109(11), (IF:1.315, I:2) K4: Tarcsayné Petrov Klára és Veszprémi Tamás, From Cyclic lylenes to Allenic Structure IJCEMO, 2011, 3(3), (IF:-) K5: Tarcsayné Petrov Klára; Pintér Balázs és Veszprémi Tamás, Bond-Stretch Isomerism in 2-Chalcogen-trimetallabicyclo[1.1.0]butane Derivatives J. Organomet. Chem., 2012, , (IF(2011):2.20) Közlésre előkészített közlemények: K6: Pintér Balázs; Tarcsayné Petrov Klára és Veszprémi Tamás, Isomerization of 2-Chalcogentrisilabicyclo[1.1.0]butanes to their Valence Isomer Cyclobutene Derivatives Organomet., publikálásra előkészítve Előadások: 2007: Stabilis szilíciumvegyületek tervezése - A ciklotriszilanilidéntől a triszilaallénig XXX. Kémiai Előadói Napok, Szeged 2009: "Egzotikus" kötések az 3 4 izomerekben KeMoMo-QSAR szimpózium, Szeged 2009: "Egzotikus" kötések az 3 4 izomerekben XII. Anyagszerkezet-kutatási Konferencia, Mátrafüred 2011: Kötés-nyújtási izomerizáció a ciklopropenilidén és biciklo[1.1.0]bután nehéz atomot tartalmazó analógjaiban Doktoráns Konferencia, Budapest
14 12 Poszter prezentációk: 2008: From cyclic silylenes to allenic structures 23rd MAT/CEM/COMP, Verbania- Intra, Italy 2009: ydrogen- and silyl-bridges in group 14 atom containing molecules Doktoráns Konferencia, Budapest
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
FÖLDÖNKÍVÜLI MOLEKULÁK A FÖLDÖN
 Műegyetem 1782 FÖLDÖNKÍVÜLI MOLEKULÁK A FÖLDÖN Pintér Balázs PhD értékezés tézisei Témavezető: Dr. Veszprémi Tamás Budapesti Műszaki és Gazdaságtudományi Egyetem Szervetlen és Analitikai Kémia Tanszék
Műegyetem 1782 FÖLDÖNKÍVÜLI MOLEKULÁK A FÖLDÖN Pintér Balázs PhD értékezés tézisei Témavezető: Dr. Veszprémi Tamás Budapesti Műszaki és Gazdaságtudományi Egyetem Szervetlen és Analitikai Kémia Tanszék
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
Fizikai kémia 2. Előzmények. A Lewis-féle kötéselmélet A VB- és az MO-elmélet, a H 2+ molekulaion
 06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
A hidrogénmolekula. Energia
 A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
Periódusos rendszer (Mengyelejev, 1869) nemesgáz csoport: zárt héj, extra stabil
 s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
A hidrogénmolekula. Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve!
 Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
Periciklusos reakciók
 Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Periciklusos reakciók gyűrűs átmeneti állapoton keresztül, köztitermék képződése nélkül, egyetlen lépésben lejátszódó ( koncertáló ) reakciókat Woodward javaslatára periciklusos reakcióknak nevezzük. Ezeknek
Kémiai alapismeretek 3. hét
 Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Szalai István. ELTE Kémiai Intézet 1/74
 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Intra- és intermolekuláris reakciók összehasonlítása
 Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Spektroszkópiai módszerek 2.
 Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Gyenge kölcsönhatások karbonilezési reakciók során Záróbeszámoló (2007)
 Gyenge kölcsönhatások karbonilezési reakciók során Záróbeszámoló (2007) Az olefinek hidroformilezése több mint 50 éve ismert ipari jelentőségű homogénkatalitikus eljárás, melynek során az átmenetifém katalizátor
Gyenge kölcsönhatások karbonilezési reakciók során Záróbeszámoló (2007) Az olefinek hidroformilezése több mint 50 éve ismert ipari jelentőségű homogénkatalitikus eljárás, melynek során az átmenetifém katalizátor
Toluol (Bruckner II/1 476) µ= 0.33 Debye
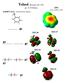 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
R R C X C X R R X + C H R CH CH R H + BH 2 + Eliminációs reakciók
 Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
FELADATMEGOLDÁS. Tesztfeladat: Válaszd ki a helyes megoldást!
 FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
Szililének és szilének stabilitásának, szerkezetének és reaktivitásának elméleti vizsgálata
 MŰEGETEM 1782 Szililének és szilének stabilitásának, szerkezetének és reaktivitásának elméleti vizsgálata Oláh Julianna Ph.D. dolgozat tézisei Témavezető: Dr. Veszprémi Tamás Budapest Műszaki és Gazdaságtudományi
MŰEGETEM 1782 Szililének és szilének stabilitásának, szerkezetének és reaktivitásának elméleti vizsgálata Oláh Julianna Ph.D. dolgozat tézisei Témavezető: Dr. Veszprémi Tamás Budapest Műszaki és Gazdaságtudományi
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
4. Fejezet Csonka Gábor István MTA Doktori Értekezés
 4. A -()- molekula ab iníció egyensúlyi geometriája és egy disszociációs csatornája. A CT2 módszer. A DFT módszerek teljesítõképessége kéntartalmú molekulák esetében III. IV. Csonka, G. I., Loos, M., Kucsman,
4. A -()- molekula ab iníció egyensúlyi geometriája és egy disszociációs csatornája. A CT2 módszer. A DFT módszerek teljesítõképessége kéntartalmú molekulák esetében III. IV. Csonka, G. I., Loos, M., Kucsman,
A periódusos rendszer, periodikus tulajdonságok
 A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
IV. Elektrofil addíció
 IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
20/10/2016 tema04_biolf_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
A kémiatanári zárószigorlat tételsora
 1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
A SZILÁRDTEST FOGALMA. Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. molekula klaszter szilárdtest > σ λ : rel.
 A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
Általános és szervetlen kémia 3. hét. Kémiai kötések. Kötések kialakítása - oktett elmélet. Az elızı órán elsajátítottuk, hogy.
 Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
ÚJ NAFTOXAZIN-SZÁRMAZÉKOK SZINTÉZISE ÉS SZTEREOKÉMIÁJA
 PhD értekezés tézisei ÚJ AFTXAZI-SZÁMAZÉKK SZITÉZISE ÉS SZTEEKÉMIÁJA Tóth Diána Szegedi Tudományegyetem Gyógyszerkémiai Intézet Szeged 2010 Szegedi Tudományegyetem Gyógyszertudományok Doktori Iskola Ph.D
PhD értekezés tézisei ÚJ AFTXAZI-SZÁMAZÉKK SZITÉZISE ÉS SZTEEKÉMIÁJA Tóth Diána Szegedi Tudományegyetem Gyógyszerkémiai Intézet Szeged 2010 Szegedi Tudományegyetem Gyógyszertudományok Doktori Iskola Ph.D
Elektronspinrezonancia (ESR) - spektroszkópia
 Elektronspinrezonancia (ESR) - spektroszkópia Paramágneses anyagok vizsgáló módszere. A mágneses momentum iránykvantáltságán alapul. A mágneses momentum energiája B indukciójú mágneses térben E m S μ z
Elektronspinrezonancia (ESR) - spektroszkópia Paramágneses anyagok vizsgáló módszere. A mágneses momentum iránykvantáltságán alapul. A mágneses momentum energiája B indukciójú mágneses térben E m S μ z
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Olyan magkedvelő részecske, amely (legalább) két különböző atomján képes kötést létesíteni a(z elektrofil) reakciópartnerrel.
 akceptorszám (akceptivitás) aktiválási energia (E a ) activation energy aktiválási szabadentalpia (ΔG ) Gibbs energy of activation aktivált komplex activated complex ambidens nukleofil amfiprotikus (oldószer)
akceptorszám (akceptivitás) aktiválási energia (E a ) activation energy aktiválási szabadentalpia (ΔG ) Gibbs energy of activation aktivált komplex activated complex ambidens nukleofil amfiprotikus (oldószer)
szabad bázis a szerves fázisban oldódik
 1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
Kutatási terület. Szervetlen és szerves molekulák szerkezetének ab initio tanulmányozása
 Kutatási terület zervetlen és szerves molekulák szerkezetének ab initio tanulmányozása Cél: a molekulák disszociatív ionizációja során keletkező semleges és ionizált fragmentumok energetikai paramétereinek
Kutatási terület zervetlen és szerves molekulák szerkezetének ab initio tanulmányozása Cél: a molekulák disszociatív ionizációja során keletkező semleges és ionizált fragmentumok energetikai paramétereinek
Összefoglaló előadás. Sav-bázis elmélet
 Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Katalízis. Tungler Antal Emeritus professzor 2017
 Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
RÖVID ÉLETTARTAMÚ FOSZFOR- ÉS SZILÍCIUMORGANIKUS
 RÖVID ÉLETTARTAMÚ SZR- ÉS SZILÍIUMRGANIKUS VEGYÜLETEK SZERKEZETE, STABILITÁSA ÉS REAKTIVITÁSA Ph.D. értekezés tézisei Készítette: Hajgató Balázs Budapesti Műszaki és Gazdaságtudományi Egyetem Szervetlen
RÖVID ÉLETTARTAMÚ SZR- ÉS SZILÍIUMRGANIKUS VEGYÜLETEK SZERKEZETE, STABILITÁSA ÉS REAKTIVITÁSA Ph.D. értekezés tézisei Készítette: Hajgató Balázs Budapesti Műszaki és Gazdaságtudományi Egyetem Szervetlen
Modern Fizika Labor. Fizika BSc. Értékelés: A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n. 2008. április 29.
 Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
6) Az átmenetifémek szerves származékai
 Rendszeres fémorganikus kémia 2009-2010 (134) Átmenetifém-átmenetifém kötések és klaszterek Történet: A. Werner (1866-1919) oligonukleáris komplexekben ligandum-hidakat tételezett fel: (H 3 N)(Cl)Pt(µ-Cl)
Rendszeres fémorganikus kémia 2009-2010 (134) Átmenetifém-átmenetifém kötések és klaszterek Történet: A. Werner (1866-1919) oligonukleáris komplexekben ligandum-hidakat tételezett fel: (H 3 N)(Cl)Pt(µ-Cl)
Vegyületek - vegyületmolekulák
 Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
tema04_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK
 ÓBUDAI EGYETEM ANYAGTUDOMÁNYI SZEMINÁRIUMOK, 2014. MÁJUS 12. PEKKER SÁNDOR MTA WIGNER SZFI KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK
ÓBUDAI EGYETEM ANYAGTUDOMÁNYI SZEMINÁRIUMOK, 2014. MÁJUS 12. PEKKER SÁNDOR MTA WIGNER SZFI KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK I. FULLERÉNEK KONJUGÁLT KÖTÉSŰ POLIMEREK ÉS SZÉN-NANOSZERKEZETEK
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése
 Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Kémiai kötés: több atom reakcióba lépése során egy közös, stabil (telített) külső elektronhéj alakul ki.
 19. Kémiai kötések (Elsődleges és másodlagos kötések. Elektronegativitás, elektronaffinitás, ionizációs energia. Ionos, fémes és kovalens kötés. A kovalens kötések fajtái, működésük, osztályozásuk, hibridizáció.
19. Kémiai kötések (Elsődleges és másodlagos kötések. Elektronegativitás, elektronaffinitás, ionizációs energia. Ionos, fémes és kovalens kötés. A kovalens kötések fajtái, működésük, osztályozásuk, hibridizáció.
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk.
 1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
1. feladat Aromás: 1, 3, 5, 6, 8, 9, 10, 11, 13, (14) Az azulén (14) szemiaromás rendszert alkot, mindkét választ (aromás, nem aromás) elfogadtuk. 2. feladat Etil-metil-keton (bután-2-on) Jelek hozzárendelése:
A tételek: Elméleti témakörök. Általános kémia
 A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését!
 I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
Kémiai reakciók mechanizmusa számítógépes szimulációval
 Kémiai reakciók mechanizmusa számítógépes szimulációval Stirling András stirling@chemres.hu Elméleti Kémiai Osztály Budapest Stirling A. (MTA Kémiai Kutatóközpont) Reakciómechanizmus szimulációból 2007.
Kémiai reakciók mechanizmusa számítógépes szimulációval Stirling András stirling@chemres.hu Elméleti Kémiai Osztály Budapest Stirling A. (MTA Kémiai Kutatóközpont) Reakciómechanizmus szimulációból 2007.
Kormeghatározás gyorsítóval
 Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
FÉLVEZETŐ ESZKÖZÖK I. Elektrotechnika 4. előadás
 FÉLVEZETŐ ESZKÖZÖK I. Elektrotechnika 4. előadás FÉLVEZETŐ ESZKÖZÖK A leggyakrabban használt félvezető anyagok a germánium (Ge), és a szilícium (Si). Félvezető tulajdonsággal rendelkező elemek: szén (C),
FÉLVEZETŐ ESZKÖZÖK I. Elektrotechnika 4. előadás FÉLVEZETŐ ESZKÖZÖK A leggyakrabban használt félvezető anyagok a germánium (Ge), és a szilícium (Si). Félvezető tulajdonsággal rendelkező elemek: szén (C),
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit
 SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
Átmenetifém-komplexek ESR-spektrumának jellemzıi
 Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Átmenetifém-komplexek ESR-spektrumának jellemzıi A párosítatlan elektron d-pályán van. Kevéssé delokalizálódik a fémionról, a fém-donoratom kötések meglehetısen ionos jellegőek. A spin-pálya csatolás viszonylag
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
Átmenetifém-komplexek mágneses momentuma
 Átmenetifém-komplexek mágneses momentuma Csakspin-momentum μ g e S(S 1) μ B μ n(n 2) μ B A komplexek mágneses momentuma többnyire közel van ahhoz a csakspin-momentum értékhez, ami az adott elektronkonfigurációjú
Átmenetifém-komplexek mágneses momentuma Csakspin-momentum μ g e S(S 1) μ B μ n(n 2) μ B A komplexek mágneses momentuma többnyire közel van ahhoz a csakspin-momentum értékhez, ami az adott elektronkonfigurációjú
Beszélgetés a szerves kémia elméleti alapjairól III.
 Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
Beszélgetés a szerves kémia elméleti alapjairól III. Csökkentett vagy fokozott reakciókészségű halogénszármazékok? A középiskolai szerves kémiai tananyag alapján, a telített alkil-halogenidek reakcióképes
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
8. Egyszerû tesztek sûrûség funkcionál módszerek minõsítésére
 8. Egyszerû tesztek sûrûség funkcionál módszerek minõsítésére XX. Csonka, G. I., Nguyen, N. A., Kolossváry, I., Simple tests for density functionals, J. Comput. Chem. 18 (1997) 1534. XXII. Csonka, G. I.,
8. Egyszerû tesztek sûrûség funkcionál módszerek minõsítésére XX. Csonka, G. I., Nguyen, N. A., Kolossváry, I., Simple tests for density functionals, J. Comput. Chem. 18 (1997) 1534. XXII. Csonka, G. I.,
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Szililén-komplexek szintonként való alkalmazhatóságának elméleti vizsgálata
 Szililén-komplexek szintonként való alkalmazhatóságának elméleti vizsgálata TDK Készítette: Orbán Balázs II. éves Vegyészmérnöki BSc hallgató Témavezető: Szilvási Tibor tanársegéd Budapesti Műszaki és
Szililén-komplexek szintonként való alkalmazhatóságának elméleti vizsgálata TDK Készítette: Orbán Balázs II. éves Vegyészmérnöki BSc hallgató Témavezető: Szilvási Tibor tanársegéd Budapesti Műszaki és
FELADATLISTA TÉMAKÖRÖK, ILLETVE KÉPESSÉGEK SZERINT
 FELADATLISTA TÉMAKÖRÖK, ILLETVE KÉPESSÉGEK SZERINT A feladatok kódját a Bevezetésben bemutatott tananyagtartalom- és képességmátrix alapján határoztuk meg. A feladat kódja a következőképpen épül fel: évfolyam/témakör1-témakör2/képesség1-képesség2/sorszám
FELADATLISTA TÉMAKÖRÖK, ILLETVE KÉPESSÉGEK SZERINT A feladatok kódját a Bevezetésben bemutatott tananyagtartalom- és képességmátrix alapján határoztuk meg. A feladat kódja a következőképpen épül fel: évfolyam/témakör1-témakör2/képesség1-képesség2/sorszám
Fizikai kémia 2. ZH II. kérdések I. félévtől
 Fizikai kémia 2. ZH II. kérdések 2018-19 I. félévtől Szükséges adatok, állandók és összefüggések: c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
Fizikai kémia 2. ZH II. kérdések 2018-19 I. félévtől Szükséges adatok, állandók és összefüggések: c= 2,99792458 10 8 m/s; e= 1,602177 10-19 C; h=6,62608 10-34 Js; N A= 6,02214 10 23 mol -1 ; me= 9,10939
Helyettesített Szénhidrogének
 elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
Kristályos fullerénszármazékok topokémiai reakciói
 Kristályos fullerénszármazékok topokémiai reakciói Doktori értekezés Kováts Éva MTA Szilárdtestfizikai és Optikai Kutatóintézet Témavezető: Dr. Pekker Sándor Tudományos tanácsadó, a kémiai tudomány doktora
Kristályos fullerénszármazékok topokémiai reakciói Doktori értekezés Kováts Éva MTA Szilárdtestfizikai és Optikai Kutatóintézet Témavezető: Dr. Pekker Sándor Tudományos tanácsadó, a kémiai tudomány doktora
Az anyagi rendszerek csoportosítása
 Kémia 1 A kémiai ismeretekről A modern technológiai folyamatok és a környezet védelmére tett intézkedések alig érthetőek kémiai tájékozottság nélkül. Ma már minden mérnök számára alapvető fontosságú a
Kémia 1 A kémiai ismeretekről A modern technológiai folyamatok és a környezet védelmére tett intézkedések alig érthetőek kémiai tájékozottság nélkül. Ma már minden mérnök számára alapvető fontosságú a
PhD DISSZERTÁCIÓ TÉZISEI
 Budapesti Muszaki és Gazdaságtudományi Egyetem Fizikai Kémia Tanszék MTA-BME Lágy Anyagok Laboratóriuma PhD DISSZERTÁCIÓ TÉZISEI Mágneses tér hatása kompozit gélek és elasztomerek rugalmasságára Készítette:
Budapesti Muszaki és Gazdaságtudományi Egyetem Fizikai Kémia Tanszék MTA-BME Lágy Anyagok Laboratóriuma PhD DISSZERTÁCIÓ TÉZISEI Mágneses tér hatása kompozit gélek és elasztomerek rugalmasságára Készítette:
A kémiai kötés magasabb szinten
 A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
A kémiai köté magaabb zinten 5-1 Mit kell tudnia a kötéelméletnek? 5- Vegyérték köté elmélet 5-3 Atompályák hibridizációja 5-4 Többzörö kovalen kötéek 5-5 Molekulapálya elmélet 5-6 Delokalizált elektronok:
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
A tudós neve: Mit tudsz róla:
 8. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
8. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
1. feladat. Versenyző rajtszáma:
 1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
1. feladat / 4 pont Válassza ki, hogy az 1 és 2 anyagok közül melyik az 1,3,4,6-tetra-O-acetil-α-D-glükózamin hidroklorid! Rajzolja fel a kérdésben szereplő molekula szerkezetét, és értelmezze részletesen
3. Fejezet Csonka Gábor István MTA Doktori Értekezés
 3. Az elektronkorreláció és a bázis függvények hatása a disziloxán hajlítási potenciális energiagörbéjére I. Csonka, G. I., Erdõsy, M. and Réffy, J., Structure of Disiloxane: Semiempirical and post-artree-fock
3. Az elektronkorreláció és a bázis függvények hatása a disziloxán hajlítási potenciális energiagörbéjére I. Csonka, G. I., Erdõsy, M. and Réffy, J., Structure of Disiloxane: Semiempirical and post-artree-fock
Atommodellek de Broglie hullámhossz Davisson-Germer-kísérlet
 Atommodellek de Broglie hullámhossz Davisson-Germer-kísérlet Utolsó módosítás: 2016. május 4. 1 Előzmények Az atomok színképe (1) A fehér fény komponensekre bontható: http://en.wikipedia.org/wiki/spectrum
Atommodellek de Broglie hullámhossz Davisson-Germer-kísérlet Utolsó módosítás: 2016. május 4. 1 Előzmények Az atomok színképe (1) A fehér fény komponensekre bontható: http://en.wikipedia.org/wiki/spectrum
Az egyensúly. Általános Kémia: Az egyensúly Slide 1 of 27
 Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Tantárgycím: Szerves kémia
 Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
1. változat. 4. Jelöld meg azt az oxidot, melynek megfelelője a vas(iii)-hidroxid! A FeO; Б Fe 2 O 3 ; В OF 2 ; Г Fe 3 O 4.
 1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
Fémorganikus kémia 1
 Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
