A benzol felfedezése
|
|
|
- Zsigmond Kiss
- 7 évvel ezelőtt
- Látták:
Átírás
1 A benzol felfedezése - izolálás olajgázból: Michael Faraday (Royal Inst.) 1825, - előállítás benzoegyantából: Eilhardt Mitscherlich (Berlin) 1834 : benzol, benzoesav barnás gyanta + a() 2 ( - - ) 2 a 2+ meszes vízzel főzte +2 (savanyítás) a 2 tapasztalat: a benzoesav kicsapódik a vizes oldatból Benzol leírása és szerkezeti tulajdonságainak meghatározás: M.Faraday (1825) olajgáz összenyomása: összegképlet offman/mansfield (1845) kőszénkátrány, 1855: aromás rendszerek August Friedrich Kekulé von Stradonitz (1865) szerkezet: 1,3,5-ciklohexatrién Kathleen Lonsdale (1929): röntgediffrakció: lapos gyűrű Verner Schomaker és Linus arl Pauling (1939) elektrondiffrakció tökéletes hatszög azonos határszerkezetek
2 A benzol térszerkezete: d(-)=1.098å d(-)=1.397å a() =120 o w() =0 o memo: d( )=1.48Å, d(=)=1.34å Benzol hatfogású szimmetriatengellyel rendelkező síkalkatú szimmetrikus gyűrűs molekula. Minden -atomja sp 2 -es hibridállapotú. A 6 db. p z atom-pályából, 3 db p molekula pálya alakul ki: aromás elektronszerkezetű vegyület. szokatlan hogy nem mutatják a alkének tipikus addíciós reakciói Addició (cisz) KMn 4 / 2 KMn 4 / 2 semmi Addició (transz) Br 2 / 4 Br Br 2 / 4 semmi Br Subsztitúció Br Br Br 2 / FeBr Br Br
3 szokatlan stabilitása: A jósolt kcal/mol, vagy ennek többszöröse D-hoz képest, a mért hidrogénezési hő jelentős stabilitásra utal: a rezonancia energia jelentős (-36 kcal/mol). A benzol tehát ugyancsak inert! D (kcal/mol) kat. / nyomás D = -49.8(kcal/mol) 3*ciklohexén = rezonancia stab. = Wade 693 aromás rendszerek (szakkifejezéssé alakult): delokalizált p-rendszer (alternáló egyes és kettős kötések): 4n+2 p-elektron részvételével (4-el nem osztható; azok: antiaromás / nem-aromás) síkalkat gyűrűs
4 VIII. Aromás szénhidrogének omoaromás vegyületek: benzol, benzolrészekből felépülő molekulák és azok származékai, amelyek lehetnek monociklusos, policiklusos és kondenzált ciklusos szénhidrogének. eteroaromás vegyületek:aromás elektronszerkezet S,, és atomokkal. 1. Monociklusos aromás szénhidrogének Két szubsztituens relatív helyzete: orto (1,2), meta (1,3) és para (1,4) árom szubsztituens relatív helyzete: vicinális (1,2,3), aszimmetrikus (1,2,4), és szimmetrikus (1,3,5) A. Telített oldalláncú monociklusos aromás szénhidrogének Típusnevek: Toluene toluol (metilbenzol) E(RF/ Gd,p) piros kék töltés Benzene benzol karcinogén!!! xylos (görög): fa petrolkémia = 0 Debye p-elektronszextett 1,2-dimetilbenzol (orto-xilol) 1,3-dimetilbenzol (meta-xilol) 1,4-dimetilbenzol (para-xilol) o-xylene m-xylene p-xylene
5 mezitilén 1,3,5-trimetilbenzol mesitylene soportnevek: kumol izopropilbenzol Isopropylbenzene 3 3 para-cimol 1-metil-4-izopropilbenzol p-ymene phenyl fenil- o-tolyl o-tolil- m-tolyl m-tolil- p -tolyl p-tolil- 2 benzil- nev. gyak (1,1-Dimethylbutyl)-4-ethyl-2-methylbenzene 1-(1,1-dimetilbutil)-4-etil-2-metilbenzol
6 ILLATS ARMÁS VEGYÜLETEK Faj: év: Vegyület: Mandula (Prunus amygdalus) keserűmandula benzaldehid Kömény (uminum cyminum) köményolaj o-, m- és p- cimol Kömény (uminum cyminum) köményolaj chuminaldehid (illatos folyadék) Fahéj (innamomum zeylanicum) fahéjaldehid fahéjaldehid benzoefa gyantája (Styrax benzoin) benzoegyanta trópusi fa XVI. sz. óta ismert benzoesav tolulbalzsam toluol
7 kérdés: helyettesíthetünk-e egy aromás hidrogént egy alkil csoporttal? válasz: igen, Friedel rafts-alkilezési (S E 2) reakció során megvalosítás: pl. alkil-halogenid + Lewis-sav 3 + Al klórpropán általánosítás: más potenciális karbokationt eredményező reagens is alkalmas, pl. propén, ciklohexén kumol izopropilbenzol 2 Solomons 670, Bruckner II-125 vinilbenzol vinylbenzene kumol cikklohexilbenzol B. Telítetlen oldalláncú monociklusos aromás szénhidrogének sztirol styrole 3 propenilbenzol propenylbenzene helyzetizoméria 2 2 allilbenzol allylbenzene 2 2 1,4-divinilbenzol p -divinilbenzol 1,4-Divinylbenzene 2 e (f Eth etinilbenzol (fenilacetilén)
8 kat. Solomons Izolált policiklusos aromás szénhidrogének >10 milliárd kg/év Biphenyl bifenil 2 diphenylmethane difenilmetán tetr tetr memo: a két aromás gyűrű se nem koplanáris se nem merőleges (~40 o )
9 = 0 Debye piros kék töltés ethane án tetraphenylmethane tetrafenilmetán soportnevek: sztilbén 1,2-diphenylethene 1,2-dif eniletén transz op: 125 tolán diphenylacetylene difenilacetilén sztilbén 1,2-diphenylethene 1,2-dif eniletén tolán diphenylacetylene difenilacetilén cisz op: 5-6 tritil-
10 3. Kondenzált policiklusos szénhidrogének kétgyűrűs rendszerek: naftalin (szintelen) naftalin (szintelen) feltétel: legalább két közös szénatom: - lineáris anelláció - anguláris anelláció memo: a naftalin kivételével mindegyik név én végződésű folytonosan konjugált (6+4 π-elektr.) aromás ( =0D, 6- és 6-tagú gyűrűk) molyirtó Bruckner II 185 magnólia azonos határszerkezetek azulén (mélykék krist.) azulén (mélykék krist.) folytonosan konjugált (6+4 π-elektron = 4*2+2 aromás) szemiaromás ( =1.1D, töltés szepar.,7- és 5-tagú gyűrűk) Bruckner II 1377 nem-azonos határszerkezetek
11 nem-aromás rendszer Bruckner II 193 (6+2 π-elektr.) ( dipol, 6- és 5-tagú gyűrűk) memo: az aromás gyűrűhöz kondenzált ciklopentadién fokozott reaktivitású 1-Indene indén (szintelen folyad.) fokozott reaktivitású ( savanyú ) metilén csop. (pl. - indén + a - indén + aldehid) a 10 p-elektron = 4*2 + 2 aromás
12 három gyűrűs rendszerek: 12 p-elektron nem-aromás bifenilén Biphenylene 2 fluorén 2-Methyl-3-vinyl-1-indene kékesen fluoreszkáló szintelen tûkristály antracén Anthracene fokozott reaktivitású ( savanyú ) metilén csoport (pl. fluorén + a) memo: a kialakuló anion esetében az aromacitás ki tud terjedni a mol. egészére a fenantrén Phenanthrene 14 p-elektron = 4*3 + 2 aromás memo: A naftalin rezonancia energiája (-60 kcal/mol) kicsit alacsonyabb mint a benzol kétszerese (-36kcal/mol*2= -72kcal/mol). Az antracéné -84kcal/mol, míg a fenantréné -91 kcal/mol (-108 helyett).
13 négy és több gyűrűs rendszerek: naftacén aphthacene krizén hrysene naftacén aphthacene krizén hrysene perilén Perylene pirén Pyrene memo: megtalálhatók a dohányfüstben, a diesel autók fekete füstjében, perilén Perylene koronén oronene pirén Pyrene pentacén Pentacene Példa: (a máj méregtelenítési stratégiája, reaktív intermedier, majd a vízoldhatóvá tétel glutationnal ) e d c b f benzo[def ]krizén Benzo[def ]chrysene aril hidroxiláz (májban) ez a ténylegesen karcinogén hatású vegyület
14 perilén bronzsárga krist. (op. 274 o ) Az teljes SF elektronsűrűség alapján számított izo-felületek memo: 2 naftalin peri helyzetű összekapcsolódása koronén sárga, krist. (op. 429 o ) hat benzolgyűrű körkörös anellációja, ciklikusan kondenzált gyűrűs aromás szénhidrogén aromaticitás nem összefüggő p rendszerek
15 IX. Aromás halogénezett szénhidrogének Egy vagy több hidrogént X-re cserélünk halogénezés helye szerint:-magban szubsztituált (aril-halogenid), -oldalláncban szubsztituált (aral-kilhalogenid) Szn: előző fejezet alapneveiből (pl. benzol, fenantrén) képezzük (pl. jódbenzol, 9-brómfenantrén). sn: előző fejezet csoportneveihez (pl. fenil, fenantril) tesszük a funkció nevet (pl. klorid) és így kapjuk a monoszubsztituált (pl. fenil-jodid, fenantril-bromid). klórbenzol chlorobenzene 1,2,4-triklórbenzol 1,2,4-Trichlorobenzene 1,2-diklórbenzol (o-diklórbenzol) 1,2-Dichlorobenzene diszubsztituált tri-,terta-, penta-, hexaszubsztituált 1,3-diklórbenzol (m-diklórbenzol 1,3-Dichlorobenzene 1,2,4-triklórbenzol 1,4-diklórbenzol (p -diklórbenzol) 1,2,4-Trichlorobenzene 1,4-Dichlorobenzene 1,2,4,5-tetraklórbenzol 1,2,4,5-Tetrachlorobenzene pentaklórbenzol Pentachlorobenzene 1,2,4,5-tetraklórbenzol 1,2,4,5-Tetrachlorobenzene hexaklórbenzol exachlorobenzene
16 aromás vegyületek tipikus és speciális reakciói: tipikus: szubsztitúció speciális: addíció Bruckner II/ hν (UV) + kat. Fe 3 Al o-diklór benzol + perhalogénezés (csak sok 2 kell): minden lépésben: + 2 és - 1,2,4,5-tetraklór benzol p-diklórbenzol 1,2,4- triklórbenzol
17 Toluolszármazékok p -klórtoluol 4-klórtoluol 1-hloro-4-methylbenzene m-klórtoluol 3-klórtoluol 1-hloro-3-methylbenzene 2,4,6-triklórtoluol 1,3,5-Trichloro-2-methylbenzene Kondenzált policiklusos szénhidrogénszármazékok Br 3 Br brómnaftalin 1-Bromonaphthalene Br 2-bróm-1-metilnaftalin 2-Bromo-1-methylnaphthalene brómantracén 9-Bromoanthracene Szélső gyűrűkkel kezdjük a számozást KÖZÉPE, anellált atomokat számozzuk utolsóként!!
18 ev. gyak DDT rovarirtószer (betiltották) 1-hloro-4-(5-chloro-1-trichloromethyl-pent-3-enyl)-benzene 1-klor-4-(5-klór-1-triklormetil-pent-3-enil)-benzol DDT szintézise: 1-bisz(4-klórfenil)-2,2,2-triklóretán (Zeidler, 1874) becenév: diklór-difenil-triklóretán 2 S 4-2 klorálhidrát klorál (triklór-acetaldehid) Bruckner II/ rovarirtó-szer kedvező hatás 2. lerakódik algákban pusztítja a halakat 3. idegrendszeri károsodást okoz káros hatás (feszültségfüggő a+-csatornák nyitva maradnak, depolarizáció, ezért az akciós potenciál kialakulása zavart lesz)
19 X. Aromás hidroxivegyületek és származékai Egy vagy több hidrogént -ra cserélünk Az - helye szerint: -magban szubsztituált (fenol), -oldalláncban szubsztituált (aromás alkohol) Alapnevek: benzol fenol, naftalin naftol, fenantrén fenantrol Szn: alapneveiből (pl. benzol, fenantrol) képezzük (pl. jódfenol, 5-brómfenantrol). 1. Fenol típusú hidroxivegyületek: Egyértékű fenolok: 3 fenol Phenol o-krezol o-cresol 2-Methyl-phenol kérdés: miért savanyúbb a fenolok kémhatása mint az alifás alkoholoké? pk a = 9.9 (fenol), 18 (ciklohexanol), 16 (etanol), 16 (víz), 4.8 (ecetsav) m-krezol m-cresol 3-Methyl-phenol 3 3 p -krezol p -cresol 4-Methyl-phenol válasz: A keletkező fenolát anion konjugáció révén stabilizálódik, az egyensúly ezért ennek javára eltolódik fenol fenolát anionok
20 kérdés: hogyan befolyásolják a szubsztituensek a fenol kémhatását? memo: a p-krezolban a konjugáció kb. annyira kiterjedt mint a fenolban, de a p-nitrofenolban viszont kiterjedtebb, ami tovább növeli a savas karaktert. memo: az eltérő savasság eltérő vízoldhatóságot eredményez: pk a = 9.9 (fenol), 16 (víz), 18 (ciklohexanol) + a erõsebb sav gyengén vízoldható 2 0 a gyeng bázis vízoldható + a fenolok disszociációja vízben szerese a ciklohexanolénak töltött részecskék megjelenése megnövekedett oldhatóság gyengébb sav alig vízoldható + a 2 0 a erõsebb bázis vízoldható + 2
21 kétértékű fenolok: három különböző izomer háromértékű fenolok: három különböző izomer pirokatechin Benzene-1,2-diol rezorcin Benzene-1,3-diol hidrokinon Benzene-1,4-diol redukáló-szer: Ag 3 fotó előhívás depigmentáció naftolok: antrolok: pirogallol Benzene-1,2,3-triol benzol-1,2,3-triol 1-naftol (a-naf tol) 1-aphthol oxihidrokinon Benzene-1,2,4-triol benzol-1,2,4-triol f loroglucin Benzene-1,3,5-triol benzol-1,3,5-triol 2-naf tol ( -naftol) 2-aphthol memo: rendhagyó nevezéktan 1-naftol és nem naft-1-ol 1-antrol és nem antr-1-ol fenantrolok: 1-antrol (a-antrol) 1-Anthrol 9-antrol (antranol) 9-Anthrol 2-fenantrol 2-Phenanthrol
22 ev. gyak Br 3 3 Br 2,4-dibrómfenol 2,4-Dibromophenol 2 4-nitrofenol (p-nitrofenol) 2-Methylbenzene-1,3-diol 2-metilbenzol-1,3-diol etil-2-metilfenol 4-Ethyl-2-methylphenol 4-itrophenol Példa: 4-(2-Amino-1-hydroxyethyl)benzene-1,2-diol 4-(2-amino-1-hidroxietil)benzol-1,2-diol noradrenalin (2-Amino-1-hydroxyethyl)benzene-1,2-diol 4-(2-amino-1-hidroxietil)benzol-1,2-diol noradrenalin Amino-3-(3,4-dihydroxyphenyl)propionic acid neurotranszmitter, stressz hormon, 2-amino-3-(3,4-dihidroxifenil)propionsav gyógyszerként: vérnyomás emelő DPA 3,4-dihidroxyphenylalanine neurotranszmitter prekurzor: dopamin, noradrenalin + Parkinson-kór kezelése
23 2. Aromás alkoholok: 2 2 benzil-alkohol benzylalcohol fenilmetanol Phenylmethanol trif enilmetanol Triphenylmethanol (2-ydroxymethyl)phenol (2-hidroxibenzil)-alkohol szalicilalkohol, szaligenin 2 3-Phenyl-prop-2-en-1-ol 3-fenil-prop-2-én-1-ol fahéjalkohol 2 2-Phenylethan-1-ol 2-feniletan-1-ol fenetil-alkohol 2 3. Fenoléterek: anizol metoxibenzol fenil-metil-éter Methoxybenzene etoxibenzol etil-fenil-éter Ethoxybenzene (alliloxi)benzol allil-fenil-éter (Allyloxy)benzene 2 esztragol 1-allil-4-metoxibenzol 1-Allyl-4-methoxybenzene Fenoléterek előállítása: a 2 5 Savas jellegük miatt már a-dal is fenolátot képeznek (Williamson szint.), míg az alkoholok csak fém a-mal adnak alkoholátot! a 2 5 -I - 2 -ai 3 3 3
24 4. Kinonok: már nem aromás vegyületek memo: könnyen oxidálhatók a fenolok és redukálhatók a kinonok hidrokinon memo: A fekete-fehér fényképezés során a lemezre rétegelt AgBr szemcséket fénnyel aktiváljuk. Előhíváskor a hidrokinon redukálja az Ag + fém Ag-é, ami fekete szemcseként rögzül a negatívon és ami a negatív kép sötét része. hidrokinon 1,4-benzokinon + AgBr* + 2Ag + 2Br memo: neve kinon de nem kinoidális szerkezetű a molekula
25 Példák: 3 kámforkinon flavanon [ÉT1 198] 1,7,7-Trimethylbicyclo[2.2.1]heptane-2,3-dione 1-Methylbicyclo[2.2.1]heptane-2,3-dione 5,7-Dihydroxy-2-(4-hydroxyphenyl)chroman-4-one kámforkinon - fogtömések egyik komponense Methyl-1,4-naphthoquinone 2 6 K 2 vitamin [Stryer 255] szükséges a protrombin és más kalciumkötő fehérjék szintézisénél (vérkoagulációs hatás), gyermekkorban: egészséges csontfejlődés 3 3 2,3-Dimethyl-1,4-benzoquinone 9 plasztokinon A oxidált forma ( a redukáltf orma a hidrokinon) [ÉT1 57], Stryer 659 fotoszintézis: fény hatására vízből 2 -t fejlesztve redukálódik a plasztokinon A
26 A mitokondrium oxidáló szere: Koenzim Q és AD az oxidációs rendszer nélkülözhetetlen részei R cukor 3 R cukor Koenzim Q oxidált + + AD redukált R:= 10 izoprén egység (membránba horgonyzás) Koenzim Q redukált AD + oxidált 1. Tiolok S XI. Aromás kénvegyületek S S S 2 3 Br Benzenethiol benzoltiol tiofenol 3-Methylbenzene-1-thiol 3-metilbenzol-1-tiol m-tiokrezol Phenylmethanethiol fenilmetántiol 4-Bromobenzene-1-thiol 4-bróm-benzol-1-tiol p-brómbenzol-1-tiol
27 2. Szulfidok S 3 S Methylsulfanylbenzene metil-fenil-szulfid methyl phenyl sulfide 3. Szulfoxidok 4. Szulfonok difenil-szulfid diphenyl sulfide S S 3 7 difenil-szulfoxid diphenyl sulfoxide fenil-propil-szulfon phenyl propyl sulfone 5. Szulfonsavak S 3 S 3 3 benzolszulfonsav Benzenesulfonic acid p-toluolszulfonsav Toluene-4-sulfonic acid
28 6. Szulfonsav-észterek S aminobenzolszulfonsav S 3 4-Aminobenzenesulfonic acid S 3 Methyl benzenesulfonate metil-benzolszulfonát Benzenesulfonic acid methyl ester benzolszulfonsav-metil-észter 2 4-Sulfobenzoic acid 4-szulfobenzoesav p-szulfobenzoesav 7. Szulfonsav-kloridok, szulfonsav-amidok S 2 tozil-klorid p-toluolszulfonil-klorid 4-Methylbenzenesulfonyl chloride 4-metilbenzolszulfonil-klorid S 2 S 2 2 benzolszulfonil-klorid Benzenesulfonyl chloride 3 3 p-toluolszulfonamid Toluene-4-sulfonamide
29 XII. Aromás nitrogéntartalmú vegyületek 1. Aromás niro- és nitrozovegyületek típusnév: nitro-arén, nitrozo-arén Előtag: nitro-, nitrozo nitrobenzol itrobenzene 1,3-dinitrobenzol m-dinitrobenzol 1,3-Dinitrobenzene 1,3,5-trinitrobenzol 1,3,5-Trinitrobenzene 3 2,4,6-trinitrotoluol (TT, trotil) 2,4,6-trinitrotoluene nitronaftalin (a-nitronaftalin) 1-itronaphthalene nitrozobenzol itrosobenzene fenilnitrometán Phenylnitromethane
30 éhány robbanékony nitrobenzol származék: 2 2 ammónium-pikrát Trinitrotoluol (TT) memo: fokozottan explozívak a TT szubsztituált származékai pl.: trinitro metakrezol (ekrazit) 2 Pikrinsav (sói a pikrátok) kémcső kísérlet (max. 1g anyaggal) memo: tárolási, stabilitási okok miatt 3 sói formában használjuk trinitrofluroglucin (TFG) memo: hevesebb mint a TT pl. tetranitro--metilanilin (tetril) memo: még hevesebb gyutacsnak használták vas-pikrát (igen explozív) kémcsöves kísérlet TILS!
31 max. 1g anyag 2. kísérlet: süvítve kilő 1. kísérlet: gyűrtpapír! alufólia gyújtópálcával vagy gyufával a papírt meggyújtjuk Bunsen-égő TT pikrinsav TFG tetril kormozó láng heves, sistereg még fényesebb kilő TILS TILS
32 fekete lőpor (Kina XI. század tűzijáték): helyes aránya a szénpor (tüzelőanyag) + kén (tüzelőanyag) + salétrom (K 3 oxidálószer) keverékének. Robbanásszerű térfogatnövekedés (pl. 2 ) bizt. a tolóerőt. memo: Stroncium-nitrát segítségével vörösre, bárium-nitrát révén zöldre, réz-karbonáttal pedig kékre lehet változtatni a robbanás színét. füst nélküli lőpor: cellulóz nitrát szilárd hajtóanyag: Al és 4 4 (ammónium-perklorát) (űrtechnika) gyufafej: K 3 (kálium-klorát oxidálószer) + szénpor, kén és antimonszulfidok (Sb 2 S 3 és Sb 2 S 5 narancssárga) (tüzelőanyagok) keveréke. Égés során keletkező gázok: pl. 2, Sb, S 2 memo: a gyufásdoboz dörzsfelületén vörös foszfort (P 4 ) van, ami a súrlódás hatására könnyen meggyullad, azaz iniciátor.
33 Robbanószerek jellemzése, az oxigénmérleg: kérdés: hány 2 molekula kell a szerves anyag elégetéséhez, ha azt feltételezzük, hogy 2, 2, 2 keletkezik? nitroglicerin (színtelen foly.) ½ 2 = Alfred obel egy mol. belül van mind a 2 csop. (oxidálószer) mind a 2 és (tüzelőanyag). Ezért igen hatékony! Összesen 14 mol gáz és gőz keletkezik: kvázi nullszaldós oxigénmérleg dinamit: diatomaföldbe (kovaföld, üledékes kőzet) felitatott nitroglicerin ,5 2 = TT 22 mol gáz és gőz keletkezik ,5 2 = TFG 18 mol gáz és gőz keletkezik
34 2-Aminophenol 2. Aromás aminok és iminek típusnév: arilamin, arilimin Ar Ar Ar Ar Ar Ar primer aromás amin (aril-amin) szekunder aromás amin (diaril-amin) tercier aromás amin (triaril-amin) A. Egyértékű primer aminok anilin 2 o-toluidin m-toluidin p -toluidin 2-aminof enol o-aminof enol 1-naftil-amin (a-naftil-amin) 2-naftil-amin ( -naftil-amin)
35 B. Egyértékű szekunder aminok difenil-amin Diphenylamine bisz(2-naftil)-amin Bis(2-naphthyl)amine. Egyértékű tercier aminok trifenil-amin Triphenylamine,-dimetilanilin,-Dimethylaniline D. Kvaterner ammóniumvegyületek benzil-trimetil-ammónium-hidroxid Benzyltrimethylammonium hydroxide anilinium-klorid anilinium chloride
36 E. Többértékű aminok naf talin-1,4-diamin 2 aphthalene-1,4-diamine p -fenilén-diamin p -Phenylenediamine Benzene-1,4-diamine F. Aromás iminek 2 2 bifenil-4,4'-diamin Biphenyl-4,4'-diamine 3 benzilidénimin Benzylideneimine -etilidénanilin -Ethylideneaniline
37 3. Aromás hidroxilamin és hidrazinszármazékok típusnév: aril-hidroxilamin 2 5 Utótag: hidroxilamin Előtag: hidroxilamino -fenilhidroxilamin 4-(hidroxiamino)fenol -etil--f enilhidroxilamin -Phenylhydroxylamine 4-(ydroxyamino)phenol -Ethyl--phenylhydroxylamine típusnév: aril-hidrazin Utótag: hidrazin Előtag: hidrazino fenilhidrazin Phenylhydrazine -metil-, -fenilhidrazin -Methyl-'-phenylhydrazine 4-hidrazinofenol 4-ydrazinophenol
38 4. Aromás azo- és azoxivegyületek típusnév: azoarén Előtag: azo Utótag: diazén Szimmetrikus aromás azovegyület Aszimmetrikus aromás azovegyület difenildiazén Diphenyldiazene azobenzol azobenzene (fenilazo)toluol 4-(phenylazo)toluene Phenyl-p-tolyldiazene fenil-p-tolildiazén (fenilazo)benzol-1,3-diamin 4-(Phenylazo)benzene-1,3-diamine (krizoidin) (fenilazo)naftalin-2-amin 1-(Phenylazo)naphthyl-2-amine 2 4-(fenilazo)naftalin-1-amin 1-(fenilazo)naftalin-2-amin 4-(Phenylazo)naphthyl-1-amine 1-(Phenylazo)naphthyl-2-amine 2 4-(fenilazo)naftalin-1-amin 4-(Phenylazo)naphthyl-1-amine
39 kérdés: miért lehet színes egy azovegyület? memo: a fehér fény ( nm) 1. teljes spektrumból szelektíven nyel el egy tartományt 2. a megmaradó komponensek keverék színét érzékeljük kérdés: mi lehet a szín molekuláris oka? válasz: a megfelelő kromofor csoport nyeli el a fényt - a finomhangolást a konjugáció kiterjedésének mértéke biztosítja memo: chroma = szín, phoros = hordozó (görög) itt: konjugált kettős-kötés rendszer sárga 4-nitroazobenzol elnyelés: nm sárgásvörös 4-nitro-4 -aminoazobenzol 3 tto ikolaus Witt aceton színtelen sötétvörös 4-nitro-4 -(,-dimetilamino)azobenzol elnyelés: nm memo: más kromofórok is finomhangolhatók pl. konjugált ketonok biacetil sárga 3 3 2,3,4-triketopentán narancssárga
40 Példa: , 3 - b i s z [ ( 2, 4 - d i a m i n o f e n i l ) a z o ] - b e n z o l ( B i s m a r c k - b a r n a ) 2 3 S S 3 4-(2-hidro benzolszul 4-(2-ydro ben ( -naftolo 4-(2-hidroxinaftalin-1-ilazo)- benzolszulfonsav 4-(2-ydroxynaphthalen-1-ylazo)- benzenesulfonic acid 3 S ( -naftoloranzs nm) 2 2 4,4, -bisz(1-amino-4-szulfonaftalin-2-ilazo)bifenil (kongóvörös: legerõsebb sáv nm között) S 3 ongo Red: a strong absorption band at 340nm (near-uv) and another at 500nm (at blue-green transition region). This dye transmits red wavelengths above 560 nm and thus, appears red to the eye.
41 azoxivegyületek,'-diphenyldiazene -oxide,'-difenildiazin--oxid azoxibenzol 2-(Phenyl-,,-azoxy)naphthalene-1-carboxylic acid 2-(fenil-,,-azoxi)-1-naftalin-1-karbonsav 5. Aromás diazónium vegyületek típusnév: aréndiazonium 2 2 Előtag: diazónio Utótag: diazónium 2 BF benzoldiazonium-klorid Benzenediazonium chloride S 3 4-diazoniobenzol-1-szulfonát 4-Diazoniobenzene-1-sulfonate 8-hidroxinaftalin-1-diazonium tetrafluoroborát 8-ydroxynaphthalene-1-diazonium tetraf luoroborate
42 Diazohidroxid A diazónium kation fontos poláris határszerkezetei: Bruckner II/1 565 A benzoldiazónium-klorid előállításának részletei: a bruttó reakció: Itt nincs meg az elektron-oktett!: potens elektrofil néhány részlet: arilamin -nitrozo-ammónium kation -nitrozoamin Bruckner II/1 569 Diazónium kation
43 Aromás diazónium vegyületek tipikus reakciói: gyökös Sandmeyer- azokapcsolás : szerű reakciók: u2, u2+, 2 Ar 2 ux X=, Br, Ar KI BF4 + hõ 3 P Aromás azidovegyületek típusnév: azidoarén és aril-azid Szn sn 3 instabil robbanékony f enil-azid Azidobenzene azidobenzol Ar Ar Ar X I F Előtag: azido Utótag: nincs 3 S 3 1-azidonaftalin-2-szulfonsav 1-Azidonaphthalene-2-sulfonic acid 3 f enil-azid Azidobenzene azidobenzol S E -X 3 1-azidonaftalin-2-szu azobenzol származékok 1-Azidonaphthalene-2 (szinezékek) elektrofil szubsztitúció Az azidobenzol két poláris határszerkezete:
44 XIII. Aromás oxovegyületek 1. Aromás aldehidek - típusnév: arilaldehid Előtag: formil Utótag :karbaldehid Képzés: az arilkarbonsav nevének megfelelő csonkított acilnévből az aldehid utótaggal képezzük pl.: ftáloil ftálaldehid, naftoil naftaldehid Triviális savnév esetén csonkított acilnév + aldehid pl.: benzoil +aldehid benzaldehid A gyűrűhöz közvetlenül csatlakozó aldehideket karbaldehideknek hívjuk pl.: naftalinkarbaldehid. A) Karbaldehidek 2-hidroxibenzaldehid 2-ydroxybenzaldehyde 3-hidroxibenzaldehid 3-ydroxybenzaldehyde 3 4-metilbenzaldehid 4-Methylbenzaldehyde
45 Példa: hidroxi-3-metoxibenzaldehid vanillin 3-fenilakrilaldehid fahéjaldehid 4-ydroxy-3-methoxybenzaldehyde 3-Phenylprop-2-enal 3 4-metoxibenzaldehid ánizsaldehid 4-Methoxybenzaldehyde B) Alifás oldalláncú aromásaldehidek 2 2 [(1-naftil)metil]-malonaldehid (1-naftil)acetaldehid
46 3 2. Aromás ketonok típusnév: alkanon A) az alifás oldallánc része az karbonilcsoport oxocsoport Szn.: előtag: oxo utótag: on sn.: keton Phenylethan-1-one 1-feniletan-1-on acetof enon 1-Phenylethan-1-one fenil-metil-keton 1-feniletan-1-on methyl-phenyl keton acetof enon fenil-metil-keton methyl-phenyl keton 1-Phenylpropan-2-one 1-fenilpropán-2-on f enilaceton 1-Phenylpropan-2-one benzil-metil-keton 1-fenilpropán-2-on 1-Phenylbutan-2-one 1-fenilbután-2-on 1-f enilbutan-2-on 1-Phenylbutan-2-one benzil-etil-keton 1-fenilbután-2-on 1-f enilbutan-2-on B) Az karbonilcsoport két aromás gyűrűhöz kapcsolódik f enilaceton benzil-metil-keton Szn. sn. benzil-etil-keton fenil-(2-naftil)-keton aphthalen-2-yl-phenyl-methanone sn. Szn. benzofenon difenil-keton difenilmetanon Diphenylmethanone
47 ) Aromás di-, tri- és poliketonok D) Aromás rendszerekhez integrálódott ketonok sn. Szn. dif enil-diketon 1,2-Diphenylethane-1,2-dione 1,2-difeniletán-1,2-dion bisz(2-naf til)-diketon Di(2-naphthyl)ethane-1,2-dione di(2-naftil)etán-1,2-dion bisz(2-naf til)-diketon Di(2-naphthyl)ethane-1,2-dione di(2-naftil)etán-1,2-dion 2 1,2-dihidronaftalin-1-on inden-1-on Inden-1-one 1,2,-Dihydronaphthalen-1-one memo: f luorén-9-on Fluoren-9-one antron 9,10-dihydroanthracen-9-one 9,10-dihidroantracén-9-on 1,2-Dihydronaphthalene 1,2-dihidronaftalin
48 XIV. Aromás karbonsavak: Az aszpirin rövid története - A fűzfakérget az ókori Ázsiában is használják (2400 éve) láz és fájdalomcsillapításra, tól a fűzfakéreg extraktumát használják hasonló célból, körül azonosítják a kivonat aktív komponensét a szalicint (salix [latin] fűzfa) encki (Bázel) kimutatja hogy a szervezetben szalicilsavvá alakul át a szalicin (a szalicilsav is fájdalom és lázcsillapító, de égeti a nyelőcsövet, gyomrot) Patikusok elkészítik a a+ sóját, működik, de borzasztó az íze, hánytat Félix ofmann/arthur Eichengrün(??) (Bayer) elkészíti az aszpirint, ami jól hat és elfogadható ízű: a acetilt, spir spirea-t (gyöngyvessző melyből szalicilsav-metilészter izolálható) Az aszpirin klinikai kipróbálása és üzemi gyártása (Bayer) sak az USA-ban > 10 millió kg-t gyártanak évente atásmechanizmus: az aspirin, mint acetilezőszer a ciklooxigenáz (X) inhibitora, gátolja a prosztaglandin szintézist) - gyulladáscsökkentő, - a köszvény és reuma hatásos gyógyszere
49 iklooxigenáz-arahidonsav komplex Loll, P.J., Picot, D., Garavito, R.M. (1995) at.struct.biol. 2: arman,.a., Rieke,.J., Garavito, R.M., Smith, W.L. (2004) J.Biol.hem. 279:
50 2 Ser Ser-Ac Szerin 2 3 Treonin S 2 iszteinszerin T
51 Szintézis tervezet: a fenolból aszpirin Bruckner: II/703 II/726 II/860 kőszén, petróleum memo: gyomorban nem, bélben hidrolizál (ecetsav + szalicilsav) Kolbe-szintézis: / 100 atm memo: az aszpirin gátolja a ciklooxigenázt, amely prosztaglandin szint. része, így ennek csökkenése a fájdalomküszöböt növeli és a gyulladást csökkenti.
52 1. Arénkarbonsavak típusnév: arénkarbonsav XIV. Aromás karbonsavak Az aromás gyűrűhöz kapcsolódó vagy annak oldalláncában a láncvégi metilcsoport hidrogénjeit cseréljük: 2 db -t -ra; 1 db -t -ra karboxilcsoport kapcsolódása szerint: arénkarbonsav arilezett alifás karbonsav karboxilcsoportok száma szerint: egy-, két-, három- és több-bázisú sav szénhidrogén oldallánc: telített telítetlen A. Egyértékű savak: 2-metilbenzoesav o-toluilsav benzolkarbonsav benzoesav Benzoic acid 3-metilbenzoesav m-toluilsav 2-naf toesav 3 2-naphtoic acid 4-metilbenzesav p-toluilsav 2-Methylbenzoic acid 3-Methylbenzoic acid 4-Methylbenzoic acid 1 4 ostradamus (1556) tartósítószer (gombák, baktériumok szaporodását gátolja): E210, E211, E212, E213 Előtag: karboxi Utótag :karbonsav 1 2-naf toesav 2-naphtoic acid 1 1-naf toesav 1-naphtoic acid
53 B. Kétértékű savak: benzol-1,2-dikarbonsav benzene-1,2-dicarboxylic acid ftálsav Phthalic acid. Többértékű savak: benzol-1,3-dikarbonsav 1,4-benzoldikarbonsav benzene-1,3-dicarboxylic benzene-1,4-dicarboxylic acid acid op=231 o izof tálsav op=348 o tereftálsav op=425 o Isophthalic acid 1 4 Terephthalic acid benzol-1,3,5-trikarbonsav (trimezinsav) Benzene-1,3,5-tricarboxylic acid kérdés: miért ennyire eltérő a három szerkezeti izomer olvadáspontja? memo: intermolekuláris -hidak Bruckner II/1 799 grafit szerkezetigazoló oxidációja benzol-1,2.3-trikar (hemimellitsav) Benzene-1,2,3-tric benzol-1,3,5-trikarbonsav (trimezinsav) Benzene-1,3,5-tricarboxylic acid benzol-1,2.3-trikarbonsav (hemimellitsav) Benzene-1,2,3-tricarboxylic acid benzol-1,2,3,4,5,6-hexakarbonsav (mellitsav) Benzene-1,2,3,4,5,6-hexacarboxylic acid
54 D. peroxisavak: perbenzoesav peroxibenzoesav perbenzoic acid diperoxi-ftálsav rossz a benzolperoxikarbonsav mert a benzolkarbonsav név sem használható a benzoesav helyett rossz a benzol-1,2-diperoxikarbonsav mert af tálsav helyett nem mondhstjuk hogy benzol-1,2-karbonsav 2. Arilezett alifás karbonsavak típusnév: arilalkánsav A. Telített oldalláncú: Előtag: karboxi Utótag :sav f enilecetsav Phenylacetic acid 3-fenilpropánsav hidrof ahéjsav 3-Phenyl-propanoic acid 2-fenilpropánsav hidratropasav 2-Phenyl-propanoic acid konstitúciós izomerek
55 B. Telítetlen oldalláncú: 2 nev. gyak. 2-fenilakrilsav (atropasav) 2-Phenylacrylic acid cisz-3-fenilpropénsav (allofahéjsav) 3-Phenylacrylic acid transz-3-fenil-propénsav (f ahéjsav) 3-Phenylacrylic acid 1 3 sztereo izomerek 3-metil-5-(1-naftil)hexánsav 3-Methyl-5-(1-naphthyl)hexanoic acid (2-karboxietil)-5-(karboximetil)benzoesav 3-(2-arboxyethyl)-5-(carboxymethyl)benzoic acid
56 3. Magban szubsztituált arénkarbonsavak típusnév: arilkarbonsav Előtag: karboxi Utótag :karbonsav klórbenzoesav o-klórbenzoesav 2-hlorobenzoic acid aminobenzoesav 4-aminobenzoesav 2-nitrobenzoesav o-aminobenzoesav 1-klórnaftalin-2-karbonsav p-aminobenzoesav o-nitrobenzoesav (antranilsav) 1-hloronaphthalene- 2-itrobenzoic 2-Aminobenzoic acid acid 2-carboxylic 4-Aminobenzoic acid acid Ikerionos szerkezet: 3 proton ,4,6-trinitrobenzoesav 2,4,6-Trinitrobenzoic acid 4 2-aminobenzoesav o-aminobenzoesav (antranilsav) 2-Aminobenzoic acid 2 4-aminobenzoesav p-aminobenzoesav 4-Aminobenzoic acid 2-aminobenzoesav 2 o-aminobenzoesav 2,4,6-trinitrobenzoesav (antranilsav) 2,4,6-Trinitrobenzoic 2-Aminobenzoic acid acid 2 4-aminobenzoesav p-aminobenzoesav 4-Aminobenzoic acid =7.58 Debye
57 2-hidroxibenzoesav o-hidroxibenzoesav (szalicilsav) 2-ydroxybenzoic acid 3,4,5-trihidroxibenzoesav (galluszsav) 3,4,5-Trihydroxybenzoic acid 3 4-hidroxi-3-metoxibenzoesav (vanillinsav) 4-ydroxy-3-methoxybenzoic acid 4. Arilezett alifás karbonsavak szubsztituált származékai típusnév: aralkilsav (pl. akrilsav szárm. : 2 =) Előtag: karboxi Utótag :karbonsav 3 4-metoxibenzoesav p-metoxibenzoesav (ánizssav) 4-Methoxybenzoic acid 3 3 3,4-dimetoxibenzoesav (verátrumsav) 3,4-Dimethoxybenzoic acid 3-(2,4-dihidroxifenil)akrilsav (kávésav) transz 3-(2-hidroxifenil)akrilsav (o-kumársav) transz 3-(2-hidroxifenil)akrilsav (o-kumarinsav) cisz 3-(2,4-Dihydroxyphenyl)- acrylic acid 3-(2-ydroxyphenyl)- acrylic acid 3-(2-ydroxyphenyl)- acrylic acid
58 nev. gyak oxo-4-fenilbutánsav 4-xo-4-phenylbutanoic acid amino-3-(4-hidroxif enil)propánsav (4-hidroxif enil)-alanin vagy tirozin 2-Amino-3-(4-hydroxyphenyl)propanoic acid 3-benzoil-propionsav ,5-dioxo-2-fenilvaleriánsav 3,5-dioxo-2-f enilpentánsav 3,5-Dioxo-2-phenylpentanoic acid
59 5. Aromáskarbonsavak funkcionális származékai A. Karbonsavanhidridek: benzoesav-anhidrid 3 benzoesav-propionsav-an (ftálsavból hevítésre k 2 ftálsav-anhidrid benzoesav-anhidrid benzoesav-propionsav-anhidrid 1,3-dihidrobenzof urán-1,3-dion (ftálsavból hevítésre könnyen képzõdik) (o-dikarbonsav) ftálsav-anhidrid 3 2 1,3-dihidrobenzof urán-1,3-dion dimetil-ftalát 3 dimethyl phtalate Ethyl benzoate (ftálsavból hevítésre könnyen képzõdik) Bruckner II/ Phthalic acid dimethyl ester etil-benzoát 3 Benzoic acid ethyl ester benzoesav-etil-észter B. Karbonsavészterek: sn benzoesav-anhidrid benzoe ftálsav-anhid 2 1,3-dihidrobe 3 antracén-9-karbonsav-metil-észter Anthracene-9-carboxylic acid methyl ester 2 ftalid 3-Isobenzofuran-1-one
60 . Karbonsavhalogenidek: szalicilsav-klorid benzoil-klorid ftaloil-diklorid Benzoyl chloride Phthaloyl dichloride D. Karbonsavamidok: (4-Methoxy)benzoyl chloride (4-metoxi)benzoil-klorid ánizssav-klorid Phtalamic acid (2-ydroxybenzoyl) chloride (2-hidroxibenzoil)-klorid 2 acetanilid -Phenylacetamide 3 2 benzoesav-amid benzamid tereftálsav-amid tereftálamid ftálamidsav Benzamide Terephthalamide Phthalamic acid ftálimid 3 -metilbenzamid -Methylbenzamide Isoindole-1,3-dione
61 E. Karbonsavnitrilek: benzonitril Benzonitrile benzoesavnitril ftalonitril Phthalonitrile ftálsav-dinitril fenil-izocianid Isocyanobenzene memo: ez nem nitril hanem izocianid
A benzol, benzoesav felfedezése
 A benzol, benzoesav felfedezése - izolálás olajgázból: Michael Faraday (Royal Inst.) 1825, - előállítás benzoegyantából: Eilhardt Mitscherlich (Berlin) 1834 : benzol, benzoesav barnás gyanta + a() 2 (
A benzol, benzoesav felfedezése - izolálás olajgázból: Michael Faraday (Royal Inst.) 1825, - előállítás benzoegyantából: Eilhardt Mitscherlich (Berlin) 1834 : benzol, benzoesav barnás gyanta + a() 2 (
VIII. Aromás szénhidrogének
 VIII. Aromás szénhidrogének omoaromás vegyületek: benzol, benzolrészekből felépülő molekulák és azok származékai, amelyek lehetnek monociklusos, policiklusos és kondenzált ciklusos szénhidrogének. eteroaromás
VIII. Aromás szénhidrogének omoaromás vegyületek: benzol, benzolrészekből felépülő molekulák és azok származékai, amelyek lehetnek monociklusos, policiklusos és kondenzált ciklusos szénhidrogének. eteroaromás
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
ALKOHOLOK ÉS SZÁRMAZÉKAIK
 ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
Aromás vegyületek II. 4. előadás
 Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
2. melléklet a 4/2011. (I. 14.) VM rendelethez
 1. Egyes légszennyező anyagok tervezési irányértékei A B C D 1. Légszennyező anyag [CAS szám] Tervezési irányértékek [µg/m 3 ] Veszélyességi 2. 24 órás 60 perces fokozat 3. Acetaldehid [75-07-0] 0,2 1
1. Egyes légszennyező anyagok tervezési irányértékei A B C D 1. Légszennyező anyag [CAS szám] Tervezési irányértékek [µg/m 3 ] Veszélyességi 2. 24 órás 60 perces fokozat 3. Acetaldehid [75-07-0] 0,2 1
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Bevezetés. Szénvegyületek kémiája Organogén elemek (C, H, O, N) Életerő (vis vitalis)
 Szerves kémia Fontos tudnivalók Tárgy neve: Kémia alapjai I. Neptun kód: SBANKE1050 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
Szerves kémia Fontos tudnivalók Tárgy neve: Kémia alapjai I. Neptun kód: SBANKE1050 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
OXOVEGYÜLETEK. Levezetés. Elnevezés O CH 2. O R C R' keton. O R C H aldehid. funkciós csoportok O. O CH oxocsoport karbonilcsoport formilcsoport
 XVEGYÜLETEK Levezetés 2 aldehid ' keton funkciós csoportok oxocsoport karbonilcsoport formilcsoport Elnevezés Aldehidek nyíltláncú (racionális név: alkánal) 3 2 2 butánal butiraldehid gyűrűs (cikloalkánkarbaldehid)
XVEGYÜLETEK Levezetés 2 aldehid ' keton funkciós csoportok oxocsoport karbonilcsoport formilcsoport Elnevezés Aldehidek nyíltláncú (racionális név: alkánal) 3 2 2 butánal butiraldehid gyűrűs (cikloalkánkarbaldehid)
Részletes tematika: I. Félév: 1. Hét (4 óra): 2. hét (4 óra): 3. hét (4 óra): 4. hét (4 óra):
 Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
KARBONSAVAK. A) Nyílt láncú telített monokarbonsavak (zsírsavak) O OH. karboxilcsoport. Példák. pl. metánsav, etánsav, propánsav...
 KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
ENOLOK & FENOLOK. Léránt István
 ENLK & FENLK Léránt István ENLK Alapvegyület: R - CH = CH - Az enolok nem igazán létképes vegyületek! 2 ENLK sp 2 -es C atomhoz kapcsolódó csoport Az enolok gyenge savak Keto enol tautomer átalakulás R1
ENLK & FENLK Léránt István ENLK Alapvegyület: R - CH = CH - Az enolok nem igazán létképes vegyületek! 2 ENLK sp 2 -es C atomhoz kapcsolódó csoport Az enolok gyenge savak Keto enol tautomer átalakulás R1
Tartalomjegyzék. Szénhidrogének... 1
 Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
KARBONIL-VEGY. aldehidek. ketonok O C O. muszkon (pézsmaszarvas)
 KABNIL-VEGY VEGYÜLETEK (XVEGYÜLETEK) aldehidek ketonok ' muszkon (pézsmaszarvas) oxocsoport: karbonilcsoport: Elnevezés Aldehidek szénhidrogén neve + al funkciós csoport neve: formil + triviális nevek
KABNIL-VEGY VEGYÜLETEK (XVEGYÜLETEK) aldehidek ketonok ' muszkon (pézsmaszarvas) oxocsoport: karbonilcsoport: Elnevezés Aldehidek szénhidrogén neve + al funkciós csoport neve: formil + triviális nevek
4) 0,1 M koncentrációjú brómos oldat térfogata, amely elszínteleníthető 0,01 mól alkénnel: a) 0,05 L; b) 2 L; c) 0,2 L; d) 500 ml; e) 100 ml
 1) A (CH 3 ) 2 C=C(CH 3 ) 2 (I) és CH 3 -C C-CH 3 (II) szénhidrogének esetében helyesek a következő kijelentések: a) A vegyületek racionális (IUPAC) nevei: 2-butén (I) és 2-butin (II) b) Az I-es telített
1) A (CH 3 ) 2 C=C(CH 3 ) 2 (I) és CH 3 -C C-CH 3 (II) szénhidrogének esetében helyesek a következő kijelentések: a) A vegyületek racionális (IUPAC) nevei: 2-butén (I) és 2-butin (II) b) Az I-es telített
szerotonin idegi mûködésben szerpet játszó vegyület
 3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
3 2 2 3 2 3 2 3 2 2 3 3 1 amin 1 amin 2 amin 3 amin 2 3 3 2 3 1-aminobután butánamin n-butilamin 2-amino-2-metil-propán 2-metil-2-propánamin tercier-butilamin 1-metilamino-propán -metil-propánamin metil-propilamin
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Helyettesített karbonsavak
 elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
Budapest, szeptember 5. Dr. Tóth Tünde egyetemi docens
 SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
SZERVES KÉMIA I. levelező B.Sc. képzés, kód: BMEVESZAL17 Tantárgy követelményei 2016/2017. tanév I. félév Az alaptárgy heti 2,5 óra (páratlan héten 2 óra, páros héten 3 óra) előadásból és ezzel integrált
Szerves kémia Fontosabb vegyülettípusok
 Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
O S O. a konfiguráció nem változik O C CH 3 O
 () ()-butanol [α] D = a konfiguráció nem változik () 6 4 ()--butil-tozilát [α] D = 1 a konfiguráció nem változik inverzió Na () () ()--butil-acetát [α] D = 7 ()--butil-acetát [α] D = - 7 1. Feladat: Milyen
() ()-butanol [α] D = a konfiguráció nem változik () 6 4 ()--butil-tozilát [α] D = 1 a konfiguráció nem változik inverzió Na () () ()--butil-acetát [α] D = 7 ()--butil-acetát [α] D = - 7 1. Feladat: Milyen
H H 2. ábra: A diazometán kötésszerkezete σ-kötések: fekete; π z -kötés: kék, π y -kötés: piros sp-hibrid magányos elektronpár: rózsaszín
 3. DIAZ- ÉS DIAZÓIUMSPRTT TARTALMAZÓ VEGYÜLETEK 3.1. A diazometán A diazometán ( 2 2 ) egy erősen mérgező (rákkeltő), robbanékony gázhalmazállapotú anyag. 1. ábra: A diazometán határszerkezetei A diazometán
3. DIAZ- ÉS DIAZÓIUMSPRTT TARTALMAZÓ VEGYÜLETEK 3.1. A diazometán A diazometán ( 2 2 ) egy erősen mérgező (rákkeltő), robbanékony gázhalmazállapotú anyag. 1. ábra: A diazometán határszerkezetei A diazometán
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
szabad bázis a szerves fázisban oldódik
 1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
Kémia fogorvostan hallgatóknak Munkafüzet 13. hét
 Kémia fogorvostan hallgatóknak Munkafüzet 13. hét Szerves anyagok vizsgálata II. (174-176. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás, Nagy Veronika, Radó-Turcsi
Kémia fogorvostan hallgatóknak Munkafüzet 13. hét Szerves anyagok vizsgálata II. (174-176. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás, Nagy Veronika, Radó-Turcsi
1,3,5-trimetil-benzol. 2 3 m-metil-etil-benzol vagy m-etil-toluol CH3. izopropil-benzol(kumol) 1,8-dimetil-naftalin
 X.-XII. osztály, III. forduló, megoldás 011 / 01 es tanév, XVII. évfolyam 1. a) 1,,-trimetil-benzol o-metil-etil-benzol vagy o-etil-toluol 1,,4-trimetil-benzol 1,,5-trimetil-benzol m-metil-etil-benzol
X.-XII. osztály, III. forduló, megoldás 011 / 01 es tanév, XVII. évfolyam 1. a) 1,,-trimetil-benzol o-metil-etil-benzol vagy o-etil-toluol 1,,4-trimetil-benzol 1,,5-trimetil-benzol m-metil-etil-benzol
COOCH 3. Ca + O - NH 2 OCH 2 CH 2 CH 3 NO 2 N H H 3 CO N OCH 3 COOH
 9. Előadás itrogéntartalmú vegyületek 26. ITGÉTATALMÚ VEGYÜLETEK épszerű származékok 3 2 metil-antranilát (szőlő) 300 S szacharin (1977) S - kalcium-ciklamát (1970: rák) a + 2 2 3 2 2 3 2 2 3 2 2 2 glükóz:
9. Előadás itrogéntartalmú vegyületek 26. ITGÉTATALMÚ VEGYÜLETEK épszerű származékok 3 2 metil-antranilát (szőlő) 300 S szacharin (1977) S - kalcium-ciklamát (1970: rák) a + 2 2 3 2 2 3 2 2 3 2 2 2 glükóz:
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2018/2019tanév II. félév
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2018/2019tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2018/2019tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2016/2017tanév II. félév
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2016/2017tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Tantárgy követelményei 2016/2017tanév II. félév Az alaptárgy heti 3 óra előadásból és heti tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul. A
Szerkezet Szisztematikus név Korábbi elnevezés Hétköznapi elnevezés. propán. n-heptán. n-nonán. Elágazó alkánok. 2,2-dimetilpropán neopentán
 ormál alkánok n H 2n+2 alkán paraffin 4 metán H 3 3 etán H 3 3 propán 3 H 3 2 n-bután H 3 2 3 n-pentán H 3 3 2 2 n-hexán H 3 2 2 3 n-heptán H 3 3 2 2 2 n-oktán H 3 2 2 2 3 n-nonán 3 H 3 2 2 2 2 n-dekán
ormál alkánok n H 2n+2 alkán paraffin 4 metán H 3 3 etán H 3 3 propán 3 H 3 2 n-bután H 3 2 3 n-pentán H 3 3 2 2 n-hexán H 3 2 2 3 n-heptán H 3 3 2 2 2 n-oktán H 3 2 2 2 3 n-nonán 3 H 3 2 2 2 2 n-dekán
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
A szervetlen vegyületek
 5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
Curie Kémia Emlékverseny 10. évfolyam országos döntő 2018/2019. A feladatok megoldásához csak periódusos rendszer és zsebszámológép használható!
 A feladatokat írta: Kódszám: Horváth Balázs, Szeged Lektorálta: 2019. május 11. Széchenyi Gábor, Budapest Curie Kémia Emlékverseny 10. évfolyam országos döntő 2018/2019. A feladatok megoldásához csak periódusos
A feladatokat írta: Kódszám: Horváth Balázs, Szeged Lektorálta: 2019. május 11. Széchenyi Gábor, Budapest Curie Kémia Emlékverseny 10. évfolyam országos döntő 2018/2019. A feladatok megoldásához csak periódusos
O 2 R-H 2 C-OH R-H 2 C-O-CH 2 -R R-HC=O
 Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
A szervetlen vegyületek
 5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
Javító vizsga követelményei kémia tantárgyból augusztus osztály
 Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
8. Előadás Karbonsavak. Karbonsav származékok.
 8. Előadás Karbonsavak. Karbonsav származékok. 24. Karbonsavak α H X H H X N karbonsav nitril X Név F, Br, l halogénsav H hidroxisav oxosav NH 2 aminosav X Név F, Br, l savhaloid R észter R anhidrid NH
8. Előadás Karbonsavak. Karbonsav származékok. 24. Karbonsavak α H X H H X N karbonsav nitril X Név F, Br, l halogénsav H hidroxisav oxosav NH 2 aminosav X Név F, Br, l savhaloid R észter R anhidrid NH
2. Szénhidrogén elegy, amely nem színteleníti el a brómos vizet: A. CH4 és C2H4 B. C2H6 és C2H2. E. C2H4 és C2H2. D. CH4 és C2H6
 1. Szerves vegyület, amely kovalens és ionos kötéseket is tartalmaz: A. terc-butil-jodid B. nátrium-palmitát C. dioleo-palmitin D. szalicilsav E. benzil-klorid 2. Szénhidrogén elegy, amely nem színteleníti
1. Szerves vegyület, amely kovalens és ionos kötéseket is tartalmaz: A. terc-butil-jodid B. nátrium-palmitát C. dioleo-palmitin D. szalicilsav E. benzil-klorid 2. Szénhidrogén elegy, amely nem színteleníti
Halogénezett szénhidrogének
 Halogénezett szénhidrogének - Jellemző kötés (funkciós csoport): X X = halogén, F, l, Br, I - soportosítás: - halogénatom(ok) minősége szerint (X = F, l, Br, I) - halogénatom(ok) száma szerint (egy-, két-
Halogénezett szénhidrogének - Jellemző kötés (funkciós csoport): X X = halogén, F, l, Br, I - soportosítás: - halogénatom(ok) minősége szerint (X = F, l, Br, I) - halogénatom(ok) száma szerint (egy-, két-
8. Előadás. Karbonsavak. Karbonsav származékok.
 8. Előadás Karbonsavak. Karbonsav származékok. 24. Karbonsavak α H X H H X N karbonsav nitril X Név F, Br, l halogénsav H hidroxisav oxosav NH 2 aminosav X Név F, Br, l savhaloid R észter R anhidrid NH
8. Előadás Karbonsavak. Karbonsav származékok. 24. Karbonsavak α H X H H X N karbonsav nitril X Név F, Br, l halogénsav H hidroxisav oxosav NH 2 aminosav X Név F, Br, l savhaloid R észter R anhidrid NH
SZERVES KÉMIAI REAKCIÓEGYENLETEK
 SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2000
 Megoldás 000. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 000 JAVÍTÁSI ÚTMUTATÓ I. A NITROGÉN ÉS SZERVES VEGYÜLETEI s s p 3 molekulák között gyenge kölcsönhatás van, ezért alacsony olvadás- és
Megoldás 000. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 000 JAVÍTÁSI ÚTMUTATÓ I. A NITROGÉN ÉS SZERVES VEGYÜLETEI s s p 3 molekulák között gyenge kölcsönhatás van, ezért alacsony olvadás- és
Helyettesített Szénhidrogének
 elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
Szerves vegyületek nevezéktana
 A main metódusnak mindig van egy paramétere az args, amely a parancssorban megadott argumentumokat tartalmazza szöveges formában. Az argumentumok számát az args tömb length metódusa segítségével lehet
A main metódusnak mindig van egy paramétere az args, amely a parancssorban megadott argumentumokat tartalmazza szöveges formában. Az argumentumok számát az args tömb length metódusa segítségével lehet
1. Önkéntes felmérő (60 perc)
 1. Önkéntes felmérő (60 perc) 2. Időpont: 2016 április 4 A. csoport 10:20 perc B. csoport 11:40 perc 3. Jelentkezés: 2016 március 31 éjfélig email: Dókus Levente dokuslevente@gmail.com 4. Mindenki visszaigazolást
1. Önkéntes felmérő (60 perc) 2. Időpont: 2016 április 4 A. csoport 10:20 perc B. csoport 11:40 perc 3. Jelentkezés: 2016 március 31 éjfélig email: Dókus Levente dokuslevente@gmail.com 4. Mindenki visszaigazolást
Aldehidek, ketonok és kinonok
 Aldehidek, ketonok és kinonok 3 3 3 innamomum camphora Agócs Attila rvosi Kémia 2018 kámfor Tanulási célok: Az oxovegyületek elnevezése és fizikai tulajdonságai Nukleofil addíció, az oxovegyületek legfontosabb
Aldehidek, ketonok és kinonok 3 3 3 innamomum camphora Agócs Attila rvosi Kémia 2018 kámfor Tanulási célok: Az oxovegyületek elnevezése és fizikai tulajdonságai Nukleofil addíció, az oxovegyületek legfontosabb
2004.március A magyarországi HPV lista OECD ajánlás szerint 1/6. mennyiség * mennyiség* kategória ** (Use pattern)
 2004.március A magyarországi HPV lista OECD ajánlás szerint 1/6 1 74-86-2 Acetilén Disszugáz 2 107-13-1 Akrilnitril 2-propénnitril Zárt rendszerben használva 3 7664-41-7 Ammónia 1A Nem izolált intermedierek
2004.március A magyarországi HPV lista OECD ajánlás szerint 1/6 1 74-86-2 Acetilén Disszugáz 2 107-13-1 Akrilnitril 2-propénnitril Zárt rendszerben használva 3 7664-41-7 Ammónia 1A Nem izolált intermedierek
Fémorganikus vegyületek
 Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
RÉSZLETEZŐ OKIRAT (2) a NAH /2017 nyilvántartási számú akkreditált státuszhoz
 RÉSZLETEZŐ OKIRAT (2) a NAH-1-1720/2017 nyilvántartási számú akkreditált státuszhoz 1) Az akkreditált szervezet neve és címe: GREEN-PARK 2000 Kft. Környezet-analitikai Laboratórium 1 (3527 Miskolc, József
RÉSZLETEZŐ OKIRAT (2) a NAH-1-1720/2017 nyilvántartási számú akkreditált státuszhoz 1) Az akkreditált szervezet neve és címe: GREEN-PARK 2000 Kft. Környezet-analitikai Laboratórium 1 (3527 Miskolc, József
Laboratóriumi technikus laboratóriumi technikus Drog és toxikológiai
 A 10/2007 (II. 27.) SzMM rendelettel módosított 1/2006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
A 10/2007 (II. 27.) SzMM rendelettel módosított 1/2006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban
 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
A tételek: Elméleti témakörök. Általános kémia
 A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
Összefoglaló előadás. Sav-bázis elmélet
 Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz
 Budapesti Műszaki és Gazdaságtudományi Egyetem Vegyészmérnöki és Biomérnöki Kar Szerves Kémia és Technológia Tanszék MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz Készítette: Kormos Attila Lektorálta:
Budapesti Műszaki és Gazdaságtudományi Egyetem Vegyészmérnöki és Biomérnöki Kar Szerves Kémia és Technológia Tanszék MECHANIZMUSGYŰJTEMÉNY a Szerves kémia I. előadáshoz Készítette: Kormos Attila Lektorálta:
Név: Pontszám: 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban
 1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
1. feladat (3 pont) Írjon példát olyan aminosav-párokra, amelyek részt vehetnek a következő kölcsönhatásokban a, diszulfidhíd (1 példa), b, hidrogénkötés (2 példa), c, töltés-töltés kölcsönhatás (2 példa)!
6. változat. 3. Jelöld meg a nem molekuláris szerkezetű anyagot! A SO 2 ; Б C 6 H 12 O 6 ; В NaBr; Г CO 2.
 6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
Toluol (Bruckner II/1 476) µ= 0.33 Debye
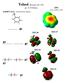 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
Új oxo-hidas vas(iii)komplexeket állítottunk elő az 1,4-di-(2 -piridil)aminoftalazin (1, PAP) ligandum felhasználásával. 1; PAP
 Új oxo-hidas vas(iii)komplexeket állítottunk elő az 1,4-di-(2 -piridil)aminoftalazin (1, PAP) ligandum felhasználásával. H 1; PAP H FeCl 2 és PAP reakciója metanolban oxigén atmoszférában Fe 2 (PAP)( -OMe)
Új oxo-hidas vas(iii)komplexeket állítottunk elő az 1,4-di-(2 -piridil)aminoftalazin (1, PAP) ligandum felhasználásával. H 1; PAP H FeCl 2 és PAP reakciója metanolban oxigén atmoszférában Fe 2 (PAP)( -OMe)
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
CH 2 =CH-CH 2 -S-S-CH 2 -CH=CH 2
 10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
Budapest, június 15. Dr. Hornyánszky Gábor egyetemi docens
 SZERVES KÉMIA BIOMÉRNÖKÖKNEK B.Sc. képzés, kód: BMEVESZA204 Tantárgy követelményei 2016/2017 tanév I. félév A tárgy heti előadásból és 2 óra tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul.
SZERVES KÉMIA BIOMÉRNÖKÖKNEK B.Sc. képzés, kód: BMEVESZA204 Tantárgy követelményei 2016/2017 tanév I. félév A tárgy heti előadásból és 2 óra tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul.
HALOGÉNEZETT SZÉNHIDROGÉNEK
 ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
6. melléklet a 4/2011. (I. 14.) VM rendelethez
 Általános technológiai kibocsátási határértékek 1. kibocsátási határérték tüzelési és termikus (a levegőből tényleges oxigén-elvonás történik) technológiáknál - ha jogszabály vagy hatósági határozat másként
Általános technológiai kibocsátási határértékek 1. kibocsátási határérték tüzelési és termikus (a levegőből tényleges oxigén-elvonás történik) technológiáknál - ha jogszabály vagy hatósági határozat másként
Kémia fogorvostan hallgatóknak Munkafüzet 12. hét
 Kémia fogorvostan hallgatóknak Munkafüzet 12. hét Szerves anyagok vizsgálata I. (167-174. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás, Nagy Veronika, Radó-Turcsi
Kémia fogorvostan hallgatóknak Munkafüzet 12. hét Szerves anyagok vizsgálata I. (167-174. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás, Nagy Veronika, Radó-Turcsi
Eredményes vizsga esetén a tárggyal 5 kreditpont szerezhető. A félév csak aláírással zárul, ha
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2018/2019 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2018/2019 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
a NAT /2012 nyilvántartási számú akkreditált státuszhoz
 Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a NAT-1-1702/2012 nyilvántartási számú akkreditált státuszhoz A QC-five Analitika Kft. (1116 Budapest, Fehérvári út 144., Csarnok II. 12. sz.) akkreditált
Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a NAT-1-1702/2012 nyilvántartási számú akkreditált státuszhoz A QC-five Analitika Kft. (1116 Budapest, Fehérvári út 144., Csarnok II. 12. sz.) akkreditált
Kémia fogorvostan hallgatóknak Munkafüzet 14. hét
 Kémia fogorvostan hallgatóknak Munkafüzet 14. hét Szerves anyagok vizsgálata III. (177-180. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás, Nagy Veronika, Radó-Turcsi
Kémia fogorvostan hallgatóknak Munkafüzet 14. hét Szerves anyagok vizsgálata III. (177-180. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás, Nagy Veronika, Radó-Turcsi
OXOVEGYÜLETEK. Levezetés. Elnevezés O CH 2. O R C H aldehid. O R C R' keton. Aldehidek. propán. karbaldehid CH 3 CH 2 CH 2 CH O. butánal butiraldehid
 XVEGYÜLETEK Levezetés 2 aldehid ' keton Elnevezés Aldehidek propán karbaldehid 3 2 2 butánal butiraldehid oxo karbonil formil Példák 3 3 2 metanal etanal propanal formaldehid acetaldehid propionaldehid
XVEGYÜLETEK Levezetés 2 aldehid ' keton Elnevezés Aldehidek propán karbaldehid 3 2 2 butánal butiraldehid oxo karbonil formil Példák 3 3 2 metanal etanal propanal formaldehid acetaldehid propionaldehid
Eredményes vizsga esetén a tárggyal 5 kreditpont szerezhető. A félév csak aláírással zárul, ha
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2017/2018 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2017/2018 tanév I. félév Az alaptárgy heti 3 óra előadásból és heti 2
Orvosi Kémia Munkafüzet 13. hét
 Orvosi Kémia Munkafüzet 13. hét Szerves anyagok vizsgálata II. (168-176. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás, Nagy Veronika, Radó-Turcsi Erika, Takátsy Anikó
Orvosi Kémia Munkafüzet 13. hét Szerves anyagok vizsgálata II. (168-176. o.) Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus Péter, Lóránd Tamás, Nagy Veronika, Radó-Turcsi Erika, Takátsy Anikó
Győr-Moson-Sopron Megyei Kormányhivatal Népegészségügyi Főosztály Laboratóriumi Osztály TEFONAZ Laboratórium 9024 Győr, Jósika u. 16.
 Foglalkozás egészségügyi akkreditált vizsgálatok listája Klórozott alifás szénhidrogének: 1,1-diklór-etán, 1,2-diklór-etán, diklór-metán, kloroform, szén-tetraklorid, tetraklór-etilén, 1,1,1-triklór-etán,
Foglalkozás egészségügyi akkreditált vizsgálatok listája Klórozott alifás szénhidrogének: 1,1-diklór-etán, 1,2-diklór-etán, diklór-metán, kloroform, szén-tetraklorid, tetraklór-etilén, 1,1,1-triklór-etán,
Budapest, szeptember 6. Dr. Huszthy Péter egyetemi tanár
 SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESKA202 és BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2016/2017 tanév I. félév Az alaptárgy heti 3 óra előadásból
SZERVES KÉMIA I. B.Sc. képzés, kód: BMEVESKA202 és BMEVESZA301 Válogatott fejezetek a szerves kémiából I., kód: BMEVESKA002 Tantárgy követelményei 2016/2017 tanév I. félév Az alaptárgy heti 3 óra előadásból
MÓDOSÍTOTT RÉSZLETEZŐ OKIRAT (1) a NAH /2016 nyilvántartási számú akkreditált státuszhoz
 MÓDOSÍTOTT RÉSZLETEZŐ OKIRAT (1) a NAH-1-1790/2016 nyilvántartási számú akkreditált státuszhoz Az Országos Közegészségügyi Intézet Munkahigiénés és Foglalkozás-egészségügyi Igazgatóság Kémiai, Zaj-, Rezgés-
MÓDOSÍTOTT RÉSZLETEZŐ OKIRAT (1) a NAH-1-1790/2016 nyilvántartási számú akkreditált státuszhoz Az Országos Közegészségügyi Intézet Munkahigiénés és Foglalkozás-egészségügyi Igazgatóság Kémiai, Zaj-, Rezgés-
R R C X C X R R X + C H R CH CH R H + BH 2 + Eliminációs reakciók
 Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Név: Pontszám: / 3 pont. 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét!
 Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét! Név: Pontszám: / 4 pont 2. feladat Az ábrán látható vegyületnek a) hány sztereoizomerje, b) hány enantiomerje van?
Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét! Név: Pontszám: / 4 pont 2. feladat Az ábrán látható vegyületnek a) hány sztereoizomerje, b) hány enantiomerje van?
6. Monoklór származékok száma, amelyek a propán klórozásával keletkeznek: A. kettő B. három C. négy D. öt E. egy
 1. Szerves vegyület, amely kovalens és ionos kötéseket is tartalmaz: A. terc-butil-jodid B. nátrium-palmitát C. dioleo-palmitin D. szalicilsav E. benzil-klorid 2. Szénhidrogén elegy, amely nem színteleníti
1. Szerves vegyület, amely kovalens és ionos kötéseket is tartalmaz: A. terc-butil-jodid B. nátrium-palmitát C. dioleo-palmitin D. szalicilsav E. benzil-klorid 2. Szénhidrogén elegy, amely nem színteleníti
Alkánok összefoglalás
 Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
Kémiai tantárgy középszintű érettségi témakörei
 Kémiai tantárgy középszintű érettségi témakörei Csongrádi Batsányi János Gimnázium, Szakgimnázium és Kollégium Összeállította: Baricsné Kapus Éva, Tábori Levente 1) témakör Mendgyelejev féle periódusos
Kémiai tantárgy középszintű érettségi témakörei Csongrádi Batsányi János Gimnázium, Szakgimnázium és Kollégium Összeállította: Baricsné Kapus Éva, Tábori Levente 1) témakör Mendgyelejev féle periódusos
Fémorganikus kémia 1
 Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
SZERVES KÉMIA biomérnököknek B.Sc. képzés, kód: BMEVESZA204 Tantárgy követelményei 2017/2018 tanév II. félév
 SZERVES KÉMIA biomérnököknek B.Sc. képzés, kód: BMEVESZA204 Tantárgy követelményei 2017/2018 tanév II. félév A tárgy heti előadásból és 2 óra tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul.
SZERVES KÉMIA biomérnököknek B.Sc. képzés, kód: BMEVESZA204 Tantárgy követelményei 2017/2018 tanév II. félév A tárgy heti előadásból és 2 óra tantermi gyakorlatból áll. A tárgy szóbeli vizsgával zárul.
Kémia OKTV I. kategória II. forduló A feladatok megoldása
 ktatási ivatal Kémia KTV I. kategória 2008-2009. II. forduló A feladatok megoldása I. FELADATSR 1. A 6. E 11. A 16. C 2. A 7. C 12. D 17. B 3. E 8. D 13. A 18. C 4. D 9. C 14. B 19. C 5. B 10. E 15. E
ktatási ivatal Kémia KTV I. kategória 2008-2009. II. forduló A feladatok megoldása I. FELADATSR 1. A 6. E 11. A 16. C 2. A 7. C 12. D 17. B 3. E 8. D 13. A 18. C 4. D 9. C 14. B 19. C 5. B 10. E 15. E
10/2000. (VI. 2.) KÖM-EÜM-FVM-KHVM EGYÜTTES RENDELET A FELSZÍN ALATTI VÍZ ÉS A FÖLDTANI KÖZEG MINŐSÉGI VÉDELMÉHEZ SZÜKSÉGES HATÁRÉRTÉKEKRŐL
 10/2000. (VI. 2.) KÖM-EÜM-FVM-KHVM EGYÜTTES RENDELET A FELSZÍN ALATTI VÍZ ÉS A FÖLDTANI KÖZEG MINŐSÉGI VÉDELMÉHEZ SZÜKSÉGES HATÁRÉRTÉKEKRŐL A felszín alatti víz és a földtani közeg minőségi védelme, a
10/2000. (VI. 2.) KÖM-EÜM-FVM-KHVM EGYÜTTES RENDELET A FELSZÍN ALATTI VÍZ ÉS A FÖLDTANI KÖZEG MINŐSÉGI VÉDELMÉHEZ SZÜKSÉGES HATÁRÉRTÉKEKRŐL A felszín alatti víz és a földtani közeg minőségi védelme, a
A szén molekulaképző sajátságai. Kémia 1 Szerves kémia. A szerves kémiai reakciók jellege. Szerves kémiai reakciók felosztása
 Kémia 1 Szerves kémia Tárgya: a szénvegyületek szerkezetének, tulajdonságainak és átalakulásainak a vizsgálata. A szerves vegyületek összetételükben és kémiai viselkedésükben jelentősen eltérnek a szervetlen
Kémia 1 Szerves kémia Tárgya: a szénvegyületek szerkezetének, tulajdonságainak és átalakulásainak a vizsgálata. A szerves vegyületek összetételükben és kémiai viselkedésükben jelentősen eltérnek a szervetlen
RÉSZLETEZŐ OKIRAT (1) a NAH /2018 nyilvántartási számú akkreditált státuszhoz
 RÉSZLETEZŐ OKIRAT (1) a NAH-1-1217/2018 nyilvántartási számú akkreditált státuszhoz 1) Az akkreditált szervezet neve és címe: Vízkutató VÍZKÉMIA KFT. Vizsgálólaboratóriuma 1026 Budapest, Szilágyi Erzsébet
RÉSZLETEZŐ OKIRAT (1) a NAH-1-1217/2018 nyilvántartási számú akkreditált státuszhoz 1) Az akkreditált szervezet neve és címe: Vízkutató VÍZKÉMIA KFT. Vizsgálólaboratóriuma 1026 Budapest, Szilágyi Erzsébet
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2014. április 25. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét!
Szerves Kémiai Problémamegoldó Verseny 2014. április 25. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét!
1. KARBONILCSOPORTOT TARTALMAZÓ VEGYÜLETEK
 1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
1. KARBILSPRTT TARTALMAZÓ VEGYÜLETEK 1.1. A karbonilcsoport szerkezete A szénsav acilcsoportja a karbonilcsoport: vagy 1. ábra: A karbonilcsoport A karbonilcsoport az alábbi vegyületcsaládokban fordul
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
10. Előadás. Heterociklusos vegyületek.
 0. Előadás eterociklusos vegyületek. ETECIKLUSS VEGYÜLETEK Felosztás:. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
0. Előadás eterociklusos vegyületek. ETECIKLUSS VEGYÜLETEK Felosztás:. telített telítetlen. heteroatomok száma 3. gyűrűk száma. heteroatomok milyensége (,, S, P, As, Si) oxa- S tia- aza- I. Monociklusos,
1. mintatétel. A) Elektrolízis vizes oldatokban
 1. mintatétel A) Elektrolízis vizes oldatokban Értelmezze az egyes elektródokon bekövetkező kémiai változásokat az alábbi oldatok, grafit elektródok között végzett elektrolízise esetén: réz(ii)-szulfát-
1. mintatétel A) Elektrolízis vizes oldatokban Értelmezze az egyes elektródokon bekövetkező kémiai változásokat az alábbi oldatok, grafit elektródok között végzett elektrolízise esetén: réz(ii)-szulfát-
H 3 C H + H 3 C C CH 3 -HX X 2
 1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
1 Gyökös szubsztitúciók (láncreakciók gázfázisban) - 3 2 2 3 2 3-3 3 Szekunder gyök 3 2 2 2 3 2 2 3 3 2 3 3 Szekunder gyök A propánban az azonos strukturális helyzetű hidrogének és a szekunder hidrogének
Nemzeti Akkreditáló Testület. RÉSZLETEZŐ OKIRAT a NAT /2014 nyilvántartási számú akkreditált státuszhoz
 Nemzeti Akkreditáló Testület RÉSZLETEZŐ OKIRAT a NAT-1-1217/2014 nyilvántartási számú akkreditált státuszhoz A Vízkutató VÍZKÉMIA KFT. Vizsgálólaboratóriuma (1026 Budapest, Szilágyi Erzsébet fasor 43/b.)
Nemzeti Akkreditáló Testület RÉSZLETEZŐ OKIRAT a NAT-1-1217/2014 nyilvántartási számú akkreditált státuszhoz A Vízkutató VÍZKÉMIA KFT. Vizsgálólaboratóriuma (1026 Budapest, Szilágyi Erzsébet fasor 43/b.)
IX. Szénhidrátok - (Polihidroxi-aldehidek és ketonok)
 IX Szénhidrátok - (Polihidroxi-aldehidek és ketonok) A szénhidrátok polihidroxi-aldehidek, polihidroxi-ketonok vagy olyan vegyületek, amelyek hidrolízisekor az előbbi vegyületek keletkeznek Növényi és
IX Szénhidrátok - (Polihidroxi-aldehidek és ketonok) A szénhidrátok polihidroxi-aldehidek, polihidroxi-ketonok vagy olyan vegyületek, amelyek hidrolízisekor az előbbi vegyületek keletkeznek Növényi és
IV. Elektrofil addíció
 IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
IV. Elektrofil addíció Szerves molekulákban a kettős kötés kimutatására ismert analitikai módszer a 2 -os vagy a KMnO 4 -os reakció. 2 2 Mi történik tehát a brómmolekula addíciója során? 2 2 ciklusos bromónium
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Minta feladatsor. Az ion neve. Az ion képlete O 4. Szulfátion O 3. Alumíniumion S 2 CHH 3 COO. Króm(III)ion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
