PROTEOMIKA Darula Zsuzsa, Gulyás Éva, Klement Éva és Medzihradszky-Fölkl Katalin 1
|
|
|
- Laura Hajdu
- 10 évvel ezelőtt
- Látták:
Átírás
1 PROTEOMIKA Darula Zsuzsa, Gulyás Éva, Klement Éva és Medzihradszky-Fölkl Katalin 1 Napjainkig a tudományos kutatás általában úgy folyt, hogy a kutatók felállítottak egy hipotézist, ennek alapján kísérleteket terveztek, amelyek eredményei a hipotézis bizonyítékát vagy cáfolatát szolgáltatták. Manapság gyakrabban folytatunk ún. rendszer-biológiai vagy az angol kifejezés tükörfordításával élve felfedezések-hajtotta kutatást. Persze ilyesmi régebben is létezett, hiszen a hipotézisek kialakításához szükség volt előzetes megfigyelésekre, adatokra. A különbség az, hogy most tudatosan próbálunk nagy mennyiségű kvalitatív és kvantitatív adatot gyűjteni egy adott rendszerről alapállapotban (kontroll) és különböző egyéb helyzetekben pl. stimulánsok hatása után, vagy stressz helyzetben, vagy meghibásodás esetén azaz betegségek során stb., továbbá, hogy az adatok feldolgozása nem csupán egy jó megfigyelő-képességű egyén agyában zajlik, hanem megfelelő informatikai infrastruktúra (hardver és szoftver) segítségével. A humán genom szekvenálása volt a legjelentősebb az úttörő-jellegű nagy volumenű és nem hipotézisen alapuló projektek közül. Hatalmas elvárásokkal indult ez az akkor éveket igénybevevő, nemzetközi összefogást igénylő munka. Joggal (és naivan) hittük, hogy a teljes genom szekvenciával kezünkbe kapjuk a kulcsot az emberiség sokszínűségéhez, megértjük majd a különbséget egészség és betegség között stb. Bizonyos csalódással kellett tudomásul vennünk, hogy nem így van, hogy nem ennyire egyszerű a dolog. A kutatás azóta is folyik, hogy minél több információt kicsikarjunk az összegyűjtött genetikai adatokból, de közben más területeken is megindult a hasonló, nagy volumenű eredeti adatfelhalmozás. A genom-szekvenálás egyik hatalmas eredményeképp a fehérje-adatbázisok feldagadtak. Fehérjéink szekvenciája ott rejlik genetikai kódunkban. A lefordítás nem teljesen egyértelmű de ennek magyarázata túlmutat ezen a fejezeten a lényeg annyi, a genom szekvenálás eredményeképp rengeteg lehetséges fehérje szekvenciája jelent meg az adatbázisokban. Csak éppen azt nem lehetett tudni ezekből az adatokból, megszintetizálja-e szervezetünk valaha is ezeket a fehérjéket. És ha igen, mikor, mennyit és milyen formában. 1 MTA SzBK Proteomikai Kutatócsoport 1
2 Mindenekelőtt tisztázzuk az alapfogalmakat. ( A fehérjék többnyire húszféle, ún. fehérje-alkotó aminosavból épülnek fel. Egy aminosav általános képlete NH 2 -CH(R)-COOH. Precízebben L α-aminosavakról van szó. A görög betű azt jelzi, hogy az aminocsoport a főfunkciónak tekintett karboxil-csoporthoz közvetlenül kapcsolódó szénatomon van. Ugyanehhez a szénatomhoz kapcsolódik az aminosavat azonosító oldallánc (R). Miután egy szénatomhoz négyféle különböző csoport kapcsolódik (a glicin kivételével), és ez az elhelyezkedés tetraéderes, ennek az a következménye, hogy ezen vegyületek két változatban léteznek, egymás tükörképi párjaként. Úgy mondjuk, hogy optikai izomerek. Szervezetünk a két variációból csak az egyiket hasznosítja, ezt jelzi az L betű. A fehérjékben az aminosavak ún. peptidkötéssel kapcsolódnak egymáshoz: NH 2 -CHR1-CO-NH-CHR2-CO-...NH-CHRn-COOH. Konvenció szerint mindig a szabad aminocsoport, azaz az amino- vagy N-terminus felől kezdjük leírni az aminosavak sorrendjét, azaz szekvenciáját. A jobb oldalon lévő véget, karboxi- vagy C-terminálisnak nevezzük. Az aminosavak megfelelő (hírvivő azaz messenger RNS által közvetített) sorrendben való összekapcsolása az ún. transzláció. Már az aminosav-lánc kiépítése közben, de főképp utána, kémiai változások történhetnek a fehérjékkel: pl. a láncot egy másik fehérje (enzim) darabokra hasíthatja, vagy egy kémiailag aktív oldalláncra valami módosító csoportot pakolhat. Ezek az ún. poszt-transzlációs módosítások. Szerepük sokféle lehet bizonyos enzimek, hormonok aktivitásához az kell, hogy elveszítsék szekvenciájuk egy részét; a jelátvitelhez foszfát-csoportokat kell egy fehérje adott oldalláncára helyezni, majd amikor betöltötte funkcióját, el kell távolítani; vannak fehérjék, amiket oldallánc-módosító zsírsav- horgony rögzít a sejtmembránhoz stb. Tehát az analitikus feladata az, határozza meg, milyen fehérjék vannak jelen egy fehérjekomplexben, vagy egy sejt organellumban, vagy akár egy teljes sejtben. Aztán, ha ezt kiderítette, mondja meg azt is, milyen módosítások estek meg ezzel a fehérjével, és lehetőleg kvantitatív választ is adjon mindezekre a kérdésekre. Igen ám, de hogyan? Fehérjéket régen is analizáltunk. Ha az aminosav sorrendre voltunk kiváncsiak, kémiai reakcióhoz folyamodtunk, pontosabban olyan reakció-sorozathoz, ami megjelölte az N-terminális aminosavat, aztán lehasította, azonosította, és utána kezdte a folyamatot elölről az immáron új terminális aminosavval. Ezt hívják Edman-degradációnak, vagy Edman szekvenálásnak. Elég sok (>10 pmól) és egységes anyag kell hozzá, nem működik olyan fehérjékre, ahol az N-terminális módosítva van (a blokkolt vég 2
3 meglehetősen gyakori). ( Immunreakción alapuló detektálással (ún. Western blot; szintén azonosíthatunk fehérjéket. Ez többnyire nagyon specifikus, és rendkívül kevés fehérjét is detektál. Csak az a bibi, hogy előre tudnunk kell, mit keresünk. A megoldást a modern tömegspektrometria szolgáltatta. ( A cél: molekulák szerkezetének meghatározása tömegmérés alapján. Ehhez először meg kell határozni a teljes molekula tömegét minél pontosabban. Aztán valahogy darabokra kell törni a molekulát, és a darabok tömegét is meg kell mérni. Ha ismert szerkezetű molekulákkal kezdünk, kitalálhatjuk a fragmentálódás szabályait, és a tanultakat alkalmazhatjuk ismeretlen molekulákra. Mérleg híján egyéb fizikai eszközöket kell alkalmaznunk. Ionok jól terelgethetőek elektromos és mágneses térben tehát szortírozhatóak és mérhetőek. Tehát a mérendő molekulákat ionizálni kell (nagy vákuumban, hogy ne veszítsük el az ionokat a levegő alkotóival való ütközések során). Nem térhetek ki a technikai részletekre, ez megint egy külön fejezet lenne ( A lényeg az, hogy fehérjék, vagy fehérje-darabkák, ún. peptidek ionizációjára az ún. electrospray (elektro-porlasztás) a legalkalmasabb. Nobel díjas feltalálójának, John Fenn-nek a régóta használt festékszóró adta az ötletet: szűk kapillárisban áramlik a vizsgálandó oldat, a kapillárison néhány kv feszültség, a tömegspektrométer bemeneti nyílása pár milliméterre van, leföldelve, a potenciálkülönbségnek hála többszörösen töltött cseppecskék képződnek, amikről a rövid úton (amíg elérik az ajtót ) lehámozódnak az oldószer-molekulák, és a készülékbe már a többszörösen töltött peptid-ionok lépnek. A fehérjékben bőven akad bázikus csoport, a használt oldószer rendszerint tartalmaz egy kevés savat, így rendszerint egyszeresen vagy többszörösen protonált ionokat tanulmányozunk. A tömegspektrométer megfelelő fizikai megoldásokkal tömeg/töltés (m/z) arány alapján válogatja szét az ionokat. A legegyszerűbben megmagyarázható megoldás a repülési idő mérése. A belépő ionokat egy elektród az eredeti repülési irányra merőlegesen kilöki és a repülési cső végén detektáljuk a beérkező ionokat. Miután minden iont ugyanakkora feszültséggel lökünk ki, minél nehezebb egy ion, annál kisebb sebességre tesz szert, azaz lassabban repül. Minél több töltés van egy adott tömegű ionon, annál sebesebben ér célba. Az óra abban a pillanatban indul, amikor az ionokat meglöki az elektród. Modern 3
4 technikával már pár nanosecundum (10-9 másodperc) időkülönbséget is detektálni tudunk. Az ionok útja elég kurta (mondjuk 1-2 m), és általában m/z 2000 a méréshatár. Miután m/z alapján szortírozunk, ha elég sok protont képes egy molekula felvenni, akkor akár egy 100 kda-os molekula is belefér ebbe a mérés-tartományba (Da = Dalton, a tömegmérés egysége. A szén 12-es izotópjának a tömege Da vagy amu, azaz atomi tömeg-egység). Hogy is néz ki egy tömegspektrum? Míg kémiai reakciókban az izotópok keverékével dolgozunk és számolunk, addig a tömegspektrometriában ezek az izotópok láthatóvá lesznek. Tegyük fel, hogy sósavat mérnénk tömegspektrometriával. Mindenki tudja, a hidrogén-klorid összetétele HCl, molekulatömege De ilyen tömegű iont hiába is keresnénk a tömegspektrumában! Két csúcsot fogunk látni: 1. ábra. Hidrogén-klorid izotóp-eloszlása (elméleti tömegspektruma) Ugyanis a klórnak van egy 35-ös és egy 37-es izotópja, és ezek előfordulási aránya 3:1. A fehérjéket alkotó elemek, C, H, N, O, S, közül csak a kénnek van jelentős mennyiségű természetes izotópja, a 34 S kb.4 %-ban fordul elő. Úgy gondolná tehát az ember, hogy nemigen kell figyelmet fordítanunk az izotópokra, hiszen csak két kén-tartalmú fehérje-alkotó aminosav létezik (metionin, cisztein) és ezek sem olyan gyakoriak, a következő leggyakoribb fehérje-alkotó izotóp pedig a 13 C 1.1%-os előfordulási aránnyal. Mit számít az? Hát bizony sokat! Miért is? Hát szénből bizony bőven akad egy peptidben vagy fehérjében, és minél több szénatomunk van, annál bizonyosabb, hogy akad közöttük a nehezebb izotópból egy fehérjében eltörpül a csupán 12 C-t tartalmazó csúcs: 4
5 2. ábra. Elméleti izotóp-eloszlás A többi fehérje-alkotó elem stabil izotópjainak előfordulási aránya sokkal alacsonyabb: 2 H %, 15 N %, 17 O %, 18 O - 0.2%. Tehát, amikor egy peptid spektrumában detektáljuk az izotóp-csúcsokat, azokért elsősorban a jelenlevő nagyszámú szénatom a felelős, de azért hozzájárulnak 5
6 egy kicsit a többiek is. Mi ennek a következménye? Először is, a csúcs-sorozatban csak a legeslegelső (nem a legintenzívebb!) ion homogén, azaz minden elemből csak egyfajta izotóp lehet jelen, ezért is nevezzük monoizotópos ionnak. Amennyiben az izotópokat el tudjuk a mérés során különíteni (úgy mondjuk, elegendő a felbontás), akkor mindig a monoizotópos tömeget határozzuk meg, mert ezt tudjuk a legpontosabban mérni, hiszen az összes többi ion keverék, és a különböző izotóp-csúcsok a felbontás függvényében átfedve, de kissé esetleg már szétválva nem annyira pontosan mérhetőek). 3. ábra. Peptid molekula-ionja, nagy és kis felbontással mérve. Monoizotópos és átlagtömeg. A másik következmény az, hogy az izotópcsúcsok közötti tömegkülönbségből meg tudjuk mondani, hány töltés volt az ionon. Hogy is van ez? Az egyszeresen töltött ion (MH + ) izotópjai között kb. 1 Da különbség van. A kétszeresen töltött ion (MH 2+ 2 ) izotópjai egymástól már csak 0.5 Da-ra vannak (ne feledjük, m/z alapján szortírozunk!), a háromszorosan töltött ionoknál a különbség 0.33 Da-ra csökken és így tovább. Tehát tulajdonképp csak le kell számolnunk, hány izotópcsúcs jut 1 Da-ra, és megvan a töltésszám! Egy molekula többféle töltésállapotban is megjelenhet. Alacsony felbontású tömegspektrometriánál (amikor az izotópcsúcsok összeszorulnak, és csak egy befoglaló csúcsot látunk), saccolnunk kell a mért tömeg-sorozatból, ha ilyesmire gyanakszunk, vagy meg kell oldanunk egy kétismeretlenes egyenletrendszert. Mondjuk, hogy a spektrumban két csúcs jelent meg és arra gyanakszunk, hogy ezek összetartoznak. Ha az alábbi spektrumban nem lennének a piros számok, akkor csak annyit tudhatnánk, hogy ha az m/z n töltést visel, akkor m/z 1019 n+1 töltéssel kell, hogy rendelkezzen. Miután a töltések száma a begyűjtött protonokat is jelenti, a következő egyenletrendszerrel 6
7 kell dolgoznunk, ha a töltések számát és a semleges molekulatömeget is szeretnénk kitalálni : 1019 x (n+1) - (n+1) = MW illetve x n-n= MW. Innen már egyszerű, ugye? Ez a spektrum viszont nagy felbontással készült, a jobb felső sarokban látható az egyik ion klaszter közelebbről. Abból az ábrácskából nyilvánvaló, hogy az m/z 1019 ion 6 töltést visel, és a peptid monoizotópos semleges tömege: (amikor ezt számoltam már nem a kerekített proton-tömeget használtam, hanem a pontosat: a pontos tömegméréseknél így dukál). 4. ábra. Egy nagyobb peptid ESI spektruma. A jobb felső sarokban egy szűkebb tömegtartományt mutatunk be. Mint a fenti példából is látható, nagyobbacska peptidek monoizotópos tömegét is meg tudjuk határozni. Milyen pontosan? A titok: a felbontáson kívül a készülék stabilitásán (rezgés - lásd közeli főút erős kamionforgalma, vagy hőmérséklet-változás - minden tömegspektrometriás laboratórium klimatizált) és a kalibráción múlik a dolog. Jól kiválasztott ismert tömegű mintával állítjuk be a masinát. Ha ezt a mintát külön mérjük, külső kalibrációról beszélünk. Ha a kalibráló anyag (standard) jelen van minden éles minta mérésekor, akkor belső kalibrációt alkalmazunk. A mérések pontosságát pedig a mérendő tömeghez viszonyítva adjuk meg, nem százalékban, hanem milliomod részekben. A legjobb készülékek belső kalibrációval már csupán 1 milliomodrészt tévednek! Azaz a mérés hibája 1 ppm (parts per million). 7
8 Ha egy relatíve kis molekulának mérjük a tömegét ilyen pontosan, akkor elemi összetételét is meghatározhatjuk. De egy adott képlet több kémiai szerkezetet írhat le. Ráadásul az aminosavak elemi összetétele eléggé hasonló. Tegyük fel, hogy a mért MH , és 0.3 ppm pontossággal sikerült meghatároznunk. Még így is 5 különböző elemi összetétele lehet a peptidnek, ami 497 különböző aminosav összetételnek felel meg, és a lehetséges permutációk száma: ( Tehát további információra van szükség, ha szeretnénk egy peptidet azonosítani. Ezt az információt pedig ún. fragmentációs analízissel, vagyis MS/MS kísérlettel szerezhetjük meg. Technikai oldalról az akció tandem tömegspektrometriával valósítható meg. Az első tömeg-analizátor segítségével kiválasztjuk az elegyből a bennünket érdeklő iont, azután a molekulát az ún. ütközési cellában nitrogénnel vagy argonnal ütköztetve (ütközéses aktiválás, collision-induced dissociation = CID) darabokra törjük, és azok a darabok, amelyeken van töltés, mérhetők a második tömeg-analizátorral. Az ütközés(ek) során begyűjtött energia egy része vibrációs energiává alakul, és különböző kötések hasadhatnak, nyilván a gyengébbek előbb szállnak el. Az egyszerűség kedvéért tekintsük úgy, hogy peptidek esetében csak maga a peptid-kötés hasad. Ha a töltés az N-terminális darabon marad, b ionok képződnek, amiket a terminális felől számozunk. Amikor a töltés a C-terminális darabon marad, akkor y fragmensekről beszélünk, ezeket is a megfelelő terminálistól számozzuk. 5. ábra. MS/MS ütközéses aktiválás A peptidek fragmentációja nyilván szekvencia-függő, azonkívül még befolyásolja a folyamatot egy csomó dolog, többek között az is, hogy milyen készüléket használunk, de ebbe talán most ne menjünk 8
9 bele. A lényeg, hogy az aminosav-sorrend alapján egy peptid MS/MS fragmenseinek tömegét kiszámíthatjuk: (azt nem tudjuk megjósolni, mind megjelennek-e, és ha igen, milyen intenzitással, de hát semmi sem tökéletes.) Mire jó ez az egész? Ideális esetben megmérhetjük egy teljes fehérje tömegét. Ha a mért tömeg és a szekvencia alapján számított tömeg stimmel, minden rendben van. Ha különbözik, akkor a különbségből lehet arra következtetni, mi is történt. Mondjuk, ha a tömeg 16 Da-nal nagyobb, könnyen lehet, hogy valamelyik metionin (NH 2 -CH(CH 2 -CH 2 -S-CH 3 )-COOH) oxidálódott. Persze az ilyen gyanút igazolni is kell. Egy fehérjét nem olyan könnyű MS/MS kísérletben megfelelően darabokra törni. Más módszerhez kell folyamodni. Vannak olyan enzimek, amiknek az a dolguk, hogy más fehérjéket feldaraboljanak. Az ilyen ún. proteolitikus enzimek gyakran válogatósak, és csak egy adott aminosav mellett hajlandóak hasítani, és annak is csak egyik oldalán. A leggyakrabban használt enzim, a tripszin a két bázikus aminosav, az arginin (Arg, NH 2 -CH(CH 2 -CH 2 -CH 2 -NHCNH(NH 2 ))-COOH) és a lizin (Lys, NH 2 -CH(CH 2 -CH 2 -CH 2 - CH 2 -NH 2 )-COOH) C-terminálisánál hasít. Tehát, ha egy fehérje aminosav sorrendjét ismerjük, megjósolhatjuk mekkora darabokat kapunk egy triptikus emésztés során. Aztán végre is hajthatjuk az emésztést, és megmérhetjük a darabokat. Egy nagy fehérje sokféle darabot produkálhat, ezért a komponenseket igyekszünk szétválasztani. Peptidekre rendszerint ún. fordított fázisú kromatográfiát használunk. A peptidek vizes oldatát egy olyan oszlopra injektáljuk, amely hosszú szénláncokkal borított gyöngyökkel van töltve. A peptidek ragadnak ezekhez a láncokhoz. Egy darabig mosogatjuk a gyöngyöket vízzel, hogy megszabaduljunk az emésztés során használt sóktól. Aztán lassan, egyenletesen szerves oldószert keverünk az oldatba, amely átfolyik az oszlopon, és a peptidek lassan eleresztik az oszlopot. A poláros peptidek jönnek le először. Könnyen belátható, hogy ez a szeparálás remekül kapcsolható a tömegspektrometriával. Az oszlopról lejövő oldatot vezetjük be az electrospray kapillárisba, és szépen megmérjük az érkező peptideket. Tudjuk, milyen tömegeket várunk. Amelyik nem található a megjósolt peptid-sorozatban, ott történt valami. Hogy a fenti példánál maradjunk, ha valóban egy metionin oxidáció történt, akkor egy metionint tartalmazó peptid tömege 16 Da-nal magasabb lesz. Persze, az is előfordulhat, hogy több ilyen aminosav van a fehérjében, és mindegyik oxidálódott egy kicsit. Akkor detektáljuk ezen peptideket módosítatlanul, meg oxidálva is. Aztán előfordulhat, hogy egy triptikus peptidben két metionin lapul, és 9
10 hol az egyik, hol a másik oxidálódik. Egyszerre két egyforma peptid-tömegünk van. Fragmentációs analízis, azaz MS/MS fedi majd fel, melyik aminosavval történt a változás. Hogyan is lehetne egy ilyen módszert hasznosítani mondjuk annak kiderítésére, milyen fehérjék vannak egy komplexben? Egyszerű! Izoláljuk a fehérje-komplexet. Megemésztjük a fehérje-elegyet tripszinnel. Az így kapott peptideket elválasztjuk az előbb leírt kromatográfiával, és tömegspektrometriával analizáljuk az eluátumot, azaz az oszlopról lejövő peptideket. Ha csak egyetlen fehérjénk lenne, akkor könnyű dolgunk lenne. Van egy mért peptid-tömeg listánk. Ezt a listát összevetjük az adatbázisban levő fehérjékhez tartozó, szekvenciájukon és a tripszin specificitásán alapuló jósolt peptid-sorozatokkal. Ez az ún. LC/MS analízis. Amelyikhez a legjobban stimmel, az az igazi. Sajnos, a peptidek összetétele nagyon hasonló, így a tömegük is gyakran egyezik, az adatbázisban sok fehérje van, időnként az aminosav-sorrendjük hasonló, azonkívül itt keverékekkel van dolgunk tehát simán peptidtömegek alapján nem tudjuk a fehérjéket megbízhatóan azonosítani. Nyilván megbízhatóbb lenne a dolog, ha a peptidek szekvenciáját is meg tudnánk határozni. Mi sem egyszerűbb! Az új készülékek képesek arra, hogy tömeget mérjenek, aztán automatikusan kiválasszák az n legintenzívebb komponenst a mérés során detektált ionok közül, és MS/MS analízist végezzenek rajta, aztán folytassák ezt az alternáló adatgyűjtést a kromatográfiás szeparálás végéig. Az adatgyűjtés végén lesz egy csomó triptikus peptid-tömegünk, és a peptid-tömegek mellé ott vannak az MS/MS fragmens tömegek is. Ebből egy ügyes programmal olyan dokumentumot kreálunk, ami megjelenési sorrendben listázza a peptid-tömegeket, és minden peptidtömeg fejléce alatt a hozzátartozó fragmenseket. Ez az ún. csúcslista. Na most, ahogy egy fehérjéhez rendelhetünk egy proteolitikus emésztéssel produkálható peptidtömeg sorozatot, így minden egyes peptidhez rendelhetünk egy a szekvencia alapján kiszámítható MS/MS fragmens sorozatot. És ezt hasznosítjuk az ún. adatbázis lekeresések során. Az adatbázis-lekereső szoftver (angolul search engine-nek hívják) megemészti in-silico az összes fehérjét az adatbázisban tripszinnel, azaz minden egyes szekvencia mellé felsorakoztatja a várható triptikus peptidek tömegeit. A szoftver utána veszi az első peptid-tömeget a csúcslistáról. Kikeresi az insilico listából az összes olyan megjósolt peptidet, aminek ugyanaz a tömege. Ezek a jelöltek. Ezeket mind fragmentálja in-silico, azaz produkál egy csomó fragmens-listát. Amelyik a legjobban passzol a mért listához, az az igazi. A szoftver így végigmegy az összes peptiden/spektrumon a csúcslistából a végeredmény egy csomó azonosított fehérje-darab. Utána a program összecsoportosítja azokat a peptideket, amik egy fehérjéhez tartoznak, és a végeredmény egy fehérje-lista. A fentebb leírt analízis egy leegyszerűsített kvalitatív kísérlet. Meglepően jól működik, ahhoz képest, hogy mennyi akadályt kell legyőznie. Mik ezek? Először is, a lekereső program számára a kezdeti feltételek szentek. A fehérjék azonban biológiai és kémiailag is aktív teremtmények. Így egy enzim 10
11 időnként ott is hasít, ahol nem illene, vagy kifelejt legitim hasító helyeket. Továbbá a minta-előkészítés során mindenféle vegyszereket használunk, amik reagálhatnak a fehérjéinkkel. A fehérjén lehetnek továbbá poszt-transzlációs módosítások, amiket a sejt pakol különböző oldalláncokra, esetleg a terminusokra a fehérje-szintézis alatt, után, permanensen vagy időszakosan stb. Mindezeket a módosított, nem előre betervezett darabokat sokkal trükkösebb azonosítani. Ráadásul a fehérjéket a darabkáikból azonosítjuk, de nem minden fehérje hasítható kedvenc enzimünkkel előnyösen ionizálható, fragmentálható (és így szekvenálható ) darabokra. Aztán a triptikus peptidekből meglehetősen nehéz következtetéseket levonni az egész fehérjéről. Mi van akkor, mondjuk, ha a fehérjét a sejt egy hosszú láncként szintetizálja, utána kettévágva tárolja, és az aktív formához még eltávolít egy darabot? Ha olyan szekvenciát találunk az elegyünkben, amely mind a három formában megtalálható, bizony nem tudhatjuk, melyikből is származik. És akkor még a mennyiségi analízisről nem is beszéltünk... De hát ettől szép és izgalmas a tudomány! 11
A TÖMEGSPEKTROMETRIA ALAPJAI
 A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
TANÍTÁSA A KÉMIA MÓDSZERTANI FOLYÓIRAT. Proteomika (Dr. Darula Zsuzsa Dr. Gulyás Éva Dr. Klement Éva Dr. Medzihradszky-Fölkl Katalin)
 A KÉMIA TANÍTÁSA MÓDSZERTANI FOLYÓIRAT Proteomika (Dr. Darula Zsuzsa Dr. Gulyás Éva Dr. Klement Éva Dr. Medzihradszky-Fölkl Katalin) Milyenek a Leclanché-féle szárazelemek? (Dr. Galbács Zoltán) Tévképzetek
A KÉMIA TANÍTÁSA MÓDSZERTANI FOLYÓIRAT Proteomika (Dr. Darula Zsuzsa Dr. Gulyás Éva Dr. Klement Éva Dr. Medzihradszky-Fölkl Katalin) Milyenek a Leclanché-féle szárazelemek? (Dr. Galbács Zoltán) Tévképzetek
Korszerű tömegspektrometria a. Szabó Pál MTA Kémiai Kutatóközpont
 Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Tematika Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Tematika Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
Anyagszerkezet vizsgálati módszerek
 Kromatográfia Folyadékkromatográfia-tömegspektrometria Anyagszerkezet vizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagszerkezet vizsgálati módszerek Kromatográfia 1/ 25 Folyadékkromatográfia-tömegspektrometria
Kromatográfia Folyadékkromatográfia-tömegspektrometria Anyagszerkezet vizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagszerkezet vizsgálati módszerek Kromatográfia 1/ 25 Folyadékkromatográfia-tömegspektrometria
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
Tematika. Korszerű tömegspektrometria a. Ionforrás. Gyors atom bombázás. Szabó Pál MTA Kémiai Kutatóközpont. Cél: Töltött részecskék előállítása
 Tematika Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
Tematika Korszerű tömegspektrometria a biokémi miában Szabó Pál MTA Kémiai Kutatóközpont Bevezetés: ionizációs technikák és analizátorok összehasonlítása a biomolekulák szemszögéből Mikromennyiségek mintaelőkészítése
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
A feladatok megoldásához csak a kiadott periódusos rendszer és számológép használható!
 1 MŰVELTSÉGI VERSENY KÉMIA TERMÉSZETTUDOMÁNYI KATEGÓRIA Kedves Versenyző! A versenyen szereplő kérdések egy része általad már tanult tananyaghoz kapcsolódik, ugyanakkor a kérdések másik része olyan ismereteket
1 MŰVELTSÉGI VERSENY KÉMIA TERMÉSZETTUDOMÁNYI KATEGÓRIA Kedves Versenyző! A versenyen szereplő kérdések egy része általad már tanult tananyaghoz kapcsolódik, ugyanakkor a kérdések másik része olyan ismereteket
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Igény a pontos minőségi és mennyiségi vizsgálatokra: LC-MS/MS módszerek gyakorlati alkalmazása az élelmiszer-analitikában
 : LC-MS/MS módszerek gyakorlati alkalmazása az élelmiszer-analitikában Tölgyesi Ádám Hungalimentária, Budapest 2017. április 26-27. Folyadékkromatográfiás hármas kvadrupol rendszerű tandem tömegspektrometria
: LC-MS/MS módszerek gyakorlati alkalmazása az élelmiszer-analitikában Tölgyesi Ádám Hungalimentária, Budapest 2017. április 26-27. Folyadékkromatográfiás hármas kvadrupol rendszerű tandem tömegspektrometria
6. változat. 3. Jelöld meg a nem molekuláris szerkezetű anyagot! A SO 2 ; Б C 6 H 12 O 6 ; В NaBr; Г CO 2.
 6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak
 Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
Modul cím: MEDICINÁLIS ALAPISMERETEK AZ ÉLŐ SZERVEZETEK KÉMIAI ÉPÍTŐKÖVEI AZ AMINOSAVAK ÉS FEHÉRJÉK 1. kulcsszó cím: Aminosavak Egy átlagos emberben 10-12 kg fehérje van, mely elsősorban a vázizomban található.
Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások
 ktatási Hivatal rszágos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások I. FELADATSR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D 9.
ktatási Hivatal rszágos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia II. kategória 2. forduló Megoldások I. FELADATSR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D 9.
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
A Proteomika Szolgáltató Laboratóriumban elérhető szolgáltatások
 A Proteomika Szolgáltató Laboratóriumban elérhető szolgáltatások Dr. Csősz Éva Proteomika Szolgáltató Laboratórium műszerpark MALDI-TOF (ABSciex) PSZL ESI-4000 QTRAP (ABSciex) Kétdimenziós elektroforézis
A Proteomika Szolgáltató Laboratóriumban elérhető szolgáltatások Dr. Csősz Éva Proteomika Szolgáltató Laboratórium műszerpark MALDI-TOF (ABSciex) PSZL ESI-4000 QTRAP (ABSciex) Kétdimenziós elektroforézis
transzláció DNS RNS Fehérje A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti fehérjék, transzportfehérjék
 Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Transzláció A molekuláris biológia centrális dogmája transzkripció transzláció DNS RNS Fehérje replikáció Reverz transzkriptáz A fehérjék jelenléte nélkülözhetetlen minden sejt számára: enzimek, szerkezeti
Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások
 Oktatási Hivatal Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások I. FELADATSOR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D
Oktatási Hivatal Országos Középiskolai Tanulmányi Verseny 2010/2011. tanév Kémia I. kategória 2. forduló Megoldások I. FELADATSOR 1. C 6. C 11. E 16. C 2. D 7. B 12. E 17. C 3. B 8. C 13. D 18. C 4. D
Jegyzet. Kémia, BMEVEAAAMM1 Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens.
 Kémia, BMEVEAAAMM Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens Jegyzet dr. Horváth Viola, KÉMIA I. http://oktatas.ch.bme.hu/oktatas/konyvek/anal/
Kémia, BMEVEAAAMM Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens Jegyzet dr. Horváth Viola, KÉMIA I. http://oktatas.ch.bme.hu/oktatas/konyvek/anal/
Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár. Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár,
 Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Facebook,
Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Facebook,
Németh Anikó 1,2, Kosáry Judit 1, Fodor Péter 1, Dernovics Mihály 1
 Németh Anikó 1,2, Kosáry Judit 1, Fodor Péter 1, Dernovics Mihály 1 1 Budapesti Corvinus Egyetem Élelmiszertudomány Kar, Alkalmazott Kémia Tanszék 2 Wessling Hungary Kft., Élelmiszervizsgáló Laboratórium
Németh Anikó 1,2, Kosáry Judit 1, Fodor Péter 1, Dernovics Mihály 1 1 Budapesti Corvinus Egyetem Élelmiszertudomány Kar, Alkalmazott Kémia Tanszék 2 Wessling Hungary Kft., Élelmiszervizsgáló Laboratórium
A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján.
 A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. Szakképesítés azonosítószáma és megnevezése 54 524 03 Vegyész technikus Tájékoztató
A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. Szakképesítés azonosítószáma és megnevezése 54 524 03 Vegyész technikus Tájékoztató
HPLC MS és HPLC MS/MS. Bobály Balázs, Fekete Jenő
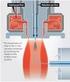 HPLC MS és HPLC MS/MS Bobály Balázs, Fekete Jenő Készülék felépítése (melyik a műszer?) MS LC ionforrás tömeganalizátor detektor P atm 10-3 torr 10-6 torr 1 ml mozgófázisból keletkező gáz atm nyomáson
HPLC MS és HPLC MS/MS Bobály Balázs, Fekete Jenő Készülék felépítése (melyik a műszer?) MS LC ionforrás tömeganalizátor detektor P atm 10-3 torr 10-6 torr 1 ml mozgófázisból keletkező gáz atm nyomáson
Bioinformatika előadás
 10. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat Genomika vs. proteomika A genomika módszereivel nem a tényleges fehérjéket vizsgáljuk,
10. előadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat Genomika vs. proteomika A genomika módszereivel nem a tényleges fehérjéket vizsgáljuk,
1. változat. 4. Jelöld meg azt az oxidot, melynek megfelelője a vas(iii)-hidroxid! A FeO; Б Fe 2 O 3 ; В OF 2 ; Г Fe 3 O 4.
 1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
Peptidek LC-MS/MS karakterisztikájának javítása fluoros kémiai módosítással, proteomikai alkalmazásokhoz
 Peptidek LC-MS/MS karakterisztikájának javítása fluoros kémiai módosítással, proteomikai alkalmazásokhoz Dr. Schlosser Gitta tudományos munkatárs MTA-ELTE Peptidkémiai Kutatócsoport MedInProt Tavaszi Konferencia
Peptidek LC-MS/MS karakterisztikájának javítása fluoros kémiai módosítással, proteomikai alkalmazásokhoz Dr. Schlosser Gitta tudományos munkatárs MTA-ELTE Peptidkémiai Kutatócsoport MedInProt Tavaszi Konferencia
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL
 TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
TRIPSZIN TISZTÍTÁSA AFFINITÁS KROMATOGRÁFIA SEGÍTSÉGÉVEL Az egyes biomolekulák izolálása kulcsfontosságú a biológiai szerepük tisztázásához. Az affinitás kromatográfia egyszerűsége, reprodukálhatósága
Tömegspektrometria. Bevezetés és Ionizációs módszerek
 Tömegspektrometria Bevezetés és Ionizációs módszerek Tömegspektrometria A tömegspektrometria, különösen korszerű elválasztási módszerekkel kapcsolva, a mai analitikai gyakorlat leghatékonyabb módszere.
Tömegspektrometria Bevezetés és Ionizációs módszerek Tömegspektrometria A tömegspektrometria, különösen korszerű elválasztási módszerekkel kapcsolva, a mai analitikai gyakorlat leghatékonyabb módszere.
Szerkesztette: Vizkievicz András
 Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
Fehérjék A fehérjék - proteinek - az élő szervezetek számára a legfontosabb vegyületek. Az élet bármilyen megnyilvánulási formája fehérjékkel kapcsolatos. A sejtek szárazanyagának minimum 50 %-át adják.
KÉMIAI ALAPISMERETEK (Teszt) Összesen: 150 pont. HCl (1 pont) HCO 3 - (1 pont) Ca 2+ (1 pont) Al 3+ (1 pont) Fe 3+ (1 pont) H 2 O (1 pont)
 KÉMIAI ALAPISMERETEK (Teszt) Összesen: 150 pont 1. Adja meg a következő ionok nevét, illetve képletét! (12 pont) Az ion neve Kloridion Az ion képlete Cl - (1 pont) Hidroxidion (1 pont) OH - Nitrátion NO
KÉMIAI ALAPISMERETEK (Teszt) Összesen: 150 pont 1. Adja meg a következő ionok nevét, illetve képletét! (12 pont) Az ion neve Kloridion Az ion képlete Cl - (1 pont) Hidroxidion (1 pont) OH - Nitrátion NO
Természetes vizek, keverékek mindig tartalmaznak oldott anyagokat! Írd le milyen természetes vizeket ismersz!
 Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Oktatáskutató és Fejlesztő Intézet TÁMOP-3.1.1-11/1-2012-0001 XXI. századi közoktatás (fejlesztés, koordináció) II. szakasz KÉMIA 4.
 Oktatáskutató és Fejlesztő Intézet TÁMOP-3.1.1-11/1-2012-0001 XXI. századi közoktatás (fejlesztés, koordináció) II. szakasz KÉMIA 4. MINTAFELADATSOR KÖZÉPSZINT 2015 Az írásbeli vizsga időtartama: 120 perc
Oktatáskutató és Fejlesztő Intézet TÁMOP-3.1.1-11/1-2012-0001 XXI. századi közoktatás (fejlesztés, koordináció) II. szakasz KÉMIA 4. MINTAFELADATSOR KÖZÉPSZINT 2015 Az írásbeli vizsga időtartama: 120 perc
Proteomika Peptid szekvenálás. Dr. Csősz Éva Debreceni Egyetem ÁOK Biokémiai és Molekuláris Biológiai Intézet Proteomika Szolgáltató Laboratórium
 Proteomika Peptid szekvenálás Dr. Csősz Éva Debreceni Egyetem ÁOK Biokémiai és Molekuláris Biológiai Intézet Proteomika Szolgáltató Laboratórium Fókuszterületek Omikák, rendszerbiológia hipotézis vezérelt
Proteomika Peptid szekvenálás Dr. Csősz Éva Debreceni Egyetem ÁOK Biokémiai és Molekuláris Biológiai Intézet Proteomika Szolgáltató Laboratórium Fókuszterületek Omikák, rendszerbiológia hipotézis vezérelt
Általános Kémia, BMEVESAA101
 Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Óravázlatok:
Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Óravázlatok:
BIOGÉN ELEMEK Azok a kémiai elemek, amelyek az élőlények számára létfontosságúak
 BIOGÉN ELEMEK Azok a kémiai elemek, amelyek az élőlények számára létfontosságúak A több mint száz ismert kémiai elem nagyobbik hányada megtalálható az élőlények testében is, de sokuknak nincsen kimutatható
BIOGÉN ELEMEK Azok a kémiai elemek, amelyek az élőlények számára létfontosságúak A több mint száz ismert kémiai elem nagyobbik hányada megtalálható az élőlények testében is, de sokuknak nincsen kimutatható
Minta feladatsor. Az ion neve. Az ion képlete O 4. Szulfátion O 3. Alumíniumion S 2 CHH 3 COO. Króm(III)ion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
7. osztály Hevesy verseny, megyei forduló, 2003.
 Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthető legyen! A feladatok megoldásában a gondolatmeneted követhető legyen! A feladatok megoldásához használhatod a periódusos
Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthető legyen! A feladatok megoldásában a gondolatmeneted követhető legyen! A feladatok megoldásához használhatod a periódusos
Tömegspektrometria. Tömeganalizátorok
 Tömegspektrometria Tömeganalizátorok Mintabeviteli rendszer Működési elv Vákuumrendszer Ionforrás Tömeganalizátor Detektor Electron impact (EI) Chemical ionization (CI) Atmospheric pressure (API) Electrospray
Tömegspektrometria Tömeganalizátorok Mintabeviteli rendszer Működési elv Vákuumrendszer Ionforrás Tömeganalizátor Detektor Electron impact (EI) Chemical ionization (CI) Atmospheric pressure (API) Electrospray
Nagyhatékonyságú folyadékkromatográfia (HPLC)
 Nagyhatékonyságú folyadékkromatográfia (HPLC) Kromatográfiás módszerek osztályba sorolása 2 Elúciós technika A mintabevitel ún. dugószerűen történik A mozgófázis a kromatogram kifejlesztése alatt folyamatosan
Nagyhatékonyságú folyadékkromatográfia (HPLC) Kromatográfiás módszerek osztályba sorolása 2 Elúciós technika A mintabevitel ún. dugószerűen történik A mozgófázis a kromatogram kifejlesztése alatt folyamatosan
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 8. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 8. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 8. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
Aminosavak, peptidek, fehérjék
 Aminosavak, peptidek, fehérjék Az aminosavak a fehérjék építőkövei. A fehérjék felépítésében mindössze 20- féle aminosav vesz részt. Ezek általános képlete: Az aminosavakban, mint arra nevük is utal van
Aminosavak, peptidek, fehérjék Az aminosavak a fehérjék építőkövei. A fehérjék felépítésében mindössze 20- féle aminosav vesz részt. Ezek általános képlete: Az aminosavakban, mint arra nevük is utal van
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
V É R Z K A S A Y E N P
 Hevesy György Országos Kémiaverseny Kerületi forduló 2012. február 14. 7. évfolyam 1. feladat (1) Írd be a felsorolt anyagok sorszámát a táblázat megfelelő helyére! fémek anyagok kémiailag tiszta anyagok
Hevesy György Országos Kémiaverseny Kerületi forduló 2012. február 14. 7. évfolyam 1. feladat (1) Írd be a felsorolt anyagok sorszámát a táblázat megfelelő helyére! fémek anyagok kémiailag tiszta anyagok
Elektrokémia. A nemesfém elemek és egymással képzett vegyületeik
 Elektrokémia Redoxireakciók: Minden olyan reakciót, amelyben elektron leadás és elektronfelvétel történik, redoxi reakciónak nevezünk. Az elektronleadás és -felvétel egyidejűleg játszódik le. Oxidálószer
Elektrokémia Redoxireakciók: Minden olyan reakciót, amelyben elektron leadás és elektronfelvétel történik, redoxi reakciónak nevezünk. Az elektronleadás és -felvétel egyidejűleg játszódik le. Oxidálószer
Mérés: Millikan olajcsepp-kísérlete
 Mérés: Millikan olajcsepp-kísérlete Mérés célja: 1909-ben ezt a mérést Robert Millikan végezte el először. Mérése során meg tudta határozni az elemi részecskék töltését. Ezért a felfedezéséért Nobel-díjat
Mérés: Millikan olajcsepp-kísérlete Mérés célja: 1909-ben ezt a mérést Robert Millikan végezte el először. Mérése során meg tudta határozni az elemi részecskék töltését. Ezért a felfedezéséért Nobel-díjat
Hevesy György Kémiaverseny. 8. osztály. megyei döntő 2003.
 Hevesy György Kémiaverseny 8. osztály megyei döntő 2003. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthető legyen! A feladatok megoldásában a gondolatmeneted követhető
Hevesy György Kémiaverseny 8. osztály megyei döntő 2003. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthető legyen! A feladatok megoldásában a gondolatmeneted követhető
Bioinformatika 2 10.el
 10.el őadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2009. 04. 24. Genomikavs. proteomika A genomika módszereivel nem a tényleges fehérjéket
10.el őadás Prof. Poppe László BME Szerves Kémia és Technológia Tsz. Bioinformatika proteomika Előadás és gyakorlat 2009. 04. 24. Genomikavs. proteomika A genomika módszereivel nem a tényleges fehérjéket
Kormeghatározás gyorsítóval
 Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
SZABADALMI IGÉNYPONTOK. képlettel rendelkezik:
 SZABADALMI IGÉNYPONTOK l. Izolált atorvasztatin epoxi dihidroxi (AED), amely az alábbi képlettel rendelkezik: 13 2. Az l. igénypont szerinti AED, amely az alábbiak közül választott adatokkal jellemezhető:
SZABADALMI IGÉNYPONTOK l. Izolált atorvasztatin epoxi dihidroxi (AED), amely az alábbi képlettel rendelkezik: 13 2. Az l. igénypont szerinti AED, amely az alábbiak közül választott adatokkal jellemezhető:
KÉMIA 10. Osztály I. FORDULÓ
 KÉMIA 10. Osztály I. FORDULÓ 1) A rejtvény egy híres ember nevét és halálának évszámát rejti. Nevét megtudod, ha a részmegoldások betűit a számozott négyzetekbe írod, halálának évszámát pedig pici számolással.
KÉMIA 10. Osztály I. FORDULÓ 1) A rejtvény egy híres ember nevét és halálának évszámát rejti. Nevét megtudod, ha a részmegoldások betűit a számozott négyzetekbe írod, halálának évszámát pedig pici számolással.
Molekulavadászat. Schlosser Gitta. MTA-ELTE Peptidkémiai Kutatócsoport
 Molekulavadászat Schlosser Gitta MTA-ELTE Peptidkémiai Kutatócsoport Tömegspektrometria A tömegspektrometria (MS, mass spectrometry) olyan analitikai módszer, amellyel meghatározható atomok és molekulák,
Molekulavadászat Schlosser Gitta MTA-ELTE Peptidkémiai Kutatócsoport Tömegspektrometria A tömegspektrometria (MS, mass spectrometry) olyan analitikai módszer, amellyel meghatározható atomok és molekulák,
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Mi a hasonlóság és mi a különbség a felsorolt kémiai részecskék között? Hasonlóság:... Különbség: atom a belőle származó (egyszerű) ion
 Kedves Versenyző! 2 Köszöntünk a Hevesy György kémiaverseny országos döntőjének írásbeli fordulóján. A következő kilenc feladat megoldására 90 perc áll rendelkezésedre. A feladatokat a számítási feladatok
Kedves Versenyző! 2 Köszöntünk a Hevesy György kémiaverseny országos döntőjének írásbeli fordulóján. A következő kilenc feladat megoldására 90 perc áll rendelkezésedre. A feladatokat a számítási feladatok
Kémia OKTV 2006/2007. II. forduló. A feladatok megoldása
 Kémia OKTV 2006/2007. II. forduló A feladatok megoldása Az értékelés szempontjai Csak a hibátlan megoldásokért adható a teljes pontszám. Részlegesen jó megoldásokat a részpontok alapján kell pontozni.
Kémia OKTV 2006/2007. II. forduló A feladatok megoldása Az értékelés szempontjai Csak a hibátlan megoldásokért adható a teljes pontszám. Részlegesen jó megoldásokat a részpontok alapján kell pontozni.
Többkomponensű rendszerek I.
 Többkomponensű rendszerek I. Műszaki kémia, Anyagtan I. 9. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Többkomponensű rendszerek Folytonos közegben (diszpergáló, ágyazó
Többkomponensű rendszerek I. Műszaki kémia, Anyagtan I. 9. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Többkomponensű rendszerek Folytonos közegben (diszpergáló, ágyazó
A nukleinsavak polimer vegyületek. Mint polimerek, monomerekből épülnek fel, melyeket nukleotidoknak nevezünk.
 Nukleinsavak Szerkesztette: Vizkievicz András A nukleinsavakat először a sejtek magjából sikerült tiszta állapotban kivonni. Innen a név: nucleus = mag (lat.), a sav a kémhatásukra utal. Azonban nukleinsavak
Nukleinsavak Szerkesztette: Vizkievicz András A nukleinsavakat először a sejtek magjából sikerült tiszta állapotban kivonni. Innen a név: nucleus = mag (lat.), a sav a kémhatásukra utal. Azonban nukleinsavak
AMINOSAVAK, FEHÉRJÉK
 AMINOSAVAK, FEHÉRJÉK Az aminosavak olyan szerves vegyületek, amelyek molekulájában aminocsoport (-NH2) és karboxilcsoport (-COOH) egyaránt előfordul. Felosztás A fehérjéket feloszthatjuk aszerint, hogy
AMINOSAVAK, FEHÉRJÉK Az aminosavak olyan szerves vegyületek, amelyek molekulájában aminocsoport (-NH2) és karboxilcsoport (-COOH) egyaránt előfordul. Felosztás A fehérjéket feloszthatjuk aszerint, hogy
3. változat. 2. Melyik megállapítás helyes: Az egyik gáz másikhoz viszonyított sűrűsége nem más,
 3. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg az egyszerű anyagok számát
3. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg az egyszerű anyagok számát
Tartalmi követelmények kémia tantárgyból az érettségin
 Témakör 1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
Témakör 1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
I. ANALITIKAI ADATOK MEGADÁSA, KONVERZIÓK
 I. ANALITIKAI ADATOK MEGADÁSA, KONVERZIÓK I.2. Konverziók Geokémiai vizsgálatok során gyakran kényszerülünk arra, hogy különböző kémiai koncentrációegységben megadott adatokat hasonlítsunk össze vagy alakítsuk
I. ANALITIKAI ADATOK MEGADÁSA, KONVERZIÓK I.2. Konverziók Geokémiai vizsgálatok során gyakran kényszerülünk arra, hogy különböző kémiai koncentrációegységben megadott adatokat hasonlítsunk össze vagy alakítsuk
Tartalmi követelmények kémia tantárgyból az érettségin K Ö Z É P S Z I N T
 1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
Lakos István WESSLING Hungary Kft. Zavaró hatások kezelése a fémanalitikában
 Lakos István WESSLING Hungary Kft. Zavaró hatások kezelése a fémanalitikában AAS ICP-MS ICP-AES ICP-AES-sel mérhető elemek ICP-MS-sel mérhető elemek A zavarások felléphetnek: Mintabevitel közben Lángban/Plazmában
Lakos István WESSLING Hungary Kft. Zavaró hatások kezelése a fémanalitikában AAS ICP-MS ICP-AES ICP-AES-sel mérhető elemek ICP-MS-sel mérhető elemek A zavarások felléphetnek: Mintabevitel közben Lángban/Plazmában
Általános Kémia GY, 2. tantermi gyakorlat
 Általános Kémia GY, 2. tantermi gyakorlat Sztöchiometriai számítások -titrálás: ld. : a 2. laborgyakorlat leírásánál Gáztörvények A kémhatás fogalma -ld.: a 2. laborgyakorlat leírásánál Honlap: http://harmatv.web.elte.hu
Általános Kémia GY, 2. tantermi gyakorlat Sztöchiometriai számítások -titrálás: ld. : a 2. laborgyakorlat leírásánál Gáztörvények A kémhatás fogalma -ld.: a 2. laborgyakorlat leírásánál Honlap: http://harmatv.web.elte.hu
5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével
 5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével 5.1. Átismétlendő anyag 1. Adszorpció (előadás) 2. Langmuir-izoterma (előadás) 3. Spektrofotometria és Lambert Beer-törvény
5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével 5.1. Átismétlendő anyag 1. Adszorpció (előadás) 2. Langmuir-izoterma (előadás) 3. Spektrofotometria és Lambert Beer-törvény
A proteomika új tudománya és alkalmazása a rákdiagnosztikában
 BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK A proteomika új tudománya és alkalmazása a rákdiagnosztikában Tárgyszavak: proteom; proteomika; rák; diagnosztika; molekuláris gyógyászat; biomarker;
BIOTECHNOLÓGIAI FEJLESZTÉSI POLITIKA, KUTATÁSI IRÁNYOK A proteomika új tudománya és alkalmazása a rákdiagnosztikában Tárgyszavak: proteom; proteomika; rák; diagnosztika; molekuláris gyógyászat; biomarker;
Duna-víz extrahálható komponenseinek meghatározása GC-MSD rendszerrel. I. Elméleti áttekintés
 Duna-víz extrahálható komponenseinek meghatározása GC-MSD rendszerrel A gyakorlat az előző évi kötelező műszeres analitika laborgyakorlat gázkromatográfiás laborjára épít. Az ott szerzett ismeretek a gyakorlat
Duna-víz extrahálható komponenseinek meghatározása GC-MSD rendszerrel A gyakorlat az előző évi kötelező műszeres analitika laborgyakorlat gázkromatográfiás laborjára épít. Az ott szerzett ismeretek a gyakorlat
Anyagvizsgálati módszerek Elektroanalitika. Anyagvizsgálati módszerek
 Anyagvizsgálati módszerek Elektroanalitika Anyagvizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagvizsgálati módszerek Optikai módszerek 1/ 18 Potenciometria Potenciometria olyan analitikai eljárások
Anyagvizsgálati módszerek Elektroanalitika Anyagvizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagvizsgálati módszerek Optikai módszerek 1/ 18 Potenciometria Potenciometria olyan analitikai eljárások
Modern Fizika Labor. A mérés száma és címe: A mérés dátuma: Értékelés: Infravörös spektroszkópia. A beadás dátuma: A mérést végezte:
 Modern Fizika Labor A mérés dátuma: 2005.10.26. A mérés száma és címe: 12. Infravörös spektroszkópia Értékelés: A beadás dátuma: 2005.11.09. A mérést végezte: Orosz Katalin Tóth Bence 1 A mérés során egy
Modern Fizika Labor A mérés dátuma: 2005.10.26. A mérés száma és címe: 12. Infravörös spektroszkópia Értékelés: A beadás dátuma: 2005.11.09. A mérést végezte: Orosz Katalin Tóth Bence 1 A mérés során egy
23. Indikátorok disszociációs állandójának meghatározása spektrofotometriásan
 23. Indikátorok disszociációs állandójának meghatározása spektrofotometriásan 1. Bevezetés Sav-bázis titrálások végpontjelzésére (a mőszeres indikáció mellett) ma is gyakran alkalmazunk festék indikátorokat.
23. Indikátorok disszociációs állandójának meghatározása spektrofotometriásan 1. Bevezetés Sav-bázis titrálások végpontjelzésére (a mőszeres indikáció mellett) ma is gyakran alkalmazunk festék indikátorokat.
A kémiai energia átalakítása a sejtekben
 A kémiai energia átalakítása a sejtekben A sejtek olyan mikroszkópikus képződmények amelyek működése egy vegyi gyárhoz hasonlítható. Tehát a sejtek mikroszkópikus vegyi gyárak. Mi mindenben hasonlítanak
A kémiai energia átalakítása a sejtekben A sejtek olyan mikroszkópikus képződmények amelyek működése egy vegyi gyárhoz hasonlítható. Tehát a sejtek mikroszkópikus vegyi gyárak. Mi mindenben hasonlítanak
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Sciex X500R készülék bemutatása a SWATH alkalmazásai tükrében. Szabó Pál, MTA TTK
 Sciex X500R készülék bemutatása a SWATH alkalmazásai tükrében Szabó Pál, MTA TTK Hagyományos QTOF rendszer Aggályok: Termetes Bonyolultnak tűnő Nem rutin feladatokra való Következmény: Nem merjük megvenni
Sciex X500R készülék bemutatása a SWATH alkalmazásai tükrében Szabó Pál, MTA TTK Hagyományos QTOF rendszer Aggályok: Termetes Bonyolultnak tűnő Nem rutin feladatokra való Következmény: Nem merjük megvenni
Az anyagi rendszerek csoportosítása
 Általános és szervetlen kémia 1. hét A kémia az anyagok tulajdonságainak leírásával, átalakulásaival, elıállításának lehetıségeivel és felhasználásával foglalkozik. Az általános kémia vizsgálja az anyagi
Általános és szervetlen kémia 1. hét A kémia az anyagok tulajdonságainak leírásával, átalakulásaival, elıállításának lehetıségeivel és felhasználásával foglalkozik. Az általános kémia vizsgálja az anyagi
ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával.
 ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával www.chem.elte.hu/pr Kvíz az előző előadáshoz Programajánlatok október 18. 16:00 ELTE Kémiai Intézet 065-ös terem Észbontogató (www.chem.elte.hu/pr)
ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával www.chem.elte.hu/pr Kvíz az előző előadáshoz Programajánlatok október 18. 16:00 ELTE Kémiai Intézet 065-ös terem Észbontogató (www.chem.elte.hu/pr)
Irányítószámok a közigazgatás szürke zónájában
 Dr. Va rga Á dá m mb. oktató Pázmány Péter Katolikus Egyetem Jog- és Államtudományi Kar Alkotmányjogi Tanszék, Közigazgatási Jogi Tanszék Irányítószámok a közigazgatás szürke zónájában Bevezetés Van egy
Dr. Va rga Á dá m mb. oktató Pázmány Péter Katolikus Egyetem Jog- és Államtudományi Kar Alkotmányjogi Tanszék, Közigazgatási Jogi Tanszék Irányítószámok a közigazgatás szürke zónájában Bevezetés Van egy
A sejtek élete. 5. Robotoló törpék és óriások Az aminosavak és fehérjék R C NH 2. C COOH 5.1. A fehérjeépítőaminosavak általános
 A sejtek élete 5. Robotoló törpék és óriások Az aminosavak és fehérjék e csak nézd! Milyen protonátmenetes reakcióra képes egy aminosav? R 2 5.1. A fehérjeépítőaminosavak általános képlete 5.2. A legegyszerűbb
A sejtek élete 5. Robotoló törpék és óriások Az aminosavak és fehérjék e csak nézd! Milyen protonátmenetes reakcióra képes egy aminosav? R 2 5.1. A fehérjeépítőaminosavak általános képlete 5.2. A legegyszerűbb
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekIKözgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekIKözgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Az α értékének változtatásakor tanulmányozzuk az y-x görbe alakját. 2 ahol K=10
 9.4. Táblázatkezelés.. Folyadék gőz egyensúly kétkomponensű rendszerben Az illékonyabb komponens koncentrációja (móltörtje) nagyobb a gőzfázisban, mint a folyadékfázisban. Móltört a folyadékfázisban x;
9.4. Táblázatkezelés.. Folyadék gőz egyensúly kétkomponensű rendszerben Az illékonyabb komponens koncentrációja (móltörtje) nagyobb a gőzfázisban, mint a folyadékfázisban. Móltört a folyadékfázisban x;
A replikáció mechanizmusa
 Az öröklődés molekuláris alapjai A DNS megkettőződése, a replikáció Szerk.: Vizkievicz András A DNS-molekula az élőlények örökítő anyaga, kódolt formában tartalmazza mindazon információkat, amelyek a sejt,
Az öröklődés molekuláris alapjai A DNS megkettőződése, a replikáció Szerk.: Vizkievicz András A DNS-molekula az élőlények örökítő anyaga, kódolt formában tartalmazza mindazon információkat, amelyek a sejt,
4. változat. 2. Jelöld meg azt a részecskét, amely megőrzi az anyag összes kémiai tulajdonságait! A molekula; Б atom; В gyök; Г ion.
 4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
1. feladat Összesen: 15 pont. 2. feladat Összesen: 10 pont
 1. feladat Összesen: 15 pont Vizsgálja meg a hidrogén-klorid (vagy vizes oldata) reakciót különböző szervetlen és szerves anyagokkal! Ha nem játszódik le reakció, akkor ezt írja be! protonátmenettel járó
1. feladat Összesen: 15 pont Vizsgálja meg a hidrogén-klorid (vagy vizes oldata) reakciót különböző szervetlen és szerves anyagokkal! Ha nem játszódik le reakció, akkor ezt írja be! protonátmenettel járó
ÁGAZATI SZAKMAI ÉRETTSÉGI VIZSGA KOZMETIKAI ISMERETEK KÖZÉPSZINTŰ SZÓBELI VIZSGA MINTAFELADATOK ÉS ÉRTÉKELÉSÜK
 KOZMETIKAI ISMERETEK KÖZÉPSZINTŰ SZÓBELI VIZSGA MINTAFELADATOK ÉS ÉRTÉKELÉSÜK MINTATÉTEL. tétel A feladat: Nevezze meg és jellemezze a képen látható bőrelváltozást, mint a bőr szerkezetében bekövetkezett
KOZMETIKAI ISMERETEK KÖZÉPSZINTŰ SZÓBELI VIZSGA MINTAFELADATOK ÉS ÉRTÉKELÉSÜK MINTATÉTEL. tétel A feladat: Nevezze meg és jellemezze a képen látható bőrelváltozást, mint a bőr szerkezetében bekövetkezett
3. feladat. Állapítsd meg az alábbi kénvegyületekben a kén oxidációs számát! Összesen 6 pont érhető el. Li2SO3 H2S SO3 S CaSO4 Na2S2O3
 10. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
10. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
1. feladat Összesen: 8 pont. 2. feladat Összesen: 11 pont. 3. feladat Összesen: 7 pont. 4. feladat Összesen: 14 pont
 1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
Szerves kémiai analízis TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ
 BSC ANYAGMÉRNÖK SZAK VEGYIPARI TECHNOLÓGIAI SZÁMÁRA KÖTELEZŐ TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2016 1 Tartalomjegyzék 1. Tantárgyleírás,
BSC ANYAGMÉRNÖK SZAK VEGYIPARI TECHNOLÓGIAI SZÁMÁRA KÖTELEZŐ TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2016 1 Tartalomjegyzék 1. Tantárgyleírás,
b./ Hány gramm szénatomban van ugyanannyi proton, mint 8g oxigénatomban? Hogyan jelöljük ezeket az anyagokat? Egyforma-e minden atom a 8g szénben?
 1. Az atommag. a./ Az atommag és az atom méretének, tömegének és töltésének összehasonlítása, a nukleonok jellemzése, rendszám, tömegszám, izotópok, nuklidok, jelölések. b./ Jelöld a Ca atom 20 neutront
1. Az atommag. a./ Az atommag és az atom méretének, tömegének és töltésének összehasonlítása, a nukleonok jellemzése, rendszám, tömegszám, izotópok, nuklidok, jelölések. b./ Jelöld a Ca atom 20 neutront
Készítette: Szikora Bence. Spirálcellás akkumulátorok és szuperkapacitások
 Készítette: Szikora Bence Spirálcellás akkumulátorok és szuperkapacitások Akkumulátorok Az akkumulátorok esetén nem elektronok, hanem ionok a töltéshordozók. Tehát nem fém vezeti az áramot hanem egy oldott
Készítette: Szikora Bence Spirálcellás akkumulátorok és szuperkapacitások Akkumulátorok Az akkumulátorok esetén nem elektronok, hanem ionok a töltéshordozók. Tehát nem fém vezeti az áramot hanem egy oldott
Megmérjük a láthatatlant
 Megmérjük a láthatatlant (részecskefizikai detektorok) Hamar Gergő MTA Wigner FK 1 Tartalom Mik azok a részecskék? mennyi van belőlük? miben különböznek? Részecskegyorsítók, CERN mire jó a gyorsító? hogy
Megmérjük a láthatatlant (részecskefizikai detektorok) Hamar Gergő MTA Wigner FK 1 Tartalom Mik azok a részecskék? mennyi van belőlük? miben különböznek? Részecskegyorsítók, CERN mire jó a gyorsító? hogy
Hevesy verseny döntő, 2001.
 7. osztály 2 Kedves Versenyző! Köszöntünk a Hevesy György kémiaverseny országos döntőjének írásbeli fordulóján. A következő kilenc feladat megoldására 90 perc áll rendelkezésedre. A feladatokat a számítási
7. osztály 2 Kedves Versenyző! Köszöntünk a Hevesy György kémiaverseny országos döntőjének írásbeli fordulóján. A következő kilenc feladat megoldására 90 perc áll rendelkezésedre. A feladatokat a számítási
Kémia OKTV I. kategória II. forduló A feladatok megoldása
 ktatási ivatal Kémia KTV I. kategória 2008-2009. II. forduló A feladatok megoldása I. FELADATSR 1. A 6. E 11. A 16. C 2. A 7. C 12. D 17. B 3. E 8. D 13. A 18. C 4. D 9. C 14. B 19. C 5. B 10. E 15. E
ktatási ivatal Kémia KTV I. kategória 2008-2009. II. forduló A feladatok megoldása I. FELADATSR 1. A 6. E 11. A 16. C 2. A 7. C 12. D 17. B 3. E 8. D 13. A 18. C 4. D 9. C 14. B 19. C 5. B 10. E 15. E
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 7. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 7. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
Szakmai cikkek 1. Szakmai cikkek. Tömegspektrometria. Stáray Judit. vákuumrendszer. Adatfeldolgozó rendszer
 1 2 Stáray Judit Tömegspektrometria 1. Bevezetés A szerkezetkutatás, azaz az ismeretlen vegyületek azonosítása, egy adott molekula szerkezetének meghatározása a kémia egyik igen speciális és érdekes szakterülete.
1 2 Stáray Judit Tömegspektrometria 1. Bevezetés A szerkezetkutatás, azaz az ismeretlen vegyületek azonosítása, egy adott molekula szerkezetének meghatározása a kémia egyik igen speciális és érdekes szakterülete.
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ
 1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
a. 35-ös tömegszámú izotópjában 18 neutron található. b. A 3. elektronhéján két vegyértékelektront tartalmaz. c. 2 mól atomjának tömege 32 g.
 MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
MAGYAR TANNYELVŰ KÖZÉPISKOLÁK IX. ORSZÁGOS VETÉLKEDŐJE AL IX.-LEA CONCURS PE ŢARĂ AL LICEELOR CU LIMBĂ DE PREDARE MAGHIARĂ FABINYI RUDOLF KÉMIA VERSENY - SZERVETLEN KÉMIA Marosvásárhely, Bolyai Farkas
LIPIDEK AZONOSÍTÁSA LC-MS/MS MÉRÉSI MÓDSZERREL
 Egészségtudományi Közlemények, 3. kötet, 1. szám (2013), pp. 133 141. LIPIDEK AZONOSÍTÁSA LC-MS/MS MÉRÉSI MÓDSZERREL DR. LOVRITY ZITA 1, DR. EMMER JÁNOS 1, JUHÁSZNÉ SZALAI ADRIENN 1, DR. FODOR BERTALAN
Egészségtudományi Közlemények, 3. kötet, 1. szám (2013), pp. 133 141. LIPIDEK AZONOSÍTÁSA LC-MS/MS MÉRÉSI MÓDSZERREL DR. LOVRITY ZITA 1, DR. EMMER JÁNOS 1, JUHÁSZNÉ SZALAI ADRIENN 1, DR. FODOR BERTALAN
A tömegspektrometria kvalitatív és kvantitatív proteomikai alkalmazása
 A tömegspektrometria kvalitatív és kvantitatív proteomikai alkalmazása Ph.D. értekezés Szájli Emília Dr. Medzihradszky-Fölkl Katalin Témavezető Kémia Doktori Iskola SZTE TTIK Magyar Tudományos Akadémia,
A tömegspektrometria kvalitatív és kvantitatív proteomikai alkalmazása Ph.D. értekezés Szájli Emília Dr. Medzihradszky-Fölkl Katalin Témavezető Kémia Doktori Iskola SZTE TTIK Magyar Tudományos Akadémia,
VIDÉKFEJLESZTÉSI MINISZTÉRIUM. Petrik Lajos Két Tanítási Nyelvű Vegyipari, Környezetvédelmi és Informatikai Szakközépiskola
 A versenyző kódja:... VIDÉKFEJLESZTÉSI MINISZTÉRIUM Petrik Lajos Két Tanítási Nyelvű Vegyipari, Környezetvédelmi és Informatikai Szakközépiskola Budapest, Thököly út 48-54. XV. KÖRNYEZETVÉDELMI ÉS VÍZÜGYI
A versenyző kódja:... VIDÉKFEJLESZTÉSI MINISZTÉRIUM Petrik Lajos Két Tanítási Nyelvű Vegyipari, Környezetvédelmi és Informatikai Szakközépiskola Budapest, Thököly út 48-54. XV. KÖRNYEZETVÉDELMI ÉS VÍZÜGYI
Versenyző rajtszáma: 1. feladat
 1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
1. feladat / 5 pont Jelölje meg az alábbi vegyület valamennyi királis szénatomját, és adja meg ezek konfigurációját a Cahn Ingold Prelog (CIP) konvenció szerint! 2. feladat / 6 pont 1887-ben egy orosz
