Preambulum. Komplexitásinformációtartam. biológia. kémia. sokaság-sokszínűség (kda) Szövet, organizmus. Sejt
|
|
|
- Fruzsina Fülöp
- 8 évvel ezelőtt
- Látták:
Átírás
1 Preambulum Komplexitásinformációtartam Szövet, organizmus biológia Sejt Szupramolekuláris komplexek és nanorendszerek Biomolekulák Biológiai kémia; a természetes vegyületek kémiája kémia sokaság-sokszínűség (kda)
2 egy példa Komplexitásinformációtartam Szövet, organizmus Sejt Szupramolekuláris komplexek és nanorendszerek Biomolekulák sokaság-sokszínűség (kda)
3 A biopolimerek három legfontosabb képviselője: -a peptidek és fehérjék - az oligo- és poliszacharidok - a nukleinsavak
4 Mit találhatunk a segédanyagban? A leírt fejezetek hagyományos értelemben vett ábra gyűjteményként szolgálnak a szerves kémia tanításához. Az első fejezetek az alapvegyület-típusok statikus vonásait hangsúlyozzák (funkciós csoportok, nevezéktan, sztereokémiai, konformációs tulajdonságok stb.). A középső részben bevezető gondolatok találhatók a szerves kémia elméleti jellegű részeinek megértéséhez. A későbbi fejezetek a szerves kémia dinamikus voltát emelik ki (alapreakciók és azok sajátosságai). A felépítés formai jellemzője a címszavas szerkesztés (kérdés, válasz, memo, példa stb.). A kérdés az átgondolandó problémát vezeti be. A válasz a kérdésre adható tömör állítás, amelynek részleteit a magyarázat fejti ki. A megértés szempontjából fontosabb utalásokat a memo címszó után olvashatjuk. A példa olyan érdekes vegyületeket vagy problémákat ismertet, amelyek szoros kapcsolatban vannak az éppen tárgyalt anyagrésszel. A nevezéktan gyakorlása (rövidítésben nev.gyak.) érdekes példákon keresztül szemlélteti a tanultakat. A leírtakkal kapcsolatos megjegyzéseiket szívesen várom a Perczel@chem.elte.hu címen. Dr. Perczel András egy. tanár
5
6 Tények Az elkészített anyag az alábbi könyvekre támaszkodik: 1. Szerves kémia (nomenklatúra) I. Dr. Kucsman Árpád és Dr. Kajtár Márton (1980 Tankönyvkiadó Bp.) 2. Szerves kémia (nomenklatúra) II. Dr. ollósi Miklós (1976 Tankönyvkiadó Bp.) 3. Szerves kémia I., II., III., IV., V. Dr. Kucsman Árpád (1976, ELTE, Tankönyvpótló kiadvány és az azt kiegészítő előadási ábragyűjtemény) 4. rganic Chemistry (7th edition) Graham Solomons and Craig Fryhle (2000 John Wiley and Sons, Inc. New York) 5. A Prime to Mechanism in rganic Chemistry Peter Sykes (1995 Longman Scientific and Technical) A számításokat a Gaussian programcsomag felhasználásával végeztem el. Köszönetnyilvánítás udáky Ilonának, Czajlik Andrásnak, Gáspári Zoltánnak és Kiss Róbertnek a képletek előkészítéséért Kucsman Árpád professzornak kritikai megjegyzéseit valamint a szakmai és módszertani javaslatait
7 Képírás? kazan (tűzhányó) ka (tűz) yama (hegy) Képletírás? ieroglifák: (nincsenek magánhangzók) pl. Rosette-i kő (1822-ben Jean Francois Champollion) Ámon Ré, az ég ura I mem ré neb pet ré: a Napisten neb: ura pet: eget hanaszu (beszélni) iu (mondani) sita (nyelv) memo: - a szimbólum független a tényleges nyelvtől - akár több ezer is szükséges lehet a közléshez m memo: - hieroglifák kódolhatnak szavakat vagy hangokat. szerves kémia: szimbólumaink és kódjaink gondolata hasonló: - nyelvtől független: C 2 - kevert írásmód: Tos-Cl
8 A kémiai szimbólumok fejlődéstörténete 3 C N N N N 1,3,7-trimetilxantin (koffein) 1,3,7-Trimethyl-3,4,5,7-tetrahydropurine-2,6-dione Bruckner III kérdés: mit akarunk kódolni: konstitúciót, konfigurációt, konformációt? Friedrich August Kekulé von Stradonitz ( ) Kekulé álma (1865) 1890-ben a benzol ünnepségeken
9 . A képletírás feladat: leírni az atommagok elrendeződését, az elektronszerkezetet Mielőtt leírjuk a salétromsav Lewis képletét, azelőtt tudnunk kell az atommagok elrendeződését (konnektivitását) pl. N 3 -ban nincs,n kötés: jó rossz N G.N. Lewis és W. Kössel (1916 azaz a kvantummechanika születése előtt ) A Lewis-féle szerkezet: épitőelemek: -az elem vegyjele az atomtörzset jelöli ( azaz vegyértékelektronok számának megfelelő pozitív töltést is a vegyjel szimbolizálja.) pl. a C szimbólum négyszeresen pozitív. -a vegyértékelektronokat egy-egy pont jelöli A semleges atom tehát a vegyértékelektronjaival körülvett atomtörzs. Gilbert N. Lewis N N C kovalens kötés : egy elektronpár megosztását jelenti két atom között (egyetlen vonallal jelölünk) nemkötő elektronpár : csupán egyetlen atomtörzshöz kapcsolódó két elektron (pontpárként tüntetjük fel).
10 Töltéssel rendelkező molekulák: Cl 3 vegyértékelektronok száma: 7 + 3(6) + 1 = 26 Cl Cl 3 Töltés = (vegyértékelektronok száma) -( asszignált elektronok száma) 1-1=0 töltése 2(1) + 6 = =0 N töltése N 5-4= +1 N töltése N 1-1=0 töltése Példák: C 3 2, N 2, CN, C3, N2, S4, C 2 memo: míg az ammóniá-ban 5, addig az ammónium kationban a nitrogénatomhoz csak 4 e rendelhető!
11 Kivételek az oktettszabály alól: - az elektronhiányos atomok esete: pl. BF 3 F F B F 6 elektron - a nem második periódusbeli atomok esete: pl. S 2-4 vagy PCl 5 10 elektron 12 elektron Cl Cl P Cl S Cl Cl
12 A szubsztitúciós nevezéktan (Szn) alapgondolata metán etán propán bután.. undekán típusnév : alkán alapvegyület alapneve etin propin típusnév : alkin butin. alapvegyület funkcionális alapneve. undekin metanol etanol propanol butanol...undekanol típusnév : alkanol vagy hidroxialkán előtag : hidroxi utótag : ol funkcionális alapnév etén propén típusnév : alkén butén. alapvegyület funkcionális alapneve. undekén klórmetán klóretán klórpropán flórbután típusnév : halogénalkán.. alapvegyület funkcionális alapneve brómundekán X előtag : halogén utótag : nincs
13 A szubsztitúciós nevezéktan alapszabályai Utótagok száma maximum egy lehet, de az -én, -in nem számít mert az módósítás és nem utótag. pl. helyes az okt-2-én vagy az okt-2-én-1-ol helytelen az okt-3-ol-1-al 3-hidroxibutanal előtag utótag hidroxi ol alkohol oxo on keton oxo al aldehid helyes a 3-oxobutánsav Előtagok száma korlátlan lehet, melyeket az angol ABC szerint rakunk sorba pl. helyes az 4-etil-2-metilheptán-1,6-diol Az utolsó előtagot az alapnévvel mindig egybeírjuk pl. helyes az 1-klór-2-fluorpropán
14 A csoportfunkciós nevezéktan (Csn) alapgondolata A molekulát gondolatban két részre osztjuk: csoportra és funkcióra, melyeknek megadjuk a nevét és ezeket kötőjellel kötjük össze. E nevezéktan jelentősége főleg a homológ sorok egyszerűbb tagjainál fontos: metil, etil, propil, izopropil, butil, szek-butil, izobutil, terc-butil, pentil, izopentil, neopentil, hexil. típusnév : alkil-halogenid X metil-klorid etil-klorid propil-klorid butil-fluorid..undecil-bromid metil-alkohol etil-alkohol propil-alkohol butil-alkohol.. típusnév : alkil-alkohol Csoportnevek Funkciós nevek metil klorid etil alkohol propil keton izopropil éter szek-butil szulfoxid izobutil... A csoportfunkciós neveket mindig kötőjelezzük: izopropil-alkohol, szek-butil-klorid, etil-alkohol, stb.
15 I. Szénhidrogének 1. Alkánok (paraffinok) (C n 2n+2 ) típusnév: alkán 1/A Normális szénláncú alkánok (elágazást nem tartalmazó vegyületek) homológ sor ( -án végződés) metán n=1 C 1 4 etán n=2 C 2 6 propán n=3 C 3 8 bután n=4 C 4 10 pentán n=5 C 5 12 hexán n=6 C 6 14 heptán n=7 C 7 16 oktán n=8 C 8 18 nonán n=9 C 9 20 dekán n=10 C undekán n=11 dodekán n=12 tridekán n=13 tetradekán n=14 eikozán n=20 C 1 -től C 4 -ig (normál körülmények között) gáz, C 5 -től C 17 -ig illékony vagy nem illékony folyadék C 18 -tól szilárd anyag. nyersolaj: szerves vegyületek összetett keveréke metán: ős-atmoszféra fő komponense (ma a Jupiter, Szaturnusz, Uránusz és Neptunusz atmosz. fő komp.), földön: földgázban (anaerob metanogén bakt. termelik C 2 és 2 -ből, egyes bakt. szénforrása)
16 Az alkánok (parafinok) kötésrendszere kötésmód: kötési adatok: típusú C-C és C- r(c-c) = 1.54 Å r(c-) = 1.09 Å (-C-) = 109 o (C-C-C) = 109 o Dipólusmomentum ( )= r * e Pauling féle elektronnegativitás: e ()=2,1 e (C)=2,5 e (N)=3,0 e ()=3,5 e (F)= 4,0 (C-) = 1.09*(0.4 )= 0.44 Debye (ez viszonylag kicsi, ezért is appoláris már a kötés is, nem csak a molekula) metán A normál és elágazó szénláncú alkánok -je nulla, de csak ha a geometria ideálisan tetraéderes. a ettől eltér (lásd itt) akkor kis megjelenhet. (C 4 )= 0 D (C 2 6 )= 0 D (C 3 8 )= 0.1 D (Bu C 1- C 2- C 3- C 4 =180 o )= 0 D (Bu C 1- C 2- C 3- C 4 =60 o )= 0,1 D (ibu)= 0,13 D (C 5 12 all-transz)= 0,1 D
17 Pauling féle elektronnegativitás alapján: erősen poláris K-héj e L-héj Li Be B C N F Ne poláris apoláris
18 Csoportnevek ( -il végződés) (C n 2n+1 ) metil n=1 -C 1 3 Me etil n=2 -C 2 5 Et propil n=3 -C 3 7 Pr butil n=4 -C 4 9 Bu pentil n=5 -C 5 11 hexil n=6 -C 6 13 undecil n=11 C /B Elágazó szénláncú alkánok keressük a leghosszabb összefüggő egyenes (normális) szénláncot és azt számozzuk 3 C C 2 C 2 szerkezeti izoméria i z o b u t á n Butane bután C 3 3 C C C 3 I s o b u t a n e izobután 2 - m e t i l p r o p á n 3 C C C 2 3 C C 2 C 2 C 2 2-Methylbutane 2-metilbután Pentane pentán izopentán 3 C C 2,2-Dimethylpropane 2,2-dimetilpropán neopentán
19 Megjegyzések az izomériáról: görög: iszosz egyenlő + merosz rész Molekulák (kettő vagy több) amelyek azonos számú és minőségű atomokból épülnek fel, azaz összegképletük azonos, de fizikai és kémiai tulajdonságai különböznek. (J.J.Berzelius, 1830) Konstitúciós izoméria (szerkezeti izoméria): az izomer vegyületek molekuláiban az atomok eltérő sorrendben kapcsolódnak egymáshoz (pl. etil-alkohol és dimetil-éter) elyzetizoméria (a konstitúciós izoméria alesete): az izomer vegyületek molekuláiban az atomlánc azonos, de a funkciós csoportok helyzete eltérő (pl. but-1-én és but-2-én, vagy orto- és para-xilol)
20 Sztereoizoméria: a sztereoizomer vegyületek molekuláinak csak a térbeli felépítése eltérő -ptikai (konfigurációs) izoméria: a sztereoizomer vegyületek molekuláiban az aszimmetriás atom(ok) konfigurációja eltérő (pl. (R)-bután-2-ol és (S)-bután-2-ol) - Cisz-transz (geometriai) izoméria: a sztereoizomer vegyületek molekuláiban a kettőskötés menti elhelyezkedése eltérő (pl. cisz-1,2-dimetilciklohexán és transz-1,2-dimetilciklohexán) -Konformációs izoméria: a sztereoizomer vegyületek molekuláiban a lehetséges téralkatok eltérőek (pl. ciklohexán szék és csavartkád téralkata
21 hexánizomerek (5 különböző molekula) 3 C C 2 C 2 C 2 C 2 3 C C 2 C C 2 exane 3-Methylpentane hexán 3-metilpentán 3 C C C 2 3 C C C 2 C 2 3 C C C 2,2-Dimethylbutane 2-Methylpentane 2,3-Dimethylbutane 2,2-dimetilbután 2-metilpentán 2,3-dimetilbután Szénatomok rendűsége hány szomszédos szénhez kapcsolódik a vizsgált szén: 0 metán, 1, 2, 3, maximum 4 primer szekunder 3 C C C 2 C 2,2,4-Trimethylpentane 2,2,4-trimetilpentán tercier kvaterner
22 Egyértékű és többértékű csoportnevek 3 C 3 C C 2 C 2 propil (Pr) 3 C C C 2 C 2 izopropil (i-pr vagy iso-pr) 3 C C 2 C 2 C 2 3 C 2 C C butil (Bu) 3 C szek-butil (s-bu vagy sec-bu) C metilén metin C 3 C C C 2 3 C C 3 C izobutil (i-bu vagy iso-bu) terc-butil (t-bu vagy terc-bu) 3 C C (C 2 ) n C 2 3 C az izoalkil a C5 vagy annál rövidebb esetekben szabályos C 2 C 2 etilén C etilidén
23 Példák az alkánok elnevezésére: 3 C 2 C C 3 C C 3-Ethyl-2-methylheptane C 2 C 2 C 2 3-etil-2-metilheptán 2 3 nev.gyak. 2,2,4-Trimethylheptane 3 C C 2 C 2 C C 2 C 2,2,4-trimrtilheptán 3 C C 2 C 2 C C 2 C C Ethyl-5-methylheptane 3-etil-5-metilheptán helytelen a (3-metil-5-etilheptán) Azonos helyzetszám esetén a névsorban előbb álló csoport (angol ABC) C 2 Közelebb legyen a láncvéghez az elágazás (kisebb szám) nem 6,6,4 vagy 4,6,6 3-Ethyl-2,6-dimethylheptane 3-etil-2,6-dimetilheptán 3 C C C 2 C 2 C C 2 6 vagy 6 2 Azonos elágazások azonos helyen akkor a következő csoport számít (3-etil és nem pedig 5- etil)
24 Feladat: A 3 C C 2 C C C 2 C C 3-Ethyl-2,5,6-trimethylheptane 3-etil-2,5,6-trimetilheptán B C 2 3-Ethyl-4-isopropyl-5,5-dimethylheptane 3 C C 2 C C C C 2 3-etil-4-izopropil-5,5-dimetilheptán 3 C C memo: a di- sokszorozó tag nem számit C 3 C C 2 C C 2 C 2 C 2 C C 2 C C 2 C C 2 C 2 C 2 C 2 3 C C C 2 3 C C 2 C C 2 6-sec-Butyl-4,4-dimethyl-8,8-bis-(2-methyl-butyl)-tridecane 6-szek-butil-4,4-dimetil-8,8-bisz(2 -metil-butil)-tridekán
25 Alkánok és cikloalkánok olvadás és forráspontja C forráspont C n 2n+2 1 n 14 olvadáspont op ( C) fp ( C) C 6 14 n-hexán 95 68,7 C metilpentán 153,7 60,3 C metilpentán ,3 C ,3-dimetilbután 128,8 58 C ,2-dimetilbután 98 49,7 -Az alkánok felületének nagysága határozza meg azok forráspontját: minél kisebb a felületük annál alacsonyabb a forráspontjuk, mivel ilyenkor a van der Waals erők a molekulák között gyengébbek. -A forráspont C 2 - csoportonként C-al emelkedik. -A felület elágazó szénláncú- vagy cikloalkánok esetében kisebb lehet, ami forráspontcsökkenéshez vezet -Az alkánok olvadáspontja a szénatom számmal nő, kivéve a propán esetében. -A páratlan szénatom számú alkánok pakoltsága a kristályban nagyobb, ezért olvadáspontjuk a vártnál alacsonyabb.
26 Van der Waals-, London-, diszperziós- vagy intermolekuláris-erők tény: az apoláris alkánok pl. metán olvadás ( 182,6 C) és forráspontja ( 162 C) alacsony. kérdés: miért? megjegyzés: egyáltalán miért fagy meg egy nem-ionos és nem-poláris molekula? magyarázat: alkánok esetén a töltéseloszlás időátlagban zéró, ezért nincs permanens dipóljuk (μ= 0). Az elektronok mozgása miatt, egy adott pillanatban viszont van töltésszeparáció: tehát létezik ekkor is átmeneti dipólmomentum. A tranziens polarizáció eredménye: - a szomszéd molekulák polaritásának indukálása, - rendező elv (intermolekuláris kölcsönhatás) megjelenése a nem volna átmeneti dipólusmomentum, akkor nem lenne kölcsönhatás! δ+ δ δ+ δ δ+ δ δ+ δ vonzás Mindig van átmeneti dipólusmomentum, ezért mindig van kölcsönhatás! Johannes Diderik van der Waals (holland, ) Fizikai Nobel-díj: 1910 δ+ δ δ+ δ δ+ δ δ+ δ optimális taszítás memo: e: fp= 4K Kr: fp= 120K N 2 : fp= 77K Cl 2 : fp= 239K
27 2. Cikloalkánok cikloparafinok (C n 2n ) típusnév: cikloalkán 2/A Elágazásmentes egygyűrűs cikloalkánok homológ sor ( -án végződés) konformációs feszültség a gyűrű tagszám függvényében 88 o α CCC = 60 α CCC = 88 α CCC = C 2 C C 2 C 2 C 2 C C C 2 C 2 C C 2 C 2 C 2 2 C C 2 Cycloheptane Cyclooctane α CCC = cikloheptán ciklooktán α CCC ~ 114 α CCC ~ 116
28 Alkánok és cikloalkánok reaktivitása C 3 memo: van aki emiatt a ciklopropil gyűrűt pszeudo-kettőskötésként emlegeti memo: egy feszültebb cikloalkil gyűrű (pl ciklopropil), akár már funkciós csoportként is felfogható! Csoportnevek ( -il végződés) (C n 2n-1 ): 2 C C 2 C C 6 ciklopropil
29 2/B ldalláncot tartalmazó egygyűrűs cikloalkánok 2 C 2 C C 2 C 2 C C 2 C 2 C 2 C C 2 C2 C Methylcyclopropane metilciklopropán 1,1-Dimethylcyclobutane 1,1-dimetilciklobután Methylcyclopentane metilciklopentán Példa: szteroidok bioszintézise növényekben szkvalénböl izolálható intermedier
30 Konstitúció: szerkezeti izoméria (bután, izobután esete) Konformáció: lehetséges térszerkezetek (etán fedő térállás, etán nyitott térállás) 3 kcal/mol 60 o (ciklohexán szék térállás, ciklohexán csavart kád térállás) axiális ekvatoriális 5.5 kcal/mol memo: 3 axiális - estén a vdw felületeik nem érnek össze, de ha Me-, -, stb. szubsztituensek kerülnek axiális helyzetbe, akkor a vdw felületek átfednek és ezért megjelenik a taszítás (instabilitás), szin-diaxiális kcs. energia minimum: szék és a csavart kád térállás átmeneti állapot: félsík (5 atom egy síkban) és a kád téralkat
31 axiális metilcsoport csavart kád E RF/3-21G = artree =0.08 Debye Térszerkezet (konformáció): a metilciklohexán konformációja axiális metilcsoport szék E RF/3-21G = artree = 0.04 Debye 6.71 kcal/mol 1.9 kcal/mol 1.92 kcal/mol ekvatoriális metilcsoport csavart kád E RF/3-21G = artree =0.05 Debye 6.73 kcal/mol ekvatoriális metilcsoport szék E RF/3-21G = artree = 0.05 Debye memo: a nagy térigényű szubsztituensek leggyakrabban az ekvatoriális pozícióban stabilabbak mint ha axiális helyzetben volnának.
32 Diszubsztituált cikloalkánok: (bővebben lásd a konformációs fejezetet) Kérdés: hány 1,2-dimetilciklopropán létezik? Válasz: 3 sztereoizomer különíthető el Eliel C C C C 3 R, R t ü k ö r s í k S, S C 3 1, 2 - D i m e t h y l c y c l o p r o p a n e 1, 2 - d i m e t i l c i k l o p r o p á n 3 C * * C 3 C 3 * * 3 C t ü k ö r s í k t ü k ö r s í k C 3 3 C C 3 C 3 C 3 C 3 c i s z - 1, 2 - d i m e t i l c i k l o p r o p á n a k i r á l i s " m e z o " f o r m a t r a n s z - 1, 2 - d i m e t i l c i k l o p r o p á n t r a n s z - 1, 2 - d i m e t i l c i k l o p r o p á n k i r á l i s o p t i k a i i z o m e r e k e n a n t i o m e r p á r
33 3. Többgyűrűs telített szénhidrogének 3/A Izolált gyűrűket tartalmazó szénhidrogének C 2 C 2 Bicyclohexyl biciklohexil Cyclopentylcyclohexane ciklopentilciklohexán 1,2-diciklohexiletán 3/B Kétgyűrűs rendszerek egy közös szénatommal (spiránok) 2 C C C 2 2 C C 2 Spiro[2.2]pentane spiro[2.2]pentán C 2 C 2 2 C C 2 C C 2 2 C C2 2 C C 2 Spiro[4.5]decane spiro[4.5]dekán 3 C 1,6-Dimethylspiro[3.4]octane 1,6-dimetilspiro[3.4]oktán
34 3/C Kétgyűrűs rendszerek két közös szénatommal ctahydro-indene biciklo[4.3.0]nonán hidrindán nem síkalkatú Decahydro-naphthalene biciklo[4.4.0]dekán dekalin előzmény: Baeyer (1885): ciklohexán síkalkatú Mohr (1918): ciklohexán szék-kád alkatú kérdés: a dekalinnak hány stereoizomerje van? válasz: kettő gyűrű anelláció 2 /Pt ( C) cisz-dekalin op: 43 o, fp: 194 o Naphthalene naftalin ückel (1925) 2 /Pt (gáz) transz-dekalin op: 31 o, fp: 185 o
35 Érdekes kondenzáltgyűrűs rendszerek: a sztrichnin és a brucin R N Bruckner : III-2/1002 R N R= sztrichnin R= brucin - hétgyűrűs molekula, - bázisos kémhatás, - tercier amin, - reszolválás (savakat) eredet: növényi cserje (Strychnos faj) Pelletier és Caventou (1819) fiziológiás hatás: - erős méreg (LD 50 = 10 mg/kg ) (merevgörcs és fulladás) - igen keserű Strychnos nux-vomica) dél-kelet Ázsiában honos, örökzöld faféle
36 3/D Áthidalt gyűrűs rendszerek C 2 C 2 C C C 2 C 2 C 2 C 2 C C 2 C 2 Bicyclo[4.3.2]undecane biciklo[4.3.2]undekán Példa: a kámfor Cinnamomum_camphora 2 C C C 3 C C 2 C C 2 C kámfor áttetsző, viaszos, szilárd kristályos anyag, erős és átható aromás illattal, helyi keringésfokozóként reumás kenőcsökben
37 Példa: gyémántrács része fullerének adamantán C 60 Fullerenes are not hydrocarbons, but consist of carbon atoms only! These compounds are composed solely of an even number of carbon atoms, which form a cage-like fused-ring polycyclic system with twelve fivemembered rings and the rest sixmembered rings. The archetypal example is [60]fullerene, where the atoms and bonds delineate a truncated icosahedron. The larger [70]fullerene is expanded by an additional ring of six-membered rings along the equator of its longer axis.
38 xidáció és redukció a szerves kémiában: Példa: a fotoszintézis 6 C 2 (gáz) fotonok C alapanyag redukálószer cukor melléktermék kérdés: mit jelent az hogy a víz redukálószer? válasz: a széndioxid szénatomja olyan C atommá redukálódik, mint amilyen a cukorban van, avagy a molekulának csökken a relatív oxigén tartama. R C karbonsav [] red. R csökken az oxigén tartam C aldehid [] red. R alkohol C 2 nő a hidrogén tartam [] red. R alkán kérdés: hogyan tegyük kvantitatívvá? válasz: 1. keressük meg azt a C-t amelyik (amelyek) oxidációs- száma a reakcióhoz köthetően változik. 2. C-X kötés ( 1) ha X e.-negativitása < C; pl. C- = 1 3. C-Y kötés (+1) ha Y e.-negativitása > C; pl. C-F = C-C kötés (0) Egy példa redukcióra: az oxidációs állapot egyre csökken: -1 C 2(+1) (+1) C C C red. red. red. = +2 = 0 = -2 = -4-1
39 példa: 1) rendezze oxidációs állapot szerint sorba a következő vegyületeket: C 4, C 2, metanol, hangyasav, formaldehid! C 4 ( 4)< ( 2)< C (0)< C (+2)< C2 (+4) 2) milyen oxidációs-szám változás kíséri a metanol formaldehiddé oxidálását? ( 2) C (0) tehát: 2 0 ami oxidációt jelent hiszen az oxidációs állapot nő memo: az előbbi oxidációt végezhetjük 2 Cr 4 -el amiből Cr 3+ lesz [kromátanion Cr 4 2 (Cr 6+ ) kromit (Cr 3+ )] tehát a Cr redukálódik példa: 3) Mi a szenek ox.-állap. az Et, C és -C-ban? (+1) 0 2(+1) -1 C C -1-1 C C C C ) Mi is történik a fotoszintézis során? 6 C 2 (gáz) fotonok C redukálószer 0 melléktermék Ami redukciót jelent, mert a C-k oxid.állapota csökken: ) Mi a szenek ox.-állapota az etánban és az eténben? C C -1 C C memo: ox.-szám nő oxidáció, pedig nem jelenik meg -atom. memo: (elektronnegativitás) K-héj e L-héj Li Be B C N F Ne
40 2 C C 2 Ethene etén (etilén) 2 C C régi nevek Propene propén 4. Alkének (olefinek) (C n 2n ) típusnév: alkén (propilén) 4/A Láncelágazástól mentes homológ sor( -én végződés) C C C 2 3 C C C But-1-ene but-1-én But-2-ene but-2-én (2-butén) Az etén szigma-váza : 5 lokalizálható kötés Az etén π-pályája : 1 delokalizált kötés
41 2 C C Isobutylene 2-metilpropén izobutilén 4/B Elágazó szénláncú alkének 3 C C C 3 C 2-Methyl-but-2-ene 3 C C C C 2 3 C 3-Methyl-but-1-ene 3-metilbut-1-én szerkezeti izomerek C 2 2 C C 2-metilbut-2-én 2-Methyl-but-1-ene 2-metilbut-1-én Csoportnevek ( -il végződés) (C n 2n+1 ) 2 C vinil C 3 C C C propenil nev.gyak.: C C C allil szerkezeti izomerek 3 C C 2 C izopropenil
42 .. C.. Az alkének (olefinek) elektronszerkezete sp 3 sp 2 Kucsman I 6/8 sp 2* (LUM) 1 (M) Az olefinek térszerkezete: cisz-transz izoméria a d b e h d a a b e b e d cisz (Z)-forma transz (E)-forma memo: Z: zusammen (együtt), E: entgegen (ellentétes) [német]
43 Alkének stabilitása: megfigyelés: 1) az alkének Pt katal. jelenlétében hidrogénezhetők. 2) ez a reakció exoterm, kb kcal.mol -1 hő képződik. 3) ez a reakció a különböző alkének stabilitásának összehasonlítására is felhasználható: # = # = memo: minél nagyobb a hidrogénezési hő (a képződési entalpia), annál instabilabb volt a kiindulási alkén. Ebben az esetben tehát, a értékek alapján a transz but-2-én a legstabilabb, a cisz forma labilisabb (~1 kcal.mol -1 ) és a but-1-én a leginstabilabb (~2.7 kcal.mol -1 ) alkén.
44 brómaddíció: Alkének kimutatása permanganátos oxidáció: a brómos víz elszíntelenedik az ibolya szín barnára vált ozonolízis: 2 3 C C l 3 á t r e n d eződ é s r e d u k t í v k ö z e g p e r o x i d b o n t á s Z n / A c m o l o z o n i d
45 5. Cikloalkének (cikloolefinek) (C n 2n-2 ) típusnév: cikloalkén Cyclopropene ciklopropén Cyclobutene Cyclopentene Cyclohexene ciklobutén ciklopentén ciklohexén 3 C C 2 5 3,3-Dimethylcyclopent-1-en 3,3-dimetilciklopent-1-én 3-Ethyl-5-methylcyclohex-1-en 3-etil-5-metilciklohex-1-én Bonyolultabb cikloalkánok (cikloparafinok) C C C 2 C 2 C 2 C C C 2 Bicyclo[3.2.1]oct-6-ene biciklo[3.2.1]oct-6-én 1 2 C C C 2 But-1-enyl-cyclohexane 1-ciklohexilbut-1-én
46 6. Két vagy több kettőskötést tartalmazó szénhidrogének (C n 2n-2 ) típusnév: alkadién, alkapolién 6/A1 kumulált diének 2 C C C 2 2 C C C 3 C C C C 5 atom egy síkban allene allén Propa-1,2-diene propa-1,2-dién Buta-1,2-diene buta-1,2-dién Penta-2,3-diene penta-2,3-dién 6/A2 konjugált diének A butadién a legegyszerűbb nyílt szénláncú konjugált dién. Színtelen gáz, ami könnyen cseppfolyó-sítható. Egy szerkezeti izomerje az 1,2-butadién létezik. 2 C C C C 2 Buta-1,3-diene buta-1,3-dién butadiene butadién 10 atom egy síkban 3 C C C C C 2 4-Methyl-penta-1,3-diene 4-metilpenta-1,3-dién
47 A buta-1,3-dén elektronszerkezete: Elektronszerkezet: konjugáció atárszerkezetek: konjugáció Kötéshosszak: konjugáció
48 Alkadiének stabilitása: megfigyelés: 1) az alkének és alkadiének is Pt katal. jelenlétében hidrogénezhetők. 2) ez a reakció exoterm, kb kcal.mol -1 hő képződik egy-egy kettőskötés telítésekor. 3) a konjugáció mértéke (extra stabilizáció) ezen az úton kvantifikálható. # = # = memo: minél nagyobb a hidrogénezés hő (a képződési entalpia), annál instabilabb volt a kiindulási alkadién. Ebben az esetben a értékek alapján az izolált 2-ös kötést tartalmazó transz pent-1,4-dién és a transz pent- 1,3-dién stabilitási különbsége éppen 6.5 kcal.mol -1, ami a konjugáció következménye.
49 izoprén C 5 8 Példák természetes konjugált di- és pliénekre: az izoprénvázas vegyületek (terpenoidok és karotinoidok) monoterpének (C 5 8 ) 2 + mircén fej-láb illeszkedés memo: a babérfa illóolaja (fp: 167 o ) ocimén (fp 30 : 81 o ) omológsor monoterpének C szeszkviterpének C diterpének C szeszterterpének C triterpének C Példák érdekesebb aciklusos monoterpén származékokra: Bruckner II-1284 transz cisz geraniol (fp: 229 o ) geraniumolaj nerol (fp: 225 o ) narancsvirágolaj Példák érdekesebb ciklusos monoterpén származékokra: * - j o n o n i b o l y a i l l a t ú o l a j k i r á l i s b - j o n o n i b o l y a i l l a t ú o l a j a k i r á l i s * g - j o n o n í r i s z v i r á g b ó l i z o l á l h a t ó k i r á l i s
50 Egy érdekes szeszkviterpén (C ): farnezol Két fontos diterpén (C ): E-vitamin: tokoferol (zsíroldható vitamin, antioxidáns) avitaminózis: terhesség megszakadása memo: a juvenil hormonnal (rovarok növekedési faktorával) azonos hatású anyag 3 C C 2 C 2 C 2 C C mg/100 g napraforgóolaj K-vitamin: fillokinon(zsíroldható vitamin, posztranszlációs módosítások során szükséges) avitaminózis: vérzékenység 3 sóska, spenót, káposzta
51 Néhány fontos szeszterterpén (C ) - a karotinoidok Egy igen fontos, a konjugáció miatt színes polién: a b-karotin: lipofil, antioxidáns béta-karotin (carotene) lipofil, antioxidáns protektív hatású magas koncentráció a makulában (retina része) (UV fény ellen véd)
52 További fontos diterpén származékok: * k a p s z a n t i n ( p a p r i k a s z i n e ) c a p s a n t i n színtelen, szagtalan fehér kristály a paprika ereje, az I típusú vanilloid receptorhoz köt M e k a p s z a r u b i n ( p a p r i k a s z i n e ) N k a p s z a i c i n ( a p a p r i k a e r e j e ) e g y a l k a l o i d
53 6/A3 Izolált diének 2 C C C 2 C C 2 Penta-1,4-diene penta-1,4-dién nev.gyak. Azt a szénláncot válasszuk amelyik a legtöbb kettőskötést tartalmazza: 3 C 3 C C C C C C C 2 C 2 C C 2 C C M e t h y l ( 1 - m e t h y l - b u t y l ) - h e p t a - 1, 5 - d i e n e 6 - m e t i l ( 1 - m e t i l - b u t i l ) - h e p t a - 1, 5 - d i é n 6/B Ciklusos diének, ciklodiolefinek (C n 2n-4 ) típusnév: cikoalkadién kumulált: konjugált: izolált: Cyclohepta-1,2-diene ciklohepta-1,2-dién 2 C C C C 2 Buta-1,2,3-triene Cyclopenta-1,3-diene ciklopenta-1,3-dién 6/C Poliének Cyclohexa-1,4-diene ciklohexa-1,4-dién buta-1,2,3-trién tipusnév: kumulén C y c l o h e p t a - 1, 3, 5 - t r i e n e c i k l o h e p t a - 1, 3, 5 - t r i é n C y c l o o c t a t e t r a e n e c i k l o o k t a - 1, 3, 5, 7 - t e t r a é n c i k l o o k t a t e t r a é n
54 Előállítás: gyökös reakció (C 2 + R. ) mol.tömeg szabályozható az iniciátor koncentrációval. memo: polietilén a legtöbbet használt műanyag (1943-óta gyártják, 10 8 t/év ): zacskók, üvegek, játékok, golyóálló mellény, stb. környezetvédelem: a PE nem biodegradál! (noha a Sphingomonas baktérium lebontja néhány hónap alatt). Polietilén: (C n 2n )
55 C Ethyne C etin acetylene acetilén 7. Alkinek (acetilén-szénhidrogének: C n 2n-2 ) típusnév: alkin homológ sor ( -in végződés) 7/A Nyílt szénláncú C C C C C C Buta-1,3-diyne Propyne buta-1,3-diin propin metilacetilén karbidlámpa műkődés során: CaC = Ca + C 2 2 Miközben az égetett mészből oltott mész lesz: Ca + 2 = Ca() 2 Az acetilén elég és ez világit: 2C = 4C C C C 2 3 C C C But-1-yne but-1-in But-2-yne but-2-in memo: 1 kg karbidból kb liter gáz keletkezik ami akár órai világításra is elegendő lehet. Csoportnevek ( alkinil végződés): C C 3 C C C C C C 2 etinil propin-1-il propin-2-il propargil
56 7/B Ciklusos alkinek (cikloalkin): C n 2n 4 típusnév: cikloalkin Cyclooct-1-yne ciklooktin 7/C kettős és hármas kötéseket tartalmazó szénhidrogének 2 C C C C példa: R But-1-en-3-yne but-1-én-3-in vinylacetylene vinilacetilén 2 C C C C 2 C 2-Ethyl-but-1-en-3-yne 2-etilbut-1-én-3-in C 2 C 2 C C 2 C C C 2 C C C C 2 C C C C 2 C nev.gyak. C C C 2 C C C C 2 6-(propin-2-il)-1,3,7-oktatrién A kettős kötés rangosabb mint a hármas kötés 6- acetilénkarbonsav hármas kötéseket tartalmazó növényi zsírsav
57 II. alogénezett szénhidrogének alapszénhidrogén: nyílt gyűrűs alapszénhidrogén: telített telítetlen X= X n n= 1, 2, 3, egy-, két-, többértékű X= típusa szerint X= kapcsolódása szerint: elsőrendű másodrendű harmadrendű primer szekunder tercier geminális vicinális diszjunkt 1. Nyílt szénláncú, telített egyértékű halogénezett szénhidrogének (C n 2n+1 X) típusnév: halogénalkán, alkil-halogenid 3 C Br 3 C C 2 Br Bromomethane Szn (egybeírjuk) Bromoethane brómmetán brómetán Methyl bromide metil-bromid ethyl bromide etil-bromid helyzetizoméria(szubsztitúciós izoméria) 1 3 C C 2 C 2 Br 1-Bromopropane 1-brómpropán propyl bromide propil-bromid Br Cl F I bróm klór fluor jód Csn (kötőjellel írjuk) Szn (egybe írjuk) Csn (kötőjellel írjuk) Csn (angolul két szóba írjuk) Br 3 C C 2 2-Bromopropane 2-brómpropán isopropyl bromide izopropil-bromid
58 Alkil-halogenidek elektronszerkezete A kapcsolódó atomok eltérő elektron-negatívitása miatt a heteronukleáris σ-kötések polarizálódnak; pl. C(δ+) míg X(δ ). Az elektron negatívitás (EN:= a kötött állapotú atom elektron vonzó képessége) a F I irányba csökken: (F:4,1, Cl: 2,8, Br:2,7, I:2,2). A kötéshossz (r) az F I irányba nő. tehát: a két hatás ellentétes, ezért a σ-kötések μ értékei nem feltétlenül monoton változnak C r(å) δ+ δ δ δ+ X C X C C Y μ 0 μ 0 I effek. alap +I effekt. C(sp3)-X(sp3) r(å) köt. energ. (kcal/mol) dipol.mom. (D) C-F 1, ,51 C-Cl 1, ,56 C-Br 1, ,48 C-I 2, ,29 A mínusz induktív effektus: X halogénatom elektronszívó hatással van a teljes molekula elektronrendszerére. memo: EN C:2,5, N:3,1. :3.5 és :2,1). metil-halogenidek kísérleti μ (D) értékei: X C 2 X 2 CX 3 CX 4 F 1,82 1,97 1,65 0 Cl 1,94 1,60 1,03 0 Br 1,79 1,45 1,02 0 I 1,64 1,11 1,00 0
59 Az induktív effektus: A jelenség leírása: egy dipólus jellegű poláros σ-kötés a molekulában a vele szomszédos kötés(ek)ben a töltések bizonyos fokú szétválását eredményezi, ami a dipólus jelleg erősödését vonja maga után. (További dipólus indukálódhat egy-egy szomszédos σ-kötéseken. A polározódás mértéke a hatást kiváltó atom- vagy atomcsoporttól való távolság függvénye. az induktív effektus erőssége a funkciós csoporttól távolodva szénatomonként kb. 1/3-ára csökken, tehát a molekulának csak az X csoporthoz közel eső részére terjed ki. ) a a molekula valamelyik szénatomjához a szénnél nagyobb elektronegativitású, tehát "elektronszívó", elektronakceptor X atom vagy atomcsoport kapcsolódik, akkor a kötés C X irányba polározódik. Így a σ-kötések elektronjai az X irányába tolódnak el és a C-atomon parciális pozitív töltés alakul ki: ezt nevezzük negatív induktív effektusnak: jele -I. a elektronküldő (elektrondonor) csoport amit jelöljük Y-nal, kapcsolódik, akkor annak hatása természetesen fordított: ezt a pozitív induktív effektus (+I). Látható, hogy a -I effektussal rendelkező elektronszívó csoportok száma nagyobb. Pozitív induktív effektust csak egyes negatív töltésű ionok, és a kis elektronegatívitású elemek (pl. P, Si, Sn, fémek) fejtenek ki.
60 Metil-halogenidek szerkezete, elektronsűrűsége a metil-halogenidek vákuumban számolt dipólusmomentumai: Me-F =2.34 Debye (RF/3-21G) =2.37 Debye (RF/ Gd,p) A teljes elektronsűrűség izofelülete a.u. Me-Cl =2.87 Debye (RF/3-21G) =2.67 Debye (RF/ Gd,p) Me-I =1.97 Debye (RF/3-21) Me-Br =2.16 Debye (RF/3-21G) =2.45 Debye (RF/ Gd,p)
61 A teljes elektronsűrűség ( a.u. ) izofelszinén színnel kódolt elektrosztatikus potenciálérték Me-F =2.37 Debye (RF/ Gd,p) C-X=1.40A piros, sárga, zöld, kék töltés Me-Br =2.45 Debye (RF/ Gd,p) C-X=2.0A piros, sárga, zöld, kék töltés
62 3 C 3 C C C 2 Br Br 3 C C C 2 3 C C Br 1-Bromo-2-methylpropane 1-bróm-2-metilpropán izobutil-bromid 2-Bromo-butane 2-brómbután szek-butil-bromid 2-Bromo-2-methylpropane 2-bróm-2-metilpropán terc-butil-bromid Csn IUPAC nevezéktan: vegyük a leghosszabb szénláncot. Azon a végen kezdjük a számozást amelyikhez közelebb van az első szubsztituens (pl. Br-, -, i Pro-): minden szubszt. egyforma. Adjuk az elágazásoknak a lehető legkisebb sorszámot, a szubsztituens sorrend az angol ABC szerint megy. nev.gyak. 6 3 C C 2 C Szn 3 C 2 C 2 C 2 C 1-Bromo-3-ethyl-6-methyloctane 1-bróm-3-etil-6-metiloktán 1 C 2 C 2 Br C 7 3 C 3 B r C C 3 C 2 3 C C 2 C C 2 C 2 C 1 7 C 3 3 C C C C 3 C 2 C 2 C C 2 C 2 B r C l 1 - B r o m o c h l o r o - 3, 6 - d i m e t h y l o c t a n e C 2 C 2 B r 1 1, 7 - D i b r o m o - 3, 6 - d i e t h y l m e t h y l o c t a n e
63 2. Gyűrűs, telített egyértékű halogénezett szénhidrogének (C n 2n 1 X) típusnév: halogéncikloalkán (Szn) cikloalkil-halogenid (Csn) Br C 2 Br 1 Bromocyclohexane brómciklohexán Bromomethylcyclohexane brómmetilciklohexán Br 1-Bromo-1-methylcyclohexane 1-bróm-1-metilciklohexán konformációanalízis az 1-bróm-1-metil-ciklohexán térszerkezete szék 1 csavart kád 1 E RF/3-21G = artree =2.46 Debye kcal/mol E RF/3-21G = artree =2.5 Debye
64 Alkil-halogenidek előallítása: Bruckner I-1 / 204. o. 1. Alkánokból halogénezéssel: szubsztitúciós reakció C n 2n+2 +X 2 C n 2n+1 -X + X ahol X=F, Cl, Br mellett a I igen lomha, nem megy A gyökös reakció elemi lépései: gyökképződés: Cl-Cl Cl.. Cl gyökátadás: termék: Cl. + C 2 6. C2 5 + Cl. C2 5 + Cl-Cl C 2 5 -Cl + Cl. C 2 5 -C 2 5 A gyökös reakció nehezen tartható kézben (a folyamat exoterm BUMM!) melléktermék: C 2 4 (C C2 5. C C 2 6 )
65 2. Alkénekből haloidsav addícióval: C 2 =C 2 + X -C 2 X Addíciós reakció alkil-halogenid Markovnyikov-szabály 3. Alkoholokból szubsztitúcióval: C n 2n X C n 2n+1 -X + 2 alkohol haloidsav alkil-halogenid 3 C Br C 3 3 C 4 Br 1 Br 1-Bromo-2-methylcyclohexane 1-bróm-2-metilciklohexán 1-Bromo-3-methylcyclohexane 1-bróm-3-metilciklohexán 1-Bromo-4-methylcyclohexane 1-bróm-4-metilciklohexán
66 3. Telítetlen, egyértékű halogénezett szénhidrogének alkénből (olefinből) (C n 2n-1 X) típusnév: halogénalkén (Szn), alkenil-halogenid (Csn) alkinből (acetilénből) (C n 2n-3 X) típusnév: halogénalkin (Szn), alkinil-halogenid (Csn) 2 C C Br helyzetizoméria (szubsztitúciós izoméria) Bromoethene brómetilén vinil-bromid IUPAC nevezéktan: a telítetlen kötés rangosabb mint a szubsztituens 3 C C C Br 1-Bromoprop-1-ene 1-brómprop-1-én propenil-bromid 1 C C C Br 2-Bromoprop-1-ene 2-brómprop-1-én izopropenil-bromid 2 C C C 2 Br 3-Bromoprop-1-ene 3-brómprop-1-én allil-bromid C C Br 3 C C C Br C C C 2 Br Bromoethyne brómacetilén etinil-bromid 1-Bromoprop-1-yne 1-brómprop-1-in propinil-bromid 3-Bromoprop-1-yne 3-brómprop-1-in propargil-bromid
67 nev.gyak. 3 C Chloro-6-methylcyclohex-1-ene Cl 3-klór-6-metilciklohex-1-én vinilklorid PVC (polivinilklorid) 4. Két- és többértékű halogénezett szénhidrogének Geminális helyzetű halogének Br C 2 Br Dibromomethane dibrómmetán metilén-dibromid Br C Br 1,1-Dibromoethane 1,1-dibrómetán etilidén-dibromid 3 C Br C Br 2,2-Dibromopropane 2,2-dibrómpropán izopropilidén-dibromid haloformok: CX 3
68 Vicinális helyzetű halogének Br C 2 C 2 Br 1,2-Dibromoethane 1,2-dibrómetán etilén-dibromid Br Br Br Br 3 C C 2 C C 2 3 C C C 1,2-Dibromobutane 2,3-Dibromobutane 1,2-dibrómbután 2,3-dibrómbután Cl 2 C CCl 2 1,1,2,2-Tetrachloroethene Cl Cl (perklór-etilén) ma már tiltott név 3,4-Dichlorocyclohex-1-ene 3,4-diklórciklohex-1-én Diszjunkt helyzetű halogének Br C 2 C 2 C 2 Br 1,3-Dibromopropane 1,3-dibrómpropán F F 3 C C CF 3 F 1,1,1,2,2,3,3,3-ktafluoropropane 1,1,1,2,2,3,3,3-oktafluorpropán perflorpropán
69 F Az optikai izoméria: C kérdés: hány fajta Br létezik? válasz: 2 molekulatípus, melyek egymás enantiomerjei. def.: az enantiomerek egymással fedésbe nem hozható sztereoizomerek, amelyeket az R-S vagy L-D prefix segítségével különböztetünk meg. kérdés: hogyan határozzuk meg hogy mi egy molekula abszolút konfigurációja? válasz: 1. megkeressük a királis C-atomot (sp 3 -as C kell legyen). 2. felállítjuk a szubsztituensek rangsorát a C* (sztereo- centrum) közvetlenül kapcsolódó atomok növekvő atomszáma (rendszáma) alapján (<C<N<<F<Cl< ). 3. elforgatjuk a királis C-t úgy, hogy a legkisebb rangú szubsztituenst ne lássuk. 4. meghatározzuk a megmaradt 3 szubsztituens körüljárási irányát azok rangja szerint: ha a rang az óramutató járása szerint növekszik akkor R a királis C abszolút konfigurációja. Ellenkező esetben S. c Cl a R b azonosak (fedésbe hozhatók) nem azonosak (tükörképi párok) nem azonosak (tükörképi párok)
70 F Példák: érdekes halogénezett alkánok: F F F F pentafluorfenol fungicid állatorvosi gyakorlatban használt inhalációs anesztetikum, májkárosító F peptidszintézisnél karboxilcsoport aktivátor ("aktív észter") F F F F F C C C C N Z R F F Br F Cl alotán (narkotikum) [GyT1 149] F Cl F F F 2-chloro-1-(difluoromethoxy)- 1,1,2-trif luoro-ethane F F F F Cl F 2-chloro-2-(dif luoromethoxy)-1,1,1-trif luoro-ethane F F F F F F 2-(dif luoromethoxy)-1,1,1,2-tetraf luoro-ethane
71 F 3 C CF 2 CF 2 CF 2 CF 2 CF 2 CF 2 CF 2 CF 2 I perfluor-1-jódnonán (jól keveredik oxigénnel: mûvér komponens) élő egér a művérben, miközben fölötte a vízben halak úszkálnak
72 III. Alkoholok és származékaik alapszénhidrogén: nyílt gyűrűs alapszénhidrogén: telített telítetlen [] n n= 1, 2, 3, egy-, két-, többértékű -k kapcsolódása szerint: elsőrendű másodrendű harmadrendű primer szekunder tercier geminális vicinális diszjunkt 1. Nyíltszénláncú, telített egyértékű alkoholok (C n 2n+1 ) típusnév: alkanol Szn alkil-alkohol Csn 3 C C 2 Ethanol etanol etil-alkohol ethyl alcohol borszesz (Saussure 1808) konformáció és térállás: hexóz -> 2Et +2C 2 fedő állás nyitott állás 3 C C 3 C M e t h a n o l m e t a n o l m e t i l - a l k o h o l f a s z e s z 3 C C 2 C 2 P r o p a n o l p r o p a n o l p r o p i l - a l k o h o l p r o p y l a l c o h o l Propan-2-ol propan-2-ol izopropil-alkohol isopropyl alcohol
73 3 C C 2 C 2 C 2 Butan-1-ol butan-1-ol butil-alkohol 1 3 C C C Methylpropan-1-ol 2-metilpropán-1-ol izobutil-alkohol alkohol rendűsége primer szekunder tercier szénatom rendűsége 1 3 C C 2 C Butan-2-ol bután-2-ol szek-butil-alkohol 1 3 C C 2-Methylpropan-2-ol 2-metilpropán-2-ol terc-butil-alkohol IUPAC nevezéktan: (Szn esetében a utótag ol, az előtag hidroxi ha van rangosabb) a leghosszabb szénláncot amin az van, az a legkisebb számot, szubsztituens sorrendet az (angol) ABC szerint (a halogén ugyanolyan szubsztituens mint az alkil) nev.gyak.: Cl C 2 C C 2 C C 2 7-Chloro-4-ethyl-6-methylheptan-2-ol C 2 C 4-etil-7-klór-6-metilheptan-2-ol
74 A hidrogén kötések szerepe: Már a legkisebb szénatomszámú alkohol is folyadék és nem gáz halmazállapotú: Bruckner I-1/245. o. alkán Fp ( o C) alkilhalogenid Fp ( o C) alkohol Fp o C Me- 162 Me-F 78 Me- +65 Et- 89 Et-F 32 Et- +78 Pr- 42 Pr-F 3 Pr C memo: érdekes hogy C 10 -től már szilárdak: p o C dekánol +7 undekánol +19 dodekánol +24 idrogén kötés-hálózat: gázfázísú stabilizációs energia : (RF/3-21G[no BSSE]) ~10 kcal/-híd (RF/3-21G[with BSSE]) ~5 kcal/-híd
75 C 3 -alkoholok (propil-alkoholok) 2 izomer: C 4 -alkoholok (butil-alkoholok) 4 izomer: C 5 -alkoholok (amil-alkoholok) 8 izomer: * bután-1-ol bután-2-ol 2-metilpropan-1-ol 2-metilpropan-2-ol 3 C C 2 C 2 propán-1-ol f p = 97.2 o C C propán-2-ol fp = 82.5 o C *
76 Csoportnevek és rangok : kiválasztani a legrangosabb csoportot tartalmazó leghosszabb szénláncot, a csoport száma a legkisebb legyen, szubsztituens-sorrend az (angol) ABC szerint C 2 C 2 C rangok: csökkenés iránya 1 3-ydroxy-propanoic acid 3-hidroxi-propánsav C C 2 C 2 C C 1 3-ydroxy-2-hydroxymethyl-propanoic acid 3-hidroxi-2-hidroximetil-propánsav S 3 CR CN 2 C karbonsav szulfonsav észter savamid savamidin N N 2 C N S N 2 N R Nitril alkohol tiol amin imin éter Példa: R C 2 zsíralkohol [NÉT1 207] a.u.
77 A fermentálás kémiája Erjesztés során a cereáliákban (pl. árpa) lévő keményítőből az amiláz enzimeknek köszönhetően maltózt kapunk. keményítő: növények energiaraktára C 2 C 2 maltóz -D-glükopiranozil-D-glükopiranóz Fermentálás során az élesztő a maltózt Et-ra és C 2 -re bontja: C C C 2, amely folyamat 1) piroszőlősav (egy keto-karbonsav: CC), majd 2) acetaldehid keletkezésén keresztül megy.
78 2. Ciklusos, telített egyértékű alkoholok (C n 2n 1 ) típusnév: cikloalkanol, cikloalkil-alkohol C 2 3 C C M e t h y l c y c l o h e x a n o l 2 - M e t h y l c y c l o h e x a n o l C y c l o h e x a n o l C y c l o h e x y l m e t h a n o l 1 - m e t i l c i k l o h e x a n o l c i k l o h e x a n o l 2 - m e t i l c i l k l o h e x á n o l c i k l o h e x i l m e t a n o l c i k l o h e x i l - a l k o h o l C 3 C M e t h y l c y c l o h e x a n o l 4 - M e t h y l c y c l o h e x a n o l 3 - m e t i l c i l k l o h e x á n o l 4 - m e t i l c i l k l o h e x á n o l nev.gyak.: 3 C Cl C Chloro-3-ethyl-5-methylcyclohexan-1-ol (3-etil-4-klór-5-metilciklohexan-1-ol) ) 4-klór-3-etil-5-metilciklohexan-1-ol magyar név, magyar ABC sor r end!
79 3. Telítetlen, egyértékű alkoholok alkénből levezetve (C n 2n-1 ) típusnév: alkenol (Szn), alkenil-alkohol (Csn) alkinből levezetve (C n 2n-3 ) típusnév: alkinol (Szn), alkinil-alkohol (Csn) 2 C C C 2 Prop-2-en-1-ol prop-2-én-1-ol C C C 2 Prop-2-yn-1-ol prop-2-in-1-ol allyl alcohol allil-alkohol propargil-alkohol nev.gyak.: C C C C 2 C C C C Cl Br C C C 2 5 C C C Cl C 2 C 4-Methylhex-4-en-2-ol 4-metilhex-4-én-2-ol 5-Bromo-3-ethylcyclopent-2-en-1-ol 5-bróm-3-etilciklopent-2-én-1-ol 4-Chloro-hex-5-yn-2-ol 4-klórohex-5-in-2-ol memo.: Szn esetében az utótag ol, az előtag hidroxi (ha van rangosabb csoport) énol és inol megengedett mert az án én án in alapnév modosítás és nem utótag
80 A vinilalkohol: a tautoméria jelensége enol-alak oxo-alak memo: a legegyszerűbb telítetlen alkohol nem is alkohol, hanem aldehid! etanal acetaldehid Acetaldehyde C C tautomerek C C Allil-alkohol szintézise: reakció ahol az alkatrészek elillannak labilis stabil Propargil-alkohol szintézise: reakció ahol az alkatrészek beépülnek: C + C C 100 o C 6 atm Cu 2 C 2 C C 2 C Reppe-féle szintézis acetilén formaldehid propargil-alkohol
81 4. Két- és többértékű alkoholok típusnév: diol, triol, tetrit, pentit, hexit stb. (C n 2n-1-k [] k ) alapszénhidrogén: nyílt gyűrűs alapszénhidrogén: telített telítetlen [] k k= 1, 2, 3, egy-, két-, többértékű [] kapcsolódása szerint: elsőrendű másodrendű harmadrendű primer szekunder tercier geminális vicinális diszjunkt instabil: C 2 Methanediol metándiol formaldehid-hidrát Geminális diolok (instabil, vízvesztés, megfelelő oxovegyület) formalin: a 0-40%-os vizes oldata ahol a metándiol és formaldehid van egyensúlyban! stabil: 2 1 I effektus stabilizál
82 C 2 C 2 Ethane-1,2-diol etán-1,2-diol ethylene glycol etilénglikol glikol Vicinális diolok 3 C C C 2 Propane-1,2-diol propán-1,2-diol (propilén-glikol) régi név Cyclohexane-1,2-diol ciklohexán-1,2-diol glüküsz (görög) édes glikol Színtelen, szagtalan, mérgező (két teáskanál), fagyálló ( 12.9 C) folyadék C C C Butane-2,3-diol bután-2,3-diol - 2 ZnCl 2 hevítés -2 2 dioxán Diszjunkt diolok persavakkal C 3 C C 2 1 C 2 Cyclohexane-1,4-diol ciklohexán-1,4-diol Butane-1,3-diol bután-1,3-diol
83 Szubsztitúciós nomenklatúra: azt a leghosszabb szénláncot amelyen a legtöbb hidroxilcsoport van, Többértékű alkoholok nev.gyak.: C C C 2 C C 2 C C 2 C C 3 C E t h y l m e t h y l h e p t a n e - 1, 6 - d i o l 2 - e t i l m e t i l h e p t á n - 1, 6 - d i o l 4 - m e t i l e t i l h e p t á n - 1, 6 - d i o l ( A B C s o r r e n d r o s s z ) glicerin C 2 C 2 C C 2 Propane-1,2,3-triol propán-1,2,3-triol glycerol glicerin (C C 2 C 2 )n C C 2 C 2 C 2 n=2 bután-1,2,3,4-tetrol tetrit n=3 pentán-1,2,3,4,5-pentol pentit n=4 hexán-1,2,3,4,5,6-hexol hexit N 3 ( 2 S 4 ) térhálósítás műgyanták, lakkok, stb. 2,2-Bis(hydroxymethyl)-propane-1,3-diol 2,2-bisz(hidroximetil)-propán-1,3-diol pentaerythritol pentaeritrit PETN (pentaerythritol tetranitrate) kiváló robbanószer Semtex plasztikbomba komponense
84 Glicerin (Scheele: 1779): -oliva olaj vizes Pb szappanosítással nyerte -Berthelot (1853) szerkezetazonosítás szintézis (1873) (régi elavult eljárás, igen sok lépésben, ma főleg hidrolízis útján) Bruckner I o. aceton red. izopropanol ZnCl 2-2 propén Cl 2 Cl 1,2-diklórpropán Cl 160 o C ICl Cl o C Cl Cl glicerin 1,2,3-triklórpropán izolálás és tisztítás: gliceridek (növényi, állati zsiradékokból) 1 ) a h i d r o l í z i s 2 C C R C 2 C C R ' C R '' + I 2 C R C C + R C 2 C R C 2 ) a k a r b o n s a v l e v á l a s z t á s a 3 ) a v i z e s o l d a t d e s z t i l l á l á s a 4 ) t i s z t a g l i c e r i n t k a p u n k
85 Példa: C P 3 2- C C C Az inozitnak hány sztereoizomerje létezhet? C C C P 3 2- P 3 2- sikimisav aminosav-bioszintézis inozit-trif oszf át IP 3 : Ca 2+ -szintet emel [Stryer 724] C 2 b-d-glükóz [Gimn2 175] 1 b C 2 C maltóz [Gimn2 184] cellulóz (lineáris) keményítő (spirális) hidrolízis cellobióz (b-forma) hidrolízis maltóz ( -forma)
86 Néhány sematikus reakció amely során az alkének, alkinok, alkil-halogenidek és alkoholok egymásba alakíthatók: R C C a l k i n 2 ( l i k. N 3, N a ) - X ( Z a j c e v s z a b.) c c. K X = F, C l, B r, I 2 ( N i k a t. ) R C C 2 a l k é n + X ( M a r k o v n y i k o v s z a b. ) R C 2 X C 3 a l k i l - h a l o g e n i d R C 2 C 3 a l k á n ( p l. c c. 2 S 4 ) cc. X ( + p l. h í g 2 S 4 ) - ( S N ) a l k i l - a l k o h o l R C C 3 o x. C u 2 v. K 2 C r 2 7 R C C 3 a l k i l - k e t o n
87 5. Éterek típusnév: alkoxialkán (Szn), alkilén-oxid (Csn) (Szn esetében az előtag alkoxi ) Víz két hidrogénjét alkilcsoportokkal helyettesítjük szimmetrikus nemszimmetrikus (R--R pl. Et 2 ) (R 1 --R 2 pl. MeEt) telített telítetlen nyíltláncú gyűrűs éter 2 2 C 2 Cl 2 szimmetrikus telített nem-szimmetrikus telített nem-szimmetrikus telítetlen 3 C Methoxymethane dimethyl ether dimetil-éter fp = -23 o C dietil-éter hidroperoxidja fp = o C 3 C C 2 Methoxyethane ethyl methyl ether etil-metil-éter fp = 7.6 o C 3 C C C 2 Methoxyethene metoxietén methyl vinyl ether metil-vinil-éter 3 C C 2 C 2 Ethoxy-ethane diethyl ether dietil-éter éter fp = 34.6 o C = 0.71 g/cm 3 dietil-éter peroxidja deszt. maradék szárazon robban! Na és Fe 2+ só val bontható (kirázás deszt. elõtt) n 3 C Methoxycyclopentane metoxiciklopentán cyclopentyl methyl ether ciklopentil-metil-éter memo: az éter csak korlátozottan elegyedik a vízzel; extrakciós rendszer. kérdés: miért alacsony az alkoholokhoz képest az éterek forráspontja? válasz: mert nem tudnak intermolekuláris -hidakat képezni.
88 (Szn esetében az előtag alkoxi ) Szubsztitúciós nomenklatúra: a leghosszabb szénláncnak megfelelő alkil illetve alkoxi csoporttal képezzük a nevet 3 C C 2 C C C 3 C 3 nev.gyak.: C M e t h o x y - 2, 3 - d i m e t h y l b u t a n e 1 - m e t o x i - 2, 3 - d i m e t i l b u t á n 2 C 2 C xirane oxirán fp = 11 o C etilén-oxid 2 C C 2 2 C xetane oxetán fp = o C Gyűrűs éterek 2 C 2 C x o l a n e o x o l á n C 2 C 2 T e t r a h y d r o f u r a n t e t r a h i d r o f u r á n f p = 6 6 o C poláris éter: = 1,8 Debye 2 C C 2 2 C C 2 1, 4 - D i o x a n e 1, 4 - d i o x á n f p = 101, 1 o C apoláris éter: = 0 Debye nev.gyak.: C l C 2 C C 2 szomszédos szeneket összekötő éter az epoxid 2 - ( C h l o r o m e t h y l ) o x i r a n e 2, 3 - e p o x i k l ó r p r o p á n Példa: C 2 C 2 C M e t h o x y e t h a n o l 2 - m e t o x i e t á n o l e t i l é n g l i k o l - m o n o m e t i l é t e r m e t i l c e l l o s z o l v C 2 C 2 C 2 C E t h o x y e t h a n o l 2 - e t o x i e t á n o l e t i l é n g l i k o l - m o n o e t i l é t e r c e l l o s z o l v
89 geminális diolból levezethető féléter vagy félacetál illetve acetál C - 2 C R- C R- C R R R Az intramolekuláris félacetál képződés glükóz esetében: C C C C C C 2 C C C 3 2 C 2 C 1 C 4 C C C C 2 C C 1 a D - g l ü k ó z n é h á n y n y í l t l á n c ú f o r m á j a C 2 C 2 nev.gyak. 3 C C 2 C 2 C C 2 D-glükóz két legfontosabb gyűrűs formája: 2 C C C C C C - D -( + )- g l ü k o p i r a n ó z C 2 3 C C C C C C C b - D - ( + ) - g l ü k o p i r a n ó z 1-Ethoxy-butan-1-ol 1-etoxibután-1-ol Dimethoxymethane dimetoximetán formaldehid-dimetil-acetál metilál C 2 1,1-Diethoxyethane 1,1-dietoxietán acetaldehid-dietil avagy acetál
90 Peroxidok C 2 5 Methylperoxyethane metilperoxietán etil-metil-peroxid diciklohexil-peroxid IV. Kéntartalmú szénvegyületek alapszénhidrogén: nyílt gyűrűs alapszénhidrogén: telített telítetlen 1. Tiolok (C n 2n+1 S): típusnév: alkántiol, tioalkohol -S merkapto csoport (elavult) előtag: szulfanil, utótag: tiol 3 C S 3 C C 2 S 3 C C Methanethiol Ethanethiol S metántiol etántiol Propane-2-thiol metil-hidrogén-szulfid metil-merkaptán etil-hidrogén-szulfid etil-merkaptán 2-propántiol izopropil-hidrogén-szulfid izopropil-merkaptán Példa: 2 N C C C 2 S cisztein
91 2. Tioéterek szulfidok R 1 -S-R 2 típusnév: dialkil-szulfid (tioéter) 3 C S 3 C S C 2 3 C C 2 S C 2 Példa: 2 N C C Methylsulfanylmethane Methylsulfanylethane Ethylsulfanyl-ethane C 2 dimetil-szulfid metil-etil-szulfid dietil-szulfid C 2 S T e t r a h y d r o t h i o p h e n e t e t r a h i d r o t i o f é n t h i o l a n e t i o l á n Illékony, büdös, színtelen folyadék op: -96 C, fp: 119 C földgáz illatosítására használják A teljes elektronsűrűség ( a.u.) izo-felszine =2.34 Debye (RF/ Gd,p) S metionin A teljes elektronsűrűség ( a.u. ) izo-felszinén színnel kódolt elektrosztatikus potenciálérték piros, sárga, zöld, kék töltés
92 3. Szulfoxidok és szulfonok R 1 -S-R 2 és R 1 -S 2 -R 2 DMS: dipoláris aprotikus oldószer op: 18.5 C, fp: 189 C érdekesség: PCR reakcióknál hasz., meggátolja a DNS kettős spirál téralkat kialakulását 3 C S C 2 Methylsulfonylethane metilszulfoniletán ethyl methyl sulfone metil-etil-szulfon 4.Szulfonsavak R 1 -S 2-3 C S 2 Methanesulfonic acid metánszulfonsav 3 C 2 C 3 C S 2 Propane-2-sulfonic acid propán-2-szulfonsav
93 nev.gyak. rangok! S 2 Példa: 3 C S 2 N 2 metánszulfonamid 3 C S 2 Cl metánszulfonil-klorid mezil-klorid 3 1 C 3 C S 2 N N-metil-metánszulfonamid S 2 Cl 3-Sulfocyclohexane-1-carboxylic acid 3-szulfociklohexán-1-karbonsav 5. Szulfinsavak R 1 -S- 6. Szulfénsavak R 1 -S- 4-Methyl-benzenesulfonyl chloride tozil-klorid 3 C C C 3 C S Butane-2-sulfinic acid bután-2-szulfinsav
Konstitúció, izoméria, konfiguráció, konformáció
 Konstitúció, izoméria, konfiguráció, konformáció Konstitúció: A molekula színezett gráffal leírható szerkezete De: a konstitúciós képlet kifejezhet egyéb információt is: cisz-transz izomériát (Z - zusammen,
Konstitúció, izoméria, konfiguráció, konformáció Konstitúció: A molekula színezett gráffal leírható szerkezete De: a konstitúciós képlet kifejezhet egyéb információt is: cisz-transz izomériát (Z - zusammen,
Hullámok és harmonikus felhangjaik feltérjék a forrást
 ullámok és harmonikus felhangjaik feltérjék a forrást következtetés: a hangok (frekvenciák) visszatükrözik a hang forrását: a hegedűt vagy a zongorát. A Wilkinson mikrohullámú anizotrópia szonda (Wilkinson
ullámok és harmonikus felhangjaik feltérjék a forrást következtetés: a hangok (frekvenciák) visszatükrözik a hang forrását: a hegedűt vagy a zongorát. A Wilkinson mikrohullámú anizotrópia szonda (Wilkinson
ALKOHOLOK ÉS SZÁRMAZÉKAIK
 ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
ALKLK ÉS SZÁRMAZÉKAIK Levezetés R R alkohol R R R éter Elnevezés Nyíltláncú, telített alkoholok általános név: alkanol alkil-alkohol 2 2 2 metanol etanol propán-1-ol metil-alkohol etil-alkohol propil-alkohol
Preambulum. Komplexitásinformációtartam. biológia. kémia. sokaság-sokszínűség (kda) Szövet, organizmus. Sejt
 Preambulum Komplexitásinformációtartam Szövet, organizmus biológia Sejt Szupramolekuláris komplexek és nanorendszerek Biomolekulák Biológiai kémia; a természetes vegyületek kémiája kémia sokaság-sokszínűség
Preambulum Komplexitásinformációtartam Szövet, organizmus biológia Sejt Szupramolekuláris komplexek és nanorendszerek Biomolekulák Biológiai kémia; a természetes vegyületek kémiája kémia sokaság-sokszínűség
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Alkánok összefoglalás
 Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
Alkánok összefoglalás Nem vagyok különösebben tehetséges, csak szenvedélyesen kíváncsi. Albert Einstein Rausch Péter kémia-környezettan tanár Szénhidrogének Szénhidrogének Telített Telítetlen Nyílt láncú
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Szerves Kémia. Farmakológus szakasszisztens képzés 2012/2013 ősz
 Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Szerves Kémia Farmakológus szakasszisztens képzés 2012/2013 ősz Általános tudnivalók Kele Péter (ELTE Északi tömb, Kémia, 646. szoba) kelep@elte.hu sütörtök 17 15 19 45 Szeptember 27. elmarad Őszi szünet
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Toluol (Bruckner II/1 476) µ= 0.33 Debye
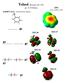 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Preambulum. Komplexitásinformációtartam. biológia. kémia. sokaság-sokszínűség (kda) Szövet, organizmus. Sejt
 Preambulum Komplexitásinformációtartam Szövet, organizmus biológia Sejt Szupramolekuláris komplexek és nanorendszerek Biomolekulák Biológiai kémia; a természetes vegyületek kémiája kémia sokaság-sokszínűség
Preambulum Komplexitásinformációtartam Szövet, organizmus biológia Sejt Szupramolekuláris komplexek és nanorendszerek Biomolekulák Biológiai kémia; a természetes vegyületek kémiája kémia sokaság-sokszínűség
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
A szervetlen vegyületek
 5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
O 2 R-H 2 C-OH R-H 2 C-O-CH 2 -R R-HC=O
 Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
Funkciós csoportok, reakcióik II C 4 C 3 C 2 C 2 R- 2 C- R- 2 C--C 2 -R C 2 R-C= ALKLK, ÉTEREK Faszesz C 3 Toxikus 30ml vakság LD 50 értékek alkoholokra patkányokban LD 50 = A populáció 50%-ának elhullásához
HALOGÉNEZETT SZÉNHIDROGÉNEK
 ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
ALOGÉNEZETT SZÉNIDOGÉNEK Elnevezés Nyíltláncú, telített általános név: halogénalkán alkilhalogenid l 2 l 2 2 l klórmetán klóretán 1klórpropán l metilklorid etilklorid propilklorid 2klórpropán izopropilklorid
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Javító vizsga követelményei kémia tantárgyból augusztus osztály
 Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
Javító vizsga követelményei kémia tantárgyból 2019. augusztus 29. 10. osztály I. Szerves kémia-bevezetés 1. A szerves kémia kialakulása, tárgya (Tk. 64-65 old.) - Lavoisier: organogén elemek (C, H, O,
A szervetlen vegyületek
 5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
5. Vegyületek osztályozása, egyszerű szerves funkciós csoportok, fontosabb szervetlen és szerves vegyületek nagyon sokféle vegyület van, többféle csoportosítás lehet hasznos szervetlen vegyületek - szerves
Bevezetés. Szénvegyületek kémiája Organogén elemek (C, H, O, N) Életerő (vis vitalis)
 Szerves kémia Fontos tudnivalók Tárgy neve: Kémia alapjai I. Neptun kód: SBANKE1050 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
Szerves kémia Fontos tudnivalók Tárgy neve: Kémia alapjai I. Neptun kód: SBANKE1050 Előadó: Borzsák István C121 szerda 11-12 e-mail: iborzsak@ttk.nyme.hu http://www.bdf.hu/ttk/fldi/iborzsak/dokumentumok/
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
Aromás vegyületek II. 4. előadás
 Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
Aromás vegyületek II. 4. előadás Szubsztituensek irányító hatása Egy következő elektrofil hova épül be orto, meta, para pozíció CH 3 CH 3 CH 3 CH 3 E E E orto (1,2) meta (1,3) para (1,4) Szubsztituensek
CH 2 =CH-CH 2 -S-S-CH 2 -CH=CH 2
 10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Laboratóriumi technikus laboratóriumi technikus Drog és toxikológiai
 A 10/2007 (II. 27.) SzMM rendelettel módosított 1/2006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
A 10/2007 (II. 27.) SzMM rendelettel módosított 1/2006 (II. 17.) OM rendelet Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről alapján. Szakképesítés,
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Tantárgycím: Szerves kémia
 Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
Eötvös Loránd Tudományegyetem Természettudományi Kar Biológia Szak Kötelező tantárgy TANTÁRGY ADATLAP és tantárgykövetelmények 2005. Tantárgycím: Szerves kémia 2. Tantárgy kódja félév Követelmény Kredit
Szabó Dénes Molekulák és reakciók három dimenzióban
 Szabó Dénes Molekulák és reakciók három dimenzióban Alkímia ma, 2012. április 19. Egy kis tudománytörténet -O azonos kémiai szerkezet -O Scheele (1769) -O különböző tulajdonságok -O Kestner (1822) borkősav
Szabó Dénes Molekulák és reakciók három dimenzióban Alkímia ma, 2012. április 19. Egy kis tudománytörténet -O azonos kémiai szerkezet -O Scheele (1769) -O különböző tulajdonságok -O Kestner (1822) borkősav
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
O S O. a konfiguráció nem változik O C CH 3 O
 () ()-butanol [α] D = a konfiguráció nem változik () 6 4 ()--butil-tozilát [α] D = 1 a konfiguráció nem változik inverzió Na () () ()--butil-acetát [α] D = 7 ()--butil-acetát [α] D = - 7 1. Feladat: Milyen
() ()-butanol [α] D = a konfiguráció nem változik () 6 4 ()--butil-tozilát [α] D = 1 a konfiguráció nem változik inverzió Na () () ()--butil-acetát [α] D = 7 ()--butil-acetát [α] D = - 7 1. Feladat: Milyen
Helyettesített karbonsavak
 elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
elyettesített karbonsavak 1 elyettesített savak alogénezett savak idroxisavak xosavak Dikarbonsavak Aminosavak (és fehérjék, l. Természetes szerves vegyületek) 2 alogénezett savak R az R halogént tartalmaz
KARBONIL-VEGY. aldehidek. ketonok O C O. muszkon (pézsmaszarvas)
 KABNIL-VEGY VEGYÜLETEK (XVEGYÜLETEK) aldehidek ketonok ' muszkon (pézsmaszarvas) oxocsoport: karbonilcsoport: Elnevezés Aldehidek szénhidrogén neve + al funkciós csoport neve: formil + triviális nevek
KABNIL-VEGY VEGYÜLETEK (XVEGYÜLETEK) aldehidek ketonok ' muszkon (pézsmaszarvas) oxocsoport: karbonilcsoport: Elnevezés Aldehidek szénhidrogén neve + al funkciós csoport neve: formil + triviális nevek
A szén molekulaképző sajátságai. Kémia 1 Szerves kémia. A szerves kémiai reakciók jellege. Szerves kémiai reakciók felosztása
 Kémia 1 Szerves kémia Tárgya: a szénvegyületek szerkezetének, tulajdonságainak és átalakulásainak a vizsgálata. A szerves vegyületek összetételükben és kémiai viselkedésükben jelentősen eltérnek a szervetlen
Kémia 1 Szerves kémia Tárgya: a szénvegyületek szerkezetének, tulajdonságainak és átalakulásainak a vizsgálata. A szerves vegyületek összetételükben és kémiai viselkedésükben jelentősen eltérnek a szervetlen
Szemináriumi feladatok (alap) I. félév
 Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
Szemináriumi feladatok (alap) I. félév I. Szeminárium 1. Az alábbi szerkezet-párok közül melyek reprezentálják valamely molekula, vagy ion rezonancia-szerkezetét? Indokolja válaszát! A/ ( ) 2 ( ) 2 F/
7. évfolyam kémia osztályozó- és pótvizsga követelményei Témakörök: 1. Anyagok tulajdonságai és változásai (fizikai és kémiai változás) 2.
 7. évfolyam kémia osztályozó- és pótvizsga követelményei 1. Anyagok tulajdonságai és változásai (fizikai és kémiai változás) 2. Hőtermelő és hőelnyelő folyamatok, halmazállapot-változások 3. A levegő,
7. évfolyam kémia osztályozó- és pótvizsga követelményei 1. Anyagok tulajdonságai és változásai (fizikai és kémiai változás) 2. Hőtermelő és hőelnyelő folyamatok, halmazállapot-változások 3. A levegő,
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
4. változat. 2. Jelöld meg azt a részecskét, amely megőrzi az anyag összes kémiai tulajdonságait! A molekula; Б atom; В gyök; Г ion.
 4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
Fémorganikus vegyületek
 Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
Fémorganikus vegyületek A fémorganikus vegyületek fém-szén kötést tartalmaznak. Ennek polaritása a fém elektropozitivitásának mértékétől függ: az alkálifém-szén kötések erősen polárosak, jelentős százalékban
A tételek: Elméleti témakörök. Általános kémia
 A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
A tételek: Elméleti témakörök Általános kémia 1. Az atomok szerkezete az atom alkotórészei, az elemi részecskék és jellemzésük a rendszám és a tömegszám, az izotópok, példával az elektronszerkezet kiépülésének
OXOVEGYÜLETEK. Levezetés. Elnevezés O CH 2. O R C R' keton. O R C H aldehid. funkciós csoportok O. O CH oxocsoport karbonilcsoport formilcsoport
 XVEGYÜLETEK Levezetés 2 aldehid ' keton funkciós csoportok oxocsoport karbonilcsoport formilcsoport Elnevezés Aldehidek nyíltláncú (racionális név: alkánal) 3 2 2 butánal butiraldehid gyűrűs (cikloalkánkarbaldehid)
XVEGYÜLETEK Levezetés 2 aldehid ' keton funkciós csoportok oxocsoport karbonilcsoport formilcsoport Elnevezés Aldehidek nyíltláncú (racionális név: alkánal) 3 2 2 butánal butiraldehid gyűrűs (cikloalkánkarbaldehid)
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
SZERVES KÉMIAI REAKCIÓEGYENLETEK
 SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
SZERVES KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Szögletes zárójel jelzi a reakciót, ami más témakörnél található meg. Alkánok, cikloalkánok
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
Összefoglalás. Telített Telítetlen Aromás Kötések Csak -kötések és -kötések és delokalizáció. Kötéshossz Nagyobb Kisebb Átmenet a kettő között
 Összefoglalás Telített Telítetlen Aromás Kötések Csak -kötések és -kötések és delokalizáció Kötéshossz Nagyobb Kisebb Átmenet a kettő között Reakciókészség Paraffin (legkevésbé) Nagy Átmenet a kettő között
Összefoglalás Telített Telítetlen Aromás Kötések Csak -kötések és -kötések és delokalizáció Kötéshossz Nagyobb Kisebb Átmenet a kettő között Reakciókészség Paraffin (legkevésbé) Nagy Átmenet a kettő között
Szerves kémia Fontosabb vegyülettípusok
 Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Fontosabb vegyülettípusok Szénhidrogének: alifás telített (metán, etán, propán, bután, ) alifás telítetlen (etén, etin, ) aromás (benzol, toluol, naftalin) Oxigéntartalmú vegyületek: hidroxivegyületek
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
szabad bázis a szerves fázisban oldódik
 1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
1. feladat Oldhatóság 1 2 vízben tel. Na 2 CO 3 oldatban EtOAc/víz elegyben O-védett protonált sóként oldódik a sóból felszabadult a nem oldódó O-védett szabad bázis a felszabadult O-védett szabad bázis
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. vörösvértest
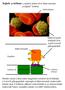 Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. vörösvértest fehérvérsejtek fehérvérsejtek felületén lévő szialil LewisX glikopeptidek Kapilláris kapiláris fal endotél sejtek szelektin
Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. vörösvértest fehérvérsejtek fehérvérsejtek felületén lévő szialil LewisX glikopeptidek Kapilláris kapiláris fal endotél sejtek szelektin
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét
 Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
Bevezetés a biokémiába fogorvostan hallgatóknak Munkafüzet 4. hét Szerves kémia ismétlése, a szerves kémiai ismeretek gyakorlása a biokémiához Írták: Agócs Attila, Berente Zoltán, Gulyás Gergely, Jakus
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
Helyettesített Szénhidrogének
 elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
elyettesített Szénhidrogének 1 alogénezett szénhidrogének 2 3 Alifás halogénvegyületek Szerkezet Kötéstávolság ( ) omolitikus disszociációs energia (kcal/mol) Alkil-F 1,38 116 Alkil-l 1,77 81 Alkil-Br
A cukrok szerkezetkémiája
 A cukrok szerkezetkémiája A cukrokról,szénhidrátokról általánosan o o o Kémiailag a cukrok a szénhidrátok,vagy szacharidok csoportjába tartozó vegyületek. A szacharid arab eredetű szó,jelentése: édes.
A cukrok szerkezetkémiája A cukrokról,szénhidrátokról általánosan o o o Kémiailag a cukrok a szénhidrátok,vagy szacharidok csoportjába tartozó vegyületek. A szacharid arab eredetű szó,jelentése: édes.
6. Monoklór származékok száma, amelyek a propán klórozásával keletkeznek: A. kettő B. három C. négy D. öt E. egy
 1. Szerves vegyület, amely kovalens és ionos kötéseket is tartalmaz: A. terc-butil-jodid B. nátrium-palmitát C. dioleo-palmitin D. szalicilsav E. benzil-klorid 2. Szénhidrogén elegy, amely nem színteleníti
1. Szerves vegyület, amely kovalens és ionos kötéseket is tartalmaz: A. terc-butil-jodid B. nátrium-palmitát C. dioleo-palmitin D. szalicilsav E. benzil-klorid 2. Szénhidrogén elegy, amely nem színteleníti
Curie Kémia Emlékverseny 10. évfolyam országos döntő 2018/2019. A feladatok megoldásához csak periódusos rendszer és zsebszámológép használható!
 A feladatokat írta: Kódszám: Horváth Balázs, Szeged Lektorálta: 2019. május 11. Széchenyi Gábor, Budapest Curie Kémia Emlékverseny 10. évfolyam országos döntő 2018/2019. A feladatok megoldásához csak periódusos
A feladatokat írta: Kódszám: Horváth Balázs, Szeged Lektorálta: 2019. május 11. Széchenyi Gábor, Budapest Curie Kémia Emlékverseny 10. évfolyam országos döntő 2018/2019. A feladatok megoldásához csak periódusos
Tartalomjegyzék. Szénhidrogének... 1
 Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Tartalomjegyzék Szénhidrogének... 1 Alkánok (Parafinok)... 1 A gyökök megnevezése... 2 Az elágazó szénláncú alkánok megnevezése... 3 Az alkánok izomériája... 4 Előállítás... 4 1) Szerves magnéziumvegyületekből...
Fémorganikus kémia 1
 Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Szerves vegyületek nevezéktana
 Szerves vegyületek nevezéktana A vegyületek megnevezése nem lehet esetleges, a vegyészek közötti kommunikációra alkalmas kell, hogy legyen. Az írott, vagy hallott szövegben elforduló névbl a vegyület szerkezete
Szerves vegyületek nevezéktana A vegyületek megnevezése nem lehet esetleges, a vegyészek közötti kommunikációra alkalmas kell, hogy legyen. Az írott, vagy hallott szövegben elforduló névbl a vegyület szerkezete
Szalai István. ELTE Kémiai Intézet 1/74
 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
KARBONSAVAK. A) Nyílt láncú telített monokarbonsavak (zsírsavak) O OH. karboxilcsoport. Példák. pl. metánsav, etánsav, propánsav...
 KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
KABNSAVAK karboxilcsoport Példák A) Nyílt láncú telített monokarbonsavak (zsírsavak) "alkánsav" pl. metánsav, etánsav, propánsav... (nem használjuk) omológ sor hangyasav 3 2 2 2 valeriánsav 3 ecetsav 3
KARBONSAV-SZÁRMAZÉKOK
 KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
KABNSAV-SZÁMAZÉKK Karbonsavszármazékok Karbonsavak H X Karbonsavszármazékok X Halogén Savhalogenid l Alkoxi Észter ' Amino Amid N '' ' Karboxilát Anhidrid Karbonsavhalogenidek Tulajdonságok: - színtelen,
Nitrogéntartalmú szerves vegyületek. 6. előadás
 Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
Nitrogéntartalmú szerves vegyületek 6. előadás Aminok Funkciós csoport: NH 2 (amino csoport) Az ammónia (NH 3 ) származékai Attól függően, hogy hány H-t cserélünk le, kapunk primer, szekundner és tercier
ÁTSZIVÁRGÁS ÁTTÖRÉSI IDEJE AZ EN374-3:2003 SZABVÁNYNAK MEGFELELŐEN (PERCEKBEN) Védelmi mutatószám
 0,7% ditranol kis viszkozitású folyékony paraffinban 1.6 0 Centexbel 374-3:2003 1% metilibolya > 480 6 8004-87-3 Centexbel 374-3:2003 1,2-dibrómetán < 1 0 106-93-4 Centexbel 374-3:2003 1,2-diklóretán (?)
0,7% ditranol kis viszkozitású folyékony paraffinban 1.6 0 Centexbel 374-3:2003 1% metilibolya > 480 6 8004-87-3 Centexbel 374-3:2003 1,2-dibrómetán < 1 0 106-93-4 Centexbel 374-3:2003 1,2-diklóretán (?)
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
A hidrogénmolekula. Energia
 A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
SZERVES KÉMIA. ANYAGMÉRNÖK BSc KÉPZÉS SZAKMAI TÖRZSANYAG (nappali munkarendben, ózdi kihelyezett képzés) TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ
 SZERVES KÉMIA ANYAGMÉRNÖK BSc KÉPZÉS SZAKMAI TÖRZSANYAG (nappali munkarendben, ózdi kihelyezett képzés) TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET 2017/18.
SZERVES KÉMIA ANYAGMÉRNÖK BSc KÉPZÉS SZAKMAI TÖRZSANYAG (nappali munkarendben, ózdi kihelyezett képzés) TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET 2017/18.
6. változat. 3. Jelöld meg a nem molekuláris szerkezetű anyagot! A SO 2 ; Б C 6 H 12 O 6 ; В NaBr; Г CO 2.
 6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
Név: Pontszám: / 3 pont. 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét!
 Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét! Név: Pontszám: / 4 pont 2. feladat Az ábrán látható vegyületnek a) hány sztereoizomerje, b) hány enantiomerje van?
Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét! Név: Pontszám: / 4 pont 2. feladat Az ábrán látható vegyületnek a) hány sztereoizomerje, b) hány enantiomerje van?
1. változat. 4. Jelöld meg azt az oxidot, melynek megfelelője a vas(iii)-hidroxid! A FeO; Б Fe 2 O 3 ; В OF 2 ; Г Fe 3 O 4.
 1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
Szerves vegyületek nevezéktana
 else { //Ha már meg volt hívva, egy betűnyit forgatunk window.status=out; out = out.substring( 1, out.length) +out.charat(1); timertwo=window.settimeout("scroll()", idointerv); } }
else { //Ha már meg volt hívva, egy betűnyit forgatunk window.status=out; out = out.substring( 1, out.length) +out.charat(1); timertwo=window.settimeout("scroll()", idointerv); } }
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Halogénezett szénhidrogének
 Halogénezett szénhidrogének - Jellemző kötés (funkciós csoport): X X = halogén, F, l, Br, I - soportosítás: - halogénatom(ok) minősége szerint (X = F, l, Br, I) - halogénatom(ok) száma szerint (egy-, két-
Halogénezett szénhidrogének - Jellemző kötés (funkciós csoport): X X = halogén, F, l, Br, I - soportosítás: - halogénatom(ok) minősége szerint (X = F, l, Br, I) - halogénatom(ok) száma szerint (egy-, két-
4) 0,1 M koncentrációjú brómos oldat térfogata, amely elszínteleníthető 0,01 mól alkénnel: a) 0,05 L; b) 2 L; c) 0,2 L; d) 500 ml; e) 100 ml
 1) A (CH 3 ) 2 C=C(CH 3 ) 2 (I) és CH 3 -C C-CH 3 (II) szénhidrogének esetében helyesek a következő kijelentések: a) A vegyületek racionális (IUPAC) nevei: 2-butén (I) és 2-butin (II) b) Az I-es telített
1) A (CH 3 ) 2 C=C(CH 3 ) 2 (I) és CH 3 -C C-CH 3 (II) szénhidrogének esetében helyesek a következő kijelentések: a) A vegyületek racionális (IUPAC) nevei: 2-butén (I) és 2-butin (II) b) Az I-es telített
fehérvérsejtek Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben.
 Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. Sérülés esetén a helyszínen megjelenő szelektin nevű fehérjék a LewisX glikopeptidek segítségével fehérvérsejtek (leukociták) kötnek
Sejtek a térben: a sejtközi térben lévő fehérvértestek szolgálat közben. Sérülés esetén a helyszínen megjelenő szelektin nevű fehérjék a LewisX glikopeptidek segítségével fehérvérsejtek (leukociták) kötnek
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1999
 1999 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1999 Figyelem! A kidolgozáskor tömör és lényegre törő megfogalmazásra törekedjék. A megadott tematikus sorrendet szigorúan tartsa be! Csak a
1999 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1999 Figyelem! A kidolgozáskor tömör és lényegre törő megfogalmazásra törekedjék. A megadott tematikus sorrendet szigorúan tartsa be! Csak a
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS
 Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
2. melléklet a 4/2011. (I. 14.) VM rendelethez
 1. Egyes légszennyező anyagok tervezési irányértékei A B C D 1. Légszennyező anyag [CAS szám] Tervezési irányértékek [µg/m 3 ] Veszélyességi 2. 24 órás 60 perces fokozat 3. Acetaldehid [75-07-0] 0,2 1
1. Egyes légszennyező anyagok tervezési irányértékei A B C D 1. Légszennyező anyag [CAS szám] Tervezési irányértékek [µg/m 3 ] Veszélyességi 2. 24 órás 60 perces fokozat 3. Acetaldehid [75-07-0] 0,2 1
Periódusos rendszer (Mengyelejev, 1869) nemesgáz csoport: zárt héj, extra stabil
 s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
Altalános Kémia BMEVESAA101 tavasz 2008
 Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Halogéntartalmú szerves vegyületek
 Szerves kémia Halogéntartalmú szerves vegyületek Halogéntartalmú szerves Csoportosítás: vegyületek A molekulában levő halogén-atomok száma szerint egy-, két-, illetve többértékű halogén származékok lehetnek.
Szerves kémia Halogéntartalmú szerves vegyületek Halogéntartalmú szerves Csoportosítás: vegyületek A molekulában levő halogén-atomok száma szerint egy-, két-, illetve többértékű halogén származékok lehetnek.
Tartalmi követelmények kémia tantárgyból az érettségin K Ö Z É P S Z I N T
 1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2014. április 25. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét!
Szerves Kémiai Problémamegoldó Verseny 2014. április 25. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Adja meg a hiányzó vegyületek szerkezeti képletét!
Szerves kémia A szerves kémia a kémia azon ága, mely a széntartalmú vegyületekkel foglalkozik. Az elnevezés onnan ered, hogy sokáig azt hitték csak az
 Szerves kémia Szerves kémia A szerves kémia a kémia azon ága, mely a széntartalmú vegyületekkel foglalkozik. Az elnevezés onnan ered, hogy sokáig azt hitték csak az élő szervezet képes előállítani az őket
Szerves kémia Szerves kémia A szerves kémia a kémia azon ága, mely a széntartalmú vegyületekkel foglalkozik. Az elnevezés onnan ered, hogy sokáig azt hitték csak az élő szervezet képes előállítani az őket
A hidrogénmolekula. Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve!
 Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Részletes tematika: I. Félév: 1. Hét (4 óra): 2. hét (4 óra): 3. hét (4 óra): 4. hét (4 óra):
 Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Részletes tematika: I. Félév: 1. Hét (4 óra): Szerves Vegyületek Szerkezete. Kötéselmélet Lewis kötéselmélet; atompálya, molekulapálya; molekulapálya elmélet; átlapolódás, orbitálok hibridizációja; molekulák
Minta feladatsor. Az ion neve. Az ion képlete O 4. Szulfátion O 3. Alumíniumion S 2 CHH 3 COO. Króm(III)ion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
R R C X C X R R X + C H R CH CH R H + BH 2 + Eliminációs reakciók
 Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
H 3 C CH 2 CH 2 CH 3
 3. Előadás Konstitució, konfiguráció, konformáció. Az izoméria fajtái. A sztereoizoméria. A kettős kötéshez kapcsolódó izoméria jelenségek. Az optikai izoméria. Az optikai aktivitás és mérése. 9. Konstitúció,
3. Előadás Konstitució, konfiguráció, konformáció. Az izoméria fajtái. A sztereoizoméria. A kettős kötéshez kapcsolódó izoméria jelenségek. Az optikai izoméria. Az optikai aktivitás és mérése. 9. Konstitúció,
Szemináriumi feladatok (kiegészítés) I. félév
 Szemináriumi feladatok (kiegészítés) I. félév I. Szeminárium 1. Rajzolja fel az alábbi ion π-molekulapályáit: N ány centrumú a delokalizált rendszer? ány elektron építi fel a delokalizált rendszert? ány
Szemináriumi feladatok (kiegészítés) I. félév I. Szeminárium 1. Rajzolja fel az alábbi ion π-molekulapályáit: N ány centrumú a delokalizált rendszer? ány elektron építi fel a delokalizált rendszert? ány
7. Előadás. Alkoholok, éterek. Oxovegyületek.
 7. Előadás Alkoholok, éterek. xovegyületek. 22. Alkoholok, fenolok, éterek Faszesz ( 3 ) Toxikus: 30ml vakság LD 50 érték patkányokban LD 50 = A populáció 50%-ának elhullásához szükséges dózis [g/kg] LD
7. Előadás Alkoholok, éterek. xovegyületek. 22. Alkoholok, fenolok, éterek Faszesz ( 3 ) Toxikus: 30ml vakság LD 50 érték patkányokban LD 50 = A populáció 50%-ának elhullásához szükséges dózis [g/kg] LD
1. feladat Maximális pontszám: 5. 2. feladat Maximális pontszám: 8. 3. feladat Maximális pontszám: 7. 4. feladat Maximális pontszám: 9
 1. feladat Maximális pontszám: 5 Mennyi az egyes komponensek parciális nyomása a földből feltörő 202 000 Pa össznyomású földgázban, ha annak térfogatszázalékos összetétele a következő: φ(ch 4 ) = 94,7;
1. feladat Maximális pontszám: 5 Mennyi az egyes komponensek parciális nyomása a földből feltörő 202 000 Pa össznyomású földgázban, ha annak térfogatszázalékos összetétele a következő: φ(ch 4 ) = 94,7;
Kémiai alapismeretek 3. hét
 Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
A kémiatanári zárószigorlat tételsora
 1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
1. A. tétel A kémiatanári zárószigorlat tételsora Kémiai alapfogalmak: Atom- és molekulatömeg, anyagmennyiség, elemek és vegyületek elnevezése, jelölése. Kémiai egyenlet, sztöchiometria. A víz jelentősége
