Gyenge kölcsönhatású rendszerek rezgési spektroszkópiai és kvantumkémiai vizsgálata
|
|
|
- Zsombor Halász
- 8 évvel ezelőtt
- Látták:
Átírás
1 Gyenge kölcsönhatású rendszerek rezgési spektroszkópiai és kvantumkémiai vizsgálata Ph.D. disszertáció Készítette: Szabó Andrea Témavezető: Dr. Kovács Attila tudományos főmunkatárs Általános és Analitikai Kémiai Tanszék Budapesti Műszaki és Gazdaságtudományi Egyetem 2003
2 Köszönetnyílvánítás Ezúton szeretnék köszönetet mondani Kovács Attilának, témavezetőmnek, akinek segítsége és türelme nékül ez a dolgozat nem jöhetett volna létre. Köszönettel tartozom Izvekov Vladiszlávnak hasznos tanácsaiért, Nemcsok Dénesnek és Farkas Máriának az együtt végzett munkáért, Keresztury Gábornak a Raman spektrumokért. Köszönöm Gál Sándornak, Hargittai Istvánnak, Pokol Györgynek valamint a Varga József Alapítványnak a lehetőséget és a támogatást. Köszönöm a Tanszék munkatársainak, hogy velük dolgozhattam. Köszönöm a Szervetlen Kémiai Tanszéknek a sok segítséget, melyet az évek során nyújtottak. Végül de nem utolsó sorban köszönöm barátnőimnek és családomnak a bíztatást, és hogy kitartottak mellettem borús pillanataimban, köszönettel tartozom Pap Tímeának, aki mindig segített ügyes-bajos dolgaimban, és különösen Horváth Viktóriának, akihez mindig fordulhattam. 2
3 TARTALOMJEGYZÉK Tartalomjegyzék... 3 I. BEVEZETÉS... 4 II. A HIDROGÉNKÖTÉS... 6 III. AZ ALKALMAZOTT SZÁMÍTÁSI ÉS KÍSÉRLETI MÓDSZEREK... 9 III.1. KVANTUMKÉMIAI SZÁMÍTÁSOK... 9 III.2. A SKÁLÁZOTT KVANTUMMECHANIKAI MÓDSZER (SQM) III.3. REZGÉSI SPEKTROSZKÓPIA IV. EREDMÉNYEK IV.1 BENZOLSZÁRMAZÉKOKBAN ELŐFORDULÓ INTRAMOLEKULÁRIS HIDROGÉNKÖTÉSEK SZERKEZETI SAJÁTSÁGAI [1] IV.1.1. Célkitűzés IV.1.2. Irodalmi áttekintés IV.1.3. Számítási részletek IV.1.4. A hidrogénkötések energetikai viszonyai IV.1.5. A hidrogénkötések geometriai jellegzetességei IV.1.6. A hidrogénkötés hatása a benzolgyűrű geometriájára IV.1.7. Rezgési sajátságok IV.2. A 4-ACETIL-3(5)-AMINO-5(3)-METIL-PIRAZOL SZERKEZETI ÉS REZGÉSI SAJÁTSÁGAI [2] IV.2.1. Célkitűzés IV.2.2. Irodalmi áttekintés IV.2.3. Számítási részletek IV.2.4. Konformáció, tautomerizáció, geometria IV.2.5. Rezgési analízis...29 IV.3. A DIMETIL-GLIOXIM SZERKEZETI ÉS REZGÉSI TULAJDONSÁGAINAK VIZSGÁLATA [3] IV.3.1. Célkitűzés IV.3.2. Irodalmi áttekintés IV.3.3. Számítási részletek IV.3.4. Szerkezeti analízis IV.3.5. Rezgési analízis...41 IV.4. A NIKKEL-DIMETIL-GLIOXIM KOMPLEX [4] IV.4.1. Célkitűzés IV.4.2. Irodalmi áttekintés IV.4.3. Számítási részletek IV.4.4. Rezgési analízis...56 IV.5. FORMALDEHID SZÁRMAZÉKOK KÉK ELTOLÓDÁSÚ C H Y (Y=O, HALOGÉN) HIDROGÉNKÖTÉSES DIMEREINEK VIZSGÁLATA [5] IV.5.1. Célkitűzés IV.5.2. Irodalmi áttekintés IV Kék eltolódású hidrogénkötések IV Formaldehid származékok dimerjeinek szerkezeti érdekességei IV.5.3. Számítási részletek IV.5.4. Monomerek IV.5.5. Dimerek IV.5.6. A H... X kölcsönhatás geometriai sajátságai IV.5.7. Kék eltolódású hidrogénkötés vizsgálata V. ÖSSZEFOGLALÁS VI. TÉZISEK VI. IRODALOMJEGYZÉK
4 I. Bevezetés A gyenge kölcsönhatású rendszerek kémiája még sok megválaszolatlan kérdést rejt magában. Ennek fő oka, hogy a kísérleti úton vizsgálható effektusok gyengék, sokszor az illető tulajdonság mérésének kísérleti hibahatára közelében vannak. Ilyen esetekben nehéz különbséget tenni a gyenge kölcsönhatást tartalmazó rendszer és az azt nem tartalmazó referencia modell között, illetve a kapott kvantitatív adatoknak nagy a bizonytalansága. A BME Általános és Analitikai Kémia Tanszéken működő Szerkezeti Kémia Csoport közel 10 éve foglalkozik gyenge kölcsönhatású rendszerek, elsősorban intramolekuláris hidrogénkötések szerkezeti vizsgálatával. Fő vizsgálati módszereik a rezgési spektroszkópia és a kvantumkémiai számítások. A kísérleti módszerek (IR, Raman) közül az IR spektroszkópia alkalmasabb a hidrogénkötés vizsgálatára, mert ott a kölcsönhatásban érintett sávok nagy intenzitással jelennek meg, s különösen az OH torziós rezgés frekvenciája érzékeny ilyen jellegű kölcsönhatásokra. A kvantumkémiai számítások előnye különösen rokon vegyületek vizsgálatakor mutatkozik meg, melyeknél a számítás relatív hibái (a származékok egymáshoz viszonyított relatív hibái) jóval a kísérleti hiba alatt vannak. Ezáltal elég jó pontossággal meg tudjuk határozni a gyenge kölcsönhatás esetén fellépő gyenge effektusokat. Ebbe a kutatásba kapcsolódtam be előbb TDK-s hallgatóként, majd 1999-ben történt diplomavédésem után doktoránsként. Munkám két fő területre tagozódott: Gyenge kölcsönhatású rendszerek szerkezeti tulajdonságainak vizsgálata kvantumkémai számítások segítségével; Intramolekuláris hidrogénkötést tartalmazó rendszerek szerkezeti és rezgési analízise. Jelen dolgozatban a következő vizsgálatokról számolok be: 1. Orto-szubsztituált fenolszármazékokban kialakuló intramolekuláris hidrogénkötések szerkezeti és rezgési jellemzői. A fenti munkában elsősorban kvantumkémiai számítások segítségével különböző akceptorok hidrogénkötés képzési hajlamát, a jellegzetes szerkezeti effektusokat vizsgáltuk és kíséreltük meg rendszerezni. 2. A 4-acetil-3(5)-amino-5(3)-metil-pirazol szerkezeti és rezgési analízise. A vegyületnek összetett tautomer/konformációs egyensúlya van, amit kvantumkémiai számításokkal tanulmányoztunk. Emellett FT-IR és FT-Raman spektrumokra alapozva elvégeztük a szilárd fázisban található szerkezet teljes rezgési analízisét. A normálkoordináta analízishez a kiindulási erőállandó mátrixot kvantumkémiai számításokból nyertük. A 4
5 számított erőtér szisztematikus hibáit a Pulay-féle skálázott kvantummechanikai (SQM) módszer alapján az erőállandók szelektív skálázásával korrigáltuk. 3. A fentivel analóg módon tanulmányoztuk a dimetil-glioxim konformációs terét és végeztük el a legstabilabb izomer rezgési (SQM) analízisét. 4. A szerkezeti és rezgési tulajdonságok teljesen megváltoznak a dimetil-glioxim fémionokkal képzett komplexeiben. Ezek közül mi a nikkel-komplex szerkezeti és rezgési jellemzését végeztük el. A koordinatív kölcsönhatás mellett a vegyület külön érdekessége a ligandumok közötti rendkívül erős intramolekuláris hidrogénkötés. 5. Végül az utolsó fejezetben formaldehid származékok dimerjeiben fellépő hidrogénkötés illetve van der Waals kölcsönhatások vizsgálatáról számolok be. Ez szintén kizárólag kvantumkémiai számításokkal történt, s a szerkezeti és rezgési jellegzetességek mellett felderítettük a jellemző hiperkonjugációs effektusokat. A disszertáció a következő megjelent illetve elfogadott közleményekre épül: - A. Kovács, A. Szabó, I. Hargittai. Structural Characteristics of intramolecular hydrogen bonding in benzene derivatives, Accounts of Chemical Research, 2002 közlés alatt [1] - A. Szabó, V. I. Češljević, A. Kovács. Tautomerism, hydrogen bonding and vibrational properties of 4-acetyl-3(5)-amino-5(3)-methylpyrazole, Chemical Physics 2001, 270, [2] - A. Szabó, A. Kovács. Structure and molecular vibrations of dimethylglioxime, Journal of Molecular Structure 2002 közlés alatt. [3] - A. Szabó, A. Kovács: Vibrational analysis of the bis(dimethylglyoximato)nickel(ii) complex, Journal of Molecular Structure 2002 közlés alatt [4] - A. Kovács, A. Szabó, D. Nemcsok, I. Hargittai. Blue-shifting C H X (X=O, halogen) hydrogen bonds in the dimers of formaldehyde derivatives, Journal of Physical Chemistry A, 2002, 106, [5] Az egyes témák különböző jellegéből adódóan a dolgozat szerkezetében eltér a hagyományostól. Az eredményeket bemutató 5 fejezet szinte teljesen független egymástól, mivel még az alkalmazott számítási módszerek (amit a molekula mérete és a vizsgálat időpontjában rendelkezésre álló számítógépes kapacitás határozott meg) is többnyire különböznek. Hasonlóképpen nincs egységes irodalmi fejezet, hanem az egyes témák elején foglalom össze az adott téma előzményeit. Egyedül az irodalomjegyzék került egy fejezetbe a disszertáció végére. 5
6 II. A hidrogénkötés A hidrogénkötés [6-9] a természetben előforduló egyik leggyakoribb gyenge kölcsönhatás, meghatározó szerepe van a biomolekulák (proteinek, nukleinsavak, enzimek) szerkezetében, továbbá a víznek (ami a biokémiai folyamatok természetes közege) tulajdonságainak alakulásában. A legtöbb hidrogénkötés X H Y típusú, ahol X elektronegatív atomot jelöl. Y lehet szintén elektronegatív atom egy vagy több magányos elektronpárral (pl.: O, N, halogének), vagy nagy elektronsűrűségű molekularészlet, mint például az aromás π-rendszer. Ezért a hidrogénkötés klasszikus képe alapján ez erősen elektrosztatikus, néha részlegesen kovalens jellegű kölcsönhatás. Az utóbbi időben a hidrogénkötés fogalma kiszélesedett a gyenge kölcsönhatások figyelembevételével. Határa egészen a van der Waals kölcsönhatásokig terjed, ahol a hidrogénkötésben leginkább a diszperziós/taszító karakter dominál, ilyen például a C H Y, P H O, M H O (M=fém) kölcsönhatás. A hidrogénkötés négyféle kölcsönhatásból tevődik össze: elektrosztatikus (sav/bázis), polarizációs (kemény/lágy), van der Waals (diszperziós/taszító) és kovalens (töltés átmenet). A polarizációs komponens nem teljesen független a másik három komponenstől. (Általában minél nagyobb az elektrosztatikus összetevő, annál keményebb, a kovalens és van der Waals jelleg erősödésével pedig lágyabb lesz.) A különböző tagok aránya a hidrogénkötésben igen változó. Az elektrosztatikus tag (főképp annak dipólus-töltés és dipólus-dipólus összetevői) a legfontosabb, és ez adja a hidrogénkötés tipikus (és igen fontos) irányultságát. Egy X H... Y (X és Y erős elektronegatív atomok) típusú hidrogénkötés az X H kötés nyúlását eredményezi, ami a megfelelő X H vegyértékrezgés (υ XH ) csökkenésével (vörös eltolódás) jár. A kölcsönhatás mértéke növekszik X és Y növekvő elektronegativitásával. A legtöbb hidrogénkötés elektrosztatikus kölcsönhatás, de az elektrosztatikus karakter mellett, a hidrogénkötésnek van töltés átmenet jellege is, így az Y H kapcsolat lehet részlegesen kovalens is. Az elektrosztatikus jelleg dominál a klasszikus N H O, O H O és O H N kötésekben. Kifejezetten kovalens karakterű hidrogénkötést csak ritkán, igen erős hidrogénkötések között lehet találni (20-40 kj/mol energiatartományban). Töltés vagy rezonancia támogatás növeli a kovalens jelleget. Ezekben a molekulákban a kovalens jellegnek köszönhetően a H Y távolság jelentősen lecsökken (1,2-1,4 Å H O távolság O H O kötésekben [10]), valamint az X H Y szög 180º közeli. 6
7 Noha korán felismerték, hogy C H is lehet donor és π rendszer is lehet akceptor ebben a kölcsönhatásban, és erre számos spektroszkópiai bizonyítékot is találtak, a klasszikus nézet az erős elektrosztatikus kölcsönhatásról továbbra is tartotta magát. Az X Y (vagy H Y) nemkötő távolság rövidebb a van der Waals rádiuszok összegénél minden erősen elektrosztatikus jellegű X H Y kölcsönhatásban, ezért az elektrosztatikus kölcsönhatásként való felfogásból eredően ez vált kritériumává, hogy egy kölcsönhatást hidrogénkötésnek tekintsenek-e. Ennek következménye, hogy régebben csak az erősen elektrosztatikus kölcsönhatásokat tekintették hidrogénkötésnek. Azonban számos más olyan kölcsönhatás létezik, amely nem olyan erős (és nem olyan elektrosztatikus), mint az N H O, O H O és O H N kötések, mégis számos hasonló geometriai, szerkezeti, spektrális jellegzetességet mutatnak, mint erősebb társaik, bár sokkal kisebb mértékben. A gyenge hidrogénkötést olyan kölcsönhatásokra definiálják, ahol X és Y közül egyik vagy mind a kettő közepes vagy gyenge elektronegativitású. A legrégebben ismert ilyen kölcsönhatás a C H O, de ismertek P H O, S H O, C H N, M H O (M=fém) kölcsönhatások, ahol a hidrogénkötés gyenge donor és erős akceptor között jön létre. Gyenge hidrogénkötésekben (C H O, O H π) a kovalens jellegű tag igen kicsi, sőt az elektrosztatikus összetevő is, leginkább a van der Waals klaszterekre jellemző diszperziós tag dominál. A diszperziós kölcsönhatás irányultsága sokkal kevésbé specifikus, mint az elektrosztatikusé. Bár ez a kölcsönhatás kisebb energiájú, biomolekulákban igen nagy számban fordulhat elő, így gyakran a klaszter stabilizációs energiájának nagy részét alkotja, míg a klaszter irányultságát az elektrosztatikus tag adja. A hidrogénhíd lehet intra-, vagy intermolekuláris. Az intramolekuláris hidrogénkötés kevésbé gyakori és általában gyengébb, mint intermolekuláris megfelelője, azonban említésre méltó hatást gyakorolhat a molekula tulajdonságaira. Meghatározhatja a konformerek relatív stabilitását, a töltés eloszlást a molekulán belül, a reaktivitást. A hidrogénkötés másodlagos jellegét tükrözi, hogy míg a kovalens kötés hosszára vagy szögére a környezet csak kismértékben hat, addig a hidrogénkötés függ az X és Y atomok közvetlen szomszédaitól. Geometriai paramétereit más intermolekuláris kölcsönhatások könnyen megváltoztathatják. A hidrogénkötésre jellemző erőállandó sokkal (kb. 15-ször) kisebb, mint a kovalens kötéseké. A geometria szempontjából a legkedvezőbb, ha a H Y B szög (X H Y B jelölést alkalmazva) megegyezik a magányos elektronpár Y B szöggel. Ez általában meg is valósulhat intermolekuláris H-híd esetén, ahol többé-kevésbé szabadon 7
8 helyezkedhetnek el a kölcsönható molekulák. Intramolekuláris kölcsönhatás esetén azonban az elrendeződés geometriailag korlátozott, innen ered az intermolekulárisnál (rendszerint) gyengébb jellegük. A hidrogénkötés kísérleti módszerekkel, elsősorban röntgen- és neutrondiffrakcióval, valamint NMR és rezgési (leggyakrabban IR) spektroszkópiával vizsgálható. Az IR spektroszkópia előnye, hogy a minta mindhárom halmazállapotban vizsgálható. A hidrogénkötés hatásai mind a donor (X H), mind az akceptor csoport (Y) rezgéseinél megfigyelhetők, de nem egyforma mértékben módosítják azokat. A jellemző effektusok: Az X H vegyértékrezgések frekvenciái a kisebb hullámszámok irányába tolódnak el, a sávok kiszélesednek, integrált IR intenzitásuk nő. Ezek a sávok általában a hidrogénkötés legjellemzőbb indikátorai. Nagyon erős hidrogénkötés esetén azonban ezek a sávok elveszíthetik jellegüket, vagy az igen erős kiszélesedés következtében az alapvonalba olvadva teljesen eltűnhetnek a spektrumból. Az XH csoport deformációs rezgéseihez tartozó sávok a nagyobb hullámszámok irányába tolódnak el, de az eltolódás mértéke kisebb, mint a vegyértékrezgés esetén. Lényeges intenzitásváltozást nem tapasztalunk. A kisebb változások oka részben az, hogy ezek a normálrezgések erősen kevertek, az XH deformáció mellett más mozgásokat is tartalmaznak. Rendkívül jellemző viszont az OH torziós sáv, mely általában nem (vagy csak kismértékben) szokott keveredni más rezgésekkel. Sávja a hidrogénkötés hatására a magasabb hullámszámok irányába tolódik el, intenzitása és szélessége nő. A protonakceptor Y csoport frekvenciái is eltolódnak az XH csoport frekvenciáihoz hasonlóan, de kisebb mértékben. A távoli IR tartományban az Y H vegyérték- és deformációs rezgéseknek megfelelően új sávok jelenhetnek meg. IR spektroszkópiával az inter- és intramolekuláris hidrogénkötések is megkülönböztethetők a következő jellegzetességek alapján: Intramolekuláris kölcsönhatás esetén az X H kötés vegyértékrezgési sávja kisebb mértékben tolódik el a kisebb hullámszámok irányába, mint intermolekuláris esetben, és kisebb mértékű a sávszélesedés is. Apoláris oldószerekben általában az intramolekuláris hidrogénkötések nem szakadnak fel higítás hatására, ellentétben az intermolekulárisokkal, így tisztán intramolekuláris esetben higítás hatására nem lép fel sáveltolódás. 8
9 Deuteráláskor az intramolekuláris kötésben részt vevő H atomok nehezebben cserélhetők ki deutériumra. A hidrogénkötés jellegzetes geometriai és spektroszkópiai megnyilvánulásait a következőképpen értelmezhetjük. Az elektrondonor magányos elektronpárjáról vagy π molekulapályájáról töltéstranszfer (CT) történik az X H kötés lazító pályájára. Ezen a pályán nő az elektronsűrűség, ez okozza a kötés megnyúlását, ami pedig a ν XH vörös eltolódását eredményezi. A CT valójában meglehetősen kicsi, rendszerint nem több 0.01 e - -nál [11]. A teljes képhez hozzátartoznak még a kevésbé gyakori, speciálisabb hidrogénkötések, úgy mint például a kék eltolódású (blue-shifting) hidrogénkötés. A kék eltolódású hidrogénkötés megjelenésében teljesen különbözik a klasszikus hidrogénkötéstől. Nem X H nyúlás, hanem rövidülés, és ezzel együtt νxh kék eltolódás figyelhető meg. Ilyen típusú C H... π kölcsönhatást találtak kloroform-fluorbenzol komplexeknél [12]. C H... O és C H... Y (Y=halogén) típusúakat pedig fluoroform-etilén-oxid és Y... H3 CX (X,Y=halogén) komplexekben figyeltek meg [13]. A kék eltolódású hidrogénkötéssel részletesebben foglalkozom a IV.5. fejezetben, ahol egy ilyen modellvegyület csoport vizsgálatáról számolok be. III. Az alkalmazott számítási és kísérleti módszerek III.1. Kvantumkémiai számítások A számítástechnika rohamos fejlődésének eredményeként az egyre magasabb szintű kvantumkémiai számítások mind nagyobb teret nyernek a molekulaszerkezet és egyéb fizikaikémiai tulajdonságok vizsgálatában [14]. A manapság már rutinszerűen alkalmazott Møller- Plesset-féle perturbációs (MP2 [15]) és sűrűségfunkcionál (B3LYP, B3P86 [16-18]) módszerekkel kapott adatok minősége olyan szintű, hogy kiegészítő információként használhatók a kísérleti adatok kiértékeléséhez. Példaként említenénk a számításokkal meghatározott különbségek rögzített paraméterként való felvételét az elektrondiffrakciós szerkezetanalízisben, az elektrongerjesztési, rezgési és NMR-spektrumok hozzárendelését a számított spektrumok alapján, reakciómechanizmus vizsgálatokat, stb. [19]. Megfelelően kis molekulák esetén már a kísérletivel vetekedő, vagy annál pontosabb eredményeket lehet a számításokkal kapni. 9
10 A kvantumkémia képes az egyedi, a környezeti kölcsönhatásoktól mentes, izolált molekulákat vizsgálni. A környezeti kölcsönhatások modellezésével (pl. oldószerhatás) arra kapunk információt, hogy ezek a kölcsönhatások hogyan változtatják meg a molekula tulajdonságait. Egy adott kötés esetén a kölcsönhatási energiát fizikai jelentéssel bíró komponensekre lehet bontani, ami által betekintést nyerhetünk a kölcsönhatás alaptermészetébe, mely kiegészítő információt szolgáltathat a jelenségek megértéséhez. Ezen kívül a kísérleti módszerek gyakran csak a globális minimum szerkezetről szolgáltatnak információt, míg a kvantumkémia az egész potenciális energia hiperfelületet feltérképezheti. Ezért a kvantumkémiai számítások további jellemző alkalmazási területe olyan molekuláris tulajdonságok vizsgálata, melyek kísérleti módszerekkel nem, vagy csak közvetve, nehezen tanulmányozhatók. Ide tartozik többek között a konformációs analízis, a kémiai kötés és gyenge kölcsönhatások elektronszerkezeti vizsgálata [19], molekuladinamikai vizsgálatok [20], stb. A kvantumkémiai számítási módszerek az utóbbi két évtizedben hatásos eszközévé váltak a rezgési spektrumok előrejelzéseinek és értelmezéseinek is. Legkényelmesebb és leggyakrabban alkalmazott az erőállandók számítása harmónikus közelítés alkalmazásával. Ezen számított és a kísérleti frekvenciák között eltérés van. Az elméleti erőállandók hibái, amik a kísérleti frekvenciák anharmonicitásával szemben alkalmazott harmonikus közelítésből, a véges bázisból, az alkalmazott kvantumkémiai közelítésekből és elhanyagolásokból, az elektronkorreláció nem tökéletes figyelembevételéből adódnak, közel szisztematikusak és empírikus módon jól korrigálhatóak. A hiba csökkenthető, de nem küszöbölhető ki teljesen az elektronkorreláció figyelembevételével és a bázis növelésével. Sajnos, a legtöbb korrelált hullámfüggvény túl nagy a gyakorlati alkalmazás céljára. A közelmúltban népszerűvé vált sűrűségfunkcionál (DFT) módszerek, melyek az elektronkorreláció egy részét tartalmazzák, összemérhető költségigényűek a Hartree-Fock számításokkal, jó eredményeket adnak. A rezgési analízis területén jelentős előrelépést jelentett az ab initio számítások és az empírikus korrekciók kombinálása a skálázott kvantummechanikai erőtér (SQM) módszerben [21,22]. A kvantumkémiai számításoknál legfontosabb a megfelelő módszer kiválasztása. Itt a módszer teljesítménye mellett a hardver és számítási idő igényét kell figyelembe venni. A stabilizációs energia HF és korrelációs komponensekből áll. A korrelációs energia fontos minden molekulaklaszterre, elhanyagolása jelentős hibát okoz. A post-hf módszerek a teljes korrelációs energia különböző részét fedik le. A teljes konfigurációs kölcsönhatás módszere (FCI) veszi figyelembe a teljes korrelációs energiát, azonban sem most, sem a 10
11 közeljövőben ez még nem lesz alkalmas nagyobb klaszterek vizsgálatához. A leggazdaságosabb és széleskörben használt MP2 használható nagyobb molekulákhoz is és a korrelációs energia meglepően jó becslését adja. A népszerű DFT módszerek számítási igénye jóval kisebb, mint a post-hf módszereké, tartalmaznak kicserélődési tagot és a korrelációs energia egy részét. Ismert, hogy a DFT módszerek jól alkalmazhatók hidrogénkötéses rendszerekben, szerkezet, dipólusmomentum, energiák és rezgési tulajdonságok kérdésében, azonban gyengébb kölcsönhatásoknál ezek használata bizonytalan, mivel egyik létező funkcionál sem írja le a London-féle diszperziós energiákat [13]. A bázist is körültekintően kell megválasztanunk. Gyenge kölcsönhatású rendszerek vizsgálata nagy bázist igényel. Hogy minél jobb stabilizációs energiát kapjunk, annál több polarizációs és diffúz függvényt kell alkalmaznunk. Sajnos még komolyabb bázisoknál is fellép a bázis szuperpozíciós hiba (BSSE), ami a teljes rendszer és az alrendszerek különböző leírásából ered, mivel a teljes rendszer báziskészlete nagyobb, mint az alrendszereké. Ez a hiba a "counterpoise" (CP) módszerrel [23,24] korrigálható. Ha nagyobb bázist használunk, a BSSE értéke zérushoz konvergál, bár ez a konvergencia lassú. Nagyobb klaszterek vizsgálatakor a bázis igen nagyméretű növelése nem járható út, itt a CP korrekció használható. Míg a kölcsönhatási energiákat többé-kevésbé korrigáltuk, addig a kommersz kvantumkémiai programokba beépített CP eljárás nem veszi figyelembe a túlbecsült kölcsönhatás geometriára gyakorolt hatását, ami arányos a BSSE teljes kölcsönhatási energiához viszonyított nagyságával. A geometria és frekvencia számításokat GAUSSIAN94 [25] illetve a Gaussian98 [26] programokkal végeztük, a vizsgált vegyületek és kérdéses tulajdonságaiknak megfelelő különböző elméleti szinteken. A vizsgálatokban az MP2 [15] és a Becke3-Lee-Yang-Parr (B3LYP) [16,17] módszereket használtuk különböző bázisokkal. A részleteket az adott fejezetekben ismertetem. A természetes kötéspálya (NBO) analíziseket és a természetes atomi töltések számítását az NBO 5.0 programmal [27] végeztük. A rezgési analízishez a számítások B3LYP sűrűségfunkcionál módszerrel 6-31G* illetve G** bázissal készültek. A numerikus integráláshoz az alapértelmezett (50,194) rácsot használtuk. Az IR intenzitások számítása a skálázatlan erőtéren történt. Az SQM analízishez a következő segédprogramokat alkalmaztuk: az elméleti erőállandó mátrixon dimenzió- és formátumváltoztatást hajtottunk végre Hartree/(Bohr) 2 -ről mdyne/åre, (ahol 1 H/B 2 =15, mdyne/å) a TGAUSS program [28] segítségével. A természetes belső koordinátákat a primitív belső koordinátákból többnyire az INTC programmal [29] 11
12 generáltuk. Az erőállandó mátrixot Descartes koordináta rendszerből áttranszformáltuk a természetes belső koordináta rendszerbe a TRA3 program [30] segítségével. A SCALE3 programmal [31,32] elvégeztük a természetes belső koordináta rendszerben kifejezett erőállandók skálázását, a frekvenciaszámítást és az egyes normálrezgések jellemzésére szolgáló teljes energia eloszlás meghatározását [33,34]. A korrekciók hatásosságát az RMS 2 kís szám / deviációval ( Σ ( ν ν ) n, ahol n a hozzárendelt alaprezgések száma) jellemeztük. III.2. A skálázott kvantummechanikai módszer (SQM) Az SQM analízis kvantumkémiai úton kapott rezgési erőtérre épül, ahol a számított erőtér szisztematikus hibáit empírikus módon (skálafaktorokkal) törekszünk korrigálni [35]. A szelektív skálázás előnyeit a teljes (vagy globális) skálázással szemben (ahol az egész rezgési erőtérre, illetve az összes frekvenciára egy közös skálafaktort használunk) Blom és Altona már 1976-ban bebizonyította [35]. Az ő módszerük szolgáltatta a skálázott kvantummechanikai (SQM) módszer alapjait. A rezgési analízis főbb céljai: -spektrumok hozzárendelése, melynek fontos szerepe van például az IR spektroszkópia következő alkalmazásaiban: - anyag azonosítása - reakciók nyomonkövetése és - intra- és intermolekuláris kölcsönhatások vizsgálata spektrumbeli jellegzetességek alapján - kvadratikus rezgési erőtér meghatározása, melynek fontos alkalmazása van például az elektrondiffrakciós szerkezetanalízisben és molekulamodellezési programokban. A mai SQM alkalmazásokban [36] a molekulageometriát többnyire egy teljes nemredundáns belső koordináta rendszerben, az ún. természetes belső koordináta rendszerben fejezik ki. A természetes belső koordinátákban a vegyértékrezgési koordináták az egyes kötéshosszak változásának, míg a deformációs koordináták az egyes kötésszög-, illetve torziós szög változások lineáris kombinációinak felelnek meg. A lineárkombináció együtthatóit a helyi pszeudoszimmetria alapján választják. Az analíziseknél használt belső koordinátákat az egyes molekulák részletes tárgyalásánál tüntetem fel. 12
13 A természetes belső koordináták kémiai jellegük szerint csoportokra osztva ugyanazt a közös skálafaktort kapják. A skálafaktort minden csoporthoz több modellvegyület számított és a kísérleti adatainak legkisebb négyzetek módszerével való illesztésével kapták. Az eredetileg Descartes koordináta-rendszerben számított erőállandókat áttranszformálják a belső koordináta reprezentációba és a belső koordináta rendszerben megadott erőállandó mátrixot (F) skálázzák (nem az egyes rezgési frekvenciákat) a következő egyenlet szerint: F ( skálázott) = ( s s ) ij i j 1/ 2 F ij ahol s i és s j a skálafaktorok, i és j a természetes belső koordináták. Az SQM módszer a számított harmonikus erőteret néhány skálafaktorral korrigálja. Ezek a skálafaktorok jól átvihetők kémiailag hasonló molekulák között, így néhány skálafaktorral a molekulák széles skálájáról szerezhetünk pontosabb rezgési információkat. Az SQM analízis az El'yashevich Wilson-féle GF módszerre épül [37]. A klasszikus normálkoordináta-analízistől annyiban különbözik, hogy nem egy rokon molekuláktól átvett limitált méretű empirikus erőállandó-készletet használ, hanem egy kvantumkémiai úton számított teljes kvadratikus erőállandó-mátrixot. A kvantumkémiai számítás közelítéseiből adódó hibákat ugyan megfelelő módon, a számított harmonikus erőállandók skálázásával korrigálni kell, de a számítás hibáinak szisztematikus jellege miatt (azonos elméleti szintet használva) a skálafaktorok átvitelének egyik molekuláról a másikra sokkal nagyobb a realitása, mint pusztán az erőállandóké. Rendkívüli esetekben, mikor a skálafaktorok optimálása szükségessé válik (egzotikus molekula, más elméleti szinten számított erőtér), ez csak kis számú (5-10) változót jelent, szemben a klasszikus normálkoordináta-analízisnél alkalmazott nagyszámú erőállandóval. III.3. Rezgési spektroszkópia Az IR spektrumok a Budapesti Műszaki Egyetem Általános és Analitikai Kémia Tanszék Perkin-Elmer System 2000 FT-IR spektrométerén készültek az analitikai IR tartományban ( cm -1 ) MCT detektorral, a távoli IR tartományban ( cm -1 ) DTGS detektorral. A szilárd fázisú spektrum felvétele az analitikai IR tartományban KBr pasztillából, a távoli IR-ben polietilén pasztillából történt. A felbontás 4 cm -1 volt. Az analitikai IR-ben 16, a távoliban 128 (a dimetil-glioxim esetében 256) akkumulációt végeztünk. 13
14 A Raman spektrumok a KKKI Nicolet Model 950 FT-Raman spektrométerével, 2 cm -1 - es felbontással, cm -1 tartományban, 512 (4-acetil-3-amino-5-metil-pirazol) illetve 2048 (nikkel-dimetil-glioxim) akkumulációval készültek. A gerjesztő fénysugár a Nd-YAG lézer 1064 nm-es vonala volt. IV. Eredmények IV.1 Benzolszármazékokban előforduló intramolekuláris hidrogénkötések szerkezeti sajátságai [1] IV.1.1. Célkitűzés Feladatom volt intramolekuláris O H... Y típusú kölcsönhatások összehasonlítása ortoszubsztituált fenolszármazékok egy csoportjában. Az összehasonlításban szereplő csoportok (BY n : C=N, NO 2, C=O, P=O, F, CF 3 ; itt B jelenti a benzolgyűrűhöz közvetlenül kapcsolódó atomokat, Y pedig a hidrogénakceptor N, O és F atomokat. Ebből a rendszerből egyedül a fluor-fenol származékok lógnak ki, ahol B-nek a benzolgyűrű kapcsolódó szénatomját vettük, lásd 1. táblázat.) lefedik a hidrogén akceptorok skáláját a gyengétől az erős hidrogénkötésekig. A következő molekuláris tulajdonságok összehasonlító elemzése volt a célunk: -a hidrogénkötés energiája (a hidrogénkötéses és a nem hidrogénkötéses konformerek relatív energiájából becsülve); -a donor (OH) és akceptor (BY n ) csoportok geometriai jellegzetességei a hidrogénkötéses rendszerben az alapmolekulákhoz képest; -a hidrogénkötés hatása a benzolgyűrűre; -az intramolekuláris hidrogénkötések rezgési sajátságai. IV.1.2. Irodalmi áttekintés: Hargittai István professzor vezetésével számos intramolekuláris hidrogénkötést tartalmazó benzolszármazék szerkezeti tulajdonságait vizsgálták az elmúlt évtizedben gáz fázisú elektrondiffrakció és kvantumkémiai számítási módszerek alkalmazásával [38-59]. Az összegyűlt kísérleti és elméleti információk alapján 2001-ben úgy éreztük, megérett az idő egy összefoglaló elemzés készítésére. 14
15 Mivel a korábbi munkákban többféle számítási módszert használtak, a kis effektusok a vegyületek összességére (közel 20) kvantitatíve nem összevethetőek. Egyik feladatom ezért a számítási eredmények egy szintre hozása volt. IV.1.3. Számítási részletek Ismert, hogy az MP2/6-31G** elméleti szint megbízhatóan írja le a hidrogénkötéses rendszerek szerkezeti tulajdonságait. Kovács és munkatársai ezen a szinten számolták az F H intramolekuláris hidrogénkötéses rendszereket [48,49,52,53]. Az összehasonlító elemzésben szereplő molekulák többségét ezen a szinten számoltam újra. Mivel a hidrogénkötések energetikájának leírására diffúz függvényekkel bővített bázist javasolnak [60], a számított geometriákra MP2/6-31+G** enerigaszámításokat végeztem. (Az energetikai viszonyokkal ellentétben a geometriai változások a diffúz függvény alkalmazásakor elhanyagolhatónak bizonyultak [49,54], ezt a 2-nitrofenol és a 2-trifluorometil-fenol molekulán végzett teszt számítások is igazolták [48].) A zérus-ponti rezgési energiakorrekció HF/6-31G** frekvencia analízissel történt 0,9135 [61] skálafaktorral korrigálva. Az elektrondiffrakciós adatokat a [39-43,51,55,56], míg a kísérleti rezgési frekvenciákat az [50,59] közleményekből vettük. IV.1.4. A hidrogénkötések energetikai viszonyai Az intramolekuláris hidrogénkötések energetikájára csak számított adatok állnak rendelkezésre (1. táblázat). Ezt a hidrogénkötést tartalmazó illetve nem tartalmazó konformerek közötti energiakülönbséggel lehet becsülni. (Ez a közelítés a valóságosnál kicsit erősebb hidrogénkötést ad, mert a hidrogénkötést nem tartalmazó konformerben kedvezőtlen sztérikus kölcsönhatások léphetnek fel a hidroxil csoport oxigénje és az akceptor nemkötő elektronpárjai valamint a hidroxil csoport hidrogénje és a gyűrű szomszédos hidrogénje között.) Az orto-szubsztituált fenolokban a hidrogénkötés erőssége a különböző akceptor csoportokkal a következő sorrend szerint változik: C=N > NO 2 ~ C=O > P=O ~ F > CF 3. Az 1. táblázatból egyértelműen látszik az sp 2 nitrogén és az oxigén preferáltsága. A hidrogénkötés energiája csökken, ahogy nehezebb elem, P, kerül az akceptor csoportba. A hidrogénkötés energiája erősen függ a szubsztitúció fokától és a szubsztituensek relatív térbeli 15
16 elrendeződésétől. A hidrokinon származékok kb. 6 kj/mollal gyengébb, a 4,6-diszubsztituált rezorcinok kb. 4 kj/mollal erősebb hidrogénkötést hoznak létre, mint a megfelelő, csak egy hidrogénkötést tartalmazó származékaik. A 2-nitrorezorcin gyengébb hidrogénkötése feltehetően a feszültebb rendszer miatti jelentős taszító erőknek tulajdonítható. A fluor nagy elektronegativitásának és az ebből adódó nagy negatív töltésének ellenére a szerves fluor akceptorok hidrogénkötései meglehetősen gyengék. Ez mind a számított hidrogénkötés energiákból, mind a szerkezeti és spektroszkópiai jellegzetességekből (1. és 2. táblázat) jól látszik. Hasonlóképpen gyenge H... F hidrogénkötést találtak a kristályban is [62]. A szerves fluorvegyületek gyenge hidrogénkötést képező hajlama a fluor gyenge proton affinitásával és nagy keménységével (kis bázicitás, kisméretű elektronhéj) magyarázható, valamint, hogy ez a tulajdonsága nehezen befolyásolható intramolekuláris delokalizáció vagy intermolekuláris kooperatív hatások révén [63]. A BY n = NO 2 és CF 3 esetekben a kisebb etilén analógokat is vizsgáltuk azzal a céllal, hogy információt kapjunk az aromás gyűrű hatására a fenti hidrogénkötésekben. Azt tapasztaltuk, hogy az etilénszármazékokban általában erősebb az intramolekuláris hidrogénkötés, mint a benzolszármazékokban, ami sztérikus és elektronikus tényezőknek tulajdonítható: - az etilénszármazékokban általában rövidebb a C=C kötés, mint a benzol megfelelő kötéshossza, emiatt a donor és akceptor csoport közelebb kerül egymáshoz; - a kedvezőtlen sztérikus hatások a BY n és az orto helyzetű aromás H között jelentősen kisebbek az etilén származékokban; - a konjugáció a vinil C=C csoporttal nagyobb, mint az aromás π rendszerrel, amit az etilénszármazék rövidebb C O és C B kötései is bizonyítanak. Ez az OH és BY n csoportok erősebb elektronikus kölcsönhatását eredményezi a vinil C=C csoporton keresztül, ami a rezonancia-támogatott hidrogénkötés-modell [64,65] alapján növeli a hidrogénkötés erősségét. Az sp 2 váz jelentőségét a hidrogénkötésben az sp 3 -mal szemben a 2-nitro-vinilalkohol és 2-nitro-etanol összehasonlítása szemlélteti, mely utóbbi vegyületben a C C kötés túl hosszú, hogy kedvező sztérikus feltételeket teremtsen a hidrogénkötés számára. Következésképpen, a kölcsönhatási energia igen kicsi, kb. 4 kj/mol. Azonban még ez a kis vonzó kölcsönhatás is látható szerkezeti hatásokat eredményez. 16
17 IV.1.5. A hidrogénkötések geometriai jellegzetességei A hidrogénkötés az elektronsűrűség eloszlás újrarendeződését eredményezi, ami jellegzetes változásokat okoz a molekula geometriájában és a spektroszkópiai tulajdonságokban. A közvetlen geometriai változások a O H és B Y kötéshosszakon, míg a legfontosabb közvetett változások az OH és BY n csoportok többi paraméterén figyelhetők meg. Legjellemzőbb az O H és a BY n kölcsönhatásban részt vevő kötésének megnyúlása, valamint a C O és C B kötések rövidülése. Több kisebb hatás jelentkezik a szomszédos molekularészleteken is. Mindezen változások érzékenyek a hidrogénkötés erősségére. Az 1. táblázat tartalmazza a vizsgált rendszerek legfontosabb geometriai jellegzetességeit. A H... Y és az O... Y távolságokra mind a kísérleti, mind a számított adatokat feltüntettem. Ezek jó alapot nyújtanak a kétféle információforrás összehasonlítására. A táblázat adatai szemléltetik, hogy a gáz fázisú elektrondiffrakció képes az intramolekuláris hidrogénkötés detektálására, azaz megmutatja, hogy a H és az akceptor térben közel van egymáshoz. Azonban a kísérleti hiba értéke relatíve nagy, különösen a hidrogént tartalmazó paramétereknél a gyengébb elektronszórás miatt. Ezért a rendelkezésre álló diffrakciós adatok nem mindig alkalmasak általános következtetések levonására, különösen a geometria finomabb változásait illetően. Jó példa erre a fluor-fenol származékok esete, amikoris a kísérleti H Y távolságok ellentétes trendet jeleznek a számítotthoz képest, ugyanakkor a kísérleti hibájuk olyan nagy, hogy abba még az ellentétes trend is belefér. A fentebb tárgyalt hidrogénkötési energiák és a H Y/O Y távolságok között az intramolekuláris hidrogénkötés esetében nem várható szoros összefüggés. Itt ugyanis az intermolekuláris rendszerekkel ellentétben kisebb-nagyobb geometriai feszültségek is vannak. A hidrogénkötés során a H... Y távolságot a kölcsönhatás erősségén kívül a kölcsönható csoportok relatív helyzete és mérete határozza meg. A csoportok rögzített egymáshoz képesti helyzete hosszabb illetve rövidebb H... Y távolságot is eredményezhet, mint az optimális. Az optimális kölcsönhatás intermolekuláris esetben mérhető, míg egy intramolekuláris kölcsönhatásban a csoportok rögzített térbeli helyzete az előbbinél hosszabb vagy rövidebb HY távolságot eredményezhet. Ez alapján egy rövidebb hidrogénkötés kisebb energiával is járhat a megnövekedett taszító erőknek megfelelően. Az 1. táblázat adataiból kiemelendő a 2- nitro-rezorcin és a 2-nitro-fenol rövidebb hidrogénhídja, míg az öttagú gyűrűs hidrogénkötést tartalmazó fluor-fenolok viszonylag nagy H... F távolsága a fellépő szögfeszültségből eredően. 17
18 1. táblázat. A vizsgált molekulák hidrogénkötési energiája (kj/mol) és néhány jellemző geometriai paramétere (Å). B Vegyület Számított értékek Ref. ED (r g ) Ref. E a H Y O Y (O H) (C O) (B Y) (C B) H Y O Y C=N 2-iminometil-fenol 35,4 1,745 2,632 0,023-0,025 0,004-0,016 NO 2 2-nitro-fenol 29,6 1,747 2,600 0,012-0,014 0,013-0,005 1,72(2) 2,58(1) [40] 2-nitro-rezorcin 21,2(42,4) b 1,717 2,571 0,011-0,016 0,011-0,020 1,76(4) 2,56(1) [39] 4,6-dinitro-rezorcin 32,9(65,8) b 1,744 2,600 0,013-0,015 0,013-0,005 1,72(2) 2,60(1) [41] 2,5-dinitro-hidrokinon 27,6(55,3) b 1,765 2,609 0,010-0,011 0,012-0,003 2-nitro-vinilalkohol 43,0 1,747 2,602 0,021-0,020 0,017 2-nitro-etanol 4,0 2,134 2,819 0,004-0,007 0,005 [57] C=O szalicilaldehid 28,4 1,788 2,664 0,015-0,021 0,011-0,026 1,74(2) 2,65(1) [43] 2,5-dihidroxi-tereftálaldehid 22,6(45,2) b 1,799 2,669 0,014-0,018 0,009-0,019 1,76(1) 2,667(8) [42] 4,6-dihidroxi-izotereftálaldehid 33,0(66,0) b 1,772 2,665 0,017-0,024 0,012-0,026 P=O 2-foszfinil-fenol 13,3 1,787 2,712 0,017-0,021 0,010-0,015 [54] F 2-fluor-fenol 12,2 2,180 2,718 0,002-0,002 0,015 c [53] 2,125(55) 2,735(22) [56] 2,6-difluor-fenol 2,203 2,732 [53] 2,054(79) 2,715(67) [56] 2,3,5,6-tetrafluor-hidrokinon (C 2h ) 2,235 2,756 [53] 2,015(69) 2,657(54) [55] 2,3,5,6-tetrafluor-hidrokinon (C 2v ) 2,257 2,772 [53] CF 3 2-trifluormetil-fenol 7,2 1,983 2,771 0,000 0,000 0,023-0,006 [48] 2,05(6) 2,792(13) [51] 2-trifluormetil-rezorcin 8,1(16,2) b 1,841 2,654-0,002-0,002 0,016-0,014 [52] 2,6-bis(trifluorometil)-fenol 1,972 2,760 [52] 2-trifluorometil-vinilalkohol 17,1 1,912 2,704 0,005-0,010 0,028 c [49] a Számításaink MP2/6-31+G**//MP2/6-31G** szinten. A zérusponti rezgési energia korrekciót HF/6-31G** frekvencia analízissel 0,9135 skálafaktorral [61] számítottuk. b Egy hidrogénkötésre normalizálva, zárójelben a molekula teljes hidrogénkötési energiája. c (C F) a fluor-benzol származékokban (BY n =F).
19 A hidrogénkötés energiáját nem tudjuk számítani a többszörösen szubsztituált fluorfenol származékokban megfelelő, hidrogénkötés nélküli referenciaszerkezet hiányában. Ezért a hidrogénkötés relatív erősségét a H... F és O... F távolságokból becsültük. Ez a következő sorrendet adta: 2-fluor-fenol > 2,6-difluor-fenol > 2,3,5,6-tetrafluor-hidrokinon(C 2h ) > > 2,3,5,6-tetrafluor-hidrokinon(C 2v ) Ezt a megfigyelést támasztja alá az is, hogy a kölcsönható fluoron a negatív töltés ugyanebben az irányban csökken [53], fokozatosan gyengülő elektrosztatikus kölcsönhatásokat jelezve a hidrogénkötésben résztvevő atomok között. A donor és akceptor csoportok geometriai változásait (1. táblázat) a hidrogénkötést nem tartalmazó konformer geometriai adataihoz viszonyítottuk. Ennek az az előnye, hogy így figyelembe vettük az OH és BY n csoport közötti, a molekula vázán keresztül történő elektronikus kölcsönhatását, mely várhatóan nagyobb jelentőségű, mint az O és BY n közötti sztérikus taszítás. (Az elektronikus kölcsönhatás elhanyagolása a hiányossága az egyszeresen szubsztituált szülő molekulát referenciaként használó modellnek.) Ideális esetben a donor és akceptor csoport egyenlő vagy közel egyenlő mértékben vesz részt a kölcsönhatásban. A C=O és P=O akceptor csoportot tartalmazó származékoknál ez közelítőleg fennáll. Ezek a kölcsönhatások nagyobb megnyúlást eredményeznek az OH kötésnél, kisebbet a C=O/P=O kötésnél, összhangban a kettős kötés merevebb jellegével (1. táblázat). A C=N akceptornál a geometriai relaxációban a domináns szerep az OH csoportnak jut. A nitro-fenolokban viszont kissé nagyobb szerep jut az NO 2 csoportoknak, mint az OHnak. A fluor és a trifluormetil származékokban pedig elsősorban az akceptor csoport változik, míg az OH csoport közel változatlan marad. Az egyszeresen szubsztituált származékokban a kötéstávolságok változására a következő sorrendet figyeltük meg: (O H): C=N >> P=O > C=O > NO 2 >> F > CF 3 (C=O): C=N > P=O ~ C=O > NO 2 >> F > CF 3 (B Y): CF 3 >> F > NO 2 > C=O ~ P=O >> C=N (C B): C=O >> C=N > P=O >> CF 3 ~ NO 2 A fenti összesítés azt mutatja, hogy nincs közvetlen kapcsolat a számított hidrogénkötési energiákkal. Igen gyenge hidrogénkötések is járhatnak jelentős geometriai változással, mint például a C F kötés Å megnyúlása a 2-trifluormetil-fenolban. Minden arra utal, hogy pusztán a geometriai effektusok alapján nem lehet az intramolekuláris 19
20 hidrogénkötések stabilitására következtetni. Azonban BY n = NO 2 és C=O akceptorok esetében jó korreláció figyelhető meg az adott akceptor hidrogénkötési energiái és a geometriai változások mértéke között. A donor és akceptor csoportok kötésszögei a hidrogénkötés hatására szintén jellegzetes változásokat mutattak. (1. ábra, itt az alap molekulákra vonatkoztattunk, hogy elkerüljük a HB-t nem tartalmazó konformerben az O... Y sztérikus taszítást.) Várható, hogy a két csoport egymás felé hajlik, megkönnyítve így a kölcsönhatás létrejöttét (amíg a taszító tag túl naggyá nem válik). E tekintetben nincs konzisztencia az eredményeinkben. NO 2 C=N C=O P=O CF 3 F -2,1-1,5-1,6 +0,6 +1,1-1,3 O +2,6-0,1-0,3 +1,5 +1,4-1,5 H +2,2-0,4-0,6 +1,9 +0,2-2,3 +0,7-0,1 +0,1-2,2-0,6 - Y B 1. ábra A donor és akceptor csoportok kötésszögeinek változása (fokokban) a hidrogénkötés hatására. A legtöbb C O H és C B Y szög csökken (max. 2º-kal), míg néhány C C O és C C B szög hasonló mértékben nő a hidrogénkötés hatására. A vonzó hidrogénkötéses kölcsönhatás mellett a sztérikus ligandum-ligandum kölcsönhatás szintén fontos az optimális kötésszög meghatározásakor. A 2-fluor-fenol esetében kicsi a sztérikus hatás az öttagú gyűrű ellenére is, így az előbb említett szögek mind csökkentek. Másrészről a 2-nitro-fenol és a 2-trifluormetilfenol esetén a nagy sztérikus kölcsönhatás lehet felelős azért, hogy az OH és a BY n csoport távolodik egymástól. Emellett az utóbbi molekulák BY n csoportjára a gyűrű hidrogénje is gyenge vonzó kölcsönhatást gyakorolhat a hidrogénkötésben részt nem vevő oxigén és fluor atomokon keresztül. Mindezek az egyes O H... Y B kölcsönhatások egyedi jellegét mutatják, azaz hogy a fenti geometriai sajátságok az egyes donor-akceptor pároktól függnek. Eredményeink arra utalnak, hogy általános következtetést nem igazán lehet levonni a hidrogénkötés geometriai következményeire intramolekuláris rendszerekben. 20
21 A fentebb tárgyalt általános jellegzetességeken kívül még néhány további geometriai sajátságot jegyezhetünk meg az intramolekuláris hidrogénkötéses rendszerekkel kapcsolatban: - A hidrogénkötéses öt- és hattagú gyűrűk sík szerkezetűek és egy síkban vannak a benzolgyűrűvel, kivéve az aromás CF 3 származékokat. - A rezorcin származékok (NO 2 és CF 3 ) szimultán kölcsönhatásai kb. kétszer nagyobb geometriai változásokat idéztek elő (C N, C C kötések, O N O és F C F szögek), mint a megfelelő egyszeres kölcsönhatást tartalmazó fenol származékok. [39,52] Ez utal, még ha közelítő jelleggel is, a HB geometriai következményeinek additivitására. IV.1.6. A hidrogénkötés hatása a benzolgyűrű geometriájára A benzolgyűrűn egy hidrogént kicserélve a szubsztitúció hatással van a gyűrű elektronsűrűség eloszlására, amit a kémiai és fizikai tulajdonságok változása követ [66]. A szubsztituensek hatása jól megfigyelhető a molekulageometrián: a monoszubsztituált származékok mintegy század angströmnyi változást szenvednek a kötéstávolságokban, és néhany fokot a szögekben [66]. A változások még nagyobbak lehetnek, ha többszörös a szubsztitúció és a szubsztituensek kölcsönhatnak egymással az aromás gyűrűn keresztül. A leghatásosabb az orto és para helyzetű szubsztituensek π kölcsönhatása, amit az is segít, hogy a benzolgyűrű kinoidális típusú rezonanciaszerkezetet vehet fel (2.ábra). H H + O Y O B Y B I. II. H + O Y - B Y H O H o Y B Y H O H O Y - B Y H O + II. I. II. 2. ábra Kinoidális rezonanciaszerkezetek szubsztituált benzolszármazékokban. 21
22 Az intramolekuláris hidrogénkötéseknél az orto helyzetű donor és akceptor csoportok erős elektronikus kölcsönhatásba lépnek a gyűrűn keresztül. Ezt már a hidrogénkötést nem tartalmazó konformer C O és C B kötéseinek rövidülése is tükrözi (az alap molekulák megfelelő kötéshosszaival összehasonlítva), de jól definiált effektusokat észlelhetünk a gyűrű geometriáján is. Itt meg kell különböztetnünk az öt- és hattagú hidrogénkötéses gyűrűs rendszereket. A hattagú gyűrűs rendszerekben (BY n : C=N, NO 2, C=O, P=O, CF 3 ) a donor C O kötésének valamint az akceptor C 2 N, C 2 C, C 2 P kötések kismértékű rövidülése a hidrogénkötés hatására ezen kötések kettőskötés jellegére utalnak, amit a 2. ábrán a II rezonanciaszerkezetek jeleznek. Az orto-kinoidális forma egy másik jellegzetességét figyelhetjük meg a benzolgyűrűben történt változásokon: C 3 C 4 és C 5 C 6 kötések rövidültek, míg a másik négy C C kötés megnyúlt a HB során (3. ábra). A legnagyobb C C megnyúlás általában a kölcsönható OH és BY n csoportok közötti C C kötésen figyelhető meg. A változások a legerősebbek a 2- foszfinil-fenolon, míg a leggyengébbek a 2-trifluormetil-fenolon. Itt ismét csak nincs korreláció sem a számított hidrogénkötési energiák, sem a donor és akceptor csoportok fentebb tárgyalt geometriai változásai között. C=N NO 2 C=O P=O CF 3 0,005 0,001 0,004 0,009 0,002 O 0,011 0,002 0,008 0,010 0,001 H Y B -0,003-0,003-0,004-0,008-0,004 0,004 0,006 0,004 0,005 0,003-0,003-0,004-0,003-0,006-0,004 0,005 0,004 0,006 0,008 0, ábra A gyűrű kötéshossz változásai (Å) az egyszeres hidrogénkötést tartalmazó rendszerekben. 22
23 A szerkezeti jellegzetességeket jól magyarázhatjuk a rezonancia-támogatott hidrogénkötés-modellel [64,65]. A 2. ábrán ábrázolt rezonanciaszerkezetek jól tükrözik a megfigyelt geometriai változásokat. Hangsúlyozni kell azonban az ábrák modell jellegét, mert a valós rendszereinkben természetesen nem történnek kettőskötés átrendeződések. A modell fő mondanivalója az, hogy a hidrogénkötés növeli a kinoidális rezonanciaszerkezet részesedését a teljes szerkezetben. Másrészről, ez a rezonanciaszerkezet mintegy visszacsatolásképpen erősíti a hidrogénkötést. A rezonancia-modell nem alkalmazható az öttagú gyűrűs fluor-fenol származékokra. A rezonanciaszerkezet támogatásának hiánya szintén szerepet játszhat a H... F kölcsönhatás gyengébb jellegében ezekben a rendszerekben. IV.1.7. Rezgési sajátságok A hidrogénkötés létrejötte során a legérdekesebb rezgési sajátságok az X H csoport vegyérték- és torziós rezgésének változásai. Az X H vegyértékrezgés vörös eltolódása a leggyakoribb spektroszkópiai jele a hidrogénkötésnek, ami közvetlen kapcsolatban áll az X H kötés megnyúlásával. Eme eltolódás és több más hidrogénkötésre jellemző tulajdonság, mint például a hidrogénkötés létrejöttét kísérő entalpiaváltozás, X H távolság, X... Y távolság, stb. között intermolekuláris hidrogénkötés esetében korrelációt mutattak ki [6]. Az X H torziós rezgés jellegzetes kék eltolódása részben a C X kötés növekvő kettőskötés jellegével, részben a hidrogénhídban kötött XH hidrogén csökkentett mobilitásával indokolható. A vizsgált vegyületek közül számosnak vizsgálták a gáz fázisú IR spektrumát (2. táblázat), mint 2-nitro-fenol [50], 2-nitro-rezorcin [59], szalicilaldehid [68], 2-fluor-fenol [68], 2,6-difluor-fenol [58], 2,3,5,6-tetrafluor-hidrokinon [68], valamint 2-trifluormetil-fenol [68]. A 4,6-dinitro-rezorcin [67], 4,6-dihidroxi-izoftálaldehid [68] vegyületekről oldatfázisú spektrumok készültek (ciklohexános, CHCl 3 -os, CCl 4 -os oldatok). Ez utóbbiak frekvenciáit azonban az oldószerhatás befolyásolja. Mivel a hidrogénkötést nem tartalmazó szerkezetet csak a 2-fluor-fenol [73] esetében észlelték a spektrumban, az OH vegyérték- és torziós rezgési (υ OH és τ OH ) frekvenciák eltolódásait az alap vegyületekhez viszonyítottuk. 23
24 2. táblázat: Karakterisztikus rezgési frekvenciák (cm -1 ) a B Vegyület ν(oh) fázis τ(oh) fázis Ref. NO 2 2-nitro-fenol 3253 gáz 690 gáz [50] 2-nitro-rezorcin 3274 gáz 674 gáz [59] 4,6-dinitro-rezorcin 3216 CHCl 3 [67] C=O szalicilaldehid 3197 gáz 757 gáz [68] 2,5-dihidroxi-terepftálaldehid 4,6-dihidroxi-izoftálaldehid ~3100 CHCl CHCl 3 [68] F 2-fluor-fenol 3633 gáz 380 gáz [68] 2,6-difluor-fenol 3631 gáz 364 gáz [58] 2,3,5,6-tetrafluor-hidrokinon 3631 gáz [68] CF 3 2-trifluormetil-fenol 3652 gáz 300 C 6 H 12 [70] [69] fenol 3656 gáz 309 gáz [71] rezorcin 3651 gáz [72] C 6 H 12 [70] hidrokinon 3652 gáz [72] [70] 266 C 6 H 12 a ν: vegyértékrezgés, τ: torziós rezgés ν~ /cm C D E F ν OH A B A 2-trifluormetil-fenol B 2-fluor-fenol C 2-nitrorezorcin D 2-nitro-fenol E szalicilaldehid F 4,6-dihidroxi-izoftálaldehid (O-H)/Å τ OH 4. ábra Az OH vegyértékrezgési frekvenciák jellegzetes vörös, és az OH torziós rezgések kék eltolódása az O H távolság függvényében, a fenol illetve rezorcin molekulákhoz viszonyítva. Visszalapozva az 1. táblázathoz, akárcsak a geometriai sajátságok esetében, itt sem látható általános korreláció a számított HB energiák és a rezgési frekvenciák között. Másrészről, mind a υ OH vörös, mind a τ OH kék eltolódása jól korrelál a számított OH kötésnyúlással (4. ábra). Még a nitro-fenol származékok közötti igen kis geometriai eltérés is tükröződik a rezgési adatokban. A 2-fluor-fenol és a 2-trifluormetil-fenol intramolekuláris hidrogénkötésének igen gyenge jellegéből adódóan a spektroszkópiai tulajdonságokban is csak csekély hatás érvényesül. A 2-trifluormetil-fenol spektrumában nincs eltolódás a υ OH és τ OH frekvenciákban, jó egyezésben a számított geometriával, azaz hogy nincs változás az O H távolságban a hidrogénkötés hatására. 24
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Spektroszkópiai módszerek 2.
 Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
A kémiai kötés. Kémiai kölcsönhatás
 A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS KOVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Ionos kötés Na Cl Ionpár képződése e - Na + Cl - Na:
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése
 Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
Célkitűzés/témák Fehérje-ligandum kölcsönhatások és a kötődés termodinamikai jellemzése Ferenczy György Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézet Biokémiai folyamatok - Ligandum-fehérje kötődés
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
Cikloalkánok és származékaik konformációja
 1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
1 ikloalkánok és származékaik konformációja telített gyűrűs szénhidrogének legegyszerűbb képviselője a ciklopropán. Gyűrűje szabályos háromszög alakú, ennek megfelelően szénatomjai egy síkban helyezkednek
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Periódusos rendszer (Mengyelejev, 1869) nemesgáz csoport: zárt héj, extra stabil
 s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
Szénhidrogének III: Alkinok. 3. előadás
 Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
Szénhidrogének III: Alkinok 3. előadás Általános jellemzők Általános képlet C n H 2n 2 Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C C kötést
NITROGÉN TARTALMÚ HETEROCIKLUSOS VEGYÜLETEK REZGÉSI SPEKTROSZKÓPIÁJA
 NITROGÉN TARTALMÚ HETEROCIKLUSOS VEGYÜLETEK REZGÉSI SPEKTROSZKÓPIÁJA Ph.D. értekezés tézisei Készítette: Endrédi Henrietta Témavezető: Dr. Billes Ferenc egyetemi magántanár Budapesti Műszaki és Gazdaságtudományi
NITROGÉN TARTALMÚ HETEROCIKLUSOS VEGYÜLETEK REZGÉSI SPEKTROSZKÓPIÁJA Ph.D. értekezés tézisei Készítette: Endrédi Henrietta Témavezető: Dr. Billes Ferenc egyetemi magántanár Budapesti Műszaki és Gazdaságtudományi
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer energia szintek atomokban
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK. Rausch Péter kémia-környezettan
 AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Modern Fizika Labor. Fizika BSc. Értékelés: A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n. 2008. április 29.
 Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 13. mérés: Molekulamodellezés PC-n Értékelés: A beadás dátuma: 2008. május 6. A mérést végezte: 1/5 A mérés célja A mérés célja az
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
BÍRÁLAT. Kállay Mihály Automatizált módszerek a kvantumkémiában című MTA doktori értekezéséről.
 BÍRÁLAT Kállay Mihály Automatizált módszerek a kvantumkémiában című MTA doktori értekezéséről. Kállay Mihály Automatizált módszerek a kvantumkémiában című az MTA doktora cím elnyerésére benyújtott 132
BÍRÁLAT Kállay Mihály Automatizált módszerek a kvantumkémiában című MTA doktori értekezéséről. Kállay Mihály Automatizált módszerek a kvantumkémiában című az MTA doktora cím elnyerésére benyújtott 132
FELADATMEGOLDÁS. Tesztfeladat: Válaszd ki a helyes megoldást!
 FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
FELADATMEGOLDÁS Tesztfeladat: Válaszd ki a helyes megoldást! 1. Melyik sorozatban található jelölések fejeznek ki 4-4 g anyagot? a) 2 H 2 ; 0,25 C b) O; 4 H; 4 H 2 c) 0,25 O; 4 H; 2 H 2 ; 1/3 C d) 2 H;
Összefoglaló előadás. Sav-bázis elmélet
 Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Összefoglaló előadás Sav-bázis elmélet SAV-BÁZIS TULAJDNSÁGKAT BEFLYÁSLÓ TÉNYEZŐK Elméletek: 1. Brönsted Lowry elmélet: sav - + donor; bázis - + akceptor; Konjugálódó (vagy korrespondáló) sav-bázis pár:
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Modern Fizika Labor. A mérés száma és címe: A mérés dátuma: Értékelés: Infravörös spektroszkópia. A beadás dátuma: A mérést végezte:
 Modern Fizika Labor A mérés dátuma: 2005.10.26. A mérés száma és címe: 12. Infravörös spektroszkópia Értékelés: A beadás dátuma: 2005.11.09. A mérést végezte: Orosz Katalin Tóth Bence 1 A mérés során egy
Modern Fizika Labor A mérés dátuma: 2005.10.26. A mérés száma és címe: 12. Infravörös spektroszkópia Értékelés: A beadás dátuma: 2005.11.09. A mérést végezte: Orosz Katalin Tóth Bence 1 A mérés során egy
Heterociklusos vegyületek
 Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
Szerves kémia A gyűrű felépítésében más atom (szénatomon kívül!), ún. HETEROATOM is részt vesz. A gyűrűt alkotó heteroatomként leggyakrabban a nitrogén, oxigén, kén szerepel, (de ismerünk arzént, szilíciumot,
4. Fejezet Csonka Gábor István MTA Doktori Értekezés
 4. A -()- molekula ab iníció egyensúlyi geometriája és egy disszociációs csatornája. A CT2 módszer. A DFT módszerek teljesítõképessége kéntartalmú molekulák esetében III. IV. Csonka, G. I., Loos, M., Kucsman,
4. A -()- molekula ab iníció egyensúlyi geometriája és egy disszociációs csatornája. A CT2 módszer. A DFT módszerek teljesítõképessége kéntartalmú molekulák esetében III. IV. Csonka, G. I., Loos, M., Kucsman,
Általános és szervetlen kémia 3. hét. Kémiai kötések. Kötések kialakítása - oktett elmélet. Az elızı órán elsajátítottuk, hogy.
 Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
Általános és szervetlen kémia 3. hét Az elızı órán elsajátítottuk, hogy milyen a kvantummechanikai atommodell hogyan épül fel a periódusos rendszer melyek a periodikus tulajdonságok Mai témakörök elsıdleges
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit
 SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén
 ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén A paraméterek anizotrópiája egykristályok rögzített tengely körüli forgatásakor
ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén A paraméterek anizotrópiája egykristályok rögzített tengely körüli forgatásakor
A hidrogénmolekula. Energia
 A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík Energia
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Kémiai alapismeretek 3. hét
 Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Az infravörös (IR) sugárzás. (Wikipédia)
 FT-IR spektroszkópia Az infravörös (IR) sugárzás (Wikipédia) Termografikus kamera (Wikipédia) Termografikus fényképek (Wikipédia) Termografikus fényképek (Wikipédia) IR spektroszkópia Tartomány: 10-12800
FT-IR spektroszkópia Az infravörös (IR) sugárzás (Wikipédia) Termografikus kamera (Wikipédia) Termografikus fényképek (Wikipédia) Termografikus fényképek (Wikipédia) IR spektroszkópia Tartomány: 10-12800
Hemoglobin - myoglobin. Konzultációs e-tananyag Szikla Károly
 Hemoglobin - myoglobin Konzultációs e-tananyag Szikla Károly Myoglobin A váz- és szívizom oxigén tároló fehérjéje Mt.: 17.800 153 aminosavból épül fel A lánc kb 75 % a hélix 8 db hélix, köztük nem helikális
Hemoglobin - myoglobin Konzultációs e-tananyag Szikla Károly Myoglobin A váz- és szívizom oxigén tároló fehérjéje Mt.: 17.800 153 aminosavból épül fel A lánc kb 75 % a hélix 8 db hélix, köztük nem helikális
Osztályozó vizsgatételek. Kémia - 9. évfolyam - I. félév
 Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
Kémia - 9. évfolyam - I. félév 1. Atom felépítése (elemi részecskék), alaptörvények (elektronszerkezet kiépülésének szabályai). 2. A periódusos rendszer felépítése, periódusok és csoportok jellemzése.
A hidrogénmolekula. Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve!
 Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Energia A hidrogénmolekula Emlékeztető: az atompályák hullámok (hullámfüggvények!) A hullámokra érvényes a szuperpozíció (erősítés és kioltás) elve! Ezt két H-atomra alkalmazva: Erősítő átfedés csomósík
Akusztikai tervezés a geometriai akusztika módszereivel
 Akusztikai tervezés a geometriai akusztika módszereivel Fürjes Andor Tamás BME Híradástechnikai Tanszék Kép- és Hangtechnikai Laborcsoport, Rezgésakusztika Laboratórium 1 Tartalom A geometriai akusztika
Akusztikai tervezés a geometriai akusztika módszereivel Fürjes Andor Tamás BME Híradástechnikai Tanszék Kép- és Hangtechnikai Laborcsoport, Rezgésakusztika Laboratórium 1 Tartalom A geometriai akusztika
Vegyületek - vegyületmolekulák
 Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Tartalomjegyzék. Emlékeztetõ. Emlékeztetõ. Spektroszkópia. Fényelnyelés híg oldatokban A fény; Abszorpciós spektroszkópia
 Tartalomjegyzék PÉCS TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNY KAR A fény; Abszorpciós spektroszkópia Elektromágneses hullám kölcsönhatása anyaggal; (Nyitrai Miklós; 2015 január 27.) Az abszorpció mérése;
Tartalomjegyzék PÉCS TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNY KAR A fény; Abszorpciós spektroszkópia Elektromágneses hullám kölcsönhatása anyaggal; (Nyitrai Miklós; 2015 január 27.) Az abszorpció mérése;
2. Hangfrekvenciás mechanikai rezgések vizsgálata jegyzőkönyv. Zsigmond Anna Fizika Bsc II. Mérés dátuma: Leadás dátuma:
 2. Hangfrekvenciás mechanikai rezgések vizsgálata jegyzőkönyv Zsigmond Anna Fizika Bsc II. Mérés dátuma: 2008. 09. 24. Leadás dátuma: 2008. 10. 01. 1 1. Mérések ismertetése Az 1. ábrán látható összeállításban
2. Hangfrekvenciás mechanikai rezgések vizsgálata jegyzőkönyv Zsigmond Anna Fizika Bsc II. Mérés dátuma: 2008. 09. 24. Leadás dátuma: 2008. 10. 01. 1 1. Mérések ismertetése Az 1. ábrán látható összeállításban
Kémiai reakciók. Közös elektronpár létrehozása. Általános és szervetlen kémia 10. hét. Elızı héten elsajátítottuk, hogy.
 Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Kormeghatározás gyorsítóval
 Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Készítette: NÁDOR JUDIT. Témavezető: Dr. HOMONNAY ZOLTÁN. ELTE TTK, Analitikai Kémia Tanszék 2010
 Készítette: NÁDOR JUDIT Témavezető: Dr. HOMONNAY ZOLTÁN ELTE TTK, Analitikai Kémia Tanszék 2010 Bevezetés, célkitűzés Mössbauer-spektroszkópia Kísérleti előzmények Mérések és eredmények Összefoglalás EDTA
Készítette: NÁDOR JUDIT Témavezető: Dr. HOMONNAY ZOLTÁN ELTE TTK, Analitikai Kémia Tanszék 2010 Bevezetés, célkitűzés Mössbauer-spektroszkópia Kísérleti előzmények Mérések és eredmények Összefoglalás EDTA
Biomatematika 12. Szent István Egyetem Állatorvos-tudományi Kar. Fodor János
 Szent István Egyetem Állatorvos-tudományi Kar Biomatematikai és Számítástechnikai Tanszék Biomatematika 12. Regresszió- és korrelációanaĺızis Fodor János Copyright c Fodor.Janos@aotk.szie.hu Last Revision
Szent István Egyetem Állatorvos-tudományi Kar Biomatematikai és Számítástechnikai Tanszék Biomatematika 12. Regresszió- és korrelációanaĺızis Fodor János Copyright c Fodor.Janos@aotk.szie.hu Last Revision
Szénhidrogének II: Alkének. 2. előadás
 Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Szénhidrogének II: Alkének 2. előadás Általános jellemzők Általános képlet C n H 2n Kevesebb C H kötés van bennük, mint a megfelelő tagszámú alkánokban : telítetlen vegyületek Legalább egy C = C kötést
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Ragyogó molekulák: dióhéjban a fluoreszcenciáról és biológiai alkalmazásairól
 Ragyogó molekulák: dióhéjban a fluoreszcenciáról és biológiai alkalmazásairól Kele Péter egyetemi adjunktus Lumineszcencia jelenségek Biolumineszcencia (biológiai folyamat, pl. luciferin-luciferáz) Kemilumineszcencia
Ragyogó molekulák: dióhéjban a fluoreszcenciáról és biológiai alkalmazásairól Kele Péter egyetemi adjunktus Lumineszcencia jelenségek Biolumineszcencia (biológiai folyamat, pl. luciferin-luciferáz) Kemilumineszcencia
Határfelületi jelenségek. Fogorvosi anyagtan fizikai alapjai 3. Általános anyagszerkezeti ismeretek. N m J 2
 Határelületi jelenségek 1. Felületi eszültség Fogorvosi anyagtan izikai alapjai 3. Általános anyagszerkezeti ismeretek Határelületi jelenségek Kiemelt témák: elületi eszültség adhézió nedvesítés ázis ázisdiagramm
Határelületi jelenségek 1. Felületi eszültség Fogorvosi anyagtan izikai alapjai 3. Általános anyagszerkezeti ismeretek Határelületi jelenségek Kiemelt témák: elületi eszültség adhézió nedvesítés ázis ázisdiagramm
AROMÁS SZÉNHIDROGÉNEK
 AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
AROMÁS SZÉNIDROGÉNK lnevezés C 3 C 3 3 C C C 3 C 3 C C 2 benzol toluol xilol (o, m, p) kumol sztirol naftalin antracén fenantrén Csoportnevek C 3 C 2 fenil fenilén (o,m,p) tolil (o,m,p) benzil 1-naftil
Mi mindenről tanúskodik a Me-OH néhány NMR spektruma
 Mi mindenről tanúskodik a Me-OH néhány NMR spektruma lcélok és fogalmak: l- az NMR-rezonancia frekvencia (jel), a kémiai környezete, a kémiai eltolódás, l- az 1 H-NMR spektrum, l- az -OH és a -CH 3 csoportokban
Mi mindenről tanúskodik a Me-OH néhány NMR spektruma lcélok és fogalmak: l- az NMR-rezonancia frekvencia (jel), a kémiai környezete, a kémiai eltolódás, l- az 1 H-NMR spektrum, l- az -OH és a -CH 3 csoportokban
Erőterek. Erőterek. Erőterek. Erőterek. Erőterek. Erőterek. Probléma: fehérjéknél nagy dimenziók értelmetlen QM eredmények.
 fehérjéknél nagy dimenziók értelmetlen QM eredmények Megoldás: egyszerűsítés dimenzió-csökkentés Közelítések Born-Oppenheimer közelítés (Ψ mol = Ψ el Ψ mag ; E tot =E el +E mag ) az energia párkölcsönhatások
fehérjéknél nagy dimenziók értelmetlen QM eredmények Megoldás: egyszerűsítés dimenzió-csökkentés Közelítések Born-Oppenheimer közelítés (Ψ mol = Ψ el Ψ mag ; E tot =E el +E mag ) az energia párkölcsönhatások
A SZILÁRDTEST FOGALMA. Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. molekula klaszter szilárdtest > σ λ : rel.
 A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Tartalomjegyzék. Emlékeztetõ. Emlékeztetõ. Spektroszkópia. Fényelnyelés híg oldatokban 4/11/2016. A fény; Abszorpciós spektroszkópia
 Tartalomjegyzék PÉCS TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNY KAR A fény; Abszorpciós spektroszkópia Elektromágneses hullám kölcsönhatása anyaggal; (Nyitrai Miklós; 2016 március 1.) Az abszorpció mérése;
Tartalomjegyzék PÉCS TUDOMÁNYEGYETEM ÁLTALÁNOS ORVOSTUDOMÁNY KAR A fény; Abszorpciós spektroszkópia Elektromágneses hullám kölcsönhatása anyaggal; (Nyitrai Miklós; 2016 március 1.) Az abszorpció mérése;
BAGME11NNF Munkavédelmi mérnökasszisztens Galla Jánosné, 2011.
 BAGME11NNF Munkavédelmi mérnökasszisztens Galla Jánosné, 2011. 1 Mérési hibák súlya és szerepe a mérési eredményben A mérési hibák csoportosítása A hiba rendűsége Mérési bizonytalanság Standard és kiterjesztett
BAGME11NNF Munkavédelmi mérnökasszisztens Galla Jánosné, 2011. 1 Mérési hibák súlya és szerepe a mérési eredményben A mérési hibák csoportosítása A hiba rendűsége Mérési bizonytalanság Standard és kiterjesztett
A periódusos rendszer, periodikus tulajdonságok
 A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
A periódusos rendszer, periodikus tulajdonságok Szalai István ELTE Kémiai Intézet 1/45 Az előadás vázlata ˆ Ismétlés ˆ Történeti áttekintés ˆ Mengyelejev periódusos rendszere ˆ Atomsugár, ionsugár ˆ Ionizációs
Modern Fizika Labor. Fizika BSc. Értékelés: A mérés dátuma: A mérés száma és címe: 5. mérés: Elektronspin rezonancia. 2008. március 18.
 Modern Fizika Labor Fizika BSc A mérés dátuma: 28. március 18. A mérés száma és címe: 5. mérés: Elektronspin rezonancia Értékelés: A beadás dátuma: 28. március 26. A mérést végezte: 1/7 A mérés leírása:
Modern Fizika Labor Fizika BSc A mérés dátuma: 28. március 18. A mérés száma és címe: 5. mérés: Elektronspin rezonancia Értékelés: A beadás dátuma: 28. március 26. A mérést végezte: 1/7 A mérés leírása:
20/10/2016 tema04_biolf_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai Kémiai kötés kialakulásának oka: energianyereség. Típusai: ionos kötés kovalens kötés fémes kötés Egy egyszerű modell a kémiai kötések kialakítására:
Szalai István. ELTE Kémiai Intézet 1/74
 Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Elsőrendű kötések Szalai István ELTE Kémiai Intézet 1/74 Az előadás vázlata ˆ Ismétlés ˆ Ionos vegyületek képződése ˆ Ionok típusai ˆ Kovalens kötés ˆ Fémes kötés ˆ VSEPR elmélet ˆ VB elmélet 2/74 Periodikus
Abszorpciós spektroszkópia
 Tartalomjegyzék Abszorpciós spektroszkópia (Nyitrai Miklós; 2011 február 1.) Dolgozat: május 3. 18:00-20:00. Egész éves anyag. Korábbi dolgozatok nem számítanak bele. Felmentés 80% felett. A fény; Elektromágneses
Tartalomjegyzék Abszorpciós spektroszkópia (Nyitrai Miklós; 2011 február 1.) Dolgozat: május 3. 18:00-20:00. Egész éves anyag. Korábbi dolgozatok nem számítanak bele. Felmentés 80% felett. A fény; Elektromágneses
Modern Fizika Labor. 12. Infravörös spektroszkópia. Fizika BSc. A mérés dátuma: okt. 04. A mérés száma és címe: Értékelés:
 Modern Fizika Labor Fizika BSc A mérés dátuma: 011. okt. 04. A mérés száma és címe: 1. Infravörös spektroszkópia Értékelés: A beadás dátuma: 011. dec. 1. A mérést végezte: Domokos Zoltán Szőke Kálmán Benjamin
Modern Fizika Labor Fizika BSc A mérés dátuma: 011. okt. 04. A mérés száma és címe: 1. Infravörös spektroszkópia Értékelés: A beadás dátuma: 011. dec. 1. A mérést végezte: Domokos Zoltán Szőke Kálmán Benjamin
Fizikai kémia 2. Előzmények. A Lewis-féle kötéselmélet A VB- és az MO-elmélet, a H 2+ molekulaion
 06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
06.07.5. Fizikai kémia. 4. A VB- és az -elmélet, a H + molekulaion Dr. Berkesi ttó ZTE Fizikai Kémiai és Anyagtudományi Tanszéke 05 Előzmények Az atomok szerkezetének kvantummehanikai leírása 90-30-as
Modern Fizika Labor. Fizika BSc. Értékelés: A mérés dátuma: A mérés száma és címe: 12. mérés: Infravörös spektroszkópia. 2008. május 6.
 Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 12. mérés: Infravörös spektroszkópia Értékelés: A beadás dátuma: 28. május 13. A mérést végezte: 1/5 A mérés célja A mérés célja az
Modern Fizika Labor Fizika BSc A mérés dátuma: A mérés száma és címe: 12. mérés: Infravörös spektroszkópia Értékelés: A beadás dátuma: 28. május 13. A mérést végezte: 1/5 A mérés célja A mérés célja az
8. Egyszerû tesztek sûrûség funkcionál módszerek minõsítésére
 8. Egyszerû tesztek sûrûség funkcionál módszerek minõsítésére XX. Csonka, G. I., Nguyen, N. A., Kolossváry, I., Simple tests for density functionals, J. Comput. Chem. 18 (1997) 1534. XXII. Csonka, G. I.,
8. Egyszerû tesztek sûrûség funkcionál módszerek minõsítésére XX. Csonka, G. I., Nguyen, N. A., Kolossváry, I., Simple tests for density functionals, J. Comput. Chem. 18 (1997) 1534. XXII. Csonka, G. I.,
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában. Szőri Milán: Kolloidkémia
 Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Kolloidkémia 1. előadás Első- és másodrendű kémiai kötések és szerepük a kolloid rendszerek kialakulásában 1 Órarend 2 Kurzussal kapcsolatos emlékeztető Kurzus: Az előadás látogatása ajánlott Gyakorlat
Mágneses módszerek a mőszeres analitikában
 Mágneses módszerek a mőszeres analitikában NMR, ESR: mágneses momentummal rendelkezı anyagok minıségi és mennyiségi meghatározására alkalmas analitikai módszer Atommag spin állapotok közötti energiaátmenetek:
Mágneses módszerek a mőszeres analitikában NMR, ESR: mágneses momentummal rendelkezı anyagok minıségi és mennyiségi meghatározására alkalmas analitikai módszer Atommag spin állapotok közötti energiaátmenetek:
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Savak bázisok 121 Az Arrhenius elmélet röviden 122 BrønstedLowry elmélet 123 A víz ionizációja és a p skála 124 Erős savak és bázisok 125 Gyenge savak és bázisok 126 Több bázisú savak 127 Ionok mint savak
Intra- és intermolekuláris reakciók összehasonlítása
 Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Intra- és intermolekuláris reakciók összehasonlítása Intr a- és inter molekulár is r eakciok összehasonlítása molekulán belüli reakciók molekulák közötti reakciók 5- és 6-tagú gyűrűk könnyen kialakulnak.
Toluol (Bruckner II/1 476) µ= 0.33 Debye
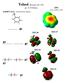 E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
E(RHF/3-21G= -268.24021020 Hartree Toluol (Bruckner II/1 476) µ= 0.33 Debye -0.04 töltés. 0.04 φ6 MO 26 MO 27 φ4 φ5 MO 24 MO 25 φ2 MO 21 φ1 TD ρ= 0.0004 a.u. Anilin (Bruckner II/1 476) µ= 1.44 Debye E(RHF/6-311++G(d,p))=
Az infravörös spektroszkópia analitikai alkalmazása
 Az infravörös spektroszkópia analitikai alkalmazása Egy molekula nemcsak haladó mozgást végez, de az atomjai (atomcsoportjai) egymáshoz képest is állandó mozgásban vannak. Tételezzünk fel egy olyan mechanikai
Az infravörös spektroszkópia analitikai alkalmazása Egy molekula nemcsak haladó mozgást végez, de az atomjai (atomcsoportjai) egymáshoz képest is állandó mozgásban vannak. Tételezzünk fel egy olyan mechanikai
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
Elektrosztatikus számítások. Elektrosztatikus számítások. Elektrosztatikus számítások. Elektrosztatikus számítások Definíciók
 Jelentősége szubsztrát kötődés szolvatáció ionizációs állapotok (pka) mechanizmus katalízis ioncsatornák szimulációk (szerkezet) all-atom dipolar fluid dipolar lattice continuum Definíciók töltéseloszlás
Jelentősége szubsztrát kötődés szolvatáció ionizációs állapotok (pka) mechanizmus katalízis ioncsatornák szimulációk (szerkezet) all-atom dipolar fluid dipolar lattice continuum Definíciók töltéseloszlás
R nem hidrogén, hanem pl. alkilcsoport
 1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
1 Minimumkövetelmények C 4 metán C 3 - metilcsoport C 3 C 3 C 3 metil kation metilgyök metil anion C 3 -C 3 C 3 -C 2 - C 3 -C 2 C 3 -C 2 C 3 -C 2 C 2 5 - C 2 5 C 2 5 C 2 5 etán etilcsoport etil kation
Műszeres analitika. Abrankó László. Molekulaspektroszkópia. Kémiai élelmiszervizsgálati módszerek csoportosítása
 Abrankó László Műszeres analitika Molekulaspektroszkópia Minőségi elemzés Kvalitatív Cél: Meghatározni, hogy egy adott mintában jelen vannak-e bizonyos ismert komponensek. Vagy ismeretlen komponensek azonosítása
Abrankó László Műszeres analitika Molekulaspektroszkópia Minőségi elemzés Kvalitatív Cél: Meghatározni, hogy egy adott mintában jelen vannak-e bizonyos ismert komponensek. Vagy ismeretlen komponensek azonosítása
5. Az elektronkorreláció szerepe a metil-amin nagy amplitúdójú mozgásainak leírásában. DFT és poszt Hartree- Fock számítások
 5. Az elektronkorreláció szerepe a metil-amin nagy amplitúdójú mozgásainak leírásában. DFT és poszt artree- Fock számítások VI. XIX. Csonka, G. I. and Sztraka L., Density functional and post artree-fock
5. Az elektronkorreláció szerepe a metil-amin nagy amplitúdójú mozgásainak leírásában. DFT és poszt artree- Fock számítások VI. XIX. Csonka, G. I. and Sztraka L., Density functional and post artree-fock
Abszorpciós fotometria
 abszorpció Abszorpciós fotometria Spektroszkópia - Színképvizsgálat Spektro-: görög; jelente kép/szín -szkópia: görög; néz/látás/vizsgálat Ujfalusi Zoltán PTE ÁOK Biofizikai Intézet 2012. február Vizsgálatok
abszorpció Abszorpciós fotometria Spektroszkópia - Színképvizsgálat Spektro-: görög; jelente kép/szín -szkópia: görög; néz/látás/vizsgálat Ujfalusi Zoltán PTE ÁOK Biofizikai Intézet 2012. február Vizsgálatok
Az oktanol-víz megoszlási hányados és a ciklodextrin komplex asszociációs állandó közötti összefüggés vizsgálata modell szennyezıanyagok esetén
 Az oktanol-víz megoszlási hányados és a ciklodextrin komplex asszociációs állandó közötti összefüggés vizsgálata modell szennyezıanyagok esetén 1. Bevezetés Korábbi jelentésünkben (IV. szakmai részjelentés)
Az oktanol-víz megoszlási hányados és a ciklodextrin komplex asszociációs állandó közötti összefüggés vizsgálata modell szennyezıanyagok esetén 1. Bevezetés Korábbi jelentésünkben (IV. szakmai részjelentés)
CH 2 =CH-CH 2 -S-S-CH 2 -CH=CH 2
 10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
10. Előadás zerves vegyületek kénatommal Példák: ZEVE VEGYÜLETEK KÉATMMAL CH 2 =CH-CH 2 ---CH 2 -CH=CH 2 diallil-diszulfid (fokhagyma olaj) H H H szacharin merkapto-purin tiofén C H2 H szulfonamid (Ultraseptyl)
tema04_
 4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
4. Molekulák, ionok, kémiai alapelvek, a kémiai kötés típusai A kötések kialakulásának oka: energianyereség. A kémiai kötés típusai: ionos kötés kovalens kötés fémes kötés Kötések kialakítása - oktett
Atomfizika. A hidrogén lámpa színképei. Elektronok H atom. Fényképlemez. emisszió H 2. gáz
 Atomfizika A hidrogén lámpa színképei - Elektronok H atom emisszió Fényképlemez V + H 2 gáz Az atom és kvantumfizika fejlődésének fontos szakasza volt a hidrogén lámpa színképeinek leírása, és a vonalas
Atomfizika A hidrogén lámpa színképei - Elektronok H atom emisszió Fényképlemez V + H 2 gáz Az atom és kvantumfizika fejlődésének fontos szakasza volt a hidrogén lámpa színképeinek leírása, és a vonalas
Speciális fluoreszcencia spektroszkópiai módszerek
 Speciális fluoreszcencia spektroszkópiai módszerek Fluoreszcencia kioltás Fluoreszcencia Rezonancia Energia Transzfer (FRET), Lumineszcencia A molekuláknak azt a fényemisszióját, melyet a valamilyen módon
Speciális fluoreszcencia spektroszkópiai módszerek Fluoreszcencia kioltás Fluoreszcencia Rezonancia Energia Transzfer (FRET), Lumineszcencia A molekuláknak azt a fényemisszióját, melyet a valamilyen módon
Kémiai reakciók mechanizmusa számítógépes szimulációval
 Kémiai reakciók mechanizmusa számítógépes szimulációval Stirling András stirling@chemres.hu Elméleti Kémiai Osztály Budapest Stirling A. (MTA Kémiai Kutatóközpont) Reakciómechanizmus szimulációból 2007.
Kémiai reakciók mechanizmusa számítógépes szimulációval Stirling András stirling@chemres.hu Elméleti Kémiai Osztály Budapest Stirling A. (MTA Kémiai Kutatóközpont) Reakciómechanizmus szimulációból 2007.
Szerves Kémiai Problémamegoldó Verseny
 Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
Szerves Kémiai Problémamegoldó Verseny 2015. április 24. Név: E-mail cím: Egyetem: Szak: Képzési szint: Évfolyam: Pontszám: Név: Pontszám: / 3 pont 1. feladat Egy C 4 H 10 O 3 összegképletű vegyület 0,1776
R R C X C X R R X + C H R CH CH R H + BH 2 + Eliminációs reakciók
 Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
Eliminációs reakciók Amennyiben egy szénatomhoz távozó csoport kapcsolódik és ugyanazon a szénatomon egy (az ábrákon vel jelölt) bázis által protonként leszakítható hidrogén is található, a nukleofil szubsztitúció
FEGYVERNEKI SÁNDOR, Valószínűség-sZÁMÍTÁs És MATEMATIKAI
 FEGYVERNEKI SÁNDOR, Valószínűség-sZÁMÍTÁs És MATEMATIKAI statisztika 8 VIII. REGREssZIÓ 1. A REGREssZIÓs EGYENEs Két valószínűségi változó kapcsolatának leírására az eddigiek alapján vagy egy numerikus
FEGYVERNEKI SÁNDOR, Valószínűség-sZÁMÍTÁs És MATEMATIKAI statisztika 8 VIII. REGREssZIÓ 1. A REGREssZIÓs EGYENEs Két valószínűségi változó kapcsolatának leírására az eddigiek alapján vagy egy numerikus
Véletlen jelenség: okok rendszere hozza létre - nem ismerhetjük mind, ezért sztochasztikus.
 Valószín ségelméleti és matematikai statisztikai alapfogalmak összefoglalása (Kemény Sándor - Deák András: Mérések tervezése és eredményeik értékelése, kivonat) Véletlen jelenség: okok rendszere hozza
Valószín ségelméleti és matematikai statisztikai alapfogalmak összefoglalása (Kemény Sándor - Deák András: Mérések tervezése és eredményeik értékelése, kivonat) Véletlen jelenség: okok rendszere hozza
Kutatási beszámoló. 2015. február. Tangens delta mérésére alkalmas mérési összeállítás elkészítése
 Kutatási beszámoló 2015. február Gyüre Balázs BME Fizika tanszék Dr. Simon Ferenc csoportja Tangens delta mérésére alkalmas mérési összeállítás elkészítése A TKI-Ferrit Fejlsztő és Gyártó Kft.-nek munkája
Kutatási beszámoló 2015. február Gyüre Balázs BME Fizika tanszék Dr. Simon Ferenc csoportja Tangens delta mérésére alkalmas mérési összeállítás elkészítése A TKI-Ferrit Fejlsztő és Gyártó Kft.-nek munkája
dinamikai tulajdonságai
 Szilárdtest rácsok statikus és dinamikai tulajdonságai Szilárdtestek osztályozása kötéstípusok szerint Kötések eredete: elektronszerkezet k t ionok (atomtörzsek) tö Coulomb- elektronok kölcsönhatás lokalizáltak
Szilárdtest rácsok statikus és dinamikai tulajdonságai Szilárdtestek osztályozása kötéstípusok szerint Kötések eredete: elektronszerkezet k t ionok (atomtörzsek) tö Coulomb- elektronok kölcsönhatás lokalizáltak
Compton-effektus. Zsigmond Anna. jegyzıkönyv. Fizika BSc III.
 Compton-effektus jegyzıkönyv Zsigmond Anna Fizika BSc III. Mérés vezetıje: Csanád Máté Mérés dátuma: 010. április. Leadás dátuma: 010. május 5. Mérés célja A kvantumelmélet egyik bizonyítékának a Compton-effektusnak
Compton-effektus jegyzıkönyv Zsigmond Anna Fizika BSc III. Mérés vezetıje: Csanád Máté Mérés dátuma: 010. április. Leadás dátuma: 010. május 5. Mérés célja A kvantumelmélet egyik bizonyítékának a Compton-effektusnak
ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával.
 ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával www.chem.elte.hu/pr Kvíz az előző előadáshoz Programajánlatok október 18. 16:00 ELTE Kémiai Intézet 065-ös terem Észbontogató (www.chem.elte.hu/pr)
ALKÍMIA MA Az anyagról mai szemmel, a régiek megszállottságával www.chem.elte.hu/pr Kvíz az előző előadáshoz Programajánlatok október 18. 16:00 ELTE Kémiai Intézet 065-ös terem Észbontogató (www.chem.elte.hu/pr)
Katalízis. Tungler Antal Emeritus professzor 2017
 Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
