A sebészet szerepe a melanoma malignum kezelésében
|
|
|
- Albert Géza Horváth
- 8 évvel ezelőtt
- Látták:
Átírás
1 A sebészet szerepe a melanoma malignum kezelésében Eredeti közlemény Péley Gábor, Farkas Emil, Mátrai Zoltán, Rényi-Vámos Ferenc, Kovács Tibor, Köves István Országos Onkológiai Intézet, Általános- és Mellkassebészeti Osztály, Budapest A melanoma malignum kezelésében a sebészi beavatkozásoknak a betegség minden stádiumában szerepe van. A lokalizált kután melanoma malignum kezelése elsôdlegesen sebészi. A primer tumor eltávolítása teszi lehetôvé a pontos szövettani diagnozis felállítását, és a patológiai prognosztikai tényezôk meghatározását. A megfelelô sebészi radikalitás a daganat lokális kontrollja szempontjából alapvetô fontosságú. A daganat pontos szövettani stádiumbesorolása (staging), és az adjuváns onkológiai kezelés meghatározása szempontjából a regionális nyirokcsomók sebészi eltávolítása (ôrszem nyirokcsomó-biopszia) és szövettani vizsgálata az utóbbi években kiemelt jelentôségûvé vált. Az izolált regionális áttétek kezelése is elsôsorban sebészi. A melanoma malignum távoli áttéteinek kezelésében is jelentôsége van a sebészi eljárásoknak, legtöbbször palliatív szándékkal. A szerzôk közleményükben részletesen áttekintik a melanoma malignum sebészi kezelésének legfontosabb kérdéseit. Magyar Onkológia 47:69 77, 2003 Surgical interventions have important role in the treatment of all stages of malignant melanoma. Surgery is the primary treatment of localized cutaneous melanoma. Excision of the primary tumor makes it possible to set up the histological diagnosis and to determine pathological prognostic factors. Appropriate surgical margin is important for local disease control. Sentinel lymph node biopsy with detailed histological examination has gained prominent importance for correct histological staging and for determining adjuvant oncological treatment. Surgery is the primary treatment of isolated regional metastases. Surgical methods also have a role in the palliative management of distant metastatic melanoma. In the present review the most important issues of the surgical treatment of malignant melanoma have been discussed in detail. Péley G, Farkas E, Mátrai Z, Rényi-Vámos F, Kovács T, Köves I. The role of surgery in the treatment of malignant melanoma. Hungarian Oncology 47:69 77, 2003 Közlésre érkezett: január 10. Elfogadva: március 1. Levelezési cím: Dr. Péley Gábor, Országos Onkológiai Intézet, Általános- és Mellkassebészeti Osztály, 1122 Budapest, Ráth Gy. u Tel.: Fax: peley@oncol.hu A melanoma malignum kezelésében a sebészetnek a betegség minden stádiumában szerepe van. A lokalizált kután melanoma malignum kezelése elsôdlegesen sebészi. A primer tumor eltávolítása teszi lehetôvé a pontos szövettani diagnozis felállítását, és a prognosztikai tényezôk meghatározását. A megfelelô sebészi ép szél a daganat lokális kontrollja szempontjából alapvetô jelentôségû. A daganat pontos szövettani stádiumbesorolása, és a további onkológiai kezelés meghatározása szempontjából a regionális nyirokcsomók szövettani vizsgálata az utóbbi években kiemelt fontosságúvá vált. Az izolált regionális áttétek kezelése is elsôsorban sebészi. A melanoma malignum távoli áttéteinek kezelésében is jelentôsége van a sebészi eljárásoknak, legtöbbször palliatív szándékkal. Közleményünkben áttekintjük a melanoma malignum sebészi kezelésének legfontosabb kérdéseit. A primer kután melanoma malignum sebészi kezelése A primer kután melanoma malignum definitív sebészi kezelése az úgynevezett széles excízió megfelelô ép széllel (30, 34, 39). Klinikailag nem egyértelmû diagnozis esetén, illetve egyes intézményekben rutinszerûen elôször diagnosztikus kimetszést, excíziós biopsziát végeznek, majd a pontos szövettani eredmény ismeretében történik meg a megfelelô széles excízió. Diagnosztikus céllal egyes kivételes esetekben (arcon elhelyezkedô, vagy nagyméretû elváltozás) megen- MagyAR ONKOLÓGUSOK Társasága Magyar Onkológia 47. évfolyam 1. szám
2 1. táblázat. Javasolt kimetszési szélek kután melanoma malignumban gedhetô az incizionális biopszia is, ugyanis retroés prospektív tanulmányok tapasztalata szerint ez nem rontja az eredményeket (5, 14, 61, 62). A sebészi ép szél nagysága kérdésében az 1980-as évek óta jelentôs szemléletbeli változás történt. Ezt megelôzôen a primer elváltozás vastagságától függetlenül az 5 cm-es ép széllel történô kimetszés az alatta lévô fasciával együtt volt az elfogadott eljárás, amely a legtöbb esetben a seb direkt varrattal történô zárását lehetetlenné tette, ezért a plasztikai megoldások aránya rendkívül magas volt ben Breslow kimutatta, hogy szövettanilag vékonyabb melanomák esetén recidívák és metasztázisok ritkábban fordulnak elô (19). Ez a felismerés vezetett oda, hogy vékonyabb elváltozások esetén keskenyebb ép szél is elegendô lehet (20, 28, 75). Ezt a feltételezést négy prospektív randomizált tanulmány is igazolta (64). Az egyik tanulmányban (World Health Organization (WHO) Melanoma Trial 10) 612 beteget, akiknek 2 mm-nél vékonyabb melanomája volt, soroltak két karra a kimetszés nagysága alapján, keskeny (1 cm-es ép szél) vagy széles (3 cm-es ép szél) kimetszés (110, 111). A másikban (Intergroup Melanoma Trial) 470 közepesen vastag (1 4 mm) melanomájú beteget soroltak szintén két karra a kimetszés szélessége szerint, 2 cm-es ép szél vagy 4 cm-es ép szél (6, 11, 50). Ebben a tanulmányban a bôrátültetések aránya a 2 cm-es csoportban jelentôsen csökkent (11% versus 46%). A harmadikban (Swedish Melanoma Study Group Trial) 989 beteget, akiknek melanomája 0,8 és 2 mm közötti vastagságú volt, soroltak két karra (2 cm-es, illetve 5 cm-es ép szél) (24, 87). A negyedikben (French Multicentric Trial) 319 beteget (2 mm-nél vékonyabb melanomával) soroltak be két karra (2, illetve 5 cm-es ép szél) (13). Statisztikailag szignifikáns különbséget egyik tanulmányban sem észleltek a karok között, sem a túlélésben, sem a recidívamentes túlélésben (medián követési idô 4,2 11 év között). A United Kingdom Melanoma Study Group prospektív randomizált tanulmánya folyamatban van (64). Ebben a tanulmányban 2 mm-nél vastagabb melanomájú betegeket soroltak két karra (1, illetve 3 cm-es ép szél). Az eddigiek alapján jelenleg javasolt sebészi kimetszési szél nagyságát az elváltozás szövettani vastagságának függvényében az 1. táblázatban ismertetjük (64). Saját gyakorlatunkban a WHO javaslatát követjük. Jelenleg a kimetszéseket a fascia szintjéig végezzük. Az elváltozás alatti fascia eltávolítását Kimetszési szél nagysága (cm) Daganatvastagság (mm ) WHO Ausztrál Holland munkacsoport In situ 0,5 0,5 0,2 < > nem tartjuk szükségesnek, kivéve azt a nagyon ritka esetet, ha a daganat érinti azt (34, 53). Ha a kimetszés után a seb direkt varrattal zárhatónak tûnik, akkor babérlevél alakú excíziót végzünk. A kimetszés hossztengelye lehetôleg a nyirokelvezetés irányába kerüljön, és megközelítôleg háromszor akkora legyen, mint a szélessége. Ha a kimetszés után a seb elôreláthatóan nem zárható, akkor az excízió megfelelô ép széllel kövesse az elváltozást. A defektus fedésére ritkán lokális elforgatott, illetve eltolásos lebenyeket is alkalmazhatunk, de gyakrabban kerül sor fél-, illetve teljes vastagságú bôrlebeny szabad átültetésére (34). A fej-nyaki terület speciális sebészi problémát jelent, lehetôleg plasztikai sebészetben jártas fej-nyak-sebészek végezzék (12, 34, 76, 107). Ha lehetséges, tartani kell a fent említett általános elveket. Kozmetikailag elfogadható eredmény érdekében az ép szél nagysága vonatkozásában azonban sokszor kell ezekbôl engedni, ami ebben a daganatlokalizációban elfogadott gyakorlat. A defektus fedését az arcon, ha a direkt varrat nem kivitelezhetô, lehetôleg elforgatott lebenyekkel végezzük. A hajas fejbôr területén nem szabad engedni az általános elvekbôl, mert ennek a területnek igen gazdag kután nyirokrendszere van, ezért kisebb kimetszések esetén gyakoriak a recidívák. A hiányt ezen a területen eltolásos lebennyel vagy szabad bôrlebeny átültetésével fedhetjük. Szubungvális melanomák esetén a megfelelô eljárás az amputáció (34, 40). A csonkolás szintjét úgy kell megválasztani, hogy az elváltozástól proximálisan az ép szél legalább 1 cm legyen. Az ujjak voláris, illetve plantáris felszínének melanomái esetén is amputáció javasolható az elváltozástól egy ízülettel proximálisabb szinten. Kivételes esetekben (vékony melanomák és/vagy hüvelykujjon elhelyezkedô elváltozás) ettôl a szabálytól el lehet térni, és a széles excízió is megengedhetô a bôrhiány szabad bôrlebennyel való fedésével (33, 34, 104). Talpon elhelyezkedô melanomák esetén a kimetszés után maradt hiányt nem célszerû elsôdlegesen fedni, érdemes megvárni, amíg sarjszövettel kitöltôdik, és második ülésben elvégezni az irhafelezett bôrlebeny szabad átültetését (26, 34). Intézetünkben az utóbbi években a talpi melanomák ellátásakor a kimetszés után keletkezett defektust egyáltalán nem fedjük, hanem hagyjuk a sebet másodlagosan meggyógyulni. A beteg a mûtét utáni naptól kezdve terhelheti az operált végtagot, önellátóvá válik, és a hiány nagyságától függôen a seb 4 8 hét alatt teljesen meggyógyul, elkerülhetô egy második mûtéti beavatkozás egy újabb sebfelülettel. Az eredmények mind funkcionális, mind kozmetikai szempontból kifejezetten jók. A perineális (anogenitális) melanomák kezelése speciális felkészültséget igényel, ennek részleteivel közleményünkben nem foglalkozunk, az ilyen betegeket célszerû a melanomák kezelésében nagy tapasztalattal rendelkezô szakintézetbe irányítani (16, 44, 46, 56, 57). 70 Magyar Onkológia 47. évfolyam 1. szám 2003 MagyAR ONKOLÓGUSOK Társasága
3 A klinikailag negatív regionális nyirokcsomók sebészi kezelése (az ôrszem nyirokcsomó-biopszia) A klinikailag negatív regionális nyirokcsomók sebészi kezelése, az úgynevezett elektív regionális nyirokcsomó-blokkdisszekció a melanoma malignum terápiájának egyik legvitatottabb kérdése volt egészen napjainkig (39, 86, 90) ben Snow javasolta elôször a klinikailag áttétmentes regionális nyirokcsomók sebészi eltávolítását. Az elektív blokkdisszekció azonban számos szövôdménnyel és kellemetlenséggel járhat a beteg számára (általános érzéstelenítés, sebfertôzés, elhúzódó savózás, limfödéma, visszatérô limfangitiszek, mozgásbeszûkülés, érzészavarok), amelyek kedvezôtlenül befolyásolják életminôségét. Az elektív blokkdisszekciót javaslók a korábbi retrospektív tanulmányok eredményeire alapozták véleményüket (29, 68, 85, 88, 95). Ezekbôl a tanulmányokból kiderült, hogy a vékony melanomák (<1 mm) esetén a regionális nyirokcsomók daganatos érintettségének kockázata rendkívül alacsony (<5%), gyógyulási esélyük pedig nagyon jó (>98%). Ennél a betegcsoportnál az elektív blokkdisszekció semmiképpen nem javasolható. A vastag melanomák (>4 mm) esetén a regionális nyirokcsomók daganatos érintettségének aránya magas (>60%), ugyanakkor azonban az okkult távoli áttétek aránya is magas (>70%), ezért az elektív regionális nyirokcsomó-blokkdisszekció ebben a betegcsoportban sem javasolható. A közepes vastagságú melanomák (1 4 mm) esetében azonban a retrospektív tanulmányok statisztikailag szignifikánsan jobb túlélési eredményeket igazoltak az elektív blokkdisszekcióval kezelt betegcsoportban. Közepes vastagságú melanomáknál az okkult regionális áttétek kockázata körülbelül 20 és 50% között van, az okkult távoli metasztázisok aránya pedig kevesebb, mint 20%. Napjainkig négy prospektív randomizált tanulmány eredményeit közölték a nemzetközi szakirodalomban (63). A korábbi két tanulmány (WHO Melanoma Trial 1 és a Mayo Clinic Melanoma Trial) nem igazolt statisztikailag jelentôs különbséget az elektív blokkdisszekcióval kezelt és az obszervált csoportok között (94, 108, 109). A két tanulmány eredményei azonban részben a megfelelô stratifikáció (prognosztikai faktorok) hiánya, részben a kis betegszám miatt nem általánosíthatók. Az utóbbi két tanulmány közül a WHO Melanoma Trial 14 csak törzsi elhelyezkedésû, 1,5 mm-nél vastagabb elváltozásokat sorolt be két karra (blokkdisszekció vs. obszerváció) (21). A tanulmány hiányossága, hogy rutinszerûen nem végeztek limfoszcintigráfiát az elvezetô régiók meghatározására. A vizsgálat nem talált statisztikailag jelentôs különbséget a két kar között, azonban egyrészt igazolta a regionális nyirokcsomók okkult daganatos érintettségének független kedvezôtlen prognosztikai szerepét, másrészt a korai terápiás blokkdisszekció (elektív blokkdisszekció során talált pozitív nyirokcsomók) túlélési elônyét a késôivel (obszerváció során klinikailag megjelent regionális nyirokcsomóáttétek) szemben. Az Intergroup Melanoma Surgical Trial a betegeket tumorvastagság, elhelyezkedés és ulceráció szerint stratifikálva sorolta be két karra (blokkdisszekció vs. obszerváció) (7, 8). Törzsi elhelyezkedésû melanomák esetén limfoszcintigráfiával határozták meg az elvezetô régió(ka)t, és az összes régióban elvégezték a blokkdisszekciót. A két kar között sem az 5, sem a 10 éves túlélésben nem volt statisztikailag szignifikáns különbség. Alcsoportvizsgálatok a 60 év alatti 1-2 mm vastag melanomájú betegek esetén az elektív blokkdisszekció túlélési elônyét igazolták. A kor azonban nem volt stratifikációs tényezô, így ez a különbség inkább statisztikai, mint biológiai jelenségnek tekinthetô. Összefoglalva: a prospektív randomizált vizsgálatok nem igazolták az elektív blokkdisszekció elônyét, azonban felhívták a figyelmet a regionális staging jelentôségére, illetve arra, hogy klinikailag okkult nyirokcsomó-metasztázis esetén a korai terápiás blokkdisszekció túlélési elônyt jelent, különösen a közepes vastagságú melanomák esetén. Morton 1992-ben közölte eredményeit egy új minimálisan invazív regionális staging eljárásról, az úgynevezett kék festékes ôrszem nyirokcsomó-biopsziáról (72). Az ôrszem nyirokcsomó elmélet lényege, hogy a regionális metasztázis kialakulása nem véletlenszerû, hanem egy meghatározható folyamat. A regionális nyirokelvezetés elsô állomását nevezzük ôrszem nyirokcsomónak. Ez a nyirokcsomó a regionális metasztázis kialakulásának elsô és legvalószínûbb helye. Ennek a nyirokcsomónak az áttétmentessége jelzi a régió többi nyirokcsomójának áttétmentességét, és a blokkdisszekció elkerülhetô. A vizsgálatot 223 beteg 237 elvezetô nyirokrégióján végezték. Törzsi lokalizációjú melanomák esetén az elvezetés irányát preoperatív kután limfoszcintigráfiával határozták meg. Mûtét elôtt 5-10 perccel az elváltozás vagy a kimetszés hege köré intrakután kék festéket (izoszulfán-kék) adtak. A régió feltárása után megkeresték a kékre festôdött nyirokuta(ka)t, és követték az elsô, az ôrszem nyirokcsomó(k)ig, amelyeket külön eltávolítottak. Ezután minden esetben elvégezték a komplettáló elektív nyirokcsomó-blokkdisszekciót. Legalább egy ôrszem nyirokcsomót a régiók 82%-ában tudtak azonosítani. Az eljárás érzékenysége 95% (38/40), a pontossága 99% (192/194) volt (a fajlagosság az ôrszem nyirokcsomó meghatározásából adódóan mindig 100%). Két esetben észleltek negatív ôrszem nyirokcsomó mellett a régió többi nyirokcsomójában (egy-egy nyirokcsomó) áttétet. A téves negatív arány így 5%-nak adódott. A módszert Alex és Krag (1993) fejlesztette tovább (4). Kék festék helyett 99mTechnécium (Tc) izotóppal jelölt kolloidot adtak intrakután az elváltozás vagy a kimetszés hege köré. Dinamikus limfoszcintigráfia után az elvezetô régióban az ôrszem nyirokcsomó(ka)t (az elsô izotópot felvevô, aktív nyirokcsomó(k) a régióban) mûtét közben úgynevezett kézi gamma-szondával azonosították. Az izotópos és a kék festékes módszer kombinálását (kettôs jelöléses technika) Krag írta le elôször 1995-ben (58). Jelenleg nemzetközi és a melanoma malignum sebészi kezelése Magyar Onkológia 47. évfolyam 1. szám
4 hazai tapasztalatok alapján a dinamikus limfoszcintigráfiával kiegészített kettôs jelöléses módszert tartjuk a követendônek (2, 15, 66, 73, 80, 83). A dinamikus limfoszcintigráfia az elvezetô nyirokrégiók (törzsi, váll, fej-nyaki, perineális lokalizáció) és az esetleges in-tranzit nyirokcsomók meghatározása céljából elengedhetetlen (44, 79, 83, 89, 97, 100, 105, 106). Az ôrszem nyirokcsomó(ka)t az összes elvezetô régióból el kell távolítani. Saját gyakorlatunkban kivételt csak a ritka testüregi (paraaortikus vagy paraszternális) nyirokelvezetés képez, ezekbôl a régiókból az ôrszem nyirokcsomó(ka)t nem távolítjuk el, ugyanis véleményünk szerint a beavatkozás várható haszna nem áll arányban annak nagyságával és kockázatával. Az iliakális elhelyezkedésû ôrszem nyirokcsomó(k)at azonban eltávolítjuk. Iliakális nyirokelvezetést eddig csak alsó végtagi melanomák esetén észleltünk. Az ôrszem nyirokcsomóbiopszia technikája melanoma malignum esetén apróbb eltérésektôl eltekintve egyezményesnek tekinthetô (73). Ezzel a módszerrel az ôrszem nyirokcsomó-eltávolítási arány 95% felett van. Az ôrszem nyirokcsomó-biopsziával szerzett kezdeti kedvezô tapasztalatokról már a hazai irodalomban is beszámoltak (66, 80, 83, 102). Mivel Morton eredeti tanulmánya óta senki nem végzett komplettáló elektív blokkdisszekciót ôrszem nyirokcsomó-biopszia után, ezért a módszer érzékenysége és a téves negatív arány közvetlenül nem adható meg, csak a követési adatokból kalkulálható az idô függvényében. Jelenlegi tapasztalatok szerint negatív ôrszem nyirokcsomó-biopszia után a regionális recidívák aránya 3 év után 2 és 7% között van (22, 35, 69, 74). A téves negatív biopsziáknak több oka is lehet. Legkézenfekvôbb ok a technikai hiba, amely az esetek egy részéért egyértelmûen felelôs, ugyanis a recidívák gyakrabban fordulnak elô a tanulási fázisban. Másik ok lehet a patológiai feldolgozás elégtelensége, amelyet az támaszt alá, hogy a regionális recidívák ôrszem nyirokcsomóinak revíziója és kiegészítô vizsgálata az esetek akár 80%-ában is igazolja az áttét jelenlétét (22, 35). Harmadik ok lehet, hogy a daganatosan elzárt ôrszem nyirokcsomó nem veszi fel a jelölôanyagot, ezért egy másik, daganatmentes nyirokcsomót azonosítunk tévesen ôrszem nyirokcsomónak. Végül az is feltételezhetô okként, hogy a biopszia idôpontjában a nyirokutakban már vannak daganatsejtek, amelyek még nem érték el az ôrszem nyirokcsomót, és annak eltávolítása után egy másik nyirokcsomóban képeznek áttétet. Az ôrszem nyirokcsomó-biopszia lehetôséget teremt a patológus számára az eltávolított nyirokcsomók költség-hatékony részletes szövettani, esetleg molekuláris patológiai (RT-PCR) feldolgozására. Ez a részletes feldolgozás jelentôsen pontosítja a staginget (93, 96). Az így felfedezett úgynevezett mikrometasztázisok klinikai jelentôsége még nem egyértelmûen tisztázott, azonban egyre több adat szól amellett, hogy jelentôs prognosztikai szerepük van (93). A patológiai feldolgozás és az intraoperatív szövettani vizsgálat kérdésével közleményünkben részletesen nem foglalkozunk (27). Az ôrszem nyirokcsomó-biopszia napjainkra az Egyesült Államokban a primer, klinikailag régió-negatív melanomák esetén rutin eljárássá vált (69). Európában és Ausztráliában a vélemények ennél kicsit visszafogottabbak, ennek ellenére a legtöbb szerzô javasolja az elvégzését (74). Az ôrszem nyirokcsomó-biopszia rutinszerû alkalmazása mellett több érv is szól. Elôször: ez a minimálisan invazív sebészi beavatkozás pontosítja a betegek stádiumba sorolását, és jelentôs prognosztikai információt nyújt (9, 10, 98). (Ez tükrözôdik az American Joint Committee on Cancer új stádiumbesorolási rendszerében is (AJCC Cancer Staging Manual 6. kiadás, 2002), amelyet egy nagy betegcsoporton végzett prognosztikai tanulmány alapján dolgoztak ki.) Másodszor: lehetôvé teszi a korai terápiás regionális nyirokcsomó-blokkdisszekció szelektív alkalmazását, amely a korábbi tanulmányok szerint szignifikánsan javítja a túlélési eredményeket (21). Harmadszor: az adjuváns onkológiai kezelés meghatározása szempontjából jelentôs információt nyújt. Negyedszer: adjuváns kezelésre vonatkozó prospektív randomizált klinikai vizsgálatokba történô besorolásnál elengedhetetlen stratifikációs tényezô (69). A módszer ellenzôi egyrészt a prospektív randomizált tanulmányok eredményeinek hiányát hozzák fel érvként (25). Tekintettel azonban arra, hogy az ôrszem nyirokcsomó-biopszia elsôsorban nem terápiás, hanem diagnosztikus (staging) eljárás, ezért értékét a korábbi staging eljárásokéval (képalkotók, elektív blokkdisszekció) kell összehasonlítani. Az összehasonlítás szerint az ôrszem nyirokcsomó-biopszia a jelenleg rendelkezésre álló legérzékenyebb és legfajlagosabb regionális staging vizsgálat (1, 23). A másik érv, hogy a melanomás betegek sorsát nem a regionális, hanem a szisztémás áttétek határozzák meg (25). Ez az érv látszólag igaz, azonban a regionális kontroll minden daganat esetén alapvetô fontosságú, illetve elméleti megfontolások és az eddigi tapasztalatok szerint is a szubklinikus regionális áttétek eltávolítása javítja a túlélést (21). Saját véleményünk megegyezik a módszert támogatókéval. Az alábbi indikációk alapján javasoljuk a beavatkozás elvégzését: 1. közepesen vastag (1 4 mm) primer elváltozás; 2. vékony melanoma (<1 mm), ha ulceráció van és/vagy az invázió szintje legalább Clark IV és/vagy regresszió észlelhetô; 3. vastag daganat (>4 mm), ha nincs ulceráció (10). Kontraindikációk a következôk: klinikailag pozitív régió, kimutatható távoli áttétek, a beteg rossz általános állapota, terhesség. Az ôrszem nyirokcsomóbiopszia megelôzô excízió után is sikerrel elvégezhetô! Kivételt jelent, ha széles excízió után a defektus fedése lokális lebennyel történt. Pozitív ôrszem nyirokcsomó-biopszia után elvégzett komplettáló blokkdisszekciók közel 80%- ában a régió többi nyirokcsomójában már nem észlelhetô áttét. Felvetôdik tehát a kérdés, hogy a komplettáló mûtét feltétlenül szükséges-e minden esetben. Az eddigi elemzések sajnos nem tudtak egyértelmûen meghatározni olyan betegcsoportot, amelynél a további nyirokcsomók po- 72 Magyar Onkológia 47. évfolyam 1. szám 2003 MagyAR ONKOLÓGUSOK Társasága
5 zitivitásának kockázata kellôen alacsony lenne ahhoz, hogy a régió további kezelése elhagyható legyen (27, 96). A régiót tehát pozitív biopszia után mindenképpen kezelni kell. A sebészi kezelés mellett egy másik lehetôség a régió irradiációja. A kérdés eldöntésére prospektív randomizált tanulmányok szükségesek (túlélés, regionális kontroll, szövôdmények, életminôség végpontokkal). Tanulmányon kívül azonban jelenleg az ôrszem nyirokcsomó-pozitív betegeknél a komplettáló korai terápiás blokkdisszekció a követendô kezelés. Lokális recidívák és regionális áttétek sebészi kezelése A helyi kiújulások sebészi kezelése az ismételt széles kimetszés. Sajnos az esetek jelentôs részében a lokális recidívák nem izoláltak, hanem regionális és/vagy távoli áttétekkel együtt manifesztálódnak. Ezekben az esetekben, illetve elhanyagolt helyi kiújulások esetén a multimodális kezelésen belül az esetleges sebészi beavatkozás idôpontját egyénileg kell meghatározni. A lokális kontrollra palliatív szándékkal (életminôség javítása) még távoli áttétek esetén is törekedni kell. A regionális áttéteket két csoportra osztjuk: 1. a primer elváltozás és a régió között megjelenô limfogén áttétek, az úgynevezett in-tranzit áttétek; 2. a regionális nyirokcsomókban kialakult áttétek. A két folyamat egyszerre is megjelenhet (10). A klinikailag észlelhetô limfogén (regionális) áttétek már a primer tumor felfedezésének idôpontjában is jelen lehetnek (szinkron regionális áttétek), vagy csak késôbb manifesztálódnak (metakron regionális áttétek). A regionális áttétek nem ritkán távoli áttétekkel egyszerre jelentkeznek. A regionális áttétek kezelési taktikáját a betegség aktuális kiterjedtsége határozza meg. Izolált regionális áttétek esetén remény van a beteg gyógyulására, ezért a sebészi kezelés is aktívabb, radikálisabb. Egyidejû távoli áttétek esetén is fontos a regionális kontroll palliatív szándékkal, azonban ilyenkor egyéni mérlegelés után (a beteg életkora, általános állapota, várható élettartama) lehetôleg a legkisebb megterhelést jelentô kezelési módszer választandó, amely az esetek egy részében nem sebészi módszereket jelent (irradiáció, intervenciós radiológiai regionális kemoterápia). Az izolált regionális nyirokcsomóáttétek kezelése a terápiás regionális nyirokcsomó-blokkdisszekció (30, 51). Irodalmi adatok szerint a beavatkozás után az ötéves túlélés nem válogatott betegcsoportban 19 és 43% között van (39, 42, 48, 114). Prognosztikai szempontból a primer tumor vastagságának és a daganatosan érintett nyirokcsomók számának van döntô jelentôsége (9, 10, 114). Négy vagy annál több pozitív nyirokcsomó esetén a túlélés esélye jelentôsen csökken. Terápiás blokkdisszekció után a betegség elsô kiújulása legtöbbször (az összes kiújulás 50 70%-a) távoli szervekben jelenik meg (114). A korábbi disszekció területében kialakult izolált recidívák aránya 10 és 20% között van (71, 113, 114). Az izolált regionális nyirokcsomó-recidívák sebészi kezelése az úgynevezett reblokkdisszekció. Ezek a beavatkozások technikailag sokszor rendkívül nehezek lehetnek, és a szövôdmények aránya is magas. A nyaki régió áttétes nyirokcsomói esetén nyaki blokkdisszekciót végzünk. A disszekció kiterjesztése kérdésében nincs egységes vélemény, de az utóbbi években a kevésbé invazív eljárások (szelektív blokkdisszekciók) terjedtek el. Fej-nyaki melanomás beteget, akinek nyaki nyirokcsomóáttétei jelentek meg, mindenképpen a melanoma sebészetében nagy gyakorlattal és tapasztalattal rendelkezô intézetbe kell irányítani (76 78). A hónalji régió nyirokcsomóáttétei esetén a sebészi álláspont egységes. Komplett (I+II+IIIas szint) axilláris blokkdisszekció végzendô. Az ingvinális régió áttétes nyirokcsomóinak sebészi kezelése az ingvinális blokkdisszekció. A disszekció kiterjedtsége vonatkozásában a vélemények egyelôre nem egységesek (42, 48, 99, 103). Szuperficiális ingvinális blokkdisszekció után az iliakális recidívák aránya 5-26% között van (42, 48). Ilioingvinális blokkdisszekció során 5-52%-ban észlelték az iliakális nyirokcsomók daganatos érintettségét (42, 48, 99). Pozitív iliakális nyirokcsomók esetén a prognozis lényegesen rosszabb, mint negatív nyirokcsomók esetén (ötéves túlélés 0 40%). Karakousis anyagában pozitív iliakális nyirokcsomók esetén a tízéves túlélés 25% volt, negatív esetben viszont 39% (48). Az áttétes iliakális nyirokcsomók eltávolítása tehát mind a regionális kontroll, mind pedig a túlélés szempontjából indokolt lenne, azonban a negatív nyirokcsomók eltávolítása a prognosztikai elônyökön kívül csak a posztoperatív morbiditást fokozná (42, 99). Ilioingvinális blokkdisszekció tehát nem javasolható minden esetben, amikor klinikailag ingvinális nyirokcsomóáttétet észlelünk. A nem invazív vizsgálatok érzékenysége sajnos jelenleg nem kielégítô annak eldöntésére, hogy kiknél végezzük el a kiterjesztett disszekciót (23, 42, 99). Karakousis javaslata szerint minden esetben végezzük el a disszekciót az iliaca bifurcatióig. Ha a vena iliaca externa melletti nyirokcsomók makroszkóposan pozitívak, akkor terjesszük ki a disszekciót az aorta bifurcatióig (48). Hughes szerint akkor végezzünk ilioingvinális disszekciót, ha az ingvinális régió klinikailag masszívan érintett, és/vagy iliakálisan tapintható elváltozást észlelünk, és/vagy képalkotó vizsgálatok kóros nyirokcsomókat igazolnak az iliakális régióban, és/vagy a Cloquet nyirokcsomó (a canalis femoralisban helyezkedik el a vena femoralistól mediálisan) makroszkóposan vagy szövettanilag áttétesnek bizonyul (42). A csak igen ritkán végzett limfadenektómiákat (genuális, kubitális, szupraklavikuláris) részletesen nem tárgyaljuk. Az izolált in-tranzit áttétek sebészi kezelésében több módszer is szóba jöhet, illetve ezek az eljárások egymással kombinálhatóak. Az áttétek kimetszése az egyik lehetôség, azonban ha számos elváltozás van jelen, akkor ez a módszer nem alkalmazható. A nagyobb méretû és/vagy mélyebben elhelyezkedô áttétek eltávolítására a melanoma malignum sebészi kezelése Magyar Onkológia 47. évfolyam 1. szám
6 azonban sokszor ez az egyetlen lehetôség. Kevésbé invazív módszerek a diatermiás-, a krio- és a lézerabláció. Általában nagyszámú, viszonylag kisebb, illetve felületes elhelyezkedésû elváltozások esetén alkalmazhatók, szükség szerint ismételhetôk. A fenti módszerekkel az 5 éves túlélés 8 50% között van (41, 43, 47). A végtagra lokalizált in-tranzit áttétek kezelésére alkalmazható eljárás az úgynevezett izolált hipertermiás végtagi (bio)kemoperfúzió (3, 59, 60). A beavatkozás során a végtag artériáját és vénáját kipreparáljuk, kanüláljuk, a végtagot mandzsettával kirekesztjük. A keringést perfúziós pumpával tarjuk fent az izolált régióban. A gyógyszert a perfundált területbe adjuk, így nagyobb koncentrációt érhetünk el lényeges szisztémás toxicitás nélkül. Alkalmazhatunk külsô oxigenizációt, vagy végezhetjük a perfúziót hipoxiás körülmények között is. A beavatkozás közben a végtagot és/vagy a perfundált folyadékot melegítjük (enyhe hipertermia: C, magas hipertermia: C). A leggyakrabban alkalmazott kemoterapeutikum a melfalan (3, 59). Ezzel a gyógyszerrel átlagban 50%-ban komplett és közel 100%-ban részleges remisszió érhetô el. A beavatkozás után az in-tranzit recidívák aránya 24 54% között van. A recidívák azonban általában mind számban, mind méretben kisebbek, így lehetôség van más módszerek (excízió, diatermiás-, krio-, lézerabláció) alkalmazására ezek kezelésében. Szükség esetén a perfúzió ismételhetô is. Perfúzió után az ötéves túlélés 28 73% között van (3, 36, 59, 60, 101). Az utóbbi években gyógyszerként a humán rekombináns tumor necrosis factor-alfát (TNF-α) és az interferon-gammát (IFN-γ) is alkalmazták egyedül vagy melfalannal kombinálva. Az eredmények biztatóak, a komplett remisszió aránya 80%-ra nôtt (3, 65). Az izolált hipertermiás végtagi kemoperfúziót magas kockázatú végtagi melanomák esetén adjuváns kezelésként is alkalmazták, azonban az eredmények nem voltak meggyôzôek (31, 91, 112). Nem szabad megfeledkezni arról sem, hogy a (bio)kemoperfúziónak súlyos lokális szövôdményei is lehetnek (kiterjedt szövetelhalások), amelyek szepszishez vezethetnek, és a végtag amputációját tehetik szükségessé (3, 59). A végtagra lokalizált egyéb módszerekkel kezelhetetlen in-tranzit áttétek esetén végsô lehetôségként az amputáció javallata is felmerül, különösen, ha többszörös, mélyen infiltráló, vérzô, váladékozó és fájdalmas elváltozásokról van szó (45). Lokális betegség (primer vagy recidíva) és regionális áttétek különbözô változatokban egyszerre is manifesztálódhatnak. Ezekben az esetekben a fenti sebészi kezelési lehetôségeket egyéni mérlegelés alapján kell kombinálni. Távoli áttétek sebészi kezelése A melanoma malignum csaknem minden szervbe adhat áttétet (82). Az áttétek leggyakoribb megjelenési helyei a bôr, lágyrészek, távoli nyirokcsomók (M1a); tüdô (M1b); máj, tápcsatorna, központi idegrendszer, csontok és egyéb szervek (M1c). Következetesen emelkedett szérum laktátdehidrogenáz- (LDH) szint esetén a beteget függetlenül az áttét lokalizációjától az M1c kategóriába soroljuk (10). A távoli áttétes melanomás (IV. stádiumú) betegek jelentôs részének többszörös és/vagy több szervet is érintô metasztázisai vannak. A betegek körülbelül 10 20%-ában észlelhetô szoliter vagy limitált számú, egy szervet érintô áttét. Kuratív céllal csak ezeknél a betegeknél jöhet szóba sebészi beavatkozás. Természetesen palliatív vagy életmentô indikációval kiterjedt metasztatikus betegség esetén is szükség lehet mûtéti kezelésre (92, 116). Összefoglalónkban nem foglalkozunk részletesen a központi idegrendszeri és az osszeális áttétek sebészi kezelésével, ezeknek a betegeknek a mûtéti ellátása az idegsebészet, az ortopédia, illetve a traumatológia körébe tartozik. A metasztatikus melanoma mûtéti kezelése kapcsán figyelembe kell venni azt a tényt, hogy jelenleg ennek a betegségnek hatékony onkológiai kezelési lehetôsége nincs. Az önmagukban alkalmazott szisztémás onkológiai kezelésekkel átmeneti javulás elérhetô ugyan, de gyógyulásra vagy tartós tünetmentességre nem számíthatunk. Az utóbbi években a klinikai tanulmányok fázisába eljutott aktív specifikus immunkezelés (vakcináció, dendritikus sejtekkel történô kezelés) komoly reményt jelenthet a melanoma kezelésében. A kezdeti tapasztalatok azonban azt mutatják, hogy ez a kezelés akkor a leghatékonyabb, ha a klinikailag kimutatható daganatos elváltozásokat makroszkóposan maradéktalanul sebészileg eltávolítják, vagy egyéb módszerrel (termo-, krio-, lézerabláció, sugárkezelés, kirekesztéses (stop-flow) regionális biokemoperfúzió) elpusztítják (komplett citoredukció) (55, 70, 81, 84, 115). A fenti beavatkozások után (feltételezhetôen) visszamaradt klinikailag okkult áttéteket (minimális reziduális betegség) az aktív specifikus immunkezelés sikeresen és tartósan képes kontrollálni (81, 115). Kuratív szándékkal mûtétet csak válogatott esetekben, szigorú javallatok alapján végzünk (32, 49, 81, 115). A beavatkozás elôtt a beteg részletes onkológiai kivizsgálása szükséges. A fizikális vizsgálat mellett a mellkasi, a hasi-kismedencei régió, a központi idegrendszer és a csontok részletes képalkotó vizsgálata (ultrahang, CT, MR, csontscan) elengedhetetlen. Az elsôdleges kezelés és az áttét megjelenése között eltelt idô, illetve az áttét növekedési tendenciája (megkettôzôdési idô) fontos kórjóslati tényezôk (49, 115). Értékes prognosztikai információkat nyújthatnak a laboratóriumi vizsgálatok eredményei is (süllyedés, LDH, S-100 fehérje) (10, 67). Az utóbbi években a pozitronemissziós tomográfia (PET) is hozzátartozik ezeknek a betegeknek a kivizsgálásához ott, ahol ennek feltételei adottak (23). Természetesen a beteg általános állapota is döntô szempont a mûtéti javallat felállítása szempontjából. A kuratív mûtét az áttétek radikális eltávolítását jelenti (metasztazektómia vagy reszekció). Ha az áttét eltávolítása makro-és mikroszkóposan radikális volt, akkor a lokalizációtól függôen az ötéves túlélés a következô: bôr, lágyrész, távoli nyi- 74 Magyar Onkológia 47. évfolyam 1. szám 2003 MagyAR ONKOLÓGUSOK Társasága
7 rokcsomók 14 33%, tüdô 12 31%, tápcsatorna, máj 0 20%, mellékvese 50% (17, 32, 38, 49, 52, 54, 115). Ha sikeres metasztazektómia vagy reszekció után szoliter áttét jelenik meg ugyanabban a szervben vagy egy másik szervben, akkor válogatott esetekben a fenti szigorú kivizsgálás után ismételt kuratív mûtét szóba jön. Morton munkacsoportjának anyagában az ötéves túlélés ismételt radikális áttételtávolítás után 21% volt (81). Palliatív vagy életmentô mûtétet a következô esetekben végzünk: tápcsatornai átfúródás, vérzés, obstrukció; visszatérô mellkasi folyadék; fájdalmas, vérzô, váladékozó bôr- vagy lágyrészáttétek. Tápcsatornai vérzés és obstrukció esetén, ha lehetséges, reszekciót kell végezni. Sokszor azonban a reszekció technikailag nem elvégezhetô, ilyenkor megkerülô anasztomózist készítünk (18, 37, 54). Visszatérô mellkasi folyadék sebészi kezelése a pleurodézis. Vérzô, váladékozó, fájdalmas bôr-, lágyrészelváltozásokat eltávolítunk vagy deminuálunk, esetleg szóba jöhet az elváltozások krio- vagy lézerablációja. Palliatív mûtétek után tartós túlélésre általában nem számíthatunk, de a betegek életminôsége jelentôsen javulhat (116). Összefoglalás, következtetés A lokoregionális stádiumú melanoma malignum kezelésében a sebészetnek meghatározó szerepe van. Az izolált regionális biokemoperfúzió és az ôrszem nyirokcsomó-biopszia technikáját melanoma malignumos betegeken dolgozták ki elôször. Az ôrszem nyirokcsomó-biopszia azóta csaknem forradalmasította a korai emlôrák ellátását, és egyéb szolid tumorok kezelésében is sikerrel alkalmazhatónak tûnik. A metasztatikus melanoma sebészi kezelése kapcsán felvetôdik a komplett sebészi citoredukció és az adjuváns aktív specifikus immunkezelés jelentôségének kérdése, amely a jövôben a többi primer és áttétes daganat kezelési eredményeit is javíthatja. Irodalom 1. Acland KM, Healy C, Calonje E, et al. Comparison of positron emission tomography scanning and sentinel node biopsy in the detection of micrometastases of primary cutaneous malignant melanoma. J Clin Oncol 19: , Albertini JJ, Cruse CW, Rapaport D, et al. Intraoperative radiolymphoscintigraphy improves sentinel lymph node identification for patients with melanoma. Ann Surg 223: , Alexander HR, Fraker DL, Bartlett DL. Isolated limb perfusion for malignant melanoma. J Surg Oncol 12: , Alex JC, Weaver DL, Fairbank JT, et al. Gamma-probe guided lymph node localization in malignant melanoma. Surg Oncol 2: , Austin JR, Byers RM, Brown WD, et al. Influence of biopsy on the prognosis of cutaneous melanoma of the head and neck. Head Neck 18: , Balch CM, Urist MM, Karakousis CP, et al. Efficacy of 2- cm surgical margins for intermediate thickness melanomas (1 to 4 mm). Ann Surg 218: , Balch CM, Soong SJ, Bartolucci AA, et al. Efficacy of an elective regional lymph node dissection of 1 to 4 mm thick melanomas for patients 60 years of age and younger. Ann Surg 224: , Balch CM, Soong SJ, Ross MI, et al. Long-term results of a multi-institutional randomized trial comparing prognostic factors and surgical results for intermediate thickness melanomas (1.0 to 4.0 mm): Intergroup Melanoma Surgical Trial. Ann Surg Oncol 7: 87-97, Balch CM, Soong SJ, Gershenwald JE, et al. Prognostic factors analysis of 17,600 melanoma patients: validation of the American Joint Committee on Cancer melanoma staging system. J Clin Oncol 19: , Balch CM, Buzaid AC, Soong SJ, et al. Final version of the American Joint Committee on Cancer staging system for cutaneous melanoma. J Clin Oncol 19: , Balch CM, Soong SJ, Smith T, et al. Long-term results of a prospective surgical trial comparing 2 cm vs 4 cm excision margins for 740 patients with 1-4 mm melanomas. Ann Surg Oncol 8: , Balm AJM, Kroon BBR, de Boer JB, et al. Report of a symposium on: diagnosis and treatment of cutaneous head and neck melanoma. Eur J Surg Oncol 20: , Banzet P, Thomas A, Vuillemin E, et al. Wide versus narrow surgical excision in thin (<2 mm) stage I primary cutaneous melanoma: long term results of a French multicentric prospective randomized trial on 319 patients (abstract). Proc Am Assoc Clin Oncol 12: 387, Bong JL, Herd RM, Hunter JAA, for and on behalf of Scottish Melanoma Group. Incisional biopsy and melanoma prognosis. J Am Acad Dermatol 46: , Bostick P, Essner R, Glass E, et al. Comparison of blue dye and probe-assisted intraoperative lymphatic mapping in melanoma to identify sentinel nodes in 100 lymphatic basins. Arch Surg 134: 43-49, Brady MS, Kavolius JP, Quan SHQ. Anorectal melanoma. A 64-year experience at Memorial Sloan-Kettering Cancer Center. Dis Colon Rectum 38: , Branum GD, Epstein RE, Leight GS, et al. The role of resection in the management of melanoma metastatic to the adrenal gland. Surgery 109: , Branum GD, Seigler HF. Role of surgical intervention in the management of intestinal metastases form malignant melanoma. Am J Surg 162: , Breslow A. Thickness, cross-sectional areas and depth of invasion in the prognosis of cutaneous melanoma. Ann Surg 172: , Breslow A, Macht SD. Optimal size of resection margins for thin cutaneous melanoma. Surg Gynecol Obstet 145: , Cascinelli N, Morabito A, Santinami M, et al. on behalf of the WHO Melanoma Programme. Immediate or delayed dissection of regional nodes in patients with melanoma of the trunk: a randomised trial. Lancet 351: , Clary BM, Brady MS, Lewis JJ, et al. Sentinel lymph node biopsy in the management of patients with primary cutaneous melanoma: review of a large singleinstitutional experience with an emphasis on recurrence. Ann Surg 233: , Cobben DCP, Koopal S, Tiebosch ATMG, et al. New diagnostic techniques in staging in the surgical treatment of cutaneous malignant melanoma. Eur J Surg Oncol 28: , Cohn-Cedermark G, Rutqvist LE, Andersson R, et al. Long term results of a randomised study by the Swedish Melanoma Study Group on 2-cm versus 5-cm resection margins for patients with cutaneous melanoma with tumor thickness of mm. Cancer 89: , Coldiron BM. Sentinel node biopsy: who needs it? Int J Dermatol 39: , Cowles RA, Johnson TM, Chang AE, et al. Useful techniques for the resection of foot melanomas. J Surg Oncol 70: , Cserni G. Melanoma malignumos betegek sentinel nyirokcsomóinak patológiai vizsgálata. Magyar Onkológia 47:51-57, Day CL Jr, Mihm TM, Sober AJ, et al. Narrower margins for clinical stage I malignant melanoma. N Engl J Med 306: , 1982 a melanoma malignum sebészi kezelése Magyar Onkológia 47. évfolyam 1. szám
8 29. Drepper H, Kohler CO, Bastian B, et al. Benefit of elective lymph node dissection in subgroups of melanoma patients. Results of a multicenter study of 3616 patients. Cancer 72: , Farkas E, Rahóty P. Melanoma malignum kezelése osztályunkon. Magyar Sebészet 44: , Fenn NJ, Horgan K, Johnson RC, et al. A randomized controlled trial of prophylactic isolated cytotoxic perfusion for poor-prognosis primary melanoma of the lower limb. Eur J Surg Oncol 23: 6-9, Fletcher WS, Pommier RF, Lum S, et al. Surgical treatment of metastatic melanoma. Am J Surg 175: , Fortin PT, Freiberg AA, Rees R, et al. Malignant melanoma of the foot and ankle. J Bone Joint Surg Am 77: , Geraghty PJ, Johnson TM, Sondak VK, et al. Surgical treatment of primary cutaneous melanoma. Semin Surg Oncol 12: , Gershenwald JF, Colome MI, Lee JE, et al. Patterns of recurrence following a negative sentinel lymph node biopsy in 243 patients with stage I or II melanoma. J Clin Oncol 16: , Guadagni S, Russo F, Rossi CR, et al. Deliberate hypoxic pelvic and limb chemoperfusion in the treatment of recurrent melanoma. Am J Surg 183: 28-36, Guiman M, Klausner JM, Inbar M, et al. Surgical approach to malignant melanoma in the gastrointestinal tract. J Surg Oncol 36: 17-20, Harpole DH Jr, Johnson CM, Wolfe WG, et al. Analysis of 945 cases of pulmonary metastatic melanoma. J Thorac Cardiovasc Surg 103: , Harris M, Shapiro RL, Roses DF. Malignant melanoma. Primary surgical management (excision and node dissection) based on pathology and staging. Cancer 75: , Heaton KM, El-Naggar A, Ensign LG, et al. Surgical management and prognostic factors in patients with subungual melanoma. Ann Surg 219: , Hill S, Thomas JM. Treatment of cutaneous metastases from malignant melanoma using carbon-dioxide laser. Eur J Surg Oncol 19: , Hughes TMD, Thomas JM. Combined inguinal and pelvic lymph node dissection for stage III melanoma. Br J Surg 86: , Hueston JT. Integumentectomy for malignant melanoma of the limbs. Aust N Z J Surg 40: , de Hullu JA, Hollema H, Hoekstra HJ, et al. Vulvar melanoma. Is there a role for sentinel lymph node biopsy? Cancer 94: , Jaques DP, Coit DG, Brennan MF. Major amputation for advanced malignant melanoma. Surg Gynecol Obstet 169: 1-6, Johnson A, Mathai G, Robinson WA. Malignant melanoma of the perineum. J Surg Oncol 54: , Karakousis CP, Choe KJ, Holyoke ED. Biologic behavior and treatment of intransit metastasis of melanoma. Surg Gynecol Obstet 150: 29-32, Karakousis CP, Driscoll DL. Groin dissection in malignant melanoma. Br J Surg 81: , Karakousis CP, Velez A, Driscoll DL, et al. Metastasectomy in malignant melanoma. Surgery 115: , Karakousis CP, Balch CM, Urist MM, et al. Local recurrence in malignant melanoma. Ann Surg Oncol 3: , Karakousis CP. Therapeutic node dissections in malignant melanoma. Semin Surg Oncol 14: , Karp NS, Boyd A, DePan HJ, et al. Thoracotomy for metastatic malignant melanoma of the lung. Surgery 107: , Kenady DE, Brown BW, McBride CM. Excision of underlying fascia with a primary malignant melanoma: effect on recurrence and survival rates. Surgery 92: , Klaase JM, Kroon BBR. Surgery for melanoma metastatic to the gastrointestinal tract. Br J Surg 77: 60-61, Klein ES, Davidson B, Apter S, et al. Total abdominal perfusion (TAP) in the treatment of abdominal metastatic melanoma. J Surg Oncol 57: , Konstadoulakis MM, Ricaniadis N, Driscoll DL, et al. Malignant melanoma of the female genital system. Eur J Surg Oncol 20: , Köves I, Besznyák I, Kovács T, et al. Az anorectalis melanomákról. Magyar Sebészet 50: , Krag DN, Meijer SJ, Weaver DL, et al. Minimal-access surgery for staging of malignant melanoma. Arch Surg 130: , Krementz ET, Carter RD, Sutherland CM, et al. Regional chemotherapy for melanoma. A 35-year experience. Ann Surg 220: , Kroon BBR, Noorda EM, Vrouenraets BC, Nieweg OE. Isolated limb perfusion for melanoma. J Surg Oncol 79: , Lederman JS, Sober AJ. Does biopsy type influence survival in clinical stage 1 cutaneous melanoma? J Am Acad Dermatol 13: , Lees VC, Briggs JC. Effect of initial biopsy procedures on prognosis in stage 1 invasive cutaneous malignant melanoma: review of 1086 patients. Br J Surg 78: , Lens MB, Dawes M, Goodacre T, et al. Elective lymph node dissection in patients with melanoma. Systematic review and meta-analysis of randomized controlled trials. Arch Surg 137: , Lens MB, Dawes M, Goodacre T, et al. Excision margins in the treatment of primary cutaneous melanoma. A systematic review of randomized controlled trials comparing narrow vs wide excision. Arch Surg 137: , Lienard D, Ewalenko P, Delmotte JJ, et al. High-dose recombinant tumor necrosis factor alpha in combination with interferon gamma and melphalan in isolation perfusion of the limbs for melanoma and sarcoma. J Clin Oncol 10: 52-60, Liszkay G, Farkas E, Péley G, et al. Preoperatív limfoszcintigráfiával végrehajtott sentinel nyirokcsomó mûtétek melanoma malignumban. Magyar Onkológia 44: , Martenson ED, Hansson LO, Nilsson B, et al. Serum S- 100b protein as a prognostic marker in malignant cutaneous melanoma. J Clin Oncol 19: , McCarthy WH, Shaw HM, Milton GW. Efficacy of elective lymph node dissection in 2347 patients with clinical stage I malignant melanoma. Surg Gynecol Obstet 161: , McMasters KM, Reintgen DS, Ross MI, et al. Sentinel lymph node biopsy for melanoma: controversy despite widespread agreement. J Clin Oncol 19: , Metzger U, Röthlin M, Burger HR, et al. Long-term complete remission of melanoma liver metastases after intermittent intra-arterial cisplatin chemotherapy and surgery. Eur J Surg Oncol 23: , Monsour PD, Sause WT, Avent JM, et al. Local control following therapeutic nodal dissection for melanoma. J Surg Oncol 54: 18-22, Morton DL, Wen DR, Wong JH, et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 127: , Morton DL, Thompson JF, Essner R, et al. Validation of the accuracy of intraoperative lymphatic mapping and sentinel lymphadenectomy for early-stage melanoma. A multicenter trial. Ann Surg 230: , Nieweg OE, Tanis PJ, de Vries JDH, et al. Sensitivity of sentinel node biopsy in melanoma. J Surg Oncol 78: , Ng AKT, Jones WO, Shaw JHF. Analysis of local recurrence and optimizing excision margins for cutaneous melanoma. Br J Surg 88: , O Brien CJ, Coates AS, Petersen-Schafer K, et al. Experience with 998 cutaneous melanomas of the head and neck. Am J Surg 162: , O Brien CJ, Gianoutsos MP, Morgan MJ. Neck dissection for cutaneous malignant melanoma. World J Surg 16: , O Brien CJ, Petersen-Schafer K, Papadopoulos T, et al. 76 Magyar Onkológia 47. évfolyam 1. szám 2003 MagyAR ONKOLÓGUSOK Társasága
9 Evaluation of 107 therapeutic and elective parotidectomies for cutaneous melanoma. Am J Surg 168: , O Brien CJ, Uren RF, Thompson JF, et al. Prediction of potential metastatic sites in cutaneous head and neck melanoma using lymphoscintigraphy. Am J Surg 170: , Oláh J, Gyulai R, Varga J, et al. Ôrszem nyirokcsomóbiopsziával szerzett tapasztalataink melanoma malignumban. LAM 11: , Ollila DW, Hsueh EC, Stern SL, et al. Metastasectomy for recurrent stage IV melanoma. J Surg Oncol 71: , Patel JK, Didolkar MS, Pickren JW, et al. Metastatic pattern of malignant melanoma. A study of 216 autopsy cases. Am J Surg 135: , Péley G, Sinkovics I, Liszkay G, et al. Az intraoperatív gamma-próba által vezérelt ôrszem nyirokcsomóbiopszia jelentôsége a melanoma malignum és az emlôrák kezelésében. Orv Hetil 140: , Pilati P, Mocellin S, Miotto D, et al. Stop-flow technique for loco-regional delivery of antiblastic agents: literature review and personal experience. Eur J Surg Oncol 28: , Reintgen D, Cox EB, McCarty KS Jr, et al. Efficacy of elective lymph node dissection in patients with intermediate thickness primary melanoma. Ann Surg 198: , Reintgen D, Balch CM, Kirkwood J, et al. Recent advances in the care of the patient with malignant melanoma. Ann Surg 225: 1-14, Ringborg U, Andersson R, Eldh J, et al. Resection margins of 2 versus 5 cm for cutaneous malignant melanoma with tumor thickness of 0.8 to 2.0 mm: randomized study by the Swedish Melanoma Study Group. Cancer 77: , Rompel R, Garbe C, Buttner P, et al. Elective lymph node dissection in primary malignant melanoma: a matched-pair analysis. Melanoma Res 5: , Roozendaal GK, de Vries JDH, van Poll D, et al. Sentinel nodes outside lymph node basins in patients with melanoma. Br J Surg 88: , Ross MI. Surgical management of stage I and II melanoma patients: approach to the regional lymph node basin. Semin Surg Oncol 12: , Schraffordt Koops H, Vaglini M, Suciu S, et al. Prophylactic isolated limb perfusion for localized, highrisk limb melanoma: results of a multicenter randomized phase III trial. J Clin Oncol 16: , Sharpless SM, Das Gupta TK. Surgery for metastatic melanoma. Semin Surg Oncol 14: , Shivers SC, Wang X, Li W, et al. Molecular staging of malignant melanoma. Correlation with clinical outcome. JAMA, 280: , Sim FH, Taylor WF, Ivins JC, et al. A prospective randomized study of the efficacy of routine prophylactic lymphadenectomy in management of malignant melanoma: preliminary results. Cancer 41: , Slingluff CL, Stidham KR, Ricci WM, et al. Surgical management of regional lymph nodes in patients with melanoma. Experience with 4682 patients. Ann Surg 219: , Starz H, Balda BR, Krämer KU, et al. A micromorphometry-based concept for routine classification of sentinel lymph node metastases and its clinical relevance for patients with melanoma. Cancer 91: , Statius Muller MG, Hennipman FA, van Leeuwen PAM, et al. Unpredictability of lymphatic drainage patterns in melanoma patients. Eur J Nucl Med 29: , Statius Muller MG, van Leeuwen PAM, de Lange-de Klerk ESM, et al. The sentinel lymph node status is an important factor for predicting clinical outcome in patients with stage I or II cutaneous melanoma. Cancer 91: , Sterne GD, Murray DS, Grimley RP. Ilioinguinal block dissection for malignant melanoma. Br J Surg 82: , Tanabe KK. Lymphatic mapping and epitrochlear lymph node dissection for melanoma. Surgery 121: , Thompson JF, Hunt JA, Shannon KF, et al. Frequency and duration of remission after isolated limb perfusion for melanoma. Arch Surg 132: , Török L, Mari B, Fórizs A, et al. A szentinel nyirokcsomó vizsgálatának jelentôsége melanoma malignumban. Orv Hetil 139: , Trias M, Targarona EM, Piulachs J, et al. Extraperitoneal laparoscopically assisted ilioinguinal lymphadenectomy for treatment of malignant melanoma. Arch Surg 133: , Tseng JF, Tanabe KK, Gadd MA, et al. Surgical management of primary cutaneous melanomas of the hands and feet. Ann Surg 225: , Uren RF, Howman-Giles R, Thompson JF. Lymphatic drainage from the skin of the back to retroperitoneal and paravertebral lymph nodes in melanoma patients. Ann Surg Oncol 5: , Uren RF, Howman-Giles R, Thompson JF, et al. Lymphatic drainage to triangular intermuscular space lymph nodes in melanoma on the back. J Nucl Med 37: , Urist MM, Balch CM, Soong SJ, et al. Head and neck melanoma in 534 stage I patients. A prognostic factors analysis and results of surgical treatment. Ann Surg 200: , Veronesi U, Adamus J, Bandiera DC, et al. Inefficacy of immediate node dissection in stage I melanoma of the limbs. N Engl J Med 297: , Veronesi U, Adamus J, Bandiera DC, et al. Delayed regional lymph node dissection in stage I melanoma of the skin of the lower extremities. Cancer 49: , Veronesi U, Cascinelli N, Adamus J, et al. Thin stage I primary cutaneous malignant melanoma: comparison of excision with margins of 1 or 3 cm. N Engl J Med 318: , Veronesi U, Cascinelli N. Narrow excision (1-cm margin): a safe procedure for thin cutaneous melanoma. Arch Surg 126: , Vrouenraets BC, Kroon BBR, Klaase JM, et al. Adjuvant regional isolated perfusion with melphalan for patients with Clark V melanoma of the extremities. J Surg Oncol 52: , Warso MA, Das Gupta TK. Melanoma recurrence in a previously dissected lymph node basin. Arch Surg 129: , White RR, Stanley WE, Johnson JL, et al. Long-term survival in 2505 patients with melanoma with regional lymph node metastasis. Ann Surg 235: , Wong JH, Skinner KA, Kim KA, et al. The role of surgery in the teratment of nonregionally recurrent melanoma. Surgery 113: , Wornom III IL, Soong SJ, Urist MM, et al. Surgery as palliative treatment for distant metastases of melanoma. Ann Surg 204: , 1986 a melanoma malignum sebészi kezelése Magyar Onkológia 47. évfolyam 1. szám
 Sebész szerepe az axilla ellátásában Mersich Tamás Uzsoki utcai Kórház Sebészeti-onkosebészeti Osztály 2014. május 24. Kecskemét Bevezetés A nyirokcsomók sebészi eltávolítása felel a legtöbb szövődményért
Sebész szerepe az axilla ellátásában Mersich Tamás Uzsoki utcai Kórház Sebészeti-onkosebészeti Osztály 2014. május 24. Kecskemét Bevezetés A nyirokcsomók sebészi eltávolítása felel a legtöbb szövődményért
A bőrmelanoma kezelésének módjai. Dr. Forgács Balázs Bőrgyógyászati Osztály
 A bőrmelanoma kezelésének módjai Dr. Forgács Balázs Bőrgyógyászati Osztály Melanoma TNM (AJCC VIII.) A melanoma kezelés alapja (T:tumor, N:nyirokcsomó, M:metasztázis) T: Breslow érték a legközelebbi 0,1
A bőrmelanoma kezelésének módjai Dr. Forgács Balázs Bőrgyógyászati Osztály Melanoma TNM (AJCC VIII.) A melanoma kezelés alapja (T:tumor, N:nyirokcsomó, M:metasztázis) T: Breslow érték a legközelebbi 0,1
XIII./5. fejezet: Terápia
 XIII./5. fejezet: Terápia A betegek kezelésekor a sebészi kezelés, a kemoterápia (klasszikus citotoxikus és a biológiai terápia), a radioterápia és ezek együttes alkalmazása egyaránt szóba jön. A gégének
XIII./5. fejezet: Terápia A betegek kezelésekor a sebészi kezelés, a kemoterápia (klasszikus citotoxikus és a biológiai terápia), a radioterápia és ezek együttes alkalmazása egyaránt szóba jön. A gégének
A malignus melanóma új TNM-klasszifikációja (AJCC, 2009) és az őrszemnyirokcsomó-biopszia patológiai jelentősége
 68 Összefoglaló közlemény A malignus melanóma új TNM-klasszifikációja (AJCC, 2009) és az őrszemnyirokcsomó-biopszia patológiai jelentősége Plótár Vanda 1, Liszkay Gabriella 2, Ladányi Andrea 1, Tóth Erika
68 Összefoglaló közlemény A malignus melanóma új TNM-klasszifikációja (AJCC, 2009) és az őrszemnyirokcsomó-biopszia patológiai jelentősége Plótár Vanda 1, Liszkay Gabriella 2, Ladányi Andrea 1, Tóth Erika
Radioizotópos sebészeti lehetőségek a korai emlőrák kezelésében
 Radioizotópos sebészeti lehetőségek a korai emlőrák kezelésében Doktori (PhD) értekezés tézisei Dr. Péley Gábor Témavezető: Prof. Dr. Kopper László Semmelweis Egyetem Doktori Iskola Patológiai Tudományok
Radioizotópos sebészeti lehetőségek a korai emlőrák kezelésében Doktori (PhD) értekezés tézisei Dr. Péley Gábor Témavezető: Prof. Dr. Kopper László Semmelweis Egyetem Doktori Iskola Patológiai Tudományok
Sentinel nyirokcsomó biopszia szájüregi laphámrák esetén
 Sentinel nyirokcsomó biopszia szájüregi laphámrák esetén Dr. Patkó Tamás, dr. Koltai Pál, dr. Remenár Éva, dr. Boér András Országos Onkológiai Intézet Fej-nyak-állcsont és Rekonstrukciós Sebészeti Osztály
Sentinel nyirokcsomó biopszia szájüregi laphámrák esetén Dr. Patkó Tamás, dr. Koltai Pál, dr. Remenár Éva, dr. Boér András Országos Onkológiai Intézet Fej-nyak-állcsont és Rekonstrukciós Sebészeti Osztály
SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA EMLŐRÁKBAN- MÓDSZERTANI ÚTMUTATÓ
 SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA EMLŐRÁKBAN- MÓDSZERTANI ÚTMUTATÓ Írta: Rajtár Mária 1. Háttér információk és definíciók Az emlőrák sebészi kezelése során az axillaris blockdissectióval eltávolított
SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA EMLŐRÁKBAN- MÓDSZERTANI ÚTMUTATÓ Írta: Rajtár Mária 1. Háttér információk és definíciók Az emlőrák sebészi kezelése során az axillaris blockdissectióval eltávolított
A vesedaganatok sebészi kezelése
 A vesedaganatok sebészi kezelése Szendrői Attila Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum Az Európai Urológus Testület képzőhelye Robson elvek (1963) Nincs szisztémás kezelés -radikális
A vesedaganatok sebészi kezelése Szendrői Attila Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum Az Európai Urológus Testület képzőhelye Robson elvek (1963) Nincs szisztémás kezelés -radikális
Változások az emlő sebészetében
 Változások az emlő sebészetében Maráz Róbert, Boross Gábor Bács-Kiskun Megyei Kórház Kecskemét Általános Sebészeti Osztály, Onkoradiológiai Központ Sebészet fejlődése Elméleti ismeretek fejlődése Diagnosztika
Változások az emlő sebészetében Maráz Róbert, Boross Gábor Bács-Kiskun Megyei Kórház Kecskemét Általános Sebészeti Osztály, Onkoradiológiai Központ Sebészet fejlődése Elméleti ismeretek fejlődése Diagnosztika
SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA MELANOMA MALIGNUMBAN- MÓDSZERTANI ÚTMUTATÓ
 SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA MELANOMA MALIGNUMBAN- MÓDSZERTANI ÚTMUTATÓ Írta: Rajtár Mária 1. Háttér információk és definíciók A melanoma malignum sebészi kezelésében nem tapintható nyirokcsomók
SENTINEL NYIROKCSOMÓ SZCINTIGRÁFIA MELANOMA MALIGNUMBAN- MÓDSZERTANI ÚTMUTATÓ Írta: Rajtár Mária 1. Háttér információk és definíciók A melanoma malignum sebészi kezelésében nem tapintható nyirokcsomók
pt1 colorectalis adenocarcinoma: diagnózis, az invázió fokának meghatározása, a daganatos betegség ellátása (EU guideline alapján)
 pt1 colorectalis adenocarcinoma: diagnózis, az invázió fokának meghatározása, a daganatos betegség ellátása (EU guideline alapján) Szentirmay Zoltán Országos Onkológiai Intézet Daganatpatológiai Centrum
pt1 colorectalis adenocarcinoma: diagnózis, az invázió fokának meghatározása, a daganatos betegség ellátása (EU guideline alapján) Szentirmay Zoltán Országos Onkológiai Intézet Daganatpatológiai Centrum
Grádus rendszerek vizsgálata IAés IB stádiumú adenocarcinomákban
 Grádus rendszerek vizsgálata IAés IB stádiumú adenocarcinomákban Zombori Tamás, Furák József, Urbán Dániel, Némedi Réka, Nyári Tibor, Cserni Gábor, TiszlaviczLászló Pathologiai Intézet, ÁOK Szegedi Tudományegyetem
Grádus rendszerek vizsgálata IAés IB stádiumú adenocarcinomákban Zombori Tamás, Furák József, Urbán Dániel, Némedi Réka, Nyári Tibor, Cserni Gábor, TiszlaviczLászló Pathologiai Intézet, ÁOK Szegedi Tudományegyetem
OncotypeDX az emlőrák kezelésében
 OncotypeDX az emlőrák kezelésében Dr. Nagy Zoltán Med Gen-Sol Kft. Szenológiai Kongresszus Kecskemét 2018. 04. 13-14. Slide 1 Az Oncotype DX korai emlőrák teszt 16 tumorral kapcsolatos gén Ösztrogén csoprt
OncotypeDX az emlőrák kezelésében Dr. Nagy Zoltán Med Gen-Sol Kft. Szenológiai Kongresszus Kecskemét 2018. 04. 13-14. Slide 1 Az Oncotype DX korai emlőrák teszt 16 tumorral kapcsolatos gén Ösztrogén csoprt
A fejezet felépítése. A.) Általános nevezéktan
 II./1.4. fejezet: Nevezéktan, stádiumbeosztás Torgyík László, Dank Magdolna A fejezet áttekintése során a hallgató megismerkedik az onkológiai kezelések során használatos kifejezések értemével és a TNM-osztályozás
II./1.4. fejezet: Nevezéktan, stádiumbeosztás Torgyík László, Dank Magdolna A fejezet áttekintése során a hallgató megismerkedik az onkológiai kezelések során használatos kifejezések értemével és a TNM-osztályozás
Az ôrszemnyirokcsomó-biopszia alkalmazhatósága és jelentôsége neoadjuváns kemoterápia után emlôrákban
 Az ôrszemnyirokcsomó-biopszia alkalmazhatósága és jelentôsége neoadjuváns kemoterápia után emlôrákban Eredeti közlemény Péley Gábor, 1 Török Klára, 1 Farkas Emil, 1 Mátrai Zoltán, 1 Horváth Zsolt, 2 Sinkovics
Az ôrszemnyirokcsomó-biopszia alkalmazhatósága és jelentôsége neoadjuváns kemoterápia után emlôrákban Eredeti közlemény Péley Gábor, 1 Török Klára, 1 Farkas Emil, 1 Mátrai Zoltán, 1 Horváth Zsolt, 2 Sinkovics
Új lehetőségek a tumoros emlőanyagok patológiai feldolgozásában
 Új lehetőségek a tumoros emlőanyagok patológiai feldolgozásában Dr. Lippai Norbert Hetényi Géza Kórház, Szolnok Múlt és jelen Szakmai irányelvek a műtéti preparátumot az eltávolítás után azonnal (maximum
Új lehetőségek a tumoros emlőanyagok patológiai feldolgozásában Dr. Lippai Norbert Hetényi Géza Kórház, Szolnok Múlt és jelen Szakmai irányelvek a műtéti preparátumot az eltávolítás után azonnal (maximum
Radioisotope-guided surgical techniques for the treatment of early breast cancer
 Radioisotope-guided surgical techniques for the treatment of early breast cancer Theses of PhD dissertation Dr. Gábor Péley Theme leader: Prof. László Kopper MD, PhD Semmelweis University PhD School Pathological
Radioisotope-guided surgical techniques for the treatment of early breast cancer Theses of PhD dissertation Dr. Gábor Péley Theme leader: Prof. László Kopper MD, PhD Semmelweis University PhD School Pathological
Előrelépések a bőr melanoma sebészi kezelésében. Progress in the surgical treatment of cutaneous melanoma
 BŐRGYÓGYÁSZATI ÉS VENEROLÓGIAI SZEMLE 2017 93. ÉVF. 4. 146 154. DOI 10.7188/bvsz.2017.93.4.2 Előrelépések a bőr melanoma sebészi kezelésében Progress in the surgical treatment of cutaneous melanoma KIS
BŐRGYÓGYÁSZATI ÉS VENEROLÓGIAI SZEMLE 2017 93. ÉVF. 4. 146 154. DOI 10.7188/bvsz.2017.93.4.2 Előrelépések a bőr melanoma sebészi kezelésében Progress in the surgical treatment of cutaneous melanoma KIS
PUBLICATIONS. doctorandus: Júlia Vízkeleti
 PUBLICATIONS doctorandus: Júlia Vízkeleti Articles in the subject of the dissertation: 1. Vízkeleti J., Vereczkey I., Fröhlich G., Varga S., Horváth K., Pulay T., Pete I.,,Kásler M., Polgár C.: Pathologic
PUBLICATIONS doctorandus: Júlia Vízkeleti Articles in the subject of the dissertation: 1. Vízkeleti J., Vereczkey I., Fröhlich G., Varga S., Horváth K., Pulay T., Pete I.,,Kásler M., Polgár C.: Pathologic
Pajzsmirigy carcinomák nyaki nyirokcsomó metastasisainak percutan ethanol infiltrációs ( PEI ) kezelése
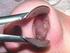 Pajzsmirigy carcinomák nyaki nyirokcsomó metastasisainak percutan ethanol infiltrációs ( PEI ) kezelése Dr. Molnár Krisztián PTE Radiológiai Klinika Prof. Dr. Mezősi Emese PTE I. Belgyógyászati Klinika
Pajzsmirigy carcinomák nyaki nyirokcsomó metastasisainak percutan ethanol infiltrációs ( PEI ) kezelése Dr. Molnár Krisztián PTE Radiológiai Klinika Prof. Dr. Mezősi Emese PTE I. Belgyógyászati Klinika
Emlômegtartó kezelés korai invazív emlôrákban: a lokális recidíva kezelése utáni túlélés prognosztikai faktorai
 Emlômegtartó kezelés korai invazív emlôrákban: a lokális recidíva kezelése utáni túlélés prognosztikai faktorai Fodor János Országos Onkológiai Intézet, Sugárterápiás Osztály, Budapest Invazív emlôrák
Emlômegtartó kezelés korai invazív emlôrákban: a lokális recidíva kezelése utáni túlélés prognosztikai faktorai Fodor János Országos Onkológiai Intézet, Sugárterápiás Osztály, Budapest Invazív emlôrák
Az ôrszem (sentinel) nyirokcsomó jelentôsége in situ emlôcarcinoma sebészi kezelésében
 Az ôrszem (sentinel) nyirokcsomó jelentôsége in situ emlôcarcinoma sebészi kezelésében Eredeti közlemény Takács Tibor 1, Szentpáli Károly 1, Paszt Attila 1, Ormándi Katalin 4, Lázár Máté 5, Pálka István
Az ôrszem (sentinel) nyirokcsomó jelentôsége in situ emlôcarcinoma sebészi kezelésében Eredeti közlemény Takács Tibor 1, Szentpáli Károly 1, Paszt Attila 1, Ormándi Katalin 4, Lázár Máté 5, Pálka István
A nem tapintható emlődaganatok sebészete
 A nem tapintható emlődaganatok sebészete Lázár György SZTE ÁOK Sebészeti Klinika, Szeged A Magyar Szenológiai Társaság Tudományos Fóruma, Kecskemét, 2013. május 17-18. Paradigma váltás Maximálisan tolerálható
A nem tapintható emlődaganatok sebészete Lázár György SZTE ÁOK Sebészeti Klinika, Szeged A Magyar Szenológiai Társaság Tudományos Fóruma, Kecskemét, 2013. május 17-18. Paradigma váltás Maximálisan tolerálható
LAM-TUDOMÁNY TOVÁBBKÉPZÉS A TÁRSSZAKMÁK HALADÁSA 18 LAM 2002;12(1):18-26.
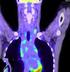 TOVÁBBKÉPZÉS A TÁRSSZAKMÁK HALADÁSA Az ôrszemnyirokcsomó-biopszia jelentôsége a daganatsebészetben Péley Gábor, Köves István, Sinkovics István, Farkas Emil, Dubecz Sándor, Kovács Tibor, Keresztes Sándor,
TOVÁBBKÉPZÉS A TÁRSSZAKMÁK HALADÁSA Az ôrszemnyirokcsomó-biopszia jelentôsége a daganatsebészetben Péley Gábor, Köves István, Sinkovics István, Farkas Emil, Dubecz Sándor, Kovács Tibor, Keresztes Sándor,
Intrapulmonális metasztázisok prognosztikai jelentôsége operált tüdôrákos esetekben
 Intrapulmonális metasztázisok prognosztikai jelentôsége operált tüdôrákos esetekben Szôke Tamás, 1 Troján Imre, 1 Furák József, 1 Tiszlavicz László, 2 Balogh Ádám 1 Szegedi Tudományegyetem, Sebészeti Klinika,
Intrapulmonális metasztázisok prognosztikai jelentôsége operált tüdôrákos esetekben Szôke Tamás, 1 Troján Imre, 1 Furák József, 1 Tiszlavicz László, 2 Balogh Ádám 1 Szegedi Tudományegyetem, Sebészeti Klinika,
Esetbemutatás. Dr. Iván Mária Uzsoki Kórház 2013.11.07.
 Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
A mammográfiás szűrővizsgálat és Z0011 vizsgálat hatása az emlőrák sebészetére (és komplex kezelésére). Kecskeméti tapasztalatok.
 A mammográfiás szűrővizsgálat és Z0011 vizsgálat hatása az emlőrák sebészetére (és komplex kezelésére). Kecskeméti tapasztalatok. Markó László 1,2 Pajkos Gábor 1, Maráz Róbert 2,1, Boross Gábor 2, Svébis
A mammográfiás szűrővizsgálat és Z0011 vizsgálat hatása az emlőrák sebészetére (és komplex kezelésére). Kecskeméti tapasztalatok. Markó László 1,2 Pajkos Gábor 1, Maráz Róbert 2,1, Boross Gábor 2, Svébis
Bevacizumab kombinációval elért hosszútávú remissziók metasztatikus colorectális carcinomában
 Bevacizumab kombinációval elért hosszútávú remissziók metasztatikus colorectális carcinomában G E LE N C S É R V I K TÓ R I A, B O É R K ATA LI N SZ E N T MA RGIT KÓ RH Á Z, O N KO LÓ GIA MAGYOT, 2016.05.05
Bevacizumab kombinációval elért hosszútávú remissziók metasztatikus colorectális carcinomában G E LE N C S É R V I K TÓ R I A, B O É R K ATA LI N SZ E N T MA RGIT KÓ RH Á Z, O N KO LÓ GIA MAGYOT, 2016.05.05
Funkcionális töréskezelés a IV-V. metacarpus diaphysis töréseinek ellátásában
 A Pécsi Orvostudományi Egyetem Balesetsebészeti és Kézsebészeti Klinikájának közleménye Funkcionális töréskezelés a IV-V. metacarpus diaphysis töréseinek ellátásában DR. TÓTH FERENC, DR. NYÁRÁDY JÓZSEF,
A Pécsi Orvostudományi Egyetem Balesetsebészeti és Kézsebészeti Klinikájának közleménye Funkcionális töréskezelés a IV-V. metacarpus diaphysis töréseinek ellátásában DR. TÓTH FERENC, DR. NYÁRÁDY JÓZSEF,
Az emlő betegek ellátása során elért eredmények, tapasztalataink
 Az emlő betegek ellátása során elért eredmények, tapasztalataink 2005.-2015. Szerző: Dinka Tibor, Abasiute A. George, Bodócs Ildikó, Kiss Csaba, Kelemen János, Kovács László, Kovács Ottó, Szántó Zoltán,
Az emlő betegek ellátása során elért eredmények, tapasztalataink 2005.-2015. Szerző: Dinka Tibor, Abasiute A. George, Bodócs Ildikó, Kiss Csaba, Kelemen János, Kovács László, Kovács Ottó, Szántó Zoltán,
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a PD-L1 és PD-1 fehérjék túlélésre gyakorolt hatása
 Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
San Antonio Breast Cancer Symposium. Dr. Tőkés Tímea
 San Antonio Breast Cancer Symposium Dr. Tőkés Tímea San Antonio, Texas, USA Henry B. Gonzalez Convention Center December 10-14, 2013 SABCS 2013 Több, mint 7500 résztvevő, több, mint 70 országból Továbbképzések,
San Antonio Breast Cancer Symposium Dr. Tőkés Tímea San Antonio, Texas, USA Henry B. Gonzalez Convention Center December 10-14, 2013 SABCS 2013 Több, mint 7500 résztvevő, több, mint 70 országból Továbbképzések,
New trends in colorectal surgery - what does it mean for the pathologist?
 New trends in colorectal surgery - what does it mean for the pathologist? Attila Bursics Uzsoki Teaching Hospital Department of General Surgery and Surgical Oncology CRC - néhány epidemiológiai adat Európában
New trends in colorectal surgery - what does it mean for the pathologist? Attila Bursics Uzsoki Teaching Hospital Department of General Surgery and Surgical Oncology CRC - néhány epidemiológiai adat Európában
Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán
 Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán Dr. Gelencsér Viktória, Dr. Boér Katalin Szent Margit Kórház, Onkológiai
Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán Dr. Gelencsér Viktória, Dr. Boér Katalin Szent Margit Kórház, Onkológiai
Gasztrointesztinális tumorok. Esetbemutatások
 Gasztrointesztinális tumorok Esetbemutatások 1. Eset: 54 éves férfibeteg 1997 jul.-ban sigma tumor miatt sigma resectio. Szövettan: adenocc. G3, pt3, pn0 (5 nyirokcsomóból) pn0, kevés eltávolított nycs.
Gasztrointesztinális tumorok Esetbemutatások 1. Eset: 54 éves férfibeteg 1997 jul.-ban sigma tumor miatt sigma resectio. Szövettan: adenocc. G3, pt3, pn0 (5 nyirokcsomóból) pn0, kevés eltávolított nycs.
Semmelweis Egyetem Urológiai Klinika Budapest. European Board of Urology Certified Department
 Nem-izominvazív hólyagrák terápiája Dr. Riesz Péter Semmelweis Egyetem Urológiai Klinika Budapest European Board of Urology Certified Department A hólyagrák halálozása Magyarországon Halálesetek száma
Nem-izominvazív hólyagrák terápiája Dr. Riesz Péter Semmelweis Egyetem Urológiai Klinika Budapest European Board of Urology Certified Department A hólyagrák halálozása Magyarországon Halálesetek száma
SUPRACLAVICULARIS NYIROKCSOMÓ DAGANATOK DIFFERENCIÁLDIAGNOSZTIKÁJA CSAPDÁK
 SUPRACLAVICULARIS NYIROKCSOMÓ DAGANATOK DIFFERENCIÁLDIAGNOSZTIKÁJA CSAPDÁK Péter Ilona¹, Boér András² és Orosz Zsolt¹ Országos Onkológiai Intézet, Humán és Kísérletes Daganatpatológiai Osztály¹ és Fej-Nyak,
SUPRACLAVICULARIS NYIROKCSOMÓ DAGANATOK DIFFERENCIÁLDIAGNOSZTIKÁJA CSAPDÁK Péter Ilona¹, Boér András² és Orosz Zsolt¹ Országos Onkológiai Intézet, Humán és Kísérletes Daganatpatológiai Osztály¹ és Fej-Nyak,
Az Egészségügyi Minisztérium szakmai protokollja Melanoma malignum cutis. Készítette: A Bőr- és Nemikórtani Szakmai Kollégium
 Az Egészségügyi Minisztérium szakmai protokollja Melanoma malignum cutis Készítette: A Bőr- és Nemikórtani Szakmai Kollégium I. Alapvető megfontolások 1. A tevékenység alkalmazási területe A melanoma ellátását
Az Egészségügyi Minisztérium szakmai protokollja Melanoma malignum cutis Készítette: A Bőr- és Nemikórtani Szakmai Kollégium I. Alapvető megfontolások 1. A tevékenység alkalmazási területe A melanoma ellátását
Melanomás betegek stádium szerinti megoszlása egy hazai centrumban
 EREDETI KÖZLEMÉNY Melanomás betegek stádium szerinti megoszlása egy hazai centrumban Tóth Veronika dr. Somlai Beáta dr. Hársing Judit dr. Hatvani Zsófia dr. Kárpáti Sarolta dr. Semmelweis Egyetem, Általános
EREDETI KÖZLEMÉNY Melanomás betegek stádium szerinti megoszlása egy hazai centrumban Tóth Veronika dr. Somlai Beáta dr. Hársing Judit dr. Hatvani Zsófia dr. Kárpáti Sarolta dr. Semmelweis Egyetem, Általános
Fulminans colitis ulcerosa a sebész szemével
 FIGAMU X. kongresszusa Balatonalmádi, 2015.04.17-19. Fulminans colitis ulcerosa a sebész szemével Besznyák István Uzsoki utcai Kórház, Sebészeti - Onkosebészeti Osztály, Budapest 1 Milyen műtétet végez
FIGAMU X. kongresszusa Balatonalmádi, 2015.04.17-19. Fulminans colitis ulcerosa a sebész szemével Besznyák István Uzsoki utcai Kórház, Sebészeti - Onkosebészeti Osztály, Budapest 1 Milyen műtétet végez
Akut alsó végtagi ischaemiakorszerű [ér]sebészeti ellátása. (ESVS [ és hazai] irányelvek)
![Akut alsó végtagi ischaemiakorszerű [ér]sebészeti ellátása. (ESVS [ és hazai] irányelvek) Akut alsó végtagi ischaemiakorszerű [ér]sebészeti ellátása. (ESVS [ és hazai] irányelvek)](/thumbs/91/107137309.jpg) Akut alsó végtagi ischaemiakorszerű [ér]sebészeti ellátása. (ESVS [ és hazai] irányelvek) Sótonyi Péter Magyar Angiológiai és Érsebészeti Társaság 2017 évi Kongresszusa Szombathely, 2017.06.15-17. Egy
Akut alsó végtagi ischaemiakorszerű [ér]sebészeti ellátása. (ESVS [ és hazai] irányelvek) Sótonyi Péter Magyar Angiológiai és Érsebészeti Társaság 2017 évi Kongresszusa Szombathely, 2017.06.15-17. Egy
Intraocularis tumorok
 Intraocularis tumorok 25 évvel ezelőtt, ha egy szemben chorioidea melanomát találtunk, akkor a szemet enucleáltuk. Szemben lévő festékes daganat (melanoma chorioideae) Chorioidea melanoma miatt eltávolított,
Intraocularis tumorok 25 évvel ezelőtt, ha egy szemben chorioidea melanomát találtunk, akkor a szemet enucleáltuk. Szemben lévő festékes daganat (melanoma chorioideae) Chorioidea melanoma miatt eltávolított,
Radioizotópos sebészeti lehetőségek a korai emlőrák kezelésében. Doktori (PhD) értekezés
 Radioizotópos sebészeti lehetőségek a korai emlőrák kezelésében Doktori (PhD) értekezés Péley Gábor dr. Országos Onkológiai Intézet, Általános-és Mellkassebészeti Osztály 2005 Témavezető: Prof. Dr. Kopper
Radioizotópos sebészeti lehetőségek a korai emlőrák kezelésében Doktori (PhD) értekezés Péley Gábor dr. Országos Onkológiai Intézet, Általános-és Mellkassebészeti Osztály 2005 Témavezető: Prof. Dr. Kopper
Melanoma malignumos betegek sentinel nyirokcsomóinak patológiai vizsgálata
 Melanoma malignumos betegek sentinel nyirokcsomóinak patológiai vizsgálata Eredeti közlemény Cserni Gábor Bács-Kiskun Megyei Önkormányzat Kórháza, Patológia, Kecskemét A jelen közleményben a szerzô a melanoma
Melanoma malignumos betegek sentinel nyirokcsomóinak patológiai vizsgálata Eredeti közlemény Cserni Gábor Bács-Kiskun Megyei Önkormányzat Kórháza, Patológia, Kecskemét A jelen közleményben a szerzô a melanoma
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja
 A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési
Túlélés elemzés október 27.
 Túlélés elemzés 2017. október 27. Néhány példa Egy adott betegség diagnózisától kezdve mennyi ideje van hátra a páciensnek? Tipikusan mennyi ideig élhet túl? Bizonyos ráktípus esetén mennyi idő telik el
Túlélés elemzés 2017. október 27. Néhány példa Egy adott betegség diagnózisától kezdve mennyi ideje van hátra a páciensnek? Tipikusan mennyi ideig élhet túl? Bizonyos ráktípus esetén mennyi idő telik el
A korai emlőrák lokoregionális kezelésének fejlődése
 A korai emlőrák tudományos bizonyítékon alapuló lokoregionális kezelése Polgár Csaba Országos Onkológiai Intézet, Sugárterápiás Központ; Semmelweis Egyetem, ÁOK, Onkológiai Tanszék A korai emlőrák lokoregionális
A korai emlőrák tudományos bizonyítékon alapuló lokoregionális kezelése Polgár Csaba Országos Onkológiai Intézet, Sugárterápiás Központ; Semmelweis Egyetem, ÁOK, Onkológiai Tanszék A korai emlőrák lokoregionális
III./8.3. Lokálisan előrehaladott emlőrák. A fejezet felépítése
 III./8.3. Lokálisan előrehaladott emlőrák Kocsis Judit A fejezet célja, hogy megismerje a hallgató a helyileg előrehaladott emlődaganat fogalmát, diagnózisát és a terápiás lehetőségeket. A fejezet teljesítését
III./8.3. Lokálisan előrehaladott emlőrák Kocsis Judit A fejezet célja, hogy megismerje a hallgató a helyileg előrehaladott emlődaganat fogalmát, diagnózisát és a terápiás lehetőségeket. A fejezet teljesítését
Lohe mûtét hosszú távú eredményei a metatarsalgia kezelésében
 POTE Ortopédiai Klinika közleménye Lohe mûtét hosszú távú eredményei a metatarsalgia kezelésében DR. LOVÁSZ GYÖRGY, DR. KRÁNICZ JÁNOS, DR. SCHMIDT BÉLA Érkezett: 1995. április 11. ÖSSZEFOGLALÁS A szerzôk
POTE Ortopédiai Klinika közleménye Lohe mûtét hosszú távú eredményei a metatarsalgia kezelésében DR. LOVÁSZ GYÖRGY, DR. KRÁNICZ JÁNOS, DR. SCHMIDT BÉLA Érkezett: 1995. április 11. ÖSSZEFOGLALÁS A szerzôk
A sejt és szövettani diagnosztika modern eszközei a diagnosztikában és terápiában. Cifra János. Tolna Megyei Balassa János Kórház, Pathologia Osztály
 A sejt és szövettani diagnosztika modern eszközei a diagnosztikában és terápiában Cifra János Tolna Megyei Balassa János Kórház, Pathologia Osztály Szekszárd 2016. Május 6. Patológus feladatai Preoperatív
A sejt és szövettani diagnosztika modern eszközei a diagnosztikában és terápiában Cifra János Tolna Megyei Balassa János Kórház, Pathologia Osztály Szekszárd 2016. Május 6. Patológus feladatai Preoperatív
Hivatalos Bírálat Dr. Gődény Mária
 Hivatalos Bírálat Dr. Gődény Mária:,,Multiparametrikus MR vizsgálat prognosztikai és prediktív faktorokat meghatározó szerepe fej-nyaki tumoroknál, valamint a kismedence főbb daganat csoportjaiban című
Hivatalos Bírálat Dr. Gődény Mária:,,Multiparametrikus MR vizsgálat prognosztikai és prediktív faktorokat meghatározó szerepe fej-nyaki tumoroknál, valamint a kismedence főbb daganat csoportjaiban című
A világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje
 MGYRKÖZLÖNY 2010. évi 77. szám 16751 2. melléklet a 31/2010. (V. 13.) EüM rendelethez világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje 1. z eljárásrend tárgyát
MGYRKÖZLÖNY 2010. évi 77. szám 16751 2. melléklet a 31/2010. (V. 13.) EüM rendelethez világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje 1. z eljárásrend tárgyát
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése
 Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend)
 A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
A nem tapintható emlôtumorok és az ôrszemnyirokcsomók izotópos jelölése
 EMLÔDIAGNOSZTIKA Klinikoradiológiai tanulmány A nem tapintható emlôtumorok és az ôrszemnyirokcsomók izotópos jelölése Monoki Erzsébet, Varga Erika, Szabó Tünde, Tarján Tibor, Petri István, Zs. Tóth Endre,
EMLÔDIAGNOSZTIKA Klinikoradiológiai tanulmány A nem tapintható emlôtumorok és az ôrszemnyirokcsomók izotópos jelölése Monoki Erzsébet, Varga Erika, Szabó Tünde, Tarján Tibor, Petri István, Zs. Tóth Endre,
Mit is csinál pontosan a patológus?
 Szász A. Marcell Mit is csinál pontosan a patológus? Ceglédi Kossuth Lajos Gimnázium Cegléd, 2015. március 19. www.meetthescientist.hu 1 26 Google - patológus www.meetthescientist.hu 2 26 Google - patológia
Szász A. Marcell Mit is csinál pontosan a patológus? Ceglédi Kossuth Lajos Gimnázium Cegléd, 2015. március 19. www.meetthescientist.hu 1 26 Google - patológus www.meetthescientist.hu 2 26 Google - patológia
Bár az emlőrák elsősorban a posztmenopauzális nők betegsége, a betegek mintegy 5,5%-a 40 évesnél, 2%-a 35 évesnél fiatalabb a diagnózis idején. Ezekbe
 Bár az emlőrák elsősorban a posztmenopauzális nők betegsége, a betegek mintegy 5,5%-a 40 évesnél, 2%-a 35 évesnél fiatalabb a diagnózis idején. Ezekben a korcsoportokban ez a leggyakoribb daganatos halálozási
Bár az emlőrák elsősorban a posztmenopauzális nők betegsége, a betegek mintegy 5,5%-a 40 évesnél, 2%-a 35 évesnél fiatalabb a diagnózis idején. Ezekben a korcsoportokban ez a leggyakoribb daganatos halálozási
Lehetőségek és korlátok a core-biopszián alapuló limfóma diagnosztikában
 Lehetőségek és korlátok a core-biopszián alapuló limfóma diagnosztikában Strausz Tamás Tóth Erika Országos Onkológiai Intézet Sebészeti és Molekuláris Patológiai Osztály FiPaT 2012 Elvi alapok WHO klasszifikáció
Lehetőségek és korlátok a core-biopszián alapuló limfóma diagnosztikában Strausz Tamás Tóth Erika Országos Onkológiai Intézet Sebészeti és Molekuláris Patológiai Osztály FiPaT 2012 Elvi alapok WHO klasszifikáció
KLINIKAI ONKOLÓGIA ÁLTALÁNOS ONKOLÓGIA, EPIDEMIOLÓGIA, ETIOLÓGIA, DIAGNOSZTIKA ÉS SZŰRÉS
 KLINIKAI ONKOLÓGIA ÁLTALÁNOS ONKOLÓGIA, EPIDEMIOLÓGIA, ETIOLÓGIA, DIAGNOSZTIKA ÉS SZŰRÉS 1. Daganatos morbiditás és mortalitás Magyarországon 2. Kémiai és fizikai tényezők szerepe a daganatok kialakulásában
KLINIKAI ONKOLÓGIA ÁLTALÁNOS ONKOLÓGIA, EPIDEMIOLÓGIA, ETIOLÓGIA, DIAGNOSZTIKA ÉS SZŰRÉS 1. Daganatos morbiditás és mortalitás Magyarországon 2. Kémiai és fizikai tényezők szerepe a daganatok kialakulásában
III./10.3. A hímvesszőrák. Bevezetés. A fejezet felépítése. A./ Etiológia. B./ Patológia. Nyirády Péter
 III./10.3. A hímvesszőrák Nyirády Péter A fejezet célja, hogy a hallgató megismerje a hímvesszőrák előfordulásával, diagnosztikájával és kezelésével kapcsolatos ismereteket. A fejezet elsajátítása során
III./10.3. A hímvesszőrák Nyirády Péter A fejezet célja, hogy a hallgató megismerje a hímvesszőrák előfordulásával, diagnosztikájával és kezelésével kapcsolatos ismereteket. A fejezet elsajátítása során
MESENCHYMALIS TUMOROK
 MESENCHYMALIS TUMOROK Dr. SZEKANECZ ÉVA M.D.,Ph.D. DE KK Onkológiai Intézet 2014. (Handout) BEVEZETÉS a malignus tumorok 0.5-1%-a bármely életkorban, de gyerekekben gyakoribb (7%) 4. lágyrész sarcomák
MESENCHYMALIS TUMOROK Dr. SZEKANECZ ÉVA M.D.,Ph.D. DE KK Onkológiai Intézet 2014. (Handout) BEVEZETÉS a malignus tumorok 0.5-1%-a bármely életkorban, de gyerekekben gyakoribb (7%) 4. lágyrész sarcomák
A tüdőrák agyi metasztázisainak komplex kezelése az onkopulmonológus szemszögéből
 A tüdőrák agyi metasztázisainak komplex kezelése az onkopulmonológus szemszögéből Ostoros Gyula Országos Korányi TBC és Pulmonológiai Intézet 2007. október 6. Az onkológia jelenlegi legnagyobb kihívása
A tüdőrák agyi metasztázisainak komplex kezelése az onkopulmonológus szemszögéből Ostoros Gyula Országos Korányi TBC és Pulmonológiai Intézet 2007. október 6. Az onkológia jelenlegi legnagyobb kihívása
MAGYOT évi Tudományos Szimpóziuma Május 5-6, Budapest
 MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
KLINIKAI ÉS EGÉSZSÉG- GAZDASÁGTANI EVIDENCIÁK A VASTAGBÉLSZŰRÉSBEN
 Vastagbélszűrési disszeminációs workshop Szeged, 2015. május 12. KLINIKAI ÉS EGÉSZSÉG- GAZDASÁGTANI EVIDENCIÁK A VASTAGBÉLSZŰRÉSBEN Prof. Dr. Boncz Imre PTE ETK Egészségbiztosítási Intézet AZ ELŐADÁS TÉMÁJA
Vastagbélszűrési disszeminációs workshop Szeged, 2015. május 12. KLINIKAI ÉS EGÉSZSÉG- GAZDASÁGTANI EVIDENCIÁK A VASTAGBÉLSZŰRÉSBEN Prof. Dr. Boncz Imre PTE ETK Egészségbiztosítási Intézet AZ ELŐADÁS TÉMÁJA
Publications: 4. Nagykálnai T, Landherr L, Németh GY: Recidiváló epipharynx tumorok lokális rádiumkezelése. Fül-Orr-Gégegyógyászat 31: 97-101, 1985.
 1 Publications: 1. Landherr L, Siminszky M, Patonay P, Patyánik M, Stumpf J. Bucca tumoros betegeink 3 és 5 éves túlélési eredményei 285 kezelt esetnél. MFE Szájsebészeti Szekció Kongresszusának gyűjteményes
1 Publications: 1. Landherr L, Siminszky M, Patonay P, Patyánik M, Stumpf J. Bucca tumoros betegeink 3 és 5 éves túlélési eredményei 285 kezelt esetnél. MFE Szájsebészeti Szekció Kongresszusának gyűjteményes
Semmelweis Egyetem, Általános Orvostudományi Kar, I. sz. Sebészeti Klinika Sebészeti onkológia
 Sebészeti onkológia Dr. Kupcsulik Péter A daganatsebészet úttörői Sebész Billroth Halsted Kocher Miles Whipple Graham Torek Wertheim Daganat gyomor emlő pajzsmirigy végbél pancreas tüdő nyelőcső méh TNM
Sebészeti onkológia Dr. Kupcsulik Péter A daganatsebészet úttörői Sebész Billroth Halsted Kocher Miles Whipple Graham Torek Wertheim Daganat gyomor emlő pajzsmirigy végbél pancreas tüdő nyelőcső méh TNM
A renalis osteodystrophia diagnosztikájára és kezelésére. Az Egészségügyi Minisztérium szakmai protokollja Szeméremtestrák
 A renalis osteodystrophia diagnosztikájára és kezelésére Az Egészségügyi Minisztérium szakmai protokollja Szeméremtestrák Készítette: A Szülészeti és Nőgyógyászati Szakmai Kollégium A Sugárterápiás és
A renalis osteodystrophia diagnosztikájára és kezelésére Az Egészségügyi Minisztérium szakmai protokollja Szeméremtestrák Készítette: A Szülészeti és Nőgyógyászati Szakmai Kollégium A Sugárterápiás és
Secunder csonttumorok kezelési algoritmusa, prognosztikai faktorok. Szendrői M. Antal I. Semmelweis Egyetem Ortopédiai Klinika, Budapest
 Secunder csonttumorok kezelési algoritmusa, prognosztikai faktorok Szendrői M. Antal I. Semmelweis Egyetem Ortopédiai Klinika, Budapest Ortopédia Szintentartó Tanf. 2011 Paradigmavált ltás s a csontátt
Secunder csonttumorok kezelési algoritmusa, prognosztikai faktorok Szendrői M. Antal I. Semmelweis Egyetem Ortopédiai Klinika, Budapest Ortopédia Szintentartó Tanf. 2011 Paradigmavált ltás s a csontátt
A tüdőcitológia jelentősége a tüdődaganatok neoadjuváns kezelésének tervezésében
 A tüdőcitológia jelentősége a tüdődaganatok neoadjuváns kezelésének tervezésében Pápay Judit SE, I.sz.Patológiai és Kísérleti Rákkutató Intézet 70. Patológus Kongresszus Siófok 2011. szept. 29 - okt.1.
A tüdőcitológia jelentősége a tüdődaganatok neoadjuváns kezelésének tervezésében Pápay Judit SE, I.sz.Patológiai és Kísérleti Rákkutató Intézet 70. Patológus Kongresszus Siófok 2011. szept. 29 - okt.1.
A világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja
 A világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009.
A világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009.
Mit tud a tüdő-citológia nyújtani a klinikus igényeinek?
 Mit tud a tüdő-citológia nyújtani a klinikus igényeinek? XVI. Citológus Kongresszus és akkreditált tanfolyam Siófok, 2017. március 30-április 1. Pápay Judit SE, I.sz.Patológiai és Kísérleti Rákkutató intézet
Mit tud a tüdő-citológia nyújtani a klinikus igényeinek? XVI. Citológus Kongresszus és akkreditált tanfolyam Siófok, 2017. március 30-április 1. Pápay Judit SE, I.sz.Patológiai és Kísérleti Rákkutató intézet
III./14.3.1. fejezet: Melanoma
 III./14.3.1. fejezet: Melanoma Somlai Beáta A fejezet célja egy eset kapcsán a cutan melanoma felismerésének, kórlefolyásának és kezelési lehetőségének bemutatása. A fejezet teljesítését követően a hallgató
III./14.3.1. fejezet: Melanoma Somlai Beáta A fejezet célja egy eset kapcsán a cutan melanoma felismerésének, kórlefolyásának és kezelési lehetőségének bemutatása. A fejezet teljesítését követően a hallgató
ÖSSZEFOGLALÁS BEVEZETÉS
 6. ÉVFOLYAM, 1. SZÁM 2010. FEBRUÁR Jou r n a l of Cl i n i c a l On c o l o g y EREDETI KÖZLEMÉNY Az elôrehaladott stádiumú emlôrák gyakorisága és az emlôrák mortalitása a mammográfiás szûréssel kapcsolatos
6. ÉVFOLYAM, 1. SZÁM 2010. FEBRUÁR Jou r n a l of Cl i n i c a l On c o l o g y EREDETI KÖZLEMÉNY Az elôrehaladott stádiumú emlôrák gyakorisága és az emlôrák mortalitása a mammográfiás szûréssel kapcsolatos
Eredményes temozolamid kezelés 2 esete glioblasztómás betegeknél
 Eredményes temozolamid kezelés 2 esete glioblasztómás betegeknél Dr. Mangel László 1,2, Prof. Dr. Dóczi Tamás 3, Dr. Balogh Zsolt 4, Dr. Lövey József 2, Dr. Sipos László 5 Pécsi Tudományegyetem, Onkoterápiás
Eredményes temozolamid kezelés 2 esete glioblasztómás betegeknél Dr. Mangel László 1,2, Prof. Dr. Dóczi Tamás 3, Dr. Balogh Zsolt 4, Dr. Lövey József 2, Dr. Sipos László 5 Pécsi Tudományegyetem, Onkoterápiás
Cervixcarcinomadefinitív radiokemoterápia. Kahán Zsuzsanna
 Cervixcarcinomadefinitív radiokemoterápia Kahán Zsuzsanna SZTE Onkoterápiás Klinika, Szeged Méhnyakrák: definitív radiokemoterápia Igen sugár-és kemoszenzitívdaganat kemoradioterápia platina készítménnyel!
Cervixcarcinomadefinitív radiokemoterápia Kahán Zsuzsanna SZTE Onkoterápiás Klinika, Szeged Méhnyakrák: definitív radiokemoterápia Igen sugár-és kemoszenzitívdaganat kemoradioterápia platina készítménnyel!
A melanóma diagnosztikájának fejlődése
 68 Összefoglaló közlemény A melanóma diagnosztikájának fejlődése Liszkay Gabriella Országos Onkológiai Intézet, Onkodermatológiai Osztály, Budapest A melanóma folyamatosan növekvő incidenciája és a disszeminált
68 Összefoglaló közlemény A melanóma diagnosztikájának fejlődése Liszkay Gabriella Országos Onkológiai Intézet, Onkodermatológiai Osztály, Budapest A melanóma folyamatosan növekvő incidenciája és a disszeminált
Endovénásbeavatkozások a bizonyítékok tükrében. Menyhei Gábor PTE KK Érsebészeti Klinika
 Endovénásbeavatkozások a bizonyítékok tükrében Menyhei Gábor PTE KK Érsebészeti Klinika Vénás betegségek diagnosztikája Fizikális és Duplex vizsgálat álló és fordított Trendelenburg helyzetben Duplex scan
Endovénásbeavatkozások a bizonyítékok tükrében Menyhei Gábor PTE KK Érsebészeti Klinika Vénás betegségek diagnosztikája Fizikális és Duplex vizsgálat álló és fordított Trendelenburg helyzetben Duplex scan
Kettős férfi emlőrák és a beteg utógondozása
 Bevezetés A férfi emlőrák ritka betegség, általában 100 női emlőrákra jut egy férfi emlőrákos beteg. Egyes populációkban ez az arány más lehet, így például az afrikai fekete lakosság körében 2,4% (1).
Bevezetés A férfi emlőrák ritka betegség, általában 100 női emlőrákra jut egy férfi emlőrákos beteg. Egyes populációkban ez az arány más lehet, így például az afrikai fekete lakosság körében 2,4% (1).
Szegedi úti akadémia PROSZTATA BETEGSÉGEK MŰTÉTEI A JÁRÓBETEG ELLÁTÁSBAN ÉS AZ EGYNAPOS SEBÉSZETEN LEHETŐSÉGEK, HATÁROK Dr.
 Szegedi úti akadémia 2017 PROSZTATA BETEGSÉGEK MŰTÉTEI A JÁRÓBETEG ELLÁTÁSBAN ÉS AZ EGYNAPOS SEBÉSZETEN LEHETŐSÉGEK, HATÁROK Dr. Siller György Egynapos sebészeten végzett műtétek aránya országonként Egynapos
Szegedi úti akadémia 2017 PROSZTATA BETEGSÉGEK MŰTÉTEI A JÁRÓBETEG ELLÁTÁSBAN ÉS AZ EGYNAPOS SEBÉSZETEN LEHETŐSÉGEK, HATÁROK Dr. Siller György Egynapos sebészeten végzett műtétek aránya országonként Egynapos
Diagnosztikai problémák onkoplasztikai műtétek után a radiológus szemszögéből
 Diagnosztikai problémák onkoplasztikai műtétek után a radiológus szemszögéből Bidlek M., Kovács E. Országos Onkológiai Intézet 2013. május 17-18 Szenológiai Kongresszus Kecskemét Műtéti típusok Kozmetikai
Diagnosztikai problémák onkoplasztikai műtétek után a radiológus szemszögéből Bidlek M., Kovács E. Országos Onkológiai Intézet 2013. május 17-18 Szenológiai Kongresszus Kecskemét Műtéti típusok Kozmetikai
Sarkadi Margit1, Mezősi Emese2, Bajnok László2, Schmidt Erzsébet1, Szabó Zsuzsanna1, Szekeres Sarolta1, Dérczy Katalin3, Molnár Krisztián3,
 Sarkadi Margit1, Mezősi Emese2, Bajnok László2, Schmidt Erzsébet1, Szabó Zsuzsanna1, Szekeres Sarolta1, Dérczy Katalin3, Molnár Krisztián3, Rostás Tamás3, Ritter Zsombor4, Zámbó Katalin1 Pécsi Tudományegyetem
Sarkadi Margit1, Mezősi Emese2, Bajnok László2, Schmidt Erzsébet1, Szabó Zsuzsanna1, Szekeres Sarolta1, Dérczy Katalin3, Molnár Krisztián3, Rostás Tamás3, Ritter Zsombor4, Zámbó Katalin1 Pécsi Tudományegyetem
OncotypeDX és más genetikai tesztek emlőrákban és azon túl. Dr. Nagy Zoltán Med Gen-Sol Kft.
 OncotypeDX és más genetikai tesztek emlőrákban és azon túl Dr. Nagy Zoltán Med Gen-Sol Kft. 2 A betegek leggyakoribb kérdései! Kiújul a betegségem?! Kell kemoterápiát kapnom?! A beteg és környezete életét,
OncotypeDX és más genetikai tesztek emlőrákban és azon túl Dr. Nagy Zoltán Med Gen-Sol Kft. 2 A betegek leggyakoribb kérdései! Kiújul a betegségem?! Kell kemoterápiát kapnom?! A beteg és környezete életét,
Hypopharynx tumorok diagnosztikája és terápiája
 Hypopharynx tumorok diagnosztikája és terápiája Dr. Répássy Gábor Semmelweis Egyetem ÁOK Fül-Orr-Gégészeti és Fej-nyaksebészeti Klinika Anatómiai régiók és alrégiók Pharyngooesophagealis határ, postcricoid
Hypopharynx tumorok diagnosztikája és terápiája Dr. Répássy Gábor Semmelweis Egyetem ÁOK Fül-Orr-Gégészeti és Fej-nyaksebészeti Klinika Anatómiai régiók és alrégiók Pharyngooesophagealis határ, postcricoid
PROGNOSZTIKAI FAKTOROK VIZSGÁLATA ÉS ÚJABB GYÓGYSZERES KEZELÉSI LEHETÕSÉGEK ROSSZINDULATÚ TÁMASZTÓSZÖVETI DAGANATOK ESETÉN. Ph. D.
 PROGNOSZTIKAI FAKTOROK VIZSGÁLATA ÉS ÚJABB GYÓGYSZERES KEZELÉSI LEHETÕSÉGEK ROSSZINDULATÚ TÁMASZTÓSZÖVETI DAGANATOK ESETÉN Ph. D. Értekezés Tézisei Dr. Pápai Zsuzsanna Témavezetõ: Dr. Kopper László egyetemi
PROGNOSZTIKAI FAKTOROK VIZSGÁLATA ÉS ÚJABB GYÓGYSZERES KEZELÉSI LEHETÕSÉGEK ROSSZINDULATÚ TÁMASZTÓSZÖVETI DAGANATOK ESETÉN Ph. D. Értekezés Tézisei Dr. Pápai Zsuzsanna Témavezetõ: Dr. Kopper László egyetemi
Epithelialis-mesenchymalis átmenet vastagbél daganatokban
 Epithelialis-mesenchymalis átmenet vastagbél daganatokban Éles Klára Országos Onkológiai Intézet Sebészi és Molekuláris Daganatpatológiai Centrum Budapest, 2010. 12. 03. Epithelialis-mesenchymalis átmenet
Epithelialis-mesenchymalis átmenet vastagbél daganatokban Éles Klára Országos Onkológiai Intézet Sebészi és Molekuláris Daganatpatológiai Centrum Budapest, 2010. 12. 03. Epithelialis-mesenchymalis átmenet
ALK+ tüdőrák a klinikai gyakorlatban. Dr. Ostoros Gyula Országos Korányi Pulmonológiai Intézet Budapest
 ALK+ tüdőrák a klinikai gyakorlatban Dr. Ostoros Gyula Országos Korányi Pulmonológiai Intézet Budapest Előadói megjegyzés Az előadás az előadó független szakmai véleményét tükrözi, ami nem feltétlenül
ALK+ tüdőrák a klinikai gyakorlatban Dr. Ostoros Gyula Országos Korányi Pulmonológiai Intézet Budapest Előadói megjegyzés Az előadás az előadó független szakmai véleményét tükrözi, ami nem feltétlenül
DIGITÁLIS MIKROSZKÓPIA AZ EMÉSZTŐRENDSZERI SZÖVETI
 DIGITÁLIS MIKROSZKÓPIA AZ EMÉSZTŐRENDSZERI SZÖVETI MINTÁK DIAGNOSZTIKÁJÁBAN Doktori tézisek Ficsór Levente Semmelweis Egyetem, 2. sz. Belgyógyászati Klinika Klinikai Orvostudományok Doktori Iskola Programvezető:
DIGITÁLIS MIKROSZKÓPIA AZ EMÉSZTŐRENDSZERI SZÖVETI MINTÁK DIAGNOSZTIKÁJÁBAN Doktori tézisek Ficsór Levente Semmelweis Egyetem, 2. sz. Belgyógyászati Klinika Klinikai Orvostudományok Doktori Iskola Programvezető:
Szövettan kérdései Ami a terápiát meghatározza és ami segíti Dr. Sápi Zoltán
 Szövettan kérdései Ami a terápiát meghatározza és ami segíti Dr. Sápi Zoltán 1.Számú Patológiai és Kísérleti Rákkutató Intézet Diagnózis (definitív): benignus, malignus, intermedier malignitás, borderline
Szövettan kérdései Ami a terápiát meghatározza és ami segíti Dr. Sápi Zoltán 1.Számú Patológiai és Kísérleti Rákkutató Intézet Diagnózis (definitív): benignus, malignus, intermedier malignitás, borderline
Publication list. List of papers published in extenso. Other publications
 Publication list List of papers published in extenso 1. Horváth K, Gődény M: Képalkotó vizsgálatok a nőgyógyászati daganatok stádium meghatározásában. Magyar Radiológia 2004; 78(6):284-292. 2. Horváth
Publication list List of papers published in extenso 1. Horváth K, Gődény M: Képalkotó vizsgálatok a nőgyógyászati daganatok stádium meghatározásában. Magyar Radiológia 2004; 78(6):284-292. 2. Horváth
Bevezetés. A fejezet felépítése
 II./3.8. fejezet: Szervátültetés kérdése daganatos betegségek esetén Langer Róbert, Végső Gyula, Horkay Ferenc, Fehérvári Imre A fejezet célja, hogy a hallgatók megismerkedjenek a szervátültetés és a daganatos
II./3.8. fejezet: Szervátültetés kérdése daganatos betegségek esetén Langer Róbert, Végső Gyula, Horkay Ferenc, Fehérvári Imre A fejezet célja, hogy a hallgatók megismerkedjenek a szervátültetés és a daganatos
III./9.5. A hüvely daganatai
 III./9.5. A hüvely daganatai Tömösváry Zoltán, Langmár Zoltán, Bánhidy Ferenc A fejezetben a hüvely rosszindulatú daganatait taglaljuk, ismertetjük gyakoriságát, típusait, diagnosztikáját, kezelését és
III./9.5. A hüvely daganatai Tömösváry Zoltán, Langmár Zoltán, Bánhidy Ferenc A fejezetben a hüvely rosszindulatú daganatait taglaljuk, ismertetjük gyakoriságát, típusait, diagnosztikáját, kezelését és
Tumorprogresszió és előrejelzése. Statisztikák. Statisztika - USA Megbetegedés / 10 leggyakoribb (2012)
 Tumorprogresszió és előrejelzése 1. Statisztikák 2. Kezelési protokollok 3. Jövő 4. Teszt írása Megbetegedés / 1 leggyakoribb (212) Statisztikák Forrás: CA Halálozás / 1 leggyakoribb (212) Statisztika
Tumorprogresszió és előrejelzése 1. Statisztikák 2. Kezelési protokollok 3. Jövő 4. Teszt írása Megbetegedés / 1 leggyakoribb (212) Statisztikák Forrás: CA Halálozás / 1 leggyakoribb (212) Statisztika
Emlődaganatok multidiszciplináris kezelése. Polgár Cs. Országos Onkológiai Intézet, Semmelweis Egyetem ÁOK, Onkológiai Tanszék
 Emlődaganatok multidiszciplináris kezelése Polgár Cs. Országos Onkológiai Intézet, Semmelweis Egyetem ÁOK, Onkológiai Tanszék Emlőrák gyakorisága Magyarországon 2014 Női lakosság 1. Emlő 7911 (21%) 2.
Emlődaganatok multidiszciplináris kezelése Polgár Cs. Országos Onkológiai Intézet, Semmelweis Egyetem ÁOK, Onkológiai Tanszék Emlőrák gyakorisága Magyarországon 2014 Női lakosság 1. Emlő 7911 (21%) 2.
Újdonságok a prosztatarák diagnosztikájában és kezelésében
 Újdonságok a prosztatarák diagnosztikájában és kezelésében Riesz Péter dr. Nyírády Péter dr. Semmelweis Egyetem, Általános Orvostudományi Kar, Urológiai Klinika és Uroonkológiai Centrum, Budapest Az elmúlt
Újdonságok a prosztatarák diagnosztikájában és kezelésében Riesz Péter dr. Nyírády Péter dr. Semmelweis Egyetem, Általános Orvostudományi Kar, Urológiai Klinika és Uroonkológiai Centrum, Budapest Az elmúlt
Magyar ILCO Szövetség. 7400 Kaposvár, Szent Imre u. 14. Alapítva 1983.
 Magyar ILCO Szövetség 7400 Kaposvár, Szent Imre u. 14. Alapítva 1983. Komplex kezelés Szűrés A felismert daganatos beteg kivizsgálása Labor Colonoscópia Szövettan RTG UH CT MR Neoadjuvans kezelés Komplex
Magyar ILCO Szövetség 7400 Kaposvár, Szent Imre u. 14. Alapítva 1983. Komplex kezelés Szűrés A felismert daganatos beteg kivizsgálása Labor Colonoscópia Szövettan RTG UH CT MR Neoadjuvans kezelés Komplex
Dr Csőszi Tibor Hetenyi G. Kórház, Onkológiai Központ
 Dr Csőszi Tibor Hetenyi G. Kórház, Onkológiai Központ Azért, mert a kemoterápia bizonyított módon fokozza a gyógyulás esélyét! A kemoterápiának az a célja, hogy az esetleg, vagy biztosan visszamaradt daganatsejtek
Dr Csőszi Tibor Hetenyi G. Kórház, Onkológiai Központ Azért, mert a kemoterápia bizonyított módon fokozza a gyógyulás esélyét! A kemoterápiának az a célja, hogy az esetleg, vagy biztosan visszamaradt daganatsejtek
