MÓDOSÍTOTT FELÜLETŰ KAOLINIT AGYAGÁSVÁNYOK KOMPLEX ANALITIKAI VIZSGÁLATA
|
|
|
- Nóra Fodorné
- 7 évvel ezelőtt
- Látták:
Átírás
1 MÓDOSÍTOTT FELÜLETŰ KAOLINIT AGYAGÁSVÁNYOK KOMPLEX ANALITIKAI VIZSGÁLATA Doktori (PhD) értekezés Készítette: Vágvölgyi Veronika okleveles vegyészmérnök Témavezető: Dr. Horváth Erzsébet egyetemi docens Készült a Pannon Egyetem Vegyészmérnöki Tudományok és Anyagtudományok Doktori Iskolája keretében 2008
2 MÓDOSÍTOTT FELÜLETŰ KAOLINIT AGYAGÁSVÁNYOK KOMPLEX ANALITIKAI VIZSGÁLATA Értekezés doktori (PhD) fokozat elnyerése érdekében Írta: Vágvölgyi Veronika Készült a Pannon Egyetem Vegyészmérnöki Tudományok és Anyagtudományok Doktori Iskolája keretében Témavezető: Dr. Horváth Erzsébet Elfogadásra javaslom (igen / nem) (aláírás) A jelölt a doktori szigorlaton... % -ot ért el, Veszprém, december a Bíráló Bizottság elnöke Az értekezést bírálóként elfogadásra javaslom: Bíráló neve: igen /nem Bíráló neve: igen /nem. (aláírás). (aláírás) A jelölt az értekezés nyilvános vitáján...% - ot ért el Veszprém, a Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése... Az EDT elnöke
3 TARTALOMJEGYZÉK KIVONAT...3 ABSTRACT...4 ABSTRAKT SZAKIRODALMI ÖSSZEFOGLALÓ A kaolinit szerkezetének felépítése, helye az agyagásványok rendszerében Az agyagásványok A kétdimenziós atomköteg Az oktaéderes réteg A rétegkomplexumok egymáshoz való csatlakozása A kaolinit szerkezetében lévő különböző OH-csoportok Szerkezeti deformációk Az agyagásványok szerkezeti polimorfizmusa, politipizmusa A kaolinit kristályszerkezeti rendezettségéből adódó eltérések A kaolinit analitikai vizsgálata Röntgendiffraktometria alkalmazása Termikus analízis alkalmazása Rezgési spektroszkópia alkalmazása Mágneses magrezonancia spektroszkópia alkalmazása Elektronmikroszkópia alkalmazása Morfológiai vizsgálatok (fajlagos felület, pórusméret) Felületi sav-bázis tulajdonságok vizsgálata A tesztmolekulák megválasztásának kritériumai Néhány gyakran alkalmazott tesztmolekula Az interkaláció Az interkaláció kinetikája Az interkaláció jelentősége Az interkaláció, mint vizsgálati módszer Az interkaláció, mint eljárás A mechanokémiai aktiválás A mechanokémiai aktiválás reakciói A mechanokémiai aktiválás során végbemenő változások KÍSÉRLETI RÉSZ...39 CÉLKITŰZÉS Alkalmazott módszerek, anyagok, eljárások és készülékek Hidrazin-hidráttal interkalált szegi kaolinit vizsgálata Kísérleti eredmények és értékelésük Termoanalitikai eredmények Röntgendiffraktometriai eredmények DRIFT spektroszkópiai eredmények Mechanokémiailag aktivált valamint formamiddal interkalált szegi kaolinit vizsgálata Kísérleti eredmények és értékelésük Röntgendiffraktometriai eredmények Termogravimetriai-tömegspektrometriai (TG-MS) vizsgálatok DRIFT spektroszkópiai eredmények Mechanokémiailag aktivált valamint formamiddal interkalált és termikusan deinterkalált szegi és zettlitzi kaolinit minták vizsgálata
4 Kísérleti eredmények és értékelésük Termoanalitikai eredmények Fajlagos felület mérési eredmények (BET, BJH) Ammónia adszorpciós vizsgálatok DRIFT spektroszkópiai eredmények ÖSSZEFOGLALÁS Hidrazin-hidráttal interkalált szegi kaolinit vizsgálata Mechanokémiailag aktivált valamint formamiddal interkalált szegi kaolinit vizsgálata Mechanokémiailag aktivált valamint formamiddal interkalált és termikusan deinterkalált szegi és zettlitzi kaolinit vizsgálata IRODALOMJEGYZÉK...81 A DOKTORI ÉRTEKEZÉS TÉZISEI...91 THESES...94 TUDOMÁNYOS KÖZLEMÉNYEK JEGYZÉKE
5 KIVONAT Széleskörű ipari felhasználása miatt a kaolinit analitikai vizsgálata nagyfokú érdeklődésre tarthat számot. Alkalmazása nagyban függ szerkezeti, illetve felületi tulajdonságaitól és ezen keresztül reaktivitásától. Ezek a tulajdonságok különböző felületmódosító eljárásokkal megváltoztathatók. A kutatás célja módosított felületű kaolinit agyagásvány szintézise valamint a felületmódosító eljárások paramétereinek hatásvizsgálata az ásvány külső és belső felületére illetve reaktivitására. A felület módosítása mechanokémiai aktiválással, interkalációval valamint termikus kezeléssel történt. Mechanokémiai aktiválás, azaz száraz őrlés során nemcsak a szemcsék morfológiája változik meg, hanem a felületen lévő aktív centrumok sav-bázis tulajdonságai is módosulnak. Interkaláció segítségével az ásvány rétegei közé vendégmolekulák építhetők be, melynek során nanoszerkezetű komplex keletkezik. Ezzel az eljárással egyben a rétegek belső felületének reaktivitása is vizsgálható. A keletkező komplex termikus kezelése termoanalitikai berendezésben (termomérlegben) történt, ami lehetővé teszi, hogy a kezelés során lejátszódó folyamatokat in situ kövessük nyomon. A kísérletek kétféle előfordulásból származó kaolinit mintára irányultak. A kétféle ásvány főként hidratáltsági fokában és szerkezeti rendezettségében tért el egymástól. A módosított felület vizsgálata termoanalitikai, tömegspektrometriai, diffúz reflexiós Fourier-transzformációs infravörös spektroszkópiai valamint röntgendiffraktometriai technikákkal valósult meg. A felületanalitikai vizsgálatok morfológiai tanulmánnyal egészültek ki, illetve kísérletek készültek a felület aktív centrumai sav-bázis tulajdonságainak meghatározására. Az alkalmazott analitikai módszerek együttes használatával lehetővé vált a felületmódosító eljárások segítségével kialakított újfajta tulajdonságokkal bíró ásványfelület komplex analitikai vizsgálata. A kutatás eredményei a jövőben hozzájárulhatnak egy tervezhető felületi tulajdonságokkal rendelkező, természetes alapú, környezetbarát ipari adszorbens illetve adalék fejlesztéséhez. 3
6 ABSTRACT Complex analytical investigation of kaolinite clay minerals with modified surface The industrial utilization of kaolinite is closely related to its reactivity and surface properties. The physical and chemical nature of the active clay surface depends strongly on the parameters of surface modification by several methods. The aim of the research is to study the effects of the mechanochemical activation, intercalation and thermal treatment on the surface of kaolinite. The modified surface was investigated by the following instrumental techniques: thermal analysis (thermogravimetry, TGA; derivative thermogravimetry, DTG, controlled-rate thermal analysis, CRTA) coupled with mass spectrometry (TG-MS), X-ray diffraction (XRD) and diffuse reflectance Fourier-transform infrared spectrometry (DRIFT). The investigations was complemented with surface acidity investigations by adsorption of ammonia as the probe molecule. With a systematic study of the effect of the treatment parameters on the surface properties of the clay, natural, environmentally friendly adsorbents with tailored surface properties can potentially be produced. 4
7 ABSTRAKT Komplexe analytische Untersuchung von Mineralien mit modifizierter Oberfläche Die Anwendung von Kaolinit hängt von seinen strukturellen und oberflächigen Eigenschaften und dadurch auch von seiner Reaktivität ab. Ziel der Forschung ist die Synthese des Minerals Kaolinit mit modifizierter Oberfläche und die Wirkungsanalyse der Parameter der Oberfläche-modifizierenden Verfahren vor allem auf die äussere und innere Oberfläche des Kristalls und auf die Reaktivität. Die Oberfläche wurde durch mechanochemisches Aktivieren, Interkalation und termisches Verfahren modifiziert. Durch mechanochemisches Aktivieren, trockenes Mahlen wird nicht nur die Morphologie der Körner, sondern auch die Säure-Base-Eigenschaften der aktiven Oberflächenzentren verändert. Durch Interkalation können zwischen die Mineralschichten Gastmoleküle eingebaut werden und dadurch entsteht ein nanostruktureller Komplex. Durch die verwendeten analytischen Methoden wurde die komplexe analytische Untersuchung der mit Hilfe von Oberfläche-modifizierenden Verfahren ausgestalteten Mineraloberfläche und ihrer neuen Eigenschaften ermöglicht. 5
8 1. SZAKIRODALMI ÖSSZEFOGLALÓ 1.1. A kaolinit szerkezetének felépítése, helye az agyagásványok rendszerében Az agyagásványok A kaolinit a szilikát ásványok csoportjába tartozó agyagásvány, azon belül pedig a réteges (kétdimenziós) szerkezetű szilikát ásványok közé sorolható [1]. Az agyagásványok kémiailag olyan hidroszilikátok, melyek felépítésében Si 4+, Al 3+, Cr 3+, Fe 3+, Fe 2+, Mg 2+, Li +, Ti 4+, Ni 2+, Cu 2+, Na +, Ca 2+, K + kationok és O 2-, F -, OH - anionok vesznek részt. A kationok és anionok fontosabb adatai az 1.1. táblázatban olvashatók. A felsorolt kationok és anionok közül a kaolinitban Si 4+, Al 3+ kation és O 2- illetve OH - anion fordul elő. A kationok az ionsugár aránytól függő koordinációs képességük szerint négyes, hatos, nyolcas, tízes koordinációban foglalnak helyet. A hatos vagy kisebb koordinációjú kationok (ilyen a Si 4+ és az Al 3+ kation is) leggyakrabban négyes (tetraéderes) vagy hatos (oktaéderes) koordinációt alakítanak ki attól függően, hogy a kation/anion ionsugár arány 0,35-nél kisebb vagy nagyobb táblázat: Az agyagásványokban szereplő kationok és anionok fontosabb adatai [2] A IV aktív négyes koordinációs számú kationok A VI aktív hatos koordinációs számú kationok I inaktív hatnál nagyobb koordinációs számú kationok [3, 4] Kationok Anionok Iontípus Ionok Koordinációs szám Ionsugár (Å) Ion térfogat (Å 3 ) Sugár arány oxigénnel Ionizációs potenciál (V) A IV Si ,40 0,27 0,29 44,95 Al ,49 0,49 0,35 29,31 A VI Al ,51 0,56 0,36 28,31 Cr ,63 1,05 0,45 32,10 Fe ,64 1,10 0,46 Mg ,66 1,20 0,47 14,97 Li + 6 0,68 1,32 0,49 5,29 Ti ,68 1,32 0,49 44,66 Ni ,69 1,35 0,49 18,13 Cu ,72 1,56 0,51 3,35 Fe ,74 1,70 0,53 16,24 Na + 6 0,97 3,82 0,69 5,138 Ca ,99 4,09 0,71 11,82 I Na + 8 1,01 4,32 0,72 5,138 Ca ,03 4,58 0,74 11,82 K ,42 12,0 1,01 4,339 K ,45 12,8 1,04 4,339 O 2-1,40 11,49 137,48 F - 1,36 10,50 184,00 OH - 6
9 A szilikátok szerkezeti felépítése során a következőket kell figyelembe venni: 1. A Si-atomok a tetraéderes sp 3 hibridszinteken lévő elektronok útján kovalens kötésben négy oxigénnel vannak körülvéve (majdnem tetraéderesen). 2. A keletkező (SiO 4 ) 4- -csoportot szilikátionnak is nevezhetjük, amely önállóan illetve egymáshoz kapcsolódva csoportokban fordulhat elő. A kapcsolódás mindig csúcsokon keresztül történik, mivel így lesz a Si-Si távolság a legnagyobb. Él menti csatlakozás csak kivételes esetben fordulhat elő, mivel így nagyobb lenne a kation-kation taszítás (1.1. ábra). 3. Az alumínium a Si-atomot helyettesítheti a szilikátokban, de a helyettesítés ritkán haladja meg az 50%-ot. Ezen kívül elvétve előfordulhat még Fe atom helyettesítés is a Si-atom helyén ábra. A (SiO 4 ) 4- -csoport csúcsmenti és élmenti kapcsolódása A szilikátok nagyobb részében határozatlan számú (SiO 4 ) 4- tetraéder kapcsolódik össze atomköteggé a következőképpen: egydimenziós atomköteg, (SiO 3 ) 2-6- n vagy (Si 4 O 11 ) n 2- kétdimenziós atomköteg, (Si 2 O 5 ) n háromdimenziós atomköteg, (SiO 2 ) n A kétdimenziós atomköteg A kaolinit esetén kétdimenziós atomkötegekről beszélhetünk. Ez a kétdimenziós atomköteg olyan tetraéderes elrendeződést mutat, amelyben egyik lapjukkal a síkon álló tetraéderek e síkban lévő három bázisoxigén-atomjuk (O B ) által szomszédos tetraéderekkel kapcsolódnak össze, míg a negyedik, a csúcson lévő oxigén atom (O A ) szabadon marad (1.2. ábra). A réteg kémiai összetétele így: [(Si 2 O 5 ) 2- ] n. A tetraéderek csatlakozása olyan, hogy a súlypontokban lévő Si-atomok és az oxigénatomok egyúttal szabályos hatszög csúcspontjain helyezkednek el. Ez a kapcsolódási mód a tetraéderek szabályos hatszöges elrendeződése. A valóságban persze a tetraéderek ideális elrendeződésétől a konkrét ásványok szerkezetében különféle eltéréseket észlelhetünk. 7
10 1.2. ábra. A tetraéderek szabályos hatszöges elrendeződése A (Si 2 O 5 ) 2- n -rétegben negatív töltésfelesleg van, mert a tetraéder csúcs-oxigénatomja csupán egy vegyértékkel kapcsolódik a Si-atomhoz. E töltésfelesleg kiegyenlítésére a tetraéderes Si-O réteghez további kétdimenziós atomkötegek csatlakoznak. Legegyszerűbb esetben a vegyértékfelesleg kiegyenlítésére elég csupán egy oktaéderes réteg csatlakozása. Ezáltal az agyagásványok, és így a kaolinit szerkezeti felépítésének tárgyalása során az oktaéderes atomköteg a következő fontos szerkezeti építő egység Az oktaéderes réteg Az oktaéder központjában alapesetben Mg 2+ vagy Al 3+ foglal helyet, míg a csúcspontokon (OH) - illetve O 2- ionok helyezkednek el. Az alapesettől eltérően előfordulhat Fe 3+ helyettesítés is az oktaéder központjában. Ha az oktaéderpozíciókban két vegyértékű ionok (pl. Mg 2+ ) foglalnak helyet, akkor az oktaéderréteg elvben megegyezik a brucit ásvány egy rétegével. Ezért ekkor brucit-szerű rétegről, vagy trioktaéderes rétegről beszélünk, mivel ilyenkor fél elemi cellánként mindhárom kationhelyzet be van töltve. Ha viszont Al 3+ ion foglal helyet az oktaéder központjában, akkor az így kialakuló réteg a gibbsit ásvány szerkezetében lévő rétegnek felel meg, amit így gibbsit-szerű rétegnek vagy dioktaéderes rétegnek nevezünk. Ez esetben fél elemi cellában két oktaéderes kationpozíció van betöltve. A dioktaéderes réteg részlete az 1.3. ábrán látható [5]. A fentiekben leírt tetraéderes és oktaéderes rétegek az agyagásványokban különféle rétegkomplexumokká kapcsolódnak össze, amelyek az ide tartozó ásványok, így a kaolinit ásványcsoport jellegzetes szerkezeti egységei. 8
11 1.3. ábra. Az oktaéderek ideális elrendeződése [5] A rétegkomplexumok egymáshoz való csatlakozása A rétegkomplexumok különbözőképpen kapcsolódva egymáshoz, különböző ásványtípusokat alakítanak ki, melyeket az 1.2. táblázatban foglaltam össze [6]. A rétegkomplexumok a következő szerkezeteket alakíthatják ki: Legegyszerűbb esetben egy tetraéderes réteg (T) egy oktaéderes réteggel (O) kapcsolódik, vagyis két rétegből álló rétegkomplexum (TO), vagy összetett kettős réteg keletkezik. Ezek az (1:1) típusú agyagásványok. Fontos körülmény, hogy ezekben a kettős réteg fő vegyértékei kiegyenlítettek, tehát a rétegkomplexum elvileg semleges. A rétegkomplexumokat H-híd kötések csatolják egymáshoz. A (TO) rétegkomplexumok kb. 0,71 nm-enként ismétlődnek a c-tengely irányában, s ezért a 0,71 nm körüli (001) reflexió jellemző rájuk, amely felismerésüket is lehetővé teszi. Attól függően, hogy di- vagy trioktaéderes réteget tartalmaznak, két fő csoportra oszlanak: kaolinokra és szerpentinekre. A rétegek kapcsolódásának egy másik típusába két, egymással szembeforduló tetraéderes réteg fog közre egy oktaéderes réteget, s így három rétegből álló rétegkomplexum (TOT), vagy összetett hármas réteg keletkezik. Ezek az ásványok a (2:1) típusú ásványok. Ezekben - ellentétben az (1:1) típusúakkal a pozitív és negatív töltések nincsenek okvetlenül kiegyenlítve, s ebből a szempontból három fontos csoportot különböztetünk meg: 9
12 - A (2:1) rétegkomplexumok semlegesek (TOT), s így van der Waals erők tartják össze őket. Ide tartozik pl. a pirofillit és a talk. A rétegkomplexumok 0,95 nm távolságra követik egymást. - Változó nagyságú negatív töltésfelesleg van a (2:1) rétegkomplexumban, s ezeket víz (A i ) és cserélhető kationok (C) kapcsolják össze egymással (TOTA i C). Ilyen ásványok a szmektitek, vermikulitok. Mivel ezek rétegközi terében változó mennyiségű víz adszorbeálódik, a (00l) reflexióhoz tartozó d-érték is változó, ezért a szmektit ásványok feltűnő sajátsága a rétegközi duzzadás (expandáló ásványok). - Elemi cellánként határozott nagyságú negatív töltésfelesleg van a (2:1) rétegkomplexumban, ezért a rétegközi térben határozott helyzetben inaktív kation (I) foglal helyet a rétegkomplexumok között (TOTI). Ide tartoznak a csillámszerkezetből levezethető agyagásványok. A rétegkomplexumok ismétlődési távolsága ebben az esetben kb. 1 nm. Önálló csatlakozási típusnak tekintjük azt az esetet, amikor a kiegyenlítetlen (2:1) rétegkomplexumok között inaktív kation helyett egy második oktaéderréteg fordul elő (TOTO). Ezek voltaképpen a [2:(1+1)] vagy (2:2) típusú ásványok, amelyek a kloritcsoport tagjait tartalmazzák. A négyes réteg periódusa és jellegzetes d(001) értéke kb. 1,4 nm táblázat: A filloszilikátok csoportosítása a rétegkomlexumok kapcsolódása alapján [6] Típus Csoport Alcsoport Példa 1:1 dioktaéderes kaolinitek kaolinit, halloysit trioktaéderes szerpentinek antigorit, lizardit dioktaéderes pirofillit trioktaéderes talk dioktaéderes montmorillonoit szmektitek trioktaéderes szaponit dioktaéderes trioktaéderes vermikulitok 2:1 dioktaéderes muszkovit, paragonit valódi csillámok trioktaéderes flogopit, annit dioktaéderes margarit merev csillámok trioktaéderes clintonit dioktaéderes donbassit di-, trioktaéderes kloritok sudoit trioktaéderes chamosit, klinoklor 10
13 Mindezek alapján elmondhatjuk, hogy a kaolinit ásványcsoport dioktaéderes kétdimenziós atomköteget tartalmazó, (1:1) típusú rétegkomplexumokkal rendelkező szilikát. A kaolinit ásványcsoport tagjait, így a kaolinitet is tehát tetraéderes és oktaéderes kettősrétegek alkotják. A kettősrétegek, vagy rétegkomplexumok ideális esetben úgy helyezkednek el egymás felett, hogy a kitöltetlen hatos gyűrűk illeszkednek egymáshoz. Ez a szerkezet persze a későbbiekben ismertetett erőhatások miatt bizonyos mértékben deformálódhat. A két réteg egyfajta kapcsolódási módját az 1.4. ábra szemlélteti. A réteg poláros, mert egyik oldalát oxigén-ionok, a másik oldalát pedig OH-ionok határolják, és minden ásványban a c-tengely irányában ezen rétegek azonos orientációban helyezkednek el. Így a réteg és egyúttal az ásvány kristálykémiai képlete: Si 2 O 5 (OH) 4 Al 2, amiből kitűnik, hogy a szerkezetben nincsenek vízmolekulák, csak OH-csoportok ábra. A kettős rétegkomplexumok kapcsolódása A kaolinit szerkezetében lévő különböző OH-csoportok [7] A kettősrétegek egymáshoz a bennük lévő OH-csoportok által kialakított H-híd kötéssel kapcsolódnak. A kaolinitben háromféle OH-csoportot különböztetünk meg (1.5. ábra): 1) külső OH-csoportnak nevezik a mikrokristályok felületén található hidroxilcsoportokat, amelyek egyrészt a töret mentén, másrészt az oktaéderes (legkülső) réteg felületén helyezkednek el. 2) A belső felületi OH-csoportok a rétegkomplexum oktaéderes részének felületén találhatók. Mivel a kaolinit sok ilyen rétegből áll, ezért nevezte el a szakirodalom belső felületi OH-csoportnak. 11
14 3) A belső OH-csoportok: az oktaéderes és tetraéderes rétegek közös síkjában helyezkednek el, és dipólusuk egy üres oktaéderes pozíció felé mutat. Vagyis a belső OH-csoportok H-atomjai az Al-atomok alatti oxigénhez kapcsolódnak, és a kaolinit rétegek közötti tér irányába mutatnak. Ezek az OH-csoportok tulajdonképpen a (001)- es síkkal párhuzamosan állnak és a kaolinit szerkezetben a dioktaéderes rétegben lévő üreg felé mutatnak. A belső OH-csoportok elhelyezkedéséről még nem alakult ki általánosan elfogadott nézet. Valószínűleg ezen csoportok irányultsága függ attól, hogy az Al-O-H-kötés hajlított vagy lineáris [8] ábra. A kaolinit elemi cellájában lévő atomok és OH-csoportok Szerkezeti deformációk Mivel az oktaéderes és tetraéderes rétegek paraméterei nem egyeznek meg pontosan egymással, ezért e rétegek kapcsolódása során deformáció áll elő. Az agyagásványok nem tekinthetők minden további nélkül tömör anion illeszkedésű szerkezeteknek, melyeknek hézagaiban megfelelő nagyságú kationok passzív értelemben vett neutralitásra törekedve foglalnak helyet. Ehelyett a valóságos helyzetnek jobban megfelel, ha az ásványt a kötőerők legkisebb belső energia elérésére irányuló dinamikus egyensúlyának fogjuk fel. E kötőerők vegyesek és különböző kényszerhatás alatt állnak, mégis a véglegesség igénye nélkül legcélszerűbben komplex ionosnak foghatók fel. Ennek megfelelően az agyagásványok szerkezetét a következő szabályszerűségek jellemzik: A kötőerők nagyobb része a Si-O és O-H kötéstől eltekintve nem irányított. A kötéstávolságok általában fordítva arányosak az elektrosztatikus kötéserősséggel [9-11]. Bár ezt a szabályszerűséget általában érvényesülni látjuk a kristályszerkezetben, de mégsem kivétel nélkül. Különleges sztérikus hatások 12
15 ugyanis rövid kötéstávolságokra vezethetnek olyan esetekben is, amikor a kötéserősség elenyészően csekély. A kötésszögek állandóbbak, mint a kötéstávolságok, s ezen belül az O-T-O szög állandóbb, mint a T-O-T szög. (A T-O-T szög magyarázata az 1.6. ábrán látható). Az anionok kölcsönös taszító hatása gyorsan növekszik a közöttük lévő távolság csökkenésével. Még jelentősebb a kationok kölcsönös taszító hatása, különösen több értékű ionok esetén, amelyeknek nagyságrendje elérheti a legerősebb kötőerőét is. Ezért a csúcsokon érintkező oktaéderek háromértékű kationjainak taszító hatása a rétegszilikátokban fellépő erők egyik legfontosabbika. A szilikátrétegben a kötésfelesleg helye és a rétegközi kation nem lehet túlságosan távol egymástól, mert nagy szabad energia alakulna ki. A felsorolt szabályszerűségek arra vezetnek, hogy a tetraéderes rétegben a nem pertubált tetraéderek T-O kötéstávolsága megfelel a T ionsugara alapján várható értéknek, ami azonban csökkenhet, ha valamely O-ionnak nem minden vegyértékét köti le csatlakozó kation. A SiO 4 -tetraéder O-T-O szöge a Si-O kötés részben kovalens jellege ellenére is gyakran eltér az ideális től ( ), vagyis a SiO 4 -tetraéder többnyire deformált. A T-O-T szög még nagyobb ingadozásnak van kitéve, mert a tetraéderek csúcsokon történő érintkezése és a kis Si/O sugárarány együttes hatása a Si atomokat jól árnyékolja egymástól. A tetraéderek ideális és deformált kapcsolódását az 1.6. ábra szemlélteti. ω ω ω a) b) c) 1.6. ábra. a) Tetraéderek trigonális szimmetria szerinti kapcsolódása, ω = 120 esetén b) Tetraéderek hexagonális szimmetria szerinti kapcsolódása, ω = 180 esetén c) Tetraéderek ditrigonális szimmetria szerinti kapcsolódása, 180 > ω > 120 ω: T-O-T szög 13
16 Az oktaéder paramétereit három különféle erő egyensúlya határozza meg: a kationanion vonzás, a kation-kation taszítás és az anion-anion taszítás, melyek együtt rendszerint az oktaéder deformációjához vezetnek. Ebben a fő szerepet a kation-kation taszító hatása játssza, mert az élek menti érintkezés miatt ezek nincsenek eléggé árnyékolva, továbbá az oktaéderes kationok változó nagysága, töltése és a kation-anion kötés nem irányított jellege is nagymértékben hozzájárul az oktaéder esetről esetre változó deformációjához. Az oktaéderek alsó és felső oxigéntriádja például az élek mentén szomszédos két oxigén távolságának csökkenésével, egymással ellentétes irányban elfordul. Ezen viszonyokat értelmező úgynevezett kation-betöltetlenségi szabálynak [12] legfontosabb következménye az, hogy a) dioktaéderes szerkezetben erős tendencia alakul ki az üres kation-pozíció körüli szabályos hexagonális elrendeződésre, b) az oktaéderes réteg paramétereit a kation-anion kötéserősség és a lehetséges O-O távolság szabja meg, c) centrumában különféle kationokat tartalmazó, egymással élek mentén kapcsolódó oktaéderek nagyjából hasonló minimális éltávolságot megközelítve rövidülnek meg Az agyagásványok szerkezeti polimorfizmusa, politipizmusa Az agyagásványok körében gyakran lépnek fel a kétdimenziós kristályokra jellemző szerkezeti variációk. Ezek amiatt alakulhatnak ki, mivel a szerkezeti rétegek, különösen a semleges rétegkomplexumok, amelyek igen gyenge erőkkel kapcsolódnak egymáshoz, elég magas saját szimmetriájuk következtében a szomszédos rétegekhez változó nagyságú transzlációs vagy rotációs elmozdulások közbejöttével kapcsolódhatnak. Ezáltal egy meghatározott összetételű agyagásvány polimorf módosulatai jönnek létre; mivel azonban a szerkezet alapegységei változatlanok a tetszőleges eltérést magában foglaló polimorfizmus helyett ilyen esetben célszerűbb a politipizmus fogalom használata [13]. A rétegkomplexumok transzlációja vagy rotációja természetesen módosítja a teljes szerkezet szimmetriáját is. Ez az agyagásványok körében gyakran észlelhető jelenség homopolitipizmusnak fogható fel, mert az elmozdulásban részt vevő rétegek összetétel és szerkezet tekintetében azonosak. Mivel a politipizmus befolyással van az agyagásvány jelzésére, elnevezésére, illetve azok tulajdonságaira, viselkedésükre, ezért szükség van a politípusok pontos jellemzésére, amelyhez homopolitipizmus esetén három adat szükséges: 14
17 1. az ismétlődő identikus távolságban lévő szerkezeti egységek, rétegkomplexumok száma, 2. a teljes szerkezet szimmetriája, 3. a szerkezet szabálytalanságának mértéke. A kaolinit ásványcsoport homopolitípusait az 1.3. táblázatában foglaltam össze. A homopolitípusok rétegismétlődését pedig az 1.7. ábra szemlélteti táblázat: A kaolinit ásványcsoport homopolitipizmusa Ásvány Homopolitípusai A homopolitípusok neve Kaolinit kaolinit-t kaolinit-2m kaolinit-2m (6R 0 ) kaolinit dickit nakrit 1.7. ábra. A kaolinit ásványcsoport politipizmusa 15
18 1.1.6 A kaolinit kristályszerkezeti rendezettségéből adódó eltérések A kaolinit d (fire-clay) szerkezete A kaolinithoz kémiai összetétel tekintetében igen hasonló ásványok gyakran olyan röntgendiffraktogrammot adnak, amelyen a kaolinit sok vonala gyengül vagy eltűnik, mások diffúzzá válnak. E diffrakciós jelenségek a kristályszerkezet szabályosságának változó mértékű csökkenésére, rendezetlenségére vezethetők vissza. Ilyen fajta eltérést az úgynevezett fire-clay ásványnak is nevezett kaolinit d produkál, ahol az indexben lévő kis d az angol disordered (rendezetlen) szóból ered. Az (1:1) típusú ásványok rendezetlensége tulajdonképpen két különféle tényezőből fakad: az egyes rétegek belső rendezetlenségéből és a rétegek halmozódásának szabálytalanságából. A rendezettség illetve rendezetlenség mértéke mesterséges úton megváltoztatható, pl. jókristályos kaolinitből hosszabb ideig tartó nedves őrlés vagy nagy nyomás vagy γ- besugárzás vagy interkaláció és deinterkaláció után kaolinit d -t kapunk. Másrészt azt is tapasztalhatjuk, hogy a rendezetlenség hő hatására csökken, pl. a szegi kaolinit d meglehetősen diffúz (001) vonala 150 C-ig történő hevítés vagy hidrotermális kezelés hatására fokozatosan élesebbé válik. A halloysit, metahalloysit és dehidrált halloysit A halloysit Al 2 O 3 :SiO 2 =1:2 arány tekintetében a kaolinittal megegyező ásvány, kémiailag attól csupán a hidratáltsági fokában különbözik. Víztartalmának egy részét természetes körülmények között is gyakran elveszíti, így metastabilis metahalloysittá alakul. Végül 200 C-ra való hevítés során minden molekuláris víz eltávozik, és formálisan a kaolinittal megegyező összetételű dehidrált halloysit keletkezik. Röntgenfelvételen az 1,01 nm-es reflexió a hidráthalloysit (001) indexű vonala, amely 110 C-os hevítés hatására eltűnik, és átadja a helyét a dehidrált halloysit 0,72 nm-es reflexiójának, amely megegyezik a kaolinit (001) síkhálótávolságával. A hidrát és dehidrált forma közti bázistávolság-különbség: 1,01-0,72 = 0,29 nm, ami ez egy vízmolekularétgenek megfelelő távolság. Hendricks szerint ez a vízmennyiség egy vízmolekula-réteg alakjában két kaolinitréteg között helyezkedik el [14]. Elektronmikroszkópi morfológiai tanulmányozások során megfigyelhető, hogy a halloysitok - az egyéb kaolinit ásványok táblás alakjával ellentétben belül üres, felcsavarodott csöveket alkotnak. Ennek magyarázatát abban a méretkülönbségben kereshetjük, amely a Si 2 O 5 és gibbsitréteg b- paraméterei között fennáll. A kaolinréteg O és OH oldala közötti hosszúságkülönbség a SiO 4 -tetraéderek alkalmas elfordulásával kiegyenlíthető, amikor is az ilyen geometriai 16
19 szerkezet fenntartásában a szomszédos rétegek (O-OH-kötés) is részt vesznek. Ha azonban mint a halloysit szerkezetében az a- és b-tengelyek szerint rendezetlenség miatt a rétegek közötti együttműködés csökken, érvényre jut az a kompressziós hatás, amelyet a gibbsit-szerű réteg a szilikátrétegre gyakorol. Minthogy a halloysitban a szomszédos rétegek 0,574 nm-re vannak egymástól, és a vízmolekula-réteg is leárnyékolja a szemben lévő rétegkomplexum oxigénhálózatának az OH-hálózatra gyakorolt szétfeszítő hatását, a gibbsit-szerű rétegben a hidroxil-csoportok a normál távolságot igyekeznek felvenni, amely ha a függőleges kötéstávolságot változatlannak képzeljük csakis a réteg meggörbülése útján lehetséges. Az 1.8. ábrán a fent leírt kaolinit- illetve halloysitréteg szerkezet vázlata, valamint a kaolinit táblás és a halloysit felcsavarodott morfológiájáról készült elektronmikroszkópos felvételek láthatók. 0,893 nm 6 O 4 Si 0,893 nm 0,451 nm 4 O + 2 (OH) 4 Al 0,451 nm 0,287; 0,299 nm (0,862 nm ) 0,893 nm 6 O 6 (O H) 0,862 nm 4 H 2 O 0,574 nm a) 6 O b) 0,893 nm OH 0,862 nm H 2 O 6O 4Si 4O+2(OH) 4Al 6(OH) 0,574 nm 0,451 nm 12,54 nm d) c) a tengely 1.8. ábra. A kaolinit és a halloysit rétegszerkezeti és morfológiai összehasonlítása a) kaolinit, b) halloysit-réteg, c) felcsavarodott, belül üres halloysithenger szelete, d) elektronmikroszkópos felvétel halloysitről, e) elektronmikroszkópos felvétel a kaolinit táblás morfológiájáról e) 17
20 1.2. A kaolinit analitikai vizsgálata Az agyagásványok analitikai vizsgálata során attól függően, hogy milyen információra van szükségünk többféle módszert alkalmazhatunk: Röntgendiffraktometria Termikus analízis Rezgési spektroszkópia (IR, Raman) Szilárd fázisú mágneses magrezonancia spektroszkópia (NMR) Elektronmikroszkópia (SEM, TEM) BET-felület, pórusméret vizsgálat Sav-bázis tulajdonságvizsgálatok (tesztmolekulák adszorpció) Röntgendiffraktometria alkalmazása A röntgendiffraktometria szabályos, kristályos anyagok és így az agyagásványok vizsgálatára is alkalmazható. A kaolinit vizsgálata szempontjából a diffraktogramból többféle információhoz juthatunk: ásványazonosítás reflexiók intenzitásának és pozíciójának megállapításával, szerkezeti rendezettség meghatározása bizonyos reflexiók arányainak vizsgálatával, a kettősrétegek közötti bázislaptávolság meghatározása a (001)-es reflexió helyének és intenzitásának vizsgálatával (interkaláció hatásfokának nyomon követése). Szerkezeti rendezettség meghatározása röntgendiffraktogramból A rendezettség diffraktogramból történő meghatározására többféle módszer terjedt el [15]: 1) Hinckley index (HI) [16]. Az egyik legszélesebb körben alkalmazott mutató, amely az 1ī0 és 11ī reflexiók az alapvonaltól mért magasságainak valamint a Θ közötti tartományra illesztett alapvonaltól mért 1ī0 reflexió magasságának aránya. Értéke 1,5 körül rendezett, míg a 0,5 alatti HI rendezetlen kaolinit struktúrára utal. 2) QF [17]: Szintén nagyon széles körben alkalmazott kristályossági mutató, amely az 11ī és 02ī reflexiók területének aránya egy olyan négyszög területéhez képest, aminek élei az 11ī reflexió magassága valamint a 11ī és 02ī reflexiók közötti távolság. Értéke 0,26 (rendezett) és 0,60 (rendezetlen) között változik. 3) IK [18]: Ugyanabban a zónában mérik, mint a HI-t és a QF-et. Kiszámítani a 020 és a 1ī0 csúcsok alapvonaltól mért magasságainak arányából lehet. Értéke 0,7 alatt rendezett, míg 1,0 fölött rendezetlen szerkezetre utal. 18
21 4) R2 [19]: ez a módszer csak véletlenszerű hibastruktúra kimutatására érzékeny. Értéke az és az 131 csúcsok intenzitásából és a két csúcs közötti völgy magasságából számolandó, amely 0,7 alatt rendezetlen szerkezetre utal, míg 1,2 körül már rendezett szerkezetről beszélhetünk. 5) H&B [20]: ez a típusú index talajban lévő kaolinok kristályossági fokának megállapítására alkalmas igazán. Számítása a 020 csúcs magasságának valamint az és 003 reflexiókhoz húzott alapvonal magasságának arányán alapul. 6) FWHM [21]: ez a mutató a 001 és 002 reflexiók félértékszélességéből következtet a rendezettségre. Értéke 0,4 fölött rendezetlen, míg 0,3 alatt rendezett szerkezetre utal. 7) A szakirodalomban a fenti módszerek kombinálására is van példa [22] Termikus analízis alkalmazása Termikus analízis során a hő hatására lejátszódó átalakulási folyamatok vizsgálhatók. Ásványok vizsgálatánál a termikus analitikai módszerek közül a termogravimetriát és a differenciáltermoanalízist alkalmazzák elterjedten. a) A termogravimetria (TGA) a minta tömegének változását regisztrálja a hőmérséklet függvényében. b) A differenciáltermoanalízissel (DTA) a mintában hő hatására bekövetkező, mérhető entalpiaváltozással járó folyamatok tanulmányozhatók. A minta és az inert anyag hőmérsékletének különbségét a minta vagy az inert anyag, vagy a kemencetér hőmérsékletének függvényében regisztráljuk. c) A szimultán termikus analízis során egyidejűleg regisztrálható a minta tömegének változása (TG), a tömegváltozás sebessége (DTG), az entalpiaváltozással arányos (DTA) görbe és a minta hőmérséklete (T). d) A termikus analízissel kinyerhető információ kiegészíthető csatolt technikákkal, pl. tömegspektrométerrel (TG-MS) vagy IR spektrométerrel (TG-FTIR) kombinált termomérleg alkalmazásával. Kontrollált sebességű termoanalitika A hőbomlási folyamatok sebességét a hő- és anyagtranszport folyamatok lassúsága alapvetően befolyásolja. Ennek következtében a gyakorlatban alkalmazott fűtési sebesség (5-10 C/perc) mellett a bomlásfolyamatok jelentős mértékben átlapolhatnak, és az egyes bomlásreakciók hőmérsékleti tartománya is jelentősen függ a kísérleti körülményektől (minta mennyisége, tömörítettsége, mintatartó geometriája, kemence szellőzésének 19
22 mértéke, stb.). A Paulik-testvérek által kidolgozott ún. Q-TG technika lehetőséget biztosít arra, hogy lassú, állandó bomlási sebesség alkalmazásával a bomlásfolyamatok reprodukálható módon kváziegyensúlyi körülmények között játszódjanak le [23] Rezgési spektroszkópia alkalmazása A rétegszilikátok infravörös rezgési spektruma a hidroxil-csoportok (O-H), a szilikát anion (Si-O), az oktaéderes kation (Al-O) és a rétegközi kationok rezgési sávjaiból tevődnek össze [24]. Ezek közül a kaolinit esetében az első hárommal kell számolni. A rétegszilikátokra jellemző rezgési tartományokat a 1.4. táblázatban foglaltam össze táblázat: A rétegszilikátok jellemző IR rezgési sávjainak spektrális pozíciója Spektrális tartomány (cm -1 ) Rezgés forrása OH vegyértékrezgés OH libráció Si-O vegyértékrezgés (gyengén átfed más szerkezeti rezgésekkel) Si-O deformációs rezgés (erősen átfed a rácsrezgésekkel) Az OH-vegyértékrezgési tartomány kitüntetett figyelmet kap a kutatások során, mivel a belső felületi változások megfigyelésének egyik legjobb módja az ebben a tartományban történő változások nyomon követése. Ledoux és White [25] hidrazinnal történő interkalációt vizsgálva kimutatta, hogy a 3697, 3669 és 3652 cm -1 -nél jelentkező sávok OH rezgések. A 3620 cm -1 -es sáv pedig a belső OH-csoport rezgéseként azonosítható [26]. Az újabb szakirodalom 3685 cm -1 -nél egy ötödik OH vegyértékrezgést is említ a Raman spektrumban, mely nagyobb rendezettséggel bíró kaolinitek esetén az IR spektrumban is megjelenik [27]. Az OH-csoportok térbeli orientációjának magyarázatában kezdetben nem volt egyetértés. Ellentmondás alakult ki a röntgendiffrakcióval és az infravörös spektroszkópiai technikával kapott eredmények között. Jacobs szerint [28] a belső OH csoport orientációja, valamint a 3669 és 3652 cm -1 -es rezgésekhez rendelhető csoportok közel párhuzamosak a rétegekkel, míg a 3697 cm -1 -es sávhoz rendelhető OH-csoport inkább merőlegesen áll. A röntgendiffrakciós vizsgálatok alapján mindhárom OH csoport merőlegesen állna, mert így válik lehetővé, hogy az OH-csoportok protonjai kölcsönhatásba tudjanak lépni a szomszédos réteg oxigénjével. Ledoux és White [25]valamint Wada [29] szerint, azonban a három nagyobb frekvenciájú rezgés különböző OH csoportokhoz tartozik. Az ellentmondás feloldására a következő magyarázat született [30, 31]: az elemi cellában a c tengellyel ot bezáró három OH-csoport van feltételezett háromszoros 20
23 szimmetriával. Azonban háromszoros szimmetria mellett csak két sáv jelenne meg: egy intenzívebb, a rétegekre merőleges rezgés (a három OH-csoport fázisban mozgó vegyértékrezgése 3697 cm -1 -nél), valamint egy gyengébb, a rétegekkel párhuzamos rezgés (a három OH-csoport nem fázisban mozgó degenerált rezgése). Mivel a háromszoros szimmetria nem teljesen pontos, ezért az utóbbi felhasad két sávra: 3652 és 3669 cm -1 -re. Hidratált halloysit esetén a cm -1 -es tartományban az adszorbeált víz széles sávja is jelentkezik és a 3696 cm -1 -es sáv gyengülése figyelhető meg, ami más interkalált komplexnél is észlelhető [32-35]. Ezek mellett a halloysit spektrumában 3570 cm -1 -nél lehet azonosítani H-híd kötésben lévő OH-csoport rezgést [36]. Az OH-csoportok rezgései az alacsonyabb hullámszámoknál is megfigyelhetők: a belső felületi OH-csoport deformációs rezgése 936 cm -1 -nél, míg a belső OH-csoportra jellemző rezgés 915 cm -1 -nél jelentkezik [29]. A szilikát anion rezgései az alacsonyabb hullámszám tartományban azonosíthatók (1.9. ábra) néhány OH-csoport rezgéssel és oktaéderes kation rezgési sávjaival átfedve: 1100 cm -1 körül: merőleges Si-O rezgés [29] 970 és 1070 cm -1 között két intenzív sáv: Si-O-Si síkbeli vegyértékrezgése cm -1 : Si-O deformációs rezgés (erősen átfed az oktaéderes kation rezgésével) cm -1 : librációs rezgések (OH-csoportét is beleértve) Az oktaéderes kation rezgései a 600 cm -1 hullámszám alatti tartományban jelentkeznek ábra. A szilikát anion rezgései az alacsonyabb hullámszám tartományban [29] 21
24 Az IR spektrumok felvételének technikája Szilárd anyagok infravörös spektroszkópiai analízisének jól bevált módszere az ún. pasztilla technika, amikor achát mozsárban 1-2mg mintát kb. 100mg szilárd KBr-dal elkeverünk, majd ezt a homogén keveréket speciális présben nyomás alá helyezünk. A nyomás alatt a KBr megolvad, majd a nyomás megszűnése után átlátszó anyaggá szilárdul. Az így kapott pasztillát, melyben a mintaszemcsék egyenletesen helyezkednek el, a fényútba helyezve a spektrum regisztrálható. Olyan anyagok esetén, melyek a pasztillázás során deformálódhatnak, esetünkben pl. a KBr a nyomás hatására bejuthat a kaolinit rétegek közé, a pasztillamódszer nem alkalmazható. Ezért a mintát csak elkeverjük a KBr-dal, de nem préseljük össze. Így azonban nem kapunk infravörös sugárzás számára átjárható mintát. Ekkor alkalmazzuk az ún. reflexiós technikát, melynek során a beeső sugárzás a minta és a KBr szemcséin diffúz módon reflektálódik, és a reflektált sugárzás mintegy 50%-a egy homorú gömbtükörrel összegyűjtve a detektorba jut. Az így előállított spektrum nagyon hasonló az abszorpciós spektrumhoz, és annak megfelelően értelmezhető és értékelhető ki. Ehhez a méréshez egy speciálisan kialakított mintatartó és tükörrendszer szükséges, ami az ábrán látható. A fény útját az 1, 2, 3, 4, 5 és 6 jelű tükrök és az S-sel jelölt minta segítségével követhetjük nyomon ábra. A DRIFT adapter felépítése és a fény útja Mágneses magrezonancia spektroszkópia alkalmazása A szerkezet ún. rövid távú rendezettségének meghatározására a szilárd fázisú MAS/NMR spektroszkópia alkalmas. Segítségével megállapítható: a tetraéderes oxigénekkel közvetlenül csatoló atomok kémiai jellege, valamint a Si második koordinációs szférája [37, 38], 22
25 az atomok közötti távolságok és szögek [39, 40], a hidrogén híd kötések erőssége [41] Elektronmikroszkópia alkalmazása Transzmissziós (TEM) és pásztázó (SEM) elektronmikroszkópiai technikákkal morfológiai sajátságok állapíthatók meg. Az ábrán néhány kaolinit SEM illetve TEM felvétele látható ábra. SEM és TEM felvételek A) SEM felvétel kaolinitről ( B) TEM felvétel kaolinitről ( C) SEM felvétel hidratált halloysit csövekről ( D) és E) TEM felvétel csöves és gömbszerű halloysitról ( Morfológiai vizsgálatok (fajlagos felület, pórusméret) Porózus anyagok felületének valamint pórusszerkezetének jellemzésében a gáz adszorpció fontos szerepet játszik. Általában nitrogén gáz adszorpciós izotermájának felvételéből következtetnek a fajlagos felületre illetve a pórusméretekre. A módszer lényege, hogy mérjük a gáz mennyiségét (térfogatát) az adszorpció előtt és után. A fajlagos felület meghatározásának legelterjedtebb, mára már standard eljárássá vált módszere a Brunauer, Emmett és Teller által kidolgozott ún. BET elmélet [42]. A modell alapja a következő: - az adszorpciós fázis több molekularétegből áll, - az első rétegnek kitüntetett szerepe van, mert csak ennek a rétegnek a molekulái érintkeznek az adszorbens felületével. Ezt a réteget valódi adszorpciós hő jellemzi, a további rétegek molekulái csak az adszorbátum molekulákkal érintkeznek, és adszorpciós hőjük a rétegszámtól függetlenül azonos az adszorptívum kondenzációs hőjével, 23
26 - egyensúly esetén az adott számú réteggel borított felületek nagysága állandó. A BET elméletből levezetett ún. kétállandós egyenlet: x 1 x( c 1) = + u( 1 x) u c u c Ahol: u adszorbátum teljes mennyisége u m teljes felület monomolekuláris borítottságához szükséges adszorbátum mennyisége x relatív nyomás (p/p o ) c gáz/szilárd kölcsönhatás erősségére jellemző paraméter m m Kísérleti adatok alapján a bal oldalt x függvényében ábrázolva egyenest kapunk, melynek meredekségéből és ordinátametszetéből u m és c meghatározható. A monomolekuláris borításhoz szükséges anyagmennyiség (u m ) és egy adszorptívum molekula felületigényének ismeretében pedig kiszámítható az adszorbens felülete. A BET egyenlet a 0,05 és 0,35 p/p 0 relatív nyomástartományban ad jó eredményt az adszorbens felületére. A nitrogén izoterma segítségével pórusméret elemzés is végezhető, melyre a Barrett, Joyner és Halenda által kidolgozott BJH elmélet ad lehetőséget [43]. A klasszikus megközelítésnek megfelelően a módosított Kelvin-egyenlet segítségével a pórusnyílás mérete meghatározható a pórust kitöltő folyadék gőznyomásából. Mindehhez feltételezzük, hogy a pórusok jól definiáltak, azaz alakjuk hengeres, faluk párhuzamos, valamint azt hogy a meniszkusz görbülete függ a pórus méretétől. Porózus anyagok esetén ún. IV. típusú adszorpciós izotermával kell számolni, amely az ábrán látható a görbe részeinek magyarázatával valamint a részlépésekhez rendelt fizikai tartalommal [44]. 24
27 1.12. ábra. Adszorpció porózus anyagokon Felületi sav-bázis tulajdonságok vizsgálata Szilárd anyagok sav-bázis tulajdonsága tesztmolekulákkal vizsgálható, bár ezek a tulajdonságok a felület és a tesztmolekula kölcsönhatásától is függnek. 25
28 Ebből az következik, hogy a savasság nem becsülhető csupán a szilárd anyag vizsgálatával, hanem a szilárd felület és a (bázikus) molekula közötti kölcsönhatás vizsgálata is szükséges. A tesztmolekula/szorpciós centrum adszorpciós sztöchiometriája meghatározható (i) spektroszkópiásan a szilárd sav funkciós csoportjainak (pl. hidroxil csoportok) változásaiból és a szorbeált molekula karakterisztikus sávjainak növekedéséből vagy (ii) párhuzamos gravimetriás illetve térfogatos mérésekből. A vizsgálat céljától függően bizonyos kritériumokat követve választhatjuk ki a megfelelő tesztmolekulát [45]. A legfontosabb kritériumokat az 1.5. táblázat foglalja össze táblázat: A tesztmolekula kiválasztásának kritériumai [46] Lewis savas centrum Bronsted savas centrum Szorpciós komplex Elektronpár donor/akceptor H- híd Ionpár (H-híd) A komplex ν kialakulásának ν B sávpozíció változása OH sávalak és sávpozíció változása detektálása A saverősség meghatározásának módszere Savas centrumok koncentrációjának meghatározása Spektrális tulajdonságokkal szembeni elvárások Általában alkalmazott molekulák Korreláció a ν B és az adszorpciós hő között ν B intenzitásából A ν B eltolódása jelentős legyen a félértékszélességhez viszonyítva Piridin, NH 3, acetonitril, benzonitril, CO jelmagyarázat: ν B a B tesztmolekula karakterisztikus rezgése ν OH - a szilárd anyag OH vegyérték rezgése ν OH eltolódás adott tesztmolekula esetén ν OH intenzitásából A tesztmolekula ne tartalmazzon OHcsoportokat Benzol, aceton, piridin, szubsztituált piridinek, aminok, acetonitril ν OH eltűnése, ν B-H és/vagy δ B-H megjelenése A H-hidas ionpár komplex termikus stabilitása Az ionpár komplex karakterisztikus sávjának intenzitásából A karakterisztikus sáv egyértelműen az ionpár komplexhez tartozzon NH 3, piridin és származékai A tesztmolekulák megválasztásának kritériumai 1. kritérium: A tesztmolekula legyen inkább bázikus illetve gyengén savas tulajdonságú. A molekula a szorpció során elsősorban bázikus (elektronpár donor) csoportjával lép kölcsönhatásba a felülettel, míg savas (elektronpár akceptor) funkciója alig van hatással az anyagra. Ilyen jellegű molekula. pl. az ammónia és a legtöbb amin, ideértve a piridint is. Ammónia alkalmazása során elsődleges kölcsönhatás a savas felületen a nitrogén atom (magányos elektronpárján keresztül) és a Bronsted vagy Lewis savas (elektronpár akceptor) centrum között jön létre. Igaz, nem csak a hidroxil csoport 26
29 saverőssége határozza meg a szorpciós komplexben lévő kölcsönhatás erősségét (az ammónia a szorpció során vagy protonálódik vagy nem) [47], vagyis minél komplexebb a savasság meghatározásra használt molekula (pl. ketonok [48, 49]), annál nagyobb az esély szimultán sav-bázis kölcsönhatás kialakulására, amely megnehezíti a szilárd anyag savassági tulajdonságainak meghatározását. 2. kritérium: Az adszorbeált molekula IR-spektrumában megkülönböztethető legyen a protonos (Bronsted) és aprotikus (Lewis) savas centrum. Ez akkor alkalmazható, amikor a két fajta módon kötött (Bronsted illetve Lewis) molekula spektrális tulajdonságai jelentősen eltérnek, illetve az adszorpció során karakterisztikus változások mennek végbe a protonos illetve a koordinatív jellegű kötődés eredményeként [50]. Erős bázisok, pl. az ammónia esetén a protonálódás könnyen kimutatható [51], míg gyengébb bázisok (alkoholok, ketonok, víz) esetén ezt nehezebb eldönteni. A koordinatíve telitetlen fém kationokon történő szorpció általában erősebb, mint a hidroxil csoportokon végbemenő [52]. 3. kritérium: A tesztmolekulának különbséget kell tenni az ugyanolyan típusú, de eltérő erősségű savas centrumok között. Általában az erős bázis (pl. piridin) alkalmasabb a kismértékű saverősségbeli különbség kimutatására, mivel nincs protonálódás, míg a gyenge bázis (pl. benzol) megfelelőbb a nagyobb mértékű különbségek detektálására, de célszerű a sav-bázis kötésben részt vevő orbitálok polarizálhatóságát is figyelembe kell venni [53]. Eszerint az összehasonlítható polarizálhatósággal rendelkező sav-bázis centrumok közötti kölcsönhatások valószínűsíthetők, vagyis inkább kemény-kemény, és lágy-lágy kölcsönhatások alakulnak ki, mintsem kemény-lágy [54-56]. Itt meg kell jegyezni, hogy a molekulák keménységéről felállított rangsor eléggé vitatott [46, 57]. 4. kritérium: A tesztmolekula mérete összehasonlítható legyen a későbbi alkalmazás során használandó reaktánsok méretével. A legkisebb méretű molekulákkal (CO, NH 3 ) a felület összes savas centruma tesztelhető. A méret növelésével egyre jobban érvényesülnek a sztérikus gátlások. Ezt kihasználva a savas centrumok körüli sztérikus gátlás tesztelhető egy növekvő méretű tesztmolekula sorozattal vagy olyan sorozattal, melyben az elektronpár donor (bázis) funkció körül növekszik a sztérikus gátlás. 27
30 Néhány gyakran alkalmazott tesztmolekula Ammónia A felületi savasság vizsgálatában az egyik legtöbbet alkalmazott tesztmolekula. Kis méretének köszönhetően minden savas centrum elérhető vele, viszont saverősség vizsgálatára nem igazán alkalmas. Kemény bázisként elvárhatjuk, hogy erős kölcsönhatásba lépjen az olyan savas centrumokkal, mint a hidroxil csoportok protonjai vagy a kis fém kationok. A protonált molekula (ammónium ion) és a koordinatíve kötött ammónia spektroszkópiai úton az NH deformációs és vegyértékrezgésük által megkülönböztethető. Az ammónium ion 1450 és 3300 cm -1 -nél, míg a koordinatíve kötött ammónia 1250, 1630 és 3330 cm -1 -nél jelenik meg a spektrumban. A legmegbízhatóbb indikátorként az 1450 és az 1630 cm -1 -es deformációs sávok használhatók. Az NH vegyértékrezgés spektrális tartománya viszonylag bonyolult, mert az adszorpció során bekövetkező molekula torzulás szabad és pertubált N-H rezgések összetett sávjaihoz vezet, mely további átlapolásokkal sújtott a deformációs rezgések felhangjai és kombinációs rezgései által [58]. Az ammónia alkalmazásánál további két komplikációval kell számolni. Az egyik a magasabb hőmérsékleten (T>500K) történő kísérletek során fordul elő, amikor az NH 3 disszociált formában NH 2 és NH csoport formában szeretne szorbeálódni a Lewis savas centrumokon, vagy a meglévő OH csoportokat NH 2 csoportokra cseréli [59, 60]. A másik komplikáció a molekuláris víz jelenléte. Ilyenkor ammónium ion keletkezhet például a szilícium-alumínium-oxidokon [61]. Az átlapolás megnehezíti az IR spektrumok kiértékelését. Alifás aminok A legtöbbet alkalmazott molekula az n-butil-amin. Oxidok Lewis savas centrumain kötődve 1605 cm -1 -nél jelenik meg (-NH 2 deformációs) sáv. Protonált butil-amint figyeltek meg szilícium-alumínium-oxidon és zeolitokon [62], mely 1590 és 1510 cm -1 -nél jelenik meg az IR spektrumban. Piridin és származékai Gáz fázisban a piridin erősebb bázis az ammóniánál, protonálódása könnyebben végbemegy és a protonált forma termikus stabilitása is nagyobb, mint az ammónia esetén [63]. Az 1540 cm -1 körüli sávot a piridinium ion karakterisztikus sávjának tulajdonítják, 28
31 míg az 1445 és 1460 cm -1 közötti sávokat a koordinált módon adszorbeált piridinhez kötik [50]. Míg az 1540 cm -1 -es sáv spektrális pozícióját tekintve a szilárd anyag savasságával nem változik, addig a koordinált piridinhez tartozó sáv a nagyobb értékek felé tolódik el a kölcsönhatás erősödésével. A piridin szorpció mennyiségi analíziséről Lavalley és munkatársai számoltak be [64, 65]. Nitrilek A nitrilek viszonylag gyenge bázisok és a nitril-csoport nitrogénjén keresztül tudnak kapcsolódni a savas centrumokhoz. A kölcsönhatás során a C-N vegyértékrezgés sávja a magasabb hullámszámok felé tolódik el. A hozzáférhető fém kationokhoz történő koordinációkor a kék eltolódás kb cm -1 [66], míg a hidroxil csoporthoz történő koordinációkor cm -1 -es eltolódás észlelhető [67-69]. Kis mérete miatt számos oxid jellemzésére az acetonitrilt használják [70-77]. Nagyobb nitrilek, melyek kevésbé reaktívak (pl. terc-butironitril) jól alkalmazhatók alumínium-oxid [66], szilícium-dioxid titán-dioxid és más kevert oxidok [75, 78, 79] vizsgálatában. Benzol és származékai A benzolok és a szubsztituált származékaik gyengén bázikus molekulák, melyek π- kötést alakítanak ki a Bronsted és Lewis savas centrumokkal. A kötések erőssége a Bronsted savas hidroxil csoportok OH sáveltolódása alapján, illetve a CH vegyértékrezgéshez és a gyűrűrezgéshez tartozó sávok változásának nyomon követésével vizsgálható [80, 81]. Amorf SiO 2 /Al 2 O 3 esetén, mely csak egy OH vegyértékrezgési sávot mutatott 3750 cm -1 -nél, adszorpció után két pertubált OH sávot figyeltek meg 110 és 310 cm -1 -rel eltolódva [73]. Továbbá elmondható, hogy általában a benzol és a Lewis savas centrumok között erősebb kölcsönhatás alakul ki, mint a Bronsted savas centrumok esetén [82]. Szén-monoxid A benzolhoz hasonlóan a CO is gyenge bázisnak tekinthető lágy karakterrel, így kemény savakkal nem igazán lép reakcióba. Kis méretének köszönhetően azonban minden savas centrum elérhető vele. A CO a szén atomon keresztül kapcsolódik a savas centrumhoz, eltolva a CO vegyértékrezgés sávját a nagyobb hullámszámok felé [83]. Szénmonoxid adszorpció segítségével nemcsak az elérhető fém kationok töltését, de a koordinációját is megállapíthatjuk. Például alumínium-oxidok vizsgálata során, 29
MÓDOSÍTOTT FELÜLETŰ KAOLINIT AGYAGÁSVÁNYOK KOMPLEX ANALITIKAI VIZSGÁLATA
 MÓDOSÍTOTT FELÜLETŰ KAOLINIT AGYAGÁSVÁNYOK KOMPLEX ANALITIKAI VIZSGÁLATA Doktori (PhD) értekezés tézisei Készítette: Vágvölgyi Veronika okleveles vegyészmérnök Témavezető: Dr. Horváth Erzsébet egyetemi
MÓDOSÍTOTT FELÜLETŰ KAOLINIT AGYAGÁSVÁNYOK KOMPLEX ANALITIKAI VIZSGÁLATA Doktori (PhD) értekezés tézisei Készítette: Vágvölgyi Veronika okleveles vegyészmérnök Témavezető: Dr. Horváth Erzsébet egyetemi
Kémiai kötések. Kémiai kötések kj / mol 0,8 40 kj / mol
 Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Kémiai kötések A természetben az anyagokat felépítő atomok nem önmagukban, hanem gyakran egymáshoz kapcsolódva léteznek. Ezeket a kötéseket összefoglaló néven kémiai kötéseknek nevezzük. Kémiai kötések
Katalízis. Tungler Antal Emeritus professzor 2017
 Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
Katalízis Tungler Antal Emeritus professzor 2017 Fontosabb időpontok: sósav oxidáció, Deacon process 1860 kéndioxid oxidáció 1875 ammónia oxidáció 1902 ammónia szintézis 1905-1912 metanol szintézis 1923
Elektronegativitás. Elektronegativitás
 Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Általános és szervetlen kémia 3. hét Elektronaffinitás Az az energiaváltozás, ami akkor következik be, ha 1 mól gáz halmazállapotú atomból 1 mól egyszeresen negatív töltésű anion keletkezik. Mértékegysége:
Kémiai kötések. Kémiai kötések. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötések A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 Cl + Na Az ionos kötés 1. Cl + - + Na Klór: 1s 2 2s 2 2p 6 3s 2 3p 5 Kloridion: 1s2 2s2 2p6 3s2 3p6 Nátrium: 1s 2 2s
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
1.7. Felületek és katalizátorok
 Mobilitás és Környezet Konferencia Magyar Tudományos Akadémia Budapest, 2012. január 23. 1.7. Felületek és katalizátorok Polimer töltőanyagként alkalmazható agyagásvány nanostruktúrák előállítása Horváth
Mobilitás és Környezet Konferencia Magyar Tudományos Akadémia Budapest, 2012. január 23. 1.7. Felületek és katalizátorok Polimer töltőanyagként alkalmazható agyagásvány nanostruktúrák előállítása Horváth
Kötések kialakítása - oktett elmélet
 Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek elsődleges kémiai kötések Kötések
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések
 Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
Sillabusz orvosi kémia szemináriumokhoz 1. Kémiai kötések Pécsi Tudományegyetem Általános Orvostudományi Kar 2010-2011. 1 A vegyületekben az atomokat kémiai kötésnek nevezett erők tartják össze. Az elektronok
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
A kémiai kötés magasabb szinten 11-1 Mit kell tudnia a kötéselméletnek? 11- Vegyérték kötés elmélet 11-3 Atompályák hibridizációja 11-4 Többszörös kovalens kötések 11-5 Molekulapálya elmélet 11-6 Delokalizált
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI
 SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 6 KRISTÁLYTAN VI. A KRIsTÁLYOs ANYAG belső RENDEZETTsÉGE 1. A KRIsTÁLYOs ÁLLAPOT A szilárd ANYAG jellemzője Az ásványok néhány kivételtől eltekintve kristályos
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 6 KRISTÁLYTAN VI. A KRIsTÁLYOs ANYAG belső RENDEZETTsÉGE 1. A KRIsTÁLYOs ÁLLAPOT A szilárd ANYAG jellemzője Az ásványok néhány kivételtől eltekintve kristályos
Kémiai kötés. Általános Kémia, szerkezet Slide 1 /39
 Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
Kémiai kötés 12-1 Lewis elmélet 12-2 Kovalens kötés: bevezetés 12-3 Poláros kovalens kötés 12-4 Lewis szerkezetek 12-5 A molekulák alakja 12-6 Kötésrend, kötéstávolság 12-7 Kötésenergiák Általános Kémia,
A kémiai kötés magasabb szinten
 A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
A kémiai kötés magasabb szinten 13-1 Mit kell tudnia a kötéselméletnek? 13- Vegyérték kötés elmélet 13-3 Atompályák hibridizációja 13-4 Többszörös kovalens kötések 13-5 Molekulapálya elmélet 13-6 Delokalizált
41. ábra A NaCl rács elemi cellája
 41. ábra A NaCl rács elemi cellája Mindkét rácsra jellemző, hogy egy tetszés szerint kiválasztott pozitív vagy negatív töltésű iont ellentétes töltésű ionok vesznek körül. Különbség a közvetlen szomszédok
41. ábra A NaCl rács elemi cellája Mindkét rácsra jellemző, hogy egy tetszés szerint kiválasztott pozitív vagy negatív töltésű iont ellentétes töltésű ionok vesznek körül. Különbség a közvetlen szomszédok
3. A kémiai kötés. Kémiai kölcsönhatás
 3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
3. A kémiai kötés Kémiai kölcsönhatás ELSŐDLEGES MÁSODLAGOS OVALENS IONOS FÉMES HIDROGÉN- KÖTÉS DIPÓL- DIPÓL, ION- DIPÓL, VAN DER WAALS v. DISZPERZIÓS Kémiai kötések Na Ionos kötés Kovalens kötés Fémes
Műszeres analitika II. (TKBE0532)
 Műszeres analitika II. (TKBE0532) 7. előadás NMR spektroszkópia Dr. Andrási Melinda Debreceni Egyetem Természettudományi és Technológiai Kar Szervetlen és Analitikai Kémiai Tanszék NMR, Nuclear Magnetic
Műszeres analitika II. (TKBE0532) 7. előadás NMR spektroszkópia Dr. Andrási Melinda Debreceni Egyetem Természettudományi és Technológiai Kar Szervetlen és Analitikai Kémiai Tanszék NMR, Nuclear Magnetic
Az anyagi rendszer fogalma, csoportosítása
 Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
Az anyagi rendszer fogalma, csoportosítása A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011 1 1 A rendszer fogalma A körülöttünk levő anyagi világot atomok, ionok, molekulák építik
5. elıadás KRISTÁLYKÉMIAI ALAPOK
 5. elıadás KRISTÁLYKÉMIAI ALAPOK KRISTÁLYKÉMIAI ALAPFOGALMAK Atomok: az anyag legkisebb olyan részei, amelyek még hordozzák a kémiai elem jellegzetességeit. Részei: atommag (mely protonokból és neutronokból
5. elıadás KRISTÁLYKÉMIAI ALAPOK KRISTÁLYKÉMIAI ALAPFOGALMAK Atomok: az anyag legkisebb olyan részei, amelyek még hordozzák a kémiai elem jellegzetességeit. Részei: atommag (mely protonokból és neutronokból
5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével
 5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével 5.1. Átismétlendő anyag 1. Adszorpció (előadás) 2. Langmuir-izoterma (előadás) 3. Spektrofotometria és Lambert Beer-törvény
5. Az adszorpciós folyamat mennyiségi leírása a Langmuir-izoterma segítségével 5.1. Átismétlendő anyag 1. Adszorpció (előadás) 2. Langmuir-izoterma (előadás) 3. Spektrofotometria és Lambert Beer-törvény
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI
 SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 30 Műszeres ÁSVÁNYHATÁROZÁS XXX. Műszeres ÁsVÁNYHATÁROZÁs 1. BEVEZETÉs Az ásványok természetes úton, a kémiai elemek kombinálódásával keletkezett (és ma is keletkező),
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 30 Műszeres ÁSVÁNYHATÁROZÁS XXX. Műszeres ÁsVÁNYHATÁROZÁs 1. BEVEZETÉs Az ásványok természetes úton, a kémiai elemek kombinálódásával keletkezett (és ma is keletkező),
A SZILÁRDTEST FOGALMA. Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. molekula klaszter szilárdtest > σ λ : rel.
 A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
A SZILÁRDTEST FOGALMA Szilárdtest: makroszkópikus, szilárd, rendezett anyagdarab. a) Méret: b) Szilárdság: molekula klaszter szilárdtest > ~ 100 Å ideálisan rugalmas test: λ = 1 E σ λ : rel. megnyúlás
Kémiai kötés Lewis elmélet
 Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
Kémiai kötés 10-1 Lewis elmélet 10-2 Kovalens kötés: bevezetés 10-3 Poláros kovalens kötés 10-4 Lewis szerkezetek 10-5 A molekulák alakja 10-6 Kötésrend, kötéstávolság 10-7 Kötésenergiák Általános Kémia,
A kovalens kötés elmélete. Kovalens kötésű molekulák geometriája. Molekula geometria. Vegyértékelektronpár taszítási elmélet (VSEPR)
 4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
4. előadás A kovalens kötés elmélete Vegyértékelektronpár taszítási elmélet (VSEPR) az atomok kötő és nemkötő elektronpárjai úgy helyezkednek el a térben, hogy egymástól minél távolabb legyenek A központi
A TÖMEGSPEKTROMETRIA ALAPJAI
 A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
A TÖMEGSPEKTROMETRIA ALAPJAI web.inc.bme.hu/csonka/csg/oktat/tomegsp.doc alapján tömeg-töltés arány szerinti szétválasztás a legérzékenyebb módszerek közé tartozik (Nagyon kis anyagmennyiség kimutatására
Modern Fizika Labor. A mérés száma és címe: A mérés dátuma: Értékelés: Infravörös spektroszkópia. A beadás dátuma: A mérést végezte:
 Modern Fizika Labor A mérés dátuma: 2005.10.26. A mérés száma és címe: 12. Infravörös spektroszkópia Értékelés: A beadás dátuma: 2005.11.09. A mérést végezte: Orosz Katalin Tóth Bence 1 A mérés során egy
Modern Fizika Labor A mérés dátuma: 2005.10.26. A mérés száma és címe: 12. Infravörös spektroszkópia Értékelés: A beadás dátuma: 2005.11.09. A mérést végezte: Orosz Katalin Tóth Bence 1 A mérés során egy
A kovalens kötés polaritása
 Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Általános és szervetlen kémia 4. hét Kovalens kötés A kovalens kötés kialakulásakor szabad atomokból molekulák jönnek létre. A molekulák létrejötte mindig energia csökkenéssel jár. A kovalens kötés polaritása
Vegyületek - vegyületmolekulák
 Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Vegyületek - vegyületmolekulák 3.Az anyagok csoportosítása összetételük szerint Egyszerű összetett Azonos atomokból állnak különböző atomokból állnak Elemek vegyületek keverékek Fémek Félfémek Nemfémek
Kémiai átalakulások. A kémiai reakciók körülményei. A rendszer energiaviszonyai
 Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
Kémiai átalakulások 9. hét A kémiai reakció: kötések felbomlása, új kötések kialakulása - az atomok vegyértékelektronszerkezetében történik változás egyirányú (irreverzibilis) vagy megfordítható (reverzibilis)
Műszeres analitika. Abrankó László. Molekulaspektroszkópia. Kémiai élelmiszervizsgálati módszerek csoportosítása
 Abrankó László Műszeres analitika Molekulaspektroszkópia Minőségi elemzés Kvalitatív Cél: Meghatározni, hogy egy adott mintában jelen vannak-e bizonyos ismert komponensek. Vagy ismeretlen komponensek azonosítása
Abrankó László Műszeres analitika Molekulaspektroszkópia Minőségi elemzés Kvalitatív Cél: Meghatározni, hogy egy adott mintában jelen vannak-e bizonyos ismert komponensek. Vagy ismeretlen komponensek azonosítása
Mikrohullámú abszorbensek vizsgálata 4. félév
 Óbudai Egyetem Anyagtudományok és Technológiák Doktori Iskola Mikrohullámú abszorbensek vizsgálata 4. félév Balla Andrea Témavezetők: Dr. Klébert Szilvia, Dr. Károly Zoltán MTA Természettudományi Kutatóközpont
Óbudai Egyetem Anyagtudományok és Technológiák Doktori Iskola Mikrohullámú abszorbensek vizsgálata 4. félév Balla Andrea Témavezetők: Dr. Klébert Szilvia, Dr. Károly Zoltán MTA Természettudományi Kutatóközpont
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését!
 I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
I. Atomszerkezeti ismeretek (9. Mozaik Tankönyv:10-30. oldal) 1. Részletezze az atom felépítését! Az atom az anyagok legkisebb, kémiai módszerekkel tovább már nem bontható része. Az atomok atommagból és
2. AZ INFRAVÖRÖS SPEKTROSZKÓPIA AZ ÁSVÁNYTANI GYAKORLATBAN
 MÓDSZERTANI KÖ ZLEM ÉNYEK X. KÖTET 1986/2. 9 2. AZ INFRAVÖRÖS SPEKTROSZKÓPIA AZ ÁSVÁNYTANI GYAKORLATBAN Az infravörös spektroszkópiát ásványok azonosítására, ásványok mennyiségi elemzésére, leggyakrabban
MÓDSZERTANI KÖ ZLEM ÉNYEK X. KÖTET 1986/2. 9 2. AZ INFRAVÖRÖS SPEKTROSZKÓPIA AZ ÁSVÁNYTANI GYAKORLATBAN Az infravörös spektroszkópiát ásványok azonosítására, ásványok mennyiségi elemzésére, leggyakrabban
Mikrohullámú abszorbensek vizsgálata
 Óbudai Egyetem Anyagtudományok és Technológiák Doktori Iskola Mikrohullámú abszorbensek vizsgálata Balla Andrea Témavezetők: Dr. Klébert Szilvia, Dr. Károly Zoltán MTA Természettudományi Kutatóközpont
Óbudai Egyetem Anyagtudományok és Technológiák Doktori Iskola Mikrohullámú abszorbensek vizsgálata Balla Andrea Témavezetők: Dr. Klébert Szilvia, Dr. Károly Zoltán MTA Természettudományi Kutatóközpont
Jegyzet. Kémia, BMEVEAAAMM1 Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens.
 Kémia, BMEVEAAAMM Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens Jegyzet dr. Horváth Viola, KÉMIA I. http://oktatas.ch.bme.hu/oktatas/konyvek/anal/
Kémia, BMEVEAAAMM Műszaki menedzser hallgatók számára Dr Csonka Gábor, egyetemi tanár Dr Madarász János, egyetemi docens Jegyzet dr. Horváth Viola, KÉMIA I. http://oktatas.ch.bme.hu/oktatas/konyvek/anal/
ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén
 ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén A paraméterek anizotrópiája egykristályok rögzített tengely körüli forgatásakor
ESR-spektrumok különbözı kísérleti körülmények között A számítógépes értékelés alapjai anizotróp kölcsönhatási tenzorok esetén A paraméterek anizotrópiája egykristályok rögzített tengely körüli forgatásakor
NEHÉZFÉMEK ELTÁVOLÍTÁSA IPARI SZENNYVIZEKBŐL Modell kísérletek Cr(VI) alkalmazásával növényi hulladékokból nyert aktív szénen
 NEHÉZFÉMEK ELTÁVOLÍTÁSA IPARI SZENNYVIZEKBŐL Modell kísérletek Cr(VI) alkalmazásával növényi hulladékokból nyert aktív szénen Készítette: Battistig Nóra Környezettudomány mesterszakos hallgató A DOLGOZAT
NEHÉZFÉMEK ELTÁVOLÍTÁSA IPARI SZENNYVIZEKBŐL Modell kísérletek Cr(VI) alkalmazásával növényi hulladékokból nyert aktív szénen Készítette: Battistig Nóra Környezettudomány mesterszakos hallgató A DOLGOZAT
Az anyagi rendszerek csoportosítása
 Általános és szervetlen kémia 1. hét A kémia az anyagok tulajdonságainak leírásával, átalakulásaival, elıállításának lehetıségeivel és felhasználásával foglalkozik. Az általános kémia vizsgálja az anyagi
Általános és szervetlen kémia 1. hét A kémia az anyagok tulajdonságainak leírásával, átalakulásaival, elıállításának lehetıségeivel és felhasználásával foglalkozik. Az általános kémia vizsgálja az anyagi
Energiaminimum- elve
 Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
Energiaminimum- elve Minden rendszer arra törekszi, hogy stabil állapotba kerüljön. Milyen kapcsolat van a stabil állapot, és az adott állapot energiája között? Energiaminimum elve Energiaminimum- elve
10. előadás Kőzettani bevezetés
 10. előadás Kőzettani bevezetés Mi a kőzet? Döntően nagy földtani folyamatok során képződik. Elsősorban ásványok keveréke. Kőzetalkotó ásványok építik fel. A kőzetalkotó komponensek azonban nemcsak ásványok,
10. előadás Kőzettani bevezetés Mi a kőzet? Döntően nagy földtani folyamatok során képződik. Elsősorban ásványok keveréke. Kőzetalkotó ásványok építik fel. A kőzetalkotó komponensek azonban nemcsak ásványok,
Kémiai kötés. Általános Kémia, szerkezet Dia 1 /39
 Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Kémiai kötés 4-1 Lewis-elmélet 4-2 Kovalens kötés: bevezetés 4-3 Poláros kovalens kötés 4-4 Lewis szerkezetek 4-5 A molekulák alakja 4-6 Kötésrend, kötéstávolság 4-7 Kötésenergiák Általános Kémia, szerkezet
Víz. Az élő anyag szerkezeti egységei. A vízmolekula szerkezete. Olyan mindennapi, hogy fel sem tűnik, milyen különleges
 Az élő anyag szerkezeti egységei víz nukleinsavak fehérjék membránok Olyan mindennapi, hogy fel sem tűnik, milyen különleges A Föld felszínének 2/3-át borítja Előfordulása az emberi szövetek felépítésében
Az élő anyag szerkezeti egységei víz nukleinsavak fehérjék membránok Olyan mindennapi, hogy fel sem tűnik, milyen különleges A Föld felszínének 2/3-át borítja Előfordulása az emberi szövetek felépítésében
Szakértesítő 1 Interkerám szakmai füzetek A folyósító szerek viselkedése a kerámia anyagokban
 Szakértesítő 1 Interkerám szakmai füzetek A folyósító szerek viselkedése a kerámia anyagokban A folyósító szerek viselkedése a kerámia anyagokban Bevezetés A kerámia masszák folyósításkor fő cél az anyag
Szakértesítő 1 Interkerám szakmai füzetek A folyósító szerek viselkedése a kerámia anyagokban A folyósító szerek viselkedése a kerámia anyagokban Bevezetés A kerámia masszák folyósításkor fő cél az anyag
1. változat. 4. Jelöld meg azt az oxidot, melynek megfelelője a vas(iii)-hidroxid! A FeO; Б Fe 2 O 3 ; В OF 2 ; Г Fe 3 O 4.
 1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
Atomszerkezet. Atommag protonok, neutronok + elektronok. atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok
 Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Atomszerkezet Atommag protonok, neutronok + elektronok izotópok atompályák, alhéjak, héjak, atomtörzs ---- vegyérték elektronok periódusos rendszer csoportjai Periódusos rendszer A kémiai kötés Kémiai
Kerámia, üveg és fém-kerámia implantátumok
 Kerámia, üveg és fém-kerámia implantátumok Bagi István BME MTAT Bevezetés Kerámiák csoportosítása teljesen tömör bioinert porózus bioinert teljesen tömör bioaktív oldódó Definíciók Bioinert a szomszédos
Kerámia, üveg és fém-kerámia implantátumok Bagi István BME MTAT Bevezetés Kerámiák csoportosítása teljesen tömör bioinert porózus bioinert teljesen tömör bioaktív oldódó Definíciók Bioinert a szomszédos
 Anyagos rész: Lásd: állapotábrás pdf. Ha többet akarsz tudni a metallográfiai vizsgálatok csodáiról, akkor: http://testorg.eu/editor_up/up/egyeb/2012_01/16/132671554730168934/metallografia.pdf
Anyagos rész: Lásd: állapotábrás pdf. Ha többet akarsz tudni a metallográfiai vizsgálatok csodáiról, akkor: http://testorg.eu/editor_up/up/egyeb/2012_01/16/132671554730168934/metallografia.pdf
A mágneses tulajdonságú magnetit ásvány, a görög Magnészia városról kapta nevét.
 MÁGNESES MEZŐ A mágneses tulajdonságú magnetit ásvány, a görög Magnészia városról kapta nevét. Megfigyelések (1, 2) Minden mágnesnek két pólusa van, északi és déli. A felfüggesztett mágnes - iránytű -
MÁGNESES MEZŐ A mágneses tulajdonságú magnetit ásvány, a görög Magnészia városról kapta nevét. Megfigyelések (1, 2) Minden mágnesnek két pólusa van, északi és déli. A felfüggesztett mágnes - iránytű -
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK. Rausch Péter kémia-környezettan
 AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
AZ ANYAGI HALMAZOK ÉS A MÁSODLAGOS KÖTÉSEK Rausch Péter kémia-környezettan Hogy viselkedik az ember egyedül? A kémiában ritkán tudunk egyetlen részecskét vizsgálni! - az anyagi részecske tudja hogy kell
Modern Fizika Labor. 12. Infravörös spektroszkópia. Fizika BSc. A mérés dátuma: okt. 04. A mérés száma és címe: Értékelés:
 Modern Fizika Labor Fizika BSc A mérés dátuma: 011. okt. 04. A mérés száma és címe: 1. Infravörös spektroszkópia Értékelés: A beadás dátuma: 011. dec. 1. A mérést végezte: Domokos Zoltán Szőke Kálmán Benjamin
Modern Fizika Labor Fizika BSc A mérés dátuma: 011. okt. 04. A mérés száma és címe: 1. Infravörös spektroszkópia Értékelés: A beadás dátuma: 011. dec. 1. A mérést végezte: Domokos Zoltán Szőke Kálmán Benjamin
Minta feladatsor. Az ion neve. Az ion képlete O 4. Szulfátion O 3. Alumíniumion S 2 CHH 3 COO. Króm(III)ion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Bevezetés a talajtanba VIII. Talajkolloidok
 Bevezetés a talajtanba VIII. Talajkolloidok Kolloid rendszerek (kolloid mérető részecskékbıl felépült anyagok): Olyan két- vagy többfázisú rendszer, amelyben valamely anyag mérete a tér valamely irányában
Bevezetés a talajtanba VIII. Talajkolloidok Kolloid rendszerek (kolloid mérető részecskékbıl felépült anyagok): Olyan két- vagy többfázisú rendszer, amelyben valamely anyag mérete a tér valamely irányában
Kémiai reakciók. Közös elektronpár létrehozása. Általános és szervetlen kémia 10. hét. Elızı héten elsajátítottuk, hogy.
 Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
A diffúz reflektancia spektroszkópia (DRS) módszerének alkalmazhatósága talajok ásványos fázisának rutinvizsgálatában
 A diffúz reflektancia spektroszkópia (DRS) módszerének alkalmazhatósága talajok ásványos fázisának rutinvizsgálatában Készítette: Ringer Marianna Témavezető: Szalai Zoltán 2015.06.16. Bevezetés Kutatási
A diffúz reflektancia spektroszkópia (DRS) módszerének alkalmazhatósága talajok ásványos fázisának rutinvizsgálatában Készítette: Ringer Marianna Témavezető: Szalai Zoltán 2015.06.16. Bevezetés Kutatási
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI
 SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 7 KRISTÁLYTAN VII. A KRIsTÁLYOK szimmetriája 1. BEVEZETÉs Az elemi cella és ebből eredően a térrácsnak a szimmetriáját a kristályok esetében az atomok, ionok
SZAKÁLL SÁNDOR, ÁsVÁNY- És kőzettan ALAPJAI 7 KRISTÁLYTAN VII. A KRIsTÁLYOK szimmetriája 1. BEVEZETÉs Az elemi cella és ebből eredően a térrácsnak a szimmetriáját a kristályok esetében az atomok, ionok
Általános és szervetlen kémia 3. hét Kémiai kötések. Kötések kialakítása - oktett elmélet. Lewis-képlet és Lewis szerkezet
 Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Általános és szervetlen kémia 3. hét Kémiai kötések Az elemek és vegyületek halmazai az atomok kapcsolódásával - kémiai kötések kialakításával - jönnek létre szabad atomként csak a nemesgázatomok léteznek
Szerves kémiai analízis TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ
 BSC ANYAGMÉRNÖK SZAK VEGYIPARI TECHNOLÓGIAI SZÁMÁRA KÖTELEZŐ TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2016 1 Tartalomjegyzék 1. Tantárgyleírás,
BSC ANYAGMÉRNÖK SZAK VEGYIPARI TECHNOLÓGIAI SZÁMÁRA KÖTELEZŐ TANTÁRGYI KOMMUNIKÁCIÓS DOSSZIÉ MISKOLCI EGYETEM MŰSZAKI ANYAGTUDOMÁNYI KAR KÉMIAI INTÉZET Miskolc, 2016 1 Tartalomjegyzék 1. Tantárgyleírás,
Röntgendiffrakció. Orbán József PTE, ÁOK, Biofizikai Intézet november
 Röntgendiffrakció Orbán József PTE, ÁOK, Biofizikai Intézet 2013. november Előadás vázlata Röntgen sugárzás Interferencia, diffrakció (elektromágneses hullámok) Kristályok szerkezete Röntgendiffrakció
Röntgendiffrakció Orbán József PTE, ÁOK, Biofizikai Intézet 2013. november Előadás vázlata Röntgen sugárzás Interferencia, diffrakció (elektromágneses hullámok) Kristályok szerkezete Röntgendiffrakció
BIOPLATFORM SZÁRMAZÉKOK HETEROGÉN KATALITIKUS ELŐÁLLÍTÁSA, MŰSZERES ANALITIKÁJA, KATALIZÁTOROK JELLEMZÉSE
 BIOPLATFORM SZÁRMAZÉKOK HETEROGÉN KATALITIKUS ELŐÁLLÍTÁSA, MŰSZERES ANALITIKÁJA, KATALIZÁTOROK JELLEMZÉSE Készítette: HORVÁT LAURA Környezettudomány szakos hallgató Témavezető: ROSENBERGERNÉ DR. MIHÁLYI
BIOPLATFORM SZÁRMAZÉKOK HETEROGÉN KATALITIKUS ELŐÁLLÍTÁSA, MŰSZERES ANALITIKÁJA, KATALIZÁTOROK JELLEMZÉSE Készítette: HORVÁT LAURA Környezettudomány szakos hallgató Témavezető: ROSENBERGERNÉ DR. MIHÁLYI
Spektroszkópiai módszerek 2.
 Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Spektroszkópiai módszerek 2. NMR spektroszkópia magspinek rendeződése külső mágneses tér hatására az eredő magspin nem nulla, ha a magot alkotó nukleonok közül legalább az egyik páratlan a szerves kémiában
Textíliák felületmódosítása és funkcionalizálása nem-egyensúlyi plazmákkal
 Óbudai Egyetem Anyagtudományok és Technológiák Doktori Iskola Textíliák felületmódosítása és funkcionalizálása nem-egyensúlyi plazmákkal Balla Andrea Témavezetők: Dr. Klébert Szilvia, Dr. Károly Zoltán
Óbudai Egyetem Anyagtudományok és Technológiák Doktori Iskola Textíliák felületmódosítása és funkcionalizálása nem-egyensúlyi plazmákkal Balla Andrea Témavezetők: Dr. Klébert Szilvia, Dr. Károly Zoltán
Koordinációs vegyületek (komplexek)
 Koordinációs vegyületek (komplexek) ML n M: központi ion/atom L: ligandum n: koordinációs szám Komplexek 1. Nevezéktan 2. Csoportosítás 3. A komplexképzıdés ismérvei 4. Koordinációs szám, geometria 5.
Koordinációs vegyületek (komplexek) ML n M: központi ion/atom L: ligandum n: koordinációs szám Komplexek 1. Nevezéktan 2. Csoportosítás 3. A komplexképzıdés ismérvei 4. Koordinációs szám, geometria 5.
Savak bázisok. Csonka Gábor Általános Kémia: 7. Savak és bázisok Dia 1 /43
 Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Savak bázisok 12-1 Az Arrhenius elmélet röviden 12-2 Brønsted-Lowry elmélet 12-3 A víz ionizációja és a p skála 12-4 Erős savak és bázisok 12-5 Gyenge savak és bázisok 12-6 Több bázisú savak 12-7 Ionok
Diffúzió 2003 március 28
 Diffúzió 3 március 8 Diffúzió: különféle anyagi részecskék (szilárd, folyékony, gáznemű) anyagon belüli helyváltozása. Szilárd anyagban való mozgás Öndiffúzió: a rácsot felépítő saját atomok energiaszint-különbség
Diffúzió 3 március 8 Diffúzió: különféle anyagi részecskék (szilárd, folyékony, gáznemű) anyagon belüli helyváltozása. Szilárd anyagban való mozgás Öndiffúzió: a rácsot felépítő saját atomok energiaszint-különbség
XXXVI. KÉMIAI ELŐADÓI NAPOK
 Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVI. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVI. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
1. feladat Összesen: 8 pont. 2. feladat Összesen: 11 pont. 3. feladat Összesen: 7 pont. 4. feladat Összesen: 14 pont
 1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
Kémiai alapismeretek 3. hét
 Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Kémiai alapismeretek 3. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2013. szeptember 17.-20. 1/15 2013/2014 I. félév, Horváth Attila c : Molekulákon
Diffúzió. Diffúzió. Diffúzió. Különféle anyagi részecskék anyagon belüli helyváltoztatása Az anyag lehet gáznemű, folyékony vagy szilárd
 Anyagszerkezettan és anyagvizsgálat 5/6 Diffúzió Dr. Szabó Péter János szpj@eik.bme.hu Diffúzió Különféle anyagi részecskék anyagon belüli helyváltoztatása Az anyag lehet gáznemű, folyékony vagy szilárd
Anyagszerkezettan és anyagvizsgálat 5/6 Diffúzió Dr. Szabó Péter János szpj@eik.bme.hu Diffúzió Különféle anyagi részecskék anyagon belüli helyváltoztatása Az anyag lehet gáznemű, folyékony vagy szilárd
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit
 SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
SZAK: KÉMIA Általános és szervetlen kémia 1. A periódusos rendszer 14. csoportja. a) Írják le a csoport nemfémes elemeinek az elektronkonfigurációit b) Tárgyalják összehasonlító módon a csoport első elemének
Általános Kémia, BMEVESAA101
 Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Óravázlatok:
Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Óravázlatok:
Altalános Kémia BMEVESAA101 tavasz 2008
 Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Folyadékok és szilárd anayagok 3-1 Intermolekuláris erők, folyadékok tulajdonságai 3-2 Folyadékok gőztenziója 3-3 Szilárd anyagok néhány tulajdonsága 3-4 Fázisdiagram 3-5 Van der Waals kölcsönhatások 3-6
Az anyagi rendszerek csoportosítása
 Kémia 1 A kémiai ismeretekről A modern technológiai folyamatok és a környezet védelmére tett intézkedések alig érthetőek kémiai tájékozottság nélkül. Ma már minden mérnök számára alapvető fontosságú a
Kémia 1 A kémiai ismeretekről A modern technológiai folyamatok és a környezet védelmére tett intézkedések alig érthetőek kémiai tájékozottság nélkül. Ma már minden mérnök számára alapvető fontosságú a
Az állományon belüli és kívüli hőmérséklet különbség alakulása a nappali órákban a koronatér fölötti térben május és október közötti időszak során
 Eredmények Részletes jelentésünkben a 2005-ös év adatait dolgoztuk fel. Természetesen a korábbi évek adatait is feldolgoztuk, de a terjedelmi korlátok miatt csak egy évet részletezünk. A tárgyévben az
Eredmények Részletes jelentésünkben a 2005-ös év adatait dolgoztuk fel. Természetesen a korábbi évek adatait is feldolgoztuk, de a terjedelmi korlátok miatt csak egy évet részletezünk. A tárgyévben az
7.1. Al2O3 95%+MLG 5% ; 3h; 4000rpm; Etanol; ZrO2 G1 (1312 keverék)
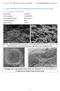 7.1. Al2O3 95%+MLG 5% ; 3h; 4000rpm; Etanol; ZrO2 G1 (1312 keverék) 7.1.1. SPS: 1150 C; 5 (1312 K1) Mért sűrűség: 3,795 g/cm 3 3,62 0,14 GPa Három pontos törés teszt: 105 4,2 GPa Súrlódási együttható:
7.1. Al2O3 95%+MLG 5% ; 3h; 4000rpm; Etanol; ZrO2 G1 (1312 keverék) 7.1.1. SPS: 1150 C; 5 (1312 K1) Mért sűrűség: 3,795 g/cm 3 3,62 0,14 GPa Három pontos törés teszt: 105 4,2 GPa Súrlódási együttható:
A gáz halmazállapot. A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 2011
 A gáz halmazállapot A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 0 Halmazállapotok, állapotjelzők Az anyagi rendszerek a részecskék közötti kölcsönhatásoktól és az állapotjelzőktől függően
A gáz halmazállapot A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 0 Halmazállapotok, állapotjelzők Az anyagi rendszerek a részecskék közötti kölcsönhatásoktól és az állapotjelzőktől függően
Gamma-röntgen spektrométer és eljárás kifejlesztése anyagok elemi összetétele és izotópszelektív radioaktivitása egyidejű elemzésére
 Gamma-röntgen spektrométer és eljárás kifejlesztése anyagok elemi összetétele és izotópszelektív radioaktivitása egyidejű elemzésére OAH-ABA-16/14-M Dr. Szalóki Imre, egyetemi docens Radócz Gábor, PhD
Gamma-röntgen spektrométer és eljárás kifejlesztése anyagok elemi összetétele és izotópszelektív radioaktivitása egyidejű elemzésére OAH-ABA-16/14-M Dr. Szalóki Imre, egyetemi docens Radócz Gábor, PhD
PhD DISSZERTÁCIÓ TÉZISEI
 Budapesti Muszaki és Gazdaságtudományi Egyetem Fizikai Kémia Tanszék MTA-BME Lágy Anyagok Laboratóriuma PhD DISSZERTÁCIÓ TÉZISEI Mágneses tér hatása kompozit gélek és elasztomerek rugalmasságára Készítette:
Budapesti Muszaki és Gazdaságtudományi Egyetem Fizikai Kémia Tanszék MTA-BME Lágy Anyagok Laboratóriuma PhD DISSZERTÁCIÓ TÉZISEI Mágneses tér hatása kompozit gélek és elasztomerek rugalmasságára Készítette:
Zárthelyi dolgozat I. /A.
 Zárthelyi dolgozat I. /A. 1. Az FCC rács és reciprokrácsa (és tudjuk, hogy: V W.S. * V B.z. /() 3 = 1 / mindig!/) a 1 = ½ a (0,1,1) ; a = ½ a (1,0,1) ; a 3 = ½ a (1,1,0) b 1 = (/a) (-1,1,1); b = (/a) (1,-1,1);
Zárthelyi dolgozat I. /A. 1. Az FCC rács és reciprokrácsa (és tudjuk, hogy: V W.S. * V B.z. /() 3 = 1 / mindig!/) a 1 = ½ a (0,1,1) ; a = ½ a (1,0,1) ; a 3 = ½ a (1,1,0) b 1 = (/a) (-1,1,1); b = (/a) (1,-1,1);
LABORATÓRIUMI PIROLÍZIS ÉS A PIROLÍZIS-TERMÉKEK NÉHÁNY JELLEMZŐJÉNEK VIZSGÁLATA
 LABORATÓRIUMI PIROLÍZIS ÉS A PIROLÍZIS-TERMÉKEK NÉHÁNY JELLEMZŐJÉNEK VIZSGÁLATA TOLNERLászló -CZINKOTAImre -SIMÁNDIPéter RÁCZ Istvánné - SOMOGYI Ferenc Mit vizsgáltunk? TSZH - Települési szilárd hulladék,
LABORATÓRIUMI PIROLÍZIS ÉS A PIROLÍZIS-TERMÉKEK NÉHÁNY JELLEMZŐJÉNEK VIZSGÁLATA TOLNERLászló -CZINKOTAImre -SIMÁNDIPéter RÁCZ Istvánné - SOMOGYI Ferenc Mit vizsgáltunk? TSZH - Települési szilárd hulladék,
ZÁRÓJELENTÉS. Fény hatására végbemenő folyamatok önszerveződő rendszerekben
 ZÁRÓJELENTÉS Fény hatására végbemenő folyamatok önszerveződő rendszerekben Jól megválasztott anyagok elegyítésekor, megfelelő körülmények között másodlagos kötésekkel összetartott szupramolekuláris rendszerek
ZÁRÓJELENTÉS Fény hatására végbemenő folyamatok önszerveződő rendszerekben Jól megválasztott anyagok elegyítésekor, megfelelő körülmények között másodlagos kötésekkel összetartott szupramolekuláris rendszerek
Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár. Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár,
 Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Facebook,
Általános Kémia, BMEVESAA101 Dr Csonka Gábor, egyetemi tanár Az anyag Készítette: Dr. Csonka Gábor egyetemi tanár, csonkagi@gmail.com 1 Jegyzet Dr. Csonka Gábor http://web.inc.bme.hu/csonka/ Facebook,
Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása.
 Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása. Adszorpció oldatból szilárd felületre Adszorpció oldatból Nem-elektrolitok
Az elektromos kettősréteg. Az elektromos potenciálkülönbség eredete, értéke és az azt befolyásoló tényezők. Kolloidok stabilitása. Adszorpció oldatból szilárd felületre Adszorpció oldatból Nem-elektrolitok
Periódusos rendszer (Mengyelejev, 1869) nemesgáz csoport: zárt héj, extra stabil
 s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
s-mezı (fémek) Periódusos rendszer (Mengyelejev, 1869) http://www.ptable.com/ nemesgáz csoport: zárt héj, extra stabil p-mezı (nemfém, félfém, fém) d-mezı (fémek) Rendezés elve: növekvı rendszám (elektronszám,
Kémiai reakciók sebessége
 Kémiai reakciók sebessége reakciósebesség (v) = koncentrációváltozás változáshoz szükséges idő A változás nem egyenletes!!!!!!!!!!!!!!!!!! v= ± dc dt a A + b B cc + dd. Melyik reagens koncentrációváltozását
Kémiai reakciók sebessége reakciósebesség (v) = koncentrációváltozás változáshoz szükséges idő A változás nem egyenletes!!!!!!!!!!!!!!!!!! v= ± dc dt a A + b B cc + dd. Melyik reagens koncentrációváltozását
XXXVII. KÉMIAI ELŐADÓI NAPOK
 Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVII. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
Magyar Kémikusok Egyesülete Csongrád Megyei Csoportja és a Magyar Kémikusok Egyesülete rendezvénye XXXVII. KÉMIAI ELŐADÓI NAPOK Program és előadás-összefoglalók Szegedi Akadémiai Bizottság Székháza Szeged,
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ
 1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
Vázlatos tartalom. Szerkezet jellemzése és vizsgálata Szilárdtestek elektronszerkezete Rácsdinamika Transzportjelenségek Mágneses tulajdonságok
 Szilárdtestfizika Kondenzált Anyagok Fizikája Vázlatos tartalom Szerkezet jellemzése és vizsgálata Szilárdtestek elektronszerkezete Rácsdinamika Transzportjelenségek Mágneses tulajdonságok 2 Szerkezet
Szilárdtestfizika Kondenzált Anyagok Fizikája Vázlatos tartalom Szerkezet jellemzése és vizsgálata Szilárdtestek elektronszerkezete Rácsdinamika Transzportjelenségek Mágneses tulajdonságok 2 Szerkezet
Az egyensúly. Általános Kémia: Az egyensúly Slide 1 of 27
 Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Az egyensúly 6'-1 6'-2 6'-3 6'-4 6'-5 Dinamikus egyensúly Az egyensúlyi állandó Az egyensúlyi állandókkal kapcsolatos összefüggések Az egyensúlyi állandó számértékének jelentősége A reakció hányados, Q:
Az atom- olvasni. 1. ábra Az atom felépítése 1. Az atomot felépítő elemi részecskék. Proton, Jele: (p+) Neutron, Jele: (n o )
 Az atom- olvasni 2.1. Az atom felépítése Az atom pozitív töltésű atommagból és negatív töltésű elektronokból áll. Az atom atommagból és elektronburokból álló semleges kémiai részecske. Az atommag pozitív
Az atom- olvasni 2.1. Az atom felépítése Az atom pozitív töltésű atommagból és negatív töltésű elektronokból áll. Az atom atommagból és elektronburokból álló semleges kémiai részecske. Az atommag pozitív
Kormeghatározás gyorsítóval
 Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Beadás határideje 2012. január 31. A megoldásokat a kémia tanárodnak add oda! 1. ESETTANULMÁNY 9. évfolyam Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre! Kormeghatározás gyorsítóval
Fémorganikus kémia 1
 Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Fémorganikus kémia 1 A fémorganikus kémia tárgya a szerves fémvegyületek előállítása, szerkezetvizsgálata és kémiai reakcióik tanulmányozása A fémorganikus kémia fejlődése 1760 Cadet bisz(dimetil-arzén(iii))-oxid
Periódusosság. Általános Kémia, Periódikus tulajdonságok. Slide 1 of 35
 Periódusosság 3-1 Az elemek csoportosítása: a periódusos táblázat 3-2 Fémek, nemfémek és ionjaik 3-3 Az atomok és ionok mérete 3-4 Ionizációs energia 3-5 Elektron affinitás 3-6 Mágneses 3-7 Az elemek periodikus
Periódusosság 3-1 Az elemek csoportosítása: a periódusos táblázat 3-2 Fémek, nemfémek és ionjaik 3-3 Az atomok és ionok mérete 3-4 Ionizációs energia 3-5 Elektron affinitás 3-6 Mágneses 3-7 Az elemek periodikus
Polimerek fizikai, mechanikai, termikus tulajdonságai
 SZÉCHENYI ISTVÁN EGYETEM ANYAGISMERETI ÉS JÁRMŰGYÁRTÁSI TANSZÉK POLIMERTECHNIKA NGB_AJ050_1 Polimerek fizikai, mechanikai, termikus tulajdonságai DR Hargitai Hajnalka 2011.10.05. BURGERS FÉLE NÉGYPARAMÉTERES
SZÉCHENYI ISTVÁN EGYETEM ANYAGISMERETI ÉS JÁRMŰGYÁRTÁSI TANSZÉK POLIMERTECHNIKA NGB_AJ050_1 Polimerek fizikai, mechanikai, termikus tulajdonságai DR Hargitai Hajnalka 2011.10.05. BURGERS FÉLE NÉGYPARAMÉTERES
Energia. Energia: munkavégző, vagy hőközlő képesség. Kinetikus energia: a mozgási energia
 Kémiai változások Energia Energia: munkavégző, vagy hőközlő képesség. Kinetikus energia: a mozgási energia Potenciális (helyzeti) energia: a részecskék kölcsönhatásából származó energia. Energiamegmaradás
Kémiai változások Energia Energia: munkavégző, vagy hőközlő képesség. Kinetikus energia: a mozgási energia Potenciális (helyzeti) energia: a részecskék kölcsönhatásából származó energia. Energiamegmaradás
Alkalmazás a makrókanónikus sokaságra: A fotongáz
 Alkalmazás a makrókanónikus sokaságra: A fotongáz A fotonok az elektromágneses sugárzás hordozó részecskéi. Spinkvantumszámuk S=, tehát kvantumstatisztikai szempontból bozonok. Fotonoknak habár a spinkvantumszámuk,
Alkalmazás a makrókanónikus sokaságra: A fotongáz A fotonok az elektromágneses sugárzás hordozó részecskéi. Spinkvantumszámuk S=, tehát kvantumstatisztikai szempontból bozonok. Fotonoknak habár a spinkvantumszámuk,
Természetes vizek, keverékek mindig tartalmaznak oldott anyagokat! Írd le milyen természetes vizeket ismersz!
 Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Periódusosság. Általános Kémia, Periódikus tulajdonságok. Slide 1 of 35
 Periódusosság 11-1 Az elemek csoportosítása: a periódusos táblázat 11-2 Fémek, nemfémek és ionjaik 11-3 Az atomok és ionok mérete 11-4 Ionizációs energia 11-5 Elektron affinitás 11-6 Mágneses 11-7 Az elemek
Periódusosság 11-1 Az elemek csoportosítása: a periódusos táblázat 11-2 Fémek, nemfémek és ionjaik 11-3 Az atomok és ionok mérete 11-4 Ionizációs energia 11-5 Elektron affinitás 11-6 Mágneses 11-7 Az elemek
4. változat. 2. Jelöld meg azt a részecskét, amely megőrzi az anyag összes kémiai tulajdonságait! A molekula; Б atom; В gyök; Г ion.
 4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
Környezet nehézfém-szennyezésének mérése és terjedésének nyomon követése
 Környezet nehézfém-szennyezésének mérése és terjedésének nyomon követése Krisztán Csaba Témavezető: Csorba Ottó 2012 Vázlat A terület bemutatása Célkitűzés A szennyeződés jellemzése Mintavételezés Módszerek
Környezet nehézfém-szennyezésének mérése és terjedésének nyomon követése Krisztán Csaba Témavezető: Csorba Ottó 2012 Vázlat A terület bemutatása Célkitűzés A szennyeződés jellemzése Mintavételezés Módszerek
