Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia
|
|
|
- Orsolya Emília Vargané
- 9 évvel ezelőtt
- Látták:
Átírás
1 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia dr. Medveczky, István dr. Rusvai, Miklós dr. Varga, János dr. Tuboly, Sándor
2 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia dr. Medveczky, István dr. Rusvai, Miklós dr. Varga, János dr. Tuboly, Sándor Publication date 1999 Szerzői jog 1999 dr. Turboly Sándor
3 Tartalom Köszönetnyilvánítás... xvi Előszó... xvii Rövidítések jegyzéke... xviii 1. Bakteriológia Általános bakteriológia A baktériumok jellemzése és helyük az élők világában A baktériumok morfológiája A baktériumok alakja és nagysága A baktériumsejt szerkezete A nukleáris állomány A cytoplasma A cytoplasmahártya A sejtfal A baktériumok burokanyagai A baktériumok csillói A fimbriák (pilusok) A baktériumok spórái A baktériumok morfológiájának vizsgálata Mikroszkópos vizsgálatok A baktériumok megfestése A baktériumok anyagcseréje Autotróf baktériumok Heterotróf baktériumok A szénhidrát-anyagforgalom és a baktériumok energianyerése A nitrogén-anyagcsere A zsíranyagcsere Vitamin- és kiegészítőanyag-igény Pigmenttermelés A baktériumok fontosabb enzimjeinek és anyagcseretermékeinek a kimutatása A nitrogénforgalom enzimjei és anyagcseretermékei A szénhidrátforgalom enzimjei és anyagcseretermékei A baktériumtevékenység gyakorlati hasznosítása A baktériumok tenyésztése A baktériumok növekedése és szaporodása A környezet hatása a baktériumok szaporodására A baktériumok ellenálló képessége a fizikai és kémiai hatásokkal szemben, sterilezés, fertőtlenítés A mikrobák elölésére szolgáló fizikai hatások Hő- és hideghatás A sugárzások hatása Mechanikai hatások A kémiai anyagok hatása Kemoterápia Egyéb kemoterapeutikumok A baktériumok genetikája A genetikai anyag szerkezete és funkciója Extrakromoszomális genetikai elemek (plazmidok) A baktériumok változékonysága A genotípus változékonysága A fenotípus változékonysága (modifikáció) A baktériumok genetikai anyagának a vizsgálata A genetikai anyag megváltoztatásának lehetőségei a baktériumokban Pathogenitás és infectio Pathogen és saprophyta mikroorganizmusok A virulencia A virulencia nem toxikus tényezői iii
4 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia 8.4. A baktériumok toxinjai Részletes bakteriológia A baktériumok rendszertana Bacillus Bacillus anthracis A Bacillus nemzetség gyakoribb saprophyta tagjai Clostridium Clostridium septicum Clostridium novyi Clostridium haemolyticum Clostridium histolyticum Clostridium chauvoei Clostridium perfringens Clostridium colinum Clostridium tetani Clostridium botulinum Clostridium piliforme Staphylococcus Micrococcus Streptococcus Enterococcus Anaerob coccusok Lactobacillus Erysipelothrix rhusiopathiae Listeria Renibacterium Corynebacterium Actinomyces Nocardia Rhodococcus Enterobacteriumok Escherichia Escherichia coli Klebsiella Klebsiella pneumoniae Enterobacter Edwardsiella Shigella Salmonella Citrobacter Serratia Proteus Yersinia Yersinia pseudotuberculosis Yersinia enterocolitica Yersinia ruckeri Anaerob, Gram-negatív, pálcika alakú baktériumok Pasteurella Egyéb pasteurella fajok Ornithobacterium rhinotracheale Actinobacillus Haemophilus Brucella Bordetella Moraxella Pseudomonas Aeromonas Vibrio Campylobacter iv
5 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia Helicobacter Arcobacter Spirochaeták Serpulina Serpulina hyodysenteriae Chlamydiák Chlamydia psittaci Rickettsiák Mycoplasmák Ureaplasma Acholeplasma Gombák Dermatophytonok Dimorf gombák Virológia Általános virológia A vírus fogalma A vírusok eredete A vírusok szaporítása Vírusok szaporítása kísérleti állatokban Vírusok szaporítása embrionált tyúktojásban Vírusok szaporítása sejt- és szövettenyészetekben A vírusok tisztítása és koncentrálása A vírusok morfológiája Vírusmorfológiai vizsgáló módszerek Vírusmorfológia A vírusok kémiai összetétele és vizsgáló módszerei Nukleinsavak A vírusnukleinsavak vizsgálata A vírusfehérjék szerepe és felosztása Fehérjevizsgáló módszerek Lipidek Szénhidrátok A vírusok szaporodása (multiplikációja) Adszorpció Penetráció Dekapszidáció (uncoating) Makromolekulák szintézise Virionok összeépülése Virionok kiszabadulása a sejtből A vírus és környezetének kölcsönhatásai Mutáció Vírus vírus kapcsolatok Vírus vírus kapcsolat a genom szintjén Vírus vírus kapcsolat a fehérje szintjén Vírus sejt kapcsolatok Interferonok Sejttranszformáció (oncogenesis) Az oncogenitás mechanizmusa Latens fertőzés Perzisztáló fertőzés Lítikus fertőzés (cytolysis) Vírus szervezet kölcsönhatások A vírus bejutása és terjedése a szervezetben A vírusfertőzés típusai Latens fertőzés Krónikus fertőzés Lassú fertőzések A vírusfertőzések diagnosztikája v
6 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia A vírusok direkt kimutatása A vírusok indirekt kimutatása Védekezés a vírusfertőzések ellen A vírusok ellenálló képessége Fertőtlenítő- és inaktiválószerek Vírusellenes kemoterápia Interferonok és interferoninducerek Szérumok Részletes virológia DNS-vírusok Parvoviridae Parvovirusok Dependovirusok Papovaviridae Papillomavirusok Polyomavirusok Herpesviridae A háziállatok fontosabb herpesvirusai Madarak jelentősebb herpesvirusai Humán herpesvirus-fertőzések Adenoviridae Emlős háziállatok fontosabb adenovirusai Humán adenovirusok Poxviridae Háziállatok fontosabb poxvirusai Hepadnaviridae Nem besorolt DNS-vírusok Az afrikai sertéspestis vírusa Csirkeanaemia-vírus RNS-vírusok Reoviridae A háziállatokat megbetegítő fontosabb reovirusok Birnaviridae A gazdasági haszonállatokat megbetegítő legfontosabb birnavirusok Picornaviridae A háziállatokat megbetegítő fontosabb picornavirusok Caliciviridae A háziállatokat megbetegítő fontosabb calicivirusok Togaviridae A háziállatokat megbetegítő fontosabb togavirusok Flaviviridae A háziállatokat megbetegítő fontosabb flavivirusok Coronaviridae A háziállatokat megbetegítő fontosabb coronavirusok Orthomyxoviridae A háziállatokat megbetegítő influenzavirus A és B genusba tartozó vírusok Mononegavirales Paramyxoviridae A háziállatokat megbetegítő fontosabb paramyxovirusok Filoviridae A Filoviridae családba tartozó fontosabb vírusok Torovirus genus A háziállatokból kimutatott fontosabb torovirusok Rhabdoviridae A haszonállatokat megbetegítő fontosabb rhabdovirusok Bunyaviridae A háziállatokban megbetegedéseket okozó fontosabb bunyavirusok Arenaviridae Az állatorvosi-közegészségügyi szempontból jelentős arenavirusok vi
7 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia Retroviridae A háziállatokat megbetegítő fontosabb retrovirusok Még nem csoportosított RNS-vírusok Bakteriofágok Néhány fontosabb fág Prionok Az állatok prionmegbetegedései Immunológia Immunológia, immunitás, immunrendszer Az immunológia története Az immunitásról általában Az emlősök immunrendszere Centrális (primer) nyirokszervek Perifériás (szekunder) nyirokszervek Phagocytarendszer Lymphocyták Receptorok B-lymphocyták NK (natural killer) sejtek Antigének Az antigének kémiai sajátosságai Az antigének specificitása Az immunrendszer molekuláris egységei Ellenanyagok (immunglobulinok) Természetes ellenanyagok Monoclonalis ellenanyagok Az ellenanyagképzés elméletei Az ellenanyagképzés genetikája MHC hisztokompatibilitási antigének (major histocompatibility complex) MHC I antigének MHC II antigének Házi emlősállatok MHC-antigénjei Lymphokinek és cytokinek Lymphokinek Interleukinek Interferonok Az immunválasz kinetikája Humorális immunválasz Primer immunválasz Szekunder immunválasz Celluláris immunválasz Baktériumokkal szembeni immunválasz Vírusokkal szembeni immunválasz Parazitákkal szembeni immunválasz Gombákkal szembeni immunválasz Transzplantátumokkal szembeni immunválasz Az alotranszplantátumok kilökődésének pathologiája A graft versus host (GHV) reakció pathologiája Nem kilökődő szövet- és sejtféleségek A transzplantáció prognosisa A hisztokompatibilitási antigének és a szövetkilökődés Immunszuppresszív szerek és a transzplantátumok túlélése Daganatokkal szembeni immunválasz Tumorantigének Tumorral társult antigének Tumorra specifikus antigének Differenciálódási antigének Daganatokkal szembeni immunológiai reakciók A daganatsejtek eliminálását gátló mechanizmusok vii
8 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia A daganatok terápiájának lehetőségei Immuntolerancia A magzatok immunválasz képessége Az újszülött állatok immunválasz képessége Az újszülöttek nem specifikus védelmi rendszere Természetes passzív (maternalis) immunitás A maternalis ellenanyagok hatása az újszülöttek immunválasz képességére Az immunkompetencia kialakulása Nem specifikus védelmi rendszerek Gyulladás A komplementrendszer Természetes ellenállás A halak immunrendszere Nem specifikus védekezési mechanizmusok Specifikus védekezési mechanizmusok A madarak immunrendszere Hisztokompatibilitási antigének Immunglobulinok Az embriók immunválasz képessége Szikimmunitás Az immunrendszer phylogenesise Immundeficienciák Primer immundeficienciák Szekunder immundeficienciák Lymphoproliferatív folyamatok okozta deficienciák Autoimmunitás Fiziológiás autoimmunitás Pathologiás autoimmunitás Szervspecifikus autoimmun betegségek A tüdő autoimmun betegségei Az emésztőcső autoimmun betegségei A vese autoimmun betegségei A nemi szervek autoimmun betegségei A szem autoimmun betegségei Az idegrendszer autoimmun betegségei Az endokrin rendszer autoimmun betegségei Az izmok autoimmun betegségei Autoimmun dermatitis Hemolitikus anaemiák Autoimmun thrombocytopenia Szisztémás autoimmun betegségek Szisztémás lupus erythematosus (SLE) Rheumathoid arthritis Allergia I. típusú hypersensitivitás (anaphylaxia) Szérumbetegség Atopiás allergia (idyosyncrasia) II. típusú hypersensitivitás III. típusú hypersensitivitás, immunkomplex- (IC-)képződés (Arthus-féle reakció) IV. Késői típusú (sejt közvetített) hypersensitivitás Az immunprophylaxis Passzív immunizálás (szérumterápia) Aktív immunizálás (vakcinázás) Attenuált vakcinák Inaktivált vakcinák Antigéneket tartalmazó vakcinák Kombinált oltóanyagok Szintetikus vakcinák viii
9 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia Bioszintetikus (rekombináns) vakcinák Anti-idiotípus vakcinák ISCOM (immunstimulating complex) vakcinák Az immunprophylaxis lehetőségei és korlátai Adjuvánsok A vakcinákkal szemben támasztott igények Immunmoduláció Immundiagnosztika Szerológiai próbák Celluláris próbák Jelzéses módszerek Allergiás diagnosztikai próbák Irodalom ix
10 Az ábrák listája 1. A baktériumsejt szerkezete. Osztódó Listeria monocytogenes. Az éppen lefűződő két sejtben a maganyag szétvált, az osztódás csaknem befejeződött, miközben a harmadik leánysejtben a maganyag szétválása éppen folyamatban van, a sejt lefűződése még épphogy csak megkezdődött. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) Osztódó Listeria monocytogenes, mindkét leánysejtben a cytoplasmamembránból betüremkedő nagyméretű mezoszóma (membrántest). A mezoszóma érintkezik a maganyaggal. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) Osztódó Staphylococcus aureus. Az újonnan képződött két sejtben az osztódás tovább folytatódik, jól látható a mezoszóma. A vastag sejtfalat kívülről burok veszi körül. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) Corynebacterium pseudotuberculosis. Középen a gombolyagszerűen feltekeredett DNS. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) Erysipelothrix rhusiopathiae. Hosszú, karcsú pálcika, vastag, a Gram-pozitívakra jellemző sejtfal. Jól látható a nukleáris állomány, a mezoszóma és a poliriboszómaszemcsék tömege. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) Actinomyces pyogenes. Az osztódó sejtet először egy vékony cytoplasmamembrán fűzi ketté. A membrán mindkét leánysejtben kapcsolatban van a kromoszómával. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) Osztódó Escherichia coli. A maganyag szétválása még folyamatban van, miközben a két sejt lefűződése is előrehaladt. A sejtfal vékony és rajta kívülről a lipopoliszacharid réteg (külső membrán). (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) 8 8. Az Escherichia coli peptidoglükánjának szerkezete. Az egymással párhuzamosan futó heteroglükánláncokat két azonos tetrapeptid alegység kapcsolja össze A Staphylococcus aureus peptidoglükánjának a vázszerkezete. (M = N-acetil-muraminsav; G = N- acetil-glükózamin) Glicerin teichosav. Ala = alanin, R = hidrogén, glükóz, aminocukrok stb A Salmonella typhimurium lipopoliszacharidjának szerkezete.kdo = keto-dezoxi-oktánsav, Hep = glicero-mannoheptóz, Glü = glükóz, Gal = galaktóz, P = foszfát Csillós Escherichia coli baktérium. (45 000, az Országos Állategészségügyi Intézet felvétele) Fimbriák Escherichia coli baktériumok felületén ( ) Clostridium tetani spóraszerkezete ( , az Országos Állategészségügyi Intézet felvétele) A glükolízis folyamata. A kettős nyilak a glükózból keletkezett 2 molekula glicerin-aldehid reakcióit jelzik; egy molekula glükózból összesen 2 molekula piroszőlősav, 2 ATP, 2 NADH+2 H + keletkezett Az Enterobacter aerogenes glükózfermentációja és lehetséges végtermékei A lactobacillusok glükózfermentációja Az alaninlebontás lehetséges folyamatai a baktériumokban A baktériumok szaporodásának szakaszai. A lag, B exponenciális, C stacioner, D regresszív fázis A penicillinek szerkezete A szulfonamidok és a diamino-pirimidinek támadáspontja a folsavszintézisben Staphylococcus aureus antibiotikum-érzékenységének vizsgálata Resistest-korongokkal Escherichia coli laktóz operonjának és kapcsolt regulátorgénjének szerkezete. A laktóz operon a kromoszóma 10. percében helyeződik; a számok az egyes génekben, lókuszokon talált bázispárok számát mutatják Fágkonverzió okozta antigénszerkezet-változás a Salmonella E-csoportban Egy R-plazmid szerkezeti modellje Az A-E jelzi a plazmid transzferjében szerepet játszó gének, rezisztenciatranszfer-faktorok egy részét; Nm = neomicin, Km = kanamicin, Sm = streptomicin, Szu = szulfonamidok, Kl = kloramfenikol, Te = IS-elemek segítségével a plazmidba épülő tetraciklinrezisztencia, transzpozon Bacillus anthracis egér lépében (tolridiukékkel festve, 1250 ) Clostridium septicum fonalai tengerimalac hashártyájáról készített kenetben (fukszinnal festve, 1250 ) Clostridium tetani levestenyészetből, spórák és vegetatív alakok (Gram-festés, 1250 ) Clostridium botulinum levestenyészetből (Gram-festés, 1250 ) x
11 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia 30. Staphylococcus aureus agartenyészetből (Gram-festés, 1250 ) Streptococcus equi subsp. zooepidemicus levestenyészetből (Gram-festés, 1250 ) Erysipelothrix rhusiquthiae telepek neomicint tartalmazó szűrőpapír körül Listeria monocytogenes agartenyészetből (Gram-festés, 1250 ) Actinomyces pyogenes véresagarról (Gram-festés, 1250 ) Mycobacterium bovis szarvasmarha nyirokcsomóban (Ziehl Neelsen-festés, 1250 ) Mycobacterium bovis, M. tuberculosis és M. avium telepei Petragnani-féle tojás táptalajon Dermatophilus congolensis agartenyészetből. Elágazódó, haránt feltöredezett fonalak (Gram-festés, 1250 ) Escherichia coli telepek neutrálvörös-laktóz agaron Salmonella typhimurium telepek bizmut-szulfit-agaron Fusobacterium necrophorum fonalak elhalt szövetekben (fukszinnal festve, 1250 ) Actinobacillus (Haemophilus) pleuropneumoniae agar táptalajon Staphylococcus dajkatelepek mellett Haemophilus paragallinarum telepek főtt vért tartalmazó agartáptalajon, Staphylococcus dajkatenyészet mellett Brucella abortus vetélt szarvasmarhamagzat burkában, intracellulárisan (Köster-féle festés, 1250 ) Bordetella bronchiseptica agartenyészetből (Gram-festés, 1250 ) Campylobacter fetus subsp. venerealis agartenyészetből (Gram-festés, 1250 ) Serpulina hyodysenteriae agartenyészetből (fukszinnal festve, 1250 ) Serpulina hyodysenteriae elektronmikroszkópos képe (8000 ) Leptospira pomona elektronmikroszkópos képe (8000 ) Chlamydia psittaci vetélt juhmagzatban (30 000, az Országos Állategészségügyi Intézet felvétele) Mycoplasma bovis elektronmikroszkópos képe ( , az Országos Állategészségügyi Intézet felvétele) Mycoplasma arginini telepei agaron (Stipkovits László anyagából) Rhizopus sp. sporangiumának felépítése (fukszinfestés, 1250 ) Aspergillus fumigatus tenyészet Sabouraud-agaron Penicillum sp. spóratartó képletei (fukszinfestés, 1250 ) Candida albicans Sabouraud-agarról (fukszinfestés, 1250 ) Vírusok szaporítása embrionált tyúktojásban. Az embrionált tyúktojás szerkezetének és a choroallatois hártyára történő oltásnak a sematikus rajza Egyrétegű sejttenyészet készítése Sejtklónozás Vírustisztítás és -koncentrálás affinitás kromatográfiás eljárással Vírustisztítás és -koncentrálás gradiens ultracentrifugálással (inkomplett és komplett virionok) Negatívkontraszt-EM technika Vírusárnyékolás A virionpartikula (adenovirus) szerkezete. A római számok az egyes struktúrpolipeptidek sorrendjére utalnak a poliakvilamid gélben végzett elektroforézist követően Helikális szimmetriájú virion Az ikezahedron képe élközéppontos, lapközéppontos és tengelyszimmetrikus vetületben Kapszomerek felépítése (trimerek, penta- és hexamerek, dimerek) Binális szimmetriájú virion Komplex szimmetriájú virion Vírusnukleinsav-térképezés (dr. Benkő Mária felvétele). Az egyes sávokban restrikciós enzimmel kezelt vírusnukleinsav-fragmensek elektroforetikus képe látható. Az elektroforetogram azonossága a vizsgált vírusminták azonosságát valószínűsíti (pl. az 1. és 3., valamint a 7. és 9. minta Ragadós végű fragmensek Nukleinsav-klónozás Nukleinsav hibridizációs eljárás Heteroduplex technika A vírus-dns-nukleotidsorrend meghatározásának sematikus rajza Nukleotidsorrend meghatározáshoz használt poliakrilamid gél fényképe (dr. Benkő Mária felvétele) Hibridomasejt-előállítás folyamata xi
12 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia 77. Hibridomasejt mikroszkópos képe (A: egy B-lymphocytából és egy myelomasejtből, B: két lymphocytából és két myelomasejtből összeolvadt hibridomasejt) Vírusok szaporodásának lépései (magyarázat a szövegben) Vírusok szaporodási ciklusa Az adszorpciós fehérjék speciális elhelyeződése A penetráció általános formái (magyarázat a szövegben) Dupla szálú DNS-vírusok (DNS/2) makromolekuláinak szintézise (Lomniczi (1978) után módosítva). Magyarázat a szövegben Szimpla szálú DNS-vírusok (DNS/1) makromolekuláinak szintézise (parvovirus) Pozitív szálú RNS-vírusok (+/RNS) makromolekuláinak szintézise (magyarázat a szövegben) Negatív szálú RNS-vírusok (-RNS) makromolekuláinak szintézise(magyarázat a szövegben) Dupla szálú RNS-vírusok (RNS/2) makromolekuláinak szintézise (magyarázat a szövegben) Pozitív szálú RNS-t DNS-re átíró vírusok (+/RNS/DNS/2) makromolekuláinak szintézise (magyarázat a szövegben) Vírusok nukleokapszidjainak összeépülése (magyarázat a szövegben) Vírusok kiszabadulása az eukaryota sejtből bimbózással (budding) A rekombináció típusai (magyarázat a szövegben) Orthomyxovírusok rekombinációja (antigén csuszamlás) Fenotípusos keveredés, transzkapszidáció (magyarázat a szövegben) Vírus sejt kapcsolatok (Lomniczi (1978) után módosítva) A vírusfertőzések típusai a sejt szintjén Az interferonok indukciója Az interferonok vírusellenes hatása Malignus transzformáció (mikrotumor) egyrétegű szövettenyészetben (900 ) (Nász I. felvétele) A c-onc- és v-oncgének elhelyeződése a genomban A sejtzárványok típusai (Fenner (1987) után módosítva) cytoplasma Vírusok cytopathogen hatása (sejtlekerekedés). Aujeszky-vírussal (K-61 törzs) fertőzött sertésvesesejt (SEM 1400 x) Vírusok cytopathogen hatása (syncytium) Aujeszky-vírussal (utcai vírustörzs) fertőzött sertésvesesejtek (SEM 1400 ) Nem fertőzött egyrétegű sertésvese-sejttenyészet (SEM 1400 ) Enterális kórképet okozó vírusok támadáspontja A perzisztáló vírusfertőzések típusai (Fenner (1987) után módosítva) A vírusizolálás folyamata Plakkok szövettenyészetben Reovirusok elektronmikroszkópos képe fertőzött sejtben (Az Országos Állat-egészségügyi Intézet felvétele) Rotavirusok immun-elektronmikroszkópos képe (Az Országos Állat-egészségügyi Intézet felvétele) Parainfluenza 3 vírus IF képe fertőzött sejt cytoplasmájában (dr. Köves Béla felvétele) Adenovírus IF képe fertőzött sejtmagban Filterhibridizációs eljárás Polimeráz-láncreakció (PCR) folyamatábrája Vírusneutralizáció hatásmechanizmusának sematikus képe (A: eredményes vírusfertőzés, B: neutralizáló ellenanyagok jelenlétében a vírus nem tud fogékony sejtreceptorához kapcsolódni) Plakkszámlálással történő infektív titermeghatározás szövettenyészeten (Dr. Kükedi András anyagáról készült felvétel) Hemagglutináció-gátlás sematikus képe Hemagglutináció-gátlás Egyes vírusellenes szerek szerkezeti képlete Bovin parvovirus (Az Országos Állategészségügyi Intézet archívumából) Ritchie A. felvétele Parvovirusgenom Parvovirusok szaporodása Bovine papillomavirus (EM). (Az Országos Állategészségügyi Intézet archívumából) Ritchie A. felvétele Papillomavirusok elhelyezkedése a papillomában Papillomák kutya szájában Szarvasmarha herpesvirus (BHV 3) (Országos Állategészségügyi Intézet archívuma, Ritchie A. felvétele) (EM) xii
13 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia 125. Herpesvirus genom osztályok Herpesvirusok multiplikációja. Murray és mtsai. (1990) után módosítva Adenovirus negatív kontraszt elektronmikroszkópos képe (Országos Állategészségügyi Intézet archívumából) Ritchie A. felvétele Adenovirusok multiplikációja Adenovirusok CP-hatása: zárványképződés borjúvese szövettenyészeten Poxvirus (papagájhimlő) virionjának EM képe. (Országos Állategészségügyi Intézet archívumából) Ritchie A. felvétele Poxvirusok multiplikációja Poxvirus zárványok Poxvirus által okozott pockok CAM-on Hepadnavirus szerkezete Hepadnavirusok multiplikációja (Murray és mtsai. (1990) után módosítva) Afrikai sertéspestis vírus sematikus képe Afrikai sertéspestis: hemadszorpció és cytoplasmazárványok fertőzött sertéslymphocytatenyészetekben Reovirus virionjainak negatívkontraszt-elektronmikroszkópos képe (Ritchie, A. felvétele) Birnaviridae. A fertőző bursitis vagy gumboroi betegség vírusával fertőzött sejt EM képén jól látható a citoplasmazárványokban a virionok parakristályos rendeződése. (Az Országos Állategészségügyi Intézet archívumából.) Picornavirus virionjainak negatívkontraszt-elektronmikroszkópos képe (Ritchie, A. felvétele) Calicivirus virionjainak negatívkontraszt-elektronmikroszkópos képe (Ritchie, A. felvétele) Coronavirus virionjának negatívkontraszt-elektronmikroszkópos képe (Ritchie, A. felvétele) Orthomyxovirus (sertésinfluenza) virionjának negatív kontraszt elektronmikroszkópos képe (Ritchie, A. felvétele) Paramyxovirus (parainfluenza 3) virionjának negatívkontraszt-elektronmikroszkópos képe (Ritchie, A. felvétele) Rhabdovirus (VSV - New Jersey) virionjának negatívkontraszt-elektronmikroszkópos képe (Ritchie, A. felvétele) A retrovirusok csoportosítása A bakteriofágok csoportosítása Prionmolekula szerkezete A fertőző fehérje modell (magyarázat a szövegben) Az agyszövet alapállományának szivacsszerűvé válása (spongioform encephalopathia). Szarvasmarha BSE (külföldi eset) (dr. Vetési Ferenc felvétele) A thymus kéreg- és velőállománya (hematoxilin-eozin festés, 160 ) Plazmasejtek csoportja a lép folliculusaiban (ELMI, 14500, az OÁI felvétele) Centrum germinativum a nyirokcsomóban (hematoxilin-eozin festés, 160 ) A SALT működése Macrophagok receptorai T-lymphocyták receptorai A lymphocyták differenciálódása B-lymphocyták receptorai Kemospecifikus antigének Az immunglobulinok alapszerkezete Az immunglobulinok doménszerkezete Az immunglobulin molekula fragmentumai Az IgG-molekula felépítése Az IgM-molekula felépítése Az IgA-molekula felépítése Anti-idiotípus antitestek Hibridomasejtek előállításának vázlata Az Ig-ok képződésének genetikája Az MHC-fehérjék és a T-sejt receptorszerkezete A T-sejt-felismerés mechanizmussa Primer immunválasz Szekunder immunválasz A kettős felismerés modellje A T-sejt-aktiválódás módja xiii
14 Állatorvosi járványtan I. - Állatorvosi mikrobiológia, bakteriológia, virológia, immunológia 175. A bakétriumokkal szembeni immunválasz Virusokkal szembeni immunválasz Parazitákkal szembeni immunválasz A transzplantátum sorsa a recipiensben (I. R. Tizard után) A transzplantátum kilökődése A daganatsejt felületi antigénjei A daganatsejt és az immunrendszer kölcsönhatása NK sejt felületi struktúrája A B-sejtes tolerancia formái Az immuntolerancia kiváltása egerekben A szarvasmarhamagzat immunológiai fejlődése A szarvasmarhamagzat immunválasz képessége A maternalis immunitás formái A maternlis Ig-ok felszívódása borjakban A colostrum-ig-ok felszívódása az enterocytákban (ELMI, ) Ig-ok az enterocyták plazmájában (ELMI, ) Colostrumból származó lymphocyta az epithelsejtekben (ELMI ) A komplementrendszer működése A Cooper-féle séma A pemphigus formái (I. R. Tizard után) Az anaphylaxiás reakció vázlata A cytotoxikus reakció vázlata IC-k az endothelsejtekben IC-k a tüdőszövetben IC-k a veseglomerulusokban A plazmidklónozás vázlata A vakcinázást követő immunstatus alakulása Az ABR próba Az antiglobulin-próba vázlata A Marrack-féle rácselmélet Az identitási reakciók Az AGP próba A Mancini-féle próba Szérumfehérjék immun-elektroforézise Szérumfehérjék immun-elektroforézise agarközegben Rocket-elektroforézis A direkt komplement kötési próba vázlata Az indirekt komplementkötési próba vázlata ELISA próba vázlata Adenovírusok kimutatása szövettenyészetben Direkt IF eljárás Indirekt IF eljárás xiv
15 A táblázatok listája 1. Egyes Clostridium fajok morfológiai és biokémiai sajátságai A C. perfringens fontosabb toxinjai és az okozott kórképek Az állatokban gyakran előforduló Staphylococcus fajok biokémiai sajátságai A fontosabb Streptococcus fajok biokémiai sajátságai A fontosabb Enterobacterium nemzetségek biokémiai tulajdonságai Egyes Salmonella szerotípusok antigénjei (Kauffmann White-séma) A fontosabb Pasteurella fajok biokémiai sajátságai A Brucella fajok és biotípusok tulajdonságai A fontosabb Campylobacter fajok biokémiai tulajdonságai A háziállatokban előforduló fontosabb Leptospira-szerotípusok és az okozott kórképek Az állatokban előforduló fontosabb Mycoplasma fajok és az általuk okozott kórképek Baltimore-féle genetikai rendszer A vírus és környezetének függőségi viszonyai A vírusok geno- és fenotípusában bekövetkező változások A vírusokban bekövetkező mutációk típusai és eredményei Interferonok típusai és fizikokémiai jellemzői (egér interferon) Retrovirus gének és funkciójuk Vírusok cytopathogén hatása Perzisztáló fertőzések kialakulásának okai Állatok parvovirusok okozta megbetegedései A parvovirus-fertőzés eredménye vemhes sertésben Papillómavirusok által okozott megbetegedések Papillómavírusok által okozott kórképek Aujeszky-vírus fehérjéinek biológiai szerepe Alphaherpeszvirinae alcsaládba tartozó vírusok Betaherpesvirinae alcsaládba tartozó vírusok Gammaherpesvirinae alcsaládba tartozó vírusok Adenovirusok taxonómiája Adenovirusok strukturproteinjei A Chordopoxvirinae alcsaládba tartozó vírusok A prionok által okozott megbetegedések állatokban és emberben A proinok inaktiválása A thymectomia és a bursectomia következményei Lymphocyták százalékaránya a perifériás vérben Az antigén molekulatömege és antigénhatása közötti összefüggés Az immunglobulin osztályok sajátosságai Szérum immunglobulinok koncentrációja háziállatokban (mg/100 ml) Ember, házi- és laboratóriumi állatok immunglobulin-osztályai és -alosztályai Az immunglobulinok mennyisége a colostrumban és a tejben (mg/ml) Ig-ok felezési ideje napokban Az immunrendszer phylogenesise Primer immundeficienciák háziállatokban Szekunder immundeficienciák háziállatokban A lymphoid szöveteket károsító vírusok Autoimmun kórképek A kutyák hemolitikus anaemiája A túlérzékenységi reakciók Vércsoport antigének háziállatokban A vakcinák típusai Élő és inaktivált vakcinák összehasonlítása Immunmoduláló szerek Szerológiai próbák A szerológiai próbák érzékenysége, a próbákkal kimutatható proteinek mennyisége xv
16 Köszönetnyilvánítás A szerzők megköszönik a lektorok észrevételeit és tanácsait, amelyek segítettek a könyv végleges anyagának kialakításában. Köszönik továbbá a bakteriológia egészéhez (Fodor László), illetve egyes fejezeteihez (Stipkovits László, Szigeti Gábor, Veresegyházi Tamás) adott szakmai tanácsokat, Bakonyi Tamás, Makrai László, Soós Pál tanszéki munkatársaknak pedig a könyv szerkesztéséhez nyújtott segítségét. Köszönet illeti a társintézményeket (ÁOTE Kórbonctani és Igazságügyi Tanszék, Freie Universität Berlin, MTA Állatorvostudományi Kutató Intézet, Országos Állategészségügyi Intézet) a könyv képanyagának gazdagításáért. xvi
17 Előszó Tanszéki elődeink (Preisz, Aujeszky, Hutÿra, Manninger, Szent-Iványi) egyedülálló szellemiségük mellett örökül hagyták ránk nemcsak a mikrobiológia és a fertőző betegségek összefüggéseinek kutatását, hanem az oktatás töretlen korszerűsítésének feladatát is. Az Állatorvosi mikrobiológia (bakteriológia, virológia, immunológia, szerk.: Szent-Iványi Tamás) legutóbbi kiadása óta 15 év telt el. Ez idő alatt a diszciplina alapvető változásokon ment át, amikor a molekuláris biológia rohamos fejlődése lehetővé tette a mikrovilágban végbemenő szüntelen változások és módosulások megismerését, értelmezhetővé tette az embert és az állatvilágot fenyegető fertőző betegségek körének új kórképekkel való bővülését, vagy a korábban klasszikusnak ismert betegségek módosult járványtani sajátosságokban való megjelenését. A mikrobiológia interdiszciplináris tudományág, ennek megfelelően könyvünk tartalmazza mindazokat az ismereteket, amelyek a korszerű bakteriológia, virológia és immunológia területén összegyűltek, de elsősorban a fertőző betegségek oktatnának, járványtanának, pathogenesisének, és immunprophylaxisának megalapozását szolgálja. A szaknyelvi írásmód tekintetében az Orvosi helyesírási szótárban (szerk.: Fábián P., Magos P., Akadémiai Kiadó, Budapest 1992.) leírtakat követtük. Reméljük, hogy a könyvet nemcsak az egyetemi hallgatóink, hanem a mikrobiológia különböző területeit művelő szakemberek és gyakorló kollégáink is hasznosíthatják. Budapest, január. A szerkesztő xvii
18 Rövidítések jegyzéke ADCC = antibody dependent cellmediated cytotoxicity AGP = agargél precipitációs próba ALV = madár leukózis vírus APC = antigen presenting cells c-onc = sejt onkogénje CAM = chorioallantois membrán CD = cluster of differentiation CP = cytopathogen CPE = citopathogén hatás DI = defektív interferáló (partikula) Dnáz = dezoxiribonukleáz DNS = dezoxiribonukleinsav ECF = eosinophil chemotactic factor ELISA = enzyme linked immunosorbent assay EM = elektronmikroszkóp ESP = eosinophil stimulation promoter Fab = fraction antigen binding FC = fraction crystalisable GALT = gut associated lymphoid tissue H-E = hematoxilin eozin H-lánc = haevy (nehéz) polipeptidlánc H= hemagglutinin-fehérje HA = hemagglutináció(s) HAG = hemagglutináció(s) IEM = immunelektronmikroszkópos IF = immunfluoreszcencia IFN = interferon Ig = immunglobulin IIF = indirekt immunfluoreszcencia IL = interleukin J-lánc = joining (kötő) lánc xviii
19 Rövidítések jegyzéke KK = komplementkötési próba L-lánc = light (könnyű) polipeptidlánc LAT= latenciához kapcsolódó transzkript MHC = major histocompatibility complex mrns = messenger (hírvivő) RNS N = neuraminidáz-fehérje NK = natural killer sejt NP = nukleoprotein PCR = polymerase chain reaction PFU = plaque forming unit PrP = prion protein RIA = radio immuno assay RNáz = ribonukleáz RNS = ribonukleinsav RSV = Rous-szarkóma virus S = Svedberg konstans SALT = skin associated lymphoid tissue SEM = scanning elektronmikroszkóp SPF = specific pathogenic free (specifikus kórokozóktól mentes) TCID 50 = tissue culture infective dose Th = T-helper lymphocyta Ti = T-iniciator lymphocyta Tk = T-killer lymphocyta Tm = T-memória sejt TNF = tumor necrosis factor trns = transzfer RNS Ts = hőérzékeny mutáns (temperature sensitive) V-onc = vírus onkogénje VN = vírusneutralizáció xix
20
21 1. fejezet - Bakteriológia 1. Általános bakteriológia 1.1. A baktériumok jellemzése és helyük az élők világában A baktériumok a legegyszerűbb sejtszerkezetű, egysejtű, önálló életre képes mikroorganizmusok, a természetben csaknem mindenütt megtalálhatók. A talajban, a természetes vizekben, a levegőben, a növényzeten, az emberi és állati test felületén, továbbá a külvilággal közvetlen összeköttetésben álló szervekben (emésztőcsatornában, légutakban, húgy- és nemi utakban stb.) egyaránt előfordulnak. Az egy adott helyen előforduló baktériumok faja és száma általában jellemző (természetes baktériumflóra), bár a rendelkezésre álló tápanyagok milyenségétől és egyéb környezeti feltételektől függően tág határok között változik. A baktériumoknak igen sok faja ismert, ezek túlnyomó többsége ártalmatlan, saprophyta, amelyek a természetben szabadon élnek és különféle elhalt növényi és állati eredetű szerves és szervetlen anyagokat használnak fel, bontanak le vagy alakítanak át anyagcseréjük során A saprophyta baktériumok biológiai jelentősége mégis igen nagy, mert más mikroorganizmusokkal együtt, anyagcsere-folyamataik révén részt vesznek a szén, a nitrogén és más elemek természetes körforgalmában, és ezzel hozzájárulnak a magasabb rendű szervezetek létfeltételeinek a megteremtéséhez. A baktériumok elenyésző töredéke betegséget képes előidézni, azaz pathogen (pathos=szenvedni). Az orvosi és állatorvosi bakteriológia elsősorban a pathogén fajokkal foglalkozik. A baktériumok rendszertani helye ma sem teljesen tisztázott. Sejtszerkezetük alapján a baktériumokat a kékeszöld algákkal (cyanobacteriumokkal) együtt a sejtmag nélküli prokaryota élőlények, a baktériumoknál magasabb rendű szervezeteket pedig, így a növényi és az állati, egy- és többsejtű organizmusokat is az eukaryota, a valódi sejtmagot tartalmazók csoportjába soroljuk. A baktériumok elnevezése a Linné-féle binominális nómenklatúra alapján a nemzetség (genus) és a faj (species) megjelölésével történik. A nemzetséget nagy, a fajt kis kezdőbetűvel írjuk. 2. A baktériumok morfológiája 2.1. A baktériumok alakja és nagysága A baktériumok gömb, pálcika vagy spirális alakúak. A gömb alakúak (coccusok) átlagos átmérője 1 µm. A gömb lehet szabályos, de zsemle, bab, vese vagy lándzsa alakú is. A coccusok osztódásuk után szétválhatnak egymástól, vagy együtt maradva kéttagú (diplococcus) vagy többtagú láncokat (streptococcus) alkotnak. Vannak azonban olyan fajok is, amelyek a tér különböző irányaiba osztódva négytagú (tetragenus), nyolctagú (sarcina) csoportokat vagy szabálytalan, szőlőfürtszerű halmokat (staphylococcus) alkotnak. A pálcika alakú baktériumok (bacillusok) rendszerint 2 5 µm hosszúak, szélességük 0,5 1 µm. Vannak azonban ennél hosszabb, 5 10 µm hosszú vagy egészen rövid coccoid alakú baktériumok is. A pálcika alakú baktériumok néha megnyúlnak, hosszú fonalakat képeznek. A fonalak hosszúsága akár a 100 µm-t is elérheti. A pálcikák alakja lehet szabályos egyenes vagy kissé görbült. A pálcikák két vége egyes baktériumfajoknál kihegyesedik, ilyenkor orsó alak jön létre (fusiform baktériumok), vagy egyik vége bunkószerűen megvastagodik (corynebacterium). A pálcika alakú baktériumok néha jellegzetes térbeli alakzatokat formálnak, hosszú láncokat képeznek, párhuzamosan egymás mellett helyeződnek (paliszád forma) vagy egy-egy pontjukon egymáshoz tapadva X, Y vagy a kínai írásjelekre emlékeztető alakokat formálnak. A csavart, spirális alakú baktériumok általában 1 5 µm hosszúak, szélességük 0,5 1 µm, vannak azonban olyan fajok is, amelyek hosszúsága akár a 100 µm-t is meghaladhatja. A spirális alakú baktériumok, ha csak egy csavarulatuk van, vessző (comma), ha azonban több, S alakúak, vagy dugóhúzószerűen csavartak (spirillumok). A spirillumokhoz hasonló alakú, de azoktól eltérően nem merev, hanem hajlékony mikroorganizmusok a spirochaeták. A pathogen spirochaeták hossza általában 5 30 µm között változik, a saprophyta spirochaeták hossza azonban ennek többszörösét is eléri. Bár a baktériumok nagysága és alakja az egyes fajokra vagy még inkább azok csoportjaira jellemző, az alakot és a nagyságot lényegesen befolyásolják a környezeti feltételek, így a tenyészet kora, a tenyésztésre használt 1
22 Bakteriológia táptalaj összetétele, a hőmérséklet stb. A fajra jellemző alakú és nagyságú baktériumok a fertőzött, beteg vagy elhullott állatok váladékaiban, szöveteiben, valamint a kóros anyagokból frissen, optimális viszonyok között kitenyésztett tenyészetekben láthatók. Idősebb, többször átoltott vagy kedvezőtlen feltételek között kifejlődött tenyészetekben gyakran jönnek létre a típusostól eltérő, széttöredezett, szemcsés, hólyag, bunkó vagy hosszú fonal alakú, elfajult degenerációs (involúciós) alakok A baktériumsejt szerkezete A baktériumsejt több jellegzetes összetevőből épül fel (1., 2., 3., 4., 5., 6., 7. ábra). Ezek egy része, így a maganyag, a cytoplasma, a cytoplasmahártya és a sejtfal a baktérium léte szempontjából nélkülözhetetlen. Más alkotórészek viszont, így a burok, a csillók, a fimbriák és a spóra, csupán a baktériumok egyes csoportjaiban találhatók meg és legalábbis optimális tenyésztési viszonyok között, in vitro nem létfontosságúak. A baktériumok (és a kékeszöld algák) sejtszerkezete alapvetően különbözik az egy- vagy többsejtű eukaryota szervezetek sejtjeitől egyebek mellett abban, hogy nincs maghártyával körülvett magjuk, hiányzik belőlük az eukaryotákra jellemző sejtszervecskék többsége, sejtfalukban pedig, néhány faj kivételével, olyan speciális szerkezeti anyag (mukopeptid, peptidoglükán, murein) található, amely az eukaryota sejtekben nem fordul elő. 1. ábra - A baktériumsejt szerkezete. Osztódó Listeria monocytogenes. Az éppen lefűződő két sejtben a maganyag szétvált, az osztódás csaknem befejeződött, miközben a harmadik leánysejtben a maganyag szétválása éppen folyamatban van, a sejt lefűződése még épphogy csak megkezdődött. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) 2
23 Bakteriológia 3
24 Bakteriológia 2. ábra - Osztódó Listeria monocytogenes, mindkét leánysejtben a cytoplasmamembránból betüremkedő nagyméretű mezoszóma (membrántest). A mezoszóma érintkezik a maganyaggal. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) 3. ábra - Osztódó Staphylococcus aureus. Az újonnan képződött két sejtben az osztódás tovább folytatódik, jól látható a mezoszóma. A vastag sejtfalat kívülről burok veszi körül. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) 4
25 Bakteriológia 4. ábra - Corynebacterium pseudotuberculosis. Középen a gombolyagszerűen feltekeredett DNS. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) 5
26 Bakteriológia 5. ábra - Erysipelothrix rhusiopathiae. Hosszú, karcsú pálcika, vastag, a Grampozitívakra jellemző sejtfal. Jól látható a nukleáris állomány, a mezoszóma és a poliriboszómaszemcsék tömege. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) 6
27 Bakteriológia 7
28 Bakteriológia 6. ábra - Actinomyces pyogenes. Az osztódó sejtet először egy vékony cytoplasmamembrán fűzi ketté. A membrán mindkét leánysejtben kapcsolatban van a kromoszómával. (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) 7. ábra - Osztódó Escherichia coli. A maganyag szétválása még folyamatban van, miközben a két sejt lefűződése is előrehaladt. A sejtfal vékony és rajta kívülről a lipopoliszacharid réteg (külső membrán). (A Freie Universität, Berlin, Állatorvosi Fakultása Elektronmikroszkópiai Laboratóriumának felvétele) 8
29 Bakteriológia 2.3. A nukleáris állomány A baktériumok prokaryoták, membránnal körülvett magjuk nincs. A nukleáris állomány egyetlen, szabad véggel nem rendelkező, körkörös, gombolyagszerűen felcsavarodott dupla szálú, óriás DNS-molekula, amely rendszerint a sejttest közepén helyeződik, elektronmikroszkópos vizsgálattal jól felismerhető. A felcsavarodott DNS-fonalak tömegét nukleoidnak, baktériumgenomnak, baktériumkromoszómának nevezzük. A DNS-fonalak funkciójukat illetően megfelelnek az eukaryota sejtek DNS-ének, a genetikai információt tárolják. A DNS-fonal egy ponton, legalábbis időszakosan, kapcsolódik a cytoplasmamembránhoz. Valószínű, hogy ez a pont a baktérium hosszirányú növekedésének és a DNS-fonal megkettőződésének a kiindulópontja is. A DNS megkettőződését, amely a növekedő baktériumokban igen gyors és csaknem folyamatos, rendszerint megkésve követi a sejttest osztódása, így a baktériumsejtben, a növekedés stádiumától függően egyszerre 1 4, egyes fajokban azonban ennél is több maganyag található A cytoplasma A baktériumok cytoplasmájának nincs finomabb belső szerkezete. A cytoplasma mintegy 80%-a víz. A cytoplasma tartalmazza a nukleáris állományt, a riboszómákat, fajonként változóan egyéb pl. polimetafoszfát- (metakrómás), poliszacharid-, és lipoidszemcséket stb., ezenkívül oldott állapotban nagyszámú enzimet, egyéb fehérjéket, ribonukleinsavakat és ásványi sókat. A riboszómák nm nagyságú, a cytoplasma fő tömegét adó szemcsék, amelyek kb. 40% fehérjét (polipeptidláncokat) és 60% RNS-t tartalmaznak. A riboszóma-rns szimpla szálú, a bázisok közül adenint, guaniant, citozint, uracilt tartalmaz. A baktériumok riboszómái kisebbek, mint az eukaryota sejtekben található riboszómák, ülepedési sebességük 70 S. A baktériumsejt nyugalmi állapotában a riboszómák több alegységre disszociálódnak. A riboszómák egy része azonos mrns-hez kapcsolódva poliriboszómákat képez. A riboszómák száma a baktériumokban folyó fehérjeszintézisnek megfelelően változik. Számuk a gyors növekedés időszakában a legnagyobb. A baktériumok cytoplasmájának bázikus festékek iránti affinitása zömmel a riboszómaszemcséknek köszönhető. A riboszómán folyik a fehérjeszintézis (transzláció). 9
30 Bakteriológia A riboszómákon kívül a baktériumok egyes csoportjainak cytoplasmájában még egyéb, a riboszómáknál jóval nagyobb, speciális festési eljárásokkal kimutatható szemcsék is találhatók.a metakrómás (volutin-) szemcsék fonalas vagy ciklikus szerkezetű polimetafoszfátokból állnak, bázikus festékek iránt erős affinitásúak. Foszfáttartalékként szolgálnak a sejt anyagcsere-folyamataihoz. A cytoplasmában található poliszacharidszemcsék (pl. glükogén) valószínűen tartalék tápanyagok. Hasonló szerepe lehet pl. a mycobacteriumokban és a corynebacteriumokban található lipoidszemcséknek is A cytoplasmahártya A baktériumok cytoplasmáját a cytoplasmamembrán határolja. Vastagsága 5 10 nm, a membrán szárazanyagának átlagosan mintegy 55 60%-a fehérje, 25%-a pedig lipoid, zömmel foszfolipid. A cytoplasmahártya a fő ozmotikus határfelület a baktériumsejt plazmája és környezete között. A víz, a krisztalloidok és a kis molekulatömegű tápanyagok egy része diffúzió és ozmózis útján jut be a baktériumsejtbe. A legtöbb molekula transzportját azonban specifikus szállító rendszerek, a membránon átnyúló kötőfehérjék és permeázok szabályozzák a baktériumsejt szükségleteinek megfelelően. A cytoplasmahártya igen gazdag enzimekben. Megtalálhatók benne, illetve a felületén a membrán átjárhatóságát szabályozó permeázok, a citrátciklus enzimjei, a citokróm enzimek, a sejtfal szintézisét végző enzimek stb. A cytoplasmahártya a baktériumok egy részénél a plazma felé helyenként zsákszerűen vagy kesztyűujjszerűen betüremkedik. Ezek a betüremkedéseka mezoszómák (membrántestek). A mezoszómák az aktív sejtműködés időszakában nagyobb felületet nyújtanak a megnövekedett enzimaktivitáshoz és valószínűleg részt vesznek a sejtosztódás folyamatának megindításában is. A cytoplasmahártya önmagában nem képes ellenállni a baktériumsejtben uralkodó nyomásnak. Ha a baktériumok felületéről a sejtfalat lizozimmel vagy egyéb, a peptidoglükánt bontani képes enzimmel leoldjuk, vagy kialakulását penicillinnel megakadályozzuk, izotóniás vagy hipotóniás közegben a cytoplasmahártya fölreped és a baktériumsejt szétesik. Hipertóniás oldatban a sejtfaluktól megfosztott baktériumok zsugorodnak, legömbölyödnek s egy ideig életképesek maradnak. A Gram-pozitív baktériumokból előállított, sejtfal nélküli képleteket protoplasztoknak, a Gram-negatív baktériumokból nyert s a cytoplasmahártyán kívül még többkevesebb lipoproteid-, lipopoliszacharid-komplexet is tartalmazó, legömbölyödött baktériumokat pedig szferoplasztoknak nevezzük. A protoplasztok (és szferoplasztok) hipertóniás tápoldatokban fenntarthatók, tömegük egy ideig növekszik, a sejtfal hiánya miatt azonban általában osztódásra képtelenek. A protoplasztok azonban bizonyos körülmények között osztódni képesek. Ezek az L-formák (Lister nevéből). Spontán vagy indukálószerek (pl. lizozim, penicillin) hatására jönnek létre. A mikroszkópos képben függetlenül attól, hogy eredetileg pálcika vagy gömb alakú baktériumokból származtak polimorfok, rendszerint hosszú fonal alakúak. Mivel e fonalak igen vékonyak, áthaladhatnak a baktériumokat visszatartó szűrőkön (szűrhető baktériumok). Az L-formák kevésbé érzékenyek a környezet ozmotikus viszonyaira, mint a protoplasztok. Az L-formák alkalmanként visszaalakulhatnak eredeti baktériumformává A sejtfal A sejtfal a cytoplasmát körülvevő merev, de bizonyos határokon belül tágulni is képes támasztóelem, amely megszabja a baktériumsejt alakját és lehetővé teszi, hogy a sejthártya ellenálljon a cytoplasmában uralkodó nagy ozmotikus nyomásnak. Vastagsága az egyes fajoktól függően nm, a baktériumsejt tömegének mintegy 10 40%-át teszi ki. A sejtfal a bakteriológiában szokásos festési eljárásokkal nem vagy alig festődik meg. Jól feltüntethető azonban, ha a fixált kenetet csersavoldattal pácoljuk, majd ezután festjük. A csersavas kezelés ugyanis megakadályozza a festékoldat bejutását a sejtbe, és így csak a sejtfal festődik meg. A baktériumok sejtfalának merevségét a hálószerűen felépülő peptidoglükán váz adja. A peptidoglükán váz egymással váltakozva kapcsolódó N-acetil-glükózamin- és N-acetil-muraminsav- (amely az N-acetilglükózamin tejsavétere) molekulákból felépülő, hosszanti elrendeződésű poliszacharid fonalakból és az ezeket harántirányban összekötő peptid alegységekből és peptidhidakból áll. A peptid alegységek rendszerint 4 5 aminosav-molekulából állnak (esetenként azonban tri- vagy hexapeptidek) és a peptidoglükán váz muraminsavmolekuláinak tejsavéteréhez kapcsolódnak peptid kötéssel. A Gram-negatív baktériumok többségében, de a Gram-pozitív fajok egy részében is (pl. a Bacillus megateriumban, a Corynebacterium diphtheriaeben) a peptid alegységek közvetlenül kapcsolódnak egymáshoz (8. ábra). 8. ábra - Az Escherichia coli peptidoglükánjának szerkezete. Az egymással párhuzamosan futó heteroglükán-láncokat két azonos tetrapeptid alegység kapcsolja össze 10
31 Bakteriológia A Gram-pozitív baktériumfajok többségében viszont a peptid alegységek nem közvetlenül, hanem peptidhidak segítségével kapcsolódnak egymáshoz (9. ábra). 9. ábra - A Staphylococcus aureus peptidoglükánjának a vázszerkezete. (M = N-acetilmuraminsav; G = N-acetil-glükózamin) 11
32 Bakteriológia Az egyes baktériumfajok között a peptidoglükán váz aminocukor-molekuláinak a tekintetében alig van eltérés, jelentős különbségek vannak azonban a peptid alegységeket és peptidhidakat felépítő aminosavak milyenségében, számában és szekvenciájában. A peptid alegységekben a leggyakoribb a 8. ábrán szereplő aminosav-összetétel (pl. Escherichia coli és Bacillus subtilis fajokban), a diamino-pimelinsavat azonban gyakran lizin (pl. a Staphylococcus aureusban) vagy ornitin (pl. egyes Spirochaeta és Lactobacillus fajokban) helyettesíti. A peptidhidak aminosav-összetétele ugyancsak változatos (glicinből, alaninból, szerinből stb. álló rövid homo- vagy heteropeptidek). Különbség van az egyes baktériumfajok között abban is, hogy míg pl. a Staphylococcus aureus törzsekben a peptidoglükán aminocukor fonalainak mindegyik muraminsav-molekulájához kapcsolódik peptid alegység, s ily módon a peptidoglükán vázat igen szilárddá tevő sok keresztirányú kötés alakul ki,addig az Escherichia coli baktériumok muraminsav-molekuláinak csak mintegy 30%-ához kapcsolódik peptid alegység, ezért a keresztkötések száma kevesebb, a sejtfal vázszerkezete lazább. Bár a peptidoglükán váz hálózatosan az egész sejt felületét összefogja, egy-egy poliszacharid lánc mindössze diszacharid (N-acetil-glükózamin, N- acetil-muraminsav) egységet tartalmaz. A peptidoglükán vázat lipoproteid-molekulák rögzítik a cytoplasmamembránhoz. A Gram-pozitív baktériumok sejtfalának a vázszerkezete peptidoglükán fonalból áll, a Gram-negatív baktériumoké azonban valószínűleg csupán kettőből. A Gram-pozitív baktériumok többségében a peptidoglükán vázszerkezet hézagait és felületét teichosavak borítják. A teichosavak polialkoholokból, ribitol- vagy glicerinfoszfátból (10. ábra) álló polimerek, amelyekbe rendszerint alanin és baktériumfajonként vagy - csoportonként eltérő összetételű és számú cukormolekulák (esetenként diszacharidok vagy oligoszacharidok) kapcsolódnak. Egyes Gram-pozitív baktériumokban (pl. a Bacillus subtilisben, a Micrococcus luteusban) a teichosavakat cukroknak uronsavakkal alkotott komplexei helyettesítik. A teichosavak és a hozzájuk kapcsolódó cukormolekulák képezik a Gram-pozitív baktériumok sejtfalantigénjeit (hapténjeit). A poliszacharidok mellett egyes Gram-pozitív baktériumok sejtfalában (pl. Streptococcus és egyes Staphylococcus fajokban) találhatók még fehérjeantigének is. A mycobacteriumok sejtfala pedig hosszú szénláncú zsírsavak (mikolsavak) formájában jelentős mennyiségű lipoidot és viaszanyagokat is tartalmaz. A Gram-pozitív baktériumok teichosavakkal borított peptidoglükán váza porózus, így a viszonylag nagy molekulájú anyagok számára is könnyen átjárható. Ezért a Gram-pozitív baktériumok igen érzékenyek a nyálban, a könnyben, a vérsavóban és a szövetnedvekben előforduló lizozim iránt. A lizozim hasítja a peptidoglükán váz két aminocukor-komponense között kialakult kötéseket, ezért a fonalas szerkezet szétesik, a baktériumok elvesztik sejtfalukat, legömbölyödnek. 10. ábra - Glicerin teichosav. Ala = alanin, R = hidrogén, glükóz, aminocukrok stb. 12
33 Bakteriológia A Gram-negatív baktériumok sejtfalának peptidoglükán vázszerkezetét kívülről lipoproteid-lipopoliszacharid- (LPS-)komplexek borítják. E két réteget együtt külső membránnak is nevezik. A lipoproteid-lipopoliszacharid komplexek teszik ki a sejtfal tömegének 80 90%-át. A lipoproteid-molekulák közvetlenül kapcsolódnak a peptidoglükán vázhoz. Ezt fedi a LPS-réteg oly módon, hogy a molekulák poliszacharid része felületesen helyeződik. A Gram-negatív baktériumok LPS-e citotoxikus és egyúttal antigén hatású. Az LPS-komplex a Gram-negatív baktériumok endotoxinja és O-antigénje. A toxicitásért az LPS foszfolipidje (lipid-a), az antigenitásért pedig a poliszacharid komplex a felelős. A lipid-a zsírsavkomponensei valamennyi enterobacteriumban nagyon hasonlóak, de lényegesen különböznek ettől más Gram-negatív baktériumok foszfolipidjének zsírsavösszetevői. Az LPS-komplex poliszacharidja is két részre bontható, mégpedig a lipid-a-hoz kapcsolódó magra (core) és a típus (O-) specifikus oldalláncokra (11. ábra). Ez utóbbiak a Gram-negatív baktériumok O-antigénjei. A mag mindössze néhányféle cukormolekulából épül fel, és ez képviseli az R telepküllemű Gram-negatív baktériumok sejtfalantigénjeit. A mag cukorösszetétele alapján az eddig e tekintetben legjobban megismert Salmonella nemzetség baktériumai mindössze öt csoportba sorolhatók. A maghoz kapcsolódnak az O-specifikus oldalláncok, amelyek 3 5 egyszerű cukorból álló, ismétlődő egységekből épülnek fel. Egy-egy O-specifikus oldallánc akár ismétlődő, lineáris triszacharidot vagy elágazó tetra-, illetve pentaszacharidot tartalmazhat. Az oldalláncok hossza és cukorösszetétele igen változatos, gyakran olyan cukormolekulák is előfordulnak bennük, amelyek a természetben másutt nem találhatók meg. A Gram-negatív baktériumok O-antigénjeinek specificitását az LPS-komplex perifériásan helyeződő cukormolekuláinak milyensége, szekvenciája és térbeli helyzete szabja meg. Az O-specifikus oldalláncok cukormolekulái, a Gram-negatív S teleptípusú baktériumokat hidrofillé teszik, ezért az ilyen baktériumokból stabil szuszpenziók készíthetők. Az O-specifikus oldalláncok részleges vagy teljes elvesztése együtt jár az O-antigenitás elvesztésével, és rendszerint maga után vonja a baktériumok telepküllemének megváltozását is (S R mutáció). 11. ábra - A Salmonella typhimurium lipopoliszacharidjának szerkezete.kdo = ketodezoxi-oktánsav, Hep = glicero-mannoheptóz, Glü = glükóz, Gal = galaktóz, P = foszfát 13
34 Bakteriológia A peptidoglükán vázhoz kapcsolódó lipoproteid- és LPS-komplexek a Gram-negatív baktériumok sejtfalát tömörré, a nagyobb molekulák számára átjárhatatlanná teszik. A sejtfal tömörségének a kialakulásában kationok, főleg kalciumionok is, szerepet játszanak. A tömörség miatt a Gram-negatív baktériumok nem vagy csak alig érzékenyek a lizozim és a penicillin iránt. Érzékennyé tehetők azonban, ha a sejtfal átjárhatóságát híg lúgokkal vagy kationkötő szerekkel fokozzuk. A sejtfal a baktériumok növekedése során a cytoplasmamembránon levő lítikus enzimek hatására egy vagy több ponton felnyílik. A cytoplasmában szintetizálódott N-acetil-muraminsav-pentapeptid-molekulák, uridindifoszfáthoz kötődve aktiválódnak, majd N-acetil-glükózamin-molekulával kapcsolódva, a cytoplasmamembránhoz kötött hordozólipid segítségével kerülnek a sejtfalba, ahol beépülnek a peptidoglükán vázba. A baktériumok sejtfalában, továbbá az ahhoz kapcsolódó felületi rétegekben levő fehérje és poliszacharidantigének vizsgálhatók különféle szerológiai próbákkal, pl. a Gram-pozitív baktériumfajok jelentős részét a sejtfalban található haptének precipitációs próbával való vizsgálata alapján soroljuk szerocsoportokba, míg a Gram-negatív fajok felületi LPS-antigénjeik alapján, agglutinációs próbával oszthatók O-szerocsoportokba. A sejtfal- és a különböző felületi antigének speciális preparálási eljárásokkal kinyerhetők, különféle elektroforetikus módszerekkel, pl. keresztimmun-elektroforézisessel, poliakrilamidgél-elektroforézissel nagyságuk, molekulatömegük, immunoblot eljárással pedig immunológiai specificitásuk is meghatározható. Mindezek a vizsgálatok értékes adatokat szolgáltatnak az egyes baktériumfajok rendszertani besorolásához, rokonsági fokuk és kórtani szempontból is fontos antigénjeik megismeréséhez A baktériumok burokanyagai A baktériumok egy része burkot (tokot) termel. A burok laza szerkezetű, éles határ nélküli, nyálkaszerű vagy tömörebb, többé-kevésbé jól körülhatárolt anyag. A buroktermelő képesség genetikai adottság, a fenotípusban való megjelenése azonban függ a tenyésztés körülményeitől és a rendelkezésre álló tápanyagok milyenségétől. A burokanyagok kémiai összetétele fajonként, baktériumcsoportonként igen változatos, rendszerint poliszacharidok vagy ritkán tisztán polipeptidek. A burokanyagok többsége antigénhatású. A burokanyagok jelenlétét gyakran felhasználjuk a pathogen baktériumok szerológiai csoportosítására. A baktériumok burokanyagai legegyszerűbben tus- vagy nigrozinfestéssel vizsgálhatók. A vizsgálandó baktériumszuszpenzió 14
35 Bakteriológia egy cseppjéhez kevés finom szemcséjű tust vagy nigrozint keverünk, tárgylemezen vékony rétegben széthúzzuk, majd szárítás után mikroszkópban vizsgáljuk. A tus vagy nigrozin miatt sötét környezetben jól láthatók a fénylő baktériumok és a körülöttük levő burok (negatív festés). A burok megfestésére igénybe vehetők speciális festési eljárások is. A pathogen buroktermelő baktériumok az állati testből rendszerint burkos formában tenyészthetők ki. A buroktermelő képesség egyes fajokban összefügg a kórokozó képességgel. A buroktermelő képesség elvesztése gyakran együtt jár a baktériumtelep küllemének megváltozásával (S R mutáció). A burok- vagy toktermelés előfordul saprophyta baktériumfajokban is. A saprophyta aerob spórás baktériumfajok egy része pl. glutaminsavból álló polipeptidburkot,a Leuconostoc mesenteroides pedig glükóztartalmú táptalajon dextránból álló burkot képez A baktériumok csillói A baktériumok egy része aktív mozgásra képes, amely a fajok túlnyomó többségében csillók (flagellumok) segítségével történik. A csillók igen vékony, a baktériumtestnél sokszorta hosszabb, hullámos lefutású, fonal alakú képletek (12. ábra), amelyek a cytoplasmamembránból indulnak ki és a Gram-negatív baktériumokban két pár gyűrű alakú lemezkével (bazális test) részben a cytoplasmamembránhoz, részben pedig a sejtfalhoz vannak rögzítve. A Gram-pozitív baktériumok csillói egyetlen lemezkepárral vannak rögzítve a cytoplasmamembránhoz. A csillók gyors rotációs mozgása eredményezi a baktériumtest elmozdulását. A csillók vékonyságuk miatt közönséges fénymikroszkópban csupán előzetes fémgőzölés vagy speciális pácolási és festési eljárások együttes alkalmazásával tehetők láthatóvá. 12. ábra - Csillós Escherichia coli baktérium. (45 000, az Országos Állategészségügyi Intézet felvétele) 15
36 Bakteriológia A csillók elhelyeződése és száma jellemző az egyes fajokra vagy a fajok csoportjaira. Azokat a baktériumokat, amelyeknek csak egy csillójuk van monotrich, a mindkét végén egy-egy csillós baktériumokat amfitrich, a körülcsillósokat pedig peritrich baktériumoknak nevezzük. A lofotrich baktériumoknak a baktériumtest egyik vagy mindkét végén ecsetszerűen elhelyezkedő csillóik vannak. A csillók összehúzódásra képes, helikális szerkezetű fehérjékből (flagellinekből) épülnek fel. A csillófehérjék immunológiai fajlagossága lehetővé teszi egyes baktériumfajok osztályozását a csillóantigének alapján. A csillófehérjék felépítését több gén kódolja. Az e gének szerkezetében végbemenő változások a csillóantigének megváltozásával, esetleg a csillók elvesztésével járnak. A csillófestési eljárások nehézkessége miatt a csillók jelenlétére rendszerint a baktériumok mozgásából következtethetünk. A mozgás vizsgálható mikroszkópban függőcsepp készítményben, fedőlemezzel lezárt natív kenetben vagy különféle félfolyékony táptalajokban végzett tenyésztéssel. A csillós baktériumok egy része, pl.a Proteus vulgaris, a szilárd táptalajok felületén élénken rajzik A fimbriák (pilusok) Számos, főleg Gram-negatív baktériumfaj felületén találhatók igen vékony, csak elektronmikroszkóppal látható, a baktériumtestnél rövidebb, szőrszerű vagy annál sokszorta hosszabb, a baktériumtestről hajfonatszerűen lelógó fonalak, fimbriák vagy pilusok. Az eddig megismert fimbriák két csoportra oszthatók. A közönséges fimbriák vékony, a baktériumtestnél rendszerint rövidebb proteincsövecskék, peritrich vagy poláris helyeződésűek (13. ábra). Biológiai szerepük csak részben ismert, növelik a baktérium felületét, elősegítve ezzel az anyagforgalmat, a légzést, a 16
37 Bakteriológia membránokhoz kötött folyamatokat, másrészt pedig tapadási (adhéziós) képességet kölcsönöznek a baktériumoknak. A fimbriákkal ellátott baktériumok agglutinálják a legkülönfélébb állatfajok vörösvérsejtjeit, erős a tapadóképességük az állati és növényi sejtekhez. Adhezív sajátságuknál fogva (pl. az emésztőcső, a légutak stb. hámsejtjeihez való tapadás miatt) a pathogen baktériumok egy részénél virulenciafaktorként szerepelnek. 13. ábra - Fimbriák Escherichia coli baktériumok felületén ( ) A közönséges fimbriák finomabb morfológiájuk, számuk, a sejt felületén való elhelyezkedésük, adhezív sajátságaik, továbbá antigénspecificitásuk alapján több csoportba sorolhatók. Leggyakoribb az 1-es típusú fimbriák előfordulása a különféle enterobacteriumok felületén. A fertilitási (F) fimbriák hasonló szerkezetűek, mint a közönséges fimbriák, azoknál azonban hosszabbak, számuk egy-egy baktériumsejten rendszerint nem több mint Képződésüket extrakromoszomális genetikai elemek, plazmidok kódolják. Ezek a fimbriák szerepet játszanak a baktériumok konjugációjában és az ezt követő DNS-átvitelben A baktériumok spórái A spórák a baktériumsejtben képződő kerek vagy ovális képletek (endospóra). A spóraképzés csupán néhány baktériumcsoport sajátsága. Bár a spóraképzés az adott faj genetikai sajátsága, a spórásodás csupán akkor indul meg, amikor a környezet a baktériumfaj szaporodása szempontjából kedvezőtlenné válik (tápanyagok hiánya, anyagcseretermékek felszaporodása, beszáradás stb.). A megindult spórásodás a baktérium kedvező tápoldatba helyezésével megállítható. A spórásodás lehetővé teszi a baktériumok életben maradását kedvezőtlen környezeti feltételek között is. A spóraképződés a baktérium maganyagának és a cytoplasma egy részének (az RNS-nek és kevés fehérjének) a tömörülésével indul meg. A maganyagot és a körülötte levő cytoplasmát a betüremkedő cytoplasmahártya lefűzi a baktériumsejt többi részéről, ezzel kialakula spóraprotoplaszt (prespóra). A spóraprotoplaszt membránja kétrétegű, egy belső és egy külső részből áll. A két membrán között képződik a vékony sejtfalréteg és egy vastag, ugyancsak peptidoglükánból álló cortex. Ezt követi a külső membránon a spóraköpeny kialakulása. A spóraköpeny diszulfidhidakkal összekötött többrétegű (kitinszerű) fehérje (14. ábra). Egyes fajokban a spóraköpenyt még egy vékony lipoprotein hártya is borítja. A spóra a baktériumtest maradékának az autolízisével válik szabaddá. Az érett spórák semmilyen anyagcsere-folyamatot sem mutatnak. 17
38 Bakteriológia 14. ábra - Clostridium tetani spóraszerkezete ( , az Országos Állategészségügyi Intézet felvétele) A spóratok cortexének felépítése hasonlít a sejtfal peptidoglükánjához, de eltérők lehetnek a peptidoglükánba kapcsolódó peptid alegységek és egyéb szubsztituensek, ezért antigenitás szempontjából a spóra jelentősen különbözhet ugyanazon faj vegetatív egyedeitől. A spóraképzés csak bizonyos feltételek között következik be. A Bacillus anthracis levegőn, a Clostridium fajok viszont anaerob viszonyok között, egyes fajok nehezen, mások könnyebben spórásodnak. A spórásodás folyamatátszámos gén szabályozza, amelyek a kromoszómán szétszórtan (valószínűleg lókuszon) helyezkednek el. Az egyik vagy másik gént érintő mutáció a spórásodást különböző szakaszokban állítja meg. A spórák a festékeket nehezen veszik fel, ezért a szokásos módon festett készítményekben a spórák színtelen, kerekded képleteknek látszanak, speciális festési eljárásokkal azonban megfesthetők. A spórák alakja és helyeződése jellemző az egyes baktériumcsoportokra. A spóra helyeződhet a baktériumsejt közepén vagy excentrikusan. Ha a spóra vastagabb, mint a baktériumsejt, a spórás baktérium orsó alakúvá válik (clostridium), ha az ilyen spóra poláris helyeződésű, dobverő vagy teniszütő alak (plectridium) jön létre. Kedvező környezeti körülmények közé kerülve a spórák kicsíráznak, vegetatív baktériumokká válnak. A spórák kicsírázása is több szakaszban megy végbe. A spórás baktériumok egy része megfelelő táptalajokba helyezve közvetlenül vegetatív alakká válik és szaporodik, más fajok spórái azonban csak akkor csíráznak ki, ha előzőleg valamilyen módon (pl. 10 percig 80 C-on való hőkezeléssel, alacsony ph-n való tartással, redukálószerekkel kezelve stb.) aktiváljuk őket. Aktiválásnak tekinthető a spórák korosodása (érése) is. Az aktiválás valószínűen felszakítja a spóraköpeny diszulfidhídjait, ezáltal kedvezővé teszi a permeabilitási viszonyokat a kicsírázáshoz. Az aktiválást felhasználjuk egyes pathogen clostridiumok kitenyésztésekor. A spórák víztartalma igen kicsi, rendszerint nem több mint 20%. Kis víztartalmuk és a spórát körülvevő vastag tok miatt a beszáradással, hővel, sugárzásokkal és kémiai szerekkel szembeni ellenálló képességük lényegesen nagyobb, mint a vegetatív baktériumsejteké. A spórák többsége néhány perces forralást is elvisel, egyes clostridiumspórák azonban akár több órás forralás után is életképesek maradnak. 3. A baktériumok morfológiájának vizsgálata 18
39 Bakteriológia 3.1. Mikroszkópos vizsgálatok A baktériumok alaki sajátságai, kis méreteik miatt csak mikroszkópban vizsgálhatók. A mikroszkópos vizsgálatokat általában közönséges fénymikroszkóppal, sötét látóteres, fáziskontraszt- vagy fluoreszcens mikroszkóppal, esetenként elektronmikroszkóppal végezzük. A közönséges fénymikroszkópban a baktériumok vizsgálatához immerziós lencséket használunk. A lehető legnagyobb feloldóképesség elérése és a fényveszteség minimálisra csökkentése végett a tárgylemezre kent készítmény és az objektív közé egy csepp cédrusolajat cseppentünk. A vizsgálatkor az immerziós lencsét a cédrusolajhoz érintve a kondenzorból a vizsgálni kívánt készítményen át a tárgylencsébe jutó fénysugár csupa azonos törésmutatójú közegen halad át (homogén immerzió). Homogén immerziós lencséket használva a feloldóképesség 0,2 0,4 µm, így a legkisebb méretű baktériumok is láthatóvá válnak. A homogén immerziós lencsék nagyítóképessége általában szoros, a közönséges fénymikroszkópban használt nagyítás pedig szoros. A sötét látóteres mikroszkópban a tárgyat speciális (parabolid vagy kardioid) kondenzorból kilépő ferde fénysugarakkal világítjuk meg. A ferdén haladó fénysugarak a tárgylemezen levő kenet korpuszkuláris elemeibe ütközve megtörnek, s egy részük bejut a tárgylencsébe. Ily módon a látótér sötét marad, a benne levő baktériumok vagy egyéb korpuszkuláris elemek pedig fénylenek, csillognak. A sötét látóteres mikroszkóp különösen alkalmas a baktériumok mozgásának a vizsgálatára. A fáziskontraszt-mikroszkópban a fényt gyűrűs diafragmával ellátott kondenzoron keresztül vetítjük a tárgyra. A kondenzor úgy van beállítva, hogy a tárgylemezen áthaladó meg nem tört fényt a mikroszkóp objektívébe épített, ugyancsak gyűrű alakú fázislemezkére fókuszálja. A készítményen áthaladó, baktériumokba vagy egyéb korpuszkuláris elemekbe ütköző fénysugarak törést és elnyelődést (s ezáltal bizonyos fáziskésést is) szenvednek, így nem a fázislemezke gyűrű alakú perifériás részén, hanem annak transzparens középső szakaszán jutnak keresztül. A fázislemezke a baktériumokon és az egyéb korpuszkuláris elemeken áthaladó megtört fénysugarak fázisát a meg nem tört fénysugarakhoz képest kb. 1/4 hullámhosszal késlelteti. A fáziseltolódást a fénysugarak interferenciája miatt szemünk fényintenzitásbeli különbségként érzékeli. Ha a baktériumokon áthaladó fénysugarak fázisa késleltetett a meg nem tört fénysugarakéhoz képest, akkor a baktériumok a fáziskontrasztmikroszkópos képben a környezetükhöz képest sötétebbek (pozitív fáziskontraszt), ha pedig a fázislemezkét úgy állították elő, hogy az a gyűrű alakban áthaladó meg nem tört fénysugarak fázisát késlelteti, a készítményben levő korpuszkuláris elemek a környezetükhöz képest világosabbak (negatív fáziskontraszt). A fáziskontrasztmikroszkóp, hasonlóan a sötét látóteres mikroszkóphoz, elsősorban élő mikroorganizmusok vizsgálatára szolgál, de benne, szemben az utóbbival, nem csupán a kontúrok, hanem a sejttest finomabb részletei is láthatók. A fluoreszcens mikroszkópban a tárgy megvilágítására ultraibolya sugarakban gazdag fényforrást (rendszerint higanygőzlámpát) használunk. A tárgylemezen levő preparátumot előzetesen fluoreszkáló festékkel (pl. akridinoranzszsal, rodaminnal, fluoreszceinnel) kezeljük. A megfestett baktériumok az ultraibolya sugarakat elnyelik és hosszabb, már a látható fény hullámtartományába eső fény formájában kibocsátják, fluoreszkálnak. Mivel a készítményre vetített fénynyalábból a látható fénysugarakat kiszűrjük, a látótér sötét, a megfestett baktériumok pedig az ultraibolya sugarak hatására kék, zöld vagy sárga színben csillognak. A fluoreszcens mikroszkóp előnye, hogy az így vizsgált készítményben a keresett baktériumok gyorsan megtalálhatók. A fluoreszcens-mikroszkópban nemcsak elölt, hanem erősen hígított fluoreszcens festékekkel intravitálisan festett élő baktériumok és más korpuszkuláris elemek is vizsgálhatók. Fluoreszcens mikroszkópban vizsgáljuk az immunfluoreszcens készítményeket is, amelyek készítése során nem a vizsgálni kívánt mikroorganizmusokat festjük meg, hanem a velük szemben termelt specifikus ellenanyagokhoz kötünk fluoreszkáló festéket. A vizsgálandó mintát a fluoreszcens festékhez kötött ellenanyaggal (ellenanyag-festék konjugátummal) összekeverve az ellenanyag kötődik az antigénhez, ezért a készítményben levő baktériumok (vírusok, egyéb korpuszkuláris elemek, oldott antigének) fluoreszkálnak. Másmás festékkel konjugálva az ellenanyagokat, az immunfluoreszcens eljárás alkalmas a különféle baktériumok (vírusok, antigének) egymástól való megkülönböztetésére is. Az elektronmikroszkópban a tárgy megvilágítására igen rövid hullámhosszú, nagy sebességű elektronsugarakat használunk. Az elektronsugarakat mágneses terek terelik a megfelelő irányba, a képalkotás a vizsgálni kívánt tárgy egyes részeinek eltérő sugártörő képességén alapszik. Mivel a sejtek, az egyéb, biológiai eredetű korpuszkuláris elemek vagy makromolekulák elektronsugár-szórásában nincs lényeges különbség, a sugártörés fokozása végett a készítményeket speciális kezeléseknek (fémgőzölésnek, negatív kontrasztozásnak stb.) vetik alá. Az elektronsugár által alkotott képet lumineszkáló ernyőn teszik láthatóvá vagy filmre rögzítik. A 19
40 Bakteriológia vizsgált tárgy különböző részeinek a képen különböző fényintenzitású, sötét vagy világos tartományok felelnek meg. A hagyományos (transzmissziós) elektronmikroszkópban az elektronsugár áthatol a vizsgálni kívánt vékony rétegű mintán. Az utóbbi évtizedekben azonban megjelent az elektronmikroszkópnak egy továbbfejlesztett változata (a pásztázó vagy scanning elektronmikroszkóp), amelyben az elektronsugár az útjába ferdén elhelyezett készítménybe ütközve (azt letapogatva) másodlagos sugárzást gerjeszt. Ezt a másodlagos elektronsugárzást felfogva és felerősítve a vizsgált mintából háromdimenziójú (sztereo) kép nyerhető. Az elektronmikroszkóp feloldóképessége nanométer nagyságrendű, ami lehetővé teszi nemcsak a baktériumok, vírusok és különféle sejtes elemek alakjának, méretének és finomabb szerkezetének tanulmányozását, hanem fehérje-, nukleinsav- és egyéb óriásmolekulák lefényképezését is A baktériumok megfestése A baktériumok natív (élő) és megfestett állapotban egyaránt vizsgálhatók. A natív (fedőlemezzel lezárt nedves kamra vagy függőcsepp) készítményeket normál fénymikroszkópban, fáziskontraszt- vagy sötét látóteres mikroszkópban vizsgáljuk. A natív készítmények előnye, hogy bennük a baktériumok megőrzik eredeti alakjukat, emellett mozgásuk is vizsgálható. A baktériumokat leggyakrabban festett állapotban vizsgáljuk. A baktériumok megfestésére kezdetben természetes eredetű festékeket (hematoxilint, lakmuszt stb.) használtak, majd ezeket felváltották a szintetikus festékek. Az első szintetikus festékek anilin- (aminobenzol-)származékok voltak, ezért a bakteriológiában használatos festékeket bázikus anilinfestékek néven szokás emlegetni, bár közülük több nem anilinszármazék. A bakteriológiában használt festékek (bázikus fukszin, metilénkék, genciánaibolya, toluidinkék, szafranin stb.) többsége bázikus jellegű, amelyek elsősorban a cytoplasma savanyú komponenseit (a DNS-t, az RNS-t, a foszfátszemcséket stb.) festik meg. A festőoldatok egyszerű vizes oldatok vagy tartalmaznak bizonyos, a festékeknek a baktériumsejtbe való bejutását elősegítő anyagokat (karbolsavat, kálium-hidroxidot vagy újabban felületaktív anyagokat stb.). Az egyszerű festési eljárások során a baktériumtartalmú anyagokból előállított keneteket vagy lenyomati készítményeket megszáradásuk után Bunsen-égő lángja felett áthúzva vagy metil-alkohollal fixáljuk, majd néhány percig festjük, vízzel leöblítjük, megszárítjuk s mikroszkópban immerziós lencsével vizsgáljuk. A fixálás, sőt afestés sem öli el feltétlenül az összes baktériumot, ezért a rögzített és megfestett készítményeket is óvatosan kell kezelni. A baktériumok szerkezeti elemeinek és az egyes baktériumcsoportoknak egymástól való megkülönböztetésére többféle összetett, differenciáló festési eljárást dolgoztak ki. A Gram-festés során a kenetet valamilyen anilinfestékkel (pl. genciána-, kristályibolyával, metilviolával) 3 5 percig festjük. Ezután a tárgylemezről a festéket leöntjük, hígított jód- (lugol-)oldatot csepegtetünk rá, majd kb. egy perc múlva a kenetet vízöblítés nélkül tömény alkohollal (vagy alkohol és aceton azonos arányú keverékével) kivonjuk (differenciáljuk). Ezután vízöblítés, majd vizes szafraninnal vagy hígított karbolvizes fukszinnal kontrasztfestés, újból öblítés és szárítás következik. A megfestett baktériumokban a lugololdat hatására jód-pararozanilin keletkezik, amely a Gram-pozitív fajokból alkoholos kezeléssel sem vonható ki, a Gram-negatív fajok viszont az alkoholos kezelés hatására elszíntelenednek. Az előbbiek a mikroszkópos képben ibolyakék, az utóbbiak pedig piros színűek. Ziehl Neelsen-féle festés. A sav- és alkoholálló baktériumok sejtfaluk nagy lipoid- és viaszanyag-tartalma miatt egyszerű festési eljárásokkal nem festhetők meg. Ezeknek a baktériumoknak a festésére szolgál a Ziehl Neelsen-féle festés. A készítményt karbolvizes fukszinoldattal (Ziehl-féle fukszinnal) öntjük le, a festékpárnát egymás után háromszor óvatosan gőzölésig melegítjük. A megfestett készítményt előzetes vízöblítés után néhány másodpercig 5%-os kénsavoldattal, majd tömény alkohollal kivonjuk. Újabb vízöblítés, majd vizes metilénkékkel való kontrasztfestés után vizsgáljuk. A sav- és alkoholálló baktériumok, amelyek a felvett festéket a savas és az alkoholos kezelés hatására sem adják le, pirosak, minden egyéb baktérium és sejtes elem pedig kék színű. A Ziehl Neelsen-féle festés nemcsak a sav- és alkoholálló baktériumok szelektív festésére, hanem a baktériumok spóráinak a megfestésére is alkalmas. A spórák ugyanis szintén savállók. Ziehl Neelsen szerint festve a spóra piros, a baktériumsejt többi része pedig kék színű. 20
41 Bakteriológia A Gram- és a Ziehl Neelsen-féle festési eljáráson kívül még számos speciális festési eljárás létezik. E festési eljárások közül az állatorvosi bakteriológiában gyakrabban használtakat az egyes baktériumcsoportok tárgyalásakor ismertetjük. 4. A baktériumok anyagcseréje A baktériumok vegyi összetétele fajonként és a szaporodáshoz rendelkezésre álló közeg összetétele szerint tág határok között változik. Tömegük 75 80%-a víz. Szárazanyaguk 2 15%-a ásványi anyagokból (sókból), 2 15%-a fehérjékből és egyéb nitrogéntartalmú anyagokból, 50%-ig terjedő mennyiségben szénhidrátokból, 2 40%-a pedig zsír- és viaszanyagokból áll. A baktériumok anyagcseréje hasonlóan az eukaryota sejtekéhez energianyeréssel járó (katabolikus) és a baktériumsejt anyagainak felépítéséhez szükséges szintetikus (anabolikus) folyamatok összessége. A baktériumok (az autotrófoktól eltekintve) energianyerés céljából nagy molekulájú anyagokat bontanak el, miközben a köztianyagcsere egyes termékeiből és a környezetből felvett anyagokból saját testanyagaikat is felépítik. A baktériumok a vizet, tápanyagaikat és minden egyéb szükséges anyagot a környezetből veszik fel. Az anyagcsere vizes fázisban zajlik le, ezért a víz a baktériumok növekedéséhez, szaporodásához nélkülözhetetlen. A nagy molekulájú anyagokat (poliszacharidokat, fehérjéket stb.) extracelluláris enzimjeik által elbontva teszik alkalmassá a sejtbe való bejutásra. Változatos enzimkészletük következtében alig van olyan természetes anyag, amelyet a baktériumok egyik vagy másik csoportja ne tudna elbontani Autotróf baktériumok A baktériumok egy része testanyagainak felépítéséhez csupán szervetlen anyagokat igényel. Ezek az autotróf baktériumok. Nitrogénszükségletüket a levegő nitrogénjéből, ammóniából vagy különféle szervetlen nitrogénsókból fedezik, szénforrásként pedig a levegő szén-dioxidját hasznosítják. A szerves anyagaik előállításához szükséges energiát vagy színtestjeik segítségével a napfényből fotoszintézis útján (fotoautotrófok), vagy különféle szervetlen anyagoknak (pl. ammóniának nitritté, nitriteknek nitrátokká, elemi kénnek, szulfidoknak szulfáttá stb.) oxidálásával nyerik (kemoautotrófok). A fotoautotróf baktériumokban a fényenergia elnyelésére bíbor, vörös, barna vagy zöld színű baktérium-klorofillek és különféle karotinoid festékek szolgálnak. A magasabb rendű növényekben és az algákban lezajló fotoszintézis abban különbözik a baktériumok fotoszintézisétől, hogy a növényekben a szén-dioxid redukciójához szükséges hidrogéndonor a víz, ezért szabad molekuláris oxigén keletkezik. A baktériumok fotoszintézisekor hidrogéndonorként különféle redukált (a víznél kisebb redoxpotenciálú) szervetlen (kénhidrogén, hidrogén stb.) és szerves anyagok szolgálnak, ezért szabad oxigén nem keletkezik. Az autotróf baktériumok közül néhány faj csak szerves anyagok hiányában használ fel szervetlen anyagokat, ezek a fajoka fakultatívautotróf baktériumok. Az autotróf baktériumoknak kórtani jelentőségük nincs, kivétel nélkül saprophyták, nagy számban találhatók a természetes vizekben és a talajban. A kemoautotrófok közül általános biológiai szempontból fontosaka nitrifikáló baktériumok. Ezek a talajba jutott ammóniát (aerob viszonyok között) energianyerés céljából NO 2-vé (pl.a Nitrosomonas fajok) vagy a NO 2-t NO 3-má (pl.a Nitrobacter fajok) oxidálják, ezáltal az ammóniából a növények számára felvehető nitrogénsókat állítanak elő Heterotróf baktériumok A heterotróf baktériumok testanyagaik felépítéséhez és energiatermelő folyamataikhoz szerves vegyületeket igényelnek. A környezetből felvett szerves anyagokat változatlanul vagy megfelelő átalakítás után felhasználják saját testanyagaik felépítésére, vagy energiatermelés céljából elbontják azokat. A heterotrófok szervesanyagigénye igen változatos. Szénhidrátforrásként felhasználnak különféle poliszacharidokat (glükogént, keményítőt, dextrint, pektint, cellulózt stb.), oligo-, di- és monoszacharidokat, ez utóbbiak között hexózokat és pentózokat, cukoralkoholokat, alkoholokat (glicerint, mannitot stb.), glükozidokat (szalicint, eszkulint stb.), különféle szerves savakat stb. Nitrogénigényük szerint a heterotrófok ugyancsak igen változatosak, egy részük számára elegendő a levegő molekuláris nitrogénje vagy különféle szervetlen ammóniumsók, mások azonban növekedésükhöz aminosavakat, sőt ezenkívül még különféle kiegészítő anyagokat (pl. vitaminokat, nukleinsavakat, hemoglobint) is igényelnek. Zsírokra a baktériumoknak általában nincs szükségük, ezeket anyagcseréjük során különféle szénhidrátokból és nitrogéntartalmú anyagokból állítják elő, egyes baktériumcsoportok (pl. a leptospirák) számára azonban a hosszú szénláncú zsírsavak esszenciális növekedési faktorok. 21
42 Bakteriológia A heterotróf baktériumok közül egyesek (pl.a Mycobacterium leprae, a Rickettsia fajok többsége, a Chlamydia nemzetség tagjai stb.) csupán élő sejtekben képesek szaporodni. Ezeket nevezzük paratróf baktériumoknak is. E sajátságuk valószínűen enzimrendszerük hiányos voltával áll kapcsolatban. A pathogen baktériumok kivétel nélkül heterotrófok, ezért az anyagcsere további tárgyalása során ezekre szorítkozunk A szénhidrát-anyagforgalom és a baktériumok energianyerése A heterotróf baktériumok energianyerési folyamatainak kiindulási anyagai igen változatosak, elsősorban szénhidrátok, amelyeket számos lépésben, enzimek segítségével bontanak le. A keletkező energia egy részét a baktériumok, közvetlenül vagy nagy energiájú foszfátkötésekben (guanozin trifoszfát, GTP, adenozin-trifoszfát, ATP stb.) való tárolás után felhasználják energiaigényük (aktív transzport, bioszintézis, mozgás) fedezésére, a másik része pedig szabad hő formájában távozik. A baktériumok energiájukat főleg oxidatív (aerob) és fermentatív (anaerob) folyamatok útján nyerik, de ismert számos más, kevésbé gyakori (pl. dekarboxilálás, dezaminálás, hidrolízis) energianyerési folyamat is. Azokat a baktériumokat, amelyeknek az energiaszerzéshez a levegő molekuláris oxigénjére van szükségük feltétlen (obligát) aerob baktériumoknak nevezzük.a feltétlen anaerob fajok csupán oxigén nélkül képesek szaporodni, a baktériumok nagy többsége viszont jól szaporodik levegő jelenlétében, de szükség esetén levegő nélkül is meg tud élni. Ez utóbbiak a feltételesen (fakultatív) anaerob baktériumok. A fermentáció során az energianyeréshez rendelkezésre álló anyagok oxidációja hidrogénelvonással, molekuláris oxigén jelenléte nélkül történik (anaerob oxidáció). A baktériumok túlnyomó többsége az energiát különféle szénhidrátok fermentálásával nyeri, vannak azonban olyan baktériumcsoportok is, amelyek erre a célra nitrogéntartalmú anyagokat (fehérjéket, aminosavakat, purin-, pirimidinbázisokat stb.) és különféle egyéb szerves anyagokat is felhasználnak. A nagymolekulájú poliszacharidokat, oligoszacharidokat és diszacharidokat a baktériumok először monoszacharidokká hidrolizálják. A glükózt közvetlenül, az egyéb monoszacharidokat (hexózokat) pedig előzetes (többnyire fruktóz-foszfáttá való) átalakítás után használják fel. A glükóz fermentációjának első szakasza a legtöbb anaerob és fakultatív anaerob baktériumfajban a glükolízis lépcsői szerint megy végbe (15. ábra). A fermentáció során a hidrogént szubsztrátspecifikus dehidrogenázok (oxidoreduktázok) vonják el. A glükózmolekulákból piroszőlősav keletkezik, miközben energia szabadul fel. A dehidrogenáz enzimek prosztetikus csoportja (NAD = nikotinsavamid-adenin-dinukleotid) a felvett két hidrogénatomot a folyamat végén keletkező piroszőlősavnak, egyéb intermedier anyagcseretermékeknek (szerves savaknak, aldehideknek stb.) vagy a környezetben rendelkezésre álló más redukálható anyagoknak (pl. cisztinnek, tioglükolátnak, tioszulfátnak stb.) adja át. Ily módon a dehidrogenáz enzimek újabb hidrogénatomokat képesek felvenni, a piroszőlősavból pedig tejsav keletkezik. A fermentáció során tehát hidrogénakceptorként nem molekuláris oxigén, hanem különféle intermedier anyagcseretermékek és egyéb redukálható anyagok szolgálnak. A redukált NAD-ról folyó hidrogénleadás miatt az anaerob baktériumok erős redukáló hatást fejtenek ki. 15. ábra - A glükolízis folyamata. A kettős nyilak a glükózból keletkezett 2 molekula glicerin-aldehid reakcióit jelzik; egy molekula glükózból összesen 2 molekula piroszőlősav, 2 ATP, 2 NADH+2 H + keletkezett 22
43 Bakteriológia Bőséges mennyiségű glükóz jelenlétében a fermentáció csupán tejsav keletkezéséig megy. Könnyen fermentálható (kis redoxipotenciálú) szénhidrátok hiányában azonban a piroszőlősav és a tejsav fermentatív bontása tovább halad, s végtermékként baktériumfajoktól és -csoportoktól függően különféle szerves savak, alkoholok stb. és gázok keletkeznek. A baktériumok fermentatív úton nemcsak glükózt (és más hexózokat), hanem számos egyéb szénhidrátféleséget is elbontanak energianyerés céljából. Ennek során a felszabaduló energia mellett zömmel szerves savak (pl. a pentózokból ecetsav), különféle alkoholok, aldehidek stb. és gázok keletkeznek. Egyes baktériumcsoportok a szénhidrátok mellett vagy azok helyett, energianyerés céljából nitrogéntartalmú komponenseket, pl. aminosavakat is elbontanak. Az aminosavak fermentatív bontásából rendszerint szerves savak, ammónia és szén-dioxid keletkezik. Az aerob (oxidatív) energianyeréskor az elbontandó anyagok végső oxidációja a levegő molekuláris oxigénjének a jelenlétében történik (légzés, respiráció). Az energianyerési folyamatok oxidatív módja is legtöbbször dehidrogénezéssel, s csak ritkán közvetlen oxidációval indul meg. Esetenként a dehidrogénezést vízmolekulák felvétele előzi meg. A glükózbontás piroszőlősavig a fermentációnál megismert módon folyik. A 23
44 Bakteriológia piroszőlősav és a tejsav, valamint az egyéb, különféle eredetű, részben átalakított vagy elbontott szénhidrátok, szerves savak, zsírsavak stb. további bontása az aerob baktériumok és a fakultatív anaerob baktériumok többségében a citrátciklusnak megfelelően történik. Az aerob folyamatokban azonban a dehidrogenáz enzimek NAD-ján levő hidrogén a flavin enzimek (flavin-mononukleotid, flavin-adenin-dinukleotid) prosztetikus csoportjain aktiválódik, hidrogénionná alakul, az elektronok pedig a citokróm enzimrendszer tagjain keresztül szállítódva a citokróm-oxidáz segítségével a levegő molekuláris oxigénjére adódnak át. Ily módon a szubsztrátokból lehasított hidrogén végül H 2O 2-dá (a baktériumok egy részében vízzé) oxidálódik, miközben jelentős mennyiségű energia szabadul fel. A baktériumok oxidatív energianyerése során tehát a szénhidrátok végül is szén-dioxiddá és vízzé oxidálódnak. A fakultatív anaerob baktériumok egy részében (és egyes, egyébként obligát aerob baktériumokban is) a citokróm enzimrendszer elektronjainak akceptora nem csupán molekuláris oxigén, hanem különféle redukálható anyagok, pl. nitrátok, nitritek, szulfátok és különféle szerves anyagok is lehetnek. Ezek a baktériumok molekuláris oxigén hiányában is képesek oxidatív úton energiát nyerni. Az ide tartozó fajok egy része a talajban él, és abban (anaerob viszonyok között) jelentős nitrogénveszteséget okoz, mert a nitrátot, nitritet ammóniává, nitrogén-oxiddá vagy elemi nitrogénné redukálja (denitrifikáló baktériumok). Bár a baktériumokban a glükózból való energianyerés fő útja a glükolízis és a citrátciklus, ugyanazon baktériumokban a glükózbontás más (kevésbé hatékony) útjai is léteznek. A sejtben keletkező hidrogén-peroxid a baktériumokra erősen mérgező. Elbontásukról a kataláz és a peroxidáz enzimek gondoskodnak. A H 2O 2-ból kataláz hatására víz és molekuláris oxigén keletkezik. A peroxidáz a H 2O 2- ból keletkező oxigént különféle szerves anyagok (pl. glutation) közvetlen oxidálására használja fel. Az obligát anaerob baktériumokból hiányzik a citokróm enzimrendszer és nem termelnek sem kataláz, sem peroxidáz enzimeket. Ez utóbbi enzimek hiánya az egyik oka annak, hogy az anaerobok oxigén jelenlétében nem tudnak szaporodni, sőt egyesek levegővel érintkezve rövid idő alatt (toxikus szuperoxidok keletkezése miatt) el is pusztulhatnak. Az aerob és fakultatív anaerob baktériumokban a szénhidrátok bontása többnyire teljes, az energiakihasználás lényegesen jobb hatásfokú, mint az anaerob baktériumokban. Bár a heterotróf baktériumok testanyagaik felépítéséhez a szerves anyagokat nem nélkülözhetik, egyes fajok, így pl.a Bacillus anthracis, a Brucella abortus, egyes Haemophilus fajok, a Campylobacter nemzetség baktériumai és mások szaporodásukhoz szén-dioxidot is igényelnek. A szén-dioxidot ezek a fajok aminosavaikba, valamint purin- és pirimidinbázisaikba építik be, azok szintézise során. A Lactobacillus fajok pl. szénforrásként csaknem kizárólag szén-dioxidot használnak, a rendelkezésre álló szénhidrátokat pedig energiaforrásként hasznosítják. Az obligát aerob baktériumok energiájukat oxidatív úton nyerik. Pathogen és saprophyta fajok egyaránt találhatók közöttük. A pathogenek közül ide tartozik pl.a Bacillus anthracis, a Brucella és a Mycobacterium fajok, a saprophyta fajokat pedigaz Acetobacter aceti, a Pseudomonas, a Micrococcus fajok stb. képviselik. Egyes obligát aerobok kissé csökkentett oxigéntartalmú légkörben szaporodnak a legjobban. Ezek a mikroaerofil baktériumok. Vannak olyan obligát aerob baktériumok is (pl. a tengervízben szabadon vagy halakon, puhatestűeken élő Photobacterium fischeri és mások), amelyekben a flavinfermentek által felvett hidrogén luciferáz enzimek segítségével a levegő molekuláris oxigénjével egyesül, miközben fény keletkezik. Ez a jelenséga biolumineszcencia. A világítóbaktériumok a tengervízben élnek, nem kórokozók, csupán élelmiszer-higiéniai jelentőségük van. A kórokozó baktériumok többsége fakultatív anaerob. Ezek a baktériumok a rendelkezésre álló tápanyagoktól és azok redoxipotenciáljától függően mind aerob, mind anaerob viszonyok között képesek energiát nyerni. A fakultatív anaerob E. coli baktériumok pl. a glükózból fermentációs úton tejsavat, ecetsavat, hangyasavat, borostyánkősavat, ezenkívül kevés etil-alkoholt, majd a hangyasavból szén-dioxidot és H 2-t képeznek. Bőséges oxigénellátás mellett oxidatív úton a glükózból tejsavon és ecetsavon keresztül, zömmel szén-dioxid és víz keletkezik. Az ugyancsak fakultatív anaerob Enterobacter aerogenes glükózfermentációja (16. ábra) során ugyanolyan szerves savak és gázok keletkeznek, mint az E. colinál, de lényegesen kisebb mennyiségben, ezenkívülaz Enterobacter fajok glükózból még egy speciális anyagcsereterméket, acetil-metil-karbinolt (acetoint) is termelnek. 16. ábra - Az Enterobacter aerogenes glükózfermentációja és lehetséges végtermékei 24
45 Bakteriológia A baktériumok egy jelentős csoportja obligát anaerob. Az obligát anaerobok (pl. a Clostridium, Bacteroides, Fusobacterium fajok, propionsavbaktériumok) csupán fermentatív úton képesek energiát termelni. Szaporodásuk anaerob viszonyok között is csak akkor indul meg, ha elegendő kis redoxipotenciálú tápanyag áll rendelkezésre. A fermentáció végtermékei jellemzőek az anaerobok egyes csoportjaira. A lactobacillusok egy része glükózból csupán tejsavat (homofermentáció), más része a tejsavon kívül egyéb anyagokat, pl. ecetsavat, hangyasavat, etil-alkoholt, szén-dioxidot és hidrogént is termel (heterofermentáció) (17. ábra). A propionsavbaktériumok a szénhidrátokból tejsavat, propionsavat, alkoholokat és különféle egyéb anyagokat állítanak elő. A sebfertőzést előidéző clostridiumok fermentációjuk során főleg vajsavat, ecetsavat és különféle gázokat, CO 2-ot és H 2-t termelnek. A clostridiumok erőteljes fermentációja magyarázza a gázoedemás betegségekben a szövetek megsavanyodását és sercegését. 17. ábra - A lactobacillusok glükózfermentációja 25
46 Bakteriológia A heterotróf baktériumok energiájuk zömét szénhidrátokból nyerik. Az energianyerés mellett azonban a baktériumok a cukormolekulák egy részét felhasználják saját poliszacharidjaik felépítésére. A baktériumsejtbe bejutott cukormolekulák, főleg hexózok, először nagyenergiájú vegyületekről makroerg kötésű foszfátcsoportot vesznek át, majd további nukleotid-trifoszfát felhasználásával uridin-, adenintrifoszfát stb. cukorkomplexek alakulnak ki. Az így létrejött cukornukleotidok cukormolekuláiból épülnek fel a baktériumsejtben (pl. a glükogén), a sejtfalban (a mukopeptidváz, a teichosavak, a sejtfalantigének) és az egyes baktériumok burkában található homo- vagy heteropolimer poliszacharidok. Valószínű, hogy a cukormolekulákat szállító nukleotidfoszfátok milyensége befolyásolja az egyes cukrok beépítésének sorrendjét (és ezáltal fajlagosságát) az egyes bakteriális poliszacharidokba. A baktériumokban lejátszódó bioszintetikus folyamatok összetettségét jelzi, hogy egyes (igénytelenebb) baktériumfajok valamennyi szerves anyagukat akár egyetlen szerves vegyületből (pl. citrátokból, acetátokból vagy más szénforrásból) is fel tudják építeni A nitrogén-anyagcsere A baktériumok nitrogénforrásként fehérjéket, aminosavakat és egyéb szerves nitrogéntartalmú vegyületeket, ammóniumsókat vagy ammóniát, sőt egyes fajok molekuláris N 2-t használnak fel. A baktériumok egy jelentős csoportja proteolitikus enzimjei segítségével képes elbontani a növényi és állati fehérjéket. Ezeka rothasztó baktériumok. A rothasztók a fehérjéket peptidekké és aminosavakká bontják. A fehérjebontók között egyaránt vannak pathogen és saprophyta fajok. A fehérjebontás történhet anaerob (rothadás) vagy aerob viszonyok (korhadás) között. Az aerob fehérjebontók fő képviselői a szaprofita Proteus fajok, a pathogenek közül ide tartozik pl.az Actinomyces pyogenes. Az anaerob fehérjebontás fő képviselője a Clostridium putrefaciens, a kórokozók közül ide tartozik pl. a C. botulinum, a C. histolyticum. A rothadás során keletkezett aminosavak tovább bomlanak, részben dekarboxilálódnak és egyebek mellett különféle igen bűzös vegyületek, aminok (pl. kadaverin, putreszcin, hisztamin), közös néven hullamérgek (ptomainok) keletkeznek, részben pedig dezaminálódnak és különféle szerves savakká (ecetsavvá, tejsavvá, vajsavvá, valeriánsavvá stb.) és gáznemű anyagokká (ammóniává, hidrogénné, szén-dioxiddá stb.) fermentálódnak, miközben energia szabadul fel (18. ábra). A szerves savakból további oxidációjuk során végső termékként szén-dioxid és víz keletkezik. Ezek mellett az aminosavakból keletkezhetnek még további jellegzetes anyagcseretermékek, így pl. a kéntartalmú aminosavakból kénhidrogén, a triptofánból indol, az argininből és más nitrogéntartalmú anyagokból ammónia. 18. ábra - Az alaninlebontás lehetséges folyamatai a baktériumokban 26
47 Bakteriológia A baktériumok többsége a fehérjéket nem képes elbontani. Ezek nitrogénszükségletüket aminosavakból, nitrátokból vagy ammóniából fedezik. Végül vannak olyan (kivétel nélkül saprophyta) baktériumok, amelyek a levegő molekuláris nitrogénjét is fel tudják használni nitrogénforrásként. Ezeknek a baktériumoknak egy része (pl. az aerob Azotobacter fajok, az anaerobok közül néhány Clostridium faj) a talajban és a természetes vizekben szabadon él. A levegő molekuláris nitrogénjéből ammóniát, majd aminosavakat, ezekből pedig fehérjét képeznek (a nitrogénből bőséges oxigénellátás mellett, vas- és molibdéntartalmú nitrogenáz enzimek képeznek ammóniát. Az ammónia alfa-ketoglutársavba kapcsolódva glutaminsavvá alakul). A fehérjék elrothadnak, a felszabaduló ammóniából pedig az autotróf nitrifikáló baktériumok a növények számára felszívható nitrogénsókat állítanak elő. A molekuláris nitrogént megkötni képes baktériumfajok egy másik csoportja (a Rhizobium fajok) a pillangós virágú növények gyökérzetén képződött gümőcskékben él. A levegő nitrogénjéből ammónián keresztül ezek is glutaminsavat képeznek, amelyet részben a baktériumok, részben pedig a gazdanövény használ fel saját fehérjéinek a felépítésére (szimbiózis). Molekuláris nitrogént és ammóniát megkötni képes baktériumok előfordulnak a kérődzők előgyomraiban is. A nitrogénből az aminosavakon keresztül ott is fehérje, majd az emésztés során a fehérjékből újra aminosavak képződnek, amelyek felszívódva hozzájárulnak a kérődzők aminosav-szükségletének a fedezéséhez. A baktériumok aminosav-szintézisét szolgáló nitrogénforrás rendszerint ammónia, függetlenül attól, hogy a nitrogén szerves anyagok bontásából vagy nitrátokból származott, a szénforrás pedig az intermedier anyagcsere valamelyik köztiterméke. A baktériumok glutaminsav-szintézise pl. alfa-keto-glutársavból, NH 3 felvételével, redukált NAD-foszfát jelenlétében, glutamát képződésén keresztül megy végbe. A glutamátból transzaminálással a megfelelő alfa-ketosavak jelenlétében majdnem minden aminosav szintetizálható. A glutaminsav aminocsoportja adja a nitrogénatomot a purin- és pirimidinbázisok szintéziséhez stb. Az aminosavszintézist végző enzimek többsége, szemben az energianyerés enzimjeivel, nem a cytoplasmamembránon, hanem a cytoplasmában található. Egyes baktériumfajok, bár nitrogénigényük nitráttal vagy ammóniumsókkal fedezhető, bizonyos aminosavakat nem tudnak szintetizálni, ezért csak akkor indulnak szaporodásnak, ha a szükséges aminosavakat készen kapják. A baktériumok fehérjéinek szintézise a riboszómán (poliriboszómán), az mrns-molekulák nukleotidszekvenciájának megfelelően, transzfer RNS-ek által szállított aminosavakból történik. Amint az a leírtakból kitűnik, a baktériumoknak fontos szerepük van a természet nitrogén-körforgalmában. Az elhalt növényi és állati fehérjék nitrogéntartalma a baktériumos bontás során ammóniává és részben közvetlenül molekuláris nitrogénné alakul. Az ammóniát és a nitrogént ismét baktériumos tevékenység juttatja vissza a talajba, a növények által felvehető nitrogénsók formájában. A növények fehérjéi részben állatokba kerülnek, és a folyamat kezdődik elölről. 27
48 Bakteriológia 4.5. A zsíranyagcsere A baktériumok cytoplasmahártyája és néhány baktériumcsoport (pl. mycobacteriumok, corynebacteriumok) sejtfala jelentős mennyiségű lipoidot is tartalmaz. Egyes baktériumfajok extracelluláris lipáz enzimeket termelnek, amelyekkel a környezetükben található zsírokat elbontják. A lipoidok, bár szerepükről a baktériumokban viszonylag keveset tudunk, a szénhidrátokhoz hasonlóan beépülnek a baktériumsejt szerkezeti anyagaiba vagy energianyerésre használódnak el. A baktériumokban a lipoid anyagok hosszú szénláncú szabad zsírsavak, zsírsavakból álló nagy molekulájú polimerek (pl. a cytoplasmában található béta-hidroxi-vajsav szemcsék) vagy különféle glükolipidek (pl. a Gram-negatív baktériumok sejtfalában levő foszfolipidek, a mycobacteriumok sejtfalában található mikolsav-cukor komplexek) formájában találhatók. A glükolipidek foszfátjához gyakran aminosavak is kapcsolódnak. A zsírsavak bioszintézise a baktériumokban éppen úgy, mint a magasabb rendű szervezetek sejtjeiben, a pantoténsav-tartalmú koenzim-a segítségével folyik Vitamin- és kiegészítőanyag-igény A heterotróf baktériumok egyes csoportjai növekedésükhöz nitrogén- és szénhidráttartalmú szerves anyagokon kívül különféle kiegészítő anyagokat, pl. vitaminokat, egyes baktériumcsoportok hemoglobint, bizonyos anyagcsere-folyamatokhoz pedig vasat stb. igényelnek. A baktériumoknak zsírban oldódó vitaminokra és C-vitaminra nincs szükségük. A legtöbbjük a B-vitamincsoport tagjait is előállítja, egyeseknek azonban egyiküket-másikukat készen kell kapniuk. A B-vitamin-csoport tagjai a baktériumokban éppúgy, mint az állati sejtekben, különféle enzimek prosztetikus csoportjai. B 1-vitamint igényelnek a sajtérésben szerepet játszó propionsavbaktériumok, B 2-vitamin szükséges a legtöbb Lactobacillus faj számára stb. A Haemophilusnemzetség baktériumai növekedésükhöz nikotinsavamidot (V-faktort) és hemoglobint (Xfaktort), a brucellák B 1-vitamint, nikotinsavamidot, pantoténsavat stb. igényelnek. A para-amino-benzoesavat a baktériumok többsége szintetizálja, de egyeseknek (pl. a sertésorbánc-baktériumnak) készen kell kapniuk. A vitaminigény ismerete egyrészt a baktériumok mesterséges táptalajokban való tenyésztése szempontjából fontos, másrészt a baktériumok vitaminigénye alapján egyes anyagok vitamintartalma biológiai úton meghatározható. A kérődzők előgyomraiban és egyéb állatfajokban a bélcsőben (főleg a vastagbélben) élő baktériumok vitamintermelése a gazdaszervezet szempontjából is hasznos Pigmenttermelés A baktériumok egyes csoportjai színanyagokat, pigmenteket termelnek. A színanyagok vagy a baktériumtestben vannak, vagy kidiffundálnak a sejtből, és ennek megfelelően vagy csak a baktériumok színeződnek el, vagy a környezetük is. A színanyagok az anyagcsere során keletkező másodlagos termékek. Kémiai természetük igen különböző (többnyire vörös, narancs vagy sárga színű, vízben nem oldódó karotinoidok, vízoldékony fenazinok) és csak néhány baktériumfajnál ismert. Biológiai szerepük is csak részben tisztázott, valószínű, hogy szerepet játszanak a baktériumsejt fénytől (napfénytől és ultraibolya sugárzástól) való védelmében, továbbá redoxi folyamatokban. A baktériumok pigmenttermelését lényegesen befolyásolják a tenyésztés körülményei. A pigmenttermelés a frissen izolált törzsekben a legkifejezettebb, különösen akkor, ha azokat a tenyésztést követően, bőséges levegőellátás mellett, szobahőn, normál megvilágításnak kitett helyen több napig tároljuk. A pigmenttermelő képesség genetikailag meghatározott tulajdonság, jellemző az egyes baktériumfajokra, és így segítséget nyújthat a baktériumok fajának meghatározásában. A pigmenttermelők között egyaránt vannak pathogen és saprophyta fajok. A pathogenek közül pl.a Staphylococcus aureus aranysárga, de egyes törzsei citromsárga vagy fehér, a fakultatív pathogen Mycobacterium fajok egy része sárga-vörös pigmenteket termel. A Pseudomonas aeruginosa tenyészeteiben kétféle festékanyagot, kék színű piocianint és sárga színű fluoreszceint is termel, ennek megfelelően tenyészetei zöld színűek. A saprophyták között is akadnak pigmenttermelők, pl.a Serratia marcescens vörös-rózsaszín, a Chromobacterium fajok kék-ibolya, a sókedvelő (halofil) baktériumok pedig vörös pigmenteket termelnek. A saprophyta pigmenttermelők előfordulnak a talajban, a természetes vizekben és a levegőben is. Élelmiszerekre kerülve színelváltozásokat idézhetnek elő. A baktériumok anyagcseréjük során még számos más anyagot, egyebek mellett pl. méreganyagokat (toxinokat), különféle antibiotikus hatású anyagokat stb. termelnek, ezekről azonban a megfelelő fejezetekben lesz szó. 28
49 Bakteriológia 4.8. A baktériumok fontosabb enzimjeinek és anyagcseretermékeinek a kimutatása A baktériumok anyagcseréjében szerepet játszó extracelluláris és intracelluláris enzimek, valamint az anyagcsere-folyamatokban keletkező termékek jellemzőek az egyes fajokra vagy a fajok egyes csoportjaira, ezért vizsgálatuk diagnosztikai szempontból igen fontos. Erre a célra szolgálnak a biokémiai próbák. A biokémiai próbákat rendszerint hagyományos módon, táptalajokon, tenyészetekben végezzük, a kérdéses anyagok bontásának, beépítésének stb. vizsgálatára alkalmas speciális táptalajok felhasználásával. Az utóbbi években azonban már kereskedelmi forgalomban is beszerezhetők több tulajdonság egyidejű vizsgálatára alkalmas készletek. Ezek olyan, több rekeszre osztott műanyag csövek vagy lemezek, amelyek különböző, egymástól elválasztott szakaszaiba más-más biokémiai sajátság vizsgálatára alkalmas, kismennyiségű speciális táptalajt töltöttek. A beoltás az egyes rekeszek hosszú tűvel való átszúrásával, vagy külön-külön történik. Hasonló készletek segítségével vizsgálható egyszerre akár több tucat intracelluláris enzim stb. A leolvasott eredmények számítógépprogram segítségével, más mikroorganizmusok sajátságaival összehasonlítva értékelhetők A nitrogénforgalom enzimjei és anyagcseretermékei A nitrátredukció vizsgálatához olyan levestáptalajt vagy peptonvizet használunk, amely 0,1% mennyiségben KNO 3-ot is tartalmaz. A keletkező nitriteket a Griess Ilosvay-féle reagenssel mutatjuk ki. A baktériumok egyes csoportjai képesek elbontani a fehérje-anyagforgalom során keletkezett karbamidot.az ureáz enzim kimutatására az 1 2% karbamidot és fenolvörös indikátort tartalmazó táptalajok szolgálnak. A karbamidból ammónia keletkezik, amely a táptalaj ph-ját lúgossá változtatja. A karbamidot gyorsan bontó (pl. Proteus) fajok tenyészetei beoltásuk után már néhány óra múlva, másoké ellenben csak több nap után lúgosodik meg. A fenilalanin-dezamináz enzim kimutatására 1 2% fenilalanint is tartalmazó ferde agaron szaporítjuk el a baktériumokat. A fenilalaninból keletkező fenil-piroszőlősav a táptalajra cseppentett néhány csepp vas(iii)- klorid-oldattal zöld színreakciót ad. A kéntartalmú aminosavakból és a különféle szulfátok redukciójából kén-hidrogén keletkezik. A kénhidrogén kimutatására a táptalajokhoz vassókat keverünk, vagy a levestenyészet fölé ólom-acetáttal átitatott papírcsíkot helyezünk. Mindkét esetben feketedést észlelünk. A vassókból kénhidrogén hatására vas-szulfid, a papírcsíkon pedig ólom-szulfid keletkezik. Egyes baktériumfajok triptofánból indolt termelnek.az indolt a tápfolyadékban a Kovács-féle reagens segítségével, színreakció alapján mutatjuk ki. Bizonyos aminosavak, pl. arginin, lizin vagy ornitin dekarboxilezése szintén jellemző egyes baktériumfajokra. Az aminosav-dekarboxiláz enzimek kimutatására olyan táptalajokat használunk, amelyek a kérdéses aminosavat 1 2%-os mennyiségben tartalmazzák. A dekarboxilezés során keletkező aminok a tápfolyadékot meglúgosítják, ami indikátorral jelezhető A szénhidrátforgalom enzimjei és anyagcseretermékei A gyakorlati diagnosztikában igen fontos a baktériumok szénhidrátbontásának (poli-, di- és monoszacharidok, cukoralkoholok, glükozidok stb.) a vizsgálata.a szénhidrátbontó képesség vizsgálatára olyan táptalajokat használunk, amelyek különféle sókat, 1% peptont és indikátort (peptonvíz), valamint a vizsgálni kívánt szénhidrátféleséget tartalmazzák. Azok a baktériumok, amelyek a táptalajban levő szénhidrátot savtermelés közben bontják el, a táptalajt megsavanyítják, s ez az indikátor színátcsapásából felismerhető. Az anaerob baktériumok szénhidrátbontásának a vizsgálatánál az indikátorok színátcsapásának a megfigyelése többnyire nem használható, mert az indikátorok az erőteljes redukciós hatás miatt a szénhidrátok bontása nélkül is elszíntelenednek, ilyen esetekben a ph elektromos úton való mérése igazít útba. A baktériumfajok egy része a szénhidrátokból nemcsak savat, hanem gázt is termel. A gáztermelés a peptonvízbe nyílásával lefelé helyezett kis erjesztőcsövecske segítségével vizsgálható. A metilvörös-próbával azt vizsgáljuk, hogy valamely baktériumfaj a glükózból sok vagy csupán kevés savat termel-e. A vizsgált baktériumfajt glükóztartalmú levestenyészetbe oltjuk. Az erősen savtermelők esetében a ph 4,4 alá süllyed, amit a tenyészethez adott néhány csepp metilvörös indikátor színe jelez. 29
50 Bakteriológia A baktériumok egyes csoportjai glükózból acetil-metil-karbinolt (acetoint) is termelnek, amely lúgos közegben, bőséges levegő jelenlétében piros színű diacetillé oxidálódik (Voges Proskauer-féle próba). Az acetointermelést, a metilvörös próbával párhuzamosan, ugyancsak glükóztartalmú levestenyészetben vizsgáljuk, a több napos tenyészethez kálium-hidroxidot és néhány kristály kreatint adva. Az anaerob és fakultatív anaerob baktériumok tenyészeteiben az erőteljes redukálóhatás kimutatható a táptalajba kevert festékek, pl. metilénkék elszíntelenedésével. Redukáló hatás eredménye lehet a táptalajban a kénsavas sókból keletkező kénhidrogén, fémes tellur vagy szelén kiválása sóikból stb. A tejalvasztás szintén jele lehet egyes baktériumfajok szénhidrátbontásának. A tejcukrot bontó fajok savtermelésük miatt a tejet megalvasztják. Egyes fajok az alvadékot proteolitikus enzimjeik segítségével el is folyósítják. A szénhidrátbontás típusát (OF-próba) olyan táptalajban vizsgáljuk, amely glükózt (vagy valamely más, a vizsgált baktériumok által felhasználható szénhidrátot) tartalmaz. A vizsgálni kívánt törzzsel egyszerre két táptalajt tartalmazó csövet oltunk be. Az egyiket aerob, a másikat anaerob (pl. paraffinnal lezárva) viszonyok között tenyésztjük. Az obligát aerobok csupán aerob (oxidatív), az anaerobok csupán anaerob (fermentatív) módon, a fakultatív anaerobok viszont mindkétféleképpen képesek a táptalajba kevert szénhidrátot bontani. A szénhidrátokból a bontás során sav (és esetleg gáz is) keletkezik, amelynek jelenléte a táptalajba kevert indikátorral jelezhető. A citokrómoxidáz enzim a terminális oxidációban a redukált citokrómról az elektronokat molekuláris oxigénre viszi át, így a citokrómokat oxidálja. Színreakció segítségével mutatható ki oly módon, hogy az oxidázreagenssel (1%-os tetrametil-parafeniléndiaminnal) átitatott szűrőpapírcsíkon finoman szétdörzsölünk egy keveset a vizsgálandó baktériumfaj tenyészetéből. Ugyancsak fontos a baktériumok kataláz enzimjének a kimutatása. A kataláztermelés kimutatható, ha a vizsgálni kívánt baktérium levestenyészetébe néhány csepp 3%-os hidrogén-peroxidot csepegtetünk, vagy ha a tárgylemezre cseppentett hidrogén-peroxidban terítjük szét a baktérium agartenyészetének egy kacsnyi mennyiségét. A kataláz enzim jelenlétét élénk pezsgés jelzi. Több baktériumfaj extracelluláris enzimeket is termel, amelyek a baktériumok környezetében levő nagy molekulájú anyagokat építőköveikre bontják, alkalmassá téve arra, hogy a baktériumok cytoplasmahártyáján át bejutva tápanyagforrásul szolgáljanak. Az extracelluláris enzimek között vannak olyanok is, amelyek az élő szöveteket is megtámadják, így az extracelluláris enzimek jelenlétének nemcsak diagnosztikai, hanem kórtani szempontból is jelentősége van. A proteolitikus enzimeket termelő baktériumok képesek a natív fehérjék elbontására. Ezek közül a rothasztók a fehérjéket teljes mértékben lebontják, mások viszont csupán zselatin, kazein stb. hidrolízisére képesek. A mélyreható fehérjebontás a tenyészetben kénhidrogén, más gázok, szerves savak és igen bűzös aminok keletkezéséről ismerhető fel.a zselatinhidrolízist a zselatintartalmú táptalajok elfolyósodása jelzi. Speciális, fehérjékre ható enzimek a koaguláz és a fibrinolizin.a koaguláz enzim serkenti a véralvadást. A koagulázt termelő fajokat nyúl citrátos vérplazmájába oltva az eredetileg folyékony plazma rövid idő alatt megalvad. A fibrinolizin a koagulált plazmát feloldja.a lecitináz enzimet termelő fajokat tojássárgáját is tartalmazó táptalajokon tenyésztve, körülöttük a lecitinbontás folytán opálos udvar keletkezik. Ha a vizsgált törzs lipázt is termel, a telep körül kicsapódott zsírsavcseppekből álló, gyöngyházfényű udvar is keletkezik. Néhány baktériumfaj foszfatáz enzimjével képes a szervezet különféle foszfátésztereit (pl. glicerin-foszfátot) hasítani. A táptalajba kevert színtelen fenolftalein-foszfátból az enzim hatására keletkező szabad fenolftalein ammóniagőzben vörös színt ad A baktériumtevékenység gyakorlati hasznosítása Mivel a baktériumok anyagcsere-tevékenységük során igen sokféle anyagot elbontanak, fontos szerepet játszanak a természetben a különféle anyagok (nitrogén, szén, foszfor, kén stb.) körforgalmában. A rothadás során a baktériumok (és más mikroorganizmusok, gombák stb.) együttes tevékenységének eredményeként elbomlanak a növényi és állati eredetű szerves anyagok. A nitrogéntartalmú anyagokból végső 30
51 Bakteriológia soron ammónia és molekuláris nitrogén, a szénhidrátokból és zsírokból pedig szén-dioxid és víz keletkezik. Az elhalt növényi és állati szervezetek szerves anyagai mikrobás tevékenység eredményeként elemeikre bomlanak (mineralizálódnak) és visszajutnak a természetbe. A talaj nitrogénsóinak fontos forrása az istállótrágya.a trágyaérés során mind a fehérje-, mind a szénhidráttartalmú anyagok elbomlanak. Az istállótrágya szakszerű érlelésekor a tömörítéssel anaerob viszonyokat létesítünk. A keletkező nitrogéntartalmú bomlástermékeket a talajban élő nitrifikáló baktériumok alakítják át nitritté és nitráttá. Ha viszont a trágyát szakszerűtlenül, aerob viszonyok között érlelik, a keletkező nitrogéntartalmú bomlástermékek zöme ammónia vagy molekuláris nitrogén formájában elillan. A trágyaérés során a szénhidráttartalmú anyagok bontásából jelentős mennyiségű hő keletkezik, ami elegendő a helyesen összerakott trágya önsterilizálódására (füllesztés). A rothasztó baktériumok hatása érvényesüla szennyvizek ártalmatlanná tételében is. A sok szerves anyagot tartalmazó szennyvizet bő levegőztetéssel aerob, oxidatív bontásnak, majd megfelelő medencékben ülepítve anaerob bontásnak (rothadásnak) vetjük alá, s az ily módon szerves anyagaik java részétől megszabadított vizet használjuk fel öntözésre vagy vezetjük a folyókba. A szennyvizekben még megmaradt szerves anyagok a vizekben végbemenő baktériumtevékenység hatására lebomlanak (a víz öntisztulása). A természetes vizek öntisztulási képességének azonban határa van. A folyóvizekbe vezetett túlságosan sok szerves anyagot vagy méreganyagokat (fenolt, higanyt, ólmot stb.) tartalmazó szennyvizek megakadályozzák a baktériumos tevékenységet, ezáltal lehetetlenné téve az öntisztulást. A szennyvizek megfelelő kezelése, a folyók és a tavak öntisztulási folyamatainak lehetővé tétele alapvető környezetvédelmi érdek. A baktériumok anyagcsere-folyamatait már régóta felhasználjuk különféle ipari célokra is. A tejsavas erjedést előidéző baktériumok, elsősorban a Streptococcus lactis ésa különféle lactobacillusok (L. delbrückii, L. plantarum stb.) fermentálóképességét használjuk ki a nedvdús, nagy szénhidráttartalmú takarmányok silózással való tartósításakor. A kellően aprított takarmánytömegben a tömörítés és a növényi anyagok autolízise következtében anaerob viszonyok alakulnak ki. A tejsavtermelő baktériumok a takarmány szénhidrátjainak néhány százalékát elbontva 1 2% tejsavat állítanak elő, amely elegendő a takarmány tartósításához. A baktériumok szénhidrátbontó tevékenységének eredményeként a szilázs belseje jelentősen fel is melegszik. A szilázsban feltétlenül anaerob viszonyokat kell teremteni, mert egyébként olyan baktériumok szaporodnak el, amelyek a szénhidrátokból nem tejsavat, hanem ecetsavat, vajsavat, különféle egyéb szerves savakat és gázokat termelnek. A tömörítés lényeges azért is, hogy a keletkező hő a szilázs hőmérsékletét testhőmérséklet fölé emelje, 37 C körüli hőmérsékleten ugyanis a szilázsban elszaporodhat pl. az ugyancsak anaerob Clostridium butyricum, amely a szénhidrátokból vajsavat és egyéb, az állatok számára kellemetlen szagú anyagokat képez. A silózással analóg folyamatok játszódnak le a különféle élelmiszerek savanyítással való tartósításakor is. Széles körben használunk baktériumkultúrákat a tejtermékek előállításakor is. A tejcukrot bontó baktériumok hatására a tej kazeinje kicsapódik, a tej megalszik. Streptococcusokat, lactobacillusokat és ritkábban gombákat használunk különféle aludttej termékek (joghurt, kefir stb.) előállítására. Sok baktérium- és gombafajt veszünk igénybe a sajtok előállításához. Ugyancsak általános a különféle baktérium- és gombatenyészetek használata az erjesztőiparban. Aerob úton, különböző Acetobacter fajok (A. aceti, A. xylinum) segítségével állítjuk elő, híg alkoholtartalmú folyadékokból az ecetsavat. Anaerob vagy aerob úton különböző gomba- és baktériumtenyészetek segítségével, ipari méretekben állítjuk elő a tejsavat, citromsavat, egyes aminosavakat (pl. glutaminsavat, szerint, triptofánt, valint), vitaminokat (pl. aszkorbinsavat, B 12-vitamint, riboflavint, antibiotikumokat) vagy használunk mikrobákat különféle vegyületek (pl. szteroid hormonok) átalakítására. Baktérium- (és gomba-)fajokból állítanak elő számos enzimet, pl. proteázokat, lipázokat. A termofil fajokból (lásd később) előállított enzimek előnye, hogy magas hőmérsékleten is működnek. Ilyen enzimeket használunk különféle mosóporokba, tisztítószerekbe keverve, továbbá speciális laboratóriumi célokra (restrikciós endonukleázok, DNS-polimerázok stb.) is. Mezőgazdasági hulladékokból baktériumok és gombák segítségével jelentős mennyiségű biogáz termelhető. Egyes, elsősorban Pseudomonas fajok képesek nagymolekulájú szénhidrogének lebontására. Ezek felhasználhatók olajszennyeződések, illetve egyébként elbonthatatlan vagy csak nehezen átalakítható szerves vegyületek biológiai úton történő ártalmatlanná tételére. 5. A baktériumok tenyésztése 31
52 Bakteriológia A baktériumok, kevés kivételtől eltekintve, mesterséges viszonyok között táptalajokon tenyészthetők.a táptalajoknak a vízen és a különféle ásványi sókon kívül tartalmazniuk kell a szükséges tápanyagokat, vitaminokat és kiegészítő anyagokat, emellett izotóniásnak és megfelelő ph-júnak, továbbá sterilnek kell lenniük. A táptalajok nitrogénforrásként komplett fehérjéket (vért, vérsavót, tojást stb.), különféle állati vagy növényi fehérjékből (húsból, kazeinből, szójából stb.) enzimes emésztéssel vagy savas kezeléssel előállított fehérjehidrolizátumokat (peptont, triptont stb.), aminosavakat vagy csupán ammóniumsókat tartalmaznak. A fehérjehidrolizátumokban bőven találhatók peptidek és aminosavak. Szénhidrátforrásként a táptalajok különféle poliszacharidokat, cukrokat, cukoralkoholokat, glikozidákat, szerves savakat stb. tartalmaznak. Vitaminforrásként a táptalajokhoz rendszerint élesztőkivonatot, egyes kényesebb fajok tenyésztésekor pedig még egyéb kiegészítő anyagokat (pl. nukleinsav-hidrolizátumot, hemoglobint) is adunk. A táptalajok folyékonyak, félfolyékonyak vagy szilárdak. Tápanyagaik általában természetes anyagok (húslé, húskivonat, pepton, tripton, glükóz, egyéb szénhidrátok), vannak azonban olyanok is, amelyeket ismert kémiai anyagból, aminosavakból, szénhidrátokból, sókból stb. állítunk elő (szintetikus táptalajok). Egyes szintetikus táptalajok csupán a baktériumok által még hasznosítható legegyszerűbb anyagokat tartalmazzák (minimális táptalajok). A baktériumoknak a táptalajokkal szembeni igénye igen sokrétű, ennek megfelelően sokféle, változatos összetételű táptalajt használunk. A táptalajokat a különböző komponensekből a laboratóriumban többnyire magunk állítjuk össze, manapság azonban kereskedelmi forgalomban, por vagy granulátum formájában csaknem minden fontosabb táptalaj előre elkészítve is megvásárolható. A kész portáptalajok megfelelő mennyiségét vízzel összekeverve, felfőzve, majd autoklávozva állítjuk elő a használatra kész táptalajokat. A Petri-csészékbe, kémcsövekbe stb. frissen kiöntött táptalajok néhány napig hűtőben tárolhatók. A szilárd táptalajok gélek, alapanyaguk tápfolyadék, amelybe agar-agart vagy ritkábban zselatint keverünk. A zselatin testhőmérsékleten folyékony, ezért szilárd táptalajként csak szobahőn használható. Az agar-agar tengeri moszatokból előállított, szálas szerkezetű anyag, 1 2% mennyiségben a táptalajhoz adva C között megolvad, C alatt pedig szilárd géllé dermed. Az agar-agar kémiailag poliszacharid, amelyet a baktériumok nem bontanak el. A szilárd táptalajok alkalmasak a baktériumok tiszta tenyészetben való izolálására. A bakteriológiai vizsgálatok során a vizsgálandó anyagokból egy keveset szilárd táptalajok felületére kenünk (szélesztés). A beoltott táptalajokat megfelelő viszonyok közé helyezve (inkubálva) azok felületén a baktériumok telepeket képeznek. A szilárd táptalaj felületén kinőtt baktériumtelepek összességét nevezzük tenyészetnek, baktériumkultúrának. Primer tenyészetben az egyes fajok rendszerint nem önállóan, hanem más fajokkal együtt fordulnak elő. A baktériumok fajának meghatározásához szükséges alaki, tenyésztésbeli, anyagcsere- stb. sajátságok vizsgálata céljából színtenyészeteket állítunk elő. A színtenyészetek előállítását megkönnyíti, ha a táptalajba olyan anyagokat keverünk (pl. különféle fémsókat, festékeket, antibiotikumokat stb.), amelyek csak bizonyos fajok szaporodását teszik lehetővé (szelektív táptalajok) vagy ezek mellett még olyan anyagokat is (pl. különféle cukrokat és indikátorokat), amelyeknek felhasználása alapján a kinőtt baktériumtelepek egymástól megkülönböztethetők (differenciáló táptalajok). A szilárd táptalajokon egy-egy telep rendszerint egy vagy csupán néhány baktériumból indul fejlődésnek. Az egy telepből továbboltott tenyészetet (szubkultúrát) nevezzük törzsnek. A táptalajok felületén fejlődött telepek alakja, nagysága, konzisztenciája jellemző az egyes baktériumfajokra. Folyékony táptalajok. A szilárd táptalajokon színtenyészetben izolált baktériumtörzsek folyékony táptalajokban is elszaporíthatók. Folyékony táptalajokban a törzseket rendszerint azért szaporítjuk, mert bennük olyan változásokat (zavarosodás, üledék- vagy hártyaképződés, sav- és gázképződés stb.) indítanak meg, amelyeket diagnosztikai szempontokból értékesíthetünk vagy azért, mert bennük a baktériumok olyan anyagokat termelnek, amelyekre az immundiagnosztikai vizsgálatokhoz van szükségünk (pl. tuberkulin, mallein), vagy pedig azért, mert így juthatunk nagy mennyiségű baktériumhoz és baktériumtermékekhez, amelyekre különféle ipari célok (oltóanyagok, antibiotikumok termelése stb.) végett van szükségünk. A tenyésztés körülményei. A kórokozó baktériumokat, kevés kivételtől eltekintve, 37 C hőmérsékleten, termosztátban tenyésztjük néhány napig. Közönséges levegőn, esetenként csökkentett oxigénnyomású, széndioxiddal dúsított légtérben (mikroaerofilek) vagy az oxigén kizárásával, anaerob viszonyok között tenyésztünk. A mikroaerofil viszonyok kialakítása érdekében a lezárt tenyésztőedényből a levegő egy részét kiszivattyúzzuk, és helyére szén-dioxidot töltünk. A kereskedelmi forgalomban azonban kaphatók olyan, fóliába zárt vegyszerkombinációk, amelyeket a tenyésztőedénybe helyezve és néhány ml vizet adva hozzá, majd a tenyésztőedényt lezárva, az oxigén egy részét megkötik és kevés szén-dioxidot is fejlesztenek, s ezáltal alakulnak ki mikroaerofil viszonyok. 32
53 Bakteriológia Az anaerob baktériumok tenyésztésére szolgáló táptalajoknak megfelelően kis redoxipotenciálúaknak kell lenniük, s bőven kell tartalmazniuk könnyen fermentálható tápanyagokat. A kis redoxipotenciál fenntartása végett a táptalajokba könnyen redukálható (hidrogénfelvételre képes) anyagokat (pl. szulfátokat, tioglikolátot, ciszteint) keverünk. A frissen készített és beoltott táptalajok inkubálásához anaerob viszonyok létesíthetők oly módon, hogy a tenyészetek fölötti légtérből az oxigént kémiai úton pirogalluszsav és kálium-hidroxid összekeverésével vonjuk el, vagy pedig úgy, hogy a táptalajokat vastag falú edénybe (anaerosztátba) tesszük, belőle a levegőt kiszivattyúzzuk vagy palládium katalizátor és hidrogén jelenlétében a levegő oxigénjét vízzé alakítjuk. A már izolált anaerob fajok többsége tovább szaporítható oly módon, hogy a törzset lágy (0,1 0,2% agaragar-tartalmú) agar aljába vagy szervdarabokat (pl. májat, darált húst) tartalmazó (anaerob) leves táptalajokba oltjuk, majd a táptalaj felszínét a levegőtől paraffinnal elzárjuk. Az oxigénre még nyomokban is érzékeny, szigorúan anaerob fajok (pl. Bacteroides, Fusobacterium) beoltásához és tenyésztéséhez speciális eljárásokat és berendezéseket (pl. levegő kizárásával készült preredukált táptalajokat, speciális, CO 2-túlnyomás alatt tartott oltókamrákat, forgó tenyészeteket) veszünk igénybe A baktériumok növekedése és szaporodása A baktériumok egyszerű, haránt irányú kettéosztódással szaporodnak. Osztódás előtt a baktériumtest megnagyobbodik, a pálcika alakú baktériumok megnyúlnak, a cytoplasmahártya a sejttest egy pontján betüremkedik és fokozatosan lefűzi a keletkező két új sejtet. A cytoplasmahártya külső felületén a lefűződéssel egyidejűleg megindul a sejtfal képződése is. A sejtosztódás folyamata a sejtfal kialakulásával fejeződik be. Ha az osztódáskor a sejtfal lefűződése zavart szenved, felpuffadt vagy hosszú, fonal alakú képletek jöhetnek létre. A csíraszám meghatározása. Szaporodás közben, optimális viszonyok között, in vitro, a baktériumok számának változása bizonyos törvényszerűségeket mutat. Ez jól érzékelhető, ha a folyékony táptalajba oltott baktériumok számát időről időre meghatározzuk.az összcsíraszámot (élő és elpusztult baktériumok együtt) a baktériumok előzetes megfestése után, a vérsejtszámláláshoz hasonlóan (pl. Bürker-kamrában) vagy egyéb speciális sejtszámláló készülékkel határozhatjuk meg.az élőcsíraszám meghatározására legtöbbször a hígításos módszert használjuk. A vizsgálandó baktériumszuszpenzió egységnyi mennyiségéből hígítási sorozatot készítünk, és a hígításokból adott mennyiséget agarlemezre szélesztve vagy a lehűlő agarba keverve a képződő telepeket megszámláljuk. A telepek számából többé-kevésbé pontosan meghatározható az eredeti baktériumszuszpenzió csíraszáma. Az összcsíraszám kielégítő pontossággal meghatározható a baktériumtenyészet sűrűségének fotoelektromos úton való mérésével is. A tenyészet kialakulásának fázisai. Az új tenyészet kialakulásaa nyugalmi szakasszal (lag fázis) kezdődik (19. ábra). A beoltást követő néhány órán belül az élő baktériumok száma lényegesen nem változik. A nyugalmi szakasz a baktériumok alkalmazkodásának az időszaka. Ez az idő szükséges ahhoz, hogy a baktériumok megtermeljék mindazokat az enzimeket, amelyek az új környezetben rendelkezésre álló tápanyagok felhasználásához szükségesek. 19. ábra - A baktériumok szaporodásának szakaszai. A lag, B exponenciális, C stacioner, D regresszív fázis 33
54 Bakteriológia A nyugalmi időszakban a baktériumsejtekben igen élénk bioszintézis folyik, osztódás azonban lényegében nincs. A nyugalmi szakasz hossza a baktérium faji sajátságain kívül függ a rendelkezésre álló tápanyagoktól, a beoltott tenyészet mennyiségétől, korától stb. Időtartama annál rövidebb, minél fiatalabb az átoltott tenyészet s minél gazdagabb tápfolyadékba oltjuk. A nyugalmi fázis rövidül akkor is, ha a törzset ugyanolyan táptalajba oltjuk, mint amilyenben korábban tenyésztettük. A nyugalmi szakasz végén megindul a baktériumok osztódása. Mivel a baktériumok osztódása során egy baktériumból kettő, kettőből négy lesz stb., az élő baktériumok számának növekedése igen gyors. Ez a szakasza logaritmusos (exponenciális) szakasz. A logaritmusos szakaszban az új generáció keletkezésének idejét (a generációs időt) a baktériumok faja és a környezeti feltételek befolyásolják. Optimális viszonyok között tenyésztve a gyorsan szaporodó E.coli törzsek generációs ideje perc, a jóval lassabban szaporodó Mycobacterium fajoké kb óra. A logaritmusos szakasz végén a baktériumok szaporodása lelassul, az osztódó és a folyamatosan elpusztuló baktériumok száma egyensúlyba kerül, kialakula stacioner szakasz. A stacioner szakasz létrejöttének oka az, hogy a gyors szaporodással párhuzamosan elfogy a rendelkezésre álló tápanyag, s feldúsulnak a tenyésztőfolyadékban a káros anyagcseretermékek. A szaporodás ütemének a csökkenésében szerepet játszik a baktériumok számára rendelkezésre álló biológiai tér nagysága is. Bizonyos sűrűség (a könnyen tenyészthetőknél kb baktérium/ml) elérése után a baktériumok szaporodása akkor is lelassul, ha tápanyag még rendelkezésre áll. Folyamatos tápanyag-utánpótlással, a keletkező káros anyagcseretermékek (pl. a szénhidrátok bontásából keletkező szerves savak) közömbösítésével, megfelelő légtér fenntartásával (pl. aeroboknál bő oxigénellátással) a baktériumok szaporodásának a logaritmusos szakasza megnyújtható. Ezt az eljárást hívjuk folyamatos tenyésztésnek. A folyamatos tenyésztést alkalmazzák ipari célokra (pl. antibiotikumok, különféle szerves savak előállítására stb.). A stacioner szakaszt követi a baktériumok rohamos pusztulása, a csökkenő (regresszív) szakasz, amely végül a tenyészet kihalásához vezet. Hossza baktériumfajonként igen változó. Vannak olyan fajok, amelyeknek a tenyészetei néhány nap alatt kihalnak (pl. Haemophilus, Actinobacillus, Pasteurella fajok), másokéi, ha a kiszáradástól megóvjuk őket, hónapokig, esetleg évekig is életben maradnak (pl. Salmonella fajok). A spórás baktériumok tenyészetei a spórák képződése következtében több évtizedig életképesek maradnak. Levestenyészetben a baktériumok könnyebben indulnak szaporodásnak, de lényegesen rövidebb ideig maradnak életben, mint szilárd táptalajokban. A baktériumtörzsek fenntartása. A bakteriológiai diagnosztikában gyakran szükséges az egyes baktériumtörzsek fenntartása. A hosszabb-rövidebb ideig fenntartani kívánt törzseket megfelelő táptalajba (pl. lágy agarba, tojás táptalajokba) oltjuk, és a tenyészeteket tartalmazó kémcsöveket a kiszáradástól való megóvás végett légmentesen lezárva, hűtőszekrényben tároljuk. A törzseket a baktériumok fajától függően időnként át kell oltani. A baktériumtörzsek tartós tárolására a fagyasztás és a fagyasztva szárítás (liofilezés) szolgál A környezet hatása a baktériumok szaporodására 34
55 Bakteriológia A baktériumok növekedését és szaporodását, ezen keresztül pedig alaki tulajdonságaikat, anyagcseréjüket és esetenként genetikai anyagukat is lényegesen befolyásolják a környezeti feltételek. Nedvesség. A baktériumok szaporodásukhoz nemcsak tápanyagokat, hanem elegendő nedvességet is igényelnek. Az egyes baktériumfajok nedvességigénye változó. Legmegfelelőbb, ha a közeg 75 90% vizet tartalmaz. A víztartalom csökkenésével a baktériumok élettevékenysége fokozatosan lassul, a beszáradással pedig előbb-utóbb megszűnik. A spórák beszáradva is hosszú ideig, akár évtizedekig is életképesek maradnak. A baktériumtevékenységnek a vízveszteséggel párhuzamos csökkenését használjuk ki az élelmiszerek (gyümölcsök, gabonafélék stb.) szárításos tartósítására. A beszáradás azonban nem minden körülmények között jár a baktériumok pusztulásával, sőt a baktériumok (más mikroorganizmusok, állati és növényi sejtek stb.) hosszú időre megbízhatóan konzerválhatók fagyasztva szárítással (liofilezéssel). Liofilezéskor a tartósítandó baktériumtenyészet védőkolloidban szuszpendált néhány tized ml-ét ampullába mérjük és speciális készülékben gyorsfagyasztva vákuumban beszárítjuk, majd az ampullát leforrasztjuk. Az ily módon beszárított, vákuumban tartott törzsek a szennyeződés veszélye nélkül évekig fenntarthatók. Hőmérséklet. A baktériumok széles hőmérsékleti határok között képesek szaporodni. A hidegkedvelő (pszichrofil) baktériumok 15 C vagy ez alatti hőmérsékleten szaporodnak a legjobban. Több közülük pigmentet is termel. Ide tartoznak egyes Achromobacter, Flavobacterium, Pseudomonas, Spirillum fajok stb. Megtalálhatók a természetes vizekben és az arktikus talajokban, a tengerekben és az óceánokban élő baktériumok többsége ide tartozik. A hidegkedvelők ártalmatlan baktériumok, mégis fontosak, egyrészt élelmiszer-higiéniai szempontból, mert hűtőszekrényben tartott élelmiszerek megromlását idézhetik elő, másrészt azért, mert alacsony hőmérsékleten képesek szerves anyagokat bontani, ezáltal közreműködnek a vizek öntisztulásában. A hőkedvelő (termofil) baktériumok szaporodásához a C az optimális, de számos faj e fölötti hőmérsékleteken is képes szaporodni. Hőforrások vizében, trópusi talajokban stb. fordulnak elő. Hőkedvelő variánsok találhatók pl.a Bacillus, a Clostridium nemzetségek fajai között. A mezofil baktériumok legjobban C között szaporodnak. A hőmérsékleti optimum felett szaporodóképességük viszonylag gyorsan megszűnik, az alacsony hőmérsékletet azonban sokkal inkább elviselik. A kórokozó baktériumok kivétel nélkül mezofilek. Ezek közül egyesek csak testhőmérsékleten képesek szaporodni (stenotermiás fajok), mások azonban jóval tágabb határok között is (pl.a Listeria monocytogenes 4 42 C között). Kémhatás. A baktériumok szaporodását erősen befolyásolja a környezet kémhatása. A legtöbb baktérium számára az enyhén lúgos, ph 7 7,6-os kémhatás az optimális, a baktériumok azonban e határok alatt és felett is egy ideig tovább szaporodnak. Vannak olyan fajok, pl. a lactobacillusok, amelyek számára a kissé savas kémhatás, a ph 6 6,5 előnyösebb, mások képesek erősen lúgos közegben, ph 7 9 között is szaporodni. A közeg ph-ja a baktériumok szaporodása során termelt anyagcseretermékek miatt jelentősen változhat, esetenként a tápfolyadék olyannyira megsavanyodhat, hogy a tenyészet kihal. A ph jelentős eltolódását a táptalajokba kevert pufferekkel akadályozzuk meg. Az ozmotikus viszonyok (a környezet sókoncentrációja) szintén befolyásolják a baktériumok szaporodását. Optimális az izotóniás közeg (0,9% NaCl). Hipotóniás oldatban a baktériumok megduzzadnak, legömbölyödnek, cytoplasmahártyájuk felreped. A hipertóniás oldatokat a baktériumok egy bizonyos sókoncentrációig elviselik, ezután a szaporodás megáll, a sejtek összezsugorodnak, elpusztulnak. Egyes fajok, így a saprophyta sókedvelő (halofil) baktériumok szaporodásához 20 30% sótartalom az optimális. A pathogen fajok között is akadnak olyanok (pl. Streptococcus, Staphylococcus fajok), amelyek 8 15% só jelenlétében is megélnek. Az ozmotikus viszonyok változtatását (sózás, pácolás, magas cukorkoncentráció stb.) rendszerint a közeg egyidejű megsavanyításával (ecetsav, citromsav, benzoesav, szorbinsav stb. hozzáadásával) használjuk ki az élelmiszerek tartósítása során. 6. A baktériumok ellenálló képessége a fizikai és kémiai hatásokkal szemben, sterilezés, fertőtlenítés Gyakran van szükségünk környezetünkben, a tárgyakon, eszközökön, élelmiszerekben stb. található mikrobák (baktériumok, gombák, vírusok, paraziták) elpusztítására, eltávolítására vagy legalább számuk jelentős csökkentésére. E célok elérésére különféle fizikai eljárások és számos kémiai anyag áll rendelkezésünkre. Ha 35
56 Bakteriológia valamennyi mikroba megsemmisítéséről vagy eltávolításáról van szó, sterilezésről, ha pedig csupán a pathogen mikrobák elpusztítása és egyéb mikrobák számának a jelentős csökkentése a cél, fertőtlenítésről beszélünk. A környezet kedvezőtlen irányú változása a baktériumok szaporodását lelassítja, megállítja, sőt, ha a kedvezőtlen hatás elég erős, a baktériumokat el is pusztítja. Ha csupán a baktériumok szaporodása gátolt, bakteriosztatikus, ha viszont a baktériumok el is pusztulnak, baktericid (virucid, fungicid) hatásról beszélünk. A bakteriosztatikus hatás reverzíbilis. A szaporodásukban gátolt baktériumok egy ideig még életképesek maradnak, ha azonban a behatás erőssége növekszik vagy hosszabb ideig tart, a baktériumok fokozatosan elpusztulnak. A baktériumok és egyéb mikrobák pusztulása időarányos folyamat. A baktériumok számára kedvezőtlen behatás kezdetekor a mikrobák pusztulása tömeges (exponenciális), míg a baktériumok számának a csökkenésével a pusztulás tempója jelentősen lefékeződik, s az utolsó mikroba elöléséig jelentősen több időre van szükség, mint ahogy az a pusztulás exponenciális szakaszában számítottból következne. Akár fizikai behatásokat (pl. hőt), akár kémiai anyagokat (fertőtlenítőszereket) veszünk igénybe a mikrobák elölésére, minden eljárásra vonatkozóan meg kell határoznunk azokat a konkrét feltételeket (hőmérsékletet, időt stb.), amelyek biztonsággal elegendők valamennyi mikroba elpusztítására. A mikrobapusztulás kinetikájának az ismerete különösen fontos az élelmiszeriparban, egyebek mellett pl. a konzervekben található mikrobák hőkezeléses megsemmisítése során, egyrészt az élelmiszer természetes állapotának minél jobb megőrzése, másrészt a mikrobák biztonságos elölése végett A mikrobák elölésére szolgáló fizikai hatások Hő- és hideghatás Magasabb hőmérsékleten a baktériumok (és egyéb mikrobák) fehérjéi denaturálódnak. A vegetatív baktériumok (és vírusok) legtöbbje C-on, a mycobacteriumok és a gombák pedig 80 C körüli hőmérsékleten perceken belül elpusztulnak, míg a baktériumok spóráinak az elpusztítására biztonságosan csak az autoklávban való hőkezelés alkalmas. Hőhatáson alapul a pasztőrözés, a frakcionált sterilezés, a hőlégszekrényben való sterilezés, a kifőzés, az autoklávban történő csíramentesítés, az elégetés, leégetés és az izzítás. Csírátlanítás hővel. A csírátlanítás történhet nedves vagy száraz hővel. Zömmel a nedves hővel való csírátlanítást használjuk. A pasztőrözés során a kezelendő folyadékokat (tejet, sört, gyümölcsleveket stb.) 30 percre C-ra, másodpercre C-ra vagy néhány másodpercre 85 C körüli hőmérsékletre hevítik. Ez a hőkezelés alkalmas a kezelt folyadékok csíraszámának a jelentős csökkentésére, de nem érhető el vele sterilitás. Az ultrapasztőrözés, amely során a tejet néhány másodpercre túlhevített gőzzel C-ra hevítik, viszont rendszerint már minden mikrobát elöl, az így kezelt tej steril. Különféle hőérzékeny anyagokat, tejet, tojást, vérsavót tartalmazó táptalajok sterilezésére szolgál a frakcionált sterilezés (tyndallozás). A táptalajokat 3 napon át naponta fél órára C-ra hevítjük (vagy áramló gőzbe helyezzük), közben pedig 37 C-on tartjuk. Az első hevítés rendszerint elpusztítja a táptalajban levő vegetatív baktériumokat, a további hevítések pedig elölik a spórákból kicsírázó vegetatív alakokat. A hővel való sterilezés egyik legrégibb módja a kifőzés. Különféle műszerek, laboratóriumi eszközök és ruhaneműk is sterilezhetők ily módon. A forrásban levő víz perc alatt elöli az összes mikrobát, kivéve a legellenállóbb baktériumspórákat. A kifőzés hatékonyságát nagyban növeli, ha a vízhez 2% szódát, kis mennyiségű fenolt vagy felületaktív anyagot adunk. A hőkezelési eljárások közül a leghatékonyabb az autoklávban való sterilezés. Az autoklávok megfelelő szelepekkel ellátott, dupla falú, nyomásálló készülékek, amelyekben nagynyomású vízgőzzel sterilezünk. Az autokláv felfűtésekor keletkező vízgőz 112 C-on fél óra alatt (0, Pa túlnyomáson) vagy 121 C-on perc alatt (10 5 Pa) minden mikroorganizmust elöl. Ennél magasabb hőmérsékleten 133 C-on ( Pa) való hőkezelésre csak kivételesen van szükség. Az autoklávban laboratóriumi üveganyagok, fémeszközök, táptalajok, kötszerek, ruhaneműk stb. egyaránt sterilezhetők. A száraz hővel való sterilizálásra leggyakrabban a hőlégszekrényt használjuk. A szigetelt falú, zárt, elektromos vagy gáz fűtésű hőlégszekrényekben a levegőt C-ra hevítjük. Kétórás hőkezelés elég a sterilitás eléréséhez. Fontos, hogy a hőmérséklet a hőlégszekrény minden részében elérje a kívánt hőfokot. Hőlégszekrényben sterilezhetők laboratóriumi üveganyagok, fa- és fémeszközök, de hőérzékeny vagy gyúlékony anyagok nem. 36
57 Bakteriológia A kevésbé értékes eszközök, anyagok, fertőzött kórházi, laboratóriumi hulladékok legegyszerűbben elégetéssel sterilezhetők, illetve tehetők ártalmatlanná. A laboratóriumi eszközök sterilezésére a leégetést vagy az izzítást (pl. oltókacs) vesszük igénybe. Hideghatás. A hőmérséklet csökkenése a baktériumok szaporodását lassítja, majd megállítja, de a baktériumok (és egyéb mikrobák) a fagypont alatti hőmérsékleten sem pusztulnak el. A természetes vizek jegébe fagyott baktériumok hónapokig életképesek maradnak. A hűtőszekrényben 5 C-on tartott élelmiszerek a baktériumok és gombák anyagcsere-tevékenységének csökkenése miatt néhány napig tárolhatók. A mélyhűtés, 20 C-on vagy az alatt, néhány hónapos tárolást tesz lehetővé (élelmiszerek, laboratóriumi minták stb.). A hűtést és a fagyasztást felhasználjuk azonban baktériumok, vírusok és egyéb sejtek élő állapotban való fenntartására is. A táptalajokon elszaporított, kevésbé igényes baktériumok hűtőszekrény-hőmérsékleten néhány hétig tárolhatók. Tartós fenntartásuk mélyhűtött (fagyasztott) állapotban C közötti hőmérsékleten vagy még inkább folyékony nitrogénbe süllyesztve, 196 C-os hőmérsékleten lehetséges. Folyékony nitrogénben tartva tárolunk spermát, embriót, baktérium- és vírustörzseket, sejtvonalakat stb. A túlélés akkor optimális, ha a fagyasztás gyors, a felolvasztás pedig lassú. Az ismételt fagyasztás és felolvasztás a baktériumokat (és más sejteket is) előbb-utóbb elpusztítja A sugárzások hatása Az elektromágneses sugárzások energiát hordoznak. A sugárzás energiatartalma fordítottan arányos a hullámhosszal. A nagy energiájú sugárzások közül a kozmikus sugárzás, a gamma-, a röntgen- és az ultraibolya sugárzás egyaránt károsítja a sejteket, közöttük a baktériumokat is. A nagy energiatartalmú ionizáló sugárzások közül a jó áthatolóképességű, rendszerint kobaltizotópból származó, gamma-sugárzást használjuk ipari méretekben, légmentesen zárt, műanyag fóliába csomagolt injekciós tűk, fecskendők, kötszerek, gyógyszerek és részben különféle élelmiszerek sterilezésére. A gamma- sugárzás előnye, hogy a sugárzás a csomagoláson is áthatol, hátránya viszont, hogy a sugárzás, mint minden radioaktív sugárzás, permanens és minden irányba szóródik, ezért a sterilezés csak speciális körülmények között végezhető. A nem ionizáló sugárzások közül az ultraibolya sugárzást használjuk csíramentesítésre. Az ultraibolya sugárzás teljes spektruma ( nm) károsítja a sejteket, a legnagyobb baktericid hatása azonban, főleg a DNS károsításának a következményeként, a nm hullámhosszúságú UV sugaraknak van. Az ultraibolya sugárzás baktericid hatását használjuk ki az UV (germicid) lámpák, (rendszerint ultraibolya sugarakban gazdag fényt kibocsátó higanygőz lámpák) használatakor. Az UV lámpák felhasználhatók laboratóriumokban, kórházakban stb. a légtér és a felületek csíramentesítésére. Alkalmazásuknak azonban határt szab, hogy a sugárzás hatékonysága a sugárforrástól való távolsággal négyzetes arányban csökken, a sugárzás áthatolóképessége kicsi, s a hatékonyságot a felületen található szennyeződések a sugárelnyelés miatt jelentősen csökkentik. Az UV lámpák használata során ügyelni kell arra, hogy sugárzás a szembe és bőr felületére ne juthasson. A napfény a látható fény mellett ultraibolya sugarakat is tartalmaz. A leginkább károsító rövidhullámú UV sugarakat a légkörben található ózon, vízgőz, füst kiszűri, egy része azonban eléri a földfelszínt. A napfény antibakteriális hatása részben szárító hatásának, részben pedig a benne található UV sugárzásnak köszönhető. A legelőkre, rétekre kijutott baktériumok a napfény hatására, az évszaktól függően, néhány héttől néhány hónapig terjedő időszak alatt, rendszerint elpusztulnak. Bár a látható fénysugarak antibakteriális hatása gyenge, a baktériumokat (és egyéb sejteket) bizonyos festékekkel intravitálisan megfestve, a fénysugarak baktericid hatásúvá válnak (fotodinámiás szenzibilizálás). A fotodinámiás hatás a baktériumokban a fontos sejtanyagok oxidálódásával kapcsolatos Mechanikai hatások A nyomás csak szélsőségesen nagy értékek ( Pa) felett károsítja a baktériumokat. A rázás, különösen, ha a baktériumtenyészethez üveggyöngyöt vagy egyéb, finom eloszlású korpuszkuláris anyagot keverünk, előbb-utóbb a baktériumok egy részének a feloldásához vezet. Szűrés. Folyadékok és légnemű anyagok szűréssel is csíramentesíthetők. A szűrők pórusnagysága olyan, hogy a baktériumok és egyéb sejtes elemek nem tudnak átjutni rajtuk. A bakteriológiában használatos szűrők pórusnagysága 0,22 0,65 µm között változik, vannak azonban ezeknél nagyobb és kisebb pórusátmérőjű szűrők is. Korábban a szűrők égetett agyagból, kovaföldből (pl. Berkefeld-szűrő), mázatlan porcelánból készültek, ma inkább a Seitz-féle azbesztszűrőket, üvegszálból készített szűrőket vagy újabban különféle cellulóz észterekből 37
58 Bakteriológia készült membránszűrőket használunk. A szűrőszerkezetet speciális, vastag falú edényzetre (szívópalackra) szereljük s autoklávban sterilezzük. A szűrőkön a folyadékot nyomással, szívással vagy egyszerre mindkettővel sajtoljuk át. A folyadékok szűrésére használt szűrők igénybe vehetők levegő (vagy gázok) sterilre szűrésére is. A membránszűrők között vannak olyanok, amelyek kis pórusnagyságuknál ( nm) fogva alkalmasak a vírusok nagyság szerint differenciált visszatartására is (ultraszűrők). ASeitz-szűrők azbesztből préselt korongok, egyszer használatosak. Az üvegszűrők szűrőfelülete préselt üveghab vagy üvegszál. Többször használhatók, használat után ezeket a szűrőket kénsavval és többszöri vízöblítéssel a visszamaradt anyagtól meg kell tisztítani. A membránszűrők (Millipore, Gelman, Sartorius stb.) cellulóz észterekből készült vékony lapok. Előnyük minden más szűrővel szemben, hogy a pórusnagyság szabályozható és egy-egy szűrőnél valamennyi azonos méretű, a szűrendő folyadékból keveset adszorbeálnak, a szűrés rajtuk keresztül gyors. Egyszer használatosak, autoklávban sterilezhetők. Beszerezhetők ipari szűréshez alkalmas nagyságban, de fecskendőre rögzíthető, tokba foglalt méretben is. Az előbbiek több száz liter, az utóbbiak néhány milliliter folyadék gyors sterilre szűrésére alkalmasak. A membránszűrőket széles körben használjuk biológiailag veszélyes anyagokkal dolgozó laboratóriumok, oltókamrák stb. belépő és távozó levegőjének a sterilre szűrésére is. A membránszűrők felhasználhatók kis baktériumtartalmú folyadékok (pl. ivóvízminták) csíraszámának a meghatározására is. A szűrőn egységnyi folyadékmennyiséget átszűrünk, majd a membránszűrőt szilárd táptalaj felületére helyezzük, és a táptalajt termosztátba tesszük. A membrán felületén kinőtt telepek számából következtethetünk az átszűrt folyadék csíraszámára. Ultrahangkezelés. Az ultrahang-generátorok nagy frekvenciájú hanghullámokat bocsátanak ki, amelyek a baktériumok membránjára kifejtett mechanikai hatás révén a baktériumok többségét elpusztítják. Az ultrahangkezelés nem alkalmas sterilezésre, de gyakran igénybe vesszük baktériumok és más sejtek feltárására, a sejtfal, a nukleinsavak, a különféle enzimek stb. viszonylag ép állapotban való kinyerésére A kémiai anyagok hatása Fertőtlenítő (dezinficiáló) hatása igen sokféle vegyi anyagnak van. A fertőtlenítőszerként használt anyagoktól megkívánjuk, hogy csíraölő hatásuk széles spektrumú legyen (baktériumok, vírusok, gombák, paraziták), vízben vagy alkoholban oldhatók, kellően stabilak, kellemes illatúak vagy legalább szagtalanok legyenek, ne vagy kevéssé legyenek mérgezők emberre, állatra és a környezetre, alkalmazásuk ne okozzon környezetszennyezést, a fém-, textil- és egyéb anyagokat ne károsítsák, szennyező anyagok hatásukat lehetőleg ne csökkentsék, kellő tisztító (mosó) hatásuk legyen és mindemellett alkalmazásuk gazdaságos legyen. Mivel mindezen igényeknek megfelelő fertőtlenítőszer nincs, az egyes fertőtlenítőszereket, illetve azok kombinációit az alkalmazás körülményeinek és céljának megfelelően kell megválasztanunk. Újabban forgalomba kerülnek olyan fertőtlenítőszerek, amelyek mosó- (tisztító-)anyagok mellett többféle, egymás hatását kiegészítő fertőtlenítőszert tartalmaznak, ezekkel a szerekkel a tisztítás, fertőtlenítés egyszerre elvégezhető (egyfázisú fertőtlenítőszerek). A fertőtlenítést klórvízzel elsőként Semmelweis Ignác alkalmazta az orvosi gyakorlatban a gyermekágyi láz megelőzésére, 1846-ban. A fertőtlenítőszerek hatékonyságát az elpusztítandó mikroorganizmusok ellenálló képességén túl a kérdéses szer hatóanyag-koncentrációja, a fertőtlenítőoldat hőmérséklete és ph-ja,a behatás ideje, a fertőtlenítendő felületek és anyagok minősége, továbbá azok szennyezettsége szabja meg. A fertőtlenítőszer koncentrációját az elpusztítandó mikroorganizmusok ellenálló képességének megfelelően választjuk meg. A vegetatív baktériumokkal szemben kis, a mycobacteriumokkal szemben viszonylag nagy, a spórás baktériumokkal szemben pedig csupán nagy töménységű oldatokkal boldogulunk. A fertőtlenítőszerek hőmérsékletének emelésével és a behatás idejének növelésével a csíraölő hatás a legtöbb esetben fokozható. Általában minél melegebb oldatban használjuk a fertőtlenítőszereket, annál rövidebb idő alatt hatnak. A szennyező anyagok a fertőtlenítendő felületeken, kevés kivételtől eltekintve, valamennyi fertőtlenítőszer hatékonyságát csökkentik, esetleg meg is szüntetik. A szennyeződés ugyanis egyrészt hatóanyagot köt meg, másrészt megakadályozza, hogy a fertőtlenítőszerek érintkezzenek az elpusztítandó mikrobákkal. A fertőtlenítendő felületeket ezért előzetesen alaposan meg kell tisztítani. 38
59 Bakteriológia A fertőtlenítőszerek igen nagy száma miatt csupán néhány, az állatorvosi gyakorlatban használatos vagy egyébként fontos fertőtlenítőszert említünk meg. Klór és klórtartalmú szerek. A klór, vízben oldott formájában (klórvíz), illetve a klórt különböző kémiai kötésekben tartalmazó formában, a legáltalánosabban használt fertőtlenítőszer. A klórgázt gáz halmazállapota és maró tulajdonságai miatt ma már csak speciális viszonyok között (pl. vízművekben) a vezetékes ivóvíz szükség szerinti klórozására veszik igénybe. A különböző klórtartalmú fertőtlenítőszerek a klórt szerves vagy szervetlen kötésben tartalmazzák. Hatékonyságukat az oldataikban belőlük keletkező hipoklórsav és hipoklorit-ionok mennyisége szabja meg. A klórszármazékok erős oxidálószerek, a baktériumok sejtfalát és a fehérjék S-H kötéseit károsítják. A szervetlen kötésű klórt tartalmazó szerek közül a nátrium-hipokloritot és kevés nátriumhidroxidot tartalmazó klórlúgot (H-lúg) és a kalcium-hipoklorit-tartalmú klórmeszet, a szervesek közül pedig a benzolszulfonkloramid-nátriumot (Chloramin B, Neomagnol) használjuk a legáltalánosabban. A hipokloritok tárolás közben gyorsan bomlanak, a szerves kötésű klórt tartalmazók lényegesen stabilabbak. A szervetlen kötésűek azonnal hatnak, ezért rövid hatási idővel is használhatók. A szerves kötésűekből a klór lassan válik le, ezért hosszabb behatási időt igényelnek. Az utóbbiakban a klórleválás sav hozzáadásával gyorsítható. A szervetlen kötésű klórt tartalmazók szennyező anyagok hatására gyorsan kimerülnek, hatástalanná válnak, a szerves kötésű klórt tartalmazó szerek kimerülése lassúbb. A vegetatív baktériumokkal szemben a klórlúg és a klórmész 1 2%-os oldatban perc alatt, a mycobacteriumokkal szemben pedig 3 5%-os oldatban 2 3 óra alatt hatékony, 8%-os oldata a spórákat is elöli. A klórmész alkalmas kutak vizének a fertőtlenítésére is, g/m 3 víz mennyiségben. A Neomagnol 1 2%-os oldatban elsősorban kézfertőtlenítésre, konyhai edényzet fertőtlenítésére használatos. Fenol és fenolszármazékok. A fenol (karbolsav) erélyes fertőtlenítőszer, de maró és mérgező volta miatt gyakorlati célokra ma már alig használatos. Annál elterjedtebbek azonban metilált (krezolok, xylenolok) és klórozott (mono-, di-, tri-, penta-, hexaklórfenolok) származékai. A fenol és a fenoltartalmú szerek használhatóságát korlátozza, hogy a természetes vizek élővilágára a fenol nyomokban is toxikus. A fenolszármazékok baktericid hatása jobb, mint a fenolé, de legtöbbjük vízben nem vagy alig oldódik, ezért szappanokban emulgeálják (krezolszappan, Lysol) vagy alkoholban oldják, esetleg felületaktív anyagokkal keverik. Nátriummal kötött sóik vízoldékonyak (pl. pentaklórfenol-nátrium). A fenol és fenolszármazékok elsősorban a cytoplasmamembránt és a sejtfalat károsítják, megváltoztatják a cytoplasmamembrán permeabilitását és a sejtfal ellenálló képességét. A fenolok és a krezolok 1 3%-os oldatban a vegetatív baktériumokat és a gombákat perceken belül elölik. Lipoidoldékonyságuknál fogva jól használhatók a mycobacteriumokkal szemben is, 3 5%-os oldatuk 24 óra alatt baktericid hatású. A spórák elölésére csupán más szerekkel keverve használhatók. A fenolt 0,5%-os koncentrációban vérsavók konzerválására használjuk. A fenolszármazékok közüla pentaklórfenol-nátrium jó gombaölő (fungicid) hatású, 1 2%-os oldatban perc alatt elöli a legellenállóbb gombákat is. 1%-os oldatban tenyésztojások héjának fertőtlenítésére használható, 5 perces bemártással. A hexaklorofent 1 3%-os koncentrációban használjuk kézfertőtlenítésre, szappanokba keverve, de hintőporokban, samponokban is alkalmazzuk. Aldehidek. Közülüka formaldehid és egyes dialdehidek (pl. glutáraldehid) használatosak vizes oldatban vagy gáz halmazállapotban. Az aldehidek a baktériumok enzimjeinek és egyéb fehérjéinek a károsításán keresztül fejtik ki hatásukat. A formaldehid használatát korlátozza, hogy toxikus és erősen izgatja a nyálkahártyákat. A formaldehid (vizes oldata, a formalin) hatékonyságát a szennyező anyagok lényegesen nem rontják. A formalin 3 5%-os oldata a vegetatív baktériumokat és a gombákat kb. fél óra, a mycobacteriumokat pedig 2 3 óra alatt öli el. Jó sporocid hatású, 5%-os oldata 8 24 óra alatt a spórákat is elpusztítja. A formaldehid gáz halmazállapotban is használható. A formaldehid a formalinból hevítéssel vagy káliumpermanganát hozzáadásával szabadítható fel. Zárt helyiségekben 80 légköbméterre 2 liter formalint számolva, legalább 75%-os relatív páratartalom mellett 12 óra alatt kielégítő csíraölő hatása van. Gáz halmazállapotban elsősorban tenyésztojások és keltetőgépek fertőtlenítésére használják. A formalin baktericid hatása10 C alatt csaknem teljesen megszűnik, ezért mind oldatait, mind pedig gáz halmazállapotban legalább C-on kell használni. Etilén-oxid. A gáz halmazállapotú fertőtlenítőszerek közül, a formaldehidtől eltekintve, az etilén-oxid, a propilén-oxid, a béta-propiolakton, az etilén-imin stb. használatosak. A baktériumok nukleáris állományát és fehérjéit károsítják. Az etilén-oxid gyúlékony és toxikus, a formaldehiddel szemben azonban előnye, hogy jól penetrál és kis relatív páratartalom mellett használható. Gőzeit belélegezni nem szabad, emberben tüdőödémát okoznak. Zárt kamrákban (gázsterilizálókban) használva 500 mg/l koncentrációban, 20 C körüli hőmérsékleten 4 5 óra alatt sterilizál. Előnyösen használható hőre vagy egyéb fertőtlenítőszerek hatására érzékeny anyagok, 39
60 Bakteriológia kényesebb műszerek sterilizálására. A béta-propiolakton és az etilén-imin különféle oltóanyagok (főleg vírusvakcinák) inaktiválására szolgál. Felületaktív anyagok (detergensek, nedvesítőszerek). A szappanok (amelyek hosszú szénláncú zsírsavak nátrium- és káliumsói) régóta és széles körben használatosak a szenny eltávolítására és ezáltal a mikrobák számának a csökkentésére, csíraölő hatásuk azonban nincs. A szappanoknál jobb hatékonyságúak a szintetikus detergensek. A fertőtlenítőszereknek ebbe a csoportjába kémiailag nagyon különböző vegyületek tartoznak, közös tulajdonságuk azonban, hogy valamennyien felületaktívak, csökkentik a felületi feszültséget, ennélfogva jól nedvesítenek, habzanak, adszorbeálódnak, penetrálnak, szennyoldó képességük erős, elősegítik a vízben oldhatatlan vagy alig oldódó anyagok vízoldékonyságát, toxicitásuk pedig igen kicsi. Az anionaktív detergensek (szintetikus szappanok) önmagukban fertőtlenítőszerként nem használhatók. Jó detergens és szennyoldó hatásuknál fogva azonban előnyösek különféle tisztító- és mosószerekben. A kationaktív detergensek (invertszappanok) közül a kvaterner ammóniumsók, (Sterogenol, Nitrogenol) használatosakalegszélesebb körben. A kationaktív detergensek természetes szappanokkal vagy anionos detergensekkel nem keverhetők, mert gyorsan inaktiválódnak. Hatásukat fehérje és egyéb szennyező anyagok, továbbá a hígításukra használt vízben jelenlevő Ca- és Mg-sók erősen rontják, viszont stabilak, jó nedvesítőképességűek, és magas hőmérsékleten is használhatók. A baktériumok cytoplasmamembránját károsítják, növelik a membrán permeabilitását. A Sterogenol 1%-os oldatban perceken belül elöli a vegetatív baktériumokat és a legtöbb gombafajt is. A mycobacteriumokkal szemben hatásuk bizonytalan, sporocid hatásuk gyakorlatilag nincs. Az amfoter felületaktív anyagok (Tego, Tagonin stb.) hosszú szénláncú aminosav-származékok. Hatékonyságuk lényegében megegyezik a kationaktív detergensek hatékonyságával. Az amfoterek egyikével-másikával szemben a Pseudomonas fajokban rezisztenciát észleltek. Elsősorban élelmiszer-ipari üzemekben használatosak. A nem ionos detergensek, kémiailag poliészterek és éterek fertőtlenítőszerként nem használatosak, de jó felületaktív hatásuk miatt mosószerekbe keverve vagy fertőtlenítőszerekkel kombinálva azok hatékonyságát jelentősen növelik. Jód és jódkomponenst is tartalmazó fertőtlenítőszerek. A jód egyike a legjobb és régóta használt antimikrobiális szereknek. Erős oxidálószer. Elemi jód és kálium vagy nátrium-jodid formájában alkoholban és vízben oldva, jódtinktúraként felületes sebek, sérülések kezelésére vesszük igénybe. A jodofórok szerves kötésű jódot, nem ionos felületaktív anyagot és az igénybevétel céljának megfelelő kiegészítő anyagokat tartalmazó fertőtlenítőszerek. Mivel a jódot szerves kötésben tartalmazzák, az elemi jódtól eltérően maró és korrozív hatásuk nincs. A fertőtlenítő hatás a komplexből szabaddá váló jódnak köszönhető. Viszonylag stabilak, detergens hatásuknál fogva jól nedvesítenek és penetrálnak. Hátrányuk, hogy csupán C körüli hőmérsékleten használhatók, magasabb hőmérsékleten az oldatok jódvesztesége ugrásszerűen megnő. A jodofórok között vannak olyanok, amelyek a jódkomplexen és a felületaktív anyagon kívül jelentős mennyiségű foszforsavat is tartalmaznak, ezek szennyezőanyagok iránt kevésbé érzékenyek. A jodofórok 0,5%- os oldatban perceken belül elölik a vegetatív baktériumokat, 0,5 1%-os oldatban pedig a mycobacteriumokat és a gombákat is. Sporocid hatásuk gyakorlatilag nincs. A jodofórok közül néhányat kifejezetten a bőr-, tőgyfertőtlenítés céljára fejlesztettek ki. Ezek a jódkomplex mellett bőrbarát anyagokat (citromsavat, glicerint stb.) is tartalmaznak, ezért 0,5%-os oldatban kéz- és tőgyfertőtlenítésére használatosak. Savak, lúgok. Erélyes fertőtlenítőszerek, hatékonyságuk a ph-értékkel vagy a molekulaszerkezettel áll összefüggésben. A fehérjéket denaturálják. Önállóan ritkán használatosak. 1,6 2% nátrium-hidroxidot tartalmaz a klórlúg. Gyengén fertőtlenítő hatásúa kalcium-hidroxid, amely mésztej formájában épületek és istállóberendezések fertőtlenítésére használatos.a szerves savak inkább bakteriosztatikus hatásúak. Közülük a szalicilsavat, a benzoesavat élelmiszerek tartósítására vesszük igénybe. Fémsók. Közülük a konyhasó bakteriosztatikus hatását a vízelvonásnak és az ozmózisos nyomás növekedésének köszönheti. A higany- és ezüstsók viszont erélyes baktericid hatásúak, a higanytartalmú mertiolát és merfen a gombák elleni fertőtlenítésre, valamint 1: es hígításban vérsavók konzerválására használatos. A tenyésztojások héján levő gombák, a tojásokat 1:5 000-es koncentrációjú oldataikban 5 percig fürdetve biztosan elpusztíthatók. 40
61 Bakteriológia Alkoholok. Az alkoholok közül az etil-alkohol 70%-os vizes oldatban vagy 2 4% jóddal kiegészítve (jódtinktúra) jól használható a bőrfelület (pl. vérvételek és injekciók beadása előtt) és felületes sebek fertőtlenítésére. Az alkoholok a fehérjéket denaturálják, és károsítják a magas lipoid tartalmú cytoplasmamembránt. Az alkohol elöli a vegetatív baktériumokat, de nem hat a spórákra. A magasabb szénatomszámú alkoholok közül a propil-alkoholok ugyanúgy használhatók, mint az etil-alkohol Kemoterápia A kemoterápia célja a szervezetbe jutott kórokozók (baktériumok, vírusok, gombák, paraziták) elpusztítása vagy fejlődésének a gátlása különféle kémiai anyagokkal (kemoterápiás szerekkel) a szervezet meggyógyulása vagy legalább a gyógyulás elősegítése érdekében anélkül, hogy ezzel komolyabban károsítanánk a gazdaszervezetet. Az egyes betegségek gyógykezelésére régóta használtak tapasztalati alapon különböző kémiai anyagokat. Így pl. a kínafa kérgét a malária okozta lázas rohamok enyhítésére vagy higanyt a syphilis gyógykezelésére, a mai értelemben vett kemoterápia kezdetét azonban az 1900-as évek elején a szerves arzént tartalmazó salvarsan előállítása, a szulfonamidok hatásának 1933-ban való felfedezése, továbbá a penicillin 1929-ben való felfedezése és az 1940-es évek elején való tömeges ipari előállítása jelentette. Ma már igen nagyszámú kemoterápiás szer ismert, ezek egy része mikrobák (baktériumok és gombák) által termelt természetes anyag vagy szintetikus úton előállított anyagok, mint pl. a szulfonamidok és más szerek. A kemoterápiás szerek kémiai szerkezetének, biokémiai tulajdonságainak (hatékonyság, toxicitás, felszívódás, kiürülés stb.) és használatának a részleteit a gyógyszertan tárgyalja, ezért a továbbiakban csupán az antibiotikumok, a szulfonamidok és néhány egyéb kemoterapeutikum antibakteriális hatásával és a velük szemben kialakuló rezisztenciával kapcsolatos kérdésekre térünk ki Antibiotikumok A baktériumok és egyes gombák számos olyan anyagot termelnek, amelyek más mikrobák fejlődését gátolják vagy kellő koncentrációban el is pusztítják azokat. Az ilyen hatású anyagokat összefoglalóan antibiotikumoknak, magát a jelenséget pedig antibiózisnak nevezzük. Az antibiotikumok rendszerint kis molekulatömegű, szekunder metabolitok. Egy részüket gombák, legtöbbjüket azonban a baktériumokhoz tartozó, természetes viszonyok között a talajban található Streptomyces, ritkán egyéb baktériumfajok tenyészeteiből állítják elő. Az antibakteriális hatású anyagok között vannak olyanok is, pl. a bakteriocinek, amelyek csupán saját vagy közel rokon fajokra hatnak. A bakteriocinek kis molekulatömegű polipeptidek, a baktériumok sejtfelületén levő specifikus receptorokhoz kötődnek, baktericid hatásúak. Az eddig megismert bakteriocinek termelődését extrakromoszomális genetikai elemek, plazmidok kódolják. A bakteriocineket éppen korlátozott hatékonyságuk miatt gyógykezelésre nem vagy csak ritkán használják. Az antibiotikumok kémiai szerkezete és hatásmódja igen változatos. Ma már több mint háromezerféle antibiotikumot ismerünk, közülük azonban gyógyászati célokra alig néhány tucatot használunk. Az antibiotikumok egy részének kémiai szerkezetét ismerjük, másokét nem. Egy részüket szintetikus úton is elő tudjuk állítani, másokét szintetikus úton átalakítjuk vagy megváltoztatjuk. A továbbiakban csupán az orvosi, állatorvosi szempontból fontos antibiotikumokkal foglalkozunk. Penicillinek. A penicillin volt az első használatba vett antibiotikum. A penicillint a Penicillium notatum, a P. chrysogenum és számos más Penicillium faj is termeli. A penicillin nem egységes szerkezetű anyag. A molekula központi magjához (6-amino-penicillánsavhoz) kapcsolódó eltérő szerkezetű oldalláncok különféle penicillinek létrejöttét eredményezik. Leggyakrabban a benzil-penicillint (penicillin G-t) állítják elő (20. ábra). 20. ábra - A penicillinek szerkezete 41
62 Bakteriológia A penicillin a baktériumok sejtfalának a szintézisét gátolja oly módon, hogy megakadályozza a peptidoglükán vázszerkezet peptid alegységei és peptidhídjai között transzpeptidációval kialakuló keresztkötések létrejöttét. A penicillin hatásának kitett baktériumok lekerekednek, felpuffadnak, hosszú, deformálódott fonalakat képeznek, s mivel a sejtfal nem tud ellenállni a cytoplasma nyomásának, előbb-utóbb feloldódnak. A penicillin az osztódó baktériumokra hat, a hatás baktericid jellegű. A penicillin elsősorban a Gram-pozitív baktériumokra hat, de hatékony a Gram-negatív coccusokkal, a spirochaetákkal és a rickettsiák egy részével szemben is. Penicillinrezisztencia a baktériumokban leggyakrabban penicillináz enzimek hatására jön létre. A penicillináz enzimek a penicillin központi magjának béta-laktám gyűrűjét felbontják (béta-laktamázok), s ezáltal a penicillin hatástalanná válik. Penicillinázt termel pl. a Staphylococcus törzsek nagy része és számos Gram-negatív bélbaktérium is. A penicillináz enzimek termelése a baktériumok egy részében indukálható. Az enzimet gyakran plazmid kódolja. A rezisztencia másik oka lehet a penicillin központi magjához kapcsolódó oldallánc lehasadása a penicillin-amidázok hatására. Ez utóbbi enzimeket főleg különféle gombák termelik. A Gram-negatív baktériumok kevésbé érzékenyek a penicillinre, aminek egyik oka az, hogy a penicillin a Gram-negatív baktériumok sejtfalában levő lipopoliszacharid-komplexek miatt nem tud eljutni a sejtfal peptidoglükánjához. A penicillin G-savra érzékeny, hatásspektruma viszonylag szűk, a penicillináz enzimek könnyen elbontják. A penicillinmolekula oldallánca a penicillint termelő gomba tápfolyadékához adott különféle anyagokkal befolyásolható. Ha a penicillin előállítása során a tápfolyadékhoz fenoxi-ecetsavat adunk, a gomba ezt beépíti a penicillinmolekulába, annak oldalláncaként. Ezáltal savstabil penicillin állítható elő (penicillin V). A penicillinek egy másik csoportját képezika félszintetikus penicillinek. Ezek előállítása során a gomba tenyészetéből a penicillin alapvegyületét, a 6-amino-penicillánsavat nyerik ki, s ehhez kémiai szintézissel in vitro, különféle, a hatékonyságot, a savérzékenységet és a penicillináz enzimekkel szembeni ellenálló képességet előnyösen befolyásoló oldalláncokat kötnek. Az így előállított penicillinféleségek (meticillin, 42
63 Bakteriológia oxacillin, ampicillin stb.) előnyösebben használhatók terápiás célokra, mint a gomba által természetes úton előállított benzil-penicillin. Cefalosporinok. A cefalosporinok a penicillinekkel rokon béta-laktám antibiotikumok, amelyeknek alapvegyületét ugyancsak gombák (Cephalosporium acromonium stb.) termelik. Az alapvegyület különböző módosításával készülnek a félszintetikus származékok. A cefalosporinok gátolják a baktériumok sejtfalához szükséges acetil-muraminsav-pentapeptid egységek cytoplasmában való szintézisét. A cefalosporinok hatásspektruma közel áll a penicillinekéhez. Hatásuk baktericid. Előnyük, hogy laktamáz enzimekre kevésbé érzékenyek, kevéssé allergizálnak. Az első generációs cefalosporinokhoz (cefalotin, cefazolin stb.) képest a félszintetikus, második generációs készítmények (cefamandol, cefoxitin stb.) számos Gram-negatív baktériummal szemben is hatékonyak, a harmadik generációs készítmények (cefotaxim, cefoperazon stb.) pedig ezek mellett még számos előnyös farmakokinetikai sajátsággal (lassabb kiürülés, jó szöveti penetráció) is rendelkeznek. Bacitracinok. A bacitracinokat a Bacillus licheniformis és rokonai termelik, kis molekulatömegű oligopeptidek, amelyek az állati szövetekben található proteolitikus enzimekkel szemben ellenállóak. A bacitracinok főleg a Gram-pozitív baktériumokra hatnak, akadályozzák a sejtfal szintézisét azáltal, hogy meggátolják a baktériumsejtben szintetizálódott acetil-glükózamin, N-acetil-muraminsav pentapeptidkomplexek sejtfalhoz szállítását. Aminoglikozidok. Az aminoglikozidok egymással szerkezetileg rokon antibiotikumok, amelyek közül a streptomicin,a neomicin, a kanamicin, a gentamicin és a spectinomicin használatos a leggyakrabban. Az aminoglikozidokat, kevés kivételtől eltekintve, különféle Streptomyces fajok, a streptomicint a Streptomyces griseus, a neomicint a Streptomyces fradiae stb. termelik. Széles terápiás skálájú antibiotikumok, egyaránt hatnak a Gram-pozitív és a Gram-negatív baktériumfajokra, hatásuk alacsony koncentrációban bakteriosztatikus, magasabb koncentrációban baktericid. A streptomicint széles körben használjuk az ember gümőkórjának a gyógykezelésére. Az aminoglikozidok a baktériumok riboszómáihoz kapcsolódva részben gátolják a fehérjeszintézist, részben pedig hibás (funkcióképtelen) fehérjemolekulák termelését okozzák. A streptomicin a baktériumriboszóma 30 S alegységének egyik fehérjemolekulájához kapcsolódva fejti ki gátló hatását. Az aminoglikozidokkal szembeni rezisztencia oka lehet a riboszómákat kódoló gének mutációja, pl. a streptomicinrezisztencia során a streptomicint megkötő riboszómafehérje szerkezetének megváltozása, aminek következtében a streptomicin nem tud a riboszómához kötődni, vagy az aminoglikozidok enzimekkel való inaktiválása (acetilálással, foszforilálással stb.). A streptomicinnel és más aminoglikozidokkal szemben is mutáció útján viszonylag gyorsan magas szintű rezisztencia alakul ki. Az aminoglikozidokat inaktiváló enzimeket gyakran plazmidok kódolják. A streptomicinnel szembeni rezisztencia rendszerint nem jár együtt más aminoglikozidokkal szembeni rezisztenciával. A streptomicinrezisztens baktériumtörzsek egyike-másika olyan mértékben hozzászokhat a streptomicinhez, hogy a továbbiakban csupán streptomicin jelenlétében képes szaporodni. Ez a jelenség a streptomicinfüggőség (dependencia). A dependencia nem csupán streptomicinnel, hanem egyéb aminoglikozidokkal és néhány más gyógyszerrel szemben is kialakítható (gyógyszer-dependencia). A dependencia oka valószínűleg az, hogy a gyógyszerhatás miatt a riboszómán keletkezett hibás fehérjék a baktériumok számára nélkülözhetetlenné válnak. Egyes streptomicindependens Salmonella törzseket vakcinaként használnak. Tetraciklinek. A tetraciklineket különféle Streptomyces fajok termelik. Közülük a klórtetraciklint, az oxitetraciklint és a doxiciklint használjuk széles körben. Az egyes tetraciklin-változatok a molekula vázához kapcsolódó szubsztituensekben különböznek egymástól. A doxiciklint az oxitetraciklinből állítják elő szintetikus úton. Széles terápiás skálájú antibiotikumok, hatékonyságuk spektruma nagyjából megegyezik egymással, a Gram-pozitív és a Gram-negatív baktériumokra, ideértve a chlamydiákat és a rickettsiákat is, egyaránt hatékonyak. A doxiciklin előnye egyebek mellett, hogy per os adva jobban felszívódik, magasabb és tartósabb vérszint alakul ki, mint a két másik tetraciklin alkalmazását követően. A tetraciklinek hatása inkább bakteriosztatikus, mint baktericid. A baktériumsejtbe aktív sejtmunka eredményeként jutnak be, s a fehérjeszintézist gátolják azáltal, hogy megakadályozzák az aminosavakat szállító transzfer-rns riboszómákhoz való kötődését. A tetraciklinekkel szembeni rezisztenciának rendszerint az az oka, hogy a gyógyszer nem tud kellő koncentrációban bejutni a baktériumsejtbe a transzportrendszer hibája vagy a sejtfalban megjelenő specifikus fehérjék gátló hatása miatt. A teraciklin-származékok között csaknem mindig keresztrezisztencia áll fenn. Klóramfenikol. A klóramfenikolt a Streptomyces venezuelae termeli. Szerkezete viszonylag egyszerű, ezért ma már inkább szintetikus úton állítják elő. Széles terápiás skálájú antibiotikum, a baktériumok riboszómáinak 50 S alegységéhez kapcsolódva gátolja a polipeptidszintézist. A klóramfenikol a baktériumsejtben enzimes úton, 43
64 Bakteriológia acetilálódással inaktiválódik. A klóramfenikol használatát korlátozza, hogy emberben aplasztikus anaemiát okozhat, ezért olyan állatoknak, amelyeknek a húsa vagy bármely terméke emberi fogyasztásra szolgál, nem adható. Makrolid antibiotikumok. A makrolid antibiotikumok egymáshoz hasonló szerkezetű, különböző Streptomyces fajok tenyészeteiből előállított anyagok. Kis koncentrációban bakteriosztatikus, nagyobb koncentrációban baktericid hatásúak. Közülük terápiás célokra leggyakrabbanaz eritromicint, az oleandomicint, a spiramicint, a tilozint és a tilmikozint használjuk. Valamennyi ide tartozó antibiotikum, a klóramfenikolhoz hasonlóan, a baktériumriboszóma 50 S alegységének egyik proteinjéhez kapcsolódva a fehérjeszintézist gátolja. A csoportból az eritromicin a leghatékonyabb, amely gátolja a legtöbb Gram-pozitív baktérium, a Gram-negatív coccusok, több más Gram-negatív baktériumcsoport és a mycoplasmák fejlődését is. A tilozin hatékony a mycoplasmákkal szemben is, a tilmikozin pedig, amely egy új félszintetikus makrolid, jól használható a pasteurellák és a haemophilusok okozta tüdőgyulladások gyógykezelésére. Az eritromicinnel szembeni rezisztencia rendszerint más makrolid antibiotikummal szembeni keresztrezisztenciát is jelent. Az eritromicinrezisztencia a törzsek egy részében a riboszómát kódoló gének mutációjának köszönhető. Rifamicinek. A rifamicinek a Streptomyces mediterranei által termelt antibiotikumok. Szerkezetileg közel állnak a makrolid antibiotikumokhoz. A DNS-ről mrns-t másoló RNS polimeráz működését gátolják. Félszintetikus származékai közül a rifampicin a humán tuberculosis gyógykezelésében használatos, más kemoterapeutikumokkal kombinálva. Az állatorvoslásban, eritromicinnel együtt, a csikók Rhodococcusequi okozta pneumoniájának a gyógykezelésére vesszük igénybe. Tiamulin. A tiamulin az egyes basidiumos gombák (Pleurotus mutilis stb.) által termelt pleuromulinből előállított, félszintetikus antibiotikum. A tiamulin és más pleuromulinszármazékok a baktériumok fehérjeszintézisét gátolják a 70 S riboszómához kötődve. A tiamulin igen alacsony koncentrációban hatékony a mycoplasmákkal és a vel szemben, de igénybe vehető a leptospirák, haemophilusok, pasteurellák okozta fertőzések gyógykezelésére is. A tiamulinnal szembeni rezisztencia a riboszóma több lépcsős mutációjának a következménye. A tiamulin elleni rezisztencia rendszerint együtt jár az eritromicinnel és tilozinnal szembeni rezisztenciával is. Linkomicin. A linkomicin a Sreptomyces lincolnensis tenyészetéből előállított antibiotikum. A riboszómákhoz kötődve a fehérjeszintézist gátolja. Hatékony a Gram-pozitív baktériumokra, továbbá a mycoplasmákra és a Serpulina hyodysenteriaere is. A vele szembeni rezisztencia rendszerint együtt jár eritromicin- rezisztenciával és fordítva is. Gyakran spectinomicinnel kombinálva használjuk. Polimixinek. A polimixinek ciklikus oligopeptidek, felületaktívak, a baktériumok cytoplasmamembránjához kapcsolódnak. Hatásukra a cytoplasmamembrán fokozatosan áteresztővé válik, a baktériumsejt feloldódik. A polimixinek főleg a Gram-negatív baktériumokra hatnak, terápiás célokra a polimixin-b-t és a polimixin-e-t (colistint) vesszük igénybe. Polien antibiotikumok. Az ide tartozó antibiotikumokat különböző Streptomyces fajok termelik. Közülük a fungicidint (nistatint) és amfotericin B-t gombák okozta fertőzések gyógykezelésére használjuk, az előbbit viszonylag magas toxicitása miatt lokálisan, az utóbbit viszont szisztémásan is. A polien antibiotikumok a cytoplasmamembrán szteroljaihoz (a gombasejtekben az ergoszterolhoz) kötődnek és ezáltal fokozzák a membrán permeabilitását Egyéb kemoterapeutikumok Szulfonamidok. A szulfonamidok a baktériumok folsavszintéziséhez szükséges paraamino-benzoesav kompetitív antagonistái. A baktériumok paraamino-benzoesavból, pteridinből és glutaminsavból dihidrofolsavat, majd abból tetrahidro-folsavat képeznek. A tetrahidro-folsavat a baktériumok intermedier anyagcseréjük során egyebek mellett a metionin, a purinbázisok, a timin, a pantoténsav stb. szintéziséhez veszik igénybe. Szulfonamidok jelenlétében zavart szenved a folsavszintézis (21. ábra), a folsav hiánya miatt pedig a baktériumok szaporodása fokozatosan megszűnik. Mivel a paraamino-benzoesavat a baktériumok intermedier anyagcseréjük során maguk állítják elő, az antagonista hatás eléréséhez a szulfonamidoknak megfelelő koncentrációban kell jelen lenniük. Számtalan szulfonamidféleség létezik. A folsavat maguk előállító baktériumfajok az egyes szulfonamidokra különböző mértékben érzékenyek. Azok a baktériumfajok, amelyek a folsavat exogén forrásokból fedezik, a szulfonamidokra eleve rezisztensek. A szulfonamidok bakteriosztatikus hatásúak. Esősorban a Gram-pozitív baktériumfajok szaporodását gátolják, hatnak azonban néhány Gramnegatív baktériumcsoportra is. 44
65 Bakteriológia 21. ábra - A szulfonamidok és a diamino-pirimidinek támadáspontja a folsavszintézisben A szulfonamidokkal éppúgy, mint más kemoterápiás szerekkel szemben, a baktériumokban rezisztencia alakulhat ki. A rezisztencia létrejöhet oly módon, hogy a kérdéses baktériumtörzs több paraamino-benzoesavat termel vagy a folsavszintézist végző enzim affinitása nő meg a paraamino-benzoesav iránt, továbbá oly módon, hogy a szulfonamidokat a baktériumok acetilálással vagy egyéb módon elbontják. Diamino-pirimidinek. Ugyancsak a baktériumok folsavszintézisét, a dihidro-folsavat tetrahidro-folsavvá alakító dihidro-folsav-reduktáz enzim működését gátolják. Közülük legszélesebb körben a trimetoprim használatos. A gátlás nem kompetitív, ezek a szerek irreverzíbilisen kötődnek az átalakítást végző enzimhez. Mivel ezek az anyagok a baktériumok folsavszintézisének egy másik lépcsőjét gátolják, fokozzák (potenciálják) a szulfonamidok hatását. Nitrofurán származékok. A furángyűrű NO 2 csoportjának szubsztituálásával állítják elő őket. Az ide tartozó vegyületek közül a furazolidon, a nitrofurazon és a nitrofurantoin használatos a legszélesebb körben. A baktériumok fehérjeszintézisét gátolják, főleg a Gram-negatív baktériumok ellen hatnak. Magasabb koncentrációban vagy hosszabb ideig adagolva toxikusak. Élelmiszer-termelésre igénybe vett állatoknak nem adhatók. Quinolonok. A quinolonszármazékok a baktériumok DNS-ének a megkettőződését (a DNS szétcsavarodását) gátolják. Közülük az oxolinsav és a nalidixinsav hatékony a legtöbb Gram-negatív baktériumfajra, de mivel gyorsan kialakul velük szemben rezisztencia, önállóan csak ritkán, többnyire más antibakteriális szerekkel kombinálva használjuk őket. A fluorquinolonok (ciprofloxacin, norfloxacin, enrofloxacin, ofloxacin stb.) hatékonysága az előbbi kettőnél lényegesen jobb, a Gram-negatív baktériumok okozta fertőzések gyógykezelésére vesszük őket igénybe. Az antibakteriális szerek használata. A szulfonamidokat, antibiotikumokat és számos más kemoterapeutikumot széles körben használjuk az állatgyógyászatban is. Mivel rendszeres alkalmazásuk fokozza a rezisztens, gyakran egyszerre több, különféle antibiotikummal szemben rezisztens (polirezisztens) baktériumtörzsek kialakulásának és gyors szelektálódásának a veszélyét, e szereket csak akkor szabad használnunk, ha az valóban indokolt. A gyógykezelés céljára azt az antibiotikumot vagy gyógyszer-kombinációt kell használnunk, amelyik a kitenyésztett kórokozó gyógyszer-rezisztenciájának a vizsgálata alapján a leghatékonyabb (célzott antibiotikum kezelés). A rezisztencia kialakulásának megelőzése érdekében célszerű, hacsak lehet, antibiotikumkombinációkat igénybe venni. A kezelést a betegség lehető legkorábbi szakaszában kell elkezdeni, a terápiás dózis maximumát adva a mielőbbi magas vér- és szöveti koncentráció kialakítása érdekében, emellett az antibiotikum-szintet célszerű a klinikai tünetek megszűnte után is legalább néhány napig fenntartani. Bár az antibiotikumokat leggyakrabban gyógykezelésre vesszük igénybe, használjuk őket preventív célból, sőt egyeseket hozamfokozóként is takarmányba vagy ivóvízbe keverve. Antibiotikumokat használunk a laboratóriumban is szelektív táptalajok készítéséhez, továbbá szövettenyészetekhez adva a baktériumszaporodás gátlására. A gyógyszerek iránti érzékenység vizsgálata. Az antibiotikumok és más kemoterápiás szerek iránti érzékenység in vitro vizsgálatára számos módszer ismeretes. Ezek közül gyakorlati célokraa korongdiffúziós módszer 45
66 Bakteriológia segítségével való vizsgálat a legalkalmasabb. A vizsgálandó baktériumtörzs friss, megfelelő sűrűségű szuszpenziójából egy kis mennyiséget élesztőkivonatot nem tartalmazó táptalajra szélesztünk. Ezután egymástól megfelelő távolságra a táptalajra helyezzük a különféle, meghatározott mennyiségű antibiotikumot, egyéb kemoterapeutikumot tartalmazó (eltérő színnel jelölt vagy számozott) papírkorongokat, majd a táptalajokat óráig tenyésztjük. A korongokban levő szer a táptalajba diffundál és a baktériumfaj érzékenységétől függően kisebb-nagyobb mértékben akadályozza a baktériumok szaporodását (22. ábra). A korongok körül kialakult gátlási gyűrűk átmérője alapján eldönthető, hogy a vizsgált baktériumtörzs melyik gyógyszerre érzékeny, mérsékelten érzékeny vagy rezisztens, s kiválasztható az adott betegség gyógykezelésére szóba jöhető leghatékonyabb kemoterapeutikum. Mivel a gátlási gyűrű nagyságát egyebek mellett lényegesen befolyásolja a felhasznált táptalaj milyensége, a beoltásra használt baktériumtenyészet kora, sűrűsége, a papírkorongokba tett gyógyszer mennyisége, a gyógyszerérzékenység vizsgálatának módszereit standardizálták. Nagyobb laboratóriumokban a gyógyszereket tartalmazó korongok felhelyezésére és az eredmények leolvasására ma már automata berendezéseket használnak. 22. ábra - Staphylococcus aureus antibiotikum-érzékenységének vizsgálata Resistestkorongokkal A korongdiffúziós módszerrel kapott eredmények a baktériumok relatív gyógyszerérzékenységéről tájékoztatnak. Ha a gyógyszerérzékenység pontos ismeretére van szükségünk a vizsgálandó baktériumtörzset a gyógyszert növekvő mennyiségben tartalmazó folyékony vagy szilárd táptalajba oltjuk, s a szaporodás vagy annak hiánya alapján meghatározzuk a vizsgált anyag legkisebb hatékony gátló koncentrációját (minimális gátló koncentrációk, MIC), illetve azt a koncentrációt, amely a baktériumokat el is öli (minimális baktericid koncentrációk, MBC). Az antibiotikumból vagy egyéb kemoterapeutikumból adandó tényleges dózist és az elérni kívánt vér- és szöveti antibiotikumszintet a célállaton végzett kísérletek eredményei alapján határozzuk meg, figyelembe véve a gyógyszer felszívódóképességét, szöveti megoszlását, lebomlását, kiürülésének módját, tempóját stb. A pontos adagról, az alkalmazás módjáról és a kezelés szükséges időtartamáról a fentiek figyelembevételével összeállított használati utasítás tájékoztat. 7. A baktériumok genetikája 46
67 Bakteriológia 7.1. A genetikai anyag szerkezete és funkciója A baktériumok genetikai anyaga, amely az örökletes tulajdonságok hordozója, dupla szálú DNS. A baktériumokban éppen úgy, mint a magasabbrendű szervezetek sejtjeiben, a DNS-ben tárolt információt a nukleotidtripletek sorrendje határozza meg. A baktériumok haploid mikroorganizmusok, az egyes tulajdonságokat meghatározó gének egyetlen körkörös, szabad vég nélküli, óriás DNS-molekulában (baktériumkromoszómában) foglalnak helyet. A kromoszómán kívül a baktériumok egy részében extrakromoszomális genetikai elemek, plazmidok is találhatók. Az E. coli baktériumok genetikai állományát képviselő kromoszomális DNS 1 1,4 mm hosszú, molekulatömege 2,7x10 9, kb. 4,6x10 6 bázispárt tartalmaz. Génenként bázispárt feltételezve az E. coli kromoszómája kb gént foglal magában. Hasonló nagyságrendű (0, bázispár) a többi baktériumfaj kromoszómája is. A baktérium kromoszómájában a gének lineárisan helyeződnek el. Az egy funkciót (pl. E. coliban a laktózbontást) kódoló gének a kromoszómában általában egymás után helyezkednek el, a bonyolult, összetett funkciókat (pl. a spórásodást, osztódást stb.) azonban rendszerint a kromoszóma különböző helyein (lokuszain) levő több gén együttesen kódolja. Egy gén egy polipeptidláncot kódol. A kromoszómában az egyes specifikus fehérjéket kódoló (struktur-)gének mellett a tárolt információ kifejeződését szabályozó regulátorgének, promoter- és operátorszekvenciák, továbbá IS (inserted sequences) szakaszok is találhatók. A baktériumkromoszóma éppen úgy, mint az eukaryota sejtekben, szemikonzervatív módon kettőződik meg. A replikáció megindulásakor a cirkuláris DNS egy rövid szakaszán a kettős szál szétcsavarodik, s a szétcsavarodott DNS- szál mindegyikének belső oldalán, DNS-polimerázok segítségével, mindkét irányban megindul a komplementer szálak felépülése. A szülőkromoszóma dupla szálú DNS-ének a szétcsavarodása speciális enzimek (kicsavaró fehérjék, DNS-girázok) hatására jön létre. A baktériumokban a kromoszóma megkettőződése egy ponton, míg az eukaryota sejtekben egyszerre több ponton indul meg. E. coli baktériumokban a DNS megkettőződésének a startpontja a kromoszóma 74. percénél, az izoleucin-valin (ilv) gének közelében van. Az újonnan képződött két dupla szálú DNS-molekula mindegyike egy-egy szülői és egyegy újonnan szintetizált (komplementer) szálat tartalmaz. A baktériumkromoszómában tárolt információ kifejeződése a transzkripcióval indul meg. A transzkripció során a DNS-dependens RNS-polimeráz enzim szimpla szálú mrns-t, trns-t és rrns-t szintetizál. Az RNS-képzést a DNS indítószekvenciájához (a promoter régióhoz) specifikusan kötődni képes RNS polimeráz indítja meg. Az RNS-lánc szintézise a DNS stop jelzésénél fejeződik be. A stopjelek az indítószekvenciákhoz hasonlóan specifikus nukleotidsorrendű szakaszok. Az RNS-szintézishez (néhány bakteriofág kivételével) csak az egyikdns-szál szolgál templátként. Az mrns-molekulák közvetítik a DNS nukleotidtripletjeibe írt (kód) információt a riboszómákhoz. A fehérjeszintézis során a riboszómán keletkező polipeptidláncok aminosavsorrendjét, s ezáltal a fehérjék funkcióját és fajlagosságát az mrns-molekulák nukleotidtripletjeinek (kodonjainak) a sorrendje határozza meg. A mrns-ek már szintézisük befejezése előtt kötődnek a riboszómákhoz. Élettartamuk igen rövid, E. coliban átlagosan 2 perc. A riboszómákról történő leválásuk után enzimatikus úton elbomlanak. A riboszóma RNS-nek kódfunkciója nincs, fehérjékhez kapcsolódva a baktériumok riboszómáiban találhatók. A riboszómákon folyik a fehérjeszintézis. A riboszómák megfelelő felületet adnak az mrns, a trns és a képződött peptidmolekulák kötődéséhez a fehérjeszintézis során. A bakteriális rrns-ek egyetlen génről íródnak át egy pre-rns-sé, majd ez a molekula esik szét több kisebb (16 S, 30 S stb.) RNS-sé. A kis rrns molekulák fehérjékhez kapcsolódnak, s csak a mrns-ek megjelenésekor, a fehérjeszintézis megindulásakor egyesülnek komplett, működőképes egységgé. A trns molekulák szállítják az aktivált aminosavakat a riboszómákhoz. A baktériumokban eddig identifikált trns-félék száma között változik, azaz az enzimek egyféle aminosavat nem csupán egyféle trns-hez képesek kötni. A trns fonalak a komplementer bázisok között kialakuló hidrogénkötések miatt lóhere alakban föltekeredtek. A lóhere egyik hurkához kötődik az aktivált aminosav, a másikon keresztül kötődik a trns a riboszómához, a harmadik hurok pedig az antikodont hordozza. Jóllehet a baktériumsejtben található RNS több mint 98%-a riboszóma-rns, mégis a DNS-nek kevesebb, mint 1%-a szolgál ezek templátjaként. A bakteriális DNS túlnyomó többségéről mrns szintetizálódik. A fehérjeszintézis a riboszómák mrns-hez való kapcsolódásával indul meg. A peptidláncok a riboszómán az mrns kodonjainak megfelelően trns által szállított aminosavakból épülnek fel. Az összes bakteriális polipeptid szintézise N-formil-metioninnal kezdődik, amely a szintézis befejeződésekor rendszerint leszakad. A 47
68 Bakteriológia peptidlánc képződésének megindulásához legalább három különféle fehérjére (lánckezdő faktorokra) is szükség van. Ugyancsak speciális fehérjék (elongációs faktorok) segítik elő a polipeptidlánc képződése során az aminosavakat szállító trns-ek riboszómához kapcsolódását és a trns-ek áthelyeződését a riboszóma egyik helyéről a másikra. A polipeptidlánc szintézise a stop tripletek (nonszensz kódok) leolvasásával ér véget. A peptidlánc terminációját, a lánc végi aminosavhoz kapcsolódó trns lehasadását, a polipeptidlánc leválását a riboszómáról ugyancsak specifikus fehérjék (release-faktorok) segítik elő. Egy mrns molekula egyszerre több (egymással szomszédos géneken elhelyezkedő) fehérje szintézisére nézve is hordozhat információt (policisztronos mrns). Az egy mrns által kódolt különféle funkciójú fehérjék (pl. E. coli béta-galaktozidáz, galaktozid-permeáz) nem feltétlenül szintetizálódnak azonos mennyiségben. Egy mrnsről egyszerre több riboszóma (poliriboszóma) is képezhet fehérjét, így ugyanarról az mrns-ről eltérő hosszúságú peptidláncok szintetizálódhatnak. A fehérjeszintézis befejeztével a riboszóma alegységeire válik szét. A peptidláncok elkészülte után a terminális aminosavak egy része lehasad vagy esetenként a peptidlánc feldarabolódik, s a funkcióképes fehérje (enzim) ezekből az átrendezett peptidláncokból áll össze. A génkifejeződés szabályozása. A baktériumokban az egyes génekben kódolt sajátságok kifejeződésének (expressziójának) a szabályozása meglehetősen bonyolult. A bakteriális DNS egy részéről permanensen íródik át mrns, így az enzimek (fehérjék) egy része (pl. a glükózbontást végző enzimek) kisebb-nagyobb mennyiségben mindig megtalálhatók a baktériumsejtben (konstitutív enzimek). Mások (pl. a laktóz bontását, egyes gyógyszerek inaktiválását stb. végző enzimek) csak akkor szintetizálódnak, ha az enzim szubsztrátja a környezetben megjelenik (indukálható enzimek). A fentieken kívülvannak olyan enzimek (pl. az aminosavak bioszintézisét végzők), amelyek az adott enzim végtermékének (korepresszorának) a táptalajba keverésével represszálhatók (represszálható enzimek). Az indukálható és represszálható fehérjék (enzimek) kódjaként szolgáló mrns molekulák transzkripciójának megindulása speciális fehérjemolekuláktól, a represszoroktól függ. A represszorfehérjéket is kromoszóma-dns,a regulátorgének kódolják. Minden represszor egy vagy több fehérje szintézisét állítja le. A represszor specifikus helyen kötődik a megfelelő DNS-hez és meggátolja az adott mrns molekula transzkripciójának megkezdődését. A DNS represszorfehérjét megkötő szakasza az operátorrégió (operátorlokusz). Azokat az egymással szomszédos DNS szakaszokat, amelyekről egyetlen mrns molekula szintetizálódik (egyetlen promoter régió szabályozása mellett) nevezzük operonoknak.az operonok funkcionális egységek, egy-egy anyagcsere-folyamatot végző enzimek kódját és az ezek kifejeződését szabályozó géneket tartalmazzák. Az E. coli laktóz operon, amely a laktóznak a baktériumsejtbe való bejutását és lebontását végző enzimeket kódolja, szerkezete ismert, transzkripcióját egy regulátorgén szabályozza (23. ábra). A represszorfehérje az operátorrégióhoz kötődve mindaddig gátolja az adott struktúrgének transzkripcióját, ameddig az indukáló anyaggal (pl. a laktózoperon esetén a laktózzal) nem találkozik. Az indukátor kötődése inaktiválja a represszorfehérjét, így az adott génszakaszokra vonatkozóan megkezdődhet az mrns-másolás. 23. ábra - Escherichia coli laktóz operonjának és kapcsolt regulátorgénjének szerkezete. A laktóz operon a kromoszóma 10. percében helyeződik; a számok az egyes génekben, lókuszokon talált bázispárok számát mutatják 48
69 Bakteriológia A represszorok működése a génkifejeződés negatív szabályozása, mert a represszor hiánya az adott enzim vagy enzimek állandó termelését okozza (konstitutív mutánsok). A génkifejeződésnek azonban van pozitív szabályozása is, ami pl. a glükózbontást végző enzimek szintézisének serkentésében jut kifejeződésre. A baktériumok glükózbontása során az egyik bomlástermék csökkenti a sejtben a ciklikus adenozin-monofoszfát (camp) mennyiségét. A camp egy specifikus, ún. katabolitaktivátor fehérjéhez (CAP-hoz) kapcsolódik, majd együtt a promoter specifikus helyeihez kötődve növelik a szomszédos operonok transzkripciójának s ezáltal a glükózbontásnak a sebességét. A baktériumok különféle anyagainak szintézisét végző enzimek expresziójában működnek végtermékgátló mechanizmusok is, amikor valamely végtermék tápfolyadékban való megjelenése leállítja az adott anyag szintézisét végző enzimet kódoló gén (vagy gének) transzkripcióját. Az E. coli tenyészet tápfolyadékához adott triptofán pl. gátolja a triptofánszintézist végző enzimek génjeinek(operonjának) atranszkripcióját. IS-elemek. Az IS-elemek aránylag rövid, bázispárt tartalmazó, azonos nukleotidszekvenciájú, nemkód funkciójú DNS-szakaszok, amelyek megtalálhatók több példányban a baktériumok kromoszómájában, az extrakromoszomális genetikai elemekben, de bakteriofágokban, egyéb vírusokban és eukaryota sejtekben is. Az IS-elemek a baktériumkromoszómába beépülve befolyásolják a génfunkció kifejeződését. A promoter- és terminátorszekvenciákat is tartalmazó IS-elemek orientációjuktól függően szerepet játszanak annak a génnek a ki- és bekapcsolásában, s ezáltal a génfunkció kifejeződésében, amely elé beépültek. Az E. coli laktóz operonjába beépített IS-elem megszüntette annak a génnek a funkcióját, amelybe beépítették, a mögötte helyeződő gének transzkripciója pedig ugyancsak megszűnt vagy jelentős gátlást szenvedett (poláris mutáció). Az IS-elemek beépülése a kromoszómába vagy a plazmidba különösen jelentős akkor, ha azok kód funkciójú DNS szakaszokat fognak közre. Az ilyen képződményeket nevezzük transzpozonoknak (lásd később).az ISelemek által közrefogott szakaszok könnyen kicserélődnek idegen gének analóg szakaszaival vagy helyeződnek át a genomban, nem igényelve a recipiens genom homológiáját vagy specifikus enzimeket. Az IS-elemeknek ily módon fontos szerepük van a prokaryoták genetikai anyagának rekombinációjában (lásd később) Extrakromoszomális genetikai elemek (plazmidok) Számos baktériumfaj a kromoszómában foglalt genetikai anyagon kívül különféle tulajdonságokat kódoló extrakromoszomális elemeket, plazmidokat is tartalmaz. A plazmidok a kromoszómához hasonlóan,kevés kivételtől eltekintve, hurok alakú, dupla szálú DNS-molekulák, molekulatömegük azonban csupán milliós nagyságrendű, szemben a kromoszóma milliárdos nagyságrendjével. A plazmidoka kromoszómától függetlenül replikálódnak, a baktériumsejtben önállók maradnakvagy integrálódnak a kromoszómába (episzóma). Az alacsony molekulatömegű, kis plazmidokból egy-egy baktériumsejt több tucatot is tartalmazhat, a nagyobb molekulatömegű, több tulajdonság kódját hordozó plazmidok száma baktériumsejtenként rendszerint nem több mint 1 4. Bár a plazmidok által kódolt sajátságok a baktériumsejt számára nem létfontosságúak, többnyire előnyt jelentenek a környezethez való alkalmazkodásban. A plazmidok egy része minden baktériumsejtben, mások csak bizonyos baktériumfajok sejtjeiben képesek szaporodni. Valamely plazmid jelenléte a baktériumsejtben megakadályozhatja homológ vagy heterológ (más tulajdonságokat kódoló) plazmidnak a sejtbe való bejutását, illetve szaporodását (plazmid-inkompatibilitás). A plazmidok a sejtből alkalmanként spontán eltűnnek, de különféle mesterséges beavatkozásokkal (UV sugárzással, akridinfestékekkel, egyes antibiotikumokkal stb.) is eltüntethetők (plazmidtörlés). A plazmidok egy része képessé teszi a baktériumsejteket arra, hogy konjugáció útján genetikai anyagot adjanak át más baktériumoknak. Ezeka konjugatív (transzferálható) plazmidok. Sok plazmid ismert, ígyaz F- (fertilitás-) plazmid, a gyógyszerrezisztenciáért felelős R-(rezisztencia-)plazmid, Col- (colicin termelését kódoló)plazmidok, egyes antigéneket, hemolizálóképességet, toxinképzést vagy bizonyos anyagok pl. toluol, xilol bontását végző enzimeket stb. kódoló plazmidok A baktériumok változékonysága Bár a baktériumok alaki, biokémiai stb. tulajdonságai az egyes fajokra jellemzőek és állandóak, mégis a baktériumok szaporodása folyamán a szülősejtektől eltérő tulajdonságú utódok is létrejönnek. A baktériumoknak ez a változékonysága érintheti a baktériumok genetikai anyagát (a genotípust) vagy csupán a küllemi tulajdonságokban (fenotípusban) jut kifejeződésre A genotípus változékonysága A mutáció 49
70 Bakteriológia A mutáció a genotípusban bekövetkezett változás, az ennek eredményeként létrejött, megváltozott tulajdonságú egyedek pedig a mutánsok. A mutáció öröklődő változás, amely az utódnemzedékben is kimutatható. A mutáció során bekövetkezett DNS-szekvencia-változás nem mindig tükröződik a fenotípusban. Ennek rendszerint az az oka, hogy a mutáció néha olyan DNS-szakaszokat érint, amelyeknek megváltozása nem vezet hibás fehérjék szintézisére, vagy a változás olyan kisfokú, hogy a fenotípusban csak finomabb módszerekkel mutatható ki. A mutációk kialakulhatnak spontán, de létrejöhetnek különféle mutagén ágensek hatására is. Az egy tulajdonságot érintő spontán mutációk gyakorisága baktériumnemzedékenként nagyságrendű. A mutagén ágensek által létrehozott mutációt nevezzük indukált mutációnak. Mutagén ágensként hat az ultraibolya sugárzás, az akridinfestékek, a metilálóanyagok, a purin-, a pirimidin-bázisanalógok stb. Az ultraibolya sugárzás a bázisok között dimerek képződéséhez vezet, az akridinszármazékok és a metilálóanyagok bázisokat távolítanak el a DNS-láncból, a bázisanalógok pedig a természetes bázisok helyett épülnek be, párképzésük azonban nem tökéletes, s ez másoláskor hibákhoz vezet. A mutáció alapja a DNS bázisszekvenciájának megváltozása egy vagy több bázis kicserélődése (szubsztitúció), beépülése (inzerció) vagy kiesése (deléció) következtében (pontmutációk). A mutáció kiterjedhet hosszabb, akár több gént magában foglaló DNS-szakaszokra is. Előfordul, hogy a DNS-szegmentum megcseréli irányultságát (inverzió), áthelyeződik a kromoszóma más helyére (transzlokáció) vagy akár megkettőződik (duplikáció). Báziscserével járó mutáció jelentheti eltérő aminosav beépülését az adott DNS- szakasz által kódolt fehérjébe vagy esetleg lánclezáró kód létrejöttéhez vezet. Az előbbiek a téves értelmű (misszensz), az utóbbiak az értelmetlen (nonszensz) mutációk. A misszensz mutáció során képződött fehérje, mivel benne csak egy aminosav cserélődött ki, rendszerint megtartja eredeti funkciójának egy részét. A nonszensz mutáció következtében, attól függően, hogy a gén melyik szakaszát érte, rövidebb vagy hosszabb, rendszerint funkcióképtelen polipeptidláncok szintetizálódnak. A polipeptidlánc hossza alapján a mutáció helye meghatározható. A nukleotidbeszúrás vagy -kimaradás a tripletek eltolódása miatt a mutáció mögötti összes kód értelmének a megváltozásával jár (fáziseltoló mutációk) s funkcióképtelen fehérjék szintézisét okozza. A mutációt szenvedett egyedek újabb mutációval visszanyerhetik eredeti genotípusukat. Ez a jelenség a reverzió. A reverzió viszonylag könnyen következik be pontmutációk után, egyéb esetekben sokkal ritkább. A reverzió lehet valódi vagy szuppresszió útján létrejövő. A valódi reverzió során az adott génszakasz újabb, ellenkező előjelű mutációt szenved, s az új mutációtól kezdődő szakaszon a kód értelme helyreáll. A szuppressziót előidéző mutáció a trns antikodonjának a megváltozásán keresztül érvényesül. A megváltozott antikodonú trns képes az eredeti mutáció során keletkezett és mrns-re átíródott nonszensz kódot értelmezni s valamelyik aminosavat a készülő peptidláncba beépíteni. Ily módon funkcióképes fehérje képződik, azaz a szuppresszió a fenotípus korrekcióját eredményezte. A baktériumcytoplasma tartalmaz olyan enzimeket, amelyek a saját nukleinsavakat pl. metilálással specifikusan megjelölik (metiltranszferázok, DNS modifikáció), továbbá endonukleázokat, amelyek az idegen DNS-eket meghatározott bázisszekvenciák között elhasítják, valamint olyan DNS-reparáló enzimeket is, amelyek képesek a másolási hibákat kijavítani, pl. az UV besugárzás után keletkezett timidin diméreket kihasítani, a beépült plusz bázispárokat a DNS láncból kivágni stb. A reparációs enzimek jelentős mértékben korrigálják a másolási hibákat, a restrikciós endonuklázok pedig elbontják a baktériumsejtbe jutott idegen DNS-t. Minden olyan anyag (gyógyszerek, vegyszerek stb.) vagy hatás, amely a DNS-t befolyásolja (potenciálisan) mutagén ágensnek tekinthető. Az egyes anyagok mutagén hatása baktériumtenyészetek segítségével (is) vizsgálható. A vizsgálathoz olyan többszörös mutáns (emiatt reverzióra igen kevéssé képes) baktériumokat, pl. hisztidint igénylő (auxotróf) S. typhimurium törzset használunk, amelyből a természetes DNS-reparáló enzimek hiányoznak és ezért a baktérium újabb mutációra nagy fokban hajlamos. A baktériumokat patkánymájból készített kivonatban szuszpendáljuk, majd olyan szintetikus, minimális táptalajra szélesztjük, amelyen a baktériumtörzs nem nő. Egy szűrőpapír korongot a vizsgálandó anyaggal átitatva a beoltott táptalaj közepére helyezünk. A májkivonat arra szolgál, hogy a benne lévő enzimek a vizsgálni kívánt anyagot különböző (esetleg mutagén) komponensekre bontsák éppen úgy, mint az élő szervezetben. Ha a vizsgált anyag vagy metabolitjai mutagének, a S. typhimurium törzs mutáció(ka)t szenved, közöttük olyanokat is, amelyek a hisztidinszintézis képességének a visszatérését jelenti, s ez esetben a korong körül baktériumtelepek fejlődnek. A S. typhimuriummal végzett próba (Ames-test) nagy biztonsággal jelzi a vizsgált anyagok mutagén hatását. A mutációk a genetikai anyag bármelyik szakaszát érinthetik. A mutánsok kiválogatása legtöbbször a megváltozott tulajdonság (szelektív bélyeg) alapján történik. Orvosi szempontból azok a mutációk a legfontosabbak, amelyek a baktériumok sejtszerkezetét, anyagcseréjét, gyógyszerekkel szembeni érzékenységét és a kórokozó baktériumok virulenciáját érintik (lásd később). 50
71 Bakteriológia A sejtszerkezetet érintő mutációk. A sejtszerkezetet érintő mutációk kifejeződésre juthatnak a baktériumtelepek megváltozott morfológiájában. A baktériumok a szilárd táptalajok felületén a fajra jellemző alakú, nagyságú, színű telepeket (kolóniákat) képeznek. Az éles határú, sima, fénylő, vajszerű vagy éppenséggel nyálkás S- (sima)telepeket képező baktériumok tenyészeteiben hosszabb ideig tartó állás vagy sorozatos továbboltás (passzálás) hatására olyan telepek is megjelennek, amelyeknek széle csipkés, felszíne matt, rögös (R-telepek). Az R-telepek kialakulása a Gram-negatív baktériumoknál a sejtfalban található lipopoliszacharidok felépítését kódoló gének több lépésben bekövetkező mutációjának a következménye. A típusspecifikus O- poliszacharid-oldallánc fokozatosan elvész. Az S R mutáció nemcsak a telepküllem megváltozásával jár, hanem mivel a poliszacharid-molekula szabja meg a Gram-negatív baktériumok O-antigénjének specificitását, a mutáción átesett törzsek antigénszerkezete is megváltozik. Az S R mutáció rendszerint együtt jár a virulencia részleges vagy teljes elvesztésével. Az ilyen törzsek autoagglutinábilisak, tenyészetükből nem képezhető stabil szuszpenzió, megváltozik a bakteriofágok iránti érzékenységük stb. A Gram-pozitív baktériumokban az S R mutáció rendszerint a buroktermelő képesség, és ezzel együtt a virulencia részleges vagy teljes elvesztésével jár együtt. A Streptococcus (Diplococcus) pneumoniae, a Bacillus anthracis, Pasteurella multocida, Haemophilus paragallinarum stb. törzsek burkos S-variánsai virulensek, burok nélküli R-variánsaik virulenciájukat részben vagy teljesen elvesztették. A sejtfal felépítését kódoló gének mutációja következtében a baktériumok elveszthetik sejtfalukat. Az ilyen mutánsok (L-formák) csak speciális viszonyok között tarthatók fenn. Mutációk következtében módosulhat a baktériumok csillóit felépítő fehérjék szerkezete, sőt csilló nélküli variánsok is létrejöhetnek. A csillókat érintő mutációk nem befolyásolják a baktériumok pathogenitását, a csillóantigének részleges vagy teljes hiánya azonban megnehezíti a baktériumok szerológiai identifikálását. A mutációk érinthetik a baktériumok fimbriáit is. A fimbriát kódoló plazmid vagy kromoszomális DNSszakaszok elvesztése kifejeződésre juthat a telepküllem megváltozásában, a hemagglutináló és a hámsejtekhez való tapadási képesség elvesztésében, ami rendszerint együtt jár a virulencia elvesztésével is (Escherichia coli, Bordetella bronchiseptica stb.). Az anyagcserét befolyásoló mutációk. A mutációk érinthetik a baktériumoknak azokat a génjeit is, amelyek az egyes anyagcsere-folyamatokat, egyes anyagok bontását vagy bizonyos metabolitok szintézisét végző enzimek termelését kódolják. Az E. coli laktóz génjét érintő mutációk a tejcukorbontó képesség elvesztését idézhetik elő azáltal, hogy a bontást végző béta-galaktozidáz enzim termelődése megszűnik. Hasonló mutáción más metabolitok felhasználását megszabó gének is áteshetnek. Az anyagcsere-változásokban kifejeződő mutációk egy másik típusa az, amikor a baktériumok a mutáció következtében képtelenek bizonyos anyagokat pl. egyes aminosavakat, purin-, pirimidinbázisokat vagy vitaminokat szintetizálni, s a továbbiakban csak akkor szaporodnak, ha ezeket az anyagokat a táptalajban készen kapják. Az ilyen, a szülősejtektől csupán bizonyos táplálkozási igényeiben különböző törzseket auxotróf mutánsoknak nevezzük. A teljes enzimgarnitúrájú (prototróf) E. coli törzsek ammóniumsót és glükózt tartalmazó minimális táptalajon is szaporíthatók. Az adenint előállítani képtelen mutánsok azonban ebben a minimális táptalajban csak akkor nőnek, ha ahhoz adenint is adunk. Az auxotrófia nemcsak egyféle anyagra, hanem egyszerre többre is kiterjedhet (poliauxotróf mutánsok). Az anyagcserét érintő mutációk közül különösen fontosak azok, amelyek a virulencia szolgálatában álló citotoxinok termelését befolyásolják. Sok baktérium termel különféle citotoxinokat. Az Actinobacillus pleuropneumoniae törzsek pl. különféle, a tüdő alveoláris macrophagjait, az Escherichia coli baktériumok a bélnyálkahártya hámsejtjeit károsító citotoxinokat termelnek. E toxinok képződését többnyire plazmidok kódolják. E plazmidok elvesztése, vagy a toxin termelését kódoló génszakaszok megváltozása a toxintermelés megszűnéséhez és ezáltal a virulencia csökkenéséhez vagy elvesztéséhez vezet. Egyes toxinok kódját (pl. Clostridium botulinum törzsek egyes toxinjait vagy a Corynebacterium diphtheriae törzsek által termelt diphtheria toxint) fágok képviselik. A fágok elvesztése vagy megváltozása ugyancsak a kórokozó képesség megszűnésével vagy csökkenésével jár. Antibakteriális szerekkel szemben rezisztens mutánsok. A baktériumok okozta betegségek gyógykezelése szempontjából különös jelentőségük van a mutáció útján keletkezett gyógyszerrezisztens törzseknek. Mutáció útján keletkezhet a baktériumokban pl. streptomicinrezisztencia. A streptomicinrezisztencia oka a riboszómaszerkezet megváltozása a riboszómák felépítését meghatározó gének mutációjának következtében. A streptomicinnel szemben rezisztens törzsek riboszómái streptomicin jelenlétében is képesek normális, funkcióképes fehérjéket szintetizálni. Mutáció következtében nem csupán streptomicinnel, hanem más antibiotikumokkal (klóramfenikollal, tetraciklinekkel stb.) szembeni rezisztencia is létrejöhet. A 51
72 Bakteriológia baktériumpopulációkban természetes viszonyok között, antibiotikumok jelenléte nélkül is keletkeznek rezisztens mutánsok. Az antibiotikumokkal való gyakori gyógykezelések azonban nagy mértékben hozzájárulnak a rezisztens mutánsok gyors szelekciójához, ezáltal ahhoz, hogy az adott egyedben és a környezetben dominánssá váljanak A baktériumok genetikai anyagának bővülése génátvitellel (rekombináció) A baktériumok bizonyos körülmények között képesek idegen (más egyedekből vagy fajokból) származó, hosszabb vagy rövidebb, új tulajdonságokat hordozó DNS szakaszok felvételére. A DNS-átvitel történhet transzformáció, transzdukció, fágkonverzió és konjugáció útján. E folyamatok során az egyik baktériumból (donorból) (vagy a fágkonverzió során vírusból) DNS jut át egy másik (recipiens) baktériumba. Az átjutott DNS lehet a kromoszóma egy-egy szakasza, vagy plazmid(ok). Az átjutott kromoszómaszakasz vagy plazmid beépül(het) a recipiens kromoszómájába vagy plazmidjába, miáltal új tulajdonságokat (rekombinálódott DNS-t, kromoszómát, plazmidot) hordozó baktériumok (rekombinánsok) jönnek (jöhetnek) létre. Transzformáció. A transzformáció genetikai információ átvitele a baktériumokat körülvevő tápfolyadékban levő, oldott, dupla szálú DNS felvételével. A transzformációt kiváltó DNS származhat más baktériumokból azok szétesése vagy a DNS kivonásának eredményeként, de eredhet más mikroorganizmusokból, vagy eukaryota sejtekből is. A transzformáció felfedezésére az S és R típusú Streptococcus pneumoniae törzsek kórtani sajátosságainak a vizsgálata vezetett. A burkos S. pneumoniae törzsek parenterálisan befecskendezve megölték a kísérleti egereket, a burok nélküli mutánsok viszont nem. Ha azonban a buroktalan törzsek tenyészetét virulens S teleptípusú, de elölt törzs lizátumával együtt fecskendezték be egerekbe, a kísérleti egerek elpusztultak, s belőlük S teleptípusú törzsek voltak izolálhatók. A későbbi vizsgálatok kiderítették, hogy az avirulens S. pneumoniae törzs a buroktermelést kódoló DNS-molekulák felvétele révén vált virulenssé. A transzformáció során tehát az egyik baktériumtörzs DNS-ének egy része átjutott egy másik, fogadó baktériumtörzsbe, miáltal az utóbbi törzs új (vagy korábban elvesztett) tulajdonságra tett szert. A recipiens baktériumsejtek növekedésüknek csupán egy bizonyos szakaszában válnak képessé (kompetenssé) új DNS molekulák felvételére. Transzformációra csak a 10 6 molekulatömeg feletti, dupla szálú DNS szakaszok alkalmasak. A DNS darabnak a recipiens sejt falán és cytoplasmamembránján való áthaladását specifikus fehérjék segítik elő. A felvett DNS molekula hossza változó, a transzformáció során egyszerre több gén is átjuthat a recipiensbe. Az átjutott DNS darab egyik szálának hosszabb vagy rövidebb szakasza beépül a recipiens kromoszómájának megfelelő szakaszába. Az integrálódott új DNS szakasz a recipiens genomjának részévé válik, s azzal együtt replikálódva megjelenik az utódgenerációkban. A transzformáció optimális viszonyok között is legfeljebb a recipiens sejtek néhány százalékát érinti. A transzformáción átesett baktériumok a szerzett új tulajdonság alapján elkülöníthetők. Transzformáció útján nem csupán a burokképzés, hanem más tulajdonságok, pl. antibiotikum-rezisztencia, különféle szénhidrátok fermentációjának kódjai stb. is átjuthatnak a recipiens baktériumokba. Transzformáció számos baktériumfajban előfordul, tisztított DNS-sel ez ideig S. pneumoniaeban, Haemophilus influenzaeben, Bacillus subtilisben és néhány más fajban sikerült mesterségesen létrehozni. Különféle manipulációkkal (a sejtek hidegben tartásával és kalciumionokkal való kezelésével, protoplasztok előállítása majd polietilénglikollal vagy egyéb módon kiváltott plazmidbejuttatás, a protoplasztok fúziója stb. útján) olyan transzformációk is kivitelezhetők, amelyek természetes úton nem jönnek létre. Transzformáció nem csupán ugyanazon faj egyedei, hanem különböző fajok pl. Staphylococcus aureus és Streptococcus pyogenes között is létrehozható. A heterológ transzformáció gyakorisága azonban lényegesen kisebb, mint az egy fajhoz tartozó egyedek közötti transzformáció. Ennek oka az, hogy a heterológ DNSfragmentum integrálódása a recipiens genomjába a DNS-molekulák finom kémiai különbségei, erősen eltérő bázisszekvenciái, továbbá a recipiens sejtek restrikciós endonukleáz enzimjeinek hatása miatt lényegesen nehezebb. Kompetens baktériumok nem csupán bakteriális DNS-t, hanem fágokból nyert DNS-t is képesek a transzformációhoz hasonló mechanizmussal felvenni (transzfekció). Transzdukció. Transzdukció alatt azt a folyamatot értjük, amikor a baktériumok DNS-ének valamely szakasza bakteriofágok segítségével jut át egyik baktériumból a másikba. Az átvitt bakteriális DNS hossza a fág nagyságától függ, rendszerint azonban igen rövid. A fággal együtt bejutott DNS fragmentumok kapcsolódnak a baktériumok kromoszómájához (parciális diploid kromoszómaszakaszok) vagy be is épülnek abba, s új tulajdonságok megjelenését eredményezhetik. Kb. minden bakteriofág-fertőzés eredményez egy sikeres transzdukciót. Egyes fágok csak bizonyos géneket (specifikus transzdukció), más fágok azonban a fágfertőzés következtében széteső bakteriális DNS bármely szakaszát (általános transzdukció) képesek a recipiens 52
73 Bakteriológia baktériumokba átvinni. A specifikuss transzdukció jellegzetes példája az E. coli lambda-fág által közvetített génátvitel. A lambda-fág a fertőzést követően az E. coli kromoszómája 17. percében helyeződő galaktózbontást és biotinszintézist kódoló gének közé épül be temperált fágként. A temperált fág (profág) spontán vagy indukció hatására aktívvá válik, kiszabadul a kromoszómából és megindul a replikációja. A fággenom kiszabadulása (excíziója) azonban nem mindig következik be pontosan. Előfordul, hogy a fággenom egy része lemarad, s helyette a fág galaktóz vagy biotin génszakaszt visz magával. Az ilyen defektív fágok a recipiens baktériumban általában nem replikálódnak, az átvitt tulajdonság azonban kifejeződésre juthat. Az általános transzdukció során a baktériumkromoszóma bármely szakasza inkorporálódhat a fágba. Az E. coli P1 fágjának transzdukciójakor a transzdukáló fágok többsége kizárólag bakteriális DNS-t tartalmaz. A fágok plazmid-dns-t is magukba építhetnek akár úgy, hogy a fág és a plazmid-dns rekombinációjának eredményeként infektív fág keletkezik (pl. klóramfenikol-rezisztenciát hordozó P1 fág) vagy úgy, hogy csupán plazmid-dns-t hordozó defektív fágok jönnek létre. Előfordulhat az is, hogy a bakteriális DNS egy része nem a fág-dns-hez kapcsolódik, hanem a fágfertőzést követően a széteső baktériumkromoszóma valamelyik része pl. a fág fehérjéhez kötődik és így kerül át a fággal a recipiens sejtbe. A transzdukció lehetőséget teremt a baktériumkromoszómában helyeződó gének sorrendjének és egymáshoz viszonyított távolságának a meghatározására. Fágkonverzió. A fágfertőzés eredményeként nemcsak más baktériumokból származó DNS juthat be recipiens egyedekbe, hanem alkalmanként a fág saját genomjának egy szakasza által kódolt sajátság is megjelenhet a fenotípusban. Ezt a jelenséget nevezzük fágkonverziónak. A bejutott fág temperált fággá alakul, s a kromoszómához asszociálódva vagy abba beépülve az utódnemzedékekben is megjelenik (lizogén baktériumok). Alkalmanként a fág aktiválódik, s valódi vírusreplikáció zajlik le, amelynek következtében a baktériumok feloldódnak. A fágkonverziók közül különösen fontosak a baktériumok toxintermelésének és antigénszerkezetének megváltozásával járók. Elsőként a Corynebacterium diphtheriaevel kapcsolatban igazolták, hogy diphthaeriatoxint csak azok a törzsek termelnek, amelyek béta-temperált fággal fertőzöttek. A diphthaeriatoxint, amely egy Da molekulatömegű fehérje, a fág genomjának egy szakasza kódolja. A bétafág toxintermelést kódoló génje bevihető volt E. coli baktériumba is, amely ezáltal diphthaeriatoxint termelt. Hasonlóan fág kódolja a Streptococcus pyogenes erythrogen toxinját, a Clostridium botulinum C és D törzsek toxinjait, az E. coli törzsek hőlabilis enterotoxinját stb. Az antigénszerkezet fágfertőzés hatására bekövetkező megváltozása előfordul a Salmonella és számos más (pl. Shigella, Pseudomonas) nemzetség baktériumaiban. Az E 1-alcsoportba tartozó salmonellák O-specifikus oldalláncai galaktóz-ramnóz-mannóz ismétlődő triszacharid egységekből állnak (3, 10 jelű antigének). Epszilon 15-ös fággal való fertőzés hatására a 10-es antigénkomponens represszálódik, s az alfa-acetil-galaktóz helyét béta-galaktóz foglalja el. A béta-galaktóz szintézisének kódját a fággenom egy szakasza hordozza. Az így módosított csoportra azután egy következő (epszilon 34) fág egy alfa-glükozil-csoportot helyez (3, 15, 34 jelű antigének) (24. ábra). 24. ábra - Fágkonverzió okozta antigénszerkezet-változás a Salmonella E-csoportban 53
74 Bakteriológia Konjugáció. A baktériumok közötti közvetlen kapcsolódással létrejövő génátadást konjugációnak nevezzük. A konjugációt poliauxotróf E. coli mutánsokon fedezték fel. Két poliauxotróf mutáns tenyészetét összekeverték, s megfelelő körülmények között tartva a keveréket, abból teljes enzimgarnitúrájú baktériumokat izoláltak. A prototróf baktériumok létrejötte csak úgy volt értelmezhető, ha feltételezték, hogy a két hiányos mutáns egyikének kromoszómáját a másik mutáns megfelelő kromoszómaszakasza kiegészítette. A mutánsok egyikében később egy plazmidot fedeztek fel, amelyről kiderült, hogy génátadásra teszi képessé a baktériumot s ezért fertilitási (F ) faktornak nevezték el. A konjugáció egyirányú génátadással jár. A konjugációt plazmidok irányítják. A folyamatban részt vevő donor és recipiens baktériumok között szexfimbriák létesítenek kapcsolatot vagy közvetlen plazmahíd alakul ki. A plazmahíd kialakulása után a donor baktérium kromoszómájának egyik szála, a plazmid által kódolt endonukleáz hatására, egy ponton felnyílik. Az ily módon lineárissá vált kromoszómaszál hosszabb vagy rövidebb szakasza a plazmid-rns által irányítva átjut a recipiens baktériumba. Az átjutott donor-dns szál kapcsolódik a recipiens DNS fonalainak egyikéhez, majd a megfelelő helyeken a recipiens fonal egyik szála felszakad, belőle a donornak megfelelő hosszúságú szakasz kivágódik, s ennek a helyére beépül a donor fragmentum. Ezt követi a komplementerszál bázispárjainak megfelelő átépülése a donorfragmentumnak megfelelően. Ily módon az átjutott kromoszómaszakaszban kódolt tulajdonságok a genom részévé válnak, s megjelenhetnek a recipiens egyedek fenotípusában is. A donor és a recipiens sejtek között létrejött közvetlen kapcsolat csupán időleges, a génátadás után a konjugációban részt vevő sejtek szétválnak. A konjugáció előfordulását az enterobacteriumokhoz tartozó valamennyi fajban és több más Gram-negatív baktériumcsoportban (pl. Pseudomonas, Vibrio, Pasteurella) is bizonyították. A konjugáció nem csupán homológ, hanem különböző pl. E. coli és Salmonella fajok között is létrehozható. A heterológ konjugáció segítségével speciális hibridek (pl. laktóz pozitív Salmonella törzsek) állíthatók elő. A heterológ rekombináció gyakorisága azonban lényegesen kisebb, mint a homológé. Az F-plazmid által irányított konjugációban részt vevő donor (F + ) és recipiens (F - ) sejtek kapcsolódását a plazmid által kódolt, a baktérium felületén jelen levő speciális (szex-) fimbriák segítik elő. F + és F variánsok konjugációjakor elsősorban a plazmid jut át a recipiens sejtekbe. Az F-plazmid felvétele a recipiens sejteket mindig donorrá teszi. Ritkán, eleinte kb gyakorisággal azonban a donor baktériumok kromoszómájából származó hosszabb-rövidebb szakaszok is átjutottak a recipiens baktériumokba és azok genomjával rekombinálódva az új sajátságok a recipiens fenotípusában is megjelentek. Később sikerült olyan F + -variánsokat is izolálni, amelyek lényegesen, a korábbinál ezerszer nagyobb gyakorisággal eredményeztek rekombinációt. Ezeket a törzseket nevezik Hfr- (high frequency) donor törzseknek. Az F + -törzsek akkor válnak Hfr-donorrá, ha a plazmában levő F + -plazmid szabad állapotát elvesztve beépül a kromoszómába. Az F-plazmid kromoszómába való beépülése IS-elemeken keresztül történik. Az F-plazmid integrációja a kromoszóma meghatározott, de különböző helyein történhet meg. Az F-plazmiddal együtt átadott tulajdonságok sorrendjét a plazmidintegráció helye (origó) és a kromoszómaszál átjutásának iránya szabja meg. 54
75 Bakteriológia A kromoszómaátvitel időarányos folyamat. A teljes kromoszóma átadása hosszú időt (E. coli baktériumokban mintegy 100 percet) vesz igénybe, s mivel a konjugálódó sejtek közvetlen kapcsolódása ilyen hosszú időn keresztül nem marad fenn, a teljes kromoszómaátadás ritka. A konjugálódott sejtek erőteljes rázással szétválaszthatók, így a konjugáció tetszőleges időben megszakítható. Több különböző, eltérő integrációs helyű Hfr-törzs segítségével feltérképezhető a gének lokalizációja a kromoszómán. A génnek a kromoszómán elfoglalt helyét az adott kromoszómaszakasz recipiensbe való belépésének idejével (vagy újabban bázispár egységekkel) jelölik. A konjugáció és más módszerek igénybevételével sikerült az E. coli, a Salmonella typhimurium és néhány más baktériumfaj génjeinek a baktériumkromoszómán elfoglalt helyét, sorrendjét és egymáshoz viszonyított távolságát meghatározni, s ennek alapján az adott faj géntérképét megszerkeszteni. E. coli baktériumokban, ez ideig 1403, a S. typhimuriumban pedig 1080 gén helye, emellett többségüknek nukleotidszekvenciája, a kódolt fehérje összetétele és funkciója is ismert. Ez az E. coli genetikai állományának kb. 1/3-a. Más baktériumok génjeinek a lokalizációját még kevésbé ismerjük. A plazmidoknak egy különösen fontos csoportját képviselik az R-plazmidok, amelyek révén a baktériumok különféle gyógyszerekkel (pl. szulfonamidokkal, antibiotikumokkal), nehézfémsókkal (pl. Hg, Ni, Co) szembeni rezisztenciát szerezhetnek. Az R-plazmidok egy része konjugatív, azaz a plazmid tartalmazza a gyógyszerrezisztenciát meghatározó egy vagy több gént (rezisztencia determinánsokat), a konjugációt létrehozó géneket (rezisztenciatranszfer-faktorokat), IS-elemeket stb. A rezisztenciát meghatározó gének rendszerint olyan enzimek kódjai, amelyek az egyes gyógyszereket elbontják, akadályozzák bejutásukat a baktériumsejtbe stb. A rezisztenciát kódoló gének esetenként transzpozonok. Ezek egy vagy több rezisztenciagént tartalmaznak a két végükön homológ, de invert orientációjú IS-elemekkel (25. ábra). Mivel az R-plazmid felvétele rendszerint képessé teszi a recipiens baktériumokat a plazmid konjugáció útján való továbbadására, az ily módon kialakult gyógyszer-rezisztenciát fertőző (infektív) rezisztenciának is nevezzük. Az infektív gyógyszer-rezisztenciát kimutatták az enterobacteriumokhoz tartozó valamennyi baktériumfajban, számos más Gram-negatív baktériumban, sőt Gram-pozitív baktériumokban pl. Staphylococcus törzsekben is. A Gram-pozitív baktériumokban előforduló (pl. penicillinrezisztenciát kódoló) plazmidok azonban nem konjugáció, hanem transzdukció útján jutnak át más baktériumokba. 25. ábra - Egy R-plazmid szerkezeti modellje Az A-E jelzi a plazmid transzferjében szerepet játszó gének, rezisztenciatranszfer-faktorok egy részét; Nm = neomicin, Km = kanamicin, Sm = streptomicin, Szu = szulfonamidok, Kl = kloramfenikol, Te = ISelemek segítségével a plazmidba épülő tetraciklin-rezisztencia, transzpozon 55
76 Bakteriológia Egyes baktériumfajok olyan antibakteriális anyagokat, bakteriocineket termelnek, amelyek ugyanazon faj más törzseinek és egyes rokontörzseknek a szaporodását gátolják. A bélbaktériumok termelte bakteriocineket colicineknek, a Pseudomonasaeruginosáét piocinnak, a Bacillus megateriumét megacinnek stb. nevezzük. Az enterobacteriumok termelte colicinek egy részének a termelését konjugatív Col-plazmidok irányítják. A Colplazmidok gyakran különféle R-plazmidokkal együtt jutnak át a recipiens sejtekbe. A Col-plazmidok egy része, hasonlóan az F-plazmidhoz, képes a kromoszómába integrálódni, vagy konjugáció során a donorsejt egyes kromoszómaszegmentjeit magával vinni. Az említetteken kívül számtalan más plazmidféleség ismert még.az Ent-plazmidok az E.coli baktériumok enterotoxin-termelését kódolják. Az enterotoxinoknak szerepe van a törzsek kórokozó képességében. A Hly (haemolysin) plazmidokat E. coli és Streptococcus fajokban mutatták ki. E plazmidok felelősek a törzsek egyikmásik hemolizinjének a termeléséért. Ugyancsak plazmidok kódolnak egyes felületi antigéneket, pl. az E. coli baktériumok K88-as, K99-es fimbria stb. antigénjeit. Ez utóbbiak szerepet játszanak a törzsek pathogenitásában A fenotípus változékonysága (modifikáció) A fenotípusos változások a környezet hatására létrejött, nem öröklődő, átmeneti, a baktériumpopuláció egy részét érintő változások. A fenotípusos változékonyság a baktériumok bármely tulajdonságát érintheti, gyakorlati szempontból azonban legfontosabb a baktériumok egyedi és telepmorfológiájában, az adaptív jellegű enzimképzésben és vegyszertűrésben kifejeződő változékonyság. A baktériumok alaki tulajdonságait befolyásolják a tenyésztés körülményei. Optimális közegben a baktériumok alakja a fajra jellemző, kedvezőtlen környezetben különféle involúciós alakok jönnek létre. Valamely azonos fajú baktériumpopuláció egyedei között kisebb-nagyobb különbségek lehetnek méretben, alakban. A Streptococcus törzsek láncokat csak folyékony táptalajon képeznek, szilárdon nem. Ugyanazon baktériumfaj telepei más és más méretűek, esetleg színűek a tenyésztésre használt táptalaj összetételétől függően. Egyes baktériumfajok (pl. a Listeria monocytogenes, egyes Yersinia fajok) szobahőmérsékleten csillósak, 37 C -on azonban csilló nélküliek. 56
77 Bakteriológia A baktériumok egyes kémiai anyagokkal, gyógyszerekkel (pl. antibiotikumokkal) szembeni rezisztenciája lehet csupán fenotípusos változás, adaptáció következménye. Az adaptív rezisztencia fokozatosan alakul ki a baktériumokban és rendszerint kisebb mértékű, mint a mutáció vagy a plazmid közvetítette rezisztencia. A környezeti hatások befolyásolják a baktériumok enzimtermelését is. A baktériumok számtalan enzimet képeznek, ezeknek egy része indukálható. Indukálható enzim pl. az E. coli laktózt bontó béta-galaktozidáz enzimje vagy egyes Staphylococcus aureus törzsekben a penicillint bontó béta-laktamáz (penicillináz) enzim stb A baktériumok genetikai anyagának a vizsgálata A guanin-citozin arány meghatározása. Mivel a baktériumok kromoszómájában a guanin-citozin és az adenintimin egymáshoz viszonyított aránya, éppen úgy, mint az eukaryota sejtekben, a fajra jellemző konstans érték, de nemzetségenként jelentősen változik, a guanin-citozin bázispárok arányának a meghatározását felhasználjuk az egyes baktériumfajok jellemzésére, más fajokhoz való rokonsági fokának a vizsgálatára és rendszertani besorolására. A DNS-ujjlenyomat vizsgálata. A kromoszomális és a plazmid-dns restrikciós endonukleázokkal való hasítása (enzimes emésztése), majd a kapott DNS fragmentumok elektroforézises képének, a DNS ujjlenyomatának (poliakrilamidgél-elektroforézissel szétválasztva, majd etidiumbromiddal festve, UV fényben vizsgálva) a vizsgálata és a különböző, szorosan vagy többé-kevésbé rokon vagy éppen idegen fajok DNS-képével való összehasonlítása ugyancsak alkalmas eljárás a bakteriális (és más mikrobákból, eukaryota sejtekből vagy vírusokból származó) DNS rokonsági fokának, azonosságának vagy különbségeinek a meghatározására, vagy éppen ugyanazon DNS esetleges genetikai változásának a nyomon követésére. Ha ugyanazon enzim vagy enzimek a különböző baktériumtörzsekből származó DNS-eket az elektroforézis során (standard körülmények között) ugyanolyan távolságra vándorló, azaz azonos nagyságú (molekulatömegű) fragmentumokra bontják, akkor igen nagy valószínűséggel a vizsgált DNS-ek egymással azonosak, míg ha a szakaszok hossza (azaz a vágások helye és száma) eltérő, más vagy megváltozott összetételű DNS-ről van szó. A DNS-ujjlenyomat vizsgálata alkalmas az egyes járványesetekből izolált baktérium- (és még inkább vírus-)törzsek nyomon követésére. A baktériumgenom és a plazmid-dns-ek relatív tiszta kinyerésére ma már több, viszonylag egyszerű, megfelelően felszerelt laboratóriumokban rutinszerűen elvégezhető biokémiai eljárás áll rendelkezésre, ezért a DNS-ujjlenyomat vizsgálata nem tartozik a ritkaságok közé. DNS-DNS hibridizáció.a baktériumok (vírusok, eukaryota sejtek) DNS-ét hevítve a kettős spirál két szála szétválik (a DNS denaturálódik), majd fokozatosan lehűtve a két, egymáshoz képest komplementer szál az eredeti dupla szálú DNS-sé egyesül. Ha a lehűlés előtt az egyik baktérium denaturált DNS-éhez rokon baktériumfajból származó, rövid, szimpla szálú, radioaktív szénnel, foszforral, nitrogénnel vagy egyéb módon jelölt DNS-t adunk, a reasszociáció a jelölt rokon-dns szakasszal is megtörténik, azaz rövid heteroduplex DNS-ek keletkeznek, mégpedig annál nagyobb számban, minél nagyobb a két baktérium DNS-ében a bázissorrend azonossága. A hosszú DNS-fonalakat az oldatból eltávolítva a képződött heteroduplexek aránya, és ezáltal a két baktérium (változat vagy faj) DNS-ének rokonsági foka meghatározható, ez pedig felhasználható az egyes baktériumfajok rendszertani besorolásában. A jelölt DNS szakaszok denaturált RNS-szálakkal is reagáltathatók, így a DNS és RNS közötti bázishomológia is vizsgálható. A DNS amplifikálása (polimeráz láncreakció). A polimeráz láncreakció (polimerase chain reaction, PCR) lehetőséget ad valamely mintában (vérben, ondóban, köpetben, sejtekben stb.) igen kis mennyiségben jelen levő, keresett DNS-szekvenciák megsokszorozására (amplifikálására), ezáltal kimutatására és analízisére. A vizsgálandó mintát az első lépésben hevítjük, hogy a benne lévő dupla szálú DNS kicsavarodását, a két komplementerszál szétválását elérjük. Ezután két rövid, szimpla szálú, olyan szintetikus DNS-t (primert) adunk a mintához, amelyeknek nukleotid szekvenciája komplementer a keresett DNS-szál végeivel. A mintát ezután fokozatosan lehűtve a primerek kötődnek a keresett génszakaszhoz. Ezután a rendszerhez DNS-polimerázt adva az enzim további nukleotidokat köt a primérek mindkét végéhez, hosszú komplementer DNS-szálakat szintetizálva. Az első ciklus végén az eredeti keresett génszakaszból két kópia, a másodikban négy, majd nyolc stb. kópia képződik. A ciklusra több millió kópia keletkezik, a mintában eredetileg igen kis mennyiségben jelen volt, keresett DNS-szekvenciából. Az amplifikálódott DNS a továbbiakban már a szokásos DNS-vizsgálati módszerekkel kimutatható és elemezhető. A PCR-technikát ma már számos laboratóriumban használják rutin diagnosztikai célokra, speciális (egy-egy fajra specifikus) bakteriális, vírus (vagy eukaryota sejtekből származó) DNS kimutatására és ezáltal a minták adott kórokozóval való fertőzöttségének a közvetlen bizonyítására. A PCR, mivel csupán DNS-t mutat ki, akkor is eredményre vezet, amikor a tenyésztéses vagy egyéb direkt baktérium- (vírus-)kimutatási módszerekkel már nem boldogulunk. Mivel a DNS kémiailag nagymértékben stabil, a keresett DNS-szakaszok beszáradt, szétesett sejtekből is kimutathatók. 57
78 Bakteriológia A DNS- és RNS-bázissorrend meghatározása. A biokémiai módszerek fejlődésének eredményeként lehetővé vált a baktériumok kromoszómájában, a plazmidokban (vírusokban, eukaryota sejtekben stb.) található gének, egyéb DNS-szakaszok bázissorrendjének pontos meghatározása (szekvenálás), s ezáltal a kódolt információ elemzése, más-más szakaszokkal való összehasonlítása. A baktériumok tekintetében különösen fontossá vált a riboszóma RNS 16S alegységének a szekvenálása, mivel kiderült, hogy ez a riboszómaszakasz konstans, az évmilliók során alig változott, s a benne levő azonosságok és különbségek támpontot nyújtanak a baktériumok filogenetikai alapon való osztályozására A genetikai anyag megváltoztatásának lehetőségei a baktériumokban A baktériumok (a vírusok és az eukaryota sejtek) genetikai anyagának a közelebbi megismerése, a génátvitel módjainak, lehetőségeinek a tisztázódása, a restrikciós endonukleázok felfedezése, kereskedelmi méretekben való előállítása stb. lehetővé tette a baktériumok (vírusok és az eukaryota sejtek) genetikai anyagának és ezáltal működésének a befolyásolását, megváltoztatását (génmanipuláció, géntechnológia). Új tulajdonságokat hordozó baktériumok előállítása.egy bakteriális gén más baktériumba való átvitelének és ottani expresszálásának a lépései főbb vonalakban a következők. A megváltoztatni vagy más baktériumba átvinni kívánt gént rendszerint valamilyen donor baktériumból preparáljuk vagy esetleg szintetikus úton állítjuk elő nukleotidokból. A kívánt gén átvitelére alkalmas hordozó- (vektor-)plazmidot kell keresnünk és izolálnunk valamilyen baktériumból. A keresést megkönnyíti, hogy ma már nagyon sok vektorplazmid tisztított formában kereskedelmi forgalomban is beszerezhető. Mind a donor, mind a plazmid-dns-t ugyanazon restrikciós endonukleázzal emésztjük, amely a DNS-t meghatározott bázispárok között hasítja úgy, hogy a két DNS mindkét végén szimpla szálú, egymásra nézve komplementer ( ragadós ) végek válnak szabaddá. Ezeken a ragadós végeken keresztül képes a kiválasztott bakteriális-dns szakasz a plazmidba beépülni. Az így előállított, a kívánt tulajdonság(ok) génjét hordozó vektorplazmidot azután transzformáció útján vagy egyéb módon (pl. bakteriofággal) a recipiens baktériumba visszük, és vizsgáljuk, hogy az adott tulajdonság a recipiens baktériumban megjelenik-e. Rendszerint a recipiens baktériumnak csak elenyészően kis száma veszi fel a rekombináns plazmidot. Az új tulajdonságot hordozó DNS, ha az új sajátság kellően stabil, a rekombináns baktériumból a természetes osztódás során az utódnemzedékekbe is átjut. A vektorplazmid bejuttatását a recipiens baktériumba klónozásnak, az új tulajdonságokat hordozó baktériumokat pedig klónoknak nevezzük. A plazmidokba nemcsak baktériumokból, hanem más plazmidokból, továbbá vírusokból vagy eukaryota sejtekből származó DNS-szakaszok is beépíthetők. A rekombináns plazmidok felhasználhatók a kívánt sajátság nemcsak baktériumokba, hanem eukaryota, pl. gombasejtekbe vagy a magasabbrendű élőlények sejtjeibe való bevitelre is. Az eukaryota sejtekből származó génszakaszok azonban a baktériumokban rendszerint nem íródnak át mrns-ekre, az eukaryota és a baktériumsejtek transzkripciójának különbségei miatt. Ehelyett az eukaryota sejtek megfelelő sajátságát kódoló DNS-ről az eukaryota sejtekben képződött mrns-t írják át in vitro (reverz transzkriptáz segítségével) komplementer DNS-re (cdns-re), amelyet plazmidba víve, majd bejuttatva a baktériumba a kívánt sajátság (pl. bizonyos fehérjék szintézise) a baktériumban expresszálódik. Géntechnológiai úton lehetővé vált humán inzulin, interferon stb. termeltetése E. coli baktériumokkal. A ragadós száj- és körömfájás vírusának VP1-es fehérjéjét kódoló RNS, cdns-be való átírása, majd plazmid segítségével való bevitele E. coli baktériumokba lehetővé tette vakcina készítésére használható vírusproteinek előállítását. A rekombinációval létrehozhatók különféle baktériumhibridek, pl. C. botulinum toxint termelő E. coli törzsek, laktóz-pozitív salmonellák stb. A laktózbontásért felelős bakteriális géneket DNS-vírusokba átvíve a megjelölt vírustörzsek a szövettenyészetben a laktózbontás alapján felismerhetők voltak (pozitív markerű vírusmutánsok). A levegő molekuláris nitrogénjét megkötni képes Azotobacter és Rhizobium fajok nitrogénkötésért felelős génjeinek a kromoszómában való megsokszorozásával jelentősen növelhető volt e baktériumfajok nitrogénkötő képessége, amely nagy mennyiségű műtrágya alkalmazását teheti feleslegessé. A géntechnológiai eljárások előnyeik mellett bizonyos veszélyeket is rejtenek magukban (pl. antibiotikumrezisztenciát, toxinképzést, onkogenitást hordozó új mikrobák létrehozása, ezek esetleges kijutása a külvilágba), ezért a fejlett országok egy része az ilyen munkák végzésének a körülményeit szabályozta. 8. Pathogenitás és infectio 8.1. Pathogen és saprophyta mikroorganizmusok 58
79 Bakteriológia A magasabb rendű szervezetek és a baktériumok (valamint más mikroorganizmusok) egymáshoz való viszonya igen különböző. A mikroorganizmusok egy része képes megbetegíteni a magasabb rendű szervezeteket, ezek a pathogen mikrobák. A baktériumok kórokozó-képessége (pathogenitása) számos, baktériumfajonként eltérő és legtöbbször részleteiben nem is ismert sajátság függvénye. A pathogen baktériumfajok száma elenyészően csekély a saprophytákéhoz képest. A pathogenek a külvilágban hosszabb-rövidebb ideig életképesek maradnak ugyan, szaporodni azonban csupán egyes fajok (pl. salmonellák, vibriók, listeriák) képesek. A pathogen fajok szerencsére csak időről időre, más fertőzött egyedekből közvetlenül vagy a külvilág közvetítésével jutnak be (fertőzés, infectio) a magasabb rendű szervezetekbe. A magasabb rendű szervezetek testfelülete, a külvilággal közvetlen összeköttetésben levő szervek, szervrendszerek (a légutak, a bélcsatorna stb.) nagy mennyiségben tartalmaznak baktériumokat. Ezek a születést követően a külvilágból kerülnek be a szervezetbe és telepszenek ott meg, többségük ártalmatlan, saprophyta. Ezek a mikrobák adják a bőr, a légutak, a bélcsatorna, a nemi szervek természetes baktérium- (mikroba-)flóráját. Az ide tartozó baktériumok a szervezethez való viszonyukat tekintve kommenzalisták, azaz olyan mikroorganizmusok, amelyek a gazdaszervezettől szerzik tápanyagaikat, de nem károsítják azt (kommenzalizmus). A normál mikroflórához tartozó baktériumok között azonban vannak olyanok is (pl. az E.coli, az Erysipelothrix rhusiopathiae, a Haemophilus fajok), amelyek bár a nyálkahártya természetes lakói, a gazdaszervezet ellenálló képességének a csökkenése (megfázás, kimerültség, éhezés stb.) esetén betörnek a szövetek közé, s a gazdaszervezetet megbetegítik. Az ilyen baktériumokat nevezzük feltételesen kórokozó, fakultatív pathogen baktériumoknak. Végül vannak olyan baktériumfajok is (pl. a Rhizobium fajok a pillangósvirágúak gyökérzetén), amelyek úgy élnek együtt a gazdaszervezettel, hogy az mindkét fél számára hasznos, ekkor beszélünk szimbiózisról. A pathogenitás nem csupán a szervezetbe bejutó mikroorganizmusok sajátsága. A Clostridium botulinum pl. a külvilágban (főleg a talajban) élő saprophyta, az emésztőcsőbe jutva nem telepszik meg, onnan rövid idő alatt kiürül. Élelmiszerekbe kerülve azonban, anaerob viszonyok között, igen hatékony méreganyagokat termel, az ilyen élelmiszerek elfogyasztása után az emberben és az állatokban súlyos mérgezés (intoxicatio) alakulhat ki. A kórokozó mikroorganizmusok nem minden állatfajban képesek betegséget előidézni, azaz a pathogenitás fajhoz kötött fogalom. A kórokozók gazdaspektruma nem egyforma. Azokat a kórokozókat, amelyek különféle állatfajokat képesek megbetegíteni széles, (euryxeniás), azokat pedig, amelyek csupán egy vagy néhány fajra nézve pathogenek, szűk gazdaspektrumú (stenoxeniás) kórokozóknak nevezzük. A Salmonella typhi pl. megbetegíti az embert, de nem idéz elő betegséget az állatokban,a Bacillus anthracis viszont az összes emlőst, sőt ritkán még a madarakat is megbetegíti.az Erysipelothrix rhusiopathiae nemcsak a sertést, hanem a legkülönfélébb emlős- és madárfajokat is megbetegíti A virulencia A virulencia a kórokozó baktériumok támadóképességének a foka. Ahhoz, hogy betegség alakuljon ki, a kórokozónak többnyire be kell jutnia a szervezetbe, el kell ott szaporodnia és olyan anyagcsere-termékeket termelnie vagy egyéb károsító hatást kifejtenie, amely a szervezet működési zavarához, megbetegedéséhez vezet. A baktériumok okozta fertőzések (infectiók) egy részében inkább a kórokozók behatolási képessége, szövetek közötti erőteljes szaporodása és szóródása (invazivitás), más baktériumoknál viszont elsősorban méreganyag- (toxin-)termelő képességük dominál. A Clostridium tetani pl. csupán a szervezetbe jutás helyén, lokálisan szaporodik el, viszont igen erős méreganyagot (tetanusztoxint) termel. Más fajok kevésbé hatékony méreganyagokat termelnek, viszont korlátlan mértékben elszaporodnak a szervezetben. Ez utóbbiak közé tartoznak a vérfertőzést (septikaemiát) előidéző baktériumfajok, pl.a Bacillus anthracis. A virulencia tekintetében nem csupán az egyes baktériumfajok viselkednek eltérően, hanem fajon belül az egyes törzsek között is nagy különbségek vannak. Egy fajon belül a fajra jellemző támadóképesség birtokában levő (vadvirulens) törzsektől a csökkent virulenciájúakon keresztül a támadóképességüket teljesen elvesztett (avirulens) baktériumtörzsekig minden változat előfordulhat. A virulencia mérése. A virulencia kísérleti úton hozzávetőlegesenmeghatározható. Azt a legkisebb baktériummennyiséget, amely a beoltott valamennyi kísérleti állatot még megöli, minimális letalis dózisnak (MLD) nevezzük. A kísérleti állatok egyedi ellenálló képességének különbsége által okozott hiba kiküszöböléséhez azonban rendszerint nem az MLD-t, hanem azt a baktériummennyiséget határozzuk meg, amely még a kísérleti állatok 50%-át elpusztítja. Ez az 50%-os halálos adag az LD 50.A Bacillus anthracis LD 50- je fehér egerekre nézve csupán néhány baktérium, míg a különféle Salmonella fajokból ugyanezen érték több mint százmillió baktérium. Hasonlóképpen mérjük a baktériumok termelte toxinok LD 50-jét is. A virulencia meghatározása során kapott LD 50 - értékek csak arra az állatfajra vonatkoztathatók, amelyen a mérést végezték. 59
80 Bakteriológia Ugyanazon Pasteurella multocida törzs parenterálisan bevíve pl. kis dózisban elpusztítja a fehér egereket, de sokkal nagyobb dózis lehet szükséges a nyulak vagy csibék megöléséhez. A virulencia változása. A virulencia ugyanazon baktériumtörzs léte során is változik. Egy baktériumpopuláció virulenciája fokozódhat, ha a baktériumok fogékony állatokba jutva passzálódnak. A sorozatos passzálódás során a populáció legvirulensebb egyedei szelektálódnak, ami a populáció egészére nézve a virulencia növekedését jelenti. Az egyes baktériumegyedek virulenciája kísérleti körülmények között, mesterségesen, új genetikai anyag bevitelével (rekombináció útján) ugyancsak fokozható. A rekombináns egyedek szert tehetnek olyan virulenciafaktorokra, amelyekkel korábban nem rendelkeztek, és ezáltal saprophyta mikroorganizmusok is pathogenné tehetők. Szerencsére azonban az ilyen rekombinánsok természetes viszonyok között kevésbé stabilak, a szerzett tulajdonságot hamar elvesztik. A virulencia génátvitellel való fokozódására azonban természetes viszonyok között, legalábbis a baktériumoknál, egyelőre nincs bizonyíték. A baktériumok virulenciája természetes viszonyok között is, de még inkább laboratóriumban való hosszabb fenntartásuk során, rendszerint csökken. A virulencia csökkenése olyan mutációk következménye, amelyek a baktériumok pathogenitása szempontjából fontos tulajdonságokat kódoló géneket érintenek. A virulencia csökkenése létrejöhet spontán, de akkor is, ha a baktériumokat a laboratóriumban az optimálistól eltérő hőmérsékleten, tápanyagban szegény, antibiotikumokat vagy különféle egyéb gátló anyagokat (pl. festékeket stb.) tartalmazó táptalajon tenyésztjük. A virulenciájukban gyengült vagy avirulens törzseket gyakran használjuk oltóanyag-termelésre. Virulenciafaktorok. Mindazokat a sajátságokat, amelyek a pathogen baktériumokat képessé teszik a magasabb rendű szervezetek megbetegítésére, virulenciafaktoroknak nevezzük. Számtalan virulenciafaktor létezik, ezeknek azonban csupán egy része ismert. A virulenciafaktorok a baktériumok legkülönfélébb sajátságaival függhetnek össze (alak, mozgásképesség, sejtszerkezet, anyagcsere stb.), s csupán a véletlenen múlik, hogy a baktériumok egyébként normális fiziológiai sajátságai a gazdaszervezetet az adott esetben károsítják-e vagy sem. A virulenciafaktorok, jelentős egyszerűsítéssel, két csoportra oszthatók. Az egyik csoportot a virulenciát befolyásoló nem toxikus faktorok alkotják, míg a másik csoportot a baktériumok termelte méreganyagok (toxinok) képviselik. A kettő között többnyire nem lehet éles határt vonni A virulencia nem toxikus tényezői A virulencia nem toxikus tényezői közé tartoznak a baktériumok sejtfelületén található különféle faktorok és a baktériumok által termelt extracelluláris enzimek. Felületi faktorok. A virulenciafaktoroknak ebbe a csoportjába soroljuk az antiphagocyta hatású sejtfalkomponenseket, a sejtfalban, illetve a sejt felületén található egyes poliszacharid- és fehérjeantigéneket, a burokanyagokat és a fimbriákat. A Listeria monocytogenes sejtfala tartalmaz egy lipidkomplexet, amely egérben monocytosist okoz. A virulens Mycobacterium tuberculosis törzsek a köpetben, a szövetekben és tenyészeteikben is szerpentinszerű kötegekben láthatók (cordformáció). A cordformációért egy a baktériumok sejtfalában található mikolsavészter (trehalóz dimikolát) felelős. A cordfaktor toxikus a leukocytákra, phagocytákba jutva pedig tönkreteszi a mitochondriumokat, lehetővé teszi a mycobacteriumoknak a phagocyta sejtekben való túlélését. Az enteroinvazív Escherichia coli törzsek bélfalba való bejutását a külső membránban található, egyes fehérjeantigének segítik elő. A pathogen baktériumok burokanyaga általában virulenciafaktornak tekinthető. A virulens lépfenebacilusok glutaminsavból álló peptidburka gátolja a phagocytosist, elősegítve ezáltal a baktérium bejutását és elszaporodását. A polipeptidburok ellen a szervezet ellenanyagokat termel, ezeknek azonban nincs védő hatásuk. Egyes streptococcusok, pl. a S. equi, a Pasteurella multocida törzsek egy része, hialuronsavból álló tokot, burkot termel, amely ugyancsak phagocytosist gátló hatású. A phagocytosis elmaradása vagy legalábbis késleltetése elősegíti, hogy a szervezetbe jutott baktériumok elszaporodjanak és a szöveteket károsító anyagokat termeljenek. A burkos törzseket hialuronidázzal kezelve a virulencia jelentősen csökken vagy elvész. A virulenciával kapcsolatban álló, antigénhatású poliszacharidokból álló burok számos más (pl. E. coli, Haemophilus paragallinarum) baktériumfajban is megtalálható. 60
81 Bakteriológia Ugyancsak virulenciafaktoroknak tekinthető a fimbriák többsége, amelyek lehetővé teszik a baktériumoknak a gazdasejteihez való tapadását (adhezióját). Extracelluláris enzimek. A baktériumok virulenciájában különféle extracelluláris enzimek is szerepet játszanak. A pathogen Staphylococcus törzsek koagulázt termelnek, amely a fertőzés helyére áramló savót megalvasztja. Az enzim hatására képződött fibrinburok megvédi a baktériumokat a phagocytosistól. Egyes Streptococcus fajok fibrinolizint (sztreptokinázt) termelnek, amely a plazma egyik proteolitikus proenzimjét, a plazminogént aktiválja. Az aktivált enzim a fertőzés helyén kialakult fibrinalvadékot oldja, elősegítve ezáltal a baktériumok szóródását. Hialuronidázt termel a Staphylococcus, a Streptococcus és a Clostridium fajok egy része. Az enzim a sejtek közötti ragasztóanyagot, a hialuronsavat oldja, fellazítva ezáltal a fertőződés helyén a szövetek állományát, ami elősegíti a bejutott baktériumok szóródását. Sok Clostridium faj termel kollagenáz enzimet, amely a kollagén bontásával ugyancsak a kórokozók terjedését szolgálja. A Clostridium perfringens törzsek,a Bacillus anthracis és néhány más baktériumfaj lecitinázt termel. Az enzim a sejtek membránjában lévő lecitint bontva a fertőzés környékén súlyos szövetelhalást idéz elő. Az enzimek és a baktériumtoxinok közötti átmenetet képviselika leukocidinek, valamint a különféle hemolizinek (hemotoxinok). A pathogen Staphylococcus és egyes Streptococcus törzsek különböző felépítésű leukocidineket termelnek, amelyek a phagocytosist végző leukocytákat károsítják. A hemolizinek a baktériumsejthez kötött vagy a tápfolyadékban megjelenő olyan anyagok, amelyek egyéb hatásuk mellett a különféle fajú állatok vörösvérsejtjeit feloldják. Hemolitikus hatású anyagokat mind pathogen baktériumok (pl. Streptococcus, Staphylococcus, E. coli), mind saprophyta fajok (pl. egyes aerob spórás baktériumok) termelnek. Egyes hemolizineknek kifejezett toxikus hatásuk van vagy valódi exotoxinok (pl. a C. perfringens thétatoxinja) A baktériumok toxinjai A pathogen baktériumok egy része különféle toxinokat termel. A toxinok két csoportba, exo- és endotoxinokba oszthatók. Az exotoxinok rendszerint kiválasztódnak a baktériumsejtből és a tenyészet felülúszójában találhatók, míg az endotoxinok a Gram-negatív baktériumok sejtfalában levő lipopoliszaharid-komplexek. Az utóbbi években kiderült, hogy a klasszikus exotoxinokon kívül számos baktériumfaj képes ugyancsak az exotoxinok csoportjába sorolható, az esetek többségében lokális hatású, különféle, gyorsan elbomló citotoxinokat termelni. Ezeket a citotoxinokat az egyes baktériumfajok tárgyalásakor említjük. Exotoxinok. A leghatékonyabb exotoxinokat a Clostridium nemzetség tagjai termelik, de exotoxinokat termelnek más fajok is, így pl. a Corynebacterium, a Streptococcus, a Staphylococcus fajok, a Gram-negatívak közül pedig a Vibrio cholerae, egyes Shigella és E. coli törzsek. Az exotoxinok igen erős mérgek, hatékonyságuk sokszorosan felülmúlja a legerősebb kémiai mérgek hatékonyságát. A C. tetani levestenyészete pl. milliliterenként akár egér MLD-t tartalmazhat. Az exotoxinok kevés kivételtől eltekintve fehérjék, ennek következtében hőre, továbbá denaturálószerekre (alkohol, híg savak, formalin stb.) érzékenyek. A legtöbb exotoxin 70 C felett denaturálódik, de kivételek pl.a Staphylococcus aureus törzsek enterotoxinjai és az E. coli hőstabil enterotoxinja, amelyek viszonylag hőállók. Fehérje természetüknek megfelelően aminosavakból állnak, rendkívüli mérgezőképességük a molekulákat felépítő aminosavak sorrendjével és térbeli helyzetével függ össze. Az exotoxinok többségét a proteolitikus enzimek károsítják, vannak azonban kivételek is. A C. botulinum által termelt toxinok egy részének a hatékonysága tripszinkezelés hatására fokozódik, a nagy molekulájú toxinok tripszin hatására több, még aktív, kisebb molekulatömegű részre hasadnak. Az exotoxinok biológiai hatása specifikus, jellemző a toxinra. Az exotoxinok többsége csupán a kórosan elváltozott szövetekből felszívódva hatásos, a Staphylococcus fajok által termelt enterotoxinok vagy pl. a C. botulinum toxinjai azonban a bélcsőből is felszívódnak. A toxinok egy része pl. a Corynebacterium diphtheriae termelte diphteriatoxin, amely egyetlen, Da molekulatömegű polipeptidlánc, a szervezet valamennyi sejtjére nézve mérgező, a fehérjeszintézist gátolja. A C. tetani toxinja, a tetanospazmin, Da molekulatömegű fehérje, amely a gerincvelő elülső szarvának mozgatóidegsejtjeire és a myoneuralis kapcsolódásra fejti ki hatását. A toxin akadályozza az acetil-kolin-eszteráz enzim működését, amely az ingerület átadását szabályozó acetil-kolint elbontja. A toxin hatásának eredményeként a reflexingerlékenység fokozódik, végül az izmok görcsös összehúzódása miatt az állatok elhullanak. A C. botulinum által termelt toxinok különböző molekulatömegű fehérjék. A toxinoka synapsisokat és az idegvégkészülékeket bénítják, 61
82 Bakteriológia megakadályozva az acetil-kolin kiválasztódását. Hatásukra a kísérleti állatok fokozatosan elerőtlenednek, s az izmok petyhüdt bénulása mellett elhullanak. Az exotoxinok hosszabb-rövidebb inkubációs idő után hatnak. Az inkubációs idő alatt a toxinok a termelődés helyéről eljutnak a hatásuk iránt érzékeny sejtcsoportokhoz, s azokhoz kötődve fejtik ki hatásukat. Az exotoxinok általában jó antigének. A hatásukra termelődött ellenanyagok (antitoxinok) a toxinmolekulákat közömbösítik. A specifikus sejtcsoportokhoz már kötődött toxinmolekulák azonban antitoxikus savó parenterális bevitelével nem semlegesíthetők. Az exotoxinok hosszabb ideig tartó állás vagy denaturáló- szerek, pl. 0,4 0,5%-os formalin hatására toxicitásukat elvesztik, immunogén sajátságukat azonban jórészt megtartják. Az ily módon kezelt toxin az anatoxin vagy toxoid. A toxicitás elvesztése feltehetően a molekulák toxikus csoportjain keresztül létrejövő dimerképződés következménye. Az anatoxinokat oltóanyagként aktív immunitás létesítésére használjuk. Endotoxinok. Az endotoxinok a Gram-negatív baktériumok sejtfalában levő lipopoliszacharid-komplexek, azonosak a baktériumok O-antigénjeivel. A lipopoliszacharid-komplex toxicitásáért a molekula szénhidrátkomponenséhez szorosan kapcsolódó foszfolipoid- (lipid-a-)frakció a felelős, a molekula teljes toxicitásához azonban a lipopoliszacharid-komplex integritása is szükséges. A Gram-negatív baktériumfajok sejtfalából speciális eljárásokkal kivonható endotoxinok molekulatömege D között változik. Az endotoxinok csupán a baktériumok feloldódása, szétesése után válnak szabaddá. A lipopoliszacharid-komplexek hőállók, a proteolitikus enzimek hatásának ellenállnak, formalinos kezeléssel nem alakíthatók átanatoxinná. A molekulakomplex toxicitásának a megszűnése egyúttal az antigénhatás megszűnését is jelenti. Az endotoxinok gyenge antigének. Hatásukra a szervezet antibakteriális ellenanyagokat termel, az endotoxint neutralizáló ellenanyagok azonban csak kis mennyiségben képződnek. Az endotoxinok jóval kevésbé mérgezők, mint az exotoxinok. Az egyes állatfajok endotoxinok iránti érzékenysége különböző. E. coli baktériumokból előállított endotoxin LD 50-értéke egérre nézve mg/kg, borjakra azonban 0,025 mg/kg. A különböző Gram-negatív baktériumokból előállított endotoxinok antigenitása egymástól különbözik, biológiai hatásuk azonban lényegében azonos. Az endotoxinok per os adva hatástalanok, a fertőződés helyén és a keringésbe bekerült, elpusztult, szétesett baktériumokból származó endotoxinok azonban jellegzetes tüneteket váltanak ki. Az endotoxinok néhány mg-os mennyiségben, iv. kísérleti állatokba fecskendezve a befecskendezést követő rövid időn belül lázat, izomremegést, fokozott légzést és szívműködést, hányást, hasmenést, majd a keringés egyensúlyának felborulása következtében sokkot és rendszerint elhullást idéznek elő. A kórbonctani képet az oedema és a gastrointestinalis rendszer haemorrhagiás elváltozásai uralják. Az élő és elölt Gram-negatív baktériumok a kísérleti állatokat ugyanazon tünetek és kórbonctani elváltozások mellett pusztítják el, a Gram-negatív baktériumok okozta betegségekben az elhullás végső oka tehát endotoxin okozta sokk. Az endotoxinok lázkeltő (pyrogen) hatásúak. A pyrogen hatás oka az endotoxinhatásra széteső leukocytákból kikerülő, fehérje természetű anyag, amely izgatja a hőközpontot. Subletalis endotoxinadagok ismételt befecskendezése az endotoxin sokkeltő hatásával szembeni tűrőképesség növekedését váltja ki. A tűrőképesség növekedése nem specifikus folyamat, valószínűen a bejutott endotoxin gyorsabb kiküszöbölésével áll kapcsolatban. Az endotoxin kis mennyisége fokozza a fertőzésekkel szembeni ellenálló képességet, növeli a RHS-sejtek (lásd később) aktivitását. A sterilen világra hozott és nevelt, csíramentes (germ free) állatok endotoxintűrő képessége a hagyományos módon nevelt állatokénak a többszöröse. A csíramentes állatok a normál egyedek számára letalis endotoxinadagokat is károsodás nélkül elviselik. A normál bélflóra kialakulása, vagy Gram-negatív baktériumokból előállított (endotoxintartalmú) oltóanyag befecskendezése a toleranciát megszünteti. Az endotoxin befecskendezésére létrejött válaszreakció tehát az élet folyamán szerzett endotoxin-túlérzékenység következménye és legalábbis részben allergiás jelenség. A fertőzött szervezetek megbetegedésében a kórokozó baktériumok faja és virulenciája, a szervezetbe jutás módja, a bejutott baktériumok mennyisége mellett döntő szerepet játszik a szervezet egyedi ellenálló képessége. Ennek megtárgyalása azonban már részben az immunológia, részben pedig az általános járványtan tárgykörébe tartozik. 62
83 2. fejezet - Részletes bakteriológia 1. A baktériumok rendszertana A magasabb rendű eukaryota szervezeteket filogenetikai alapon rendszerezzük. A prokaryota baktériumok törzsfejlődését azonban nem vagy alig ismerjük, így filogenetikai, természetes rendszerezésük sem lehetséges. Az élővilág tagjait két nagy csoportba soroljuk. A baktériumok, az algák egy részével együtt a prokaryoták, míg az összes többi valódi sejtmaggal rendelkező szervezet az eukaryoták (eukaryota egysejtűek, gombák, növények, állatok) világába tartozik. Az utóbbi néhány évtized genetikai vizsgálatainak eredményei alapján a baktériumokat is két nagy csoportba, a legősibb (Archeobacteria) és a valódi baktériumok (Eubacteria) csoportjába osztjuk. A kórtani szempontból fontos valamennyi baktérium az eubacteriumokhoz tartozik. A baktériumokat fenotípusos és genetikai tulajdonságaik együttes figyelembevételével osztályozzuk és soroljuk különféle rendszertani egységekbe, így törzsekbe (divisio), osztályokba (classis), ezeken belül rendekbe (ordo), családokba (familia), nemzetségekbe (genus) és fajokba (species). Egyes fajokon belül további csoportok, alfajok (subspecies), biotípusok, szerotípusok, fágtípusok stb. léteznek. A baktériumok faji meghatározására (identifikálására), legalábbis a klinikai mikrobiológiai gyakorlatban, elegendő a tenyésztési, morfológiai, biokémiai, szerológiai (antigénszerkezeti) és a kórtani (pathogenitási) sajátságok vizsgálata, míg a taxonómiai célú vizsgálatok során igen nagyszámú (akár több száz) tulajdonságot vizsgálunk, amelyeket azután számítógéppel elemezve hasonlítunk össze más rokon vagy távolabbi rendszertani kategóriába tartozó baktériumok sajátságaival (numerikus taxonómia). Ahhoz, hogy egy klinikai anyagból származó izolátumot azonosítani tudjunk, az első lépés a kérdéses kórokozó színtenyészetben való kitenyésztése (izolálása). Ezt követően megvizsgáljuk az adott izolátum legalapvetőbb sajátságait (alak, Gram-festés, mozgásképesség, aerob vagy anaerob növekedés, kataláz- és oxidázpróba, és a szénhidrátbontás típusának a vizsgálata, OF-próba). Ezek a vizsgálatok (primer tesztek), kevés kivételtől eltekintve, lehetővé teszik legalább az adott baktérium nemzetségének a meghatározását, majd ha szükséges, a további biokémiai, szerológiai, kórtani stb. tulajdonságok alapján meg tudjuk határozni az adott kórokozó faját is. Az azonos vagy egymáshoz nagyon hasonló tulajdonságú baktériumok összességét tekintjük fajnak. Mivel az egyes baktériumok rokonsági foka a filogenezisre vonatkozó ismereteink hiányosságai miatt a fajok túlnyomó többségében csak a jelenleg élő változatok tulajdonságainak a vizsgálata alapján állapítható meg, a nemzetség és a faj az a két legmagasabb rendszertani kategória, amely a baktériumok feno- és genotípusának vizsgálata alapján még több-kevesebb pontossággal meghatározható. Minél magasabb rendszertani egységről van szó, az együvé tartozás kritériumai annál bizonytalanabbak. A baktériumok mai legáltalánosabban elfogadott osztályozását és nómenklatúráját a Bergey s Manual of Systematic Bacteriology 1984 és 1989 között megjelent négy kötete, továbbá a Bergey s Manual of Determinative Bacteriology 9. kiadása (1994) tartalmazza. A baktériumok rendszertanára és nómenklatúrájára vonatkozó legújabb eredmények pedig az International Journal of Systematic Bacteriology című szakfolyóiratban követhetők nyomon. A továbbiakban megelégszünk az állatorvosi szempontból fontos (pathogen) baktériumfajok ismertetésével. Az egyes fajok ismertetésekor elsősorban a klinikai mikrobiológia igényeit vettük figyelembe, a taxonómiai vonatkozásokból pedig csak annyit vettünk át, amennyit az érthetőség megkívánt Bacillus Pálcika alakú, Gram-pozitív, aerob spórás, a B. anthracistól eltekintve csillós baktériumok. Természetes előfordulási helyük, a B. anthracis kivételével, a talaj, de megtalálhatók a levegőben, a természetes vizekben, a növényzeten, valamint az ember és az állatok bőrén és bélcsatornájában is. A nemzetségbe számos faj tartozik, közülük legnagyobb jelentősége a B. anthracisnak van, amely a lépfene okozója. Néhány fajuk pathogen az ízeltlábúakra nézve, túlnyomó többségük azonban saprophyta. Az utóbbiak közül egyesek antibiotikumokat termelnek Bacillus anthracis Morfológia. Csilló nélküli, 4 5 µm hosszú,1 1,2 µm vastag pálcák, amelyek hosszabb-rövidebb, bambusznádra emlékeztető láncokat képeznek. Az állati testben vastag burok veszi körül (26. ábra). A kenetet karbolvizes toluidinkékkel megfestve a cytoplasma kék, a burok rózsaszínű (metakrómás festődés). Spórája ovális alakú, 63
84 Részletes bakteriológia centrálisan helyeződik. Az élő szervezetben spóra nem képződik, mivel a spórásodáshoz levegő, legalább 15 C hőmérséklet és nedvesség szükséges. 26. ábra - Bacillus anthracis egér lépében (tolridiukékkel festve, 1250 ) Tenyésztés. Közönséges agaron is jól szaporodik, legjobban testhőmérsékleten. Az állati testből kitenyésztett virulens törzsek, ha a tenyésztést levegőn végeztük, 2 3 mm átmérőjű, hajfonatszerű, száraz R-telepeket képeznek, 5 10% CO 2-ot is tartalmazó légtérben tenyésztve azonban a lépfenebacilusok burkosak, ennek megfelelően nyálkás, S-telepeket alkotnak. Véresagaron nem okoznak típusos hemolízist, de 2 3 napos telepeik alatt a táptalaj feltisztul, zöldessárga színű lesz. Közönséges levesben a virulens lépfenebacilusok vattaszerű üledéket képeznek. A lépfenebacilusok virulenciájukat mind természetes viszonyok között, mind tenyészeteikben mutáció útján elveszíthetik. A buroktermelő képességüket elvesztett, de egérben még toxikus oedemát okozó törzseket (pl. a Sterne-féle F32 törzset) oltóanyanyag előállítására használjuk. Biokémiai sajátságok. Hasonlóan a nemzetség saprophyta tagjainak többségéhez, a B. anthracis katalázpozitív, a nitrátokat nitritté redukálja, a zselatint és a kazeint elfolyósítja, lecitinázt termel, glükózból oxidatív úton savat képez. Antigénszerkezet. A lépfenebacilusok burokanyaga hőérzékeny glutaminsav polipeptid, amely megtalálható néhány saprophyta fajban (pl. a B. subtilisben, a B. megateriumban) is. Sejtfalukban található egy típusspecifikus poliszacharid (haptén), egyes törzsek azonban tartalmaznak egy további haptént, amely megtalálható a B. cereus törzsekben is. Vágóhídról származó vizsgálati anyagok, bőrök, erősen rothadt hullarészek lépfenével való fertőzöttségének kiderítésére szolgál az Ascoli-féle termoprecipitációs próba, amely a lépfenebacilusok poliszacharid hapténjének kimutatásán alapul. A lépfenebacilusok a pathogenitás szolgálatában álló, antigén hatású, oedemafaktornak, letalis faktornak és protektív antigénnek nevezett anyagokat (toxinokat) termelnek. Ez utóbbival szemben előállított hiperimmun vérsavóval a lépfenefertőzés kivédhető, a másik két faktorral szemben termelt ellenanyagoknak azonban védőhatása nincs. Ellenálló képesség. A nem spórás lépfenebacilusok kevésbé ellenállók. A felbontatlan hullában, rothadás következtében, 4 5 napon belül elpusztulnak. Hő hatására C-on 15 perc alatt tönkremennek, spóráik azonban igen ellenállók. Ha a hullában vagy kényszervágott állatokban levő bacilusoknak módjuk volt 64
85 Részletes bakteriológia spórásodni, a földbe került spórák évtizedekig megőrzik fertőzőképességüket. A spórák is elpusztíthatók azonban 5 10 perces forralással vagy 8 10%-os formalinban óra alatt. Pathogenitás. A lépfenebacilusok természetes viszonyok között megbetegítik a házi és vadon élő növényevőket, de fogékony irántuk a legtöbb emlős, így az ember is. A burkos lépfenebacilusok parenterális fertőzés után az egeret, a tengerimalacot és a nyulat 1 3 nap alatt septikaemiában elpusztítják. A buroktermelő képességüket elvesztett mutánsok egerek bőre alá oltva legfeljebb toxikus oedemát okoznak, vagy az egereket meg sem betegítik A Bacillus nemzetség gyakoribb saprophyta tagjai A természetben a Bacillus nemzetség saprophyta tagjai, így a B. subtilis, a B. megaterium, a B. cereus stb. igen elterjedtek. Különböznek a virulens lépfenebacilustól abban, hogy csillósak, így élénken mozognak, egyikmásik fajuk (pl. a B. subtilis, a B. megaterium) levegőn tenyésztve is képez burkot, véresagaron egyes fajok erős hemolízist okoznak (pl. a B. cereus), továbbá ellentétben a lépfenebacilusokkal a kísérleti állatokat nem pusztítják el. Bár a B. cereus saprophyta, egyes törzsei földdel szennyezett élelmiszerekben elszaporodva hányással és hasmenéssel járó ételmérgezést idézhetnek elő. Az ételmérgezés előidézésében a törzsek termelte hemolizin, egy letalisnak nevezett toxin, foszfolipáz enzim és valószínűleg egy fehérje természetű enterotoxin játszik szerepet. A B. thüringiensis, és a B. larvae biokémiai sajátságaikat tekintve közel állnak a B. cereushoz. A B. thüringiesist igénybe veszik az ízeltlábúak elleni biológiai védekezésben, míg a B. larvae a mézelő méh nyúlós (amerikai) költésrothadásának az okozója. A Bacillus nemzetség egyes tagjai különféle antibiotikumot is termelnek. A B. licheniformis termeli a bacitracinokat, a B. polymyxa törzsei pedig a polimixineket. A bacitracin gyűrűs hexapeptid, főleg a Grampozitív baktériumokra hat. A polimixinek ugyancsak ciklikus oligopeptidek. Ezek hatékonyak a legtöbb Gramnegatív baktériumfaj, köztük a Pseudomonas törzsekkel szemben Clostridium A Clostridium fajok Gram-pozitív, anaerob, pálcika alakú, spórás baktériumok. Természetes előfordulási helyük a talaj, de többségük megtelepszik az ember és az állatok bélcsatornájában is. Ez ideig mintegy 100 fajuk ismert. Nagyfokú biokémiai aktivitásuk folytán jelentős szerepük van a talajba került szerves anyagok lebontásában. Morfológia. Nagyméretű, vaskos pálcák, hosszúságuk elérheti a 7 10 µm-t, vastagságuk az 1 2 µm-t. A mikroszkópos kenetben általában egyesével vagy szabálytalan halmazokban láthatók, egyikük-másikuk azonban hosszú fonalakat is képez. Valamennyien spórások, a spórák átmérője meghaladja a baktériumtest harántátmérőjét. A spóraképzés optimális feltételei fajonként változnak. A C. perfringens csak enyhén lúgos közegben spórásodik, ezért ha a táptalaj szénhidrátokat is tartalmaz, a spórásodás rendszerint elmarad. Ha a spóra centrális helyeződésű, orsó alak (clostridium), ha pedig terminális vagy szubterminális helyeződésű, dobverő vagy evező alak (plectridium) jön létre. A spóra lehet gömb vagy ovális alakú. A spórák helyeződése és alakja támpontot ad az ide tartozó fajok identifikálásához. Az állatorvosi szempontból fontos fajok körülcsillósak, kivéve a C. perfringenst, amelynek csillója nincs, viszont a szövetek között szaporodva rendszerint burkot képez. Fiatal, 1 2 napos tenyészeteikben valamennyi Clostridium Gram-pozitív, megfesthetők azonban fukszinnal vagy más festékkel is. Tenyésztés. Anaerobok, tenyésztésükre tápanyagokban gazdag, kis (< 110 mv) redoxipotenciálú táptalajokat használunk. Más baktériumokkal szennyezett anyagokból a mintákat a kioltás előtt 10 percig 80 C-on hevítve szelektíven izolálhatók. Általában 37 C-on tenyésztjük őket, a C. perfringens szaporodásának optimális hőmérséklete azonban C, a saprophyta C. putrefaciens viszont hidegkedvelő, 30 C felett nem szaporodik. Jelentős különbségek vannak az egyes fajok oxigéntűrő képességében is. A C. novyi B típusa, továbbá a C. tetani már 0,05% oxigén jelenlétében sem indul szaporodásnak, a C. histolyticum viszont csökkentett oxigénnyomás mellett is szaporodik. Tenyésztésükre szilárd és folyékony táptalajok egyaránt alkalmasak. A folyékony táptalajok közül a főtt húst (Holman), a májdarabkákat (Tarozzi) vagy agypépet (Hibler) tartalmazó anaerob levesekben egyenletes zavarosodást okoznak, a táptalajban levő szénhidrátokból nagy mennyiségű gázt és különféle szerves savakat, 65
86 Részletes bakteriológia alkoholokat stb. képeznek. A proteolítikus enzimeket termelő fajok (pl. a C. histolyticum, a C. botulinum és a C. tetani) az agypépet megfeketítik, miközben igen bűzös anyagok keletkeznek. A szilárd táptalajok közül a fajok többségének tenyésztésére alkalmas a közönséges agar, sokkal jobban szaporodnak azonban glükózt is tartalmazó véresagaron. A pathogen fajok többsége véresagaron hemolízist okoz. Biokémiai sajátságok. Többségük biokémiailag igen aktív, kataláz-negatívak, szénhidrátbontásuk fermentatív. A pathogen fajok (a C. histolyticum és a C. tetani kivételével) glükózt és számos más szénhidrátot is elbontanak, többféle extracelluláris enzimet és igen erős hatású exotoxinokat termelnek, ezenkívül a fajok egy része proteolítikus hatású (1. táblázat). Ellenálló képesség. Spóráik igen ellenállóak. Természetes viszonyok között beszáradt váladékokban, szövetnedvekben évekig életképesek maradnak. A C. botulinum spórái pl. 3 4 órás forralást is elviselnek, a C. perfringens spórái azonban 5 10 perces forralás hatására rendszerint elpusztulnak. Hőlég-sterilizátorban vagy autoklávban való kezeléssel azonban a Clostridium spórák is elpusztíthatók. A fertőtlenítőszerek közül a spórák elpusztítására 8%-os formalin vehető igénybe legalább 2 órás behatási idővel. 1. táblázat - Egyes Clostridium fajok morfológiai és biokémiai sajátságai Megnevezés C. chauv oei C. spetic um C. nov yi A-B C. histolytic um C. perfring ens C. teta ni C. botulin um A-F C. colinu m Spóraalak O O O O O K O O Spórahelyeződé s ST ST ST ST ST T ST ST Mozgás Hemolízis / NO 3 NO 2 + k +/ Zselatinelfolyós ítás Lecitináz + + Lipáz +/ + Glükóz Laktóz Szacharóz + + /+ + O: ovális, ST: szubterminalis, K: kerek, T: terminalis Pathogenitás. Többségük természetes lakója az ember és az állatok bélcsatornájának, s betegséget csak akkor idéznek elő, ha a bélcsatornából vagy a talajból valamilyen okból (roncsolt, elhalt) szövetek közé jutnak, s ott elszaporodnak, vagy ha a bélcsatornából toxinjaiknak módjuk van felszívódni. 66
87 Részletes bakteriológia Az általuk okozott betegségek állatról állatra nem terjednek, rendszerint sebfertőzéshez társuló, gázoedemás betegségek (gázgangraena), enterotoxaemia vagy intoxicatio formájában zajlanak le. A gázoedemás betegségek esetén a toxicitást kiegészíti a kórokozók extracelluláris enzimjeinek és erős szénhidrátbontó képességének a lokális hatása. A fertőzött szövetek oedemássá válnak, elhalnak, s a szénhidrátokból és fehérjékből keletkező szerves savak és gázok miatt tapintásra sercegnek (gázoedema). A gázoedemát okozó baktériumok közül a háziállatok rosszindulatú vizenyőjének az előidézésében a C. septicum, a C. novyi és a C. histolyticum játszik elsősorban szerepet. A betegséget létrehozhatják azonban más, alkalomadtán a szövetekbe kerülő Clostridium fajok is (C. perfringens, C. sordellii stb.). A sercegő üszök okozója a C. chauvoei (C. feseri). A C. perfringens törzsek a háziállatokban enterotoxaemiákat okoznak. A C. colinum fürjben, csirkében okoz fekélyes bélgyulladást. A C. tetani a tetanus (merevgörcs), a C. botulinum pedig a botulismus (kolbászmérgezés) okozója. A saprophyta Clostridium fajok közül a C. putrefaciens a rothadásos folyamatokban való részvétele miatt érdemel figyelmet, más saprophytákat pedig ipari célra használnak (pl. C. butyricum). A saprophyták alkalmanként a kórokozó fajokkal együtt szennyező mikrobákként bejuthatnak a szövetek közé is Clostridium septicum Közönséges és véresagaron egyaránt nő. Telepei laposak, szabálytalan alakúak, szélük felrostozott. Nedves agar felületén a telepek hamar összefolynak. Leves táptalajban erőteljes gázfejlődést indít meg. Legalább négyféle toxint termel. Fő toxinja a letalis, necrotizáló és hemolizáló sajátságú alfa-toxin. További toxinjai közül kettő extracelluláris enzim (dezoxiribonukleáz és hialuronidáz), egy pedig hemolizin. A szövetek közé jutva az összes házi emlősállatot megbetegíti, a madarakban alkalmanként gangraenás dermatitist okoz. A laboratóriumi kísérleti állatok közül legfogékonyabb iránta a tengerimalac, amelyben a spóratartalmú anyag izomba történő fecskendezését követően óra alatt halálra vezető gázoedema fejlődik ki. A befecskendezés körül az izomzat és a kötőszövet savósan, véresen beivódik, az elváltozott szövetek avasvaj-szagúak, gázhólyagokat tartalmaznak. Az elhullott tengerimalacok hashártyájáról vett lenyomati készítményben a kórokozó gyakran hosszú fonalak formájában látható (27. ábra). 27. ábra - Clostridium septicum fonalai tengerimalac hashártyájáról készített kenetben (fukszinnal festve, 1250 ) 67
88 Részletes bakteriológia Clostridium novyi Morfológiailag hasonlít a C. septicumhoz, de annál valamivel vaskosabb, telepei zártabbak. Nehezen tenyészthető, az oxigénnyomok iránt is érzékeny. Tenyésztési optimuma 45 C. Levestenyészeteiben legalább nyolcféle (letális, necroticus, hemolitikus stb. hatású) toxint termel. A toxinok egy része extracelluláris enzim (lipáz, lecitináz). A toxinok antigenitása és biológiai hatása alapján a C. novyinak A, B és C típusa különböztethető meg. A C. novyi A azonosnak tekinthető a korábban C. oedematiensnek nevezett fajjal, a B típus pedig a C. gigasszal. A C típus toxinokat nem termel. Pathogenitásuk megegyezik a C. septicuméval, az A és B típus gázoedemás betegséget idéz elő, a B típus ezenkívül főleg juhokban fertőző elhalásos májgyulladást is okoz. Spóratartalmú anyagot tengerimalac bőre alá fecskendezve a kialakuló gázoedemás elváltozások azonosak a C. septicum által előidézettel, de nem véres, hanem csupán oedemás jellegűek, s kevés gázbuborékot tartalmaznak Clostridium haemolyticum Tulajdonságai megegyeznek a C. novyiéval, korábban az előbbi egyik (D) típusának tekintették. A szarvasmarha ún. bacilusos vérfestékvizelését idézi elő Clostridium histolyticum Véresagaron aerob, mikroaerofil viszonyok között is szaporítható, de ilyenkor spórát nem képez. Biokémiai tulajdonságaira jellemző, hogy a szénhidrátokat nem bontja, viszont igen erős proteolítikus hatású, levestenyészeteiben legalább ötféle toxint termel. Az alfa-toxin letalis és necrotizáló hatású, immunológiailag azonos a C. septicum alfa-toxinjával. A béta-, gamma- és delta-toxinok extracelluláris enzimek (kollagenáz, proteáz, elasztáz). Az epszilon-toxin oxigénre érzékeny hemolizin. Valamennyi házi emlősállatban előidézhet rosszindulatú vizenyőt. Tengerimalacba oltva az erős proteolítikus hatás miatt az oltás helyén a szövetek véresen beivódnak, elhalnak, majd elfolyósodnak (hisztolízis). 68
89 Részletes bakteriológia Clostridium chauvoei Morfológiai tulajdonságait illetően igen hasonló a C. septicuméhoz, fonalakat azonban nem képez. Közönséges agaron nem indul fejlődésnek, véresagaron erősebb hemolízist okoz, mint a C. septicum. Folyékony táptalajokban erős gázképződést okoz és többféle toxint termel. Az alfa-toxin letalis, necrotizáló és hemolitikus, antigenitás tekintetében rokon a C. septicum alfa-toxinjával. A béta-toxin dezoxiribonukleáz, a gamma-toxin hialuronidáz, a delta-toxin hemolizin. Levestenyészeteiben ezenkívül még hőlabilis protektív antigének is találhatók. A C. chauvoei főleg kérődzőkben okoz betegséget (sercegő üszök), megbetegíthet azonban egyéb állatfajokat is. A laboratóriumi kísérleti állatok közül a tengerimalac érzékeny, de ellentétben a C. septicummal, az egér, a patkány és a nyúl rezisztens a C. chauvoeivel szemben. Spóratartalmú anyagot tengerimalacba oltva ugyanolyan gázoedemás betegség alakul ki, mint C. septicum fertőzés hatására. A rosszindulatú vizenyő és a sercegő üszök megelőzésére a betegséget előidéző kórokozók formalinnal kezelt levestenyészeteinek szűrletét (anakultúrát) vagy tisztított toxoidokat tartalmazó vakcinákat használunk. A rosszindulatú vizenyő kórokozóinak elkülönítése. A rosszindulatú vizenyő kórokozóinak egymástól, a C. chauvoeitól, más pathogen és egyes társfertőzőként előforduló saprophyta fajoktól való megkülönböztetése meglehetősen nehéz. Az elkülönítésre felhasználhatók a fajokat jellemző mikroszkópos, tenyésztési és biokémiai sajátságok, továbbá az immunfluoreszcencia (IF) és a kísérletiállat-oltás. Bár a különböző Clostridium fajok sejtfalantigénjei és exotoxinjai gyakran szoros antigénszerkezeti rokonságot mutatnak s sejtfalantigénjeik alapján egy-egy faj is rendszerint több csoportra osztható, a fontosabb pathogen fajokkal szemben mégis olyan antibakteriális, kimerített IF-savók állíthatók elő, amelyek alapján az identifikálás megbízhatóan elvégezhető. Különböző fluoreszcens festékekkel jelzett savókkal a C. septicum, a C. chauvoei és más fajok, eltérő színű fluoreszkálásuk alapján, még kevert tenyészetben is elkülöníthetők egymástól. Specifikus, antitoxikus hiperimmun savókkal állatkísérletet is végezhetünk az identifikálás céljából. A homológ immunsavóval kezelt tengerimalacok a kísérleti fertőzést túlélik (toxinsemlegesítési próba) Clostridium perfringens A pathogen Clostridium fajok közül az egyetlen, amely nem csillós, az állati testben és néha tenyészeteiben is burkot képez. Közönséges agaron lapos, szürkésfehér, kerek vagy csipkézett szélű telepekben nő. Telepei véresagaron nagyobbak, körülöttük szennyesbarna színű, vérsejtoldódásos udvar keletkezik. Hőmérsékleti optimuma C között van, amit felhasználhatunk szelektív izolálására. Nehezen, csak szénhidrátoktól mentes táptalajokban spórásodik. Biokémiailag igen aktív, sokféle szénhidrátot bont, ennek megfelelően tenyészeteiben igen erős gázképződést okoz. Szulfitokat és vasat tartalmazó táptalajokban a szulfitok redukciója miatt feketít. Levestenyészeteiben különféle toxinokat termel. Legalább 12 féle toxinja ismert. Valamennyi toxin fehérje, többségük extracelluláris enzim. A főbb toxinok alapján a C. perfringens törzsek öt típusba sorolhatók (2. táblázat). A főtoxinok közül az alfa toxin foszfolipáz C, a sejtek membránját károsítja. A béta-toxin tripszinre érzékeny, kb Da molekulatömegű peptid, a vérerek átjárhatóságát fokozza, lokális gyulladást és elhalást okoz. Az epszilon- és a iota-toxinok inaktív prototoxinok formájában képződnek, amelyeket proteolítikus enzimek (tripszin) aktiválnak. Mindkét toxin a vérerek átjárhatóságát fokozza, oedemát okoz, amely végül elhaláshoz vezet. 2. táblázat - A C. perfringens fontosabb toxinjai és az okozott kórképek Fő toxinok Mellékes toxinok Típu s Kórkép Alfaletali s, necrotizál ó, lecitináz Bétaletali s, necrotizál ó Epszilonleta lis, necrotizáló Iotaletali s, necrotizá ló Gamm a- Deltaletali s, hemolitik us Théta- Kappa- Lambda - proteiná z Mű- hialuronid áz 69
90 Részletes bakteriológia letalis hemolitik us kollegen áz A Emberi gázgangraen a, B ételmérgezés Bárányvérha s Juh: struck, C D E necroticus enteritis malacban, csirkében, emberben Juh (szm, kecske): enterotoxaem ia Patogenitása nem bizonyított : minden törzs termeli ++: a törzsek többsége termeli +: csak egyes törzsek termelik -: egyetlen törzs sem termeli A típusok elkülönítése. A típusok toxinneutralizációs próbával különböztethetők meg egymástól. Fehér egerek a törzsek toxintartalmú levestenyészeteinek szűrletével iv. vagy hasüregbe oltva toxaemiában hamarosan elpusztulnak, de életben maradnak, ha előzetesen megfelelő antitoxintartalmú hiperimmun savóval összekeverve fél óráig 37 C-on tartjuk, és ezután fecskendezzük be. A C. perfringens törzsek parenteralisan kísérleti állatokba fecskendezve gázoedemás elváltozásokat idéznek elő. A C. perfringens A törzsek természetes előfordulási helye a talaj, a B, C, D és E törzsek viszont főleg a bélcsőben élnek, a talajban csak átmenetileg találhatók meg. A C. perfringens törzsek a háziállatokban enterotoxaemiákat idéznek elő (2. táblázat). 70
91 Részletes bakteriológia A C. perfringens A, de ritkán egyes C és D típusok is termelnek egy enterotoxint, amely a spórák bélcsatornában való kicsírázásakor képződik, s az emésztőcsatornában folyadékfelhalmozódást s ennek következményeként emberben hasmenéssel járó ételmérgezést idézhet elő. A C. perfringens okozta betegségek aktív immunizálással való megelőzésére a megfelelő típusból készült anakultúrát vagy az egyes tisztított toxinféleségeket anatoxin formájában tartalmazó vakcinákat használjuk Clostridium colinum Izolálása nehéz, erre a célra ló vérsavót is tartalmazó triptóz-foszfát-glükóz agar a legalkalmasabb. Nehezen spórásodik. Szemben a többi pathogen Clostridiummal a zselatint nem bontja el. Fürjben, csirkében a vastagbél kifekélyesedésével járó bélgyulladást okoz Clostridium tetani Szigorúan anaerob, spórája terminális helyeződésű, amely a baktériumtestet kidomborítja, teniszütő alakúvá teszi (28. ábra). Telepei igen finomak, laposak, jégvirágra emlékeztetnek, nedves agar felületén rajzanak. Véresagaron hemolízist okoznak. A szénhidrátokat nem bontja. Gyenge proteolítikus hatású, a levesben levő izomdarabkákat lassan emészti. Levestenyészeteiben egy hemolízist okozó és egy igen erős hatású neurotoxint (tetanustoxint) termel. A C. tetani iránt valamennyi emlősfaj fogékony, beleértve az embert is. A toxin a fertőzött sebekből felszívódva főleg a gerincvelő motoros sejtjeire hat. Formalinnal kezelve anatoxinná (toxoiddá) alakítható. A tetanusanatoxint oltóanyagként aktív immunitás létesítésére használjuk. 28. ábra - Clostridium tetani levestenyészetből, spórák és vegetatív alakok (Gram-festés, 1250 ) A toxintermelő törzsek levestenyészetének akár sokmilliószorosan hígított szűrletét bőr alá oltva az egerek merevgörcs tünetei között pusztulnak el. A toxicitás antitoxikus savó egyidejű adagolásával kivédhető. Spóratartalmú anyagoknak bőr alá fecskendezése néhány nap alatt ugyancsak az egerek pusztulására vezet Clostridium botulinum 71
92 Részletes bakteriológia Nagyméretű pálca, spórája többnyire az egyik pólus közelében helyeződik (29. ábra). Telepei szilárd táptalajokon szabálytalan kör alakúak, laposak, szélük egyenetlen, felületük szemcsés. Levestenyészetekben nagymennyiségű gázt és különféle toxinokat termelnek. 29. ábra - Clostridium botulinum levestenyészetből (Gram-festés, 1250 ) Biokémiailag a törzsek nem egységesek, egy részük elbontja a fehérjéket, miközben igen bűzös gázok keletkeznek, a törzsek másik része azonban nem proteolítikus. A termelt toxinok alapján a törzsek hét (A, B, C, D, E, F, G) típusba sorolhatók. A C. botulinum különböző típusainak a toxinjai emberben, lóban, szarvasmarhában, tenyésztett prémesállatokban és különösen gyakran házi- és vadon élő vízimadarakban (főként vadkacsákban) idéznek elő betegséget. A C. botulinum talajlakó, az A, B, E és F típusok, toxinjai főként az embert betegítik meg. Nálunk emberben az E típus okozta botulismus a leggyakoribb. A C és D típus a talajon kívül megtalálható az állatok (főleg a madarak) bélcsövében is, állatokban csaknem kivétel nélkül ezek idéznek elő botulismust. A C. botulinum C és D típusaiban a toxinképzést fág kódolja. A G típus ugyancsak talajlakó, de toxint csak kis mennyiségben termel. A botulismust nem maga a baktérium, hanem a földdel szennyezett élelmiszerekben (kolbászban, disznósajtban, hús- és növényi konzervekben stb.), rosszul elkészített szilázsokban, rothadt tápokban, ízeltlábúak álcáiban, állatok hulláiban, kivételesen sebekben, anaerob viszonyok között elszaporodott baktériumok toxinjai hozzák létre. A C. botulinum-toxinok különböző molekulatömegű fehérjék. A toxinok antigénhatása különböző, biológiai hatásuk azonban azonos. Hőérzékenységük C között változik. Az A és F toxinokat a tripszin aktiválja. A toxinok a bélből felszívódnak, a myoneuralis synapsisokra hatnak. A C. botulinum-toxinok kimutathatók, ha a toxintartalmú levestenyészetekkel vagy a gyanús takarmányokból (élelmiszerekből) készített vizes kivonatokkal intraperitonealisan, nagyobb mennyiségű toxin esetén per os fehér egereket vagy tengerimalacokat oltunk. A kísérleti állatok a toxinok hatására elerőtlenednek és petyhüdt bénulás tünetei között elhullanak Clostridium piliforme 72
93 Részletes bakteriológia A C. piliforme (korábban Bacillus piliformis) intracellularisan, a fertőzött állatok vakbelének a hámsejtjeiben és a májsejtekben szaporodó, 5 10 µm hosszú, pálcika alakú, spórás, csillós baktérium. Szöveti metszetekben többnyire Gram-negatívan festődik. A bakteriológiában szokásos táptalajokon nem, egérfibroblast-, továbbá májsejt-tenyészetekben, valamint embrionált tojásban azonban szaporítható. A bélsárral ürülő spórái az alomban több mint egy évig életképesek maradnak. Monoklonális ellenanyagokkal a C. piliforme törzsek legalább hat, antigénszerkezetileg egymástól különböző csoportba oszthatók. A C. piliforme főleg rágcsálókban (egérben, patkányban, tengerimalacban, nyúlban stb.), továbbá kutyában, macskában, csikóban és néhány más állatfajban okoz vízszerű vagy véres hasmenéssel, gócos májelhalással és szívizomgyulladással járó (Tyzzer-féle) betegséget Staphylococcus A staphylococcusok Gram-pozitív, gömb alakú baktériumok. Megtalálhatók az ember és az állatok bőrén, a felső légutakban, a nemi szervek és húgyutak nyálkahártyáján, az emésztőcsatornában, bizonyos fajok előfordulnak a tejben, tejtermékekben, más élelmiszerekben, de a természetes vizekben, talajban és a növényzeten is. Morfológia. Átlagosan 1 µm átmérőjű, szabályos gömb vagy kissé ovális alakú baktériumok. A mikroszkópos képben gyakran szőlőfürtszerű (staphyli = szőlőfürt) halmazok formájában láthatók (30. ábra). Csillójuk, spórájuk nincs, burkot nem képeznek. 30. ábra - Staphylococcus aureus agartenyészetből (Gram-festés, 1250 ) Tenyésztés. Igénytelen, aerob, fakultatív anaerob baktériumok. Közönséges agaron, 37 C-on tenyésztve, 1 3 mm átmérőjű, kerek, fénylő, domború, vaj konzisztenciájú telepeket képeznek. 37 C-on is, de még inkább szobahőn való néhány napos állás után a fajok egy része sárga, vörös vagy fehér karotinoid pigmenteket termel. Véresagaron a pathogen törzsek rendszerint erős hemolízist okoznak. A közönséges levest egyenletesen megzavarosítják. Szelektív tenyésztésükre, sótűrésük alapján, felhasználható a 10% konyhasót, mannitot és fenolvöröst tartalmazó agar. A mannitot bontó Staphylococcus törzsek körül a táptalaj megsárgul. A nátrium- 73
94 Részletes bakteriológia telluritot, glicint, piroszőlősavat és tojássárgáját tartalmazó táptalajon a Staphylococcus telepek a telluritredukció miatt feketék. Biokémiai sajátságok. Aerobok, fakultatív anaerobok, kataláz-pozitívak. Az előbbi tulajdonságaik alapján elkülöníthetők a Micrococcus, az utóbbi alapján a pedig a Streptococcus fajoktól. A Staphylococcus nemzetségbe ma már több mint 30 faj tartozik. Fajokba sorolásuk, szénhidrátbontásuk, hemolizáló képességük, extracelluláris enzimjeik vizsgálata és néhány egyéb sajátságuk alapján történik. A nagyszámú faj közül kórtani szempontból fontosak a koaguláz-pozitív fajok, így a S. aureus, a S. aureus subsp. anaerobius (korábban Micrococcus abscedens ovis), a S. intermedius és néhány egyéb újonnan leírt, de jelentőségét tekintve még alig ismert faj. A koaguláz-negatív fajok túlnyomó többsége saprophyta, egyes fajok azonban, így pl. a S. hyicus, a S. epidermidis, a S. gallinarum, a S. equinum, a S. haemolyticus, a S. felis bőrgyulladást, helyi gennyesedéseket stb. idézhetnek elő. A pathogen S. aureus törzsek, azonkívül, hogy koaguláz-pozitívok, véresagaron erős hemolízist okoznak, elbontják a mannitot és számos extracelluláris enzimet, így fibrinolizint, alkalikus foszfatázt és nukleázokat is termelnek (3. táblázat). A S. hyicus törzsek egy része képes koagulázt termelni. A S. aureus subsp. anaerobius elkülöníthető a S. aureustól, egyebek mellett azon az alapon, hogy anaerob, nem termel karotinoid pigmenteket, kataláz-negatív és nem redukálja a nitrátot. 3. táblázat - Az állatokban gyakran előforduló Staphylococcus fajok biokémiai sajátságai Fajok Hemolí zis Koagul áz Hialuroni dáz Foszfat áz Dezoxiribonuk leáz Aceto in Mann it Szachar óz Trehal óz S. aureus S. intermedi us S. hycius subsp. hyicus S. hyicus subsp. chromoge nes S. epidermid is S. saprophyti cus S. gallinaru m k k + + k k k + + k nv. + k + + k + nv k: különböző típusok nv.: nem vizsgált 74
95 Részletes bakteriológia A bizonyos gazdákon (ember, sertés és baromfi, szarvasmarha és juh, nyúl, valamint kutya és ló) élő S. aureus törzsek fágérzékenységük, koagulázuk típusa, kristályibolya-felvétele és néhány más tulajdonság alapján egymástól megkülönböztethetők és 5 biotípusba (A, B, C, D, E) sorolhatók. Bár az egyes biotípusok többnyire a nekik megfelelő gazdákból izolálhatók, az emberben előforduló törzsek okozhatnak mastitist szarvasmarhában, megtelepedhetnek lóban, kutyában stb., és az állatokban előforduló törzsek is alkalmanként megtelepedhetnek emberben is. A S. aureus törzsek pathogenitása extracelluláris enzimek és különféle toxinok termelésén alapul. A pathogen törzsek termelnek koagulázt, fibrinolizint, hialuronidázt, hőstabil dezoxiribonukleázt, ezenkívül lipázokat, zselatin- és kazeinbontó enzimeket is. Toxinjaik hemolizinek, leukocydinek és enterotoxinok. A hemolizinek (alfa, béta, gamma és delta) hőlabilis exotoxinok (citolizinek), amelyek a különféle állatok vörösvérsejtjeit feloldják. Az alfa-hemolizin Da molekulatömegű fehérje, feloldja a nyúl és a juh vörösvérsejtjeit, citotoxikus, dermonecroticus hatású, iv. befecskendezve a kísérleti állatokat megöli. Az alfa-toxin okozza elsősorban a fertőzés helyén kialakuló szövetkárosodást. A béta-hemolizin kb Da molekulatömegű fehérje, extracelluláris enzim, főleg a szarvasmarha és a juh vörösvérsejtjeit oldja, citotoxikus a leukocytákra és a macrophagokra. A delta-hemolizin ugyancsak fehérje, citotoxikus, a sejtek membránját teszi tönkre. A gammahemolizin két komponensből áll, citotoxikus, sok állatfaj vörösvérsejtjét oldja, főleg a S. epidermidis törzsek termelik. A különféle állatfajokból izolált Staphylococcus törzsek az egyes hemolizineket eltérő mennyiségben termelik. Az alfa- és béta-toxinokat toxoiddá alakítva és kísérleti állatoknak befecskendezve részleges védettség volt előidézhető a Staphylococcus okozta tőgygyulladásokkal szemben. A leukocydin két fehérjekomponensből összetevődő toxikus anyag, amely az ember és a nyúl leukocytáinak és macrophagjainak cytoplasmamembránját károsítja. Egyes humán eredetű Staphylococcus törzsek termelnek bőrelhalást okozó dermo- (exfoliatív) toxinokat is. Kétféle toxin ismert, mindkettő fehérje, molekulatömegük D körüli, a bőr stratum germinativumának a sejtjeit teszik tönkre. Enterotoxinokat főleg egyes humán eredetű, illetve élelmiszermintákból származó törzsek termelnek. Kis ( Da) molekulatömegű, hőstabil fehérjék, per os bejutva hányást, hasmenést okoznak. A toxinoknak ez ideig hat (A F) típusa ismert. A S. aureus törzsek csaknem mindegyike hordoz a felületén egy protein-a-nak nevezett fehérjét, amely virulenciafaktornak tekinthető. A protein-a képes az Fc komponensen keresztül immunglobulinokat megkötni. Emiatt a S. aureus törzseket gyakran használjuk koagglutinációs próbához. A staphylococcusokhoz kötött specifikus ellenanyagok antigénjeikkel találkozva reakcióba lépnek, amelyet a staphylococcusok agglutinációja jelez. Ellenálló képesség. A Staphylococcus fajok a nem spórás baktériumok között a legellenállóbbak közé tartoznak. Beszáradt váladékokban hónapokig életképesek maradnak. Hevítés hatására 60 C-on fél óra alatt rendszerint elpusztulnak. A fertőtlenítőszerek közül a formalin 3%-os oldata 30 perc alatt, a klórlúg 3%-os, a szervesjód-tartalmú fertőtlenítőszerek 0,5%-os oldata pedig 10 perc alatt öli el a Staphylococcus fajokat. Pathogenitás. A S. aureus törzsek állatokban különféle gennyesedéssel járó, rendszerint helyi folyamatokat, tályogképződést, bőrgyulladást, hallójárat-gyulladást stb., ezenkívül szarvasmarhában, juhban és kecskében, lóban, kutyában ritkábban egyéb állatfajokban tőgygyulladást, méhgyulladást, tyúkban és más madarakban septikaemiát, ízületgyulladást és bőrgyulladást idéznek elő. A S. aureus subsp. anaerobius törzsek idézik elő a juhok és a kecskék enzootiás jellegű, a testtájéki nyirokcsomók elgennyesedésével járó (Morel-féle) betegségét. A S. intermedius törzsek (amelyeket korábban a S. aureus E biotípusának tekintettek) zömmel húsevőkben (kutya, nyérc, róka) okoznak gennyesedéssel járó folyamatokat. A S. hyicus sertésben exsudatív bőrgyulladást okoz. Emberben a Staphylococcus fajok okozta fertőzések ugyancsak gyakoriak (tonsillitis, bronchitis, arthritis, dermatitis, endocarditis stb.). 75
96 Részletes bakteriológia Virulens S. aureus törzzsel fehéregereket iv. fertőzve az egerek 1 2 nap alatt septikaemiában elhullanak. A kevésbé virulens törzsek lassúbb lefolyású általános gennyesedést, gócos gennyes vesegyulladást vagy mindössze helyi folyamatokat idéznek elő. Nyulak a S. aureus alfa-hemolizinje iránt különösen érzékenyek, virulens törzzsel iv. fertőzve septikaemiában hullanak el Micrococcus A Micrococcus fajok megtalálhatók az ember és az állatok bőrén, a tejben, tejtermékekben, húsban, nyers húskészítményekben, különféle egyéb élelmiszerekben, de a természetes vizekben és a talajban is. Grampozitívak, a mikroszkópos képben egyesével, párokban, szabálytalan halmazokban, négyes vagy nyolcas kötegekben láthatók. Sárga, rózsaszín vagy narancsvörös pigmenteket termelnek. Közönséges agaron és levesben egyaránt könnyen tenyészthetők. Obligát aerobok, kataláz- és többnyire oxidáz-pozitívak, e tulajdonságaik alapján elkülöníthetők a morfológiailag hozzájuk hasonló Staphylococcus és Streptococcus fajoktól, kórtani jelentőségük nincs, saprophyták Streptococcus A Streptococcus nemzetségbe sorolt fajok széles körben elterjedtek, megtalálhatók az ember és az állatok szájüregében, az emésztőcsatornában, a légutakban, a húgy- és nemi utak nyálkahártyáin, a bőrön, de jelen vannak a tejben, tejtermékekben, egyéb állati és növényi eredetű élelmiszerekben, továbbá a szennyvizekben is. Morfológia. Szabályos gömb vagy kissé ovális alakú, 0,5 1 µm, ritkán ennél valamivel nagyobb átmérőjű baktériumok, amelyek rövidebb vagy hosszabb láncokat képeznek (streptos = gyöngyfüzér). A láncok hosszúsága függ a Streptococcus fajától és a tenyésztés körülményeitől. A kórokozó fajok többsége, különösen kóros anyagokban vagy glükóztartalmú levestenyészetekben, hosszú láncokat alkot (31. ábra), mások egyesével, párosával vagy kisebb, szabálytalan csoportokba rendeződve fordulnak elő. Néhány kivételtől eltekintve csilló nélküliek, egyes fajok (S. pyogenes, S. salivarus, S. sanguis) felületén fimbriák találhatók. A fajok egy része, pl. a S. equi, frissen izolált fiatal tenyészeteiben vékony burkot képez. A S. suis törzseknek poliszacharid burkuk van. A S. pneumoniaeben a coccusok párosával állnak (diplococcusok), egymással össze nem függő végük lándzsaszerűen kihegyesedik, a virulens törzseknek vastag poliszacharid burka van. A Streptococcus fajok Gram-pozitívak, megfesthetők azonban bármelyik egyszerű festési eljárással is. 31. ábra - Streptococcus equi subsp. zooepidemicus levestenyészetből (Gram-festés, 1250 ) 76
97 Részletes bakteriológia Tenyésztés. Az igényes baktériumok közé tartoznak, szaporodásukat vérsavó, élesztőkivonat és glükóz jelentősen serkenti. Aerobok, fakultatív anaerobok, utóbb azonban néhány obligát anaerob fajt is a streptococcusok közé soroltak. Néhány faj, pl. a S. pneumoniae, a tenyésztéskor 5% CO 2-ot is igényel, míg más fajok, bár nem igénylik, jobban nőnek ilyen körülmények között. Optimális tenyésztési hőmérsékletük 37 C, a saprophyták között azonban vannak olyanok, amelyek 5 10 C-on, sőt 45 C-on is jól szaporodnak. Közönséges agaron nehezen erednek meg, telepeik is igen aprók. Tenyésztésükhöz általában véresagart használunk. Telepeik véresagaron is aprók, 24 óra múlva 0,5 1 mm átmérőjűek, domborúak, éles szélűek, fénylők. A fajok egy része a vörösvérsejteket feloldja, részleges (alfa-) vagy teljes (béta-) hemolízist idéz elő. A többnapos telepek középső része gyakran emlőszerűen kiemelkedik. A streptococcusok szelektív izolálására kristályibolyát, tallium-szulfátot, nátrium-azidot, esetenként azonban antibiotikumokat is tartalmazó táptalajokat használunk. A Streptococcus fajok osztályozása. A streptococcusok hemolizáló képességük, biokémiai sajátságaik, sejtfalantigénjeik és néhány egyéb sajátság alapján több csoportba, így a gennykeltő (pyogen) streptococcusok, a szájüregben előfordulók (oralis streptococcusok), a lactis csoport, az anaerob streptococcusok és az egyebek csoportjába sorolhatók. Hemolízis. A pathogen fajok többsége véresagaron erős, a telepek körül gyűrű formában megjelenő hemolízist (béta-hemolízis) okoz. A S. pyogenes esetében a béta-hemolízist a törzsek által termelt, oxigénre nem érzékeny, kis molekulatömegű peptid (steptolizin-s) idézi elő. Egyes törzsek (így pl. a Lancefield-féle A, C és G csoportba tartozók) termelnek egy oxigénre érzékeny hemolizint (streptolizin O-t) is, amely protein természetű, antigénhatású, feloldja a vörösvérsejteket és citotoxikus a leukocytákra is. A Streptococcus fajok egy másik része véresagaron csupán részleges hemolízist okoz. Az alfa-hemolízis során a telepek alatt és közvetlenül körülöttük a vörösvérsejtekből kioldódó hemoglobin bomlása miatt a táptalaj zöldes színűvé válik. Végül a Streptococcus fajok egy további csoportja véresagaron egyáltalán nem okoz hemolízist. A hemolizáló képesség a fajokon belül törzsenként is változik. Biokémiai sajátságok. Kataláz- és oxidáz-negatívak, szénhidrátbontásuk fermentatív, gázképződés nélkül (4. táblázat). A szénhidrátokból főleg tejsavat termelnek. A pyogen streptococcusok jelentős része amellett, hogy többségük véresagaron hemolízist okoz, különféle extracelluláris enzimeket, így fibrinolizint (streptokinázt), 77
98 Részletes bakteriológia hialuronidázt, különféle nukleázokat és gyenge aktivitású proteázokat is termel, amelyek kórtani szempontból fontosak. 4. táblázat - A fontosabb Streptococcus fajok biokémiai sajátságai Fajok Szerocsoport Béta- hemolí zis Argini n- hidrolí zis Eszkul in- hidrolí zis Hippur át hidrolí zis Voges Proska uer Laktóz Mannit Ribóz Szalici n Szorbit Trehal óz S. agalactiae B k k + k + S. equi subsp. equi S. equi subsp. zooepidemi cus S. equi subsp. equisimilis S. dysgalactiae C + + k + + C + + k + k + + C + + k k + + C k k k + S. uberis (E) nv S. suis D k nv. + nv. + nv S. porcinus E, P, U, V k S. bovis D + nv. + k + k S. canis G k: különböző típusok nv.: nem vizsgált Antigénszerkezet. A sejtfalban levő csoportspecifikus, poliszacharid antigénjeik (hapténjeik) alapján a Streptococcus fajok több (ez ideig legalább 20) csoportba sorolhatók. A csoportokat az ábécé betűivel jelöljük A-tól H-ig és K-tól V-ig. Előfordulnak azonban olyan fajok is, amelyek nem tartalmaznak csoportspecifikus antigént, továbbá olyanok is, amelyeknél a törzsek egy része az egyik, másik része pedig egy másik csoportantigént hordoz. A csoportspecifikus antigének a sejtfalból autoklávozással, enzimes emésztéssel vagy más módon kivonhatók. A Streptococcus nemzetség csoportantigénjeit híg sósavas kivonással elsőként Lancefield állította elő és vizsgálta precipitációs próbában (Lancefield-féle antigének). A csoportspecifikus antigéneken kívül a kórtani szempontból fontos pyogen streptococcusok többsége tartalmaz különféle típusspecifikus, felületi fehérje- és szénhidrátantigéneket is. A S. suis törzsek poliszacharid burokantigénjeik alapján ez ideig legalább 30 szerotípusba sorolhatók. A S. pneumoniae törzsek nem sorolhatók be 78
99 Részletes bakteriológia sejtfalantigénjeik szerint, osztályozásuk a burok poliszacharid antigénjei alapján történik, ez ideig legalább 84 típus ismert. A pyogen streptococcusok burok-, tok- és felületi protein-antigénjei virulenciafaktorként szolgálnak. Ellenálló képesség. A streptococcusok ellenálló képessége nagy. A bőrön, nyálkahártyákon tartósan jelen vannak, kóros anyagokban, porban, levegőben hetekig életképesek maradnak. A gennykeltő streptococcusok 60 C-on percek alatt elpusztulnak. A fertőtlenítőszerekkel szembeni érzékenységük nagyjából megegyezik a Staphylococcus fajokéval. Pathogenitás. A streptococcusok fakultatív pathogenek. Az állatokban és az emberben egyaránt különféle gennyesedéssel járó helyi folyamatokat, ritkábban generalizált fertőzéseket idéznek elő. A háziállatokban leggyakrabban tőgygyulladást, méhgyulladást, ízületgyulladást okoznak, gyakoriak, azonban különösen lovakban, sertésekben, szarvasmarhában és madarakban, a septikaemiával járó streptococcus fertőzések is. A S. pyogenes human pathogen, emberekben heveny vagy idült lefolyású betegségeket (pharyngitist, tonsillitist, erysipelast, impetigót, gennyesedéseket, sepsist stb.) idéz elő. Egyes törzsei a vérerekre ható erythrogen toxint termelnek, amely a skarlát (vörheny) okozója. A S. pyogenes és alkalmanként más Streptococcus fajok az emberben létrehoznak különféle allergiás betegségeket (rheumás lázat, vesegyulladást, szívbelhártya-gyulladást) is. Az állatokban betegséget okozni képes Streptococcus fajok közül több megbetegítheti az embert is, egyebek között a S. agalactiae, a S. equi subsp. zooepidemicus fajokról tudott, hogy emberben septikaemiát okozhatnak. A S. agalactiae, a S. dysgalactiae és a S. uberis tehenekben, ritkábban egyéb állatfajokban tőgygyulladást idéz elő. A S. uberis törzseknek csak egy része tartozik az E csoportba, a többi számos más csoportba sorolható be. A S. equi subsp. zooepidemicus valamennyi háziállatfajban előfordulhat, tőgygyulladást, méhgyulladást, vetélést, ízületgyulladást, tályogképződést, továbbá lovakban, sertésekben, ritkábban egyéb fajokban septicaemiát idéz elő. A S. equi subsp. equi lovakban mirigykórt, ezenkívül gennyesedéssel járó helyi folyamatokat idéz elő. A S. equi subsp. equisimilis lovakban lymphadenitist, metritist, ritkán vetélést okoz, de megtelepedhet emberben és sertésekben is. A S. suis törzsek a sertés tonsilláinak a lakói, septikaemiát, arthritist, tüdőgyulladást, meningoencephalitist idézhetnek elő. A S. porcinus törzsek természetes viszonyok között megtalálhatók a sertés tonsilláiban, a fej nyirokcsomóinak eltályogosodásával járó betegséget okoznak, de izolálható lóból és macskából is. A S. canis törzsek kutyában, macskában lymphadenitist, metritist, puerperalis gennyesedéseket idéznek elő. A felsorolt streptococcusokon kívül számos egyéb, pl. a Lancefield-féle G, L, M, P, U, V és néhány más csoportba tartozó streptococcusok is idézhetnek elő alkalmanként betegséget emberben és állatokban. A S. bovis a szarvasmarha és más kérődzők, továbbá a galambok bélcsatornájának a természetes lakója, de jelen lehet a tejben, tejtermékekben, s időnként kitenyészthető a sertés, a madarak és az ember bélcsatornájából is. Emberben ritkán endocarditist, galambokban viszont jelentős számú elhullással járó septikaemiát idézhet elő. A szájüregben előforduló streptococcusok (S. salivarus, S. sanguis és mások) emberben és állatokban egyaránt megtalálhatók, kitenyészthetők a szájból, nyálból, bélsárból. A szájüreg sérülései során gennyesedést, ritkán emberben endocarditist okoznak. Egyes fajai (S. mutans) szerepet játszanak a fogszuvasodásban. A lactis csoportba tartozó streptococcusok (S. lactis) megtalálhatók a tejben, tejtermékekben, növényzeten, nyers élelmiszerekben. Saprophyták, a tejcukrot elbontják, abból tejsavat termelnek, a tejiparban használják őket más baktériumokkal együtt aludttejek, sajtok stb. előállításához. Az anaerob streptococcusok alkalmanként sebekből, tályogokból, a bélcsatorna vagy a nemiutak sérüléseit követő gennyesedésekből izolálhatók. A S. pneumoniae természetes lakója az ember felső légutainak, alkalmanként azonban megtalálható az állatok légutainak nyálkahártyáján is. Főként humán pathogen, tüdőgyulladást, sinusitist, otitist stb. idéz elő. Az állatok közül borjakban, csikókban bronchopneumoniát, septikaemiát, tehenekben esetenként tőgygyulladást, azonkívül laboratóriumi rágcsálókban (tengerimalacban, egérben stb.) tüdőgyulladást okoz. 79
100 Részletes bakteriológia Laboratóriumi rágcsálókban az állatpathogen Streptococcus fajok egy része (pl. a S. equi subsp. zooepidemicus, a S. equi subsp. equi) többnyire csupán a bőr alatti kötőszövetre és a nyirokcsomókra kiterjedő gennyesedést, esetleg gennyes áttéteket hoz létre, más részük azonban még ilyen elváltozásokat sem okoz. A S. pyogenes és a S. pneumoniae virulens törzsei azonban iv. fertőzve a fehér egereket és a nyulakat néhány nap alatt septikaemiában megölik Enterococcus Az enterococcusokat korábban a streptococcusokhoz soroltuk, így alaki, tenyésztési sajátságaik, továbbá biokémiai tulajdonságaik egy része megegyezik az ott leírtakkal. Az enterococcusok, közülük a S. faecalis, a S. faecium, a S. avium, a S. gallinarum és néhány további újonnan leírt faj a bélcsatorna lakója, emberben és a legkülönfélébb állatfajokban egyaránt megtalálhatók. Az enterococcusok biokémiai sajátságaik alapján jól elkülöníthetők a streptococcusoktól, mert egyaránt jól nőnek 10 C-on és 45 C-on, 9,6-os ph-jú, valamint 6,5% NaCl-t tartalmazó leves táptalajokban, továbbá túlélik a 60 C-on történő 30 perces hevítést. Bontják az eszkulint, ezért eszkulint is tartalmazó táptalajon telepeik feketék. Poliszacharid hapténjeik alapján a Lancefieldféle D csoportba tartoznak. Saprophytáknak tekinthetők, alkalmanként azonban okozhatnak emberben, állatokban egyaránt endocarditist, tályogképződést Anaerob coccusok Az állatok és az ember emésztőcsatornájában, a nemi szervek nyálkahártyáján és másutt fordulnak elő. Alakilag coccusok, Gram-pozitívak, amelyek egyesével helyeződnek el, hosszabb-rövidebb láncokat vagy tetrádokat képeznek, szigorúan anaerobok. Különböző nemzetségekbe tartoznak, egy részük, így pl. a Peptococcus és a Peptostreptococcus fajok, alkalmanként állatokban különféle putrid, gangraenás folyamatokat (méhgyulladást, tüdőgyulladást, ízületgyulladást, tályogképződést stb.) idéznek elő. Más részük a kérődzők bendőjének és a különféle állatfajok vakbelének lakói (Ruminococcus fajok), vagy a bőrön, a gyomorban, bélsárban előforduló saprophyták (Sarcina fajok) Lactobacillus Egyenes vagy kissé hajlott, vékony pálcika alakú, Gram-pozitív, spóra és csilló nélküli, aerob, fakultatív anaerob vagy mikroaerofil baktériumok. Előfordulnak az ember és az állatok szájüregében, az emésztőcsatorna és a hüvely nyálkahártyáján, de megtalálhatók a tejben, a tejtermékekben, a húskészítményekben, különböző növényeken, növényi nedvekben, erjesztett takarmányokban és a szennyvizekben is. Számtalan fajuk ismert, egy részük, pl. a L. acidophilus, L. salivarius, L. plantarum stb., az újszülött állatokban a születés után megtelepedve, más baktériumokkal együtt részt vesz a bélcsatorna természetes baktériumflórájának a kialakításában. Az ide tartozó fajok egy további csoportját, így a L. helveticust, L. delbrückii subsp. bulgaricust, a L. delbrückii subsp. lactist és néhány más fajt a tejiparban különféle aludttejek és sajtok előállítására veszik igénybe. Kórtani jelentőségük nincs, saprophyták Erysipelothrix rhusiopathiae Természetes viszonyok között megtalálható a sertés, szarvasmarha, juh, a házi- és vadon élő madarak emésztőcsatornájában, de előfordul a halakat és a puhatestűeket borító nyálkában, szennyvizekben, tavi iszapban is. Morfológia. Karcsú, enyhén hajlott, 1 3 µm hosszú pálcikák. Az R törzsek hosszú láncokat, fonalakat alkotnak. Csillója nincs, Gram-pozitívan festődnek. Tenyésztés. Aerob, fakultatív anaerob, bár közönséges agaron is nő, tenyésztésére célszerű glükózt és vérsavót tartalmazó agar táptalajt használni. Vérsavós agaron 37 C-on a virulens orbáncbaktériumok apró, harmatcseppszerű, fénylő S-telepeket képeznek (32. ábra). Az avirulens törzsek nagyobb, matt, egyenetlen szélű R-telepeket alkotnak. Az idült elváltozásokból kitenyésztett törzsek gyakran R-típusúak. A virulens orbáncbaktériumok közönséges levesben finom, egyenletes zavarosodást okoznak, az R törzsek viszont csak a leves alján szaporodnak, szemcsés vagy pelyhes üledék formájában. 32. ábra - Erysipelothrix rhusiquthiae telepek neomicint tartalmazó szűrőpapír körül 80
101 Részletes bakteriológia Erősen szennyezett vagy rothadt vizsgálati anyagokból az orbáncbaktérium nátrium-azidot és kristályibolyát vagy neomicint tartalmazó, szelektív táptalajon tenyészthető ki. Biokémiai sajátságok. Kataláz- és oxidáz-negatív, tioszulfát-tartalmú táptalajban H 2S-t képez. Gázképzés nélkül bontja a glükózt, a laktózt és a maltózt. A törzsek többsége hialuronidáz enzimet termel. Antigénszerkezet. A virulens orbáncbaktériumok tartalmaznak a fajra jellemző, a törzsek többségében meglevő, a baktériumok felületéről leoldható, kétféle hőlabilis fehérjeantigént, amellyel szemben védő ellenanyagok termelhetők. Szerológiai osztályozásuk azonban a sejtfalukban található, hőstabil, típusspecifikus poliszacharid-antigének alapján történik. Ez utóbbiak alapján, precipitációs próbával, a törzsek ez ideig 26 szerotípusba sorolhatók. Egyes szerotípusokon belül alcsoportok különíthetők el. A törzsek szerotípusát arab számokkal jelöljük. A sertés tonsilláiból izoláltak 7-es szerotípusba tartozó, egyébként sertésre és csirkére nézve avirulens, olyan sertésorbánctörzseket, amelyek a szokásos biokémiai próbákban nem, de DNS-hibridizációjuk alapján jelentősen különböztek a többi szerotípustól. E törzseket újabban önálló fajnak tekintik és E. tonsillarum névvel jelölik. Ellenálló képesség. Az orbáncbaktériumok ellenálló képessége viszonylag nagy. A talajban, fertőzött tavak vizében, iszapjában, rothadó hullákban, vágóhídi hulladékokban hónapokig életben maradnak. Sótűrő, húsokban a sózás, pácolás, füstölés sem pusztítja el, hő hatására azonban 60 C-on perceken belül elpusztul. A szokásos fertőtlenítőszerek ugyancsak perceken belül elölik. Pathogenitás. Fakultatív pathogen baktérium, leggyakrabban a sertést betegíti meg, de előfordulnak tömeges megbetegedések juhokban, házi- és vadon élő madarakban (főleg liba-, kacsa- és pulykaállományokban) is. Sertésállományainkban a septikaemiás esetek túlnyomó többségét az 1a, kivételesen egyéb szerotípusú, az idülten lezajló kórképeket pedig főleg a 2a szerotípusú törzsek idézik elő. Az egyéb szerotípusok, bár előfordulhatnak sertésekben is, főleg talajból, madarakból, halak felületéről izolálhatók. A sertésorbánc megelőzésére inaktivált, a 2-es vagy az 1-es és 2-es szerotípust egyaránt tartalmazó alumínium-hidroxid gélhez adszorbeált vakcinák vannak forgalomban. A hetes szerotípusba tartozó (E. tonsillarum) törzseket utóbb kutya endocarditis esetekből is izoláltak. 81
102 Részletes bakteriológia A sertések virulens orbáncbaktériumokkal per os csak ritkán betegíthetők meg, ugyanígy bizonytalan a parenterális fertőzés eredménye is. A természetessel egyező kórkép alakul azonban ki, ha a sertéseket skarifikálással bőrbe fertőzzük (Fortner-féle eljárás). Kis mennyiségű virulens orbáncbaktériumot parenterálisan egerekbe, nyulakba vagy galambokba fecskendezve a kísérleti állatok 2 5 nap alatt septikaemiában elpusztulnak. Boncoláskor lépduzzanat s testszerte vérzések láthatók. A lépből a baktériumok mikroszkópos vizsgálattal és tenyésztéssel egyaránt kimutathatók Listeria A listeriák rövid, pálcika alakú, csillós Gram-pozitív baktériumok. A nemzetségbe tartozó fajok közül kórtani szempontból a L. monocytogenesnek van jelentősége, esetenként azonban a L. ivanovii is okozhat betegséget háziállatokban Listeria monocytogenes Megtalálható a talajban, a természetes vizekben, a szennyvizekben, a növényzeten, földdel szennyezett, romlott szilázsokban, az egészséges emberek és állatok (szarvasmarha, juh, madarak stb.) bélcsatornájában, különféle élelmiszerekben, így pl. sertéshúsból készült nyers kolbászokban, nyers baromfihúsban, tejben. Valószínű, hogy fő tartózkodási helye a talaj, s földdel szennyezett élelmiszerekkel, takarmányokkal kerül az emberbe és az állatokba. Morfológia. Az orbáncbaktériumnál valamivel vaskosabb, 1 2 µm hosszú, pálcika (33. ábra), C -on tenyésztve csillós, jellegzetes bukfencező mozgást végez. 33. ábra - Listeria monocytogenes agartenyészetből (Gram-festés, 1250 ) Tenyésztés. Aerob, fakultatív anaerob. Hőmérsékleti optimuma 37 C, de képes szaporodni 4 42 C között. Közönséges agaron apró, kerek, kékesfehér fényű telepeket képez. Virulens törzseinek telepeit juh-, szarvasmarha- vagy lóvért tartalmazó agaron keskeny, béta-hemolitikus udvar övezi. Az elváltozott szövetekből a listeriák kitenyésztését elősegíti, ha a vizsgálati anyagot finom szuszpenzióvá dörzsöljük szét, leves táptalajba tesszük, s több hétig 4 C-on tárolva időnként szilárd táptalajra oltunk belőle. A 4 C-on való tartás közben a listeriák kellően elszaporodnak. Erősen szennyezett anyagokból (szennyvízből, bélsárból, földből, szennyezett 82
103 Részletes bakteriológia váladékokból stb.) a listeriák szarvasmarha-vérsavót, tripaflavint és nalidixsavattartalmazó szelektív táptalajon izolálhatók. A közönséges levest egyenletesen megzavarosítja. Biokémiai sajátságok. Kataláz-pozitív, az eszkulint hidrolizálja, az arginint viszont nem, glükózból, maltózból, szalicinból és ramnózból savat képez, a mannitot és a xilózt azonban nem bontja. Kórokozó képessége a törzsek hemolizáló és lipolítikus sajátságával, továbbá a sejtfalban található, monocytosist okozó faktor, valamint a sejtfal lipoid anyagainak toxikus sajátságával áll kapcsolatban. A hemolízist kis molekulatömegű fehérje idézi elő. Antigénszerkezet. A listeriák a sejtfalban található poliszacharid és a csillókban levő fehérjeantigénjeik alapján, faji besorolásuktól függetlenül, agglutinációs próbával 16 szerotípusba (szerovariánsba) sorolhatók. Mind a sejtfal, mind pedig a csillóantigének több komponensből állnak (antigénmozaik), s az egyes antigénkomponensek a különböző szerotípusokban egymással variálódva fordulnak elő. A listeriosisban elhullott állatokból izolált L. monocytogenes törzsek többsége nálunk az 1/2-es, kisebb része pedig a 4-es szerotípusba tartozik. Az egyes szerotípusokon belül a törzsek fágtípusuk szerint tovább osztályozhatók. Ellenálló képesség. A talajban, szennyvizekben hónapokig életképes marad, sőt el is szaporodik. 60 C feletti hőmérsékleten és fertőtlenítőszerek hatására azonban perceken belül elpusztul. Pathogenitás. Fakultatív pathogen, fogékony iránta az ember, az összes házi- és vadon élő emlős és a madarak is. Főleg a fiatal állatokat, közülük is elsősorban a juhot, a szarvasmarhát, a nyulat, a csincsillát, alkalmanként azonban az egyéb prémesállatokat és a baromfifajokat is megbetegíti. A L. monocytogenes foetopathogen, szarvasmarhákban, juhokban, kecskékben, nyulakban és alkalmanként terhes asszonyokban is magzatkárosodást, vetélést okoz. Virulens tenyészet, tengerimalac vagy fiatal nyúl kötőhártyájára cseppentve, óra alatt gennyes szaru- és kötőhártya-gyulladást idéz elő (Anton-féle teszt). Egérben, tengerimalacban septikaemiát, vemhesekben vetélést idézhet elő. A házinyulakban nagyobb mennyiségű tenyészet iv. befecskendezése után myeloid típusú leukocytosis (monocytosis) fejlődik ki, az elhullott állatok májában, lépében, szívizomzatában apró elhalásos gócok láthatók Listeria ivanovii A L. ivanovii törzsek juh- vagy lóvért tartalmazó véresagaron tenyésztve széles, rendszerint kétszeres, háromszoros hemolitikus udvart hoznak létre. Biokémiai tulajdonságaik többsége megegyezik a L. monocytogenesével, megkülönböztethetők azonban tőle azáltal, hogy a Staphylococcus aureusszal végzett CAMP-próbában negatívak, viszont elbontják a xilózt, de nem a mannitot és a ramnózt. A L. ivanovii törzsek az 5-ös szerotípusba tartoznak. A L. ivonovii juhokban, kecskében, ritkábban tehenekben okoz vetélést, megbetegítheti azonban az embert is. Fehér egerekre nézve pathogen Renibacterium Gram-pozitív, 1 1,5 µm hosszú, gyakran párosával álló vagy rövid láncokat formáló baktérium, csillói nincsenek. Aerob, ciszteint és vérsavót vagy vért tartalmazó agartáptalajokon tenyészthető. Lassan szaporodik, legjobban C között, 37 C-on azonban nem. A beoltott táptalajokat tartalmazó edényt a táptalajok kiszáradásának a megelőzése érdekében légmentesen le kell zárni. A telepek aprók, sárgásfehérek. A primer izolálás során 3 5 hét, a táptalajhoz már hozzászoktatott törzsek egy hét alatt fejlődnek ki. Kataláz-pozitív, oxidáz-negatív, a cukrokat nem bontja. A nemzetségbe tartozó egyetlen faj, a Renibacterium salmoninarum, obligát, intracellularisan szaporodó, halpathogen baktérium. Tenyésztett lazacfélékben (különféle lazac- és pisztrángfajokban) okoz főleg a vesékben (innen ered a neve), de más szervekben is elhalással, tályogképződéssel járó betegséget. Nálunk ez ideig a betegséget nem észlelték Corynebacterium 83
104 Részletes bakteriológia A Corynebacterium nemzetségbe tartozó fajok egyenes vagy kissé hajlott pálcika alakú, Gram-pozitív baktériumok. Megtalálhatók az ember és a különféle állatok nyálkahártyáin, valamint a bőrön. A korábban ide sorolt fajok egy jelentős részéről kiderült, hogy valójában nem tekinthetők corynebacteriumoknak, ezeket a fajokat manapság a Rhodococcus, Actinomyces, az Eubacterium és néhány egyéb nemzetségbe soroljuk. Morfológia. A corynebacteriumokat alakilag a nagyfokú polimorfizmus jellemzi. A mikroszkópos képben rövid coccoid formák, hajlott pálcikák és megnyúlt fonalszerű alakok egyaránt láthatók. A pálcikák egyik vagy mindkét vége rendszerint duzzadt, emiatt a baktériumok gyakran bunkó vagy körte alakúak (coryne = bunkó). Spórát nem képeznek, csilló nélküliek. Egyenetlenül festődnek, idősebb tenyészetekben az alakok egy része Gram-negatív lehet, a cytoplasmában egy vagy több metakrómás szemcse található. E szemcsék miatt a hosszabb baktériumalakok gyakran coccusokból álló láncoknak tűnnek. Tenyésztés. Aerob, fakultatív anaerob baktériumok, többségük közönséges agaron is elszaporodik, de sokkal jobban növekednek vérsavót vagy vért tartalmazó táptalajokon. Egyes fajok növekedését a táptalajhoz kevert kevés detergens (pl. Tween 80) elősegíti. Biokémiai sajátságok. Kataláz-pozitívak, oxidáz-negatívak, szénhidrátbontásuk fermentatív. A Corynebacterium nemzetségbe tartozó fajokközül a C. diphtheriae az ember diphtheriájának az okozója. A garatban, gégében szaporodik el, pathogen törzsei erősen mérgező exotoxint termelnek. Állatorvosi szempontból jelentősége nincs. Az állatokban előforduló Corynebacterium fajok mindegyike fakultatív pathogen, közülük az alábbiak fontosak Corynebacterium pseudotuberculosis Hajlott, 1 3 µm hosszú, bunkós végű, egyenetlenül festődő pálcikák, felületükön fimbriák találhatók. Közönséges agaron, 37 C-on 48 óra múlva apró, kerek, fehér telepeket képez, amelyek néhány nap múlva megnagyobbodnak, sárgás színűekké válnak. Véresagaron a törzsek többsége béta-hemolízist okoz. Leves táptalajban elszaporodva a kémcső alján szemcsés üledék, a felületen pedig vékony hártya képződik. Glükózból, maltózból és néhány más szénhidrátból savat termel, ureáz- és metilvörös-pozitív, a kazeint nem bontja, a lovakból származó törzsek a nitrátot nitritté redukálják, míg a juhokból és kecskékből származó törzsek nem. Virulens törzsei hőlabilis exotoxint termelnek. A toxin Da molekulatömegű extracelluláris enzim, foszfolipáz-d, amely a sejthártya lipoprotein-komponenseit teszi tönkre. A toxikus törzsek levestenyészeteinek szűrletével bőr alá oltott tengerimalacok 1 2 nap alatt toxaemiában elhullanak. A beoltás helyén savós, gyakran véres beivódás keletkezik, az elhullott állatokban testszerte oedema és vérzések láthatók. Nagyjából hasonló kép fejlődik ki a toxin hatására juhokban is. A virulencia másik fontos tényezője a sejtfal toxikus lipidrétege, ez az oka a tályogképződésnek és ez teszi lehetővé a macrophagokban való túlélést. A C. pseudotuberculosis juhokban, kecskékben, elsajtosodással járó nyirokcsomó-gyulladást (pseudotuberculosist), lovakban fekélyes nyirokérgyulladást, a mellkas és a has bőr alatti kötőszövetében tályogosodást okoz, de a nyirokcsomók és a nyirokerek gyulladásával, beolvadásával járó idült folyamatokat előidézhet szarvasmarhában és szórványosan más állatfajokban is. A kísérleti állatok közül a hasüregbe fertőzött hím tengerimalacban hashártyagyulladás és fibrines gennyes heregyulladás alakul ki. Juhok parenterálisan fertőzve lesoványodnak, a tüdőben és másutt sajtos, elhalásos gócok keletkeznek. Bőrsérüléseken át fertőződött emberekben a testtájéki nyirokcsomók gennyes gyulladását idézi elő Corynebacterium renale Enyhén hajlott, 1 3 µm hosszú pálcikák, felületükön kis számban fimbriák találhatók. Közönséges agaron 2 3 nap alatt apró, krémszínű telepeket alkot, levesben szaporodva pedig a táptalaj felületén hártyát vagy finom porszerű üledéket képez. Glükózból és néhány más szénhidrátból savat termel, ureáz-pozitív, elbontja a kazeint, a metilvörös próbában negatív. A C. renale szarvasmarhában, de ritkán sertésben és lóban is gennyes hólyag- és vesemedence-gyulladást okoz. Levestenyészetét iv. kísérleti egerekbe vagy nyulakba fecskendezve bennük elhulláshoz vezető vesemedencegyulladás alakul ki Egyéb Corynebacterium fajok Az eddig felsoroltakon kívül még sok más Corynebacterium faj ismert. Közülük a C. pilosum és a C. cystitidis (korábban a C. renale II-es és III-as biotípusai) szarvasmarhában szórványosan húgyhólyag- és vesemedence- 84
105 Részletes bakteriológia gyulladást, kosokban, valamint kecskebakokban pedig tasakgyulladást okoz. A C. kutscheri (C. murium) egerekben, patkányokban, pockokban okoz elhalással, tályogképződéssel járó pneumoniát. A C. bovis saprophytaként a tehenek tőgyén és a tejben fordul elő, alkalmanként azonban tőgygyulladásokból és vetélt magzatokból is izolálható. A korábban a Corynebacterium nemzetségbe sorolt fajok közül a C. pyogenestmanapság Actinomyces pyogenesnek, a C. suist Actinomyces suisnak, a C. equitpedig Rhodococcus equinek nevezzük Actinomyces Az Actinomyces fajok az ember és a különféle állatfajok nyálkahártyáinak, főleg a száj- és garatüregnek a lakói. Hosszú, elágazódó fonalakat képező, Gram-pozitív baktériumok, a fonalak gyakran pálcika vagy egészen rövid coccoid alakokra töredeznek szét. A kóros váladékokban egyes fajok hosszú, duzzadt végű fonalai, jellegzetes sugár alakú csoportokba rendeződve láthatók, innen származik a nemzetség elnevezése (actinomyces = sugárgomba). Csillót, spórát nem képeznek, aerob, mikroaerofil és anaerob fajok egyaránt tartoznak ide. A nemzetségbe tartozó fajok közül az A. israelii az ember actinomycosisának az okozója. Az A. viscosum, az A. odontolyticus és néhány más faj, egyebek mellett a fogszuvasodásban, periodontitis kialakításában játszik szerepet. Az A. viscosum időnként megbetegíti a kutyát is. Állatorvosi szempontból az alábbi fajok fontosak Actinomyces bovis Megtalálható a szarvasmarha és az egyéb növényevők száj- és garatüregében és bélcsatornájában. Morfológia. Kissé hajlott, 3 4 µm hosszú, bunkós végű pálcikák. A kórosan elváltozott szövetekben hosszú, egyenetlen, elágazódó fonalak vagy ún. tőkék formájában láthatók. Ez utóbbiak egészen gombostűfej nagyságú, némelykor szabad szemmel is látható, szürkéssárga csomócskák, amelyek általában puhák, ha azonban mészsók rakódtak le bennük, kemények is lehetnek. A tőkék középső része sugár alakban rendeződött Gram-pozitív, elágazódó fonalakból áll, széli részükön a fonalak végei körteszerűen duzzadtak. Ez utóbbiak Gram-negatívak, jól megfesthetők azonban savanyú festékekkel, pl. eozinnal. Tenyésztés. Véresagaron, anaerob viszonyok között, 37 C-on viszonylag könnyen tenyészthető. Az elváltozások mélyéből vett vizsgálati anyagot felkenés előtt finoman dörzsöljük szét. A tenyészet rendszerint 2 4 nap alatt ered meg. Véresagaron 2 3 mm átmérőjű, fehér, szemcsés telepeket képez, amelyeket némelykor keskeny vérsejtoldódásos udvar vesz körül. A telepek erősen tapadnak a táptalajhoz. Primer tenyészetben a baktériumok fonalas szerkezetűek, többször átoltott tenyészetekben viszont hajlott, duzzadt végű pálcikák, igen hasonlítanak a corynebacteriumokhoz. Vérsavótartalmú levesben szemcsés üledéket képez, olykor azonban egyenletes zavarosodást okoz. Biokémiai sajátságok. Kataláz-negatív, glükózból, fruktózból, laktózból, maltózból, szacharózból savat képez, de az arabinózt és a raffinózt nem bontja. A glükózbontás során acetoin is képződik. Tioszulfátból kénhidrogént képez, a keményítőt hidrolizálja, a nitrátot nem redukálja. Pathogenitás. Szarvasmarhában, ritkán más állatfajokban az állcsontokban, a nyelvben, a fej és a nyak lágy részeiben, ritkábban egyéb helyeken okoz idült gyulladással és a szövetek beolvadásával járó kórfolyamatokat (sugárgomba-betegség, actinomycosis). Betegség csak akkor alakul ki, ha a baktériumoknak módjuk van sérüléseken át a szövetek közé jutni és ott anaerob viszonyok között elszaporodni Actinomyces suis Az A. suis elnevezése és rendszertani helye (korábban Corynebacterium suis, majd Eubacterium suis) máig bizonytalan. Korábban az Actinomyces bovis egyik biokémiai variánsának tartották. Különbözik tőle abban, hogy aerob viszonyok között is szaporodik, a nitrátot nitritté redukálja, a szénhidrátok közül pedig elbontja a trehalózt. Fakultatív pathogen, gyakran izolálható klinikailag egészséges sertéskanok vizeletéből. Sertésekben, főleg a tőgyben, a szarvasmarha actinomycosisához hasonló idült elváltozásokat okoz, de előidézhet emellett gennyes hólyag- és vesemedence-gyulladást, továbbá alkalmanként vetélést is Actinomyces pyogenes Egyenes vagy kissé hajlott 0,5 2 µm hosszú pálcikák (34. ábra). Aerob, közönséges agaron és levesben nem fejlődik, tenyésztéséhez natív fehérjét igényel. Véres agaron, 37 C-on, levegő jelenlétében 1 2 nap alatt apró, tűszúrásnyi telepeket képez, a telepek körül béta-hemolízis látható. Alvasztott vérsavón és tojástartalmú táptalajon tenyésztve 2 3 nap alatt pontszerű szürke telepeket alkot, miközben a táptalaj a telepek alatt és körül 85
106 Részletes bakteriológia a törzsek fehérjebontó képessége következtében elfolyósodik. Jól szaporodik a tejben is, a tejet megalvasztja, az alvadékot pedig elfolyósítja. Egyes törzsei a vörösvérsejtek feloldódását és a szövetek elhalását előidéző exotoxint termelnek. A toxin D molekulatömegű, valószínűleg fehérje, vele szemben nyúlban immunsavó termelhető. 34. ábra - Actinomyces pyogenes véresagarról (Gram-festés, 1250 ) Biokémiai tulajdonságok. Kataláz-negatív, a zselatint, kazeint és az alvasztott vérsavót elfolyósítja, nitrát- és ureáz-negatív, a glükózból, laktózból és számos más szénhidrátból savat termel. Ellenálló képessége nem nagy, beszáradt váladékokban ugyan hetekig életképes marad, C-on azonban perceken belül elpusztul. A klórlúg és a formalin 3%-os, valamint a szerves jódot tartalmazó szerek 0,5%-os oldata perceken belül elpusztítja. Pathogenitás. Az A. pyogenes a különféle állatfajok nyálkahártyáinak a természetes lakója, sertésben, szarvasmarhában, juhban, kecskében gennyesedéssel járó helyi folyamatokat (sebfertőzést, csülökbántalmakat, ízületgyulladást, köldökgyulladást, méhgyulladást, mellékhere- és heregyulladást stb.), gennyes, elhalásos, tályogképződéssel járó tüdőgyulladást, tőgygyulladást, esetenként septikaemiát, a magzatokba jutva pedig vetélést idéz elő. Alkalmanként azonban izolálható lovak, baromfi, ritkábban más állatfajok tályogosodással járó folyamataiból is. Ritkán ugyan, de megbetegítheti az embert is. A kísérleti állatok közül tengerimalacban és egérben a tenyészetnek a bőr alá oltásával legfeljebb helyi gennyesedés hozható létre. Nyulak az iv. fertőzés következtében rendszerint elhullanak vagy néhány hét alatt lesoványodnak és különböző szerveikben tályogok képződnek Mycobacterium Pálcika alakú, sav- és alkoholálló baktériumok. Idősebb tenyészeteikben néha hosszú, esetenként elágazó, a gombához hasonló fonalak képződnek, innen ered a nemzetség elnevezése. A Mycobacterium nemzetségbe tartozó nagyszámú faj között találhatók pathogenek, közöttük az ember és a különféle állatfajok gümőkórjának előidézői, így a M. tuberculosis, a M. africanum, a M. bovis, a M. microti és a M. avium, valamint a M. 86
107 Részletes bakteriológia paratuberculosis továbbá a M. lepraemurium és a M. leprae, míg az ide tartozó további fajok fakultatív pathogenek vagy saprophyták. A kórokozó fajok természetes viszonyok között csupán a fertőzött szervezetben szaporodnak. A saprophyta és a fakultatív pathogen fajok többsége azonban a külvilágban is széles körben elterjedt, megtalálhatók a talajban, a természetes vizekben, a növényzeten (pl. savanyú füveken, fűrészporban), a tejben, az állatok bőrén és bélsarában stb. Morfológia. Egyenes vagy kissé hajlott, 1,5 4 µm hosszú, 0,3 0,6 µm széles, csilló nélküli pálcikák. A M. tuberculosis általában hosszabb és karcsúbb, finoman hajlott, gyakran szakaszosan festődő, míg a M. bovis rövidebb, vaskosabb, inkább egyenes pálcikák formájában látható, többnyire egyneműen festődik (35. ábra). A M. aviumot a polimorfizmus jellemzi. Hol egészen rövid coccoid, hol pedig hosszú pálcika alakot ölt. A M. paratuberculosis rövid, rendszerint egyneműen festődő pálcika. A saprophyták a pathogenekhez viszonyítva rövidebbek és jóval vaskosabbak. 35. ábra - Mycobacterium bovis szarvasmarha nyirokcsomóban (Ziehl Neelsen-festés, 1250 ) 87
108 Részletes bakteriológia A szövetekből készített kenetekben a pathogen Mycobacterium fajok egyesével vagy szabálytalan halmazokban, gyakran macrophagokban phagocytáltan láthatók. A fészekszerű, halmazokba való elrendeződés különösen 88
109 Részletes bakteriológia jellemző a M. paratuberculosisra. A szövet közé jutott mycobacteriumok alkalmanként degenerálódnak, elvesztik sav- és alkoholállóságukat, s a pálcikák alakját utánzó, gyöngyfüzérhez hasonló elrendeződésű vagy esetenként elszórtan szabadon található, Gram-pozitív rögöcskék formájában láthatók. Levestenyészetből festve a M. bovis és a M. paratuberculosis, de néha más Mycobacterium fajok is szorosan egymáshoz tapadó baktériumokból álló kötegek (cord) formájában láthatók. A cordképződést kapcsolatban áll a törzsek virulenciájával. Festődés. Sav- és alkoholállók, Ziehl Neelsen szerint festhetők. Sav- és alkoholállóságukat a sejtfalban, különösen annak külső, fonalas szerkezetű rétegében található különféle lipoidoknak (mikolsavtartalmú glükolipideknek) és viaszoknak köszönhetik. A mikolsavszintézis gátlása pl. izonikotinsav-hidraziddal a gümőbaktériumok sav- és alkoholállóságát felfüggeszti. Az egyes Mycobacterium fajok sav- és alkoholállóságában lényeges különbségek vannak. Az erősen sav- és alkoholálló (pathogen) fajok Ziehl Neelsen szerint festve rubinpirosak, a saprophyták azonban az alkoholos kezelés hatására a festék egy részét leadják, ezért halványpirosak vagy rózsaszínűek. A Mycobacterium fajok szövetekben, váladékokban való kimutatására fluoreszcens festést is alkalmazhatunk. Az auraminnal kezelt kenetekben levő mycobacteriumok sárgászöld színben fluoreszkálnak. A fluoreszcens festés megkönnyíti a mycobacteriumoknak a vizsgálati anyagokban való felismerését. Tenyésztés. Obligát aerobok, a pathogenek számára a tenyésztés optimális hőmérséklete C. Táplálóanyag-szükségletük tekintetében nem igényesek. Szénforrásként különféle egyszerű vegyületek (piroszőlősav, egyszerű cukrok, glicerin, citrát stb.) szolgálnak, nitrogénszükségletüket pedig aminosavakon (pl. glutaminsavon, aszparaginsavon) kívül nitrátokból, sőt ammóniából is fedezni tudják. Tenyésztésükre a szilárd táptalajok közül a tojástartalmúakat (Dorset-, Petragnani-, Löwenstein Jensen-féle stb.) használjuk leggyakrabban. Elszaporíthatók azonban glükózzal dúsított alvasztott vérsavón, albumintartalmú agaron, sőt glicerines burgonya felületén is. A glicerin általában elősegíti a gümőbaktériumok szaporodását, a M. bovisfejlődését azonban gátolja. A tojás táptalajok egy része malachitzöldet is tartalmaz. A malachitzöld szelektívvé teszi a táptalajt, gátolja a mycobacteriumoknál gyorsabb növekedésű más baktériumfajok szaporodását. A folyékony táptalajok közül a mycobacteriumok tenyésztésére a szintetikus vagy félszintetikus leves táptalajokat (Henley-, Souton-, Sula-, Dubos-féle) használjuk. A mycobacteriumok színtenyészetben való izolálását elősegíti sav- és alkoholálló képességük. Az elváltozott szövetekből vett mintát szétdörzsölve kb. ötszörös mennyiségű, 6 térfogatszázalékos kénsavval (vagy NaOHdal) kezeljük percig. Centrifugálás, majd az üledék semlegesítése után a felkent anyagból rendszerint csak a sav- és alkoholálló mycobacteriumok tenyésznek ki. Szilárd táptalajokon az állati testből frissen kitenyésztett Mycobacterium fajok növekedése és telepmorfológiája között jellegzetes különbségek állapíthatók meg (36. ábra). A M. tuberculosis 3 6 hét alatt domború, száraz, szemecskés, karfiolra vagy kenyérmorzsára emlékeztető telepeket képez. A M. bovis telepei 4 8 hét alatt jelennek meg, nedvesen fénylenek, laposak, szürkésfehérek, idősebb tenyészetekben világossárgák. A M. avium telepei már az első hét vége felé felismerhetők nedves, fénylő kolóniák formájában, amelyek elég hamar sárga, kenőcsös bevonattá folyhatnak össze. A M. avium, szemben az emlősökben betegséget okozó fajokkal, jól szaporodik C-on is. 36. ábra - Mycobacterium bovis, M. tuberculosis és M. avium telepei Petragnani-féle tojás táptalajon 89
110 Részletes bakteriológia A szintetikus vagy félszintetikus leves táptalajokon a M. tuberculosis az egész leves felületét ellepő, sőt az edény falára is felkapaszkodó, vaskos, ráncos hártya formájában szaporodik (eugonikus növekedés). A M. bovis a leves felületét rendszerint nem lepi el teljesen, hanem málnaszemszerűen dudorzatos szigetek formájában szaporodik (dysgonikus növekedés). A M. avium szintetikus levesek felületén egyenletesen elterülő, finom, alig ráncolt hártyát, a tenyésztőedény alján pedig szemecskés üledéket képez. A gümőbaktériumok tenyésztésbeli sajátságai csak primer kultúrában jellegzetesek. Továbbtenyésztésük során a fajok közötti különbségek rendszerint elmosódnak. A Mycobacterium fajok szaporodása meggyorsítható, ha a tenyésztésükre szolgáló táptalajba bovin albumint és Tween-80-at teszünk. A Tween-80 (olajsav szorbittal alkotott észtere) felületaktív hatásánál fogva elősegíti a 90
111 Részletes bakteriológia hidrofób mycobacteriumok diszpergálódását. Az ilyen folyékony táptalajokban a M. tuberculosis és a M. bovis 4 8 nap, a M. avium pedig már 1 2 nap múlva is egyenletes zavarosodást okoz. A M. paratuberculosis csak olyan szilárd táptalajokon izolálható és tenyészthető, amelyek mycobacteriumokból (rendszerint M. phleiből) származó kivonatot (mycobactint) is tartalmaznak. Az ilyen táptalajokon, 37 C-on a M. paratuberculosis telepek legkorábban 6 8 hét elteltével válnak láthatóvá. Első izoláláskor a telepek aprók, szürkésfehérek, felületük sima, fénylő, többszöri átoltás után azonban már 2 3 hét elteltével nagy tömegben fejlődnek. Folyékony táptalajokhoz nehezen szoktatható hozzá. Mycobacteriumokból származó kivonatanyagokkal kiegészített félszintetikus leves táptalajok felületén finom, vékony hártyát képez. A fakultatív pathogen és saprophyta mycobacteriumok többsége, szemben a pathogen fajokkal, jól szaporodik szobahőmérsékleten is, tenyésztési idejük általában 1 3 hét, de vannak közöttük gyorsan szaporodó fajok is. Ez utóbbiak tojás táptalajokon, de közönséges agaron is 7 napon belül elszaporodnak. Egyes fajaik sárga, rózsaszín vagy vörös, karotinoid pigmenteket termelnek. A M. lepraemurium és a M. leprae fajokat eddig hagyományos táptalajokon nem sikerült tenyészteni. Biokémiai sajátságok. A mycobacteriumok faj szerinti meghatározásához a különböző hőmérsékleteken (25 45 C) való szaporodás, a telepek kifejlődésének ideje, a telepmorfológia, a pigmentképzés, a sav- és alkoholállóság, különböző kémiai anyagokkal (pl. hidroxil-aminnal, nitrobenzoesavval) szembeni rezisztencia vizsgálata mellett számos biokémiai próbát veszünk igénybe. Ez utóbbiak közül fontos, egyebek mellett, a nitrátredukció, a kataláz, ureáz, savanyú foszfatáz, arilszulfatáz, pirazinamidáz, béta-galaktozidáz enzimek kimutatása, a niacin-termelés, a Tween-80-hidrolízis és a különféle szénamidok (acetamid, izonikotinamid, benzamid stb.) bontásának a vizsgálata. A M. bovis törzsek megkülönböztethetők a M. tuberculosis törzsektől egyebek mellett azáltal, hogy az előbbiek a nitrátot nem redukálják, pirazin-amidáz enzimet és niacint nem termelnek, míg az utóbbiak a nitrátot redukálják, pirazin-amidáz enzimet és niacint termelnek. A M. avium törzsek az előbbi próbák közül csak a pirazin-amidáz-próbában pozitívak. Antigénszerkezet. A mycobacteriumok sejtfalában és a sejttestben is számos antigénhatású anyag található. A sejtfal antigénhatású anyagainak többsége glükolipid (a peptidoglükán vázhoz és a hosszú szénláncú mikolsavakhoz kapcsolódó arabinóz-galaktóz, arabinóz-mannóz stb. komplexek), kisebb része lipoprotein (szabad zsírsavakhoz, mikolsavakhoz, viaszokhoz stb. kapcsolódó polipeptidek, kis molekulatömegű fehérjék). A mycobacteriumok szoros antigénszerkezeti rokonságban állnak egymással. Immun-elektroforézises módszerekkel a M. tuberculosis kivonatában legalább 60, a M. bovis BCG-törzsében 48, a M. paratuberculosiséban pedig 44 antigénkomponens volt kimutatható. A M. bovis antigénszerkezetileg szorosan rokon a M. tuberculosisszal, attól csak nagyon érzékeny módszerekkel különböztethető meg. A M. paratuberculosisban talált antigének közül 24 kimutatható volt a M. bovis BCG-törzsében, 27 pedig a M. avium törzsekben is. A M. bovis antigénkomponensei közül 11 megtalálható volt a fakultatív pathogen M. scrofulaceumban, 5 pedig a saprophyta M. phleiben is. A M. avium és néhány más fakultatív pathogen Mycobacterium faj felületi antigénjeik alapján agglutinációs próbával szerocsoportokba sorolhatók. A szintetikus leves táptalajokban elszaporított Mycobacterium tenyészetek felfőzött szűrletéből állítják elő a tuberkulint, amely a mycobacteriumok különböző antigénjeit (hapténjeit) tartalmazza. A nyers tuberkulin triklórecetsavas, acetonos és éteres tisztításával nyerjük a PPD-tuberkulint (purified protein derivate). A PPD antigenitásáért a benne lévő alacsony molekulatömegű peptidek (tuberkulo-proteinek) felelősek. A humán, a bovin, az avian tuberkulin és a paratuberkulin a megfelelő Mycobacterium faj tenyészetéből készül. A mycobacteriumok osztályozása. A Mycobacterium nemzetségen belül jelenleg mintegy 80 fajt különböztetünk meg. Ezeknek egy része kórokozó, többségük pedig fakultatív pathogen vagy saprophyta. Kórokozó mycobacteriumok. Ide tartozik a M. tuberculosis, a M. africanum, a M. bovis, a M. microti, a M. avium, a M. paratuberculosis, a M. lepraemurium és a M. leprae. A M. aviumot human szempontból a fakultatív pathogenek közé sorolják. Újabban a M. aviumot, a M. paratuberculosist és egy M. silvaticumnak nevezett, örvös galambból izolált törzset egy fajnak tekintik és a M. aviumon belül, három alfajként különböztetik meg őket, M. avium subsp. avium, M. avium subsp. paratuberculosis stb. néven. Fakultatív pathogen (atípusos) és saprophyta mycobacteriumok. Pigmenttermelésük és szaporodásuk gyorsasága alapján további négy csoportra oszthatók. 91
112 Részletes bakteriológia I. Fotokromogének (fény jelenlétében pigmenteket termelnek): M. kansasii, M. marinum, M. simiae stb. II. Szkotokromogének (sötétben tenyésztve is termelnek pigmenteket): M. scrofulaceum, M. szulgai, M. farcinogenes, M. gordonae stb. III. Nem pigmenttermelők: M. intracellulare, M. xenopi, M. terrae, M. gastri stb. IV. Gyorsan növekvők (telepeik 7 napon belül kifejlődnek): M. fortuitum, M. porcinum, M. flavescens, M. phlei, M. vaccae, M. smegmatis stb. Ellenálló képesség. A mycobacteriumok a nem spórás baktériumok között a legellenállóbbak. Nagy ellenálló képességüket a sejtfalban levő lipoidoknak köszönhetik. Beszáradt váladékokban, trágyában hónapokig életképesek maradnak. A tejben és a tejtermékekben ugyancsak hetekig, hónapokig megőrzik fertőzőképességüket. A tejben 80 C-on 20 perc, a forrás hőmérsékletén pedig már néhány perc alatt elpusztulnak. A fertőtlenítőszerek közül a klórlúg és a formalin 3 5%-os oldata 2 3 óra alatt, a szervesjód-tartalmú szerek 0,5 1%-os oldata pedig in vitro perc alatt elöli a mycobacteriumokat. Pathogenitás. A M. tuberculosis az ember gümőkórjának az okozója, megbetegíti azonban a sertést, a kutyát, a macskát, továbbá a szobai díszmadarak közül a kanárimadarat és a papagájt (kakadut) is. Szarvasmarhába jutva rendszerint csak rövid ideig tartó, gyógyulásra hajlamos produktív folyamatokat idéz elő. A M. africanum az ember gümőkórjának előidézésében játszik szerepet Afrikában. A M. bovis a szarvasmarha, más házi- és vadon élő kérődzők, a sertés, a kutya, a macska stb. gümókórjának az okozója. Megbetegíti az embert is. A M. bovis egyik törzsét epetartalmú talajon sorozatosan passzálva állították elő az attenuált BCG (Bacillus Calmette et Guérin) törzset, amely az ember védőoltására szolgál. A M. microti (vole bacilus) a pockok és más rágcsálók gümőkórját idézi elő. Antigénszerkezetileg gyakorlatilag azonos a M. tuberculosisszal. A M. avium a madarakban idéz elő gümőkórt, hosszabb-rövidebb ideig azonban megtelepedhet az emlős háziállatokban is. A M. paratuberculosis szarvasmarhában, ritkábban juhban, kecskében és vadon élő kérődzőkben idéz elő idült, proliferatív bélgyulladást (paratuberculosist). A M. lepaemurium az egér leprájának az előidézője, megbetígíti azonban a macskát is. A M. leprae az ember leprájának az okozója. A fakultatív pathogen mycobacteriumok egy része emberben és háziállatokban a gümókórhoz hasonló elváltozásokat idéz elő (innen ered az atípusos mycobacteriumok vagy nem tuberculosist okozó mycobacteriumok elnevezés), más részük azonban, bár a szövetek között alkalmilag megtelepedhet, gyakorlatilag saprophyta (M. phlei, M. smegmatis, M. terrae, M. triviale stb.). A fakultatív pathogenek a háziállatok közül főként sertésben és szarvasmarhában idéznek elő rendszerint lokális, a bélre, bélfodorra, ritkábban nyirokcsomókra, szarvasmarhában esetenként a bőrre korlátozódó folyamatokat. A fakultatív pathogenekkel való fertőződés megnehezíti a gümőkór diagnosztizálásához használt allergiás próbák értékelését. Fakultatív pathogen mycobacteriumok idézhetnek elő generalizált gümőkórt állatkertben tartott madarakban is. A fakultatív pathogen mycobacteriumok egyes törzsei (pl. a M. fortuitum, a M. marinum) idézik elő a hidegvérű állatok (hal, béka, kígyó stb.) gümőkórját. A kísérleti állatoltás igénybe vehető a M. tuberculosis, a M. bovis és a M. avium kimutatására a tenyésztési eljárások helyett vagy azokkal párhuzamosan akkor is, ha valamely anyagban a mikroszkópos vizsgálattal nem tudtunk mycobacteriumokat kimutatni. Erre a célra rendszerint tengerimalacot, nyulat és csirkét használunk. A M. tuberculosis bőr alá oltva, 6 12 hét alatt, generalizált gümőkórban elpusztítja a tengerimalacot, de csupán helyi elváltozásokat idéz elő nyúlban, a tyúkot pedig nem betegíti meg. A M. bovis generalizált gümőkórt hoz létre mind a tengerimalacban, mind pedig a nyúlban, de nem betegíti meg a tyúkot. Végül a M. avium csak a tyúkot betegíti meg, a tengerimalacot egyáltalán nem, a nyúlban pedig legfeljebb helyi elváltozásokat idéz elő. A bőr alá vagy izomba fertőzött, fogékony kísérleti állatok megfelelő környéki nyirokcsomói 1 2 hét múlva megduzzadnak, majd 8 10 hét elteltével a kísérleti állatok elhullásakor vagy leölésekor a lépben, a májban és 92
113 Részletes bakteriológia más szervekben gyulladásos, elhalásos gócok, gümők találhatók. Az elhullott kísérleti állatokból a mycobacteriumok mikroszkópos vizsgálattal és tenyésztéssel egyaránt kimutathatók. M. paratuberculosis rágcsálók hasüregébe való befecskendezése után 1 2 hónap múlva a szervekben gyulladásos, elhalásos gócok alakulnak ki. A fakultatív pathogen mycobacteriumok a kísérleti állatokat nem betegítik meg Nocardia Főként a talajban élő, a gombákhoz hasonlóan elágazódó fonalakat képező, Gram-pozitív baktériumok. A fajok egy része a mycobacteriumokhoz hasonlóan a sejtfal mikolsavtartalma miatt saválló festődésű. A hosszú fonalak feltöredezésével szaporodnak. Obligát aerobok, agaron, véresagaron és leves táptalajok felületén 1 3 nap alatt lencsényi vagy nagyobb, bőrszerű, ráncos, szürkéssárga vagy pigmentált telepekben fejlődnek. A pigmenttermelő törzsek telepeinek a színe a világossárgától a vörösön át a barnáig változik, festékanyaguk vízben nem oldódó karotinoid. Kataláz-pozitívak, oxidáz-negatívak, a szénhidrátokat oxidatív módon bontják. A saválló Nocardia törzsek megkülönböztethetők a mycobacteriumoktól azáltal, hogy a nocardiák telepei néhány nap alatt kifejlődnek, a levegőbe és a táptalajba nyúló, elágazódó fonalakat képeznek. A levegőbe fölemelkedő fonalak Ziehl Neelsen szerint festve a savas-alkoholos kivonás során elszíntelenednek. A nocardiák anyagcseréje a mycobacteriumokénál élénkebb, a szénhidrátokat és a szénamidokat gyorsan és szobahőn is bontják, nitrofenol-oxidázt termelnek, de nem bontják a kazeint és nem képeznek arilszulfatázt. A törzsek zöme fakultatív pathogen vagy saprophyta, kórtani jelentősége csak néhány fajnak van Nocardia asteroides Morfológia. Hosszú, elágazódó, egyenetlen festődésű, mérsékelten saválló fonalak. A fonalak gyakran coccoid alakokká töredeznek szét. Tenyésztés. Közönséges és véresagaron 37 C-on, sárga vagy narancsvörös színű, szabálytalan, csillag alakú telepeket képez. Levegőbe fölemelkedő fonalak rendszerint egyáltalán nem vagy legfeljebb a telepek szélén képződnek. Szérumtartalmú leves felületén vékony hártya, alján pedig finom, pelyhes üledék képződik, a levestenyészet nem zavarosodik meg. Biokémiai sajátságok. Ureáz-pozitív, a nitrátokat nitritté redukálja, glükózból és glicerinből savat képez, de nem bontja a maltózt, a mannitot, az inozitot, ezenkívül a zselatint és a kazeint sem. Pathogenitás. Fakultatív pathogen, alkalmanként szarvasmarhában, ritkábban kutyában, macskában okoz idült gennyesedéssel, granulomatosissal járó folyamatokat a bőrben, a bőr alatti kötőszövetben, a tőgyben stb. A laboratóriumi állatok közül egérre nem pathogen, de a nyúlban és a tengerimalacban a fertőzés megered Rhodococcus A rhodococcusok Gram-pozitív, többségükben talajlakó baktériumok, közülük kórtani szempontból a Rhodococcus equi (korábbi nevén Corynebacterium equi) fontos Rhodococcus equi Coccoid, vagy rövid 1 3 µm hosszú pálcikák. Idősebb tenyészeteiben saválló alakok is előfordulnak. Aerob, közönséges agaron is jól szaporodik, óra alatt apró, áttetsző, cseppszerű, nyálkás telepeket alkotnak, amelyek néhány nap múlva megnagyobbodnak, sűrű tenyészetben gyakran össze is folynak, s pigmenttermelésük következtében rózsaszínűek (lazacszínűek). Levesbe oltva egyenletes zavarosodást okoznak. Kataláz-pozitív, a nitrátot redukálja, ureáz-pozitív, a szacharózt és a trehalózt elbontja. Nyálkás, nyúlós burkuk van, amely poliszacharid, ennek alapján agglutinációs próbával ez ideig 7 szerocsoportba sorolhatók. A nálunk csikókból izolált törzsek mindegyike az 1-es szerocsoportba tartozott. Természetes előfordulási helye a talaj, a növényevő állatok trágyája, alkalmanként a ló, szarvasmarha, juh, sertés emésztőcsatornája. Fiatal, 1 4 hónapos csikókban okoz tályogképződéssel járó bronchopneumoniát, 93
114 Részletes bakteriológia ritkábban a bélfal és a bélfodri nyirokcsomók gennyes gyulladását, de megbetegítheti a szarvasmarhát, a sertést és az immunszuppressziónak kitett embert is Dermatophilus congolensis A Dermatophilus nemzetség egyetlen faja. Gram-pozitív, hosszú, elágazódó fonalakat képző baktérium(37. ábra). A fonalak haránt irányban feltöredeznek, ezekből alakulnak ki a több sorban egymás mellett helyeződő coccoid, csillós zoospórák. 37. ábra - Dermatophilus congolensis agartenyészetből. Elágazódó, haránt feltöredezett fonalak (Gram-festés, 1250 ) Tenyésztés. Véresagaron, 10% CO 2-ot is tartalmazó légtérben tenyésztve a telepek a második napon jelennek meg, a 3 4 napos tenyészetekben 2 5 mm átmérőjűek, besüllyednek az agarba, felületük ráncolt, sárgás színűek. A telepek alatt és körül erős béta-hemolízises udvar alakul ki. Biokémiai tulajdonságok. Kataláz-pozitív, ureáz-pozitív, elfolyósítja a zselatint, az alvasztott vérsavót és a kazeint. Glükózból, fruktózból, maltózból savat termel. Ellenálló képesség. A zoospórák ellenálló képessége nagy, a bőrről levált pörkökben, gyapjúban hetekig életképesek maradnak, ezekkel történik a fertőződés. Pathogenitás. A D. congolensis juhokban, szarvasmarhában és számos más állatfajban savós, pörkképződéssel járó idült bőrgyulladást okoz. A kórokozó iránt fogékony az ember is Enterobacteriumok Az enterobacteriumok (bélbaktériumok) igen széles körben elterjedtek, többségük természetes lakója az ember és az állatok bélcsatornájának, főleg a vastagbeleknek, de megtalálhatók a talajban, a növényzeten, a felszíni vizekben, szennyvizekben, rothadó anyagokban is. Morfológia. Rendszerint körülcsillós, ritkán csillótlan, spórát nem képező, 1 6 µm hosszú, pálcika alakú, Gram-negatív baktériumok. Fukszinnal vagy bármely más, a bakteriológiában használt festékkel jól megfesthetők. 94
115 Részletes bakteriológia Tenyésztés. Aerob, fakultatív anaerob baktériumok, 37 C-on, de többségük C között is, a bakteriológiában használt legtöbb táptalajon gyorsan és jól elszaporítható. Közönséges agar felületén óra alatt 1 2 mm átmérőjű, enyhén domború vagy lapos, nagyjából egyforma telepeket képeznek. Vizsgálati anyagokból (bélsárból, vizeletből, hullarészekből, élelmiszermintákból) való kitenyésztésükre szelektív és differenciáló táptalajokat használunk. Sokféle ilyen táptalaj ismert. Közülük a laktózt elbontó fajok szelektív izolálására leggyakrabban a brómtimolkék-laktóz, a lakmusz-laktóz (Drigalski-agar), a neutrálvörös-laktóz és epesavas sót tartalmazó (Mac Conkey) agart vagy az eozin-metilénkék-laktóz agart használjuk. Az előbbi három táptalaj a Gram-pozitív fajok szaporodásának a visszaszorítására kevés kristályibolyát is tartalmaz. A laktózt elbontó fajok a laktózból savat termelnek, telepeik körül a táptalaj ph-ja és ezáltal színe is megváltozik, így megkülönböztethetők a laktózt nem bontó fajoktól. Ez utóbbiak szelektív izolálására szolgál a brillantzöldfenolvörös-laktóz, a bizmut-szulfit, a dezoxikolát-citrát és több más táptalaj. A brillantzöld és a bizmut-szultit agaron főleg a salmonellák nőnek. A shigellák az előbbi két táptalajon nem szaporodnak, izolálásukra dezoxikolát-citrát táptalajok használatosak. A differenciáló és szelektív táptalajokról izolált törzseket a biokémiai tulajdonságok vizsgálata céljából rendszerint több tulajdonság egyidejű vizsgálatára alkalmas politrop táptalajokba oltjuk. A politrop táptalajok egyik változata pl. a gáztermelés, a laktóz- és a glükózbontás, a kénhidrogén-termelés és a karbamidbontás együttes kimutatására alkalmas. Biokémiai sajátságok. Biokémiailag, kevés kivételtől eltekintve, igen aktívak. Kataláz-pozitívok, oxidáznegatívok, a nitrátokat nitritté redukálják, a glükózt mind aerob, mind anaerob viszonyok között elbontják, s belőle nemcsak savat, hanem rendszerint gázt is képeznek. Az enterobacteriumokhoz igen sok nemzetséget sorolunk. A nemzetségbe sorolás a biokémiai tulajdonságok, a nemzetségen belül a fajokba sorolás pedig a biokémiai és szerológiai sajátságok együttes figyelembevételével történik. Az egyes fajokba tartozó törzsek O-antigénjeik alapján szerocsoportokba, O-, K- (burok-) és H- (csilló- ) antigénjeik együttes ismerete alapján pedig szerotípusokba sorolhatók. Egyes szerotípusokon belül a törzsek fermentációs tulajdonságai alapján biotípusok, fágérzékenységük alapján fágtípusok stb. különíthetők el. Az enterobacteriumok szoros biokémiai és antigénszerkezeti rokonságban állnak egymással. Az orvosi, állatorvosi szempontból fontos enterobacterium nemzetségek megkülönböztetésére alkalmas főbb biokémiai tulajdonságokat az 5. táblázat tartalmazza. A táblázatban feltüntetett biokémiai sajátságok a nemzetségbe tartozó fajok többségét jellemzik, de gyakran előfordulnak kivételek, továbbá az egyes nemzetségek közötti átmenetet képviselő törzsek is. A laktózt bontó enterobacteriumokat (Escherichia, Klebsiella, Enterobacter fajok), szemben a laktózt nem bontó (Shigella, Salmonella, Proteus) fajokkal összefoglalóan gyakran coliform baktériumok névvel is illetik. 5. táblázat - A fontosabb Enterobacterium nemzetségek biokémiai tulajdonságai Próba Escherichid ea Shigell a Edwardsiel la Salmonell a Citrobacte r Klebsiell a Enterobact er Serratia Proteu s Yersini a Indol + /+ +/ /+ +/ /+ Metilvörös + + +/ + + /+ + + Voges Proskauer Citrátfelhasznál ás / / H 2S-termelés +/ + +/ +/ Ureáz /+ + /+ /+ + + Növekedés KCN-talajon
116 Részletes bakteriológia Lizin- dekarboxiláz Zselatinelfolyó sítás +/ / + /+ /+ + +/ Mozgás +/ +/ C Fenilalanin- dezamináz + Laktóz + +/ + + Mannit + / /+ + Ellenálló képesség. Az enterobacteriumok ellenálló képessége nem nagy. Vízben, szennyvízben, bélsárban stb. hetekig, hónapokig életképesek ugyan, beszáradva azonban néhány nap alatt elpusztulnak, 60 C-os hő perc alatt, az 1%-os klórlúg vagy formalin pedig 5 10 perc alatt elöli őket. Pathogenitás. Az enterobacteriumok között vannak pathogen fajok, egy jelentős részük fakultatív pathogen, túlnyomó többségük pedig saprophyta. A továbbiakban csak azokat a nemzetségeket és fajokat említjük, amelyek állatorvosi vagy orvosi szempontból fontosak Escherichia Az ide tartozó fajok közül az E. colinak van jelentősége Escherichia coli Az ebbe a fajba tartozó baktériumok természetes viszonyok között megtalálhatók az ember és az állatok bélcsatornájában, ahol az aerob, fakultatív anaerob baktériumflóra részét képezik. A születéskor és az azt követő napokban szájon át jutnak be s telepszenek meg, elsősorban a vastagbelekben. Morfológia. Rendszerint körülcsillós, ritkán csilló nélküli, 2 3 µm hosszú pálcikák (38. ábra), a törzsek egy jelentős részének a felületén fimbriák (pilusok) is találhatók. A törzsek egy további része vékony tokot, vagy vastag burkot képez. 38. ábra - Escherichia coli telepek neutrálvörös-laktóz agaron 96
117 Részletes bakteriológia Tenyésztés. Közönséges agaron, aerob és anaerob viszonyok között egyaránt, 24 óra alatt 1 2 mm átmérőjű telepeket képez. (38. ábra) Laktóz-lakmusz agaron telepei a laktózbontás miatt pirosak, brómtimolkék-laktóz agaron pedig sárgák. A szopósborjakban hasmenést okozó törzsek zöme burkos, a táptalajokon nyálkás telepeket képez. Az E. coli okozta hasmenésben (lásd később) beteg vagy elhullott szopós- és választott malacokból izolált törzsek nagy többsége véresagaron béta-hemolízist okoz. A közönséges levest egyenletesen megzavarosítják. Biokémiai sajátságok. Triptofánból indolt termelnek, a metilvörös próbában pozitívak, laktózból savat és gázt is képeznek, de találhatók közöttük a laktózt csak lassan vagy egyáltalán nem bontó törzsek is (5. táblázat). Antigénszerkezet. Az E. coli baktériumok O-, K-, H- és F- (fimbria) antigénjeik alapján szerotípusokba sorolhatók. Az O-antigének a baktériumok sejtfalában található típusspecifikus lipopoliszacharidok. A K- antigének tok- vagy burokantigének, kémiailag (savanyú) poliszacharidok. Közülük azok, amelyek antigenitásukat és ellenanyagkötő képességüket 121 C-on 2 óráig történő autoklávozás során sem vesztik el, a K(A)-antigének. Az ilyen antigénű törzsek telepei nyálkásak, nyúlósak. A korábban K-antigének közé sorolt fimbria-antigéneket újabban önálló antigéncsoportként F betűvel jelölik. A fimbria-antigének egy vagy több komponensből álló fehérjék. Változó összeállításban agglutinálják az ember és a különféle állatfajok vörösvérsejtjeit, továbbá képessé teszik az E. coli baktériumokat a hámsejtekhez való tapadásra (adhézió), ezért többségük virulenciafaktorként (kolonizációs faktorok) szolgál. A H-antigének monofázisos, fehérje természetű csillóantigének. Ez ideig legalább 173 O-, 80 K-, 56 H- és 18 F-antigén ismert. Mivel az egyes antigének egymással szabadon kombinálódva fordulhatnak elő, igen nagyszámú E. coli-szerotípus létezik. Az egyes szerotípusokat antigénszerkezeti formulájukkal jelöljük pl. E. coli O101:K30(A), F5:H9. A fimbria-antigének közül az F 1-gyel jelölt, az ún. 1-es típusú vagy közönséges fimbria az E. coli törzsek túlnyomó többségének a felületén jelen van, az általa okozott hemagglutináció mannózzal gátolható. A többi fimbria által okozott hemagglutináció mannózzal nem gátolható (mannózrezisztens hemagglutináció). Ez utóbbi fimbriák adhéziós képessége bizonyos mértékű faji és szervi specificitást mutat. Közülük az F 2 és az F 3-as antigének az emberben hasmenést előidéző törzsek felületén találhatók (humán kolonizációs faktorok), az F4-es azonos a korábbi K88-as antigénnel, és zömmel a sertésben hasmenést előidéző törzsek hordozzák, az F5-ös azonos a korábbi K99-es antigénnel, a borjakat megbetegítő törzsek hordozzák, az F 6-os ugyancsak főleg a sertésekben enteritist okozó törzseken fordul elő, míg az F 7 F 16-ig számozott fimbriájú E. coli törzsek főleg emberben okoznak húgyúti fertőzéseket, ritkán septikaemiát. A szopósborjakból származó E. coli törzsekben találtak egy F 41-nek jelölt fimbriát is, amely többnyire a K 99-es (F 5-ös) antigénnel együtt fordul elő. Az F 17-es fimbriájú törzseket eredetileg E. coli-hasmenésben, illetve septikaemiában szenvedő borjakból izolálták, de előfordulnak bárányban és más állatfajokban is, míg az F 18-as fimbriát a sertés oedemabetegségét előidéző 97
118 Részletes bakteriológia törzsek hordozzák. A fentieken kívül az utóbbi években számos további fimbria vált ismertté, amelyek még besorolásra várnak. Egyes fimbria-antigéneken belül újabb alcsoportok különíthetők el (K 88 a, b, c stb.) A fimbriák ellen termelt típusspecifikus ellenanyagokkal az E. coli törzsek adhéziója (és ezáltal a kolonizáció) gátolható. In vitro tenyésztve a törzsek nem mindegyike képez fimbriákat, erre a célra speciális táptalajokat használunk. Pathogenitás. Az E. coli baktériumok fakultatív pathogenek, leggyakrabban fiatal állatokat betegítenek meg. Újszülött borjakban és malacokban hasmenéssel járó betegséget (coli-hasmenést), ritkán septikaemiát, választott malacokban ugyancsak hasmenéssel járó bélgyulladást vagy oedema betegséget idéznek elő. Gyakran okoznak tehenekben tőgygyulladást, kocákban tőgy- és méhgyulladást. Szopósbárányokban ugyanúgy mint szopósborjakban coli-hasmenést, ritkán septikaemiát idéznek elő. Megbetegíthetik a házinyulakat, amelyekben vízszerű hasmenést, illetve septikaemiát okoznak. Esetenként okozhatnak kutyában, ritkábban macskában újszülött korban septikaemiát, felnőttekben pedig húgyúti fertőzéseket, metritist. Gyakran okoznak betegséget baromfiállományokban is. Napos- és növendékcsibékben septikaemiát, felnőtt állatokban pedig többnyire egyegy szervre korlátozódó betegségeket (légzsákgyulladást, szívburokgyulladást, perihepatitist, coligranulomatosist stb.) okoznak. Alkalmanként azonban más állatfajokat is megbetegítenek. Az E. coli baktériumok bizonyos szerocsoportjai megbetegítik az embert is, újszülöttekben enteritist, septikaemiát, gyermekekben és felnőttekben enteritist és húgyúti fertőzéseket, ritkán egyéb kórképeket idéznek elő. A különféle betegségekből izolált E. coli törzsek pathogenitásának a megítélése meglehetősen nehéz. Bizonyos O szerocsoportokba tartozó törzsek főleg az embert, mások pedig az állatokat betegítik meg. Az E. coli törzsek többsége hasmenést okoz, másik része azonban hasmenéssel együtt vagy anélkül septikaemiát hoz létre, illetve egyes szervekre korlátozódó betegséget idéz elő. A pathogennek tekintett törzsek egy részénél ismerjük a virulenciafaktorokat, ezek az esetek többségében fimbriák és különféle citotoxinok. A burok, tok poliszacharid K-antigénjei antiphagocyta hatásúak, és megvédik a sejtfalat a komplement hatásától. A K-antigének jelenléte megakadályozza az élő baktériumok agglutinációját homológ O- immunsavókban. Az E. coli törzsek bizonyos szerocsoportjai hasmenést képesek előidézni anélkül, hogy ez a képességük különböző, legalábbis eddig ismert virulenciafaktorokhoz köthető lenne. Az ilyen törzsek is képesek a bélnyálkahártyához adszorbeálódni, a hámsejtek bolyhait tönkretenni és a hámsejtekben bizonyos szerkezeti és fiziológiai változásokat előidézni, amelyek a felszívódás romlásához és a bél üregébe történő folyadékkiáramláshoz vezetnek (enteropathogen E. coli törzsek). A törzsek egy másik része enterotoxinokat termel (enterotoxikus E. coli törzsek) és egyúttal a tapadást elősegítő, különféle fimbriákat is hordoz. Az enterotoxinok az E. coli törzsek tápfolyadékában és a baktériumtestben egyaránt kimutatható toxikus anyagok, exotoxinok. Ez ideig kétféle, egy hőstabil (ST) és egy hőlabilis (LT) toxin ismert. Az enterotoxikus E. coli törzsek vagy csupán ST-t vagy ST-t és LT-t egyaránt termelnek. Az LT Da molekulatömegű fehérje, toxoiddá alakítható, vele szemben nyulakban immunsavó termelhető, amellyel valamennyi E. coli törzs által termelt LT neutralizálható. Az LT szerkezetében és funkciójában rokon a Vibrio cholerae törzsek által termelt choleratoxinnal. Az ST kis molekulatömegű ( Da), gyenge antigénhatású peptid. Mindkét enterotoxin a bélnyálkahártya hámsejtjeinek adenil- (guanil-)cikláz rendszerét aktiválja, ami által jelentős folyadékkiválasztást idéz elő. Mindkét enterotoxint plazmid kódolja. Az E. coli törzsek enterotoxin-termelése kimutatható in vivo lekötött bélkacsszegmentekben, szopós egerekben, a sejttenyészetekre gyakorolt citotoxikus hatásuk alapján vagy újabban monoklonális ellenanyagokkal működő ELISA vagy a toxintermelést kódoló plazmidok specifikus DNS probe-okkal való vizsgálata alapján. Az enterotoxint termelő törzseknek a bélhámsejtekhez való kötődését a különböző fimbriák teszik lehetővé. Egyes E. coli törzsek termelnek Vero-sejtekre (majomvese eredetű sejtvonal) nézve toxikus anyagokat, citotoxinokat (Vero-toxinok), amelyek hatása a Shigella fajok által termelt Shiga-toxinhoz hasonló (SLT), a gazdasejtek riboszómáihoz kötődve gátolják a fehérjeszintézist. A verotoxinok (VT) vagy SLT toxinok is legalább kétfélék. Verotoxinokat termelő (pl. O157-es) E. coli törzsek idézik elő emberben a haemorrhagiás colitist (enterohaemorrhagiás E. coli) és a hemolitikus uraemiás szindrómát. Ugyanezek a törzsek borjakban is okozhatnak haemorrhagiás colitist. Verotoxinokat termelő törzsek jelen lehetnek a különféle állatfajok, szarvasmarha, juh, kecske, ló, kutya emésztőcsatornájában klinikai tünetek nélkül is. 98
119 Részletes bakteriológia A sertésben oedemabetegséget előidéző E. coli törzsek termelik az egyik vero-toxint (VT 2-t), amelyik a bélből felszívódva (E. coli enterotoxaemia) a vérerek falának endothelsejtjeit károsítva oedemát idéz elő. Egyes, emberben, borjakban, bárányokban és malacokban előforduló, haemorrhagias enterocolitist előidéző törzsek, amelyek igen különféle szerocsoportokba tartozhatnak, termelnek citotoxikus necrotizáló faktornak (CNF) nevezett toxinokat. A toxinok legalább kétfélék (CNF 1 és CNF 2), molekulatömegük és Da. Ezek a toxinok hőlabilisak, toxikusak Vero- és HeLa-sejtekre, letalisak egérre, csirkére és borjakra, nyúlbőrbe oltva pedig helyileg necrosist és testszerte vérzéseket okoznak. Az E. coli törzsek egy része képes bejutni a vastagbél nyálkahártyájába és az okozott hámelhalás következtében hasmenést előidézni (enteroinvasiv E. coli törzsek). E törzsek pathogenitása a sejtfal külső rétegében található különféle alacsony molekulatömegű fehérjékkel áll összefüggésben. A septikaemiát okozó törzsek enterotoxinokat nem termelnek, kórhatásukat egyebek mellett a bejutott baktériumok szétesésekor felszabaduló endotoxinoknak köszönhetik. Egyelőre azonban nem tudjuk, hogy pontosan melyek azok a faktorok, amelyek a törzseket képessé teszik arra, hogy a keringésbe bejussanak. A septikaemiát előidéző törzsek között gyakran szerepelnek az O78:K80, továbbá a különböző O-antigénű, K1 burokantigénű törzsek. Az egyes állatfajokban betegséget előidéző E. coli törzsek rendszerint csupán néhány OK szerocsoportba vagy szerotípusba tartoznak, s az egyes szerotípusok előfordulási gyakorisága területenként és időszakonként is változhat. Szopós malacokban nálunk leggyakrabban az O149:K91, 88, az O147:K89, 88, az O8, az O138:K85, 88, O141, O157 és néhány más törzs, szopós borjakban az O101:K28(A), 99, az O101:K30(A), 99, továbbá az O20, O21, O8, O9 és O78-as törzsek, csirkében és tyúkban az O1:K1, O2:K2, O78:K80 és még néhány más törzs, házinyulakban pedig rendszerint az O132, O14, O128 és néhány más törzs idéz elő leggyakrabban betegséget. A malacok választáskori hasmenését rendszerint ugyanazok az O szerocsoportú E. coli törzsek okozzák, mint a szopóskori hasmenést, a felületükön azonban rendszerint a szopósmalacokban előforduló törzsekétől eltérő, eddig csak részben ismert fimbriák vannak jelen. Az oedemabetegséget rendszerint O138, O139:K12: :F18, vagy O141:K85-ös törzsek idézik elő. A szopós malacok coli-hasmenését okozó törzsek mintegy háromnegyede hordozza a K 88 (F 4) fimbria antigént, de előfordulnak F 6-os és ritkán más fimbria-antigénű törzsek is. A szopós borjakat megbetegítő törzsek mintegy felében pedig a K 99 (F 5-ös), továbbá a F 41-es antigén van jelen. A borjak coli-hasmenését előidéző törzsek csak ST-t termelnek. A csirkében septikaemiát előidéző törzsek gyakran hordozzák az F 1-es fimbriát. Az ember E. coli fertőzéseit rendszerint más szerocsoportú törzsek idézik elő, mint amelyek az állatokat megbetegítik, egyes háziállatokban, pl. a szarvasmarha bélcsatornájában és esetenként a tejben is előforduló verotoxinokat termelő (pl. O157-es) törzsek azonban emberbe bejutva haemorrhagiás enterocolitist idézhetnek elő. Bár az E. coli baktériumok fakultatív pathogenek, újszülött (főleg colostrumot nem kapott) malacok és borjak azonban per os fertőzve életük első órájában többnyire sikerrel megbetegíthetők, amikor is a természetes betegséggel egyező kórkép alakul ki. A laboratóriumi állatok közül a fehér egerek iv. fertőzve legfeljebb nagy adagok hatására pusztulnak el Klebsiella A klebsiellák közül a K. pneumoniae megtalálható az ember és az állatok emésztőcsatornájában, továbbá gyakran a légutak és a nemi szervek váladékaiban, a genusba tartozó további fajok a talajban vagy a természetes vizekben élő saprophyták Klebsiella pneumoniae Morfológia. Rövid, csilló nélküli pálcikák, vaskos poliszacharid burkuk van. Tenyésztés. Közönséges agaron és az enterobacteriumok tenyésztésére használt szelektív és differenciáló táptalajokon is, a törzstől és a táptalaj szénhidráttartalmától függően erősen domború, átlátszatlan, nyúlós, nyálkás telepeket képez. A leves táptalajokban egyenletes, sűrű zavarosodást okoz. 99
120 Részletes bakteriológia Biokémiai sajátságok. A K. pneumoniaen belül három alfajt különböztetünk meg. A többi bélbaktériumtól egyebek mellett megkülönböztethető azon az alapon, hogy nem mozog, a Voges Proskauer próbában pozitív, ureáz enzimet termel, a laktózt elbontja (5. táblázat). Antigénszerkezet. A klebsiellákat a burokantigénjeik alapján soroljuk csoportokba, ezideig legalább 82 buroktípusuk ismert. Pathogenitás. A K. pneumoniae a bélcsatorna természetes lakója, bár jóval kisebb számban fordul ott elő, mint pl. az E. coli. Saprophyta, illetve fakultatív pathogen, alkalmanként azonban emberben légúti fertőzéseket, tüdőgyulladást, húgyúti fertőzéseket, az állatok közül pedig szarvasmarhában tőgygyulladást, lóban pedig metritist okoz. Gyakran kitenyészthetők klinikailag egészséges mének ondójából is Enterobacter Az ide tartozó fajok (E. cloacae, E. aerogenes stb.) megtalálhatók az ember és az állatok bélcsatornájában, a természetes vizekben, a talajban, élelmiszerekben stb. Biokémiailag igen aktívak, élénken mozognak, a Voges Proskauer próbában pozitívak, a laktózt elbontják (5. táblázat). Saprophyták, esetenként azonban emberben légúti és húgyúti fertőzéseket, kivételesen septikaemiát okozhatnak. A K. pneumoniaevel együtt gyakran kitenyészthetők kancák hüvelyváladékából, illetve a mének ondójából Edwardsiella Rövid pálcikák, a fajok egy része csillós. Tenyésztésükhöz aminosavakat és vitaminokat igényelnek, telepeik 24 óra elteltével kisebbek, mint a többi enterobacterium telepei. Biokémiailag igen heterogének (5. táblázat). Kórtani jelentőségüket csak kevéssé ismerjük. Fakultatív pathogenek, illetve saprophyták. Főleg hidegvérű állatokból (gyíkokból, békákból, halakból stb.) és természetes vizekből izolálhatók. Az ide tartozó fajok közül az E. tarda izolálható különféle állatfajok (háziállatok, madarak, gyíkok, halak stb.), de alkalmanként az ember bélcsatornájából is. Emberben ritkán hasmenést, sebfertőzést okozhat, de megbetegítheti az angolnákat és egyéb halfajokat is. Az E. ictaluri nehezen tenyészthető, a szokásos biokémiai próbák többségében negatív eredményt ad, tenyésztett csatornaharcsákban (Ictalurus punctatus), ritkán egyéb halfajokban idéz elő tömeges elhullással járó septikaemiát Shigella A Shigella nemzetség tagjai (a S. dysenteriae, a S. flexneri, a S. boydii és a S. sonnei) 2 3 µm hosszú, csilló nélküli pálcikák. Az emberi vérhas (lázzal, nyálkás, véres hasmenéssel járó vastagbélgyulladás) okozói. A háziállatokban nem fordulnak elő, endémiás jelleggel azonban vérhast idézhetnek elő állatkertekben tartott majmokban és egyéb főemlősökben Salmonella A salmonellák előfordulnak az ember és az állatok bélcsatornájában, de gyakran megtalálhatók felszíni vizekben, szennyvizekben, állati eredetű takarmányokban (húslisztben, hallisztben stb.), élelmiszerekben is. Morfológia. A salmonellák 2 5 µm hosszú, a S. gallinarum és a S. pullorum kivételével, csillós pálcikák. Tenyésztés. Egyszerű táptalajokon is jól szaporodnak és a többi enterobacteriumhoz hasonló telepeket képeznek. Egyes szerotípusok (pl. S. paratyphi B, S. enteritidis) telepei körül, ha tenyészeteiket szobahőn állni hagyjuk, nyálkás sánc fejlődik ki. Brómtimolkék-laktóz- és lakmusz-laktóz- tartalmú agar táptalajokon telepeik kék színűek. Brillantzöld-fenolvörös-laktóz-agaron tenyésztve telepeik alatt a táptalaj meglúgosodik, piros színű. Bizmut-szulfit táptalajon a fémes bizmut kiválása miatt a Salmonella telepek centruma fekete (39. ábra). A salmonellák a vizsgálati anyagokban (pl. élelmiszerekben, takarmányokban, bélsárban stb.) esetenként olyan kis számban vannak jelen, hogy közvetlen kitenyésztésük nem sikerül. Ilyen esetekben a vizsgálati anyag egy részét, homogenizálás után, dúsító táptalajokba oltjuk, majd órás tenyésztés után ezekből szélesztünk táptalajokra. A dúsító leves táptalajok olyan anyagokat (pl. nátrium-tetrationátot, epesavas sókat, nátriumszelenitet és ciszteint) tartalmaznak, amelyek a salmonellák elszaporodását elősegítik, más fajokét azonban gátolják. Leves táptalajokban a salmonellák egyenletes, sűrű zavarosodást okoznak. 39. ábra - Salmonella typhimurium telepek bizmut-szulfit-agaron 100
121 Részletes bakteriológia Biokémiai sajátságok. A salmonellák indol- és ureáz-negatívak, kevés kivételtől (S. typhisuis, egyes S. gallinarum, S. berta stb. törzsektől) eltekintve, H 2S-t képeznek (5. táblázat). Az antigénszerkezetileg azonos törzsek, pl. S. choleraesuis és a S. typhisuis, szénhidrátbontásuk alapján különhöztethetők meg egymástól. Az előbbi az arabinózt és a dulcitot nem, a mannitot viszont elbontja, az utóbbi szénhidrátbontása ennek éppen a fordítottja. A S. pullorum a S. gallinarum biokémiai variánsa. A genetikai vizsgálatok eredményei alapján manapság az összes Salmonellát egy fajnak (S. enterica) tekintjük, s a fajon belül ez ideig hét alfajt, az alfajokon belül pedig szerovariánsokat (szerotípusokat) különböztetünk meg. A kórtanilag fontos szerotípusok többsége az I-es alfajba tartozik (pl. S. enterica subsp. enterica serovar.typhimurium stb.). Antigénszerkezet. A salmonellák O-antigénjeik alapján (az ábécé nagybetűivel, majd a Z betű után arab számokkal jelölt) szerocsoportokba, ezeken belül pedig az H-antigénjeik alapján szerotípusokba sorolhatók (6. táblázat). A S. typhi és néhány más szerotípus hőlabilis K-antigént is tartalmaz. Ezt az antigént Vi-antigénnek nevezik, mert a törzsek virulenciájával áll kapcsolatban. Az O-antigének általában több, ritkábban egy faktorból állnak. Ha több faktorból állnak (antigénmozaik), akkor a csoportra jellemző, csoportspecifikus antigén vagy antigének mellett az egyes csoportok közötti keresztagglutinációra vezető mellékantigének is megtalálhatók. Egyes O-antigének jelenléte (pl. Ol, O14, O15) fágfertőzés (fágkonverzió) következménye. 6. táblázat - Egyes Salmonella szerotípusok antigénjei (Kauffmann White-séma) Antigének Csoport Szerotípus 0 1. fázis H 2. fázis A S. paratyphi A 1, 2, a 101
122 Részletes bakteriológia 12 S. paratyphi B 1, 4, (5) b 1,2 S. typhimurium 1, 4, (5), 12 i 1,2 B S. abortusbovis 4, 12 c 1,6 S. abortusbovis 1, 4, 12, 27 b e, n, x S. abortusequi 4, 12 e, n, x S. paratyphi C 6, 7 (Vi) c 1,5 s. choleraesuis 6, 7 (c) 1,5 C 1 S. typhisuis 6, 7 (c) 1,5 S. thompson 6, 7 k 1,5 S. infantis 6, 7 r 1,5 C 2 S. hadar 6, 8 z 10 e, n, x S. typhi 9, 12, (Vi) d D 1 S. enteritidis 1, 9, 12 g, m S. berta 1, 9, 12 f, g. t S. gallinarum 1, 9, 12 S. anatum 3, 10 e, h 1,6 E 1 S. meleagridis 3, 10 e, h 1, w A zárójelbe tett antigének esetenként hiányoznak 102
123 Részletes bakteriológia A csilló- (H-)antigének kétfélék. Első fázisú (specifikus) és második fázisú (nem specifikus) antigének. Specifikusak azok, amelyek önmagukban vagy az adott kombinációban a vizsgált szerotípust meghatározzák, ezeket latin kisbetűkkel jelöljük. A Salmonella szerotípusok egy részének (pl. S. paratyphi A, S. enteritidis) csillói csupán specifikus antigéneket tartalmaznak (monofázisos típusok), többségüknek csillóiban azonban a specifikus H-antigének mellett nem specifikus H-antigének is megtalálhatók (difázisos típusok). Ez utóbbi antigéneket arab számokkal jelöljük. A difázisos típusok tenyészeteiben vannak olyan baktériumok, amelyeknek csillóiban csak első vagy második fázisú antigének találhatók. Az egyik fázisú csillóantigéneket tartalmazó törzsek tiszta tenyészetét továbboltva az utódok között kb gyakorisággal olyan példányok is megjelennek, amelyekben a másik fázisú csillóantigének vannak jelen. Ez a jelenség a fázisváltás. A salmonellák antigénjeit agglutinációs próbával határozzuk meg. Mivel a Salmonella szerotípusok többségének O- és H-antigénjei több komponensből állnak, s ezeknek egyike-másika más Salmonella szerotípusokban is előfordul, az antigének szerológiai vizsgálatához rendszerint kimerített, csupán egy antigénkomponenssel szembeni ellenanyagot tartalmazó, ún. faktorsavókat használunk. Alkalmanként előfordul, hogy a törzsek egyikmásik antigénkomponense hiányzik. A szerológiai osztályozás megkönnyítése végett a salmonellák fontosabb antigénjeit antigénszerkezeti sémában foglalták össze (Kauffmann White-séma). A salmonellák szerológiai identifikálása a nagyszámú szerotípus, a törzsek közötti számtalan keresztreakció, egyes antigénkomponensek esetleges hiánya, a fázisváltás jelensége stb. miatt nem tartozik az egyszerű feladatok közé, ezért a vizsgálatokat erre a célra berendezett, speciális (referencia) laboratóriumok végzik. A salmonellák identifikálására, biokémiai és szerológiai sajátságaikon túl felhasználjuk fágok iránti érzékenységüket (különféle fágtípusok), plazmidjaik elemzését (milyen molekulatömegű plazmidokat hordoznak), továbbá a DNS-ük restrikciós endonukleázokkal való emésztése után végzett analízisét (DNSujjlenyomat). Ez utóbbi vizsgálatok szerencsés esetben lehetőséget adnak az azonos szerotípusba tartozó, de különböző forrásokból származó salmonellák egymástól való megkülönböztetésére és ezáltal eredetük felderítésére. A Salmonella szerotípusok elnevezése általában az általuk okozott kórképpel vagy az izolálás helyével áll kapcsolatban. Manapság már csak az I-es alfajba tartozó salmonellák kapnak binominális nevet, a többieket csupán az alfaj és az antigénszerkezeti formula feltüntetésével jelöljük. Pathogenitás. A salmonellák pathogen vagy fakultatív pathogen baktériumok. Egyes szerotípusok kizárólag emberi kórokozók, többségük azonban egyaránt megbetegítheti az embert és az állatot is, végül van néhány szerotípus, amely gyakorlatilag csak az állatokat betegíti meg. Az állatokban betegséget okozó salmonellák túlnyomó többsége a B, C, D és E csoportok valamelyikébe tartozik. a) A human pathogenek közül a S. typhi az ember typhusát, a S. paratyphi A, B és C és a S. sendai pedig a typhushoz hasonló kórképet (paratyphust) idéz elő. b) A salmonellák néhány szerotípusa csupán állatokat betegít meg, ezek emberben általában nem telepszenek meg. A S. typhisuis a sertéstyphusnak, míg a S. gallinarum, S. pullorum a baromfityphusnak az okozója. c) A salmonellák túlnyomó többsége fakultatív pathogen. Ezek állatokban paratyphust vagy csupán az emésztőrendszerre korlátozódó tünetmentes fertőzöttséget (Salmonella-hordozást), emberben pedig septikaemiával járó kórképeket vagy gyomor-bél gyulladást (ételfertőzést) idéznek elő. Bár a háziállatokban Salmonella fertőzést bármelyik fakultatív pathogen szerotípus létrehozhat, mégis leggyakrabban a S. enteritidis, S. typhimurium, a S. choleraesuis, a S. thompson, a S. infantis, S. anatum és még néhány más szerotípus okoz betegséget. A háziállatokban vetéléssel járó kórformákból rendszerint S. abortusequi, S. abortusbovis, S. abortusovis törzsek vagy ritkábban más szerotípus izolálható. Paratyphusban megbetegedhetnek a madarak, közöttük gyakran a tyúkfélék, a víziszárnyasok és a galambok. A laboratóriumi állatok közül egérben és más rágcsálókban a S. typhimurium lázas általános állapottal járó kórképet idéz elő, amely rendszerint elhullásra vezet. Ilyenkor a májban és az egyéb szervekben apró, gyulladásos, elhalásos gócok láthatók. Egyéb szerotípusok csak nagyobb mennyiségű tenyészet parenteralis befecskendezése után betegítik meg az egeret Citrobacter 103
124 Részletes bakteriológia Az emlősök és a madarak bélcsatornájának természetes lakói, de megtalálhatók a természetes vizekben, szennyvizekben és élelmiszerekben is. Biokémiailag igen aktívak. A salmonelláktól megkülönböztethetők azon az alapon, hogy KCN-tartalmú táptalajon is növekednek, a lizint nem dekarboxilálják (5. táblázat). Állatorvosi szempontból kórtani jelentőségük nincs, saprophyták Serratia Az ide tartozó fajok megtalálhatók a talajban, a vízben, a szennyvizekben, ritkábban az ember és az állatok bélcsatornájában. Főleg 30 C alatt vízben nem oldódó, vörös vagy vízben oldódó, ezért a környezetet is elszínező rózsaszínű pigmenteket termelnek. A Voges Proskauer-próbában pozitívak, a laktózt nem vagy csak késve bontják, számos extracelluláris enzimet, így dezoxiribonukleázt, lipázt, lecitinázt, továbbá proteázokat, közöttük a zselatint és a kazeint bontó enzimeket termelnek (5. táblázat). Tenyészeteikben a halra, illetve vizeletre emlékeztető szaganyagok is képződnek. Saprophyták, közülük a Serratia marcescens és néhány más faj gyakran megtalálható élelmiszerekben (sajtokban és más tejtermékekben stb.). Alacsony (4 5 C) hőmérsékleten is képesek szaporodni, ezért hűtőszekrényben tárolt élelmiszerek megromlását idézhetik elő Proteus Az ember és az állatok bélcsatornájának természetes lakói (a Providentia és a Retgerella fajokkal együtt), megtalálhatók azonban szennyvízben, rothadó anyagokban is. Az aerob rothasztók fő képviselői. A proteusok, közöttük a P. vulgaris és a P. mirabilis körülcsillósak, élénken rajzanak, a nedves táptalajok felületét leheletszerű, vékony rétegben benövik. A nem egészen friss állati szervekben és váladékokban elszaporodva megakadályozhatják az azokban levő kórokozók kitenyésztését. A rajzás nátrium-azidnak, felületaktív anyagoknak stb. a táptalajokhoz való hozzáadásával gátolható. A többi enterobacteriumtól elkülöníthetők azon az alapon, hogy valamennyi ide tartozó faj fenilalanindezamináz- és ureáz-pozitív, a triptofánból (a P. mirabilis kivételével) indolt, kéntartalmú aminosavakból pedig kénhidrogént termelnek, a zselatint elbontják (5. táblázat). A Proteus nemzetség tagjai saprophyták, kórfolyamatokban ritkán, akkor is csupán másodlagosan vesznek részt Yersinia Az ide tartozó fajok közül a Y. pestis (Pasteurella pestis) az emberi pestis okozója. Állatorvosi szempontból a nemzetségbe sorolt további fajok közül a Y. pseudotuberculosis, a Y. enterocolitica és a Y. ruckeri tart érdeklődésre számot Yersinia pseudotuberculosis Morfológia. A Y. pseudotuberculosis (Bacterium pseudotuberculosis rodentium) a pasteurellákhoz hasonló coccoid vagy rövid, 1 3 µm hosszú, pálcika alakú baktérium. Gram-negatív, a kórosan elváltozott szövetekből kikent készítményekben gyakran, a pasteurellákhoz hasonlóan, bipolárisan festődik. Nincsen burka, spórát nem képez. Testhőmérsékleten csillótlan, 22 C-on tenyésztve azonban csillókat képez, s többé-kevésbé élénken mozog. Tenyésztés. Aerob, fakultatív anaerob, 4 42 C között képes szaporodni, optimális tenyésztési hőmérséklete 30 C. Közönséges agaron 24 óra alatt valamennyi más enterobacteriuménál kisebb, kb. 1 mm átmérőjű kerek, szemcsés felületű, sárgásszürke telepeket formál. Az enterobacteriumok izolálására használt brómtimolkéklaktóz-agaron kék, az epesavas sókat, neutrálvöröst és laktózt tartalmazó agaron pedig színtelen telepeket képez. Brillantzöld és bizmut-szulfit-agaron nem vagy alig ered meg. Leves táptalajban finom zavarosodás, a tenyészet alján pedig pelyhes üledék képződik C-on, a több napos levestenyészetek felületén finom nyálkás hártya, alján pedig bőséges, nehezen felrázható üledék képződik. Biokémiai sajátságok. Az enterobacteriumokhoz hasonlóan kataláz-pozitív, oxidáz-negatív, a széhhidrátbontás fermentatív. A glükózból és a mannitból savat termel, nem bontja a laktózt (5. táblázat). 104
125 Részletes bakteriológia Antigénszerkezet. Hőstabil sejtfalantigénjei alapján legalább 6 szerocsoportba sorolhatók (I-től-VI-ig), ezenkívül legalább 5 különféle hőlabilis csillóantigénjük is van (a-tól e-ig). Sejtfalantigénjeik rokonságban állnak a salmonellák és egyes E. coli-szerotípusok sejtfalantigénjeivel. Pathogenitás. Fakultatív pathogen baktérium, megbetegíti a vadon élő és tenyésztett rágcsálókat (mezei és házinyulat, tengerimalacot, nutriát, csincsillát, stb.) bennük rendszerint idült, a gümőkórhoz hasonló elváltozásokat okoz (rodentiosis). A rágcsálókon kívül azonban okozhat septikaemiát és tályogképződéssel járó folyamatokat házi és vadon élő madarakban (pulykában, fácánban, fogolyban stb.), vetélést szarvasmarhában, juhban, sertésben, továbbá állatkertekben és vadasparkokban tartott kérődzőkben. Szórványosan számos más állatfajt is megbetegíthet. Fogékony iránta az ember is, emberben többnyire lymphadenitist, enteritist, septikaemiát idéz elő. A laboratóriumi állatok közül a mesterséges fertőzés iránt fogékony a tengerimalac, a nyúl, a patkány, az egér, de megbetegíthető a macska, a tyúk és a galamb is. Leginkább fogékony a tengerimalac. A parenterálisan fertőzött tengerimalacokban rendszerint idült, két-három hét alatt elhullásra vezető elváltozások alakulnak ki. A fertőzés környékén levő nyirokcsomók megduzzadnak, bennük, továbbá a lépben, a májban, a tüdőben stb. a gümőkórra emlékeztető, sajtos elhalásos gócok jönnek létre. A fertőzés per os is megered, ilyenkor a bélfalban és a bélfodri nyirokcsomókban alakulnak ki elsősorban az elváltozások Yersinia enterocolitica Morfológiai és tenyésztésbeli tulajdonságait illetően hasonlít a Y. pseudotuberculosisra. Váladékokból nátriumoxalátot és epesavas sókat tartalmazó szelektív táptalajon izolálható. Szobahőmérsékleten (22 C) jobban szaporodik, mint 37 C-on. Biokémiai sajátságaiban (5. táblázat) különbözik a Y. pseudotuberculosistól egyebek mellett abban, hogy elbontja a szacharózt és a szorbitot, viszont nem hidrolizálja az eszkulint. A Y. enterocolitica törzsekben eddig legalább 34 O-antigént és több mint 20 H-antigént azonosítottak, ezek alapján a törzsek szerotípusokba sorolhatók. Az O-antigének közül a 9-es szoros rokonságban áll a Brucella fajok antigénjeivel, ami a brucellosissal kapcsolatos szerológiai próbák értékelését megzavarhatja. A Y. enterocolitica természetes viszonyok között megtalálható a legkülönfélébb állatfajok (nyúl, kutya, macska, szarvasmarha, sertés, vadon élő állatok stb.) és az ember bélcsatornájában, de felszíni vizekben és szennyvizekben is. Emberben gyomor- és bélrendszeri tüneteket, bélfodri tályogokat stb., sertésben és nyúlban, alkalmanként más állatfajokban, a bélre, a bélfodri nyirokcsomókra kiterjedő, idült, a gümőkórhoz hasonló elváltozásokat idéz elő. Szemben a Y. pseudotuberculosisszal a laboratóriumi rágcsálókat nem betegíti meg Yersinia ruckeri Rövid, 2 3 µm hosszúságú, pálcika alakú baktérium, idősebb tenyészeteiben fonal alakok is képződnek. Tenyésztési és biokémiai tulajdonságaiban nagy fokban hasonlít a Y. pseudotuberculosishoz, biokémiailag azonban meglehetősen inaktív. Egyedüli szénforrásként hasznosítani tudja a citrátot, ureáz-negatív, glükózból, mannitból savat termel. Pisztrángfélékben idéz elő vesekárosodással járó septikaemiát Anaerob, Gram-negatív, pálcika alakú baktériumok Az anaerob, pálcika alakú, Gram-negatív baktériumok csoportjába igen sok nemzetség és baktériumfaj tartozik. Közülük kórtani szempontból a Fusobacterium és a Bacteroides nemzetségbe sorolt fajok fontosak. Ezek megtalálhatók az ember és a különféle állatfajok nyálkahártyáin, így az orr- és szájüregben, az emésztőcsatornában, különösen a bendőben, a növényevők vakbelében és a vastagbél egyéb szakaszaiban, a nemi szervek nyálkahártyáin stb. Az ide tartozó fajok a bélcső természetes lakói, az anaerob bélflóra tagjai. Fakultatív pathogenek, rendszerint sérülések következtében jutnak a szövetek közé. Az általuk okozott fertőzésekre jellemző, hogy általában a nyálkahártyák felületére lokalizálódnak, a megtámadott szövetek elhalásával járnak, s az elhalt szövetek a baktériumok proteolítikus hatása miatt bűzösek. Az elváltozásokból gyakran más fakultatív anaerob baktériumokkal együtt tenyészthetők ki Fusobacterium Morfológia. Polimorfok, rövid coccoid alakok, hosszabb, középen duzzadt, kihegyezett végű, 5 10 µm hosszú pálcák és hosszú fonalak egyaránt előfordulnak. A coccoid formák főként idősebb tenyészetekben láthatók. A fajok többsége csilló nélküli, egyesek azonban csillósak. Spórát nem képeznek, Gram-negatívok, egyenetlenül festődnek. 105
126 Részletes bakteriológia Tenyésztés. Szigorúan anaerobok, az oxigént legfeljebb csak nyomokban tűrik el. Tápanyagok szempontjából igényesek. Fehérje, élesztőkivonat és 5 10% CO 2 növekedésüket serkenti. Szelektív izolálásukra a kristályibolyát, a brillantzöldet vagy vankomicint tartalmazó táptalajok használatosak. Telepeik 37 C-on 1 3 nap alatt fejlődnek ki. Biokémiai sajátságok. Biokémiailag kevéssé aktívak, osztályozásuk meglehetősen nehéz és bizonytalan. Szénhidrátbontó képességük gyenge, a törzsek egy jelentős része a cukrokat egyáltalán nem bontja. A szénhidrátokból és peptonból főleg vajsavat, gyakran még ecetsavat, tejsavat, kisebb mértékben pedig propionsavat és hangyasavat is képeznek. Egyes fajok indolt termelnek, hidrolizálják az eszkulint és a keményítőt, elbontják a zselatint, emésztik a kazeint. Pathogenitás. Számtalan fajuk ismert (F. necrophorum, F. nucleatum, F.varium stb.), a szájüreg, az emésztőcső, a felső légutak és a nemi szervek nyálkahártyáit borító nyálkarétegben élnek. Fakultatív pathogenek, az emberből szájüregi necrosisokból, anaerob sebekből, légúti, nemi szervi és emésztőszervi tályogokból, gangraenás, putrid folyamatokból izolálhatók. A Fusobacterium fajok fiatal kérődzőkben (borjúban, bárányban, kecskegidában), malacokban és nyulakban nyálkahártya- bőr- és májelhalással járó necrobacillosist, hízómarhákban májtályogokat, tehenekben ritkán tőgygyulladást okoznak, de gyakran izolálhatók kutya, macska méhgyulladásából, hashártyagyulladásából és fertőzött sebeiből is. A fusobacteriumok elősegítik, illetve súlyosbítják a juhok (és ritkán más kérődzők) Bacteroides nodosus által okozott panaritiumának ( büdös sántaságának ) a kialakulását és lefolyását Fusobacterium necrophorum Csilló nélküli, Gram-negatív pálcika, amely mind tenyészeteiben, mind a szövetekben hosszú láncokat, fonalakat képez (40. ábra). A rövid pálcikák egyenletesen festődnek, a fonalakban azonban szabályos egymásutánban megfestett és festetlen részek látszanak. Véresagaron, szigorúan anaerob viszonyok között tenyészthető. Telepei körül a vörösvérsejtek feloldódnak. A szénhidrátokat rendszerint nem bontja, legfeljebb glükózból, fruktózból termel kevés vajsavat és propionsavat. Indol-pozitív, többségük számos extracelluláris enzimet, alkalikus foszfatázt, lipázt, dezoxiribonukleázt, hialuronidázt stb. is termel. 40. ábra - Fusobacterium necrophorum fonalak elhalt szövetekben (fukszinnal festve, 1250 ) 106
127 Részletes bakteriológia Újabban a törzseket két alfajba sorolják. Virulens törzsei (F. necrophorum subsp. necrophorum) véresagaron tenyésztve erős hemolízist okoznak, agglutinálják a csirke vörösvérsejtjeit, adszorbeálódnak a különféle emlőssejtekhez, leukotoxint és dezoxiribonukleáz enzimet termelnek. Ezek a törzsek idézik elő a háziállatok necrobacillosisát és a B. nodosusszal együtt a juhok büdös sántaságát. A virulens törzsek, intraperitonealis fertőzést követően, a kísérleti egereket elpusztítják. A kevésbé virulens törzsek (F. necrophorum subsp. funduliforme) vaskosabbak, gyengébb hemolízist okoznak, kórfolyamatokban nem vagy csak ritkán vesznek részt Bacteroides Morfológia. Vaskos, 3 5 µm nagyságú pálcikák, Gram-negatívak, gyakran egyenetlenül festődnek. Többségük csillót nem képez, néhány faj azonban csillós. Egyes fajok felületén fimbriák találhatók. Tenyésztés. A fusobacteriumokhoz hasonlóan igényesek, szigorúan anaerobok, véresagaron tenyészthetők. Biokémiai sajátságok. Szénhidrátbontásuk tekintetében aktívabbak, mint a fusobacteriumok, többségük bontja a glükózt és számos más szénhidrátot is. A szénhidrátokból és aminosavakból a fusobacteriumoktól eltérően elsősorban nem vajsavat, hanem főleg borostyánkősavat és propionsavat képeznek. A fajok egy része a zselatint és a húsdarabkákat elfolyósítja. Pathogenitás. Több mint húsz fajuk s ezeken belül számos változatuk ismert. Megtalálhatók a bélsárban, a kérődzők előgyomraiban, a nyúl és a baromfifajok vakbelében, de a légutak és a nemi szervek nyálkahártyáján, sőt egy részük természetes vizekben, szennyvizekben is. Fakultatív pathogenek, a nyálkahártyák és a bőr elhalásával és tályogosodással járó folyamatokból izolálhatók emberből és háziállatokból egyaránt. A B. fragilis az anaerob bélflóra tagja, gyakran izolálható human kórfolyamatokból (appendicitis, a bélcsatorna, a húgy- és nemi utak tályogosodással járó folyamatai, anaerob sebek stb.). A B. melaninogenicus fekete pigmenteket és proteolítikus enzimeket termel, gyakran izolálható kutya, macska tályogjaiból, putrid folyamatokból. A B. ureolyticus nemi szervi váladékokból izolálható, kórtani szerepe bizonytalan. A B. nodosus (újabb nevén Dichelobacter nodosus) felületén fimbriák találhatók. Szigorúan anaerob viszonyok között, 10% CO 2-ot is tartalmazó légtérben, legcélszerűbben porított szarut is tartalmazó táptalajokon tenyészthető. Hemolízist nem okoz, elfolyósítja a zselatint, elemészti a húst, és elbontja a szarut is. A felületén levő fimbriák alapján, agglutinációs próbával a törzsek eddig 8 szerocsoportba (A H) sorolhatók. A szerocsoportok gyakorisága földrajzi régiónként változik. A juh, kecske, szarvasmarha, ritkán egyéb kérődzők büdös sántaságát idézi elő Pasteurella A pasteurellák a nyálkahártyák, főleg a felső légutak és a szájüreg természetes lakói emlősökben és madarakban egyaránt. Morfológia. Apró, 0,5 2 µm átmérőjű, coccoid alakú baktériumok vagy rövid pálcák. Csillóik nincsenek, spórát nem képeznek. Gram-negatívak, fukszinnal vagy bármely más, a bakteriológiában használatos festékkel jól megfesthetők. A virulens P. multocida és a P. haemolytica törzseknek poliszacharid burkuk van. Váladékokból, szövetekből vagy friss tenyészetekből festve egyes példányoknak gyakran csupán a két vége festődik meg (bipoláris festődés). Tenyésztés. Aerob, fakultatív anaerob baktériumok, a táptalajok iránt igényesek, váladékokból, szervekből való kitenyésztésükre élesztőkivonatot, vérsavót vagy vért is tartalmazó táptalajokat veszünk igénybe. Érzékenyek a táptalajok ph-ja iránt is, a neutrális vagy enyhén lúgos táptalajokat kedvelik, folyékony táptalajokban, ha annak ph-ja a szénhidrátbontás miatt savassá válik, néhány nap alatt kihalnak. A tenyésztés optimális hőmérséklete 37 C. Telepeik általában már 24 óra alatt kinőnek, gombostűfej nagyságúak, sima szélűek, fénylenek, szürkésfehérek. A Pasteurella nemzetségbe igen sok baktériumfaj tartozik, közülük kórtani szempontból a P. multocida és a P. haemolytica a legfontosabbak. A P. multocida véresagaron nem okoz hemolízist, az emlősökből kitenyésztett virulens P. multocida törzsek egy része azonban erősen nyálkás, nyúlós (mukoid) telepeket képez. Közönséges levesben az S és a mukoid törzsek egyenletes zavarosodást okoznak, majd néhány nap alatt a tenyészet alján nyálkás, nyúlós, felrázással nehezen 107
128 Részletes bakteriológia eloszlatható üledék képződik. Az R törzsek burok nélküliek, a levestenyészetek alján szemecskés üledéket képeznek. A P. haemolytica törzsek véresagaron béta-hemolízist okoznak. Biokémiai sajátságok. A pasteurellák kataláz- és oxidáz-pozitívak, a nitrátot nitritté redukálják, a szénhidrátokat fermentatívan, kevés kivételtől eltekintve gázképződés nélkül bontják. Az egymástól való elkülönítésükre alkalmas, fontosabb biokémiai tulajdonságokat a 7. táblázat mutatja. A különböző állatfajokból izolált P. multocida törzsek között egyes szénhidrátok bontásában különbségek vannak, ezen az alapon a fajon belül három alfajt különböztetnek meg. A P. haemolytica törzsekben két biotípus (A és T) különböztethető meg. Az A biotípus kataláz-pozitív, az arabinózt és a xilózt elbontja, a trehalózt viszont nem. A T biotípus kataláz-negatív, elbontja a trehalózt, de nem az arabinózt és a xilózt. A T biotípust újabban P. trehalosi néven önálló fajnak tekintik. 7. táblázat - A fontosabb Pasteurella fajok biokémiai sajátságai P. P. P. P. P. Próba multocid a pneumotropic a haemolytic a aerogene s anatipestife r Hemolízi s + Indol + + H 2S + + +/ + Ureáz NO 3 NO Glükóz Laktóz +/ +/ Mannit + + +/ Maltóz A D buroktípusú P. multocida törzsek egy része a sertés orrnyálkahártyáját károsító hőlabilis citotoxinokat termel. A P. haemolytica törzsek is termelnek a tüdő macrophagjait károsító citotoxint. Antigénszerkezet. A P. multocida törzsek a sejtfalban levő O- és a burokban található poliszacharid antigénjeik alapján agglutinációs próbákkal szerotípusokba sorolhatók. A P. multocida törzsek O-antigénjeik alapján 11 típusba (Namioka), a poliszacharid burokantigénjeik alapján pedig A, B, D, E és F típusokba (Carter) sorolhatók. Az A típusú törzsekben a burok hialuronsavból áll, ezek a törzsek mukoid telepekben nőnek. Az O- antigének több komponensből állnak, amelyek egymással számos keresztagglutinációt adnak. Az agglutinációs próba okozta nehézségek elkerülése végett kialakítottak egy másik tipizálási rendszert is, amely az egyes izolátumok kivonatantigénjeit agargél-precipitációs próbával vizsgálja. Ez utóbbi rendszer szerint a P. multocida törzsek ez ideig legalább 16 szerotípusba sorolhatók (Heddleston-típusok). A két tipizálási rendszer egymással nem hasonlítható össze. A P. haemolytica törzsek passzív hemagglutinációs próbával felületi poliszacharid antigénjeik alapján ez ideig 17 szerotípusba sorolhatók. Közülük a szarvasmarhát rendszerint az 1-es és a 2-es típusú törzsek betegítik meg, juhokban azonban valamennyi egyéb szerotípus előfordulhat. 108
129 Részletes bakteriológia Ellenálló képesség. A kevéssé ellenálló baktériumok közé tartoznak. Beszáradva 2 3 nap alatt elpusztulnak, a vérben és a bélsárban sem maradnak 10 napnál hosszabb ideig életben. 60 C-on percek alatt elpusztulnak, a formalin vagy a klórlúg 1 3%-os oldata ugyancsak percek alatt elöli őket. Pathogenitás. A pasteurellák fakultatív pathogenek, a törzsek virulenciája azonban tág határok között változik. A virulens P. multocida törzsek, főleg az A, kisebb részben a D buroktípusba tartoznak, szarvasmarhában, juhban, kecskében, ritkán állatkerti és vadon élő kérődzőkben bronchopneumoniát, esetenként septikaemiát, mastitist stb., sertésben szórványosan pneumoniát, nyulakban náthával, orrfolyással járó tüneteket, bronchopneumoniát, tüdőgyulladást, septikaemiát, a baromfifajokban (főleg kacsában, libában, pulykában) pedig heveny septikaemiával járó baromficholerát idéznek elő. Sertésben citotoxinokat termelő, D buroktípusú törzsek idézik elő a torzító orrgyulladást. A P. multocida gyakran másodlagos kórokozóként társul különféle légúti vírusos betegségekhez. Trópusi területeken a P. multocida B (Ázsiában) és E (Afrikában) típusú törzsei okozzák a szarvasmarha és a bivaly, továbbá számos házi és vadon élő kérődző vérzéses septikaemiáját (bivalyvész). A P. haemolytica A biotípusú törzsei szarvasmarhában, juhban, kecskében és egyéb kérődzőkben okoznak tüdőés mellhártyagyulladást, tőgy- és ízületgyulladást, alkalmanként septikaemiát. A P. haemolytica T biotípusú törzsei idézik elő a növendék juhok ún. heveny szisztémás pasteurellosisát, tüdőgyulladásos esetekből viszont ritkán izolálhatók. A kísérleti állatok közül az egér, a nyúl, a tyúk és a galambok virulens P. multocida törzs tenyészetével parenteralisan fertőzve 1 3 nap alatt vérfertőzésben elhullanak. A virulenciájukban csökkent törzsek a kísérleti állatokat egyáltalán nem betegítik meg, vagy csupán enyhe lefolyású betegséget okoznak. A P. haemolytica törzsekkel a fehéregerek nem betegíthetők meg Egyéb pasteurella fajok A P. pneumotropica véresagaron hemolízist nem okoz, a P. multocidától egyebek mellett különbözik abban, hogy ureáz-pozitív. Természetes viszonyok között előfordul a rágcsálók, továbbá a kutya és a macska száj- és garatüregében. Esetenként rágcsálókban pneumoniát, továbbá harapások következtében emberben, állatban egyaránt sebfertőzést, tályogképződést okozhat. A P. aerogenes ugyancsak ureáz-pozitív, emellett glükózból kevés gázt is termel. Megtalálható a sertés szájüregében és az emésztőcsatornában, esetenként tüdőgyulladást, ritkán vetélést okoz sertésben, továbbá harapások következtében sebfertőzést, tályogképződést emberben. A P. canis, a P. dagmatis, a P. stomatis néven leírt fajok, a kutya, a macska, ritkán az ember szájüregének természetes lakói, saprophyták, az előbbi két faj esetenként kutya-, macskaharapást követő sebekből tenyészthető ki emberből. A P. caballi lovakban okozhat légúti fertőzéseket. A P. avium és a P. gallinarum fajok természetes lakói a csirke, a pulyka és más baromfifajok légutainak, saprophyták. Pasteurella (Riemerella) anatipestifer. A pasteurellákhoz hasonló, rövid, coccoid pálcika alakú, csilló nélküli baktérium. Legjobban főtt vért tartalmazó agaron (csokoládéagar), 10% szén-dioxidot is tartalmazó légtérben, 37 C-on tenyészthető. Kataláz- és oxidáz-pozitív, a nitrátot azonban nem redukálja, ureáz-pozitív. A szénhidrátok egy részét lassan és gyengén bontja, számos extracelluláris enzimet termel, elfolyósítja a zselatint, az alvasztott vérsavót és a tojástartalmú táptalajokat. Agglutinációs próbával, felületi antigénjeik alapján a különböző madárfajokból és földrajzi régiókból izolált törzsek ez ideig legalább 19 szerotípusba sorolhatók. A korábban leírt típusokat egy ideig az ábécé nagybetűivel jelölték. Fakultatív pathogen baktérium, természetes viszonyok között is megtalálható a kacsafélék légutainak nyálkahártyáján, fiatal kacsákban, libákban, hattyúban, ritkán más házi- és vadon élő madárfajokban okoz lázas általános tünetekkel, savós-fibrines hashártya-, légzsák- és szívburokgyulladással járó septikaemiát. 109
130 Részletes bakteriológia Ornithobacterium rhinotracheale Morfológia. Gram-negatív, rövid pálcika alakú, csilló nélküli baktérium. A tenyészetekből készített kenetben 1 3 µm-es, a pasteurellákhoz hasonlóan gyakran bipolárisan fertőző pálcikák és hosszabb fonalak is láthatók. Tenyésztés. Tápanyagban gazdag táptalajokat igényel. Mikroaerofil, 10% CO 2-ot is tartalmazó légtérben, véresagaron tenyésztve telepei 48 óra múltán jelennek meg, aprók, fénylők, kerekek, szürkésfehérek, vajszerűen kenhetők. Közönséges levesben nem ered meg, triptont, élesztőkivonatot és vérsavót tartalmazó levesben viszont finom, egyenletes zavarosodást okoz. Biokémiai tulajdonságok. Kataláz-negatív, oxidáz-pozitív, indolt nem termel, a nitrátot nem redukálja, viszont ureáz- és Voges Proskauer-pozitív. A szénhidrátbontás fermentatív, a szénhidrátokat savtermeléssel bontja. Extracellularis hialuronidázt termel. Ellenálló képessége kicsi. Beszáradva a környezetben néhány nap alatt elpusztul, 4 C-on azonban legalább 11 napig életképes marad. Pathogenitás. Természetes viszonyok között megtalálható a pulyka, a csirke és néhány más madárfaj (fogoly, varjú) orrüregében és felső légutaiban. Fakultatív pathogen, fiatal pulykában, csirkében okoz a légcső mélyebb részének gyulladásával, nehezített légzéssel és jelentős elhullással járó betegséget Actinobacillus Pleomorf baktériumok, a mikroszkópos képben coccoid alakok, rövid pálcikák és hosszabb fonalak egyaránt láthatók. Gram-negatívok, csilló és spóra nélküliek, aerobok, fakultatív anaerobok. Természetes viszonyok között megtalálhatók a különféle állatfajok szájüregében, az emésztőcsatornában, a légutak és a nemi szervek nyálkahártyáin, fakultatív pathogenek. Az utóbbi évtizedben számos, korábban a Pasteurella vagy a Haemophilus nemzetségbe tartozó fajt soroltak ide Actinobacillus lignieresii Természetes viszonyok között megtalálható a szarvasmarha és a juh szájüregében, valamint a bendőben. Morfológia. Fiatal tenyészeteiben apró, 1 1,2 µm hosszú pálcikák. A fertőzött, ellágyult szövetekben az apró coccobacilusok mellett az actinomycosishoz hasonló tőkék is láthatók, amelyek rozettaszerűen rendeződött, megnyúlt Gram-negatív baktériumokból állnak. Megfesthetők azonban pl. eozinnal. Tenyésztés. Levegőn, 37 C-on könnyen tenyészthető. Közönséges agaron óra alatt apró, domború, kékesfehéren fénylő telepek fejlődnek, amelyek erősen tapadnak a táptalajhoz. Hasonló, de valamivel dúsabb tenyészeteket kapunk véresagaron. Közönséges levesben pelyhes üledék képződik, ritkábban az egész leves egyenletesen megzavarosodik. Biokémiai sajátságok. Kataláz- és oxidáz-pozitív, szénhidrátbontása fermentatív. A nitrátokat nitritté redukálja, ureáz-pozitív, H 2S-t termel, a glükózt, a laktózt, a szacharózt és még néhány más szénhidrátot savképzéssel elbontja. Ellenálló képesség. Igen érzékeny, tenyészetei is néhány nap múltán kipusztulnak. Pathogenitás. Sérülések, fogváltás stb. következtében jut a szövetek közé. Szarvasmarhában és juhban, ritkán egyéb állatfajokban okoz idült, a szövetek beolvadásával és kötőszövet-szaporodással járó gyulladást (actinobacillosist), a nyelvben, a szájüregben, a légutakban, a tőgyben, ritkábban egyéb szövetekben. A laboratóriumi kísérleti állatokat nem betegíti meg. Nagy mennyiségű tenyészetet hím tengerimalac hasüregébe fecskendezve azonban hashártya-, here- és hereborék-gyulladás alakul ki Actinobacillus equuli Megtalálható az egészséges lovak szájüregében, tonsilláiban és bélcsatornájában, de alkalmanként kitenyészthető sertésekből is. Morfológia. Polimorf, rövid, 1 2 µm hosszú pálcikák mellett hosszabb fonalak is láthatók a mikroszkópos képben. 110
131 Részletes bakteriológia Tenyésztés. Közönséges agaron, 37 C-on 1 2 nap alatt viszonylag nagy, 2 3 mm átmérőjű, domború, kerek vagy csillagszerűen lebenyezett, feltűnően nyúlós telepek (Bacterium pyosepticum viscosum) alakulnak ki. Közönséges levesben tenyésztve nyúlós üledék képződik. Biokémiai sajátságok. Főbb biokémiai sajátságai megegyeznek az A. lignieresiiével, különbözik azonban tőle abban, hogy elbontja a raffinózt és a trehalózt, a zselatint pedig többnyire elfolyósítja. Pathogenitás. Újszülött csikókban köldökgyulladást, septikaemiát, gennyes ízületgyulladást, vesegyulladást, felnőtt lovakban pedig, a belső szervekben tályogképződéssel járó septikaemiát (ún. pyoseptikaemiát) okoz. A csikókhoz hasonlóan megbetegítheti a malacokat, ritkán egyéb állatfajokat is Actinobacillus suis Megtalálható a sertések felső légutaiban, a tonsillákban, alkalmanként a nemi szervek nyálkahártyáin. Közönséges agaron alig szaporodik, véresagaron 24 óra alatt 1 2 mm átmérőjű, domború, szürkésfehér, bétahemolízist okozó telepeket képez, amelyek nem tapadnak a táptalajhoz. Kataláz- és oxidáz-pozitívok, ureázpozitívok, indolt nem termelnek, a törzsek egy része H 2S-pozitív. Glükózból, szacharózból, laktózból és sok más szénhidrátból savat képeznek. A kóros anyagokból gyakran izolálhatók a típustól eltérő biokémiai viselkedésű törzsek, ezek egy részét ma már önálló fajnak tekintik (A. rossii, Pasteurella mairii). Felnőtt sertésekben szórványosan septikaemiát, metritist, vetélést, újszülött és szopós malacokban septikaemiát idéz elő Actinobacillus seminis Természetes előfordulási helye a kosok genitális nyálkahártyái, jelen lehet tünetmentes kosok ondójában is. Véresagaron, 10% CO 2-dal dúsított légtérben óra alatt gombostűfejnyi, enyhén domború, szürkésfehér, vajszerűen kenhető telepeket képez, nem okoz hemolízist. Kataláz-, oxidáz-pozitív, a nitrátot nitritté redukálja, H 2S-pozitív, de ureáz- és indol-negatív. Glükózból és néhány más szénhidrátból savat termel. Különböző biotípusai léteznek. Fakultatív pathogen, kosokban a járulékos nemi mirigyek gyulladásával, ritkábban mellékhere-gyulladással járó betegséget, anyajuhokban pedig vetélést okozhat. Elvétve izolálható növendék juhok pyelonephritiséből is Actinobacillus (Pasteurella) ureae Szórványosan előfordul az ember légúti nyálkahártyáin. Szemben az A. suiszszal véresagaron nem okoz hemolízist, kataláz- és oxidáz-pozitív, ureáz-pozitív, glükózból, mannitból és néhány más szénhidrátból savat termel. Emberben okoz ritkán légúti tüneteket. Hogy valójában állatokban előfordul-e és okoz-e betegséget, nem tudjuk Actinobacillus (Haemophilus) pleuropneumoniae Morfológia. Coccoid, rövid pálcikák, vékony poliszacharid burkuk van. A törzsek egy részének a felületén fimbriák vannak. Tenyésztés. Igényes baktériumok, tenyésztésükhöz élesztő- és szójakivonatot tartalmazó agar táptalajokat, véresagart vagy csokoládéagart használunk. Telepeik csokoládéagaron 48 óra múlva 1 2 mm átmérőjűek, szürkésfehérek, véresagaron erős béta-hemolízist okoznak. Élesztőkivonatot is tartalmazó leves táptalajokban finom, egyenletes zavarosodást okoznak. Az A. pleuropneumoniae törzseknek két biotípusa van. Az 1-es biotípusba tartozó törzsek tenyésztésükhöz NAD-ot (V-faktort) igényelnek, ezek csak élesztőkivonatot is tartalmazó táptalajokon vagy a haemophilusokhoz hasonlóan Staphylococcus dajkatelepek mellett tenyészthetők, amikor is jellegzetes dependencia figyelhető meg (41. ábra). A 2-es biotípusú törzsek NAD-ot nem igényelnek, ezért NAD nélkül is jól szaporodnak, telepeik valamivel nagyobbak, mint az 1-es biotípusú törzseké, véresagaron erőteljesebb béta-hemolízist okoznak, s levestenyészetekben jobban szaporodnak. 41. ábra - Actinobacillus (Haemophilus) pleuropneumoniae agar táptalajon Staphylococcus dajkatelepek mellett 111
132 Részletes bakteriológia Biokémiai tulajdonságok. Kataláz-negatívok, oxidáz-pozitívok, szénhidrátbontásuk fermentatív, a nitrátot nitritté redukálják, ureáz-pozitívok. Glükózból, laktózból, mannitból és számos más szénhidrátból savat képeznek. Az A. pleuropneumoniae törzsek legalább háromféle, hemolitikus és toxikus hatású citotoxint (Apx I II III) termelnek. A citotoxinok virulenciafaktorok. Egyes törzsek csak az egyik, mások kétféle vagy akár mind a háromféle toxint termelik. A citotoxinokkal szemben immunsavók állíthatók elő, amelyek a megfelelő citotoxint neutralizálják függetlenül attól, hogy azt milyen típusú törzs termelte. A citotoxinokat újabban vakcinák készítésére is felhasználják. Antigénszerkezet. Az A. pleuropneumoniae 1-es biotípusú törzsei felületi poliszacharid antigénjeik alapján, agglutinációs próbával, passzív hemagglutinációval, immunfluorescenciás próbákkal és koagglutinációs próbával ez ideig 12 szerotípusba, a 2-es biotípusba tartozó törzsek pedig eddig 3 szerotípusba sorolhatók. A megbetegedések túlnyomó többségét az 1-es biotípusú törzsek okozzák, ezen belül nálunk a 2-es és az 1-es szerotípusok fordulnak elő leggyakrabban. Ellenálló képesség. Az A. pleuropneumoniae ellenálló képessége csekély. A beszáradás néhány nap alatt, 60 C, továbbá a szokásos fertőtlenítőszerek pedig percek alatt elpusztítják. Pathogenitás. Az A. pleuropneumoniae sertésekben okoz heveny vérzéses, elhalásos tüdő- és mellhártyagyulladást (pleuropneumoniát), ritkábban más kórformákat (septikaemiát, endocarditist) Haemophilus Az ide tartozó fajok az ember és az állatok nyálkahártyáin, főleg a felső légutakban, egyes fajok pedig a nemi szervek nyálkahártyáin találhatók meg, a külvilágban nem fordulnak elő. Valamennyiüket jellemzi, hogy növekedésükhöz kiegészítő anyagokat igényelnek. Morfológia. A baktériumok megjelenési formája fajonként és a tenyésztés körülményeitől függően változik. Kóros váladékokban rendszerint rövid, 0,5 2 µm hosszú coccobacillusok, idősebb tenyészetekben gyakoriak a 112
133 Részletes bakteriológia hosszabb-rövidebb fonalak is. Csillóik nincsenek, egyik-másik faj azonban frissen kitenyésztve burkot képez. Egyes fajok felületén fimbriák találhatók. Gram-negatívak, jól megfesthetők fukszinnal. Tenyésztés. Igen kényes baktériumok, a szokásos egyszerű táptalajokon nem szaporodnak. Növekedésükhöz kétféle kiegészítő anyagot, vastartalmú hemet (X- faktort) és nikotinsav-adenin-dinukleotidot (V-faktort) igényelnek. A fajok egy része növekedéséhez mindkét faktort igényli, más része azonban csak az egyiket vagy csak a másikat. Az X-faktor hőstabil, a V-faktor hőérzékeny. A haemophilusok X-faktor-igénye kielégíthető a táptalajhoz 80 C-on hozzákevert vérrel (csokoládéagar), a V-faktort pedig, mivel azt az élesztő bőven tartalmazza, élesztőkivonat formájában adjuk a táptalajhoz vagy a tenyésztést ún. dajkatelepek segítségével végezzük. A V-faktort ugyanis egyes baktériumfajok (Staphylococcus, Micrococcus stb.) növekedésük során önmaguk előállítják, ezért ha a haemophilusok tenyésztésére szolgáló, a vizsgálati anyaggal már beoltott csokoládéagar felületére egy-két csíkban megfelelő dajkatörzset oltunk, a haemophilusok a dajkatelepekből kidiffundáló V-faktor hatására csak e telepek közelében fejlődnek ki (42. ábra). A haemophilusok, ugyancsak dajkatörzs felhasználásával, jól elszaporíthatók a mycoplasmák (1ásd. később) tenyésztésére szolgáló agar táptalajokon is. 42. ábra - Haemophilus paragallinarum telepek főtt vért tartalmazó agartáptalajon, Staphylococcus dajkatenyészet mellett Aerobok, fakultatív anaerobok, a fajok egy része azonban növekedéséhez legalább 10% CO 2-ot is tartalmazó légteret igényel, tenyésztésük optimális hőmérséklete 37 C. Csokoládéagaron 1 2 nap alatt valamennyi Haemophilus faj apró, enyhén domború, cseppszerű, fénylő telepeket formál. A V-faktort igénylő telepek csupán a dajkatelepek körül, míg az X-faktort igénylők másutt is képeznek telepeket. Véresagaron a haemophilusok lényegesen nehezebben szaporodnak, kolóniáik a dajkatelepek szomszédságában is aprók. Egyik-másik faj a vörös vértesteket feloldja. Leves táptalajokban csak akkor erednek meg, ha azok a szükséges kiegészítő anyagokat is tartalmazzák, a szaporodás azonban ilyenkor is gyér. Biokémiai sajátságok. Vizsgálatuk meglehetősen nehéz. A nitrátokat nitritté redukálják, fermentatívan elbontják a glükózt és még néhány más szénhidrátot. Fajokba sorolásuk eredetük, növekedésbeli igényeik, biokémiai sajátságaik stb. együttes figyelembevételével történik. 113
134 Részletes bakteriológia Antigénszerkezet. A haemophilusok sejtfalantigénjeik, illetve poliszacharid burokantigénjeik alapján szerocsoportokba, szerotípusokba sorolhatók. Ellenálló képesség. Ellenálló képességük igen kicsi, tenyészeteikben is kipusztulnak 3 7 nap alatt. Pathogenitás. Fakultatív pathogenek, számos fajuk ismert. Az emberben előforduló fajok közül a H. influenzae légúti fertőzéseket okoz, a b-poliszacharid burokantigénű törzsek pedig, főleg gyermekekben, meningitist idéznek elő. Az állatokban előforduló fajok közül az alábbiak fontosak Haemophilus parasuis Csokoládéagaron, 5 10% CO 2-ot is tartalmazó levegő jelenlétében tenyészthető, csupán NAD-ot igényel. A korábban H. suisnak tekintett törzsekről kiderült, hogy ezek is csupán NAD-ot igényelnek tenyésztésükhöz, ezért ezek is valójában H. parasuis baktériumok. Kataláz-pozitív, glükózból, galaktózból, mannózból savat termel. Sejtfalkivonataikat gélprecipitációs próbával vizsgálva, hőstabil antigénjeik alapján a törzsek eddig legalább 15 szerotípusba sorolhatók. A sertésben betegséget okozó törzsek szerotípusai földrajzi régiónként jelentősen különböznek egymástól. Fakultatív pathogen, megtalálható az egészséges sertések orrüregében. Fiatal, 2 6 hetes malacokban a savóshártyák, az ízületek és esetenként az agyburok gyulladásával járó (Glässer-féle) betegséget idéz elő Haemophilus paragallinarum Csokoládéagaron 10% CO 2-ot is tartalmazó légtérben tenyészthető, kiegészítőanyagként csak NAD-ot igényel. Kataláz- és oxidáz-negatív. A virulens törzseknek vékony burkuk van. Felületi antigénjeik alapján legalább három szerotípusba sorolhatók. Pathogenitás. Fakultatív pathogen, természetes körülmények között megtalálhatók a tenyésztett és vadon élő madarak orrüregében és a felső légutak nyálkahártyáin. Növendék és fiatal tojótyúk állományokban idéz elő a felső légutakra és a fejre korlátozódó, lázas általános tünetekkel járó betegséget (haemophilus nátha) Haemophilus somnus Bár a tápanyagok iránt igényes, sem X-, sem pedig V-faktort nem igényel. Véresagaron is, de még jobban csokoládéagaron, 10% CO 2-ot is tartalmazó légtérben tenyészthető. Telepei 48 óra múltán is aprók, sárgás színűek. Kataláz-negatív, oxidáz-pozitív, indolt termel. A törzsek antigénszerkezetileg heterogének. A sejtfal külső rétegéből készített antigénkivonatokat ELISA-ban vizsgálva a H. somnus törzsek ez ideig legalább 11 szerotípusba (csoportba) sorolhatók. Természetes viszonyok között előfordul a szarvasmarha urogenitalis nyálkahártyáin, bikákban főként a tasak nyálkahártyáján, nőivarúakban a hüvelyben, de alkalmanként a légutakban is. Megtalálható ezenkívül juhokban is. A juhokból izolált Histophilus ovis és Haemophilus agni néven leírt fajok azonosnak tekinthetők a Haemophilus somnusszal. A H. somnus fakultatív pathogen, növendék és felnőtt szarvasmarhában tromboemboliás meningoencephalitist, légúti fertőzéseket, ízületgyulladást, a nemi szervekbe beszaporodva reprodukciós zavarokat, borjakban elhúzódó tüdő- és ízületgyulladást idéz elő. Juhok közül kosokban mellékhere- és heregyulladást, anyajuhokban szórványosan vetélést, tőgygyulladást, bárányokban pedig septikaemiát és ízületgyulladást okozhat Taylorella equigenitalis Apró, Gram-negatív, a haemophilusokhoz hasonló coccobacillus (korábbi nevén Haemophilus equigenitalis), alkalmanként azonban hosszabb fonalakat is képez, csillói nincsenek. Mikroaerofil, lóvérrel készült csokoládéagaron, 10% CO 2-ot is tartalmazó levegőn tenyészthető 37 C-on. Telepei 2 3 nap múlva válnak láthatóvá, aprók, szürkésfehérek, vajszerű konzisztenciájúak. Szaporodásához sem X-, sem V-faktort nem igényel. Véresagaron növekedése igen gyenge, az egyéb, szokásosan használt táptalajokban nem ered meg. A törzsek szelektív izolálására streptomicint is tartalmazó csokoládéagar használható, utóbb azonban streptomicinre érzékeny törzseket is találtak. Az anyagcsere típusa oxidatív, kataláz- és oxidáz-pozitív, alkalikus foszfatáz enzimet termel, az egyéb szokásos biokémiai próbákban viszont negatív. 114
135 Részletes bakteriológia Ellenálló képessége igen kicsi, a külvilágban nem marad életben. Megtalálható a klinikailag tünetmentes tenyészmének külső nemi szerveinek nyálkahártyáján, ezek tartják fenn a kórokozót, de hónapokig jelen lehet a fertőzött kancák külső nemi szerveinek nyálkahártyaredői között is. A mének tünetmentesek maradnak, a fedeztetés útján, frissen fertőződött kancákban viszont, gyorsan terjedő heveny metritist okoz (a ló ragályos méhgyulladása). A laboratóriumi kísérleti állatok a kórokozó iránt nem fogékonyak Francisella tularensis Coccoid, 0,5 2 µm hosszú, Gram-negatív, csilló nélküli baktérium, a pasteurellákhoz hasonlóan gyakran bipolárisan festődik. A virulens törzseknek vékony burkuk van. Tenyésztés. Obligát aerob, közönséges és véresagaron nem ered meg, tenyésztéséhez ciszteint vagy cisztint igényel. Tenyészthető glükózt, nyúlsavót és ciszteint tartalmazó (Francis-féle) véresagaron, továbbá glükóz- és ciszteintartalmú alvasztott tojássárgáján. Ezeken a táptalajokon, 37 C-on, 3 4 nap alatt, 2 3 mm átmérőjű félgömbszerűen fölemelkedő, fénylő, kissé nyálkás konzisztenciájú telepek képződnek. Hemolízist nem okoz. A primer tenyészeteket továbboltva a telepek rendszerint már 24 óra alatt kialakulnak, főleg, ha bőséges mennyiségű tenyészetet oltottunk tovább. Folyékony táptalajokban cisztein jelenlétében sem szaporodik el. Biokémiai sajátságok. Kataláz-pozitív, oxidáz-negatív, a ciszteinből H 2S-t termel. Glükózból és néhány más szénhidrátból gázképződés nélkül kismennyiségű savat termel. Egyes szénhidrátok bontása és néhány más biokémiai tulajdonság alapján legalább két biotípus (egyesek szerint alfaj; A biotípus, F. tularensis var. tularensis és B biotípus, F. tularensis var. palaearctica vagy ez utóbbi újabban F.tularensis var. holarctica) különböztethető meg. A törzsek antigénszerkezetileg egységesek, szerológiailag rokon a brucellákkal és a Yersinia pestisel. Az agglutinációs próbát felhasználjuk a kitenyésztett törzsek azonosítására. Ellenálló képesség. Ellenálló képessége kisfokú. Tenyészetei hűtőszekrényben 2 hónapig életképesek, 60 C-on és fertőtlenítőszerek hatására azonban perceken belül elpusztulnak. Pathogenitás. A F. tularensis az északi félteke országaiban mindenütt előfordul. Az A biotípus, úgy látszik, csak Észak-Amerikában, a B típus viszont Észak-Amerikán kívül Európában és egész Ázsiában is honos, emellett az A típus pathogenitása nagyobb, mint a B típusé. A F. tularensis megbetegítőképessége igen széles körű. Természetes gazdái a vadon élő rágcsálók, főleg a pocok, a vízipatkány, a pézsmapatkány és a hód, de megtelepszik madarakban is. Nagyon fogékony iránta a pocok, az egér, a hörcsög, a mókus és számos más vadon élő rágcsáló, ezek, ha fertőződnek, rendszerint kivétel nélkül el is pusztulnak. Megbetegíti a mezei nyulat, a legtöbb háziállatfajt és az embert is. Ezekben a fajokban septikaemiát, a nyirokcsomók gyulladásával és a parenchymás szervekben elhalásos gócok képződésével járó betegséget (tularaemiát) okoz. Hullából származó vizsgálati anyagnak vagy tenyészetnek parenterális befecskendezésével a laboratóriumi rágcsálók (egér, tengerimalac), valamint a vadon élő kis rágcsálók könnyen megbetegíthetők, ezek rendszerint 4 10 nap alatt vérfertőzésben elpusztulnak. A fertőzés per os is megered. Az elhullott állatokban lépduzzanat, a lépben és a májban apró elhalásos gócok láthatók. A házinyúl és a patkány a parenterális fertőzésnek is ellenáll, vérükben azonban ellenanyagok jelennek meg Brucella Coccoid, rövid pálcika alakú baktériumok, kivétel nélkül pathogenek, természetes viszonyok között csupán a fertőzött szervezetekben képesek szaporodni. Morfológia. A brucellák 0,6 1,5 µm hosszú pálcikák. Csillóik nincsenek, burkot nem képeznek. Gramnegatívok, szelektív festésükre viszonylagos savállóságuk alapján a Köster-féle festés használatos. A láng felett fixált kenetet 3%-os vizes szafranin-oldattal 3 5 percig festjük úgy, hogy közben a festékoldatot gőzölésig melegítjük. A festéket leöntve a kenetet néhány másodpercig 0,5%-os kénsavval kivonjuk, majd alapos vízöblítés után vizes metilénkékkel kontrasztfestést végzünk. A készítményben a brucellák pirosak, minden egyéb baktérium és sejtes elem pedig kék színű. A magzatburkokról vett lenyomati készítményekben a brucellák egy része rendszerint intracellulárisan, phagocytákba foglaltan látható (43. ábra). 43. ábra - Brucella abortus vetélt szarvasmarhamagzat burkában, intracellulárisan (Köster-féle festés, 1250 ) 115
136 Részletes bakteriológia Tenyésztés. A brucellák obligát aerobok, testhőmérsékleten szaporíthatók. A szervekből, váladékokból való kitenyésztésükhöz a B. abortus törzsek többsége és a B. ovis 5 10% CO 2-ot tartalmazó légkört igényel. Többszöri átoltás után a törzsek CO 2-igényüket elveszthetik (kivétel a B. ovis). A táptalajok iránt igényesek, növekedésükhöz vitaminokra (tiaminra, nikotinsav-amidra, biotinra és pantoténsavra) is szükségük van. A brucellákat triptont, glükózt és élesztőkivonatot tartalmazó véresagaron izoláljuk, többségük elszaporítható azonban közönséges agaron és levesben is. A szervekből, váladékokból kitenyésztett B. melitensis, B. abortus és B. suis törzsek primer tenyészeteikben rendszerint S típusú telepeket képeznek. A B. ovis és a B. canis törzsek viszont primer tenyészeteikben is R-telepeket formálnak. Triptontartalmú véresagaron a brucellák 48 óra alatt igen apró, domború, átlátszó, sárgás színű telepeket képeznek. A telepek a további tenyésztés során megnagyobbodnak, átlátszóságukat elvesztik. Erősen szennyezett vizsgálati anyagokból (magzatburkokból, vetélt magzatokból) való kitenyésztésükhöz antibiotikumokat (polimixint, bacitracint) és ciklo-heximidet is tartalmazó táptalajokat veszünk igénybe. Szükség esetén a vizsgálati anyagból kísérleti állatokat (tengerimalacot) oltunk. Biokémiai sajátságok. A brucellák kataláz-pozitívak, az oxidáz-próbában a B. ovis és a B. neotomae kivételével ugyancsak pozitív reakciót adnak. A karbamidot változó mértékben hidrolizálják, a nitrátokat nitritté redukálják, indolt nem képeznek. A glükóz kivételével a bakteriológiában használatos szénhidrátok többségét nem vagy alig bontják, szénhidrátbontásuk oxidatív. A brucellák osztályozása. A brucellák fajokba sorolását fágérzékenységük (pl. Tbiliszi-fág), oxidatív metabolizmusuk (az egyes aminosavakat és szénhidrátokat mekkora oxigénfogyasztás mellett metabolizálják), továbbá természetes gazdáik szerint végezzük. Egyes fajok CO 2- igényük, kénhidrogén-termelésük, bázikus fukszin- és tionintűrésük, továbbá kimerített immunsavókban való agglutinációjuk alapján biotípusokba sorolhatók (8. táblázat). 8. táblázat - A Brucella fajok és biotípusok tulajdonságai Faj Biotípu s TBfágérzékenység CO 2- H 2S- Növekedés * Agglutináció Természete s 116
137 Részletes bakteriológia igény termelé s fukszin - tionin- kimerített savókban gazda RTD 10 4 RTD agaron agaron A M B Juh, kecske meliten tis B. abortus / / + _ / / / Szarvasmar ha B. suis Sertés, Sertés és mezeinyúl Sertés, Rénszarvas B. neotom ae + + Patkány B. ovis + +/ + Juh B. canis /+ +/ Kutya TB: Tbiliszi RTD: routine test dilution (rutinhigítás) *: a festék koncentrációja 1 :
138 Részletes bakteriológia Antigénszerkezet. A brucellák szoros antigénszerkezeti rokonságban állnak egymással. A B. abortus vagy a B. suis törzzsel termelt immunsavóban valamennyi S-telepeket képező Brucella faj agglutinálódik. Az S- teleptípusú törzsek a sejtfalban található (A és M betűvel jelölt) lipopoliszacharid-antigének alapján, megfelelő standard, kimerített immunsavókkal biotípusokba sorolhatók (lásd később). A csupán R-telepekben szaporodó B. ovis és B. canis antigénszerkezetileg is különbözik az előbb említett fajoktól. Az R-telepű B. ovisszal készített immunsavóban azonban mindkét faj agglutinálódik. A B. ovisból kivont szolubilis antigének a komplementkötési és a precipitációs próbában a homológ immunsavókkal pozitív, az összes többi Brucella fajjal előállított immunsavókkal negatív eredményt adnak. Szerológiailag (és biológiailag) aktív antigénkivonatok más Brucella fajokból is előállíthatók. Ellenálló képesség. A brucellák ellenálló képessége közepes. Magzatburokban, bélsárban stb. hónapokig életképesek ugyan, beszáradva azonban rendszerint napok alatt elpusztulnak. A tejben ugyancsak hónapokig megőrizhetik fertőzőképességüket, a tej savanyodása azonban 1 2 hét alatt elpusztítja őket. 60 C-on percek alatt elpusztulnak, így a pasztőrözött tejben is biztosan tönkremennek. A szokásos fertőtlenítőszerekkel ugyancsak könnyen elpusztíthatók. Pathogenitás. Idült gyulladásos folyamatokat okoznak, főleg a nemi szervekben, hímekben a mellékhere- és heregyulladás, nőivarúakban a vetélés a legfőbb tünet (brucellosis). A B. melitensis a juh és a kecske brucellosisának az okozója, de megtelepszik szarvasmarhában is, nálunk eddig nem fordult elő. A B. abortus a szarvasmarha, a B. suis pedig a sertés brucellosisának az okozója. Közülük a B. suis 2-es biotípusa megbetegítheti a mezeinyulat is. A B. suis biotípusai megtelepedhetnek más vadon élő rágcsáló- és ragadozófajokban is. A B. abortus és a B. suis a szarvasmarha- és a sertésbrucellosis felszámolásának eredményeként nálunk már nem fordul elő. A B. abortus egy virulenciájában gyengült B 19 jelű törzsét élő és az ugyancsak B. abortus, de R típusú 45/20 jelű törzsét pedig elölt állapotban, korábban szarvasmarhák védőoltására vettük igénybe. A B. ovis a kosok fertőző mellékhere- és heregyulladását, ritkán vemhes juhok vetélését idézi elő. A B. canis kutyában okoz idült fertőzést, magzatkárosodást, nálunk ez ideig nem izolálták. A B. neotomaeteddig kizárólag Észak-Amerikában izolálták, sivatagi patkányból. B. abortusszal, vagy B. suisszal hasüregbe vagy bőr alá fertőzött tengerimalacok néhány hét múlva megbetegszenek, a lépük megduzzad, a szervekben gyulladásos, elhalásos gócok keletkeznek. A vemhes tengerimalacok rendszerint elvetélnek. Az elhullott vagy leölt állatok szerveiből a brucellák mikroszkópos vizsgálattal és tenyésztéssel egyaránt kimutathatók. Néhány hét múlva azonban a fertőzött tengerimalacok vérét is megvizsgálhatjuk agglutinációs próbával brucellák elleni ellenanyagokra. A B. abortusszal vagy B. suisszal fertőzött egerekben vérfertőzés alakul ki, mely rendszerint 1 hét alatt az egerek elhullásához vezet Bordetella Rövid, pálcika alakú, Gram-negatív, obligát aerob baktériumok. Megtalálhatók a különféle emlősfajok és a madarak légutainak a nyálkahártyáin. Az ide tartozó fajok közül a B. pertussis és a B. parapertussis emberben fordul elő, a szamárköhögés okozói. Az utóbbi faj ritkán állatok orrüregéből is izolálható. Az állatokban két fajuk, a B. bronchiseptica és a B. avium fordul elő, ez a két utóbbi faj, szemben az előbbiekkel, körülcsillós. Valamennyien kataláz- és oxidáz-pozitívak, a szénhidrátokat nem bontják. Az állatokban előforduló mindkét faj könnyen tenyészthető közönséges és véresagaron egyaránt Bordetella bronchiseptica Rövid, 2 3 µm hosszú pálcikák (44. ábra). A virulens törzsek burkosak, és felületükön a csillókon kívül fimbriák is találhatók. 44. ábra - Bordetella bronchiseptica agartenyészetből (Gram-festés, 1250 ) 118
139 Részletes bakteriológia Tenyésztés. Közönséges agaron, 48 óra alatt, a virulens törzsek apró, domború, kerek, fénylő telepeket (I-es fázis) formálnak. A telepek néhány nap alatt megnagyobbodnak, szürkésfehér vagy porcelánfehér színűek lesznek. Továbboltva a törzsek fimbriáikat, burkukat könnyen elvesztik, eközben telepküllemük is megváltozik (IV. fázisú, R-telepek). Szelektív izolálására alkalmas a kristályibolyát, epesavas sókat, laktózt, neutrálvöröst, penicillint és nitrofurantoint tartalmazó agar táptalaj, ezen a bordetellák színtelen telepekben fejlődnek. Közönséges levesben egyenletes zavarosodást okoz, kevés szemcsés vagy nyúlós üledékkel. A levest meglúgosítja. Biokémiai sajátságok. A nitrátot nitritté redukálja, ureáz-pozitív. Szénhidrátforrásként csupán citrátot tartalmazó táptalajban is képes szaporodni. A virulens törzsek különféle citotoxinokat termelnek, képesek vörösvérsejteket agglutinálni, a fimbriák jelenléte pedig elősegíti a törzseknek az orr és a légutak nyálkahártya-hámsejtjeihez való tapadását. A citotoxinok egyike dermonecroticus hatású, tengerimalac bőrébe oltva elhalást okoz. Antigénszerkezet. A B. bronchiseptica törzsek több komponensből álló O-antigéneket, a frissen kitenyésztett, virulens törzsek emellett ugyancsak több komponensből álló burok- és fimbriaantigéneket is tartalmaznak. A burokantigének egy része a nemzetség valamennyi tagjában megtalálható, mások csak az egyes fajokban. Ellenálló képesség. Ellenálló képessége csekély, légúti váladékokban beszáradva néhány nap alatt, 60 C-on egy-két perc alatt elpusztul. Ugyancsak percek alatt elpusztul a szokásos fertőtlenítőszerek hatására is. Pathogenitás. Fakultatív pathogen. Természetes viszonyok között megtalálható a sertés, a kutya, a macska, a ló, a nyúl, a különféle egyéb rágcsálók és számos más faj orrüregében, ritkábban felső légúti nyálkahártyáin. Sertésben rhinitist, a P. multocida törzsekkel együtt torzító orrgyulladást, esetenként tüdőgyulladást, kutyában, macskában önállóan vagy különféle vírusok okozta betegségekhez társulva, ezenkívül házinyúl-állományokban náthás tüneteket, bronchitist, bronchopneumoniát okozhat. A B. bronchiseptica átmenetileg megtelepedhet az ember orrüregében is. Laboratóriumi kísérleti állatokban a fertőzés rendszerint nem okoz betegséget Bordetella avium 119
140 Részletes bakteriológia A B. bronchisepticához hasonló méretű, körülcsillós, virulens törzsei burkosak, és a felületükön fimbriák vannak. A tenyésztés iránt igénytelen, közönséges agaron 24 óra alatt apró, kerek, gyöngyszerűen fénylő telepeket képez. A nitrátot nem redukálja, ureáz-negatív. A virulens törzsek különféle, a légúti nyálkahártya hámsejtjeit károsító citotoxinokat, dermonecroticus toxint termelnek, s agglutinálják egyes állatfajok vörösvérsejtjeit. Pathogenitás. Fakultatív pathogen, természetes viszonyok között is jelen van, a pulyka, csirke és más madárfajok légutainak nyálkahártyáin. Növendék pulykában, valószínűen légúti fertőzéseket okozó vírusokhoz társulva, idéz elő a tyúkok haemophilus náthájához hasonló légúti tüneteket Moraxella Rövid, vaskos, Gram-negatív, csilló nélküli, kettesével álló pálcikák (Moraxella subgenus) vagy coccusok (Branhamella subgenus). Aerobok, a szénhidrátokat nem bontják. Természetes viszonyok között ember és a különféle állatfajok nyálkahártyáin, főleg az orr- és a garatüregben, a kötőhártyán, a nemi szervek nyálkahártyáin élnek. Az ide tartozó fajok közül a M. lacunata az emberben okoz kötőhártya- és szaruhártya-gyulladást, időnként azonban izolálható egészséges tengerimalacok kötőhártyájáról és más állatfajokból is. Állatorvosi szempontból a M. bovis és a M. (Branhamella) ovis fontos Moraxella bovis Morfológia. Rövid, 1 3 µm hosszú, vaskos, kettesével álló pálcikák (diplobacilusok). A törzsek egy részének a felületén fimbriák találhatók. Tenyésztés. Közönséges agaron nem vagy alig ered meg, tenyésztéséhez vért vagy vérsavót tartalmazó táptalajok szükségesek. Véresagaron, 37 C-on tenyésztve 24 óra alatt apró tűszúrásnyi, 48 óra alatt azonban nagyobb, 2 3 mm átmérőjű, domború, kerek, fénylő, szürkéssárga telepeket képez. Béta-hemolízist okoz. Alvasztottvérsavó-tartalmú agaron a vérsavó oldása következtében a telepek a táptalajba besüllyednek. Biokémiai sajátságok. Kataláz- és oxidáz-pozitív, a nitrátot nem redukálja. Többféle extracelluláris enzimet, így zselatinázt, hialuronidázt, fibrinolizint, kazeint bontó proteázt stb. termel. Ellenálló képesség. Ellenálló képessége gyenge, a külvilágban igen hamar elpusztul. Tenyészeteiben is csak akkor ered meg, ha a váladékokat néhány órán belül táptalajokra oltjuk. Antigénszerkezet. Fimbriái alapján, agglutinációs próbával a M. bovis törzsek legalább 7 szerocsoportba sorolhatók. A fimbriák teszik képessé a törzseket a szaruhártya hámsejtjeihez való tapadásra, az ilyen törzsek egyúttal agglutinálják a juh- és a sertés-vörösvérsejteket. A fimbriák ellen termelt immunsavókkal az adhézió típusspecifikus módon gátolható. Pathogenitás. Fakultatív pathogen, szarvasmarhában, ritkán bivalyban okoz fertőző kötő- és szaruhártyagyulladást. A béta-hemolízist okozó, fimbriás törzsek kötőhártyára cseppentve megbetegítik az egeret is. Időnként ló kötőhártya-gyulladásából is izolálhatók a M. bovisnak tekintett törzsek Moraxella ovis Lapos felületükkel egymáshoz tapadt zsemlére emlékeztető, párosával előforduló coccusok. A törzsek egy részének a felületén fimbriák találhatók. Tenyésztési tulajdonságaiban nem különbözik a M. bovistól. Kataláz- és oxidáz-pozitív, a nitrátot nitritté redukálja, de nem folyósítja el sem a zselatint, sem pedig a kazeint. A juhból származó törzsek agglutinálják a csirke-vörösvérsejteket. Fakultatív pathogen, természetes viszonyok között megtalálható mind a juh, mind a szarvasmarha kötőhártyáján és orrüregében. Juhokban és kecskékben (gyakran mycoplasmákkal együtt), ezenkívül fiatal borjakban okoz enyhe tünetekkel járó keratoconjunctivitist Pseudomonas 120
141 Részletes bakteriológia Gram-negatív, 1,5 5 µm hosszú, pálcika alakú, többségükben egy vagy néhány polárisan helyeződő csillóval rendelkező baktériumok. Obligát aerobok, számos fajuk pigmenteket termel. Igénytelenek, könnyen tenyészthetők, többségük egyetlen szerves vegyületet tartalmazó közegben is képes szaporodni. A Pseudomonas mallei kivételével a természetben igen széles körben elterjedtek, megtalálhatók a felszíni vizekben, a talajban, a növényzeten stb. Néhány fajuk pathogen vagy fakultatív pathogen, túlnyomó többségük azonban saprophyta. Vannak közöttük növénypathogen fajok is. A saprophyták közül egyesek (P. fluorescens, P. maltophilia stb.) megtelepedhetnek az állati eredetű élelmiszerekben (tojás, tej, hal, darált hús stb.) romlást, élelmiszerhibákat idézve elő. Az állatorvosi szempontból fontos fajok a következők Pseudomonas mallei Morfológia. A többi pseudomonastól eltérőeni nincsenek csilló. Vizes festékoldatokkal nehezen, karbolsavtartalmú (pl. Ziehl-fukszin) vagy lúgos festékoldatokkal azonban jól megfesthető. Mind tenyészetekből, mind a kóros termékekből kikenve egyenetlenül, szakaszosan festődik. Tenyésztés. Közönséges agaron, 37 C-on, levegő jelenlétében, 24 óra alatt apró, sima szélű, szürkésfehér, áttetsző telepek keletkeznek. A telepek néhány nap alatt jelentősen megnagyobbodnak. A növekedést elősegíti az agarhoz adott glicerin. Levestenyészeteiben egyenletes zavarosodást okoz, később pedig a kémcső alján nyúlós üledék képződik. Pigmentet nem képez. Biokémiai sajátságok. Kataláz- és oxidáz-pozitív. Glükózból és számos más szénhidrátból is savat termel, a zselatint elfolyósítja. Ellenálló képesség. Ellenálló képessége kicsi, beszáradt váladékokban néhány nap alatt tönkremegy, nedves állapotban azonban akár 4 hétig is életben marad. Perceken belül elpusztul azonban C-on és fertőtlenítőoldatok hatására. Pathogenitás. Obligát pathogen, a szabad természetben nem fordul elő. Az egypatásokban idéz elő takonykórt (malleust), megbetegíti azonban a macskát, ideértve az állatkerti nagymacskákat is, és a kutyát, de fogékony iránta az ember és néhány más faj is. Európában a malleus évtizedek óta nem fordul elő. A laboratóriumi állatok közül a hörcsög és a tengerimalac a leginkább fogékony, a nyulak ellenállnak a fertőzésnek. P. malleit tartalmazó vizsgálati anyagot hím tengerimalac hasüregébe fecskendezve 2 4 nap alatt hashártyagyulladás, továbbá fájdalmas here- és hereborék-duzzanat fejlődik ki. A here burkai között felhalmozódott fibrines, gennyes váladékból a baktériumok mikroszkópos vizsgálattal és tenyésztéssel egyaránt kimutathatók. A kitenyésztett baktériumokat szerológiai (agglutinációs, komplementkötési) próbával azonosítjuk, mert a takonykórra emlékeztető hashártya- és heregyulladást a vizsgálati anyagban esetleg jelenlevő más baktériumok, pl. C. pseudotuberculosis,pseudomonas aeruginosa, létrehozhatják Pseudomonas pseudomallei Hasonlít a takonykór baktériumához, de csillós, egyes törzsei narancsvörös színű, vízben nem oldódó pigmenteket termelnek. Glicerintartalmú agaron ráncolt telepekben nő, a levestenyészetek tetején pedig szemölcsös hártyát képez Nedves, trópusi területeken, főként Délkelet-Ázsiában megtalálható a talajban és a természetes vizekben, ezek képezik a fertőzés forrását. Fakultatív pathogen, a fajok igen széles köre fogékony iránta. A takonykórhoz hasonló, testszerte gennyes beolvadásokkal járó betegséget (melioidosist) idézhet elő szarvasmarhában, juhban, kecskében, sertésben, kutyában, macskában, majmokban és az emberben is Pseudomonas aeruginosa Igen széles körben elterjedt baktérium, megtalálható a természetes vizekben, szennyvizekben, a talajban, a növényzeten, alacsony számban az emlősök és a madarak bélcsatornájában, alkalmanként a bőrön is. Morfológia. Egyetlen, poláris helyeződésű csillója van, amellyel élénken mozog. A csilló mellett ugyancsak polárisan helyeződő fimbriái is vannak. Fukszinnal vagy genciánaibolyával egyenletesen festődik. Tenyésztés. Levegő jelenlétében bármely táptalajon, 5 42 C között, de legjobban 37 C-on, gyorsan és bőségesen elszaporodik, nedves lapos, sima szélű telepeket képez. Véresagaron béta-hemolízist okoz. 121
142 Részletes bakteriológia Tenyészeteiben kétféle festéket termel: a kloroformban is oldódó, kék színű piocianint és az abban nem oldódó, sárga színű fluoreszceint. A festékek a táptalajba diffundálnak, ezért a baktériumok telepeinek környéke is zöldre festődik. A tenyészetek zöld színe idővel a festékek oxidációja miatt barnásba megy át, innen ered a baktérium elnevezése is (aerugo: rozsda). A P. aeruginosa tenyészeteinek jellegzetes, aromás szaga van. Levestenyészetben egyenletes, sűrű zavarosodást okoz, a táptalaj felső, levegővel érintkező része itt is zöld színűre festődik. Biokémiai sajátságok. Kataláz-, oxidáz- és ureáz-pozitív, a nitrátokat nitritté redukálja. A glükózt, a mannitot és még néhány más szénhidrátot savtermeléssel elbont, ezenkívül hidrolizálja a zselatint és a kazeint. Antigénszerkezet. A sejtfalban található főbb hőstabil antigének alapján agglutinációs próbával a P. aeruginosa törzsek ez ideig legalább 17 szerocsoportba sorolhatók. Az egyes csoportokon belül több alcsoport különíthető el, s számos keresztreakció létezik az egyes csoportok között is. Az egyes szerocsoporton belül a törzsek egymástól való további megkülönböztetésére felhasználható a piocintermelés és a fágtipizálás. Ellenálló képesség. Ellenálló képessége nem nagy, beszáradva néhány nap alatt, 60 C-on pedig perceken belül elpusztul. A fertőtlenítőszerek 1 2%-os oldatai ugyancsak perceken belül elölik, de szokatlanul rezisztensek pl. a kvaterner ammóniumsókat tartalmazó fertőtlenítőszerekkel szemben, sőt egyes amfoter, felületaktív anyagokat tartalmazó fertőtlenítőszerek híg oldataiban, éppen igénytelenségük miatt, szaporodni is képesek. Gyakran eleve rezisztensek, vagy gyorsan rezisztenciát szereznek több, a gyakorlatban használatos antibiotikummal szemben is. Pathogenitás. Fakultatív pathogen, megbetegítheti valamennyi állatfajt és az embert is. Emberben bőrsérülésekhez, égéshez társuló fertőzéseket, conjunctivitist, közép- és belsőfülgyulladást, csecsemőkben enteritist, septikaemiát okoz. Az állatok közül szarvasmarhában metritist, mastitist, meleg, nedves éghajlati viszonyok között tartott juhokban gyapjúrothadással járó bőrgyulladást, valamennyi állatfajban sebfertőzéseket, kutyában conjunctivitist, fülgyulladást, madarakban septikaemiát, a prémes állatok közül nyércben, csincsillában pneumoniát, septikaemiát okoz. A fertőzött sebekben rendszerint csupán a kék színű piocianint termeli, innen ered a baktérium korábbi elnevezése: Bacterium pyocyaneum (kék gennybaktérium). Az egészséges laboratóriumi állatokat csak nagy mennyiségű tenyészet parenteralis befecskendezésével lehet megbetegíteni Pseudomonas anguilliseptica Rövid, pálcika alakú, csillós baktérium. Kataláz- és oxidáz-pozitív, elfolyósítja a zselatint, szénhidrátokat azonban nem bont. Halpathogen baktérium, amely elsősorban tenyésztett lazacfélékben, angolnákban és dévérkeszegekben vérzéses vérfertőzéssel és szaruhártya-gyulladással járó tömeges megbetegedést és elhullást okoz Aeromonas Gram-negatív, 1 4 µm hosszú, pálcika alakú baktériumok, megtalálhatók a természetes vizekben, szennyvizekben, alkalmanként azonban az állatok bélcsatornájában is. Néhány kivételtől eltekintve csillósak, többnyire egyetlen poláris csillójuk van. Kataláz- és oxidáz-pozitívak, a nitrátokat nitritté redukálják. Az alakilag és biokémiailag is hozzájuk sokban hasonló pseudomonasoktól megkülönböztethetők azon az alapon, hogy aerobok, fakultatív anaerobok, szénhidrátbontásuk fermentatív. A nemzetségbe tartozó fajok közül az alábbiaknak van kórtani jelentősége Aeromonas hydrophila Könnyen tenyészthető, tenyésztési optimuma 28 C, de nő 37 C-on is. Telepei közönséges és véresagaron egyaránt nagyok, sárgásfehérek, véresagaron béta-hemolízist okoz. Közönséges levesben egyenletes sűrű zavarosodást okoz. Indol-pozitív, a metilvörös- és a Voges Proskauer-próbában egyaránt pozitív, kéntartalmú sókból és aminosavakból H 2S-t termel, elfolyósítja a zselatint. Glükózból és számos más szénhidrátból savat és gázt egyaránt termel. Fakultatív pathogen. Főleg a hidegvérűeket, békát, kígyót stb., alkalmanként halakat betegít meg, de szórványosan megtelepedhet a háziállatokban is Aeromonas salmonicida 122
143 Részletes bakteriológia Rövid, coccobacilus, csillója nincs, tenyésztési optimuma C, 37 C-on nem indul fejlődésnek. Tenyészeteiben rendszerint sötétbarna színű, a táptalajba diffundáló pigmentet képez, előfordulnak azonban pigmentet nem termelő törzsek is. A zselatint elfolyósítják. Egyéb biokémiai sajátságaik alapján a törzsek legalább 3 alfajba sorolhatók. Fakultatív pathogen, a velük fertőzött halakon él, de nem a természetes vizekben. Tengeri és édesvízi halakban (lazacfélékben, ritkán pontyokban stb.) okoz septikaemiával, továbbá testszerte tályogképződéssel és bőrfekélyekkel járó betegséget (furunculosist) Vibrio Kissé hajlott, a vesszőhöz hasonló, 1,5 3 µm hosszú, pálcika alakú, Gram-negatív baktériumok. Többségüknek egyetlen, egyes fajoknak azonban több, polárisan helyeződő csillójuk van. Burkot nem képeznek. Tenyésztés. Aerobok, fakultatív anaerobok. Igénytelenek, a legegyszerűbb táptalajokon is gyorsan elszaporodnak. Valamennyi faj tenyészthető 20 C-on, de többségük 37 C-on is. Szaporodásukat NaCl jelenléte elősegíti. Szelektív izolálásukra alkalmasak az erősen lúgos (ph 8,6) táptalajok, savas közegben viszont hamar tönkremennek. Leves táptalajok felületén finom hártyát képeznek. Biokémiai sajátságok. Kataláz- és néhány kivétellel oxidáz-pozitívak, az orvosi, állatorvosi szempontból fontos fajok többsége triptofánból indolt termel, a nitrátot nitritté redukálják, elfolyósítják a zselatint, H 2S-t viszont nem termelnek. Szénhidrátbontásuk fermentatív, a glükózból, mannitból és számos más szénhidrátból gáztermelés nélkül savat képeznek. Pathogenitás. Többségük a tengerek vízében él, ezek megtalálhatók a tengeri élőlények emésztőcsatornájában és felületükön is, egyes fajok viszont az édesvizek lakói. Többségükben saprophyták, vannak azonban közöttük pathogenek és fakultatív pathogenek is Vibrio cholerae Oxidáz-pozitív, indol-pozitív, a nitrátot nitritté redukálja. Az ember cholerájának az okozója. Két biotípusa van (a klasszikus és az El Tor) mindkettő az O 1-es szerocsoportba tartozik. Az utóbbi években az emberben cholerát okozó V. cholerae törzseknek egy újabb változata bukkant fel, amely, szemben az eddigiekkel, a sejtfal lipopoliszacharid antigénje alapján az O 139-es szerocsoportba tartozott (V. cholerae Bengal), és ugyanúgy, mint az O 1-es csoportba tartozó két korábbi biotípus, choleratoxint (amely Da molekulatömegű fehérje) termelt. Az emberi cholera Európában, kivételes esetektől eltekintve, nem fordul elő. A nem cholerát okozó V. cholerae törzsek O-antigénjeik alapján számos szerocsoportba sorolhatók. Közülük egyesek emberben choleraszerű hasmenést idézhetnek elő, de alkalmanként izolálhatók természetes édesvizekből, városi szennyvizekből, édesvízi halakból, továbbá tünetmentes vagy hasmenésben szenvedő madarakból (pl. vadkacsából, vadlibából) is Vibrio metchnikovii Alaki, tenyésztési és biokémiai sajátságait illetően megegyezik a genus egészére leírtakkal, a V. cholerae törzsektől azonban egyebek mellett abban különbözik, hogy oxidáz-negatív, nem termel indolt és nem redukálja a nitrátot sem. Megtalálható a természetes édesvizekben, a szennyvizekben, kagylókban, csigákban, rákokban, halakban. Szórványosan madarakban (főleg libákban) okozhat hasmenéssel járó vérzéses bélgyulladást, septikaemiát, az embert csak kivételesen betegíti meg. A laboratóriumi kísérleti állatok közül a tengerimalacot bőr alá oltva elpusztítja, és ugyancsak halálosan szoktak megbetegedni a galambok, mellizomba való fertőzésük után Vibrio parahaemolyticus Biokémiai tulajdonságaiban nagyban hasonlít a V. choleraera. Természetes előfordulási helye a tengervíz, továbbá a tengeri halak, puhatestűek stb. Emberben okoz tengeri eredetű kagyló, csiga, rák stb. fogyasztását követően, gastroenteritissel, ritkán septikaemiával járó ételfertőzést Vibrio (Listonella) anguillarum 123
144 Részletes bakteriológia Kataláz- és oxidáz-pozitív, további biokémiai sajátságaik alapján a törzsek több biotípusba, sejtfalantigénjeik alapján pedig ez ideig legalább 10 szerocsoportba sorolhatók. Tengervízben él, fiatal lazacfélékben és angolnákban okozhat tömeges elhullást Campylobacter Hajlott pálcika, vessző vagy S alakú (campylo = hajlott) baktériumok, mikroaerofilek, utóbb azonban a genetikai rokonság okán néhány anaerob fajt is ebbe a nemzetségbe soroltak. Az ide tartozó fajokat korábban mikroaerofil vibriókként tartották számon. Megtalálhatók a szarvasmarha, a juh, de alkalomadtán más kérődzők nemi szerveinek a nyálkahártyáin, továbbá a különféle állatfajok és az ember szájüregében és emésztőcsatornájában. Morfológia. Vessző alakú, 2 5 µm hosszú baktériumok. Ha a többször osztódott pálcikák egymáshoz tapadva maradnak, S alakok és hosszú, spirális fonalak is láthatók (45. ábra). Többször átoltott vagy idősebb tenyészetekben elvesztik jellegzetes alakjukat, rövid, egyenes pálcák, coccoidok lesznek. Egyik vagy mindkét végükön egyetlen poláris csillójuk van, friss tenyészetben élénken mozognak. Gram-negatívok, jól megfesthetők karbolvizes fukszinnal. 45. ábra - Campylobacter fetus subsp. venerealis agartenyészetből (Gram-festés, 1250 ) Tenyésztés. Közönséges levegőn tenyészeteik nem erednek meg. Mikroaerofilek, növekedésük akkor a legjobb, ha 37 C-on 6% O 2-t és 10% CO 2-ot tartalmazó gázkeverékben tenyésztjük. Egyes törzsek többszöri passzázs után hozzászoktathatók a levegőn való növekedéshez is. Véresagaron tenyésztve óra alatt kb. l 3 mm átmérőjű, kerek, domború, fénylő telepek képződnek. Esetenként a friss tenyészetekben is, de a többszöri átoltás során mindenképpen, sárgásszürke, nyúlós, mukoid és szemcsés R-telepek is kialakulnak. A C. jejuni és a C. coli törzsek frissen kitenyésztve, nedves véresagar felületén rajzanak, a telepek laposak, nedvesek, összefolynak. Piroszőlősavnak a táptalajhoz adása jelentősen segíti szaporodásukat. Közönséges agaron rendszerint nem erednek meg. Erősen szennyezett anyagokból (vetélt magzatból, bélsárból stb.) való szelektív izolálásukra antibiotikumokat (pl. vankomicint, polimixint és trimetoprimet) tartalmazó véresagar használatos. Közönséges levesben nem erednek meg, de aminosavakat bőven tartalmazó, félfolyékony táptalajba oltva a felszín alatt 0,5 1 cm vastag rétegben jól elszaporodnak, diffúz zavarosodást okozva. 124
145 Részletes bakteriológia Biokémiai sajátságok. Oxidáz-pozitívok, a szénhidrátokat nem bontják, energiájukat főként aminosavakból és különféle szerves savakból (piroszőlősavból stb.) fedezik. Anyagcseréjük típusa oxidatív. A kataláz-próba, 25 és 42 C-on való növekedés, glicin- és konyhasótűrés, nalidixinsav iránti érzékenység stb. alapján fajokba, ezen belül alfajokba, változatokba sorolhatók (9. táblázat). 9. táblázat - A fontosabb Campylobacter fajok biokémiai tulajdonságai Növekedés Érzékeny H 2S Fajok Katalá z 25 C 42 C 1% glicin 3,5% NaCl 30µg 30µg nalidix sav cephalo tin Nitrátreduk ció Ólom- acetát TSI Hippur át- hidrolíz is Indoxil - acetát hidrolí zis C. fetus sp. venerealis sp. fetus C.jejuni sp. jejuni _ sp. doylei nv. k + C. coli C. lari C. mucosalis C. sputorum var. sputorum var. bubulus var. fecalis C. hyointestin alis k: különböző típusok nv.: nem vizsgált Antigénszerkezet. A C. fetus két alfaja a sejtfalban levő O-antigének alapján, agglutinációs próbával két szerocsoportba, O1 (vagy A) és O2 (vagy B) sorolható. Mindkét szerocsoportú törzs előfordul mindkét alfajban. A baktériumsejt felületén található hőlabilis és a csillóantigének legalább 7 félék, ezek az egyes törzsekben különböző kombinációkban fordulnak elő. 125
146 Részletes bakteriológia A C. jejuni és C. coli törzsek a sejtfalból kivont hőstabil antigénjeik alapján, passzív hemagglutinációs próbával, ez ideig legalább 66 szerocsoportba sorolhatók. Kidolgoztak egy a hőlabilis antigéneket is figyelembe vevő szerológiai osztályozást, e szerint a rendszer szerint több mint 120 szerotípus ismert. A két tipizálási rendszer egymással nem kompatibilis. Ellenálló képesség. Ellenálló képességük csekély. Kitenyésztésük is csak akkor sikerül, ha a vizsgálati anyagokat a mintavétel után rövid időn belül táptalajra oltjuk. Beszáradva néhány óra alatt, 60 C-on pedig perceken belül elpusztulnak. Pathogenitás. Az ide sorolt fajok többsége saprophyta, egy részük azonban fakultatív pathogen. A C. fetus subsp. venerealis (korábban Vibrio fetus) megtalálható a bikák tasaknyálkahártyáján és alkalmanként a húgycső disztális részében is. A bikák tünetmentesek, mesterséges termékenyítés vagy még inkább természetes fedeztetés útján üszőkbe, tehenekbe jutva, azokban hüvely- és méhgyulladást, gyakori visszaivarzást, esetenként vetélést, következményes meddőséget okoz. A C. fetus subsp. venerealis a szarvasmarhán kívül más fajban nem telepszik meg. A C. fetus subsp. fetus (korábban C. fetus subsp. intestinalis) előfordul szarvasmarhában, juhban és valószínűleg más kérődzőkben is a nemi szervek nyálkahártyáin, de alacsony számban megtalálható a különféle állatfajok és az ember bélcsatornájában is. Juhban tömeges, szarvasmarhában szórványos vetélést okozhat. Ritkán megbetegíti az embert is, septikaemiát, vetélést okoz. A C. jejuni és a C. coli a madarak és a legtöbb emlősállat bélcsatornájának természetes lakói. Szarvasmarhában, juhban, kecskében szórványosan vetélést, mastitist, újszülöttekben ritkán enteritist okozhatnak. Fiatal kutyában, macskában hasmenéssel járó enteritist idéznek elő, a tojásrakás kezdetén levő tyúkállományokban pedig a bélcsatornából beszaporodva hasmenést és hepatitist okozhatnak. Jelen lehetnek a tejben, továbbá gyakran a konyhakész, friss, vágott baromfi felületén is. Emberben (főleg gyermekekben) enyhe tünetekkel járó hasmenést okozhatnak. A C. lari főleg vadon élő madarak bélcsatornájában honos, megbetegítőképessége ugyanolyan, mint a C. jejuni és a C. coli törzseké. A C. mucosalis, a C. hyointestinalis és a C. hyoilei a sertések vékonybelének lakói. Korábban összefüggésbe hozták ezeket a baktériumokat a sertések proliferatív enteropathiájával (intestinalis adenomatosis, necroticus enteritis, proliferatív haemorrhagiás enteropathia stb.), utóbb azonban kiderült, hogy ezeket a betegségeket egy önálló, alakilag a campylobacterekhez hasonló, a sertések bélnyálkahártya-hámsejtjeinek cytoplasmájában szaporodó, a bakteriológiában használt táptalajokon nem, de patkány enterocytákban tenyészthető baktériumfaj, a Lawsonia intracellularis idézi elő. A C. sputorum változatai közül a C. sputorum var. sputorum az ember szájüregében, a C. sputorum var. bubulus a szarvasmarha nemi szerveinek a nyálkahártyáin, a C. sputorum var. fecalis pedig a juhok bélcsatornájában található meg. Az utóbbi években leírt egyéb Campylobacter fajok kórtani szerepét még nem ismerjük kellően Helicobacter Az ide tartozó baktériumfajokat alaki hasonlóságuk miatt korábban a campylobacterekhez sorolták. Közülük a kórtanilag fontos fajok természetes viszonyok között megtalálhatók az ember és az együregű gyomrú (monogastricus) emlős állatfajok (főként a húsevők) gyomor- és nyombél-nyálkahártyáján. Morfológia. Hajlott, vessző, S vagy U alakú, ritkábban egyenes, csavart, 1,5 5 µm hosszú pálcikák, amelyek egy vagy több polárisan helyeződő csillóval rendelkeznek. A táptalajon többször átoltott tenyészetekből készített kenetekben zömmel polimorf coccobacillusokként jelennek meg. Tenyésztés. A campylobacterekhez hasonlóan mikroaerofilek. A táptalajok iránt igényesek. Aminosavakat, (ló-) vérsavót vagy vért és növekedést serkentő anyagokat (pl. IsoVitalex) is tartalmazó agar táptalajokon szaporíthatók. A táptalajok szelektívvé tételére antibiotikumokat használunk. A gyomorból vett váladék- és biopsziás szövetmintákat célszerű rögtön táptalajra széleszteni vagy ha erre nincs mód transzport táptalajba oltva szobahőn tárolni. A helicobacterek C-on primer tenyészeteikben 3 7 nap alatt (a továbboltott tenyészeteikben 2 4 nap alatt) apró, kb. 1 mm átmérőjű, áttetsző, enyhén domború, fénylő, kerek, zárt szélű telepeket képeznek. Biokémiai tulajdonságok. Kataláz- és oxidáz-pozitívak. Többségük alkalikus foszfatáz- és ureázaktivitással is rendelkezik. A szénhidrátokat nem bontják. Ez ideig mintegy húsz fajuk ismert. 126
147 Részletes bakteriológia A virulens H. pylori és H. mustelae törzsek az ember és néhány emlősállatfaj vörösvérsejtjeit agglutinálják. A H. pylori törzsek ezenkívül hámsejtkárosító toxint (citotoxint) is termelnek. A baktériumok nyálkahártyához való tapadása és azon (abban) való elszaporodása feltehetően összefügg a törzsek hemagglutinációs képességével. Ellenálló képesség. A helicobacterek ellenálló képessége kicsi, fertőzött váladékokban a külvilágon rövid idő alatt elpusztulnak, a kórtanilag fontos fajok csupán a gazdafaj gyomor- és nyombél-nyálkahártyáján életképesek. Pathogenitás. A nemzetségbe tartozó fajok közül a H. pylori emberben idült gyomorgyulladást és következményes gyomor- vagy nyombélfekélyt, a H. felis macskában és a H. canisszal együtt kutyában, a H. mustelae menyétfélékben, a H. acinonyx pedig gepárdokban okoz a lymphoid tüszők hyperplasiájával járó idült gyomorgyulladást. Ezenkívül fogságban tartott, idült gyomorgyulladásban szenvedő tigrisekből és oroszlánokból is izoláltak eddig be nem sorolt Helicobacter törzseket. A H. heilmannii kórokozó szerepét pedig a sertések oesophagealis gyomorfekélyének kialakulásában valószínűsítik Arcobacter A campylobacterek között korábban leírtak olyan fajokat is, amelyek alaki és tenyésztési sajátságaikban hasonlóak voltak a campylobacterekhez, de különböztek tőlük egyebek mellett abban, hogy bár növekedésük mikroaerofil viszonyok között optimális, az izolálást követően normál légtérben is képesek szaporodni. Ezeket az aerotoleráns, 1 3 µm hosszú, hajlott pálcika alakú, egyetlen, poláris helyeződésű csillóval rendelkező baktériumokat újabban önálló, Arcobacter nemzetségbe sorolják. Az Arcobacter fajok tenyésztésére alkalmasak a leptospirák izolálására szolgáló, félfolyékony táptalajok, továbbá a campylobacterek tenyésztésére használt tioglikolát és tioltáptalajok. A szelektivitás biztosítása érdekében az előbbiekhez 5-fluoruracilt, az utóbbiakhoz pedig antibiotikumokat (bacitracint, novobiocint stb.) keverünk. A telepek hasonlítanak a campylobacterekéire. Fenotípusos tulajdonságaik alapján a campylobacterektől nehezen különböztethetők meg, kataláz- és oxidáz-pozitívak, a nitrátot csak egy részük redukálja. Az ide tartozó fajok közül az A. cryaerophilust szarvasmarha és sertés vetéléseiből, tőgygyulladásban beteg tehenek tejéből, ezenkívül bélsárból is izolálták. A további fajok közül az A. skirowii természetes viszonyok között megtalálható a bikák preputiumában, de alkalmanként vetélt szarvasmarha-, juh- és sertésmagzatokból és e fajok bélsarából is izolálható. Az A. butzlerit hasmenésben szenvedő emberek és majmok bélsarából izolálják Spirochaeták Hosszú, vékony, a dugóhúzó alakjára emlékeztető, hajlékony mikroorganizmusok. Bár a spirochaeták baktériumok, szerkezetük kissé eltér a többi baktériumfajétól. A spirochaetákat legkívül egy vékony, főleg lipoproteinből álló, elasztikus membrán veszi körül. Ez alatt találhatók a hosszú, esetenként a sejtvégeken is túlnyúló, a csillóhoz hasonló szerkezetű, proteinből álló tengelyfonalak (axiális fibrillumok). Alattuk helyeződik el egy ugyancsak igen vékony mukopeptid réteg, majd a cytoplasmahártya s ezen belül a cytoplasma. A spirochaeták életképessége a külső elasztikus membrán sértetlenségétől függ. Savas közegben, epesavas sók hatására, beszáradás stb. következtében a membrán megsérül, a spirochaeták feloldódnak és elpusztulnak. Az elasztikus membrán tartalmazza ezenkívül azokat a lipoprotein-antigéneket, amelyek alapján a spirochaeták egy része (pl. a leptospirák) szerológiailag csoportosítható. A membrán alatt helyeződő tengelyfonalak felelősek a spirochaeták mozgásáért, és ezek határozzák meg alakjukat is. A spirochaeták közül a kórtani szempontból fontos fajok a Borrelia, a Serpulina, a Treponema és a Leptospira nemzetségbe tartoznak. Morfológia. A borreliák, a serpulinák, a treponemák és a leptospirák hosszú, igen vékony, csavart, fonal alakú képletek, amelyek annyiban különböznek egymástól, hogy a borreliák, a serpulinák és a treponemák csavarulatai tágak, s így hullámos alakjuk mikroszkóp alatt jól felismerhető, a leptospirák csavarulatai viszont annyira szorosak, hogy csak elektronmikroszkópos vizsgálat során tűnnek elő. A borreliák, a serpulinák és a treponemák mindkét vége hegyes, a leptospiráké ellenben egyik vagy mindkét végén horogszerűen görbült. Csillóik nincsenek, de csillók hiányában is élénk, dugóhúzószerű vagy csapkodó mozgást végeznek. Festődés. A fajok egy része (pl. a borreliák és a serpulinák) a bakteriológiában szokásosan használt festékekkel, pl. karbolvizes fukszinnal is jól megfestődik, legtöbbjük azonban csak előzetes pácolás után (erősebb festékoldatokkal) vagy Giemsa szerint festhető meg. Gram-negatívok. A nehezen festődő fajok feltüntetésére jól 127
148 Részletes bakteriológia használható a Vágó-féle festési eljárás is. Szöveti metszetekben a spirochaeták kimutathatók a Levaditi-féle ezüstimpregnációs eljárással. Jól felismerhetők natív készítményekben, élő állapotban sötét látóteres vagy fáziskontraszt-mikroszkópos vizsgálattal. Frissen vett vizsgálati anyagban mozgásuk is megfigyelhető. A spirochaeták vizsgálatára jól felhasználhatók az immunfluoreszcenciás eljárások. Megfelelő specifikus (kimerített) immunsavókat vagy monoklonális ellenanyagokat használva az azonos morfológiájú fajok egymástól el is különíthetők. AGiemsa-féle festésnek több változata van. Az ún. gyors eljárást a következőképpen végezzük. A vékonyan felkent, megszáradt készítményt 3 percig metil-alkohollal fixáljuk. A festést egy térfogatrész Giemsa-oldat (metilénkék és eozin keveréke) és két térfogatrész semleges kémhatású desztillált víz (vagy célszerűbben 1/15 mólos Sörensen-féle puffer) keverékével végezzük 5 percig. A megfestett kenetet desztillált vízben tartjuk 1/2 1 percig, majd megszárítjuk és immerziós lencsével vizsgáljuk. A spirochaeták piros vagy kékes színűek. A Giemsa-féle festés alkalmas nemcsak a treponemák, hanem más mikroorganizmusok, pl. a rickettsiák (lásd később) feltüntetésére is. A Vágó-féle festési eljárás során a megszáradt, de nem fixált kenetet tömény vizes merkurokrómoldattal (dibróm-hidroximerkuri-fluoreszceinnel), majd vízzel való öblítés után tömény vizes pioktaninoldattal kezeljük néhány percig. Újra öblítjük, majd szárítás után immerziós lencsével vizsgáljuk. A leptospirák kékesfeketére festődnek. Tenyésztés. A spirochaeták közül csupán a serpulinákat és a leptospirákat tudjuk következetesen tenyészteni. A pathogen borreliákat és treponemákat (pl. a Treponema pallidumot és a Treponema paraluiscuniculit) elszaporításuk céljából megfelelő kísérleti állatokba oltjuk, és a kórosan elváltozott szerveket fagyasztott állapotban tároljuk. A fertőzött szervekből egy keveset kísérleti állatokba oltva a törzsek újra életre kelthetők Borrelia A borreliák 3 20 µm hosszúak, csavarulataik tágak, egyenetlenek. Viszonylag sok, axiális fibrillumuk van. Giemsa-féle festéssel jól megfesthetők. A borreliák széles körben elterjedtek. Obligát paraziták, csak a velük fertőzött gazdákban és ízeltlábú vektoraikban élnek. Természetes gazdáik vadon élő apró rágcsálók (egér, patkány, mókus, hód stb.), egyes fajok esetében azonban a szarvasmarha és a ló (B. theileri), a madarak (B. anserina) és az ember is. Vektoraik különféle kullancsok, az ember visszatérő lázát okozó B. recurrentis esetén azonban a ruhatetű. Az ízeltlábúak a fajok túlnyomó többségénél valódi vektorok, bennük a borreliák elszaporodnak és átjutnak az utódokba is. A borreliák okozta fertőzések természeti gócfertőzések formájában léteznek, földrajzi elterjedtségük igen változatos, többségük a melegégövi területeken fordul elő. A borreliák fajokba sorolása ízeltlábú vektoraik és fő gazdáik szerint történik. A borreliák közül számos faj, így a B. recurrentis, a B. caucasica, a B. hispanica stb. az emberben okoz ismétlődő lázas tünetekkel járó betegséget (visszatérő lázat). Állatorvosi szempontból az alábbi fajoknak van jelentősége Borrelia anserina Hullámos lefutású, 8 30 µm hosszú spirochaeta. Megfestődik karbolvizes fukszinoldattal is, de különösen szépen Giemsa szerint. Festetlen állapotban is jól felismerhető tuskészítményben vagy sötét látóteres és fáziskontraszt-mikroszkópban. Natív fehérjét és különféle, növekedést serkentő anyagokat (pl. hemoglobint és aszkorbinsavat) is tartalmazó leves táptalajokba oltva a B. anserina törzsek hosszabb-rövidebb ideig fenntarthatók, jól elszaporodnak azonban mesterségesen fertőzött tyúkokban. A törzsek többsége elszaporítható napos embrionált tyúktojásban is. Ellenálló képességük csekély, a hullákban gyorsan elpusztulnak, kivételesen azonban 1 3 napos hullákban is akadhatunk élő borreliákra. A beteg állatok defibrinált vérében 4 C-on akár 2 hónapig is életben maradhatnak, szobahőmérsékleten, valamint beszáradva azonban gyorsan elpusztulnak. A B. anserina világszerte előfordul. Libában, kacsában, tyúkban, pulykában, fácánban, kanáriban és néhány vadon élő madárfajban idéz elő lázas általános tünetekkel, aluszékonysággal járó betegséget (baromfispirochaetosis, borreliosis). A betegség terjesztésében a kullancsoknak és az atkáknak, nálunk főleg az óvantagoknak és más vérszívó ízeltlábúaknak van szerepük. Az emlősöket nem betegíti meg. 128
149 Részletes bakteriológia Kísérleti állatként fiatal madarak (liba, kacsa, tyúk, galamb stb.) használhatók. Beteg állatokból származó vérrel vagy tenyészettel parenterálisan fertőzve bennük a természetesnél rendszerint enyhébb betegség alakul ki Borrelia theileri Laza csavarulatokat mutató, µm hosszú borrelia. Vektorai kullancsok. A szarvasmarha, ló, ritkán a juh borreliosisát idézi elő, főként Dél-Afrikában és Ausztráliában Borrelia burgdorferi µm hosszú, sötét látóteres vagy fáziskontraszt-mikroszkópban natívan, továbbá Giemsa-szerint festve vagy immunfluoreszcenciás eljárással vizsgálható. Speciális tápfolyadékokban, nehezen ugyan, de tenyészthető. Vektorai kullancsok, Európában főleg az Ixodes ricinus. A kullancsokban szaporodik és az utódokba is átjut. Természetes gazdái a kullancsokon kívül vadon élő rágcsálók (főleg egérfélék), az apró emlősök, egyes vadon élő kérődzőfajok, de megtelepszik vadon élő madarakban is. Főleg az embert betegíti meg, lázas általános tüneteket, vándorló bőrpírt, ízület- és szívizomgyulladást okoz (Lyme borreliosis). A háziállatok közül megbetegíti a kutyát, a lovat, de ritkábban szarvasmarhában és egyéb fajokban is okozhat klinikai tünetekkel járó fertőzést. A Lyme borreliosis okozója Európában és Észak-Amerikában a B. burgdorferi. Japánban és más délkelet-ázsiai országokban azonban a Lyme borreliosist más, kullancsokból, apró rágcsálókból és madarakból egyaránt izolálható borreliák, így a B. garinii, B. afzelii és egyéb, eddig be nem sorolt borreliák idézik elő Serpulina A serpulinák (korábban Treponema hyodysenteriae és rokonai) néhány, tág csavarulatot mutató, 7 9 µm hosszú, 0,3 0,4 µm vastag spirochaeták. Karbolvizes fukszinnal és Giemsa szerint egyaránt megfesthetők. Szigorúan anaerobok, triptont, szójafehérje hidrolizátumot, élesztőkivonatot, valamint vért vagy vérsavót is tartalmazó agar táptalajokon és tápfolyadékokban, C között jól tenyészthetők. A nemzetségbe ma már számos faj tartozik, többségüket az utóbbi néhány évben írták le. Természetes előfordulási helyük a sertés vastagbelének nyálkahártyája, fakultatív pathogenek vagy saprophyták Serpulina hyodysenteriae A S. (Treponema) hyodysenteriae alaki, festődési, tenyésztésbeli tulajdonságai megegyeznek a nemzetség egészére jellemzőkkel (46. ábra). Az elektronmikroszkópos képen jól láthatók a tengelyfonalak (47. ábra). 46. ábra - Serpulina hyodysenteriae agartenyészetből (fukszinnal festve, 1250 ) 129
150 Részletes bakteriológia 47. ábra - Serpulina hyodysenteriae elektronmikroszkópos képe (8000 ) Tenyésztés. Frissen kiöntött véresagaron, anaerob viszonyok között, szén-dioxidot és hidrogént vagy egyéb gázt tartalmazó légtérben 37 C-on tenyésztve 5 8 nap alatt inkább az agarban, mint a felületén, apró, bétahemolízist okozó telepeket képez. Jól növekszik 42 C-on is. A táptalajhoz adott RNS-kivonat a növekedést elősegíti. Speciális anaerob, folyékony táptalajokban is elszaporítható, mégpedig 42 C-on jobban, mint 37 C- 130
151 Részletes bakteriológia on. Szennyezett anyagokból (bélsárból, bélnyálkahártya-kaparékból) való kitenyésztésére spektinomicint, illetve egyéb antibiotikumokat is tartalmazó szelektív táptalajokat használunk. Biokémiai sajátságok. A tenyészetek felületére helyezett szűrőpapírral végzett indolpróbában pozitív, ezenkívül termel alkalikus foszfatázt, lipázt és néhány más enzimet is. Antigénszerkezet. A sejtfalból kivont lipopoliszacharid antigének alapján gélprecipitációs próbával a S. hyodysenteriae törzsek ez ideig legalább 9 szerocsoportba (A I) sorolhatók. Az azonos csoportba tartozó törzsek között is vannak további finomabb antigénszerkezeti különbségek. Az egyes földrajzi régiókban a különböző szerocsoportba tartozó törzsek más és más gyakorisággal fordulnak elő. A betegség kiállása típusspecifikus védettséget ad. Ellenálló képessége csekély, a beszáradás, a hő és a fertőtlenítőszerek gyorsan elpusztítják, nyálkás, véres bélsárban azonban kb. 1 hétig a külvilágban is életképes marad. Pathogenitás. A S. hyodysenteriae fakultatív pathogen. Természetes gazdája, a sertés, a vastagbél nyálkahártyájának a felületén él. A virulens törzsek erős béta-hemolízist okoznak, a nem hemolizáló törzsek avirulensnek tekinthetők. A virulens törzsek sertésben idéznek elő a vastagbél nyálkahártyájának gyulladásával, korpaszerű elhalásával, nyálkás, majd véres, csokoládébarna színű bélsár ürítésével járó hasmenést (sertésdysenteria), ritkán megbetegíthetik azonban a nutriát is és átmenetileg, tünetek okozása nélkül megtelepedhetnek a fertőzött sertéstelepeken élő rágcsálók, főleg egerek és patkányok vastagbelében is. Virulens S. hyodysenteriae törzzsel fogékony süldőket fertőzve rendszerint a természetessel azonos kórkép idézhető elő Egyéb Serpulina fajok A sertés vastagbelében még számos egyéb, a S. hyodysenteriaehoz hasonló Serpulina él. Közülük a S. innocens megkülönböztethető az előbbi fajtól azáltal, hogy véresagaron nem hemolizál vagy csupán gyenge hemolízist okoz, ezenkívül indol-negatív, kórtani jelentősége nincs, saprophyta. A S. pilosicoli ugyancsak gyenge hemolízist okoz, a S. innocenshez hasonlóan indol-negatív, viszont szemben a S. hyodysenteriaevel és a S. innocenssel a hippurátot elbontja. Fakultatív pathogen, választott malacokban és süldőkben enyhe, vízszerű hasmenést (a sertés intestinalis spirochaetosisa) és fejlődésben való visszamaradást idéz elő. A S. pilosicoli a sertésen kívül megtalálható számos faj, így a madarak, a kutya, a majom és az ember vastagbelének a nyálkahártyáin is. Úgy látszik, ez a faj emberben is képes vízszerű hasmenést előidézni. A S. intermedia ugyancsak enyhe béta-hemolízist okoz, a colonban okoz vízszerű hasmenéssel járó gyulladást (spirochaeta okozta colitis) Treponema A treponemák 5 20 µm hosszú, szabálytalan csavarulatokat mutató spirochaeták. A kórtanilag fontos fajok nem tenyészthetők. Csak a velük fertőzött gazdaszervezetekben találhatók meg, a szájüregben, emésztőcsatornában és a nemi szervek nyálkahártyáin, fajoktól függően emberben és állatokban egyaránt. A T. pallidum az ember syphilisének az okozója. A T. paraluiscuniculi a nyulakban okoz a nemi szervek gyulladásával járó, a syphilishez hasonló betegséget. A T. denticola és a T. vincenti számos más treponemával együtt az ember szájüregének a lakója, saprophyták Leptospira Morfológia. Egyik vagy mindkét végükön horogszerűen visszahajló, 6 20 µm hosszú, igen vékony (0,1 µm) mikrobák (48. ábra), csavarulataik annyira sűrűek, hogy hullámos lefutásuk fénymikroszkópban alig látható. Általában sötét látóteres vagy fáziskontraszt-mikroszkópban vizsgáljuk őket, friss tenyészeteikben élénken mozognak. Festésükre a Vágó-féle festési eljárás alkalmas, szövettani metszetekben pedig a Levaditi-féle ezüstimpregnációs eljárással tüntethetők fel. 48. ábra - Leptospira pomona elektronmikroszkópos képe (8000 ) 131
152 Részletes bakteriológia Tenyésztés. A leptospirák tápigénye viszonylag szerény, de a vizsgálati anyagokban rendszerint jelen levő különböző baktériumok és a viszonylag hosszú tenyésztési idő miatt váladékokból, szövetekből való izolálásuk nem tartozik az egyszerű feladatok közé. A leptospirák tenyésztésükhöz aminosavakon és különféle sókon kívül hosszú szénláncú zsírsavakat, ezenkívül B 1- és B 12 -vitamint is igényelnek. Tenyésztésükre folyékony vagy kevés agart is tartalmazó félfolyékony táptalajokat, leggyakrabban az EMJH és a Korthof-féle táptalajt használjuk. Az előbbi tápfolyadék alkalmas a legkényesebb leptospirák izolálásra is, a tápanyagokon kívül bovin-szérumalbumint is tartalmaz, a hosszú szénláncú zsírsavak és az oxidációjukból keletkező toxikus anyagcseretermékek megkötésére. A Korthof-féle táptalaj különféle puffer sókat, kevés peptont és 8 10% steril nyúlsavót tartalmaz. A táptalajok ph-ja gyengén lúgos, ph 7,4 körüli kell, hogy legyen. A kész Korthof-féle táptalajt a nyúlsavó inaktiválása végett a felhasználás előtt 1/2 1 óráig 56 C-on tartjuk. A leptospirák aerobok, a beoltott táptalajokat C-on keltetjük. Ha primer izolálás a cél, a váladékokat lehetőleg sterilen kell vennünk vagy a vizsgálati anyagot előbb fogékony kísérleti állatokba oltjuk, és a lázas szakaszban a vérből vagy később a sterilen kivett vesékből próbáljuk meg az izolálást. Szennyezett vizsgálati anyagokból történő szelektív izolálás érdekében a tápfolyadékhoz kevés fluoruracilt, illetve neomicint keverhetünk. A szöveteket is tartalmazó mintából a beoltás előtt hígítási sorozatot készítünk, s ezekkel oltjuk be a tápfolyadékokat a szövetekben levő enzimek leptospirákra gyakorolt lítikus hatásának az elkerülése érdekében. Az izolálás a többnyire erős kontamináció miatt csak ritkán sikeres. A primer izolálások megeredésére rendszerint 6 16 hetet várni kell. Ha tiszta tenyészetet oltunk tovább, a tenyészetek néhány nap alatt megerednek, kb. 1 hetes tenyésztés után érik el maximális sűrűségüket, ilyenkor a levestenyészetben finom, füstszerű zavarosodás látható. A leptospirák tiszta tenyészetei a folyékony táptalajok összetételével azonos agar táptalajokon is elszaporíthatók. Embrionált tyúktojásba oltva a leptospirák ugyancsak elszaporodnak. Biokémiai sajátságok. A leptospirák energiájukat főleg hosszú szénláncú, telítetlen zsírsavakból nyerik, nitrogénforrásul pedig különféle ammóniumsókat vesznek igénybe. A cukrokat, a cukorszerű alkoholokat nem bontják. Egyes szerotípusok (L. pomona, L. canicola, L. grippotyphosa stb.) extracelluláris lipázt termelnek, ezek feloldják a kérődzők vörösvérsejtjeit, intravasalis hemolízist okozva. Ellenálló képesség. A leptospirák ellenálló képessége kicsi. A beszáradás, a savas közeg órák alatt, a 60 C-on való kezelés és a szokásosan használt fertőtlenítőszerek pedig perceken belül elpusztítják őket. A külvilágban csak akkor maradnak életben, ha a rendszerint a vizelettel ürülő leptospiráknak módjuk van természetes vizekbe jutni és ezáltal a vizeletnek felhígulni. Fertőzött tavakban, kisebb vízfolyásokban és nedves talajokban nyári, meleg időszakban néhány hétig életképesek maradnak. A fagyás elpusztítja őket. 132
153 Részletes bakteriológia Osztályozás. A leptospirákat a felületüket borító elasztikus membránban és a sejtfalban található antigének alapján mikroagglutinációs próbával szerotípusokba (szerovariánsokba) soroljuk, az egymással rokon szerotípusokat pedig szerocsoportokba vonjuk össze. Megkülönböztetjük a pathogenek (L. interrogans) és a szaprofiták (L. biflexa) csoportját. Az utóbbi években a DNS-hibridizációs vizsgálatok eredményei alapján a pathogen leptospirákat hét fajba sorolták. A pathogenek a velük fertőzött gazdafajokban (vadon élő rágcsálókban, sertésben, szarvasmarhában stb.), főleg a vesék kanyarulatos csatornácskáiban élnek és a vizelettel ürülnek. A saprophyta fajok a természetben szabadon élnek, alacsony hőmérsékleten is képesek szaporodni, megtalálhatók a természetes vizekben és a nedves talajokban. Néhány fajuk halofil, ezek a tengerek vizének a lakói. A L. interrogans csoportban ez ideig kb. 230 szerovariáns ismert, amelyeket a kb. 23 szerocsoportba sorolunk. Pathogenitás. A L. interrogans csoportba sorolt szerotípusok egyaránt megbetegíthetik az embert és a különféle háziállatfajokat. Nedves trópusi területeken az előforduló szerotípusok száma sokkal nagyobb, mint a mérsékelt égöv országaiban. A nálunk is előforduló fontosabb Leptospira- szerotípusokat, ezek fő gazdafajait és az általuk okozott betegségeket a 10. táblázat mutatja. Az ugyanazon Leptospira-szerotípus által okozott megbetegedés klinikai képe állatfajonként jelentős különbségeket mutathat. A L. pomona sertésben rendszerint tömeges vetélést okoz egyéb tünetek nélkül, míg fiatal borjakban és bárányokban lázas általános tünetekkel, sárgasággal, vérfestékvizeléssel járó betegséget (heveny leptospirosist) idéz elő. Az ember mindegyik Leptospira-szerotípus iránt fogékony. 10. táblázat - A háziállatokban előforduló fontosabb Leptospira-szerotípusok és az okozott kórképek Szerotípus Fő fenntartó gazda Okozott betegség Másodlagos gazdák L. icterohaemorrhagiae Patkány Fiatal állatokban lázas általános tünetek, sárgaság Ritkán kutya, ló, egyéb állatfajok Egérfélék, pocok, Lázas általános tünetek, Szarvasmarha, Egyéb rágcsálók sárgaság, ritkán egyéb L. grippotyphosa L. hardjo Szarvasmarha vérfestékvizelés, meningitis, mastitis, ritkábban vetélés Vetélés, juhban tünetmentes háziállatfajok is Szarvasmarha, juh L. pomona Sertés Vetélés Sertés, szarvasmarha és egyéb fajok is L. tarassovi Sertés Vetélés Sertés L. canicola Kutya Fiatalokban láz, sárgaság, idősebbekben vese- Kutya, ritkán egyéb 133
154 Részletes bakteriológia elégtelenség háziállatfaj A leptospirák fertőzött anyagokból való izolálására a laboratóriumi rágcsálók közül a tengerimalacot és aranyhörcsögöt vehetjük igénybe. A leptospirák szerotípusuktól függően mind a tengerimalacot, mind pedig az aranyhörcsögöt hol gyorsabban, hol lassabban megölik vagy legalább átmeneti lázas állapotot hoznak létre bennük. A L. icterohaemorrhagiaeval fertőzött tengerimalacok a fertőzés után néhány nap múlva lázassá válnak, majd sárgaságban betegszenek meg és 5 14 nap alatt elhullanak. Boncoláskor a legkülönfélébb szervekben, főleg a tüdőben, vérzések, a májban pedig esetleg elhalások láthatók. A L. pomona, a L. tarassovi, a L. sejroe stb. fertőzés hatására tengerimalacokban rendszerint mindössze átmeneti lázas állapot alakul ki. A leptospirák azonban ilyenkor is kimutathatók a lázas szakaszban vett vér mikroszkópos vizsgálatával vagy folyékony táptalajba oltva kitenyészthetők, a leölt vagy elhullott állatok szöveteiben pedig ezüstimpregnációs eljárással is kimutathatók. A kísérleti fertőzést túlélő állatok vérében pedig 2 3 hét múlva az adott szerotípusra nézve specifikus ellenanyagok jelennek meg, amelyek agglutinációs próbával kimutathatók Chlamydiák A chlamydiák rövid, coccoid 0,2 0,4 µm hosszú, intracellularisan, a fertőzött gazda sejtjeinek vacuolumaiban szaporodó mikroorganizmusok. Szaporodásuk jellegzetes szakaszosságot mutat. A sejtbe jutott chlamydiák (kis chlamydiasejtek, elemi testek) megnagyobbodnak, belső szerkezetük fellazul, ún. hálózatos sejtekké alakulnak, majd többszörösen osztódnak. Az osztódás bizonyos idő (kb óra) után leáll, és az osztódott sejtek zsugorodva, ismét 0,2 0,4 µm nagyságú, fertőzőképes, kis chlamydia sejtekké alakulnak. A chlamydiák tömege a sejteken belül, hártyával körülvett (chlamys: köpönyeg, palást), kisebb-nagyobb halmazok (zárványok) formájában látható (49. ábra). A chlamydiákat körülvevő hártya a gazdasejt cytoplasmamembránjából származik, az elemi testek a sejtbe való bejutáskor viszik magukkal. 49. ábra - Chlamydia psittaci vetélt juhmagzatban (30 000, az Országos Állategészségügyi Intézet felvétele) Festődés. A chlamydiák Gram-negatívok, megfestésükre a Stamp-, Giemsa-, vagy a Castaneda-féle eljárást használjuk. Közülük leggyakrabban a Stamp-félefestést és annak különféle módosított változatait vesszük igénybe. A láng felett fixált készítményt Stamp-féle fukszinnal (30 ml karbolvizes fukszin 120 ml desztillált vízben) 5 8 percig festjük, 1%-os ecetsavval kivonjuk, majd vízzel öblítjük, ezután 3%-os vizes malachitzöld 134
155 Részletes bakteriológia oldattal 1/2 1 percig festjük, újra öblítjük, szárítjuk és immerziós lencsével vizsgáljuk. A chlamydiák piros, a készítményben levő sejtes elemek pedig zöld színűek. A fertőzött szövetekben a chlamydiák kimutathatók immunfluoreszcenciával és elektronmikroszkópos vizsgálattal is. Tenyésztés. A chlamydiák obligát sejtparaziták, csak élő sejtekben képesek szaporodni. Rendelkeznek saját DNS-sel, RNS-sel és különféle enzimekkel, amelyekkel saját testanyagaikat felépítik, a nagy energiájú vegyületeket és a különböző alacsony molekulatömegű intermedier anyagokat azonban a gazdasejttől szerzik. A chlamydiák elszaporíthatók egyrétegű sejttenyészetekben (McCoy, HeLa stb.), továbbá 5 7 napos embrionált tyúktojások szikzsákjába oltva és kísérleti állatokban (egérben, tengerimalacban) is. A legáltalánosabban használt McCoy sejtvonalat a vizsgálati anyaggal való beoltás előtt vagy közvetlenül azután citosztatikumokkal (pl. jód-dezoxi-uridinnel) kezelik, a sejt saját makromolekulaszintézisének a gátlása érdekében, a vizsgálati anyagot pedig alacsony fordulatszámmal rácentrifugálják a sejttenyészetre. A fertőzött sejteket 37 C-on tenyésztve, 2 3 nap múlva a cytoplasmában a chlamydiák zárványok formájában felismerhetők. A chlamydiák a csirkeembriókat 3 4 nap alatt elpusztítják vagy legalábbis károsítják. Az izolálásukhoz, mind a sejttenyészetekben, mind az embrionált tojásokban gyakran több vakpasszázs szükséges. A chlamydiák szaporodását a tetraciklinek, az eritromicin és néhány más antibiotikum gátolja. Antigénszerkezet. A nemzetségbe tartozó valamennyi fajnak van egy közös hőstabil lipopoliszacharid sejtfalantigénje, amely komplementkötési próbával kimutatható. Emellett a chlamydiák tartalmaznak még számos további, zömmel hőlabilis antigént is, amelyek alapján az egyes fajok szerotípusokba sorolhatók. A chlamydiák fajai. A chlamydiákat természetes gazdáik, az elemi testeknek a fertőzött sejtekben való elhelyeződése, finomabb szerkezete és festődése, továbbá néhány egyéb tulajdonság alapján soroljuk fajokba. A nemzetségbe tartozó fajok közül a C. trachomatis és a C. pneumoniae orvosi szempontból fontos. A C. trachomatisnak három biovariánsa van, ezek egyike idézi elő az ember trachomáját (idült, gennyes conjunctivitis), az inclusiós conjunctivitist és számos más kórképet, a másik variánsa az inguinalis és az anorectalis nyirokcsomók gyulladásával járó, szexuális úton terjedő, lymphogranuloma venereum elnevezésű betegséget okozza, a harmadik variáns pedig az egerekben telepszik meg, a tüdőben szaporodik, pneumoniát okoz, a fertőzés azonban gyakran tünetmentes marad. A C. pneumoniae az emberben okoz pneumoniát, bronchitist és más légúti tüneteket. A C. psittaci (psittakos: papagáj) az embert és az állatokat egyaránt megbetegíti Chlamydia psittaci Igen széles körben elterjedt mikroorganizmus. Természetes viszonyok között megtalálható a legkülönfélébb madárfajok, továbbá a házi és vadon élő emlősök bélcsatornájának nyálkahártya-hámsejtjeiben, ahonnan a bélsárral nagy mennyiségben ürül. Morfológiai és tenyésztési tulajdonságai megegyeznek a nemzetség egészére mondottakkal. Antigénszerkezet. A törzsek antigénszerkezetileg meglehetősen heterogének. A valamennyi törzsben jelenlevő közös lipopoliszacharid antigén-mellett a madarakból származó C. psittaci izolátumok monoklonális ellenanyagokkal működő immunfluorescenciás próbával ez ideig legalább 5 szerovariánsba (szerotípusba: A E), az emlősökből kitenyésztett C. psittaci-izolátumok pedig legalább 8 szerovariánsba sorolhatók. Közülük a szarvasmarhában és juhban polyarthritist, encephalomyelitist, pneumoniát és enteritist előidéző, szerológiailag három variánst képviselő törzseket, a C. psittacitól való DNS-homológiabeli és szerológiai eltéréseik alapján önálló fajnak tekintik és C. pecorum névvel illetik. Ellenálló képesség. A chlamydiák ellenálló képessége hővel és fertőtlenítő- szerekkel szemben nem nagy, 65 C-ra hevítve vagy 1 3%-os klórtartalmú fertőtlenítőszert tartalmazó oldatokkal kezelve perceken belül elpusztulnak. Bélsárban, hörgőváladékban, magzatburkokban, továbbá beszáradva a porban is azonban kb. 3 hétig életképesek maradnak. Pathogenitás. A C. psittaci gazdaspektruma igen széles, a legkülönbözőbb madár- és emlősfajokat megbetegítheti. Fakultatív pathogen. Az esetek egy részében septikaemia alakul ki, a tünetek azonban korlátozódhatnak egy vagy néhány szervre, de gyakori a tünetmentes fertőzés is. Klinikai tünetekben is megnyilvánuló betegséget főként papagájfélékben, galambokban, pulykában, kacsában, ritkábban más madarakban, az emlősök közül pedig szarvasmarhában, juhban, kecskében, macskában, lóban és az emberben okoz. Madarakban náthás tünetek, orrfolyás, könnyezés, hasmenés, olykor meningitis, encephalitis alakul ki. A kérődzőkben vetélés, bronchopneumonia, ízületgyulladások, enteritis, encephalomyelitis a fő tünetek. Lóban kötőhártya-gyulladás, légúti hurutos tünetek, macskában conjunctivitis alakul ki. Az ember többnyire 135
156 Részletes bakteriológia papagájoktól (papagájkór, psittacosis) vagy más madaraktól (ornithosis), ritkán kérődző állatoktól fertőződik, amelynek a következményeként lázas általános tünetek, atípusos pneumonia, esetenként ízületgyulladás stb. alakul ki Rickettsiák A rickettsiák obligát sejtparaziták, természetes viszonyok között megtalálhatók különféle ízeltlábúakban (kullancsban, tetűben, bolhában, atkában), továbbá a velük fertőzött gerincesekben. Az ízeltlábúak a rickettsiák valódi gazdái vagy csupán vektorai. Az ember és a háziállatok, kevés kivételtől eltekintve, az arthropoda vektorok vérszívása útján fertőződnek. A rickettsiák okozta fertőzések többsége természeti gócfertőzés formájában létezik, az ember és a háziállatok többnyire csak alkalmi gazdák. E kórokozók egy része az arthropoda vektor elterjedtségének megfelelő, korlátozott területen, más részük azonban világszerte (pl. Q-láz) előfordul. Morfológia. Coccoid 0,3 0,8 µm, ritkán hosszabb, pálcika alakú mikroorganizmusok. A festéket nehezen veszik fel, Gram-negatívak, megfesthetők, azonban különféle speciális festési eljárásokkal (Gimenez, Giemsa, Romanowsky stb.), de jól feltüntethetők immunfluoreszcenciás eljárással is. A fertőzött sejtek cytoplasmájában egyenként vagy halmazokban, cytoplasmazárványok formájában láthatók. Tenyésztés. Kevés kivételtől eltekintve csupán élő sejtekben, intracellulárisan szaporodnak. Jól elszaporíthatók embrionált tojásban, egyrétegű sejttenyészetekben és laboratóriumi kísérleti állatokban. Legáltalánosabban az embrionált tyúktojást használjuk, 5 6 napos tojások szikzsákjába oltva a rickettsiák nap alatt elszaporodnak, miközben az embriót elpusztítják. A tetraciklinek és kisebb mértékben más széles terápiás skálájú antibiotikumok a rickettsiák szaporodását gátolják. A rickettsiák osztályozása. A rickettsiák aszerint, hogy a velük fertőzött gerincesek milyen sejtjeiben (különféle szöveti sejtekben, leukocytákban, vörösvérsejtekben stb.) szaporodnak elsősorban, extra- vagy intracellulárisan helyeződnek, természetes gazdáik ízeltlábúak vagy azok csupán vektorok stb., több családba s ezeken belül számos nemzetségbe sorolhatók. A kórtanilag fontos fajokat magukba foglaló nemzetségek közül a Rickettsia és a Coxiella nemzetségbe tartozó fajok a velük fertőzött gerincesek gyakorlatilag minden sejtféleségében szaporodnak. Az Ehrlichia és a Cowdria fajok főként a fertőzött gazdák lymphoid sejtjeiben és az ereket bélelő endothelsejtekben szaporodnak, ezért ezeket a fertőzéseket kiterjedt oedemák kísérik, míg a vörösvérsejtekben vagy azok felületén szaporodó, Anaplasma, Eperythrozoon és Haemobartonella fajok okozta fertőzések során a vörösvérsejtek szétesése, anaemia és sárgaság a jellemző tünetek Rickettsia Rövid, 0,8 2 µm hosszú, 0,2 0,4 µm vastag intracellularisan helyeződő pálcikák. Embrionált tojásban és egyrétegű sejttenyészetekben egyaránt jól elszaporíthatók. Ellenálló képességük kicsi, 56 C-on gyorsan elpusztulnak. Az ide tartozó fajok fő rezervoárjai az apró rágcsálók, továbbá ízeltlábúak. A R. prowazekii az ember kiütéses typhusának az okozója. A kórokozó természetes vektora a ruhatetű. A csoportba még számos humán pathogen faj tartozik, így a R. rickettsii, amely az amerikai kontinensen előforduló sziklás-hegységi foltos láz okozója, kullancsok viszik tovább a fertőzést. A R. sibirica Oroszország keleti és délkeleti területein fordul elő, ugyancsak kullancsok közvetítik, a R. conorii, amely a mediterrán területeken, Afrikában és Ázsiában honos, természetes gazdái kullancsok, továbbá a kutya, a patkány- és egérfélék. Ezek a fertőzések Európában már nem vagy csak kivételes körülmények között fordulnak elő Coxiella A nemzetség ez ideig egyetlen faja a Coxiella burnetii. Biológiai sajátságait illetően hasonlít a Rickettsia nemzetségbe sorolt fajokra, de egyebek mellett különbözik tőlük abban, hogy kisebb, 0,4 1 µm hosszú, a fertőzött gazdasejtek vacuolumaiban szaporodik, ellenálló képessége pedig igen nagy. A C. burnetii embrionált tojás szikzsákjába oltva tenyészthető. Beszáradt váladékokban, gyapjún stb. akár egy évig is életben marad, a 60 C-on való hevítést fél óráig elviseli. Világszerte, így nálunk is előfordul. Gazdaspektruma igen széles. Természetes gazdái és vektorai kullancsok, amelyekben a kórokozó az utódokba is átjut, de a kórokozó továbbvitelében, mechanikus úton, számos más 136
157 Részletes bakteriológia ízeltlábú (légy, bolha, tetű, szúnyog stb.) is szerepet játszik. Szemben más rickettsiákkal, a fertőzött állatok váladékaival ürülve, vektorok közvetítése nélkül, közvetlenül is átjut egyik állatról a másikba. A kórokozó iránt a madarak és az emlősök széles köre fogékony, klinikai tünetekkel járó betegséget leggyakrabban kérődzőkben okoz. A C. burnetii az emberben, szarvasmarhában, juhban, kecskében, ritkán egyéb állatfajokban idéz elő, lázas általános tünetekkel, tüdőgyulladással, kérődzőkben leggyakrabban vetéléssel járó betegséget (Q-láz). A laboratóriumi állatok közül a C. burnetii iránt a hörcsög, a tengerimalac, az egér és a nyúl egyaránt fogékony. Tengerimalacok fertőzésük után 4 8 nap múlva lázas tünetek között megbetegszenek, 2 3 hét múlva pedig elhullanak. Boncoláskor lépduzzanat látható, a lépből a kórokozók izolálhatók Ehrlichia Coccoid, 0,5 µm átmérőjű, intracellulárisan helyeződő mikrobák, a fertőzött sejtekben membránnal körülvett halmazok formájában láthatók. Közülük az E. canis tenyészthető kutyából származó monocyta sejttenyészetekben, egyes további fajok egyéb sejtvonalakban is, embrionált tojásban azonban nem. Vektoraik, ahol ismertek, zömmel kullancsok. Számtalan fajuk van, közülük a E. canis a kutyában okoz lázas általános tünetekkel, vérzésekkel járó betegséget. Klinikai tünetekkel járó formájában főleg meleg égövi területeken észlelhető (a kutya trópusi pancytopeniája). Az E. phagocytophila juhban, kecskében, szarvasmarhában és szarvasban okoz lázas tüneteket ( kullancsláz ), Északnyugat-Európában is előfordul. Az E. equi lóban okoz lázas tünetekkel, oedemákkal, lymphodenopathiával és thrombocytopeniával járó betegséget. Az E. risticii ugyancsak a lovat betegíti meg, lázas általános tüneteket, leukopeniát, hasmenést, alkalmanként vetélést okozva (Potomac horse fever). Az Ehrlichia-fertőzések hazai előfordulásáról ez ideig nincs tudomásunk Cowdria Coccoid 0,2 0,5 µm nagyságú mikrobák, metilénkékkel és más bázikus festékekkel is megfesthetők, intracellularisan helyeződő halmazok formájában láthatók. Eddig egyetlen fajuk, a Cowdria ruminantium ismert. A kérődzők vérereinek endothel sejtjeiben és a különféle fehérvérsejtekben szaporodik, vektorai kullancsok, de a kullancsokban az utódokba nem jut át. Főleg Afrika déli részén fordul elő, a kérődzőkben okoz lázas általános tünetekkel, kiterjedt oedemákkal, szívburokvizenyővel járó betegséget (heartwater) Anaplasma Kerekded, 0,3 1 µm nagyságú, vékony membránnal körülvett képletek formájában láthatók a fertőzött gazdák vörösvérsejtjeiben. Összetett festési eljárásokkal, pl. Giemsa-szerint megfesthetők. Nem tenyészthetők. Világszerte előfordulnak. Természetes gazdái kullancsok, továbbá a házi- és vadon élő kérődzők. Az ide tartozó fajok közül az A. marginale és az A. centrale szarvasmarhában, bivalyban és a vadon élő kérődzők széles körében, az A. ovis pedig juhban, kecskében okoz lázas általános tünetekkel, anaemiával járó betegséget (anaplasmosis). A szarvasmarha anaplasmosisát nálunk is megállapították Eperythrozoon Coccoid vagy kiflire emlékeztető, 0,4 1,5 µm hosszú pálcikák vagy gyűrűk, amelyek a vörösvérsejtek felületén élnek, de szabadon a vérplazmában is megtalálhatók. Giemsa vagy Romanowsky szerint megfesthetők. Többségük nem tenyészthető, egyes fajaik azonban embrionált tojásba oltva elszaporodnak. A különböző gerincesekben, főleg a rágcsálókban, a kérődzőkben és a sertésekben élő, obligát paraziták. Világszerte előfordulnak. Ahol ismert, vektoraik arthropodák. Az ide tartozó fajok közül az E. suis sertésben okoz sárgasággal és anaemiával járó betegséget (icteroanaemia), nálunk is megállapították. Az E. ovis juhban fordul elő, a fertőzés többnyire tünetmentes, de anaemia, lesoványodás és elhullás is lehet a következménye Haemobartonella Coccoid vagy rövid, kiflire emlékeztető pálcikák, a vörösvérsejtek felületén találhatók. Jól feltűntethetők Romanowsky-féle festéssel. Nem tenyészthetők. Világszerte előfordulnak. Vektoraik, ahol vannak és ismerjük, arthropodák. 137
158 Részletes bakteriológia Az ide tartozó fajok közül a H. felis macskában, a H. canis pedig kutyában idéz elő anaemiával járó betegséget. E fajoknál nem tudjuk, hogy a fertőzés továbbvitelében szerepet játszanak-e a vektorok. A H. felis-fertőzést nálunk is megállapították. A macskában előfordul egy további rickettsia, a Bartonella (Rochalimea) henselae, amely a fertőzött macska vörösvérsejtek lizátumából speciális táptalajokon kitenyészthető. A kórokozó a macska vörösvérsejtjeiben szaporodik. A macskák tünetmentesek, de a kórokozó karmolással, harapással, nyállal emberbe jutva helyi gyulladással, hólyagképződéssel, továbbá a regionális nyirokcsomók hosszan tartó gyulladásával, ritkán septicaemiával járó betegséget idéz elő (macskakarmolási betegség) Mycoplasmák A mycoplasmák, tágabb értelemben ideértve a Mycoplasmatales rendbe tartozó valamennyi nemzetséget és fajt, sejtfal nélküli prokaryoták, a cytoplasmát vékony, háromrétegű membrán veszi körül. Morfológia. Alakjuk, szilárd vázat adó sejtfal híján, a tenyésztés körülményeitől, a tenyészet korától és phjától, valamint a környezet ozmotikus viszonyaitól függően igen változatos (50. ábra). Hol coccoid, ellipszis vagy csillag alakúak, ilyenkor általában 0,2 0,8 µm közötti nagyságúak, hol pedig néhány µm-től akár 150 µm hosszú, a gombákra emlékeztető, elágazódó fonalakat képeznek, amelyek gyöngyfüzérszerű coccoid alakokká töredeznek szét. Néhány fajra (pl. M. pneumoniaera, M. gallisepticumra) jellemző a sejtek körte alakja. A spiroplasmák helikális alakúak. A mycoplasmák alaki tulajdonságaikat illetően hasonlítanak a baktériumok L (sejtfalukat vesztett) formáira, de sohasem revertálódnak baktériummá. Csillóik nincsenek, Gram-negatívok. Vizsgálatukra gyakran az immunfluoreszcenciás eljárást vesszük igénybe. 50. ábra - Mycoplasma bovis elektronmikroszkópos képe ( , az Országos Állategészségügyi Intézet felvétele) Tenyésztés. A mycoplasmák a legkisebb szabadon élő mikrobák. Sejtmentes, mesterséges táptalajokban szaporíthatók, többnyire fakultatív aerobok, microaerophilek, egy nemzetségük azonban anaerob. Igényes mikróbák, tenyésztésükre olyan tápanyagokban gazdag folyékony és szilárd táptalajokat használunk, amelyek kiegészítésképpen vérsavót (koleszterint), élesztőkivonatot, azonkívül DNS-t is tartalmaznak. Egyes fajok speciális igényeinek a kielégítésére alkalmanként a táptalajhoz egyéb anyagot (laktalbumin-hidrolizátumot, 138
159 Részletes bakteriológia nikotin-adenin-dinukleotidot, ciszteint stb.) is adunk. Mivel sejtfaluk nincs a penicillin szaporodásukat nem gátolja. Telepeik szilárd táptalajokon a tenyészet korától és a tenyésztés körülményeitől függően 0,1 1 mm átmérőjűek. A fajok többsége szilárd táptalajok felületén a középen vastagabb, a táptalajba is belenövő, szélük felé ellaposodó (tükörtojáshoz hasonló kinézetű) telepeket képez. Folyékony táptalajokban, kevés kivételtől eltekintve nem okoznak látható zavarosodást, az egyes fajok elszaporodásáról a különféle szubsztrátok (glükóz, arginin, ureum) bontása vagy szilárd táptalajokra való kioltásuk alapján győződünk meg. Osztályozás. A mycoplasmákat a genom mérete, koleszterinigényük és morfológiájuk alapján családokba, ezeken belül pedig optimális tenyésztési hőmérsékletük, ph-igényük, a glükóz-, arginin-, ureum- és eszkulinbontás, foszfatáz- aktivitás, továbbá a trifenil-tetrazóliumklorid-redukció alapján a Mycoplasma, Ureaplasma, Acholeplasma és Spiroplasma nemzetségekbe soroljuk. Az Anaeroplasma nemzetség tagjai az előbbiektől egyebek mellett különböznek abban, hogy anaerobok. A mycoplasmák széles körben elterjedtek, a légutak, a nemi szervek és az emésztőcsatorna nyálkahártyáin élnek emlősökben és madarakban egyaránt (Mycoplasma, Ureaplasma, Acholeplasma), de tartoznak ide olyanok is, amelyek ízeltlábúakban, növényeken (Spiroplasma) vagy a természetben szabadon élnek. Vannak közöttük pathogen fajok is, többségük azonban fakultatív pathogen vagy saprophyta. Közülük állatorvosi szempontból a Mycoplasma, Ureaplasma és az Acholeplasma nemzetségbe sorolt fajok fontosak. Az egyebek, közöttük az Anaeroplasma fajok, természetes előfordulási helye kérődzők bendője, saprophyták. A Spiroplasma nemzetségbe tartozó fajok pedig különböző ízeltlábúakból (kullancsokból, méhekből, szúnyogokból, muslicákból stb.) és növényekből izolálhatók, egyik-másik fajuk növénypathogen Mycoplasma Alaki és tenyésztési tulajdonságaikat illetően megegyeznek a mycoplasmákra általában mondottakkal. Fakultatív anaerobok, mikroaerofilek, tenyésztésüket a valamelyest csökkentett O 2-nyomás és néhány % CO 2 jelenléte elősegíti. Tenyésztésükhöz koleszterint (vérsavót) igényelnek. Szilárd táptalajokon, 37 C-on, lassan, 2 10 nap alatt alakulnak ki a telepek, amelyek igen aprók, általában csak telep mikroszkóppal láthatók, egyes fajok több napos telepei azonban szabad szemmel is észlelhetők. A telepek rendszerint tükörtojásra emlékeztetnek (51. ábra). Szervekből, szövetekből való izolálásukra olyan, folyékony táptalajokat veszünk igénybe, amelyek a Gram-pozitív baktériumok visszaszorítására penicillint, a Gram-negatív fajok szaporodásának a gátlására pedig tallium-acetátot is tartalmaznak. 51. ábra - Mycoplasma arginini telepei agaron (Stipkovits László anyagából) 139
160 Részletes bakteriológia Biokémiai tulajdonságok. A fajok egy része elbontja a glükózt, másik része az arginint vagy mindkét szubsztrátumot. Előfordulnak azonban olyan fajok is, amelyek egyiket sem képesek elbontani. A glükózt bontó fajok a glükózból savat termelnek, ezek megsavanyítják a tápfolyadékot. Közülük egyesek elbontják a mannózt és néhány más szénhidrátot is. Az arginint elbontó fajok az arginin hidrolízise következtében ammóniát termelnek, a táptalajt meglúgosítják. Egyes Mycoplasma fajok foszfatáz és lipáz enzimeket is termelnek, redukálják a tetrazóliumsókat, elfolyósítják a zselatint, adszorbeálódnak a vörösvérsejteken és feloldják azokat. Ellenálló képesség. A mycoplasmák ellenálló képessége kicsi. A beszáradás, az C és a szokásosan használt fertőtlenítőszerek egyaránt perceken belül elpusztítják őket, fehérjében dús váladékokban azonban napokon keresztül életben maradnak. Osztályozás. A Mycoplasma (Ureaplasma, Acholeplasma) fajok tenyésztési, biokémiai és szerológiai sajátságaik együttes figyelembevételével határozhatók meg. Szerológiai besorolásukra a növekedés- és anyagcseregátlási próba, továbbá az immunfluoreszcenciás eljárás használatos. A beoltott táptalajra helyezett, immunsavót tartalmazó papírkorong vagy a folyékony táptalajba kevert immunsavó megakadályozza a homológ fajok korongok közelében való növekedését (növekedésgátlási próba) vagy levestenyészetekben az egyes anyagok (glükóz, arginin, tetrazólium sók, ureum stb) metabolizálását (anyagcseregátlási próba). Az immunfluorescens eljárás a telepek fénylése alapján alkalmas szilárd táptalajokon a kevert tenyészetek felismerésére is. A Mycoplasma nemzetségen belül ez ideig több mint 90 faj ismert. Pathogenitás. A mycoplasmák között vannak pathogen, fakultatív pathogen és saprophyta fajok egyaránt. Az utóbbiak gyakran megtalálhatók a klinikailag egészséges állatok nyálkahártyáin, sőt egyes fajok előfordulnak a különféle szervekből készített sejttenyészetekben is. A M. pneumoniae az emberben okoz légúti tüneteket, pneumoniát. Az állatokban előforduló fontosabb fajokat és általuk előidézett kórképeket a 11. táblázat mutatja. 11. táblázat - Az állatokban előforduló fontosabb Mycoplasma fajok és az általuk okozott kórképek Mycoplasma faj Gazda Kórkép M. mycoides subsp. mycoides Szarvasmarha Ragadós tüdőlob 140
161 Részletes bakteriológia (kis telep) Mastitis, gentitális fertőzések, M. bovis vetélés, borjakban pneumonia, artritis M. bovigenitalium hüvely- és méhgyulladás, mastitis M. dispar Tüdőgyulladás borjakban M. californicum Mastitis M. canadense Mastitis M. bovoculi Fertőző keratoconjunctivitis M. mycoides subsp. mycoides (nagy telep) M. mycoides, subsp. capri M. capricolum subsp. Kecske Ragadós tüdőlob caprineumoniae M. capricolum subsp. capricolum Kecske Polyarthritis, pneumonia, mastitis M. agalactiae Juh, kecske Fertőző elapasztás M. ovipneumoniae Juh Tüdőgyulladás M. conjunctivae Juh, kecske Keratoconjunctivitis M. hyopneumoniae Sertés Pneumonia M. hyorhinis Arthritis, polyserositis M. hyosynoviae Arthritis M. equifetale Ló Légzőszervi tünetek M. felis Légzőszervi tünetek lóban és conjunctivitis macskában M. cynos Kutya Köhögés, légúti hurut 141
162 Részletes bakteriológia M. gallisepticum Madarak Idült légzőszervi betegség, CRD (csirke, pulyka) M. synoviae Synovitis (csirke, pulyka) M. meleagridis M. iowae Lábgyengeség, mozgászavar, légzsákgyulladás (pulyka) Légzsákgyulladás, satnyaság (pulyka) M. anatis Sinusitis (kacsa) M. anseris Légzsákgyulladás (lúd) Ureaplasma A Mycoplasma nemzetség fajaihoz hasonlóan fakultatív anaerobok, mikroaerofilek. Tenyésztésükhöz koleszterint igényelnek, az enyhén savas, ph 6,0-os táptalajokat kedvelik, telepeik a mycoplasmákéinál is apróbbak. Energiaforrásul karbamidot használnak, belőle ammóniát termelnek, viszont nem bontják el a szénhidrátokat és az arginint. Az ureaplasmák osztályozása tenyésztési, biokémiai sajátságai mellett gazdafajaik és szerológiai tulajdonságaik (növekedés-, illetve anyagcsere-gátlási próbák) alapján történik. Mind az emberből, mind a szarvasmarhából, kutyából izolált ureaplasmák több szerocsoportba, szerotípusba oszthatók. Természetes előfordulási helyük a szájüreg, a légutak és a nemi utak nyálkahártyái az emberben és a különféle állatfajokban. Fakultatív pathogenek vagy saprophyták. Az emberben előforduló faj az U. urealyticum, a nemi utakban hurutot, gyulladást idézhet elő, terméketlenséget stb. okozhat. Az U. diversum a szarvasmarha nyálkahártyáin fordul elő, a nemi utak hurutját, az ondótermelés zavarát, következményes meddőséget, borjakban pneumoniát okozhat. Az U. canigenitalium kutyában fordul elő és reproduktív zavarokat okozhat, az U. felinum és a U. cati törzseket a macska szájüregéből tenyésztették ki, feltehetően saprophyták. Az U. gallorale fajt csirke orrüregéből izolálták Acholeplasma Fakultatív anaerobok, mikroaerofilek, tenyésztésükhöz koleszterint nem igényelnek. Telepeik általában nagyobbak, mint a mycoplasmákéi. Folyékony táptalajokban szaporodva látható zavarosodást okoznak, 25 Con is növekednek. Kevés kivételtől eltekintve bontják a glükózt és az arginint, az ureumot azonban nem. Megtalálhatók a különféle állatfajok nyálkahártyáin, de szabadon élve a szennyvizekben és a talajban is. Saprophyták, egyes fajok (A. axanthum, A. laidlawii) gyakran előfordulnak klinikai vizsgálati anyagokban, az A. oculi pedig fakultatív pathogen, juhban, kecskében conjunctivitist idézhet elő Gombák A gombák (Fungi, Myceteae) valódi sejtmagvú, klorofill nélküli, egy- vagy többsejtű szervezetek, amelyeket korábban a növényvilágba soroltak, manapság azonban önálló csoportnak tekintenek. Elnevezésük a baktériumokhoz és a magasabb rendű szervezetekhez hasonlóan a Linné-féle binominális nómenklatúra szabályai szerint történik. A gombáknak több mint faja van. A természetben igen elterjedtek, megtalálhatók a talajban, a levegőben, a természetes vizekben, a növényeken, az ember és az állatok bőrén, nyálkahártyáin, a bélsárban stb. Túlnyomó többségük saprophyta, általában elhalt növényi és állati anyagokon élnek, egy részük azonban élő növényeken és ritkán állatokon is megtelepszik. 142
163 Részletes bakteriológia A gombák heterotróf szervezetek, energiájukat különféle szerves anyagok bontásából nyerik, ezáltal közreműködnek a természet anyagkörforgalmának a fenntartásában. A gombák vizsgálatával a mikológia foglalkozik, amely nem tartozik szorosan a mikrobiológiához. A gombák ismerete azonban több szempontból mégis fontos. Egyes gombafajok anyagcsere-tevékenységét felhasználjuk különféle ipari és mezőgazdasági célokra (penicillintermelésre, szerves savak, alkoholok előállítására, bor, sör erjesztésére, élesztőgombák használata a sütőiparban stb.). Más fajokat azért kell ismernünk, mert jelentős károkat okoznak (pl. növénypathogen gombák, faanyagok gombásodása). Végül néhány fajuk ismerete állatorvosi szempontból is fontos, mert különféle élelmiszerekben és takarmányokban elszaporodva azok megromlását idézik elő vagy éppenséggel olyan mérgező anyagcsere-termékeket (mikotoxinokat) termelnek, amelyek később a takarmánnyal együtt az állati szervezetbe jutva mérgezést (mycotoxicosist) idéznek elő, vagy más mikroorganizmusokhoz hasonlóan maguk idéznek elő betegséget (mycosist). Az emberben és az állatokban betegséget előidéző gombafajok száma a saprophyták nagy számához képest elenyészően csekély. A valódi gombák (Eumycetes) ivaros szaporodásuk módjai, morfológiai és anyagcsere-sajátságaik stb. alapján négy osztályba sorolhatók: Zygomycetes (járomspórás gombák), Ascomycetes (tömlős gombák), Basidiomycetes (bazídiumos gombák), Deuteromycetes (konídiumos gombák). Morfológia. A gombák egy- vagy többsejtű szervezetek, a sejtek nagysága néhány µm és 100 µm között változik. Valódi sejtmagjuk és a növényi sejtekre jellemző sejtorganellumaik vannak. Sejtfaluk anyaga főként kitin (acetil-glükózamin-polimer), hemicellulóz vagy cellulóz (különböző szerkezetű glükózpolimerek), de előfordulnak benne glükoproteinek, proteinek, lipidek, esetenként festékanyagok stb. is. A gombák szerkezeti felépítésük alapján kétfélék: fonalas vagy élesztőszerű gombák. A fonalas gombák egy vagy több megnyúlt sejtből álló, hosszabb vagy rövidebb fonalakat, hifákat képeznek. A hifák végén levő csúcssejtek megnyúlásával és osztódásával növekednek. Gyakran a csúcssejt alatti sejtek is osztódnak, ennek következtében elágazódó fonalak jönnek létre. A hifák egy része a tápanyagok felszívására és a gombatelep rögzítésére szolgál (vegetatív hifák), más részük a szaporodás szolgálatában áll (reproduktív hifák). Ez utóbbiakon képződnek a gombák szaporodását szolgáló spórák. Az elágazódó hifák szövedéke a vattaszerű gombatelep, a micélium. Az ilyen telepekben fejlődő gombákat nevezik penészgombáknak. Az élesztőszerű gombák rendszerint sarjadzással szaporodnak. Kerek vagy ovális alakúak, nagyságuk általában 5 10 µm, de valódi és pszeudomicéliumokat is képezhetnek, telepeik hasonlítanak a baktériumok telepeire. A dimorf gombák olyan, többsejtű fonalas gombák, amelyek 26 C-on a penészgombákéra, 37 C-on azonban a sarjadzó gombákéra jellemző telepeket képeznek. A gombák ivartalan (aszexuális) vagy ivaros (szexuális) módon szaporodnak. Az ivartalan és az ivaros szaporodási forma ugyanazon gombafaj szaporodási ciklusában gyakran egyidejűleg is folyik vagy váltogatja egymást. Mind a fonalas, mind az élesztőszerű gombák szaporodhatnak ivartalan és ivaros úton is. Az ivaros szaporodáskor két gombasejt összeolvadásából keletkeznek a spórák. Az ivaros szaporodás fő spóraalakjai a zigospórák (a járomspórás gombákon) az aszkospórák (a tömlős gombákon) vagy a bazidiospórák (a bazídiumos gombákon). Az ivartalan szaporodáskor a spórák megtermékenyítés nélkül keletkeznek. A spórák létrejöhetnek a hifán belül vagy azon kívül. A hifán belül oly módon keletkeznek, hogy a hifa csúcssejtje vagy más szakasza megduzzad és spórává alakul (klamidospóra), vagy úgy, hogy a hifa feltöredezik és spórákká esik szét (artrospóra). A hifán kívül képződő spórák (konidiospórák, konídiumok) vagy közvetlenül a hifán helyezkednek el, vagy egy kocsány (konídiumtartó) segítségével kapcsolódnak hozzá egyesével vagy füzérszerű elrendeződésben. Az élesztőszerű gombák ivartalan szaporodásakor rendszerint bimbózással jönnek létre az új sejtek (blasztospórák). A gombák morfológiáját többnyire festetlen, natív preparátumokban, kis nagyítású lencsékkel, normál fényvagy fáziskontraszt-mikroszkópban vizsgáljuk. A gombák megfesthetők a bakteriológiában használt festékekkel 143
164 Részletes bakteriológia és Gram szerint is. Festésükre azonban gyakran speciális, összetett festési eljárásokat veszünk igénybe (pl. perjódsavas Schiff-féle festés). Tenyésztés. A gombák viszonylag igénytelen, aerob, heterotróf organizmusok. Nitrogénforrásként a legtöbb gomba szerves és szervetlen nitrogénvegyületeket (fehérjéket, peptideket, aminosavakat, nitrátokat, ammóniát) egyaránt fel tud használni, egyes fajok azonban kizárólag szerves nitrogént képesek hasznosítani. A gombák tenyésztésére használt táptalajokban a nitrogénforrás általában pepton vagy nitrátsók. Szénszükségletüket kivétel nélkül szerves anyagok, főként szénhidrátok (egyszerű cukrok, cukoralkoholok, szerves savak, cellulóz, kitin stb.) bontásából nyerik. Laboratóriumi tenyésztésükre leggyakrabban a Sabouraud-féle, peptont és glükózt tartalmazó agart, valamint maláta-, melasz- vagy kukoricaliszt-tartalmú táptalajokat használunk. A szintetikus táptalajok közül mind folyékony, mind szilárd formában használjuk a Czapek-féle, szacharózt, nitrátot és különféle sókat tartalmazó táptalajt. A táptalajok optimális ph-ja enyhén savanyú, 5 7 között van. A savanyú ph önmagában is gátolja a baktériumok szaporodását. A neutrális ph-t igénylő, hosszú tenyészidejű gombafajok (pl. a dermatophytonok) kitenyésztésére a baktériumok szaporodásának gátlására antibiotikumokat (pl. penicillint, streptomicint), a penészgombák gátlására pedig esetleg ciklo-heximidet is tartalmazó táptalajokat használunk. A gombákat általában addig tenyésztjük, amíg a telepeken spórák, konídiumok képződnek. Ezek képződésének módja, alakja, nagysága, színe az identifikálás alapja. A tenyésztés optimális hőmérséklete a gomba fajától függően C között változik. Az identifikáláshoz szükséges morfológiai bélyegek általában 5 7 nap alatt alakulnak ki, esetenként azonban a spóraképződést serkentő táptalajokra és sokkal hosszabb tenyésztési időre van szükség. Ellenálló képesség. A gombák ellenálló képessége nagyobb, mint a vegetatív baktériumoké. Beszáradva akár évekig is életképesek maradnak, C-on azonban perceken belül elpusztulnak. A fertőtlenítőszerek a gombák elölésére rendszerint ugyanolyan koncentrációban használhatók, mint a mycobacteriumok elpusztítására. Speciálisan a gombák elpusztítására a pentaklórfenol-nátrium, valamint a merfen és a mertiolát használhatók. A gombák szaporodása számos kemoterapeutikummal gátolható, a mycosisok gyógykezelésére egyéb szerek mellett néhány antibiotikum (nystatin, amfotericin B, griseofulvin stb.) is rendelkezésre áll. Pathogenitás. Az állatorvost érdeklő gombák legnagyobb része fakultatív kórokozó, amelyek szabadon a talajban vagy szerves anyagokon, esetleg a növényeken élnek és onnan kerülnek az állati szervezetbe. A gombák egy része az emberben és az állatokban mycosist, mások mycotoxicosist okoznak. A mycosisok általános (szisztémás) vagy csupán helyi mycosisok (pl. dermatomycosis). A következőkben az egyes osztályokba tartozó, igen nagyszámú gombafaj közül csak azokat ismertetjük, amelyeknek állatorvosi vagy egyéb szempontok miatt jelentőségük van Zygomycetes Az ide tartozó gombák közül a Mucor, a Rhizopus és az Absidia nemzetségbe sorolt fajok gyakran előforduló penészgombák. Ivarosan két megduzzadt hifasejt összeolvadásából keletkező zigospórával szaporodnak. A gyakoribb ivartalan szaporodási formánál a reproduktív hifák végein gömb alakú, sporangiumnak nevezett spóraképző szerv alakul ki. A sporagiumban számtalan spóra (sporangiospóra) képződik. A gömb alakú sporangiumok miatt az ide tartozó fajokat nevezik fejespenészeknek (52. ábra) is. Az egyes genusokba tartozó fajok a szaporítószervek alaki sajátságai, továbbá tenyésztési sajátságaik alapján különböztethetők meg. 52. ábra - Rhizopus sp. sporangiumának felépítése (fukszinfestés, 1250 ) 144
165 Részletes bakteriológia Az említett nemzetségbe tartozó fajok (pl. a Mucor racemosus, Rhizopus nigricans, Rhizopus orizae, Absidia corymbifera) igen elterjedtek, gyakran megtalálhatók nedves, penészes alomban, takarmányokban, romlott élelmiszerekben (pl. penészes kenyérben, konzervekben). Szórványosan vetélést is előidézhetnek szarvasmarhában és egyéb állatfajokban Ascomycetes Fonalas és élesztőszerű gombák egyaránt tartoznak ide. Ivarosan aszkospórákkal, ivartalanul pedig egyéb spóraképzéssel szaporodnak. A fonalas gombák közül ide tartozik az anyarozs (Claviceps purpurea), de ismert penészgombák (Penicillium, Aspergillus, Fusarium stb.), dermatophytonok (Microsporum, Trichophyton) egyes fajainak perfekt (ivaros) alakjai ugyancsak tömlős gombák. A gyakoribb ivartalan szaporodási alak miatt azonban a Deuteromycetes csoportban tárgyaljuk őket. A tömlős gombák közé tartozó számos élesztőgombafaj ivartalan szaporodása sarjadzással vagy egyszerű harántosztódással történik, osztódásuk után együtt maradva, hosszabb-rövidebb láncot képeznek. Az élesztőgombák egy részét ipari célokra is felhasználjuk, közülük a közönséges élesztő, a (Saccharomyces cerevisiae) a legismertebb. Élesztőgombákat használunk a sütőiparban (tésztafélék kelesztése), bor-, sör-, alkoholgyártásban stb. Az élesztőgombák fakultatív anaerobok, anaerob viszonyok között a szénhidrátokból szén-dioxidot és etil-alkoholt képeznek. Nagy mennyiségben szintetizálnak különféle B-vitaminokat, tenyészeteik ezért értékes vitaminforrások. Élelmiszerekbe (takarmányba) kerülve azok megromlását (erjedését) idézhetik elő, megfelelő technológiával azonban felhasználhatók a takarmányok tápanyagainak a feltárására is Basidiomycetes Ivarosan a módosult tartósejteken (bazídiumokon) képződő, szabadon álló bazidiospórákkal szaporodnak. Ide tartoznak, számos egyéb faj mellett a növényparazita üszöggombák (pl. Ustilago zeae), a gabonafélék rozsdagombái (pl. Puccinia graminis), valamint az ehető és mérgező kalaposgombák többsége. A Cryptococcus neoformans nevű imperfekt élesztőgomba ivaros formája ugyancsak bazídiumos gomba (Filobasidiella neoformans) Deuteromycetes Ebbe az osztályba azokat a gombákat soroljuk, amelyeknek ivaros szaporodási formája nincs, vagy amelyeknél ezt a szaporodási formát a gombafaj leírása idején nem ismerték. Nevezik ezért az ide tartozó fajokat befejezetlen vagy nem teljesen ismert szaporodású gombáknak (Fungi imperfecti) is. Számos fajukról azonban utólag kiderült, hogy tömlős, esetleg bazídiumos gombák ivartalan (imperfekt) alakjai. 145
166 Részletes bakteriológia Ivartalanul konídiumokkal szaporodnak, amelyeknek keletkezési módja, alakja és színe igen változatos. Az ivartalanul szaporodó (imperfekt) és az ivarosan szaporodó (perfekt) formák alakilag olyannyira eltérnek egymástól, hogy a kétféle formát önálló fajoknak tekintették és külön névvel illették. A Fungi imperfecti osztályba számos, kórtani szempontból fontos gombafaj tartozik, közülük az állatorvosi szempontból fontosabbakat az alábbiakban ismertetjük Imperfekt fonalas gombák Aspergillus A konídiumokat képző hifák feji, duzzadt részén vannak a konídiumok (53. ábra). Az aspergillusoknak számos faja ismert, közülük több kórtanilag is fontos. Az A. fumigatus (ritkábban más aspergillusok) nedves alomban elszaporodva csibékben, kacsákban, pulykákban tüdőpenészesedést okoz. A szennyezett alomról gyakran bejut a víziszárnyasok (főleg kacsa, liba) tojásaiba, s a keltetés során elszaporodva a tojások gombás rothadását idézi elő. Szarvasmarhákban alkalmanként a méhlepényben elszaporodva vetélést okoz. Az A. flavus meleg, nedves viszonyok között tárolt takarmányokban elszaporodva toxint (aflatoxint) termel, naposkacsák és pulykapipék a legérzékenyebbek iránta. A toxin több komponensből áll, karcinogén hatású, elsősorban a májsejteket károsítja. Rosszul tárolt, penészes takarmányokból gyakran más toxintermelő Aspergillus fajok is izolálhatók, pl. az A. ochraceus, A. niger, A. candidus. Az A. ochraceus és egyes Penicillium fajok által termelt ochratoxin főleg a vese kanyarulatos csatornácskáinak hámját károsítja (nephropathia). 53. ábra - Aspergillus fumigatus tenyészet Sabouraud-agaron Penicillium A hifákon kifejlődő konídiumtartók ecsetszerűen elágazódnak (ecsetpenész), rajtuk képződnek a lánc alakban egymással összefüggésben maradó konidiospórák (54. ábra). A P. notatum, a P. chrysogenum és néhány más faj termeli a penicillint. Egyes fajok pl. a P. viridicatum, P. cyclopium, P. rubrum és számos más faj gyakran megtalálható penészes takarmányokban, ahol különféle toxinokat (citrinint, patulint, rubratoxint, ochratoxint stb.) termelhetnek. A toxinok főleg sertésben és baromfifélékben étvágytalanságot, vesekárosodást, vérzéses bélgyulladást stb. idéznek elő. 146
167 Részletes bakteriológia 54. ábra - Penicillum sp. spóratartó képletei (fukszinfestés, 1250 ) Fusarium Növényparaziták, főleg a gabonanövényeket betegítik meg. Megnyúlt, kifli alakú makrokonídiumokkal, mikrokonídiumokkal szaporodnak. Egyes fajok takarmánynövényeken és tenyészeteikben is piros színű pigmenteket termelnek. A F. graminearum (perfekt alakja Gibberella zeae), a F. culmorum, a F. sporotrichioides, a F. moniliforme és számos más faj nagy nedvességtartalmú kukoricán, búzán vagy egyéb takarmányban elszaporodva toxinokat (F 2-t, T 2-t, fumonizint stb.) termel. Az F 2 toxin (zearalenon) sertésekben álivarzást és termékenységi zavarokat okoz, de megbetegíthet más állatfajokat (szarvasmarhát, juhot, ludat stb.) is. A T 2 toxin és más trichothecének lóban, szarvasmarhában, sertésben és más állatfajokban étvágytalanságot, hányást, szövetelhalással és érfalkárosodással járó gyomor-, bélgyulladást okoznak. A toxinok súlyosan károsítják az immunrendszert is, ezáltal immunszuppresszív hatásúak Stachybotrys Az ide tartozó fajok közül a S. atra (S. alternans) mindenütt megtalálható, erőteljes cellulózbontó képességű penészgomba. Szalmán, szénán, alkalomadtán gabonamagvakon vagy egyéb cellulóztartalmú anyagokon elszaporodva fekete színű telepeket képez. Viszonylag nagy, citrom alakú, sima felületű, fekete színű konídiumai a konídiumtartók oldalán helyezkednek el. Egyes törzsei toxinokat termelnek (stachybotryotoxinok), amelyek lovakban, szopós malacokban és borjakban, ritkán egyéb állatfajokban a bőr és a nyálkahártyák elhalásával, vérzésekkel járó kórképeket okoznak. A toxinhatáshoz gyakran baktériumfertőzések társulnak (pl. lovak pyoseptikaemiája) Dermatophytonok Különféle állatfajokban (szarvasmarhában, lóban, húsevőkben, nyúlban, baromfiban stb.) és az emberben a bőr hámrétegét és a szőrt (tollat) betegítik meg, gombás bőrbetegséget (tarlósömört) okoznak. A bőr a gombákkal fertőzött helyeken megduzzad, hámlik, a szőrszálak letöredeznek. Háziállatokban a tarlósömör előidézésében a Trichophyton (perfekt formája Arthroderma) és a Microsporum (Nanizzia) fajoknak van szerepe. A kórokozók a beteg bőrfelületről vett kaparékban, szőrszálakban, a szöveti sejtek, illetve a keratin meleg kálium-hidroxidos feloldása után fonalak vagy azok feltöredezésével keletkezett artrokonídiumok formájában mutathatók ki. 147
168 Részletes bakteriológia Tenyésztésükre többnyire glükózt és peptont tartalmazó, antibiotikumokkal és ciklo-heximiddel kiegészített Sabouraud-féle táptalajt használunk. A tenyészetek 1 3 hét alatt fejlődnek ki, a gombatelepek kevés kivételtől eltekintve fehér vagy piszkosfehér színűek, porszerű, szőrös vagy bolyhos felületűek. A Trichophyton fajok közül a T. equinum a ló, a T. mentagrophytes a ló, a kutya, a macska, a nyúl és az ember, a T. verrucosum pedig a szarvasmarha és ritkán az ember tarlósömörének az okozója. A Microsporum fajok közül a M. gypseum elsősorban a lovat, ritkán más háziállatokat és az embert, a M. canis pedig a kutyát, a macskát és az embert betegíti meg. A M. (Trichophyton) gallinae tyúkban idézi elő a favusnak (kosznak) nevezett bőrgombásodást Imperfect élesztőgombák A Fungi imperfecti csoportba sorolt élesztőszerű gombák között több olyan faj van, amelyek az emberben és az állatokban egyaránt helyi vagy szisztémás mycosist idéznek elő. Az ide tartozó fajok identifikálására a morfológiai sajátságokon túl figyelembe veszik a biokémiai sajátságokat (különféle szénhidrátok fermentálását, szénhidrátok és nitrátok beépítését stb.), továbbá az utóbbi években az általuk okozott szisztémás mycosisok diagnosztizálására egyes szerológiai (komplementkötési, agglutinációs, immundiffúziós) próbákat, valamint az immunfluoreszcenciát is. Az ide tartozó fajok közül állatorvosi szempontból a következők fontosak. A Candidafajok mindegyike képez pszeudohifát a sarjadzás mellett, de egyeseknél valódi fonal is van. A leggyakoribb kórokozó a C. albicans (55. ábra), de előfordul néhány más faj, így a C. tropicalis, a C. krusei, a C. guillermondii stb. is. A C. albicans kukoricaliszt agarba oltva jellegzetes klamidospórákat képez. A C. albicans, ritkán más fajok is emberben, szopós malacban, borjúban, madárban stb. idéz elő a nyálkahártyákon (főleg a szájban), a légutakban, a húgy- és ivarszervekben gombásodást. Alkalmanként izolálhatók szarvasmarha és egyéb állatfajok vetéléseiből, bikák ondójából stb. 55. ábra - Candida albicans Sabouraud-agarról (fukszinfestés, 1250 ) A Cryptococcus fajok közül a C. neoformans szarvasmarhában, kecskében tőgygyulladást okozhat, de előidézhet emberen, kutyában, macskában és egyéb állatfajokban szisztémás mycosist is. A Malassezia pachydermatis zoopathogen élesztőgomba, amely különböző állatfajok korpázó pikkelyező bőrgyulladásaiból, leggyakrabban azonban a kutya és a macska külső hallójárat-gyulladásaiból izolálható. 148
169 Részletes bakteriológia Dimorf gombák A dimorf gombák közül a Histoplasma farciminosum az egypatások járványos nyirokérgyulladásának az okozója. A közeli rokon H. capsulatum pedig emberben, azonkívül kutyában, macskában idéz elő szisztémás mycosist. A Sporothrix schenkii által előidézett sporotrichosis lovakban, kutyákban jelentkezik leggyakrabban bőr alatti granulomatosis formájában. A Coccidioides immitis emberben, szarvasmarhában, juhban és kutyában okoz főleg a tüdő, ritkábban egyéb szervek granulomatosisával járó mycosist. A Blastomyces dermatitidis főként az emberen és a kutyában idéz elő mycosist. 149
170 3. fejezet - Virológia 1. Általános virológia 1.1. A vírus fogalma A vírusok a mikroorganizmusok sajátos csoportját alkotják. Felépítésük, szaporodásmódjuk alapvetően eltér a többi élőlényétől. Általában kisebbek, mint a többi mikroorganizmusok, méretük vírustípustól függően nanométer (nm) között van. Mivel nagyságuk a fénymikroszkóp feloldóképességének határa alatt van, csak elektronmikroszkóppal láthatók. Nevüket is egy tudományos tévedésnek köszönhetik: mivel kicsiny méretükből adódóan áthatolnak a baktérium-visszatartó szűrőkön, kezdetben toxinnak vélték őket (virus: méreg lat.); korpuszkuláris természetük csak később igazolódott. Manapság a szűrhetőség már nem tekinthető a vírusok jellemző tulajdonságának, egyrészt mivel kiderült, hogy vannak baktériumok is, amelyek a baktériumszűrőkön átjutnak (pl. a mycoplasmák), másrészt mivel napjainkban már olyan kis pórusméretű szűrők is előállíthatók, amelyeken a vírusok is fennakadnak. A vírusok jellemzése a fertőzőképes víruspartikula, a virion tulajdonságai alapján történik. A vírus (virion) a magasabbrendű, sejtes élőlényektől az alábbi tulajdonságokban tér el: csak egyféle nukleinsavat (RNS-t vagy DNS-t) tartalmaz. Ezek víruscsaládtól függően szimpla szálú vagy dupla szálú formában egyaránt előfordulhatnak. A genetikai információ hordozója tehát a vírusok esetében egyés kétszálú DNS, illetve egy- és kétszálú RNS lehet, szemben a magasabb rendű élőlényekkel, amelyekben az információ mindig kétszálú DNS formájában tárolódik. Megsokszorozódással szaporodik, növekedni és osztódni nem képes. A vírusoknak ugyanis nincs saját energiaszolgáltató és fehérjeszintetizáló enzimrendszerük, sőt többnyire a nukleinsav replikálódásához szükséges enzimkészletük is hiányos. Ezért a vírusok obligát sejtparaziták: élő sejtekbe jutva a fertőzött sejt enzimrendszerét használják saját szaporodásukhoz, gyakran a sejt saját anyagcseréjének a rovására. A fertőzött sejtek által termelt extracelluláris virion sem növekedésre, sem osztódásra nem képes. A fentiekből következik, hogy a vírusoknak két megjelenési formája van: az egyik, amikor génparazitaként a gazdasejt biokémiai folyamataiba beavatkoznak (ebben az állapotban vegetatív vírusnak nevezzük őket), a másik pedig az e folyamatok révén létrejött, a gazdasejttől független fertőző részecske a virion. Egyetlen virion utódvirion előállítását is indukálhatja egy sejten belül, ezt a szaporodási módot ezért megsokszorozódásnak (vírusmultiplikációnak) is nevezzük. A vírusok igen széles körben elterjedtek: izoláltak már vírusokat baktériumokból, gombákból, protozoonokból, növényekből és az állatvilág minden csoportjából a puhatestűektől az ízeltlábúakon át a gerincesekig. Állatorvosi szempontból a halakat, madarakat és emlősöket megbetegítő vírusok a legfontosabbak (ilyenek pl. a pontyok tavaszi hasvízkórjának, a baromfipestisnek, a ragadós száj- és körömfájásnak, a veszettségnek a vírusa stb.). Ugyanakkor azt is tudnunk kell, hogy a vírusok többsége nem okoz betegséget (ezek az ún. orphan vírusok) csakúgy, mint ahogy a baktériumok túlnyomó többsége is apathogen. Jelen tudásunk szerint azonban hasznos vírusok nincsenek (szemben pl. az élelmiszeriparban használt baktériumokkal vagy az emésztésben fontos szerepet betöltő bélbaktériumokkal) A vírusok eredete A vírusok eredete jelenleg még tisztázatlan, de valószínű, hogy a vírusok többféle módon alakultak ki. A bonyolultabb felépítésű vírusok (pl. poxvirusok) a sejt degradációja révén alakulhattak ki: a parazita sejt annyira leegyszerűsödött, hogy elveszítette önállóságát. Élettelen környezetben nem képes szaporodni: információt tárol, de annak átadására csak élő sejtbe jutva képes. Az egyszerűbb vírusok a sejt valamelyik, genetikai utasítást hordozó részéből alakulhattak ki, így pl. az RNS tartalmú vírusok egy része mrns molekulákból, az egyszerűbb DNS-vírusok kromoszómatöredékekből stb. Ez az elmélet nem magyarázza a szimpla szálú DNS-t, a dupla szálú RNS-t és a negatív irányítottságú szimpla szálú RNS-t tartalmazó vírusok eredetét, mivel ilyen nukleinsav- formációk a sejtben nem fordulnak elő. (Ez a vírus szempontjából nagy előny, hiszen így a fertőzött sejt megfelelő enzimek híján nem tudja a vírust 150
171 Virológia lebontani.) Feltételezik, hogy ezek más vírusok nukleinsav-replikációs folyamatának köztes termékei, vagy ma már nem létező élőlények sejtjeiből származnak. A gazdasejtek és az azokat fertőző vírusok nukleinsavának szerkezete (riboszómakötő helyek száma, egyes génszakaszok bázissorrendje stb.) között felismerhető hasonlóság is támogatja a fenti elképzelést, vagyis azt, hogy a vírusok különböző módon, de a szaporodásukat segítő sejtekből származnak A vírusok szaporítása A vírusok okozta fertőző betegségek kórjelzéséhez (vírusdiagnosztika), a vírusok tulajdonságainak vizsgálatához (vírusanalitika) és az oltóanyag-termeléshez stb. szükség van a vírusok mesterséges elszaporítására. Mivel e kórokozók obligát sejtparaziták, a vírusszaporítás csak élő sejtekben történhet. Erre a célra mesterségesen fertőzött kísérleti állatok, embrionált tojások és in vitro sejttenyészetek használhatók Vírusok szaporítása kísérleti állatokban Napjainkban elsősorban állatvédelmi, de gazdaságossági és szakmai szempontok miatt is ez a módszer szinte teljesen kiszorult a vírusok szaporításának eljárásai közül. Kísérleti, diagnosztikai és oltóanyag-ellenőrzési célból jelenleg is rendszeresen végeznek kísérleti állatoltásokat, de ezekben az esetekben a vírus elszaporítása nem cél, hanem csak eszköz a szükséges eredmények elérése érdekében. Jelenleg Magyarországon vírustermelés céljából csak két, más módszerrel még nem szaporítható vírust, a nyulak haemorrhagiás betegségének vírusát és a sertéspestis elleni immunizálásra használt vakcinavírus-törzset szaporítják ily módon (mindkettőt nyulakban) Vírusok szaporítása embrionált tyúktojásban Embrionált tyúktojásokat (56. ábra) főleg korábban, a szövettenyészetek széleskörű elterjedése előtt alkalmaztak vírusszaporítás céljából, de ez a technika még ma is rendszeresen használatos a virológiai munkálatok során bizonyos vírusok izolálása és vakcinatermelés céljából egyaránt. 56. ábra - Vírusok szaporítása embrionált tyúktojásban. Az embrionált tyúktojás szerkezetének és a choroallatois hártyára történő oltásnak a sematikus rajza A szikhólyag fala, a chorioallantois- és az amnionhártya, valamint maga a csirkeembrió olyan szövetekből épül fel, amelyek egyes vírusok elszaporítására alkalmasak. Tojásban való vírusszaporításhoz lehetőleg SPF (Specific Pathogen Free-specifikus kórokozóktól mentes) állományból származó, fehér héjú, jól átvilágítható tojásokat célszerű alkalmazni. A tojásoltás munkafázisai a következők: lámpázással meggyőződünk arról, hogy az embrió él-e, megfelelő fejlettségi stádiumban van-e, és megközelítő helyeződéséről is tájékozódunk; ez segítséget nyújt az oltás irányának és mélységének helyes megválasztásához, mivel a tojáshéj mikroorganizmusokkal szennyezett lehet, a tojás héját az oltás területén fertőtleníteni kell (pl. jódtinktúrával). 151
172 Virológia A tojáshéj átfúrása oltólándzsával vagy vastag injekciós tűvel történik. Amennyiben nagyobb héjdarab eltávolítása szükséges, akkor fogászati fúróval vágjuk körül a megfelelő nagyságú területet. A tojás oltása többféleképpen történhet, mivel a különféle vírusok az embrionált tyúktojás különböző részeiben találják meg a szaporodásukhoz legjobban megfelelő környezetet. A különböző oltásokhoz eltérő ideig keltetett tojásokat használunk: Chorioallantois-hártyára történő oltáshoz napos tojás alkalmas. Ez a módszer alkalmazható pl. poxvirusok vagy herpesvirusok szaporítására. A vírus elszaporodását a membránon jelentkező diffúz homály vagy göb (pock) jelzi. A göbök morfológiája (a pock nagysága, esetleges gyulladásos kísérőtünetek, vérzéses vagy elhalásos jellege stb.) egyes vírusok esetében jellemző eltéréseket mutat (pl. a tehénhimlő vírusa vérzéses, a tyúkhimlő vírusa kezdetben proliferatív, majd necrotisaló pockokat képez). Allantoisüregbe és amnionüregbe történő oltáshoz 9 12 napig keltetett tojásokat használunk. Ily módon szaporíthatók pl. az influenzavirusok, a baromfipestis, és a fertőző bronchitis vírusa. A vírus először az üreget határoló membrán sejtjeiben szaporodik, később bejut az embrióba is. Az allantois- vagy amnionfolyadékba kiszabaduló, hemagglutináló tulajdonságú vírusok jelenléte hemagglutinációs próbával bizonyítható. Szikzsákba történő oltásra az 5 7 napig keltetett tojások alkalmasak, így szaporítható pl. a csirkék fertőző agyés gerincvelő-gyulladásának vírusa. (Ezzel a módszerrel chlamydiák, rickettsiák is tenyészthetők.) Viszonylag ritkán alkalmazzák (pl. a bluetongue vírusának szaporítására) az intravénás tojásoltást, ilyenkor a tojáshéj alatt futó nagy erek valamelyikébe juttatjuk a vizsgálati anyagot. A tojáshéjon ejtett nyílást, a fertőződés elkerülése érdekében, általában olvasztott paraffinnal lezárjuk. Ezután az oltott tojásokat inkubáljuk, vagyis visszahelyezzük a keltetőgépbe, és tovább keltetjük. A továbbiakban az embriókat naponta lámpázással ellenőrizzük. Ha jelentkeznek az egyes vírusokra jellemző elváltozások vagy az embrió elpusztul, akkor a tojásokat felbontjuk és a kialakult tünetek (pl. törpenövés, torzfejlődés), vagy a tojásfolyadékok hemagglutinációja alapján győződhetünk meg a vírusszaporítás eredményességéről. (Ha az oltást követő első napon belül pusztulnak el az embriók, az mechanikai sérülés vagy szennyeződés következményének tekinthető.) Vírusok szaporítása sejt- és szövettenyészetekben A virológia fejlődésében fordulópontot jelentett az in vitro sejttenyésztési technika kidolgozása. Szövettenyészeteket vagy sejtkultúrákat akkor kapunk, ha a szervezetből frissen kivett szervek apró darabkáit vagy azok különálló sejtjeit in vitro körülmények között életben tartjuk és szaporítjuk. A szövettenyésztési technika rutinszerű alkalmazása akkor vált lehetővé, amikor az antibiotikumok és a gombaellenes szerek már rendelkezésre álltak a baktériumok, valamint a gombák elszaporodásának megakadályozására. A kezdeti kultúrák éles ollóval vagy szikével apróra vágott túlélő szervdarabok voltak (pl. Carrel-féle explantált tenyészet). Ezeket embriókivonat és tyúkplazma keverékével az üvegedény felületére ragasztották, tápfolyadékkal fedték és így tartották életben. Túlélő szervdarabkákat vakcinatermelésre is használtak. Így pl. a ragadós száj- és körömfájás elleni vakcina készítésére használják az ún. Frenkel-módszert. Ehhez nagyméretű keverőtartályokban szarvasmarha-nyelvhám darabkákat tartanak életben tápfolyadék segítségével, és ezekben szaporítják a vírust. A virológiai technikában jelenleg legkiterjedtebben az egyrétegű sejttenyészet használatos. A módszer lényege, hogy sterilen kivett szervek apróra vágott darabjait híg tripszinoldatban emésztjük (57. ábra). Ha az enzimkezelés kíméletes, akkor a sejtek elválnak egymástól anélkül, hogy károsodnának. Így az emésztés során sejtszuszpenziót kapunk, amelyet a tripszinhatás felfüggesztése céljából jéggel hűtött edényben gyűjtünk, majd kíméletesen centrifugálunk. A tripszinoldatot leöntjük, és a leülepedett sejteket előzetes sejtszámolás után tápfolyadékban reszuszpendáljuk, amely a szaporodásukhoz szükséges anyagokat tartalmazza. A tenyésztésre szánt sejtszuszpenzió sűrűségét általában sejt/ml értékre állítjuk be. A tápfolyadék különféle sók (szükség esetén aminosavakkal gazdagított) pufferolt oldatából áll (pl. Hank s MEM, RPMI 1640), amely fehérjeforrásként 5 15% borjúsavót is tartalmaz. A baktériumok és gombák szaporodásának megakadályozása érdekében a tápfolyadékot antibiotikumokkal és antimycotikumokkal egészítjük ki. A sejtszuszpenziót különféle steril edényekbe (Roux-palackba, kémcsőbe, Petri-csészébe stb.) adagoljuk, és a tenyészeteket 37 C-os termosztátban inkubáljuk. Néhány órán belül a sejtek az üvegre tapadnak és megkezdődik szaporodásuk. A szomszédos sejtek hártyájának érintkezése kiváltja az ún. kontakt gátlást, és a sejtszaporodás leáll, ezért az ép, 152
173 Virológia egészséges sejtek a felületen egyetlen rétegben szaporodnak addig, míg egymással összeérnek. Így egyrétegű sejttenyészetet kapunk, amely egyenletesen bevonja az üvegedény falát, és így a sejtek állapota kis nagyítású mikroszkóppal ellenőrizhető. Ekkor a tápfolyadékot ún. fenntartó folyadékra (pl. Earle s MEM) cseréljük, amely tápanyagokban szegényebb, csupán a sejtek életben tartását szolgálja. 57. ábra - Egyrétegű sejttenyészet készítése Az állati szervdarabkákból ily módon közvetlenül előállított tenyészeteket nevezzük elsődleges vagy primer kultúráknak. Primer tenyészetek szinte minden faj számos szervéből készíthetők, de legalkalmasabbak a hámsejtekben gazdag szervek (vese, here, pajzsmirigy stb.). Minden vírus esetében ismernünk kell annak sejtspektrumát, vagyis azokat a sejttenyészet-féleségeket, amelyekben az adott vírus szaporodni képes. Ekkor nem csupán az állat faját, hanem a szervet is figyelembe kell venni, amelyből a tenyészetet készítjük. Általánosságban azok a szervek a legalkalmasabbak egy adott vírus szaporítására, amelyekben az in vivo körülmények között is szaporodik. Sikerrel használhatunk azonban más szerveket is, pl. sok faj vesetenyészete egész sor vírus szaporítására alkalmas. Vírusizoláláskor (lásd később) mindenképpen ajánlatos különböző tenyészetek párhuzamos oltása, mivel egy adott faj különböző szerveiből származó sejteknek a fogékonysága eltérő lehet (pl. az I. és II. alcsoportba tartozó bovin adenovirusok szaporíthatósága borjúvese-, illetve borjúhere-tenyészetekben). Ugyancsak a vírusizolálás esélyeit növeli az ún. kokultúrák alkalmazása is. Ilyenkor a fertőzésre gyanús állatból származó szerv darabkáit egészséges állatból származó szervdarabkákkal együtt emésztjük tripszinoldattal, így olyan sejttenyészetet kapunk, amely vírussal fertőzött és egészséges sejteket egyaránt tartalmaz. Más esetekben a fertőzött állatból származó szervdarabokat vagy perifériás fehérvérsejtek szuszpenzióját adják a sejttenyészethez. Az eljárás lényege az, hogy a fertőzött sejtekben termelődő víruspartikulák elszaporodására a közvetlen környezetben fogékony sejtek állnak rendelkezésre. A primer kultúrákat vagy közvetlenül felhasználjuk, tehát vírussal oltjuk, vagy másodlagos kultúrákat (szubkultúrákat) készíthetünk belőlük. Az utóbbi esetben a primer kultúra sejtjeit az üveg faláról tripszinnel leemésztjük, centrifugáljuk, majd újabb tápfolyadékban reszuszpendálva újabb üvegedényekbe adagoljuk, melyek falán a sejtek pár nap alatt ismét egyrétegű tenyészetet alkotnak. A másodlagos tenyészetnek számos előnye van, pl. az, hogy ily módon egy szervből kiindulva a sejtek ismételt leemésztésével és szaporításával (további szubkultúrázásokkal ) heteken át friss sejttenyészetek birtokába jutunk. Ezáltal egyrészt a tenyészetek mennyiségét növelhetjük, másrészt a szubkultúrák általában minőségileg is jobbak, simább, egyöntetűbb réteget alkotnak. A primer (és szekunder) sejttenyészetek előnye, hogy általában fogékonyabbak a vírusfertőzésre, mint a többszörösen passzált sejtek, hátrányuk viszont az lehet, hogy eleve fertőzve lehetnek valamilyen vírussal vagy mycoplasmával, amellyel a szervet szolgáltató állat fertőzve volt. Ezért igényesebb munkák céljára csíramentes (gnotobiotikus) vagy legalább SPF állatok szerveit használják szövettenyészetek készítésére. A sejttenyészet fentiekben ismertetett, ismételt átoltásával (passzálásával), szaporításával permanens tenyészetek 153
174 Virológia vagy sejtvonalak nyerhetők. A feladat azonban általában nem ilyen egyszerű. A tenyészetek zöme ugyanis néhány átoltás után elveszti eredeti jellegét, pl. a fibroblast jellegű sejtek előbb-utóbb túlnövik a hám jellegűeket. A vírusok zömének ez nem kedvez, a tenyészet egyre kevésbé alkalmas a vírusok szaporítására. Ezért permanens sejtvonalakat általában sejtklónozással állítanak elő. Ehhez egyetlen sejt utódait igyekeznek izolálni. Sikeres izolálás esetén így genetikailag homogén sejtpopulációt nyernek (58. ábra). E sejtek utódai nem csupán egyöntetűek, hanem szaporodóképességük is megfelelő. Ma már a virológiában nagyon sok permanens sejtvonalat használunk. Közülük számos állati eredetű. Ilyenek pl. a PK l5 (sertésvese-) és az MDBK (borjúvese-) sejtvonalak. 58. ábra - Sejtklónozás A sejtvonalak használata lényegesen kényelmesebb, mint a primer és szekunder kultúráké, mert nem kell állandóan friss szervekről gondoskodni és azokat feldolgozni. Ezért a vakcinakészítéshez szükséges vírusszuszpenzió egy részét is sejtvonalakon készítik. Számos előnyük mellett a sejtvonalaknak több hátrányos tulajdonságuk is lehet, pl. kevésbé fogékonyak bizonyos vírusfertőzésekre és így kevésbé alkalmasak a vírusok izolálására, másrészt eredetileg fertőzöttek lehetnek valamilyen, esetleg onkogén vírussal. (Permanens tenyészetek ugyanis viszonylag egyszerűen állíthatók elő daganatos szövetekből, ilyen többek között a méhszájdaganatból előállított HeLa sejtvonal vagy a hörcsögvesetumorból származó BHK 21 sejtvonal.) Mindez egyrészt közvetlenül veszélyes lehet (élővírusos vakcinák készítéskor), másrészt pedig tovább ronthatja a sejtvonal érzékenységét a szaporításra szánt vírussal szemben. A sejtvonalak használatát megkönnyíti, hogy azok mélyhűtve tárolhatók, vagyis a sejtek folyékony nitrogénben akár évekig is megőrzik életképességüket. A nagy szaporodóképességű sejtvonalak lehetővé teszik, hogy ma tömegtermelés céljára az ún. szuszpenziós tenyészeteket használjuk. Ennek lényege, hogy a sejteket nem hagyjuk letapadni az edény falára, hanem állandó keveréssel szuszpenzióban tartjuk azokat. Így lényegesen több sejtet tudunk adott méretű tankokban fenntartani, anyag-, energia- és helytakarékossággal erőteljesen növelhetjük a vírustermelés gazdaságosságát. A módszert üzemi méretekben többek között a ragadós száj- és körömfájás vakcinájának készítésére használják. Előfordulhat, hogy olyan sejteket kell nagy tömegben elszaporítanunk, amelyek csak szilárd felületre tapadva képesek osztódni és életben maradni. Ilyenkor alkalmazzuk az ún. mikrokarrier tenyészetet, amelynek lényege 154
175 Virológia az, hogy a sejteket apró műanyag golyócskák (pl. Cytodex) felületére hagyjuk tapadni, majd ezeket a golyócskákat tartjuk szuszpenzióban, állandó keveréssel A vírusok tisztítása és koncentrálása A vírusok szerkezetének és molekuláris összetevőinek vizsgálata legtöbbször a különböző vírusszaporítási eljárásokkal nagy mennyiségben előállított, majd megfelelő módszerekkel tisztított és koncentrált vírusszuszpenzió felhasználásával történik. A vírusanalitikai vizsgálatoknak mindig mikrobiológiailag tiszta, más vírusokkal vagy baktériumokkal nem szennyezett vírusszuszpenzióból kell kiindulniuk, szemben a víruskimutatás céljára történő vizsgálatokkal (lásd később). Az alkalmazható tisztítási és koncentrálási eljárásokat alapvetően a kérdéses vírus kémiai és fizikai ellenálló képessége határozza meg. Az első lépés rendszerint a sejtekben lévő virionok kiszabadítása a szuszpenzió ismételt lefagyasztása majd felolvasztása útján, mechanikai homogenizálással, ultrahangos kezeléssel vagy kémiai anyagok (pl. detergensek) segítségével. A szuszpenziót ezután alacsony fordulatszámon ( g) centrifugáljuk. Ilyen nehézségi erő mellett a sejttörmelék leülepszik, a virionok pedig a felülúszóban maradnak, és így elkülöníthetők az üledéktől. A vírustartalmú folyadék tovább is tisztítható szűrők segítségével, amelyekkel a visszamaradt és a kérdéses vírusnál nagyobb részecskék kiszűrhetők. Az előbbiek szerint előkészített vírusszuszpenzió általában túl híg, ezért a továbbiakban a víruskoncentrálás valamelyik módszerét kell alkalmaznunk. A legegyszerűbb, de a legkevésbé kíméletes eljárás az, ha a virionokat a szuszpenzióból alkohollal vagy ammónium-szulfáttal kicsapatjuk, majd kisebb mennyiségű pufferoldatban reszuszpendáljuk. Ugyancsak célravezető lehet, ha a virionokat valamely felülethez adszorbeáltatjuk, majd kisebb térfogatban eluáljuk. Erre legalkalmasabb az affinitás kromatográfiás eljárás: az adott virionra specifikus ellenanyagokkal konjugált műanyag gél oszlopokon átbocsátjuk a vírusszuszpenziót, amelyből a szilárd fázishoz kötött ellenanyagok megkötik a virionokat. Megfelelő pufferoldat alkalmazásával az antigén-ellenanyag kötődés bontható, ily módon a virionok az oszlopról leoldhatók (59. ábra). Az alumínium-hidroxidgél vagy a kalciumfoszfát szemcsék spontán módon is megkötik a virionokat (ez a kötődés azonban nem specifikus, mint az affinitás kromatográfiás eljárásnál), majd megfelelő ph-érték mellett azok kisebb térfogatú oldatban eluálhatók. A vörösvérsejtekhez spontán kötődő (hemagglutináló) vírusokat e tulajdonságukat felhasználva is koncentrálhatjuk. Az elúció ez esetben enzim hatására jön létre. 59. ábra - Vírustisztítás és -koncentrálás affinitás kromatográfiás eljárással 155
176 Virológia Ultraszűrők alkalmazása esetén a vírustartalmú folyadék olyan csőrendszerben kering, melynek falán meghatározott átmérőjű (a koncentrálni kívánt vírusnál kisebb) pórusok vannak. A csövecskékben nagy nyomás alatt cirkuláló vírusfolyadékból a kisebb molekulák (víz, ionok, kisméretű szerves molekulák) a csövek falán át elhagyják a rendszert, a vírus pedig kis térfogatra besűrűsödve a rendszer belsejében marad. Elvében hasonló, de a túlnyomás helyett az ozmotikus nyomáskülönbséget használja fel a dializálás, amikor is a koncentrálni kívánt vírusszuszpenziót féligáteresztő falú (semipermeabilis) zsákba tesszük, amelyet valamilyen hidrofil anyag (pl. polietilénglikol) hiperozmotikus oldatába helyezzük. A víz és a kis molekulájú anyagok a zsák pórusain át távoznak, a víruspartikulák és a nagy molekulájú anyagok a zsákban koncentrálódnak. A vírustisztítás és -koncentrálás leggyakrabban alkalmazott, legcélravezetőbb és legkíméletesebb módszere az ultracentrifugálás. E művelet során nagy fordulatszámú, ezer g előállítására alkalmas ultracentrifugákat használunk. A legegyszerűbb ultracentrifugálási művelet a pelletizálás, amikor a vírusszuszpenzióból a részecskéket a centrifugacső aljára ülepítjük. Az eljárás során a szuszpenzióban levő korpuszkuláris szennyező elemek (mitochondriumok, lysosomák, chromosomák stb.) is leülepszenek, ezért ez az eljárás az igényesebb vizsgálatokhoz szükséges tiszta víruspopuláció előállítására nem alkalmas. Az ún. gradiens ultracentrifugálás esetén a centrifugacsőbe, a vírus úszósűrűsége alapján meghatározott sűrűségű szacharóz- vagy sóoldatot (Cs 2SO 4, CsCl) mérünk, és erre rétegezzük a vírusszuszpenziót. A centrifugális erő hatására a cukor- vagy sóoldatban koncentrációgradiens alakul ki, vagyis a csőben felül hígabb, lefelé egyre sűrűbb oldatot kapunk. A virionok az úszósűrűségüknek megfelelő rétegben helyezkednek el. Ez az 156
177 Virológia egyensúlyi állapot csak hosszabb ideig tartó centrifugálás eredményeképpen alakul ki, de ez az idő preformált gradiens alkalmazása esetén rövidíthető. Ilyenkor a centrifugálás előtt a centrifugacsőbe változó töménységű (alulra töményebb, majd egyre hígabb) cukor- vagy sóoldatot rétegezünk, és így meggyorsítjuk a koncentrációgradiens kialakulását. A vírusok a gradiens ultracentrifugálás végén opaleszkáló zónák formájában különülnek el a centrifugacsőben. Ha a vírusszuszpenzió centrifugálása során több csík jelenik meg, akkor ez vagy azt jelenti, hogy többféle vírust tartalmazott a szuszpenzió (hiszen minden vírus a rá jellemző sűrűségű rétegben alkot csíkot), vagy ugyanannak a vírusnak komplett és inkomplett partikulái (lásd később) alkotnak több csíkot. Ez utóbbi esetben az inkomplett virionok alkotják a felső, kisebb úszósűrűségű csíkot, mert belőlük a virion legnehezebb alkotórésze, a nukleinsav részben vagy egészen hiányzik (60. ábra). 60. ábra - Vírustisztítás és -koncentrálás gradiens ultracentrifugálással (inkomplett és komplett virionok) A gradiens ultracentrifugálás végén a centrifugacső alját megfúrjuk, és a lassan kicsöpögő szuszpenziót rétegek szerint kémcsövekbe gyűjtjük (frakcionáljuk), vagy a csövek oldalát megfúrva leszívjuk a megfelelő réteget. Az opaleszkáló csíkokat tartalmazó frakciókat elkülönítve koncentrált, tiszta és egységes víruspopulációkat nyerünk. Ezeket a sótól vagy cukortól dializálással megtisztítjuk, majd analitikai módszerekkel vizsgáljuk A vírusok morfológiája Vírusmorfológiai vizsgáló módszerek A víruspartikula morfológiai sajátosságai csak az elektronmikroszkóp felfedezése után váltak vizsgálhatóvá, noha azt, hogy a vírusok részecske természetűek (nem pedig toxinmolekulák) és e részecskék megközelítő méretét már a különböző pórusméretű szűrőkkel végzett tanulmányok bebizonyították. Az azóta eltelt idő alatt az elektronmikroszkópos technikák fejlődésével számos olyan módszert dolgoztak ki, amelyek alkalmazhatók a virológiai vizsgálatok során is: részben a morfológiai tulajdonságok tanulmányozására, részben diagnosztikai célból. 157
178 Virológia A vírusmorfológiai vizsgálatok során leggyakrabban a negatívkontraszt- technikát alkalmazzák (61. ábra), melynek lényege, hogy a vírusszuszpenziót foszforvolfrámsav, uranil-acetát vagy más kontrasztanyag oldatával kezeljük, és a mintát elektronmikroszkóp mintafelfogó rácsára (grid) szárítjuk. Ezek az anyagok a fehérjékhez nem kötődnek, ezért száradás közben a részecskék kidomborodó felszíni képleteiről lefolynak, a mélyedéseket pedig kiöntik. Az üres (inkomplett) virionokba is behatolnak, és kitöltik annak belsejét. Az üregeket, mélyedéseket kitöltő kontrasztanyag, vastagságától függően, eltérő módon szórja, illetve nyeli el az elektronsugarakat, így a vírusok felületéről negatív kontraszt kép nyerhető. E módszerrel a vírusok felszíni struktúrája részletesen tanulmányozható, de ez a módszer használható a tisztított, koncentrált vírusszuszpenziók tisztaságának ellenőrzésére is, a további biokémiai, vírusanalitikai vizsgálatok előtt. 61. ábra - Negatívkontraszt-EM technika Az elektronmikroszkópos vizsgálatok egy másik, igen gyakran alkalmazott módja az ultravékony metszetek készítése. A sejteket fixáljuk, speciálisan beágyazzuk, majd ultravékony metszeteket készítünk, és ezeket elektronelnyelő festékekkel (volfrám- vagy urániumsókkal) kezeljük, majd elektronmikroszkóppal vizsgáljuk. E metszetekben a vírusok keresztmetszeti képét és a sejtben a vírusszaporodás során jelentkező változásokat tanulmányozhatjuk. A vírusárnyékolás módszere ma már ritkábban használatos, de korábban a vírusok (főleg az ún. ikozahedrális virionok) alakjának pontos meghatározása során fontos szerepet játszott (62.ábra). Az eljárás lényege, hogy az elektronmikroszkópos membrán felületén levő mintára oldalirányból, légüres térben, meghatározott szögben arany-, palládium- vagy platinapárát juttatunk elektromos tér segítségével. Ezt különböző szögekből megismételhetjük. Az elektronmikroszkópos készítményen ezután nemcsak a részecske felülnézeti képe, hanem az árnyék révén oldalnézeti vetülete is tanulmányozható, ezáltal segítve a részecske alakjának pontosabb megismerését. 62. ábra - Vírusárnyékolás 158
179 Virológia 159
180 Virológia Vírusmorfológia A virionok alakja és nagysága rendkívül változatos, de ennek ellenére felépítésükben közös vonások is megfigyelhetők. A virionpartikula belsejében található a nukleinsav mag (core), melyet az ún. pleomorf vírusok kivételével fehérjékből álló tok (kapszid) vesz körül (63. ábra). A kapszid homológ fehérje építőkövekből, morfológiai egységekből épül fel. Egyes vírusok esetében ezek szorosan kapcsolódnak a nukleinsavszálhoz, ebben az esetben nukleokapszidról beszélünk. Néhány víruscsalád esetében a kapszidot sejt eredetű, lipid természetű, de a vírusgenom által kódolt fehérjeelemeket is tartalmazó burok (peplon, envelop) veszi körül, melyen felületi képletek, nyúlványok (peplomerek) lehetnek. 63. ábra - A virionpartikula (adenovirus) szerkezete. A római számok az egyes struktúrpolipeptidek sorrendjére utalnak a poliakvilamid gélben végzett elektroforézist követően Egyes vírusok (pl. a dohánymozaik-vírus) fehérje egységei spontán épülnek össze; ehhez a vírusnak nem kell külön genetikai információt szállítania. A vírusok zömében azonban a virion-összeépülés igen komplikált, számos vírusgén által szabályozott folyamat. A bonyolult összetételű farkos bakteriofágoknál pl. legalább 30 gén irányítja az összeépülést. A nukleokapszid változatos formákat ölthet, az eltérő alakoknak megfelelően beszélünk a virion szimmetriaviszonyairól. Ennek alapján a következő alapformákat különíthetjük el: A helikális szimmetria szerint felépülő virionok (64.ábra) kapszidja olyan, mint egy belül üres cső, amelyet spirális vonalban (helikálisan) futó nukleinsavszál mentén rendeződő identikus, protein vagy glükoprotein természetű szerkezeti egységek alkotnak. Ha az egységek közötti kötések azonos erősségűek, akkor a kapszid merev, egyenes (pl. a dohánymozaik betegség virionjában), ha eltérő erősségűek, akkor a kapszid hajlított (orthomyxo-, paramyxo-, rhabdovirusok). E vírusok esetében a hajlékony nukleokapszid felcsavarodik vagy szabálytalan gombolyagot képez és a korábban említett lipid természetű burokkal körülvéve, megközelítőleg 160
181 Virológia gömbölyű képletet alkot. A klasszifikációs érték tehát a nukleokapszidszál átmérője, de a látszólagos vírusméret szemléltetése érdekében általában a burokba zárt víruspartikula átmérőjét szoktuk vírusméretként megadni. 64. ábra - Helikális szimmetriájú virion Az ikozahedrális (kubikális, köbös) szerkezetű vírusok ikozahedron (ikozaéder) alakúak. Ezt a téridomot húsz egyenlő oldalú háromszöglap határolja, szimmetriaviszonyait az 65.ábra szemlélteti. 65. ábra - Az ikezahedron képe élközéppontos, lapközéppontos és tengelyszimmetrikus vetületben A korábban említett szerkezeti egységek e vírusok kapszidjában az ikozaéder felületének megfelelően rendeződve alakítják ki a kapszidot, a nukleinsav mag (core) ennek belsejében található. A fehérje szerkezeti egységek vírusonként jellegzetes kapszomerekbe rendeződése, csoportosulása határozza meg a víruskapszid jellegzetes képét (66.ábra). A picornavirusok fehérjeegységei pl. 60 trimert képeznek, a parvovirusok esetében 12 pentamert és 20 hexamert alkotnak, a calicivirusok jellegzetes csésze alakú képletekből álló felszínét dimerekbe rendeződött fehérjeegységek alakítják ki. 66. ábra - Kapszomerek felépítése (trimerek, penta- és hexamerek, dimerek) Burok megfigyelhető bizonyos ikozahedrális szimmetriájú víruscsaládok esetében is (herpesvirusok, retrovirusok, afrikai sertéspestis vírusa stb.). A binális szimmetriájú partikulákban az előző két szimmetria alapelemei keverednek. A farkos bakteriofágok (T-fág) teste helikális, tehát cső alakú, és ezen egy hosszirányban kissé megnyúlt ikozahedrális fej ül (67. ábra). 161
182 Virológia 67. ábra - Binális szimmetriájú virion A komplex virionok egyik eddig ismertetett szimmetriával sem jellemezhetők, kapszomerek, illetve fehérje alegységek sem figyelhetők meg a szerkezet tanulmányozása során. A hagyományos értelemben vett fehérjekapszid szerepét itt egy bonyolult felépítésű, fehérjéből, glükoproteinekből és lipid természetű anyagokból álló komplex tok tölti be. Ez a forma jellemző a poxvirusokra (68.ábra). 68. ábra - Komplex szimmetriájú virion 162
183 Virológia A pleomorf vírusoknak szintén nincs hagyományos értelemben vett kapszidjuk, a genetikai információt hordozó nukleinsavat itt kapszid nem, csupán a korábban említett, egyes helikális és ikozahedrális vírusok esetében is megfigyelhető, lipid eredetű burok veszi körül. Ilyen pl. az ún. pleomorf fágok és az arenavirusok felépítése A vírusok kémiai összetétele és vizsgáló módszerei A virion esszenciális alkotórésze a nukleinsav és a fehérje. A burkos és a komplex szerkezetű vírusok ezenkívül lipideket és szénhidrátokat (glükoproteineket) is tartalmaznak Nukleinsavak A vírusok genetikai információja az élővilágban egyedülálló módon nemcsak DNS, hanem RNS formájában is tárolódhat, de minden vírus csak egyféle nukleinsavat tartalmaz. A vírusok genomja általában haploid, kivétel a retrovirusok csoportja, ennek tagjai diploid genommal rendelkeznek. A vírus-dns vagy -RNS víruscsaládtól függően lehet egyszálú vagy kétszálú, illetve alakja szerint lineáris vagy gyűrűszerűen záródó (cirkuláris). A vírusnukleinsavak molekulatömege a DNS-vírusok esetében 1 és 200 millió, az RNS-vírusok esetében 2 és 16 millió dalton szélső értékek között lehet. A nukleotidok száma meghatározza, hogy adott nukleinsav mennyi információt képes tárolni. Az egy meghatározott fehérje kódolására képes nukleinsavszakaszt a vírusok esetében is génnek nevezzük, és a gén itt is az egy-egy aminosav beépülését kódoló bázishármasokból (tripletekből) épül fel. A nukleotidsorrend szintén meghatározó a vírusok esetében. Egyes egyszálú RNS-vírusok nukleotidsorrendje olyan, hogy a fertőzött sejt riboszómája közvetlenül le tudja olvasni. Ha óvatos kezelésekkel megtisztítjuk az egyéb vírusalkotóktól, akkor ezeknek az mrns-hez hasonlóan 5 3 irányban leolvasható ún. pozitív szálú RNS-vírusoknak (pl. picornavirusok, coronavirusok) a nukleinsava fertőzőképes, vagyis sejtbe juttatva önmagában is megindítja a vírusszaporodás folyamatát. Ezzel szemben a 3 5 irányban értelmezhető, ún. negatív szálú RNS-vírusok (pl. orthomyxovirusok, rhabdovirusok) tisztított, fehérjementes nukleinsava nem fertőző, az általa hordozott információ a sejt számára nem hozzáférhető, mivel ilyen nukleinsavak a sejtben nem fordulnak elő, így annak enzimkészlete nem képes a genetikai kód lefordítására. Ehhez szükség van az ilyen vírusok fehérjekészletében megtalálható enzim természetű fehérjékre (RNS dependens RNS polimerázokra) is. A vírusgenomot a DNS-vírusok és több RNS-víruscsalád esetében egyetlen nukleinsavszál alkotja, de bizonyos RNS-vírusok genomja szegmentált, több (2 12) különálló szálból áll (reo-, birna-, orthomyxovirusok stb.). A vírusokban esetenként nem vírusspecifikus nukleinsav is kimutatható: a papovavirusokba gyakran a gazdasejt nukleinsavdarabjai is bekerülnek, az arenavirusokba riboszómák (RNS) épülnek be, a retrovirusok onc és src génjeinek egy része is gazdasejt eredetű (lásd később). Ugyanakkor az is gyakori, hogy a vírus-összeépülés során a virionból a nukleinsav részben vagy egészben kimarad (inkomplett vagy defektív partikulák), az ilyen virion fogékony sejtbe jutva természetesen képtelen a szaporodásra A vírusnukleinsavak vizsgálata A vírusgenetikai vizsgálatok kiindulási anyaga a korábbi fejezetben leírtak szerint előállított, tisztított és koncentrált vírusszuszpenzió. A további vizsgálatok során a vírusszuszpenziót proteázokkal, detergensekkel és fenollal (vagy ezek különböző kombinációjával) kezelve a nukleinsavról eltávolítják a fehérjéket. A kiszabadított, tisztított nukleinsav elektronmikroszkópos vizsgálatával megállapítható, hogy az lineáris vagy cirkuláris szerkezetű. Enzimemésztési próbákkal meghatározható a nukleinsav fajtája: a DN-áz, illetve RN-áz enzimek csak a megfelelő nukleinsavat emésztik. A DNS-vírusok genetikai vizsgálata során legelőször általában a vírusgenom fizikális térképezését végzik el. Ekkor a tisztított nukleinsavat restrikciós endonukleázokkal kezelik. Ezek olyan bakteriális eredetű enzimek, melyek a nukleinsavszálon egy adott, 4 7 bázispárból álló szakaszt felismernek, és a DNS-t ezen a ponton hasítják. A vírusgenom így meghatározott számú fragmensre esik szét attól függően, hogy ez a specifikus bázissorrend hány alkalommal fordul elő a DNS-szálon. A nukleinsavfragmenseket ezután agarózgélben elektroforetikusan futtatják. Megfelelő időpontban az elektroforézist leállítják és az agarózlemezt etídiumbromid-oldattal kezelik, így a nukleinsavfragmensek helyeződése láthatóvá válik. A fragmensek kiindulóponttól mért távolsága és azok molekulatömege között fordított az arány, a fragmensek tömege ezért megfelelő molekulatömeg-markerek (ismert tömegű fragmensek) egyidejű futtatásával meghatározható. Részleges 163
184 Virológia enzimemésztéssel (az enzimhatás korai felfüggesztésével) azt is meg lehet állapítani, hogy mely fragmensek helyeződnek egymás mellett (ilyenkor ugyanis nem minden hasítási pontnál vágódik a genom). Így végül minden fragmens nukleinsavszálon elfoglalt helyét meg lehet határozni. Ez a folyamat a genom fizikális térképezése. Mivel jelenleg már több mint 150 restrikciós endonukleáz ismert, a megfelelő enzim kiválasztásával valamely vírus DNS-szála szinte tetszés szerinti helyen hasítható. A vírusok közötti genetikai különbség így kimutatható, mert megfelelő enzim alkalmazása után még közel rokon vírusok esetében is különböző fragmensek képződnek, és ez eltérő DNS-elektroforetogram (DNS-térkép) kialakulásával jár. A vírusok azonosításában és osztályozásában, a járványtani nyomozásban egyre nagyobb szerepet kap a nukleinsav-térképezés (69. ábra). 69. ábra - Vírusnukleinsav-térképezés (dr. Benkő Mária felvétele). Az egyes sávokban restrikciós enzimmel kezelt vírusnukleinsav-fragmensek elektroforetikus képe látható. Az elektroforetogram azonossága a vizsgált vírusminták azonosságát valószínűsíti (pl. az 1. és 3., valamint a 7. és 9. minta A vírusgenomból adott nukleinsavszakaszok ún. ragadós végű fragmenseket (70. ábra) produkáló restrikciós enzimekkel kivághatók. 70. ábra - Ragadós végű fragmensek A ragadós végű fragmensek baktérium plazmidjába (élesztőgombába, eukaryota sejtbe) ültethetők úgy, hogy a plazmidot ugyanannak az endonukleáznak a segítségével felnyitjuk és a vírusnukleinsav-szakaszt ezen a hasítási helyen a plazmidba illesztjük. Ez a folyamat a nukleinsav-klónozás (71. ábra). 71. ábra - Nukleinsav-klónozás 164
185 Virológia A plazmidot a baktériumsejtbe visszajuttatva az ily módon átalakított baktérium szaporodása során az adott vírus-dns szakaszt is nagy mennyiségben termeli, és így a hagyományos eljárásnál (szövettenyésztés, vírusszaporítás, vírusnukleinsav-tisztítás) gyorsabban és kevesebb költséggel termelhető vírus-dns. Ez a DNS vagy a belőle készített fragmensek többek között az analitikai és a diagnosztikai célból végzett nukleinsavhibridizációs próbákban használhatók fel. A nukleinsav-hibridizációs eljárás alapja az, hogy a DNS-szálon egymással szemben helyezkedő, komplementer nukleinsavszálak mesterséges szétválasztásukat követően megtalálják egymást, és újra kialakítják a dupla láncot. A vírusazonosítás, illetve a különböző vírusgenomok összehasonlító vizsgálata során az egyik vírus DNS-t vagy annak baktériumokkal termeltetett, klónozott szakaszát 32 P izotóppal megjelöljük (próba), majd a 165
186 Virológia másik vírus DNS-ét nitrocellulóz filterhez kötve hőkezeléssel hosszában szétválasztjuk, és az így denaturált nukleinsavhoz hozzáadjuk az izotóppal jelölt mintát. Lehűlés közben ismét kialakul a kettős nukleinsavszál. Amennyiben a vizsgálandó vírus-dns és a próba-dns komplementer, akkor a kialakuló kétszálú DNS egy részébe az izotóppal jelölt próba-dns épül be. Ismételt mosással a nem kötődött próba-dns eltávolítható. A visszamaradó radioaktivitás (amit ma a legtöbb helyen autoradiográfiás eljárással mutatnak ki) a két vírus közötti azonosságot, illetve rokonságot jelzi (72. ábra). 72. ábra - Nukleinsav hibridizációs eljárás Próbaként nemcsak DNS, hanem mrns is alkalmazható, hiszen egy adott génszakaszról készült mrns-kópia is komplementere a megfelelő DNS-szálnak. Az izotóp használatával járó nehézségek és veszélyek kiküszöbölése érdekében újabban különböző enzimekkel jelölt próba-nukleinsavakat is használnak hibridizáció során. A kötődést ebben az esetben nem radioaktivitás, hanem színreakció jelzi. A diagnosztikai célból végzett nukleinsav-hibridizációs eljárásokról később lesz szó. A fentiekben ismertetett hibridizációs technika alapfeltétele a DNS szálakat szétválasztó hőkezelés. Az ilyen vizsgálatokat tehát a 100 C-os hőkezelést elviselő közegben, nitrocellulóz- vagy nylonfiltereken kell végezni, ezért hívják az eljárást gyakran filterhibridizációs eljárásnak. Az agarózgél közegből, amelyet a vírusanalitikai vizsgálatoknál a nukleinsavfragmensek szétválasztására legtöbbször alkalmaznak, a hibridizáció előtt diffúzió segítségével vihetők át az elkülönített fragmensek a nitrocellulóz vagy nylonfilterre (Southern-blot technika). Az ún. heteroduplex technika is a hibridizáció során ismertetett jelenséget, a kettős DNS hőkezelésre bekövetkező reverzibilis denaturációját, felnyílását használja ki. A két különböző vírus hosszában felnyitott, majd lehűlve egyesülő DNS-éből kialakult, kevert kettős DNS-szálat (heteroduplexet) itt elektronmikroszkóppal vizsgálják. Ahol a két szál komplementer, ott az elektronmikroszkópos képen egységes szálként jelenik meg, a nem komplementer szakaszok viszont egymástól elválnak, hurkot képeznek (ún. D-loopot). Ezzel a két vírus genomján elektronmikroszkópos felvételeken a homológ és heterológ szakaszok hossza és helyeződése is megállapítható (73. ábra). 73. ábra - Heteroduplex technika 166
187 Virológia Ez a módszer génlokalizációra is alkalmas, ha a DNS szál és a róla másolódott mrns szál elegyét hőkezeljük. A felnyíló DNS szálhoz a lehűtés során hozzátapad a mrns molekula, ahhoz a génszakaszhoz, amely a transzkripció során az adott mrns templátjául szolgált. A DNS komplementerszála ilyenkor már nem tud visszatapadni, mert a szabad nukleotidokat az adott szakaszon az mrns foglalja el. A hurokképződés (R-loop) ebben az esetben is elektronmikroszkóppal figyelhető meg. A vírus-dns-nukleotidsorrend meghatározása során a kettős DNS-szálat hosszában hőkezeléssel szétválasztják, a szimpla szálú DNS-t jelölik (pl. izotóppal vagy fluoreszkáló festékkel), majd a nukleinsavoldathoz szabad nukleotidokat (adenin, guanin, citozin, timin), szintetikus oligonukleotid primer szálat, polimeráz enzimet és az egyik nukleotid didezoxi-változatát adják (pl. didezoxi-adenint, dda). Az oldat lehűlésekor az oligonukleotid primer szál hozzátapad a komplementer vírus-dns-hez, a polimeráz enzim pedig a primerről kiindulva elkezdi felépíteni a szabad nukleotidokból a szimpla szálú DNS komplementerszálát. Random módon vagy dezoxiadenint vagy didezoxi-adenint épít be a komplementer szálba a templátként szolgáló szál timidin nukleotidjaival szemben. A dezoxi-adenin beépítése esetén a láncépítés folytatódhat, a didezoxi-adenin után azonban megszakad a szál, mert erről a molekuláról hiányzik a következő nukleotid kapcsolódásához szükséges -OH csoport. Vagyis aszerint, hogy hányszor és hol fordul elő timidin a templátként szolgáló szálon, különböző hosszúságú komplementer szállal kiegészült DNS-molekulapopulációk képződnek, melyek mind didezoxiadenin-molekulával végződnek. Egyidejűleg ugyanezt a reakciót három másik reakcióelegyben is elvégzik, de ezek a három másik nukleotid egyikének didezoxi variánsát tartalmazzák. A négy minta párhuzamos elektroforézisével négy egymással párhuzamos sávban a különböző hosszúságú fragmensek elkülöníthetők és a nukleotidsorrend leolvasható (74. ábra és 75 ábra). 74. ábra - A vírus-dns-nukleotidsorrend meghatározásának sematikus rajza 167
188 Virológia 75. ábra - Nukleotidsorrend meghatározáshoz használt poliakrilamid gél fényképe (dr. Benkő Mária felvétele) 168
189 Virológia Az RNS-vírusok esetében az ún. RNS-ujjlenyomat technika segítségével történik a nukleinsav vizsgálata. Ekkor a megfelelő RNS-t hasító enzim (pl. T l ribonukleáz, ribonukleáz-a) a nukleinsavszálat egy-egy meghatározott nukleotid (pl. minden uracil) mellett elvágja. Mivel ezek az enzimek nem nukleotidcsoportokat, hanem egyes nukleotidokat ismernek fel, a nukleinsavszálat több helyen hasítják, és kevesebb nukleotidból álló fragmenseket képeznek (oligonukleotidok), mint a restrikciós endonukleázok a DNS-vírusok esetében. Az oligonukleotidokat kétdimenziós poliakrilamidgél-elektroforézissel szétválasztják. A legyezőszerűen szétterülő pontokból kialakuló oligonukleotid-kép ugyanúgy jellemző egy adott RNS-vírusra, mint a DNS-vírusokra a fragmenstérkép. Az RNS-vírusok genomjának vizsgálatához igen gyakran alkalmazzák a reverz transzkriptázos konverziót, ilyenkor a genomként szolgáló RNS-ről reverz transzkriptáz enzimmel DNS-szálat másolnak. Ezt a DNSmásolatot (ún. cdns-t) használják a hibridizációs vizsgálatokhoz, a nukleotidsorrend meghatározásához, klónozáshoz, restrikciós endonukleázos analízishez, mert ezek az eljárások csak dupla szálú DNS vizsgálatához használhatók A vírusfehérjék szerepe és felosztása A virion szerkezetének a nukleinsavak mellett a fehérjék is alapvető komponensei. Szerepük többféle lehet, így többek között meghatározzák a virion alakját, enzimként szerepelnek a vírusszaporodás folyamataiban stb. A virion fehérje-összetétele jellemző az adott vírusra. A vírusfehérjék alapvetően két csoportra oszthatók. A struktúrproteinek a virion felépítésében vesznek részt, a nem strukturális fehérjék (pl. az ún. korai fehérjék, egyes enzimek és különböző prekurzor fehérjék) pedig csak 169
190 Virológia a vírusszaporodás bizonyos fázisaiban termelődnek, tehát csak a vegetatív vírusban (a fertőzött sejtben) vannak jelen, a virionba nem épülnek be. Ez utóbbiaknak csak genetikai kódja található meg a virion nukleinsavában. A virion struktúrproteinjeit tovább oszthatjuk külső fehérjékre és core-proteinekre. A külső fehérjéknek alapvető szerepe van a fogékony sejtekhez való adszorpcióban, a vírus antigén természetének és a kapszid szimmetriaviszonyainak meghatározásában, továbbá védik a vírusgenomot a környezet inaktiváló hatása ellen. A virion belsejében levő fehérjék (core-proteinek) általában a nukleinsavhoz kapcsolódnak és annak védelmében játszanak szerepet. A virion enzim természetű struktúrproteinjeinek többsége is a core-ban található, ezek többnyire a vírusszaporodás folyamán játszanak szerepet (lásd később) Fehérjevizsgáló módszerek A vírusfehérjék vizsgálatára leggyakrabban a poliakrilamid gélben végrehajtott elektroforézist alkalmazzák. A korábban leírtak szerint tisztított és koncentrált preparátumot nátrium-lauril-szulfáttal (SDS, sodium dodecyl sulphate) és merkaptoetanollal kezelik, ezáltal a diszulfidhidak és a hidrogénkötések felszakadnak, a vírusalkotó fehérjék lineáris polipeptid láncokra esnek szét. Az ily módon feltárt fehérjék megfelelő ph-viszonyok mellett elektroforetikus térben egységesen a pozitív sarok felé vándorolnak, a molekulatömegük által megszabott sebességgel. Megfelelő idejű futtatás után az elektroforézist leállítva és a fehérjéket megfelelő eljárásokkal (pl. ezüst-nitrátos festéssel) láthatóvá téve az azonos molekulatömegű fehérjék a kiindulóponttól azonos távolságra találhatók. A megtett út és a molekula tömege itt is fordított arányban van. Egy adott vírusra éppúgy jellemző az így kapott polipeptidkép, mint az endonukleázos emésztés után a DNS-fragmensek elektroforetogramja. A vírusok antigénszerkezetének, fehérje-összetevőinek vizsgálatára használják a monoklonális ellenanyagokat is. Ezeket mesterségesen előállított hibridomasejtekkel termeltetik. Az eljárás során a vizsgálni kívánt vírussal, illetve annak meghatározott fehérjéjével egereket immunizálnak, majd a megfelelő szintű immunitás kialakulása után ezek lépét eltávolítják. A lépből az ellenanyag-termelésért felelős B-lymphocytákat kiszabadítják és a sejtszuszpenzióhoz lymphoid tumorból származó myelomasejteket kevernek. Polietilénglikol hatására a sejtek cytoplasmamembránja összeolvad, sejtfúzió jön létre. A kialakuló tetraploid hibridsejtek mindkét szülősejttől örökölnek tulajdonságokat: a lépsejttől az ellenanyag-termelő képességet, a myelomasejttől pedig a korlátlan szaporodóképességet (76. és 77. ábra). A hibridsejtek (a B-lymhocytákhoz hasonlóan) rendelkeznek továbbá egy enzimmel (hypoxantin-guanin-foszforibozil-transzferáz, HPRT), melynek segítségével át tudják alakítani a hipoxantint, amely az ilyen enzimmel nem rendelkező myelomasejtek számára toxikus. 76. ábra - Hibridomasejt-előállítás folyamata 170
191 Virológia 77. ábra - Hibridomasejt mikroszkópos képe (A: egy B-lymphocytából és egy myelomasejtből, B: két lymphocytából és két myelomasejtből összeolvadt hibridomasejt) 171
192 Virológia A hibridsejtek klónozásával olyan, egy-egy hibridomából származó sejtvonalak (klónok) különíthetők el, melyeknek sejtjei egyetlen epitop ellen termelnek ellenanyagokat (monoklonális ellenanyagok). A megfelelő ellenanyagok kiválasztásával egyrészt a korábbiaknál specifikusabb és gyorsabb diagnosztikai próbák dolgozhatók ki, másrészt a vírusok fehérjeszerkezetének, a vírusneutralizáció mechanizmusának, a vírusok rokonsági viszonyainak stb. vizsgálatára nyílik lehetőség Lipidek A burkos vírusok tömegének 30 35%-át kitevő lipidtartalmú külső burok sejt eredetű, a kiszabaduló víruspartikula a szaporodási ciklus végén a gazdasejt különböző membránrendszerein áthatolva és azokból egy darabot kiszakítva jut a burokhoz. Ezért a burok lipidösszetétele mindig a gazdasejtéhez hasonló (foszfolipid és koleszterol). A lipidmembránba azonban mindig beépülnek vírusspecifikus proteinek és glükoproteinek is, ezeket a membránhoz mirisztil-csoportok (kovalensen kötött zsírsavak) rögzítik. A komplex szerkezetű poxvirusok kapszidjában vírusspecifikus lipidek vannak, melyek összetétele a gazdasejt membránkomponenseitől eltér. Az afrikai sertéspestis vírusának ikozahedrális kapszidjában is találhatók vírusspecifikus lipidkomponensek, de a külső burok e vírusok esetében is sejteredetű Szénhidrátok A virionban a nukleinsavban található ribózon vagy dezoxiribózon kívül szénhidrátok elsősorban a burkos vírusok peplomerjeiben (felszíni membránfehérjéiben) fordulnak elő, glükoproteinek formájában. Hidrofób részük a lipidmembránba ágyazódik, glükozilált hidrofil részük pedig kifelé irányul. A komplex szerkezetű poxvirusok magjában is kimutatható glükoprotein A vírusok szaporodása (multiplikációja) A már eddig megismert és az újonnan jelentkező vírusos betegségek elleni küzdelemben kulcsfontosságú a vírusok szaporodási stratégiájának minél részletesebb megismerése. A vírusok parazita életmódjukat kizárólag a gazdasejtben történő szaporodásuk (multiplikációjuk) során valósítják meg, amelynek központi lépésére utalva, a folyamatot gyakran replikációnak is nevezik. Minden vírus szaporodási stratégiája lényegében három lépésből áll 172
193 Virológia behatolás a sejtbe (lehetőség a parazitizmusra), a multiplikáció módja (a genetikai parazita életmód megvalósítása), a sejtből való kijutás lehetősége (alkalom a terjedésre, az újabb parazitizmusra). Ezeket a feladatokat a vírusok hat különböző lépésben valósítják meg (78. ábra). Ennek során a vírusnak először meg kell találni azokat a sejtfelszíni struktúrákat, ahol kapcsolódni tud a sejthez (adszorpció), majd ahol behatolhat a cytoplasmába (penetráció). A cytoplasmába jutott vírusnak alkalmassá kell tenni genetikai információját a replikációra, ezért legelőször meg kell szabadulnia a vírusgenomot körülvevő fehérjéktől (lemeztelenedés). Az utódvirionok létrehozásához különböző replikációs, transzkripciós és transzlációs stratégiákat kell alkalmazni, attól függően, hogy milyen típusú nukleinsav tárolta a vírus genetikai információját és hogy a replikáció a sejtmagban vagy a cytoplasmában jön-e létre (makromolekulák szintézise). Az utódvirionoknak az összeépülés után meg kell találni a módot a sejt elhagyására (kiszabadulás), ami különösen nehéz feladat a baktériumokat és a növényi sejteket megtámadó vírusok számára. A sikeresen végrehajtott szaporodási stratégia eredménye a fertőzés. 78. ábra - Vírusok szaporodásának lépései (magyarázat a szövegben) A szaporodási stratégia legfontosabb lépéseit magába foglaló eklipszis (napfogyatkozás) elnevezést eredetileg a pathomorphológusok alkalmazták arra a szaporodási szakaszra, amikor elektronmikroszkópos vizsgálattal nem látták a sejtben a vírus struktúráját. Virológiai értelemben az eklipszis, az első mrns szintézisétől az első 173
194 Virológia utódvirion megjelenéséig tart. A vírusok szaporodási ciklusában az eklipszis a leghosszabb szakasz, melynek időtartalma DNS-vírusoknál átlag 5 15 óra, RNS-vírusoknál pedig 3 10 óra (79. ábra). 79. ábra - Vírusok szaporodási ciklusa Adszorpció Az adszorpció egy specifikus kapcsolat a sejtmembrán bizonyos fehérjéi (receptor) és a virion egyes felszíni, adszorpciós fehérjéi (antireceptor) között. Annak ellenére, hogy a vírus a sejtmembrán teljes felszínén képes landolni, a sejtbe történő behatolás csak azokon a membránrészeken keresztül valósulhat meg, ahol lehetőség nyílik erőteljes, stabil receptor antireceptor kapcsolatra (80. ábra). 80. ábra - Az adszorpciós fehérjék speciális elhelyeződése 174
195 Virológia Az adszorpció rendszerint a sejtek és a virionok véletlenszerű ütközésével indul meg, amit a két lépésben zajló fizikokémiai folyamat követ. Az első lépés során reverzíbilis kapcsolat alakul ki a véletlenszerűen találkozó receptor- és antireceptormolekulák között. Ez a kapcsolat csak akkor jöhet létre, ha a környezetben elegendő kation van jelen ahhoz, hogy semlegesítse az azonos negatív töltéssel rendelkező receptor- és antireceptormolekulák között jelen levő elektrosztatikus erőt. A második lépésben a folyamat irreverzíbilissé válik, a fehérjemolekulák közötti kémiai kötéseknek köszönhetően. A evolúciós események során kialakult receptormolekulák szinte kivétel nélkül a sejt felszínén helyezkednek el és többnyire glükoproteinek. Csak azok a vírusok képesek megfertőzni a sejtet, amelyek az adszorpciós fehérjéjüknek megfelelő receptormolekulát megtalálják a sejtmembránon. Ezért a fertőző vírus sejt, illetve fajspecificitását valójában a receptormolekulák jelenléte határozza meg. Az egy vírus egy receptor kapcsolat mellett különösen az egy családba tartozó vírusok között megvalósulhat az egy receptor több vírus modell is. Adott receptor- molekulából általában példány található a sejt felszínén. A receptorfehérjék genetikai kódját több vírus esetében azonosították (pl. a 19. emberi kromoszóma kódolja a poliovírus, a 3. pedig a herpesz szimplex vírus receptor fehérjéit). A receptormolekulák genetikai kódja a legtöbb esetben már a magzati életben kifejeződik, és ez teszi lehetővé adott vírusok magzatkárosító hatását. Ugyanakkor ismertek olyan eseteket is, amikor a receptorfehérjék csak bizonyos körülmények között jelentek meg annak ellenére, 175
196 Virológia hogy genetikai kódjuk jelen volt a kromoszómában. (pl. az ember vesesejtjei nem tartalmaznak receptort a fertőző gyermekbénulást okozó poliovirussal szemben, ugyanakkor a humán veséből készült egyrétegű sejtkultúrák felszínén kifejeződnek). A genetikailag kódolt specifikus vírusreceptorok mellett a sejtmembránon található komplement és hormonreceptorok is több vírus számára biztosítanak adszorpciós lehetőséget (pl. HIV CD 4-receptor, veszettség vírus acetilkolin-receptor, vaccinia vírus epidermalis növekedési faktor, EGF-receptor). Az antireceptormolekulák általában a vírus kapszidjában vagy a burkában helyezkednek el, ugyanakkor egyes vírusoknál speciális nyúlványokon találhatók (80. ábra.) Amíg a sejtreceptorok kémiai szerkezete és térbeli helyzete viszonylag stabil, addig egyes vírusok éppen az adszorpciós fehérjéik (antireceptor) változtatásával biztosítják túlélésüket a természetben (pl. orthomyxovirusok, HIV). Több vírus esetében a jelentős evolúciós előnyt jelentő gazdafajváltás is az adszorpciós fehérjék sikeres megváltoztatására vezethető vissza (pl. a macska pánleukopénia vírusa így adaptálódott a kutyához és a nyérchez vagy a kutya szopornyica vírusa a fókákhoz és a delfinekhez). Az adszorpciós fehérjékhez kötődő ellenanyagok lehetetlenné teszik az adszorpciót, így megakadályozzák a sejt fertőződését. Ezért az adszorpciós fehérjék doménjeinek változtatása az immunrendszerrel szemben is előnyhöz juttathatja a vírust. A legtöbb vírus esetében az adszorpció a sejttel való találkozás után egy órán belül irreverzíbilissé válik. Ha ezt a kapcsolatot kémiai vagy fizikai módszerekkel megszakítjuk, az antireceptormolekulák sérülése miatt a vírus elvesztheti adszorpciós és fertőzőképességét. Az orthomyxovirusok ugyanakkor rendelkeznek egy speciális enzimatikus hatású felszíni fehérjével is (neuraminidáz), ami úgy oldja fel az adszorpciós kapcsolatot, hogy az antireceptormolekulák (hemagglutinin) épségben maradnak (80. ábra). Ezért a vírusnak ismételt lehetősége adódik az adszorpcióra és a fertőzésre. Az adszorpció kialakulása után azonnal kezdetét veszi a penetráció Penetráció A penetráció energiaigényes, kizárólag élő sejtben végbemenő, gyors folyamat. A ragadós száj- és körömfájás vírusa a 3 percen belül lezajlódó penetrációhoz, 37 C-on kj/mol aktivációs energiát igényel. (Az adszorpció kialakulásához elegendő kj/mol energia még 2 4 C-on is, de ezen a hőmérsékleten nem történik penetráció) az energiatermelő folyamatok lelassulása miatt. A penetráció módját meghatározza a virion struktúrája és a sejt típusa, valamint a koncentrációs tényezők alakulása. A penetráció eddig megismert általános és alternatív formáit elektronmikroszkópos és membránkémiai módszerekkel derítették fel A penetráció általános formái Transzlokáció. Az adszorbeálódott virion előtt megnyílik, majd áthatolás után újra összezárul a sejtmembrán. A csapóajtó mechanizmus -ként is emlegetett transzlokációt elsősorban a nem burkos, ikozahedrális szimmetriájú virusok veszik igénybe. A picornavirusok kapszidja a transzlokáció során elveszti ikozahedrális szerkezetét, és egy amorf, RNS-fehérjekomplexként hatol át a sejtmembránon (81. ábra). 81. ábra - A penetráció általános formái (magyarázat a szövegben) 176
197 Virológia Endocytosis (viropexis). A sejtek táplálkozásuk során adott makromolekulákat, a receptorhoz kötött endocytosissal kebelezik be. A viropexis során az adszorbeálódott vírus, ezt a lehetőséget használja ki, mivel mérete még a bekebelezhető tartományba esik. Az adszorbeálódott vírus mögött a sejtmembrán lefűződik és a vírus, sejtmembránnal körülvett vesiculumként (endosoma), a cytoplasmába jut. Ezzel a vírustartalmú vesiculummal a sejt lysosomája hamarosan fuzionál. Az így kialakult phagolysosomában kezdetét veszi a dekapszidáció. A nem burkos vírusok döntő többsége viropexissel jut a sejtbe. A burkos vírusok viropexise abban különbözik a nem burkos vírusokétől, hogy itt a vírusburok is lefűződik, miközben fuzionál az endosoma sejt eredetű membránjával (81. ábra). A burkos vírusok közül elsősorban a herpesz- és poxvirusok használják az endocytosist a penetrációhoz. 177
198 Virológia Membánfúzió. A membránfúziót kizárólag burkos vírusok vehetik igénybe. A folyamat során a vírus burka egyesül a sejt membránjával, és ezért kizárólag a nukleokapszid lép be a cytoplasmába. A membránfúziót a vírus indukálja, a burokban helyeződő fúziós proteinjei (F) révén. A fúziós fehérjék működésének mechanizmusát még nem tisztázták. A paramyxovirusok és egyes herpesvirusok membránfúzióval jutnak be a sejtbe (81. ábra). A penetráció alternatív formáit elsősorban a baktériumok és növények vírusai alakították ki, mivel a sejtfalon összehasonlíthatatlanul nehezebb az áthatolás, mint az állati sejtek membránján A penetráció alternatív formái A T-bakteriofágok nyaki részében összehúzódásra képes fehérjemolekulák találhatók. A fág adszorpciója után a farki végben levő lizozim enzimek lyukat vágnak a baktériumsejt falába, majd a fág nyaki részében található fehérjék hirtelen összehúzódnak, és szinte belövik a fág nukleinsavát a baktérium cytoplasmájába. Néhány ribofág szellemes módon, a baktérium sejtfal nélküli részén, a sex-fimbrián keresztül hatol be a baktériumba. A ribofág csak a sexfimbriával rendelkező baktériumokat képes megfertőzni, ezért ezt a fertőződési formát a baktériumok nemi betegségének is nevezik. A növényi vírusok a sejtfal sérülésein (pl. rovarszúrás, -harapás, metszés) keresztül, közvetlenül hatolnak a sejtbe Dekapszidáció (uncoating) A cytoplasmába jutott vírus számára létkérdés, hogy genomját vagy legalábbis a korai fehérjéket kódoló génszakaszokat minél gyorsabban alkalmassá tegye a transzkripcióra. Ennek érdekében a vírusnak meg kell szabadulnia a nukleinsavat körülvevő és védelmet nyújtó nukleokapszid fehérjéktől. A dekapszidáció során ezt a feladatot a cytoplasmában található proteolitikus enzimek közül feltételezhetően a lysosomális enzimek végzik el. A vírusburok vagy endosomamembrán emésztésében feltételezhetően az intracelluláris proteázoknak jut kulcsszerep. A dekapszidáció ugyanakkor komoly veszélyt is jelenthet a vírusnak, ha a védőfehérjéktől megszabadított genomja megsérül vagy áldozatul esik a nukleáz enzimek emésztő hatásának. Ennek elkerülésére a vírus számos stratégiát alkalmaz. Több ikozahedrális vírus esetében bizonyították, hogy a dekapszidáció soha sem teljes, és a transzkripció már akkor megindul, amikor a vírus még csak néhány kapszidproteinjét vesztette el. A sejtmagban szaporodó DNSvírusok csak így biztosíthatják nukleinsavuk számára, hogy épségben jussanak be a sejtmagba, ahol transzkripciójuk és replikációjuk zajlik. A cytoplasmában szaporodó poxvirusok egy ún. vetkőztető (uncoating) enzimet kódolnak, amely kíméletesen fejezi be a sejtenzimek által megkezdett, meglehetősen agresszív dekapszidációt. A picornavirusok már az adszorpciót követő struktúraváltozás során elvesztik két kapszidproteinjüket (V 2, VP 4), és maradék fehérjéik ezúton válnak különösen fogékonnyá a proteolytikus enzimekkel szemben. Ennek eredményeképpen a vírus-rns már néhány perc alatt szabaddá válik nemcsak a transzkripcióra, de a nukleáz enzimek számára is. Ez a versenyhelyzet kényszeríti a picornavirusokat a rendkívül gyors szaporodásra. A T-bakteriofágok teljes dekapszidációja már a penetráció során megtörténik, mivel a fág csak a nukleinsavát juttatja be (lövi be) a cytoplasmába Makromolekulák szintézise A vírusok többsége az élővilágban egyedülálló formákban tárolja a genetikai információt (DNS/1, RNS/1, RNS/2), ezért speciális replikációs és transzkripciós stratégiákat kellett kifejlesztenie ahhoz, hogy a makromolekuláit szintetizálni tudja a prokaryota és eukaryota sejtekben (82. ábra). 82. ábra - Dupla szálú DNS-vírusok (DNS/2) makromolekuláinak szintézise (Lomniczi (1978) után módosítva). Magyarázat a szövegben 178
199 Virológia Ezt a feladatot a nukleinsav-szintézist végző replikáció, valamint a fehérjeszintézist irányító transzkripció és transzláció során hajtja végre. Habár ezek az események közel azonos időben zajlanak, mégis funkcionálisan három, jól elkülöníthető szakaszra bonthatók: korai transzkripció (mrns-szintézis) és transzláció (fehérjeszintézis), genomreplikáció (nukleinsav-szintézis), késői transzkripció (mrns-szintézis) és transzláció (fehérjeszintézis). A korai transzkripció és transzláció már az eklipszis fázisban elindul, és ennek során a vírus előállíttatja a sejttel azokat a korai fehérjéket, amelyekre még a vírusgenom replikációja előtt szüksége van. Keletkezésük időbeli eltérése alapján megkülönböztetünk azonnali korai (immediate early) és késleltetett korai (delayed early) fehérjéket. Ezek a korai fehérjék olyan vírus által kódolt enzimek, amelyek egyrészt gátolják a sejt saját fehérjeés nukleinsav-szintézisét (represszorfehérjék), másrészt segítik a vírusgenom replikációját (pl. a vírus által kódolt nukleinsav polimerázok is ekkor szintetizálódnak). Több vírus esetében bizonyították a korai fehérjék primer szerepét is. A korai fehérjék nem épülnek be az utódvirionokba. Feladatuk a vírusgenom replikációjához szükséges körülmények megteremtésével véget ért. A vírusgenom replikációja során a szülő nukleinsavról mint templátról szintetizálódnak az utódvirionok genomjai. A szintézist a HDV, a papovavirusok és a parvovirusok kivételével a vírus által kódolt polimeráz (replikáz) enzimek végzik. (A parvovirusok pl. a sejt illetve más vírus replikáz enzimét használják fel.) A vírusreplikáz enzimek specificitása teszi lehetővé, hogy a cytoplasmában szaporodó vírusok (poxvirusok, afrikai sertéspestis vírusa, RNS-vírusok) is szintetizálni tudják nukleinsavukat. Az eukaryota sejtekben a replikációs mechanizmus ugyanis kizárólag a magban található. A vírus által kódolt replikáz enzimek közös tulajdonsága, hogy nagyságrenddel gyorsabbak, agresszívabbak a sejt replikáz enzimeinél. A vírusok ezáltal jutnak, többnyire behozhatatlan előnyhöz a sejttel szemben a makromolekulák szintéziséért vívott harcban. A késői transzkripció és transzláció során szintetizálódnak az utódvirionok struktúrfehérjéi és azok az enzimek (pl. transzkriptázok) amelyeket adott vírusoknak készen, a nukleokapszidba csomagoltan kell szállítani a fogékony sejtekhez, ahol szaporodási feltételeiket majd megtalálják. Eukaryota sejtekben a transzkripciós események kizárólag a sejtmagban zajlanak, amelynek során a sejt által kódolt transzkriptáz (DNS/2-mRNS-polimeráz) enzim mrns-t szintetizál a mintát adó kromoszomális DNS pozitív száláról. A vírusok közül kizárólag a sejtmagban szaporodó vírusok (herpesz-, adeno-, papova-, hepadna-parvovirusok) használhatják ezt a stratégiát. A sejt cytoplasmájában szaporodó vírusok a saját 179
200 Virológia genomtípusuknak megfelelő transzkripciós enzimkészletet fejlesztettek ki, melyet a (+)RNS-vírusok kivételével nemcsak kódolva, de készen is kénytelenek magukkal vinni. A cytoplasmában ugyanis nincs lehetőség a transzkripcióra. A (+)RNS vírusok genomját a sejt riboszómája mrns-nek fogadja el, ezért a vírusgenomról közvetlenül szintetizálódhatnak a fehérjék. Szimpla szálú RNS-vírusoknál nehéz élesen szétválasztani a replikációt és a transzkripciót, mivel mindkét folyamatnál RNS-dependens RNS-polimeráz végzi a szintézist. Minden vírus, a gazdasejt ribosomáit, trns-eit és transzlációs-poszttranszlációs mechanizmusát használja fel fehérjéinek szintéziséhez (transzláció). Bizonyos vírusfehérjék transzláció utáni glükolizációja és foszforilációja (poszttranszláció) a gazdasejt fehérjéinél alkalmazott módszerekkel történik, többnyire a sejtenzimek irányításával. A herpesvirusok fehérjéinek foszforilációját a vírus által kódolt protein kináz enzim végzi el. A vírusfehérjék glükolizációja a sejtmembránokon zajlik. A magas mannóztartalmú glükoproteinek, a maghártya és a Golgi-rendszer membránjában szintetizálódnak. A vírusok által alkalmazott különböző replikációs, transzkripciós és transzlációs stratégiák jellegzetességeit a Baltimore-féle genetikai rendszer csoportosítása alapján tárgyaljuk (12. táblázat). 12. táblázat - Baltimore-féle genetikai rendszer A Baltimore-féle genetikai rendszerek és az azokat képviselő víruscsaládok A rendszer osztályai I. II. III. IV. V. VI. kettős szálú DNS-vírusok egyszálú DNS-vírusok dupla szálú RNSvírusok pozitív, szimplaszál ú RNSvírusok negatív, szimplaszál ú RNSvírusok DNS közvetítőt használó RNS-vírusok papova- * Parvo- Reo- Astro- Orthomyxo- Retro- adeno- ** Cirko- (Birna-) Picorna- Paramyxo- herpes- *** Hepadna- Calici- Rhabdo- irido- Toga- + Arena- pox- Corona- + Bunya- Toro- Filo- Flavi- * lineáris DNS + Ambiszenc RNS **cirkuláris DNS ***részlegesen duplaszálú DNS Dupla szálú DNS-vírusok (DNS/2) A legtöbb dupla szálú DNS-vírus (herpes-, adeno-, papovavirus) replikációja és transzkripciója a sejtmagban, míg néhányuké (pox-, afrikai sertéspestis vírusa) a cytoplasmában zajlik. A sejtmagban szaporodó DNS/2 vírusok kódolva szállítják és használják virális replikáz (DNS/2-DNS/2 polimeráz) és transzkriptáz (DNS/2-180
201 Virológia mrns polimeráz) enzimeiket annak ellenére, hogy a sejt által kódolt enzimeket is felhasználhatják. A szülő vírus korai transzkripcióját, éppen a sejt által kódolt transzkriptáz enzimek végzik el. Transzláció előtt a policisztronos mrns-t a vírus enzimei monocisztronos részekre vágják (82. ábra). A cytoplasmában szaporodó DNS/2-vírusok ugyancsak kódolják a replikáz és transzkriptáz enzimet. A korai transzkripciót a vírus által készen szállított transzkriptáz enzim végzi el, mivel a sejt cytoplasmájában ez az enzim nem fordul elő. A poxvirus genomjáról monocisztronos mrns-ek szintetizálódnak Szimpla szálú DNS-vírusok (DNS/1) A szimpla szálú DNS-vírusok replikációja és transzkripciója a sejtmagban történik. A replikáció alapfeltétele, hogy a vírus dupla szálú DNS-sé (a replikációhoz szükséges templáttá) alakítsa át genomját. A Parvoviridae család vírusai ezt a feladatot kétféle módon oldják meg. Egyrészt a sejtmagba bejutott + és - irányítottságú szimpla nukleinsavszálak, ha elég közel kerülnek egymáshoz, spontán összeépüléssel létrehozzák a DNS/2-genomot (dependovirus, densovirus). Másrészt a negatív irányítottságú DNS- szálaknak (parvovirus) lehetőségük adódik a komplementációra az ún. kifoltozódásra. Erre az önmagába visszaforduló szimpla szál struktúrája ad lehetőséget. (A genom két vége visszahajlik, így valójában csak egy viszonylag kis szakasz marad egyszálú formában.) A kifoltozódás során erre az egyszálú szakaszra egy komplementer pozitív szál szintetizálódik, és kialakul a replikáció templátját adó dupla szálú vírusgenom. Ezt a folyamatot a sejt enzimei (DNS-DNS polimeráz) végzik el, mivel a parvovirusok, nem kódolnak virális replikáz és transzkriptáz enzimet. Ez az oka annak, hogy replikációjukhoz különösen igénylik az osztódó sejteket, melyek S fázisában nagymértékben felszaporodnak a replikációt és a transzkripciót irányító enzimek (83. ábra). 83. ábra - Szimpla szálú DNS-vírusok (DNS/1) makromolekuláinak szintézise (parvovirus) A parvovirusok egy csoportja (dependovirusok) a herpesz- és adenovirusok polimeráz enzimeit használja fel. Ezek a vírusok hiába alakították ki spontán összeépüléssel a kettős DNS-szálat, szaporodni csak akkor képesek, ha a sejtben egyidejűleg herpes- vagy adenovirus is jelen van. 181
202 Virológia A hepadnavirusok cirkuláris genomjának kb. 50%-a egyszálú DNS. A hepadnavirusok genomjának kifoltozását és cirkuláris formába történő alakítását, a vírus által kódolt és készen szállított DNS-polimeráz enzim végzi (Hepatitis-B vírus) a sejt magjában. A replikációt és a transzkripciót is virális enzimek irányítják. A cirkuláris formába átalakított hepadnavirus genom pozitív száláról egy genom hosszúságú ún. hosszú transzkript (+RNS) és több un. rövid transzkript szintetizálódik. A rövid transzkriptek egy részéről korai fehérjék (enzimek), más részéről késői fehérjék (struktúrproteinek) szintetizálódnak. A hosszú transzkript becsomagolódik az időközben elkészült struktúrproteinekből összeépülő még éretlen (immature) nukleokapszidba és elhagyja a sejtmagot. Amikor a +RNS-t tartalmazó nukleokapszid a cytoplasmába ér, a vírus által előállított reverz transzkriptáz enzimek erre a genom hosszúságú transzkriptre (+RNS-re), egy DNS-szálat szintetizálnak, majd ezután a DNS szál egy részére komplementer +DNS szálat építenek, így kialakul a csak részlegesen dupla szálú vírusgenom. Ezt követően befejeződik a nukleokapszid összeépülése is. A szimpla szálú DNS-vírusok transzkripciós és transzlációs mechanizmusa megegyezik a sejtmagban replikálódó DNS/2-vírusoknál leírtakkal Pozitív szimpla szálú RNS-vírusok (+RNS). A pozitív RNS-vírusok genomját a sejt riboszómája mrns-nek fogadja el, ezért a genomról a dekapszidáció után megindulhat a korai fehérjék transzlációja, melynek eredményeként virális replikáz és transzkriptáz enzimek termelődnek. A replikáció két lépésben zajlik. Először a pozitív RNS-szálra a replikáz enzim (+)RNS/( )RNS polimeráz szintetizál egy komplementer negatív RNS-szálat és kialakul a replikációhoz szükséges kettős szálú intermedier templát (+)RNS/( )RNS). Ennek negatív száláról ugyanez a replikáz enzim, mint ( )RNS/(+)RNS polimeráz most már pozitív RNS szálakat szintetizál (84. ábra). A picornavirusok és flavivirusok esetében ezeknek a pozitív nukleinsav- szálaknak az egyik része az utódvirionok genomját alkotja, másik része policisztronos mrns-ként a riboszómákhoz vándorol. A transzláció során keletkező policisztronos fehérjét a proteolytikus enzimek kész struktúrfehérjékre vágják. 84. ábra - Pozitív szálú RNS-vírusok (+/RNS) makromolekuláinak szintézise (magyarázat a szövegben) Számos növényi és egyes állati vírusok pl. a toga- és coronavirusok, struktúrfehérjéik szintéziséhez, szakaszos transzkripcióval állítanak elő mrns-eket Negatív szimpla szálú RNS-vírusok ( RNS). A negatív irányítottságú vírus-rns-genomot, a riboszóma nem fogadja el, így a vírusnak első lépésben mrnsre kell szert tenni, hogy mind a transzkripcióra, mind a replikációra nyitott legyen. A negatív szálú RNS-vírusok ezért nemcsak kódolva, de a nukleokapszidba becsomagolva, készen is magukkal viszik a virális transzkriptáz enzimüket, amelyik a negatív szálú genomról mrns-t másol. 182
203 Virológia A paramyxovirusok, és a rhabdovirusok genomjáról a transzkriptáz enzim két különböző úton, replikációs módban és transzkripciós módban másol mrns-eket és replikációs RNS-t is. A két folyamat egy időben zajlik (85. ábra). 85. ábra - Negatív szálú RNS-vírusok (-RNS) makromolekuláinak szintézise(magyarázat a szövegben) Replikációs módban, a szülő genom teljes hosszára egy pozitív szál másolódik ( )RNS/(+)RNS polimeráz és kialakul egy kettős szálú intermedier, amelynek pozitív száláról másolódnak az utódvirionok negatív RNSgenomjai, a (+)RNS/( )RNS polimeráz enzim segítségével. Transzkripciós módban a ( )RNS/(+)RNS polimeráz lemásolja a strukturfehérjéket és a kész transzkriptáz enzimet kódoló monocisztronos mrns szakaszokat. Dupla szálú RNS-vírusok (RNS/2) A Reoviridae és Birnaviridae családok vírusai az egyetlenek a ma ismert élővilágban, amelyek genetikai információjukat dupla szálú RNS-ben tárolják. A dupla szálú RNS-vírusok genomja szegmentált, és mivel minden szegment egy-egy fehérjét kódol, a transzkripció során monocisztronos mrns-ek szintetizálódnak. A makromolekulák szintézise az egyes genomszakaszok transzkripciójával indul, amit vírus által készen szállított transzkriptáz enzimek végeznek. A transzkripció során keletkező korai mrns-ek már akkor elhagyják a szülő viriont, amikor annak nukleokapszidját még csak részlegesen emésztették meg a sejt proteolytikus enzimei. (A részlegesen emésztett nukleokapszidot elhagyó mrns-ek elektronmikroszkópos felvételeken százlábú pók -hoz hasonló struktúrát kölcsönöznek a virionnak.) A szülői pozitív nukleinsav szál templátként szolgál azoknak a negatív szálaknak a szintéziséhez, amelyek az utódvirionok kettős genomját alkotják. Az utódvirionok kapszidjába beépülő genomszegmenteket a vírus által szintetizált fehérjék láncba kapcsolják, és ezt követően a korai transzkripcióhoz szükséges transzkriptáz enzimmel együtt becsomagolódnak a kapszidba (86. ábra). 86. ábra - Dupla szálú RNS-vírusok (RNS/2) makromolekuláinak szintézise (magyarázat a szövegben) 183
204 Virológia Pozitív szálú RNS-t DNS-re átíró vírusok (+RNS/DNS2) A Retroviridae családba tartozó vírusok a makromolekulák szintézisét megindító korai transzkripció előtt egy speciális, ún. reverz transzkripciót hajtanak végre, amelynek révén (+)RNS-genomjukat DNS/2-genommá alakítják. A reverz transzkripciót a virionba készen becsomagolt reverz transzkriptáz (visszafelé író transzkriptáz) enzim végzi el, három lépésben. Az első lépésben az RNS-dependens DNS-polimerázként működő reverz transzkriptáz enzim szimpla szálú komplementer DNS-szálat szintetizál a vírus RNS-re. A szintézis megindításához trns-t használ primerként. A második lépésben a vírus által készen szállított ribonukleáz-h enzim leemészti az RNS-t a cdns-ről és ( repair ) javítóenzim-ként működve kijavítja az új DNS szál hibáit. A harmadik lépésben a DNS-dependens DNS-polimerázként funkcionáló reverz transzkriptáz enzim erre a DNS-szálra komplementer DNS-t szintetizál. Ily módon kialakul egy dupla szálú, lineáris vírus -genom, ennek mindkét végére egy-egy ún. hosszú terminális ismétlődő szakasz (long terminal repeat, LTR) kerül. A DNS/2- vírus genom ezután bejut a gazdasejt magjába, ahol cirkuláris formát vesz fel, és lehetősége adódik a sejt kromoszómájába történő integrációra. Az integrálódott vírusgenomot provírusnak nevezzük. A provírus komplett és önálló transzkripciós egység, mivel az LTR régió tartalmaz egy promoter szakaszt (ami a transzkripció közvetlen megindításához szükséges) és egy szabályozó (enchancer) szakaszt (ami a transzkripció megerősítéséhez nélkülözhetetlen). Az integrálódott vírusgenom provírusként, most már a sejt kromoszómájának szerves részévé válik, és róla a sejt transzkripciós enzimjei (DNS-dependens RNS- polimeráz) fognak vírus-mrns-t szintetizálni úgy, mintha saját mrns-t állítanának elő. Az így szintetizálódott vírus-mrns-k akár 1%-át is kitehetik a sejt mrns készletének. Mivel a retrovirusok nem kódolnak RNS-dependens RNS-polimeráz enzimet, a transzkripciót és a replikációt a gazdasejt RNS/RNS- polimeráz enzime végzi el, egyazon lépésben. A transzkripció során genom hosszúságú és annál rövidebb transzkriptek képződnek. A genom hosszúságú transzkriptek vírusnukleinsavként funkcionálnak, ezért kizárólag ezek csomagolódnak be a készülő nukleokapszidba. A rövidebb transzkriptek egy poliproteint szintetizálnak a riboszómákon, és ezek vágásával alakulnak majd ki a struktúrproteinek és a reverz transzkiptázvalamint a ribonukleáz-h enzimek. Ezeket az enzimeket az újonnan szintetizálódó vírusok a vírusgenomhoz kapcsoltan magukkal viszik. A retrovirusok két példányban csomagolják be nukleinsavukat (diploidok) (87. ábra). 87. ábra - Pozitív szálú RNS-t DNS-re átíró vírusok (+/RNS/DNS/2) makromolekuláinak szintézise (magyarázat a szövegben) 184
205 Virológia A transzláció során szintetizálódnak azok a fehérjék is, amelyek a v-onc. génnel rendelkező retrovirusok esetében kialakítják a sejt daganatos transzformációját (lásd. onkogenitás fejezet). A retrovirusok multiplikációs stratégiáját látva érthetővé válik, hogy ezek a vírusok miért nem használják ki a +RNS genom adta lehetőséget (mrns-ként működik). A reverz transzkriptáz enzim ugyanis lehetővé teszi számukra a gazdasejt kromoszómájába történő integrálódást. Az integráció mint a latens fertőzés egyik formája, egyrészt rendkívül gazdaságos (hosszan tartó) túlélési lehetőséget biztosít a vírusnak, másrészt ily módon elkerülheti a cytoplasmában zajló replikáció és transzkripció veszélyeit. A molekuláris biológiát forradalmasító és a centrális dogmán rést ütő reverz transzkriptáz enzim 1970-ben történő felfedezéséért H. Temin és D. Baltimore 1975-ben kapott orvosi Nobel díjat Virionok összeépülése A nukleokapszid összeépülése (a retrovirusok) a genom-replikáció helyén történik. A DNS-vírusok nukleokapszidja a sejtmagban, az összes RNS-vírus és a két cytoplasmában szaporodó DNS-vírus (pox, afrikai sertéspestis vírusa) nukleokapszidja a cytoplasmában épül össze. A replikáció és az összeépülés helyének közelsége révén a vírus így próbálja minél gyorsabban védelem alá helyezni az utódvirionok nukleinsavát. A nukleokapszid és a virusgenom egymásra találását a vírus által kódolt ún. nukleinsavszignál teszi lehetővé. Ez a jelző rendszer még akkor is kitűnően működik, ha a replikáció és a nukleokapszid-előállítás helye meglehetősen távol van egymástól (pl. több DNS-vírus nukleokapszidja a cytoplasmából jut be a sejtmagba, ahol a virusgenom replikációja zajlik (herpesz-, adeno-, parvo-, papillomavirusok). A nukleokapszid összeépülése stratégiai fontosságú a vírus számára. A komplett (fertőzőképes) és az inkomplett (nem fertőzőképes) utódvirionok aránya ugyanis attól függ, hogy az összeépülés ideje alatt mennyi kész nukleinsav és nukleokapszid állt rendelkezésre. Ha kevés a nukleinsav, az elkészült nukleokapszidokba nem kerül vírusgenom, ezért inkomplett virionként hagyják el a sejtet. Ha kevés a nukleokapszid, az elkészült utódvírus-genomok nem találnak menedéket a nukleáz enzimek elől, és ezért megemésztődnek. Mindkét esemény zsákutca a vírus számára, amit a transzkripciós, transzlációs és replikációs folyamatok időbeli és koncentrációfüggő koordinálásával igyekszik elkerülni. Ennek a szabályozásnak a nehézségét jelzi, hogy egy átlagos vírusszaporodás során az inkomplett utódvirionok aránya megközelíti a 60 70%-ot. A nukleokapszid-összeépülés megtörténhet úgy, hogy a kapszomerekből összeépülő üres nukleokapszidba (prokapszid) becsúszik a vírusgenom (A), illetve úgy, hogy a nukleokapszid fehérje egységei körbeépítik a vírusgenomot (B). Mindkét folyamatot a specifikus felépítő (scaffolding) fehérjék irányítják (88. ábra). 88. ábra - Vírusok nukleokapszidjainak összeépülése (magyarázat a szövegben) 185
206 Virológia Egyes vírusok a replikációs stratégiájukhoz nemcsak genetikailag kódolt, de működőképes kész enzimeket (transzkriptázokat) is kénytelenek biztosítani. Ezek az enzimek is az összeépülés során kerülnek be az utódvirionokba. Burkos vírusok utódvirionjainak a nukleokapszidjai a sejtmembránokon történő áthaladás során tesznek szert burokra. A vírusburok és a nukleokapszid összeépülése azokon a sejtmembránrészeken zajlik, amelyekbe már előzetesen a transzlációt követően beépültek a víruseredetű burokfehérjék (glükoproteinek) és amelyek belső felszínén már koncentrálódtak a mátrixproteinek is. A mátrixproteinek megerősítik a kapcsolatot a nukleokapszid és a burok között. A herpesvirusok még egy ún. belső burkot is felvesznek a maghártyán való áthaladás során; nagy mannóztartalma elengedhetetlen a membránfehérjék glükolizációjához. Ez a belső burok egyben egyedülálló védelmet is nyújt a nukleokapszidnak a cytoplasma proteolytikus enzimeivel szemben, a vírus kiszabadulásáig. A coronavirusok és a bunyavirusok burkaikat az endoplasmatikus retikulumhálózat és a Golgi-apparátus membránjaiból nyerik Virionok kiszabadulása a sejtből Bizonyos esetekben az utódvirionok nem hagyják el a sejtet, hanem a sejttel együtt élnek, és csak a sejt halálakor vagy membránjának drasztikus sérülése esetén jutnak az extracelluláris térbe. Ezeket a vírusokat sejthez kötött, (cell-assosiated) vírusoknak nevezzük (pl. Gammaherpesvirinae). Az utódvirionok a sejtet vagy aktív folyamattal, exocytosissal, bimbózással(budding), vagy a sejt lízisét követően passzív úton hagyják el. A legtöbb nem burkos vírus aggregálódik az összeépülés helyén a cytoplasmában vagy a sejtmagban, és rendszerint egyszerre hagyják el a sejtet, amikor a sikeres vírusszaporodás következményeként kialakul a sejt lízise (pl. picornavirus) vagy a lassú degenerálódást követően a sejt halála (pl. parvovirus), illetve az apoptózisnak nevezett, programozott sejthalál (pl. adenovirus). A burkos vírusok többsége bimbózással (budding) hagyja el a sejtet, az összeépülést követően. A bimbózás a sejtmembránnak mindig azokon a helyein következik be, amelyekbe már beépültek a vírus felszíni glükoproteinjei. Ezért a bimbózás már az összeépüléssel kezdetét veszi. Ez azért is fontos, mivel a fertőzött sejt 186
207 Virológia membránja most már kitűnő célpont a szervezet immunsejtjei számára, a membránba integrálódott vírusfehérjéknek (antigéneknek) köszönhetően (89. ábra). 89. ábra - Vírusok kiszabadulása az eukaryota sejtből bimbózással (budding) A bimbózás során az utódvirionok folyamatosan hagyják el a sejtet, és az ebből eredő membránkárosító hatás lényegesen eltér az egyes víruscsoportok között. Amíg a tógavirusok, paramyxovirusok és rhabdovirusok bimbózása gyors, fatális cytolysist eredményez, addig az arenavirusok és a retrovirusok kiszabadulása csak csekély mértékű, gyakran észrevehetetlen membránkárosodással jár. Az alphaherpesvirusok és a paramyxovirusok membránkárosító hatásának eredményeként a szomszédos sejtekben membránfúzió, syncytium is kialakul. A syncytium membránalagútjaiban a vírus biztonságos lehetőséget kap a szomszédos sejtek közötti extracelluláris terjedésre anélkül, hogy az ellenanyagokkal találkozna a szervezetben. A herpesvirusok esetében bizonyították, hogy különböző vírusfehérjék felelősek az intercelluláris, illetve az extracelluláris kiszabadulásért A kiszabadulás alternatív formái Herpesvirusok szaporodása során előállhat olyan eset, amikor az utódvirionok phagocytosisa során a fertőzött sejt lizoszómái szétrobbantják magukat. Ezeknek az öngyilkos lizoszómáknak az emésztő enzimei most már a sejt lízisét is meggyorsítják. A T-bakteriofágok egyik késői gén terméke, a lizozim enzim. Amikor az első fágok összeépülése megkezdődik, ezek a lizozim enzimek elkezdik emészteni a baktérium sejtfalát és a fágok nagy része az így kialakult sejtfalhiányokon keresztül hagyja el a baktériumot, mielőtt a lízis bekövetkezne. Mivel in situ körülmények között, a növényi sejtben nem alakul ki lízis a vírusfertőzés hatására, a növényi vírusok az intercelluláris sejtfalkapcsolatokon keresztül terjednek sejtről sejtre. Ezzel magyarázható több növényi vírus mozaikszerű levélkárosítása, pl. a dohány-mozaikvirus által okozott elváltozás is A vírus és környezetének kölcsönhatásai A vegetatív vírus számára a környezet az a sejt, amelyben szaporodik. A sejtet elhagyó virion környezetén azt a miliőt értjük, amely közvetlen hatással van a vírus létfeltételeire (a vírussal kapcsolatba kerülő másik vírus is környezeti tényezőnek tekinthető). Éppen ezért egy adott vírus életfeltételeit vizsgáló in vitro kísérletek eredményeit legtöbbször csak tájékozódó jellegűnek lehet tekinteni az in vivo-in situ körülményekre vonatkoztatva. 187
208 Virológia A vírust más élőlényekhez hasonlóan a környezet részéről állandó evolúciós kényszerhatás éri, ezért folyamatosan küzdenie kell a fennmaradásáért. Ez a küzdelem egyaránt zajlik térben és időben is. A térben zajló küzdelem célja a multiplikáció lehetőségének megteremtése egy vagy több faj sejtjeiben. Az időben zajló küzdelem célja a már megszerzett optimális életfeltételek megtartása, lehetőleg minél több ideig. A sikeres küzdelem valójában alkalmazkodást jelent a változó környezetei feltételekhez. Ennek a sikernek többnyire az a záloga, hogy változás áll be a vírus genotípusában és/vagy fenotípusában. Az alkalmazkodás tehát változás. Ebben a helyzetben függőségi viszonyok alakulnak ki a vírus és környezete között (13. és 14. táblázat). 13. táblázat - A vírus és környezetének függőségi viszonyai Függőségi viszonyok A VÍRUS a nukleinsav replikáció biokémiai következményei B VÍRUS VÍRUS más vírussal kerül kapcsolatba C VÍRUS SEJT a sejttel kerül kapcsolatba D VÍRUS SZERVEZET a szervezettel és az immunrendszerrel kialakuló kölcsönhatás Függőségi viszonyok típusai A ) mutáció B) rekombináció komplementáció fenotípusos keveredés interferencia exaltáció C) interferon latens fertőzés perzisztens fertőzés onkogenitás CPE (lyzis) D) akut fertőzés perszisztens fertőzés 14. táblázat - A vírusok geno- és fenotípusában bekövetkező változások GENOM öröklődő (ismétlődő esemény) FENOTÍPUS nem öröklődő (egyszeri esemény) mutáció 1 genom rekombináció 2 genom komplementáci ó (enzim) fenotípusos keveredés (fehérje) vírus/virus (génátrendeződés) (szegmentátrendeződés ) vírus/sejt (integráció) interferencia (enzim/fehérje) Ezeknek a változásoknak az eredménye lehet előnyös, hátrányos vagy semleges mind a vírusra, mind a környezetre nézve. A vírusnak, mint parazitának, evolúciós szempontból az a leghasznosabb, ha a változás 188
209 Virológia számára előnyt, a környezet számára pedig legalább semleges hatást biztosít. Ez az ideális állapot azonban rendkívül ritkán következik be (pl. latens fertőződés alatt). A természetben a vírus és környezetének kölcsönhatását a folyamatos küzdelem jellemzi (ugyanis a környezetet ért hátrányos hatás újabb változtatásra kényszeríti a környezetet, ami ismételt kihívást jelent a vírusnak.) Mutáció A vírus genetikai anyagában bekövetkező nukleotid változást mutációnak nevezzük. A természetben a mutáció állandóan zajló folyamat, melynek létrejöttét vagy a fenotípus változásain, vagy a genom analízise során észlelhetjük. A víruspopulációkban az egyedeket érő mutációk sokasága biztosítja azt a variabilitást, ami kulcsfontosságú a populáció fennmaradásához. A mutáció lehetőséget teremt a vírusnak, hogy genotípusát és/vagy fenotípusát alkalmassá tegye új, előnyös környezeti kapcsolatokra, mint pl. a rekombináció, komplementáció, interferencia, de ugyanakkor nagy veszélyt is jelenthet, mivel elveszítheti az addig megszerzett evolúciós előnyét, ami pl. a letális vagy feltételesen letális mutációk során bekövetkezik. A multiplikáció során egy szülő vírus több millió utódviriont hoz létre, többnyire rövidebb idő alatt, mint ami alatt a szaporodását biztosító sejt egyszer osztódna. A sejtgenomhoz viszonyítva ebben a nagy egyedszámú utódpopulációban a mutációk előfordulásának aránya nagyságrendekkel magasabb lesz, mivel a rendkívüli intenzitásra kényszerített víruspolimeráz enzim tévedési aránya is megnő. Pontmutációk. A tévedés (átírási hiba) valójában hibás nukleotid beépítését jelenti, ami a pontmutációk leggyakoribb kialakulási módját okozza (15. táblázat). 15. táblázat - A vírusokban bekövetkező mutációk típusai és eredményei Mutáció típusa Folyamat a genomban Eredmény a fenotípusban Pontmutáció 1 nukleotidváltozás változó Sorozatos pontmutáció több nukleotidváltozás többnyire inaktív fehérje (L) Szakasz kiesése (deléció) nukleotidok esnek ki fehérje nem alakul ki (L) Szakasz betoldása (inzerció) Visszamutáció Frameshift mutáció Szupresszor-mutáció nukleotid épülhet be 1 mutáns nukleotidot újabb mutáció éri eltolódás a transzláció leolvasó fázisában génszabályozás felbomlik fehérje nem alakul ki (L) nem észlelhető fehérje inaktív (L) új variáns keletkezik (pl. RSV) változó (L) Misszensz-mutáció kódon változik változó (más aminosav keletkezik) Nonszensz-mutáció kódon értelmetlen fehérje nem alakul ki, inaktív Néma mutáció 1 nukleotidváltozás nem észlelhető Feltételesen letális kódon megváltozik a fehérje csak bizonyos környezeti 189
210 Virológia mutáció feltételek között aktív Letális mutáció kodon megváltozik a fehérje vagy nem alakul ki. L= letális hatás vagy inaktív (L) A sejt DNS-ének másolását végző polimeráz enzimek tévedéseire visszavezethető mutációk nagy részét a sejtmagban található ún. javítóenzimek (pl. ligáz) korrigálják, a megfelelő nukleotidok kicserélésével. Ezt a javítómechanizmust (proofreading) azok a vírusok is igénybe veszik, amelyek a sejtmagban végzik replikációjukat (DNS/2-, DNS/1-vírusok, a pox- és az afrikai sertéspestis vírusa kivételével). A replikáció hiánya miatt a cytoplasmában nincs javítómechanizmus, ezért az itt szaporodó vírusok nem tudják korrigáltatni a nukleinsav- polimerizáció során kialakult átírási hibákat (pontmutációkat). Ezzel magyarázható, hogy a mutációk előfordulásának gyakoriságát kifejező mutációs ráta (átírási hiba/beépült nukleotid) a sejtben a legalacsonyabb ( ), ennél magasabb a magban szaporodó DNS-vírusokban (10-5 ) és legmagasabb a cytoplasmában szaporodó RNS-vírusokban ( ). Az RNS-vírusok esetében ez azt jelenti, hogy minden ezredik nukleotidbeépítésnél hiba történt (ami pl. a 11 kb. genommal rendelkező vesiculovirusok esetében azt eredményezi, hogy az utódvirionok között nem lesz két egyforma!). A javító (proofreading) mechanizmuson kívül az ún. visszamutáció (back mutation) is segít az átírási hibák korrigálásában. Visszamutáció akkor fordul elő, ha az átírási hibát egy újabb mutáció éri, és szerencsés esetben ez az eredeti aminosav sorrend helyreállítását jelentheti. Indukált mutációk. A környezeti hatásokra kialakuló mutációt indukált mutációnak nevezzük. Indukált mutáció létrehozható kémiai mutagénekkel, sugárzással, hőmérséklet-, ph-, ozmolaritásváltoztatással. Az indukált mutációk esetében a mutációs ráta elérheti a értéket is (vagyis minden századik nukleotid beépítés hibás). Deléciók és inzerciók. A vírus genomjában bekövetkezett mutáció érinthet egy nukleotidot (pontmutáció) vagy több nukleotidot is (sorozatos pontmutáció), valamint kiterjedhet kisebb-nagyobb összefüggő szakaszra is. A szakaszkieséssel járó mutációt deléciónak, a szakaszbetoldással járót inzerciónak nevezzük. Ha a deléció a virulenciagéneket érinti, ún. deléciós vakcinatörzsekhez juthatunk, és éppen a delécióból adódóan nyílik lehetőség olyan diagnosztikai módszer kifejlesztésére, amelyik különbséget tud tenni a vakcinatörzs és a vad vírusok között. Ma már több vírus okozta betegség elleni mentesítési programban használnak ilyen deléciós vakcinákat (Aujeszky-betegség, IBR, klasszikus sertéspestis). A deléciók és az inzerciók a vírusgenomban eltolják a transzláció normális leolvasó fázisát, és ez gyakran működésképtelen fehérjék keletkezését eredményezi (frameshift mutációk). A replikációs enzimeket érintő deléció vagy inzerció többnyire letális mutációhoz vezet. A delécióval elvesztett tulajdonság a mutáció javítómechanizmusaival nem állítható vissza (erre legfeljebb a rekombináció adhat lehetőséget). Az inzerció mindig valamilyen génszakasznak a kárára történhet, ami legtöbb esetben vagy a replikációs, vagy az adszorpciós képesség megszűnéséhez vezet (pl. sarcomát okozó vírusokban az onc gén a polimeráz enzim helyére épült be, ezért ezek a vírusok legtöbbször önállóan nem képesek szaporodni). A mutáció élettani hatása (eredménye a fenotípusra) alapvetően attól függ, hogy a genom melyik génszakaszára lokalizálódott, de kifejeződését egyes esetekben meghatározhatja a genom többi génjének aktivitása is (szuppresszor mutáció). A fenotípusban a mutáció vagy észlelhető élettani változást okoz, vagy eredményének nem lesz kimutatható élettani hatása (néma mutáció). Az észlelhető elváltozás típusa alapján megkülönböztetünk misszensz (eltévesztett) és nonszensz (értelmetlen) mutációt. A missszensz mutáció egy bizonyos aminosavat meghatározó kodont egy másik aminosavnak megfelelő kodonra változtat át. Nonszensz mutáció során egy kodon úgy alakul át, hogy többé egyetlen aminosavat sem kódol. Az esetek többségében ez azt jelenti, hogy az aminosavkodon stop kodonra változik. Ha ez a stop kodon létfontosságú fehérje kialakulását hiúsítja meg, a mutáció letálissá válik. 190
211 Virológia Az észlelhető mutáció eredményét vagy a vírus élettani tulajdonságainak változásain keresztül és/vagy a vírusfehérjék analízise (pl. elektroforézis) során figyelhetjük meg. Néma mutáció akkor fordulhat elő, ha a megváltozott triplet a genetikai kód degeneráltsága miatt nem hoz létre más aminosavat, vagy ha a mutáció nem lényeges aminosav kodonját érintette. A néma mutációk szekvenciaanalízissel felismerhetők és azonosíthatók. A vírus legfontosabb élettani tulajdonsága a multiplikáció. Ha a multiplikációért felelős génekben kialakuló mutáció miatt a vírus szaporodása csak bizonyos környezeti feltételek között valósulhat meg, feltételesen letális mutációról beszélünk. Ezek közül legrészletesebben a hőérzékeny mutációkattanulmányozták. Hőérzékeny mutáns (Ts, temperature sensitive) vírustörzsek esetében, a replikáció csak egy meghatározott hőmérsékleten mehet végbe, mivel a mutáció következtében más hőmérsékleten a polimeráz enzim működése gátolt. Hideg mutánsok esetében (pl. Vnukovo 32 veszettség elleni vakcinatörzs) a vírus-polimeráz enzim a testhőmérsékletnél alacsonyabb hőfokon (32 C) aktív, ezért a szervezetben szaporodása gátolt. Letális mutáció során a vírus szaporodása teljes mértékben blokkolt, ezérta letális mutánsok izolálása nehézségbe ütközik. A replikációs enzimek és/vagy az adszorpciós fehérjék inaktiválását okozó mutációk mindig letálisak. A mutáció következtében kialakuló további észlelhető fenotípus- (tulajdonság-)változások közül a legfontosabbak: Plakkmutánsok (pl. az Aujeszky-betegség vírusának virulens törzsei nagy plakkot, a K 61 vakcinatörzs ugyanakkor kicsi plakkot képez). Gazdafajmutánsok (pl. macska parvovirusa mutáció révén adaptálódott a kutyához és a nyérchez), Attenuált mutánsok (a virulens törzsekkel ellentétben, a szervezetben elszaporodva nem okoznak jelentős klinikai tünetekben megnyilvánuló megbetegedést). A szervezetben szaporodó vírust és utódait az immunrendszer és a szöveti struktúra részéről olyan szelekciós nyomás éri, hogy még az életképes virionok sem jutnak el minden esetben a szaporodásukhoz nélkülözhetetlen célsejtekhez. Mivel laboratóriumi körülmények között ezek a szelektív hatások a kémcsőben nem érvényesülnek, a sejtkultúrákban szaporított vírusok közül a kevésbé életképes mutánsoknak is van esélyük a túlélésre. A sorozatos passzálások során ezért csökkenhet a vad vírustörzsek virulenciája vagy a szaporodóképessége. Ez a hatás tovább fokozható, ha a vírust idegen sejtben próbálják szaporítani (pl. lapinizálás, avinizálás). Ezeket a jelenségeket használják fel attenuált vakcinatörzsek előállítására is Vírus vírus kapcsolatok A továbbiakban részletezésre kerülő vírus vírus kapcsolatok közös jellemzője, hogy kialakulásukhoz mindig szükség van egy sejtre is, ugyanis ezek a kapcsolatok kizárólag a vírusszaporodás valamelyik fázisában jönnek létre. Még abban a ritka esetben is, amikor csak egy vírus fertőz egy sejtet, a számos utódvirion óhatatlanul kapcsolatba kerül egymással. Ezért a vírus vírus kapcsolatok döntően a rokonvírusok között fordulnak elő, bár elvétve nem rokon vírusok között is kialakulhat kapcsolat (pl. adenovirus és dependovirus között). A vírus vírus kapcsolat a genom (rekombináció) és a fehérjék szintjén (komplementáció, fenotípusos keveredés, exaltáció, interferencia) jöhet létre (14. táblázat) Vírus vírus kapcsolat a genom szintjén Rekombináció Amikor két vírus szimultán fertőz egy sejtet, a szintetizálódó utódvirionok nukleinsav szálai között, különböző genetikai rekombinációra nyílik lehetőség, úgymint: génátrendeződés, újrarendeződés, reaktiváció. A vírusnukleinsav és a sejtgenom közötti rekombinációk eredménye az integráció és a pseudovirus. A rekombináció létrejöttének alapvető feltételei: egy sejtben legalább két vírusgenom (vagy 1 vírus- és 1 sejtgenom) legyen jelen egymáshoz közel, 191
212 Virológia legalább nukleotidhomológia legyen a nukleinsavakban, szegmentált genommal rendelkező vírusoknál a cserélődő nukleinsav-szegmentek azonosak legyenek. Génátrendeződés (intramolekuláris rekombináció). Elsősorban rokon vírusok között létrejövő genetikai kapcsolat, melynek során a genomok akár 50 60%-a is kicserélődhet (herpesvirus). A génátrendeződés oka, hogy az egymáshoz közel kerülő két vírusgenom replikációja során a vírusreplikáz enzimek szálat tévesztenek, és átugranak a szomszédos nukleinsavszálra, ahol mit sem sejtve tovább folytatják az átírást. A folyamat eredményeként olyan utódvirionok jönnek létre, amelyek genetikai anyaga vegyesen tartalmazza a két szülői genom információját. Az esetek döntő többségében ez nem vezet új tulajdonságok megjelenéséhez, mivel a rekombinációban részt vevő genomok között is nagy volt az azonosság (ez tette lehetővé a száltévesztést) (90. ábra). 90. ábra - A rekombináció típusai (magyarázat a szövegben) A génátrendeződés elsősorban DNS-vírusok között fordul elő, de kivételesen megfigyelték egyes RNSvírusoknál is (ragadós száj- és körömfájás vírusa, poliovírusok). Nem rokon vírusok között a nukleotidhomológia hiánya miatt nincs lehetőség a génátrendeződésre. Ez alól kivételt képez, az adeno- és papovavirusok (SV-40) között megfigyelt génátrendeződés. Újrarendeződés (szegmentátrendeződés, reassortment). Az újrarendeződés nagy gyakorisággal fordul elő olyan rokon RNS-vírusok között, amelyek genomja szegmentált. Szegmentált genommal a következő szimpla és dupla szálú RNS-vírusok rendelkeznek: birna-, arenavirusok (2 szegment), bunyavirusok (3 szegment), orthomyxovirusok (8 szegment), reovirusok (10 12 szegment). A rekombinációhoz szükséges nukleinsavhomológia biztosítása érdekében csak azonos szegmentek cserélődhetnek ki. Mivel egy szegment többnyire egy gént kódol, ez a rekombináció igen jelentős változást okozhat a szegmentált vírusoknál, különösen az influenzás megbetegedésekért felelős orthomyxovirusoknál (90. ábra). Az orthomyxovírusok virulenciájáért és fertőzőképességéért a vírus burkában található neuraminidáz (NE) és hemagglutinin (HA) fehérjék a felelősek, ezért minden olyan változás, ami az őket kódoló génszakaszokat érinti, rendkívül jelentős a vírus életében. Ezeket, a fenotípusban (HA, NE epitópok) is megjelenő változásokat két csoportra osztjuk. Antigénsodródás (drift) és antigéncsuszamlás (shift) (91. ábra). 91. ábra - Orthomyxovírusok rekombinációja (antigén csuszamlás) 192
213 Virológia Antigénsodródásról akkor beszélünk, ha az egymást követő vírusgenerációk HA és NE fehérjéket kódoló génszakaszában folyamatosan csak minimális változások keletkeznek, többnyire pontmutációk hatására. Ezzel a generációrólgenerációra bekövetkező, de kismértékű változással a vírustörzs (populáció) pillanatnyi előnyökhöz jut a környezettel (pl. az immunrendszerrel) szemben és ez biztosítja a törzs túlélését a természetben (szervezetben), nemegyszer az új törzs születéséig (az antigénsodródás pl. a lovak fertőző arteriitésének vírusainál olyan hatékony, hogy az egy sejtben keletkező utódvírusok minden egyes generációja más-más antigénszerkezettel rendelkezik, ezért az immunrendszernek nem jut elég idő semlegesítésükre). Antigéncsuszamlás akkor következik be, ha hirtelen, egy generációváltáson belül, olyan mértékű változás érte a genomot, ami teljesen új HA és/vagy NE kialakulásához vezet. Az antigéncsuszamlás legtöbbször szegmentújrarendeződés hatására alakul ki és olyan új törzsek (szubtípusok) születését is okozza, amelyek a kontinensekre kiterjedő humán influenzafertőzésekért (pándemiákért) felelősek (ilyen jelentős mértékű szegment-újrarendeződés átlag 10 évenként következik be). Feltételezhetően a szegment-átrendeződés okolható a háziállatok (lovak, sertések, madarak) között időnként fellépő pándémiás influenzamegbetegedésekért is (91. ábra). Az orthomyxovirusoknála szegment újrarendeződés, az emberi és állati vírustörzsek, valamint a különböző állatok (vadkacsa, sirály, fóka) vírustörzsei között is létrejöhet (ezért időnként a humán törzs lemegy egy állatba pl. sertésbe, kacsába, és annak az állatfajnak a saját orthomyxovirusával rekombinálódva új HA és NE antigénkészlettel visszatér) Reaktiváció (kifoltozódás) A reaktiváció az a rekombinációs folyamat, ami lehetőséget biztosít a vírusnak, hogy a korábbi mutációk vagy rekombinációk által sérült vagy evolúciós szempontból hátrányos genomszakaszát kifoltozza és az esetleges inaktív genomot újra (re!)aktiválja (90. ábra). A reaktivációnak két formája ismert: a keresztreaktiváció (marker rescue) és a többszörös reaktiváció. Keresztreaktivációról akkor beszélünk, ha a két rokon vírus között lezajló reaktiváció olyan, többnyire letális vagy feltételesen letális mutációt javít ki, amelyik az egyik vírus meghatározott genetikai szakaszában (pl. restrikciósenzim- fragmentumban) fordult elő. Mivel vírustörzsek azonosításában a restrikciós fragmensek többnyire marker értékű szakaszok, a folyamatot markerkifoltozódásnak (marker rescue) is nevezik. A keresztreaktivációt nem rokon vírusok között is megfigyelték. A keresztreaktiváció révén, az eredetileg sérült genomú szülői vírus is örökítheti genetikai információját. Ez a jelenség gyakran fordul elő a pox- és orthomyxovirus-fertőzések során (90. ábra). Többszörös keresztreaktiváció akkor fordul elő, ha két rokon vírustöbb, de nem azonos helyen sérült genomszakaszai kölcsönösen kicserélődnek (kifoltozódnak), és ennek eredményeként most már mindegyikük fertőző utódvírusokat hoz létre. Ez a vírus számára előnyös evolúciós lehetőség, ugyanakkor komoly veszélyt is rejt magában. Ha egy állatot rövid időn belül két különböző attenuált vakcinával oltunk, előfordulhat, hogy a más-más genetikai szakaszokon sérült (attenuálódott) vakcinatörzsek a keresztreaktiváció révén kifoltozódnak és virulens utódvirionokat hoznak létre, amelyek már súlyos, esetenként halálos kimenetelű megbetegedést 193
214 Virológia okozhatnak (ennek elkerülésére a rövid időn belüli ismételt oltásnál lehetőleg ugyanazt a vakcinatörzset használjuk) Vírus és sejt közötti rekombinációk A multiplikáció során a sejtmagba bejutó vírusnukleinsavnak lehetősége adódik, hogy rekombinációs kapcsolatba lépjen a sejt genomjával. Integrációnak nevezzük azt a folyamatot, amelynek eredményeként a vírus nukleinsava épül be a sejt genomjába. Az integrálódott vírust provírusnak nevezzük. A provírus nem azonos a szintén a sejt genomjában helyeződő endogén vírussal (az endogén vírusról nem képződnek virionok, míg a provírusról igen). Az integrációnak komoly szerepe van a latens fertőzések kialakításában (lásd. később). Pseudovírus keletkezik akkor, ha sejtgenomszakasz épül be a vírus nukleinsavába. Ez többnyire letális a vírusra nézve Vírus vírus kapcsolat a fehérje szintjén A következő vírus vírus kapcsolatok közös jellemzője, hogy a kapcsolat nem a gének, hanem a géntermékek (fehérjék) között jön létre, ezért a mutációval és a rekombinációval ellentétben ezek nem öröklődő, egyszeri események. A kapcsolatok egy része támogató jellegű, amikor a defektes vírus lehetőséget kap az életben maradásra (komplementáció, fenotípusos keveredés, pszeudotípus), más esetben viszont erőteljesen gátolt a kapcsolatban részt vevő valamelyik (többnyire a komplett) vírus szaporodása (interferencia) (14. ábra) Komplementáció A komplementáció során a kapcsolatban részt vevő defektív vírus a komplett vírus enzimeit használja fel szaporodásához. A komplementáció a defektív virionok túlélésének és fennmaradásának leggyakoribb eszköze. Komplementáció rokon vírusok között. A Ts-mutáns (hidegmutáns) vírustörzsek polimeráz enzimje a feltételesen letális mutáció következtében testhőmérsékleten nem tud aktiválódni, csak pl. 32 C-on. Ezért a Tsmutánsok testhőmérsékleten nem szaporodnak. Ha ez a Ts-mutáns a sejtben kapcsolatba kerül egy replikálódó komplett rokon vírussal, akkor annak polimeráz enzimét felhasználhatja saját replikációjához. Ily módon a komplementáció biztosítja a hőmutánsnak azt a lehetőséget, hogy testhőmérsékleten is létrehozza utódait. Komplementációval két rokon vírushőmutáns is létrehozhat komplett utódvirionokat, ha kölcsönösen használják egymás polimeráz enzimét. Erre azonban csak akkor van lehetőség, ha a két hőmutáns enzimei más-más helyen sérültek. Inaktivált virulens és élő avirulens rokon vírusok között is létrejöhet a komplementáció, ha egy időben vannak jelen a sejtben. Ennek feltétele, hogy az inaktiváció ne érintse a vírus adszorpciós fehérjéit, csak a multiplikációért felelős enzimeit (különben az inaktivált vírus nem tudna bejutni a sejtbe). Ebben az esetben a replikálódó élő avirulens vírus polimeráz enzimei, a genetikai rokonságnak köszönhetően, akadály nélkül szintetizálják az inaktivált vírus virulenciáért felelős fehérjéit is, aminek eredményeként a sejtben élő, virulens utódvirionok jönnek létre. Ezt a jelenséget a himlővirusok (poxvirusok) között figyelték meg, és ennek a felismerésnek köszönhető az a nemzetközileg elfogadott határozat, hogy virulens vírustörzsből nem szabad vakcinát készíteni. Komplementáció nem rokon vírusok között. A Parvoviridae családba tartozó dependovirusok az adeno- és herpesvirusok polimeráz enzimeit használják fel saját replikációjukhoz, mivel genomjuk olyan rövid, hogy nem jutott hely a saját replikáz enzim kódolásához. Ennek a komplementációs lehetőségnek viszont az az ára, hogy a dependovirusok kizárólag az adeno- és/vagy herpesvirusok jelenlétében képesek életben maradni. A dependovirusokat támogató herpesz- és adenovirusokat korábban helper (segítő) vírusoknak nevezték, és a dependo (függő) elnevezés is a komplementáció jelenségére utal Fenotípusos keveredés A fenotípusos keveredésről akkor beszélünk, ha az egy időben, egymás mellett replikálódó rokon vírusok olyan utódokat hoznak létre, amelyekben keverednek a szülők struktúrproteinjei, ugyanakkor genomjukban különkülön, tisztán megőrizték az egyes szülők genetikai információját (92. ábra). 92. ábra - Fenotípusos keveredés, transzkapszidáció (magyarázat a szövegben) 194
215 Virológia A fenotípusos keveredés abban különbözik a komplementációtól, hogy itt nem enzimet, hanem strukturális fehérjét vesz át az egyik vírus a másiktól. A fenotípusos keveredés különleges jelentőségét az adja, hogy nem rokon vírusok között is gyakran előfordul (habár ezekben az esetekben az evolúciós kapcsolat kimutatható). Az orthomyxovírussal és paramyxovirussal egy időben fertőződött sejtben olyan utódvirionok is keletkeznek, amelyek burkában keverten jelennek meg a két vírus burokfehérjéi. A Rous-szarkóma-vírus (RSV) multiplikációja során mindig egy madárleukózis-vírus (ALV) teljes burkát ölti magára, mivel saját burokfehérjéit nem tudja szintetizálni (a sarcoma kialakulását elősegítő sarc. gén ugyanis a burokfehérjéket kódoló génszakaszba épült be). A fenotípusos keveredésnek köszönhetően az RSV leukózisvirusként lép be a sejtbe, és sarcomavirusként hajtja végre annak malignus transzformációját. A fenotípusos keveredés olyan egyedi felszíni struktúrát is érinthet, mint az adenovirusok fiberjei vagy kapszidjai. Két különböző típusú adenovirussal történő fertőzéskor az utódvirionok egy részében kevert típusú fiberek vagy kapszidok alakulnak ki. A fenotípusos keveredés különleges formája a transzkapszidáció, amikor az utódvirion az egyik szülő vírus kapszidját és a másik szülő vírus genetikai állományát örökli. (Pl. poliovírus és coxsackievirus közös fertőzésekor kialakultak olyan utódvirionok, amelyek coxsackievirus kapszidot és poliovirus-genomot tartalmaztak. Hasonló jelenséget figyeltek meg humán adenovirus-fertőzés során is, amikor az egyes utódvirionok az adenovirus 2 szülői kapszidját és az adenovirus 7 szülői genetikai anyagát örökölték, 92. ábra) Pszeudotípus Pszeudotípus akkor alakul ki, ha kizárólag a burokfehérjék keverednek össze a burokban (pl. VSV+retrovirus) Interferencia Interferenciának azt a folyamatot nevezzük, amikor egy vírus adszorpcióját vagy replikációját egy másik vírus gátolja. Az interferencia három típusát ismerjük: adszorpciós interferencia,autointerferencia és heterológ interferencia. Az adszorpciós- és autointerferencia kizárólag a rokonvírusok, a heterológ interferencia a nem rokon vírusok közt jön létre Adszorpciós interferencia Adszorpciós interferencia akkor alakul ki, ha a sejtfelszínre először érkező vírus a receptormolekulák lekötésével megakadályozza a következő vírus (vírusok) adszorpcióját. Az először érkező vírust ezért interferáló vírusnak nevezzük. A jelenség kizárólag szoros rokonságban álló vírusok között fordul elő, mivel az antireceptormolekulák legkisebb különbsége esetén a másodszorra érkező vírusnak már lehetősége nyílna az adszorpcióra olyan receptormolekulákon, amit az első vírus nem tudott lefoglalni. A jelenséget leggyakrabban ugyanazon vírus defektív és komplett partikulái között figyelték meg, amikor a sejtfelszínhez először érkező defektív (vagy inaktivált) vírusok megakadályozták a sejt felülfertőződését a komplett (pathogen) virionokkal. Az adszorpciós interferencia ép, érintetlen adszorpciós fehérjéket igényel. Ezért egy inaktivált vírus kizárólag akkor képes interferenciára, ha az inaktiválás nem érintette az adszorpciós fehérjéket, csak a genomot (ezért 195
216 Virológia tudja az UV fénnyel inaktivált baromfipestis-vírus megakadályozni az élő baromfipestis-vírussal történő felülfertőzést). Az adszorpciós interferencia evolúciós szempontból mindenképpen hátrányos a vírusnak, mivel a defektív (inaktivált) partikulák nem tudnak multiplikálódni, ezért a fajfenntartás szempontjából zsákutcát jelentenek. A Rous-sarcoma-vírus (RSV) és a baromfileukózis-vírus (ALV) együttes fertőzésekor, ha az ALV előbb érkezik a sejtreceptorokhoz, az ALV-vel azonos burkot (antireceptor fehérjét) viselő RSV-nek nem lesz lehetősége az adszorpcióra, ami a pusztulását jelenti (itt kell drámai árat fizetnie az ALV-től komplementációval megszerzett burokfehérjékért). A fertőző betegségek elleni védekezésben az adszorpciós interferenciát a javunkra fordíthatjuk. Ha pl. attenuált vakcinával oltjuk az állatot, az attenuált vakcinavírus és utódvirionjai lefoglalják a szervezet fogékony sejtjein levő receptorokat, ezért a vakcinázás után érkező utcai vírus nem tudja létrehozni a fertőzést. Ez az interferencia még tovább fokozható, ha az attenuált vakcinavírust, a fertőzés bemeneti kapujában levő sejtekre juttatjuk. Egyes herpesz- és coronavirusok elleni intranasalis vakcinázással a vakcina hatékonysága számottevően megemelhető az intramuscularis oltáshoz viszonyítva (pl. Aujeszky-betegség, macskák fertőző peritonitise). Az interferencia addig érvényesül, ameddig az interferáló vakcinavírusok szaporodnak (adszorbeálódnak), és hatékonyságát az attenuált és utcai vírusok mindenkori mennyiségi viszonya szabja meg (a második vírusnak az adszorpcióhoz elméletileg elegendő egy szabad hely a sejtfelszínen található több tízezer receptorból) Autointerferencia Autointerferenciáról akkor beszélünk, ha vírus saját utódvirion társaival interferál. Ez a jelenség mindig sejten belül, a multiplikáció közben alakul ki a defektív és komplett utódvirionok között. A vírus multiplikációja során keletkező utódvirionok döntő többsége (nemegyszer 60 70%-a) inkomplett, defektív partikula lesz. Ezek az inkomplett virionok képtelenek a további multiplikációra, mivel esetükben a defektivitás a genomjuk sérülését vagy hiányát jelenti. A defektív virionok több módon gátolják a komplett viriontársak megszületését. A komplett vírussal szembeni mennyiségi előnyt kihasználva, saját maguk számára lefoglalják azokat a sejtorganellumokat, ahol a makromolekulák szintézise folyik. Ebben a folyamatban minden inkomplett virion részt vehet. Az interferencia további lehetőségével csak azok az inkomplett virionok élhetnek, amelyeknél a defektivitás a genom deléciójára vezethető vissza (vagyis rövidebb a nukleinsavuk). Ezeket az interferenciára képes inkomplett vírusokat defektív interferáló (DI) partikuláknak nevezzük. Az elmondottakból következik, hogy nem minden defektív vírus képes interferálni, de minden interferáló vírus defektív. A DI partikulák egy része úgy valósítja meg az interferenciát, hogy elhalássza a közvetlen környezetében replikálódó komplett vírus polimeráz enzimjét, amivel saját inkomplett utódait szintetizáltatja. (Ennek eredményeként a fertőzött sejtben tovább növekszik az inkomplett utódvirionok száma.) Erre feltételezhetően azért van lehetősége, mert a rövidebb nukleinsavszál (és annak lánczáró kodonja) nagyobb affinitást biztosít a polimeráz enzimhez, mint a komplett vírus hosszabb genomja. Ezért részesíti előnybe a replikáz enzim a DI partikulákat. Más DI vírusok az ép struktúrfehérjéket rabolják el a komplett vírusok elől (poliovírusok). Az autointerferencia révén egyre nagyobb számban termelődő inkomplett vírusok a fertőzött sejt elhagyása után az adszorpciós interferencia lehetőségét is kihasználhatják, amivel tovább rontják a komplett virionok életben maradási esélyeit. Többek között ezért válhat a szervezet szintjén önkorlátozóvá egy vírusos betegség Heterológ interferencia Heterológ interferencia rendszertanilag nem rokon vírusok között fordul elő, rendkívül ritkán. Az interferenciát kimutatták adenovirus és poxvirus együttes fertőzéskor, amikor a poxvirus gátolta az adenovirus szaporodását. A jelenség hátterében eddig még nem azonosított szuppresszor fehérjék szerepét valószínűsítik. A heterológ interferencia eltérő az interferon-indukció által létrehozott interferenciától Vírusexaltáció Amikor két rendszertanilag különböző vírus egyszerre szaporodik egy sejtben, előállhat az az eset, hogy egymással szemben közömbösek (a másik multiplikációjába nem avatkoznak be), de együttes jelenlétükkel a sejt károsítását (CPE) fokozzák. Ezt a vírusexaltációnak nevezett jelenséget leírták in vitro és in vivo fertőzéskor is. A nem cytopathogen BVD- és sertéspestis-vírus sejtkárosító hatása sejtkultúrában felerősödött a baromfipestis- 196
217 Virológia vírussal történt egyidejű fertőzés hatására. A majmokban szubklinikai megbetegedést okozó Coxsackie-vírus és poliovírus együttes fertőzéskor idegrendszeri tüneteket idézett elő. Mivel evolúciós szempontból a parazitának nem kifizetődő a gazdasejt fokozott károsítása, a vírusexaltáció mindkét vírus számára hátrányt jelent Vírus sejt kapcsolatok Amikor a vírus találkozik egy sejttel, többféle kapcsolatrendszer alakulhat ki közöttük (93. ábra). 93. ábra - Vírus sejt kapcsolatok (Lomniczi (1978) után módosítva) A víruskapcsolatok közül az 1., 2., 3. pontban a sejt győz a vírus felett, a latencia (4. pont) egy átmeneti egyensúlyi állapotot jelent a sejt és a vírus között, az pontban jelzett kapcsolatok viszont a vírus totális győzelmét jelentik (93. ábra). E kapcsolatrendszerek közül a továbbiakban azokat a lehetőségeket vizsgáljuk, amelyekben a vírus fertőzni tudja a sejtet (3 7.). A vírus szempontjából a fertőzés lehet produktív amikor multiplikációját zavartalanul végrehajtja és ennek eredményeként új virionok képződnek, vagy lehet abortív, amikor a multiplikáció egy adott szinten megakad és ezért nem keletkeznek utódvirionok. Az abortív fertőzés a sejt szempontjából nem megnyugtató állapot, mivel a már elkészült vírusalkotórészek (fehérjék, nukleinsavak) zavart okozhatnak a sejt anyagcsererendszerében (94. ábra). 94. ábra - A vírusfertőzések típusai a sejt szintjén 197
218 Virológia A sejt szempontjából a fertőzés lehet elviselhető (tolerálható) vagy halálos (lítikus fertőzés). A tolerálhatóság mértéke attól függ, hogy a vírus milyen mértékű cytopathogén hatást fejt ki, illetve a sejt védekező rendszere (lizoszóma, nukleáz) milyen hatékonyan tudja megemészteni a vírusokat vagy alkotórészeiket. A vírus sejt kapcsolatokat in vitro körülmények között, egyrétegű szövettenyészetekben (többnyire klónozással homogénné tett sejtvonalakon) vizsgálják. Ezért ezek az események csak modell értékűek a szervezetben zajló fertőzések magyarázatára, ugyanis a szöveti kötelékben levő sejtek más-más felszíni struktúrával rendelkeznek, a károsodott sejtek egy része pótlódhat vagy funkcióját más sejtek átveszik, és ezen túlmenően a fertőzés kimenetelét (vagy létrejöttét) az immunrendszer nagymértékben befolyásolja. A szervezet szintjén a fertőzés eredménye attól is függ, hogy a vírusfehérjék toxikus hatása milyen típusú sejtet (létfontosságú szerv) érintett Interferonok Az interferonok a sejt által kódolt mediátor fehérjék, amelyek a vírussal fertőzött sejtben aktiválódnak és gátolják (interferálják) a vírusok replikációját. Az interferon fehérjék fontos szerepet játszanak a sejtnövekedés, sejtdifferenciálódás és az immunreguláció szabályozásában. Evolúciós szempontból a vírusellenes hatás másodlagos funkciónak tekinthető, habár a sejt védekező rendszerében betöltött jelentősége vitathatatlan. Az interferonok az eddig megismert leghatékonyabb biológiai anyagok közé tartoznak. Az interferon hatékony adagja 10-9 mg! (Összehasonlításként: a tetanusz-toxinból az ember LD mg). Az interferonok felfedezése is a vírusellenes hatás felismerésének köszönhető. ISAACS és LINDEMANN 1957-ben megfigyelte, hogy az influenzavirussal fertőzött CAM sejtek szekretálnak egy olyan vegyületet, ami meggátolja (interferálja) a még fogékony CAM sejtek vírusfertőződését. Mivel azt gondolták, hogy az interferencia mediátorát találták meg, a szekretált fehérjét interferonnak nevezték el (azóta bebizonyosodott, hogy az interferon és az interferencia két teljesen különböző biológiai jelenség). Az 1970-es évek kutatásai bizonyították, hogy a különböző interferon fehérjéket, három géncsalád (IFNα, IFNβ, IFNγ) kódolja, és tisztázódtak az egyes gének kromoszómában elfoglalt helyei is (16. táblázat). Az IFNα-t és az IFNβ-t korábban az I. típusú (klasszikus), az IFNγ-ta II. típusú (immun) interferonnak nevezték. Az interferonok (IFN) leírásánál feltüntetik az interferont termelő faj latin nevének rövidítését és az interferon típusát is (pl. a szarvasmarha Bovidae α-interferonjának elnevezése: BovIFNα, az emberé HuIFNα, a lovaké EqIFNα stb.). Az elnevezés is jelzi, hogy az interferonoknak szűk a gazdaspektrumuk. Ez alól a humán interferonok kivételek, mivel több állatfaj (borjú, macska, nyúl, patkány) sejtjeiben is kifejtik hatásukat. A szekvenciaanalízisek eredményei már evolúciós kapcsolatokat is feltártak a három interferon-géncsalád között. Az IFNγ valószínűleg közvetlen leszármazottja a három interferon-géncsalád közös ősének, amelyik feltételezhetően 500 millió éve jelent meg a törzsfejlődés palettáján. Az IFNβ gén kb. 250 millió éve vált el az IFNα-tól. A közös származást már csak a 30%-os genomazonosság őrizte meg. Az IFNα körülbelül 60 millió éve vált szét két genetikai alcsoportra, amelyekbe a ma ismert összes IFNα altípus besorolható. Az IFNα szubtípusok között 77%-os azonosság mutatható ki. Az állatok törzsfejlődése során az interferon a halaknál 198
219 Virológia jelent meg először. A gerincesek genetikai állományában (az emlősök kivételével) csak az IFNα és az IFNβ gének azonosíthatók, az IFNγ-tnem kódolják. Az emlősfajokban mindhárom IFN-géncsalád kimutatható. Amíg a legtöbb emlősfaj csak egy IFNβ gént kódol, addig pl. a nyúlban két IFNβ génalcsaládot, a szarvasmarhában, lóban és sertésben több IFNβ génalcsaládot különítettek el. Az emlősmagzatok az interferont a magzati élet második felétől kezdik el termelni. 16. táblázat - Interferonok típusai és fizikokémiai jellemzői (egér interferon) Interferon Tulajdonság α β γ Korábbi elnevezések Le IFN 1. típus F IFN 1. típus Immun IFN 2. típus Szubtípusok száma 20 kettő három Molekulatömeg (d) Nagy szubtípusok Klónok Glikoziláció nem igen igen ph 2 stabilitás stabil stabil labilis Indukció vírusok vírusok mitogének, antigének Termelő sejtek epithel sejtek, leukociták fibroblast lymphocyta Intron a génben nem nem igen Hu-IFN α-val homológia 80 95% 30 50% 10% Interferonok indukciója Élettani körülmények között a sejtek nem termelnek kimutatható mennyiségű interferont, de különböző aktiválóanyagok (interferoninduktorok) hatására az interferon termelése jelentősen fokozódik. Ilyen interferontermelést indukáló ágensek a mikroorganizmusok (vírusok, baktériumok, protozoonok), az immunstimulátorok vagy mitogének (endotoxinok, fitohemagglutinin), az antibiotikumok (pl. kanamicin, ciklohexamid), kettős szálú-polinukleotidok (poly I:C), valamint egyes kis molekulatömegű szintetikus vegyületek (pl. akridinfestékek). A továbbiakban, részletesen tárgyaljuk a vírusok által indukált interferonok (IFNα, IFNβ) termelésének mechanizmusát és a vírusszaporodásra kifejtett gátló hatásukat (95. ábra). 95. ábra - Az interferonok indukciója 199
220 Virológia A leghatékonyabb interferoninduktorok a kettős szálú RNS-nukleinsavak. A reo- és birnavirusok a genomszerkezetük (2/RNS), a többi RNS-vírus a replikáció során keletkező intermedier-(+rns/-rns) révén indukálja az IFN gént (sejtenként már egyetlen 2/RNS-molekula képes aktiválni az interferontermelést). Általánosságban elmondhatjuk, hogy az RNS-vírusok erős interferoninduktorok, a DNS-vírusok a (poxvirusok kivételével) viszont gyengén aktiválják az interferon gént. Az IFN gén indukciójának hatékonysága függ a vírustörzs specificitásától és a sejt típusától. Ugyanazon vírus különböző törzsei eltérő intenzitással indukálhatják az interferontermelését. Egyazon vírustörzs különböző típusú sejtekben más és más hatékonysággal aktiválhatja az IFN gént. Az interferon vírusellenes hatásának kifejlődéséhez minimálisan két sejt szükséges. Az első sejtben a vírus aktiválja az interferon gént (indukció), amelyik a sejt riboszómáival letermelteti az interferonokat és ezek az interferonmolekulák a második sejtben fejtik majd ki vírusellenes hatásukat Amíg az indukció előfeltétele a vírusfertőzés, addig a vírusellenes hatás kifejlődéséhez az interferonnak meg kell előzni a fertőző vírust a fogékony sejt eléréséért vívott küzdelemben. A vírussal fertőzött sejtekhez, ha interferont adtak, a vírus multiplikációja zavartalanul folyt tovább. Ugyanakkor, ha a vírusfertőzés előtt kezelték a sejteket interferonnal, a sejt fertőződését, illetve a vírus multiplikációját gátolni tudták. A vírusok nagy valószínűséggel azért képesek aktiválni az interferon gént, mert a fertőzés során a vírusfehérjék gátolják a sejt saját fehérjeszintézisét. Ennek eredményeként a sejt nem tud elegendő interferon gént represszáló fehérjét termelni, így megindulhat az interferon fehérjék szintézise. Az interferontermelés a fertőzés után 2 4 órán belül megkezdődik, és maximumát a vírusfehérje-szintézis csúcspontján éri el, majd mennyisége (és ezzel párhuzamosan hatékonysága is) 1 2 nap után drasztikusan csökkenni kezd. Ezek az interferonmolekulák a saját sejtjüket már nem tudják megvédeni az aktivációjukat elősegítő vírus károsításától. Ahhoz, hogy az interferonok 200
221 Virológia antivirális hatásukat a környező sejt(ek)ben kifejthessék, két fontos lépést kell megtenniük: el kell hagyniuk az őket létrehozó sejtet és kapcsolódniuk kell a vírusfertőzésre még fogékony sejt membránjához Interferonok antivirális hatása Az interferonmolekulák a vírusfertőzésre még fogékony sejt sejtmembránjának interferonreceptoraihoz kapcsolódnak. Az interferonreceptorok glükoproteinekből épülnek fel. Két különböző interferonreceptort ismerünk. Az egyikhez kapcsolódik az IFNα és/vagy az IFNβ, a másikhoz kizárólag az IFNγ. A tumorsejtek több IFNγ-receptort hordoznak, mint a normál sejtek. A membránkapcsolat fontosságát bizonyítja, hogy a sejt plazmájába közvetlenül injektált interferon nem fejtett ki vírusellenes hatást. A receptorhoz kapcsolódó interferon mélyreható változásokat hoz létre a sejtmembránban, amelynek eredményeként a lipid kettős réteg merevvé válik és az egyes membránkomponensek újraépülése, pótlódása felfüggesztődik vagy megszűnik. Az ebből adódó strukturális változások már önmagukban is gátolják a vírusszaporodás egyes lépéseit, úgymint az adszorpciót, a penetrációt és a víruskiszabadulást. Az adszorbeálódott interferon a sejtfúzió gátlása révén megakadályozza a sejtből sejtbe történő vírusterjedést és a sejttranszformáció gátlásával, a tumorvírusok és retrovíruok szaporodását. A sejtmembránban lejátszódó események hatással lesznek a cytoplasmában zajló vírusszaporodási folyamatokra is (96. ábra). 96. ábra - Az interferonok vírusellenes hatása Amikor az IFNα és IFNβ a receptorokhoz kapcsolódik, egy olyan kaszkádreakció indul be, aminek eredményeként a sejt cytoplasmájában három különböző enzim szintetizálódik: a 2,5-oligoA szintetáz, az L RN-áz (endoribonukleáz) és aproteinkináz. Ezek az enzimek különböző mechanizmusokon keresztül gátolják a vírusfehérjék szintézisét. A 2,5-oligoA szintetáz aktiválja az L RN-ázt, ami endoribonukleázként működveszéttördeli az mrns-eket. Alternatív úton, az interferonok az mrns-ek (5 G-cap) metilizációját is gátolják, aminek eredményeként az mrns-ek nem tudnak a riboszómákhoz kapcsolódni. A vírus-mrns-ek enzimatikus emésztése és metilizációjának gátlása lehetetlenné teszi a transzlációs folyamatok elindulását. Mivel az RNSvírusoknál az mrns-ek pozitív szálú templátként (+RNS) is funkcionálnak, károsodásuk a replikáció blokkolását okozza (lásd RNS-vírusok replikációja). Interferonhatásra a normál sejtben inaktív 67kD proteinkináz aktiválódik. A proteinkináz a peptidláncok kialakulását gátolja. Megfigyelték, hogy interferonkezelésre nem mindig aktiválódik a proteinkináz, ugyanakkor néhány esetben a cytoplasmában zajló vírusellenes hatást egyedül hajtotta végre (93. ábra). Több 201
222 Virológia vírus interferonrezisztenciája annak köszönhető, hogy olyan fehérjét szintetizál, amely képes inaktiválni a proteinkinázt (adenovirus, ortomyxovírus). Az interferonok speciális vírusellenes hatását fedezték fel egerek influenzavirussal való fertőzésekor. Az IFNα és IFNβ aktiválták az egerek kromoszómájában jelenlevő ún. Mx-gént, amelynek fehérjetermékei drasztikusan gátolták az influenzavirusok transzkripcióját, ma még nem tisztázott mechanizmusokon keresztül. A fentiekben részletezett vírusellenes hatást kizárólag az IFNα és az IFNβ váltja ki. Az IFNγ annyira elkülönül az IFNα és IFNβ géncsaládoktól, hogy indukcióját vírusokkal nem is lehet kiváltani. A kizárólag lymphocyták által kódolt IFNγ gének indukciója csak specifikus antigének vagy mitogének hatására megy végbe. Az IFNγ valójában az immunreguláció szabályozása révén fejti ki gátló hatását a vírusok szaporodására. Az immuninterferonnak is nevezett IFNγ és az immunrendszer kapcsolatát az Immunológia c. fejezet tárgyalja részletesen Interferonok terápiás alkalmazhatósága Az interferonok a rendkívül magas előállítási költségek miatt az állatgyógyászatban nem terjedtek el (nagyon ritkán, pl. influenzavirussal fertőződött értékes sportlovak gyógykezelésére használták). Az IFNα terápiás jelentősége a humán daganatos betegségek gyógykezelésében számottevő. (papilloma, lymphoma, mononucleosis infectiosa, hairy cell leukémia). A malignus daganatokra csak részleges hatásuk van. Az interferont jelenleg az emberi krónikus (aktív) hepatitisek (HCV, HBV, HDV) kezelésében alkalmazzák. A HCV (hepatitis C vírus) terápiában az interferon önmagában 50%-os gyógyulást, míg a vírus ellenes szerrel (RIBAVIRIN) kombinálva közel 100%-os felépülést eredményezett. Az interferonok vírusellenes hatását a terápiában nehezen tudták felhasználni a következő okok miatt: a terápiás dózis előállítása rendkívül költséges (újabban géntechnikai eszközök alkalmazásával próbálják csökkenteni az előállítás és a tisztítás költségeit, pl. klónozás), az IFN kizárólag parenterálisan alkalmazható, a mesterséges IFN induktorok (poly I:C) mérgezők (a toxikus és hatékony dózis közel esik egymáshoz), az interferon rövid ideig hatékony (pár órán belül lebomlik és a vesén át kiürül a szervezetből), ezért a kezelést gyakran kell ismételni, ami az alkalmazási nehézségek mellet a kezelés költségeit is jelentősen növeli, rosszindulatú (malignus) daganatok gyógykezelésénél életen át kellene adni, súlyos toxikus mellékhatások (láz, orrváladékozás, hányás, anorexia, myalgia, leukopénia stb.) lépnek fel, (az influenzafertőzések során fellépő hasonló klinikai tünetek is valószínűleg az interferonok toxikus hatására vezethetők vissza). A vírusellenes interferonterápia jövőbeni jelentőségét elsősorban olyan életveszélyes vírusfertőzések, mint pl. a veszettség, a haemorrhagiás láz és az encephalitis halálos kimenetelének a megakadályozásában látják Sejttranszformáció (oncogenesis) A vírus sejt kapcsolat egyik különleges formája a sejttranszformáció. Megfigyelték, hogy egyes vírusok a sejtbe jutásuk után a sejt növekedési és osztódási képességét megváltoztatják. Egyrétegű sejttenyészetekben ez a hatás jól azonosítható sejtmorfológiai változással jár, amit a folyamat alapján sejttranszformációnak, a folyamat eredménye alapján mikrotumornak nevezünk (97. ábra). A szervezet szintjén, a szöveti kötelékekben kialakuló sejttranszformáció a tumor vagy daganat. A tumor sejtkárosító hatásának és szervezeten belüli terjedőképességének (áttétképződésének) mértéke alapján megkülönböztetünk jóindulatú (benignus) és rosszindulatú (malignus, rákos) daganatokat. A malignus tumorok elnevezése attól függ, hogy milyen sejttípusban alakult ki a tumor (pl. carcinoma: epithelsejt, sarcoma: mesenchymasejt, lymphoma, leukémia: lymphocyta). A tumorképződés folyamatát tumorgenezisnek vagy az ezzel szinonim oncogenezisnek vagy carciongenezisnek nevezik. 97. ábra - Malignus transzformáció (mikrotumor) egyrétegű szövettenyészetben (900 ) (Nász I. felvétele) 202
223 Virológia Az utóbbi évtizedek kiterjedt kutatásai bizonyították, hogy a sejttranszformáció speciális fehérjékhez (oncoprotein) kötött tulajdonság. Ezeknek a fehérjéknek a genetikai kódját onkogénnek nevezik. Az eukaryota sejtek kromoszómájában megtalálható oncogéneket sejt onkogénnek (c-onc,cellular-oncogen)vagy proto onkogénnek (ősi), a vírusokban azonosított oncogéneket vírus onkogénnek (v-onc) nevezik (98. ábra). 98. ábra - A c-onc- és v-oncgének elhelyeződése a genomban A c-oncgének ősi gének, mivel az élesztősejtektől az emberig minden fajban megtalálhatók. Evolúciós szerepük valószínűleg a sejtosztódás és a sejtdifferenciálódás szabályozásában keresendő. Talán ez az oka annak, hogy az eukaryota sejtek kromoszómájának kb. 5%-át c-oncgének alkotják. A c-oncgének univerzális és konzervatív jellegét bizonyítja, hogy pl. a muslica (Drosophila) és az ember c-oncgénje (c-sarc) 95%-ban azonos szekvenciával rendelkezik. A sejt oncogének által kódolt oncoproteinek a sejtmembránban és a cytoplasmában, a sejt jelző rendszerének (short-term signal chain) tagjaiként funkcionálnak, a sejtmagban található oncoproteinek pedig nagy 203
224 Virológia valószínűséggel részt vesznek a DNS-replikáció és a transzkripció szabályozásában. Élettani körülmények között az oncoproteinek termelése szigorú kontroll alatt áll. Ha ez az ellenőrző rendszer felborul, az oncoproteinek tevékenysége a sejt transzformációjához és ezen keresztül a daganatok kialakulásához vezet. A vírusokban található v-oncgének valójában a sejtből származó c-oncgének. Ezt bizonyítja, hogy a c-onc- és v- oncgének (néhány, pontmutációból adódó nukleotid különbségtől és a v-oncgének intronhiányától eltekintve), majdnem teljesen azonosak. Az említett különbségek evolúciós eseményekre vezethetők vissza. A v-oncgénnel rendelkező vírusok (pl. egyes retrovirusok) multiplikációja során c-oncgének épültek be a vírus genomjába és annak szerves részévé váltak. A v-oncgéneknek nincs szerepük a vírus multiplikációjában, ezért a vírus számára nem lényeges (non essential) fehérjéket kódolnak. A v-oncgének által kódolt oncoproteinek a sejt transzformációját okozzák Az oncogenitás mechanizmusa A sejttranszformáció kialakulásának okai és folyamatai még nem teljesen tisztázottak. Azt azonban biztosan állíthatjuk, hogy a daganatképzésért minden esetben a sejt által kódolt c-oncgén a felelős, egy kivételtől eltekintve, amikor a sejtet megtámadó vírus szállítja a transzformációt okozó (bár szintén a sejtből származó) v- oncgént. A v-oncgénnel rendelkező vírusok éppen ezért különleges helyet foglalnak el a daganatkutatásban Vírusok által kiváltott daganatképződés V-oncgént hordozó vírusok a sejtbe jutva mindig daganatot okoznak, mivel a vírusmultiplikáció során a vírus saját fehérjéjeként nagy mennyiségben termelődő oncoproteinek kontroll nélkül fejthetik ki a sejt transzformációjához vezető hatásukat. A v-oncgént hordozó retrovirusok a v-oncgén (pl. sarcgén) hordozásáért nagy árat fizetnek, ugyanis a v-oncgén valamelyik létfontosságú vírusgénszakaszba (gag, pol, env) épül be. Ebből adódóan a v-oncgént hordozó retrovirusok kizárólag v-oncgént nem hordozó rokon vírussal pl. leukózisvírussal együtt képesek fertőzni a sejtet. Ez az oka annak, hogy pl. macskákban a szarkómavírus- (FSV) fertőzés viszonylag ritkán fordul elő, de olyankor minden esetben malignus daganatos megbetegedést, sarcomát okoz (a sarcgénnek köszönhetően), és biztosak lehetünk abban, hogy az FSV-vel fertőzött macska leukózisvírussal (FLV) is fertőzött volt (17. táblázat). 17. táblázat - Retrovirus gének és funkciójuk Gének Funkció gag pol env csoportspecifikus antigén: core és kapszid fehérje polymeráz: reverz transzkriptáz, proteáz, endonukláz burok fehérje * tax/tex tat rev (art, trs) nef (F, 3' orf, B) vif (Q, sor, A) vpr (R) vpx (X) transzaktiváció transzaktiváció, HIV replikáció szabályozás gén szabályozás (HIV-replikáció) negatív korai faktor (expresszió szabályozás) vírus fertőzőképesség kifejeződése, replikáció kezdetét segíti nem ismert nem ismert 204
225 Virológia LTR (Long terminal repeat) promoter, enhancer (génszabályozás) * csak a lentivirusokban előforduló gének V-oncgént nem tartalmazó vírusok esetében a vírus fehérjéi zavart okoznak a sejt onkogénjének szabályozásában és ezért a sejt transzformációját tulajdonképpen a represszált állapotból felszabaduló c-oncgén által termelt onkoproteinek hajtják végre. Ezt a jelenséget DNS vírusoknál figyelték meg. A DNS vírusoknál kimutatták, hogy az episzomális állapotú vírusnukleinsavakról termelődő vírusfehérjék (T-antigén, EGF, E1) képesek megkötni a sejt által termelt ún. antionkogén fehérjéket (p53, anti-rb), amelyek a c-oncgének működését szabályozzák. Ennek eredményeként a sejt S fázisba kerül és az intenzívvé váló sejtosztódás jóindulatú daganat képződését eredményezheti (immortalizáció). Az esetek egy részében azonban megszűnik a vírus episzomális állapota és a vírusgenom integrálódik a sejt genomjába. Az integráció lesz az első lépés a rosszindulatú daganat kialakulásához vezető úton (transzformáció). Az integrációval a vírus nemcsak végteleníti a sejt osztódását, de a felfokozott replikációs folyamatok során az antionkogénekben is bekövetkezhetnek mutációk. Ezek, az antionkogénekben bekövetkező mutációk eredményezhetik végsősoron a sejt malignus transzformációját. A herpesvirusok közül a Gammaherpesvirinae alcsaládba tartozó vírusokról mutatták ki, hogy daganatképződést indítanak el a szervezetben. A korábban Gammaherpesvirinae alcsaládba tartozó Marekbetegség vírusa (GHV 2) a T lymphocyták transzformációját indítja el, ami a szervezet szintjén letális kimenetelű generalizált lymphadenosis kifejlődéséhez vezet. A lymphadenomákban nem lehet víruspartikulákat kimutatni (abortív fertőzés). A produktív fertőzés lehetőségét a Marek betegség vírusa a tolltüsző hámsejtjeiben találja meg, ami rendkívül jó lehetőséget biztosít az utódvirionoknak a populáción belüli terjedésre (A tollverdesés során leváló hámsejtekben levő vírust könnyen felveszi a fogékony baromfi). Az Epstein Barr-vírus (EBV) kizárólag a B lymphocytákban okoz transzformációt. A transzformáció kialakulását kofaktorok segíthetik (pl. Burkitt-lymphomáknál a malária miatti immunszupresszió és a 6 hónapos kornál korábbi EBV fertőzés, a Singapur köré húzott 1500 km sugarú körön belül pedig a sózott hal nagymértékű fogyasztása okozza a malignus daganatok kifejlődését.) Az EBV által okozott rákokban a c- myconkogént az ellenanyag-termelő promoterek működtetik a B-lymphocitákban. A papillomavirus-fertőzéskor kialakuló transzformáció az emlős állatfajok bőr- és nyálkahártyájában benignus tumorok kialakulásához vezet. Habár ezek a tumorok legtöbbször spontán gyógyulnak, néhány esetben bizonyos kofaktorok hatására malignussá válnak. Ilyen malignustranszformációt írtak le szarvasmarháknál Skóciában, ahol a zsurlófű legelése vezetett a malignustranszformáció kialakulásához. Hasonló jelenséget írtak le Texasaban és Ausztráliában, ahol a napsugárzás hatására vált malignussá a szarvasmarhák bőrpapillomatózisa. Az emlős-papillomavirusok rágcsálóba oltva is kiváltanak sejttranszformációt. A transzformálódott sejtekben nem találtak viriont. A bovin- papillomavirus egy esetében bizonyították, hogy a vírus-dns 69%-a már elindítja a transzformációt. A hepadnavirusok közé tartozó Hepatitis B vírus világszerte elterjedt, és az általa kiváltott hepatocelluláris carcinoma az egyik leggyakoribb letális humán daganatos megbetegedés. A vírus nemcsak emberben hanem az amerikai mormotában (Marmota monax) és a pekingi kacsában is májdaganatot okoz. A vírus ugyan integrálódik a sejtgenomba, de a transzformáció megindításának stratégiáját még nem tisztázták. Egyes poxvirusokról bizonyították, hogy benignus tumorokhoz vezető sejttranszformációt hoznak létre. A transzformációért feltételezhetően a vírusfehérjék közvetlenül játszanak szerepet. A vacciniavirus-fertőzéseknél pl. kimutatták, hogy az egyik korai virusprotein az epidermális növekedési faktorral homológ szerepet képes betölteni, ezért ez a korai fehérje felelős azoknak az epidermális hiperpláziáknak a kialakulásáért, ami a vaccinavirus-fertőzések bemeneti kapujában megfigyelhetők. Hasonló benign tumorképződés figyelhető meg nyulakban a Leporipox genusba tartozó nyúlfibromatózisvirusfertőzésnél, madarakban a bőrön keresztüli Avipox vírusok okozta fertőzésnél és Rhesus majmokban a Yabapoxvirus fertőzése során. Ezekben az esetekben a tumorképződés mechanizmusa még nem tisztázott Vírus jelenléte nélkül kialakuló daganatképződés Mutáció hatására aktiválódik a represszált állapotban levő c-oncgén, és ez az esemény sejttranszformációt okozó oncoproteinek termeléséhez vezet. Ilyen mutációt okoznak a carcinogen anyagok, a sugárzás (pl. a csernobili atomerőmű katasztrófája) és a DNS-replikáció során előforduló spontán átírási hibák. 205
226 Virológia A sejt osztódása során, környezeti hatásra megnőhet a c-oncgének száma (gén-amplifikáció), ami még a represszált állapot ellenére is olyan mértékben megnöveli az oncoproteinek mennyiségét, hogy az a sejttranszformáció megindulásához vezet. Az ugráló gén (transzpozíció) jelensége alapján ismert, hogy egyes gének (pl. ellenanyagokat kódoló gének) megváltoztatják a kromoszómán belül elfoglalt helyüket. Epstein Barr-vírus-fertőzéseknél megfigyelték a c- oncgének transzpozícióját, aminek eredményeként megindult a sejt transzformációja. Feltételezik, hogy egyes retrovirusok is kényszeríthetik a c-oncgéneket transzpozícióra Latens fertőzés A vírus sejt kapcsolatok azon különleges helyzete a latens fertőzés, amikor a vírus saját elhatározásából felfüggeszti a multiplikációját, és ezért átmenetileg nem termelődnek utódvirionok, vagyis a latencia alatt a fertőzés abortív jelleget ölt. Latencia alatt a vírus csak nukleinsav (és esetleg transzkriptek) formájában van jelen a sejtben. A latencia mind a sejt, mind a vírus számára a legkedvezőbb együttélést jelenti, ugyanis a latens fertőzés alatt a vírus nem károsítja a sejtet (mivel nincs vírusfehérje-szintézis), és ezért a sejt is eltűri a vírus jelenlétét, ami evolúciós szempontból a vírusnak rendkívül kedvező túlélési lehetőséget biztosít (noncytocidal fertőzés). A latens állapot a sejtek, sejtvonalak passzálása során is fennmaradhat. A latencia a reaktivációval szűnik meg, amikor a latens állapotban levő vírusgenomról megindul az utódvirionok szintézise (az alvó vírus felébred). Éppen ezért a reaktiváció eredménye mindig produktív fertőzés lesz. A reaktiváció okait és pontos mechanizmusát még nem ismerjük, de pl. a kortizonmolekulákról bizonyították, hogy a sejtbe jutva képesek reaktiválni a latens vírusgenomot. A reaktiváció után ismételten kialakulhat a latens állapot. A latens állapot laboratóriumi diagnosztikája a latens vírusgenom (vagy vírustranszkript) kimutatásán és/vagy reaktiválásán alapszik. A latens genom vagy transzkript azonosítása nukleinsav-hibridizációval (in vitro, in situ) történik, a reaktivációt pedig az ún. ko-kultivációs módszerrel hajtják végre. A ko-cultivációs módszer egyik fajtája, amikor egyrétegű sejttenyészetre egy fertőzött állat olyan szervdarabkáját helyezzük, amelyik a latens vírust feltételezhetően tartalmazza (cell and organ culture). Azon a felületen, ahol a szervdarabka és a sejttenyészet membránjai érintkeznek, sejtfúzió indul meg. Valószínűsíthető, hogy a sejtfúzióhoz szükséges fehérjék termelésének transzkripciós és transzlációs folyamatai játszanak szerepet a reaktivációban, de erre vonatkozóan közvetlen bizonyítékaink még nincsenek. A reaktiváció eredményeként termelődő utódvirionok elhagyják a szervdarabka sejtjeit, és az egyrétegű szövettenyészet sejtjeit fertőzik meg, ahol többnyire jól azonosítható cytopathologiás elváltozást (CPE) okoznak. A latenciát a herpesvirus és a retrovirus-fertőzések során vizsgálták részletesen. A retrovirusok multiplikációs stratégiája a latens állapot kialakítására irányul. A retrovirusok esetében éppen a reverz transzkripció teremti meg a lehetőséget arra, hogy a +RNS-vírusgenom DNS/2-ként integrálódni tudjon a sejt kromoszómájába. Ezért a retrovirusoknál a latencia tulajdonképpen az első DNS/2 megjelenésétől az első utódvirion kialakulásáig tart. A retrovirusok nukleinsava a latencia alatt integrálódott formában van jelen. Bizonyították, hogy a sejtbe jutó kortizonmolekulák közvetlenül képesek reaktiválni az integrálódott retrovirusgenomot. A reaktivációt követően a transzkripciós és transzlációs folyamatokat a gazdasejt enzimei végzik. A herpesvirusok legfontosabb élettani jellemzője a latencia. A latencia kialakulását a vírus által kódolt ún. latenciához kapcsolódó mrns-ek vagy LAT-ok (Latency Associated Transcript) irányítják A humán herpesvirusoknál (HSV 1) eddig 6 különböző LAT-ot azonosítottak. Az Alphaherpesvirusok által latensen fertőzött sejt kb vírusgenomot tartalmaz. Latencia alatt a herpesvirusgenom extrakromoszomálisan, cirkuláris formában (episzoma) van jelen a sejtmagban. Betaherpesvirusoknál (cytomegalovirus, Epstein Barrvirus) előfordul, hogy a latens vírusgenom integrálódik a sejt kromoszómájába. A humán herpesvirusok esetében megfigyelték, hogy a virulens vírustörzseknél magasabb hatásfokkal ment végbe a reaktiváció, mint az avirulens törzseknél. Bizonyos deléciós mutánsok kialakítanak ugyan latenciát, de nem reaktiválhatók. Ezért diagnosztikai szempontból nagyon fontos, hogy a reaktiváció negatív eredménye még nem jelenti a latencia hiányát. Herpesvirusoknál a latencia a LAT-ok azonosításával (hibridizációval) igazolható Perzisztáló fertőzés A sejt vírus kapcsolatokban perzisztáló fertőzés akkor alakul ki, ha a vírus multiplikációja során nem pusztítja el a sejtet. A perzisztáló fertőzés tehát egy olyan együttélési forma, amelyben a sejt megtartja életfunkcióit, miközben folyamatosan termeli az őt fertőző vírusokat(produktív fertőzés). Perzisztáló fertőzést elsősorban a 206
227 Virológia nem cytopathogen (noncytocidal) vírusok hoznak létre (arenavirusok, retrovirusok, néhány paramyxovirus, pestivirus). A perzisztensen fertőzött sejtekben a vírustermelés mindenképpen anyag- és energiaveszteséggel jár, de ez általában nem olyan mértékű, ami a sejtnövekedés vagy a sejtosztódás megszűnését okozná. Ennek köszönhetően a perzisztensen fertőzött sejtek osztódásuk után is folyamatosan ürítik a vírusokat. Ez a vírus számára komoly evolúciós előnyt jelent, mivel sejtgenerációkon keresztül fenntarthatja a sikeresen elindított multiplikációját. Habár a perzisztensen fertőzött sejtek hosszú ideig megtartják osztódóképességüket, a folyamatos energia- és tápanyagveszteségek előbb-utóbb egy lassú progresszív változást okoznak a sejt anyagcseréjében, ami végül is a sejt halálához vezet. Szervezeten belül egyes szervekben olyan gyorsan váltódnak vagy pótlódnak a szöveti kötelékben levő sejtek (pl. bélhám, epidermisz), hogy a perzisztensen fertőzött sejtek, sejtcsoportok halála legtöbbször nem okoz kiesést a szerv funkciójában. A perzisztensen fertőzött egyrétegű szövettenyészeteket nem lehet használni vírusdiagnosztikai célra (pl. vírusizolálás, VN próba) mivel a perzisztens fertőzést kialakító vírus már előre lefoglalta az izolálandó vírus multiplikációjához szükséges enzimeket és sejtorganellumokat. A sertéspestisvirus avirulens törzsei perzisztens fertőzést okozhatnak sertés eredetű sejtvonalakban (PK IBR 2). A sejtvonalak perzisztens fertőzöttségének felismerését megnehezíti a cytopathogen hatás (cytopathogenic effect, CPE) hiánya, ezért a sejtvonalak ellenőrzése során a perzisztáló vírus jelenlétére az izolálás mellett a vírus nukleinsavát és/vagy fehérjéit kimutató jelzéses módszerekkel (IF, immunperoxidáz-próba, nukleinsavhibridizáció stb.) következtetünk. Ritka esetekben a perzisztensen fertőzött sejtvonalakat vírus- vagy vírusantigén-termelésre is használhatjuk (pl. szarvasmarha-leukózisvirus) Lítikus fertőzés (cytolysis) Amikor a vírusfertőzés a sejt halálához (líziséhez) vezet, litikus fertőzésről beszélünk. A sejt szempontjából végzetes kimenetelű cytolysis mindig produktív fertőzés eredménye, vagyis vírustermeléssel járó folyamat. A lítikus fertőzést elindító vírus a sejtkárosító hatását (CPE) a multiplikációja során, a következő folyamatokban fejti ki: Egyes vírusok már az adszorpciójuk révén közvetlenül is károsítják a sejtmembránt (pl. az adenovirusok peptonfehérjéi önálló toxikus hatást fejtenek ki). A korai transzkripció és transzláció során termelődő fehérjék leállítják vagy gátolják a sejt saját fehérjéinek termelését (poliovirusok, herpesvirusok, poxvirusok, togavirusok). A DNS-vírusok korai fehérjéi gátolják a sejt kromoszomális DNS-ének és mrns-ének szintézisét (herpesvirusok, adenovirusok). A folyamatosan termelődő vírusfehérjék, nuklokapszidok felhalmozódnak és toxikus hatásuk mellett még szinte kiszorítják a sejtalkotókat is (pl. adenovirusok, picornavirusok). Ez a folyamat vezet a zárvány (inclusion body) kialakulásához. Burkos vírusok a sejtmembránba ágyazzák burokfehérjéiket, aminek következtében megváltozik a membrán permeabilitása. Ez az ozmotikus viszonyok felborulásához vezet (herpesvirusok). A legtöbb vírus depolimerizálja a sejtstruktúrát és a sejtorganellumok transzportját biztosító cytosceletont, ami a sejt lekerekedése néven ismert cytopathogen hatást okozza. A cytosceletonkárosítás a makromolekulák szintézise során következik be. (A cytosceleton depolimerizációját elsősorban a herpesvirusok és a szopornyicavirus estében tanulmányozták.) Egyes burkos vírusok (herpesvirus, paramyxovirusok) speciális felszíni fehérjével rendelkeznek (fúziós protein), amelyek a sejtmembránba ágyazódva a szomszédos sejtek sejtmembránjainak összeolvadását (sejtfúzióját) okozzák. A sejtfúzió végső soron a szomszédos sejtek membránstruktúrájának teljes feloldódásához és a sejtplazma összeolvadásához, vagyis syncytium képződéshez vezet. A felsorolt sejtkárosító hatások önállóan és kumulatív úton is jelentkezhetnek a fertőzött sejtben, és ennek eredményeként fénymikroszkópos vizsgálattal jól elkülöníthető morfológiai elváltozásokat figyelhetünk meg. 207
228 Virológia Ez a morfológiai változás (CP-hatás) egyes vírusok esetében diagnosztikai értékű lehet, habár a vírusok azonosításához ma már szerológiai és immunhisztokémia módszerek is elengedhetetlenül szükségesek. A vírusok által okozott cytopathogén elváltozásokat egyrétegű szövettenyészetekben tanulmányozhatjuk fénymikroszkópos vizsgálattal. Egyes cytopathogén hatások festetlen, élő sejtkultúrákban is felismerhetők (pl. sejtlekerekedés, syncytiumképzés, sejtleválás), de a sejtkárosító hatások többsége csak metanollal fixált és kontraszt festékkel (hematoxilin-eosin, Giemsa) festett sejttenyészetben azonosítható (zárvány, rögösödés, vakuolás elfajulás stb.). A leggyakoribb CP-hatásokat az alábbiakban foglaljuk össze (18. táblázat). 18. táblázat - Vírusok cytopathogén hatása Cytopathogen hatásmechanizmus Sejt fehérje szintézisét gátolják Sejt DNS + inaktiválják, széttördelik Sejt membrán struktúrát változtatják gliboprotein beépülés A hatást kiváltó vírusok herpesvirusok, poliovirusok, tógavirusok, poxvirusok, herpesvirusok minden burkos vírus herpesvirusok, paramyxovirusok, HIV syncytium cytoszkeleton darabolódik Permeabilitás megnő virion komponens toxikus apoptózis (programozott sejthalál) transzformáció herpesvirusok tógavirusok, herpesvirusok adenovirusok pepton-fehérjéi adenovirusok, circovirusok, papovavirusok, herpesvirusok, retrovirusok Zárvány. A zárványok a nukleokapszid-összeépülésének a helyén jönnek létre. Elektronmikroszkópos vizsgálatokkal látható, hogy a zárványok tulajdonképpen nukleokapszidok tömegéből álló vírusraktárak. Mivel az akkumulálódott nukleokapszidok az összeépülés helyéről kiszorítják a sejtorganellumokat, a zárvány körül fénymikroszkóppal jól megfigyelhető világos udvar, ún. halo keletkezik. A halo mellett a homogén festődés segít a zárvány felismerésében. Sejtbeli helyeződésük alapján magzárványokat és cytoplasmazárványokat különítünk el (99. ábra). 99. ábra - A sejtzárványok típusai (Fenner (1987) után módosítva) cytoplasma 208
229 Virológia Magzárványokat azok a DNS-vírusok okoznak, amelyek replikációja és nukleokapszidjainak összeépülése a sejtmagban történik (herpesz-, adeno-, papova-, parvovirusok). A szintén DNS-nukleinsavval rendelkező poxvirus és az afrikai sertéspestisvírus a cytoplasmában alakít ki zárványt (mivel replikációjuk és nukleokapszidjuk összeépülése a sejtplazmában megy végbe). A magzárványok alakjuk és festődésük alapján elkülöníthetők, de ennek ma már nincs diagnosztikai jelentősége (pl. Cowdry-A és -B). A zárványok alakja ugyanis döntően attól függ, hogy a vírus makromolekuláinak szintézise éppen milyen fázisban van. Herpesvirusoknál megfigyelték, hogy a zárványképződés intenzitása függ a sejt típusától is (pl. Aujeszky vírus nyúl vesesejtben (RK sejtvonal) kifejezettebb zárványképződést okoz, mint más fajok sejtjeinek fertőzésekor). Cytoplasma-zárványokat az RNS-vírusok (és a DNS-genommal rendelkező poxvirus és az afrikai sertéspestis virusa) alakítanak ki, mivel a replikáció és a nukleokapszid-összeépülés is a cytoplasmában zajlik. Ebből a szempontból külön csoportot képviselnek a retrovirusok, amelyeknél a replikáció a sejtmagban, a nukleokapszid-összeépülés azonban a cytoplasmában megy végbe (ez az egyetlen ismert víruscsalád, ahol az összeépülés nem a replikáció helyén történik). A cytoplasmazárványok többnyire eosinofil festődésű képletek, 209
230 Virológia és gyakran gyűrűszerűen veszik körül a sejtmagot (pl. reovirusok). Poxvirusok multiplikációja során mind basofil, mind eosinofil festődésű zárvány előfordul. A cytoplasmazárványokat körülvevő halo sokkal kifejezettebb, mint a magzárványok esetében. A zárványképzés egyes esetekben diagnosztikai értékű, mint pl. Negri-test (veszettség vírusa, cytoplasmazárvány), bagolyszem (cytomegalovirus, magzárvány); Guarnieri-féle testek (poxvirus, cytoplasmazárvány). Sejtek lekerekedése. AzRNS- (pl. picornavirus) és DNS- (pl. herpesvirus, adenovirus) vírusok egyaránt kialakítják ezt az egyik leggyakoribb cytopathogen hatást. Festetlen sejtkultúrákban a kettős fénytörésű (autókerékszerű sejthatárral rendelkező) kerek sejtek már jelzik a lekerekedésben megnyilvánuló cytopathogen hatást. Ezek a sejtek viszonylag hamar kiszabadulnak a szöveti kötelékből és leválnak az üveg faláról. Festett sejttenyészetben a lekerekedett sejtek intenzívebben festődnek. A sejt lekerekedését az ozmotikus viszonyok megváltozása okozza (100. ábra). A sertés-enterovirusok esetében a sejtlekerekedés a pathogen törzsekre jellemző (differenciál diagnosztikai értékű) CP-hatás, mivel az apathogen törzsek a sejtek szétrobbanását okozzák ábra - Vírusok cytopathogen hatása (sejtlekerekedés). Aujeszky-vírussal (K-61 törzs) fertőzött sertésvesesejt (SEM 1400 x) Sejtfúzió, syncytiumképzés. A sejtfúziót kizárólag burokkal rendelkező vírusok alakíthatják ki, mivel az eseményt a fertőzött sejt membránjába beépült vírusfehérjék irányítják. A vírus által kódolt fúziós proteinek (pl. 210
231 Virológia paramyxovirusoknál az F-protein) a késői transzláció után jutnak el a sejtmembrán azon szakaszaihoz, ahol a vírus majd el fogja hagyni a sejtet. A fúziós proteinek a szomszédos sejtek közötti membránkapcsolatok feloldásával összeolvasztják a fertőzött és nem fertőzött szomszédos sejteket, így hatalmas közös plazmájú óriássejtek jönnek létre, amelyekben a sejtmagok csoportba verődve vagy koszorú alakban láthatók. Ezek az óriássejtek membránalagutakon keresztül kapcsolatba maradnak egymással, és kialakul a syncytium (101. ábra). A syncytium kiváló lehetőséget biztosít a vírusnak az intracelluláris terjedésre (ez a szervezet szintjén történő fertőzéskor rendkívüli előnyt jelenthet a vírusnak az immunrendszerrel szemben). A sejtek lekerekedése és a sejtfúzió a natív (nem festett) egyrétegű szövettenyészetben is jól elkülöníthető a nem fertőződött sejtektől (102. ábra) 101. ábra - Vírusok cytopathogen hatása (syncytium) Aujeszky-vírussal (utcai vírustörzs) fertőzött sertésvesesejtek (SEM 1400 ) 102. ábra - Nem fertőzött egyrétegű sertésvese-sejttenyészet (SEM 1400 ) 211
232 Virológia A DNS-vírusok közül egyedül a herpesvirus (Alphaherpesvirinae), az RNS-virusok közül több viruscsalád (paramyxo, corona, RS stb.) is képez syncytiumot. A herpesvirusoknál a syncytiumképzés intenzitása függ a vírustörzs virulenciájától és a fertőzött sejt típusától. Egyéb cytopathogen hatások. A hemadszorpció egy olyan sejtmembrán-károsítással járó esemény, amikor a sejtmembránba beépült vírusfehérje képes megkötni a sejt felületén a vörösvérsejteket. Hemadszorpciót azok a burkos vírusok alakítanak ki, amelyek vörösvérsejtet megkötő (agglutináló) felszíni fehérjével (HA) rendelkeznek. A jelenséget a laboratóriumi vírusdiagnosztikában (hemadszorpciós próba) is alkalmazzuk, egyes vírusok (paramyxovirus, afrikai sertéspestis virusa) felismerésében. A további cytopathologiás elváltozások, mint a sejtek rögösödése (parvovirus), sejtek vakuolizációja (BVD-, adenovirus, Aujeszky-virus) festett sejtkultúrákban tanulmányozhatók. A felsorolt sejtkárosító hatások együtt és külön-külön is a sejt lízisét okozzák, ami végső soron a sejt halálához vezet. Nem vírusspecifikus sejtkárosító hatás jön létre a szövettenyészet elöregedése, a tápfolyadék ph-jának, az inkubáció hőmérsékleténekmegváltozása miatt. A vírusizolálásra nem kellően előkészített minta (pl. bélsár), toxintartalma, baktériumos fertőzöttsége (pl. mycoplasma, leptospira) olyan degenerációkat hozhat létre a sejttenyészetben, ami könnyen összetéveszthető a vírusok által okozott CP-hatással. Ezekben az esetekben több 212
233 Virológia laboratóriumi diagnosztikai módszer (szövetátoltás, VN próba, immunhisztokémia stb.) összehangolt alkalmazása segít a specifikus és nem specifikus CP-hatások elkülönítésében. A sejttenyészetben kialakuló cytopathogen hatás nem minden esetben jelenti a vírus szervezetre kifejtett pathogen hatását is. Az árva (orphan) vírusok egy része kifejezett cytopathogen hatást mutat, de az állatban nem okoz klinikai tünetekben megnyilvánuló fertőzést. Ugyanakkor a sertéspestis vírusa sertéssejtvonalakon nem fejt ki cytopathogen hatást, de a szervezet szintjén történő fertőződés legtöbbször a sertés elpusztulásához vezet Vírus szervezet kölcsönhatások A vírus szervezet kölcsönhatásai bonyolult, hosszú evolúciós folyamat eredményeként alakultak ki. A vírus és a szervezet közötti kapcsolat lényegében három, egymástól függő folyamaton keresztül valósul meg: a vírus belépése a szervezetbe, a vírus eljutása a célsejtig, a vírus szaporodása a célsejtekben. A vírus számára az első két folyamat csak kényszerű (és ki nem kerülhető) eszköz ahhoz, hogy megtalálja a szaporodásának feltételeit biztosító célsejteket. A célsejtekben történő vírusszaporodás kimenetele nagymértékben függ a vírus mennyiségétől, virulenciájától és szaporodási stratégiájától (pl. latencia), valamint a szervezet immunállapotától és a célsejtek fogékonyságától. A vírusok a fertőzés után, rendszerint a fertőzési kapuban (szervezetbe történt belépés helyén) elszaporodnak. A vírusok egy része vagy lokalizált vagy generalizált fertőzést okoz. A lokalizált fertőzés során a vírus csak a fertőzési kapuhoz tartozó szervben vagy esetenként a szervhez tartozó regionális nyirokcsomóban szaporodik el (elsődleges vírusszaporodás). A fertőzési kapu hámsejtjeit elhagyó vírusok az extracelluláris térbe lépnek, és a nyirokereken keresztül jutnak el a regionális nyirokcsomókba. Az extracelluláris térben és a nyirokerekben levő macrophagok a legtöbb lokalizált fertőzést okozó vírust ekkor megemésztik, és ezáltal elejét veszik a fertőzés szervezeten belüli terjedésének (pl. egyes poxvirusok, papillomavirusok). Más vírusok (pl. morbillivirusok, arterivirusok) azonban képesek elszaporodni a macrophagokban és a lymphocytákban is, így akadály nélkül juthatnak el a regionális nyirokcsomókba és a véráramba, amivel kezdetét veszi a generalizált fertőzés. Ezt a lehetőséget azonban számos, lokális fertőzést okozó vírus nem tudja kihasználni, mivel hiába jut el más szervekhez, ha adszorpciós fehérjéi kizárólag a fertőzési kapuban levő sejtekhez adaptálódtak (pl. rotavirusok, enterális coronavirusok, egyes paramyxovirusok, ortomyxovirusok). A generalizált fertőzés során a vírus elhagyja a primer vírusszaporodásra szolgáló szervet, és a nyirokrendszeren keresztül belép a véráramba. A generalizált fertőzésnek azt a szakaszát, amíg a vírus a véráramban tartózkodik, viraemiának nevezzük. Egyes vírusok még a viraemiás időszak alatt is folytatják a primer vírusszaporodást, de most már a fehérvérsejtekben (pl. arterivirusok) és/vagy az erek endothelsejtjeiben (sertéspestis vírusa). Általában hosszan tartó viraemiához vezet a nyirokszervek (lép, csontvelő, nyirokcsomók) és a máj vírusos fertőzöttsége. A vérárammal a vírusok eljutnak a fertőzési kaputól nemegyszer távol levő szervekbe is, ahol ismételten lehetőségük nyílik a vírusszaporodásra (másodlagos vírusszaporodás). Több vírusfertőzés esetében ez a másodlagos vírusszaporodás felelős a nemegyszer végzetes kimenetelű kórtani folyamatokért (pl. IBR, Aujeszky-betegség, szopornyica). A vírusfertőzés a szervezet szintjén abban különbözik a sejt szintű fertőződéstől, hogy a fertőzés kimenetelét (és nemegyszer a létrejöttét is) alapvetően meghatározza az immunrendszer állapota A vírus bejutása és terjedése a szervezetben Természetes körülmények között a vírus a szervezetbe a bőr vagy a légző, emésztő és urogenitális rendszer nyálkahártyasejtjein, valamint a kötőhártyán keresztül juthat be. Speciális bejutási lehetőséget jelent az ízeltlábúak szúrása (pl. arbovírusok), az állatok harapása (pl. veszettség) és az orvosi beavatkozás (injekciós tűvel, sebészi műszerekkel, pl. leukózis, sertéspestis). A szervezetbe bejutó vírus első szaporodási ciklusával (ami többnyire a behatolás helyén található sejtekben történik) kezdetét veszi a fertőzés Fertőzés a bőrön keresztül 213
234 Virológia Az intakt bőr hámrétege a vírusok számára átjárhatatlan. Az epidermis külső, keratinizálódó sejtjei speciális védelmet jelentenek a vírusokkal szemben, ugyanis a keratinizálódó sejtekben a vírusok szaporodása gátolt. Ez alól csak a papillomavirusok kivételek, mivel kapszidjaik felépüléséhez keratinra van szükségük. A bőrön keresztüli fertőződésre akkor van lehetőség, ha a bőr folytonossága valamilyen ok (pl. felpállás, sérülés) miatt megszakad. A bőr sérülésein keresztül leggyakrabban a poxvirusok és a papillomavirusok alakítanak ki lokális fertőzést a bemeneti kapuban történt szaporodásuk révén. Mivel az epidermisz nem tartalmaz vér- és nyirokereket, az itt szaporodó vírusok többsége nem alakít ki generalizált megbetegedést (papillomavirusok, egyes poxvirusok). Ugyanakkor néhány vírus a dermiszben (irhában) jelenlevő fibroblastok és macrophagok segítségével eljuthat a vér- és nyirokáramba, ahonnan szétterjedve a szervezetben generalizált fertőzést alakíthat ki, vagy a bőrben (bőrcsomósodási kór) vagy a szervezet egyéb szerveiben is (egérhimlő, juhhimlő, SVD). Ezzel a lehetőséggel csak azok a vírusok élhetnek, amelyek képesek a fibroblastokhoz és a macrophagokhoz adszorbeálódni, illetve azokban elszaporodni. A vírus bőrön keresztüli szervezetbe jutásának különösen veszélyes módja az ízeltlábúak szúrásávalharapásával történő behatolás (kullancsok, szúnyogok, tetvek, legyek stb.). Az ízeltlábúak szúró szájszerve ugyanis többnyire a bőr alatti rétegbe, nemegyszer közvetlenül a benne futó nyirok- és vérerekbe juttatja a vírust, ami kitűnő lehetőséget teremt a szervezeten belüli gyors invázióra. A házi légy (Musca domestica), habár nem rendelkezik szúró szájszervvel, praestomális fogaival képes legalább három sejtréteget kiharapni a szöveti kötelékből, így fertőzésközvetítő szerepe jelentősebb, mint korábban gondolták. Az ízeltlábúak lehetnek ún. mechanikai vektorok, amikor a vírust, csak mint felületi szennyező anyagot hordozzák testfelületükön (szájszervükön), és azok az ízeltlábú táplálkozása során, mechanikusan kerülnek be a melegvérűek szervezetébe (pl. Aujeszky-vírus, myxomatosis vírusa, baromfi himlővírusa). Egyes vírusok azonban képesek elszaporodni a melegvérű fajt megtámadó ízeltlábú sejtjeiben is, így ezek az ízeltlábúak biológiai vektorokká válnak (pl. az afrikai sertéspestis vírusa az Ornithodorus kullancsfajokban nemcsak elszaporodni képes, hanem transovarialisan a kullancs utódaiba is átmegy, így a kullancsgenerációk végtelen sokaságát teszi biológiai vektorrá). Az ízeltlábúakat mint biológiai vektorokat igénybe vevő vírusokat, korábban az arbovirusok (arthropode born) csoportjába sorolták (alpha-, flavi-, orbi-, bunyavirusok). Különleges, bőrön keresztüli fertőződést jelent a vírussal fertőzött gerinces harapása, amelynek révén a vírus közvetlenül bejuthat a nagy vérerekbe és az idegekbe is (pl. veszettség). Az orvosi beavatkozások során (pl. vakcinázás, farokcsonkítás stb.) az injekciós tűvel vagy sebészi eszközzel subcutan, intramuscularisan vagy akár intravénásan is beoltható az eszközre tapadt vírus. Ebből a szempontból különösen veszélyes a tömegoltó készülékek használata, mivel egy viraemiás állapotban levő állat vakcinázása során annyi vírus kerülhet a tűre, amivel több állat is fertőzhető (pl. sertéspestis, leukózis, fertőző lóarteritis, macska immunhiányos betegségének vírusa) Fertőzés a légzőszerveken keresztül A légzőszervek és a hozzájuk tartozó testnyílások rendkívül fontos bemeneti kaput jelentenek a vírusok számára. A legtöbb vírus ezt az utat választja a fertőzéshez. A légző rendszert megtámadó vírusoknak az alábbi akadályokat kell legyőzni a sikeres fertőzés megindításához: A felső légutak 33 C-os hőmérséklete nem kedvez a testhőmérséklethez (37 39 C) adaptálódott víruspolimeráz enzim működésének. (A rhinovirusok éppen ezt a hátrányt fordították javukra, mivel polimeráz enzimjük 33 C-on aktív.) A légutak felületét borító mucociliaris hámsejtek egyrészt mechanikus szűrőként viselkednek, másrészt az általuk szekretált nyálka vírusspecifikus IgA ellenanyagokat tartalmazhat, amelyek már a bemeneti kapuban megakadályozzák a vírusok adszorpcióját (pl. a herpesvirusok elleni intranasalis vakcinázáskor éppen ezt a jelenséget használjuk ki). Az alveolusokban jelenlevő lymphoid sejtek és macrophagok a phagocytosis révén jelentősen csökkentik a vírusok megtelepedését (immunszuppresszált vagy immunhiányos állatok ezért is fogékonyabbak a légúti vírusfertőzésekkel szemben). A légzőszerveket a vírusok általában aerosol formájában érik el, ami annak köszönhető, hogy a légúti fertőzésben szenvedő állat köhögése és tüsszögése révén aerosol formában juttatja ki a külvilágra a fertőző 214
235 Virológia víruspartikulákat tartalmazó hörgőváladékát. Az aerosolcseppek átmérője alapvetően meghatározza a vírus fogékony szervezetbe jutásának lehetőségét a légutakon keresztül. A 10 μm-nél nagyobb partikulák általában lerakódnak az orrüregben, többnyire az orrkagylókat borító nyálkahártyákban. Az orrüreg anatómiai szűrőjén fennakadt vírusnak további komoly akadályt jelenthet a nyálkahártyasejtek által esetlegesen kiválasztott IgA ellenanyagok semlegesítő hatása. Amennyiben ezeket az akadályokat sikerül a vírusoknak elhárítani, az orrüreg hámsejtjeiben kitűnő lehetőséget találnak a szaporodásra, sőt egyesek (pl. herpesvirus) a szaglóhámon és a szaglóidegen keresztül az idegrendszerbe történő közvetlen bejutásra is. Az 5 10 μm közötti partikulák elérik légcsövet és a hörgőket, itt azonban nagy részük fennakad a mucociliáris rétegben. (Ha a ciliumok retrográd mozgása gyógyszerek vagy társfertőzések hatására lelassul, vagy leáll, a szervezet légúti fertőzésekkel szembeni fogékonysága megnő, mivel az 5 μm-nél nagyobb partikulák is lecsúsznak az alveolusok közelébe.) Az 4 μm-nél kisebb partikulák (mint a gázmolekulák) az inhaláció révén általában közvetlenül eljutnak a tüdő alveolusaiba, ahol a vírusok az alveolust borító egyetlen hámsejt rétegen való áthatolás után már belépnek a véráramba, amennyiben sikerül elkerülniük az alveoláris macrophagok emésztő hatását. Az aerosolpartikulákban a vírusok túlélése nagymértékben függ a környezet hőmérsékletétől, páratartalmától és a nap UV sugárzásától. A burkos vírusok ellenállóbbak az alacsony páratartalom esetén bekövetkező kiszáradással szemben, mint a nem burkos vírusok. A légúti fertőzést okozó vírusok esetén különösen jelentős airborne (levegővel terjedő) fertőzési mód tanulmányozása során megfigyelték, hogy az aerosolcseppekbe zárt vírusok több mint 40 km távolság megtétele után is megtartották fertőzőképességüket (Aujeszky-vírus). A felső légutakba nemcsak belégzéssel, de kontaminációval is bejuthatnak vírusok (pl. a humán rhinovirusokkal történő fertőzésben kiemelt szerepet játszik az ujjakra tapadt vírus orrpiszkálás útján történő bejuttatása). A légző rendszerbe jutó vírusok egy része csak lokálisan szaporodik el (pl. rhinovirusok, coronavirusok, adenovirusok), más részük generalizált megbetegedést okoz (pl. herpesvirusok, paramyxovirusok) Fertőzés az emésztő rendszeren keresztül A szervezetbe az emésztő rendszeren keresztül bejutó vírusok egy rendkívül ellenséges környezettel találják szemben magukat, amíg eljuthatnak a szaporodásukhoz ideális környezetet biztosító bélhámsejtekhez. A gyomor savas ph-ja, a bél alkalikus ph-ja és fehérjeemésztő enzimei,az epesavak emulgeáló hatása, valamint a bélhámsejtek által szekretált IgA ellenanyagok olyan hatékony védelmet jelentenek a szervezetnek, hogy a vírusoknak csak viszonylag szűk köre (rotavirusok, coronavirusok, enterovirusok, astrovirusok, torovirusok, reovirusok) képes az áttörésére. A vírus a következő (eddig megismert) stratégiákkal próbálja megóvni a multiplikáció szempontjából létfontosságú adszorpciós fehérjéit a felsorolt károsító hatásoktól. Egyes virusoknál (pl. enterovirusok, rotavirusok, calicivirusok) az adszorpciós fehérjék térszerkezete biztosítja a gyomorsavval szembeni rezisztenciát. A rhinovirusok pl. éppen a savas ph-nak köszönhetően vesztik el az adszorpcióhoz szükséges felszíni fehérjéjüket (VP 4 protein). Az epesavak emulgeáló hatása elsősorban a burkos vírusok számára jelent veszélyt, mivel kizárólag ezek felszíni fehérjéiben találhatók lipidek (vélhetően e hatásra kialakuló szelekciónak köszönhető, hogy az emésztő rendszeren keresztül támadó vírusok közül egyedül a coronavirusok viselnek burkot). A fehérjeemésztő enzimek hatását a vírusok nem tudják elkerülni, ezért fehérjéiket különböző módszerekkel próbálják védeni. A felszíni fehérjék védelmét az anyatej, illetve a táplálék pufferkapacitásával biztosítják (pl. coronavirusok). Egyes vírusok (rotavirusok, coronavirusok, reovirusok) a receptorkötő fehérjék egy részét inaktivált, ún. komplex fehérje formában hordozzák. A proteáz enzimek vágáshelyei éppen azokat a felszíni struktúrákat érintik, amelyek az inaktivált állapotban levő adszorpciós fehérjék aktiválásához szükségesek (pl. proteáz inhibitorok jelenlétében a reovirusok szaporodása csökken, ugyanakkor tripszinkezelésre a rotavirusok infektivitása megnő). Bizonyos vírusok kizárólag a bélhámsejtben képesek elszaporodni (rotavirus), míg más vírusok (pl. reovirus, poliovirus) a bél lumene felől eljutnak a bélhám alatti lymphoid szövetbe (Peyer-plakkokba) is. A reovirusok esetében bizonyították, hogy ezt a transzportot a bélhám speciális, ún. M sejtjei végzik, amelyek több táplálékfehérjének a transzportjáért felelősek. Az enterovirusok egy része a bél hámsejtjeiből a központi idegrendszerbe is eljut, ahol poliomielitist okoz (fertőző sertésbénulás). 215
236 Virológia Az emésztőszerven keresztül támadó vírusok esetében még nem ismertek azok a faktorok, amelyek elősegítik, hogy az emésztő rendszerre korlátozódó fertőzés generalizált fertőzéssé váljon. A nemegyszer súlyos enterális megbetegedést okozó parvovirusok (CHV-2, MEV), az emésztő rendszer megkerülésével, a véráram felől érik el a bélhámsejteket, miközben a corona- és rotavirus-fertőzésekkel ellentétben az azokat pótló basalis sejteket is elpusztítják (103. ábra) ábra - Enterális kórképet okozó vírusok támadáspontja Fertőzés az urogenitális rendszeren keresztül A vírusok esetében az uréteren keresztüli ascendáló fertőzésnek nincs nagy jelentősége (egyes adenovirusok esetében még vitatott, hogy az uréter vagy a véráram felől érik el a húgyhólyagot, amelynek sejtjeiben elszaporodnak). Az érintetlen genitáliák fiziológiás környezete (hüvelyváladék ph-ja, kémiai összetétele, a vizelet savas hatása) hatékony védelmet biztosít a vírusfertőzésekkel szemben. A szexuális érintkezés, illetve művi beavatkozások során (mesterséges termékenyítés, hüvelyvizsgálat stb.) a genitáliákon kialakuló nyálkahártya-sérülések ugyanakkor több vírus számára jelentenek bemeneti kaput (herpesvirus, papillomavirus). Ennek során a nemi szervekben és esetleg a húgyutakban (papillomavirus) történő lokális elszaporodás után akár generalizált fertőzést is kialakíthatnak (Aujeszky-vírus, BHV 1,) Fertőzés a conjunctiván keresztül A conjunctiva hámsejtjeiben elszaporodó vírusok (pl. adenovirus, herpesvirus, BVD) lokális elváltozásokat (conjunctivitist, szaruhártyahomályt) hoznak létre, amelyek bakteriális társinfekció hatására súlyosbodhatnak (szaruhártyafekély, vakság). A lokális elszaporodás helyéről kiindulva egyes vírusok generalizált fertőzést alakíthatnak ki. (Az Aujeszkyvírus és a humán enterovirus 70, a conjunctiva felől eljut a központi idegrendszerbe, ahol ismételt elszaporodásával többnyire halálos kimenetelű megbetegedést okoz.) Az idegrendszer fertőzése Az idegrendszer természetes körülmények között nem jelent fertőzési kaput a vírusoknak, ezért ebben a fejezetben az idegrendszer szervezeten belüli fertőződésének körülményeit vizsgáljuk. A vírusok többsége a központi idegrendszert két úton éri el. Vagy a véráram felől, vagy a perifériás idegeken keresztül. A vérárammal érkező vírus többféleképpen kerülheti ki a vér agy gát blokkoló hatását. A vírusok egy része elszaporodik az agyi kapillárisok endothelsejtjeiben, és azok destrukciója után már közvetlenül eléri az agysejteket, míg a vírusok másik csoportja az endothelsejtek károsítása nélkül, közvetlen passzív transzporttal jut be az agyszövetbe a vasculáris réseken keresztül. A véráramban levő vírus ritkán a lymphocytákba és/vagy 216
237 Virológia leukocytákba zártan, azok migrációja során jut át a vér agy gáton. A meningitist okozó vírusok (pl. flavivirusok) többnyire az agyhártya vagy a kamrai érfonat (plexus chorioideus) sejtjeiben szaporodnak el, melynek eredményeképpen az agykamrák ozmotikus nyomása megemelkedik. Az ebből adódó interstitialis oedema kitűnő lehetőséget teremt az agyszövetben történő intenzív vírusterjedésnek. A perifériáról támadó vírusok axonális transzporton keresztül, az idegrostokban haladva érik el a központi idegrendszert. Ennek a szervezeten belüli terjedési módnak az a rendkívüli előnye, hogy a perifériás idegrendszerben megbújó vírus láthatatlan az immunrendszer számára. In vivo kísérletekkel bizonyították, hogy a veszettség vírusa (rhabdovirus) az izomsejtekben a neuromuscularis junctio nikotin acetilkolin receptoraihoz kapcsolódva jut át az idegsejt axonjába, ahol a cytoplasmaáramlás szállítja tovább az idegtest felé. Amíg a herpesvirusok az axonba jutva fertőzik a Schwann-sejteket, addig a veszettséget okozó vírusok az idegsejt fertőzése nélkül jutnak el a központi idegrendszerbe a viszonylag gyors ( mm/nap) axonális transzporttal. A spongiform encephalopathiát okozó prionfertőzések esetén lassú (0,5 1,3 mm/nap) axonális transzportot figyeltek meg. A szervezet fogékony sejtjeibe eljutó vírus a multiplikációja során különböző típusú fertőzéseket alakít ki A vírusfertőzés típusai Amikor a szervezet először találkozik a vírussal, a kialakult kapcsolatot akut fertőzésnek nevezzük. Az akut fertőzés kimenetele háromféle lehet: a szervezet eliminálja a vírust és vírusmentessé válik (klinikai értelemben, felgyógyul), a vírus a szervezet halálát okozza, a vírus hosszabb-rövidebb ideig fennmarad (perzisztál) a szervezetben. Azt az állapotot, amikor a vírus az akut fertőzés után együtt él a szervezettel, perzisztens fertőzésnek nevezzük. Járványtani és kórtani szempontból a perzisztens fertőzés rendkívül jelentős, mivel kitűnő lehetőséget biztosít a vírusnak a természetben való túlélésre és terjedésre, valamint meghatározó szerepet játszik az immunpathológiai kórképek és a neoplasiák kialakulásában. A perzisztens fertőzések kialakulásában nemcsak a kórokozó vírus de a szervezet immunállapota is meghatározó szerepet játszik (19. táblázat). 19. táblázat - Perzisztáló fertőzések kialakulásának okai A vírus részéről: nem immunogén az ágens (pl. prion), a vírusgenom integrálódik a sejt kromoszómájába (retrovirusok), a vírus az immunrendszertől védett helyen szaporodik (pl. herpesvirusok latenciája a ganglionban), a vírusnak csökkent a virulenciája (sertéspestis), gyors antigénsodródás a szervezetben (lentivirusok), diaplacentáris fertőzés (hepatitis B, hantavirus, stb.) Az immunrendszer részéről: ellenanyagot nem termel, mert az ágens nem immunogén (prion), ellenanyagot nem termel, mert a vírus elbújt" (herpesvirus, Rabies vírus), 217
238 Virológia ellenanyagot termel, de az nem neutralizálja a vírust (afrikai sertéspestis BHV 4), immunrendszer károsodott (veleszületett immundeficienciák), immunrendszert a vírus károsítja a multiplikációja során (PRRS, HIV), makrofágkárosítás (afrikai sertéspestis, PRRS), lymphoid sejtkárosítás(fertőző bursitis, cytomegalo vírus, HIV), immuntolerancia (BVI, sertéspestis, retrovirusok) A perzisztens fertőzéseken belül a vírusürítés, a vírushordozás és a klinikai tünetek jelenléte és kifejeződése alapján megkülönböztetünk: latens, krónikus (alkalmilag krónikus), és lassú fertőzéseket. Klinikai értelemben a vírusfertőzés lehet tünetekben megnyilvánuló (apparens) vagy klinikai tünetek nélkül (innapparens) jelentkező, ún. szubklinikai megbetegedés. A perzisztens fertőzések közül valódi szubklinikai megbetegedés a latens és a lassú fertőzések alatt alakul ki, bár ez utóbbiban a klinikai tünetek megjelenése a szervezet halálát okozza. A krónikus fertőzések során átmenetileg jelentkezhet klinikai tünet. A perzisztens fertőzésekről összefoglaló áttekintést ad a 101. ábra Latens fertőzés Az akut fertőzés után egyes vírusok (pl. herpesvirus, retrovirus) a szervezet meghatározott sejtjeiben latens fertőzést alakítanak ki. A latens fertőzés alatt a vírus felfüggeszti szaporodását, ezért kizárólag nukleinsav- és vírustranszkriptek (LAT) formájában van jelen a szervezetben. A latens vírusgenom vagy extrakromoszomálisan (pl. herpesvirus) helyezkedik el a sejtmagban, vagy integrálódik a sejt kromoszómájába (pl. retrovirusok). Latens fertőzés alatt az állat tünetmentes, nem üríti a vírust, és a szervezetben komplett vírust nem lehet kimutatni. A vírushordozás csak vírusnukleinsav formájában történik. (A szervezetben vírust nem lehet izolálni). A latens fertőzés adott esetében az állat életének végéig fennállhat, de gyakoribb, hogy a latens genom reaktiválódik és megindul az utódvirionok szintézise. A reaktiváció eredményeként vírustermelés indul meg, ami a szervezet szintjén vírusürítést és vírushordozást eredményez. A reaktiváció során enyhe fokú klinikai tünetek is jelentkezhetnek. A reaktiváció tehát alacsonyabb szinten megismételt akut fázisnak is felfogható. Az akut fertőzés során kialakult immunmemóriának köszönhetően a reaktiváció alatt termelődő virionok nagy részét az immunrendszer eliminálja, ezért lesznek enyhébbek a klinikai tünetek és ezért ürít kevesebb vírust a fertőzött állat. A latensen fertőzött állat óriási veszélyt jelent fogékony társaira, mivel egyelőre tisztázatlan, hogy természetes körülmények között mikor és milyen hatásra reaktiválódik benne a latens vírus. Ez a fertőzési veszély még fokozottabb, ha a latencia keringő lymphocytákban alakul ki (retrovirus-fertőzések), mert ilyenkor a latens vírus a lymphocytákat tartalmazó vérrel és testváladékokkal átkerülhet fogékony egyedekbe (pl. vérvétel, transzfúzió) anélkül, hogy reaktiválódna. Herpesvirus-fertőzéseknél kimutatták, hogy bizonyos immunszuppresszív hatások (stresszhelyzetek, kortizonkezelések) reaktiválják a latens fertőzést. A latens fertőzés és a reaktiváció veszélye miatt pl. minden herpesvirussal fertőződött állatot élete végéig potenciális vírusterjesztőnek kell tekinteni, még akkor is, ha klinikailag egészséges Krónikus fertőzés Krónikus fertőzés során a vírusmultiplikáció esetenként kisebb-nagyobb megszakításokkal ugyan, de zavartalan. Ezért krónikus fertőzéseknél akár évekig is tartó folyamatos vírushordozás, folyamatos vagy periodikus 218
239 Virológia vírusürítés alakul ki (104. ábra). A betegségre jellemző klinikai tünetek nem jelentkeznek, vagy csak nagyon enyhe formában láthatók ábra - A perzisztáló vírusfertőzések típusai (Fenner (1987) után módosítva) A folyamatos vírusürítéssel járó krónikus fertőzések (sertéspestis, BVD, arenavirus-fertőzések) általában a magzati életben bekövetkezett fertőzéssel szembeni immuntoleranciának köszönhetőek. A periodikus vírusürítés a postnatalis fertőzések során alakul ki (ragadós száj- és körömfájás, afrikai sertéspestis). A száj- és körömfájás vírusa pl. a kérődzők garathámsejtjeiben alakít ki krónikus fertőzést, ezért a fertőzött (tünetmentes) állat köhögésekor a garatváladékkal nagy mennyiségű vírust juttat ki a környezetébe. A postnatalis életben kialakult krónikus fertőzés a folyamatos vírustermelés révén állandó antigéningert biztosít az immunrendszernek, ezért a szervezetben mind a vírus, mind az ellene termelődő ellenanyag kimutatható. Ha a magzati életben történő fertőzés immuntolerancia kialakuláshoz vezet, a megszülető állat úgy termeli és üríti a vírust, hogy a szervezet nem termel ellene ellenanyagot, mivel a vírusfehérjéket sajátjaként ismeri fel. A kutyák szopornyicavírussal történt fertőződése után ún. alkalmilag krónikus fertőzés is kialakulhat (104. ábra). Az akut fertőzést túlélt kutyák egy részében az akut fertőzés alatt a vírus eljuthat a központi 219
240 Virológia idegrendszerbe, ahol egy viszonylag lassú vírusszaporodás történik, amelynek eredményeként az ún. posztinfekciós agyvelőgyulladás vagy gyakran néhány év után rendszerint halálos kimenetelű ún. öregkori (old dog) encephalitis alakul ki. Az idegrendszeri károsodást a vírus indítja el, de annak súlyosbodásáért a lokális immunpathológiás folyamatok felelősek. Hasonló esemény játszódik le a szopornyicavírussal rokon humán kanyaróvirus-fertőzéskor, ahol a krónikus fertőzés egy halálos kimenetelű szubakut sclerotikus panencephalitis kialakulásához is vezethet. Ezekben az esetekben a kanyaró vírust kokultivációval izolálni tudták az idegsejtekből. Az alkalmilag krónikus fertőzések során tehát komplett vírushordozás van, és a klinikai tünetek megjelenése esetenként halálhoz vezet. Mivel a vírustermelés a központi idegrendszerben történik, az alkalmilag krónikus fertőzés alatt vírusürítést nem tapasztaltak. A vérben a vírusspecifikus ellenanyagok folyamatosan kimutathatók Lassú fertőzések A lassú fertőzések valójában olyan elhúzódó akut megbetegedések, amikor a klinikai tünetek megjelenése előtti állapot (inkubáció) rendkívül sokáig (akár évekig) is tart. A perzisztens fertőzés tulajdonképpen az inkubációs periódusban alakul ki, amikor a vírus kimutatható az állat szervezetében (104. ábra). Egyes vírusok esetében (HIV, lovak fertőző anaemiája) a testváladékokkal történő (sejthez kötött) vírusürítést figyeltek meg. Lassú fertőzést eddigi ismereteink szerint a lentivirusok és a prionok alakítanak ki. A Lentivirusok okozta lassú fertőzések során a vírus a macrophagokban (visna-maedi), a T-lymphocytákban (HIV, BIV, FIV), valamint az agy, a tüdő és az ízületek sejtjeiben perzisztál. A fertőzés során keletkező ellenanyagok nem neutralizálják a vírust. Az átoltható szivacsos agyvelőbántalmat okozó prionfertőzések során a fertőző fehérjék az idegrendszer és a lymphoid szövet sejtjeiben halmozódnak fel és a scraepi kivételével egyetlen esetben sem bizonyították a kórokozó testváladékokkal történő ürítését. A fertőző prionmolekulák ellen nem termelődnek sem specifikus ellenanyagok, sem interferonok (lásd Prionok c. fejezet) A vírusfertőzések diagnosztikája A különböző kórformákat előidéző, pathogen vírusok elleni védekezés az állatorvosi munka egyik leglényegesebb eleme. A hatékony védekezés alapvető feltétele pedig a specifikus és lehetőleg minél gyorsabb diagnózis. Hazai viszonyok között a gyakorló állatorvosoknak vírusdiagnosztikai munkára alig van lehetőségük. Néhány kórokozó kimutatására ugyan már forgalomban vannak olyan diagnosztikai készletek (pl. antigénkimutatásra vagy szerológiai gyorsvizsgálatokra alkalmas reagenskészletek), melyekkel egyes vizsgálatok a mintavétel helyszínén is elvégezhetők, de a specifikus vírusdiagnosztikai munkához (szövettenyésztéshez, diagnosztikai minták feldolgozásához stb.) szükséges feltételek az esetek túlnyomó többségében csak laboratóriumi körülmények között teremthetők meg. A vírusfertőzések specifikus diagnosztikájában ezért többnyire nélkülözhetetlen a gyakorló állatorvos munkáját kiegészítő intézeti vizsgálat, pl. amikor a klinikai kép és a helyszínen végzett boncolások valamely vírusos betegség gyanúját vetik fel, de egyértelmű diagnózis nincs, amikor rendelet vagy jogszabály írja elő, pl. valamely egzotikus betegség (afrikai sertéspestis, száj- és körömfájás stb.) gyanújának megerősítése vagy kizárása céljából, mentesítési eljárások során a folyamat ellenőrzése céljából, mentesség igazolásához (SPF állományok, spermadonorok ellenőrzése során, kiállításra, versenyre szállított állatok esetében stb.), egyes állományok járványhelyzetének ( vírusterheltségének ) felmérésekor, zoonosis (állatról emberre terjedő betegség, pl. veszettség) gyanúja esetén stb. A vírusfertőzések felismerésére direkt és indirekt módszereket alkalmazunk; a direkt eljárások során magát a vírust vagy annak valamely alkotórészét (fehérje- vagy nukleinsav-komponenseit) mutatjuk ki, az indirekt (vírusszerológiai) eljárásokkal pedig az ezek hatására a fertőzött állatokban termelődött ellenanyagokat. 220
241 Virológia A vizsgálat célja meghatározza, hogy milyen vizsgálati anyagot kell a laboratóriumba küldeni: a beteg vagy elhullott állatot vagy az abból származó szerveket, szervdarabokat, tamponmintákat, vért, vérsavót stb. Állományszintű vizsgálatkor figyelni kell arra is, hogy a mintaszám statisztikailag reprezentatív legyen. Mintavételnél igen fontos, hogy a mintát mikor és honnan vesszük és az mennyi idő alatt érkezik a vizsgálatot végző laboratóriumba. A direkt víruskimutatásra szánt diagnosztikai minták beküldésekor minél korábban, röviddel a klinikai tünetek jelentkezése után célszerű mintát venni, mielőtt a másodlagos (baktériumos) társfertőzések megnehezítenék az elsődleges kórokozó felderítését. A mintavétel az elváltozást mutató szervrendszerből történjék, pl. légzőszervi megbetegedés során élő állat esetén orrtampont, elhullott állatból pedig a tüdőt, a légcsövet vagy annak darabjait kell beküldeni. Frissnek (vagyis virológiai vizsgálatra legalkalmasabbnak) tekinthető a mintavételtől számított egy napon belül laboratóriumba érkező minta. Egyes, ma még meglehetősen ritkán és a betegségek szűk körében alkalmazott vizsgálati módszerekkel (pl. az ún. polimeráz-láncreakción alapuló eljárásnál, lásd később) bomló, autolizált mintából is kimutatható a vírus. Az indirekt víruskimutatási vizsgálatokra szánt vérmintát alvadásgátló- és konzerválószert nem tartalmazó, steril csövekbe vesszük. Az intézetben a véralvadékot centrifugálják, a vérsavót elkülönítik, és felhasználásig 20 Con tárolják. Mindig különös figyelmet kell fordítani a legfontosabb járványtani és klinikai megfigyeléseket, a korábbi kezeléseket stb. felsoroló kísérőirat megírására, mely a laboratóriumi szakemberek munkáját irányíthatja és nagymértékben megkönnyíti A vírusok direkt kimutatása Vírusizolálás A vírus direkt kimutatásának alapvető módszere a vírusizolálás, vagyis az a folyamat, melynek során a diagnosztikai mintából a vírust valamelyik vírusszaporítási módszerrel (pl. embrionált tyúktojásban vagy szövettenyészetekben) elszaporítjuk és azonosítjuk (105. ábra). Az izolálás tehát csak akkor lehetséges, ha a mintában fertőzőképes virionok vannak, ezért kell a mintavételt a klinikai tünetek megjelenésekor (vagyis a vírusok tömeges ürülésekor) végezni ábra - A vírusizolálás folyamata 221
242 Virológia Mivel a vírusizolálási céllal beküldött minták általában baktériumokkal, takarmányszemcsékkel, szövettörmelékkel, porral stb. szennyezettek (pl. orrtampon, bélsár, hullából származó szervminta stb.), ezeket megfelelő módon elő kell készíteni. Először a mintához antibiotikumtartalmú pufferoldatot adunk az izotónia és az izoiónia biztosítása, illetve a baktériumszaporodás visszaszorítása érdekében. A szervdarabokat ebben a pufferoldatban homogenizáljuk (dörzscsészében, potterben stb.). Ezután viszonylag kis fordulatszámú centrifugálással leülepítjük a durva törmeléket. A vírustartalmú felülúszó folyadékot vagy szűréssel, vagy egy újabb, nagyobb fordulatszámon történő centrifugálással megtisztítjuk a finomszemcsés szennyeződéstől, baktériumoktól, spóráktól stb. Ezután olthatjuk a szuszpenziót tojásba és/vagy szövettenyészetre. A vírus sejt kapcsolódás korábban ismertetett specificitása miatt az ismeretlen vírust tartalmazó mintákat célszerű párhuzamosan többféle tenyészetre (vese-, here-, fibroblast-, pajzsmirigysejtekre stb.) leoltani. Ugyancsak az izolálás esélyeit növeli a kokultivációs technika vagy a fertőzésre fogékonyabb primer és szekunder tenyészetek alkalmazása sejtvonalak helyett. Még ilyen esetekben is gyakran előfordul, hogy a 222
243 Virológia rendelkezésre álló sejttípusok közül egyik sem fogékony az adott vírusra, ezért az nem kezd multiplikálódni. Embrionált tyúktojások oltása esetén az oltás helyének helyes megválasztása is fontos a sikeres izolálás szempontjából. A továbbiakban az oltott tojásokat lámpázással, a szövettenyészeteket mikroszkóppal naponta ellenőrizzük. Az oltott tojások szükség esetén felbonthatók, belőlük mintát lehet venni (pl. allantoisfolyadék, CAM-darab) és ezekkel kiegészítő vizsgálatokat lehet végezni (EM, HA). A szövettenyészetek szükség esetén a szövettani technikából ismert eljárásokkal megfesthetők. Amennyiben több napon át sem észlelünk vírus jelenlétére utaló elváltozást, akkor a tenyészet levált sejtjeit, kiszabadult virionokat stb. tartalmazó sejtfelülúszó folyadék 0,1 0,2 ml-ét (inoculum) friss szövettenyészetre oltjuk át. Ha a mintában fertőzőképes partikulák, a tenyészetekben pedig fogékony sejtek voltak, akkor legfeljebb két-három ilyen vakpasszázs után feldúsul a vírus, és jelentkezik a rá jellemző sejtkárosító hatás. A nem cytopathogen vírusok izolálásakor a vizsgálatot egyéb diagnosztikai eljárásokkal (EM, IF, immunperoxidáz-festés stb., lásd később) is ki kell egészíteni. Az izolátumot ezután plakkozással szokták tisztítani, vagyis genetikailag egységes víruspopulációt alakítanak ki. Ekkor a fertőzött sejtfelületet tápfolyadékból és agarózból készült géllel fedik le, mely nem engedi, hogy egy adott sejtben frissen termelődött partikulák távoli sejtekhez jussanak el, hanem csak a közvetlenül szomszédos sejtekben indul meg az újabb szaporodási ciklus. Az ilyen, fokozatosan terjedő lokális elváltozást plakknak nevezzük (106. ábra). Egy plakkot megfelelő módszerrel kiemelve a tenyészetből, genetikailag tiszta (egyetlen virion utódaiból álló) víruspopulációt nyerünk: ettől kezdve az izolátumot vírustörzsnek nevezzük ábra - Plakkok szövettenyészetben A plakktisztítás műveletét a gyakorlati vírusdiagnosztikában legtöbbször megelőzi a vírus azonosítása, vagyis vírusrendszertani helyének pontos megállapítása, noha elméletileg csak tisztított vírust lenne szabad azonosítani. Legelőször azt kell megállapítani, hogy a vírus melyik családba tartozik. A törzs azonosításában segítséget nyújthat a mikroszkópos vizsgálatok során tapasztalt sejtkárosító hatás, a vírus sejtspektruma stb., de ezek önmagukban semmiképpen nem elegendőek, a pontos besorolást a vírus fizikokémiai tulajdonságainak vizsgálata teszi lehetővé. Kloroformkezeléssel állapítjuk meg, hogy burkos vagy burok nélküli vírust izoláltunk: a burkos vírusok e kezelés hatására elveszítik fertőzőképességüket, mivel lipidtartalmú burkukat (és ezzel a sejthez való kötődésben szerepet játszó külső fehérjéket) a kloroform leoldja. Elektronmikroszkópos vizsgálattal (legtöbbször ultravékony metszetekben vagy negatívkontraszt-eljárással) megállapíthatjuk a kapszid méretét, szimmetriaviszonyait, a kapszomerek rendeződését stb. A vírusszaporítás során a sejttenyészethez halogénezett uridinszármazékokat adva eldönthető, hogy a vírus genomja DNS vagy RNS. A halogénezett uridinszármazékok (jód-, bróm-dezoxiuridin) a DNS replikációja során a timidin helyére épülnek, ezért a vírus nem szaporodik. A timidint nem tartalmazó RNS-vírusok replikációját e vegyületek nem gátolják. A vírussal fertőzött szövettenyészetben akridinsárga festés után a szimpla szálú vírusnukleinsav piros, a dupla szálú sárga fényben fluoreszkál. 223
244 Virológia A fenti vizsgálatokat elvégezve megállapítható, hogy az izolátum melyik víruscsaládba tartozik. A továbbiakban szerológiai módszerekkel a vírus szerotípusát kell meghatározni. Erre az immunológiából ismert szerológiai eljárások, valamint a későbbiekben ismertetett vírusneutralizációs (VN) és hemagglutináló vírusok esetében a hemagglutinációgátlási (HAG) próbák használhatók. A szerotípusokon belül gyakran szubtípusok, variánsok különíthetők el, melyek pathogenitása, virulenciája, szervspecificitása stb. eltérő lehet (pl. a szarvasmarha fertőző rhinotracheitisének vírusa, baromfipestis-vírus stb.). Mivel az ilyen fenotípusos változások hátterében mindig eltérő genetikai információ áll, az egyes változatok nukleinsav-vizsgáló módszerekkel (restrikciós endonukleázokkal végzett hasítás, heteroduplex technika, nukleinsav-hibridizáció) elkülöníthetők és azonosíthatók. Ha a genombeli eltérés a struktúrproteinek szerkezetében is változásokat okoz, akkor ezek poliakrilamid-gélelektroforézissel vagy monoklonális ellenanyagokkal kimutathatók még akkor is, ha hagyományos, poliklonális immunsavókkal a szerológiai próbákban a variánsok nem különíthetők el egymástól Kísérleti állatoltás A fertőzőképes vírus kimutatására és azonosítására bizonyos esetekben még ma is alkalmazzák a diagnosztikai állatoltást, noha állatvédelmi okokból alkalmazási köre erősen beszűkült. Így pl. az afrikai lópestis és a veszettség diagnosztikájában a más diagnosztikai módszerekkel (immunfluoreszcencia, kórbonctani és kórszövettani vizsgálatok stb.) kiegészített állatoltás gyorsabb és megbízhatóbb diagnózist tesz lehetővé, mint a vírusizolálás Elektronmikroszkópos vizsgálatok Az elektronmikroszkópos diagnosztikával nemcsak a fertőzőképes, komplett virionok mutathatók ki, mint az előző két esetben, hanem az éretlen, inkomplett, sőt üres kapszidok is (pl. burok nélküli herpesvirus-partikulák a sejtmagokban). Ez a módszer célravezető lehet olyan esetekben is, amikor a kórokozó vírus szövettenyészeten, tojásban vagy kísérleti állatoltással nem izolálható. (Pl. a házinyúl haemorrhagiás betegségének vírusát eddig nem tudták izolálni, diagnosztikájában és kórokozójának meghatározásában az elektronmikroszkópos vizsgálat igen fontos szerepet játszik.) Ezért a korábban említett vírusszerkezeti vizsgálatok mellett az elektronmikroszkóp a diagnosztikai munka során is felhasználható. Az elhullott állatok szerveiből készült ultravékony metszetek (107. ábra) vizsgálata során a predilekciós helyekről vett minta sejtjeiben a termelődő víruspartikulák felismerhetők, egyes esetekben azonosíthatók is. Az immunelektronmikroszkópos vizsgálat (108. ábra) csak akkor alkalmazható, ha előre valószínűsíthető, hogy milyen vírus(ok) okoz(nak) egy adott megbetegedést. A vírusizolálásnál leírtak szerint előkészített (homogenizált, pufferrel kiegészített, centrifugált) vírusszuszpenzióhoz specifikus ellenanyagokat tartalmazó savót adunk (ennek helyes megválasztása érdekében kell előre behatárolnunk azon vírusok csoportját, melyek az adott kórkép kiváltásában szerepet játszhatnak). Az ellenanyagok hatására összecsapódó víruspartikulákat centrifugálással leülepítjük, és az üledéket negatívkontraszt-eljárással vizsgáljuk. A képződött virionhalmazok a látótérben a különálló virionoknál könnyebben megtalálhatók. A vizsgálat bizonyos vírusok esetében egyben szerotipizálásnak (vírusazonosításnak) is tekinthető ábra - Reovirusok elektronmikroszkópos képe fertőzött sejtben (Az Országos Állategészségügyi Intézet felvétele) 224
245 Virológia 108. ábra - Rotavirusok immun-elektronmikroszkópos képe (Az Országos Állategészségügyi Intézet felvétele) 225
246 Virológia Vírusantigének kimutatása A vírusantigének kimutatásakor ugyancsak a specifikus ellenanyagok kötődését használjuk fel diagnosztikai célból. Ezekkel az immunológiából ismert szerológiai próbákkal komplett és inkomplett virionok, sőt még a kapsziddá össze nem épült vírusfehérjék is kimutathatók. Természetesen a megfelelő savó kiválasztása itt is alapfeltétel, csak a kórbonctani és klinikai kép alapján valószínűsíthető kórokozók ellen termelt savók használata indokolt. A direkt és indirekt immunfluoreszcenciás (IF) próba segítségével szövettani metszetekben, levált sejtekben (pl. rotavirus-fertőzés esetén a bélsárral ürülő hámsejtekben) vagy lenyomati készítményekben (pl. a veszettség diagnosztikája agyvelőlenyomati készítményekben) intracellulárisan mutatható ki az antigén (109. és 110. ábra) ábra - Parainfluenza 3 vírus IF képe fertőzött sejt cytoplasmájában (dr. Köves Béla felvétele) 226
247 Virológia 110. ábra - Adenovírus IF képe fertőzött sejtmagban A további antigénkimutási eljárásokkal a sejtből kiszabadult (vagy különböző módszerekkel kiszabadított), oldatban lévő vírusok, vírusfehérjék mutathatók ki. A komplementkötési (KK) próbával mutatják ki a vírusantigént pl. száj- és körömfájás esetén a szájnyálkahártya elváltozásaiból gyűjtött hólyagfalból, hólyagnyirokból. 227
248 Virológia Az agargél-precipitációs próbával vagy újabban annak kb. tízszer érzékenyebb és gyorsabb változatával az ellenáramú (counter current) immunelektroforézissel kimutathatók a fertőzött állatok bélsarából a nagy mennyiségben ürülő rota-, parvo- és adenovirusok. Igen érzékenyek az enzimreakciókat és izotópos jelzést alkalmazó próbák (ELISA, RIA és ezek különféle változatai). E próbákban egyre gyakrabban alkalmaznak hibridomasejtekkel termeltetett monoklonális ellenanyagokat, kihasználva ezek specificitását, tisztaságát és standardizálhatóságát. E módszereket azonban inkább a fertőzött állatokban megjelenő ellenanyagok kimutatására, vagyis az indirekt víruskimutatásra használják, noha antigénkimutatásra is alkalmasak Vírusnukleinsav kimutatása A korábban ismertetett nukleinsav-hibridizációs eljárás a genetikai kutatásokon kívül a vírusdiagnosztikában is felhasználható. A vizsgálati mintában lévő DNS-t hőkezeléssel hosszában felnyitják, majd hozzáadják a 32 P izotóppal jelzett próba-nukleinsavat. Ez lehet fertőzött sejtekből tisztított vagy klónozás után baktériumokkal termeltetett DNS vagy mrns. Amennyiben a vizsgálati anyagban van vírusspecifikus DNS, akkor az a komplementer próba-dns-szállal kettős szálat alakít ki; ezt a többszöri mosás után is visszamaradó radioaktivitás jelzi. Az izotópfelhalmozódást általában autoradiográfiás módszerrel vagy műszeres méréssel mutatják ki. Az eljárásnak a diagnosztikában két változatát használják. Az in situ hibridizáció során szövettani metszetekben mutatható ki a vírus-dns (pl. az Aujeszky-féle betegség vírusával latens módon fertőzött ganglionokban). A dot blot hibridizációt a korábban már említett nitrocellulóz filtereken végzik (az eljárást ezért filterhibridizációnak is nevezik). Ilyenkor a vizsgálati mintát (szervdörzsölékből, orrtamponból stb. származó sejteket) nitrocellulóz filterre csöppentik, és kémiai úton roncsolják. A sejtekből kiszabaduló DNS aspecifikusan kötődik a filterhez. Hőkezelés és a megfelelő specifikus próba hozzácseppentése esetén a többszöri mosás után is visszamaradó radioaktivitás egyértelműen arra utal, hogy a mintában specifikus vírus-dns volt (111. ábra) ábra - Filterhibridizációs eljárás 228
249 Virológia Specificitásuk miatt a nukleinsav-hibridizációs próbák is csak olyan esetekben használhatók, ha szűkíthető azon vírusok köre, amelyek az adott fertőzést okozhatták, vagy sejtjük, hogy milyen vírus idézte elő a fertőzést, és ezt a feltevésünket akarjuk igazolni vagy kizárni. (A módszer ugyanis jelenleg még meglehetősen drága, és a különböző vírusokra specifikus próbanukleinsavakkal végzett párhuzamos vizsgálatok a költségeket megtöbbszörözik.) A sejtben latens fertőzést okozó vírus-dns (pl. a kromoszómába épülő DNS közvetítőt alkalmazó retrovirusok vagy egyes herpesvirusok episomálisan perzisztáló nukleinsava) más módszerrel nem mutatható ki. Az izotópok használatával járó sugárveszély kiküszöbölésére a diagnosztikában is alkalmazható az enzimreakciókon alapuló nukleinsav-kimutatás (pl. biotinnal jelzett próba-dns) a foszforizotóp használata helyett. A polimeráz-láncreakción (polymerase chain reaction, PCR) alapuló eljárással a latensen fertőzött sejtekből az igen kis mennyiségű nukleinsav is kimutatható, és ez a módszer alkalmas a régen elpusztult, autolizált sejtekből történő víruskimutatásra is. A vizsgálni kívánt sejtekből származó DNS-hez ekkor mesterségesen előállított, vírusspecifikus oligonukleotid szekvenciákat (primert, indító szakaszt) Thermobacter törzsekből származó polimeráz enzimet és nukleotidokat adnak. Az oligonukleotidok a fertőzött mintában levő vírus DNS-hez tapadva primerként szolgálnak a polimeráz enzim számára, amely a szabad nukleotidokból felépíti a teljes, vírusspecifikus nukleinsavat. A mintát ezután C-ra melegítik (a thermobacter-polimeráz ezen a hőmérsékleten nem veszti el aktivitását), így a frissen szintetizált szál leválik a templátként szolgáló nukleinsavról. Ez a folyamat többször megismételhető, így a minden ciklusban megduplázódó templátokról az eredetinél nagyságrendekkel több vírus-dns szál képződik, és ez a nukleinsav a következő lépésben filterhibridizációval vagy restrikciós endonukleáz emésztéssel azonosítható (112. ábra) ábra - Polimeráz-láncreakció (PCR) folyamatábrája 229
250 Virológia A vírusok indirekt kimutatása Az előbbiek alapján nyilvánvaló, hogy a direkt víruskimutatás a fertőző megbetegedések közül, főleg a heveny fertőzések esetében, csak egy igen rövid (néhány napos) vírusürítési, illetve vírushordozási periódusban lehetséges, és a siker még megfelelő mintavétel esetén is kétséges. Ezért sokszor az indirekt víruskimutatás módszereit kell felhasználnunk a vírusok okozta betegségek kórjelzésére vagy egy állományban rendszeresen előforduló vírusok meghatározására (vagyis az állomány járványtani állapotának felmérésére). Ilyenkor a különböző szerológiai módszerekkel a vérsavóban kimutatott ellenanyagok jelenléte utal egy állat vagy az állomány fertőzöttségére. Mivel az immunglobulinok a vérben a fertőzést követően több hónapig perzisztálnak, ebben az esetben a vizsgálat időpontja nem olyan szűken behatárolt. Lényeges, hogy figyelembe vegyük az állományban végzett esetleges immunizálásokat, valamint fiatal állatokban a maternális ellenanyagok jelenlétének lehetőségét. A jelenleg alkalmazott vakcinákkal és szerológiai módszerekkel ugyanis a maternális ellenanyagok, valamint a vakcinázás és a fertőződés következtében kialakuló immunglobulinok között többnyire nem lehet különbséget tenni. A vírusellenes ellenanyagok kimutatásának két célja lehet. Az egyik, amikor a vizsgálat a járványtani állapot felmérésére irányul, vagyis azt kell megállapítani, hogy milyen vírusok fordulnak elő rendszeresen egy adott állományban. Ilyenkor a statisztikai mintavétel szabályai szerint (általában kb. az állatok 10%-ából) vett 230
251 Virológia vérmintákat kell intézeti vizsgálatra küldeni. A több vírussal elvégzett szerológiai vizsgálatok során a pozitív eredmények mutatják az állomány vírusfertőzöttségét. Más esetekben a vizsgálat célja az adott időpontban megbetegedéseket előidéző járvány kórokozójának felderítése. Ilyenkor a direkt víruskimutatás mellett (ha arra nincs lehetőség, ahelyett) savópárokat kell vizsgálni. Ez azt jelenti, hogy frissen megbetegedett állatokból veszünk vért, majd 2 3 hét múlva (áthangolódásuk után) ugyanazokból az állatokból ismét küldünk vérmintát. Ha a később vett mintákban egy adott vírus ellen ellenanyagok jelennek meg, vagy a korábbinál lényegesen magasabb titerben vannak jelen, az arra utal, hogy az állományban ez a vírus okozza a megbetegedéseket. Az indirekt vírusdiagnosztikában az immunológiában tárgyalt ellenanyag-kimutatásra alkalmas eljárások használhatók fel: az agargél-precipitáció (AGP), a komplementkötési (KK) próba, az enzimreakción alapuló eljárások (ELISA) és a radioimmunológiai tesztek (RIA). Ezeken kívül van két szerológiai módszer, amelyeket a vírusszerológiában igen gyakran alkalmaznak: a vírusneutralizáció (VN) és a hemagglutináció-gátlás (HAG) Vírusneutralizáció A vírus elveszíti fertőzőképességét (semlegesítődik, neutralizálódik) akkor, ha a vírusokat olyan vérsavóval hozzuk össze, amelyben a sejthez kötődésért felelős felszíni antigéneket blokkoló ellenanyagok vannak (113. ábra). A reakció rendkívül specifikus, az egyes vírusok (szerotípusok) közötti különbségeket ugyanis éppen e fehérjék eltérései okozzák. A vírusok besorolásának, identifikálásának ezért fontos eszköze a VN próba. A vizsgálati mintában levő ellenanyagok mennyiségének (titerének) meghatározására a próbához ml-enként ismert számú fertőzőképes viriont tartalmazó (standardizált) vírusszuszpenziót használunk. A standardizálás első lépése a vírus infektív titerének meghatározása. Erre a célra a szövettenyészeten (tojásban) elszaporított vírusszuszpenzióból (általában tízes léptékű) hígítási sort készítünk, és annak minden fokozatával több (4 6 db) sejttenyészetet (tojást) oltunk. A megfelelő inkubációs idő elteltével a töményebb szuszpenzióval oltott tenyészetekben megjelenik a vírusra jellemző CPE, egy bizonyos hígítási fok felett pedig nem észlelhető vírushatás. Azt a legnagyobb hígítási fokot, amelynél a vírus hatása a tenyészetek 50%-ában jelentkezik, a vírus hígítási végpontjának nevezzük. Ez az a hígítási fok, melynek vírustartalma 1 TCID 50 (tissue culture infective dose 50%). A továbbiakban, a vírusneutralizációs próbában felhasznált vírusszuszpenzió a nemzetközi standard szerint ennél 100-szor töményebb, vagyis koncentrációja 100 TCID 50. A vírusszuszpenzió infektív titere plakkszámlálással még pontosabban megállapítható. Ilyenkor az egyes vírushígításokkal oltott sejtréteget a plakktisztításnál leírt módon fedjük, és megfelelő idő elteltével a kialakuló plakkokat megszámoljuk. Az ily módon titrált szuszpenzió víruskoncentrációját PFU-ban (plaque forming unit) adjuk meg (114. ábra) ábra - Vírusneutralizáció hatásmechanizmusának sematikus képe (A: eredményes vírusfertőzés, B: neutralizáló ellenanyagok jelenlétében a vírus nem tud fogékony sejtreceptorához kapcsolódni) 231
252 Virológia 114. ábra - Plakkszámlálással történő infektív titermeghatározás szövettenyészeten (Dr. Kükedi András anyagáról készült felvétel) 232
253 Virológia Magát a VN próbát a vizsgálandó savónak az immunológiai részben ismertetett kettes alapú logaritmus szerint történő hígításával (1:2, 1:4 stb.) kezdjük. Az egyes hígítási fokokhoz 100 TCID 50 vagy 100 PFU koncentrációjú vírusszuszpenziót adunk, összekeverjük, és 37 C-on egy órán át inkubáljuk. Ezután minden hígítási fokozattal sejttenyészeteket oltunk, és naponta vizsgáljuk, hogy melyekben mutatkozik vírushatás. Ahol nem tapasztalunk CPE-t, ott a savóban a neutralizációhoz elegendő mennyiségű ellenanyag volt. Ennek mennyisége azonban a hígulás mértékében csökken. A savónak az a legnagyobb hígítása, amely még tartalmaz vírussemlegesítő ellenanyagokat, megadja a savó neutralizációs titerét. Ez a titerérték, tehát az ún. konstans vírus, változó savóhígítás módszere szerint végzett VN próbával határozható meg. Viszonylag ritkábban (főleg az ún. párhuzamos titrálásokban, az egymással keresztreagáló, szoros antigénrokonságban lévő vírusok azonosítására) alkalmazzák a konstans savó, változó vírushígítás módszerével végzett VN próbát, amikor a vírusból 10-es alapú logaritmus szerint több hígítási sorozatot készítenek. Ezek közül az egyik sorozat tagjaira mérik rá az egy adott (konstans) mértékben hígított vizsgálandó savók mintáit, egy másik sorozatra pedig biztosan ellenanyagmentes savót mérnek (kontroll), majd inkubációt követően a keverékekkel szövettenyészeteket oltanak. A savó ellenanyag-tartalmára abból következtetünk, hogy a kontrollhoz képest milyen mértékben csökkenti a vírus infektív titerét. A két érték hányadosa az ún. neutralizációs indexet adja; minél magasabb ez az érték, annál több ellenanyagot tartalmazott a vizsgált savó. Matematikailag jobban értékelhető eredményt ad, ha a plakkredukció módszerét alkalmazzuk. Ilyenkor a neutralizáló ellenanyagok jelenlétére a plakkok számának a kontrollokhoz viszonyított csökkenéséből következtethetünk Hemagglutináció-gátlás (HAG) A próba csak olyan vírusok esetében alkalmazható, melyek felületükön speciális fehérjéket (hemagglutinineket) hordoznak, és ezekkel meghatározott fajok vörösvérsejtjeinek specifikus receptormolekuláikhoz képesek kötődni. Mivel mind a vírus, mind a vörösvérsejt több ilyen kötőfehérjével rendelkezik, összekeveredésük esetén, többszörös kapcsolódás révén, vírusokból és erythrocytákból álló aggregátumok jönnek létre. Ezek a szuszpenzióból kicsapódnak, és a reakciócső alján zegzugos szélű, szétterült üledéket alkotnak. Amennyiben a hemagglutináló vírusszuszpenziót specifikus ellenanyagokat tartalmazó savóval hozzuk össze, akkor a hemagglutinin-fehérjékhez kapcsolódó ellenanyagok meggátolják a vírus-erythrocyta kapcsolat kialakulását, és a vörösvérsejtek szabályos korong formában ülepednek le (115. és 116. ábra). 233
254 Virológia 115. ábra - Hemagglutináció-gátlás sematikus képe 116. ábra - Hemagglutináció-gátlás 234
255 Virológia A vizsgálatot ebben az esetben is a vírusoldat standardizálásával kezdjük. Ezúttal azonban a vírus hemagglutinációs titerének meghatározása a cél. A vírusszuszpenzió kettes léptékű hígítási sort készítünk, melynek minden egyes tagjához hozzáadjuk a megfelelő állatfajból származó, mosott (0,5 1%-os) vörösvérsejtszuszpenziót. A keveréket ezután a reakció számára optimális (vírusonként eltérő) hőmérsékleten és ideig inkubáljuk (pl. a juh-adenovirusokat patkány-vörösvérsejtekkel 4 C-on, 12 óráig, a parainfluenza-vírusokat tengerimalac-vörösvérsejtekkel 37 C-on, 2 12 óráig stb.). Az a legnagyobb hígítási érték, amelyben még létrejön az agglutináció, a vírusszuszpenzió hemagglutinációs titerét adja meg. Ennek koncentrációja 1 HAegység. A HAG próbában ennél 4 8-szor töményebb vírusoldatot használunk. A HAG próbát úgy hajtjuk végre, hogy a vizsgálandó vérsavót kettes léptékben hígítjuk, a hígítási sor minden tagjára azonos mennyiségben 4 8 HA-egység koncentrációjú vírusoldatot mérünk, és a keveréket (1 óráig 37 Con) inkubáljuk. Ezt követően a csövekbe mosott vörösvérsejtek 0,5 1%-os szuszpenzióját mérjük. Megfelelő ideig tartó és megfelelő hőmérsékleten történő inkubálás után az ellenanyagot nem tartalmazó csövekben kialakul az agglutináció. A savónak azt a hígítási fokát, amelyben még gátolni képes az agglutináció kialakulását, a savó HAG-titerének nevezzük. A HA és HAG vizsgálatok során anyag- és munkaerő-megtakarítást jelent, ha a próbákat csövek helyett műanyag lemezek vájulataiban végezzük, a hígításhoz pedig ún. Takátsy-féle hígítókacsot (újabban inkább többcsatornás mikropipettákat) használunk Védekezés a vírusfertőzések ellen A direkt és indirekt diagnosztikai módszerekkel a fertőzött egyedekben vagy állományokban kimutatott pathogen vírusok ellen értelemszerűen védekezni kell. A védekezés során részben állat-egészségügyi igazgatási és állathigiéniai intézkedésekkel védekezünk: karanténozással, az állatforgalom ellenőrzésével, megfelelő tartási és takarmányozási körülmények biztosításával stb. Emellett a fertőzött vagy fertőzésveszélynek kitett állatok védelmére a vírusellenes szereket és a vakcinákat, a környezetben a kiürülő, fertőzőképes virionok ellen pedig a különböző fertőtlenítőszereket vesszük igénybe. Ez utóbbiak megfelelő alkalmazásához mindenekelőtt a vírusok ellenálló képességét kell ismernünk A vírusok ellenálló képessége A környezet hőmérséklete alapvetően befolyásolja a vírusok élettartamát. A bakteriológiából ismert sterilizálási eljárásokkal (autoklávozással, hőlég-sterilizálással) minden vírus inaktiválható, sőt a struktúrproteinek 235
256 Virológia denaturációja miatt a vírusok többsége (elsősorban az érzékenyebb burkos vírusok) már 1 2 óráig tartó, 56 Cos inkubálás alatt is elveszti fertőzőképességét. A beszáradás iránt szintén elsősorban a burkos vírusok érzékenyek, ezek a különböző testváladékokkal a környezetbe jutva csak rövid ideig maradnak életben. Más vírusok (pl. a parvo-, pox- és picornavirusok) több hétig, sőt több hónapig is túlélnek beszáradt állapotban. A különböző sugárhatások közül a látható fény, különösen a napfény közvetlen hatására a legtöbb vírus elpusztul. Ez a folyamat tiszta ultraibolya fény hatására még gyorsabban végbemegy. Az ionizáló sugárzás (gamma-sugárzás) töréseket okoz a nukleinsavszálon, és ezért szintén inaktiválja a vírusokat. Ha a környezet kémhatása az intracellulárisan jellemző értékektől nagymértékben eltér, akkor a vírusfehérjék denaturálódnak, a vírus elveszti fertőzőképességét. A vírusok ugyanis fiziológiás ph-értékek között (ph 6,5 7,5) a legstabilabbak, noha sok vírus hosszabb ideig képes elviselni a ph 3-as közeget is (pl. az enterovirusok, adenovirusok, coronavirusok stb.) Fertőtlenítő- és inaktiválószerek A vírusok különböző alkotóelemeivel reagáló vegyületek közül kerülnek ki a leggyakrabban alkalmazott fertőtlenítőszerek és a vakcinakészítéskor használt inaktiválószerek egyaránt. Mind fertőtlenítésnél, mind inaktiválásnál az alapvető cél a vírus infektivitásának megszüntetése, de inaktiváláskor fontos szempont az is, hogy az antigenitásért felelős (glüko)proteinkomponensek minél kevésbé módosuljanak a beavatkozás következtében. Ezért az inaktiváláskor használt szerek hatásmechanizmusa eltér a fertőtlenítőszerekétől (pl. a fehérjékkel nem reagálnak), vagy koncentrációjuk töredéke a fertőtlenítéskor alkalmazott koncentrációnak. Fertőtlenítőszerként használhatók pl. a ph-viszonyokat szélsőségesen megváltoztató erős savak és lúgok (pl. a 2 3%-os nátronlúg vagy a 0,1 0,2%-os kénsav). A különböző oxidálószerek, szervetlen és szerves halogénszármazékok (klórlúg, klórmész, jódtinktúra, jodofórok stb.) a szulfidcsoportok oxidációja révén inaktiválják a vírusokat. Hatásukat a fehérjetartalmú szennyeződések (vér, bélsár, nyálka stb.) erősen csökkenthetik. Találunk köztük a vírusszennyezésnek kitett ( ragályfogó ) tárgyak és a fertőzött testfelületek fertőtlenítésére alkalmas vegyületeket egyaránt (előbbi célra pl. a klórlúg és klórmész, utóbbira a Neomagnol-oldat vagy a jodoforok használhatók). A fehérjedenaturáló vegyületek (alkoholok, fenol stb.) általában csak kisebb kézi műszerek, üvegtárgyak gyors fertőtlenítésére alkalmasak, de tudnunk kell, hogy e szerek nem inaktiválják a vírusok nukleinsavát, csak a fehérjekomponenseket precipitálják vagy oldják. Ezért használható mindkét vegyület pl. nukleinsav-tisztításra az analitikai vizsgálatok előtt. A zsíroldó szereket és a detergenseket általában nem fertőtlenítőszerként, hanem tisztítószerként használják. E vegyületek közül némelyik csak a burkos vírusokat inaktiválja a lipoprotein-komponensek oldása révén. Ezek az anyagok vírusinaktiválásra csak bizonyos célból (pl. vírusazonosításkor) alkalmazhatók. Az alkilálószerek közül a formalin 3%-os oldatát tárgyak, berendezések lemosására, gőzét légterek fertőtlenítésére használják. A formalint a vakcinakészítés során inaktiválószerként is általánosan használják. A vírusfolyadékhoz kis koncentrációban (0,001%) hozzámért formalin ugyanis a vírusnukleinsav aminocsoportjait is alkilálja és ezáltal inaktiválja, de az antigénszerkezetet nem változtatja meg jelentősen, mert a polipeptidmolekulákon keresztkötéseket hoz létre, stabilizálva az eredeti antigénszerkezetet. (Nagyobb koncentrációban a fehérjéket is erőteljesen denaturálja és azok antigenitását is megváltoztatja.) Az inaktiválásra újabban egyre inkább terjed a nukleinsav-denaturáló szerek (pl. béta-propiolakton, etiletilénimin) használata, melyek a vírus antigenitásért felelős fehérjekomponenseit érintetlenül hagyják, ugyanakkor keresztkötéseket létesítenek a nukleinsavon, ezért inaktiválószerként sokkal biztonságosabban alkalmazhatók vakcinakészítéskor Vírusellenes kemoterápia A vírusellenes szerek részletes ismertetésével (kémiai szerkezet, alkalmazás módja stb.) a gyógyszertan foglalkozik, az alábbiakban csak az antivirális kemoterápia néhány alapelvét ismertetjük, példaként említve néhány vegyületet (117. ábra). Ezek elsősorban a orvosi terápiában használatos gyógyszerek, állatorvosi 236
257 Virológia területen alkalmazásuk legfeljebb a kisállatgyógyászatban elképzelhető. Gazdasági haszonállatok gyógyítására vagy netán tömegkezelésekre alkalmas vírusellenes szerek még nem állnak rendelkezésre, mert az antibakteriális terápiában bevált antibiotikumokhoz hasonló, általánosan hatékony vagy legalábbis széles terápiás skálájú antivirális szerek egyelőre nem ismeretesek. Ennek fő oka az, hogy a vírusok nagyon szorosan kapcsolódnak a sejtben zajló metabolikus folyamatokhoz, ezért a legtöbb vírusellenes szer a sejtre is toxikus. Legismertebbek a különböző nukleozidanalógok (pl. iodoxuridin, trifluortimidin adenin arabinozid), melyek beépülnek a nukleinsavláncba, de a polimeráz enzim számára nem értelmezhetők, ezért gátolják a nukleinsavreplikációt. Ezek a hagyományos nukleozidanalógok a sejtek kromoszomális DNS-ének replikációjakor is beépülnek a DNS másolatba, vagyis többé-kevésbé citotoxikus hatásúak, ezért általában csak külsőleges kezelésre alkalmazhatók (pl. herpeszellenes kenőcsökben) ábra - Egyes vírusellenes szerek szerkezeti képlete 237
258 Virológia 238
259 Virológia A vírusszaporodás biokémiai folyamatainak alaposabb megismerése után úgy tűnik, hogy a vírus multiplikációs ciklusának több olyan szakasza is van, amely alkalmas lehet a szelektív beavatkozásra. Az újabb vírusellenes gyógyszereket már ennek ismeretében tervezték és szintetizálták. A logikai megközelítés alapján bármely olyan folyamat, amelyben vírusspecifikus enzimek szerepelnek, potenciális célpont lehet olyan szer előállítására, amely iránt a kérdéses enzim affinitása fokozott. Az ilyen molekulákat és annak analógjait szintetizálják, hatástani és ártalmatlansági vizsgálatokat végeznek, végül kiválasztják a gyógyszernek legalkalmasabb változatot. Mivel vírusspecifikus enzimek csak a fertőzött sejtekben vannak, az intakt sejtek működését ezek a szerek nem befolyásolják. Ilyen előre megtervezett, szelektív gyógyszerek az ún. második generációs nukleozidanalógok, pl. az acikloguanozin (acyclovir) és valin-észtere a vacyclovir, valamint származékai (famciclovir, penciclovir, gaciclovir). Az acyclovirt és rokonvegyületeit elsősorban a herpeszfertőzések (herpes simplex és cytomegalovirus fertőzés ) terápiájában alkalmazzák. Az acyclovir egy herpesvirus-specifikus enzim (dezoxitimidin-dezoxicitidin kináz) segítségével alakul át acikloguanozin-trifoszfáttá, amely a szintén vírusspecifikus DNS-polimeráz enzim működését gátolja. A folyamatban tehát két helyen is szerepelnek csak a vírussal fertőzött sejtekben jelen lévő enzimek; a szelektív hatás így biztosított. A didezoxinukleotidokban pl. didezoxicitidin (ddc), didezoxinadenozin (dda) a DNS-t alkotó dezoxinukleotidhoz képest az a különbség, hogy a nukleotidok egymáshoz kapcsolódásához szükséges 3 hidroxilcsoport hiányzik, így az ilyen didezoxinukleotid beépülésekor a DNS lánc polimerizációja megszakad. E szereket a human immunodeficiency virus (HIV) szaporodásának csökkenésére alkalmazzák, általában kombinációban. Az ilyen kombinációk általában valamilyen proteáz inhibitort is tartalmaznak (pl. indinavir, saquinavir, ritonavir), mivel a HIV egyik prekurzor fehérjéjét vírusspecifikus enzim vágja végleges méretűre a proteáz inhibítorok ezt az enzimet blokkolják. Az AIDS (acquired immunodeficiency syndrome) kezelésére fejlesztették ki az azidotimidint (AZT), amelyet a vírusspecifikus reverz transzkriptáz enzim timidinmolekula helyett beépít a vírus RNS-genomjáról másolt DNSláncba. Mivel az AZT-ról hiányzik a 3 -hidroxilcsoport, a következő nukleotidnak nincs hová kötődnie, a DNSlánc növekedése megáll, egy inkomplett és ezért inaktív provírus jön létre. A szert legtöbbször egyéb, a HIV vírus szaporodását más pontokon gátló komponensekkel kombinálva alkalmazzák, ezzel a módszerrel a fertőzöttek kezelésében ígéretes eredményeket értek el. A ribavirin a guanozin analógja, és így elvileg hasonló módon fejtené ki hatását. A molekula azonban intracellulárisan átalakul (trifoszfát formájában fordul elő), és ez a származék a mrns-molekulák felépítésében szerepet játszó guaniltranszferáz enzimet gátolja. Arenavirus fertőzések leküzdésére alkalmazzák. A nem nukleozidanalóg kemoterápiás szerek közül a methisazont a emberi himlőmegbetegedések megelőzésére használták. Ez a szer elsősorban a késői transzlációt gátolja, így a struktúrproteinek felépülését akadályozza. Az amantadin és származéka, a rimantadin, az influenzavirusok külső burkának és a sejtmembránnak az összeolvadását gátolja. Szűk spektrumú gyógyszer, csak az influenzás tünetek enyhítésére használható, noha in vitro szövettenyészeteken néhány paramyxovirus szaporodását is gátolta. A Zanamivir és a GS4104 nevű vegyület neraminidáz gátló és így az influenzavirus szaporodását csökkenti. A Foscarnet (foszfonoformolsav trinátrium sója) egyrészt a reverz transzkriptáz működését gátolja, másrészt a herpesvirus-specifikus polimerázt is, igy HIV, cytomegalovirus és herpes simplex fertőzések esetén alkalmazható. A fenti szerek egy része a sejtek működését is befolyásolja (többé-kevésbé cytotoxikusak), néha az in vitro tapasztalt antivirális hatásnál az in vivo kísérletekben észlelt eredmények kevésbé megfelelőek, és rezisztens vírustörzsek megjelenését is leírták Interferonok és interferoninducerek Elméletileg az interferonok ideális vírusellenes szerek. Nem szintetikus termékek, hanem a szervezetben képződnek, nem toxikusak, és a vírusok széles skálája ellen hatásosak. Ennek ellenére az interferonokat terápiás vagy preventív célból a vírusos megbetegedések kezelésére a korábban leírt gyakorlati nehézségek miatt még a humán gyógyászatban is csak bizonyos esetekben (vírusos hepatitis, influenza, rhinovirusos nátha) alkalmazzák. Az állatorvosi praxisban a közeljövőben nem várható széles körben felhasználható, gazdaságos és hatékony készítmények forgalomba hozatala. Az interferon inducerek általában toxikusak és hatásuk in vitro jóval erősebb, mint in vivo. Ezért ilyen szerek nincsenek forgalomban Szérumok 239
260 Virológia A vírusfertőzések ellen a szervezetbe bevitt kész ellenanyagok segítségével a betegség klinikai tünetei enyhíthetők, a gyógyulás gyorsítható, a vírusürítés csökkenthető. Számtalan készítmény van forgalomban a kisállatok vírusfertőzéseinek kezelésére. A szérumterápia (passzív immunizálás) lehetőségeivel és kockázataival az Immunológia fejezet foglalkozik. 240
261 4. fejezet - Részletes virológia 1. DNS-vírusok 1.1. Parvoviridae A parvovirus elnevezés a latin parvus (kicsiny, apró) szóból ered, ami a virionok kis méretére utal. Az állatokat megbetegítő vírusok közül a parvovirusok az eddig ismert legkisebb DNS-vírusok. A Parvoviridae családba három nemzetség tartozik: Parvovirus, Dependovirus, Densovirus genus. A Parvovirus genusba tartozó vírusok kizárólag melegvérű állatokat (gerinceseket) betegítenek, meg és multiplikációjuk során a gazdasejt polimeráz enzimét használják fel. A Dependovirus genus tagjai szintén melegvérű állatokat betegítenek meg, de szaporodásukhoz más vírus (pl. adeno- és herpesvirus) polimeráz enzimét veszik igénybe. A nemzetség elnevezése a latin dependeo (függ valamitől) szóból ered, ami erre a függőségi viszonyra utal. A Densovirus genus tagjai rovarokban fordulnak elő, de néhány densovirusszerű (densovirus-like) kórokozót izoláltak tengeri rákokból is. A densovirusok a rovar életciklusának bármely szakaszában (lárva, imágó, rovar) képesek önállóan, a parvovirusokhoz hasonlóan szaporodni. A nemzetség elnevezése a latin densus (sűrű, tömött) szóból ered, ami a genusba tartozó Densonucleosis vírus által okozott cytopathogen hatásra és annak festődési viszonyaira utal. Állatorvosi szempontból a Parvovirus nemzetség tagjai a jelentősek, ezért a továbbiakban ezek tulajdonságait részletezzük, majd a fejezet végén még kitérünk a dependovirusokra is Parvovirusok Morfológia A burok nélküli virion ikozahedrális szimmetriájú és nm átmérőjű. (118. ábra). A nukleokapszid kapszomerből épül fel. A vírus molekulatömege 5,5 6,2 x 10 6 Da. A virion 80%-a fehérjét, 20%-a nukleinsavat tartalmaz. A relatíve magas nukleinsavarány a virionnak 1,39 1,42 g/cm 3 úszósűrűséget biztosít CsCl oldatban, ami lehetővé teszi a Dependovirus genomok szeparálását a helpervirusoktól ábra - Bovin parvovirus (Az Országos Állategészségügyi Intézet archívumából) Ritchie A. felvétele 241
262 Részletes virológia Nukleinsav. A lineáris ssdns molekulatömege 1,55 1,97 x 10 6 Da és irányítottsága (transzkripciós készsége) szerint megkülönböztetünk (+) és ( ) nukleinsavszálakat. A parvovirusok multiplikációjuk alatt mind ( ) mind (+) szálakat szintetizálnak, de ezeket az egyes nemzetségbe tartozó vírusok eltérő arányban csomagolják be a kapszidba (+ szál aránya 1 50%). A Parvovirus nemzetségbe tartozó vírusok kapszidja szinte kizárólag ( ) szálat tartalmaz. A (-) irányítottságú genom két vége (5 és 3 terminális) visszahajlik, és kovalens kötésekkel egy-egy dupla szálú véget alakít ki, ami speciális hajtű- (hairpin-)struktúrát ad a szimpla szálú vírus-dns-nek. A 3 terminálon kialakuló hajlat Y vagy T formát kölcsönöz a genomnak. Ez a hajtűstruktúra palindrom szekvenciával rendelkezik és a DNS-polimeráz enzimek primerként fogadják el (önkezdő szál), ami a vírus replikációs stratégiájában jelentős szerepet játszik (lásd vírusok multiplikációja). Több parvovirus genom teljes nukleotid-szekvenciáját feltárták (119. ábra) ábra - Parvovirusgenom Vírusfehérjék. Antigéntulajdonság. Minden parvovirus és dependovirus három különböző kapszidfehérjét (VP1 VP2 VP3) kódol, az Aleuti-betegség vírusának kivételével, ahol csak két struktúrprotein (VP1 VP2)gén található. Ez utóbbi esetben a VP3 protein a VP2 fehérjéből keletkezik a transzláció utáni enzimatikus vágással. A vírusfehérjék 80%-a VP3 protein. 242
263 Részletes virológia A parvovirusgenom olyan rövid, hogy a struktúrproteingének átfedik egymást, ezért nincs szabad hely más fehérjék, pl. transzkriptáz enzimek kódolására. Ez az oka annak, hogy a papovavirus és a HDV-n kívül a parvovirusnak sincs DNS-polimerázenzime. A legtöbb parvovirus kapszidproteinjei haemagglutinációs képességgel rendelkeznek. A haemagglutinációs képesség azonban még ugyanazon vírus törzsei között is eltérő lehet (pl. macskák panleukopeniája). A sertés és a kutya parvovirus-fertőzéseinek diagnosztikájában a hemagglutinációs próbákat kiterjedten alkalmazzák. Az Aleuti-betegség vírusa, a libák parvovirusa és néhány sertésparvovirus-törzs nem haemagglutinál. A parvovirus-fehérjék jó hatásfokú antigének, mivel a szervezetet erős, magas szintű immunválaszra késztetik. A természetes fertőzés és a szakszerű vakcinázás után kialakult immunitás hosszan tartó és protektív. A vírusok ellen termelt kolosztrális ellenanyagok hosszú ideig perzisztálnak (sertésben akár 6 hónapos, kutyában akár 18 hetes életkorig). Ellenálló képesség. Fizikokémiai tulajdonságok. A parvovirusok kiemelkedően ellenállnak a fizikokémiai hatásoknak. Szaporodóképességüket megőrzik ph 3 9 között. Szobahőmérsékleten hetekig túlélnek, 56 C-os hőkezelésnek 60 percig ellenállnak. A kutya és a sertés parvovirusai a bélsárban hónapokig is megtartják fertőzőképességüket. A fertőtlenítőszerek közül hatékony a formalin, nátronlúg, klórlúg, de hatástalan az alkohol, a fenol és a kvaterner ammóniumsók. Multiplikáció. A parvovirusok szaporodását a Vírusok multiplikációja c. fejezetben részletesen tárgyaljuk. Mivel a parvovirusok nem kódolnak transzkriptáz enzimeket, a makromolekuláik szintéziséhez a sejt replikáz és transzkriptáz enzimeire támaszkodnak (120. ábra). Ezért szaporodásukhoz elsősorban a mitotikus osztódás S fázisában levő sejteket használják. A dependovirusok a közelükben szaporodó herpesz- vagy adenovirusoktól veszik el a virális enzimeket ábra - Parvovirusok szaporodása Kórokozó képesség. A parvovirusok gazdaspektruma szűk. Mivel szaporodásukhoz osztódó sejtet igényelnek, pathogen hatásukat a szervezetben ott fejtik ki, ahol intenzív sejtosztódás van. A parvovirus számára ilyen 243
264 Részletes virológia célszervek a magzat, az újszülött és a fiatal állat bélhám-, szívizom- és idegsejtjei, felnőtt állatban az immunrendszer sejtjei (20. táblázat). 20. táblázat - Állatok parvovirusok okozta megbetegedései Állatfaj Fetopathogén hatás Enteritis Myocarditis, pericarditis Egyéb Ló (+?) Szarvasmarha + Sertés ++ (smedi) Kutya ++ + Macska + (ataxia) ++ panleukopenia immunszuppresszív hatás Nyérc ent. ++ Nyérc Aleuti betegsége Liba Derzsy betegsége immunkomplex képződés nátha májelváltozás A sertés parvovirusa (PPV, Porcine Parvovirus). A sertésparvovirusok egy szerocsoportba tartoznak, és jól szaporodnak sertésvese- és sertéspajzsmirigy-tenyészetekben. A hemagglutináló törzsek több állatfaj (tengerimalac, patkány, csirke, humán O) vörösvérsejtjeit agglutinálják. Sertésben a parvovirus-fertőzés kizárólag terméketlenséget és magzatkárosodást (vetélést) okoz. A SMEDI néven ismert tünetegyüttes a fertőzés során megfigyelt kórképeket egyesíti (Stillbirth-Mummification-Embryonic Death-Infertility, vagyis halvaszületés-mumifikáció-embrióelhalás-terméketlenség). A fertőzés kimenetele attól függ, hogy a fogékony állatot a vemhesség melyik időszakában érte a fertőzés (21. táblázat). A nem vemhes sertésben a parvovirus szubklinikai fertőzést okoz, az állat korától függetlenül. Eddigi ismereteink szerint a sertésparvovirus nem alakít ki sem latenciát, sem perzisztens fertőzést. A fertőzött állat a bélsarával üríti a vírust. A kereskedelmi forgalomban levő attenuált és inaktivált vakcinák hatékony védelmet biztosítanak a vemhes sertéseknek. 21. táblázat - A parvovirus-fertőzés eredménye vemhes sertésben Vemhesség ideje (nap) Fertőzés eredménye vírusdiagnosztika 30 embrió elpusztul és felszívódik vírus(+) ellenanyag(+) visszaivarzás kocában embrió elpusztul, mumifikálódik vetélés vírus(+) ellenanyag(-) vírus(+) ellenanyag(+) 244
265 Részletes virológia magzatban kocában vetélés vagy halvaszületés remegő", szétcsúszott lábú" malac vírus(+) ellenanyag(+) vírus(+) ellenanyag(+) magzatban kocában Macska panleukopeniájának vírusa (FPLV Feline Panleucopenia Virus). A vírus macskaveseszövetből készült sejteken szaporítható, ahol magzárványokat hoz létre. Az FPLV törzsek egy szerocsoportba tartoznak de virulenciájuk különböző. Minden macskaféle (Felidae) fogékony a fertőzésre, amely valószínűleg a macskák legfontosabb vírusos betegsége. A parvovirus a fehérvérsejtekben intenzíven szaporodik, és ennek eredményeképpen a fehérvérsejtek száma drasztikusan csökken (panleucopenia). A viraemia során a bélhámba eljutó és ott szaporodó parvovirus véres hasmenésben, hányásban megnyilvánuló kórképet okoz. Ha a magzatot 2 héttel a születés előtt vagy az újszülött kismacskát 2 héttel a születés után éri a fertőzés, a vírus eljuthat a kisagyba, ahol szaporodása révén a Purkinje-sejtek hypoplasiáját okozza. Ez a kismacskákban a kórjelző értékű ataxia kialakulásához vezet. Idősebb kölykökben és felnőtt macskákban szubklinikai fertőzés gyakran előfordul, de ezekben az állatokban is kialakul immunszuppresszió, a fehérvérsejtszám csökkenése miatt. A fertőzött állat a bélsárral üríti a vírust (1g bélsár akár 10 9 vírust is tartalmazhat). A betegség ellen hatékony vakcinákat állítottak elő. A maternális immunitás 6 14 hétig biztosít védelmet a kismacskáknak. A kutya parvovirusai (Minor Virus of Canine CPV 1, Canine parvovirus CPV 2). Az emlősparvovirusok közül a kutyákban 2 parvovirus okoz fertőzést. Az apathogennek tartottcpv 1 (Minute virus of Canine, MCV) és a kutyák parvovirusos bélgyulladásaként vagy kutyaparvóként ismert súlyos enterális betegséget és myocarditist okozó CPV 2 (Canine parvovirus Type 2). ACPV 1 vírust 1967-ben izolálták egészséges kutyák bélsarából, és a legutóbbi időkig ártalmatlan vírusnak tartották. Amerikai szerzők azonban 1995-ben fatális kimenetelű megbetegedést írtak le kölyökkutyákban, melyek hátterében bizonyítottnak látták a CPV 1 vírus szerepét A kutyák parvovirusos bélgyulladását okozó CPV 2 vírustörzs 1978-ban tűnt fel, és a genetikai vizsgálatok bizonyították, hogy a macskák panleukopeniájának vírusából (FPV) keletkezett mutációval a laboratóriumi szövetpasszálások során. A rendkívül konzervatívnak gondolt eredeti CPV 2 törzsek a járványok során további genetikai mutációkat szenvedtek, melynek eredményeként 2 új szubtípus alakult ki, 1979-ben acpv 2a és 1984-ben acpv 2b törzsek. A CPV 2b törzs a CPV 2a törzsből született mutációval. Ezek az új szubtípusok ma már világszerte elterjedtek és több területen kiszorították az eredeti CPV 2 törzseket A CPV 2 törzsek nem fertőzték a macskát, a CPV 2a, CPV 2b szubtípusokat izolálták enterális megbetegedésben szenvedő macskák bélsarából. A CPV 2 szubtípusok virulensebbnek bizonyultak, mint a CPV 2 törzsek. Ugyanakkor a CPV 2 törzsekből készült vakcinák védelmet nyújtanak a szubtípusokkal szemben is. A nyérc parvovirus betegségei. A nyércben két különböző parvovirus megbetegedés fordul elő. A nyérc parvovirus okozta bélgyulladása (Mink Virus Enteritis, MVE) és a nyércek Aleuti betegsége ( Aleutian Disease of Mink, ADV). A nyérc parvovirus okozta bélgyulladása gyors lefolyású, súlyos hasmenésben megnyilvánuló és nagy mortalitással járó akut megbetegedés, amely főként fiatal nyércekben fordul elő. A vírus nyérc és macska eredetű szöveten szaporítható. A nyércek Aleuti-betegségelassú lefolyású és többnyire az állat halálával végződő krónikus immunkomplex megbetegedés. Az ADV a nyérc önálló parvovirusa, mivel mind a szerológiai mind a genetikai vizsgálatok alapján különbözött a macskák parvovirusától. A betegség iránt nyérceken kívül a görények és szkunkok is fogékonyak. Az ADV ellen termelt ellenanyagok nem neutralizálják a vírust, ami a perzisztens fertőzés kialakulásához és a folyamatos immunkomplex- (vírus + ellenanyag) képződéshez vezet. 245
266 Részletes virológia A liba Derzsy-féle betegsége (Goose parvovirus, GPV). A kislibákban generalizált megbetegedést (hasmenés, idegrendszeri tünet, nátha) okozó vírus a vírushordozó ludak tojásaival és bélsarával terjed. A vírus libaembrióból készült szövettenyészeten szaporítható. A betegség ellen hiperimmun szérumterápiát alkalmaznak, de kifejlesztettek bakulovírusba expresszált vektorvakcinát is. Laboratóriumi diagnosztika. A vírusizolálás többnyire a bélsárból és a mumifikált magzatokból történik, faj azonos szövettenyészeten. A CP-hatás nem kifejezett (magzárvány), ezért a vírus azonosítására az IF próbát is használják. A vírustörzsek azonosítását NS szekvenciaanalízissel és restrikciós enzimvizsgálatokkal végzik. A vírusdiagnosztikában széles körben használják az elektronmikroszkópos vizsgálatot. A vírusfehérjéket ELISA, IF és HA próbákkal mutatják ki. A vírusspecifikus ellenanyagok meghatározását ELISA, HAG (hemagglutináció gátlás), VN(vírusneutralizáció) próbákkal végzik. Speciális esetekben használják még a counter-immunelektroforézist (Aleuti-betegség), az immundiffúziós próbát és a radioimmun assayt. Humán parvovirus-fertőzések. Az egy szerotípusba tartozó humán parvovirusok (B19 vírus) felelősek a fertőző erythema és haemolitikus anémia néven ismert kórképek, valamint a krónikus polyarthritisek kialakulásáért. A B 19-vírusfertőzésnél leírtak magzatelhalást (abortuszt) és halállal végződő szívizom-elfajulást is. Az 5,5 kb. hosszúságú vírusgenom három kapszidproteint és egy nem strukturális fehérjét kódol. A B19 vírus nem haemagglutninál Dependovirusok A korábban adenoassociated vírusoknak (AAV) nevezett dependovirusok az adenovirusokon kívül, több herpesvirus (cytomegalovirus, HSV, Aujeszky-vírus) polimeráz enzimét felhasználják szaporodásukhoz. Mivel multiplikációjuknak létfeltétele a segítő vírus jelenléte, a dependovirusok csak olyan sejtben képesek szaporodni, amelyet a segítő vírus is fertőzni tud. A dependovirusok egyedülálló tulajdonsága a parvoviridae családon belül, hogy integrálódni képesek mind a segítő vírus genomjába, mind a sejtgenomba. A sejtgenomba történő integráció latens fertőzést okoz, a segítő vírus nukleinsavába történő beépülés legtöbbször a segítő vírus halálát okozza. Dependovirus-fertőzést több fajban (kutyában, lóban, szarvasmarhában, csirkében) leírtak. Önálló megbetegítő szerepük még nem bizonyított, de feltételezik, hogy jelenlétükkel súlyosbíthatják a segítő vírus által kiváltott kórképeket Papovaviridae A Papovaviridae család elnevezésében a családot alkotó két vírusnemzetség, Papilloma és Polyoma, valamint ez utóbbi vírusokat jellemző cytopathogen hatás (vacuolizáció) szerepel. A papilloma szó a latin papilla (csecsbimbó, bőrkidudorodás) és a görög -oma (daganat) szóösszetételből ered, amely bimbódzó (bőr) daganatként értelmezhető. A polyoma szó a görög poly (sok) és az -oma szóösszetétel alapján sok daganatként fordítható. A vacuolizáló vírus szó a Polyoma nemzetségbe tartozó SV40 vírus korábbi (a diagnosztikai értékű CP-hatást jelző) taxonómiai elnevezése utal. A Papovaviridae vírus család, a Papillomavirus és a Polyomavirus genusokból áll. A polyoma- és a papillomavirusok mind genetikai, mind immunológiai szempontból határozottan különböznek egymástól. A Papilloma genusba tartozó vírusok szűk gazdaspektummal rendelkeznek. A nemzetségen belül állatfajok szerint csoportosítjuk a vírusokat. Adott állatfaj vírusait a (a legalább 50%-os nukleinsavszekvenciakülönbségek alapján genomtípusokba soroljuk (pl. szarvasmarha-papillomavirus 1. típus, Bovine papillomavirus 1, BPV 1). A papillomavirusok az általuk okozott pathologiai elváltozás alapján három csoportba sorolhatók. A papilloma genusba tartozó vírusok jóindulatú hámsejtdaganatokat okoznak, amelyek kofaktorok hatására malignussá válhatnak (BPV 4). A vírus a fajazonos sejttenyészetekben sejttranszformációt hoz létre. A papillomavirusok sejttenyészetben nem szaporíthatók. A Polyoma genusba tartozó vírusokat a szaporodásukat biztosító állatfajok neve szerint csoportosítjuk (pl. szarvasmarha-polyomavirus, Bovine polyomavirus, BPoV). Az egyes fajok vírusai szerológiai próbákkal elkülöníthetők. A Polyoma genusba tartozó vírusok közös jellemzője, hogy a természetes gazdafajban (amelyben szaporodnak) többnyire szubklinikai fertőzést hoznak létre, ugyanakkor egyesek más, fogékony fajban (pl. rágcsálókban) malignus transzformációt indítanak meg. Ez alól kivétel az egér polyomavirusa, ami 6 eltérő szövettani típusú daganatot okoz a saját gazdájában. A polyomavirusok sejttenyészetben kifejezett CP- 246
267 Részletes virológia hatást (pl. vacuolizáció) okoznak. Állat-egészségügyi szempontból a polyomavirusok nem jelentősek, ezért a továbbiakban a papillomavirusokat tárgyaljuk részletesebben Papillomavirusok Morfológia. A virion szerkezete. A papovaviridae családba tartozó vírusok ikozahedrális szerkezetű nukleokapsziddal rendelkeznek, burkuk nincs. A nukleokapszid átmérője 55 nm (papillomavirus), illetve 45 nm (polyomavirusok), amely 72 henger alakú kapszomert tartalmaz. Elektronmikroszkópos vizsgálattal a virion egyéb degeneratív formái is felismerhetők (121. ábra) ábra - Bovine papillomavirus (EM). (Az Országos Állategészségügyi Intézet archívumából) Ritchie A. felvétele Nukleinsav. A papillomavirusok dupla szálú, (DNS/2) cirkuláris genomja nukleoszomákat alkot a virionban. A vírus DNS-hez sejt eredetű hisztonfehérje kapcsolódik. Számottevő bázispárkülönbség van az egyes papillomavirusok nukleinsava között (pl. szarvasmarha papillomavirus 6,7 kb. a kutya papillomavirusok 3 8 kb.). A vírusnukleinsav molekulatömege 5 x 10 6 Da. Eddig 10 fehérjét kódoló szakaszt (open reading frame, ORF) azonosítottak. Ezek közül nyolc (E1 E8) a kapszidfehérjéket kódoló, ún. korai genomszakaszban, kettő pedig a regulációért és a replikációért felelős, ún. késői genomszakaszban helyezkedik. Vírusfehérjék. Antigéntulajdonság. Mivel a papillomavirusok nem szaporíthatók szövettenyészeten, a vírusfehérjék tanulmányozása nehézségbe ütközik. Ezideig 10 polypeptidet azonosítottak, melyek közül egy, ún. nagy kapszidproteint (kb. 57 kb.) és több ún. kis kapszidproteint (43 53 kb.) azonosítottak. A genusspecifikus fehérjék a kapszid belsejében, a fajspecifikus fehérjék a virion felszínén helyezkednek el. A replikáció során keletkező, ún. korai vírusfehérjék fontos szerepet játszanak a sejttranszformációban. A virion nem tartalmaz sem szénhidrátot sem hemagglutinációra alkalmas fehérjét (Bár a nyúl papillomavirus képes adszorbeálni a vörösvérsejteket, azonban ez nem vezet haemagglutináció kialakulásához.) Szerológiai próbákkal (AGP) a felszíni fajspecifikus fehérjék alapján az egyes papillomavirusok megkülönböztethetők egymástól. A 247
268 Részletes virológia detergensekkel kezelt virionban a szabaddá váló, belső genusspecifikus fehérjék nagyfokú keresztreakciót adnak az összes papillomavirus között. Ellenálló képesség. Fizikokémiai tulajdonságok. A papillomavirusok zsíroldószerekkel (pl. éter) szemben rezisztensek. Ellenállnak a savas kémhatásnak (ph 3 7 között) és a 30 percig tartó 56 C-os az hőkezelésnek is. Multiplikáció. A papillomavirusok makromolekuláinak szintézisét A vírusok multiplikációja c. fejezetben részletezzük (DNS/2). A papillomavirusok a bőrsérüléseken keresztül fertőzik a szervezet, és a behatolás helyén majd ennek környékén lokális fertőzést okoznak.(bár emberben generalizált papillomatózist is leírtak). Replikációjukat sejtreplikáz enzimek irányítják. A papillomavirusok latens fertőzést alakíthatnak ki. Ilyenkor a vírusgenom extrakromoszómálisan, episzóma formában található a sejtmagban. A nukleokapszid összeépüléshez többnyire keratin fehérjék jelenlétét igénylik. Ezért nem lehet a papillomavirusokat sejttenyészetben szaporítani. Kórokozó képesség. A bőrsérüléseken és folytonossági hiányokon keresztül bejutó papillomavirusok az epithelsejtekben elszaporodva lokális elváltozásokat okoznak (23. táblázat). A papillomák felszíni sejtjeiben komplett vírusokat, a basalis rétegekben azonban csak vírusnukleinsavakat lehet kimutatni (122. ábra). Nem alakul ki generalizált fertőzés. Az állat-egészségügyi klinikai gyakorlatban jó hatásfokkal használhatók az ún. autovakcinák. Az autovakcina hatékonysága és a spontán regresszió hátterében álló immunológiai folyamatokat még nem tisztázták. 22. táblázat - Papillómavirusok által okozott megbetegedések Vírus Fogékony állatfaj Betegség Szarvasmarha papillomavirus Genotípus 1 Szarvasmarha Bőr fibropapilloma Ló Sarcoid Genotípus 2 Szarvasmarha Bőr fibropapilloma Ló Sarcoid Genotípus 3 Szarvasmarha Bőr papilloma Genotípus 4 Szarvasmarha Emésztő rendszerben kialakuló papilloma (rosszindulatúvá válhat) Genotípus 5 Szarvasmarha Csecsbimbó fibropapilloma Genotípus 6 Szarvasmarha Csecsbimbó papilloma Juh papillomavirus Juh Bőr fibropapilloma Ló papillomavirus Ló Bőr papilloma Sertés papillomavirus Sertés Bőr papilloma Kutya papillomavirus Kutya Száj papilloma Nyúl papillomavirus Nyúl Bőr papilloma (rossz indulatúvá válhat) 248
269 Részletes virológia Ember papillomavirusai (75 típus) Ember Bőr és nyálkahártya papillomák (némelyik rosszindulatúvá válik) 23. táblázat - Papillómavírusok által okozott kórképek Kórkép Vírus 1. csoport Bőr epithel sejtjeinek neopláziája 2. csoport Szarvasmarha 3, 6 Ló, nyúl* papillomavirusok Szarvasmarha 4**, kutya papillomavirus Epithel sejtek hiperpláziája 3. csoport Szarvasmarha 1, 2, 5 Bőrpapilloma bőr alatti kötőszövetben fibróma kialakulásával * carcinoma fejlődhet ki ** ko-faktor hatására carcinoma fejlődhet ki 122. ábra - Papillomavirusok elhelyezkedése a papillomában Szarvasmarha papillomavirusai (Bovine papillomavirus, BPV 1 6). A szarvasmarha- papilomavirusokat 6 genomtípusba osztjuk. A nukleinsav-szekvencia és a szerológiai vizsgálatok alapján szorosabb genetikai rokonság állapítható meg a BPV 1 2 5, valamint a BPV típusok között. Az ún. bőrpapillomatózis a nyakon, háton, a szem környékén jelentkezik, és leggyakrabban a BPV típus okozza. A csecsbimbókon jelentkező papillomákban nagy gyakorisággal a BPV 5 6 típus fordul elő. A szarvasmarha különleges faji fogékonyságát jelzi a papillomavirussal szemben, hogy a fertőzés legtöbbször kiterjedt, nagy, karfiolszerű 249
270 Részletes virológia transzformációt okoz, és nem ritka az állományszintű fertőzés sem. A szűk gazdaspektumú papillomavirusok közül kivétel a BPV 1 és 2 típus, mivel ezek a vírusok lóban sarcoid típusú daganatokat idéznek elő. A lovak papillomavirusai (Equine papillomavirus, EPV). Lovakban az eddig izolált papillomavirusok egy genomtípusba tartoztak. Az EPV az ajak és az orr környékén okoz többnyire kicsi, szemölcsszerű papillomákat. Diagnosztikai szempontból lényeges, hogy a BPV 1 2 típus szerepet játszhat a lóban kialakuló sarcoidok oktanában. A kutyák papillomavirusai (Canine papillomavirus, CPV). Kutyákban a papillomák a száj környékén jelennek meg, majd innen átterjedhetnek a szájüreg és torok nyálkahártyájára és a nyelvre is (123. ábra). A nyelési nehézségeket és étvágytalanságot (ízérzészavart) okozó papillomákat sebészeti úton kell eltávolítani. Az autovakcinák használatától jó eredmény várható. Gyakorlati tapasztalat, hogy az örökletes immunhiánnyal született kutyákban gyakrabban és súlyosabban jelentkezik a kórkép. A kutyákat megtámadó papillomavirusok egy típusba sorolhatók ábra - Papillomák kutya szájában 250
271 Részletes virológia Egyéb állatfajok papillomavirusai. Nyúlban két papillomavirust izoláltak. A gyapotfarkú nyúl (Sylviagus sp.) bőrpapillomatozisát okozó CRPV (Cottontail rabbit papillomavirus) vagy Shope-vírust, ami a házinyúlban ritkán hasonló bőrelváltozást okoz. Házinyulakban a szájban megjelenő papillomákból izolált papillomavirusok különböztek a Shope-vírustól.Sertésben a ritkán előforduló papillomavirus-fertőzés általában a genitáliákra 251
272 Részletes virológia korlátozódik és többnyire spontán gyógyul. Papillomafertőzést leírtak vadon élő kérődzőkben(őz, zerge) és húsevőkben(róka) is. Az őzekben előforduló papillomafertőzés járványos méretű neurofibromatozist okozott. Laboratóriumi diagnózis. A víruskimutatás a papillomák elektronmikroszkópos vizsgálatával történik. A vírusfehérjéket IF és immunperoxidáz-próbákkal, a vírusnukleinsavakat hibridizációs módszerekkel azonosítjuk. Humán papillomavirus-fertőzések. A humán papillomavirusokat (HPV) ez ideig 75 típusba sorolták. Klinikai szempontból a rákkeltő bőrpapillomákat (szemölcsöket), a rákkeltő típusoktól 5 7 éven belül törvényszerűen malignussá váló anogenitális régiókban előforduló papillomákat és a jóindulatú feji és nyaki daganatot okozó papillomákat különböztetjük meg. A fertőzések terjesztésében kiemelkedő szerepet játszik a szexuális érintkezés és a közös törülköző használata Polyomavirusok A polyomavirusok kisebbek a papillomavirusoknál (virion 45 nm, molekulatömege 27x10 6 D). A cirkuláris nukleinsav (DNS/2) 5000 bázispárból áll, és 12%-át alkotja a virion tömegének. A genom ún. késői szakasza tartalmazza a struktúrproteinek (VP1 VP2, VP3) genetikai információját, az ún. korai szakasz pedig a T antigéneket. A T antigének nem épülnek be a víruskapszidba. A multifunkcionális T antigének szabályozzák a vírusnukleinsav replikációját, és felelősek a sejt transzformációjáért (T = tumor antigén). A T antigéneket az SV 40 vírus tanulmányozása során ismerték meg. A papillomavirusokkal ellentétben, a polyomavirus generalizált fertőzést okoz, és a vírusgenom a latens fertőzés alatt integrálódik a sejt kromoszómájába. A legjelentősebb humán polyomavirusok a BK és JC vírusok, melyek terhesség alatt is reaktiválódhatnak, de nincs magzatkárosító hatásuk. Immunhiányos egyénekben a JC vírusok azonban az agy fehérállományának, halálhoz vezető károsodását okozzák Herpesviridae A herpesvirusoknak az ókorból eredő elnevezése, a görög herpes, herpetos (csúszómászó állat, kígyó) szóból ered, ami az egyik humán herpesvirus (HHV 3) által okozott bőrelváltozás (övsömör) jellegére utalt. A közel 100 különböző herpesvirust felölelő víruscsalád tagjait már izolálták minden fontosabb evolúciós lépcsőt képviselő magasabb rendű állatfajból (rovarok, kétéltűek, hüllők, madarak, emlősök). Az embernek és a háziállatfajoknak többnyire szigorúan fajspecifikus vírusai vannak (a sertés Aujeszky-vírusának, SHV 1, kivételével). A juh az egyetlen háziállat, amelyikből még nem izoláltak fajspecifikus herpesvirust. A herpesvirusok rendszerbe sorolása még ma sem tekinthető véglegesnek. A Herpesviridae családon belül három alcsaládot(alphaherpesvirinae, Betaherpesvirinae, Gammaherpesvirinae) különböztetünk meg, a vírusok biológiai tulajdonságai alapján. A rendszertani besorolás ma már egyre inkább a genomszerkezeti sajátosságokra épül. Az Alphaherpesvirinae alcsaládot a Simplex virus genus és Varicello virus genus, az egységesebb genomszerkezetű Betaherpesvirinae alcsaládot Cytomegalovirus, Muromegalovirus, Roesolovirus nemzetségekre osztották fel. A Gammaherpesvirinae alcsaládot a Lymphocryptovirus és a Rhadinovirus nemzetségek alkotják. A nemzetségeken belül szerotípusokat különböztetünk meg. Alphaherpesvirinae alcsalád. Az alcsaládba tartozó vírusokra jellemző, hogy sejttenyészetben viszonylag rövid (<24 óra) szaporodási ciklussal és gyors terjedőképességgel rendelkeznek. A fertőzött sejtekben cytolysist (sokszor syntytium-képzés) okoznak. A szervezetben a latenciát elsősorban az idegsejtekben (ganglion) alakítják ki, de egyes nyirokszervek (pl. tonsilla, lép) latens fertőzöttségét is megfigyelték. A latenciát kialakító vírusgenom extrakomoszomálisan helyezkedik el, episoma formájában. Az alcsaládba tartozó vírusok gazdasejtspecificitása változó, az FHV 1 csak a macskát fertőzi, az Aujeszky-vírus (SHV 1) több állatfajt is megbetegít. Betaherpesvirinae alcsalád. Sejttenyészetben az alcsalád vírusainak viszonylag lassú (> 24 óra) szaporodási ciklusa és terjedőképessége van. A fertőzött sejtekben jellegzetes magzárványban (bagolyszem) és sejtmegnagyobbodásban (cytomegalovirus) megnyilvánuló CP-hatást okoznak. A csoport elnevezését ez utóbbi CP-hatásról (óriássejt a vizeletben) kapta. A cytomegalovirusok elsősorban a nyálmirigyekben és a nyirokszövetekben alakítanak ki latenciát, de latens vírusgenomot azonosítottak más szervben (vese) is. A cytomegalovirusok latens állapotban extrakromoszomálisan helyeződnek a sejtmagban, de kivételesen előfordul, hogy a latens vírusgenom integrálódik a sejt kromoszómájába. Az alcsaládba tartozó vírusok többnyire szűk gazdaspektrummal rendelkeznek. 252
273 Részletes virológia Gammaherpesvirinae alcsalád. Az alcsaládba tartozó vírusok minden tagja szaporodik lymphoid szövetben, amelyben egyesek sejttranszformációt okoznak. A transzformálódott sejtekben nem képződnek virionok (abortív fertőzés). Az alcsalád egyes tagjai a T lymphocyták (EHV 7), mások a B lymphocyták (HHV 4) transzformációját okozzák. Több vírus a hám- és kötőszövetből készült sejtkultúrákban is elszaporodik, ahol cytolysisben megnyilvánuló CP-hatást fejt ki. A gammaherpesvirusok a lymphoid szövetben (és esetenként a hámszövetben is) latenciát alakítanak ki. A latens vírusgenom episzomális formában található meg a sejtmagban. Rosszindulatú daganatokban (Burkitt lymphoma) a vírusgenom azonban integrálódik a daganatsejt kromoszómájába. A gammaherpesvirusok szűk gazdaspektrummal rendelkeznek. Morfológia. A virion szerkezete. A pleomorf buroknak köszönhetően a herpesvirusok nagysága nm között változik. Az ikozahedrális szimmetriájú nukleokapszid átmérője nm. A nukleokapszid 162 kapszomert (150 hexont és 12 pentont) tartalmaz. A hexagonális szerkezetű, üreges kapszomereket a herpesvirusok morfológiai jegyének is tekintik A kapszomerek hossza nm, szélessége 9 10 nm, az üreg 4 nm átmérőjű. A nukleokapszid és a burok között található a magas fehérjetartalmú, tegumentnek nevezett réteg. A virionban többnyire aszimmetrikusan helyeződő tegument vastagsága a vírus sejtben elfoglalt helyétől függ. A tegumentfehérjéket a vírus kódolja. A nm vastagságú, sejtmembrán eredetű vírusburok felszínén kb. 8 nm hosszúságú tüskéket lehet megfigyelni elektronmikroszkópos vizsgálattal. Ezek a struktúrák hordozzák az adszorpcióért felelős antireceptor glükoproteineket (124. ábra) ábra - Szarvasmarha herpesvirus (BHV 3) (Országos Állategészségügyi Intézet archívuma, Ritchie A. felvétele) (EM) Nukleinsav. A herpesvirusok nukleinsava kétszálú DNS/2. A genom a virionban lineáris szerkezetű, de a virionból kiszabadulva, a fertőzött sejt magjában cirkuláris formába alakul át, ami szükséges a rolling circle (gördülő kör) elnevezésű replikációs forma kialakuláshoz. A herpesvirusok genomjának hossza kb , molekulatömege Da, struktúrája változó. A G+C arány nagy variabilitást mutat az egyes vírusok között (CHV 1:32%, SHV 1 :74%). A genomot egy hosszú (82%) és egy rövid (12%) szakaszra lehet felosztani. A szakaszok végeit ún. ismétlődő szekvenciák: (internal repeat-ir és terminal repeat-tr) zárhatják le, amelyek a genomot hosszú (UL) és rövid 253
274 Részletes virológia (Us) egyedi egységre osztják. Az ismétlődő szekvenciák száma és helyeződése alapján a herpesvirusokat 6 különböző genomosztályba (A F) sorolják (125. ábra) ábra - Herpesvirus genom osztályok A simplexvirusoknál a rövid (US) szakasz kódolja a vírus számos nélkülözhető fehérjére (ge). A hosszú egység (UL) kódolja többek között a herpesvirusok ősi közös fehérjéit (gb protein) és a TK (timidinkináz) enzimeket is. A herpesvirusgenom kb vírusfehérjét kódol. Antigén-tulajdonság. Vírusfehérjék. A virion több mint 20 struktúrproteint tartalmaz, amelyekből 6 a kapszidban, 2 DNS-hez kapcsolódva és legalább 5 a burokban található. A többi fehérjét a tegumentben azonosították. A vírus multiplikációja és virulenciája szempontjából a legfontosabbak a burokban található glükoproteidek. A glükoproteidek rendkívül fontos szerepet játszanak a vírus sejt, valamint az immunrendszer aktiválása révén, a vírus szervezet kapcsolatokban. A HSV és az Aujeszky vírus tanulmányozása során tisztázták, hogy a herpesvirusok neurovirulenciájának kialakításában központi szerepe van age-, gc-, TK-, gifehérjéknek, melyek többnyire együttes hatásként alakítják ki az adott vírustörzsre jellemző virulenciát (24. táblázat). A ge-fehérje diagnosztikai szempontból különleges jelentőségre tett szert. Az Aujeszky-vírus- és az IBR-fertőzéseknél ennek a fehérjének a kimutatásán alapszik az a differenciáló diagnosztikai teszt (gemonoklonális ELISA), amellyel megkülönböztethető a vakcinázott és a fertőzött állat. 24. táblázat - Aujeszky-vírus fehérjéinek biológiai szerepe Megnevezés Létfontosságú fehérje Virion alkotórésze Adszorpció Penetráció Sejt sejt terjedés gb (gii)* gc (giii) + (+) gd (gp50) + + (+) + (+) ge (gi) + (+) gg (gx) gh gl (gp63) + 254
275 Részletes virológia gk????? gi * korábbi elnevezés A vírus olyan glükoproteideket (gg) is szintetizál, amelyek bizonyos herpesvirusokba nem épülnek be a virionba. Egyes herpesvirusok polimeráz enzimje felelős a természetes hőmutáns vírusok létrejötéért (CHV 1). A herpesvirusok között nem azonosítottak közös család- vagy alcsalád-specifikus antigéneket. Az egyes herpesvirusok a szerológiai próbák alapján jól elkülöníthetők egymástól. Néhány esetben azonban csak nukleinsav analízissel lehetett különbséget tenni adott állatfaj különböző megbetegedéseit okozó vírustörzsek között (IBR IPV, EHV 1 EHV 4, lásd Az emlősállatok fontosabb herpesvirusai c. fejezetben). Az emberi és állati herpesvirusok között szerológiai próbákkal kimutatható rokonságot ez ideig egyes humán (HSV), sertés (SHV 1) és szarvasmarha (IBR)vírusok, valamint az Epstein Barr (HSV 3) és Marek-vírus (GHV 2)között mutattak ki. A herpesvirusok antigénhatása gyenge, ezért az ellenük termelődő neutralizáló ellenanyagok nem védik meg az állatot az ismételt fertőzéstől. A protektivitást biztosító ellenanyagok a vírus burkában elhelyeződő glükoproteinek ellen termelődnek. Ellenálló képesség. Fizikokémiai tulajdonságok. A herpesvirusok a kevésbé ellenálló vírusok közé tartoznak. Lipidtartalmú buruk miatt a herpesvirusok zsíroldó szerekkel (éter, kloroform) könnyen inaktiválhatók. A formaldehid- és a klórtartalmú fertőtlenítőszerekkel, valamint a jodofórokkal szemben érzékenyek. A tripszinnel szembeni érzékenység vírustörzsenként eltérő lehet. Az UV fény és a röntgenbesugárzás könnyen inaktiválja a vírusgenomot. Hőérzékeny vírusok, de kíméletes hőkezeléssel viszonylag hőtűrő törzsek szelektálhatók ki a víruspopulációból. A legtöbb herpesvirus ph 5 12 között stabilnak bizonyult. Ettől eltérő értéknél néhány órán belül inaktiválódnak. Fertőzőképességüket 70 C alatt évekig megtartják, de 18 C és 25 C között hetek alatt inaktiválódnak. (Ezért nem szabad a vírusizolálásra gyűjtött mintát háztartási hűtőszekrényben tárolni!) Multiplikáció. A herpesvirusok replikációs és transzkripciós stratégiáját A vírusok multiplikációja c. fejezetben részletezzük (126. ábra) ábra - Herpesvirusok multiplikációja. Murray és mtsai. (1990) után módosítva 255
276 Részletes virológia A háziállatok fontosabb herpesvirusai A könnyebb áttekinthetőség kedvéért a herpesvirusokat az állatfajok szerint tárgyaljuk. Alphaherpesvirinae vírusok által okozott betegségek. (25. táblázat). 25. táblázat - Alphaherpeszvirinae alcsaládba tartozó vírusok Simplexvírus, (genus) Variocellovírus (genus) 256
277 Részletes virológia HHV-1 Herpes simplex 1 AHV-1 Kacsapestis v. HHV-2 Herpes simplex 2 MHV-1 Pulykaherpesz v. BHV-2 Szarvasmarha herpes mammilitis HHV-3 Varicella-Zoster v. BHV-5 Borjú encephalitis BHV-1 IBR-IPV (Szarvasmarha) EHV-3 (?) Lovak ivarszervi hólyagos kiütése EHV-1 Lovak járványos abortusza EHV-6 (?) Szamár herpesv. EHV-4 Lovak rhinopneumonitise EHV-8 (?) Szamár herpesv. SHV-1 Aujeszky-betegség CHV-1 Kecske herpesv. B-virus Majom CHV-1 FHV-1 (?) GHV-1 GHV-2-3 PEV PHV-1 Kutya herpesv. Macska rhinotrachertisv. Baromfi fertőző laringohacheitisv. Marek betegség. vírusa Galamb encephalitisv. Galamb herpesv. Jelmagyarázat: (?) Még nem besorolt 26. táblázat - Betaherpesvirinae alcsaládba tartozó vírusok HHV 5 HHV 6 EHV 2 (?) SHV 2 (?) EHV 7 (?) Humán cytomegalov Roseola infectiosa Lovak cytomegalov. Sertés cytomegalov. Szamár herpesv. ( ) Szarvasmarha cytomegalov. FHV 2 (?) Macska cytomegalov. Jelmagyarázat: (?) Nem besorolt A szarvasmarhák herpesvirusai 257
278 Részletes virológia A BHV-1 (bovide herpesvirus 1) szerotípusba két különböző betegség vírusa,a szarvasmarha fertőző rhinotracheitisének vírusa (IBR) és a szarvasmarha fertőző hüvely- és tasakgyulladását (IPV) okozó vírus tartozik. Szerológiai próbákkal és fehérjeanalízissel a két kórformát okozó vírusokat nem lehet megkülönböztetni. Ugyanakkor restrikciós enzimvizsgálattal az IBR és IPV vírusok egymástól elkülöníthetők. A klinikai tünetek jellegéből nagy valószínűséggel következtetni lehet arra, hogy a kórképért az IBR vagy az IPV vírus a felelős. Az IBR vírus mind szubklinikai, mind klinikai tünetekben (légzőszervi, idegrendszeri tünetek, conjunctivitis és vetélés) megnyilvánuló kórképet okoz. Az IPV lokális, hólyagképződéssel járó elváltozást okoz, kizárólag a nemi szervek nyálkahártyájában, és vetélés soha nem fordul elő. A két vírus azonos szervadaptációs készsége (nemi szervek) és szoros antigénrokonsága miatt az IBR-rel fertőzött populációban ritkán jelentkezik IPVfertőzés. Az IBR vírus ellen mind inaktivált, mind attenuált vakcinákat kifejlesztettek. Az elmúlt években forgalomba kerültek olyan monoklonális ELISA-reagens, amelyekkel biztosan elkülöníthető a meghatározott deléciós vakcinával (ge-deléció) oltott és/vagy fertőzött állat. A BHV 2 (bovid herpesvirus 2) szerotípusba tartozó vírusok klinikailag két, jól elkülöníthető betegséget okoznak. A szarvasmarha herpes mammilitise egy hevenyen lezajló és a tőgyre korlátozódó lokális, hólyagképződéssel járó megbetegedés, amely világszerte előfordul. Afrikai szarvasmarhákon a BHV 2 generalizált bőrelváltozást idézett elő, amit (a himlővírusok által okozott bőrcsomósodási kórhoz való hasonlatossága alapján) ál-bőrcsomósodási kórnak neveztek el. A BHV 3 (bovid herpesvirus 3) Alcelaphin herpesvirus (AHV 1, AHV 2) (Malignant catarrhal fever). A szarvasmarha roncsoló orrhurutja néven ismert akut, fatális kimenetelű generalizált betegség egyes vadon élő kérődzők között is előfordul. A vírus nehezen izolálható. Leginkább a fertőzött állat perifériás fehérvérsejtjeinek borjúpajzsmirigysejtekkel történő együttes tenyésztésével kísérelhető meg. Az erősen sejthez kötött (cellassociated) vírus jelenlétét jelző magzárvány és esetleg syntytiumképzés gyakran csak 2 3 szövetpasszálás (vakpasszázs) után figyelhető meg. A Gammmaherpesvirinae alcsaládba sorolását a genomszerkezeti jellegzetességek mellett az indokolta, hogy a vírus a keringő lymphocytákban perzisztáló (latens) fertőzést hoz létre. Sejttranszformációs tulajdonságáról nem tudunk. Az AHV 1 törzseket ez ideig Afrikában izolálták, ahol a fogékony kérődzők a vírusfenntartó és vírushordozó gnúborjaktól fertőződnek. A gnúban a fertőzés mindig szubklinikai formában zajlik. Az AHV 2 törzseket Afrikán kívül előforduló fertőzésekből izolálták. Az AHV 2 törzsek fenntartója és terjesztője a vírussal fertőződött juh, amelyben a betegség mindig szubklinikai formában zajlik. Az AHV 1- és AHV 2-vírus iránt fogékony a nyúl, amelyben a szarvasmarhához hasonló kórkép alakul ki. (MÓVÁR-vírus) (Bovid herpesvirus 4) Az elsőként Bartha Adorján által izolált, lassú szaporodóképességgel rendelkező MÓVÁR-vírusok (Mosonmagyaróvár) többnyire szubklinikai fertőzést okoznak szarvasmarhákban. A vírust és az ellene termelődött ellenanyagokat állatkerti macskafélékből is kimutatták (oroszlán, puma). A szarvasmarhákból izolált cytomegalovirusok pathológiai szerepe nem bizonyított, de feltételezik, hogy esetleg terméketlenséget okoznak. Borjú eredetű szövettenyészetekben a cytomegalovirusok perzisztens fertőzést eredményezhetnek A kecske herpesvirusai CHV 1 (caprine herpesvirus 1, kecskeherpesvirus). A kecskéből izolált CHV 1 vírusok egy szerotípusba tartoznak és szoros antigénrokonságot mutatnak a BHV 1 vírussal. A CHV 1 és BHV 1 vírusok restrikciós enzimanalízissel elkülöníthetők. A CHV 1 nem fertőzi sem a juhot, sem a szarvasmarhát. Kecskében a fertőzés az IBR-hez hasonló kórképet (légzőszervi tüneteket, conjunctivitist és vetélést) okoz A ló herpesvirusai EHV 1, EHV 4 (ló járványos abortusza, ló rhinopneumonitise) Korábban azt gondolták, hogy a lovak járványos abortuszát és rhinopneumonitisét ugyanaz az EHV-1 vírus okozza. A járványesetekből izolált vírustörzsek restrikciós enzimanalízise azonban bizonyította, hogy az EHV 1 törzsek valójában a lovak járványos abortuszát, az EHV 4 típusba sorolt vírustörzsek pedig a lovak rhinopneumonitisét okozzák. A szerológiai rokonság ellenére a restrikciós enzimmel kimutatott vágáshely-azonosság kevesebb, mint 20% volt. Az EHV 1 törzsek ritkán légzőszervi és idegrendszeri tüneteket is okoztak, és egyes EHV 4 törzsek vemhes kancákban vetélést idéztek elő. Az EHV 4 törzsek csak lószöveten szaporodnak, az EHV 1 törzsekkel azonban más állatfajból 258
279 Részletes virológia (sertés, borjú) készült szövettenyészetek is fertőzhetők. Az EHV 1 vírus a lovak egyik legfontosabb fertőző ágense. Mind az EHV 1 mind az EHV 4 ellen kidolgoztak attenuált és inaktivált vakcinákat. EHV 3 (lovak ivarszervi kiütésének vírusa). A lovak ivarszervi kiütésének vírusa általában enyhe lefolyású hólyagos megbetegedést okoz a genitáliákon. Vetélés és generalizált fertőzés nem fordul elő, de fiatal csikókban légzőszervi megbetegedést hozhat létre. Vírusneutralizációs próbában az EHV 3 vírusok nem adtak keresztreakciót más ló herpesvirussal, bár az EHV 1 és az EHV 3 között kimutattak mérsékelt antigénrokonságot. Az EHV 3-törzsek kizárólag lóból készült sejtkultúrákban szaporodnak. A lovakból izolált cytomegalovirusok (Equid herpesvirus 2, EHV 2) elsősorban baktériumos társfertőzéssel (Rhodococcus equi) együtt alakítanak ki fogékony csikókban tüdőgyulladásban és tályogképződésben megnyilvánuló kórképet. Az EHV 2 törzsek egy szerocsoportba tartoznak, de nukleinsav-analízissel a törzsek DNS-e között rendkívül nagyfokú variabilitást lehetett kimutatni. Ebből adódóan az EHV 2-nek nagyon sok antigénváltozata fordul elő. Még ugyanabból a lóból is több antigénvariánst lehet izolálni. A vírus lósejtből készült szövettenyészeten jól szaporítható A sertés herpesvirusai SHV 1 (suid herpesvirus 1, Aujeszky-betegség vírusa, AyV, Pseudorabies-virus, PrV). Az Aujeszky Aladár által, 1902-ben leírt betegség vírusa a legszélesebb gazdasejtspektummal rendelkező herpesvirus, ugyanis a sertésen kívül végzetes kimenetelű idegrendszeri megbetegedést okoz rágcsálókban, emlősökben és madarakban is. A sertés az egyetlen faj, amelyiknek esélye van a fertőzés túlélésére, ezért a vírus egyedüli fenntartója a természetben. A vírusa sertésekben kortól függően, légzőszervi, idegrendszeri megbetegedést és vetélést okoz. Az ember és az alacsonyabb rendű fajok (rovarok, hüllők, kétéltűek és halak) rezisztensek a fertőzés iránt, bár humán HeLa sejtvonalon mérsékelt vírusszaporodás megfigyelhető. A vírus a felsorolt fogékony fajok sejtjeiből készült egyrétegű szövettenyészeten az alphaherpesvirusokra jellemző CPhatást (sejtmagzárvány, sejtlekerekedés, syncytiumképződés) alakítja ki. Sertésszövet fertőzésekor az avirulens vírusok sejtlekerekedést, a virulens vírustörzsek syncytiumot hoznak létre. Az SHV 1 törzsek egy szerotípusba tartoznak, de a vírustörzsek biológiai tulajdonságaiban (pl. virulencia) különbségek vannak. A vírusnukleinsavak restrikciós enzimanalízisével a vágáshelyek megoszlása alapján törzsmarkereket határozhatunk meg, melyek a járványtani nyomozásban is felhasználhatók. A genom közel 70%-át szekvenálták, és ma már az összes lényeges vírusfehérje génszekvenciája ismert. A genom US szakaszán elhelyezkedő gének (ge,gc) közül a ge(korábban gi néven ismert fehérjegén) szakasz deléciója két eredménnyel jár. Egyrészt a ge deléciós törzsek a virulenciacsökkenés következtében kitűnő vakcinatörzsnek bizonyultak, másrészt az ilyen deléciós vakcinával oltott sertések esetében a ge ellenes ellenanyagok kimutatására szolgáló monoklonális ELISA vizsgálattal eldönthető, hogy a sertés csak vakcinázva volt vagy esetleg találkozott az utcai vírussal is. Az utcai vírusok ugyanis hordozzák a ge gént és termelik a ge-proteint (mivel ennek a fehérjének fontos szerepe van az idegrendszeren belüli terjedésben), ezért a ge elleni ellenanyagok megjelenése mindig az utcai vad törzsekkel történt fertőzésre utal. A ge nem játszik szerepet sem a vírus multiplikációjában, sem a protektivitásért felelős ellenanyagok képzésének megindításában, ezért a ge-delécióval rendelkező vakcinatörzsek jól szaporíthatók szövettenyészeten és az általuk kiváltott protektív immunitás védelmet nyújt az utcai vírussal történő fertőzéssel szemben. Az ilyen deléciós vakcinák teremtették meg a lehetőségét az olyan országos kiterjedésű mentesítési programoknak, amelyekkel ma már földrészek Aujeszky-vírus-mentességét kívánják elérni. Magyarország sertésállományának e vírustól történő mentesítése ma is folyamatban van. A sertés cytomegalovirus (Suid herpesvirus 2, SHV 2)fertőzése a sertés zárványtestes rhinitise néven ismert betegséget okozza. A fertőzés klinikai tüneteket (rhinitis) csak a 10 hétnél fiatalabb malacokban idéz elő. Az SHV 2 esetenként vetélést vagy az újszülött malac generalizált fertőzését okozhatja. A vírus sertés eredetű szövettenyészeten szaporítható A kutya herpesvirusai CHV 1 (Canine herpesvirus 1, kutya herpesvirus). A kutyából izolált herpesvirusok (CHV 1) egy szerotípusba tartoznak. A vírus fogékony kölyökkutyákban nagy letalitással járó haemorrhagiás megbetegedést, felnőtt állatban rendszerint szubklinikai fertőzést (esetleg tracheobronchitist), vemhes kutyában vetélést és terméketlenséget okoz. A vírus a viraemia során az anyai fehérvérsejtekbe zártan jut át a placentán. A vírus DNS-polimeráz enzime C-on aktív, ezért a vírusszaporodás csak azokban a szervekben zajlik, ahol a 259
280 Részletes virológia hőmérsékleti érték megfelel ennek az igénynek (felső légutak, genitáliák). Az újszülött kiskutyák hőregulációja a születés után 2 4 héttel normalizálódik, ezért a fogékony kutyakölykökben kéthetes korig generalizált fertőzés alakul ki, amely többnyire fatális kimenetelű. A vírus kizárólag kutyasejtekből készült szövettenyészeten szaporodik, és vírusizoláláskor figyelembe kell venni a vírus hőigényét (inkubáció C). A fertőzést túlélt kutyákban latens vírushordozás lehetséges (genitális szervek ganglionjában is). A latens vírusgenom immunszuppresszív hatásra (pl. fialás) reaktiválódik. A betegség ellen mind hiperimmun szérumterápiát, mind vakcinát használnak A macska herpesvirusai FHV 1 (Feline herpesvirus 1, macskaherpesvirus). A macskákban többnyire akut lefolyású, felsőlégúti tünetekben megnyilvánuló betegséget okozó FHV 1 vírusok egy szerotípusba tartoznak, de virulenciájukban különbözők. A vírus kizárólag macskából készült sejttenyészeten szaporodik. Latens vírushordozás elsősorban az agyi ganglionokban alakul ki, a fertőzött macskák kb. 70%-ában Madarak jelentősebb herpesvirusai Tyúkfélék herpesvirusai GHV 1 (Gallid herpesvirus 1, baromfi fertőző laryngotracheitis vírusa, ILV). A fertőző laryngotracheitis vírusa (ILV) több madárfajban (tyúk, pulyka, fácán páva) okoz felsőlégúti tünetekben és conjunctivitisben megnyilvánuló fertőzést. Az egy szerotípusba tartozó ILV törzsek jelentős virulenciakülönbséggel rendelkeznek. A vírus embrionált tyúktojás chorioallantois-membránjába (CAM) oltva, pockképződésben megnyilvánuló cytopathogen hatást fejt ki. Naposcsibe és pulyka hámsejtjeiből készült szövettenyésztben jól szaporítható. A populációban a fertőzést a latensen fertőzött és a reaktiváció révén vírust ürítő felnőtt állatok tartják fent. GHV 2 (Gallid herpesvirus 2, Marek-betegség, MDV). A Marek József által 1907-ben leírt betegség vírusát a biológiai tulajdonságok alapján korábban a gammaherpesvirusok közé sorolták (lymphoid sejtek transzformációját okozza), de az utóbbi években elvégzett vírusgenetikai vizsgálatok eredménye révén átkerült az Alphaherpesvirinae alcsaládba. Az MDV a fertőzött baromfi légzőszervének hámsejtjeiben elszaporodva sejthez kötött viraemiát hoz létre. A macrophagokba zárt vírus eljut a különböző nyirokszervekbe, és elsősorban a T-lymphocyták sejttranszformációját okozza, ami a lymphoid szövetek daganatos elfajulásához vezet. Az idegeket (pl. ágyékkersztfonat) körülvevő lymphoid szövet daganatos burjánzása az ideg összenyomásával idegrendszeri tüneteket vált ki (Marek-bénulás). A tolltüszők hámsejtjeibe eljutó vírus produktív fertőzést hoz létre. A leváló tolltüszőhámsejtekben a vírus hetekig fertőzőképes marad a természetben. A vírus CAM-ra oltva pockot alakít ki. Csirkeszövetből készült szövettenyészetben lassan kialakuló sejtdegenerációt okoz. A termelődő virionok sejten belül maradnak (cell-asssotiated). A MDV szoros antigénrokonságot mutat a pulyka alphaherpesvirusával (MHV 1). A Marek-betegség ellen mind attenuált MDV törzsből, mind THV 1 törzsből készült vakcina forgalomba került A kacsa herpesvirusai AHV 1 (Anatid herpesvirus-1, kacsapestis vírusa, DHV 1). Az AHV 1 kacsában és más vízimadarakban (lúd, hattyú) okoz akut lefolyású, vérzéses kórképet. Az eddig izolált vírustörzsek egy szerotípusba tartoznak, de jelentős virulenciakülönbségek figyelhetők meg a törzsek között. A vírus embrionált kacsatojásban (CAM-ra oltva) és kacsafibroblastból készült szövettenyészeten jól szaporítható. Csirkeszöveten szaporodása lassúbb A galamb herpesvirusai PHV 1 (Pigeon herpesvirus 1). A galambokban generalizált fertőzést okozó PHV-1 a galamb- és csirkeembrióból készült fibroblastszöveten és CAM-ra oltással jól szaporítható. PEM 1 (Pigeon encephalomyelitis virus 1). A galambok encephalomyelitisét okozó PEM 1 szerológiai vizsgálatokkal elkülöníthető a PHV 1-től. Laboratóriumi diagnosztika. Vírusizolálásra testváladékokat (orr-garat váladék, ondó) és szervmintákat kell küldeni. A fajazonos sejtekből készült hám és fibroblast típusú szövettenyészeteken az alphaherpesvirusok magzárványképzésben, sejtlekerekedésben és syntytiumképzésben megnyilvánuló cytopathogen hatást okoznak. 260
281 Részletes virológia A betaherpesvirusok CP-hatására a jellegzetes alakú magzárvány és óriássejt a jellemző. A gammaherpesvirusok lymphoid szövetekben transzformációt alakítanak ki. Vírusfehérjéket IF, ELISA tesztekkel, monoklonális ellenanyagokkal, és SDS PAGE-módszerrel, valamint Western-blot hibridizációval azonosítunk. A vírusnukleinsavak és nukleinsavszakaszok azonosítása PCR, nukleinsav-hibridizáció, restrikciós enzimanalízis segítségével történik. A latencia kimutatása nukleinsav-hibridizációval (in vitro, in situ) lehetséges. A latens genom reaktivációjára kokultivációt használunk. A vírusspecifikus ellenanyagokat VN (vírusneutralizáció) és ELISA próbákkal mutatjuk ki. Az IBR- és Aujeszky-vírus diagnosztikájában monoklonális ellenanyagokat alkalmazó differenciáló ELISA-készleteket (ge-elisa) dolgoztak ki. Ezekkel a tesztekkel különböztethető meg a vakcinázott és/vagy az utcai vírussal fertőzött állat. 27. táblázat - Gammaherpesvirinae alcsaládba tartozó vírusok HHV 4 Epstein Barr v. HHV 7 (?) HHV 8 Kaposi sarkoma v. ALH 1 ALH 2 Ovine herpesvirus 2 BHV 4 MÓVÁR v. RHV 1 (?) Házinyúl h.erpesz v. EHV 5 (?) Ló herpesvirus Jelmagyarázat: (?) Még nem besorolt Humán herpesvirus-fertőzések Alphaherpesvirinae. A humán herpesvirus 1 (Herpes simplex virus 1, HSV 1) a labiális herpes, a humán herpesvirus 2 (Herpes simplex virus 2, HSV 2) a genitális herpeszként ismert, viszkető hólyagképződéssel járó betegségeket okozzák. A HSV 1 a legrészletesebben tanulmányozott herpesvirus. Immunszuppresszív kezeléskor (pl. AIDS-terápia) a latens genom reaktivációjának eredményeként generalizált herpesvirus-fertőzés is kialakulhat. A latens HSV 2 a szüléskor reaktiválódhat és az újszülöttben encephalitist okozhat. A HSV 2 segédfaktor szerepét bizonyították cervixcarcinomák kialakulásában, ahol a rákos folyamatot papillomavirus indítja el. Humán herpesvirus 3, HHV 3 (Varicella-Zoster-vírus). A varicella (bárányhimlő) a HHV 3 primer akut fertőzésének hólyagos, generalizált bőrkiütésekben megnyilvánuló klinikai formája. A zoster (övsömör) pedig a latens HHV 3-genom reaktivációjának eredményéből kialakuló, viszkető hólyagképződéssel járó klinikai formája. Az övsömör mindig annak az idegnek a beidegzési területén (dermatomában) látható, amelynek szenzoros ganglionjában a vírus kialakította a latenciát. Betaherpesvirinae.HHV 5, humán herpesvirus 5(Humán cytomegalovirus). A humán fertőzés már az ovodáskorú lakosság közel 50 70%-ában fordul elő, többnyire szubklinikai formában. A terhesség alatt reaktiválódott vírustól fertőződött újszülöttek közel 10%-ában microcephalia és hepatomegalia alakulhat ki. A friss fertőzés sokkal gyakrabban okoz magzati károsodást (50%) Gammaherpesvirinae. HHV 4, humán herpesvirus 4 (Epstein Barr-vírus, EBV). A HHV 4-fertőzés különböző klinikai formában megnyilvánuló daganatos kórképet alakít ki az egyes emberi rasszokban (lásd A vírusok által kiváltott daganatképződés c. fejezetben). 261
282 Részletes virológia HHV 6, humán herpesvirus 6. Elsőként AIDS-betegek T-lymphocytáiból izolált vírus. Gyerekekben bőrkiütést (roseolát), felnőttekben mononucleosisban megnyilvánuló kórképeket alakíthat ki. A HHV 6 vírust cervixtumorokban is kimutatták. HHV 7 humán herpesvirus 7. A vírust 1990-ben izolálták egészséges férfi T-lymphocytáiból. HHV 8, humán herpesvirus 8,. A vírust 1995-ben klónozták és bizonyított szerepe van az AIDS betegekben megjelenő Kaposi szarkóma kialakulásában. Az állatokat megbetegítő több mint 100 különböző herpesvirus közül az embert, egyedül a majom B vírusa (CHV 1) fertőzi meg. A B-vírus emberről-emberre is terjed. A vírus elnevezése annak a fiatal férfinak a nevéből (W. B). ered, aki az első ismert humán áldozata volt a Macacus rhesus majom harapásával terjedő fertőzésnek Adenoviridae Az adenovirusok elnevezése a görög aden, adenos (garatmandula) szóból ered, ami arra utal, hogy e vírusokat először olyan sejttenyészetekből izolálták, amiket gyermekek műtétileg eltávolított garatmanduláiból próbáltak készíteni. Az Adenoviridae családon belül Mastadenovirus és Aviadenovirus nemzetségeket különböztetünk meg. A Mastadenovirus nemzetségbe tartoznak a humán és emlősállatból izolált adenovirusok. A nemzetségen belül a gazdafaj szerinti csoportosításban szerotípusokat különböztetünk meg. Jelenleg a nemzetségen belül a szarvasmarha (bovin) adenovirusokatkét alcsoportba (BAV 1 és BAV 2) soroljuk. (28. táblázat) 28. táblázat - Adenovirusok taxonómiája Mastadenovirus genus (szerotípusok) Aviadenovirus genus (szerotípusok) I. csoport II. csoport III. csoport Szarvasmarha 1. alcsoport Csirkék légzőszervi és enterális betegsége (1 12) Pulyka enteritis EDS 2. alcsoport (1., 2., 3., 9) (4., 5., 6., 7., 8., 10.) (CELO, GAL) Fácán márványlép betegsége Kacsa adenovirus 1 Ló (2) Kacsa hepatitis (1) Csirkék Sertés (6) Pulyka légző- splenomegáliája Juh (6) szervi betegsége Kecske (2) (1 5) Kutya (2) (Cav 1, Cav 2) Fürj bronchitis Ember (51) (alcsoport: A F) * 262
283 Részletes virológia *Magyar kutatók molekuláris biológiai és filogenetikai vizsgálataik alapján 1997-ben javasolták egy új nemzetség felállítását Atadenovirus genus elnevezéssel, amely a genusba sorolható vírusok (2. alcsoportbeli BAV, EDS) DNS-ében megfigyelt magas AT-tartalomra utal. Az Aviadenovirus nemzetségen belül megtalálható összes madárból izolált adenovirust három csoportba (I., II., III.) soroljuk be a közös szolubilis antigének alapján. A csoportokon belül szerotípusokat különböztetünk meg. Az adenovirusok besorolását mutatja a 28. táblázat. Morfológia. Virion szerkezete. A burok nélküli adenovirusok ikozahedrális szerkezetű, nm átmérőjű nukleokapsziddal rendelkeznek. A nukleokapszid 252 kapszomerből áll (240 hexon és 12 penton). A pentonok felületén az ún. pentonbázishoz, egy speciális fehérjenyúlvány, a fiber kapcsolódik (mastadenovirusoknál általában 1, az aviadenovirusoknál 2 fiber kapcsolódik egy pentonhoz). A fiber- és a pentonbáziskomplexet pentonkapszomernek nevezik. Az adenovirusok morfológiai jellegzetességét adó fiber hossza nm között változik, és a végén található gömbszerű képződmény epitópjainak meghatározó szerepe van a vírus adszorbciójában (127. ábra). A virion úszósűrűsége 1,34 g/cm 3 CsCl-oldatban ábra - Adenovirus negatív kontraszt elektronmikroszkópos képe (Országos Állategészségügyi Intézet archívumából) Ritchie A. felvétele Nukleinsav. Az adenovirusok kettős szálú lineáris DNS/2 molekulatömege Da között változik a szerotípustól függően. Mindkét DNS szál 5 -végén egy vírus által kódolt polypeptid az ún. terminális fehérje (TP) található, ami a DNS replikációban primerként funkcionál. A vírusnukleinsav 11 14%-át képezi a virion tömegének. Az adenovirusgenom korai (E1 4) és késői (L1 5) fehérjéket kódoló génszakaszokra osztható. Vírusfehérjék. Antigéntulajdonság. Az elektroforézissel elkülöníthető nukleokapszid-proteinek száma (11 15) és molekulatömege ( D) szerotípusonként eltérő. A hexonok és pentonok bazálisan helyeződő fehérjéi alkotják a csoportspecifikus, a felületi fehérjéi pedig a típusspecifikus antigéneket. A legnagyobb 263
284 Részletes virológia adenovirus polypeptid (hexon II), 3 fehérje-alegységből épül fel. A fiberben található epitópok felelősek a szerotípus-specificitásért és a haemagglutinációért. (29. táblázat). 29. táblázat - Adenovirusok strukturproteinjei Lokáció Sorszá m Molekulatöme g Név Megjegyzés KAPSZID II 120 E Hexon fehérje Csoport és szerotípus specifikus antigén III B5 K Penton fehérje toxikus a sejtmembránra IV 62 K Fiber Adszorbció, hemagglutináció, VI 24 K szerotípus specifikus antigén VIII IX 13 K 12 K Hexonhoz kapcsolódó fehérjék Hls 66 K Pentonhoz kapcsolódó fehérjék CORE V 48 K Core protein 1 hisztonszerű proteinek az adenovirusok VII 18 K Core protein 2 ősi evolúciós eredetét bizonyítják A 2. alcsoportba tartozó szarvasmarha vírusok (BAV 4 8 és 10.) kivételével minden emlős adenovirusnak van egy közös ún. solubilis antigénje (a genomszerkezeti eltérés mellett ez indokolta a BAV alcsoportok kialakítását). Az adenovirus E1 4 genomrégióiban kódolt korai fehérjék irányítják a vírus makromolekuláinak szintézisét (E2 E4), felelősek a perzisztencia (E3) és esetenként a sejttranszformáció kialakításáért (E1A+E1B). Ez utóbbi köti meg az antionkogéneket (n53, Rb) ami a sejttranszformáció megindulásához vezet (lásd Az onkogenitás mechanizmusa). Az emlős adenovirusok legtöbbje rendelkezik hemagglutináló képességgel, bár esetenként jelenős különbségek lehetnek egyazon faj különböző adenovirusai között. Az eddig izolált humán adenovirusokat 4 csoportba sorolják a hemagglutinációs képesség alapján. Az aviadenovirusok III. csoportjának vírusai (EDS, kacsa adenovirus1) hemagglutinálnak, az I. és II. csoportba tartozók nem. Ellenálló képesség. Fizikokémiai tulajdonságok. Az adenovirusok hővel szembeni érzékenysége változó. A mastadenovirusok (a 2. alcsoportbeli BAV-ok kivételével) már 50 C-on percek alatt inaktiválódnak, az aviadenovirusok még 56 C-on is megtartják fertőzőképességüket. A kétértékű kationok (Ca 2+, Mg 2+ ) fokozzák a hőérzékenységet. Az adenovirusok a savas vegyhatással (ph 3,0) szemben ellenállók. A zsíroldószerek (éter, kloroform) nem inaktiválják. 264
285 Részletes virológia Fertőtlenítőszerek közül a klórtartalmú szerek és az aldehidszármazékok (3 5%) hatékonyak az adenovirus ellen. A sebfertőtlenítéseknél is alkalmazott jodofórok azonban hatástalanok. Multiplikáció. Az adenovirusok multiplikációjuk során a dupla szálú DNS-vírusokra (DNS/2) jellemző replikációs, transzkripciós és transzlációs stratégiákat alkalmazzák, A vírusok multiplikációja c. fejezetben leírtak szerint (128. ábra) ábra - Adenovirusok multiplikációja Kórokozó képesség. Az emlős-adenovirusok legtöbbje általában enyhe klinikai tünetekben vagy szubklinikai formában jelentkező, felső légúti megbetegedést és/vagy conjunctivitist okoz, többnyire a fiatal állatokban. Néhány adenovirus enyhébb-súlyosabb enterális kórképet (pneumoenteritis) is előidéz. Az emlős-adenovirusok közül a CAV 1 (Rubart-kór) hepatitist, encephalopathiát és nephritist okoz. A lymphoid szövetekben perzisztáló fertőzés (latencia) alakulhat ki, és ez a latens állapot immunszuppresszív hatásra reaktiválódik Emlős háziállatok fontosabb adenovirusai Mastadenovirusok Szarvasmarha-adenovirusok (bovin adenovirus, BAV 1 10). Klinikai tünetekben megnyilvánuló fertőzés legtöbbször az intenzív körülmények között tartott fiatal borjakban jelentkezik, légzőszervi és hasmenéses tünetekben. Conjunctivitis gyakran társul a kórképhez. A bovin adenovirusokat a csoportspecifikus antigénjük alapján két alcsoportba és 10 szerocsoportba soroljuk (28. táblázat). Az 1. alcsoportba tartozó szerotípusoknak (1, 2, 3, 9,) a humán adenovirusokkal közös csoportspecifikus antigénjük van, míg a 2. alcsoport vírusaiban (4 8, 10) ilyen közös antigént nem lehetett kimutatni. Az 1. alcsoport vírusai borjúherén- és borjúhereszöveten egyaránt szaporodnak, és egy nagyméretű, basofil festődésű zárványt hoznak létre. A 2. alcsoport vírusai csak borjúvesén szaporodnak, és több, kisebb, eozinofil festődésű zárvány megjelenése jellemzi cytopathogen hatásukat. A BAV 2 a szarvasmarhán kívül a juhot is megbetegíti (légző- és emésztőszervi tünetek). A haemagglutinációs spektrum és a genomszerkezeti különbségek alapján a szerotípuson belül, két szubtípus (BAV 2A és BAV 2B) kialakítását javasolják Juhadenovirusok (Ovine adenovirus, OAV 1 6) A juhadenovirusok elsősorban a nagyüzemi körülmények között tartott bárányokban okozhatnak légző és emésztő rendszeri megbetegedést. A vírus sejtkárosító hatásának következtében, kosbárányokban húgykövesség is kialakulhat. Mivel a BAV 2 is felelőssé tehető a juhok adenovirus-fertőzéséért, a vakcina használatára alapozott védekezésnél érdemes meghatározni az állományt fertőző adenovirus(ok) szerotípusát. 265
286 Részletes virológia Kutya-adenovirusok (CAV 1, CAV 2, Canin adenovirus) A kutyák heveny lezajlású fertőző májgyulladását (Rubarth-kór) a CAV 1 okozza. A hepatocytákban és a retikuloendotheliális sejtekben elszaporodó vírus iránt minden Canidae családba tartozó faj fogékony. A CAV 1 rókákban és medvében sporadikusan előforduló, vérzéses encephalitist okoz, ami az emlős-adenovirusok esetében egyedülálló kórtani hatás. A vesében is elszaporodó vírust a kutya vizeletével nagy mennyiségben üríti. A betegségből felgyógyult vagy vakcinázott kutyákban esetenként kék szem néven ismert corneahomály (ödéma) alakul ki, amely néhány nap után spontán gyógyul. Az elváltozás hátterében immunkomplexek szerepét feltételezik. A CAV 1 elleni inaktivált és attenuált vakcinákat kiterjedten használják. A CAV 1 újszülött hörcsögben daganatot okozott a humán adenovirusokhoz hasonlóan. A kutyák fertőző laryngotracheitisét a CAV 2 vírus okozza. A vírus kizárólag a felső légutakat betegíti meg, és súlyosabb kórkép csak baktériumos szövődmények esetén alakul ki. A CAV 2 és a CAV 1 vírus között szoros antigénrokonság van (mindkét vírus teljes DNS szekvenciája ismert). A CAV 1 törzsekből készült vakcinák védelmet nyújtanak a CAV 2 vírusfertőzéssel szemben is Ló-adenovirusok (EAV 1 2, Equine adenovirus) Az adenovirusok csikókban enyhe felső légúti megbetegedést okoznak. Immundeficienciában (T- és B-sejthiányban) szenvedő lovaknál az EAV 1-fertőzés súlyos légző és emésztő rendszeri tüneteket okozott Sertés és kecske Sertésekben idáig 6 szerotípust különítettek el, de önálló pathogen szerepük még nem kellően bizonyított. A kecskékben2 szerotípust írtak le Aviadenovirusok Az I. csoportba tartozó adenovirusok közös szolubilis antigént tartalmaznak. A csoportba tartoznak a tyúkokból izolált és korábban CELO (chicken embryo lethal orphan), GAL (gallus adeno like) összefoglaló néven ismert vírusok is. Az I. csoportba tartozó vírusok több madárfajban (fürj, kacsa, pulyka) okoznak szubklinikai fertőzést vagy főként immunszuppresszív hatásra kialakuló, súlyos megbetegedést. A II. csoportba tartozó három betegség (pulykák vérzéses bélgyulladása, fácán márványlép betegsége, csirkék splenomegáliája) súlyos veszteségeket okoz. A csoportot alkotó három adenovirus között rendkívül szoros antigénrokonság alapján erős gyanú van arra, hogy esetleg egy vírus (pulyka-adenovirus) három különböző fajhoz adaptálódott antigénvariánsát képviselik. A csoportba tartozó vírusok nem szaporodnak sem szövettenyészetben, sem embrionált tyúktojásban. A III. csoportba tartozó EDS (Egg Dropp Syndrome) vírus a szintén e csoportba tartozó kacsaorphan-(árva- )vírusból (kacsa adenovirus 1) keletkezett mutációval, feltételezhetően laboratóriumi passzálások során. A vírus a tojótyúkok petevezetőjének hámsejtjeiben elszaporodik, és emiatt a mészhéjképzés zavart szenved. Ennek eredményeként a tyúk lágy héjú tojást tojik, ami a tojást cseppentő kórkép kialakulásához vezet. Az EDS vírus ellen hatékony vakcinát fejlesztettek ki. Laboratóriumi diagnosztika. Víruskimutatás fajazonos szövetből (pl. vese) készült szövettenyészeten történik, melyben a CP-hatást a magzárványok kialakulása és a sejtek lekerekedése jellemzi (129. ábra). A vírusantigéneket IF, immunproxidáz-próbával, és elektroforézissel mutatjuk ki. A vírus DNS PCR és in situ DNS-hibridizációs módszerrel is kimutatható. A rutin diagnosztikában a csoportspecifikus ellenanyagokat AGP, KK, és IF próbával, a típusspecifikus ellenanyagokat VN-teszttel határozzuk meg ábra - Adenovirusok CP-hatása: zárványképződés borjúvese szövettenyészeten 266
287 Részletes virológia Humán adenovirusok Az eddig izolált humán adenovirusokat 5 alnemzetségbe (A, B, C, D, E, F) és 51 szerotípusba sorolták. Az A alnemzetségbe tartozó szerotípusok (12, 18, 31) rágcsálókban nagy gyakorisággal, a B alnemzetségbe tartozók ritkán daganatot okoznak. A humán adenovirusok a gyerekközösségekben gyakran előforduló enyhébb-súlyosabb légző és emésztőszervi megbetegedéseket okoznak. Ugyanakkor oktani szerepüket bizonyították a felnőttkori légzőszervi tünetekben (military disease) és fertőző conjunctivitisben (shipyard eye) megnyilvánuló betegségben is. Immunszupresszív kezelésben részesülő betegekben (AIDS) halált okozó generalizált kórkép alakulhat ki. Súlyos enterocolitis és meningitis is kialakulhat adenovirus fertőzés során. Több humán adenovirust használtak vakcina vagy génterápiás vektorként Poxviridae A poxvirusok elnevezése a régi angol pock szóból ered, ami gennyes fekélyt jelent, és a történelmet formáló fekete himlő klinikai képének megjelenítésére használták (a mai angol fordításban a pock szó már csomót jelent, utalva a tojásoltás során észlelt CAM elváltozásokra). A Poxviridae családot Chordopoxvirinae és Entomopoxvirinaealcsaládokra osztjuk. A gerincesek poxvirusait magába foglaló Chordopoxvirinae alcsaládot 8 nemzetség alkotja (30. táblázat). A rovarok himlővírusait egyesítő Entomopoxvirinae alcsalád három nemzetségből (A, B, C) áll. 30. táblázat - A Chordopoxvirinae alcsaládba tartozó vírusok Alcsaládok Genus Tagok Chordopoxvirinae (gerincesek poxvirusai) Orthopoxvirus Capripoxvirus Variola, vaccina, tehénhimlő, majomhimlő, tevehimlő, Uasin-Gishu, bivalyhimlő, nyúlhimlő juhhimlő, kecskehimlő, bőrcsomósodási kór 267
288 Részletes virológia Suipoxvirus Leporipoxvirus Sertéshimlő Nyúl myxomatózis, nyúl fibromatózis, mókus fibromatózis Avipoxvirus Tyúkhimlő, galambhimlő, kanári himlő, pulykahimlő, verébhimlő, papagájhimlő Parapoxvirus Tőgyhimlő, szarvasmarha göbös szájgyulladása juhok varas szájfájása Molluscipoxvirus Molluscum contagiosum Yatapoxvirus Tanapox, Yabapox Morfológia. A virion szerkezete. A poxvirusok az egyik legnagyobb állati vírusok. A virionok alakja téglatestreemlékeztető (220x450 nm), az ovoid alakú parapoxvirusok ( nm) kivételével. A virion nukleinsavát és a hozzá kapcsolódó fibrilláris fehérjéket a piskóta alakú vírusmag (core) tartalmazza. A vírusmagot egy ún. belső membrán határolja és két oldalán találhatók az ún. laterális testek, melynek funkcióját még nem ismerjük. Mivel nem alakult ki kettős szimmetriájú kapszid, a poxvirusoknak komplex szimmetriája van. A vírusmagot és a laterális testeket kívülről egy dupla falú burok határolja, amelynek külső felületét cső alakú vagy spirális (parapox) fehérjék hálózzák be. (a rovarok téglatest alakú poxvirusaiban vese alakú vírusmag és csak egy laterális test található). (130. ábra) ábra - Poxvirus (papagájhimlő) virionjának EM képe. (Országos Állategészségügyi Intézet archívumából) Ritchie A. felvétele 268
289 Részletes virológia Vírusnukleinsav. A poxvirusok lineáris kettős szálú (DNS/2) nukleinsavának molekulatömege ( Da), genomhosszúsága ( kb.) és G+C aránya (35 60%) nagy változatosságot mutat. A legnagyobb nukleinsavval az Avipox genus tagjai rendelkeznek. A lináris himlővírus DNS mindkét vége kovalens kötéssel hajtűszerűen összekapcsolódik, hasonlóan az emlős kromoszóma DNS telomérjeihez. A poxvirusok genomja kb gént kódol. Vírusfehérjék. Antigéntulajdonság. A poxvirusokban kb. 100 polypeptid található. A vírusmagban helyeződnek el a transzkripció és replikáció szabályozáshoz szükséges enzimek (RNS-polimeráz, proteinkináz, korai transzkripciós faktorok, stb.) és a struktúrproteinek. A vírus-dns-hez szorosan kapcsolódik két (11 Da és 25 Da) fehérje, amelyek a nukleinsav stabilitást segítik. A sejtmembrán eredetű vírusburokban legalább 8 különböző polipeptid található, melyek között hőstabil és hőlabilis fehérjék is vannak. A burok külső felszínén találhatók a vírusneutralizációért és a hemagglutinációs tulajdonságért felelős fehérjék. A poxvirusok felszíni fehérjéi erős antigénhatással rendelkeznek (a parapoxvírusok kivételével), ezért a természetes fertőzés átvészelése és a szakszerű vakcinázás hosszan tartó immunitást biztosít (az emberi himlő esetében az átvészelés életre szóló védelmet jelentett, a védőoltást azonban 3 évenként meg kellett ismételni). Az egyes genusba tartozó vírusok között erős keresztvédelem van. Nemzetségen belül az egyes vírusok nagyfokú keresztreakciót adnak a szerológiai próbákban. Hemagglutinációs tulajdonsággal kizárólag az Orthopox és Avipox genus tagjai rendelkeznek. Multiplikáció. A poxvirusok (annak ellenére, hogy DNS-genommal rendelkeznek) a sejt cytoplasmájában szaporodnak. A korai transzkripció a teljes dekapszidáció (uncoating) befejezése előtt megkezdődik. A vírus készen viszi magával a korai transzkripciót végző RNS-transzkriptáz enzimet és az ún. vetkőztető enzimet is. Ez utóbbi kíméletesebben végzi a DNS-t körülölelő struktúrfehérjék lebontását. Mivel a DNS körül több létfontosságú enzim helyeződik el, erre rendkívül nagy szükség van. A poxvirusok nagy része a Golgi-apparátus membránját használja fel a vírusburok képzéséhez. A vírusburokban levő glükoproteinek között olyan szénhidrát található (N-acetil glükozamin), amit a vírusok közül egyedül a poxvirus szintetizál. Egy fertőzött sejt kb viriont állít elő a kb. 12 órás szaporodási ciklus alatt (131. ábra) ábra - Poxvirusok multiplikációja 269
290 Részletes virológia Ellenálló képesség. Fizikokémiai tulajdonság. Az emlősállatok poxvirusai rendkívüli hőrezisztenciával rendelkeznek (60 C/10 perc). Ez a hőrezisztencia beszáradt állapotban még kifejezettebb (Orthopoxvirusok 100 C-os hőkezelést 1 2 percig túlélnek). Ugyanakkor izoláltak több hőérzékeny mutáns törzset is. A vegyhatással szemben ph 5 9 között ellenállóak. Fertőzőképességüket beszáradt sejtekben évekig is fenntartják. Az Avipox genus tagjai hőérzékenyek (50 C/30 perc, 60 C/1 perc) de a vegyhatással szemben hasonló ellenállást tanúsítanak mint az emlősállatok himlővírusai. Az Orthopox és az Avipox genus tagjai éterrezisztensek, a többi poxvirus az éter kezeléssel szemben érzékeny. A kloroform minden poxvirust hatékonyan inaktivál, de a fertőtlenítőszerekkel szemben általában ellenállóak. A Parapox genus tagjai hővel és vegyhatással szemben érzékenyek Háziállatok fontosabb poxvirusai Orthopoxvirus nemzetség. A variola vírusa az emberi fekete himlő kórokozója. Ez volt az első vírus, amitől mentesítették bolygónkat (1980 óta csak laboratóriumban található) és a védőoltást is abbahagyták. A vacciniavírus a variola elleni vakcinázásokhoz használt vírustörzseket reprezentálja. A vacciniavírus vélhetően a tehénhimlőből keletkezett (tehénhimlő- mutáns). A vakcina szó eredete is erre vezethető vissza (vacca = tehén), ugyanis ez volt az első vírus, amit megelőző védőoltásra (vakcinázásra) használtak. A vacciniavírusok kérődzőkben lokális himlős elváltozást okoznak, de immunszuppresszált állatokban generalizált fertőzés is kialakulhat. A vírus iránt fogékony a nyúl és sertés is. A tehénhimlő vírusa a tehén tőgyén haemorrhagiás himlős pörköket alakít ki. A vírus protektív védelmet ad a variolavírussal szemben. A tehénhimlő vírusa fatális kimenetelű fertőzést okoz állatkerti nagymacskákban (oroszlán, puma, tigris) és az elefántban is, amelyben generalizált kórképet idéz elő. Feltételezhető, hogy a vadon élő rágcsálók a vírus valódi gazdái, a tehén csak véletlenül vált vírushordozóvá. A majomhimlő vírusa generalizált fertőzést okoz majmokban. Afrikában (Zaire) leírt humán megbetegedések generalizált bőrhimlőben jelentkeztek, melyek a variolánál látott elváltozásokhoz voltak hasonlók. A tevehimlő vírusa súlyos, generalizált bőrhimlőt okoz, elsősorban a fejen. A szemet ért fertőzések gyakran vaksághoz vezetnek. A fertőzés fiatal állatokban fatális kimenetelű lehet. Csak a teve fogékony a fertőzésre. Uasin-Gishu betegség vírusa a lovak ritkán előforduló himlős megbetegedését okozza. A betegséget Kenyában és Zambiában észlelték. 270
291 Részletes virológia A nemzetségbe tartozó vírusok a nukleinsav-restrikciós enzimanalízissel megkülönböztethetők egymástól. Szerológiai próbák közül a VN, KK, és AGP használható fajazonosításra. Capripoxvirus nemzetség. A juhhimlő vírusa a juhokban nagy mortalitással járó, generalizált fertőzést okoz, melynek eredményeként vetélés is előfordul. A vírust rovarok is terjesztik. A juhhimlő elleni vakcina védelmet ad a nemzetségbe tartozó (bőrcsomósodási kór, LSD) ellen is. A kecskehimlő vírusa a kecskékben okoz generalizált fertőzést, ami tünetileg emlékeztet a juhhimlőre, de annál lényegesen enyhébb lefolyású. A fertőzés iránt csak a kecske fogékony. A bőrcsomósodási kór(lumphy skin disease, LSD) vírusa a szarvasmarhák generalizált bőrhimlőjét okozza. Az Afrikában elterjedt vírus időnként Európában is megjelenik (vándorcirkusz, állatkert). A végtagok ödémája megkülönbözteti a BHV 2 által okozott ál-bőrcsomósodási kórtól. A vírus a fertőzött állat nyálában, vérében és ondójában is kimutatható. A genusba tartozó három betegség vírusai között szoros antigénrokonság van. AGP, VN próbában keresztreakciót adnak egymással. A vírusok elkülönítése nukleinsav-analízissel történik. A vírusok terjesztésében vérszívó rovarok is szerepet játszanak. Suipoxvirus nemzetség. A sertéshimlő vírusa a fiatal malacokban a bőr himlős elváltozásával járó, többnyire sporadikus megbetegedést okoz. A vírus terjesztésében kiemelkedő szerepük van a vérszívó tetveknek(hematopinus suis). A vírus elszaporítható juh-, kecske- és borjúszöveten is. Leporipox nemzetség. A nyúl myxomatosisának vírusa(myxoma virus) lokalizált jóindulatú fibromát okoz mezei (Lepus sp.) és az amerikai gyapotfarkú nyulakban (Silviagus sp.). Ugyanakkor nagy mortalitással járó generalizált megbetegedést házi- és üregi nyulakban (Oryctolagus sp.). A vírus terjesztésében nagy szerepe van a vérszívó rovaroknak (szúnyog). Ezt a vírust használták biológiai fegyverként Ausztráliában az üregi nyulak kiirtására. A nyúl fibromatosisa szoros szerológiai rokonságban áll a myxomatosis vírussal. A két vírus között AGP próbával különbséget lehet tenni. Avipoxvirus nemzetség. A genusba tartozó vírusokat azokról a fajokról nevezték el, amelyekből izolálták őket. A nemzetségbe tartozó vírusok közül a legfontosabb a tyúkhimlő vírusa (Fowlpox virus). A vírus több baromfifaj (tyúk, pulyka, galamb) megbetegedését okozza. A rovarok vérszívása által létrejött fertőződéskor himlős bőrkiütések keletkeznek. Az aerogén fertőződéskor (belélegzés) viszont a nyálkahártyák fertőződése (fibrines felrakódások) kerül előtérbe, ami rendszerint fatális kimenetelű. A betegség ellen védelmet adnak a tyúkhimlő attenuált vírustörzseiből, valamint a galambhimlőből készült vakcinák. Parapoxvirus nemzetség. A Parapoxvirus nemzetségbe tartozó vírusok közös jellegzetessége, hogy az embert megbetegítik (zoonosis!). A tőgyhimlő(áltehénhimlő, pseudopox) vírusa a tehenek csecsbimbóin okoz jóindulatú himlős elváltozást. Az ember a fejés során fertőződik a vírussal, és kialakul a fejési csomóként ismert bőrelváltozás. A házi légy (Musca domestica) mechanikai vektorként, populáción belül terjesztheti a fertőzést. Szopós borjakban a száj környékének hámsejtjei is fertőződnek. A szarvasmarha göbös szájgyulladásának vírusa (bovine papular stomatitis) a száj nyálkahártyájának jóindulatú himlős megbetegedése, amelynek során a fertőzött területeken proliferatív jellegű, kiemelkedő papulák keletkeznek. A vírus az ember arcán, kezén és a szája körül okoz proliferatív elváltozást. A juhok varas szájfájásának vírusa (orfvirus) a juhok és kecskék ragályos megbetegedését okozza. A vírust a perzisztensen fertőzött juhok tartják fent. A parapoxvirusok gyenge antigénhatásával magyarázható, hogy krónikus és ismételt fertőzés is előfordulhat. Az aerogén úton (belélegzés) terjedő betegség generalizált kórkép kialakulásához vezet. A vírus iránt fogékony a kutya is. A poxvirusok között egyedülálló jelenség, hogy a más genusba tartozó kecskehimlő vírusa (Capriox) protektív védelmet ad a juhok varas szájfájásának vírusa ellen. (Ez a védelem fordítva nem érvényesül.) Emberben a kéz bőrén alakulnak ki himlős elváltozások. A Parapoxvirus nemzetségbe tartozó vírustörzsek immunológiailag egységesek, szerológiai próbákkal nem különíthetők el. A vírusok azonosítása nukleinsav-analízissel lehetséges. 271
292 Részletes virológia Molluscipoxvirus nemzetség. A genus egyetlen tagja a Molluscipox vírus (MCV), amely a Molluscum contagiosum elnevezésű emberi bőrbetegséget okozza. A betegség nevét a bőrön kialakuló gyöngyházszínű tömör csomókról kapta. A vírus nem szaporítható sem sejtkultúrákban, sem embrionált tojásban. A gyenge immunitást kiváltó MCV szerológiai próbákban nem adott keresztreakciót sem a vaccinia, sem a tehénhimlő, sem a tyúkhimlő vírusával. A vírus elsősorban közvetlen érintkezéssel uszodacsomó vagy szexuális úton terjed. Yatapoxvirus nemzetség. A nemzetségbe két vírus a Tanapoxvirus és a Yabapoxvirus tartozik. Mindkét vírust majmokból izolálták. A Tanapoxvirus (az Afrikában található Tana folyóról kapta nevét) a majmokból vélhetően vérszívó rovarok közvetítésével került át az emberbe, ahol lázas, fejfájással és bőrviszketéssel járó megbetegedést okoz. Az ember-ember terjedést is leírták. A Macacus rhesus majmokból izolált Yabapoxvírus a bőr alatti kötőszövet jóindulatú daganatos elváltozását okozza mind majmokban mind az emberben, mindkettő egy éven belül többnyire magától meggyógyul. Laboratóriumi diagnosztika. A vírus kimutatása elektronmikroszkópos vizsgálattal történik az elváltozást mutató szervekből. A vírusok izolálása a fajazonos szövetekből készült egyrétegű szövettenyészetekben történik, ahol a cytoplasmazárvány kialakulása és a syncytiumok megjelenése utal a poxvirusok CP-hatására (132. ábra). A Parapox genus kivételével minden poxvirus elszaporítható embrionált tyúktojás chorioallantois membránjára (CAM) oltva ahol pockok kialakulását okozza (133. ábra). A vírusfehérjék ellen termelt ellenanyagok VN-, KK-, AGP-próbákkal meghatározhatók, bár genuson belül rendkívül nagy a keresztreakció. Ugyanakkor ezek a próbák a nemzetségek elkülönítésére alkalmasak. Nemzetségen belül az egyes vírusokat nukleinsavanalízis (restrikciós enzimvizsgálattal kapott fragment eloszlás) alapján különítjük el ábra - Poxvirus zárványok 133. ábra - Poxvirus által okozott pockok CAM-on 272
293 Részletes virológia 1.6. Hepadnaviridae A víruscsalád elnevezésében a vírus hepatotropizmusa (hepar: máj) és nukleinsavának típusa (DNA=DNS) kapott szerepet. A családba a fertőző hepatitist okozó DNS-vírusok tartoznak. A Hepadnaviridae család két genusból áll. Az Orthohepadnavirus genusban (Hepatitis-B víruscsoportban) található az embert megbetegítő Hepatitis-B vírus (human hepatitis Bvírus, HBV), valamint a mormota(marmata monax) (woodchuck hepatitis B vírus, WHV) és a mókus (ground squirell hepatitis Bvirus, GSHV) hepatitis B vírusa. Az Avihepadnavirus genusba tartozik a kacsa (duck hepatitis Bvirus, DHBV) és a kócsag (heron hepatitis Bvirus, HHBV) hepatitist okozó vírusa. Morfológia. A virion szerkezete. A nm átmérőjű, burokkal rendelkező hepadnavirusok (Danepartikulák) kapszidja ikozahedrális szimmetriájú. A nukleokapszid 180 kapszomerből épül fel. A három emlőshepadnavirus morfológiai felépítése különbözik a madarakból izolált hepadnavirusok struktúrájától (a kacsahepatititis B vírus nukleokapszidjának felszínén fehérjetüskék találhatók, amik hiányoznak az emlőshepadnavirusokból). A nukleokapszidban található a vírusmultiplikációt irányító DNS-polimeráz és proteinkináz enzim. A fertőzött emberek vérsavójában található core nélküli buroktöredékek morfológiája rendkívül változatos mérete nm. (134. ábra) ábra - Hepadnavirus szerkezete 273
294 Részletes virológia Nukleinsav. Az eddig megismert vírusok közül a hepadnavirusok rendelkeznek az egyik legkisebb nukleinsavval ( bázispár). Az egyszálú, negatív irányítottságú cirkuláris vírusgenomot rövidebb-hosszabb szakaszon (40 85%) egy komplementer szál egészíti ki, miáltal a cirkuláris genom részlegesen egyszálú (DNS/1), részlegesen kétszálú (DNS/2) lesz. A vírusnukleinsav molekulatömege 1, Da. A genomban négy különböző, egymást átfedő génszakaszt azonosítottak. Az S-gén kódolja a kórtani és diagnosztikai szempontból fontos HBsAg fehérjét, a C-gén a nukleokapszidban található HBcAg fehérjét, a P-gén pedig a vírusreplikációban nélkülözhetetlen enzimeket (pl. reverztranszkriptáz, DNS-polimeráz, RN-áz). A negyedik, X-gén a HBV tumorkeltő fehérje. Vírusfehérjék. Antigén-tulajdonság. A komplett vírusok burkában és az inkomplett partikulák felszínén található HBsAg polipeptid glükoprotein. A HBsAg-fehérjék protektív immunválaszt váltanak ki a szervezetben, ezért a hepatitis B-vírus-fertőzés elleni védelemben kiemelkedő szerepük van. A HBsAg-fehérjék hordozzák a csoportés típusspecifikus antigéndeterminánsokat. A nukleokapszidban található HBcAg és HBeAg fehérjék szintén immunogének. Ellenálló képesség. Fizikokémiai tulajdonságok. A vírus a zsíroldó szerekkel (kloroform, éter) szemben érzékeny. A savas vegyhatás inaktiválja. Hőhatással szemben ellenálló (fertőzőképességét 30 C-on 6 hónapig, 60 C-on 10 óráig megtartja). Multiplikáció. A hepadnavirusok multiplikációja a máj- és fehérvérsejtekben zajlik. A makromolekulák szintéziséhez reverz transzkripciót alkalmaz, a Vírusok multiplikációja c. fejezetben leírtak szerint (135. ábra) ábra - Hepadnavirusok multiplikációja (Murray és mtsai. (1990) után módosítva) 274
295 Részletes virológia 275
296 Részletes virológia Kórokozó képesség. A hepadnavirusok állategészségügyi jelentősége nem nagy. A kacsahepatitis B vírus kórtani szerepét feltételezik azoknak a fertőző hepatitiseknek és májtumoroknak a kialakulásában, amelyek Kína egyes területein halmozottan jelentkeztek a kacsák között. A fertőzés vertikálisan is terjed. A humán hepatitis B vírus ugyanakkor rendkívül fontos szerepet játszik a nemi betegségként jelentkező fertőző hepatitisek, májcirrhosisok és májtumorok kialakulásban. A humán hepatitis B-fertőzéseket a 10 legtöbb halálozással járó fertőző betegség között tartják nyilván. Laboratóriumi diagnosztika. A hepatitis B-vírus-fertőzések diagnosztikája a vírusfehérjék (HBsAg, HBcAg, HBeAg) és az ellenük termelt ellenanyagok kimutatásán alapszik. A leggyakrabban használt szerológiai próbák az ELISA és a RIA. 2. Nem besorolt DNS-vírusok 2.1. Az afrikai sertéspestis vírusa A vírus, az általa okozott betegségről kapta a nevét. Az Afrikai sertéspestis vírusa (African swine fever virus, ASFV) korábban az Iridoviridae családba tartozott, de eltérő nukleinsav-struktúrája és replikációs stratégiája miatt ebből a családból kivették. Az ASF vírus jelenleg egyik víruscsaládba sincs besorolva. Az önálló vírus minden eddig izolált törzse egy szerotípusba tartozik. Morfológia. A virion szerkezete. Az ikozahedrális szimmetriával rendelkező, burkos vírus átmérője nm (136. ábra). A nukleokapszid rendkívül nagy számú ( ) kapszomert tartalmaz. A nukleokapszid belsejében (a vírusok között egyedülálló módon) egy belső burok (lipoprotein tartalmú, sejt eredetű membrán) található, amely körülöleli a vírus nukleinsavát. A sejt plazmamembránjaiból származó külső vírusburok a virionnak határozatlan alakot kölcsönöz. Nukleinsav. A lineáris, kettős szálú DNS ( kb.) mindkét végén ismétlődő szekvenciák (TIR) találhatók. A nukleinsav-analízisek alapján az eddig izolált vírustörzsek három DNS-osztályba sorolhatók ábra - Afrikai sertéspestis vírus sematikus képe 276
297 Részletes virológia Vírusfehérjék. Antigén-tulajdonság. Az eddig elkülönített 50 vírusfehérjéből 9 struktúrprotein és 3 nem strukturális fehérje ellen termelődött ellenanyagok közül egy sem neutralizálta a vírust. Az egyes ASFVizolátumok rendelkeznek hemadszorpciós képességgel, mások nem. Ellenálló képesség. Fizikokémiai tulajdonságok. A vírusburoknak köszönhetően az ASF vírus érzékeny a zsíroldó szerekre (éter, kloroform). Vegyhatással szembeni tűrőképessége rendkívül jó (ph 4 13). A kereskedelmi forgalomba levő fertőtlenítőszerek közül a fenoltartalmúak a leghatékonyabbak. Vérben, húsban hónapokig megtartja fertőzőképességét. Talajban nyáron legalább 100, télen legalább 200 napig túlél. A vírus hővel szembeni ellenálló képessége (56 C-on 30 perc) fertőzött húsban, vérben fokozódik (legalább 75 C-on történő hőkezelés szükséges az inaktiváláshoz). Fagyasztott húsban évekig megtartja fertőzőképességét. Multiplikáció. A DNS-genommal rendelkező vírus a cytoplasmában szaporodik. A multiplikációja hasonló a szintén cytoplasmában szaporodó poxvirusok stratégiájához (A vírusok multiplikációja c. fejezetben foglaltak szerint). Érdekes jelenség, hogy az ASFV multiplikációja akkor is zavartalan, ha a sejtmag működése leáll (pl. az orthomyxovirusok mindenképpen működő sejtmagot igényelnek makromolekuláinak szintéziséhez). Kórokozó képesség. Az ASFV kizárólag a sertést és az ízeltlábúakat fertőzi meg, ezért az egyetlen ismert DNSarbovírus. Sertésben a klasszikus sertéspestishez (Pestivirus genus) hasonló, vérzéses kórképet okoz. A fehérvérsejtekben és macrophagokban jelenlevő vírusok az ún. sejtes viraemiát hozzák létre. A sejtes viraemiás stádiummal járó generalizált fertőzés során a fertőzött állat 1 ml vérében vagy 1 g szöveteiben nemegyszer 10 9 ID 50 vírus található. A fertőzött állat minden testváladékával üríti a vírust. A betegségnek két formáját, az ún. afrikai ciklust és az ún. Afrikán kívüli ciklust különítjük el. Az Afrikában honos ASF-vírusok rendkívül virulensek a házi sertésre, ezért ezekben többnyire fatális kimenetelű, akut megbetegedést (közel 100% mortalitás) okoznak. 277
298 Részletes virológia Afrikán kívül a háziasított sertésekben passzálódó vírustörzsek virulenciája már nagyfokú heterogenitást mutat. A gyengébb virulenciájú ASF-törzsek krónikus fertőzést alakítanak ki sertésben, amit nagymértékben elősegít a vírusneutralizáló ellenanyagok hiánya. Az ízeltlábúak közül a kullancs (Ornitodorus benus) valódi vektorként szerepel, mivel a vírus a kullancs minden fejlődési alakjának sejtjeiben elszaporodik. Laboratóriumi diagnosztika. Az ASF vírus izolálása és kimutatása a fertőzött fehérvérsejteket tartalmazó szervmintákból (lép, nyirokcsomók) és az alvadásában gátolt vérből kísérelhető meg. A vírusizolálás történhet sejttenyészet fertőzésével és kísérleti állatoltással (ez utóbbi a klasszikus sertéspestistől történő differenciáldiagnózisra is lehetőséget biztosít). A sertésfehérvérsejtekből készített primer sejtkultúrákban a vírus cytoplasmazárványok képződésével járó CPhatást okoz, néhány nappal a fertőzés után. Az ASFV adaptálható sejtvonalakhoz is (PK 2a, Vero). A zárványképzés mellett a legfontosabb CP-hatás a haemadszorpció (137. ábra). A fertőzött sejtek membránjába inkorpolálódott vírusfehérjék adszorbeálják a sertés vörösvérsejtjeit. Mivel nem mindegyik ASF vírustörzs rendelkezik hemadszorpciós készséggel, a vizsgálatokat ajánlott IF próbával is kiegészíteni. Az IF és hemadszorpcióspróbákon túl a vírusantigének még kimutathatók KK, AGP, vagy immunproxidáz-próbával is. A vírus elleni ellenanyagok kimutatására használják az IF, immunoelektroforézist és legkiterjedtebben a monoklonális ELISA próbát ábra - Afrikai sertéspestis: hemadszorpció és cytoplasmazárványok fertőzött sertéslymphocyta-tenyészetekben 2.2. Csirkeanaemia-vírus Az 1979-ben izolált kórokozó az általa okozott kórképről kapta a nevét. A csirke-anaemia-vírust (chicken anaemia virus, CAV, chiken infectious anaemia virus, CIAV) jelenleg az újonnan létesített Circoviridae víruscsalád tagjai között említik. Ebbe a családba tartozik még a sertéscircovirus (porcine circovirus, PCV), a papagáj bőr- és tollbetegségének vírusa (psittacine beak and feather disease virus, PBFDV), valamint a galamb cirkovirusa(pigeon circovirus, PICV). A taxonomiai besorolást nehezíti, hogy a CAV morfológiai jegyekben és antigénrokonságban különbözik az eddig megismert circovírusoktól. A világszerte eddig izolált csirkeanaemia vírustörzsek egy szerocsoportba tartoznak. 278
299 Részletes virológia Morfológia. A virion szerkezete. Az ikozahedrális szimetriával rendelkező, burok nélküli vírus nukleokapszidjának átmérője nm. Elektronmikroszkópos vizsgálatokkal két különböző struktúrával rendelkező víruspartikulákat lehet felismerni (I. és II. típus). Nukleinsav. A negatív irányítottságú, egyszálú genom (DNS/1) cirkuláris formában található a vírusban (innen ered a Circoviridae család elnevezése). A rendkívül rövid vírusgenom 2319 bázispárt (bp) tartalmaz. A legtöbb CAV-genomban 4 5 ismétlődő szakasz található. A fertőzött sejtben dupla szálú CAV-nukleinsavak is megjelennek, megtartva a vírusgenom cirkuláris formáját A genomban három, egymást átfedő génszakasz azonosítható. A néhány szekvenciakülönbségtől eltekintve, az eddig vizsgált CAV törzsek nukleinsava rendkívül hasonló volt. Vírusfehérjék. Antigéntulajdonság. A CAV három struktúrproteint (VP1, VP2, VP3) tartalmaz. A VP 1 és VP2 kapszidfehérjék ellen termelődnek a vírusneutralizáló ellenanyagok, az apoptózist okozó VP3 fehérjét teszik felelőssé, a lymphoid sejtek elpusztításáért. Ellenálló képesség. Fizikokémiai tulajdonságok. A vírus ellenáll a zsíroldó szerekkel (éter, kloroform) történő kezelésnek és a savas vegyhatásnak (ph 3) is. A 90%-os acetonban 24 óráig megtartja fertőzőképességét, ezért a szövettani vizsgálatoknál körültekintően kell eljárni. A fertőtlenítőszerek közül a jodofórok és hypoklorittartalmú oldatok is csak legalább 10%-os koncentrációban tudják inaktiválni a vírust, mintegy 2 órás kezelés után. A vírus rendkívüli ellenálló képességét jelzi, hogy a 24 órás formalinkezelés is csak részleges inaktiválást okozott. A CAV hőrezisztenciája (56 C /60 perc, 100 C/15 perc) egyedülállóan magas. Multiplikáció. A vírus makromolekuláinak szintézisét irányító folyamatok részleteiben még nem ismertek. Az első transzkriptek 8 órával a fertőzés után jelennek meg a fertőzött sejtben, a kapszidfehérjék (VP1) 30 óra múlva mutathatók ki. Kórokozó képesség. A CAV-fertőzéssel szemben kizárólag a házityúk fogékony. Fiatal (1 3 hetes korú) csirkékben a vírus anaemiát és immunszuppressziót okoz. Idősebb baromfiban szubklinikai fertőzés alakul ki. A fertőzés mind horizontálisan, mind vertikálisan terjed. A vírus elsősorban a vérképző sejteket és a nyirokszervek immunsejtjeit támadja meg, melynek hatására anaemia és a nyirokszervekben (thymus, bursa, lép) atrophia alakul ki. Laboratóriumi diagnosztika. A vírus izolálásra csirkeembriót, illetve 1 napos csirkét használnak, amelyekben kialakul a csirkeanaemiára jellemző patológiai kórkép. A (kizárólag) csirke eredetű sejtekből készült sejtvonalak (pl. MSB1) fertőzött sejtjeiben kialakuló cytopathogen hatást a magzárvány, a sejtlekerekedés és a sejtmegnagyobbodás jellemzi. A vírus ellen termelt ellenanyagok kimutathatók VN próbával, IF, ELISA technikákkal. A vírusnukleinsav azonosítására hibridizációs próbát és PCR technikát alkalmaznak. 3. RNS-vírusok 3.1. Reoviridae A víruscsalád neve arra utal, hogy az első reovirusokat légző- és emésztőszervi megbetegedésekből izolálták, de kóroktani szerepük vitatott volt (respiratory enteric orphan-reo). Azóta számos, bizonyítottan pathogen vírust is izoláltak emberből és különféle állatfajokból, az elnevezés azonban megmaradt. A családba tartozó állatpathogen vírusokat jelenleg 5 nemzetségbe, az Orthoreovirus, Orbivirus, Coltivirus, Rotavirus és Aquareovirus genusba sorolják, három további nemzetségbe (Cypovirus, Phytoreovirus, Fijivirus) növénybetegségeket okozó vírusok tartoznak. Morfológia. A reovirusok genomja szegmensből álló, dupla szálú RNS (ds RNS). Ikozahedrális kapszidjuk kb. 70 nm átmérőjű és két rétegből áll. Poliakrilamid-gél elektroforézissel 6 10 strukturális polipeptidjük különíthető el. Burokkal nem rendelkeznek (138. ábra) ábra - Reovirus virionjainak negatívkontraszt-elektronmikroszkópos képe (Ritchie, A. felvétele) 279
300 Részletes virológia Ellenálló képesség. A Reovirus és a Rotavirus genus tagjai viszonylag ellenállóak a környezeti behatásokkal szemben. A 30 percig tartó 56 C-os hőkezelést túlélik, hőtűrő képességüket a kétértékű kationok fokozzák (kationstabilizáció). A savas vegyhatást ph 3 értékig elviselik. Zsíroldó szerekkel szemben rezisztensek. Az Orbivirus és Coltivirus genus tagjai valamivel érzékenyebbek, 56 C-on vagy ph 5 alatti vegyhatásnál néhány perc alatt elpusztulnak, és a kloroformkezelés inaktíválja őket. Elsősorban jodofórokra érzékenyek, de klórtartalmú szerekkel és formalinnal is inaktiválhatók. Biológiai tulajdonságok. Mivel genomjuk a celluláris transzkriptázok számára nem hozzáférhető, a dupla szálú RNS-ről mrns-kópiát készítő vírusspecifikus enzimet (RNS-dependens RNS-polimeráz) coreproteinként, a fertőzött sejtbe magukkal viszik. Szimultán fertőzés során a szegmentált genom következtében gyakori a génátrendeződés. Az Orthoreovirus genusba tartozó vírusok erőteljes cytopathogen tulajdonsággal rendelkeznek (kristályszerűen rendeződő virionokból álló, nagy, eozinofilan festődő cytoplasmazárványokat képeznek, sejtlekerekedést, sejtszétesést okoznak), de a rotavirustörzsek többsége natív készítményekben viszonylag nehezen felismerhető elváltozásokat idéz elő. Gyakorta csak megnyúlt, leválófélben levő sejtek figyelhetők meg a tenyészetben. A Reovirus genus tagjai hemagglutinációs képességgel is rendelkeznek. Antigéntulajdonság. A reovirusok jó antigének. Az egyes genusok között keresztreakciókat nem figyeltek meg. A Reovirus genusba tartozó 3 emlős-szerotípus belső fehérjéi igen szoros antigénrokonságot mutatnak, ami KK és AGP próbákkal kimutatható. A külső kapszidfehérjék részleges rokonsága miatt még a VN-próbában is keresztreakciót adnak, de párhuzamos titrálásokkal a három szerotípus elkülöníthető. Az avian- és az emlős orthoreovirus törzsek antigenitás tekintetében csak igen távoli rokonságot mutatnak. A Rotavirus genusba tartozó vírusok belső kapszidjának antigénszerkezete is hasonló, ezért az ún. atipikus rotavirusok kivételével IF-próbában szintén keresztreagálnak. Laboratóriumi diagnosztika. Az Orthoreovirus genus tagjai szövettenyészetekben viszonylag könnyen izolálhatók. Az orbivirusok csak többszöri passzálással szoktathatók szövettenyészethez, ezért izolálásuk 280
301 Részletes virológia embrionált tyúktojásban (bluetongue vírus) vagy kísérleti állatoltással (afrikai lópestisvírus: szopósegerek intracerebrális oltásával) történik. A rotavirusok ugyancsak nehezen izolálhatók, ezért direkt kimutatásuk többnyire bélnyálkahártya lenyomati készítményből IF próbával vagy metszetből EM vizsgálattal, illetve a bélsárból ellenáramú immunelektroforézissel vagy IEM-eljárással történhet. A fertőzésen átesett állatok vérében az ellenanyagok többnyire HAG (reovirusok) vagy VN próbával, esetleg ellenáramú immunelektroforézissel (rotavirusok) mutathatók ki A háziállatokat megbetegítő fontosabb reovirusok Orthoreovirus genus Az emlősreovirusok (Mammalian reovirus 1 3): nem fajspecifikusak, mindhárom szerotípust izolálták több állatfajból és emberből is. Borjak légzőszervi megbetegedésétmindhárom típus, bárányok légző- és emésztőszervi megbetegedését az 1-es és 2-es szerotípus idézheti elő. A lovakból és házinyulakból izolált reovirusok kórtani szerepe nem bizonyított. Madárreovirusok (Avian reovirus 1 11): kóroktani szerepük a csibék fertőző tenosynovitisénekelőidézésében bizonyított. Csibék, pulykák és kislibák légzőszervi megbetegedése és myocarditise során is izolálták őket. Mivel fertőzött tyúkokban a tojásba is bejutnak (germinatív fertőzés), valószínűleg szerepet játszanak a kelési arány csökkenésében, illetve a naposcsibék fejletlenségét, gyenge életképességét idézik elő Orbivirus genus A genus tagjainak terjesztésében ízeltlábú vektorok (elsősorban különböző szúnyogfajok) játszanak szerepet, vagyis az orbivirusok ökológiailag arbovírusok. Az afrikai lópestis vírusa (African horse sickness virus 1 9) páratlan ujjú patásokban heveny lázas tünetekkel, testszerte oedemák és vérzések megjelenésével, magas mortalitással járó betegséget okoz. A bluetongue vírusa (Bluetongue virus 1 24) főként juhokban, az erek falának megbetegedése révén oedemákkal, a nyálkahártyák kifekélyesedésével, magzatkárosodással járó megbetegedést idéz elő. Az Ibaraki betegség vírusa (Ibaraki virus) szarvasmarhában néhány napos lázzal járó, többnyire jóindulatúan lezajló kórképet okoz. Az Orbivirus genusba tartozik még a szarvas enzootiás haemorrhagiás lázának vírusa, melyet vadon élő kérődzőkből izoláltak Amerikában, és a lóencephalosis vírusa, amely Afrika déli részén lovakban idegrendszeri tüneteket idéz elő. Ugyancsak ebbe a genusba tartozik még számos más, járványtani szempontból Európában szerepet nem játszó állat- és emberpathogen vírus (Changuinola, Corriparta, Eubenange stb.) is Coltivirus genus A genus névadója a coloradói kullancsláz vírusa (Colorado tick fever virus), de több indonéziai és kínai vírustörzs is tartozik a nemzetségbe. Az ember alkalmi gazdafajnak tekinthető, a természetben a vírus vadon élő gerincesekben (őz, rágcsálók) és a vektorként is szereplő ízeltlábúakban marad fenn Rotavirus genus Rotavirusokat több háziállatfajban (borjakban, malacokban, csikókban, nyulakban, pulykákban stb.) kimutattak naposkori enteritises megbetegedésekből. Az izolált vírustörzseket hat szerocsoportba (A F) sorolják. A vírusfertőzés kórtani jelentőségét a szekunder E. coli-fertőzések előkészítésében játszott szerepe fokozza Aquareovirus genus A genusba különböző halfajokat (lazac, törpeharcsa stb.) és kagylókat megbetegítő vírusok tartoznak Birnaviridae Morfológia. Dupla szálú RNS-genomjuk (ds RNS) amelyről a nevüket is kapták (bi-rna) két szegmensből áll. Ikozahedrális kapszidjuk kb. 60 nm átmérőjű, 32 kapszomerből áll. A viriont négy struktúrpolipeptid építi fel. Burokkal nem rendelkeznek. 281
302 Részletes virológia Ellenálló képesség. A birnavirusok ellenálló képessége nagy: a 30 percig tartó, 56 C-os hőkezelést elviselik, ellenállnak a ph 3 9 értékek közötti vegyhatásnak. A reovirusokhoz hasonlóan a birnavirusok is jodofórokkal inaktiválhatók legeredményesebben. Biológiai tulajdonságok. A dupla szálú RNS-genom transzkripciójához szükséges transzkriptáz enzimet kapszidjukba zárva magukkal viszik a fertőzött sejtbe. A vírusösszeépülés a cytoplasmában történik. A specifikus gazdafaj eredetű szövetekben szaporodnak legjobban: a fertőző bursitis vírusa embrionált tyúktojásban, a pancreas necrosis vírusa pedig 23 C-on, lazacfélékből származó szövettenyészetekben. A genomszegmensek genetikai rekombinációjának előfordulását igazolták. Antigéntulajdonság. A családba tartozó vírusok általában jó antigének. A különböző kórformákat előidéző vírusok között antigénrokonságot nem figyeltek meg. Laboratóriumi diagnosztika. A vírusizolálás gazdafaj eredetű szövetekben megkísérelhető. A beteg szervek (a bursa Fabricii, illetve a pancreas) lenyomati készítményeiben a vírusantigén IF próbával kimutatható. Az indirekt víruskimutatás a fertőző bursitis esetében VN és AGP próbával, a pancreas necrosis esetében VNpróbával történik A gazdasági haszonállatokat megbetegítő legfontosabb birnavirusok A fertőző bursitis vírusa (Infectious bursal disease virus 1 2, IBDV 1 2) fiatal csirkékben a bursa Fabricii praekurzor B-lymphocytáinak károsodásával járó kórképet (gumboroi betegség) idéz elő. Az ennek következtében kialakuló immundeficiencia következtében a csirkék ellenálló képessége, immunizálhatósága stb. erősen romlik. A pisztráng pancreas necrosisának vírusa (Infectious pancreatic necrosis virus, IPNV) haltenyészetekben sokszor igen nagy elhullással járó járványokat idéz elő. A családba tartozik még az osztrigák pusztulását előidéző Oyster virus (OV) és a genetikai vizsgálatokban előszeretettel használt muslicafajokat megbetegítő Drosophila X virus (DXV) ábra - Birnaviridae. A fertőző bursitis vagy gumboroi betegség vírusával fertőzött sejt EM képén jól látható a citoplasmazárványokban a virionok parakristályos rendeződése. (Az Országos Állategészségügyi Intézet archívumából.) 282
303 Részletes virológia 3.3. Picornaviridae A picornavirusok neve a pico = kicsi és az angol RNA (RNS) szavak összetételéből származik. A családba az Entero-, Hepato-, Rhino-, Cardio- és Aphtovirus genusok tartoznak. Morfológia. A picornavirusok genomja szimpla szálú RNS, melynek leolvasási iránya a mrns-ével megegyező (+ss RNS). Ikozahedrális kapszidjuk nm átmérőjű, 60 kapszomerből áll és 4 strukturális polipeptidet tartalmaz. Burokkal nem rendelkeznek (140. ábra) ábra - Picornavirus virionjainak negatívkontraszt-elektronmikroszkópos képe (Ritchie, A. felvétele) 283
304 Részletes virológia Ellenálló képesség. A picornavirusok általában ellenállóak a fizikai-kémiai hatásokkal szemben (zsíroldó szerek, detergensek, beszáradás), és ezért az élettelen környezetbe jutva viszonylag hosszú ideig fertőzőképesek maradnak. A genusba sorolásnál fontos kritérium az egyes nemzetségek fizikokémiai hatásokkal szemben tanúsított eltérő ellenálló képessége. Az Enterovirus genus tagjai a környezet vegyhatásával szemben ellenállóbbak, fertőzőképességüket ph 3 9 értékek között megtartják. E vírusok hővel szemben tanúsított ellenálló képessége kétértékű kationok (Ca 2+, Mg 2+ ) jelenlétében fokozódik (kationstabilizáció). A Rhinovirusok és Aphtovirusok savérzékenyek, ph 6-os érték alatt inaktiválódnak. A Rhinovirusok hőérzékenyek is, 33 C-on szaporíthatók. A Cardiovirusok ph-érzékenysége bifázisos: ph 3 5, illetve ph 6 8 értékek között stabilak, ph 3 alatt, ph 5 6 értékek között és ph 8 felett elpusztulnak. A picornavirusok inaktiválására a klórtartalmú szerek, a jodofórok és a formalin használhatók. Biológiai tulajdonságok. Szaporodásuk rendkívül gyors, replikációs ciklusuk rendszerint 24 óránál rövidebb, többnyire 8 10 óra. Fajspecificitásuk genusonként eltérő: az entero-, hepato- és a rhinovirusok fajspecifikusak, a cardio- és aphtovirusok gazdaspektruma valamivel tágabb (az utóbbi csoportba tartozó száj- és körömfájásvírussal pl. a párosujjú patás állatok, tengerimalac és egér is fertőzhető, valamint az ember is fogékony iránta). Ez az eltérő igényesség in vitro körülmények között is megfigyelhető, a sertés hólyagos betegségének vírusa (Enterovirus genus) csak sertés eredetű szöveten, a száj- és körömfájás vírusa több fajból származó szöveten szaporítható. Sejtkárosító hatásukra lekerekedett, zsugorodott (pycnoticus) sejtalakok megjelenése, esetleg cytorrhexis (sejtek rögös szétesése) jellemző. Zárványok kialakulása nem figyelhető meg. Antigéntulajdonság. A picornavirusok jó antigének. A fenotípusos keveredés (transzkapszidáció) előfordulását az enterovirusok esetében bizonyították. A genusok között antigénrokonságra utaló keresztreakciókat nem figyeltek meg. Az egyes nemzetségeken belül a különböző szerotípusok is jól elkülöníthetők. 284
305 Részletes virológia Víruskimutatás. A picornavirusok megfelelő szövettenyészetben viszonylag könnyen izolálhatók. Egyes esetekben azonban (pl. száj- és körömfájás gyanújakor) a legalább 3 4 napig tartó vírusizolálásnál gyorsabb diagnózisra van szükség. Ezért a vírusantigén ELISA, IF vagy KK próbában történő kimutatásával történik a vírusazonosítás. A bélben szaporodó enterovirusokat a bélsárból ellenáramú immunelektroforézissel is gyorsan ki lehet mutatni. A vérben levő ellenanyagok kimutatására a VN, KK, AGP, ELISA próba és az ellenáramú immunelektroforézis használható A háziállatokat megbetegítő fontosabb picornavirusok Enterovirus genus Állatorvosi jelentősége csak a sertésenterovirusok néhány szerotípusának és egyes madárenterovirusoknak van. A fertőző sertésbénulás vírusa(porcine enterovirus l, Teschen/Talfan virus), sertésekben nem gennyes agy- és gerincvelő-gyulladást és ennek következtében a hátsó testfél petyhüdt bénulását okozza. A tescheni betegség bármely korú sertésben jelentkezhet, a talfan kórkép csak 4 hónaposnál fiatalabb malacokban fordul elő. A két kórforma előidézéséért felelős vírusok között hagyományos szerológiai módszerekkel nem lehet különbséget tenni. A sertés 2 és 8 típusú enterovirusa szintén okozhat agy- és gerincvelőgyulladást. A sertés hólyagos betegségének vírusa (Swine vesicular disease /SVD/ virus), a 9-es típusú sertés-enterovirus a túrókarimán, a száj nyálkahártyáján és a lábvégeken a száj- és körömfájáshoz hasonló hólyagokat idéz elő. A két betegség különbözik abban, hogy az SVD esetén a tünetek enyhébbek, és a betegség csak sertésekben jelentkezik. A sertésből izolált többi szerotípus (3 7 szerotípus) betegséget nem okoz, orphan vírusok. Az emésztőszervi tüneteket mutató szarvasmarhákból izolált enterovirusok (Bovine enterovirus 1, 2) kórtani jelentősége vitatott. A csirkék fertőző agy- és gerincvelőgyulladásának vírusa (Avian encephalomyelitis virus) fiatal csibékben idegrendszeri tüneteket, tojótyúkokban tojáshozam-csökkenést okoz. A kacsahepatitis vírusa (Duck hepatitis virus) néhány hetes kacsák tömegesen jelentkező és heveny májgyulladásban megnyilvánuló megbetegedését idézi elő. Az ember enterovirusos megbetegedései közül kiemelkedő jelentőségű a fertőző gyermekbénulás(polio) vírusa. Az ugyancsak humán pathogen echo (enteric cytopathogenic human orphan) és coxsackievírusokaseptikus agyhártyagyulladást, neuritist, szívizomgyulladást, agyvelőgyulladást és cukorbetegséget, ritkán bénulást okoznak Hepatovirus genus A genusba az emberi hepatitis A- és a majom hepatitis A-vírus tartozik Cardiovirus genus Az encephalomyocarditis (EMC) vírusa sertésekben, szarvasmarhában, lóban és emberben agyvelő- és szívizomgyulladást okozhat (zoonosis). A vírust vadon élő rágcsálók hordozzák, melyekben szintén kialakíthatja a fenti kórképet, de gyakori a tünetmentes fertőzés is. A genusba több más, hasonló klinikai tünetekkel járó vírusfaj is tartozik (mengovirus, Columbia SK virus, murine encephalomyelitis virus stb.) Rhinovirus genus Szarvasmarhából két (Bovine rhinovirus 1 2) lovakból három szerotípust (Equine rhinovirus 1 3) izoláltak, de ezek pathogenitása legalábbis kétséges. Emberi légzőszervi kórképekből eddig több mint 70 rhinovirus ( náthavírus ) szerotípust izoláltak Aphtovirus genus 285
306 Részletes virológia A ragadós száj- és körömfájás vírusa(foot and mouth disease virus, FMDV) a kérődzőket és a sertést betegíti meg. A heveny lefolyású betegségre lázas általános tünetek, valamint a szájnyálkahártyán, a lábvégeken és a csecsbimbók bőrén jelentkező hólyagok a jellemzőek. A vírusnak 7 szerotípusa van, melyeket a hagyományok szerint nem számokkal, hanem kódokkal jelölünk. Európában és az amerikai földrészen az O, A és C típusok fordulnak elő, Afrikában ezeken kívül a SAT l, 2, 3 típusok, Ázsiában pedig az Asia 1 típus. A folytonos antigénsodródás (antigenic drift) következtében az antigenitásért felelős külső fehérjéken epitopeltérések jöttek létre, ezért a szerotípusok többségén belül hagyományos szerológiai módszerekkel is több szubtípust lehet elkülöníteni. Ennek elsősorban járványveszély esetén van jelentősége, ugyanis megbízható védelem csak szubtípus-specifikus vakcinától várható Caliciviridae A víruscsalád neve a latin calix (kehely, csésze) szóból származik, és a vírusok dimerekből felépülő csésze alakú kapszomerjeire utal. Morfológia. A calicivirusok genomja szimpla szálú, pozitív irányítottságú RNS (+ss RNS), amit 32 csésze alakú kapszomerből álló, nm átmérőjű, ikozahedrális kapszid vesz körül. A kapszid egyetlen polipeptidből épül fel. Burokkal nem rendelkeznek (141. ábra) ábra - Calicivirus virionjainak negatívkontraszt-elektronmikroszkópos képe (Ritchie, A. felvétele) Ellenálló képesség. E vírusok közepesen savérzékenyek: ph 5 értékig stabilak, ph 3 alatt gyorsan inaktiválódnak. Hővel szemben is ellenállók, a 30 perces 56 C-os hőkezelést túlélik. Vírustartalmú állati termékekben, ragályfogó tárgyakon hosszú ideig fertőzőképesek maradnak. Fertőtlenítésre a klórtartalmú szerek, a formalin és a jodofórok alkalmazhatók. 286
307 Részletes virológia Biológiai tulajdonságok. A családba tartozó vírusok fajspecifikusak vagy szűk gazdaspektrumúak. Elsősorban gazdafaj eredetű szövettenyészetekben szaporíthatók jól, és a sejtek pycnoticus elváltozását és cytolysist okoznak. A vírus-összeépülés a sejt cytoplasmájában történik. Antigéntulajdonság. A calicivirusok jó antigének. Az egyes szerotípusok jól elkülöníthetők, keresztreakciókat eddig nem figyeltek meg. Víruskimutatás. A direkt víruskimutatás többnyire vírusizolálással történik. Szerológiai vizsgálatokban többnyire a VN- és a KK-próbát alkalmazzák A háziállatokat megbetegítő fontosabb calicivirusok A sertés hólyagos kiütésének (VES) vírusa (Vesicular exanthema virus) sertésekben a ragadós száj- és körömfájáshoz nagyon hasonló elváltozásokat okoz: hólyagok jelennek meg a szájban és a lábvégeken. A betegség rendkívül ragályos. A VES-vírussal szoros rokonságban van a bizonyos fóka- és halfajokat, valamint a sertést is megbetegítő San Miguel sea lion virus, amely fókákban és sertésekben szintén hasonló tüneteket okoz. A kórokozónak eddig legalább 8 szerotípusát különítették el. A macska calicivirusos náthájának vírusa (Feline calicivirus) a macskák felső légutaira korlátozódó, többnyire jóindulatúan lezajló, hurutos gyulladást idéz elő. A nyulak haemorrhagiás betegségének vírusa (Rabbit haemorrhagic disease virus) nyúlállományokban magas mortalitással járó betegséget okoz, mely testszerte jelentkező vérzésekben, tüdőoedemában és májdystrophiában nyilvánul meg. Szoros antigénrokonság figyelhető meg a vírus és a mezei nyulak caliivirusa (European brown hare virus, EBH virus) között. Calicivirusokat izoláltak még gyöngyöscsibékből vakbélgyulladás, kutyákból enteritis és borjakból légzőszervi tünetek előfordulása esetén. Ezek kóroktani szerepe vitatott Togaviridae A togavirusok nevüket morfológiai jellegzetességükről, az őket köpenyként körülvevő burokról kapták (toga = a rómaiak köpenye). A víruscsaládot jelenleg Alphavirus, Rubivirus és Arterivirus genusokra osztják. Morfológia. A togavirusok genomja szimpla szálú lineáris RNS, melynek irányítottsága a mrns-ével megegyező (+ss RNS). A 32 kapszomerből álló ikozahedrális kapszid átmérője nm. Poliakrilamid-gél elektroforézissel 3 4 struktúrpolipeptidet különítettek el. Burkuk van, burokkal együtt nm átmérőjűek. Ellenálló képesség. A togavirusok ellenálló képessége csekély. Fertőzőképességük még 37 o C-on is gyorsan csökken, 56 o C-on pedig azonnal inaktiválódnak. Csak enyhe ph-változásokat viselnek el: ph 6 9 értékek között stabilak. Éter- és kloroformkezelésre érzékenyek. A szokványos fertőtlenítőszerekkel a togavirusok könnyen elpusztíthatók. Biológiai tulajdonságok. A sejtbe bejutó vírusnukleinsavról megindul a korai vírusfehérjék, többek között az RNS-dependens RNS-polimeráz transzlációja; a vírusnukleinsav megsokszorozását ez az enzim végzi. A togavirusok összeépülése a fertőzött sejtek cytoplasmájában történik, a virionok a sejtből bimbózással (budding) szabadulnak ki, és ekkor, a cytoplasmamembránon áthaladva veszik fel burkukat. A togavirusok in vitro számtalan szövettenyészetben (elsősorban hámsejtekben) és embrionált tyúktojásban is jól szaporíthatók, replikációs ciklusuk viszonylag gyors (24 48 óra). Az Alphavirusok terjesztésében ízeltlábú vektorok játszanak szerepet (arbovirusok), ennek a genusnak a tagjai ízeltlábúakban és ízeltlábúakból származó sejttenyészeteken is jól szaporíthatók. Antigéntulajdonság. A genusokon belül az egyes vírusok között igen szoros, esetenként a VN próbában is keresztreakciókat okozó antigénrokonság figyelhető meg, ezért a szerotípusok meghatározása sokszor csak párhuzamos titrálásokkal lehetséges. A nemzetségek között antigénrokonságot nem mutattak ki. Laboratóriumi diagnosztika. A direkt víruskimutatás során az IF eljárással kiegészített vírusizolálást, illetve a fertőzött állatokból származó minták IF és szövettani vizsgálatát alkalmazzák. Az ellenanyagkimutatásra a VN és KK próbák használhatók. 287
308 Részletes virológia A háziállatokat megbetegítő fontosabb togavirusok Alphavirus genus A lovak járványos agy- és gerincvelő-gyulladásainak vírusai(equine encephalomyelitis virus 1 3) a lovak heveny, vérömléses agy- és gerincvelő-gyulladását okozzák. A vírusok igen széles fertőzési spektrumúak, vírusrezervoárként különböző vadmadárfajok és vadon élő rágcsálók szerepelnek. A vírusok iránt az ember is fogékony. A vírusokat ízeltlábú vektorok (elsősorban szúnyogfajok) terjesztik. A három szerotípust az amerikai kontinensen megfigyelt földrajzi elterjedésük szerint keleti, nyugati és venezuelai lóencephalomyelitis (EEE, WEE, VEE) néven tartják számon. Sporadikus megbetegedéseket más földrészeken (pl. Európában, Távol- Keleten) is leírtak. A genusba tartozik még számos, általában az izolálás helyéről elnevezett vírus, melyek általában magas lázzal, encephalitissel járó kórképeket idéznek elő különböző fajokban. Ilyenek például a lovakban lázas megbetegedést előidéző Getah-vírus, a genus prototípus vírustörzse a Sindbis virus, az O nyong-nyong és Semliki Forest vírusok. Ezek előfordulása elsősorban a trópusi övezet egyes vidékeire korlátozódik Rubivirus genus A nemzetségbe egyedül az ember rubeolavírusa tartozik, amely terhes nőkben magzatkárosító hatást fejt ki, egyébként pedig csak enyhe bőrtüneteket (rózsahimlőt) okoz Arterivirus genus A lóarteritis vírusa (Equine arteritis virus) a lovak vérereinek megbetegedése (a kis arteriák simaizomsejtjeinek elhalása és az érfal gyulladásos beszűrődése) következtében heveny, lázas és oedemás tüneteket okoz, esetenként vemhes kancák tömeges vetélését idézi elő. A sertés PRRS kórképét előidéző vírus(porcine Reproductive and Respiratory Syndrome, Lelystadt virus), amely 1990 óta sertésekben számos európai országban idéz elő lázzal, bénulásokkal, légzőszervi tünetekkel és vemhes kocákban magzatkárosodással járó kórképet. A genusba tartozik még az egerekben előforduló, a laktát dehidrogenáz enzim szintjét fokozó vírus (Lactate dehdrogenase virus, LDV) és a majmok haemorrhagiás lázának vírusa (Simian haemorrhagic fever virus, SHFV) is, de ezeknek állatorvosi szempontból nincs jelentőségük Flaviviridae Elnevezésüket az emberi sárgalázról (flavus=sárga, lat.) kapták, amely a család prototípus vírusa. A családot a Flavivirus és a Pestivirus genus és a Hepatitis C vírus csoport alkotja. Morfológia. A flavivirusok egyszálú, pozitív irányítottságú RNS-genomját (+ss RNS) nm átmérőjű, ikozahedrális szimmetriájú kapszid veszi körül. Fehérjeállományuk 3 struktúrpolipeptidből épül fel. Burkuk van, burokkal együtt nm átmérőjűek. Ellenálló képesség. A környezeti hatásokra meglehetősen érzékenyek. Infektivitásukat ph 6,5 8 közötti értékektől eltérő vegyhatás és 50 o C-os hőmérséklet hatására perceken belül elveszítik. A flavivirusok az enyhébb fertőtlenítőszerekkel (detergensek, zsíroldó szerek, kvaterner ammóniumsók) is inaktiválhatók. Biológiai tulajdonságok. A fertőzött sejt cytoplasmájában szaporodnak. A virionok összeépülése és a burok felvétele az endoplasmaticus reticulumról leváló vesiculumokban történik, az érett burkos vírusok a fertőzött sejt lysise révén szabadulnak ki. A Flavi- és főleg a Pestivirus genus tagjai sokszor nem rendelkeznek cytopathologiás hatással (a törzsek között e tekintetben eltérések lehetnek), ezért jelenlétüket a fertőzött sejtekben IF vagy immunperoxidáz-próbával kell kimutatni; a cytopathogen törzsek általában csak jellegtelen cytopathologiás elváltozásokat (cytolysist, karyorrhexist), ritkán syncytiumképződést okoznak. A Flavivirus genus tagjai többnyire széles gazdaspektrumú vírusok; az állatorvosi szempontból jelentős flavivirusok közül valamennyi több állatfajt is megbetegít, illetve valamennyien zoonosisokat is okoznak. Közegészségügyi jelentőségük nemegyszer felülmúlja állatorvosi jelentőségüket is. 288
309 Részletes virológia In vitro szaporításukra többféle egyrétegű szövettenyészetet és embrionált tyúktojásokat használnak. A flavivirusok ökológiailag arbovírusok: az átvivő ízeltlábú vektorok szerint szúnyogok vagy kullancsok által közvetített vírusokat különböztetünk meg. A vírusok az ízelt lábú vektorok sejtjeiben (illetve az ezekből származó szövettenyészetekben) is szaporodnak. Vírusrezervoárként többnyire vadon élő madár- és rágcsálófajok szerepelnek. A Flavivirus genus tagjai általában rendelkeznek hemagglutinációs tulajdonsággal, ez a tulajdonságuk a burokban levő glükoproteinhez kötött. A lúd-vörösvérsejteket agglutinálják, a reakció erősen ph-függő, enyhén savanyú (~ ph 6) közeget igényel. Antigéntulajdonság. Az azonos genusba tartozó vírusok között antigénrokonság figyelhető meg. Ez a rokonság, melynek alapján a Flavivirus genus tagjai szerocsoportokba (pl. Rio Bravo csoport, Kullancsencephalitis csoport, Japán encephalitis csoport, Tyuleniy csoport stb.) sorolhatók, a KK és IF próbában, sőt többé-kevésbé a HAG próbában is kimutatható, a Pestivirus genus tagjai között pedig a VN próbában is. Laboratóriumi diagnosztika. A vírusok egyrétegű sejttenyészetekben (gerinces- és ízeltlábú-szöveteken) és embrionált tyúktojásban izolálhatók. A víruskimutatás egyes esetekben (főleg a nem cytopathogen törzsek esetében) IF vizsgálattal történik. Az ellenanyagok kimutatására a VN próba, egyes vírusok esetében (VD, sertéspestis) az ELISA próba alkalmazható A háziállatokat megbetegítő fontosabb flavivirusok Flavivirus genus A louping ill(ugróbetegség) vírusa (Kullancsencephalitis csoport) juhokban általános lázas tüneteket, később meningoencephalitist és ezért mozgászavarokat okoz. A vírust az Ixodes ricinus kullancsfaj terjeszti. A japán (B) encephalitis vírusa(japán encephalitis csoport) a Távol-Keleten lóban, sertésben és emberben okoz encephalitist. Szúnyogfajok terjesztik. A nyugat-nílusi lóencephalitis vírusa(japán encephalitis csoport) lovakat, szarvasmarhákat, juhokat betegít meg, de az ember is fogékony iránta. Szúnyogok terjesztik. Vírusrezervoárként különböző vadmadárfajok (pl. vadliba) szerepelnek, ezekből Magyarországon is kimutatták a vírust. A St. Louis encephalitis vírusa(japán encephalitis csoport) lovakban agyvelőgyulladást idéz elő, köztigazdái különböző szúnyogfajok. A Wesselsbron-betegség vírusa(csoportba még nem sorolt flavivirus) Kelet-Afrikában fordul elő, és juhokban agyvelőgyulladást, vemhes anyajuhokban vetélést okoz vagy a fertőzés következtében gyenge életképességű bárányok születnek. A pulykák meningoencephalitisének vírusa(ntaya csoport) szúnyogok közvetítésével terjed, és bénulásos tünetekben megnyilvánuló megbetegedéseket okoz a Közel-Keleten. A flavivirusok okozta human megbetegedések közül legjelentősebb a szúnyogok által terjesztett sárgaláz (csoportba nem sorolt flavivirus) és a különböző kullancsencephalitisek(pl. a közép-európai és távol keleti kullancsencephalitis, az omszki haemorrhagiás láz stb.) Pestivirus genus A szarvasmarha vírusos hasmenésének vírusa (Bovine viral diarrhoea/mucosal disease virus, BVD/MD virus) szarvasmarhában és rokonfajaiban esetenként tünetmentes fertőzést, de gyakran az emésztőszervek nyálkahártyáinak megbetegedésével járó, súlyos hasmenést idéz elő. Ugyanez a vírus vemhes juhokat fertőzve magzatkárosító hatást fejt ki, és a bárányok ún. border betegségét okozza. A gyenge, ataxiás, rendellenes szőrzettel születő bárányok nagy része néhány napon belül elpusztul. A sertéspestis vírusa(classical swine fever, hog cholera virus) sertésállományokban ragályos, nagy veszteségeket okozó, lázas tünetekkel és vérzésekkel járó kórképet idéz elő (klasszikus vagy európai sertéspestis). 289
310 Részletes virológia A fenti kórképekből izolált vírusok szerológiailag hasonlóak (VN próbában is keresztreakciókat adnak), és mesterséges körülmények között a keresztfertőzések lehetőségét is igazolták Hepatitis C víruscsoport A csoportba a közegészségügyileg jelentős, májgyulladást okozó, human hepatitis C-vírus és a majmok haemorrhagiás lázának vírusa tartozik Coronaviridae A víruscsalád nevét az elektronmikroszkópos felvételeken megfigyelhető alakjáról kapta: a burokból kinyúló peplomerek a nap koronájára emlékeztető képet kölcsönöznek a virionnak (142. ábra). A családot egyedül a Coronavirus genus alkotja ábra - Coronavirus virionjának negatívkontraszt-elektronmikroszkópos képe (Ritchie, A. felvétele) Morfológia. Genomjuk szimpla szálú, pozitív irányítottságú RNS (+ss RNS). Helikális nukleokapszidjuk átmérője 9 13 nm. Burkuk van, a burokban a nukleokapszid feltekeredve helyezkedik el. Az így nm átmérőjű, pleomorf virionokat 3 4 struktúrpolipeptid alkotja (135. ábra). Ellenállóképesség. A coronavirusok viszonylag kevéssé érzékenyek a savas vegyhatásra ph 3 11 értékek között infektivitásukat megtartják. A testhőmérsékletnél magasabb hőmérsékletre viszont érzékenyek, 50 C-on percek alatt elpusztulnak, sőt szobahőmérsékleten is csak két-három napig maradnak fertőzőképesek. A szokásos fertőtlenítőszerek, detergensek, zsíroldó szerek hatására inaktiválódnak. Biológiai tulajdonságok. A coronavirusok többsége fajspecifikus, és in vitro is gazdafaj eredetű sejttenyészetekben, illetve a madárpathogen vírusok embrionált tojásban, allantoisüregbe oltva szaporíthatók. A szövettenyészetekben többnyire jellegtelen cytopathogen elváltozásokat (vacuolisatiót, pycnosist) okoznak, de némelyik vírus (pl. a sertés transmissibilis gastroenteritisének vírusa, a macska fertőző peritonitisenek vírusa, a fertőző bronchitis vírusa), megfelelő szövettenyészetekben syncytiumokat képez. A tojásban szaporított, madárpathogen fertőző bronchitis vírus az embrió törpenövését és torzfejlődését idézi elő. 290
311 Részletes virológia Hemagglutináló tulajdonsággal csak a sertéspathogen hemagglutináló encephalomyelitis vírus és néhány szarvasmarha coronavirus rendelkezik, ezek a csirke-, pulyka-, hörcsög-, macska- vörösvérsejteket agglutinálják. Antigéntulajdonság. A coronavirusokat az IF próbában tapasztalható antigénrokonságuk alapján négy szerocsoportba sorolják: l. Emlős l. csoport:a sertés transmissibilis gastroenteritisének vírusa, a sertés pulmonalis coronavirusa, sertés fertőző hasmenésének (epidemic diarrhoea, ED) vírusa, a macska fertőző peritonitisenek (Feline infectious peritonitis, FIP) vírusa, a macska enterális coronavirusa, kutya coronavirus és egy human pathogen légzőszervi megbetegedést okozó vírus. 2. Emlős 2. csoport: a malacok agy- és gerincvelő-gyulladását okozó hemagglutináló coronavirus(porcine hemagglutinating encephalomyelitis virus, PHEV), a borjak coronavirusa, az egérhepatitisvírus, a patkány coronavirusa és egy másik humán légzőszervi kórképből izolált vírus. 3. Madár l. csoport: a fertőző bronchitis vírusának (Infectious bronchitis virus, IBV) tíz szerotípusa, és a humán enterális coronavirus. 4. Madár 2. csoport: a pulykaenteritis vírusa. A szerocsoportokon belül a szerotípusok VN próbával különíthetők el. Laboratóriumi diagnosztika. A coronavirusok többsége viszonylag nehezen izolálható (faj- és azon belül nem egyszer csak szervspecifikus primer tenyészetben), és az izolálást a jellegtelen CP-hatás miatt többnyire IF próbával kell kiegészíteni. A beteg állatok szerveinek lenyomati készítményeiben vagy azok metszeteiben szintén IF próbával mutatható ki a vírusantigén felhalmozódása, a bélsárral ürülő vírus pedig IEM módszerrel azonosítható. Az indirekt víruskimutatásra többnyire a VN próbát alkalmazzák A háziállatokat megbetegítő fontosabb coronavirusok A borjak coronavirusos hasmenésének vírusa (Bovine coronavirus) fiatal borjakban a rotavirusos kórképhez hasonló megbetegedést okoz, és ugyancsak szerepet játszhat az E. coli-fertőzés aktiválásában is. Ritkábban felnőtt állományokban is előidéz ún. téli hasmenés járványokat. A sertés transmissibilis gastroenteritisének vírusa (Transmissible gastroenteritis, TGE virus) bármely életkorú sertésben súlyos hasmenést idéz elő, a betegség fiatal malacokban igen súlyos mortalitással jár. A sertés pulmonalis coronavirusa (PCV) a TGE vírussal antigénszerkezetileg azonos, de csak enyhe légzőszervi tüneteket okoz. A sertés TGE-hez hasonló megbetegedésének vírusa (Porcine epidemic diarrhoea virus, PED virus) szintén hasmenéses kórképet idéz elő, de a vírus nem hemagglutinál és VN próbával az előbbi két sertés-coronavirustól elkülöníthető. A malacok agy- és gerincvelő-gyulladását okozó hemagglutináló coronavirus (Porcine hemagglutinating encephalomyelitis virus, PHEV) kétféle kórképet idézhet elő: az egyikben a szopós malacok a központi idegrendszer gyulladásos tünetei között betegednek meg, a másikban hányással és csököttséggel járó, elhúzódó betegség alakul ki. A kutya coronavirusa (Canine coronavirus) kutyában és vadon élő kutyafélékben gastroenteritist idéz elő. A macska fertőző peritonitisének vírusa (Feline infectious peritonitis, FIP virus) macskákban progresszív immunpathológiás kórkép keretében hashártyagyulladást okoz. A macska enterális coronavirusa enyhe enteritist idéz elő macskafélékben. A csirkék fertőző bronchitisének vírusa (Infectious bronchitis virus, IBV 1 10) fiatal csibékben légzőszervi megbetegedést és petevezetőkárosodást okoz, amely az átvészelt jércékben tojásrakási zavarokhoz vezet (tojáshozam csökkenés, rücskös héjú és terméketlen tojások). 291
312 Részletes virológia A pulykaenteritis vírusa (Bluecomb virus) főleg fiatal pulykaállományokban okoz súlyos járványokat, a betegség hasmenéssel, lesoványodással, a fejfüggelékek cyanosisával jár. A családba tartozik még három, a laborállat-tenyészetekben időnként súlyos veszteségeket okozó vírus (egérhepatitis, patkány légzőszervi és patkány syaloadenitist okozó coronavirus), valamint az emberből légzőszervi megbetegedések során izolált, két szerológiailag különböző coronavirus és a humán enteralis coronavirus is Orthomyxoviridae Régebben a nyálkahártyát fertőző vírusokat a (görög myxo = nyálka) szóból eredően myxovirusoknak nevezték. Később a morfológiai és szaporodásbeli eltérések alapján ezeket két családba az Orthomyxoviridae és a Paramyxoviridae családokba sorolták. Az Orthomyxoviridae családot jelenleg két nemzetség, az Influenzavirus A és B, valamint az Influenzavirus C genus alkotja. Morfológia. Az orthomyxovirusok genomja 8 szegmensből álló, szimpla szálú RNS, melynek irányítottsága ellentétes a mrns-ével (-ssrns). A nukleinsav a ráépülő core-fehérjékkel helikális szimmetriájú nukleokapszidot alkot, melynek átmérője 9 15 nm. A nukleoprotein orsószerűen felcsavarodva helyezkedik el a lipoprotein burokban. A komplett, burkos virion átmérője nm, és felépítésében 7 struktúrprotein vesz részt (143. ábra) ábra - Orthomyxovirus (sertésinfluenza) virionjának negatív kontraszt elektronmikroszkópos képe (Ritchie, A. felvétele) Ellenálló képesség. Az influenzavirusok a viszonylag érzékeny vírusok közé tartoznak, hőérzékenyek (56 o C hőmérsékleten 30 perc alatt elpusztulnak) és savérzékenyek (ph 5 vegyhatáson inaktiválódnak). Az általánosan használt fertőtlenítőszerek, detergensek, zsíroldó szerek iránt érzékenyek. Biológiai tulajdonságok. Mivel -ssrns-genomjuk a sejtpolimerázok számára nem értelmezhető, az influenzavirusok a negatív RNS-szálról mrns-t készítő vírusspecifikus enzimet magukkal viszik a fertőzött 292
313 Részletes virológia sejtbe. Az influenzavirusok esetében viszonylag gyakori a pontmutáció, részben mert az influenzavirus-genom bizonyos szakaszai mutációra hajlamosak, és részben azért, mert a celluláris polimeráz működését ellenőrzőjavító mechanizmusok az RNS-vírusok esetében nem tudják feladatukat betölteni. Ezek a vírus membránproteinjeinek kódolásáért felelős génszakaszon bekövetkező pontmutációk fokozatos antigénszerkezeti változást idéznek elő (antigénsodródás). Amennyiben két, antigénszerkezetileg eltérő influenzavirus szimultán fertőz egy sejtet, akkor az egyidejűleg replikálódó genomszegmensek átrendeződése révén új antigénvariánsok jelenhetnek meg (antigéncsuszamlás). Az influenzavirusokat legtöbbször embrionált tyúktojásban, allantoisüregbe oltva szaporítják. Egyes izolátumok ugyan sejttenyészetekben is szaporíthatók, de az így kapott vírustiter nagyságrendekkel elmarad a tojásban elérhető titerektől. Sejtkárosító hatásuk nem jellegzetes: sejtlekerekedés és a sejtek leválása figyelhető meg. Az általánosan használt tojásoltás hatékonyságának ellenőrzésére, a vírusszaporodás kimutatására a tojás allantois-, illetve amnionfolyadékának HA-aktivitását kell ellenőrizni, az influenzavirusok ugyanis erőteljes hemagglutináló tulajdonsággal rendelkeznek. Antigéntulajdonság. A 7 struktúrprotein közül a nukleoprotein (NP) fontos szerepet játszik az influenzavirusok csoportosításában. Ez a viszonylag stabil, mutációra nem hajlamos génszakasz által kódolt belső fehérje csoportspecifikus, kimutatására a KK és AGP próbák alkalmasak. A nukleoprotein szerológiai reakciója alapján az influenzavirus-izolátumok A, B és C típusba sorolhatók. Génátrendeződés csak azonos NP-típusba tartozó influenzavirusok között lehetséges. Az influenzavirusok külső proteinjei, a burokban helyeződő hemagglutinin (H) és neuraminidáz (N) a szubtípusok elkülönítésében játszik fontos szerepet. Az A típusú influenzavirusok esetében a hemagglutininnek 15 (Hl 15), a neuraminidáznak 9 (Nl 9) változatát különítették el. Ezt a két fehérjét a genom variábilis szakasza kódolja, ennek köszönhető a struktúrájukban viszonylag gyakran bekövetkező változás, ami az antigénsodródást okozza. Ez a változás a szubtípuson belül következik be, és kimutatása csak monoklonális ellenanyagokkal vagy párhuzamos titrálásokkal lehetséges. Az N- és a H-fehérjék kódját külön-külön szegmensek tartalmazzák, ezért a jelenleg ismert 15 H és 9 N típusú fehérjéből elméletileg 135 különböző szubtípus jöhetne létre génátrendeződés (és az ennek következtében jelentkező antigéncsuszamlás) révén. A H- és N-antigének ismerete azért is fontos, mert ezek a fehérjék felelősek a protektív ellenanyagok képződéséért, vagyis vakcinakészítéshez a megfelelő vírustípust ezek ismeretében kell kiválasztani. A H-protein teszi lehetővé ugyanis a vírus sejthez való kötődését, ennek blokkolása után a vírus nem tud bejutni a fogékony sejtbe. A H- fehérjéhez kötődő, hemagglutinációt gátló ellenanyagok tehát influenzavirusok esetében vírusneutralizáló hatással is rendelkeznek. Az orthomyxovirusok nagy variabilitása miatt az egyes izolátumokat azonosító kóddal látják el, amely tartalmazza az NP típusát (A, B vagy C), azt, hogy milyen állatfajból és hol izolálták a vírust, és az adott földrajzi helyen hányadik izolátum volt abban az évben, az izolálás évének két utolsó számjegyét, továbbá a H és N protein típusát. Így pl. a lovakból Prágában 1956-ban elsőként izolált törzs jele A/equi/Prague/1/56(H7N7); a kacsából 1967-ben Németországban 210.-ként izolált influenzavirus-törzs kódja pedig A/duck/Germany/210/67(H4N1) Laboratóriumi diagnosztika. A vírus embrionált tyúktojásban viszonylag könnyen izolálható. Az indirekt víruskimutatásra a HAG-próbát alkalmazzák A háziállatokat megbetegítő influenzavirus A és B genusba tartozó vírusok Állatorvosi jelentősége csak az A típusú influenzavirusoknak van. Ezen belül elvileg bármely szubtípus előfordulhatna bármely állatfajban, illetve emberben is. Úgy tűnik ugyanis, hogy a különböző fajok A típusú influenzavirus fertőzései járványtani kapcsolatban állnak egymással, mivel a különböző fajokból izolált vírustörzseken azonos H- és N-antigéneket mutattak ki. Ennek az sem mond ellent, hogy egyes vírustörzsek fajhoz adaptálódnak, és abból a fajból következetesen izolálhatók, más fajra nézve pedig pathogenitásuk csökken. A sertésinfluenza esetekből pl. következetesen HlN1 szubtípusú vírustörzseket izolálnak, de ez a szubtípus sem tekinthető sertésspecifikusnak, mert időnként hasonló antigénszerkezetű vírustörzsek a humán populációban és pulykák között is okoztak járványokat. (A hírhedt 1918, évi ún. spanyolnátha járványt is a H1N1 szubtípus okozta). Újabban több országban H3N2 vírus okozta sertésinfluenzát (és humán járványokat) észleltek. 293
314 Részletes virológia Lovakban két típus okoz légzőszervi megbetegedéseket, lóinfluenzát. A H7N7 szubtípus többnyire endémiás jelleggel, tartósan kering egy populációban, a H3N8 szubtípus pedig néhány éves időközökkel nagyobb járványokat (epidemiákat) okoz. A madarakat megbetegítő influenzavirusok mutatják a legnagyobb változatosságot: a madarakból eddig izolált madárinfluenza vírustörzseken valamennyi H- és N-variánst ki lehetett mutatni rendkívül sokféle kombinációban. A madarak szervezetében a vírus a bélcsatorna hámsejtjeiben szaporodik, szemben az emlősökkel, ahol az elsődleges vírusszaporodás a légutakban zajlik.valószínű, hogy az influenzavirusok génátrendeződése éppen a madarak szervezetén belül következik be leggyakrabban, és ezt követően terjed át adaptáció révén más fajokra (így emberre is). A fertőzöttség az egész világon előfordul, és eddig mintegy 50 madárfajból izoláltak orthomyxovirusokat. Bármely fajban jelentkezik is az influenzavirus okozta bántalom, az emberi megbetegedéshez hasonló általános lázas tünetekben és légzőszervi elváltozásokban nyilvánul meg. Emberi megbetegedésekből a túlnyomó többségben izolált A típusú törzsek mellett B és C típusú influenzavirusokat is izoláltak, ez utóbbiak az influenzavirus C-genusba tartoznak, genomjuk csak 7 szegmensből áll, ezért csak hét struktúrproteinjük van, ugyanis a hemagglutinációért, neuraminidázaktivitásért és fogékony sejthez való kötődésért ugyanaz a fehérje felelős (HEF) Mononegavirales A virológián belül ez az egyetlen rend (ordo), vagyis rendszertanilag a családnál nagyobb osztályozási egység, melybe genomstruktúrájuk, transzkripciós és nukleinsavreplikációs mechanizmusaik alapján hasonló víruscsaládokat (Paramyxoviridae, Rhabdoviridae, Filoviridae) és egy családba nem sorolt nemzetséget (Torovirus genus) soroltak Paramyxoviridae A családba a Paramyxovirinae alcsalád Paramyxovirus és Morbillivirus genusa, valamint a Pneumovirinae alcsalád Pneumovirus nemzetsége tartozik. Morfológia. A paramyxovirusok genomja nem szegmentált, lineáris, negatív irányítottságú RNS (-ssrns). A nukleinsavra épülő nukleoproteinek helikális szimmetriájú kapszidot alkotnak, melynek átmérője nm. A szabálytalanul felcsavarodó helikális kapszidot burok veszi körül, amely a vírusnak pleomorf jelleget ad. A vírus átmérője így nm. Felépítésükben struktúrprotein vesz részt (144. ábra) ábra - Paramyxovirus (parainfluenza 3) virionjának negatívkontrasztelektronmikroszkópos képe (Ritchie, A. felvétele) 294
315 Részletes virológia Ellenálló képesség. A vírusok a környezet hatásaira viszonylag érzékenyek, 56 C-on és ph 3 alatti vegyhatásnál perceken belül inaktiválódnak. Fertőtlenítésre az általánosan használt fertőtlenítőszerek, detergensek használhatók, zsíroldó szerek hatására is elpusztulnak. Biológiai tulajdonságok. Negatív irányítottságú RNS genomjuk a celluláris enzimek számára értelmezhetetlen, ezért a -ssrns templátról mrns-t másoló vírusspecifikus polimeráz enzimet struktúrproteinként magukkal viszik a fertőzött sejtbe. A vírus szaporítására különböző egyrétegű szövettenyészetek (pl. vese- és herehámsejtek) és embrionált tyúktojás egyaránt alkalmas. Jellegzetes sejtkárosító hatásuk a szövettenyészetben viszonylag könnyen felismerhető: hemadszorpciót idéznek elő (a fertőzött sejtek membránján megjelenő hemagglutinin hatására az erythrocyták a fertőzött sejt felszínére tapadnak), syncytiumokat képeznek (a sejtfelszínen megjelenő F proteinek hatására a szomszédos sejtek összeolvadnak), és a vírusösszeépülés helyén a cytoplasmában zárványok alakulnak ki. A madárpathogén paramyxovirusokat embrionált tyúktojás allantoisüregébe oltva szaporítják, az elszaporodó vírus az allantoisfolyadékból HA-próbával mutatható ki. Antigéntulajdonság. Az orthomyxovirusok esetében tapasztalt antigén-variabilitással ellentétben a paramyxovirusok fehérjéinek antigénszerkezete viszonylag stabil. A külső struktúrproteinek (burokproteinek) közül az F (fúziós) protein a burokban helyeződik, és a fogékony sejtbe való bejutásban illetve a vírusokra jellemző cytopathológiás elváltozás (syncytiumok) kialakulásában játszik szerepet. A másik burokfehérje a hemagglutinin (HN) az adszorpcióban játszik szerepet. A Paramyxovirus genus tagjai a tengerimalac, az afrikai zöldmajom és csirke vörösvérsejteket hemagglutinálják, de pl. a Pneumovirus nemzetség egyes tagjaiban ez az adszorpciós fehérje nem rendelkezik hemagglutinációs képességgel, de vírusanalitikai szempontok miatt ebben az esetben is hemagglutininnek hívjuk. Ugyanez a fehérje a Paramyxovirus genus tagjaiban neuraminidázaktivitással is rendelkezik. A protektív ellenanyagok a fúziós fehérje (F) és a hemagglutinin (HN) ellen termelődnek: az F protein ellen termelt ellenanyagok a sejtmembrán és a vírusburok fúzióját (a penetrációt), a HN protein ellen termelődők pedig a sejthez való kötődést (vagyis az adszorpciót) akadályozzák meg. A Morbillivirus genus tagjai közös csoportspecifikus epitopokat is hordoznak az F-proteinen, ezek a közös antigéndetermináns helyek okozzák az e vírusok esetében megfigyelt keresztimmunitást. 295
316 Részletes virológia Laboratóriumi diagnosztika. A paramyxovirusok viszonylag könnyen izolálhatók szövettenyészetben vagy embrionált tyúktojásban. Egyes vírusok (pl. a szopornyicavírus törzsek többsége) cytopathológiás elváltozást nem okoz, ezért a vírusizolálást IF próbával kell kiegészíteni. Az indirekt víruskimutatásra leggyakrabban a VNés a HAG-próbát alkalmazzák A háziállatokat megbetegítő fontosabb paramyxovirusok Paramyxovirinae alcsalád, Paramyxovirus genus Az emlős parainfluenzavirusok(parainfluenzavirus, PI 1 4) állatokban és emberben légzőszervi megbetegedést idéznek elő. Az állatpathogen szerotípusok meglehetősen széles, de eltérő gazdaspektrummal rendelkeznek. A PI 1 vírust (Sendai virus) elsősorban tengerimalacból laboratóriumi rágcsálókból (egér, patkány nyúl), a PI 2 vírust kutyákból és majmokból, a PI 3 szerotípust pedig szarvasmarhából, juhból és más kérődzőfajokból izolálják leggyakrabban. Emberben mind a 4 szerotípus okoz megbetegedéseket. A madarak paramyxovirusai (Avian paramyxovirus 1 9) közül az 1-es szerotípusnak van a legnagyobb jelentősége, ez a baromfipestis vírusa (Newcastle disease virus, NDV, Avian paramyxovirus 1), amely légzőszervi és idegrendszeri tünetekben megnyilvánuló betegséget okoz baromfiban, főként tyúkfélékben. Embrionált tyúktojásra, napos csibékre és felnőtt baromfira gyakorolt pathogenitása alapján a vírusnak különböző virulenciájú változatai különíthetők el. A leggyengébb virulenciájú vírustörzseket lentogéneknek a közepeseket mezogéneknek, a legvirulensebbeket pedig velogéneknek nevezzük. A vírusnak a galambhoz adaptálódott, de hagyományos szerológiai módszerekkel nem, csak monoklonális ellenanyagokkal vagy nukleinsav-vizsgálattal elkülöníthető törzsei a galambokban hoznak létre baromfipestishez hasonló megbetegedést A 3-as típusú madár-paramyxovirus pulykákban okoz légzőszervi tünetekben megnyilvánuló betegséget. A többi 7 madár-paramyxovirusnak állatorvosi jelentősége nincs. Ebbe a nemzetségbe tartozik még a emberpathogen fertőző fültőmirigy- gyulladás (mumpsz) vírusa is, amelynek szövődménye orchitis, pancreatitis petefészek gyulladás és mastitis lehet Morbillivirus genus A keleti marhavész vírusa (Rinderpest virus) szarvasmarhában és rokon fajaiban heveny, rosszindulatú, járványos megbetegedést okoz, a lázas általános tünetek mellett a kórképre a légző- és emésztőkészülék nyálkahártyáján megjelenő elhalások, fekélyek jellemzők. A kiskérődzők pestisének vírusa (Peste des petits ruminants, PPR virus) juh- és kecskeállományokban okoz általános lázas tünetekkel és nyálkahártya-elváltozásokkal járó megbetegedést. A szopornyica vírusa (Distemper virus) kutyában súlyos, általános légző-, emésztőszervi és idegrendszeri megbetegedést idéz elő. Ebbe a genusba tartozik a kanyaró vírusa (Morbilli virus), a nemzetség névadója, amely emberben lázas, kiütéses megbetegedést idéz elő. A genusba tartozó vírusok között keresztimmunitást okozó antigénrokonság figyelhető meg Pneumovirinae alcsalád, Pneumovirus genus A szarvasmarha RS vírusa(respiratory syncytial, RS virus) szarvasmarha- állományokban hevenyen lezajló, kifejezetten ragályos jellegű légzőszervi megbetegedést idéz elő. A pulyka rhinotracheitisének vírusa(turkey rhinotracheitis virus) pulykákban a légutak gyulladásával, nyálkaképződéssel, légzőszervi tünetekkel járó megbetegedést idéz elő. A nemzetséghez tartozik még a laborállat-tenyészetekben néha súlyos járványokat okozó egérpneumonia vírus és az ugyancsak légzőszervi megbetegedéseket előidéző human RSvírus is Filoviridae 296
317 Részletes virológia Elnevezésüket hosszú, fonálszerű alakjukról (filum = fonal, lat.) kapták. A családot egy nemzetség, a Filovirus genus alkotja. Morfológia. Negatív szimpla szálú RNS-genomjukat (-ssrns) hosszú, fonálszerű, vagy U, 6, 9 vagy gyűrű alakba görbült helikális kapszid védi, melyet 7 struktúrprotein alkot. Alakjuk és méretük rendkívül változatos (pleomorfok), az akár nm hosszúságot is elérő, de a többnyire nm hosszú virionok átmérője kb. 80 nm. A helikális kapszidot burok veszi körül. Ellenálló képesség. A környezeti hatásokra viszonylag érzékenyek, 56 o C hatására 30 perc alatt inaktiválódnak, de szobahőmérsékleten viszonylag stabilak. A zsíroldószerek és az általánosan használt fertőtlenítőszerek hatására infektivitásukat biztosan elveszítik. Biológiai tulajdonságok. Negatív irányítottságú RNS-genomjuk a celluláris enzimek számára értelmezhetetlen, ezért a -ssrns templátról mrns-t másoló vírusspecifikus polimeráz enzimet struktúrproteinként magukkal viszik a fertőzött sejtbe. A családba tartozó vírusok Afrika trópusi vidékén honosak, más világrészekre csak alkalomszerűen, behurcolással terjedtek át. Euryxen vírusok, zoonosisokat is előidéznek, ugyanis a főemlősök (köztük az ember) fogékonyak a fertőzésre, a letalitás az eddig ismert járványesetekben igen magas, akár a 88%- ot is elérheti. A rezervoárfaj egyelőre nem ismert. Antigéntulajdonság. A genusba tartozó szerotípusok között keresztreakcó nem figyelhető meg. Laboratóriumi diagnosztika. A jellegzetes járványtani-klinikai kép alapján a fertőzés valószínűsíthető, a vírusizolálás majom eredetű szövettenyészeteken (pl. vero) lehetséges. A szerotípusok azonosítása és az indirekt diagnosztika komplementkötési próbával történik, mert a vírus in vitro nem neutralizálható A Filoviridae családba tartozó fontosabb vírusok Az Afrikában több esetben lokális járványokat előidéző Ebola vírus és az európai esetekből izolált Marburg vírusemberben súlyos haemorrhagiás lázat okoz, a Reston vírus tünetmentes fertőzést idéz elő. Az utóbbi két vírus minden esetben főemlősökkel (különböző majomfajokkal) dolgozó vagy érintkező személyek között vagy ezek közvetlen környezetében lépett fel, az Ebola vírus közvetítőjét és rezervoárját még nem azonosították Torovirus genus A családba nem sorolt vírusnemzetség neve a latin torus (= teljesen nem zárt kör) szóból származik, és a virion jellegzetes alakjára utal. Morfológia. A negatív szimpla szálú RNS-genomot (-ssrns) helikális kapszid veszi körül, mely félkör, C betű vagy hatos alakban hajlik. Burkosak, a vírusrészecske átmérője burokkal együtt nm. Poliakrilamid-gél elektroforézissel három struktúrpolipeptidet különítettek el. Ellenálló képesség. Viszonylag széles ph-értékek között megőrzik fertőzőképességüket (ph 2,5 9,5), de hőtűrő képességük kicsi, testhőmérsékleten már 7 óra alatt inaktiválódnak. Biológiai tulajdonság. Negatív irányítottságú RNS-genomjuk a celluláris enzimek számára értelmezhetetlen, ezért a -ssrns-templátról mrns-t másoló vírusspecifikus polimeráz enzimet struktúrproteinként magukkal viszik a fertőzött sejtbe. Hemagglutináló képességgel rendelkeznek, az egér- és patkány-vörösvérsejteket agglutinálják. Laboratóriumi diagnosztika. A vírusizolálás fajspecifikus szövettenyészetben lehetséges, a sejtkárosító hatás meglehetősen jellegtelen, a fertőzött sejtek lekerekedése és lysise figyelhető meg. A vírusantigén a fertőzött szövetekből IF próbával, béltartalomból immun-elektronmikroszkópos technikával mutatható ki. Az indirekt víruskimutatásra a VN vagy a HAG próba használható A háziállatokból kimutatott fontosabb torovirusok A Breda vírusszarvasmarhában enteritist okoz, a Bern víruskülönböző patás- állatokban (ló, szarvasmarha, kiskérődzők, sertés) és emberben tünetmentes fertőzést idéz elő Rhabdoviridae 297
318 Részletes virológia A rhabdovirusok nevüket a növényekből izolált hosszúkás alakjukról kapták (rhabdos = pálca, gör.). A különböző haszonállatokban a Vesiculovirus és a Lyssavirus genusba tartozó rhabdovirusok okoznak betegségeket. Morfológia. A rhabdovirusok genomja szimpla szálú, negatív irányítottságú, lineáris RNS (-ssrns). Az 5 nm átmérőjű, helikális szimmetriájú nukleokapszid egy hosszanti tengely mentén másodlagosan felcsavarodva alakítja ki a növényi vírusok pálca, illetve az állati rhabdovirusok jellegzetes lövedék alakját. A másodlagosan felcsavarodott nukleokapszidot lipoprotein membránburok veszi körül; a víruspartikula átlagos nagysága így nm. A virion 5 struktúrproteint tartalmaz (145. ábra) ábra - Rhabdovirus (VSV - New Jersey) virionjának negatívkontrasztelektronmikroszkópos képe (Ritchie, A. felvétele) Ellenálló képesség. A rhabdovirusok meglehetősen érzékenyek, 56 C-os hőmérséklet, ph 3-as vegyhatás, zsíroldó szerek vagy napfény (UV fény) hatására inaktiválódnak. Az általánosan használt fertőtlenítőszerekkel, detergensekkel elpusztíthatók. Biológiai tulajdonságok. A negatív szálú RNS-genom transzkripcióját virális transzkriptáz végzi. A vírusszaporodás a cytoplasmában történik, az érett virionok többnyire a sejtmembránon áthatolva veszik fel burkukat, de pl. a veszettség-vírus belső membránstruktúrákon keresztül bimbózik. A rhabdovirusok burkos vírus létükre meglepően sejthez kötöttek, a sejtben képződő virionok kis számban fűződnek le a membránról, és a folyamat hosszú ideig tart. Mesterséges szaporításukra embrionált tyúktojásokat és szövettenyészeteket használnak. A vírusszaporodás egyes vírusok esetében nem jár cytopathologiás elváltozással vagy csak jellegtelen sejtkárosító hatás (sejtlekerekedés, zsugorodás) figyelhető meg. A halakat megbetegítő vesiculovirusok hal eredetű szövettenyészetekben, C-on szaporodnak legjobban. A rhabdovirusok szaporodása során viszonylag nagy számban képződnek inkomplett T (truncated) részecskék, amelyek a komplett B (bullet shaped) virionoknál rövidebbek. Szaporodásra nem képesek, sőt a komplett virionok szaporodását is gátolják (defektív interferencia). 298
319 Részletes virológia A rhabdovirusok többsége hemagglutinációra képes, ez a tulajdonság a membránba ágyazott külső glükoproteinhez kötött. Antigéntulajdonság. A genusok között keresztreakció nem figyelhető meg. A Vesiculovirus genuson belül az egyes szerotípusok jól elkülöníthetők pl. VN vagy KK próbákkal, a Lyssavirus genus tagjai viszont egymással antigénrokonságban vannak. A neutralizáló ellenanyagok a burokban helyeződő G-glükoprotein ellen képződnek. Laboratóriumi diagnosztika. A rhabdovirusok egy része viszonylag nehezen izolálható, és a jellegtelen cytopathológiás elváltozások miatt a szövettenyészetek vizsgálatát IF próbával is ki kell egészíteni. A viszonylag hosszú ideig tartó vírusizolálás helyett a veszettség diagnosztikájában a szövetminták IF-vizsgálatát, illetve az IF-vizsgálattal kiegészített kísérleti állatoltást szokták alkalmazni. Első lépésben a veszettségre gyanús hulla agyvelejének lenyomati készítményét vizsgálják IF-próbával, ha ez a próba negatív, akkor az agyvelőhomogenizátummal intracerebrálisan fiatal egereket oltanak. A kísérleti egerek agyában a 8. naptól kísérelhető meg a vírusantigén kimutatása, szintén IF próbával. A Vesiculovirus genus tagjai ellen termelődő ellenanyagok VN és KK próbával mutathatók ki A haszonállatokat megbetegítő fontosabb rhabdovirusok Vesiculovirus genus A fertőző hólyagos szájgyulladás vírusa(vesicular stomatitis virus, VSV 1 8) hólyagképződéssel járó elváltozásokat okoz lovakon, szarvasmarhában, juhokban és sertésben. Az ember is fertőződhet (zoonosis). A vírus kontaktfertőzéssel vagy ízeltlábú vektorok közvetítésével terjed. A különböző szerotípusokat általában nem számmal, hanem a prototípus törzs izolálási helyére utaló névvel jelölik (Indiana, New Jersey, Alagoas stb.). A betegség járványtani jelentőségét az okozott gazdasági kár mellett fokozza, hogy a kialakuló tünetek a ragadós száj- és körömfájáshoz hasonlóak. A ponty tavaszi hasvízkórjának vírusa(spring viraemia of carp virus) pontytenyészetekben okoz érzékeny veszteségeket. A betegség testszerte vérzések kialakulásával és hasűri folyadékfelhalmozódással jár Lyssavirus genus A veszettség vírusa (Rabies virus) az egyik legrettegettebb zoonosist okozó vírus, amely főként emlősökben idéz elő következetesen halálos kimenetelű agy- és gerincvelő-gyulladást. A víruscsoport 4 szerotípusa közül legelterjedtebb az 1-es (prototípusa a Challenge virus standard, CVS). Ebbe a szerotípusba tartozik a világszerte izolált valamennyi, ún. utcai veszettségvírus törzs, továbbá az immunizálásra használt törzsek: a Pasteur-féle fix vírus, valamint a Flury, a Kelev, az ERA és a Vnukovo 32 törzsek. A lyssavirus genus másik 3 szerotípusa (2-es: Lagos bat, 3-as: Mokola, 4-es: Duvenhage) elsősorban Afrikában fordul elő. A 2 4-es szerotípusok protektív antigénjei csak részben azonosak az 1-es szerotípuséval. Az európai denevérekből izolált törzseket (European bat lyssavirus, EBL 1, 2) önálló szerotípusnak tekintik (5-ös szerotípus). A szarvasmarha ún. háromnapos lázának vírusa (Ephemeral fever virus) rövid ideig tartó lázas állapotot, tejhozam- és testtömegcsökkenést okoz. A haemorrhagiás septicaemia vírusa (Viral haemorrhagic septicaemia virus, VHSV, Egtved virus) pisztrángtenyészetekben okoz viraemiával és petecsképződéssel járó megbetegedést. A fertőző haemopoieticus necrosis vírusa (Infectious haemopoietic necrosis virus, IHSV) különböző lazacfélékben okoz anaemiával, hasnyálmirigy- és veseelhalással járó megbetegedést Bunyaviridae A család neve az ugandai Bunyamwera helység nevéből származik, ahol a család prototípusvírusát izolálták. Az egyik legnépesebb víruscsalád, kb. 200 különböző vírus tartozik ide, melyeket 5 genusba csoportosítanak. Állatorvosi jelentősége a Bunyavirus, Phlebovirus, Nairovirus és Hantavirus genusoknak van. 299
320 Részletes virológia Morfológia. A bunyavirusok genomja három szegmensből álló, negatív irányítottságú, szimpla szálú RNS (- ssrns). A 2,5 nm átmérőjű helikális nukleokapszid felcsavarodik és burok veszi körül, a virion átmérője így kb. 100 nm. A viriont négy struktúrprotein alkotja. Ellenálló képesség. A bunyavirusok ellenálló képessége csekély, hő- és savérzékenyek, az általánosan használt fertőtlenítőszerekkel, detergensekkel elpusztíthatók, zsíroldószerek és napfény (UV-fény) hatására is gyorsan inaktiválódnak. Biológiai tulajdonságok. A négy struktúrprotein között RNS-dependens RNS-polimeráz is van, amely a negatív RNS-genomról mrns-t másol. A bunyavirusok arbovírusok (kivéve az inkább közegészségügyi szempontból jelentős Hantavirus genus tagjait), az ízeltlábú köztigazdában is szaporodnak és transovariálisan azok utódaiba is átjutnak. Szegmentált genomjuk lehetőséget nyújt a génátrendeződésre, ami az antigenitás nagyfokú varianciáját eredményezi. Szövettenyészetekben jól szaporíthatók, a cytoplasmában szaporodnak, burkukat a Golgi-készülékben történő bimbózással szerzik. A fertőzött tenyészetekben syncytiumok képződése és cytoplasmazárványok kialakulása figyelhető meg, a Hantavirus genus tagjai nem cytopathogenek. A bunyavirusok többsége hemagglutinál. Antigéntulajdonság. Az egyes genusok között antigénrokonság nem figyelhető meg, viszont genuson belül a vírusok a HAG és KK próbákban keresztreagálnak, azonosításukra a VN próba alkalmas. Laboratóriumi diagnosztika. Szövettenyészetben és embrionált tyúktojásba oltva izolálhatók, a vírusantigén a fertőzött állatok nyirokszerveiből IF próbával kimutatható. Az indirekt víruskimutatásra a VN próbát használják A háziállatokban megbetegedéseket okozó fontosabb bunyavirusok Bunyavirus genus Az Akabane vírus(akabane virus) kérődzőkben koraellést, vetélést, magzati rendellenességeket (arthrogryposist, hydrocephaliát) okoz. Kelet- és Délkelet-Ázsiában elterjedt betegség Phlebovirus genus A Rift-völgyi láz vírusa(rift valley fever virus) Afrikában fordul elő, különböző kérődzőfajokban okoz általános lázas tünetekkel, vetéléssel és főleg fiatal állatok között magas mortalitással járó betegséget. A vírus iránt az ember is fogékony. A fertőzést szúnyogok terjesztik Nairovirus genus A Nairobi-betegség vírusa(nairobi sheep disease virus) juhokban magas lázzal, vérzéses gyomor- és bélgyulladással, vetéléssel járó megbetegedést okoz Kelet-Afrikában. Szórványosan emberek megbetegedését is észlelték. A vírus átvitelében különböző kullancsfajok szerepelnek. Humán pathológiai jelentősége van a Krimi kongói haemorrhagiás láz vírusának, melyet szintén kullancsok közvetítenek Hantavirus genus A hantaan hemorrhagiás láz és veseszindróma (Hantaan virus) köztigazdái különböző rágcsálófajok, Európában elsősorban a vándorpatkány. A fertőzésre az ember is fogékony (zoonosis), háziállatokban nincs jelentősége Arenaviridae A család neve a latin arena (homok) szóból származik, és a vírusok sajátságos, szemcsézett elektronmikroszkópos képére utal. A vékonyrétegű EM felvételeken látható szemcsék tulajdonképpen a gazdasejtnek a vírusba véletlenszerűen bejutott riboszómái, melyeknek jelen tudásunk szerint a vírusokban nincs funkcionális jelentősége. A családba egyetlen genus, az Arenavirus genus tartozik. Morfológia. A vírusgenom 2 lineáris, szimpla szálú, részben negatív (ambiszenz) RNS-szegmensből áll. A virionban hagyományos értelemben vett nukleokapszid nem figyelhető meg, a helikálisan felcsavarodó RNSszegmensek a hozzájuk kapcsolódó fehérjemolekulákkal rögzítve helyezkednek el a burkon belül. Az arenavirusok rendkívül pleomorfok, átmérőjük nm. A virion felépítésében 4 struktúrprotein vesz részt. 300
321 Részletes virológia Ellenálló képesség. Az arenavirusok rendkívül érzékenyek, csak ph 5,5 8,5 értékek között őrzik meg fertőzőképességüket. Különösen érzékenyek az UV és a gamma sugárzásra. 56 C-os hőkezelés hatására gyorsan elpusztulnak. Biológiai tulajdonságok. Az ambiszenz RNS genom pozitív szakaszához kapcsolódó riboszómákon RNS dependens RNS polimeráz transzlálódik, és a negatív RNS-genomról ez a polimeráz enzim készít mrnsmolekulát. A vírusok a cytoplasmában szaporodnak és a sejtmembránon át bimbózva jutnak ki a sejtből. Valamennyi arenavirusnak különböző rágcsálófajok a rezervoárjai a természetben. Antigén-tulajdonság. A család összes tagja antigénrokonságban áll egymással, ez a rokonság KK és IF próbákkal mutatható ki. Elkülönítésükre a VN próba alkalmas. Laboratóriumi diagnosztika. A vírusok többféle szövettenyészetben és kísérleti egéroltással izolálhatók. A vírusantigén kimutatására az IF próbát, indirekt víruskimutatásra pedig a VN próbát használják Az állatorvosi-közegészségügyi szempontból jelentős arenavirusok A lymphocytás choriomeningitis vírusa(lymphocytic choriomeningitis, LCM virus) jelentőségét az adja, hogy a kedvtelésből tartott fertőzött rágcsálókról (aranyhörcsög, ugróegér stb.), illetve a háziegérről a fertőzés az emberre is átterjedhet, és súlyos megbetegedést (asepticus meningitist, encephalomyelitist) okozhat. A fenti, Európában (így hazánkban is) elterjedt víruson kívül más földrészeken egyéb zoonosist okozó arenavirusok is előfordulnak különböző rágcsálófajokban (Lhassa virus, Tacaraibe, Machupo virus stb.). A kedvtelésből tartott, egzotikus rágcsálók ezért potenciális veszélyforrást jelentenek Retroviridae A víruscsalád neve (retro: vissza) arra utal, hogy ezek a vírusok reverz transzkriptázt, vagyis visszafelé átíró (RNS-ről DNS-t másoló) enzimet tartalmaznak. A családba tartozó vírusokat 7 genusba (illetve a genusnak megfelelő, de rövid rendszertani nevet még nem kapott csoportba sorolják. Ezek: Emlős B oncovirus csoport, Emlős C retrovirus csoport, D típusú retrovirus csoport, Madár C típusú retrovirus csoport, Spumavirus genus, HTLV-BLV csoport, Lentivirus genus. Morfológia. A retrovirusok genomja a többi vírussal ellentétben diploid, vagyis a vírus genetikai információját két példányban kódolja, szimpla szálú, pozitív RNS formájában. Az ún. nem defektív retrovirusok génkészlete rendszerint csupán négy génből áll (5 -gag-pro-pol-env-3 ) amelyek mindegyike két vagy több polipeptidet kódol: a gag szakasza kódolja a csoportspecifikus core- proteineket, a pro szakasz a virális proteázt, az env szakasz a két külső burokproteint, a pol szakasz pedig a reverz transzkriptázt. A nukleinsav és a nukleoprotein helikális nukleokapszidot alkot, melyet egy második, ikozahedrális kapszid vesz körül. Az ikozahedrális kapszidot lipid eredetű burok övezi. A komplett partikula átmérője kb. 100 nm. A vírus felépítésében 7 8 polipeptid vesz részt. A retroviridae család egyes tagjai esetében a víruspartikulák elektronmikroszkópos képe (a core helyeződése, a peplomerek alakja és rendeződése stb.) alapján a vírusokat A, B, C és D típusú vírusoknak nevezzük, ez a morfológiai sajátosság tükröződik az egyes csoportok elnevezésében. Az A típusú retrovirusok valószínűleg a B típusú vírusok prekurzorai (146. ábra) ábra - A retrovirusok csoportosítása 301
322 Részletes virológia Ellenálló képesség. A retrovirusok rendkívül érzékenyek, a gazdaszervezeten kívül még fiziológiás körülmények között is gyorsan inaktiválódnak. Zsíroldó szerek, beszáradás, 50 o C-os hőhatás, ph-eltolódás következtében néhány percen belül elvesztik fertőzőképességüket. Elpusztításukra a legenyhébb fertőtlenítőszerek is hatásosan alkalmazhatók. Többrétegű kapszidjuk és diploid genomjuk miatt viszont a többi vírusnál rezisztensebbek az UV- és gammasugárzásra. Érzékenységük miatt a retrovirusok egy része csak sejthez kötötten képes fertőzést előidézni; vertikálisan pl. a csírasejtek útján (germinatív fertőzés), vagy a kolosztrumsejtekkel (szarvasmarha-leucosis), horizontálisan pedig leváló nyálkahártyasejtekkel (pl. az AIDS vírus esetében), vagy vérsejtekkel pl. a sorozatoltásra használt injekcióstűkkel vagy vérátömlesztéssel (iatrogén fertőzés), esetleg vérszívó vektorok útján (fertőző kevésvérűség). Biológiai tulajdonságok. Pozitív irányítottságú RNS-genomjuk a fertőzött sejtbe jutva nem működik mrnsként, hanem a vírusspecifikus reverz transzkriptáz enzim DNS-kópiát készít róla, amely beépül a gazdasejt genomjába (provirus). Ettől kezdve a gazdasejt enzimrendszere végzi a vírusnukleinsav replikációját és a vírusspecifikus fehérjék transzkripcióját és transzlációját. Az ún. gyorsan transzformáló oncovirusok v-onc gént is tartalmaznak, amelynek beépülése a vírusgenomba legtöbb esetben az env gén deléciójával jár, ezért ezek a vírusok replikációjukban defektesek, helpervirus segítségére szorulnak. Kivétel a Rous sarcoma vírusa, amelynek egyes törzsei mind az öt gént tartalmazzák. A nem defektív retrovirusok sejttenyészetben is elszaporíthatók, és nemegyszer igen erős cytopathologiás elváltozásokat okoznak. A Spumavirinae alcsalád tagjai például igen erőteljes vacuolisatiót, egyes C típusú retrovirusok syncytiumképződést idéznek elő. A nem cytopathogen retrovirusok jelenléte és szaporodása a szövettenyészetekben IF-próbával mutatható ki. Az önálló szaporodásra képtelen defektív vírusok egy része szövettenyészetben is kiváltja a sejtek daganatos transzformációját, ilyenkor a tenyészetben ún. mikrotumorok jelennek meg. A retrovirusok többnyire szigorúan fajspecifikusak. Ebbe a családba tartozik az eddig ismert összes daganatképző RNS-vírus. Antigén-tulajdonság. Az egyes alcsaládok között genetikai rokonság nem figyelhető meg. Alcsaládon, illetve genuson belül egyes vírusok core-proteinjei csoportspecifikusak, így pl. a KK próbában az összes avian C típusú retrovirus, illetve az összes emlős C típusú retrovirus homológ reakciót ad. Kissé szűkebb a csoportspecificitása a burok alatt helyeződő fajspecifikus fehérjéknek, amelyek az azonos fajból származó C típusú retrovirusok esetében (pl. a macskaleucosis és a macskasarcoma vírus között) adnak keresztreakciót az AGP próbában. A legspecifikusabbak a felszínen levő burokantigének, amelyek típusspecifikusak, és megkülönböztetésükre a VN próba alkalmas. Minél mélyebben helyeződik tehát egy antigén a virionban, annál kevésbé specifikus. Laboratóriumi diagnosztika. A retrovirusos megbetegedéseket legtöbbször a klinikai és kórbonctani megfigyelések alapján diagnosztizálják. A vírusizolálás a kóros szövetből többnyire csak kokulivációval (pl. fertőzött fehérvérsejtek szövettenyészetre oltásával) lehetséges. A beteg állatokból származó leukocytákban a vírus gyakran direkt EM vizsgálattal is kimutatható. Az indirekt víruskimutatásra az egyes retrovirusos betegségek esetében más és más próbát alkalmaznak, leggyakrabban az AGP és az ELISA próbát (pl. a szarvasmarha-leucosis és a fertőző kevésvérűség esetében vagy a közegészségügyi szempontból jelentős, szerzett immunhiányos betegséget előidéző HIV-fertőzés kimutatására) A háziállatokat megbetegítő fontosabb retrovirusok Emlős B típusú oncovirus csoport A B típusú oncovirusok közül az egéremlőtumor vírusát a daganatkutatásban modellvírusként alkalmazzák Emlős C típusú retrovirus csoport A macskaleucosis vírusa (Feline leukaemia virus 1 3) szintén a lymphoreticularis szövetek megbetegedésével járó kórképet okoz. A macskasarcoma vírusa (Feline sarcoma virus) ugyanennek a vírusnak a szaporodásban defektív formája. A vírusba beépülő v-onc gén ugyanis az env gén helyét foglalja el, ezért a vírusnak erőteljes oncogen hatása van: fibrosarcomát és melanomát okoz. Csak a macskaleucosis vírus jelenlétében képes szaporodni, és peplonproteinjei részben megegyeznek a macskaleucosis víruséval. 302
323 Részletes virológia C típusú emlősretrovirusokat izoláltak még juhból, sertésből és lovakból leucosisos kórképek esetén, de ezek a kórformák ritkán fordulnak elő. A reticuloendotheliosis vírusok (Avian reticuloendotheliosis virus) genetikai jellemzőik alapján ugyanebbe a genusba sorolhatók, noha különböző madárfajokban okoznak megbetegedéseket. A csoportba 5 vírus tartozik: a replikációban defektes reticuloendotheliosis vírus, ami pulykában okoz megbetegedést (reticuloendotheliosist), ugyanennek a vírusnak replikációra képes változata (Reticuloendotheliosis-associated virus), ami csirkékben lymphoid leucosishoz hasonló kórképet okoz, a kacsák fertőző anaemiavírusa, a kacsák lépnecrosisvírusa és a csirkék syncytialis vírusa (az utóbbi három vírus is replikációra képes, v-onc gént nem tartalmaz). Ugyanebbe a genusba (tehát az emlős C típusú retrovirus csoportba) sorolhatók a bizonyos hüllőfajokból izolált C típusú vírusok is (pl. a vipera-retrovirus) D típusú retrovirus csoport A csoportba tartozó vírusok különböző majomfajtákat betegítenek meg, állatorvosi szempontból kevéssé jelentősek. A juh tüdőadenomatosisának vírusa(ovine pulmonary adenomatosis virus, Jaagsiekte virus) juhok tüdejében adenomaszerűen burjánzó daganatgócok képződését idézi elő. Hivatalosan még be nem sorolt retrovirus, de bizonyos genomszekvenciák és egyes core-proteinek hasonlósága miatt lehetséges, hogy a későbbiekben ebbe a genusba sorolják Madár C típusú retrovirus csoport A madár leucosis-sarcoma vírusok(avian leucosis-sarcoma viruses) által baromfiban előidézett kórképeket leucosis-sarcoma komplexnek nevezzük. A vírus 7 szubtípusát az ábécé nagybetűivel jelölik (A E). A v-onc génnel nem rendelkező vírusok (Avian leucosis viruses, ALV) önálló szaporodásra képesek, tumorképződést csak akkor indukálnak, ha a sejt c-onc génjét aktiválják; lymphoid leucosist, osteopetrosist vagy vesetumort idéznek elő. A v-onc génnel rendelkező, replikációban defektes vírusok (Avian sarcoma viruses) gyorsan kifejlődő mesenchymalis tumorokat okoznak: erythroblastosist, myeloblastosist, sarcomát stb. A Rous-sarcoma vírusa (RSV), amely szintén ebbe a csoportba tartozik, többnyire replikációra és transzformációra is képes, gyorsan kifejlődő sarcomát idéz elő Spumavirus genus A nemzetségbe az emberben és különböző állatfajokban (szarvasmarha, macska, majom) tünetmentes fertőzést okozó, erősen cytopathogen (orphan) vírusok tartoznak HTLV-BLV csoport A szarvasmarha-leucosis vírusa (Bovine leucosis virus, BLV) lassan kifejlődő de következetesen halálos kimenetelű betegséget okoz, amely a lymphoreticularis szövetek daganatos burjánzásában nyilvánul meg. Az ember és a főemlősök lymphoid sejtjeiben szaporodó vírusokat (Human T-cell lymphotropic virus,illetve Simian T-cell lymphotropic virus) T- vagy B-sejtes leukémia- vagy lymphomaesetekből izolálták Lentivirus genus A visna-maedi vírusa (Visna-maedi virus) kecskékben és juhokban kétféle megbetegedést idézhet elő: a visna progresszív meningoencephalitis, a maedi idült interstitiális pneumonia képében zajlik le. Mindkét kórkép lassan fejlődik ki és következetesen elhullásra vezet. 303
324 Részletes virológia A kecske arthritis-encephalitis vírusa (Caprine athritisencephalomyelitis, CAE virus) többnyire a carpalis, ritkábban más ízületek idült gyulladását és leucoencephalitist okoz. A lovak fertőző kevésvérűségének vírusa(equine infectious anaemia, EIA virus) kezdetben heveny, később azonban idült lezajlású, lázrohamokkal és vérképeltolódással járó kórképet idéz elő lovakban. A fertőzés szúnyogok és vérszívó legyek közvetítésével terjed. Ebbe a nemzetségbe tartozik még a macska, illetve a szarvasmarha szerzett immunhiányos betegségének vírusa (Feline immundeficiency virus, Bovine immunodeficiency virus) és az emberben hasonló kórképet (Acquired immunodeficiency syndrome, AIDS) előidéző vírusok (HIV 1, 2, Human immunodeficiency virus 1, 2) is Még nem csoportosított RNS-vírusok Az RNS-vírusok között számos olyan kórokozót találunk, amely tulajdonságai alapján az eddig ismert víruscsaládok közül egyikbe sem tartozik. Ezek egy részének besorolása valószínűleg újabb családok kialakítását teszi szükségessé. Több új víruscsalád nevére már javaslat is született, de ezeket a Nemzetközi Vírustaxonómiai Bizottság még nem fogadta el. Astroviridae. Nevüket jellegzetes elektronmikroszkópos képükről kapták. Mintegy 30 nm átmérőjű, ikozahedrális kapszidjuk csillag alakú (aster: csillag, lat.). Genomjuk +ssrns. Hasmenéses kórképekből (bárányokból, borjakból, malacokból, emberből) mutatták ki őket, vesehámszöveteken szaporíthatók, de cythopathogen hatást nem fejtenek ki. A bornai betegség vírusa lovakban és juhokban fertőző agy- és gerincvelőgyulladást okoz. Az először ben Svájcban és Németországban felismert vírus morfológiai jellegzetességeit eddig nem sikerült megállapítani. Szeropozitivitást emberben is kimutattak. 4. Bakteriofágok A bakteriofágok a baktériumokban élősködő vírusok, és általános jellemzőik megegyeznek a eukaryota szervezetekben fertőzést okozó vírusokéval (abszolút sejtparaziták, nukleinsav- és fehérjeszintetizáló enzimrendszerük nincs, csak egyféle nukleinsavat tartalmaznak stb.), de ugyanakkor e korlátokon belül legalább olyan heterogének, mint azok. Eszerint csak egyféle nukleinsavat tartalmaznak, de ez lehet DNS vagy RNS, szimpla szálú vagy dupla szálú, lineáris vagy cirkuláris, folyamatos vagy szegmentált. A nukleinsav mellett mindig tartalmaznak fehérjéket is, illetve bizonyos fágok lipidkomponenseket tartalmazó burokkal is rendelkeznek. A fehérje- és lipidkomponensek határozzák meg a virion alakját, szimmetriaviszonyait. E jellegzetességek alapján négyféle fágformát különböztetünk meg: farkos (tailed), ikozahedrális (köbös), helikális (rod shaped) és pleomorf fágokat. Osztályozásuk nukleinsavuk és morfológiai jellegzetességeik alapján történik: 6 főcsoportba sorolják őket, az ábécé nagybetűivel jelölve (A G). Egyes főcsoportokon belül alcsoportokat is elkülönítenek, ezek megkülönböztetése a főcsoport betűjele mellé tett számmal történik (147. ábra) ábra - A bakteriofágok csoportosítása 304
325 Részletes virológia I. A farkos bakteriofágok kapszidja binális szimmetriájú: a köbös szerkezetű feji részhez helikális szimmetriájú farki rész kapcsolódik. Burkuk (peplonjuk) nincs, nukleinsavuk dupla szálú DNS. A farki rész tulajdonságai alapján 3 főcsoportba sorolják őket. Az A csoportban a helikális rész hosszú és összehúzódásra képes (e csoportba tartozik pl. a T 4- fág), a B főcsoportban hosszú és nem kontraktilis, a C főcsoportban pedig igen rövid. Mindhárom főcsoporton belül alcsoportokat különítenek el a feji rész arányai alapján: az 1. alcsoportúakra az izometriás, a 2. alcsoportúakra a mérsékelten megnyúlt, a 3. alcsoportúakra az erősen megnyúlt fej jellemző. II. A köbös bakteriofágokat a D és az E főcsoportokba sorolják aszerint, hogy milyen nukleinsavat tartalmaznak. A D főcsoportba tartozó fágok genomja DNS, és négy alcsoportba sorolják őket. A Dl fágok genomja szimpla szálú DNS, burkuk nincs; igen aprók (a jelenleg ismert legkisebb vírus a nm átmérőjű Ø 174 fág ebbe a csoportba tartozik). A többi D fág genomja dupla szálú DNS, nagyméretűek; a D2 fágok kapszidja egyrétegű, a D3 fágok kapszidja lipidelemeket tartalmaz, a D4 fágok kapszidja kétrétegű. 305
326 Részletes virológia Az E főcsoport tagjainak genomja RNS, az El fágoké szimpla, az E2 fágoké dupla szálú, ez utóbbiaknak burkuk is van. III. A fonalas fágok nukleinsava szimpla szálú DNS, az Fl csoport tagjai helikális szimmetriájúak (hajlékonyak) és igen hosszúak (több száz nm-esek), az F2 fágok 100 nm-nél rövidebbek és merevek, az F3 fágok burkosak. IV. A pleomorf G fágoknak nincs kapszidja, a dupla szálú DNS-genomot matrix-proteinnel kitöltött burok veszi körül. A fágok szaporodása az eukaryota sejtek vírusaihoz hasonlóan igen változatos, de mindenképpen a gazdabaktérium-sejten belül történik. A fágadszorpció igen specifikus folyamat, ezért a fágok többnyire szűk gazdaspektrumúak, csak egy baktériumfajban, sőt többnyire annak csak meghatározott törzseiben képesek szaporodni. Ezt a tulajdonságukat használják ki a fágtipizálás során, vagyis bizonyos baktériumtörzsek identifikálására, vagy a fágtiter-emelkedési reakcióban bizonyos vizsgálati minták baktériumtartalmának meghatározására. (Pl. ha az ivóvízmintában Salmonella typhi baktérium van, akkor a mintához adott S. typhispecifikus M3 fág titere néhány órán belül többszörösére emelkedik). Vannak ugyanakkor széles gazdaspektrummal rendelkező fágok is, amelyek még a Gram + és Gram baktériumok közötti határt is át tudják lépni. Szerepük van bizonyos gének terjesztésében. A fágok penetrációjuk során vagy a baktérium sejtfallal nem védett részein (csilló, fimbria) keresztül jutnak be a gazdasejtbe, vagy a sejtfalon át fecskendezik be nukleinsavukat a baktériumba (pl. a T-fágok). A sejtbe jutott fággenom vagy litikus fertőzést indít meg, vagyis azonnal szaporodni kezd a baktériumban (ezek az ún. virulens vagy vegetatív fágok), vagy lizogén fertőzést okoz, amikoris a fágdns beépül a baktérium genomjába, profággá alakul (temperált fágok). A profág a baktériumsejt osztódásakor az utódbaktériumokba is átjut. Bizonyos hatásokra (ph- vagy hőmérséklet-változás, UV sugárzás, stb.) a profág vegetatív fággá alakul és litikus folyamatot indít meg. Az ilyen hatást indukciónak nevezzük. A litikus fertőzés végén kiszabaduló fágok a gazdabaktérium nukleinsavkészletéből származó génszakaszt is hordozhatnak, és azt lizogén fertőzés során másik baktériumba vihetik át, amikor annak genomjába profágként beépülnek. Ez a jelenség a transzdukció, melynek eredménye új, öröklődő tulajdonságok megjelenése a recipiens baktérium utódaiban. Ha lizogén fertőzés során a fággal fertőzött baktériumsejt tulajdonságainak megváltozását nem másik baktériumból származó génszakasz, hanem a fággenom idézi elő, akkor lizogén konverziórólbeszélünk. A fágok igen fontos szerepet játszottak az oncogen vírusok hatásmechanizmusának modellezésében (profág provírus párhuzam felismerése) és a vírusreplikáció egyes alapvető kérdéseinek tisztázása során Néhány fontosabb fág ß-fág: a Corynebacterium diphtheriae fágja, mely lizogén konverziót okoz, vagyis a profágot hordozó baktériumtörzsek erős toxintermelő-képességre tesznek szert. Tb- (Tbiliszi-)fág: a Brucella fajok elkülönítése során fágtipizálásra használják. T4-fág: az egyik legnagyobb és legösszetettebb szerkezetű vírus, a binális szimmetriájú kapszid összeépülését kb. 40 gén (a fág génkészletének fele) szabályozza. - φ X 174-fág: a legkisebb és legegyszerűbb felépítésű az eddig ismert vírusok közül - λ-fág: fontos szerepet játszott a profág provírus elmélet kialakításában. Pontosan feltérképezett DNS-genomja restrikciós endonukleázos vizsgálatok során molekulatömeg-markerként használatos. 5. Prionok A halálos kimenetelű átoltható, transmissibilis subacut spongioform encephalopathiák (TSE) oktanában a prionok szerepét az emberben és több állatfajban leírták (31. táblázat). Ezek közül a legrégebben azonosított megbetegedés a juhok és kecskék scrapie (súrlókór) néven ismert prionbetegsége volt, amelyet korábban a nem konvecionális vírusok által okozott betegségek modelljének tekintettek. Az utóbbi évek kiterjedt kutatási eredményeinek köszönhetően TSE oktanában, a vírusmodell és a virinomodell háttérbe szorult, és egyre 306
327 Részletes virológia elfogadottabbá válik a Prusiner(1982) által javasolt fertőző fehérje vagy prionmodell (prion = protein of infecious nature). 31. táblázat - A prionok által okozott megbetegedések állatokban és emberben Betegség elnevezése Állatfaj Első megállapítás SCRAPIE (súrlókór) TME (Transmissible Mink Echephalopathy) Nyércek átoltható encephalopathiája CWD (Chronic Wasting Disease) Szarvasok sorvasztó betegsége juh, kecske nyérc öszvérszarvas jávorantilop kb BSE (Bovine Spongioform Encephalopathy) szarvasmarha 1985 Szarvasmarhák szivacsos encephalopathiája FSE (Feline Spongioform encephalopathy) Macskák szivacsos encephalopathiája SLSE (Scrapie-like Spongioform Encephalopaty) Scrapieszerű spongioform encephalopathiák macska gepárd puma 5 antilopfaj 3 macskaféle A prionmolekula felépítése. Az emberi és állati sejt kromoszómájában genetikailag kódolt normál prionfehérjék (PrP C ) a többi sejtfehérjéhez hasonlóan a sejt transzkripciós és transzlációs mechanizmusa által termelődnek. Ezek a kis molekulasúlyú PrP C -k ( Da és Da praecursorfehérjék) glükolizálódnak, majd a glükolipid részükkel beágyazódnak sejtmembránba, és feltételezhetően az idegsejtek membránjai közötti kapcsolatokban játszanak szerepet (148. és 149. ábra). A normál PrP C -k viszonylag gyorsan (átlag 2 5 órás felezési idővel) áldozatául esnek a sejt fehérjeemésztő enzimjeinek, ezért fiziológiás körülmények között sejten belüli felhalmozódásukat nem figyelték meg. Ugyancsak semmi jel nem mutat arra, hogy képesek lennének a sejt elhagyására. Az egyes állatfajokból és az emberből izolált normál PrP C K között, 85 90%-os homológiát állapítottak meg, és ez a homológia a rokon fajok között még kifejezettebb volt (pl. szarvasmarha BSE juh scrapie: 95%). Az egyes fajok közötti keresztfertőzést az immunválasz alapján nem lehet detektátni. Betegség elnevezése CJD (Creutzfeldt Jakob-Disease) GSS (Gerstmann-Stäussler Scheinker Syndrome) KURU (nevető halál) vcjd (CJD variáns) FFI (Fatal Familiar Insomnia) 148. ábra - Prionmolekula szerkezete 307
328 Részletes virológia 149. ábra - A fertőző fehérje modell (magyarázat a szövegben) 308
329 Részletes virológia Ellenálló képesség. Fizikokémiai tulajdonság. A normál prionfehérjékkel (PrP c ) ellentétben a koros prionmolekkulák (PrP sc ) rendkívüli ellenálló képességgel rendelkeznek. A PrPsc inaktiválásának lehetőségeit foglalja össze a 32. táblázat. 32. táblázat - A proinok inaktiválása Hatásos eljárások NaOH 1M Fenol 2% Na-hypoklorit ionos detergensek (?) 121 C 60 percig Hatástalan formaldehid éter kloroform szövettani eljárások során használt vegyszerek egyéb fertőtlenítő szerek A fertőző prionmodell. Más genetikai információhoz hasonlóan, a PrP C génen is bekövetkezhetnek mutációk, melyek közül előfordulhatnak olyan pontmutációk is, amelyek a normál PrP C strukturális szerkezetében mélyreható változást eredményeznek; nevezetesen az eredeti alfa-helix szerkezeten belül ún. ß-láncok alakulnak ki, és a fehérjelánc egyes pontjain az aminosav típusa is megváltozik (148. ábra). Ez a változás drámai eseménysorozatot indít el. Ugyanis az ily módon megváltozott prionmolekula egyrészt ellenálló lesz a proteináz enzimekkel szemben, ami lehetőséget teremt arra, hogy fibrillumok formájában felhalmozódjanak a sejtben és a semlegesítésükre törekvő lizoszómákban (32. táblázat). Másrészt ezek a felhalmozódó fibrillumok feltételezhetően már puszta jelenlétükkel (mechanikusan) is károsítják a sejtet, ami egy idő után annak teljes pusztulásához vezet. A spongiform encephalopathiák esetén megfigyelhető szövettani elváltozások (amiloidfelhalmozódás, vakuolizáció stb.) vélhetően ezekre a több sejtre kiterjedő patológiás folyamatokra vezethetők vissza (150. ábra) ábra - Az agyszövet alapállományának szivacsszerűvé válása (spongioform encephalopathia). Szarvasmarha BSE (külföldi eset) (dr. Vetési Ferenc felvétele) 309
330 Részletes virológia Az így kialakult ellenálló kóros PrP-molekulák, amelyeket a scrapie megbetegedésekben találtakra utalva PrP Sc - nek (scrapie prion protein) neveznek, (a normál PrP C molekulával ellentétben), már képesek áthatolni a sejtmembránokon. Valószínűleg ezzel magyarázható átoltható vagy fertőző tulajdonságuk. Ezek a kóros PrP Sc -fehérjék, ha bejutnak egy egészséges idegsejtbe (ma még nem ismert mechanizmuson keresztül), kapcsolatba lépnek az egészséges sejt által termelt normál PrP-molekulákkal, és azokat a saját képmásukra alakítják át. Tehát az a rendkívüli helyzet áll elő, hogy az egészséges sejt által termelt normál PrP C a transzlációs folyamatok végére kóros PrP Sc -molekulává alakul át, és kialakulása pillanatában máris kórossá változtatja a továbbiakban termelődő normál PrP C -molekulákat. Ez a dominó elvnek nevezett esemény végül is oda vezet, hogy minél több normál PrP-t termel a sejt, annál hamarabb készíti elő saját halálát (149. ábra). Ellentétben az eddig megismert fertőzési folyamatokkal, ahol az adott kórokozónak meg kellett sokszoroznia önmagát, itt a patológiás folyamat kialakulásához elméletileg elegendő néhány PrP Sc -molekula, amelyik puszta jelenlétével beindítja a láncreakciót. Az átoltható prionmolekula képes áttörni a faji barriert, vagyis az egyik faj PrP Sc -je képes kórossá átalakítani a másik faj normál PrP C -jeit is. A faji barrier áttörésében a mutáción kívül vélhetően lényeges szerepet játszik a priongén polimorfizmusra képes szakasza is. A fent említett prionmodell alapján tehát a TSE-megbetegedések kialakulhatnak genetikai mutációk révén, ami örökletessé is válhat, ami zárt populációkban halmozódáshoz vezethet (pl. a Creutzfeldt-Jacob betegség, CJD, familiaris változatai Szlovákiában, Közel-Keleten, Chilében), valamint kórossá vált mutáns prionok átoltása révén is (pl. CJD-ben meghalt emberek hypophysis-kivonatából készült hormonterápia, szaruhártyaátültetés vagy agyi elektródákkal történő vizsgálatok során). Az eddigi transzgenetikus egérkísérletek (amikor az egér saját priongénjét kiveszik, és helyére vagy egy másik faj priongénjét ültetik, vagy prionhiányos egeret hoznak létre) alátámasztották a prionmodell elméletet. Ugyanis prionhiányos (priongénjüktől megfosztott, ún. knock-out) egerekben nem sikerült a betegséget kiváltani fertőző prionok idegsejtbe juttatásával, ami bizonyítja, hogy a pathológiás folyamatok megindulásához nem elég a fertőző ágens jelenléte, hanem szükség van átalakítható normál prionokra is. Laboratóriumi diagnosztika. A prionok kimutatásában és azonosításában kiterjedten használják a laboratóriumi rágcsálók intracerebrális fertőzését. Az napos inkubációs idő után kialakuló klinikai tünetek, szövettani elváltozások (idegsejtek spongiform vakuolizációja, amiloid megjelenése) kórjelző értékűek. Immun-hisztokémiai módszerekkel és aminosavszekvencia analízisekkel a fertőző és a normál prion megkülönböztethető, és ez utóbbi vizsgálattal az egyes priontörzsek is azonosíthatók ben beszámoltak egy új immundiagnosztikai lehetőségről, amellyel élő scrapie-fertőzött juhok tonisállájából vett biopsziás mintákban sikerült azonosítani a PrP Sc -t. 310
331 Részletes virológia 5.1. Az állatok prionmegbetegedései Súrlókór, scrapie. A súrlókór természetes körülmények között elsősorban juhállományokban fordul elő, kecskék között ritkábban észlelték. A klinikai megbetegedések általában 2,5 4,5 évvel a fertőződés után alakulnak ki, bár az inkubációs idő gyakran hosszabb, mint a juhok életkora. A két faj keresztirányban (odavissza) fertőzhető. A házi és vadon élő kérődzők, a húsevők (macskafélék, nyércek) és a rágcsálók mellett a majmok is fertőzhetők a scrapie törzsekkel. Az eddig izolált 20 scrapie és 5 rida (Izlandi izolátum) törzs az egérpasszázsok során mutatott stabilitása alapján 3 osztályba sorolható. A törzsek azonosításánál a hőrezisztenciát, valamint az intracerebrális egéroltások során mért inkubációs időt és a pathologiai elváltozások jellegzetességeit veszik figyelembe. A scrapie-vel szembeni fogékonyság tekintetében az egértörzsek között is különbség van, ugyanis ugyanazon törzs különböző inkubációs indexet mutatott a különböző egértörzsekben. Egértörzsek fertőzésekor, a szervmintákban a minimális kimutathatósági titer 100 fertőző egérdózis/g. Scrapie-törzzsel intracerebrálisan fertőzött hörcsögökben a fertőzés után adott Amphotericin B-származék (MS 8209) jelentősen késleltette a betegség kialakulást a nem kezelt kontrollcsoporthoz képest. Szarvasmarhák szivacsos ecephalopathiája, BSE. A BSE vélhetően első klinikai esetei 1985-ben jelentek meg a brit szarvasmarha-állományokban. A klinikai esetekből származó szervminták laboratóriumi és kórtani vizsgálata egyre nyilvánvalóbbá tette azt a felismerést, hogy a szarvasmarhák BSE-megbetegedéséért a juhokból származó scrapie-mutáns tehető felelőssé, amely a járványtani nyomozások alapján a juhfehérjét tartalmazó takarmányon keresztül fertőzte a szarvasmarhákat. Egyes kutatócsoportok eredményei megkérdőjelezik a scrapie-priongén, mutációval történt adaptációját a szarvasmarhához, és feltételezik, hogy a BSEmegbetegedések hátterében egy önálló szarvasmarha-priongén áll, amelyik már a 80-as évek előtt is okozott sporadikus megbetegedést, csak ez a prion a vágóhídi mellékterméket feldolgozó technológiák változtatása előtt nem kapott lehetőséget a terjedésre, ezért a rendkívül alacsony esetszám miatt nem ismerték fel. Ezt a feltételezést látszanak alátámasztani azok az egérkísérletek, amelyekben a scrapie és BSE-törzsekkel oltott egércsoportokban jól elkülöníthető kórszövettani elváltozások alakultak ki a fertőzések hatására A BSE-t okozó prion a testváladékokban nem jelenik meg. A természetes esetek és a fertőzési kísérletek során a fertőző priont az idegrendszerből, a nyirokszervekből és a vastagbélből tudták kimutatni. A fertőzést kizárólag az idegrendszerből származó szervmintával tudták átoltani. Az intracerebrális fertőzési kísérletek során fertőzhető volt a majom(macaca fascicularis), a borjú, az egér, a juh a kecske a nyérc és a sertés. A sertést a TSE-esetek közül ez ideig kizárólag a kuru eredetű szervszuszpenzióval (prionnal) sikerült megfertőzni intracerebrális úton. A BSE-prionnal fertőzött kismajmok agyában 128 hetes inkubáció után, hasonló jellegű elváltozásokat találtak, mint amit abban a 12 angliai humán esetben írtak le, amelyeket a CJD új variánsának (vcjd) tekintenek, és amelyek kialakulásában vetődött fel először a BSE-prion szerepe (31. táblázat). A BSE-törzsek megkülönböztethetetlenek egymástól, de különböznek a scrapie-törzsektől. Nyércek átoltható encephalopathiája, TME. A nyérc az első Carnivora, amelyben természetes körülmények között TSE megbetegedés jelentkezett. A betegség klinikai képe és a patológiás elváltozások rendkívül hasonlítottak a scrapie-hez. Állományon belül a TME prion elsősorban a kannibalizmus (beteg elhullott állatok felfalásával) és a verekedés révén terjed. Érintkezéssel és méhen belül a fertőzés nem terjed. A TME-prionnal fertőzhető a kecske, a bűzös borz, a mosómedve, a görény, menyét, a szíriai aranyhörcsög, a majom (Rhesus majom, Mókus majom). A TME jellegzetessége, hogy adott fajokba (macska, szarvasmarha, egér, csirke) intracerebrálisan oltva szubklinikai fertőzöttséget alakít ki. Az egéroltás lehetőséget ad a TME- és a scrapie törzsek megkülönböztetésére, ugyanis a scrapie törzsek kivétel nélkül ölik az egeret. A fertőzött nyércekben a TME-priont legnagyobb mennyiségben az agyszövetben azonosították, de kimutatták még a májban, lépben, tüdőben, vesében, húgyhólyagban, és az izomszövetben is. A TSE-megbetegedések közül egyedül a TME-priont tudták kimutatni bélsárból is. A vér és a vizelet nem tartalmazott priont. 311
332 Részletes virológia Macskák szivacsos encephalopathiája, FSE. Házimacskákban a TSE- megbetegedést először 1990-ben állapították meg Angliában. A betegséget idáig kizárólag öreg macskákon figyelték meg, és az előfordulás mindig sporadikus volt. Kísérletes körülmények között az FSE-prion átoltható volt egérbe, amelyben néhány hónaptól 2 évig tartó inkubációs idő után kialakult a TSE. A CJD betegségben meghalt ember agyvelő-szuszpenziójával fertőzött macskában kialakult a TSE. Egyelőre tisztázatlan, hogy az FSE macskáról macskára terjed-e. Jelenleg az FSE-t a macskák önálló prionmegbetegedésének tartják. 312
333 5. fejezet - Immunológia 1. Immunológia, immunitás, immunrendszer 1.1. Az immunológia története Az immunológia mint tudományág alig százéves, de történetének gyökerei messze az elmúlt századokba nyúlnak vissza és összefonódtak a fertőző betegségek elleni védekezéssel. Az embert és az állatvilágot pusztító járványok ugyanis szüntelenül arra kényszerítették az embert, hogy ismerje meg a betegségek természetét, azok terjedési módját, másrészt, hogy megtalálja velük szemben a védekezés legeredményesebb formáját. A védekezés az ókortól az újkorig az oktani ismeretek hiányában inkább csak menekülés volt, különösen egyes nagy rettegést és nagy mortalitást okozó fertőzések elől. A középkor hosszú évszázadai sem hoztak előrehaladást annak ellenére, hogy a betegségek mibenlétét számos természettudós törekedett megfejteni, de a mai ismeretek szerint ítélve csak téveszmék megalkotásáig juthattak. A fertőző betegségek elleni specifikus védekezés kezdete megelőzte az oktani ismeretek megszerzését, és csupán tapasztalati úton vagy gyakorlati megfigyelésekből eredően ősidők óta alkalmazták a variolizációnak nevezett eljárást Kínában, amikor himlős emberből származó fertőző anyagot dörzsöltek be egészséges gyermekek bőrébe, sikeresen védve ilyen módon a himlős megbetegedéstől. A XVIII. században hasonló eljárást, az ún. ovinációt alkalmazták a juhhimlő megelőzésére. A mai értelemben vett védőoltást az emberi himlő ellen E. JENNER (1796) alkalmazta először, amikor tehenekből származó himlős nyirokanyagot skarifikált a betegségtől megvédendő emberek bőrébe. Innen ered a vakcinázás kifejezés (vacca = tehén). JENNER-től a múlt században a nyolcvanas évek végéig kellett várni, amíg L. PASTEUR (1879) és R. KOCH (1892) végérvényesen tisztázták egyes baktériumok szerepét néhány betegség oktanában. A korszerű immunprophylaxis megalapítása PASTEUR nevéhez fűződik, aki felismerte, hogy egyes baktériumok (pl. Pasteurella multocida, Bacillus anthracis) bizonyos hatásokra elveszíthetik a megbetegítőképességüket, viszont állatokba oltva megvédik azokat a betegséggel (baromficholera, anthrax) szemben. Ilyen alapon fejlesztette ki a veszettség elleni oltóanyagot is a kórokozó ismerete nélkül, amikor a veszett állatból származó agyvelődörzsöléket sorozatosan nyúlagyvelő-oltásokkal passzálta. Így jutott el a ma fix-vírusnak nevezett törzshöz, amely elveszítette azt a képességét, hogy parenterálisan a szervezetbe juttatva veszettséget okozzon, viszont megtartotta immunizálóképességét. Jelentős haladást hozott SALMON és SMITH (1896) munkássága, akik elölt kórokozókkal állítottak elő vakcinát. Nem sokkal később ROUX és YERSIN (1888) megállapították, hogy nemcsak a baktériumtest, hanem annak termékei is alkalmasak lehetnek a betegség elleni védőoltásra. Miközben a gyakorlatban már elterjedtek bizonyos fertőző betegségekkel szembeni vakcinás oltások, mit sem tudtak arról, hogy tulajdonképpen milyen mechanizmusnak tulajdonítható a szervezet védelme. Alapvető és rendkívüli fontosságú volt ezért BEHRINGnek (1890) az a felfedezése, hogy a diphtheriatoxinnal szemben a vérsavóban olyan anyagok (ellenanyagok) jelennek meg, amelyek a toxint közömbösíteni képesek. További lépést jelentett a szervezet védekezési rendszerének megismerésében BORDET (1899) megállapítása, amely szerint a baktériumok feloldódnak az ellenanyagokkal való kapcsolódást követően, ha ehhez a komplexhez más szérumfehérje-faktorok (komplement) is kapcsolódnak. A századforduló óta kiterjedten vizsgálták a szervezet védekező rendszerét. Rövidesen számos fertőző betegség esetében kimutatták, hogy a meggyógyult állat vérsavója a kórokozót károsító vagy pusztító anyagokat tartalmaz. Azt is megállapították, hogy a vérsavó ilyen hatása akkor is érvényesült, ha azt egy másik állatba oltották. A vizsgáló módszerek elsősorban a vérsavóban levő ellenanyagok kimutatására szolgáltak (agglutinációs, precipitációs, komplementkötési próba), és a megfigyelések alapján az a felfogás vált általánossá, amely szerint a szervezet védekezése ellenanyagok termelésén alapszik (humorális immunitás). Csupán a humorális faktorok alapján azonban számos esetben nem lehetett kielégítő magyarázatot adni a védettség folyamataira, ezért a kutatók másik csoportja a celluláris immunitás elméletét vallotta. A celluláris védekezés alapját MECSNYIKOVnak (1883) a phagocytosisról tett alapvető megállapításai képezték. 313
334 Immunológia Nem sokkal később igazolódott az is, hogy léteznek a baktériumoknál kisebb méretű ágensek, a vírusok (IVANOVSZKIJ, 1892; LÖFFLER és FORSCH, 1898), amelyek betegségeket képesek kiváltani. Az immunológiának ebben a klasszikus korszakában számos vakcinaféleséget fejlesztettek ki, ami nagy haladást eredményezett a fertőző betegségek elleni védekezésben. Az immunológia modern korszaka a század 50-es éveiben vette kezdetét. Megszületett az immunrendszer működését magyarázó BURNET-féle klónszelekciós elmélet, ismertté vált az immunglobulin-molekulák szerkezeti felépítése, továbbá az osztályok és alosztályok funkciója, valamint a sejtfelületi struktúrák, közöttük az MHC I és MHC II antigének szerepe. A humorális és a celluláris immunválasz-képesség alapvető mechanizmusainak feltárása, valamint az immunreguláció egyes törvényszerűségeinek megismerése lehetőséget teremtett az immunrendszer működési zavarainak, közöttük a veleszületett és a szerzett immundeficienciák, az autoimmun és az allergiás kórképek természetének tisztázására is. Az embert és az állatvilágot fenyegető betegségek több évszázada ismert listája, különösen az elmúlt évtizedekben, újabb kórképekkel gyarapodott. Akár az újonnan felismert betegségek, akár a klasszikus kórképek módosuló jellege vagy változó terjedési tendenciája sokszor próbára tették az immunológia teherbíró képességét. Az immunológia elméleti ismereteinek bővülése maga után vonta az immunprophylaxis fejlődését is. Ez úgy vált lehetővé, hogy az immunológia egyrészt kihasználta a korszerű technológiák nyújtotta lehetőségeket, másrészt alkalmazta a baktérium- és vírusgenetika eredményeit (fontosabb baktériumok és vírusok antigénszerkezetének feltérképezése, az immunogén hatást hordozó fragmensek jellemzése) és a molekuláris biológia vívmányait (az immunogén génszakaszok lokalizálása, génsebészeti manipulációkban való felhasználása, rekombináns és bioszintetikus vakcinák előállítása). Az immunbiológia, a mikrobiológia és a fertőző betegségek tudományágainak szoros összefonódása kiemelkedő eredmények eléréséhez vezetett, ami lehetővé tette egyes fertőző betegségek végleges felszámolását (pl. az emberi himlő), terjedésének meggátlását (pl. keleti marhavész) vagy az okozott károk tetemes csökkentését (pl. baromfipestis) Az immunitásról általában Az immunitás fogalma a latin immunis (jelentése: védett valamitől) szóból ered és arra utal, hogy az egyed ellenáll a mikrobás fertőzéseknek. Az immunitás fogalma ma már sokkal szélesebb, mivel magában foglalja a szervezet számára idegen anyagok felismerését és kiküszöbölését célzó valamennyi reakciót is. Mikrobiológiai értelemben az immunitás fogalma a szervezet védettségét, illetve fokozott ellenálló képességét jelenti valamilyen kórokozóval vagy annak toxikus anyagaival szemben. Az immunitás ilyen értelemben a szervezetnek meghatározott állapota. Ez leggyakrabban úgy jön létre, hogy a szervezet természetes körülmények között találkozik a kórokozóval, és ennek következménye a szervezet immunreakciója (természetes úton szerzett aktív immunitás). Máskor mesterségesen juttatjuk a kórokozókat vagy azok termékeit a szervezetbe azzal a céllal, hogy immunitás kialakítására késztessük (mesterségesen kiváltott aktív immunitás). Kialakulhat immunitás úgy is, hogy egy adott kórokozóval szemben hatékony, kész ellenanyagokat viszünk a szervezetbe (mesterségesen létesített passzív immunitás) vagy az ellenanyagok természetes úton, az anya colostrumával, ill. diaplacentárisan madarakban pedig a tojásszik útján jutnak az újszülött állatba (maternalis immunitás). A védettség bármely formájáról legyen is szó, az ellenanyaghatás mellett a szervezet más, ún. nemspecifikus védekező mechanizmusaiis szükségesek ahhoz, hogy a szervezet felülkerekedjék a kórokozó támadásával szemben, illetve hogy azt káros következmények nélkül elviselje. Az immunitás rendkívül bonyolult összefüggésű folyamatok eredménye, amely meghatározott sejtrendszerek működésén, együttműködésén keresztül valósul meg. A sejtrendszerek az immunitás folyamatában szigorú munkamegosztás szerint működnek, és amíg egyesek azzal tűnnek ki, hogy az idegen anyagot (antigént) felismerik, addig mások az ellenanyagokat termelik vagy reakcióra képes, ún. immunocytákká differenciálódnak, és találni olyan sejteket is, amelyek a sejtcsoportok közötti együttműködést koordinálják. Általánosságban úgy fogalmazhatunk, hogy az immunitás olyan állapot, amelyben a szervezet felismeri a számára idegen anyagokat (pl. a kórokozókat vagy azok anyagcseretermékeit) és ezekkel szemben szigorúan meghatározott lépéseken át, célzott immunválaszt ad. Az immunválasz formája többféle lehet. Abban az esetben, ha a behatoló fertőző ágenssel szemben a vérsavóban megjelenő ellenanyagok dominálnak, akkor humorális immunválaszról beszélünk, ha viszont a 314
335 Immunológia kórokozó megsemmisítése érdekében bizonyos sejtcsoportok proliferációja játssza a döntő szerepet, akkor celluláris immunitásról van szó. Az immunválasz általában az egész szervezetre kiterjed, és ezt az immunválasz szisztémás formájának nevezzük. Előfordul azonban az is, hogy a specifikus védekezés csak helyileg, pl. a légző- vagy emésztőkészülékben érvényesül, amikor is lokális immunitásról beszélünk. Az immunitás fentiekben említett megnyilvánulási formái egymástól csak meghatározott esetekben különíthetők el élesen. Legtöbbször csak abban van különbség, hogy valamelyik forma dominál az adott védekezési folyamatban. A szervezet védekezésének bármelyik formája a kórokozó elpusztítását vagy káros hatásának kiküszöbölését szolgálja. Az immúnis szervezetbe bejutó kórokozó vagy idegen anyag megsemmisítése a szervezet számára általában nem jár káros következményekkel, főként akkor nem, ha azok semlegesítése a vérpályában vagy a szövetnedvekben zajlik le. Adódhat azonban olyan eset is, amikor az antigén ellenanyag kapcsolat a sejtek felületén megy végbe, és ilyenkor a védekezési folyamat károsítja a sejteket vagy szöveteket (allergiás kórképek, túlérzékenységi reakciók). A fertőző betegségek okozta káros következményeket immunológiai szempontból úgy határozhatjuk meg, hogy azok tulajdonképpen a szervezet kvantitatív vagy kvalitatív védekezési elégtelenségének következményei. A szervezet sorsa a kórokozóval való találkozás esetében ugyanis attól függ, hogy milyen a viszony a szervezet védekezési készsége és a kórokozó virulenciája között. Ha az egyensúly ez utóbbi javára billen, a szervezet életműködésében olyan zavarok keletkeznek, amelyekből csak nehezen vagy egyáltalán nem tud kigyógyulni, és elpusztul. Ha viszont a szervezet védekezése felülkerekedik a kórokozó támadásával szemben, akkor átvészeli a betegséget, és hosszabb-rövidebb vagy akár egy életre szóló védettségre tesz szert az adott kórokozóval szemben. Az embert és az állatvilágot fenyegető fertőző betegségek száma, különösen az elmúlt évtizedekben, újabb kórképekkel gyarapodott. Akár az újonnan felismert betegségek, akár a klasszikus kórképek jelentős részének, csupán igazgatási intézkedésekkel történő visszaszorítása vagy felszámolása reménytelen vállalkozásnak tűnhet. Ebből eredően Jenner, PasteurésKoch munkásságának korszakát követően mindennapi törekvéssé vált olyan vakcinák kifejlesztése, amelyek a lehető legkisebb kockázat mellett, a lehető leghatékonyabb immunitást képesek kiváltani Az emlősök immunrendszere Az immunsejtek eredete. Az embrionális élet során a lymphoid őssejtek a májban és a saccus vitellinusban termelődnek. A magzat fejlődésének későbbi szakaszában, majd az extrauterinális életben is, a csontvelő a legfontosabb forrása a lymphoid sejteknek, amely képes sejtekkel ellátni valamennyi lymphoid szervet Centrális (primer) nyirokszervek Centrális vagy elsődleges nyirokszervnek nevezzük azokat a szerveket, ahol a lymphocyták termelődnek és differenciálódnak. Az elsődleges (centrális) nyirokszervek közé tartozik a thymus és a bursa Fabricii (madarakban), amelyekben szövettanilag kéreg- és velőállomány különíthető el. Emlősökben a bursának megfelelő ún. bursaekvivalens szerv a csontvelő. Az elsődleges nyirokszervek legfőbb feladata, hogy szabályozzák a lymphocyták képződését és differenciálódását. A thymusban differenciálódott sejteket T-lymphocytának, a Fabricius-féle tömlőben, illetve a bursaekvivalens szervekben differenciálódottakat pedig B-lymphocytáknak nevezzük. A centrális szervekből kikerülő lymphocyták egy része a másodlagos (perifériás) nyirokszervekben (a lépben, a nyirokcsomókban, a tonsillákban, a Peyer-plakkokban) telepszik meg. A T-lymphocyták a perifériás nyirokszervek ún. T-dependens, míg a B-lymphocyták a B-dependens területeket kolonizálják Thymus A magzati élet során az ide vándorló őssejtek a kéreg- és velőállományon áthaladva, részben a thymusepithel-, részben az ún. interdigitális sejtek hatására T-lymphocytákká differenciálódnak (151. ábra). Ez a folyamat három érési szakaszt jelent: 151. ábra - A thymus kéreg- és velőállománya (hematoxilin-eozin festés, 160 ) 315
336 Immunológia I. stádium: a sejtek felületén megjelennek a CD2-nek (Cluster of Differentiation) nevezett antigének, plazmájukban pedig az ún. gamma-gén aktiválódik, ami a T-sejt-receptor egyik típusának gamma-láncát kódolja. II. stádium: a sejtek elveszítik eddigi markerüket, majd felületükön a CD4, CD5 és a CD8 antigének fejeződnek ki, a sejtben pedig a T-sejt-receptor ß-láncát kódoló gén aktiválódik. A többi CD marker ezt követően a sejt pillanatnyi állapotától függően jelenhet meg vagy tűnhet el a sejtek felületéről. 316
337 Immunológia III. stádium: a CD5 marker eltűnik a sejtekről, és a végső differenciálódás olyan módon fejeződik be, hogy a felületen a továbbiakban vagy csak a CD4 marker marad meg és ezek válnak a T-helper-inducer sejtekké, vagy csak a CD8 markert tartják meg, és ilyen módon képviselik a T-killer vagy a T-szuppresszor sejtek populációját. A sejtek a 2 3 napot igénylő differenciálódás után kilépnek a thymusból a véráramba és a perifériás lymphoid szervek T-zónáiban kolonizálódnak. A thymus sebészi úton való eltávolítása azt igazolja, hogy az újszülöttekben fontos forrása a perifériás lymphocytáknak, vagyis a T-sejteknek, amelyek a celluláris immunválaszt mediálják. Eredetileg ugyan a csontvelőből származtak, de a thymusban tanulják meg a saját és nem saját struktúrák megkülönböztetését. Azok a sejtek, amelyek autoreproduktívak, a programozott sejthalálnak esnek áldozatul, azaz a thymocyták legnagyobb része a thymuson belül elpusztul. Más részük, amelyek képességet szereztek az idegen felismerésére (pl. borjakban kb. 25%), elhagyja a thymust és kolonizálja a másodlagos nyirokszervek meghatározott zónáit. Az újszülött állatokon végzett thymectomiakövetkezményeit a 33. táblázattünteti fel: rohamosan csökken a lymphocyták száma a nyirokcsomók és a lép T-sejt zónáiban, csökken az ún. szövetkilökődési reakció, vagyis csökken a celluláris immunválasz, csökken a humorális immunválasz mértéke, ezen belül elsősorban az IgG immunglobulin-osztály képzése, viszont az ún. thymus-independens antigénekre adott immunválasz normális szinten marad, az egyed fokozottan érzékenyebbé válik a fertőzések iránt, és rövid időn belül elpusztulhat vagy növekedésében visszamaradhat. 33. táblázat - A thymectomia és a bursectomia következményei Megnevezés Thymectomia Bursectomia Keringő lymphocyták száma +++ T-depedens zóna +++ Szövetkilökődési reakció +++ B-depedens zóna Plazmasejtek száma Ellenanyagképzés = nagymértékben csökken + = kismértékben csökken = nem változik A felnőtt állatokon végzett thymectomia vagy a thymus egyéb okból való károsodása nem jár azonnali következményekkel, hanem csak hónapokkal később figyelhető meg a T-lymphocyták számának csökkenése, valamint a celluláris immunválasz-képesség mérséklődése. Az újabb vizsgálatok eredményei szerint a bőr, ami a thymushoz hasonlóan entodermális eredetű, fontos helye a T-sejtek érésének, és egyes felfogások szerint ilyen alapon a centrális lymphoid rendszerhez sorolható. A bőrben található egy olyan T-sejt-szubpopuláció ugyanis, amely másutt nem fordul elő, és a keratinocyták valamint a Langerhans-sejtek közreműködésével fontos szerepet játszik a lokális védelemben (lásd SALT c. fejezetben) Csontvelő (bursaekvivalens szerv) 317
338 Immunológia Emlősállatokban a bursa Fabriciinek megfelelő, ún. bursaekvivalens szerv a vörös csontvelő, ahol az őssejtekellenanyag-termelésre képes B-lymphocytákkádifferenciálódnak, majd innen a másodlagos lymphoidszervekbe vándorolnak, ahol antigéninger hatására alakulnak kiaz ellenanyagképzésre érett utódsejtek Ileocaecalis Peyer-plakkok A kérődzőkben, elsősorban a bárányokban az ileocecalis Peyer-plakkok nagysága eléri a thymusét, és különlegessége, hogy itt rendkívül nagy mennyiségű B-lymphocyta (3, ) képződik óránként, és ebből 0, /óra kerül a véráramba. A bárányokban a csontvelő egyébként kevesebb B-sejtet tartalmaz, mint pl. az egerekben, ezért úgy tűnik, hogy ebben az állatfajban funkciója a bursa Fabriciivel egyezik. A jejunum Peyer-plakkjainak lymphoid sejtjeiből a T-sejtek mintegy 30%-ot képviselnek és ezek már a szekunder nyirokszervekhez tartoznak Perifériás (szekunder) nyirokszervek A magzati fejlődés viszonylag késői szakaszában alakulnak ki. Mesodermális eredetűek, és az egész élet során megmaradnak. Sebészi úton való eltávolításuk nem csökkenti a szervezet immunválasz-képességét. A bennük levő macrophagok, dendritikus sejtek, valamint a T- és a B-sejtek megkönnyítik az antigének megkötését és prezentálását Nyirokcsomók Emlősökre jellemző lymphoid szerv, amely afferens és efferens nyirokutakkal rendelkezik. A nyirokcsomók folliculusainak centrumában (152. ábra) differenciálódnak a B-lymphocyták plazmasejtekké (153. ábra). A paracorticalis zónát főleg T-lymphocyták alkotják. Fontos funkciójuk továbbá a lympha szűrése is. Borjakban pl. a ductus thoracicuson keresztül 500 ml lympha áramlik át óránként, amely lymphocytát tartalmaz ábra - Plazmasejtek csoportja a lép folliculusaiban (ELMI, 14500, az OÁI felvétele) 318
339 Immunológia 153. ábra - Centrum germinativum a nyirokcsomóban (hematoxilin-eozin festés, 160 ) Az immunválasz kinetikája szempontjából fontos, hogy az antigén-ellenanyag komplexeket a subcapsularis sinusokban lévő macrophagok és a follicularis dendritikus sejtek hónapokon át képesek megkötve tartani az F c és a C 3 receptoraik révén, ezért állandó ingert képeznek a csíraközpontokra, ahol a B-memóriasejtek proliferálódnak. A sertés, az elefánt és a rinocérosz nyirokcsomójának felépítése eltérő a többi emlősétől, mivel a medulla a perifériás részen található (ez abból ered, hogy a nyirokcsomók aggregált csomócskákból tevődnek össze, amelyek kéreg része esik a középpont felé). A nyirokcsomókban az antigének megkötés kétféle módon történhet: A medulla macrophagjai ellenanyagok jelenléte nélkül kötik meg az antigéneket, ami az első antigénexpozíció alkalmával szokott bekövetkezni. Ezt követően a macrophagok a cortex folliculusaiba emigrálnak és bemutatják az antigéneket a T- és a B-sejteknek, ahonnan a B-sejtek a medullába vándorolnak és itt kezdődik az ellenanyagok termelése. A dendritikus sejtek a cortex szekunder folliculusaiban a cytoplasma megnyúlásával olyan membránt képeznek, amelyen az antigéneknek át kell haladnia, és itt megkötődnek, amihez ellenanyagok jelenléte is szükséges Lép Amíg a nyirokcsomók a lympha szűrését szolgálják, addig a lép a vér legnagyobb szűrője, és képes az idegen anyagok, valamint az elöregedett sejtek megkötésére. A lép összetett szerv, és a vörös pulpa a haemopoeticus rendszer része, a fehér pulpa pedig a lymphoid rendszer tartozéka. Ez utóbbit a marginális zóna veszi körül, ahol a centrális artériák kapillárisai szabadon végződnek és rendkívül fontos szerepet játszanak a lymhocyták recirkulációjában. A centrális artériák körül található az a periarteriolaris lymphoid hüvely (PALS), amelyben a T-sejtek találhatók, és ezek zónáját B-sejtek veszik körül. 319
340 Immunológia Az emésztőcsőhöz asszociált lymphoid szövet (GALT: gut associated lymphoid tissue) Több önálló nyiroktüszőből álló, különböző nagyságú képződmények összessége. Ide tartoznak a tonsillák, a Peyer-plakkok, valamint az emésztőcső nyálkahártyájában elszórt, magános lymphoid képletek, az ún. nyiroktüszők. Az emésztőcső lymphoid szövetei fontos szerepet játszanak a bemeneti kapuban a kórokozók elleni védekezésben és az ún. lokális immunitás kialakulásában A bőrhöz asszociált lymphoid szövet (SALT: skin associated lymphoid tissue) A legutóbbi évek kutatásai derítették ki, hogy a bőr, mint a legkiterjedtebb szerv, integrált immunreakciókra képes. A reakciókban a T-sejtek, a Langerhans-típusú sejtek és a keratinocyták vesznek részt. A Langerhanssejtek felületén megjelenő antigéneket a T-sejtek ismerik fel, amelyeken ennek következményeként az IL 1 receptorok fejeződnek ki. A keratinocyták által termelt IL 1 megkötődik a T-sejt IL 1 receptorán, aminek hatására IL 2 receptorok fejeződnek ki, és a T-sejt IL-2-t szekretál. Ez kapcsolódik más T-sejtek IL 2 receptorához, ami a T-sejtek clonalis differenciálódását váltja ki (154. ábra) ábra - A SALT működése Phagocytarendszer Az emlősállatok phagocytosisra képes sejtjei, mint az immunválasz kialakulásában közreműködő sejtek, kétféle rendszerhez tartoznak. A myeloid rendszerhez tartozó sejtek gyors reakcióképességgel rendelkeznek, de aktivitásuk csak rövid távon marad fenn, ezzel szemben a mononuclearis phagocytarendszer sejtjei lassabban reagálnak, viszont aktivitásuk hosszabb időn át érvényesül és ismételt phagocytosisra is képesek Myeloid rendszer 320
341 Immunológia Az ide tartozó phagocyta sejtek a csontvelőből származnak. Rövid életű (2 3 nap) sejtek, szemben a monocytamacrophagokkal, amelyek élettartama hónapokban vagy években mérhető. A vérben lévő fehérvérsejtek 60 70%-át teszik ki. Az endothelsejteken és az intercellularis réseken képesek áthatolni, így extravascularisan is előfordulnak. A sejtek plazmája granulumokat tartalmaz (granulocyták), magjuk szabálytalan alakú és szegmentált (polimorphonuclearis sejtek). A granulumok festődése alapján a sejteket neutrophil, eosinophil vagy basophil granulocytáknak nevezzük. Neutrophil granulocyták (gennysejtek, microphagok): 90%-os arányt képviselnek a granulocyták között. A húsevőkben 60 70, a kérődzőkben 20 30%-át adják a vér fehérvérsejtjeinek. Felületükön számos receptorféleséget hordoznak. Tulajdonképpen a védelmi rendszer frontvonalát képezik, mivel elsőként érik el pl. a baktériumok behatolási helyét. Bekebeleznek és megemésztenek mindenféle idegen vagy idegenné váló anyagot. Eosinophil granulocyták: a phagocytosis nem elsődleges funkciójuk, de képesek erre. Meghatározott ingerek hatására degranulálódhatnak (hasonlóan a basophil granulocytákhoz és a hízósejtekhez) és a felszabaduló ún. anaphylatoxinok révén allergiás folyamatokat válthatnak ki. Ez a típusú reakció érvényesül olyan organizmusokkal (pl. parazitákkal) szemben is, ahol a phagocytosis nem jöhet létre. Basophil granulocyták és hízósejtek (mastocyták): morphologiai alapon olykor nehezen különböztethetők meg egymástól. A hízósejtek a nyálkahártyákban, a hámsejtekkel társulva találhatók, és proliferációjuk T-dependens. Ezzel szemben az egyes szervek kötőszövetében előfordulnak olyan hízósejtek is, amelyek T-independensek. Granulumaik heparint, histamint SRS-A faktort (lásd később) tartalmaznak. Degranulálódásuk akkor szokott bekövetkezni, ha a felületükön található reaginek (pl. IgE) allergénekkel kötődnek (lásd az Allergia c. fejezetben). Thrombocyták: egyéb élettani szerepük mellett a gyulladásos folyamatokban játszanak szerepet. IgG-, valamint IgE-kötő receptoraik vannak, és olyan anyagokat szabadítanak fel, amelyek fokozzák az érfal permeabilitását és aktiválhatják a komplement rendszert Mononuclearis phagocytarendszer Macrophagok: kerek magvú sejtek, azonos eredettel, hasonló morphologiával és funkcióval. Funkcióik közé nemcsak az idegen anyagok, antigének bekebelezése és eliminálása tartozik, hanem azok prezentálása is az idegen anyagokat felismerő sejtek felé, ami az immunválasz indukciójában alapvető fontosságú. További szerepük olyan mediátor anyagok kiválasztása, amivel az immunválasz erősségét fokozzák. Ellenőrzik továbbá a gyulladásos folyamatokat, és részt vesznek a károsodott szövetek regenerálódásában. A mononuclearis phagocyták a szervezet minden részén megtalálhatók, és megnevezésük ennek megfelelően változó: a vérben monocyta,a kötőszövetben hystiocyta, a májban Kupfer-sejt,az agyvelőben microglia,a tüdőben alveoláris macrophagnaknevezzük. Nagy számban találhatók a lép szinuszoidjaiban, a csontvelőben és a nyirokcsomókban is. Felületükön számos receptor található (155. ábra). Közülük a CD64 egy ellenanyag-receptor, ami a lymphocyták felületén nem fordul elő ábra - Macrophagok receptorai 321
342 Immunológia A macrophagok aktiválódhatnak közvetlenül az antigének hatására, amikor pl. gyulladásos folyamatok esetén az adott területen akkumulálódnak, aktiválódhatnak azonban interferonok hatására is. Ilyenkor növekszik a lizozimtermelésük, valamint fokozódik a sejtfelületi receptorok kifejeződése. Az antigének emésztése, illetve prezentálása kétféleképpen mehet végbe: Exogén antigének: azok a macrophagok (lép, máj, thymus), amelyek sejtfelületükön MHC II. antigénnel rendelkeznek, és cytoplasmájukban az antigéneket fragmensekre hasították (15 20 aminosav), amely fragmensek a plasmában az MHC II. molekulákhoz kötődnek, kijutnak a sejtfelszínre, és mint a megváltozott saját struktúrát bemutatják a T-helper (CD4) sejteknek. Az olyan macrophagok, amelyek felületén MHC II. antigén nincs, azok az immunválasz indukciójában nem tudnak részt venni. Ebbe a folyamatba csak akkor tudnak bekapcsolódni, ha aktiválódnak és MHC II. fejeződik ki a sejtfelületen. Endogen antigének: a sejtben szaporodó vírusok proteinjei vagy partikulái a plasma MHC I. molekuláival kötődve a felszínre jutnak, és a megváltozott struktúrát a T-killer (CD8) sejtek ismerik fel. A macrophagok által termelt mediátor anyagok (interleukinek) sajátosságait az Interleukinek c. fejezet tárgyalja. Dentriticus (antigénprezentáló) sejtek. A szervezetben mindenütt előfordulnak, de főként a lymphoid szervekben, a T- és a B-sejtek zónáiban. MHC II. antigénnel rendelkező sejtek, de phagocytálóképességük alacsony. Elsősorban az ellenanyagokkal kapcsolódott antigéneket (immunkomplexeket) kötik meg. Fontos tulajdonságuk, hogy felületükön az antigéneket akár 3 hónapon át is tárolni képesek Lymphocyták A lymphocyták különböző átmérőjű, kerek magvú, általában keskeny plazmájú sejtek. Fénymikroszkópos vizsgálattal morfológiai alapon nem különböztethetők meg, viszont eredetük, receptoraik, enzimjeik és mitogénekkel szembeni reakcióik alapján három csoportba sorolhatók: a thymusból eredő T-lymphocytákra és a bursa vagy bursaekvivalens (csontvelő) eredetű B-lymphocytákra. Azokat a lymphocytákat, amelyek a fenti markerek alapján egyik csoportba sem sorolhatók, NK (natural killer), természetes killer sejtekneknevezzük. A lymphocyták a fehérvérsejteknek kb. 20%-át teszik ki a vérkeringésben. Legtöbbjük hosszú életű, és mint memóriasejt sok éven át aktív marad. A lymphocyták arányát a perifériás vérben a 34.táblázat mutatja be. 34. táblázat - Lymphocyták százalékaránya a perifériás vérben Állatfaj T-lymphocyta B-lymphocyta 322
343 Immunológia Szarvasmarha Ló Juh Sertés Kutya Macska Tyúk Ember A lymphocyták felületi struktúrái A lymphocyták differenciálódási antigénjei. A differenciálódási antigéneket CD antigéneknek (cluster of differentiation) nevezzük, és sorszámmal jelöljük. Ezek a struktúrák a membránon található heterogén molekulacsoportok, amelyek a sejtosztódás különböző stádiumaiban jelennek meg, illetve tűnnek el a felszínről. Felismerésüket és egymástól való megkülönböztetésüket a monoclonalis ellenanyagok alkalmazása tette lehetővé, mivel az ilyen vizsgálatokkal kimutatható antigénjeik alapján csoportokba sorolhatók (emberben pl. ma már kb. 80-féle leukocyta-differenciálódási antigén ismeretes). Így pl. a CD3 a T-sejtek antigénkötő receptorához társult antigén, a CD4 marker azokon a sejteken fordul elő, amelyek az ún. MHC II. fehérje (lásd később) felismerésére szolgálnak és helper (segítő) aktivitásra képesek, a CD8 pedig a T-killer sejtek felületén kimutatható antigént jelöli. A CD molekulák, az MHC antigének (lásd később), a béta-2 mikroglobulin és egyes Fc-receptorok az ún. immunglobulin szupercsalád tagjai. Ezek a molekulák egy ősi béta-2-mikroglobulinszerű molekulából fejlődtek ki, és a sejtkölcsönhatásokban játszanak szerepet. A CD44 antigén a phagocytáló sejtek felületén, lymphocytákon, csontvelősejteken, granulocytákon, máj-, vese-, idegsejtek felületén mutatható ki. A CD45 antigén minden leukocytán megtalálható. A B-sejtek differenciálódási antigénjei kevésbé ismertek. A legfiatalabb sejtek Ia és CD19 antigént hordoznak, melyek közül az Ia szigorúan B-sejt-specifikus így a leukémiák elkülönítésében fontos. A további differenciálódás során a CD20, majd a CD21, végül a plasmasejteken a CD38 antigén jelenik meg. Szarvasmarha lymphocytáinak antigénjei: monoclonalis ellenanyagokkal a CD 2-t (BOT2-t), a CD3, valamint a CD4 (BOT4) és a CD8 (BOT8) markereit határozták meg. A BOT2 a legtöbb perifériás lymphocytán kifejeződik. A BOT4 és a BOT8 antigének az MHC-korlátozást (lásd később) szabályozzák. A sertés lymphocytáinak antigénjei: eltérőek más fajokban talált viszonyoktól. A T-sejtek 25%-ában pl. mind a CD4, mind a CD8 antigén kifejeződik. A humán leukocyta antigénekre specifikus monoclonális antitestek közül több képes reagálni a szarvasmarha, a juh, a kecske, a sertés, a ló, a macska, a kutya, a nyérc és a nyúl egyes differenciálódási antigénjeivel Receptorok A lymphocyták receptorai rendkívül fontos szerepet játszanak az immunválasz kialakulásában és kinetikájában. Ezek teszik lehetővé az antigének felismerését, prezentálását és a sejtek közötti együttműködés szabályozását. 323
344 Immunológia Proteinreceptorok: olyan katalitikus fehérjék, amelyek az antigén sejthez való kötődése után enzimként viselkednek és részt vesznek a sejtanyagcsere szabályozásában. Antigénkötő receptorok: közülük a CD3, a CD4 és a CD8 a legfontosabbak. További receptorok találhatók még a lymphocyták felületén, amelyek a citokinek, az antitestek, a komplement, valamint a hisztamin és a transferrin megkötésére szolgálnak. Egyéb sejtfelületi proteinek közé lehet sorolni azokat a fehérjéket, amelyek funkciója még kevésbé ismert. Közöttük a legfontosabbak a CD1, a Thy 1, a BoWC1 és a CD45. A BoWC1 a kérődzőkben magas számban előforduló kettős negatív sejtek (CD4, CD8 ) felületén található glükoprotein, és ezek a sejtek a nodulos haemalesekben és a thymusban fordulnak elő nagy számban. Adherenciafaktorok Alymphocyták egymással és más sejtekkel való együttműködését a sejtmembrán- proteinek szabályozzák. Ezek a fehérjék, mint ún. integráló- és szelektálófehérjék, szintén az immunglobulinok szupercsaládjába(lásd az Immunrendszer molekuláris egységei c. fejezetben) tartoznak. Az integrinek alfa- és béta-láncból álló sejtmembránproteinek, és a sejt sejt kapcsolatokat szabályozzák. Három alcsaládra (béta 1, 2, 3) oszthatók. A szelektinek a lymphocyták szövetek felé történő migrációját szabályozzák T-lymphocyták A csontvelő eredetű őssejtek közül a thymusban differenciálódó csoport képviseli a T-lymphocytákat. Ezek egy része a nyirok vagy a véráram útján elhagyja a thymust és vagy a keringésben marad, vagy megtelepszik a másodlagos nyirokszervekben, mégpedig a nyirokcsomókban paracorticalisan, a lépben periarteriolarisan, a Peyer-plakkokban pedig intrafollicularisan. Jellemző rájuk, hogy hosszan élő, recirkuláló sejtek. Ez utóbbi annyit jelent, hogy a másodlagos nyirokszervekből időről időre újra bejutnak a keringésbe, és hosszabbrövidebb vándorlás után visszatérnek a nyirokszervek T-dependens zónáiba. A keringő lymphocyták zömét (kb %-át) teszik ki. A T-lymphocytáknak fontos szerepük van a celluláris immunválaszban, de sejtkölcsönhatásokon keresztül befolyásolják az ellenanyag-termelést is. A felületükön kifejeződő struktúrák (156.ábra) jellegzetessége több tényező függvénye, mivel ezek a sejt érettségi stádiuma, az aktiváltság állapota, valamint a differenciáltság foka szerint változnak. Ennek egyik példája a humán T-sejt, amely éretlenül CD9 és CD10 markeret hordoz, majd a thymusba kerülve elveszíti a CD9-et és helyébe felveszi a CD4, a CD6 és a CD8 struktúrákat. Ezek a későbbiekben kétféle szubpopulációra oszlanak: kooperáló sejtek (CD4 +,CD8 ) amelyek részt vesznek az immunválaszban, szuppresszor/killer sejtek (CD4,CD8 + ), amelyek cytotoxicus sejtek, de szuppresszorként is aktívak ábra - T-lymphocyták receptorai 324
345 Immunológia A T-és a B-lymphocyták funkcióinak meghatározásában alapvető változást hozott azok membránstruktúrájának megismerése, mivel ezeken keresztül kerülnek kapcsolatba az immunválaszban együttműködő sejtekkel, továbbá az antigénekkel vagy az immunkomplexekkel. Ennek megfelelően a membránjukon felismerhető differenciálódási antigének alapján, illetve funkcióik szerint a lymphocytákat az alábbiak szerint jellemezhetjük. A humorális, illetve a celluláris immunfolyamatokban részt vevő lymphocyták szubpopulációkká való differenciálódását vázlatosan a 157. ábra mutatja ábra - A lymphocyták differenciálódása 325
346 Immunológia T-lymphocyta-szubpopulációk Iniciator/memória lymphocyta (T i): az immunválasz megindításában játszanak döntő szerepet. Hosszú életű sejtek. Feladatuk az idegen struktúrák felismerése, és az antigénnel való kölcsönhatás után a regionális nyirokcsomókban a lymphocyták akkumulálódásának elősegítése. T-helper/kooperáló lymphocyta (T h) CD4: a humorális és a celluláris immunválasz valamennyi formájában részt vevő és az immunválaszt elősegítő sejtpopuláció. Fokozni képes a B-sejtek ellenanyag-termelését, a T- killer és a T-szuppresszor sejtek proliferációját. Egyes feltételezések szerint az immunmemóriát is ez a szubpopuláció hordozza. A T-sejtek több mint 50%át a CD 4 markert és az MHC II. antigént viselő sejtek képviselik. Ezek egyik alcsoportja a T h-1, amelyik interleukin-2-t, gamma-interferont termel és a protektív immunválaszban játszik meghatározó szerepet, míg a T h-2 alcsoport interleukin-4-et, valamint interleukin-5-öt termel és a hypersensitivitási reakciók kialakításában vesz részt. T-szuppresszor (T s) lymphocyta: a humorális és a celluláris immunválasz kialakulását egyaránt gátló sejtek, így az immunválasz szabályozásában központi szerepet játszanak. Részt vesznek továbbá az immuntolerancia létrehozásában, valamint az autoimmun folyamatok kialakulásában. T-killer lymphocyták (T k) CD 8: a celluláris immunválasz effektor sejtpopulációját képviselik, részt vesznek a szövetkilökődési reakcióban, valamint a cytotoxicus és a késői típusú hypersensitivitási reakcióban. A T-killer sejtek nem képeznek egységes sejtpopulációt. Hosszú életű sejtek B-lymphocyták Emlősökben a csontvelőből, Peyer-plakkokból, madarakban pedig a Fabricius-tömlőből származnak, és innen közvetlenül jutnak a perifériás nyirokszervekbe. Jellemző rájuk, hogy a plazmájukban immunglobulinok vannak, amelyek a membránon is kifejeződnek (158. ábra). Ez utóbbiak az ún. antigénkötő receptorok, amelyek konjugált anti-immunglobulinokkal, immunfluoreszcenciával (IF) kimutathatók. Legtöbbjük IgM- és IgDmolekulát hordoz. A keringésben nagyon kevés sejten található IgG-, IgA- vagy IgE-molekula, de pl. a bélfalban az IgA-pozitív sejtek vannak túlsúlyban ábra - B-lymphocyták receptorai 326
347 Immunológia A B-lymphocyták az ellenanyag-termelő sejtek praecursor (előd) sejtjei. Rövid életű sejtek és számuk a vérkeringésben a T-lymphocytáknál kisebb (30%). Antigéninger hatására blastos átalakuláson mennek át, amelyből meghatározott érési folyamatokon keresztül átalakulnak ellenanyag-termelő plazmasejtekké, amelyek a humorális immunválasz effektor sejtjei. A B-sejtek mint prezentáló sejtek is szerepelhetnek,a felületükön előforduló antitestreceptorukkal megkötik az antigéneket, és azok fragmenseit az MHC II antigénjükön keresztül bemutatják a T-helper sejteknek B-lymphocyta szubpopulációk B1 sejtcsoport: thymusindependens sejtek, amelyek a csontvelőben és a lépben egyaránt előfordulnak. B2 sejtcsoport: thymusdependens sejtek, és elsősorban a lép állományában találhatók. B-memória sejtek: eddig pontosan nem jellemzett lymphocyták, de annyi bizonyos, hogy hosszan élő és recirkuláló sejtek. Plazmasejtek: az antigénnel stimulált B-lymphocytákból differenciálódnak. Átalakulásuk közben elveszítik addigi markereiket, beleértve az Ig, Fc, és a C3 receptorokat is. Megjelenik viszont felületükön a csak rájuk jellemző CD38 antigén. A plazmasejt működésének intenzitására jellemző, hogy másodpercenként mintegy 300 Ig-molekula szintézisére képes. A differenciált plazmasejtek kb. 3 6 nap alatt elpusztulnak, majd újakkal pótlódnak NK (natural killer) sejtek Morfológiailag hasonlóak a lymphocytákhoz, de nem rendelkeznek az ezeken található markerekkel. Felületükön C3 (komplement) és Fc-receptorok találhatók. Részt vesznek a cytotoxikus reakciók kialakításában és a daganatsejtek elpusztításában (lásd a Daganatokkal szembeni immunválasz c. fejezetben) Antigének 327
348 Immunológia Az antigének definíciója az újabb és újabb felismeréseknek megfelelően többször módosult. Mai felfogásunk szerint antigén minden olyan anyag, amely egy adott szervezetet immunreakcióra késztet, és a képződött ellenanyagokkal vagy a vele szemben elkötelezett immunsejtekkel specifikusan reagálni képes. Az antigén elnevezés (anti: ellene, genere: nemzeni) DETRE (Deutsch) LÁSZLÓ magyar mikrobiológustól ered (1897). A megnevezés olyan anyagokra (fehérjékre, poliszacharidokra, sejtekre, sejtalkotórészekre, vírusokra stb.) vonatkozik, amelyeket egy adott szervezet immunrendszere idegen -nek, tehát a saját genetikai anyagától eltérő struktúrának ismer fel. A ló szérumalbuminja pl. a lóban fiziológiás fehérje, de más állatfaj immunrendszere számára idegen anyag, tehát antigénként hat, és immunválaszt indukál. Az antigén ilyen értelemben funkcionális fogalom, és sajátosságai csak az adott szervezet reakciójával jellemezhetők. Az antigének két alapvető funkcióval rendelkeznek: immunogenitás vagy produktív funkció, ami azt jelenti, hogy adott szervezetben immunválaszt indukálnak, antigenitás vagy kötődési képesség, ami alatt azt értjük, hogy a vele szemben képződő ellenanyagokkal vagy immunocytákkal specifikusan képesek kötődni. Attól függően, hogy az antigénmolekula mindkét funkcióval rendelkezik-e vagy ezek egyike hiányzik, az antigéneket a következőképpen csoportosíthatjuk: teljes antigének (immunogének): egyaránt képesek immunválaszt kiváltani és a képződött ellenanyagokkal, valamint az immunsejtekkel specifikusan kötődni, haptének: olyan anyagok, amelyek önmagukban nem immunogének, immunválaszt nem indukálnak, viszont kötődni képesek az ellenanyagokkal vagy az immunsejtekkel, és az ellenanyagokkal in vitro, látható szerológiai reakciót adnak, haptidek: nem immunogének és az ellenanyagokhoz való kötődésük nem hoz létre látható szerológiai reakciót. A szervezet immunrendszere meghatározott feltételek között eltűrheti, tolerálja az idegen anyag jelenlétét, és ilyenkor az antigént tolerogennek nevezzük. Az antigénnek az immunrendszer felismerőreceptoraival kapcsolódó részei a determináns vagy epitop csoportok, amelyek az ún. immundomináns csoportot alkotják, ami az antigén fajlagosságát meghatározza. Ez utóbbi struktúrában akár természetes, akár mesterséges beavatkozás hatására létrejövő szerkezeti változások sokkal nagyobb mértékben befolyásolják az antigén specificitását, mint az antigén egyéb részeit érintő módosulások. Az antigének megkülönböztetésére más elnevezések is használatosak: T-dependensantigének: elsősorban a T-lymphocyták reakcióit váltják ki (pl. egyes Salmonella O- és Viantigének), T-independens antigének: a B-lymphocytákat stimulálják, és az immunválasz kialakulásához nem szükséges a T-lymphocyták kooperációja (pl. az E. coli lipopoliszacharidja). Az antigének a szerológiai reakciókban kimutatható ellenanyagok sajátosságai alapján is megkülönböztethetők: agglutinogének: a szervezetben olyan ellenanyagok (agglutininek) termelődését indukálják, amelyek a korpuszkuláris antigéneket (pl. baktériumsejteket) az in vitro szerológiai próbákban összecsapják (agglutinálják), precipitinogének: hatásukra a vérsavóban megjelenő ellenanyagok (precipitinek) az oldott antigéneket in vitro kicsapják (precipitálják), Az antigéneknek azt a csoportját, amelyek a szervezetben allergiás (túlérzékenységi) reakciókat okoznak, allergéneknek nevezzük. 328
349 Immunológia Az antigének osztályozása olyan szempontok szerint is lehetséges, hogy milyen a viszonyuk a szervezethez, amelyben jelen vannak: autoantigének: a szervezet saját anyagai (pl. szemlencse, hereszövet), amelyekkel az immunsejtek az embrionális érés során nem találkoztak, ezért ha adott feltételek között az immunrendszerrel kapcsolatba kerülnek, velük szemben immunválasz alakul ki, ami autoimmun betegségek kialakulásához vezet. Autoimmun folyamatok olyan módon is létrejöhetnek, hogy a szervezet saját anyagaiban valamilyen ok folytán szerkezeti változások következnek be (pl. huzamos gyógyszeres kezelésekből eredően kémiai gyökök kötődnek fehérjemolekulákhoz) és ezek immunválaszt indukálnak. alloantigének: fajon belüli, genetikai polimorfizmusból eredő antigének. Legismertebbek közöttük a vércsoport- és a hisztokompatibilitási antigének. xenoantigének: különböző fajokra jellemző anyagok, amelyek más fajokban antigén hatásúak Az antigének kémiai sajátosságai Az antigének kémiai természetük alapján lehetnek fehérjék, poliszacharidok és nukleinsavak. Antigénként szerepelhetnek ezek vegyületei: lipoproteinek, glükoproteinek vagy sejtfelszíni struktúra formájában oligoszacharidok, glikolipidek és kisebb peptidek is. Több komplex poliszacharid és lipoid természetű anyag önmagában is lehet antigén. A kémiai természet alapján úgy is rangsorolhatjuk az antigéneket, hogy a legerősebb immunogén hatással a fehérjék rendelkeznek, és utánuk sorrendben a poliszacharidok, lipoidok és végül a nukleinsavak következnek. Fehérje antigének. Korábban általános volt az a felfogás, hogy csak a fehérjék lehetnek antigének. A legtöbb természetes antigén valóban fehérje. A fehérje akár önmagában, akár más kémiai anyagokkal kombinálva (glükoprotein, lipoprotein, nukleoprotein) lehet immunogén. A fehérjemolekulák antigénspecificitását elsősorban a primer szerkezet, vagyis a bennük foglalt aminosavak milyensége és szekvenciája határozza meg, míg a szekunder szerkezet (a peptidláncok elágazódásai), valamint a tercier szerkezet (hidrogén- és diszulfidhidak által kialakított globuláris felépítés) pedig alapvetően az immunogenitást és az antigenitást szabják meg. Globuláris fehérjéknél az epitop csoport gyakran a peptidlánc felgombolyodása által közel kerülő aminosav-maradékokból tevődik össze (ún. konformációs epitopok), ezért a tercier szerkezet felbontása a determináns csoport denaturálódásához vezet. A fehérje antigénekben az epitopok gyakran a peptidlánc hajtűkanyarjaiban lokalizálódnak. Az állati fehérjék általában jó immunogén hatásúak. Ezért pl. a heterológ vérsavóval végzettszérumterápia immunpathologiás folyamatokat is (lásd később) kiválthat. A különböző állatfajok vérsavója ellen más állatfajban termelt antisavók specificitása több területen hasznosítható, pl. fajok és fajták genetikai rokonságának meghatározásában, szerológiai eljárásokban, mint az Uhlenhut-féle próba, Coombs-féle próba, indirekt immunfluoreszcenciás eljárások, ELISA stb. (lásd az Immundiagnosztika c. fejezetben). A baktériumok és vírusok fehérjéi szintén a jó immunogének közé tartoznak (lásd az Immunválasz kinetikája c. fejezetben). Poliszacharid antigének. A poliszacharidok legtöbbször fehérjékhez (glükoproteinek) vagy lipoidokhoz kötve szerepelnek immunogén anyagként. Némelyik poliszacharid anyag önmagában is lehet immunogén. A pneumococcusok burokanyagában található poliszacharidféleség pl. emberben és egérben teljes antigénként viselkedik, tehát ellenanyag-termelést indít meg, nyúlban viszont vele szemben nem termelődnek szerológiailag kimutatható ellenanyagok, a tengerimalacot pedig nem sensibilizálja. A poliszacharid antigének közé tartoznak a különböző vércsoportrendszerek antigénjei is, amelyeket alloantigénnek nevezünk. Az alloantigének ugyanazon fajon belül egyedi különbözőséget, vagyis genetikailag meghatározott polimorfizmust képviselnek. A vörösvérsejt-alloantigének megkülönböztetésére a jelenlegi vércsoport-terminológia az ABC betűit alkalmazza (AB0-, Hh-, Sese-, Lele-, P-rendszer stb.). Az emberi vörösvérsejteken ma már több száz alloantigént azonosítottak, és ezeket 18 vércsoportrendszerbe sorolták, közülük legjelentősebb az AB0-rendszer. Az alloantigének a vörösvérsejtek membránján kívül 329
350 Immunológia megtalálhatók más vérsejteken és számos szöveti sejt membránján is, így jelentősek a szervátültetések sikerének kimenetelében. A vértranszfúzió szempontjából rendkívül fontosak a vérsejtek membránjában előforduló A és B alloantigének. Ezek közül egyes emberek vörösvérsejtjei csak az egyik, mindkét vagy egyik antigént sem tartalmazzák (A, B, 0). A fenti antigének ellen ható antitestek (anti-a, anti-b) megtalálhatók minden olyan egyed vérsavójában, amelynek a vörösvérsejtjeiben homológ antigén nincs jelen. Az A-antigén mellett anti-b, a B mellett anti-a fordul elő. Az 0 csoportú egyén vérsejtjei sem A-, sem B-antigént nem tartalmaznak, így egyik antitesttel sem agglutinálódnak, tehát az ilyen egyed univerzális véradó (donor) lehet. Az AB-csoport ezzel szemben univerzális recipiens, mert vérsavójukban a két antitest egyike sem fordul elő. Az AB0-specificitások kémiai szerkezete nagy hasonlóságot mutat %-ban szénhidrátokból, 10 20%-ban pedig aminosavakból állnak, és polipeptidláncokhoz kapcsolódva glükoprotein-makromolekulákat alkotnak. Kémiai szerkezetükből eredően igen ellenállóak, így beszáradt vérből évek múltával is meghatározhatók. Ez adja törvényszéki orvostani jelentőségüket. A különböző állatfajok alloantigénjeinek ismerete jelentős az állattenyésztés és az állatnemesítés munkájában. Szarvasmarhában több mint 100 alloantigént ismerünk, és ezek 13 vércsoportrendszerbe sorolhatók, juhban 7, sertésben 15, lóban 8, tyúkban 13 rendszer ismeretes. A vörösvérsejtek membránjában előfordul egy Rh- (rhesus-)faktornak nevezett antigén, amely immunogén hatású. Az Rh-negatív anyától és Rh-pozitív apától származó magzat az apa genetikailag domináns Rhpozitivitását örökli. Így a magzat az anyai szervezet számára idegen anyagot hordoz, ezért vele szemben az anya immunrendszere antitesteket termelhet, amelyek a magzat vörösvérsejtjeit károsítják és hemolitikus sárgaság kialakulását okozzák. Az Rh-faktorhoz hasonló antigént sertésekben is meghatároztak és ezt Su-faktornak nevezték el. Lipoid antigének. A foszfolipidek (lecitin, kefalin), a szteroidok (koleszterin, ergoszterin) és a nemi hormonok immunogenitása a preparátumok tisztíthatóságának nehézségei miatt még nem tekinthető tisztázottnak. A nagy molekulatömegű lipoidok általában nem immunogének, de ezek között is találtak már antigéneket, mint pl. a kardiolipint, amely borjúszívből kivonható komplex lipoid, és jól hasznosítható az emberi syphilis diagnosztikájában. Heterogenetikus antigének. A törzsfejlődésben egymástól távol álló fajokban előforduló olyan antigének, amelyek azonos szerkezetű determinánsokat tartalmaznak. Ebből következik, hogy az ellenük termelődött ellenanyagok reagálnak a különböző fajokból származó szöveti vagy egyéb kivonatanyagokkal, amelyekben ilyen antigén előfordul. FORSSMAN (1911) írt le először heterogenetikus antigént. Vizsgálataiban megfigyelte, hogy a tengerimalac máj-, vese-, here- és agyvelőkivonattal szemben a nyulakban termelődő ellenanyagok a juhvörösvérsejtekkel is reakcióba lépnek, és komplement jelenlétében feloldják azokat. A tengerimalac vörösvérsejtjei és szérumfehérjéi ellenében viszont nem termelődnek ilyen típusú ellenanyagok. Ezt a típusú antigént és ellenanyagot leírójuk után Forssman-féle antigénnek, illetve ellenanyagnak nevezzük. A Forssmanféleantigén fehérjementes. Szerkezete még nem teljesen ismert, de fő komponense glükózamin. A Forssman-féleantigénhez hasonló anyag előfordul a ló, a kutya, a macska, az egér és több más állatfaj szöveteiben vagy vörösvérsejtjeiben, de egyidejűleg mindkettőben sohasem.megtalálható továbbá ez az anyag az ember és a juh vörösvérsejtjeiben is, valamint a Shigella dysenteriae, a Streptococcus pneumoniae és a Bacillus anthracis baktériumokban. Heterogenetikus antigének madarakban is előfordulnak. Jelentős az a heterogenetikus antigén, amely az emberi vörösvérsejtekben és a XIV. típusú a S. pneumoniae-ben fordul elő. Ez utóbbival szemben a lóban termelt immunsavó ugyanis agglutinálja az emberi vörösvérsejteket. A kémiai összetétel mellett az immunogenitás más tényezőktől is függ: molekulatömeg: korábban az antigén immunogenitásának definíciójában a nagy molekulatömeg egyik meghatározó kritérium volt; ma ezt úgy kell módosítani, hogy egyenes összefüggésfigyelhető meg az antigén hatású anyag molekulatömege és immunogenitása között (az erre vonatkozó adatokat a 35. táblázat tartalmazza), a determinánsok száma: az antigének immunogenitása egyenes összefüggést mutat a bennük vagy felületükön található determináns csoportok számával is. 35. táblázat - Az antigén molekulatömege és antigénhatása közötti összefüggés 330
351 Immunológia Antigén Molekulatömeg Antigénhatás Glukagon gyenge ACTH gyenge Albumin jó Immunglobulinok jó Thyreoglobulinok erős Hemocianin erős Az immunogenitást befolyásolják továbbá az anyag oldhatósága és enzimatikus hidrolízis iránti érzékenysége, mivel a nem oldható és enzimatikusan nem bontható anyagok nem fejtenek ki immunogén hatást. Pl. valamennyi természetes fehérje balra forgató (L) alfa-aminosavból épül fel és jó immunogén hatású. Ezzel szemben a jobbra forgató (D) aminosavakból felépített peptidek és vegyületek legfeljebb igen gyenge immunogének, feltehetően azért, mert a szervezet nincs berendezkedve lebontásukra Az antigének specificitása Az antigének a velük szemben termelődöttellenanyagokkal vagy az elkötelezett immunocytákkal akár in vivo, akár in vitro kötődni képesek. Az ellenanyagokhoz vagy sejtreceptorokhoz kapcsolódó antigéneket ligandumnak is szoktuk nevezni, ami általános megjelölés és magában foglalja nemcsak a teljes antigéneket, a hapténeket, hanem a sejtes antigéneket is. A ligandum receptor kapcsolatokat a nagyfokú specificitás jellemzi, ami annyit jelent, hogy az antigénmolekula-ligandum csak a vele szemben termelődött (homológ) ellenanyagokkal reagál. Ha pl. ovalbumint oltunk be nyúlba, akkor ebben olyan ellenanyag termelődik, amely az ovalbuminnal reakcióba lép (precipitálja), de nem reagál pl. a lóból származó albuminnal. Az antigének specificitását vagy fajlagosságát a felületükön elhelyezkedő epitopok (poláris atomcsoportok) száma és térbeli elhelyezkedése határozza meg, amelyek az ellenanyag-molekula megfelelő kötőhelyeivel, más néven paratop csoportjaival kapcsolódnak. Az epitop, illetve paratop csoportokon belül az -NH 2 (amino) és a - COOH (karboxil) gyökök hordozzák a reaktivitást. Az antigén ellenanyag kapcsolat tehát kémiai természetű és úgy jön létre, hogy az antigén epitop és az ellenanyag-molekula paratop csoportjainak -NH2 és -COOH csoportjai egymással kölcsönösen reagálnak. A kapcsolódás létrejöttében egyéb tényezők, mint a van der Waals-erők és a H-hidak kialakulása is szerepet játszanak. Az antigén és a hatására képződött ellenanyag konfigurációja egymásnak tükörképei, ezért találkozásukkor valamennyi epitop és paratop csoport receptorai reakcióba lépnek, és az antigén úgy illeszkedik az ellenanyaghoz, mint kulcs a megfelelő zárhoz. Az antigén specificitását meghatározó tényezők ismeretében már nem meglepő az a jelenség, hogy ugyanolyan elemi felépítésű anyag eltérő antigénhatást képviselhet, ha determinánsainak térbeli konfigurációja különböző és megfordítva: különböző elemi felépítésű anyagok azonos specificitást képviselnek, amennyiben aktív csoportjaik száma és konfigurációja azonos. Az immunválasz olyan szigorúan specifikus, hogy a reagáló szervezet pl. a sztereoizomériából eredő különbségeket is felismeri. Abban az esetben, ha a borkősav dextro-, levo- és mezováltozatait diazotálással pl. lófehérjéhez kötjük, 3, különböző fajlagosságú antigént kapunk, amit az ellenük termelt ellenanyagok reakciói bizonyítanak. A specificitás szigorú immunbiológiai törvényeinek megfelelően az antigének és az ellenanyagok között azonban ún. keresztreakciók is kialakulhatnak. Tételezzük fel, hogy a két baktériumféleség közül az egyikben A és B a másikban B és C antigénkomponensek fordulnak elő. Az A+B antigént tartalmazó baktériummal szemben a szervezetben a+b ellenanyagok termelődnek. Az ilyen ellenanyag-tartalmú savó azonban nemcsak a homológ A+B antigénnel, hanem ha gyengébben is, de reagál a B+C 331
352 Immunológia antigénkomponenseket tartalmazó baktériumokkal is, mivel a B antigén bennük közös. Ez a kapcsolat, bár nem teljes, tehát csak az egymásnak megfelelő epitopok és paratopok kapcsolódnak, de mégis érzékelhető szerológiai reakció alakul ki. Az ilyen keresztreakciók kvantitatív mérése egyben a két baktériumféleség rokonságának meghatározására is lehetőséget nyújt Kemospecifikus antigének Az antigének specificitásának megismerésében döntő fontosságú volt LANDSTEINER megállapítása, miszerint a makromolekulákhoz kötött, kis molekulatömegű anyagok megváltoztatják azok antigénsajátosságait, és új specificitású, ún. kemospecifikus antigének jönnek létre. Ezek klasszikus példája a paraaminobenzoesav (PAB) kapcsolódása fehérjemolekulával. Abban az esetben, ha ezt a komplexet kísérleti állatba oltjuk, vele szemben ellenanyagok termelődnek (anti-pab P1). Ez az ellenanyag reakcióba lép a P1-fehérjével, de ugyanígy a PAB P1 komplexszel, sőt minden olyan fehérjemolekulával is, amelyben a PAB-csoport jelen van. Amennyiben az anti-pab P1 ellenanyag csak a PAB vegyülettel reagál, akkor ezt látható szerológiai reakció nélkül megköti, és az ilyen ellenanyag már nem képes reagálni a PAB P1 antigénnel, mivel reaktív csoportjai lekötődtek. A reakció sémáját a 159. ábra szemlélteti ábra - Kemospecifikus antigének Baktériumantigének A baktériumantigének helyeződhetnek akár a baktériumsejt felületén (csilló, fimbria, burokantigének), akár a sejtfalban, vagy annak ún. járulékos képleteiben. Antigénhatásúak továbbá a cytoplasmában található enzimek, nucleoproteinek, valamint számos anyagcseretermékmintpl. az extracelluláris enzimek: Sejtfalantigének: a Gram-pozitív baktériumokban a sejtfal nm méret között váltakozik és kb %- át adja a sejt szárazanyagának, ezzel szemben a Gram-negatív baktériumokban a sejtfal 110 nm méretű, és kb. 332
353 Immunológia csak 15%-át képviseli a szárazanyag tartalomnak. A Gram-negatív baktériumoksejtfala hálószerű, keresztkötésű peptidoglikán vázból tevődik össze, ami eltérő mennyiségben a legtöbb baktériumspeciesben megtalálható (kivételt képeznek pl. a mycoplasmák és a halophil baktériumok). A sejtfal lipoprotein és lipopoliszacharid (LPS) komplexekkel (endotoxinok) egészül ki, amelyek cytotoxicusak és antigén hatásúak. Ezeket O- antigéneknek is nevezik. A Gram-pozitív baktériumok sejtfalantigénjeit a teichonsavakhoz kapcsolódó cukormolekkulák képezik. Egyes baktériumok (pl. staphylococcusok) sejtfalában fehérje antigének is találhatók, másokban (pl. mycobacteriumok) zsírsavak és viaszanyagok is előfordulnak. Burokantigének: kémiai összetételük fajonként igen változatos, poliszacharid-polipeptid komplexekből vagy pedig tisztán polipeptidekből épülnek fel, és szoros összefüggést mutatnak a kórokozó képességgel. Többségük antigénhatású, így felhasználhatók a baktériumok szerológiai identifikálásában. Csillóantigének (H-antigének): helikális szerkezetű fehérjékből felépülő, fonal alakú képletek, amelyek elhelyeződése és száma jellemző egyes speciesekre vagy azok meghatározott csoportjára. A csillófehérjék immunológiai specificitása lehetőséget nyújt a fajok szerológiai besorolására. Fimbriák: az ún. közönséges fimbriák (pilusok) elsősorban a Gram-negatív baktériumok felületét borító, finom, vékony csövecskék. Ezek az ún. adhéziós faktorok. A fimbriákkal rendelkező baktériumok agglutinálják a különböző állatfajok vörösvérsejtjeit. Antigénspecificitásuk alapján több csoportba sorolhatók. A szexfimbriák fehérje természetűek és antigénspecifikusak. Cytoplasmahártya: protein, lipoid, foszfolipoid összetételű, enzimekben rendkívül gazdag, és a baktériumsejt ozmotikus nyomásának szabályozásában meghatározó szerepet játszik (itt termelődnek a baktériumok extracelluláris enzimjei is). Cytoplasma: tartalmazza a nuclearis állományt, a riboszómákat, a különféle enzimeket, vitaminokat, ásványi sókat stb., amelyek a sejtműködéshez szükségesek. A riboszómákban folyik a fehérjeszintézis. Felépítésükben hasonlítanak az emlőssejtek riboszómáinak szerkezetéhez. Endotoxinok: poliszacharid-foszfolipid komplexek. A szervezetbe juttatva lázas állapotot, közérzeti zavarokat, sokkot és a szervezet pusztulását válthatják ki. Gyenge immunogének. Exotoxinok: fehérje természetű antigének és jó immunogének. Hatásuk a gazdaszervezet meghatározott sejtcsoportjaira irányul Vírusantigének A vírusok abszolút sejtparaziták. Felépítésükre jellemző, hogy a nukleinsavat kapszomerekből (ismétlődő fehérje alegységekből) álló, ún. kapszid veszi körül, és fehérjéik jó antigénhatásúak. Számos vírus burokkal is rendelkezik, amelyek lipo- és glükoproteineket tartalmaznak. A vírusok a sejten belül az ellenanyagokkal szemben fedetten helyeződnek, ezért az immunválsz a sejtfelületen kifejeződő antigének ellen irányul, amikor az immunrendszer a vírusfertőzött sejtet pusztítja el. A vírusok antigénjei fehérjék (peptidek, polipeptidek), lipo- és glükoproteinek, illetve nukleinsavak: a fehérjeantigének megtalálhatók a nukleokapszidban, a lipoproteinek a vírusok burkában, illetve az abból kiálló képletekben. A vírusantigéneket a protektív védelem szempontjából 3 típusba sorolhatjuk: A vírus felületi antigénjei, amelyek olyan antitestek képződését váltják ki, amelyek gátolják a vírus kötődését a célsejtekhez, vagyis képesek a vírust neutralizálni. Ezek az ellenanyagok, amikor a vírus külső fehérje antigénjeihez kötődnek, előidézhetnek szterikus módosulást, ami befolyásolja a vírus dekapszidációját vagy a korai transzkripcióját. A VN (vírusneutralizáló) antitestek károsíthatják a vírus fúziós faktorait, gátolva ilyen módon a vírus sejtről sejtre való terjedését (pl. paramyxovirus) vagy csökkentve a vírus kiszabadulási sebességét (pl. influenzavírus). Opszonizálhatják a vírust, előkészítve a komplementhatás vagy a phagocytaaktivitás fokozódását. 333
354 Immunológia Az MHC I.-hez kötödő vírusantigének: a vírus olyan fehérjeantigénjei, amelyek a fertőzött sejt MHC I. strukturájához kötődnek, és a CD8 + lymphocyták közreműködésével cytotoxikus reakciókat váltanak ki. A sejt felületén kifejeződő antigének: olyan fehérjeantigének, amelyek a fertőzött sejteken fejeződnek ki, és az ezekkel szemben kialakuló humorális és celluláris immunválasz a sejt lízisét eredményezi, akár az antitest, akár a komplement dependens cytotoxicus reakciókon keresztül, akár a természetes K (killer) sejtek közbejöttével Az immunrendszer molekuláris egységei Ellenanyagok (immunglobulinok) Az ellenanyagok a globulinokhoz tartozó, sajátos szerkezetű glükoproteinek, amelyek a szervezetben antigéninger hatására képződnek, és azzal a képességgel rendelkeznek, hogy a termelődésüket kiváltó antigénekkel akár in vivo, akár in vitro képesek kötődni. Az immunológia fejlődése szempontjából alapvető volt FODOR JÓZSEF (1887) felfedezése a vérsavó baktériumölő hatásáról, valamint BEHRINGnek az a felismerése (1890), hogy diphtheriatoxinnal szemben a vérsavóban olyan anyagok (ellenanyagok) jelennek meg, amelyek a toxint közömbösíteni képesek. Ezt követően további ellenanyagok képződését figyelték meg, és ezeket hatásuk szerint nevezték el: antitoxinok, agglutininek, precipitinek, opszoninok stb. Az ellenanyaghatást hordozó fehérjéknek a globulinokhoz való tartozását a század első felében kémiai módszerrel határozták meg, amikor pl. ammóniumszulfáttal történő kisózással a szérumfehérjéket euglobulinok, peseudoglobulinok, fibrinogen stb. frakciókra választották szét, és azt találták, hogy az ellenanyaghatás a pseudoglobulin II. frakcióhoz kötődik. Lényeges előrehaladást jelentett TISELIUS (1937) ún. szabad fázisban végzett elektroforézise, amikor a szérumfehérjéket elektromos töltésüknek megfelelően albumin, alfa-, beta- és gamma-globulinokra bontotta fel. Ezt követően az elektroforetikus analízist már szilárd hordozókon (papír-, agargél-elektroforézis) végezték, és megállapították, hogy a gammaglobulinok immunglobulin-osztályokra (IgG, IgM, IgA, IgE) különíthetők el (HEREMANS 1959). Kiderült tehát, hogy a sokféle hatás ugyanazon ellenanyagnak különböző reaktivitási formája, és ezt az ún. immunglobulinok hordozzák, amelyeket a közös funkció és a szerkezeti rokonság köt össze. Az immunglobulinokat a plazmasejtek termelik. Az immunglobulinok megtalálhatók a legtöbb testfolyadékban, közöttük legmagasabb koncentrációt általában a vérsavóban érik el. Az ellenanyagok heterogén molekulapopulációk összessége és kettős funkciót látnak el: elsődleges szerepük: az antigének immunkomplex formában való megkötése, másodlagos szerepük: a komplexek olyan mechanizmusokhoz, illetve sejtekhez (komplement rendszer, phagocyták, hízósejtek) való kapcsolása, amelyek az antigén felismerésére önmaguk nem képesek, de azokat a szervezetből kiküszöbölni hivatottak Az immunglobulinok (Ig) általános szerkezete Az Ig-ok szerkezetének felderítése sokáig megoldhatatlan feladatnak látszott, mivel szerkezeti és funkcionális hasonlóságuk ellenére nagy heterogenitást mutatnak. A heterogenitás abból ered, hogy a különböző antigéningerek hatására egyrészt eltérő specificitású ellenanyagok képződnek, másrészt az Ig-ok policlonalis eredetűek, és ennek megfelelő szerkezeti különbségek jegyeit hordozzák. Emiatt az Ig-ok szerkezetére vonatkozó kutatások csak akkor indulhattak meg, amikor felismerték, hogy bizonyos malignus sejtburjánzások esetében ún. monoclonalis ellenanyagok termelődnek. A myeloma multiplex esetén pl. a B-sejtekből olyan daganat keletkezhet, amely egyetlen praekurzor elősejtből származik, így egyetlen Ig-molekulaféleséget termel. Az Ig-ok szerkezetének megismerésében alapvető szerepe volt PORTER és mtsai., valamint EDELMAN (1959) munkásságának. Vizsgálataik alapján lehetővé vált az enzimes hasítással nyert egyes fragmentumok funkciójának részletes meghatározása, valamint a diszulfidhidak felbontásával a molekulát felépítő polipeptidláncok izolálása és jellemzése. 334
355 Immunológia Az Ig-molekulák 4 polipeptidláncból épülnek fel. Közülük 2 hosszabb és nagyobb molekulatömegű, ún. nehézvagy H- (heavy) polipeptidlánc és 2 rövidebb, kisebb molekulatömegű, ún. könnyűvagy L-(light) polipeptidlánc. A 2 H-lánc és a 2 L-lánc egymáshoz diszulfidhidakkal és nem kovalens kötésekkel kapcsolódik. A polipeptidláncok aminosav-szekvenciája a lánc meghatározott részén állandó, a végén szabad karboxilcsoporttal. A molekulának ezt a részét konstans szakasznak vagy C-terminálisnak nevezzük. A lánc fennmaradó része változó aminosav-szekvenciát mutat, a végén szabad aminocsoporttal, ezért ezt variábilis szakasznak vagy N-terminálisnak nevezzük (160.ábra). A könnyű vagy L-lánc 214 aminosavból épül fel, és ennek mintegy a fele képezi a molekula variábilis részét ábra - Az immunglobulinok alapszerkezete Az ember és a különböző állatfajok Ig-jaiban a könnyű láncok kétféle típusa különíthető el a konstans szakasz összetétele alapján. Abban az esetben, ha a láncban cisztein fordul elő, akkor kappa (κ), ha viszont a láncba szerin épül be, akkor lambda (λ) típusú könnyű láncról beszélünk. A különböző Ig-molekulákban vagy az egyik, vagy a másik lánctípus fordul elő, és ez képezi az immunglobulin-osztályok szerológiai rokonságát. A nehéz vagy H-láncok 450 aminosavból épülnek fel, ebből a konstans szekvenciát mutató rész a láncnak mintegy háromnegyed részét adja, a fennmaradó hányad pedig 118 aminosavval a variábilis részt képezi. A láncok konstans szakaszában előforduló szekvencia alapján 5 nehézlánc-típust különböztethetünk meg (gamma-, mű-, alfa-, epszilon-, delta-), amelyek alapján az Ig-ok különböző osztályokba sorolhatók. A H-lánc-típusok aminosav-szekvenciájában előfordulnak ún. konzervatív szakaszok, amelyek azonosak vagy csak alig különböznek egymástól, így szerkezeti rokonságuk, illetve homológiájuk felismerhető. Mind a nehéz, mind a könnyű láncok aminoterminális végén található egy-egy variábilis szakasz, amelyek együttesen alkotják a molekula antigénkötő helyeit. A H- és az L-láncok egymáshoz diszulfidhidakkal kapcsolódnak, de ugyanilyen áthidalások találhatók a láncokon belül is, mégpedig szabályos elrendeződésben. Az L-láncokban 2, a H-láncokban pedig 4 (gamma-, alfa-, delta-), illetve 5 (mü-, epszilon-) diszulfidhíd fordul elő. Ilyen módon mintegy 110 aminosavból felépülő láncszakaszok alakulnak ki, amiket EDELMAN után doméneknek nevezünk, és a lánc kezdőbetűjével, illetve a variábilis vagy a konstans szakaszra utaló betűkkel jelöljük (161. ábra) ábra - Az immunglobulinok doménszerkezete 335
356 Immunológia Az egyes domének meghatározott funkciókat hordoznak. Így pl. az IgG CH2-es doménje megköti a komplement megfelelő fragmensét, míg az IgM-nél ugyanezt a funkciót a CH4-domén képviseli, a CH3-as domén pedig az Ig-molekulának a macrophagokhoz való kötődését szabályozza Az immunglobulin-molekula felépítése Az Ig-molekulákban a polipeptidláncokat diszulfidhidak kapcsolják össze. A H-láncok közötti diszulfidkötések gyengébbek, mint a H- és L-láncok közöttiek. A nehéz láncokat összekötő diszulfidhidak száma és helyeződése nemcsak az Ig-osztályok szerint változik, hanem állatfajok szerint is különbözik. A diszulfidhidak a középtájékon helyeződnek, ezt a helyet kapocsrégiónak nevezzük. A kapocsrégió fontos funkcionális szerepet tölt be, mivel ez képezi a molekula merev részét, ami a molekula stabilitását biztosítja, amikor az antigénnel való kötődéskor benne flexibilis térszerkezeti változások következnek be. Az L- és a H-láncok variábilis régióinak a diszulfidhidak közelében helyeződő részét hypervariábilis szakaszoknak nevezzük Az immunglobulinok fragmentumai Az Ig-molekulák proteolitikus enzimekkel különböző fragmentumokra hasíthatók. Az IgG-molekula papainnal emésztve, cisztein jelenlétében 3 fragmentumra hasad szét. Ezek közül 2 fragmentum azonos, D molekulatömegű, míg a harmadik D molekulatömegű fragmentum, és abban különbözik a másik kettőtől, hogy kristályosítható. Ezért az utóbbi molekularészt Fc (Fraction crystalisable) szakasznak nevezzük. Az jellemzi, hogy nem rendelkezik antigénkötő képességgel, de megtartja az eredeti molekula más funkcióit (pl. szövetaffinitás). A másik két fragmentum a Fab (Fraction antigen binding) hordozza az antigénkötő képességeket. Monovalens ellenanyagként viselkednek, ami azt jelenti, hogy az antigénmolekulával kapcsolódnak ugyan, de nem hoznak létre látható szerológiai reakciót, precipitációt vagy agglutinációt. Az IgGmolekula enzimes hasítással nyerhető fragmentumait a 162. ábra szemlélteti. A pepszines hidrolízis a C- terminálistól kezdve a kapocsrégióig bontja a H-láncokon belüli diszulfidhidakat, így ez a szakasz az emésztés 336
357 Immunológia során elveszti eredeti sajátosságait. A molekula többi része, a F(ab) 2 fragmentum megtartja két antigénkötő helyét, és mint bivalens fragmentum az antigénnel egyesülve látható szerológiai reakciót eredményez, pl. precipitációt vagy agglutinációt. Az F(ab) 2 fragmentum mint bivalens molekularész enyhe redukcióval két monovalens, 3,5 S fragmentumra választható szét. Ezek hasonlóak, de nem azonosak a papainos emésztéssel kapott Fab-fragmentumokhoz, ezért Fab,-vel jelöljük. A monovalens fragmentumok hajlamosak a rekombinációkra, így különböző specificitást hordozó IgG-molekula-fragmentumokkal létrehozhatók hibridizált IgG-molekulák is. Az új molekula bivalens, de a két antigénkötő hely más-más antigénnel reagálhat ábra - Az immunglobulin molekula fragmentumai 337
358 Immunológia 338
359 Immunológia Az immunglobulinok osztályai és alosztályai Az Ig-ok Janus-arcú fehérjék, tehát nemcsak mint ellenanyagok, hanem mint antigének is felismerhetők és jellemezhetők. Az Ig-ok antigénszerkezeti különbsége a nehéz (H) láncok C-terminálisának eltérő aminosavösszetételéből és -sorrendjéből ered, és ennek alapján az Ig-okat osztályokba soroljuk. Emberben és a különböző állatfajokban 5 Ig-osztály különböztethető meg: IgG, IgA, IgM, IgD és IgE. Az állatokban kimutatható Ig-ok a fizikokémiai sajátosságaik alapján általánosságban az emberi Ig-okhoz hasonlóak. Az immunglobulin-osztályok sajátosságait a 36. táblázat mutatja be. Az azonos osztályba tartozó Ig-molekulák az osztályra jellemző aminosav-szekvencián belül előforduló eltérések alapján alosztályokba sorolhatók. Emberben pl. az IgG osztálynak 4 (IgG l, 2, 3, 4) alosztálya különíthető el. 36. táblázat - Az immunglobulin osztályok sajátosságai Jellemzők IgG IgM IgA* IgD IgE Molekulatömeg Svedberg-konstans 6,7 7, ,5 7,9 Szénhidráttartalom(%) H-lánc típusa gamma mű alfa delta epszilon H-lánc molekulatömege Szekreciós komponens + Alosztályok H-láncának gamma 1 mű 1 alfa 1 jelölése gamma 2 mű 2 alfa 2 gamma 3 gamma 4 * Az IgA-ra vonatkozó molekulatömeg és a Svedberg-konstans adatai a szérum IgA-ra, illetve a szekreciós IgA-ra vonatkoznak IgG osztály Az Ig-k legnagyobb mennyiségét, kb. 75%-át teszik ki. Viszonylag kisebb molekulatömege miatt ( D) a többi Ig-hez viszonyítva könnyebben szűrődik át a szövethézagokba, így azok védelmében is jelentős szerepet játszik. Az IgG-molekula felépítését vázlatosan a 163. ábra szemlélteti ábra - Az IgG-molekula felépítése 339
360 Immunológia Az IgG hordozza a legtöbb baktérium- és vírusellenes aktivitást. A baktériumokkal vagy oldott antigénekkel immunkomplexeket képez, elősegíti a phagocytosist, aktiválja a komplement rendszert, közvetíti a cytotoxikus reakciókat, és részt vesz a legtöbb szerológiai reakcióban (agglutinációban, precipitációban, komplementkötési, vírussemlegesítési próbában). Némely alosztálya képes a hízósejtekhez kötődni, így szerepet játszhat az allergiás és anaphylaxiás reakciók kiváltásában. IgG alosztályok: az alosztályokban a H-láncokat összekötő diszulfidhidak száma változó. A vérsavóban különböző százalékos arányt képviselnek. Az egyes alosztályok különböző biológiai funkciókat hordoznak: szarvasmarha IgG 1 alosztálya jó agglutinálóképességgel bír, ugyanakkor az IgG 2 alosztálynak ilyen képessége nincs: a két alosztály közül csak az IgG 1 jut át a colostrumba, az IgG 2 alosztály kétféle szubpopulációból tevődik össze (IgG 2a, és IgG 2b), lóban, szarvasmarhában és juhban 2 2 alosztály (IgG 1, 2), sertésben és kutyában 4 4 alosztály fordul elő. Az IgG osztályban előfordulhatnak ún. inkomplett ellenanyagok is, amelyek csak egy antigénmolekulával tudnak kapcsolódni. Az ilyen univalens ellenanyagok nem képesek két baktériumsejtet összekötni, így nem idézik elő azok agglutinációját. Az inkomplett ellenanyagok klasszikus példája az anti-rh ellenanyag, amely az Rh-pozitív vörösvérsejteket nem agglutinálja, de kötődik hozzájuk, és így meggátolja a komplett agglutininek hatását. Ilyen alapon ezeket az ellenanyag-molekulákat blokkoló antitesteknek is szoktuk nevezni. Az állatorvosi gyakorlatban az inkomplett ellenanyagok kimutatásának pl. a brucellosis szerológiai diagnosztikájában (antiglobulin-próba) van jelentősége IgM osztály Az Ig-ok 6,5 7%-át teszi ki és koncentrációját tekintve valamennyi állatfajban az IgG után a második helyen áll. Molekulatömege D, Svedberg-konstansa l8 20 S, előfordul azonban S alakban is. Az IgM-molekula 5, egyenként 2 2 H- és L-láncot tartalmazó 7S alegységből épül fel (164. ábra). Ezek az alegységek a µ-láncok CH3 doménjei között diszulfidhidakkal és nem kovalens kötésekkel, csillag formában kapcsolódnak egymáshoz úgy, hogy 2 monomer között egy D molekulatömegű J- (joining, kötő)lánc található. Az alegységek 1 1 antigénmolekula megkötésére képesek. Ha merkaptoetanollal vagy szulfhidrilbontó enzimekkel hozzuk össze, akkor a molekula elveszíti antigénkötő képességét ábra - Az IgM-molekula felépítése 340
361 Immunológia A szervezetet érő primer antigéninger hatására kialakuló immunválaszban az IgM termelődik a legnagyobb mennyiségben. Aktivitása a korpuszkuláris antigénekkel szemben nagyobb, mint az oldott antigénekkel szemben. Az IgM szerológiai aktivitása pl. agglutinációs próbában nagyobb, mint az IgG-molekuláé, de felülmúlja azt a komplementrendszert aktiváló hatásban és az opszonizációs képességben is. Az IgM-molekula 7 S monomer formája előfordul a vérsavóban minimális mennyiségben, továbbá megtalálható az antigénsensitív B-sejtek felületén is. Ez az ún. antigénkötő receptor, ami jelentős szerepet játszik az immunindukció folyamatában. Az IgM pentamer formája nagy molekulatömege miatt lényegében csak a vérsavóban található meg, és alig vesz részt a szövethézagok védelmében. Lokális gyulladásos folyamatoknál azonban a károsodott kapillárisok falán képes átjutni a trans- és az exsudatummal IgA osztály Az IgA a vérsavóban az Ig-oknak 0,4%-át teszi ki. Molekulatömege l D között változik. Svedberg-konstansa S. Szénhidráttartalma 9 10%, tehát magasabb, mint az IgG-é. Az IgA könnyen képez polimereket, így dimer, trimer stb. alakban is előfordul. Az ember vérsavójában koncentrációja az IgG után következik, az állatok vérsavójában azonban alacsonyabb, mint az IgM mennyisége. A test szekrétumaiban (nyálban, könnyben, epében, húgyutakban, az emésztő- és a légutak nyálkahártyájában) viszont mennyisége valamennyi immunglobulin-osztály koncentrációját meghaladja. A polimer IgA-molekulákban az alegységeket egy rövid J-lánc kapcsolja egymáshoz, és ezen a részen kötődik a molekulához a hámsejtekben termelődő szekréciós rész, amelynek molekulatömege kb D. Ezt az Ig-t szekréciós IgA-nak nevezzük. A szekréciós IgA nagyfokú ellenálló képességgel rendelkezik a fehérjebontó enzimekkel szemben. A molekulának ez a tulajdonsága a szekréciós résznek tulajdonítható, és ez biztosítja az emésztőnedvekkel szembeni ellenálló képességét, továbbá a bél lumenében való perzisztálását. A szekréciós IgA szerkezeti sémáját a 165. ábra mutatja be. 341
362 Immunológia 165. ábra - Az IgA-molekula felépítése 342
363 Immunológia 343
364 Immunológia Az IgA-nak juhban és sertésben, akárcsak az emberben, 2 alosztályát tartjuk számon. Az IgA nem aktiválja a komplementet és nem képes opszonizációra, agglutinálja azonban az antigénpartikulákat, és neutralizálja a vírusokat. Az IgA legfontosabb funkciója a bélhám, a légzőszervek, az urogenitalis szervek stb. nyálkahártyájának fertőzésekkel szembeni lokális védelme IgD osztály Az Ig-ok 0,2%-át teszi ki. A vérsavóban csak igen kis mennyiségben van jelen, de mint sejtfelszíni receptornak, fontos szerepet tulajdonítanak a B-sejtek differenciálódásában. Feltételezhető ugyanis, hogy az ilyen receptorral bíró sejtek antigéninger hatására átkapcsolás révén válnak IgM-, IgG-, illetve IgA-szintetizálóvá. A komplementet aktiválja IgE osztály A szérumban rendkívül alacsony koncentrációban fordul elő, viszont fontos szerepet játszik egyes parazitákkal szembeni immunitásban, továbbá az allergiás és anaphylaxiás reakciókban (lásd az Allergia c. fejezetben) Az immunglobulinok térszerkezete Az immunglobulinok térszerkezetének megismerésében a molekulák elektronmikroszkópos vizsgálata és az emésztéssel kapott kristályosítható fragmentumok röntgendifrakciós analízise alapvető előrelépést jelentett. Az IgG-molekuláról megállapították, hogy az Y alakú. Amikor az Fab-fragmentumok antigénnel kapcsolódnak, egymástól távolodnak, és az Y szárai szétnyílnak, így a molekula T-alakot ölthet. A nyugalmi állapotban lévő IgM-molekula ötágú, tengeri csillag alakú, amelyben a középen helyeződő korongból nyúlnak ki az Y vagy V alakú Fab részek. Amikor a molekula antigénnel lép kölcsönhatásba, változatos molekulaformák alakulhatnak ki, minthogy az Fab részek egy merev tengely körül minden irányban elmozdulnak Az immunglobulinok funkciói Az Ig-ok kettős funkciója a molekula más-más fragmentumához kötődik. Az Fab rész képes az antigén felismerésére és annak immunkomplex formában való megkötésére. Az antigénkötődés a molekulában térszerkezeti változásokat idéz elő, ez aktiválja az effektor funkciókat, amelyek az antigén eliminálását célozzák. Az effektor funkciók a molekula konstans szekvenciájú doménjeihez (Fc rész) kötődnek. Az effektor funkció aktiválását többféleképpen magyarázzák. Egyes feltételezések szerint az antigénnel való kapcsolódás térszerkezeti változásokat okoz, ami az addig rejtett helyzetben lévő csoportok felszínre kerülését eredményezi, ami az Fab és az Fc részek által bezárt szög megváltozásával függ össze (disztorziós modell). Más vizsgálatok szerint az effektor funkció létrejöttéhez az immunglobulin-molekulák asszociációja szükséges, ami úgy jön létre, hogy az antigénmolekulák különböző Ig-molekulákat az Fab résznél összekapcsolnak, ezáltal ezek Fc részei is kölcsönhatásba kerülnek (asszociációs modell). Az immunglobulinok heterogenitása: az Ig-ok nemcsak mint ellenanyagok, hanem mint antigének is felismerhetők és jellemezhetők. Ennek alapját az képezi, hogy az Ig-ok eltérő felépítésű és különböző specificitású, heterogén molekulák populációja. Az antigénszerkezeti különbségek alapján az Ig-okat három kategóriába sorolhatjuk: Izotípiás variánsok: ugyanazon faj minden egyedében előforduló immunglobulin-osztályok, illetve - alosztályok. allotípiás variánsok: ugyanazon faj egyes egyedeiben található, azonos osztályba tartozó, de egymástól a nehéz vagy könnyű láncok aminosav-összetételében eltérő Ig-molekulák (genetikai polimorfizmus). Az allotípiás variánsokat meghatározó szerkezetbeli eltérések genetikai szabályozás alatt állnak, és a mendeli szabályok szerint öröklődnek. Emberben az IgG nehéz láncában (Gm-marker), az IgA nehéz láncában (Ammarker) és a kappa típusú könnyű láncokban (Km-marker) írtak le allotípiás variánsokat. Eddig több mint 20 Gm- és 3 Km-markert különítettek el. Laboratóriumi állatok között egerekben az IgE és az IgA nehéz láncaiban figyeltek meg genetikai polimorfizmust. A könnyű lánc allotípusmarkerek csak egyes egértörzsekben fordulnak elő. Nyulakban eddig mintegy 13 allotípus-variáns ismeretes. 344
365 Immunológia Idiotípiás variánsok: immunglobulinok variábilis szakaszában megnyilvánuló heterogenitásból erednek. A variáns tulajdonképpen egy adott klónhoz tartozó sejtek által termelt Ig-molekulákra jellemző antigénsajátosság. Az Ig-ok idiotípiás variánsai fontos szerepet játszanak az immunregulációban. A T- és a B-lymphocyták, illetve ezek klónjai a felszínükön elhelyezkedő antigénspecifikus receptorokat tekintve rendkívül heterogének és egymás felismerésére is képesek. JERNE (1975) szerint ezek a sejtek és a különböző specificitású ellenanyagok egy olyan hálózatot képeznek, amelyben az alkotóelemek kölcsönösen hatnak egymásra és befolyásolják egymás működését. Ilyen módon az immunrendszer önmagát szabályozó hálózatként működik, mivel bármelyik tagjának mennyiségi, minőségi változása az egész rendszer összetételében is változást hoz. A hálózatot elsősorban az idiotípus antiidiotípus kölcsönhatások tartják fenn, de az izo- és allotípus-determinánsok is szerepelhetnek a kölcsönös felismerésben. A variábilis régióval szemben termelődő anti-idiotípus ellenanyag egy része szerkezetileg és funkcionálisan megegyezik az antigén valamelyik determinánsával. Ez az alapja az anti-idiotípus ellenanyagok immunprophylaxisban való hasznosíthatóságának, minthogy az anti-idiotípus vakcinák az antigénre specifikus immunválaszt képesek kiváltani (166. ábra) ábra - Anti-idiotípus antitestek A házi emlősállatok immunglobulinjai Ló: IgG, IgM és IgA osztályok ismeretesek. Az IgG-nek több alosztályát írták le, amelyeket különféleképpen (IgG a, IgG b, IgG o, illetve IgG/B és IgG/T) jelöltek. Az IgG/T szénhidrátokban gazdag és megtalálható a szervezet szekrétumaiban is, de különösen megemelkedik olyan lovak vérsavójában, amelyeket tetanuszantitoxin termelésre használtak. Az IgG/T nem köti meg a komplementet, a precipitációs reakciókban pedig jellegzetes flokkulációt okoz. Szarvasmarha: az IgG-nek két alosztálya ismert (IgG l és IgG 2), amelyek antigenitásuk és elektroforetikus mobilitásuk alapján jól megkülönböztethetők. A szérum IgG 50%-át az IgG 1 molekulapopuláció adja. Az IgM-nek szedimentációs állandója l8 l9 S, és szekréciós komponenssel is képes kötődni. Az IgA a szérumban elsősorban dimer formában található, míg a váladékokban szekréciós IgA-ként (lls) fordul elő, a vemhesség vége felé ugyanilyen formában a szérumban is megtalálható. Sertés: az IgG-nek négy alosztálya ismeretes (IgG l IgG 4). Az IgA és IgM mellett az IgE osztály előfordulását is megállapították. Kutya, macska: kutyában négy, macskában két IgG-alosztály fordul elő. Mindkét állatfajban az IgE előfordulását is megállapították. Kutyában IgM-allotípusokat is megfigyeltek. A háziállatok szérum Ig-jainak koncentrációját a 37. táblázat tünteti fel. 345
366 Immunológia 37. táblázat - Szérum immunglobulinok koncentrációja háziállatokban (mg/100 ml) Állatfaj IgG IgM IgA IgE Szarvasmarha ? Ló ? Juh ? Sertés ? Kutya Macska ? Tyúk ? Ember ,002 0, A laboratóriumi állatok immunglobulinjai Nyúl: IgG, IgM, IgA és IgE fordul elő. Az IgG-nek két alosztályát lehet megkülönböztetni. Allotípusokat is leírtak az IgG, IgM és az IgA nehéz láncain. Tengerimalac: az IgG-nek két alosztálya van. Az IgG 2 megköti a komplementet, az IgG l kifejezett cytophil tulajdonsága miatt részt vesz az anaphylaxiás reakciók kiváltásában. IgE előfordulását is megállapították. Egér és patkány: mindkettőben négy IgG-alosztály fordul elő. Egérben az IgD-t is kimutatták mint a lymphocyták egyik receptorstruktúráját. Az ember, a háziállatok és a laboratóriumi állatok Ig-osztályait és -alosztályait a 38.táblázat szemlélteti. 38. táblázat - Ember, házi- és laboratóriumi állatok immunglobulin-osztályai és - alosztályai Megnevezés IgG IgA IgM IgE IgD Ember G 1, G 2, G 3, G 4 A 1, A 2 M E D Ló G a, G b, G c, G/B/G/T A M Szarvasmarha G 1, G 2 A M E Juh G 1, G 2 A 1, A 2 M Sertés G 1, G 2, G 3, G 4 A 1, A 2 M E Kutya G 1, G 2a, G 2b, G 2c A M E Tyúk G 1 A M Nyúl G 1, G 2 A M E 346
367 Immunológia Tengerimalac G 1, G 2 A M E Egér G 1, G 2, G 3, G 4 A M E D Patkány G 1, G 2, G 3, G 4 A M E Természetes ellenanyagok Természetes ellenanyagoknak nevezzük a kimutatható antigéninger nélkül képződő antitesteket. Létezésük vitatott, mivel rendkívül nehéz a szervezetet antigén nélküli környezetben tartani, pl. a bélflóra megtelepedése, illetve változása vagy a szervezetben keletkező megváltozott saját molekulák is antigénhatást jelentenek, ami ellenanyag-termelődést indukálhat Monoclonalis ellenanyagok A monoclonalis ellenanyag egyetlen lymphocytából kialakuló plazmasejtek által termelt, azonos szerkezetű és fajlagosságú immunglobulin, amely a szervezetbe jutott antigén számos epitopja közül csak egyikkel kapcsolódik, mégpedig azzal, amellyel szemben a B-sejt szelektálódott. A homogén, egyféle fajlagosságú immunreagensek előállítását a monoclonalis ellenanyagokat termelő hibridoma-sejtvonalak kifejlesztése tette lehetővé. Ennek lényege az, hogy valamely klónhoz tartozó és egyféle ellenanyag termelésére elkötelezett plazmasejtet, amely továbbszaporodásra képtelen, olyan daganatsejttel fúzionáltatjuk, amely szaporodási képességét tekintve örök életű. KÖHLER és MILSTEIN l975-ben ismertette azt a módszert, amelynek segítségével in vitro körülmények között egérből származó myelomasejteket és ellenanyag-termelő sejteket fúzionáltattak. Eljárásukkal olyan in vitro is szaporodó, tetraploid sejteket állítottak elő, amelyek folyamatosan termelik a lépsejt DNS-e által kódolt immunglobulin-molekulát, és ugyanakkor korlátlan szaporodóképességgel rendelkeznek (167. ábra) ábra - Hibridomasejtek előállításának vázlata 347
368 Immunológia Az ellenanyagokat termelő hibridomák folyékony nitrogénben korlátlan ideig tárolhatók, és újraélesztésük után a korábbiakhoz hasonlóan felhasználhatók. A monoclonalis ellenanyagok használatára épülő módszerek (kitek) kifejlesztésével a diagnosztikai eljárások gyorsabbá, pontossá és megbízhatóvá tehetők Az ellenanyagképzés elméletei Az ellenanyagok képződését az immunológia története során többféle elmélet magyarázta. Az EHRLICH-féle oldalláncelmélet azért érdemel különös figyelmet, mivel az egykor elvetett elmélet a mai korszerű elméletekben újraéledt. EHRLICH elmélete szerint az ellenanyagok képződését az antigénnek a sejt felszínén lévő oldalláncokkal való kapcsolódása indítja meg. Az oldalláncok a szervezetbe jutó idegen anyagokkal, antigénekkel, a tápanyag-molekulákhoz hasonló módon képesek kapcsolódni, ilyenkor azonban nutritív funkciójuk gátlást szenved, aminek az lesz a következménye, hogy ezeket a receptorokat a sejt többszörösen újratermeli. A feleslegben képződött receptorok leválnak a sejtfelületről, bejutnak a véráramba, és ellenanyaghatásuk révén védik a szervezetet. Ehrlich feltételezése szerint az oldalláncok kémiailag különbözőek, ezért eltérő szerkezetű antigénekkel képesek reagálni. Elmélete szerint három receptorféleség létezik: toxinokkal reagáló receptor, 348
369 Immunológia agglutináló- és precipitálóreceptor, olyan receptor, amely az előbbi tulajdonságokat magában hordozza és a komplementet is megköti. BURNET-féle klónszelekciós elmélet. A Burnet-féle elmélet (1959) tulajdonképpen logikus szintézise és továbbfejlesztése a korábbi szelekciós elméleteknek. Eszerint az immunválasz olyan, immunológiailag kompetens sejtklónok létével függ össze, amelyek közvetlenül képesek az antigénnel reakcióba lépni. Az antigénnek megfelelő klón szelektálódik, és sejtjei mint specifikus ellenanyag-termelő sejtek szaporodnak. A szervezetben a különböző ellenanyag-termelő klónok száma olyan nagy, hogy a rendkívül nagyszámú és variabilitású antigénekkel szemben is megvan a specifikus immunválaszadás lehetősége. A klónok nagy számban való kialakulása az immunrendszer ontogenezisével áll összefüggésben, amikor az immunológiailag kompetens sejtek mesenchymális őssejtjeit a hypermutabilitás jellemzi. Az elmélet szerint az ellenanyagképző sejtek a mozgó, ősmesenchymális sejtpopulációból származnak, és ezek az immunológiai érés folyamán a thymusban, illetve a bursa Fabriciiben meghatározott fiziológiai és szomatikus változáson esnek át. Az embrionális élet folyamán ezek a mesenchymális sejtek a felületükön lévő globulinszerkezetekkel kivándorolnak a lépbe, illetve a nyirokcsomókba, és a véráram segítségével találkoznak a szervezet valamennyi anyagával. Azok a sejtklónok, amelyek a szervezet saját anyagával reagáló ellenanyagokat termelnének, kiszelektálódnak ( tiltott klónok ) és immunparalitikus állapotba kerülnek. Ez a találkozás meghatározó jelentőségű, mivel a szervezet a továbbiakban ezeket az anyagokat sajátként ismeri el, velük szemben immuntoleranciát mutat, azaz ellenanyag-képződés nélkül tűri el jelenlétüket. Minden más specificitású sejt viszont hordozza az immunkompetenciát, tehát azt a felismerő- és válaszképességet, amely a szervezetbe került nem saját anyagokkal szemben megnyilvánul. Ilyenformán a sejtek bizonyos immunológiai elkötelezettséget hordoznak. Fontos tudnunk azt is, hogy antigéninger hatására a nem saját -ra illő kompetenciájú sejtekből szaporodás útján homogén leánysejt-populáció, ún. klón alakul ki. Az azonos klónhoz tartozó sejtek egyféle vagy csak korlátozott számú rokon antigénnel képesek reagálni. A klónok összessége viszont valamennyi antigén elleni specificitás lehetőségét hordozza. Ezek szerint az ellenanyag-termelés megindítása meghatározott klónokhoz tartozó sejtek tulajdonsága. Ezek felépítését a DNS-ben kódolt genetikus információ szabályozza. Az antigénnek a szerepe abban van, hogy a meghatározott klón elszaporodását serkenti. A BURNET-féle elmélet alapján az immunrendszer kompetens sejtjeit képletesen olyan szótárhoz hasonlíthatjuk, amelyben az anyanyelv szókészlete van kódolva, ezért egy más nyelvhez tartozó szót azonnal idegennek ismer fel. Ennek alapján sok olyan immunológiai jelenség vált magyarázhatóvá, amelyek okát és összefüggéseit korábban nem ismertük. Ezek közül legfontosabbak az anamnesztikus reakció, az ellenanyagok perzisztálása, az immuntolerancia, az immunszuppresszió és a normál ellenanyagok létezése. Ez utóbbiakat ugyanis a BURNET-elmélet alapján úgy is felfoghatjuk, mint a klónok összessége által örökletesen képzett ellenanyagok minimumát. Ismeretesek viszont olyan immunológiai jelenségek is, amelyek a BURNET-féle elmélet alapján nem értelmezhetők. Így pl. nem világos, hogy a haptének, amelyek specifikusan kötődnek a sejtek receptoraihoz, miért nem váltanak ki ellenanyag-termelődést. Nem magyarázható továbbá az ún. antigénkonkurencia jelensége sem, azaz hogy egyidejű bevitelkor egyik antigénnel szemben a szervezet több ellenanyagot termel, mint a másikkal szemben. A BURNET-féle klónszelekciós elméletet a szintetikus antigének immunogén tulajdonságainak magyarázatához bizonyos értelemben módosítani kellett. Eszerint az ellenanyag-termelő sejtek hypermutabilisak, és bennük antigén jelenlétében gyors, véletlenszerű mutációk keletkezhetnek. Az antigénmolekulák azokkal a sejtekkel kerülnek kapcsolatba, amelyek a homológ antitesteket képezik, és a mutánst stabilizálják. Ez a módosítás feleslegessé teszi azt az elképzelést, hogy valamennyi elképzelhető ellenanyaghoz genetikai információra lenne szükség. JERNE-féle hálózatelmélet. A hálózatelmélet, a korszerű immunológiai szemléleti mód megfogalmazása JERNE-től (1974) származik, amely szerint a feltételezettnagyszámú klón nem egymástólfüggetlenül funkcionál, hanem ezek és termékeik egymással szoros kölcsönhatásban állnak és ún. hálózat rendszert alkotnak. A hálózat működésének alapját az idiotípus anti-idiotípus kölcsönhatások adják. Elmélete szerint minden ellenanyag-molekula az antigénszerkezetének megfelelő idiotípus-determinánst hordoz (Ea 1), amely idiotípus ellenanyag-termelést válthat ki (Ea 2). Ez utóbbi további anti-idiotípus (Ea 3) termelődését indítja meg, amely láncreakció egy negatív feed back folyamatot indít el, és ez visszahat a stimuláló sejt irányába, így döntő szerepe van az immunfolyamatok szabályozásában Az ellenanyagképzés genetikája 349
370 Immunológia Az ellenanyagok variábilitásának genetikai alapjait a korábbi évtizedekben különbözőképpen magyarázták. Arra nézve ugyanis, hogy a sejt-dns hogyan képes az élete során kb. 10 millió-féle ellenanyagot kódolni, kétféle elmélet alakult ki. Az egyik elmélet szerint valamennyi Ig-gént tartalmazza a genom (ez el is férne, mivel kb. 1 10%-át jelenti a teljes DNS-készletnek), a másik szerint viszont minden típusból csak egyféle van, amelyek szomatikusan mutálódnak, és ilyen módon alakulnak ki a különböző specificitású immunglobulinok. Végül is ma már ismert, hogy mindkét teóriában van némi igazság. A gének ugyanis általában nem egy lineáris, összefüggő génszakaszon vannak kódolva, hanem szakaszosan. Azt a részt, amely fehérjét kódol, intronnak, a közöttük levő szakaszokat pedig exonnak nevezzük. Az exonokat még a mrns-re való átírás előtt valamilyen mechanizmus kivágja, és így marad az a gén, ami a fehérjét kódolja. Az Ig-gének is ilyen módon épülnek fel. TONEGAVA (1986) bizonyította, hogy az antitestgének kis szakaszokra tördelve, szétszórtan, különböző kromoszómákon találhatók a genomban. A könnyű és a nehéz láncokhoz V-gének kódolják a variábilis, a C- gének pedig a konstans szakaszokat, amelyek mellett J (joining: egyesítő), illetve D (diversity: változatosság) szakaszok is találhatók (168. ábra) ábra - Az Ig-ok képződésének genetikája A könnyű láncokban a konstans régiót egy génszegment adja (CL), a variabilis régiót pedig több száz variabilis (VL) és összekötő (JL) génszegment kódolja. A nehéz lánc kódolása hasonlóan történik, de ott különböző szegmentek adják az Ig-típusnak megfelelő konstans géndarabot, valamint a variábilis rész VC és VJ darabja kiegészül egy diverzitási (DC) darabbal. Az ellenanyagok változatosságát a V- J- és D-szegmentek kombinációja hozza létre. A V- és J-szegmentek véletlenszerű találkozása adja a variabilis régió hipervariabilis szakaszát. A további két hasonló szakasz az ellenanyag-affinitás érése során alakul ki. A szétszórt töredékek összeállása több szakaszban történik: 350
371 Immunológia a génátrendeződési folyamatokban a véletlenszerűen kiválasztott V- és J-szakaszokat olyan enzimek egyesítik, amelyek kivágják a közöttük lévő DNS- szakaszokat. Az így egymás mellé kerülő V- és J-szakaszok a C-gén végéig átíródnak RNS-sé, az RNS újraszerkesztése során más enzimek kivágják a génszakaszok közé eső RNS-részt, lefordítás: az így kialakult messenger-rns fehérjévé íródik át. Ilyen módon a kombinációk száma több tízezer, ami egy L H-lánc egyesítése után, milliós nagyságrendben hozhat létre különböző antigénkötő helyeket MHC hisztokompatibilitási antigének (major histocompatibility complex) A szervek és szövetek sebészi átültetése azonos fajú, de genetikailag különböző egyedek között a recipiens szervezetben heveny immunreakciókat eredményez, ami a transzplantátum kilökődéséhez vezet. A transzplantátum sejtfelületi fehérje természetű antigéjeit, amelyeket a recipiens szervezet felismer, hisztokompatibilitási antigéneknek nevezzük. Közülük egyesek hatékonyabbak a szövetkilökődési reakció kiváltásában, ezek az ún. legnagyobb hisztokompatibilitási antigének (major histocompatibility antigens). A hisztokompatibilitási (transzplantációs) antigének a sejtek membránjába integrálódott glükoproteinek, amelyek egyrészt megszabják a sejt saját jellegét, másrészt részt vesznek az antigén-felismerésben, továbbá az immunválasz során a sejtegyüttműködés kialakításában. Az MHC-antigéneket szerkezetük alapján I és II-es osztályba soroljuk (169.ábra) ábra - Az MHC-fehérjék és a T-sejt receptorszerkezete Az MHC antigének génkomplexeken keresztül öröklődnek. Minden MHC 3 génosztállyal rendelkezik, jóllehet ezeknek a komplexen belüli rendeződése nagy variabilitást mutat, így az általuk kódolt MHC-fehérjék variabilitása is igen nagy. I. osztály: az I. osztály génjei kódolják a magvas sejtek felületén lévő fehérjéket, valamint egyes specieszek vörösvérsejtjein lévő fehérjéket, II. osztályú gének kódolják a lymphocyták és a macrophagok felületén lévő fehérjéket, III. osztályú gének számos különböző fehérjét kódolnak (komplement rendszer proteinjei, a tumornecrosisfactorok), amelyek az immunválasz kialakulásában vesznek részt. 351
372 Immunológia MHC I antigének Az I. osztályba tartozó antigének a szervezet minden sejtmaggal bíró sejtféleségén megtalálhatók, és ezek határozzák meg a szervezet genetikai egyediségét. Az I. és II. osztályú fehérjék a sejtfelszínen különböző mennyiségben találhatók, a sejt differenciálódási vagy funkcionális állapotától függően, de ezt genetikai és környezeti tényezők is befolyásolhatják, pl. az alfa- és a gamma-interferonok vagy az interleukinok fokozzák az MHC-antigének kifejeződését. A hisztokompatibilitási antigének a sejtmembránokról leválva, oldott formában a testnedvekben is megtalálhatók, ahol jelentős immunregulációs szerepet töltenek be. Az ember MHC-antigénjeit HLA (humán lymphocyta antigén), a házi emlősállatokét pedig ugyanilyen alapon pl. a kutyáét DLA (dog lymphocyte antigen), a szarvasmarháét BoLA (bovine lymphocyte antigen), a sertését SLA- (swine lymphocyte antigen-)nak nevezzük. Azok a gének, amelyek az MHC-n belül az antigéneket kódolják, mintegy blokk -ként öröklődnek. Ezt a blokkot haplotípusnak nevezzük. Az MHC I fehérjék alfa-láncból és egy ehhez kapcsolódó béta-2 mikroglobulinból tevődnek össze. Az alfa-lánc a kettős lipidrétegbe ágyazva a plazmamembránhoz kötődik. A sejten kívüli része három domenből áll, amelyhez negyedikként kapcsolódik a béta-2 domén. Szerkezetét tekintve hasonlítanak az immunglobulinmolekulák doménjeihez. Az MHC I polomorfizmusa: az MHC I molekulák peptidreceptorok, alacsony specificitással. Funkciójuk, hogy az idegen anyagok antigénfragmenseit preszentálják a T-sejtek felé. Az idegen anyagok némelyikét könnyebben ismerik fel, mint másokat. Az ilyen irányú specificitás formálódásában számos aminosav-féleség vesz részt, és ebből ered, hogy az I. osztályú lánc adott populáción belül igen nagy variabilitást mutat. A nukleinsav-analízisek arra utalnak, hogy a nagyfokú polimorfizmus a gének konversiójából ered. De hozzájárul a polimorfizmushoz egy másik mechanizmus is, ez pedig a cromatidák kereszteződéséből ered. Az MHC-gének egyébként a legnagyobb hajlamot mutatják a mutációkra. Az MHC-t tekintve az egyedek legnagyobb hányada heterozygota, ezért minden egyed 6 különböző MHCmolekulát kódol olyan módon, hogy az A, B és a C szakaszok 2 2 molekulát kódolnak. Ez a 6 molekula nagy lehetőséget ad az idegen molekulák felismerésére, viszont csak minimálisat a saját struktúrákhoz való kötődésre. A homozygotákban csak 3 lókusz kódolja az I. fehérjeosztályt, így 6-ról 5-re csökken az MHC-antigének diszponibilitása, ami lényegében az egyed immunkapacitásában nagy veszteséget jelent. Az MHC I antigének funkciói: a T-sejt-funkciók egyike a vírussal fertőzött sejt elpusztítása, ami a cytotoxicus reakciók útján megy végbe abban az esetben, ha az antigén az MHC I-hez kötődött, mivel csak ezt a komplexet képes felismerni. A T-sejt felületén a CD8 szorosan asszociált a T-sejt antigénreceptorához. Az MHC I antigének azonosítása IF és monoclonális ellenanyagok alkalmazásával lehetséges MHC II antigének A II osztályba sorolt antigének főleg az antigénprezentáló sejteken, a B-sejtek, a macrophagok és a dendritikus sejtek felületén találhatók, de kisebb számban előfordulnak az endothelsejteken, a thymus epithelsejtjein, valamint a keratinocyták felületén is. Legfontosabb szerepük az, hogy az antigénprezentáló sejtek ezekhez a fehérjékhez kötve mutatják be, vagyis a T-sejtek számára ilyen módon teszik felismerhetővé az antigén fragmenseit (170. ábra) ábra - A T-sejt-felismerés mechanizmussa 352
373 Immunológia AzMHC II szerkezete: a molekulák közel azonos hosszúságú, alfa- és béta-láncokból álló molekulák. A láncok doménszerkezetekre tagozódnak. Az aminosav-szekvencia alapján igen nagy a variabilitásuk. Az MHC II polimorfizmusa: az aminosav-szekvencia alapján igen nagy a variabilitásuk, különösen a 3. és a 4. régióban. Ezek a molekula zsebszerű betüremkedésében találhatók, és ezek határozzák meg a szervezet adott epitopokkal szembeni responderképességét. A variabilitásban, akárcsak az MHC I.-nél, a mutációk itt is szerephez jutnak. Az MHC II funkciói: az aminosav-szekvencia alapján igen nagy a variabilitásuk. Az antigénprezentáló sejteken, mint peptidreceptorok működnek, ennek eredményeként részük van a T-helper sejtek antigénfelismerő képességének szabályozásában. Minthogy nem minden antigénnel képes kötődni, az antigének bemutatásában kialakulhat bizonyos fokú szelekció, és egyes feltételezések szerint ez közrejátszik az antigénekkel szembeni erős, gyenge vagy hiányos immunválasz kialakulásában. Az immunválasz Ir (immune response) génjei: kísérletekben igazolták, hogy az immunválasz képességet az Ir gén határozza meg, amely az MHC II génjei között helyeződik. Amikor ugyanis szintetikus antigénekkel 2 egértörzset (CBA és C57B1) oltottak, akkor az egyik törzs jó responder volt, a másik nem. Amikor keresztezték a 2 egérvonalat, akkor kialakult egy átlagos válaszképesség. Minthogy az MHC regulálja az immunválaszt, logikus, hogy génjei befolyásolják az egyed fertőző betegségekkel szembeni érzékenységét vagy rezisztenciáját. A szarvasmarhák leukózissal szembeni rezisztenciája a BoLA-w7-tel, míg az érzékenység a BoLA-w12-vel függ össze. Az M vércsoport-antigén a BoLA-w16-hoz fűződik, és ugyanez a mastitisszel szembeni érzékenység hordozója is. Az M-negatív szarvasmarhák rezisztensek a mastitisszel szemben. 353
374 Immunológia A B2, B6, B14 és a B21 tyúkhaplotípusok rezisztensek a Marek-betegséggel szemben, míg a B1 haplotípusok nemcsak a Marek-betegség iránt, hanem a salmonellás fertőzésekre is nagyban érzékenyek. Az MHC II identifikálása: LMC (kevert lymphocytakultúrákban) eljárással (lásd a transzplantációs immunitás c. fejezetet). MHC III antigének: az MHC-n belül találhatók olyan gének is, amelyek számos, az immunrendszer működését befolyásoló fehérjét kódolnak, pl. a komplement rendszerhez tartozó fehérjéket, különböző hatású enzimeket, tumornecrosis-faktort és ún. shokkfehérjéket Házi emlősállatok MHC-antigénjei A BoLA (bovin lymphocyta antigén) I. osztályának eddig csak egy lókuszát határozták meg (BoLA-A), bár bizonyosnak látszik egy második lókusz (BoLA-B) létezése is. A lokusz I. 10 gént tartalmaz. Az A-lókusz 32 aléllel bír, amelyek szerológiailag jól determináltak. A bovin II. osztály hasonló az emberéhez, és ennek megfelelő szubrégiók találhatók (DQ, DR, DO, DN). ELA (equin lymphocyta antigén) szisztéma: a lónak két lókusza található az MHC I-en: az ELA-A és az ELA- B. Valószínűleg génjük van, az ELA-A 21 aléllel, az ELA-B 3 aléllel rendelkezik. Az MHC II-n 2 lókuszt azonosítottak: DR, és a DQ. SLA (sertés lymphocyta antigén) szisztéma: az I. osztálynak 3 lókusza van: SLA-A, SLA-B és az SLA-C. Az I. osztálynak mintegy 40 alélljét identifikálták. A II. osztálynak SLA-DR és SLA-DQ lókusza ismert. Ezek ismerete olyan szempontból is jelentős, hogy pl. modellkísérletekben tisztázták: a nagy fehér sertés növekedési hiánya az SLA 4 és SLA 5-höz kötődik, míg pl. a Landstrasse fajtában a hízékonyság az SLA 1, SLA 15 és 18-hoz kötött. OLA szisztéma (juh): az I. osztályban eddig 16 allélt ismertek fel, amelyeket 3 lókusz kontrollál (OLA-A-B-C). Újabb vizsgálatok szerint a juh scrapie nevű, prion okozta betegsége az allélek egyikéhez kötődik. CLA szisztéma (kecske): az I. osztályban 13 allél van. A kecske arthritis-encephalitis, retrovirus által okozott betegsége (CAE), illetve az ez irányú fogékonysága az 5. alléllel áll összefüggésben. DLA szisztéma (kutya): az I. osztálynak 3 lókusza van DLA néven (A-B-C), A: 8, B: 5, C: 4 alléllel. FLA szisztéma (macska): az FLA a B2 kromoszómán lokalizálódik. Polimorfizmusa még alig ismert Lymphokinek és cytokinek A T-sejtek az antigénstimulus hatására olyan proteinanyagok keverékét szekretálják, amelyek az immunválaszban részt vevő sejtek reakcióit szabályozzák. Ezeket a regulálóanyagokat amelyeket a sejtek termelnek, általános néven cytokineknek nevezzük. Ezek közül azokat, amelyeket a monocyták szekretálnak, monokineknek, míg a lymphocyták által termelt mediátorokat lymphokineknek hívjuk Lymphokinek A lymphokinek lymphocyták és más fehérvérsejtek által termelt, polipeptid természetű, intercelluláris mediátorok, amelyek az immunválasz során módosítják a fehérvérsejtek aktivitását. A célsejtek, amelyekre hatásukat kifejtik, széles skálát képviselnek: lymphocyták, monocyták, granulocyták, endothelsejtek, fibroblastok, osteoblastok, illetve osteoclastok és tumorsejtek. Növelhetik a sejtosztódást és fokozhatják a sejtnövekedést, de sejtkárosító hatásuk is lehet. Ide tartoznak a gyulladásos folyamatokat szabályozó mediátor anyagok is, mint pl. a macrophagmigrációt gátló faktor, a macrophag-kemotaktikus faktor, a leucocytagátló faktor stb., amelyek a gyulladásos beszűrődés sejtjeinek működését befolyásolják. A lymphokinek már igen alacsony koncentrációban is aktív hatásúak. Biológiai felezési idejük percekben fejezhető ki, és alapvető szerepük az immunválasz szabályozásában jut érvényre. Ezek a kémiai messengerek hatásukat legtöbbször rövid távolságon (kontakt vagy néhány sejt távolság) belül fejtik ki Interleukinek Az interleukinek olyan citokinek, amelyek a leucokyták reakcióit szabályozzák. 354
375 Immunológia Interleukin l (IL l). Ezt az anyagot a dentritikus sejtek, a neutrophil granulocyták, a T- és a B-sejtek, az endothelsejtek, a fibroblastok, a keratinocyták, az astrocyták és a microglia sejtek termelik. Legfőbb termelődési helye azonban az aktivált macrophagokban van. Az IL 1-nek két formája ismeretes: IL 1-alfa, és az IL 1-béta. Mindkettő glukozilált protein 17 Kd molekulatömeggel. Az IL 1 faktor alapvető szereppel bír az immunválasz és a gyulladásos folyamatok indításában. Lázkeltő hatása miatt korábban endogén pyrogennek nevezték. Az IL 1 fontos szerepet játszik az induktív fázisban a T-sejtek aktiválásában azon keresztül, hogy fokozza az IL 2 és a gamma-interferon termelését, valamint az IL 2 receptor kifejeződését. Az IL l receptor számos sejtféleségen megtalálható. Fontosabb hatásai: szerepet játszik a T- és a B-sejtek érésében, a saját-mhc II. -felismerés szabályozásában, aktiválja a T-sejteket és növeli killeraktivitásukat, elősegíti a B-sejtek clonalis differenciálódását, mobilizálja a csontvelő neutrophil granulocytáit stb. Interleukin 2 (IL 2): a T-helper sejtek termelik a prezentált antigének vagy mitogének hatására. Glukoprotein, amely az emberben, sertésben és az egérben 15 Kd, míg a juhban és a szarvasmarhában 17 Kd, a kutyákban és a patkányban 30 Kd. A T- és a B- sejtek proliferációjában játszik meghatározó szerepet. Az IL 2 indukálja az antigének által aktivált T-sejtek clonalis differenciálódását, fokozza a T-sejt-receptor kifejeződését, és kulcsszerepet játszik az immunválasz regulációjában. Ez úgy megy végbe, hogy a nyugvó T- sejtek tömegéből az antigénspecificitásnak megfelelően szelektálódott sejtekben aktiválódnak az IL 2 termelést és az IL 2 receptort kódoló gének. Az IL 2 termelése, illetve az IL 2 kis és nagy aktivitású receptorainak kifejeződése biztosítja a megfelelő klón proliferációját, továbbá megszabja az immunválasz mértékét és időtartamát. Az IL 2 hat a lymphoid sejtek (B-sejtek, T-killer sejtek, monocyták) proliferációjára és differenciálódására. Számos vírus és baktérium olyan módon vált ki immunszuppresziót, hogy gátolja az IL 2 termelését. Ez egyben arra is utal, hogy IL 2 applikálásával, illetve termelésének stimulálásával az immunitás növelhető. Tumornecrosis-faktor (TNF) és lymphotoxin (LT) jelenlétét endotoxinnal kezelt egerek szérumában figyelték meg először. A 157 aminosavból felépülő protein más egerekbe átoltva nekrotizáló hatást fejt ki bizonyos daganatsejtekre. Két típusa ismert: a TNF-alfát a monocyták, a 0 sejtek és az NK sejtek termelik az IL-2- stimuláció, valamint vírusok és baktériumok termékeinek hatására. Ezzel szemben a TNF-béta az aktivált T- sejtek terméke, és a nem lymphoid típusú sejtek lysisét okozza. B-lymphocyta-növekedési és -differenciálódási faktor (BcGF): a T-lymphocyták és a macrophagok termelik, és hatásuk az ellenanyag-termelő B-lymphocytákra irányul. Haemopoeticus növekedési faktor: az aktivált T-sejtek haemopoetint termelnek, amit IL 3 nak is nevezünk. Stimulálja a myeloid őssejtek proliferációját és fejlődését Interferonok Az interferon (IFN) megnevezés olyan proteincsaládot jelent, amelynek tagjai nemcsak termelődési helyük és kémiai összetételük szerint, hanem hatásmechanizmusukban is különböznek. Felismerésük után kezdetben csak a vírusszaporodás gátlásában (interferálásában) vélték hatásosnak, később azonban igazolták, hogy az interferonok befolyásolják a sejtszaporodást és -differenciálódást, továbbá immunmoduláló sajátossággal is rendelkeznek. Alfa- és béta-interferon. Leukocyták, legnagyobbrészt a 0 sejtek termelik, illetve a fibroblastokban termelődik, vírusfertőzést követően. Gamma-interferon. A specifikus immunválasz során a T-sejtek termelik. A termeléshez macrophagok jelenléte is szükséges. A gamma-ifn más receptorokon hat, mint az alfa- vagy béta-ifn. Regulálja az MHC II. kifejeződését monocytákon, endothel- és epithelsejteken, aktivál macrophagfunkciókat, beleértve az IL 2- termelődést és az intracelluláris baktériumemésztést is Az immunválasz kinetikája 355
376 Immunológia Az immunválasz az idegen anyag felismerésével kezdődik, majd szigorúan meghatározott sejtkölcsönhatások következményeként alakul ki a célzott immunválasz, amely specifikus ellenanyagok termelődését (humorális immunválasz), illetve ún. immunocyták proliferációját (celluláris immunválasz) eredményezi. Az immunválaszban három szakaszt szokás megkülönböztetni: az afferens (antigénfelismerés és információ továbbítás), a centrális (sejtkölcsönhatások) és az efferens (effektor hatás) fázist. Afferens szakasz: az antigén-felismerés és az információ továbbításának folyamatát jelenti, ami a szervezetben bárhol, bármilyen szövetféleségben végbemehet. A macrophagok és egyéb antigénprezentáló sejtek az antigéneket legtöbbször rövidebb fragmensekre hasítják, és ezeket az MHC-molekulákhoz kapcsoltan a sejtfelszínen rögzítik. A T h-sejtek adhéziós molekuláikkal a macrophagokhoz kötődnek, és T-sejt-receptoruk felismeri az MHC II. felületén levő antigénrészletet. Az antigén-felismerés hatására aktiválódnak a T-sejtek, lymphokineket termelnek, vagyis továbbítják az információt a többi együttműködésre képes sejtnek. Centrális szakasz: a clonalis proliferáció szakasza, amely a lymphoid szervekben zajlik le. A centrális folyamat T T, illetve T B sejtkölcsönhatásokat foglal magában, amelynek eredményeként effektor funkciókkal rendelkező T-sejtek (paracorticalis zóna), illetve Ig-szintézisre képes plazmasejtek (folliculusok) differenciálódnak. Az interleukintermelés alapvető szerepet játszik e folyamatban is, minthogy az IL 2 hiányában a clonalis proliferáció elmarad. Efferens szakasz: a specifikus Ig-ok kötődnek az antigénekkel és a komplementrendszerrel együttműködve azokat eliminálják, illetve a killer hatású sejtek az antigénhordozó célsejteket elpusztítják Humorális immunválasz A humorális immunválasz praecursor sejtjei a B-lymphocyták, amelyek az antigéninger (első szignál) hatására plazmasejtekké differenciálódnak. Ezek a sejtek ellenanyagokat termelnek, amelyek a véráramba, illetve a szövetnedvekbe kerülve szolgálják a humorális védettséget. A humorális immunválasz kialakulásában és kinetikájának szabályozásában a T- (helper-)lymphocyták, az aktivált macrophagok, valamint az IL 1 is jelentős szerepet játszanak. A humorális immunválasz induktív szakaszában az antigén bemutatását követően három, egymástól megkülönböztethető folyamat zajlik le: A nyirokcsomó ún. paracorticalis zónájában a T-sejtek (CD 4) aktiválódnak, kb. 24 óra múlva blastosan transzformálódnak, majd különböző szubpopulációkká differenciálódnak. Ezek közül a T-helper sejtek IL 2 lymphokinje (második szignál) döntő befolyást gyakorol az immunválasz további alakulására. A nyirokcsomó cortexében, a folliculusokban a B-lymphocyták az IL 4, IL 5, IL 6 faktorok közreműködésével óra alatt plasmoblastokká alakulnak, majd kb. a 4. napra plazmasejtekké differenciálódnak. A nyirokcsomó-folliculusokban a 4. napon már nagy számban jelennek meg blastsejtek, illetve a cortexben a plazmasejtek. Az általuk termelt Ig-ok az 5 7. napon jelennek meg a vérpályában. Az ellenanyagválasz kinetikája különbözik aszerint, hogy a szervezet első alkalommal vagy pedig ismételten találkozik-e az antigénnel. Eszerint primer és szekunder immunválaszt különböztetünk meg Primer immunválasz Az antigénnel való első találkozást követő immunválaszban jellegzetes fázisok különíthetők el: induktív fázis, amely az immunválasz afferens és centráis szakaszát foglalja magában, produktív fázis, a centrális és az efferens szakaszból áll (171. ábra). Az antigén bejutását követő latencia időszakában kimutatható változás még nem történik. A log fázisban az 5 6. naptól megjelennek az ellenanyagok (előbb az IgM, később az IgG), majd mennyiségük fokozatosan emelkedik a vérpályában. Ezt követi a perzisztáló fázis, amikor az ellenanyagok szintje változatlan, majd a kiürülési fázis, amelyben a titer fokozatosan csökken, és előbb az IgM, majd az IgG típusú ellenanyagok eltűnnek a vérpályából ábra - Primer immunválasz 356
377 Immunológia A primer immunválasz kinetikája természetesen függ az antigén természetétől és az egyed válaszképességétől is Szekunder immunválasz Az ismételt antigéningert követően az ellenanyagok rövidebb idő (l 3 nap) alatt jelennek meg a véráramban. Koncentrációjuk magasabb, és ebben az IgG jóval nagyobb mennyiségben van jelen az IgM-hez viszonyítva. A szekunder immunválasz milyenségét nagyban befolyásolja az az idő, amely a primer és a szekunder inger között eltelik. Ha az ismételt antigéninger a szervezetet az ellenanyag-termelés log -fázisában vagy a perzisztáló szakaszban éri, akkor az ellenanyagtiter csökken, mivel a bejutó antigén az ellenanyagok egy részét megköti. Ez a csökkenés csak átmeneti (ún. negatív fázis), és az ellenanyagszint l 2 nap eltelte után ismét emelkedik. További antigéningerekre az ellenanyagszint lépcsőzetesen emelkedik, majd adott titerértékben megállapodik (hyperimmun állapot, 172. ábra) ábra - Szekunder immunválasz 357
378 Immunológia A humorális immunválasz kialakulását, ezen belül az immunglobulin-osztályok milyenségét alapvetően befolyásolja az, hogy az antigén thymusdependens vagy thymusindependens. Thymusindependens antigének (TI): T-sejtek közreműködése nélkül is képesek humorális immunválaszt indukálni. Ezek általában szénhidrátokból álló, bakteriális sejtfalkomponensek vagy sokszorosan ismétlődő, azonos epitopokat hordozó makromolekulák, amelyek a szervezetben rendkívül lassan, nehezen bomlanak el, ezért az antigénprezentáló sejtek nem tudják ezeket a T-sejteknek bemutatni (pl. E. coli endotoxinja, lipopoliszacharidja). Jellemzőjük még, hogy legtöbbjük ún. policlonalis B-sejtaktivátor. Ez azt jelenti, hogy egyidejűleg nagyszámú B-sejtet stimulálhatnak, mivel nemcsak a specifikus receptorokhoz, hanem a mitogén receptorokhoz is képesek kötődni. 358
379 Immunológia Thymusdependens antigének (TD): kizárólag a T h-sejtek közreműködésével indukálnak humorális immunválaszt, amelyben memóriasejtek is kialakulnak, így az antigén ismételt bejutása után erőteljes szekunder (IgG) immunválasz jön létre. Ilyen antigének pl. a baktériumok, a vírusok szolubilis fehérjéi, hapténhordozó komplexek stb. A T- és B-sejt-kölcsönhatás lényegét igazolja az ún. haptén-carrirer effektus. Ennek az a lényege, hogy az immunválasz centrális fázisában az antigénmolekula különböző determinánsait az egymással kölcsönhatásban álló T- és B-sejtek ismerik fel. Ha pl. dinitrofenol-molekulát (DNF) kötünk bovin globulinhoz és ezt kísérleti állatba oltjuk, akkor a DNF-hapténnel szemben primer immunválasz alakul ki. Ha ezután a DNF-t ovalbuminhoz kötve oltjuk be, akkor szekunder immunválasz nem alakul ki. Ez ugyanis csak akkor jön létre, ha a DNF az eredeti molekulához kötött. A jelenség úgy magyarázható, hogy a hapténre B-sejtek differenciálódnak, míg a carriert T h-sejtek ismerik fel Celluláris immunválasz A celluláris immunválaszban az effektor funkciók a T-killer lymphocytákhoz és a macrophagokhoz kötődnek. A celluláris immunválasz afferens szakaszában az antigén-felismerés folyamata a nyirokcsomó paracorticalis zónájában megy végbe. A felismerés feltétele, hogy az MHC II. osztályú struktúrát hordozó APC (antigénprezentáló) sejtek és a macrophagok az antigént a T-sejtek számára felismerhetővé tegyék. A T-helper sejtek ugyanis csak antigénrészeket képesek felismerni és csak akkor, ha azok az APC sejtek felületén az MHC II-höz kötődnek, és így a saját struktúrát megváltoztatták ( megváltozott saját felismerése). Más felfogások szerint az antigént és az MHC-molekulát külön-külön receptorok ismerik fel (kettős felismerés, 173. ábra) ábra - A kettős felismerés modellje Az antigénfelismerést követő T-sejt aktiválódás folyamatát vázlatosan a 174. ábra mutatja be: a felismerés az APC sejt felé olyan szignált képez, amely a sejtet IL l-termelésre készteti, a felszabadult IL l a T-helper sejtek IL 2-termelését, illetve az IL 2-receptor kifejeződését indítja meg, amelyek a továbbiakban a T-szubpopulációk és B-sejtek osztódását szabályozzák, az IL l hatására a T k sejtek növelik a CD 8 antigén és az IL 2-receptoruk expresszióját ábra - A T-sejt-aktiválódás módja 359
380 Immunológia A centrális fázisra a szubpopulációk differenciálódása a jellemző, amely folyamat a T-szuppresszor és a T- helper sejtek szabályozása alatt áll. A szubpopulációk egy része lymphokinek révén aktiválja a macrophagokat, más része cytotoxikus T-sejtté differenciálódik. A T-helper sejtek egyúttal hatnak a B-sejtekre, amelyek a termelt Ig révén elősegítik az ún. antitestdependens (ellenanyagtól függő) cytotoxikus reakciókat (ADCC: antibody dependent cell mediated cytotoxicity). Az NK (natural killer), vagyis a természetes killersejtek nem specifikus úton pusztítják a target (céltábla) sejteket. A celluláris immunválasz effektor fázisában a targetsejt litikus folyamatok áldozatává válik. A cytolysis három fázisban zajlik le: A targetsejt ( célsejt ) szoros érintkezésbe kerül a T-killer lymphocytával. Ez a folyamat percek alatt megy végbe. A killer fázisban a targetsejt a killer által kibocsátott cytolyticus faktorok és aktív gyökök hatására irreverzíbilis károsodást szenved. A lysis fázisa: a sejt néhány óra alatt destruálódik, és a lysis folyamata befejeződik. Ebben a lymphocyta már nem vesz részt, mert leválik a targetsejtről. Arra vonatkozóan, hogy milyen ismérvek határozzák meg egy adott antigéningerre a szervezet humorális, celluláris vagy ezek együttes reakcióját, ma még keveset tudunk. Bizonyos azonban, hogy erre elsősorban az antigén természete és behatolási módja van befolyással. A celluláris immunválasz döntő szerepet játszik az átültetett szövetek, valamint a daganatsejtek elpusztításában, a saját módosult szöveti antigének eliminálásában, továbbá egyes fertőző betegségekkel (pl. gümőkór) szembeni rezisztenciában Baktériumokkal szembeni immunválasz A baktériumok kórokozó képessége: a pathogen baktériumok fogékony fajok egyedeiben kóros folyamatokat idézhetnek elő. A megbetegítőképesség szorosan összefügg az adott baktérium virulenciájával (lásd a Baktériumantigének c. fejezetet). A baktériumokkal szemben a szervezet egyrészt számos nem specifikus mechanizmussal, másrészt specifikus immunreakciókkal, illetve ezek együttes hatásával védekezik. Bármelyik folyamat is kerül a védekezés előterébe, a legtöbb baktérium destrukciója és eliminációja phagocyták közreműködésével zajlik le. A nem specifikus folyamatok között szerepelnek természetes barrierek, ami az első védelmi vonalat képezi, mint a bőr, a nyálkahártya, a lysosomális enzimek, a komplementrendszer egyes faktorai (pl. C3b), IgA-, ADCC-reakció, phagocytosis, opszonizáció, laktoferrin, chemotacticus faktorok, leukotriének, prosztaglandinok, gyulladás stb. 360
381 Immunológia A második védelmi vonallal akkor találkozik a kórokozó, ha akár virulenciafaktorai révén, akár vektorok közvetítésével vagy éppen sérülések következtében túljutnak az első védelmi vonalon, és ilyenkor a specifikus folyamatok lépnek a védekezés előterébe. A specifikus folyamatok a humorális és a celluláris immunválaszból tevődnek össze. A védekezés lefolyása és az immunitás kialakulása nagymértékben függ attól, hogy a szervezet milyen módon képes a baktériumot, illetve sejtfalát károsítani. Ez utóbbi lényegében a baktérium sajátosságaitól (extracellulárisan vagy intracellulárisan szaporodik-e) függ, és ilyen szempontból azokat négy alaptípusba sorolhatjuk (175. ábra): Gram-pozitív baktériumokat a phagocytáló sejtek pusztítják el, amely folyamat a komplementfaktorok és az ellenanyagok opszonizációs hatása mellett megy végbe. Gram-negatív baktériumokat, specifikus antitestek ölik el lyticus úton, komplementfaktorok közreműködésével. Egyes mikroorganizmusok (pl. Mycobacterium bovis, M. paratuberculosis) a macrophagokban képesek gátolni a lysosomák és a phagosomák fúzióját. Ilyen módon ellenállnak az emésztési folyamatoknak, vagyis képesek a macrophagokban intracellulárisan élni és szaporodni. E baktériumokkal szemben a celluláris immunválasz effektor funkciója csak részben érvényesül, ezért a szervezet velük szemben az ún. granulomás hypersensitivitási reakcióval védekezik. Más baktériumok is (pl. serpulinák, spirochaeták) lehetnek ellenállóbbak a phagocytosissal szemben, ezért ezek legtöbbször ellenanyagok, komplement faktorok és lysosomális enzimek együttes hatására pusztulnak el a szervezetben ábra - A bakétriumokkal szembeni immunválasz 361
382 Immunológia A specifikus ellenanyagok szerepe a baktériumokkal szemben többféle lehet, de alapvetően függ a baktériumok antigénjeitől, illetve azok helyeződésétől. Hatásuk négy főbb csoportba sorolható: blokkolják a kórokozók ún. kolonizációs faktorait, amelyek a sejthez való kötődést biztosítják (pl. E. coli, Bordetella bronchiseptica), közömbösíthetik egyes mikroorganizmusok olyan proteinjeit (pl. streptococcusok M-proteinjei), amelyek gátolják a phagocytosist, opszonizálják a baktériumokat, így a macrophagok Fc-receptoruk útján azokat megköthetik és a phagocytosis felgyorsul, neutralizálják a toxinokat (pl. tetanustoxin), így a szervezet pusztulását meggátolják. A baktériumos betegségek során lezajló immunológiai folyamatok a szervezetre nézve általában nem járnak káros következményekkel. Némelykor azonban a szervezet védekezése káros folyamatok kialakulását vonja maga után. A sertés E. coli okozta oedemabetegségének pathogenesisében a védekezés következtében kialakuló anaphylaxiás folyamat is jelentős szerepet játszik. Ugyancsak az immunológiai folyamatok káros következményeként alakul ki olykor a sertésorbánc esetén az ízületgyulladás vagy a szívbelhártya-gyulladás, ami az ún. immunkomplexek képződésének a következménye. Egyes baktériumok az immunrendszer működését gátolhatják olyan módon, hogy az immunválasz kialakulásában szerepet játszó sejteket károsítják Vírusokkal szembeni immunválasz 362
383 Immunológia A vírusfertőződés feltételei. A vírusok csak az irántuk fogékony fajokat képesek megbetegíteni. A fogékony fajok sejtjei ugyanis egyrészt olyan receptorral rendelkeznek, amely a vírusnak sejthez való kötődését lehetővé teszi, másrészt a sejtbe jutott vírus megtalálja a szaporodásához szükséges feltételeket. Más fajok ún. természetes rezisztenciával rendelkeznek. A fogékony fajon belül az egyed érzékenységét belső (pl. hormonális hatások) vagy külső (pl. környezeti, tartási, klimatikus) tényezők, mint hajlamosító okok befolyásolják. A szervezet tulajdonságai közül a kölcsönhatások során legfontosabb a fogékonyság, vagyis az, hogy az adott vírus talál-e a fertőzött szervezet sejtjein olyan receptorokat, amelyekhez kötődve fertőzést indíthat meg. Amennyiben a vírus a szervezetben rezisztens sejtekkel találkozik, a vírusszaporodás meg sem kezdődik. Az ilyen abortív fertőzések során a vírus rövid időn belül eliminálódik a szervezetből. Ez előfordulhat pl., ha a vírus az adott fajra nem pathogen (pl. a ragadós száj- és körömfájás vírusa húsevőkre) vagy ha a vírus nem megfelelő úton jut a szervezetbe, pl. a rovarok közvetítette ún. arbovírusok többsége alimentáris vagy aerogén úton (vagyis a tápcsatornán, illetve a légutakon keresztül) nem indít hatékony vírusfertőzést még akkor sem, ha különben fogékony szervezetbe jut. Minél több állatfaj sejtjein fordulnak elő az adott vírusra specifikus membránreceptorok, annál szélesebb az illető vírus gazdaspektruma. Ennek megfelelően megkülönböztetünk stenoxen (szűk gazdaspektrumú) és euryxen (széles gazdaspektrumú) vírusokat. Stenoxen kórokozó pl. a Marek-féle betegség vírusa, amely csak tyúkféléket betegít meg, euryxen pedig pl. a veszettség vírusa, amely bármely emlősfajban okozhat megbetegedést. A vírus tulajdonságai közül legfontosabb az infektivitás, vagyis az, hogy a vírus rendelkezzen mindazokkal a strukturális elemekkel, amelyek nélkülözhetetlenek a szaporodásához. A másik alapvető tulajdonság pedig a pathogenitás, ami a vírus szervezet kapcsolat további alakulását meghatározza. A vírusfertőzés az esetek többségében ugyanis nem jelenti feltétlenül azt, hogy a fertőzött állat meg is betegszik, mivel a vírusok többsége apathogen, vagyis nem rendelkezik olyan genetikai információval, amely képessé tenné arra, hogy a szervezet egésze szempontjából számottevő károsodást idézzen elő. Néhány sejt ugyan áldozatul eshet az ilyen fertőzéseknek, de ez nem jelent funkciózavart, klinikai tünetek, szövettani elváltozások stb. nem figyelhetők meg. A szervezetben interferonszintézis indul meg, aktiválódik a humorális és celluláris immunrendszer stb. Az ilyen fertőzéseknek ezért fontos szerepük van a szervezet általános ellenálló képességének fokozásában, az immunrendszer reakciókészségének szinten tartásában. Az egyes betegségek előidézésére képes (pathogen) vírusok között is különbségek vannak a pathogenitásért felelős gének expressziójában. Erőteljes génexpresszió esetén virulens a kórokozó, ellenkező esetben pedig avirulens. A virulencia tehát a pathogenitás mértékét jelzi (pl. a baromfipestisvírus-törzsek virulenciájuk szerint csoportosíthatók). Az alacsony virulenciájú vírusok legfeljebb enyhe kórképet okoznak vagy helyi tüneteket idézhetnek elő, a virulens vírusok viszont potenciálisan az adott faj bármely egyedét megbetegíthetik, noha a kórlefolyást az egyedek immunállapota, természetes ellenálló képessége, élettani állapota (kor, vemhesség) stb. nagymértékben befolyásolja. Ugyanaz a vírus az egyedtől függően eltérő fertőzési formák előidézésére is képes. Az Aujeszky-betegség vírusa pl. előidézhet akár latens, akár heveny vagy akár idült fertőzést is. A latens formában a kezdeti heveny kórfolyamatot követően a vírus látszólag eltűnik a szervezetből, csak a nukleinsav perzisztál a szervezet sejtjeiben megbújva. Immunszuppresszív hatások vagy egyéb hajlamosító tényezők következtében viszont aktiválódnak, megindul a vírusszaporodás, és kialakulhatnak a betegség jellegzetes tünetei. A fertőzés másik formája az ún. tolerált fertőzés (lásd az Immuntolerancia c. fejezetben). Az ún. perzisztens fertőzés többnyire heveny megbetegedést követően alakul ki, jellemzője a tartós vírushordozás és a folyamatos vírusürítés (pl. az afrikai sertéspestissel fertőzödött és a betegséget túlélő egyedekben). A vírusok pathologiás hatása a gazdasejt károsításából ered. Ez a károsítás okozhatja: a gazdasejt degenerációját, szétesését, ami a jellegzetes klinikai tünetekhez, illetve funkciózavarokhoz vagy a szervezet pusztulásához vezet, a sejtburjánzás kialakulását, ami jó- vagy rosszindulatú daganat képződésében nyilvánul meg, 363
384 Immunológia az immunológiai alapon létrejövő sejtkárosodást, amikor a gazdasejt felszínén megjelenő antigénnel szembeni humorális vagy celluláris immunválasz károsítja azt, mint target- (cél-)sejtet. A vírusfertőzésekkel szembeni védekezés többféle mechanizmusra épül, és ezek működése függ egyrészt a vírus sajátosságaitól, másrészt a kórfolyamat adott fázisától (176. ábra) ábra - Virusokkal szembeni immunválasz A különböző vírusfehérjékkel (glükoproteinekkel stb.) szemben képződött ellenanyagok neutralizálhatják a vírusokat, megakadályozva ezáltal a fogékony sejtekhez való kötődésüket, elősegíthetik továbbá a víruspartikulák phagocytosisát, a vírussal fertőzött sejtek pusztulását stb. Az IgG-molekulák főleg a keringésben, míg az IgA-molekulák a nyálkahártyák felületén segítenek a vírusok eliminálásában. A vírusneutralizáló ellenanyagok akkor jutnak szóhoz, amikor a virionok sejten kívül, szövetfolyadékokban vagy testnedvekben találhatók. Ezek az antitestek kötődve a virionokhoz meggátolják, hogy azok újabb sejtekbe, távolabbi szervekbe jussanak (pl. poliovirus idegrendszeri szövődményeinek gátlása). Olyan vírusok esetében viszont, amelyek közvetlenül is átjuthatnak a másik sejtbe (pl. egyes herpesvirusok), a VNellenanyagok nem nyújthatnak védelmet. Az ellenanyagok VN-hatását a komplement jelenléte fokozza, feltehetően úgy, hogy a C4b fragmens akadályozza a vírus sejtbe való bejutását. A vírusokkal szembeni védekezésben a celluláris immunreakciók is érvényre jutnak, és a vírussal fertőzött gazdasejtek elpusztításában nagyobb a jelentősége, mint az ellenanyagoknak. A T-killer sejtek cytotoxikus hatása a vírust hordozó sejttel szemben direkt módon vagy indirekt formában (ellenanyag, illetve komplement jelenlétében) érvényesülhet. A vírusokkal szembeni nem immunológiai jellegű védelem fontos képviselője az interferon, amely ellentétben az ellenanyaggal, nem antigén-, hanem gazdafaj-specifikus. Az interferon a vírus penetrálása előtt fejti ki hatását olyan módon, hogy a sejtreceptorokhoz kötődve, a vírusfertőzéssel szemben rezisztenciát vált ki. Ismeretesek olyan vírusfertőzések is, amelyek a lymphoid sejteket és szöveteket károsítják, ezáltal az immunrendszer működésében deficienciát okoznak (lásd az Immundeficienciák c. fejezetben) Parazitákkal szembeni immunválasz 364
385 Immunológia A parazitákkal szemben az immunrendszer legtöbbször csak részlegesen képes védettséget nyújtani annak ellenére, hogy parazitás fertőzöttség esetén a szervezet mind a humorális, mind a celluláris védekezés rendszerét mozgósítja. Ez nagyrészt abból ered, hogy akár intracellulárisan szaporodnak (pl. plasmodiumok), akár cisztában (T. spiralis, E. histolytica) találhatók vagy az emésztőcsőben élősködnek (pl. nematodák), az ellenanyagok, illetve az effektorsejtek részére nehezen hozzáférhetők. A paraziták testanyagai, mirigyszekrétumai, anyagcseretermékei mint antigének egyrészt humorális immunválaszt indukálnak, másrészt egyes paraziták differenciált szöveti felépítésük alapján testidegen szövetként, celluláris immunválaszt is kiváltanak. A parazita-antigénekkel szemben IgM, IgG, IgA és IgE típusú ellenanyagok termelődnek, ezek azonban legtöbbször közvetett módon jutnak szerephez a szervezet védettségének alakulásában. A specifikus ellenanyagok termelése a T h-sejtek szabályozása alatt áll. Számos parazitás fertőzöttségnél azonban megfigyelhető hypergammaglobulinaemia is, ami feltehetően azzal áll összefüggésben, hogy a paraziták egyes antigénjei mint policlonalis B-sejt-aktivátorok is szerepelnek. A specifikus ellenanyagok jelentős szerepet játszanak az extracelluláris parazitákkal szembeni védekezésben. Gátolhatják a vérparaziták reinvázióját a sejtekbe, és károsíthatják azokat akár önmagukban, akár komplement faktorok közbejöttével, részt vehetnek továbbá az antitestdependens cytotoxicitási reakciókban (ADCC). A cytotoxicus T-sejtek az intracelluláris paraziták esetében a vírusfertőzésekhez hasonlóan, a targetsejtek pusztításával fejtik ki hatásukat. Az eosinophil granulocyták, úgy tűnik, rendkívül fontosak a parazitás fertőzés elleni védekezésben. A bél nyálkahártyájában pl. nagy számban jelennek meg, és a folyamatot a T-sejtek szabályozzák az ESP (eosinophil stimulation promoter) felszabadításával (177. ábra) ábra - Parazitákkal szembeni immunválasz 365
386 Immunológia A bélnyálka immunológiai válasza pl. olyan módon vezet a parazita eliminálásához, hogy az ellenanyag károsítja a parazita anyagcseréjét, a T-sejtek pedig nem specifikus faktorokkal növelik a kehelysejtek szekrécióját, növelik továbbá a nyálkahártyabeli és a kötőszöveti hízósejtek számát, ami végül a parazita eliminációját okozza. Egyes gyomor-bél férgességek esetén a nyálkahártyára lokalizálódó anaphylaxiás reakció zajlik le, amikor a felszabaduló vazoaktív aminok fokozzák a simaizmok összehúzódását, az erek áteresztőképességét, és ez a nagyfokú szekrécióval együtt elősegíti a paraziták kilökődését Gombákkal szembeni immunválasz A gombás fertőzések változó kórképeket idézhetnek elő. Ezek lehetnek lokálisan a bőrre vagy a nyálkahártyákra korlátozódó elváltozások, vagy pedig egyes szervekre (tüdő, vese, emésztőcső stb.) vagy szervrendszerekre kiterjedő károsodások. A gombás fertőzésekkel szembeni védekezésben az immunrendszer funkciója döntő jelentőségű, amit bizonyít az is, hogy immunhiányos állapotban gyakoribbak a súlyos kimenetelű gombás betegségek. 366
387 Immunológia A pathogen gombákkal szemben a szervezet védekezése mind humorális, mind celluláris reakciókban kifejeződik, de kiválthatnak IV. típusú hypersensitivitási reakciókat is. Valószínű, hogy a gombaantigének hatására a T-sejtekből felszabaduló lymphokinek által aktivált macrophagok pusztítják el a gombákat. A specifikus ellenanyagok védő hatása gombás betegségekben még bizonytalan. A belső szervi mycosisok esetén termelődő ellenanyagoknak diagnosztikus értékük van, és szerológiai reakciókban jól detektálhatók. A gombás betegségek pathogenesise teljességében még nem ismert, de immunológiai szempontból annyi bizonyos, hogy gátolhatják a macrophagok aktivitását és azok funkcióit a phagosomák és a lysosomák fúziójának akadályozása révén. A gombás fertőzések az I., III. és a IV. típusú reakciók mechanizmusa szerint immundeficienciákat is előidézhetnek Transzplantátumokkal szembeni immunválasz A század korai évtizedeiben megfigyelték már, hogy pl. ugyanazon fajhoz tartozó egyedek közötti bőrtranszplantátumokat a szervezet nem fogadja be, hanem azok elhalnak és kilökődnek, míg ugyanazon szervezet különböző testrészeiről származó bőrátültetés sikerre vezet. Ezek a megfigyelések vezettek később arra a felismerésre, hogy az immunrendszernek nemcsak a kórokozókkal szembeni védekezés az alapvető feladata, hanem funkciója a szervezet integritásának megőrzésére is kiterjed. Az immunrendszer arra hivatott sejtjei a saját genetikai állandóságot, a homeosztázist szüntelenül ellenőrzik a sejtfelületi receptorokon keresztül. Amikor egy sejt felületi struktúrája módosul, vagyis abnormálissá válik, vagy ha idegen sejt, illetve szövet kerül a szervezetbe, akkor ezt a T-lymphocyták, valamint az NK sejtek felismerik, és funkciójuknak megfelelően elpusztítják. A felismerés alapját az MHC I. és II. antigének képezik. Az átültetett szövet a gazdaszervezethez való viszony szerint lehet: autotranszplantátum: ugyanazon egyed szövetének más helyre való átültetése, izotranszplantátum: genetikailag identikus egyedek közötti szövetátültetés, alotranszplantátum: genetikailag különböző, de fajon belüli szövetátültetés, xenotranszplantátum: szövetátültetés különböző speciesek között, A transzplantátumoknak a recipiens szempontjából történő befogadását vagy azoknak a szervezetből való kilökődését a 178. ábra szemlélteti ábra - A transzplantátum sorsa a recipiensben (I. R. Tizard után) 367
388 Immunológia Az alotranszplantátumok kilökődésének pathologiája A donor szövet elpusztítása és kilökődésének folyamata több körülménytől függ: A donor és a recipiens genetikai távolságától, pl. xenotranszplantátum esetében a donor veséje a szervezet heveny reakciója miatt igen rövid idő alatt (kb. 20 perc) elhal és kilökődik. Alotranszplantátumnál a donor veséje 7 8 napon át túlélhet, de ha pl. ugyanazon donorból még egy vese kerül átültetésre, akkor ez a szerv rövidebb idő alatt (kb. 2 nap) pusztul el. Bőr-alotranszplantátum esetében napok kellenek ahhoz, hogy a vérerek és a nyirokerek megfelelő összeköttetést teremtsenek a gazdaszervezet és a transzplantátum között. Miután ez az összeköttetés kialakult, megkezdődik a gazdaszervezet sejtjeinek (neutrophil granulocyták, lymphocyták, macrophagok) akkumulációja, ami végül is a beültetett szövet endothelsejtjeinek károsodásához, a capillárisokban a vér coagulációjához, majd a transzplantátum necrosisához vezet. A transzplantátumok kilökődésében más folyamatok is részt vesznek, ezekről a 179.ábra nyújt áttekintést. Mint az ábra szemlélteti, a transzplantátumból származó szolubilis MHC-antigének eljutnak a nyirokcsomóba, ahol egyrészt mobilizálják a T-, az NK-sejteket, valamint a macrophagokat, másrészt megindítják a B-sejtaktiválódást. Az említett folyamatok a cytotoxikus reakciókon, valamint az ellenanyagok termelődésén és a komplementaktiválódáson keresztül a transzplantátum kilökődését eredményezi ábra - A transzplantátum kilökődése 368
389 Immunológia A graft versus host (GHV) reakció pathologiája Amikor adott donor lymphocytáit alogen recipiensbe oltjuk, akkor ezek a sejtek megtámadják a befogadó szervezet sejtjeit és acut, lokális gyulladást váltanak ki. Ez azonban nem jelent súlyos kórtani folyamatot, mivel a recipiens képes az idegen lymphocyták elpusztítására. Olyan esetekben viszont, amikor a recipiens pl. immunszuppresszív vagy immundeficiens állapotban van, akkor az idegen sejtek súlyosan károsítják a befogadó gazdaszervezetet. A reakció súlyossága az MHC-fehérjék inkopatibilitásától függ. MHC I-inkompatibilitás esetében a következő folyamatok zajlanak le: a donor lymphocyták megtámadják a gazdaszervezet valamennyi magvas sejtjét, vagyis mindazokat, amelyek a saját integritást hordozó MHC I- struktúrát viselik, károsodik a csontvelő, pancytopenia, anaemia, lymphopenia alakul ki, lymphocytás beszűrődés lesz megfigyelhető a májban és az emésztőcsőben, fekélyek és más szöveteróziók alakulnak ki a TNF termelődése miatt. MHC II-inkompatibilitás esetében az egész szervezetet érintő olyan elváltozások alakulnak ki, amelyek hasonlóak lehetnek a szisztémás lupus erithematosushoz Nem kilökődő szövet- és sejtféleségek A szervezet bizonyos szövetei és sejtjei, mint pl. az elülső szemcsarnok, a cornea, és az agyvelő, nincsenek összeköttetésben a nyirokrendszerrel, így az ilyen transzplantátumokat az immunrendszer sejtjei nem károsítják. A spermasejtekanélkülpenetrálhatnak a női genitáliákba, hogy annak bármilyen reakcióját váltanák ki. Ez egyrészt abból ered, hogy az ondó plazmája, valamint a prostata váladéka immunszuppresszív hatású, másrészt abból, hogy a spermasejtek nem indukálnak immunreakciókat, mivel nem viselik az MHC- antigéneket. Az embrióvégül is alotranszplantátumnak fogható fel, ha figyelembe vesszük, hogy genetikai állományának 50%-a apai eredetű. Az embrió immunológiai destrukcióját azonban számos mechanizmus gátolja. Ezek között jelentős az, hogy az embrió sejtjein az implantáció befejeztéig nem fejeződnek ki az MHC- antigének. Az implantációt követően a trophoblastok nyújtanak védelmet az anyai immunrendszerrel szemben. A későbbiekben a fetus termel olyan anyagokat (prostaglandin, béta-2 mikroglobulin, alfa-fetoprotein), amelyek 369
390 Immunológia immunszuppresszív hatásúak. Működik továbbá egy olyan védelem is, ami a blokkoló antitestek termelődéséből ered, ezek ugyanis gátolják a magzati antigének felismerését A transzplantáció prognosisa A szövetátültetések sikere, az RLM (reaction of mixed lymphocytes), a kevert lymphocyta reakciók alapján nagy valószínűséggel prognosztizálható. Ez lényegében a recipiens periferiás lymphocytáinak megfelelő tápfolyadékban lezajló reakciója a donor sejtjeivel szemben, amely utóbbiak reaktivitását előzetesen mitomicin- C-vel gátoljuk. A lymphocyták blastos transzformációjának indexe a genetikai távolsággal egyenes arányú A hisztokompatibilitási antigének és a szövetkilökődés A sebészi transzplantációnak nincs természetes megfelelője. Kivételt képeznek a spermasejtek, amelyek viszont nem viselik az MHC-antigéneket. Kutyákban amelyek az I és II osztályban inkompatibilisek, az átültetett vese 10 napig képes túlélni, ha az osztályok kompatibilisek, akkor 40 nap a túlélés ideje. A máj ugyanakkor napig túlél. Az I. osztály gyors választ indukál. A II.-nál, mivel csak meghatározott sejtek felületén van jelen, a kilökődés függ a transzplantátumban levő a dentritikus sejtek és más, II. pozitív sejtek mennyiségétől Immunszuppresszív szerek és a transzplantátumok túlélése A transzplantáció eredményessége különböző gyógyszerekkel vagy immunológiai eljárásokkal fokozható. Közülük leginkább a következők használatosak: olyan vegyületek, amelyek a T-lymphocyták aktiválódását gátolják (pl. Ciclosporin A, FK 5O6, ez utóbbi szuppresszív hatása erősebb, mint a Ciclosporin A-nak, a két vegyület kombinációja viszont a legerősebb hatású az immunszuppresszív szerek között) Azatioprin a purinbázisok szintézisén keresztül gátolja a T-sejtek proliferációját a corticosteroidok a proteinek szintézisét gátolják, így az IL 1, az IL 2-t, amelyek befolyásolják a macrophagok, a Th- és a Tk-sejtek aktivitását. A B-sejtek proliferációját szintén gátolják. anti-lymphocyta savó (periferiás lymphocyták antigénjeivel termelt antisavó), amely gátolja a T-sejtek felismerőképességét. Az antiszérum adagolásánál figyelembe kell venni az anaphylaxia veszélyét is Daganatokkal szembeni immunválasz A szervezet fiziológiás folyamataiban a sejtek aktivitása, szaporodása és a szövetek működése szigorú szabályozás, illetve kontroll mellett zajlik. Adott feltételek között azonban a sejtek egyrészt kémiai anyagok, továbbá vírusos fertőzések, másrészt mutációk révén kiszabadulhatnak a sejtszaporodás kontrollja alól, így olyan klónná válhatnak, amelyekben a regulációs folyamatok már nem jutnak érvényre, és daganatokká vagy neoplasiákká fejlődnek. Amennyiben az említett sejtek csupán egyetlen helyen fejlődnek és nem terjeszkednek, akkor jóindulatú, benignus daganatról van szó. Más esetekben a daganatsejtek a vér- vagy a nyirokáram útján elkerülhetnek távolabbi helyekre is, ahol folytatják osztódásukat és rosszindulatú, malignus daganatokká válnak. Az immunrendszer cenzori funkciójához tartozik a daganatsejtek felismerése és elpusztítása is. Ennek lehetősége abból ered, hogy a daganatsejtek felületi struktúrája különbözhet a normális sejtek antigénszerkezetétől, így velük szemben a szövettranszplantátumokra érvényes, ún. szövetkilökődési reakciókhoz hasonló védekezési mechanizmusok indukálódnak Tumorantigének Amikor a sejtekben megindul a malignizáció folyamata, az változásokat eredményez részben a sejtfelületi antigénekben, másrészt a sejtek funkciójában. Ezek a következők lehetnek: 370
391 Immunológia a daganatsejtek elveszíthetik az addig meglévő antigénjeiketvagy azok egy részét (pl. MHC-antigének, vércsoport-antigének), a daganatsejtek elveszíthetik addigi fiziológiás funkciójukat (pl. a coloncarcinoma sejtjei nem képesek nyálkatermelésre) Tumorral társult antigének A daganatsejtek felületén új antigének fejeződhetnek ki (180. ábra) ábra - A daganatsejt felületi antigénjei A daganatsejtek képesek olyan új proteinanyagokat szekretálni, amelyek a fetus sejtjeinek sajátossága (pl. az emésztőcső neoplasiás képletei olyan, carcinoembrionális antigénnek nevezett glükoproteint termelnek, amely csak az embrionális korban fordul elő) vagy pl. a hepatoma sejtek alfa-fetoproteineket szekretálnak. A fentiekben említett oncofetális antigének gyenge immunogének, és velük szemben nem fejlődik ki protektív immunitás, mivel a CD4 és CD8 sejtek nem ismerik fel a megváltozott struktúrát az MHC-antigének hiányában Tumorra specifikus antigének Az oncogén vírusok által indukált tumorok esetében olyan új antigének jelennek meg a sejtfelületen, amelyek jellegzetesek a vírusra pl. FOCMA (Felin oncovirus membran associated) vagy a MATSA (Marek asssociated T surface antigen). A kémiai anyagok okozta tumorok esetében a sejtek felületén változatos antigének jelenhetnek meg, de ezek nem jellemzőek az indukálóanyagra. Akkor is, ha ugyanazon kémiai anyag különböző egyedekben vált ki malignizációs folyamatot, a sejtek felületén megjelenő antigének alig mutatnak közös vonásokat. Ezek az antigének csak a daganatsejtek felületén előforduló és a normális sejtek felületéről hiányzó antigének. Ilyen struktúrákat mind a kémiai anyagok, mind az egyes vírusok okozta daganatok esetében ki lehet mutatni, de ezek megtalálhatók a spontán malignizálódó sejtek felületén is Differenciálódási antigének Az ilyen antigének jelenléte a daganatsejtben arra utalhat, hogy a malignus klón egy olyan érési stádiumban megrekedt sejtből származott, amelyben a differenciálódási antigén még jelen volt. 371
392 Immunológia Daganatokkal szembeni immunológiai reakciók A daganatokkal szembeni specifikus immunológiai védekezés tanulmányozása a legutóbbi évtizedekben számos új összefüggést tárt fel. Lényegében két alapvető kérdés várt tisztázásra: kialakulnak-e a daganatra specifikus antigének, kialakulhat-e ellenük protektív immunválasz. Amennyiben a daganatsejt antigenitása a normál sejtekétől jelentősen eltér, akkor az exogén sejtekhez hasonlóan a szervezet immunreakciókkal azt megtámadja. A tumor elleni védekezés alapvető mechanizmusai az NK sejtek, a cytotoxicus T-sejtek, valamint a macrophagok aktivitására épülnek (181. ábra) ábra - A daganatsejt és az immunrendszer kölcsönhatása Az NK sejtek felületéről hiányoznak az MHC-antigének, viszont kifejeződnek a felületen a CD2 és a CD56 struktúrák (182. ábra). Az NK sejtek funkciója többirányú: a tumorokkal szembeni védekezés, a xenogen sejtek elpusztítása, a vírussal fertőzött sejtek eliminálása, antibakteriális aktivitás ábra - NK sejt felületi struktúrája 372
393 Immunológia A daganatokkal szembeni védekezésben a T-sejtek és a macrophagok szerepe az INF és az IL 2-termelődésén keresztül valósul meg. A daganatsejtekkel szembeni védelemben a felületi antigénekkel szemben termelődött antitestek is szerepet játszanak. A legutóbbi évek megfigyelései szerint a daganatos transzformáció nem jár szükségszerűen a sejt fenotípusának megváltozásával, és ilyenkor nem alakul ki a daganatsejttel szembeni immunválasz. A fenotípus változásával járó, malignus átalakulás esetén sem biztos az új vagy megváltozott struktúrák immunológiai felismerése. A daganatokkal szembeni reakciók a következőkben összegezhetők: NK sejtek reakciói: az érzékeny tumorsejteket sejt sejt kontaktus útján pusztítják el. A tumorsejt érzékenysége függ a sejt differenciáltságától és az elhárító mechanizmusok aktivitásától. Az NK sejtek a tumor elleni védekezésben első vonalbeli szerepet töltenek be, megelőzve más, ún. járulékos reakciókat. Állatkísérletekben megállapították, hogy az NK-sejtek közreműködnek a transzplantált daganatok kilökődésében, hátráltatják az áttétek kialakulását, de nincs befolyásuk a már kialakult daganatokra. A betegség előrehaladásával az NK sejtek aktivitása jelentősen csökken, de aktivitásuk interferonok és IL 2 adagolásával fokozható. Macrophagok aktivitása: a tumordestrukció elsősorban sejtkontaktus útján átadott cytolyticus faktorokkal kapcsolatos, de a macrophagok további módon, az ADCC-reakció effektorsejtjeiként is kifejtenek tumor elleni aktivitást, A granulocyták hatása: tumorellenes aktivitásukat mint az ADCC-reakció killer sejtjei fejtik ki. A lymphokin által aktivált killer (LAK) sejtek fenotípusa megegyezik a cytotoxicus T-sejtével, de nem az MHC-antigének segítségével ismerik fel a tumorsejteket. A LAK sejtek olyan friss szolid tumorsejteket is károsítanak, amelyek az NK sejteknek viszonylag képesek ellenállni. A komplementrendszert adott esetben a tumorantigének (pl. BURKITT-lymphoma) alternatív úton aktiválhatják, amely így direkt cytotoxicus hatást fejthet ki a malignus sejtekre. Olyan ritka esetekben, amikor a 373
394 Immunológia tumorral szemben cytotoxikus antitestek képződnek (pl. melanoma malignum esetén), a komplement klasszikus úton aktiválódva is részt vesz a tumornövekedés gátlásában. A daganatsejtek gyakran átcsúsznak az immunvédelem szűrőjén, máskor pedig megtévesztik annak cenzori működését. Ez utóbbi abból ered, hogy egyes daganatsejtek felszíni antigénjeiket levedlik, és ezek az effektorsejtek receptoraihoz kötődve meggátolhatják az effektor- és a targetsejt kapcsolódását. Lehetséges továbbá az is, hogy a levedlett receptorok az ellenanyagokkal immunkomplexeket képeznek, amelyek szintén gátolhatják az effektor és a target találkozását vagy elnyomják a tumorantigének elleni további immunreakciókat. A daganatsejttel szembeni immunológiai védelem hatékonyságát ronthatja az is, hogy a malignus sejt megváltoztatja felszíni antigénjeit, és olyan mutáns sejtklónok szelektálódhatnak, amelyek már különböznek az eredeti daganatos sejttől, ami az alap sensibilizálódást kiváltotta. A daganatok aktiválhatják továbbá a szuppresszor sejteket is, ami az eredményes védekezés csökkenését okozhatja A daganatsejtek eliminálását gátló mechanizmusok Immunszuppresszió: a lymphoid típusú neoplasiákban deficiencia mutatkozik az ellenanyag termelődésében, valamint az NK sejtek funkciójában. A kémiai eredetű neoplasiák sejtjei szuppresszív hatású (prosztaglandin) anyagokat szekretálnak, deficienciát vált ki a védekezésben a szuppresszor sejtek aktivitása is. Tumorsejtek szelektálódása: olyan alapon, hogy hiányzik az antigenitásuk, amiért képtelenek immunválaszt indukálni A daganatok terápiájának lehetőségei Nem specifikus immunstimuláció céljából különböző anyagok alkalmazhatók: BCG mint attenuált M. bovis törzs aktiválja a macrophagokat és stimulálja az IL 1 termelődését. Alkalmazzák akár parenterális formában, akár közvetlenül a daganat szövetébe való oltással. Egyes tumorok esetében a metastasisok kialakulását is gátolhatja. Komplett szénhidrátok: elsősorban kutyák fibrómáiban alkalmazták több-kevesebb sikerrel. Aktív immunizálás: az eljárást szokták egyrészt komplett daganatsejtekkel, másrészt azok antigénjeivel végezni. Az eddig nyert eredmények ellentmondásosak. Cytokinek alkalmazása: az IFN alkalmazása csak bizonyos tumorok (pl. leukémiák) esetében mutat kedvező eredményeket, ezért használata egyre ritkábbá válik. A TNF hatása bizonytalan, sőt káros követkeményekkel is járhat az alkalmazása, és esetenként az endotoxinokhoz hasonló hatást válthat ki (pl. tüdőoedema a tromboxánok aktiválása miatt). Az IL 2 túladagolása káros hatást fejt ki a védekezésben. Cytokinekkel aktivált sejtek: a lymphocyták által aktivált NK sejtek a különböző daganatféleségek remisszióját váltják ki. Az in vitro stimulált IL 2-ben gazdag szupernatáns gátolja pl. a macska FeLV vírus szaporodását Specifikus ellenanyagok A daganatterápiában új lehetőséget nyitott a sejtre toxikus anyagok monoclonális ellenanyagokkal történő célbajuttatása. A difteria toxin A-lánca pl. a sejt pusztulását váltja ki, míg a B-lánc csupán a sejthez való kötődést szolgálja. Amennyiben a toxin B-láncát olyan monoclonalis ellenanyaggal helyettesítjük, amelyik kizárólag a daganatsejtre jellemző antigénhez kötődik, akkor olyan, ún. immuntoxinhoz jutunk, ami a daganatsejtet úgy képes elpusztítatni, hogy az egészséges sejtekre káros hatást nem fejt ki. A módszer még finomításra szorul, mivel előfordulhat az immuntoxin céltévesztése vagy nem éri el a célsejtet, mivel azok levedlett receptorai már a vérpályában megkötik az immuntoxint. (Részletesebben lásd az Immunmoduláció c. fejezetben.) Vakcinák alkalmazása 374
395 Immunológia Ismereteink szerint eddig a Marek-féle betegség, a macskaleucemia és a szarvasmarha papillomatosisa ellen sikerült hatékony vakcinát kifejleszteni. A Marek-betegség elleni vakcina pl. egyrészt ellenanyag-termelést indukál, ami gátolja a vírusnak a sejtekhez való kötődését, másrészt celluláris immunválaszt indít meg a T-sejtek felületén kifejeződő, a vírusra specifikus ún. MATSA-antigénnel szemben Immuntolerancia Az immunrendszer meghatározott antigéningerre olyan módon is reagálhat, hogy eltűri, tolerálja az antigén jelenlétét. Az immuntolerancia tehát olyan, specifikus immunválasz-képtelenség állapotát jelenti, amikor a szervezet adott antigéningerre nem reagál. A válaszképtelenség azonban csak egy adott antigénre vonatkozik, viszont más antigénekre a szervezet a megszokott módon reagál. A tolerancia ilyen alapon úgy is felfogható, mint az immunológiai memória negatív formája. Kialakulásához ugyanis elsődleges antigénhatás szükséges, ami indukálja a toleranciát, amelynek létrejötte másodlagos antigénhatás eredménytelenségével állapítható meg. A tolerancia lehet teljes vagy részleges, átmeneti vagy tartós. Kialakulásának körülményeit tekintve megkülönböztetjük a természetes és a szerzett toleranciát, a részt vevő sejtek szerint pedig a T- és B-sejtes toleranciát (183. ábra) ábra - A B-sejtes tolerancia formái A B-sejtes tolerancia többféleképpen alakulhat ki: clonalis anergia (vagy clonalis abortus ) olyan módon alakul ki, hogy a még éretlen B-sejtek alacsony koncentrációjú antigénekkel kerülnek kapcsolatba, és érett állapotban már képtelenek clonalisan differenciálódni, az exhaustiv terminális differenciálódás, ami ismételt T-independens antigéninger hatására jöhet létre, amikor a B-sejtek úgy differenciálódnak plazmasejtekké, hogy nem képződnek B-memória sejtek, funkcionális deletio, ami a T-helper sejtek hiányát jelenti, antitestképző sejtek gátlása: nagy dózisú T-independens antigén hatására alakulhat ki. A T-sejtes immunválasz hiánya lényegében hasonló a B-sejtes toleranciához. Különbség azonban az, hogy a T-szuppresszor sejtek, amelyek antigén-specifikusak, bizonyos körülmények között megszaporodhatnak, és ilyenkor gátolhatják a többi T-szubpopuláció, illetve a B-sejtek funkcióit. A toleranciának ez a fajtája egyébként T-sejtekkel átvihető normális immunválasz képességű egyedbe. 375
396 Immunológia OWEN (1945) figyelte meg először azt a jelenséget, amely szerint szarvasmarhák kétpetéjű, különböző vércsoportú ikrei reakció nélkül viselik el egymás vérének átömlesztését. Az ilyen ikrek placentáris vérkeringése közös, így tulajdonképpen kölcsönös (magzatkori) intrauterin vértranszfúzió alakul ki. Az újszülöttekben ilyen módon kétféle vércsoportot képviselő vérsejtek keringenek, és ezek az ún. vércsoportkimérák egymás vérét reakciómentesen elviselik, tolerálják, és egymás bőrtranszplantátumát is befogadják. A jelenség magyarázata abban van, hogy a szervezet számára egyébként nem saját anyagokat az immunrendszer nem idegenként, hanem sajátként ismeri fel, tekintve, hogy a magzati fejlődés során, az önfelismerés szakaszában, az immunkompetens sejtek kölcsönösen találkoztak egymás antigénjeivel. MEDAWAR (1953) egereken végzett kísérletei igazolták, hogy az immuntolerancia akkor is kialakulhat, ha a nem saját anyagot a megszületés utáni első napokban juttatjuk a szervezetbe. Olyan beltenyésztett egértörzsek pl., amelyek egymástól bőr transzplantátumot nem fogadtak be, eltűrték a bőrátültetést, ha közvetlenül megszületésük után a másik egértörzs lép- vagy csontvelősejtjeinek szuszpenzióját juttatták a szervezetükbe (184. ábra). Ilyen módon tehát a recipiens az immuntolerancia állapotába került a donor egértörzs hisztokompatibilitási antigénjeivel szemben. Ez a tolerancia azonban csak az adott antigénre vonatkozik, mert pl. egy harmadik egértörzs transzplantátumát a recipiens szervezet kiveti magából. MEDAWAR kísérletei igazolták, hogy az immuntolerancia kiváltásának feltételei a megszületés utáni hetekben megszűnnek ábra - Az immuntolerancia kiváltása egerekben A tolerancia kiváltásában az antigén dózisa is fontos szerepet játszott. Ha ugyanis egy szolubilis antigén mennyisége az immunizáló dózishoz viszonyítva kritikusan alacsony, ún. alacsony dózisú tolerancia, vagy ha kritikusan magas, ún. magas dózisú tolerancia jön létre, mivel az antigénsensitív sejtekben csak akkor indukálódik a humorális vagy celluláris immunválasz, ha az antigén megfelelő mennyiségben van jelen. A tolerancia létrejöttében az antigénnek is jelentős szerep jut. Ennek alapvető feltétele, hogy az antigén az immunrendszer felé ne immunogén, hanem tolerogén jelet képezzen. Az idegen anyag immunogén vagy tolerogén profilját ugyanis a macrophagokkal való kölcsönhatások is jelentősen befolyásolják, mivel az immunogén ezek közvetítésével jut el az immunkompetens sejtekhez. A tolerogén ezzel szemben közvetlenül 376
397 Immunológia kapcsolódik az immunsejtekhez. Ez a feltevés kísérletileg is igazolható úgy, hogy ha pl. aggregált fehérjemolekulákat juttatunk a szervezetbe, akkor azok a macrophagokhoz kötődve jutnak az immunkompetens sejtekhez és immunválaszt indukálnak, viszont ugyanez a fehérje nem aggregált formában immuntoleranciát vált ki A magzatok immunválasz képessége Korábban az volt a felfogás, hogy a magzat fejlődése immunológiailag nulla fázist jelent, tehát immunológiailag éretlenül jön a világra, és az immunrendszer működőképessége csak a megszületés után alakul ki. Az immunrendszer ontogenesisének tanulmányozása azonban az elmúlt évtizedekben több olyan felismerést eredményezett, amelyek a korábbi felfogást megváltoztatták vagy módosították. A legfontosabb megállapítások a következőkben összegezhetők: az immunválasz képesség a magzat fejlődésének meghatározott szakaszában kialakul, a magzati immunrendszer az antigének között ún. hierarchikus különbséget tesz, ami abban nyilvánul meg, hogy adott antigének csak a fejlettség meghatározott szakaszában indukálnak immunválaszt, az immunrendszer fejlődése a megszületés után is folytatódik és fajonként változó ideig tart. A szarvasmarhamagzatban a vemhesség 285 napos időtartamán belül a thymus kialakulása a fogamzást követő 41. napon már megfigyelhető, a lép és a csontvelő az 58. napon, a nyirokcsomók a 60. napon jelennek meg, viszont a Peyer-féle plakkok csak a 175. napon találhatók meg az emésztőcsőben. A perifériás lymphocyták a 45., az IgM- és az IgG-pozitív sejtek pedig az 59., illetve a l35. napon jelennek meg a véráramban. IgM szerkezetet mutató molekulákat a l30., IgG osztályba sorolható molekulákat pedig a l35. naptól lehet a vérsavóból kimutatni (185. ábra) ábra - A szarvasmarhamagzat immunológiai fejlődése 377
398 Immunológia A magzat 100 nap után aktív immunválaszra képes az IBR- és a BVD-vírussal szemben, a Leptospira saxkoebingre a l32., az Anaplasma marginalera a l40., a parainfluenza-3 vírusra pedig a l50. naptól reagál, ezzel szemben a Brucella abortus-antigénekkel csak a megszületés körüli korban lehet immunválaszt indukálni (186. ábra) ábra - A szarvasmarhamagzat immunválasz képessége 378
399 Immunológia 379
400 Immunológia Ló. A vemhesség 340 napja alatt a fogamzást követően a napon jelennek meg a lymphocyták a thymusban, a 90. napon a mesenteriális nyirokcsomókban és a 175. napon a lépben. A szövetkilökődési reakció a 79. naptól figyelhető meg. A magzat immunválaszképes a T2-es colifággal szemben, viszont az encephalomyelitis vírusával szemben csak a 230. naptól alakul ki az immunválasz. Juh. A vemhességi idő l45 nap. A thymus és a nyirokcsomók nappal a fogamzást követően már megfigyelhetők. A lymphocyták (CD4 és CD8) a nap után mutathatók ki a vérben, az 58. nap körül jelennek meg a lépben és kb nap után a Peyer-féle plakkokban. A juhmagzat 4l napos korában már képes reagálni a fi-x147 bakteriofágra, a 70. naptól pedig az adenovírusokra. A szövetkilökődési reakció a 77. naptól figyelhető meg, a salmonella- és a BCG-antigénre viszont csak közvetlenül a megszületés előtt ad immunválaszt. A megszületéskor a vérsavóban igen alacsony koncentrációban ugyan, de IgG- és IgA-molekulák mutathatók ki. Sertés. A magzat ll5 napos fejlődési periódusában a lymphoid őssejtek egy része már a fogamzást követő 28. napon megjelenik a thymusban, ahol T-lymphocytákká érnek, más részük a májba, majd a csontvelőbe (bursaekvivalens) vándorol, ahol B-lymphocytákká differenciálódnak. Adataink szerint a B-sejtek a magzati érés 50. napján jelennek meg a lépben és a Peyer-féle plakkokban. Ellenanyagszerű molekulákat (IgM) hordozó lymphocyták a lépben az 55. naptól, a bélfodri nyirokcsomókban a 65. naptól figyelhetők meg, az emésztőcső lymphoid tüszőiben pedig kb. a 80. naptól mutathatók ki. A sertésmagzat immunrendszere salmonellákkal szemben a 60. napon még nem, a 80. naptól viszont már immunválaszra képes. Az Erysipelothrix rhusiopathiaeval a magzatokban a fogamzást követő 70. naptól lehet aktív immunválaszt kiváltani. A parvovirusokkal szemben a magzati immunrendszer a 72., az influenzavírusra pedig a naptól képes specifikus ellenanyagok termelésére. Sertésekben azt is megfigyelték, hogy a magzat szekunder nyirokszerveiben csak akkor képződnek csíraközpontok az intrauterinálisan bejuttatott antigének hatására, ha a magzat életkora a 73 napot meghaladta. Ilyenkor viszont az említett csíracentrumok 6 napon belül kialakulnak, és mintegy l3 2l nap után a vérsavóban is megjelennek a specifikus ellenanyagok. Kutya. A vemhesség időtartama 60 nap. Ezen belül a 23. napon mármegjelenik a thymus, és a magzatok a fix147. bakteriofágra a 40. napon aktív immunválaszra képesek. A lymphocyták a 45. nap körül jelennek meg a lépben, és ugyanerre az időpontra esik a szövetkilökődési reakció megjelenése is. A humorális immunválasz képesség más állatfajokhoz viszonyítva késve jelenik meg. Macska. Viszonylag kevés adat áll rendelkezésre a macskamagzatok immunológiai fejlődéséről. A fogamzást követően a 42. napon jelennek meg a májban a B-típusú lymphocyták. Tolerált fertőzések kialakulása magzatokban: a magzati fejlődés meghatározott időintervallumában az immunrendszer az önfelismerés szakaszában megtanulja a saját struktúrák felismerését, és ezt követően ezt saját anyagként ismeri el. Ebből ered, hogy ha pl. egy vírus (pl. sertéspestis, BVD) a nevezett fejlődési fázisban, diaplacentarisan az anyából átjut a magzatba, akkor azt is sajátnak tekinti, vele szemben immunreakciókkal nem reagál, hanem ún. tolerált fertőzés alakul ki. Ez az állapot azért jelent rendkívüli veszélyt, mert a magzat látszólag egészségesen születhet, de fertőzöttsége szerológiailag nem ismerhető fel, és vakcinás oltással sem lehet benne aktív immunitást indukálni Az újszülött állatok immunválasz képessége Az újszülött állatok a steril uterusból születnek a kórokozókkal terhelt, az immunrendszer számára idegen külvilágra, és fogékonyak olyan mikroorganizmusokkal szemben is, amelyek felnőttekben nem szoktak megbetegedést kiváltani. Ezekkel szemben az újszülött szervezete többféle módon védekezhet, egyrészt nem specifikus úton (meghatározott sejtekkel és plazmafehérjékkel), másrészt maternalis, passzív immunitással, később pedig aktív immunválasz kialakulásával Az újszülöttek nem specifikus védelmi rendszere Neutrophil granulocyták az újszülött borjakban az élet első l0 napjában nagyobb számban vannak jelen a vérpályában, mint a felnőtt állatokéban, és képesek phagocytálni pl. az E. colités a Staphylococcus aureust. Ezt a képességet a hiányos colostrum ellátás vagy a hideg környezet mint stresszor felfüggesztheti. 380
401 Immunológia A természetes killersejtek képesek felismerni a vírussal fertőzött targetsejteket és azokat feloldani. A komplementaktivitás az újszülöttekben viszonylag lassan fejlődik ki. A komplementfaktorok egy része a colostrumból származik, más részét az újszülött saját maga termeli. A születés utáni napokban viszont borjakban, bárányokban és malacokban csak l2 60%-ban vannak jelen, és a fajra jellemző mennyiséget borjakban 6 hónap, bárányokban 8 l0 hét, sertésben l 4 hét után érik el Természetes passzív (maternalis) immunitás Az immunitásnak ez a formája úgy jön létre, hogy az anyai szervezetből specifikus ellenanyagok jutnak át az utód szervezetébe. Az ellenanyag átjutása az utódba emlősökben a placenta szerkezetétől függ, és ennek megfelelően 3 csoportot lehet megkülönböztetni: I. csoport. Haemochorialis placentaszerkezet esetében az anya vérkeringése közvetlenül érintkezik a trophoblast sejtekkel. Az ember és a nyúl estében így még a méhen belüli életben, a placentán keresztül jutnak IgG osztályba tartozó ellenanyagok az anyából a magzatba (a passzív immunitásnak ezt a formáját diaplacentáris immunitásnak nevezzük). II. csoport. Endotheliochoriális placentával rendelkező állatfajokban (húsevők, rágcsálók) részben diaplacentárisan, részben a colostrummal jutnak ellenanyagok az utódba. III. csoport. Syndesmochoralis placentaszerkezettel bíró állatfajokban (ló, szarvasmarha, sertés, kecske) az Ig-ok transzplacentárisan nem tudnak átjutni, ezért az újszülöttek csak a megszületés után, a colostrummal jutnak hozzá az anyai (maternalis) Ig-okhoz. A maternalis immunitásnak ezt a formáját colostralis immunitásnak nevezzük. A maternalis immunitás formáit a 187. ábra szemlélteti ábra - A maternalis immunitás formái Az újszülött emésztőcsövében a hámsejtek pynocytosis útján veszik fel az Ig-okat. Minthogy az újszülöttek bélnyálkahártyájának permeabilitása, szelektivitása eltérő, a colostrumban foglalt Ig-ok felszívódásának időtartama háziállat fajonként különbségeket mutat: lóban és sertésben az IgG és az IgM felszívódik, ugyanakkor az IgA-molekulák a bél lumenében maradnak, kérődzőkben nincs szelektív transzfer, így minden Ig-molekula, közöttük az IgA is felszívódik, de ezt követően az IgA-molekulák kiválasztódnak a bél lumene felé. A bélnyálkahártya Ig-ok részére mutatkozó átjárhatósága fajonként változó. Közvetlenül a születés után a legnagyobb és ezt követően gyorsan csökken, mivel az Ig-okat abszorbeálni képes sejteket érettebb sejtek váltják fel. Az újszülött vérsavójában, megfelelő colostrumfelvétel esetén kb. 48 óra elteltével a maternalis Ig-szint eléri az anyai vérsavó Ig-szintjét, majd fokozatosan csökken és kb. a 4 6. héten kiürül a vérpályából (188. ábra). 381
402 Immunológia 188. ábra - A maternlis Ig-ok felszívódása borjakban A szarvasmarha-colostrum Ig-jainak mintegy 80%-át az IgG l teszi ki, az IgM és IgA mennyisége 14% körül ingadozik. Mivel az újszülött borjú emésztőcsöve nem fejt ki szelektív hatást a maternalis Ig-ok felszívódására, a colostrum felvételét követően a borjú szérumának fehérje-összetétele hasonló a colostruméhoz, vagyis szekréciós IgA jelenléte a borjú szérumában fiziológiás jelenség. A háziállatok Ig-jainak megoszlását a tejben és a colostrumban a 39. táblázat tartalmazza. 39. táblázat - Az immunglobulinok mennyisége a colostrumban és a tejben (mg/ml) Állatfaj IgG IgM IgA Szarvasmarha Ló Juh Kutya
403 Immunológia Macska Sertésben, hasonlóan a szarvasmarháéhoz, kb. 27 óráig képesek a bélhámsejtek pynocytosis útján az Ig-ok felvételére. A maternalis Ig-ok óra között érik el a legmagasabb szintet a malac vérsavójában. Az Ig-ok felszívódásával kapcsolatban elektronmikroszkópos vizsgálatokkal megfigyelhető, hogy a felszívódásban részt vevő bélhámsejtek duzzadt mikrobolyhai helyenként széttolódnak (189. ábra), és ezeken a területeken az enterocyták felületét borító erősen elektrodenz anyag beáramlik a hámsejtekbe (190. ábra). A tágult tubulo-vesicularis hálózatba bejutó denzanyag a perinuclearis térben már kisebb-nagyobb cseppek alakjában mutatkozik, amelyek összeolvadva, fokozatosan nagyobbá válva haladnak a nyirokutak felé. Az Ig felszívódása a vékonybél meghatározott szakaszához kötött, és döntően a duodenum végső szakaszában, a jejunum teljes hosszában, továbbá az ileum első kétharmadában szívódnak fel ábra - A colostrum-ig-ok felszívódása az enterocytákban (ELMI, ) 190. ábra - Ig-ok az enterocyták plazmájában (ELMI, ) 383
404 Immunológia Az újszülött állatok immunstátuszának kialakulásában a colostrum lymphoid sejtjei is szerepet játszanak. Megállapították, hogy a saját anyai lymphocyták abszorbeálódnak az emésztőcsőből, és antigénelkötelezettségük mellett celluláris reaktivitást is transzferálhatnak (191.ábra) ábra - Colostrumból származó lymphocyta az epithelsejtekben (ELMI ) 384
405 Immunológia A maternalis immunitásnak nagy szerepe van abban, hogy specifikus védőanyagokkal látja el az újszülöttet, és az újszülött minden olyan ellenanyagot megkap, amelyet az anyai szervezet az élet során aktívan termelt. Az újszülött szervezetben ez a maternalis immunitás hosszabb életű (4 6 hét), mint a mesterségesen létrehozott, passzív immunitás A maternalis ellenanyagok hatása az újszülöttek immunválasz képességére A maternalis immunglobulinok jelenléte az ún. feed-back hatás révén kétféle úton gátolja az újszülött aktív Igtermelését: Az anyai ellenanyagok antigénspecificitásától független gátló hatás. Borjakban végzett vizsgálatokban megfigyelték pl., hogy a colostrummentes nevelés során 1 hét múlva megindul az Ig-ok termelése, ezzel szemben a colostrumot kapott állatokban erre csak 3 4 hét elteltével került sor. A colostrummentesen nevelt bárányok vérsavójában az IgG 1 l hét, az IgG 2 3 hét után már megjelenik, viszont az anyai ellenanyagok jelenlétében ezek szintézise csak 5 6 hét elteltével indul meg. A maternalis Ig-ok másik gátlási formája viszont antigénspecifikus. Ez annyit jelent, hogy ha az újszülött a colostrummal specifikus ellenanyagokhoz jut egy adott kórokozóval szemben, akkor az immunrendszer ugyanezen kórokozó antigénjeivel nem stimulálható. Minthogy azonban az immunmemória kialakul, az ismételt vakcinázás már szekunder immunválaszt vált ki. A jelenséget többféleképpen magyarázzák, feltehetően azonban ebben az antigén-ellenanyag komplexeknek az immunkompetens sejtek felé adott negatív szignálja játsza az alapvető szerepet. 385
406 Immunológia A feed-back hatás időtartama függ az Ig izotípusától, illetve ún. felezési idejétől. Ezek adatait a 40. táblázat szemlélteti. 40. táblázat - Ig-ok felezési ideje napokban Állatfaj IgG IgM IgA Szarvasmarha 20 4,8 2,8 Juh 8 4 1,8 Ló ,0 Sertés 6 4 3,0 Kutya ,1 Macska , Az immunkompetencia kialakulása A lymphoid szervek (mind a primer, mind a szekunder) immunocytákkal történő kolonizációja a megszületésig gyakorlatilag befejeződik. A keringésben viszont a felnőtt állatokhoz viszonyítva alacsonyabb számban vannak jelen, és pl. a B-sejtszám borjakban, valamint csikókban a 20., malacokban pedig a 35. napig éri el a fajra jellemző szintet. Az immunglobulinok aktív termelése a colostrummentesen nevelt állatfajokban eltérő időpontokban indul meg. Borjakban pl. az IgM, IgA, IgG 2 és az IgG 1 sorrendben a 4., 4., 8. és 32. napon jelenik meg a vérpályában, A lokális immunrendszer borjakban és malacokban az első héten már működőképes. A borjak és a malacok emésztőcsövében a 3. hétig az IgM-termelő sejtek, később pedig az IgA-pozitív sejtek dominálnak. A lokális immunválasz az élet első l0 napján belül már kiváltható, de az ellenanyagok a 4. hétig eliminálódnak, és nem alakul ki az immunmemória, A celluláris immunválasz képesség az újszülött állatokban az élet első két hetében gyengébb, ezt követően viszont a felnőtt állatokéhoz hasonló intenzitással működik Nem specifikus védelmi rendszerek Gyulladás A gyulladás a szervezet olyan reakciója, amely különböző hatások (mikroorganizmusok, immunpathologiás folyamata, sérülések, toxikus ártalmak) miatt károsodott szövetekben alakulhat ki. A mechanizmus különböző faktorokat, mint pl. immunglobulinokat, interleukineket, komplement fehérjéket, valamint phagocyta sejtek működését foglalja magába. A gyulladásos folyamatokat részben lefolyásuk, részben súlyosságuk szerint különbözőképpen csoportosíthatjuk: Heveny gyulladás: a szövetkárosodást követően néhány órán belül kifejlődik (környezeténél melegebb, kipirosodás, oedema, fájdalom). Ezek a tünetek a kapilláris erek sajátosságainak megváltozásából erednek, ami annyit jelent, hogy átmeneti konstrikció után az erek dilatációja következik be, aminek következtében exsudatum áramlik a környező szövetekbe. A szövetekbe áramló exsudátum fehérjékben gazdag, és nagy számban tartalmaz leukocytákat (neutrofil-, eozinofil granulocytákat és monocitákat), amelyek megkötődnek az endothelsejteken (margináció). 386
407 Immunológia A fentiekben említett adherenciát a leukocyták migrációja követi amely folyamatban elsőként a neutrophilek és az eozinophilek kivándorlása következik be, mivel a vérbeli monocyták emigrációja lassúbb és csak később érkeznek a környező szövetekbe. A koagulációs rendszer. Amikor az exsudátum a véráramból kilép a szövetekbe, lényegében véve három enzimatikus folyamat zajlik le, mégpedig a komplement rendszer, koagulációs rendszer és fibrinolitikus rendszer aktíválódásán keresztül. A koagulációs rendszerben a trombin képződése a lényeges, amely hat a fibrinogénre és befolyásolja a véralvadást. A gyulladásos folyamatokban szerepet játszó vazoaktív anyagok: hisztaminok: a hízósejtek granulumaiból szabadulnak fel és vazoaktív anyagok, szerotonin: a triptofán derivátuma, és a hízósejtekből szabadul fel, de preformáltan megtalálható a vérlemezkékben és az idegsejtekben is, arahnionsav: foszfolipáz vegyület, amely a zsírsavakból szabadul fel, leukotriénok: ismereteink szerint négy csoportjuk létezik, amelyek hatnak a kemotaxis folyamataiban, valamint a C3b kifejeződés folyamatában, mások, mint a C4, D4 és az E4, az anaphilaxiás reakciókban hatnak, valamint részt vesznek a simaizom elemek összehúzódásában, prosztraglandoinok: komplett lipidek, amelyek nagyon széles hatáskörrel rendelkeznek, négy csoportot ismerünk, mint a PGE, a PGF, valamint a tromboxánok és a prosztaciklinek; hatásuk lényegében a simaizom sejtek és a kapillárisok összehúzódásában, illetve ezek vazodilatációjában mutatkozik meg, vazoaktív polipeptidek: közöttük legfontosabbak a kininek és az anaphylaktoninek, amelyek fokozzák a vérerek permeabilitását. A gyulladásos folyamatokban részt vesznek továbbá túlérzékenységi reakciók is (lásd az Allergia c. fejezetben). Idült gyulladás: az előbbiekkel ellentétben több óra elteltével megkezdődik a monocyták emigrációja a gyulladásos területre. Ezek olyan faktorokat szabadítanak fel, amelyek degradálják a kollagén-, valamint az elasztikus rostokat. A krónikus gyulladásos folyamat végső formája a granulomák kialakulása (lásd az Allergia c. fejezetben) A komplementrendszer A komplementrendszer a vérplazmaproteinek közé tartozik. l4 faktorból tevődik össze, amelyek közül több proteináz aktivitású. A vérben a rendszer inaktív állapotban van jelen. Aktiválódásakor a faktorok láncreakcióban (kaszkád) működnek, amely folyamat számos biológiailag aktív anyag képződésével jár, és az immunválasz egyik legfontosabb effektor mechanizmusaként részt vesznek az idegen struktúrák eliminálásában. Hatásuk kifejeződhet más sejtek aktiválásában, a targetsejtek lysisében és opszonizálódásában. A rendszer kétféleképpen aktiválódhat: klasszikus vagy alternatív úton. Klasszikus úton történő aktiválódáskor a rendszer működését az antigénnel komplexet képező ellenanyagmolekulák váltják ki, tehát a komplement immunkomplex-specifikus. Az ellenanyag mintegy megjelöli és céltáblává teszi az idegen struktúrákat a litikus hatású komplement számára. A sejtes elemek, amelyek felületén a komplement aktiválódik, lizis vagy más cytotoxikus hatás révén elpusztulnak, az oldott anyagokat pedig a phagocyták és más sejtek a felületükön lévő komplementreceptoraik révén leköthetik. Alternatív úton való aktiválódáskor egyes baktériumok, endotoxinok, vírusok, paraziták, valamint daganatsejtek közvetlenül vagy az ún. properdinrendszeren keresztül váltják ki a reakciót. Az ilyen aktivátorok iniciálófaktornak nevezett fehérjével reagálnak, amelyek a C3 komponenshez kötődve aktiválják a rendszert. A folyamat ettől kezdve lényegében a klasszikus aktiválódás útját követi. A komplementmechanizmus működésének középpontjában a C3 komponens aktiválása áll, amelyet a Cl, C4 és C2 komponensek kölcsönhatásából keletkező, konvertáz tulajdonságú enzimek indítanak meg. Ezt követi a terminális komponensek (C5 C9) aktiválása, amely végül is a targetsejt-feloldódásához vezet. 387
408 Immunológia A komplement kaszkád reakciót a 192. ábra mutatja be ábra - A komplementrendszer működése Amint az ábrából kitűnik, a három alkomponensből felépülő Cl faktorból a Clq kötődik az Ig-molekula megfelelő doménjéhez (a Clq elektronmikroszkópos képen 6 tulipánt tartalmazó virágvázára emlékeztet, amelyben a virágok képezik a domenekhez kapcsolódó kötőhelyeket). Ez a kötődés a Cl összetevőt enzimmé aktiválja, amely a harmadik, a Cls összetevőben egy peptidkötést hasít, aminek következtében az egész komponens enzimaktivitást nyer (Cl-eszteráz). A Cl-eszteráz a C4 (3 polipeptidlánc) és a C2 (l polipeptidlánc) komponensből lehasít egy-egy részt (C2a), és a megmaradó C4b a sejt membránjához kötődik, majd kiegészül a C2b résszel. Az így létrejövő molekula a C3 konvertáz. A C3 konvertáz a C3 komponens (alfa- és béta-polipeptidlánc) alfa-láncából lehasít egy kemotaktikus és anaphylatoxin hatású részt ( a ), a megmaradó C3b fragmens pedig a sejtmembránhoz kötődik. A már lekötött C4b2b molekulák közelébe kerülve azokkal kölcsönhatásba lép, és aktiválja a terminális komplement komponenseket (C5 C9), így részt vesz a sejtmembrán károsításának előkészítésében. A C3b és C4b megkötésére szolgáló receptorok a szervezetben számos sejtféleségen megtalálhatók pl. a B- és 0 -sejteken, neutrophil granulocytákon, macrophagokon, vörösvérsejteken, egyes fajokban (nyúlban, rágcsálókban, macskában) pedig a vérlemezkéken is. Amikor a C9 kapcsolódik a többi komplementfragmenshez, polimerizálódik és egy belül üres, hengerszerű képletet alkot, amely mélyen besüllyed a membránba. A lízis úgy megy végbe, hogy a sejt megduzzad, a membránon lyukak keletkeznek, és mialatt a K+ nagy része kiáramlik a sejtből, Na +, továbbá víz jut be a sejt plazmájába Természetes ellenállás Különböző formái játszanak szerepet az immunstatus kialakításában. A természetes ellenállás lehet abszolút vagy részleges. Abszolút rezisztencia alatt azt értjük, hogy egy adott szervezet, az egyébként kórokozó mikroorganizmus iránt nem érzékeny. Az állatok pl. mai ismereteink szerint rezisztensek a növényi vírusokkal szemben és megfordítva. Az ember rezisztens a sertéspestis, a ló pedig a ragadós száj- és körömfájás vírusával szemben. Ez utóbbiakat faji rezisztenciának is nevezzük. Részleges rezisztencia alatt azt értjük, hogy ugyanazon pathogen mikroorganizmussal szemben a különböző fajok eltérő mértékű fogékonyságot mutatnak (pl. a juh a keleti marhavész vagy a ragadós száj- és körömfájás vírusa iránt kevésbé érzékeny, mint a szarvasmarha). 388
409 Immunológia A természetes rezisztencia mechanizmusa még nem teljesen ismert. Annyi azonban bizonyos, hogy specifikus ellenanyagok nem szerepelnek kialakulásában. Az a tény, hogy bizonyos mikroorganizmusok nem képesek adott szervezetet megbetegíteni, nyilvánvalóan a kórokozó és a gazdaszervezet biokémiai, illetve fiziológiai funkcióinak a függvénye. A természetes rezisztencia fogalomkörébe sorolható az ún. egyedi és a genetikai rezisztencia is. Az egyedi rezisztencián azt értjük, hogy valamely állatpopuláción belül bizonyos egyedek nagyobb ellenálló képességet mutatnak egyes kórokozókkal szemben, mint társaik. Az ellenálló képesség ilyen alakulásában nyilvánvalóan a genetikai konstitúció játszik szerepet. A genetikai rezisztencia jó példája a patkánynak a Salmonella typhimurium iránti érzékenysége, viszont szelekcióval a kórokozóval szembeni rezisztens vonalak tenyészthetők ki. Gyakran tapasztalható az is, hogy azonos állatfaj parlagi fajtái kevésbé fogékonyak adott kórokozók iránt, mint a nagy termelőképességre kitenyésztett, nemesített, ún. kultúrfajták A halak immunrendszere Az immunrendszer phylogenesise során a halak képviselik a gerincesek első olyan csoportját, amelyekben az immunrendszer működését az ellenanyag-termelő képesség megjelenése jellemzi. Az emlősökkel ellentétben a halak immunválasz képessége a környezeti hőmérséklet függvénye. A testhőmérséklet ugyanis követi a környezet, vagyis a víz hőmérséklet-változásait, és a ponty pl 25 C-on képes az optimális immunreakciókra. A komplement- és a phagocytaaktivitás is hőmérséklet-dependenciát mutat, ezért pl. nagyon alacsony hőmérsékleten mind a nem specifikus, mind a specifikus immunológiai védekezés csökken vagy meg is szűnhet. A fentiek miatt a halak fertőző betegségeinek szezonalitása szoros korrelációt mutat a környezeti hőmérsékleti viszonyokkal. Ez különösen a tavaszi időszakban szembetűnő, amikor a mikroorganizmusok szaporodásához a hőmérséklet már kedvező, viszont az immunrendszer működése még depresszált Nem specifikus védekezési mechanizmusok A komplementrendszer kevesebb faktorból tevődik össze, mint emlősökben, a phagocytáló sejtek viszont az emlősökéhez hasonlóan működnek Specifikus védekezési mechanizmusok A lymphoid szervek közül megtalálhatók a thymus és a lép, valamint a speciesre jellemző a renális lymphoid szövet (praenephros), továbbá lymphoidszövet-aggregátumok pl. a bélben. Elkülönülnek a T- és a B-lymphocyták, megtalálhatók azok CD4 és CD8 markerei, az MHC I, az MHC II fehérjék, megfigyelhető az IL 1- és az IL 2-termelődés, és kiváltható a tuberkulin típusú bőrreakció is. Immunglobulinok: a szérumproteinek 40 50%- át teszik ki (4,5 10,8 mg/ml). Az immunglobulinok között legnagyobb volument az IgM képviseli, és ugyanez szekréciós formában is megtalálható. Jellemző, hogy az IgM a szövetnedvekben is előfordul. A molekula képes agglutinálni, precipitálni és a komplementkötési reakcióban való részvételre. A halak a kopoltyún keresztül képesek akár oldott antigéneket, akár antigénpartikulákat abszorbeálni, ezért megfelelő vakcinák a vízhez elegyítve is alkalmazhatók immunizáló eljárásokban A madarak immunrendszere A madarak és az emlősök immunrendszere több sajátosságban különbözik. Felépítésében, illetve struktúrájában alapvető eltérést jelent a madarakban a bursa Fabricii önálló szervként való léte, valamint a nyirokcsomók hiánya. 389
410 Immunológia A bursa Fabricii a madarak lymphoepithelialis szerve, amely a kikelés után a thymushoz hasonlóan sorvadni kezd. A bursába belépő őssejtek megfelelő érési folyamat után, ellenanyag-termelésre képes B-lymphocytákká differenciálódnak. Ezt követően a szekunder lymphoid szövetekbe vándorolnak, ahol antigéningerek hatására válnak elkötelezett sejtekké. Bursectomiát vagy a bursa károsodását követően eltűnnek a B-lymphocyták és a plazmasejtek, ami az ellenanyag-termelés rohamos csökkenését vonja maga után, de a cellulárisimmunválasz-képesség (lásd 33. táblázat) változatlan marad. Ha az embrionális fejlődés 18. napjáig anti-mű-lánc-savót oltunk az embrióba, akkor totális Ig-szuppresszió következik be, ami arra utal, hogy a különböző Ig osztályok nehéz láncai az IgM praecursorból fejlődnek ki, mint ezt a Cooper-féle séma mutatja be a193. ábrán ábra - A Cooper-féle séma A házityúkban a nyirokerek mellett találhatók kisebb diffúz lymphoid halmazok, de ezek nem képesek a lympha szűrésére. A vízimadarak (a lúd, a kacsa) centrális nyirokcsomója funkcionálisan hasonlít a házityúk kezdetleges lymphoid halmazaira. További nyiroktüszők találhatók az emésztőcsőben, a paraocularis (Harderféle) mirigyben, a paranasalis szövetekben és más szervekben (bőr, máj, vese, gége, légcső) is Hisztokompatibilitási antigének A madarak lymphocyta antigénjei. Az MHC vagy más néven B komplex (bird complex), különbözik az emlősökétől. Az emlősök I. és a II. osztálynak megfelelően eddig két alcsaládot különítettek el: a B F és a B L antigéneket. A III. MHC-osztályt eddig nem írták le, felismertek viszont egy B G-nek vagy más néven a IV. osztálynak nevezett antigént is. Újabb felfogás szerint az MHC IV fehérje, ami csak madarakban fordul elő, összefüggésbe hozható a Marekféle betegséggel szembeni genetikai rezisztenciával Immunglobulinok Az IgG-t korábban IgY-nak nevezték, mivel strukturálisan az emlős-iga-hoz hasonló, de kiderült, hogy funkcionálisan egyezik az emlős IgG-vel, olyan különbséggel, hogy a tengerimalac-komplementet nem képes megkötni, de a fajazonos komplementrendszerrel reagál. H-láncainak különbözősége alapján allotípusok előfordulását is megállapították. Az IgM inkább a halak IgM-jéhez hasonló. Monomerje a B-lymphocyták felületén, mint antigénreceptor működik (emlősöknél ez az IgD-hez kötött funkció). Ez az immunglobulin domináns a primer immunválaszban, de a komplement faktorokat nem köti meg. A 7S IgM feltehetően a petevezető szekrétuma, ami a tojás amnionfolyadékában és a naposcsibék vérsavójában is megtalálható. Az IgA a szekréciós IgM- és IgY-molekulával együtt a nyálkahártyák védelmében játszik meghatározó szerepet. 390
411 Immunológia Az IgB izotípus csak tyúkfélékben fordul elő, és az ún. hepatobiliáris immunglobulin-transzportban jut szerephez Az embriók immunválasz képessége A celluláris immunválasz képesség a keltetés napjától váltható ki. A humorális reakciók kialakulásával kapcsolatos nézetek azonban ellentmondásosak. Egyes megfigyelések szerint az embrióba jutó antigének immuntoleranciát hoznak létre, mások szerint viszont képződnek ugyan ellenanyagok, de alacsony titerértékük miatt nem mutathatók ki. Az embriók különböző kórokozókkal, pl. baktériumokkal szembeni reakciókészsége részben az embrionális élet, részben közvetlenül a kikelés után alakul ki, és ebben nagy szerepet játszik a szikzsákból felszívódó opszonin mennyisége, a phagocyták növekvő aktivitása, valamint a kikelés időszakát követően a komplement ugrásszerűen növekvő mennyisége Szikimmunitás A maternális (szikimmunitás) olyan módon alakul ki, hogy az anyai keringésből a petefészek tüszőhámsejtjei révén IgG jut a szikanyagba, ami a tojó szérum-igg-koncentrációjától függően akár 8 mg/ml mennyiséget is elérhet. A termékenyülés után ebből az nap között kb. 25 µg/nap, ezt követően kb. 100 µg/nap, majd a keltetés utolsó napjaiban mintegy 600 µg mennyiség szívódik fel az embrió keringésébe. A kikelő csirke kb. 1 2 mg/ml szérum-igg-koncentrációval rendelkezik. A petevezető szekréciós folliculusai által termelt IgG-, IgM- és IgA-molekulák bejutnak a tojásfehérjébe, de ezek nem transzferálódnak a vérkeringésbe. A maternalis ellenanyagok általában a 2. és a 4. hét között eliminálódnak a csirke vérkeringéséből, és ez időszak alatt az ún. feed-back hatás révén ugyanolyan módon gátolják az aktív immunitás vagy immunizálhatóság kialakulását, mint az emlősöknél Az immunrendszer phylogenesise A phylogenesis megismerésében alapvető törekvés volt annak kiderítése, hogy a törzsfejlődés során hol jelenik meg elsőként az immunválasz legősibb formája, mikor vált külön a humorális és a celluláris immunválasz, és milyen módon alakultak az Ig-osztályok. A gerinctelenekben a celluláris immunválaszra emlékeztető reakció, az idegen szövet kilökődése már kimutatható, és a testnedvekben már ellenanyag hatású anyagok is jelen lehetnek. A vizsgálatok alapján az a felfogás alakult ki, hogy a phylogenesis során elsőként a celluláris immunválasz jelent meg, és a fejlődés későbbi szakaszában alakult csak ki a humorálisimmunválasz-képesség. Gerincesekben már a legprimitívebb körszájúakban megjelennek a perifériás lymphocyták, és bennük már a lépnek megfelelő képződmény is megtalálható. A nyirokcsomók (germinatív centrumok nélkül) a kétéltűekben válnak megfigyelhetővé, a hangyászsünfélékben viszont már a germinatív centrumok is kialakulnak. A centrális nyirokszervek közül a thymus a legősibb formában az orsóhalakban, fejletebb formája (kéreg- és velőállomány) a porcos halakban mutatható ki. A bursa Fabricii a madarakban jelenik meg először, bár egyesek felfogása szerint a porcos halak rectális mirigye a bursa Fabricii primitívebb formája. A lép és a thymus együttesen a porcos halakban figyelhető meg legkorábban, de a T- és a B-lymphocyták még nem határolódnak el. A csontos halakban a lymphocyták már bizonyos heterogenitást mutatnak (pl. a pisztrángban csaknem valamennyi, a pontyban viszont csak 70%-a sig-pozitív a lymphocytáknak). A T- és a B-sejtek a békákban különülnek el elsőként. A humorális immunválasz az orsós halakban jelenik meg. Az immunglobulinok H- és L-láncokból tevődnek össze, de ezek összekapcsolása nem diszulfidhidakkal, hanem kovalens kötésekkel valósul meg. 391
412 Immunológia Az Ig-osztályok békákban és szalamandrákban különülnek el. A kétéltűek emésztőtraktusában olyan, a plazmasejtekhez hasonló sejtek figyelhetők meg, amelyek az IgA, illetve a szekréciós IgA képződését teszik lehetővé. A hüllők statusa lényegében megegyezik a kétéltűekével. A phylogenesisben jelentős változás a madarakban következik be, ahol már elkülönül az Ig-k két könnyűlánctípusa, a kappa és a lambda. Az emlősökben előforduló Ig-ok hasonló szerkezeteket mutatnak, ami arra utal, hogy ezek egy közös, ősi fehérjére vezethetők vissza, és ebből a praecursorból génduplikációk, deléciók és pontmutációk eredményeként fejlődhettek ki az Ig-ok ma ismert osztályai. Az immunrendszer phylogenesisét a 41. táblázat szemlélteti. 41. táblázat - Az immunrendszer phylogenesise Gerinctelenek Gerincesek Immunrendszer amőbá k coelenteratá k rovarok férgek körszájúak kétéltűek, hüllők madarak emlősök Fagocitózis Speciális sejtek Humorális válasz? Lymphoid szövet Késői típusú allergia IgM IgG IgA + + IgE Immundeficienciák Az immunrendszer sokoldalú funkciójából eredően különleges szerepet tölt be nemcsak a fertőző betegségekkel szembeni védekezésben, továbbá a szervezet homeosztázisának megőrzésében, hanem a környezet élő- (makroés mikro-) világához való alkalmazkodás folyamatában is. Az immunrendszer legalapvetőbb és minden más szervtől megkülönböztető egyedi sajátosságai a következőkkel jellemezhetők: felismerőképesség, vagyis a saját és az idegen strukturák megkülönböztetése, reakcióképesség az idegennek felismert anyagokkal szemben, memorizálóképesség, az egyszeri találkozás és felismerés immunmemóriaként való tárolása. Számítások szerint a lymphoid rendszerben percenként milliónyi lymphocyta képződik, különböző receptorstruktúrákkal, eltérő funkciókkal és elkötelezettséggel. Ez a folyamat rendkívül bonyolult regulációs rendszerek és mechanizmusok működésén, illetve kölcsönhatásán keresztül valósul meg, így érthető, hogy az 392
413 Immunológia immunrendszer működésében hibás vagy téves kapcsolások következhetnek be, amelyek klinikai rendellenességekhez vezethetnek. Az immunrendszer működési zavarai lehetnek öröklött, vagyis genetikai eredetűek vagy szerzettimmunhiányok, amelyeknek kialakulásában számos belső és külső tényező juthat érvényre. Az immundeficienciák a szervezetnek olyan állapotát jelölik, amely csökkent reakcióképességben vagy az immunreakciók elmaradásában mutatkozik meg. Ilyen alapon bármilyen deficiencia a fertőző betegségekkel szembeni fokozott érzékenységben nyilvánul meg, akár fakultatív pathogen, opportunista ágensekkel szemben is, amelyek egyébként nem lennének képesek a betegséget előidézni. Az immundeficienciák eredetük szerint két csoportra oszthatók: Primer (öröklött) immundeficienciák: B-sejtes immundeficienciák, T-sejtes immundeficienciák, kombinált immundeficienciák, a phagocytarendszer deficienciája, a komplementrendszer deficienciája. Szekunder (szerzett) immundeficienciák Primer immundeficienciák A primer vagy elsődleges immundeficienciák csoportjába az immunrendszer veleszületett működési zavarai sorolhatók, amelyek a pluripotens őssejtek érésének, illetve differenciálódásának valamelyik fázisában érvényre jutó hibák miatt következhetnek be. A háziállatokban leggyakrabban előforduló primer immundeficienciákról a 42. táblázat nyújt áttekintést. 42. táblázat - Primer immundeficienciák háziállatokban B-sejtes deficiencia Kórkép Állatfaj Sejttípus Megjelenési forma X-kromoszómához kötött deficiencia ló B éretlen B-sejtek Agamma-globulinaemia ló B lymphoid hypoplasia Hypogamma-globulinaemia juh, ló B csökkent IgG-szint Hiper IgM szindróma szarvasmarha B magas IgM-szint Szelektív IgG 2-deficiencia szarvasmarha B csökkent IgG 2-szint Szelektív IgM szindróma ló, kutya B csökkent IgM-szint Szelektív IgA-deficiencia kutya B csökkent IgA-szint T-sejtes deficiencia 393
414 Immunológia Acrodermatitis kutya T thymus hypoplasia Parakeratosis szarvasmarha T T-sejt-depleció Thymus hypoplasia kutya T növekedési zavarok Phagocyta rendszer deficienciája Neutrophil granulocyták hiányos képződése kutya, szarvasmarha N Chediak Higashi szindróma macska, szarvasmarha N abnormalis granulumok Ciklikus haematopoesis kutya N neutropenia Gramulocytopathias szindróma diszfunkciók kutya N phagocyta Pelge Huet szindróma kutya N migráció hiánya LAD (leucocyta adherencia folyamatok hiánya) kutya L gyulladásos BLAD (leucocyta adherencia hiánya) szarvasmarha L phagocytosis hiánya Neutrophil granulocyták működési zavara kutya L bélgyulladások Kombinált deficienciák Ló T B immundeficiencia Kutya T B Ig-szint csökkenése Csirke T B Ig-szint csökkenése A humorális és celluláris immunreakciók a B- és T-sejtek megfelelő működéséhez kötődnek. A nevezett sejtek funkcióját korlátozó vagy gátló genetikai károsodások rendszerint vagy csak az egyik (B-sejt), vagy csak a másik (T-sejt) lymphocytapopulációban jutnak érvényre, de a hatás érintheti mindkét sejtféleséget is, amikor ún. kombinált immundefektusok alakulnak ki B-sejtes immundeficienciák A B-lymphocyták működésének örökletes hibái állatokban meglehetősen gyakran fordulnak elő. Ilyenkor a celluláris immunreakciók kifogástalanul működnek, de a humorális immunválasz hiányos. A B-lymphocyták a csontvelői praecursor sejtekből származnak, és az immunreakció során Ig-termelő plazmasejtekké differenciálódnak. Amennyiben ez a genetikailag determinált folyamat zavart szenved, akkor annak csökkent Ig-termelés, vagyis humorális immundeficiencia lesz a következménye. Ez különösen akkor válhat súlyossá, ha ez a gátló hatás a B-sejtvonal differenciálódásának korai időszakában jut érvényre. Meg kell azonban jegyezni, hogy a humorális immundeficiencia, vagyis a csökkent Ig-képződés, a T-sejtek regulációs mechanizmusainak hibájából is bekövetkezhet olyan módon, hogy pl. a T-helper sejtek aktivitása csökken vagy a T-szuppresszor sejtek aktivitása fokozódik. 394
415 Immunológia X-kromoszómához kötött agammaglobulinaemia: a legrégebben ismert primer immundeficiencia. A kórkép immunpathologiai lényegét a B-sejteknek az ontogenesis során bekövetkező zavara képezi. Ez úgy alakul ki, hogy a csontvelőben a prae-b-sejt stádiumban olyan lymphocyták jelennek meg, amelyekben az IgM nehéz, mű-lánca a cytoplazmában kimutatható, viszont a könnyű lánc szintézise, valamint ezek összekapcsolása a nehéz láncokkal zavart szenved. Hiányosan működnek továbbá azok a mechanizmusok is, amelyek az IgMmolekulákat a plazmamembránba, vagyis a sejtfelületre juttatnák. Lényegében tehát az immundeficienciának ez a formája úgy is megfogalmazható, hogy az X-kromoszómán hiányoznak a prae-b-sejt -ből a B-sejtté való átalakulást irányító gének. Ezért az ilyen kórképben a perifériás vérben alacsony számban kimutatható B-sejtek fenotípus szerint éretlenek, a plazmasejtek pedig teljes egészében hiányoznak. A lovakprimer agammaglobulinaemiája: az agammaglobulinaemiás lovakban a T-sejtek aránya normális szintű, viszont a B-sejtszám csökkent. Ennek kifejeződése az agammaglobulinaemia, ami valamennyi immunglobulin-osztályra és -alosztályra kiterjed. Szövettanilag a lépben és a nyirokcsomókban a folliculusok germinatív centrumának hiánya, valamint plazmasejthiány figyelhető meg. A kórkép az ellenálló képesség csökkenésében és különösen a légzőszervi megbetegedések iránti fogékonyságban nyilvánul meg. Átmeneti hypogammaglobulinaemia: arab telivérekben előforduló immunhiányos állapot. A kórképet az jellemzi, hogy a normál B-lymphocyta-szám mellett az Ig-szintézis a csikókban késéssel indul meg, vagyis a csikó hypogammaglobulinaemiás marad, mégpedig a kb. 2 4 hónapos kor közötti időszakban, tehát akkor, amikor a maternalis Ig-k már eliminálódtak a vérpályából. Hasonló deficiencia a bárányokban az IgG 2 alosztály, egyes terrier kutyákban pedig az IgG osztály hiányában mutatkozhat. A fentnevezett állatokban 2 hónapos kor után is alacsony szintű Ig-értékeket lehet kimutatni, mivel a fiziológiás szintű saját-ig-termelés csak 4 5 hónapos korban következik be. A deficiencia elsősorban a fertőző betegségekkel szembeni fokozott érzékenységben fejeződik ki. A hyper-igm-syndroma kórképben is a B-sejt-ontogenesis zavaráról van szó, amely abban nyilvánul meg, hogy az IgM-hordozó és -szekretáló sejtekben nem következik be az ún. izotípus átkapcsolás. Ilyen esetben az egyed B-lymphocytái nem képesek sem IgG, sem IgA, sem IgE termelésére. Ebből eredően antigénstimulus hatására a nyirokszervekben, a lépben és a csontvelőben egyaránt megszaporodnak az IgM-termelő plazmasejtek, és a szérum-ig-koncentráció is megemelkedik. Szelektív IgG 2- deficiencia: a dán vörös fajtájú szarvasmarhában előforduló kórkép. Az IgG 2 szintézise, valamint annak szekretálása is hiányos, ami elsősorban a pyogen baktériumokkal szembeni érzékenységben mutatkozik meg, és rendszerint mastitisben és bronchopneumoniában manifesztálódik. Szelektív IgA-hiány: a leggyakoribb B-sejtes deficiencia. Humán statisztikai adatok szerint minden 800 fehér bőrű ember közül egyben biztosan előfordul. Jellemzője, hogy a szérum-iga koncentrációja lényegesen alacsonyabb a fiziológiás értéknél, ugyanakkor az IgM és az IgG szérumban lévő mennyisége normális szintű. A kórkép magyarázatára többféle elképzelés látott napvilágot. Egyik felfogás szerint a perifériás vérben nagy számban lehetnek jelen olyan siga+ (felületükön IgA-molekulákat hordozó) sejtek, amelyek IgM- vagy más Igmolekulákat is hordoznak. Az ilyen dupla vagy tripla izotípus-hordozásból eredő deficiencia pontos mechanizmusa még nem ismert. A másik elképzelés szerint a pathogenesisben alapvető szerepet játszik, hogy az IgA-termelő B-sejtek nem érnek siga+ plazmasejtekké. A zavar a genetikailag programozott differenciálódás végső fázisában jut érvényre, ezért az IgG és az IgM koncentrációja normális értékeket mutat, viszont az IgA szintje csökkent. Az még nem világos, hogy az ilyen deficienciát mutató kutyák miért reagálnak pozitívan a rheumathoid faktorra, továbbá, hogy az ilyen kórkép emberben milyen összefüggésben van a szisztémás lupus erithematosussal, a rheumathoid arthritissel, továbbá a lymphocytás thyroiditisszel. Az IgA fontos szerepet játszik a légző- és emésztőszervek nyálkahártyájának védelmében, gátolva a baktériumok és a vírusok kolonizációját és behatolását. Hiánya az ilyen oktanú betegségekben jelent prediszpozíciót. Az állatok közül beagle, valamint németjuhász kutyákban figyelték meg a kórképet. A deficiencia tüdő-, valamint bőrgyulladásban, továbbá középfülgyulladásban szokott kifejeződni. A szelektív IgM-hiány ritkán előforduló kórkép. Eddig emberben, lóban és dobermann kutyákban állapították meg. A klinikai tünetek kutyában általában már 1 hónapos korban megfigyelhetők, és fokozatos soványodás 395
416 Immunológia mellett kb. 4 hónapos kor után következik be az elhullás. A kórképben a keringő T- és B-sejtek aránya megfelelő, viszont az IgM koncentrációja 10%, vagy ezt meghaladó csökkenést mutat. Az IgM-hiányos lovakban gyakran lymphosarcomás elváltozásokat is megfigyeltek T-sejtes immundeficienciák A B-sejtes immundeficienciákkal ellentétben az állatokban eddig három olyan kórforma ismert, amelyek a T- sejtek hiányos működésére vezethetők vissza. Ezek legfontosabb klinikai következménye, hogy a szervezet érzékennyé válik a fakultatív pathogen kórokozókkal, különösen az enterobaktériumokkal szemben, továbbá a vírusok, valamint a gombák okozta fertőzések iránt. Öröklött parakeratosis ( A 46 szindróma): a fríz eredetű fekete dán szarvasmarhában előforduló, öröklött immunhiányos állapot. Jellemzője a thymus hypoplasiája és a keringő lymphocyták számának csökkenése. Oka valószínűleg a cink hiányos felszívódásából ered, ez az elem ugyanis alapvető komponense az egyik thymushormonnak, a thymulinnak. Ennek hiánya allopeciahoz, parakeratosishoz, exanthemák kialakulásához és a thymus hypoplasiájához vezet. Az ilyen tehenektől született borjak egészségesnek látszanak, de 4 8 hetes korra megjelennek az előbb felsorolt tünetek, és az egyedek pusztulása néhány hónappal később következik be. Az ilyen borjakban az ellenanyagválasz viszonylag megfelelő szintű, viszont a T-sejtek működésében funkciózavarok mutatkoznak, ami cink adagolásával részlegesen korrigálható. Hasonló jelenséget holstein-fríz borjakban is megfigyeltek. A kórkép immunológiai jellegzetességei: lymphopenia a (T-sejtszám csökkenése miatt), lymphocyta depletio a nyirokcsomók T-sejt zónájában, csökkent szintű sejtes immunreakciók, normál szintű immunglobulin-koncentráció, normál szintű humorális immunválasz. Acrodermatitis: dobermann és terrier kutyákban megfigyelt deficiencia. Mechanizmusa hasonló a fekete dán szarvasmarhában előforduló kórképhez. Lényeges különbség azonban, hogy a kutyák cinkterápiára nem javulnak. Jellemzője a thymushypoplasia, valamint a T-dependens zónákban a T-sejtfunkciók hiánya. Thymushypoplasia: a törpe weimari kutyában kifejlődő kórkép, ami egyes vélemények szerint a növekedési hormonok és a T-sejtfunkciók zavarából ered. Ilyen esetekben a B-sejtarány és az Ig-koncentráció a fiziológiás szinten marad. A szindrómát mutató kölyökkutyák rendkívül érzékenyek a különböző fertőző ágensekkel szemben. A deficiencia növekedési hormonok adagolásával gyógykezelhető Kombinált immundeficienciák A deficienciáknak a kombinált formája a T- és a B-sejtek csökkent működése következtében alakul ki. Kombinált immundeficiencia kutyákban. Az X-kromoszómához kötött recesszív működési zavar. A deficiencia általában 3 6 hónapos korban jelentkezik, a maternális immunglobulinok kiürülése után. Csökken ilyenkor a IV. típusú hypersensitivitási reakció, alacsonyabb a keringő T-sejtek száma, és csökken a PHA-val indukálható blastogenesis aránya is. Csökken az IgG- és IgA-koncentráció, ami a B-sejt-deficienciát igazolja. Az IgM-szint változó lehet. Szövettanilag a lymphoid szervekben hypoplasia figyelhető meg. Kombinált immundeficiencia arab telivérekben. Ez az autoszomális, recesszíve öröklődő betegség arab telivérekben meglehetősen gyakori előfordulást mutat. A felnőtt lovak kb. 26%-a hordozza a genetikai hibát, és a csikók 2,5 3%-ában realizálódik a kórkép, ami az érett T- és B-sejtek képződésének hiányosságaiból ered. Mindez a celluláris, valamint a humorális immunválasz zavarában mutatkozik meg. A csikóknak ilyen esetben egyedüli protektív védelmet csak a maternalis immunitás nyújt, így annak csökkenésével, illetve megszűnésével a csikók elpusztulnak, rendszerint valamilyen légzőszervi betegségben, amit pl. adenovirus vagy a Pneumocystis carinii idéz elő. 396
417 Immunológia A deficiencia pathogenesise nem ismert teljes részletességgel, de feltételezik, hogy kialakulásában a purinanyagcsere zavara játszhat kulcsszerepet, hasonlóan az ember ún. Swiss (svájci) típusú deficienciájához. A kórkép immunológiai jellemzői: lymphopenia (a lymphoid törzssejtek hiánya), csökkent mitogén- (PHA-, Con-A-)stimulációs index, az Ig-szintézis hiánya vagy igen alacsony volta, a thymus és a lymphoid szövetek hypoplasiája. A betegség megbízható diagnosztizálása szempontjából alapvetően fontos az IgM mennyiségének pontos meghatározása, mégpedig az újszülött vérsavójából, a colostrum felvétele előtt. A megszületés előtti IgM mennyiségéből ugyanis következtetni lehet az immunrendszer működésére. Egészséges csikókban a colostrumfelvétel előtt 0,08 0,2 g/l IgM található, 1 hónap után pedig, amikor a maternalis IgM-molekulák már kiürülnek a vérpályából, akkor kb. 0,4 g/l mennyiség tekinthető fiziológiásnak. Kombinált immundeficiencia csirkékben: egyes csirkevonalakban szelektív IgA-hiányban, más vonalakban szelektív IgG-hiányban mutatkozik. Ez utóbbinál a csirkékben az IgG-szint kb. 50 napos korig megfelelő, ettől kezdődően azonban rohamosan csökken, miközben az IgM és az IgA szintje emelkedik, és fokozott immunkomplex-képződés kíséri a deficienciát A phagocytarendszer immundeficienciája Az elsődleges, ún. aspecifikus deficienciák megnyilvánulási formái a neutrofil granulocyták kvantitatív vagy kvalitatív hiányosságaihoz kötődnek. A neutrophil granulocyták hiányos képződése: a haemopoesis zavara következtében kialakuló neutropeniát eddig kutyákban és hereford szarvasmarhákban írták le. A kórkép az ellenálló képesség csökkenésében és különösen a légzőszervi megbetegedések iránti fogékonyságban nyilvánul meg. A CHEDIAK HIGASHI-szindróma. Klinikailag albinizmusban, vérzékenységre való hajlamban, továbbá a különböző kórokozókkal szembeni fokozott érzékenységben nyilvánul meg. A kórkép ismeretes az emberben, de megállapították hereford szarvasmarhákban, kék perzsamacskákban, nyércekben, kék- és ezüstrókákban, valamint egerekben is. Autoszomális, recesszív öröklődésű betegség. Jellemzője, hogy minden olyan sejtet érint, amelyek cytoplazmájában granulumok találhatók (neutrofil granulocyták, szekréciós sejtek, melanocyták, vesetubulusok hámsejtjei, pancreassejtek stb.), és ezekben óriás cytoplasmagranulumok alakulnak ki, amelyek a lysosomák fúziójából származnak. A szindróma az említett sejtek csökkent funkcióját jelenti. Amacskafélék közül a szindróma a perzsamacskákban és a tigrisekben a leggyakoribb. Az előbbiekben feltűnő a bőr világosabb, valamint a szem halványzöld vagy sárgás színe, továbbá a fénykerülés, hematomák kialakulása pl. az injekciók helyén vagy műtéti területeken. Sebészi beavatkozásokat követően a macskák elvérezhetnek annak ellenére, hogy a véralvadási teszt vagy a thrombocyták száma normál értéket mutat. A kórkép hematológiai vizsgálat során felismerhető azon az alapon, hogy a leukocytákban a granulumok mérete többszörösére növekszik. Macskákban a szindróma súlyosabb formát ölt, mint más fajokban, mivel a kórképhez mindig társul a neutrofil granulocyták kemotaktikus ingerek iránti érzéketlensége, valamint az intracelluláris baktériumemésztés hiánya. A kutya ciklikus haematopoesise autoszomális, recesszíven öröklődő zavar, ami a neutrofil granulocyták csontvelőbeli érésének zavarából ered. Leggyakrabban a skót juhász kutyákban jelentkező deficiencia, ami 6 hónapos kor körül válik letálissá. A betegség során csökken a keringő fehérvérsejtek száma. A neutropenia pl. l0 l2 naponként következik be és 2 5 napig tart, amikor is a neutrofil granulocyták száma 1x10 9 /l alá csökken. A sejtképzés zavara főleg baktériumos fertőzések iránti fogékonysághoz vezet, ami legtöbbször bélgyulladás és légzőszervi megbetegedések, továbbá arthritis kialakulásához vezet, de elváltozások alakulnak ki a szájüregben (pl. gingivitis) is. Mivel a kórképben a thrombocyták képzése is zavart, a deficiens kutyákban testszerte vérzések is mutatkozhatnak. Granulocytopathiás szindróma: ír szetter kutyákban előforduló kórkép, amelyben a neutrofil granulocyták normális szintű phagocytálóképességgel rendelkeznek, de a bekebelezett baktériumok intracelluláris emésztése nem következik be. 397
418 Immunológia A szindróma következménye elsősorban a pyogen fertőzésekkel szembeni érzékenység fokozódásában fejeződik ki. Klinikailag a deficiencia purulens bőrgyulladásban, továbbá gingivitisben és lymphadenopathiákban mutatkozhat. Pelge Huët-syndroma: a korábban csak az emberben ismert tünetegyüttest foxi és más kutyafajtákban (spaniel, terrier), macskában, valamint házinyúlban is megfigyelték. A kórkép abban nyilvánul meg, hogy a neutrofil (házinyúlban heterofil) és az eosinofil granulocyták magja nem szegmentálódik, hanem kerek marad, ennek következtében az nem flexíbilis, így a sejtek nem képesek a szövethézagokba migrálni. Az immundeficienciákban játszott szerepe még kevésbé ismert. A leukocyták adherenciájának deficienciája (LAD) kutyákban: acd11b és a CD18 protein öröklött hiányából eredő kórkép. A nevezett protein mint integrin a leukocyták és más sejtek adherenciájában, továbbá a kemotaktikus faktorok hatásának érvényre jutásában játszik meghatározó szerepet. A deficiens kutyákban a kórkép a gyulladásos folyamatok súlyosságában nyilvánul meg, mivel a neutrofil granulocyták érzéketlenek a kemotatktikus ingerekre, képtelenek az endothelsejtekhez való kötődésre, ami lehetővé tenné a gyulladásos folyamat helyére történő kiáramlásukat. Ez az oka annak, hogy bár a véráramban a neutrofil granulocyták aránya magas, a gyulladás helyén gennyesedési folyamat nem figyelhető meg. A leukocyta adherencia zavara szarvasmarhában (BLAD): a kórkép a neutrofil granulocyták migrációs készségének csökkenésében, valamint a phagocytosis baktericid funkciójának elmaradásában nyilvánul meg. Holstein-fríz szarvasmarhákban, leggyakrabban 2 és 7 hónapos kor között megfigyelt kórkép, ami a fertőző betegségekkel szembeni fokozott érzékenységben, orális fekélyek képződésében nyilvánul meg. A neutrofil garnulocyták működésének deficienciája dobermann és a weimari fajtájú kutyákban is megfigyelhető, és a kórkép enteritisben, pneumoniában, továbbá osteomyelitisben jelentkezik. A mucociliaris rendszer működési zavara: angol springer spaniel kutyákban előforduló örökletes zavar, és hasonló az ember ugyanilyen szindrómájához. A kórképet jellemzi a csökkent csillómozgás, ennek következtében a mucociliáris rendszer hiányos működése, amiért is visszatérő légzőszervi betegségek kerülnek az immunhiányos szindróma előterébe. Megfigyelések szerint az ilyen immundeficienciában a kanok spermiumainak mozgásképessége is csökken, ami esetenként terméketlenséget idéz elő A komplementrendszer deficienciája A komplementfehérjék hiánya lehet öröklött, de lehet szerzett is, amely utóbbit a rendszer túlzott aktivációja idézhet elő. A legtöbb komplementfehérje hiánya meghatározott betegséggel szokott társulni. A klasszikus aktiválódás korai komponenseinek hiányával járó esetekben gyakoriak a szisztémás lupus erythematosusnál (lásd később) is előforduló tünetek. A deficienciát gyakran glomerulonephritis kíséri. A C3 faktor hiánya vagy alacsony koncentrációja pl. spaniel kutyákban gyakori. Ilyenkor jelentősen csökken a komplement rendszer anaphylatoxicus, opszonizáló és litikus hatása. Az ilyen egyedek érzékenyek a Gramnegatív baktériumok, továbbá a clostridiumok és pyogen baktériumok okozta fertőzésekkel szemben. A késői komplementkomponensek hiánya esetén viszont a visszatérő fertőzések állnak előtérben, ami egyúttal a faktorok alapvetően fontos szerepét is bizonyítja egyes mikroorganizmusok eliminálásában. Egyes komplementfaktorok hasítási termékei a sejtfelszíni receptorokon befolyásolják a celluláris immunfunkciókat (lásd a Komplement c. fejezetet), és hiányuk természetszerűleg e funkciókkal összefüggő deficienciát idéz elő. A komplementrendszer deficienciája laboratóriumiállatokban(egérben, patkányban, tengerimalacban, hörcsögben, nyúlban) isismeretes Szekunder immundeficienciák A másodlagos immundeficienciák az ún. szerzett működési zavarokat foglalják magukban, és a legtöbb állatfajban jóval gyakrabban fordulnak elő, mint a primer működési rendellenességek. A szekunder immundeficienciákat általában az jellemzi, hogy az egyébként ép immunrendszer funkcionális zavarát vagy 398
419 Immunológia csökkent működését olyan ágensek (baktériumok, vírusok, paraziták, daganatok, sugárártalmak, táplálkozási, valamint toxikus zavarok stb.) idézik elő, amelyek a lymphoid rendszer sejtjeit, mint célsejteket közvetlenül károsítják. Leggyakrabban abban nyilvánulnak meg, hogy fokozódik a kórokozók iránti fogékonyság, ami akár a születés után közvetlenül, akár a későbbiekben az életkortól függetlenül is megfigyelhető. Az ismétlődő felső légúti gyulladások vagy tüdőgyulladások általában a humorális rendszer deficienciáját jelzik, míg az ismétlődő vagy perzisztens, vírus, gomba, parazita okozta fertőzések a celluláris immunválasz hiányosságaira utalnak. A krónikus emésztőszervi bántalmak viszont mindkét rendszer működési elégtelenségét jelezhetik. Máskor a szekunder immundeficienciák endokrin zavarokban, anyagcsere- rendellenességekben, valamint immunmediálta betegségek kialakulásában nyilvánulnak meg. A szekunder immundeficienciák eredete rendkívül változatos, a legfontosabbakat a 43. táblázat tünteti fel. 43. táblázat - Szekunder immundeficienciák háziállatokban Maternális immunitás hiánya Vírus okozta immundeficienciák Szopornyicavirus Herpesvirusok Parvovirusok BVD vírus Fertőző bursitis vírusa FELV, FTVL, ALV, BLV. Macska-deficienciavirus Retrovirusok Baktérium okozta immundeficienciák Mycoplasmák Pasteurellák A maternalis immunitás hiánya Az epitheliochorialis placentájú állatfajok újszülött állataiban egyike a leggyakrabban előforduló deficienciáknak.ezek az állatok ugyanis csak a colostrummal juthatnak immunglobulinokhoz, ami a passzív maternalis immunitás kialakulását jelenti. Ennek hiánya vagy nem kielégítő volta az újszülött állat megbetegedéséhez vagy pusztulásához vezethet (lásd. az Újszülöttek immunválasz képessége c. fejezetben). A maternalis ellenanyagok vérbeli koncentrációja különböző módszerekkel (pl. agargélprecipitációs próbával vagy megfelelő koncentrációjú nátrium-szulfitos kisózással) határozható meg Vírusok okozta immundeficienciák Az elmúlt évek kiterjedt kutatásai alapján a vírusok okozta immundeficienciákról nagyszámú adat birtokába jutottunk. Az ilyen eredetű deficienciák megnyilvánulási formái rendkívül változatosak aszerint, hogy a vírusfertőzés következtében az immunrendszer milyen szerve, szövet- vagy sejtféleségei károsodnak. 399
420 Immunológia A csirkék fertőző bursitisének vírusa pl. a bursa Fabriciiben a B-lymphocyták károsodását okozza, ami a humorális immunválasz deficienciáját idézi elő, és megjelenésében hasonló a bursectomia következtében kialakuló tünetekhez. Az egér herpesvirusa viszont a thymusban a CD4 sejteket pusztítja, és következményei a mesterségesen végzett thymectomia klinikumával azonosak. A vírusok funkciócsökkenést vagy -kiesést okozhatnak: a T- és a B-lymphocyták valamennyi populációjában (pl. szopornyicavírus, macska-parvovirus, BVD vírus), kizárólag a B-lymphocytákban (pl. a fertőző bursitis virusa, a bovin és az avian leukosis vírusa), kizárólag a T-lymphocytákban (pl. a Marek-betegség vírusa), csak valamelyik (pl. CD 4) szubpopulációban olyan módon, hogy a vírus acd4 + (T-helper-inducer) sejteket fertőzi, és ilyen módon lymphocytadepletiót vagy immunregulációs zavart idéznek elő (mint pl. a humán, simian, és a felin immundeficiencia-vírusok), a vírus kötődhet az interleukin 2 molekulákkal és gátolja azok működését, a vírus zavart okozhat a macrophagok funkciójában (pl. herpes-, paramyxovirusok, egérleucaemia-vírus), a vírus felszabadíthat immunszuppresszív hatású envelop proteineket (pl. a retrovírusok p15e proteinje). Humorális és celluláris immundeficienciákat olyan vírusok váltanak ki, amelyek a lymphoid szövetekben szaporodnak (43. táblázat). Szopornyicavirus. A szopornyica vírusa és a vele rokon kanyaróvírus, valamint a keleti marhavész vírusa a lymphocyták lysise folytán jelentős immunszuppressziót okoznak. Thymusatrophia, generalizált lymphoid depletio (elsősorban a T-dependens zónákban), valamint lymphopenia alakul ki. Emiatt a kórképhez rendszerint másodlagos baktériumos fertőzések társulnak. A szopornyica a Paramyxoviridae család Morbillivirus genusába tartozó vírus által okozott betegség kutyákban. A vírus a lymphoreticularis szövetben szaporodik el, majd a viraemiás szakban a macrophagokba jut, így elárasztja az egész szervezetet. A fertőzés kimenetele szempontjából alapvető fontosságú a B- és a T- lymphocyták zavartalan működése. A fertőzést követően általában a 7 9. napon VN-ellenanyagok jelennek meg a vérpályában, és a kutyák gyógyulhatnak. Azokban az állatokban viszont, amelyekben a B-sejt működészavara miatt az immunválasz késik, jelentős károsodás következhet be a légzőkészülék és az emésztőcső nyálkahártyájában, valamint a bőrben és a központi idegrendszerben. A fertőzés kimenetele és lefolyása alapvetően függ továbbá a T-sejtek károsodásának mértékétől és időtartamától. Ha a szuppresszió 7 10 napnál hosszabb időn át érvényesül, akkor ez lehetőséget ad a vírus magas titerig való szaporodására, aminek gyakran végzetes encephalitis és encephalopathia lesz a következménye. Ha viszont a szuppresszió csak 7 10 napig érvényesül, úgy a kialakuló celluláris és humorális immunválasz meggátolja az idegrendszer károsodását. Az immundeficiencia klinikai és kórszövettani jellemzői: lymphopenia, celluláris immunreakciók csökkenése, az IL 2-képződés hiányosságai, a szérum-immunglobulin-koncentráció csökkenése, a VN-titer alacsony szintje, másodlagosan baktériumok és véglények okozta fertőzések, illetve generalizált kórképek kialakulása (pl. toxoplasmosis), PHA-és Con-A-val szembeni csökkent reakcióképesség. 400
421 Immunológia BVD vírus. Szarvasmarhában a Flaviviridae család Pestivirus genusába tartozó vírus a betegségnek akár heveny, akár idült formájában a lymphocyták necrosisát okozza az elsődleges és a másodlagos nyirokszervekben. Ilyen módon jelentős immunszuppressziót vált ki, amit szekunder fertőzések kísérnek (pl. PI 3, mycoplasma, pasteurella). Megfigyelések szerint az attenuált vakcinavírus is kifejthet immunszuppresszív hatást. A szervezetbe kerülő vírus az emésztőcső nyálkahártyájában és annak nyirokképleteiben szaporodik el. A viraemiás szakban a vírus eljut a lymphoid szervekbe is, és leukopeniát alakít ki, ami társulva a vírusnak az alveolaris hámsejtekre gyakorolt hatásával, más kórokozók (IBR, PI3, mycoplasmák, pasteurellák) okozta tüdőgyulladáshoz vezet. A fertőzést követően 9 14 nap után VN-ellenanyagok vérpályában való megjelenése miatt a vírus eltűnik a vérpályából, de tovább perzisztál a lymphocytákban és macrophagokban. A kialakuló immunkomplexek következménye az endothelsejtek és a veseglomerulusok károsodása. A vírus diaplacentárisan a magzatba is átjuthat, aminek többféle következménye lehet. A magzati önfelismerés szakaszában bekerülő vírust a magzati immunrendszer saját anyagként ismeri fel, és a magzat a kialakuló immuntolerancia miatt ún. tolerált fertőzéssel születik. Az ilyen borjúban megfigyelhető a lymphoid szövetek atrophiája, a csökkent blastogenesis és a B-sejtek számának 30-ról 4 15%-ra való fogyatkozása. A tolerált fertőzéssel született borjak vérsavójában vírussal szembeni ellenanyagok nem mutathatók ki, és bennük aktív immunitás vakcinás oltásal nem váltható ki. Az immundeficiencia klinikai tünetei és kórbonctani vonatkozásai: fokozott fogékonyság a másodlagos fertőzésekkel szemben, átmeneti lymphopenia a B- és a T-sejtszám csökkenése miatt, a szubpopulációk arányának megváltozása, a PHA-val indukálható blastogenesis alacsony indexe, az IL 2-termelés hiánya vagy nem kielégítő szintje, ami maga után vonja a CD 8 sejtek differenciálódásának gátlását, valamint a természetes killer sejtek proliferációját. Fertőző bursitis vírusa. A vírus, amely a Birnaviridae családba tartozó dupla szálú RNS-vírus, az emésztőcső macrophagjaiban és lymphoid sejtjeiben szaporodik el elsőként, majd a véráram útján kerül a különböző lymphoid szervekbe. A vírus célszerve a bursa Fabricii, amit igazol az is, hogy bursectomizált csirkék túlélik a letális dózissal történő fertőzést. A vírus a bursában megtelepedve a B-sejtek károsodását, a lymphoid szövet necrosisát és atrophiáját idézi elő. Ez a folyamat a humoralis immunválasz csökkenését okozza, aminek következtében az állatok fokozott érzékenységet mutatnak a különböző kórokozókkal szemben. A vírus károsítja a B-lymphocyták praecursor sejtjeit is, ami jelentős B-sejtszámcsökkenéshez vezet. A vírus immunszuppresszív hatása alapvetően függ a fertőzés idejétől és a vírus virulenciájától. A B-sejtek elkötelezettsége ugyanis 2 3 hetes korra már kialakul, így jelentős immunszuppresszióra ezt követő fertőződés esetén már nem kell számítani. Az immunszuppresszió viszont ezt megelőzően annál kifejezettebb, minél gyengébb immunogén hatású az az antigén, amivel szemben kellene az immunválasznak kialakulni. Ebből ered, hogy a fertőző bursitis vírusával terhelt állományok a baromfipestissel szemben csak többszöri vakcinázással immunizálhatók eredményesen. Parvovirusok okozta immundeficienciák. A kutya és a macska parvovirus fertőzöttségénél a vírus a garatüreg nyirokképleteiben szaporodik el, majd bejut a véráramba. Ezt követően a gyorsan osztódó sejtekben (pl. a bélhámsejtekben, újszülöttekben a szívizomsejtekben) telepszenek meg, ahol számukra legkedvezőbbek a szaporodáshoz szükséges feltételek. A lymphoid szövetben necrosist okoznak, T- és B-sejtdepletióval és lymphopeniával. A macskáknál ebben a neutropenia a legjelentősebb, ami a másodlagos baktériumos fertőzésekkel szembeni fogékonyságot fokozza. Megváltozik a sejt mediálta immunválasz képesség is, mégpedig jelentősen csökken a fertőzést követő 2 3. héttől. 401
422 Immunológia Kutyában pl. a virulens vírus okozta deficiencia következtében az attenuált törzset tartalmazó, szopornyica elleni vakcina alkalmazását követően encephalitis alakulhat ki. Az attenuált parvovirustörzsek nem váltanak ki immundeficienciát, ezért aggály nélkül kombinálhatók más vírustörzsekkel. Az immundeficiencia klinikai tünetei és kórbonctani leletei a kutya parvovírus-2-vel történt fertőződése esetében: thymusatrophia, lymphopenia, lymphocytadepletio a Peyer-plakkokban, a nyirokcsomókban és a lépben, PHA- és Con-A-val szembeni csökkent reakciókészség. A macska leukosisvírusa (FeLV). A vírus a Retroviridae család Oncovirinae alcsaládjába tartozik, és predilekciós szaporodási helyét az immunrendszer sejtjei képezik. A fertőzést követő viraemia maga után vonja a lymphoreticularis szövet elfajulását, és a thymus atrophiája miatt jelentősen csökken a celluláris immunválasz képesség. Mindez önmagában több veszteséget vált ki, mint a macskák kisebb hányadában kialakuló leucaemia vagy a daganatos forma. A FeLV-fertőzés következménye lehet egyrészt lympholyticus hatású, ami a thymus és a lymphoid szervek atrophiáját okozza, másrészt lehet immunszuppresszió, amit a vírus p15e proteinje vált ki. Ez a faktor ugyanis gátolja a lymphocyták blastogenesisét, valamint az IgG szintézisét. A vírus az immunrendszer számos molekuláris egységével is képes reagálni, ezért az immundeficiencia is sokféleképpen nyilvánulhat meg: csökken a humorális és a celluláris immunválasz, a phagocytosis kapacitása, valamint a komplementrendszer aktivitása, a lymphocyták depletiója mellett kialakulhatnak ún. immunmediált betegségek, mint pl. az autoimmun glomerulonephritis. Modellkísérletben azt is megállapították, hogy a vírus a keringő lymphocyták nagymértékű (közel 100%-os) csökkenését idézi elő, ezért a vírust FeLV FAIDS-nek is nevezik, utalva a fatális immundeficiencia kialakulására, bár ennek eltérő a mechanizmusa az AIDS kórfejlődésétől. Az immundeficiencia kialakulásának feltételeit vizsgálva az is kiderült, hogy a FeLV envelop proteinje (p15) specifikusan gátolja a T-sejtek működését, akadályozza az IL 2 kötődését a kooperációban részt vevő sejtekhez, továbbá gátolja a gamma-interferon termelődését. A vírussal fertőzött egyed lymphocytái nem stimulálhatók Con-A-val, mivel a vírusprotein a reagáló lymphocyták receptorait leköti. A retrovírusok okozta immundeficienciák jellemző példája a macska leucaemia vírusa által okozott kórkép klinikai és kórbonctani manifesztációja, ami a következőkben összegezhető: A fertőzött macskák fokozott érzékenysége a másodlagos fertőzésekre, ami a lymphopenia, a neutropenia, a thymusatrophia, valamint a lymphocytadepletio következménye. A humorális immunválasz képesség deficienciáját jelzi a hypogammaglobulinaemia, valamint a csökkent IgGválasz a T-dependens antigénekre. A celluláris immunrendszer deficienciájára a szövetkilökődési reakció elmaradásából, a cytotoxikus lymphocyták csökkenő reakcióképességéből, továbbá az IL 2 és a gammainterferon hiányából lehet következtetni. A macska immundeficiencia virusa (FTLV: Felin T-Lymphotroph Virus). A macskához adaptálódott lentivírus okozza, amelynek az immundeficienciában játszott szerepe még nem teljesen tisztázott. Gátolja a T- és a B-lymphocyták kooperációját, továbbá a granulocytopoesis károsításával neutropeniát vált ki. Egyes esetekben generalizált lymphadenopathia (follicularis hyperplasia, plasmocytosis) kialakulását is megfigyelték. Hasonlóan a humán AIDS- fertőzéshez, károsítja a CD 4 + -populációt, B-sejt típusú 402
423 Immunológia lymphosarcoma képződését és neurológiai tünetek kialakulását okozhatja. Az egészséges macska 1,5 értékű CD 4 : CD 8 aránya, 0,8-ra módosulhat a beteg egyedekben. Avian leukosis virus (ALV). Ezek a vírusok a B-lymphocytákat fertőzik, és ezekben proliferációt, máskor daganatképződést váltanak ki vagy pedig károsan befolyásolják a nevezett sejtek funkcióját. Az avian retrovirusok lehetnek egyrészt ún. transzformáló vírusok, amelyek fogékony állatba oltva rövid lappangási idő után daganatokat okoznak, másrészt lehetnek ún. nem transzformáló vírusok, amelyek viszont főként immunszuppressziót váltanak ki. Az avian leucosis vírusának célszerve a bursa Fabricii, és itt a B- lymphocyták annál nagyobb mértékben transzformálódnak, minél fiatalabbak ezek a sejtek. A transzformált sejtek felületén IgM-molekulák találhatók. A replikálódó vírus hatására az IgM-et tartalmazó sejtek proliferálódnak, amelyek azonban nem képesek tovább differenciálódni IgG-vagy IgA-termelő plazmasejtekké. A daganatok 2 4 hónap alatt fejlődnek ki a bursában, amelyekből az ivarérés után áttétek képződnek a májban, lépben, vesében, petefészekben, a pancreasban és a thymusban. Bovin leukosis virus- (BLV-)fertőzésnél hasonló módon csökken az ellenanyagok termelése, de alacsony marad az IgM szintje is. Az ellenanyagok IgG természetűek, és az antigénaffinitásuk alacsony. A lymphocyták blastogenesise és a késői típusú hypersensitivitás ugyancsak csökken Baktériumok okozta immundeficienciák Egyes baktériumok okozta fertőzések esetében megfigyelték, hogy azok az immunrendszer működését befolyásolják, és pl. csökkentik az immunreakciók intenzitását. Ennek mechanizmusa kevéssé ismert, de néhány baktériumféleség (pl. mycoplasmák) olyan faktorokat termel, amelyek befolyásolják a macrophagok és neutrofil granulocyták funkcióját. Közülük a macrophagok kulcsszerepet töltenek be az immunindukcióban, ezért funkcióik csökkenése vagy kiesése alapvetően befolyásolja az immunstátusz alakulását. Mycobacteriumok okozta fertőzéseknél hatékony celluláris immunválasz alakul ki a kórokozóval szemben, ugyanakkor azonban más kórokozókkal vagy antigénekkel szemben gyakran csökken az immunválasz képesség. Ez a paradox jelenség eredhet abból, hogy megnő a szuppresszor sejtek aktivitása, de következménye lehet a macrophagok csökkent funkciójának is. Pasteurella haemolytica törzsek a kérődzőkben specifikus leukotoxint termelnek, amelyek előidézhetik a phagocyták lízisét, továbbá a T- és a B-sejtek blastogenesisének gátlását. Az Actinobacillus pleuropneumoniae, továbbá néhány Staphylococcus aureusés E. coli törzs ún. leukotoxinok termelésével a leukocytákat károsítják Lymphoproliferatív folyamatok okozta deficienciák A lymphoproliferatív eredetű immundeficienciák közé tartoznak az ellenanyag-termelő sejtekkel kapcsolatos rendellenességek, valamint a krónikus immunstimulációk következményei A plazmasejtek proliferációs zavarai A B-lymphocytáknak vagy praecursor sejtjeinek malignus transzformációja és proliferációja sorolható ide. A B- sejtproliferáció növekvő immunglobulin-termelést vált ki, ami hypergammaglobulinaemiához vezet. A pathológiai folyamatokkal kísért kórképet gammopathiának is nevezik, megjelölve az Ig-molekula izotípusát is (pl. IgM-gammopathia). Monoclonalis gammopathiák. Eredetük és kialakulásuk feltételei változóak. Myeloma (plasmocytoma): plazmasejtes daganatok, amelyek a praecursor B-lymphocyták malignus transzformációja alapján alakulnak ki. Előfordulnak emberben, kutyában, macskában, lóban, szarvasmarhában, sertésben, nyúlban és egérben, részben mint szoliter, részben mint multiplex tumorok. Általában a csontvelőben vagy disszemináltan a lymphoid és más szövetekben alakulnak ki. Az ilyen plazmasejtek ugyanazt az Ig-molekulát szekretálják. Ez az M-(myeloma) protein leggyakrabban IgA, IgG vagy IgM osztályú. A klónszaporodás mechanizmusát indító szignál nem ismert, de úgy tűnik, nem antigén 403
424 Immunológia eredetű. A legtöbb myelomasejt csak L-láncfragmenseket termel, ez alacsony molekulatömege ( D) miatt átmegy a glomerulusokon, így proteinuriát okoz (Bence Jones-protein). A gammopathia klinikai megjelenési formája többféle lehet, függően a myeloma által kiváltott szerv- vagy szövetkárosodásoktól: a myelomasejtek osteolyticus aktivitása okozhat gócos csontvelő-károsodást, ami a csontok gyengüléséhez vagy töréséhez vezethet, a myeloma expanzív proliferatiója a csontvelőben gátolhatja pl. az erythroid praecursorsejtek szaporodását, ami anaemiát okoz, a növekvő szérum-ig-koncentrációval összefüggésben növekszik a vér viszkozitása, különösen a polimer IgMés IgA-molekulákat szekretáló myelomák esetében, ennek pathologiás szintje a hyperviscositási syndroma, ami vérzéses hajlamban nyilvánul meg az endothelsejtek károsodása, továbbá a véralvadási faktoroknak az M- proteinhez való kötődése miatt, egyúttal csökken a vesefunkció is, a glomerulusok csökkenő szűrő kapacitása, miatt. A myeloma ischaemiás necrosist is okozhat a bőrben és a végtagokon. Ez különösen IgM-myelomákban gyakori és nem malignus IgM-macroglobulinemiában, amikor az IgM cryoglobulinként (hideg agglutininként) viselkedik, vagyis alacsony hőmérsékleten kicsapódik. A bőr vérereiben való kicsapódás a bőr ischaemiás necrosisát okozza. A myeloma által kiváltott immundeficiencia a baktériumok iránti fokozott érzékenységben is megnyilvánulhat. A myeloma diagnosztikájának alapja az M-protein kimutatása elektroforézissel, valamint a daganatsejt jelenlétének megállapítása a biopsziás mintában. Macroglobulinaemia: a monoclonalis gammopathiák másik formája a macroglobulinaemia, amikor az IgM-t termelő plazmasejtek kórosan proliferálódnak, de nem válnak malignussá. A kórkép emberben és idősebb kutyában 5 8%-ban előfordulhat klinikai tünetek nélkül is. Policlonalis gammopathiák. Számos betegség során alakulhat ki hypergammaglobulinaemia, amely policlonalis eredetű. Leggyakrabban antigének, különösen fertőző ágensekből eredő antigének perzisztálása esetén jön létre, amikor az immunrendszer tartósan és huzamos időn keresztül antigénstimulációnak van kitéve. Az ilyen kórkép gyakori kísérője lehet egyes parazitás bántalmaknak, különösen pedig vírusok okozta betegségeknek, pl. lovak fertőző kevésvérűségének, macskák fertőző peritonitisének vagy a nyércek Aleutibetegségének. Autoimmun betegségekhez is csatlakozhatnak policlonalis gammopathiák, pl. a szisztémás lupus erithematosushoz, amit a szuppresszor sejtek hiányos működésével magyaráznak. Amyloidosis: a policlonalis gammopathiák egyik különleges formája, amelyben az amyloid (szálagos szerkezetű proteinanyag) extracellulárisan lerakódik. Képződése tulajdonképpen az immunrendszer fokozott aktivitására vezethető vissza. Két klasszikus formája ismeretes: Primer AL (Amyloid-L) típusú amyloidosis: a myeloma és más lymphoid daganatok az Ig-molekula könnyű láncát termelik. A proteolyticus enzimek a szérumban és a szövetnedvekben ezeket részlegesen bontják, illetve degradálják, és ilyen módon nyerik el különleges stabilitásukat. A módosult szerkezetű molekulákat amyloid L -nek nevezik. Másodlagos, AA, (Amyloid-Alfa) típusú amyloidosis: amyloid termelődik olyan betegségekben is, amelyek során az immunrendszer huzamos ideig antigéninger hatása alatt marad (pl. policlonalis gammopathiák, granulomák képződésével és idült pyogen folyamatokkal járó betegségek) vagy ismételten immunizált állatokban (pl. hiperimmunizált szérumlovakban). A praecursor anyag az alfa-globulin (szérum amyloid alfa-protein: SAA). Ezt a fehérjét a hepatocyták termelik a macrophagok által szekretált IL 1 hatására. Ennek részleges lebontása rendkívül stabil proteint hoz létre, és ez hasonló az amyloid L-hez, csupán az eredetük különböző. Az amyloid számos szövet extracelluláris réseiben rakódhat le. Különösen az alaphártyákra, a reticularis rostokra, továbbá a kapillárisok külső falában, az arteriák mediájában, valamint a vénák intimájában figyelhetők meg. A lerakódás elsősorban a májban, a lépben, a vesében és a mellékvesékben szokott bekövetkezni. Az 404
425 Immunológia amyloidszálak rendkívüli stabilitásuk miatt viszonylag nehezen oldódnak, ezért a lerakódás gyakorlatilag irreverzíbilis. Az amyloid depozitálódásának szövetkárosodás, nyomási atrophia, majd funkciókiesés lesz a következménye. Klinikai szempontból a vesében lerakódó amyloid a legjelentősebb, mivel ez veseelégtelenséget okoz. Az amyloid lerakódása miatt ugyanis megváltozik a glomerulus működése, kiszűrődnek a nagy molekulájú anyagok is, mint az albumin, aminek proteinuria, továbbá vérérthrombosis lehet a következménye (nephrosis syndroma) Autoimmunitás Az autoimmunitás a szervezet saját anyagaival szemben kialakuló immunreakciókat fejezi ki. Korábban úgy vélték, hogy az egészséges szervezetben a saját struktúrákkal szembeni immunreakciók az autotolerancia miatt nem alakulhathatnak ki. Az autoimmunitás oktani összefüggéseinek megfejtése igen nagy kihívást jelentett az immunológiának, és ennek napjainkig csak részben volt képes eleget tenni, ami annyit jelent, hogy az autoimmunitás kialakulásának feltételei még nem teljesen ismertek. Autoimmun reakciókból eredő szövetkárosodásokat már a századfordulót követően megfigyeltek, de az autoimmun betegségek elnevezés csak mintegy két évtizede vált általánosan elfogadottá. A helyes felfogás kialakulását a BURNET-féle klónszelekciós teória bizonyos mértékig gátolta, ami szerint olyan ellenanyagok, illetve olyan lymphocytaklónok, amelyek a saját anyagokkal reagálhatnának, nem fordulhatnak elő a szervezetben. Ma már ismeretes, hogy az ún. tiltott klónok az egész élet során jelen vannak, és ha valamilyen ok folytán aktiválódnak, úgy autoimmun folyamatokat váltanak ki. Ma azonban már ismeretes, hogy az autoimmun reakciók egy része fiziológiásfolyamat, legnagyobb részük azonban pathologiás reakció, és károsítja a szervezetet Fiziológiás autoimmunitás Az autoimmun reakciók egy része nélkülözhetetlen a szervezet zavartalan működésében, akár a kórokozókkal szembeni védekezésben, akár a szervezet integritásának fenntartása szempontjából. Ezek a reakciók lényegében a következők. Az MHC-antigének felismerése, ami az immunrendszer ún. cenzor funkciója szempontjából lényeges. Ilyen módon képes az immunrendszer a homeostasis fentartására. Az MHC-korlátozás törvényszerűségei szerint a CD4 (T-helper) sejtek az MHC II.-t, a CD8 (T-killer) sejtek pedig az MHC I. antigéneket ismerik fel. Az immunglobulin-molekulák idiotípiás variánsainak felismerése, ami anti-idiotípiás antitestképződéséhez vezet, és ez egyik fontos szabályozómechanizmus az immunregulációban, valamint az immunglobulin-képződés kinetikájában. Az elöregedő sejtek eliminálása, ami annyit jelent, hogy pl. amikor a vörösvérsejtek elérkeznek az élettartamuk végéhez, a membránjukon kifejeződik egy olyan új antigén, ami ellenanyag-termelést vált ki. A képződő antitestek ezekhez kötődve a sejteket megjelölik, aminek alapján a lépben lévő macrophagok ezeket megkötik és eliminálják. Hasonló antigén fejeződik ki a vérlemezkék, a lymphocyták, valamint a máj és a vese sejtjeinek felületén is. A fentiek alapján a szervezetre káros autoimmun folyamatok megítélésében nagy körültekintéssel kell eljárni, figyelembe véve a Witebsky-féle posztulátumokat: az antitestek minden esetben megtalálhatók a vérpályában, a betegség kísérleti úton reprodukálható, a betegségben immunpathologiás elváltozásoknak kell megjelenni, átvihető kell, legyen a betegről normál egyedre Pathologiás autoimmunitás 405
426 Immunológia Az autoimmun kórképek kialakulásában más és más mechanizmusok jutnak érvényre. Ez abból ered, hogy az adott szervspecifikus antigénekkel szemben a toleranciát szigorúan meghatározott immunregulációs folyamatok biztosítják, amelyben a tiltott klónok működését a T-szuppresszor sejtek blokkolják. Ha azonban ezek reagulációs hatása csökken vagy zavart szenved, akkor autoimmun folyamatok alakulnak ki. Ezt bizonyítja, hogy olyan T-sejteket is sikerült elkülöníteni, amelyek cytokinjeikkel a szuppresszor sejtek működését gátolják. Ilyen T-sejtpopulációval az autoimmun folyamat transzferálható másik egyedbe is. A szöveteket, szerveket, valamint a különböző sejteket károsító autoimmun folyamatok eredete többféle lehet: autoantigének felismerése (hereszövet, agyvelőszövet, thyreoglobulin), saját anyagok hibás felismerése, tiltott klónok reaktiválódása. Az autoimmun betegségek következményei klinikailag funkcionális zavarokban, gyulladásos folyamatokban, pathologiailag szövetkárosodásokban mutatkoznak meg, súlyosabb esetekben pedig a szervezet pusztulását okozzák Az autoimmunitás kialakulása Az autoimmun betegségek legnagyobb részében ismeretlenek azok a mechanizmusok, amelyek az autotoleranciát csökkentik vagy megszüntetik. Ismeretes azonban, hogy a genetikai és a környezeti tényező meghatározó az autoimmunitással szembeni érzékenységben, valamint számos esetben megfigyelhető az autoimmun folyamatok spontánkialakulása vagy ismétlődése. Az autoimmun megbetegedés kiterjedhet akár egy vagy több szervre is, és a következőkben vázolt immunológiai alapokon jöhet létre: komplement mediálta sejtoldódás, amely folyamatban az autoantitestek a megváltozott szöveti antigénekkel reagálnak, és a komplementrendszer aktiválását követően oldódik a targetsejt. A hemolízis bekövetkezhet pl. a véráramban is, és ilyenkor autoimmun hemolitikus anaemia alakul ki, immunkomplexek képződése és lerakódása komplementaktiválódást eredményez, ami lokális gyulladást és szövetkárosodást vált ki (autoimmun glomerulonephritis). T-sejt mediálta lisis: alapvetően a cytotoxicus T-sejtek, illetve lymphokinjeik szabályozzák a sejt oldódását. Immunválasz az autoantigénekkel szemben. Az autoantigének (pl. idegsejtek, cornea és a hereszövet sejtjei) az intrauterinális élettől kezdődően az immunrendszertől szigorúan elzártan fejlődnek. A postnatalis életben bármelyik nevezett szerv pl. sérülése során kapcsolatba kerül az immunrendszerrel, ami immunreakciókat vált ki. Felismerték azt is, hogy pl. a szívizomzat infarktusa után olyan antitestek képződnek, amelyek a mitokondriumokat destruálják. Olyan antigének továbbá, mint a myelin proteinje, valamint a thyreoglobulin, amelyek a magzati fejlődés során nem, hanem csak később termelődnek, így velük szemben a tolerancia kialakulásának feltételei már hiányoznak, vagy alig érvényesülnek. Ebből az alacsony szintű toleranciából ered, hogy amikor idegen myelinexpozíciónak van kitéve a szervezet (pl. agyvelő alapanyagú veszettség elleni vakcinás oltás) vagy trauma, esetleg gyulladás következtében endogén myelin szabadul fel, a folyamat antitesttermelést, majd celluláris reakciók kialakulását indukálja, aminek következtében encephalitis fejlődhet ki. Immunválasz a megváltozott saját antigénekkel szemben. Az exogén faktorok között meglehetősen gyakran szerepelnek vírusok, amelyek módosulásokat eredményezhetnek a saját struktúrákban vagy pl. egyes vírusok epitopjai rokonságot mutathatnak szöveti antigénekkel, vagy pedig saját antigénrészletek is beépülhetnek a vírusba. Az immunrendszer hibás felismeréséből eredő autoimmunitás elsősorban lymphoproliferativ folyamatokat kiváltó, perzisztáló vírusfertőzések (leukosis, maedi-visna, lovak fertőző kevésvérsűsége, nyércek Aleutibetegsége stb.) során alakulhatnak ki. Huzamos gyógyszeres kezelések után a gyógyszer metabolitja kötődik a saját anyaghoz, és ez mint új fajlagosságú antigén immunválaszt indukál. A rheumathoid arthritisek egy része ilyen alapon fejlődik ki, amikor 406
427 Immunológia elsősorban az IgG-molekula Fc részén változás következik be, így anti-igg termelődik, amelyek paratopjai képezik az ún. rheumatoid faktorokat. Az endogén antigén helytelen kifejeződése. A normál epithelsejtek MHC I fehérjét hordoznak a felületükön, de az MHC II-es fehérje nem található meg rajtuk. A diabetesnek abban a formájában, amelyben az autoimmun válasz károsítja a pancreasszigetek sejtjeit, azt találták, hogy ezeken a sejteken mind az MHC I, mind az MHC II kifejeződik, és ez lehetővé teszi a sejtfelülettel szembeni immunreakciókat. Keresztreakció mikroorganizmusokkal. Ennek gyakorlati példája, hogy az ember Epstein Barr-vírussal történő fertőződését antimyelin képződés követi, és ez sclerosis multiplexhez vezethet. Másik példája a poliovirus VP2 fragmense, amely anti-acetilkolin termelődését indukálva myasthenia gravis kialakulásához vezet. Vírusok okozta fertőzések. Számos vírus károsítja a lymphoid szöveteket (44. táblázat), vagy pl.a retrovirusok antinukleáris antitestek képződését indukálhatják, a paramyxovirusok antitestek képződését válthatják ki a különböző szervekben, reovirusok antitesteket indukálhatnak a pancreas sejtjeivel szemben. 44. táblázat - A lymphoid szöveteket károsító vírusok Sejtek és szövetek destrukcióját okozó vírusok Macskák panleukopenia vírusa Macska immundeficiencia vírusa Szopornyica Fertőző bursitis vírusa Baromfipestis vírusa Afrikai sertéspestis vírusa BVD EHV 1 HIV Majom immundeficiencia vírusa A lymophoid sejteket és szöveteket stimuláló vírusok Maedi-visna vírusa Aleuti betegség vírusa Roncsoló orrhurut vírusa Neoplasiakat okozó vírusok Marek-betegség vírusa Macskaleukémia vírusa 407
428 Immunológia Bovinleukémia vírusa Egérleukémia vírusa Az autoimmun betegségek szervspecifikus és poliszisztémás betegségekre oszthatók. A fontosabb autoimmun kórképekről a 45. táblázat nyújt áttekintést. 45. táblázat - Autoimmun kórképek SZERVSPECIFIKUS AUTOIMMUN BETEGSÉGEK Légzőszervek Bőr Pemphigus Urogenitális szervek Endokrin rendszer Hypothyreoidismus Hyperthyreoidismus Adrenalitis Idegrendszer Ló polineuritise Szem Lovak havivaksága Vogt Koyangi Harada-szindróma Izmok Miastaenia gravis Polimyositis Hemolitikus anaemiák Autoimmun thrombocytopenia SZISZTÉMÁS AUTOIMMUN BETEGSÉGEK Lupus erithematosus Rheumatoid arthritis 408
429 Immunológia Szervspecifikus autoimmun betegségek A tüdő autoimmun betegségei Az alveoláris macrophag rendszer szerepe már régóta ismert, de továbbra is vitatott, hogy a légzőszervrendszer önálló védelmi rendszer-e avagy a szisztemás immunrendszer tartozéka. Kutyákban és borjakban a bronchoalveoláris lymphoid sejtek legtöbbje B-lymphocyta és macrophag, kisebb hányada T-sejt, míg más állatoknál ez az arány fordított. A légzőkészülék többféle védőmechanizmust foglal magában: Fizikai védőmechanizmusok: az első védelmi vonalat képviselik. Ezek biztosítják a l0 µm-nél nagyobb részecskék kiszűrését, amit elősegít a levegő turbulens áramlása, továbbá pl. a köhögés reflexe. Ennek fontos kiegészítője a mucociliáris rendszer működése, amely egyrészt a submucosában lévő mirigyek és kehelysejtek által termelt elektrolitokat, lipideket, szénhidrátokat, enzimeket tartalmazó nyákból, valamint az alatta helyeződő csillókból áll. A ciliumok mozgási frekvenciája /perc, a nyák mozgása pedig 0,5 1 mm/perc a kislégutakban, 5 20 mm/perc a nagyhörgőkben és a tracheában. A ciliaris mozgásra toxikus emberben pl. a dohányzás, állatokban és emberben pedig a levegő kén-dioxid-, és a nitrogén-dioxid-határérték feletti tartalma, Sejt közvetítette védőmechanizmusok: ez a rendszer az alveoláris macrophagok és a neutrofil granulocyták működésén alapszik. Amikor ez a védőmechanizmus nem elégséges, akkor a lymphocyták reakciói lépnek előtérbe. Sarcoidosis. A sarcoidosis pathogenesise pontosan nem ismert, de a lényeg az aktivált sejtszám növekedése és az óriássejtes granulomaképződés. Mindez a lymphokintermelődés fokozódásához, valamint a monocyták macrophagokká, majd epitheloidsejtekké való alakulásához vezet, ami sarcoid granulomaképződést okoz. A kórképben mind a humorális, mind a celluláris immunreakciók eltérései megfigyelhetők: A humorális immunreakciók eltérései: a szérum-ig szintje emelkedik a policlonalis aktiválódás következményeként, fokozott humorális válasz alakulhat ki bizonyos antigénekkel szemben (pl. Mycoplasma pneumoniae), csökken a vérpályában lévő B-lymphocyták száma, növekszik a keringő immunkomplexek mennyisége. A celluláris immunreakciók eltérései: a IV. típusú reakciókban (lásd az Allergia c. fejezetben) teljes vagy részleges allergia, a vérsavó gátolhatja a lymphocyták mitogénekkel szembeni reakcióit, a lymphocyták csökkent válaszképességet mutatnak mind az antigénekkel szemben, mind a kevert lymphocytakultúrákban, T-lymphocytákkal szembeni antitestek jelennek meg a vérpályában, és csökken a T-sejtek száma Az emésztőcső autoimmun betegségei Az emésztőcsőben autoimmun folyamatok alapján kialakulhatnak krónikus vagy visszatérő gyulladásos betegségek (pl. szájüregben fekélyek, krónikus atrophiás gastritis, colitis ulcerosa), ezek oktani összefüggéseiről, továbbá kialakulásuk feltételeiről csak kevés adattal rendelkezünk A vese autoimmun betegségei A vesében lévő ellenanyagképző sejtek jelenléte arra utal, hogy ennek a szervnek is lehet lokális védelme, bár számos adat szól amellett, hogy pl. a pyelonephritisben az ellenanyagok a szérumból származnak. 409
430 Immunológia Az autoimmun nephritisnek immunpathologiailag két típusa ismeretes: az immunkomplex típusú, amely az antigén antitest komplex mellett tartalmaz még komplementfaktorokat is, és a komplex a glomerulusok alaphártyájára elszórtan rögös-szemecskés formában rakódik le, ahol a podocyták Fc, receptora megköti a keringő immunkomplexet, a glomerulus alaphártya antigénjeivel szemben képződő autoimmun ellenanyagok esetében az immunkomplexek lerakódása sima lemezes formában figyelhető meg; a glomerulusalaphártya-antigénekkel szemben termelődő antitestek egyébként reakcióba léphetnek a tüdőalveolusokban található alaphártyákkal, valamint a szervek endothelsejtjeivel is. Az immunkomplex-lerakódás lymphoid sejtes proliferációs folyamatokat vált ki (lásd. az Immunpathologia c. fejezetben) A nemi szervek autoimmun betegségei Akár a hüvelyben, akár az endometriumban lokális immunválasz alakulhat ki nemcsak mikroorganizmusokkal, hanem a spermasejtekkel szemben is. Szarvasmarhákban ritkán fordul elő, viszont nyércekben az ebből eredő terméketlenség akár 20%-ot is elérhet. Ilyen esetekben a termelődő ellenanyagok a cervicalis nyálkából kimutathatók, viszont a szérumban nem jelennek meg. Az ivari érés során a herékben újabb antigének jelennek meg, amelyekkel szemben az immunrendszer nem toleráns. A kialakuló autoimmun folyamat orchitisben nyilvánul meg. A spermával szemben képződő ellenanyagok mutathatók ki egyes állatfajok vérsavójában a herék sérülésekor vagy a kanyarulatos herecsatornácskák elzáródása esetén. Erre példa lehet a kutya Brucella canisfertőzése, amikor krónikus epididimytis alakul ki, és a macrophagok által prezentált spermaantigénekkel szemben a lymphoid rendszer sensibilizálódik. Az antigének ellen termelődő ellenanyagok IgG vagy IgA osztálybeliek, és ezek agglutinálják vagy mozgásképtelenné teszik a spermiumokat, ami terméketlenséghez vezet A szem autoimmun betegségei A szemben önálló autoimmun betegségként az emberben és a kutyákban is megfigyelt uveitis fordul elő. Ennek immunológiai alapja azzal magyarázható, hogy a szemlencseantigének és az uveaantigének között immunológiai keresztreakciók jöhetnek létre. Az autoimmun folyamat olyan módon fejlődik ki, hogy a szemlencse (sérülésből eredően) érintkezésbe kerülhet az immunrendszerrel, és autoantigénként immunreakciókat vált ki. E reakciók effektor fázisa az uveaantigénekre irányul, ami gyulladásos reakciót és helyi anaphylaxiát okozhat. Endogen uveitis gyakran csatlakozik más immunpathológiai kórképekhez (pl. szisztémás lupus erythematosushoz, sarcoidosishoz, rheumatoid arthritishez). Az endogén uveitist mai ismereteink szerint nemcsak valamilyen specifikus immunreakció válthatja ki, hanem immunkomplexek lerakódásából is eredhet. A ló recurrens uveitise (havivakság) kialakulásában leptospirák és borreliák szerepét tételezik fel. Elváltozások az irisben, továbbá az üvegtestben alakulnak ki lymphocytás és neutrophil granulocytás beszűrődéssel, amit később fibrinkiválás követ. A gyulladásos folyamat időszakosan ismétlődik és mind súlyosabbá válik, ami végül vaksághoz vezethet. Vogt Koyanagi Horada-szindróma: emberben és kutyában előforduló uveitisben és a bőr pigmenthiányában mutatkozik. A kórképhez emberben neurológiai tünetek is társulnak, feltehetően a melanocytákkal szemben termelődő ellenanyagok és a T-killer sejtek reakciói miatt Az idegrendszer autoimmun betegségei A neuroimmunológia viszonylag rövid, mintegy három évtizedes múltra tekint vissza, így érthető, hogy akár védelmi rendszerével, akár a benne kialakuló autoimmun folyamatokkal kapcsolatos ismereteink még hiányosak. Mivel az agyvelő antigénjei fiziológiásan sem az embrionális élet során, sem később nem kerülnek kapcsolatba az immunrendszerrel, az agyvelő szövetével kísérleti körülmények között könnyen kiváltható autoimmun encephalomyelitis (EAE experimental autoimmune encephalomyelitis). 410
431 Immunológia A gyakorlatban ehhez hasonló kórkép alakul ki, amikor a veszettség elleni, agyvelő alapanyagú vakcinát ismételten alkalmaznak. Szövettanilag ilyenkor gócos vasculitis, mononuclearis sejtes beszűrődés figyelhető meg, amit demyelinizációs folyamat kísér. Az egyed vérsavójában az agyvelőantigénekkel szemben antitestek mutathatók ki, de a kórfolyamat kialakulásában az immunrendszer celluláris reakciói játsszák a döntő szerepet. Valószínű, hogy a kutyák szopornyicájában megfigyelhető leukoencephalomyelitis, amit az idegsejtek demyelinizációja kísér, szintén autoimmun folyamatok következménye. A lópolineuritise a gerincvelő caudalis részének betegségéből eredő kórkép. Az autoimmun folyamat a sacrococcidiális idegeket károsítja, amelyekben az ideggyökök extradurális részein lymphocytás beszűrődés és demyelinizáció alakul ki. A kórkép hyperaesthesiával, majd hypoaesthesiával jár, ezután a farok, valamint a végbélnyílás bénulását a húgyhólyag bénulása követi. Több fertőző betegséget kísérhet autoimmun alapon kifejlődő idegrendszeri kórkép annak következtében, hogy autoantitestek kötődnek a myelinfehérjékkel, és ezek demyelinizációt okoznak. Ide tartoznak: sclerosis multiplex, myasthenia gravis. A sclerosis multiplex pathologiai szempontból az agyvelő szegmentális gyulladása, amelyben perivascularis infiltráció és a fehérállományt érintő velőtlenedés (leukoencephalitis) figyelhető meg. Patomechanizmusa összetett: a genetikai hajlam mellett fertőző ágensek, környezeti tényezők (földrajzi adottságok, klimatikus tényezők) és főként immunpathologiai reakciók vezetnek kialakulásához. Ugyanilyen alapokon a perifériás idegek is károsodhatnak: pl. a kutya polyradiculoneurosisa. A myasthenia gravis kórképet (lásd Az izmok autoimmun betegségei c. fejezetben) Az endokrin rendszer autoimmun betegségei Az emberben és a legtöbb állatfajban az autoimmunitás az endokrin megbetegedések vagy zavarok egész sorát képes előidézni. Az emberben pl. az autoimmunitás alapján egyrészt kialakulhat hyperthyreoidismus (V. típusú hypersensitivitás) vagy hypothyreoidismus, amit a II. és IV. típusú túlérzékenységi reakciók okoznak (lásd az Allergia c. fejezetben). A hypothyreoidismus gyakori kutyákban, csirkékben és az emberben. A kórkép lényege abban fejeződik ki, hogy antitestek jelennek meg a thyreoglobulinokkal szemben, a mirigy infiltrálódik plazmasejtekkel és lymphocytákkal, amelyek germinatív centrumra emlékeztető formában rendeződhetnek. A sejtes beszűrődés egy ADCC- (lásd később) reakción keresztül károsítja az epithelsejteket, amely folyamat következménye a mirigy hypofunkciója. Az esetek nagy részében nemcsak egy, hanem akár több thyreoid- antigénnel szemben is képződhetnek ellenanyagok. Kutyákban a kórkép akkor manifesztálódik klinikailag, amikor a pajzsmirigynek legalább 75%-a károsodott. Klinikailag a hypothyreoidismust szimmetrikus allopecia, a bőrben myxoedema és a hámréteg atrophiája kíséri. Az autoimmun thyreoiditis retriever, spaniel és beagle kutyákban genetikai alapon öröklődhet. Az állatok elhíznak, inaktívvá és terméketlenné válnak, továbbá gyakran ismétlődő hasmenés kíséri a kórfolyamatot. Csirkékben, főként egyes vonalakban (Leghorn), szintén genetikai alapon fejlődik ki, és a kórképben a B-sejtek fokozott reaktivitását észlelték a thyreoid- antigénnel szemben. A mirigy plazmasejtekkel infiltrálódik, és a képződő ellenanyagok elsősorban a thyreoglobulinnal reagálnak, de olyanok is képződnek, amelyek a pancreas és a mellékvese antigénjeivel is képesek reagálni. Hyperthyreoidismus: főként idősebb macskákban ismert kórkép. A képződő ellenanyagok a thyreoid peroxidázzal szemben termelődnek, de antinuclearis ellanyagok is képződnek. A kórkép hyperplasia adenomatosában nyilvánul meg. Az ember hasonló kórképétől abban különbözik, hogy exophtalmus nem alakul ki. Mellékvesekéreg-elégtelenség (Addison-kór): kutyában is előforduló kórkép, amit a mirigy cortexének pusztulása és lymphoid sejtes infiltrációja jellemez. 411
432 Immunológia Az izmok autoimmun betegségei A myasthenia gravis emberben, kutyában, macskában előforduló kórkép. A pathogenesis lényege abban összegezhető, hogy autoantitestek, amelyek specifikusak az acetilkolin receptorra, ezzel kötődve gátolják a neuromuscularis összeköttetéseken az ingerületátvitelt, mégpedig olyan módon, hogy a motoros véglemezkéken az acetilkolin receptorokat blokkolják. A betegség gyakran thymushypoplasiához vagy a thymus daganatos megbetegedéséhez társul, ezért feltehető, hogy a pathogenesisben valamilyen T-sejtkárosodás vagy a T-szuppresszor sejtek csökkent működése játszik szerepet. Kevésbé ismertek a vázizomzat immunmediálta betegségei (polymyositisek), amelyek humorális és celluláris immunreakciók alapján jönnek létre. Ezeket generalizált vagy szelektív szimmetrikus gyulladás és fibrosis jellemzi Autoimmun dermatitis Kutyában, macskában, lóban, valamint emberben előforduló kórkép. Az autoimmunitást olyan antitestek képződése jellemzi, amelyek a bőr kötőszöveti ún. endogén antigénjével (pemphigus antigénnel), illetve az epidermis alapmembránjával reagálni képesek. A folyamat hólyagképződéssel, kimaródással, fekélyképződéssel járó bőrbetegségeket idézhet elő. A pemphigus antigén 200 kda molekulatömegű glükoprotein. Ilyen antigént hordoznak az emlősök és a madarak szövetei is, halakban, hüllőkben és kétéltűekben azonban eddig nem sikerült kimutatni. Jellemző, hogy a nem gyulladásos bőrben hólyagok, ebből eróziók és pörkök keletkeznek. Szövettanilag az intracelluláris rések kiszélesednek, és oedema alakul ki. Ilyenkor a plazmamembrán és a desmosomák még épek. A hólyagok intraepidermálisan találhatók, amelyet csak igen enyhe gyulladásos beszűrődés kísér. A vérsavóban specifikus, ún. pemphigus antitest mutatható ki, aminek jelenléte más betegségeknél nem figyelhető meg. Ennek titerértéke nemcsak a betegség kiterjedtségétől, hanem a kezdetének időpontjától is függ. Ez az ellenanyag reagálni képes nemcsak a bőr, hanem a cornea, valamint a száj, a gége, a genitáliák, a húgyhólyag és a nyelőcső nyálkahártya intercelluláris anyagával is, de a corneában a kórkép nem fejlődik ki. Pemphigus komplex. Krónikus lefolyású betegség, és a fenti tüneteken kívül acantholysis és immunkomplexek lerakódása jellemzi. A pemphigus csoportban a stratum spinosum sejtrétegei közé savó lép ki, aminek következtében intracellulárisan hólyagocskák képződnek, ezek viszonylag gyorsan felrepednek és pörkösödnek. A kórképnek klinikailag több formáját szokás megkülönböztetni (194.ábra): pemphigus vulgaris, pemphigus vegetans, pemphigus foliaceus, pemphigus erythematosus, pemphigus bullosus ábra - A pemphigus formái (I. R. Tizard után) 412
433 Immunológia Pemphigus vulgaris: a legsúlyosabb autoimmun folyamat. Kutyákban fordul elő, és független az életkortól, de főként idősebb kutyák betegsége. Jellemzője a mucocutan zónákban (orr, száj, szem, anus, praeputium, nyelv, szájpadlás) kialakuló vesiculák. Ezek könnyen felrepednek, és az így kialakuló hámhiányokon keresztül másodlagos fertőzések jöhetnek létre. Szövettanilag a dermis és az epidermis szétválása következik be (acantholysis). Az autoimmun folyamat a kötőszöveti sejtek antigénjeivel szembeni antitestek képződésének következménye, ami a keratinocytákat plazminogen fehérje szekretálására készteti. Pemphigus vegetans: a pemphigus vulgaris egyik variánsa, amely hólyagok és göbök képződésében nyilvánul meg. A hámhiányok hegesedése folyamán papillomákra emlékeztető sejtproliferáció következik be. Pemphigus foliaceus (ember, kutya, macska, kecske, ló)esetében a bőrön az egész testfelületre kiterjedően, szabálytalan elrendeződésben, apró kiemelkedések mutatkoznak, majd később ezek helyén a hámréteg felületes leválásából eredő folytonossághiányokat lehet megfigyelni. Pemphigus erythematosusnál az orrháton, a szemek körül, a fülkagyló belső felületén, vagyis csak körülírt bőrfelületeken vaskos pörkösödés látszik. A pörkök spontán ellökődése vagy óvatos leválasztása után helyükön enyhén vérzékeny alapú eróziók maradnak vissza. Pemphigus bullosus: az epidermis alatti feszes hólyagok, papulák és kimaródások képződésével járó kórkép. A betegség antigénjét (200 kd molekulatömegű glükoprotein) a hámsejtek szintetizálják, és ennek fontos szerepet tulajdonítanak a hám és az irha közötti összeköttetés kialakításában. Az elváltozott területeken a bazális membránhoz kötődő antitestek mutathatók ki, a bőrben nagyszámú eosinophil sejtet tartalmazó infiltrátum található. Elektronmikroszkóposan a lamina lucida károsodása is megfigyelhető. Ide kötődnek ugyanis az ellenanyagok a komplementfaktorokkal együttesen, és ezt elválasztják a bazális sejtek plazmamembránjától. A kórképben a hólyag kialakulását tehát az ellenanyag és komplement kötődésének tulajdonítják. A lokális eosinophil sejtes infiltrációt a komplement kemotaktikus faktorai idézik elő, a derma nevezett rétegeinek szétválását pedig a felszabaduló anaphylatoxinok a hízósejtek degranulációja folytán váltják ki Hemolitikus anaemiák A hemolitikus kórképek kialakulásában különböző tényezők játszhatnak szerepet, amelyek között az immunmediálta folyamatok is tekintélyes részt képviselnek. 413
434 Immunológia Autoimmun hemolitikus anaemia (AIHA). A betegség olyan módon alakul ki, hogy a vörösvérsejtekkel szemben autoantitestek képződnek a szervezetben, amelynek hemolízis lesz a következménye. A kórkép előfordul kutyában, macskában, lóban és szarvasmarhában. Az immunológiai alapon kialakuló hemolitikus anaemia leggyakrabban gyógyszeres kezelések vagy kémiai anyagok, vírusok és baktérium antigének hatására jön létre. Ezek az ágensek ugyanis kötődve a vörösvérsejtek felületéhez megváltoztatják a membrán struktúráját, ilyen módon idegenné teszik azt az immunrendszer számára. A kórkép kialakulásában genetikai prediszpozíció is közrejátszhat. Az AIHA során kialakuló reakciók attól függően, hogy milyen az autoantitest osztálybeli hovatartozása, továbbá, hogy milyen fokú az aktivitása, a komplement rendszere, öt osztályba sorolhatók. A kutyákra vonatkozó adatokat a 46. táblázat mutatja be. 46. táblázat - A kutyák hemolitikus anaemiája Típus A VVS károsodása Antitest Kpl. aktiválás I. intravascularis aggl. IgG II. intravascularis hemolysis IgM + III. phagocytosis inmkomplet IgG + IV. intravascularis aggl. hideg IgM aggl. + V. intravascularis hemolysis hideg nem aggl. IgM + VVS: vörösvérsejt Kpl: komplement aggl.: agglutináció, agglutunáló A vörösvérsejtek károsodása a következő formákban jöhet létre: Intravascularis agglutináció: amikor az ellenanyagok a vörösvérsejtekkel rácsot képeznek, vagyis közöttük csupán áthidalást létesítenek. Ilyen módon aktiválják a phagocytáló sejteket, amelyek a komplexeket a lépbe, illetve a májba szállítják. A kórképnek ez a formája az I. osztályba sorolható, mivel komplementaktivitás nem jön létre a kórkép kialakulása folyamán, a vörösvérsejtek pusztulása extravascularisan jön létre, Intravascularis hemolízis: a II. típusú osztályba tartozó kórkép. A vörösvérsejtekhez kötődő antitestek aktiválják a komplementet, ami hemolízishez vezet. A kórképet haemoglobinaemia, anaemia és icterus kíséri, ami a szérum-bilirubin, valamint a methaemoglobin vérparamétereit megváltoztatja, Extravascularis hemolízis: agglutinációra nem képes, ún. inkomplett, komplementkötő IgG-antitestek idézik elő. A III. osztályba sorolható rendellenesség, ezek az antitestek ugyanis kötődnek a vörösvérsejtekhez, opszonizálják és előkészítik azokat a phagocytosishoz. Mindez maga után vonja a komplementrendszer aktiválódását is. A IV. osztályba sorolható kórképben IgM-antitestek képződnek a vörösvérsejtekkel szemben, de az agglutináció csak hideg környezetben (4 10 C ) jön létre (hideg agglutininek). Amikor pl. az állat végtagjai lehűlnek, a vér a capillarisokban agglutinálódik, ami ischiaemiához és necrosishoz vezethet. Hasonló a mechanizmusa az V. osztálybeli AIHA-nak is azzal a különbséggel, hogy ez esetben a hideg inkomplet agglutininek, rendszerint IgM-molekulák is jelen vannak. Fiatal vagy középkorú kutyákban a betegség részben heveny, részben elhúzódó formában jelentkezhet. Heveny esetben a kórkép 2 3 nap alatt zajlik le, amelynek legfőbb megnyilvánulási formája a vörösvérsejtszám és a hemoglobinérték csökkenése. Az elhúzódó formában a kórkép 2 3 hét alatt fejlődik ki, amelyben az előbbiek mellett a hemolízis egyéb kísérő tünetei (pl. icterus, haemoglobinaemia) is kialakulnak. 414
435 Immunológia A diagnosis a Coombs-féle próbával történhet. A próbában a kutya-vörösvérsejteket az ún. Coombs-reagenssel kell összehozni, amely anti-igg-t, -IgM-t és anti-c3-t tartalmaz. A próba azonban nem tesz különbséget az autoimmun és az immunmediálta anaemia között, ezért a próbát a differenciál diagnosztika szempontjából passzív formában is el kell végezni, vagyis a vizsgálandó vérsavót abszorbeálni kell kutya vörösvérsejtekhez (lásd az Immundiagnosztika c. fejezetben) Autoimmun thrombocytopenia Az autoimmun thrombocytopenia olyan autoantitestek képződésének hatására kialakuló kórkép, amelyben az antitestek a megakaryocytákat és a thrombocytákat károsítják. Viszonylag gyakori lóban, kutyában és szarvasmarhában. Kutyában haemorrhagiás formában is előfordulhat. Klinikailag petechiák jelentkezhetnek a nyálkahártyákban, a szemben és a bőrben. A betegséget haematuria és epistaxis kísérheti. A kórkép gyakran társul más autoimmun betegségekhez, mint pl. a szisztémás lupus erythematosushoz, az autoimmun hemolitikus anaemiához és a rheumathoid arthritishez. Más immunmechanizmusok, kapcsolódva a myeloma multiplexhez vagy lymphoproliferatív kórképekhez, szintén hozzájárulhatnak a thrombocytopenia kialakulásához. Ez utóbbi alapon kialakuló kórfolyamatokat másodlagos thrombocytopeniáknak is nevezik, mivel ezek nem állnak összefüggésben az autoantitestek jelenlétével. A pathogenesisben a vérlemezkék membránjában végbemenő antigénmódosulás a lényegi elem. Ezekkel szemben képződő antitestek olyan IgG-molekulák, amelyek nem kötik a komplementfaktorokat, hanem opszonizáló hatásukkal a vérlemezkéket alkalmassá teszik a phagocytálódásra. A diagnosis a thrombocytákkal szembeni antitestek kimutatásán alapszik. A vérlemezkékhez kötött autoantitestek kimutatása azonban sokszor bizonytalan, ezért újabban olyan tesztet használnak, amellyel a vérlemezkék károsodása indirekt úton kimutatható. Ez a próba a beteg kutyáknak több mint 70%-ában ad biztosan pozitív reakciót Szisztémás autoimmun betegségek A szisztémás autoimmun betegségekben az immunrendszer reakciója egyidejűleg több szervet érint, vagyis olyan sejt-, illetve szövetalkotórészek ellen irányulnak, amelyek a szervezeten belül több szövetféleségben is előfordulnak Szisztémás lupus erythematosus (SLE) Az SLE egyidejűleg több szervet érintő betegség, ami különféle autoantitestek termelődésével és különböző klinikai tünetekkel, valamint immunkomplex- képződéssel jár. Előfordul emberben, kutyában és macskában. Az SLE pathogenesise még nem ismert teljességében, de úgy tűnik, hogy kialakulásában a B-sejtes válasz kontrolljának csökkenése vagy hiánya, valamint genetikai tényezők, fertőző ágensek és környezeti tényezők is döntő szerepet játszanak. A kórképben egyrészt csökken a szuppresszor sejtek funkciója, másrészt megnövekszik a B-sejtek aktivitása. E folyamatoknak az lesz a következménye, hogy csökken a saját antigénekkel szembeni tolerancia, és nagy mennyiségben képződnek autoantitestek a saját nukleinsavakkal szemben. Ezek az ún. antinukleáris antitestek (ANA) reakcióba lépnek a nukleinsavakkal és a nukleoproteinekkel. Az ANA önmagában nem, de más antitestekkel közösen részt vesz immunkomplexek képzésében, aminek polyarthritis, glomerulo-nephritis és dermatitis lesz a következménye. Más tünetek, mint a hemolitikus anaemia, thrombocytopenia, polymyositis és myocarditis, a II. és IV. típusú hypersensitivitási reakciók alapján jönnek létre. A betegség diagnosztikájában az immunfluoreszcenciás eljárással az anti-dna ellenanyagok megbízhatóan kimutathatók. A betegség gyógykezelésében egyrészt olyan gyógyszerek használatosak, amelyek az autoantitestek képződését szuppresszálják, másrészt a gyulladásos folyamatokat gátolják (szteroidok) Rheumathoid arthritis 415
436 Immunológia A leggyakoribb autoimmun betegség, és különösen szobakutyákban gyakori. A beteg kutyában krónikus, progresszív, porceróziókkal járó arthritis fejlődik ki, rendszerint a végtagokon szimmetrikusan, ami ancylosishoz vezethet. A betegség pathogenesise még nem teljesen ismert, de lényegében a saját IgG elleni autoimmunitásról van szó. A betegség kórlefolyása során a synovialis membrán lymphocytákkal, plazmasejtekkel, valamint egyéb mononuclearis sejtekkel infiltrálódik. Ugyanitt, de a szervezetben másutt is jelentős mennyiségű IgG (rheumathoid faktor) képződik. Az IgG, valamint az anti-igg és komplementkötődésből immunkomplexek képződnek, amelyek a III. típusú sensitivitás szerint lokális gyulladást idéznek elő. Később ehhez társul még a IV. típusú hypersensitivitási reakció is, ami az ízületi porc kimaródását, továbbá a subchondralis csontszövet károsodását okozza. A betegség diagnózisa: a rheumathoid faktor kimutatása a vérsavóból agglutinációs próbával latexhez vagy juhvörösvérsejtekhez kötött kutya-igg-vel. Minthogy a rheumathoid faktor más krónikus fertőző betegségekben, lymphoproliferatív zavarokban, valamint más autoimmun betegségekben is jelen lehet, a szerológiai vizsgálat mellett további kiegészítő vizsgálatokat is el kell végezni. A rheumathoid arthritis oktana változatos képet mutat. A Mycoplasma hyorhinis sertésben okozhat idült, nem gennyes ízületgyulladást, amely szövettanilag hasonlít az ember reumás arthritiséhez. Hasonló a sertésben az Erysipelothrix rhusiopathiae által előidézett ízületgyulladás kórképe is. Az autoimmun folyamatok gátlása a T-sejtaktivitás csökkentésével érhető el. A cyclosporin pl. csökkenti a CD 4 + és CD 8 + sejtek proliferációját, viszont nem gátolja a T-szuppresszor sejtek működését Allergia Az allergia elnevezés Pirquet-től (1902) származik (allos = másképpen, ergon = hatni), és azt fejezi ki, hogy a szervezet másként reagál egy adott antigénre, ha azzal előzetesen már találkozott. A hangsúly tehát a másként reagáláson van, és Pirqueteredeti megfogalmazása szerint az megnyilvánulhat csökkent (hypo-) vagy fokozott (hypersensibilis) reakciókészségben. A fogalomzavar elkerülése érdekében Pirquet eredeti meghatározását változatlanul hagyva, gyakorlati szempontból az allergián általában a szervezet fokozott reakciókészségét, túlérzékenységét értjük, szemben az immunitással, amely az antigénnel szembeni védettséget jelenti. A kórokozókkal, illetve az idegen anyagokkal szembeni immunreakciók a szervezet számára általában nem járnak káros következményekkel, elsősorban akkor, ha az antigén ellenanyag kapcsolat a vérpályában vagy a szövetnedvekben zajlik le: euergiás forma ( eu = jól, ergon = hatni). A szervezet szempontjából azonban az antigén ellenanyag kapcsolat káros is lehet, mégpedig akkor, ha az antigén ellenanyag kötődés a sejtekben vagy azok felületén jön létre. A reakció ilyenkor dysergiás formában (dys = rossz) játszódik le, mert olyan anyagok képződéséhez vezet, amelyek a sejteket vagy szöveteket károsítják. Az ilyen reakciókat, amelyek tehát az antigén ellenanyag kötődés következményeként jönnek létre, túlérzékenységi (hypersensitivitási) reakciónak nevezzük. A túlérzékenységi reakciók szinonimájaként az allergiás megjelölést használjuk, mivel a hypersensibilitás végső fokon az allergia fogalomkörébe tartozik, és az allergiás szervezet fokozott reakciókészségét jelzi. RICHET és PORTIER (1902) megfigyelték, hogy ha kutyának toxinokat fecskendeztek be, az első oltások tünetmentesen zajlottak le, viszont a második bevitelt követően a kísérleti állatok perceken belül megfulladtak. A jelenséget akut anaphylaxiának nevezték. Arthus pedig megállapította, hogy nyulakban az ismételten beoltott idegen vérsavó az első oltás helyén gyulladásos reakciót, vérzéseket és elhalást okozott. Az allergiás reakciók fentiekben leírt két klasszikus példáját a későbbi kutatások további adatokkal egészítették ki, és ennek alapján az allergiás vagy hypersensibilitási reakciókat 4 típusba soroljuk. I. típus. Anaphylaxiás reakció. A szervezetbe ismételten bejutó antigének anergének a sejtek felületén lévő ellenanyagokkal kötődnek. A szervezet reakciója nagyon rövid időn belül jelentkezik, és ezért korai típusú reakciónak is nevezik. II. típus. Cytotoxikus reakció. Ebben a reakcióban az ellenanyagok sejtekhez kötött vagy szöveti antigénekkel reagálnak. A cytotoxikus hatáshoz az esetek egy részében komplement is szükséges. Ez a reakció is korai típusú. 416
437 Immunológia III. típus. Toxikus komplex reakció. Ha az antigén ellenanyag ekvivalencia az antigének javára tolódott el, akkor ún. toxikus komplexek jönnek létre, amelyek főként az erek falában lerakódva, gyulladásos reakciót idézhetnek elő. Ez is korai típusú reakció. IV. típus. Sejt közvetítette reakció (késői típusú sensibilizáció). Ebben a reakciótípusban nem ellenanyagok szerepelnek, hanem abban az antigénnel szemben sensibilis mononuclearis sejtek vesznek részt. A reakció rendszerint csak később, 1 3 nap múlva jelentkezik, amiért késői típusúnak nevezik. A túlérzékenységi reakció típusairól a 47. táblázat nyújt áttekintést. 47. táblázat - A túlérzékenységi reakciók Megnevezés Anapylaxiás reakció Cytotoxikus reakció Toxikus komplex reakció Sejt közvetítette reakció A reakció típusa korai korai korai késői Ellenanyag típusa IgE, reagin IgG, IgM, IgG, antigén túlsúlyban sensibilizált T- lymphocyták Antigén exogén sejtfelületi extracelluláris extracelluláris vagy sejtfelületi Reakcióidő 1 30 perc 4 8 óra óra vagy több Átvitel lehetősége vérsavóval vérsavóval vérsavóval lymphoid sejtekkel A táblázatban feltűntetett reakciótípusok mellett újabban megkülönböztetnek egy V. típusú reakciót is, ami az ember hyperthyreoidismusában játszik szerepet, mégpedig olyan alapon, hogy az ellenanyagok reakcióba lépnek a pajzsmirigy sejtjeivel I. típusú hypersensitivitás (anaphylaxia) Korai vagy azonnali típusú allergiás reakció, amelyet a hízósejtek (mastocyták), valamint a basophil granulocyták váltanak ki akkor, ha a felületükön lévő IgE- (egyes állatfajoknál IgG-)molekulák a trmelődésüket indukáló antigénekkel, reaginekkel vagy más anyagokkal (anti-ige-, anti-fc-molekulákkal) kötődnek (195. ábra), és a sejtfelületi Fc receptorok között kölcsönhatás alakul ki. A reakció következtében a nevezett sejtek degranulálódnak, ami vazoaktív aminok felszabadulását vonja maga után. Az allergiás reakciók egy része hasznos a szervezet számára, amikor az antigén vagy egyes paraziták eliminálását célozza, legtöbbször azonban a szövetek vagy adott szervek károsodását vonják maguk után ábra - Az anaphylaxiás reakció vázlata 417
438 Immunológia Az IgE-termelődést indukáló antigének természete ma még kevéssé ismert, de az tisztázódott, hogy pl. a virágpollenek proteinjei, rovarok méreganyagai vagy a paraziták antigénjei a Th2-szubpopulációt aktiválják. Az IgE képződését genetikai adottságok is befolyásolják, és annak túlzott mértékű termelődését atopiának nevezzük. Azt is feltételezik, hogy az IgE- és az MHC-termelődést reguláló gén hibája prediszponálja az egyedet az atopiára. A hízósejtek mindenütt előfordulnak a szervezet kötőszövetében. Korábban pluripotens haemopoeticus sejtek származékainak tartották, ma feltételezik, hogy T-lymphocyta eredetűek, és fejlődésüket thymus eredetű hormonok irányítják. Az IgE-molekulákat Fc-receptoraikkal kötik meg. A basophil sejtek passzív úton sensibilizálódnak IgE-vel, és az antigénre ugyanúgy reagálnak, mint a hízósejtek. A hízósejtekből, illetve a basophil granulocytákból kiszabaduló granulumok különböző anyagokat tesznek szabaddá. 418
439 Immunológia Hisztamin. Többféle hatást fejt ki a vérerekre és a simaizmokra. A kapillárisokat általában tágítja, de pl. a növényevőkben a tüdő kapillárisait szűkíti. Fokozza a kapillárisok permeabilitását, a bronchusok, az emésztőcső és a méh simaizmainak működését (görcsös összehúzódását). Fokozza az egyes exokrin mirigyek szekrécióját (könny, nyál, tüdőnyálka). A hisztamin kis mennyiségben kemotaktikus az eosinophil granulocytákra, amelyek hisztaminázban gazdagok, és semlegesíteni képesek a hisztamin hatását, Szerotonin. Preformáltan a vérlemezkék granulumaiban, egyes fajokban (egérben, patkányban, nyúlban, kérődzőkben) a hízósejtekben fordul elő, megtalálható továbbá a központi idegrendszer és a bélcsatorna egyes sejtjeiben is. A felszabaduló szerotonin érszűkítő hatást fejt ki, növeli a vérnyomást, különösen kérődzőkben, és fokozza a postcapillaris venulák permeabilitását. Az I. típusú reakció számos kórképet okozhat állatokban. Az allergén (vagyis az allergiás reakciót kiváltó antigén) lehet természetes vagy szintetikus anyag, gyógyszer vagy biológiai anyag. A kórkép alapjait képező sensibilizáció rendszerint hónapok, esetleg évek alatt megy végbe. Az I. típusú reakció klinikai megjelenési formája függ egyrészt a részt vevő hízósejtek számától és a szervek szerinti megoszlásától, másrészt az antigén mennyiségétől, továbbá a szervezetbe való bejutás módjától. Ennek megfelelően a reakció megnyilvánulhat lokális (pl. légutakra, emésztőcsőre, bőrre terjedő) formában, de jelentkezhet szisztémás (az egész szervezetet vagy több szervrendszert érintő) reakció alakjában is. Lokális anaphylaxia. Különböző allergének játszhatnak szerepet a kiváltásában: inhalációs allergének: pl. pollenfehérjék, gombaspórák, por, emberben asthma, szénanátha, ekcéma, urticaria formájában, kutyában és macskában nasolacrimális reakcióként bőséges váladékürülésében mutatkozhat, lovakban pedig az idült tüdőemphysema gyakran az alveoláris rendszer gombákkal (pl. Aspergillus) szembeni érzékenységéből ered, táplálék-, takarmányallergia: emberben a legkülönfélébb természetes anyagok (tej, málna, dió, tojás, hal stb.) elfogyasztása válthat ki reakciót, aminek létrejöttében konstitucionális adottságok is szerepet játszhatnak, kutyákban a bőrallergiák mintegy 30%-a táplálkozási eredetű, amelyhez társul az emésztőcső reakciójából eredő egyéb tünet (pl. hasmenés, hányás), sertésekben a halliszt szokott az emésztőcsőre kiterjedő allergiát kiváltani, parazitákkal szembeni allergia: a parazitákkal szembeni humorális immunválasz során sokszor IgE típusú ellenanyagok termelődnek, éppen ezért az effektor funkciókban különféle lokális, illetve szisztémás allergiás reakciók figyelhetők meg. Ezek megnyilvánulhatnak bélműködési zavarokban, bronchusgörcsökben, ekcémában, oedemákban, csalánkiütésben stb., vakcinákkal és gyógyszerekkel szembeni allergia: a reakciók különböző úton-módon alakulhatnak ki, szarvasmarhákban pl. a ragadós száj- és körömfájás elleni, ún. Frenkel-típusú vakcina IgE-termelődést is indukál, és a vakcina ismételt alkalmazásakor lokális allergiás folyamatok alakulhatnak ki. Egyes gyógyszerek akkor válthatnak ki allergiás folyamatokat, ha huzamos alkalmazásukat követően egyes bomlási termékeik a saját testfehérjékhez kötődnek, és mint kemospecifikus antigének a szervezet számára idegenné válnak, így a velük szemben termelődő Ig-ok a hízósejtekhez kötődnek (pl. penicillinallergia). A penicillinallergia azonban kialakulhat olyan módon is, hogy a penicilliumok spórái természetes úton sensibilizálják a szervezetet. Szisztémás anaphylaxia. Az egész szervezetre kiterjedő anaphylaxiás reakció. Drámai gyorsasággal lezajló kórkép, a bekövetkező shock legtöbbször az állat elhullását okozza. A hízósejtek eloszlása a szervezetben állatfajonként különböző, és ez a magyarázata annak, hogy bár a reakció pathomechanizmusa valamennyi állatfajban azonos, azonban a klinikai megnyilvánulási formák, valamint a kórbonctani leletek az egyes állatfajokban eltérőek, és az ún. shockszervektől függően változnak. Az anaphylaxiás tüneteket mutató állatok nyugtalanok, szőrzetük borzolt, és tűrhetetlen bőrviszketés jelzése mellett tüsszögnek, köhögnek, légzésük nehezített, végül görcsös állapotban elhullhatnak. Kérődzőkben a shockszerv a tüdő. Az anaphylaxiát a tüdő vérkeringésében a hypertensio, míg az egész szervezetben a hypotensió jellemzi. A tüdőben kialakuló hypertensió nehezített lélegzést és tüdőoedemát idéz elő. A simaizmok (húgyhólyag, bél) összehúzódásának következménye a gyakori vizelés és véres bélsárürítés. A hisztamin a kérődző állatokban alárendelt szerepet játszik a szerotonin, a kininek és a leukotriének hatásához viszonyítva. 419
440 Immunológia Lovakban a tüdő és a bél a shockszerv. Köhögés, nehezített lélegzés és oedemás, vérzéses bélgyulladás alakulhat ki. A reakcióban a hisztamin és a szerotonin hasonló intenzitással vesz részt. Sertésben a tüdőbeli hypertensió a jellemző, amely nehezített légzésben mutatkozik, majd az állat fulladásos tünetek között elpusztul. Kutyában a tüdő és a máj a shockszerv. Kezdetben hányás, hasmenés, gyakori vizeletürítés figyelhető meg, majd nehezített légzés után kómás állapotban az állat elhullik. Boncolásnál a máj megnagyobbodott, és a vérmennyiségnek jelentős részét magában foglalhatja. Macskában a tüdő a shockszerv, és nehezített légzés mellett hányás, a mozgás inkoordináltsága, majd a rövidesen bekövetkező vérkeringési zavar jellemzi a kórképet. Tyúkban a kép hasonló az emlősökben megfigyelhető klinikai képhez. Élénk nyálképződés mellett nehezített lélegzés, cyanosis, súlyos vérkeringési zavar, majd a gyorsan bekövetkező halál jellemzi. A reakció tengerimalacokon a leghevesebb, izgatottsággal, nehézlégzéssel, gyakori vizelet- és bélsárürítéssel kísért reakció. Boncolás során heveny tüdőtágulatot lehet megfigyelni. Az anaphylaxiás típusú reakciók pathomechanizmusában a simaizom sejtek görcsös állapota a meghatározó. Ez bizonyítható a Schultz Dale-féle reakcióval, amikor az érzékennyé tett állatokból kimetszett bélszakaszok vagy méhszarvak simaizomzata összehúzódik, ha a túlélést biztosító Ringer-oldathoz a sensibilizáláshoz használt antigének néhány cseppjét hozzáadjuk. Az anaphylaxiás reakció a túlérzékeny egyedek utódaiban is kiváltható néhány hetes korig (passzív anaphylaxia). Adott allergénnel szembeni sensibilitást, vagyis az anaphylaxiára készséget többféle reakcióval lehet meghatározni: Prausnitz Küstner-féle reakcióval határozták meg korábban egy adott szervezetben a reaginek jelenlétét. Úgy jártak el, hogy a vizsgálandó egyed savóját beoltották egy nem sensibilizált egyed bőrébe, és 2 nap múlva a kérdéses allergént ugyanoda adták. Ha a vizsgálandó szervezet az alkalmazott allergén iránt sensibilis volt, úgy lokális gyulladásos reakció alakult ki. Passzív kután anaphylaxiás reakció, amit úgy végzünk, hogy a vizsgálandó vérsavót pl. a tengerimalac hasfalának a bőrébe oltjuk, majd 2 óra elteltével iv. bevisszük a szervezetbe a kérdéses, megfestett allergént. A reakció pozitív, ha a bőrbeoltás helyén színes folt jelenik meg, mivel ez azt jelenti, hogy a bőr sejtjeihez kötődött reaginek reakcióba léptek az iv. bevitt, festett allergénnel Szérumbetegség A szérumbetegséget a kórkép pathomechanizmusa alapján az anaphylaxiás reakciók között tárgyaljuk annak ellenére, hogy egyes forrásmunkák, főként a betegség idült formájának kialakulása alapján, a III. típusú reakciók közé sorolják. Heveny szérumbetegség. A gyakorlatban számos esetben alkalmazhatunk hiperimmun vagy esetleg reconvalescens savót egyes fertőző betegségek megelőzése, olykor gyógyítása céljából. Amennyiben ezt az ún. szérumterápiát heterológ vérsavóval végezzük, ez, mint antigén szerepel a szervezetben, tehát vele szemben ellenanyagok termelődnek. Amennyiben az antigén ellenanyag kötődés a sejtek felületén alakul ki, akkor szérumbetegség jön létre, amely lehet: Elsődleges: amikor pl. a nagy dózisú szérumbevitelt követően a fajidegen savóval szemben képződő ellenanyagok a sejtek felületén megkötik az antigént. Állatokban a tünetek általában enyhék, és a nap között szoktak jelentkezni. Emberben hőmérsékletemelkedés, csalánkiütés, ritkán gégeoedema jellemzi a kórképet. Másodlagos: ha ugyanazon egyedet ismételten kezeljük a heterológ vérsavóval. A tünetek lehetnek azonnaliak, ha a szérumos kezelést ugyanazon heterológ savóval néhány hónap különbséggel megismételjük (ilyenkor ugyanis a sejtek felületén még megtalálhatók az ellenanyag-molekulák), vagy lehet gyorsított, ha a második szérumos oltás később, akár évek elmúltával történik. Ez utóbbinál a szérum beoltását követően a memóriasejtek 2 3 nap elteltével ellenanyag-termelést indítanak meg, így a reakció rövidebb idő alatt alakul ki, mint az elsődleges szérumbetegségben. 420
441 Immunológia A heveny szérumbetegség megelőzhető olyan módon, hogy a fajidegen vérsavót nem egyszerre fecskendezzük be az állatba, hanem először mintegy fél órával a teljes adag előtt, csak néhány tized ml-nyi mennyiségét fecskendezzük be iv. vagy a bőr alá. Ilyen módon a Danys-féle elv alapján a szevezetet desensibilizáljuk, azaz reaktív csoportjait lekötjük, és ezt követően már reakciómentesen adható a fajidegen vérsavó teljes adagja. Idült szérumbetegség. A kórképet a glomerulonephritis, valamint az arteritis kialakulása jellemzi. A glomerulonephritis képe az immunkomplexek mérete szerint változó. Abban az esetben, ha nagyméretű komplexek képződnek, ezek nem jutnak el a membrana basalisig, hanem subendotheliálisan rakódnak le, és az endothel proliferációját váltják ki. Amikor viszont kisméretű komplexek képződnek, akkor ezek eljutnak a membrana basalisig, ahol neutrophil granulocytás infiltrációt okoznak, amit proteinuria követ. Az arteritiskialakulását az érfal neutrophil granulocytás infiltrációja vezeti be, ami a membrana elastica interna destrukciójához, majd necrotikus zónák kialakulásához vezet Atopiás allergia (idyosyncrasia) Az atopy megnevezés arra utal, hogy a kórkép genetikai prediszpozícióval áll összefüggésben. Az idyosyncrasia megnevezés (idyos: különleges, syncrasis: összekeveredés) pedig Ptolemaiosztól származik. Az atopiás allergiakórképek közé sorolhatók tehát mindazok az allergiás folyamatok, amelyeknek kialakulásában konstitucionális adottságok játszanak szerepet. Az allergiák bonyolult összefüggései még máig is csak főbb vonatkozásaikban ismeretesek, de annyi bizonyos, hogy a kórképek kialakulásában a genetikai adottságok meghatározó szerepet játszanak. Elsősorban emberekben és kutyákban figyelték meg, hogy az egyedek egy tekintélyes része, genetikai alapokból eredően, az immunreakciók folyamán nagyobb mennyiségben termel IgE típusú ellenanyagokat. Olyan esetekben, ha pl. mindkét szülő atopiás, akkor az utód hajlamos lesz az I. típusú sensibilitási reakciók kialakulására. Amennyiben viszont a szülőpárból csak az egyik egyed atopiás, akkor az utód ilyen irányú immunstatusa variálódik. Az atopiás dermatitis pl. gyakran fordul elő terrier kutyákban, míg spanielekben ritkán lehet megfigyelni. Az IgE-termelés egyedenként változó, sokszor nagymértékű eltérésével kapcslotaban már korábban megfigyelték, hogy pl. atopiától mentes egyedekben a legkülönbözőbb antigéningerekre csak alacsony titerben képződnek IgE-molekulák, míg a genetikailag prediszponált egyedekben csekély antigéningerekre is magas titerű és gyakran permanens IgE-termelődés indul meg (az IgE termelődés genetikai szabályozását lásd a fejezet első részében). Az atopiás egyedekben a következő rendellenességek fordulhatnak elő: a T h-sejtek túlzott aktivitása fokozott IgE-választ okoz, a T s-sejtek csökkent aktivitása miatt fokozott az IgE-válasz, a T h-sejtek csökkent aktivitása miatt alacsony szintű az IgG-képződés. Mindezek következtében az atopiás egyedekben számos antigénnel szemben alakulhat ki I. típusú reakció, amelynek klinikai tünetei: dermatitis, urticaria, serosus rhinitis, sinusitis, conjunctivitis, asthma stb II. típusú hypersensitivitás Korai típusú reakció, amelyben a sejtek felületi antigénjeihez ellenanyagok kötődnek (196. ábra). A sejtfelületi antigének lehetnek saját membránantigének (pl. vörösvérsejtek membránantigénjei), de lehetnek olyan, akár baktériumokból, akár vírusokból, vagy kémiai vegyületekből származó anyagok is, amelyek a sejtfelületre kötődve módosítják a saját felületi antigénstruktúrát ábra - A cytotoxikus reakció vázlata 421
442 Immunológia A vörösvérsejtek felületén található sajátos szerkezetű izoantigének (polisaccharidok és glükoproteinek) a sejtmembrán alkotórészei. Ezek az antigének meghatározók egyrészt a szövetkilökődési reakciókban, másrészt a vértranszfúziós reakciókban. A csoportba többféle reakció tartozik: Transzfúziós reakció akkor alakul ki, ha a donor vére inkompatibilis a recipiens szervezet számára. A háziállatok vércsoportjait az 48. táblázat tünteti fel. 48. táblázat - Vércsoport antigének háziállatokban Állatfaj Szarvasmarha A vércsoport-antigének rendszerei A, B, C, F, J, L, M, R, S, T, Z 422
443 Immunológia Juh A, B, C, D, M, R, X Sertés A, B, C, D, E, F, G, H, I, J, K, L, M, N, O Ló Kutya Macska A, C, D, K, P, Q, U A, B, C, D, F, J, K, L, M, N, Tr A, B Szarvasmarhában 11 vércsoportrendszer ismeretes. Közülük a B csoport 60 antigénféleséget tartalmaz, a J csoportban viszont a lipid természetű antigének a testfolyadékokban passzívan kötődnek a vörösvérsejtek felületére. Inkompatibilis vértranszfúzió esetén a donor vörösvérsejtjeinek antigénjeihez a recipiens szervezet ellenanyagai kapcsolódnak, és ezért a donor vörösvérsejtjei agglutinálódnak. A transzfúziós reakció a vörösvérsejtek gyors eliminálását célozza. Újszülöttek hemolitikus betegsége akkor alakul ki, ha az anyai szervezet ellenanyagokat termel saját magzatának az apától örökölt, idegen vörösvérsejt-antigénjével szemben. Emberben a szülők Rhinkompatibilitása miatt az anyai ellenanyagok már az intrauterinális életben károsítják a magzati vörösvérsejteket, mivel diaplacentárisan átjutnak a magzatba. Újszülött malacok Su faktor miatti hemolitikus icterusa viszont csak a colostrum felvétele után alakul ki. Szarhasmarhában és lóban a kórkép úgy is kialakulhat, hogy a magzatból az anya szervezetébe jutó vörösvérsejtek (pl. a placenta valamilyen ok folytán bekövetkező vérzése esetén) sensibilisálják annak immunrendszerét, és a colostrummal transzferált ellenanyagok hemolízist okoznak. Ilyen alapon létrejövő hemolítikus kórkép az öszvérek 8 10%-ában, a telivérek 0,5 1%-ában fordul elő. Szarvasmarhák, lovak és sertések sensibilisálódhatnak olyan módon is, hogy a korábban alkalmazott vakcina, amelynek termelésére pl. állatpasszázsokat vettek igénybe, a benne foglalt szöveti vagy vércsoport-antigének révén áthangolta az anyai szervezetet. A hemolitikus anaemia klinikai tünetei kb. l2 órával a colostrum felvétele után jelentkeznek az újszülöttekben: sápadtság, reszketés, gyengeség majd elhullás következik be. Gyógyszerek által indukált reakciók: bizonyos gyógyszerek (pl. penicillin, kinin, amino-szalicilsav, fenacetin) metabolitjai a vörösvérsejtek felületi antigénjeihez kötődnek, és az ilyen komplexekkel szemben antitestek képződnek, aminek a vörösvérsejtek lízise lesz a következménye. A szulfonamidok és a kloramfenikol, a granulocyták felületére, a fenilbutazol és a kinin pedig a thrombocyták felületére kötődik. Az immunrendszer ezeket a sejteket elpusztíthatja, aminek agranulocytosis, illetve thrombocytopenia lesz a következménye III. típusú hypersensitivitás, immunkomplex- (IC-)képződés (Arthus-féle reakció) Az antigén ellenanyag kötődésből eredő immunkomplex képződés fiziológiás folyamat, ami több kedvező hatású immunológiai folyamat első lépésének tekinthető. E folyamatok végső célja az idegen anyagok eltávolítása, amit az immunrendszer eredményesen teljesíthet. A komplexhez ugyanis komplement is kapcsolódik, ilyen módon a komplement C3b faktorát megkötni képes sejtek (pl. vörösvérsejtek) ebben a folyamatban közvetítő szerepet játszanak. A vörösvérsejtek immunkomplexeket közvetítő szerepe védi az endothelsejteket az IC-k károsító hatásától, amikor a lépbe és a májba szállított IC-ket átadják a RES phagocytáinak. Az immunkomplex képződés azonban legtöbbször káros következményeket von maga után. A III. típusú reakció alapja az immunkomplexek képződése és azok szövetkárosító hatása. Antigéntúlsúly esetében ugyanis ún. toxikus antigén-antitest komplexek keletkeznek, amelyek nem iminálódnak el a keringésből, ezért a szövetekben lerakódnak, szövetkárosodásokat idéznek elő. 423
444 Immunológia Az immunkomplex betegségek pathogenesisét az IC-k mérete és oldékonysága határozza meg. Az előbbit a komplexbe épült Ig-molekula osztálybeli hovatartozása, továbbá az antigén iránti affinitása, az utóbbit a komplement befolyásolja. Az IgM komplexei méretükben nagyobbak és gyorsabban eliminálódnak, mint az IgG vagy az IgA komplexei. A kisméretű IC-k napokig a keringésben maradhatnak. A szöveteket általában a l9skomplexek károsítják leginkább. A komplement immunkomplexek általi aktiválása a szövetekben pathologiás reakciót indít meg. A különböző sejttípusokból, mint a keringő thrombocytákból, basophil, neutrophil granulocytákból vagy a szöveti mastocytákból kibocsátott vazoaktív aminok növelik a terminális vérérszakaszok áteresztőképességét, ezáltal az immunkomplexek átjuthatnak az érfalakon és lerakódhatnak a szövetekben (ezek okozzák az immunkomplex betegségekben, pl. a szérumbetegségben kialakuló urticariát vagy csalánkiütést). A hasított komplementtermékek ugyanakkor neutrophil granulocytákat is vonzanak a lerakódás helyére, és ezeket számos, a szöveteket károsító szolubilis faktor kibocsátására serkentik. A neutrophil granulocyták a macrophagokra ható kemotaktikus faktorokat is termelnek, mely utóbbiak az immunkomplex betegség idült szakaszában gyakran átveszik azok szerepét, és a szövetkárosodás fő okozójává válnak. A III. típusú reakciót Arthus-féle reakciónak is nevezik, akinek eredeti megfigyelése szerint, ha a nyúl bőrébe olyan antigént oltunk, amivel szemben precipitáló ellenanyagok képződnek, akkor ismételt beoltás következményeként képződő immunkomplexek hatására lokálisan gyulladásos-elhalásos reakció lép fel. Az immunkomplexek képződéséből eredő betegségek klinikai megjelenési formája különböző lehet. Az Arthus-féle reakció lehet lokális vagy szisztémás immunkomplex reakció, mint pl. az ide is besorolható szérumbetegség. Az immunkomplexek lerakódva az erekben (197. ábra) és a szövetekben (198. ábra), azok károsodását idézik elő ábra - IC-k az endothelsejtekben 198. ábra - IC-k a tüdőszövetben 424
445 Immunológia Az immunkomplexek lerakódása a szervezetben bárhol megtörténhet, de bizonyos szervekben, mint például a vesékben (199. ábra) gyakoribb ábra - IC-k a veseglomerulusokban A vesék gyakori érintettségét immunkomplex betegségekben több tényező is magyarázhatja: a nagy vérátáramlás, a gyors filtráció, a magas vérnyomás, 425
446 Immunológia a szövettani szerkezet, amelyek együttesen elősegítik a veseglomerulusokban az immunkomplexek lerakódását. Immunkomplexeknek az endothelsejtekben és a glomerulusokban való lerakódása elsősorban perzisztáló vírusfertőzéseknél figyelhető meg, de létrejöhet akkor is, ha adott kórokozó antigénjei huzamos ideig jelen vannak a vérpályában. Vírusos betegségek (pl. a szarvasmarha vírusos hasmenése, a lovak fertőző kevésvérűsége, az afrikai sertéspestis, a macska fertőző peritonitise) során gyakran figyelhető meg az IC-k depozíciója a nevezett helyeken. Autoimmun betegségekhez (pl. szisztémás lupus erythematosus) gyakran társulnak immunkomplex-képződésből eredő szövetkárosodások. Az autoantitestek által képzett komplexek lerakódhatnak a képződési helyükön, pl. ízületekben, bőrben vagy távolabb is, pl. a vérerek falában vagy a glomerulusokban. Ha a komplexek a vérsejtekhez kötődnek, akkor azok károsítása miatt anaemia, agranulocytosis vagy thrombocytopenia lesz a következmény. A kékszem betegség a canin adenovirus-1. által kiváltott III. típusú reakció lokális formájának következménye. A reakció átmeneti, gyors lezajlású, uveitis anterior, oedema alakul ki, majd a cornea opálossá válik. A cornea infiltrálódik neutrophil granulocytákkal és immunfluoreszcenciás módszerrel vírus ellenanyag komplexek figyelhetők meg a cornea szövetében, ami viszont a cornea tartós károsodását idézi elő. Immunkomplexek képződhetnek és lerakódhatnak a tüdőben olyan esetekben, ha inhalációs úton ismételten allergének (pl. pollenszemcsék) jutnak az alveolusokba, és sensibilisálják a tüdő szöveteit. Szarvasmarhában a Micropolyspora fenei spórái méretük kicsinysége miatt (1 μm) az alveolusokig penetrálhatnak. A szarvasmarha egy idő után sensibilisálódik, és a képződő antitestek a spórákat megkötik immunkomplex formájában, ami komplement-faktorokkal társulva intersticiális pneumoniát vált ki IV. Késői típusú (sejt közvetített) hypersensitivitás Az előbbiekben tárgyalt korai típusú reakcióktól egyrészt abban különbözik, hogy kiváltásában nem a már meglévő ellenanyagok, hanem sensibilis sejtek szerepelnek, másrészt, hogy passzív átvitele szérummal nem, hanem csak lymphoid sejtekkel lehetséges. A lokálisan lezajló reakciókban a mononuclearis sejtek felhalmozódása a legszembetűnőbb. A reakció kifejlődése órát vesz igénybe. A késői típusú hypersensitivitásnak négyféle formája különböztethető meg: 1. Jones Mote-féle hypersensitivitás gyakran figyelhető meg kísérleti állatokon, szolubilis antigének ismételt bőrbe oltásakor. A bőr duzzanata 24 órán belül kialakul, és a bőr basophil granulocytákkal történő beszűrődése jellemzi. 2. A kontakt hypersensitivitás a bőr epidermisében kialakuló reakció. Ez legtöbbször olyan módon jön létre, hogy valamilyen kis molekulatömegű kémiai vegyület a bőrben saját fehérjéhez kötődve túlérzékenységet okoz. Amikor a szervezet ugyanezzel az anyaggal ismételten érintkezésbe kerül, akkor órán belül az epidermisben microvesiculák képződnek, majd oedemás folyamat alakul ki, amelyet a mononuclearis sejtek infiltrációja jellemez. A bőr túlérzékenységét kiváltani képes anyagok molekulatömege általában alacsony, és úgy hatnak, mint a haptének (anilinszármazékok, formaldehid, szerves foszfátok, fémek, műanyagok stb.). A reakció során klinikailag dermatitis és pruritus szokott az érintkezés helyén kialakulni, általában a szőrtelen bőrfelületeken, kutyában pl. az inguinális és az abdominális tájékon. Következményként hiperkeratosis, acanthosis, hyperpigmentáció is kísérheti a kórfolyamatot. A reakciótípus diagnosztikailag is hasznosítható, ha pl. adott egyed celluláris reakcióképességét szándékozunk meghatározni. A próbához a dinitro-klórbenzolt (DNCB) használjuk, amellyel előbb ecsetelés formájában sensibilisáljuk a bőrfelület kb. húszforintos nagyságú területét, majd órával később ismételt ecseteléssel provokáljuk az adott bőrterületet. A reakció erősségéből következtetünk a celluláris válaszképességre, 3. Tuberkulin típusú hypersensitivitás a bőr dermális rétegében 72 órán belül kialakuló reakció, amikor pl. a gümőkórral fertőzött szarvasmarha bőrének irharétegébe tuberkulint juttatunk. (A reakció mechanizmusának részleteit lásd az Allergiás diagnosztikai próbák c. fejezetben.) A reakció előzménye a sensibilis állapot, vagyis az allergiás készség kialakulása, amely lényegében véve úgy jön létre, hogy amikor a fertőződést követően a macrophagok a Mycobacterium bovis baktériumokat a nyirokcsomó paracorticalis zónájában bemutatják a CD4+ sejteknek, akkor ezek osztódása során kialakul egy Tdh-nak (T-delayed hypersensitivity) nevezett 426
447 Immunológia szubpopuláció. Ezek hosszú életű sejtek, és egyik részük MHC II. struktúrával rendelkezik, másik részük viszont negatív. Amikor a már sensibilis egyedbe a tuberkulint mint antigént a bőrbe oltjuk, akkor annak egy része a dendritikus sejtekhez kötődik, amelyek a nyirokcsomó paracorticalis zónájába vándorolnak az antigén prezentálása céljából. A Tdh-sejtek ezt felismerik, az antigéneket megkötik, majd az antigénbevitel helyére emigrálnak. Ez a folyamat több órát vesz igénybe, miközben a termelődő gamma-inf, a TNF, az IL 1 és a cytokinek fokozzák a kemotaxist, a macrophagaktivitást, valamint a basophil sejtes infiltrálódást. Ez utóbbi sejtekből származó szerotonin fokozza a mononuclearis sejtek migrációját. A lokális reakció végül a bőr megduzzadásához vezet, amelynek méretéből lehet az egyed fertőzöttségére következtetni. 4. A granulomás hypersensitivitás kb. 14 napon belül kifejlődő reakció. Az ilyen típusú immunpathologiás folyamat olyan kórokozókkal szembeni védekezés során alakul ki, amikor a fertőző ágenst (pl. Mycobacterium bovis) a macrophagrendszer képtelen a szervezetből eliminálni, így körülötte a szövetekben specifikus granulomák képződnek Az immunprophylaxis Az immunprophylaxis fogalma az elmúlt évtizedekben szélesebbé vált, és ma magában foglalja nemcsak az immunizálási beavatkozások aktív és passzív módozatait, hanem az immunrendszer működési zavaraiból eredő deficienciák modulációját, valamint az autoimmun betegségek célzott gyógykezelését is. Ennek megfelelően a következő kategóriákra osztható: immunprophylaxis, szérumterápia, aktív immunizálás, immunmoduláció, immunstimuláció, immunszuppresszió. Az immunprophylaxis az immunitás mesterséges kialakítását jelenti, és a fertőző betegségek megelőzését szolgálja. Ez úgy érhető el, hogy az adott kórokozótól megvédendő szervezetben mesterségesen váltjuk ki az immunitást, akár kész ellenanyagokat tartalmazó vérsavóval (passzív immunizálás), akár a kórokozó gyengített virulenciájú vagy elölt változatának vagy antigénjeinek beoltásával aktív ellenanyag-termelésre késztetjük (aktív immunizálás) Passzív immunizálás (szérumterápia) A passzív védettség úgy alakítható ki, hogy a kórokozóval szembeni specifikus ellenanyagokat tartalmazó vérsavót fecskendezünk a megvédendő szervezetbe. Az immunizálásnak ez a formája azonnali védettséget nyújt, ami azonban csak rövid ideig tart: fajazonos (homológ) savó alkalmazásakor 2 3 hét, fajidegen (heterológ) savóval végzett szérumterápia esetén 7 l4 nap. A heterológ vérsavó ismételt alkalmazása az anaphylaxia veszélyével jár. Passzív immunizálást akkor alkalmazunk, ha a fertőzés veszélye közvetlenül fennáll (pl. sertésorbánc, Derzsyféle betegség, kutya parvovirus okozta betegsége), vagy pedig valamely kórokozó toxinjaival szemben kell megvédeni a szervezetet (pl. tetanus), vagy a már beteg egyedek gyógyulását szándékozunk elősegíteni (pl. sertésorbánc). Az immunsavót bőr alá vagy intravénásan olthatjuk. Ez utóbbi esetben azonban figyelembe kell venni, hogy a hiperimmunsavók különböző konzerválószereket, karbolsavat, mertiolátot stb. tartalmaznak, amelyek toxikusak lehetnek, ha egyszerre nagy mennyiségben oltjuk a véráramba. Az elmúlt évtizedben egyes fertőző betegségekkel szembeni védekezésben, a korábban szélesebb körben preventív célból alkalmazott passzív immunizálás fokozatosan háttérbe szorult (pl. anthrax, Aujeszky-betegség). Ennek magyarázata abban kereshető, hogy egyrészt a preventív célból alkalmazott hiperimmunszérumok csak rövid időtartamra szóló védettséget nyújtanak, másrészt általában csak olyan állatok gyógykezelésében 427
448 Immunológia hatásosak, amelyek a betegségnek még csak a kezdeti szakaszában vannak. Egyes esetekben, pl. a szopornyica második lázcsipkéjében, a hiperimmunszérum alkalmazása káros is lehet, mivel fokozza az immunkomplexek képződését, ami végül is kedvezőtlenül befolyásolja a betegség kimenetelét Aktív immunizálás (vakcinázás) Aktív immunizálás esetében ismert, csökkent virulenciájú vagy elölt kórokozót, illetve annak antigénjeit, gyakran tisztított formában, esetleg más mikroorganizmusba építve vagy éppen szintetikus úton előállított formában juttatjuk be a szervezetbe azzal a céllal, hogy az immunrendszert ellenanyagok képzésére késztessük. Az aktív immunizálási módszerekkel egyrészt hosszabb időtartamra (hónapokra, évekre, esetleg egész életre) szóló védettség alakítható ki, másrészt az antigén, illetve a vakcina ismételt alkalmazásával ún. boosterhatást (az immunválasz növelését) lehet kiváltani. A vemhes állatok aktív immunizálásával a colostrumon keresztül transzferált ellenanyagok útján az újszülött állatok is megvédhetők. Ugyanígy madaraknál a szikimmunitáson keresztül sikeresen védhetők a napos madarak a kikelést követő napokban pl. a Derzsy-féle betegséggel, vagy néhány hetes korig a gumboroi betegséggel szemben. A vakcinák típusai: az állatgyógyászatban használatos vakcinák különbözőképpen csoportosíthatók. Az eddig ismert számos osztályozási rendszer is bizonyítja, hogy ezek egyike sem tökéletes, ezért talán legegyszerűbb a benne foglalt vakcinatörzs (élő, elölt), illetve az antigén jellege szerinti besorolás, amelyet a 49. táblázat tüntet fel. 49. táblázat - A vakcinák típusai ÉLŐCSÍRÁS VAKCINÁK Attenuált törzsek Virulens törzsek INAKTIVÁLT VAKCINÁK ANTIGÉNEKET TARTALMAZÓ VAKCINÁK Anatoxinok Alegységvakcinák KOMBINÁLT VAKCINÁK AUTOVAKCINÁK SZINTETIKUS VAKCINÁK BIOSZINTETIKUS (REKOMBINÁNS) VAKCINÁK ANTI-IDIOTÍPUS VAKCINÁK Attenuált vakcinák Olyan oltóanyagok, amelyek élő, szaporodásra képes, gyengített virulenciájú kórokozót tartalmaznak. A kórokozónak ez az attenuált, szelídített formája a szervezetre nézve veszélytelen. Baktériumok vagy vírusok virulenciájának csökkenése természetes körülmények között is létrejöhet, leggyakrabban azonban mesterséges úton attenuálják a kórokozót. Természetes módon attenuálódott vakcinatörzsek: pl. a Bl9 törzs, amelyet a szarvasmarha brucellosis elleni vakcinázásban alkalmaznak, laboratóriumban történt huzamos fenntartás során, spontán veszítette el megbetegítő képességét. 428
449 Immunológia A természetben pl. a baromfipestis-vírus teljes virulenciájú (velogén) változata mellett előfordulnak csökkent megbetegítőképességű (mezogén) és olyan törzsek is, amelyek megbetegítőképességüket gyakorlatilag elvesztették (lentogén törzsek). Ez utóbbi változatokhoz tartozó törzsekből készülnek a hazánkban is forgalomban lévő H (Herfordshire) mezogén és a La-Sota lentogén baromfipestis elleni vakcinák. Lentogén változatok csirkeembrió fibroblastszöveten való passzálásával is előállíthatók. Mesterségesen attenuált vakcinatörzsek: a baktériumok és vírusok kórokozóképessége többféle úton csökkenthető. Bármilyen beavatkozásról legyen is szó, az a lényeg, hogy a kórokozó virulenciájának csökkentése mellett az immunogén hatás megmaradjon. Hőhatás: PASTEUR a lépfenevakcinát úgy állította elő, hogy a Bacillus anthracis virulens törzsét 42,5 C-on inkubálta, és ez az optimálisnál magasabb hőmérsékleten való tartás a kórokozó megszelídüléséhez vezetett. Egyes vírusok, pl. a veszettség (Vnukovo-32 törzs) vírusa esetében a szokásosnál alacsonyabb hőmérsékleten C-on történt tenyésztéssel sikerült ún. hidegmutánsokat előállítani, amelyek csökkent megbetegítőképességük mellett megőrizték immunogén hatásukat. Kémiai anyagok: baktériumtörzsek virulenciája csökkenthető, ha azokat bizonyos vegyszereket tartalmazó táptalajokon passzáljuk.calmette és GUERIN az ember gümőkórjával szemben alkalmazott BCG (Bacillus Calmette Guérin) vakcinatörzset úgy nyertek, hogy egy virulens Mycobacterium bovis törzset 70 generáción át epét tartalmazó burgonyás táptalajon tenyésztette. Állatpasszázsok útján való attenuálás: elsősorban vírusok esetében alkalmazható olyan módon, hogy a vírusokat sorozatban passzálják olyan állatfajokban, amelyek eredetileg nem vagy csak kevéssé fogékonyak az illető vírus iránt. A virulencia csökkenésének mértékét a passzázsok száma befolyásolja. Sok ilyen módon előállított törzset tartalmazó vakcina ismeretes: pl. a keleti marhavész ellen kecskében passzált (caprinizált) vagy csirkeembrióban passzált (avianizált) vírus, a sertéspestis ellen nyúlban passzált (lapinizált) vírus, az afrikai lópestis ellen egéragyvelőben passzált vírus stb. Az állatpasszázsok virulenciacsökkentő hatását elsőként PASTEUR alkalmazta. A veszettség virulens utcai vírusát nyulak agyvelejébe oltotta, és megfigyelte, hogy sorozatos agyvelőpasszázsok következtében a lappangási idő fokozatosan rövidült, majd mintegy 90 passzázs után 5 6 napban rögzült ( fix vírus ). Ilyenkor a vírus agyvelőbe oltva elérte virulenciájának legmagasabb fokát, közben azonban elvesztette azt a képességét, hogy bőr alá oltva az állatokat megbetegítse. Ugyanakkor immunogén hatása a passzázsok során változatlan maradt. A veszettség elleni immunizálásra használták az ún. Flury törzset, melyet csirkeembrió-passzázsokkal szelídítettek. Embrionált tojásban termelik pl. a baromfihimlő, a fertőző bronchitis, a baromfipestis, a kacsák vírusos májgyulladása elleni vakcinákat is. A vírusok virulenciájának csökkenése szövettenyészetben: az elmúlt években számos vírusvakcinát állítottak elő szövettenyészetekben, pl. az emberi poliomyelitis, a fertőző sertésbénulás, szarvasmarhák vírusos hasmenése, a veszettség, a kutya fertőző májgyulladása, a szopornyica, a myxomatosis, a baromfihimlő stb. elleni vakcinákat. Az így nyert vakcinák könnyebben tisztíthatók és koncentrálhatók, valamint további előnyük az, hogy amennyiben homológ szöveten állítják elő, úgy azok allergizáló hatása minimális Inaktivált vakcinák Az inaktivált vakcinák a kórokozót valamilyen kémiai vagy fizikai hatással elölt, szaporodásra képtelen állapotban tartalmazzák, ezért a megfelelő immunválasz kiváltásához eleve nagyobb és pontosan kiszámított mennyiségű antigént kell alkalmazni. A hatás fokozható a vakcinás oltás ismétlésével, valamint a vakcinához leginkább illő adjuváns felhasználásával. A hővel való inaktiválás károsítja a proteineket, rontja immunogenitásukat. Ezért a vakcinatermeléshez használt kórokozók inaktiválására ma kémiai anyagokat szoktak igénybe venni. Az inaktiválószertől megkívánják, hogy a kórokozók fertőzőképességének megbízható megszüntetése ( elölése ) mellett minél kevésbé befolyásolja (denaturálja) azok antigénjeit. A legszélesebb körben használt inaktiválószer a formalin, amely a fehérjék amino- és amidcsoportjaira, valamint a nukleinsav purin- és pirimidinbázisaira fejti ki hatását. Formalinnal készül pl. a sertésorbánc, a sercegő üszök, az enterotoxaemia, a leptospirosisok és több más betegség elleni inaktivált vakcina. A vírusvakcinák közül pl. a ragadós száj- és körömfájás, az adenovírusok és a szarvasmarhák fertőző rhinotracheitise (IBR) elleni vakcinatörzseket inaktiválták vagy inaktiválják jelenleg is formalinnal. A 429
450 Immunológia formalinnak a koncentrációtól és a hőmérséklettől függő hatását azonban egy bizonyos fokon nehéz megszüntetni, és további hatása már az antigén denaturálásához vezet. Ezért újabban más, jobban irányítható hatású inaktiválószerek terjedtek el (pl. a ß-propiolakton, etilénimin). Ezek az anyagok a nukleinsavak keresztkötéseit, valamint a fehérjék felületi csoportjait érintetlenül hagyják, így az immunogén hatást nem befolyásolják. Egyes krónikus, nehezen gyógyuló folyamatoknál a betegből izolált kórokozó törzs inaktiválása útján készítenek ún. autovakcinát (vakcinaterápia), mint pl. a szarvasmarha, a ló, a kutya papillomatosisa vagy a staphylococcusok okozta bőrgyulladások elleni oltóanyagok Antigéneket tartalmazó vakcinák A baktériumok exotoxinjai immunogén tulajdonságukat akkor is megtartják, ha a mérgező hatású toxofor csoportjaikat formalinnal vagy egyéb vegyszerrel inaktiváljuk, mert ez a beavatkozás érintetlenül hagyja a molekula haptofor (sejthez kötődő) immunogén részét. Ilyenek pl. a clostridiumok okozta fertőzések (Cl. tetani, Cl. botulinum, Cl. perfringens) elleni anatoxinokat vagy toxoidokat tartalmazó oltóanyagok. Az alegységvakcinák a kórokozónak (pl. veszettségvírus) csak az immunogén hatású antigén fragmensét (pl. Gp I.) tartalmazzák Kombinált oltóanyagok A kombinált vagy társított vakcinák lehetővé teszik, hogy több kórokozó ellen egyidejűleg létesítsünk aktív immunitást. Emberek immunizálására szolgáló társított vakcina pl. a DIPERTE (diphteria-pertussis-tetanus) vagy a typhus-tetanus elleni oltóanyag. Az állatorvoslásban számtalan kombinált vakcinaféleség került forgalomba a kutyák szopornyicája, fertőző májgyulladása és leptospirosisa ellen ható társított vakcinák formájában, de használatban vannak olyan vakcinák is (pl. Pentadog, Hexadog), amelyek öt vagy hat antigénféleséget tartalmaznak. Az egyes antigének társításakor figyelembe kell venni a közöttük esetleg kialakuló antigén-konkurenciát is. Egymással konkuráló antigének ugyanis egymással vagy egyáltalán nem társíthatók, vagy rendkívül gondosan kell a mennyiségi viszonyokat megválasztani, ellenkező esetben előfordulhat, hogy az erősebb immunogén hatású anyag elnyomja a rosszabb immunogén hatású antigénnel szembeni immunválaszt. A polivalens vakcinák egyre növekvő részesedése jogosan veti fel a kérdést: vajon mi a magyarázata annak, hogy míg korábban a többféle antigénkomponens együttes használata kontraindikáltnak számított, addig ma már nem ritka a 4, 5, sőt akár 8 antigénféleséget tartalmazó vakcina sem. Az nyilvánvaló, hogy nem az immunrendszer válaszképessége változott, hanem ennek magyarázata egyrészt az oltóanyag-termelés fejlődésében, másrészt a gyakorlati igényekben kereshető. Ez utóbbi ugyanis szükségszerűvé teszi, hogy többféle betegség megjelenési kockázatát figyelembe véve, adott életkorban egyidejűleg különböző kórokozókkal szembeni immunitással ruházzuk fel háziállatainkat. Az oltóanyag-termelés mai szintjén az nem is képezheti vita tárgyát, hogy megfelelőek-e a többértékű kombinált vakcinák. Az oltóanyag-ellenőrző és az oltóanyagokat regisztráló hatóságok ugyanis általában ugyanazon követelményeket támasztják a polivalens vakcinák egyes összetevői iránt, mint amelyek a monovalens vakcinákra kötelezőek Szintetikus vakcinák Mivel a polipeptidek szintézisének automatizált módszerei a szerves kémia mindennapi eszközévé váltak, egyes kórokozók immunogén antigénfragmenseinek szekvenciaanalízisét követően több antigént szintetikus úton is előállítottak. A ragadós száj- és körömfájás elleni immunitás pl. a vírus nukleokapszidjában található, D molekulatömegű, 213 aminosavból álló, VP1-nek nevezett peptid ellen képződő ellenanyagnak köszönhető. Az immunitás kiváltásában ezen belül különösen a l4l l60-as sorszámú aminosavszakasz játszik szerepet. E peptidszakasz szintetikus úton előállított változata megfelelő adjuvánsokkal tengerimalacban olyan ellenanyagválaszt eredményezett, amely megvédte a kísérleti állatokat a fertőzéssel szemben. A szintetikus peptid immunogenitása azonban nemcsak az aminosavak milyenségétől és sorrendjétől, hanem az adott peptid másodlagos és harmadlagos szerkezetétől is függ, bár ezek sikeres mesterséges előállítása ma még meglehetősen bonyolult feladat. 430
451 Immunológia Hasonló módon, szintetikus úton, jó immunogenitással rendelkező antigéneket állítottak elő az influenzavirusok, a veszettségvírus, az emberi hepatitis B-virus és más vírusok antigénfragmenseinek megfelelően is Bioszintetikus (rekombináns) vakcinák Az ún. új generációs vakcinák előállításának lényege az, hogy a megfelelő antigéneket (fehérjéket, peptideket) kódoló DNS-szegmentumokat beépítik pl. a baktériumok plazmidjába, majd ezeket prokaryota (pl. E. coli) vagy eukaryota sejtekbe (pl. Sacharomyces cerevisiae) juttatják, amelyek a plazmid közvetítette információk alapján a megfelelő immunogén hatású fehérjéket vagy peptideket fogják termelni (200. ábra) ábra - A plazmidklónozás vázlata A korszerű rekombináns-dns-technika alapjai már több évtizede megteremtődtek, de az első sikeres génsebészeti manipulációval preparált genetikai anyag átültetésére csak az l970-es években került sor, amikor Salmonella baktériumból transzferáltak antibiotikum-rezisztenciát E. coliba, klónozott DNS segítségével. RNSvírusok esetében a genetikai információt hordozó gént előbb klónozásra alkalmas DNS-szállá kell átalakítani. A klónozáshoz használt vektorok szerint az ilyen vakcinákat különböző csoportokba sorolhatjuk. Plazmidvektorok: amelyekben pl. a vírusnukleinsavból megfelelő restrikciós enzimmel kivágott génszakaszt baktérium (pl. E. coli) plazmidjába építik. Ha az adott gén a baktériumban kifejeződik, vagyis a fehérje termelése róla megindul, akkor a baktériumot nagy mennyiségben elszaporítják, majd a baktérium által termelt vírusfehérjét tisztítják, és ilyen formában vakcinaként alkalmazzák. Ezen az úton állítottak elő megfelelő hatékonyságú vakcinát pl. a baromfipestis, a veszettség, a humán hepatitis B és a herpes simplex vírusa ellen. 431
452 Immunológia Vírusvektorok. Jellemzőjük, hogy a bioszintetikus vakcinához hasonlóan hordozzák a kórokozó immunogén antigénjét kódoló gént, de erről a génről a beoltott egyedben másolódnak a fehérjék, csakúgy, mint a hagyományos attenuált vakcinák esetében, de immár a kórokozó jelenléte nélkül. Az ilyen ún. új generációs vakcinák hatásukban, a hagyományos élő vagy attenuált vakcinákhoz hasonlóan, T- és B-sejtes immunválaszt egyaránt képesek indukálni. Az aktuális gént leggyakrabban olyan ártalmatlan vírusokba ültetik, amelyek képesek az adott fajban szaporodni. Természetesen törekedni kell arra, hogy a vektor maga valóban ártalmatlan legyen, tehát pl. előnyös olyan vektor használata, amelyik természetes körülmények között nem fordul elő az oltandó állatfajban. Ilyen az emlősálatok számára a madárhimlő vírusa. Ez a vírus bejut az emlős sejtbe, ott megkezdődik a gének másolása, de a vírus szaporodása leáll egy bizonyos ponton és új fertőzőképes virionok már nem képződnek. Az ilyen ún. abortív fertőzés eredményeként az immunitás létrejön, és a vektorvírus más állatokra sem tud átterjedni. A vírusvektorok kettős szálú DNS vírusok (pl. Papovaviridae családhoz tartozó SV-40 vagy a Poxviridae vakcina vírusa, Baculovirus), amelyek alkalmasak a szükséges génszakasz eukaryota sejtekbe való bevitelére. Erről a génszakaszról kódolt fehérjék protektív immunválaszt indukálnak, és védetté válik a szervezet a kérdéses kórokozóval szemben. Az adenovirusok pl. csak kevés génszakaszt fogadnak be, mivel ezer bázispárja van a genomban. Baculovirus vektorral a kiválasztott génszakaszt rovarsejtekbe (SF21) viszik, amely rendkívül nagy mennyiségben termeli a fehérje antigént. Hátrány mutatkozik viszont abban, hogy a rovarsejtek nem úgy glükolizálják a fehérjéket, mint az emlős sejtek. A termelt fehérjék vírusszerű partikulákat képeznek (nukleinsav nélkül). T-sejtes immunválasz nem alakul ki. A vakcinavírus genom, amely bázispárból áll, 12 inserciós hellyel bír, így elméletileg akár több mint tíz kórokozó elleni polivalens vakcina készítésére is alkamas Anti-idiotípus vakcinák Adott kórokozóval szemben képződő specifikus ellenanyag variábilis régiója ún. idiotípiás variánst képvisel az immunglobulin-molekulák között. Ezek a molekulák más klónok számára a variabilis régió miatt idegenek, ezért velük szemben anti-idiotípus immunglobulin-molekulák termelődnek. Ez utóbbi immunglobulin-molekuláknak a variábilis régiója konfigurációját tekintve hasonló vagy megegyezik az Ig-termelődést indukáló eredeti antigén konfigurációjával (lásd 166. ábra), így alkalmas lehet arra, hogy az antigénhez hasonló specifikus immunválaszt indukáljon az eredeti kórokozóval szemben (pl. poliomyelitis elleni anti-idiotípus vakcina). Az anti-idiotipus vakcinák csak bizonyos esetekben alkalmasak védőoltásokra, hiszen ha egy járvány során megváltozik a kórokozónak a domináns epitopja, akkor a vakcina hatástalanná válik. Nagy jövője lehet azonban hormonkészítmények kiváltásában. A hormon aktív csoportjához hasonló anti-idiotípusokkal ugyanis hormonhatás érhető el ISCOM (immunstimulating complex) vakcinák Elsősorban burkos vírusokból állíthatók elő olyan módon, hogy a burokban levő fehérjét megfelelő detergenssel oldatba viszik, és immunstimuláns anyag felületére kötik. Az így létrejövő partikulák ultracentrifugálással elkülöníthetők a többi vírusalkotórésztől, vagyis az eljárással olyan oltóanyag nyerhető, amely döntően az immunogén hatást hordozó antigéneket tartalmazza Az immunprophylaxis lehetőségei és korlátai Bármely vakcinázási programnak vagy beavatkozásnak az a célja, hogy a lehető leghatékonyabb védettség alakuljon ki egy adott fertőző betegséggel szemben. Akár az egyed, akár az állatpopuláció szempontjából a vakcinával kiváltott védettség eredményességét az határozza meg, hogy a teljes virulenciájú kórokozóval történő fertőzést a szervezet kiállja-e. Kísérleti adatok és gyakorlati megfigyelések egyaránt bizonyítják azonban, hogy az állatpopulációkon belül 100%-os védettség, tehát az ún. homogén immunstatus nem érhető el, mivel az egyedek immunstatusában eltérések vagy lényeges különbségek alakulhatnak ki (201. ábra) a következők szerint: a populáció egy része (általában nagy vagy legnagyobb része) az alkalmazott vakcinától elvárhatóan jól immunizálódik, az állatok más része csak gyengén immunizálódik, a populációban lesznek viszont olyan egyedek is, amelyek egyáltalán nem immunizálódnak. 432
453 Immunológia 201. ábra - A vakcinázást követő immunstatus alakulása A csoportok arányának alakulása, vagyis annak pozitív vagy negatív irányú eltolódása számos tényező függvénye, döntően azonban ezt a következők befolyásolják: Genetikai adottságok: amelyek ab ovo meghatározzák az adott egyedek vagy fajták jó, illetve rossz responderképességét az alkalmazott antigénnel szemben. Ezt a képességet az ún. Ir-(Immune response-)gének szabályozzák. Genetikai szelekcióval pl. nemcsak magasabb rezisztencia érhető el (pl. Marek-féle betegség), hanem ellenkezőleg, fokozottabb érzékenység is kialakulhat (pl. a maximális fejlődési erély, magasabb termelőképesség irányában kitenyésztett hibridek esetében). Ismereteink szerint ugyancsak genetikai eredetre vezethető vissza a parlagi állatfajták nagyobb ellenálló képessége a kultúrfajtákéhoz viszonyítva. Öröklött immundeficienciák (lásd az Immundeficienciák c. fejezetet). Szerzett immundeficienciák (lásd az Immundeficienciák c. fejezetet). Tolerált fertőzések: amelyek annyit jelentenek, hogy a magzatokba az önfelismerés szakaszában diaplacentárisan bejutó vírusokat a magzati immunrendszer sajátként ismeri el, vagyis vele szemben a későbbiekben semmiféle immunválasszal nem reagál. Ilyen típusú fertőzések tapasztalhatók a flavivírusfertőzések esetében (pl. sertéspestis-, BVD-vírus). Ezek a fertőzések járványtanilag azért jelentenek rendkívüli veszélyt, mert a tolerált fertőzöttséggel született állatok szerológiai vizsgálatokkal nem ismerhetők fel, vakcinákkal bennük nem váltható ki immunválasz, viszont mint vírusürítők fertőzhetik a környezetükben lévő fogékony egyedeket. Immunszuppresszív anyagok: amelyek hatása elsősorban a lymphoid sejtekre irányul, de hatásuk olyan módon is érvényre juthat, hogy az immunreakciók valamely szakaszát gátolják. Ilyenek lehetnek a lymphoid szövetek működésére ható mikroorganizmusok (pl. retrovírusok, a baromfipestis vírusa, a BVD vírusa, a mycoplasmák), egyes gombatoxinok (pl. T 2 toxin, ochratoxin), gyógyszerek (pl. prednisolon) és sugárártalmak (pl. röntgenbesugárzás). Környezetélettani hatások, amelyek kedvezőtlen befolyása az immunválasz induktív vagy produktív szakaszában egyaránt érvényre juthat, és a következményük az immunválasz késésében vagy annak 433
454 Immunológia elmaradásában nyilvánul meg (pl. stresszorok, meteorológiai tényezők, táplálkozási zavarok, fehérjék és egyes aminosavak: lizin, methionin, triptofán, treonin, leucin, valamint ásványi anyagok cink, vas hiánya). Maternális immunitás feed-back hatása: (lásd az Újszülöttek immunválasz képessége c. fejezetben). A vakcinázás eredményességét további számos más tényező is befolyásolja, mint pl. a vakcina típusa (élő, elölt, alegység-, szintetikus, rekombináns, anti-idiotípus vakcina), a vakcinában alkalmazott adjuváns típusa és minősége, a vakcina alkalmazási módja és gyakorisága. A hatékonyság függ továbbá az immunizálandó egyed vagy állatpopuláció életkorától, egészségi és tápláltsági állapotától, valamint a környezeti és tartási viszonyoktól. Az immunizálás bármely formája káros következményekkel is járhat (lásd később), ezért az immunizálás alkalmazásának eldöntése előtt a következőket kell tisztázni és mérlegelni: mi a kórokozó, illetve annak pontos típusa, amivel szemben a vakcinát alkalmazni szándékozunk, az immunprophylactikus eljárás alkalmas lesz-e az egyedek megvédésére a virulens kórokozóval szemben, a védekezés ilyen módja nem jelent-e hátrányt a későbbiekben a betegség immundiagnosztikája szempontjából Adjuvánsok A vakcinák immunogén hatása növelhető ún. adjuválószerek (ásványi anyagok, baktériumok és növények kivonatai, szintetikus vegyületek vagy a gazdaszervezet anyagai, pl. IL 1, IL 2 stb.) hozzáadásával. A megfelelő adjuváns lehetővé teszi a tisztított antigén mennyiségének csökkentését is, ami a vakcinatermelés gazdaságosságában lehet előnyös. Az adjuvánsok fejlesztése tapasztalati alapokon indult el. Sok olyan anyagot ismertek meg, amelyek módosították az immunválaszt. Ezek az anyagok nemcsak kémiai felépítésükben, hanem hatásukban is eltérők, így akár hatásmechanizmusuk szerint is besorolhatók (pl. az antigént lokalizálják vagy direkt úton hatnak a macrophagokra, esetleg a lymphocytákra). Alumíniumvegyületek. A leggyakrabban használt adjuvánsok. Hatásukat többféleképpen fejthetik ki: Elnyújtják a kölcsöhatást az antigén és az APC-sejtek, valamint a macrophagok és a follicularis dendriticus sejtek között. Az adjuváns által képzett depót immunkompetens sejtek veszik körül, ilyen módon növelhetik a humorális immunválaszt, és kedvezően elősegíthetik a celluláris reakciókat is. További előnye lehet az adjuvánsnak a komplementrendszer aktiválása. Hátránya lehet az adjuválószereknek az, hogy allergizáló hatásuk miatt az IgE-molekulák képződését indukálják és allergiás reakciókat okozhatnak, esetleg helyi szöveti reakciót (granulomaképződést) válthatnak ki. Liposomák. Az antigénekhez kötött liposzómák helyettesíthetik a macrophagot, és képesek az antigén prezentálására. A hatás az alkalmazott módszer függvénye. Növelni képesek a humorális immunitást a depóhatás révén, de fokozhatják a celluláris immunreakciókat is. Szintetikus polimerek. A nem ionos polimervegyületek, a hydrophyl és hydrophob kopolimerek olajos emulzióban az antigénnel lokális gyulladásos folyamatot és granulomaképződést váltanak ki. Növelik a kemotaxist, elősegítik a komplement aktiválódását és az ellenanyagképzést, valamint növelik a celluláris immunválaszt. Bakteriális eredetű adjuvánsok. Elősegítik a macrophagok aktiválódását, fokozzák az interleukinek termelődését. Ilyenek pl. a Bordetella bronchiseptica anyagai, valamint egyes baktériumok muramilpeptidjei. Az adjuvánsokkal szemben támasztott legfőbb követelmény az anyag ártalmatlansága (pl. rákkeltő hatástól való megbízható mentesség). 434
455 Immunológia Az adjuvánsok hatása többféleképpen juthat érvényre. Egyrészt az antigénnel adszorbeálódva azok felszívódását elnyújtják, tehát depóhatásúak (pl. alumíniumvegyületek, olajos emulziók, liposzómák, szintetikus polimerek), másrészt közvetlenül növelhetik a humorális és celluláris immunválaszt olyan módon, hogy fokozzák a macrophagok, illetve a lymphocyták aktivitását, mint pl. a baktériumok lipopoliszacharidjai (LPS) vagy muramil dipeptidjei (MPD). Ismeretesek olyan adjuvánsok is, amelyek a kétféle hatást egyesítik (pl. Freund-féle komplett adjuváns, amely ásványi olajat és elölt mycobacteriumokat is tartalmaz). A megfelelő adjuválószer megválasztásakor nemcsak az antigén természetét, de az állatfajt is figyelembe kell venni, amelyben a vakcinát alkalmazzuk. A szarvasmarhák lépfene elleni oltására pl. szaponinos vakcinát használnak, a lovak azonban érzékenyek a szaponin iránt, ezért részükre aluminium-hidroxidos csapadékos oltóanyag kerül forgalomba. A kérődző állatokban jó hatású alumínium-hidroxid géllel adjuvált ragadós száj- és körömfájás elleni vakcina sertésekben gyenge hatású. Sertésekben és baromfiban általában a finom diszperzitású olajos vivőszerek fejtik ki a legjobb adjuváló hatást A vakcinákkal szemben támasztott igények Az élő és inaktivált vakcinatípusok közötti különbségeket, illetve azok előnyeit az 50. táblázattünteti fel. Az összehasonlításból kitűnik, hogy az élő vakcinák adjuváns nélkül, kisebb dózisban is megfelelő immunválaszt indukálnak, és általában nem váltanak ki allergiás reakciókat. 50. táblázat - Élő és inaktivált vakcinák összehasonlítása Élő vakcinák előnyei Alacsonyabb dózisban való alkalmazhatóság Általában nem igényelnek adjuvánsokat Kisebb kockázat a hypersensibilitás szempontjából Interferonképződést indukálnak Alkalmazásuk gazdaságos Inaktivált vakcinák előnyei Tárolás során stabilak maradnak Nem okoznak megbetegedést a megmaradt virulencia miatt Nem tartalmaznak más kontamináló ágenseket Az inaktivált vakcinák nem okoznak megbetegedést, nem tartalmaznak kontamináló mikroorganizmust, nem rekombinálódnak, és megfelelő tárolás során stabilitásukat megőrzik. Az ideális vakcina alapvető kritériumait a következőkben lehet megfogalmazni: ártalmatlan, vagyis sem helyi, sem általános reakciót nem okoz, hatékony védettséggel ruházza fel a szervezetet az adott kórokozóval szemben, hosszan tartó védettséget nyújt, applikálása egyszerű, tömeges immunizálásra is alkalmas, nem költséges és nem igényel hűtőláncot, a természetes fertőződéstől megkülönböztethető immunválaszt indukál. 435
456 Immunológia Az élő csírákat tartalmazó oltóanyag felhasználásakor fontos az alkalmazott törzs virulenciájának és immunogén hatásának ismerete a következők miatt: A nem kellően gyengített törzsek az oltott szervezetet megbetegíthetik vagy károsíthatják (pl. a baromfipestis elleni H-törzs, a fertőző bronchitis elleni Bronchovac II., a varas szájfájás elleni vakcina). Az erősen gyengített virulenciájú törzsek immunogén hatása gyenge vagy teljesen elveszett. Az élő csírákat tartalmazó oltóanyagok, bár az esetek többségében jó immunitást eredményeznek, az oltott egyedekből hosszabb-rövidebb ideig ürülhetnek. Fennáll a törzsek mutációjának, rekombinációjának, illetve revertálódásának veszélye is. Az élőcsírás attenuált vírusvakcinák alkalmazása olyan veszélyt is magában hordozhat, hogy az előállításhoz használt szövetek eredetüknél fogva fertőzöttek lehetnek (pl. a szarvasmarha-hereszövet a BVD-vírusával, a sertésszövetek adenovírusokkal). A vakcinázást követően 1 2 napig tartó ún. negatív fázis alakul ki, ami az állatok természetes ellenálló képességét csökkenti, ezáltal addig latens fertőzéseket aktiválhat. Ilyenkor az állatok fokozottan érzékenyek a megerőltető igénybevételekkel, valamint a legkülönbözőbb stresszorhatásokkal szemben. A vakcina kísérőanyagai (szövettenyészet, tápfolyadék fehérjék, antibiotikumok) allergizáló hatása, különösen ismételt applikálás esetében, allergiás folyamatokat válthat ki. Az attenuált vakcinák alkalmazása a legtöbb esetben zavarja a betegség immundiagnosztikáját, mivel a beoltást követően pl. a vakcinatörzs antigénjei is kimutathatók a szövetmintákban, a vérsavóban megjelenő ellenanyagokról pedig nem dönthető el, hogy azok képződését a vakcinatörzs indukálta-e vagy természetes fertőződés következtében termelődtek. A gyakorlat ma már az ellenkezőjére is teremtett példát, mint pl. a gi - Bartha-féle vakcinatörzs által kiváltott ellenanyag-képződés, amely monoclonalis ellenanyagokkal elkülöníthető a gi + virulens vírus okozta ellenanyag-képződéstől. A klasszikus és új generációs vakcinák közötti határvonalat a molekuláris biológiai módszerek alkalmazása jelenti, ezért inkább didaktikai jellegű, hiszen közöttük ma már átfedések is adódhatnak (pl. az attenuálás klasszikus, sok évtizedes módszerei mellett génmanipulációs úton is készíthető attenuált vakcina). Az említett vakcinatípusok közül a gyakorlatban leggyakrabban a homológ attenuált, valamint az inaktivált oltóanyagokat alkalmazzák. Közülük az élő, attenuált vakcinák engedélyezése során az oltóanyag-ellenőrzés hatósági intézményei nem kívánnak kockázatot vállalni, ezért az engedélyezést a következő három alapfeltételhez kötik: genetikai stabilitás, jellegzetes markerek kimutathatósága, immunogenitás, ártalmatlanság, hatékonyság. A vakcinák előállításában felmerülnek még termeléstechnikaiigények, minta vakcinatörzs ipari méretekben való elszaporíthatósága és a maximális antigén- kinyerés lehetősége, továbbá felhasználhatósággalkapcsolatos elvárások, mint amilyen a hosszú eltarthatóság, stabilitás, egyes baromfibetegségek megelőzése céljából a tűmentes alkalmazás lehetősége (pl. ivóvízben, belélegeztetés útján való alkalmazhatóság). Oltási balesetek : ide soroljuk mindazokat a károsodásokat, amelyek a vakcinázás következtében alakulhatnak ki, akár a vakcina hibájából, akár annak helytelen megválasztásából vagy nem megfelelő alkalmazási módjából erednek. Néhány példa: az inaktivált Gram-negatív baktériumokat tartalmazó vakcinák pl. endotoxinjaik révén lázas állapot mellett leukopeniát, ritkábban pedig abortust is okozhatnak, a bluetongue-gal (kéknyelv betegséggel) szemben a vemhesség időszakában juhokban alkalmazott vakcina congenitális anomáliákat okozhat, az afrikai lópestis elleni vakcina herpeszvirus fertőzéseket aktiválhat, 436
457 Immunológia a szopornyicavakcinával oltott kutyákban encephalitis alakulhat ki. Máskor a vakcinák immunszuppressziót okozhatnak (pl. egyes parvovirus-vakcinák, kombinált virusvakcinák) vagy hypersensibilitási reakciókat válthatnak ki (pl. tojás alapanyagot tartalmazó vakcinák) Immunmoduláció Az elmúlt évtizedekben felismerték, hogy egyes gyógyszerek, illetve vegyületek az immunrendszer működését képesek serkenteni vagy gátolni. Az ilyen hatás legtöbbször azonban csak olyan esetben mutatkozik, ha az immunrendszer működése hiányos vagy rendellenes, ezért az ilyen vegyületeket immunkorrektoroknak, immunstimulánsoknak vagy immunmodulátoroknak nevezik. Az immunmoduláns szerekről az 51. táblázatnyújt áttekintést. 51. táblázat - Immunmoduláló szerek IMMUNSTIMULÁNS ANYAGOK Fiziológiás immunstimulánsok Thymus hormonok Lymphokinek Interferonok Baktériumok és antigénjeik BCG* MER* MDP* Szintetikus anyagok Levamisol Nukleozidok Izoprinozin IMMUNSZUPPRESSZIV ANYAGOK Kortikoszteroidok Ciklosporinok Anti-lymphocyta savók * Jelmagyarázat a szövegben Az immunmoduláns szerek kifejthetnek immunstimuláns, de ugyanígy immunszuppresszív hatást is, ami irányulhat egy meghatározott antigén (pl. adott vakcinatörzs) immunogén hatásának fokozására (lásd az Adjuvánsok c. fejezetet) vagy adott antigénnel szembeni desensibilizálásra. Az immunmoduláció irányulhat a T- vagy a B-lymphocytákra, továbbá a monocyta-macrophagokra, valamint a granulocyták aktivitására, illetve ezek szekrétumainak termelődésére. Az immunmoduláns szerek nemcsak az immunrendszerre kifejtett hatásukban, hanem szerkezetük és eredetük szerint is különböznek. Fontosabb csoportjaik: 437
458 Immunológia fiziológiás anyagok (hormonok, cytokinek, interferonok, interleukinok, növekedési faktorok), baktériumokból eredő anyagok (pl. BCG, MER, MDP), szintetikusan előállított készítmények (thiolvegyületek pl. levamizol, nukleotidok, polianionok, poliszacharid anyagok, pl. lentinan). Az immunmoduláns anyagok hatásmechanizmusának egyes részletei még nem teljesen tisztázódtak, de annyi bizonyosnak látszik, hogy a sejt ciklikus nukleotidáira (ciklikus adenozin-monofoszfát: camp, ciklikus guanozin-monofoszfát: cgmp) hatnak. Adott immunmoduláns növelheti pl. a camp-aktivitást, mások a lymphocytamembránra kifejtett hatásuk miatt immunszuppressziót válthatnak ki Immunstimuláns anyagok Fiziológiás immunstimulánsok Thymushormonok: olyan vegyületek, amelyek stimulálják a T-lymphocyták aktivitását, növelve a cgmp szintjét. Ezek a hormonok magukban foglalják a thymozin V. frakciót, a thymozin a-1-et, a thymopoetint, valamint a thymus szérumfaktort. Ezek a faktorok valamennyien az epithelsejtekben termelődnek. A thymus egyik humorális faktora, amelyik a véráramba kerül, növeli a camp-szintet a lymphocytákban, így szuppresszív hatást fejthet ki. Lymphokinek és interferonok: az interferon módosítja az immunkompetens sejtek aktivitását olyan módon, hogy aktiválja a macrophagokat, stimulálja a B-sejteket, valamint növeli a természetes killer- és a T-killersejtek hatékonyságát. Az interleukin 1 (IL 1) lymphocytaaktiváló-faktor, az interleukin 2 (IL 2) T-sejt növekedési faktor, amely fokozza a T-lymphocyták IL 1-gyel szembeni válaszát Baktériumok és antigénjeik BCG (Bacilus Calmette Guerin) vakcinatörzs alkalmazását követően megfigyelték, hogy fokozza a T-sejtek, valamint a macrophagok aktivitását és gátolja bizonyos daganatok növekedését. MER (metanol extrakciós residuum) a BCG-ből készített kivonat, amely egyes daganatok regressziójában bizonyult hatásosnak. MDP (muramil dipeptid) egyes baktériumok sejtfalából származó kivonat, amely immunmoduláns hatást fejt ki. Baktérium-endotoxinok: a baktériumok lipopoliszacharidjai (LPS) a Gram-negatív baktériumok sejtfalából származnak, és hatásuk kifejeződhet akár az immunválasz növelésében, akár az immunválasz elnyomásában. Hatásukat a lymphocyták és a macrophagok membránján fejtik ki, megváltoztatva a ciklikus nukleotidek (pl. a camp) plazmabeli arányát Szintetikus készítmények Levamisol: a vegyület egy imidazolszármazék, és antihelmintikumként használatos az állatgyógyászatban. A levamisol egyaránt fokozza a humorális és celluláris immunválaszt azáltal, hogy növeli a lymphocyták differenciálódását, mobilitását, valamint a szekréciós tevékenységet. Toxikus mellékhatása granulocytopeniában mutatkozik, ezért az utóbbi években egy kevésbé toxikus változatát (Na-dietil-ditiokarbamát, DTC) használják. Nukleozidok: a T-sejtek működését stimulálják, hatásuk elsősorban az antivirális (pl. herpesvirusok elleni) védelem fokozásában hasznosítható. Ilyenek a poliribonucleozidok: pl. poliadenil-poliuridilsav komplex vagy poliinozin-policitilsav komplex. Izoprinozin: a vegyület antivirális hatású, kifejezett immunmoduláns sajátossággal. Hatása a lymphocyták és macrophagok cgmp-aktivításának növelésében mutatkozik. Szintetikus polinukleotidok: e vegyületek olyan komplex molekulák (pl. poly I:C), amelyek immunmoduláns hatásukat az interferontermelődés fokozásán keresztül fejtik ki. Ehhez adódik még, hogy segítik a T-helpersejtek aktivitását is, így áttételesen növelik az ellenanyag-termelést Immunszuppresszív szerek 438
459 Immunológia Immunszuppressziót leggyakrabban immunológiai alapokon kialakuló gyulladásos folyamatok kezelése céljából, továbbá szövetek vagy szervek transzplantációja esetén szokás alkalmazni. Az immunszuppresszió lehet: Antigénspecifikus, ami szövetátültetéseknél vezethet eredményre olyan módon, hogy az immunrendszer működését meghatározott időtartamra szuppresszáljuk, amíg a transzplantátum antigénjeivel szemben kialakul az immuntolerancia. Az ilyen eljárások alkalmazása könnyebbé teszi a donorszelekciót, továbbá jelentősen növeli a transzplantátumok élettartamát. A transzplantátumokkal szembeni tolerancia kialakításában járhatónak látszik még olyan eljárások továbbfejlesztése is, mint pl. az anti-idiotípus antitestek indukciója, vagy az antiallogén antitestek stimulációja, valamint a célzott klóndeléció előidézése immunotoxinokkal. Gyulladásos folyamatok csökkentése (nem antigénspecifikus immunszuppresszió): jóval gyakrabban alkalmazott eljárás, ami az immunrendszer fokozott reakcióinak csökkentésére vagy kiiktatására irányul. Figyelembe kell azonban venni, hogy ilyen szuppresszió kiváltásánál a szervezet védekezőképessége általában csökken, ami fertőzésekre és malignus daganatokra való hajlamban mutatkozhat meg. Az ilyen szuppressziók kiváltásának lehetőségei a következő csoportokba sorolhatók: röntgen vagy gamma-sugárzás, glükokortikoidok, cytostaticumok (pl. ciklosporinok), anti-lymphocyta savók. Kortikoszteroidok: a mellékvese által termelt hormonok, a leggyakrabban alkalmazott szuppresszív hatású készítmények (hidrokortizon, prednizolon, metilprednizolon, dexametazol, betametazon). A kortikoszteroidok hatása többirányú: lympholyticus hatás: thymus-nyirokcsomó involució, T-sejtszámcsökkenés, az immunreakciók gátlása, az antigénfelismerés és az IL 2-expresszió fázisában, gyulladásgátló hatás, sejtmigráció gátlás stb. Cytostaticumok (imuran, leukeran): gátolják a sejtszaporodást, a vérképzést, a ciklosporin-a pedig az immunindukció szakaszában fejti ki hatását, és gátolja mind a T-, mind a B-lymphocyták, továbbá az NK sejtek működését is. Anti-lymphocyta savó: szuppresszív hatása részben lymphocytadeléción, részben receptorgátláson alapszik, leggyakrabban transzplantátumok védelmében adagolják. Nem szteroid gyulladásgátlók: alaptípusa az acetilsalicilsav. Az ide tartozó vegyületek a ciklooxigenáz működését gátolják, így a folyamatban a prosztaglandin-szintézis blokkolása a jellemző, tehát gyulladásgátló, de az immunreakciókat nem vagy alig befolyásolják (indometacin, fenilbutazon, voltaren, kalmopyrin). Immunotoxinok: meghatározott sejtfelületi receptorokra ható monoclonalis ellenanyagok és a hozzájuk kötött, a célsejtet elpusztítani képes toxikus anyag konjugátuma. Az immunotoxinok alkalmazása alapvetően új utat jelenthet akár az immunmodulációkban (pl. célzott klóndeléció előidézése) meghatározott szervi betegségek kezelésében, akár egyes daganatos elváltozások terápiájában. Ennek lényege abban foglalható össze, hogy a monoclonalis ellenanyagokkal, amely csak meghatározott sejtreceptorhoz vagy azok csoportjához képesek kötődni, olyan toxikus anyagokat juttathatunk a célsejthez (pl. daganatsejthez), amely azt elpusztítja anélkül, hogy a szervezet más, a célantigént nem hordozó sejtjeit károsítaná. Az immunotoxinok alkalmazásában a jelenlegi nehézségeket az jelenti, hogy a toxikus molekula sejthez való kötődési képességét biztonságosan lehessen kiiktatni, mivel ennek kikapcsolása nélkül a toxin a szervezet más, egészséges sejtjeit is elpusztíthatja. A diphtheriatoxinról pl., amelynek egyetlen molekulája rendkívül gyorsan tönkreteszi a megtámadott sejt fehérjeszintézisét, megállapították, hogy a két polipeptidlánca közül az A-lánc enzimatikusan aktív, a B-lánc pedig a molekula sejtfelszíni kötődéséért felelős. A két polipeptidláncot összekötő 439
460 Immunológia diszulfidhíd felbontásával a B-lánc kiiktatható, az A-lánc viszont a kötődést létrehozó monoclonalis ellenanyaggal célba juttatható, ugyanis ez biztosítja az A-lánc sejtbe való bejutását, amely azután toxikus hatása révén a célsejtet elpusztítja. Az immunotoxinok alkalmazásában természetesen még ma is akadnak nehézségek. Ilyen lehet pl. az ún. céltévesztés,amikor az immunotoxin immunkomplexbe épül be, ilyen módon nem jut el a célsejtig. További lehetőség, hogy az egyébként nagy változatosságot mutató daganatsejteken eltűnik a megcélzott receptor, így a monoclonalis ellenanyag nem képes kötődésre. Az is előfordulhat, hogy a daganatsejtek pl. levedlik a receptoraikat, ilyen módon a kötődés még a sejt elérése előtt, a vérpályában is végbemehet Immundiagnosztika Az immundiagnosztikai próbákat és eljárásokat az alkalmazás célját alapul véve a következők szerint lehet csoportosítani: a fertőző betegségek diagnosztikája, mikroorganizmusok vagy azok antigénjeinek identifikálása, az immunrendszer működésének vagy működési rendellenességeinek meghatározása, autoimmun kórképek diagnosztikája. Az immundiagnosztikai próbák in vitro végezhető eljárásait az 52. táblázat mutatja be. Az in vitro módszerek között megkülönböztetjük: az ún. klasszikus szerológiai próbákat, a vérsavóban lévő ellenanyagok kimutatására, az ún. jelzéses módszereket, a sejtes reakciók meghatározására szolgáló celluláris próbákat, az immunhisztokémiai eljárásokat. Az in vivo módszerekhez az allergiás diagnosztikai próbák tartoznak. 52. táblázat - Szerológiai próbák Agglutinációs próbák Csőagglutinációs próbák Tárgylemez-agglutinációs próbák ABR próba Coombs-próba Hemagglutinációs próbák Precipitációs próbák Acoli-féle próba Uhlenhut-féle próba Immundifuziós próbák Agargél precipitációs próba 440
461 Immunológia Oudin-módszer Oucherloney-módszer Mancini-próba Komplementkötési próbák Vírusneutralizációs próba Jelzéses módszerek RIA, IRMA ELISA Immunfluoreszcencia Immunoblot Celluláris próbák Lymphocytastimulációs próba Macrophagmigrációs próba Rozettaképzési próba Cytotoxikus reakciók Szerológiai próbák A szerológiai módszerekkel leggyakrabban a vérsavóból, a tejből, ritkábban biológiai folyadékokból (pl. liquorból, hüvelynyálkából, spermából) ismert kórokozókkal vagy azok antigénjeivel szembeni ellenanyagok mutathatók ki, és ennek alapján a szervezetnek a kérdéses kórokozóval való fertőzöttsége megállapítható A szerológiai reakciók általános törvényszerűségei Az antigén és ellenanyag kapcsolódása két fázisban zajlik le: I. fázis: kémiai kötődések révén valósul meg, néhány másodperc alatt végbemegy, de nem jár látható eredménnyel, II. fázis: amelyben kolloidkémiai folyamatok zajlanak le, és ezek percek vagy órák elteltével látható reakciót eredményeznek. Ez utóbbi fázisban az antigén ellenanyag kötődés csökkenti az oldat negatív töltését, s amikor a komplex eléri az izoelektromos pontot, akkor megszűnik a korábbi stabilitása, és a baktériumsejtek összecsapódnak (agglutináció) vagy az oldott antigének kicsapódnak (precipitáció). Más esetben a II. fázis nem mutat látható reakciót, viszont az antigén ellenanyag komplex olyan adszorbeálófelületet képez, amely a komplementet megköti, és ha ehhez hozzáadunk egy hemolitikus jelző rendszert, akkor annak változásával érzékelhető reakció alakul ki (komplementkötési próba). A vírusok okozta betegségek jelentős részénél az ellenanyagok vérsavóbeli jelenlétét vírusneutralizációs próbával határozhatjuk meg szövetkultúrákban vagy kísérleti állatokban. A szerológiai reakciók érzékenységét az általuk kimutatható ellenanyag mennyisége szabja meg (53. táblázat). Adott vérsavó ellenanyagtartalmát az ún. titerértékkel fejezzük ki, ami a vérsavónak azt a legmagasabb hígítási értékét jelenti, amelyben a homológ antigénnel még látható szerológiai reakciót ad. 441
462 Immunológia 53. táblázat - A szerológiai próbák érzékenysége, a próbákkal kimutatható proteinek mennyisége Szerológia próba Protein mennyisége (µg/ml) Vírusneutralizáció 0,00005 ELISA 0,0005 Agglutináció 0,05 Hemagglutináció 0,01 Komplementkötés 0,05 Precipitáció folyadék fázisban 18,00 Precipitáció gélközegben 30, Agglutinációs próbák Az agglutináció baktériumok (pl. brucellák), sejtek (pl. vörösvérsejtek) vagy antigénekkel kapcsolt korpuszkuláris anyagok (pl. latex) ellenanyagok hatására létrejövő összecsapódását jelenti, amikor a bivalens ellenanyag-molekulák Fab-részei a korpuszkuláris antigéneket összekapcsolják. Az antigént ebben az értelemben agglutinogénnek, az ellenanyagot pedig agglutininnek is szoktuk nevezni. A próbának két formáját, a tárgylemez- és a csőagglutinációt szokás megkülönböztetni. Tárgylemez-agglutináció. Használatos baktériumtörzsek identifikálására, amikor ismert típussavóval (adott antigén ellen termelt immunsavóval) hozzuk össze a vizsgálandó baktériumokat (pl. salmonellák típusmeghatározása). Máskor ismert baktériumokkal mint antigénnel a vérsavóból mutatunk ki ellenanyagokat (pl. baromfityphus). A tárgylemez-agglutináció megfelelő hőmérsékleten perceken belül kialakul. Csőagglutináció. A próbát úgy hajtjuk végre, hogy a vizsgálandó vérsavó különböző hígításaihoz megfelelő sűrűségű baktériumszuszpenziót adunk. Ha a sejtfalantigén vesz részt a reakcióban, akkor az agglutinátum a cső fenekéhez tapadó, felkúszó szélű üledéket képez, amely felrázva rögökké esik szét (O-agglutináció). Abban az esetben, ha a reakcióban a csillóantigének szerepelnek, akkor az üledék vattaszerű, és felrázásakor laza pelyhek láthatók a szuszpenzióban (H-agglutináció). Ha az antigénhez viszonyítva az ellenanyagok jelentős túlsúlyban vannak a rendszerben, akkor a partikulák receptorai külön-külön is kötődnek egy-egy ellenanyag-molekulával, és így a partikulák összekapcsolódása elmarad, tehát a reakció megtévesztően negatív eredményt ad. A szerológiában ezt zóna jelenségnek nevezik, és kiküszöbölése a vérsavó hígításával lehetséges. Az állatorvosi gyakorlatban az agglutinációs próbát leggyakrabban a brucellosis, a malleus, a baromfityphus, a paratyphus, a leptospirosis stb. diagnosztikájában használjuk. Indirekt agglutinációs próbánál úgy járunk el, hogy vörösvérsejtekhez vagy stabil szuszpenziójú anyagokhoz (bentonithoz, latexhez) adszorbeáltatjuk az oldott antigéneket, és ehhez adjuk a vizsgálandó vérsavót. Az ABR (Abortus Bang Ring) vagy a Fleischhauer-féle gyűrűs próba az agglutinációs próba egy változata, amellyel a tejből brucellák ellen ható ellenanyagokat mutatunk ki. Agglutinációs csőben 1 ml friss tehéntejhez többnyire TTC-vel (trifenil-tetrazolium-kloriddal) pirosra festett, elölt brucellabaktérium-szuszpenzióból 1 2 cseppet adunk, és a tejjel összekeverjük. Ha a tejben ellenanyagok vannak, azok agglutinálják a megfestett brucellákat. Az így keletkezett baktériumaggregátumot a felemelkedő zsírgolyócskák magukkal ragadják, és a feltisztuló tejoszlop felületén intenzív piros gyűrű keletkezik. Negatív esetben a rózsaszínű tejoszlop felületén fehér tejszínréteg alakul ki (202. ábra). 442
463 Immunológia 202. ábra - Az ABR próba Kétes eredményű ABR-reakció esetén a próbát meg kell ismételni olyan módon, hogy a kérdéses tejmintát 1:5 arányban hígítjuk biztosan negatív tejjel. A próba colostrummal is elvégezhető a hasonló hígítás alkalmazásával. Hemagglutináció-gátlási (HAG) próba. Egyes baktériumok, illetve vírusok képesek meghatározott állatfajok vörösvérsejtjeit agglutinálni. Ennek ismeretében, ha pl. a vírusszuszpenziót előzetesen specifikus ellenanyagokat tartalmazó vérsavóval inkubáljuk, akkor a hemagglutináció elmarad. A próba a vizsgálandó savó ellenanyagtartalmáról ad felvilágosítást. Gyakran használjuk pl. a baromfipestis elleni antitestek kimutatására, illetve a vakcinázás hatékonyságának az ellenőrzésére is. Antiglobulin-próba. Az inkomplett ellenanyagok kimutatására szolgál. Leggyakrabban a brucellosis szerodiagnosztikájában használatos. Az inkomplett ellenanyagok univalensek, és bár specifikusan kötődnek a baktériumok vagy egyéb sejtes antigének felületéhez, nem okoznak látható reakciót, sőt azáltal, hogy az antigén receptorait lefoglalják, megakadályozzák a komplett ellenanyagok megkötését. Ezért az inkomplett ellenanyagokat blokkoló ellenanyagoknak is nevezzük. Ezeknek az inkomplett ellenanyagoknak a kötődését úgy tudjuk láthatóvá tenni, hogy a vizsgált állatfaj vérsavója ellen ható antiglobulin-savót adunk a rendszerhez, amely összekapcsolja a baktériumhoz kötődött inkomplett ellenanyagokat (203. ábra),és kialakul az agglutináció ábra - Az antiglobulin-próba vázlata 443
464 Immunológia Precipitációs próbák A precipitációs reakciókban az ellenanyag oldatban lévő antigénnel reagál, és az ezt követő kolloidkémiai folyamatok hatására az antigén ellenanyag komplex oldatából csapadék alakjában válik ki. A reakciónak több változata ismeretes. Csőprecipitációs próbának nevezzük azt a változatát, amikor az antigén és az ellenanyag oldata egy arra alkalmas kémcsőben közvetlenül érintkezik, tehát a komponensek folyadékfázisban reagálnak. A csőben végzett próbánál az antigén- és az ellenanyagoldatot vagy egymással összekeverjük, amikor is a precipitációt az egész folyadékközeg zavarossá válása, majd finom pelyhes ülepedés jelzi (pl. toxinflokkuláció), vagy úgy járunk el, hogy a vérsavóra rárétegezzük az antigénoldatot, és ilyenkor egy precipitációs gyűrű alakul ki a két folyadék érintkezési határán. Ha az antigén és az ellenanyag egymáshoz viszonyított mennyiségei megfelelők, a precipitációs gyűrű középső zónájában nincs szabad antigén vagy szabad ellenanyag, tehát a reakció intenzitása itt a legerősebb. A zóna előtt fokozatosan erősödő (prezóna), utána pedig fokozatosan csökkenő csapadékképződés figyelhető meg (posztzóna). A két zónában a reakció intenzitása aszerint nő vagy csökken, hogy a két komponens mennyisége mennyire egyenlítődik ki. Nagymértékű antigén- vagy ellenanyag felesleg esetén látható precipitációs reakció nem alakul ki. A csapadékképződés fokozatos kialakulása és csökkenése, akárcsak a reakció létrejöttének gátlása, a Marrack-féle rácselmélettel magyarázható (204. ábra) ábra - A Marrack-féle rácselmélet A rácselmélet szerint az antigénnek legalább 4, az ellenanyagnak 2 valenciája, azaz kötődésre képes aktív csoportja van. Egy ellenanyag-molekula tehát 2 antigén-molekulával tud kapcsolódni, az antigén pedig szabadon maradó receptoraival újabb ellenanyag-molekulákkal kötődhet. Az antigén és az ellenanyag ekvivalenciája esetén az összekapcsolódás rácsszerűen történik, és a létrejövő komplex már méreténél fogva is kicsapódásra hajlamos. Ellenanyag-felesleg esetén viszont csak olyan kisebb komplexek képződnek, amelyek nem csapódnak ki. 444
465 Immunológia A gyakorlatban leginkább használatos csőprecipitációs próbák a következők: Ascoli-féle termoprecipitációs próba. A lépfene-fertőzöttség kimutatására szolgáló eljárás. Úgy járunk el, hogy a Bacillus anthracis elleni hiperimmun vérsavót precipitációs csőbe mérjük, és erre rárétegezzük a vizsgálandó szervmintából főzéssel készített, majd azbesztvattán átszűrt vizes kivonatot. A precipitációs reakció 2 3 perc alatt alakul ki. A próba előnye, hogy még rothadt, sőt több éve elföldelt hullaanyagból is elvégezhető, mert a hőálló antigének (haptének) a rothadásnak ellenállnak. A B. anthracis elleni hiperimmun vérsavó keresztreakciót adhat a B. cereus egyes törzseivel. Uhlenhut-féle precipitációs próba. A különféle állatfajok fehérjeantigénjeinek azonosítására vagy a közöttük lévő rokonság megállapítására használatos eljárás. Az egyes állatfajok fehérjéire specifikus antisavókat a kérdéses minta vizes kivonatával hozzuk össze. A precipitációs reakció alapján meghatározható, hogy a minta milyen állatfajból származó fehérjét tartalmaz. Agargél-precipitációs próba (AGP). Az antigén és az ellenanyag találkozása agargél közegben jön létre. A reakció általában 24 óra után bírálható el, és a pozitív reakciót a találkozás zónájában kialakuló precipitációs ív jelzi. Több változata ismeretes: Lineáris géldiffúzió (Oudin módszer). A vizsgálandó vérsavót egyenlő mennyiségben 2%-os agaroldattal elegyítjük, precipitációs csőbe mérjük, majd megdermedés után rámérjük az antigénoldatot. Az antigén a gélközegbe diffundál, és a reakció a gélközegben alakul ki. Lineáris kettős géldiffúzió. Mind a vizsgálandó vérsavót, mind az antigént agaroldattal elegyítjük és egymás fölé rétegezzük. A mennyiségi viszonyoktól függően a precipitációs sávok az antigén vagy az ellenanyag zónájában alakulnak ki. Kétdimenziós kettős géldiffúzió (Ouchterlony-módszer). Petri-csészében vagy tárgylemezen megmerevített agarlemezbe tartályokat vágunk, és ezekbe bemérjük az antigént, illetve az ellenanyagot. A komponensek az agarban radiálisan diffundálnak, és találkozásuk vonalában alakul ki a precipitációs ív. Az AGP próbát több betegség diagnosztizálásában használjuk, pl. a Brucellaovis fertőzés, a lovak fertőző kevésvérűsége (Coggins-teszt), a szarvasmarha-leukosis, egyes vírus okozta baromfibetegségek stb. kórjelzésében. Az Ouchterlony-féle rendszer alkalmazása lehetővé teszi baktériumok, vírusok stb. antigénszerkezetének tanulmányozását is azon az alapon, hogy a kialakuló precipitációs ívek száma a rendszerben levő antigén ellenanyag párok minimális számát adja meg, így tehát meghatározható egy feltárt baktérium vagy vírus esetében az antigénkomponensek minimális száma. Az ún. identitási reakcióból pedig következtetni lehet két antigénoldat komponenseinek a különbözőségére vagy azonosságára aszerint, hogy az ívek keresztezik egymást vagy áthajolnak egymásba. Az identitási reakciók sémáját a 205. és 206. ábra szemlélteti ábra - Az identitási reakciók 206. ábra - Az AGP próba 445
466 Immunológia Mancini-próba (radiális immundiffúzió). Ha az antigénoldat a megfelelően előkészített tartályból olyan agarlemezbe diffundál, amelybe előzőleg ellenanyagot elegyítettünk, akkor gyűrű alakú precipitáció alakul ki. A gyűrű átmérője arányban áll az antigén koncentrációjával, így a módszer megbízhatóan alkalmazható kvantitatív mérésekre. Természetesen előzetesen standard sorral kell a gyűrű nagyságának megfelelő koncentrációt meghatározni (207. ábra) ábra - A Mancini-féle próba Immunelektroforézis Ez a módszer lényegében az AGP kombinálása elektroforézissel. Két fázisban végezzük: első fázis: elektroforézis agargél közegben, amelynek során az oldatban lévő antigénkomponenseket elektroforetikus mobilitásuknak megfelelően szétválasztjuk, második fázis: az immunprecipitáció, amelyet úgy végzünk, hogy az elektroforézis után a lemez szélén készített keskeny vályúba bemérjük az immunsavót. A lemezt nedveskamrába helyezzük, és 37 C-on inkubáljuk, majd az eredményt 24 óra múlva leolvassuk. A módszer előnye, hogy az egyes antigénkomponensek nemcsak antigenitásuk, hanem elektroforetikus sajátosságaik alapján is jellemezhetők. A szérumfehérjék és más testfolyadékok vizsgálatában vagy mikroorganizmusok antigénszerkezetének tanulmányozásában és 446
467 Immunológia összehasonlításában az immunelektroforézis kiterjedten használatos eljárás. A szérumfehérjék immunelektroforézisét a 208. és a 209. ábra szemlélteti ábra - Szérumfehérjék immun-elektroforézise 209. ábra - Szérumfehérjék immun-elektroforézise agarközegben Az immun-elektroforézisnek több olyan változata ismeretes, amelyek kvantitatív mérésekre is alkalmasak. Ilyen eljárás az ún. rocket-elektroforézis vagy elektroimmun-diffúzió, amely lényegében kétféleképpen használatos aszerint, hogy antigénkeverék vagy csupán egy antigénféleség kvantitatív méréséről van-e szó. Antigénkeverékek esetében az elektroforézis két dimenzióban történik, vagyis egyszer elektroforetizáljuk az antigénoldatot, majd az ún. nem hasznos agarrészt eltávolítjuk, és helyébe az antigénkeverékkel szembeni antisavóval elegyített agart mérjük. Ezt követően a lemezt 90 -kal elfordítjuk, és újra elektroforetizáljuk (210. ábra). Ebben a dimenzióban az antigénkomponensek ellenanyagokkal kapcsolódnak és precipitálódnak. Olyan 447
468 Immunológia esetben, ha csupán egy antigén mennyiségét vizsgáljuk (pl. tejminták laktalbumin-tartalmát), akkor a mintát közvetlenül az ellenanyag tartalmú agarba futtatjuk ábra - Rocket-elektroforézis Immunoblot eljárás Az elmúlt évtizedben kifejlesztett eljárás, amely új lehetőségeket teremtett a fehérjék, a peptidek és a nukleinsavak vizsgálatában. Az elektroforézist SDS-t (nátrium dodecil szulfát) tartalmazó poliakrilamid-gélen (PAG) végezzük. A szétválasztott fehérjéket (WESTERN bloting) vagy nukleinsavakat (SOUTHERN bloting) megfelelő módon olyan membránra (pl. cellulózacetátra) visszük át, ami azokat megköti, majd a membránon a különböző fragmenseket FITC-vel, peroxidázzal vagy izotóppal jelzett ellenanyagokkal reagáltatjuk. A módszer alkalmas pl. a kórokozó antigénszerkezetének összehasonlítására vagy annak megállapítására, hogy a vizsgált antigének közül melyek képviselik az immunogén hatást Komplementkötési (KK) próba A KK próba érzékeny szerológiai eljárás, amely az ellenanyagok vagy antigének kis mennyiségének kimutatására is alkalmas. A próba során általában oldott, ritkábban korpuszkuláris antigént alkalmazunk, mivel azonban ezek kötődése az ellenanyagokkal nem hoz létre látható szerológiai reakciót, a komponenseket kiegészítjük egy ún. hemolitikus jelző rendszerrel, amelynek működését az a komplement szabályozza, amit ugyancsak kiegészítésként adunk a keverékhez. A próba mechanizmusa a következőkben foglalható össze. A vizsgálandó vérsavóban lévő ellenanyagok kötődnek az antigénnel, és ez a kapcsolódás aktiválja a komplementet, amely az antigén ellenanyag komplex felületén megkötődik. Mivel szabad komplement nem marad, a jelző rendszerben levő hemolizin (juhvörösvérsejt ellenanyaga) nem tudja feloldani a vörösvérsejteket, azok leülepednek, így az eredmény pozitív. Ha viszont antigén ellenanyag kötődés nem történik, a komplement szabadon marad, és feloldja a hemolizinnel kapcsolt vörösvérsejteket. A reakció direkt változatát két fázisban hajtjuk végre: 448
469 Immunológia Az 56 C-on inaktivált vérsavót és az antigént egy csőbe mérjük, majd kiegészítjük meghatározott mennyiségű komplementtel (friss tengerimalac-vérsavóval). Ezt az első fázist 37 C-on vízfürdőn 20 percig inkubáljuk. Az inkubálás után kiegészítjük a rendszert a juhvörösvérsejtek és hemolizin (juhvörösvérsejtekkel szemben termelt ellenanyag) keverékével, majd ismét 20 percen át 37 C-on inkubáljuk. A KK próba vázlatát a 211. ábra szemlélteti. A KK próbát kiterjedten alkalmazzuk a brucellosis, a malleus, a tenyészbénaság, valamint számos vírusos betegség diagnosztikájában ábra - A direkt komplement kötési próba vázlata A KK próbának ismeretes az ún. indirekt változata is. Olyan esetekben, amikor a vizsgálandó vérsavóban inkomplett ellenanyagok lehetnek jelen, akkor azok az antigénnel való kötődéskor nem képeznek olyan komplexet, amely alkalmas felületet adna a komplement adszorbeálódásához. Az ilyen inkomplett antitestek kimutatására használjuk az indirekt KK próbát. A próbát 3 fázisban hajtjuk végre, amint azt vázlatosan a 212. ábra mutatja. Az első fázisban az antigént és a vizsgálandó vérsavót inkubáljuk, majd a II. fázisban komplementet és olyan vérsavót adunk hozzá, amely ismert titerben komplett ellenanyagokat tartalmaz az alkalmazott antigénnel szemben. Ismételt inkubálás után a III. fázisban hozzáadjuk a hemolitikus rendszert ábra - Az indirekt komplementkötési próba vázlata Amennyiben a vizsgálandó vérsavóban inkomplett antitestek nincsenek jelen, akkor a II. fázis vérsavójában lévő komplett ellenanyagokkal kötődik az antigén, amely alkalmas a komplement megkötésére, tehát hemolízis nem következik be. Az indirekt KK próba tehát negatív eredményű. A vizsgálandó vérsavó inkomplettantitest-tartalma esetén ezek kötődnek az antigénhez, ezáltal a II. fázisban alkalmazott vérsavó már nem jut szerephez. Az említett okok miatt ilyenkor a komplement szabadon marad, hatását a hemolitikus rendszerre fejti ki, és a bekövetkező hemolízis pozitív eredményt jelent, azaz a vizsgálandó vérsavóban inkomplett antitestek jelenlétére utal Vírusneutralizációs (VN) próba Ismert vírusszuszpenziót az ellenanyag-tartalmú vérsavóval megfelelő arányban elegyítünk, majd a vérsavó vírussemlegesítő hatását szövettenyészetben, fiasított tyúktojásban vagy kísérleti állatokban ellenőrizzük A szerológiai próbák értékelése 449
470 Immunológia A szerodiagnosztikai eljárásokkal leggyakrabban arra kívánunk választ kapni, hogy az adott vérmintában az alkalmazott antigénekkel szemben kimutathatók-e ellenanyagok. Az immunválasz során korai és késői ellenanyagok jelennek meg a véráramban, amelyek lehetnek agglutináló, precipitáló, komplementkötő, vírusneutralizáló stb. ellenanyagok. A különféle ellenanyagok a fertőzés meghatározott időszakában egymagukban, vagy együttesen fordulhatnak elő. Az elmondottakból következik, hogy a különféle szerológiai próbák eredményeinek nem kell szükségszerűen fedniük egymást. A precipitációs reakciókban főleg IgG és részben IgM típusú ellenanyagok, az agglutinációs próbákban az IgM- és az IgG-molekulák szerepelnek, a KK és az antiglobulin-próbában pedig elsősorban IgG típusú antitesteket mutatunk ki (az utóbbi próbában inkomplett formában is). Ennek alapján a többféle próba együttes eredményéből a fertőzés lefolyásáról is tájékozódást nyerhetünk, mivel a precipitációs és az agglutinációs próbák többnyire a friss fertőzésekben, a KK próba pedig inkább a betegség előrehaladott szakaszában ad pozitív eredményt. Mivel az inkomplett ellenanyagok perzisztálnak leghosszabb ideig, az antiglobulin-próba még olyan idült fertőzések esetében is pozitív lehet, amikor a többi szerológiai próba már nem jelzi a fertőzöttséget Celluláris próbák A celluláris próbák élő lymphoid sejtekkel in vitro végzett vizsgáló eljárások, amelyek alkalmasak a szervezet immunstátusának meghatározására. A próbában a vizsgálandó szervezet perifériás fehérvérsejtjeit használjuk, amelyeket vérmintából nyerünk. A fehérvérsejtek szeparálására célszerű Ficoll-paque-ot alkalmazni, ami lehetőséget nyújt a sejtek gradiens centrifugálással történő kinyerésére. A szeparált fehérvérsejteket a túlélésük érdekében arra alkalmas tápfolyadékban (pl. Parker-100 vagy Hanks-féle oldatban) szuszpendáljuk, amely 10% fetális borjúsavót tartalmaz. A fehérvérsejtszámot általában 10 6 /ml sűrűségre állítjuk. Az élő és az elhalt sejtek arányát tripánkékfestéssel ellenőrizzük. A különböző reakciók során a sejteket 3 5% CO 2 jelenlétében inkubáljuk Immunrozetta-képzés A fehérvérsejt-szuszpenzióhoz olyan juhvörösvérsejteket adunk, amelyek felületére előzetesen a kérdéses antigént adszorbeáltattuk, majd a rendszert kiegészítjük az antigénre specifikus ellenanyagok meghatározott hígításával (EAC-rozetta). Amennyiben az antigént a felismerő képességgel rendelkező fehérvérsejtek már ismerik, tehát korábban már találkoztak ugyanezzel az antigénnel, akkor 3 6 órán belül a vörösvérsejteket a felületükhöz kapcsolják Lymphocytastimulációs próba (LST) A T- és a B-lymphocyták blastosan transzformálódhatnak specifikus úton, olyan antigénekkel való stimuláció következtében, amelyekkel szemben korábban már sensibilisálódtak. A blastos transzformálódás órát vesz igénybe. A blastogenesis arányából, amelyet a 3 HTdR (triciál-timidin) incorporációja alapján autoradiografiás úton vagy folyadékszcintillációs módszerrel határozunk meg, következtetni lehet a vizsgált szervezetnek az alkalmazott antigénnel szembeni reakciókészségére. A lymphocytastimuláció nem specifikus úton, mitogénekkel (PHA, Con-A) is kiváltható, és a kapott stimulációs indexek a T- és a B-sejtek reakcióképességét jelzik Macrophagmigráció-gátlás A reakciót a késői típusú sensitivitás in vitro reprodukciójaként foghatjuk fel. A macrophagok vándorlását (migrációját) gátolja egy olyan faktor, amelyet az alkalmazott antigénnel szemben a már sensibilis lymphocyták termelnek. A lymphocyták az antigénnel való érintkezés után kb. 6 órával kezdik termelni ezt a faktort. A próbát leggyakrabban úgy hajtjuk végre, hogy a fehérvérsejt-szuszpenziót kapilláris csőbe szívjuk, majd a sejteket a cső lezárt vége irányába centrifugálással ülepítjük. A sejt folyadék határnál a kapillárist eltörjük, és nyitott végével olyan cellácskákba helyezzük, amelybe előzetesen antigéntartalmú tápfolyadékot öntöttünk. Ezt a rendszert inkubáljuk, és ha a lymphocyták az antigénnel szemben érzékenyek, akkor a macrophagoknak a csőből való migrációját a már említett faktor termelésével meggátolják Cytotoxikus reakció A próba mechanizmusa azon alapszik, hogy a celluláris immunrendszer effektorsejtjei, a T-killersejtek az antigénhordozó célsejtet (targetsejtet) elpusztítják. Ez lehet közvetlen T-sejthatás, máskor azonban a célsejt elpusztítása komplement- vagy antitestdependens (lásd a Vírusokkal szembeni immunválasz c. fejezetet). 450
471 Immunológia A targetsejteket általában 5l Cr-mal jelöljük, és a cytotoxicitás mértékét a reakció során felszabaduló 5l Cr alapján értékeljük Jelzéses módszerek Radioimmunológiai eljárások Az izotóppal jelzett immunreagensek felhasználásával ezek a módszerek egyesítik az izotóptechnika érzékenységét és az immunológiai módszerek fajlagosságát. Ez magyarázza azt, hogy e módszerek a biológiai anyagok mérésében az elmúlt évtizedekben széleskörűen elterjedtek. A radioimmun módszer elméleti megalapozása és gyakorlati felhasználása YALOW és BERSON (1950) nevéhez fűződik, akik a vérben jelenlévő inzulin pontos mérésére alkalmazták. Módszerük lényege azon a megfigyelésen alapszik, hogy az ellenanyaghoz kötött 131 I-inzulint a jelöletlen inzulin kiszorítja az antigén ellenanyag komplexből, és a felszabaduló 131 I-inzulin mérése lehetővé teszi a vizsgálandó vérsavóban lévő inzulin mennyiségének pontos meghatározását. A radioimmun módszerek számos változata ismeretes aszerint, hogy egyrészt a jelölt immunreagens antigén (RIA: Radioimmune Assay) vagy ellenanyag-e (IRMA: Immunoradiometric Assay), másrészt az antigénellenanyagkomplex és a szabadon maradó immunreagens elválasztásának módja szerint. Ezek közös alapelve az, hogy a jelölt és a jelöletlen reagensek versenyeznek a korlátozott számú fajlagos kötődési helyért, és a jelöletlen anyag koncentrációjának növelése a jelölt anyag kötődésére gátlólag hat. A mérendő anyag koncentrációja úgy határozható meg, hogy a mintában, valamint a standardokban mért gátlások értékeit összehasonlítjuk. A változatok közül gyakran alkalmazzák azt a formát, amelyben az immunreagenst szilárd fázishoz kötik, mert az elválasztás így könnyebb (szilárd fázisú radioimmun módszer). A radioimmun módszerek közé soroljuk az ún. lemezmódszereket is, amelyekben a jelölt antigén pl. agargél közegben reagál az immunsavóval, és az így kialakuló precipitációs reakciók kimutathatósága megnő ELISA (Enzyme Linked Immunosorbent Assay) Az eljárás megbízhatósága és egyszerűsége miatt nagy népszerűségre tett szert. A módszer egyaránt alkalmas antigének és ellenanyagok kimutatására. A próba során az antigént a megfelelő polisztirol lemezek falához, tehát szilárd felülethez adszorbeáljuk. A vizsgálandó vérsavó specifikus ellenanyagai kötődnek az antigénnel, a nem kötődő ellenanyagokat pedig mosással eltávolítjuk, majd olyan fajspecifikus antiglobulin-savóval egészítjük ki a rendszert, amelyet torma-peroxidáz vagy egyéb enzimmel konjugáltunk. A reakcióba nem lépett antiglobulin-konjugátum molekulákat mosással távolítjuk el. Az antigén ellenanyag antiglobulin konjugátum szendvicset az enzim szubsztrátjának hozzáadásával színreakció formájában láthatóvá tesszük és kolorimetrikusan értékeljük (213. ábra) ábra - ELISA próba vázlata 451
472 Immunológia Immunfluoreszcencia (IF) Az IF széles körben elterjedt, igen érzékeny vizsgáló módszer, amely antigének és ellenanyagok kimutatására egyaránt alkalmas. A leggyakrabban használt jelzőfesték a fluoreszcein-izotiocianát (FITC) és a rodamin-b, amelyek UV fényben zöld, illetve vörös színben fluoreszkálnak. E festékkel jelzett Ig-tartalmú savót konjugátumnak nevezzük. Amikor a vizsgálat során a jelzőfestéket nem látható ultraibolya fény éri (290 nm), akkor az 525 nm hullámhosszúságú látható fényt ad vissza. Az IF módszer direkt és indirekt változata ismeretes. Direkt IF módszernél a kórokozókat (baktériumokat, vírusokat) közvetlenül a vizsgálati anyagokból vagy táptalajból, illetve szövettenyészetekből mutatjuk ki a kórokozóra vagy antigénjeire nézve specifikus konjugátummal. A mintákat rendszerint acetonban fixáljuk, specifikus konjugátummal fedjük, majd legalább 30 percig 37 C-on, nedves kamrában inkubáljuk. A lemezt mosás után Evans-kékkel kontrasztfestjük, glicerines pufferben fedőlemezzel zárjuk, és fluoreszcensz mikroszkópban vizsgáljuk. A próba vázlatát a 214. ábra szemlélteti. A 215.ábra adenovírus kimutatását demonstrálja direkt IF-próbával ábra - Adenovírusok kimutatása szövettenyészetben 215. ábra - Direkt IF eljárás 452
473 Immunológia Az indirekt IF módszer (szendvicsmódszer) során az ismert kórokozót vagy antigénjeit tartalmazó mintákat az első lépésben a vizsgálandó vérsavóval inkubáljuk. Ezt követően a vizsgálandó vérsavónak megfelelő specificitású antiglobulin-konjugátummal fedjük a készítményt (216. ábra) ábra - Indirekt IF eljárás Avidin-biotin módszer A legutóbbi években kifejlesztett eljárás, amely növeli mind az ELISA, mind az immunfluoreszcencia érzékenységét. A módszer azon alapszik, hogy az ellenanyagokhoz kötött biotinmolekula több, de legalább négy FITC-vel vagy peroxidázzal jelzett avidinmolekulával képes kapcsolódni Immunperoxidáz reakció Eredetileg immunhisztokémiai eljárásnak számított, majd elterjedt antigének kimutatására is. A próba során használt tisztított ellenanyagokat peroxidázzal jelöljük, majd az antigén ellenanyag kapcsolatot az enzim szubsztrátjának hozzáadása után intenzív sötétbarna szín mutatja. A módszer előnye, hogy az így kezelt szövettani metszetek elektronmikroszkópos vizsgálatra is alkalmasak, továbbá, hogy a készítmények, szemben az IF preparátumokkal, korlátlan ideig tárolhatók és értékelhetők Allergiás diagnosztikai próbák Az allergiás diagnosztikai próbák olyan in vivo végzett vizsgálati módszerek, amelyekkel megállapítható az adott szervezet meghatározott kórokozókkal való fertőzöttsége. Az allergiás diagnosztikai próbák arra adnak választ, hogy a vizsgált szervezetben vannak-e az alkalmazott allergénnel szemben áthangolódott sejtek. Ha pl. a tuberkulint olyan egyed bőrébe oltjuk, amely korábban a M. bovisszal fertőződött, akkor lokális gyulladásos reakció alakul ki, amely mechanizmusát tekintve megfelel a IV. típusú hypersensitivitási reakciónak. Ez a gyulladásos reakció szövettanilag is különbözik a klasszikus heveny gyulladás képétől, mivel az infiltrációban szereplő sejtek legnagyobb része mononuclearis sejtekből (macrophagokból és lymphocytákból) adódik, és neutrophil granulocyták legfeljebb átmenetileg, a reakció kezdeti szakaszában akkumulálódnak. A gyulladásos reakció pl. szarvasmarhában a 72. órára válik legerősebbé, majd intenzitása fokozatosan csökken. Néha a reakció olyan intenzív is lehet, hogy az antigénbevitel helyén necrosis alakul ki. Kutyában a próbát a comb belső felületén szokás végezni, és a próbát a 48. órában lehet elbírálni. Kutyában a próba megbízhatósága kérdéses, ezért csak a pozitív eredmény lehet mérvadó. Baromfiban az állebenybe oltjuk a madártuberkulint, és 36 óra után bíráljuk el. Az állatorvosi gyakorlatban többféle allergént használunk. Az allergének (tuberkulin, mallein, brucellin stb.) a baktériumokból vagy azok levestenyészetének szűrletéből készülnek. Az allergének előállításának 453
SZIGORLATI KÉRDÉSEK Általános és orális mikrobiológia III. éves fogorvostan-hallgatók
 SZIGORLATI KÉRDÉSEK Általános és orális mikrobiológia III. éves fogorvostan-hallgatók 2010/2011. tanév. I. félév I. 1. A mikrobiológia felosztása, és rövid története 2. A baktériumok mérete, alakja és
SZIGORLATI KÉRDÉSEK Általános és orális mikrobiológia III. éves fogorvostan-hallgatók 2010/2011. tanév. I. félév I. 1. A mikrobiológia felosztása, és rövid története 2. A baktériumok mérete, alakja és
11. Szelektív toxicitás, kemoterápiás index és az antibakteriális kemoterápia alapelvei
 Általános Orvostudományi Kar Orvosi Mikrobiológia Kollokvium kérdések 2018/2019-as tanév I. Általános mikrobiológia és általános bakteriológia 1. Az orvosi mikrobiológia tárgya, felosztása, rövid története
Általános Orvostudományi Kar Orvosi Mikrobiológia Kollokvium kérdések 2018/2019-as tanév I. Általános mikrobiológia és általános bakteriológia 1. Az orvosi mikrobiológia tárgya, felosztása, rövid története
a NAT /2008 számú akkreditálási ügyirathoz
 Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a NAT-1-1422/2008 számú akkreditálási ügyirathoz Az Állat-egészségügyi Labor Diagnosztikai Szolgáltató Kft. (5600 Békéscsaba, Szabolcs u. 34.) akkreditált
Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a NAT-1-1422/2008 számú akkreditálási ügyirathoz Az Állat-egészségügyi Labor Diagnosztikai Szolgáltató Kft. (5600 Békéscsaba, Szabolcs u. 34.) akkreditált
Bakteriológia. 2. fejezet
 Bakteriológia 2. fejezet Prokarióta sejtszerkezetű élőlényekkel foglalkozik Baktériumok Ősbaktériumok Prokarióta: nem rendelkezik valódi, magmembránnal határolt sejtmaggal, citoplazmájában nincsenek membránnal
Bakteriológia 2. fejezet Prokarióta sejtszerkezetű élőlényekkel foglalkozik Baktériumok Ősbaktériumok Prokarióta: nem rendelkezik valódi, magmembránnal határolt sejtmaggal, citoplazmájában nincsenek membránnal
NUKLEINSAVAK. Nukleinsav: az élő szervezetek sejtmagvában és a citoplazmában található, az átöröklésben szerepet játszó, nagy molekulájú anyag
 NUKLEINSAVAK Nukleinsav: az élő szervezetek sejtmagvában és a citoplazmában található, az átöröklésben szerepet játszó, nagy molekulájú anyag RNS = Ribonukleinsav DNS = Dezoxi-ribonukleinsav A nukleinsavak
NUKLEINSAVAK Nukleinsav: az élő szervezetek sejtmagvában és a citoplazmában található, az átöröklésben szerepet játszó, nagy molekulájú anyag RNS = Ribonukleinsav DNS = Dezoxi-ribonukleinsav A nukleinsavak
Immunológia alapjai előadás. Az immunológiai felismerés molekuláris összetevői.
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Mikroorganizmusok patogenitása
 Mikroorganizmusok patogenitása Dr. Maráz Anna egyetemi tanár Mikrobiológia és Biotechnológia Tanszék Élelmiszertudományi Kar Budapesti Corvinus Egyetem Mikroorganizmusok kölcsönhatásai (interakciói) Szimbiózis
Mikroorganizmusok patogenitása Dr. Maráz Anna egyetemi tanár Mikrobiológia és Biotechnológia Tanszék Élelmiszertudományi Kar Budapesti Corvinus Egyetem Mikroorganizmusok kölcsönhatásai (interakciói) Szimbiózis
A preventív vakcináció lényege :
 Vakcináció Célja: antigénspecifkus immunválasz kiváltása a szervezetben A vakcina egy olyan készítmény, amely fokozza az immunitást egy adott betegséggel szemben (aktiválja az immunrendszert). A preventív
Vakcináció Célja: antigénspecifkus immunválasz kiváltása a szervezetben A vakcina egy olyan készítmény, amely fokozza az immunitást egy adott betegséggel szemben (aktiválja az immunrendszert). A preventív
Immunológia alapjai előadás. Az immunológiai felismerés molekuláris összetevői
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői Az antigén fogalma. Antitestek, T- és B- sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
Immunológiai módszerek a klinikai kutatásban 3. előadás Az immunrendszer molekuláris elemei: antigén, ellenanyag, Ig osztályok Az antigén meghatározása Detre László: antitest generátor - Régi meghatározás:
INTRACELLULÁRIS PATOGÉNEK
 INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
INTRACELLULÁRIS PATOGÉNEK Bácsi Attila, PhD, DSc etele@med.unideb.hu Debreceni Egyetem, ÁOK Immunológiai Intézet INTRACELLULÁRIS BAKTÉRIUMOK ELLENI IMMUNVÁLASZ Példák intracelluláris baktériumokra Intracelluláris
Immunológia alapjai előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok:
 Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
Immunológia alapjai 3 4. előadás Az immunológiai felismerés molekuláris összetevői. Az antigén fogalma. Antitestek, T- és B-sejt receptorok: molekuláris szerkezet, funkciók, alcsoportok Az antigén meghatározása
TERMÉKMINŐSÍTÉS ÉS TERMÉKHIGIÉNIA. Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010
 TERMÉKMINŐSÍTÉS ÉS TERMÉKHIGIÉNIA Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 Előadás áttekintése Gazdasági haszonállatok tartástechnológiájának higiéniai kérdései állategészségügyi
TERMÉKMINŐSÍTÉS ÉS TERMÉKHIGIÉNIA Az Agrármérnöki MSc szak tananyagfejlesztése TÁMOP-4.1.2-08/1/A-2009-0010 Előadás áttekintése Gazdasági haszonállatok tartástechnológiájának higiéniai kérdései állategészségügyi
A nukleinsavak polimer vegyületek. Mint polimerek, monomerekből épülnek fel, melyeket nukleotidoknak nevezünk.
 Nukleinsavak Szerkesztette: Vizkievicz András A nukleinsavakat először a sejtek magjából sikerült tiszta állapotban kivonni. Innen a név: nucleus = mag (lat.), a sav a kémhatásukra utal. Azonban nukleinsavak
Nukleinsavak Szerkesztette: Vizkievicz András A nukleinsavakat először a sejtek magjából sikerült tiszta állapotban kivonni. Innen a név: nucleus = mag (lat.), a sav a kémhatásukra utal. Azonban nukleinsavak
A T sejt receptor (TCR) heterodimer
 Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Immunbiológia - II A T sejt receptor (TCR) heterodimer 1 kötőhely lánc lánc 14. kromoszóma 7. kromoszóma V V C C EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL lánc: VJ régió lánc: VDJ régió Nincs szomatikus
Natív antigének felismerése. B sejt receptorok, immunglobulinok
 Natív antigének felismerése B sejt receptorok, immunglobulinok B és T sejt receptorok A B és T sejt receptorok is az immunglobulin fehérje család tagjai A TCR nem ismeri fel az antigéneket, kizárólag az
Natív antigének felismerése B sejt receptorok, immunglobulinok B és T sejt receptorok A B és T sejt receptorok is az immunglobulin fehérje család tagjai A TCR nem ismeri fel az antigéneket, kizárólag az
Szervezetünk védelmének alapja: az immunológiai felismerés
 Szervezetünk védelmének alapja: az immunológiai felismerés Erdei Anna ELTE, TTK, Biológiai Intézet Immunológiai Tanszék ELTE, Pázmány-nap, 2012. Az immunrendszer fő feladata a gazdaszervezet védelme a
Szervezetünk védelmének alapja: az immunológiai felismerés Erdei Anna ELTE, TTK, Biológiai Intézet Immunológiai Tanszék ELTE, Pázmány-nap, 2012. Az immunrendszer fő feladata a gazdaszervezet védelme a
(1) A T sejtek aktiválása (2) Az ön reaktív T sejtek toleranciája. α lánc. β lánc. V α. V β. C β. C α.
 Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
Immunbiológia II A T sejt receptor () heterodimer α lánc kötőhely β lánc 14. kromoszóma 7. kromoszóma 1 V α V β C α C β EXTRACELLULÁRIS TÉR SEJTMEMBRÁN CITOSZÓL αlánc: VJ régió β lánc: VDJ régió Nincs
A vírusok kutatásának gyakorlati és elméleti jelentősége
 Vírustan - virológia Jenner himlő elleni vakcina (1798) Pasteur veszettség elleni vakcina (1885) Ivanovszkij az első növénykórokozó vírus felfedezése (dohánymozaik vírus) (1892) Loeffler és Frosch száj-
Vírustan - virológia Jenner himlő elleni vakcina (1798) Pasteur veszettség elleni vakcina (1885) Ivanovszkij az első növénykórokozó vírus felfedezése (dohánymozaik vírus) (1892) Loeffler és Frosch száj-
A baktériumok (Bacteria) egysejtű, többnyire pár mikrométeres mikroorganizmusok. Változatos megjelenésűek: sejtjeik gömb, pálcika, csavart stb.
 BAKTÉRIUMOK A baktériumok (Bacteria) egysejtű, többnyire pár mikrométeres mikroorganizmusok. Változatos megjelenésűek: sejtjeik gömb, pálcika, csavart stb. alakúak lehetnek. A mikrobiológia egyik ága,
BAKTÉRIUMOK A baktériumok (Bacteria) egysejtű, többnyire pár mikrométeres mikroorganizmusok. Változatos megjelenésűek: sejtjeik gömb, pálcika, csavart stb. alakúak lehetnek. A mikrobiológia egyik ága,
Chlamydiaceae család 2014.12.02. Obligát intracelluláris baktérium. Replikációs ciklus: Antigenitás. Humán patogén chlamydiák
 Chlamydiaceae család Obligát intracelluláris baktérium Replikáció: élő szövetekben, élőlényekben Replikációs ciklus: Elemi test, reticularis test Antigenitás Csoportspecifikus LPS antigen Faj- és típusspecifikus
Chlamydiaceae család Obligát intracelluláris baktérium Replikáció: élő szövetekben, élőlényekben Replikációs ciklus: Elemi test, reticularis test Antigenitás Csoportspecifikus LPS antigen Faj- és típusspecifikus
A BRDC KÓROKTANA ÉS TÜNETTANA AETIOLOGY AND CLINICAL SIGNS OF BRDC
 Nemzetközi Szarvasmarha Akadémia Szarvasmarha telepi BRDC menedzsment a gyakorlatban Budapest, 2012. november 30. A BRDC KÓROKTANA ÉS TÜNETTANA AETIOLOGY AND CLINICAL SIGNS OF BRDC Fodor László Szent István
Nemzetközi Szarvasmarha Akadémia Szarvasmarha telepi BRDC menedzsment a gyakorlatban Budapest, 2012. november 30. A BRDC KÓROKTANA ÉS TÜNETTANA AETIOLOGY AND CLINICAL SIGNS OF BRDC Fodor László Szent István
Mikroorganizmusok patogenitása
 Mikroorganizmusok patogenitása Dr. Maráz Anna egyetemi tanár Mikrobiológia és Biotechnológia Tanszék Élelmiszertudományi Kar Budapesti Corvinus Egyetem Mikroorganizmusok kölcsönhatásai (interakciói) Szimbiózis
Mikroorganizmusok patogenitása Dr. Maráz Anna egyetemi tanár Mikrobiológia és Biotechnológia Tanszék Élelmiszertudományi Kar Budapesti Corvinus Egyetem Mikroorganizmusok kölcsönhatásai (interakciói) Szimbiózis
Az ellenanyagok szerkezete és funkciója. Erdei Anna Immunológiai Tanszék ELTE
 Az ellenanyagok szerkezete és funkciója Erdei Anna Immunológiai Tanszék ELTE Bev. 1. ábra Immunhomeosztázis A veleszületett és az adaptív immunrendszer szorosan együttműködik az immunhomeosztázis fenntartásáért
Az ellenanyagok szerkezete és funkciója Erdei Anna Immunológiai Tanszék ELTE Bev. 1. ábra Immunhomeosztázis A veleszületett és az adaptív immunrendszer szorosan együttműködik az immunhomeosztázis fenntartásáért
17.2. ábra Az immunválasz kialakulása és lezajlása patogén hatására
 11. 2016. nov 30. 17.2. ábra Az immunválasz kialakulása és lezajlása patogén hatására 17.3. ábra A sejtközötti térben és a sejten belül élő és szaporodó kórokozók ellen kialakuló védekezési mechanizmusok
11. 2016. nov 30. 17.2. ábra Az immunválasz kialakulása és lezajlása patogén hatására 17.3. ábra A sejtközötti térben és a sejten belül élő és szaporodó kórokozók ellen kialakuló védekezési mechanizmusok
A malacok fontosabb felnevelési betegségei
 A malacok fontosabb felnevelési betegségei Varga János egyetemi tanár az MTA tagja Szent István Egyetem Állatorvos-tudományi Kar Mikrobiológia és Járványtan Tanszék 1581 Budapest, 146 Pf. 22. A szopós
A malacok fontosabb felnevelési betegségei Varga János egyetemi tanár az MTA tagja Szent István Egyetem Állatorvos-tudományi Kar Mikrobiológia és Járványtan Tanszék 1581 Budapest, 146 Pf. 22. A szopós
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás.
 Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Az immunrendszer felépítése Veleszületett immunitás (komplement, antibakteriális
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Az immunrendszer felépítése Veleszületett immunitás (komplement, antibakteriális
Immunszerológia I. Agglutináció, Precipitáció. Immunológiai és Biotechnológiai Intézet PTE-KK
 Immunszerológia I. Agglutináció, Precipitáció Immunológiai és Biotechnológiai Intézet PTE-KK Antigén Antitest Alapok Antigén: vvt,, baktérium, latex gyöngy felszínén (µm( m nagyságú partikulum) Antitest:
Immunszerológia I. Agglutináció, Precipitáció Immunológiai és Biotechnológiai Intézet PTE-KK Antigén Antitest Alapok Antigén: vvt,, baktérium, latex gyöngy felszínén (µm( m nagyságú partikulum) Antitest:
Az adenovírusok morfológiája I.
 Adenovírusok A vírusok Elnevezésük a latin virus szóból ered, amelynek jelentése méreg. A vírusok a legkisebb ismert entitások. Csak elektronmikroszkóppal tanulmányozhatóak, mert méretük 20-400 nanométerig
Adenovírusok A vírusok Elnevezésük a latin virus szóból ered, amelynek jelentése méreg. A vírusok a legkisebb ismert entitások. Csak elektronmikroszkóppal tanulmányozhatóak, mert méretük 20-400 nanométerig
Mikrobiális antigének
 Mikrobiális antigének Dr. Pusztai Rozália SZTE, ÁOK, Orvosi Mikrobiológiai és Immunbiológiai Intézet 2008. november 17. Antigének Konvencionális antigének Superantigének Antigén - az érett immunrendszer
Mikrobiális antigének Dr. Pusztai Rozália SZTE, ÁOK, Orvosi Mikrobiológiai és Immunbiológiai Intézet 2008. november 17. Antigének Konvencionális antigének Superantigének Antigén - az érett immunrendszer
A baktériumok szaporodása
 A baktériumok szaporodása Baktériumsejt növekszik, majd osztódik a populáció szaporodik - Optimális körülmények esetén a sejttömeg (sejtszám) exponenciálisan nõ az idõvel - Generációs idõ: az az idõ, ami
A baktériumok szaporodása Baktériumsejt növekszik, majd osztódik a populáció szaporodik - Optimális körülmények esetén a sejttömeg (sejtszám) exponenciálisan nõ az idõvel - Generációs idõ: az az idõ, ami
Az adaptív immunválasz kialakulása. Erdei Anna Immunológiai Tanszék ELTE
 Az adaptív immunválasz kialakulása Erdei Anna Immunológiai Tanszék ELTE NK sejt T Bev. 1. ábra Immunhomeosztázis A veleszületett immunrendszer elemei nélkül nem alakulhat ki az adaptív immunválasz A veleszületett
Az adaptív immunválasz kialakulása Erdei Anna Immunológiai Tanszék ELTE NK sejt T Bev. 1. ábra Immunhomeosztázis A veleszületett immunrendszer elemei nélkül nem alakulhat ki az adaptív immunválasz A veleszületett
SZAKKÉPZÉSI KERETTANTERV a(z) 55 725 18 KLINIKAI LABORATÓRIUMI SZAKASSZISZTENS SZAKKÉPESÍTÉS-RÁÉPÜLÉSHEZ
 SZAKKÉPZÉSI KERETTANTERV a(z) 55 725 18 KLINIKAI LABORATÓRIUMI SZAKASSZISZTENS SZAKKÉPESÍTÉS-RÁÉPÜLÉSHEZ I. A szakképzés jogi háttere A szakképzési kerettanterv a nemzeti köznevelésről szóló 2011. évi
SZAKKÉPZÉSI KERETTANTERV a(z) 55 725 18 KLINIKAI LABORATÓRIUMI SZAKASSZISZTENS SZAKKÉPESÍTÉS-RÁÉPÜLÉSHEZ I. A szakképzés jogi háttere A szakképzési kerettanterv a nemzeti köznevelésről szóló 2011. évi
A tananyag felépítése: A BIOLÓGIA ALAPJAI. I. Prokarióták és eukarióták. Az eukarióta sejt. Pécs Miklós: A biológia alapjai
 A BIOLÓGIA ALAPJAI A tananyag felépítése: Környezetmérnök és műszaki menedzser hallgatók számára Előadó: 2 + 0 + 0 óra, félévközi számonkérés 3 ZH: október 3, november 5, december 5 dr. Pécs Miklós egyetemi
A BIOLÓGIA ALAPJAI A tananyag felépítése: Környezetmérnök és műszaki menedzser hallgatók számára Előadó: 2 + 0 + 0 óra, félévközi számonkérés 3 ZH: október 3, november 5, december 5 dr. Pécs Miklós egyetemi
A SZARVASMARHA LÉGZŐSZERVI BETEGSÉG-KOMPLEXE
 VII. Praxismenedzsment Konferencia Budapest, 2013. november 23. A SZARVASMARHA LÉGZŐSZERVI BETEGSÉG-KOMPLEXE Fodor László Szent István Egyetem, Állatorvos-tudományi Kar, Járványtani és Mikrobiológiai Tanszék
VII. Praxismenedzsment Konferencia Budapest, 2013. november 23. A SZARVASMARHA LÉGZŐSZERVI BETEGSÉG-KOMPLEXE Fodor László Szent István Egyetem, Állatorvos-tudományi Kar, Járványtani és Mikrobiológiai Tanszék
Antigén, Antigén prezentáció
 Antigén, Antigén prezentáció Biológiai Intézet Immunológiai Tanszék Bajtay Zsuzsa ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2019. február. 26 Bev. 2. ábra Az
Antigén, Antigén prezentáció Biológiai Intézet Immunológiai Tanszék Bajtay Zsuzsa ELTE, TTK Biológiai Intézet Immunológiai Tanszék ORFI Klinikai immunológia tanfolyam, 2019. február. 26 Bev. 2. ábra Az
AZ ÉLET KÉMIÁJA... ÉLŐ ANYAG SZERVEZETI ALAPEGYSÉGE
 AZ ÉLET KÉMIÁJA... ÉLŐ ANYAG SZERVEZETI ALAPEGYSÉGE A biológia az élet tanulmányozásával foglalkozik, az élő szervezetekre viszont vonatkoznak a fizika és kémia törvényei MI ÉPÍTI FEL AZ ÉLŐ ANYAGOT? HOGYAN
AZ ÉLET KÉMIÁJA... ÉLŐ ANYAG SZERVEZETI ALAPEGYSÉGE A biológia az élet tanulmányozásával foglalkozik, az élő szervezetekre viszont vonatkoznak a fizika és kémia törvényei MI ÉPÍTI FEL AZ ÉLŐ ANYAGOT? HOGYAN
Baktériumok tenyésztése
 Baktériumok tenyésztése Koch posztulátumok A betegből a kórokozó izolálása Izolálás, tenyésztés, tápközegben fenntartás Kísérleti állatba oltva a betegségre jellemző tünetek kialakulása Ezen állatokból
Baktériumok tenyésztése Koch posztulátumok A betegből a kórokozó izolálása Izolálás, tenyésztés, tápközegben fenntartás Kísérleti állatba oltva a betegségre jellemző tünetek kialakulása Ezen állatokból
BIOKÉMIA. Simonné Prof. Dr. Sarkadi Livia egyetemi tanár.
 BIOKÉMIA Simonné Prof. Dr. Sarkadi Livia egyetemi tanár e-mail: sarkadi@mail.bme.hu Tudományterületi elhelyezés Alaptudományok (pl.: matematika, fizika, kémia, biológia) Alkalmazott tudományok Interdiszciplináris
BIOKÉMIA Simonné Prof. Dr. Sarkadi Livia egyetemi tanár e-mail: sarkadi@mail.bme.hu Tudományterületi elhelyezés Alaptudományok (pl.: matematika, fizika, kémia, biológia) Alkalmazott tudományok Interdiszciplináris
A klórozás hatása a vizek mikrobaközösségeire. Készítette: Vincze Ildikó Környezettan BSc Témavezető: dr. Makk Judit Mikrobiológia Tanszék
 A klórozás hatása a vizek mikrobaközösségeire Készítette: Vincze Ildikó Környezettan BSc Témavezető: dr. Makk Judit Mikrobiológia Tanszék A víz Az élet alapja, tápanyagforrás Az ivóvíz nélkülözhetetlen
A klórozás hatása a vizek mikrobaközösségeire Készítette: Vincze Ildikó Környezettan BSc Témavezető: dr. Makk Judit Mikrobiológia Tanszék A víz Az élet alapja, tápanyagforrás Az ivóvíz nélkülözhetetlen
A B sejtek érése, aktivációja, az immunglobulin osztályok kialakulása. Uher Ferenc, PhD, DSc
 A B sejtek érése, aktivációja, az immunglobulin osztályok kialakulása Uher Ferenc, PhD, DSc Az immunglobulinok szerkezete Fab V L V H C L C H 1 C H 1 Az egér immunglobulin géncsaládok szerveződése Hlánc
A B sejtek érése, aktivációja, az immunglobulin osztályok kialakulása Uher Ferenc, PhD, DSc Az immunglobulinok szerkezete Fab V L V H C L C H 1 C H 1 Az egér immunglobulin géncsaládok szerveződése Hlánc
Immunológia alapjai. 10. előadás. Komplement rendszer
 Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén
 Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén Dr. Dallmann Klára A molekuláris biológia célja az élőlények és sejtek működésének molekuláris szintű
Molekuláris biológiai eljárások alkalmazása a GMO analitikában és az élelmiszerbiztonság területén Dr. Dallmann Klára A molekuláris biológia célja az élőlények és sejtek működésének molekuláris szintű
Antibiotikumok a kutyapraxisban
 Antibiotikumok a kutyapraxisban Antibiotikum választás Bakteriális fertőzés Célzott Empirikus Megelőző Indokolt esetben Ismert betegség kiújulásának megelőzésére Rizikócsoportoknál Mikor ne adjunk? Nem
Antibiotikumok a kutyapraxisban Antibiotikum választás Bakteriális fertőzés Célzott Empirikus Megelőző Indokolt esetben Ismert betegség kiújulásának megelőzésére Rizikócsoportoknál Mikor ne adjunk? Nem
Az emberi sejtek általános jellemzése
 Sejttan (cytológia) Az emberi sejtek általános jellemzése A sejtek a szervezet alaki és működési egységei Alakjuk: nagyon változó. Meghatározza: Sejtek funkciója Felületi feszültség Sejtplazma sűrűsége
Sejttan (cytológia) Az emberi sejtek általános jellemzése A sejtek a szervezet alaki és működési egységei Alakjuk: nagyon változó. Meghatározza: Sejtek funkciója Felületi feszültség Sejtplazma sűrűsége
II. Mikrobiológiai alapok. Mekkorák a mikroorganizmusok? Szabad szemmel mit látunk a mikrobákból? Mikrobatenyészetek
 II. Mikrobiológiai alapok Mekkorák a mikroorganizmusok? A biotechnológiai eljárások alanyai és eszközei az esetek nagy többségében mikroorganizmusok. Anyagcseréjük sok hasonlóságot mutat, külső megjelenésük
II. Mikrobiológiai alapok Mekkorák a mikroorganizmusok? A biotechnológiai eljárások alanyai és eszközei az esetek nagy többségében mikroorganizmusok. Anyagcseréjük sok hasonlóságot mutat, külső megjelenésük
Légúti pathogének és azok antibiotikum rezisztenciája
 Légúti pathogének és azok antibiotikum rezisztenciája Dr.Nagy Erzsébet SZTE ÁOK Központi Klinikai Mikrobiológia Laboratórium, Szeged I dhpfcu-k h M H * a releváns diagnózist befolyásoló i' Egyes légúti
Légúti pathogének és azok antibiotikum rezisztenciája Dr.Nagy Erzsébet SZTE ÁOK Központi Klinikai Mikrobiológia Laboratórium, Szeged I dhpfcu-k h M H * a releváns diagnózist befolyásoló i' Egyes légúti
Immunológia alapjai előadás MHC. szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás.
 Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Antigén felismerés Az ellenanyagok és a B sejt receptorok natív formában
Immunológia alapjai 5-6. előadás MHC szerkezete és genetikája, és az immunológiai felismerésben játszott szerepe. Antigén bemutatás. Antigén felismerés Az ellenanyagok és a B sejt receptorok natív formában
sejt működés jovo.notebook March 13, 2018
 1 A R É F Z S O I B T S Z E S R V E Z D É S I S E Z I N E T E K M O I B T O V N H C J W W R X S M R F Z Ö R E W T L D L K T E I A D Z W I O S W W E T H Á E J P S E I Z Z T L Y G O A R B Z M L A H E K J
1 A R É F Z S O I B T S Z E S R V E Z D É S I S E Z I N E T E K M O I B T O V N H C J W W R X S M R F Z Ö R E W T L D L K T E I A D Z W I O S W W E T H Á E J P S E I Z Z T L Y G O A R B Z M L A H E K J
Mikrobiológia előadások: A vírusok
 Mikrobiológia előadások: A vírusok 1 Történeti vonatkozások Vírus=méreg: Pasteur vírusbetegségek leírása (Babilon, Kína ) TMV: Ivanovszkij, 1892 ragadós száj- és körömfájás, 1898 mai nevezéktan: angol,
Mikrobiológia előadások: A vírusok 1 Történeti vonatkozások Vírus=méreg: Pasteur vírusbetegségek leírása (Babilon, Kína ) TMV: Ivanovszkij, 1892 ragadós száj- és körömfájás, 1898 mai nevezéktan: angol,
Immunológia alapjai. 16. előadás. Komplement rendszer
 Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
Immunológia alapjai 16. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Plazma enzim mediátorok: - Kinin rendszer - Véralvadási rendszer Lipid mediátorok Kemoattraktánsok: - Chemokinek:
INDIKÁTOR MIKROORGANIZMUSOK
 INDIKÁTOR MIKROORGANIZMUSOK Mohácsiné dr. Farkas Csilla Indikátor vagy jelző mikroflóra Jelentősége: jelenlétükből következtetni lehet az élelmiszert ért szennyezés tényére ill. mértékére, fejlődésükhöz
INDIKÁTOR MIKROORGANIZMUSOK Mohácsiné dr. Farkas Csilla Indikátor vagy jelző mikroflóra Jelentősége: jelenlétükből következtetni lehet az élelmiszert ért szennyezés tényére ill. mértékére, fejlődésükhöz
II. Mikrobiológiai alapok. Mikrobatenyészetek. Mekkorák a mikroorganizmusok? Mikrobatenyészetek. Szabad szemmel mit látunk a mikrobákból?
 II. Mikrobiológiai alapok Mikrobatenyészetek A biotechnológiai eljárások alanyai és eszközei az esetek nagy többségében mikroorganizmusok. Anyagcseréjük sok hasonlóságot mutat, külső megjelenésük (morfológiájuk)
II. Mikrobiológiai alapok Mikrobatenyészetek A biotechnológiai eljárások alanyai és eszközei az esetek nagy többségében mikroorganizmusok. Anyagcseréjük sok hasonlóságot mutat, külső megjelenésük (morfológiájuk)
INDIKÁTOR MIKROORGANIZMUSOK
 INDIKÁTOR MIKROORGANIZMUSOK Mohácsiné dr. Farkas Csilla Indikátor vagy jelző mikroflóra Jelentősége: jelenlétükből következtetni lehet az élelmiszert ért szennyezés tényére ill. mértékére, fejlődésükhöz
INDIKÁTOR MIKROORGANIZMUSOK Mohácsiné dr. Farkas Csilla Indikátor vagy jelző mikroflóra Jelentősége: jelenlétükből következtetni lehet az élelmiszert ért szennyezés tényére ill. mértékére, fejlődésükhöz
a NAT /2006 számú akkreditálási ügyirathoz
 Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a számú akkreditálási ügyirathoz Az Állami Népegészségügyi és Tisztiorvosi Szolgálat Dél-alföldi Regionális Intézet Kirendeltsége, Laboratóriumi Osztály Mikrobiológiai
Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a számú akkreditálási ügyirathoz Az Állami Népegészségügyi és Tisztiorvosi Szolgálat Dél-alföldi Regionális Intézet Kirendeltsége, Laboratóriumi Osztály Mikrobiológiai
Gyógyszerrezisztenciát okozó fehérjék vizsgálata
 Gyógyszerrezisztenciát okozó fehérjék vizsgálata AKI kíváncsi kémikus kutatótábor 2017.06.25-07.01. Témavezetők : Telbisz Ágnes, Horváth Tamás Kutatók : Dobolyi Zsófia, Bereczki Kristóf, Horváth Ákos Gyógyszerrezisztencia
Gyógyszerrezisztenciát okozó fehérjék vizsgálata AKI kíváncsi kémikus kutatótábor 2017.06.25-07.01. Témavezetők : Telbisz Ágnes, Horváth Tamás Kutatók : Dobolyi Zsófia, Bereczki Kristóf, Horváth Ákos Gyógyszerrezisztencia
Kocák tejtermelési zavara és ami mögötte van 2016. 06. 02. dr. Dobos László
 Kocák tejtermelési zavara és ami mögötte van 2016. 06. 02. dr. Dobos László Postpartum Dysgalactia Syndrome PPDS Meghatározás Közvetlenül fialás után kezdődik Tejtermelés zavara (mennyiség és minőség)
Kocák tejtermelési zavara és ami mögötte van 2016. 06. 02. dr. Dobos László Postpartum Dysgalactia Syndrome PPDS Meghatározás Közvetlenül fialás után kezdődik Tejtermelés zavara (mennyiség és minőség)
-pl. baktériumok és gombák toxinjai, mérgező növények, mérgező állati termékek, növényvédő szerek, különböző szennyező anyagok
 ÉLELEM ÚTJÁN TERJEDŐ MEGBETEGEDÉSEK = elfogyasztott ételben, italban levő mérgező hatású anyag (mikroorganizmus, mérgező növény, vegyi anyag) okoz Jellemzői: rövid lappangási idő heveny, robbanásszerű
ÉLELEM ÚTJÁN TERJEDŐ MEGBETEGEDÉSEK = elfogyasztott ételben, italban levő mérgező hatású anyag (mikroorganizmus, mérgező növény, vegyi anyag) okoz Jellemzői: rövid lappangási idő heveny, robbanásszerű
Marker koncepció (Bovilis BVD)
 Marker koncepció (Bovilis BVD) VI. MSDay Budapest 2013. február 21. Dr. Földi József Mi a marker vagy diva koncepció? Típusai BVDV NS3 (p80) marker vakcinák és tesztek A BVDV NS3 marker elv gyakorlati
Marker koncepció (Bovilis BVD) VI. MSDay Budapest 2013. február 21. Dr. Földi József Mi a marker vagy diva koncepció? Típusai BVDV NS3 (p80) marker vakcinák és tesztek A BVDV NS3 marker elv gyakorlati
A vakcinázás hatékonyságát alapvetően befolyásoló tényezők. Dr. Albert Mihály
 A vakcinázás hatékonyságát alapvetően befolyásoló tényezők Dr. Albert Mihály Vakcinázás Fogalma: Aktív immunizáláskor ismert, csökkent virulenciájú, vagy elölt kórokozót, illetve annak antigénjeit, gyakran
A vakcinázás hatékonyságát alapvetően befolyásoló tényezők Dr. Albert Mihály Vakcinázás Fogalma: Aktív immunizáláskor ismert, csökkent virulenciájú, vagy elölt kórokozót, illetve annak antigénjeit, gyakran
Mikroszkópos vizsgálatok
 Mikroszkópos vizsgálatok 2009 A baktériumok obligát sejtalkotói - sejtfal, - citoplazma membrán, - riboszóma, - nukleoid, - mezoszóma, - periplazmatikus tér 1 Endospóraképzõdés = Sporuláció folyamata pathmicro.med.sc.edu
Mikroszkópos vizsgálatok 2009 A baktériumok obligát sejtalkotói - sejtfal, - citoplazma membrán, - riboszóma, - nukleoid, - mezoszóma, - periplazmatikus tér 1 Endospóraképzõdés = Sporuláció folyamata pathmicro.med.sc.edu
A kemotaxis kiváltására specializálódott molekula-család: Cytokinek
 A kemotaxis kiváltására specializálódott molekula-család: Cytokinek Cytokinek - definíció Cytokin (Cohen 1974): Sejtek közötti kémi miai kommunikációra alkalmas anyagok; legtöbbjük növekedési vagy differenciációs
A kemotaxis kiváltására specializálódott molekula-család: Cytokinek Cytokinek - definíció Cytokin (Cohen 1974): Sejtek közötti kémi miai kommunikációra alkalmas anyagok; legtöbbjük növekedési vagy differenciációs
A kórokozók ellen kialakuló immunválasz jellemzői; vírusok, baktériumok
 A kórokozók ellen kialakuló immunválasz jellemzői; vírusok, baktériumok A tankönyben (http://immunologia.elte.hu/oktatas.php): Bajtay Zsuzsa Immunológiai Tanszék ELTE Tanárszakosok, 2016 A mikrobák és
A kórokozók ellen kialakuló immunválasz jellemzői; vírusok, baktériumok A tankönyben (http://immunologia.elte.hu/oktatas.php): Bajtay Zsuzsa Immunológiai Tanszék ELTE Tanárszakosok, 2016 A mikrobák és
BIOGÉN ELEMEK Azok a kémiai elemek, amelyek az élőlények számára létfontosságúak
 BIOGÉN ELEMEK Azok a kémiai elemek, amelyek az élőlények számára létfontosságúak A több mint száz ismert kémiai elem nagyobbik hányada megtalálható az élőlények testében is, de sokuknak nincsen kimutatható
BIOGÉN ELEMEK Azok a kémiai elemek, amelyek az élőlények számára létfontosságúak A több mint száz ismert kémiai elem nagyobbik hányada megtalálható az élőlények testében is, de sokuknak nincsen kimutatható
Kórokozók elleni adaptiv mechanizmusok
 Kórokozók elleni adaptiv mechanizmusok 2016. 10. 05. Az immunválasz kialakulása és lezajlása patogén hatására. Nyálkahártyán keresztül Különbözó patogének eltérő utakon jutnak a szervezetbe Légutakon
Kórokozók elleni adaptiv mechanizmusok 2016. 10. 05. Az immunválasz kialakulása és lezajlása patogén hatására. Nyálkahártyán keresztül Különbözó patogének eltérő utakon jutnak a szervezetbe Légutakon
Vírusok. A vírusok általános tulajdonságai, felépítésük: A vírusok eredete: Virion állapot: A vírusok vizsgálata, alakja, mérete:
 Vírusok Virológia: - növényekre, állatokra és az emberre patogén vírusok felismerése A vírusok azok vírusok Lwoff francia Nobel-díjas A vírusok felfedezése: Ivanovszkij (1892) dohány mozaikvírus Loeffler
Vírusok Virológia: - növényekre, állatokra és az emberre patogén vírusok felismerése A vírusok azok vírusok Lwoff francia Nobel-díjas A vírusok felfedezése: Ivanovszkij (1892) dohány mozaikvírus Loeffler
 Az élő szervezetek felépítése I. Biogén elemek biomolekulák alkotóelemei a természetben előforduló elemek közül 22 fordul elő az élővilágban O; N; C; H; P; és S; - élő anyag 99%-a Biogén elemek sajátosságai:
Az élő szervezetek felépítése I. Biogén elemek biomolekulák alkotóelemei a természetben előforduló elemek közül 22 fordul elő az élővilágban O; N; C; H; P; és S; - élő anyag 99%-a Biogén elemek sajátosságai:
A baktériumok alakja: A baktériumok alaktana. Coccusok. Mikroszkópos vizsgálat. Hajlott formák. Bacillusok
 A baktériumok alaktana A baktériumok alakja: genetikailag meghatározott osztályozásuk alapját képezi Fiatal baktériumok 3 forma 2009 LL 1 gömb coccus pálca bacillus spirális 2009 LL 2 Mikroszkópos vizsgálat
A baktériumok alaktana A baktériumok alakja: genetikailag meghatározott osztályozásuk alapját képezi Fiatal baktériumok 3 forma 2009 LL 1 gömb coccus pálca bacillus spirális 2009 LL 2 Mikroszkópos vizsgálat
Immunológia alapjai előadás. Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás.
 Immunológia alapjai 24-25. előadás Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás. Tolerált bőr graftok MHC (H2) azonos egereken TOLERANCIA & AUTOIMMUNITÁS Toleranciáról beszélünk, ha
Immunológia alapjai 24-25. előadás Immunológiai tolerancia. Fiziológiás és patológiás autoimmunitás. Tolerált bőr graftok MHC (H2) azonos egereken TOLERANCIA & AUTOIMMUNITÁS Toleranciáról beszélünk, ha
Kacsa IMMUNOLÓGIA. A jobb megértés alapjai. S. Lemiere, F.X. Le Gros May Immunrendszer. Saját, veleszületett immunitás. Szerzett immunitás
 Kacsa IMMUNOLÓGIA Immunrendszer Saját, veleszületett immunitás A jobb megértés alapjai Szerzett immunitás S. Lemiere, F.X. Le Gros May 2016 Háziasított viziszárnyasok Cairina moschata dom. Anas platyrhyncos
Kacsa IMMUNOLÓGIA Immunrendszer Saját, veleszületett immunitás A jobb megértés alapjai Szerzett immunitás S. Lemiere, F.X. Le Gros May 2016 Háziasított viziszárnyasok Cairina moschata dom. Anas platyrhyncos
Immunológiai módszerek a klinikai kutatásban
 Immunológiai módszerek a klinikai kutatásban 6. előadás Humorális és celluláris immunválasz A humorális (B sejtes) immunválasz lépései Antigén felismerés B sejt aktiváció: proliferáció, differenciálódás
Immunológiai módszerek a klinikai kutatásban 6. előadás Humorális és celluláris immunválasz A humorális (B sejtes) immunválasz lépései Antigén felismerés B sejt aktiváció: proliferáció, differenciálódás
I/3 Lemez agar táptalaj: (bouillon, 1-3% agar-agar)
 I. Steril táptalajok 1. Bouillon 2. Ferde és magas agar I/1,2 Steril táptalajok: Bouillon, Ferdeagar, Magasagar 3. Lemez agar I/3 Lemez agar táptalaj: (bouillon, 1-3% agar-agar) 4. Dúsító táptalajok (húsos
I. Steril táptalajok 1. Bouillon 2. Ferde és magas agar I/1,2 Steril táptalajok: Bouillon, Ferdeagar, Magasagar 3. Lemez agar I/3 Lemez agar táptalaj: (bouillon, 1-3% agar-agar) 4. Dúsító táptalajok (húsos
Az élelmiszerek mikrobiális ökológiája. Mohácsiné dr. Farkas Csilla
 Az élelmiszerek mikrobiális ökológiája Mohácsiné dr. Farkas Csilla Az élelmiszerek mikroökológiai tényezői Szennyeződés forrásai és közvetítői A mikroorganizmusok belső tulajdosnágai Belső tényezők (az
Az élelmiszerek mikrobiális ökológiája Mohácsiné dr. Farkas Csilla Az élelmiszerek mikroökológiai tényezői Szennyeződés forrásai és közvetítői A mikroorganizmusok belső tulajdosnágai Belső tényezők (az
Allergia immunológiája 2012.
 Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Allergia immunológiája 2012. AZ IMMUNVÁLASZ SZEREPLŐI BIOLÓGIAI MEGKÖZELÍTÉS Az immunrendszer A fő ellenfelek /ellenségek/ Limfociták, makrofágok antitestek, stb külső és belső élősködők (fertőzés, daganat)
Immunológia alapjai. Az immunválasz szupressziója Előadás. A szupresszióban részt vevő sejtes és molekuláris elemek
 Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
Immunológia alapjai 19 20. Előadás Az immunválasz szupressziója A szupresszióban részt vevő sejtes és molekuláris elemek Mi a szupresszió? Általános biológiai szabályzó funkció. Az immunszupresszió az
A növény inváziójában szerepet játszó bakteriális gének
 A növény inváziójában szerepet játszó bakteriális gének merisztéma korai szimbiotikus zóna késői szimbiotikus zóna öregedési zóna gyökér keresztmetszet NODULÁCIÓ növényi jel Rhizobium meliloti rhizobium
A növény inváziójában szerepet játszó bakteriális gének merisztéma korai szimbiotikus zóna késői szimbiotikus zóna öregedési zóna gyökér keresztmetszet NODULÁCIÓ növényi jel Rhizobium meliloti rhizobium
A vér élettana III. Fehérvérsejtek és az immunrendszer
 A vér élettana III. Fehérvérsejtek és az immunrendszer Prof. Kéri Szabolcs SZTE ÁOK Élettani Intézet, 2015 ELLENSÉG AZ IMMUNOLÓGIÁBAN: - VÍRUS, BAKTÉRIUM, GOMBA, PARAZITÁK - IDEGEN SEJTEK - SAJÁT SEJTEK
A vér élettana III. Fehérvérsejtek és az immunrendszer Prof. Kéri Szabolcs SZTE ÁOK Élettani Intézet, 2015 ELLENSÉG AZ IMMUNOLÓGIÁBAN: - VÍRUS, BAKTÉRIUM, GOMBA, PARAZITÁK - IDEGEN SEJTEK - SAJÁT SEJTEK
Az immunológia alapjai
 Az immunológia alapjai Kacskovics Imre Eötvös Loránd Tudományegyetem Immunológiai Tanszék Budapest Citokinek Kisméretű, szolubilis proteinek és glikoproteinek. Hírvivő és szabályozó szereppel rendelkeznek.
Az immunológia alapjai Kacskovics Imre Eötvös Loránd Tudományegyetem Immunológiai Tanszék Budapest Citokinek Kisméretű, szolubilis proteinek és glikoproteinek. Hírvivő és szabályozó szereppel rendelkeznek.
- A vírus infektív titerének meghatározása szövettenyészeten biológiai módszer (a 4. és 5.
 2. gyakorlat Témák: 1. Vírustitrálás (hemagglutinációs próba) az előző gyakorlaton fertőzött tojás allantois folyadékából 2. Citopatogén hatások (Cytopathic effects [CPE]) 3. Vírusok azonosítása 1. Vírus
2. gyakorlat Témák: 1. Vírustitrálás (hemagglutinációs próba) az előző gyakorlaton fertőzött tojás allantois folyadékából 2. Citopatogén hatások (Cytopathic effects [CPE]) 3. Vírusok azonosítása 1. Vírus
a NAT-1-1280/2013 nyilvántartási számú akkreditált státuszhoz
 Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a NAT-1-1280/2013 nyilvántartási számú akkreditált státuszhoz A Csongrád Megyei Kormányhivatal Népegészségügyi Szakigazgatási Szerve Laboratóriumi Decentrum/Osztály
Nemzeti Akkreditáló Testület RÉSZLETEZÕ OKIRAT a NAT-1-1280/2013 nyilvántartási számú akkreditált státuszhoz A Csongrád Megyei Kormányhivatal Népegészségügyi Szakigazgatási Szerve Laboratóriumi Decentrum/Osztály
2. Melyik virulenciafaktor felelős a Listeria monocytogenes intracelluláris terjedéséért? A ActA B CagA C Yop D pertactin
 Név: soportszám: H kód: GYSZRŰ VÁLSZTÁS 1. rucella átvitelében szerepet játszik, KIVÉV: aerosol transzmisszió nem pasztőrözött tej fogyasztása emberről emberre való terjedés szarvasmarha abortummal való
Név: soportszám: H kód: GYSZRŰ VÁLSZTÁS 1. rucella átvitelében szerepet játszik, KIVÉV: aerosol transzmisszió nem pasztőrözött tej fogyasztása emberről emberre való terjedés szarvasmarha abortummal való
1. Az immunrendszer működése. Sejtfelszíni markerek, antigén receptorok. 2. Az immunrendszer szervei és a leukociták
 Sejtfelszíni markerek, antigén receptorok A test őrei 1. Az immunrendszer működése Az individualitás legjobban az immunitásban mutatkozik meg. Feladatai: - a saját és idegen elkülönítése, felismerése -
Sejtfelszíni markerek, antigén receptorok A test őrei 1. Az immunrendszer működése Az individualitás legjobban az immunitásban mutatkozik meg. Feladatai: - a saját és idegen elkülönítése, felismerése -
Kutatási terület: Haszonállatok egészségvédelme, állománydiagnosztika
 Dr. Abonyi Tamás Tanulmányok: Állatorvostudományi Egyetem, 1981. Kutatási terület: Haszonállatok egészségvédelme, állománydiagnosztika Korábbi munkahelyek: MTA Mezőgazdasági Kutató Intézet Kísérleti Gazdasága
Dr. Abonyi Tamás Tanulmányok: Állatorvostudományi Egyetem, 1981. Kutatási terület: Haszonállatok egészségvédelme, állománydiagnosztika Korábbi munkahelyek: MTA Mezőgazdasági Kutató Intézet Kísérleti Gazdasága
I. Steril táptalajok
 Gyakorlati vizsga I. Steril táptalajok 1. Bouillon, 2. Ferde agar, magas agar 4. Dúsító táptalajok: húsos bouillon 3., 5., 6.: Lemez agar, véres agar és csokoládé agar 7. Szelektív és differenciáló táptalajok
Gyakorlati vizsga I. Steril táptalajok 1. Bouillon, 2. Ferde agar, magas agar 4. Dúsító táptalajok: húsos bouillon 3., 5., 6.: Lemez agar, véres agar és csokoládé agar 7. Szelektív és differenciáló táptalajok
Az egysejtű eukarióták teste egyetlen sejtből áll, és az az összes működést elvégzi, amely az élet fenntartásához, valamint megújításához, a
 Az egysejtű eukarióták teste egyetlen sejtből áll, és az az összes működést elvégzi, amely az élet fenntartásához, valamint megújításához, a szaporodáshoz szükséges. A sejtplazmától hártyával elhatárolt
Az egysejtű eukarióták teste egyetlen sejtből áll, és az az összes működést elvégzi, amely az élet fenntartásához, valamint megújításához, a szaporodáshoz szükséges. A sejtplazmától hártyával elhatárolt
Immunszupprimáltak, transzplantáltak és immunkompromittáltak infekciói. ORFI, 2016 Kádár János
 Immunszupprimáltak, transzplantáltak és immunkompromittáltak infekciói ORFI, 2016 Kádár János Kikről beszélünk malignitás (nem kontrollált) kemo/radioterápia haemopoieticus őssejt / solid szerv átültetés
Immunszupprimáltak, transzplantáltak és immunkompromittáltak infekciói ORFI, 2016 Kádár János Kikről beszélünk malignitás (nem kontrollált) kemo/radioterápia haemopoieticus őssejt / solid szerv átültetés
Spóraképző baktériumok. Bacillus, Clostridium
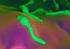 Spóraképző baktériumok Bacillus, Clostridium Gram + pálcák Spóraképző szabályos Nem spóraképző aerob Bacillus anaerob Clostridium szabályos szabálytalan Corynebacterium fak. anaerob Listeria Erysipelothrix
Spóraképző baktériumok Bacillus, Clostridium Gram + pálcák Spóraképző szabályos Nem spóraképző aerob Bacillus anaerob Clostridium szabályos szabálytalan Corynebacterium fak. anaerob Listeria Erysipelothrix
a NAT-1-1476/2006 számú akkreditált státuszhoz
 Nemzeti Akkreditáló Testület SZÛKÍTETT RÉSZLETEZÕ OKIRAT a számú akkreditált státuszhoz Az Állami Népegészségügyi és Tisztiorvosi Szolgálat Észak-magyarországi Regionális Intézet Kirendeltsége Regionális
Nemzeti Akkreditáló Testület SZÛKÍTETT RÉSZLETEZÕ OKIRAT a számú akkreditált státuszhoz Az Állami Népegészségügyi és Tisztiorvosi Szolgálat Észak-magyarországi Regionális Intézet Kirendeltsége Regionális
A centriólum és a sejtek mozgási organellumai
 A centriólum A centriólum és a sejtek mozgási organellumai Egysejtű eukarióta sejtekben,soksejtű állatok sejtjeiben 9x3-triplet A,B és C tubulus alegységek hengerpalástszerű helyezkedéssel Hossza 0,3mm
A centriólum A centriólum és a sejtek mozgási organellumai Egysejtű eukarióta sejtekben,soksejtű állatok sejtjeiben 9x3-triplet A,B és C tubulus alegységek hengerpalástszerű helyezkedéssel Hossza 0,3mm
SPÓRAKÉPZİ BAKTÉRIUMOK ANAEROB BAKTÉRIUMOK. Anderlik P.
 SPÓRAKÉPZİ BAKTÉRIUMOK ANAEROB BAKTÉRIUMOK Anderlik P. 2008 1 Gram pozitív, spórak raképzı, pálcák aerob : Bacillus anaerob: Clostridium extotoxin talajspórás 2 1 3 4 2 Bacillus anthracis Tüdıantrax!!!
SPÓRAKÉPZİ BAKTÉRIUMOK ANAEROB BAKTÉRIUMOK Anderlik P. 2008 1 Gram pozitív, spórak raképzı, pálcák aerob : Bacillus anaerob: Clostridium extotoxin talajspórás 2 1 3 4 2 Bacillus anthracis Tüdıantrax!!!
Beszámoló a XXIV. WPSA kongresszus állategészségügyi témájú előadásairól. Dr. Kőrösi László
 Beszámoló a XXIV. WPSA kongresszus állategészségügyi témájú előadásairól Dr. Kőrösi László Baromfi állategészségügyi előadások Baromfi egészségügy és járványvédelem blokk minden nap Általános járványvédelmi
Beszámoló a XXIV. WPSA kongresszus állategészségügyi témájú előadásairól Dr. Kőrösi László Baromfi állategészségügyi előadások Baromfi egészségügy és járványvédelem blokk minden nap Általános járványvédelmi
2012.02.24. Immunrendszer. Immunrendszer. Immunológiai alapfogalmak Vércsoport antigének,antitestek Alloimmunizáció mechanizmusa Agglutináció
 VÉRCSOPORTSZEROLÓGIA Immunológiai alapfogalmak Vércsoport antigének,antitestek Alloimmunizáció mechanizmusa Agglutináció Dr. Nemes Nagy Zsuzsa Szakképzés 2011. Immunrendszer Immunrendszer védi a szervezet
VÉRCSOPORTSZEROLÓGIA Immunológiai alapfogalmak Vércsoport antigének,antitestek Alloimmunizáció mechanizmusa Agglutináció Dr. Nemes Nagy Zsuzsa Szakképzés 2011. Immunrendszer Immunrendszer védi a szervezet
Virológia gyakorlatok
 Virológia gyakorlatok A virológia gyakorlatok célja, hogy a hallgatók betekintést nyerhessenek az állatorvosi virológiai diagnosztika különböző módszereibe. A hallgatók a gyakorlatokon esetfeldolgozás
Virológia gyakorlatok A virológia gyakorlatok célja, hogy a hallgatók betekintést nyerhessenek az állatorvosi virológiai diagnosztika különböző módszereibe. A hallgatók a gyakorlatokon esetfeldolgozás
Nemzeti Akkreditáló Testület. SZŰKÍTETT RÉSZLETEZŐ OKIRAT (1) a NAT /2013 nyilvántartási számú akkreditált státuszhoz
 Nemzeti Akkreditáló Testület SZŰKÍTETT RÉSZLETEZŐ OKIRAT (1) a NAT-1-1280/2013 nyilvántartási számú akkreditált státuszhoz A Csongrád Megyei Kormányhivatal Népegészségügyi Szakigazgatási Szerve Laboratóriumi
Nemzeti Akkreditáló Testület SZŰKÍTETT RÉSZLETEZŐ OKIRAT (1) a NAT-1-1280/2013 nyilvántartási számú akkreditált státuszhoz A Csongrád Megyei Kormányhivatal Népegészségügyi Szakigazgatási Szerve Laboratóriumi
Telepspecifikus vakcinák engedélyezésének jogi és szakmai háttere
 Telepspecifikus vakcinák engedélyezésének jogi és szakmai háttere Dr. Kulcsár Gábor Nemzeti Élelmiszerlánc-biztonsági Hivatal, Állatgyógyászati Termékek Igazgatósága 2016. június 2. Tartalom Mik azok a
Telepspecifikus vakcinák engedélyezésének jogi és szakmai háttere Dr. Kulcsár Gábor Nemzeti Élelmiszerlánc-biztonsági Hivatal, Állatgyógyászati Termékek Igazgatósága 2016. június 2. Tartalom Mik azok a
2.6.16. VIZSGÁLATOK IDEGEN KÓROKOZÓKRA HUMÁN ÉLŐVÍRUS-VAKCINÁKBAN
 2.6.16. Vizsgálatok idegen kórokozókra Ph.Hg.VIII. - Ph.Eur.7.0 1 2.6.16. VIZSGÁLATOK IDEGEN KÓROKOZÓKRA HUMÁN ÉLŐVÍRUS-VAKCINÁKBAN 01/2011:20616 Azokhoz a vizsgálatokhoz, amelyekhez a vírust előzőleg
2.6.16. Vizsgálatok idegen kórokozókra Ph.Hg.VIII. - Ph.Eur.7.0 1 2.6.16. VIZSGÁLATOK IDEGEN KÓROKOZÓKRA HUMÁN ÉLŐVÍRUS-VAKCINÁKBAN 01/2011:20616 Azokhoz a vizsgálatokhoz, amelyekhez a vírust előzőleg
Immunológia 4. A BCR diverzitás kialakulása
 Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
Immunológia 4. A BCR diverzitás kialakulása 2017. október 4. Bajtay Zsuzsa A klónszelekciós elmélet sarokpontjai: Monospecifictás: 1 sejt 1-féle specificitású receptor Az antigén receptorhoz kötődése aktiválja
MÓDOSÍTOTT RÉSZLETEZŐ OKIRAT (3) a NAT /2013 nyilvántartási számú akkreditált státuszhoz
 MÓDOSÍTOTT RÉSZLETEZŐ OKIRAT (3) a NAT-1-1280/2013 nyilvántartási számú akkreditált státuszhoz A Csongrád Megyei Kormányhivatal Népegészségügyi Főosztály Laboratóriumi Osztály Környezetmikrobiológiai Laboratórium
MÓDOSÍTOTT RÉSZLETEZŐ OKIRAT (3) a NAT-1-1280/2013 nyilvántartási számú akkreditált státuszhoz A Csongrád Megyei Kormányhivatal Népegészségügyi Főosztály Laboratóriumi Osztály Környezetmikrobiológiai Laboratórium
3. Kombinált, amelynek van helikális és kubikális szakasza, pl. a bakteriofágok és egyes rákkeltő RNS vírusok.
 Vírusok Szerkesztette: Vizkievicz András A XIX. sz. végén Dmitrij Ivanovszkij orosz biológus a dohány mozaikosodásának kórokozóját próbálta kimutatni. A mozaikosodás a levél foltokban jelentkező sárgulása.
Vírusok Szerkesztette: Vizkievicz András A XIX. sz. végén Dmitrij Ivanovszkij orosz biológus a dohány mozaikosodásának kórokozóját próbálta kimutatni. A mozaikosodás a levél foltokban jelentkező sárgulása.
