MabThera. rituximab. Milyen típusú gyógyszer a MabThera? Milyen betegségek esetén alkalmazható a MabThera? EPAR-összefoglaló a nyilvánosság számára
|
|
|
- Zsolt Tamás
- 8 évvel ezelőtt
- Látták:
Átírás
1 EMA/614203/2010 EMEA/H/C/ EPAR-összefoglaló a nyilvánosság számára rituximab Ez a dokumentum a -ra vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az emberi felhasználásra szánt gyógyszerek bizottságának (CHMP) a gyógyszerre vonatkozó értékelése miként vezetett a forgalomba hozatali engedély kiadását támogató véleményéhez és a alkalmazási feltételeire vonatkozó ajánlásaihoz. Milyen típusú gyógyszer a? A egy rituximab nevű hatóanyagot tartalmazó gyógyszer. Intravénásan (vénába) adandó oldatos infúzió készítésére alkalmas koncentrátum és szubkután (bőr alá) adandó oldatos injekció formájában kapható. Milyen betegségek esetén alkalmazható a? A -t felnőtteknél az alábbi betegségek esetében alkalmazzák: a non-hodgkin limfóma (a nyirokszövetek daganatos betegsége) két formájának, a follikuláris limfóma és a diffúz, nagy B-sejtes limfóma kezelésére. A alkalmazható monoterápiában vagy kemoterápiával (daganatos betegségek kezelésére szolgáló gyógyszerekkel) kombinációban. Intravénásan, illetve szubkután egyaránt adható. krónikus limfocitás leukémia (CLL, a B-limfociták, a fehérvérsejtek egyik típusának rákja) kezelésére. A -t kemoterápiával kombinációban, intravénásan kell alkalmazni. súlyos reumatoid artritisz (ízületi gyulladást okozó betegség) kezelésére. A -t metotrexáttal kombinációban kell alkalmazni, és intravénásan kell beadni. a súlyos vaszkulitisz (kis- és közepes méretű vérerek gyulladása) két formájának, a granulomatózis poliangiitisz (GPA vagy Wegener-granulomatózis) és a mikroszkópikus poliangiitisz (MPA) kezelésére. A -t kortikoszteroidoknak nevezett gyógyszerekkel kombinációban kell alkalmazni, és intravénásan kell beadni. 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom Telephone +44 (0) Facsimile +44 (0) info@ema.europa.eu Website An agency of the European Union European Medicines Agency, Reproduction is authorised provided the source is acknowledged.
2 A gyógyszer csak receptre kapható. Hogyan kell alkalmazni a -t? A -t tapasztalt egészségügyi szakember szigorú felügyelete mellett kell alkalmazni. A -t mindig olyan helyen kell beadni, ahol az újraélesztéshez szükséges felszerelések azonnal rendelkezésre állnak. Ha kemoterápiával együtt alkalmazzák, a -t az egyes kemoterápiás ciklusok első napján kell beadni. A betegeknek az allergiás reakciók megelőzésére antihisztamint, valamint lázcsillapítót kell adni minden infúzió előtt. A betegeknek kortikoszteroidra is szükségük lehet a kezelés részeként. A non-hodgkin limfóma kezelése esetében a szokásos adagja intravénás alkalmazáskor (a beteg testsúlya és magassága alapján számított) testfelület négyzetméterenként 375 mg. Az infúziók száma és az alkalmazás gyakorisága a kezelt limfóma típusától függ. Egyes betegeknek, akik már kaptak egy teljes dózis intravénás infúziót, a további dózisok szubkután injekcióban is adhatók. A szubkután injekció ajánlott adagja (a beteg testfelületétől függetlenül) 1400 mg. CLL esetében a -t hat alkalommal, intravénásan kell beadni: az első adag 375 mg/m 2, az ezt követő adagok mindegyike pedig 500 mg/m 2. A rákos limfociták pusztításából fakadó mellékhatások megelőzése érdekében a kezelés előtt gondoskodni kell a betegek megfelelő folyadékbeviteléről és a húgysavszint stabilizálását elősegítő gyógyszerekkel történő kezeléséről. Reumatoid artritisz esetében a -t kettő 1000 mg-os, intravénás infúzióban kell alkalmazni, két hét időkülönbséggel. A betegek általában a kezdeti kezelés után héten belül reagálnak a kezelésre. 24 hét elteltével a kezelés a beteg terápiás válaszától függően megismételhető. A reumatoid artritisz, illetve a GPA/MPA ellen -val kezelt betegeknek speciális kártyát kell adni, amely ismerteti a mellékhatásaként esetleg előforduló, bizonyos fajta fertőzések tüneteit, tanáccsal látva el a betegeket, hogy ezek jelentkezése esetén azonnal forduljanak orvoshoz. A részletes információk a (szintén az EPAR részét képező) alkalmazási előírásban találhatók. GPA és MPA esetében a -t négy héten keresztül hetente egyszer, 375 mg/m 2 dózisú intravénás infúzióban kell alkalmazni. Hogyan fejti ki hatását a? A hatóanyaga, a rituximab, egy monoklonális antitest. A monoklonális antitest egy olyan antitest (fehérjetípus), amelyet úgy alakítottak ki, hogy felismerjen egy, a szervezet bizonyos sejtjein megtalálható (antigénnek nevezett) specifikus struktúrát, és ahhoz kötődjön. A rituximabot úgy alakították ki, hogy a B-limfociták felületén megtalálható C20 nevű antigént célozza meg. A rituximab kötődése az antigénhez a sejt pusztulását eredményezi. Ez segít limfóma és CLL esetén, mivel elpusztítja a rákos B-limfocitákat. Reumatoid artritisz esetében az ízületekben lévő B-limfociták pusztulnak el, és ez segít a gyulladás csökkenésében. GPA és MPA esetében a B-limfociták pusztulásával mérséklődik az antineutrofil citoplazmatikus antitestek (ANCA) termelődése, és csökken a gyulladás. Az ANCA egy olyan antitesttípus, amelyről úgy vélik, hogy fontos szerepet játszik a vérerek megtámadásában. Milyen módszerekkel vizsgálták a -t? A -t a non-hodgkin limfóma mindkét típusa esetében vizsgálták: Follikuláris limfóma esetében a -t egy fő vizsgálatban, 322 olyan beteg bevonásával tanulmányozták, akik follikuláris limfómáját korábban nem kezelték. Ebben a vizsgálatban a hatékonyságát a standard kemoterápia (CVP: ciklofoszfamid, vinkrisztin és prednizolon) EMA/76051/2014 Oldal 2/5
3 kiegészítéseként alkalmazva annak mérésével tanulmányozták, hogy mennyi ideig éltek a betegek anélkül, hogy a betegség kiújult volna. Három másik, a szakirodalomban publikált vizsgálatban a hatékonyságát más típusú kemoterápiák kiegészítéseként alkalmazva tanulmányozták. Három vizsgálatban a -t önmagában adva is tanulmányozták: az egyik vizsgálatban a -ra reagálók összesített arányát vizsgálták 203 olyan betegnél, akik esetében a korábbi kezelések sikertelennek bizonyultak; a másik kettő vizsgálat pedig összesen 1353 beteggel (334 korábbi kezelés után kiújult betegségben szenvedő és 1019 korábban nem kezelt beteg) végzett fenntartó vizsgálat volt, amelyekben azt mérték, hogy mennyi ideig éltek a betegek anélkül, hogy a betegség súlyosbodott volna. Egy további, 127, follikuláris limfómában szenvedő beteg részvételével végzett vizsgálatban a szubkután és intravénás alkalmazását hasonlították össze. A -t CHOP- (ciklofoszfamid, doxorubicin, vinkrisztin és prednizolon), illetve CVPkemoterápia előtt alkalmazták. A fő hatékonysági mutató azon alapult, hogy mennyi rituximab volt a vérben a szubkután és intravénás alkalmazása esetén, annak bizonyítására, hogy megfelelő szint alakul ki szubkután alkalmazáskor. A vizsgálatban a kezelésre teljesen és részlegesen reagálók arányát is nézték. A kezelésre adott választ a testről készített felvételek és a betegek klinikai adatai segítségével értékelték. Diffúz, nagy B-sejtes limfóma esetében a hatékonyságát CHOP-kemoterápia kiegészítéseként alkalmazva egy vizsgálatban 399, hatvan éven felüli beteg bevonásával vizsgálták. A fő hatékonysági mutató az volt, hogy mennyi ideig éltek a betegek anélkül, hogy a betegség súlyosbodott volna, vagy a kezelés megváltoztatása szükségessé vált volna. CLL esetében 817, korábban nem kezelt betegnél, valamint 552, korábbi kezelés után kiújult betegségben szenvedő betegnél vizsgálták az FC (fludarabin és ciklofoszfamid) kemoterápia -val történő kiegészítésének hatékonyságát. A fő hatékonysági mutató az volt, hogy mennyi ideig éltek a betegek anélkül, hogy a betegség súlyosbodott volna. A szakirodalomban publikált további vizsgálatokban azt tanulmányozták, hogy milyen hatással jár, ha másfajta kemoterápiákat val egészítenek ki. Reumatoid artritisz esetében a -t 517 betegnél vizsgálták. A metotrexáthoz hozzáadott hatékonyságát a kezeléshez hozzáadott placebo (hatóanyag nélküli kezelés) hatékonyságával hasonlították össze. A vizsgálatban azt mérték, hogy 24 hét után hány betegnél következett be 20%-os javulás a reumatoid artritisz legfontosabb tüneteiben. GPA és MPA esetében a -t egyetlen, 18 hónapig tartó vizsgálatban a vaszkulitisz kezelésére alkalmazott másik gyógyszerrel, ciklofoszfamiddal hasonlították össze 198, korábban kezelt vagy még nem kezelt betegnél (akiknek körülbelül háromnegyede GPA-ban szenvedett). A fő hatékonysági mutató azoknak a betegeknek a száma volt, akik a vizsgálat megkezdése után hat hónappal tünetmentessé váltak (teljes remisszió) és már nem volt szükségük kortikoszteroidra. Milyen előnyei voltak a alkalmazásának a vizsgálatok során? Non-Hodgkin limfóma esetében a -val kezelt betegeknél jobb eredményeket értek el az azzal nem kezelt betegekhez képest: Follikuláris limfóma esetében a CVP-kemoterápia kiegészítéseként alkalmazott -val kezelt betegek átlagosan 25,9 hónapig éltek anélkül, hogy a betegség kiújult volna, szemben a csak CVPvel kezelt betegeknél megfigyelt 6,7 hónappal. A három további vizsgálat is azt mutatta, hogy a más típusú kemoterápiák kiegészítéseként alkalmazva is javította a kezelés eredményességét. A monoterápiára vonatkozó vizsgálatokban azoknak a betegeknek a 48%-a reagált a -ra, akiknél a korábbi kezelés eredménytelen volt. A korábbi kezelés után kiújult betegségben szenvedő betegekkel végzett fenntartó vizsgálat azt mutatta, hogy a EMA/76051/2014 Oldal 3/5
4 -val kezelt betegek átlagosan 42,2 hónapig éltek anélkül, hogy a betegség súlyosbodott volna, szemben azoknak a betegeknek a 14,3 hónapjával, akik nem kapták a készítményt. A korábban nem kezelt betegekkel végzett fenntartó vizsgálat azt mutatta, hogy a -val kezelt betegeknél a betegség súlyosbodásának valószínűsége 50%-kal csökkent. A szubkután alkalmazásakor mért hatóanyagszint összehasonlítható volt az intravénás alkalmazás esetében mért szinttel. A -t szubkután kapó betegek válaszaránya is hasonló volt a -t intravénásan kapó betegeknél tapasztalt arányhoz. Diffúz, nagy B-sejtes limfóma esetében azok a betegek, akiknél a CHOP-kemoterápiát val egészítették ki, átlagosan 35 hónapig éltek anélkül, hogy a betegség súlyosbodott volna, vagy a kezelés megváltoztatására lett volna szükség, míg a kizárólag CHOP-vel kezelt betegeknél ez az idő 13 hónap volt. CLL-ben szenvedő betegeknél is jobb eredmények születtek a alkalmazása esetén. A korábban nem kezelt betegek átlagosan 39,8 hónapig éltek a betegség súlyosbodása nélkül, amikor az FC-kezelés mellett -t is kaptak, szemben a kizárólag FC-kezelés alatt álló betegeknél megfigyelt 32,2 hónappal. Azon betegek közül, akiknél a betegség a korábbi kezelés után kiújult, a -val is kezeltek 30,6 hónapig éltek a betegség súlyosbodása nélkül, míg a kizárólag FC-vel kezelt betegeknél ez az érték 20,6 hónap volt. A további vizsgálatok szintén azt mutatták, hogy a másfajta kemoterápiák mellé adott is javította a CLL-ben szenvedő betegeknél elért eredményeket. Reumatoid artritisz esetében a hatékonyabb volt a placebónál: a -t kapó betegek 51%-ánál javultak a tünetek, szemben a placebót szedők 18%-ával. GPA és MPA esetében a -val kezelt betegek 64%-ánál (98-ból 63) figyeltek meg teljes remissziót hat hónap elteltével, szemben a ciklofoszfamidot kapók 55%-ával (95-ből 52). Milyen kockázatokkal jár a alkalmazása? A non-hodgkin limfóma vagy a CLL kezelése esetén a leggyakoribb mellékhatásai (10 beteg közül több mint 1-nél jelentkezik) a bakteriális fertőzések, vírusfertőzések, bronchitis (a levegőjáratok gyulladása a tüdőben), neutropénia (a fehérvérsejtek egy típusának, a neutrofileknek az alacsony szintje), leukopénia (a fehérvérsejtek alacsony szintje), lázzal járó neutropénia, trombocitopénia (alacsony vérlemezkeszám), az infúzióhoz köthető reakciók (főként láz, hidegrázás és reszketés), angioödéma (bőr alatti duzzanat), émelygés, viszketés, kiütés, hajhullás, láz, hidegrázás, gyengeség, fejfájás és az IgG (egy bizonyos típusú antitest) alacsony szintje. A reumatoid artritisz kezelése esetén a leggyakoribb mellékhatások (10 beteg közül több mint 1-nél jelentkezik) a fejfájás, felső légúti fertőzés (megfázás), húgyúti fertőzés és az infúzióhoz köthető reakciók. A GPA vagy az MPA kezelése esetén a leggyakoribb mellékhatások (10 beteg közül több mint 1-nél jelentkezik) a hasmenés, perifériás ödéma (a boka és a lábfej duzzanata), izomgörcsök, ízületi és hátfájdalom, szédülés, remegés, álmatlanság, köhögés, nehézlégzés, orrvérzés és a magas vérnyomás. Ezek némelyike az infúzióhoz köthető reakciók részeként jelentkezhet. A szubkután és intravénás alkalmazásának összehasonlítására irányuló vizsgálatban a mellékhatások összehasonlíthatóak voltak, az injekció beadásának helyén jelentkező reakciók (fájdalom, duzzanat, kiütés) kivételével, amelyek szubkután alkalmazás esetén gyakrabban fordultak elő. A alkalmazásával kapcsolatban jelentett összes mellékhatás teljes felsorolása a betegtájékoztatóban található. EMA/76051/2014 Oldal 4/5
5 A nem alkalmazható olyan személyeknél, akik túlérzékenyek (allergiásak) a rituximabbal, az egérfehérjékkel vagy a készítmény bármely más összetevőjével szemben. A szubkután alkalmazásra szánt készítmény nem adható olyan betegeknek, akik allergiásak a hialuronidáz nevű anyagra. A nem adható aktív, súlyos fertőzésben szenvedő, illetve súlyosan meggyengült immunrendszerű betegeknek. Ezen túlmenően a nem adható olyan, reumatoid artritiszben, GPA-ban vagy MPA-ban szenvedő betegeknek, akiknél súlyos szívelégtelenség (a szív nem képes elég vért pumpálni a szervezet egészébe) vagy súlyos szívbetegség áll fenn. Miért engedélyezték a forgalomba hozatalát? Az emberi felhasználásra szánt gyógyszerek bizottsága (CHMP) megállapította, hogy a alkalmazásának előnyei meghaladják a kockázatokat, és javasolta a gyógyszerre vonatkozó forgalomba hozatali engedély kiadását. A -val kapcsolatos egyéb információ június 2-án az Európai Bizottság a -ra vonatkozóan kiadta az Európai Unió egész területére érvényes forgalomba hozatali engedélyt. A -ra vonatkozó teljes EPAR az Ügynökség weboldalán található: ema.europa.eu/find medicine/human medicines/european Public Assessment Reports. Amennyiben a -val történő kezeléssel kapcsolatban bővebb információra van szüksége, olvassa el a (szintén az EPAR részét képező) betegtájékoztatót, illetve forduljon kezelőorvosához vagy gyógyszerészéhez. Az összefoglaló utolsó aktualizálása: EMA/76051/2014 Oldal 5/5
Mielóma multiplex (a fehérvérsejtek egy típusa, a plazmasejtek daganatos betegsége) esetében a Revlimid-et a következőképpen alkalmazzák:
 EMA/112959/2016 EMEA/H/C/000717 EPAR-összefoglaló a nyilvánosság számára lenalidomid Ez a dokumentum a -re vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az emberi
EMA/112959/2016 EMEA/H/C/000717 EPAR-összefoglaló a nyilvánosság számára lenalidomid Ez a dokumentum a -re vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az emberi
Az Avastin-t más daganatellenes gyógyszerekkel kombinálva, az alábbi típusú daganatos betegségekben szenvedő felnőttek kezelésére alkalmazzák:
 EMEA/H/C/000582 EPAR-összefoglaló a nyilvánosság számára bevacizumab Ez a dokumentum az -ra vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az emberi felhasználásra
EMEA/H/C/000582 EPAR-összefoglaló a nyilvánosság számára bevacizumab Ez a dokumentum az -ra vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az emberi felhasználásra
A Pradaxa egy dabigatrán etexilát nevű hatóanyagot tartalmazó gyógyszer. Kapszula formájában kapható (75, 110 és 150 mg).
 EMEA/H/C/000829 EPAR-összefoglaló a nyilvánosság számára dabigatrán etexilát Ez a dokumentum a -ra vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az emberi felhasználásra
EMEA/H/C/000829 EPAR-összefoglaló a nyilvánosság számára dabigatrán etexilát Ez a dokumentum a -ra vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az emberi felhasználásra
Mielóma multiplex (a fehérvérsejtek egy típusa, a plazmasejtek daganatos betegsége) esetében a Revlimid-et a következőképpen alkalmazzák:
 EMA/113870/2017 EMEA/H/C/000717 EPAR-összefoglaló a nyilvánosság számára lenalidomid Ez a dokumentum a -re vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az Ügynökségnek
EMA/113870/2017 EMEA/H/C/000717 EPAR-összefoglaló a nyilvánosság számára lenalidomid Ez a dokumentum a -re vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az Ügynökségnek
Az Opdivo nevű gyógyszer áttekintése és indoklás, hogy miért engedélyezték az EU-ban
 EMA/489091/2018 EMEA/H/C/003985 Az Opdivo nevű gyógyszer áttekintése és indoklás, hogy miért engedélyezték az EU-ban Milyen típusú gyógyszer az Opdivo és milyen betegségek esetén alkalmazható? Az Opdivo
EMA/489091/2018 EMEA/H/C/003985 Az Opdivo nevű gyógyszer áttekintése és indoklás, hogy miért engedélyezték az EU-ban Milyen típusú gyógyszer az Opdivo és milyen betegségek esetén alkalmazható? Az Opdivo
Az Opdivo nevű gyógyszer áttekintése és indoklás, hogy miért engedélyezték az EU-ban
 EMA/55240/2019 EMEA/H/C/003985 Az Opdivo nevű gyógyszer áttekintése és indoklás, hogy miért engedélyezték az EU-ban Milyen típusú gyógyszer az Opdivo és milyen betegségek esetén alkalmazható? Az Opdivo
EMA/55240/2019 EMEA/H/C/003985 Az Opdivo nevű gyógyszer áttekintése és indoklás, hogy miért engedélyezték az EU-ban Milyen típusú gyógyszer az Opdivo és milyen betegségek esetén alkalmazható? Az Opdivo
pneumococcus poliszacharid konjugált vakcina (13-valens, adszorbeált)
 EMA/90006/2015 EMEA/H/C/001104 EPAR-összefoglaló a nyilvánosság számára pneumococcus poliszacharid konjugált vakcina (13-valens, adszorbeált) Ez a dokumentum a -ra vonatkozó európai nyilvános értékelő
EMA/90006/2015 EMEA/H/C/001104 EPAR-összefoglaló a nyilvánosság számára pneumococcus poliszacharid konjugált vakcina (13-valens, adszorbeált) Ez a dokumentum a -ra vonatkozó európai nyilvános értékelő
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 A Keytruda nevű gyógyszer áttekintése és indoklás, hogy miért engedélyezték az EU-ban Milyen típusú gyógyszer a Keytruda és milyen betegségek esetén alkalmazható? A Keytruda
EMA/235911/2019 EMEA/H/C/003820 A Keytruda nevű gyógyszer áttekintése és indoklás, hogy miért engedélyezték az EU-ban Milyen típusú gyógyszer a Keytruda és milyen betegségek esetén alkalmazható? A Keytruda
Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból
 25 January 2018 EMA/PRAC/35603/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból A PRAC 2018. január 8-11-i ülésén
25 January 2018 EMA/PRAC/35603/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból A PRAC 2018. január 8-11-i ülésén
Oktatási anyagok a Suliqua elnevezésű diabétesz gyógyszert alkalmazó egészségügyi szakemberek és betegek számára
 2017. január 19. EMA/747766/2016 Oktatási anyagok a Suliqua elnevezésű diabétesz gyógyszert alkalmazó egészségügyi szakemberek és betegek számára Két különböző hatáserősségű toll összecserélési kockázatának
2017. január 19. EMA/747766/2016 Oktatási anyagok a Suliqua elnevezésű diabétesz gyógyszert alkalmazó egészségügyi szakemberek és betegek számára Két különböző hatáserősségű toll összecserélési kockázatának
Új korlátozások a szívritmusra gyakorolt hatások kockázatainak minimalizálására vonatkozóan hidroxizin tartalmú gyógyszerekkel
 2015. március 27. Új korlátozások a szívritmusra gyakorolt hatások kockázatainak minimalizálására vonatkozóan hidroxizin tartalmú gyógyszerekkel Használatuk kerülendő a legnagyobb kockázatnak kitett betegeknél,
2015. március 27. Új korlátozások a szívritmusra gyakorolt hatások kockázatainak minimalizálására vonatkozóan hidroxizin tartalmú gyógyszerekkel Használatuk kerülendő a legnagyobb kockázatnak kitett betegeknél,
Online jelentés felhasználói útmutató
 Beteg egészségvédelem Ez az online jelentés felhasználói útmutató az online jelentés adatelemeivel, szerkezetével, értelmezésével és funkcióival kapcsolatban nyújt tájékoztatást. 1. Adatelemek... 2 2.
Beteg egészségvédelem Ez az online jelentés felhasználói útmutató az online jelentés adatelemeivel, szerkezetével, értelmezésével és funkcióival kapcsolatban nyújt tájékoztatást. 1. Adatelemek... 2 2.
Az EMA jóváhagyta a PML nevű agyi fertőzésnek a Tysabri alkalmazásával kapcsolatos kockázata csökkentésére vonatkozó ajánlásokat
 25/04/2016 Az EMA jóváhagyta a PML nevű agyi fertőzésnek a Tysabri alkalmazásával kapcsolatos kockázata csökkentésére vonatkozó ajánlásokat A nagyobb kockázatnak kitett betegeknél meg kell fontolni a gyakoribb
25/04/2016 Az EMA jóváhagyta a PML nevű agyi fertőzésnek a Tysabri alkalmazásával kapcsolatos kockázata csökkentésére vonatkozó ajánlásokat A nagyobb kockázatnak kitett betegeknél meg kell fontolni a gyakoribb
Útmutató a gyógyszerekkel szembeni, feltételezett mellékhatások spontán esetjelentéseinek értelmezéséhez
 2017. január 30. Ellenőrzések, emberi felhasználásra szánt gyógyszerek farmakovigilancia és bizottságok EMA/749446/2016 Revision 1* Útmutató a gyógyszerekkel szembeni, feltételezett mellékhatások spontán
2017. január 30. Ellenőrzések, emberi felhasználásra szánt gyógyszerek farmakovigilancia és bizottságok EMA/749446/2016 Revision 1* Útmutató a gyógyszerekkel szembeni, feltételezett mellékhatások spontán
Az Metacam-ra vonatkozó áttekintés és az EU-ban való engedélyezésének indoklása
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Az Metacam-ra vonatkozó áttekintés és az EU-ban való engedélyezésének indoklása Milyen típusú készítmény a Metacam és milyen betegségek esetén alkalmazható? A Metacam
EMA/CVMP/259397/2006 EMEA/V/C/000033 Az Metacam-ra vonatkozó áttekintés és az EU-ban való engedélyezésének indoklása Milyen típusú készítmény a Metacam és milyen betegségek esetén alkalmazható? A Metacam
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye alapján jött létre.
 II. melléklet Az alkalmazási előírás és a betegtájékoztató módosítása az Európai Gyógyszerügynökség előterjesztésére Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye
II. melléklet Az alkalmazási előírás és a betegtájékoztató módosítása az Európai Gyógyszerügynökség előterjesztésére Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
Immunológia I. 2. előadás. Kacskovics Imre (imre.kacskovics@ttk.elte.hu)
 Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
 www.printo.it/pediatric-rheumatology/hu/intro Gyógyszeres Kezelés Verzió 2016 13. Biológiai szerek Az elmúlt néhány évben új perspektívákat nyitottak a biológiai szereknek nevezett hatóanyagok. Az orvosok
www.printo.it/pediatric-rheumatology/hu/intro Gyógyszeres Kezelés Verzió 2016 13. Biológiai szerek Az elmúlt néhány évben új perspektívákat nyitottak a biológiai szereknek nevezett hatóanyagok. Az orvosok
Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból
 17 December 2015 Pharmacovigilance Risk Assessment Committee (PRAC) Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból A PRAC 2015. november 30 december 3-i ülésén elfogadva
17 December 2015 Pharmacovigilance Risk Assessment Committee (PRAC) Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból A PRAC 2015. november 30 december 3-i ülésén elfogadva
I. melléklet Tudományos következtetések és a forgalomba hozatali engedélyek feltételei módosításának indoklása
 I. melléklet Tudományos következtetések és a forgalomba hozatali engedélyek feltételei módosításának indoklása Tudományos következtetések Figyelembe véve a farmakovigilanciai kockázatértékelő bizottságnak
I. melléklet Tudományos következtetések és a forgalomba hozatali engedélyek feltételei módosításának indoklása Tudományos következtetések Figyelembe véve a farmakovigilanciai kockázatértékelő bizottságnak
Az Európai Gyógyszerügynökség a metoklopramid alkalmazásának módosítását javasolja
 2013. december 20. Corr. 1 Az Európai Gyógyszerügynökség a metoklopramid alkalmazásának módosítását A változtatások célja főként a neurológiai mellékhatások kockázatának csökkentése Október 24-én az Európai
2013. december 20. Corr. 1 Az Európai Gyógyszerügynökség a metoklopramid alkalmazásának módosítását A változtatások célja főként a neurológiai mellékhatások kockázatának csökkentése Október 24-én az Európai
Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból
 10 November 2016 EMA/PRAC/730045/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból A PRAC 2016. október 24-27-i ülésén
10 November 2016 EMA/PRAC/730045/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból A PRAC 2016. október 24-27-i ülésén
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen e gyógyszer körültekintő alkalmazása.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Version 7 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Fexgen 180
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Version 7 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Fexgen 180
MELLÉKLET TUDOMÁNYOS KÖVETKEZTETÉSEK ÉS A FORGALOMBA HOZATALI ENGEDÉLY KIADÁSA ELUTASÍTÁSÁNAK AZ EMEA ÁLTAL ISMERTETETT INDOKLÁSA
 MELLÉKLET TUDOMÁNYOS KÖVETKEZTETÉSEK ÉS A FORGALOMBA HOZATALI ENGEDÉLY KIADÁSA ELUTASÍTÁSÁNAK AZ EMEA ÁLTAL ISMERTETETT INDOKLÁSA 1 A MYLOTARG TUDOMÁNYOS ÉRTÉKELÉSÉNEK ÁTFOGÓ ÖSSZEGZÉSE A gemtuzumab-ozogamicin
MELLÉKLET TUDOMÁNYOS KÖVETKEZTETÉSEK ÉS A FORGALOMBA HOZATALI ENGEDÉLY KIADÁSA ELUTASÍTÁSÁNAK AZ EMEA ÁLTAL ISMERTETETT INDOKLÁSA 1 A MYLOTARG TUDOMÁNYOS ÉRTÉKELÉSÉNEK ÁTFOGÓ ÖSSZEGZÉSE A gemtuzumab-ozogamicin
Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból
 15 September 2016 Pharmacovigilance Risk Assessment Committee (PRAC) Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból A PRAC 2016. augusztus 30-szeptember 2-i ülésén elfogadva
15 September 2016 Pharmacovigilance Risk Assessment Committee (PRAC) Új kísérőirat szövegezés Kivonatok a PRAC szignálokkal kapcsolatos ajánlásaiból A PRAC 2016. augusztus 30-szeptember 2-i ülésén elfogadva
Betegtájékoztató: Információk a felhasználó számára. Aspirin 500 mg tabletta acetilszalicilsav
 Betegtájékoztató: Információk a felhasználó számára Aspirin 500 mg tabletta acetilszalicilsav Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára
Betegtájékoztató: Információk a felhasználó számára Aspirin 500 mg tabletta acetilszalicilsav Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára
A köpenysejtes limfómákról
 A köpenysejtes limfómákról Dr. Schneider Tamás Országos Onkológiai Intézet Lymphoma Centrum Limfóma Világnap 2014. szeptember 15. Limfómám van! Limfómám van! Igen? De milyen típusú? Gyógyítható? Nem gyógyítható?
A köpenysejtes limfómákról Dr. Schneider Tamás Országos Onkológiai Intézet Lymphoma Centrum Limfóma Világnap 2014. szeptember 15. Limfómám van! Limfómám van! Igen? De milyen típusú? Gyógyítható? Nem gyógyítható?
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Otrivin allergia adagoló orrspray Otrivin Allergia adagoló oldatos orrspray
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Otrivin allergia adagoló orrspray Otrivin Allergia adagoló oldatos orrspray
B. BETEGTÁJÉKOZTATÓ 1
 B. BETEGTÁJÉKOZTATÓ 1 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Zevalin 1,6 mg/ml készlet radioaktív infúziós gyógyszerhez Ibritumomab-tiuxetán [ 90 Y] Mielőtt elkezdenék alkalmazni Önnél ezt
B. BETEGTÁJÉKOZTATÓ 1 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Zevalin 1,6 mg/ml készlet radioaktív infúziós gyógyszerhez Ibritumomab-tiuxetán [ 90 Y] Mielőtt elkezdenék alkalmazni Önnél ezt
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen e gyógyszer körültekintő bevétele.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
Olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára fontos információkat tartalmaz.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Plavix 75 mg filmtabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Plavix 75 mg filmtabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! B BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Jumex 5 mg tabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! B BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Jumex 5 mg tabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Ibutop
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Ibutop
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Duphalac szirup Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Duphalac szirup Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmes Mielőtt elkezdené
FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmes Mielőtt elkezdené
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni,
Generated by Unregistered Batch DOC TO PDF Converter , please register! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
 Generated by Unregistered Batch DOC TO PDF Converter 2011.3.827.1514, please register! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Neupogen 30 millió Egység/0,5 ml (0,6 mg/ml) oldatos injekció
Generated by Unregistered Batch DOC TO PDF Converter 2011.3.827.1514, please register! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Neupogen 30 millió Egység/0,5 ml (0,6 mg/ml) oldatos injekció
ELLENJAVALLAT: Ne alkalmazza a VPRIV-et, ha allergiás a velagluceráz-alfára vagy a gyógyszer egyéb összetevõjére.
 VPRIV 400 EGYSÉG POR OLDATOS INFÚZIÓHOZ VPRIV 400 egység por oldatos infúzióhoz velagluceráz-alfa HATÓANYAG: Velagluceráz-alfa. A 400 egység VPRIV port tartalmazó injekciós üveg 400 egység velagluceráz-alfát
VPRIV 400 EGYSÉG POR OLDATOS INFÚZIÓHOZ VPRIV 400 egység por oldatos infúzióhoz velagluceráz-alfa HATÓANYAG: Velagluceráz-alfa. A 400 egység VPRIV port tartalmazó injekciós üveg 400 egység velagluceráz-alfát
PRAC ajánlások a kísérőiratok frissítését igénylő szignálokkal kapcsolatban
 2015. január 22. Farmakovigilancia kockázatértékelő bizottság (Pharmacovigilance Risk Assessment Committee- PRAC) PRAC ajánlások a kísérőiratok frissítését igénylő szignálokkal kapcsolatban A PRAC 2015.
2015. január 22. Farmakovigilancia kockázatértékelő bizottság (Pharmacovigilance Risk Assessment Committee- PRAC) PRAC ajánlások a kísérőiratok frissítését igénylő szignálokkal kapcsolatban A PRAC 2015.
Immunológia I. 4. előadás. Kacskovics Imre
 Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Miért volt szükséges ez a vizsgálat?
 CARMELINA: A linagliptin hatása a kardiovaszkuláris egészségre és a veseműködésre kardiovaszkuláris kockázattal rendelkező, 2-es típusú cukorbetegségben szenvedő betegeknél Ez egy 2-es típusú diabéteszben
CARMELINA: A linagliptin hatása a kardiovaszkuláris egészségre és a veseműködésre kardiovaszkuláris kockázattal rendelkező, 2-es típusú cukorbetegségben szenvedő betegeknél Ez egy 2-es típusú diabéteszben
Olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára fontos információkat tartalmaz.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Ambrobene 30 mg tabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Ambrobene 30 mg tabletta BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
II. melléklet. Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása
 II. melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 7 Tudományos következtetések A Cymevene i.v. és kapcsolódó nevek (lásd I. melléklet)
II. melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 7 Tudományos következtetések A Cymevene i.v. és kapcsolódó nevek (lásd I. melléklet)
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen e gyógyszer körültekintő bevétele.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ACC 100 granulátum BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA ACC
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ACC 100 granulátum BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA ACC
Katasztrófális antifoszfolipid szindróma
 Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen a gyógyszer körültekintő alkalmazása.
 FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató Betegtájékoztató:információk a felhasználó számára Béres
FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató Betegtájékoztató:információk a felhasználó számára Béres
Olvassa el figyelmesen az alábbi betegtájékoztatót, mely az Ön számára fontos információkat tartalmaz.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen az alábbi
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen az alábbi
Gyermekkori asztma és légúti túlérzékenység kezelési napló
 Gyermekkori asztma és légúti túlérzékenység kezelési napló Általános tájékoztató a gyermekkori asztma és légúti túlérzékenység kezeléséről A kezelés célja a teljes tünetmentesség elérése, tünetek jelentkezésekor
Gyermekkori asztma és légúti túlérzékenység kezelési napló Általános tájékoztató a gyermekkori asztma és légúti túlérzékenység kezeléséről A kezelés célja a teljes tünetmentesség elérése, tünetek jelentkezésekor
NÉV, GYÓGYSZERFORMA, HATÁSERŐSSÉG, ALKALMAZÁSI MÓD ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJÁNAK NEVE ÉS CÍME AZ EURÓPAI UNIÓ TAGORSZÁGAIN BELÜL
 I. MELLÉKLET NÉV, GYÓGYSZERFORMA, HATÁSERŐSSÉG, ALKALMAZÁSI MÓD ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJÁNAK NEVE ÉS CÍME AZ EURÓPAI UNIÓ TAGORSZÁGAIN BELÜL 1 EU Tagország Olaszország JÓD-KAZEINT/TIAMINT
I. MELLÉKLET NÉV, GYÓGYSZERFORMA, HATÁSERŐSSÉG, ALKALMAZÁSI MÓD ÉS A FORGALOMBA HOZATALI ENGEDÉLY JOGOSULTJÁNAK NEVE ÉS CÍME AZ EURÓPAI UNIÓ TAGORSZÁGAIN BELÜL 1 EU Tagország Olaszország JÓD-KAZEINT/TIAMINT
1. MILYEN TÍPUSÚ GYÓGYSZER A NEBILET TABLETTA ÉS MILYEN BETEGSÉGEK ESETÉN ALKALMAZHATÓ?
 NEBILET 5 MG TABLETTA NEBILET TABLETTA nebivolol 1. MILYEN TÍPUSÚ GYÓGYSZER A NEBILET TABLETTA ÉS MILYEN BETEGSÉGEK ESETÉN ALKALMAZHATÓ? A Nebilet tabletta magas vérnyomás és krónikus szívelégtelenség
NEBILET 5 MG TABLETTA NEBILET TABLETTA nebivolol 1. MILYEN TÍPUSÚ GYÓGYSZER A NEBILET TABLETTA ÉS MILYEN BETEGSÉGEK ESETÉN ALKALMAZHATÓ? A Nebilet tabletta magas vérnyomás és krónikus szívelégtelenség
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató Betegtájékoztató Lioton 100 000 gél Mielőtt elkezdené gyógyszerét
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató Betegtájékoztató Lioton 100 000 gél Mielőtt elkezdené gyógyszerét
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Magnesium 250 mg Pharmavit pezsgőtabletta Magnesium Pharmavit 250 mg pezsgőtabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Magnesium 250 mg Pharmavit pezsgőtabletta Magnesium Pharmavit 250 mg pezsgőtabletta
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Cervarix szuszpenziós injekció előretöltött fecskendőben Humán papillomavírus vakcina [16-os és 18-as típus] (rekombináns, adjuvánssal adszorbeált) Mielőtt
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Cervarix szuszpenziós injekció előretöltött fecskendőben Humán papillomavírus vakcina [16-os és 18-as típus] (rekombináns, adjuvánssal adszorbeált) Mielőtt
MAGYOT évi Tudományos Szimpóziuma Május 5-6, Budapest
 MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
III. melléklet. Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteit érintő módosítások
 III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteit érintő módosítások Megjegyzés: Az alkalmazási előírás és a betegtájékoztató módosításait értelemszerűen a referencia-tagállammal
III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteit érintő módosítások Megjegyzés: Az alkalmazási előírás és a betegtájékoztató módosításait értelemszerűen a referencia-tagállammal
KETTŐS EREJÉVEL GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ ORRDUGULÁS ORRFOLYÁS IBUPROFÉN ÉS PSZEUDOEFEDRIN A MEGFÁZÁS TÜNETEI ELLEN FEJFÁJÁS TOROKGYULLADÁS
 IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
Betegtájékoztató: Információk a felhasználó számára. ACC Hot 200 mg por belsőleges oldathoz ACC Hot 600 mg por belsőleges oldathoz.
 Betegtájékoztató: Információk a felhasználó számára ACC Hot 200 mg por belsőleges oldathoz ACC Hot 600 mg por belsőleges oldathoz acetilcisztein Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen
Betegtájékoztató: Információk a felhasználó számára ACC Hot 200 mg por belsőleges oldathoz ACC Hot 600 mg por belsőleges oldathoz acetilcisztein Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen
A Kockázatkezelési Terv Összefoglalója
 1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené gyógyszerét alkalmazni, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Allergodil orrspray 4. sz. melléklete az OGYI-T- 5334/01-04 sz. Forgalomba
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Allergodil orrspray 4. sz. melléklete az OGYI-T- 5334/01-04 sz. Forgalomba
I. melléklet. Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása
 I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilancia Kockázatértékelő
I. melléklet Tudományos következtetések és a forgalomba hozatali engedély(ek) feltételeit érintő módosítások indoklása 1 Tudományos következtetések Figyelembe véve a Farmakovigilancia Kockázatértékelő
Evidencia vagy ígéret? Evidencián alapuló orvoslás a haematológiában
 Evidencia vagy ígéret? Evidencián alapuló orvoslás a haematológiában Dr. Mikala Gábor Egy. Szt István és Szent László Kórház Haematológiai és Őssejt-Transzplantációs Osztály Lymphoma és Myeloma Terápiás
Evidencia vagy ígéret? Evidencián alapuló orvoslás a haematológiában Dr. Mikala Gábor Egy. Szt István és Szent László Kórház Haematológiai és Őssejt-Transzplantációs Osztály Lymphoma és Myeloma Terápiás
Betegtájékoztató: Információk a felhasználó számára
 Betegtájékoztató: Információk a felhasználó számára PARAMAX Junior 250 mg tabletta PARAMAX Rapid 500 mg tabletta PARAMAX Forte 1 g tabletta paracetamol Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa
Betegtájékoztató: Információk a felhasználó számára PARAMAX Junior 250 mg tabletta PARAMAX Rapid 500 mg tabletta PARAMAX Forte 1 g tabletta paracetamol Mielőtt elkezdi alkalmazni ezt a gyógyszert, olvassa
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
I. melléklet TUDOMÁNYOS KÖVETKEZTETÉSEK ÉS A FORGALOMBA HOZATALI ENGEDÉLY(EK) FELTÉTELEI MÓDOSÍTÁSÁNAK INDOKLÁSA
 I. melléklet TUDOMÁNYOS KÖVETKEZTETÉSEK ÉS A FORGALOMBA HOZATALI ENGEDÉLY(EK) FELTÉTELEI MÓDOSÍTÁSÁNAK INDOKLÁSA Tudományos következtetések Figyelembe véve a farmakovigilanciai kockázatértékelő bizottságnak
I. melléklet TUDOMÁNYOS KÖVETKEZTETÉSEK ÉS A FORGALOMBA HOZATALI ENGEDÉLY(EK) FELTÉTELEI MÓDOSÍTÁSÁNAK INDOKLÁSA Tudományos következtetések Figyelembe véve a farmakovigilanciai kockázatértékelő bizottságnak
Az Európai Gyógyszerügynökség 2006-ban
 European Medicines Agency EMEA/2323/27/HU/VÉGLEGES Az EMEA tizenkettedik éves jelentésének összefoglalója Ez a dokumentum az EMEA 26. évi éves jelentésének összefoglalója. Az EMEA 26. évi teljes éves jelentését
European Medicines Agency EMEA/2323/27/HU/VÉGLEGES Az EMEA tizenkettedik éves jelentésének összefoglalója Ez a dokumentum az EMEA 26. évi éves jelentésének összefoglalója. Az EMEA 26. évi teljes éves jelentését
Immunológia Világnapja
 a Magyar Tudományos Akadémia Biológiai Osztály, Immunológiai Bizottsága és a Magyar Immunológiai Társaság Immunológia Világnapja - 2016 Tumorbiológia Dr. Tóvári József, Országos Onkológiai Intézet Mágikus
a Magyar Tudományos Akadémia Biológiai Osztály, Immunológiai Bizottsága és a Magyar Immunológiai Társaság Immunológia Világnapja - 2016 Tumorbiológia Dr. Tóvári József, Országos Onkológiai Intézet Mágikus
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Cetirizin-ratiopharm 10 mg filmtabletta Cetirizin-ratiopharm 10 mg filmtabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Cetirizin-ratiopharm 10 mg filmtabletta Cetirizin-ratiopharm 10 mg filmtabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR 24.991/75/2006 sz. határozat
FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR 24.991/75/2006 sz. határozat
Betegtájékoztató CEREZYME 400 E POR OLDATOS INFÚZIÓHOZ VALÓ KONCENTRÁTUMHOZ
 CEREZYME 400 E POR OLDATOS INFÚZIÓHOZ VALÓ KONCENTRÁTUMHOZ Cerezyme 400 egység por oldatos infúzióhoz való koncentrátumhoz Imigluceráz HATÓANYAG: Imigluceráz. Az imigluceráz a savas -glükozidáz emberi
CEREZYME 400 E POR OLDATOS INFÚZIÓHOZ VALÓ KONCENTRÁTUMHOZ Cerezyme 400 egység por oldatos infúzióhoz való koncentrátumhoz Imigluceráz HATÓANYAG: Imigluceráz. Az imigluceráz a savas -glükozidáz emberi
Betegtájékoztató ATG-FRESENIUS 20 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ
 ATG-FRESENIUS 20 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ ATG Fresenius 20 mg/ml koncentrátum oldatos infúzióhoz nyúl eredetû anti humán T lymphocyta immunglobulin HATÓANYAG: 20 mg/ml nyúl eredetû anti humán
ATG-FRESENIUS 20 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ ATG Fresenius 20 mg/ml koncentrátum oldatos infúzióhoz nyúl eredetû anti humán T lymphocyta immunglobulin HATÓANYAG: 20 mg/ml nyúl eredetû anti humán
Betegtájékoztató: Információk a beteg számára. Dassergo 5 mg filmtabletta dezloratadin
 Betegtájékoztató: Információk a beteg számára Dassergo 5 mg filmtabletta dezloratadin Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára fontos
Betegtájékoztató: Információk a beteg számára Dassergo 5 mg filmtabletta dezloratadin Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára fontos
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! OGYI fejléces papír BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Tetran
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! OGYI fejléces papír BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Tetran
HATÓANYAG: 30 mg vízmentes dinátrium-pamidronát (+0,90 mg rámérés) (dinátrium-pamidronát pentahidrátból bemérve) injekciós üvegenként.
 AREDIA 30 MG POR ÉS OLDÓSZER OLDATOS INFÚZIÓHOZ Aredia 30 mg por és oldószer oldatos infúzióhoz dinátrium-pamidronát HATÓANYAG: 30 mg vízmentes dinátrium-pamidronát (+0,90 mg rámérés) (dinátrium-pamidronát
AREDIA 30 MG POR ÉS OLDÓSZER OLDATOS INFÚZIÓHOZ Aredia 30 mg por és oldószer oldatos infúzióhoz dinátrium-pamidronát HATÓANYAG: 30 mg vízmentes dinátrium-pamidronát (+0,90 mg rámérés) (dinátrium-pamidronát
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A BETEG SZÁMÁRA AZ EASY LEG ÍZÜLETI KRÉMRŐL (250 ml)
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A BETEG SZÁMÁRA AZ EASY LEG ÍZÜLETI KRÉMRŐL (250 ml) Kalendula (körömvirág), rozmaring, mentol, kámfor, aloe vera, kurkuma, csalán, angelika (angyalgyökér), boróka, kakukkfű,
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A BETEG SZÁMÁRA AZ EASY LEG ÍZÜLETI KRÉMRŐL (250 ml) Kalendula (körömvirág), rozmaring, mentol, kámfor, aloe vera, kurkuma, csalán, angelika (angyalgyökér), boróka, kakukkfű,
I. MELLÉKLET FELSOROLÁS: MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZERKÉSZÍTMÉNY- DÓZIS, ALKALMAZÁSI MÓD, KÉRELMEZŐK A TAGÁLLAMOKBAN
 I. MELLÉKLET FELSOROLÁS: MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZERKÉSZÍTMÉNY- DÓZIS, ALKALMAZÁSI MÓD, KÉRELMEZŐK A TAGÁLLAMOKBAN 1 Tagállam EU/EGT Ausztria Belgium Dánia Finnország Franciaország Írország Olaszország
I. MELLÉKLET FELSOROLÁS: MEGNEVEZÉS, GYÓGYSZERFORMA, GYÓGYSZERKÉSZÍTMÉNY- DÓZIS, ALKALMAZÁSI MÓD, KÉRELMEZŐK A TAGÁLLAMOKBAN 1 Tagállam EU/EGT Ausztria Belgium Dánia Finnország Franciaország Írország Olaszország
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
1. Milyen típusú gyógyszer a Bilutamid 150 mg filmtabletta és milyen betegségek esetén alkalmazható?
 BILUTAMID 150 MG FILMTABLETTA Bilutamid 150 mg filmtabletta bikalutamid 1. Milyen típusú gyógyszer a Bilutamid 150 mg filmtabletta és milyen betegségek esetén alkalmazható? A Bilutamid 150 mg filmtablettát
BILUTAMID 150 MG FILMTABLETTA Bilutamid 150 mg filmtabletta bikalutamid 1. Milyen típusú gyógyszer a Bilutamid 150 mg filmtabletta és milyen betegségek esetén alkalmazható? A Bilutamid 150 mg filmtablettát
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tabletta Magnesii Citrici 500 mg Fono VII. Parma Mielőtt elkezdené gyógyszerét
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tabletta Magnesii Citrici 500 mg Fono VII. Parma Mielőtt elkezdené gyógyszerét
védelme az influenza ellen
 HUNGARIAN translation Pre-school Flu Leaflet Gyermekének védelme az influenza ellen Védőoltás kisgyermekek és óvodások részére 2016 Gyermekének védelme az influenza ellen Az éves influenza elleni védőoltást
HUNGARIAN translation Pre-school Flu Leaflet Gyermekének védelme az influenza ellen Védőoltás kisgyermekek és óvodások részére 2016 Gyermekének védelme az influenza ellen Az éves influenza elleni védőoltást
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen e gyógyszer körültekintő bevétele.
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ACC 100 ptbl. PIL jav. BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! ACC 100 ptbl. PIL jav. BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA
Ritka Gyermekkori Elsődleges Szisztémás Vaszkulitisz
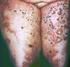 www.printo.it/pediatric-rheumatology/hu/intro Ritka Gyermekkori Elsődleges Szisztémás Vaszkulitisz Verzió 2016 1. MI A VASZKULITISZ 1.1 Mi ez? A vaszkulitisz a vérerek falának gyulladásos betegsége. A
www.printo.it/pediatric-rheumatology/hu/intro Ritka Gyermekkori Elsődleges Szisztémás Vaszkulitisz Verzió 2016 1. MI A VASZKULITISZ 1.1 Mi ez? A vaszkulitisz a vérerek falának gyulladásos betegsége. A
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A BETEG SZÁMÁRA BODY BALANCE ÍZÜLETI VITAMIN
 BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A BETEG SZÁMÁRA BODY BALANCE ÍZÜLETI VITAMIN MSM (Metil-Szulfonil-Metán), glükozamin szulfát, kondroitin szulfát, magnézium, kurkuma, gyömbér, boswelia, quercetin, bromelain,
BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A BETEG SZÁMÁRA BODY BALANCE ÍZÜLETI VITAMIN MSM (Metil-Szulfonil-Metán), glükozamin szulfát, kondroitin szulfát, magnézium, kurkuma, gyömbér, boswelia, quercetin, bromelain,
Betegtájékoztató: Információk a felhasználó számára. Aspirin Plus C pezsgőtabletta. acetilszalicilsav/ aszkorbinsav
 Betegtájékoztató: Információk a felhasználó számára Aspirin Plus C pezsgőtabletta acetilszalicilsav/ aszkorbinsav Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót,
Betegtájékoztató: Információk a felhasználó számára Aspirin Plus C pezsgőtabletta acetilszalicilsav/ aszkorbinsav Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót,
Betegtájékoztató PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ. Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát
 PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát HATÓANYAG: Milliliterenként 15 mg dinátrium-pamidronát (ami megfelel 12,6 mg pamidronsavnak).
PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát HATÓANYAG: Milliliterenként 15 mg dinátrium-pamidronát (ami megfelel 12,6 mg pamidronsavnak).
II. melléklet. Az EMA által beterjesztett tudományos következtetések, valamint a termékek forgalmazása és alkalmazása felfüggesztésének indokolása
 II. melléklet Az EMA által beterjesztett tudományos következtetések, valamint a termékek forgalmazása és alkalmazása felfüggesztésének indokolása 14 Tudományos következtetések A buflomedilt tartalmazó
II. melléklet Az EMA által beterjesztett tudományos következtetések, valamint a termékek forgalmazása és alkalmazása felfüggesztésének indokolása 14 Tudományos következtetések A buflomedilt tartalmazó
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
Alkalmazási előírás. 4.2 Adagolás és alkalmazás. 4.3 Ellenjavallatok
 A Strattera (atomoxetine) hatásai a vérnyomásra és a szívfrekvenciára a forgalomba hozatali engedély jogosultja (MAH) által végzett klinikai vizsgálat adatainak felülvizsgálata alapján. Végleges SPC és
A Strattera (atomoxetine) hatásai a vérnyomásra és a szívfrekvenciára a forgalomba hozatali engedély jogosultja (MAH) által végzett klinikai vizsgálat adatainak felülvizsgálata alapján. Végleges SPC és
Hungarian translation of Protecting your child against flu - Vaccination for your P6 child
 Gyermekének influenza elleni védelme P6 osztályos gyermekének beoltása Hungarian translation of Protecting your child against flu - Vaccination for your P6 child Gyermekének influenza elleni védelme Az
Gyermekének influenza elleni védelme P6 osztályos gyermekének beoltása Hungarian translation of Protecting your child against flu - Vaccination for your P6 child Gyermekének influenza elleni védelme Az
Betegtájékoztató: Információk a felhasználó számára
 Betegtájékoztató: Információk a felhasználó számára Havrix 1440 szuszpenziós injekció előretöltött fecskendőben Havrix 720 Junior szuszpenziós injekció előretöltött fecskendőben Hepatitisz A vakcina (inaktivált,
Betegtájékoztató: Információk a felhasználó számára Havrix 1440 szuszpenziós injekció előretöltött fecskendőben Havrix 720 Junior szuszpenziós injekció előretöltött fecskendőben Hepatitisz A vakcina (inaktivált,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR (szövegjavaslat) BETEGTÁJÉKOZTTÓ:
FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTTÓ: INFORMÁCIÓK FELHSZNÁLÓ SZÁMÁR (szövegjavaslat) BETEGTÁJÉKOZTTÓ:
Ez a gyógyszer orvosi rendelvény nélkül kapható. Mindemellett az optimális hatás érdekében elengedhetetlen e gyógyszer körültekintő alkalmazása.
 FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató Betegtájékoztató: Információk a felhasználó számára Béres
FIGYELEM!!! z alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató Betegtájékoztató: Információk a felhasználó számára Béres
III. MELLÉKLET. Az Alkalmazási előírások és Betegtájékoztatók vonatkozó részeiben szükséges módosítások
 III. MELLÉKLET Az Alkalmazási előírások és Betegtájékoztatók vonatkozó részeiben szükséges módosítások Megjegyzés: A későbbiekben szükség lehet arra, hogy adott esetben a Referencia-tagállammal együttműködve,
III. MELLÉKLET Az Alkalmazási előírások és Betegtájékoztatók vonatkozó részeiben szükséges módosítások Megjegyzés: A későbbiekben szükség lehet arra, hogy adott esetben a Referencia-tagállammal együttműködve,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Termék neve (gyártó megnevezése) BETEGTÁJÉKOZTTÓ Mielőtt elkezdené gyógyszerét
FIGYELEM!!! alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Termék neve (gyártó megnevezése) BETEGTÁJÉKOZTTÓ Mielőtt elkezdené gyógyszerét
III. melléklet. A kísérőiratok vonatkozó pontjaiba bevezetendő módosítások
 III. melléklet A kísérőiratok vonatkozó pontjaiba bevezetendő módosítások Megjegyzés: Ezen kísérőiratok annak a referál eljárásnak az eredményeként készültek, amelyre a Bizottság e döntése vonatkozik.
III. melléklet A kísérőiratok vonatkozó pontjaiba bevezetendő módosítások Megjegyzés: Ezen kísérőiratok annak a referál eljárásnak az eredményeként készültek, amelyre a Bizottság e döntése vonatkozik.
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató tervezet Naphazolin orrcsepp Mielőtt elkezdené gyógyszerét
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Betegtájékoztató tervezet Naphazolin orrcsepp Mielőtt elkezdené gyógyszerét
