Betegtájékoztató: Információk a felhasználó számára. Magnerot tabletta. magnézium-orotát-dihidrát
|
|
|
- Katalin Gálné
- 10 évvel ezelőtt
- Látták:
Átírás
1 Betegtájékoztató: Információk a felhasználó számára Magnerot tabletta magnézium-orotát-dihidrát Mielőtt elkezdi szedni ezt a gyógyszert, olvassa el figyelmesen az alábbi betegtájékoztatót, mert az Ön számára fontos információkat tartalmaz. Ezt a gyógyszert mindig pontosan a betegtájékoztatóban leírtaknak, vagy az Ön kezelőorvosa vagy gyógyszerésze által elmondottaknak megfelelően alkalmazza. Tartsa meg a betegtájékoztatót, mert a benne szereplő információkra a későbbiekben is szüksége lehet. További információkért vagy tanácsért forduljon gyógyszerészéhez. Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármely lehetséges mellékhatásra is vonatkozik. Lásd 4. pont. Feltétlenül tájékoztassa kezelőorvosát, ha tünetei nem enyhülnek, vagy éppen súlyosbodnak. A betegtájékoztató tartalma: 1. Milyen típusú gyógyszer a Magnerot tabletta és milyen betegségek esetén alkalmazható? 2. Tudnivalók a Magnerot tabletta szedése előtt 3. Hogyan kell alkalmazni a Magnerot tablettát? 4. Lehetséges mellékhatások 5 Hogyan kell a Magnerot tablettát tárolni? 6. A csomagolás tartalma és egyéb információk 1. Milyen típusú gyógyszer a Magnerot tabletta és milyen betegségek esetén alkalmazható? A Magnerot tabletta ásványi anyag, ezen belül magnézium-tartalmú készítmény. Magnéziumhiány megelőzésére és kezelésére javasolt. A magnézium-tartalmú készítményeket alkalmazzák magnéziumhiánnyal összefüggő szív- és érrendszeri betegségek esetén, így o szívroham (szívinfarktus) és a szívizom sejtek elhalásának (nekrózis) kivédésére, o szívtáji szorító fájdalom (angina pektorisz) kiegészítő kezelésére, továbbá o érelmeszesedés (arterioszklerozis), o a nagy és kis verőerek falának gyulladása (arteritisz és arteriolitisz) és o a zsír (lipid) anyagcsere zavarainak kiegészítő kezelésére. A fenti kórképekben azonban hatékonyságuk nincs igazolva a mai követelményeknek megfelelő klinikai vizsgálatokkal. A Magnerot tabletta alkalmazható a sima- és harántcsíkolt izomzat görcsös állapotai, így az éjszakai lábikragörcs, fokozott ideg-izom ingerlékenység kezelésére is, ha az izomműködés zavarának oka a magnéziumhiány. 2. Tudnivalók a Magnerot tabletta szedése előtt Ne szedje a Magnerot tablettát, ha - allergiás a magnézium-orotát-dihidrát hatóanyagra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére, - súlyos vesebetegsége van (vesefunkciói károsodtak), - kalcium-, ill. magnézium-ammónium-foszfát vesekövessége van, - szív ingerületvezetési zavara van (pitvar-kamra átvezetési blokk), OGYI/22130/2014
2 - szervezetében felborult az ásványi anyagok egyensúlya (súlyos zavar a sóháztartásban), - súlyos izomgyengeséggel járó betegségben (miaszténia grávisz) szenved. Figyelmeztetések és óvintézkedések A Magnerot tabletta szedése előtt beszéljen kezelőorvosával vagy gyógyszerészével. Ha állapota a kezelés ellenére sem javul, forduljon orvosához, aki szükség esetén módosítani fogja a terápiát ha Ön más gyógyszert is szed ha veseelégtelenségben szenved ha nincs vizelete ha kiszáradás áll fenn Egyéb gyógyszerek és a Magnerot tabletta Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről. A Magnerot tabletta egyidejű alkalmazása nem ajánlott: foszfát-, kalcium-tartalmú készítményekkel (gátolják a magnézium felszívódását a bélből) vas(ii)-ion tartalmú készítményekkel (a magnézium gátolja a vas felszívódását) tetraciklin antibiotikumokkal, valamint csontritkulás elleni bifoszfonátokkal és nátrium-fluoriddal (felszívódásukat a magnézium gátolhatja). A fenti készítmények és a Magnerot tabletta bevétele között 2-3 óra idő intervallum ajánlott. 2 A Magnerot tabletta egyidejű alkalmazása étellel, itallal vagy alkohollal Nem ajánlott az alkoholfogyasztás a Magnerot tablettával történő kezelés időtartama alatt. Az alkohol a szervezetben gátolja a magnézium felszívódását és fokozza a kiürülését. Terhesség, szoptatás és termékenység Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével. A magnézium vegyületek biztonságosan alkalmazhatók terhesség és szoptatás alatt. A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre A Magnerot tabletta nem befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket. A Magnerot tabletta tejcukrot (laktóz-monohidrátot) tartalmaz. Amennyiben kezelőorvosa korábban már figyelmeztette Önt, hogy bizonyos cukrokra érzékeny, a gyógyszer alkalmazása előtt forduljon kezelőorvosához. 3. Hogyan kell alkalmazni a Magnerot tablettát? Ezt a gyógyszert mindig pontosan a betegtájékoztatóban leírtaknak, vagy az Ön kezelőorvosa vagy gyógyszerésze által elmondottaknak megfelelően szedje. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét. A készítmény ajánlott adagja: Az ajánlott adag naponta 3-szor 2 tabletta1 héten át. Fenntartó adagja naponta 2-3 tabletta. Éjszakai lábikragörcs jelentkezésekor esténként 2-3 tabletta bevétele ajánlott. Alkalmazása gyermekeknél 6 éven felüli gyermekek szokásos napi adagja 1-3 tabletta. A kezelés időtartama:
3 A Magnerot tablettát legalább 6 hétig kell szedni, de a készítmény tartósan is alkalmazható. Kezelőorvosa fogja meghatározni a kezelés időtartamát. Az alkalmazás módja: A Magnerot tablettát szétrágva, kevés folyadékkal kell bevenni étkezés előtt vagy közben. Ha az alkalmazás során a Magnerot tabletta hatását túlzottan erősnek érzi, vagy a készítmény csekély hatásúnak bizonyul, forduljon orvosához vagy gyógyszerészéhez. 3 Ha az előírtnál több Magnerot tablettát vett be Nagy adagok hasmenést vagy híg székletet okozhatnak, azonban ezek a tünetek nem veszélyesek. Ha hasmenés lép fel, csökkentse a napi adagot vagy szakítsa félbe a kezelést, és keresse fel orvosát. Ha elfelejtette bevenni a Magnerot tablettát Folytassa a kezelést oly módon, hogy a legközelebbi szokásos időpontban vegye be a következő Magnerot adagot és továbbiakban figyeljen arra, hogy a jövőben rendszeresen szedje a tablettákat. Ne vegyen be kétszeres adagot a kihagyott adag pótlására. Ha idő előtt abbahagyja a Magnerot tabletta szedését A kezelés eredményessége érdeklében a Magnerot tablettákat olyan rendszeresen kell szedni, amennyire csak lehetséges. Ha idő előtt kívánja megszakítani vagy abbahagyni a kezelést, kérjük, beszéljen orvosával. Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét. 4. Lehetséges mellékhatások Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek. Ritka mellékhatások (1000 közül legfeljebb 1 beteget érinthet): Hasmenés vagy híg széklet jelentkezhet (a szokásos adagok túllépésekor), amelyek azonban ártalmatlan tünetek. Hasmenés esetén csökkenteni kell a napi adagot vagy abba kell hagyni a kezelést. Nagy dózisok tartós alkalmazása esetén fáradékonyság fordulhat elő. (Ez esetben klinikai- és laboratóriumi vizsgálat, a szérum magnéziumszint ellenőrzése szükséges). Magnézium-tartalmú savkötő szerek egyidejű szedése fokozhatja a hatást. Mellékhatások bejelentése Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban. 5. Hogyan kell a Magnerot tablettát tárolni? Legfeljebb 25 C-on tárolandó. A gyógyszer gyermekektől elzárva tartandó! A dobozon és a buborékcsomagoláson feltüntetett lejárati idő után (Felhasználható/Felh.:) ne szedje ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
4 4 Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét. 6. A csomagolás tartalma és egyéb információk Mit tartalmaz a Magnerot tabletta A készítmény hatóanyaga: 500 mg magnézium-orotát-dihidrát, Egyéb összetevők: magnézium-sztearát, nátrium-ciklamát, vízmentes kolloid szilícium-dioxid, karmellóz-nátrium, talkum, kukoricakeményítő, povidon K30, laktóz-monohidrát, mikrokristályos cellulóz. Milyen a Magnerot tabletta külleme és mit tartalmaz a csomagolás? Fehér, kerek, lapos, metszett élű tabletta, egyik oldalán felezővonallal. 20 db, 50 db, 100 db, 200 db tabletta, illetve kórházi kiszerelésben 1000 db tabletta fehér, átlátszatlan PVC/PVDC//Al buborékcsomagolásban és dobozban. A forgalomba hozatali engedély jogosultja és a gyártó A forgalomba hozatali engedély jogosultja: Wörwag Pharma GmbH & Co. KG Calwer Strasse 7, Böblingen Németország Gyártó: Mauermann Arzneimittel KG Heinrich-Knote-Strasse 2, Pöcking Németország A készítményhez kapcsolódó további kérdéseivel forduljon a forgalomba hozatali engedély jogosultjának helyi képviseletéhez: Wörwag Pharma Ker. Kft Budapest, Hűvösvölgyi út 54. Tel.: info@woerwagpharma.hu OGYI-T-1645/01 OGYI-T-1645/02 OGYI-T-1645/03 OGYI-T-1645/04 OGYI-T-1645/05 (20 db) (50 db) (100 db) (200 db) (1000 db) A betegtájékoztató legutóbbi felülvizsgálatának dátuma: június
HBVAXPRO 10 µg/ml szuszpenziós injekció előretöltött fecskendőben
 HBVAXPRO 10 µg/ml szuszpenziós injekció előretöltött fecskendőben hepatitis b antigen ATC-kód: J07BC01 Sanofi Pasteur/MSD SNC 1x előretöltött fecskendő tű nélkül V Szabadáras EU/1/01/183 / 011 TTT-kód:
HBVAXPRO 10 µg/ml szuszpenziós injekció előretöltött fecskendőben hepatitis b antigen ATC-kód: J07BC01 Sanofi Pasteur/MSD SNC 1x előretöltött fecskendő tű nélkül V Szabadáras EU/1/01/183 / 011 TTT-kód:
A HIV és az életminôséged: mellékhatások és egyéb komplikációk
 A HIV és az életminôséged: mellékhatások és egyéb komplikációk Hogyan beszéld meg problémáidat orvosoddal? Általános kérdések Gyógyszerváltás További információk 2011. december A kiadványt teljes körûen
A HIV és az életminôséged: mellékhatások és egyéb komplikációk Hogyan beszéld meg problémáidat orvosoddal? Általános kérdések Gyógyszerváltás További információk 2011. december A kiadványt teljes körûen
Teljes térdízületi protézis
 Teljes térdízületi protézis Mi az ízületi gyulladás? Az ízületi gyulladás olyan betegségek gyűjtőneve, amely egy vagy több ízület károsodását okozza. Az Ön sebésze teljes térdízületi protézis műtétet javasolt.
Teljes térdízületi protézis Mi az ízületi gyulladás? Az ízületi gyulladás olyan betegségek gyűjtőneve, amely egy vagy több ízület károsodását okozza. Az Ön sebésze teljes térdízületi protézis műtétet javasolt.
A dexametazon és egyéb szteroidok megismerése
 A dexametazon és egyéb szteroidok megismerése Nemzetközi Myeloma Alapítvány 12650 Riverside Drive, Suite 206 North Hollywood, CA 91607 USA Telefon: 800-452-CURE (2873) (USA & Canada) 818-487-7455 Fax:
A dexametazon és egyéb szteroidok megismerése Nemzetközi Myeloma Alapítvány 12650 Riverside Drive, Suite 206 North Hollywood, CA 91607 USA Telefon: 800-452-CURE (2873) (USA & Canada) 818-487-7455 Fax:
VÉRADÓK NYILVÁNTARTÁSA, VÉRADÁS ELŐTTI KIVIZSGÁLÁSA ÉS A TELJES VÉR VÉTELE
 VÉRADÓK NYILVÁNTARTÁSA, VÉRADÁS ELŐTTI KIVIZSGÁLÁSA ÉS A TELJES VÉR VÉTELE Felelős kiadó: dr. Miskovits Eszter az OVSZ főigazgatója Technikai szerkesztő: dr. Jenei Béla ISBN 978-963-88164-1-2 ISSN 1416-3152
VÉRADÓK NYILVÁNTARTÁSA, VÉRADÁS ELŐTTI KIVIZSGÁLÁSA ÉS A TELJES VÉR VÉTELE Felelős kiadó: dr. Miskovits Eszter az OVSZ főigazgatója Technikai szerkesztő: dr. Jenei Béla ISBN 978-963-88164-1-2 ISSN 1416-3152
GYÓGYSZERELÉS. Aranysas Patikamúzeum /Budai Vár/
 GYÓGYSZERELÉS Aranysas Patikamúzeum /Budai Vár/ 1 Gyógyszertan (farmakológia): a betegségek gyógyítására, megelőzésére, ill kórismézésre (diagnosztizálásra) szolgáló vegyületekkel, vagyis a gyógyszerekkel
GYÓGYSZERELÉS Aranysas Patikamúzeum /Budai Vár/ 1 Gyógyszertan (farmakológia): a betegségek gyógyítására, megelőzésére, ill kórismézésre (diagnosztizálásra) szolgáló vegyületekkel, vagyis a gyógyszerekkel
A Grapefruit mag kivonat
 A Grapefruit mag kivonat Miért a Grape Vital terméket válassza? TOP 4 Az egyetlen eredeti Grapefruit mag kivonat koncentrátum a világon, amely 1. vírus, 2. baktérium, 3. gombaölő és 4. sporicid* hatással
A Grapefruit mag kivonat Miért a Grape Vital terméket válassza? TOP 4 Az egyetlen eredeti Grapefruit mag kivonat koncentrátum a világon, amely 1. vírus, 2. baktérium, 3. gombaölő és 4. sporicid* hatással
Élet a szívinfarktus 2.BETEGTÁJÉKOZTATÓ. után
 Élet a szívinfarktus 2.BETEGTÁJÉKOZTATÓ után Bevezetés A szívinfarktus (köznapi nevén szívroham) a koszorúérbetegség legsúlyosabb formája, mindenki által rettegett, nem ritkán az életet veszélyeztető
Élet a szívinfarktus 2.BETEGTÁJÉKOZTATÓ után Bevezetés A szívinfarktus (köznapi nevén szívroham) a koszorúérbetegség legsúlyosabb formája, mindenki által rettegett, nem ritkán az életet veszélyeztető
VIZSGÁLJUK MEG A DOPPINGOLÁST EGY KICSIT KÖZELEBBRÕL ÁLTALÁNOSSÁGBAN! KÖZÉP SZINT
 Harmonising the knowledge about biomedical side effects of doping VIZSGÁLJUK MEG A DOPPINGOLÁST EGY KICSIT KÖZELEBBRÕL ÁLTALÁNOSSÁGBAN! KÖZÉP SZINT 2. DIA: A Nemzetközi Doppingellenes Liga (WADA) a Nemzetközi
Harmonising the knowledge about biomedical side effects of doping VIZSGÁLJUK MEG A DOPPINGOLÁST EGY KICSIT KÖZELEBBRÕL ÁLTALÁNOSSÁGBAN! KÖZÉP SZINT 2. DIA: A Nemzetközi Doppingellenes Liga (WADA) a Nemzetközi
dr. Kovács Norbert, dr. Balás István, dr. Nagy Ferenc Parkinson-kór kezelése mély agyi stimulációval
 dr. Kovács Norbert, dr. Balás István, dr. Nagy Ferenc Parkinson-kór kezelése mély agyi stimulációval Betegtájékoztató Elôszó Tisztelt Olvasó! A mély agyi stimuláció az elmúlt húsz évben a mozgászavarok
dr. Kovács Norbert, dr. Balás István, dr. Nagy Ferenc Parkinson-kór kezelése mély agyi stimulációval Betegtájékoztató Elôszó Tisztelt Olvasó! A mély agyi stimuláció az elmúlt húsz évben a mozgászavarok
- Tervezet - A Suboxone terápia protokollja
 A Suboxone terápia protokollja I.) Alapvető megfontolások 1. A protokollok alkalmazási / érvényességi területe Jelen protokoll az opiátfüggőség egyik kezelési lehetőségével, a Suboxone terápiával foglalkozik.
A Suboxone terápia protokollja I.) Alapvető megfontolások 1. A protokollok alkalmazási / érvényességi területe Jelen protokoll az opiátfüggőség egyik kezelési lehetőségével, a Suboxone terápiával foglalkozik.
Írta: Dr. Kovács Gábor Dr. Csóka Mónika Prof. Dr. Nagy Kálmán Segítõ füzetek 4.
 Akut lymphoid leukemia Írta: Dr. Kovács Gábor Dr. Csóka Mónika Prof. Dr. Nagy Kálmán Segítõ füzetek 4. 2 Dr. Kovács Gábor Dr. Csóka Mónika Prof. Dr. Nagy Kálmán Akut lymphoid leukemia 3 Készült az Egészségügyi
Akut lymphoid leukemia Írta: Dr. Kovács Gábor Dr. Csóka Mónika Prof. Dr. Nagy Kálmán Segítõ füzetek 4. 2 Dr. Kovács Gábor Dr. Csóka Mónika Prof. Dr. Nagy Kálmán Akut lymphoid leukemia 3 Készült az Egészségügyi
KITÖLTÉSI ÚTMUTATÓ. A SNH-val kapcsolatos minden további dokumentációt csatolni kell az űrlaphoz.
 KITÖLTÉSI ÚTMUTATÓ SÚLYOS NEMKÍVÁNATOS HATÁS (SNH) C ŰRLAP VÉGFELHASZNÁLÓ VAGY EGÉSZSÉGÜGYI SZAKEMBER RÉSZÉRŐL JELENTETT SNH TOVÁBBÍTÁSA ILLETÉKES HATÓSÁG ÁLTAL TOVÁBBI ILLETÉKES HATÓSÁGNAK VAGY FELELŐS
KITÖLTÉSI ÚTMUTATÓ SÚLYOS NEMKÍVÁNATOS HATÁS (SNH) C ŰRLAP VÉGFELHASZNÁLÓ VAGY EGÉSZSÉGÜGYI SZAKEMBER RÉSZÉRŐL JELENTETT SNH TOVÁBBÍTÁSA ILLETÉKES HATÓSÁG ÁLTAL TOVÁBBI ILLETÉKES HATÓSÁGNAK VAGY FELELŐS
H I V A T A L O S É R T E S Í T Ő 2010. évi 104. szám 15277
 H I V A T A L O S É R T E S Í T Ő 2010. évi 104. szám 15277 A Nemzeti Erőforrás Minisztérium szakmai protokollja az egészséges csecsemő (0-12 hónap) táplálásáról (1. módosított változat) Készítette: a
H I V A T A L O S É R T E S Í T Ő 2010. évi 104. szám 15277 A Nemzeti Erőforrás Minisztérium szakmai protokollja az egészséges csecsemő (0-12 hónap) táplálásáról (1. módosított változat) Készítette: a
Biztonsági adatlap 1907/2006/EK, 31. cikk szerin CREAMPEL Bőrápoló hidratálókrém
 1, Készítmény és a vállalat azonosítása: Biztonsági adatlap Termék kereskedelmi megnevezése: Felhasználási terület: Autóápolás és tisztítás során alkalmazható szer Gyártó forgalmazó megnevezése: PRIMATEC
1, Készítmény és a vállalat azonosítása: Biztonsági adatlap Termék kereskedelmi megnevezése: Felhasználási terület: Autóápolás és tisztítás során alkalmazható szer Gyártó forgalmazó megnevezése: PRIMATEC
BIZTONSÁGI ADATLAP Összhangban van 453/2010 (EU) rendelettel és a módosított 1907/2006 számú (EU) rendelet (REACH) II.
 1. oldal, összesen: 19 BIZTONSÁGI ADATLAP Összhangban van 453/2010 (EU) rendelettel és a módosított 1907/2006 számú (EU) rendelet (REACH) II. mellékletével Domestos Turbo Fresh WC rúd Pine Fresh 1. SZAKASZ:
1. oldal, összesen: 19 BIZTONSÁGI ADATLAP Összhangban van 453/2010 (EU) rendelettel és a módosított 1907/2006 számú (EU) rendelet (REACH) II. mellékletével Domestos Turbo Fresh WC rúd Pine Fresh 1. SZAKASZ:
A hasmenésre és a szájon át történő rehidrálásra vonatkozó kérdések
 A hasmenésre és a szájon át történő rehidrálásra vonatkozó kérdések 1. Miért okoz a hasmenés óriási gazdasági veszteséget? A hasmenéssel összefüggő gazdasági veszteségek a gyógykezelés és a vizsgálat költségeiből,
A hasmenésre és a szájon át történő rehidrálásra vonatkozó kérdések 1. Miért okoz a hasmenés óriási gazdasági veszteséget? A hasmenéssel összefüggő gazdasági veszteségek a gyógykezelés és a vizsgálat költségeiből,
Tájékoztató betegek számára. Mit kell tudnunk az epilepsziáról?
 Kepra_Press_155x155 8/27/10 12:33 PM Page 1 Tájékoztató betegek számára Mit kell tudnunk az epilepsziáról? Kepra_Press_155x155 8/27/10 12:33 PM Page 2 Összeállította: Békés Judit és Halász Péter - 2010
Kepra_Press_155x155 8/27/10 12:33 PM Page 1 Tájékoztató betegek számára Mit kell tudnunk az epilepsziáról? Kepra_Press_155x155 8/27/10 12:33 PM Page 2 Összeállította: Békés Judit és Halász Péter - 2010
SCHÖNOX PL. Az 1999/45/EK. számú irányelv és annak módosításai szerint a készítmény veszélyes anyagként van besorolva.
 Mellékletével Magyarország 1. Fejezet Vegyi termék és gyártó azonosítása Terméknév Gyártó SCHÖNOX GmbH AlfredNobelStraße 6 48720 Rosendahl Germany Tel. ++49 (0) 2547 9100 Fax ++49 (0) 2547 910101 Email
Mellékletével Magyarország 1. Fejezet Vegyi termék és gyártó azonosítása Terméknév Gyártó SCHÖNOX GmbH AlfredNobelStraße 6 48720 Rosendahl Germany Tel. ++49 (0) 2547 9100 Fax ++49 (0) 2547 910101 Email
Használati utasítás. Testösszetételt elemző monitor BF214 IM-HBF-214-EBW-01-08/2012 5337477-2A. All for Healthcare 12K2590
 Használati utasítás Testösszetételt elemző monitor BF214 All for Healthcare IM-HBF-214-EBW-01-08/2012 5337477-2A 12K2590 BF214 Testösszetételt elemző monitor Köszönjük, hogy megvásárolta ezt a testösszetételt
Használati utasítás Testösszetételt elemző monitor BF214 All for Healthcare IM-HBF-214-EBW-01-08/2012 5337477-2A 12K2590 BF214 Testösszetételt elemző monitor Köszönjük, hogy megvásárolta ezt a testösszetételt
Mély agyi stimuláció: múlt, jelen és jövő
 Dr. Kovács Norbert Mély agyi stimuláció: múlt, jelen és jövő Neurology Kft, 2014 Dr. Kovács Norbert: Mély agyi stimuláció: múlt, jelen, jövő Elektronikus könyv Dr. Kovács Norbert A könyv tartalma szerzői
Dr. Kovács Norbert Mély agyi stimuláció: múlt, jelen és jövő Neurology Kft, 2014 Dr. Kovács Norbert: Mély agyi stimuláció: múlt, jelen, jövő Elektronikus könyv Dr. Kovács Norbert A könyv tartalma szerzői
IRÁNYELVEK AZ ELŐREHALADOTT DAGANATOS BETEGEK SZÁMÁRA HOGYAN LEHET AZ ONKOLÓGUSUKTÓL A LEGTÖBBET MEGTUDNI
 IRÁNYELVEK AZ ELŐREHALADOTT DAGANATOS BETEGEK SZÁMÁRA HOGYAN LEHET AZ ONKOLÓGUSUKTÓL A LEGTÖBBET MEGTUDNI www.esmo.org/patients/ A következő szervezetek segítségével készült: IRÁNYELVEK AZ ELŐREHALADOTT
IRÁNYELVEK AZ ELŐREHALADOTT DAGANATOS BETEGEK SZÁMÁRA HOGYAN LEHET AZ ONKOLÓGUSUKTÓL A LEGTÖBBET MEGTUDNI www.esmo.org/patients/ A következő szervezetek segítségével készült: IRÁNYELVEK AZ ELŐREHALADOTT
Az emberi erõforrások minisztere 15/2012. (VIII. 22.) EMMI rendelete az emberi alkalmazásra kerülõ gyógyszerek farmakovigilanciájáról
 M A G Y A R K Ö Z L Ö N Y 2012. évi 109. szám 18509 Az emberi erõforrások minisztere 15/2012. (VIII. 22.) EMMI rendelete az emberi alkalmazásra kerülõ gyógyszerek farmakovigilanciájáról Az emberi alkalmazásra
M A G Y A R K Ö Z L Ö N Y 2012. évi 109. szám 18509 Az emberi erõforrások minisztere 15/2012. (VIII. 22.) EMMI rendelete az emberi alkalmazásra kerülõ gyógyszerek farmakovigilanciájáról Az emberi alkalmazásra
BETEGTÁJÉKOZTATÓ A PAJZSMIRIGY-ALULMÛKÖDÉSRÕL
 Lényeg BETEGTÁJÉKOZTATÓ A PAJZSMIRIGY-ALULMÛKÖDÉSRÕL Az emberi betegségek közül talán a legideálisabban kezelhetõ rendellenesség. Az esetek nagy részében ugyan egy életen át kell gyógyszert szedni, de
Lényeg BETEGTÁJÉKOZTATÓ A PAJZSMIRIGY-ALULMÛKÖDÉSRÕL Az emberi betegségek közül talán a legideálisabban kezelhetõ rendellenesség. Az esetek nagy részében ugyan egy életen át kell gyógyszert szedni, de
Automatikus digitális vérnyomásmér Model M10-IT Használati utasítás
 Automatikus digitális vérnyomásmér Model M10-IT Használati utasítás HU IM-HEM-7080IT-E-05-10/2011 Tartalom A készülék használata el tt Bevezetés...3 Fontos biztonsági el írások...4 1. Áttekintés...6 2.
Automatikus digitális vérnyomásmér Model M10-IT Használati utasítás HU IM-HEM-7080IT-E-05-10/2011 Tartalom A készülék használata el tt Bevezetés...3 Fontos biztonsági el írások...4 1. Áttekintés...6 2.
Használati útmutató. Úti vízforraló. Felhasználóbarát útmutató ID: #05002
 NÉMETORSZÁGBAN GYÁRTVA Használati útmutató Úti vízforraló myhansecontrol.com myhansecontrol.com Felhasználóbarát útmutató ID: #05002 Tartalom Használata... 3 Áttekintő... 4 Általános tudnivalók... 5 Olvassa
NÉMETORSZÁGBAN GYÁRTVA Használati útmutató Úti vízforraló myhansecontrol.com myhansecontrol.com Felhasználóbarát útmutató ID: #05002 Tartalom Használata... 3 Áttekintő... 4 Általános tudnivalók... 5 Olvassa
Milyen eredményre számíthat, hogyan fog látni a beavatkozást követően?
 Köszönjük, hogy bizalmával megtisztelte klinikánkat! Tisztelt Páciensünk! Jelenlegi, első találkozásunknak kettős célja van. Egyrészt meg kell állapítanunk, hogy Ön alkalmas-e a beavatkozásra. Nagyon fontos,
Köszönjük, hogy bizalmával megtisztelte klinikánkat! Tisztelt Páciensünk! Jelenlegi, első találkozásunknak kettős célja van. Egyrészt meg kell állapítanunk, hogy Ön alkalmas-e a beavatkozásra. Nagyon fontos,
MIT KELL TUDNI A PAJZSMIRIGY BETEGSÉGEIRÕL?
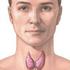 MIT KELL TUDNI A PAJZSMIRIGY BETEGSÉGEIRÕL? A KIVIZSGÁLÁS, A KEZELÉS ÉS A MEGELÕZÉS LEHETÕSÉGEI Betegtájékoztató Írta: Dr. Solymosi Tamás 2003 2 A KIVIZSGÁLÁS, A KEZELÉS ÉS A... 1 BEVEZETÉS... 5 A pajzsmirigyhormonok
MIT KELL TUDNI A PAJZSMIRIGY BETEGSÉGEIRÕL? A KIVIZSGÁLÁS, A KEZELÉS ÉS A MEGELÕZÉS LEHETÕSÉGEI Betegtájékoztató Írta: Dr. Solymosi Tamás 2003 2 A KIVIZSGÁLÁS, A KEZELÉS ÉS A... 1 BEVEZETÉS... 5 A pajzsmirigyhormonok
(a 98/24/EK irányelv 3., 4., 5. és 6. cikke, valamint a II. mellékletének 1. része) Európai Bizottság
 NEM KÖTELEZŐ ÉRVÉNYŰ GYAKORLATI ÚTMUTATÁS A MUNKÁJUK SORÁN VEGYI ANYAGOKKAL KAPCSOLATOS KOCKÁZATOKNAK KITETT MUNKAVÁLLALÓK EGÉSZSÉGÉNEK ÉS BIZTONSÁGÁNAK VÉDELMÉHEZ (a 98/24/EK irányelv 3., 4., 5. és 6.
NEM KÖTELEZŐ ÉRVÉNYŰ GYAKORLATI ÚTMUTATÁS A MUNKÁJUK SORÁN VEGYI ANYAGOKKAL KAPCSOLATOS KOCKÁZATOKNAK KITETT MUNKAVÁLLALÓK EGÉSZSÉGÉNEK ÉS BIZTONSÁGÁNAK VÉDELMÉHEZ (a 98/24/EK irányelv 3., 4., 5. és 6.
