Sav-bázis háztartás. Debrecen, Ökrös Ilona. B-A-Z Z Megyei Kórház és Egyetemi Oktató Kórház Miskolc
|
|
|
- Valéria Horváthné
- 9 évvel ezelőtt
- Látták:
Átírás
1 Sav-bázis háztartás Ökrös Ilona B-A-Z Z Megyei Kórház és Egyetemi Oktató Kórház Miskolc Debrecen,
2 Sav-bázis háztartás Jelentősége: - a sejtszintű folyamatok egyik alapfeltétele - az enzimek szűk ph-n működnek - a vízterek ion-összetételét befolyásolja (K + ) H + forgalom: - termelés: energiatermelés (citrátkör, glukóz-lebontás) - C6H12O6 a H + energiává alakul! (a pl. H + aco 2 származéka) a CO 2 vízoldékony CO 2 CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - szabad viz - ürítés: vesén át (- gyomornedv?)
3 Mi történik a CO2-vel? 1. A Hb szállitja - carboxyhb 2. Egy része fizikailag oldódik paco2- kevés 1-2. ürül a tüdőn át 3. A vérben szénsavvá alakul és ez a döntő folyamat
4 Mi törtt rténik a CO2-vel? CO 2, H +, szénsav, HCO - 3? CO 2 +H 2 O H 2 CO 3 H + + HCO 3 - pufferek pufferol vesén át ürül a vese visszatartja H 2 CO 3 nehezen mérhető, nem meghatározható -a CO 2 /H 2 CO 3 egyensúlyban van - a képződő H + cc-ja a ph - mivel a szénsav könnyen bomlik, a tüdőben, ha jó a ventilláció, sok CO2-t ürithetünk A ph értéke tehát végső soron a CO 2 (tüdő) és a HCO 3- (vese) közötti balance-t mutatja.
5 A H + -ion H + : cc. alacsony ionok mmol/l (10-3 ) H + -ion: nmol/l (10-9 ) EC térben 0, mmol/l (40 nmol/l) H + súlyos acidosisban 160 nmol/l súlyos alkalosisban 16 nmol/l Sorensen, ph (potentia hydrogenii) = a H + ion 10-es alapú logaritmusának negatív hatványkitevője - ph 6,8-7,8 között változhat (csak EC-re vonatkozik!) fiziológiás: 7,35 7,45
6 1. Bicarbonát: - a legfontosabb és a legnagyobb tömegű - a máj termeli, a vese visszatartja 2. Foszfát: -jelentős, de a bicarbonat-nál kisebb -a H + kiválasztást segíti (a bicarbonátnál jobban köti, a veséhez transzportál) 3. Ammónium: - a vesében H + terhelés után NH 3 (ammónia) termelődik -H + -t akkumulál NH 4 (ammónium) vizelettel ürül 4. Protein: - intracellularis, plazma, vér Puffer-rendszerek rendszerek - legfontosabb a Hb (megköt, szállit az Fe-rész, de a fehérje maga is H-t köt meg)
7 A H + körforgása 1. Képződés (mindig metabolikus a tüdő nem képez!) 2. Elsődleges közömbösítés vérpufferek - normális sav:bázis arány 1:20 (a szervezet túlbiztosít) 3. Elimináció respiráció - CO 2 vese - H +
8 Pufferek Bázispárok: - gyenge savak, melyek képesek H - -t leadni H 2 O + CO 2 H 2 CO 3 H + + HCO ezek erős kationokkal képzett sói Szénsav / bicarbonat rendszer HCO 3- / NaHCO 3 a. termelődés: CO 2 CO 2 + H 2 O H 2 CO 3 H + + HCO 3 - b. a HCO 3- K + -hoz (i.c) vagy Na + -hoz (e.c.) kötődik c. plazmában NaHCO 3 vese Na + -ot ürít, HCO 3- marad vissza d. H + ion a szabad HCO 3- -hoz kötődik e. HCO 3- -at a máj is termel laktátból
9 Sav-bázis egyensúly, laboratóriumi mérés I. 1. mért: ph és pco 2 közvetlenül mérhető, po 2 is ( aktuális hőmérsékletre korrigálható) 2. számított: HCO 3 (aktuális, standard) BE, BB, szaturáció 3. a bicarbonat nagy tömegű, mmol/l, ionmeghatározással mérhető (Astrup dán kémikus)
10 ph: Sav-bázis egyensúly, laboratóriumi mérés II. HCO - 3 ph = pk + log [H 2 CO 3 ] x [0,03xpCO 2 ] - 0,03 a CO 2 molaris oldódási coefficiense -pk 6,1 -ph a CO 2 : HCO 3 aránytól függ 1 : 20 ha együtt változnak, ph változatlan - aktuális adott hőmérsékleten - standard: 37 C-ra korrigálva
11 Sav-bázis egyensúly, laboratóriumi mérés II. 3. BE: bázis eltérés: - az a sav vagy bázis mmol/l-ben, melyet a mintához adva normalizálná a ph-t (± 2 mmol/l) 4. BB: a teljes pufferkapacitás - a bicarbonaton kívüli puffer-kapacitás - a bicarb-ból és a BE-ből deriválva, 37 C-ra komp. érték 5. Szaturáció: - csak azok az eszközök tudják, amelyek Hb-t is meg tudnak határozni
12 Artériás: Laboratóriumi mintavétel - releváns minta, ágymelletti meghatározással Kapilláris: - elméletileg arterializált vér, de szövettörmelékkel szennyezett lehet! - ne használjuk! Vénás nem, csak kevert vénás - az oxigén-extractio jellemzésére!!!
13 Artériás, kevert vénás értékek fiziológiás range kevert vénás ph 7,4 7,35-7,45 7,33-7,43 PaCO 2 (Hgmm) PaO 2 (Hgmm) sat. (%) BE ± 2 se HCO 3- (mmol/l)
14 Az egyes értékek jelentősége ph a fiziológiás érték fontos, de nem zárja ki a sav-bázis eltérést paco 2 alveolaris ventilláció pao 2 fiz. Viszonyok között sav-bázis vonatkozásban nem elsődleges szerep anaerob viszonyok?
15 Az egyes értékek jelentősége szaturáció Befolyásolja ph, hőmérséklet, PaCO 2 PaO 2 60 Hgmm alatt gyorsan csökken BE Aktuális bázishiány BB A Hb és a HCO 3- (plazma) összes kapacitása 37 C-ra kompenzált érték
16 Javasolt lépések ph PaCO 2 HCO - 3 BE PaO 2
17 Metabolikus zavar kompenzálása a. acidosis H + + HCO 3- H 2 CO 3 H 2 O + CO 2 Következmény: (ph, HCO 3 ) tüdő: CO 2 -t ürít - hyperventilláció vese: H + -t ürít, HCO 3- -at tart vissza b. alkalosis (HCO 3-, ph ) vese: H + -t tart vissza, HCO 3 -at ürít (lassú) tüdő: CO 2 -t tart vissza (nem effektív) hypoventilláció?
18 Metabolikus acidosis Okai: 1. Fokozott termelés - fokozott anyagcsere - fix savak felszaporodása (tejsav, acetecetsav) (anion-gap ) 2. Csökkent kiválasztás veseelégtelenség (anion-gap ) Gyors kompenzálás: -tüdő: hyperventilláció (resp. alkalózis) - vese bikarbonátot tart vissza
19 Metabolikus acidosis kezelése Kiváltó ok megszüntetése (diabeteses ketoacidosis, vizeletkiválasztás fokozása) 2. Alkalizálás - NaHCO 3 molos oldattal de nem azonnal és nem teljeskörűen! - a képződő CO 2 intracellularisan diffundál - Na-terhelés vízterhelés (szívbetegek, agyoedema - ICP) (se. osm. fibrillációs küszöb ) -a CO 2 -t a tüdő kilégzi-e? (respiratoricus acidosis?)
20 Metabolikus acidosis kezelése Kezelendő: ph < 7,2, HCO 3 - < 8-10 mmol/l - kivétel súlyos állapotban lévő beteg, veseelégtelenség Korrekció: -NaHCO 3 (mmol/l) = -BE x tskg x 0,2 EC térre számított érték - a számolt mennyiség felét / harmadát beadni
21 Metabolikus alkalózis Ok: H + Cl - vesztés (HCl) Cl - csökken HCO 3- felszaporodás (citrát) hypo K + és hyperaldosteronizmus Tünet: HCO 2- ph HCl vesztés (több liter) hypovolaemia renin/aldosteron aktiválódás sec. hyperaldosteronizmus Na + és víz-reabszorpció
22 Metabolikus alkalózis kezelése 1. Belső kompenzálás - respirációs acidosis - pco 2 növelése de ennek a hypoxia gátat szab 2. Oki terápia HCl nem! 3. NaCl infúzió
23 Acidosis PaCO 2 ph HCO 3 - Akut resp. 50 7,15 25 metab. 38 7,15 15 Comp. resp. 66 7,34 34 metab. 23 7,28 9 Kevert 50 7,20 20
24 Respirációs zavarok a. hypoventilláció (pco 2, ph ) H 2 O + CO 2 H 2 CO 3 H + + HCO 3 - vese: bicarbonátot ürít késői b. hyperventilláció (pco 2,pH ) H 2 CO 3 H 2 O + CO 2 vese: bicarbonátot tart vissza késői (3-6 nap) Respirációs zavar kompenzálása metabolikus komponensekkel
25 Respirációs acidosis Oka: CO 2 retenció - hypoventilláció CO 2 + H 2 O H 2 CO 3 H + + HCO - 3 Tünet: pco 2, ph Belső kompenzáció: - metabolikus alkalózis vesén át H + ürítés fokozása HCO 3- visszatartás Kezelés: lélegeztetés
26 Respirációs alkalózis Ok: hyperventilláció (mérgezés, hisztéria, iatrogen) pco 2 ph Belső kompenzáció: vesében H + ion visszatartása (lassú) Kezelés: nyugtatás, lélegeztetés korrigálása Akut respirációs alkalózis
27 Alkalózis PaCO 2 ph HCO 3 - Akut resp. 25 7,60 24 metab. 44 7,54 36 Comp. resp. 25 7,54 21 metab. 50 7,42 31 Kevert 40 7,56 38
28 Az ion- és sav-bázis háztartás összefüggései (emlékeztető) 1. K + és H + -forgalom hypokalaemia - metabolikus alkalózis 2. Cl - és HCO 3 - hyperchloraemia metabolikus acidózis hypochloraemia metabolikus alkalózis
29 Fiziológiás: Savak H 2 CO 3 és fix savak 1. Fix savak: metabolikus sav Zavara: metabolikus zavar pl.: HCl, tejsav, piroszőlősav, acetecetsav β-hidroxyvajsav metabolizációval tovább bomlanak CO 2 H 2 CO 3 (anorganikus fix savak vizelettel ürülnek) 2. H 2 CO 3 CO 2 + H 2 O respiratorikus sav Zavara: respirációs zavar
Sav-bázis egyensúly. Dr. Miseta Attila
 Sav-bázis egyensúly Dr. Miseta Attila A szervezet és a ph A ph egyensúly szorosan kontrollált A vérben a referencia tartomány: ph = 7.35 7.45 (35-45 nmol/l) < 6.8 vagy > 8.0 halálozáshoz vezet Acidózis
Sav-bázis egyensúly Dr. Miseta Attila A szervezet és a ph A ph egyensúly szorosan kontrollált A vérben a referencia tartomány: ph = 7.35 7.45 (35-45 nmol/l) < 6.8 vagy > 8.0 halálozáshoz vezet Acidózis
ph jelentősége a szervezetben
 PH fogalma Sav-bázis egyensúly ph = -log [H+] ph=7 => 10-7 Mol H + (100 nmol/l) ph=8 => 10-8 Mol H + (10 nmol/l) Normal plazma ph: 7.35-7.45; 7.45; (H+: 45-35 nmol/l) Acidózis: ph7.45
PH fogalma Sav-bázis egyensúly ph = -log [H+] ph=7 => 10-7 Mol H + (100 nmol/l) ph=8 => 10-8 Mol H + (10 nmol/l) Normal plazma ph: 7.35-7.45; 7.45; (H+: 45-35 nmol/l) Acidózis: ph7.45
Sav-bázis és vérgáz elemzés. Dr Molnár Zsolt Pécsi Tudományegyetem
 Sav-bázis és vérgáz elemzés Dr Molnár Zsolt Pécsi Tudományegyetem A H + potenciája H + nmol/l H + potenciája: ph (pondus Hydrogenii) Sörensen, 1909 ph = -lg H + -lg 40 = 7.40 40 A H + potenciája H + nmol/l
Sav-bázis és vérgáz elemzés Dr Molnár Zsolt Pécsi Tudományegyetem A H + potenciája H + nmol/l H + potenciája: ph (pondus Hydrogenii) Sörensen, 1909 ph = -lg H + -lg 40 = 7.40 40 A H + potenciája H + nmol/l
A SAV-BÁZIS EGYENSÚLY ZAVARAI
 A SAV-BÁZIS EGYENSÚLY ZAVARAI ph, normálértékek ph = a H-koncentráció negativ tizes alapú logaritmusa a H koncentrációt a vérben a CO2 és a HCO3- közti egyensúly határozza meg CO2 + H2O H2CO3 HCO3- + H+
A SAV-BÁZIS EGYENSÚLY ZAVARAI ph, normálértékek ph = a H-koncentráció negativ tizes alapú logaritmusa a H koncentrációt a vérben a CO2 és a HCO3- közti egyensúly határozza meg CO2 + H2O H2CO3 HCO3- + H+
Sürgősségi vérgázelemzés
 Sürgősségi vérgázelemzés A vérgázvizsgálat minden betegnél segítséget nyújthat az állapot súlyosságának megítéléséhez és a terápia hatékonyságának nyomon követéséhez. Nem csak az oxigenizációról és a ventillációról
Sürgősségi vérgázelemzés A vérgázvizsgálat minden betegnél segítséget nyújthat az állapot súlyosságának megítéléséhez és a terápia hatékonyságának nyomon követéséhez. Nem csak az oxigenizációról és a ventillációról
Sav-bázis háztartás. Dr Sotkovszki Tamás
 Sav-bázis háztartás Dr Sotkovszki Tamás Sav acidus bizonyos kémiai tulajdonságokkal bíró anyag (pl savanyú, a lakmusz piros színű lesz) Arrhenius 1887 sav: H+ vizes oldatban bázis : OH- vizes oldatban
Sav-bázis háztartás Dr Sotkovszki Tamás Sav acidus bizonyos kémiai tulajdonságokkal bíró anyag (pl savanyú, a lakmusz piros színű lesz) Arrhenius 1887 sav: H+ vizes oldatban bázis : OH- vizes oldatban
SAV BÁZIS EGYENSÚLY 1
 SAV BÁZIS EGYENSÚLY 1 ph- a H ion koncentráció negativ tizes alapú logaritmusa ph= - Log 10 [ H + ] Normál értéke: 7,35-7,45 (H + 35-45 nmol/l) Az élettel kompatibilis: 20-160 nmol/l (ph 6,8-7,7) 2 3 A
SAV BÁZIS EGYENSÚLY 1 ph- a H ion koncentráció negativ tizes alapú logaritmusa ph= - Log 10 [ H + ] Normál értéke: 7,35-7,45 (H + 35-45 nmol/l) Az élettel kompatibilis: 20-160 nmol/l (ph 6,8-7,7) 2 3 A
A vizeletürítés mechanizmusa
 A veseműködés élettana, a kiválasztás funkciója, az emberi test víztereinek élettana (4) Dr. Nagy Attila A vizeletürítés mechanizmusa 1 Felső húgyutak -vesekelyhek -vesemedence -ureter Alsó húgyutak -húgyhólyag
A veseműködés élettana, a kiválasztás funkciója, az emberi test víztereinek élettana (4) Dr. Nagy Attila A vizeletürítés mechanizmusa 1 Felső húgyutak -vesekelyhek -vesemedence -ureter Alsó húgyutak -húgyhólyag
5.1. A pufferek mûködése
 Isohydria jelentôsége H5. Savbázis háztartás 5.1. A pufferek mûködése Fiziológiás ph: 7.38 7.42 (acidózis alkalózis) Kihívások: dominánsan savanyodás (szervetlen savak, szerves savak, CO 2 ) Védelem: azonnali
Isohydria jelentôsége H5. Savbázis háztartás 5.1. A pufferek mûködése Fiziológiás ph: 7.38 7.42 (acidózis alkalózis) Kihívások: dominánsan savanyodás (szervetlen savak, szerves savak, CO 2 ) Védelem: azonnali
ELEKTROLIT VIZSGÁLATOK 1. ELEKTROLITOK
 ELEKTROLIT VIZSGÁLATOK 1. ELEKTROLITOK - A SZERVEZET VÍZTEREI (KOMPARTMENTEK) -A VÉRPLAZMA LEGFONTOSABB ELEKTROLITJAI *nátrium ion (Na + ) *kálium ion ( ) *klorid ion (Cl - ) TELJES TESTTÖMEG: * szilárd
ELEKTROLIT VIZSGÁLATOK 1. ELEKTROLITOK - A SZERVEZET VÍZTEREI (KOMPARTMENTEK) -A VÉRPLAZMA LEGFONTOSABB ELEKTROLITJAI *nátrium ion (Na + ) *kálium ion ( ) *klorid ion (Cl - ) TELJES TESTTÖMEG: * szilárd
A veseműködés élettana, a kiválasztás funkciója, az emberi test víztereinek élettana (5)
 A veseműködés élettana, a kiválasztás funkciója, az emberi test víztereinek élettana (5) Dr. Attila Nagy 2016 Kalcium és foszfátháztartás (Tanulási támpont: 63) A szabályozásban a pajzsmirigy, mellékpajzsmirigy
A veseműködés élettana, a kiválasztás funkciója, az emberi test víztereinek élettana (5) Dr. Attila Nagy 2016 Kalcium és foszfátháztartás (Tanulási támpont: 63) A szabályozásban a pajzsmirigy, mellékpajzsmirigy
Általános Kémia. Sav-bázis egyensúlyok. Ecetsav és sósav elegye. Gyenge sav és erős sav keveréke. Példa8-1. Példa 8-1
 Sav-bázis egyensúlyok 8-1 A közös ion effektus 8-1 A közös ion effektus 8-2 ek 8-3 Indikátorok 8- Semlegesítési reakció, titrálási görbe 8-5 Poliprotikus savak oldatai 8-6 Sav-bázis egyensúlyi számítások,
Sav-bázis egyensúlyok 8-1 A közös ion effektus 8-1 A közös ion effektus 8-2 ek 8-3 Indikátorok 8- Semlegesítési reakció, titrálási görbe 8-5 Poliprotikus savak oldatai 8-6 Sav-bázis egyensúlyi számítások,
A kiválasztó szervrendszer élettana
 A kiválasztó szervrendszer élettana A kiválasztó szervrendszer funkciói kiválasztó funkció (anyagcsere végtermékek, ammónia, urea, hormonok, gyógyszerek... a szervezet számára értékes anyagok konzerválása
A kiválasztó szervrendszer élettana A kiválasztó szervrendszer funkciói kiválasztó funkció (anyagcsere végtermékek, ammónia, urea, hormonok, gyógyszerek... a szervezet számára értékes anyagok konzerválása
Sav bázis egyensúlyok vizes oldatban
 Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
vénás vérben mmol/l Aktuális bikarbonát: normál értékei: artériás vérben mmol/l
 É L E T T A N A SAV-BÁZIS ANYAGCSERE ZAVARAI Dr. Mezei Zsófia 2008/09 A SAV-BÁZIS ANYAGCSERE SZEREPE: isohydria, azaz a vér H + koncentráció (ph) állandóságának biztosítása, a folyamatos savanyú anyagcsere
É L E T T A N A SAV-BÁZIS ANYAGCSERE ZAVARAI Dr. Mezei Zsófia 2008/09 A SAV-BÁZIS ANYAGCSERE SZEREPE: isohydria, azaz a vér H + koncentráció (ph) állandóságának biztosítása, a folyamatos savanyú anyagcsere
A sav-bázis anyagcsere és legfontosabb zavarai. Prof. Dr. SzabóGyula tanszékvezető egyetemi tanár
 A sav-bázis anyagcsere és legfontosabb zavarai Prof. Dr. SzabóGyula tanszékvezető egyetemi tanár ph Táplálék felvétel Emésztés Felszívódás IC és EC pufferolás Légzési pufferolás Vese pufferolás Lebontás
A sav-bázis anyagcsere és legfontosabb zavarai Prof. Dr. SzabóGyula tanszékvezető egyetemi tanár ph Táplálék felvétel Emésztés Felszívódás IC és EC pufferolás Légzési pufferolás Vese pufferolás Lebontás
Sav-bázis háztartás laboratóriumi jellemzése. Patócs Attila Semmelweis Egyetem Laboratóriumi Medicina Intézet
 Sav-bázis háztartás laboratóriumi jellemzése Patócs Attila Semmelweis Egyetem Laboratóriumi Medicina Intézet Laboratóriumi paraméterek a sav-bázis anyagcsere zavarainak diagnosztikájában ph: a H+-koncentráció
Sav-bázis háztartás laboratóriumi jellemzése Patócs Attila Semmelweis Egyetem Laboratóriumi Medicina Intézet Laboratóriumi paraméterek a sav-bázis anyagcsere zavarainak diagnosztikájában ph: a H+-koncentráció
A TESTFOLYADÉKOK SAV BÁZIS ÁLLAPOTA ÉS SZABÁLYOZÁSA
 1 A TESTFOLYADÉKOK SAV BÁZIS ÁLLAPOTA ÉS SZABÁLYOZÁSA Bevezetés Ez a fejezet a testfolyadékok H 3 + O (H + ) ionjaival kapcsolatos jelenségeket tárgyalja. Ám a tárgyalás menete egy kissé eltér a kationokétól,
1 A TESTFOLYADÉKOK SAV BÁZIS ÁLLAPOTA ÉS SZABÁLYOZÁSA Bevezetés Ez a fejezet a testfolyadékok H 3 + O (H + ) ionjaival kapcsolatos jelenségeket tárgyalja. Ám a tárgyalás menete egy kissé eltér a kationokétól,
Indikátorok. brómtimolkék
 Indikátorok brómtimolkék A vöröskáposzta kivonat, mint indikátor Antociánok 12 40 mg/100 g ph Bodzában, ribizliben is! A szupersavak Szupersav: a kénsavnál erősebb sav Hammett savassági függvény: a savak
Indikátorok brómtimolkék A vöröskáposzta kivonat, mint indikátor Antociánok 12 40 mg/100 g ph Bodzában, ribizliben is! A szupersavak Szupersav: a kénsavnál erősebb sav Hammett savassági függvény: a savak
Általános és szervetlen kémia Laborelıkészítı elıadás IX-X.
 Általános és szervetlen kémia Laborelıkészítı elıadás IX-X. A réz(i)-oxid és a lecsapott kén előállítása Metallurgia, a fém mangán előállítása Megfordítható redoxreakciók Szervetlen vegyületek hőbomlása
Általános és szervetlen kémia Laborelıkészítı elıadás IX-X. A réz(i)-oxid és a lecsapott kén előállítása Metallurgia, a fém mangán előállítása Megfordítható redoxreakciók Szervetlen vegyületek hőbomlása
Kémiai alapismeretek 6. hét
 Kémiai alapismeretek 6. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék biner 2013. október 7-11. 1/15 2013/2014 I. félév, Horváth Attila c Egyensúly:
Kémiai alapismeretek 6. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék biner 2013. október 7-11. 1/15 2013/2014 I. félév, Horváth Attila c Egyensúly:
Oldódás, mint egyensúly
 Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott =
Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott =
Oldódás, mint egyensúly
 Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott K
Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott K
HÁZTARTÁSI VEGYI ANYAGOK
 HÁZTARTÁSI VEGYI ANYAGOK OKOZTA MÉRGEZÉSEK ELİADÓ DR. LEHEL JÓZSEF 2008.04.23. 1 HÁZTARTÁSI VEGYI ANYAGOK MARÓSZERMÉRGEZÉS Savak - lúgok lefolyó/tőzhely/fémtisztító szerek Detergensek Parfümök, kölnivizek
HÁZTARTÁSI VEGYI ANYAGOK OKOZTA MÉRGEZÉSEK ELİADÓ DR. LEHEL JÓZSEF 2008.04.23. 1 HÁZTARTÁSI VEGYI ANYAGOK MARÓSZERMÉRGEZÉS Savak - lúgok lefolyó/tőzhely/fémtisztító szerek Detergensek Parfümök, kölnivizek
Metabolikus krizis állapot enterális infekció kapcsán. Tóth-Urbán Krisztina dr. Baranyi Judit dr. Rosdy Bea dr. Heim Pál Gyermekkórház
 Metabolikus krizis állapot enterális infekció kapcsán Tóth-Urbán Krisztina dr. Baranyi Judit dr. Rosdy Bea dr. Heim Pál Gyermekkórház Acut toxikus-metabolikus encephalopathia okai Sav-bázis zavar: Acidosis-diabetikus
Metabolikus krizis állapot enterális infekció kapcsán Tóth-Urbán Krisztina dr. Baranyi Judit dr. Rosdy Bea dr. Heim Pál Gyermekkórház Acut toxikus-metabolikus encephalopathia okai Sav-bázis zavar: Acidosis-diabetikus
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
a réz(ii)-ion klorokomplexének előállítása...
 Általános és szervetlen kémia Laborelőkészítő előadás IX-X. (2008. október 18.) A réz(i)-oxid és a lecsapott kén előállítása Metallurgia, a fém mangán előállítása Megfordítható redoxreakciók Szervetlen
Általános és szervetlen kémia Laborelőkészítő előadás IX-X. (2008. október 18.) A réz(i)-oxid és a lecsapott kén előállítása Metallurgia, a fém mangán előállítása Megfordítható redoxreakciók Szervetlen
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
A tengerszint feletti magasság. Just Zsuzsanna Bereczki Zsolt Humánökológia, SZTE-TTIK Embertani Tanszék, 2011
 A tengerszint feletti magasság Just Zsuzsanna Bereczki Zsolt Humánökológia, SZTE-TTIK Embertani Tanszék, 2011 Stressz faktorok Sugárzás: kozmikus és UV Alacsony hőmérséklet: az Egyenlítőnél 5000 m magasságban
A tengerszint feletti magasság Just Zsuzsanna Bereczki Zsolt Humánökológia, SZTE-TTIK Embertani Tanszék, 2011 Stressz faktorok Sugárzás: kozmikus és UV Alacsony hőmérséklet: az Egyenlítőnél 5000 m magasságban
Homeosztázis A szervezet folyadékterei
 Homeosztázis A szervezet folyadékterei Homeosztázis Homeosztázis: a folytonos változások mellett az organizáció állandóságát létrehozó biológiai jelenség. A belső környezet szabályozott stabilitása. Megengedett
Homeosztázis A szervezet folyadékterei Homeosztázis Homeosztázis: a folytonos változások mellett az organizáció állandóságát létrehozó biológiai jelenség. A belső környezet szabályozott stabilitása. Megengedett
Közös elektronpár létrehozása
 Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
Kémiai reakciók 10. hét a reagáló részecskék között közös elektronpár létrehozása valósul meg sav-bázis reakciók komplexképződés elektronátadás és átvétel történik redoxi reakciók Közös elektronpár létrehozása
Energia források a vázizomban
 Energia források a vázizomban útvonal sebesség mennyiség ATP/glükóz 1. direkt foszforiláció igen gyors igen limitált - 2. glikolízis gyors limitált 2-3 3. oxidatív foszforiláció lassú nem limitált 36 Izomtípusok
Energia források a vázizomban útvonal sebesség mennyiség ATP/glükóz 1. direkt foszforiláció igen gyors igen limitált - 2. glikolízis gyors limitált 2-3 3. oxidatív foszforiláció lassú nem limitált 36 Izomtípusok
2334-06 Intenzív ellátást igénylő betegek megfigyelése, monitorizálása követelménymodul szóbeli vizsgafeladatai
 1. feladat A mentőegység által 45 éves keringési rendszer megbetegedésében szenvedő, kritikus állapotú férfi beteg érkezik az intenzív osztályra. Tanítsa meg a pályakezdő ápolótársának milyen eszköz nélküli
1. feladat A mentőegység által 45 éves keringési rendszer megbetegedésében szenvedő, kritikus állapotú férfi beteg érkezik az intenzív osztályra. Tanítsa meg a pályakezdő ápolótársának milyen eszköz nélküli
KETOACIDOTICUS COMA KEZELÉSE
 Változtatás átvezetésére kötelezett példány: nem kötelezett példány: Példány sorszám: KETOACIDOTICUS COMA KEZELÉSE (MP 057.B1) Készítette: Dr. Balogh Zoltán egyetemi adjunktus Átvizsgálta: Dr. Várvölgyi
Változtatás átvezetésére kötelezett példány: nem kötelezett példány: Példány sorszám: KETOACIDOTICUS COMA KEZELÉSE (MP 057.B1) Készítette: Dr. Balogh Zoltán egyetemi adjunktus Átvizsgálta: Dr. Várvölgyi
Kínaiak i.e. 37. kis fejfájás és nagy fejfájás hegyek Jose de Acosta spanyol hódítókat kísérı jezsuita pap Peruban AMS tkp. egy tünetegyüttes:
 A tengerszint feletti magasság Just Zsuzsanna Bereczki Zsolt Humánökológia, SZTE-TTIK TTIK Embertani Tanszék, 2011 Stressz faktorok Sugárzás: kozmikus és UV Alacsony hımérséklet: az Egyenlítınél 5000 m
A tengerszint feletti magasság Just Zsuzsanna Bereczki Zsolt Humánökológia, SZTE-TTIK TTIK Embertani Tanszék, 2011 Stressz faktorok Sugárzás: kozmikus és UV Alacsony hımérséklet: az Egyenlítınél 5000 m
Folyadék-elektrolyt háztartás
 Folyadék-elektrolyt háztartás Ökrös Ilona B-A-Z Z Megyei Kórház és Egyetemi Oktató Kórház Miskolc Debrecen, 2006.12.06. Fizikai alapfogalmak I. Atom: az anyag legkisebb része, az adott anyagra jellemző
Folyadék-elektrolyt háztartás Ökrös Ilona B-A-Z Z Megyei Kórház és Egyetemi Oktató Kórház Miskolc Debrecen, 2006.12.06. Fizikai alapfogalmak I. Atom: az anyag legkisebb része, az adott anyagra jellemző
Gázhalmazállapot. Relatív sűrűség: A anyag B anyagra vonatkoztatott relatív sűrűsége: ρ rel = ρ A / ρ B = M A /M B (ρ: sűrűség, M: moláris tömeg)
 Gázhalmazállapot Ideális gáztörvény: pv = nrt p: nyomás [Pa]; V: térfogat [m 3 ]; n: anyagmennyiség [mol], R: egyetemes gázállandó (8.314 J/molK); T: hőmérséklet [K]. (vagy p: nyomás [kpa] és V: térfogat
Gázhalmazállapot Ideális gáztörvény: pv = nrt p: nyomás [Pa]; V: térfogat [m 3 ]; n: anyagmennyiség [mol], R: egyetemes gázállandó (8.314 J/molK); T: hőmérséklet [K]. (vagy p: nyomás [kpa] és V: térfogat
Savasodás, vitaminok
 Savasodás, vitaminok Dr. Jekő József főiskolai tanár, intézetigazgató Nyíregyházi Főiskola, Agrár és Molekuláris Kutató és Szolgáltató Intézet Orvosi Wellness Konferencia Budapest, 2013. április 18-19.
Savasodás, vitaminok Dr. Jekő József főiskolai tanár, intézetigazgató Nyíregyházi Főiskola, Agrár és Molekuláris Kutató és Szolgáltató Intézet Orvosi Wellness Konferencia Budapest, 2013. április 18-19.
Az inhalációs anesztetikumok farmakokinetikája
 Az inhalációs anesztetikumok farmakokinetikája dr. Márton Sándor PTE A.O.K. A.I.T.I. Gáztörvények Dalton törvénye:gázkeverékek használatakor a gáz parciális nyomása egyenlő az őt alkotó gázok parciális
Az inhalációs anesztetikumok farmakokinetikája dr. Márton Sándor PTE A.O.K. A.I.T.I. Gáztörvények Dalton törvénye:gázkeverékek használatakor a gáz parciális nyomása egyenlő az őt alkotó gázok parciális
Kémiai reakciók Műszaki kémia, Anyagtan I. 11. előadás
 Kémiai reakciók Műszaki kémia, Anyagtan I. 11. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Kémiai reakció Kémiai reakció: különböző anyagok kémiai összetételének, ill. szerkezetének
Kémiai reakciók Műszaki kémia, Anyagtan I. 11. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Kémiai reakció Kémiai reakció: különböző anyagok kémiai összetételének, ill. szerkezetének
ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra :
 ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra : H 2 O H + + OH -, (2 H 2 O H 3 O + + 2 OH - ). Semleges oldatban a hidrogén-ion
ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra : H 2 O H + + OH -, (2 H 2 O H 3 O + + 2 OH - ). Semleges oldatban a hidrogén-ion
Tápanyagfelvétel, tápelemek arányai. Szőriné Zielinska Alicja Rockwool B.V.
 Tápanyagfelvétel, tápelemek arányai Szőriné Zielinska Alicja Rockwool B.V. Vízfelvétel és mozgás a növényben Vízfelvételt befolyásolja: besugárzás (növény) hőmérséklete Páratartalom (% v. HD) EC (magas
Tápanyagfelvétel, tápelemek arányai Szőriné Zielinska Alicja Rockwool B.V. Vízfelvétel és mozgás a növényben Vízfelvételt befolyásolja: besugárzás (növény) hőmérséklete Páratartalom (% v. HD) EC (magas
A gázcsere alapjai, a légzési gázok szállítása
 A gázcsere alapjai, a légzési gázok szállítása Alapfogalmak szárazföldi gerincesek: a hatékony gázcseréhez a környezet és a sejtek közötti egyszerű diffúzió nem elég - légutak kialakítása (melegítés, párásítás,
A gázcsere alapjai, a légzési gázok szállítása Alapfogalmak szárazföldi gerincesek: a hatékony gázcseréhez a környezet és a sejtek közötti egyszerű diffúzió nem elég - légutak kialakítása (melegítés, párásítás,
A kémiai egyensúlyi rendszerek
 A kémiai egyensúlyi rendszerek HenryLouis Le Chatelier (1850196) Karl Ferdinand Braun (18501918) A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 011 A kémiai egyensúly A kémiai egyensúlyok
A kémiai egyensúlyi rendszerek HenryLouis Le Chatelier (1850196) Karl Ferdinand Braun (18501918) A bemutatót összeállította: Fogarasi József, Petrik Lajos SZKI, 011 A kémiai egyensúly A kémiai egyensúlyok
A Ca, P és Mg háztartás szabályozása, mellékpajzsmirigy és D-vitamin szerepe
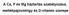 A Ca, P és Mg háztartás szabályozása, mellékpajzsmirigy és D-vitamin szerepe Ásványi anyag Kalcium Legnagyobb mennyiségben ez az ásványi anyag van jelen a szervezetben Kb. egy átlagos felnőttben 1 kg kalcium
A Ca, P és Mg háztartás szabályozása, mellékpajzsmirigy és D-vitamin szerepe Ásványi anyag Kalcium Legnagyobb mennyiségben ez az ásványi anyag van jelen a szervezetben Kb. egy átlagos felnőttben 1 kg kalcium
Sürgősségi betegellátás Krízisállapotok 1es típusú diabetes mellitusos gyermekekben. Dr. Felszeghy Enikő DE OEC Gyermekklinika
 Sürgősségi betegellátás Krízisállapotok 1es típusú diabetes mellitusos gyermekekben Dr. Felszeghy Enikő DE OEC Gyermekklinika Etiológia Döntően gyermekkori előfordulás T sejt mediált autoimmun folyamat
Sürgősségi betegellátás Krízisállapotok 1es típusú diabetes mellitusos gyermekekben Dr. Felszeghy Enikő DE OEC Gyermekklinika Etiológia Döntően gyermekkori előfordulás T sejt mediált autoimmun folyamat
A klórozás kémiája. Kémiai reakciók. Affinitási sorrend. Klórgáz és a víz reakciói gáz oldódása hidrolízis disszociáció
 Víz és szennyvíztechnológiai gyakorlatok Fertőtlenítés klórgázzal Vincze lászlóné dr. főiskolai docens A klórozás kémiája Klórgáz és a víz reakciói gáz oldódása hidrolízis disszociáció Szabad aktív klórformák
Víz és szennyvíztechnológiai gyakorlatok Fertőtlenítés klórgázzal Vincze lászlóné dr. főiskolai docens A klórozás kémiája Klórgáz és a víz reakciói gáz oldódása hidrolízis disszociáció Szabad aktív klórformák
6. A TALAJ KÉMIAI TULAJDONSÁGAI. Dr. Varga Csaba
 6. A TALAJ KÉMIAI TULAJDONSÁGAI Dr. Varga Csaba Oldódási és kicsapódási reakciók a talajban Fizikai oldódás (bepárlás után a teljes mennyiség visszanyerhető) NaCl Na + + Cl Kémiai oldódás Al(OH) 3 + 3H
6. A TALAJ KÉMIAI TULAJDONSÁGAI Dr. Varga Csaba Oldódási és kicsapódási reakciók a talajban Fizikai oldódás (bepárlás után a teljes mennyiség visszanyerhető) NaCl Na + + Cl Kémiai oldódás Al(OH) 3 + 3H
A XVII. VegyÉSZtorna I. fordulójának feladatai és megoldásai
 Megoldások: 1. Mekkora a ph-ja annak a sósavoldatnak, amelyben a kloridion koncentrációja 0,01 mol/dm 3? (ph =?,??) A sósav a hidrogén-klorid (HCl) vizes oldata, amelyben a HCl teljesen disszociál, mivel
Megoldások: 1. Mekkora a ph-ja annak a sósavoldatnak, amelyben a kloridion koncentrációja 0,01 mol/dm 3? (ph =?,??) A sósav a hidrogén-klorid (HCl) vizes oldata, amelyben a HCl teljesen disszociál, mivel
A szervezet folyadékterei, Homeostasis
 A szervezet folyadékterei, Homeostasis Bányász Tamás Az emberi test mint nyílt rendszer 1. Nyílt rendszerek: A szervezet anyag- és energiaforgalmat bonyolít a környezettel 2. Homeostasis: A folyamat, mely
A szervezet folyadékterei, Homeostasis Bányász Tamás Az emberi test mint nyílt rendszer 1. Nyílt rendszerek: A szervezet anyag- és energiaforgalmat bonyolít a környezettel 2. Homeostasis: A folyamat, mely
KÉMIA TANMENETEK 7-8-9-10 osztályoknak
 KÉMIA TANMENETEK 7-8-9-10 osztályoknak Néhány gondolat a mellékletekhez: A tanterv nem tankönyvhöz készült, hanem témakörökre bontva mutatja be a minimumot és az optimumot. A felsőbb osztályba lépés alapja
KÉMIA TANMENETEK 7-8-9-10 osztályoknak Néhány gondolat a mellékletekhez: A tanterv nem tankönyvhöz készült, hanem témakörökre bontva mutatja be a minimumot és az optimumot. A felsőbb osztályba lépés alapja
2014/2015. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA. II. KATEGÓRIA Javítási-értékelési útmutató
 Oktatási Hivatal I. FELADATSOR 01/015. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA II. KATEGÓRIA Javítási-értékelési útmutató 1. B. 70Yb. C. A fenti reakióban a HDS képződése
Oktatási Hivatal I. FELADATSOR 01/015. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA II. KATEGÓRIA Javítási-értékelési útmutató 1. B. 70Yb. C. A fenti reakióban a HDS képződése
KÉMIA. Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003
 KÉMIA Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003 ű érettségire felkészítő tananyag tanterve /11-12. ill. 12-13. évfolyam/ Elérendő célok: a természettudományos gondolkodás
KÉMIA Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003 ű érettségire felkészítő tananyag tanterve /11-12. ill. 12-13. évfolyam/ Elérendő célok: a természettudományos gondolkodás
3. változat. 2. Melyik megállapítás helyes: Az egyik gáz másikhoz viszonyított sűrűsége nem más,
 3. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg az egyszerű anyagok számát
3. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg az egyszerű anyagok számát
M E G O L D Ó L A P. Egészségügyi Minisztérium
 Egészségügyi Minisztérium Szolgálati titok! Titkos! Érvényességi idı: az írásbeli vizsga befejezésének idıpontjáig A minısítı neve: Vízvári László A minısítı beosztása: fıigazgató M E G O L D Ó L A P szakmai
Egészségügyi Minisztérium Szolgálati titok! Titkos! Érvényességi idı: az írásbeli vizsga befejezésének idıpontjáig A minısítı neve: Vízvári László A minısítı beosztása: fıigazgató M E G O L D Ó L A P szakmai
5. Laboratóriumi gyakorlat
 5. Laboratóriumi gyakorlat HETEROGÉN KÉMIAI REAKCIÓ SEBESSÉGÉNEK VIZSGÁLATA A CO 2 -nak vízben történő oldódása és az azt követő egyensúlyra vezető kémiai reakció az alábbi reakcióegyenlettel írható le:
5. Laboratóriumi gyakorlat HETEROGÉN KÉMIAI REAKCIÓ SEBESSÉGÉNEK VIZSGÁLATA A CO 2 -nak vízben történő oldódása és az azt követő egyensúlyra vezető kémiai reakció az alábbi reakcióegyenlettel írható le:
1. feladat Összesen: 10 pont
 1. feladat Összesen: 10 pont Minden feladatnál a betűjel bekarikázásával jelölje meg az egyetlen helyes, vagy az egyetlen helytelen választ! I. Melyik sorban szerepelnek olyan vegyületek, amelyek mindegyike
1. feladat Összesen: 10 pont Minden feladatnál a betűjel bekarikázásával jelölje meg az egyetlen helyes, vagy az egyetlen helytelen választ! I. Melyik sorban szerepelnek olyan vegyületek, amelyek mindegyike
Általános Kémia GY 3.tantermi gyakorlat
 Általános Kémia GY 3.tantermi gyakorlat ph számítás: Erős savak, erős bázisok Gyenge savak, gyenge bázisok Pufferek, pufferkapacitás Honlap: http://harmatv.web.elte.hu Példatárak: Villányi Attila: Ötösöm
Általános Kémia GY 3.tantermi gyakorlat ph számítás: Erős savak, erős bázisok Gyenge savak, gyenge bázisok Pufferek, pufferkapacitás Honlap: http://harmatv.web.elte.hu Példatárak: Villányi Attila: Ötösöm
Anyagvizsgálati módszerek Elektroanalitika. Anyagvizsgálati módszerek
 Anyagvizsgálati módszerek Elektroanalitika Anyagvizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagvizsgálati módszerek Optikai módszerek 1/ 18 Potenciometria Potenciometria olyan analitikai eljárások
Anyagvizsgálati módszerek Elektroanalitika Anyagvizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagvizsgálati módszerek Optikai módszerek 1/ 18 Potenciometria Potenciometria olyan analitikai eljárások
Alkalmazott élettan: légzés, oxigénterápia
 Alkalmazott élettan: légzés, oxigénterápia Molnár Zsolt Aneszteziológiai és Intenzív terápiás Intézet Szegedi Tudományegyetem 2013 Nobel díj C vitamin Szent-Györgyi Albert 1893-1986 Szent-Györgyi Krebs
Alkalmazott élettan: légzés, oxigénterápia Molnár Zsolt Aneszteziológiai és Intenzív terápiás Intézet Szegedi Tudományegyetem 2013 Nobel díj C vitamin Szent-Györgyi Albert 1893-1986 Szent-Györgyi Krebs
Kémiai fizikai alapok I. Vízminőség, vízvédelem 2009-2010. tavasz
 Kémiai fizikai alapok I. Vízminőség, vízvédelem 2009-2010. tavasz 1. A vízmolekula szerkezete Elektronegativitás, polaritás, másodlagos kötések 2. Fizikai tulajdonságok a) Szerkezetből adódó különleges
Kémiai fizikai alapok I. Vízminőség, vízvédelem 2009-2010. tavasz 1. A vízmolekula szerkezete Elektronegativitás, polaritás, másodlagos kötések 2. Fizikai tulajdonságok a) Szerkezetből adódó különleges
MSZ 20135: Ft nitrit+nitrát-nitrogén (NO2 - + NO3 - -N), [KCl] -os kivonatból. MSZ 20135: Ft ammónia-nitrogén (NH4 + -N),
![MSZ 20135: Ft nitrit+nitrát-nitrogén (NO2 - + NO3 - -N), [KCl] -os kivonatból. MSZ 20135: Ft ammónia-nitrogén (NH4 + -N), MSZ 20135: Ft nitrit+nitrát-nitrogén (NO2 - + NO3 - -N), [KCl] -os kivonatból. MSZ 20135: Ft ammónia-nitrogén (NH4 + -N),](/thumbs/88/114668894.jpg) Az árlista érvényes 2018. január 4-től Laboratóriumi vizsgálatok Talaj VIZSGÁLATI CSOMAGOK Talajtani alapvizsgálati csomag kötöttség, összes só, CaCO 3, humusz, ph Talajtani szűkített vizsgálati csomag
Az árlista érvényes 2018. január 4-től Laboratóriumi vizsgálatok Talaj VIZSGÁLATI CSOMAGOK Talajtani alapvizsgálati csomag kötöttség, összes só, CaCO 3, humusz, ph Talajtani szűkített vizsgálati csomag
KÉMIA Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003
 KÉMIA Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003 I. RÉSZLETES ÉRETTSÉGI VIZSGAKÖVETELMÉNY A) KOMPETENCIÁK A vizsgázónak a követelményrendszerben és a vizsgaleírásban
KÉMIA Kiss Árpád Országos Közoktatási Szolgáltató Intézmény Vizsgafejlesztő Központ 2003 I. RÉSZLETES ÉRETTSÉGI VIZSGAKÖVETELMÉNY A) KOMPETENCIÁK A vizsgázónak a követelményrendszerben és a vizsgaleírásban
KÉMIA I. RÉSZLETES ÉRETTSÉGI VIZSGAKÖVETELMÉNY A) KOMPETENCIÁK
 KÉMIA Elvárt kompetenciák: I. RÉSZLETES ÉRETTSÉGI VIZSGAKÖVETELMÉNY A) KOMPETENCIÁK induktív következtetés (egyedi tényekből az általános törvényszerűségekre) deduktív következtetés (az általános törvényszerűségekből
KÉMIA Elvárt kompetenciák: I. RÉSZLETES ÉRETTSÉGI VIZSGAKÖVETELMÉNY A) KOMPETENCIÁK induktív következtetés (egyedi tényekből az általános törvényszerűségekre) deduktív következtetés (az általános törvényszerűségekből
Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás
 Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás I. Egyatomos molekulák He, Ne, Ar, Kr, Xe, Rn - a molekula alakja: pontszerű - a kovalens kötés polaritása: NINCS kötés
Molekulák alakja és polaritása, a molekulák között működő legerősebb kölcsönhatás I. Egyatomos molekulák He, Ne, Ar, Kr, Xe, Rn - a molekula alakja: pontszerű - a kovalens kötés polaritása: NINCS kötés
ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra :
 ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra : H 2 O H + + OH -, (2 H 2 O H 3 O + + 2 OH - ). Semleges oldatban a hidrogén-ion
ph-számítás A víz gyenge elektrolit. Kismértékben disszociál hidrogénionokra (helyesebben hidroxónium-ionokra) és hidroxid-ionokra : H 2 O H + + OH -, (2 H 2 O H 3 O + + 2 OH - ). Semleges oldatban a hidrogén-ion
1. feladat Összesen: 18 pont. 2. feladat Összesen: 9 pont
 1. feladat Összesen: 18 pont Különböző anyagok vízzel való kölcsönhatását vizsgáljuk. Töltse ki a táblázatot! második oszlopba írja, hogy oldódik-e vagy nem oldódik vízben az anyag, illetve ha reagál,
1. feladat Összesen: 18 pont Különböző anyagok vízzel való kölcsönhatását vizsgáljuk. Töltse ki a táblázatot! második oszlopba írja, hogy oldódik-e vagy nem oldódik vízben az anyag, illetve ha reagál,
A vér alakos elemei és számadatokkal jellemezhető tulajdonságaik
 PTE ETK. 2011/2012. tanév II. szemeszter Élettan tantárgy NORMÁLÉRTÉKEK ÉS EGYÉB FONTOSABB SZÁMADATOK (I.) A vér alakos elemei és számadatokkal jellemezhető tulajdonságaik Az erythrocyta A teljes vér vörösvértest
PTE ETK. 2011/2012. tanév II. szemeszter Élettan tantárgy NORMÁLÉRTÉKEK ÉS EGYÉB FONTOSABB SZÁMADATOK (I.) A vér alakos elemei és számadatokkal jellemezhető tulajdonságaik Az erythrocyta A teljes vér vörösvértest
Kémiai reakciók. Közös elektronpár létrehozása. Általános és szervetlen kémia 10. hét. Elızı héten elsajátítottuk, hogy.
 Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Általános és szervetlen kémia 10. hét Elızı héten elsajátítottuk, hogy a kémiai reakciókat hogyan lehet csoportosítani milyen kinetikai összefüggések érvényesek Mai témakörök a közös elektronpár létrehozásával
Paradicsom és paprika tápoldatozása fejlődési fázisai szerint. Szőriné Zielinska Alicja Rockwool B.V
 Paradicsom és paprika tápoldatozása fejlődési fázisai szerint Szőriné Zielinska Alicja Rockwool B.V page 2 A növények növekedésének alapjai: Napenergia,CO2, víz, tápelemek Tápelemeket 2 csoportra osztjuk:
Paradicsom és paprika tápoldatozása fejlődési fázisai szerint Szőriné Zielinska Alicja Rockwool B.V page 2 A növények növekedésének alapjai: Napenergia,CO2, víz, tápelemek Tápelemeket 2 csoportra osztjuk:
Biofizika (molekuláris biofizika és biológiai anyagtan) 2014, tavaszi szemeszter
 A biofizika a biológia és fizika hatátudománya, mely fizikai és fizikai-kémiai módszeeket használ az élő endszeek tanulmányozásáa. Biofizika (molekuláis biofizika és biológiai anyagtan) 014, tavaszi szemeszte
A biofizika a biológia és fizika hatátudománya, mely fizikai és fizikai-kémiai módszeeket használ az élő endszeek tanulmányozásáa. Biofizika (molekuláis biofizika és biológiai anyagtan) 014, tavaszi szemeszte
Tubularis működések. A veseműködés élettana, a kiválasztás funkciója, az emberi test víztereinek élettana (2) (Tanulási támpontok: 54-57)
 A veseműködés élettana, a kiválasztás funkciója, az emberi test víztereinek élettana (2) Dr. Attila Nagy 2018 Tubularis működések (Tanulási támpontok: 54-57) 1 A transzport irányai Tubuláris transzportok
A veseműködés élettana, a kiválasztás funkciója, az emberi test víztereinek élettana (2) Dr. Attila Nagy 2018 Tubularis működések (Tanulási támpontok: 54-57) 1 A transzport irányai Tubuláris transzportok
1) Standard hidrogénelektród készülhet sósavból vagy kénsavoldatból is. Ezt a savat 100-szorosára hígítva, mekkora ph-jú oldatot nyerünk?
 Számítások ph-val kombinálva 1) Standard hidrogénelektród készülhet sósavból vagy kénsavoldatból is. Ezt a savat 100-szorosára hígítva, mekkora ph-jú oldatot nyerünk? Mekkora az eredeti oldatok anyagmennyiség-koncentrációja?
Számítások ph-val kombinálva 1) Standard hidrogénelektród készülhet sósavból vagy kénsavoldatból is. Ezt a savat 100-szorosára hígítva, mekkora ph-jú oldatot nyerünk? Mekkora az eredeti oldatok anyagmennyiség-koncentrációja?
Számítások ph-val kombinálva
 Bemelegítő, gondolkodtató kérdések Igaz-e? Indoklással válaszolj! A A semleges oldat ph-ja mindig éppen 7. B A tömény kénsav ph-ja 0 vagy annál is kisebb. C A 0,1 mol/dm 3 koncentrációjú sósav ph-ja azonos
Bemelegítő, gondolkodtató kérdések Igaz-e? Indoklással válaszolj! A A semleges oldat ph-ja mindig éppen 7. B A tömény kénsav ph-ja 0 vagy annál is kisebb. C A 0,1 mol/dm 3 koncentrációjú sósav ph-ja azonos
Vérvétel artériából és vénából
 Vérvétel vénából és artériából leggyakoribb ápolói beavatkozás Vérvétel artériából és vénából Pécsi Tudományegyetem Egészségtudományi Kar Ápolás és Betegellátás Intézet Ápolástudományi Tanszék Dr. Oláh
Vérvétel vénából és artériából leggyakoribb ápolói beavatkozás Vérvétel artériából és vénából Pécsi Tudományegyetem Egészségtudományi Kar Ápolás és Betegellátás Intézet Ápolástudományi Tanszék Dr. Oláh
AsMET víztisztító és technológiája
 AsMET víztisztító és technológiája Horváth Dániel mérnök daniel.horvath@smet.hu S-Metalltech 98. Kft. Tartalom I. AsMET adszorbens - Tulajdonságok II. Alkalmazási példák III. Regenerálás Hulladék kezelése
AsMET víztisztító és technológiája Horváth Dániel mérnök daniel.horvath@smet.hu S-Metalltech 98. Kft. Tartalom I. AsMET adszorbens - Tulajdonságok II. Alkalmazási példák III. Regenerálás Hulladék kezelése
ELTE Kémiai Intézet (http://www.chem.elte.hu) kislexikonja a vörösiszap-katasztrófával kapcsolatos fogalmak magyarázatára 2010. október 18.
 ELTE Kémiai Intézet (http://www.chem.elte.hu) kislexikonja a vörösiszap-katasztrófával kapcsolatos fogalmak magyarázatára 2010. október 18. A vörösiszap-katasztrófáról tudósító hírekben sok olyan kifejezés
ELTE Kémiai Intézet (http://www.chem.elte.hu) kislexikonja a vörösiszap-katasztrófával kapcsolatos fogalmak magyarázatára 2010. október 18. A vörösiszap-katasztrófáról tudósító hírekben sok olyan kifejezés
Elektrolitok nem elektrolitok, vezetőképesség mérése
 Elektrolitok nem elektrolitok, vezetőképesség mérése Név: Neptun-kód: mérőhely: Labor előzetes feladatok A vezetőképesség változása kémiai reakció közben 10,00 cm 3 ismeretlen koncentrációjú sósav oldatához
Elektrolitok nem elektrolitok, vezetőképesség mérése Név: Neptun-kód: mérőhely: Labor előzetes feladatok A vezetőképesség változása kémiai reakció közben 10,00 cm 3 ismeretlen koncentrációjú sósav oldatához
KÉMIA I. RÉSZLETES ÉRETTSÉGIVIZSGA-KÖVETELMÉNY A) KOMPETENCIÁK
 KÉMIA I. RÉSZLETES ÉRETTSÉGIVIZSGA-KÖVETELMÉNY A) KOMPETENCIÁK A vizsgázónak a követelményrendszerben és a vizsgaleírásban meghatározott módon, az alábbi kompetenciák meglétét kell bizonyítania: - a természettudományos
KÉMIA I. RÉSZLETES ÉRETTSÉGIVIZSGA-KÖVETELMÉNY A) KOMPETENCIÁK A vizsgázónak a követelményrendszerben és a vizsgaleírásban meghatározott módon, az alábbi kompetenciák meglétét kell bizonyítania: - a természettudományos
Általános Kémia GY 4.tantermi gyakorlat
 Általános Kémia GY 4.tantermi gyakorlat Csapadékképződési egyensúlyok, oldhatósági szorzat Termokémiai számítások Hess tétel Közömbösítési hő meghatározása kísérlet (példaszámítás: 4. labor leírásánál)
Általános Kémia GY 4.tantermi gyakorlat Csapadékképződési egyensúlyok, oldhatósági szorzat Termokémiai számítások Hess tétel Közömbösítési hő meghatározása kísérlet (példaszámítás: 4. labor leírásánál)
A víz, a nátrium és kálium egyensúly zavarai. Dr. Miseta Attila Dr.Kőszegi Tamás 2016
 A víz, a nátrium és kálium egyensúly zavarai Dr. Miseta Attila Dr.Kőszegi Tamás 2016 1 Átlagos napi vízfelvétel 2 Az egyes ionok és molekulák hozzájárulása a plazma ozmolaritáshoz 3 A szervezet vízháztartása
A víz, a nátrium és kálium egyensúly zavarai Dr. Miseta Attila Dr.Kőszegi Tamás 2016 1 Átlagos napi vízfelvétel 2 Az egyes ionok és molekulák hozzájárulása a plazma ozmolaritáshoz 3 A szervezet vízháztartása
Hiperbár oxigénkezelés a toxikológiában. dr. Ágoston Viktor Antal Péterfy Sándor utcai Kórház Toxikológia
 Hiperbár oxigénkezelés a toxikológiában dr. Ágoston Viktor Antal Péterfy Sándor utcai Kórház Toxikológia physiological effects of carbon monoxide could be mitigated considerably by increasing the partial
Hiperbár oxigénkezelés a toxikológiában dr. Ágoston Viktor Antal Péterfy Sándor utcai Kórház Toxikológia physiological effects of carbon monoxide could be mitigated considerably by increasing the partial
Hypoxia oxigénhiány. Definíció és alapfogalmak
 Hypoxia oxigénhiány Rácz Olivér és Dombrovský Péter Miskolci Egyetem, Egészségügyi Kar Šafárik Egyetem, Orvosi Kar hypoxmisk 1 Definíció és alapfogalmak Hypoxia szöveti oxigénhiány Hypoxémia alacsony O
Hypoxia oxigénhiány Rácz Olivér és Dombrovský Péter Miskolci Egyetem, Egészségügyi Kar Šafárik Egyetem, Orvosi Kar hypoxmisk 1 Definíció és alapfogalmak Hypoxia szöveti oxigénhiány Hypoxémia alacsony O
Szigeti Gyula Péter. Homeosztázis
 Szigeti Gyula Péter Homeosztázis A szervezet egy nyitott rendszer, 1. rész 1. Homeosztázis. Azon folyamatok összessége, amelyek a szervezet belső állandóságát ( internal milieu ) biztosítják. (a testfolyadékok,
Szigeti Gyula Péter Homeosztázis A szervezet egy nyitott rendszer, 1. rész 1. Homeosztázis. Azon folyamatok összessége, amelyek a szervezet belső állandóságát ( internal milieu ) biztosítják. (a testfolyadékok,
A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján.
 A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. Szakképesítés azonosítószáma és megnevezése 54 524 03 Vegyész technikus Tájékoztató
A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. Szakképesítés azonosítószáma és megnevezése 54 524 03 Vegyész technikus Tájékoztató
11. Március 14. Klinikai enzimológia Szarka András 12. Március 21. Preanalitika, klinikai kémia, vizeletvizsgálat gyakorlat
 Klinikai Kémia hét dátum témakör előadó 6. Február 7. Klinikai kémia fogalma. Mintavétel, Szarka András előkészítés, sztenderdizáció. 7. Február 14. Öröklött rendellenességek, (cisztás Szarka András fibrózis,
Klinikai Kémia hét dátum témakör előadó 6. Február 7. Klinikai kémia fogalma. Mintavétel, Szarka András előkészítés, sztenderdizáció. 7. Február 14. Öröklött rendellenességek, (cisztás Szarka András fibrózis,
1. feladat Összesen: 8 pont. 2. feladat Összesen: 11 pont. 3. feladat Összesen: 7 pont. 4. feladat Összesen: 14 pont
 1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
Minta feladatsor. Az ion neve. Az ion képlete O 4. Szulfátion O 3. Alumíniumion S 2 CHH 3 COO. Króm(III)ion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
O k t a t á si Hivatal
 O k t a t á si Hivatal A versenyző kódszáma: 2015/2016. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. kategória FELADATLAP Munkaidő: 300 perc Elérhető pontszám: 100 pont ÚTMUTATÓ
O k t a t á si Hivatal A versenyző kódszáma: 2015/2016. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. kategória FELADATLAP Munkaidő: 300 perc Elérhető pontszám: 100 pont ÚTMUTATÓ
O k t a t á si Hivatal
 O k t a t á si Hivatal 0/0. tanévi Országos Középiskolai Tanulmányi Verseny Kémia II. kategória. forduló I. FELADATSOR Megoldások. A helyes válasz(ok) betűjele: B, D, E. A legnagyobb elektromotoros erejű
O k t a t á si Hivatal 0/0. tanévi Országos Középiskolai Tanulmányi Verseny Kémia II. kategória. forduló I. FELADATSOR Megoldások. A helyes válasz(ok) betűjele: B, D, E. A legnagyobb elektromotoros erejű
Talajvédelem. Talajok átalakítása és elzárása Talajok beépítése Talajművelés Talajok víztelenítése és öntözése Erózió, defláció Talajok szennyezése
 Talajvédelem Talajok átalakítása és elzárása Talajok beépítése Talajművelés Talajok víztelenítése és öntözése Erózió, defláció Talajok szennyezése Talajok szennyezése Porok Savak Fémek Sók Növény-védőszerek
Talajvédelem Talajok átalakítása és elzárása Talajok beépítése Talajművelés Talajok víztelenítése és öntözése Erózió, defláció Talajok szennyezése Talajok szennyezése Porok Savak Fémek Sók Növény-védőszerek
(Kémiai alapok) és
 01/013 tavaszi félév 6. óra ph-számítás (I) Vízionszorzat, Erős savak és bázisok ph-ja Erős savak és bázisok nagyon híg oldatának ph-ja (pl. 10 7 M HCl) Gyenge savak és bázisok ph-ja (töményebb, illetve
01/013 tavaszi félév 6. óra ph-számítás (I) Vízionszorzat, Erős savak és bázisok ph-ja Erős savak és bázisok nagyon híg oldatának ph-ja (pl. 10 7 M HCl) Gyenge savak és bázisok ph-ja (töményebb, illetve
Sebészeti Műtéttani Intézet
 Sebészeti Műtéttani Intézet B Modul Gyakorlati Orvosi Alapismeretek rvostechnika és Monitorozás a Gyakorlatban 1-2. gyakorlat Perioperatív folyadékterápia a gyakorlatban (A volumenkorrekció eszközei, injekciózás,
Sebészeti Műtéttani Intézet B Modul Gyakorlati Orvosi Alapismeretek rvostechnika és Monitorozás a Gyakorlatban 1-2. gyakorlat Perioperatív folyadékterápia a gyakorlatban (A volumenkorrekció eszközei, injekciózás,
Endocrin anyagcsere-krízis állapotok a gyermeksürgősségi ellátásbanfókuszban
 Endocrin anyagcsere-krízis állapotok a gyermeksürgősségi ellátásbanfókuszban a DKA Kaposi Mór Oktató Kórház Sürgősségi Betegellátó Centrum Gyermeksürgősségi részleg Bátori Beáta, Garábi Beáta, Kiss Mariann,
Endocrin anyagcsere-krízis állapotok a gyermeksürgősségi ellátásbanfókuszban a DKA Kaposi Mór Oktató Kórház Sürgősségi Betegellátó Centrum Gyermeksürgősségi részleg Bátori Beáta, Garábi Beáta, Kiss Mariann,
X = 9,477 10 3 mol. ph = 4,07 [H + ] = 8,51138 10 5 mol/dm 3 Gyenge sav ph-jának a számolása (általánosan alkalmazható képlet):
![X = 9,477 10 3 mol. ph = 4,07 [H + ] = 8,51138 10 5 mol/dm 3 Gyenge sav ph-jának a számolása (általánosan alkalmazható képlet): X = 9,477 10 3 mol. ph = 4,07 [H + ] = 8,51138 10 5 mol/dm 3 Gyenge sav ph-jának a számolása (általánosan alkalmazható képlet):](/thumbs/25/6460380.jpg) . Egy átrium-hidroxidot és átrium-acetátot tartalmazó mita 50,00 cm 3 -es részletée megmérjük a ph-t, ami,65-ek adódott. 8,65 cm 3 0, mol/dm 3 kocetrációjú sósavat adva a mitához, a mért ph 5,065. Meyi
. Egy átrium-hidroxidot és átrium-acetátot tartalmazó mita 50,00 cm 3 -es részletée megmérjük a ph-t, ami,65-ek adódott. 8,65 cm 3 0, mol/dm 3 kocetrációjú sósavat adva a mitához, a mért ph 5,065. Meyi
2014/2015. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA. I. KATEGÓRIA Javítási-értékelési útmutató
 Oktatási Hivatal I. FELADATSOR 014/015. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. KATEGÓRIA Javítási-értékelési útmutató 1. B. 70Yb 3. C 4. A fenti reakióban a HDS képződése
Oktatási Hivatal I. FELADATSOR 014/015. tanévi Országos Középiskolai Tanulmányi Verseny második forduló KÉMIA I. KATEGÓRIA Javítási-értékelési útmutató 1. B. 70Yb 3. C 4. A fenti reakióban a HDS képződése
1.1. Reakciósebességet befolyásoló tényezők, a tioszulfát bomlása
 2. Laboratóriumi gyakorlat A laborgyakorlatok anyagát összeállította: dr. Pasinszki Tibor egyetemi tanár 1.1. Reakciósebességet befolyásoló tényezők, a tioszulfát bomlása A reakciósebesség növelhető a
2. Laboratóriumi gyakorlat A laborgyakorlatok anyagát összeállította: dr. Pasinszki Tibor egyetemi tanár 1.1. Reakciósebességet befolyásoló tényezők, a tioszulfát bomlása A reakciósebesség növelhető a
Légzés 4. Légzésszabályozás. Jenes Ágnes
 Légzés 4. Légzésszabályozás Jenes Ágnes Spontán légzés: - idegi szabályzás - automatikus (híd, nyúltvelı) - akaratlagos (agykéreg) A légzés leáll, ha a gerincvelıt a n. phrenicus eredése felett átvágjuk.
Légzés 4. Légzésszabályozás Jenes Ágnes Spontán légzés: - idegi szabályzás - automatikus (híd, nyúltvelı) - akaratlagos (agykéreg) A légzés leáll, ha a gerincvelıt a n. phrenicus eredése felett átvágjuk.
EGYÉB GYAKORLÓ FELADATOK Összetétel számítás
 EGYÉB GYAKORLÓ FELADATOK Összetétel számítás 1. Mekkora tömegű NaOH-ot kell bemérni 50 cm 3 1,00 mol/dm 3 koncentrációjú NaOH-oldat elkészítéséhez? M r (NaCl) = 40,0. 2. Mekkora tömegű KHCO 3 -ot kell
EGYÉB GYAKORLÓ FELADATOK Összetétel számítás 1. Mekkora tömegű NaOH-ot kell bemérni 50 cm 3 1,00 mol/dm 3 koncentrációjú NaOH-oldat elkészítéséhez? M r (NaCl) = 40,0. 2. Mekkora tömegű KHCO 3 -ot kell
Javítókulcs (Kémia emelt szintű feladatsor)
 Javítókulcs (Kémia emelt szintű feladatsor) I. feladat 1. C 2. B. fenolos hidroxilcsoport, éter, tercier amin db. ; 2 db. 4. észter 5. E 6. A tercier amino-nitrogén. 7. Pl. a trimetil-amin reakciója HCl-dal.
Javítókulcs (Kémia emelt szintű feladatsor) I. feladat 1. C 2. B. fenolos hidroxilcsoport, éter, tercier amin db. ; 2 db. 4. észter 5. E 6. A tercier amino-nitrogén. 7. Pl. a trimetil-amin reakciója HCl-dal.
