Klór alkáli elektrolízis
|
|
|
- Géza Mészáros
- 7 évvel ezelőtt
- Látták:
Átírás
1 Cruickshank már 1800-ban előállította a klórt elektrolízissel, mégis ipari eljárássá akkor vált, amikor kidolgozták a szintetikus grafit anódot és rendelkezésre állt a szükséges elektromos áram. Az 1800-as évek végén párhuzamosan fejlődött ki a diafragmás és a higanykatódos eljárás, míg a membrános technológiát az 1970-es években valósították meg ipari léptékben. Ugyanebben az időszakban a grafit anódokat kiszorították az aktivált titán anódok mind a diafragmás, mind a higanyos eljárásokban. A 19. században a klórt csak fehérítésre használták, termelése az 1940-es évektől növekedett jelentősen a PVC és poliuretán igényekkel együtt. Az aromás klórvegyületek, a propilénoxid, a klórozott szénhidrogén oldószerek és szervetlen klórvegyületek előállítása szintén növelte a klór igényt. Jelenleg a Nyugat-Európai termelés 9 millió tonna körül van, a US 11,2 millió tonnás és Japán 4,2 millió tonnás termelése mellett, a világban 1994-ben 38 millió tonna klórt állítottak elő. A klór előállítása az egyik legnagyobb elektromos energia fogyasztó eljárás. Az egyes országok vegyiparának fejlettségét szokták klórtermelésével is jellemezni. A Budapesten működő klóralkáli üzemben klórt (sósavat) és marónátront (NaOH) gyártanak. Hasonló termékeket állítanak elő Balatofűzfőn is. A marónátron nagy mennyiségben szükséges a timföldgyártáshoz, ezért Kazincbarcikán a BVK keretében nagy kapacitású klóralkáli üzem épült, ahol a PVC-gyártásnak nagy mennyiségű klórra van szüksége, amit importált kősóból állítanak elő, a kelekező nátriumból pedig marónátron készül. Dr. Pátzay György 1
2 Klór alkáli elektrolízis Az elektrolízist eredetileg a klór előállítására fejlesztették ki, de az együtt képződő lúg is felhasználásra talált, mint például a textilkikészítés, mosószerek előállítása. A lúg termelés a molekulatömegek arányában 1,128 tonna NaOH / tonna Cl 2. A lúg általában 50%-os oldat formájában képződik, egyszerűen tárolható és szállítható is. Fontosabb felhasználási területei a következők: - szerves és szervetlen anyagok szintézise, - metallurgiai eljárások, alumíniumipar, - cellulóz és papíripar, - textilipar, - szappan és mosószergyártás, - vízkezelés, - fogyasztási cikkek. A hidrogén szintén a klór gyártás mellékterméke, 28 kg keletkezik 1 tonna klór előállításánál. Felhasználása lehet tüzelőanyagként, nagyobb vegyi üzemekben hidrogénezési reakciókhoz, metanol, ammónia szintézishez, sósav, hidrogénperoxid előállításához. Dr. Pátzay György 2
3 Eljárások A klór előállítására szolgáló három eljárás (higanyos, diafragmás, membrános) elsősorban abban különbözik egymástól, hogy miképpen oldják meg az anódon keletkező klór és a katódon képződő lúg és hidrogén elválasztását. A NaCl oldat elektrolízisének alapelve a következő: - az anódon a klorid ionok oxidálódnak és klórt adnak, NaCl Na + + Cl - 2 Cl - (old) Cl 2 (g) + 2 e - - a katódon a higanyos eljárásnál nátrium/higany amalgám képződik, amiből a bontóban vízzel hidrogén és NaOH keletkezik, a membrános és diafragmás cellákban vízbontás megy végbe hidrogén és OH - ionok képződése mellett. 2 Na + (old) +2 H 2 O + 2e - H 2 (g) + 2 Na + (old) + 2 OH - (old) Dr. Pátzay György 3
4 Higanyos elektrolizáló és bontó cella elvi működése A higanyos cella működése azon alapul, hogy a hidrogén túlfeszültsége nagy a higanyon, ezért a nátrium válik le. A sóban lévő szennyezések (pl. V) csökkenthetik ezt a túlfeszültséget, emiatt hidrogén válhat le a Hg katódon és bejuthat a klórgázba. Ez veszélyes, mert a hidrogén a klórral is, ugyanúgy mint az oxigénnel, már 4%-os mennyiségben robbanó elegyet alkot. Dr. Pátzay György 4
5 Higanykatódos NaCl elektrolízis A) Hg cella: a) Hg bevezetés; b) Anódok; c) végrekesz; d) mosórekesz B) Vízszintes bontó: e) Hidrogén gáz hűtő; f) Grafit lemezek; g) Hg szivattyú C) Függőleges bontó: e) Hidrogén gáz ; g) Hg szivattyú; h) Hg elosztó; i) Tömítés szorító rugók Dr. Pátzay György 5
6 Higanykatódos NaCl elektrolízis Az elektrolizáló cellában titán fémanódok sűrűn helyezkednek el. A telített sóoldat és a higany a kamra vékonyabb oldalán lép be, a higany a katód. A keletkezett klórgáz kibuborékol és elvezetik. A keletkezett fém nátrium híg amalgámot képez a higannyal és a keletkezett hidrogén is az amalgámba kerül. A bontócellába jutó higany-amalgám grafit katalizátorokon hígítóvíz hatására elbomlik és a fém nátrium reagálva a vízzel NaOH-t és H 2 -t szolgáltat. Dr. Pátzay György 6
7 A higanykatódos elektrolízis sémája Dr. Pátzay György 7
8 a) Perforált acél tartó; b) Katód; c) Azbeszt diafragma (újabban PTFE(politetrafluoroetilén); d) DSA anód; e) Cu tartólemez; f) Titán tartólemez Diafragmás NaCl elektrolízis DSA dimensionally stable anode Dr. Pátzay György 8
9 Diafragmás NaCl elektrolízis Telített sóoldat lép be az anódtérnél, áthalad a diafragmán és felhígulva NaOH-val keverten lép ki a katódtérnél Klórgáz képződik az anódtérben, hidrogénház a katódtérben. Az áramlás miatt a H 2 gáz nem tud átmenni az anódtérbe és a hidroxid nem jut át az anódtérbe Az NaOH-t a NaCl-től bepárlással választják el (az NaOH ldhatósága sokkal nagyobb!) Dr. Pátzay György 9
10 Membrános NaCl elektrolízis Ennél az eljárásnál az anódot és a katódot vízzáró, ionvezető membrán választja el, a sóoldat az anódtérben áramlik, ahol a klorid ionok klórrá oxidálódnak. A nátrium ionok a membránon átjutva a katódtérbe kerülnek, ahol lúgoldat áramlik. Ide vezetik be az ionmentes vizet, amiből hidrogén és hidroxil ionok lesznek, ez utóbbiak a nátrium ionokkal 32-35%-os töménységű lúgot adnak. A kimerült sóoldatot szilárd NaCl hozzáadásával, a lúgoldatot bepárlással töményítik. A katód anyaga nikkel vagy saválló acél, felületén katalitikus hatású bevonattal, mint például Ni-NiO. Az anód a már ismertetett Ti nemesfémoxid bevonattal. A membrán anyaga perfluorozott polimer, amin karboxil csoportok vannak a katódos oldali rétegben, míg az anódos oldalon szulfonsav csoportokat építenek a polimer rétegbe, a membránt teflon szálakkal erősítik. Élettartamuk 2-5 év közötti. Dr. Pátzay György 10
11 Membrános NaCl elektrolízis Az ioncserélő membrán lehetővé teszi az anódtérbe befolyó sóoldatból a Na + ionok és egy kevés víz katódtérbe jutását, de a klorid ionok és a klórgáz nem jut át a membránon. A katódtérben keletkező OH - ionok sem jutnak át az anódtérbe. Az anódtérben klórgáz, a katódtérben hidrogéngáz keletkezik. A telített sóoldat az anódtérbe alul lép be és a felhígult oldat felül lép ki. A membrán eltömődésének megakadályozására a Ca 2+ és Mg 2+ lecsapják, szűrik és kationcserével tisztítják. Dr. Pátzay György 11
12 Elektrokémiai reakciók a higanykatódos eljárásban [1] 2Cl - ==> Cl 2 + 2e - (anódos reakció) [2] 2Na + + 2Hg + 2e - ==> 2Na (Hg-ban) (katódos reakció) [3] 2Cl - + 2Na + + 2Hg ==> Cl 2 + 2Na (Hg-ban) (összesített cella reakció) [4] 2Na (Hg-ban) + 2H 2 O ==> H 2 +2NaOH + Hg (bontási reakció) [5] 2NaCl + 2H 2 O ==> Cl 2 +2NaOH + H 2 (összesített folyamat reakció) Elektrokémiai reakciók a membrános és diafragmás eljárásokban 1] 2Cl - ==> Cl 2 + 2e - (anódos reakció) [6] 2H 2 O + 2e - ==> 2OH - + H 2 (katódos reakció) [7] 2Cl - + 2H 2 O ==> Cl 2 + H 2 + 2OH - (összesített ionos reakció) [5] 2NaCl + 2H 2 O ==> Cl 2 +2NaOH + H 2 (összesített reakció) [8] Cl 2 + 2NaOH ==> NaOCl + NaCl + H 2 O (mellék reakció) [9] 3NaOCl ==> NaClO 3 + 2NaCl (mellék reakció) Dr. Pátzay György 12
13 Elektrolízis technológiák értékelése Folyamat Előnyök Hátrányok Diafragmás 50% Bányászati sóoldat használata, kis elektromos energia fogyasztás Azbeszt használata, nagy gőzfogyasztás a lúg betöményítésnél, gyenge lúg és klór minőség, érzékeny a nyomásváltozásra Higanyos 20% 50 % -os lúg közvetlenül a cellákból, tiszta klór és hidrogén, egyszerű sóoldat tisztítás Higany használat, szilárd só használata szükséges, drága cella működtetés, drága környezetvédelem, nagy területigény Membrános 30% Kis teljes energia igény, kis beruházási költség, olcsó cella működtetés, tiszta lúg, kis érzékenység a cella terhelés változásra és leállásra, javítások várhatóak Szilárd só használata, tiszta sóoldat kell, nagy a klór oxigéntartalma, drágák a membránok Dr. Pátzay György 13
14 Higanyos Diafragma Membrán Aramsűrűség ( ka/m 2 ) Cella feszültség (V) NaOH koncentráció (wt%) Energia fogyasztás ( kwh/mt Cl 2 ) adott áramsűrűségnél (ka/m 2 ) Gőz felhasználás (kwh/mt Cl 2 ) 50%-os NaOH előállításánál 3360 (10) 2720 (1.7) 2650 (5) kg klórgáz termelés mellett 1128kg 100%-os NaOH és 28 kg hidrogén keletkezik Alkáli-klorid elektrolízis hazánkban A Borsodchem üzemeiben működik klór gyár alkáli klorid elektrolízis higanykatódos De-Nora és membráncellás Japán Chlorine Engineers technológiák Dr. Pátzay György 14
15 Vasércek összetétele: vaskarbonát, vas II és vas III oxidok, vasszulfid Kohósítás: indirekt és direkt redukció ( fok) ( fok) FeO + CO = Fe + CO 2 FeO + C = Fe + CO Alapanyagok: vasérc, koksz, salakképzők (CaO, szilikátok, aluminátok) nyersvas Acélgyártás: szennyezések (C, Si, S, P) eltávolítása a nyersvasból oxidációval, levegővel vagy oxigénnel Elektroacél gyártás Ötvözött acélok (Ni, Cr-korrózióálló) Dr. Pátzay György 15
16 Magyarország kohászatának nyersanyagellátását csak kis részben lehet hazai forrásból fedezni, ezért a kohászat ellátása csak import segítségével oldható meg. Az ország egyetlen vasércbányája Rudabányán volt, 1986-ban megszüntették. A magyar vaskohók kizárólag külföldi vasércet dolgoznak fel. A vasérc nagy részét Ukrajnából importáljuk. A Dunai Vasmű kokszolója a kohókoksz 1/3-át komlói feketekőszénből képes fedezni. A kohókoksz nagyobb részét importból biztosítják. Az acélgyártás legfontosabb ötvözőféme a mangán, amelynek ércét a Bakonyban, Úrkút közelében bányásszák. Az érc egy részét exportálják. Az acélgyártáshoz szükséges hulladékvas nagy részét belföldi források fedezik. Az acélgyárak pakurát és földgázt használnak fűtőanyagként. A mészkő iránti szükségletet a belföldi bányák korlátlanul ki tudják elégíteni. Az 1990-es években megszűnt a nyersvasgyártás Ózdon és Diósgyőrben (nagyolvasztó már csak Dunaújvárosban üzemel), és lebontották a Siemens-Martin-kemencéket is. Ózdon miniacélmű létesült, az utolsó években a diósgyőri kohászat megszűnéséig Diósgyőrben acélt pedig már csak elektrokemencében gyártottak. Dr. Pátzay György 16
17 Termékek Dr. Pátzay György 17
18 Dr. Pátzay György 18
19 o C a szabad és kötött vizek eltávoznak o C karbonátok bomlanak, indirekt redukció 3Fe 2 O 3 + CO 2 Fe 3 O 4 + CO 2 Fe 3 O 4 + CO 3 FeO + CO 2 FeO + CO Fe + CO o C 2 CO C + CO2 750 o C direkt redukció 3Fe 2 O 3 + C 2 Fe 3 O 4 + CO Fe 3 O 4 + C 3 FeO + CO FeO + C Fe + CO 900 o C egyéb vegyületek redukciója FeSiO C Fe + Si + 3 CO SiO C si + 2 CO MnO + C Mn + CO P 2 O C 2 P + 5 CO redukáló anyagok keletkezése vas-oxid redukció salak képződése Dr. Pátzay György 19
20 Dr. Pátzay György 20
21 Nyersvas C c 1,7% Acél C c 1,7 % Fehér Szürke C c 1-2 % C c 2% C tartalom Fe 3 C grafit Nem forgácsolható nem kovácsolható nem kovácsolható Öntöttvas termékek acélgyártás Szénacélok Kemény acélok C c 0,5-1,7 % Közép kemény acélok C c 0,2-0.5 % Lágy acélok C c 0.2 % Speciális-, nemesacélok Lágyacél + fémes ötvözők Dr. Pátzay György 21
22 Acélgyártás Acél képződése A C tartalom csökkentése, eltávolítása CO formájában, a Si, Mn és P tartalom reagál a salakképzővel. Típusai - Siemens-Martin az oxidációt ócskavas végzi, salakképző kalcium-oxid, hőntartás gázlánggal - Konverteres acélgyártás: Bessemer: oxidáló ágens az átbuborékoltatott oxigén, bélés savanyú, csak alacsony foszfortartalmú nyersvas dolgozható fel. Thomas: a bélés bázikus (dolomit), magas foszfortartalmú nyersvas is feldolgozható LD konverter: oxigén ráfúvatás A konverterekben a Si, P, C, Mn oxidációjának reakcióhője emeli a hőmérsékletet és tartja olvadt állapotban az acélt. - Elektroacél: az oxidációt elektromos ívvel végzik Dr. Pátzay György 22
23 A vas és acélgyártás folyamata a) Tablettázó; b) Szinterező; c) Kokszoló; d) Nagyolvasztó; e) Torpedó kanál; f) Buga öntő; g) Alap oxigénes konverter; h) Siemens Martin kemence; i) Elektromos ív kemence; j) Folyamatos öntés; k) Nedves akna; l) Buga öntés; m) Hengerdébe; n) Szállításhoz Dr. Pátzay György 23
24 Dr. Pátzay György 24
25 Oxigénes konverter A mészkövet, nyersvasat és acélhulladék keveréket nagynyomású oxigénnel kezelik. Az oxigén eltávolítja a szennyező anyagokat oxidok (CO 2, SO 2 ), vagy salak [MnSiO 3, Ca 3 (PO 4 ) 2 ] formájában. Dr. Pátzay György 25
26 Dr. Pátzay György 26
27 Dr. Pátzay György 27
28 Dr. Pátzay György 28
29 Dr. Pátzay György 29
30 A világ acéltermelése és az ahhoz használt nyersanyagok Nyersvas, vashulladék, direkt redukált vas Scrap-vashulladék DRI-direkt redukált vas (90-97%Fe) Dr. Pátzay György 30
31 Acélgyártás 2006 Termelés Megoszlás Kumulatív BOF acél EAF acél OHF acél termelés % % % Mt/év % % Kína Japán USA Orosz o Korea közt Német o India Ukrajna Olasz o Brazília Egyéb Összesen BOF-oxigénes konverter, EAF-ívkemence, OHF-Siemens-Martin Dr. Pátzay György 31
32 A Föld gyakori eleme az alumínium (~8%), a földkéregben oxid formában (Al 2 O 3 ) bauxit, kaolinit, nefelin és alunit ásványként fordul elő. Dr. Pátzay György 32
33
34 Alumínium gyártás Bauxit feltárással timföld, alumíniumoxid Bayer eljárás lúgos oldás, majd Al(OH) 3 kristályosítás Al 2 O 3 + 2NaOH + 3H 2 O 2NaAl(OH) 4 Alumíniumoxid elektrolízise fém alumíniummá redukálják többkomponensű elektrolitban (Na 3 AlF 6, CaF 2, AlF 3, LiF, MgF 2 ) Az Al nem korrodeál levegőn, mert stabil oxidréteg képződik a felületén Ötvözeteit használják: Mg, Zn, Cu Dr. Pátzay György 34
35 Bayer eljárás timföld előállítására Dr. Pátzay György 35
36 Dr. Pátzay György 36
37 A timföldgyártás folyamata Dr. Pátzay György 37
38 Timföld előállítása Bayer eljárással Kioldás A finomra őrölt bauxitot autoklávokban tömény NaOH oldattal tárják fel magas hőmérsékleten NaOH oldatban g /l Na 2 O van Az autoklávok nyomása 5-30 atm Hőmérséklet az autoklávokban C Az aluminium AlO 2 - anion formában oldódik Vas-hidroxid, TiO 2 és más szennyezők nem oldódnak Szilícium-dioxid oldódik, majd a nátriummal kicsapódik és az aluminát ionnal nátrium-alumínium-szilikátokat képez Dr. Pátzay György 38
39 Szilárd-folyadék elválasztás/al(oh) 3 kicsapatása Miután az oldat alumínium-hidroxidra telítetté válik az oldhatatlan részeket ülepítéssel, mosással, szűréssel választják el A visszamaradt oldatot hűtik és vízzel hígítják A hőmérséklet csökkentésével és a ph-val optimális feltételt biztosítanak az Al(OH) 3 kristályosodására. Oltókristályok adagolásával növelik a kristályosodás sebességét szobahőmérsékleten. A kivált hidroxid kristályok ülepítéssel, mosással, szűréssel választják el. A hidroxidot Al(OH) 3 kalcinálják ~ 1200 C-on 99.5% Al 2 O 3 előállítására. Dr. Pátzay György 39
40 Dr. Pátzay György 40
41 Alumínium elektrolízis Hall Héroult cella Söderberg anóddal szerelt cella Önsülő elektród, folyamatosan keletkezik Dr. Pátzay György 41
42 Söderberg (önsülő anódos) elektrolizálókád Dr. Pátzay György 42
43 Primer alumínium termelés-2006 Termelés Megoszlás Kumulált megoszlás Mt/év % % Kína Orosz o Kanada USA Ausztrália Brazília Norvégia India Dél-Afrika Bahrain Dubai Venezuela Mozambik Német o Tadzsikisztán Izland Egyéb Összesen Dr. Pátzay György 43
44 Alumínium gyártás hazánkban Bauxitbányászat: két nagy területre összpontosul. - Móri-árok és a Bakony találkozása, ahol Iszkaszentgyörgy körzetében működnek kizárólag mélyművelésű bányák. - Dél-Bakonyban Halimba-Nyirád-Szőc térsége, ahol mélyművelésű és külszíni fejtéses bányák egyaránt találhatók. A Bakony északi részén, Fenyőfőn is folyik bauxitbányászat. Magyarországon a bauxitbányászat környezeti ártalmakat okoz. A karsztvíz a bauxitrétegekkel gyakran egy szinten van, így a biztonságos bányászat érdekében a vizet ki kell szivattyúzni, ami gyakran apasztja a térség vízforrásait. Timföldgyártás: három telephelye van. A legnagyobb termelési kapacitás Ajkán van, ahol két gyár is működik. A bauxitot a közeli, dél-bakonyi bauxitbányák, a hőenergiát az ajkai hőerőmű hulladékgőze szolgáltatja. A víz forrása a bauxitbányászat karsztvize. Almásfüzítőn a timföldgyár a Dunát használja ipari víz forrásnak, a bauxitellátást nagy részét a Fejér megyei bányák fedezik. A legkisebb timföldgyár Mosonmagyaróváron működik. A vizet itt is a Duna szolgáltatja. Melléktermékként a bauxitból vanádiumot (V2O5) állítanak elő. Alumíniumkohászat: három üzeme van. A nagy villamosenergia felhasználás miatt mindegyik erőmű mellé települt. A legnagyobb kohó Várpalotán működik, a helyi lignitre települt erőmű áramát használja. A tatabányai kohó a tatabányai szénmedence szenét felhasználó erőmű energiájával működik. Ajkán a kohó az ajkai hőerőmű villamos energiáját használja. Az ajkai telepítés optimális, mert helyben van a szén, a timföld, az ipari víz, és a kombináthoz egy nagy kapacitású alumíniumöntöde is kapcsolódik. A szénnel termelt elektromos energia magas ára miatt a hazai alumíniumkohászat gazdaságtalan, Ajkán és Tatbányán már megszűnt. A bauxitot és timföldet Oroszországba és Ukrajnába exportáljuk, és az ott olcsó, vízerőművekben termelt elektromos energiával kohósított kész fémtömbök egy részét visszavásároljuk. Így, még a nagy szállítási költségek ellenére is olcsóbban jutunk alumíniumhoz. Ez után az alumíniumból félkész terméket állítanak elő a hengerművekben. Székesfehérváron nagy kapacitású henger-, prés- és huzalmű működik, Európa alumíniumiparában számottevő méretet képvisel. Budapesten két alumínium-hengermű található: az egyik a Csepel Művek keretében, a másik Kőbányán, melynek fő terméke a fólia (élelmiszer-csomagolás számára). Dr. Pátzay György 44
45 Az alumíniumkohászat környezetterhelése Levegőszennyezés - diffúz - pontszerű Légszennyező anyagok - timföldpor, AlF 3 - CO, CO 2, SO 2 az anód égéséből - HF, AlF 3 + H 2 O = HF + Al 2 O 3 - PAH vegyületek, az anód kötőanyagból - CF 4, C 2 F 6 Dr. Pátzay György 45
46 Üvegházhatású gázképződés átlag= 1.9 Elektromos energia 15.6 MWh/t Al t CO 2 /t Al átlag = 5.8 Al termelésre t CO 2 eq/t Al Gázok adagoló Anód elektrolit Al olvadék katód PFC képződés t CO 2 eq/t Al átlag= 1.26 Anódszén t CO 2 eq/t Al átlag = 2.0 GHG képződés az Al termelésnél Két PFC (perfluorokarbon vegyület - CF 4 és C 2 F 6 ) a primer Al termelés GHG kibocsátásának ~40%át teszi ki. Dr. Pátzay György 46
47 Vörösiszap Nagy fajlagos felületű, tixotróp anyag Fő komponensei: % Al 2 O 3, % Fe 2 O 3,9-15 % SiO 2, 4-6 % TiO 2, 8-12 % Na 2 O, 0,3-1 % MgO, 0,5-3,5 % CaO, 0,2-0,3 % V 2 O 5 Elvi felhasználási lehetőségek: - ülepítőszer gyártása vízderítési célokra, - téglagyártáshoz adalékanyag, - bitumenes masszákba útépítési célokra, - vaskohászati alapanyag. Dr. Pátzay György 47
48 Környezeti hatások, amelyek elsősorban az anyagok felületét érintik, ezáltal használhatóságukat rontják. A fémeket érintő hatások nagy része elektrokémiai eredetű. Dr. Pátzay György 48
49 A korrózió típusai A kárt okozó folyamat jellege szerint beszélhetünk: kémiai korrózióról elektrokémiai korrózióról átmeneti vagy vegyes korrózióról fizikai korrózióról. A kémiai korróziós folyamatban az elektronátlépéssel járó egyidejű oxidációs és redukciós folyamat térben nem elkülönülve, molekuláris méreten belül játszódik le. Ilyen kémiai korróziós folyamat a nedvesség hiányában bekövetkező vasfelület oxidációja, revésedése. Elektrokémiai korróziós folyamatról beszélünk, ha az elektronátlépéssel járó egyidejű oxidációs és redukciós folyamat térben elkülönülve, molekuláris méreten kívül játszódik le. Ilyen elektrokémiai korróziós folyamat a vas víz jelenlétében bekövetkező rozsdásodása, mely során lokális galvánelem jön létre, a lokális anódon a vas oxidálódik és 2 elekront hátrahagyva Fe 2+ ionként oldatba megy, míg a tőle molekuláris méretnél nagyobb távolságra lévő lokális katódon redukciós folyamat játszódik le, azaz a vas által leadott 2 elektron a fémben a lokális katódhoz vándorol és ott a vízzel és a benne oldott oxigénnel hidroxid ionokat képez. Savas oldat esetén a vízben lévő hidrogén ionok veszik fel az elektronokat és hidrogén gáz képződik. Dr. Pátzay György 49
50 Az átmeneti korrózió tipikus példája a fémek oldódása savakban, vagy lúgokban. A fémek oldódása átmenetet képez a kémiai és az elektrokémiai korrózió között. A fémion és az elektron, térben nem elválasztva, külön részfolyamatban lép ki a fémes rácsból. A termék, az ion viszont kilép, és oldatba megy át. Végül fizikai a korróziós folyamat, ha a felületről kiinduló károsodást fizikai folyamat okozza. Tipikus fizikai korrózió a szelepekben lévő gumimembránokban létrejövő üregek, melyek az enyhén nyitott szelepek esetén a létrejövő résen nagysebességgel átfolyó vízsugár által létrehozott vákuum (Bernoulli törvény) által a felületről leszakított gumidarabok révén keletkeztek. De fizikai jellegű károsodás a csővezetékek íves szakaszain az áramló folyadékban lévő homokszemcsék által okozott eróziós kopás is. Dr. Pátzay György 50
51 Redox elektródra a Nernst egyenlet: Galvánelem és korróziós elem összehasonlítása A) Galvánelem; B) korróziós elem a) Anód; b) Katód Anódos folyamat: M M e (fémoldódás) Katódos folyamat: 2 H + +2 e H 2 (hidrogénfejlődés) Dr. Pátzay György 51
52 Egy sós víz cseppben lejátszódó korróziós folyamat a) Levegő; b) Sós víz csepp; c) Rozsda gyűrű; d) Vas; e) Katódos oxigén redukció ½ O 2 + H 2 O + 2 e 2 OH ; f) Anódos fém oldódás Fe Fe e Dr. Pátzay György 52
53 Mikroszkópikus cella a fém felületen Fém oldódás (korrózió) az anódon Elektrolit (víz) Fe 2+ Anode Anód H H + + e - H + +e - H Cathode Katód Elektronok felhasználása a katódon Acél felület e Dr. Pátzay György 53
54 Különböző oldott oxigéntartalmú víz korróziós hatása Dr. Pátzay György 54
55 Az acél korróziós sebessége az oldott O 2 és a ph függvényében 25 C-on Dr. Pátzay György 55
56 Pourbaix diagram rézre híg vizes oldatban, szobahőmérsékleten Pourbaix diagram alumíniumra, hidrargillite oxid film jelenlétében (Al 2 O 3 3H 2 O) at 25 C Dr. Pátzay György 56
57 Az anódos és katódos részreakciókból összeadódó áramsűrűség-potenciál görbe = részáramgörbék; = összegzett áram görbe; U corr = korróziós potenciál Dr. Pátzay György 57
58 A korróziós áram erősségének meghatározása i corr a) A katódos reakció túlfeszültség görbéje; b) Az anódos reakció túlfeszültség görbéje; c) Az a görbe tükrözése Dr. Pátzay György 58
59 A korrózió típusai Dr. Pátzay György 59
60 Dr. Pátzay György 60
61 Fémes anyagok működés közbeni károsodásai Dr. Pátzay György 61
62 a, bevonatos korrózióvédelem Fém bevonatok Szervetlen nemfémes bevonatok Zománc Kerámia Termikus szórt bevonatok Szerves bevonatok Gumi borítás Gumi-műanyag kompozit bevonatok Hőre térhálósodó műanyag bevonatok Katalizátorral, hőre térhálósodó műanyag bevonatok Hőre lágyuló festék és por bevonatok Inhibítorok Dr. Pátzay György 62
63 Dr. Pátzay György 63
64 Dr. Pátzay György 64
65 Korróziós sebességek korróziós ellenállás Korr. ellenállás mpy mm/y mm/y nm/h pm/s Extrém <1 <0.02 <25 <2 <1 Kiválló Jó Megfelelő Gyenge Elfogadhatatlan >200 >5 >5000 >500 >200 mpy milli inch (mils) per year mdd - mg/(dm 2.day) Dr. Pátzay György 65
66 Korróziós sebesség- Faraday törvény Általános felületi korrózió esetén a korrózió sebességét tömegveszteséggel ( mg dm -2 day -1, mdd) vagy a behatolás mélységével mm year -1, mpy adhatjuk meg. Az átlagos korróziós áramból vagy áramsűrűségből (i corr I corr /A) a tömegveszteség ( m) állandó I corr áramerősség mellett: Az átlagos behatolás mélysége x/t a fém sűrűsége alapján számítható: F n M i A F n M I At m F n t I M m corr és átrendezve (A) l felületéve az elektród vagy osztva F n M i F n A M I t x F n M t I A x m Dr. Pátzay György 66
67 Számítási példa Vizsgáljuk például egy acél csővezeték korrózióját savas oldat hatására. Mekkora a korróziós sebesség, ha az állandó korróziós áramsűrűség 0,1 ma cm -2? M Fe =55.85, Fe =7.86 g cm -3, n=2, F=96500 As m A t i M n F A/ dm 55850mg mg /( day. dm ) As /86400s / day x t i M n F A/ mm 55.85g 3 g / mm As y / s 1.16mm/ y Ez egy elég nagy korróziós sebesség! Dr. Pátzay György 67
68 Pilling-Bedworth arány Dr. Pátzay György 68
69 Cink korróziós sebessége különböző anódos felületek esetén 1. Kis cink felület (1 cm 2 és nagy réz felület (100 cm 2 ): 2. Nagy cink felület (100 cm 2 ) és kis réz felület (1 cm 2 ): A cink korróziós sebessége jelentősen lecsökken ha az anód felület sokkal nagyobb, mint a katódé. Dr. Pátzay György 69
70 Korróziós veszély csökkentése Dr. Pátzay György 70
71 Dr. Pátzay György 71
72 Anódos védelem egy lúgbepárlón (térfogat 115 m 3, felület 2400 m 2 ) feszültség korróziós törés ellen a) PTFE; b) Katód; c) Anód; d) központi cső e) Folyadék betáp; f ) Gyűrű elektród; g) Szigetelés; h) Keverő; i) Potenciosztát; j) Elektród E 2 ; k) Forrcsövek; l) Elektród E 1 ; m) Töltési szint Dr. Pátzay György 72
Klór és nátriumhidroxid előállítása Tungler Antal emeritus professor
 Klór és nátriumhidroxid előállítása Tungler Antal emeritus professor Cruickshank már 1800-ban előállította a klórt elektrolízissel, mégis ipari eljárássá akkor vált, amikor kidolgozták a szintetikus grafit
Klór és nátriumhidroxid előállítása Tungler Antal emeritus professor Cruickshank már 1800-ban előállította a klórt elektrolízissel, mégis ipari eljárássá akkor vált, amikor kidolgozták a szintetikus grafit
Klór alkáli elektrolízis
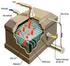 Cruickshank már 1800-ban előállította a klórt elektrolízissel, mégis ipari eljárássá akkor vált, amikor kidolgozták a szintetikus grafit anódot és rendelkezésre állt a szükséges elektromos áram. Az 1800-as
Cruickshank már 1800-ban előállította a klórt elektrolízissel, mégis ipari eljárássá akkor vált, amikor kidolgozták a szintetikus grafit anódot és rendelkezésre állt a szükséges elektromos áram. Az 1800-as
Kémiai energia - elektromos energia
 Általános és szervetlen kémia 12. hét Elızı héten elsajátítottuk, hogy a redoxi reakciók lejátszódásának milyen feltételei vannak a galvánelemek hogyan mőködnek Mai témakörök az elektrolízis és alkalmazása
Általános és szervetlen kémia 12. hét Elızı héten elsajátítottuk, hogy a redoxi reakciók lejátszódásának milyen feltételei vannak a galvánelemek hogyan mőködnek Mai témakörök az elektrolízis és alkalmazása
13 Elektrokémia. Elektrokémia Dia 1 /52
 13 Elektrokémia 13-1 Elektródpotenciálok mérése 13-2 Standard elektródpotenciálok 13-3 E cella, ΔG és K eq 13-4 E cella koncentráció függése 13-5 Elemek: áramtermelés kémiai reakciókkal 13-6 Korrózió:
13 Elektrokémia 13-1 Elektródpotenciálok mérése 13-2 Standard elektródpotenciálok 13-3 E cella, ΔG és K eq 13-4 E cella koncentráció függése 13-5 Elemek: áramtermelés kémiai reakciókkal 13-6 Korrózió:
Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei
 Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Gazdálkodási modul Gazdaságtudományi ismeretek I. Közgazdasá Adatgyűjtés, mérési alapok, a környezetgazdálkodás fontosabb műszerei KÖRNYEZETGAZDÁLKODÁSI
Általános Kémia, 2008 tavasz
 9 Elektrokémia 9-1 Elektródpotenciálok mérése 9-1 Elektródpotenciálok mérése 9-2 Standard elektródpotenciálok 9-3 E cell, ΔG, és K eq 9-4 E cell koncentráció függése 9-5 Elemek: áramtermelés kémiai reakciókkal
9 Elektrokémia 9-1 Elektródpotenciálok mérése 9-1 Elektródpotenciálok mérése 9-2 Standard elektródpotenciálok 9-3 E cell, ΔG, és K eq 9-4 E cell koncentráció függése 9-5 Elemek: áramtermelés kémiai reakciókkal
7 Elektrokémia. 7-1 Elektródpotenciálok mérése
 7 Elektrokémia 7-1 Elektródpotenciálok mérése 7-2 Standard elektródpotenciálok 7-3 E cell, ΔG, és K eq 7-4 E cell koncentráció függése 7-5 Elemek: áramtermelés kémiai reakciókkal 7-6 Korrózió: nem kívánt
7 Elektrokémia 7-1 Elektródpotenciálok mérése 7-2 Standard elektródpotenciálok 7-3 E cell, ΔG, és K eq 7-4 E cell koncentráció függése 7-5 Elemek: áramtermelés kémiai reakciókkal 7-6 Korrózió: nem kívánt
1. feladat Összesen: 8 pont. 2. feladat Összesen: 11 pont. 3. feladat Összesen: 7 pont. 4. feladat Összesen: 14 pont
 1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
1. feladat Összesen: 8 pont 150 gramm vízmentes nátrium-karbonátból 30 dm 3 standard nyomású, és 25 C hőmérsékletű szén-dioxid gáz fejlődött 1800 cm 3 sósav hatására. A) Írja fel a lejátszódó folyamat
ÉRCEK ércnek ércásványok
 ÉRCEK Minden olyan kőzetet ércnek nevezünk, melyből azadottkor technológiai szintjén gazdaságosan fémet nyerhetünk ki. Az érc azon komponensei, melyek az adott fémet (fémeket) tartalmazzák az ércásványok.
ÉRCEK Minden olyan kőzetet ércnek nevezünk, melyből azadottkor technológiai szintjén gazdaságosan fémet nyerhetünk ki. Az érc azon komponensei, melyek az adott fémet (fémeket) tartalmazzák az ércásványok.
T I T - M T T. Hevesy György Kémiaverseny. A megyei forduló feladatlapja. 8. osztály. A versenyző jeligéje:... Megye:...
 T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 8. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
T I T - M T T Hevesy György Kémiaverseny A megyei forduló feladatlapja 8. osztály A versenyző jeligéje:... Megye:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:... pont 4. feladat:...
SZERVETLEN KÉMIAI REAKCIÓEGYENLETEK
 SZERVETLEN KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Zárójel jelzi a reakciót, ami más témakörnél található meg. REAKCIÓK FÉMEKKEL fém
SZERVETLEN KÉMIAI REAKCIÓEGYENLETEK Budapesti Reáltanoda Fontos! Sok reakcióegyenlet több témakörhöz is hozzátartozik. Zárójel jelzi a reakciót, ami más témakörnél található meg. REAKCIÓK FÉMEKKEL fém
ELEKTROKÉMIA. - elektrolitokban: ionok irányított mozgása. Elektrolízis: elektromos áram által előidézett kémiai átalakulás
 Elekrtokémia 1 ELEKTROKÉMIA Elektromos áram: - fémekben: elektronok áramlása - elektrolitokban: ionok irányított mozgása Elektrolízis: elektromos áram által előidézett kémiai átalakulás Galvánelem: elektromos
Elekrtokémia 1 ELEKTROKÉMIA Elektromos áram: - fémekben: elektronok áramlása - elektrolitokban: ionok irányított mozgása Elektrolízis: elektromos áram által előidézett kémiai átalakulás Galvánelem: elektromos
Minta feladatsor. Az ion neve. Az ion képlete O 4. Szulfátion O 3. Alumíniumion S 2 CHH 3 COO. Króm(III)ion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve.. Szulfátion
Áramforrások. Másodlagos cella: Használat előtt fel kell tölteni. Használat előtt van a rendszer egyensúlyban. Újratölthető.
 Áramforrások Elsődleges cella: áramot termel kémiai anyagokból, melyek a cellába vannak bezárva. Ha a reakció elérte az egyensúlyt, kimerül. Nem tölthető. Másodlagos cella: Használat előtt fel kell tölteni.
Áramforrások Elsődleges cella: áramot termel kémiai anyagokból, melyek a cellába vannak bezárva. Ha a reakció elérte az egyensúlyt, kimerül. Nem tölthető. Másodlagos cella: Használat előtt fel kell tölteni.
6. változat. 3. Jelöld meg a nem molekuláris szerkezetű anyagot! A SO 2 ; Б C 6 H 12 O 6 ; В NaBr; Г CO 2.
 6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
6. változat Az 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Jelöld meg azt a sort, amely helyesen
1. feladat Összesen 10 pont. 2. feladat Összesen 10 pont
 1. feladat Összesen 10 pont Töltse ki a táblázatot oxigéntartalmú szerves vegyületek jellemzőivel! Tulajdonság Egy hidroxil csoportot tartalmaz, moláris tömege 46 g/mol. Vizes oldatát ételek savanyítására
1. feladat Összesen 10 pont Töltse ki a táblázatot oxigéntartalmú szerves vegyületek jellemzőivel! Tulajdonság Egy hidroxil csoportot tartalmaz, moláris tömege 46 g/mol. Vizes oldatát ételek savanyítására
A ferrát-technológia klórozással szembeni előnyei a kommunális szennyvizek utókezelésekor
 A ferrát-technológia klórozással szembeni előnyei a kommunális szennyvizek utókezelésekor Gombos Erzsébet PhD hallgató ELTE TTK Környezettudományi Kooperációs Kutató Központ Környezettudományi Doktori
A ferrát-technológia klórozással szembeni előnyei a kommunális szennyvizek utókezelésekor Gombos Erzsébet PhD hallgató ELTE TTK Környezettudományi Kooperációs Kutató Központ Környezettudományi Doktori
Sav bázis egyensúlyok vizes oldatban
 Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
Sav bázis egyensúlyok vizes oldatban Disszociációs egyensúlyi állandó HAc H + + Ac - ecetsav disszociációja [H + ] [Ac - ] K sav = [HAc] NH 4 OH NH 4 + + OH - [NH + 4 ] [OH - ] K bázis = [ NH 4 OH] Ammóniumhidroxid
Fémek. Fémfeldolgozás - Alumínium
 Fémek Fémfeldolgozás - Alumínium Felosztás - Vas - Nemvasfémek Nemvasfémek: - könnyűfémek (Al, Mg, Be, Ti) ρ < 5000kg / m3 - színesfémek (Cu, Pb, Sb, Zn) - nemesfémek (Au, Ag, Pt) Előfordulás - Elemi állapotban
Fémek Fémfeldolgozás - Alumínium Felosztás - Vas - Nemvasfémek Nemvasfémek: - könnyűfémek (Al, Mg, Be, Ti) ρ < 5000kg / m3 - színesfémek (Cu, Pb, Sb, Zn) - nemesfémek (Au, Ag, Pt) Előfordulás - Elemi állapotban
Fémkohászat. Vas- és acél gyártás Alumínium gyártás Réz- és szinesfém kohászat
 Fémkohászat Vas- és acél gyártás Alumínium gyártás Réz- és szinesfém kohászat A fémkohászat főbb folyamatai Érc előkészítés (törés, őrlés, szétválasztás) Nyers fém kinyerése A nyers fém finomítása Ötvözés
Fémkohászat Vas- és acél gyártás Alumínium gyártás Réz- és szinesfém kohászat A fémkohászat főbb folyamatai Érc előkészítés (törés, őrlés, szétválasztás) Nyers fém kinyerése A nyers fém finomítása Ötvözés
Magyarország gazdasága I.
 Magyarország gazdasága I. Magyarország ipari-agrár ország. Egy főre jutó GNI: 3010 dollár. A társadalmi össztermék megoszlása ágazatonként: mező- és erdőgazdaság 14,7%; ipar 62,6%; építőipar 8,4%; közlekedés,
Magyarország gazdasága I. Magyarország ipari-agrár ország. Egy főre jutó GNI: 3010 dollár. A társadalmi össztermék megoszlása ágazatonként: mező- és erdőgazdaság 14,7%; ipar 62,6%; építőipar 8,4%; közlekedés,
ELEKTROKÉMIA. - elektrolitokban: ionok irányított mozgása. Elektrolízis: elektromos áram által előidézett kémiai átalakulás
 ELEKTROKÉMIA 1 ELEKTROKÉMIA Elektromos áram: - fémekben: elektronok áramlása - elektrolitokban: ionok irányított mozgása Elektrolízis: elektromos áram által előidézett kémiai átalakulás Galvánelem: elektromos
ELEKTROKÉMIA 1 ELEKTROKÉMIA Elektromos áram: - fémekben: elektronok áramlása - elektrolitokban: ionok irányított mozgása Elektrolízis: elektromos áram által előidézett kémiai átalakulás Galvánelem: elektromos
A feladatok megoldásához csak a kiadott periódusos rendszer és számológép használható!
 1 MŰVELTSÉGI VERSENY KÉMIA TERMÉSZETTUDOMÁNYI KATEGÓRIA Kedves Versenyző! A versenyen szereplő kérdések egy része általad már tanult tananyaghoz kapcsolódik, ugyanakkor a kérdések másik része olyan ismereteket
1 MŰVELTSÉGI VERSENY KÉMIA TERMÉSZETTUDOMÁNYI KATEGÓRIA Kedves Versenyző! A versenyen szereplő kérdések egy része általad már tanult tananyaghoz kapcsolódik, ugyanakkor a kérdések másik része olyan ismereteket
a réz(ii)-ion klorokomplexének előállítása...
 Általános és szervetlen kémia Laborelőkészítő előadás IX-X. (2008. október 18.) A réz(i)-oxid és a lecsapott kén előállítása Metallurgia, a fém mangán előállítása Megfordítható redoxreakciók Szervetlen
Általános és szervetlen kémia Laborelőkészítő előadás IX-X. (2008. október 18.) A réz(i)-oxid és a lecsapott kén előállítása Metallurgia, a fém mangán előállítása Megfordítható redoxreakciók Szervetlen
Elektro-analitikai számítási feladatok 1. Potenciometria
 Elektro-analitikai számítási feladatok 1. Potenciometria 1. Vas-só részlegesen oxidált oldatába Pt elektródot merítettünk. Ennek az elektródnak a potenciálját egy telített kalomel elektródhoz képest mérjük
Elektro-analitikai számítási feladatok 1. Potenciometria 1. Vas-só részlegesen oxidált oldatába Pt elektródot merítettünk. Ennek az elektródnak a potenciálját egy telített kalomel elektródhoz képest mérjük
A 27/2012 (VIII. 27.) NGM rendelet (12/2013. (III. 28.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján.
 A 27/2012 (VIII. 27.) NGM rendelet (12/2013. (III. 28.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. 54 524 01 Laboratóriumi technikus Tájékoztató A vizsgázó az első lapra írja
A 27/2012 (VIII. 27.) NGM rendelet (12/2013. (III. 28.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. 54 524 01 Laboratóriumi technikus Tájékoztató A vizsgázó az első lapra írja
Elektrokémia. A nemesfém elemek és egymással képzett vegyületeik
 Elektrokémia Redoxireakciók: Minden olyan reakciót, amelyben elektron leadás és elektronfelvétel történik, redoxi reakciónak nevezünk. Az elektronleadás és -felvétel egyidejűleg játszódik le. Oxidálószer
Elektrokémia Redoxireakciók: Minden olyan reakciót, amelyben elektron leadás és elektronfelvétel történik, redoxi reakciónak nevezünk. Az elektronleadás és -felvétel egyidejűleg játszódik le. Oxidálószer
Minta feladatsor. Az ion képlete. Az ion neve O 4. Foszfátion. Szulfátion CO 3. Karbonátion. Hidrogénkarbonátion O 3. Alumíniumion. Al 3+ + Szulfidion
 Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve Foszfátion Szulfátion
Minta feladatsor A feladatok megoldására 90 perc áll rendelkezésére. A megoldáshoz zsebszámológépet használhat. 1. Adja meg a következő ionok nevét, illetve képletét! (8 pont) Az ion neve Foszfátion Szulfátion
Természetes vizek, keverékek mindig tartalmaznak oldott anyagokat! Írd le milyen természetes vizeket ismersz!
 Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Összefoglalás Víz Természetes víz. Melyik anyagcsoportba tartozik? Sorolj fel természetes vizeket. Mitől kemény, mitől lágy a víz? Milyen okokból kell a vizet tisztítani? Kémiailag tiszta víz a... Sorold
Ipari vizek tisztítási lehetőségei rövid összefoglalás. Székely Edit BME Kémiai és Környezeti Folyamatmérnöki Tanszék
 Ipari vizek tisztítási lehetőségei rövid összefoglalás Székely Edit BME Kémiai és Környezeti Folyamatmérnöki Tanszék Kezelés Fizikai, fizikai-kémiai Biológiai Kémiai Szennyezők típusai Módszerek Előnyök
Ipari vizek tisztítási lehetőségei rövid összefoglalás Székely Edit BME Kémiai és Környezeti Folyamatmérnöki Tanszék Kezelés Fizikai, fizikai-kémiai Biológiai Kémiai Szennyezők típusai Módszerek Előnyök
Redoxi reakciók Elektrokémiai alapok Műszaki kémia, Anyagtan I. 12-13. előadás
 Redoxi reakciók Elektrokémiai alapok Műszaki kémia, Anyagtan I. 12-13. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Redoxi reakciók Például: 2Mg + O 2 = 2MgO Részfolyamatok:
Redoxi reakciók Elektrokémiai alapok Műszaki kémia, Anyagtan I. 12-13. előadás Dolgosné dr. Kovács Anita egy.doc. PTE MIK Környezetmérnöki Tanszék Redoxi reakciók Például: 2Mg + O 2 = 2MgO Részfolyamatok:
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS
 Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Kémiai kötések és kristályrácsok ISMÉTLÉS, GYAKORLÁS Milyen képlet adódik a következő atomok kapcsolódásából? Fe - Fe H - O P - H O - O Na O Al - O Ca - S Cl - Cl C - O Ne N - N C - H Li - Br Pb - Pb N
Redox reakciók. azok a reakciók, melyekben valamely atom oxidációs száma megváltozik.
 Redox reakciók azok a reakciók, melyekben valamely atom oxidációs száma megváltozik. Az oxidációs szám megadja, hogy egy atomnak mennyi lenne a töltése, ha gondolatban a kötő elektronpárokat teljes mértékben
Redox reakciók azok a reakciók, melyekben valamely atom oxidációs száma megváltozik. Az oxidációs szám megadja, hogy egy atomnak mennyi lenne a töltése, ha gondolatban a kötő elektronpárokat teljes mértékben
Mérnöki anyagismeret
 Mérnöki anyagismeret Termikus, villamos, mágneses tulajdonságok Alapanyagok gyártása Fémkohászat Vas- és acélgyártás Termikus tulajdonságok A szilárd anyagok az olvadás illetve amorf anyagok esetében a
Mérnöki anyagismeret Termikus, villamos, mágneses tulajdonságok Alapanyagok gyártása Fémkohászat Vas- és acélgyártás Termikus tulajdonságok A szilárd anyagok az olvadás illetve amorf anyagok esetében a
1) Standard hidrogénelektród készülhet sósavból vagy kénsavoldatból is. Ezt a savat 100-szorosára hígítva, mekkora ph-jú oldatot nyerünk?
 Számítások ph-val kombinálva 1) Standard hidrogénelektród készülhet sósavból vagy kénsavoldatból is. Ezt a savat 100-szorosára hígítva, mekkora ph-jú oldatot nyerünk? Mekkora az eredeti oldatok anyagmennyiség-koncentrációja?
Számítások ph-val kombinálva 1) Standard hidrogénelektród készülhet sósavból vagy kénsavoldatból is. Ezt a savat 100-szorosára hígítva, mekkora ph-jú oldatot nyerünk? Mekkora az eredeti oldatok anyagmennyiség-koncentrációja?
Kémiai alapismeretek 7.-8. hét
 Kémiai alapismeretek 7.-8. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2012. október 16.-október 19. 1/12 2012/2013 I. félév, Horváth Attila
Kémiai alapismeretek 7.-8. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2012. október 16.-október 19. 1/12 2012/2013 I. félév, Horváth Attila
1. feladat Összesen: 15 pont. 2. feladat Összesen: 10 pont
 1. feladat Összesen: 15 pont Vizsgálja meg a hidrogén-klorid (vagy vizes oldata) reakciót különböző szervetlen és szerves anyagokkal! Ha nem játszódik le reakció, akkor ezt írja be! protonátmenettel járó
1. feladat Összesen: 15 pont Vizsgálja meg a hidrogén-klorid (vagy vizes oldata) reakciót különböző szervetlen és szerves anyagokkal! Ha nem játszódik le reakció, akkor ezt írja be! protonátmenettel járó
VÖRÖSISZAP HASZNOSÍTÁS ROMELT TECHNOLÓGIÁVAL PROJEKT ÖSSZEFOGLALÓ. Feladat. Termékek. Cél. Közreműködők BERUHÁZÁSI TERVEZET
 BERUHÁZÁSI TERVEZET VÖRÖSISZAP HASZNOSÍTÁS ROMELT TECHNOLÓGIÁVAL PROJEKT ÖSSZEFOGLALÓ Feladat Termékek Cél Vörösiszap és egyéb ipari hulladékok hasznosítására alkalmas létesítmény megvalósítása innovatív
BERUHÁZÁSI TERVEZET VÖRÖSISZAP HASZNOSÍTÁS ROMELT TECHNOLÓGIÁVAL PROJEKT ÖSSZEFOGLALÓ Feladat Termékek Cél Vörösiszap és egyéb ipari hulladékok hasznosítására alkalmas létesítmény megvalósítása innovatív
A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján.
 A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. Szakképesítés azonosítószáma és megnevezése 54 524 03 Vegyész technikus Tájékoztató
A 27/2012. (VIII. 27.) NGM rendelet (29/2016. (VIII. 26.) NGM rendelet által módosított) szakmai és vizsgakövetelménye alapján. Szakképesítés azonosítószáma és megnevezése 54 524 03 Vegyész technikus Tájékoztató
Adatgyőjtés, mérési alapok, a környezetgazdálkodás fontosabb mőszerei
 GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
GazdálkodásimodulGazdaságtudományismeretekI.Közgazdaságtan KÖRNYEZETGAZDÁLKODÁSIMÉRNÖKIMScTERMÉSZETVÉDELMIMÉRNÖKIMSc Tudományos kutatásmódszertani, elemzési és közlési ismeretek modul Adatgyőjtés, mérési
Gázelosztó rendszerek üzemeltetése III. rész Gázelosztó vezetékek korrózióvédelme
 Gázelosztó rendszerek üzemeltetése III. rész Gázelosztó vezetékek korrózióvédelme 1 Korrózió Anyagkárosodás, -rongálódás Az anyag stabil állapota instabillá válik a környező közeg megváltozása miatt A
Gázelosztó rendszerek üzemeltetése III. rész Gázelosztó vezetékek korrózióvédelme 1 Korrózió Anyagkárosodás, -rongálódás Az anyag stabil állapota instabillá válik a környező közeg megváltozása miatt A
9. évfolyam II. félév 2. dolgozat B csoport. a. Arrheneus szerint bázisok azok a vegyületek, amelyek... b. Arrheneus szerint a sók...
 9. évfolyam II. félév 2. dolgozat B csoport 1. Egészítsd ki az alábbi mondatokat! a. Arrheneus szerint bázisok azok a vegyületek, amelyek... b. Arrheneus szerint a sók.... c. Az erős savak vízben........
9. évfolyam II. félév 2. dolgozat B csoport 1. Egészítsd ki az alábbi mondatokat! a. Arrheneus szerint bázisok azok a vegyületek, amelyek... b. Arrheneus szerint a sók.... c. Az erős savak vízben........
KÉMIA FELVÉTELI DOLGOZAT
 KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
KÉMIA FELVÉTELI DOLGOZAT I. Egyszerű választásos teszt Karikázza be az egyetlen helyes, vagy egyetlen helytelen választ! 1. Hány neutront tartalmaz a 127-es tömegszámú, 53-as rendszámú jód izotóp? A) 74
1. változat. 4. Jelöld meg azt az oxidot, melynek megfelelője a vas(iii)-hidroxid! A FeO; Б Fe 2 O 3 ; В OF 2 ; Г Fe 3 O 4.
 1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
1. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
Számítások ph-val kombinálva
 Bemelegítő, gondolkodtató kérdések Igaz-e? Indoklással válaszolj! A A semleges oldat ph-ja mindig éppen 7. B A tömény kénsav ph-ja 0 vagy annál is kisebb. C A 0,1 mol/dm 3 koncentrációjú sósav ph-ja azonos
Bemelegítő, gondolkodtató kérdések Igaz-e? Indoklással válaszolj! A A semleges oldat ph-ja mindig éppen 7. B A tömény kénsav ph-ja 0 vagy annál is kisebb. C A 0,1 mol/dm 3 koncentrációjú sósav ph-ja azonos
ACÉLOK MÉRNÖKI ANYAGOK
 ACÉLOK MÉRNÖKI ANYAGOK 80%-a (5000 kg/fő/év) kerámia, kő, homok... Ebből csak kb. 7% a iparilag előállított cserép, cement, tégla, porcelán... 14%-a (870 kg/fő/év) a polimerek csoportja, melynek kb. 90%-a
ACÉLOK MÉRNÖKI ANYAGOK 80%-a (5000 kg/fő/év) kerámia, kő, homok... Ebből csak kb. 7% a iparilag előállított cserép, cement, tégla, porcelán... 14%-a (870 kg/fő/év) a polimerek csoportja, melynek kb. 90%-a
1. feladat Összesen: 18 pont. 2. feladat Összesen: 9 pont
 1. feladat Összesen: 18 pont Különböző anyagok vízzel való kölcsönhatását vizsgáljuk. Töltse ki a táblázatot! második oszlopba írja, hogy oldódik-e vagy nem oldódik vízben az anyag, illetve ha reagál,
1. feladat Összesen: 18 pont Különböző anyagok vízzel való kölcsönhatását vizsgáljuk. Töltse ki a táblázatot! második oszlopba írja, hogy oldódik-e vagy nem oldódik vízben az anyag, illetve ha reagál,
Általános és szervetlen kémia Laborelıkészítı elıadás VI
 Általános és szervetlen kémia Laborelıkészítı elıadás VI Redoxiegyenletek rendezésének általános lépései Példák fémoldódási egyenletek rendezésére Halogénvegyületek reakciói A gyakorlaton vizsgált redoxireakciók
Általános és szervetlen kémia Laborelıkészítı elıadás VI Redoxiegyenletek rendezésének általános lépései Példák fémoldódási egyenletek rendezésére Halogénvegyületek reakciói A gyakorlaton vizsgált redoxireakciók
Áramforrások. Másodlagos cella: Használat előtt fel kell tölteni. Használat előtt van a rendszer egyensúlyban. Újratölthető.
 Áramforrások Elsődleges cella: áramot termel kémiai anyagokból, melyek a cellába vannak bezárva. Ha a reakció elérte az egyensúlyt, kimerül. Nem tölthető. Másodlagos cella: Használat előtt fel kell tölteni.
Áramforrások Elsődleges cella: áramot termel kémiai anyagokból, melyek a cellába vannak bezárva. Ha a reakció elérte az egyensúlyt, kimerül. Nem tölthető. Másodlagos cella: Használat előtt fel kell tölteni.
STS GROUP ZRt. FUELCELL (Hidrogén üzemanyagcellás erőművek). Előadó: Gyepes Tamás (Elnök Igazgató) Kriston Ákos. Vándorgyűlés előadás, 2009.09.11.
 STS GROUP ZRt. FUELCELL (Hidrogén üzemanyagcellás erőművek). Előadó: Gyepes Tamás (Elnök Igazgató) Vándorgyűlés előadás, 2009.09.11. Kriston Ákos Tartalom Elméleti ismertetők Kriston Ákos Mi az az üzemanyagcella?
STS GROUP ZRt. FUELCELL (Hidrogén üzemanyagcellás erőművek). Előadó: Gyepes Tamás (Elnök Igazgató) Vándorgyűlés előadás, 2009.09.11. Kriston Ákos Tartalom Elméleti ismertetők Kriston Ákos Mi az az üzemanyagcella?
Ni 2+ Reakciósebesség mol. A mérés sorszáma
 1. feladat Összesen 10 pont Egy kén-dioxidot és kén-trioxidot tartalmazó gázelegyben a kén és oxigén tömegaránya 1,0:1,4. A) Számítsa ki a gázelegy térfogatszázalékos összetételét! B) Számítsa ki 1,0 mol
1. feladat Összesen 10 pont Egy kén-dioxidot és kén-trioxidot tartalmazó gázelegyben a kén és oxigén tömegaránya 1,0:1,4. A) Számítsa ki a gázelegy térfogatszázalékos összetételét! B) Számítsa ki 1,0 mol
Elektronátadás és elektronátvétel
 Általános és szervetlen kémia 11. hét Elızı héten elsajátítottuk, hogy a közös elektronpár létrehozásával járó reakciók csoportjában milyen jellemzıi vannak sav-bázis és komplexképzı reakcióknak Mai témakörök
Általános és szervetlen kémia 11. hét Elızı héten elsajátítottuk, hogy a közös elektronpár létrehozásával járó reakciók csoportjában milyen jellemzıi vannak sav-bázis és komplexképzı reakcióknak Mai témakörök
Kémiai tantárgy középszintű érettségi témakörei
 Kémiai tantárgy középszintű érettségi témakörei Csongrádi Batsányi János Gimnázium, Szakgimnázium és Kollégium Összeállította: Baricsné Kapus Éva, Tábori Levente 1) témakör Mendgyelejev féle periódusos
Kémiai tantárgy középszintű érettségi témakörei Csongrádi Batsányi János Gimnázium, Szakgimnázium és Kollégium Összeállította: Baricsné Kapus Éva, Tábori Levente 1) témakör Mendgyelejev féle periódusos
Összesen: 20 pont. 1,120 mol gázelegy anyagmennyisége: 0,560 mol H 2 és 0,560 mol Cl 2 tömege: 1,120 g 39,76 g (2)
 I. FELADATSOR (KÖZÖS) 1. B 6. C 11. D 16. A 2. B 7. E 12. C 17. E 3. A 8. A 13. D 18. C 4. E 9. A 14. B 19. B 5. B (E is) 10. C 15. C 20. D 20 pont II. FELADATSOR 1. feladat (közös) 1,120 mol gázelegy
I. FELADATSOR (KÖZÖS) 1. B 6. C 11. D 16. A 2. B 7. E 12. C 17. E 3. A 8. A 13. D 18. C 4. E 9. A 14. B 19. B 5. B (E is) 10. C 15. C 20. D 20 pont II. FELADATSOR 1. feladat (közös) 1,120 mol gázelegy
100% = 100 pont A VIZSGAFELADAT MEGOLDÁSÁRA JAVASOLT %-OS EREDMÉNY: EBBEN A VIZSGARÉSZBEN A VIZSGAFELADAT ARÁNYA 50%.
 Az Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről szóló 133/2010. (IV. 22.) Korm. rendelet alapján. Szakképesítés, szakképesítés-elágazás, rész-szakképesítés,
Az Országos Képzési Jegyzékről és az Országos Képzési Jegyzékbe történő felvétel és törlés eljárási rendjéről szóló 133/2010. (IV. 22.) Korm. rendelet alapján. Szakképesítés, szakképesítés-elágazás, rész-szakképesítés,
TTV típusú pillangószelepek
 TTV típusú pillangószelepek MŰSZAKI JELLEMZŐK Hosszított nyak ISO csatlakozás Átmenő orsós kivitel Kivehető ülék Saválló tányér Rilsan (250-300µm) bevonatú ház RAL 5012 színben 10 állásban lezárható kézikar
TTV típusú pillangószelepek MŰSZAKI JELLEMZŐK Hosszított nyak ISO csatlakozás Átmenő orsós kivitel Kivehető ülék Saválló tányér Rilsan (250-300µm) bevonatú ház RAL 5012 színben 10 állásban lezárható kézikar
Mérnöki anyagismeret. Alapanyagok gyártása Alumínium és könnyűfém kohászat Réz és színesfém kohászat Öntészet
 Mérnöki anyagismeret Alapanyagok gyártása Alumínium és könnyűfém kohászat Réz és színesfém kohászat Öntészet A fémkohászat főbb folyamatai Bányászat Érc előkészítés Nyers fém kinyerése A nyers fém finomítása
Mérnöki anyagismeret Alapanyagok gyártása Alumínium és könnyűfém kohászat Réz és színesfém kohászat Öntészet A fémkohászat főbb folyamatai Bányászat Érc előkészítés Nyers fém kinyerése A nyers fém finomítása
Építményeink védelme március 27. Acélfelületek korrózió elleni védelme fémbevonatokkal
 Építményeink védelme 2018. március 27. Acélfelületek korrózió elleni védelme fémbevonatokkal Dr. Seidl Ágoston okl. vegyészmérnök, korróziós szakmérnök c.egy.docens A korrózióról általában A korrózióról
Építményeink védelme 2018. március 27. Acélfelületek korrózió elleni védelme fémbevonatokkal Dr. Seidl Ágoston okl. vegyészmérnök, korróziós szakmérnök c.egy.docens A korrózióról általában A korrózióról
8. osztály 2 Hevesy verseny, megyei forduló, 2008.
 8. osztály 2 Hevesy verseny, megyei forduló, 2008. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthető legyen! A feladatok megoldásában a gondolatmeneted követhető
8. osztály 2 Hevesy verseny, megyei forduló, 2008. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthető legyen! A feladatok megoldásában a gondolatmeneted követhető
AZ EGYENÁRAM HATÁSAI
 AZ EGYENÁRAM HATÁSAI 1) HŐHATÁS Az elektromos áram hatására a zseblámpa világít, mert izzószála felmelegszik, izzásba jön. Oka: az áramló elektronok kölcsönhatásba kerülnek a vezető helyhez kötött részecskéivel,
AZ EGYENÁRAM HATÁSAI 1) HŐHATÁS Az elektromos áram hatására a zseblámpa világít, mert izzószála felmelegszik, izzásba jön. Oka: az áramló elektronok kölcsönhatásba kerülnek a vezető helyhez kötött részecskéivel,
Anyagvizsgálati módszerek Elektroanalitika. Anyagvizsgálati módszerek
 Anyagvizsgálati módszerek Elektroanalitika Anyagvizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagvizsgálati módszerek Optikai módszerek 1/ 18 Potenciometria Potenciometria olyan analitikai eljárások
Anyagvizsgálati módszerek Elektroanalitika Anyagvizsgálati módszerek Pannon Egyetem Mérnöki Kar Anyagvizsgálati módszerek Optikai módszerek 1/ 18 Potenciometria Potenciometria olyan analitikai eljárások
4. változat. 2. Jelöld meg azt a részecskét, amely megőrzi az anyag összes kémiai tulajdonságait! A molekula; Б atom; В gyök; Г ion.
 4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
4. változat z 1-től 16-ig terjedő feladatokban négy válaszlehetőség van, amelyek közül csak egy helyes. Válaszd ki a helyes választ és jelöld be a válaszlapon! 1. Melyik sor fejezi be helyesen az állítást:
Előadás címe: A vörösiszappal szennyezett felszíni vizek kárenyhítése. Mihelyt tudjátok, hogy mi a kérdés érteni fogjátok a választ is Douglas Adams
 Előadás címe: A vörösiszappal szennyezett felszíni vizek kárenyhítése Bálint Mária Bálint Analitika Kft Mihelyt tudjátok, hogy mi a kérdés érteni fogjátok a választ is Douglas Adams Kármentesítés aktuális
Előadás címe: A vörösiszappal szennyezett felszíni vizek kárenyhítése Bálint Mária Bálint Analitika Kft Mihelyt tudjátok, hogy mi a kérdés érteni fogjátok a választ is Douglas Adams Kármentesítés aktuális
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 2002
 1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2002 JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden
1. oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI FELVÉTELI FELADATOK 2002 JAVÍTÁSI ÚTMUTATÓ Az írásbeli felvételi vizsgadolgozatra összesen 100 (dolgozat) pont adható, a javítási útmutató részletezése szerint. Minden
0 1 2 3 4 5 6 7 8 9 0 E C D C E B B A E 1 A C D B B D D A A D 2 C E D A B C B C C E 3 C C B B E
 XII. FÉMEK XII. 1. FELELETVÁLASZTÁSOS TESZTEK 0 1 2 4 5 6 7 8 9 0 E C D C E B B A E 1 A C D B B D D A A D 2 C E D A B C B C C E C C B B E XII. 2. TÁBLÁZATKIEGÉSZÍTÉS Fémek összehasonlítása Kalcium Vas
XII. FÉMEK XII. 1. FELELETVÁLASZTÁSOS TESZTEK 0 1 2 4 5 6 7 8 9 0 E C D C E B B A E 1 A C D B B D D A A D 2 C E D A B C B C C E C C B B E XII. 2. TÁBLÁZATKIEGÉSZÍTÉS Fémek összehasonlítása Kalcium Vas
8. osztály 2 Hevesy verseny, megyei forduló, 2004.
 8. osztály 2 Hevesy verseny, megyei forduló, 2004. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthető legyen! A feladatok megoldásában a gondolatmeneted követhető
8. osztály 2 Hevesy verseny, megyei forduló, 2004. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthető legyen! A feladatok megoldásában a gondolatmeneted követhető
AZ INERT ANÓDOK HATÁSA AZ ELSŐDLEGES ALUMÍNIUM ELŐÁLLÍTÁS ENERGIAIGÉNYÉRE ÉS KÖRNYEZETI HATÁSAIRA
 AZ INERT ANÓDOK HATÁSA AZ ELSŐDLEGES ALUMÍNIUM ELŐÁLLÍTÁS ENERGIAIGÉNYÉRE ÉS KÖRNYEZETI HATÁSAIRA - a modellalkotás nehézségei - Dr. Kovács Viktória Barbara Világ elsődleges alumínium előállítása Rio Tinto
AZ INERT ANÓDOK HATÁSA AZ ELSŐDLEGES ALUMÍNIUM ELŐÁLLÍTÁS ENERGIAIGÉNYÉRE ÉS KÖRNYEZETI HATÁSAIRA - a modellalkotás nehézségei - Dr. Kovács Viktória Barbara Világ elsődleges alumínium előállítása Rio Tinto
T I T - M T T. Hevesy György Kémiaverseny. országos dönt. Az írásbeli forduló feladatlapja. 8. osztály. 2. feladat:... pont. 3. feladat:...
 T I T - M T T Hevesy György Kémiaverseny országos dönt Az írásbeli forduló feladatlapja 8. osztály A versenyz azonosítási száma:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:...
T I T - M T T Hevesy György Kémiaverseny országos dönt Az írásbeli forduló feladatlapja 8. osztály A versenyz azonosítási száma:... Elért pontszám: 1. feladat:... pont 2. feladat:... pont 3. feladat:...
KÉMIA TEMATIKUS ÉRTÉKELİ FELADATLAPOK. 9. osztály A változat
 KÉMIA TEMATIKUS ÉRTÉKELİ FELADATLAPOK 9. osztály A változat Beregszász 2005 A munkafüzet megjelenését a Magyar Köztársaság Oktatási Minisztériuma támogatta A kiadásért felel: Orosz Ildikó Felelıs szerkesztı:
KÉMIA TEMATIKUS ÉRTÉKELİ FELADATLAPOK 9. osztály A változat Beregszász 2005 A munkafüzet megjelenését a Magyar Köztársaság Oktatási Minisztériuma támogatta A kiadásért felel: Orosz Ildikó Felelıs szerkesztı:
Oldódás, mint egyensúly
 Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott =
Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott =
O k t a t á si Hivatal
 O k t a t á si Hivatal 0/0. tanévi Országos Középiskolai Tanulmányi Verseny Kémia II. kategória. forduló I. FELADATSOR Megoldások. A helyes válasz(ok) betűjele: B, D, E. A legnagyobb elektromotoros erejű
O k t a t á si Hivatal 0/0. tanévi Országos Középiskolai Tanulmányi Verseny Kémia II. kategória. forduló I. FELADATSOR Megoldások. A helyes válasz(ok) betűjele: B, D, E. A legnagyobb elektromotoros erejű
Anyagismeret tételek
 Anyagismeret tételek 1. Iparban használatos anyagok csoportosítása - Anyagok: - fémek: - vas - nem vas: könnyű fémek, nehéz fémek - nemesfémek - nem fémek: - műanyagok: - hőre lágyuló - hőre keményedő
Anyagismeret tételek 1. Iparban használatos anyagok csoportosítása - Anyagok: - fémek: - vas - nem vas: könnyű fémek, nehéz fémek - nemesfémek - nem fémek: - műanyagok: - hőre lágyuló - hőre keményedő
7. évfolyam kémia osztályozó- és pótvizsga követelményei Témakörök: 1. Anyagok tulajdonságai és változásai (fizikai és kémiai változás) 2.
 7. évfolyam kémia osztályozó- és pótvizsga követelményei 1. Anyagok tulajdonságai és változásai (fizikai és kémiai változás) 2. Hőtermelő és hőelnyelő folyamatok, halmazállapot-változások 3. A levegő,
7. évfolyam kémia osztályozó- és pótvizsga követelményei 1. Anyagok tulajdonságai és változásai (fizikai és kémiai változás) 2. Hőtermelő és hőelnyelő folyamatok, halmazállapot-változások 3. A levegő,
Általános és szervetlen kémia Laborelıkészítı elıadás IX-X.
 Általános és szervetlen kémia Laborelıkészítı elıadás IX-X. A réz(i)-oxid és a lecsapott kén előállítása Metallurgia, a fém mangán előállítása Megfordítható redoxreakciók Szervetlen vegyületek hőbomlása
Általános és szervetlen kémia Laborelıkészítı elıadás IX-X. A réz(i)-oxid és a lecsapott kén előállítása Metallurgia, a fém mangán előállítása Megfordítható redoxreakciók Szervetlen vegyületek hőbomlása
Technológiai szennyvizek kezelése
 Környezeti innováció és jogszabályi megfelelés Környezeti innováció a BorsodChem Zrt.-nél szennyvíz és technológiai víz kezelési eljárások Klement Tibor EBK főosztályvezető Budapesti Corvinus Egyetem TTMK,
Környezeti innováció és jogszabályi megfelelés Környezeti innováció a BorsodChem Zrt.-nél szennyvíz és technológiai víz kezelési eljárások Klement Tibor EBK főosztályvezető Budapesti Corvinus Egyetem TTMK,
RÉSZLETEZŐ OKIRAT a NAH /2016 nyilvántartási számú akkreditált státuszhoz
 RÉSZLETEZŐ OKIRAT a NAH-1-1795/2016 nyilvántartási számú akkreditált státuszhoz Az AIRMON Levegőszennyezés Monitoring Kft. (1112 Budapest, Repülőtéri út 6. 27. ép.) akkreditált területe: I. Az akkreditált
RÉSZLETEZŐ OKIRAT a NAH-1-1795/2016 nyilvántartási számú akkreditált státuszhoz Az AIRMON Levegőszennyezés Monitoring Kft. (1112 Budapest, Repülőtéri út 6. 27. ép.) akkreditált területe: I. Az akkreditált
A standardpotenciál meghatározása a cink példáján. A galváncella működése elektrolizáló cellaként Elektródreakciók standard- és formálpotenciálja
 Általános és szervetlen kémia Laborelőkészítő előadás VII-VIII. (október 17.) Az elektródok típusai A standardpotenciál meghatározása a cink példáján Számítási példák galvánelemekre Koncentrációs elemek
Általános és szervetlen kémia Laborelőkészítő előadás VII-VIII. (október 17.) Az elektródok típusai A standardpotenciál meghatározása a cink példáján Számítási példák galvánelemekre Koncentrációs elemek
Curie Kémia Emlékverseny 2018/2019. Országos Döntő 7. évfolyam
 A feladatokat írta: Kódszám: Harkai Jánosné, Szeged... Lektorálta: Kovács Lászlóné, Szolnok 2019. május 11. Curie Kémia Emlékverseny 2018/2019. Országos Döntő 7. évfolyam A feladatok megoldásához csak
A feladatokat írta: Kódszám: Harkai Jánosné, Szeged... Lektorálta: Kovács Lászlóné, Szolnok 2019. május 11. Curie Kémia Emlékverseny 2018/2019. Országos Döntő 7. évfolyam A feladatok megoldásához csak
A nemfémes elemek oxidjai közül válassz két-két példát a megadott szempontok szerint! A vegyületek képletével válaszolj!
 8. osztály 1 Hevesy verseny, országos döntő, 2005. Kedves Versenyző! Köszöntünk a Hevesy György kémiaverseny országos döntőjének írásbeli fordulóján. A következő kilenc feladat megoldására 90 perc áll
8. osztály 1 Hevesy verseny, országos döntő, 2005. Kedves Versenyző! Köszöntünk a Hevesy György kémiaverseny országos döntőjének írásbeli fordulóján. A következő kilenc feladat megoldására 90 perc áll
RÉSZLETEZŐ OKIRAT (2) a NAH /2016 nyilvántartási számú akkreditált státuszhoz
 RÉSZLETEZŐ OKIRAT (2) a NAH-1-1795/2016 nyilvántartási számú akkreditált státuszhoz 1) Az akkreditált szervezet neve és címe: AIRMON Levegőszennyezés Monitoring Kft. (1112 Budapest, Repülőtéri út 6. 27.
RÉSZLETEZŐ OKIRAT (2) a NAH-1-1795/2016 nyilvántartási számú akkreditált státuszhoz 1) Az akkreditált szervezet neve és címe: AIRMON Levegőszennyezés Monitoring Kft. (1112 Budapest, Repülőtéri út 6. 27.
Szent-Györgyi Albert kémiavetélkedő
 9. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
9. osztály Kedves Versenyző! A jobb felső sarokban található mezőbe a verseny lebonyolításáért felelős személy írja be a kódot a feladatlap minden oldalára a verseny végén. A feladatokat lehetőleg a feladatlapon
... Dátum:... (olvasható név)
 ... Dátum:... (olvasható név) (szak) Szervetlen kémia írásbeli vizsga A hallgató aláírása:. Pontok összesítése: I.. (10 pont) II/A. (10 pont) II/B. (5 pont) III.. (20 pont) IV.. (20 pont) V.. (5 pont)
... Dátum:... (olvasható név) (szak) Szervetlen kémia írásbeli vizsga A hallgató aláírása:. Pontok összesítése: I.. (10 pont) II/A. (10 pont) II/B. (5 pont) III.. (20 pont) IV.. (20 pont) V.. (5 pont)
1. feladat Összesen 20 pont
 1. feladat Összesen 20 pont Minden feladatnál a betűjel bekarikázásával jelölje meg az egyetlen helyes választ! I. 1 nk -ú a víz, amelynek 1 dm 3 -ében: II. A) 10 mg CaO van. B) 1000 mg CaO van. C) 5,6
1. feladat Összesen 20 pont Minden feladatnál a betűjel bekarikázásával jelölje meg az egyetlen helyes választ! I. 1 nk -ú a víz, amelynek 1 dm 3 -ében: II. A) 10 mg CaO van. B) 1000 mg CaO van. C) 5,6
2011/2012 tavaszi félév 3. óra
 2011/2012 tavaszi félév 3. óra Redoxegyenletek rendezése (diszproporció, szinproporció, stb.); Sztöchiometria Vegyületek sztöchiometriai együtthatóinak meghatározása elemösszetétel alapján Adott rendezendő
2011/2012 tavaszi félév 3. óra Redoxegyenletek rendezése (diszproporció, szinproporció, stb.); Sztöchiometria Vegyületek sztöchiometriai együtthatóinak meghatározása elemösszetétel alapján Adott rendezendő
Dr. JUVANCZ ZOLTÁN Óbudai Egyetem Dr. FENYVESI ÉVA CycloLab Kft
 Dr. JUVANCZ ZOLTÁN Óbudai Egyetem Dr. FENYVESI ÉVA CycloLab Kft Klasszikus analitikai módszerek Csapadékképzéses reakciók: Gravimetria (SZOE, víztartalom), csapadékos titrálások (szulfát, klorid) Sav-bázis
Dr. JUVANCZ ZOLTÁN Óbudai Egyetem Dr. FENYVESI ÉVA CycloLab Kft Klasszikus analitikai módszerek Csapadékképzéses reakciók: Gravimetria (SZOE, víztartalom), csapadékos titrálások (szulfát, klorid) Sav-bázis
Elektromos áram. Vezetési jelenségek
 Elektromos áram. Vezetési jelenségek Emlékeztető Elektromos áram: töltéshordozók egyirányú áramlása Áramkör részei: áramforrás, vezető, fogyasztó Áramköri jelek Emlékeztető Elektromos áram hatásai: Kémiai
Elektromos áram. Vezetési jelenségek Emlékeztető Elektromos áram: töltéshordozók egyirányú áramlása Áramkör részei: áramforrás, vezető, fogyasztó Áramköri jelek Emlékeztető Elektromos áram hatásai: Kémiai
KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ
 1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
1 oldal KÉMIA ÍRÁSBELI ÉRETTSÉGI- FELVÉTELI FELADATOK 1995 JAVÍTÁSI ÚTMUTATÓ I A VÍZ - A víz molekulája V-alakú, kötésszöge 109,5 fok, poláris kovalens kötések; - a jég molekularácsos, tetraéderes elrendeződés,
Hevesy György Országos Kémiaverseny Kerületi forduló február évfolyam
 Hevesy György Országos Kémiaverseny Kerületi forduló 2013. február 20. 8. évfolyam A feladatlap megoldásához kizárólag periódusos rendszert és elektronikus adatok tárolására nem alkalmas zsebszámológép
Hevesy György Országos Kémiaverseny Kerületi forduló 2013. február 20. 8. évfolyam A feladatlap megoldásához kizárólag periódusos rendszert és elektronikus adatok tárolására nem alkalmas zsebszámológép
8. osztály 2 Hevesy verseny, megyei forduló, 2009.
 8. osztály 2 Hevesy verseny, megyei forduló, 2009. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthet legyen! A feladatok megoldásában a gondolatmeneted követhet
8. osztály 2 Hevesy verseny, megyei forduló, 2009. Figyelem! A feladatokat ezen a feladatlapon oldd meg! Megoldásod olvasható és áttekinthet legyen! A feladatok megoldásában a gondolatmeneted követhet
Orvosi Fizika 13. Bari Ferenc egyetemi tanár SZTE ÁOK-TTIK Orvosi Fizikai és Orvosi Informatikai Intézet
 Orvosi Fizika 13. Elektromosságtan és mágnességtan az életfolyamatokban 2. Bari Ferenc egyetemi tanár SZTE ÁOK-TTIK Orvosi Fizikai és Orvosi Informatikai Intézet Szeged, 2011. december 5. Egyenáram Vezető
Orvosi Fizika 13. Elektromosságtan és mágnességtan az életfolyamatokban 2. Bari Ferenc egyetemi tanár SZTE ÁOK-TTIK Orvosi Fizikai és Orvosi Informatikai Intézet Szeged, 2011. december 5. Egyenáram Vezető
Oldódás, mint egyensúly
 Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott K
Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K = [A] oldott [A] szilárd állandó K [A] szilárd = [A] oldott S = telített oldat conc. Folyadék oldódása: analóg módon Gázok oldódása: [gáz] oldott K
A VAS ÉS AZ ALUMÍNIUM
 A VAS ÉS AZ ALUMÍNIUM Fejezet 1 A vas A vas története Sokáig úgy tűnt, hogy mindennapi életünk egyik leggyakrabban felhasznált féme, pontosabban annak ellátása az "istenek kegyétől" függ, hisz kr.e. 4200
A VAS ÉS AZ ALUMÍNIUM Fejezet 1 A vas A vas története Sokáig úgy tűnt, hogy mindennapi életünk egyik leggyakrabban felhasznált féme, pontosabban annak ellátása az "istenek kegyétől" függ, hisz kr.e. 4200
Tartalmi követelmények kémia tantárgyból az érettségin K Ö Z É P S Z I N T
 1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
1. Általános kémia Atomok és a belőlük származtatható ionok Molekulák és összetett ionok Halmazok A kémiai reakciók A kémiai reakciók jelölése Termokémia Reakciókinetika Kémiai egyensúly Reakciótípusok
Az ötvözet a fémek szilárd oldata, ami a következő anyagokból tevődik össze:
 Az ötvözet a fémek szilárd oldata, ami a következő anyagokból tevődik össze: alapfém: pl. vas, alumínium, ötvözőanyagok: amelyek kedvezően befolyásolják az alapfém tulajdonságait pl. a vas esetében a szén,
Az ötvözet a fémek szilárd oldata, ami a következő anyagokból tevődik össze: alapfém: pl. vas, alumínium, ötvözőanyagok: amelyek kedvezően befolyásolják az alapfém tulajdonságait pl. a vas esetében a szén,
VÍZKEZELÉS Kazántápvíz előkészítés ioncserés sómentesítéssel
 A víz keménysége VÍZKEZELÉS Kazántápvíz előkészítés ioncserés sómentesítéssel A természetes vizek alkotóelemei között számos kation ( pl.: Na +, Ca ++, Mg ++, H +, K +, NH 4 +, Fe ++, stb) és anion (Cl
A víz keménysége VÍZKEZELÉS Kazántápvíz előkészítés ioncserés sómentesítéssel A természetes vizek alkotóelemei között számos kation ( pl.: Na +, Ca ++, Mg ++, H +, K +, NH 4 +, Fe ++, stb) és anion (Cl
Kémiai alapismeretek 11. hét
 Kémiai alapismeretek 11. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2011. május 3. 1/8 2009/2010 II. félév, Horváth Attila c Elektród: Fémes
Kémiai alapismeretek 11. hét Horváth Attila Pécsi Tudományegyetem, Természettudományi Kar, Kémia Intézet, Szervetlen Kémiai Tanszék 2011. május 3. 1/8 2009/2010 II. félév, Horváth Attila c Elektród: Fémes
SZŰKÍTETT RÉSZLETEZŐ OKIRAT (1) a NAH /2014 nyilvántartási számú (2) akkreditált státuszhoz
 SZŰKÍTETT RÉSZLETEZŐ OKIRAT (1) a NAH-1-1626/2014 nyilvántartási számú (2) akkreditált státuszhoz Az IMSYS Mérnöki Szolgáltató Kft. Környezet- és Munkavédelmi Vizsgálólaboratórium (1033 Budapest, Mozaik
SZŰKÍTETT RÉSZLETEZŐ OKIRAT (1) a NAH-1-1626/2014 nyilvántartási számú (2) akkreditált státuszhoz Az IMSYS Mérnöki Szolgáltató Kft. Környezet- és Munkavédelmi Vizsgálólaboratórium (1033 Budapest, Mozaik
1. feladat Összesen: 8 pont. 2. feladat Összesen: 12 pont. 3. feladat Összesen: 14 pont. 4. feladat Összesen: 15 pont
 1. feladat Összesen: 8 pont Az autók légzsákját ütközéskor a nátrium-azid bomlásakor keletkező nitrogéngáz tölti fel. A folyamat a következő reakcióegyenlet szerint játszódik le: 2 NaN 3(s) 2 Na (s) +
1. feladat Összesen: 8 pont Az autók légzsákját ütközéskor a nátrium-azid bomlásakor keletkező nitrogéngáz tölti fel. A folyamat a következő reakcióegyenlet szerint játszódik le: 2 NaN 3(s) 2 Na (s) +
