I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS. A gyógyszerkészítmény forgalomba hozatali engedélye megszűnt
|
|
|
- Dániel Székely
- 8 évvel ezelőtt
- Látták:
Átírás
1 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1
2 1. A GYÓGYSZER MEGNEVEZÉSE Trudexa 40 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós üvegben. Az adalimumab egy rekombináns humán monoklonális antitest, melyet kínai hörcsög petefészek sejtekben állítanak elő. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA Oldatos injekció 4. KLINIKAI JELLEMZŐK 4.1 Terápiás javallatok Rheumatoid arthritis Metotrexáttal együtt adagolva javallott: középsúlyos, illetve súlyos aktív rheumatoid arthritisben szenvedő felnőtt betegek kezelésére, ha a betegséget befolyásoló reumaellenes szerek (disease-modifying antirheumatic drugs), beleértve a metotrexátot, nem hatásosak. súlyos, aktív és progresszív rheumatoid arthritisben szendvedő felnőttek kezelésére, akiket előzőleg még nem kezeltek metotrexáttal. A Trudexa metotrexát-intolerancia esetén, vagy ha a folyamatos metotrexátkezelés nem megfelelő, monoterápiaként is alkalmazható. A Trudexa csökkenti a röntgenfelvétellel kimutatott ízületi károsodás progressziójának mértékét és javítja a fizikai funkciókat, ha metotrexáttal kombinálva kerül alkalmazásra. Arthritis psoriatica Trudexa javasolt felnőttkori aktív és progrediáló arthritis psoriatica kezelésére, ha a betegséget befolyásoló reumaellenes szerek (disease-modifying antirheumatic drugs) használata nem járt terápiás sikerrel. Spondylitis ankylopoetica A Trudexa felnőttkori súlyos, aktív spondylitis ankylopoetica kezelésére javallott, ha a beteg a hagyományos kezelésre nem megfelelő módon reagált. Crohn-betegség A Trudexa súlyos, aktív Crohn-betegség kezelésére javallott olyan betegeknél, akik nem reagáltak a kortikoszteroiddal és/vagy immunszuppresszív szerrel végzett teljes és adekvát kúrára, vagy akik nem 2
3 tolerálják ezeket a szereket, vagy akiknél e szerek alkalmazása orvosi szempontból ellenjavallt. Indukciós kezelésként a Trudexa-t kortikoszteroiddal együtt kell adni. A Trudexa adható monoterápiaként kortikoszteroid intolerancia esetén, vagy ha a kortkoszteroid-kezelés folytatólagosan nem alkalmazható (lásd 4.2 pont). 4.2 Adagolás és alkalmazás Trudexa-val történő kezelést csak olyan szakorvos kezdhet el, illetve folytathat, aki jártas a rheumatoid arthritis, az arthritis psoriatica, a spondylitis ankylopoetica vagy a Crohn-betegség diagnosztikájában és kezelésében. A Trudexa-val kezelt betegek egy készenléti adatlapot kapnak. A helyes injekciós technika elsajátítása után a betegek, ha az orvos úgy ítéli meg, akár önmaguknak is beadhatják a Trudexa-t, szükség szerinti orvosi ellenőrzés mellett. A Trudexa-kezelés ideje alatt optimalizálni kell a más szerek (pl. kortikoszteroidok és/vagy immunmodulánsok) alkalmazásával végzett terápiát. Felnőttek Rheumatoid arthritis A Trudexa javasolt dózisa rheumatoid arthritisben szenvedő felnőttek esetében 40 mg adalimumab, kéthetente egy alkalommal egy adagban subcutan injekció formájában. A metotrexát folytatása javasolt a Trudexa-val való kezelés ideje alatt. Glükokortikoidok, szalicilátok, nem-szteroid gyulladáscsökkentők, illetve analgetikumok adása is folytatható a Trudexa-kezelés ideje alatt. A metotrexáton kívüli más, betegséget befolyásoló reumaellenes szerekkel való együttes szedést illetően lásd a 4.4 és az 5.1 pontokat. Monoterápiában, olyan betegek esetében, akiknél hatáscsökkenés mutatkozik, jó eredmény érhető el a dózis hetenkénti 40 mg-ra való emelésével. Arthritis psoriatica és spondylitis ankylopoetica A Trudexa ajánlott adagja arthritis psoriaticában és spondylitis ankylopoetica eseteiben 40 mg adalimumab kéthetente egy alkalommal subcutan injekcióban. A fenti összes javallat esetén a rendelkezésre álló adatok alapján a klinikai válasz általában 12 héten belül elérhető a kezeléssel. Olyan betegek esetében, akik ezen idő alatt nem reagálnak a kezelésre, a terápia folytatása alaposan megfontolandó. Crohn-betegség A Trudexa javasolt adagolása súlyos Crohn-betegségben szenvedő felnőttek indukciós kezelésére 80 mg a 0. héten, majd 40 mg a 2. héten. Ha hamarabb szükséges elérni a terápiás hatást, akkor a készítmény alkalmazható a 0. héten 160 mg (a dózis beadható 4 injekcióban egyetlen napon, vagy napi 2 injekcióban két egymást követő napon), a 2. héten 80 mg dózisban annak tudatában, hogy az indukciós kezelés során nagyobb a mellékhatások kockázata. Az indukciós kezelést követően a javasolt adag 40 mg minden második héten, subcután injekcióban. Ha a betegnél abbahagyták a Trudexa alkalmazását, és kiújulnak a betegség okozta panaszok és tünetek, újrakezdhető a Trudexa adása. Kevés a tapasztalat a kezelés újrakezdésével, ha az előző dózis beadása után 8 hétnél hosszabb idő telt el. A fenntartó kezelés során a kortikoszteroidokat a klinikai irányelvekkel összhangban fokozatosan csökkenteni lehet. 3
4 Azoknál a betegeknél, akiknél csökken a terápiás hatás, előnyös lehet a Trudexa dózis intenzitását heti 40 mg-ra emelni. Azoknál a betegeknél, akiknél a kezelés 4. hetéig nem jelentkezik terápiás hatás, előnyös lehet a fenntartó kezelést folytatása a 12. hétig. A kezelésre ennyi idő alatt sem reagáló betegek esetében körültekintően át kell gondolni a terápia folytatását. Idős betegek Az adagolás megváltoztatása nem szükséges. Gyermekek és serdülők Gyermekek esetében nincs tapasztalat. Csökkent vese- illetve májműködés Ezen betegpopulációkban nem állnak rendelkezésre adatok, így dózisra javaslat nem tehető. 4.3 Ellenjavallatok A készítmény hatóanyagával, vagy bármely segédanyagával szembeni túlérzékenység. Aktív tuberkulózis vagy más súlyos fertőzés, mint szepszis vagy opportunista fertőzések (lásd 4.4 pont). Középsúlyos, súlyos szívelégtelenség (NYHA III/IV) (lásd 4.4 pont). 4.4 Különleges figyelmeztetések és az alkalmazással kapcsolatos óvintézkedések Fertőzések A Trudexa-val való kezelés előtt, alatt és után a betegek szoros megfigyelése szükséges a fertőzések, beleértve a tuberkulózis észlelését. Tekintettel arra, hogy az adalimumab teljes eliminációja akár öt hónapot vehet igénybe, a megfigyelés ezen idő alatt is szükséges. Trudexa-val való kezelés nem kezdhető aktív fertőzésben szenvedő betegek esetében, beleértve a krónikus és lokális fertőzéseket is, amíg a fertőzés nem gyógyul meg. Szoros megfigyelés alatt kell tartani azokat a betegeket, akiknél a Trudexa-val való kezelés során alakul ki új fertőzés. A Trudexa-val való kezelést abba kell hagyni, olyan esetekben, amikor súlyos fertőzés alakul ki mindaddig, míg a fertőzés meg nem gyógyul. Az orvos különös gonddal döntsön a Trudexa adása mellett olyan betegek esetében, akiknek az anamnézisében visszatérő, gyakori fertőzések illetve fertőzésekre való hajlamosító tényező szerepel, az immunoszuppresszív szerek egyidejű alkalmazását is beleértve. Súlyos fertőzéseket, sepsist, tuberkulózist és egyéb opportunista fertőzéseket, haláleseteket is leírtak Trudexa-val való kezelés során. Súlyos fertőzések: A klinikai vizsgálatokban a Trudexa-t kapó betegeknél a súlyos fertőzések fokozott kockázatát igazolták. Ezt a megállapítást a forgalomba hozatalt követő jelentések is alátámasztják. Különösen nagy jelentőségűek az olyan fertőzések, mint a pneumonia, a pyelonephritis, a szeptikus arthritis, valamint a septicaemia. 4
5 Tuberkulózis: Vannak tuberkulózisról szóló beszámolók a Trudexa-val kezelt betegeknél. Megjegyzendő, hogy a beszámolók zömében a tuberkulózis extrapulmonális, azaz disszeminált volt. A Trudexa-val való kezelés megkezdése előtt minden beteget meg kell vizsgálni aktív és inaktív (látens) tuberkulózis irányában. A vizsgálat során fel kell venni a beteg részletes kórtörténetét, különös tekintettel a tuberkulózisra vonatkozóan. Tisztázni kell, hogy a beteg kapcsolatban állt-e bármikor aktív tuberkulózisban szenvedő beteggel, illetve a múltban vagy jelenleg immunszuppresszív kezelés alatt áll-e. Minden beteg esetében a megfelelő szűrő vizsgálatok pl. tuberkulin bőrteszt és mellkasröntgen elvégzése szükséges (helyi irányelvek követendők). A szűrővizsgálatok elvégzésének tényét fel kell tüntetni a készenléti adatlapon. A kezelést indikáló orvosnak számolnia kell az ál-negatív tuberculin bőrteszt lehetőségével is, különösen súlyos, illetve immundeficiens betegek esetében. Ha a diagnózis aktív tuberkulózis, a Trudexa-kezelést nem szabadelkezdeni (lásd 4.3 pont). Latens tuberkulózis eseteiben, a Trudexa-kezelés megkezdése előtt megfelelő profilaktikus antituberkuloticus kezelést kell indítani a helyi javaslatok figyelembevételével. A Trudexa-kezeléstől várható haszon, illetve a kezelés kockázata ezen esetekben különösen mérlegelendők. A betegeket külön figyelmeztetni kell arra, hogy ha a Trudexa-kezelés alatt vagy után a tuberkulózisra jellemző tüneteket (pl. tartós köhögés, fogyás, kisebb fokú láz) észlelnek magukon, azonnal forduljanak orvoshoz. Egyéb opportunista fertőzések: A Trudexa-kezelés során súlyos, heves lefolyású opportunista fertőzések pl. Pneumocystis carinii pneumonia, disszeminált histoplasmosis, listeriosis, valamint aspergillosis kialakulásáról számoltak be. Ha a Trudexa-val kezelt betegen általános állapotromlást tükröző vagy fertőzésre utaló, huzamosan fennálló/atípusos panaszok/tünetek észlelhetők, akkor opportunista fertőzés lehetőségét is számításba kell venni. Hepatitis B reaktiválódása TNF-antagonistákat (többek között Trudexa-t) kapó, hepatitis B idült vírushordozó betegeknél a hepatitis B reaktiválódása fordult elő. Néhány esetben ez halálhoz vezetett. A HBV fertőzés által veszélyeztetett betegeknél a Trudexa-kezelés elkezdése előtt meg kell vizsgálni, hogy van-e korábbi HBV fertőzésre utaló bizonyíték. A Trudexa terápiára szoruló HBV hordozókat a kezelés ideje alatt, illetve a befejezését követő néhány hónapon keresztül gondosan meg kell figyelni, hogy jelentkezneke rajtuk aktív HBV fertőzésre utaló panaszok és tünetek. A HBV hordozóknak a HBV reaktiválódásának megelőzése céljából végzett TNF-antagonista és antiretrovirális szer kombinációjával végzett kezeléséről nem állnak rendelkezésre megfelelő adatok. Azoknál a betegeknél, akiknél a HBV reaktiválódása alakul ki, abba kell hagyni a Trudexa adását, és hatékony antiretrovirális szer adását, valamint megfelelő szupportív kezelést kell kezdeni. Neurológiai vonatkozások A TNF-antagonisták, beleértve a Trudexa-t, néhány esetben összefüggésbe kerültek központi idegrendszeri demyelinizációs betegség klinikai szimptómáinak és/vagy radiológiai bizonyítékának új megjelenésével vagy súlyosbodásával. A gyógyszert felíró orvosnak különös gonddal kell eljárnia, olyan esetekben, amikor Trudexa-kezelés lehetősége felmerül régi vagy friss demyelinizációs központi idegrendszeri betegségben szenvedő betegeknél. 5
6 Allergiás reakciók A klinikai vizsgálatok során subcutan alkalmazott Trudexa mellett nem tapasztaltak súlyos allergiás mellékhatásokat. Enyhe allergiás reakciók is csak ritka esetben fordultak elő a Trudexa-val végzett klinikai vizsgálatok során. A Trudexa posztmarketing alkalmazása során nagyon ritkán jelentettek súlyos allergiás reakciót, beleértve az anafilaxiát. Ha anafilaxiás vagy más súlyos allergiás reakció előfordulna, a Trudexa adását azonnal abba kell hagyni, és a megfelelő kezelést kell elkezdeni. A fecskendő tűvédő kupakja természetes gumit (latex) tartalmaz. Ez súlyos allergiás reakciót válthat ki latexre érzékeny betegeknél. Immunszuppresszió Rheumatoid arthritisben szenvedő, Trudexa-val kezelt 64 beteg vizsgálata során nem tapasztaltak csökkent késői típusú hyperszenzitivitási reakciót, alacsonyabb immunglobulin szinteket, illetve nem észleltek változást az effektor-t és B sejtek, és NK-sejtek, monocyták/macrophagok és neutrophilek számában. Malignus és lymphoproliferativ betegségek A TNF-gátlókkal végzett, kontrollált klinikai vizsgálatok során a TNF-gátlót kapott betegek körében nagyobb számban észleltek malignomákat, beleértve a lymphomát, mint a kontroll-csoport betegeinél. Ez azonban ritkán fordult elő. A kockázat megítélését tovább nehezíti, hogy a lymphoma kialakulásának szempontjából alapvetően veszélyeztetettebbek azok a rheumatoid arthritisben szenvedő betegek, akiknek régóta fennálló, fokozott aktivitású, gyulladásos betegségük van. Jelenlegi ismereteink szerint a TNF-gátlókkal kezelt betegeknél a lyphoma vagy más malignus betegségek kialakulásának lehetséges rizikója nem zárható ki. Ezidáig nem végeztek vizsgálatokat Trudexa-kezeléssel olyan betegeken, akiknek kórtörténetében malignitás szerepelt, vagy a kezelés alatt malignus folyamatok jelentkeztek. Ezért ezen betegek Trudexa-kezelésbe való bevonásának mérlegelésekor fokozott elővigyázatosság szükséges (lásd 4.8 pont). Egy másik TNF-elleni szer, az infliximab hatásait középsúlyos-súlyos idült obstruktív tüdőbetegségben (COPD) értékelték egy előzetes klinikai vizsgálattal. Az infliximabbal kezelt betegeken több rosszindulatú (javarészt tüdő-, fej-, vagy nyaki) daganatot észleltek, mint a kontrollcsoportban. A kórelőzmény alapján mindegyik beteg erős dohányos volt. Ennélfogva, COPD-ban szenvedő, valamint az erős dohányzás miatt rosszindulatú daganat kialakulása szempontjából fokozottan veszélyeztetett betegeken körültekintően kell alkalmazni a TNF-antagonistákat. Hematológiai reakciók TNF gátló szerek használata kapcsán ritkán pancytopeniáról számoltak be, belelértve az aplasticus anaemiát is. A Trudexa kapcsán ritkán számoltak be hematológiai mellékhatásokról, köztük klinikailag jelentős cytopeniáról (pl. thrombocytopenia, leukopenia). Minden betegnél javasolt az azonnali orvosi felügyelet, amennyiben Trudexa-kezelés alatt a vérképváltozásra utaló jelek és tünetek jelentkeznek (pl. állandósult láz, véraláfutások, vérzés, sápadtság). A Trudexa-kezelés megszakítását fontolóra kell venni, ha a betegnél igazolt, jelentős hematológiai eltérések vannak. Védőoltások Egy vizsgálat 226 rheumatoid arthritises, adalimumabbal vagy placebóval kezelt résztvevőjén hasonló antitest-választ figyeltek meg a Pneumococcus 23 szerotípusát tartalmazó standard oltóanyaggal, valamint a trivalens influenza vírus vakcinával szemben. Nincs adat arról, hogy Trudexa-val kezelt betegek élő kórokozót tartalmazó vakcinával végzett védőoltása esetén bekövetkezhet-e a fertőzés másodlagos transzmissziója. A Trudexa-val kezelt betegeknek élő kórokozót tartalmazó vakcinák 6
7 kivételével adható egyidejűleg védőoltás. Pangásos szívelégtelenség Egy másik TNF- antagonistával végzett klinikai vizsgálat során a pangásos szívelégtelenség súlyosbodását illetve a pangásos szívelégtelenséggel összefüggésben levő halálesetek számának növekedését tapasztalták. A pangásos szívelégtelenség súlyosbodásáról szintén beszámoltak Trudexaval kezelt betegeknél. A Trudexa-t csak fokozott óvatossággal szabad használni enyhe szívelégtelenségben (NYHA I/II) szenvedők kezelésére. A Trudexa kontraindikált a középsúlyos-súlyos szívelégtelenség eseteiben (lásd 4.3 pont). A Trudexa-kezelést fel kell függeszteni minden olyan beteg esetében, akinél a pangásos szívelégtelenség rosszabbodása, illetve új tünet megjelenése tapasztalható. Autoimmun folyamatok A Trudexa-val való kezelés során auto-antitestek képződése előfordulhat. A Trudexa hosszútávú hatása az autoimmun betegségek kialakulására nem ismert. Ha a Trudexa alkalmazása után lupusszerű szindrómára utaló tünetek jelentkeznek, továbbá kettős szálú DNS elleni antitestek jelennek meg, akkor nem szabad folytatni a Trudexa adását (lásd 4.8 pont). TNF-antagonisták és anakinra együttadása Klinikai vizsgálatokban súlyos fertőzéseket tapasztaltak előnyösebb klinikai hatás nélkül anakinra és egy másik TNF-antagonista, az etanercept együttes adásakor, amennyiben a kombinált kezelés hatását az önmagában adagolt etanercept hatásával hasonlították össze. Az etanercept és anakinra kombinációs kezelésnél észlelt mellékhatások természete miatt hasonló toxicitás várható az anakinra és más TNF-antagonista kombinációnál is. Ezért az adalimumab és anakinra kombináció adása nem javasolt. Sebészet Sebészeti beavatkozások során Trudexa-val kezelt betegek körében biztonságossági tapasztalatok korlátozottan állnak rendelkezésre. Az adalimumab hosszú felezési idejét a tervezett műtéti beavatkozás során figyelembe kell venni. Trudexa-kezelés alatt műtéti beavatkozást igénylő beteget infekció tekintetében szorosan monitorizálni kell és megfelelő módon kell ellátni. Korlátozottak az ízületi plasztikai beavatkozások során Trudexa-val kezelt betegek körében a biztonságossági tapasztalatok. Vékonybél-elzáródás A Crohn-betegség miatt végzett kezelés hatástalansága műtéti kezelést igénylő, heges szűkület jelenlétére utalhat. A rendelkezésre álló adatok alapján a Trudexa nem idéz elő bélszűkületet, és nem is súlyosbítja a már kialakult stricturát. 4.5 Gyógyszerkölcsönhatások és egyéb interakciók A Trudexa-t vizsgálták monoterápiában, illetve metotrexát kombinációban szedő rheumatoid arthritises, valamint arthritis psoriaticában szenvedő betegek köreiben is. Ha a Trudexa-t kombinációban adták metotrexáttal az antitestképződés alacsonyabb volt (< 1%), mint monoterápiában. A Trudexa metotrexát nélküli alkalmazása fokozott antitestképződést, továbbá az adalimumab-clearance fokozódását és a hatékonyság csökkenését eredményezte (lásd 5.1 pont). 4.6 Terhesség és szoptatás Az adalimumabbal kapcsolatban nincsenek terhességre vonatkozó klinikai adatok. 7
8 Majmokban végzett fejlődés toxicitási vizsgálat során anyai, illetve embriótoxicitásra vagy teratogenitásra utaló eltérést nem észleltek. Az adalimumab postnatalis toxicitást okozó, illetve termékenységet befolyásoló hatására vonatkozó preklinikai adatok nem állnak rendelkezésre (lásd 5.3 pont). A TNF-alfa gátlást okozó hatása miatt, a terhesség alatt adott adalimumab befolyásolhatja az újszülött normális immunreakcióit. Az adalimumab alkalmazása nem javasolt terhességben. Fogamzásképes nőbetegek esetében fokozottan ajánlott a fogamzásgátlás a Trudexa-kezelés alatt, illetve az utolsó kezelést követő öt hónapban. A szoptatás alatti kezelésről Nem ismert, hogy az adalimumab kiválasztódik-e az anyatejbe illetve, hogy felszívódik-e a tápcsatornából. Tekintettel arra, hogy a humán immunglobulinok kiválasztódnak az anyatejbe, az utolsó Trudexa-kezelést követően legalább öt hónapon keresztül szoptatni nem szabad. 4.7 A készítmény hatásai a gépjárművezetéshez és gépek üzemeltetéséhez szükséges képességekre A készítménynek a gépjárművezetéshez és gépek üzemeltetéséhez szükséges képességeket befolyásoló hatásait nem vizsgálták. 4.8 Nemkívánatos hatások, mellékhatások Klinikai vizsgálatok A Trudexa-t 5293 beteg bevonásával tanulmányozták kontrollált és nyílt vizsgálatokban, legfeljebb 60 hónapig. Ezekbe a vizsgálatokba rövidebb vagy hosszabb ideje rheumatoid arthritisben és arthritis psoriaticában, spondylitis ankylopoeticában, vagy Crohn-betegségben szenvedő betegeket választottak be. Az 1. táblázat adatai (az I - IX, CLASSIC I, GAIN és CHARM) kontrollált vizsgálatokon (leírásuk az 5.1 pontban) alapulnak, melyek során 3271 beteg részesült Trudexa-kezelésben és 1809 beteg kapott placebót, vagy aktív összehasonlító gyógyszert az ellenőrzött periódusban. Azon betegek aránya, akik az I - IX, CLASSIC I, GAIN és CHARM vizsgálatok kettős-vak, kontrollált részében nemkívánatos események miatt abbahagyták a kezelést, a Trudexa-val kezelt betegcsoportban 5,7%, míg a kontroll kezelt betegeknél 5,3% volt. Nemkívánatos események, amelyek az I - IX, CLASSIC I, GAIN és CHARM vizsgálatokban klinikailag vagy laboratóriumilag valószínűsíthetően oki összefüggésben vannak az adalimumab alkalmazásával, szervrendszer és gyakoriság szerint (nagyon gyakori 1/10; gyakori 1/100 - < 1/10; nem gyakori 1/ < 1/100 és ritka < 1/1000) csoportosítva szerepelnek az 1. táblázatban. Az egyes gyakorisági kategóriákon belül a mellékhatások csökkenő súlyosság szerint kerülnek megadásra. 8
9 1. táblázat A klinikai vizsgálatok során tapasztalt nemkívánatos hatások Szervrendszer Gyakoriság Mellékhatások Fertőző betegségek és parazitafertőzések gyakori alsó légúti fertőzések (beleértve pneumonia, bronchitis), vírusfertőzések (beleértve influenza, herpeszvírusfertőzések), candidiasis, baktérium-fertőzések (beleértve húgyúti fertőzések), felső légúti fertőzés Jó-, rosszindulatú és nem meghatározott daganatok (beleértve a cisztákat és polipokat is) Vérképzőszervi és nyirokrendszeri betegségek és tünetek Immunrendszeri betegségek és tünetek nem gyakori ritka nem gyakori ritka gyakori nem gyakori ritka nem gyakori szepszis, opportunista fertőzések (beleértve tuberkulózis, histoplasmosis), tályog, ízületi fertőzés, sebfertőzés, bőrfertőzés (beleértve cellulitis és impetigo), felületes gombafertőzések (beleértve bőr-, köröm-, és lábgombásodás) fasciitis necrotisans, vírusos menigitis, diverticulitis bőr papilloma lymphoma, parenchymás szervek daganatai (beleértve emlő-, petefészek-, heretumor), a bőr laphámrákja lymphopenia neutropenia (beleértve agranulocytosis), leukopenia, thrombocytopenia, anémia, lymphadenopathia, leukocytosis, pancytopenia, idiopathiás thrombocytopeniás purpura szisztémás lupus erythematosus, angioödéma, gyógyszerérzékenység, szezonális allergia ritka szérumbetegség Endokrin betegségek és tünetek ritka pajzsmirigy-betegség (beleértve golyva) 9
10 Anyagcsere- és táplálkozási betegségek és tünetek nem gyakori ritka hypokalaemia, hyperlipidaemia, étvágyzavarok (beleértve anorexia), hyperuricaemia, hypercalcaemia Pszichiátriai kórképek nem gyakori hangulatzavarok, szorongás (beleértve idegesség és agitatio) Idegrendszeri betegségek és tünetek Szembetegségek és szemészeti tünetek A fül és az egyensúly-érzékelő szerv betegségei és tünetei Szívbetegségek és a szívvel kapcsolatos tünetek gyakori nem gyakori ritka gyakori nem gyakori ritka nem gyakori ritka nem gyakori ritka szédülés (beleértve vertigo), fejfájás, neurológiai érzészavarok (beleértve paraesthesia), syncope, migrén, tremor, alvászavarok sclerosis multiplex a szem fertőzése, irritációja, vagy gyulladása látászavarok, a szem érzészavarai, panophthalmitis, iritis, glaukóma tinnitus, fülpanaszok (beleértve fájdalom és duzzanat) halláscsökkenés szívritmuszavarok, tachycardia, palpitatio szívmegállás, koszorúérelégtelenség, angina pectoris, pericardialis folyadékgyülem Érbetegségek és tünetek nem gyakori hipertónia, bőrpír, haematoma Légzőszervi, mellkasi és mediastinalis betegségek és tünetek ritka gyakori nem gyakori érelzáródás, aortaszükület, thrombophlebitis, aortaaneurysma köhögés, nasopharingealis fájdalom asthma, nehézlégzés, diszfónia, orrdugulás 10
11 Emésztőrendszeri betegségek és tünetek Máj és epebetegségek illetve tünetek Bőr és a bőralatti szövetek betegségei és tünetei A csont-izomrendszer és a kötőszövet betegségei és tünetei Vese- és húgyúti betegségek és tünetek A nemi szervekkel és az emlőkkel kapcsolatos betegségek és tünetek ritka gyakori nem gyakori ritka gyakori ritka gyakori nem gyakori ritka gyakori ritka nem gyakori ritka nem gyakori tüdővizenyő, garatvizenyő, pleuralis folyadkgyülem, pleuritis hasmenés, hasi fájdalom, stomatitis és szájfekély, émelygés végbélvérzés, gastritis, hányás, dyspepsia, haspuffadás, székrekedés bélszűkület, colitis, enteritis, oesophagitis májenzimek aktivitásának fokozódása májnecrosis, hepatitis bőrkiütés, dermatitis és ekcéma, pruritus, hajhullás csalánkiütés, psoriasis, ecchymosis és fokozott suffusio, purpura erythema multiforme, panniculitis csont- és izomfájdalom rhabdomyolysis haematuria, vesekárosodás, húgyhólyag- és húgycsőpanaszok proteinuria, vesefájdalom a menstruációs ciklus és a méhvérzés rendellenességei 11
12 Általános tünetek, az alkalmazás helyén fellépő reakciók Laboratóriumi vizsgálatok eredményei Sérülés, mérgezés és a beavatkozással kapcsolatos szövődmények Beadást követő helyi reakció nagyon gyakori gyakori nem gyakori nem gyakori nem gyakori helyi reakció a beadás helyén (beleértve fájdalom, duzzadás, bőrpír vagy viszketés) láz, fáradtság (beleértve gyengeség és rossz közérzet) mellkasi fájdalom, ödéma, influenzaszerű betegség fokozott kreatin-foszfokinázaktivitás a szérumban, megnyúlt aktivált parciális thromboplasztin idő, autoantitestek megjelenése baleseti sérülés, sebgyógyulási zavar A 12 kontrollált vizsgálatban, a Trudexa-val kezelt betegek 16%-ánál alakult ki lokális reakció az injekció helyén (bőrpír és/vagy viszketés, véraláfutás, fájdalom vagy duzzadás), míg a placebo vagy aktív kontroll csoportban a betegek 10%-ánál. A helyi reakciók általában nem tették szükségessé a kezelés felfüggesztését. Fertőzések A tizenkét kontrollált vizsgálatban a fertőzések arányszáma a Trudexa-val kezelt csoportban betegévenként 1,49 volt, míg beteg-évenként 1,42 volt a placebo és az aktív kontroll kezelt beteg csoportjában. A fertőzések döntő többsége felső légúti infekció, bronchitis és húgyúti fertőzés volt. A Trudexa-kezelést a fertőzés megszűnését követően a betegek nagy részénél folytatni lehetett. A súlyos fertőzések incidenciája 0,03 volt beteg-évenként a Trudexa-t kapottak csoportjában, míg 0,03 volt beteg-évenként a placebóval és az aktív kontroll kezelt betegek csoportjában. A Trudexa-val végzett kontrollált és a nyílt vizsgálatokban súlyos fertőzésekről (beleértve halálos kimenetelű fertőzést, amely csak ritkán fordult elő) számoltak be többek között tuberkulózisról (miliaris és extrapulmonális előfordulással) és invazív opportunista fertőzésekről (pl. disszeminált histoplasmosis, Pneumocystis carinii pneumonia, aspergillosis és listeriosis). A tuberkulózisos megbetegedések többsége a Trudexa-kezelés első 8 hónapjában következett be, és korábbi betegség kiújulásaként manifesztálódhatott. Rosszindulatú és lymphoproliferativ betegségek A Trudexa hatásait közepes-erős aktivitású rheumatoid arthritisben, arthritis psoriaticában, spondylitis ankylopoeticában vagy Crohn-betegségben szenvedő betegeken értékelő 10, legalább 12 hét időtartamú vizsgálat (I - IX és CHARM) kontrollált szakaszaiban a következőképpen alakult a rosszindulatú daganatok gyakorisága (a lymphoma és a nem melanomás bőrrák kivételével): az 1000 beteg-évre számított gyakoriság (95%-os konfidencia intervallum) a 2887 Trudexa-val kezelt beteg esetében 5,7 (3,3, 10,1), míg az 1570 fős kontroll-csoportban 4,1 (1,5, 10,9) volt. (A kezelés medián 12
13 időtartama a Trudexa-csoportban 5,7 hónap, a kontroll-csoportban 5,5 hónap volt.) A nem melanomás bőrrák 1000 beteg-évre számított gyakorisága (95%-os konfidencia intervallum) ugyanebben a sorrendben 7,6 (4,7, 12,4), illetve 2,0 (0,5, 8,2) volt. Ezek közül a bőrrákok közül, a squamosus sejt carcinoma 1000 beteg-évre számított gyakorisága (95%-os konfidencia intervallum) a Trudexa-csoportban 2,4 (1,0, 5,7). A kontroll-csoportban ez a daganat nem fordult elő. A lymphomák 1000 beteg-évre vetített gyakorisága (95%-os konfidencia intervallum) a Trudexa-val kezelt betegek körében 1,0 (0,2, 3,8), a kontrollok esetében 1,0 (0,1, 7,3) volt. Tíz vizsgálat (I - IX és a CHARM) kontrollos szakaszainak és a vizsgálatok folyamatban lévő nyílt kiterjesztéseinek összevont értékelésekor összesen 4843 beteg kb. 2,6 év medián időtartama több mint beteg-év kezelés során a (lymphomát és a nem melanomás bőrrákot figyelmen kívül hagyva) rosszindulatú daganatok 1000 beteg-évre számított gyakorisága 13,6 volt. A nem melanomás bőrrák 1000 beteg-évre vetített, megfigyelt aránya kb. 9,0, míg a lymphomáké 1,2 volt. A Trudexa forgalomba hozatala (2003. január) után, javarészt rheumatoid arthritises betegeken szerzett tapaszalatok alapján, a rosszindulatú daganatok bejelentett gyakorisága kb. 1,7/1000 beteg-év a lymphomákat és a nem melanomás bőrrákot figyelmen kívül hagyva. Az utóbbiak 1000 beteg-évre számított gyakorisága (sorrendben) 0,2, illetve 0,4 (lásd a 4.4 pontban). Autoantitestek A betegektől vett vérsavó mintákban különböző időpontokban vizsgálták az autoantitesteket az I - V. rheumatoid arthritis vizsgálatokban. Ezekben a vizsgálatokban, a negatív kiindulási antinukleáris antitest titerrel rendelkező betegek közül a Trudexa-val kezeltek 11,9%-ánál, míg a placebo és aktív kontroll kezelt betegek 8,1%-ánál fejlődött ki antinukleáris antitest titer pozitivitás a 24. hétre. Az összes rheumatoid arthritis és arthritis psoriatica vizsgálatban a 3441 Trudexa-val kezelt beteg közül 2-nél alakultak ki újonnan fellépő lupus-szerű szindróma klinikai jelei. A beteg állapota javult, amint a kezelést abbahagyták. Egy beteg esetében sem alakult ki lupus-nephritis vagy központi idegrendszeri tünet. Májenzim emelkedések Rheumatoid arthritis klinikai vizsgálatok:a kontrollált rheumatoid arthritis klinikai vizsgálatokban (I - IV vizsgálatok) az ALT fokozódása hasonló volt az adalimumab-mal kezelt betegekben és a placebocsoportban. A rheumatoid arthritis korai szakaszában lévő betegekben (a betegség időtartama kevesebb mint 3 év) (V. vizsgálat) az ALT fokozódása sokkal gyakoribb volt a kombinált kezelési ágon (Trudexa/metotrexát), mint a metotrexát vagy a Trudexa monoterápia ágakon. Arthritis psoriatica klinikai vizsgálatok: Az ALT fokozódása gyakoribb volt az arthritis psoriaticában szenvedő betegekben (VI - VII vizsgálatok), mint a rheumatoid arthritis klinikai vizsgálatok betegeiben. Az összes vizsgálatban (I - VII) a magasabb ALT-vel rendelkező betegek tünetmentesek voltak, a legtöbb esetben az emelkedés átmeneti volt és megszűnt a folyamatos kezelés során. Crohn-betegségben végzett klinikai vizsgálatok: A kontrollos klinikai vizsgálatok során adalimumabbal vagy placebóval kezelt betegeken hasonló mértékű volt az ALT aktivitás fokozódása. További mellékhatások a posztmarketing megfigyelésekben, vagy IV-es fázisú klinikai vizsgálatokban További mellékhatások (2. táblázat), melyeket postmarketing megfigyelések során vagy IV-es fázisú klinikai vizsgálatokban tapasztaltak: 13
14 2. táblázat Nemkívánatos hatások posztmarketing megfigyelésekben és IV-es fázisú klinikai vizsgálatokban Szervrendszer Máj-, epebetegségek Idegrendszeri betegségek Légzőszervi, mellkasi és mediastinalis betegségek A bőr és a bőr alatti szövetek betegségei Immunrendszeri betegségek 4.9 Túladagolás Mellékhatások hepatitis B reaktivációja demyelinisatiós betegségek (pl. neuritis optica) interstitialis tüdőbetegségek, beleértve pulmonalis fibrosis cutan vasculitis anafilaxia A klinikai vizsgálatok során nem észleltek dózis-korlátozó toxicitásra utaló jeleket. A legmagasabb vizsgált dózis az intravénásan beadott 10 mg/kg-os dózis többszöröse volt. 5. FARMAKOLÓGIAI TULAJDONSÁGOK 5.1 Farmakodinámiás tulajdonságok Farmakoterápiás csoport: Szelektív immunszupresszív szerek. ATC kód: L04AA17 Hatásmechanizmus Az adalimumab specifikusan kötődik a TNF-hez és semlegesíti a TNF biológiai hatását, megakadályozva a TNF interakcióját a p55 és p75 sejtfelszíni TNF receptorokkal. Továbbá az adalimumab módosítja a biológiai válaszokat, melyeket a TNF indukál, illetve szabályoz, beleértve a leukocyták vándorlásáért felelős adhéziós molekulák szintjeinek változtatását (ELAM-1, VCAM-1 és ICAM-1, melyek IC 50 értékei 1-2x10-10 M). Farmakodinámiás hatás A rheumatoid arthritisben szenvedő betegek Trudexa-val való kezelését követően gyors csökkenés tapasztalható az akut fázis fehérjék (C reaktív protein-crp), a süllyedés, illetve a citokinek (IL-6) szintjeiben összehasonlítva a kezelés előtti kiindulási értékekkel. A porcszövet pusztulását eredményező szöveti remodelingért felelős matrix metalloproteinázok (MMP-1 és MMP-3) szérum szintjeiben is csökkenés tapasztalható a Trudexa alkalmazása után. A Trudexa-val kezelt betegeknél rendszerint a krónikus gyulladás hematológiai leleteiben is javulás tapasztalható. A CRP-szint gyors ütemű csökkenését Crohn-betegségben szenvedő betegekben is megfigyelték. Klinikai vizsgálatok Rheumatoid arthritis A Trudexa-t több mint 3000 betegen vizsgálták az összes rheumatoid arthritises klinikai vizsgálatok során. Néhány beteg legfeljebb 60 hónapig tartó kezelést kapott. A Trudexa-kezelés biztonságosságát és hatásosságát rheumatoid arthritis indikációban öt randomizált, kettősvak, jól-kontrollált vizsgálattal mérték fel. Az I. vizsgálatban 271 beteget értékeltek. A résztvevők mind középsúlyos-súlyos aktív rheumatoid arthritisben szenvedő 18 éves és 18 évesnél idősebb betegek voltak, akiknél legalább egy betegséget befolyásoló reumaellenes gyógyszer nem járt eredménnyel és a metotrexát heti 12,5-25 mg-os (10 mg 14
15 metotrexát intolerantia esetén) dózisaival sem lehetett kielégítő hatást elérni, és azok a betegek, akik tartósan heti mg dózisban kaptak metotrexátot. A vizsgálat során 20, 40 illetve 80 mg Trudexa-t vagy placebót kaptak minden második héten, 24 héten át. A II. vizsgálatban 544 beteget értékeltek. A betegek mind középsúlyos-súlyos rheumatoid arthritisben szenvedtek, 18 éves és 18 évesnél idősebb betegek, esetükben legalább egy betegséget befolyásoló reumaellenes gyógyszer alkalmazása nem járt eredménnyel. Húsz illetve 40 mg Trudexa-t kaptak subcutan injekció formájában minden második héten, placebóval az alternáló heteken vagy minden héten 26 héten át; illetve placebót kaptak minden héten azonos időtartamban. Egyéb betegséget befolyásoló reumaellenes gyógyszert nem kaphattak. A III. vizsgálatban 619 beteget értékeltek. A betegek mind középsúlyos-súlyos aktív rheumatoid arthritisben szenvedtek, 18 éves és 18 évesnél idősebb betegek, esetükben hetente 12,5 mg-tól 25 mg-ig (metotrexát intolerancia esetén 10 mg) terjedő dózisban szedett metotrexát elégtelennek bizonyult és azok a betegek, akik tartósan hetente 10 mg-tól 25 mg-ig terjedő dózisban szedték a metotrexátot. Ebben a vizsgálatban a betegeket három csoportra osztották. Az első csoportba tartozók placebo injekciót kaptak minden héten 52 héten át. A második csoport tagjai 20 mg Trudexa-t kaptak hetente 52 héten át. A harmadik csoport 40 mg Trudexa-t kapott minden második héten és placebo injekciót az alternáló heteken. Ezt követően a betegeket egy nyílt, kiterjesztett fázásba választották be, melynek során kéthetente 40 mg Trudexa-t kaptak, legfeljebb 60 hónapig. A IV. vizsgálat elsősorban a kezelés biztonságosságát volt hivatott felmérni. Ebbe a vizsgálatba 636 középsúlyos-súlyos rheumatoid arthritisben szenvedő, 18 éves és 18 évesnél idősebb beteget vontak be. A vizsgálatban részt vevő betegek vagy soha nem szedtek betegséget befolyásoló reumaellenes szereket, vagy a korábban alkalmazott anti-rheumás kezelésüket folytatták, ha a kezelés legalább 28 napig változatlan volt. A kezelések metotrexát, leflunomid, hidroxiklorokin, szulfaszalazin és/vagy arany sók alkalmazását foglalták magukba. A betegeket 40 mg Trudexa vagy placebo adására randomizálták, a kezelést minden második héten 24 héten át kapták. Az V. vizsgálatban 799 felnőtt, középsúlyos-súlyos, aktív korai (betegség kezdete < 9 hónap) rheumatoid arthritisben szenvedő, metotrexáttal még nem kezelt beteget vizsgáltak. A vizsgálat 104 hétig tartó időszaka alatt a kéthetente egyszer metotrexát kombinációban adott 40 mg Trudexa, 40 mg Trudexa monoterápia, illetve metotrexát monoterápia hatását vizsgálták arra vonatkozóan, hogy a betegség jelei, megjelenése, illetve rheumatoid arthritisben az ízületi károsodás előrehaladásának folyamata csökken-e. Az I., II., és III. vizsgálatokban az elsődleges végpont, míg a IV. vizsgálatban a másodlagos végpont azon betegek százalékos aránya volt, akik a 24 illetve 26 hét leteltével egy ACR 20-as választ produkáltak. Az V. vizsgálatban az elsődleges végpont az ACR 50-es választ adó betegek százalékos aránya volt a vizsgálat 52. hetében. A III. és V. vizsgálatban másik elsődleges végpontot jelentett 52 hét után a betegség progressziójának lassulása (röntgenfelvételek alapján). A III. vizsgálatban elsődleges végpont volt még az életminőség megváltozása. ACR válasz Az ACR 20, 50 vagy 70-es választ produkáló Trudexa-kezelt betegek százalékos aránya állandó volt az I., II., és III. vizsgálatokban. Minden második héten adott 40 mg-os dózissal elért eredmények összefoglalása található a 3. táblázatban. 3. táblázat: ACR válasz placebo-kontrollos vizsgálatokban (Betegek százaléka) Válasz I. vizsgálat a** II. vizsgálat a** III. vizsgálat a** Placebo/ MTX c n=60 Trudexa b / MTX c n=63 Placebo n=110 Trudexa b n=113 Placebo/ MTX c n=200 Trudexa b / MTX c n=207 ACR 20 15
16 6 hónap 13,3% 65,1% 19,1% 46,0% 29,5% 63,3% 12 hónap NA NA NA NA 24,0% 58,9% ACR 50 6 hónap 6,7% 52,4% 8,2% 22,1% 9,5% 39,1% 12 hónap NA NA NA NA 9,5% 41,5% ACR 70 6 hónap 3,3% 23,8% 1,8% 12,4% 2,5% 20,8% 12 hónap NA NA NA NA 4,5% 23,2% a I. vizsgálat 24. héten, II. vizsgálat 26. héten, III. vizsgálat 24. és 52. héten b 40 mg Trudexa minden második héten alkalmazva c MTX = metotrexát ** p < 0,01, Trudexa kontra placebo NA: nincs adat Az I - IV. vizsgálatokban az ACR választ alkotó kritériumok (duzzadt és érzékeny ízületek száma, a beteg és az orvos értékelése a betegség aktivitásáról és a fájdalomról, rokkantsági index (HAQ), CRP (mg/dl) értéke) mindegyike egyénileg is javulást mutatott 24 illetve 26 hét elteltével a placebo csoporthoz képest. A III vizsgálatban ez a javuló tendencia 52 héten át tartott. Ezt követően az ACR válasz mértéke a nyílt, kiterjesztett fázisban is a betegek nagyobb részében a 104. hétig fennmaradt. A 207 beteg közül 60 hónapig 114 továbbra is kapott minden második héten 40 mg Trudexa-t. Közülük sorrendben 86, 72 és 41 betegnél volt ACR 20/50/70-es válasz a 60. hónapban. A IV. vizsgálatban, a Trudexa-val és a standard terápiával kezelt betegek szignifikánsan jobb ACR 20- as választ értek el mint a placebóval és a terápiával kezeltek (p < 0,001). Az I - IV. vizsgálatban, a Trudexa-val kezelt betegek statisztikailag szignifikánsan jobb ACR 20-as és 50-es választ értek el a placebo csoporttal összehasonlítva, már egy vagy két héttel a vizsgálat kezdete után. Az V. vizsgálatban, amelybe korábbi metotrexát kezelés nélkül korai rheumatoid arthritises betegeket vontak be, a kombinációs kezelés metotrexáttal gyorsabb és jelentősen nagyobb ACR választ adott, mint a metotrexát, vagy a Trudexa monoterápia az 52. héten és a hatás fennmaradt a 104. hétig (lásd 4. táblázat). 4. táblázat: ACR válasz az V. vizsgálatban (a betegek százaléka) Válasz MTX Trudexa Trudexa/MTX p-érték a p-érték b p-érték c (n=257) (n=274) (n=268) ACR hét 62,6% 54,4% 72,8% 0,013 < 0,001 0, hét 56,0% 49,3% 69,4% 0,002 < 0,001 0,140 ACR hét 45,9% 41,2% 61,6% < 0,001 < 0,001 0, hét 42,8% 36,9% 59,0% < 0,001 < 0,001 0,162 ACR hét 27,2% 25,9% 45,5% < 0,001 < 0,001 0, hét 28,4% 28,1% 46,6% < 0,001 < 0,001 0,864 a = a p-érték a metotrexát monoterápia és a Trudexa/metotrexát kombinációs terápia páros összehasonlítása alapján Mann-Whitney U teszt szerint b = a p-érték a Trudexa monoterápia és a Trudexa/metotrexát kombinációs terápia páros összehasonlítása alapján Mann-Whitney U teszt szerint c = a p-érték a Trudexa monoterápia és a metotrexát monoterápia páros összehasonlítása alapján Mann-Whitney U teszt szerint Az 52. héten a Trudexa/metotrexát kombinációval kezelt betegek 42,9%-a klinikai remisszióba került (DAS28 < 2,6) összehasonlítva a metotrexát monoterápiát kapó 20,6% és Trudexa monoterápiában 16
17 részesült 23,4% beteggel. A Trudexa/metotrexát kombinációs terápia klinikailag és statisztikailag jobb volt, mint a metotrexát (p < 0,001) és Trudexa monoterápia (p < 0,001), a betegek alacsony betegség szintet értek el amennyiben korai mérsékelt-súlyos rheumatoid arthritisük volt. A két monoterápiás karon kapott válasz hasonló volt (p = 0,447). Radiológiai válasz A III vizsgálatban, amelyben a Trudexa-val kezelt betegek rheumatoid arthritise átlagosan 11 éve fennállt, az ízületek szerkezeti károsodását radiológiailag értékelték és a változást módosított teljes Sharp pontértékkel és összetevőivel az eróziós pontértékkel és az ízületi rés beszűkülésének pontértékével fejezték ki. Trudexa-val/metotrexáttal kezelt betegeknél szignifikánsan kisebb mértékű radiológiai progressziót mutattak ki, mint a 6 és 12 hónapig csak metotrexáttal kezelt betegeknél (lásd 5. táblázat). A nyílt, kiterjesztett fázis adatai jelzik, hogy a strukturális károsodás progressziójának csökkent mértéke 60 hónapig fenntartható a betegek egy részénél. Az eredetileg minden második héten 40 mg Trudexa-val kezelt 207 beteg közül 113-at értékeltek radiológiailag az 5. évnél. Közülük 66 betegnél nem észlelték a strukturális károsodás progresszióját, melynek definíciója a Teljes Sharp pontértékben bekövetkezett 0 vagy még alacsonyabb változás volt. 5. táblázat: A III. vizsgálatban észlelt radiológiai változások átlaga 12 hónapot követően Teljes Sharp pontérték Placebo/ MTX a TRUDEXA/MTX 40 mg kéthetente Placebo/MTX- TRUDEXA/MTX (95%-os konfidencia intervallum) P-érték 2,7 0,1 2,6 (1,4, 3,8) < 0,001 c Eróziós pontérték 1,6 0,0 1,6 (0,9, 2,2) < 0,001 JSN d pontérték 1,0 0,1 0,9 (0,3, 1,4) 0,002 a metotrexát b 95%-os konfidencia intervallum a metotrexát és a Trudexa score változása közötti különbségre c rank analízis alapján dj Ízületi rés beszűkülése (JSP-Joint Space Narrowing) Az V. vizsgálatban az ízületi károsodást radiológiailag is megerősítették és módosított teljes Sharp pontokban fejezték ki (lásd 6. tábl.). 6. táblázat: Radiográfiás átlagos változások az 52. héten az V. vizsgálatban MTX Trudexa Trudexa/MTX p-érték a p-érték b p-érték c n=257 (95%-os konfidencia intervallum n=274 (95%-os konfidencia intervallum) n=268 (95%- os konfidencia intervallum) Teljes 5,7 (4,2-7,3) 3,0 (1,7-4,3) 1,3 (0,5-2,1) < 0,001 0,0020 < 0,001 Sharp pont Eróziós 3,7 (2,7-4,7) 1,7 (1,0-2,4) 0,8 (0,4-1,2) < 0,001 0,0082 < 0,001 pont JSN pont 2,0 (1,2-2,8) 1,3 (0,5-2,1) 0,5 (0-1,0) < 0,001 0,0037 0,151 17
18 a = a p-érték a metotrexát monoterápia és a Trudexa/metotrexát kombinációs terápia páros összehasonlítása alapján Mann-Whitney U teszt szerint b = a p-érték a Trudexa monoterápia és a Trudexa/metotrexát kombinációs terápia páros összehasonlítása alapján Mann-Whitney U teszt szerint c = a p-érték a Trudexa monoterápia és a metotrexát kombinációs terápia páros összehasonlítása alapján Mann-Whitney U teszt szerint Ötvenkét, illetve 104 hétig tartó kezelés után a progresszió nélküli betegek százaléka (a módosított total Sharp pont alapértéke < 0,5-től való eltérés) jelentősen magasabb volt a Trudexa/metotrexát kombinációs kezelésben részesült betegeknél (63,8%, illetve 61,2%) összehasonlítva a metotrexát monoterápia eredményével (37,4% és 33,%, p < 0,001) és Trudexa monoterápiával (50,7%, p < 0,002 és 44,5%, p < 0,001). Életminőség és fizikai aktivitás Az Egészségfelmérő Kérdőív (Health Assessment Questionnaire-HAQ) rokkantsági indexének segítségével a négy eredeti vizsgálatban vizsgálták az egészség-függő életminőséget és fizikális működést, illetve a III. vizsgálatban ez egy előre megállapított elsődleges végpontja volt a vizsgálatnak az 52. héten. A Trudexa, adagolási módtól és dózistól függetlenül, a vizsgálatok mindegyikében a vizsgált hat hónap alatt statisztikailag szignifikáns javulást eredményezett a HAQ rokkantsági indexében a placebóval összehasonlítva és a III. vizsgálatban ugyanezt észlelték az 52. héten. A Rövid Egészségfelmérés (Short Form Health Survey (SF 36)) eredményei is alátámasztják a fentieket, hogy a Trudexa, függetlenül az adagolás módjától és dózisától mind a négy vizsgálatban javulást mutatott. A fizikális komponensre (PCS) adott értékek, illetve a másodhetente alkalmazott 40 mg-os dózis esetében a fájdalmat valamint a vitalitást mérő értékek is statisztikailag szignifikáns javulást mutattak a placebóhoz képest. A krónikus betegségek terápiájának funkcionális felmérését szolgáló kérdőívben a fáradtságra adott értékek alapján statisztikailag jelentős javulás állapítható meg mindhárom vizsgálatban, amelyben ezt kiértékelték (I., III., IV. vizsgálatok). A III vizsgálatban a nyílt kezelés során a fizikai funkció 260 héten (60 hónap) keresztül fenntartható volt. Az életminőség javulását legfeljebb 156 hétig (36 hónap) mérték, és a javulás ezalatt az idő alatt fennmaradt. Az V. vizsgálatban az 52. héten a HAQ rokkantsági indexben és az SF 36 fizikai összetevőiben mutatkozó javulás nagyobb volt (p < 0,001) a Trudexa/metotrexát kombinációs kezelést kapott csoportban, mint a metotrexát és Trudexa monoterápiákban. Ezek a változások a 104. hétig fennálltak. Arthritis psoriatica A 40 mg Trudexa hatását kéthetenkénti egyszeri adagolással középsúlyos súlyos aktív arthritis psoriaticában szenvedő betegeken vizsgálaták 2 placebo-kontrollált vizsgálatban, a VI. és VII. vizsgálatban. A VI. vizsgálat 24 hét időtartammal folyt, 313 felnőtt, nem-szteroid gyulladáscsökkentőre nem reagáló beteg vett részt benne, akiknek kb. 50%-a metotrexátot kapott. A 12 hétig tartó VII. vizsgálatban 100 olyan beteget kezeltek, akik nem megfelelő választ adtak a DMARD kezelésre. A betegek kis száma miatt nincs meggyőző bizonyíték a Trudexa hatékonyságára spondylitis ankylopoetica-szerű psoriazisos arthropathiában (lásd 7. táblázat). 7. táblázat: ACR válasz placebo-kontrollált arthritis psoriaticában (betegek százaléka) VI. vizsgálat VII. vizsgálat Válasz Placebo (N=162) Trudexa (N=151) Placebo (N=49) Trudexa (N=51) ACR hét 14% 58% *** 16% 39% * 18
19 24. hét 15% 57% *** N/A N/A ACR hét 4% 36% *** 2% 25% *** 24. hét 6% 39% *** N/A N/A ACR hét 1% 20% *** 0% 14% * 24. hét 1% 23% *** N/A N/A *** = p < 0,001 minden összehasonlításra Trudexa és placebo között * = p < 0,05 minden összehasonlításra Trudexa és placebo között N/A nincs adat A VI. vizsgálatban az ACR válaszok hasonlóak voltak az alkalmazott metotrexát kombinációtól függetlenül (vele vagy nélküle). A Trudexa-val kezelt betegek a fizikai funkcióban javulást értek el, amit a HAQ és az SF 36 vizsgálatok is igazoltak a kiindulási szinttől (base-line) a 24. hétig. Spondylitis ankylopoetica A 40 mg Trudexa hatását kéthetenkénti egyszeri adagolással 393 aktív spondylitis ankylopoeticában szenvedő olyan betegen vizsgálták két, randomizált, 24 hetes, kettős-vak, placebo-kontrollos vizsgálatban (betegség aktivitásának átlagos pontértéke [Bath Ankylosing Spondilitis Disease Activity Index (BASDAI)] 6,3% volt mindegyik csoportban), akik nem adtak megfelelő választ a szokásos kezelésre. 79 beteg (20,1%) kezelését megszakítás nélkül, a betegséget befolyásoló reumaellenes szerekkel folytatták, és 37 beteget (9,4%) glükokortikoiddal kezeltek. A vak szakaszt egy nyílt vizsgálati fázissal folytatták, amelynek során a betegek kéthetente subcutan 40 mg Trudexa-t kaptak, további 28 héten keresztül. Azok a betegek, akik nem érték el az ASAS 20-at (n = 215, 54,7%) a 12. vagy a 16. vagy a 20. hétre a nyílt, kéthetente 40 mg adalimumab subcutan kezelésből korai kizárásra kerültek, és ezután nem reagálóként dolgozták fel a kettős-vak statisztikai elemzés során. Egy 315 betegen végzett nagyobb klinikai vizsgálatban (VIII) az eredmények a spondylitis ankylopoetica jeleinek és tüneteinek statisztikailag szignifikáns javulását mutatták a Trudexa-val kezelt betegek körében, a placebóval kezeltekhez képest. Szignifikáns hatást először a 2. héten észleltek, ami 24 héten keresztül fennmaradt (8. táblázat). 8. táblázat Hatásosságot mutató válaszreakciók placebo-kontrollos AS vizsgálatban VIII. vizsgálat Válasz ASAS a 20 Jelek és tünetek csökkenése Placebo N=107 Trudexa N= hét 16% 42%*** 12. hét 21% 58%*** 14. hét 19% 51%*** ASAS hét 3% 16%*** 12. hét 10% 38%*** 14. hét % 35%*** ASAS hét 0% 7%** 19
20 12. hét 5% 23%*** 14. hét 8% 24%*** BASDAI b hét 4% 20%*** 12. hét 16% 45%*** 14. hét 15% 42%*** ***,**Statisztikailag szignifikáns különbség (p < 0,001, < 0,01) a Trudexa- és a placebo-csoportok között a 2, 12 és 24. hétben is a ASsessments in Ankylosing Spondylitis (értékelés spondylitis ankylopoeticában) (ASAS értékeket [20, 50, 70] elérők aránya) b Bath Ankylosing Spondylitis Disease Activity Index (BAS Betegség Aktivitási Index) Trudexa-val kezelt betegek szignifikánsan nagyobb mértékű javulást mutattak a 12. héten mind a SF36-ban, mind az Ankylosing Spondylitis Quality of Life Questionnaire (ASQoL) (Spondylitis ankylopoetica Életminőség Kérdőív) alapján, ami 24 héten keresztül fennmaradt. Hasonló trendeket (nem minden esetben statisztikailag szignifikáns) észleltek egy kisebb, 82 aktív spondylitis ankylopoeticában szenvedő beteg bevonásával végzett randomizált, kettős-vak, placebo-kontrollos vizsgálatban (IX). Crohn-betegség A Trudexa biztonságosságát és hatékonyságát több mint 1400, középsúlyos-súlyos aktivitású Crohn-betegségben (CDAI [Crohn s Disease Activity Index Crohn-betegség aktivitási index] ) szenvedő betegen értékelték randomizált, kettős-vak, placebo-kontrollos vizsgálattal. A beválasztott betegek közül 478 (32%) betegsége a javallatokban meghatározott populációnak (lásd 4.1 pont) megfelelően súlyos volt (CDAI pontszám > 300 és kortikoszteroidokat és/vagy immunszuppresszív szereket is kaptak egyidejűleg). Az aminoszalicilátok, kortikoszteroidok és/vagy immunmodulánsok alkalmazását változatlan dózisban engedélyezték; e szerek legalább egyikét a betegek 79%-a továbbra is kapta. A klinikai remisszió indukcióját (meghatározás szerint CDAI < 150) két vizsgálat (a CLASSIC I és a GAIN) értékelte. A CLASSIC I vizsgálatban 299, TNF-antagonistával korábban még nem kezelt beteget soroltak véletlenszerűen a négy terápiás csoport valamelyikébe (placebo-kezelés a 0. és a 2. héten; 160 mg Trudexa a 0. és 80 mg a 2. héten; 80 mg Trudexa a 0. és 40 mg a 2. héten; 40 mg Trudexa a 0. és 20 mg a 2. héten). A GAIN-vizsgálatban 325 beteget, akinél hatástalanná vált az infliximab, vagy infliximab-intolerancia állt fenn, véletlenszerű besorolás alapján a 0. héten 160 mg, illetve a 2. héten 80 mg Trudexa-val vagy a 0. és a 2. héten adott placebóval kezeltek. A primer nem reagálókat kizárták a vizsgálatokból, ezért ezeket a betegeket a továbbiakban nem értékelték. A klinikai remisszió fenntartását a CHARM-vizsgálat értékelte. Ennek során 854 beteget kezeltek nyílt vizsgálati elrendezésben, a 0. héten 80 mg, a 2. héten 40 mg dózissal. A 4. héten a résztvevőket véletlenszerűen sorolták be minden második héten 40 mg dózissal, hetente 40 mg dózissal vagy placebóval kezelt csoportba, összességében 56 hetes vizsgálati időtartammal. A kezelés 4. hetében a klinikailag reagáló (a CDAI 70 pontos csökkenése) betegek csoportját rétegezték, és eredményeiket a kezelésre a 4. hétig klinikailag nem reagáló betegekétől különválasztva értékelték. A 8. hét után engedélyezték a kortikoszteroid fokozatos csökkentését. A 9. táblázat a CLASSIC I és a GAIN-vizsgálat során kiváltott remisszió gyakoriságát és a kezelésre reagáló betegek részarányát összegezi. 20
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Humira 40 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós üvegben. Az adalimumab egy
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Humira 40 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós üvegben. Az adalimumab egy
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Humira 40 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós üvegben. Az adalimumab egy
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Humira 40 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós üvegben. Az adalimumab egy
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 40 mg/0,8 ml oldatos injekció gyermekgyógyászati alkalmazásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 40 mg/0,8 ml oldatos injekció gyermekgyógyászati alkalmazásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 40 mg/0,8 ml oldatos injekció gyermekgyógyászati alkalmazásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 40 mg/0,8 ml oldatos injekció gyermekgyógyászati alkalmazásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós
I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Humira 40 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós üvegben. Az
I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Humira 40 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós üvegben. Az
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Humira 40 mg/0,8 ml oldatos injekció gyermekgyógyászati alkalmazásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Humira 40 mg/0,8 ml oldatos injekció gyermekgyógyászati alkalmazásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos
Az Enbrel önmagában is alkalmazható a metotrexátra való túlérzékenység esetén, vagy akkor, ha a metotrexáttal való folyamatos kezelés nem alkalmas.
 1. A GYÓGYSZER MEGNEVEZÉSE Enbrel 50 mg oldatos injekció előretöltött injekciós tollban 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 50 mg etanercept előretöltött injekciós tollanként. Az etanercept egy humán
1. A GYÓGYSZER MEGNEVEZÉSE Enbrel 50 mg oldatos injekció előretöltött injekciós tollban 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 50 mg etanercept előretöltött injekciós tollanként. Az etanercept egy humán
Országos Egészségbiztosítási Pénztár tájékoztatója a tételes elszámolás alá eső hatóanyagok körének bővítéséről
 Országos Egészségbiztosítási Pénztár tájékoztatója a tételes elszámolás alá eső hatóanyagok körének bővítéséről Az egészségügyért felelős miniszter 2011. december 23-i rendeletében módosította az egészségügyi
Országos Egészségbiztosítási Pénztár tájékoztatója a tételes elszámolás alá eső hatóanyagok körének bővítéséről Az egészségügyért felelős miniszter 2011. december 23-i rendeletében módosította az egészségügyi
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Enbrel 25 mg por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 25 mg etanercept injekciós üvegenként. Az etanercept egy humán
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Enbrel 25 mg por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 25 mg etanercept injekciós üvegenként. Az etanercept egy humán
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE STELARA 45 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 45 mg/0,5 ml usztekinumab injekciós üvegenként. Az usztekinumab egér myeloma
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE STELARA 45 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 45 mg/0,5 ml usztekinumab injekciós üvegenként. Az usztekinumab egér myeloma
1. A GYÓGYSZER NEVE 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL. 1 adag (1 ml) tartalma: Hepatitisz B felszíni antigén 1,2. 20 mikrogramm
 1. A GYÓGYSZER NEVE Engerix-B szuszpenziós injekció felnőtteknek Engerix-B szuszpenziós injekció előretöltött fecskendőben felnőtteknek Hepatitisz B (rekombináns DNS) vakcina (adszorbeált) (HBV) 2. MINŐSÉGI
1. A GYÓGYSZER NEVE Engerix-B szuszpenziós injekció felnőtteknek Engerix-B szuszpenziós injekció előretöltött fecskendőben felnőtteknek Hepatitisz B (rekombináns DNS) vakcina (adszorbeált) (HBV) 2. MINŐSÉGI
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 20 mg oldatos injekció előretöltött fecskendőben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 20 mg adalimumab 0,2 ml-es, egyadagos injekciós üvegben.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 20 mg oldatos injekció előretöltött fecskendőben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 20 mg adalimumab 0,2 ml-es, egyadagos injekciós üvegben.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Simponi 50 mg oldatos injekció előretöltött injekciós tollban. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy 0,5 ml-es előretöltött injekciós toll 50 mg
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Simponi 50 mg oldatos injekció előretöltött injekciós tollban. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy 0,5 ml-es előretöltött injekciós toll 50 mg
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 20 mg oldatos injekció előretöltött fecskendőben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 20 mg adalimumab 0,2 ml-es, egyadagos injekciós üvegben.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 20 mg oldatos injekció előretöltött fecskendőben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 20 mg adalimumab 0,2 ml-es, egyadagos injekciós üvegben.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Simponi 50 mg oldatos injekció előretöltött injekciós tollban. Simponi 50 mg oldatos injekció előretöltött fecskendőben. 2. MINŐSÉGI ÉS MENNYISÉGI
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Simponi 50 mg oldatos injekció előretöltött injekciós tollban. Simponi 50 mg oldatos injekció előretöltött fecskendőben. 2. MINŐSÉGI ÉS MENNYISÉGI
Salmonella typhi (Ty2 törzs) Vi poliszacharidja
 1. A GYÓGYSZER NEVE Typherix oldat injekcióhoz előretöltött fecskendőben Hastífusz elleni poliszacharid vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina egy adagjának (0,5 ml) tartalma: Salmonella
1. A GYÓGYSZER NEVE Typherix oldat injekcióhoz előretöltött fecskendőben Hastífusz elleni poliszacharid vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A vakcina egy adagjának (0,5 ml) tartalma: Salmonella
B/Brisbane/60/2008 15,0 mikrogramm HA**
 1. A GYÓGYSZER MEGNEVEZÉSE Influvac szuszpenziós injekció előretöltött fecskendőben (2010/2011) 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy 0,5 ml-es adag vakcina az alábbi törzsekhez tartozó influenzavírusok
1. A GYÓGYSZER MEGNEVEZÉSE Influvac szuszpenziós injekció előretöltött fecskendőben (2010/2011) 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy 0,5 ml-es adag vakcina az alábbi törzsekhez tartozó influenzavírusok
Etanercept. Finanszírozott indikációk:
 Etanercept Finanszírozott indikációk: 1. Spondylitis ankylopoeticában, amennyiben radiológiailag legalább 2-es stádiumú bilateralis, vagy 3-as, 4-es stádiumú unilateralis sacroileitis, és legalább 3 hónapja
Etanercept Finanszírozott indikációk: 1. Spondylitis ankylopoeticában, amennyiben radiológiailag legalább 2-es stádiumú bilateralis, vagy 3-as, 4-es stádiumú unilateralis sacroileitis, és legalább 3 hónapja
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye alapján jött létre.
 II. melléklet Az alkalmazási előírás és a betegtájékoztató módosítása az Európai Gyógyszerügynökség előterjesztésére Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye
II. melléklet Az alkalmazási előírás és a betegtájékoztató módosítása az Európai Gyógyszerügynökség előterjesztésére Ez az alkalmazási előírás és a betegtájékoztató az előterjesztési eljárás eredménye
Alkalmazási előírás. 4.2 Adagolás és alkalmazás. 4.3 Ellenjavallatok
 A Strattera (atomoxetine) hatásai a vérnyomásra és a szívfrekvenciára a forgalomba hozatali engedély jogosultja (MAH) által végzett klinikai vizsgálat adatainak felülvizsgálata alapján. Végleges SPC és
A Strattera (atomoxetine) hatásai a vérnyomásra és a szívfrekvenciára a forgalomba hozatali engedély jogosultja (MAH) által végzett klinikai vizsgálat adatainak felülvizsgálata alapján. Végleges SPC és
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
A Varilrix megfelel az Egészségügyi Világszervezet (WHO) biológiai anyagokra és a varicella vakcinákra előírt követelményeinek.
 1. A GYÓGYSZER NEVE Varilrix por és oldószer oldatos injekcióhoz Élő, attenuált varicella-zoster vírus (OKA törzs) vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A Varilrix a varicella-zoster vírus élő,
1. A GYÓGYSZER NEVE Varilrix por és oldószer oldatos injekcióhoz Élő, attenuált varicella-zoster vírus (OKA törzs) vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL A Varilrix a varicella-zoster vírus élő,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS A BETEGTÁJÉKOZTATÓ VONATKOZÓ PONTJAI Megjegyzés: Ezek az alkalmazási előírásnak és a betegtájékoztatónak a bizottsági határozat idején érvényes módosításai. A bizottsági
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA
 III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
III. MELLÉKLET AZ ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSA Az alkalmazási előírás és a betegtájékoztató módosításai a Bizottság Határozatával egyidőben lépnek érvénybe. A Bizottsági Határozat
Az oldat tartalma milliliterenként: humán plazmaprotein... 200 mg (legalább 98%-os tisztaságú IgG)
 1. A GYÓGYSZER MEGNEVEZÉSE Hizentra 200 mg/ml oldatos injekció bőr alá történő beadásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán normál immunglobulin (SCIg). Az oldat tartalma milliliterenként: humán
1. A GYÓGYSZER MEGNEVEZÉSE Hizentra 200 mg/ml oldatos injekció bőr alá történő beadásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Humán normál immunglobulin (SCIg). Az oldat tartalma milliliterenként: humán
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1/33 1. A GYÓGYSZER MEGNEVEZÉSE Resolor 1 mg-os filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 mg prukaloprid filmtablettánként (prukaloprid-szukcinát formájában).
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1/33 1. A GYÓGYSZER MEGNEVEZÉSE Resolor 1 mg-os filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 mg prukaloprid filmtablettánként (prukaloprid-szukcinát formájában).
45 mg/0,5 ml usztekinumab előretöltött fecskendőben, egyszeri alkalmazásra.
 1. A GYÓGYSZER MEGNEVEZÉSE STELARA 45 mg oldatos injekció előretöltött fecskendőben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 45 mg/0,5 ml usztekinumab előretöltött fecskendőben, egyszeri alkalmazásra. Az usztekinumab
1. A GYÓGYSZER MEGNEVEZÉSE STELARA 45 mg oldatos injekció előretöltött fecskendőben 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 45 mg/0,5 ml usztekinumab előretöltött fecskendőben, egyszeri alkalmazásra. Az usztekinumab
PPI VÉDELEM A KEZELÉS SORÁN
 75 mg diclofenák-nátrium, 20 mg omeprazol módosított hatóanyag-leadású kemény kapszula PPI VÉDELEM A KEZELÉS SORÁN Jelentős fájdalom- és gyulladáscsökkentő hatás 1 Savkontroll az omeprazol segítségével
75 mg diclofenák-nátrium, 20 mg omeprazol módosított hatóanyag-leadású kemény kapszula PPI VÉDELEM A KEZELÉS SORÁN Jelentős fájdalom- és gyulladáscsökkentő hatás 1 Savkontroll az omeprazol segítségével
III. melléklet Az Alkalmazási előírás és a Betegtájékoztató egyes fejezeteinek módosításai
 III. melléklet Az Alkalmazási előírás és a Betegtájékoztató egyes fejezeteinek módosításai 34/42 A. Alkalmazási előírás 4.1 Terápiás javallatok [a jelenleg elfogadott indikációk törlendők és a következőkkel
III. melléklet Az Alkalmazási előírás és a Betegtájékoztató egyes fejezeteinek módosításai 34/42 A. Alkalmazási előírás 4.1 Terápiás javallatok [a jelenleg elfogadott indikációk törlendők és a következőkkel
Egészségügyi szakembereknek szóló közvetlen tájékoztatás
 Egészségügyi szakembereknek szóló közvetlen tájékoztatás A Protelos (stronciumranelát) alkalmazásával kapcsolatos új korlátozások, a szívinfarktus kialakulásának fokozott kockázatát jelző új adatok alapján
Egészségügyi szakembereknek szóló közvetlen tájékoztatás A Protelos (stronciumranelát) alkalmazásával kapcsolatos új korlátozások, a szívinfarktus kialakulásának fokozott kockázatát jelző új adatok alapján
III. melléklet. Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások
 III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
III. melléklet Az Alkalmazási előírás és a Betegtájékoztató vonatkozó fejezeteiben szükséges módosítások Megjegyzés: Ezen alkalmazási előírás, betegtájékoztató és cimkeszöveg a referál eljárás eredményeként
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Enbrel 25 mg por oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 25 mg etanercept injekciós üvegenként. Az etanercept egy humán tumor nekrózis
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Enbrel 25 mg por oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 25 mg etanercept injekciós üvegenként. Az etanercept egy humán tumor nekrózis
Metotrexát és célzott terápiák rheumatoid arthritisben
 + Metotrexát és célzott terápiák rheumatoid arthritisben Dr. Pálinkás Márton ORSZÁGOS REUMATOLÓGIAI ÉS FIZIOTERÁPIÁS INTÉZET + Metotrexát (MTX) mint első választandó szer MTX és célzott terápiák kombinációja
+ Metotrexát és célzott terápiák rheumatoid arthritisben Dr. Pálinkás Márton ORSZÁGOS REUMATOLÓGIAI ÉS FIZIOTERÁPIÁS INTÉZET + Metotrexát (MTX) mint első választandó szer MTX és célzott terápiák kombinációja
A Boostrix Polio diphtheria, tetanus, pertussis és poliomyelitis elleni emlékeztető oltásra javasolt 4 éves kortól (lásd 4.2 pont).
 1. A GYÓGYSZER NEVE Boostrix Polio szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus, pertussis (acelluláris összetevő) és (inaktivált) poliomyelitis vakcina (adszorbeált, csökkentett
1. A GYÓGYSZER NEVE Boostrix Polio szuszpenziós injekció előretöltött fecskendőben diphtheria, tetanus, pertussis (acelluláris összetevő) és (inaktivált) poliomyelitis vakcina (adszorbeált, csökkentett
Az arthritis psoriatica diagnosztikájának és kezelésének finanszírozási protokollja
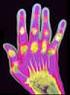 Az arthritis psoriatica diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
Az arthritis psoriatica diagnosztikájának és kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
III. melléklet. Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteit érintő módosítások
 III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteit érintő módosítások Megjegyzés: Az alkalmazási előírás és a betegtájékoztató módosításait értelemszerűen a referencia-tagállammal
III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteit érintő módosítások Megjegyzés: Az alkalmazási előírás és a betegtájékoztató módosításait értelemszerűen a referencia-tagállammal
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
KETTŐS EREJÉVEL GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ ORRDUGULÁS ORRFOLYÁS IBUPROFÉN ÉS PSZEUDOEFEDRIN A MEGFÁZÁS TÜNETEI ELLEN FEJFÁJÁS TOROKGYULLADÁS
 IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
IBUPROFÉN ÉS PSZEUDOEFEDRIN KETTŐS EREJÉVEL A MEGFÁZÁS TÜNETEI ELLEN GYULLADÁSCSÖKKENTO JÓL TOLERÁLHATÓ FEJFÁJÁS ORRFOLYÁS IZOMFÁJDALMAK Vény nélkül kapható gyógyszerkészítmény. LÁZ ORRDUGULÁS TOROKGYULLADÁS
A Kockázatkezelési Terv Összefoglalója
 1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
1 A Kockázatkezelési Terv Összefoglalója Hatóanyag/hatóanyagcsoport paracetamol ATC N02BE01 Érintett készítmény(ek) Magyarországon Paracetamol Teva 10 mg/ml oldatos infúzió (MAH: Teva Gyógyszergyár Zrt.,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 40 mg/0,8 ml oldatos injekció gyermekgyógyászati alkalmazásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Humira 40 mg/0,8 ml oldatos injekció gyermekgyógyászati alkalmazásra 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40 mg adalimumab 0,8 ml-es, egyadagos injekciós
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 A Keytruda nevű gyógyszer áttekintése és indoklás, hogy miért engedélyezték az EU-ban Milyen típusú gyógyszer a Keytruda és milyen betegségek esetén alkalmazható? A Keytruda
EMA/235911/2019 EMEA/H/C/003820 A Keytruda nevű gyógyszer áttekintése és indoklás, hogy miért engedélyezték az EU-ban Milyen típusú gyógyszer a Keytruda és milyen betegségek esetén alkalmazható? A Keytruda
I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Xolair 75 mg por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 75 mg omalizumab injekciós üvegenként.
I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Xolair 75 mg por és oldószer oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 75 mg omalizumab injekciós üvegenként.
40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban).
 1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
II. A RHEUMATOID ARTHRITIS KEZELÉSÉNEK ÁLTALÁNOS ELVEI. origamigroup BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA
 BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA II. A RHEUMATOID ARTHRITIS KEZELÉSÉNEK ÁLTALÁNOS ELVEI origamigroup www.origami.co.hu II. A rheumatoid arthritis kezelésének általános
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA II. A RHEUMATOID ARTHRITIS KEZELÉSÉNEK ÁLTALÁNOS ELVEI origamigroup www.origami.co.hu II. A rheumatoid arthritis kezelésének általános
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Remicade 100 mg por oldatos infúzióhoz való koncentrátumhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 mg infliximab injekciós üvegenként. Az infliximab
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Remicade 100 mg por oldatos infúzióhoz való koncentrátumhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 mg infliximab injekciós üvegenként. Az infliximab
 www.printo.it/pediatric-rheumatology/hu/intro Gyógyszeres Kezelés Verzió 2016 13. Biológiai szerek Az elmúlt néhány évben új perspektívákat nyitottak a biológiai szereknek nevezett hatóanyagok. Az orvosok
www.printo.it/pediatric-rheumatology/hu/intro Gyógyszeres Kezelés Verzió 2016 13. Biológiai szerek Az elmúlt néhány évben új perspektívákat nyitottak a biológiai szereknek nevezett hatóanyagok. Az orvosok
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Remicade 100 mg por oldatos infúzióhoz való koncentrátumhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 mg infliximab injekciós üvegenként. Az infliximab
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Remicade 100 mg por oldatos infúzióhoz való koncentrátumhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 mg infliximab injekciós üvegenként. Az infliximab
I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Remicade 100 mg por oldatos infúzióhoz való koncentrátumhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg Remicade
I. sz. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Remicade 100 mg por oldatos infúzióhoz való koncentrátumhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg Remicade
1. A GYÓGYSZER NEVE 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL. 1 adag (0,5 ml) tartalma: Hepatitisz B felszíni antigén 1,2.
 1. A GYÓGYSZER NEVE Engerix-B szuszpenziós injekció gyermekeknek Engerix-B szuszpenziós injekció előretöltött fecskendőben gyermekeknek Hepatitisz B (rekombináns DNS) vakcina (adszorbeált) (HBV) 2. MINŐSÉGI
1. A GYÓGYSZER NEVE Engerix-B szuszpenziós injekció gyermekeknek Engerix-B szuszpenziós injekció előretöltött fecskendőben gyermekeknek Hepatitisz B (rekombináns DNS) vakcina (adszorbeált) (HBV) 2. MINŐSÉGI
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE VPRIV 200 egység por oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg 200 egység* velagluceráz-alfát tartalmaz.
A Havrix megfelel az Egészségügyi Világszervezet (WHO) biológiai anyagokra előírt követelményeinek.
 1. A GYÓGYSZER MEGNEVEZÉSE Havrix 1440 Elisa Egység szuszpenziós injekció előretöltött fecskendőben Havrix 720 Elisa Egység Junior szuszpenziós injekció előretöltött fecskendőben Hepatitis A vakcina antigén
1. A GYÓGYSZER MEGNEVEZÉSE Havrix 1440 Elisa Egység szuszpenziós injekció előretöltött fecskendőben Havrix 720 Elisa Egység Junior szuszpenziós injekció előretöltött fecskendőben Hepatitis A vakcina antigén
Kenőcs A kenőcs különösen alkalmas a száraz, lichenifikált és pikkelyesen hámló elváltozásokra.
 1. A GYÓGYSZER NEVE Dermovate krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg klobetazol-propionát 1 g 0,05%-os kenőcsben. Dermovate krém 0,5 mg klobetazol-propionát 1 g 0,05%-os krémben. A segédanyagok
1. A GYÓGYSZER NEVE Dermovate krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg klobetazol-propionát 1 g 0,05%-os kenőcsben. Dermovate krém 0,5 mg klobetazol-propionát 1 g 0,05%-os krémben. A segédanyagok
Tudományos következtetések. A Prevora tudományos értékelésének átfogó összegzése
 II. MELLÉKLET AZ EURÓPAI GYÓGYSZERÜGYNÖKSÉG (EMA) ÁLTAL BETERJESZTETT TUDOMÁNYOS KÖVETKEZTETÉSEK, A POZITÍV VÉLEMÉNY, AZ ALKALMAZÁSI ELŐÍRÁS, A CÍMKESZÖVEG, VALAMINT A BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSÁNAK INDOKLÁSA
II. MELLÉKLET AZ EURÓPAI GYÓGYSZERÜGYNÖKSÉG (EMA) ÁLTAL BETERJESZTETT TUDOMÁNYOS KÖVETKEZTETÉSEK, A POZITÍV VÉLEMÉNY, AZ ALKALMAZÁSI ELŐÍRÁS, A CÍMKESZÖVEG, VALAMINT A BETEGTÁJÉKOZTATÓ MÓDOSÍTÁSÁNAK INDOKLÁSA
A spondylitis ankylopoetica diagnosztikájának és kezelésének finanszírozási protokollja
 A spondylitis ankylopoetica diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009. szeptember
A spondylitis ankylopoetica diagnosztikájának és kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009. szeptember
Adalimumab. Finanszírozott indikációk:
 Adalimumab Finanszírozott indikációk: 1. Felnőttkori súlyos luminaris Crohn-betegség (18 éves kor felett és CDAI > 300) kezelésére - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott
Adalimumab Finanszírozott indikációk: 1. Felnőttkori súlyos luminaris Crohn-betegség (18 éves kor felett és CDAI > 300) kezelésére - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott
I. melléklet Tudományos következtetések és az Európai Gyógyszerügynökség által kiadott forgalomba hozatali engedély felfüggesztésének indoklása
 I. melléklet Tudományos következtetések és az Európai Gyógyszerügynökség által kiadott forgalomba hozatali engedély felfüggesztésének indoklása 1 Tudományos következtetések A nikotinsav/laropiprant tudományos
I. melléklet Tudományos következtetések és az Európai Gyógyszerügynökség által kiadott forgalomba hozatali engedély felfüggesztésének indoklása 1 Tudományos következtetések A nikotinsav/laropiprant tudományos
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Protopy 0,03% kenőcs 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 g Protopy 0,03% kenőcs 0,3 mg takrolimuszt tartalmaz takrolimusz-monohidrát formájában.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Protopy 0,03% kenőcs 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 g Protopy 0,03% kenőcs 0,3 mg takrolimuszt tartalmaz takrolimusz-monohidrát formájában.
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS. origamigroup. www.origami.co.hu
 BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
BETEGTÁJÉKOZTATÓ RHEUMATOID ARTHRITISBEN SZENVEDŐ BETEGEK SZÁMÁRA I. RHEUMATOID ARTHRITIS origamigroup www.origami.co.hu I. Rheumatoid arthritis Sokat hallunk napjainkban az immunrendszernek az egészség
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Remicade 100 mg por oldatos infúzióhoz való koncentrátumhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 mg infliximab injekciós üvegenként. Az infliximab
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Remicade 100 mg por oldatos infúzióhoz való koncentrátumhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 mg infliximab injekciós üvegenként. Az infliximab
Er teljes és tartós vérnyomáscsökkentés 1,2 Kett s kardiovaszkuláris védelem 3 Javuló beteg-együttm ködés 4 Flexibilis alkalmazhatóság 5
 Mesteri kombinációk Er teljes és tartós vérnyomáscsökkentés 1,2 Kett s kardiovaszkuláris védelem 3 Javuló beteg-együttm ködés 4 Flexibilis alkalmazhatóság 5 Rövidített alkalamazási előírás Covercard 5
Mesteri kombinációk Er teljes és tartós vérnyomáscsökkentés 1,2 Kett s kardiovaszkuláris védelem 3 Javuló beteg-együttm ködés 4 Flexibilis alkalmazhatóság 5 Rövidített alkalamazási előírás Covercard 5
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Cosentyx 150 mg por oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 150 mg szekukinumab port tartalmaz injekciós üvegenként. Feloldás után
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Cosentyx 150 mg por oldatos injekcióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 150 mg szekukinumab port tartalmaz injekciós üvegenként. Feloldás után
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tetanol pur betegtájékoztató - PIL alapján.doc BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! Tetanol pur betegtájékoztató - PIL alapján.doc BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK
II. melléklet. Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása
 II. melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 7 Tudományos következtetések A Cymevene i.v. és kapcsolódó nevek (lásd I. melléklet)
II. melléklet Tudományos következtetések és a forgalomba hozatali engedély feltételeit érintő változtatások indoklása 7 Tudományos következtetések A Cymevene i.v. és kapcsolódó nevek (lásd I. melléklet)
MabThera. rituximab. Milyen típusú gyógyszer a MabThera? Milyen betegségek esetén alkalmazható a MabThera? EPAR-összefoglaló a nyilvánosság számára
 EMA/614203/2010 EMEA/H/C/000165 EPAR-összefoglaló a nyilvánosság számára rituximab Ez a dokumentum a -ra vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az emberi
EMA/614203/2010 EMEA/H/C/000165 EPAR-összefoglaló a nyilvánosság számára rituximab Ez a dokumentum a -ra vonatkozó európai nyilvános értékelő jelentés (EPAR) összefoglalója. Azt mutatja be, hogy az emberi
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! B BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Jumex 5 mg tabletta
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! B BETEGTÁJÉKOZTATÓ: INFORMÁCIÓK A FELHASZNÁLÓ SZÁMÁRA Jumex 5 mg tabletta
alumínium-hidroxidhoz adszorbeálva 0,3-0,4 mg Al 3+
 1. A GYÓGYSZER NEVE Menjugate 10 mikrogramm por és oldószer szuszpenziós injekcióhoz C-csoportú meningococcus konjugált vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy adag (0,5 ml,előkészített) vakcina
1. A GYÓGYSZER NEVE Menjugate 10 mikrogramm por és oldószer szuszpenziós injekcióhoz C-csoportú meningococcus konjugált vakcina 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy adag (0,5 ml,előkészített) vakcina
Infliximab. Finanszírozott indikációk:
 Infliximab Finanszírozott indikációk: 1. Felnőttkori súlyos luminaris Crohn-betegség (18 éves kor felett és CDAI > 300) kezelésére - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott
Infliximab Finanszírozott indikációk: 1. Felnőttkori súlyos luminaris Crohn-betegség (18 éves kor felett és CDAI > 300) kezelésére - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót!
 FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
FIGYELEM!!! Az alábbi dokumentum csak tájékoztató jellegű, minden esetben olvassa el a termék dobozában található tájékoztatót! BETEGTÁJÉKOZTATÓ Mielőtt elkezdené szedni ezt a gyógyszert, olvassa el figyelmesen
Az állapot súlyosságától függően prekóma vagy kóma esetében 24 óra alatt az adag 8 ampulláig emelhető.
 1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
1. A GYÓGYSZER NEVE Hepa-Merz 0,5 g/ml koncentrátum oldatos infúzióhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 1 db 10 ml-es ampulla 5 g L-ornitin-L-aszpartátot tartalmaz. A segédanyagok teljes listáját
300 mg ekulizumab 30 milliliteres injekciós üvegenként (10 mg/ml). Ismert hatású segédanyagok: Nátrium [5,00 mmol dózisonként (1 injekciós üveg)]
![300 mg ekulizumab 30 milliliteres injekciós üvegenként (10 mg/ml). Ismert hatású segédanyagok: Nátrium [5,00 mmol dózisonként (1 injekciós üveg)] 300 mg ekulizumab 30 milliliteres injekciós üvegenként (10 mg/ml). Ismert hatású segédanyagok: Nátrium [5,00 mmol dózisonként (1 injekciós üveg)]](/thumbs/38/17854654.jpg) 1. A GYÓGYSZER MEGNEVEZÉSE Soliris 300 mg koncentrátum oldatos infúzióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 2.1 Általános leírás Az ekulizumab egy humanizált monoklonális IgG 2/4κ antitest, amelyet
1. A GYÓGYSZER MEGNEVEZÉSE Soliris 300 mg koncentrátum oldatos infúzióhoz 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 2.1 Általános leírás Az ekulizumab egy humanizált monoklonális IgG 2/4κ antitest, amelyet
GYERMEK-TÜDŐGYÓGYÁSZAT
 GYERMEK-TÜDŐGYÓGYÁSZAT I. 1. Légutak és a tüdő fejlődése 2. Légzőrendszer élettani működése 3. Újszülöttkori légzészavarok 4. Bronchopulmonalis dysplasia 5. A gége veleszületett és szerzett rendellenességei
GYERMEK-TÜDŐGYÓGYÁSZAT I. 1. Légutak és a tüdő fejlődése 2. Légzőrendszer élettani működése 3. Újszülöttkori légzészavarok 4. Bronchopulmonalis dysplasia 5. A gége veleszületett és szerzett rendellenességei
Betegtájékoztató PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ. Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát
 PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát HATÓANYAG: Milliliterenként 15 mg dinátrium-pamidronát (ami megfelel 12,6 mg pamidronsavnak).
PAMITOR 15 MG/ML KONCENTRÁTUM OLDATOS INFÚZIÓHOZ Pamitor 15 mg / ml koncentrátum oldatos infúzióhoz dinátrium-pamidronát HATÓANYAG: Milliliterenként 15 mg dinátrium-pamidronát (ami megfelel 12,6 mg pamidronsavnak).
Rovarméreg (méh, darázs) - allergia
 Rovarméreg (méh, darázs) - allergia Herjavecz Irén Országos Korányi TBC és Pulmonológiai Intézet Epidemiológia I. Prevalencia: - nagy helyi reakció: felnőtt 10-15 % - szisztémás reakció: gyerek 0.4-0.8
Rovarméreg (méh, darázs) - allergia Herjavecz Irén Országos Korányi TBC és Pulmonológiai Intézet Epidemiológia I. Prevalencia: - nagy helyi reakció: felnőtt 10-15 % - szisztémás reakció: gyerek 0.4-0.8
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE STELARA 45 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 45 mg/0,5 ml usztekinumab injekciós üvegenként. Az usztekinumab egér myeloma sejtvonalban,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE STELARA 45 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 45 mg/0,5 ml usztekinumab injekciós üvegenként. Az usztekinumab egér myeloma sejtvonalban,
500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb flavonoidot tartalmaz).
 1. A GYÓGYSZER NEVE VenoprotEP 500 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb
1. A GYÓGYSZER NEVE VenoprotEP 500 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 500 mg tisztított és mikronizált flavonoid frakció (amely 450 mg diozmint és 50 mg heszperidinben kifejezett egyéb
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Kineret 100 mg oldatos injekció előretöltött fecskendőben. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Előretöltött fecskendőnként 100 mg anakinra* 0,67
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Kineret 100 mg oldatos injekció előretöltött fecskendőben. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Előretöltött fecskendőnként 100 mg anakinra* 0,67
A spondylitis ankylopoetica diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend)
 A spondylitis ankylopoetica diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest,
A spondylitis ankylopoetica diagnosztikájának és kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest,
III. melléklet. Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral eljárás eredményeként jöttek létre.
 III. melléklet Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak módosításai Megjegyzés: Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral
III. melléklet Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak módosításai Megjegyzés: Az alkalmazási előírás és a betegtájékoztató érintett szakaszainak ezen módosításai a referral
942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát mg nátrium-klorid) filmtablettánként.
 1. A GYÓGYSZER MEGNEVEZÉSE Dona 750 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát + 192 mg nátrium-klorid) filmtablettánként. A segédanyagok
1. A GYÓGYSZER MEGNEVEZÉSE Dona 750 mg filmtabletta 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 942 mg kristályos glükózamin-szulfát (750 mg glükózamin-szulfát + 192 mg nátrium-klorid) filmtablettánként. A segédanyagok
III. melléklet. Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai. Megjegyzés:
 III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai Megjegyzés: Az alkalmazási előírás, a címke és a betegtájékoztató a referál eljárás eredménye. Lehetséges,
III. melléklet Az alkalmazási előírás és a betegtájékoztató vonatkozó fejezeteinek módosításai Megjegyzés: Az alkalmazási előírás, a címke és a betegtájékoztató a referál eljárás eredménye. Lehetséges,
III. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ
 III. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ 11 ALKALMAZÁSI ELŐÍRÁS 12 1. A GYÓGYSZER MEGNEVEZÉSE Dexrazoxán tartalmú gyógyszer (lásd I. Melléklet) 500 mg por oldatos infúzióhoz. [Lásd I. Melléklet
III. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS ÉS BETEGTÁJÉKOZTATÓ 11 ALKALMAZÁSI ELŐÍRÁS 12 1. A GYÓGYSZER MEGNEVEZÉSE Dexrazoxán tartalmú gyógyszer (lásd I. Melléklet) 500 mg por oldatos infúzióhoz. [Lásd I. Melléklet
1. A GYÓGYSZER MEGNEVEZÉSE. Cutivate 0,5 mg/g krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
 1. A GYÓGYSZER MEGNEVEZÉSE Cutivate 0,5 mg/g krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg flutikazon-propionát (mikronizált) 1 gramm krémben. 7,5 mg flutikazon-propionát (mikronizált) 15 g krémben.
1. A GYÓGYSZER MEGNEVEZÉSE Cutivate 0,5 mg/g krém 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 0,5 mg flutikazon-propionát (mikronizált) 1 gramm krémben. 7,5 mg flutikazon-propionát (mikronizált) 15 g krémben.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Cimzia 200 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden előre töltött fecskendő 200 mg certolizumab pegolt tartalmaz, egy milliliterben.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Cimzia 200 mg oldatos injekció 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Minden előre töltött fecskendő 200 mg certolizumab pegolt tartalmaz, egy milliliterben.
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük,
I. SZ. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. SZ. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1/38 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Remicade 100 mg por oldatos infúzióhoz való koncentrátumhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg Remicade
I. SZ. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1/38 1. A GYÓGYSZERKÉSZÍTMÉNY MEGNEVEZÉSE Remicade 100 mg por oldatos infúzióhoz való koncentrátumhoz. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Egy injekciós üveg Remicade
1. A GYÓGYSZER NEVE. Serevent Diskus 50 mikrogramm/adag adagolt inhalációs por 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
 1. A GYÓGYSZER NEVE Serevent Diskus 50 mikrogramm/adag adagolt inhalációs por 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 50 mikrogramm szalmeterol (szalmeterol-xinafoát formájában) adagonként. Ismert hatású
1. A GYÓGYSZER NEVE Serevent Diskus 50 mikrogramm/adag adagolt inhalációs por 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 50 mikrogramm szalmeterol (szalmeterol-xinafoát formájában) adagonként. Ismert hatású
1. Milyen típusú gyógyszer a Bilutamid 150 mg filmtabletta és milyen betegségek esetén alkalmazható?
 BILUTAMID 150 MG FILMTABLETTA Bilutamid 150 mg filmtabletta bikalutamid 1. Milyen típusú gyógyszer a Bilutamid 150 mg filmtabletta és milyen betegségek esetén alkalmazható? A Bilutamid 150 mg filmtablettát
BILUTAMID 150 MG FILMTABLETTA Bilutamid 150 mg filmtabletta bikalutamid 1. Milyen típusú gyógyszer a Bilutamid 150 mg filmtabletta és milyen betegségek esetén alkalmazható? A Bilutamid 150 mg filmtablettát
MELLÉKLET TUDOMÁNYOS KÖVETKEZTETÉSEK ÉS A FORGALOMBA HOZATALI ENGEDÉLY KIADÁSA ELUTASÍTÁSÁNAK AZ EMEA ÁLTAL ISMERTETETT INDOKLÁSA
 MELLÉKLET TUDOMÁNYOS KÖVETKEZTETÉSEK ÉS A FORGALOMBA HOZATALI ENGEDÉLY KIADÁSA ELUTASÍTÁSÁNAK AZ EMEA ÁLTAL ISMERTETETT INDOKLÁSA 1 A MYLOTARG TUDOMÁNYOS ÉRTÉKELÉSÉNEK ÁTFOGÓ ÖSSZEGZÉSE A gemtuzumab-ozogamicin
MELLÉKLET TUDOMÁNYOS KÖVETKEZTETÉSEK ÉS A FORGALOMBA HOZATALI ENGEDÉLY KIADÁSA ELUTASÍTÁSÁNAK AZ EMEA ÁLTAL ISMERTETETT INDOKLÁSA 1 A MYLOTARG TUDOMÁNYOS ÉRTÉKELÉSÉNEK ÁTFOGÓ ÖSSZEGZÉSE A gemtuzumab-ozogamicin
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Tecfidera 120 mg gyomornedv-ellenálló kemény kapszula Tecfidera 240 mg gyomornedv-ellenálló kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Tecfidera
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER NEVE Tecfidera 120 mg gyomornedv-ellenálló kemény kapszula Tecfidera 240 mg gyomornedv-ellenálló kemény kapszula 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Tecfidera
Fehér kapszula, felső részén fekete OGT 918, alsó részén fekete 100 jelzéssel.
 1. A GYÓGYSZER MEGNEVEZÉSE Zavesca 100 mg kemény kapszula. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 mg miglusztát kapszulánként. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA Kemény
1. A GYÓGYSZER MEGNEVEZÉSE Zavesca 100 mg kemény kapszula. 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 100 mg miglusztát kapszulánként. A segédanyagok teljes listáját lásd a 6.1 pontban. 3. GYÓGYSZERFORMA Kemény
