MYELODYSPLASIÁS SYNDROMA. Dr. Csalódi Renáta
|
|
|
- Máté Vass
- 6 évvel ezelőtt
- Látták:
Átírás
1 MYELODYSPLASIÁS SYNDROMA Dr. Csalódi Renáta
2 DEFINÍCÓ, JELLEMZŐK A myelodysplastikus szindrómát egy vagy több sejtrendszert érintő cytopenia jellemzi, mely a hemopoietikus őssejt klonális eltérése miatt jön létre. A betegség biológiáját jellemzi exrém túlprodukció proapoptotikus, proinflammatorikus cytokinekből és ezáltal az éretlen hemopoetikus őssejtek halála, másrészről kifejezett proliferáció és epigenetikus reguláció, és stop a diiferenciálódásban A betegek jelentős részében akut leukaemiás transzformációra lehet számítani A prognózis kedvezőtlen A súlyos cytopenia következtében kialakulhatnak fertőzések, vagy a vérzések (akár fatális). A betegség kialakulásában a genetikai, az epigenetikai és az immunológiai tényezők egyaránt fontosak
3 JELLEMZŐK Az MDS patofiziológiája több lépéses folyamat Beletartoznak a genetikai eltérések (konvencionális cytogenetikával vizsgálható) és egyéb anomáliák (csak szofisztikáltabb diagnosztikával vizsgálhatók: sigle nucleotid polymorfizmus array, szekvenálás) A szomatikus mutációk vizsgálata napjainkban klinikai gyakorlat a legtöbb beteg esetén Gének kódolásának jelátviteli molekulái: NRAS, KRAS, CBL, JAK2, FLT3 Epigén regulátorok: TET2, ASXL1, EZH2, UTX, IDH1, IDH2, DNMT3A, SETBP1 Splicing factorok: SF3B1, SRSF2, ZRSF2, U2AF1 Transzkripció regulátorai: RUNX1, NPM1 and TP53 A gének hypermetilációja az MDS fontos prognosztikai faktora A grade 2 vagy nagyobb fibrózis az alacsony rizikójú MDS betegekben magasabb rizikót jelent AML-be transzfrormálódásba és rosszabb a túlélés
4 JELLEMZŐK A TP53 gén mutációja MDS esetén is kifejezetten rossz prognózist jelöl Az izocitrát dehidrogenáz 1 és 2 (IDH1 és IDH2) enzimeket kódoló gének mutációja előfordul 10-20%ban az MDS betegek körében és rosszabb prognózist vetít előre alacsony rizikójú MDS estében is Az IDH1/2 mutáció előfordulása növekszik a malignus betegségek számának emelkedésével, az eredmények azt sugallják, hogy az IDH1/2 mutációk fontos driver-ek az MDS és egyéb malignus betegségek progressziójában Alacsony rizikójú MDS betegeknek, akik megtartják az alacsony rizikót, de ESA rezisztensekké válnak (non del 5q betegek) vagy rezisztensekké válnak lenalidomidra (LEN) (del 5q betegek), és cytogenetikai abnormalitás vagy életveszélyes cytopenia alakul ki (főként thrombocytopenia) rosszabb a prognózisuk
5 INCIDENCIA, ETIOLÓGIA Időskorban jellemző (80% 60 évnél idősebb) Férfi túlsúly Családi halmozódás Down sy., Fanconi anaemia Ionizáló sugárzás Szerves oldószer Dohányzás Citosztatikumok Alkiláló szerek Topo-II gátlók Terápiás irradiáció
6 DIAGNÓZIS Vérkép Metabolikus paraméterek Csontvelő biopsia FCM, FISH, cytogenetika
7 GRANULOCY TÁK Hypersegmentált magvú neutrophilek (úgy néz ki, mint B 12 vitamin /folsav hiány esetén) Hyposegmentált neutrophilk (pseudo Pelger-Huet) hypogranulált neutrophilek vagy pseudo Chediak-Higashi (nagy azurophilic granules) Auer pálcák - automatikusan RAEB II (blast < 5% a perifériás vérben és < 10% a csontvelő aspirátumban) dimorf granulumok (basophil és eosinophil granulumok) az eosinophil sejtek közt
8 NEUTROPHILEK DYSPLASIÁS VONÁSAI
9 ERITHROIDOK binucleált erythroid előalakok és karyorrhexis (a sejtmag fragmentációja, a chromatin irregularisan oszlik el a cytoplazmában) erythroid magok lefűződése (nuclear budding) erythroid magok elvékonyodnak és internucleáris hidak képződnek (olyan, mint a congenital dyserythropoietikus anemia) Csökken az e-cadherin (1 típusú transzmembrán protein) a normoblastokban PAS (gömb alakú festődés a vacuolumokban vagy diffúzan a cytoplazmában) pozitivitás az erythroid precursorok közt az aspirátumban (a paraffinban fixált csontvelőben nem festődik) ringed sideroblastok (10 vagy több körkörös vas granulomok a mag minimum 1/3-ban) Prussian kék vas festéssel látható (>15% ringed sideroblas esetén RARS)
10 ERY THROIDOK DYSPLASTICUS VONÁSAI
11 MEGAKARYOCY TÁK Hyposegmenált magok a thrombocytákat képző megakaryocytákban (csökkent a lobulusok száma) hypersegmentált (osteoclastic kinézetű) megakaryocyták Felfúvódott thrombocyták (interference contrast mikroszkóppal vizsgálva)
12 MEGAKARYOCY TÁK DYSPLASTICUS VONÁSAI
13 WHO KLASSZIFIKÁCIÓ Myelodysplastic syndromes (MDS) MDS with single lineage dysplasia MDS with ring sideroblasts (MDS-RS) MDS-RS and single lineage dysplasia MDS-RS and multilineage dysplasia MDS with multilineage dysplasia MDS with excess blasts MDS with isolated del(5q) MDS, unclassifiable Provisional entity: Refractory cytopenia of childhood Myeloid neoplasms with germ line predisposition
14 WHO KLASSZIFIKÁCIÓ Name Dysplastic lineages Cytopenias * Ring sideroblasts as % of marrow erythroid elements BM and PB blasts Cytogenetics by conventional karyotype analysis MDS with single lineage dysplasia (MDS-SLD) MDS with multilineage dysplasia (MDS-MLD) MDS with ring sideroblasts (MDS- RS) MDS-RS with single lineage dysplasia (MDS-RS-SLD) MDS-RS with multilineage dysplasia (MDS-RS-MLD) 1 1 or 2 <15%/<5% BM <5%, PB <1%, no Auer rods 2 or <15%/<5% BM <5%, PB <1%, no Auer rods 1 1 or 2 15%/ 5% BM <5%, PB <1%, no Auer rods 2 or %/ 5% BM <5%, PB <1%, no Auer rods Any, unless fulfills all criteria for MDS with isolated del(5q) Any, unless fulfills all criteria for MDS with isolated del(5q) Any, unless fulfills all criteria for MDS with isolated del(5q) Any, unless fulfills all criteria for MDS with isolated del(5q) MDS with isolated del(5q) None or any BM <5%, PB <1%, no Auer rods del(5q) alone or with 1 additional abnormality except 7 or del(7q) MDS with excess blasts (MDS-EB) MDS-EB None or any MDS-EB None or any BM 5%-9% or PB 2%-4%, no Auer rods Any BM 10%-19% or PB 5%-19% or Auer Any rods MDS, unclassifiable (MDS-U) with 1% blood blasts None or any BM <5%, PB = 1%, no Auer rods Any with single lineage dysplasia and pancytopenia based on defining cytogenetic abnormality 1 3 None or any BM <5%, PB <1%, no Auer rods Any <15% BM <5%, PB <1%, no Auer rods MDS-defining abnormality Refractory cytopenia of childhood None BM <5%, PB <2% Any * Cytopenias defined as: hemoglobin, <10 g/dl; platelet count, < /L; and absolute neutrophil count, < /L. Rarely, MDS may present with mild anemia or thrombocytopenia above these levels. PB monocytes must be < /L If SF3B1 mutation is present. One percent PB blasts must be recorded on at least 2 separate occasions. Cases with 15% ring sideroblasts by definition have significant erythroid dysplasia, and are classified as MDS-RS-SLD.
15 KARYOTÍPUS ABNORMALITÁSOK A karyotípus az egyik legfontosabb prognosztikai faktor MDSben is A számbeli eltérések a leggyakoribbak (deléciók, amplifikációk): 5 kr. (36%), kr. 7 (21%), kr. 8 (16%), kr. 20 (7%) 5q- (magában vagy komplex citogenetikai eltéréssel) a leggyakoribb eltérés de novo MDS-ben Azonosították a proximalis régiót 5q31.2 -n, mely magas rizkót jelent AML transzformációra és egy distalis régiót az 5q33.1-en, mely összefügg az 5q syndromával és alacsony rizikót jelent AML transzformációra
16 HISTON FUNKCIÓT ÉRINTŐ MUTÁCIÓK A hiszton fehérjék közreműködnek a gén expresszió szabályozásában (aktív, inaktív chromatin) A folyamat szabályozza a posttranszlációs módosításokat (acetiláció, metiláció stb.) Relative rossz a túlélés
17 A LEGGYAKORIBB KROMOSZÓMA ELTÉRÉSEK
18 REVISED INTERNATIONAL PROGNOSTIC SCORING SYSTEM (IPSS-R) IN MYELODYSPLASTIC SYNDROME Prognostic variable Score Cytogenetics* Very good Good Inter medi ate Poor Very poor Bone marrow blast (percent) 2 >2 to <5 5 to 10 >10 Hemoglobin (g/dl) 10 8 to <10 <8 Platelets (cells/microl) to 100 <50 Absolute neutrophil count (cells/microl) 0.8 <0.8 * Cytogenetic definitions: Very good: -Y, del(11q). Good: Normal, del(5q), del(12p), del(20q), double including del(5q). Intermediate: del(7q), +8, +19, i(17q), any other single or double independent clones. Poor: -7, inv(3)/t(3q)/del(3q), double including -7/del(7q), complex: 3 abnormalities. Very poor: Complex: >3 abnormalities.
19 REVISED INTERNATIONAL PROGNOSTIC SCORING SYSTEM (IPSS-R) IN MYELODYSPLASTIC SYNDROME Risk group IPSS-R score Median overall survival (years) Median time to 25 percent AML evolution (years) Very low >14.5 Low >1.5 to Intermediate >3 to High >4.5 to Very high > Greenberg PL, Tuechler H, Schanz J, et al. Revised International Prognostic Scoring System (IPSS-R) for myelodysplastic syndromes. Blood 2012.
20 KEZELÉS Biológiai jellemzők szerint: életkor komorbiditás rizikó (R-IPSS alapján) Kis kockázatú betegekben: (nincs súlyos neutropenia, thormbocytopenia az anaemia mellett; alacsony blast arány) cytopenia mérséklése, normális hemopoesis javítása Nagy kockázatú betegekben: intenzív kemoterápia a kóros klón kiírtására
21 KEZELÉS ALACSONY RIZIKÓ ESETÉN transzfúzió: 80 g/l alaltt illetve 90 vagy 100 g/l alatt súlyos komorbiditás esetén, amit az anaemia súlyosbít [pl. coronaria betegség, szívelégtelenség] vagy amikor a beteg rosszul tolerálja az anaemiát Nincs pontos adat a transzfúzió dependens MDS betegkben a kardialis komorbiditásról, de magasabb az arányuk, mint a nem MDS populációban és ennek nem csupán a vastúlterhelés az okia. Szignifikáns vastúlterhelés kialakulása előtt már szívelégtelenség tünetei jelennek meg, később a májban látható lerakódás Szív MRI vizsgálat kimutatta, hogy a vastúlterhelés jelei akkor mutatkoznak, ha minimum 70-80vagy több vörösvérsejt transzfúziót A kelátképzők alkalmazását a viszonylagosan jobb prognózisú betegek esetén ajánlott elkezdeni (low vagy intermediate-1 risk MDS), akik minimum E vörösvérsejt transzfúzió adásán átetek már vagy a szérum ferritin szintjük >2500 U/L Akiknél allogén őssejt transzplantációt tervezünk kivételt képeznek. Ebben az esetben enyhe vastúlterhelés estén is alkalmazandó a kelátklépző az SCT előtt A per oralisan szedhető készítmények ajánlottak (Magyarországon elérhet: deferasirox), de használható a parenteralis deferoxamine is
22 KEZELÉS ALACSONY RIZIKÓ ESETÉN ESA: ajánlott dózisok: heti egység az EPO-α-ból, egység az EPO-β-ból, 150 to 300 μg a darbepoetinből (DAR) 60%-ban észlelhető válasz Az első 8 heti terápia után alakul ki a válasz a legtöbb esetben, de előfordul még a 12. hétig is A bevezető kezelés alatt a Hgb szintet monitorozni kell, ha 120 g/l fölé emelkedik a kezelést le kell A betegek kb. kb. 70%-ában a relapsus (jó ESA válasz után ismételten felépő anaemia az ESA ellenére) általában az MDS progresszióját is jelenti, de lehet, hogy egyszerűen elveszítik az érzékenységüket az erithroid progenitor sejtek az ESA kezelésre. Az alacsonyabb rizikójú MDS betegek del 5q státusszal jobban reagálnak az ESA kezelésre, mint az egyéb alacsony rizikójú MDS betegek (39% vs 52%)
23 KEZELÉS ALACSONY RIZIKÓ ESETÉN <1.5 G/l fehérvérsejt szám csak 7% körül fordul elő alacsony rizikójú MDS betegekben; a neutropenia ritkán okoz életveszélyes infekciót. G-CSF hatékony lehet, de a hosszasan alkalmazva nem észleltek a túlélésen előnyt mellette Magasabb rizikóba vagy AML-be való progressziót stimulálhat a G -CSF hosszas alkalmazása, ezért csak aktuálisan súlyos sepsis esetén javasolt a használata < G/l thrombocyta szám az alacsony rizikójú MDS betegekben kb. 30%- ban fordul elő és a súlyos vérzés ritka Megpróbálható a nagyb dózisú androgén, ami javíthatja a thrombopeniát, de hatása jellemzően átmeneti Romiplostim nagy dózisban alkalmazva ( μg/week) 55%-os választ hozott, ami a thrombocyta számot illeti (II fázisú trial in lower-risk MDS with thrombocytopenia). A betegek kb. 15%-ában átmenetileg emelkedett a csontvelői blastok aránya, de a gyógyszer felfüggesztésést követően reverzibilisnek bizonyult. Amellett, hogy a romiplostim csökkentette a vérzéses eseméynek előfordulását, azt gyanítható, hogy növeli az AML-be való transzformáció rizikóját. A TPO mimetikumok alkalmazását nem javasolják a klinikai napi gyakorlatban MDS thrombocytopenia kezelésére
24 KEZELÉS ALACSONY RIZIKÓ ESETÉN LEN: Ha transzfúzi ó dependens anaemia kialakult és LEN kezelés indult 50-73% cytogenetikai válasz jött létre (30%-45% CR). Napi 10 mg dózis javasolt alacsony rizikójú del 5q MDS. A LEN leggyakoribb mellékhatása a cytopenia. A másik LEN mellékhatás a V TE (DV T, PE). Az incidenciája nagyon alacsony. Anticoauglálás csak azoknak ajánlott, akinek az anamnézisében szerepelt korábbi V TE. LEN és ESA lehet előnyös ESA rezisztens betegekben A LEN kezelés javasolt időtartama egyelőre nem ismert, mert a del(5q) a jól válaszoló betegekben is perzisztálhat. EMA: A LEN potenciális rizikót jelent AML-re alacsony rizikójú MDS del 5q betegekben. Amíg a zajló klinikai vizsgálatok nem zárulnak le csak az ESA után második vonalban javasolják a LEN használatát vagy klinikai vizsgálatban.
25 KEZELÉS ALACSONY RIZIKÓ ESETÉN ATG (cyclosporinnal vagy anélkül): lehet haszna az erithroid vonalban (a válasz összefügg az egyéb cytopeniákra való válasszal, főként a thrombocytopeniával) A betegek 25% - 40% kezelik ATG-vel Javasolt: relatíve fiatal (<65 év) Alacsony rizikójú MDS beteg, akinek az anamnézisében <2 éve alakult ki a transzfúziós igénye normál karyotípus (vagy 8 triszómia) Nincs emelkedett blsat arány HLA DR15 genotípus lehet thrombocytopenia, anemia, Lehet egy pici PNH klón csontvelő hypocellularitás Az ATG kezelésre alkalmas betegek köre viszonylag kicsi MDSben. A dominálóan thrombocytopeniás betegeknel ajánlott főként.
26 KEZELÉS ALACSONY RIZIKÓ ESETÉN HMA: az IPSS szerinti lower-risk betegeknél kevés adat van a használatára (főként a magas rizikójú betegeknek ajánlott) Javasolt HMA második vonalban anaemia és thrombocytopenia együttes fennállása esetén illetve izolált thrombocytopeniában. Alacsony rizikójú MDS betegek túlélési előnye várható. Az alacsony rizikójú betegeknél is szóba jön az allogén őssejt transzplantáció <60 65 év HLA identikus donor rendelkezésre áll nincs egyéb kontraindikáció életet veszélyeztető thrombocytopenia áll fenn a karyotípust tekintve kedvezőtlen a prognózis az IPSS-R alapján TP53, EZH2, or ASXL1 mutáció Major válasz hiánya HMA-ra vagy HMA kezelés után relapsus
27 KEZELÉS 2. Nagy kockázatú és kezelésre alkalmas betegek: Hypometiláló szerek Akut myeloid leukemiás protokoll szerint Allogén SCT
28 KEZELÉS MAGAS RIZIKÓ ESETÉN A magas rizikójú MDS betegek kezelését lehet hypometiláló ágenssel (HMA) kezdeni azacitidine vagy decitabine Ez a DNS metiltransferáz csökkenését eredményezi és teoretikusan megfordítja a kóros metilációt, ami csendesíti (silencing) a tumor szupresszor géneket. Ez upregulálja a késői myeloid differenciáció kulcs regulálóját a CEBPE génjét is. Ez szignifikánsan késlelteti az AML-be való transzformációt és a halált, de szignifikánsan meghosszabbítja a túlélést az 5 AZA kezeléssel. Konvencionális terápiával összehasonlítva szignifikánsan jobb az OS 5 AZA alkalmazása esetén Javasolt minimum 6 cikluson után megítélni a választ A kezelésből profitálhatnak azok a magas rizikójú MDS betegek, akiknek emelkedett blast arányuk, komplex karyotípus eltérésük vagy 7 kromoszóma aberrációjuk van grade 3 vagy 4 cytopenia HMA mellett különösen az első ciklusban előfordul, ami szoros monitorozást és intenzív transzfúziós szupprotáci ót tehet szükségessé, megnőhet a neutropeniás lázas epizódok száma. Ajánlott protokoll (FDA által) 7 napon át 75 mg/m 2 per nap, 28 napos ciklusokban ( subcutan)
29 KEZELÉS MAGAS RIZIKÓ ESETÉN A clofarabine létrehozhat HMA failure esetén kb. 30%-ban választ (ORR) Továbbá adható low-dose cytarabine vagy AML indukciós protokoll (emelkedett blast aránnyal bíró betegek) kb. 50%-ban várható válasz, ami megegyezik a hasonló korú de novo AML betegekkel AML indukciót követően nincs másodvonalbeli kezelés, ami túlélési előnyt hozna a BSC-vel összehasonlítva Szóba jön klinikai vizsgálatba bevonás (pl: rigosertib (polo-like kinase inhibitor); sapacitabine (purine analóg))
30 KEZELÉS MAGAS RIZIKÓ ESETÉN Őssejt transzplantáció A döntést illetően nincs egyértelmű ajánlás. Függ a túlélési eredményektől, a várható életminőségtől A döntés individuális ami függ a pácienstől és a donor lehetőségektől is pre-hct kezelés 5-AZA-val szerény előnyt hozhat az indukciós kezeléssel szemben, legfőképp az alacsonyabb toxikus hatásai miatt ajánlott pre-hct azacitidine vagy decitabine terápia azoknak a betegeknek, ahol őssejt transzplantációt tervezünk A HSCT előtt CR elérése a cél A fiatal, nagyon magas blast aránnyal rendelkező MDS betegeknek (>15%), kedvező vagy intermedier risk karyotípus betegségben és jó performance status esetén vagy akik progrediálnak a hypometiláló terápia mellett javasolt az AML-es protokollok alkalmazása HCT előtt
31 KEZELÉS MAGAS RIZIKÓ ESETÉN A kedvező cytogenetikai eltérésekkel rendelkező betegeknél HCT nem ajánlott. Idős, kedvezőtlen karyotípus abnormalitásokkal rendelkező beteg esetén, a pre-hct indukciós kemoterápia elkeserítő eredményeket mutat. Amíg a HCT-re várakozik cytoreduktív kezelés ajánlott, ahol a blast arány >10% - 15% közt van. Ahol alacsonyabb a blast arány, ott szorosan monitorozzuk a beteg blast arányát és kemoterápiát ne adjunk Lenalidomide: del (5q) MDS betegeknél az indukciós terápiában alkalmazva HCT előtt hatékony, de fokozza a GVHD-t Donor: idősebb match releated donor vagy fiatalabb unreleated donor? Egyértelmű előny a match releated donor esetén. Optimális a sibling donor, de itt 60 éves életkor a limit.
32 IRODALOM 1. B o r b ény i Z, A myelodyspla stiku s szindróma d iagnózisa és kezelése. 2. B owen D, Culligan D, J owitt S, Kelesey S, Muf t i G, Oscier D, Parker J. G u idelines for the d iagnosis a n d therapy o f a d u lt myelodyspla stic syndro m es. Br J H a emato l ; 1 2 0: S werdlow SH, C a m p o E, H a r r is NL et al. W H O Classificatio n o f Tu m o u r s of H a emato p o iet ic a n d Ly m p h o id T issues. Lyo n : I A RC P r ess, M itelman F, J o h a n sson B, M er tens F. T h e M itelman Database o f C h ro m o s o m e A b errations in C a n c er. Ava ilable at: h t t p : / / cgapncinihg ov/chro m osomes/mitelm a n a c c essed 1 November, G r eenberg P, Cox C, LeBeau M M, Fenaux P, Morel P, S a n z G, Sanz M, Va llespi T, Hamblin T, Oscier D, Ohyashiki K, Toyama K, Au l C, Muf t i G, B ennet t J. I n ternatio nal scoring system for eva luating p ro g n o sis in myelodysplastic syndro m es. B lood ; 8 9 : M a lcova t i L, G e r m ing U, Ku endgen A, Della Por t a M G, Pascutto C, Invernizzi R, Gagounidis A, Hildebrandt B, B ernasconi P, Knipp S, S t r u p p C, Lazzarin o M, Au l C, Cazzola M. T imed ependent p ro g n o stic s c o r ing system for p r edicting sur viva l a n d leukemic evo lution in myelodyspla stic syndro m e s. J C lin Oncol ; 2 5 : J a d ersten M, H ellström-lindberg E. myelodyspla stic syndro m es: b iology a n d treatment. J o f I n t Med; ; 2 6 5: N C C N C linical P r a c t ice G u idelines in Oncology: M yelodyspla stic S y n d ro m es V w w w. nc cn.o r g. 9. T imothy G r a u b e r t, M a t tew J. Wa lter G enet ics o f M yelodysplastic S y n d ro m ees: N ew I n sights
33 ACUT MYELOID LEUKEMIA Dr. Csalódi Renáta
34 AZ AML KLINIKAI FELOSZTÁSA De novo Secunder Főleg fiatalok Derült égből Kormoszóma transzlokációk Kemokurabilis lehet Idősek Anamnesis (MDS, MNP, gyógyszer) Numerikus és komplex aberrációk Legtöbbször fatalis
35 A myeloid blastsejtek clonalis, heveny lefolyású proliferációja a csontvelőben, vérben, vagy más szövetben a csontvelői és/vagy a perifériás keneten található sejtek legalább 20%-os blasztarányával jár*, igazoltan (Auer-pálcák, citokémiai, vagy immunhisztokémiai festések) myeloid eredetű. *: kivéve visszatérő genetikai abnormalitásal járó leukemiák: t(8;21), inv(16), t(15;17), illetve erythroleukemia bizonyos esetei
36 EPIDEMOLÓGIA Incidencia Magyarországon: 2,5 új eset/százezer fő/év Átlagos életkor: 60 év Férfi-nő arány- 1:1 A felnőttkori akut leukemiák 70-80%-a A gyermekkori akut leukemiák 15%-a Összesített hosszú távú túlélés: 20-40% Őssejttranszplantációval fiatal betegekben akár 40-50% A jó prognózisú esetek akár 80-90%-ában indukálható remisszió, míg kedvezőtlen prognózisú eltéréseknél ez csak 50%
37
38
39
40
41 WHO KLASSZIFIKÁCIÓ AML with recurrent genetic abnormalities AML with t(8;21)(q22;q22.1);runx1-runx1t1 AML with inv(16)(p13.1q22) or t(16;16)(p13.1;q22);cbfb-myh11 APL with PML-RARA AML with t(9;11)(p21.3;q23.3);mllt3-kmt2a AML with t(6;9)(p23;q34.1);dek-nup214 AML with inv(3)(q21.3q26.2) or t(3;3)(q21.3;q26.2); GATA2, MECOM AML (megakaryoblastic) with t(1;22)(p13.3;q13.3);rbm15-mkl1 Provisional entity: AML with BCR-ABL1 AML with mutated NPM1 AML with biallelic mutations of CEBPA Provisional entity: AML with mutated RUNX1
42 APL: t(15;17)(q22;q12); PML-RARA Akut promyelocytás leukemia (APL). külön entitásként kezeljük, mivel mind prognózisát (időben felfedezett betegség esetén kiváló), mind kezelését tekintve erősen eltér a többi AML-től. M3 fagottsejtekkel Hypergranuláris M3 Hypogranuláris M3
43 WHO KLASSZIFIKÁCIÓ II. AML myelodysplasiához kapcsolódó eltérésekkel: MDS/myeloproliferativ megbetegedést követően kialakult AML, 20% feletti blasztaránnyal, MDS-re jellemző citogenetikai abnormalitás jelenléte: -komplex karyotípus -nem kiegyensúlyoztott krsz. eltérések: -7, vagy del(7q); -5, vagy del(5q); i(17q), vagy t(17p); -13, vagy del(13q); del(11q); del(12p), vagy t(12p); idic(x)(q13) -kiegyensúlyozott krsz. eltérések: t(11;16)(q23;p13.3); t(3;21)(q26.2;q22.1); t(1;3)(p36.3; q21.1); t(2;11)(p21;q23); t(5;12)(q33;p12); (5;7)(q33;q11.2); t(5;17)(q33;p13); t(5;10)(q33;q21); t(3;5)(q25;q34), vagy Kettő, vagy több myeloid sejtvonalban a sejtek több mint fele dysplasiás vonásokat mutat NPM1 vagy CEPBA mutáció
44 WHO KLASSZIFIKÁCIÓ III. Terápia kapcsán kialakult AML: Külön entitás Főleg alkiláló szerekkel és topoizomeráz II-gátlókkal (anthracyclin/ mitoxantron/ podofillotoxinok) történő kemoterápia után Régen eszerint két csoportra osztották, de mostanában nem szokták, a kétféle szert ugyanis gyakran együtt alkalmazzák
45 WHO KLASSZIFIKÁCIÓ IV. AML-Not Otherwise Specified (AML-NOS) Az ide tartozó kórképeket a régebbi, morfológiai kritériumokon alapuló FAB (French-American-British) klasszifikáció szerint osztályozhatjuk: M0: AML minimális differenciációval M1: AML érés nélkül M2: AML kiéréssel M3: APL ma már citogenetikai dg. és kategória M4: akut myelomonocytaer leukemia M5: akut monoblastos/monocytás leukemia M6: akut erythroleukemia tiszta erythroleukemia Erythroleukemia erythroid/myeloid eredettel M7: akut megakaryoblastos leukemia: ált. citogenetikai eltérés szerint osztják be (t(1;22)) M8: akut basophil leukemia M9: akut panmyelosis myelofibrosissal
46 WHO KLASSZIFIKÁCIÓ V. -EGYÉB M yeloid sarcoma (primeren extramedulláris myeloid tumor, granulocytás sarcoma, chloroma) Down-syndromához kapcsolódó myeloid proliferációk: Tranziens abnormális myelopoiesis (TAM) Down-szindrómához asszociálódó AML GATA1 mutations and mutations of the JAK-STAT pathway Blasz tos plaz mocytoid dendritikus sejtes neoplasia Acute leukemias of ambiguous lineage Acute undifferentiated leukemia Mixed phenotype acute leukemia (MPAL) with t(9;22)(q34.1;q11.2); BCR- ABL1 MPAL with t(v;11q23.3); KMT2A rearranged MPAL, B/myeloid, NOS MPAL, T/myeloid, NOS Kikerült az erythroid leukemia (A myeloblastokat mindig az összes csontvel ő sejtek százalékos arányaként kell megadni. Ha <20% akkor MDS)
47 ETIOLÓGIA-SZEKUNDER AML Terápia következményeként: leggyakrabban a kezelés után 5-10 évvel jelentkezik. Kemoterápia: Topoizomeráz II gátlók (anthracyclin,mtx, podofillotoxinok) Alkiláló szerek Radioterápia MDS, vagy myeloproliferativ megbetegedés a beteg kórtörténetében
48 ETIOLÓGIA DE NOVO AML de novo AML: nincs ismert oka, de számos tényező fennállása esetén gyakrabban fordul elő Kemikáliáknak való gyakori expozíció: Benzol Benzin, gázolaj, egyéb kőolajszármazékok Rovarirtók, gyomirtók Ragasztók, festékek, tinták Nehézfém expozíció, főleg kohóban, vagy fémmegmunkáló üzemben
49 ETIOLÓGIA DE NOVO AML Ionizáló sugárzásnak való fokozott expozíció: pl. atombombák után Japán: az érintett populációban a gyakoriság 5-7 évig erősen emelkedett Elektromágneses mező, pl. távvezetékek változó eredmények, nem egyértelmű korreláció Kolóniastimuláló faktorok: egyes források szerint a korábbi (főleg gyermekkori) daganatellenes kezelésben történő használatuk a kemoterápián felül fokozza az AML és MDS rizikót
50 ETIOLÓGIA DE NOVO AML Örökletes tényezők: Egyes források szerint a szülők (különösen az édesanya) alkoholfogyasztása fokozza a gyermekkorban előforduló AML rizikóját Down-szindróma Rendkívül ritka örökletes szindrómák következményes fokozott AML rizikóval: 8-as triszómia (komplett, vagy mozaik) - Warkany-szindróma Bloom-szindróma Fanconi anaemia Neurofibromatosis Li-Fraumeni-szindróma Wiskott-Aldrich-szindróma Kostmann-szindróma Diamond-Blackfan-szindróma Thrombocytopenia, absent radius(tar)-szindróma
51 ELVÉGZENDŐ VIZSGÁLATOK Teljes kvalitativ vérkép Csontvelő aspirátum. A crista ilei biopszia opcionális, de bizonytalanság, vagy punctio sicca esetén el kell végezni. Részletes anamnézis és státusz Rutin vér és vizelet laborvizsgálatok Véralvadási paraméterek vizsgálata Hepatitis A/B/C szerológiai vizsg. Mellkas rtg., 12 elvezetéses EKG Indikáció esetén echocardiographia KIR érintettség gyanúja estén lumbal punctio Terhességi teszt (reproduktív korú nőbetegnél)
52 MORFOLÓGIAI VIZSGÁLAT A csontvelő és a perifériás vér alakos elemeinek kvalitativ vizsgálata: Dg. kritérium: legalább 20% a blasztok aránya a csontvelőben és/vagy a perifériás vérben (kivéve CBF-AML, APL) A periférián legalább 200 fvs., csontvelőkeneten legalább 500 magvas sejt vizsgálata alapján mondható ki a diagnózis Gyanújelek a kvalitativ vérképben, különösen, ha egyszerre több is jelen van: Anaemia Thrombocytopenia Leukopenia, vagy leukocytosis
53 MORFOLÓGIAI VIZSGÁLAT Citokémiai vizsgálatok: Myeloperoxidáz (MPO)-festés: több, mint 3% festődés a blasztokban myeloid sejtvonal eredetre utal, de a festődés hiánya ezt nem zárja ki (korai myeloblastok és monoblastok nem mindig tartalmaznak MPO-t) Sudan black B (SBB): MPO-hoz hasonló, kevésbé specifikus, mint az MPO festés Nemspecifikus észteráz (NSE): monoblasztokban diffúz cytoplazmatikus festődés (>80% pozitív), monocyták (>20% poz.) kimutatására is alkalmas Perjódsav-Schiff festés (PAS): nagyobb sejtfelszíni globulusok erythroid leukemiában
54 IMMUNFENOTÍPUS MEGHATÁROZÁSA Az eszköz: legalább 3-4 színnel dolgozó áramási citométer Hasznosítás: A leukemiás sejtvonal eredetének meghatározása Bizonyos altípusok diagnózisa csak így lehetséges Aberráns immunfenotípusok esetén lehetséges a leukemiás sejtek mennyiségének követése a morfológiai vizsgálatoknál érzékenységének határain jóval túl (MRD kimutatása)
55 IMMUNFENOTÍPUS MEGHATÁROZÁSA Leggyakoribb markerek (pozitív>20%): Hemopoieticus prekurzor markerek: CD34, CD38, CD117, HLA-DR Granulocyta markerek: CD13, CD15, CD33, CD65, citoplazmatikus MPO Monocyta markerek: NSE, CD11c, CD14, CD36, CD64, lyzozim Megakarycyta markerek: CD41, CD42, CD61 Erythroid marker: glycophorina (CD235a)
56 CITOGENETIKAI VIZSGÁLAT Több mint 55%-ban mutatható ki felnőttkori AML-ben cytogenetikai eltérés A hét visszatérő citogenetikai eltéréssel járó WHO kategória diagnózisához elengedhetetlen Legalább 20 metafázisos sejtmag vizsgálata kötelező normális karyotípus, és ajánlott kromoszómaaberráció jelenétének kimondásához
57 MOLEKULÁRIS CITOGENETIKA (FISH) Amennyiben a citogenetikai analízis sikertelen, megkísérelhető a leggyakoribb visszatérő abnormalitások vizsgálata FISH segítségével Az MLL gén fúziós partnerének meghatározásához különösen gyakran szükséges FISH 5q és 7q kromoszóma régiók elvesztése is igazolható
58
59 MOLEKULÁRIS VIZSGÁLAT (PCR) RT-PCR segítségével kimutathatók visszatérő genetikai eltérések olyan esetekben, ahol a morfológiai vizsgálat ezt valószínűsíti, de a citogenetika negatív, vagy nem értékelhető (pl. CBFB-MYH11). Szomatikus mutációk igazolása, pl. a NPM1, FLT3, CEBPA gének érintettsége. Az alábbi hármat ajánlott elvégezni negatív karyotípusú AML-ben További génlókuszok vizsgálata kutatási céllal: pl. MLL, WT1, KIT, RUNX-1, TET2, IDH1 Amennyiben a fenti eljárásokkal a neoplasiás sejtvonalra specifikus molekuláris targetet nyertünk, használható ennek követése a betegség dinamikájának, illetve MRD-nek a követésére.
60 KEZELÉSRE ADOTT LEHETSÉGES VÁLASZOK Komplett remisszió (CR): csontvelői blasztarány <5%, nincsenek Auer-pálcák, abszolút neutrofil szám>1 G/l, thrombocytaszám >100 G/l, nem igényel vvt. Transzfúziót CR inkomplett regenerációval (CRi): a fenti morf. Kritériumok, de a thrombocyta, vagy neutrofil szám alacsonyabb Citogenetikai CR (CRc): citogenetikai eltérés után visszatérés normál karytípushoz a CR során Molekuláris CR: a molekuláris célpont határérték alá csökkenése + CR, nincs standard definíció Partiális remisszió (PR): CR-hez hasonló kritériumok, a blasztarány csak 5-25%, és legalább a 50%-al csökkent a kezelés alatt Rezisztens betegség: CR nem érhető el (csak az első kezelést követő 7 napon túl értelmezendő, perzisztáló leukemia esetén) Relapszus: újból 5% feletti csontvelői blasztok, perifériás vérben felbukkanó blasztok, vagy extrameduláris betegség kialakulása. Halál: apláziában, leukemia szövődményként, vagy nem meghatározható okból.
61 A BETEGRE JELLEMZŐ PROGNOSZTIKUS FAKTOROK Életkor: önálló rizikótényező idősebb betegek azonos genetikai eltérések, komorbiditás, stb. esetén is rosszabb prognózissal bírnak. Ráadásul a kedvezőtlenebb genetikai eltérések, és a szekunder leukemiák aránya is nő a korral. A beteg neme Komorbiditás: megítélhető score-rendszerek alapján, pl. Hemopoietic Stem Cell Transplant-Comorbidity Index (HCT-CI) Általános állapot, megítélhető performance-skálák segítségével
62 A BETEGSÉGRE JELLEMZŐ PROGNOSZTIKUS FAKTOROK Fehérvérsejt szám diagnóziskor A szekunder AML rossz prognózist jelent (kemotherápia, vagy MDS az anamnézisben) Az első kezelésre adott válasz: CR jó, PR rosszabb, míg a válasz hiánya igen rossz prognózist tükröz Citogenetikai eltérések: kedvező, intermedier és kedvezőtlen rizikócsoportok Molekuláris eltérések
63 KEDVEZŐBB PROGNÓZIST JELENTŐ ELTÉRÉSEK CBF (core binding factor)-aml-ek: előnyös prognózist jelentenek Diagnózisukhoz (hasonlóan a t(15;17) -hez) nem szükséges a 20%-ot meghaladó blasztarány, amennyiben a kromoszóma-transzlokáció bizonyított t(8;21)(q22;q22) inv(16)(p13.1;q22) Bizonyos szomatikus mutációk karyotípus eltérés nélkül: II. osztályba tar tozó mutációk, melyek a dif ferenciáció gátlását okozzák. Különlegességük, hogy nem citogenetikai abnormalitások, hanem a fenti gének egyszerű mutációi okozzák. Kimutatás: RT-PCR Ha semmilyen egyéb karyotípus eltérés, vagy mutáció nem társul hozzájuk, előnyös prognózi s. Mutáns NPM1 (nucleophosmin1) normális karyotípussal Mutáns CEBPA (CCAAT Enchancer Binding Protein Alpha)
64 KEDVEZŐTLEN PROGNÓZIST JELENTŐ ELTÉRÉSEK Inv(3)(q21;q26.2) t(6;9)(p23;q34) A 11q23 régióban található MLL gén transzlokációját jelentő eltérések, kivéve a t(9;11)(p22;q23) transzlokációt, mely közepes prognózisú betegséget jelez 5., és 7. kromoszómák hiánya, 5q-, illetve a 17. krsz. abnormalitásai Komplex karytípus: három, vagy több kromoszómaeltérés, kivéve t(8;21), inv(16), t(15;17) Monoszomális karyotípus: bármely kromoszóma monoszómiája (kivéve X/Y), mely egy másik monoszómiával, vagy strukturális kromoszómaeltéréssel társul.
65 INTERMEDIER PROGNÓZIST JELENTŐ ELTÉRÉSEK I. Citogenetikai eltérések: t(9;11)(p22;q23) MLLT3-MLL Egyéb, eddig nem felsorolt kromoszóma eltérések prognózist befolyásoló hatása nem bizonyított Sem kedvezőnek, sem kedvezőtlennek nem besorolt citogenetikai eltérések
66 INTERMEDIER PROGNÓZIST JELENTŐ ELTÉRÉSEK II. Szomatikus génmutációk közül az FLT3-ITD (Internal Tandem Duplication) Az ITD jelentése: egy génen belüli szakasz megduplázódik (ld. lenti ábra) Az FLT3 egy tirozin kinázt kódoló gén mutációja ún. I. típusú mutáció, mely proliferációs, vagy túlélési előnyt biztosít a leukémiás sejtek számára A mutáció jelenléte esetén a betegség közepes prognózisú FLT3-ITD mellett már a NPM1 szomatikus mutáció sem jelent előnyös prognosztikai faktort Normális FLT3 gén Az FLT3 gén egy szakasza tandem módon megduplázódott
67 KURATÍV CÉLÚ KEMOTERÁPIÁS KEZELÉS Indukciós kezelés: 7+3 kezelési séma 1. nap 2. nap 3. nap 4. nap 5. nap 6. nap 7. nap Cytarabin mg/m 2 /d folyamatos iv. inf. 1. nap 2. nap 3. nap Anthracyclin: daunorubicin minimum. 60mg/m 2 /d vagy idarubicin 10-12mg/m 2 /d, vagy mitoxantron 10-12mg/m 2 /d Intenzifikált indukciós módszerek: Dupla indukció: a napokon egy második, hasonló, kicsit rövidebb indukciós kezelés Időzített, szekvenciális induckió: az előbbihez hasonlóan a napokon
68 KURATÍV CÉLÚ KEMOTERÁPIÁS KEZELÉS Konszolidációs kezelés: 4 ciklus nagy dózisú cytarabin terápia (HiDAC) 1. nap 3. nap 5. nap 3 g/m 2 /d Cytarabin 12 óra alatt bejutattva A HiDAC kezelés hatékonyabbnak bizonyult a korábban használt közepes, illetve kis dózisú Cytarabin kezelésekhez képest. Ezt a hatékonyságot más citosztatikumokal kombinálva sem sikerüt felülmúlni konszolidációs kezelésben.
69 HEMATOPOIETICUS ŐSSEJTTRANSZPLANTÁCIÓ Allogén őssejttranszplantáció: Rokon, vagy MUD (matched unrelated donor) Perifériás, vagy csontvelőből történő őssejt nyerés Különböző kondícionálási módok: Myeloablatív kondícionálás általában egésztest-besugárzás (TBI), kombinálva cytosztatikummal és/vagy monoklonális antitesttel (anticd45, anticd66): magasabb mortalitás, kevesebb relapszus Reduced intensity conditioning (RIC) alacsonyabb transzplantációs mortalitás, de gyakoribb relapszus
70 HEMATOPOIETICUS ŐSSEJTTRANSZPLANTÁCIÓ Allogén őssejttranszplantáció: A hatékonyság kulcsa: Aggresszív myeloablatív kezelés lehetséges Graft versus leukemia (GVL) effektus Hátrány: nagy transzplantációhoz kapcsolódó mortalitás Főleg intermedier és kedvezőtlen prognózisú betegeknél éri meg a kockázatot Mindig egyéni mérlegelés: prognosztikai csoport, komorbitditási score (HCT-CI), CMV szerostátusz, egyéb, nem HLA génpolimorfizmusok
71 HEMATOPOIETICUS ŐSSEJTTRANSZPLANTÁCIÓ Autológ őssejttranszplantáció: Hasonló túlélés, mint kemoterápiánál kedvező és intermedier prognózisú betegeknél Nagy rizikójú betegekben nem ajánlott
72 PALLIATIV KEZELÉS Legtöbbször szupportív kezelés mellett, idős, leromlott állapotú betegeknél jön szóba, akik kísérőbetegségeik, és általános állapotuk miatt valószínűleg nem tudnák elviselni a kuratív célú kezelés mellékhatásait. Például: 5+3 séma: a 7+3 -hoz hasonló, rövidebb ideig adott Cytarabinnal. A kuratív és a palliativ kezelés közötti átmenet. Etoposid + Cytarabin Hydroxyurea (Litalir) per os adható
73 SZUPPORTÍV KEZELÉS Antimikrobiális kezelés: nagy rizikó esetén akár profilaktikusan Antimikotikus kezelés azolok Antimikrobiális kezelés: profilaxisra fluorokinolonok, egyébként célzott, vagy empirikus terápia Transzfúziók: Vörösvértest-koncentrátum Thrombocyta-koncentrátum Amennyiben őssejttranszplantáció szóba jöhet, vagy történik, csak szűrt és irradiált készítmények adhatók (CMV fertőzés, alloimmunizáció, GVHD veszélye) Növekedési faktorok (CSF): nem javítanak a betegek túlélésén, ezért nem részei az általános terápiás irányelveknek.
74 MOLEKULÁRISAN CÉLZOTT TERÁPIA FLT3-kináz gátlók: jelenleg kutatás alatt, FLT3-ITD pozitív AML kombinációs terápiájára. Pl. sorafenib, midostaurin, lestaurtinib, sunitinib Demetilálószerek azacitidin: MDS-ben, illetve idősek 20-30% blaszttal járó AML-jében eredmények Gemtuzumab ozogamicin (GO): humanizált anti-cd33 antitest, citosztatikumhoz kötve. USA -ban és Japánban idősebb páciensekben használják relapszus esetén, ha más kemotherápia nem jön szóba
75 KEZELÉSI STRATÉGIÁK PROGNOSZTIKAI CSOPORTONKÉNT PERFORMANCE STÁTUSZ
76 KEDVEZŐ PROGNÓZISÚ GENETIKAI ELTÉRÉSEKKEL - KURATÍV A legjobb eredményeket 7+3 indukciós sémát követő, 3, vagy több ciklus HiDAC kezeléssel érték el Az őssejt transzplantáció itt általánosságban nem jár jobb eredménnyel, mint a hagyományos kemoterápia, viszont jóval több szövődménye van Legfeljebb rosszul reagáló, vagy molekulárisan perzisztáló betegségnél jöhet szóba, jó állapotú, alacsony transzplant rizikójú betegeknél
77 INTERMEDIER PROGNÓZISÚ GENETIKAI ELTÉRÉSEKKEL - KURATÍV Itt is elterjedten alkalmazzák 7+3 indukciót követő HiDAC konszolidációt, de kevésbé eredményesen, mint az előbbi csoportban Emiatt itt fontosabb szerepet kap az allogén hematopoieticus őssejt transzplantáció, mint konszolidációs kezelés Egyéni mérlegelés szükséges: inkább magasabb relapszus kockázatú, közepes,vagy alacsony transzplantációs rizikójú betegeknél érdemes transzplantálni
78 KEDVEZŐTLEN PROGNÓZISÚ GENETIKAI ELTÉRÉSEKKEL - KURATÍV A hagyományos konszolidációs kezelés általában nem vezet kielégítő eredményre A választandó kezelés: allogén HSCT az első komplett remisszió időszakában Egyes források (CIBMTR) szerint több, mint 30%-os hosszú távú túlélés érhető el kedvezőtlen citogenetika mellett is allo-hsctvel, szemben a hagyományos konszolidációval elért 15% körüli túléléssel
79 PALLIATÍV KEZELÉS Idősebb ill. rosszabb általános állapotú betegek, szignifikáns komorbiditás Jellemzően gyakoribbak a rossz prognosztikai faktorok, de az életkor ettől függetlenül is kedvezőtlenül befolyásolja a prognózist Jó általános állapot, és relative kedvező prognózis esetén itt is alkalmazható kuratív célú kezelés: Hagyományos 7+3 indukciós kezelés, majd közepes (400mg/m2/d) dózisú cytarabin konszolidációs kezelés A dózis csökkentése gyakran szóba jön, ez betegre szabottan mérlegelendő (pl. 5+3 ) HSCT-nél: kevésbé intenzív kondícionálási protokollok is lehetségesek (RIC - reduced intensity conditioning)
80 BEST SUPPORTIVE CARE 75 év feletti, vagy rossz állapotú, társbetegségekben szenvedő betegek Jelenleg nem ismert kuratív hatású, mortalitású kezelés Palliativ, és szupportív kezelések Az alacsony dózisú cytarabint (LDAC) tartalmazó kezelés vagy hydroxyurea alapú kezelés
81 RELAPSZUS Általában véve igen rossz prognosztikai jel A prognózist a korábbi tényezőkön kívül a CR időtartama is befolyásolja (korai relapszusnak hívjuk, ha az első (CR1) kevesebb, mint 6 hónapig tart) Kezelés: Indukciós kezelésként cytarabin anthracyclinnel kombinálva, vagy anélkül Konszolidációként főleg allo-hsct alkalmazandó, nagy transzplant rizikójú betegeknél akár RIC kondícionálással Amennyiben erre nincs mód, alternatív, vagy experimentális kezelési sémák HSCT-t követő egy éven túli relapszus esetén újabb transzplantáció ajánlható fel a betegnek
82 SPECIÁLIS HELYZETEK KEZELÉSE Hyperleukocytosis (WBC>100G/l): tumorlysis-szindróma, hemorrhagia, infectio veszélye. Ajánlott Hydroxyurea kezeléssel a sejtszámot G/l alá csökkenteni, de leukapheresis is lehetséges. KIR érintettség: kb. 5%-ban; amennyiben kialakul, mg cytarabin intrathecalisan 2-3x hetente, a blasztok eltűnéséig, és utána még három alkalommal. Myeloid sarcoma: AML-ként kezelendő, nincs bizonyított prognosztikai különbség. Terhesség: a betegség lefolyása nem különbözik a nem terhesekhez képest. A cytotoxikus kezelés spontán abortushoz, magzati malformatiókhoz vezethet az 1. trimeszterben, a 2., 3. trimeszterben koraszülést, alacsony magzati születési súlyt okozhat. A lipofil idarubicin helyett a kevésbé teratogén daunorubicin alkalmazandó.
83 UTÁNKÖVETÉS Az indukcióra történő válasz megítélése protokolltól függően, általában a napok között történik indukciótól számítva A legtöbb relapszus 1-3 évvel a terápia befejezése után A követés során csontvelői mintavétel csak a normálistól eltérő vérkép esetén szükséges A vérkép kontrollja az első két évben 1-3 havonta, majd az 5. év végéig 3-6 havonta szükséges MRD monitorozás előre meghatározott időpontokban
84 ACUT PROMYELOCY TÁS LEUKEMIA (APL) A perifériás kenetben gyakran leukopenia és promyelocyták láthatóak, bőséges, gyakran szabélytalan külsejű primer azurofil granulomokkal. A leukemiás promyelocytákban számos Auer pálca található. Ez az egyetlen AML szubtípus, amelynél a kezelést azonnal el kell kezdeni, ha a betegség gyanúja felmerül A folyamatosan fellépő vérzéses események a leggyakoribb halálokot jelentik a korai időszakban (a korai halál kb. 10%) Low risk: fvs < 10,000/µL és a tct > 40,000/µL; Intermediate risk: fvs < 10,000/µL és a tct < 40,000/µL; High risk: fvs > 10,000/µL A metafázis karyotipizálás előnye, hogy magas a specificitása és vizsgálhatóak a különböző variáns transzlokációk A reverse-transcriptase polymerase chain reaction (RT-PCR) alkalmas a PML-RAR-α fúziós transzkriptum vizsgálatához Florescence in situ hybridization (FISH) is végezhető, de emellett szükséges a kar yotipizálás és az RT-PCR.
85 APL BEVEZETŐ KEZELÉS Az alacsony és intermedier rizikójú betegeknél, ha coagulopathia is fennáll 1-3 napig ATRA (45 mg/m2) kezelés javasolt a kemoterápia megkezdése előtt. Magas rizikó esetén az ATRA csökkentheti ugyan a leukocytosist, ami a coagulopatiát súlyosbítja, de ATRA szindróma alakulhat ki mellette. Emiatt a magas rizikójú betegek számára kezdetben is ATRA plus kemoterápia kombinációja javasolt még cytogenetikai vagy molekuláris vizsgálatok elkészülte előtt. A standard dózis ATRA kezelést a CR kialakulásáig kell folytatni (jól tolerálható) ATRA szindróma: kardiorespiratorikus distress szindróma, pleuralis, pericardilais folyadékgyülemmel, pneumoniával (diff. dg: diffútz alveolaris vérzés) kezelése napi 2x10 mg dexamethasone ha a fvs /μL profilaktikus corticosteroid adása megfontolandó (dexamethasone) ha nincs kifejezett kontraindikáció (immunszuppresszív hatású!) S weet syndro m a (aku t lázas neutro fil d ermato sis): a subcutan szövet b en a n eutro p h il sejtek infiltrác ió ja. AT R A kezelés m ellet t n em r itka ( stero idra jól reagál) AT R A egyéb m ellékhatásai: c sontvelő necro sis, p a n c r eatitis, hypercalc em ia; g yermekekb en r elatíve g yako r i a p seudotumor c erebri előfordulá sa M ellékhatások jelentkezése eset én is betegek a z z a l járnak a legjobban, h a végig kapják a z AT R A - t
86 APL - COAGULOPATHIA Teljes vérkép napi 2-3x szükséges a coagulopathia megszűntéig Fibrinogén, INR és apti legalább naponta 2x legyen Thrombocyta transzfúzió adandó, amíg G/L eléri És FFP adandó,a míg a fibrinogén szintje 1.5 g/l fölé nem emelkedik Akár naponta többször is szükséges lehet a transzfúziók adása az első héten vagy a coagulopathia megszűntéig Ez a nagyon aggresszív szupportáció csökkentheti a fatalis vérzések számát A rutinszerűen alkalmazott heparin előnyös hatása nem egyértelmű, kivéve ha nagy véna trombózis esetén vagy antifibrinolytikus kezelés mellett A lumbál punkció rutinszerűen elvégzendő a high risk betegeknél (!de a coagulopathia megszűntéig kontraindikált) centrál véna katéter behelyezését kerülni kell
87 APL - HYPERLEUKOSIS APL esetében a leukapheresis nem ajánlott a halálos szövődményei miatt Ennek oka, hogy az apheresis a leukémiás sejtek lysisét eredményezi és rontja a meglévő coagulopatiát Így hyperleukosis esetén ajánlott ATRA plus kemoterápia együttes alkalmazása A magas rizikójú betegek (vagy ha > G/L fvs szám alakul ki az ATRA kezelés alatt) KIR profilaxis javasolt 4 alkalommal (sze. több) hetente a CR eléréséig (intrathecalis methotrexate alternálva Ara-C-vel) A high-risk betegeknél megfontolandó: corticosteroidok, LMWH, FLT3 inhibitor (magas az FLT3 internal tandem duplikáció incidenciája) és az autológ HCT az első CR-ban (CR1) (miután az egyértelmű, hogy hatékony a második molekuláris CR (CR2) elérésére és a TRM kifejezetten alacsony)
88 APL - KEZELÉS Alacsony és intermediate rizikójú betegeknél javasolt ATRA plus idarubicin adása Ara-C nélkül G-CSF rutinszerű alkalmazása nem javasolt az indukció során Új stratégia az arzén trioxid (ATO) beépítése a korai kezelésbe, amivel bizonyos szövődmények elkerülhetők ATO az egyik legaktívabb szer APL-ben. Direkt módon elpusztítja a PML- RAR-α fúziós transzkriptumot (RNS) ami eredményezi a RAR-α gén transzkripcióját (RNS szintézis), ez differenciálódáshoz valamint növekedéshez vezet, ami megállítja a leukemiás sejtek osztódását apoptózis útján vagy csökkenti az önmegújító képességüket ATO kiszabadítja a cytochrome C enzimet a mitochondriumból, ami caspase aktivációhoz vezet, ami önmagában is apoptózist okoz és szinergista az ATRA-val A betegek hatékonyan kezelhetők és potenciálisan meggyógyíthatók ATRA plus ATO kombinációjával (dream team) Akik nem tolerálják az antracyclin terápiát (szívbetegség, korábbi antracyclin kezelés, (idős kor, rossz performace státusz) az ATRA plus ATO adható csökkentett dózisú anthracyclinnel (1-4 ciklus). Az idarubicin ajánlott és csak akkor ha a fvs > G/L (kezdetben vagy kezelés hatására). Addig szükséges, amíg kontrollálni kell a magas fvs számot.
89 APL - RELAPSUS Magas rizikójú betegségben ATO ajánlott legalább 2 ciklus 25 napos terápia. Ha létrejön a CR2 további 4 ciklus ATO szükséges Az ATRA adása rutinszerűen nem javasolt ATO mellé relabált APL-ben 4 ciklus hetente alkalmazott intrathecalis methotrexate vagy methotrexate és Ara-C alternálva Molekularis relapsus esetén a kezelés ugyanez. Ennek diagnózishoz 2 pozitív minta vizsgálata szükséges 2-4 héten belül RT-PCR-ral Konszolidáció relapsusban: A molekularis CR2-ben a legjobb eredmények nagy dózisú kemoterápiával és autológ HCT-vel érhetők el. Perifériás őssejt mobilizáláshoz ajánlott high-dose Ara-C (hatékonyan mobilizál és bejut a KIR-be) A salvage kezelés célja elérni a molekuláris CR2 -t majd autológ HCT-vel folytatni Ha HCT nem jön szóba, akkor további 4 ciklus ATO adható az indukció után (6 teljes ciklus)
90 APL - KEZELÉS Konszolidáció A stratégia a rizikótól függ. 2 vagy 3 ciklus anthracyclin bázisú kemoterápia adandó az alacsony - és intermediate-risk betegeknek az CR1-ban Az anthracycline daunorubicin vagy idarubicin lehet, emellé 1-2 hét ATRA terápia is szükséges, amíg kialakul a molekuláris CR Magas rizikó esetén közepes- vagy nagy dózisú Ara-C adható (életkortól függően) vagy 2 ciklus ATO 25 napig. A két opció közül nincs egyértelműen preferált
91 APL - KEZELÉS A fenntartó kezelés A túlélési előny egyértelmű, így kötelező része a kezelésnek 1-2 év, intermittálva ATRA és kis dózisú kemoterápia (6- mercaptopurine és methotrexate) A molekularis remisszió a konszolidációs kezelés után egy fontos prognosztikai faktor. Ha az indukciós kezelés végén a cytogenetika normál karyotípust mutat és molekularis vizsgálat is negatív, a továbbiakban perifériás vérből RT-PCR-ral a PML-RAR-α fúziós transcriptum monitorozása elegendő a beteg követésére csontvelő vizsgálat ismétlése nélkül A fenntartó kezelést követően az alacsony rizikójú betegeknél nem igényelnek monitorozást a molekuláris CR1 -ben Az intermedier ill. magas rizikójú csoportban a fenntartó kezelés után 3 havonta RT-PCR (vsz. kisebb frekvenciával is megfelelő)
92 ACUT LYMPHOID LEUKEMIA Dr. Csalódi Renáta
93 ACUT LYMPHOID LEUKEMIA A csontvelő malignus betegsége, mely a pluripotens haemopoeticus ősssejtekből indul ki Kontrollálatlan, clonalis sejtproliferáció, mely infiltrálja a csontvelőt és kiszorítja a normális hemopoesist ill. az extramedullaris infiltráció okozta szervi tünetek jellemzik 20% feletti blast arány a csontvelőben vagy a perifériás vérben
94
95
96 EPIDEMIOLÓGIA Incidencia gyermekkorban 2 és 6 év között 60%-uk 20 évnél fiatalabb A gyermekkori malignomák 30%-a A felnőtt acute leukemiák 20%-a Férfi túlsúly Medián életkor felnőtteknél 35 év
97 ETIOLÓGIA A legtöbbször ismeretlen Genetikai predispositio Radioaktív sugárzás (terápiás vagy baleset) Toxinok (aromás szénhidrogének) Dohányzás: kis rizikó emelkedés >60 év Secunder ALL: kemoterápia (topo-ii gátlók) Vírusok HTLV-1 felnőtt T-sejtes ALL EBV endémiás Burkitt lymphoma/leukemia
98 PREDISPONALÓ FAKTOROK öröklött szerzett Down sy., Klienfelter sy., Turner sy. Fanconi anaemia, Blackfan-Diamond sy. ionizáló sugárzás gyógyszer, vegyszer: I. típusú neurofibromatosis alkiláló szerek ataxia teleangiectasia mustránitrogén súlyos kombinált immundeficiencia parox. nocturnalis hgb-uria Li-Fraumeni sy. Blooms sy. epipodophyllotoxin benzol expositio magas anyai életkor apa dohányzása
99 TÚLÉLÉS komplett remisszió 5 éves túlélés felnőtt 80-90% 35% gyermek (2-10 év) 97% 80% Az ALL prognózisa drámaian jobb gyermekekben, ennek oka nem világos Keresendő a leukemiás sejtekben lévő különbségben, ami oka lehet az intenzív kezelése adott jó válasznak Az idősebb betegek rosszabbul tolerálják a high dose kezeléseket, ezért sok felnőtt protokoll kevésbé intenzív, mint amit a gyermekeknek adnak A fiatal felnőttek, (>39 y - AYA), képesek tolerálni a gyermekeknél alkalmazott dózisokat Az 5-éves túlélés: 30% - 40% a 60 év alattiakban <15% a 60 év felettiekben <5% a 70 év felettiekben
100 FAB ( F RENCH- A M ERICAN-BRITISH) KLASSZIFIKÁCIÓ M O RFO LÓGIÁN A LAPULÓ B EOSZTÁS K EVÉS PRO GNOSZTIKAI ÉS TERÁPIÁS SEGÍTSÉGET NYÚJT A K EZELÉS TERV EZÉSÉBEN cytologiai jellemzők Sejtméret L1 (75%) L2 (20%) L3 (5%) Kis, homogén sejtek Nagy, heterogén méretű sejtek Cytoplasma Kicsi, elégtelen Változatos, gyakran bőséges Sejtmag kicsi Egy vagy több, gyakran nagy Sejtmag alakja homogén Változatos, heterogén Nagy, homogén sejtek Mérsékelten bő Egy vagy több erőteljes Homogén Sejtmag alakja Regularis Irreguláris, hasadt reguláris Cyt. Basophilia Változó Változó Intenzíven basophil Cyt. vacuolisatio változó változó erőteljesen
101
102
103
104
105
106 IMMUNPHENOT YPUS Típus FAB Tdt T-sejt Ag B-sejt Ag c Ig s Ig Precursor B L1, L , 19, 20, 22, 24 -/+ - Precursor-T L1, L , 3, 4, 5, 7, 8 _ - - B-sejt L
107
108 WHO KLASSZIFIKÁCIÓ (WORLD HEALTH ORG ANIZATION) A BEOSZTÁS BIOLÓGIAI ÉS PATHOGENETIKAI JELLEMŐK ALAPJÁN B-lymphoblastic leukemia/lymphoma B-lymphoblastic leukemia/lymphoma, NOS B-lymphoblastic leukemia/lymphoma with recurrent genetic abnormalities B-lymphoblastic leukemia/lymphoma with t(9;22)(q34.1;q11.2);bcr-abl1 B-lymphoblastic leukemia/lymphoma with t(v;11q23.3);kmt2a rearranged B-lymphoblastic leukemia/lymphoma with t(12;21)(p13.2;q22.1); ETV6-RUNX1 B-lymphoblastic leukemia/lymphoma with hyperdiploidy B-lymphoblastic leukemia/lymphoma with hypodiploidy B-lymphoblastic leukemia/lymphoma with t(5;14)(q31.1;q32.3) IL3-IGH B-lymphoblastic leukemia/lymphoma with t(1;19)(q23;p13.3);tcf3-pbx1 Provisional entity: B-lymphoblastic leukemia/lymphoma, BCR-ABL1 like Provisional entity: B-lymphoblastic leukemia/lymphoma with iamp21 T-lymphoblastic leukemia/lymphoma Provisional entity: Early T-cell precursor lymphoblastic leukemia Provisional entity: Natural killer (NK) cell lymphoblastic leukemia/lymphoma
109 PROGNÓZIS 1. Cytogenetikai abnormalitás gén felnőtt gyermek típus prognózis t (9;22) BCR/ABL 30% 3% common/pre B ALL (CD10+) nagyon rossz t (4;11) vagy (V;11) MLL 5% 3% pro B (CD10-) rossz (korai th failure) t (8;14) MYC/IGH 5% 2% Burkitt (L3) t (1;14) TAL1/TCR 3% T-sejtes t (1;19) PBX/E2A 3% 6% (25% pre B) normal agresszív th-val! t (12;21) TEL/AML1 (ETV6/RUNX) 2% 16-28% (T-sejtes) jó hyperdiploid > 50 hypodiploid < 44 7% 25% jó 2% 5% rossz
110 PROGNÓZIS 2. faktor jó prognózis rossz prognózis fvs szám < G/l > G/l életkor 2-10 év <1 év, >10 év nem nő férfi etnikum fehér fekete nyirokcs., máj, lép mérsékelt masszív here érintettség nincs van KIR-i infiltráció nincs blast v. pleiocytosis a liquorban FAB típus L1 L2 cytogenetika t(12;21) trisomia 4, 10, 17 t(9;22) t(4;11) ploiditás hyperdiploiditás Hypodyploiditás (TP53 poitivitás gyakori) remisszióig eltelt idő <14 nap >28 nap
111 TÜNETEK tünet % gyengeség 92 csont-, izületi fájdalom 79 láz 71 fogyás 66 növekvő terime 62 bőrvérzés 51 egyéb vérzés 27 infekciók 17
112 FIZIKÁLIS ELTÉRÉSEK eltérés % splenomegalia 86 lyphadenomegalia 76 hepatomegalia 74 sternalis érzékenység 69 purpura 50 fundus eltérés 14
113 DIAGNÓZIS Laboratóriumi vizsgálatok Metabolikus panel, LDH, húgysav Alvadási paraméterek Hemokultúra (egyéb mikrobiológiai vizsgálat) Perifériás vér kenet Csontvelő biopsia, aspiráció FCM, FISH, cytogenetika RT-PCR Mellkas rtg vagy CT EKG, echocardiográfia Lumbalpunctio CMV serológia, HLA tipizálás (allogén TX)
114 KEZELÉS Cél: elérni és megtartani a komplett remissziót (CR) Aki komplett remisszióba kerül szignifikánsan jobb a túlélése Komplett remisszió kritériumai: Bizonyíték a normál csontvelői működés visszatérése Min. 25%-os cellularitású csontvelő Tct szám > 100 G/l ANC > 1 G/l Bizonyíték a leukémiás sejtek eliminálására < 5% blast a csontvelőben és
115 KEZELÉS közel 2 év része az intratecalis kemoterápia és KIR-i irradiáció kemoterápia prefázis (dexamethasone, cyclophosphamid indukció (vincristin, doxorubicin, dexamethasone, L- asparagináz, cyclophosphamid, cytarabin, 6-mercaptopurin) (korai intenzifikáció) konszolidáció (methotrexat) (reindukció) fenntartó (MTX, 6-MP)
116 KEZELÉS Gyermekkori protokollok: GRAALL-2003, COG AALL, CCG, CALGB, DFCI (15-39 y) éves populáció Ezen betegek számára gyermekkori ALL kezelésére használatos protokollokat ajánlanak COG ALL vizsgálat eredményei: TRM 3%, 2-éves EFS és OS 66% és 78% volt Ezen populációt gyermek protokollokkal kezelve kifejezett emelkedés érhető el az EFS-ben 39%-ről 70%-ra
117 KEZELÉS Remisszió kontroll: csontvelő aspiráció ill. biopsia, amikor a tct > G/l és ANC: > 1G/l (core biopsia a cellularitás megítélésére) Minimalis rezidualis betegség követése, ha kezdetben cytogenetikai eltérés Cél MRD negativitás elérése (szignifikánsan jobb túlélés)
118 KEZELÉS BCR- ABL1 like (vagy Ph-like) pozitivitás rossz prognózist jelent. FISH és/vagy komparatív gén hibridizáció: tar talmaz za ABL1, ABL2, PDGFRB, JAK1, JAK2, and CRLF2 géneket Ha rezidualis betegséget észlelünk az 28. napon az indukciós kezelés során, feltételeznünk kell, hogy BCR- ABL1 like pozitivitás van, és meg kell vizsgálni komparatív gén hibridizációs array -vel és a kezeléshez napi 100 mg dasatinibet kell hozzáadni a standard konszolidációs kezeléshez továbbá allogén HCT szüskéges az CR1- ban BCR- ABL1 fúziós gén előfordulása nő az életkorral 25% - 30% pozitivitás az idősebb populációban, de egyre gyakoribb a fiatal felnőtteknél A tyrosine kinase inhibitorok ( TKIs) hozzáadása a standard terápiához drámaian javította a kimenetelt minden életkorban Jellemzően a dasatinibet használjuk, mer t bejut a KIR-be Cél elérni a molekuláris remissziót fontos folytatni a fenntar tó TKI kezelést a HCT után is Minimal reziduális betegség (MRD) FCM vagy quantitative (q)pcr-rel vizsgálható. Az egyik legfontosabb prognosztikai faktor mind a gyermek mind a felnőtt ALL esetén. Az új, MRD-bázisú prognosztikai adatokat beépítve rizikó adaptált kezelésbe azt igazolták, hogy nem származik előny az allogén HCT-ből CR1-ben összehasonlítva a konszolidációs kemoterápiával Javasolt monitorozni az MRD státuszt standardizált és prosrektív módon validált módszerrel és akkor kell az allogén HCT-t elvégezni, ha az MRD perzisztál a korai konszolidációs fázisig A relapsus aránya az MRD+ betegekben aránylag magas 40% -től akár több, mint 80% -ig
119 KIR-I TERÁPIA < 10% van KIR érintettség a diagnóziskor, mégis KIR-i profilaxis nélkül 60%! KIR-i relapsus Rizikó KIR-i érintettségre felnőttekben: Éretlen B-sejtes ALL Magas LDH diagnóziskor (> 600 U/l) Magas proliferációs index Ha a diagnóziskor liquor pozitív: IT kemoterápia és KIR irradiáció KIR profilaxis liquor negatív esetekben: IT MTX és szisztémás high dose MTX (néhány protokollban IT triplet: MTX, Ara-C, steroid) +/- KIR irradiáció
120 FENNTARTÓ TERÁPIA Heti MTX + napi 6-MP 1 év Minden betegnél (kivéve Ph+ ALL TKI) Elmaradása rontja a prognózist 6-MP dózis változó (thiopurin-methyltransferase veleszületett hiánya vagy csökkent szintje esetén hosszú és súlyos myelosuppreszió - felfüggeszteni) Genetikai polymorphisms észlelhető thiopurine methyltransferase (TPMT) enzimben Ajánlott a dózis eszkaláció 6-mercaptopurine (6-MP) és methotrexat esetében A folyamatos adagolás jobb, mint a gyakori felfüggesztés és újraindítás a terápiában és fontos meghatározója a DFS-nek Májtoxikus mindkettő
121 SZUPPORTÍV TERÁPIA Metabolikus eltérések kezelése hyperuricaemia - infúzió, allopurinol, rasburicase hyperphosphataemia - foszfát kötők hypocalcaemia Ca pótlás Hyperleukosis leukaferesis Neutropenia profilaktikus AB, antiviralis és antifungalis szerek Inkeciók széles spektrumú AB, antifungalis th, antiviralis th. Hemosubstitutio (minősített készítmények) GCSF
122 ALLOGÉN TRANSZPLANTÁCIÓ HLA identikus rokon vagy idegen donor Relabált betegség esetén Magas rizikó esetén az 1. remisszióban UKALL XII/E2993) vizsgálat: szignifikánsan nő az OS allogén HCT-vel az első komplett remisszióban (CR1) összehasonlítva a standard felnőtt ALL protokollokkal (63% vs 52%). Szignifikáns előny (hazard ratio 3.1; P <.0001) látható mind a DFS és az OS tekintetében azon betegeknél, akik intenzív gyermek protokoll szerinti kezelést kaptak összehasonlítva azokkal, akik átestek allogén HCT-n az CR1-ban. A TRM miatt nem ajánlják rutinszerűen az allogén HCT-t az CR1- ban a éves populációban. Rutinszerűen megvizsgáljuk a beteg HLA típusát a diagnóziskor Autológ transzplantáció nem jobb a kemoterápiánál
123 SPECIÁLIS ENTITÁS Burkitt: nagyon gyors proliferáció, 8-as kromoszóma transzlokáció, magas CD20 expresszió, rövid intenzív kemoterápia, intenzív KIR profilaxis, fenntartó nem szükséges, jó gyógyhajlam
124 L-ASPARAGINASE Csak ALL-ben használjuk Baktérium enzimből származik (E. coli) Csökkenti a serum L-asparagin szintjét (a normál sejt képes termelni asparagin synthetase enzimmel, az ALL-es sejt a serumból jut hozzá; fehérje szintézis DNS, RNS szintézis leukemiás sejt apoptózisa) Hatása függ a serum L-Asp szint csökkenésétől Nem myelosuppressiv Nincs késői hatása Mellékhatás: hypersensitivitás, májtoxicitás, alvadási zavar ( VTE készség), pancreatitis, DM, KIR-i tünetek Javasolt a pegylált forma alkalmazása. Ha széleskörben elérhetővé válik, a serum szinthez igazított dózis igazítás biztonságossá teszi az alkalmazását. Allergia esetén: Erwinase
125 ÚJ SZEREK Monoclonalis antitestek rituximab (anticd20), alemtuzumab (anticd52), epratuzumab (anticd22), gemtuzumab (anticd33) Antimetabolitok clofarabin, nelarabin (T-sejtes), forodesin trimetrexate Tyrosin kinase inhibitorok imatinib, nilotinib, dasatinib mtor gátlók, FLT-3 inhibitorok, farnesil-tranferase gátló, NOTCH1 gátló pegylált L-Asp Liposomás citostaticumok Blinatumomab a bispecific T-cell engager (BiTE) antibody (two binding sites: a CD3 site for T cells and a CD19 site for the target B cells) chimeric antigen receptor (CAR) ; CAR T-cells targeting CD19
126 A KEZELÉS KÉSŐI HATÁSAI KIR irradiáció kognitív funkciók, intellektus csökkenése, KIR-i neoplasia, mentalis zavarok Kemoterápia secunder malignomák (AML) Endocrin funkciók hypothyreosis, növekedés zavara, obesitás Antracyclin cardiopathia Steroid osteoporosis, avascularis csontnecrosis
127 RELAPSUS KEZELÉSE Fogalma: ismételten megjelenő blastok bármely szervrendszerben kezelés közben, ill. miután már remisszió kialakult vagy a kezelés befejeztével remisszió után Csontvelői relapsus rossz progózis hypercvad allogén csontvelő transzplantáció KIR-i relapsus IT triplet másnaponta a negatív liquorig, majd hetente 2x (6 alkalom), majd hetente (6 alkalom) KIR irradiáció Testicularis relapsus kemoterápia here irradiáció
128 RELAPSUS KEZELÉSE Relabált/refrakter betegek inotuzumab ozogamicin: egy CD22 MoAb, ami calicheamicinnal konjugált. Úgy tűnik biztonságos és hatékony relabált/refrakter ALL-ben. ORR 58%-ról 82%-ra nőtt klinikai vizsgálatban. Blinatumomab: a bispecific T-sejt ellenes antitest. A beteg T sejtjei felismerik a malignus B sejteket. Két kötődési pontja van a szernek: CD3-on keresztül a T-sejtekhez és a CD19-en keresztül a B-sejtekhez. A CD3 a T-sejt receptor része. A szer azáltal, hogy a kétféle sejthez kötődik egyszerre, aktiválja a T sejteket, ami cytotoxikus hatást gyakorol a CD19-et expresszáló target sejtekre (malignus B sejt). 43% ORR érhető el a Ph-negatív relabált/refrakter precursor B-sejtes ALL-ben. A blinatumomab frontline kezelésben való alkalmazása még vizsgálat alatt áll (felnőtt ALL, év)
129 IRODALOM 1. Harrison s Principles of Internal Medicine 17th edition 2. William s Hematology 8th edition 3. Wintrobe s Clinical Hematology 4. Nelson Textbook of Paediatrics 5. ash.hematologylibrar y.com /image bank 6. Center of International Blood and Marrow Transplant Research 7. Hoelzer D, et al. Blood. 1998;71: Larson R, et al. Blood. 1995;85: Kantarjian H, et al. Cancer. 2004;101: Möricke A, Reiter A, Zimmermann M, et al.: Risk-adjusted therapy of acute lymphoblastic leukemia can decrease treatment burden and improve sur vival: treatment results of 2169 unselected pediatric and adolescent patients enrolled in the trial ALL-BFM 95. Blood 111 (9): , Amstron SA, et al. J Clin Oncol. 2005;26: Graux C, et al. Leukemia 2006;20: Bassan R, et al Crit Rev Oncol Hematol. 2004;50: Swerdlow SH, Campo E, Harris NL et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: IARC Press, 2008.
130 KÖSZÖNÖM A FIGYELMET!
A krónikus myeloid leukémia kezelésének finanszírozási protokollja (eljárásrend)
 A krónikus myeloid leukémia kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2013. június 26.
A krónikus myeloid leukémia kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2013. június 26.
MDS (és AML) Masszi Tamás. SE III. Belklinika Szent László Kórház Hematológiai és Őssejt-transzplantációs Osztály
 MDS (és AML) Masszi Tamás SE III. Belklinika Szent László Kórház Hematológiai és Őssejt-transzplantációs Osztály Az őssejt lehetséges sorsa Nyugvás Differenciálódás Osztódás Apoptosis Leukémiás versus
MDS (és AML) Masszi Tamás SE III. Belklinika Szent László Kórház Hematológiai és Őssejt-transzplantációs Osztály Az őssejt lehetséges sorsa Nyugvás Differenciálódás Osztódás Apoptosis Leukémiás versus
Kappelmayer János. Malignus hematológiai megbetegedések molekuláris háttere. MOLSZE IX. Nagygyűlése. Bük, 2005 szeptember
 Kappelmayer János Malignus hematológiai megbetegedések molekuláris háttere MOLSZE IX. Nagygyűlése Bük, 2005 szeptember 29-30. Laboratóriumi vizsgálatok hematológiai malignómákban Általános laboratóriumi
Kappelmayer János Malignus hematológiai megbetegedések molekuláris háttere MOLSZE IX. Nagygyűlése Bük, 2005 szeptember 29-30. Laboratóriumi vizsgálatok hematológiai malignómákban Általános laboratóriumi
Myelodysplasias szindróma
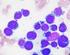 Myelodysplasias szindróma Myelodysplasia szindróma Heterogén betegségek csoportja, amelyekre jellemző: Egy vagy több sejtvonal citopéniája Diszplasztikus sejtek Kóros vagy károsodott sejtműködés Változó
Myelodysplasias szindróma Myelodysplasia szindróma Heterogén betegségek csoportja, amelyekre jellemző: Egy vagy több sejtvonal citopéniája Diszplasztikus sejtek Kóros vagy károsodott sejtműködés Változó
Katasztrófális antifoszfolipid szindróma
 Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
Katasztrófális antifoszfolipid szindróma Gadó Klára Semmelweis Egyetem, I.sz. Belgyógyászati Klinika Antifoszfolipid szindróma Artériás és vénás thrombosis Habituális vetélés apl antitest jelenléte Mi
M y e l o i d b e t e g s é g e k
 M y e l o i d b e t e g s é g e k Csomor Judit ÁOK 2018. A Pathology haemopoeticus of hemopoetic rendszer system betegségei A haemopoeticus hemopoeticus rendszer differenciációja (Őssejt) (Érett sejtek)
M y e l o i d b e t e g s é g e k Csomor Judit ÁOK 2018. A Pathology haemopoeticus of hemopoetic rendszer system betegségei A haemopoeticus hemopoeticus rendszer differenciációja (Őssejt) (Érett sejtek)
A krónikus myeloid leukémia kezelésének finanszírozási protokollja
 A krónikus myeloid leukémia kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest,
A krónikus myeloid leukémia kezelésének finanszírozási protokollja (finanszírozási eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest,
A krónikus myeloid leukémia kezelésének finanszírozási protokollja (eljárásrend)
 A krónikus myeloid leukémia kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2013. június 26.
A krónikus myeloid leukémia kezelésének finanszírozási protokollja (eljárásrend) Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2013. június 26.
III./18.2. Myelodysplasiás szindróma
 III./18.2. Myelodysplasiás szindróma Sréter Lídia Ebben a tanulási egységben a myeloproliferatív neoplazmákhoz (WHO klasszifikáció, 2008) tartozó myelodysplasiás szindróma epidemiológiáját, tüneteit, diagnosztikáját,
III./18.2. Myelodysplasiás szindróma Sréter Lídia Ebben a tanulási egységben a myeloproliferatív neoplazmákhoz (WHO klasszifikáció, 2008) tartozó myelodysplasiás szindróma epidemiológiáját, tüneteit, diagnosztikáját,
Kórélettan hematológiai esetek
 8. eset Középkorú nőbeteg. Két hete gyengébb, fáradékonyabb. Háziorvosa laborvizsgálatot kért, a lelet ismeretében kórházba utalta. Fehérvérsejt 62,7 G/l H 4 10 G/l Neutrophil % 40 70 % Neutrophil (abs)
8. eset Középkorú nőbeteg. Két hete gyengébb, fáradékonyabb. Háziorvosa laborvizsgálatot kért, a lelet ismeretében kórházba utalta. Fehérvérsejt 62,7 G/l H 4 10 G/l Neutrophil % 40 70 % Neutrophil (abs)
Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata
 Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata Dr. Nemes Karolina, Márk Ágnes, Dr. Hajdu Melinda, Csorba Gézáné, Dr. Kopper László, Dr. Csóka Monika, Dr.
Lymphoma sejtvonalak és gyerekkori leukémia (ALL) sejtek mikro RNS (mir) profiljának vizsgálata Dr. Nemes Karolina, Márk Ágnes, Dr. Hajdu Melinda, Csorba Gézáné, Dr. Kopper László, Dr. Csóka Monika, Dr.
M y e l o i d b e t e g s é g e k
 M y e l o i d b e t e g s é g e k Csomor Judit ÁOK 2015. Csontvelő a vérképzés szerve Lymphoid Stromal Myeloid Granulopoiesis Erythropoiesis Megakaryopoiesis Monocyta képzés Mastocytaképzés Dendritikus
M y e l o i d b e t e g s é g e k Csomor Judit ÁOK 2015. Csontvelő a vérképzés szerve Lymphoid Stromal Myeloid Granulopoiesis Erythropoiesis Megakaryopoiesis Monocyta képzés Mastocytaképzés Dendritikus
Egyénre szabott terápiás választás myeloma multiplexben
 Egyénre szabott terápiás választás myeloma multiplexben Dr. Mikala Gábor Főv. Önk. Egy. Szt István és Szent László Kórház Haematológiai és Őssejt-Transzplantációs Osztály Mit kell tudni a myelomáról? Csontvelőből
Egyénre szabott terápiás választás myeloma multiplexben Dr. Mikala Gábor Főv. Önk. Egy. Szt István és Szent László Kórház Haematológiai és Őssejt-Transzplantációs Osztály Mit kell tudni a myelomáról? Csontvelőből
A laboratóriumi vérkenetvizsgálatok szerepe a hematológiai diagnosztikában a 2012-14 időszak körvizsgálatai alapján
 A laboratóriumi vérkenetvizsgálatok szerepe a hematológiai diagnosztikában a 2012-14 időszak körvizsgálatai alapján Dr Modok Szabolcs, PhD egyetemi adjunktus SZTE, II. Sz. Belgyógyászati Klinika és Kardiológiai
A laboratóriumi vérkenetvizsgálatok szerepe a hematológiai diagnosztikában a 2012-14 időszak körvizsgálatai alapján Dr Modok Szabolcs, PhD egyetemi adjunktus SZTE, II. Sz. Belgyógyászati Klinika és Kardiológiai
Baán Julianna, Barta Katalin, Somogyi Józsefné, Tóth Erzsébet, Bognár Balázs, Laczik Lívia, Kerezsi Katalin
 Baán Julianna, Barta Katalin, Somogyi Józsefné, Tóth Erzsébet, Bognár Balázs, Laczik Lívia, Kerezsi Katalin Egyesített Szent István és Szent László Kórház -Rendelőintézet Hematológia és Őssejt-transzplantációs
Baán Julianna, Barta Katalin, Somogyi Józsefné, Tóth Erzsébet, Bognár Balázs, Laczik Lívia, Kerezsi Katalin Egyesített Szent István és Szent László Kórház -Rendelőintézet Hematológia és Őssejt-transzplantációs
Heveny myeloid leukaemiás betegeink kezelésével szerzett tapasztalataink (2007 2013)
 EREDETI KÖZLEMÉNY Heveny myeloid leukaemiás betegeink kezelésével szerzett tapasztalataink (2007 2013) Selmeczi Anna dr. 1 Udvardy Miklós dr. 1 Illés Árpád dr. 1 Telek Béla dr. 1 Kiss Attila dr. 1 Batár
EREDETI KÖZLEMÉNY Heveny myeloid leukaemiás betegeink kezelésével szerzett tapasztalataink (2007 2013) Selmeczi Anna dr. 1 Udvardy Miklós dr. 1 Illés Árpád dr. 1 Telek Béla dr. 1 Kiss Attila dr. 1 Batár
A krónikus myeloid leukémia kezelésének finanszírozási protokollja
 A krónikus myeloid leukémia kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009. szeptember 15. 1 1. Azonosítószám:
A krónikus myeloid leukémia kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértői és Szakmai Ellenőrzési Főosztály Budapest, 2009. szeptember 15. 1 1. Azonosítószám:
A szervezet immunválasza a vérátömlesztésre
 A szervezet immunválasza a vérátömlesztésre Prohászka Zoltán III. Sz. Belgyógyászati Klinika, Kutatólaboratórium Semmelweis Egyetem, Budapest prohoz@kut.sote.hu Transzfúziós Tanfolyam Szigorló Orvostanhallgatóknak
A szervezet immunválasza a vérátömlesztésre Prohászka Zoltán III. Sz. Belgyógyászati Klinika, Kutatólaboratórium Semmelweis Egyetem, Budapest prohoz@kut.sote.hu Transzfúziós Tanfolyam Szigorló Orvostanhallgatóknak
MAGYOT évi Tudományos Szimpóziuma Május 5-6, Budapest
 MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
MAGYOT 2017. évi Tudományos Szimpóziuma Május 5-6, Budapest A petefészekrákok kezelésében nem régen került bevezetésre egy újabb fenntartó kezelés BRCA mutációt hordozó (szomatikus vagy germinális) magas
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése
 Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
Colorectalis carcinomában szenvedő betegek postoperatív öt éves követése Kegyes Lászlóné 1, Némethné Lesó Zita 1, Varga Sándor Attiláné 1, Barna T. Katalin 1, Rombauer Edit 2 Dunaújvárosi Prodia Központi
Citopeniák. Vérszegénységek Neutropéniák Trombocitopeniák
 Citopeniák Vérszegénységek Neutropéniák Trombocitopeniák Anémia okai Fokozott pusztulás-vvt élettartam csökkenés (
Citopeniák Vérszegénységek Neutropéniák Trombocitopeniák Anémia okai Fokozott pusztulás-vvt élettartam csökkenés (
Allogén hemopoetikus őssejt transzplantáció
 Allogén hemopoetikus őssejt transzplantáció Dr. Szomor Árpád PTE KK I.Belklinika Belgyógyászati Szintentartó tanfolyam 2014.03.29. Orvosi Nobel Díj 1990 E. Donnall Thomas Első sikeres allogén- HSCT acut
Allogén hemopoetikus őssejt transzplantáció Dr. Szomor Árpád PTE KK I.Belklinika Belgyógyászati Szintentartó tanfolyam 2014.03.29. Orvosi Nobel Díj 1990 E. Donnall Thomas Első sikeres allogén- HSCT acut
Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE
 Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2017. Bev. 2. ábra Az immunválasz kialakulása 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán
Az immunrendszer működésében résztvevő sejtek Erdei Anna Immunológiai Tanszék ELTE Tanárszakosok, 2017. Bev. 2. ábra Az immunválasz kialakulása 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a PD-L1 és PD-1 fehérjék túlélésre gyakorolt hatása
 Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
Tüdő adenocarcinomásbetegek agyi áttéteiben jelenlévő immunsejtek, valamint a és PD-1 fehérjék túlélésre gyakorolt hatása Téglási Vanda, MoldvayJudit, Fábián Katalin, Csala Irén, PipekOrsolya, Bagó Attila,
Rovarméreg (méh, darázs) - allergia
 Rovarméreg (méh, darázs) - allergia Herjavecz Irén Országos Korányi TBC és Pulmonológiai Intézet Epidemiológia I. Prevalencia: - nagy helyi reakció: felnőtt 10-15 % - szisztémás reakció: gyerek 0.4-0.8
Rovarméreg (méh, darázs) - allergia Herjavecz Irén Országos Korányi TBC és Pulmonológiai Intézet Epidemiológia I. Prevalencia: - nagy helyi reakció: felnőtt 10-15 % - szisztémás reakció: gyerek 0.4-0.8
Biológiai módszerek alkalmazása környezeti hatások okozta terhelések kimutatására
 Szalma Katalin Biológiai módszerek alkalmazása környezeti hatások okozta terhelések kimutatására Témavezető: Dr. Turai István, OSSKI Budapest, 2010. október 4. Az ionizáló sugárzás sejt kölcsönhatása Antone
Szalma Katalin Biológiai módszerek alkalmazása környezeti hatások okozta terhelések kimutatására Témavezető: Dr. Turai István, OSSKI Budapest, 2010. október 4. Az ionizáló sugárzás sejt kölcsönhatása Antone
A keringı tumor markerek klinikai alkalmazásának aktuális kérdései és irányelvei
 A keringı tumor markerek klinikai alkalmazásának aktuális kérdései és irányelvei A TM vizsgálatok alapkérdései A vizsgálatok célja, információértéke? Az alkalmazás területei? Hogyan válasszuk ki az alkalmazott
A keringı tumor markerek klinikai alkalmazásának aktuális kérdései és irányelvei A TM vizsgálatok alapkérdései A vizsgálatok célja, információértéke? Az alkalmazás területei? Hogyan válasszuk ki az alkalmazott
A fejezet felépítése
 III./18.6. Osteomyelofibrosis Sréter Lídia Ebben a tanulási egységben a myeloproliferatív neoplazmákhoz (WHO klasszifikáció, 2008) tartozó osteomyelofibrosis epidemiológiáját, tüneteit, diagnosztikáját,
III./18.6. Osteomyelofibrosis Sréter Lídia Ebben a tanulási egységben a myeloproliferatív neoplazmákhoz (WHO klasszifikáció, 2008) tartozó osteomyelofibrosis epidemiológiáját, tüneteit, diagnosztikáját,
A születéskor gyűjthető. őssejtekről, felhasználási. lehetőségükről, valamint a KRIO Intézet. szolgáltatásairól
 A születéskor gyűjthető őssejtekről, felhasználási lehetőségükről, valamint a KRIO Intézet szolgáltatásairól krio Családi Őssejtbank A KRIO Intézet Sejt- és Szövetbank Zrt. 2004 óta végzi köldökzsinórvér
A születéskor gyűjthető őssejtekről, felhasználási lehetőségükről, valamint a KRIO Intézet szolgáltatásairól krio Családi Őssejtbank A KRIO Intézet Sejt- és Szövetbank Zrt. 2004 óta végzi köldökzsinórvér
III./19.4. Myeloma multiplex. Bevezetés. A fejezet felépítése. A.) Anamnézis. Nagy Zsolt, Istenes Ildikó, Demeter Judit
 III./19.4. Myeloma multiplex Nagy Zsolt, Istenes Ildikó, Demeter Judit A fejezet célja a hallgató megismertetése a myeloma multiplex diagnosztikájával, a kezelési döntés menetével, a kezelés lehetséges
III./19.4. Myeloma multiplex Nagy Zsolt, Istenes Ildikó, Demeter Judit A fejezet célja a hallgató megismertetése a myeloma multiplex diagnosztikájával, a kezelési döntés menetével, a kezelés lehetséges
Kassa Csaba, Kállay Krisztián, Benyó Gábor, Kriván Gergely. Szent László Kórház, Budapest Gyermekhematológiai- és őssejt-transzplantációs Osztály
 Kassa Csaba, Kállay Krisztián, Benyó Gábor, Kriván Gergely Szent László Kórház, Budapest Gyermekhematológiai- és őssejt-transzplantációs Osztály Enzimdefektus A mucopolysaccharidosis Fratantoni, Neufeld
Kassa Csaba, Kállay Krisztián, Benyó Gábor, Kriván Gergely Szent László Kórház, Budapest Gyermekhematológiai- és őssejt-transzplantációs Osztály Enzimdefektus A mucopolysaccharidosis Fratantoni, Neufeld
A köpenysejtes limfómákról
 A köpenysejtes limfómákról Dr. Schneider Tamás Országos Onkológiai Intézet Lymphoma Centrum Limfóma Világnap 2014. szeptember 15. Limfómám van! Limfómám van! Igen? De milyen típusú? Gyógyítható? Nem gyógyítható?
A köpenysejtes limfómákról Dr. Schneider Tamás Országos Onkológiai Intézet Lymphoma Centrum Limfóma Világnap 2014. szeptember 15. Limfómám van! Limfómám van! Igen? De milyen típusú? Gyógyítható? Nem gyógyítható?
PLAZMASEJT OKOZTA BETEGSÉGEK, MYELOMA MULTIPLEX, LYMPHOMÁK
 PLAZMASEJT OKOZTA BETEGSÉGEK, MYELOMA MULTIPLEX, LYMPHOMÁK Belgyógyászat alapjai fogorvosoknak Reismann Péter SE ÁOK II.sz. Belgyógyászati Klinika 2015.09.15 Fehérvérsejtképzés, myelopoesis Haemopoetikus
PLAZMASEJT OKOZTA BETEGSÉGEK, MYELOMA MULTIPLEX, LYMPHOMÁK Belgyógyászat alapjai fogorvosoknak Reismann Péter SE ÁOK II.sz. Belgyógyászati Klinika 2015.09.15 Fehérvérsejtképzés, myelopoesis Haemopoetikus
A vasanyagcsere. Dr.Várkonyi Judit SE III. Belklinika November 15. Belgyógyászat szakvizsga fenntartó tanfolyam Budapest, Lurdy ház
 A vasanyagcsere hematológiai vonatkozásai Dr.Várkonyi Judit SE III. Belklinika 2013. November 15. Belgyógyászat szakvizsga fenntartó tanfolyam Budapest, Lurdy ház Megbeszélésre szánt témák 1/ vashiány
A vasanyagcsere hematológiai vonatkozásai Dr.Várkonyi Judit SE III. Belklinika 2013. November 15. Belgyógyászat szakvizsga fenntartó tanfolyam Budapest, Lurdy ház Megbeszélésre szánt témák 1/ vashiány
Sejtfeldolgozás Felhasználás
 Sejtterápia Sejtfeldolgozás Felhasználás Fagyasztva tárolás Sejtmosás Alap sejtszelekció Komplex sejtszelekció Ex vivo sejtszaporítás Sejtaktiválás Immunizálás Génmodifikálás Köldökzsinórvér bank Limfocita
Sejtterápia Sejtfeldolgozás Felhasználás Fagyasztva tárolás Sejtmosás Alap sejtszelekció Komplex sejtszelekció Ex vivo sejtszaporítás Sejtaktiválás Immunizálás Génmodifikálás Köldökzsinórvér bank Limfocita
Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály
 Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály Definíció A prenatális diagnosztika a klinikai genetika azon
Prenatalis diagnosztika lehetőségei mikor, hogyan, miért? Dr. Almássy Zsuzsanna Heim Pál Kórház, Budapest Toxikológia és Anyagcsere Osztály Definíció A prenatális diagnosztika a klinikai genetika azon
Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán
 Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán Dr. Gelencsér Viktória, Dr. Boér Katalin Szent Margit Kórház, Onkológiai
Metasztatikus HER2+ emlőrák kezelése: pertuzumab-trasztuzumab és docetaxel kombinációval szerzett tapasztalataink esetismertetés kapcsán Dr. Gelencsér Viktória, Dr. Boér Katalin Szent Margit Kórház, Onkológiai
III./18.1. Akut leukaemia. Bevezetés. A fejezet felépítése. A./ Panaszok. B./ Anamnézis. Sréter Lídia
 III./18.1. Akut leukaemia Sréter Lídia Ebben a tanulási egységben a myeloproliferatív neoplazmákhoz (WHO klasszifikáció, 2008) tartozó akut myeloid leukaemia epidemiológiáját, tüneteit, diagnosztikáját,
III./18.1. Akut leukaemia Sréter Lídia Ebben a tanulási egységben a myeloproliferatív neoplazmákhoz (WHO klasszifikáció, 2008) tartozó akut myeloid leukaemia epidemiológiáját, tüneteit, diagnosztikáját,
Immunológia I. 4. előadás. Kacskovics Imre
 Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
Immunológia I. 4. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) 3.1. ábra A vérsejtek képződésének helyszínei az élet folyamán 3.2. ábra A hemopoetikus őssejt aszimmetrikus osztódása 3.3. ábra
III./18.3. Krónikus myeloid leukaemia
 III./18.3. Krónikus myeloid leukaemia Sréter Lídia Ebben a tanulási egységben a krónikus myeloproliferatív neoplazmákhoz (WHO klasszifikáció, 2008) tartozó egyik megbetegedést, a krónikus myeloid leukaemia
III./18.3. Krónikus myeloid leukaemia Sréter Lídia Ebben a tanulási egységben a krónikus myeloproliferatív neoplazmákhoz (WHO klasszifikáció, 2008) tartozó egyik megbetegedést, a krónikus myeloid leukaemia
Az akut myeloid leukaemia gyógyszeres kezelése
 ÖSSZEFOGLALÓ KÖZLEMÉNY Az akut myeloid leukaemia gyógyszeres kezelése Jelenlegi lehetőségek, jövőbeli kilátások Telek Béla dr. 1 Rejtő László dr. 2 Batár Péter dr. 1 Miltényi Zsófia dr. 1 Reményi Gyula
ÖSSZEFOGLALÓ KÖZLEMÉNY Az akut myeloid leukaemia gyógyszeres kezelése Jelenlegi lehetőségek, jövőbeli kilátások Telek Béla dr. 1 Rejtő László dr. 2 Batár Péter dr. 1 Miltényi Zsófia dr. 1 Reményi Gyula
III./18.4. Polycythaemia vera
 III./18.4. Polycythaemia vera Sréter Lídia Ebben a tanulási egységben a myeloproliferatív neoplazmákhoz (WHO klasszifikáció, 2008) tartozó polycythaemia vera epidemiológiáját, tüneteit, diagnosztikáját,
III./18.4. Polycythaemia vera Sréter Lídia Ebben a tanulási egységben a myeloproliferatív neoplazmákhoz (WHO klasszifikáció, 2008) tartozó polycythaemia vera epidemiológiáját, tüneteit, diagnosztikáját,
A. Fogalmi Meghatározások
 II./3.9. fejezet: Daganatos betegségek őssejt-kezelése Masszi Tamás Ebben a tanulási egységben az egyes daganatos betegségek őssejt-transzplantációval történő kezelési lehetőségeinek és a felmerülő szövődményeknek
II./3.9. fejezet: Daganatos betegségek őssejt-kezelése Masszi Tamás Ebben a tanulási egységben az egyes daganatos betegségek őssejt-transzplantációval történő kezelési lehetőségeinek és a felmerülő szövődményeknek
A ROSSZ PROGNÓZISÚ GYERMEKKORI SZOLID TUMOROK VIZSGÁLATA. Dr. Győrffy Balázs
 A ROSSZ PROGNÓZISÚ GYERMEKKORI SZOLID TUMOROK VIZSGÁLATA Dr. Győrffy Balázs ELŐADÁS ÁTTEKINTÉSE 1. Elmélet Gyermekkori tumorok Központi idegrendszer tumorai 2. Kutatás szakmai koncepciója 3. Együttműködés
A ROSSZ PROGNÓZISÚ GYERMEKKORI SZOLID TUMOROK VIZSGÁLATA Dr. Győrffy Balázs ELŐADÁS ÁTTEKINTÉSE 1. Elmélet Gyermekkori tumorok Központi idegrendszer tumorai 2. Kutatás szakmai koncepciója 3. Együttműködés
Poszttranszplantációs lymphoproliferatív betegség
 Poszttranszplantációs lymphoproliferatív betegség Végső Gy, Piros L, Toronyi É, Chmel R, Török Sz, Földes K, Molnár M, Langer R Semmelweis Egyetem, Transzplantációs és Sebészeti Klinika, Budapest A daganatok
Poszttranszplantációs lymphoproliferatív betegség Végső Gy, Piros L, Toronyi É, Chmel R, Török Sz, Földes K, Molnár M, Langer R Semmelweis Egyetem, Transzplantációs és Sebészeti Klinika, Budapest A daganatok
Leukémia (fehérvérûség)
 Leukémia (fehérvérûség) Leukémia - fehérvérûség A leukémia a rosszindulatú rákos megbetegedések azon formája, amely a vérképzõ sejtekbõl indul ki. A leukémia a csontvelõben lévõ éretlen és érettebb vérképzõ
Leukémia (fehérvérûség) Leukémia - fehérvérûség A leukémia a rosszindulatú rákos megbetegedések azon formája, amely a vérképzõ sejtekbõl indul ki. A leukémia a csontvelõben lévõ éretlen és érettebb vérképzõ
Őssejttranszplantált gyermekek intenzív ellátása
 Őssejttranszplantált gyermekek intenzív ellátása Dr. Faggyas Attila Szent László Kórház, GYITO Őssejttranszplantáció (SCT) Az őssejttranszplantáció egy rohamosan fejlődő terápiás lehetőség különböző malignus
Őssejttranszplantált gyermekek intenzív ellátása Dr. Faggyas Attila Szent László Kórház, GYITO Őssejttranszplantáció (SCT) Az őssejttranszplantáció egy rohamosan fejlődő terápiás lehetőség különböző malignus
Myelodysplasia-szindrómák új terápiás lehetôségek
 Myelodysplasia-szindrómák új terápiás lehetôségek Gadó Klára A myelodysplasia-szindróma heterogén betegségcsoport, közös jellemzôje a csontvelôi ineffektív haemopoesis, a perifériás vérben cytopenia jelenléte.
Myelodysplasia-szindrómák új terápiás lehetôségek Gadó Klára A myelodysplasia-szindróma heterogén betegségcsoport, közös jellemzôje a csontvelôi ineffektív haemopoesis, a perifériás vérben cytopenia jelenléte.
Bevacizumab kombinációval elért hosszútávú remissziók metasztatikus colorectális carcinomában
 Bevacizumab kombinációval elért hosszútávú remissziók metasztatikus colorectális carcinomában G E LE N C S É R V I K TÓ R I A, B O É R K ATA LI N SZ E N T MA RGIT KÓ RH Á Z, O N KO LÓ GIA MAGYOT, 2016.05.05
Bevacizumab kombinációval elért hosszútávú remissziók metasztatikus colorectális carcinomában G E LE N C S É R V I K TÓ R I A, B O É R K ATA LI N SZ E N T MA RGIT KÓ RH Á Z, O N KO LÓ GIA MAGYOT, 2016.05.05
IV. melléklet. Tudományos következtetések
 IV. melléklet Tudományos következtetések 61 Tudományos következtetések Háttér-információ A ponatinib egy tirozin-kináz inhibitor (TKI), amelyet a natív BCR-ABL, valamint minden mutáns variáns kináz beleértve
IV. melléklet Tudományos következtetések 61 Tudományos következtetések Háttér-információ A ponatinib egy tirozin-kináz inhibitor (TKI), amelyet a natív BCR-ABL, valamint minden mutáns variáns kináz beleértve
30 év tapasztalata a TTP-HUS kezelésében
 30 év tapasztalata a TTP-HUS kezelésében Dr.Réti Marienn Egyesített Szent István és Szent László Kórház Hematológia és Őssejt-transzplantációs Osztály Thrombotikus mikroangiopathiák ENDOTHEL INFEKCIÓK:
30 év tapasztalata a TTP-HUS kezelésében Dr.Réti Marienn Egyesített Szent István és Szent László Kórház Hematológia és Őssejt-transzplantációs Osztály Thrombotikus mikroangiopathiák ENDOTHEL INFEKCIÓK:
Nemekre szabott terápia: NOCDURNA
 Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
Nemekre szabott terápia: NOCDURNA Dr Jaczina Csaba, Ferring Magyarország Kft. Magyar Urológus Társaság XXI. Kongresszusa, Debrecen Régi és új megfigyelések a dezmopresszin kutatása során 65 év felett megnő
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: TÁMOP-4.1.2-08/1/A-2009-0011 Az orvosi
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS
 I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Nivestim 12 millió Egység/0,2 ml oldatos injekció / infúzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Az oldatos injekció / infúzió 60 milló Egység
I. MELLÉKLET ALKALMAZÁSI ELŐÍRÁS 1 1. A GYÓGYSZER MEGNEVEZÉSE Nivestim 12 millió Egység/0,2 ml oldatos injekció / infúzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL Az oldatos injekció / infúzió 60 milló Egység
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen
 Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
Az orvosi biotechnológiai mesterképzés megfeleltetése az Európai Unió új társadalmi kihívásainak a Pécsi Tudományegyetemen és a Debreceni Egyetemen Azonosító szám: Az orvosi biotechnológiai mesterképzés
Leukémiák. Dr. Szücs Nikolette Semmelweis Egyetem II. sz. Belklinika
 Leukémiák Dr. Szücs Nikolette Semmelweis Egyetem II. sz. Belklinika Acut myeloid leukémiák AML a myeloid rendszer klonális megbetegedése, melyben a kóros sejtek haemopoeticus őssejtből, vagy valamely myeloid
Leukémiák Dr. Szücs Nikolette Semmelweis Egyetem II. sz. Belklinika Acut myeloid leukémiák AML a myeloid rendszer klonális megbetegedése, melyben a kóros sejtek haemopoeticus őssejtből, vagy valamely myeloid
Cardiovascularis (szív- és érrendszeri) kockázat
 Cardiovascularis (szív- és érrendszeri) kockázat Varga Gábor dr. www.gvmd.hu 1/7 Cardiovascularis kockázatbecslő tábla Fatális szív- és érrendszeri események előfordulásának kockázata 10 éven belül Nő
Cardiovascularis (szív- és érrendszeri) kockázat Varga Gábor dr. www.gvmd.hu 1/7 Cardiovascularis kockázatbecslő tábla Fatális szív- és érrendszeri események előfordulásának kockázata 10 éven belül Nő
Dr.Lászlóffy Marianna 2012.Március 7.
 Dr.Lászlóffy Marianna 2012.Március 7. Bevezetés Az iparosodott világ lakosságának 30-40%-ában fejlődik ki élete folyamán daganatos megbetegedése. A megbetegedések kb.70-90%-át környezeti karcinogének okozzák.
Dr.Lászlóffy Marianna 2012.Március 7. Bevezetés Az iparosodott világ lakosságának 30-40%-ában fejlődik ki élete folyamán daganatos megbetegedése. A megbetegedések kb.70-90%-át környezeti karcinogének okozzák.
HUMAN IMMUNDEFICIENCIA VÍRUS (HIV) ÉS AIDS
 HUMAN IMMUNDEFICIENCIA VÍRUS (HIV) ÉS AIDS Dr. Mohamed Mahdi MD. MPH. Department of Infectology and Pediatric Immunology University of Debrecen (MHSC) 2012 Diagnózis HIV antitest teszt: A HIV ellen termel
HUMAN IMMUNDEFICIENCIA VÍRUS (HIV) ÉS AIDS Dr. Mohamed Mahdi MD. MPH. Department of Infectology and Pediatric Immunology University of Debrecen (MHSC) 2012 Diagnózis HIV antitest teszt: A HIV ellen termel
Sugárbiológiai ismeretek: LNT modell. Sztochasztikus hatások. Daganat epidemiológia. Dr. Sáfrány Géza OKK - OSSKI
 Sugárbiológiai ismeretek: LNT modell. Sztochasztikus hatások. Daganat epidemiológia Dr. Sáfrány Géza OKK - OSSKI Az ionizáló sugárzás biológiai hatásai Determinisztikus hatás Sztochasztikus hatás Sugársérülések
Sugárbiológiai ismeretek: LNT modell. Sztochasztikus hatások. Daganat epidemiológia Dr. Sáfrány Géza OKK - OSSKI Az ionizáló sugárzás biológiai hatásai Determinisztikus hatás Sztochasztikus hatás Sugársérülések
Tóth Erika Sebészeti és Molekuláris Patológia Osztály Országos Onkológiai Intézet. Frank Diagnosztika Szimpózium, DAKO workshop 2012.
 Tóth Erika Sebészeti és Molekuláris Patológia Osztály Országos Onkológiai Intézet Frank Diagnosztika Szimpózium, DAKO workshop 2012.december 7 Follicularis hám eredetű daganatok Jól differenciált tumorok
Tóth Erika Sebészeti és Molekuláris Patológia Osztály Országos Onkológiai Intézet Frank Diagnosztika Szimpózium, DAKO workshop 2012.december 7 Follicularis hám eredetű daganatok Jól differenciált tumorok
OncotypeDX az emlőrák kezelésében
 OncotypeDX az emlőrák kezelésében Dr. Nagy Zoltán Med Gen-Sol Kft. Szenológiai Kongresszus Kecskemét 2018. 04. 13-14. Slide 1 Az Oncotype DX korai emlőrák teszt 16 tumorral kapcsolatos gén Ösztrogén csoprt
OncotypeDX az emlőrák kezelésében Dr. Nagy Zoltán Med Gen-Sol Kft. Szenológiai Kongresszus Kecskemét 2018. 04. 13-14. Slide 1 Az Oncotype DX korai emlőrák teszt 16 tumorral kapcsolatos gén Ösztrogén csoprt
A hólyagrák aktuális kérdései a pathologus szemszögéből. Iványi Béla SZTE Pathologia
 A hólyagrák aktuális kérdései a pathologus szemszögéből Iványi Béla SZTE Pathologia Hólyagrák 7. leggyakoribb carcinoma Férfi : nő arány 3.5 : 1 Csúcsa: 60-80 év között Oka: jórészt ismeretlen Rizikótényezők:
A hólyagrák aktuális kérdései a pathologus szemszögéből Iványi Béla SZTE Pathologia Hólyagrák 7. leggyakoribb carcinoma Férfi : nő arány 3.5 : 1 Csúcsa: 60-80 év között Oka: jórészt ismeretlen Rizikótényezők:
Postterápiás követés daganatos betegségekben: mellkasi szerveket érintő korai és késői szövődmények
 Postterápiás követés daganatos betegségekben: mellkasi szerveket érintő korai és késői szövődmények Lipták Zsuzsanna, Bajcsay András, Molnár Zsuzsa, Küronya Zsófia, Nagy Tünde, Ganovszky Erna, Monostori
Postterápiás követés daganatos betegségekben: mellkasi szerveket érintő korai és késői szövődmények Lipták Zsuzsanna, Bajcsay András, Molnár Zsuzsa, Küronya Zsófia, Nagy Tünde, Ganovszky Erna, Monostori
Dr. Nemes Nagy Zsuzsa Szakképzés Karl Landsteiner Karl Landsteiner:
 Az AB0 vércsoport rendszer Dr. Nemes Nagy Zsuzsa Szakképzés 2011 Az AB0 rendszer felfedezése 1901. Karl Landsteiner Landsteiner szabály 1901 Karl Landsteiner: Munkatársai vérmintáit vizsgálva fedezte fel
Az AB0 vércsoport rendszer Dr. Nemes Nagy Zsuzsa Szakképzés 2011 Az AB0 rendszer felfedezése 1901. Karl Landsteiner Landsteiner szabály 1901 Karl Landsteiner: Munkatársai vérmintáit vizsgálva fedezte fel
Krónikus myeloproliferatív daganatok
 Krónikus myeloproliferatív daganatok előadás V. éves orvostanhallgatóknak 2015. március 5. Dr. Tóth Miklós egyetemi tanár Myeloid daganatok osztályozása (WHO, 2008) 1. Akut myeloid leukaemia 2. Myelodysplasiás
Krónikus myeloproliferatív daganatok előadás V. éves orvostanhallgatóknak 2015. március 5. Dr. Tóth Miklós egyetemi tanár Myeloid daganatok osztályozása (WHO, 2008) 1. Akut myeloid leukaemia 2. Myelodysplasiás
II./3.3.2 fejezet:. A daganatok célzott kezelése
 II./3.3.2 fejezet:. A daganatok célzott kezelése Kopper László A fejezet célja, hogy megismerje a hallgató a célzott terápiák lehetőségeit és a fejlesztés lényeges lépéseit. A fejezet teljesítését követően
II./3.3.2 fejezet:. A daganatok célzott kezelése Kopper László A fejezet célja, hogy megismerje a hallgató a célzott terápiák lehetőségeit és a fejlesztés lényeges lépéseit. A fejezet teljesítését követően
III./5. GIST. Bevezetés. A fejezet felépítése. A.) Panaszok. B.) Anamnézis. Pápai Zsuzsanna
 III./5. GIST Pápai Zsuzsanna A fejezet célja: a GIST daganatok epidemiológiájának, tüneteinek, diagnosztikájának valamint, kezelési lehetőségeinek áttekintése egy beteg esetének bemutatásán keresztül.
III./5. GIST Pápai Zsuzsanna A fejezet célja: a GIST daganatok epidemiológiájának, tüneteinek, diagnosztikájának valamint, kezelési lehetőségeinek áttekintése egy beteg esetének bemutatásán keresztül.
Hematológia. Dr. Adamkovich Nóra SZTE II.sz Belgyógyászati Klinika és Kardiológiai Központ
 Hematológia Dr. Adamkovich Nóra SZTE II.sz Belgyógyászati Klinika és Kardiológiai Központ A vérsejtképzés (haemopoesis) A neutrophil és monocyta phagocyták fejlődése Lymphocyták Nyirokcsomó megnagyobbodás
Hematológia Dr. Adamkovich Nóra SZTE II.sz Belgyógyászati Klinika és Kardiológiai Központ A vérsejtképzés (haemopoesis) A neutrophil és monocyta phagocyták fejlődése Lymphocyták Nyirokcsomó megnagyobbodás
Immunológia I. 2. előadás. Kacskovics Imre (imre.kacskovics@ttk.elte.hu)
 Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
Immunológia I. 2. előadás Kacskovics Imre (imre.kacskovics@ttk.elte.hu) Az immunválasz kialakulása A veleszületett és az adaptív immunválasz összefonódása A veleszületett immunválasz mechanizmusai A veleszületett
HAEMOTERÁPIA. Általános szempontok
 Általános szempontok HAEMOTERÁPIA Komponens (zélzott) terápia Csoportazonos vér adható Négy órán belül beadandó (lejárati idő 35 nap) Egyéb gyógyszerrel nem adható (fiz. só, 5%-os albumin) 1 E vér 10g/L-el
Általános szempontok HAEMOTERÁPIA Komponens (zélzott) terápia Csoportazonos vér adható Négy órán belül beadandó (lejárati idő 35 nap) Egyéb gyógyszerrel nem adható (fiz. só, 5%-os albumin) 1 E vér 10g/L-el
Új orális véralvadásgátlók
 Új orális véralvadásgátlók XI. Magyar Sürgősségi Orvostani Kongresszus Lovas András, Szegedi Tudományegyetem, Aneszteziológiai és Intenzív Terápiás Intézet Véralvadásgátlók alkalmazási területei posztoperatív
Új orális véralvadásgátlók XI. Magyar Sürgősségi Orvostani Kongresszus Lovas András, Szegedi Tudományegyetem, Aneszteziológiai és Intenzív Terápiás Intézet Véralvadásgátlók alkalmazási területei posztoperatív
XIII./5. fejezet: Terápia
 XIII./5. fejezet: Terápia A betegek kezelésekor a sebészi kezelés, a kemoterápia (klasszikus citotoxikus és a biológiai terápia), a radioterápia és ezek együttes alkalmazása egyaránt szóba jön. A gégének
XIII./5. fejezet: Terápia A betegek kezelésekor a sebészi kezelés, a kemoterápia (klasszikus citotoxikus és a biológiai terápia), a radioterápia és ezek együttes alkalmazása egyaránt szóba jön. A gégének
Humán genom variációk single nucleotide polymorphism (SNP)
 Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
Humán genom variációk single nucleotide polymorphism (SNP) A genom ~ 97 %-a két különböző egyedben teljesen azonos ~ 1% különbség: SNP miatt ~2% különbség: kópiaszámbeli eltérés, deléciók miatt 11-12 millió
A T sejtes immunválasz egy evolúciós szempontból váratlan helyzetben: Szervtranszplantáció
 A T sejtes immunválasz egy evolúciós szempontból váratlan helyzetben: Szervtranszplantáció Autotranszplantáció: saját szövet átültetése, pl. autológ bőrtranszplantáció, autológ őssejt-transzplantáció.
A T sejtes immunválasz egy evolúciós szempontból váratlan helyzetben: Szervtranszplantáció Autotranszplantáció: saját szövet átültetése, pl. autológ bőrtranszplantáció, autológ őssejt-transzplantáció.
NEFMI szakmai irányelv
 1. oldal NEFMI szakmai irányelv a hematológiai betegségek korszerű kezeléséről - a myeloproliferativ betegségek diagnosztikája és korszerű kezelése 1 - Felnőttkori heveny leukémiák - Krónikus myeloid leukémia
1. oldal NEFMI szakmai irányelv a hematológiai betegségek korszerű kezeléséről - a myeloproliferativ betegségek diagnosztikája és korszerű kezelése 1 - Felnőttkori heveny leukémiák - Krónikus myeloid leukémia
A vér élettana III. Fehérvérsejtek és az immunrendszer
 A vér élettana III. Fehérvérsejtek és az immunrendszer Prof. Kéri Szabolcs SZTE ÁOK Élettani Intézet, 2015 ELLENSÉG AZ IMMUNOLÓGIÁBAN: - VÍRUS, BAKTÉRIUM, GOMBA, PARAZITÁK - IDEGEN SEJTEK - SAJÁT SEJTEK
A vér élettana III. Fehérvérsejtek és az immunrendszer Prof. Kéri Szabolcs SZTE ÁOK Élettani Intézet, 2015 ELLENSÉG AZ IMMUNOLÓGIÁBAN: - VÍRUS, BAKTÉRIUM, GOMBA, PARAZITÁK - IDEGEN SEJTEK - SAJÁT SEJTEK
MUTÁCIÓK. A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik.
 MUTÁCIÓK A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik. Pontmutáció: A kromoszóma egy génjében pár nukleotidnál következik be változás.
MUTÁCIÓK A mutáció az örökítő anyag spontán, maradandó megváltozása, amelynek során új genetikai tulajdonság keletkezik. Pontmutáció: A kromoszóma egy génjében pár nukleotidnál következik be változás.
Esettanulmányok. Dr. Toldi József OVSZ Szegedi Regionális Vérellátó Központ
 Esettanulmányok Dr. Toldi József OVSZ Szegedi Regionális Vérellátó Központ Esetismertetések: ABO vércsoport meghatározással kapcsolatos nehézségek és megoldások RhD bizonytalanság kivizsgálása Antitest-azonosítással
Esettanulmányok Dr. Toldi József OVSZ Szegedi Regionális Vérellátó Központ Esetismertetések: ABO vércsoport meghatározással kapcsolatos nehézségek és megoldások RhD bizonytalanság kivizsgálása Antitest-azonosítással
Jurásné Lukovics Mónika, Dr. Bohaty Ilona, Dr. Kozma László PhD OVSz Debreceni RVK
 Jurásné Lukovics Mónika, Dr. Bohaty Ilona, Dr. Kozma László PhD OVSz Debreceni RVK Az újszülöttben kialakuló trombocitopénia (
Jurásné Lukovics Mónika, Dr. Bohaty Ilona, Dr. Kozma László PhD OVSz Debreceni RVK Az újszülöttben kialakuló trombocitopénia (
III./16.2. Gyermekkori leukémiák
 III./16.2. Gyermekkori leukémiák Csóka Mónika, Kovács Gábor A fejezet célja, hogy megismerje a hallgató a gyermekkori leukémiák előfordulási gyakoriságát, kezdeti tüneteit, a diagnózis felállításához szükséges
III./16.2. Gyermekkori leukémiák Csóka Mónika, Kovács Gábor A fejezet célja, hogy megismerje a hallgató a gyermekkori leukémiák előfordulási gyakoriságát, kezdeti tüneteit, a diagnózis felállításához szükséges
Semmelweis Egyetem Urológiai Klinika Budapest. European Board of Urology Certified Department
 Nem-izominvazív hólyagrák terápiája Dr. Riesz Péter Semmelweis Egyetem Urológiai Klinika Budapest European Board of Urology Certified Department A hólyagrák halálozása Magyarországon Halálesetek száma
Nem-izominvazív hólyagrák terápiája Dr. Riesz Péter Semmelweis Egyetem Urológiai Klinika Budapest European Board of Urology Certified Department A hólyagrák halálozása Magyarországon Halálesetek száma
A krónikus myeloid leukémia kezelésének finanszírozási protokollja
 A krónikus myeloid leukémia kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértıi és Szakmai Ellenırzési Fıosztály Budapest, 2010. február 15. 1 1. Azonosítószám:
A krónikus myeloid leukémia kezelésének finanszírozási protokollja Országos Egészségbiztosítási Pénztár Elemzési, Orvosszakértıi és Szakmai Ellenırzési Fıosztály Budapest, 2010. február 15. 1 1. Azonosítószám:
Fókuszált ultrahangvizsgálat gyermekkorban
 Fókuszált ultrahangvizsgálat gyermekkorban DrGőblGergely, SE AITK II.Gyermeksürgősségi Kongresszus Budapest 2017.09.15. POCUS = Pointof careultrasound Betegágy melletti UH-vizsgálat Fókuszált UH-vizsgálat
Fókuszált ultrahangvizsgálat gyermekkorban DrGőblGergely, SE AITK II.Gyermeksürgősségi Kongresszus Budapest 2017.09.15. POCUS = Pointof careultrasound Betegágy melletti UH-vizsgálat Fókuszált UH-vizsgálat
Engedélyszám: 18211-2/2011-EAHUF Verziószám: 1. 2448-06 Hematológiai és hemosztazeológiai vizsgálatok követelménymodulszóbeli vizsgafeladatai
 1. feladat Belső továbbképzésen vesz részt, ami esetmegbeszéléssel zárul. Számoljon be szakmai vezetőjének az alábbi esetről! 60 éves nőbeteg jobb középső lábujján hónapokkal korábban jelentkező fájdalmas
1. feladat Belső továbbképzésen vesz részt, ami esetmegbeszéléssel zárul. Számoljon be szakmai vezetőjének az alábbi esetről! 60 éves nőbeteg jobb középső lábujján hónapokkal korábban jelentkező fájdalmas
Egy labororvos dilemmái. Dr Kalmár Katalin Csolnoky Ferenc Kórház Veszprém Központi laboratórium
 Egy labororvos dilemmái Dr Kalmár Katalin Csolnoky Ferenc Kórház Veszprém Központi laboratórium Labororvos egyetemi hallgatóként választják ezt a szakterületet? - társadalmilag, kollégák által ismert?
Egy labororvos dilemmái Dr Kalmár Katalin Csolnoky Ferenc Kórház Veszprém Központi laboratórium Labororvos egyetemi hallgatóként választják ezt a szakterületet? - társadalmilag, kollégák által ismert?
Bár az emlőrák elsősorban a posztmenopauzális nők betegsége, a betegek mintegy 5,5%-a 40 évesnél, 2%-a 35 évesnél fiatalabb a diagnózis idején. Ezekbe
 Bár az emlőrák elsősorban a posztmenopauzális nők betegsége, a betegek mintegy 5,5%-a 40 évesnél, 2%-a 35 évesnél fiatalabb a diagnózis idején. Ezekben a korcsoportokban ez a leggyakoribb daganatos halálozási
Bár az emlőrák elsősorban a posztmenopauzális nők betegsége, a betegek mintegy 5,5%-a 40 évesnél, 2%-a 35 évesnél fiatalabb a diagnózis idején. Ezekben a korcsoportokban ez a leggyakoribb daganatos halálozási
Országos Egészségbiztosítási Pénztár tájékoztatója a tételes elszámolás alá eső hatóanyagok körének bővítéséről
 Országos Egészségbiztosítási Pénztár tájékoztatója a tételes elszámolás alá eső hatóanyagok körének bővítéséről Az egészségügyért felelős miniszter 2011. december 23-i rendeletében módosította az egészségügyi
Országos Egészségbiztosítási Pénztár tájékoztatója a tételes elszámolás alá eső hatóanyagok körének bővítéséről Az egészségügyért felelős miniszter 2011. december 23-i rendeletében módosította az egészségügyi
Sejtek - őssejtek dióhéjban. 2014. február. Sarkadi Balázs, MTA-TTK Molekuláris Farmakológiai Intézet - SE Kutatócsoport, Budapest
 Sejtek - őssejtek dióhéjban 2014. február Sarkadi Balázs, MTA-TTK Molekuláris Farmakológiai Intézet - SE Kutatócsoport, Budapest A legtöbb sejtünk osztódik, differenciálódik, elpusztul... vérsejtek Vannak
Sejtek - őssejtek dióhéjban 2014. február Sarkadi Balázs, MTA-TTK Molekuláris Farmakológiai Intézet - SE Kutatócsoport, Budapest A legtöbb sejtünk osztódik, differenciálódik, elpusztul... vérsejtek Vannak
Immunológia alapjai. 10. előadás. Komplement rendszer
 Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Immunológia alapjai 10. előadás Komplement rendszer A gyulladás molekuláris mediátorai: Miért fontos a komplement rendszer? A veleszületett (nem-specifikus) immunválasz része Azonnali válaszreakció A veleszületett
Esetbemutatás. Dr. Iván Mária Uzsoki Kórház 2013.11.07.
 Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
Esetbemutatás Dr. Iván Mária Uzsoki Kórház 2013.11.07. Esetbemutatás I. 26 éves férfi 6 héttel korábban bal oldali herében elváltozást észlelt,majd 3 héttel később haemoptoe miatt kereste fel orvosát antibiotikumos
változások az SM kezelésében: tények és remények
 változások az SM kezelésében: tények és remények Prof. Dr. Illés Zsolt Dél-Dániai Egyetem Odense az SM klinikai típusai relapszussal remisszióval szekunderprogresszív primer progresszív progresszív relapszáló
változások az SM kezelésében: tények és remények Prof. Dr. Illés Zsolt Dél-Dániai Egyetem Odense az SM klinikai típusai relapszussal remisszióval szekunderprogresszív primer progresszív progresszív relapszáló
Őssejt-transzplantáció
 Őssejt-transzplantáció orvostanhallgatóknak Dr. Masszi Tamás Semmelweis Egyetem III. Belgyógyászati Klinika ÁOK V. évfolyam 2018/2019. tanév II. szemeszter Az előadás vázlata 1. Alapelvek 2. Őssejt források
Őssejt-transzplantáció orvostanhallgatóknak Dr. Masszi Tamás Semmelweis Egyetem III. Belgyógyászati Klinika ÁOK V. évfolyam 2018/2019. tanév II. szemeszter Az előadás vázlata 1. Alapelvek 2. Őssejt források
Normál vérképzés HEMATOPOIETICUS ŐSSEJT LYMPHO- BLAST LYMPHO- BLAST MEGAKARYO- BLAST PRONORMO- BLAST PRO NK MONOBLAST MYELOBLAST MONOCYTA EOSINO- PHIL
 Hematopatológia Normál vérképzés KÖZÖS MYELOID PROGENITOR HEMATOPOIETICUS ŐSSEJT KÖZÖS LYMPHOID PROGENITOR NK T B MEGAKARYO- BLAST PRONORMO- BLAST MONOBLAST MYELOBLAST PRO NK LYMPHO- BLAST LYMPHO- BLAST
Hematopatológia Normál vérképzés KÖZÖS MYELOID PROGENITOR HEMATOPOIETICUS ŐSSEJT KÖZÖS LYMPHOID PROGENITOR NK T B MEGAKARYO- BLAST PRONORMO- BLAST MONOBLAST MYELOBLAST PRO NK LYMPHO- BLAST LYMPHO- BLAST
Immunológia Alapjai. 13. előadás. Elsődleges T sejt érés és differenciálódás
 Immunológia Alapjai 13. előadás Elsődleges T sejt érés és differenciálódás A T és B sejt receptor eltérő szerkezetű A T sejt receptor komplex felépítése + DOMÉNES SZERKEZET αβ ΤcR SP(CD4+ vagy CD8+) γδ
Immunológia Alapjai 13. előadás Elsődleges T sejt érés és differenciálódás A T és B sejt receptor eltérő szerkezetű A T sejt receptor komplex felépítése + DOMÉNES SZERKEZET αβ ΤcR SP(CD4+ vagy CD8+) γδ
Kryoglobulinaemia kezelése. Domján Gyula. Semmelweis Egyetem I. Belklinika. III. Terápiás Aferezis Konferencia, 2014. Debrecen
 Kryoglobulinaemia kezelése Domján Gyula Semmelweis Egyetem I. Belklinika Mi a kryoglobulin? Hidegben kicsapódó immunglobulin Melegben visszaoldódik (37 C-on) Klasszifikáció 3 csoport az Ig komponens
Kryoglobulinaemia kezelése Domján Gyula Semmelweis Egyetem I. Belklinika Mi a kryoglobulin? Hidegben kicsapódó immunglobulin Melegben visszaoldódik (37 C-on) Klasszifikáció 3 csoport az Ig komponens
A SZÍVELÉGTELENSÉG KORSZERŰ DIAGNOSZTIZÁLÁSÁNAK LEHETŐSÉGEI A SÜRGŐSSÉGI OSZTÁLYON
 A SZÍVELÉGTELENSÉG KORSZERŰ DIAGNOSZTIZÁLÁSÁNAK LEHETŐSÉGEI A SÜRGŐSSÉGI OSZTÁLYON Botos Péter, Fogl Anita. Király Szilvia, Szabó Katalin HMÖ Markhot Ferenc Kórház Rendelőintézet Sürgősségi Betegellátó
A SZÍVELÉGTELENSÉG KORSZERŰ DIAGNOSZTIZÁLÁSÁNAK LEHETŐSÉGEI A SÜRGŐSSÉGI OSZTÁLYON Botos Péter, Fogl Anita. Király Szilvia, Szabó Katalin HMÖ Markhot Ferenc Kórház Rendelőintézet Sürgősségi Betegellátó
40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban).
 1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
1. A GYÓGYSZER NEVE Zovirax 40 mg/ml belsőleges szuszpenzió 2. MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL 40,0 mg aciklovir 1 ml szuszpenzióban (200,0 mg aciklovir 5 ml 1 adag szuszpenzióban). Ismert hatású segédanyagok:
In Situ Hibridizáció a pathologiai diagnosztikában és ami mögötte van.
 In Situ Hibridizáció a pathologiai diagnosztikában és ami mögötte van. Kneif Józsefné PTE KK Pathologiai Intézet Budapest 2017. 05. 26 Kromoszóma rendellenesség kimutatás PCR technika: izolált nukleinsavak
In Situ Hibridizáció a pathologiai diagnosztikában és ami mögötte van. Kneif Józsefné PTE KK Pathologiai Intézet Budapest 2017. 05. 26 Kromoszóma rendellenesség kimutatás PCR technika: izolált nukleinsavak
Norvég Finanszírozási Mechanizmus által támogatott projekt HU-0115/NA/2008-3/ÖP-9 ÚJ TERÁPIÁS CÉLPONTOK AZONOSÍTÁSA GENOMIKAI MÓDSZEREKKEL
 Norvég Finanszírozási Mechanizmus által támogatott projekt HU-0115/NA/2008-3/ÖP-9 ÚJ TERÁPIÁS CÉLPONTOK AZONOSÍTÁSA GENOMIKAI MÓDSZEREKKEL KÖZÖS STRATÉGIA KIFEJLESZTÉSE MOLEKULÁRIS MÓDSZEREK ALKALMAZÁSÁVAL
Norvég Finanszírozási Mechanizmus által támogatott projekt HU-0115/NA/2008-3/ÖP-9 ÚJ TERÁPIÁS CÉLPONTOK AZONOSÍTÁSA GENOMIKAI MÓDSZEREKKEL KÖZÖS STRATÉGIA KIFEJLESZTÉSE MOLEKULÁRIS MÓDSZEREK ALKALMAZÁSÁVAL
